EP0241685B1 - Process for dehalogenating chloro- and bromo-acetic acids - Google Patents
Process for dehalogenating chloro- and bromo-acetic acids Download PDFInfo
- Publication number
- EP0241685B1 EP0241685B1 EP87102846A EP87102846A EP0241685B1 EP 0241685 B1 EP0241685 B1 EP 0241685B1 EP 87102846 A EP87102846 A EP 87102846A EP 87102846 A EP87102846 A EP 87102846A EP 0241685 B1 EP0241685 B1 EP 0241685B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- electrolysis
- cells
- salts
- acid
- divided
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C25—ELECTROLYTIC OR ELECTROPHORETIC PROCESSES; APPARATUS THEREFOR
- C25B—ELECTROLYTIC OR ELECTROPHORETIC PROCESSES FOR THE PRODUCTION OF COMPOUNDS OR NON-METALS; APPARATUS THEREFOR
- C25B3/00—Electrolytic production of organic compounds
- C25B3/20—Processes
- C25B3/25—Reduction
Definitions
- Chloro and bromoacetic acids are the mono-, di- and tri-haloacetic acids of the formulas
- the partial dehalogenation of the triple and the double halogenated acetic acids is desirable or necessary, for example, if the intention is to obtain the monohalogenated acetic acids by chlorination or bromination of acetic acid in the highest possible yields.
- a current density of about 500 to 700 A / m 2 is used.
- the electrolysis temperature is below 100 ° C.
- the yields of the desired partially or completely dehalogenated products should be between 95 and 100% of theory lie.
- Example 4 the electrolysis is continued until complete dehalogenation - i.e. to halogen-free acetic acid - continued.
- the catholyte is an aqueous solution of dichloroacetic acid + HCl and / or H 2 S0 4 with a conductivity of more than 0.01 Ohm -1 ⁇ cm-1.
- this object could be achieved by using such aqueous solutions of chloro- or bromoacetic acids as starting electrolysis solutions which still contain one or more salts of metals with a hydrogen overvoltage of at least 0.4 V (at a current density of 4000 A / m 2 ) included dissolved.
- the subject of the invention is therefore a process for the dehalogenation of chloroacids and bromoacetic acids by electrolysis of aqueous solutions of these acids using carbon cathodes and anodes also made of carbon or from other conventional electrode materials in undivided or divided (electrolysis) cells, which is characterized in that that the aqueous electrolysis solutions in the undivided cells and in the cathode compartment of the divided cells still contain one or more salts of metals with a hydrogen overvoltage of at least 0.4 V (at a current density of 4000 A / m 2 ) dissolved.
- salts of metals with a hydrogen overvoltage of at least 0.4 V come mainly the soluble salts of Cu, Ag, Au, Zn, Cd, Hg, Sn, Pb, Ti, Zr, Bi, V, Ta, Cr and / or Ni, preferably only the soluble Cu and Pb salts, in question.
- the most common anions of these salts are mainly CI-, Br, S0 4 2- , NO s - and CH 3 0CO-.
- these anions cannot be combined in the same way with all of the above-mentioned metals, because in some cases this results in salts which are difficult to dissolve (such as AgCI and AgBr; AgNOs are primarily possible as soluble salts).
- the salts can be added directly to the electrolysis solution or, e.g. by adding oxides, carbonates etc. - in some cases also the metals themselves (if soluble) - in the solution.
- the salt concentration in the electrolyte of the undivided cell and in the catholyte of the divided cell is expediently set to about 0.1 to 5000 ppm, preferably to about 10 to 1000 ppm.
- This modification of the known methods ensures an extraordinary corrosion resistance of the electrodes, combined with the possibility of working with current densities that are about 10 times higher (up to about 8000 A / m 2 ), without deposits forming on the electrodes even during prolonged continuous operation ; the process is therefore extremely economical and progressive.
- Trichloric and dichloroacetic acid and tribromoic and dibromoacetic acid are preferably used as starting compounds for the process; the electrolysis here is preferably carried out only up to the monohalogen stage (monochloro or monobromoacetic acid).
- aqueous solutions of the starting haloacetic acids of all possible concentrations can be used as the electrolyte (in the undivided cell) or catholyte (in the divided cell).
- the solutions can also contain mineral acids (for example HCl, H 2 S0 4 etc.) and must contain the content of certain metal salts according to the invention.
- the anolyte (in the divided cell) is preferably an aqueous mineral acid, in particular aqueous hydrochloric acid and sulfuric acid.
- carbon cathodes e.g. Electrode graphites, impregnated graphite materials and also glassy carbon.
- the metal on which the metal salt added according to the invention is based is deposited on the cathode, which leads to a change in the properties of the cathode.
- the cathodic current density can be increased to values of up to about 8000 A / m 2 , preferably up to about 6000 A / m 2 , without excessive hydrogen evolution and a progress of the dehalogenation reaction beyond the desired stage occurring as side reactions.
- the metal deposited on the cathode is repeatedly partially dissolved by the acidic solution surrounding the cathode and then deposited again, etc. There is no disruptive deposit formation on the cathode.
- the same material as for the cathode can be used as the anode material.
- other conventional electrode materials which, however, must be inert under the electrolysis conditions.
- a preferred such other common electrode material is titanium, coated with Ti0 2 and doped with a noble metal oxide such as platinum oxide.
- Preferred anolyte liquids are aqueous mineral acids such as e.g. aqueous hydrochloric acid or aqueous sulfuric acid, the use of aqueous hydrochloric acid is preferable when working in divided cells and other uses exist for the anodically formed chlorine; otherwise the use of aqueous sulfuric acid is cheaper.
- aqueous mineral acids such as e.g. aqueous hydrochloric acid or aqueous sulfuric acid
- the implementation in the divided cells is preferred.
- the same ion exchange membranes as those described in the aforementioned JP-A-54 (1979) -76521 are suitable for dividing the cells into the anode and cathode compartments; d.s. thus those made from perfluorinated polymers with carboxyl and / or sulfonic acid groups, preferably also with the ion exchange capacities specified in JP-A.
- diaphragms made of other perfluorinated polymers or inorganic materials that are stable in the electrolyte.
- the electrolysis temperature should be below 100 ° C; it is preferably between about 5 and 95 ° C., in particular between about 40 and 80 ° C.
- a method of operation in divided electrolysis cells with discontinuous execution of the cathode reaction and continuous operation of the anode reaction is particularly expedient. If the anolyte contains HCI, the anodic chlorine evolution constantly consumes CI, which can be compensated for by the continuous addition of gaseous HCI or aqueous hydrochloric acid.
- the electrolysis product is worked up in a known manner, for example by distillation.
- the Metal salts remain behind here and can be returned to the process.
- the electrolytic cell used in all (invention and comparative) examples was a split (plate and frame) circulation cell.
Abstract
Description
Chlor- und Brom-Essigsäuren sind die Mono-, Di- und Tri-halogenessigsäuren der Formeln
Es wurden daher bereits verschiedene Verfahren entwickelt, um die 2- und 3-fach halogenierten Essigsäuren zu enthalogenieren und die Enthalogenierung auch bei der Monohalogenstufe anzuhalten. Nach dem z.B. in der DE-B 848 807 beschriebenen Verfahren erfolgt diese Enthalogenierung auf elektrochemischem Weg durch Elektrolyse der entsprechenden Mischungen oder Lösungen in ungeteilten Elektrolysezellen. Als Kathodenmaterialien werden Kohle, Acheson-Graphit, Blei und Magnetit, als Anodenmaterialien Kohle und Magnetit namentlich genannt. Die Gegenwart indifferenter Stoffe oder anorganischer Verunreinigungen der Ausgangs-Halogenessig säuren soll sich hier nicht störend bemerkbar machen.Various processes have therefore already been developed to dehalogenate the 2 and 3-fold halogenated acetic acids and to stop the dehalogenation even in the monohalogen stage. After e.g. In the process described in DE-B 848 807, this dehalogenation takes place electrochemically by electrolysis of the corresponding mixtures or solutions in undivided electrolysis cells. Coal, Acheson graphite, lead and magnetite are mentioned as cathode materials, and coal and magnetite as anode materials. The presence of indifferent substances or inorganic impurities in the starting haloacetic acids should not be a problem here.
Nach den Beispielen wird bei einer Stromdichte von etwa 500 bis 700 A/m2 gearbeitet. Die Elektrolysetemperatur liegt unterhalb 100°C.According to the examples, a current density of about 500 to 700 A / m 2 is used. The electrolysis temperature is below 100 ° C.
Die Stoffausbeuten an den gewünschten teilweise- oder auch vollständig - enthalogenierten Produkten sollen zwischen 95 und 100 % d.Th. liegen.The yields of the desired partially or completely dehalogenated products should be between 95 and 100% of theory lie.
Etwa nach Beispiel 2 wird folgendes Gemisch elektrolysiert:
- unter Verwendung von Magnetit-Kathoden und Kohle-Anoden bei einer Spannung von im Mittel 3,25 V und einer Stromdichte von 500 bis 600 A/m2
- bei 65°C
- bis zur Enthalogenierung der Di- und Tri-Chloressigsäuren bis zur Monohalogenstufe. Die Ausbeute an Monochloressigsäure wird als nahezu quantitativ angegeben.
- using magnetite cathodes and carbon anodes at a voltage of 3.25 V on average and a current density of 500 to 600 A / m 2
- at 65 ° C
- up to the dehalogenation of the di- and trichloroacetic acids up to the monohalogen stage. The yield of monochloroacetic acid is given as almost quantitative.
In Beispiel 4 wird die Elektrolyse noch bis zur vollständigen Enthalogenierung - d.i. bis zur halogenfreien Essigsäure - weitergeführt.In Example 4, the electrolysis is continued until complete dehalogenation - i.e. to halogen-free acetic acid - continued.
Die für diesen Prozeß wesentliche Enthalogenierung ist eine an der Kathode stattfindende Reduktionsreaktion. Etwa für die teilweise Enthalogenierung der Dichloressigsäure bis zur Stufe der Monochloressigsäure kann folgende Reaktionsgleichung angegeben werden:
- CHCI2COOH + 2 H+ + 2 e → CH2CICOOH + HCI
Die Reaktion der aggressiven Halogenessigsäuren an der Kathode wirkt auf das Kathodenmaterial in erheblichem Maß korrodierend, wie auch durch eigene Elektrolyseversuche unter Verwendung von Magnetit- und von Blei-Kathoden gezeigt werden konnte. An Kohle-Kathoden ist die Korrosion kaum gravierend. Nachteilig für sämtliche hier genannten Kathodenmaterialien ist jedoch, daß bei einer Erhöhung der Stromdichte in zunehmenden Maß Wasserstoffentwicklung an der Kathode erfolgt, und die Elektroden im Dauerversuch über 600 h mit einem Belag bedeckt werden, der die Reinigung der Kathode erforderlich macht, was natürlich die Wirtschaftlichkeit des Verfahrens erheblich beeinträchtigt.The dehalogenation essential for this process is a reduction reaction taking place at the cathode. For the partial dehalogenation of dichloroacetic acid up to the monochloroacetic acid stage, the following reaction equation can be given:
- CHCI 2 COOH + 2 H + + 2 e → CH 2 CICOOH + HCl
The reaction of the aggressive haloacetic acids at the cathode has a considerable corrosive effect on the cathode material, as was also shown by our own electrolysis experiments using magnetite and lead cathodes. Corrosion is hardly serious on carbon cathodes. A disadvantage of all of the cathode materials mentioned here, however, is that increasing the current density leads to increasing hydrogen evolution at the cathode, and the electrodes are covered in a long-term test for 600 hours with a coating which makes cleaning the cathode necessary, which of course is economical the procedure significantly affected.
An der Anode findet zumindest teilweise die Entladung der an der Kathode gebildeten Halogenionen statt; im Falle von Chlorionen also:
- 2 Cl- - Clz + 2 e
In den ungeteilten Zellen gemäß der vorerwähnten DE-B kann das anodisch gebildete Halogen mit dem an der Kathode enthalogenierten Produkt leicht in Kontakt kommen und wieder zum Ausgangsprodukt "zurückreagieren"; z.B.
- CH2CICOOH + Clz → CHCI2COOH + HCI
Diese "Rückreaktion" kann durch die Durchführung der Elektrolyse in geteilten Elektrolysezellen verhindert werden. Die zum Zeitpunkt der Anmeldung der vorerwähnten DE-B (im Jahr 1942) bekannten Diaphragmen-Materialien (für die Teilung der Zellen in Kathoden- und Anodenraum) hielten je doch der Einwirkung der aggressiven Halogenessigsäuren und des mindestens ebenso aggressiven Halogens insbesondere in der Wärme nicht lange Stand. Deswegen werden in der genannten DE-B auch geteilte Elektrolysezellen als ungeeignet für die elektrolytische Enthalogenierung von Halogenessigsäuren beurteilt.At least partially the halogen ions formed on the cathode are discharged at the anode; in the case of chlorine ions:
- 2 Cl- - Clz + 2 e
In the undivided cells according to the aforementioned DE-B, the anodically formed halogen can with the easily come into contact with the product dehaled by the cathode and "react" back to the starting product; e.g.
- CH 2 CICOOH + Clz → CHCI 2 COOH + HCl
This "back reaction" can be prevented by carrying out the electrolysis in divided electrolysis cells. The diaphragm materials known at the time of registration of the aforementioned DE-B (in 1942) (for the division of the cells into the cathode and anode compartments) did not withstand the action of the aggressive halogen acetic acids and the at least as aggressive halogen, especially in the heat Long stand. For this reason, divided electrolysis cells are also assessed in the DE-B as unsuitable for the electrolytic dehalogenation of haloacetic acids.
Mit der Entwicklung der chemisch und thermisch außerordentlich stabilen Membranmaterialien aus perfluorierten Polymeren in neuerer Zeit ist jedoch auch die Durchführung der Elektrolyse mit aggressiven Reagentien in geteilten Zellen möglich geworden.With the development of chemically and thermally extremely stable membrane materials made of perfluorinated polymers in recent times, however, it has also become possible to carry out electrolysis with aggressive reagents in divided cells.
Ein Verfahren zur elektrochemischen Enthalogenierung von Dichloressigsäure bis zur Stufe der Monochloressigsäure in geteilten Elektrolysezellen ist in der JP-A-54 (1979)-76521 beschrieben; als Membranmaterialien werden hier speziell Kationenaustauschermembranen aus perfluorierten Polymeren mit noch COOH- oder SOgH-Gruppen am Polymerengerüst verwendet.A process for the electrochemical dehalogenation of dichloroacetic acid up to the monochloroacetic acid stage in divided electrolysis cells is described in JP-A-54 (1979) -76521; In particular, cation exchange membranes made of perfluorinated polymers with COOH or SOgH groups on the polymer backbone are used as membrane materials.
Bei diesem Verfahren dienen Blei oder Bleilegierungen als Kathoden-Werkstoffe; der Katholyt ist eine wässrige Lösung von Dichloressigsäure + HCI und/oder H2S04 mit einer Leitfähigkeit über 0,01 Ohm-1· cm-1.In this process, lead or lead alloys are used as cathode materials; the catholyte is an aqueous solution of dichloroacetic acid + HCl and / or H 2 S0 4 with a conductivity of more than 0.01 Ohm -1 · cm-1.
Als Anodenmaterialien sind Graphit, Blei, Bleilegierungen sowie Titan mit einem Überzug von Oxiden der Platinmetalle genannt; als Anolyt dient eine wässrige Mineralsäurelösung, wobei Sauerstoffsäuren als Mineralsäuren bevorzugt sind, weil hier keine Chlor-, sondern nur Sauerstoffentwicklung erfolgt:
- H2O → 1/2 02 + 2 H+ + 2 e
Für das Membranmaterial wird die erforderlich Ionenaustauschkapazität in Gramm Trockengewicht des Austauscher harzes angegeben, die nötig sind, um 1 Grammäquivalent Base zu neutralisieren. Für Membranmaterial mit Carboxylgruppen soll die Austauschkapazität zu 500 bis 1500, vorzugsweise 500 bis 1000,
für Membranmaterial mit SOaH-Gruppen 500 bis 1800, vorzugsweise 1000 bis 1500, betragen.Graphite, lead, lead alloys and titanium with a coating of oxides of platinum metals are mentioned as anode materials; An aqueous mineral acid solution serves as the anolyte, with oxygen acids being preferred as mineral acids because here there is no chlorine but only oxygen evolution:
- H 2 O → 1/2 0 2 + 2 H + + 2 e
For the membrane material, the required ion exchange capacity in grams of dry weight of the exchange resin is given, which is necessary to neutralize 1 gram equivalent of base. For membrane material with carboxyl groups, the exchange capacity should be 500 to 1500, preferably 500 to 1000,
for membrane material with SO a H groups 500 to 1800, preferably 1000 to 1500.
Die Stromdichten bewegen sich in ähnlichen Größenordnungen wie diejenigen des Verfahrens der vorher erwähnten DE-B 848 807. Bei einer Konzentration der Dichloressigsäure unter 25 % soll die Stromdichte unter 10 A/dm2 = 1000 AJm2,
- bei einer Dichloressigsäurekonzentration unter 15 % unterhalb 800 A/m2 und
- bei einer Dichloressigsäurekonzentration unter 10 % unterhalb 400 A/m2 liegen.
- at a dichloroacetic acid concentration below 15% below 800 A / m 2 and
- with a dichloroacetic acid concentration below 10% are below 400 A / m 2 .
Selbst die hier als Kathoden bevorzugten reinen Bleikathoden unterliegen noch einer erheblichen Korrosion. Bei der Elektrolyse mit einer Kathode aus 99,99 %igem Blei und einer Elektrodenfläche von 1 dm2 sowie einer Stromdichte von 4 A/dm2 = 400 A/m2 soll in 4 Stunden ein Gewichtsverlust der Kathode von 59,6 mg eingetreten sein.Even the pure lead cathodes preferred here as cathodes are still subject to considerable corrosion. In electrolysis with a 99.99% lead cathode and an electrode area of 1 dm 2 and a current density of 4 A / dm 2 = 400 A / m 2 , a weight loss of 59.6 mg of the cathode should have occurred in 4 hours .
Für verschiedene Bleilegierungen wird unter den gleichen Bedingungen folgender Gewichtsverlust angegeben:
Obwohl die bekannten elektrochemischen Verfahren zur teilweisen oder vollständigen Enthalogenierung von Chlor- und Bromessigsäuren verschiedene Vorteile besitzen, sind sie doch insbesondere hinsichtlich der Korrosionsbeständigkeit der Kathodenmaterialien und der relativ niedrigen Stromdichten noch verbesserungsbedürftig; es bestand daher die Aufgabe, die bekannten Verfahren noch vor allem bezüglich der Kathodenmaterialien und der Stromdichten zu verbessern und die Verfahren damit noch wirtschaftlicher zu machen.Although the known electrochemical processes for partial or complete dehalogenation of chloro and bromoacetic acids have various advantages, they still need to be improved, in particular with regard to the corrosion resistance of the cathode materials and the relatively low current densities; It was therefore the task of improving the known processes, particularly with regard to the cathode materials and the current densities, and thus making the processes even more economical.
Diese Aufgabe konnte erfindungsgemäß dadurch gelöst werden, daß man als Ausgangs-Elektrolyselösungen solche wässrigen Lösungen der Chlor- bzw. Bromessigsäuren verwendet, die noch ein oder mehrere Salze von Metallen mit einer Wasserstoffüberspannung von mindestens 0,4 V (bei einer Stromdichte von 4000 A/m2) gelöst enthalten.According to the invention, this object could be achieved by using such aqueous solutions of chloro- or bromoacetic acids as starting electrolysis solutions which still contain one or more salts of metals with a hydrogen overvoltage of at least 0.4 V (at a current density of 4000 A / m 2 ) included dissolved.
Erfindungsgegenstand ist daher ein Verfahren zur Enthalogenierung von Chlor- und von Bromessigsäuren durch Elektrolyse wässriger Lösungen dieser Säuren unter Verwendung von Kohlenstoffkathoden und von Anoden ebenfalls aus Kohlenstoff oder aus anderen üblichen Elektrodenmaterialien in ungeteilten oder in geteilten (Elektrolyse-)Zellen, das dadurch gekennzeichnet ist, daß die wässrigen Elektrolyselösungen in den ungeteilten Zellen sowie im Kathodenraum der geteilten Zellen noch ein oder mehrere Salze von Metallen mit einer Wasserstoffüberspannung von mindestens 0,4 V (bei einer Stromdichte von 4000 A/m2) gelöst enthalten.The subject of the invention is therefore a process for the dehalogenation of chloroacids and bromoacetic acids by electrolysis of aqueous solutions of these acids using carbon cathodes and anodes also made of carbon or from other conventional electrode materials in undivided or divided (electrolysis) cells, which is characterized in that that the aqueous electrolysis solutions in the undivided cells and in the cathode compartment of the divided cells still contain one or more salts of metals with a hydrogen overvoltage of at least 0.4 V (at a current density of 4000 A / m 2 ) dissolved.
Als Salze von Metallen mit einer Wasserstoffüberspannung von mindestens 0,4 V (bei einer Stromdichte von 4000A/m2) kommen hauptsächlich die löslichen Salze von Cu, Ag, Au, Zn, Cd, Hg, Sn, Pb, Ti, Zr, Bi, V, Ta, Cr und/oder Ni, vorzugsweise nur die löslichen Cu- und Pb-Salze, in Frage. Die gängigsten Anionen dieser Salze sind hauptsächlich CI-, Br, S04 2-, NOs- und CH30CO-. Diese Anionen können aber nicht in gleicher Weise mit allen vorerwähnten Metallen kombiniert werden, weil hier in einigen Fällen schwer lösliche Salze resultieren (wie z.B. AgCI und AgBr; hier kommt als lösliches Salz in erster Linie AgNOs in Frage).As salts of metals with a hydrogen overvoltage of at least 0.4 V (with a current density of 4000A / m2) come mainly the soluble salts of Cu, Ag, Au, Zn, Cd, Hg, Sn, Pb, Ti, Zr, Bi, V, Ta, Cr and / or Ni, preferably only the soluble Cu and Pb salts, in question. The most common anions of these salts are mainly CI-, Br, S0 4 2- , NO s - and CH 3 0CO-. However, these anions cannot be combined in the same way with all of the above-mentioned metals, because in some cases this results in salts which are difficult to dissolve (such as AgCI and AgBr; AgNOs are primarily possible as soluble salts).
Die Salze können der Elektrolyselösung direkt zugesetzt oder auch z.B. durch Zugabe von Oxiden, Carbonaten etc. - in einigen Fällen auch der Metalle selbst (sofern löslich) - in der Lösung erzeugt werden.The salts can be added directly to the electrolysis solution or, e.g. by adding oxides, carbonates etc. - in some cases also the metals themselves (if soluble) - in the solution.
Die Salzkonzentration im Elektrolyten der ungeteilten Zelle sowie im Katholyten der geteilten Zelle wird zweckmäßig auf etwa 0,1 bis 5000 ppm, vorzugsweise auf etwa 10 bis 1000 ppm, eingestellt.The salt concentration in the electrolyte of the undivided cell and in the catholyte of the divided cell is expediently set to about 0.1 to 5000 ppm, preferably to about 10 to 1000 ppm.
Durch diese Abänderung der bekannten Verfahren ist eine außerordentliche Korrosionsbeständigkeit der Elektroden, verbunden mit der Möglichkeit des Arbeitens bei um den Faktor etwa 10 höheren Stromdichten (bis etwa 8000 A/m2) gewährleistet, ohne daß sich auch bei längerem Dauerbetrieb Beläge auf den Elektroden bilden; das Verfahren ist daher außerordentlich wirtschaftlich und fortschrittlich.This modification of the known methods ensures an extraordinary corrosion resistance of the electrodes, combined with the possibility of working with current densities that are about 10 times higher (up to about 8000 A / m 2 ), without deposits forming on the electrodes even during prolonged continuous operation ; the process is therefore extremely economical and progressive.
Es war nach dem Stand der Technik in keiner Weise zu erwarten, daß durch die Kombination von Kohlekathoden und der Gegenwart bestimmter Metallsalze in der Elektrolyt-bzw. Katholyt-Lösung eine derartige Erhöhung der Wirtschaftlichkeit des Verfahrens - insbesondere durch die Möglichkeit des Arbeitens mit höheren Stromdichten ohne die Bildung von Belägen auf den Elektroden erzielt wird.According to the prior art, it was in no way to be expected that the combination of carbon cathodes and the presence of certain metal salts in the electrolyte or. Such an increase in the cost-effectiveness of the process is achieved in particular by the possibility of working with higher current densities without the formation of deposits on the electrodes.
Als Ausgangsverbindungen für das Verfahren werden vorzugsweise Trichlor- und Dichloressigsäure sowie Tribrom- und Dibromessigsäure, insbesondere nur Trichlor- und/oder Dichloressigsäure verwendet; die Elektrolyse wird hier vorzugsweise nur bis zur Monohalogenstufe (monochlor-bzw. Monobromessigsäure) geführt.Trichloric and dichloroacetic acid and tribromoic and dibromoacetic acid, in particular only trichloric and / or dichloroacetic acid, are preferably used as starting compounds for the process; the electrolysis here is preferably carried out only up to the monohalogen stage (monochloro or monobromoacetic acid).
Die Fortführung der Elektrolyse bis zur (völlig enthalogenierten) Essigsäure ist natürlich möglich, aber nicht bevorzugt.The continuation of the electrolysis up to (completely dehalogenated) acetic acid is of course possible, but not preferred.
Als Elektrolyt (in der ungeteilten Zelle) bzw. Katholyt (in der geteilten Zelle) können im Prinzip wäßrige Lösungen der Ausgangs-Halogenessigsäuren aller möglichen Konzentrationen (ca. 1 bis 95 %) verwendet werden. Die Lösungen können auch noch Mineralsäuren (z.B. HCI, H2S04 etc.) und müssen den erfindungsgemäßen Gehalt an bestimmten Metallsalzen enthalten.In principle, aqueous solutions of the starting haloacetic acids of all possible concentrations (approx. 1 to 95%) can be used as the electrolyte (in the undivided cell) or catholyte (in the divided cell). The solutions can also contain mineral acids (for example HCl, H 2 S0 4 etc.) and must contain the content of certain metal salts according to the invention.
Der Anolyt (in der geteilten Zelle) ist bevorzugt eine wässrige Mineralsäure, insbesondere wässrige Salzsäure und Schwefelsäure.The anolyte (in the divided cell) is preferably an aqueous mineral acid, in particular aqueous hydrochloric acid and sulfuric acid.
Als Kohlenstoffkathoden kommen im Prinzip alle möglichen Kohle-Elektrodenmaterialien in Frage wie z.B. Elektrodengraphite, imprägnierte Graphitwerkstoffe und auch glasartiger Kohlenstoff.In principle, all possible carbon electrode materials come into question as carbon cathodes, e.g. Electrode graphites, impregnated graphite materials and also glassy carbon.
Während der Elektrolyse scheidet sich auf der Kathode das dem erfindungsgemäß zugesetzten Metallsalz zugrundeliegende Metall ab, was zu einer Veränderung der Eigenschaften der Kathode führt. Dadurch kann die kathodische Stromdichte auf Werte bis zu etwa 8000 A/m2, vorzugsweise bis zu etwa 6000 A/m2, erhöht werden, ohne daß als Nebenreaktionen zu starke Wasserstoffentwicklung und ein Fortgang der Enthalogenierungsreaktion über die gewünschte Stufe hinaus auftreten. Das auf der Kathode abgeschiedene Metall wird von der die Kathode umgebenden sauren Lösung immer wieder teilweise aufgelöst und dann wieder abgeschieden usw. Eine störende Belagbildung auf der Kathode findet nicht statt.During the electrolysis, the metal on which the metal salt added according to the invention is based is deposited on the cathode, which leads to a change in the properties of the cathode. As a result, the cathodic current density can be increased to values of up to about 8000 A / m 2 , preferably up to about 6000 A / m 2 , without excessive hydrogen evolution and a progress of the dehalogenation reaction beyond the desired stage occurring as side reactions. The metal deposited on the cathode is repeatedly partially dissolved by the acidic solution surrounding the cathode and then deposited again, etc. There is no disruptive deposit formation on the cathode.
Als Anodenmaterial kann das gleiche Material wie für die Kathode verwendet werden. Darüberhinaus ist auch der Einsatz anderer üblicher Elektrodenmaterialien, die jedoch unter den Elektrolysebedinungen inert sein müssen, möglich. Ein bevorzugtes derartiges anderes übliches Elektrodenmaterial ist Titan, beschichtet mit Ti02 und dotiert mit einem Edelmetalloxid wie z.B. Platinoxid.The same material as for the cathode can be used as the anode material. In addition, it is also possible to use other conventional electrode materials which, however, must be inert under the electrolysis conditions. A preferred such other common electrode material is titanium, coated with Ti0 2 and doped with a noble metal oxide such as platinum oxide.
Bevorzugte Anolyt-Flüssigkeiten sind wässrige Mineralsäuren wie z.B. wässrige Salzsäure oder wässrige Schwefelsäure, Hierbei ist der Einsatz der wässrigen Salzsäure dann vorzuziehen, wenn man in geteilten Zellen arbeitet und für das anodisch gebildete Chlor anderweitige Verwendungsmöglichkeiten existieren; andernfalls ist der Einsatz der wässrigen Schwefelsäure günstiger.Preferred anolyte liquids are aqueous mineral acids such as e.g. aqueous hydrochloric acid or aqueous sulfuric acid, the use of aqueous hydrochloric acid is preferable when working in divided cells and other uses exist for the anodically formed chlorine; otherwise the use of aqueous sulfuric acid is cheaper.
Von den beiden Möglichkeiten der Elektrolysezellen, in denen das erfindungsgemäße Verfahren ausgeführt werden kann - ungeteilte und geteilte Zellen - ist die Durchführung in den geteilten Zellen bevorzugt. Zur Teilung der Zellen in Anoden- und Kathodenraum kommen hier die gleichen lonenaustauschermembranen in Frage wie sie auch in der vorerwähnten JP-A-54 (1979)-76521 beschrieben sind; d.s. also solche aus perfluorierten Polymeren mit Carboxyl- und/oder Sulfonsäuregruppen, vorzugsweise auch mit den in der JP-A angegebenen lonenaustauschkapazitäten. Auch die Verwendung von im Elektrolyten stabilen Diaphragmen aus anderen perfluorierten Polymeren oder anorganischen Werkstoffen ist im Prinzip möglich.Of the two possibilities of the electrolysis cells in which the method according to the invention can be carried out - undivided and divided cells - the implementation in the divided cells is preferred. The same ion exchange membranes as those described in the aforementioned JP-A-54 (1979) -76521 are suitable for dividing the cells into the anode and cathode compartments; d.s. thus those made from perfluorinated polymers with carboxyl and / or sulfonic acid groups, preferably also with the ion exchange capacities specified in JP-A. In principle, it is also possible to use diaphragms made of other perfluorinated polymers or inorganic materials that are stable in the electrolyte.
Die Elektrolysetemperatur soll unter 100°C liegen; vorzugsweise liegt sie zwischen etwa 5 und 95°C, insbesondere zwischen etwa 40 und 80°C.The electrolysis temperature should be below 100 ° C; it is preferably between about 5 and 95 ° C., in particular between about 40 and 80 ° C.
Es ist möglich, die Elektrolyse sowohl kontinuierlich als auch diskontinuierlich durchzuführen. Besonders zweckmäßig ist eine Arbeitsweise in geteilten Elektrolysezellen mit diskontinuierlicher Ausführung der Kathodenreaktion und kontinuierlichem Betrieb der Anodenreaktion. Wenn der Anolyt HCI enthält, wird durch die anodische Chlorentwicklung ständig CI- verbraucht, was durch laufende Ergänzung von gasförmigem HCI oder von wässriger Salzsäure auszugleichen ist.It is possible to carry out the electrolysis both continuously and batchwise. A method of operation in divided electrolysis cells with discontinuous execution of the cathode reaction and continuous operation of the anode reaction is particularly expedient. If the anolyte contains HCI, the anodic chlorine evolution constantly consumes CI, which can be compensated for by the continuous addition of gaseous HCI or aqueous hydrochloric acid.
Die Aufarbeitung des Elektrolyseproduktes erfolgt auf bekannte Weise, z.B. durch Destillation. Die Metallsalze bleiben hier im Rückstand und können wieder in den Prozeß zurückgeführt werden.The electrolysis product is worked up in a known manner, for example by distillation. The Metal salts remain behind here and can be returned to the process.
Die Erfindung wird nun durch die folgenden Beispiele näher erläutert. Nach den (Erfindungs-)-Beispielen A folgen noch einige Vergleichsbeispiele B, aus denen hervorgeht, daß an Magnetitkathoden (anstelle von Kohlenstoffkathoden) auch in Gegenwart etwa eines Bleisalzes in der Elektrolytlösung, nicht unerhebliche Korrosion und bei höheren Stromdichten auch beträchtliche Wasserstoffentwicklung erfolgt. Ein weiteres Vergleichsbeispiel mit einer Kohlenstoffkathode, aber ohne den erfindungsgemäßen Zusatz eines Metallsalzes zur Elektrolytlösung, zeigt, daß hier bereits bei nicht zu hohen Stromdichten in erheblichem Ausmaß Wasserstoff gebildet wird; setzt man der Elektrolytlösung dagegen noch etwa ein Bleisalz zu, so unterbleibt die Wasserstoffentwicklung und die Stromdichte kann erhöht werden.The invention will now be explained in more detail by the following examples. After the (invention) examples A there follow some comparative examples B, from which it can be seen that magnetite cathodes (instead of carbon cathodes), in the presence of, for example, a lead salt in the electrolyte solution, undergo not insignificant corrosion and, at higher current densities, also considerable hydrogen evolution. Another comparative example with a carbon cathode, but without the addition of a metal salt to the electrolyte solution according to the invention, shows that hydrogen is formed to a considerable extent even when the current densities are not too high; if, on the other hand, a lead salt is added to the electrolytic solution, the evolution of hydrogen is suppressed and the current density can be increased.
Die in sämtlichen (Erfindungs- und Vergleichs-) Beispielen verwendte Elektrolysezelle war eine geteilte (Platten- und Rahmen-) Umlaufzellen.
Umlaufzelle mit 0,02 m2 Elektrodenfläche, Elektrodenabstand 4 mm
- Elektroden: Elektrodengraphit EH (der Firma Sigri, Meitingen)
- Kationenautauschermembran: (R)Nafion 315 (der Firma DuPont); es handelt sich um eine 2-Schichtenmembran aus Copolymerisaten aus Perfluorsulfonylethoxyvinylether + Tetrafluorethylen. Auf der Kathodenseite befindet sich eine Schicht mit dem Äquivalentgewicht 1300, auf der Anodenseite eine solche mit dem Äquivalentgewicht 1100.
- Electrodes: Electrode graphite EH (from Sigri, Meitingen)
- Cation exchange membrane: (R) Nafion 315 (from DuPont); it is a 2-layer membrane made from copolymers of perfluorosulfonylethoxy vinyl ether + tetrafluoroethylene. There is a layer with the equivalent weight 1300 on the cathode side and one with the equivalent weight 1100 on the anode side.
Die Zusammensetzung des Katholyten und das Elektrolyseergebnis sind aus der folgenden Tabelle ersichtlich:The composition of the catholyte and the electrolysis result are shown in the following table:
Umlaufzelle mit 0,25 m2 Elektrodenfläche, Elektrodenabstand 4 mm
- Elektroden: Elektrodengraphit EH (der Firma Sigri, Meitingen)
- Kationenaustauschermembran: (R)Nafion 324 (der Firma DuPont) es handelt sich um eine 2-Schichtenmembran der gleichen Zusammensetzung wie Nafion 315, lediglich mit etwas dünneren Schichten.
- Electrodes: Electrode graphite EH (from Sigri, Meitingen)
- Cation exchange membrane: ( R ) Nafion 324 (from DuPont) it is a 2-layer membrane of the same composition as Nafion 315, only with slightly thinner layers.
Umlaufzelle mit 0,02m2 Elektrodenfläche, Elektrodenabstand 6 mm
- Anode: Elektrodengraphit EH (der Firma Sigri, Meitingen)
- Kathode: mit Magnetit vollständig und dicht beschichteter Edelstahl
- Kationenaustauschermembran: (R)Nafion 324 (der Firma DuPont)
- Abstandhalter: Polyethylennetze
- Durchfluß: 500 I/h
- Temp.: 39°C
- Anolyt: konz. HCI, kontinuierlich ergänzt durch gasförmige HCI
- Es wurde ein Katholyt mit der Zusammensetzungbei einer Stromdichte von 2000 A/m2 elektrolysiert. Die Klemmenspannung betrug 3,2 V. Der Anteil des Stroms, der für die Entwicklung von Wasserstoff verbraucht wurde, lag bei 14,3%.
- Nach der Zugabe von 0,75 g Pb(OAc)2·2 H20 (100 ppm Pb2+) ging die Wasserstoffentwicklung kurzzeitig zurück, stieg dann aber wieder an.
- Nach 270 Ah wurden 28% des Stroms für Wasserstoffentwicklung verbraucht, nach 350 Ah lag der Wert bei 45% und stieg dann weiter auf ca. 80%.
- Nach einem Ladungsverbrauch von 752 Ah erhielt man einen Elektrolyten mit der Zusammensetzung:
- Die Stromausbeute für diese geringfügige Abreicherung der Dichloressigsäure betrug nur 44%. An der Magnetitschicht der Kathode wurden schwere Korrosionsschäden festgestellt. Die Korrosionsrate betrug 14 mgFe/Ah.
- Anode: Electrode graphite EH (from Sigri, Meitingen)
- Cathode: completely and densely coated stainless steel with magnetite
- Cation exchange membrane: ( R ) Nafion 324 (from DuPont)
- Spacers: polyethylene nets
- Flow: 500 l / h
- Temp .: 39 ° C
- Anolyte: conc. HCI, continuously supplemented by gaseous HCI
- It became a catholyte with the composition electrolyzed at a current density of 2000 A / m 2 . The terminal voltage was 3.2 V. The proportion of the current that was used for the development of hydrogen was 14.3%.
- After the addition of 0.75 g of Pb (OAc) 2 .2 H 2 0 (100 ppm Pb 2 +), the hydrogen evolution decreased briefly, but then rose again.
- After 270 Ah, 28% of the electricity was used for hydrogen development, after 350 Ah the value was 45% and then rose further to approx. 80%.
- After a charge consumption of 752 Ah, an electrolyte with the composition:
- The current yield for this slight depletion of dichloroacetic acid was only 44%. Serious corrosion damage was found on the magnetite layer of the cathode. The corrosion rate was 14 mgFe / Ah.
Unter den in den Erfindungsbeispielen (A) 1 - 8 beschriebenen Bedingungen, aber ohne den Zusatz eines Metallsalzes, wurde ein Katholyt mit der Zusammensetzung
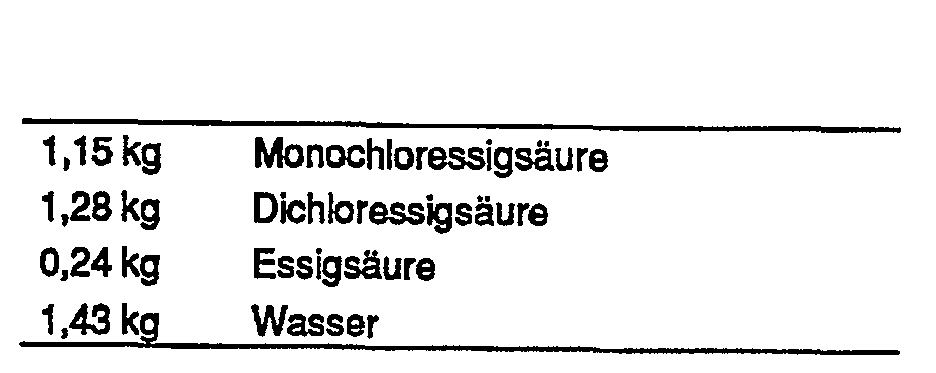
Nach Zugabe von 10 g Pb(N03)2 (* 400 ppm Pb2+) zum Katholyten fand keine Wasserstoffentwicklung mehr statt. Die Stromdichte konnte auf 4000 A/m2 erhöht werden (Klemmenspannung 4,1 V; Temperatur 52°C). Die Nebenreaktion der Wasserstoffentwicklung setzte bei einer Dichloressigsäure-Konzentration von 3 % wieder ein. Die Stromausbeute für die Reduzierung des Dichloressigsäure-Anteils auf 0,15 kg betrug 97,2 %.After addition of 10 g Pb (N0 3 ) 2 (* 400 ppm Pb 2+ ) to the catholyte, no more hydrogen evolution took place. The current density could be increased to 4000 A / m 2 (terminal voltage 4.1 V; temperature 52 ° C). The side reaction of hydrogen evolution started again at a dichloroacetic acid concentration of 3%. The current yield for reducing the dichloroacetic acid content to 0.15 kg was 97.2%.
Claims (6)
wherein the aqueous electrolysis solutions in the undivided cells and in the cathode area of the divided cells contain, dissolved, one or more salts of metals having a hydrogen excess voltage of at least 0.4 V (at a current density of 4,000 A/m2).
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT87102846T ATE48657T1 (en) | 1986-03-07 | 1987-02-27 | PROCESSES FOR THE DEHALOGENATION OF CHLORIC AND BROMOMETIC ACIDS. |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19863607446 DE3607446A1 (en) | 1986-03-07 | 1986-03-07 | METHOD FOR THE DEHALOGENATION OF CHLORINE AND BROMIC ACID ACIDS |
| DE3607446 | 1986-03-07 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0241685A1 EP0241685A1 (en) | 1987-10-21 |
| EP0241685B1 true EP0241685B1 (en) | 1989-12-13 |
Family
ID=6295698
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP87102846A Expired EP0241685B1 (en) | 1986-03-07 | 1987-02-27 | Process for dehalogenating chloro- and bromo-acetic acids |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US4707226A (en) |
| EP (1) | EP0241685B1 (en) |
| JP (1) | JPS62214189A (en) |
| AT (1) | ATE48657T1 (en) |
| AU (1) | AU583980B2 (en) |
| BR (1) | BR8701046A (en) |
| CA (1) | CA1313362C (en) |
| DD (1) | DD258424A5 (en) |
| DE (2) | DE3607446A1 (en) |
| FI (1) | FI79863C (en) |
| HU (1) | HUT43023A (en) |
| IL (1) | IL81785A (en) |
| MX (1) | MX168882B (en) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3731914A1 (en) * | 1987-09-23 | 1989-04-06 | Hoechst Ag | METHOD FOR THE PRODUCTION OF FLUORINATED ACRYLIC ACIDS AND THEIR DERIVATIVES |
| DE3802745A1 (en) * | 1988-01-30 | 1989-08-03 | Hoechst Ag | METHOD FOR PRODUCING FLUORMALONIC ACID AND THEIR DERIVATIVES |
| DE58904307D1 (en) * | 1988-03-19 | 1993-06-17 | Hoechst Ag | METHOD FOR PRODUCING UNSATURATED HALOGENATED HYDROCARBONS. |
| US5348629A (en) * | 1989-11-17 | 1994-09-20 | Khudenko Boris M | Method and apparatus for electrolytic processing of materials |
| DE4016063A1 (en) * | 1990-05-18 | 1991-11-21 | Hoechst Ag | METHOD FOR PARTLY ELECTROLYTIC ENTHALOGENATION OF DI- AND TRICHLOROACETIC ACID AND ELECTROLYSIS SOLUTION |
| US5474658A (en) * | 1992-02-22 | 1995-12-12 | Hoechst Ag | Electrochemical process for preparing glyoxylic acid |
| DE4217338C2 (en) * | 1992-05-26 | 1994-09-01 | Hoechst Ag | Electrochemical process for the reduction of oxalic acid to glyoxylic acid |
| JP2003205221A (en) * | 2001-11-12 | 2003-07-22 | Canon Inc | Chlorinated organic compound treating method and apparatus and soil restoring method and apparatus |
| JP5413836B2 (en) * | 2006-05-26 | 2014-02-12 | ディーエイチ テクノロジーズ デベロップメント プライベート リミテッド | Tagging reagents for hydroxylated compounds and methods thereof |
| CN114409025A (en) * | 2021-12-17 | 2022-04-29 | 浙江工业大学 | Method for debrominating tribromoacetic acid through catalytic electrolysis of vitamin B12 modified electrode |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL63449C (en) * | 1942-03-12 | |||
| FR1471108A (en) * | 1965-03-13 | 1967-02-24 | Ajinomoto Kk | Electrolytic method of converting polychloromethyl groups of organic compounds to monochloromethyl group |
| JPS5476521A (en) * | 1977-11-30 | 1979-06-19 | Chlorine Eng Corp Ltd | Preparation of monochloroacetic acid |
| US4588484A (en) * | 1985-02-28 | 1986-05-13 | Eli Lilly And Company | Electrochemical reduction of 3-chlorobenzo[b]thiophenes |
| US4585533A (en) * | 1985-04-19 | 1986-04-29 | Exxon Research And Engineering Co. | Removal of halogen from polyhalogenated compounds by electrolysis |
-
1986
- 1986-03-07 DE DE19863607446 patent/DE3607446A1/en active Granted
-
1987
- 1987-02-27 DE DE8787102846T patent/DE3761151D1/en not_active Expired - Fee Related
- 1987-02-27 EP EP87102846A patent/EP0241685B1/en not_active Expired
- 1987-02-27 AT AT87102846T patent/ATE48657T1/en not_active IP Right Cessation
- 1987-03-03 DD DD87300407A patent/DD258424A5/en not_active IP Right Cessation
- 1987-03-05 US US07/021,991 patent/US4707226A/en not_active Expired - Fee Related
- 1987-03-05 HU HU87940A patent/HUT43023A/en unknown
- 1987-03-05 IL IL81785A patent/IL81785A/en unknown
- 1987-03-05 FI FI870972A patent/FI79863C/en not_active IP Right Cessation
- 1987-03-06 BR BR8701046A patent/BR8701046A/en unknown
- 1987-03-06 AU AU69778/87A patent/AU583980B2/en not_active Ceased
- 1987-03-06 JP JP62050439A patent/JPS62214189A/en active Pending
- 1987-03-06 MX MX005489A patent/MX168882B/en unknown
- 1987-03-06 CA CA000531325A patent/CA1313362C/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| ATE48657T1 (en) | 1989-12-15 |
| US4707226A (en) | 1987-11-17 |
| EP0241685A1 (en) | 1987-10-21 |
| IL81785A (en) | 1990-03-19 |
| FI870972A0 (en) | 1987-03-05 |
| JPS62214189A (en) | 1987-09-19 |
| CA1313362C (en) | 1993-02-02 |
| DE3761151D1 (en) | 1990-01-18 |
| AU6977887A (en) | 1987-09-10 |
| AU583980B2 (en) | 1989-05-11 |
| IL81785A0 (en) | 1987-10-20 |
| MX168882B (en) | 1993-06-14 |
| FI79863C (en) | 1990-03-12 |
| FI870972A (en) | 1987-09-08 |
| DD258424A5 (en) | 1988-07-20 |
| DE3607446A1 (en) | 1987-09-10 |
| FI79863B (en) | 1989-11-30 |
| DE3607446C2 (en) | 1987-12-03 |
| HUT43023A (en) | 1987-09-28 |
| BR8701046A (en) | 1988-01-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0989206B1 (en) | Electrolysis cell and use thereof | |
| EP0627020B1 (en) | Electrochemical process for preparing glyoxylic acid | |
| EP0457320B1 (en) | Process for partial electrolyte dehalogenation dichloro- and trichloro-acetic acids and electrolysis solution | |
| EP0241685B1 (en) | Process for dehalogenating chloro- and bromo-acetic acids | |
| DE3420483A1 (en) | BIPOLAR ELECTROLYSIS WITH GAS DIFFUSION CATHODE | |
| DE2949379C2 (en) | Process for the production of glyoxalic acid by the oxidation of glyoxal | |
| DE2017204C2 (en) | Process for the production of titanium or titanium alloys by electrochemical deposition | |
| DE10101494A1 (en) | Tetramethylammonium hydroxide synthesis | |
| DE2704213A1 (en) | Electrolytic dissociation of sodium chloride - using a raney neckel cathode and a perforated anode with a diaphragm made of a cation exchange material sandwiched between the electrodes | |
| DE2251262C2 (en) | Process for the continuous production of aluminum by the electrolysis of aluminum chloride | |
| DE3143304A1 (en) | METHOD FOR OPERATING AN ELECTROLYTIC CELL | |
| EP0308838B1 (en) | Process for the production of fluorinated acrylic acids and their derivatives | |
| DE2924601A1 (en) | METHOD FOR TREATING A METAL BODY | |
| DE4217338C2 (en) | Electrochemical process for the reduction of oxalic acid to glyoxylic acid | |
| DE2819964C2 (en) | Metallic diaphragm | |
| DE2952646A1 (en) | METHOD FOR THE ELECTROLYSIS OF AN AQUEOUS ALKALINE METAL CHLORIDE SOLUTION | |
| DE2550224A1 (en) | ANODE ARRANGEMENT AND BIPOLAR ELECTROLYZING DEVICE WITH SUCH ANODE ARRANGEMENT | |
| DE2434921B2 (en) | Electrolysis cell and process for the electrolysis of ionizable chemical compounds | |
| WO1992005299A1 (en) | Process for producing halogenated acrylic acids | |
| DE2937992A1 (en) | METHOD AND DEVICE FOR CONTINUOUSLY ELECTROLYTICALLY DESCALING STEEL WIRE BY CONTACT-FREE CURRENT FLOW | |
| DE2213528A1 (en) | Process for removing used coatings from metallic electrodes | |
| EP3426825A1 (en) | Electrolytic refinement of raw gold | |
| DE3141744A1 (en) | METHOD FOR TREATING A PERMIONIC MEMBRANE IN AN ELECTROLYTIC CELL AND FOR OPERATING THIS CELL | |
| DE19905672C2 (en) | Process for the electrolytic production of amalgam from metal salt | |
| DE3018538A1 (en) | CYLINDRICAL CATION EXCHANGE MEMBRANE |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE FR GB IT LI NL SE |
|
| 17P | Request for examination filed |
Effective date: 19880127 |
|
| 17Q | First examination report despatched |
Effective date: 19890228 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE FR GB IT LI NL SE |
|
| REF | Corresponds to: |
Ref document number: 48657 Country of ref document: AT Date of ref document: 19891215 Kind code of ref document: T |
|
| ITF | It: translation for a ep patent filed |
Owner name: ING. C. GREGORJ S.P.A. |
|
| REF | Corresponds to: |
Ref document number: 3761151 Country of ref document: DE Date of ref document: 19900118 |
|
| ET | Fr: translation filed | ||
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| ITTA | It: last paid annual fee | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19930118 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19930120 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19930121 Year of fee payment: 7 Ref country code: GB Payment date: 19930121 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19930127 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19930205 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19930228 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19930416 Year of fee payment: 7 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19940227 Ref country code: AT Effective date: 19940227 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Effective date: 19940228 Ref country code: LI Effective date: 19940228 Ref country code: CH Effective date: 19940228 Ref country code: BE Effective date: 19940228 |
|
| BERE | Be: lapsed |
Owner name: HOECHST A.G. Effective date: 19940228 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19940901 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee | ||
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19940227 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Effective date: 19941031 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19941101 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| EUG | Se: european patent has lapsed |
Ref document number: 87102846.0 Effective date: 19940910 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES;WARNING: LAPSES OF ITALIAN PATENTS WITH EFFECTIVE DATE BEFORE 2007 MAY HAVE OCCURRED AT ANY TIME BEFORE 2007. THE CORRECT EFFECTIVE DATE MAY BE DIFFERENT FROM THE ONE RECORDED. Effective date: 20050227 |