CN114053417A - 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 - Google Patents
用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 Download PDFInfo
- Publication number
- CN114053417A CN114053417A CN202111352284.7A CN202111352284A CN114053417A CN 114053417 A CN114053417 A CN 114053417A CN 202111352284 A CN202111352284 A CN 202111352284A CN 114053417 A CN114053417 A CN 114053417A
- Authority
- CN
- China
- Prior art keywords
- cochleate
- cryptococcus
- oral formulation
- antifungal
- antifungal compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940121375 antifungal agent Drugs 0.000 title claims abstract description 119
- 230000000843 anti-fungal effect Effects 0.000 title claims abstract description 94
- 150000001875 compounds Chemical class 0.000 title claims abstract description 93
- 201000007336 Cryptococcosis Diseases 0.000 title claims abstract description 44
- 238000011282 treatment Methods 0.000 title abstract description 24
- 210000003169 central nervous system Anatomy 0.000 title abstract description 19
- 239000000203 mixture Substances 0.000 claims abstract description 90
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 claims abstract description 56
- XRECTZIEBJDKEO-UHFFFAOYSA-N flucytosine Chemical compound NC1=NC(=O)NC=C1F XRECTZIEBJDKEO-UHFFFAOYSA-N 0.000 claims abstract description 53
- 238000009472 formulation Methods 0.000 claims abstract description 46
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 claims abstract description 29
- 229960003942 amphotericin b Drugs 0.000 claims abstract description 29
- RFHAOTPXVQNOHP-UHFFFAOYSA-N fluconazole Chemical compound C1=NC=NN1CC(C=1C(=CC(F)=CC=1)F)(O)CN1C=NC=N1 RFHAOTPXVQNOHP-UHFFFAOYSA-N 0.000 claims abstract description 29
- 229960004884 fluconazole Drugs 0.000 claims abstract description 29
- -1 abaconazole Chemical compound 0.000 claims abstract description 27
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 claims abstract description 8
- VHVPQPYKVGDNFY-DFMJLFEVSA-N 2-[(2r)-butan-2-yl]-4-[4-[4-[4-[[(2r,4s)-2-(2,4-dichlorophenyl)-2-(1,2,4-triazol-1-ylmethyl)-1,3-dioxolan-4-yl]methoxy]phenyl]piperazin-1-yl]phenyl]-1,2,4-triazol-3-one Chemical compound O=C1N([C@H](C)CC)N=CN1C1=CC=C(N2CCN(CC2)C=2C=CC(OC[C@@H]3O[C@](CN4N=CN=C4)(OC3)C=3C(=CC(Cl)=CC=3)Cl)=CC=2)C=C1 VHVPQPYKVGDNFY-DFMJLFEVSA-N 0.000 claims abstract description 8
- 229960004130 itraconazole Drugs 0.000 claims abstract description 8
- 229960004125 ketoconazole Drugs 0.000 claims abstract description 8
- 229960001589 posaconazole Drugs 0.000 claims abstract description 8
- RAGOYPUPXAKGKH-XAKZXMRKSA-N posaconazole Chemical compound O=C1N([C@H]([C@H](C)O)CC)N=CN1C1=CC=C(N2CCN(CC2)C=2C=CC(OC[C@H]3C[C@@](CN4N=CN=C4)(OC3)C=3C(=CC(F)=CC=3)F)=CC=2)C=C1 RAGOYPUPXAKGKH-XAKZXMRKSA-N 0.000 claims abstract description 8
- OPAHEYNNJWPQPX-RCDICMHDSA-N ravuconazole Chemical compound C=1SC([C@H](C)[C@](O)(CN2N=CN=C2)C=2C(=CC(F)=CC=2)F)=NC=1C1=CC=C(C#N)C=C1 OPAHEYNNJWPQPX-RCDICMHDSA-N 0.000 claims abstract description 8
- 229950004154 ravuconazole Drugs 0.000 claims abstract description 8
- 229960004740 voriconazole Drugs 0.000 claims abstract description 8
- BCEHBSKCWLPMDN-MGPLVRAMSA-N voriconazole Chemical compound C1([C@H](C)[C@](O)(CN2N=CN=C2)C=2C(=CC(F)=CC=2)F)=NC=NC=C1F BCEHBSKCWLPMDN-MGPLVRAMSA-N 0.000 claims abstract description 8
- 150000002632 lipids Chemical class 0.000 claims description 86
- 241001337994 Cryptococcus <scale insect> Species 0.000 claims description 54
- 229960004413 flucytosine Drugs 0.000 claims description 46
- 241000221204 Cryptococcus neoformans Species 0.000 claims description 37
- 208000015181 infectious disease Diseases 0.000 claims description 37
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 claims description 27
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 claims description 25
- 210000004556 brain Anatomy 0.000 claims description 20
- 239000000427 antigen Substances 0.000 claims description 7
- 108091007433 antigens Proteins 0.000 claims description 7
- 102000036639 antigens Human genes 0.000 claims description 7
- 241000124008 Mammalia Species 0.000 claims description 6
- 206010014599 encephalitis Diseases 0.000 claims description 6
- 201000011475 meningoencephalitis Diseases 0.000 claims description 6
- 201000010099 disease Diseases 0.000 claims description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 5
- 208000030507 AIDS Diseases 0.000 claims description 4
- 208000006081 Cryptococcal meningitis Diseases 0.000 claims description 4
- 206010016654 Fibrosis Diseases 0.000 claims description 4
- 206010025323 Lymphomas Diseases 0.000 claims description 4
- 206010027209 Meningitis cryptococcal Diseases 0.000 claims description 4
- 230000007882 cirrhosis Effects 0.000 claims description 4
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 4
- 210000000056 organ Anatomy 0.000 claims description 4
- 241000894007 species Species 0.000 claims description 3
- 241001522864 Cryptococcus gattii VGI Species 0.000 claims description 2
- 238000011321 prophylaxis Methods 0.000 claims 2
- 238000000034 method Methods 0.000 abstract description 33
- 241000699670 Mus sp. Species 0.000 description 39
- 150000003904 phospholipids Chemical class 0.000 description 33
- 239000003429 antifungal agent Substances 0.000 description 25
- 230000002209 hydrophobic effect Effects 0.000 description 20
- 150000001768 cations Chemical class 0.000 description 19
- 239000002502 liposome Substances 0.000 description 19
- 230000004083 survival effect Effects 0.000 description 18
- 239000000725 suspension Substances 0.000 description 15
- 238000007912 intraperitoneal administration Methods 0.000 description 14
- 239000003795 chemical substances by application Substances 0.000 description 12
- 239000000243 solution Substances 0.000 description 12
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 11
- 239000003833 bile salt Substances 0.000 description 10
- 230000015572 biosynthetic process Effects 0.000 description 10
- 239000003112 inhibitor Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 230000002776 aggregation Effects 0.000 description 9
- 238000004220 aggregation Methods 0.000 description 9
- 230000007935 neutral effect Effects 0.000 description 9
- 239000002245 particle Substances 0.000 description 9
- 238000001990 intravenous administration Methods 0.000 description 8
- 231100000419 toxicity Toxicity 0.000 description 8
- 230000001988 toxicity Effects 0.000 description 8
- 210000005013 brain tissue Anatomy 0.000 description 7
- 230000034994 death Effects 0.000 description 7
- 231100000517 death Toxicity 0.000 description 7
- 239000000839 emulsion Substances 0.000 description 7
- 230000000855 fungicidal effect Effects 0.000 description 7
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 239000013078 crystal Substances 0.000 description 6
- 229940009976 deoxycholate Drugs 0.000 description 6
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 6
- 238000007913 intrathecal administration Methods 0.000 description 6
- 239000013554 lipid monolayer Substances 0.000 description 6
- 210000004072 lung Anatomy 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 239000008223 sterile water Substances 0.000 description 6
- 229920001817 Agar Polymers 0.000 description 5
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- 241000725303 Human immunodeficiency virus Species 0.000 description 5
- 239000008272 agar Substances 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- 229910052791 calcium Inorganic materials 0.000 description 5
- 239000011575 calcium Substances 0.000 description 5
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 5
- 239000010408 film Substances 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 239000007928 intraperitoneal injection Substances 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 206010061598 Immunodeficiency Diseases 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- 239000003613 bile acid Substances 0.000 description 4
- 229940093761 bile salts Drugs 0.000 description 4
- 239000001110 calcium chloride Substances 0.000 description 4
- 229910001628 calcium chloride Inorganic materials 0.000 description 4
- 229940099352 cholate Drugs 0.000 description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 4
- 230000002538 fungal effect Effects 0.000 description 4
- 229930004094 glycosylphosphatidylinositol Natural products 0.000 description 4
- 238000011194 good manufacturing practice Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 238000011068 loading method Methods 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 238000003305 oral gavage Methods 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 150000003230 pyrimidines Chemical class 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- WTBFLCSPLLEDEM-JIDRGYQWSA-N 1,2-dioleoyl-sn-glycero-3-phospho-L-serine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCC\C=C/CCCCCCCC WTBFLCSPLLEDEM-JIDRGYQWSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- 239000001856 Ethyl cellulose Substances 0.000 description 3
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 3
- 241000233866 Fungi Species 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 208000019693 Lung disease Diseases 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229920002125 Sokalan® Polymers 0.000 description 3
- 239000008186 active pharmaceutical agent Substances 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000001332 colony forming effect Effects 0.000 description 3
- 239000003651 drinking water Substances 0.000 description 3
- 235000020188 drinking water Nutrition 0.000 description 3
- 238000001647 drug administration Methods 0.000 description 3
- 235000019325 ethyl cellulose Nutrition 0.000 description 3
- 229920001249 ethyl cellulose Polymers 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000003018 immunosuppressive agent Substances 0.000 description 3
- 229940125721 immunosuppressive agent Drugs 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 239000008267 milk Substances 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 150000004291 polyenes Chemical class 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 210000002307 prostate Anatomy 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- WKJDWDLHIOUPPL-JSOSNVBQSA-N (2s)-2-amino-3-({[(2r)-2,3-bis(tetradecanoyloxy)propoxy](hydroxy)phosphoryl}oxy)propanoic acid Chemical compound CCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCC WKJDWDLHIOUPPL-JSOSNVBQSA-N 0.000 description 2
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 2
- BIABMEZBCHDPBV-MPQUPPDSSA-N 1,2-palmitoyl-sn-glycero-3-phospho-(1'-sn-glycerol) Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@@H](O)CO)OC(=O)CCCCCCCCCCCCCCC BIABMEZBCHDPBV-MPQUPPDSSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 2
- 229930183010 Amphotericin Natural products 0.000 description 2
- QGGFZZLFKABGNL-UHFFFAOYSA-N Amphotericin A Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCCC=CC=CC(C)C(O)C(C)C(C)OC(=O)CC(O)CC(O)CCC(O)C(O)CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 QGGFZZLFKABGNL-UHFFFAOYSA-N 0.000 description 2
- 229920001685 Amylomaize Polymers 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 208000007204 Brain death Diseases 0.000 description 2
- 102000011632 Caseins Human genes 0.000 description 2
- 108010076119 Caseins Proteins 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- 206010017533 Fungal infection Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 2
- 108010015031 Glycochenodeoxycholic Acid Proteins 0.000 description 2
- 108010007979 Glycocholic Acid Proteins 0.000 description 2
- 229920002907 Guar gum Polymers 0.000 description 2
- 102100024023 Histone PARylation factor 1 Human genes 0.000 description 2
- 101001047783 Homo sapiens Histone PARylation factor 1 Proteins 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 208000031888 Mycoses Diseases 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 102000007562 Serum Albumin Human genes 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- ZUAAPNNKRHMPKG-UHFFFAOYSA-N acetic acid;butanedioic acid;methanol;propane-1,2-diol Chemical compound OC.CC(O)=O.CC(O)CO.OC(=O)CCC(O)=O ZUAAPNNKRHMPKG-UHFFFAOYSA-N 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 2
- 229960005260 amiodarone Drugs 0.000 description 2
- 229940009444 amphotericin Drugs 0.000 description 2
- 230000003288 anthiarrhythmic effect Effects 0.000 description 2
- 230000000561 anti-psychotic effect Effects 0.000 description 2
- 239000003416 antiarrhythmic agent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 210000000941 bile Anatomy 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229960001631 carbomer Drugs 0.000 description 2
- 230000000747 cardiac effect Effects 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 229940009025 chenodeoxycholate Drugs 0.000 description 2
- RUDATBOHQWOJDD-BSWAIDMHSA-N chenodeoxycholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 RUDATBOHQWOJDD-BSWAIDMHSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 239000008119 colloidal silica Substances 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 238000011393 cytotoxic chemotherapy Methods 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- FLKPEMZONWLCSK-UHFFFAOYSA-N diethyl phthalate Chemical compound CCOC(=O)C1=CC=CC=C1C(=O)OCC FLKPEMZONWLCSK-UHFFFAOYSA-N 0.000 description 2
- MHUWZNTUIIFHAS-CLFAGFIQSA-N dioleoyl phosphatidic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(O)=O)OC(=O)CCCCCCC\C=C/CCCCCCCC MHUWZNTUIIFHAS-CLFAGFIQSA-N 0.000 description 2
- FRKBLBQTSTUKOV-UHFFFAOYSA-N diphosphatidyl glycerol Natural products OP(O)(=O)OCC(OP(O)(O)=O)COP(O)(O)=O FRKBLBQTSTUKOV-UHFFFAOYSA-N 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000008686 ergosterol biosynthesis Effects 0.000 description 2
- 239000000328 estrogen antagonist Substances 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 230000001408 fungistatic effect Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000003862 glucocorticoid Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- GHCZAUBVMUEKKP-GYPHWSFCSA-N glycochenodeoxycholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCC(O)=O)C)[C@@]2(C)CC1 GHCZAUBVMUEKKP-GYPHWSFCSA-N 0.000 description 2
- RFDAIACWWDREDC-FRVQLJSFSA-N glycocholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 RFDAIACWWDREDC-FRVQLJSFSA-N 0.000 description 2
- 235000010417 guar gum Nutrition 0.000 description 2
- 239000000665 guar gum Substances 0.000 description 2
- 229960002154 guar gum Drugs 0.000 description 2
- 239000000017 hydrogel Substances 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000011221 initial treatment Methods 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 210000002418 meninge Anatomy 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 210000003097 mucus Anatomy 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 229950000688 phenothiazine Drugs 0.000 description 2
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 2
- 150000003905 phosphatidylinositols Chemical class 0.000 description 2
- 238000007747 plating Methods 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 150000004671 saturated fatty acids Chemical class 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000002689 soil Substances 0.000 description 2
- 238000000527 sonication Methods 0.000 description 2
- 150000003429 steroid acids Chemical class 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 230000002195 synergetic effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229940037128 systemic glucocorticoids Drugs 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- BHTRKEVKTKCXOH-BJLOMENOSA-N taurochenodeoxycholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)CC1 BHTRKEVKTKCXOH-BJLOMENOSA-N 0.000 description 2
- WBWWGRHZICKQGZ-HZAMXZRMSA-N taurocholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCS(O)(=O)=O)C)[C@@]2(C)[C@@H](O)C1 WBWWGRHZICKQGZ-HZAMXZRMSA-N 0.000 description 2
- 239000002452 tumor necrosis factor alpha inhibitor Substances 0.000 description 2
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 239000008256 whipped cream Substances 0.000 description 2
- JSPNNZKWADNWHI-PNANGNLXSA-N (2r)-2-hydroxy-n-[(2s,3r,4e,8e)-3-hydroxy-9-methyl-1-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoctadeca-4,8-dien-2-yl]heptadecanamide Chemical compound CCCCCCCCCCCCCCC[C@@H](O)C(=O)N[C@H]([C@H](O)\C=C\CC\C=C(/C)CCCCCCCCC)CO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O JSPNNZKWADNWHI-PNANGNLXSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- KILNVBDSWZSGLL-KXQOOQHDSA-N 1,2-dihexadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCC KILNVBDSWZSGLL-KXQOOQHDSA-N 0.000 description 1
- NRJAVPSFFCBXDT-HUESYALOSA-N 1,2-distearoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCCCCCCCCCCC NRJAVPSFFCBXDT-HUESYALOSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- CFWRDBDJAOHXSH-SECBINFHSA-N 2-azaniumylethyl [(2r)-2,3-diacetyloxypropyl] phosphate Chemical compound CC(=O)OC[C@@H](OC(C)=O)COP(O)(=O)OCCN CFWRDBDJAOHXSH-SECBINFHSA-N 0.000 description 1
- HVCOBJNICQPDBP-UHFFFAOYSA-N 3-[3-[3,5-dihydroxy-6-methyl-4-(3,4,5-trihydroxy-6-methyloxan-2-yl)oxyoxan-2-yl]oxydecanoyloxy]decanoic acid;hydrate Chemical compound O.OC1C(OC(CC(=O)OC(CCCCCCC)CC(O)=O)CCCCCCC)OC(C)C(O)C1OC1C(O)C(O)C(O)C(C)O1 HVCOBJNICQPDBP-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 229920000945 Amylopectin Polymers 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 241000221198 Basidiomycota Species 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 208000014912 Central Nervous System Infections Diseases 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- 201000003874 Common Variable Immunodeficiency Diseases 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 241000776296 Cryptococcus neoformans var. grubii Species 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 101100379081 Emericella variicolor andC gene Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 229920002670 Fructan Polymers 0.000 description 1
- 206010059024 Gastrointestinal toxicity Diseases 0.000 description 1
- 108010068370 Glutens Proteins 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 206010022773 Intracranial pressure increased Diseases 0.000 description 1
- 206010024264 Lethargy Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 102000014171 Milk Proteins Human genes 0.000 description 1
- 108010011756 Milk Proteins Proteins 0.000 description 1
- CRJGESKKUOMBCT-VQTJNVASSA-N N-acetylsphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-VQTJNVASSA-N 0.000 description 1
- JOCBASBOOFNAJA-UHFFFAOYSA-N N-tris(hydroxymethyl)methyl-2-aminoethanesulfonic acid Chemical compound OCC(CO)(CO)NCCS(O)(=O)=O JOCBASBOOFNAJA-UHFFFAOYSA-N 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 206010053159 Organ failure Diseases 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 206010034719 Personality change Diseases 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- 206010035623 Pleuritic pain Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000031074 Reinjury Diseases 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 108010073771 Soybean Proteins Proteins 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 1
- 108010046377 Whey Proteins Proteins 0.000 description 1
- 102000007544 Whey Proteins Human genes 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 229920002494 Zein Polymers 0.000 description 1
- 108010055615 Zein Proteins 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 241001099166 [Candida] californica Species 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 239000001785 acacia senegal l. willd gum Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000004520 agglutination Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 150000003851 azoles Chemical class 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 229920003064 carboxyethyl cellulose Polymers 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 235000013869 carnauba wax Nutrition 0.000 description 1
- 239000004203 carnauba wax Substances 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 229940106189 ceramide Drugs 0.000 description 1
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 description 1
- 229930183167 cerebroside Natural products 0.000 description 1
- RIZIAUKTHDLMQX-UHFFFAOYSA-N cerebroside D Natural products CCCCCCCCCCCCCCCCC(O)C(=O)NC(C(O)C=CCCC=C(C)CCCCCCCCC)COC1OC(CO)C(O)C(O)C1O RIZIAUKTHDLMQX-UHFFFAOYSA-N 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 231100000414 gastrointestinal toxicity Toxicity 0.000 description 1
- 235000021312 gluten Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 150000002433 hydrophilic molecules Chemical class 0.000 description 1
- 230000005660 hydrophilic surface Effects 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 235000021374 legumes Nutrition 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 238000003760 magnetic stirring Methods 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 206010025482 malaise Diseases 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 235000021239 milk protein Nutrition 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 239000007908 nanoemulsion Substances 0.000 description 1
- 231100000417 nephrotoxicity Toxicity 0.000 description 1
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000004792 oxidative damage Effects 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 238000001907 polarising light microscopy Methods 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001987 poloxamine Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 235000003441 saturated fatty acids Nutrition 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 229940001941 soy protein Drugs 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000001069 triethyl citrate Substances 0.000 description 1
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 1
- 235000013769 triethyl citrate Nutrition 0.000 description 1
- 239000002691 unilamellar liposome Substances 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical group 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 235000021119 whey protein Nutrition 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
- 239000005019 zein Substances 0.000 description 1
- 229940093612 zein Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
- 235000021246 κ-casein Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/513—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim having oxo groups directly attached to the heterocyclic ring, e.g. cytosine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/661—Phosphorus acids or esters thereof not having P—C bonds, e.g. fosfosal, dichlorvos, malathion or mevinphos
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/24—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing atoms other than carbon, hydrogen, oxygen, halogen, nitrogen or sulfur, e.g. cyclomethicone or phospholipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0043—Nose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1274—Non-vesicle bilayer structures, e.g. liquid crystals, tubules, cubic phases, cochleates; Sponge phases
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Dispersion Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Biophysics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Psychology (AREA)
- Dermatology (AREA)
- Otolaryngology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
本申请是用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物。本申请涉及一种脂质卷组合物,包含一种或多种脂质卷和至少两种抗真菌化合物,所述抗真菌化合物选自两性霉素B、5‑氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑。还公开了使用该抗真菌脂质卷制剂的方法。
Description
本申请是国际申请日为2017年7月12日的发明名称为“用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物”、国家申请号为201780056037.8的发明专利申请的分案申请。
相关申请的交叉引用
本申请要求于2016年7月12日提交的美国临时申请No. 62/361,351和2017年6月1日提交的美国临时申请No. 62/513,800的权益并依赖于这些专利的申请日;每个申请的全部公开内容通过引用结合到本文中。
领域
概括而言,本申请涉及包含抗真菌剂的脂质卷组合物和施用该组合物来治疗真菌感染、特别是由隐球菌属(Cryptococcus spp.)引起的真菌感染的方法。
背景
隐球菌病是一种机会性真菌感染,在全世界人类免疫缺陷病毒患者中由于中枢神经系统(CNS)疾病每年导致估计约100万例病例和625,000例死亡。与地理上更受限制的加蒂隐球菌(Cryptococcus gattii)相比,全球大多数病例由新型隐球菌(Cryptococcus neoformans)引起。尽管隐球菌病最常与HIV感染有关,但在许多地区,特别是在较发达国家,大多数病例发生在非HIV感染个体中,包括移植受者;接受免疫抑制剂的患者,免疫抑制剂诸如糖皮质激素、细胞毒性化疗、TNF-α抑制剂和其他疾病调节剂;和还患有潜在疾病的不同种类患者,潜在疾病诸如器官衰竭综合征、先天性免疫学问题、常见变异性免疫缺陷和血液学疾病。此外,在许多地区,多达20%的隐球菌病病例发生在表型“正常”或临床上非免疫受损的患者中。
认为隐球菌病病例始于从环境中吸入真菌细胞。在肺内,隐球菌属可在免疫抑制患者中引起肺炎,但在免疫活性宿主中,真菌细胞通常被免疫系统清除或建立无症状的潜在感染。在随后的免疫抑制中,这种潜在感染可随后传播到其他组织,最明显的是中枢神经系统(CNS)。一旦在CNS中确立,隐球菌病就会引起脑膜和脑组织的势不可挡的感染,这通常伴有颅内压升高。如果没有快速有效的治疗,CNS感染总是致命的。
治疗隐球菌性脑膜脑炎的基础是20世纪50年代开发的两性霉素B脱氧胆酸盐(AmBd),其通过在细胞膜中产生孔并通过氧化损伤诱导细胞死亡而发挥其杀真菌作用。与单独使用AmBd治疗相比,AmBd有时与5-氟胞嘧啶(5-FC)组合以提供组合疗法,可以改善患者的10周存活。这种组合仍然是推荐的“黄金标准”引导治疗,但由于AmBd具有显著的毒性并且其IV制剂需要复杂的电解质监测和静脉内导管(这阻止了在资源贫乏的环境中使用该药物),因此存在实质性挑战。
为了避免与AmBd和5-FC组合疗法相关的问题,考虑了氟康唑与5-FC的组合。氟康唑具有良好的口服生物利用度并且可以穿透脑脊液,这也使其成为初始治疗后的维持疗法的良好候选者。然而,氟康唑是一种抑制真菌的化合物(而不是杀真菌化合物),因此它在病原体清除方面效果较差,因此不推荐用于初始治疗。因此,仍然清楚且持续地需要提供可口服利用、有效并且可以降低成本提供的隐球菌病治疗。
概述
本发明人已意外地发现,脂质卷包封的两性霉素B(在本文中也称为AmB,其为可口服利用的并且具有低毒性)与口服施用的5-氟胞嘧啶组合在小鼠中清除隐球菌属方面与全身性施用两性霉素B脱氧胆酸盐和口服施用5-氟胞嘧啶一样有效。
此外,本发明人已经表明,将脂质卷包封的两性霉素B递送至隐球菌属感染发生最严重的脑部。因此,本发明组合物,其可方便地口服施用,具有开辟发展中世界的巨大地区的基于两性霉素的治疗剂的有效杀真菌活性来治疗隐球菌病的潜力。本文进一步描述了本发明的抗真菌脂质卷的这些和其他益处。
本公开涉及一种脂质卷组合物,包含:一种或多种脂质卷和治疗有效量的至少两种例如选自以下的抗真菌化合物:两性霉素B、5-氟胞嘧啶(也称作5-FC和氟胞嘧啶)、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑。在一些实施方案中,所述至少两种抗真菌化合物是两性霉素B和5-氟胞嘧啶。本文描述了另外的抗真菌化合物。
在一些实施方案中,将脂质卷配制用于粘膜施用,诸如口服施用或鼻内施用。在其他实施方式中,将脂质卷配制用于静脉内施用。在一些实施方式中,将脂质卷配制用于鞘内施用。
在一些实施方案中,将所述至少两种抗真菌化合物中的仅一种配制成脂质卷。在其他实施方式中,将至少两种抗真菌化合物配制成脂质卷。在一些实施方式中,将所述至少两种抗真菌化合物配制在相同的脂质卷内。在其他实施方案中,将所述至少两种抗真菌化合物各自配制在不同的脂质卷中。
在一些实施方案中,本文所述的一种或多种脂质卷是也如本文所述的晶洞脂质卷。
在一些实施方案中,本文所述的一种或多种脂质卷包含脂质组分,所述脂质组分包括大豆磷脂酰丝氨酸,其量为约30%至70%重量,更典型地40%至70重量%,更典型地40%至60%重量,更典型地45%至55%重量,更典型地45%至60%重量且最典型地45%至约55%重量。
本公开还涉及治疗或预防由于隐球菌属引起的感染的方法,所述方法包括:向有需要的受试者口服施用包含脂质卷的制剂,其中所述脂质卷包含两性霉素B。在一些实施方案中,每天施用所述制剂历时至少7天,至少14天,至少21天,或至少28天。在一些实施方案中,所述方法还包括向受试者施用5-氟胞嘧啶。在一些实施方案中,口服施用5-氟胞嘧啶。在一些实施方案中,每天施用5-氟胞嘧啶历时至少7天,至少14天,至少21天,或至少28天。
本公开还涉及治疗或预防由于隐球菌属引起的感染的方法,所述方法包括:向有需要的受试者施用包含脂质卷组合物的制剂,其中所述脂质卷组合物包含至少两种抗真菌化合物,其中所述至少两种抗真菌化合物选自两性霉素B、5-氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑,其中将所述至少两种抗真菌化合物中的至少一种配制成脂质卷。在一些实施方案中,所述至少两种抗真菌化合物是两性霉素B和5-氟胞嘧啶。本文描述了另外的抗真菌化合物。在一些实施方案中,将抗真菌化合物递送至脑。
在一些实施方案中,感染涉及皮肤、肺、前列腺和/或中枢神经系统。在一些实施方案中,感染是隐球菌性脑膜脑炎。在一些实施方案中,感染是隐球菌性脑膜炎。
在一些实施方案中,隐球菌属是新型隐球菌。在一些实施方案中,隐球菌属是加蒂隐球菌。
在一些实施方案中,施用是口服、鼻内、鞘内或静脉内施用。在一些实施方案中,口服施用所述脂质卷制剂并将抗真菌化合物递送至脑。
在一些实施方案中,受试者是人。在一些实施方案中,受试者患有HIV/AIDS、淋巴瘤、肝硬化或已接受器官移植。
本文还提供了治疗或预防由于隐球菌属引起的感染的方法,所述方法包括:向有需要的受试者施用包含脂质卷的制剂,其中所述脂质卷包含抗真菌化合物,其中所述抗真菌化合物选自5-氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑中的至少一种。本文描述了另外的抗真菌化合物。
在一些实施方案中,预防由于隐球菌属引起的感染包括预防感染复发。在一些实施方案中,预防由于隐球菌属引起的感染包括治疗哺乳动物或人,其中所述哺乳动物或人对隐球菌性物质抗原呈阳性(使用例如IMMY Inc. (Norman,OK)的隐球菌抗原试验)。
附图简述
结合在本说明书中并构成本说明书一部分的附图说明了某些实施方案,并与书面描述一起用于解释本文公开的组合物和方法的某些原理。
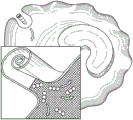
图1是脂质卷的示意图。插图描绘了脂质卷的脂质多层(strata),其包含磷脂双层(圆圈和尾部)、多价阳离子(无阴影圆圈)和保护在脂质卷内的示例性负载(cargo)部分(有阴影圆圈)。
图2描绘了吞噬脂质卷及其负载的巨噬细胞的示意图。插图描述了脂质卷的开口和负载在巨噬细胞内部的释放,如详细描述中所述。
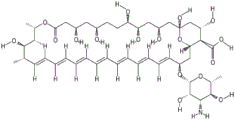
图3描绘了两性霉素B的结构图。
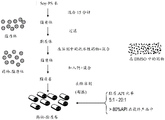
图4是制备两性霉素B-脂质卷(本文也称为CAMB)的方案的示意图。
图5描绘了如详细描述中所述的晶洞脂质卷的示例性制备。
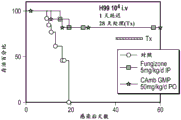
图6描绘了如实施例2中所述用CAMB或FUNGIZONE®处理的感染新型隐球菌小鼠的体内功效结果。
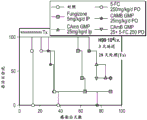
图7描绘了如实施例2中所述用CAMB、FUNGIZONE®和/或5-氟胞嘧啶处理的感染新型隐球菌小鼠的体内功效结果。
图8描绘了如实施例2中所述用CAMB、FUNGIZONE®、5-FC和/或氟康唑处理的感染新型隐球菌小鼠的体内功效结果。
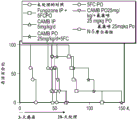
图9描绘了如实施例2中所述用CAMB、FUNGIZONE®、5-FC、氟康唑及其组合处理的小鼠观察到的每克脑组织的菌落形成单位(CFU)的数目。
图10描绘了研究设计,其用于证明如实施例3中所述在口服施用后脂质卷包封的两性霉素B局限于脑。
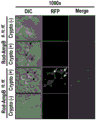
图11描绘了如实施例3中所述荧光标记的CAMB颗粒向感染新型隐球菌小鼠脑中的递送。
详细描述
现在将详细参考各种示例性实施方案,这些实施方案的实例在附图中示出并在随后的详细描述中讨论。应当理解的是,下面的详细描述为读者提供对本发明的某些实施方案、特征和各方面细节的更全面理解,并且不应该解释为限制本发明的范围。
隐球菌属和抗真菌化合物
本公开涉及一种脂质卷组合物,包含:一种或多种脂质卷和至少两种抗真菌化合物,所述抗真菌化合物有效对抗由隐球菌属引起的感染。如本文所用,术语“隐球菌属(Cryptococcus spp.)”是指属于隐球菌(Cryptococcus)属的真菌种,其是担子菌包封的酵母。这种感染例如可以通过确定受试者对隐球菌类抗原是否呈阳性来检测。用于进行这种测试的试剂盒可商购获得,例如,来自IMMY Inc.(Norman,OK)。
典型地,本公开的抗真菌脂质卷有效对抗新型隐球菌。新型隐球菌最初基于片状凝集反应分类为血清型A,B,C,D和AD。最近,新型隐球菌已分为两个变种:C. neoformansvar. grubii (以前的A类)和C. neoformans var. neoformans(以前的D类)。新型隐球菌是世界上大多数温带地区发现的普遍存在的病原体,但通常存在于腐烂的有机物和许多土壤类型中,特别是已经富集动物和鸟类粪便的土壤中。
在一些实施方案中,本公开的抗真菌脂质卷有效对抗加蒂隐球菌(以前的B和C类)。加蒂隐球菌可以分为四个分子类型,包括VGI、VGII、VGIII和VGIV。VGII型可以进一步分为VGIIa、VGIIb和VGIIc亚型。加蒂隐球菌可以通过将分离物铺板在刀豆氨酸-甘氨酸-溴百里酚(CGB)琼脂上来容易地分化。在这种生物体存在下,CGB琼脂变成蓝色。加蒂隐球菌通常发现于热带和亚热带地理区域。
在一些实施方案中,本公开的隐球菌属,诸如加蒂隐球菌或新型隐球菌,更典型地加蒂隐球菌,例如加蒂隐球菌的VGII谱系,诸如VGIIa,能够感染免疫活性受试者。如本文所用,免疫活性受试者是在暴露于抗原后能够产生正常免疫反应的受试者,通常是哺乳动物受试者诸如人受试者。然而,更典型地,本公开的隐球菌属能够感染免疫受损的受试者。免疫受损的受试者包括患有HIV/AIDS、淋巴瘤、肝硬化或者是器官移植受者的受试者,正在接受免疫抑制剂诸如糖皮质激素、细胞毒性化疗和/或TNF-α抑制剂的受试者(通常是哺乳动物受试者诸如人受试者)。
在一些实施方案中,隐球菌属可导致受试者的隐球菌性肺病。隐球菌性肺病的症状从无症状呼吸道定植到急性呼吸窘迫综合征。患有肺隐球菌病的受试者可能出现轻度至中度症状,包括发烧、不适、咳嗽痰少和/或胸膜疼痛。在一些实施方案中,患有肺隐球菌病的受试者可能出现肺炎。在一些实施方案中,肺病可在不存在肺外疾病的情况下发生。
在一些实施方案中,隐球菌属可以从肺部浸染以感染受试者的皮肤、前列腺、骨髓腔和/或中枢神经系统(CNS)。典型地,隐球菌属感染CNS。在一些实施方案中,隐球菌属导致CNS隐球菌病,诸如脑膜炎和/或脑膜脑炎。如果没有适当的治疗,这些感染形式总是致命的;症状出现后2周至数年可能发生死亡。隐球菌性脑膜炎和脑膜脑炎的最常见症状是头痛和精神状态改变,包括性格改变、精神错乱、嗜睡和昏迷。
本公开的所述一种或多种脂质卷与一种或多种抗真菌化合物结合或加载有一种或多种抗真菌化合物,诸如至少两种抗真菌化合物,诸如至少三种抗真菌化合物或诸如至少四种抗真菌化合物。在一些实施方案中,所述一种或多种抗真菌化合物是杀真菌化合物,诸如两性霉素B或抑制真菌化合物,诸如氟康唑和/或5-氟胞嘧啶。如本文所用,“杀真菌”化合物是杀死真菌而不是简单地防止其生长的抗真菌化合物。相比之下,如本文所用的“抑制真菌”化合物是防止真菌生长、但不杀死真菌的抗真菌化合物。
典型地,本公开的脂质卷与一种或多种多烯、唑和/或嘧啶类似物结合或加载有一种或多种多烯、唑和/或嘧啶类似物。典型地,多烯是两性霉素B。在一些实施方案中,唑是氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑。更典型地,唑是氟康唑。典型地,嘧啶类似物是5-氟胞嘧啶。
在一些实施方案中,考虑其他抗真菌化合物用于配制成本发明的脂质卷组合物。这样的其他抗真菌化合物包括能够抑制细胞壁组分合成的那些,诸如糖基磷脂酰肌醇(GPI)-锚接的甘露糖蛋白,例如E1210,一种口服活性分子,其具有抗隐球菌属的体外活性。在其他实施方案中,抗真菌化合物是麦角甾醇合成抑制剂,诸如VT-1129,其可口服利用,显示出良好的CNS渗透并且在感染隐球菌属的小鼠模型中是杀真菌的。
在其他实施方案中,抗真菌化合物是口服利用的化合物,已知其与氟康唑对隐球菌属表现出加和或协同活性。这样的抗真菌化合物包括胺碘达隆(心脏抗心律失常药物)、吩噻嗪(抗精神病药)和他莫昔芬(雌激素拮抗剂)。
在一些实施方案中,本发明的脂质卷组合物的所述至少两种抗真菌化合物中的每一种在单独的脂质卷中。在其他实施方案中,所述至少两种抗真菌化合物中的每一种在相同的脂质卷中。然而,更典型地,所述至少两种抗真菌化合物中的仅一种是脂质卷包封的。甚至更典型地,所述脂质卷包封的抗真菌化合物是多烯,诸如两性霉素B,第二、第三或第更多种抗真菌化合物是未经脂质卷包封的。
在典型的实施方案中,本发明的脂质卷组合物包含脂质卷包封的两性霉素B和未经脂质卷包封的唑和/或未经脂质卷包封的嘧啶类似物。典型地,未经脂质卷包封的唑是氟康唑,未经脂质卷包封的嘧啶类似物是5-氟胞嘧啶。甚至更典型地,本发明的脂质卷组合物包含脂质卷包封的两性霉素B和未经脂质卷包封的5-氟胞嘧啶。
在一些实施方案中,将本发明的脂质卷组合物配制用于粘膜施用,典型地是口服和/或鼻内施用,更典型地是口服施用。然而,也考虑配制所述脂质卷组合物用于静脉内、皮下、腹膜内和鞘内施用。
脂质卷及其制备方法
脂质卷是无水、稳定、多层的脂质晶体,其在带负电荷的脂质(诸如磷脂酰丝氨酸)和二价阳离子(诸如钙)的相互作用后自发形成(参见,例如,美国专利号4,078,052;5,643,574;5,840,707;5,994,318;6,153,217;6,592,894,以及PCT公开号WO 2004/091572;WO2004/091578;WO 2005/110361,WO 2012/151517和WO2014/022414,美国专利公开号2014/220108和专利公开号2010/0178325;其中每个在此通过全文引用并入本文)。典型地,这些称为晶体脂质卷。
晶体脂质卷具有独特的多层结构,该结构由以螺旋卷起的或作为堆叠片的大的、连续的、固体磷脂双层片或多层组成,没有内部含水空间(图1)。这种独特的结构为缔合的“脂质卷包封的”分子提供保护以防止降解。由于整个脂质卷结构是一系列固体层,因此脂质卷结构内部的组分保持完好无损,即使脂质卷的外层可能暴露于苛刻的环境条件或酶。血清和粘膜分泌物中的体内二价阳离子浓度使得脂质卷结构得到保持。因此,大多数脂质卷缔合的分子存在于固态、稳定的、不可渗透结构的内层中。然而,一旦在细胞的内部中,低钙浓度导致脂质卷晶体打开并释放已经配制到脂质卷中的分子(图2)。因此,脂质卷制剂在生理流体(包括粘膜分泌物、血浆和胃肠液)中保持完好无损,由此通过许多施用途径(包括粘膜例如口服和鼻内施用)介导生物活性化合物的递送。
典型的脂质卷结构包含脂质多层,所述脂质多层包含交替的二价阳离子和磷脂双层,所述磷脂双层包括至少一种带负电荷的磷脂。典型地,负载部分(诸如抗真菌剂,例如两性霉素B)(图3)被隔离在脂质卷的脂质多层内。
可以使用已知方法制备脂质卷。在一个典型的实施方式中,美国专利公开号2014/220108中描述的方法用于制备本公开的脂质卷,其通过引用整体并入本文。该过程的概述示于图4。在该方法中,将疏水性抗真菌化合物(诸如两性霉素B)溶解在溶剂(例如,二甲基亚砜)中并通过例如0.22μm过滤器过滤,并与例如在200毫升无菌水中的2000毫克50%大豆磷脂酰丝氨酸(PS)脂质体组合(PS脂质体首先通过例如5、0.8和0.45μm过滤器过滤)以形成包含抗真菌剂诸如AmB的脂质体。可向所得混合物中加入阳离子诸如多价或二价阳离子。多价或二价阳离子的添加导致脂质体的坍塌,并形成阳离子螯合的磷脂双层片,其卷起或堆叠以形成包含抗真菌剂诸如AmB的脂质卷。含抗真菌剂的脂质卷诸如含AmB的脂质卷可以在冻干下干燥。可以将无菌水加入干燥的粉末状抗真菌脂质卷中以制备悬浮液。悬浮液可以在4℃下避光储存。
制备包含抗真菌剂的脂质卷的其他方法包括捕集-高pH (trapping-high pH)方法、捕集-膜(trapping-film)方法和水凝胶方法。在捕集-高pH方法中,脂质粉末和抗真菌化合物(例如AmB)在例如无菌聚丙烯管中以例如10:1的脂质/抗真菌剂摩尔比混合。加入缓冲液,例如TES [N-三(羟甲基)-甲基-2-氨基甲磺酸](pH7.4)。涡旋后形成多层脂质体。然后通过添加例如1N NaOH将pH增加至例如11.5,以溶解抗真菌化合物例如AmB。可以通过使用相对照和偏振光学显微镜来监测AmB晶体的缺乏和脂质体的存在。将多价或二价阳离子(诸如氯化钙)以例如2:1的脂质/阳离子摩尔比缓慢加入抗真菌脂质体悬浮液中,以形成脂质卷。然后可以将外部pH调节至pH 7。
在捕集膜方法中,将抗真菌化合物(例如AmB)溶解在溶剂(例如甲醇)中,同时进行短暂声处理,并将溶液加入到氯仿中的脂质中。抗真菌剂例如AmB易溶于氯仿/甲醇混合物中。然后可以使用旋转蒸发器将混合物干燥成膜,并在例如35℃-40℃、减压(1巴)下温和加热。然后可以用去离子水使干燥的脂质膜水合并且声处理。抗真菌-脂质体大小应为约50纳米。为了形成脂质卷,将多价或二价阳离子溶液(例如溶液中的氯化钙)缓慢加入到脂质体悬浮液中以形成脂质卷。
为了使用水凝胶方法制备抗真菌脂质卷,将抗真菌化合物诸如AmB溶解在甲醇中,并加入到氯仿中的脂质中,例如以10:1的摩尔比,然后使用旋转蒸发器将混合物干燥成药物-脂质膜。然后可以用去离子水使膜水合,并且将该药物-脂质悬浮液声处理,直到获得包含抗真菌化合物的小脂质体。然后可以将抗真菌剂-脂质体悬浮液与例如40%w/w的葡聚糖-500,000在例如2/1 v/v葡聚糖/脂质体的悬浮液中混合。然后在磁力搅拌(800-1000rpm)下使用注射器将该混合物注入例如15% w/w PEG-8000中。获得分散在PEG连续相中的抗真菌脂质体/葡聚糖液滴的水-水乳液。然后将多价或二价阳离子溶液(例如在溶液中的氯化钙)加入到乳液中。继续搅拌以允许缓慢形成小尺寸的抗真菌脂质卷,其被隔离在葡聚糖液滴中。然后通过加入包含例如1 mM CaCl2和150 mM NaCl的洗涤缓冲液洗涤聚合物。
如普通技术人员所知晓,许多参数,包括pH、盐浓度、搅拌方法和速率、阳离子类型、浓度和添加速率、脂质组成、浓度以及脂质与其他材料的比率等影响制剂,并且可以对此进行改变以优化特定材料的脂质卷包封。
在一些实施方案中,亲水性抗真菌化合物诸如5-FC或包含亲水性结构域的抗真菌化合物诸如氟康唑也可以配制成脂质卷。将这些化合物结合到脂质卷中的方法是本领域熟知的,并且描述于例如美国专利公开号2014/220108中。不希望束缚于任何特定理论,据信,亲水性分子或具有亲水结构域的大分子诸如感兴趣的活性药物成分(API)(包括本公开的抗真菌化合物)可以以增强的方式通过将API与起到“筏”作用的脂质结构域缔合配制成脂质卷,并且其保持完整并包埋在脂质卷晶体基质内。这样的脂质包括本领域已知并在本文中所述的“中性脂质”。
在一个典型的实施方式中,可用于将脂质体塌缩成脂质卷的本文所述的多价阳离子是二价金属阳离子,诸如钙、锌、镁和钡。在一个更典型的实施方式中,二价金属阳离子是钙。
在一些实施方式中,抗真菌剂与脂质的比率(wt/wt)为1:1至1:50,或其间的任何范围,诸如1:2、1:3、1:4、1:6、1:8、1:10、1:12、1:15、1:20和1:25,典型地为1:1至1-1:20,诸如1:2.5至1:10,典型地为1:10。
在形成脂质卷期间使用的脂质体可以是多层(MLV)或单层(ULV)的,包括小单层囊泡(SUV)。这些脂质体溶液中的脂质浓度可为约0.1mg/ml至500mg/ml。典型地,脂质浓度为约0.5mg/ml至约50mg/ml,更典型地为约1mg/ml至约25mg/ml。
可以在制备脂质卷的方法中引入尺寸调节剂。如本文所用,尺寸调节剂是指降低脂质卷的粒度的试剂。如本文所用,术语“粒度”是指颗粒直径,或者在颗粒不是球形的情况下,是指在颗粒的一个方向上的最大延伸。可以使用常规方法测量脂质卷的粒度,诸如亚微米粒度分析仪。在某些实施方案中,尺寸调节剂是脂质的锚定多核苷酸、脂质锚定的糖(糖脂)或脂质锚定多肽。在其他实施方案中,尺寸调节剂是胆汁盐,例如氧胆酸盐(oxycholate)、胆酸盐、鹅脱氧胆酸盐、牛磺胆酸盐、甘氨胆酸盐、牛磺鹅脱氧胆酸盐、甘氨鹅脱氧胆酸盐、脱氧胆酸盐或石胆酸盐。胆汁盐是与阳离子(通常为钠)化合的胆汁酸。胆汁酸是主要存在于哺乳动物胆汁中的类固醇酸,可商购获得。
在某些实施方案中,在形成沉淀的脂质卷之前,将尺寸调节剂加入脂质或脂质体中。例如,在一个实施方案中,将尺寸调节剂引入脂质体悬浮液中,随后将由该悬浮液形成脂质卷(例如,通过添加阳离子或渗析)。或者,可以在添加药理活性剂之前或之后将尺寸调节剂引入脂质溶液中。
在一些实施方案中,本发明的脂质卷可任选地包含一种或多种聚集抑制剂。如本文所用,术语“聚集抑制剂”是指抑制脂质卷聚集的试剂。聚集抑制剂通常至少存在于脂质卷表面上,并且可以仅存在于脂质卷表面上(例如,当脂质卷形成后引入聚集抑制剂时)。可以在脂质卷形成之前、之后或期间添加聚集抑制剂。本领域普通技术人员仅仅通过常规实验即能够容易地确定形成所需尺寸的脂质卷所需的聚集抑制剂的量。
根据本公开可以使用的合适的聚集抑制剂包括但不限于下列中的至少一种:酪蛋白、κ-酪蛋白、乳、白蛋白、血清白蛋白、牛血清白蛋白、兔血清白蛋白、甲基纤维素、乙基纤维素、丙基纤维素、羟基纤维素、羟甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、羧甲基纤维素、羧乙基纤维素、支链淀粉、聚乙烯醇、海藻酸钠、聚乙二醇、聚环氧乙烷、黄原胶、黄蓍胶、瓜尔胶、金合欢胶、阿拉伯树胶、聚丙烯酸、甲基丙烯酸甲酯共聚物、羧基聚合物、直链淀粉、高直链淀粉、羟丙基化高直链淀粉、糊精、果胶、甲壳素、壳聚糖、果聚糖、爱生兰(elsinan)、胶原蛋白、明胶、玉米醇溶蛋白、谷蛋白、角叉菜胶、巴西棕榈蜡、虫胶、乳胶聚合物、乳蛋白分离物、大豆蛋白分离物、乳清蛋白分离物及其混合物。
任何合适的脂质可用于制备脂质卷。在一个实施方案中,脂质包括一种或多种带负电荷的脂质。如本文所用,术语“带负电荷的脂质”包括在酸性、碱性或生理pH下在水溶液中具有带形式负电荷的头基的脂质,并且还包括具有两性离子头基的脂质。在一个实施方案中,带负电荷的脂质是磷脂。
脂质卷还可以包括不带负电荷的脂质(例如,带正电荷和/或中性的脂质)。典型地,脂质卷包含显著量的带负电荷的脂质。在某些实施方案中,大多数脂质带负电荷。在一个实施方案中,脂质是脂质的混合物,其包含至少50%的带负电荷的脂质,诸如磷脂。在另一个实施方案中,脂质包括至少75%的带负电荷的脂质,诸如磷脂。在其他实施方案中,脂质包括至少85%、90%、95%或98%的带负电荷的脂质,诸如磷脂。在其他实施方案中,带负电荷的脂质(例如,磷脂)占脂质卷中总脂质的30%至70%,35%至70%,40%至70%,45%至65%,45%至70%,40%至60%,50%至60%,45%至55%,45%至65%或45%至50%。在某些实施方案中,带负电荷的脂质(例如,磷脂)占脂质卷中总脂质的40%至60%或45%至55%。在一些实施方案中,带负电荷的脂质(例如,磷脂)占脂质卷的非疏水结构域组分中的总脂质的30%至70%,35%至70%,40%至70%,45%至65%,45%至70%,40%至60%,50%至60%,45%至55%,45%至65%或45%至50%。在某些实施方案中,带负电荷的脂质(例如,磷脂)占脂质卷的非疏水结构域组分中的总脂质的40%至60%或45%至55%。在一些实施方案中,带负电荷的脂质是磷脂并且占脂质卷中或脂质卷的非疏水结构域组分中的总磷脂的30%至70%,35%至70%,40%至70%,45%至65%,45%至70%,40%至60%,50%至60%,45%至55%,45%至65%或45%至50%。在一些实施方案中,带负电荷的脂质是磷脂并且占脂质卷中或脂质卷的非疏水结构域组分中的总磷脂的40%至60%或45%至55%。
带负电荷的脂质可以包括基于蛋的脂质、基于牛的脂质、基于猪的脂质、基于植物的脂质或衍生自其他来源的类似脂质,包括合成产生的脂质。带负电荷的脂质可包括磷脂酰丝氨酸(PS)、二油酰磷脂酰丝氨酸(DOPS)、磷脂酸(PA)、磷脂酰肌醇(PI)和/或磷脂酰甘油(PG)和/或这些脂质中的一种或多种与其他脂质的混合物。另外地或另选地,脂质可包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、二磷脂酰甘油(DPG)、二油酰磷脂酸(DOPA)、二硬脂酰磷脂酰丝氨酸(DSPS)、二肉豆蔻酰磷脂酰丝氨酸(DMPS)、二棕榈酰磷脂酰甘油(DPPG)等。在另一个实施方案中,磷脂酰丝氨酸是衍生自卵或牛的磷脂酰丝氨酸。
包含大豆脂质的脂质卷
在一些典型的实施方案中,脂质卷(包括晶洞脂质卷,如下文所述)使用基于豆类的磷脂、更典型地基于大豆的脂质制备。这种基于大豆的脂质可以是天然的或合成的。甚至更典型地,基于大豆的脂质是大豆磷脂,诸如大豆磷脂酰丝氨酸的量为脂质卷的脂质组分重量的40%至74%。或者,大豆磷脂酰丝氨酸可以是脂质卷的脂质组分重量的约40%、45%、50%、55%、60%、65%或70%或其任何增量值。应理解,本公开旨在涵盖这些值和范围之间的所有值和范围。在一个典型的实施方案中,磷脂包含45-70%的大豆磷脂酰丝氨酸。在一个更典型的实施方案中,磷脂包含45-55%的大豆磷脂酰丝氨酸。
大豆磷脂酰丝氨酸是可商购的,例如,来自Avanti Polar Lipids, Inc.Alabaster, AL。或者,根据众所周知的标准纯化技术,可以从大豆磷脂组合物中纯化大豆磷脂酰丝氨酸,所述大豆磷脂组合物是数种大豆磷脂的混合物。
在一些实施方案中,中性脂质与大豆磷脂酰丝氨酸组合使用以制备本发明的脂质卷。如本文所用,术语“中性脂质”包括许多脂质物质中的任何一种,其在生理pH下以不带电或中性两性离子形式存在,并因此包括在无阴离子功能的脂质类型中。这样的脂质包括例如二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂和脑苷脂。用于本文所述的脂质卷组合物中的中性脂质的选择通常通过考虑例如脂质卷大小和稳定性来指导。具有不同链长和饱和度的各种酰基链基团的脂质是可获得的,或者可以通过众所周知的技术分离或合成。在一组实施方案中,可以使用包含碳链长度在C14至C22范围内的饱和脂肪酸的脂质。在另一组实施方案中,可以使用具有碳链长度在C14至C22范围内的单或二-不饱和脂肪酸的脂质。在另一组实施方案中,可以使用具有碳链长度在C8至C12范围内的单或二-不饱和脂肪酸的脂质。另外,可以使用具有饱和和不饱和脂肪酸链的混合物的脂质。
在一些实施方案中,在本公开中使用的中性脂质是DOPE、DSPC、DPPC、POPC,或者任何相关的磷脂酰胆碱。可用于本公开的中性脂质也可以由鞘磷脂、二氢鞘磷脂或具有其他头基诸如丝氨酸和肌醇的磷脂构成。
在一个典型的实施方式中,使用99.9%纯的二油酰磷脂酰丝氨酸、99.9%纯的大豆磷脂酰丝氨酸、75%的大豆磷脂酰丝氨酸和50%的大豆磷脂酰丝氨酸来制造脂质卷。通常通过添加中性脂质来改性99.9%纯的磷脂酰丝氨酸的脂质组合物,所述中性脂质包括但不限于鞘磷脂和/或磷脂酰胆碱。当使用较低纯度的磷脂酰丝氨酸(例如,50%大豆磷脂酰丝氨酸)作为起始材料时,可以对较低纯度的磷脂酰丝氨酸进行提取步骤以除去不需要的杂质诸如核酸酶。
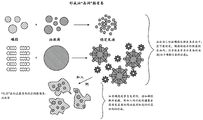
晶洞脂质卷
在一些实施方式中,本公开的脂质卷是晶洞脂质卷或晶洞状物(geodate),如例如美国专利公开2013/0224284中所描述,其全部公开内容通过引用并入本文。晶洞脂质卷进一步包含含有带负电荷的磷脂的脂质单层,其中脂质单层包围疏水结构域(诸如油)和分散在疏水结构域内的负载部分(诸如本文所述的抗真菌化合物)。脂质单层隔离在晶洞脂质卷的脂质多层内。
如本文所使用,“疏水结构域”是在性质上有足够的疏水性以允许围绕其周边形成脂质单层的组合物。疏水结构域通常包括与负载部分(诸如本公开的抗真菌化合物,诸如AmB)缔合的疏水性组合物(诸如油或脂肪)。在某些实施方案中,疏水结构域(HD)与晶洞脂质卷的磷脂组分(PPLGD)之间的比率HD:PPLGD或蓖麻油结构域(COD)与晶洞脂质卷的磷脂组分(PPLGD)之间的比率COD:PPLGD是1:20或更少,1:15或更少,1:10或更少,1:8或更少,1:6或更少,1:5或更少,1:4或更少,1:3.5或更少,1:3或更少,1:2.75或更少,1:2.5或更少,1:2.25或更少,1:2或更少,1:1.75或更少,1:1.5或更少,1:1.25或更少,1:1或更少。
图5示出了可以如何制造晶洞脂质卷的示例性示意图。在该示例性方法中,将磷脂(表示为开环)与疏水结构域(带阴影圆圈)(诸如油)组合,并混合以形成包含脂质体和围绕疏水结构域的脂质单层的稳定乳液。负载部分(诸如抗真菌化合物等)可以分散在疏水结构域内。疏水结构域将磷脂包埋在其表面中。不旨在受任何理论的束缚,据信磷脂的疏水酰基链在疏水结构域内,导致疏水结构域具有亲水表面(由于磷脂头基的涂覆)并形成稳定的乳液。如果磷脂是带负电荷的,诸如磷脂酰丝氨酸,则加入二价阳离子诸如钙会引起包含交替的二价阳离子和磷脂双层的结晶结构(或脂质多层)的形成。脂质多层用阴影表示。在晶洞脂质卷中,围绕疏水结构域的脂质单层被“包壳”或“包埋”在结晶基质内,类似于“晶洞”。
药物组合物
可将如本文所述的脂质卷组合物作为药物组合物制备。用于本文所公开的药物组合物的合适的制剂形式包括例如片剂、胶囊剂、软胶囊剂、颗粒剂、散剂、混悬剂、乳剂、微乳剂、纳米乳剂、单位剂型、环、膜、栓剂、溶液剂、乳膏剂、糖浆剂、透皮贴剂、软膏剂和凝胶剂。然而,典型地,脂质卷制备用于粘膜(例如口服或鼻内,典型地是口服)施用。
药物组合物可包括其他药学上可接受的赋形剂,诸如各种pH和离子强度的缓冲剂(例如Tris-HCl、乙酸盐、磷酸盐);添加剂,诸如白蛋白或明胶,以防止吸附于表面;蛋白酶抑制剂;渗透促进剂;增溶剂(例如甘油、聚乙烯甘油(polyethylene glycerol));抗氧化剂(例如抗坏血酸、焦亚硫酸钠、丁基化羟基苯甲醚);稳定剂(例如羟丙基纤维素、羟丙基甲基纤维素);增粘剂(例如卡波姆、胶体二氧化硅、乙基纤维素、瓜尔胶);甜味剂(例如阿斯巴特、柠檬酸);防腐剂(例如硫柳汞、苄醇、对羟基苯甲酸酯类);流动助剂(例如胶体二氧化硅)、增塑剂(例如邻苯二甲酸二乙酯、柠檬酸三乙酯);乳化剂(例如卡波姆、羟丙基纤维素、月桂基硫酸钠);聚合物包衣(例如泊洛沙姆或泊洛沙胺、乙酸琥珀酸羟丙甲纤维素);包衣和成膜剂(例如乙基纤维素、丙烯酸酯、聚甲基丙烯酸酯、乙酸琥珀酸羟丙甲纤维素);佐剂;用于液体制剂的药学上可接受的载体,诸如水性(水、醇性/水性溶液、乳液或混悬液,包括盐水和缓冲介质)或非水性(例如丙二醇、聚乙二醇和可注射有机酯例如油酸乙酯)溶液、混悬液、乳液或油;以及胃肠外溶媒(用于皮下、静脉内、动脉内、鞘内或肌内注射),包括但不限于氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸化林格氏液和非挥发性油。
在某些实施方案中,药物组合物包含盐,诸如NaCl或胆汁盐,诸如氧胆酸盐、胆酸盐、鹅脱氧胆酸盐、牛磺胆酸盐、甘氨胆酸盐、牛磺鹅脱氧胆酸盐、甘氨鹅脱氧胆酸盐、脱氧胆酸盐或石胆酸盐。胆汁盐是与阳离子(通常为钠)化合的胆汁酸。胆汁酸是主要存在于哺乳动物胆汁中的类固醇酸,可商购获得。在一个实施方案中,胆汁盐包括胆酸盐。在另一个实施方案中,胆汁盐包括脱氧胆酸盐。在另一个实施方案中,胆汁盐包括胆酸盐和脱氧胆酸盐。在另一个实施方案中,胆汁盐由胆酸盐和脱氧胆酸盐组成。
在某些实施方案中,NaCl的浓度是1 mM至1M、1mM至0.5M、1mM至0.1M、1mM至50mM、10mM至100mM、10mM至50mM、0.1M至1M、0.1M至0.5M或0.5M至1M。在某些实施方案中,胆汁盐的浓度是1mM至100mM、1mM至50mM、1mM至25mM、1mM至10mM、1mM至5mM、0.1mM至5mM、0.1mM至1mM或0.1mM至0.5mM胆汁盐。
通过实例提供这些赋形剂,且本领域技术人员将知晓存在可提供与本文所列举的那些相同的化学特征的其他或不同的赋形剂。
剂量和施用
将如本文所公开的包含脂质卷组合物的药物组合物配制为与其预期的施用途径相容。实现该施用的方法对于本领域普通技术人员是已知的。这包括例如通过胃肠外途径(诸如鞘内、静脉内、血管内、动脉内、皮下、肌内、腹膜内、心室内、硬膜内或其他)注射以及经口、经鼻、经眼、经直肠或局部施用。典型地,鼻内施用脂质卷,例如通过施用悬浮液,或口服施用,例如通过施用悬浮液、片剂、胶囊、软凝胶或其他口服剂型。
在某些实施方案中,抗真菌剂(例如,脂质卷包封的两性霉素B、未经脂质卷包封的5-FC和/或未经脂质卷包封的氟康唑)以0.1-20 mg/kg, 5-10 mg/kg, 5-15 mg/kg, 10-15mg/kg, 10-13 mg/kg, 10-20 mg/kg, 5-25 mg/kg, 1-30 mg/kg之间或2.5 mg/kg的剂量施用。例如,脂质卷包封的两性霉素B可以0.1mg/kg至10mg/kg,诸如1mg/kg的量施用。或者,可以下列固定剂量施用抗真菌剂:约200-1000 mg/天、400-1000 mg/天、200-800 mg/天、300-800 mg/天、400-800 mg/天、500-700 mg/天、200-2000 mg/天、100-4000 mg/天、100-600 mg/天、200-600 mg/天、400-600 mg/天或300-700 mg/天,包括但不限于约400、500、600、700、800、900、1000、1500、2000、2500、3000、3500或4000mg。例如,脂质卷包封的两性霉素B可以0.1mg/kg/天至4mg/kg/天,诸如0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、2、3、4 mg/kg/天的量施用两周。由于较低的毒性,可更频繁地施用脂质卷包封的抗真菌剂或持续比静脉内施用的抗真菌剂更长的时间。在某些实施方案中,可每天一次、每天两次、每天三次或每天四次施用脂质卷包封的抗真菌剂。在另一个实施方案中,每周一次、每周两次、每周三次或每周四次施用脂质卷包封的制剂。在一个实施方案中,可每周施用脂质卷包封的抗真菌剂2-3次。在其他实施方案中,每天施用脂质卷制剂,历时至少1、2、3、4、5、6、7、8、9、10、11或12周。在另一个实施方案中,每天施用脂质卷制剂,历时至少3个月、至少4个月,或至少6个月。典型地,施用脂质卷组合物历时两周。
治疗方法
本发明的一个方面涉及一种治疗或预防由于隐球菌属引起的受试者的感染的方法,所述方法包括:向有此需要的受试者施用包含脂质卷组合物的制剂,其中所述脂质卷组合物包含至少两种抗真菌化合物,其中所述至少两种抗真菌化合物选自两性霉素B、5-氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑,其中所述至少两种抗真菌化合物中的至少一种配制成脂质卷。
在本发明方法中所用的脂质卷可使用脂质和如本文所述的方法来制备。在一些实施方案中,将所述至少两种抗真菌化合物配制在相同的脂质卷中。在其他实施方案中,将所述至少两种抗真菌化合物配制在不同的脂质卷中。典型地,所述至少两种抗真菌化合物是两性霉素B和5-氟胞嘧啶,并且两性霉素B配制成脂质卷。
在一些实施方案中,感染涉及皮肤、肺、前列腺、骨和/或中枢神经系统(CNS)。典型地,感染涉及CNS,诸如脑膜。在一些实施方案中,感染是隐球菌性脑膜脑炎或隐球菌性脑膜炎。在一些实施方案中,由隐球菌属引起的感染是由Cryptococcus neoformans引起的。在其他实施方案中,感染是由加蒂隐球菌引起的。
施用可以是口服、鼻内、鞘内或静脉内施用。然而,最典型的是,施用是口服施用。在一些实施方案中,每天施用脂质卷组合物历时至少7天,至少14天,至少21天,或至少28天。
在一些实施方案中,将脂质卷组合物的抗真菌化合物递送至脑。在一些实施方案中,在口服施用后将脂质卷组合物的抗真菌化合物递送至脑。在一些实施方案中,本公开的脂质卷组合物具有将真菌菌落形成单位(CFU)减少至少5%,诸如至少8%的能力。更优选地,AmB脂质卷可以将脑中的CFU减少例如至少10%,诸如至少25%,甚至更优选地50%、75%、85%、95%、96%、97%、98%、99%、99.5%、99.9%或100%。落在这些范围和值之间的所有单个值和范围都在本发明的范围内。菌落形成单位的减少可以是体内或体外的。
本文所用的术语“受试者”是指任何动物,包括但不限于人、小鼠、大鼠、兔、非人灵长类动物或任何其他哺乳动物。在一个实施方案中,受试者是灵长类动物。在另一个实施方案中,受试者是人。
在一些实施方案中,受试者是免疫受损的受试者。例如,受试者可能患有HIV/AIDS、淋巴瘤、肝硬化或受试者可能已接受器官移植。在其他实施方案中,受试者是免疫活性个体。
本公开还提供了一种治疗或预防由于隐球菌属引起的感染的方法,如本文所述,所述方法包括:向有此需要的受试者施用包含脂质卷的制剂,如本文所述,其中所述脂质卷包含抗真菌化合物,其中所述抗真菌化合物选自5-氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和/或伏立康唑中的至少一种。
其他考虑的用于本发明方法的抗真菌化合物包括能够抑制细胞壁组分合成的那些,诸如糖基磷脂酰肌醇(GPI)-锚定甘露糖蛋白,例如E1210。在其他实施方案中,用于该方法的抗真菌化合物是麦角甾醇合成抑制剂,诸如VT-1129,其口服可用,显示出良好的CNS渗透并且在感染隐球菌属的小鼠模型中是杀真菌的。
在其他实施方案中,抗真菌化合物是口服可用的化合物,已知其与氟康唑对隐球菌属具有加和或协同活性。这样的抗真菌化合物包括胺碘达隆(心脏抗心律失常药物)、吩噻嗪(抗精神病药)和他莫昔芬(雌激素拮抗剂)。
如本文使用,“预防”由于隐球菌属引起的感染包括防止感染复发。在用于防止感染复发的一些实施方案中,本发明的脂质卷组合物不含AmB。在一些实施方案中,预防由于隐球菌属引起的感染包括治疗对隐球菌属抗原呈阳性的哺乳动物或人(使用例如IMMYInc.(Norman,OK)隐球菌抗原试验)。
毒性
与胃肠外施用未经脂质卷包封的抗真菌剂相比,口服给予脂质卷包封的抗真菌剂诸如AmB显示出降低的毒性。由于与其使用相关的潜在的例如肾毒性,用胃肠外、未经脂质卷包封的抗真菌剂诸如AmB治疗的受试者必须处于紧密的临床观察下。
施用作为脂质卷制剂的一部分的抗真菌剂诸如AmB,降低了与该抗真菌剂相关的毒性并允许施用较高剂量的AmB。脂质卷包封的抗真菌剂如两性霉素B的较低毒性允许在较低剂量下以改善的功效和降低的毒性口服递送这样的抗真菌剂。或者,由于较低的毒性,包封的抗真菌剂可以更频繁地施用和/或以更高的剂量施用,而不良后果的风险更少。
实施例
实施例1. 材料和方法
抗真菌剂
对脂质卷包封的两性霉素B(CAMB)(单独或与5-氟胞嘧啶或氟康唑组合)的制剂和施用途径进行评价并与FUNGIZONE®进行比较以评估哪个处理对清除小鼠中的新型隐球菌最有效,通过隐球菌接种后的存活来测定。评价的制剂、剂量和施用途径描述于下表1-3中。
CAMB使用良好生产规范(GMP)如美国公开号2014/0220108和图4所述制备。评估了另外的CAMB制剂,这些制剂也根据GMP制造,包括在脂质体形成后进行声波处理以进一步减少如上所述的脂质卷大小的那些,以及在脂质卷制备期间被修饰以包括聚集抑制剂(牛血清白蛋白或淡奶油和牛奶)或大小选择剂(例如,脱氧胆酸盐)的制剂。其他评估的CAMB GMP制剂包括使用2.5:1而不是10:1的脂质与两性霉素B比率制备的包含脂质卷的那些。参见表2和表3。
5-氟胞嘧啶(5-FC),C4H4FN3O,(Sigma Aldrich, Inc. St. Louis, MO)和FUNGIZONE®(两性霉素B去氧胆酸盐,由National Institutes of Health Department ofVeterinary Resources, Bethesda, MD提供)根据制造商的说明书重构并在无菌水中稀释。在研究期间,FUNGIZONE®每周用新的重构小瓶更换并在每次使用后冷藏。氟康唑(99%),C13H12F2N6O, 得自Alfa Aesar, Thermo-Fisher Scientific, Inc., Ward Hill,MA。
传染性菌株和培养条件
将小鼠用C. neoformans, 菌株H99/ATCC 208821, (American Type CultureCollection, Rockville, MD)接种,制备如下。将来自新型隐球菌悬浮液的细胞划线到酵母提取粉胨葡萄糖(YPD)琼脂板上,然后将其在37℃下温育48小时。将分离良好的菌落重新悬浮于包含氯霉素的25毫升YPD肉汤中,并在振荡培养箱上的烧瓶中于37℃下温育过夜。通过以4,000rpm离心5分钟回收细胞,并通过重悬浮和离心在磷酸盐缓冲盐水(PBS)中洗涤两次。通过血细胞计数法定量挑战生物体,并用PBS稀释至终浓度为105个生物体/毫升。通过连续稀释新型隐球菌悬浮液并将接种物铺板在YPD琼脂板上来确认活菌数。
新型隐球菌感染通过在记录初始体重之后经由侧尾静脉注射在0.1毫升PBS中的104个H99细胞来诱导。产生全身感染,在14至24天内导致未治疗的对照组完全死亡。在整个实验中使用雌性Hsd:ND4 Swiss Webster Outbred小鼠(年龄:9至10周;体重:20至29克)(Harlan Laboratories, Frederick, MD (Now Envigo, Inc.)。小鼠已允许在感染前适应环境一周并保持在微隔离笼中。
进行了三个不同的处理试验。在第一个试验中,通过口服管饲法(PO)用50毫克/千克/天(mg/kg/天)的CAMB或通过腹膜内(IP)注射用5 mg/kg/天的FUNGIZONE®处理感染小鼠(表1)。每个处理组使用5只小鼠。在感染后24小时开始药剂施用,并且在测量体重后每天继续一次,连续历时28天。5只感染的未处理小鼠组用作对照。
在第二个试验中,感染的小鼠通过PO、IP或皮下注射(SQ)用10mg/kg/天、25mg/kg/天或50mg/kg/天的CAMB处理。CAMB单独施用或与5-氟胞嘧啶联合施用。另外,用单独的5-氟胞嘧啶或单独的5mg/kg/天的FUNGIZONE®处理感染的小鼠,每次通过IP注射施用(表2)。如在第一次试验中,每个治疗组也使用5只小鼠,并且将5只感染的未治疗小鼠组用作对照。对于所示各组,每三天制备250 mg 5-氟胞嘧啶/250毫升无菌水,等分到干净的高压灭菌水瓶中并置于两组小鼠的笼中。在感染后72小时开始药剂施用,并且在测量体重后每天继续一次,连续历时28天。
在第三个试验中,感染的小鼠通过PO或IP注射用5mg/kg/剂量、25mg/kg/剂量或50mg/kg/剂量的CAMB处理,单独施用或与5-氟胞嘧啶或氟康唑联合施用。小鼠也给予单独的5-氟胞嘧啶、单独的氟康唑或5 mg/kg/剂量的FUNGIZONE®(通过IP注射,单独或与5-氟胞嘧啶组合)(表3)。在每日体重测量后,如表3中所述,动物每天给药一次或两次。每个处理组使用5只小鼠,5只感染的未处理小鼠组用作对照。对于所示各组,每三天制备250mg 5-氟胞嘧啶/250ml无菌水,等分到干净的高压灭菌水瓶中并置于四组小鼠的笼中。如所示,氟康唑通过口服管饲法以25mg/kg/天分两个剂量单独或组合施用。在感染后72小时开始药剂施用,并且每天继续一次,连续历时28天。
三个试验中的每一个的存活和脑研究用于确定抗真菌效力。记录三个试验的每一个的死亡率。在死亡时对动物进行尸体剖检,在无菌条件下取出脑,称重,并在1毫升无菌水中匀浆。通过脑组织中新型隐球菌的浓度(单位为CFU/g)评价对抗真菌处理的微生物反应。将使用无菌PBS的系列稀释的经匀浆的脑一式两份铺板到YPD琼脂板上。将培养板在37℃下温育48小时,然后对CFU计数并计算每克脑组织的CFU数。该方法对≥10 CFU/g的检测敏感。培养阴性板的计数为0 CFU/g。
实施例2. 结果
试验1
小鼠通过静脉内方式感染新型隐球菌菌株H99 (1×104 CFU),1天后开始每日治疗,历时28天,如上所述并如图6所示,然后跟踪60天。图6示出了在所指定时间每组的存活百分比。从图6中可以明显看出,在1天的感染潜伏期后单独使用的CAMB导致80%的小鼠存活了60天,这相当于注射两性霉素B去氧胆酸盐(FUNGIZONE®)并优于未处理的对照组(第20天显示100%死亡)。
试验2
小鼠通过静脉内方式感染新型隐球菌菌株H99 (1×104 CFU)。3天后开始每日治疗,历时28天,如上所述并如表4和图7所示。跟踪小鼠直至垂死,然后处死。实验在第188天终止,其中第1组有1只小鼠存活。表4显示第1-11组的存活百分比。图7仅描绘了第1、2和4-6组的存活百分比。如表4所示,未治疗小鼠的中位生存期为13天,通过用FUNGIZONE® IP 5mg/kg/天延长(61天, p = 0.004),或通过PO、SQ或IP途径中的任何一种施用CAMB延长(33,50, 84天, p = 0.004)。然而,使用CAMB的存活通过使用IP途径来改进(84天, p =0.022),或者通过在饮用水中添加口服5-FC来改进(75天,p<0.05)。
通过在死亡时存在头部肿大和通过培养小鼠尸体的经匀浆脑部并随后从YPD板获得菌落来验证新型隐球菌相关的脑死亡(见表5)。培养的第1组中存活的一只小鼠包含225CFU的新型隐球菌,表明通过FUNGIZONE® IP进行了部分处理。
基于11组测试化合物的存活率分析,第1、2和6组中的小鼠存活时间最长,在处理结束后超过了60天。可以得出结论,第1组(FUNGIZONE® IP注射)、第2组(CAMB IP注射)和第6组(CAMB PO + 在饮用水中的5-氟胞嘧啶)为小鼠提供了比其他治疗组更好的抗新型隐球菌存活率。对于口服处理,添加5-FC比用单独的脂质卷包封的两性霉素B显著延长了存活率,并且大致相当于FUNGIZONE® IP。
试验3
小鼠通过静脉内方式感染新型隐球菌菌株H99 (1×104 CFU)。3天后开始每日治疗,历时28天,如上所述并如表6和图8所示。跟踪小鼠直至垂死,然后处死。表6显示第1-11组的存活百分比。图8仅描绘了第1、2、6、8和9组的存活百分比。如表6所示,未治疗小鼠的中位生存期为19天,通过用FUNGIZONE® IP 5 mg/kg/天 + 5-FC 延长(80天, p = 0.003),或通过PO或IP途径每天给予CAMB延长(分别为35或49天; p = 0.003)。每日两次给药导致更短存活的趋势,这可能是由于重复的损伤,导致减少的PO摄取或CAMB胃肠毒性(31 天vs. 35 天, p = 无统计学显著性 (NS))。口服CAMB制剂的存活通过添加在饮用水中的5-FC来提高(102天, p = 0.002 vs. 单独口服CAMB)或者通过添加口服氟康唑来提高(尽管未大到一定的程度)(56天, p = 0.002)。
实验在第151天终止,第6组(CAMB + 5-FC组)有一只小鼠存活。新型隐球菌相关的脑死亡通过在死亡时存在头部肿大和通过培养小鼠尸体的经匀浆脑部并随后从YPD板获得菌落来验证。参见表7和图9中的CFU数/g脑组织。
实施例3. 口服施用后荧光脂质卷的脑局域化
为了确定CAMB是否真正递送到脑组织,三只小鼠通过尾静脉感染104 新型隐球菌, 菌株H99且三只保持未感染的。5天后,来自每组的两只小鼠以10 mg/kg/天通过口服管饲法用罗丹明标记的CAMB (Rod-AmpB)等同物每天处理一次,历时3天。(参见图10,研究设计的示意图)。在第7天处死小鼠并回收脑物质,匀浆并使用差分干涉对比(DIC)进行显微镜检查并观察荧光(RFP)。
图11描绘了该研究的结果。如图11所示,荧光成像表明用CAMB口服制剂治疗的小鼠的脑中大量的荧光颗粒。与在未感染小鼠中相比,在感染小鼠的大脑中递送增加明显。见图11。黑色箭头描绘了新型隐球菌包封的生物体,白色箭头描绘了脂质卷荧光(条=10毫米)。因此,该研究表明,CAMB被递送到感染新型隐球菌小鼠中的大脑,并且可以与5-FC组合用作有效的口服抗真菌剂,其相当于全身性的FUNGIZONE® + 5-FC,以治疗C. neoforman感染。
表1.试验1给药组和施用途径
表2.试验2给药组和施用途径
S = 声波处理, BSA = 牛血清白蛋白, FAT = 50/50 淡奶油和牛奶,
IP=腹膜内, SQ = 皮下, PO=口服管饲
表3.试验3 给药组和施用途径
表4 来自表2的各组的中位生存期
表5 脑部的CFU/g数(来自表2的各组)
表6. 来自表3各组的中位生存期
表7. CFU/g脑组织数(来自表3的各组)
Claims (19)
1.一种口服制剂,其用于治疗或预防由于受试者中一种隐球菌属(Cryptococcus spp.)引起的中枢神经系统感染症,其中所述口服制剂包含:
(a)脂质卷组合物,该脂质卷组合物包含一种或多种脂质卷和治疗有效量的第一抗真菌化合物,其中所述第一抗真菌化合物为两性霉素B;和
(b)治疗有效量的第二抗真菌化合物,其中所述第二抗真菌化合物选自5-氟胞嘧啶、氟康唑、酮康唑、雷夫康唑、阿巴康唑、伊曲康唑、泊沙康唑、艾沙康唑和伏立康唑,
且其中所述第一抗真菌化合物和第二抗真菌化合物是所述口服制剂中仅有的两种抗真菌化合物。
2.根据权利要求1所述的口服制剂,其中,每天施用所述口服制剂历时至少7天、至少14天、至少21天、或至少28天。
3.根据权利要求1或2所述的口服制剂,其中,所述第二抗真菌化合物为5-氟胞嘧啶。
4.根据权利要求1-3中任一项所述的口服制剂,其中所述感染症是隐球菌性脑膜脑炎。
5.根据权利要求1-3中任一项所述的口服制剂,其中所述感染症是隐球菌性脑膜炎。
6.根据权利要求1-5中任一项所述的口服制剂,其中所述一种隐球菌属(Cryptococcus spp.)是新型隐球菌(Cryptococcus neoformans)。
7.根据权利要求1-5中任一项所述的口服制剂,其中所述一种隐球菌属(Cryptococcus spp.)是加蒂隐球菌(Cryptococcus gattii)。
8.根据权利要求1-7中任一项所述的口服制剂,其中受试者是人。
9.根据权利要求1-8中任一项所述的口服制剂,其中受试者患有HIV/AIDS、淋巴瘤、肝硬化或已接受器官移植。
10.根据权利要求1-9中任一项所述的口服制剂,其中所述抗真菌化合物被递送到脑。
11.根据权利要求1-10中任一项所述的口服制剂,其中预防由于一种隐球菌属(Cryptococcus spp.)引起的感染症包括预防感染症复发。
12.根据权利要求1-11中任一项所述的口服制剂,其中预防由于一种隐球菌属(Cryptococcus spp.)引起的感染症包括处置哺乳动物或人,其中所述哺乳动物或人对隐球菌性物质抗原呈阳性。
13.根据权利要求1-12中任一项所述的口服制剂,其中所述第二抗真菌化合物被脂质卷包封,且其中所述两性霉素B和所述第二抗真菌化合物配制在相同的脂质卷中。
14.根据权利要求1、2和4-12中任一项所述的口服制剂,其中所述第二抗真菌化合物为5-氟胞嘧啶或氟康唑,且其中所述5-氟胞嘧啶或氟康唑未经脂质卷包封。
15.根据权利要求1、2和4-12中任一项所述的口服制剂,其中所述第二抗真菌化合物为氟康唑。
16.根据权利要求1-15中任一项所述的口服制剂,其中一种或多种所述脂质卷是晶洞脂质卷。
17.根据权利要求1-16中任一项所述的口服制剂,其中一种或多种所述脂质卷包含脂质组分,所述脂质组分包含大豆磷脂酰丝氨酸,其量为约30%至70%重量。
18.根据权利要求1-12、14、16和17中任一项所述的口服制剂,其中,所述第二抗真菌化合物为5-氟胞嘧啶且其中所述5-氟胞嘧啶未经脂质卷包封。
19.根据权利要求1-12和14-18中任一项所述的口服制剂,其中,配制所述脂质卷组合物,以与所述第二抗真菌化合物分开施用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662361351P | 2016-07-12 | 2016-07-12 | |
| US62/361351 | 2016-07-12 | ||
| US201762513800P | 2017-06-01 | 2017-06-01 | |
| US62/513800 | 2017-06-01 | ||
| CN201780056037.8A CN109689028A (zh) | 2016-07-12 | 2017-07-12 | 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780056037.8A Division CN109689028A (zh) | 2016-07-12 | 2017-07-12 | 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN114053417A true CN114053417A (zh) | 2022-02-18 |
Family
ID=60952715
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111352284.7A Pending CN114053417A (zh) | 2016-07-12 | 2017-07-12 | 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 |
| CN201780056037.8A Pending CN109689028A (zh) | 2016-07-12 | 2017-07-12 | 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780056037.8A Pending CN109689028A (zh) | 2016-07-12 | 2017-07-12 | 用于中枢神经系统递送和治疗隐球菌感染的脂质卷包封的抗真菌化合物 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US11123295B2 (zh) |
| EP (1) | EP3484447A4 (zh) |
| JP (1) | JP6991592B2 (zh) |
| KR (2) | KR20230003167A (zh) |
| CN (2) | CN114053417A (zh) |
| AU (1) | AU2017297402B2 (zh) |
| CA (1) | CA3027668A1 (zh) |
| WO (1) | WO2018013711A1 (zh) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4013400A4 (en) * | 2019-08-13 | 2023-08-30 | Matinas BioPharma Nanotechnologies, Inc. | METHODS OF TREATMENT OF CRYPTOCOCCUS INFECTIONS |
| CN118370831A (zh) * | 2023-01-20 | 2024-07-23 | 中国科学院微生物研究所 | 肌醇磷脂酰胺合成酶抑制剂与两性霉素b的联合用药及其用途 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004092123A2 (en) * | 2003-04-10 | 2004-10-28 | Microbia, Inc. | Inhibitors of fungal invasion |
| US20090087480A1 (en) * | 2005-04-07 | 2009-04-02 | Toyama Chemical Co., Ltd. | Pharmaceutical composition and method using antifungal agent in combination |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1998006265A2 (en) | 1996-08-09 | 1998-02-19 | Buckman Laboratories International, Inc. | Treatment of fungal infections using a combination of an anti-fungal compound and an n-alkyl-heterocyclic compound, especially n-dodecyl-morpholine |
| US5837254A (en) * | 1996-11-14 | 1998-11-17 | Chen; Yu | Method of treating candida and cryptococcus fungal infections by administering gentian |
| US6153217A (en) * | 1999-01-22 | 2000-11-28 | Biodelivery Sciences, Inc. | Nanocochleate formulations, process of preparation and method of delivery of pharmaceutical agents |
| AUPQ066399A0 (en) | 1999-05-31 | 1999-06-24 | Fujisawa Pharmaceutical Co., Ltd. | Antifungal combination use |
| CA2397792A1 (en) | 2000-01-24 | 2001-07-26 | Biodelivery Sciences, Inc. | Cochleate formulations and their use for delivering biologically relevant molecules |
| US20030219473A1 (en) * | 2002-03-26 | 2003-11-27 | Leila Zarif | Cochleates made with purified soy phosphatidylserine |
| CA2504329C (en) | 2002-11-01 | 2013-08-20 | Biodelivery Sciences International, Inc. | Geodate delivery vehicles |
| WO2004091578A2 (en) | 2003-04-09 | 2004-10-28 | Biodelivery Sciences International, Inc. | Novel encochleation methods, cochleates and methods of use |
| EP2626415A3 (en) * | 2004-10-25 | 2014-04-16 | Cellerant Therapeutics, Inc. | Methods of expanding myeloid cell populations and uses thereof |
| NZ565039A (en) * | 2005-06-29 | 2010-04-30 | Univ New York State Res Found | Compositions and methods for less immunogenic protein-lipid complexes |
| US20100210575A1 (en) * | 2007-06-29 | 2010-08-19 | Wisconsin Alumni Research Foundation | Structuring effect of cholesterol in peg-phospholipid micelles, drug delivery of amphotericin b, and combination antifungals |
| DE102008054431B3 (de) * | 2008-12-09 | 2010-06-17 | Pari Pharma Gmbh | Aerosoltherapievorrichtung |
| WO2010091090A1 (en) * | 2009-02-03 | 2010-08-12 | Biodelivery Sciences International, Inc. | Cochleate compositions and methods of use |
| WO2012151517A1 (en) * | 2011-05-05 | 2012-11-08 | Coordinated Program Development, Llc | Cochleate compositions and methods of making and using same |
| JP6444865B2 (ja) | 2012-07-30 | 2018-12-26 | マティナス バイオファーマ ナノテクノロジーズ,インコーポレーテッド | ダイズホスファチジルセリンで作られたコクリエート |
-
2017
- 2017-07-12 US US16/312,047 patent/US11123295B2/en active Active
- 2017-07-12 CN CN202111352284.7A patent/CN114053417A/zh active Pending
- 2017-07-12 CN CN201780056037.8A patent/CN109689028A/zh active Pending
- 2017-07-12 AU AU2017297402A patent/AU2017297402B2/en active Active
- 2017-07-12 KR KR1020227041763A patent/KR20230003167A/ko not_active IP Right Cessation
- 2017-07-12 JP JP2019500624A patent/JP6991592B2/ja active Active
- 2017-07-12 WO PCT/US2017/041750 patent/WO2018013711A1/en unknown
- 2017-07-12 CA CA3027668A patent/CA3027668A1/en active Pending
- 2017-07-12 EP EP17828400.6A patent/EP3484447A4/en active Pending
- 2017-07-12 KR KR1020197003873A patent/KR20190029642A/ko not_active Application Discontinuation
-
2021
- 2021-08-31 US US17/463,021 patent/US20210393526A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004092123A2 (en) * | 2003-04-10 | 2004-10-28 | Microbia, Inc. | Inhibitors of fungal invasion |
| US20090087480A1 (en) * | 2005-04-07 | 2009-04-02 | Toyama Chemical Co., Ltd. | Pharmaceutical composition and method using antifungal agent in combination |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6991592B2 (ja) | 2022-01-12 |
| US11123295B2 (en) | 2021-09-21 |
| CN109689028A (zh) | 2019-04-26 |
| WO2018013711A1 (en) | 2018-01-18 |
| KR20230003167A (ko) | 2023-01-05 |
| JP2019520407A (ja) | 2019-07-18 |
| CA3027668A1 (en) | 2018-01-18 |
| EP3484447A1 (en) | 2019-05-22 |
| US20200121601A1 (en) | 2020-04-23 |
| AU2017297402B2 (en) | 2023-02-09 |
| AU2017297402A1 (en) | 2019-01-03 |
| US20210393526A1 (en) | 2021-12-23 |
| KR20190029642A (ko) | 2019-03-20 |
| EP3484447A4 (en) | 2020-07-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5855829B2 (ja) | リポソーム化バンコマイシン製剤 | |
| US20210393526A1 (en) | Encholeated antifungal compounds for central nervous system delivery and treatment of cryptococcus infections | |
| AU2013296651B2 (en) | Cochleates made with soy phosphatidylserine | |
| US20210113595A1 (en) | Liposomal nano formulation of combinational antibiotics and the uses thereof | |
| US9820940B2 (en) | Liposomal formulations of polymyxin and uses thereof | |
| JP5920875B2 (ja) | 真菌感染症を治療するための新規な製剤 | |
| JPH07501825A (ja) | 高められた抗真菌活性を有するアンフォテリシンb組成物 | |
| US20220313717A1 (en) | Methods of treating cryptococcus infections | |
| US11273124B2 (en) | Antifungal nanoparticles for targeted treatment of fungal infections | |
| WO2024039729A1 (en) | Antifungal agent encapsulated in a lipid nanocrystal for treating mucormycosis | |
| US10092515B2 (en) | Liposomal formulations of polymyxin B and uses thereof | |
| WO2021202912A1 (en) | Compositions for treatment of viral respiratory infections and methods of use thereof | |
| Georgiev | Treatment and Developmental Therapeutics in Aspergillosis. 1. Amphotericin B and Its Derivatives: 1. Amphotericin B and Its Derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |