CN111010867B - 抗双皮层蛋白样激酶1抗体及其使用方法 - Google Patents
抗双皮层蛋白样激酶1抗体及其使用方法 Download PDFInfo
- Publication number
- CN111010867B CN111010867B CN201880046217.2A CN201880046217A CN111010867B CN 111010867 B CN111010867 B CN 111010867B CN 201880046217 A CN201880046217 A CN 201880046217A CN 111010867 B CN111010867 B CN 111010867B
- Authority
- CN
- China
- Prior art keywords
- antibody
- seq
- amino acid
- antigen
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2851—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the lectin superfamily, e.g. CD23, CD72
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6871—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting an enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3038—Kidney, bladder
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/11—Protein-serine/threonine kinases (2.7.11)
- C12Y207/11001—Non-specific serine/threonine protein kinase (2.7.11.1), i.e. casein kinase or checkpoint kinase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/91—Transferases (2.)
- G01N2333/912—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- G01N2333/91205—Phosphotransferases in general
- G01N2333/9121—Phosphotransferases in general with an alcohol group as acceptor (2.7.1), e.g. general tyrosine, serine or threonine kinases
- G01N2333/91215—Phosphotransferases in general with an alcohol group as acceptor (2.7.1), e.g. general tyrosine, serine or threonine kinases with a definite EC number (2.7.1.-)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57438—Specifically defined cancers of liver, pancreas or kidney
Abstract
本发明公开了特异性结合人DCLK1蛋白的抗体及其抗原结合片段,表达此类抗体及其抗原结合片段的杂交瘤或其他细胞系,包含编码此类抗体和其抗原结合片段的核酸、载体和宿主细胞,及其使用方法。在至少某些非限制性实施方案中,抗体或其抗原结合片段特异性结合DCLK1蛋白的同工型2或4内的表位。
Description
相关申请的交叉参考/引用并入本文
本申请根据35U.S.C.§119(e)的规定要求2017年5月30日提交的美国系列号62/512,372的优先权,该申请整体通过参考明确并入本文中。
关于联邦资助的研究或开发的申明
不适用。
背景
肾细胞癌(RCC)是世界第八大最常见的癌症,在美国,它在男性中约占所有恶性肿瘤的7%,在女性中约占所有恶性肿瘤的4%。值得注意的是,近48%的RCC患者出现区域性扩散或远处转移,导致高死亡率。此外,手术切除后的患者中有40%倾向于复发。使事情复杂化的是,RCC由于对化学疗法和放射疗法的强抗性而成为高度难治的肿瘤。当前,靶向治疗包括免疫疗法和受体酪氨酸激酶(RTK)和mTOR抑制剂。然而,这些并不能导致完全的反应,因此需要对RCC的分子和细胞驱动因子进行更多研究以改善患者预后。
肾细胞癌的特征是生长缓慢、低氧的微环境以及对药物和放射疗法的破坏性抵抗力。这些特征与肿瘤干细胞或干样细胞的存在一致。先前的发现表明,胃肠道肿瘤干细胞(TSC)标记双皮层蛋白样激酶1(Doublecortin-like kinase 1,DCLK1)在RCC中表观遗传失调和过表达。此外,RCC细胞系中DCLK1的靶向下调导致肿瘤发生和转移的分子和功能性标志明显降低。
表现出诊断为转移性疾病以及复发趋势的患者的很大比例可能是由于肿瘤内异质性以及RCC中存在强的上皮到间质转化(EMT)特征所致。Von-Hippel Lindau(VHL)肿瘤抑制基因的失活通过干扰低氧诱导型转录因子(HIF)的蛋白酶体降解而在RCC肿瘤发生中起重要作用。HIF参与了对缺氧的反应,从而为肿瘤干细胞(TSC)提供了支持环境。已知TSC具有EMT表型和对治疗的抵抗力,这是RCC的关键特征。这些发现表明,RCC的发生和发展可能与肿瘤干细胞或干样细胞紧密相关。
DCLK1是钙调蛋白依赖性激酶家族的成员,并在许多癌症中表达,包括结肠癌、胰腺癌、肝癌和食道癌。DCLK1是TSC特异性标记,与癌症的发生、EMT和胃肠道肿瘤的进展高度相关。非胃肠道肿瘤中DCLK1在肿瘤发生中的作用的研究是有限的。但是,最近报道了DCLK1在RCC肿瘤的基因和蛋白质水平上的表观遗传失调和过度表达(Weygant等人,“DCLK1 is abroadly dysregulated target against epithelial-mesenchymal transition,focaladhesion,and stemness in clear cell renal carcinoma”,Oncotarget,6(4):2193-205(2015))。DCLK1包含来自两个启动子的四个主要人类同工型,分别称为α和β。有证据表明这些同工型在癌症中具有不同的功能和表达水平。所有同工型均具有共享的激酶结构域和自磷酸化区域。α启动子产生两个具有不同C端区域的结合双皮层蛋白的82kDa同工型(1和2)。β启动子产生两个缩短的主要激酶结构域52kDa同工型(3和4),具有相当但不同的C端区域。
附图的简要说明
本专利或申请文件包含至少一个彩色附图。专利局将在请求并提供必要的费用时提供带有彩色附图的本专利或专利申请公开的副本。
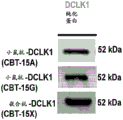
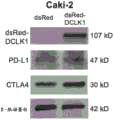
图1显示了Western印迹,表明CBT-15单克隆抗体(A,G和X)检测纯化的DCLK1同工型4蛋白。
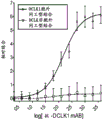
图2显示了ELISA结果,表明CBT-15单克隆抗体(mAB)选择性地检测细胞外DCLK1同工型4(上部线)并且非选择性结合细胞内DCLK1同工型1(下部线)。
图3显示了荧光激活细胞分选(FACS)分析图,表明CBT-15单克隆抗体检测表达细胞外DCLK1的AsPC-1人胰腺细胞的小亚群。
图4显示在Caki-2人肾癌细胞中DCLK1同工型2的过表达定位于微管并导致标志物缺氧诱导型转录因子-1(HIF-1),醛脱氢酶1A1(ALDH1A1)和波形蛋白表达的上调。
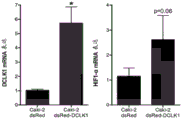
图5是显示当在Caki-2人肾癌细胞中DCLK1同工型2过表达时,HIF-1mRNA也过表达的图。
图6是显示DCLK1同工型2的过表达导致Caki-2细胞增殖显著增加的图。
图7是显示DCLK1同工型2的过表达不改变Caki-2细胞周期状态的图。
图8A是示出ACHN人肾癌细胞的一个亚组对于DCLK1同工型2或4是阳性的并且另一个亚组对于ALDH是阳性、以及该细胞群的少数亚组(0.5%)对于两种标记物都是阳性的图。
图8B显示了Caki-2人肾癌细胞的一个子集对于DCLK1同工型2或4是阳性的,另一个子集对于ALDH(醛脱氢酶)是阳性的,以及该细胞群的少数子集(1.5%)对于两种标记物都是阳性的。
图9是显示在Caki-2人肾癌细胞中DCLK1同工型2的过表达导致ALDH+细胞群增加的图。
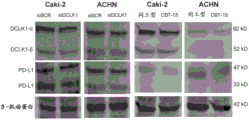
图10显示DCLK1同工型2或4在ACHN人肾癌细胞中细胞外表达。
图11的图显示了具有细胞外DCLK1同工型2或4的ACHN人肾癌细胞比没有细胞外DCLK1同工型2或4的人肾癌细胞更能形成球体。
图12是在Caki-2人肾癌细胞中DCLK1蛋白敲低的印迹确认。
图13显示在DCLK1敲低后,Caki-2人肾癌细胞形成球体的能力显著受损。
图14以图形方式显示,舒尼替尼预处理过表达DCLK1同工型2的Caki-2人肾癌细胞仅轻微影响细胞形成球状体的能力。
图15显示了对照或过表达DCLK1同工型2的Caki-2球体的代表性显微图像。
图16是显示过表达DCLK1同工型2的Caki-2细胞对舒尼替尼具有抗性的图。
图17是显示过表达DCLK1同工型2的Caki-2细胞对索拉非尼没有抗性的图。
图18是显示用抗DCLK1 siRNA(siDCLK1)和乱序列siRNA(scrambled sequencesiRNA,siSCR)下调DCLK1导致在Caki-2和ACHN人肾癌细胞中对舒尼替尼致敏的图。
图19显示DCLK1抗DCLK1 siRNA(siDCLK1)和加扰序列siRNA(siSCR)的下调在Caki-2和ACHN人肾癌细胞中导致对索拉非尼敏感。
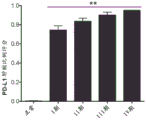
图20是显示编程性死亡配体1(PD-L1)表达与患者肿瘤组织中的肾癌分期相关的图。
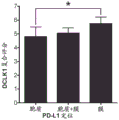
图21显示了DCLK1表达与来自患者的肾癌组织中膜PD-L1的表达相关。
图22是显示在Caki-2人肾癌细胞中DCLK1同工型2的过表达导致免疫检查点标记PD-L1和细胞毒性T淋巴细胞相关蛋白4(CTLA4)的过表达的印迹。
图23是一系列蛋白质印迹,显示DCLK1 siRNA或CBT-15A抗体部分下调了Caki-2和ACHN人肾癌细胞中PD-L1的表达。
图24A显示,如通过胱天蛋白酶-3/7活性所测量的,CBT-15A mAB治疗使ACHN肾细胞癌(RCC)细胞对外周血单个核细胞(PBMC)介导的凋亡敏感。
图24B是显示通过胱天蛋白酶-3/7活性测量的CBT-15G和CBT-15X mAB在体外增强胰腺癌细胞中免疫细胞介导的细胞杀伤的图。
图25证明了CBT-15A mAB对小鼠中的ACHN人肾肿瘤异种移植物生长的抑制作用(p<0.03)。该图显示了随着时间推移肿瘤体积的增长。下图显示了切除的肾脏肿瘤异种移植物的照片,这些照片用于测量肿瘤体积。CBT-15A mAB大大降低了肿瘤的生长。
图26示出了图25的切除肿瘤的肿瘤体积(p<0.001)。
图27示出了图25的切除肿瘤的肿瘤质量(p<0.001)。
图28证明了CBT-15G mAB对小鼠中胰腺癌SW1990肿瘤异种移植物生长的抑制作用(p<0.0001)。该图显示了随着时间推移肿瘤体积的增长。下图显示了切除的肾肿瘤异种移植物的照片。CBT-15G mAB大大降低了肿瘤的生长。
图29示出了图28的切除肿瘤的肿瘤体积(p<0.001)。
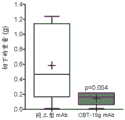
图30示出了图28的切除肿瘤的肿瘤质量(p<0.054)。
图31显示了嵌合的CBT-15X mAB对小鼠中胰腺癌SW1990肿瘤异种移植物生长的抑制作用(p<0.005)。该图显示了随着时间推移肿瘤体积的增长。下图显示了切除的肾肿瘤异种移植物的照片。CBT-15X mAB大大降低了肿瘤的生长。
图32是显示图31的切除肿瘤的肿瘤体积的图(p<0.05)。
图33是显示图31的切除肿瘤的肿瘤质量的图(p<0.05)。
图34证明了嵌合CBT-15X mAB对小鼠中胰腺癌AsPC-1肿瘤异种移植物生长的抑制作用(p<0.005)。该图显示了随着时间推移肿瘤体积的增长。下图显示了切除的肾肿瘤异种移植物的照片。CBT-15X mAB大大降低了肿瘤的生长。
图35显示了图34的切除肿瘤的肿瘤体积(p<0.05)。
图36显示了图34的切除肿瘤的肿瘤质量(p<0.05)。
详细说明
本公开涉及特异性结合人DCLK1蛋白的抗体及其抗原结合片段,以及表达这种抗体及其抗原结合片段的杂交瘤或其他细胞系,还涉及包含编码此类抗体及其抗原结合片段的核酸、载体和宿主细胞。在至少某些非限制性的实施方案中,所述抗体或其抗原结合片段特异性结合DCLK1同工型2(SEQ ID NO:1)或DCLK1同工型4(SEQ ID NO:2)内的表位。在特定的(但非限制性的)实施方案中,同工型2或4表位包含氨基酸序列SEQ ID NO:3-12,更特别是SEQ ID NO:10(但不限于此)。所公开的抗体及其抗原结合片段可用于例如治疗和诊断表达DCLK1的癌症,以及用于检测DCLK1蛋白和表达DCLK1蛋白的细胞。DCLK1不仅是一种在某些癌症(例如RCC)发展中的因子,而且如本文所证明的,也是治疗表达DCLK1的癌症的治疗靶标。这样的癌症的例子包括但不限于胃肠道癌症(即结肠,直肠,肠,胃,食道),乳腺癌,肺癌,肾癌,胰腺癌,肝癌,膀胱癌,子宫癌和卵巢癌。因此,在某些实施方案中,本公开内容涉及治疗罹患此类癌症的受试者的方法。
在通过示例性描述、实施例和结果进一步详细描述本公开的各种实施方案之前,应理解本公开的化合物、组合物和方法在应用中不限于以下描述中阐述的具体实施方案和实施例的细节。本文提供的描述仅用于说明目的,而无意在限制意义上进行解释。这样,本文所使用的语言旨在给予尽可能广泛的范围和含义,并且实施方式和实施例是示例性的,而不是穷举的。另外,应理解,本文所采用的措词和术语仅仅是出于描述的目的,除非另有说明,否则不应视为限制性的。此外,在下面的详细描述中,阐述了许多具体细节以便提供对本公开的更透彻的理解。然而,对于本领域普通技术人员将显而易见的是,可以在没有这些具体细节的情况下实施本公开。在其他情况下,没有详细描述本领域普通技术人员公知的特征,以避免说明书有不必要的复杂。申请人意图将对本领域普通技术人员显而易见的所有替代、替换、修改和等同方式都包括在本公开的范围内。根据本公开内容,无需过度实验即可制备和实施本文公开的所有化合物、组合物、方法、应用和用途。因此,尽管已经根据特定实施方案描述了本公开的化合物、组合物和方法,但是对于本领域技术人员而言显而易见的是,本文描述的化合物、组合物、方法以及方法的步骤或步骤的顺序可以有变化而不脱离本发明构思的概念、精神和范围。
说明书中提到的或在本申请的任何部分中引用的所有专利、公开的专利申请和非专利出版物(包括公开文章)均以引用的方式明确地全文并入本文,其程度与每篇单独的专利或出版物被具体和单独地指出以引用方式并入的程度相同。
除非本文另有定义,否则与本公开内容结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另外要求,否则单数术语应包括复数并且复数术语应包括单数。在本文中使用时,特定术语“单/单个”仅限于“一个”。
根据本发明的方法、化合物和组合物使用时,除非另有说明,否则以下术语应理解为具有以下含义:
在权利要求书和/或说明书中,词语“一”或“一个/种”与术语“包含”结合使用时,其含义可能是“一个”,但也与“一或多个/种、“至少一个/种”和“一个/种或多于一个/种”的含义一致。在权利要求中使用的术语“或”用于表示“和/或”,除非明确指出仅指代替代方案,或者当各替代方案相互是排他性的,尽管本公开内容支持仅指代替代方案和“和/或”的定义。术语“至少一个/种”的使用将被理解为包括一个/种以及超过一个/种的任何数量,包括但不限于2、3、4、5、6、7、8、9、10、15、20、30、40、50、100或其中的任何整数。术语“至少一个/种”可延伸至高达100或1000或更多个/种,具体取决于其所连接的术语。此外,不应将100/1000的数量视为限制性的,因为更高的限制可能也会产生令人满意的结果。另外,术语“X、Y和Z中的至少一个/种”的使用将被理解为包括单独的X、单独的Y和单独的Z,以及X、Y和Z的任何组合。
如本文所使用的,除非上下文另外明确指出,否则所有数值或范围都包括在这样的范围内的值和整数的分数以及在这样的范围内的整数的分数。因此,为了说明,提及数字范围例如1-10时,包括1、2、3、4、5、6、7、8、9、10以及1.1、1.2、1.3、1.4、1.5等。因此,提及1-50的范围包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20,高达并包括50个,以及1.1、1.2、1.3、1.4、1.5等,2.1、2.2、2.3、2.4、2.5等。提及一系列范围时包括组合该系列内不同范围的边界的值的范围。因此,为了说明对一系列范围的引用,例如1-10、10-20、20-30、30-40、40-50、50-60、60-75、75-100、100-150、150-200、200-250、250-300、300-400、400-500、500-750、750-1,000包括例如1-20、10-50、50-100、100-500和500-1,000。提及多于(大于)或小于的整数分别包括大于或小于该参考数字的任何数字。因此,例如,提及小于100时包括99、98、97等,一直到数字1;小于10的数字包括9、8、7等,一直减小到数字1。
如本说明书和权利要求书中所使用的,词语“包含”(以及包含的任何形式,例如“含有”和“具有”)、“有”(以及有的任何形式),“包括”(以及包括的任何形式,例如“包含”和“包含”)等是包含性的或开放式的,不排除其他未引用的元素或方法步骤。
如本文所用,术语“或其组合”是指该术语之前所列项目的所有排列和组合。例如,“A,B,C或其组合”旨在包括以下至少之一:A,B,C,AB,AC,BC或ABC,如果顺序在特定情况下很重要,那么也包括BA,CA,CB,CBA,BCA,ACB,BAC或CAB。继续该示例,还明确包括包含一个或多个项目或术语的重复的组合,例如BB,AAA,AAB,BBC,AAABCCCC,CBBAAA,CABABB等。本领域技术人员将理解,除非从上下文明显看出,否则通常对任何组合中的项或术语的数量没有限制。
在整个本申请中,术语“约”用于表示,对于组合物、用于施用该组合物的方法,数值包括固有误差变化,或研究对象之间存在的变化。如本文中所使用的,修饰语“大约”或“大致”不仅包括该具体的数值,数量,程度,方向或其他修饰的特性或数值,而且还包括由于例如测量误差、制造公差、施加在各个零件或组件上的应力,观察者错误、磨损以及它们的组合而引起的一些细微变化。术语“大约”或“大致”在本文中指诸如数量、持续时间等可测量值时,意在涵盖该指定值的例如±20%或±10%、或±5%、或±1%或±0.1%的变化,因为这样的变化适合于执行所公开的方法,并且是本领域普通技术人员所理解的。如本文所用,术语“基本上”是指随后描述的事件或情况完全发生,或者随后描述的事件或情况在很大程度上或水平上发生。例如,术语“基本上”是指随后描述的事件或情况发生至少90%的时间,或至少95%的时间,或至少98%的时间。
如本文所使用的,对“一个实施方式”或“实施方式”的任何提及表示结合该实施方式描述的特定元件、特征、结构或特性包括在至少一个实施方式中,并且可以包括在其他实施方式中。说明书中各个地方出现的短语“在一个实施方式中”不一定全部指的是同一个实施方式,也不必限于单个或特定的实施方式。此外,所有提及一个或多分实施方式或实施例都应理解为对权利要求书没有限制。
术语“药学上可接受的”是指适合于对人和/或动物给药而没有不适当的副作用例如毒性、刺激性和/或过敏反应但具有合理的获益/风险比的化合物和组合物。本公开内容的化合物或缀合物可以与一种或多种药学上可接受的赋形剂组合,包括可以改善化合物或其缀合物的溶解性、递送性、分散性、稳定性和/或构象完整性的载体、赋形剂和稀释剂。
“生物活性”是指改变生物体的生理系统的能力,但不提及活性剂如何具有其生理作用。
如本文所用,“纯的”或“基本上纯的”是指目标物质是存在的主要物质(即,以摩尔计,其比其组合物中的任何其他目标物质更丰富),特别地,基本上纯化的级分这样的组合物,其中目标物质占存在的所有大分子物质的至少约50%(以摩尔计)。通常,基本上纯的组合物包含的所有大分子物质将占组合物的大于约80%,更特别地大于约85%,大于约90%,大于约95%或大于约99%。术语“纯”或“基本上纯”还指其中目标物种至少为60%(w/w)纯、或至少70%(w/w)纯或至少75%(w/w)、或至少80%(w/w)纯度、或至少85%(w/w)纯度、或至少90%(w/w)纯度、或至少92%(w/w)纯度、或至少95%(w/w)纯度、或至少96%(w/w)纯度、或至少97%(w/w)纯度、或至少98%(w/w)纯度、或纯度至少为99%(w/w)或100%(w/w)纯的制剂。
在该术语范围和含义内的动物或受试者的非限制性实例包括狗,猫,大鼠,小鼠,豚鼠,龙猫,马,山羊,牛,绵羊,动物园动物,旧世界和新世界猴子,非人类灵长类动物和人类。
“治疗”是指治疗方法。“预防”是指预防性或预防性治疗措施或减轻病症或疾病的发作。术语“治疗”是指出于治疗目的和/或预防目的将组合物给予受试者。
术语“治疗性组合物”和“药物组合物”是指可以通过本领域已知的或本文设想的任何方法向受试者施用的含活性剂的组合物,其中组合物的施用带来了本文其他地方描述的治疗作用。另外,本公开的组合物可以被设计为使用本领域熟知的配制技术提供延迟、控制、延长和/或持续的释放。
术语“有效量”是指当以本公开的方式使用时,足以在受试者中表现出可检测的治疗或处理效果而没有与合理的益处/风险比率相称的过度的副作用(例如实质性毒性、刺激性和过敏性反应)的活性剂的量。受试者的有效量将取决于受试者的类型,身材和健康状况,所治疗疾病的性质和严重程度,给药方法,治疗持续时间,同时治疗的性质(如果有),具体使用的配方等。因此,不可能预先指定确切的有效量。然而,对于给定情况的有效量可以由本领域普通技术人员基于本文提供的信息使用常规实验来确定。
术语“改善”是指受试者的状况、疾病或其症状的可检测或可测量的改善。可检测的或可测量的改善包括病症或疾病的发生、频率、严重性、进展或持续时间的主观或客观减少、降低、抑制、阻抑、限制或控制,或疾病的症状或根本原因或后果的改善,或疾病的逆转。成功的治疗结果可以导致在受试者中改善、减少、降低、抑制、阻抑、限制、控制或预防疾病或状况的发生、频率、严重性、进展或持续时间,或者疾病或病症的后果的“治疗效果”或“益处”。
减轻或减少恶化,例如稳定病情或疾病,也是成功的治疗结果。因此,治疗益处不需要完全消除或逆转疾病或病症,或与疾病或病症相关的任何、大多数或所有不良症状、并发症、后果或根本原因。因此,当短期或长期(数小时,数天,数周,数月等)存在增加式的改善时,例如部分减少、降低、抑制、阻抑、限制、控制或预防病症或疾病的发生、频率、严重性、进展或持续时间,或者抑制或逆转(例如稳定),则可以达到令人满意的终点。可以通过各种方法和测试测定来确定方法或用途的有效性,例如提供病症或疾病的潜在治疗益处或改善的治疗。
术语DCLK1同工型2和DCLK1同工型4是指由RefSeq NM_001330072.1(同工型2)和NM_001195416.1(同工型4)表示的转录物序列产生的多肽同工型。DCLK1同工型2进一步定义为具有氨基酸序列SEQ ID NO:1(表1),DCLK1同工型4进一步定义为具有氨基酸序列SEQID NO:2(表2)。
表1.DCLK1同工型2的氨基酸序列
MSFGRDMELEHFDERDKAQRYSRGSRVNGLPSPTHSAHCSFYRTRTLQTLSSEKKAKKVRFYRNGDRYFKGIVYAISPDRFRSFEALLADLTRTLSDNVNLPQGVRTIYTIDGLKKISSLDQLVEGESYVCGSIEPFKKLEYTKNVNPNWSVNVKTTSASRAVSSLATAKGSPSEVRENKDFIRPKLVTIIRSGVKPRKAVRILLNKKTAHSFEQVLTDITDAIKLDSGVVKRLYTLDGKQVMCLQDFFGDDDIFIACGPEKFRYQDDFLLDESECRVVKSTSYTKIASSSRRSTTKSPGPSRRSKSPASTSSVNGTPGSQLSTPRSGKSPSPTSPGSLRKQRSSQHGGSSTSLASTKVCSSMDENDGPGEEVSEEGFQIPATITERYKVGRTIGDGNFAVVKECVERSTAREYALKIIKKSKCRGKEHMIQNEVSILRRVKHPNIVLLIEEMDVPTELYLVMELVKGGDLFDAITSTNKYTERDASGMLYNLASAIKYLHSLNIVHRDIKPENLLVYEHQDGSKSLKLGDFGLATIVDGPLYTVCGTPTYVAPEIIAETGYGLKVDIWAAGVITYILLCGFPPFRGSGDDQEVLFDQILMGQVDFPSPYWDNVSDSAKELITMMLLVDVDQRFSAVQVLEHPWVNDDGLPENEHQLSVAGKIKKHFNTGPKPNSTAAGVSVIATTALDKERQVFRRRRNQDVRSRYKAQPAPPELNSESEDYSPSSSETVRSPNSPF。
表2.DCLK1同工型4的氨基酸序列
MLELIEVNGTPGSQLSTPRSGKSPSPSPTSPGSLRKQRSSQHGGSSTSLASTKVCSSMDENDGPGEEVSEEGFQIPATITERYKVGRTIGDGNFAVVKECVERSTAREYALKIIKKSKCRGKEHMIQNEVSILRRVKHPNIVLLIEEMDVPTELYLVMELVKGGDLFDAITSTNKYTERDASGMLYNLASAIKYLHSLNIVHRDIKPENLLVYEHQDGSKSLKLGDFGLATIVDGPLYTVCGTPTYVAPEIIAETGYGLKVDIWAAGVITYILLCGFPPFRGSGDDQEVLFDQILMGQVDFPSPYWDNVSDSAKELITMMLLVDVDQRFSAVQVLEHPWVNDDGLPENEHQLSVAGKIKKHFNTGPKPNSTAAGVSVIATTALDKERQVFRRRRNQDVRSRYKAQPAPPELNSESEDYSPSSSETVRSPNSPF。
如本文所用,术语“抗体”既可以指完整的“全长”抗体,也可以指其DCLK1结合片段(本文也称为抗原结合片段,抗原结合部分,结合片段或结合部分)。如本文所用,术语“抗体”包括但不限于合成抗体,单克隆抗体,重组产生的抗体,内抗体(intrabody),多特异性抗体(包括双特异性抗体),人抗体,人源化抗体,嵌合抗体,其中轻链和重链可变区通过肽接头连接的重组单链多肽分子,即单链Fv(scFv)片段,二价scFv(bi-scFv),三价scFv(tri-scFv),Fab片段,Fab'片段,F(ab')片段,F(ab')2片段,F(ab)2片段,二硫键连接的Fv(sdFv)(包括双特异性sdFv)和抗独特型(anti-Id)抗体,双抗体,dAb片段,纳米抗体,双抗体,三抗体,四抗体,线性抗体,分离的CDR和以上任何一种的表位结合片段。不论结构如何,抗体片段都与完整抗体识别的相同抗原结合。例如,抗DCLK1抗体片段与DCLK1的表位结合。片段可以通过重组DNA技术或完整免疫球蛋白的酶促或化学分离产生。
本文提供的几个实施方案的抗体可以是单特异性,双特异性,三特异性或更大的多特异性,例如由抗体片段形成的多特异性抗体。术语“抗体”还包括双抗体(同型二聚Fv片段)或小抗体(VL-VH-CH3),双特异性抗体等。双特异性或双功能抗体是具有两个不同的重链/轻链对和两个不同的结合位点的人工杂合抗体。多特异性抗体可以对多肽的不同表位具有特异性,或者对多肽以及异源表位(例如异源多肽或固体支持物)都具有特异性。通过使用重组方法或合成接头连接抗体片段而产生的单链抗体也包括在本公开内容中(例如,参见国际专利申请公开号WO 93/17715;WO 92/08802;WO 91/00360;和WO 92/05793;以及美国专利4,474,893、4,714,681、4,925,648、5,573,920和5,601,819)。
如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群体中获得的抗体,即,除了可能以少量存在的天然突变以外,构成该群体的各个抗体是相同的。修饰语“单克隆”表示从基本上同质的抗体群体获得的抗体的特征,并且不应解释为要求通过任何特定方法来生产抗体。例如,根据本发明使用的针对DCLK1同工型2和4的单克隆抗体可以通过首先由Kohler等(Nature 256:495(1975))描述的杂交瘤方法来制备,或可以通过重组DNA方法制备(参见,例如,美国专利号4,816,567)。
本文所述的组合物,制剂和方法可包括单克隆抗体。可以通过本领域技术人员已知的方法获得针对特定抗原的啮齿类动物单克隆抗体(例如,参见Kohler和Milstein,同上,和Coligan等(编辑),Current Protocols in Immunology,第1卷,第2.5.1-2.6.7页(John Wiley&Sons1991))。克隆鼠类免疫球蛋白可变域的一般技术已公开于例如Orlandi等的出版物(Proc.Natl.Acad.Sci.USA 86:3833(1989))中。
“分离的”抗体是指已经从其天然环境的成分中鉴定和分离和/或回收的抗体和/或重组产生的抗体。“纯化的抗体”是这样的抗体,其通常对于由其生产或纯化引起的干扰蛋白和其他污染物而言至少50%w/w纯,但不排除该单克隆抗体与过量的药学上可接受的载体或旨在促进其使用的其他赋型剂组合的可能性。干扰蛋白和其他污染物可包括例如从中分离或重组产生抗体的细胞的细胞组分。有时,单克隆抗体对于来自生产或纯化的干扰蛋白和污染物而言纯度为至少60%、至少70%、至少80%、至少90%、至少95%或至少99%w/w。可以以分离和/或纯化的形式提供本文所述的抗体,包括鼠、嵌合和人源化抗体。
“治疗剂”是可用于治疗疾病的原子、分子或化合物。治疗剂的实例包括但不限于抗体,抗体片段,药物,细胞因子或趋化因子抑制剂,促凋亡剂,酪氨酸激酶抑制剂,毒素,酶,核酸酶,激素,免疫调节剂,反义寡核苷酸,siRNA,RNAi,螯合剂,硼化合物,光敏剂,染料和放射性同位素。
“诊断剂”是可用于诊断疾病的原子,分子或化合物。有用的诊断剂包括但不限于放射性同位素,染料,造影剂,荧光化合物或分子和增强剂(例如顺磁性离子)。在某些特定的(但非限制性的)实施方案中,诊断剂选自放射性同位素,增强剂和荧光化合物。
“免疫缀合物”或“抗体-药物缀合物”是抗体与原子、分子或更高阶结构(例如,与脂质体)、治疗剂或诊断剂的缀合物。本文所用的术语“抗体”也可以指完整的抗体,也指与治疗剂(例如,细胞毒性或细胞抑制药)或诊断剂缀合的DCLK1结合片段。
如本文所用,术语“抗体融合蛋白”是重组产生的抗原结合分子,其中抗体或抗体片段连接另一种蛋白质或肽,例如相同或不同的抗体或抗体片段。融合蛋白可包含单个抗体组分,不同抗体组分的多价或多特异性组合或相同抗体组分的多个拷贝。融合蛋白可另外包含抗体或抗体片段和治疗剂。
基本抗体结构单元是亚基的四聚体。每个四聚体包括两对相同的多肽链,每对具有一条“轻”链(约25kDa)和一条“重”链(约50-70kDa)。每条链的氨基末端部分包括约100至120个或更多个氨基酸的可变区,包括如下所述的称为互补决定区的部分,主要负责抗原识别。该可变区最初被表达为与可裂解的信号肽连接的形式。没有信号肽的可变区有时被称为成熟可变区。因此,例如,“轻链成熟可变区”是指没有轻链信号肽的轻链可变区。每条链的羧基末端部分定义一个恒定区,主要负责效应子功能。
轻链分为κ或λ。重链被分类为γ,μ,α,δ或ε,并将抗体的同工型分别定义为IgG,IgM,IgA,IgD和IgE。在轻链和重链中,可变区和恒定区由约12个或更多氨基酸的“J”区相连,重链还包括约10个或更多氨基酸的“D”区。(一般参见Fundamental Immunology(Paul,W.,ed.,2nd ed.Raven Press,N.Y.,1989,,第7章))。
每个轻/重链对的成熟可变区形成抗体结合位点。因此,完整的抗体具有两个结合位点。除双功能或双特异性抗体外,两个结合位点相同。链均显示由三个高变区(也称为互补决定区或CDR)连接的相对保守的框架区(FR)的相同一般结构。来自每个对的两条链的CDR通过框架区对齐,从而能够结合至特定的表位。从N末端到C末端,轻链和重链均包含结构域FR1,CDR1,FR2,CDR2,FR3,CDR3和FR4。氨基酸对每个结构域的分配根据Kabat(Sequences of Proteins of Immunological Interest(National Institutes ofHealth,Bethesda,Md.,1987and 1991)或Chothia&Lesk(J.Mol.Biol.196:901-917(1987);Chothia et al.,Nature 342:878-883(1989))的定义。Kabat还提供了一种广泛使用的编号约定(Kabat编号),其中不同重链之间或不同轻链之间的相应残基分配了相同的编号。
在某些非限制性的实施方案中,本文公开的抗体或其抗原结合部分包含至少一个重链可变区和/或至少一个轻链可变区。重链可变区(或轻链可变区)可以包含三个CDR和四个构架区(FR),从氨基端到羧基端按以下顺序排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4。
术语“表位”是指抗原上抗体结合的位点。表位可以由通过一种或多种蛋白质的三级折叠而并置的连续氨基酸或不连续氨基酸形成。由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而由三级折叠形成的表位在用变性溶剂处理时通常会丧失。表位通常以独特的空间构象包含至少3个、更通常至少5或8-10个氨基酸。确定表位的空间构象的方法包括例如X射线晶体学和二维核磁共振。参见例如“Epitope Mapping Protocols”,Methodsin Molecular Biology,Vol.66,Glenn E.Morris,Ed.(1996)。
同样在本公开内容的范围内的是其中特定氨基酸已被取代、缺失或添加的抗体或其抗原结合部分。这些改变对肽的生物学特性例如(但不限于)结合活性没有实质性影响。例如,抗体可以在构架区中具有氨基酸取代,以例如改善与抗原的结合。在另一个实例中,所选的少量受体框架残基可以被相应的供体氨基酸取代。供体框架可以是成熟的或种系的人抗体框架序列或共有序列。Bowie等人(Science,247:1306-1310(1990)),Cunningham等人(Science,244:1081-1085(1989)),Ausubel(编)(Current Protocols in MolecularBiology,John Wiley and Sons,Inc.(1994)),Maniatis等人(Molecular Cloning:ALaboratory Manual,Cold Spring Harbor laboratory,Cold Spring Harbor,N.Y.(1989)),Pearson(Methods Mol.Biol.243:307-31(1994))和Gonnet等人(Science 256:1443-45(1992))提供了关于如何进行表型沉默氨基酸取代的指南。
为了将氨基酸取代分类为保守或非保守,在一个非限制性的实施方案中将氨基酸分组如下:I组(疏水性侧链):met,ala,val,leu,ile;II组(中性亲水性侧链):cys,ser,thr;III组(酸性侧链):asp,glu;IV组(碱性侧链):asn,gln,his,lys,arg;V组(影响链取向的残基):gly,pro;和VI组(芳香族侧链):trp,tyr,phe。保守取代涉及同一组氨基酸之间的取代。非保守取代包括将这些组之一的成员替换为另一组的成员。
已经构建了保守氨基酸取代的表并且在本领域中是已知的。在其他实施方案中,可互换的氨基酸的实例包括但不限于以下:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。在其他非限制性的实施方案中,可以进行以下取代:Ala(A)由leu,ile或val取代;Arg(R)由gln,asn或lys取代;Asn(N)由his,asp,lys,arg或gln取代;Asp(D)由asn或glu取代;Cys(C)由ala或ser取代;Gln(Q)由glu或asn取代;Glu(E)由gln或asp取代;Gly(G)由ala取代;His(H)由asn,gln,lys,或arg取代;Ile(I)由val,met,ala,phe或leu取代;Leu(L)由val,met,ala,phe或ile取代;Lys(K)由gln,asn或arg取代;Met(M)由phe,ile或leu取代;Phe(F)由leu,val,ile,ala或tyr取代;Pro(P)由ala取代;Ser(S)由thr取代;Thr(T)由ser取代;Trp(W)由phe或tyr取代;Tyr(Y)由trp,phe,thr或ser取代;以及Val(V)由ile,leu,met,phe或ala取代。
氨基酸取代的其他考虑因素包括残基是否位于蛋白质内部或是否暴露于溶剂(即外部)。对于内部残基,保守取代包括例如:Asp和Asn;Ser和Thr;Ser和Ala;Thr和Ala;Ala和Gly;Ile和Val;Val和Leu;Leu和Ile;Leu和Met;Phe和Tyr;以及Tyr和Trp。对于溶剂暴露的残基,保守取代包括例如:Asp和Asn;Asp和Glu;Glu和Gln;Glu和Ala;Gly和Asn;Ala和Pro;Ala和Gly;Ala和Ser;Ala和Lys;Ser和Thr;Lys和Arg;Val和Leu;Leu和Ile;Ile和Val;以及Phe和Tyr。
序列同一性百分比可以通过由Kabat编号约定最大比对的抗体序列来确定。对齐后,如果将特定抗体区域(例如,重链或轻链的整个成熟可变区)与参考抗体的相同区域进行比较,则目标和参考抗体区域之间的序列同一性百分比为目标和参考抗体区域中相同氨基酸占据的位置除以两个区域的对齐位置总数(未计算缺口),乘以100即可转换成百分比。
“包括”一个或多个所列举的元件的组合物或方法可以包括未具体列举的其他元件。例如,包含抗体的组合物可以单独或与其他成分组合地包含抗体。短语“药学上可接受的盐”是指抗DCLK1抗体或其结合片段或缀合物或与抗DCLK1抗体一起施用的药物的药学上可接受的有机或无机盐。示例性的盐包括硫酸盐,柠檬酸盐,乙酸盐,草酸盐,氯化物,溴化物,碘化物,硝酸盐,硫酸氢盐,磷酸盐,酸性磷酸盐,异烟酸盐,乳酸盐,水杨酸盐,酸性柠檬酸盐,酒石酸盐,油酸盐,鞣酸盐,泛酸盐,酒石酸氢盐,抗坏血酸盐,琥珀酸盐,马来酸盐,龙胆酸盐,富马酸盐,葡萄糖酸盐,葡糖醛酸盐,蔗糖酸盐,甲酸盐,苯甲酸盐,谷氨酸盐,甲磺酸盐,乙磺酸盐,苯磺酸盐,对甲苯磺酸盐和棕榈酸盐(即1,1'亚甲基双-(2-羟基-3-萘甲酸盐))盐。药学上可接受的盐可包括包含另一种分子,例如但不限于乙酸根离子,琥珀酸根离子或其他抗衡离子。抗衡离子可以是稳定母体化合物上的电荷的任何有机或无机部分。此外,药学上可接受的盐在其结构中可以具有一个以上的带电原子。其中多个带电原子是药学上可接受的盐的一部分的实例可以具有多个抗衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个抗衡离子。
嵌合抗体是其中不同部分衍生自不同动物物种的分子。例如,抗体可包含源自鼠mAb的可变区和人免疫球蛋白恒定区。嵌合抗体可以通过重组DNA技术产生,例如参见Morrison等(Proc Natl Acad Sci,81:6851-6855(1984))。例如,用限制酶消化编码鼠(或其他物种)单克隆抗体分子的基因以除去编码鼠Fc的区域,并代之以编码人Fc恒定区的基因的等效部分。嵌合抗体也可以通过重组DNA技术产生,其中编码鼠类可变区的DNA可以与编码人恒定区的DNA连接,例如,参见国际专利公开号WO 87/002671和WO 86/01533,以及美国专利No.4,816,567。
嵌合抗体是一种重组蛋白,其包含衍生自一种物种的抗体(例如啮齿动物或兔抗体)的互补决定区(CDR)的可变域,而抗体分子的恒定域通常衍生自人类抗体。对于兽医应用,嵌合抗体的恒定结构域可以衍生自其他物种的恒定结构域,例如但不限于猫,狗或马。
嵌合抗体可以通过用一个或多个不同的人FR序列替换嵌合抗体的可变域中的例如鼠构架序列(FR)的序列来人源化。具体而言,将小鼠CDR从小鼠免疫球蛋白的重链和轻链可变链转移到人抗体的相应可变域中。由于简单地将小鼠CDR转移到人FR中可能会导致抗体亲和力降低,因此可能需要进行其他修饰以恢复鼠抗体的原始亲和力。这可以通过用其鼠对应物替换FR区中的一个或多个人残基来实现,以获得对DCLK1表位具有增强的结合亲和力的抗体(例如,参见Tempest等,Biotechnology 9:266(1991)和Verhoeyen等,Science239:1534(1988))。产生人源化抗体的技术公开于例如Jones等人(Nature 321:522(1986)),Riechmann等人(Nature 332:323(1988)),Verhoeyen等人(Science 239:1534(1988)),Carter等人(Proc.Nat'l Acad.Sci.USA 89:4285(1992)),Sandhu(Crit.Rev.Biotech.12:437(1992))和Singer等人(J.Immun.150:2844(1993))中。
如所指出的,抗体的轻链或重链可变区由被三个高变区(称为互补决定区(CDR))中断的框架区组成。在一个非限制性的实施方案中,人源化抗体是来自非人类物种的抗体分子,其具有来自该非人类物种的一个、两个或全部CDR以及来自人类免疫球蛋白分子的框架区。
人源化抗体是一种基因工程抗体,其中将来自非人“供体”抗体的可变重链和可变轻链CDR移植到人“受体”抗体序列中(参见,例如,美国专利号5,530,101;5,585,089;5,225,539;6,407,213;5,859,205;和6,881,557)。受体抗体序列可以是例如成熟的人抗体序列,此类序列的复合体,人抗体序列的共有序列或种系区域序列。因此,人源化抗体是具有一些或全部CDR完全或基本上来自非人供体抗体以及可变区框架序列和恒定区(如果存在的话)全部或基本上来自人抗体序列的抗体。类似地,人源化重链具有至少一个、两个且通常全部三个CDR全部或基本上来自供体抗体重链,以及重链可变区框架序列和重链恒定区(如果存在的话)基本上来自人重链可变区框架和恒定区序列。类似地,人源化轻链具有至少一个、两个且通常全部三个CDR完全或基本上来自供体抗体轻链,以及轻链可变区框架序列和轻链恒定区(如果存在的话)基本上来自人轻链可变区框架和恒定区序列。除了纳米抗体和dAb外,人源化抗体还包含人源化重链和人源化轻链。
如所指出的,可以通过用来自人可变区的等同序列替换可变区内不直接参与抗原结合的框架序列来产生人源化抗体。那些方法包括分离、操纵和表达编码来自重链或轻链的至少一个中的全部或部分可变区的核酸序列。此类核酸的来源可得自产生抗DCLK1同工型2或4的抗体的杂交瘤,例如如本文所述。然后可以将编码人源化抗体或其片段的重组DNA克隆到合适的表达载体中。抗体轻链或重链可变区由被三个高变区(CDR)中断的框架区组成。在一个非限制性的实施方案中,人源化抗体是来自非人类物种的抗体分子,其具有来自该非人类物种的一个、两个或全部CDR以及来自人类免疫球蛋白分子的框架区。
可以通过用来自人可变区的等同序列替换可变区内不直接参与抗原结合的框架序列来产生人源化抗体。那些方法包括分离、操纵和表达编码来自重链或轻链中至少一个的全部或部分可变区的核酸序列。此类核酸的来源是本领域技术人员众所周知的,并且例如可以从产生针对DCLK1同工型2或4的抗体的杂交瘤获得,例如本文所述。然后可以将编码人源化抗体或其片段的重组DNA克隆到合适的表达载体中。
本公开的人源化抗体可以通过本领域已知的方法产生。例如,一旦获得非人(例如鼠)抗体,就可以对可变区进行测序,并确定CDR和构架残基的位置。参阅例如Kabat等人((1991)Sequences of Proteins of Immunological Interest,第5版,U.S.Departmentof Health and Human Services,NIH Publication No.91-3242)和Chothia等人(J.Mol.Biol.,196:901-917(1987))。轻链和重链可变区可以任选地连接相应的恒定区。CDR移植的抗体分子可以通过CDR移植或CDR取代产生。免疫球蛋白链的一个、两个或所有CDR均可被替换。例如,特定抗体的所有CDR可以来自非人类动物(例如,小鼠,例如但不限于本文所示的CDR)的至少一部分,或者可以仅替换某些CDR。仅需要保留抗体与DCLK1同工型2或4的特异性和高结合亲和力所需的CDR。
可以从转基因非人动物获得完全人抗体。(参见,例如,Mendez等(NatureGenetics,15:146-156,1997)和美国专利号5,633,425)。使用组合方法或用人免疫球蛋白基因座转化的转基因动物产生完全人抗体的方法是已知的(例如Mancini等(NewMicrobiol.27:315-28(2004));Conrad和Scheller(Comb.Chem.High ThroughputScreen.8:117-26(2005);以及Brekke和Loset(Curr.Opin。(Pharmacol.3:544-50(2003))。与嵌合或人源化抗体相比,预期此类完全人抗体表现出甚至更少的副作用,并且在体内作为基本上内源性的人抗体起作用。在某些非限制性的实施方案中,要求保护的方法和操作可以利用通过这种技术产生的人抗体。
当人源化或人抗体中的CDR与非人抗体中的相应CDR中至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%或100%的相应残基(如Kabat所定义)相同时,则该人源化或人抗体中的CDR基本上衍生自该非人抗体中的相应CDR或与其基本上相同。在一些非限制性的实施方案中,当在任何给定的CDR中有不超过一个、两个或三个保守氨基酸取代时,则人源化抗体或人抗体中的CDR基本上衍生自非人抗体中的相应CDR或与其基本相同。当抗体链的可变区框架序列或抗体链的恒定区与人可变区框架序列或人恒定区有至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%或约100%的相应残基(Kabat编号定义)相同时,则该抗体链的可变区框架序列或抗体链的恒定区基本上来自人可变区框架序列或人恒定区。尽管人源化抗体通常掺入来自非人(例如小鼠或兔)抗体的所有六个CDR(例如Kabat定义),但也可以用少于全部非人CDR(例如至少2、3、4或5个)来制备人源化抗体。
本公开的人源化抗体可以通过本领域已知的方法产生。例如,一旦获得非人(例如鼠)抗体,就可以对可变区进行测序,并确定CDR和构架残基的位置(Kabat等人,Sequencesof Proteins of Immunological Interest,第5版,U.S.Department of Health andHuman Services,NIH Publication No.91-3242(1991);Chothia等人,J.Mol.Biol.,196:901-917(1987))。轻链和重链可变区可以任选地连接相应的恒定区。CDR移植的抗体分子可以通过CDR移植或CDR取代产生。免疫球蛋白链的一个、两个或所有CDR均可被替换。例如,特定抗体的所有CDR可以来自非人类动物(例如小鼠,例如但不限于本文所示的CDR)的至少一部分,或者可以仅替换某些CDR。仅需要保留抗体与DCLK1同工型2或4的特异性和高结合亲和力所需的CDR。
在某些非限制性的实施方案中,本公开提供了抗DCLK1抗体,其中重链可变区与本文公开的重链可变序列有至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%,至少约92%,至少约93%,至少约94%,至少约95%、至少约96%,至少约97%,至少约98%,至少约99%或约100%相同,并且轻链可变区与本文公开的轻链可变序列有至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%、至少约92%,至少约93%,至少约94%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或约100%相同。在一些方面,该抗体是人源化抗体,并且在重链可变框架区中存在至少一个鼠类回复突变。在其他方面,该抗体是人源化抗体,并且在轻链可变框架区中存在至少一个鼠类回复突变。
另外,本公开内容提供了抗体,其中人源化重链可变区包含与本文公开的重链可变序列的CDR有至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%,至少约92%,至少约93%,至少约94%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或约100%序列同一性的CDR,并且人源化轻链可变区包含与本文公开的轻链可变序列的CDR有至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%,至少约92%,至少约93%,至少约94%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或约100%序列同一性的CDR。
人源化抗体的重链和轻链可变区可以与人恒定区的至少一部分连接,例如对于人抗体同工型IgG1,IgG2,IgG3或IgG4而言。轻链恒定区可以是λ或κ。抗体可以表达为包含两个轻链和两个重链的四聚体,单独的重链、轻链,Fab,Fab',F(ab')2和Fv,或表达为其中重链和轻链可变域通过间隔子连接的单链抗体。本公开涵盖所有抗体同工型,包括IgG(例如,IgG1,IgG2,IgG3,IgG4),IgM,IgA(IgA1,IgA2),IgD或IgE。抗体或其抗原结合部分可以是哺乳动物(例如小鼠,兔,人)抗体或其抗原结合部分。
人源化或嵌合抗体通常通过重组表达产生。重组多核苷酸构建体通常包括与抗体链的编码序列可操作地连接的表达控制序列,包括天然相关或异源的启动子区域。表达控制序列可以是能够转化或转染真核宿主细胞的载体中的真核启动子系统。一旦将载体掺入合适的宿主中,就将宿主维持在适合于核苷酸序列的高水平表达以及交叉反应抗体的收集和纯化的条件下。
哺乳动物细胞可用作表达编码免疫球蛋白或其片段的核苷酸片段的宿主(例如,参见Winnacker,From Genes to Clones,VCH Publishers,NY,1987)。现有技术中已经开发了许多能够分泌完整异源蛋白质的合适宿主细胞系,包括(但不限于)CHO细胞系(例如DG44),各种COS细胞系,HeLa细胞,HEK293细胞,L细胞和不产生抗体的骨髓瘤,包括Sp2/0和NS0。在一些具体(但非限制性的)实施方案中,细胞是非人类的。这些细胞的表达载体可包括表达控制序列,例如(但不限于)复制起点,启动子,增强子(例如,Queen等,Immunol.Rev.89:49(1986)),以及必要的加工信息位点,例如(但不限于)核糖体结合位点,RNA剪接位点,聚腺苷酸化位点和转录终止子序列。表达控制序列的例子包括但不限于源自内源性基因、巨细胞病毒、SV40、腺病毒或牛乳头瘤病毒的启动子(例如参见Co等,J.Immunol.148:1149(1992))。
可以通过下面描述的多种技术提供针对DCLK1蛋白的人抗体。一旦表达,就可以根据本领域的标准程序纯化抗体,包括但不限于HPLC纯化、柱色谱法和凝胶电泳。产生人抗体的方法包括但不限于美国专利No.4,634,664、4,634,666、5,877,397、5,874,299、5,814,318、5,789,650、5,770,429、5,661,016、5,633,425、5,625,126、5,569,825、5,545,806、5,877,218、5,871,907、5,858,657、5,837,242、5,733,743和5,565,332;以及国际专利申请公开号WO 91/17271、WO 92/01047和WO93/12227中提到的方法。
本公开还涵盖编码与DCLK1蛋白特异性结合的本发明抗体或其抗原结合部分的核酸。核酸可在细胞中表达以产生目前公开的抗体或其抗原结合部分。本公开内容的分离的核酸包含例如(但不限于)编码与SEQ ID NO:3-12、14、16-22、24和26-32中至少其一至少约70%,至少约75%,至少约80%,至少约81%,至少约82%,至少约83%,至少约84%,至少约85%,至少约86%,至少约87%,至少约88%,至少约89%,至少约90%,至少约91%,至少约92%,至少约93%,至少约94%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或约100%同源的肽的序列。
可以将编码本发明的抗体或其抗原结合部分的核酸引入可以在合适的表达系统中表达的表达载体中,然后分离或纯化所表达的抗体或其抗原结合部分。任选地,可以在无细胞翻译系统中翻译编码本发明抗体或其抗原结合部分的核酸,例如参见美国专利No.4,816,567。
抗DCLK1抗体或其抗原结合部分可以通过用编码所需抗体的轻链和重链(或其CDR部分)的DNA转化的宿主细胞产生。可以使用标准技术从这些培养上清液和/或细胞中分离和纯化抗体。例如,可以用编码抗体的轻链、重链或两者的DNA转化宿主细胞。重组DNA技术也可用于除去编码对于结合不是必需的轻链和重链中的一个或两个(例如恒定区)的部分或全部DNA。
本发明的核酸可以在各种合适的细胞中表达,包括原核和真核细胞,例如细菌细胞(例如大肠杆菌),酵母细胞,植物细胞,昆虫细胞和哺乳动物细胞。许多哺乳动物细胞系是本领域已知的,包括(但不限于)可从美国典型培养物保藏中心(ATCC)获得的永生细胞系。细胞的非限制性实例包括哺乳动物起源或哺乳动物样特征的所有细胞系,包括但不限于猴肾细胞的亲代细胞、衍生物和/或工程变体(COS,例如COS-1,COS-7),HEK293,幼仓鼠肾细胞(BHK,例如BHK21),中国仓鼠卵巢细胞(CHO),NS0,PerC6,BSC-1,人肝细胞癌细胞(例如HepG2),SP2/0,HeLa,Madin-Darby牛肾(MDBK)细胞,骨髓瘤细胞和淋巴瘤细胞。工程化的变体包括(例如但不限于)聚糖谱修饰的和/或位点特异性整合位点衍生物。
本公开还提供了包含本文所述核酸的细胞。细胞可以是杂交瘤或转染子。上面讨论了细胞类型的示例。
各种技术,例如嵌合或人源化抗体的生产,可能涉及抗体克隆和构建的过程。可以通过多种分子克隆程序,例如RT-PCR,5'-RACE和cDNA文库筛选,获得目标抗体的抗原结合VL(可变轻链)和VH(可变重链)序列。可以通过PCR扩增来克隆来自表达鼠抗体的细胞的抗体的VL和VH基因并进行测序。为了证实其真实性,克隆的VL和VH基因可以在细胞培养物中作为嵌合抗体表达,例如(但不限于)如Orlandi等(Proc.Natl.Acad.Sci.,USA,86:3833(1989))所述。基于VL和VH基因序列,然后可以按照例如但不限于Leung等(Mol.Immunol.,32:1413(1995))所述设计和构建人源化抗体。
本公开进一步提供了编码本文所述的任何人源化重链和轻链的核酸。通常,所述核酸还编码与成熟重链和轻链融合的信号肽。核酸上的编码序列可以与调节序列可操作地连接以确保编码序列的表达,例如(但不限于)启动子、增强子、核糖体结合位点、转录终止信号等。在另外的实施方案中,本公开内容包括包含编码重链和轻链的核酸的载体,以及已经用这种载体转染的宿主细胞。可以通过例如(但不限于)固态合成或重叠寡核苷酸的PCR来合成核酸。编码重链和轻链的核酸可以连接成一个连续核酸,例如在表达载体内,或者可以是分开的,例如各自克隆到其自身的表达载体中。
在一个非限制性的实施方案中,本公开内容提供了一种分离的多核苷酸,其编码包含SEQ ID NO:14或SEQ ID NO:24的氨基酸序列的抗体重链可变区。该分离的多核苷酸可以进一步编码人IgG重链恒定区(例如,IgG1,IgG2,IgG3或IgG4)。在一个非限制性的实施方案中,IgG恒定区的氨基酸序列包含一个或多个取代。本公开还提供了表达载体,其包含编码含有SEQ ID NO:14或SEQ ID NO:24的氨基酸序列的抗体重链可变区的所述多核苷酸,还提供了包含该表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在另一个非限制性的实施方案中,本公开内容提供了分离的多核苷酸,其编码包含SEQ ID NO:16或SEQ ID NO:26的氨基酸序列的抗体轻链可变区。该分离的多核苷酸可以进一步编码人IgG轻链恒定区,例如κ恒定区。κ恒定区的氨基酸序列可以包含一个或多个取代。本公开还提供了表达载体,其包含编码含有SEQ ID NO:16或SEQ ID NO:26的氨基酸序列的抗体轻链可变区的所述多核苷酸,还提供了包含该表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在一个非限制性的实施方案中,本公开提供了编码包含SEQ ID NO:14或SEQ IDNO:24的氨基酸序列的抗体重链可变区的分离的重链多核苷酸,以及编码包含SEQ ID NO:16或SEQ ID NO:26的氨基酸序列的抗体轻链可变区的分离的轻链多核苷酸。重链多核苷酸可进一步编码人IgG重链恒定区(例如IgG1,IgG2,IgG3或IgG4)。在一个非限制性的实施方案中,IgG恒定区的氨基酸序列包含一个或多个取代。轻链多核苷酸可进一步编码人IgG轻链恒定区,例如κ恒定区。IgG恒定区的氨基酸序列可以包含一个或多个取代。κ恒定区的氨基酸序列可以包含一个或多个取代。本公开还提供了表达载体,其包含编码包含SEQ IDNO:14或SEQ ID NO:24的氨基酸序列的抗体重链可变区和包含SEQ ID NO:16或SEQ ID NO:26的氨基酸序列的抗体轻链可变区的所述多核苷酸。本公开内容还提供了包含所述表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在一个非限制性的实施方案中,本公开内容提供了分离的多核苷酸,其编码包含SEQ ID NOS:17、18和19中的一个或多个或SEQ ID NOS:27、28和29中的一个或多个的氨基酸序列的抗体重链可变区。该分离的多核苷酸可以进一步编码人IgG重链恒定区(例如IgG1,IgG2,IgG3或IgG4)。在一个非限制性的实施方案中,IgG恒定区的氨基酸序列包含一个或多个取代。本公开内容还提供了包含编码所述重链可变区的多核苷酸的表达载体,以及进一步包括包含该表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在另一个非限制性的实施方案中,本公开提供了编码抗体轻链可变区的分离的多核苷酸,所述抗体轻链可变区包含SEQ ID NO:20、21和22中的一个或多个或SEQ ID NO:30、31和32中的一个或多个的氨基酸序列。该分离的多核苷酸可以进一步编码人IgG轻链恒定区,例如κ恒定区。κ恒定区的氨基酸序列可以包含一个或多个取代。本公开还提供了包含编码所述轻链可变区的多核苷酸的表达载体,并且进一步提供了包含该表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在一个非限制性的实施方案中,本公开提供了编码包含SEQ ID NOS:17、18和19中的一个或多个的抗体重链可变区的分离的重链多核苷酸,以及编码包含SEQ ID NO:20、21和22中的一个或多个的抗体轻链可变区的分离的轻链多核苷酸。重链多核苷酸可以进一步编码人IgG重链恒定区(例如,IgG1,IgG2,IgG3或IgG4)。在一个非限制性的实施方案中,IgG恒定区的氨基酸序列包含一个或多个取代。轻链多核苷酸可进一步编码人IgG轻链恒定区,例如κ恒定区。IgG恒定区的氨基酸序列可以包含一个或多个取代。κ恒定区的氨基酸序列可以包含一个或多个取代。本公开内容还提供了表达载体,其包含编码包含SEQ ID NOS:17、18和19中的一个或多个的重链可变区的所述多核苷酸,以及编码包含SEQ ID NO:20、21和22中的一个或多个的抗体轻链可变区的分离的轻链多核苷酸。本公开内容还提供了包含表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在一个非限制性的实施方案中,本公开提供了编码包含SEQ ID NOS:27、28和29中的一个或多个的抗体重链可变区的分离的重链多核苷酸,以及编码包含SEQ ID NO:30、31和32中的一个或多个的抗体轻链可变区的分离的轻链多核苷酸。所述重链多核苷酸可进一步编码人IgG重链恒定区(例如,IgG1,IgG2,IgG3或IgG4)。在一个非限制性的实施方案中,IgG恒定区的氨基酸序列包含一个或多个取代。轻链多核苷酸可进一步编码人IgG轻链恒定区,例如κ恒定区。IgG恒定区的氨基酸序列可以包含一个或多个取代。κ恒定区的氨基酸序列可以包含一个或多个取代。本公开还提供了表达载体,其包含编码包含SEQ ID NOS:27、28和29中的一个或多个的重链可变区的多核苷酸,以及编码包含SEQ ID NO:30、31和32中的一个或多个的抗体轻链可变区的分离的轻链多核苷酸。本公开内容还提供了包含表达载体的宿主细胞。在一些非限制性的实施方案中,宿主细胞是哺乳动物宿主细胞,例如CHO细胞。
在某些非限制性的实施方案中,本发明的抗体或其抗原结合部分可以通过本领域众所周知的固相方法来合成(例如但不限于Solid Phase Peptide Synthesis:APractical Approach,作者E.Atherton和R.C.Sheppard,IRL at Oxford UniversityPress(1989)出版;Methods in Molecular Biology,Vol.35:Peptide SynthesisProtocols(M.W.Pennington和B.M.Dunn编),第7章,Solid Phase Peptide Synthesis,第2版,Pierce Chemical Co.,Rockford,Ill.(1984);G.Barany和R.B.Merrifield,ThePeptides:Analysis,Synthesis,Biology,E.Gross和J.Meienhofer编,第1和2卷,AcademicPress,New York,(1980),pp.3-254;以及M.Bodansky,Principles of PeptideSynthesis,Springer-Verlag,Berlin(1984)中公开的方法)。
本公开提供了制备与DCLK1同工型2或4特异性结合的抗体或其抗原结合部分的方法。例如,非人类动物用包含DCLK1同工型2或4的一部分(例如但不限于SEQ ID NOS:3-12中一个或多个的至少一部分)的组合物进行免疫,然后从该动物中分离特异性抗体。该方法可以进一步包括评估抗体与DCLK1同工型2或4的抗原部分的结合。
可以通过已知技术产生识别特异性表位的抗体片段。抗体片段是抗体的抗原结合部分,例如(但不限于)F(ab)2,Fab',Fab,Fv,scFv和本文所述的其他片段,或本领域中已知的其他片段。其他抗体片段包括但不限于:可以通过胃蛋白酶消化抗体分子产生的F(ab')2片段和可以通过还原F(ab')2的二硫桥生成的Fab'片段。或者,可以构建Fab'表达文库以允许快速和容易地鉴定具有所需特异性的单克隆Fab'片段。在某些非限制性的实施方案中,抗体片段可以是并非scFv片段的片段。
单链Fv分子(scFv)包含VL结构域和VH结构域。VL和VH结构域结合形成目标结合位点。这两个结构域通过肽接头(L)进一步共价连接。制备scFv分子和设计合适的肽接头的方法在本领域中是已知的,包括(但不限于)公开于例如美国专利No.4,704,692和4,946,778中的那些。抗体片段可以通过已知方法来制备,例如(但不限于)公开于美国专利No.4,036,945和4,331,647中的那些。
CDR是抗体可变区的一段,在结构上与抗体结合的表位互补,并且比其余可变区更具可变性。因此,CDR有时被称为高变区。可变区包含三个CDR。CDR肽可通过构建编码目标抗体的CDR的基因来获得。
抗体片段的另一种形式是单结构域抗体(dAb),有时也称为单链抗体。产生单结构域抗体的技术是本领域众所周知的(参见例如但不限于Cossins等,Protein Expressionand Purification,51:253-59(2007);Shuntao等,Molec.Immunol,43:1912-19(2006);Tanha等,J.Biol.Chem.,276:24774-780(2001))。
在某些非限制性的实施方案中,可以改变抗体的序列,例如(但不限于)抗体的Fc部分,以优化缀合物的生理特性,例如(但不限于)在血清中的半衰期。取代蛋白质中的氨基酸序列的方法是本领域广泛已知的,例如(但不限于)通过定点诱变(例如,Sambrook等,Molecular Cloning,A Laboratory manual,第2版,1989)。在某些非限制性的实施方案中,该变异可包括Fc序列中一个或多个糖基化位点的添加或去除(参见例如但不限于美国专利号6,254,868)。
当前公开的抗体或其抗原结合片段对DCLK1同工型2或4的特异性结合KD小于约10-6M,小于约10-7M,小于约10-8M,小于约10-9M,小于约10-10M,小于约10-11M或小于约10-12M。特异性结合在强度上可以可检测地高于至少一个无关靶标发生的非特异性结合并且可以区分开。例如(但不限于如此),当前公开的抗体或其抗原结合片段对包含SEQ ID NO:10的表位具有小于约10-6M,小于约10-7M,小于约10-8M,小于约10-9M,小于约10-10M,小于约10-11M或小于约10-12M的特异性结合KD。
本发明公开的抗DCLK1抗体及其结合片段可以被衍生化或连接,例如缀合至治疗剂和/或诊断剂,以形成抗体-药物缀合物(ADC)。例如,抗体可以通过共价键合或通过非共价相互作用与一个或多个其他分子实体(例如但不限于另一种抗体,抗体片段,可检测剂,细胞毒剂,药物,可以介导与另一个分子(例如链霉亲和素核心区域或聚组氨酸标签)的缔合的蛋白质或肽,氨基酸接头,间隔区,桥,信号序列,免疫原性载体或可用于蛋白质纯化的配体(例如但不限于谷胱甘肽-S-转移酶,组氨酸标签和葡萄球菌蛋白A)直接或间接地功能性连接。可以将蛋白衍生化(或标记)的有用的可检测试剂包括但不限于荧光化合物,各种酶,辅基,发光材料,生物发光材料和放射性材料。非限制性的示例性荧光可检测剂包括荧光素,异硫氰酸荧光素,若丹明和藻红蛋白。蛋白质或抗体也可以用可检测的酶衍生化,例如但不限于碱性磷酸酶,辣根过氧化物酶,β-半乳糖苷酶,乙酰胆碱酯酶,葡萄糖氧化酶等。蛋白质也可以用辅基(例如但不限于链霉亲和素/生物素和抗生物素蛋白/生物素)衍生化。
用于与抗体缀合的特别合适的部分(但不限于此)是细胞毒性剂(例如化学治疗剂),前药转化酶,放射性核素(例如但不限于放射性同位素或化合物),免疫调节剂,抗血管生成剂,促凋亡剂,细胞因子,趋化因子,药物,激素,siRNA,酶,生长因子,前药,寡核苷酸,促凋亡剂,干扰RNA,光敏治疗剂,酪氨酸激酶抑制剂,Bruton激酶抑制剂,鞘氨醇抑制剂,细胞毒性剂或毒素(这些部分统称为治疗剂或药物)。例如(但不限于此),可以将抗DCLK1抗体与细胞毒性剂例如化学治疗剂或毒素(例如,细胞抑制剂或杀细胞剂,例如阿布林,蓖麻毒素A,假单胞菌外毒素或白喉毒素)缀合。有用类别的细胞毒性剂的例子包括但不限于DNA小沟结合剂,DNA烷基化剂和微管蛋白抑制剂。示例性的细胞毒性剂包括但不限于澳瑞他汀,喜树碱,杜卡霉素,依托泊苷,美登素和美登木素生物碱(例如,DM1和DM4),紫杉烷,苯并二氮杂类(例如,吡咯并[1,4]苯二氮类(PBD),吲哚基苯并二氮杂和唑烷基苯并二氮杂)和长春花生物碱。使治疗剂与蛋白质,特别是与抗体缀合的技术是众所周知的(例如,参见Carter,PJ和Senter PD,“Antibody-Drug Conjugates for Cancer Therapy”,CancerJ.,14(3):154-169(2008))。
放射性核素的实例包括但不限于111In,111At,177Lu,211Bi,212Bi,213Bi,211At,62Cu,67Cu,90Y,125I,131I,133I,32P,33P,47Sc,111Ag,67Ga,153Sm,161Tb,152Dy,166Dy,161Ho,166Ho,186Re,188Re,189Re,211Pb,212Pb,223Ra,225Ac,227Th,77As,89Sr,99Mo,105Rh,149Pm,169Er,194Ir,58Co,80mBr,99mTc,103mRh,109Pt,119Sb,125I,189mOs,192Ir,219Rn,215Po,221Fr,255Fm,11C,13N,15O,75Br,198Au,199Au,224Ac,77Br,113mIn,95Ru,97Ru,103Ru,105Ru,107Hg,203Hg,121mTe,122mTe,227Th,125mTe,165Tm,167Tm,168Tm,197Pt,109Pd,142Pr,143Pr,161Tb,57Co,58Co,51Cr,59Fe,75Se,201T1,76Br,和169Yb。
诊断剂的实例包括但不限于放射性核素,造影剂,荧光剂,化学发光剂,生物发光剂,顺磁性离子,酶和光活性诊断剂。
诊断性的放射性核素的例子包括但不限于110In,111In,177Lu,18F,52Fe,62Cu,64Cu,67Cu,67Ga,68Ga,86Y,90Y,89Zr,94mTc,94Tc,99mTc,120I,123I,124I,125I,131I,154-158Gd,32F,11C,13N,15O,186Re,188Re,51Mn,52mMn,55Co,72As,75Br,76Br,82mRb,83Sr或其他γ-,β-或正电子发射体。
顺磁性离子的实例包括但不限于铬(III),锰(II),铁(III),铁(II),钴(II),镍(II),铜(II),钕(III)),钐(III),镱(III),钆(III),钒(II),铽(III),镝(III),钬(III)和铒(III)。
荧光标记诊断剂的实例包括但不限于:异硫氰酸荧光素,罗丹明,藻红蛋白,藻蓝蛋白,别藻蓝蛋白,邻苯二甲醛和荧光胺,或化学发光标记化合物,选自鲁米诺,异鲁米诺,芳族吖啶酯,咪唑,吖啶鎓盐和草酸酯,或选自荧光素、荧光素酶和水母发光蛋白的生物发光化合物。
如所指出的,在某些非限制性的实施方案中,抗体或其片段可以与一种或多种治疗剂和/或诊断剂组合使用。当药剂与抗体或其片段连接以通过皮下、肌内或透皮给药时,则仅考虑非细胞毒性剂。非细胞毒性剂可包括但不限于免疫调节剂、细胞因子(及其抑制剂)、趋化因子(及其抑制剂)、酪氨酸激酶抑制剂、生长因子、激素和某些酶(即那些不会引起局部坏死的酶),或他们的抑制剂。当在皮下、肌内或透皮抗体制剂之前、同时或之后共同施用所述药剂时,则可以利用细胞毒性剂。药剂可以作为与第二抗体或其片段的免疫缀合物施用,或者可以作为游离药剂施用。以下讨论适用于细胞毒性剂和非细胞毒性剂。
可以缀合(或分开递送)的治疗剂的实例包括、但不限于:5-氟尿嘧啶,阿普丁,阿扎利比恩,阿那曲唑,蒽环类,苯达莫司汀,博来霉素,硼替佐米,溴代他汀-1,白消安,卡奇霉素,喜树碱,卡铂,10-羟基喜树碱,卡莫司汀,塞来昔布,苯丁酸氮芥,顺铂,Cox-2抑制剂,CPT-11SN-38,卡铂,克拉屈滨,喜树碱,环磷酰胺,阿糖胞苷,达卡巴嗪,多西他赛,放线菌素,柔红霉素,2-吡咯并阿霉素(2P-DOX),pro-2P-DOX,氰基吗啉代阿霉素,阿霉素葡糖苷酸,表柔比星葡糖苷酸,雌莫司汀,表鬼臼毒素,雌激素受体结合剂,依托泊苷(VP16),依托泊苷葡糖苷酸,依托泊苷磷酸酯,氟尿嘧啶(FUdR),3’,5’-O-二油酰基-FudR(FUdR-dO),氟达拉滨,氟他酰胺,法呢基蛋白转移酶抑制剂,吉西他滨,羟基脲,伊达比星,异环磷酰胺,L-天冬酰胺酶,来那度胺(lenolidamide),亚叶酸,洛莫司汀,甲氯乙胺,美法仑,巯基嘌呤,6-巯基嘌呤,甲氨蝶呤,米托蒽醌,光神霉素,丝裂霉素,米托坦,那韦尔滨,亚硝基脲,古霉素,丙卡巴嗪,紫杉醇,喷司他汀,PSI-341,雷洛昔芬,司他汀,帕托西汀,帕托西汀,帕托西汀,帕托米汀,沙利度胺,硫鸟嘌呤,噻替帕,替尼泊苷,拓扑替康,尿嘧啶氮芥,长春瑞滨,长春碱,长春新碱,长春花生物碱,tyrophostin,卡奈替尼(canertinib),达沙替尼,埃洛替尼,吉非替尼,伊马替尼,拉帕替尼,来氟替尼,尼洛替尼(nilotinib),帕唑帕尼(pazopanib),司马沙尼(semaxinib),索拉非尼(sorafenib),塞拉非尼(sunitinib),索坦(sutent),瓦他拉尼(vatalanib),PCI-32765(依鲁替尼(ibrutinib)),PCI-45292,GDC-0834,LFM-A13和RN486。
毒素的例子包括但不限于蓖麻毒素,阿布林,α毒素,皂苷,核糖核酸酶(RNase,例如onconase),DNase I,葡萄球菌肠毒素-A,商陆抗病毒蛋白,明胶蛋白,白喉毒素,假单胞菌外毒素和假单胞菌内毒素。
免疫调节剂包括但不限于细胞因子,干细胞生长因子,淋巴毒素,造血因子,集落刺激因子(CSF),干扰素(IFN),促红细胞生成素,血小板生成素及其组合。特别有用的是淋巴毒素,例如但不限于肿瘤坏死因子(TNF),造血因子,例如但不限于白介素(IL),集落刺激因子,例如但不限于粒细胞集落刺激因子(G-CSF)或粒细胞巨噬细胞集落刺激因子(GM-CSF),干扰素(例如但不限于干扰素α、β、λ或γ)和干细胞生长因子(例如但不限于称为“S1因子”的干细胞生长因子)。细胞因子中包括生长激素,例如但不限于:人类生长激素,N-甲硫氨酰人生长激素和牛生长激素;甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;前松弛素;糖蛋白激素,例如但不限于卵泡刺激素(FSH),甲状腺刺激素(TSH)和黄体生成素(LH);肝生长因子;前列腺素,成纤维细胞生长因子;催乳素;胎盘催乳素,OB蛋白;肿瘤坏死因子-α和-β;苗勒抑制剂;小鼠促性腺激素相关肽;抑制素;激活素;血管内皮细胞行因子;整联蛋白;血小板生成素(TPO);神经生长因子,例如但不限于NGF-β;血小板生长因子;转化生长因子(TGF),例如但不限于TGF-α和TGF-β。胰岛素样生长因子-I和-II;促红细胞生成素(EPO);骨诱导因子;干扰素,例如α-干扰素,β-干扰素、λ-干扰素和γ-干扰素;集落刺激因子(CSF),例如但不限于巨噬细胞-CSF(M-CSF);白介素(IL),例如但不限于IL-1,IL-1α,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8,IL-9,IL-10,IL-11,IL-12;IL-13,IL-14,IL-15,IL-16,IL-17,IL-18,IL-21,IL-23,IL-25,白血病抑制因子(LIF),kit配体或FLT-3配体,血管生成抑制素,血小板反应蛋白,内皮抑素,肿瘤坏死因子和淋巴毒素。使用的趋化因子包括但不限于RANTES,MCAF,MIP1-α,MIP1-β和IP-10。
在某些非限制性实施方案中,治疗性的放射性核素的衰变能量在20至6,000keV的范围内,例如但不限于,对于Auger发射器来说在60至200keV的范围内,对于β发射器来说在100至2,500keV的范围内,对于α发射器来说在4,000-6,000keV的范围内。有用的发射β粒子的核素的最大衰变能量可以是但不限于20-5,000keV,100-4,000keV或500-2,500keV。还包括随Auger发射粒子实质上衰变的放射性核素,例如但不限于:Co-58,Ga-67,Br-80m,Tc-99m,Rh-103m,Pt-109,In-111,Sb-119、I-125,Ho-161,Os-189m和Ir-192。有用的发射β粒子的核素的衰变能量可以是例如但不限于<1,000keV,<100keV或<70keV。还包括随着α粒子的产生而实质上衰减的放射性核素。这样的放射性核素包括但不限于:Dy-152,At-211,Bi-212,Ra-223,Rn-219,Po-215,Bi-211,Ac-225,Fr-221,At-217,Bi-213,Th-227和Fm-255。有用的发射α粒子的放射性核素的衰变能量包括但不限于2,000-10,000keV,3,000-8,000keV或4,000-7,000keV。
在某些非限制性的实施方案中,可以以降低其活性的方式(除非其与抗体脱离/裂解,例如通过水解,通过抗体降解或通过裂解剂)将治疗剂(例如,细胞毒性剂)与抗体缀合作为前药。这样的治疗剂可以通过诸如但不限于可切割的接头之类的接头连接至抗体。在一个非限制性的实施方案中,可裂解的接头对在表达DCLK1的癌细胞的细胞内环境中裂解敏感,但是对细胞外环境基本上不敏感,从而当缀合物被表达DCLK1的癌细胞内化时,其从抗体上裂解(例如,在内体中,或例如由于pH敏感性或蛋白酶敏感性,在溶酶体环境中或在小窝环境中)。治疗剂也可以通过不可切割的接头与抗体连接。如所指出的,接头可以包含可切割的单元。在一些这样的实施方案中,选择可切割单元的结构和/或序列,以使其通过存在于靶位点(例如靶细胞)上的酶的作用而被切割。在其他非限制性的实施方案中,也可以使用可通过pH(例如酸或碱不稳定)、温度的变化或在辐射下(例如光不稳定)而裂解的可裂解单元。
在一些非限制性的实施方案中,可切割单元可包含一个氨基酸或氨基酸的连续序列。氨基酸序列可以是酶的靶底物。在一些方面,可切割的单元是肽基单元,并且至少两个氨基酸长。切割剂可以包括组织蛋白酶B和D以及纤溶酶(参见,例如,Dubowchik和Walker,Pharm.Therapeutics 83:67-123(1999))。最典型的是可被存在于表达DCLK1的细胞中的酶(即酶可裂解的接头)裂解的可裂解单位。因此,接头可以被细胞内肽酶或蛋白酶(包括但不限于溶酶体或内体蛋白酶)切割。例如,可以使用在癌组织中高表达的硫醇依赖性蛋白酶组织蛋白酶-B可裂解的接头(例如,包含Phe-Leu或Val-瓜氨酸肽或Val-Ala肽的接头)。
在一些非限制性的实施方案中,接头将包含通过另外的功能单元(例如自消炎性间隔单元或非自消炎性间隔单元)与治疗剂缀合的可裂解单元。非自消灭性间隔单元是这样一种间隔单元,其中在从抗体药物缀合物上裂解下可切割单元(例如氨基酸)后,部分或全部间隔单元保持与药物单元结合。为了释放药物,在靶细胞内发生独立的水解反应以从药物上切割间隔单元。借助自消灭性间隔单元,无需单独的水解步骤即可释放药物。在一个非限制性的实施方案中,其中所述接头包含可裂解的单元和自消灭性基团,所述可裂解的单元可通过酶的作用裂解,并且在裂解所述可裂解的单元后,所述自消炎性基团释放治疗剂。在一些非限制性的实施方案中,接头的可切割单元将在一端直接或间接缀合至治疗剂,而在另一端将直接或间接缀合至抗体。在一些这样的实施方案中,所述可切割单元在一端直接或间接地(例如,经由自消灭性或非自消灭性间隔单元)缀合至治疗剂,而在另一端通过伸展单元(stretcher unit)直接或间接地缀合至抗体。伸展单元将抗体与药物和/或药物接头的其余部分连接。在一个非限制性的实施方案中,抗体与药物或药物接头的其余部分之间的连接是通过马来酰亚胺基团,例如但不限于通过马来酰亚胺基己酰基接头。在一些非限制性的实施方案中,抗体将通过二硫键连接至药物,例如二硫键连接的美登木素生物碱缀合物SPDB-DM4和SPP-DM1。
抗体和接头之间的连接可以通过许多不同的途径,例如但不限于:通过硫醚键,通过二硫键,通过酰胺键或通过酯键。在一个非限制性的实施方案中,抗DCLK1抗体和接头之间的连接在抗体的半胱氨酸残基的巯基和接头的马来酰亚胺基团之间形成。在一些非限制性的实施方案中,在与接头的官能团反应之前,将抗体的链间键转化为游离硫醇基。在一些非限制性的实施方案中,将半胱氨酸残基引入抗体的重链或轻链中并与接头反应。通过在抗体重链或轻链中的取代进行半胱氨酸插入的位置包括在美国专利申请公开号2007/0092940和国际专利申请公开号WO 2008/070593中描述的位置。
在一些非限制性的实施方案中,抗体-药物缀合物具有下式:Mab-(LU-D)n,其中Mab是抗DCLK1抗体,LU是接头单元,D是药物单元(即治疗或诊断剂)。下标n的范围是例如但不限于1到20(即1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,或20)或更多。此类缀合物包含经由接头与至少一种药物共价连接的抗DCLK1抗体。LU在一端连接到抗体,在另一端连接到药物分子。本领域技术人员将理解,在某些方面,下标n代表单一抗体上药物接头的数目。在其他方面,n代表每个抗体的药物接头分子的平均数目,例如反应混合物或组合物(例如药物组合物)中每个抗体的药物接头的平均数目,并且可以是整数或非整数值。因此,在一些方面,对于组合物(例如,药物组合物),n代表组合物中抗体-药物缀合物的平均药物载量,并且n在1至20的范围内。在一些非限制性的实施方案中,本发明提供了抗体-接头缀合物,其具有下式:Mab-(LU)n,其中Mab是抗DCLK1抗体,LU是用于将药物连接至抗体的接头单元。下标n的范围为例如1至20(即1、2,3、4、5、6、7、8、9、10、11、13、14、15、16、17、18、19或20)或更多。此类缀合物包含与一个或多个接头共价连接的抗DCLK1抗体,其中接头单元在一端连接至抗体,并具有自由端用于连接至药物分子。在一些非限制性的实施方案中,n是每个抗体约1至约18个药物。在一些非限制性的实施方案中,n为1。在一些非限制性的实施方案中,n为2。在一些非限制性的实施方案中,n为每抗体约2至约12个药物。在一些非限制性的实施方案中,n为每抗体约2至约10,约2至约8,约2至约6,约2至约5,约2至约4或约2至约3。
在某些非限制性的实施方案中,可以将治疗剂和/或诊断剂共价连接抗体或其片段以形成免疫缀合物。在一些非限制性的实施方案中,治疗剂和/或诊断剂可以通过载体部分连接至抗体或其片段。载体部分可以连接至例如但不限于还原的SH基团和/或碳水化合物侧链。可以通过二硫键形成将载体部分连接在还原的抗体组分的铰链区。或者,可以使用异双功能交联剂,例如但不限于N-琥珀酰基3-(2-吡啶基二硫代)丙酸酯连接这类试剂(例如,参见Yu等,Int.J.Cancer 56:244(1994)。这种缀合的一般技术在本领域是众所周知的,参见例如Wong,CHEMISTRY OF PROTEIN CONJUGATION AND CROSS-LINKING(CRC Press1991);Upeslacis等,"Modification of Antibodies by Chemical Methods",MONOCLONALANTIBODIES:PRINCIPLES AND APPLICATIONS,Birch等编,第187-230页(Wiley-Liss,Inc.,1995);Price,"Production and Characterization of Synthetic Peptide-DerivedAntibodies",MONOCLONAL ANTIBODIES:PRODUCTION,ENGINEERING AND CLINICALAPPLICATION,Ritter等编,第60-84页(Cambridge University Press 1995)。或者,载体部分可通过抗体Fc区中的碳水化合物部分缀合。
通过抗体碳水化合物部分将官能团与抗体缀合的方法是本领域技术人员众所周知的。参见,例如,Shih等,Int.J.Cancer 41:832(1988);Shih等,Int.J.Cancer 46:1101(1990)和美国专利5,057,313。通用方法包括使具有氧化的碳水化合物部分的抗体与具有至少一个游离胺官能的载体聚合物反应。该反应产生初始的席夫碱(亚胺)键,该键可通过还原成仲胺而稳定化,形成最终的缀合物。
此类部分与生物分子化学缀合的其他方法是本领域众所周知的,并且可以利用任何此类已知方法来形成根据本公开起作用的抗体缀合物。此类免疫缀合物形成的方法公开于例如但不限于美国专利No.4,699,784;4,824,659;5,525,338;5,677,427;5,697,902;5,716,595;6,071,490;6,187,284;6,306,393;6,548,275;6,653,104;6,962,702;7,033,572;7,147,856;和7,259,240。
示例性的抗体-药物缀合物包括但不限于基于澳瑞他汀(Auristatin)的抗体-药物缀合物,即其中治疗剂组分为澳瑞他汀型药物的缀合物。澳瑞他汀结合微管蛋白,已显示出干扰微管动力学以及核和细胞分裂的作用,并具有抗癌活性。通常,基于澳瑞他汀的抗体-药物缀合物在澳瑞他汀药物和抗DCLK1抗体之间包含接头。澳瑞他汀可以在适合于与接头缀合的任何位置与抗DCLK1抗体连接。如上所述,接头可以是例如可裂解的接头(例如肽基接头)或不可裂解的接头(例如通过抗体降解释放的接头)。澳瑞他汀可以是澳瑞他汀E或其衍生物。澳瑞他汀可以是例如但不限于在澳瑞他汀E和酮酸之间形成的酯。例如,澳瑞他汀E可以与对乙酰基苯甲酸或苯甲酰基戊酸反应以分别产生AEB和AEVB。其他典型的澳瑞他汀包括但不限于MMAF(单甲基澳瑞他汀F)和MMAE(单甲基澳瑞他汀E)。示例性澳瑞他汀的合成和结构描述于美国专利No.7,659,241;7,498,298和7,968,687以及美国公开专利申请号2009/0111756和2009/0018086。
可以将本发明的抗体或其抗原结合部分配制成用于递送至哺乳动物受试者的组合物。该组合物可以单独施用,和/或与药学上可接受的媒介物或赋形剂混合施用。合适的媒介物是例如水但不限于水,盐水,右旋糖,甘油,乙醇等,以及它们的组合。另外,媒介物可以包含少量的辅助物质,例如但不限于润湿剂或乳化剂,pH缓冲剂或助剂。本公开内容的组合物还可包含辅助物质,例如但不限于药理剂,细胞因子或其他生物反应调节剂。
此外,可以将组合物配制成中性或盐形式的组合物。药学上可接受的盐包括但不限于酸加成盐(由活性多肽的游离氨基形成),其由无机酸例如盐酸或磷酸或者有机酸例如乙酸、草酸、酒石酸、扁桃酸等形成。由游离羧基形成的盐也可以衍生自无机碱,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,以及有机碱,例如异丙胺、三甲胺、2-乙基氨基乙醇、组氨酸和普鲁卡因。
组合物可以按照适合受试者的年龄、体重和状况,所使用的特定组合物和施用途径的时间表和时间段内以单剂量治疗或多剂量治疗进行施用。在一个非限制性的实施方案中,施用单剂量的根据本发明的组合物。在其他非限制性的实施方案中,施用多个剂量。给药频率可根据多种因素中的任何一种而变化,例如症状的严重程度、所需的免疫保护程度或该组合物是用于预防还是治疗目的。例如,在某些非限制性的实施方案中,组合物以每月一次,每月两次,每月三次,隔周,每周一次,每周两次,每周三次,每周四次,每周五次,每周六次,隔天一次,每天一次,一天两次或一天三次施用。治疗的持续时间(即施用组合物的时间段)可以根据多种因素中的任何一种而变化,例如受试者的反应。例如,可以在约一天至约一周,约两周至约四周,约一个月至约两个月,约两个月至约四个月,约四个月到约六个月,约六个月到约八个月,约八个月到约一年,约一年到约2年,或者约2年到约4年或更多的时间段内施用该组合物。
所述组合物可以与药学上可接受的载体(赋形剂)组合以形成药理学组合物。药学上可接受的载体可以包含生理上可接受的化合物,其起到例如但不限于稳定或增加或降低药物组合物的吸收或清除速率的作用。生理上可接受的化合物可包括例如但不限于:碳水化合物,例如葡萄糖、蔗糖或葡聚糖;抗氧化剂,例如抗坏血酸或谷胱甘肽;螯合剂;低分子量蛋白质;去污剂;脂质体载体;赋形剂;或其他稳定剂和/或缓冲剂。其他生理上可接受的化合物包括但不限于湿润剂、乳化剂、分散剂或防腐剂。
当口服施用时,可以保护本发明的组合物免于消化。这可以通过将抗体或其抗原结合部分与组合物复合以使其对酸性和酶促水解具有抗性,或者通过将抗体或其抗原结合部分包装在适当抗性的载体例如但不限于脂质体中来实现,例如如美国专利No.5,391,377中所示。
对于透粘膜或透皮给药,在制剂中可以使用适合于透过屏障的渗透剂。此类渗透剂在本领域中是普遍已知的,对于经粘膜施用而言,包括例如胆汁盐和夫西地酸衍生物。另外,可以使用去污剂促进渗透。透粘膜给药可以通过鼻喷雾剂或使用栓剂。对于局部透皮给药,将药剂配制成软膏、乳膏、药膏、粉剂和凝胶剂。透皮递送系统还可包括例如但不限于贴剂。本发明的组合物也可以以持续递送或持续释放机制给药。例如,本文可以包括能够持续递送肽的可生物降解的微球或胶囊或其他可生物降解的聚合物构型。
对于吸入,可以使用本领域已知的任何系统来递送本发明的组合物,包括但不限于干粉气雾剂,液体递送系统,喷气式喷雾器,推进剂系统等。例如,药物制剂可以以气雾剂或薄雾的形式给药,但不限于此。对于气雾剂给药,制剂可以细分形式与表面活性剂和推进剂一起提供。在另一方面,用于将制剂输送到呼吸组织的装置是吸入器,制剂在该吸入器中蒸发。其他液体输送系统包括例如但不限于空气喷雾器。
抗体或抗体的抗原结合部分可以通过本领域已知的任何方式单独或作为药物组合物递送,例如全身性地,区域性地或局部地。通过动脉内,鞘内(IT),静脉内(IV),肠胃外,胸膜腔内,局部,口服或局部给药,如皮下,气管内(如通过气雾剂)或经粘膜(如颊,膀胱,阴道,子宫,直肠,鼻黏膜)。
一方面,将包含组合物或核酸、抗体或其片段的药物制剂掺入脂质单层或双层例如但不限于脂质体中,如美国专利No.6,110,490;6,096,716;5,283,185;和5,279,833中所示。在其他方面,本公开的非限制性实施方案包括其中多肽或核酸已经附着至脂质体的单层或双层表面的制剂。脂质体和脂质体制剂可以根据标准方法制备,并且也是本领域众所周知的,例如但不限于美国专利No.4,235,871;4,501,728和4,837,028中公开的那些。
在一方面,用可保护抗体或其片段免于从体内快速清除的载体制备组合物,例如但不限于控释制剂,包括植入物和微囊递送系统。可以使用可生物降解的生物相容性聚合物,例如但不限于乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。这类制剂的制备方法对本领域技术人员而言是显而易见的。
通常可以配制本发明的抗体及其片段以获得包含一种或多种药学上合适的赋形剂、表面活性剂、多元醇、缓冲剂、盐、氨基酸或其他成分或这些成分的某种组合的组合物。这可以通过制备药学上有用的剂量的已知方法来完成,其中将活性化合物与一种或多种药学上合适的赋形剂混合在一起。无菌的磷酸盐缓冲盐水是药学上合适的赋形剂的一个非限制性实例。
本文所述组合物的施用途径的非限制性实例包括肠胃外注射,例如通过皮下、肌内或透皮递送。肠胃外给药的其他形式包括但不限于静脉内、动脉内、淋巴内、鞘内、眼内、脑内或腔内注射。在肠胃外给药中,将组合物与药学上可接受的赋形剂一起配制成单位剂量注射形式,例如但不限于溶液、悬浮液或乳剂。这样的赋形剂固有地是无毒的和非治疗性的。这种赋形剂的非限制性实例是盐水、林格氏溶液、右旋糖溶液和汉克斯氏溶液。也可以使用非水性赋形剂,例如但不限于不挥发性油和油酸乙酯。另一种非限制性的赋形剂是在盐水中的5%葡萄糖。赋形剂可包含少量添加剂,例如但不限于增强等渗性和化学稳定性的物质,包括缓冲剂和防腐剂。
配制的包含抗体的组合物可以用于例如但不限于皮下、肌内或透皮给药。组合物可以单位剂型存在,例如在安瓿中或在多剂量容器中,并加入防腐剂。组合物也可以采取诸如在油性或水性运载体中的悬浮液、溶液或乳液的形式,并且可以包含配制剂,例如悬浮剂、稳定剂和/或分散剂。或者,该组合物可以是粉末形式,以便在使用前与合适的载体例如无菌的无热原水一起配制。
所述组合物可以溶液形式施用。其制剂可以在具有合适的药学上可接受的缓冲剂例如但不限于磷酸盐,三(羟甲基)氨基甲烷-HCl或柠檬酸盐等的溶液中。缓冲液浓度应在1到100mM之间。配制溶液还可以包含浓度为50至150mM的盐,例如但不限于氯化钠或氯化钾。还可以包括有效量的稳定剂,例如但不限于甘露醇,海藻糖,山梨糖醇,甘油,白蛋白,球蛋白,去污剂,明胶,鱼精蛋白或鱼精蛋白的盐。
治疗或预防有效量的抗体或其抗原结合部分的示例性的非限制性范围,例如但不限于对抗DCLK1抗体或抗DCLK1抗体-药物缀合物(例如,其中缀合的药物为澳瑞他汀)而言,包括约0.001mg/kg受试者体重至约100mg/kg受试者体重的范围,例如但不限于约0.01mg/kg至约50mg/kg,约0.1mg/kg至约50mg/kg、约0.1mg/kg至约40mg/kg,约1mg/kg至约30mg/kg,约1mg/kg至约20mg/kg,约2mg/kg至约30mg/kg,约2mg/kg至约20mg/kg,约2mg/kg至约15mg/kg,约2mg/kg至约12mg/kg,约2mg/kg至约10mg/kg,约3mg/kg至约30mg/kg,约3mg/kg至约20mg/kg,约3mg/kg至约15mg/kg,约3mg/kg至约12mg/kg或约3mg/kg至约10mg/kg,或约10mg至约1500mg作为固定剂量。
将该组合物配制成包含有效量的本发明的抗体或其抗原结合部分(或缀合物),其中所述量取决于要治疗的动物和要治疗的状况。在某些非限制性的实施方案中,本抗体或其抗原结合部分(或其药物缀合物)以下述剂量施用:约0.001mg至约10g,约0.01mg至约10g,约0.1mg至约10g,约1mg至约10g,约1mg至约9g,约1mg至约8g,约1mg至约7g,约1mg至约6g,约1mg至约5g,约10mg至约10g,约50mg至约5g,约50mg至约5g,约50mg至约2g,约0.05μg至约1.5mg,约10μg至约1mg蛋白质,约30μg至约500μg,约40μg至约300μg,约0.1μg至约200mg,约0.1μg至约5μg,约5μg至约10μg,约10μg至约25μg,约25μg至约50μg,约50μg至约100μg,约100μg至约500μg,约500μg至约1mg,或约1毫克至约2毫克。任何特定受试者的特定剂量水平取决于多种因素,包括但不限于特定肽的活性,年龄,体重,总体健康状况,性别,饮食,给药时间,给药途径,排泄速率,药物组合以及接受治疗的特定疾病的严重程度。
对人施用的抗体的剂量将根据诸如但不限于患者的年龄、体重、身高、性别、一般医疗状况和以前的病史等因素而变化。在某些非限制性的实施方案中,以单次输注或者单次或多次注射的方式向接受者提供约1mg至约1000mg范围内的剂量的抗体或抗体片段(或其药物缀合物),尽管也可以施用更低或更高的剂量。在某些非限制性的实施方案中,对于典型的成年人,剂量可以在每平方米(m2)体表面积约25mg至约100mg抗体(或片段或其缀合物)的范围内,尽管也可以施用更低或更高的剂量。可以施用于人类受试者的抗体剂量的非限制性实例还包括例如1至500mg,1至70mg或1至20mg,尽管可以使用更高或更低的剂量。可以根据需要重复剂量,例如但不限于每周一次持续4-10周,或每周一次持续8周,或每周一次持续4周。也可以更低频率施用,例如每隔一周一次持续数月,或者更高频率,例如每周两次或连续输注。
在一些非限制性的实施方案中,足以以本文所述的任何程度抑制癌细胞或癌症干细胞生长的抗DCLK1抗体或其结合片段(或其药物缀合物)的有效量为以下浓度:约1nM,约5nM,约10nM,约25nM,约50nM,约75nM,约100nM,约150nM,约200nM,约250nM,约300nM,约350nM,约400nM,约500nM,约550nM,约600nM,约700nM,约800nM,约900nM,约1μM,约2μM,约3μM,约4μM,约5μM,约6μM,约7μM,约8μM,约9μM,约10μM,约15μM,约20μM,约25μM,约30μM,约35μM,约40μM,约45μM,约50μM,约60μM,约70μM,约75μM,约80μM,约90μM,约100μM,约125μM,约150μM,约175μM,约200μM,约250μM,约300μM,约350μM,约400μM,约500μM,约600μM,约700μM,约750μM,约800μM,约900μM,约1mM,约2mM,约3mM,约4mM,约5mM,约6mM,约7mM,约8mM,约9mM,约10mM,约11mM,约12mM,约13mM,约14mM,约15mM,约20mM,约25mM,约30mM,约35mM,约40mM,约45mM,约50mM,约55mM,约60mM,约65mM,约70mM,约75mM,约80mM,约85mM,约90mM,约95mM,约100mM,约100mM,约110mM,约120mM,约130mM,约140mM,约150mM,约160mM,约170mM,约180mM,约190mM,约200mM,约250mM,约300mM,约400mM,约500mM,约600mM,约700mM,约800mM,约900mM,约1000mM,约1M,约1.1M,约1.2M,约1.3M,约1.4M,约1.5M,约1.6M,约1.7M,约1.8M,约1.9M,约2M,约3M,约4M,约5M,约6M,约7M,约8M,约9M,约10M,约15M,约20M,约25M,约30M,约35M,约40M,约45M,约50M,约75M,约100M,或上述任何两个浓度之间的任意范围,包括两个浓度作为该范围的终点,或介于前述浓度中的任何两个浓度之间的任何数字。
在一些非限制性的方法中,例如每隔一周、两周、三周或四周向患者施用抗体或其结合片段(或抗体药物缀合物)。剂量取决于给药频率,患者状况,对先前治疗的反应(如果有的话),治疗是预防性的还是治疗性的,以及疾病是急性还是慢性的等等。
给药可以是例如但不限于肠胃外,静脉内,口服,皮下,动脉内,颅内,鞘内,腹膜内,局部,鼻内或肌内给药。给药也可以直接定位在肿瘤中。通常通过静脉内或皮下给药而进入全身循环。静脉内给药可以例如通过在诸如但不限于30-90分钟的时期内输注或通过单次大剂量注射来进行。
施用频率取决于抗体或抗体-药物缀合物在循环中的半衰期、患者的状况、施用途径以及其他因素。该频率可以是每天,每周,每月,每季度或不规则的间隔,以响应患者状况的变化或所治疗癌症的进展。静脉内给药的一种示例性但非限制性的频率是在连续的治疗过程中,每周两次至每季度两次,尽管也可能更低或更高频率的给药。静脉内给药的其他示例性但非限制性的频率是在连续的治疗过程中每周一次或每月一次之间,尽管也可能更高或更低频率的给药。对于皮下给药,一种示例性但非限制性的给药频率是每天至每月,尽管更高或更低频率的给药也是可能的。
所施用的剂量数量取决于癌症的性质(例如,是否表现出急性或慢性症状)以及疾病对治疗的反应。对于急性疾病或慢性疾病的急性加重,1至10剂通常就足够了。有时,单次推注剂量(可选为分开的剂量)足以处理急性疾病或慢性疾病的急性加重。对于急性疾病或急性加重的复发,可以重复治疗。对于慢性疾病,可以定期施用抗体,例如但不限于每周,每两周,每月,每季度,每六个月,至少1、5或10年,或者患者的生命期间。
在某些非限制性的实施方案中,用于肠胃外施用的药物组合物是无菌的,基本上等渗的,并且在GMP条件下生产。药物组合物可以单位剂型(即单次给药的剂量)提供。可以使用一种或多种生理上可接受的载体,稀释剂,赋形剂或助剂来配制药物组合物。配方取决于所选的给药途径。对于注射,可以在水溶液中配制抗体,例如(但不限于)在生理相容的缓冲液(例如Hank溶液,Ringer溶液或生理盐水或醋酸盐缓冲液)中配制(以减少注射部位的不适感)。该溶液可以包含配制剂,例如悬浮剂、稳定剂和/或分散剂。或者,在使用前,抗体可以冻干的形式与合适的媒介例如无菌的无热原水一起配制。液体制剂中抗体的浓度可以是例如但不限于0.01-10mg/ml,例如1.0mg/ml。
如上所述,用本发明的抗体或其结合片段进行的治疗可以与化学疗法,放射疗法,干细胞治疗,外科手术或者对所治疗的疾病有效的其他治疗组合。可以与抗DCLK1的人源化抗体一起使用的其他药物的有用类别包括例如但不限于针对癌细胞上表达的其他受体的抗体,抗微管蛋白药物(例如澳瑞他汀),DNA小沟结合剂(例如PBD),DNA复制抑制剂,烷基化剂(例如铂配合物,如顺铂,单铂,双铂和三核铂配合物和卡铂),蒽环类,抗生素,抗叶酸剂,抗代谢物,化学疗法敏化剂,双羧霉素,依托泊苷,氟化嘧啶,离子载体,促排卵素,亚硝基脲,铂类,预形成的化合物,嘌呤抗代谢物,嘌呤霉素,放射增敏剂,类固醇,紫杉烷类,拓扑异构酶抑制剂,长春花生物碱等。
在一些非限制性的实施方案中,抗体包含与本文所述的可变重链的序列和/或可变轻链序列的序列至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%相同的序列。在一些非限制性的实施方案中,抗体或其抗体片段包含与上述可变重链和可变轻链序列在10、11、12、13、14、15、16、17、18、19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69,70,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117或118个残基的跨度上100%相同的序列。
在某些非限制性的实施方案中,两个氨基酸序列(或两个核酸序列)的同一性百分比可以例如通过比对序列以获得最佳比较目的来确定(例如,可以在第一序列的序列中引入缺口)。然后比较相应位置上的氨基酸或核苷酸,两个序列之间的同一性百分比是该序列共有的相同位置数的函数(即,%同一性=(相同位置数÷位置总数)×100)。两个序列的实际比较可以通过众所周知的方法来完成,例如使用数学算法。这种数学算法的具体的非限制性示例在Karlin等(Proc.Natl.Acad.Sci.USA 90:5873-5877(1993))中有所描述。如Schaffer等(Nucleic Acids Res.,29:2994-3005(2001))中所述将这种算法并入BLASTN和BLASTX程序(2.2版)中。当使用BLAST和Gapped BLAST程序时,可以使用各个程序的默认参数(例如BLASTN)。在一个非限制性的实施例中,搜索的数据库是非冗余(NR)数据库,并且用于序列比较的参数可以设置为:无过滤器;期望值为10;字长为3;矩阵是BLOSUM62;并且缺口成本是存在为11,延伸为1。
几个非限制性的实施方案还涵盖上述抗体的变体,包括在本文中生产和描述的称为CBT-15A和CBT-15G的任何一种抗DCLK-1抗体,其在可变轻(VL)结构域和/或其可变重(VH)结构域中包含一个或多个氨基酸残基取代。几种非限制性的实施方式还包括在一个或多个VL CDR和/或一个或多个VH CDR中具有一个或多个其他氨基酸残基取代的上述抗体的变体。通过在本文所述的VH结构域、VH CDR、VL结构域和/或VL CDR中引入取代而产生的抗体或其结合片段可以在体外和体内进行测试,例如测试其与DCLK1结合的能力(通过例如免疫测定,包括但不限于ELISA和BIAcore)。
本公开内容还涵盖编码与DCLK1同工型2和4特异性结合的当前公开的抗体或其抗原结合部分的核酸。所述核酸可以在细胞中表达以产生当前公开的抗体或其抗原结合部分。例如,本发明的分离的核酸包含编码与本文公开的氨基酸序列具有至少约70%、至少约75%、至少约80%、至少约80%、至少约81%、至少大约82%、至少大约83%、至少大约84%、至少大约85%、至少大约86%、至少大约87%、至少大约88%、至少大约89%、至少大约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一性的肽的序列。可以将编码本发明的抗体或其抗原结合部分的核酸引入可以在合适的表达系统中表达的表达载体中,然后分离或纯化所表达的抗体或其抗原结合部分。任选地,可以在无细胞翻译系统中翻译编码本发明抗体或其抗原结合部分的核酸,例如但不限于美国专利No.4,816,567中公开的系统。
抗DCLK1抗体或其抗原结合部分可以通过用编码所需抗体的轻链和重链(或其CDR部分)的DNA转化的宿主细胞产生。可以使用标准技术从这些培养上清液和/或细胞中分离和纯化抗体。例如,可以用编码抗体的轻链、重链或两者的DNA转化宿主细胞。重组DNA技术也可用于除去编码对于结合不是必需的轻链和重链的一个或两个中的部分或全部DNA,例如恒定区。
如本文所用,术语“癌症干细胞”是指可以广泛或无限地增殖并在癌症中引起很大比例的癌细胞的细胞。在一些方面,大部分癌细胞代表给定癌症中的大多数癌细胞。出于说明而非限制的目的,癌症干细胞可以是肿瘤的始祖或占癌症实体大部分的癌细胞的祖细胞。在一些方面,癌症干细胞是指在不存在细胞的任何其他突变或引入外源细胞增殖诱导剂或致癌剂的情况下,当植入免疫受损的个体中时分裂形成一个或多个肿瘤的细胞。在某些方面,癌干细胞分裂以产生另外的癌干细胞以及终末分化的癌细胞或癌组织。
如针对阻断癌细胞生长所使用的,术语“有效量”是指足以使癌细胞的生长降低任何程度的抗DCLK1抗体的量。本领域已知的任何测定法均可用于测量癌细胞的生长。例如,可以通过集落计数,总细胞数,或细胞群体、集落或肿瘤的体积/大小来测量癌细胞的生长。在一些非限制性的实施方案中,可以通过肿瘤球生长测定法测量癌细胞的生长。如针对阻断癌症干细胞生长所使用的,术语“有效量”是指足以使癌症干细胞的生长减少任何程度的抗DCLK1抗体的量。本领域已知的任何测定法均可用于测量癌症干细胞的生长。例如,可以通过集落计数,总细胞数或者细胞群体或集落的体积/大小来测量癌症干细胞的生长。在一些非限制性的实施方案中,可以通过肿瘤球生长测定法测量癌症干细胞的生长。
在某些非限制性的实施方案中,有效量的抗DCLK1抗体或其结合片段可以阻断癌细胞或癌细胞干细胞的生长,如癌细胞或癌症干细胞群体或肿瘤球生长或细胞或肿瘤生长的其他适当量度减少至少约5%、至少约10%、至少约15%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%,或任何上述数字之间的任何百分比。
例如,在一些非限制性的实施方案中,有效量的抗DCLK1抗体或其结合片段可以阻断癌细胞或癌细胞干细胞的生长,如癌细胞或癌症干细胞群体或肿瘤球生长或其他适当的度量减少至少约5%至约95%、至少约5%至约75%、至少约5%至约50%、至少约10%至约95%、至少约10%至约75%、至少约10%至约50%、至少约10%至约25%、至少约20%至约95%、至少约20%至约80%、至少约20%至约60%、至少约20%至约50%、至少约25%至约90%、至少约25%至约75%或至少约30%至约50%所测量的。
在其他非限制性的实施方案中,有效量的抗DCLK1抗体或其结合片段可以阻断或抑制癌细胞或癌细胞干细胞的生长,如癌细胞或癌症干细胞群体或肿瘤球生长至少约1.1倍、至少约1.2倍、至少约1.3倍、至少约1.4倍、至少约1.5倍、至少约1.6倍、至少约1.7倍、至少约1.8倍、至少约1.9倍、至少约2.0倍、至少约2.1倍、至少约2.2倍、至少约2.3倍、至少约2.4倍、至少约2.5倍、至少约2.6倍、至少约2.7倍、至少约2.8倍、至少约2.9倍、至少约3.0倍、至少约3.5倍、至少约4.0倍、至少约4.5倍、至少约5.0倍、至少约10倍、至少约25倍、至少约50倍、至少约75倍、至少约100倍、至少约200倍、至少约500倍或至少约1000倍减少、或上述任何数字之间的任何倍数减少所测量的。
在一些非限制性的实施方案中,抑制的细胞是肿瘤细胞,包括但不限于结肠直肠肿瘤细胞(即结肠、直肠、肠或胃肿瘤细胞),乳腺癌细胞,肺癌细胞,肾癌细胞或胰腺肿瘤细胞。在一些非限制性的实施方案中,肿瘤细胞可以表达升高水平的DCLK1蛋白。在一些非限制性的实施方案中,本文提供的抗DCLK1抗体或其结合片段通过例如但不限于减少癌细胞或癌症干细胞的数量和/或频率来抑制肿瘤细胞的生长。
本公开的一些非限制性的实施方案包括通过施用治疗有效量的如本文提供的抗DCLK1抗体或其结合片段来治疗患有此类癌症的受试者的方法。在一些非限制性的实施方案中,所述癌症选自胰腺癌,结肠直肠癌,肺癌,肾癌和乳腺癌,例如三阴性乳腺癌。
一些非限制性的实施方案包括治疗疾病的方法,该方法包括向需要这种治疗的受试者施用治疗有效量的本文所提供的抗DCLK1抗体或其结合片段与至少一种其他治疗剂的组合。如本文其他地方所讨论的,治疗剂可以直接或通过接头与抗体或其结合片段缀合。在一些非限制性的实施方案中,所述其他治疗剂包括化学治疗剂。在一些非限制性的实施方案中,所述其他治疗剂包括生物剂。一些非限制性的实施方案包括施用本文提供的抗DCLK1抗体或其结合片段与化学治疗剂和生物剂的组合。本文提供的方法的一些非限制性的实施方案包括确定肿瘤或癌症中DCLK1蛋白表达的水平。
本文提供的方法的一些非限制性的实施方案包括鉴定用于用本文提供的抗DCLK1抗体或其结合片段治疗的受试者。一些非限制性的实施方案包括确定与正常组织中相同DCLK1蛋白的表达相比,受试者是否具有包含DCLK1表达水平升高的肿瘤或循环细胞。一些非限制性的实施方案包括,如果肿瘤或循环细胞具有升高的DCLK1表达水平,则选择受试者用于治疗。
本文提供的一些非限制性的实施方案包括试剂盒。在一些非限制性的实施方案中,试剂盒可以包含本文所述或以其他方式涵盖的任何抗体或其结合片段,例如但不限于人源化抗体或其人源化结合片段。在一些非限制性的实施方案中,所述抗体或其结合片段被冻干。在一些非限制性的实施方案中,所述抗体或其结合片段在水溶液或本文所述的其他载体中。在一些非限制性的实施方案中,试剂盒包括用于施用抗体的药物载体。在一些非限制性的实施方案中,试剂盒还包含化学治疗剂。本公开的某些非限制性的实施方案包括包含适合于治疗或诊断的组分的试剂盒。示例性的试剂盒可包含本文所述的至少一种抗DCLK1抗体或其结合片段。在某些非限制性的实施方案中可以包括能够通过注射递送试剂盒组分的装置,例如用于皮下注射的注射器。在使用透皮给药的情况下,在某些非限制性的实施方案中试剂盒内可以包括递送装置,诸如空心微针递送装置。示例性的透皮递送装置在本领域中是已知的,例如但不限于中空的微结构化透皮系统(例如3M Corp.),并且可以使用任何这样的已知装置。试剂盒组分可以包装在一起或分成两个或多个容器。在一些非限制性的实施方案中,容器可以是装有适合于重建的组合物的无菌冻干制剂的小瓶。试剂盒还可以包含适于重建和/或稀释其他试剂的一种或多种缓冲液。或者,可以将抗体或片段作为液体制剂递送和储存。可以使用的其他容器包括但不限于小袋、托盘、盒子、管等。试剂盒组件可以包装并在容器内无菌保存。可以包括的另一组件是该试剂盒用于治疗某些疾病或状况或用于诊断此类疾病的说明书。
实验
在总体上描述了针对DCLK1的抗DCLK1抗体或其抗原结合片段、表达该抗体或其抗原结合片段的杂交瘤或其他细胞系、编码这种抗体和结合片段的核酸、包含该核酸的载体和宿主细胞以及用这种抗体和抗原结合片段阻断癌症干细胞生长的方法后,通过参考某些具体实施例可以获得进一步的理解,提供这些具体实施例仅是为了说明的目的,并不是用于限制。
方法
人DCLK1同工型2cDNA序列的构建
对于DCLK1同工型2构建体,使用了一个364bp的gBlock合成DNA(IDT),其中包含5'-ScaI和3'-EcoRI限制酶消化位点。该gBlock还包含与同工型2共享的一部分人DCLK1同工型1序列,并添加了独特的DCLK1同工型2C端序列(NCBI参考序列:XM_005266592.2)。用EcoRI和ScaI消化含有DCLK1同工型1的载体和gBlock。凝胶纯化消化的载体和gBlock片段,并通过将消化的载体与合成的DNA片段连接来构建DCLK1同工型2。通过自动测序确认连接的cDNA产物。然后将DCLK1同工型2载体进一步构建成慢病毒构建体,如先前所述(Weygant等人,“Small molecule kinase inhibitor LRRK2-IN-1 demonstrates potent activityagainst colorectal and pancreatic cancer through inhibition of doublecortin-like kinase 1”,Molecular cancer,13(1):103(2014))。用含有人DCLK1 cDNA序列的慢病毒感染RCC细胞系Caki-2,以过表达DCLK1同工型2/long-α(caki2-dsRed-DCLK1)或红色荧光蛋白(RFP)cDNA作为对照(caki2-dsRed),并用嘌呤霉素选择到100%表达。
细胞培养
Caki-2和ACHN人透明细胞肾癌细胞直接从美国典型培养物保藏中心(ATCC)获得,在这里它们通过形态学、核型分析和PCR进行了测试和鉴定,以排除种间和种内污染。将细胞在含有10%胎牛血清(FBS)(Sigma-Aldrich,St.Louis,MO)的RPMI培养基中于37℃和5%CO2培养。
siRNA介导的DCLK1的敲低
将105个Caki-2或ACHN细胞接种到6cm培养皿中,并使其附着过夜。将Lipofectamine 3000(Invitrogen,Carlsbad,CA)与25nM商业验证的靶向人DCLK1编码区的siRNA(siDCLK;Santa Cruz Biotechnology,Inc.,Dallas,TX;sc-45618)或25nM不匹配任何已知基因的混乱序列(siSCR)复合。转染72小时后,收集RNA和蛋白质以确认敲低。
实时定量RT-PCR
根据制造商的说明书,使用Tri Reagent(Sigma-Aldrich,St.Louis,MO)从细胞中分离出总RNA。使用SuperScriptTM II逆转录酶(Invitrogen,Carlsbad,CA)和随机六核苷酸引物进行逆转录。然后使用SYBR Green(Molecular Probes,Eugene,OR)在iCycler IQ5热循环仪(Bio-Rad Laboratories Inc.,Hercules,CA)上使用互补DNA进行实时聚合酶链反应(PCR)。为了检测特定的转录本,在反应中使用了基因特异性引物和JumpStartTM Taq DNA聚合酶(Sigma-Aldrich,St.Louis,MO)。β-肌动蛋白用于标准化阈值,mRNA的定量变化被评估为相对于对照的倍数变化。Student’s t检验用于确定统计学显著性。
蛋白质印迹
对来自ACHN或CAKI2细胞的裂解物进行Western印迹分析。通过BCA蛋白质测定法(Pierce,Rockford,IL)确定总蛋白质的浓度。在4%–20%SDS聚丙烯酰胺凝胶上将40μg蛋白质裂解物进行大小分离,并转移到PVDF膜上。将膜在1%酪蛋白中封闭30分钟,并用一抗α-DCLK1(ABCAM,Cambridge,UK;ab31704)、HIF-1α(ABCAM,ab2185)、波形蛋白(Santa CruzBiotechnology,Inc.,Dallas,TX;SC-7557)、ALDH1A1(ABCAM,ab52492)和β-肌动蛋白(ABCAM,ab8226)在4℃探测过夜。然后将膜用TBST洗涤3次,并在室温下避光用适合物种的二抗(cw800-缀合的)探测30分钟。最后,使用LI-COR Odyssey红外成像仪检测蛋白质,并在适当时在Image Studio Lite(LI-COR Biosciences,Lincoln,NE)中进行密度定量。
增殖/耐药性测定
一式四份将细胞(5000/孔)接种到96孔组织培养板中。在存在索拉非尼、舒尼替尼、依维莫司或西罗莫司的情况下培养细胞,其中以DMSO为载体,浓度为100、50、25、12.5、6.25、3.13、1.56、0.78、0.39、0.20和0.10μM或载体(索拉非尼、舒尼替尼);和浓度为300、150、75、37.5、18.8、9.38、4.69、2.34、1.17、0.59和0.29μM或赋形剂(依维莫司、替西罗莫司)。孵育后48或72h,将10μL MTT(R&D Systems,Minneapolis,MN)添加到每个孔中,并将细胞在37℃孵育4h。当可见深色晶体沉淀物时,将含有266mM NH4OH的50μL DMSO添加到孔中。为了完全溶解沉淀的MTT晶体,将板置于振荡器上低速1分钟,并使用微量滴定板读数仪读取每个孔的OD570。最后,将结果取平均值,并针对DMSO(载体)对照处理的孔进行标准化。
二维集落形成试验
将细胞(100个/孔)接种到含有新鲜细胞培养基(含有10%FBS和DMSO或浓度为0.5或5μM的舒尼替尼)的6孔板中。处理72小时后,更新培养基,并使细胞生长9-15天。在形成集落之后,用PBS洗涤培养皿,并用冰醋酸/甲醇溶液(1∶3)固定。固定后,使用0.5%的结晶紫对集落染色,并通过用自来水轻轻洗涤除去多余的染料。干燥后,使用1cm2的网格在立体显微镜下计数集落。每个板计数来自四个象限的四个正方形。为了获得相对集落形成,对于每个细胞系,将结果针对DMSO标准化。然后将染色的集落成像并使用ImageJ(NationalInstitutes of Health,Bethesda,MD)分析。
3D集落形成测定
将降低的生长因子基质胶(Corning Inc.,Corning,NY)与含有RPMI培养基的细胞悬液混合(体积1:1)。将100μL混合物以50个细胞/孔的密度吸移到96孔板中。在基质胶固化后,将具有10%胎牛血清的50μL RPMI培养基添加到每个孔中。然后将板在37℃,5%CO2下孵育。每周一次更新培养基,并监测细胞的集落形成。对于药物应答,在药物处理72小时后,按照上述方案将细胞用胰蛋白酶消化并接种,并如上所述更新培养基。使细胞生长10-15天以形成集落,其定义为由超过15个细胞组成,并且将板用PBS洗涤并用福尔马林固定。之后,手动计数每个孔中的集落。
流式细胞术
为了评估细胞周期状态,将细胞用胰蛋白酶消化,在4℃离心,用冷PBS洗涤,然后在冰上的70%乙醇中固定>2h。固定后,再次用PBS洗涤细胞,并与碘化丙锭(50μg/ml)孵育,并用RNAse A处理。在另一个分析DCLK1表达的实验中,将细胞用胰蛋白酶消化,离心,洗涤,然后加入5μL活化的ALDEFLUORTM(Stemcell Technologies Inc.,Cambridge,MA)和5μL分别与荧光染料缀合的抗DCLK1抗体,在37℃下孵育60分钟。温育后,用ALDEFLUORTM缓冲液(Stemcell Technologies Inc.)洗涤细胞。在FACSCaliburTM(BD Biosciences,San Jose,CA)上收集数据,并在ModFit LT或Flowing Software中进行分析。为了分析ALDH的表达水平,将细胞重悬于含有ALDH底物,BAA(Bodipy-氨基乙醛)(50mg无水试剂),含或不含5ml特定ALDH抑制剂二乙基氨基苯甲醛(DEAB 1.5mM,在95%乙醇中的储液)(作为阴性对照)的ALDEFLUORTM分析缓冲液中。在37℃下孵育60分钟后,通过FACSCaliburTM(BD Biosciences)收集数据。对于基于DCLK1细胞外结构域的细胞分选,将细胞用胰蛋白酶消化并如上所述洗涤。洗涤后,将细胞与缀有荧光染料的抗DCLK1抗体在冰上孵育60分钟,并使用FACSAriaTMIII细胞分选仪(BD Biosciences,San Jose,CA)进行分选。将分选的细胞保存在冰上,直接接种到ECM中。
单克隆抗体
如上所述,DCLK1包含由两个启动子(称为α和β)生成的四种不同的人类主要同工型。所有同工型均具有共享的激酶结构域和自磷酸化区域。α启动子产生两个具有不同C端区域的结合双皮层蛋白的82kDa同工型。β启动子产生两个缩短的主要激酶结构域52kDa同工型,具有同样不同的C端区域。通过使用序列分析和同源性建模,鉴定了同工型2和4的共享胞外C端区域,并制备了针对该区域的一组免疫原以产生多种抗体。免疫原的序列示于表3。
表3.来自DCLK1同工型2和4的C末端区域的肽免疫原用于生成抗体
| 免疫原编号 | 氨基酸序列 | SEQ ID NO: |
| 1 | RRRNQDVRSRYKAQ | 3 |
| 2 | ELNSESEDYSPS | 4 |
| 3 | DVRSRYKAQPA | 5 |
| 4 | PELNSESEDYSPSSS | 6 |
| 5 | RSRYKAQPAPPELNS | 7 |
| 6 | DVRSRYKAQPAPPE | 8 |
| 7 | RYKAQPAPPELNSES | 9 |
| 8 | DYSPSSSETVRSPNSPF | 10 |
| 9 | EDYSPSSSETVRSPN | 11 |
| 10 | ESEDYSPSSSETVR | 12 |
将免疫原序列与KLH连接以形成KLH连接肽。将这些KLH连接的肽皮下注射给Balb/c小鼠,并在4周后加强免疫。加强免疫后取下免疫小鼠的脾脏,并与骨髓瘤细胞融合。通过ELISA针对特定的肽和纯化的DCLK1蛋白筛选克隆以供选择。
由该筛选过程产生的单克隆抗体包括免疫球蛋白A种类(CBT-15A)和免疫球蛋白G2β种类(CBT-15G)。纯化所得抗体后,通过针对DCLK1同工型4纯化蛋白的蛋白质印迹法证实了它们对DCLK1的亲和力(图1)。用DCLK1同工型4和DCLK1同工型1纯化的蛋白进行的ELISA显示,与存在于DCLK1同工型1(图2)中的非细胞外结构域相比,针对免疫原8(SEQ IDNO:10)产生的CBT-15单克隆抗体对于存在于DCLK1同工型4中的DCLK1胞外域具有高度选择性。这些抗体结合细胞外DCLK1的能力在FACS分选实验中更加明显。在非透化条件下,在冰上以10μg/mL浓度用同工型对照、CBT-15A抗体或CBT-15A抗体加中和肽对活的AsPC-1人胰腺癌细胞进行染色。FACS分选表明,CBT-15A可以分选该胰腺癌细胞系中的活细胞外DCLK1+群体,该胰腺癌细胞系先前已显示出具有癌症干细胞样特征(图3)。这些发现共同表明,针对细胞外DCLK1 C末端8号免疫原(SEQ ID NO:10)的单克隆抗体能够在体外选择性靶向该结构域。
在确认了CBT-15mAB与细胞外DCLK1结合的能力后,如下制备分泌CBT-15G嵌合变异体(嵌合体在本文中称为CBT-15X)的细胞系:
1.从分泌CBT-15G抗体的单克隆杂交瘤细胞中纯化RNA。
2.使用小鼠重链恒定区和轻链κ恒定区的最后一个可变区下游的引物创建cDNA,并鉴定CBT-15G的重链和轻链可变区cDNA和氨基酸序列(见下文)。
3.使用简并引物组(USBIO,11904-10A)对每个RT反应进行PCR,以扩增所有可能的重排。
4.为了产生人/小鼠IgG嵌合抗体,将上述反应的PCR片段插入pFUSEss-CHIg-hG1中,以表达DCLK1重链;插入pFUSEss-CLIg-hK中以表达DCKL1轻链κ。
通过针对DCLK1纯化的蛋白质进行蛋白质印迹证实了CBT-15X嵌合体对DCLK1保留了特异性结合亲和力(图1)。
体外PBMC杀伤测定
将ACHN细胞以每孔5×104个细胞的密度接种到96孔板中,并在37℃下附着过夜。将CBT-15mAB或同工型对照mAB以100μg/mL的浓度一式四份添加到ACHN孔中,并在37℃下孵育72小时。mAB处理后,更换培养基,并将1.25x 105个原代人PBMC细胞(ATCC)与ACHN细胞共孵育72小时。最后,根据制造商的规程进行了发光3/7活性测定(Promega,Madison,WI),作为细胞凋亡的替代指标。
异种移植肿瘤研究
将ACHN细胞(5×105)皮下注射到雄性无胸腺裸鼠的腹侧,使其生长直至肿瘤平均体积达到100mm3。一旦达到该体积,便每两周一次以25mg/kg的剂量腹膜内递送CBT-15mAB或同工型对照mAB,每隔一天进行一次肿瘤体积测量。在每个注射日期用卡尺测量水平和垂直肿瘤直径,并使用下式计算肿瘤体积:肿瘤体积=0.5×长度×宽度2。在注射期结束时,通过CO2窒息杀死小鼠,并切除肿瘤,称重并测量肿瘤。所有动物实验都是根据俄克拉荷马大学健康科学中心的机构动物护理和使用委员会(Oklahoma City,OK)制定的标准进行的。
免疫组织化学
使用市售的肾癌微阵列(US Biomax,Inc.,Rockvillw,MD,KD2085),如先前针对PD-L1和DCLK1所述进行免疫组织化学。染色结果由经验丰富的临床病理学家定量。
统计分析
使用SPSS Statistics 19,Graphpad Prism 6.0和Microsoft Excel进行所有统计分析。单向方差分析和Student’s T检验用于确定统计学显著性。对于所有分析,p<0.05被认为具有统计学显著性。
结果
确定了CBT-15A的以下轻链和重链可变区cDNA和氨基酸序列:
CBT-15A的重链可变区cDNA序列:
GACGTGAAGCTCGTGGAGTCTGGGGGAGGCTTAGTGAAGCTTGGAGGGTCCCTGAAACTCTCCTGTGCAGCCTCTGGATTCACTTTCAGTAGCTATTACATGTCTTGGGTTCGCCAGACTCCAGAGAAGAGGCTGGAGTTGGTCGCAGCCATTAATAGTAATGGTGGTAGCACCTACTATCCAGACACTGTGAAGGGCCGATTCACCATCTCCAGAGACAATGCCAAGAACACCCTGTACCTGCAAATGAGCAGTCTGAAGTCTGAGGACACAGCCTTGTATTACTGTGCAAGACATGGGGGTAACTACTGGTACTTCGATGTCTGGGGCGCAGGGACCACGGTCACCGTCTCCTCA(SEQ ID NO:13)。
CBT-15A的重链可变区氨基酸序列:
DVKLVESGGGLVKLGGSLKLSCAASGFTFSSYYMSWVRQTPEKRLELVAAINSNGGSTYYPDTVKGRFTISRDNAKNTLYLQMSSLKSEDTALYYCARHGGNYWYFDVWGAGTTVTVSS(SEQ ID NO:14)。
CBT-15A的轻链可变区cDNA序列:
GACATTGTGATGTCACAGTCTCCATCCTCCCTAGCTGTGTCAGTTGGAGAGAAGGTTACTATGAGCTGCAAGTCCAGTCAGAGCCTTTTATATAGTAGCAATCAAAAGAACTACTTGGCCTGGTACCAGCAGAAACCAGGGCAGTCTCCTAAACTGCTGATTTACTGGGCATCCACTAGGGAATCTGGGGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGTGTGAAGGCTGAAGACCTGGCAGTTTATTACTGTCAGCAATATTATAGCTATCCGTACACGTTCGGAGGGGGGACCAAGCTGGAAATAAAA(SEQ ID NO:15)。
CBT-15A的轻链可变区氨基酸序列:
DIVMSQSPSSLAVSVGEKVTMSCKSSQSLLYSSNQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVKAEDLAVYYCQQYYSYPYTFGGGTKLEIK(SEQ ID NO:16)。
CBT-15A的重链可变互补决定区(VH CDR):
VH CDR1:GFTFSSYY(SEQ ID NO:17)。
VH CDR2:INSNGGST(SEQ ID NO:18)。
VH CDR3:ARHGGNYWYFDV(SEQ ID NO:19)。
CBT-15A的轻链可变互补决定区(VL CDR):
VL CDR1:QSLLYSSNQKNY(SEQ ID NO:20)。
VL CDR2:WAS(SEQ ID NO:21)。
VL CDR3:QQYYSYPYT(SEQ ID NO:22)。
还确定了CBT-15G的重链和轻链可变区cDNA和氨基酸序列:
CBT-15G的重链可变区cDNA序列:
GAGGTCCAGCTGCAGCAGTCTGGGACTGCGCTGGCAAGGCCTGGGGCTTCCGTGAAGATGTCCTGCAAGGCTTCTGGCTACAGCTTTACCAGCTACTGGATGCACTGGGTAAAACAGAGGCCTGGACAGGGTCTAGAATGGATTGGTGCTATTTATCCTGGAAAAAGTGATACTAGCTACAACCAGAAGTTCAAGGGCAAGGCCAAACTGACTGCAGTCACATCCGCCAGCACTGCCTACATGGAGCTCAGCAGCCTGACAAATGAGGACTCTGCGGTCTATTACTGTACAAGATATGGTAAGGGTGCTATGGACTACTGGGGTCAAGGAACCTCAGTCACCGTCTCCTCA(SEQ ID NO:23)。
CBT-15G的重链可变区氨基酸序列:
EVQLQQSGTALARPGASVKMSCKASGYSFTSYWMHWVKQRPGQGLEWIGAIYPGKSDTSYNQKFKGKAKLTAVTSASTAYMELSSLTNEDSAVYYCTRYGKGAMDYWGQGTSVTVSS(SEQ ID NO:24)。
CBT-15G的轻链可变区cDNA序列:
GACATTGTGCTGACCCAATCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCACCATCACCTGCAAGGCCAGTCAGGATGTGAATACTGCTGTAGCCTGGTATCAAAAAAAACCAGGGCAATCTCCTAAACTGCTGATTTACTGGGCATCCACCCGGCTCACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGATTATACTCTCACCATCAGCAGTGTGCAGGCTGAAGACCTGGCACTTTATTACTGTCAGCAACATTATAGTACTCCGTACACGTTCGGAGGGGGGACCAAGCTGGAAATAAAA(SEQ ID NO:25)。
CBT-15G的轻链可变区氨基酸序列:
DIVLTQSHKFMSTSVGDRVTITCKASQDVNTAVAWYQKKPGQSPKLLIYWASTRLTGVPDRFTGSGSGTDYTLTISSVQAEDLALYYCQQHYSTPYTFGGGTKLEIK(SEQ ID NO:26)。
CBT-15G的重链可变互补决定区(VH CDR):
VH CDR1:SYWMH(SEQ ID NO:27)。
VH CDR2:AIYPGKSDTSYNQKFKG(SEQ ID NO:28)。
VH CDR3:YGKGAMDY(SEQ ID NO:29)。
CBT-15G的轻链可变互补决定区(VL CDR):
VL CDR1:KASQDVNTAVA(SEQ ID NO:30)。
VL CDR2:WASTRLT(SEQ ID NO:31)。
VL CDR3:QQHYSTPYT(SEQ ID NO:32)。
因此,在一些非限制性的实施方案中,本公开中提供的抗DCLK1抗体包含具有GFTFSSYY(SEQ ID NO:17)的可变重链CDR1,具有INSNGGST(SEQ ID NO:18)的可变重链CDR2,和具有ARHGGNYWYFDV(SEQ ID NO:19)的可变重链CDR3。在一些非限制性的实施方案中,本文提供的抗DCLK1抗体包含具有QSLLYSSNQKNY(SEQ ID NO:20)的可变轻链CDR1,具有WAS(SEQ ID NO:21)的可变轻链CDR2和具有QQYYSYPYT(SEQ ID NO:22)的可变轻链CDR3。在一些非限制性的实施方案中,这些CDR序列中的1、2、3、4、5或6个包含1、2或3个氨基酸取代。在一些非限制性的实施方案中,氨基酸取代是保守氨基酸取代。
在一些非限制性的实施方案中,本文提供的抗DCLK1抗体包含具有SYWMH(SEQ IDNO:27)的可变重链CDR1,具有AIYPGKSDTSYNQKFKG(SEQ ID NO:28)的可变重链CDR2和具有YGKGAMDY(SEQ ID NO:29)的可变重链CDR3。在一些非限制性的实施方案中,本文提供的抗DCLK1抗体包含具有KASQDVNTAVA(SEQ ID NO:30)的可变轻链CDR1,具有WASTRLT(SEQ IDNO:31)的可变轻链CDR2和具有QQHYSTPYT(SEQ ID NO:32)的可变轻链CDR3。在一些非限制性的实施方案中,这些CDR序列中的1、2、3、4、5或6个包含1、2或3个氨基酸取代。在一些非限制性的实施方案中,氨基酸取代是保守氨基酸取代。
在一些非限制性的实施方案中,本文提供的抗DCLK1抗体包含抗体或其结合片段,所述抗体或其结合片段包含与本文所述的特定重链可变区序列(例如,SEQ ID NO:14或SEQID NO:24)具有至少80%或至少90%的序列同一性(或本文公开的其他%同一性)的重链可变区,和/或与本文所述的特定轻链可变区序列(例如,SEQ ID NO:16或SEQ ID NO:26)具有至少80%或至少90%序列同一性(或本文公开的其他%同一性)的轻链可变区。
DCLK1过表达驱动支持干性的标志物的表达
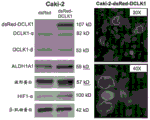
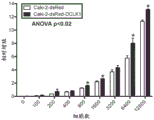
为了评估DCLK1在肾癌进展中的作用,我们通过慢病毒感染(Caki-2-dsRed-DCLK1)在Caki-2 RCC细胞中过表达了DCLK1(同工型2;DCLK1-long-α)。通过实时PCR和蛋白质印迹证实过表达,揭示了与载体对照感染的细胞(Caki-2-dsRed;图4-5)相比,DCLK1mRNA水平增加>5倍,蛋白质表达增加相当。DCLK1由alpha启动子驱动的同工型具有双皮层蛋白微管结合结构域,通常与微管相关,在细胞周期调控中很重要(Lin等人,“DCAMKL1 encodesa protein kinase with homology to doublecortin that regulates microtubulepolymerization”,J Neurosci.:20(24):9152-61(2000))。荧光显微镜检查显示在dsRed标记的DCLK1过表达细胞中微管/细胞骨架相关的表达(图4)。
根据以前的研究,在患有RCC的患者中间充质标记波形蛋白可能预示了总体生存力。此外,发明人先前证明了DCLK1的靶向敲低可大大降低波形蛋白在RCC中的表达。与这些先前的发现一致,DCLK1的过表达诱导波形蛋白的表达(图4)。HIF-1α参与肾癌的发展和成干性,通过激活上皮和间充质细胞中的组蛋白脱乙酰基酶3(HDAC3)介导EMT,并通过驱动厌氧糖酵解维持癌症干细胞的生成。以前,我们显示DCLK1在缺氧条件下被诱导,而siRNA介导的DCLK1敲低会降低HIF-1α表达。在目前的工作中,HIF-1αmRNA和蛋白质显示出通过DCLK1的过表达而被上调(图4-5)。醛脱氢酶(ALDH/ALDH1A1)是仅有的少数与患者致瘤性增加,无复发和总体生存率降低相关的RCC干细胞标记之一。高ALDH活性还预示着多种类型的肿瘤(包括食道癌,乳腺癌,卵巢癌等)的侵袭性和转移潜力增加,以及威尔姆斯肿瘤的耐药性。我们先前证明了RCC中的DCLK1敲低显著降低了ALDH的表达。与这些发现一致,在过表达DCLK1的Caki-2细胞中,ALDH蛋白表达被显著上调(图4),表明ALDH可能是RCC中的关键DCLK1效应蛋白。
DCLK1过表达增加RCC增殖,但对细胞周期动力学没有影响
先前的研究直接暗示了在其他肿瘤的细胞增殖和细胞周期动力学中DCLK1的表达和活性(Weygant等人,“Small molecule kinase inhibitor LRRK2-IN-1 demonstratespotent activity against colorectal and pancreatic cancer through inhibitionof doublecortin-like kinase 1”,Molecular cancer,13:103(2014);和Sureban等人,“XMD8-92 inhibits pancreatic tumor xenograft growth via a DCLK1-dependentmechanism”,Cancer letters,351(1):151-61(2014))。为了确定DCLK1的过表达是否影响RCC的增殖,将Caki2-dsRed-DCLK1和Caki2-dsRed细胞一式四份接种,并使其附着并增殖24h。MTT摄取证明了DCLK1过表达显著增加了Caki-2细胞系的增殖(P<0.038)(图6)。为了确定过度表达是否对RCC细胞周期动力学有任何影响,进行了基于FACS的细胞周期分析。在对照细胞和DCLK1过表达细胞之间没有发现显著变化(图7)。这些发现支持了DCLK1在细胞增殖中的作用与先前在RCC中的研究一致(Weygant等人,“DCLK1 is a broadlydysregulated target against epithelial-mesenchymal transition,focal adhesion,and stemness in clear cell renal carcinoma”,Oncotarget,6(4):2193-205(2015))。
RCC中的DCLK1上调导致ALDH癌症干细胞标志物过表达
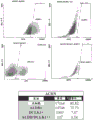
鉴于ALDH在RCC中的重要性以及关于DCLK1驱动的ALDH表达调节的发现,通过FACS评估了这些蛋白质之间的关系。使用AldefluorTM试剂(Stemcell Technologies Inc.,Cambridge,MA)和DCLK1抗体,我们发现了很大比例的ALDH+细胞(ACHN中为73.73%,在Caki-2中为55.12%),而DCLK1+细胞的百分比则小得多(ACHN为7.47%,Caki-2为17.87%),以及在Caki-2(1.51%)和ACHN(0.54%)细胞系中的ALDH/DCLK1双阳性群体部分(图8A-8B)。进一步的FACS分析表明,Caki-2细胞中DCLK1的过表达使ALDH+细胞的数目增加了约7%(图9)。这些发现表明肾癌细胞系中存在ALDH/DCLK1++细胞的小亚群,并将DCLK1与ALDH表达和ALDH+细胞的增殖联系在一起。
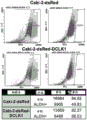
ACHN RCC细胞系包含细胞外DCLK1+亚群,其克隆形成能力增强
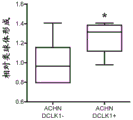
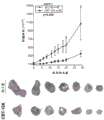
癌症干细胞或干样细胞的细胞外标记物对于靶向治疗的发展是非常需要的。假设在FACS实验中观察到的DCLK1+细胞的少数亚群中的一部分可能表达细胞外DCLK1。为了评估这一假设,使用靶向DCLK1胞外结构域的缀合荧光团的一级抗体和缀合荧光团的同工型对照以排除具有非特异性染色的细胞,在非透化条件下通过FACS从ACHN细胞系中分选DCLK1+细胞(图10)。FACS之后,立即将细胞接种到细胞外基质中进行三维集落形成测定。生长两周后,与ACHN-DCLK1-细胞相比,ACHN-DCLK1+细胞形成了明显更多的球状体(>25%)(图11)。该发现表明细胞外DCLK1存在于具有增强的克隆形成能力的RCC细胞群体中,并且提供了DCLK1在支持RCC干性中的作用和作为RCC干细胞标志物的证据。
DCLK1表达调节肾癌细胞的功能干性
响应药物处理的球状和集落形成能力是干细胞或干样细胞的明显特征。先前曾报道,以siRNA靶向DCLK1可以抑制RCC中的三维集落形成。为了扩大这些发现,使用针对DCLK1的特异性siRNA(siDCLK1)或无靶的扰乱序列siRNA(siSCR)敲低Caki-2细胞系中的DCLK1表达72小时。在确认成功的DCLK1敲低后(图12),将细胞用0.5μM舒尼替尼进行72小时处理,并通过台盼蓝排除法评估活力。然后将细胞接种到生长因子降低的基质胶中,以评估药物处理后的集落形成能力。观察到与siSCR相比,在集落形成2周后,用siDCLK1处理的Caki-2细胞(图13)中形成的球体数量减少了>50%。为了进一步评估DCLK1在RCC功能性成干性中的作用,如上所述,用未经处理或经DMSO或0.5μM舒尼替尼处理72h的Caki-2-dsRed-DCLK1和Caki2-dsRed细胞进行三维集落形成分析。生长2周后,在所有三个组中,由DCLK1过表达细胞形成的集落数量急剧增加(图14)。如前所述,使用图像处理技术评估球体面积(Weygant等人,“DCLK1 is a broadly dysregulated target against epithelial-mesenchymaltransition,focal adhesion,and stemness in clear cell renal carcinoma”,Oncotarget,6(4):2193-205(2015)),发现过表达DCLK1的细胞中三维集落的平均大小显著增加(图15)。如早期的FAC研究所预测的,未经处理的球体的免疫染色显示ALDH在Caki-2-dsRed-DCLK1细胞形成的集落中强表达,而在Caki-2-dsRed对照细胞形成的集落中微弱至低水平表达。这些发现共同表明,DCLK1是RCC锚定非依赖性生长、集落形成和自我更新能力的重要调节剂。此外,这些发现支持了DCLK1作为RCC中干细胞样细胞的标志物和调节剂的作用。
DCLK1调节RCC细胞对FDA批准的RTK和mTOR抑制剂的反应
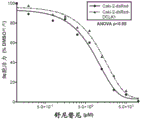
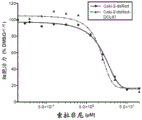
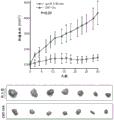
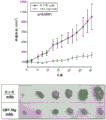
RCC中血管内皮生长因子(VEGF)及其受体的高水平表达支持其高度血管性质,从而使VEGF及其受体成为治疗靶标。当前,舒尼替尼和索拉非尼,受体酪氨酸激酶(RTK)的小分子抑制剂,已被FDA批准用于晚期RCC。发明人先前显示的初步证据表明DCLK1可能是调节RCC中对RTK抑制剂反应的重要因素(Weygant等人,“DCLK1 is a broadly dysregulatedtarget against epithelial-mesenchymal transition,focal adhesion,and stemnessin clear cell renal carcinoma”,Oncotarget,6(4):2193-205(2015))。考虑到干性与靶向疗法的反应之间的紧密关系及其对患者生存的重要性,进一步研究了DCLK1在此过程中的作用。将过表达DCLK1的Caki-2细胞接种到96孔板中,使其附着过夜,然后用递增浓度的舒尼替尼或索拉非尼处理。然后通过MTT测定评估相对细胞生存力。发现与dsRed载体对照细胞相比,过表达DCLK1显著降低了Caki-2细胞对舒尼替尼的敏感性(图16),但并未引起对索拉非尼的显著抗性(图17)。相反,与siSCR对照相比,用25nM siDCLK1预处理72小时的ACHN和Caki-2细胞对舒尼替尼和索拉非尼二者均显著敏化(图18-19)。
细胞内丝氨酸/苏氨酸激酶mTOR参与多种途径,并在细胞代谢和癌症进展中起重要作用。几种mTOR抑制剂(例如依维莫司和西罗莫司)已被批准用于治疗某些癌症,包括晚期肾癌。由于DCLK1的表达调节了响应于RTK抑制剂的细胞存活,接着研究了过表达DCLK1是否使RCC对mTOR抑制剂脱敏。按照与上述相同的方案,发现Caki-2细胞中DCLK1的过表达显著降低了对依维莫司和替西罗莫司的敏感性。这些结果说明,DCLK1调节RCC中对主要类型的FDA批准的抑制剂的耐药性,并且表达高水平DCLK1的RCC可能对舒尼替尼比对索拉非尼更易受影响。最后,这些发现表明,靶向DCLK1可以改善RCC患者对目前批准的药物的反应。
DCLK1和PD-L1在RCC肿瘤中共表达
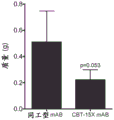
程序性死亡配体1(PD-L1/CD274)是一种免疫检查点标记,已知在包括肾癌在内的各种肿瘤的细胞表面上表达。它的表达通过与肿瘤特异性T细胞上的其受体--编程性死亡1(PD-1)结合、导致细胞凋亡以及使肿瘤细胞逃逸由活化T细胞诱导的细胞溶解作用而负调控免疫反应。虽然肾癌对化学疗法和放射疗法的反应较差,但集中于免疫治疗和免疫检查点策略(包括PD-L1/PD-1相互作用)的研究已显示出令人鼓舞的结果(Sznol等人,“Antagonist antibodies to PD-1 and B7-H1(PD-L1)in the treatment of advancedhuman cancer”,Clinical cancer research:an official journal of the AmericanAssociation for Cancer Research.19(5):1021-34(2013);Pardoll DM.“The blockadeof immune checkpoints in cancer immunotherapy”,Nature reviews Cancer.12(4):252-64(2012);Brahmer等人,“Safety and activity of anti-PD-L1 antibody inpatients with advanced cancer”.The New England journal of medicine.366(26):2455-65(2012);Topalian等人,“Targeting the PD-1/B7-H1(PD-L1)pathway toactivate anti-tumor immunity”.Current opinion in immunology.24(2):207-12(2012))。为了确定DCLK1和PD-L1是否在RCC中共表达,使用高密度组织微阵列进行了免疫组织化学分析,并由经验丰富的病理学家对结果进行了量化。PD-L1在RCC中以阶段依赖性方式强烈上调,类似于先前针对DCLK1报道的结果(图20)。此外,与具有细胞质PD-L1的肿瘤相比,具有膜定位的PD-L1的肿瘤表现出显著更高的DCLK1表达水平(图21)。
靶向DCLK1抑制RCC细胞中的免疫检查点,导致PBMC驱动的凋亡增加
鉴于组织芯片数据、免疫检查点与癌症干细胞之间假设的联系以及新出现的将免疫检查点与DCLK1支持的EMT表型联系起来的数据,评估了靶向的DCLK1敲低是否可能使RCC对免疫疗法敏感。在这些实验中,在Caki-2细胞中,DCLK1的过表达使PD-L1上调>2倍,使CTLA4上调>1.5倍(图22)。相反,通过用25nM siRNA或100μg/mL单克隆抗体CBT-15A处理72小时而靶向DCLK1显著降低了PD-L1的蛋白水平表达(图23),但对ACHN和Caki-2 RCC细胞中的CTLA4没有影响(数据未显示)。
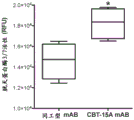
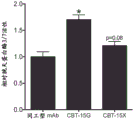
为了进一步评估这些发现的功能相关性,将ACHN肾和AsPC-1胰腺癌细胞接种到96孔中,并进行抗体依赖性细胞介导的细胞毒性测定。简而言之,在用同工型对照或CBT-15单克隆抗体预处理48小时后,将104个癌细胞接种到每个孔中。然后将人外周血单核细胞以每孔105个细胞的量接种到每个孔中,并共培养72小时。72小时后,进行CASPACEGLO-3/7活性测定(Promega,Madison,WI)以评估细胞凋亡。相对于对照治疗,胱天蛋白酶-3/7活性在CBT-15A治疗的肾癌细胞和CBT-15G治疗的胰腺癌细胞中显著增加,并且在CBT-15X治疗的胰腺癌细胞中也显著增加(图24A-24B)。这些发现证明了靶向DCLK1的单克隆抗体被用作针对肾癌和胰腺癌的免疫疗法的潜力。
CBT-15DCLK1靶向抗体可用作抗癌免疫疗法
为了证明CBT-15单克隆抗体的功效,从人肾腺癌(ACHN)和人胰腺腺癌(SW1990和AsPC-1)细胞系建立了肿瘤异种移植物。将0.5×106个细胞注射到8周大的无胸腺裸鼠的胁腹中,并使所得的肿瘤生长至平均体积为100mm3。达到此体积后,每两周提供25mg/kg的CBT-15或同工型对照mAB。大约每隔一天进行一次肿瘤体积测量。从注射开始的4周结束时,处死动物并切除肿瘤,测量并称重。
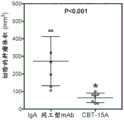
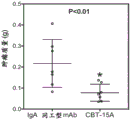
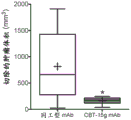
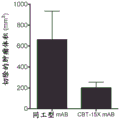
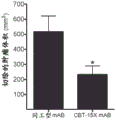
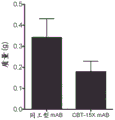
与同工型mAB相比,用CBT-15A mAb治疗强烈抑制了肾癌ACHN异种移植物的生长(图25;p<0.03)。通过在治疗结束时测量切除的肿瘤体积(图26;p<0.001)和重量(图27;p<0.01)来证实这一点。CBT-15A mAb导致切除的肿瘤体积和肿瘤重量显著减少。这些发现首次证明了DCLK1靶向药物对抗肾癌的强大体内效力。
用CBT-15G mAb治疗强烈抑制胰腺癌SW1990异种移植物的肿瘤发生,导致切除的肿瘤体积显著降低和肿瘤重量降低(图28-30)。
用CBT-15X mAb治疗强烈抑制胰腺癌SW1990异种移植物的肿瘤发生,导致切除的肿瘤体积显著减少和肿瘤重量减少(图31-33)。
用CBT-15X mAb治疗强烈抑制胰腺癌AsPC-1异种移植物的肿瘤发生,导致切除的肿瘤体积显著减少和肿瘤重量减少(图34-36)。
这些发现表明,靶向细胞外DCLK1的单克隆抗体对表达DCLK1同工型2和4的癌症(例如但不限于肾癌和胰腺癌)非常有效。
肾癌是高度侵袭性的,导致生存期差,并且与癌症干细胞特征紧密相关。肾细胞癌的特点是生长缓慢,低氧的微环境以及对药物和放射疗法的破坏性抵抗力。这些特征与肿瘤干细胞或干样细胞的存在一致。发明人最近报道,肿瘤干细胞特异性标记DCLK1在透明细胞肾细胞癌(RCC)中表观遗传失调和过表达,其下调抑制了该疾病的迁移/侵袭、局灶粘着和干性。本公开内容扩展了这些发现,并证明了DCLK1介导功能性干性,导致对FDA批准的药物的抗性,与ALDH RCC肿瘤干细胞标志物有关,并且其细胞外表达标志着RCC中具有增强的克隆形成能力的细胞。此外,已显示DCLK1介导免疫检查点标记CTLA4和PD-L1的表达,并且以新型靶向DCLK1的单克隆抗体(CBT-15A和CBT-15G)治疗可以使RCC细胞对免疫细胞介导的细胞凋亡敏感。最后,CBT-15 mAB强烈抑制RCC异种移植物中的肿瘤发生,为靶向RCC中的DCLK1提供了第一个体内证据。
从前面的描述将理解,可以在不背离其真实精神的情况下,对本公开的各种实施方式进行各种修改和改变。除非特别指出,否则本文提供的描述仅用于说明目的,而无意在限制意义上进行解释。因此,尽管这里已经结合某些非限制性的实施方式描述了本公开,使得可以更充分地理解和领会其各方面,但是并不意味着本公开限于这些特定的实施方式。相反,所有替代、修改和等同方式均意图包括在本文所定义的本公开的范围内。因此,上述各示例,包括具体的实施方案,将用于举例说明本公开的实践,应当理解,所示的细节仅是示例性的,仅是出于对特定实施方式的说明性讨论的目的,并且是为了提供被认为是对程序以及发明构思的原理和概念方面的有用且容易理解的描述而展示的。可以在不脱离本公开的精神和范围的情况下对本文所述的各种组分和组合物的配制,本文所述的方法或本文所述的方法的步骤或步骤顺序进行改变。
序列表
<110> The Board of Regents of the University of Oklahoma
<120> 抗双皮层蛋白样激酶1抗体及其使用方法
<130> 5835.181wo
<150> 62/512,372
<151> 2017-05-30
<160> 32
<170> PatentIn version 3.5
<210> 1
<211> 740
<212> PRT
<213> 人(Homo sapiens)
<400> 1
Met Ser Phe Gly Arg Asp Met Glu Leu Glu His Phe Asp Glu Arg Asp
1 5 10 15
Lys Ala Gln Arg Tyr Ser Arg Gly Ser Arg Val Asn Gly Leu Pro Ser
20 25 30
Pro Thr His Ser Ala His Cys Ser Phe Tyr Arg Thr Arg Thr Leu Gln
35 40 45
Thr Leu Ser Ser Glu Lys Lys Ala Lys Lys Val Arg Phe Tyr Arg Asn
50 55 60
Gly Asp Arg Tyr Phe Lys Gly Ile Val Tyr Ala Ile Ser Pro Asp Arg
65 70 75 80
Phe Arg Ser Phe Glu Ala Leu Leu Ala Asp Leu Thr Arg Thr Leu Ser
85 90 95
Asp Asn Val Asn Leu Pro Gln Gly Val Arg Thr Ile Tyr Thr Ile Asp
100 105 110
Gly Leu Lys Lys Ile Ser Ser Leu Asp Gln Leu Val Glu Gly Glu Ser
115 120 125
Tyr Val Cys Gly Ser Ile Glu Pro Phe Lys Lys Leu Glu Tyr Thr Lys
130 135 140
Asn Val Asn Pro Asn Trp Ser Val Asn Val Lys Thr Thr Ser Ala Ser
145 150 155 160
Arg Ala Val Ser Ser Leu Ala Thr Ala Lys Gly Ser Pro Ser Glu Val
165 170 175
Arg Glu Asn Lys Asp Phe Ile Arg Pro Lys Leu Val Thr Ile Ile Arg
180 185 190
Ser Gly Val Lys Pro Arg Lys Ala Val Arg Ile Leu Leu Asn Lys Lys
195 200 205
Thr Ala His Ser Phe Glu Gln Val Leu Thr Asp Ile Thr Asp Ala Ile
210 215 220
Lys Leu Asp Ser Gly Val Val Lys Arg Leu Tyr Thr Leu Asp Gly Lys
225 230 235 240
Gln Val Met Cys Leu Gln Asp Phe Phe Gly Asp Asp Asp Ile Phe Ile
245 250 255
Ala Cys Gly Pro Glu Lys Phe Arg Tyr Gln Asp Asp Phe Leu Leu Asp
260 265 270
Glu Ser Glu Cys Arg Val Val Lys Ser Thr Ser Tyr Thr Lys Ile Ala
275 280 285
Ser Ser Ser Arg Arg Ser Thr Thr Lys Ser Pro Gly Pro Ser Arg Arg
290 295 300
Ser Lys Ser Pro Ala Ser Thr Ser Ser Val Asn Gly Thr Pro Gly Ser
305 310 315 320
Gln Leu Ser Thr Pro Arg Ser Gly Lys Ser Pro Ser Pro Ser Pro Thr
325 330 335
Ser Pro Gly Ser Leu Arg Lys Gln Arg Ser Ser Gln His Gly Gly Ser
340 345 350
Ser Thr Ser Leu Ala Ser Thr Lys Val Cys Ser Ser Met Asp Glu Asn
355 360 365
Asp Gly Pro Gly Glu Glu Val Ser Glu Glu Gly Phe Gln Ile Pro Ala
370 375 380
Thr Ile Thr Glu Arg Tyr Lys Val Gly Arg Thr Ile Gly Asp Gly Asn
385 390 395 400
Phe Ala Val Val Lys Glu Cys Val Glu Arg Ser Thr Ala Arg Glu Tyr
405 410 415
Ala Leu Lys Ile Ile Lys Lys Ser Lys Cys Arg Gly Lys Glu His Met
420 425 430
Ile Gln Asn Glu Val Ser Ile Leu Arg Arg Val Lys His Pro Asn Ile
435 440 445
Val Leu Leu Ile Glu Glu Met Asp Val Pro Thr Glu Leu Tyr Leu Val
450 455 460
Met Glu Leu Val Lys Gly Gly Asp Leu Phe Asp Ala Ile Thr Ser Thr
465 470 475 480
Asn Lys Tyr Thr Glu Arg Asp Ala Ser Gly Met Leu Tyr Asn Leu Ala
485 490 495
Ser Ala Ile Lys Tyr Leu His Ser Leu Asn Ile Val His Arg Asp Ile
500 505 510
Lys Pro Glu Asn Leu Leu Val Tyr Glu His Gln Asp Gly Ser Lys Ser
515 520 525
Leu Lys Leu Gly Asp Phe Gly Leu Ala Thr Ile Val Asp Gly Pro Leu
530 535 540
Tyr Thr Val Cys Gly Thr Pro Thr Tyr Val Ala Pro Glu Ile Ile Ala
545 550 555 560
Glu Thr Gly Tyr Gly Leu Lys Val Asp Ile Trp Ala Ala Gly Val Ile
565 570 575
Thr Tyr Ile Leu Leu Cys Gly Phe Pro Pro Phe Arg Gly Ser Gly Asp
580 585 590
Asp Gln Glu Val Leu Phe Asp Gln Ile Leu Met Gly Gln Val Asp Phe
595 600 605
Pro Ser Pro Tyr Trp Asp Asn Val Ser Asp Ser Ala Lys Glu Leu Ile
610 615 620
Thr Met Met Leu Leu Val Asp Val Asp Gln Arg Phe Ser Ala Val Gln
625 630 635 640
Val Leu Glu His Pro Trp Val Asn Asp Asp Gly Leu Pro Glu Asn Glu
645 650 655
His Gln Leu Ser Val Ala Gly Lys Ile Lys Lys His Phe Asn Thr Gly
660 665 670
Pro Lys Pro Asn Ser Thr Ala Ala Gly Val Ser Val Ile Ala Thr Thr
675 680 685
Ala Leu Asp Lys Glu Arg Gln Val Phe Arg Arg Arg Arg Asn Gln Asp
690 695 700
Val Arg Ser Arg Tyr Lys Ala Gln Pro Ala Pro Pro Glu Leu Asn Ser
705 710 715 720
Glu Ser Glu Asp Tyr Ser Pro Ser Ser Ser Glu Thr Val Arg Ser Pro
725 730 735
Asn Ser Pro Phe
740
<210> 2
<211> 433
<212> PRT
<213> 人
<400> 2
Met Leu Glu Leu Ile Glu Val Asn Gly Thr Pro Gly Ser Gln Leu Ser
1 5 10 15
Thr Pro Arg Ser Gly Lys Ser Pro Ser Pro Ser Pro Thr Ser Pro Gly
20 25 30
Ser Leu Arg Lys Gln Arg Ser Ser Gln His Gly Gly Ser Ser Thr Ser
35 40 45
Leu Ala Ser Thr Lys Val Cys Ser Ser Met Asp Glu Asn Asp Gly Pro
50 55 60
Gly Glu Glu Val Ser Glu Glu Gly Phe Gln Ile Pro Ala Thr Ile Thr
65 70 75 80
Glu Arg Tyr Lys Val Gly Arg Thr Ile Gly Asp Gly Asn Phe Ala Val
85 90 95
Val Lys Glu Cys Val Glu Arg Ser Thr Ala Arg Glu Tyr Ala Leu Lys
100 105 110
Ile Ile Lys Lys Ser Lys Cys Arg Gly Lys Glu His Met Ile Gln Asn
115 120 125
Glu Val Ser Ile Leu Arg Arg Val Lys His Pro Asn Ile Val Leu Leu
130 135 140
Ile Glu Glu Met Asp Val Pro Thr Glu Leu Tyr Leu Val Met Glu Leu
145 150 155 160
Val Lys Gly Gly Asp Leu Phe Asp Ala Ile Thr Ser Thr Asn Lys Tyr
165 170 175
Thr Glu Arg Asp Ala Ser Gly Met Leu Tyr Asn Leu Ala Ser Ala Ile
180 185 190
Lys Tyr Leu His Ser Leu Asn Ile Val His Arg Asp Ile Lys Pro Glu
195 200 205
Asn Leu Leu Val Tyr Glu His Gln Asp Gly Ser Lys Ser Leu Lys Leu
210 215 220
Gly Asp Phe Gly Leu Ala Thr Ile Val Asp Gly Pro Leu Tyr Thr Val
225 230 235 240
Cys Gly Thr Pro Thr Tyr Val Ala Pro Glu Ile Ile Ala Glu Thr Gly
245 250 255
Tyr Gly Leu Lys Val Asp Ile Trp Ala Ala Gly Val Ile Thr Tyr Ile
260 265 270
Leu Leu Cys Gly Phe Pro Pro Phe Arg Gly Ser Gly Asp Asp Gln Glu
275 280 285
Val Leu Phe Asp Gln Ile Leu Met Gly Gln Val Asp Phe Pro Ser Pro
290 295 300
Tyr Trp Asp Asn Val Ser Asp Ser Ala Lys Glu Leu Ile Thr Met Met
305 310 315 320
Leu Leu Val Asp Val Asp Gln Arg Phe Ser Ala Val Gln Val Leu Glu
325 330 335
His Pro Trp Val Asn Asp Asp Gly Leu Pro Glu Asn Glu His Gln Leu
340 345 350
Ser Val Ala Gly Lys Ile Lys Lys His Phe Asn Thr Gly Pro Lys Pro
355 360 365
Asn Ser Thr Ala Ala Gly Val Ser Val Ile Ala Thr Thr Ala Leu Asp
370 375 380
Lys Glu Arg Gln Val Phe Arg Arg Arg Arg Asn Gln Asp Val Arg Ser
385 390 395 400
Arg Tyr Lys Ala Gln Pro Ala Pro Pro Glu Leu Asn Ser Glu Ser Glu
405 410 415
Asp Tyr Ser Pro Ser Ser Ser Glu Thr Val Arg Ser Pro Asn Ser Pro
420 425 430
Phe
<210> 3
<211> 14
<212> PRT
<213> 人
<400> 3
Arg Arg Arg Asn Gln Asp Val Arg Ser Arg Tyr Lys Ala Gln
1 5 10
<210> 4
<211> 12
<212> PRT
<213> 人
<400> 4
Glu Leu Asn Ser Glu Ser Glu Asp Tyr Ser Pro Ser
1 5 10
<210> 5
<211> 11
<212> PRT
<213> 人
<400> 5
Asp Val Arg Ser Arg Tyr Lys Ala Gln Pro Ala
1 5 10
<210> 6
<211> 15
<212> PRT
<213> 人
<400> 6
Pro Glu Leu Asn Ser Glu Ser Glu Asp Tyr Ser Pro Ser Ser Ser
1 5 10 15
<210> 7
<211> 15
<212> PRT
<213> 人
<400> 7
Arg Ser Arg Tyr Lys Ala Gln Pro Ala Pro Pro Glu Leu Asn Ser
1 5 10 15
<210> 8
<211> 14
<212> PRT
<213> 人
<400> 8
Asp Val Arg Ser Arg Tyr Lys Ala Gln Pro Ala Pro Pro Glu
1 5 10
<210> 9
<211> 15
<212> PRT
<213> 人
<400> 9
Arg Tyr Lys Ala Gln Pro Ala Pro Pro Glu Leu Asn Ser Glu Ser
1 5 10 15
<210> 10
<211> 17
<212> PRT
<213> 人
<400> 10
Asp Tyr Ser Pro Ser Ser Ser Glu Thr Val Arg Ser Pro Asn Ser Pro
1 5 10 15
Phe
<210> 11
<211> 15
<212> PRT
<213> 人
<400> 11
Glu Asp Tyr Ser Pro Ser Ser Ser Glu Thr Val Arg Ser Pro Asn
1 5 10 15
<210> 12
<211> 14
<212> PRT
<213> 人
<400> 12
Glu Ser Glu Asp Tyr Ser Pro Ser Ser Ser Glu Thr Val Arg
1 5 10
<210> 13
<211> 357
<212> DNA
<213> 人工序列
<220>
<223> 合成的核苷酸; CBT-15A的HC可变区cDNA序列
<400> 13
gacgtgaagc tcgtggagtc tgggggaggc ttagtgaagc ttggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctattaca tgtcttgggt tcgccagact 120
ccagagaaga ggctggagtt ggtcgcagcc attaatagta atggtggtag cacctactat 180
ccagacactg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccttgt attactgtgc aagacatggg 300
ggtaactact ggtacttcga tgtctggggc gcagggacca cggtcaccgt ctcctca 357
<210> 14
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的HC可变区氨基酸序列
<400> 14
Asp Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Leu Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Leu Val
35 40 45
Ala Ala Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg His Gly Gly Asn Tyr Trp Tyr Phe Asp Val Trp Gly Ala Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 15
<211> 339
<212> DNA
<213> 人工序列
<220>
<223> 合成的核苷酸; CBT-15A的LC可变区cDNA序列
<400> 15
gacattgtga tgtcacagtc tccatcctcc ctagctgtgt cagttggaga gaaggttact 60
atgagctgca agtccagtca gagcctttta tatagtagca atcaaaagaa ctacttggcc 120
tggtaccagc agaaaccagg gcagtctcct aaactgctga tttactgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactctcacc 240
atcagcagtg tgaaggctga agacctggca gtttattact gtcagcaata ttatagctat 300
ccgtacacgt tcggaggggg gaccaagctg gaaataaaa 339
<210> 16
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的LC可变区氨基酸序列
<400> 16
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 17
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VH CDR1
<400> 17
Gly Phe Thr Phe Ser Ser Tyr Tyr
1 5
<210> 18
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VH CDR2
<400> 18
Ile Asn Ser Asn Gly Gly Ser Thr
1 5
<210> 19
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VH CDR3
<400> 19
Ala Arg His Gly Gly Asn Tyr Trp Tyr Phe Asp Val
1 5 10
<210> 20
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VL CDR1
<400> 20
Gln Ser Leu Leu Tyr Ser Ser Asn Gln Lys Asn Tyr
1 5 10
<210> 21
<211> 3
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VL CDR2
<400> 21
Trp Ala Ser
1
<210> 22
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15A的VL CDR3
<400> 22
Gln Gln Tyr Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 23
<211> 351
<212> DNA
<213> 人工序列
<220>
<223> 合成的核苷酸; CBT-15G的HC可变区cDNA序列
<400> 23
gaggtccagc tgcagcagtc tgggactgcg ctggcaaggc ctggggcttc cgtgaagatg 60
tcctgcaagg cttctggcta cagctttacc agctactgga tgcactgggt aaaacagagg 120
cctggacagg gtctagaatg gattggtgct atttatcctg gaaaaagtga tactagctac 180
aaccagaagt tcaagggcaa ggccaaactg actgcagtca catccgccag cactgcctac 240
atggagctca gcagcctgac aaatgaggac tctgcggtct attactgtac aagatatggt 300
aagggtgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 24
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的HC可变区氨基酸序列
<400> 24
Glu Val Gln Leu Gln Gln Ser Gly Thr Ala Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Lys Ser Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Tyr Gly Lys Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 25
<211> 321
<212> DNA
<213> 人工序列
<220>
<223> 合成的核苷酸; CBT-15G的LC可变区cDNA序列
<400> 25
gacattgtgc tgacccaatc tcacaaattc atgtccacat cagtaggaga cagggtcacc 60
atcacctgca aggccagtca ggatgtgaat actgctgtag cctggtatca aaaaaaacca 120
gggcaatctc ctaaactgct gatttactgg gcatccaccc ggctcactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat tatactctca ccatcagcag tgtgcaggct 240
gaagacctgg cactttatta ctgtcagcaa cattatagta ctccgtacac gttcggaggg 300
gggaccaagc tggaaataaa a 321
<210> 26
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的LC可变区氨基酸序列
<400> 26
Asp Ile Val Leu Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Lys Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg Leu Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VH CDR1
<400> 27
Ser Tyr Trp Met His
1 5
<210> 28
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VH CDR2
<400> 28
Ala Ile Tyr Pro Gly Lys Ser Asp Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 29
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VH CDR3
<400> 29
Tyr Gly Lys Gly Ala Met Asp Tyr
1 5
<210> 30
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VL CDR1
<400> 30
Lys Ala Ser Gln Asp Val Asn Thr Ala Val Ala
1 5 10
<210> 31
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VL CDR2
<400> 31
Trp Ala Ser Thr Arg Leu Thr
1 5
<210> 32
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成肽; CBT-15G的VL CDR3
<400> 32
Gln Gln His Tyr Ser Thr Pro Tyr Thr
1 5
Claims (18)
1.抗体或其抗原结合部分,其包含:
重链可变区,其包含下述三个互补决定区:SEQ ID NO:17所示氨基酸序列的VH CDR1,SEQ ID NO:18所示氨基酸序列的VH CDR2和SEQ ID NO:19所示氨基酸序列的VH CDR3;以及
轻链可变区,其包含下述三个互补决定区:SEQ ID NO:20所示氨基酸序列的VL CDR1,SEQ ID NO:21所示氨基酸序列的VL CDR2和SEQ ID NO:22所示氨基酸序列的VL CDR3;并且
其中所述抗体或其抗原结合部分特异性结合SEQ ID NO:1所示的双皮层蛋白样激酶1(DCLK1)同工型2或SEQ ID NO:2所示的双皮层蛋白样激酶1(DCLK1)同工型4。
2.根据权利要求1所述的抗体或其抗原结合部分,其中所述重链可变区包含SEQ IDNO:14的氨基酸序列,并且所述轻链可变区包含SEQ ID NO:16的氨基酸序列。
3.根据权利要求1所述的抗体或其抗原结合部分,其中所述重链可变区包含与SEQ IDNO:14的氨基酸序列具有至少90%同一性的氨基酸序列,并且所述轻链可变区包含与SEQID NO:16的氨基酸序列具有至少90%同一性的氨基酸序列。
4.抗体或其抗原结合部分,其包含:
重链可变区,其包含下述三个互补决定区:SEQ ID NO:27所示氨基酸序列的VH CDR1,SEQ ID NO:28所示氨基酸序列的VH CDR2和SEQ ID NO:29所示氨基酸序列的VH CDR3;以及
轻链可变区,其包含下述三个互补决定区:SEQ ID NO:30所示氨基酸序列的VL CDR1,SEQ ID NO:31所示氨基酸序列的VL CDR2和SEQ ID NO:32所示氨基酸序列的VL CDR3;并且
其中所述抗体或其抗原结合部分特异性结合SEQ ID NO:1所示的双皮层蛋白样激酶1(DCLK1)同工型2或SEQ ID NO:2所示的双皮层蛋白样激酶1(DCLK1)同工型4。
5.根据权利要求4所述的抗体或其抗原结合部分,其中所述重链可变区包含SEQ IDNO:24的氨基酸序列,并且所述轻链可变区包含SEQ ID NO:26的氨基酸序列。
6.根据权利要求4所述的抗体或其抗原结合部分,其中所述重链可变区包含与SEQ IDNO:24的氨基酸序列具有至少90%同一性的氨基酸序列,并且所述轻链可变区包含与SEQID NO:26的氨基酸序列具有至少90%同一性的氨基酸序列。
7.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分的解离常数(KD)小于10-9M。
8.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分是鼠的、嵌合的或人源化的。
9.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗原结合部分选自scFv,di-scFv,Fab,Fab',F(ab')2,F(ab)2,二硫键连接的Fv,双抗体和小抗体片段。
10.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分包含至少一个恒定结构域,所述恒定结构域选自包含IgG恒定结构域和IgA恒定结构域的组。
11.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分特异性结合包含SEQ ID NO:10所示氨基酸序列的DCLK1的表位。
12.根据权利要求1或4所述的抗体或其抗原结合部分,其中:
所述抗体或其抗原结合部分与治疗剂或诊断剂缀合,并且任选地其中所述治疗剂或诊断剂通过酶可切割的接头与所述抗体或其抗原结合部分缀合。
13.根据权利要求1或4所述的抗体或其抗原结合部分,其中所述抗体或其抗原结合部分对体内赘生性细胞的生长具有抑制活性,并且其中所述赘生性细胞选自肿瘤干细胞,肺肿瘤细胞,乳腺肿瘤细胞,胰腺肿瘤细胞,肾肿瘤细胞,胃肿瘤细胞,食道肿瘤细胞,小肠肿瘤细胞,结肠肿瘤细胞和直肠肿瘤细胞。
14.一种组合物,其包含:
权利要求1-13中任一项所述的抗体或其抗原结合部分;和
至少一种药学上可接受的载体。
15.根据权利要求1至13中任一项所述的抗体或其抗原结合部分在制备用于在有需要的受试者中治疗与DCLK1相关的疾病或病症的药物中的用途。
16.一种分离的多核苷酸,其编码权利要求1-13中任一项所述的抗体或其抗原结合部分。
17.包含权利要求16所述的分离的多核苷酸的表达载体。
18.包含权利要求17所述的表达载体的宿主细胞。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762512372P | 2017-05-30 | 2017-05-30 | |
| US62/512,372 | 2017-05-30 | ||
| PCT/US2018/035071 WO2018222675A1 (en) | 2017-05-30 | 2018-05-30 | Anti-doublecortin-like kinase 1 antibodies and methods of use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN111010867A CN111010867A (zh) | 2020-04-14 |
| CN111010867B true CN111010867B (zh) | 2023-05-12 |
Family
ID=64455044
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201880046217.2A Active CN111010867B (zh) | 2017-05-30 | 2018-05-30 | 抗双皮层蛋白样激酶1抗体及其使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11655307B2 (zh) |
| EP (1) | EP3630046A4 (zh) |
| JP (1) | JP7366755B2 (zh) |
| KR (1) | KR102344616B1 (zh) |
| CN (1) | CN111010867B (zh) |
| WO (1) | WO2018222675A1 (zh) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7409669B2 (ja) * | 2017-12-04 | 2024-01-09 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティ オブ オクラホマ | 抗dclk1抗体およびキメラ抗原受容体、ならびにこれらの組成物および使用方法 |
| CA3207893A1 (en) | 2021-01-15 | 2022-07-21 | Seagen Inc. | Immunomodulatory antibody-drug conjugates |
| JP2024506300A (ja) | 2021-02-03 | 2024-02-13 | シージェン インコーポレイテッド | 免疫刺激化合物及びコンジュゲート体 |
| KR102452957B1 (ko) | 2022-03-14 | 2022-10-11 | 한동대학교 산학협력단 | 프로바이오틱스 균주를 유효성분으로 포함하는 클로스트리디오이데스 디피실레 감염을 예방 또는 치료하기 위한 조성물 |
| WO2023215740A1 (en) | 2022-05-06 | 2023-11-09 | Seagen Inc. | Immunomodulatory antibody-drug conjugates |
| WO2024030577A1 (en) | 2022-08-03 | 2024-02-08 | Seagen Inc. | Immunostimulatory anti-pd-l1-drug conjugates |
| EP4321522A1 (en) | 2022-08-12 | 2024-02-14 | Seagen Inc. | Cytotoxic compounds and conjugates thereof |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2388932T3 (es) * | 2005-12-02 | 2012-10-19 | Genentech, Inc. | Polipéptidos de unión y usos de los mismos |
| WO2008030543A2 (en) | 2006-09-08 | 2008-03-13 | Cell Signaling Technology, Inc. | Tyrosine, serine and threonine phosphorylation sites |
| US7902166B2 (en) | 2008-04-03 | 2011-03-08 | The Board Of Regents Of The University Of Oklahoma | Compositions comprising inhibitors of RNA binding proteins and methods of producing and using same |
| US8936941B2 (en) | 2008-04-03 | 2015-01-20 | The Board Of Regents Of The University Of Oklahoma | Compositions useful for cancer detection and treatment, a cancer stem cell model, and methods of production and use thereof |
| US9663585B2 (en) * | 2008-05-16 | 2017-05-30 | The Board Of Regents Of The University Of Oklahoma | Anti-DCLK1 monoclonal antibodies and methods of production and use thereof |
| JP2015518471A (ja) | 2012-03-28 | 2015-07-02 | ジェネンテック, インコーポレイテッド | 抗hcmvイディオタイプ抗体およびそれらの使用 |
| MX2016002574A (es) | 2013-08-28 | 2016-06-14 | Stemcentrx Inc | Nuevos moduladores del homologo 6 (sez6) y metodos de uso. |
| GB2537445A (en) | 2014-11-10 | 2016-10-19 | Medimmune Ltd | Binding molecules specific for CD73 and uses thereof |
| CN116063541A (zh) | 2015-04-17 | 2023-05-05 | 安进研发(慕尼黑)股份有限公司 | 用于cdh3和cd3的双特异性抗体构建体 |
| US9822184B2 (en) | 2015-04-22 | 2017-11-21 | The Board Of Regents Of The University Of Texas System | DCLK1 short form specific binding agents |
| JP7409669B2 (ja) | 2017-12-04 | 2024-01-09 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティ オブ オクラホマ | 抗dclk1抗体およびキメラ抗原受容体、ならびにこれらの組成物および使用方法 |
-
2018
- 2018-05-30 WO PCT/US2018/035071 patent/WO2018222675A1/en unknown
- 2018-05-30 US US16/617,074 patent/US11655307B2/en active Active
- 2018-05-30 KR KR1020197038154A patent/KR102344616B1/ko active IP Right Grant
- 2018-05-30 CN CN201880046217.2A patent/CN111010867B/zh active Active
- 2018-05-30 EP EP18810790.8A patent/EP3630046A4/en active Pending
- 2018-05-30 JP JP2019566107A patent/JP7366755B2/ja active Active
Non-Patent Citations (1)
| Title |
|---|
| "Systemic delivery of CBT-15G DCLK1-targeted monoclonal antibody dramatically decreases tumorigenesis in a xenograft model of pancreatic cancer";Nathaniel Weygant等;《Nathaniel Weygant》;20161231;第76卷(第S14期);第577页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3630046A1 (en) | 2020-04-08 |
| CN111010867A (zh) | 2020-04-14 |
| KR102344616B1 (ko) | 2021-12-31 |
| US20210189007A1 (en) | 2021-06-24 |
| US11655307B2 (en) | 2023-05-23 |
| JP2020522488A (ja) | 2020-07-30 |
| WO2018222675A1 (en) | 2018-12-06 |
| JP7366755B2 (ja) | 2023-10-23 |
| EP3630046A4 (en) | 2021-03-03 |
| KR20200010497A (ko) | 2020-01-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN111010867B (zh) | 抗双皮层蛋白样激酶1抗体及其使用方法 | |
| JP7144121B2 (ja) | 抗体-薬物コンジュゲートのネオアジュバント使用 | |
| RU2758234C2 (ru) | ЛЕЧЕНИЕ ТРИЖДЫ НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, ХАРАКТЕРИЗУЮЩЕГОСЯ ЭКСПРЕССИЕЙ Trop-2, С ПОМОЩЬЮ САЦИТУЗУМАБА ГОВИТЕКАНА И ИНГИБИТОРА Rad51 | |
| TWI782930B (zh) | 抗met抗體,結合met之雙特異性抗原結合分子及其使用方法 | |
| RU2708075C2 (ru) | Конъюгаты анти-ртк7 антитело-лекарственное средство | |
| JP2021120382A (ja) | 部位特異的抗体コンジュゲーション方法および組成物 | |
| ES2645272T3 (es) | Moduladores de DLL3 y procedimientos de utilización | |
| CN109195991B (zh) | 对糖基化pd-l1特异的双重功能抗体及其使用方法 | |
| KR101809072B1 (ko) | 항-cxcr4 항체 및 항체-약물 접합체 | |
| JP2018517888A (ja) | 循環trop−2陽性癌細胞の単離、検出、診断及び/または特徴付け | |
| CA2919570A1 (en) | Diagnosis and therapy of cancer involving cancer stem cells | |
| KR20170010764A (ko) | 신규한 항-rnf43 항체 및 사용 방법 | |
| KR20170045351A (ko) | 신규한 항-mfi2 항체 및 사용 방법 | |
| KR20210130755A (ko) | 항-met 항체 및 met에 결합하는 이중특이적 항원 결합 분자를 사용하여 안구암을 치료하는 방법 | |
| US20180296691A1 (en) | Anti-efna4 antibody-drug conjugates | |
| JP2020523414A (ja) | Lgr5に結合する抗体薬物複合体 | |
| WO2018187158A1 (en) | Combination therapy of cancer with anti-endoglin antibodies and anti-programmed death receptor agents | |
| JP2020508292A (ja) | Trop−2を標的化するトポイソメラーゼ−i阻害抗体−薬物コンジュゲート(adc)による小細胞肺癌(sclc)の療法 | |
| WO2023146866A2 (en) | Methods for treating calcitonin gene-related peptide (cgrp) - expressing cancers | |
| SAHIN et al. | Patent 2919570 Summary |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 40027735 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |