CN108140117B - 组织微阵列分析 - Google Patents
组织微阵列分析 Download PDFInfo
- Publication number
- CN108140117B CN108140117B CN201680060975.0A CN201680060975A CN108140117B CN 108140117 B CN108140117 B CN 108140117B CN 201680060975 A CN201680060975 A CN 201680060975A CN 108140117 B CN108140117 B CN 108140117B
- Authority
- CN
- China
- Prior art keywords
- tissue
- image
- microarray
- core
- registered
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/30—Determination of transform parameters for the alignment of images, i.e. image registration
- G06T7/33—Determination of transform parameters for the alignment of images, i.e. image registration using feature-based methods
- G06T7/337—Determination of transform parameters for the alignment of images, i.e. image registration using feature-based methods involving reference images or patches
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06F—ELECTRIC DIGITAL DATA PROCESSING
- G06F18/00—Pattern recognition
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/0002—Inspection of images, e.g. flaw detection
- G06T7/0012—Biomedical image inspection
- G06T7/0014—Biomedical image inspection using an image reference approach
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/20—Scenes; Scene-specific elements in augmented reality scenes
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/695—Preprocessing, e.g. image segmentation
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V20/00—Scenes; Scene-specific elements
- G06V20/60—Type of objects
- G06V20/69—Microscopic objects, e.g. biological cells or cellular parts
- G06V20/698—Matching; Classification
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06F—ELECTRIC DIGITAL DATA PROCESSING
- G06F3/00—Input arrangements for transferring data to be processed into a form capable of being handled by the computer; Output arrangements for transferring data from processing unit to output unit, e.g. interface arrangements
- G06F3/14—Digital output to display device ; Cooperation and interconnection of the display device with other functional units
- G06F3/147—Digital output to display device ; Cooperation and interconnection of the display device with other functional units using display panels
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10056—Microscopic image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/20—Special algorithmic details
- G06T2207/20212—Image combination
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
- G06T2207/30024—Cell structures in vitro; Tissue sections in vitro
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
- G06T2207/30072—Microarray; Biochip, DNA array; Well plate
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V2201/00—Indexing scheme relating to image or video recognition or understanding
- G06V2201/03—Recognition of patterns in medical or anatomical images
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06V—IMAGE OR VIDEO RECOGNITION OR UNDERSTANDING
- G06V2201/00—Indexing scheme relating to image or video recognition or understanding
- G06V2201/04—Recognition of patterns in DNA microarrays
Landscapes
- Engineering & Computer Science (AREA)
- Theoretical Computer Science (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Multimedia (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Medical Informatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Quality & Reliability (AREA)
- Radiology & Medical Imaging (AREA)
- Evolutionary Biology (AREA)
- Evolutionary Computation (AREA)
- General Engineering & Computer Science (AREA)
- Artificial Intelligence (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Data Mining & Analysis (AREA)
- Bioinformatics & Computational Biology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Sampling And Sample Adjustment (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Image Analysis (AREA)
Abstract
本发明涉及数字病理学。为了便于分析组织微阵列,提供用于组织检查的设备。所述设备包括数据输入器(102)、组织微阵列分析单元(104)和输出器(106)。所述数据输入器被配置为接收从组织样品块获得的参照切片的参照图像;和接收包含从至少组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像。所述组织微阵列分析单元被配置为基于各组织核心在组织样品块内的空间排列来将至少一个组织核心的组织核心图像与参照图像配准。输出器被配置为提供从组织微阵列分析单元获得的配准结果用于进一步分析目的。
Description
技术领域
本发明涉及数字病理学领域,且尤其涉及用于组织检查的设备、系统和方法。此外,本发明涉及计算机程序元件以及计算机可读介质。
背景技术
患者材料(例如组织和细胞)的病理学诊断研究是许多治疗决策的基础,例如,在肿瘤学中。在标准解剖病理学中,基于细胞形态学和染色特征进行诊断。疾病诸如癌症的发病机理和进展的研究可能需要使用多种生物标志物用于染色。使用标准组织病理学技术验证这些生物标志物可能是耗时且费力的。
近年来,已经提出组织微阵列来克服这些问题。组织微阵列是通过从不同的石蜡供体块提取组织核心并将这些重新包埋入单个受体(或微阵列)块中作为阵列而产生的石蜡块。因此,组织微阵列可以允许同时高通量分析多个样本。例如,US 2009/0247416 A1描述了用于分析组织微阵列的方法。然而,分析组织微阵列的图像可能是困难的,例如,具有多个组织核心和/或多种染色剂。WO2015063192涉及配准整个组织切片的两个图像的方法。确定第一图像中的不可靠区域,并基于第一图像中不可靠区域之外的区域进行配准。
发明内容
可能需要促进分析组织微阵列。
本发明的目的通过独立权利要求的主题来解决,其中进一步实施方案被并入从属权利要求中。应当注意,本发明的以下描述的方面也适于用于组织检查的设备、系统和方法,以及计算机程序元件和计算机可读介质。
根据本发明的第一个方面,提供用于组织检查的设备。该设备包括数据输入器、组织微阵列分析单元和输出器。数据输入器被配置为接收从组织样品块获得的参照切片的参照图像;接收包含从至少组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;和将参照图像和微阵列图像提供给组织微阵列分析单元。组织微阵列分析单元被配置为基于各组织核心在组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准。输出器被配置为提供从组织微阵列分析单元获得的配准结果用于进一步分析目的。
作为结果,组织核心图像被布置在组织的参照图像(例如,整个载片图像)中的对应位置处。这允许操作者,例如病理学家,在来源组织的整个载片图像的背景中解释组织核心上的染色结果。
根据本发明的一个实例,组织微阵列分析单元进一步被配置为基于配准的组织核心图像的形态信息来鉴定配准的组织核心图像内的目标特征。另外,组织微阵列分析单元被配置为基于形态信息识别参照图像上的外围区域中的匹配特征,其中外围区域围绕各个配准的组织核心图像。此外,组织微阵列分析单元被配置为将配准的组织核心图像内的目标特征的染色模式延伸至外围区域中的匹配特征中,使得染色模式继续通过并超过各个配准的组织核心图像的周界。
作为结果,将染色结果延伸或外推至一个或多个组织核心之外的区域在组织核心周围创建数字染色,这可以便于手动评分和解释。
根据本发明的第二个方面,提供用于组织检查的系统。该系统包括提供图像的设备和根据上文和下文中描述的实例之一的用于组织检查的设备。提供图像的设备被配置为提供从组织样品块获得的参照切片的参照图像。提供图像的设备被进一步配置为提供微阵列切片的微阵列图像,所述微阵列切片包含从至少组织样品块获得的至少一个组织核心。另外,提供图像的设备被配置为将参照图像和微阵列图像提供给用于组织检查的设备。
作为结果,该系统允许来源组织的组织核心图像和参照图像(例如,整个载片图像)中的形态信息的组合,因此使得更容易理解整个样品中(例如,在全部肿瘤中)的组织核心图像的背景。
根据本发明的一个实例,该系统进一步包括显示器。该显示器被配置为显示配准的组织核心图像与参照图像的组合以用于分析目的。
作为结果,配准结果被可视地呈现给操作者,例如,病理学家,用于更好地解释染色结果。
根据本发明的第三个方面,提供用于组织检查的分法。该方法包括以下步骤:
a) 提供从组织样品块获得的参照切片的参照图像;
b) 提供包含从至少组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;
c) 基于各组织核心在组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准;和
d) 提供配准的组织核心图像与参照图像的组合以用于分析目的。
作为结果,这可以有助于理解组织核心在全部组织中的背景。
该组合可以以几种方法实现。例如,配准的组织核心图像以叠加方式与参照图像组合。在一个进一步实例中,将配准的组织核心图像插入参照图像中。
根据本发明的一个实例,对于步骤a),其提供:
a1) 从组织样品块生成参照切片;和
a2) 从参照切片生成图像作为参照图像。
在步骤a1)中,可以在生成图像之前将参照切片染色(例如,用苏木精和伊红(H&E)染料染色)以增强对比度并使某些形态特征可见。例如,所述参照图像是待检查的组织的完整载片图像。
根据本发明的一个实例,对于步骤b),其提供:
b1) 创建包含布置在块结构内的至少一个组织核心的微阵列块;
b2) 生成所述微阵列块的至少一个微阵列切片;和
b3) 生成所述微阵列切片的图像作为组织微阵列图像。
根据本发明的一个实例,在步骤b2)中,将至少一个微阵列切片染色。任选地,所述至少一个微阵列切片与参照切片不同地染色。
换言之,所述至少一个微阵列切片可以用至少一种染色方案染色用于显现某些目标特征的形态信息。生物标志物,诸如蛋白或核酸,也可以是染色靶标。
根据本发明的一个实例,所述方法进一步包括:
f) 基于配准的组织核心图像的形态信息,鉴定配准的组织核心图像内的目标特征;
g) 基于形态信息识别参照图像上的外围区域中的匹配特征,其中外围区域围绕各个配准的组织核心图像;且
h) 将配准的组织核心图像内的目标特征的染色模式延伸至外围区域中的匹配特征中,使得染色模式继续通过并超过各个配准的组织核心图像的周界。
通过将染色模式延伸至组织核心图像周围的外围区域中,组织核心之外的匹配特征也被着色或标记。这可以允许用户,例如,病理学家,鉴定不仅在组织核心图像内部而且在组织核心图像外部的目标特征。换言之,染色模式的延伸可以扩大染色结果,因此有助于例如手动评分和解释某些特征。
根据本发明的一个实例,步骤g)进一步包括:
g1) 为外围区域中的匹配特征分配质量指数;和
g2) 基于分配的质量指数来确定外围区域的范围。
换言之,延伸(或外推)的范围由可能与特征匹配的可靠性相关的质量指数来确定。这允许用户控制组织核心图像之外的特征匹配过程的程度。
根据本发明的一个实例,延伸至匹配特征中的染色模式具有依赖于以下的透明度和/或强度:
- 分配的质量指数;和/或
- 距配准的组织核心图像的距离。
在一个实例中,所述强度可以随着距组织核心的距离增加而逐渐变化。强度的降低还可以取决于与特征延伸的可靠性相关的质量指数。作为结果,用户(例如病理学家)可以根据匹配特征的相应强度和/或透明度来鉴定特征延伸(或特征匹配)的可靠性。
根据本发明的一个实例,至少两个组织核心用不同的染色方案染色。在步骤c)中,将至少两个组织核心的组织核心图像与参照图像配准。
作为结果,可以在同一参照图像(例如整个载片图像)上同时在不同的位置显现和分析多个染色点。这可以有助于例如对肿瘤亚分型用于肿瘤诊断。在不同位置取多个核心也可以是有用的,例如,用于理解肿瘤的异质性方面。
根据本发明的一个实例,所述方法进一步包括:
b4) 提供从所述微阵列块获得的另一个微阵列切片的另一个微阵列图像,其中所述另一个微阵列切片与所述微阵列切片不同地染色;且
c1) 将所述另一个微阵列图像的组织核心中的至少一个的另外的组织核心图像与参照图像配准。
微阵列切片也被称为第一微阵列切片,而另一个微阵列切片也被称为第二微阵列切片。
换言之,连续的载片可以接受不同的染色,和/或针对不同的生物标志物染色。作为结果,可以用不同的染色方案染色相同的组织核心,用于更好地理解病理学信息。
根据本发明的一个实例,在步骤c1)中,基于至少一个先前配准的组织核心图像来配准另外的组织核心图像。
由于某些信息(诸如单个组织核心相对于组织微阵列方向的取向)对于来自相同微阵列块的所有切片保持不变(或几乎不变),所以这种信息可用于改善匹配过程。
根据本发明的第四个方面,提供计算机程序元件,用于控制根据上文和下面描述的实施方案之一的设备,所述计算机程序元件当由处理单元执行时适于执行本发明的方法。
根据本发明的第五个方面,提供存储有程序元件的计算机可读介质。
术语“参照图像”也可以被称为“整个载片图像”、数字图像或数字载片。参照图像涉及使用扫描装置从(例如玻璃)载片创建的图像数据。参照图像(整个载片图像、数字图像或数字载片)可以直接由扫描装置(如桌面载片扫描仪)提供。或者,参照图像可以由图像管理系统提供,所述图像管理系统允许经由互联网本地或远程进行归档和智能检索。
术语“组织样品块”,也被称为供体块,涉及从人或非人的区域获得的组织。所述组织样品块可以从活生物体中获得,或者也可以从非活(死亡)生物体中获得,其可以包埋于石蜡中用于后来使用。例如,取决于怀疑的癌症类型,组织样品块可以以不同的方式(例如穿孔/组织芯活检(core biopsy)、切除/切开活检、切除等)获得。
术语“样本切片”或“切片”涉及病理样品块的薄切片,其通过将石蜡包埋的病理样品块(在例如化学固定、处理和包埋程序之后)切片成薄片(厚度可以涉及几微米的量级)来获得。
术语“样品载片”涉及用于支持(并且因此携带)样品切片用于成像目的的且还用于存储样品切片的存档目的而提供的载体。在一个实例中,所述样品载片包含其上提供有样品切片的玻璃基板。可以提供覆盖物,例如薄玻璃或聚合物层或板以保护和保持样品切片。
术语“微阵列块”,也被称为受体块,涉及可属于且来自相同组织样品块中的不同位置和/或来自不同组织样品块的组织核心的阵列。
术语“组织核心”涉及微阵列块内的样品切片。组织核心可以在不同位置从组织样品块(或供体块)中穿孔获得(punched out),并且以规则模式布置在微阵列块(或受体块)中。组织核心可以具有0.6至2mm或任何其他合适的值的直径。因此,微阵列块可以在单个载片上包含数百个斑点形式的组织核心。例如,在样品切片是组织切片的情况下,组织核心也被称为组织核心。
术语“微阵列切片”涉及微阵列块的薄切片,其通过将微阵列块切片成薄切片而获得。
术语“微阵列图像”涉及使用数字图像采集或扫描装置从微阵列切片创建的图像数据。微阵列图像可以包含单独文件和/或与单独文件关联,所述单独文件含有注释以跟踪各个图像和每个图像内的来源样品。
根据本发明的一个方面,组织微阵列的组织核心的图像与相应位置处的组织的原始整个载片图像配准。组织核心的图像与原始整个载片图像的配准可以有助于理解总组织(例如,总肿瘤)中的组织核心的背景。配准可以涉及图像的面内位移、旋转和拉伸以获得图像和参照图像之间的最小数量的匹配特征。匹配特征的数量可以在50和500之间或另一个期望的数量。
配准图像的显示允许用户在参照图像的视图和提供不同染色程序的结果的相应组织核心的视图之间切换(toggle)。可以从都与彼此配准的相同核心得到多个染色图像,使得用户可以在不同的图像之间切换。或者,半透明图像可以叠加在参照图像上以帮助解释观察结果。任选地,可以在组织核心的图像外部的区域中实施数字染色,使得组织核心的染色模式延伸至配准的参照图像的外围区域中。随着与其相关的组织核心的不确定性和/或距离增加,数字染色强度可以变淡(即透明度增加)。染色模式的延伸可以有助于手动评分和解释。作为进一步选择,可以将不同位置和/或多个染色点处的多个核心与原始整个载片图像一起配准,例如,用于理解肿瘤的异质性方面,用于将肿瘤亚分型用于肿瘤诊断或用于任何其他分析目的。
参照图像可以优选为患者样品的苏木精和伊红染料(H&E)染色的组织切片。该切片优选在制造微阵列之前获得。可以在参照图像上确定待从供体组织块提取的核心的位置。核心位置的坐标可以存储在文件中,并用作用于将来自各个核心的图像与参照图像配准的起始位置。含有核心阵列的切片经历不同的、优选生物标志物定向的染色测定,例如用于将肿瘤亚分型并获得支持诊断患者病例的信息。
对应于相同组织块来源的核心的图像可以组合在单个图像中并与参照图像配准。这可以是来自不同染料的图像。核心区域以外的虚拟染色可以是来自不同图像的组合染色以代表信息的组合。作为一个实例,可以将例如人表皮生长因子受体2(HER2)的细胞膜染色与例如雌激素受体(ER)的核染色组合,并任选地将其与乳腺肿瘤样品中的Her2-neu基因扩增的荧光原位杂交(FISH)染色组合。以该方式,所有信息都可以显示于单个视图中,并可以单独加亮或调暗每个染色点。通过在核心区域之外覆盖和延伸染色点,病理学家可以更好地了解肿瘤特性。通过在覆盖图中加亮或调暗染色图像,除了核心周围的区域之外,还在核心区域中呈现虚拟染色。虚拟染色可以使用与原始染料不同的颜色以促进观察叠加区域。
参照下文描述的实施方案,本发明的这些和其他方面将变得显而易见并得到阐明。
附图说明
下面将参照以下附图来描述本发明的示例性实施方案:
图1显示用于组织检查的方法的实例。
图2显示用于组织检查的方法的另一个实例。
图3A至3C显示图2的示意图。
图4显示用于将组织核心图像与参照图像配准的实例。
图5显示用于组织检查的方法的另一个实例。
图6显示图4的延伸染色模式的实例。
图7显示用于组织检查的方法的另一个实例。
图8显示用于组织检查的方法的又另一个实例。
图9显示用于组织检查的方法的另一个实例。
图10显示用于组织检查的设备的实例的示意性设置。
图11显示用于组织检查的系统的实例的示意性设置。
图12、图13和图14分别显示图4、图6和图8的实施方案的照片图像。
所述图仅仅示意性举例说明,且不是按比例的。在所有附图中相同的附图标记是指相同或相似的特征。
具体实施方式
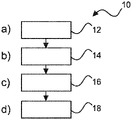
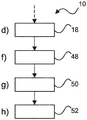
图1显示用于组织检查的方法10的基本步骤。该方法包括以下步骤:
- 在也被称为步骤a)的第一步骤12中,提供从组织样品块获得的参照切片的参照图像。
- 在也被称为步骤b)的第二步骤14中,提供包含从至少组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像。
- 在也被称为步骤c)的第三步骤16中,基于各组织核心在组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准。
- 在也被称为步骤d)的第四步骤18中,为了分析目的,将配准的组织核心图像与参照图像组合提供。
在步骤a)中,可以将参照图像预先存储在图像管理系统中,所述图像管理系统允许本地或远程检索。所述参照图像也可以由图像采集装置(诸如桌面载片扫描仪)直接提供。
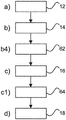
图2显示一个选项,根据所述选项,对于步骤a),其提供:a1)从组织样品块生成20参照图像切片;和a2)从参照切片生成22图像作为参照图像。任选的步骤a1)和a2)在图2中通过虚线指示。
在步骤a1)中,可以在生成图像之前将参照切片染色(例如,用H&E染料染色)以增强对比度并使形态特征可见。
在步骤b)中,微阵列图像也可以预先存储在图像管理中。或者,微阵列图像可以由图像采集装置提供。
应注意到,用于方法步骤的字母符号(字母)用于区分方法步骤,然而,所述符号并不意味着将该方法步骤的顺序限制于字母顺序。例如,参照图像也可以在去除组织核心之后获得。换言之,还可以基于以下顺序步骤进行组织检查:b)-a)-c)-d)。
在图2中还举例说明另一个选项,根据所述选项,对于步骤b),其提供:b1)创建24包含布置在块结构内的至少一个组织核心的微阵列块;b2)生成26所述微阵列块的至少一个微阵列切片;和b3)生成28所述微阵列切片的图像作为组织微阵列图像。任选的步骤b1)至b3)也在图2中通过虚线指示。
在步骤b2)中,可以将至少一个微阵列切片染色。任选地,所述至少一个微阵列切片与参照切片不同地染色。
换言之,所述微阵列切片可以任选地用染色方案处理,例如,用于评估癌症的信号传导蛋白或分子生物标志物。
图3A至图3C 显示任选的步骤b1)至b3)。
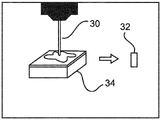
在图3A中,使用供体穿孔器30从组织样品块34(或供体块)提取至少一个组织核心32。
任选地,可以在穿孔过程之前采集从组织样品块34(即具有石蜡包埋的组织样品的供体块)获得的H&E染色的切片的数字整个载片图像。待去除的组织核心的位置可以在相应的数字整个载片图像上选择和指示。以该方式,可以得到不同组织核心的坐标。因此,可以自动创建组织微阵列36。
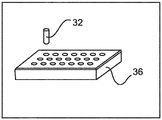
在图3B中,在微阵列块36(或受体块)中布置或重新组装提取的组织核心32。
组织核心32的产生和微阵列块36中的组装可能需要来自组织样品块34的一些反馈。例如,为了验证,可以在去除组织核心32之后从组织样品块34获取数字整个载片图像。尽管没有举例说明,但作为选项,可以从参照样品添加额外的组织核心以充当各种预期的染色反应的校准参照。
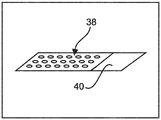
在图3C中,通过将微阵列块36切割或切成例如 4至5微米厚切片来创建至少一个组织微阵列切片38。组织微阵列切片38由透明载片40支撑。可以扫描微阵列切片38以获得微阵列切片38的整个载片图像,或者将其存储用于以后使用。
任选地,根据手边的研究,微阵列切片38可以用生物标志物染色。这可以是明场模式或荧光下的免疫或原位杂交(ISH)染色或任何其他特殊染色或其组合。在染色程序之后,扫描微阵列切片38以获得染色的微阵列切片38的整个载片图像。
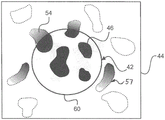
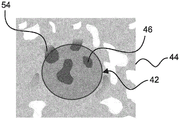
图4显示用于将组织核心图像42与参照图像44配准的步骤c)的实例。
组织核心图像42涉及对应于微阵列切片38(参见图3C)的整个载片图像中的组织核心32(参见图3C)的图像区域。参照图像44可以在除去组织核心之前或之后采集。在核心除去之后获取参照图像44的情况下,可能需要小心的提取和组装过程,因为仅可以使用来自组织核心的坐标。
也作为图4中的选项进行举例说明,组织核心32用染色方案进行处理,以使组织核心32内的目标特征46染色或着色。在该实例中,目标特征46涉及肿瘤细胞的细胞质。
基于组织样品块内的相应组织核心的空间布置,将组织核心图像42与参照图像46配准。空间布置可以基于特征匹配、基于坐标或其组合来确定。
术语“配准”涉及将组织核心图像布置或定位在参照图像上的相应位置上。所述配准可以是基于强度的或基于特征的。
基于强度的方法通过相关性度量来比较图像中的强度模式。
基于特征的方法找到图像特征(诸如点、线、轮廓或图像分析中已知的其他特征)之间的对应性,这可以由强度变化决定。因此,基于强度的方法也可以被认为是基于特征的方法。可以通过检测组织核心图像和参照图像的部分(或子图像)之间的匹配特征来进行配准。可以将组织核心图像旋转、平移或拉伸以匹配参照图像的对应部分。例如,对于图像配准,组织核心图像中的至少一些特征(例如A、B、C)被投影至参照图像的相应部分中的相似特征(例如,A’、B’、C’)。
术语“目标特征”涉及点、线和轮廓或图像分析中已知的其他特征。目标特征可以与例如某些生物材料(例如肿瘤细胞的细胞质)的亚结构、目标区域(例如含有组织的区域)或去除区域(例如为了例如分子诊断测试目的刮除组织的区域)等相关。
图5显示另一个选项,根据该选项,方法10进一步包括:
f) 基于配准的组织核心图像的形态信息,鉴定48配准的组织核心图像内的目标特征;
g) 基于形态信息识别50参照图像上的外围区域中的匹配特征,其中外围区域围绕各个配准的组织核心图像;且
h) 将配准的组织核心图像内的目标特征的染色模式延伸52至外围区域中的匹配特征中,使得染色模式继续通过并超过各个配准的组织核心图像的周界。
在与该选项相关的实施方案中,通过确定目标特征是否与核心图像的边界接触,组织微阵列单元鉴定核心图像中的何种目标特征可以根据步骤h)被延伸。如果存在接触,则可表明在参照图像上的外围区域中可以存在匹配特征。然后组织微阵列单元分析接触位置处或周围的外围区域中的参照图像,以确定在参照图像中是否可以实际找到匹配特征。所述匹配特征还应该在与目标特征相同的位置上与核心图像的边界接触。本领域技术人员将理解,一些替代方案是可能的。例如,组织微阵列单元可以使用参照图像而不是核心图像来检测核心图像的边界和潜在的匹配特征之间的接触的存在。当检测到接触时,它可表明核心图像中的目标特征可以对应于潜在的匹配特征并且因此是根据步骤h)的染色模式的延伸的对象。
将配准的组织核心图像内的目标特征的染色模式延伸至外围区域中的匹配特征中,使得染色模式继续通过并超过各个配准的组织核心图像的周界,可以通过在核心图像中分析在所述边界附近的目标特征的像素的强度来实施。这些像素的强度可以充当确定构成染色模式的延伸的像素的强度的基础。本领域技术人员将理解,对于这种确定,诸如但不限于计算所述像素的平均强度,存在许多不同的可能性。术语“形态信息”涉及图像内的特征的外观,诸如形状、结构、颜色、模式等。在染色过程后可以获得一些形态信息。
术语“匹配特征”涉及参照图像上的外围区域中的点、线和轮廓,其具有与组织核心图像内的目标特征相似的形态信息。例如,如果目标特征涉及某些生物材料的亚结构,诸如肿瘤细胞的细胞质,则匹配特征还可以涉及外围区域中的对应亚结构。在另一个实例中,在目标特征涉及目标区域(诸如包含组织的区域)的情况下,所述匹配特征还可以涉及目标区域。
也称为染色模式的外推的该延伸,涉及以与目标特征相似的染色颜色将匹配特征进行数字着色。如果需要,可以针对例如匹配特征和目标特征之间的距离或相似度调整强度/透明度。将染色模式延伸至组织核心区域之外的区域中可以有助于手动评分和解释。
图6显示图4的延伸染色模式的实例。
鉴定对应于目标特征46的匹配特征54。在该实例中,匹配特征54还涉及肿瘤细胞的细胞质,但在组织核心图像42的外部。
以该方式,在组织核心图像之外的相应的目标特征,即匹配特征,可以被数字染色或标记。这可以支持用户,例如,病理学家,不仅在组织核心图像内部、而且在外部区域中鉴定目标特征,这因此有助于例如手动评分和解释。
外围区域可以具有范围。换言之,该范围之外的特征不被进一步数字染色或着色。该范围可以是例如约核心半径的1/100至半径的2倍或更多。
此外,图6显示尚未讨论的本发明的实施方案,其中组织微阵列分析单元已经数字地染色参照图像中的目标特征57,其不与核心图像的边界接触,但仍然在距所述边界的预定距离内。事实上,组织微阵列分析单元已经确定该特征57具有与存在于核心图像中的目标特征类似的架构(图6中未显示)。通过非限制性实例的方式,目标特征可以是具有带有由分析单元良好识别的特征的架构的密封物(gland)。取决于目标特征的类型,一种特定特征参数可以由分析单元使用,诸如但不限于细胞密度、核大小、染色强度、核质比率、细胞形状等。
图7显示另一个选项,根据该选项,步骤g)进一步包括:g1)为外围区域中的匹配特征分配56质量指数;和g2)基于分配的质量指数来确定58外围区域的范围。
在一个实例中,基于目标特征和匹配特征之间的形态信息的相似性来分配质量指数。
在一个进一步实例中,可以使用其他量度,诸如整个组织的相似性,来确定质量指数。
现在参照图6,作为另一个选项,延伸至匹配特征54中的染色模式具有依赖于以下的透明度和/或强度:分配的质量指数和/或距配准的组织核心图像的距离。
例如,如图6中所示,匹配特征54的透明度和/或强度可以根据距配准的组织核心图像的距离而变化。换言之,接近于组织核心图像42的边界60的匹配特征54可以接收与组织核心图像42内的目标特征46相同的染色强度,而远离组织核心图像的匹配特征54可以逐渐减少。
在一个进一步实例中,未进一步显示,如映射或延伸的染色强度可以在分配至匹配特征的分配质量指数降低的情况下减少。例如,肿瘤细胞的核可以被分配为高质量指数和因此高强度,而肿瘤细胞的细胞质可以被分配为低质量指数和因此低强度。在一个进一步实例中,质量指数与样品载片上应用的染色方案相关。因此,质量指标可以用于分别估计每种生物标志物的边界或范围。
以该方式,用户可以根据匹配特征的相应强度和/或透明度来鉴定特征延伸(或特征匹配)的可靠性。
图8显示另一个选项,根据该选项,至少两个组织核心38(参见图3C中的实例)用不同的染色方案染色(用不同的模式指示),并且在步骤c)中,将至少两个组织核心38的组织核心图像42与参照图像44配准。
任选地,组织核心图像42可以具有不同程度的延伸。
术语“染色方案”涉及应用于组织核心的特定程序。术语“染色”涉及以其他方式将透明组织切片着色,因此允许训练有素的病理学家例如观察组织形态(结构)或寻找特定细胞类型、结构或甚至微生物诸如细菌、蛋白和核酸的存在或普遍性。
将理解各种染色方案,包括例如常规染料、特殊染料和高级染料。
术语“常规染料”涉及H&E染料或HE染料(其为病理学中的主要染料之一),并且与所有组织标本“常规”地使用以揭示基本的组织结构和条件。
术语“特殊染料”涉及大量的替代染色技术,其当H&E染色不能提供病理学家或研究人员需要的所有信息时使用。例如,过碘酸Schiff (PAS)染色经常用于染色肾活检、肝活检、横纹肌肉中的某些糖原贮积病和疑似的真菌感染。
术语“高级染料”涉及使用基于亲和力的结合试剂(免疫组织化学)或ISH(原位杂交)分别靶向特定蛋白或DNA/RNA序列的染色方法。例如,在乳腺癌诊断的情况下,可以使用不同的IHC染色(例如针对ER、PR、Ki67和HER2蛋白)来确定癌症的确切亚型。
以该方式,可以在相同的参照图像上同时在相同和/或不同的位置显现多个染色点。显示多个核心可以用于指示肿瘤异质性并生成整个肿瘤的更好概述。通过任选地延伸染色模式,用户可以获取组织核心区域外的染色信息,并且可以终止于整个载片的或多或少的完全染色。可以对于每个单独的生物标志物染色重复这些程序。作为结果,可以促进解释或手动评分程序。
图9显示另一个选项,根据该选项,方法10进一步包括:
b4) 提供62从所述微阵列块获得的另一个微阵列切片的另一个微阵列图像,所述另一个微阵列切片与所述微阵列切片不同地染色;且
c1) 将所述另一个微阵列图像的至少一个组织核心的另外的组织核心图像与参照图像配准64。
另一个微阵列切片也可以被称为第二微阵列切片,而微阵列切片可以被称为第一微阵列切片。
换言之,也可以在不同(例如连续地)微阵列切片上在相同位置(例如在相同的组织核心内)显现多个染色点。
任选地,在步骤c1)中,基于至少一个先前配准的组织核心图像来配准另外的组织核心图像。
这是因为特定信息(诸如单个组织核心相对于组织微阵列的方向的取向)对于来自相同微阵列块(或受体块)的所有微阵列切片是相同的(或几乎相同)。该信息因此可以用于改进配准过程。例如,通过假设来自相同位置的所有组织核心图像的相同的旋转取向,可以使用从一个组织核心图像获得的信息来重定向来自相同组织核心的另外或另一个组织核心图像。
组织核心图像与参照图像的配准可以例如以切片(slicing)(或切片(sectioning))的顺序进行,当染色含有足够的信息时,每个另一个微阵列切片可以将先前的微阵列切片作为参照。染色的一个实例是H-复染。在荧光染色的情况下,可以使用用例如4',6-二脒基-2-苯基吲哚(DAPI)的核染色。
因此可以在两个连续的微阵列切片上进行两种不同的染色方案,然后组合相同核心的结果并且任选地将其与参照图像重叠以延伸至周围。换言之,该选项是对于来自相同微阵列块的多个切片具有多种染色方案,并且将与参照图像配准的单个图像中来自这些染料的图像组合。以该方式,相同组织核心的结果可以显示在单个图像或可以由用户切换等的覆盖图序列中。
因此,作为图8中的额外或替代选项,可以通过在两个连续微阵列切片上组合不同的染色方案而在同一核心上具有不同的染色(未进一步显示)。
当然,可以同时进行这两者,即具有多种染色方案并配准和显示来自同一样品的所有核心位置的结果。换言之,作为进一步选项,可以组合如图8和图9中所示的选项。
还应当注意的是,可以组合与方法步骤相关的一些实例。例如,如上所示,可以在具有数字染色的参照图像上以单个表示显示来自不同核心的多个染色点。在本申请中也考虑其他组合。
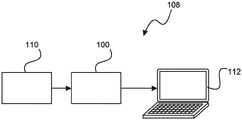
图10显示用于组织检查的设备100的实例。该设备包括数据输入器102、组织微阵列分析单元104和输出器106。
数据输入器102被配置为接收从组织样品块获得的参照切片的参照图像;接收包含从至少组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;和将参照图像和微阵列图像提供给组织微阵列分析单元。数据输入器102可以在硬件、软件或其组合中实现。
组织微阵列分析单元104被配置为基于各组织核心在组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准。同样,组织微阵列分析单元104也可以在硬件、软件或其组合中实现。例如,组织微阵列分析单元104可以是例如处理单元。
输出器106被配置为提供从组织微阵列分析单元获得的配准结果用于进一步分析目的。输出器106也可以在硬件、软件或其组合中实现。
数据输入器102可以因此被称为数据输入接口、数据输入单元或数据输入装置,这取决于实现的类型。同样,输出器106可以被称为输出接口、输出单元或输出装置。
在一个实例中,数据输入器102、组织微阵列分析单元104和输出器106可以在单个单一装置中实现。
在一个进一步实例中,数据输入器102、组织微阵列分析单元104和输出器106可以是组装在设备100中的分开的装置。
还应当注意的是,至少一个组织核心可以被(例如,用ISH染料)染色,或未染色。
如果将至少一个组织染色,作为选项,组织微阵列分析单元104还被配置为基于配准的组织核心图像的形态信息来鉴定配准的组织核心图像内的目标特征和基于形态信息来识别参照图像上的外围区域中的匹配特征,其中外围区域围绕配准的组织核心图像。组织微阵列分析单元104也被配置为将配准的组织核心图像内的目标特征的染色模式延伸至外围区域中的匹配特征中,使得染色模式继续通过并超过配准的组织核心图像的周界。
图11显示用于组织检查的系统108的实例。该系统包括提供图像的设备110和根据上面提及的实例之一的用于组织检查的设备。
提供图像的设备110被配置为提供从组织样品块获得的参照切片的参照图像。此外,提供图像的设备110被配置为提供微阵列切片的微阵列图像,所述微阵列切片包含从至少组织样品块获得的至少一个组织核心。提供图像的设备110也被配置为将参照图像和微阵列图像提供给用于组织检查的设备。
在一个实例中,提供图像的设备可以包括图像采集装置,诸如数字病理载片扫描仪或显微镜。
在一个进一步实例中,提供图像的设备还可以包括图像管理系统,其允许经由互联网本地或远程进行归档和智能检索。
在又一个进一步实例中,提供图像的设备可以包括图像采集装置(例如,用于获取微阵列切片的微阵列图像)以及图像管理系统(例如,用于提供先前存储在图像管理系统中的参照图像)。
还作为选项在图11中显示,提供显示器112。显示器112被配置为显示配准的组织核心图像与参照图像的组合(例如,以叠加的方式)以用于分析目的。
尽管显示器112在图11中被举例说明为计算机屏幕,但显示器也可以是交互式用户界面,例如,触摸屏,用于允许用户输入另外的参数来控制配准过程。
为了更好地理解,图12、图13和图14分别显示根据图4、图6和图8的附图的照片图像。因此,关于图12到14指示相同的附图标记。为了避免不必要的重复,因此关于图12至14的描述是不必要的。
在本发明的另一个示例性实施方案中,提供计算机程序或计算机程序元件,其特征在于适于在适当的系统上执行根据前述实施方案之一的方法的方法步骤。
计算机程序元件因此可以被存储在计算机单元上,所述计算机单元也可以是本发明的实施方案的一部分。该计算单元可以适于执行或诱导上述方法的步骤的执行。此外,它可以适于操作上述设备的组件。所述计算单元可以适于自动操作和/或执行用户的命令。计算机程序可以被加载至数据处理器的工作存储器中。数据处理器因此可以被配备为实施本发明的方法。
本发明的该示例性实施方案涵盖从一开始就使用本发明的计算机程序和通过更新将现有程序变为使用本发明的程序的计算机程序两者。
此外,计算机程序元件可以能够提供所有必要步骤来完成如上所述的方法的示例性实施方案的程序。
根据本发明的一个进一步示例性实施方案,提供计算机可读介质,诸如CD-ROM,其中所述计算机可读介质具有存储在其上的计算机程序元件,所述计算机程序元件由前一部分描述。
计算机程序可以存储和/或分布在合适的介质,诸如与其他硬件一起提供或作为其他硬件的部分提供的光学存储介质或固态介质中,但也可以以其他形式分布,诸如经由互联网或其他有线或无线电信系统。
然而,计算机程序也可以在网络(如万维网)上呈现,并且可以从此网络下载至数据处理器的工作存储器中。根据本发明的一个进一步示例性实施方案,提供用于使计算机程序元件可用于下载的介质,所述计算机程序元件被布置为执行根据本发明的前述实施方案之一的方法。
必须注意的是,参照不同的主题描述本发明的实施方案。具体而言,参照方法类型权利要求描述一些实施方案,而参照装置类型权利要求描述其他实施方案。然而,本领域技术人员将从以上和以下描述中收集到,除非另有通知,否则除了属于一类主题的特征的任何组合之外,还考虑与不同主题相关的特征之间的任何组合与本申请一起公开。然而,可以组合所有特征,提供超过特征的简单总和的协同效果。
尽管已经在附图和前面的描述中详细地说明和描述了本发明,但此类说明和描述将被认为是说明性的或示例性的,而不是限制性的。本发明不限于所公开的实施方案。本领域技术人员可以在实施请求保护的发明中通过研究附图、公开内容和从属权利要求来理解和实现所公开的实施方案的其他变型。
在权利要求中,词语“包括/包含”并不排除其他要素或步骤,并且不定冠词“一个/种(a)”或“一个/种(an)”不排除多个/种。单个处理器或其他单元可以实现权利要求中所述的几项的功能。在相互不同的从属权利要求中仅记载某些措施的事实并不表示这些措施的组合不能有利地使用。权利要求中的任何参考标记不应被解释为限制范围。
Claims (15)
1.用于组织检查的设备(100),其包括:
- 数据输入器(102);
- 组织微阵列分析单元(104);和
- 输出器(106);
其中所述数据输入器被配置为接收参照切片的参照图像,所述参照切片是通过将组织样品块切片而获得的样品切片;接收包含从组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;和将参照图像和微阵列图像提供给组织微阵列分析单元;
其中所述组织微阵列分析单元被配置为基于各组织核心在所述组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准;且
其中所述输出器被配置为提供从组织微阵列分析单元获得的配准结果用于进一步分析目的。
2.根据权利要求1所述的设备,其中所述组织微阵列分析单元被进一步配置为基于配准的组织核心图像的形态信息鉴定配准的组织核心图像内的至少一种目标特征;基于形态信息识别参照图像上的外围区域中的匹配特征,其中所述外围区域围绕配准的组织核心图像;和将配准的组织核心图像内的目标特征的染色模式延伸至外围区域中的匹配特征中,使得染色模式继续通过并超过配准的组织核心图像的周界。
3.用于组织检查的系统(108),其包括:
- 提供图像的设备(110);和
- 根据权利要求1或2所述的用于组织检查的设备;
其中所述提供图像的设备被配置为提供从组织样品块获得的参照切片的参照图像;提供包含从组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;和将所述参照图像和所述微阵列图像提供给用于组织检查的设备。
4.根据权利要求3所述的系统,其进一步包括:
- 显示器(112);
其中所述显示器被配置为显示配准的组织核心图像与参照图像的组合以用于分析目的。
5.用于组织检查的方法(10),其包括以下步骤:
a) 提供(12)参照切片的参照图像,所述参照切片是通过将组织样品块切片而获得的样品切片;
b) 提供(14)包含从组织样品块获得的至少一个组织核心的微阵列切片的微阵列图像;
c) 基于各组织核心在组织样品块内的空间布置来将至少一个组织核心的组织核心图像与参照图像配准(16);和
d) 提供(18)配准的组织核心图像与参照图像的组合以用于分析目的。
6.根据权利要求5所述的方法,其中对于步骤a),其提供:
a1) 从所述组织样品块生成(20)所述参照切片;和
a2) 从所述参照切片生成(22)图像作为参照图像;和/或
其中对于步骤b),其提供:
b1) 创建(24)包含布置在块结构内的至少一个组织核心的微阵列块;
b2) 生成(26)所述微阵列块的至少一个微阵列切片;和
b3) 生成(28)所述微阵列切片的图像作为组织微阵列图像。
7.根据权利要求6所述的方法,其中在步骤b2)中,将至少一个微阵列切片染色;且
其中所述至少一个微阵列切片与所述参照切片不同地染色。
8.根据权利要求5至7之一所述的方法,其进一步包括:
f) 基于配准的组织核心图像的形态信息,鉴定(48)配准的组织核心图像内的目标特征;
g) 基于形态信息识别(50)所述参照图像上的外围区域中的匹配特征,其中所述外围区域围绕各个配准的组织核心图像;和
h) 将配准的组织核心图像内的目标特征的染色模式延伸(52)至外围区域中的匹配特征中,使得染色模式继续通过并超过各个配准的组织核心图像的周界。
9.根据权利要求8所述的方法,其中步骤g)进一步包括:
g1) 为所述外围区域中的匹配特征分配(56)质量指数;和
g2) 基于分配的质量指数来确定(58)所述外围区域的范围。
10.根据权利要求9所述的方法,其中延伸至匹配特征中的染色模式具有依赖于以下的透明度和/或强度:
- 分配的质量指数;和/或
- 距配准的组织核心图像的距离。
11.根据权利要求5至7和9至10之一所述的方法,其中至少两个组织核心用不同的染色方案染色;且
其中在步骤c)中,将至少两个组织核心的组织核心图像与所述参照图像配准。
12.根据权利要求6至7之一所述的方法,其进一步包括:
b4) 提供(62)从所述微阵列块获得的另一个微阵列切片的另一个微阵列图像;
其中所述另一个微阵列切片与所述微阵列切片不同地染色;
c1) 将所述另一个微阵列图像的至少一个组织核心的另一个组织核心图像与参照图像配准(64)。
13.根据权利要求12所述的方法,其中在步骤c1)中,基于至少一个先前配准的组织核心图像来配准所述另一个组织核心图像。
14.用于控制根据权利要求1至4之一所述的设备或系统的计算机程序元件,所述计算机程序元件当由处理单元执行时适于进行权利要求5至13之一的方法步骤。
15.一种存储有权利要求14的程序元件的计算机可读介质。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15182257 | 2015-08-25 | ||
| EP15182257.4 | 2015-08-25 | ||
| PCT/EP2016/068995 WO2017032595A1 (en) | 2015-08-25 | 2016-08-10 | Tissue microarray analysis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108140117A CN108140117A (zh) | 2018-06-08 |
| CN108140117B true CN108140117B (zh) | 2022-06-07 |
Family
ID=54010907
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680060975.0A Active CN108140117B (zh) | 2015-08-25 | 2016-08-10 | 组织微阵列分析 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10685210B2 (zh) |
| EP (1) | EP3341890B1 (zh) |
| JP (1) | JP6843121B2 (zh) |
| CN (1) | CN108140117B (zh) |
| RU (1) | RU2707326C2 (zh) |
| WO (1) | WO2017032595A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017009450A1 (en) * | 2015-07-16 | 2017-01-19 | Koninklijke Philips N.V. | Digital pathology system |
| DE102020105697B3 (de) * | 2020-03-03 | 2021-03-04 | Carl Zeiss Meditec Ag | Computerimplementiertes Verfahren zum Auffinden möglicher Artefakte in einem virtuell eingefärbten Histologiebild |
| US20230351619A1 (en) * | 2020-09-18 | 2023-11-02 | 10X Genomics, Inc. | Sample handling apparatus and image registration methods |
| TWI774120B (zh) * | 2020-11-10 | 2022-08-11 | 中國醫藥大學 | 生物組織影像分析方法及生物組織影像分析系統 |
| WO2022147154A1 (en) * | 2020-12-30 | 2022-07-07 | Leica Biosystems Imaging, Inc. | System and method for matching of block and slice histological samples |
| CN113052166A (zh) * | 2021-02-05 | 2021-06-29 | 杭州依图医疗技术有限公司 | 病理图像的显示方法及装置 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2318789C (en) * | 1998-02-25 | 2011-05-10 | The United States Of America As Represented By The Secretary Department Of Health And Human Services | Cellular arrays for rapid molecular profiling |
| US7171030B2 (en) * | 2000-11-30 | 2007-01-30 | University Of Medicine & Denistry Of New Jersey | Systems for analyzing microtissue arrays |
| US20040085443A1 (en) * | 2000-12-13 | 2004-05-06 | Kallioniemi Olli P | Method and system for processing regions of interest for objects comprising biological material |
| US20030048931A1 (en) * | 2001-03-23 | 2003-03-13 | Peter Johnson | Quantification and differentiation of tissue based upon quantitative image analysis |
| CA2619759A1 (en) * | 2005-08-16 | 2007-02-22 | Genentech, Inc. | Apoptosis sensitivity to ap02l/trail by testing for galnac-t14 expression in cells/tissues |
| US8369600B2 (en) | 2008-03-25 | 2013-02-05 | General Electric Company | Method and apparatus for detecting irregularities in tissue microarrays |
| US8880351B2 (en) | 2008-03-25 | 2014-11-04 | General Electric Company | Method and apparatus for analysis of tissue microarrays |
| US20130210648A1 (en) | 2009-01-14 | 2013-08-15 | The United States of America, as Represented by the Secretary, Department of Health and Human Services | Ratio based biomarkers and methods of use thereof |
| US20140100188A1 (en) | 2009-07-20 | 2014-04-10 | University College Dublin | Phenotyping tumor-infiltrating leukocytes |
| US9418292B2 (en) | 2011-10-04 | 2016-08-16 | Here Global B.V. | Methods, apparatuses, and computer program products for restricting overlay of an augmentation |
| BR112014018076A8 (pt) * | 2012-01-27 | 2017-07-11 | Koninklijke Philips Nv | Sistema de imagiologia médica, método de imagiologia médica, meio legível de computador não transitório de carregamento de software e sistema de processamento de imagem |
| US20130338016A1 (en) | 2012-04-17 | 2013-12-19 | Vala Sciences, Inc. | Method For Integrated Pathology Diagnosis And Digital Biomarker Pattern Analysis |
| CN103054646B (zh) * | 2012-12-25 | 2015-06-17 | 周翔 | 一种适于超声-ct/mri/pet等融合成像的非侵入性标准配准装置 |
| CN105659288B (zh) | 2013-10-30 | 2020-08-07 | 皇家飞利浦有限公司 | 组织切片图像的配准的方法、计算机可读介质和图像处理设备 |
-
2016
- 2016-08-10 US US15/753,401 patent/US10685210B2/en active Active
- 2016-08-10 JP JP2018510091A patent/JP6843121B2/ja active Active
- 2016-08-10 RU RU2018110327A patent/RU2707326C2/ru active
- 2016-08-10 WO PCT/EP2016/068995 patent/WO2017032595A1/en active Application Filing
- 2016-08-10 CN CN201680060975.0A patent/CN108140117B/zh active Active
- 2016-08-10 EP EP16753628.3A patent/EP3341890B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| RU2018110327A3 (zh) | 2019-09-27 |
| JP2018534532A (ja) | 2018-11-22 |
| EP3341890B1 (en) | 2021-04-28 |
| US10685210B2 (en) | 2020-06-16 |
| EP3341890A1 (en) | 2018-07-04 |
| RU2707326C2 (ru) | 2019-11-26 |
| JP6843121B2 (ja) | 2021-03-17 |
| WO2017032595A1 (en) | 2017-03-02 |
| US20180247101A1 (en) | 2018-08-30 |
| RU2018110327A (ru) | 2019-09-27 |
| CN108140117A (zh) | 2018-06-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108140117B (zh) | 组织微阵列分析 | |
| JP7228688B2 (ja) | 改善された核検出およびセグメンテーションを可能にする画像強化 | |
| CN107111874B (zh) | 用于共表达分析的系统和方法 | |
| RU2690224C2 (ru) | Обследующее устройство для обработки и анализа изображения | |
| JP6823646B2 (ja) | 生体試料の複数の画像を表示するための画像処理システムおよび方法 | |
| EP3469548B1 (en) | System for bright field image simulation | |
| JP6629762B2 (ja) | 画像内の生物学的構造及び/又はパターンの検出のためのシステム及び方法 | |
| JP6698663B2 (ja) | 自動化スライド全域解析の品質管理 | |
| JP2019179030A (ja) | 包括的なマルチアッセイ組織分析のためのシステムおよび方法 | |
| JP2017529513A (ja) | 複数の染色で染色されている生物組織サンプルから取得されるマルチチャネル画像を分析するための画像処理方法及びシステム | |
| JP7011036B2 (ja) | 組織標本の分析を支援するためのスライド画像のカラーデコンボリューションのためのシステムおよび方法 | |
| CN108027968B (zh) | 在数字病理学中的信息转换 | |
| WO2009006696A1 (en) | Pathology method | |
| JP2018511036A (ja) | メソダイセクションのためのシステムおよび方法 | |
| CN112424825A (zh) | 染色聚集体中信号的定量 | |
| Ulaganathan et al. | A clinicopathological study of various oral cancer diagnostic techniques | |
| US20100177942A1 (en) | Method and apparatus for analyzing imagery data | |
| JP2008188012A (ja) | 分子組織学 | |
| CN115917594A (zh) | 使用几何特征的整个载玻片注释转移 | |
| Baird et al. | Multiplex: From Acquisition to Analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |