CN102307598A - TGF-β1抑制肽的药物制剂 - Google Patents
TGF-β1抑制肽的药物制剂 Download PDFInfo
- Publication number
- CN102307598A CN102307598A CN2010800067872A CN201080006787A CN102307598A CN 102307598 A CN102307598 A CN 102307598A CN 2010800067872 A CN2010800067872 A CN 2010800067872A CN 201080006787 A CN201080006787 A CN 201080006787A CN 102307598 A CN102307598 A CN 102307598A
- Authority
- CN
- China
- Prior art keywords
- tgf
- peptide
- emulsion
- inhibiting
- cyclodextrin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/40—Cyclodextrins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6949—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit inclusion complexes, e.g. clathrates, cavitates or fullerenes
- A61K47/6951—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit inclusion complexes, e.g. clathrates, cavitates or fullerenes using cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/107—Emulsions ; Emulsion preconcentrates; Micelles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Nanotechnology (AREA)
- Immunology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Neurology (AREA)
- Dermatology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Molecular Biology (AREA)
- Dispersion Chemistry (AREA)
- Medical Informatics (AREA)
- Inorganic Chemistry (AREA)
- Biophysics (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Vascular Medicine (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Transplantation (AREA)
- Neurosurgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明涉及一种包含TGF-β1抑制肽和环糊精或其衍生物的络合物。本发明还提供了一种包含十六烷基PEG/PPG-10/1二甲基硅油的TGF-β1抑制肽乳剂。本发明还描述了所述络合物和所述TGF-β1抑制肽乳剂的制备工艺,及其在用于制备治疗TGF-β1介导的疾病或异常的药物的制备中的用途。
Description
技术领域
本发明属于药物学特别是盖伦(galenic)制剂的技术领域。
技术背景
转化生长因子β(TGF-β)表示一个蛋白家族(TGF-β1、TGF-β2和TGF-β3),其是细胞生长和分化、胚胎和骨骼发育、细胞外基质形成、造血、免疫和炎性反应的多效性调节因子(Roberts和Sporn Handbook ofExperimental Pharmacology(1990)95:419-58;Massagué等,Ann Rev CellBiol(1990)6:597-646)。这个超家族的其它成员包括活化素、抑制素、骨形成蛋白,以及缪勒氏抑制物质。TGF-β启动最终导致基因表达的细胞内信号通路,所述基因调节细胞周期,控制增殖反应,或涉及调节由外向内的细胞信号、细胞黏附、迁移以及细胞通讯的细胞外基质蛋白。
TGF-β超家族成员关键性地调节心血管系统以及女性生殖系统内的多种不同进程。TGF-β超家族成员在骨环境中大量表达并调节许多重要的骨过程。已经广泛研究了TGF-β信号对人类癌症和结缔组织疾病的贡献。TGF-β超家族信号在从囊胚形成初期开始、经过原肠胚形成以及器官发育多个阶段的胚胎形成中也很关键。TGF-β超家族成员不断被联系到其它疾病诸如神经性疾病、耳硬化征、银屑病、胆汁性肝硬化以及小儿哮喘。TGF-β超家族成员起作用的疾病的范围很可能继续增加(Gordon和BlobeBiochimica et Biophysica Acta(2008)1782:197-228)。
由于TGF-β超家族在一些病变中普遍存在的作用,已经设计了不同的拮抗剂分子用以中和TGF-β1活性,包括了小分子以及反义寡核苷酸和抗体。
WO2000/31135(Proyecto de Biomedicina Cima,S.L.)涉及拮抗TGF-β1与TGF-β1III型受体或内皮糖蛋白结合的肽。
WO2007/048857(Proyecto de Biomedicina Cima,S.L)涉及选自下述抑制TGF-β1的肽或其片段在免疫反应调节剂的制备中的应用:序列对应于SEQ ID NO:1的肽P144、序列对应于SEQ ID NO:2的肽p17、与上述肽具有至少90%同源性的肽。
由于TGF-β1抑制肽的临床开发,日益需要用于给机体施用这些拮抗剂的盖伦制剂。
在这一方面,US2007/0207965提供了一种用抑制TGF-β的肽治疗皮肤纤维化的方法,以及用于施用的合适的组合物。特别地,该方法包括肽P144的应用。为了施用这种肽,还提供了二甲基亚砜作为增溶剂的稳定的乳剂(965乳剂或E.965)。亲脂相包含二甲基硅油350和矿物油。所述乳剂每毫升可加载最多300μg的肽,其储藏条件要求5℃左右的温度。
肽类性质药物的配制通常是具有挑战性的。特别地,TGF-β肽抑制剂P144不溶于水、聚乙二醇400(PEG400)、乙醇、甘油、环氧乙烷-环氧丙烷嵌段共聚物(F68)、四氢呋喃、正己烷、二甲基甲酰胺、二氯甲烷、聚乙烯吡咯烷酮丙二醇、S97、脱氧胆酸钠,以上仅为举例。
环糊精是本领域已知的用于增溶治疗化合物的合理手段。环糊精是由6个或更多个形成具有特定容积中空内部的刚性锥形分子结构的α-D-吡喃葡萄糖苷单元构成的环状低聚糖。他们能与某些疏水分子形成主-客体络合物,修饰客体分子的主要在水溶性方面的物理和化学特性。
在这个方面,WO2008/013928(Biogen IDEC MA Inc.,The Trustees ofthe University of Pennsylvania)涉及治疗癌症的方法,包括给有治疗需要的目标实施综合疗法,其包括:(a)施用TGF-β抑制剂以及(b)包含编码干扰素多肽的分离的多核苷酸的载体。所述TGF-β抑制剂包括可溶性人TGFRIII多肽。增溶剂如环糊精或本领域熟悉的其它已知的增溶剂,可用作递送治疗化合物的药用赋形剂。然而,该公开专利并未提供包含TGF-β抑制剂和环糊精的实际制剂。
WO2003/048323(Bristol-Myers Squibb Company)涉及诊断、治疗和预防类风湿关节炎及相关疾病状态的多肽,其中所述与类风湿性关节炎相关的多肽具有与氨基酸序列SEQ ID NO:48至少95%相同的氨基酸序列。SEQ ID NO:48对应于人转化生长因子βIII型受体氨基酸序列(AccessionNo.Q03167)。本发明的化合物可与快速溶解稀释剂如甘露醇、乳糖、蔗糖和/或环糊精一同配制。类似地,用于增溶TGFBRIII多肽的环糊精有效活性未被证明。
环糊精络合物的形成取决于环糊精与客体分子之间的几何与结构亲和性,以及环糊精内腔的体积。因此,并非所有的分子都能够与环糊精或其特定类型形成络合物。因此,TGF-β1抑制肽能否与环糊精络合,以及何种类型的环糊精适于形成这些分子封装,仍有待证实。
仅增溶TGF-β1抑制肽还不够,还要求所述制剂满足提供可有效递送活性化合物至机体的最终制剂的终极目标。在这个方面,脂质制剂如乳剂看起来可作为递送难溶药物的有前途的载体系统。乳剂是两种不完全互溶液体(如油和水)的均匀混合物,其中一种液体通常在乳化剂或表面活性剂的协助下以细液滴的形式分散在另一种液体中。
用于制备足够稳定的用于特定应用的乳剂的合适表面活性剂的选择,不是可预测的或不能常规应用。此外,在制备增加剂量的TGF-β1抑制肽的特定情况下,需要考虑其它参数诸如药物结晶及沉淀的减少。
在竭尽全力提高TGF-β1抑制肽的理化特性特别是溶解性,以及建立改进965乳剂(E.965)制剂的任务时,本发明的发明人成功获得环糊精与目标TGF-β1抑制肽的络合物,并调制了含有这些环糊精络合物和TGF-β1抑制肽以及表面活性剂十六烷基PEG/PPG-10/1二甲基硅油(EM90)的乳剂,其满足以下提到的一个或多个目标。
本发明的一个目标是,提供提高TGF-β1抑制肽水溶性的制剂。
本发明的一个目标是,提供提高TGF-β1抑制肽水溶性的制剂,其避免了有机溶剂的存在或减少了有机溶剂的量。
本发明的一个目标是,提供应用药学上可接受赋形剂的安全TGF-β1抑制肽制剂。
本发明的一个目标是,提供足够稳定的、具有合适保质期或化学稳定性的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供无结晶或结晶可忽略不计的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供足够均匀的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供每份组合物具有增加的药物负载的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供具有细颗粒级(内部颗粒)的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供可在温和条件下例如很少加热时制备的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供适于工业大规模生产的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供允许TGF-β1抑制肽局部作用而不被吸收或很少被吸收的制剂。
本发明的一个目标是,提供允许通过不同途径例如通过口服、非肠道或局部途径施用给机体的TGF-β1抑制肽制剂。
本发明的一个目标是,提供容易涂抹的TGF-β1抑制肽乳剂。
本发明的一个目标是,提供具有美观外形而不油腻的TGF-β1抑制肽乳剂。
一方面,本发明涉及含有TGF-β1抑制肽和环糊精或其衍生物的络合物,其中:
TGF-β1抑制肽选自与氨基酸序列SEQ ID NO:1-23之一具有至少70%序列同一性的肽、可抑制TGF-β1的其盐、功能性衍生物、变体、类似物或片段;以及
选自β-环糊精以及γ-环糊精的环糊精或其衍生物。
另一方面,本发明涉及含有所述络合物的药物制剂,其中TGF-β1抑制肽以治疗有效量存在并且环糊精是药学上可接受的环糊精。在特定的实施方式中,所述药物制剂包含十六烷基PEG/PPG-10/1二甲基硅油。
另一方面,本发明涉及TGF-β1抑制肽乳剂,其特征在于所述乳剂含有十六烷基PEG/PPG-10/1二甲基硅油。
另一方面,本发明涉及包含所述TGF-β1抑制肽乳剂的药物制剂,其中所述TGF-β1抑制肽以治疗有效量存在。在所述乳剂的特定实施方案中,所述TGF-β1抑制肽与环糊精或其衍生物形成络合物,并且所述环糊精是药学上可接受的环糊精。
另一方面,本发明涉及包含TGF-β1抑制肽和环糊精或其衍生物的所述络合物的制备步骤,包括将TGF-β1抑制肽与包含环糊精或其衍生物的水溶液混合的步骤。通过该步骤获得的产品构成本发明的又一方面。
另一方面,本发明涉及包含十六烷基PEG/PPG-10/1二甲基硅油的所述TGF-β1抑制肽乳剂的制备步骤,所述步骤包含:
a)(i)通过混合TGF-β1抑制肽和包含环糊精或其衍生物的水溶液制备一络合物;和(ii)制备包含十六烷基PEG/PPG-10/1二甲基硅油的亲脂相;以及
b)将所述络合物在所述亲脂相上混合。
通过该步骤获得的产品构成本发明的又一方面。
另一方面,本发明涉及所述络合物、所述TGF-β1抑制肽乳剂、或者所述药物制剂的应用,其用于制造用于治疗TGF-β1介导的疾病或异常的药物。另一方面,本发明涉及治疗哺乳动物中TGF-β1介导的疾病或异常的方法,所述方法包括使用有效量的所述络合物、或所述TGF-β1抑制肽乳剂或所述药物制剂。
附图说明
图1:100μg/g的硅乳剂的显微图像,批次A-2,左边是可见光,右边是紫外光,随后将视图处理为黑色和白色(转换为CMYK色彩模式;选择通道或黑色组件;灰色反演,其存在于图像中)。
图2:空白硅乳剂的显微图像,批次A-3,左边是可见光,右边是紫外光,并且如上所述进行处理。
图3:硅乳剂的显微图像,批次A-10,左边是可见光,右边是紫外光,并且如上所述进行处理(P144浓度:1,000μg/g)。
图4:硅乳剂的显微图像,批次A-16,左边是可见光,右边是紫外光,并且如上所述进行处理(P144浓度:1,000μg/g)。
图5:硅乳剂的显微图像,批次A-18,左边是可见光,右边是紫外光,并且如上所述进行处理(P144浓度:700μg/g)。P144的结晶由箭头标明。
图6:具有1,100μg/g浓度P144的硅乳剂的显微图像,批次A-28,左边是可见光,右边是紫外光。P144的结晶由箭头标明。
图7:具有800μg/g浓度P144的硅乳剂的显微图像,批次A-30,左边是可见光,右边是紫外光,并进行处理。
图8:P144乳剂(ESD600)的照片。
图9-16:P144乳剂(ESD600)扩展能力的测量[实施例6,2.2段];在毫米为单位的纸上描画载玻片的边(图9)并描画对角线(图10);然后,下部载玻片位于与前述描画相符的位置(图11)并且P144乳剂ESD600的样品放置在对角线的交叉点(图12)。然后,上部载玻片位于含有乳剂样品的下部载玻片上(图13),并且测量由于覆盖载玻片重量而由乳剂形成的圆周直径(图14);然后,在交叉对角线的样品上放置已知重量,(图15)并且测量沿着所描画的对角线的直径。
图17:作为所施加重量函数的P144乳剂(ESD600)表面增量的表示。
图18:应用稀释法测量P144乳剂(ESD600)的外相。
图19:应用稀释法测量P144乳剂(ESD600)的外相。
图20:应用染色法测量P144乳剂(ESD600)的外相。
图21:弗朗茨池受体室中P144的量。ES-0:对照硅乳剂ESD600[0];ES-100:具有100μg P144/g的硅乳剂ESD600(ESD600[100])。数据表示均值±标准偏差(SD)(ES-0,n=4;ES-100,n=8)。
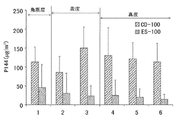
图22:猪耳皮肤不同区域内P144的定量比较。每个柱代表保留在皮肤部分内的P144浓度的平均值,表示为毫克P144/cm3皮肤+SD(n=8)。CD-100:具有100μg P144/g(E.965[100])的E.965乳剂;ES-100:具有100μgP144/g的硅乳剂ESD600[100]。
图23:猪耳皮肤不同区域内P144的定量。每个柱代表保留在皮肤部分内的P144浓度的平均值,表示为毫克P144/cm3皮肤+SD(n=8)。CD-100:具有100μg P144/g(E.965[100])的E.965乳剂;ES-100:具有100μgP144/g的硅乳剂ESD600[100]。
图24:不同切片的P144理论量值的表示。如果所有药品都从半固体制剂传递至皮肤(猪皮肤:176mm2×1mm深度),则可达到100%。CD-100:具有100μg P144/g(E.965[100])的E.965乳剂;ES-100:具有100μg P144/g的硅乳剂ESD600[100]。
发明内容
一方面,本发明涉及包含TGF-β1抑制肽和环糊精或其衍生物的络合物(下文称为“本发明的络合物“),其中:
所述TGF-β1抑制肽选自与氨基酸序列SEQ ID NO:1-23之一具有至少70%序列同一性的肽、可抑制TGF-β1的其盐、功能性衍生物、变体、类似物及其片段;并且
所述环糊精或其衍生物选自β-环糊精和γ-环糊精。
术语“络合物”是指一种结构,其中一个或多个环糊精分子(“主体”)形成空腔,第二化合物(“客体”)的一个或多个分子位于该空腔内。本文中所使用的,第二化合物指的是TGF-β1抑制肽。术语络合物与分子封装可交换使用。
术语“TGF-β1抑制肽”是指一种通过与TGF-β1活性形式相互作用而具有能够抑制TGF-β1、特别是登录号为AAL27646或NP 000651的TGF-β亚型1的生物学功能的分子。虽然此处的抑制剂的特征在于其与TGF-β1相互作用的能力,其还可以与其它哺乳动物亚型(TGF-β2和β3)相互作用。这种活性抑制TGF-β与相应的超家族受体的相互作用,像I型受体如活化素样激酶ALK1、ALK2、ALK5;II型受体如II型TGF-β受体(TβRII);协同受体如内皮蛋白和crypto。此外,抑制剂也可以与下列物质相互作用:I型受体如ALK3、ALK4、ALK6、ALK7;II型受体如ActRII、ActRIIb、BMPRII、MISRII和TβRII;共受体如RGMa、RGMb和血幼素(hemojuvelin);拟受体如BAMBI;信号组件如键蛋白(chordin)、卵泡抑素、lefty1、noggin、硬化蛋白(sclerostin);以及TGF-β信号转导通路中的其它成员或TGF-β信号转导通路与另一通路共有的成员。
这些分子具有肽类性质,意味着他们包含被酰胺键即肽键连接的α氨基酸。术语“肽”不局限于短的氨基酸链,其可以包括长度超过50个氨基酸的链。同样地,此处的术语肽也包含多肽和蛋白。
在本发明中,TGF-β1抑制肽优选自与下述表1所示的SEQ ID NO:1-23之一的氨基酸序列具有至少70%、优选至少80%或者更优选至少90%序列同一性的肽。
表1
TGF-β1抑制肽可以从多种合成这些肽的细胞来源获得,包括,例如以能够引导所述肽的合成或分泌的重组DNA分子转染的细胞。可选择地,TGF-β1抑制肽可以由化学合成的方法合成,包括但不限于固相肽合成。所述肽也可以是市售的,例如Sigma-Genosys,Ltd.(英国剑桥)供应的P144。
如本领域已知的,两个(多)肽或蛋白之间的“序列同一性”通过将一个(多)肽的氨基酸序列与第二(多)肽的序列相比较来确定。如本文所讨论的,一个特定(多)肽是否与另一(多)肽具有至少约70%、75%、80%、85%、90%或95%同一性,可通过应用本领域已知的方法和计算机程序或软件确定,例如但不限于BESTFIT程序(Wisconsin SequenceAnalysis Package,Version 8 for Unix,Genetics Computer Group)或GCG软件包(GAP version 8,Genetics Computer Group,USA)。BESTFIT使用Smith和Waterman的局部同源性算法(Advances in Applied Mathematics 2:482-489(1981)),来寻找两个序列间同源的最佳段。GCG软件包应用蛋白质的标准罚(standard penalties):GAP权重3.00,长度权重0.100,并且所述矩阵描述于Gribskov and Brugess,Nucl.Acids Res.(1986)14(16),6745-6763。
在特定的实施方案中,TGF-β1抑制肽是能够抑制TGF-β1的选自SEQID NO:1-23所示序列的肽组的肽,或其盐、功能性衍生物、变体、类似物或其片段。因此,在一个特定的具体实施方式中,TGF-β1抑制肽是能够抑制TGF-β1的具有SEQ ID NO:1、或SEQ ID NO:2、或SEQ ID NO:3或SEQ ID NO:4、或SEQ ID NO:5、或SEQ ID NO:6、或SEQ ID NO:7、或SEQ ID NO:8、或SEQ ID NO:9、或SEQ ID NO:10、或SEQ ID NO:11、或SEQ ID NO:12、或SEQ ID NO:13、或SEQ ID NO:14、或SEQ ID NO:15、或SEQ ID NO:16、或SEQ ID NO:17、或SEQ ID NO:18、或SEQ ID NO:19、或SEQ ID NO:20、或SEQ ID NO:21、或SEQ ID NO:22、或SEQ ID NO:23所示氨基酸序列的肽、或其盐、功能性衍生物、变体、类似物或其片段。
在另一特定的实施方式中,TGF-β1抑制肽选自能够抑制TGF-β1的与SEQ ID NO:1-23的氨基酸序列具有至少70%、优选至少80%、更优选至少90%序列同一性的肽、或盐、功能性衍生物、变体、类似物或其片段。
因此,在一个特定的具体实施方式中,TGF-β1抑制肽是一种能够抑制TGF-β1的氨基酸序列与SEQ ID NO:1、或SEQ ID NO:2、或SEQ ID NO:3或SEQ ID NO:4、或SEQ ID NO:5、或SEQ ID NO:6、或SEQ ID NO:7、或SEQ ID NO:8、或SEQ ID NO:9、或SEQ ID NO:10、或SEQ ID NO:11、或SEQ ID NO:12、或SEQ ID NO:13、或SEQ ID NO:14、或SEQ ID NO:15、或SEQ ID NO:16、或SEQ ID NO:17、或SEQ ID NO:18、或SEQ ID NO:19、或SEQ ID NO:20、或SEQ ID NO:21、或SEQ ID NO:22、或SEQ ID NO:23所示氨基酸序列具有至少70%、优选至少80%、更优选至少90%序列同一性的肽、或其盐、功能性衍生物、变体、类似物或其片段。
本文中的术语“盐”是指羧基的盐和TGF-β1抑制肽氨基的酸加成盐。羧基的盐可通过本领域已知的方式形成且包括无机盐例如钠盐、钙盐、铵盐、铁盐、或锌盐等等,以及如那些例如与胺类诸如三乙醇胺、精氨酸、赖氨酸、哌啶、普鲁卡因等形成的有机碱的盐。酸加成盐包括,无机酸盐如盐酸或硫酸,有机酸盐如醋酸或草酸。当然,任何这样的盐必须保留TGF-β1抑制肽的生物活性。为了治疗应用,TGF-β1抑制肽的盐是那些盐,其中抗衡离子是药学上可接受的。由于药学上不可接受的盐可用于药学上可接受终产物的生产,其也可被包括在本发明的范围内。
此处使用的“功能性衍生物”涵盖了可由作为残基侧链的功能团或N末端基团或C末端基团,通过本领域已知的方式制备的衍生物,这些可包括在本发明内,只要其仍旧是药学上可接受的,即,它们未破坏上述肽的生物活性,即结合相应受体或起动受体信号的能力,并且不给包含其的组合物带来毒性。衍生物可具有化学部分,如糖类或磷酸盐残基,只要这种衍生物保留所述肽生物活性并且仍是药学上可接受的。
例如,衍生物可包括羧基的脂肪族酯、通过与氨或与伯胺或仲胺反应的羧基的氨基化合物、N-酰基衍生物或酰基部分构成的氨基酸残基的游离氨基基团(如链烷酰基或碳环芳酰基团)、或由酰基部分构成的游离羟基的O-酰基衍生物(如丝氨酰或苏氨酰残基的)。这样的衍生物还可包括例如,聚乙二醇侧链,其可以屏蔽抗原性位点并延长所述分子在体液中的驻留。
本发明的“变体”是指一种分子,其基本上与任一种上述的完整肽或其片段相似。变体肽可应用本领域熟知的方法,通过直接化学合成变体肽方便地制备。当然,所述变体可具有与相应的TGF-β1抑制肽相似的受体结合和信号起始活性。
肽一级结构中的突变,以及更高级结构组织中的突变,如连接氨基酸残基的共价键的类型或肽末端残基的基团添加的突变,都包括在本发明的范围内。此外,所述肽分子可包括在氨基酸序列中导致保留所述分子功能的沉默变化的保守或非保守改变,例如缺失、添加以及取代。当这些改变的分子在其应用上提供了某种优势时,其可能是合意的。如本发明所应用的,保守取代包括相应肽序列内一个或多个氨基酸被另一个具有相似极性和疏水性/亲水性的氨基酸替换以产生功能相同的分子。这种保守取代包括但不限于下列氨基酸基团内的取代:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸;天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;苯丙氨酸、酪氨酸;以及甲硫氨酸、正亮氨酸。
上述肽的氨基酸序列变体可通过编码所述合成衍生物的DNA中的突变制备。所述变体包括,例如,从氨基酸序列中缺失、或在氨基酸序列中插入或替换残基。缺失、插入和替换的任意组合也可用于获得最终构建体,只要最终构建体拥有所需的活性。显然,在编码变体肽的DNA内进行的突变不得改变阅读框并且优选不会生成可产生二级mRNA结构的互补区。
在基因水平上,一般通过在编码肽分子的DNA内的核苷酸的定点诱变,从而产生编码变体的DNA,并由此在重组细胞培养物中表达所述DNA,从而制得这些突变体。所述变体通常展示与非变体肽相同性质的生物活性。
根据本发明的上述肽的“类似物”是指其与其整个分子或活性片段基本上类似的非天然分子。所述类似物可展示与相应TGF-β1抑制肽相同的活性。
根据本发明的“片段”是指所述分子的任意亚单位,其是一种保留所需生物活性例如抑制TGF-β1能力的短肽。通过从所述分子的任一端移除氨基酸并检测生成物作为受体拮抗剂的特性,可以很容易地制备片段。依次从多肽的N末端或C末端移除一个氨基酸的蛋白酶是本领域所熟知的。
所需的TGF-β1抑制肽的生物活性(例如抑制TGF-β1的能力)可通过任意合适的测量TGF-β1活性的传统生物测定来确定,例如通过MeagerJournal of Immunological Methods(1991)141:1-14所描述的测定方法。在这些方法中,Mv-1-Lu细胞生长抑制测定法特别合适。WO2005/019244也提供了Mv-1-Lu细胞测定的描述。优选地,本发明的TGF-β1抑制肽在Mv-1-Lu细胞生长抑制测定中具有20%或更高的抑制活性。更优选的,本发明的TGF-β1抑制肽在Mv-1-Lu细胞生长抑制测定中具有50%的抑制活性。
本发明中使用的术语“环糊精”包括任何已知的环糊精如含有6至12个葡萄糖单元的未取代的环糊精,特别是α-环糊精、β-环糊精、γ-环糊精、它们的衍生物及其混合物。α-环糊精由6个葡萄糖单元组成,β-环糊精由7个葡萄糖单元组成,γ-环糊精由8个葡萄糖单元组成,排列成环形圈。
本发明中使用的术语“环糊精衍生物”包括任意具有至少一个修饰的末端羟基的环糊精。环糊精的化学修饰可以改变其物理化学特性,改善其溶解度、稳定性并控制所述分子被(客体分子)连接时的化学活性。已经描述了通过环糊精羟基反应整合烷基、aryl carboxialquil、氰基烷基、羟烷基、磺基烷基、氨基、叠氮、杂环基、乙酰基、苯甲酰、琥珀酰,和其它含有磷、硫的基团......[Robyt(1998)″Essentials of carbohydrate chemistry″,EdCharles R.Cantor,Springer Advanced Text in Chemistry]。
优选的与TGF-β1肽抑制剂形成络合物的环糊精是β-环糊精和γ-环糊精。更优选的是β-环糊精和γ-环糊精的亲水衍生物,如2-羟丙基-β-环糊精、2-羟乙基-γ-环糊精、2-羟丙基-γ-环糊精、或磺化β-环糊精和磺化β-γ-环糊精。β环糊精衍生物的说明性的例子包括但不限于:单或多(C1-C6)烷基化β-环糊精,如二甲基-β-环糊精或七(2,6-二-0-甲基)-β-环糊精(DIMEB)、三甲基-β-环糊精或七(2,3,,6-三-0-甲基)-β-环糊精(TRIMEB)、随机甲基化的β-环糊精(RM-β-CD);单或多(C1-C6)羟烷基化β-环糊精,如羟乙基-β-环糊精、2-羟丙基-β-环糊精(HP-β-CD)、羟丁基-β-环糊精;羧基(C1-C6)烷基化β-环糊精,如羧甲基-β-环糊精、羧乙基-β-环糊精;(C1-C6)烷基羰基化β-环糊精,如乙酰基-β-环糊精;单取代、四取代或七取代β-环糊精;磺烷基醚环糊精(SAE-CD),如磺丁基环糊精(SBECD);麦芽糖基-β-环糊精;(2-羧甲氧基)丙基-β-环糊精等等。
用于本发明的环糊精及其衍生物是可购买的,如从Sigma-Aldrich公司购买。它们还可由本领域技术人员依据已知技术合成。
本发明络合物中TGF-β1抑制肽的量可在宽范围内变动,然而,在本发明的一个特定具体实施方式中,本发明络合物中的TGF-β1抑制肽相对于环糊精的重量比为约0.002∶1至约0.024∶1(0.002-0.024∶1)。在另一个特定的具体实施方式中,本发明络合物中的TGF-β1抑制肽相对于环糊精的重量比为约0.004∶1至约0.018∶1(0.004-0.018∶1)。在另一个特定的具体实施方式中,本发明络合物中的TGF-β1抑制肽相对于环糊精的重量比为约0.004∶1至约0.024∶1(0.004-0.024∶1)。在另一个特定的具体实施方式中,本发明络合物中的TGF-β1抑制肽相对于环糊精的重量比为约0.002∶1至约0.018∶1(0.002-0.018∶1)。TGF-β1抑制肽与环糊精之间的可行比例范围可取决于本发明任一具体实施方式的乳剂制剂中存在的其它赋形剂。优选的络合物包含SEQ ID NO:6的TGF-β1抑制肽和HP-β-CD。更优选的本发明的络合物包含SEQ ID NO:6的TGF-β1抑制肽和HP-β-CD,TGF-β1抑制肽相对于环糊精的重量比为约0.004∶1至约0.018∶1(0.004-0.018∶1)。更优选的,本发明的络合物包含重量比为约0.018∶1的SEQ ID NO:6的TGF-β1抑制肽和HP-β-CD。
另一方面,本发明涉及一种包含本发明的络合物的药物制剂(以下称为“本发明的药物组合物[1]”),其中所述TGF-β1抑制肽为治疗有效量,并且所述环糊精是药学上可接受的环糊精。
本文中的“治疗有效量”是足以预防性地对抗、稳定或治疗患有这种疾病或异常的患者体内由TGF-β1介导的疾病或异常的量。
TGF-β1抑制肽的治疗有效量可包括每天0.0lmg至50g、每天0.02mg至40g、每天0.05mg至30g、每天0.1mg至20g、每天0.2mg至10g、每天0.5mg至5g、每天1mg至3g、每天2mg至2g、每天5mg至1.5g、每天10mg至1g、每天10mg至500mg。
本发明上下文中用于环糊精的术语“药学上可接受”意指对受治疗患者的健康没有持久有害影响。在其它因素中,环糊精的药学接受性取决于所考虑的特定环糊精化合物、其在施用组合物中的浓度以及给药途径。例如,β-环糊精在静脉用组合物或非肠道组合物中作为赋形剂的应用受限于溶血和肾毒效应,但口服施用时其通常是无毒的。
在特定的实施方案中,包含根据本发明的络合物的本发明的药物制剂[1]进一步包含十六烷基PEG/PPG-10/1二甲基硅油。
本发明的另一方面涉及TGF-β1抑制肽乳剂(以下称为“本发明的乳剂”),其特征在于所述乳剂含有十六烷基PEG/PPG-10/1二甲基硅油。
由于本发明的乳剂是油包水(w/o)乳剂,因此其包含分散在连续介质-亲脂相中的基本上均匀并且球形的液滴-亲水相。亲水相包含与β-环糊精或γ-环糊精络合的TGF-β1抑制肽。亲脂相包含在其它赋形剂中的十六烷基PEG/PPG-10/1二甲基硅油。
通常地,本发明的乳剂的特征在于其热力学稳定性以及微米范围内的平均粒度,即直径在约0.5至20μm之间,优选包含在约0.5μm至10μm之间的直径,更优选在1至10μm之间。在其它因素中,平均粒度取决于与水介质的混合速度。
本发明乳剂的亲脂相可包含除十六烷基PEG/PPG-10/1二甲基硅油之外的其它表面活性剂,只要所利用的表面活性剂体系拥有基于HLB体系的0和8之间的总HLB值。然而,包含十六烷基PEG/PPG-10/1二甲基硅油以及一个或多个其它具有任意HLB值的表面活性剂、且仍能够铺开水/油乳剂的表面活性剂组合物也适合于本发明的乳剂。所述表面活性剂组合物因而可包括一个或多个HLB高于8或本质上更亲水的的表面活性剂,只要具有十六烷基PEG/PPG-10/1二甲基硅油的最终表面活性剂组合物能铺开水/油乳剂;或表面活性剂体系的总HLB至少小于8。为计算表面活性剂组合物的终HLB值,可应用Griffin的方法,其进一步允许计算生产用于特定水/油组合的物理稳定制剂所必需的表面活性剂的相对量。
本发明的特定实施方式涉及本发明的TGF-β1抑制肽乳剂,其中所述TGF-β1抑制肽选自与SEQ ID NO:1-23的氨基酸序列具有至少70%、优选至少80%、或更优选至少90%序列同一性的肽。本发明的乳剂的说明性的例子包括TGF-β1抑制肽与环糊精或其衍生物形成络合物的那些。
特定的实施方式涉及本发明的乳剂,其中所述TGF-β1抑制肽相对于环糊精的重量比为约0.002∶1至约0.024∶1(0.002-0.024∶1)、或重量比为约0.004∶1至约0.024∶1(0.004-0.024∶1)、或重量比为约0.002∶1至约0.018∶1(0.002-0.018∶1)、或重量比为约0.004∶1至约0.018∶1(0.004-0.018∶1)。TGF-β1抑制肽与环糊精之间的可行比率的范围可取决于本发明乳剂中存在的其它赋形剂。
因此,另一方面,本发明涉及包含本发明乳剂的药物制剂(以下称为“本发明的药物组合物[2]”),其中所述TGF-β1抑制肽为治疗有效量,并且所述环糊精是药学上可接受的环糊精。
本发明的另一方面涉及本发明络合物的制备步骤,所述步骤包括TGF-β1抑制肽与包含环糊精或其衍生物的水溶液混合。由所述步骤获得的产物(本发明的络合物)构成本发明的又一方面。
本发明的另一方面涉及本发明乳剂的制备步骤(以下称为“本发明乳剂的制备步骤”),所述步骤包括:
a)(i)通过将TGF-β1抑制肽与包含环糊精或其衍生物的水溶液混合以制备络合物;以及(ii)制备包含十六烷基PEG/PPG-10/1二甲基硅油的亲脂相;以及
b)所述络合物在所述亲脂相上的混合。
在一个特定的实施方式中,在所述乳剂的制备步骤中,在步骤b)之前,络合物和亲脂相均在15℃至70℃之间的温度加热,优选20℃至50℃,更优选25℃至35℃。
由所述本发明乳剂制备步骤获得的产物(本发明的乳剂)构成本发明的又一方面。
本发明的各种乳剂通常通过下述方法制备,即分别称量在合适容积的不锈钢容器内的每个乳剂相(水相和油相)的成分。然后,每个相水浴加热,适当地恒温控制在15℃至70℃之间,优选20℃至50℃,更优选25℃至35℃。可覆盖包含水相的容器以防止蒸发导致的损失。油相被加热直至获得均匀的熔体。优选地,每个相在25℃至70℃之间展示出清晰、均一的外观。随后,搅拌油相,水相一点点逐渐灌注到油相上。乳剂保持搅拌30至40分钟。在该过程末期,乳剂处于室温。最终阶段为乳剂的成熟。这个阶段具有可变持续时间,通常在48与72小时之间,即验证其稳定性的充足时间。
通常应用于制药领域的各种赋形剂可加入到本发明的乳剂中。这些药学上可接受的赋形剂可以是保藏剂、润肤剂、消泡剂、抗氧化剂、缓冲剂、颜料、着色剂、甜味剂、调味剂、涂层剂、造粒剂、崩解剂、助流剂、润滑剂、传统的基质材料、络合剂、吸收剂、填料。它们可用于惯用目的并以通常用量使用,而对所述组合物的特性没有不利影响。本发明所提供产品的剂型也可含有其它有治疗价值的物质。
表2中收集了用于本发明的进一步优选的制剂,包括用于制剂的化合物的通用描述及其功能,优选的范围,以及这些化合物说明性的例子的实际量。
表2
*重量/重量比(w/w);q.sp.:必要时足量
因此,本发明的一个特定实施方式涉及包含0.01%至1%w/w量的TGF-β1抑制肽、1至10%w/w量的β-环糊精或γ-环糊精、0.5%至6%w/w量的十六烷基PEG/PPG-10/1二甲基硅油、0.005%至0.6%w/w量的防腐剂(如对羟基苯甲酸酯,诸如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯等)、3%至20%w/w量的硅酮、10%-40%w/w量的矿物油以及必要时足量的100%的水。
本发明的乳剂可经任何给药途径施用给患者,局部或作为口腔或鼻腔喷雾剂、眼药等等。
本发明的络合物包含TGF-β1抑制肽和环糊精或其衍生物,其中:所述TGF-β1抑制肽选自与SEQ ID NO:1-23之一的氨基酸序列具有至少70%序列同一性的肽、可抑制TGF-β1的其盐、功能性衍生物、变体、类似物及其片段;并且所述环糊精或其衍生物选自β-环糊精和γ-环糊精;该络合物可通过任何适当的给药途径例如口服、直肠的、非肠道的如静脉内、肌肉内或皮下等、脑池内、阴道内、腹膜内、膀胱内、局部或通过口鼻或肺途径如作为口腔或鼻喷雾剂、眼药等等施用给患者。
可用于本发明的适当的单位剂型包括,如硬明胶胶囊、软明胶胶囊、片剂、囊片、肠溶片、肠溶硬明胶胶囊、肠溶软明胶胶囊、糖衣丸、口服液、糖浆、喷雾剂、栓剂等等。
本发明的另一方面涉及本发明络合物、或本发明乳剂、或本发明药物制剂[1]、或本发明药物制剂[2]的应用,其用于制造用于治疗由TGF-β1介导的疾病或异常的药物。另一方面,本发明涉及本发明络合物、或本发明乳剂、或本发明药物制剂[1]、或本发明药物制剂[2]在治疗TGF-β1介导的疾病或异常中的应用。此外,本发明提供了在需要治疗的哺乳动物中治疗TGF-β1介导的疾病或异常的方法,所述方法包括给有治疗需要的哺乳动物施用有效量的本发明络合物、或本发明乳剂或本发明药物制剂[1]或本发明药物制剂[2]。
术语“TGF-β1介导的疾病或异常”包括心血管疾病如遗传性出血性毛细血管扩张症(Rendu-Osler-Weber综合征),大动脉疾病如Loeys-Dietz综合征、家族性胸主动脉瘤综合征、以及动脉迂曲综合征、原发性肺动脉高压以及家族性肺动脉高压、先兆子痫、动脉粥样硬化、再狭窄、高血压、肥厚型心肌病/充血性心力衰竭;结缔组织疾病如马方综合征和马方样疾病,纤维化疾病;骨骼和肌肉疾病如Camurati-Engelmann病、进行性骨化性纤维发育不良、亨特-汤普森和鸊鷉类型软骨发育不全、骨质疏松症、硬化性狭窄病和Van Buchem疾病、短指和指(趾)关节粘连、以及迪谢内肌营养不良;生殖疾病如卵巢功能早衰和持续性苗勒管综合症;遗传性癌症综合征如幼年性息肉综合征、遗传性非息肉性结直肠癌、以及Bannayan-Riley-Ruvalcaba和考登综合征;偶发癌症如乳癌、结直肠癌、胰腺癌、肺癌以及前列腺癌;发育障碍如腭裂和内脏异位以及内脏对称位。
在特定的实施方式中,所述由TGF-β1介导的疾病或异常包括纤维增生性疾病。特别地,纤维增生性疾病包括与不受调控的TGF-β活性相关的肾异常和包括肾小球肾炎(GN)的过度纤维化,如系膜增生GN、免疫GN以及新月体GN。其它的肾异常包括糖尿病肾病、肾间质纤维化、接受环孢菌素的移植患者的肾纤维化、以及与人免疫缺陷病毒(HIV)相关的肾病。胶原血管异常包括进行性全身性硬化症、多肌炎、硬皮病、皮肌炎、嗜酸性筋膜炎、硬斑病或与雷诺氏综合症发生相关的那些疾病。TGF-β活性过度导致的肺纤维化包括成年呼吸窘迫综合症、特发性肺纤维化、通常与自身免疫异常相关的肺间质纤维化,如系统性红斑狼疮和硬皮病、化学接触或过敏症。与纤维增生性疾病性状相关的另一种自身免疫异常是类风湿性关节炎。
在特定的实施方案中,所述由TGF-β1介导的疾病或病理学异常选自肝纤维化、肺纤维化、角膜纤维化和腹膜损伤的纤维化(如腹膜透析损伤诱导的纤维化)。
TGF-β超家族成员经常与其它疾病相联系。例如,已在包括孤独症、精神分裂症、帕金森氏症、多发性硬化和阿尔茨海默病的多种神经性异常中观察到TGF-β1表达的改变,而在亨廷顿和帕金森氏病中是激活素表达改变。TGFB1多态性也与耳硬化症(一种由听软骨囊的增强重构导致的进行性听力丧失),以及银屑病、胆汁性肝硬化和小二气喘相关。
TGF-β1介导的更多的疾病或异常包括瘢痕疙瘩、肥厚性瘢痕如手术或创伤导致的那些瘢痕,化学烧伤或由热或冷引起的热灼伤,与骨髓移植相关的皮肤纤维化,硬斑病,硬皮病及类似疾病如肢端角化性弹性组织角化症;特发性皮肤萎缩;CREST综合症;人为性皮炎;弥漫性硬皮病;嗜酸性筋膜炎;移植物抗宿主病;瘢痕疙瘩硬皮病;硬化性苔藓;线状硬皮病;局限系统性硬皮病;下颌骨末端发育不良症;与骨髓瘤相关的皮肤变化;肾源性纤维化皮肤病;重叠综合症;Parry-Romberg综合症;迟发性皮肤卟啉症;早衰症;多发性神经病综合症相关的皮肤变化,脏器肿大,内分泌病,单克隆蛋白或皮肤改变或POEMS;假硬皮病;Buschke硬皮症;硬化性粘液水肿;白癜风;沃纳综合症,痤疮,蜂窝组织炎,迪皮特朗综合征,Peyronie疾病,皱纹以及通常的任何经过纤维化阶段或TGF-β产量和/或活性上升的皮肤损害或病变,以及皮肤纤维化作为并发症的任何疾病。
适合施用本发明络合物、本发明乳剂、或本发明的药物制剂[1]或[2]的哺乳动物包括狗、猫、马、猪、小鼠、大鼠、灵长类以及特别是人类。
以下非限制性实施例有助于阐明本发明的原理。
实施例
实施例1
制剂的组分研究
目的是获得具有某种闭塞特征的、适当地流动的制剂,从而便于大规模的工业生产,并在乳剂965(E.965)的情况下不允许P144被吸收以及全身性分布。
为获得硅乳剂,为了获得最好的可能乳剂,检索了几种表面活性剂。系统性检索后在不同供应商中选择了Care 85(Bis-PEG/PPG-16/16PEG/PPG16/16)和EM90(cethyl PEG/PPG-10/1 dimethycone)。
测试几种制剂直至获得稳定的、具有良好感官特征的下述乳剂。表3总结了不同的试验过的制剂。
表3
硅乳剂的待测起始制剂的组分
[CD:羟丙基-β-环糊精]
使用表3所示制剂获得的结果如下:
配方1:一旦相混合物的搅拌结束,所述相就分离,没有形成乳剂。
配方2:获得了乳剂并保持了数小时,但在静置一段时间后分离。
配方3:发生了与前一例相同的情况,但其在比制剂2稍长的静置时间后分离。
配方4:与配方2相比未观察到大的区别。
配方5:最终未获得乳剂。
配方6:获得了稳定的乳剂,具有良好的流动性和可接受的感官特性。一部分在室温保存而另一部分在4℃保存。
配方7:最终制剂具有目标所定义的参数。
因此,配方7的制剂被选择作为所述肽(P144)转运或负载能力测试的出发点。
实施例2
制备负载有P144(100μg/g)的硅乳剂的方法
制备依据配方7的硅乳剂的方法,如下:
1.称量水。
2.称量对羟基苯甲酸丙酯和对羟基苯甲酸甲酯并溶于水,轻微加热(低于35℃)以利于防腐剂的溶解。
3.一旦对羟基苯甲酸酯溶解,让溶液冷却,然后边搅拌边逐渐加入CD(羟丙基-β-环糊精)直至完全溶解。
4.然后,在搅拌下缓慢加入P144,溶解P144所需时间相当长(一个晚上)。
5.在另一个容器中,称量超过所加入EM 90重量的石蜡和二甲基硅油350。三个组分在磁力搅拌下混匀。
6.具有P144的水相在油相添加溶解直至获得乳剂。一旦乳剂的成熟过程结束,三等份约6g的乳剂被用于检测乳剂稳定性的测试。
所述测试由以下步骤组成:
-2,000r.p.m离心5分钟
-4,000r.p.m离心10分钟
-8,000r.p.m离心10分钟
-13,000r.p.m离心10分钟
-在90℃加热。
在前两种情况下,未观测到所述乳剂外观的变化。在第三种情况下,观察到极少量的水释放在乳剂表面上。然而,在所述乳剂以13,000r.p.m离心或加热后,未观察到变化。
另一种方法用于测试制剂中整合的P144:物理混合。所述方法由P144和环糊精在研钵辅助下的干法混合构成。然后所述混合物添加至所述制剂的水上,形成不能完全溶解的悬浮液。为此,放弃了这种整合P144的方式。
由于选择了制备环糊精溶液而加入肽的制造方法,尽管有所改进,乳剂中的两种相还是被轻微加热(低于35℃)。
实施例3
硅乳剂中P144肽溶液的验证
检索了可获知P144是否溶解于制剂中或相反地其以晶体形式分散于乳剂中的快速简便的方法。因为P144的特点,我们确定所述方法是通过可见光和紫外光利用显微镜观察来自不同测试制剂的代表性样品。
实验测定条件如下:Nikon ECLIPSE ES00显微镜,Nikon DIGITALCAMERADXM 1200相机,ACT-1图像分析程序。不同样品在可见光和紫外辐射(EX 330-380,DM 400,BA 420)下四倍观测。图1-7示出了根据上述制剂制备的部分批次的图像。图1和2分别示出了具有100μg/g P144的硅乳剂以及不具有P144的作为空白的硅乳剂的图片。
实施例4
E.965乳剂和新的硅乳剂的P144运载能力的比较
比较了乳剂E.965和依据起初所选配方7的新的硅乳剂的P144运载能力。而且,加入了新配方8和9,其环糊精的含量增加,目的是平行增加P144的负载能力。在表4中列出这些新的制剂。
表4
依据最初选择的配方7、以及改良的配方8和9的新的硅乳剂组合物。通过改变肽P144的负载浓度(参见表5)分析3种配方的运载能力
最初,制备了肽量加倍达到200μg/g的乳剂(配方7)。通过减少水的含量补偿质量的增长,尽管对整体而言它是制剂的微不足道的变化。获得所述乳剂的步骤与前面实施例的相同。
在该制剂(批次A-4)的利用可见光和紫外光的显微镜分析中,未发现P144的结晶,其预示着P144的适当溶解。
接下来,对相同的制剂7以及方法进行分析,但浓度为300μg/g,其类似于乳剂E.965能达到的最高浓度。在该制剂(批次A-5)利用可见光和紫外光的显微镜研究中,未检测到晶体。
因此,可以断定,已经获得了一种具有与E.965乳剂相似P144负载能力的制剂,其具有更好的盖伦特性,并且其制备方法要求提供相当少的热。
从这个角度,制剂中P144浓度的任何增加而未检测到肽结晶可被视为相对于E.965乳剂负载能力的改进,并且可推想达到了既定目标。
使用前例中相同的制剂7制备了新的硅乳剂,其中P144的浓度逐渐增加:每克制剂中400μg、600μg、800μg和1,000μg的P144。当以可见光或紫外光分析新的四个制剂时,未观察到P144结晶(图3)。
然而,在之后再次加工分别具有1,000μg/g、1,200μg/g和800μg/g浓度P144的新批次乳剂(A-12、A-14和A-15)。这时候以紫外光分析时能清楚地观测到P144晶体。
相似批次中结果不同的原因,可能是A-9(800μg/g)和A-10(1,000μg/g)批次的制备,是以预先制备的P144溶液按这两个批次中任一个的要求以不同浓度稀释进行的。
一个可能的原因是,可能已经非常接近该制剂的P144溶解限度并因而一些晶体在某些情况出现而在另外的情况下观测不到P144的晶体。
为验证这种可能性,测试了在起始制剂7上稍作改进的新的配方8。羟丙基-β-环糊精(CD)的含量从2.5%w/w增加到4.2%w/w,并且对羟基苯甲酸酯的含量加倍,从而,如表4所示着手新的制剂。
以这种新的替代制剂制备了负载有1000μg/g的P144的批次(A-16)。显微镜下在不同区域观测未见到P144结晶,表明第二种猜想是正确的。通过增加羟丙基-β-环糊精(CD)的量,达到了所述肽的完全溶解。
据文献报道,制剂的这种改变导致了在制剂中增加防腐剂的必要性,因为众所周知环糊精的存在降低了对羟基苯甲酸酯的效率。为此,使对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的浓度加倍。
已经明了P144晶体出现的原因之后,决定保留最初测试的制剂7,并调整可摄取的肽的量。以这种方式,制备了具有接近溶解限度的肽浓度:750μg/g和700μg/g的新批次乳剂(A-17和A-18)。两种情况下都检测到结晶(图5)。
考虑到这些结果,决定将600μg/g设置为制剂7的P144最大浓度,命名为ESD600。
表5总结了不同制剂的P144负载研究中不同测试批次所获得的结果。
表5
根据配方7、配方8和配方9制备的肽P144负载浓度变化的不同乳剂批次所获得结果(晶体形成)的比较总结(实施例2、4和5)
P144的新的硅乳剂、制剂ESD6000的结论
可以认为这个方案一开始既定的目标已经达到。两种制剂最初所公开的要求是:
-允许P144局部作用而不被明显吸收
-显示良好的铺展性
-显示令人愉快的外观而不油腻。
对于新的制剂ESD600,期望达到如下目标:
-使用允许移除/减少有机溶剂的任何体系促进活性成分的溶解
-获得更均匀和稳定的乳剂,并且
-减少为获得乳剂的加热阶段,而没有活性物质丧失稳定性的风险。
移除作为溶剂的二甲基亚砜(DMSO),由还可以倍增乳剂E.965所获的最高肽浓度的羟丙基-β-环糊精溶液代替,从而完成第一个目标,。
第二个目标也达到了。减小乳剂形成阶段的加热温度,最终也完成了第三个目标。制备乳剂ESD600的工作温度一直保持低于35℃,而制备乳剂E.965的工作温度达到50-56℃。
实施例5
硅乳剂P144、制剂ESD600的改进
确定了获得能够运载更高肽浓度的制剂的新目标。
制剂7(ESD600)做了尽可能小的改进以尽可能地增加P144负载能力。为此,羟丙基-β-环糊精的浓度增至5%w/w并且对羟基苯甲酸酯的浓度也加倍了,相对地减小了石蜡的百分比。这样,所述制剂如表4配方9(ESD900)所示。该乳剂将是可运载相当高量活性物质的媒介。根据这个新配方,制备了负载浓度提高(P144:0μg/g(空白制剂)、700μg/g、800μg/g、1,100μg/g、1,200μg/g、1,400μg/g)的不同批次的乳剂。
空白制剂(没有P144的ESD900)对应于批次A-21,可调控为可见光和紫外光都没有信号。
表6
P144的硅乳剂ESD600和ESD900的组分
通过用显微镜观察相应样品,表明制剂中P144晶体形成的P144浓度等于或大于1000μg/g(图5和6)。
之后,制备了肽浓度为900μg/g的批次A-31。这种情况下未观测到P144晶体。
因此,可以断定对于含有5%w/w羟丙基-β-环糊精的新制剂9,P144的最大浓度为900μg/g。这种制剂被命名为ESD900。
结论
P144的硅乳剂(ESD600或ESD900)允许P144局部作用而不被吸收;显示了良好的铺展性和令人愉悦的外表而不油腻,是一种更均匀和稳定的乳剂;促进应用羟丙基-β-环糊精的水溶液(ESD600中2.5%w/w或ESD900中5.0w/w)溶解活性成分而不需要有机溶剂。
通过使乳剂E.965的负载能力倍增(ESD600)或增大三倍(ESD900),增加了P144运载的能力。
对于新的硅乳剂,为获得所述乳剂的加热阶段减少了,而没有活性物质丧失稳定性的风险。
实施例6
制剂ESD600的盖伦特点
1.宏观特征
外观:硅乳剂ESD600显得均匀并且呈乳状,具有流体的一致性和良好的均一性。
气味:无味。
触感:硅乳剂ESD600呈现出闭塞的特性,没有干燥效果,并在施用后留下微量缓慢吸收的油性残留物。触感光滑,具有明亮的外观。
2.微观特征
2.1液滴大小:
步骤:在玻片上放置一等份的ESD600硅乳剂。在Olympus CH40显微镜下(x100 x 1.25=x125)显像。
结果:非常均匀的液滴,大小为2-3μm,约10%的液滴大小为10μm。参见图8。
2.2一致性测定
-延展能力测量(图9-16):
步骤:在毫米的纸张(millimetered paper)上标记玻片的边缘并描画相应的对角线以获得它们的交叉点作为参考中心点,之后,小心地安置玻片以确保其与上述的描画相符,并且,将约25mg的乳剂放置于中心点。然后已知重量的第二块玻片被轻轻放置在前一块玻片上,并在等候一分钟后,测量形成的圆相对于所描画对角线交叉点的两个直径,计算平均值并除以2。从而计算出所述圆的平均半径。然后以三个不同的重量重复相同的步骤,并总是间隔一分钟。这样获得的半径用于计算相应的表面积,基于公式S=π*r2。在室温下测定延展能力,参见图9-16。
结果:表7报告了用于确定所述制剂延展能力的重量以及相应的直径增量、平均半径和P144硅乳剂ESD600样品的表面积。
表7
P144硅乳剂ESD600延展能力测试的结果
参见图17。
计算的表面积增量是1,884.955mm2。
P144硅乳剂ESD600显示了比乳剂E.965更好的延展能力,因为表面积增量约为两倍大。
3.乳剂类型的测定
通过两种方法进行乳剂类型的确定:
3.1稀释法:向含有水(3ml)的管内加入少量的P144硅乳剂ESD600,不搅拌。如果外相是水性的,所述水变浑浊。如果外相是油性的,所述水保持不变且不会变浑浊。
在实行上述测试后,所述水没有变浑浊,并且甚至能看到油性液滴;因而可以肯定所述硅乳剂呈现为油性外相(w/o)。图18和图19示出了以该方法获得的结果。
3.2染色法:应用了水溶性染料,特别是亚甲蓝溶液(0.4%w/v)。如果所述乳剂是油/水型,所述染料将分散开。然而,如果所述乳剂是水/油型,其将被排斥且不分散开。
少量的研究乳剂被置于玻片上。然后加入一滴亚甲蓝,不混合。在实行上述的测试后,看到乳剂排斥染料;我们因此断定其是水/油型的。参见图20。
4.pH的测定
通过在l0ml水中稀释500mg的乳剂,随后过滤以测定pH值。以GLP21Crison pH计进行三次测量,结果如下:
样品1:5.78
样品2:5.79
样品3:5.70
平均值pH=5.76±0.049
实施例7
配制在乳剂ESD600中的P144的经皮吸收研究
规划和目标
这项研究的目标是评估命名为“ESD600”浓度为100μg/g(ESD600[100])制剂中配制的肽P144在猪耳皮肤样品中的吸收和经皮渗透。应用不具有肽的制剂“ESD600对照”(ESD600[0])作为对照产品。
原料和方法
猪耳皮肤从用于人类消费的杂种猪获得。耳朵如随后的“方法1步骤1:取皮(Dermatomization)”所公开的进行处理。
测试产品是具有100μg P144/g的乳剂ESD600(ESD600[100],批次号:X-6)。这种半固体制备依据上述的方法进行。它的组成如表8所示。
表8
CD:羟丙基-β-环糊精
所述对照产品是没有P144的对照硅乳剂ESD600[0](ESD600[0],批次号:X-5)。这种半固体的制备依据上述的方法进行,而没有添加活性成分。它的组成如表9所示。
表9
CD:羟丙基-β-环糊精
应用的试剂盒:
-Mettler AT261 Delta Range天平
-Crison pH计,pH计GLP 21
-Franz Variomag Telesystem扩散池。Franz池设备由6个池组成,所述池由硼硅玻璃和特氟龙制成,具有受体室(7mL容积)以及供体室(直径15mm)。
-Dermatomo(Aesculap-Wagner取皮机C.GA 630;B.Braun SurgicalS.A.,巴塞罗那,西班牙)
-零下80℃的保存(Arch)(Forma Scientific,938)
-零下20℃的冷冻
所有的化学试剂、盐和产品具有分析质量。磷酸盐缓冲液(PBS)(Sigma,ref:P4417-100TAB)、羟丙基-β-环糊精(OH-CD),(Sigma,ref.332607)、TissueOCT化合物(Sakura,ref:4583)。在Wasserlab(Automatic ModelN°AU 050503)系统中获得的II型水用于制备溶液。
用于从池中收集样品的小瓶(Watters Ref.:7176)。
用于保存样品的冻存管(Criotubes)
“Franz扩散池”设备由6个池组成,分为两排。每个池具有两个腔室:供体室和受体室。待分析的产品或其对照被置于第一个腔室内,并且可捕捉透过实验系统(猪皮肤或人皮肤)的药物量的溶液被置于第二个腔室内。该实验系统放在供体室和受体室的分界面。待分析产品在“Franz池”设备中的分布如下进行:ESD600[100](池5和池6),ESD600[0]对照(池2)。猪耳皮肤的实验重复4次。
方法
1.步骤1:取皮
获得猪耳朵的当天,洗涤猪耳朵,借助于取皮机处理并切割以获得1mm厚度、最小面积为4cm2的薄膜。所述膜分别以-20℃储存于冰箱。
2.步骤2:经皮扩散测试
2.1经皮扩散测试
进行了24小时(h)的扩散测试,其中测试了具有100μg/g肽的硅乳剂ESD600[100]。所取的1.0mm的猪耳朵皮肤被用作扩散薄膜。在开始测试前,以PBS(磷酸盐缓冲液,pH7.4±0.2)浸泡30分钟水化皮肤。另一方面,每个池的受体室以7ml含有5%w/w的OH-CD、pH为7.4±0.2的磷酸盐缓冲液灌注。所取的并水化过的皮肤部分被置于受体室上。在该皮肤上,固定受体室(直径15mm),其中放置了约0.9g半固体制剂(容积1ml)、待测产品(ESD600[100])或其对照产品(对照硅乳剂ESD600;ESD600[0])。所述受体室保持在32.5±0.5℃的温度并以400r.p.m搅拌。在固定时间间隔(0h、1h、2h、6h、12h和24h)后,从受体室手动收集1ml样品,然后以1ml原始液替换此体积以保持受体室体积恒定。收集的样品以-80℃储存于-80℃冰箱的冻存管内用于随后的色谱分析。
3.不同皮层内P144存在的研究
一旦测试结束,进行薄膜切割。为此,先从所述池移开皮肤,并将残余的待测产品或对照以II型水洗涤除去。所述样品被放置在一个硬表面上并加入足量的OCT以获得均匀的冻结块,其可以进行连续切割。借助于criostate,每个猪耳皮肤样品以50μm厚度连续切割6次。将这些切片分别收集入冻存管中,以代码标记并最终在-80℃储藏直到后续的色谱分析。表10-13总结了皮肤样品的特征。所述表示出了在criostate内切割之后所分析的皮肤表面(用于定量其P144所需)的百分比。
表10
猪耳皮肤切片中的定量。切片表面积(S=176mm2;厚度=50mm)。
实验1
LOQ:定量极限
表11
猪耳皮肤切片中的定量。切片表面积(S=176mm2;厚度=50mm)。
实验2
表12
猪耳皮肤切片中的定量。切片表面积(S=176mm2;厚度=50mm)。
实验3
表13
猪耳皮肤切片中的定量。切片表面积(S=176mm2;厚度=50mm)。
实验4
结果的处理、评估和解释
通过高效液相色谱和质谱检测(HPLC/MS/MS)完成皮肤样品和储存器内P144的定量。
受体室的样品:
高效液相色谱-质谱技术用于受体室样品的定量极限是10ng/ml,并已被用于作出下述声明之一:
当在受体室内收集的溶液中未检测到肽P144的量(阴性样品或任何低于分析技术的定量极限的情况):“配制在半固体制剂ESD600中的P144,其不能够穿越皮肤障碍”
当在受体室内收集的溶液中检测到肽P144的量高于分析技术的定量极限:“配制在半固体制剂ESD600中的P144,能够穿越皮肤障碍”
如果已经检测了受体室中肽P144的量,那么就完成累积的量相对于时间的X-Y图像。同样地,存在大量药物时,应从表征稳态的曲线的斜率计算透皮流量(J)。
皮肤水平切片的样品:
在皮肤不同层(深度)的P144存在的研究中,通过高效液相色谱-质谱定量的P144的量相对于深度来表征。所有数据表示为平均值和标准差,显示重复次数(n)。通过ANOVA分析存在的显著性差异和统计比较。对于不同处理间的这些比较,应用Tukey测试和Dunnett测试。在任何其它情况下,p<0.05被认为是显著性的。应用SPSS程序版本11完成统计学分析。
猪耳皮肤皮肤吸收和渗透研究的结果和讨论
图21示出了配制于100μg P144/g的ESD600(ESD600[100])中的、能在透皮吸收研究中到达受体室的P144的量。如图所示,受体室中检测到的P144量在所有分析的情况下总是低于2ng(HPLC/MS/MS技术的定量极限,参见表14)。在任何情况下都不可能看到可允许尝试最小肽片段通过的信号。正因为如此,可以说,在该研究的条件下,没有P144经猪耳皮肤朝向总体循环的透皮流动。
表14
受体室定量结果的表格
表10-13示出了猪皮肤的不同分析层中P144的定量结果。图22示出了局部应用ESD600[100]24小时后P144在猪耳皮肤中的分布,并将其与乳剂965(E.965)所获得的结果相比较。该分布依靠50mm的部分皮肤水平切片估算。不具有P144的ESD600[0]处理的皮肤切片用作对照。在任何情况下,6个完成的切片内的药物含量未发现显著性差异(p<0.05)。对照乳剂ESD600[0]的情况下,未发现P144(LOQ:100ng)。
从结构的观点来看,猪皮肤看起来与人类皮肤最为相似(Touitou等.J.Controlled Release,1998,56,7-21;Simon和Maibach.Skin Pharmacol.Appl.Skin Physiol.2000,13,229-234)。此外,已公开了许多药物适合通过皮肤的渗透性研究(Neubert和Wohlrab.Acta Pharm.Technol.,1990,36,197-206)。Jenning等(Jenning等.Eur.J.Pharm.Biopharm.,2000,49,211-218)已确定,依靠光学显微镜,在猪皮肤中,可以区分约100mm的角质层以及随后的100-200mm的表皮层。考虑到剩下的真皮部分以及小部分的皮下脂肪组织,真皮应位于200和500mm之间(Jenning等.Eur.J.Pharm.Biopharm.,2000,49,211-218)。
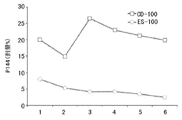
猪耳皮肤中P144的分布结果(图23)清楚地显示了P144对其不同区域的亲和力。然而,在ESD600的情况下,与E.965获得结果相反,对皮肤角质层(SC),这种亲和力更高。实际上,可从角质层至真皮的最后一层观测到P144的浓度梯度。
以皮肤渗透相关的数据,计算了存在于不同层皮肤的部分剂量的理论量。图24示出了ESD600的这些结果并与E.965获得的结果相比较。如能够显示的,硅乳剂ESD600增强P144在不同层皮肤渗透的效果比乳剂E.965明显低得多。
实施例8
P144溶解性研究
优化的肽产品的制备
1、人白蛋白肽冻干样品:2小瓶,每瓶含有500μg所述肽和400mg人白蛋白的冻干产品。
2、人白蛋白肽冻干样品:2小瓶,每瓶含有500μg所述肽和200mg人白蛋白的冻干产品。
3、羟基-丙基-β-环糊精-肽冻干样品:2小瓶,每瓶含有500μg所述肽和100mg羟基-丙基-β-环糊精的冻干产品。
4、尿素-肽冻干样品:2小瓶,每瓶含有500μg所述肽和200mg尿素的冻干产品。
冻干前的原始体积是2ml。我们推荐每小瓶以2ml蒸馏水分散。
表15
Claims (18)
1.包含TGF-β1抑制肽和环糊精或其衍生物的络合物,其中
所述TGF-β1抑制肽选自与SEQ ID NO: 1-23之一的氨基酸序列具有至少70%序列同一性的肽、能够抑制TGF-β1的其盐、功能性衍生物、变体、类似物、或其片段;并且
所述环糊精或其衍生物选自β-环糊精和γ-环糊精。
2.根据权利要求1所述的络合物,其中所述β-环糊精是单或多 (C1-C6) 烷基化的β-环糊精。
3.根据权利要求1或2所述的络合物,其中所述TGF-β1抑制肽以相对于环糊精约为0.002:1-0.024:1的重量比存在。
4.包含权利要求1-3任一项所述的络合物的药物制剂,其中TGF-β1抑制肽以治疗有效量存在并且环糊精是药学上可接受的环糊精。
5.根据权利要求4所述的药物制剂,其进一步包含十六烷基PEG/PPG-10/1二甲基硅油。
6.包含十六烷基PEG/PPG-10/1二甲基硅油的TGF-β1抑制肽乳剂。
7.根据权利要求6所述的乳剂,其中所述TGF-β1抑制肽选自与SEQ ID NO: 1-23的氨基酸序列具有至少70%序列同一性的肽。
8.根据权利要求7所述的乳剂,其中所述TGF-β1抑制肽与环糊精或其衍生物形成络合物。
9.根据权利要求8所述的乳剂,其中所述TGF-β1抑制肽以相对于环糊精约为0.002:1-0.024:1的重量比存在。
10.包含权利要求6-9任一项所述的TGF-β1抑制肽乳剂的药物制剂,其中所述TGF-β1抑制肽以治疗有效量存在,并且权利要求8的乳剂中的环糊精是药学上可接受的环糊精。
11.根据权利要求10所述的药物制剂,其包含0.01%至1% w/w的TGF-β1抑制肽、1%至10% w/w的β-环糊精或γ-环糊精、0.5%至6% w/w的十六烷基PEG/PPG-10/1二甲基硅油、0.005%至0.6% w/w的对羟基苯甲酸酯、3%至20% w/w的硅酮、10%-40% w/w的矿物油以及必要时足量的100%的水。
12.根据权利要求1-3任一项所述的络合物的制备步骤,其包括TGF-β1抑制肽与含有环糊精或其衍生物的水溶液的混合。
13.根据权利要求8的TGF-β1抑制肽乳剂的制备步骤,其包括
(i)根据权利要求1-3任一项所述的络合物的制备;和(ii)包含十六烷基PEG/PPG-10/1二甲基硅油的亲脂相的制备;以及
所述亲脂相上所述络合物的混合。
14.根据权利要求13所述的步骤,其中在步骤b)之前,所述络合物和所述亲脂相在25oC和70°C之间的温度下加热。
15.根据权利要求12-14任一项所述的步骤获得的产品。
16.根据权利要求1-3任一项所述的络合物,或根据权利要求6-9任一项所述的乳剂,或根据权利要求4、5、10或11任一项所述的药物制剂,在用于治疗TGF-β1介导的疾病或异常的药物的制备中的应用。
17.根据权利要求1-3任一项所述的络合物,或根据权利要求6-9任一项所述的乳剂,或根据权利要求4、5、10或11任一项所述的药物制剂,其用于治疗TGF-β1介导的疾病或异常。
18.用于在有治疗需要的哺乳动物中治疗TGF-β1介导的疾病或异常的方法,所述方法包括,给所述哺乳动物施用有效量的根据权利要求1-3任一项所述的络合物,或根据权利要求6-9任一项所述的乳剂,或根据权利要求4、5、10或11任一项所述的药物制剂。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ESP200900319 | 2009-02-05 | ||
| ES200900319 | 2009-02-05 | ||
| PCT/ES2010/070062 WO2010089443A2 (es) | 2009-02-05 | 2010-02-04 | FORMULACIONES FARMACÉUTICAS DE PÉPTIDOS INHIBIDORES DE TGF- β1 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102307598A true CN102307598A (zh) | 2012-01-04 |
Family
ID=42320987
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2010800067872A Pending CN102307598A (zh) | 2009-02-05 | 2010-02-04 | TGF-β1抑制肽的药物制剂 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20110294734A1 (zh) |
| EP (1) | EP2394666A2 (zh) |
| JP (1) | JP2012516879A (zh) |
| CN (1) | CN102307598A (zh) |
| AU (1) | AU2010210033A1 (zh) |
| BR (1) | BRPI1008815A2 (zh) |
| CA (1) | CA2750559A1 (zh) |
| MX (1) | MX2011008261A (zh) |
| RU (1) | RU2011136694A (zh) |
| WO (1) | WO2010089443A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110483648A (zh) * | 2019-08-27 | 2019-11-22 | 南京安吉生物科技有限公司 | 一种融合多肽及其应用 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9970057B2 (en) | 2011-05-06 | 2018-05-15 | Albert Einstein College Of Medicine, Inc. | Human invasion signature for prognosis of metastatic risk |
| RU2678117C2 (ru) | 2012-11-02 | 2019-01-23 | Селджин Корпорейшн | Антагонисты активина-actrii и их применение для лечения нарушений костной ткани и других нарушений |
| AU2014262517B2 (en) * | 2013-05-10 | 2018-10-18 | Southern Research Institute | Compounds, compositions and methods for the treatment of diseases through inhibiting TGF-beta activity |
| MA41052A (fr) | 2014-10-09 | 2017-08-15 | Celgene Corp | Traitement d'une maladie cardiovasculaire à l'aide de pièges de ligands d'actrii |
| HUE062189T2 (hu) | 2014-12-03 | 2023-09-28 | Celgene Corp | Aktivin-ACTRII-antagonisták és alkalmazások mielodiszpláziás szindróma kezelésére |
| KR101841748B1 (ko) | 2016-02-18 | 2018-05-08 | (주)케어젠 | 멜라닌 생성 촉진 활성을 나타내는 펩타이드 및 이의 용도 |
| WO2019234221A1 (en) | 2018-06-08 | 2019-12-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for stratification and treatment of a patient suffering from chronic lymphocytic leukemia |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5730969A (en) * | 1988-10-05 | 1998-03-24 | Chiron Corporation | Method and compositions for solubilization and stabilization of polypeptides, especially proteins |
| CN1839149A (zh) * | 2003-08-22 | 2006-09-27 | 西玛生物医学信息公司 | 能够结合转化生长因子β1(TGF-β1)的肽 |
| US20070207965A1 (en) * | 2006-03-01 | 2007-09-06 | Digna Biotech, S.L. | Method for the treatment of skin fibrosis and suitable compositions for such treatment |
| WO2008003685A1 (de) * | 2006-07-06 | 2008-01-10 | Henkel Ag & Co. Kgaa | O/w-emulsion |
| WO2008013928A2 (en) * | 2006-07-28 | 2008-01-31 | Biogen Idec Ma Inc. | Treatment of cancer with interferon gene delivery in combination with a tgf-beta inhibitor |
| CN101340927A (zh) * | 2005-10-24 | 2009-01-07 | 西玛生物医学信息公司 | TGF-β1抑制性多肽在制备免疫反应调节剂上的用途 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5215520A (en) * | 1991-09-17 | 1993-06-01 | Centre Internationale De Recherches Dermatologiques Galderma (C.I.R.D. Galderma) | Method for delivering an active substance topically or percutaneously |
| US6132739A (en) * | 1998-09-01 | 2000-10-17 | Amway Corporation | Makeup compositions and methods of making same |
| ES2146552B1 (es) * | 1998-11-24 | 2001-04-16 | Inst Cientifico Tecnol Navarra | Peptidos inhibidores de tgf/31 |
| ES2371026T3 (es) * | 2001-10-19 | 2011-12-26 | Atritech, Inc. | Dispositivo de oclusión ajustable en la orejuela auricular izquierda. |
| AU2002346613A1 (en) | 2001-12-03 | 2003-06-17 | Michael Bowen | Polynucleotides and polypeptides associated with the development of rheumatoid arthritis |
| ITRM20020119A1 (it) * | 2002-03-05 | 2003-09-05 | Geymonat Spa | Composizioni contenenti plgf ad uso farmaceutico e cosmetico. |
| US7279503B1 (en) * | 2004-11-02 | 2007-10-09 | Siltech Llc | Water in oil emulsions |
| WO2008140594A2 (en) * | 2006-12-01 | 2008-11-20 | Anterios, Inc. | Peptide nanoparticles and uses therefor |
-
2010
- 2010-02-04 CA CA2750559A patent/CA2750559A1/en not_active Abandoned
- 2010-02-04 BR BRPI1008815-6A patent/BRPI1008815A2/pt not_active IP Right Cessation
- 2010-02-04 EP EP10708231A patent/EP2394666A2/en not_active Withdrawn
- 2010-02-04 AU AU2010210033A patent/AU2010210033A1/en not_active Abandoned
- 2010-02-04 JP JP2011548731A patent/JP2012516879A/ja active Pending
- 2010-02-04 RU RU2011136694/15A patent/RU2011136694A/ru not_active Application Discontinuation
- 2010-02-04 MX MX2011008261A patent/MX2011008261A/es not_active Application Discontinuation
- 2010-02-04 CN CN2010800067872A patent/CN102307598A/zh active Pending
- 2010-02-04 US US13/147,145 patent/US20110294734A1/en not_active Abandoned
- 2010-02-04 WO PCT/ES2010/070062 patent/WO2010089443A2/es active Application Filing
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5730969A (en) * | 1988-10-05 | 1998-03-24 | Chiron Corporation | Method and compositions for solubilization and stabilization of polypeptides, especially proteins |
| CN1839149A (zh) * | 2003-08-22 | 2006-09-27 | 西玛生物医学信息公司 | 能够结合转化生长因子β1(TGF-β1)的肽 |
| CN101340927A (zh) * | 2005-10-24 | 2009-01-07 | 西玛生物医学信息公司 | TGF-β1抑制性多肽在制备免疫反应调节剂上的用途 |
| US20070207965A1 (en) * | 2006-03-01 | 2007-09-06 | Digna Biotech, S.L. | Method for the treatment of skin fibrosis and suitable compositions for such treatment |
| WO2008003685A1 (de) * | 2006-07-06 | 2008-01-10 | Henkel Ag & Co. Kgaa | O/w-emulsion |
| WO2008013928A2 (en) * | 2006-07-28 | 2008-01-31 | Biogen Idec Ma Inc. | Treatment of cancer with interferon gene delivery in combination with a tgf-beta inhibitor |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110483648A (zh) * | 2019-08-27 | 2019-11-22 | 南京安吉生物科技有限公司 | 一种融合多肽及其应用 |
| WO2021037290A3 (zh) * | 2019-08-27 | 2021-04-15 | 南京安吉生物科技有限公司 | 一种融合多肽及其应用 |
| GB2600594A (en) * | 2019-08-27 | 2022-05-04 | Nanjing Anji Biological Tech Co Ltd | Fused polypeptide and use thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2012516879A (ja) | 2012-07-26 |
| BRPI1008815A2 (pt) | 2018-02-14 |
| RU2011136694A (ru) | 2013-03-10 |
| MX2011008261A (es) | 2011-09-01 |
| WO2010089443A3 (es) | 2010-10-21 |
| EP2394666A2 (en) | 2011-12-14 |
| CA2750559A1 (en) | 2010-08-12 |
| AU2010210033A1 (en) | 2011-08-04 |
| US20110294734A1 (en) | 2011-12-01 |
| WO2010089443A2 (es) | 2010-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102307598A (zh) | TGF-β1抑制肽的药物制剂 | |
| EP3155008B1 (en) | Formulated receptor polypeptides and related methods | |
| Tolcher et al. | A phase I, first in human study of FP-1039 (GSK3052230), a novel FGF ligand trap, in patients with advanced solid tumors | |
| Shi et al. | Elastin-based protein polymer nanoparticles carrying drug at both corona and core suppress tumor growth in vivo | |
| Aroui et al. | Cytotoxicity, intracellular distribution and uptake of doxorubicin and doxorubicin coupled to cell-penetrating peptides in different cell lines: a comparative study | |
| Johnson et al. | The high Km glucose transporter of islets of Langerhans is functionally similar to the low affinity transporter of liver and has an identical primary sequence. | |
| Lee et al. | Plasma membrane calcium-ATPase 2 and 4 in human breast cancer cell lines | |
| Vanderburgh et al. | Systemic delivery of a Gli inhibitor via polymeric nanocarriers inhibits tumor-induced bone disease | |
| Dhandhukia et al. | Bifunctional elastin-like polypeptide nanoparticles bind rapamycin and integrins and suppress tumor growth in vivo | |
| Ju et al. | Overcoming Mfsd2a‐mediated low transcytosis to boost nanoparticle delivery to brain for chemotherapy of brain metastases | |
| Grabellus et al. | ETV6–NTRK3 gene fusion in a secretory carcinoma of the breast of a male-to-female transsexual | |
| Tan et al. | Cabazitaxel-loaded human serum albumin nanoparticles combined with TGFβ-1 siRNA lipid nanoparticles for the treatment of paclitaxel-resistant non-small cell lung cancer | |
| TW201733618A (zh) | 含有抗人類tslp受體抗體之醫藥組成物 | |
| Li et al. | Secreted phosphoprotein 24 kD (Spp24) inhibits growth of human pancreatic cancer cells caused by BMP-2 | |
| Dhandhukia et al. | Berunda polypeptides: multi-headed fusion proteins promote subcutaneous administration of rapamycin to breast cancer in vivo | |
| Wang et al. | Immunomodulatory and enhanced antitumor activity of a modified thymosin α1 in melanoma and lung cancer | |
| Knudsen et al. | Design of cyclic RKKH peptide-conjugated PEG liposomes targeting the integrin α2β1 receptor | |
| EP2968209B1 (en) | Metadichol r liquid and gel nanoparticle formulations | |
| JP2019196389A (ja) | 転移を阻害し、線維症を処置し、かつ創傷の治癒を向上させる方法および組成物 | |
| EP3060256A1 (en) | A novel stable formulation | |
| Wu et al. | A pluripotential neutrophil-mimic nanovehicle modulates immune microenvironment with targeted drug delivery for augmented antitumor chemotherapy | |
| Simón-Gracia et al. | Preclinical Validation of Tumor-Penetrating and Interfering Peptides against Chronic Lymphocytic Leukemia | |
| CN107226844B (zh) | 增强整合素受体亲和力及靶细胞摄取能力的结构分子及其应用 | |
| Liu et al. | Nano-engineered lymphocytes for alleviating suppressive tumor immune microenvironment | |
| Fan et al. | Somatostatin receptor2 (SSTR2) expression, prognostic implications, modifications and potential therapeutic strategies associates with head and neck squamous cell carcinomas |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned |
Effective date of abandoning: 20120104 |
|
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |