CN101918004A - 克拉维酸的药物制剂 - Google Patents
克拉维酸的药物制剂 Download PDFInfo
- Publication number
- CN101918004A CN101918004A CN2008801224638A CN200880122463A CN101918004A CN 101918004 A CN101918004 A CN 101918004A CN 2008801224638 A CN2008801224638 A CN 2008801224638A CN 200880122463 A CN200880122463 A CN 200880122463A CN 101918004 A CN101918004 A CN 101918004A
- Authority
- CN
- China
- Prior art keywords
- clavulanic acid
- acid class
- class material
- pharmaceutical composition
- clavulanate potassium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/424—Oxazoles condensed with heterocyclic ring systems, e.g. clavulanic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1682—Processes
- A61K9/1694—Processes resulting in granules or microspheres of the matrix type containing more than 5% of excipient
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
本发明总体上涉及稳定的药物组合物,以及制备和给予这种组合物的方法。在一个方面,本发明以稳定化的药物组合物为特征,这种药物组合物包含药物活性成分,如克拉维酸钾或ClavitesseTM,优选以立即释放的固体剂型或缓释固体剂型。本发明还提供了制备和使用这种立即释放的稳定化组合物或缓释的稳定化组合物的方法。
Description
技术领域
本发明涉及含有克拉维酸、药用的克拉维酸盐、盐组合物和衍生物的固体口服剂型。具体而言,本发明提供适用于日常使用并实现治疗水平的克拉维酸类物质(clavulanate)的克拉维酸钾的立即释放组合物和缓释组合物。本发明还涉及其制备方法并涉及其作为药物,例如,治疗焦虑症、抑郁症、性功能障碍和神经性障碍的用途。
背景技术
克拉维酸的名称来源于产生克拉维酸的棒状链霉菌(Streptomyces clavuligerus)微生物。克拉维酸是由氨基酸精氨酸和糖甘油醛3-磷酸酯生物合成产生的。
克拉维酸具有可以忽略的内在抗微生物活性,尽管具有β-内酰胺抗菌素的特征性的β-内酰胺环。然而,化学结构上的类似性容许该分子起到由某些细菌分泌的β-内酰胺酶的竞争抑制剂而赋予β-内酰胺抗生素抗性。当与一些β-内酰胺抗生素如替卡西林或阿莫西林组合给予时,克拉维酸能够拓展抗菌谱并增强抗生活性(AHFS,1991)。这种协同作用活性是可能的,因为克拉维酸起到了天然降解和惰性化β-内酰胺抗生素的细菌β-内酰胺酶不可逆竞争性抑制剂的作用(Brown et al.,J Antibiot(Tokyo).1976,29:668-669;Readingand Cole,Antimicrob Agents Chemother.1977,11:852-857)。
克拉维酸在美国仅仅以与其它药物固定组合才可以商购获得。例如,常见处方药物就是克拉维酸和替卡西林的组合产品,通常以200-300mg/kg/天的剂量(基于替卡西林含量)静脉注射给药,这对应于卡拉维酸大约7-10mg/kg/天的剂量(AHFS,1991)。在这个剂量范围给予克拉维酸,还没有见到不良反应或禁忌症的报道(Koyu et al.,Jpn J Antibiot.1986,39:2831-2862;Yamabe et al.,Chemioterapia.1987,6:337-40)。沃格孟 (阿莫克拉),这种克拉维酸和阿莫西林的组合产品,已经显示出针对抗阿莫西林的产生β-内酰胺酶的菌株的效能。呼吸道、尿路、腹部和牙科感染以及蜂窝织炎和动物叮咬的标准成年剂量是阿莫克拉250/125(250mg的阿莫西林/125mg的克拉维酸)每8h服用,这可以在严重感染的情况下加倍。在美国,沃格孟汀XR(阿莫克拉1000/62.5)在社会上市售用于获得性肺炎的是每日两次,每次服用两片。
除了其对β-内酰胺酶的抑制作用之外,克拉维酸已经显示出神经保护作用以及在治疗焦虑症和性功能障碍方面的效能。Koppel等在美国专利6,489,319;6,610,681;和6,627,625中描述了克拉维酸自身在腹腔注射给药小于1mg/kg时具有抗焦虑药活性。在美国专利6,426,342中,Koppel描述了当用克拉维酸1μg/kg的腹腔注射剂量处理大鼠时,克拉维酸具有强效神经保护活性。Koppel在美国专利7,166,626中还公开了给予克拉维酸治疗性功能障碍的方法。美国专利6,489,319报道了以10ng至10μg/kg的剂量克拉维酸能够改变CNS活性和行为。因此,克拉维酸的独特神经活性特性曲线提供了这种化合物与独特神经靶组织相互作用的强有力的证据。Rothstein等也证实,几种β-内酰胺抗生素能够通过活化谷氨酸神经递质转运器的基因而能够提供神经保护作用(Nature,2005,433:73-77)。自从在1928年首次发现青霉素以来,β-内酰胺抗生素已经成为最广泛使用的抗生素,但是在标准抗菌剂量下还没有显示出显著毒性的CNS作用。因此,β-内酰胺抗生素可以作为治疗CNS有关疾病的新的安全的治疗性药物进行使用。
含有克拉维酸及其衍生物或盐(统称为克拉维酸类物)的许多干制剂的制备要求包含赋形剂的复杂制剂,包括粘结剂、助流剂、崩解剂和甚至还有干燥剂等而获得药用载体。这部分是因为这个事实,即克拉维酸类物是高度吸湿性的物质,在含水介质中是高度不稳定的。制备的方法因此必须确保产品能够在其储存期间保持其效能,而也能够随后产生满意的溶解速率。这样的一种方法公开于WO 92/19227中并要求同时包含胞内和胞外崩解剂。另一描述于美国专利4,537,887中的方法特别强调在组合物自身中包含可食用的干燥剂。其它方法证实要确保在盛装阿莫西林/克拉维酸类物组合制剂的容器中包含干燥剂。在这方面,美国专利4,301,149和4,441,609尤为突出。
克拉维酸钾比游离酸和最低吸湿性的药用克拉维酸盐更稳定,因此其最常用于商业性制剂。然而,克拉维酸钾仍然是极度吸湿性并易于水解而使阿莫西林/克拉维酸类物共制剂易于在储存甚至在低湿度条件时发生降解。阿莫西林结晶中存在水,可以有助于这种剂型的不稳定性,一旦开始任何降解作用就加速克拉维酸类物质的分解。
发明内容
克拉维酸类物质(clavulanate)因为其湿热敏感性是异常难以配制的物质。仍需要开发单独克拉维酸类物质的稳定制剂,尤其是低剂量如10μg至10mg,例如约0.1mg至约5mg,这种剂量是口服活性的并可以用于焦虑症、抑郁症、神经保护、性功能障碍等。
本发明是一种含有克拉维酸类物质的稳定口服剂量组合物,包括立即释放组合物和缓释组合物,由克拉维酸或其衍生物或盐,例如克拉维酸钾或ClavitesseTM制备,适合日常使用。
本发明通过开发新型口服克拉维酸类物质的药物组合物和方法而克服和缓解了以上提及的缺陷和缺点。一般而言,本发明涉及稳定化固体药物组合物,而具体而言是立即释放或缓释的包含克拉维酸类物质作为药物活性成分的稳定化药物组合物。该新型药物组合物能够以固体剂型如片剂、胶囊、丸剂、锭剂或粉末提供。这种固体药物组合物能够在一种或多种药用赋形剂存在下包含克拉维酸类物质,其中克拉维酸类物质的存在量为约10μg至约10mg或,例如,约0.1mg至约5mg。这种组合物一旦给予能够提供治疗有用量的克拉维酸类物质。克拉维酸类物质的实例包括克拉维酸、克拉维酸衍生物及其克拉维酸药用盐。克拉维酸类物质能够存在的量为组合物重量的约0.01%至约10%。在一些实施方式中,组合物的水分含量低于总重量的约4%。这种制剂是片剂、胶囊、丸剂、锭剂或粉末的形式。根据本发明示例性的固体药物组合物在25℃和60%相对湿度下或在30℃和65%相对湿度下储存3个月之后能够具有的水分含量低于10%。
在示例性的组合物中,克拉维酸类物质是克拉维酸钾。克拉维酸钾能够作为,例如,粉末或作为与二氧化硅或微晶纤维素的1∶1混合物提供。示例性组合物是立即释放组合物,其在给药之后大约5至大约30min内从药片中释放出超过80%的克拉维酸类物质。在示例性实施方式中,这种组合物通过其中将克拉维酸钾在一种或多种药用赋形剂存在下冻干的方法进行制备。在立即释放组合物的一个实例中,该组合物能够含有约10wt%至约20wt%的粘结剂或稀释剂,约45wt%至约55wt%的填充剂,约20wt%至约40wt%的崩解剂和约3wt%至约6wt%的润滑剂。在这种实施方式中,示例性粘结剂或稀释剂是Maltrin M 150,示例性填充剂是Prosolve SMCC 50,示例性崩解剂是Pharmaburst和/或L HPC LH-11和/或Acdisol,而示例性润滑剂是硬脂酸。
在其它示例性实施方式中,这种组合物通过其中将克拉维酸钾以1∶1与二氧化硅或微晶纤维素的混合物在一种或多种药用赋形剂存在下冻干的方法进行制备。在立即释放组合物的另一实例中,药物组合物能够含有约50%-60%的填充剂,约20%-30%的崩解剂,约0.5%-5%的流动增强剂/防潮剂和/或约3%-6%的润滑剂。在这种实施方式中,示例性填充剂是Prosolve SMCC 50,示例性崩解剂是Pharmaburst和/或Acidisol,示例性流动增强剂/防潮剂是Carbosil,而示例性润滑剂是硬脂酸镁。
在另一实施方式中,药物组合物是缓释组合物,其释放克拉维酸钾至少约4h。缓释组合物能够通过在一种或多种药用赋形剂存在下冻干克拉维酸钾粉末或克拉维酸钾与微晶纤维素的1∶1混合物而进行制备。示例性赋形剂能够包含一种或多种基质、填充剂、助流剂和润滑剂。在缓释组合物的一个实例中,这种组合物能够含有约20wt%至约40wt%基质,约50wt%至约75wt%填充剂,约0.1wt%至约1wt%助流剂和约1wt%至约2wt%润滑剂。在这种实施方式中,示例性基质是Klucel LF和/或Methocel KlOOLV Prem-M CR,Eudragit RS PO粉末,或其混合物;示例性填充剂是无水乳糖,AvicelPH-1 12,Avicel PH-113,Isomalt,或其混合物;示例性助流剂是Carbosil,而示例性润滑剂是硬脂酸镁和滑石中的至少一种。
在其它实施方式中,固体药物剂型通过以下进行制备:提供克拉维酸类物质如克拉维酸、克拉维酸衍生物或克拉维酸的药用盐;将该克拉维酸类物质与至少一种赋形剂混合;将克拉维酸类物质和至少一种赋形剂的混合物造粒;和冻干克拉维酸类物质和至少一种赋形剂的造粒混合物。造粒步骤能够是例如湿法造粒。示例性的克拉维酸类物质是克拉维酸钾,例如以克拉维酸钾粉末或克拉维酸钾作为与二氧化硅或微晶纤维素的1∶1混合物的形式。在示例性方法中,赋形剂是粘结剂、稀释剂、填充剂、崩解剂、基质、填充剂、助流剂、流动增强剂、防潮剂和润滑剂中至少一种。该方法能够包括将所述剂型形成片剂或颗粒,并可选地用缓释聚合物对药片或颗粒涂覆。
本发明包括如以提供有效治疗障碍如性功能障碍(sexualdysfunction)和神经性障碍(neurological disorder)的克拉维酸类物质的量给予根据本发明的固体药物组合物的治疗。在一些实施方式中,使用了缓释组合物且障碍是焦虑症和抑郁症障碍。在其它实施方式中,使用了立即释放组合物且障碍是性功能障碍。
本发明的其它实施方式涉及适用于口服给药的克拉维酸类物质的立即和缓释制剂。
本发明的其它实施方式涉及用于制备药物制剂的冻干方法,其中冻干包括对水合药物组合物脱水的干燥工艺过程。
本发明其它实施方式涉及用于制备含有克拉维酸类物质的药物组合物的方法和其作为药物的用途。
附图说明
图1示出了克拉维酸类物质立即释放制剂,样品B(●)和C(○)的体外溶解特性曲线。
图2示出了克拉维酸类物质缓释制剂,样品F的体外溶解特性曲线。
图3示出了克拉维酸类物质缓释制剂,样品I的体外溶解特性曲线。
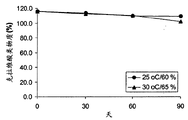
图4举例说明了样品D(5mg/片的克拉维酸钾与微晶纤维素1∶1混合物)在25℃/60%湿度(●)和30℃/65%湿度(▲)下的稳定性。
图5举例说明了样品E(5mg/片的克拉维酸钾与二氧化硅1∶1混合物)在25℃/60%湿度(●)和30℃/65%湿度(▲)下的稳定性。
图6举例说明了样品F(5mg/片的克拉维酸钾与微晶纤维素1∶1混合物)在2-8℃(o),25℃/60%湿度(●)和30℃/65%湿度(▲)下的稳定性。
图7举例说明了样品G(5mg/片)在2-8℃(○),25℃/60%湿度(●)和30℃/65%湿度(▲)下的稳定性。
具体实施方式
如本文中所用的,术语克拉维酸类物质包括克拉维酸(I)、药用的克拉维酸盐、盐组合物和衍生物,如酯。药用的克拉维酸盐的实例是克拉维酸钾。克拉维酸钾可以作为纯化合物或作为ClavitessTM,克拉维酸钾与微晶纤维素1∶1混合物或克拉维酸钾与二氧化硅1∶1混合物(可以从荷兰DSM Anti-Infectives B.V.获得)提供。
本文中所用的术语“口服给药”包括向主体递送任何形式的治疗药剂或其组合物,其中药剂或组合物放置于主体口内,无论药物或组合物吞咽与否。因此,“口服给药”包括口腔和舌下以及食道给药。药物吸收能够发生于包括嘴、食道、胃、十二指肠、回肠和结肠的消化道的任何一个或多个部位。
正如本文中所用治疗药剂或其组合物能够向其给药的“主体”包括任意性别和任何年龄的人类患者,而也包括任何非人类动物,尤其是家畜或宠物,举例而言有猫、狗或马。
术语“神经性(neurological)”是指与神经系统有关的病症、障碍和/或疾病。因此,任何影响神经系统(是中枢神经或外周神经)的部分或方面的病症、障碍和/或疾病是指作为神经性病症、障碍和/或疾病。正如本文中所用的术语“神经性”涵盖了术语“神经精神病的”或“神经精神病学”和“神经心理学的”或“神经心理学”。因此,神经性疾病、病症或障碍包括但不限于,认知障碍、情感障碍(例如,抑郁症和/或焦虑症)、运动障碍、精神障碍、疼痛障碍、睡眠障碍等。
本文中所使用的术语“赋形剂”是指任何物质,自身并非治疗药物,作为载体或媒介物用于向主体递送治疗药剂或加到药物组合物中改进其加工、处理、储存、崩解、分散、溶解、释放或器官感觉特性或容许或有利于组合物剂量单位配制成离散制品如适用于口服给药的胶囊或片剂。赋形剂能够包括,以举例说明而非限制性的方式,稀释剂、崩解剂、粘结剂、粘合剂、润湿剂、聚合物、润滑剂、助流剂、加入掩蔽或抵销不愉快的味道或气味的物质、调味剂、染料、芳香剂和加入改进组合物外观的物质。
因此,本发明涉及克拉维酸钾或ClavitesseTM适用于口服给药的立即释放或缓释制剂。本发明的制剂含有一定量的克拉维酸类物质快速释放制剂或克拉维酸类物质慢释(或缓释)制剂。本发明的立即释放制剂特征为克拉维酸类物质的快速释放,快速释放通过在给药之后大约5至大约30min获得克拉维酸类物质的最大释放表征。缓释制剂通过较缓慢地释放克拉维酸类物质例如至少4h的时间进行表征。在其它示例性实施方式中,这种缓释制剂能够释放克拉维酸类物质至少约6h或至少约8h。这些或其他实施方式能够在初始给药之后释放克拉维酸类物质至少3h,至少约4h,至少约5h,至少约6h,至少约7h,or至少约8h。在示例性实施方式中,本发明是含有立即释放或缓释制剂的片剂或胶囊,基于制剂中药物的总量而不是制剂的总重量,含有活性化合物的量为约10μg至10mg或活性化合物总重量的约0.01%至10%。
这种药物试剂作为片剂或胶囊口服给药具有优于非肠道给药如静脉给药或肌肉注射的某些优点。需要采用疼痛的可注射制剂治疗的疾病被认为是比那些能够用口服剂型治疗的病症更严重的病症。然而,采用口服制剂的主要优点在于其自我给药的适用性,而非肠道给药大多数情况下必须通过医师或医护人员进行给药。
各种药物的性质,例如,粒径分布、容积密度、可流动性、润湿行为、表面积和粘着性,都有很大的不同,而能够影响固体剂型如片剂的可加工性。克拉维酸类物是高度吸湿性的,而一旦接触水,就会从晶体状态变为无定形态,这表明稳定性很差。这些障碍组合到一起就使得标准的片剂生产加工过程变得极其困难,使得克拉维酸类物质制剂的储存产生很大问题,而导致含有克拉维酸类物质的制剂的储存和制备要求特殊条件。
克拉维酸钾,尽管属于最常见的易于处理的形式,仍属于异常难以配制的物质,是极端吸湿性的和水份敏感性的。在水和含水介质存在下易于发生降解。
因此,克服上述克拉维酸类物质性质问题的合适强效克拉维酸类物质制剂仍需要开发。克拉维酸类物质制剂所遇到的问题尤其具有挑战性的地方是在低剂量如10μg至10mg甚至发生小程度降解,也导致主体可利用的克拉维酸类物质的量显著变化。
本发明涉及克拉维酸类物质的稳定固体口服剂型的制备及其在治疗性功能障碍、抑郁症或焦虑症、或神经性障碍中的用途。根据本发明的固体口服剂型能够包含一般适用于固体口服剂型制备的添加剂或赋形剂。
也能够使用通常在片剂制剂中使用的片剂佐剂,而参考有关主题的广泛文献,参见具体Fiedler的″Lexicon der Hilfstoffe″,4thEdition,ECV Aulendorf 1996,其结合于本文中作为参考。这些包括但不限于,填充剂、粘结剂、崩解剂、润滑剂、助流剂、稳定剂、填充剂或稀释剂、表面活性剂、成膜剂、软化剂、颜料等。
填充剂包括淀粉,例如,土豆淀粉、小麦淀粉、玉米淀粉、羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素(HPMC)和微晶纤维素,例如,以注册商标AVICEL、FILTRAK、HEWETEN、ProsolveSMCC50或PHARMACEL可获得的产品。填充剂的其它实例包括乳糖、蔗糖、葡萄糖、甘露醇、山梨醇和碳酸钙。
粘结剂包括淀粉、蔗糖、纤维素或改性纤维素如羟丙基纤维素、乳糖、或糖醇如木糖醇、山梨醇或甘露醇。示例性粘结剂有麦芽糖糊精(Maltrin M 150)。
作为崩解剂能够提及的是羧甲基纤维素钙(CMC-Ca)、羧甲基纤维素钠(CMC-Na)、交联PVP(例如CROSPOVIDONE,POLYPLASDONE或KOLLIDON XL)、海藻酸、海藻酸钠和瓜尔胶。交联的PVP(CROSPOVIDONE)、交联的CMC(Ac-Di-SoI)、羧甲基淀粉-Na(PIRIMOJEL和EXPLOTAB)、Pharmaburst和羟丙基纤维素(L HPC LH-11)都是示例性崩解剂。
基质能够包括,例如,Methocel K100 Prem-M或Eudragit RS PO粉末。
助流剂的实例包括胶态硅石(colloidal silica),如胶态二氧化硅(colloidal silicon dioxide),例如,气相法二氧化硅(Cabosil,Aerosil),三硅酸镁(Mg),粉末化纤维素,淀粉,滑石和磷酸三钙或这些与填充剂或粘结剂的组合,例如硅酸化微晶纤维素(PROSOLV)。Cabosil(胶态氧化硅)也能起到流动增强剂/水分保护剂(防潮剂)的作用。
而且,填充剂或稀释剂能够包括糖果厂商的糖、可压缩糖、葡萄糖结合剂(dextrates)、糊精、右旋糖、乳糖、甘露醇、微晶纤维素,例如密度为约0.45g/cm3微晶纤维素,如AVICEL,粉末化纤维素、山梨醇、蔗糖和滑石。
润滑剂包括硬脂酸和其盐,例如硬脂酸镁,硬脂酸铝和硬脂酸钙,PEG4000~PEG8000,滑石,氢化蓖麻油,甘油酯,Na-硬脂基富马酸盐,氢化棉籽油等。常见的润滑剂是硬脂酸和硬脂酸镁。
片剂和胶囊能够另外采用肠包衣和其它轻度保护和可吞咽性目的的受控释放包衣进行制备。肠包衣的实例可以包括由以下制备的化合物,例如,甲基丙烯酸共聚物、纤维素乙酸酯(及其琥珀酸酯和邻苯二甲酸酯形式)、苯乙烯马来酸共聚物、聚甲基丙烯酸/丙烯酸共聚物、羟丙基甲基纤维素邻苯二甲酸酯、聚乙烯乙酸酯邻苯二甲酸酯、羟乙基乙基纤维素邻苯二甲酸酯、羟丙基甲基纤维素乙酸酯琥珀酸酯(hydroxypropyl methyl cellulose acetate succinate)、纤维素乙酸酯四氢邻苯二甲酸酯(cellulose acetate tetrahydrophtalate)、丙烯酸树脂、偏苯三甲酸酯(timellitate)和虫胶。肠包衣示例性的聚合物包括甲基丙烯酸共聚物如Eudragit。其它肠包衣的合适聚合物在本领域内是已知的。这些包衣可以采用药用染料着色。在包衣液体中的染料和其它赋形剂的含量可以进行变化而将不会影响立即释放或缓释片剂的性能。包衣液体一般含有成膜聚合物,如羟丙基纤维素、羟丙基甲基纤维素、纤维素酯或醚、丙烯酸聚合物或聚合物的混合物。包衣溶液一般是进一步含有丙二醇、山梨糖醇单油酸酯、山梨酸、填充剂如二氧化钛、药用染料的水溶液。
根据本发明的固体口服剂型含有作为活性剂的治疗有效剂量的克拉维酸类物质和作为添加剂的填充剂。其它添加剂能够包括但不限于,粘结剂、崩解剂、润滑剂、助流剂、稳定剂、稀释剂、表面活性剂、成膜剂、颜料、软化剂和防粘剂等。
克拉维酸钾既是吸湿性的又是通过水易于水解的,因此对于处理和长期储存克拉维酸钾,一般而言有必要对直接环境保持极度干燥。这在过去是通过向组合物中加入可食用二氧化硅或通过在密封容器中在干燥剂存在下储存组合物而实现的。
克拉维酸钾当暴露于约35%相对湿度96h时具有相对低的水分含量(基于干重<1%),如表7中所示。然而,看起来在任何湿度超过40%的相对湿度时实际上都会发生潮解。当暴露于50%的相对湿度时,干克拉维酸钾吸收水分以大约1.44%/h的速率发生。
我们已经发现,在制备含有克拉维酸类物质的药物组合物期间采用冻干(lyophilization),或冷冻干燥(freeze drying),将克拉维酸类物质片剂的稳定性提高至约97%(参见表8)。
根据本发明,稳定的药物组合物能够进行制备而包含作为药物活性成分(API)的克拉维酸类物质剂量范围为约10μg至10mg,例如,约0.1mg至约5mg。在示例性实施方式中,克拉维酸类物质是克拉维酸盐,例如克拉维酸钾。据报道,10ng至10μg/kg剂量范围的克拉维酸能够改变CNS活性和行为(参见美国专利6,489,319)。治疗性功能障碍的方法也包括以10ng至10μg/kg剂量给予克拉维酸(参见美国专利7,166,626)。
根据本发明,各种剂型的克拉维酸类物质能够进行制备,包括立即释放和缓释剂型,其含有约10μg至约10mg克拉维酸类物质,例如约0.1mg至约5mg克拉维酸类物质。这种剂型能够用于治疗性功能障碍,焦虑障碍及其症状(symptomst)。具体而言,在本发明中立即释放形式能够用于治疗性功能障碍及其症状。本发明的缓释制剂能够用于治疗焦虑症、抑郁症及其症状。
立即释放形式按需要可以按照本文公开的标准分析方法测定在低于约30min内提供至少约80%(w/v)的克拉维酸类物质溶解。根据本发明实施方式的立即释放药物组合物能够迅速地溶解于合适水溶液(例如水、盐水、液汁)或胶体状悬浮液(例如,婴儿配方或牛奶)中以方便向不能处理固体制剂形式的患者给药。这种患者的实例有婴儿、幼儿和或许经受吞咽困难的成年人。因此,而在一个实施方式中,本发明特征为包含克拉维酸类物质如克拉维酸的盐的立即释放药物组合物。在示例性实施方式中,从组合物放置于水溶液中的时间开始约15min,至少约80%的克拉维酸类物质就溶解于水溶液中。在其它实施方式中,在将组合物暴露于水溶液之后约30min,或约15min,至少约90%的克拉维酸类物质释放到水溶液中。如图1所示,根据本发明的示例性立即释放组合物在暴露于水溶液之后约15min内,释放90%的克拉维酸类物质。
缓释组合物能够长时间(例如约8h或约10h)释放活性成分,即克拉维酸类物质。缓释制剂能够从制剂一到达消化道开始释放活性成分并继续以大约恒定的方式缓慢溶解和释放活性成分。这种特性曲线是所需的,因为这在给药之后在血流中提供较稳定的浓度的活性成分。如图2中所示,根据本发明的示例性缓释组合物在暴露于水溶液之后能够提供高达约8至10小时的克拉维酸类物基本水平的释放。
根据本发明实施方式的药物组合物提供了重要用途和优点。本发明的一个优点是组合物中活性成分的稳定性。水含量的控制在含克拉维酸类物质的组合物的配制和储存中是关键问题,因为克拉维酸类物是高度吸湿性的且不稳定或在水中水解。根据本发明,采用冻干方法制备稳定化的立即释放或缓释组合物,提供了出人意料的稳定增强,尤其是当克拉维酸类物质在冻干之前组合赋形剂,更是如此。
根据本发明的实施方式,克拉维酸类物质的冻干组合物能够使用包括:(1)通过将克拉维酸类物质与至少一种赋形剂混合而形成克拉维酸类物质组合物;(2)在0℃或低于0℃冷冻一定量的克拉维酸类物组合物,例如克拉维酸类物,直至转化成冷冻的固体;和(3)在气密性容器中对克拉维酸类物质组合物脱水。脱水(冻干)的组合物(包括药物),以粉末化形式,能够与其他赋形剂混合之后压制成片剂或制备成一定粒度的颗粒。
最终干制剂的水分含量低。本文中陈列的各个实施方式将具有的最终水分含量不超过约10%(按重量计),不超过约5%,或不超过约4%,或甚至更低。根据本发明的这些实施方式的干制剂在诸如25℃和60%相对湿度或30℃和65%相对湿度的条件下对于长期储存是高度储存稳定的,如例如约30天,约60天或约90天是稳定的。一旦用合适的液体稀释,它们就是以其基本上所述初始剂量的全效(fully potent)。
在本发明的一些实施方式中,制剂通过以下制备:干混聚合物,例如基质,如Eudragit(甲基丙烯酸和丙烯酸乙酯的阴离子共聚物),粘结剂/稀释剂如Maltrin M50和/或崩解剂如Pharmaburst,填充剂,克拉维酸类物,和其它赋形剂(参见实例),接着采用水对混合物造粒而直至获得合适的颗粒物。造粒操作通过本领域已知的方法完成。湿颗粒在冻干机中冻干,过筛并碾磨成合适的尺寸。润滑剂能够与干燥的颗粒物混合而获得成品制剂。由于克拉维酸类物是吸湿性的而在水中是不稳定的,最小化混合物是湿润的时间是必要的,例如由称重和造粒至冻干的加工时间可以为约1h。
本发明的组合物能够以片剂或胶囊口服给药。片剂能够通过本领域内已知的技术制备,并含有治疗有效量的克拉维酸类物和这些必需的赋形剂而通过这种技术形成片剂。安慰剂颗粒也能够不使用克拉维酸类物质但是使用相同组成而进行制备。
药代动力学研究
对于本发明制剂的生物利用度研究通过向健康对象给予立即释放或缓释制剂的片剂并在24h内以不同时间间隔测定血浆中克拉维酸类物质的水平(浓度)。血浆样品通过BAS分析(West Lafayette,Ind)采用类似于文献中描述的验证了的高效液相色谱方法对克拉维酸类物质进行分析。参见,例如,Chu S-Y,et al.,″Simultaneousdetermination of clarithromycin and 14(R)-hydroxyclarithromycin inplasma and urine using high performance liquid chromatography withelectrochemical detection″,J.Chromatography,571,pp 199-208(1991)。
实施例
以下实施例仅仅出于举例说明目的而并非用来限制附加权利要求的范围。
实施例1:克拉维酸类物质片剂的制备
实施例1A-采用克拉维酸钾粉末制备立即释放克拉维酸类物质的片剂
片剂制备工艺方法的示例性描述:湿法造粒片剂制剂工艺方法已经发现,其中水包含在造粒步骤内,接着通过干燥而获得低水分含量(<3%)的颗粒。干燥的制剂相比于现有技术的制剂是非吸湿性的,但是维持了由其制备片剂的等价物理特性(例如,溶解性,崩解性,生物利用度和其它物理性质)。片剂制备通过用水在粘结剂/稀释剂存在下对克拉维酸类物质造粒而实施。
对于样品C的制备,将Maltrin M150(130g)溶解于纯水中并加入克拉维酸钾(API;59.5g)。Prosolve SMCC-50(490.5g),Pharmaburst(130.0g),L HPC LH-11(120.0g),Acdisol(20.0g)和硬脂酸(50g)称重并在袋中通过振荡和旋转袋子而进行混合。混合物转移至Hobart混合机的转筒中,向混合物中加入API/Maltrin M150溶液并搅拌10min。在完成湿块化之后,Hobart混合机的转筒内容物转移到挤出机中并挤出。挤出物置于搓圆机(spheronizer)中并在袋中收集搓圆的物质而在gortex-lyoguard浅盘中冻干。干燥的物质筛分并压制成片剂或制成一定尺寸的颗粒(sized bead)。样品A和B按照样品C相同的方法进行制备。
实施例1B-采用Clavitesse TM 制备立即释放克拉维酸类物质的片剂
对于样品D的制备,ClavitesseTM(API;50.6g),Prosolve SMCC50(213.4g),Pharmaburst(100.0g),Acdisol(8.0g),Cabosil(8.0g)和硬脂酸镁(20.0g)称重并在gortex-lyoguard浅盘中于2-8℃下冻干过夜。在第二天,在袋中混合API,Prosolve SMCC 50,Pharmaburst和Acdisol,通过#40目过筛,转入到V型混合器中混合7min。混合物再次过筛并在V型混合器中混合4min。Cabosil和硬脂酸镁过筛并在V型混合机中与含有API的混合物混合4min。掺混物在gortex-lyoguard浅盘中冻干过夜。物料压制成片剂,并将片剂在gortex-lyoguard浅盘中冻干并包装。样品E按照样品D相同的方式进行制备。
实施例1C-用Clavitesse TM 制备缓释克拉维酸类物质的片剂
对于样品F的制备,适量Clavitesse(API;41.07g),MethocellK100LV Prem CR(90.0g),Isomalt(83.55g),Avicel PH-112(80.04g),Cabosil(1.5g),滑石(2.4g)和硬脂酸镁(1.5g)称重并施加到gortex-lyoguard浅盘中于2-8℃下在冻干机中过夜干燥。每一成分过筛并在独立的袋中收集。API和Methocel K100LV Prem CR装入V型混合机中,混合,通过合适的筛子过筛并继续混合。Avicel PH-112和Isomalt加入到混合物中并混合。所得的混合物过筛而再次混合。将Cabosil和滑石混合并加入到混合物中进行混合。硬脂酸镁在V型混合机中与混合物混合。最后的掺混物在gortex-lyoguard浅盘中冻干过夜并压制成片剂或制备成一定尺寸颗粒。药片压制至更高硬度进行缓释包衣。药片或颗粒采用缓释聚合物,Eudragit包衣。
实施例1D-采用克拉维酸钾粉末制备缓释克拉维酸类物质的片剂
对于采用克拉维酸钾的缓释片剂,样品G的制备,克拉维酸钾(API;20.69g)通过#60目筛子过筛,而其它赋形剂,Methocel K100LVPrem CR(90.02g),Isomalt(83.56g),Avicel PH-112(100.41g),Cabosil(1.52g),滑石(2.4g)和硬脂酸镁(1.5g)通过#40目筛子过筛。每一成分在独立的袋中收集。API和Methocel K100LV Prem CR装入V型混合机中,混合5min。混合物过筛并再混合另外5min。AvicelPH-112和Isomalt加入到混合物中而在V型混合机中混合5min。所得的混合物过筛而再混合5min。将Cabosil和滑石混合后加入到混合物中并随后混合所得混合物2min。最后,硬脂酸镁在V型混合机中与混合物混合3min而最后的掺混物在gortex-lyoguard浅盘中冻干过夜并随后压制成片剂或制备成一定尺寸的颗粒。药片压制至更高硬度用于缓释包衣。药片或颗粒采用缓释聚合物,Eudragit包衣。样品H和I以与样品G相同的方式进行制备。
实施例2:克拉维酸类物质的分析
制备的药物组合物的克拉维酸类物质的含量通过Waters HPLC(高效液相色谱)系统(柱子:μBondapack-NH2(10μm)300mm×3.9mm,流动相:CH3CN∶pH 5.2KH2PO4=65∶35,流速:1.0ml/min)采用以下步骤进行测定:将约10个药片精确称重并碾碎,加入100mL水并将混合物超声破碎20min。在用水稀释之后,部分溶液过滤并注射到HPLC中。主峰通过对应于HPLC标准制剂的色谱图的样品保留时间确定。克拉维酸类物质的%基于分析物响应因子相对于参照标准的响应因子进行计算。
克拉维酸类物质标准曲线的线性度以标称浓度0.01mg/mL的参照标准在25%,50%,75%,100%,125%,150%进行检验。R2为0.9998。在标称浓度0.01mg/mL的克拉维酸类物质,采用6个样品检验精度,RSD百分数为1.4。精度通过一式三份制备和分析0.01mg/mL 50%,100%和150%的掺混安慰剂的掺混物来确定。
实施例3:示例性制剂和特性
以下实验描述了设计为立即释放(IR)片剂和缓释(ER)片剂的不同剂量的片剂制剂。以下片剂也表示根据本发明制剂的片剂物理性质。
实施例3A-采用克拉维酸钾的立即释放组合物
立即释放组合物由克拉维酸钾粉末和赋形剂如表1所示采用以上描述的方法进行制备。
表1
API*:活性药物成分。
表2总结了采用克拉维酸钾粉末的立即释放片剂的特性。样品C片剂显示出优异的稳定性,在2-8℃下1星期之后含有克拉维酸钾94.4%。
表2
实施例3B-采用Clavitesse
TM
的立即释放组合物
含有5mg克拉维酸类物质的立即释放组合物如表3中所示采用ClavitesseTM进行制备。
表3
API*:活性药物成分。
表4总结了采用ClavitesseTM的立即释放片剂的特性。
表4
实施例3C-采用Clavitesse
TM
和克拉维酸钾粉末的缓释组合物
如表5中所示采用ClavitesseTM或克拉维酸钾粉末制备缓释组合物。
表5
API*:活性药物成分。
表6总结了采用ClavitesseTM和克拉维酸钾粉末的特性。
表6
实施例4:体外溶解研究
将片剂置于500mL的溶剂(对于立即释放剂是去离子水;对于缓释片剂第一个2h是pH1.2的溶液而下一8h是pH7.0的柠檬酸盐缓冲液)中。混合物在100rpm下于37℃下涡旋振荡并定期收集样品而通过HPLC检测溶解的克拉维酸类物质的含量。
结果如图1~3所示。图1是显示样品B和样品C克拉维酸类物质的立即释放制剂的体外溶解特性曲线图。如图1所示,立即释放片剂在暴露于水溶液之后15min内溶解了90%或更多的克拉维酸类物质。图2是样品F克拉维酸类物质的缓释制剂的体外溶解特性曲线图。图3是样品I克拉维酸类物质的缓释制剂的体外溶解特性曲线图。如图2和图3所示,缓释片剂中克拉维酸类物质的总剂量经磨蚀和溶解机理缓慢释放了至少约8至10小时的一段时间。在缓释形式中的克拉维酸类物质的释放在pH1.2的溶液中并未检测到。
实施例5:稳定性测试
以其固体形式的克拉维酸钾在水蒸汽存在下既是吸湿性的又是不稳定的。克拉维酸类物质的稳定性研究采用通过色谱法监控而进行。通过在不同相对湿度的室内储存样品采用静态或平衡法而尽力产生吸收等温线。吸收等温线表示平衡水分含量和大气中相对湿度(RH)之间的定量关系。表7显示了克拉维酸钾粉末在暴露于不同湿度条件之后水分含量的变化。
表7
如表7中所示,克拉维酸钾当暴露于约35%或更低的相对湿度96h时具有相对较低的水分含量(基于干重<1%)。然而,看起来在超过40%的相对湿度的任何湿度潮解将会实际上发生。暴露于约50%相对湿度的干克拉维酸钾的水分吸收以大约1.44%/h的速率发生。
克拉维酸钾是异常难以配制的物质,是极度吸湿和热敏感性的。在水分和含水介质存在下易于发生降解。几种方法经过测试而发现了在湿法造粒之后去除水分而保持活性成分克拉维酸类完整性的合适条件。样品C中的物质通过湿法造粒和球粒化(spheronized)。含水分的球粒化制剂转移至浅盘中并经受不同储存条件除去水分。
正如在表8中的总结的,在30℃下储存69h(储存1),或在45℃下储存75h(储存2),结果克拉维酸钾分别发生降解高达45%和60%。流化床系统中干燥导致在仅仅1.5h内克拉维酸类物质降解13%。这些数据表明,克拉维酸钾也是温度敏感性的。在21h的冻干工艺方法之后冻干法处理保持了97%的活性成分。在表8中的结果表明,克拉维酸类物质的冻干法处理能够用于降低克拉维酸类物质制剂中的水分含量而提高制剂的稳定性。
表8
由ClavitesseTM制备的立即释放制剂,样品D和样品E的稳定性,进行高达3个月的评价。图4是显示样品D(5mg/片克拉维酸钾和微晶纤维素1∶1混合物)在25℃/60%相对湿度和30℃/65%相对湿度下稳定性的曲线图。图5是显示样品E(5mg/片克拉维酸钾和二氧化硅1∶1混合物)在25℃/60%相对湿度和30℃/65%相对湿度下稳定性的曲线图。如表4和图4和图5所示,根据样品D和样品E制备的片剂初始含有不到4%的水分,并在25℃/60%湿度对于克拉维酸类物质相对高湿度条件下降解低于7%。由ClavitesseTM制备的缓释片剂,样品F和G的稳定性进行高达2月的评价。图6是显示2-8℃(冻干)样品F(5mg/片克拉维酸钾和微晶纤维素1∶1混合物)在25℃/60%湿度和30℃/65%湿度下稳定性的曲线图。图7是显示2-8℃(冻干)样品G(5mg/片)在25℃/60%湿度和30℃/65%湿度下稳定性的曲线图。正如表5和图6和7中所示,根据样品F和G制备的片剂初始含有不到4%的水分而在30℃/65%湿度,对于克拉维酸类物质的相对高湿度条件下降解低于1.6%。因此,看起来在ClavitesseTM中的微晶纤维素或二氧化硅可以进一步有助于通过捕获片剂中的水分而提高克拉维酸钾的稳定性。
实施例6.药代动力学研究
通过LC/MS/MS方法测定比格犬血浆中克拉维酸类物质的含量。分析物的色谱分离在反向PLRP-S聚合物柱上进行。克拉维酸钾和他唑巴坦(对照化合物)的保留时间分别为8.51和8.54min。总色谱运行时间为25min。M/S分析在Applied Biosystems′API 2000三重四极杆质谱仪上通过以负电喷雾离子化模式多重反应监控而进行。质谱数据通过Analyst 1.4.1(Applied Biosystems)分析。药代动力学分析通过采用PK Solutions 2.0(Summit Research Services)进行。
实施例6A-在雄性比格犬中口服给予立即释放(IR)片剂
在整个研究中三只雄性比格犬用于交叉设计中,在治疗中采用清除期(washout period)。这些犬经由口服途径给予作为实施例3A的IR片剂的测试物质,在剂量给药之间采用不短于24h的清除期。这些动物在给药测试物质之前禁食过夜而在剂量给药之后4h进食。在整个治疗期间,血样(1.5mL)在剂量给药0、5、15、30min,1、1.5、2、2.5、3、4、6、9和12h之后从头静脉通过静脉穿刺抽入肝素化管中。血浆经由3,000rpm离心10min获得而通过LC-MS/MS系统进行分析。有关的平均药代动力学参数在表9中提供。
实施例6B-在雄性比格犬中静脉给予克拉维酸钾溶液
在整个研究中三只雄性比格犬用于交叉设计中,在治疗中采用清除期(washout period)。这些犬经由静脉注射途径给予作为水溶液的测试物质,在剂量给药之间采用不短于24h的清除期。这些动物在给药测试物质之前禁食过夜而在剂量给药之后4h进食。在整个治疗期间,血样(1.5mL)在剂量给药0、5、15、30min,1、1.5、2、2.5、3、4、6、9和12h之后从头静脉通过静脉穿刺抽入肝素化管中。血浆经由3,000rpm离心10min获得而通过LC-MS/MS系统进行分析。有关的平均药代动力学参数在表9中提供。
实施例6C-在雄性比格犬中口服给药缓释(ER)片剂
在整个研究中四只雄性比格犬用于交叉设计中,在治疗之间采用清除期。这些犬经口服途径给药作为实施例3C的ER片剂的测试物质,在剂量给药之间采用不短于24h的清除期。这些动物在给药测试物质之前禁食过夜而在剂量给药之后4h进食。在整个治疗期间,血样(1.5mL)在剂量给药1、2、3、4、5、6、7、8、9、10、11和12h之后从头静脉通过静脉穿刺抽入肝素化管中。血浆经由3,000rpm离心10min获得而通过LC-MS/MS系统进行分析。有关的平均药代动力学参数在表9中提供。
表9
*PK参数:T最大:最大浓度的时间,C最大:最大浓度,AUC:曲线下的面积,CL:清除率,Vd:分布容量,Vss:稳态下分布容量,t1/2:半衰期,MRTinf:平均保留时间,F:生物利用度
克拉维酸钾当口服给药时证明在禁食动物中吸收良好,平均生物利用度为30%~41%。表观最终半衰期为0.5h。
在本说明书中举例说明和讨论的实施方式用来仅仅教导本领域技术人员本发明已知的最佳方式而制备和使用本发明。在本说明书中没有任何内容应该认为是限制本发明的范围。所有出现的实施例是代表性的而非限制性的。以上描述的本发明实施方式可以进行修改或变化,而不会偏离本发明,这一点对于本领域技术人员根据以上的教导内容而应该理解。因此,应该理解到,在权利要求和其等同替换的范围内,本发明可以按照除了明确描述的内容另外进行实施。
Claims (24)
1.一种固体药物组合物,在一种或多种药用赋形剂存在下含有约10μg至约10mg的克拉维酸类物质;其中所述克拉维酸类物质选自由克拉维酸、克拉维酸衍生物或克拉维酸的药用盐组成的组。
2.根据权利要求1所述的药物组合物,含有按重量计约0.01%至约10%的所述克拉维酸类物质。
3.根据权利要求1所述的药物组合物,具有的水分含量低于所述药物组合物总重量的约4%。
4.根据权利要求1所述的药物组合物,其中所述克拉维酸类物质是克拉维酸钾。
5.根据权利要求4所述的药物组合物,其中所述克拉维酸钾作为粉末或作为与二氧化硅或微晶纤维素的1∶1混合物提供。
6.根据权利要求1所述的药物组合物,其中所述制剂是一种在给药之后大约30min内从片剂中释放超过80%的克拉维酸类物质的立即释放组合物。
7.根据权利要求6所述的药物组合物,进一步含有按重量计约10%至约20%的粘结剂或稀释剂,按重量计约45%至约55%的填充剂,按重量计约20%至约40%的崩解剂和按重量计约3%至约6%的润滑剂;其中所述克拉维酸钾作为粉末提供。
8.根据权利要求6所述的药物组合物,进一步含有约50%至约60%的填充剂,约20%至约30%的崩解剂,约0.5%至约5%的流动增强剂/防潮剂和/或约3%至约6%的润滑剂;其中所述克拉维酸钾作为与二氧化硅或微晶纤维素的1∶1混合物提供。
9.根据权利要求1所述的药物组合物,其中所述制剂是一种克拉维酸类物质释放至少约4h的缓释组合物。
10.根据权利要求9所述的药物组合物,其中所述克拉维酸类物质作为克拉维酸钾粉末或克拉维酸钾与微晶纤维素1∶1的混合物提供。
11.根据权利要求10所述的药物组合物,进一步含有按重量计约20%至约40%的基质,按重量计约50%至约75%的填充剂,按重量计约0.1%至约1%的助流剂和按重量计约1%至约2%的润滑剂。
12.根据权利要求1所述的药物组合物,其中所述制剂是片剂、胶囊、丸剂、锭剂或粉末的形式。
13.一种制备固体药物剂型的方法,包括以下步骤:
提供选自由克拉维酸、克拉维酸衍生物或克拉维酸的药用盐组成的组中的克拉维酸类物质;
将所述克拉维酸类物质与至少一种赋形剂混合;
将克拉维酸类物质和所述至少一种赋形剂的混合物造粒;以及
将克拉维酸类物质和所述至少一种赋形剂的所述造粒混合物冻干。
14.根据权利要求13所述的方法,其中所述造粒步骤包括湿法造粒。
15.根据权利要求13所述的方法,其中所述克拉维酸类物质是克拉维酸钾。
16.根据权利要求15所述的方法,其中所述克拉维酸钾是克拉维酸钾粉末或克拉维酸钾作为与二氧化硅或微晶纤维素的1∶1混合物。
17.根据权利要求13所述的方法,其中所述赋形剂选自由粘结剂、稀释剂、填充剂、崩解剂、基质、填充剂、助流剂、流动增强剂、防潮剂和润滑剂组成的组。
18.根据权利要求13所述的方法,进一步包括将所述剂型形成片剂或颗粒。
19.根据权利要求18所述的方法,进一步包括用缓释聚合物包覆所述片剂或颗粒。
20.一种固体药物组合物,通过以下步骤制备:
提供选自由克拉维酸、克拉维酸衍生物或克拉维酸的药用盐组成的组中的克拉维酸类物质;
将所述克拉维酸类物质与至少一种赋形剂混合;
将所述克拉维酸类物质和所述至少一种赋形剂的混合物造粒;以及
将克拉维酸类物质和所述至少一种赋形剂的造粒混合物冻干。
21.根据权利要求1所述的药物组合物,在25℃和60%的相对湿度或30℃和65%的相对湿度下储存之后,具有的水分含量低于10%。
22.一种治疗方法,包括给予权利要求1所述的药物组合物,所述药物组合物含有有效量的用于治疗选自性功能障碍和神经性障碍的障碍的克拉维酸类物质。
23.根据权利要求22所述的方法,其中所述组合物是一种缓释组合物且所述障碍是选自焦虑症和抑郁症的神经性障碍。
24.根据权利要求23所述的方法,其中所述组合物是一种立即释放组合物且所述障碍是性功能障碍。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US99607907P | 2007-10-26 | 2007-10-26 | |
| US60/996,079 | 2007-10-26 | ||
| PCT/US2008/012126 WO2009055038A1 (en) | 2007-10-26 | 2008-10-24 | Pharmaceutical formulation of clavulanic acid |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN101918004A true CN101918004A (zh) | 2010-12-15 |
Family
ID=40579869
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2008801224638A Pending CN101918004A (zh) | 2007-10-26 | 2008-10-24 | 克拉维酸的药物制剂 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20090270358A1 (zh) |
| EP (1) | EP2214680A4 (zh) |
| JP (1) | JP2011500811A (zh) |
| KR (1) | KR20100101574A (zh) |
| CN (1) | CN101918004A (zh) |
| AU (1) | AU2008317315A1 (zh) |
| BR (1) | BRPI0818702A2 (zh) |
| CA (1) | CA2703224A1 (zh) |
| IL (1) | IL205313A0 (zh) |
| MX (1) | MX2010004556A (zh) |
| WO (1) | WO2009055038A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102058584A (zh) * | 2010-12-30 | 2011-05-18 | 石药集团河北中润制药有限公司 | 克拉维酸钾/微晶纤维素组合物的制备方法 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7635773B2 (en) | 2008-04-28 | 2009-12-22 | Cydex Pharmaceuticals, Inc. | Sulfoalkyl ether cyclodextrin compositions |
| CA2758029A1 (en) * | 2009-04-29 | 2011-11-04 | Rexahn Pharmaceuticals, Inc. | Clavulanate formulation for neuroprotection and treatment of neurodegenerative disorders |
| KR101628095B1 (ko) | 2010-10-18 | 2016-06-08 | 현대자동차 주식회사 | 저압 egr시스템 제어장치 및 방법 |
| DK3702374T3 (da) | 2012-02-15 | 2022-06-27 | Cydex Pharmaceuticals Inc | Fremsgangsmåde til fremstilling for cyclodextrin-derivater |
| CA2888822C (en) | 2012-10-22 | 2021-01-26 | Cydex Pharmaceuticals, Inc. | Alkylated cyclodextrin compositions and processes for preparing and using the same |
| HUE051406T2 (hu) | 2012-11-14 | 2021-03-01 | Grace W R & Co | Biológiailag aktív anyagot és rendezetlen szervetlen oxidot tartalmazó kompozíciók |
| EP3125873B1 (en) | 2014-04-04 | 2020-06-03 | Pharmaquest International Center, LLC | Disintegrating monolithic modified release tablets containing quadri-layer extended release granules |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040014739A1 (en) * | 1999-08-16 | 2004-01-22 | Koppel Gary A. | Neurotherapeutic clavulanate composition and method |
| US20060093680A1 (en) * | 2003-02-12 | 2006-05-04 | Vlasta Humar | Coated particles and pharmaceutical dosage forms |
| US20060122159A1 (en) * | 2004-08-13 | 2006-06-08 | Huq Abu S | Pharmaceutical formulation |
| US20070249523A1 (en) * | 2001-02-14 | 2007-10-25 | Koppel Gary A | Neurotherapeutic composition and method therefor |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JO984B1 (en) * | 1977-10-11 | 1979-12-01 | بيتشام غروب ليمتد | A dry pharmaceutical compound with a suitable dosage unit for oral administration |
| NZ189022A (en) * | 1977-12-08 | 1981-11-19 | Beecham Group Ltd | Pharmaceutically acceptable particles of clavulanates dispersed in a polymeric binder |
| NZ198241A (en) | 1980-09-27 | 1983-12-16 | Beecham Group Ltd | Tablet containing amoxycillin and potassium clavulanate |
| GB9109862D0 (en) | 1991-05-08 | 1991-07-03 | Beecham Lab Sa | Pharmaceutical formulations |
| GB9405856D0 (en) * | 1994-03-24 | 1994-05-11 | Smithkline Beecham Plc | Pharmaceutical formulation |
| GB9518917D0 (en) * | 1995-09-15 | 1995-11-15 | Smithkline Beecham Plc | Compounds |
| IE990159A1 (en) * | 1999-02-26 | 2000-09-20 | Fuisz Internat Ltd | Storage Stable Amoxycillin and Clavulanate Suspension Composition. |
| US6426342B2 (en) | 1999-08-16 | 2002-07-30 | Revaax Pharmaceuticals, Llc | Use of β-lactamase inhibitors as neuroprotectants |
| US7166626B2 (en) * | 2001-06-18 | 2007-01-23 | Revaax Pharmaceuticals, Llc | Therapeutic treatment for sexual dysfunction |
| IL154370A0 (en) * | 2003-02-10 | 2003-09-17 | Chemagis Ltd | Solid amorphous mixtures, processes for the preparation thereof and pharmaceutical compositions containing the same |
| DE102006007830A1 (de) * | 2006-02-17 | 2007-08-30 | Grünenthal GmbH | Lagerstabile orale Darreichungsform von Amoxicillin und Clavulansäure |
| ZA200807943B (en) * | 2006-03-24 | 2009-11-25 | Panacea Biotec Ltd | Antibiotic compositions of modified release and process of production thereof |
| CA2758029A1 (en) * | 2009-04-29 | 2011-11-04 | Rexahn Pharmaceuticals, Inc. | Clavulanate formulation for neuroprotection and treatment of neurodegenerative disorders |
-
2008
- 2008-10-24 EP EP20080842941 patent/EP2214680A4/en not_active Withdrawn
- 2008-10-24 CN CN2008801224638A patent/CN101918004A/zh active Pending
- 2008-10-24 JP JP2010531050A patent/JP2011500811A/ja active Pending
- 2008-10-24 KR KR1020107011374A patent/KR20100101574A/ko not_active Application Discontinuation
- 2008-10-24 WO PCT/US2008/012126 patent/WO2009055038A1/en active Application Filing
- 2008-10-24 AU AU2008317315A patent/AU2008317315A1/en not_active Abandoned
- 2008-10-24 BR BRPI0818702 patent/BRPI0818702A2/pt not_active IP Right Cessation
- 2008-10-24 CA CA2703224A patent/CA2703224A1/en not_active Abandoned
- 2008-10-24 US US12/258,062 patent/US20090270358A1/en not_active Abandoned
- 2008-10-24 MX MX2010004556A patent/MX2010004556A/es not_active Application Discontinuation
-
2010
- 2010-04-25 IL IL205313A patent/IL205313A0/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040014739A1 (en) * | 1999-08-16 | 2004-01-22 | Koppel Gary A. | Neurotherapeutic clavulanate composition and method |
| US20070249523A1 (en) * | 2001-02-14 | 2007-10-25 | Koppel Gary A | Neurotherapeutic composition and method therefor |
| US20060093680A1 (en) * | 2003-02-12 | 2006-05-04 | Vlasta Humar | Coated particles and pharmaceutical dosage forms |
| US20060122159A1 (en) * | 2004-08-13 | 2006-06-08 | Huq Abu S | Pharmaceutical formulation |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102058584A (zh) * | 2010-12-30 | 2011-05-18 | 石药集团河北中润制药有限公司 | 克拉维酸钾/微晶纤维素组合物的制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL205313A0 (en) | 2010-12-30 |
| BRPI0818702A2 (pt) | 2015-04-22 |
| EP2214680A1 (en) | 2010-08-11 |
| KR20100101574A (ko) | 2010-09-17 |
| JP2011500811A (ja) | 2011-01-06 |
| MX2010004556A (es) | 2010-07-01 |
| CA2703224A1 (en) | 2009-04-30 |
| WO2009055038A1 (en) | 2009-04-30 |
| AU2008317315A1 (en) | 2009-04-30 |
| US20090270358A1 (en) | 2009-10-29 |
| EP2214680A4 (en) | 2010-12-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101918004A (zh) | 克拉维酸的药物制剂 | |
| US4343789A (en) | Sustained release pharmaceutical composition of solid medical material | |
| CN102946869B (zh) | γ-羟基丁酸的速释制剂及剂型 | |
| US10441585B2 (en) | Formulations containing nalbuphine and uses thereof | |
| AU728526B2 (en) | Pharmaceutical formulations comprising amoxocyllin and clavulanate | |
| CN102413814A (zh) | 用于神经保护和治疗神经变性病症的克拉维酸类物质制剂 | |
| KR100882156B1 (ko) | 나테글리니드 함유 제제 | |
| EP2528589A2 (en) | Stable efervescent formulations comprising cefaclor | |
| EP3167876B1 (en) | Pharmaceutical tablet formulation for the veterinary medical sector, method of production and use thereof | |
| WO2006114042A1 (fr) | Application du levo-ornidazole dans la preparation d'un medicament anti-infections par des bacteries anaerobies | |
| CN104840971A (zh) | 稳定的卡立氨酯儿科混悬剂 | |
| AU2003212491B2 (en) | Colonic release composition | |
| KR20190015329A (ko) | 다파글리플로진 공결정의 약학 조성물 | |
| EP1596841B1 (en) | Therapeutic system comprising amoxicillin and clavulanic acid | |
| AU2004251439B2 (en) | Tablet comprising fluvastatin and carmellose calcium | |
| CN105407875A (zh) | 包含异烟肼颗粒和利福喷汀颗粒的呈包衣片剂形式的抗结核病的稳定的药物组合物及其制备方法 | |
| EP3581180B1 (en) | Antimicrobial compositions with effervescent agents | |
| MX2011000349A (es) | Composiciones de eprosartan. | |
| RU2611194C2 (ru) | Лекарственное средство на основе тетраметилтетраазобициклооктандиона и способ его получения | |
| Khemariya et al. | A Pioneering Approach to Enhance Dissolution and Bioavailability of Multiple Drugs in a Single Dosage Form: Speedy Disintegrating Tablet of Cefpodoxime Proxetil and Potassium Clavulanate | |
| AU2021321092A1 (en) | Solid oral composition comprising carbamate compound, and preparation method therefor | |
| CN117797105A (zh) | 一种奥卡西平咀嚼片及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20101215 |