KR20180040516A - 신경조절 장치 - Google Patents
신경조절 장치 Download PDFInfo
- Publication number
- KR20180040516A KR20180040516A KR1020177034006A KR20177034006A KR20180040516A KR 20180040516 A KR20180040516 A KR 20180040516A KR 1020177034006 A KR1020177034006 A KR 1020177034006A KR 20177034006 A KR20177034006 A KR 20177034006A KR 20180040516 A KR20180040516 A KR 20180040516A
- Authority
- KR
- South Korea
- Prior art keywords
- signal
- nerve
- patient
- activity
- spleen
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/3605—Implantable neurostimulators for stimulating central or peripheral nerve system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/05—Electrodes for implantation or insertion into the body, e.g. heart electrode
- A61N1/0551—Spinal or peripheral nerve electrodes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
- A61K38/13—Cyclosporins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/05—Electrodes for implantation or insertion into the body, e.g. heart electrode
- A61N1/0551—Spinal or peripheral nerve electrodes
- A61N1/0556—Cuff electrodes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/3605—Implantable neurostimulators for stimulating central or peripheral nerve system
- A61N1/3606—Implantable neurostimulators for stimulating central or peripheral nerve system adapted for a particular treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/36007—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation of urogenital or gastrointestinal organs, e.g. for incontinence control
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/3605—Implantable neurostimulators for stimulating central or peripheral nerve system
- A61N1/36128—Control systems
- A61N1/36135—Control systems using physiological parameters
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Radiology & Medical Imaging (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Gastroenterology & Hepatology (AREA)
- Physiology (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Electrotherapy Devices (AREA)
Abstract
본 발명은 장의 염증을 치료하고 완화시키기 위한 장치, 기구, 시스템 및 방법을 제공한다. 특히, 본 발명은 신경조절 시그널이 비장 신경 및/또는 상부 장간막신경총(SMP)에 전달되는 장치, 기구 및 방법을 제공한다. 상기 시그널은 또한 염증 질환, 예를 들면, 염증성 장질환에서, 예를 들면, 결장염을 치료할 수 있다.
Description
배경
신경 메카니즘은 운동, 분비 및 혈관조절과 같은 위?장관의 모든 주요 기능을 조절한다. 이의 활동이 직접적인 의식의 제어 하에 있지 않다는 점에서 크게 자체적으로 작용하는 자율신경계(ANS)는 장의 고유의 제어를 나타내며, 교감 및 부교감 계통으로 나누어진다. ANS 교감 및 부교감 성분은 중추 신경계(CNS)(뇌간 및 척수내 세포체가 있는)에서 기원하지만; 벽재신경총(enteric nervous system: ENS)은 위?장관의 벽 내에 존재한다. ANS는 통합적인 신경세포 연결 및 심지어 완전한 반사궁(reflex arc)을 함유하는 말초 신경계의 주요한 원심성 성분을 형성한다.
신경과학 및 면역학에서의 연구는 신경계와 면역계 사이에 양방향성 상호작용에 대한 다수의 지시를 확인하여 왔다. 장 면역 반응 및 면역력의 발달은 다른 기관을 사용하므로, 신경 반사에 의해 영향받은 것으로 보인다. 지난 십여년 사이에, 부교감 원심성 미주 신경이 이러한 면역-조절 네트워크에 더해져 왔다. "염증성 반사(inflammatory reflex)"로 지정된 당해 시스템은 염증을 감지하는 구심성(즉, 감각) 아암(afferent arm), 및 전신계 및 국소 면역 반응을 억제하는 원심성 아암(efferent arm)을 포함하는 것으로 고려되고 있다.
미주신경의 부교감신경 절전 섬유(vagal parasympathetic preganglionic fiber)는 장 내에서 신경절뒤의 부교감 신경원(예를 들면, 근층간신경총)을 지닌 미주신경 및 시냅스(synapse)의 등쪽 핵의 운동 신경세포로부터 기원한다. 미주 신경분포의 밀도는 십이지장에서 관찰된 최대 밀도 및 회장의 원위 부분에서 관찰된 최저 밀도로서 장을 따라 근위원위 구배(proximodistal gradient)를 나타낸다. 대장은 미주 신경이 근위 결장의 부교감 신경분포를 제공하지만 원위 결장으로는 어떠한 신경 도입이든 거의 제공하지 않는다는 점에서 위?장관의 나머지와는 상이하다.
미주(vagus 또는 vagal) 신경 신경자극전달은 전신계 염증을 제어하는데 있어서 중요한 것으로 밝혀졌다. 패혈증의 LPS 모델에서, 미주 신경 자극은 소염 효과를 발휘하는 것으로 밝혀졌다(Borovikova et al. 2000, Nature; 405, 458-462). 이와 관련하여, 비장 및 비장 신경은 전신계 염증의 미주신경-매개된 억제에 있어서 중요한 역활을 함이 또한 밝혀졌다(Huston et al. 2006, J. Exp. Med, 203. 1623-1628, 본원에 참고로 포함됨). 전신계적 소염 효과는, 비장 신경이 자극되는 경우 미주 신경 시그널링(signalling)없이 유도될 수 있음이 또한 입증되었다(Vida et al, 2011, J. Immunol. 186: 4340-4346, 본원에 참고로 포함됨). 그러나, 비장 신경 자극이 어떠한 국소의 치료학적 점막 소염 효과도 생성할 수 있음은 입증되지 않았다.
보다 광범위한 점막 염증(예를 들면, 염증성 장질환 또는 "IBD")에서, 미주 신경의 잠재적인 소염 반사궁이 관찰되지만, 근본적인 메카니즘은 전신계 염증에 대해서보다 잘 확립되어 있지 않다. 일반적인 측면에서, 약리학적 니코틴 효능제 활성화는 장의 염증(gut inflammation)을 완화시킨다. 유사하게, 아세틸콜린에스테라제 억제제의 투여는 중추 억제를 통해 실험적 결장염을 완화시킨다. 아세틸콜린에스테라제 억제제의 효과는 미주신경섬유절제술을 겪은 동물에서는 상실되어 있으며, 이는 부교감신경 아세틸콜린 시그널링이 미주신경적으로 매개된 소염 효과에 관여함을 나타낸다(Pavlov, et al Brain Beh Immun 2009, 및 Ji et al, Muc Immunol 2014, 이들 각각은 본원에 참고로 포함됨).
치료요법의 형태로서 이러한 미주신경 염증성 반응(vagal inflammatory reflex)에서의 개입이 미주 신경 자극(VNS)의 시험으로 현재 연구 중에 있다. VNS는 장내 염증 수준에 영향을 미치기 위하여 목 안의 우측 경동맥 미주신경을 자극하기 위한 이식가능한 장치를 사용한다. 그러나, VNS가 일부 긍적적인 효과를 가진 것으로 고려되고 있다고 해도, 작용 방식은 완전히 확립되지 않은 채 남아있다. 중요하게도, 미주 신경은 많은 신체 시스템과 상호작용하는 다기능성의 혼합 신경이므로, 미주신경 시그널링에 있어서의 개입은 심장부정맥 및 비정상적인 호흡 방식과 같은, 다수의 바람직하지 않은 전신계 부작용을 가지는 것으로 알려져 있다. 따라서, 비장 및 장(예를 들면, 창자(intestines) 및 결장(colon))에서 국소 점막 염증 반응을 조절하기 위한 신경조절의 보다 특이적이고 표적화된 방법이 바람직하다.
발명의 요약
본 발명자들은 미주 신경에 의한 하부 장(lower intestine)의 자극 전달이 원위 결장의 미주신경 신경자극전달 없이, 근위 결장에 제한될 수 있음을 확인하였다. 원위 신경자극전달의 이러한 결여는 미주 신경(vagus nerve, vagal) 자극 후 결장 내에서 소염 효과를 유발하는 제한된 능력을 이끌 수 있다. 그러나, 놀랍게도, 장 및/또는 비장의 교감신경 신경자극전달(부교감신경 보다는)은 하부 장(특히 결장)에서 소염 효과를 발휘할 수 있다. 이러한 교감신경 신경자극전달이 제거되는 경우, 장 내에서 염증의 조직학적 및 면역학적 척도(measure)가 증가한다. 교감신경 활성의 소염 효과는 장 또는 비장 내 노르에피네프린 수준(교감신경 활성의 지표)과 염증의 증가된 척도 사이에 강력한 역 상관관계로 또한 나타난다. 본 발명자들은 상부 장간막 신경(Supra Mesenteric Nerve), 또는 비장 신경을 포함하는 상부 장간막신경총(superior mesenteric plexus: SMP)을 신경조절 장치로 자극함으로써, 장 내 노르에피네프린 수준을 증가시키는 것이 가능하며, 따라서 이는 결장염-관련 염증의 수준을 감소시킬 것임을 입증하였다. 아드레날린성 수용체(AR)의 활성화는, 이러한 활성화가 아드레날린성 신경전달물질(에피네프린)에 의한 것인지 또는 인공 AR 효능제(살부타몰)에 의한 것인지에 상관없이, 수지상 세포(DC)에 의한 전-염증성 사이토킨 생산에 있어서의 감소를 생성함이 밝혀졌다(Nijhuis. L et al, PLoS One. 2014; 9(1)의 도 1, 본원에 참고로 포함됨). 따라서, 국소(및 임의로 전신계) 소염 효과를 생산하기 위하여, SMP 및/또는 비장 신경의 신경조절에 의해 조직 NE에 있어서의 증가를 유발하는 것이 유용할 수 있다.
놀랍게도, 본 발명자들은 염증을 감소시키기 위한 교감신경 시그널링의 효과가 미주 신경을 필요로 하지 않으므로, 미주 신경 시그널링의 하향(downstream) 결과가 아님을 확인하였다. 미주신경섬유절제술은 염증 수준에 있어서의 효과가 없는 반면(미주신경 시그널링으로부터 기원한 억제 효과가 거의 없거나 없음을 나타냄), 장 또는 비장을 신경자극전달(innervating)하는 교감 신경의 절제는 염증의 수준을 악화시켰으며, 이는 SMP 및 비장 신경이 미주신경 시그널링과는 독립적으로 염증을 억제할 수 있음을 나타낸다.
따라서, 이들 교감 신경(특히 비장 신경 및 SMP의 섬유)에서 신경세포 활동을 조절함으로써, 본 발명자들은 결장과 관련된 염증을 치료(즉, 감소)할 수 있음을 입증하였다. 이러한 치료는 대장 및 결장이 부교감신경신경의 미주신경 신경자극전달을 거의 가지고 있지 않지만, 교감신경 신경자극전달을 가지고 있으므로, 결장의 염증(즉, "결장염")을 치료하는데 있어서 미주 신경의 자극보다 특별한 장점을 갖는다. 따라서, 비장 신경 및 SMP를 표적화하는 것은 치료할 신체의 새로운 부위가 신경조절의 특이성 및 효능을 증가시키도록 한다. 더욱이, 미주 신경보다 더 말초인 신경을 표적화함으로써, 본 발명은 다른 신체 시스템에 영향을 미치는 것을 피하도록 하고 이에 의해 원치않는 부작용을 감소시킨다. 따라서, 본 개시내용은 환자에서 염증 질환을 치료하기 위한 장치 또는 시스템을 제공한다. 양호하게도, 염증 질환은 궤양성 결장염(UC) 또는 크론병(Crohn's Disease)과 같은 증상으로서 결장염을 포함하는 염증 질환, 예를 들면, IBD이다.
따라서, 제1 국면에서, 본 발명은 환자의 비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및/또는 SMP의 신경세포 활동을 조절하기 위한 장치 또는 시스템을 제공하며, 당해 장치 또는 시스템은: 제1의 시그널을 비장 신경 또는 SMP에 적용하도록 구성된 제1의 변환기 및 임의로 SMP 또는 비장 신경의 다른 것에 제2의 시그널을 적용하기 위한 제2의 변환기; 및 변환기 또는 변환기들에 커플링되고, 변환기 또는 변환기들에 의해 적용될 시그널을 제어함으로써, 상기 시그널이 이것이 적용되어 환자에서 생리학적 반응을 생산하는 신경의 신경세포 활동을 제어하도록 하는 제어기를 포함한다. 특정의 구현예에서, 적용된 시그널은 당해 시그널이 적용되는 신경내 신경세포 활동을 증가시킨다.
바람직하게는, 유발된 생리학적 반응은 환자의 비장 및/또는 장(예를 들면, 창자 및/또는 결장)에서 국소 교감신경 활성도(sympathetic tone)에 있어서의 증가이다. 특정의 구현예에서, 생리학적 반응은 장 조직내 및/또는 순환하는 노르에피네프린에 있어서의 증가, 장 조직 및/또는 순환시 하나 이상의 염증성 마커에 있어서의 감소, 장 병리학에 있어서의 감소, 결장 섬유종에 있어서의 감소, 및 결장염의 하나 이상의 증상에 있어서의 감소 중 하나 이상을 포함한다.
특정의 구현예에서, 시그널은 전기 시그널이고 변환기는 전극이다. 특정의 이러한 구현예에서, 시그널은 임의로 0.01-20 Hz, 예를 들면, 10 Hz의 주파수를 갖는 저 주파수 AC 파형이다.
특정의 구현예에서, 상기 장치 또는 시스템은 환자에서 하나 이상의 생리학적 매개변수를 검출하기 위한 검출기 소자(element)를 추가로 포함한다. 특정의 이러한 구현예에서, 제어기는 검출기 소자에 커플링되어, 생리학적 매개변수가 예정된 역치값(threshold value)에 부합하거나 초과하도록 검출되는 경우 하나 이상의 변환기 각각이 시그널을 적용하도록 한다. 특정의 구현예에서, 검출된 생리학적 매개변수 중 하나 이상은 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커의 순환하는 수준으로부터 선택된다. 특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경에서 활동 전위(action potential) 또는 활동 전위의 양식을 포함한다.
다른 국면에서, 본 발명은 (i) 환자에게 상기 기술한 바와 같은 장치, 기구 또는 시스템의 부품을 이식하는 단계; (ii) 상기 장치, 기구 또는 시스템의 제1의 변환기를 환자의 비장 신경 및/또는 SMP와 시그널링 접촉하도록 위치시키는 단계; 및 (iii) 상기 기구 또는 시스템을 활성화시켜 비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및/또는 SMP의 신경 활동을 조절하는 단계를 포함하여, 환자에서 결장염을 치료하는 방법을 제공한다.
특정의 구현예에서, 상기 방법은 크론병 및/또는 UC를 치료하는 것과 같이, IBD를 치료하는 방법이다.
다른 국면에서, 본 발명은 환자의 비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및/또는 상부 장간막 신경총(SMP)에 시그널을 적용하여 환자내 신경의 신경세포 활동을 조절하는 단계를 포함하여, 환자에서 결장염, 특히 IBD를 치료하는 방법을 제공한다. 특정의 구현예에서, 시그널 또는 시그널들은 당해 시그널에 적용하도록 구성된 변환기를 포함하는 신경조절 장치에 의해 적용된다. 특정의 이러한 구현예에서, 상기 신경조절 장치는 환자에게 적어도 부분적으로 이식되며, 임의로 환자에게 전체적으로 이식된다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용되는 신경내 신경세포 활동에 있어서의 증가이다. 특정의 구현예에서, 시그널은 전기 시그널이며 임의로 0.01-20 Hz, 예를 들면 10 Hz의 주파수를 갖는 저 주파수의 교류(AC) 파형을 포함한다.
특정의 구현예에서, 상기 방법은 환자의 하나 이상의 생리학적 매개변수를 검출하는 단계를 추가로 포함하며, 여기서 상기 시그널은 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만 적용된다. 특정의 이러한 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증 마커의 순환하는 수준으로부터 선택된다. 특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경에서 작용 전위 또는 작용 전위들의 양식을 포함한다.
다른 국면에서, 본 발명은 환자에서 결장염을 치료하는 방법에 사용하기 위한 소염제를 제공하며, 여기서 상기 방법은 (i) 환자의 비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및/또는 상부 장간막신경총에 시그널을 적용하여 환자의 신경에서 신경세포 활동을 조절하는 단계; 및 (ii) 소염제를 환자에게 투여하는 단계를 포함한다. 특정의 구현예에서, 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF 제제로부터 선택된다. 특정의 구현예에서, 소염제는 IBD, 임의로 UC 및/또는 크론병을 치료하는 방법에서 사용하기 위함이다.
특정의 구현예에서, 상기 시그널 또는 시그널들은 각각의 시그널을 적용하기 위해 구성된 변환기를 포함하는 신경조절 장치에 의해 적용되며, 임의로 여기서 상기 신경조절 장치는 환자 내에 적어도 부분적으로 이식되고, 임의로 환자 내에 완전히 이식된다.
특정의 구현예에서, 적용된 시그널 또는 시그널들은 이것이 적용된 신경 내에서 신경세포 활동을 증가시킨다. 특정의 구현예에서, 상기 시그널은 전기 시그널, 임의로 0.01-20 Hz, 예를 들면 10 Hz의 주파수를 갖는, 임의로 낮은 주파수 AC 파형이다.
다른 국면에서, 본 발명은 환자에서 결장염을 치료하는데 사용하기 위한 신경조절 전기 파형을 제공하며, 여기서 상기 파형은 주파수가 0.01-20 Hz인 AC 파형이어서, 비장 신경 또는 SMP에 적용되는 경우 상기 파형은 신경내 신경세포 시그널링을 증가시킨다.
다른 국면에서, 본 발명은 환자의 비장 신경 또는 SMP에서 신경세포 활동을 조절함으로써 환자에서 결장염을 치료하기 위한 신경조절 장치의 용도를 제공한다.
본 발명의 모든 국면의 바람직한 구현예에서, 환자는 포유동물 환자, 임의로 사람 환자이다.
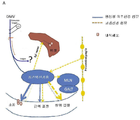
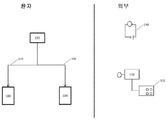
도 1:
A. 림프구 구조의 상호작용성 부교감 및 교감신경 신경자극전달의 개략적인 도시. 미주 신경의 등 운동 핵(DMV)에서 기원하는 원심성 미주신경 신경자극전달(실선)은 장 장간막신경총 및 외 근육증(muscularis externa)을 신경자극전달하며, 여기서 잔류하는 대식세포-유사 세포는 미주 신경 종말(vagus nerve ending)과 해부학적으로 관련되어 있다. 근위 장은 원위 세그먼트(distal segment)와 비교하여 고유의 미주 신경자극전달에 의해 보다 강하게 신경자극전달된다. 추골전 신경절로부터 발생한 교감신경 신경자극전달(실선)은 미주신경 신경자극전달에 대치되는 구배를 따르며, 이는 화살표의 두께로 반영된다. 교감신경 신경자극전달은 림프구 기관(예를 들면, GALT 및 장간막림프절(MLN))을 위해 존재한다. B. 개입의 신경세포 경로의 개략적인 도시. 자극/신경제거의 가장 관련있는 교감신경 경로를 나타낸다. 비장 신경은 비장 동맥과 함께 정렬되어 동맥내 총(inter-arterial plexus)(비장 총)을 구성한다. 당해 총은 동맥을 따라 비장에 이르며, 갈라져서, 동맥의 췌장 및 위장을 따라 부수적인 총들이 이어진다. 점선은 본 출원에 기술된 바와 같은 DSS 결장염 실험에서 개입의 경로를 나타낸다.
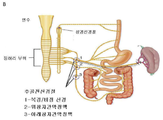
도 2a 내지 도 2c: 본 발명의 기구, 장치, 시스템 및 방법이 효과를 낼 수 있는 방법을 나타내는 개략도이다.
도 3: 예비 데이타, 마우스에서 DSS 유도된 결장염에 있어서 선택적인 교감신경절제술 및 신경섬유절제술의 효과. 교감신경절제술은 질병 과정을 악화시키지만 신경섬유절제술은 효과가 없다. 나타낸 데이타는 DSS 유도 후 7일째에 ELISA에 의해 측정된, 인터루킨 6 및 인터루킨 1베타 조직 수준이다. 각각의 그룹에 대한 데이타 n=8 SEM. *p<0.05 ANOVA.
도 4: 상부 장간막 신경(Sx)의 절제 후 및 이어서 16일째의 Rag1-/- 마우스. 도 4a)의 체중을 1일째의 체중과 비교하여 체중의 퍼센트로서 나타낸, 질병의 지표로서 측정하였다.
도 4b) 결장 길이에 대해 표준화한 결장 중량을 결장염의 표시로 측정하였다.
도 4c-4f) 임상 질병 특성의 합으로 나타낸 내시경 병리학 점수. 대변을 0(표준 대변)으로부터 4(혈변의 설사)로 측정하였다. 조직학적 특성은 경험이 있는 병리학자가 평가하였다. 조직학적 점수의 합은 별도의 그래프로서 또한 나타낸, 상이한 특징으로부터 계산한다. 침윤물, 과형성, 배상 세포 고갈을 나타낸다.
도 4g) 회장 노르에피네프린(NE)을 질량 분광법으로 측정하였다. 이는 총 조직 중량(그램) 당 피코그램(picogram)으로 측정된다. Rag1-/- 마우스 모의 수술(sham surgery)의 기본 노르에피네프린 수준을 Sx와 비교하였다.
도 4a - 도 4g의 경우: 데이타는 2개의 독립적인 실험을 대표한다. 샘플 평균 + SEM이 나타나 있다. 만-휘트니(Mann-Withney) U 시험(또는 대변에 대한 카이 자승 검증(Chi Square test), 내시경 및 모든 조직학적 특징)을 통계적 분석에 사용하였다. *P < 0.05, **P < 0.01, ***P < 0.001, Sx를 제공받은 마우스의 경우 n = 17 및 모의 수술(-)을 받은 마우스의 경우 n = 16.
도 5: 종양 괴사 인자(TNF)-α, 인터루킨(IL)1β, IL-6, IL-10, IL-12 및 단핵구 화학주성 단백질(monocyte chemoattractant protein: MCP)-1에 대한 유전자의 qPCR 분석. 하우스키핑 유전자(housekeeping gene) β-액틴, 하이포크산틴-구아닌 포스포리보실트랜스퍼라제(HPRT) 및 유비퀴틴에 대해 표준화됨. 모의 수술된 마우스(-)와 관련된 상대적인 mRNA 발현이 나타나 있다.
B) 모의(좌측) 및 Sx(우측)의 2개의 대표적인 H&E 염샘. 하부 화살표: 침윤물, 상부 화살표: 배상 세포 고갈. 확대: 20x.
도 6: C57BL/6 마우스는 모의 수술(-), 비장 신경의 절개(Sx)를 겪었다. 2주의 회복 후, 급성 결장염을 음료수 중 2%(w/v) DSS, 또는 대조군으로서 비히클을 제공하여 유도시켰다.
A) IL-1β, IL-6, IL-10, 형질전환 성장 인자(TGF)-β 및 TNF-α에 대한 유전자의 qPCR 분석. 하우스키핑 유전자 β-액틴, HPRT 및 유비퀴틴에 대해 표준화하였다. 비히클로 처리한 모의 수술된 마우스와 관련된 상대적인 mRNA 발현으로 나타낸다.
B) 질병 활성 지수는 질병의 지수로 측정하였다. 섬유증은 0(섬유증 없음) 내지 2(심각한 섬유증)의 거시적 점수로서 질병 활성에 대한 척도로 포함된다. 대변은 0(정상적인 대변)으로부터 4(혈변의 설사)로 측정하였다. 샘플 평균 + SEM이 나타나 있다. 만-휘트니 U 시험(또는 대변, 대장 잠혈 및 섬유증에 대한 카이 자승 시험)을 통계적 분석을 위해 사용하였다. *P < 0.05, **P < 0.01, n = 각각의 그룹에 대해 10마리의 마우스(-, Sx, DSS 결장염의 존재 또는 부재).
도 7: 원위 장 세그먼트에 대한 근위의 노르에피네프린(NE) 수준을 나타내었다. NE 수준을 질량 분광법을 사용하여 측정하였다. 수준은 나타낸 매개변수에서 후크 자극(hook stimulation) 직후 취한, 총 조직 중량(그램) 당 피코롤로 제공된다. 나타낸 데이타는 평균 n=3이다. 자극은 나타낸 매개변수에서 수행하였다.
도 8a 및 도 8b: 복막 근육에서 근전도 기록. 커프 전극(cuff electrode)을 이식하여, 상부 장간막신경총 및 상부 장간막 동맥 주변에 위치시켰다. 이후에, EMG 전극을 측정을 위해 이식시켰다. 랫트에게 A) 200 마이크로Amp 10Hz 자극 또는 B) 400 마이크로Amp(화살표) 10Hz 자극을 겪게 하고 EMG를 나타낸 시간에 대하여 측정하였다.
도 9a 및 도 9b: 상부 장간막신경총 및 동맥 주변에 위치한 전극 커프를 통한 자극 후, 정맥(도 9a) 또는 동맥(도 9b) 장간막 혈관에서 랫트 도플러 순환 유동 측정(Doppler circulation flow measurement). 3마리의 랫트의 측정을 나타낸다. 나타낸 10Hz 자극에서 자극 매개변수는 200, 400, 및 600 마이크로Amp이었다.
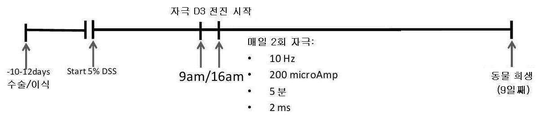
도 10: 실험적인 랫트 상부 장간막신경총(SMP) 자극 과정의 프로토콜 세부사항.
도 11: 랫트 내 DSS 결장염에서 파일러트 SMP 자극의 실험 결과. A) DSS 결장염의 9일째에 모의(상부) 및 자극된 결장의 내시경 현미경사진. 섬유종에서 부위의 궤양화에 주목한다(화살표). B) DSS 결장염의 9일째 랫트 결장에서 측정된 결장 중량/길이비. C) 측정된 도 1 매개변수에서와 같이 모의, 또는 SMP의 자극을 겪은 랫트에서 9일째에 결장염의 임상 매개변수는 설사(검은색 바아) 또는 대변 속의 혈액(관측됨; 회색 바아)이다. D) 사이토킨 및 케모킨의 전사를 QPCR로 결장 균질물에서 측정하였다. 선택된 생물지표는 9일째에 랫트 DSS에서 CCL3, CCL12, CCL17, IL1b의 상향조절을 나타낸 QPCR 배열 스크리닝(SA Biosciences 사람 염증 키트)으로부터 유추되었다. 9일째에 DSS에서 모의, 또는 자극 하에 CCL3 및 IL-1β의 수준을 나타낸다. CCL12, CCL17은 동일하게 감소하였으며(나타내지 않음); CCL19 및 COX 2는 자극에 의해 영향받지 않았다. 나타낸 데이타는 치료 그룹 당 평균 +/- SEM n=7-9이다.
도 12: 조직학 점수-SMP 자극. 랫트에서의 DSS 결장염에 있어서 파일러트 SMP 자극의 실험적 결과. 경험한 및 블라인드 처리된(blinded) 병리학자에 의해 평가된 조직학 점수. 나타낸 데이타는 치료 그룹당 평균 +/- SEM n=7-9이다.
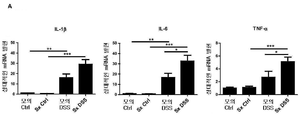
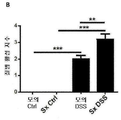
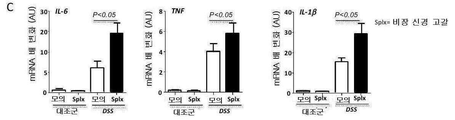
도 13: 교감신경 비장 신경자극전달은 DSS-유도된 결장 염증에서 소염 효과를 발휘한다. DSS 투여 전에 수행된 비장 신경제거는 마우스에서 DSS 결장염을 증강시킨다. 결장 전사물의 QPCR 배열 데이타; 염증성 유전자에 대한 상승된 발현 프로파일은 모의 수술과 비교한 것으로서 splx(비장 신경 병변) 후 관찰된다. B) 비장 신경 병변은 DSS 투여에 의해 유도된 질병 활성 지수(C)를 향상시킨다. C). 비장 신경제거는 전-염증성 사이토킨 IL-6 및 TNF-α 및 IL-1β의 발현 수준에 있어서 유의적인 증가를 가져온다. 데이타는 평균±SEM(n = 그룹당 11 내지 15마리의 동물)로서 나타낸다. *p<0.05; **p<0.01; ***p<0.001. DSS 결장염 및 비장 신경 신경제거에 있어서 사이토킨 발현 수준(n=12).
상세한 설명
본원에 사용된 용어는 하기에 달리 정의하지 않는 한, 기술자에 의해 이해된 것으로서 당해 분야에서 이들의 통상적인 정의로 제공된다. 어떠한 불일치 또는 의심이 되는 경우, 본원에 제공된 것으로서의 정의가 우선하여야 한다.
본원에 사용된 것으로서, 시그널의 적용은 에너지의 이동을 적합한 형태로 동일하게 하여 시그널의 의도된 효과를 수행할 수 있다. 즉, 시그널을 신경 또는 들경들에 적용하여 에너지의 이동을 동일하게 함으로써 신경(들)을(또는 로부터) 의도된 효과를 수행하도록 할 수 있다. 예를 들면, 이동된 에너지는 전기, 기계(초음파와 같은 음향을 포함함), 전자기(예를 들면, 광학적), 자기 또는 열 에너지일 수 있다. 본원에 사용된 시그널의 적용은 약제학적 개입을 포함하지 않음에 주목한다.
본원에 사용된 것으로서, "변환기"는 신경 또는 신경총(plexus)에 시그널, 예를 들면, 전극, 다이오드, 펠티어 소자 또는 초음파 변환기를 적용하는 어떠한 소자를 의미하기 위해 사용된다.
본원에 사용된 것으로서, "비-파괴 시그널"은 적용되는 경우 이것이 적용된 신경의 근본적인 신경세포 시그널 전도에 비가역적으로 손상을 입히지 않는, 상기 정의한 바와 같은 시그널이다. 즉, 비-파괴적인 시그널의 적용은 이러한 전도가 비-파괴적인 시그널의 적용 결과로서 실제로 억제되거나 차단되는 경우에도, 시그널의 적용이 중지되는 경우 활동 전위를 수행하는 신경 또는 신경들(또는 이의 섬유)의 능력을 유지한다. 신경의 적어도 일부의 제거 및 소작술(cauterisation)은 파괴적인 시그널의 예이다.
본원에 사용된 것으로서, 신경의 "신경세포 활동"은 신경의 시그널링 활동, 예를 들면, 신경내 활동 전위의 진폭, 진동수 및/또는 양식을 의미하기 위해 사용된다.
본원에 사용된 것으로서, 신경세포 활동의 조절은 신경의 시그널링 활성이 기본 신경세포 활동, 즉, 어떠한 개입 전 환자에서 신경의 시그널링 활동으로부터 변경됨을 의미하기 위해 사용된다. 이러한 조절은 기본 활동과 비교하여 신경세포 활동을 중지하거나, 억제(예를 들면, 차단)하거나, 또는 달리는 변경시킬 수 있다.
신경세포 활동의 조절이 자극성(신경세포 활동의 증가를 가져옴)인 경우, 이는 전체 신경의 총 시그널링 활동에 있어서의 증가일 수 있거나, 이는 신경의 신경 섬유의 소세트의 총 시그널링 활성이 신경의 이러한 부분에서 기본 신경세포 활동과 비교하여 증가되는 것일 수 있다.
신경세포 활동의 조절이 신경세포 활동의 억제인 경우, 이러한 억제는 부분적인 억제일 수 있다. 부분적인 억제는 전체 신경의 총 시그널링 활동이 부분적으로 감소되거나, 신경의 신경 섬유의 소세트의 총 시그널링 활동이 완전히 감소되거나(즉, 신경 섬유의 이러한 소세트내 신경세포 활동이 없음), 또는 신경의 신경 섬유의 소세트의 총 시그널링이 개입 전 신경 섬유의 소세트내 신경세포 활동과 비교하여 부분적으로 감소되는 것일 수 있다. 신경세포 활동의 조절이 신경세포 활동의 억제인 경우, 이는 또한 신경의 신경세포 활동의 완전한 억제를 포함한다.
신경세포 활동의 억제는 신경세포 활동을 차단시킬 수 있다. 이러한 차단은 부분적인 차단, 즉 신경의 신경 섬유의 소세트내 신경세포 활동의 차단일 수 있다. 대안적으로, 이러한 차단은 완전한 차단, 즉, 전체 신경에 걸쳐 신경세포 활동의 차단일 수 있다. 신경세포 활동에 있어서의 차단은 차단 지점을 지나 지속적으로 신경세포 활동을 차단하는 것으로 이해된다. 즉, 차단이 적용되는 경우, 작용 전위는 신경 또는 신경 섬유의 소세트를 따라 차단 지점까지 이동할 수 있으나, 차단 지점을 넘어서지는 않는다.
신경세포 활동의 제어는 또한 활동 전위의 양식에 있어서의 변경일 수 있다. 활동 전위의 양식은 전체적인 빈도 또는 진폭을 필수적으로 변경시키지 않고 조절될 수 있다. 예를 들면, 신경세포 활동의 조절은 활동 전위의 양식이 질병 상태보다는 건강한 상태에 보다 가깝게 유사하도록 하는 것일 수 있다.
신경세포 활동의 조절은 다양한 다른 방식으로 신경세포 활성을 변경시키는 것, 예를 들면, 신경세포 활동의 특수한 부분을 증가시키거나 억제하고/하거나 활동의 새로운 요소를 예를 들면, 특히 시간 간격, 특히 특수한 양식 등에 따라, 주파수 대역에서 자극하는 것을 포함할 수 있다.
신경세포 활동의 조절은 일시적일 수 있다. 본원에 사용된 것으로서, "일시적"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절에 상관없이)이 영구적이지 않음을 의미하기 위해 사용된다. 즉, 시그널의 중지에 따른 신경세포 활동은 시그널이 적용되기 전, 즉, 조절 전 신경세포 활동과 실질적으로 동일하다. 조절 전 신경세포 활동은 본원에서 "기본" 활동으로 언급된다.
신경세포 활동의 조절은 영구적일 수 있다. 본원에 사용된 것으로서, "영구적"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절인지에 상관없이)이 연장된 효과를 가짐을 의미하기 위해 사용된다. 즉, 시그널이 중지되면, 신경에서 신경세포 활동은 시그널이 적용되는 경우와 실질적으로 동일하다(즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다). 연장된 효과는 위에서 기술한 바와 같이, 시그널이 중지된 다음 기간(예를 들면, 분, 예를 들면, 30분 이상, 또는 수 시간, 또는 심지어 수 일) 후, 신경세포 활동이 기본으로 되돌아오거나, 연장된 효과가 무한하게 또는 영구적으로 지속될 수 있도록 일시적일 수 있다.
신경세포 활동의 조절은 수정될 수 있다. 본원에 사용된 것으로서, "수정된"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)이 건강한 개인에서의 신경세포 활동의 양식으로 신경세포 활동을 변경시킴을 의미하기 위해 사용된다. 즉, 시그널의 적용시(및/또는 중지 후), 신경에서 신경세포 활동은 조절 이전 보다 건강한 개인에서 관찰된 신경내 활동 전위의 양식과 매우 근접하게 유사하고, 바람직하게는 건강한 대상체에서 관찰된 신경내 활동 전위의 양식과 실질적으로 완전히 유사하다.
상기 시그널에 의해 유발된 이러한 수정된 조절은 본원에 정의한 바와 같은 어떠한 조절일 수 있다. 예를 들면, 시그널의 적용은 신경세포 활동에 있어서의 변화를 가져올 수 있으며, 시그널의 중지 시, 신경내 활동 전위의 양식은 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하다. 추가의 예로써, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰된 작동 전위의 양식과 유사하도록 하는 조절을 생성할 수 있으며, 시그널이 중지되면, 신경내 활동 전위의 양식은 건강한 개인에서 관찰된 활동 전위의 양식과 유사하다.
본원에 사용된 것으로서, "상부 장간막신경총"은 장간막 동맥과 관련된 신경세포 섬유의 신경총을 나타내기 위해 사용된다. 비장 신경은 숙련가에게 이해되는 것으로서 비장을 신경자극전달하는 신경을 나타낸다.
본원에 사용된 것으로서, "결장염"은 결장의 염증, 특히 점막 염증을 나타내기 위해 사용된다. 결장염을 유발하는 질환은 염증성 장질환(궤양성 결장염(UC) 및 크론병 포함), 허혈성 결장염, 및 감염성 결장염을 포함한다. 결장염은 감염, 자가면역성, 및/또는 약리학적 작용(예를 들면, 비-스테로이드성 소염 약물(NSAID))과 관련될 수 있다.
본원에 사용된 것으로서, "염증성 장질환(IBD)"은 UC 및 크론병을 포함한다. 크론병 및 UC는 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈 및 피로를 포함하나, 이에 한정되지 않는 증상을 특징으로 하는 각각 만성의 재발 및 경감 형태의 염증성 질병이며 또한 빈혈, 오심 및 체온 증가(열)을 또한 포함할 수 있다. 크론병은 위장(GI) 관, 예를 들면, 결장의 특정 부분에 영향을 미칠 수 있으며 고르지 못한, 경점막 및 점막 염증을 특징으로 한다. UC에서, 염증은 직장으로부터 근위적으로 연속하여 연장되어 있으며 일반적으로 결장에 한정된다.
"결장염의 치료" - 본원에 사용된 것으로서, "결장염의 치료"는 결장 질환으로 고생하는 환자가 나타낸 하나 이상의 증상에 있어서의 감소를 특징으로 한다. 예를 들면, 치료는 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와(crypt loss), 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 복부 팽창, 경련 통증 또는 불편함, 설사, 오심, 체온 증가, 체중 감소, 직장 출혈, 빈혈 및 피로 중 하나 이상의 감소 중 어느 하나 이상에 의해 특징화될 수 있다. 증상에 있어서의 이러한 감소는 증상이 빈도가 거의 없어지거나, 거의 심각해지지 않거나, 또는 둘 다에 의해 특징화될 수 있다.
치료는 예방학적 또는 치료학적일 수 있다. 예방학적 치료는 증상의 발병의 예방으로 특징화될 수 있다. 예를 들면, 결장염 환자는 증상 발생과 위기 사이의 완화 기간을 거칠 수 있다. 예방학적 치료는 추가의 증상 발생의 발병을 예방할 수 있거나 완화 기간을 연장할 수 있다. 치료학적 치료는 결장염의 진행중인 증상발생의 완화로 특징화될 수 있다. 예를 들면, 치료학적 치료는 증상발생 동안 증상의 빈도 및/또는 심각성의 완화를 제공할 수 있거나, 환자가 완화 상태로 도입되도록 할 수 있다. 치료학적 치료는 결장염 환자를 전적으로 치유할 수 있다.
본원에 사용된 것으로서, "측정가능한 생리학적 매개변수에 있어서의 개선"은 어떠한 제공된 생리학적 매개변수에 대해, 개선이 정상 값 또는 이러한 값에 대한 정상 범위, 즉, 건강한 개인에서 예측된 값을 향한 환자에서 이러한 매개변수의 값에 있어서의 변화를 의미하기 위해 사용된다.
예를 들면, 결장염으로 고생하는 환자에서, 측정가능한 매개변수에 있어서의 개선은 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는(즉, 혈액/혈장) 노르에피네프린에 있어서의 증가, 장 조직 및/또는 순환에서 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로와 같은 하나 이상의 증상에 있어서의 감소 중 어느 하나일 수 있다.
적합한 생리학적 매개변수는 환자의 신경에서 활동 전위 또는 활동 전위의 양식일 수 있다. 이러한 매개변수에 있어서의 개선은 개입 전보다는 건강한 개인에 의해 나타나는 것에 보다 밀접하게 유사한 신경에서 활동 전위 또는 활동 전위의 양식으로 특징화된다.
본원에 사용된 것으로서, 생리학적 매개변수는 당해 매개변수가 개입이 수행되지 않은 경우 대상체 또는 환자에 의해 나타난 이러한 매개변수의 평균 값으로부터의 조절의 결과로서 변하지 않을 경우, 즉, 이것이 이러한 매개변수에 대해 기본 값에서 멀어지지 않는 경우 신경세포 활동의 조절에 의해 영향받지 않는다.
숙련가는 개인에서 어떠한 신경세포 활동 또는 생리학적 매개변수에 대한 기본선이 고정되거나 특정 값일 필요는 없지만, 정상 범위 내에서 변동을 거듭할 수 있거나 관련된 오차 및 신뢰 구간과 관련된 평균 값일 수 있음을 인식할 것이다. 기본선 값을 측정하기에 적합한 값은 당해 분야의 기술자에게 잘 알려져 있을 수 있다.
본원에 사용된 것으로서, 측정가능한 생리학적 매개변수는 검출 시간에 환자가 나타낸 매개변수에 대한 값이 측정되는 경우 환자에서 "검출"된다. 검출기는 이러한 측정을 가능하도록 하는 어떠한 소자이다.
생리학적 매개변수에 대한 "예정된 역치 값(threshold value)"은 당해 값 또는 초과 값은 개입이 적용되기 전에 대상체 또는 환자가 나타내어야만 하는 이러한 매개변수에 대한 값이다. 어떠한 제공된 매개변수에 대해서도, 역치 값은 결장염의 지표 값일 수 있다. 이러한 예적된 역치 값의 예는 역치 교감신경 활성도 미만의 교감신경 활성도, 예를 들면, 건강한 개인에서의 교감신경 활성도; 역치 NE 수준 이상의 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준, 예를 들면, 건강한 개인에서의 NE 수준; 건강한 개인의 특징보다 더 큰 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)의 장 조직 및/또는 순환하는 수준을 포함한다. 어떠한 제공된 매개변수에 적절한 값도 숙련가에 의해 단순히 측정될 수 있다.
제공된 생리학적 매개변수에 대한 이러한 역치 값은, 환자가 나타낸 값이 역치를 초과하는 경우, 즉, 나타낸 값이 예정된 역치 값보다 이러한 매개변수에 대한 정상 또는 건강한 값에서 크게 벗어난 경우, 초과된다.
본원에 사용된 것으로서, 교감신경 활성도는 교감신경 신경세포 활동으로부터 생성되는 전체적인 생리학적 균형을 의미하기 위해 사용된다. 이러한 교감신경 활성도는 당해 분야에 공지된 방법, 예를 들면, 신경학적 방법, 혈류역학적 방법(예를 들면, 심 박동수, 혈압, 심박 변이) 또는 순환하는 혈장/뇨 생물지표에 의해 측정할 수 있다.
본원에 사용된 것으로서 "신경조절 장치"는 신경의 신경세포 활동을 조절하도록 구성된 장치이다. 본원에 기술된 신경조절 장치는 신경에 시그널을 효과적으로 적용할 수 있는 적어도 하나의 변환기를 포함한다. 신경조절 장치가 환자에 적어도 부분적으로 이식된 이들 구현예에서, 환자에게 이식될 장치의 소자는 이들이 이러한 이식에 적합하도록 구성된다. 이러한 적합한 구성은 숙련가에게 잘 알려져 있을 수 있다. 실제로, 다양한 완전히 이식가능한 신경조절 장치, 예를 들면, SetPoint Medical, in clinical development for the treatment of rheumatoid arthritis (Arthritis & Rheumatism, Volume 64, No. 10 (Supplement), page S195 (Abstract No. 451), October 2012. "Pilot Study of Stimulation of the Cholinergic Anti-Inflammatory Pathway with an Implantable Vagus Nerve Stimulation Device in Patients with Rheumatoid Arthritis", Frieda A. Koopman et al)의 미주 신경 자극기, 및 INTERSTIMTM 장치(Medtronic, Inc), 과민성 방광의 치료시 천골 신경 조절에 활용된 완전히 이식가능한 장치와 같이 현재 이용가능하다. 특정의 구현예에서, 신경조절 장치, 또는 장치 또는 시스템의 이식가능한 부위는 1cm 미만의 크기로 소형화될 수 있다.
본원에 사용된 것으로서, "이식된"은 환자의 체내에서 적어도 부분적으로 위치함을 의미하기 위해 사용된다. 부분 이식은 장치(또는 기구 또는 시스템)의 부분만이 이식되는 것, 즉, 장치의 부분만이 환자의 체내에 위치하고, 장치의 다른 소자는 환자의 신체의 외부에 위치함을 의미한다. 용어 "전체적으로 이식된"은 장치의 전체가 환자의 체내에 위치됨을 의미한다. 의심할 여지없이, "전체적으로 이식된" 장치는 장치와는 독립적이지만 실제로, 환자의 신체와 독립적으로 형성되고 이의 외부에 존재하는, 이의 기능(예를 들면, 원격 무선 충전 유닛 또는 원격 무선 수동 중단 유닛)에 유용한, 추가의 소자를 배제하지 않는다.
본원에 사용된 것으로서, 전류(예를 들면, DC 전류)와 관련하여 "전하-균형된"은 적용되는 전류의 결과로서 어떠한 시스템(예를 들면, 신경) 내로 도입된 양 전하 또는 음 전하가 전체적으로(즉, 순수하게) 중성을 달성하도록 하기 위해 반대 전하의 도입으로 균형을 이루게 하는 것을 의미하기 위해 사용된다.
본원에 나타낸 것으로서, 결장염은 비장 신경 및/또는 상부 장간막신경총의 신경세포 활동의 조절에 의해 완화되고/되거나 예방될 수 있는 것으로 확인되었다.
IBD의 치료에 관한 앞서의 연구는 미주 신경(때때로 미주신경 신경으로 언급됨), 특히 좌측 경부 미주에 촛점을 맞추고 있으며, 이는 콜린성(즉, 부교감신경) 시그널링을 통해 소염 효과를 매개하는 것으로 고려되었다. 그러나, 놀랍게도 본원에서 장에 대한 교감신경(즉, 아드레날린성) 신경세포 시그널링은 결장염 모델에서 소염 반응에 요구됨이 밝혀졌다. 특히, 비장 신경 또는 SMP, 또는 둘 다를 통한 복강 신경절로부터 장에의 교감신경 시그널링은 결장염의 중증도에 조절시 역활을 담당하는 것으로 밝혀져 있다. 이는 어떠한 소염 효과도 이에 의해 매개된 메카니즘으로서 장에 대해 부교감신경성 미주신경 시그널링을 지시하는 것으로 추정된 앞서의 가설과는 대조적이다. 더욱이, 본 발명자는 장에 대한 이러한 교감신경 시그널링이 또한 미주 신경의 소염 효과와는 독립적으로 소염 효과를 매개한다는 것을 밝혀내었다.
비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및 SMP 중 하나 또는 둘 다에서 신경세포 활동의 조절이 결장염을 완화시키게 될 것임은 본원에서 추가로 입증된다. 본 개시내용 전체에서, 비장 신경을 참고하는 경우, 이러한 참고는 비장을 신경자극전달하는 어떠한 교감 신경도 포함하는 것으로 이해되어야 한다. 미주 신경보다 장과 더 멀고 보다 구체적으로 관련된 신경의 신경세포 활동을 조절함으로써, 본 발명은 또한 미주 신경 자극(때때로 미주신경 신경 자극으로 언급되며, 본원에 사용된 바와 같이, 당해 용어 미주 신경 및 미주신경 신경은 상호교환적으로 사용될 수 있다)과 흔히 관련된 원치않는 부작용의 위험 없이 결장염을 치료할 수 있다.
따라서, 비장 신경 및/또는 SMP의 신경세포 활동을 조절하는 신경조절 장치는 효과적인 결장염 치료를 제공한다.
따라서, 본 개시내용은 환자의 비장 신경 및/또는 SMP의 신경세포 활동을 조절하기 위한 기구 또는 시스템을 제공하며, 당해 기구 또는 시스템은: 비장 신경 또는 SMP에 제1의 시그널을 적용하도록 구성된 제1의 변환기 및 임의로 제2의 시그널을 SMP 또는 비장 신경의 다른 것에 적용하기 위한 제2의 변환기; 및 변환기 또는 변환기들에 커플링된 제어기(당해 제어기는, 시그널이 이것이 적용된 신경(즉, 적절하게는 비장 신경 및/또는 SMP)의 신경세포 활동을 조절하여 환자에서 생리학적 반응을 생산하도록, 변환기 또는 변환기들에 의해 적용된 시그널을 조절한다)를 포함한다.
기구 또는 시스템이 적어도 2개의 변환기를 갖는 이들 구현예에서, 각각의 변환기가 적용하도록 구성된 시그널이 독립적으로 선택된다. 특정의 구현예에서, 각각의 변환기는 동일한 시그널을 적용하도록 구성된다.
시그널의 다음의 설명 및 구현예는 장치에 의해 적용된 어떠한 시그널에도 적용되는데, 즉, 제1 및 제2의 시그널, 및 장치에 의해 적용된 어떠한 추가의 시그널과는 독립적으로 적용될 수 있다.
특정의 구현예에서, 하나 이상의 변환기에 의해 적용된 시그널은 전기 시그널, 광학 시그널, 초음파 시그널 또는 열 시그널이다.
특정의 구현예에서, 하나 이상의 변환기 각각은 하나 이상의 전극, 하나 이상의 광원, 하나 이상의 초음파 변환기, 하나 이상의 열원, 또는 시그널이 효과적이도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
특정의 구현예에서, 하나 이상의 변환기에 의해 적용된 시그널 또는 시그널들은 전기 시그널, 예를 들면, 전압 또는 전류이다. 특정의 이러한 구현예에서 적용된 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 낮은 전파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 예를 들면 1 내지 15Hz, 바람직하게는 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA, 예를 들면 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형(AC square biphasic form)을 포함한다.
숙련가에게 익숙한 바와 같이, 시그널의 전류 또는 전압은 어떠한 제공된 장치-신경 배열에 대한 다른 매개변수의 의도된 값을 달성하기 위하여 변할 수 있다.
특정의 구현예에서, 시그널은 DC 램프에 이어서 플래토우(plateau) 및 전하-균형에 이어서, 제1의 AC 파형을 포함하며, 여기서 제1의 AC 파형의 크기는 상기 제1의 AC 파형이 적용된 후, 제1의 AC 파형보다 더 낮은 크기 및/또는 더 낮은 주파수를 갖는 제2의 AC 파형이 적용되는 기간 동안 증가한다. 특정의 이러한 구현예에서, DC 램프, 제1의 AC 파형 및 제2의 AC 파형은 실질적으로 연속적으로 적용된다.
특정의 구현예에서, 상기 시그널은 킬로헤르츠 주파수의 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 하나 이상의 AC 파형을 포함하고, 각각의 AC 파형은 5 내지 25 kHz, 임의로 10 내지 25 kHz, 임의로 15 내지 25 kHz, 임의로 20 내지 25 kHz의 AC 파형으로부터 독립적으로 선택된다. 특정의 구현예에서, 시그널은 5 kHz의 AC 파형 시그널을 포함한다. 특정의 대안적 구현예에서, 시그널은 25 kHz의 AC 파형을 포함한다.
적용된 시그널이 전기 시그널인 이들 구현예에서, 하나 이상의 변환기 중 적어도 하나는 전기 시그널을 적용하도록 구성된 전극이다. 특정의 이러한 구현예에서, 모든 변환기는 전기 시그널, 임의로 동일한 전기 시그널을 적용하도록 구성된 전극이다.
적용된 시그널이 전기 시그널인 특정의 구현예에서, 당해 시그널은 커프 전극(cuff electrode)에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
적용된 시그널이 말단 시그널인 특정의 구현예에서, 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 증가시킨다(즉, 신경을 가열한다). 특정의 구현예에서, 상기 시그널은 신경을 가열 및 냉각 둘 다를 수행한다.
적용된 시그널이 열 시그널인 이들 구현예에서, 하나 이상의 변환기 중 적어도 하나는 열 시그널을 적용하도록 구성된 변환기이다. 특정의 이러한 구현예에서, 모든 변환기는 열 시그널, 임의로 동일한 열 시그널을 적용하도록 구성된다.
특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널을 적용하도록 구성된 열전 효과(Peltier element)를 포함하며, 임의로 하나 이상의 변환기 각각은 열전 효과를 포함한다. 특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널(예를 들면, 근적외선(NIR) 다이오드 레이저)를 적용하도록 구성된 레이저 다이오드를 포함하며, 임의로 하나 이상의 변환기 중 모두는 열 시그널을 적용하도록 구성된 레이저 다이오드를 포함한다. 특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널을 적용하도록 구성된 전기 저항 소자를 포함하며, 임의로 하나 이상의 변환 중 각각은 열 시그널을 적용하도록 구성된 전기 저항 소자를 포함한다.
특정의 구현예에서, 적용된 시그널은 기계적 시그널, 임의로 초음파 시그널이다. 특정의 대한적인 구현예에서, 기계적 시그널은 압력 시그널이다.
특정의 구현예에서, 시그널은 전자기 시그널, 임의로 광학 시그널이다. 특정의 이러한 구현예에서, 하나 이상의 변환기는 광학 시그널을 적용하도록 구성된 레이저 및/또는 발광 다이오드(예를 들면, NIR 다이오드 레이저)를 포함한다. 일부 구현예에서, 상기 기구 또는 시스템은 하나 이상의 변환기로부터 적어도 하나의 신경으로 시그널을 적용하도록 구성된 광 섬유 인터페이스(fibre optic interface)를 포함한다.
특정의 구현예에서, 환자에서 생산된 생리학적 반응은 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는/혈장 노르에피네프린에 있어서의 증가, 장 조직 및/또는 혈장에서 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로와 같은 하나 이상의 증상에 있어서의 감소 중 하나 이상이다.
특정의 구현예에서, 환자에서 생산된 생리학적 반응은 환자의 신경내 활동 전위의 양식에 있어서의 개선일 수 있는데, 즉, 개입 전보다 건강한 개인에 의해 나타난 것에 보다 근접하게 유사한 신경내 활동 전위의 양식일 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경, SMP 또는 미주 신경이다.
특정의 구현예에서, 상기 기구 또는 시스템은 환자에서 하나 이상의 생리학적 매개변수를 검출하기 위한 검출기 소자를 추가로 포함한다. 이러한 검출기 소자는 하나 이상의 생리학적 매개변수를 검출하도록 구성될 수 있다. 즉, 이러한 구현예에서, 각각의 검출기는 하나 이상의 생리학적 매개변수, 예를 들면, 모든 검출된 생리학적 매개변수를 검출할 수 있다. 대안적으로, 이러한 구현예에서, 하나 이상의 검출기 소자 각각은 검출된 하나 이상의 생리학적 매개변수 중 별개의 매개변수를 검출하도록 구성된다.
이러한 특정의 구현예에서, 제어기는 하나 이상의 생리학적 매개변수를 검출하도록 구성된 검출기에 커플링되어, 생리학적 매개변수가 예정된 역치 값에 충족하거나 초과하는 것으로 검출되는 경우 변환기 또는 변환기들이 이들의 각각의 시그널을 적용하도록 한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, 칼프로텍틴)의 순환하는 수준 중 하나 이상이다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있으며, 여기서 상기 활동 전위 또는 활동 전위의 양식은 결장염과 관련된다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 상기 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면, 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수 중 어떠한 2개 이상은 나란히 또는 연속해서 검출될 수 있다. 예를 들면, 특정의 구현예에서, 제어기는 SGM에서 활동 전위의 양식 및 또한 교감신경 활성도의 지표로서 환자의 심박수 변동성을 검출하도록 구성된 검출기 또는 검출기들에 커플링된다.
특정의 구현예에서, 시그널의 적용 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 이러한 부분내 기본선 신경세포 활동과 비교하여 증가된 신경의 적어도 일부분에서의 신경세포 활동을 생성한다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동일하게 교차할 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널의 적용 결과는 전체 신경에 따른 신경세포 활동에 있어서의 증가이다. 결장염의 치료는 비장 신경 또는 SMP 중의 하나 또는 둘 다에 의한 교감신경 시그널링이 증가되는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 시그널은 낮은 주파수의 AC 파형을 포함하는 전기 시그널이다. 특정의 구현예에서, 상기 전기 시그널은 저 주파수 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA, 예를 들면 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면, 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 구현예에서, 시그널은 사각형 파형이다.
특정의 구현예에서, 전기 시그널은 20-500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형(biphasic waveform)을 포함한다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 신경내 활동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경내 활동 전위의 수득되는 양식이 시그널이 적용되기 전보다 건강한 대상체에서 관찰된 신경 또는 신경들내 활동 전위의 양식과 더 근접하게 유사하도록 조절된다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경의 부분에서의 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 시그널이 적용되기 전 신경의 이러한 부분에서의 신경세포 활동과 비교하여 감소된 신경세포 활동을 가져온다.
신경세포 활동의 조절은 다양한 다른 방식으로 신경세포 활동을 변경시키는 것, 예를 들면, 활동의 특수한 부분을 증가시키거나 억제하고 활동의 새로운 요인, 예를 들면, 특히 시간 간격, 특히 특수한 양식 등에 따라, 주파수 대역에서 자극하는 것을 포함할 수 있다. 신경세포 활동의 이러한 변경은 예를 들면 기본선 활동과 관련하여 증가 및/또는 감소 둘 다를 나타낼 수 있다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 시간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 교호하는 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 시간의 특정한 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호되는 이러한 구현예에서, 시그널은 1일에 걸쳐 불연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 시그널은 환자가 특정의 생리학적 상태에 있는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염 발생을 경험하는 경우에만, 즉, 이들이 결장염 위기 또는 발생과 관련된 하나 이상의 증상, 예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 상승 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면 이들이 병의 발생을 경험한 상태)는 환자에 의해 나타낼 수 있다. 대안적 구현예에서, 환자의 상태는 환자로부터의 어떠한 조언과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함하며, 여기서 시그널은 검출기가 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 비정상적인(예를 들면, 감소된) 교감신경 활성도를 나타내는 경우에만 적용된다.
특정의 이러한 구현예에서, 기구 또는 시스템은 이를 통해 환자의 상태(예를 들면, 이들이 결장염의 증상을 경험하고 있는 상태)가 환자 또는 주치의에 의해 나타날 수 있는 통신, 또는 조언, 요소를 추가로 포함한다. 대안적 구현예에서, 상기 기구 또는 시스템은 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함한다. 임의로, 시그널은 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다.
특정의 대안적 구현예에서, 제어기는 시그널이 영구적으로 적용되도록 한다. 즉, 일단 시작하면, 시그널은 신경 또는 신경들에 지속적으로 적용된다. 시그널이 일련의 펄스인 구현예에서, 펄스와 펄스 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지 않음이 인식될 것이다.
기구 또는 시스템의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널이 중지하면, 신경 또는 신경들 내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간내에 기본선 신경세포 활동으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안의 구현예에서, 시그널 또는 시그널들의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지시, 신경 또는 신경들내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후에 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 적용(및 임의로 중지)시, 신경 또는 신경들에서의 신경세포 활동은 조절 전 대상체에서 보다 건강한 피험자에서 관찰된 신경(들)에서의 활동 전위의 양식과 유사하며, 바람직하게는 실질적으로 건강한 대상체에서 관찰된 신경(들)에서의 활동 전위 양식과 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지시 신경 또는 신경들의 활동 전위의 양식은 건강한 개인에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중단시, 신경 또는 신경들에서의 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 야기할 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프(feedback loop)의 결과, 즉, 대장염을 유발하는 근본적인 염증 상태는 장치 및 청구된 방법의 사용의 결과인 것으로 취급되며, 이로 인해 원심성의 감각적인 미주신경 활성도가 건강한 개인의 것으로 적어도 부분적으로 회복되도록 장으로부터의 구심성(즉, 감각적인) 시그널(예를 들면, 구심성 미주신경 시그널)이 변경되도록 한다. 이러한 수정 메카니즘은 면역-신경세포 반영을 통해 매개될 수 있다.
특정의 구현예에서, 장치 또는 시스템 (또는 이의 적어도 하나의 부품)은 환자로의 적어도 부분적인 이식에 적합하다. 특정의 이러한 구현예에서, 장치 또는 시스템(또는 이의 부품)은 환자에서 완전히 이식되기에 적합하다.
특정의 구현예에서, 장치 또는 시스템은 하나 이상의 전원 공급 소자, 예를 들면, 배터리 및/또는 하나 이상의 통신 소자를 추가로 포함한다.
본 발명은 환자에서 대장염, 특히 IBD를 치료하는 방법을 제공하며, 당해 방법은 위에서 기술한 바와 같은 장치 또는 시스템의 하나 이상의 구성 부품을 이식하는 단계, 상기 장치 또는 시스템의 제1의 변환기를 환자의 비장 신경 또는 SMP와 시그널 접촉하도록 위치시키는 단계, 및 상기 장치 또는 시스템을 활성화시키는 단계를 포함한다. 이러한 구현예에서, 상기 변환기는 시그널이 신경에 효과적으로 적용될 수 있도록 위치하는 경우 신경과 시그널 접촉한다. 상기 장치 또는 시스템은 당해 장치 또는 시스템이, 상기 시그널이 제어기에 의해 결정된 바와 같이 적용되도록 하는 작동 상태에 있는 경우 활성화된다.
특정의 국면에서, 상기 방법은 상기 장치 또는 시스템의 제 2의 변환기를 환자의 SMP 또는 비장 신경과 시그널 접촉하도록 위치시킴을 포함하며, 이때 어느 하나는 제1의 변환기와 시그널 접촉하지 않는다.
본 발명의 모든 측면의 실행(상기 및 하기 둘 다에서 논의 된 바와 같음)은도 2a 내지 도 2c를 참조하여 더 잘 이해 될 것이다.
도 2a 내지 2c는 본원에 기술된 다양한 방법 중 임의의 것을 수행하기 위해 환자에게 이식되거나, 환자 상에 위치되거나, 그렇지 않으면 배치되는 하나 이상의 신경조절 장치를 사용하여 본 발명이 실행되는 방법을 도시한다. 이러한 방식으로, 하나 이상의 신경조절 장치를 사용하여 환자의 비장 신경 및/또는 SMP, 임의로 비장 신경 및 SMP 둘 다에서 신경세포 활동을 조절함으로써 결장염, 예를 들면 IBD(크론병 또는 UC)를 치료할 수 있다.
도 2b 및 도 2c 각각에서, 별도의 신경조절 장치(100)는, 본원에서 논의된 바와 같이, 장치가 SMP 또는 비장 신경 중 단지 하나와 관련하여 제공되거나 사용될 수 있지만, 비장 신경 및 SMP 각각에 대해 제공된다. 유사하게, 본원에서 논의 된 바와 같이, 하나의 장치는 비장 신경 및 SMP 둘 다와 관련하여 제공되거나 사용될 수 있는데, 즉, 하나의 장치는 신경 둘 다에 시그널을 적용하도록 구성되어 제공된다.
각각의 신경조절 장치(100)는, 각각의 신경 또는 신경들의 신경 조절을 제공하도록, 환자 내에 완전히 또는 부분적으로 이식되거나, 기타의 경우에는 위치할 수 있다. 각각의 신경조절 장치(100)는 독립적으로 작동할 수 있거나, 서로 통신하도록 작동할 수 있다. 도 2a는 또한 이식된 신경조절 장치(100)의 부품을 개략적으로 나타내며, 여기서 상기 장치는 단일 유닛과 함께 그룹화되어 환자에 이식된 수개의 소자, 부품 또는 기능을 포함한다. 제1의 이러한 소자는 제1의 변환기, 바람직하게는 환자의 비장 신경 또는 SMP(90)에 근접하여 나타낸 전극(102)이다. 기술된 바와 같이, 장치(100)는 SMP 또는 비장 신경에 대해 구성되고 근접하게 위치된 제2의 변환기를 포함할 수 있으며, 이중 어느 것은 제1의 변환기와 시그널링 접촉하지 않는다(나타내지 않음). 변환기(102)는 제어기 소자(104)에 의해 작동될 수 있다. 장치는 통신 소자(106), 검출기 소자(108), 전원 소자(110) 등과 같은 하나 이상의 추가의 소자를 포함할 수 있다. 위에서 기술한 바와 같이, 변환기(102)는, 이식되는 경우, 이것이 신경(SMP 또는 비장 신경) 및 관련된 혈관(예를 들면, SMP 및 관련 장간막 동맥)을 포함하도록 구성된 커프 전극 형태일 수 있다.
각각의 신경조절 장치(100)는 하나 이상의 제어 시그널과는 독립적으로, 또는 이에 반응하여 필요한 신경조절을 수행할 수 있다. 이러한 제어 시그널은 하나 이상의 검출기 소자(108)의 출력에 응답하고/하거나 통신 소자를 사용하여 수신된 하나 이상의 외부 공급원으로부터의 통신에 대해 반응하여, 알고리즘에 따라 제어기(104)에 의해 제공될 수 있다. 본원에 논의 된 바와 같이, 검출기 소자(들)은 각종의 상이한 생리학적 매개 변수에 대해 반응성일 수 있다.
도 2b는 도 2a의 장치 또는 시스템이 상이하게 분포될 수 있는 몇 가지 방법을 도시한다. 예를 들어, 도 2B에서 신경조절 장치(100)는 비장 신경 또는 SMP (90)에 근접하게 이식된 변환기(102)를 포함하지만, 제어기(104), 통신 소자(106) 및 전원(110)과 같은 다른 소자는, 또한 이식될 수 있는(도 2b에서와 같이), 또는 기타의 경우에는 환자에 의해 운반될 수 있는 별도의 제어 유닛(130)으로 이식된다. 이후에, 제어 유닛(130)은 예를 들면, 시그널 및/또는 전원을 변환기에 전달하기 위한 전선 및/또는 광섬유를 포함할 수 있는 연결부(132)를 통해 신경조절 장치의 둘 다에서 변환기를 조절한다.
도 2b의 배열에서, 하나 이상의 검출기(108)는, 이러한 검출기 중 하나 이상이 또한 또는 대신 제어 유닛(130) 내에 및/또는 신경조절 장치(100) 중 하나 또는 둘 다에 위치할 수 있다고 해도, 제어 유닛으로부터 별도로 위치한다. 상기 검출기는 환자의 하나 이상의 생리학적 매개변수를 검출하는데 사용될 수 있으며, 이후에 상기 제어기 소자 또는 제어 유닛은 예를 들면, 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만, 검출된 매개변수(들)에 반응하여 시그널을 적용하도록 한다. 이러한 목적을 위해 검출될 수 있는 생리학적 매개 변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)의 순환하는 수준을 포함한다. 유사하게, 검출된 생리학적 매개변수는 환자의 신경, 예를 들면, 비장 신경, SMP 또는 미주 신경에서의 활동 전위 또는 활동 전위이 양식일 수 있다.
다양한 기능성 소자가 신경조절 장치로 위치하여 그룹화될 수 있는 다양한 다른 방식에서, 제어 유닛(130) 및 다른 어느 곳도 물론 가능하다. 예를 들면, 도 2b의 하나 이상의 센서는 도 2a 또는 도 2c의 배열 또는 다른 배열에 사용될 수 있다.
도 2c는 도 2a 또는 2b의 장치 또는 시스템의 일부 기능이 환자에서 이식되지 않은 일부 방식을 도시한다. 예를 들어, 도 2c에서, 당업자에게 친숙한 방식으로 장치 또는 시스템의 이식 소자에 전력을 제공할 수 있는 외부 전원(140)이 제공되고, 외부 제어기(150)는 제어기(104)의 기능 중 일부 또는 모두를 제공하고/하거나 장치 또는 시스템의 제어의 다른 국면을 제공하고/하거나 상기 장치 또는 시스템으로부터의 데이터 판독을 제공하고/하거나 데이터 입력 설비(152)를 제공한다. 데이터 입력 설비는 예를 들면, 환자의 상태(예를 들면, 이들이 복부 통증 또는 불편함을 겪고 있고, 결장염이 발생되고 있는 경우)에 관한 데이터를 입력하기 위해, 다양한 방식으로 환자 또는 다른 운영자가 사용할 수 있다.
각각의 신경조절 장치는 시그널을 비장 신경 및/또는 SMP에 적용하는 것을 전형적으로 포함하는 하나 이상의 물리적 작동 모드를 사용하여 필요한 신경조절을 수행하도록 채택될 수 있으며, 이러한 시그널은 전형적으로 신경(들)로의(또는 이로부터의) 에너지의 전달을 포함한다. 이미 논의된 바와 같이, 그러한 방식은 전기 시그널, 광 시그널, 초음파 또는 다른 기계적 시그널, 열 시그널, 자기 또는 전자기 시그널을 사용하거나, 필요한 조절을 수행하기 위한 일부 다른 에너지를 사용하여 신경 또는 신경들을 조절하는 것을 포함할 수 있다. 이러한 시그널은 비-파괴적 시그널일 수 있다. 이러한 조절은 신경 또는 신경들에서 신경세포 활동의 양식을 증가, 억제, 차단 또는 기타의 경우 변화시키는 것을 포함할 수 있다. 이러한 목적으로, 도 2a에 도시된 변환기(90)는 하나 이상의 전극, 하나 이상의 광원, 하나 이상의 초음파 변환기, 하나 이상의 열원, 또는 필요한 신경조절이 발휘되도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
신경세포 조절 장치 또는 기구 또는 시스템은, 예를 들면, AC 파형과 같은 전압 또는 전류를 적용시키기 위해 변환기(들)를 사용함으로써 비장 신경 및/또는 SMP의 신경세포 활동을 증가시키도록 배열될 수 있다. 상기 장치 또는 기구 또는 시스템은 저주파수 AC 파형, 예를 들어 주파수가 0.01 Hz 내지 1 kHz, 0.01 내지 500 Hz, 0.01 내지 100 Hz, 0.01 Hz 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 적용하기 위해 변환기(들)을 사용하도록 배열될 수 있다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01Hz, 0.05Hz, 0.1Hz, 0.5Hz, 1Hz, 2Hz, 3Hz, 4Hz, 5Hz, 6Hz, 7Hz, 8Hz, 9Hz 또는 10Hz, 예를 들면, 10Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 상기 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 상기 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10mA 예를 들어 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 직사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 갖는다. 특정의 바람직한 구현예에서, 시그널은 직사각형 파형을 갖는다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(㎲)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 ㎲, 30내지 400 ㎲, 40 내지 300 ㎲, 50 내지 200 ㎲, 60 내지 150 ㎲, 70 내지 120 ㎲, 80 내지 100 ㎲의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 0.1 내지 20V의 전압을 갖는 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 0.1 내지 15V, 임의로 0.1 내지 10V의 전압을 갖는다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V 중에서 선택된다.
특정의 구현예에서, 전기 시그널은 10Hz 0.2mA의 AC 정사각형 이상 파형을 포함한다.
신경세포 활동을 자극하기 위한 신경조절 기술은 열적, 물리적, 화학적 및 전자기 기술을 포함한다.
온도 변화는 뉴우런의 막(membrane) 내 이온 채널에 영향을 미쳐서, 흔히 휴지 전위(resting potential) 및 탈분극화율과 같은 특성에 영향을 미친다. 구체적으로, 고양이의 시상하부 내 가열 영역은 증가된 속도의 자발적인 방전(discharge)을 유발하였다(Teruo Nakayama, HT Hammel, JD Hardy, JS Eisenman American Journal of Physiology Published 1 June 1963 Vol.20 204, 1122-1126, 본원에 참고로 포함됨). 적외선(IR) 방사선의 짧은 펄스를 통한 열의 집중적인 적용은 일시적인 국소 온도 증가를 유발하고 또한 뉴런을 탈분극시킬 수 있다(Goyal V,, 2012 Nov; 295(11): 1987-99, 본원에 참고로 포함됨). 전기적 자극을 초과하는 IR 방사선의 장점은 보다 높은 공간-시간 해상도 및 신경세포 시그널 기록을 방해할 수 있는 전기적 인공물의 회피를 포함한다. 레이저 자극을 추가로 향상시키기 위해, 막 근처에 주입된 플라즈몬 금 나노 막대는 근적외선(IR) 에너지를 열로 변환시키는 것으로 밝혀졌다(Eom K, Small. 2014 Oct 15; 10(19):3853-7 (본원에 참고로 포함됨)). 자기장은 또한 인접 뉴우런에서 활동 전위를 생산하기 위해 나노 입자를 가열함이 밝혀졌다(Heng Huang. Nature Nanotechnoliogy 5, 602-606(2010), 본원에 참고로 포함됨).
기계적 변형은 또한 막 전위를 변화시킬 수 있다. 축삭돌기의 신속하고, 짧은 기간의 기계적 압축은 탈분극을 생산한다(Fred J. Julian and David E. Goldman, The General of Physiology: Published November 1, 1962, 본원에 참고로 포함됨). 또한, 축삭돌기를 신장시키기 위해 하중을 적용하는 것은 축삭돌기가 궁극적으로 탈분극되도록 한다. 20%를 초과하는 신장에서, 축삭돌기는 비가역적으로 손상된다(J. A. Galbraith, J Biomech Eng 115 (1), 13-22 (Feb 01, 1993), 본원에 참고로 포함됨). 초음파는 뇌, 망막 및 달팽이관의 영역을 포함하는 신경세포 조직 구조를 자극하는데 사용되어 왔다(King. R, Ultrasound Med. Biol. July 2014, Vol. 40 Issue 7, pl512, 11; Menz, MD, J Neurosci. 2013 Mar 6;33(10):4550-6Q; LR. Gavriiov, Ultrasound Med Biol, 22(1996), pp. 179-192, 이의 모두는 본원에 참고로 포함됨). 시험관 내 해마 제제를 사용한 연구는 유발된 장 전위(evoked field potential)를 변형시키는 동시 기계적 및 열적 메카니즘을 제안하였다(Bachtoid, M. Ultrasound Med Biol. 1998 May; 24(4):557-65, 본원에 참고로 포함됨). 수 밀리미터(few millimeter) 순서의 초음파 자극의 공간 해상도. 초음파 압력 파장은 조직 내에 깊게 침투할 수 있지만, 음향 임피던스가 불일치하는 조직 계면에서 반사된다.
비-침입성 자기 자극은 뇌, 척수, 신경 뿌리 및 말초 신경을 자극하는데 사용되어 왔다(Rossini, PM et al, Clin Neurophysiol. 2015 Feb, 본원에 참고로 포함됨). 신속하게 변화하는 자기장은 신경세포 조직의 축삭돌기내에서 탈분극화를 유발하는 전류를 생산한다.
위에서 논의된 기술은 원칙적으로 뉴우런 활성의 자극에 관한 것이다. 다양한 방식으로 활성을 억제하거나 차단하거나 또한 활성을 변형시킴에 의한 조절이 필요한 경우, 변환기를 하기 기술된 차단 기술 중 하나 이상을 적용하도록 구성시킬 수 있다.
신경조절의 열 방법은 또한 신경의 온도를 조작하여 시그널 전파를 억제할 수 있다. 예를 들면, Patberg 등(Blocking of impulse conduction in peripheral nerves by local cooling as a routine in animal experimentation; Journal of Neuroscience Methods 1984;10:267-75, 이는 본원에 참고로 포함됨)은 신경을 냉각시키는 것이 반응의 발생 없이 시그널 전도를 수십 초 이하로 발생시켜, 가역적으로 및 신속한 작용 둘 다로 차단하는 방법을 논의하고 있다. 신경을 가열하는 것은 또한 전도를 차단하는데 사용될 수 있으며 작은 이식가능하거나 국재화된 변환기 또는 장치 내에서, 예를 들면, 신속하고, 가역적이며, 공간적으로 매우 국재화된 가열 효과를 제공하기 위해 사용될 수 있는, 레이저 다이오드로부터의 적외선 또는 전기적으로 내성인 소자와 같은 열적 열원을 사용하여 실행하기에 일반적으로 더 용이하다(참고: 예를 들면 Duke et al. J Neural Eng. 2012 Jun;9(3):036003. Spatial and temporal variability in response to hybrid electro-optical stimulation., 이는 본원에 참고로 포함됨). 가열, 또는 냉각, 또는 이들 둘 다는 페티에 소자(Peltier element)를 사용하여 제공될 수 있다.
광유전학기술은 광민감성 특징을 발현하도록 세포를 유전적으로 변형시키는 기술이며, 이는 이후 광으로 활성화시켜 세포 기능을 조절할 수 있다. 신경세포 점화를 억제하는데 사용될 수 있는 많은 상이한 광유전학 도구가 개발되어 왔다. 신경세포 활동을 억제하기 위한 광유전학적 도구의 목록은 편집되어 있다(Epilepsia. 2014 Oct 9. doi: 10.1111/epi.12804. WONOEP appraisal: Optogenetic tools to suppress seizures and explore the mechanisms of epileptogenesis. Ritter LM et al., 이는 본원에 참고로 포함됨). 아크릴아민-아조벤젠-4급 암모늄(AAQ)은 많은 유형의 K+ 채널을 차단하는 광색성 리간드이며, 시스(cis) 배열에서, K+ 채널의 경감은 점화를 억제한다(Nat Neurosci. 2013 Jul;16(7):816-23. doi: 10.1038/nn.3424. Optogenetic pharmacology for control of native neuronal signaling proteins Kramer RHet al, 이는 본원에 참고로 포함됨). 채널 로돕신-2를 채택하여 이를 렌티바이러스로 포유동물 뉴우런에 도입시킴으로써, 억제성 시냅스 전달을 제어하는 것이 가능하다(Boyden ES 2005). 레이저 또는 발광 다이오드와 같은 외부 광원을 사용하는 대신에, 광은 개똥벌레 루시퍼라제를 기본으로 하는 유전자를 도입함으로써 내부적으로 생성될 수 있다(Land BB 2014). 내부적으로 발생된 광은 억제를 생성하기에 충분하다.
신경조절의 기계적 형태는 이식된 초음파 변환기 대신에 편리하게 외적으로 실행될 수 있는 초음파의 사용을 포함할 수 있다. 다른 형태의 기계적 신경조절은 압력의 사용을 포함한다(예를 들면, 참고: "The effects of compression upon conduction in myelinated axons of the isolated frog sciatic nerve" by Robert Fern and P. J. Harrison Br.j. Anaesth. (1975), 47, 1123, 본원에 참고로 포함됨).
신경조절의 일부 전기적 형태는 하나 이상의 전극을 사용하여 신경에 적용된 직류(DC), 또는 교류(AC) 파형을 사용할 수 있다. DC 차단은 DC 파형 진폭을 일반적으로 상향 램핑(ramping up)함으로써 달성할 수 있다(Bhadra and Kilgore, IEEE Transactions on Neural systems and rehabilitation engineering, 2004 12(3) pp313-324, 이는 본원에 참고로 포함됨). 일부 AC 기술은 가역적인 차단을 제공하기 위한 HFAC 또는 KHFAC(고-주파수 또는 킬로헤르츠 주파수)를 포함한다(예를 들면, 참고: Kilgore and Badra, 2004, Medical and Biological Engineering and Computing, 이의 내용은 모든 목적을 위해 본원에 참고로 포함됨). Kilgore 및 Bhadra의 작업에서, 제안된 파형은 3 내지 5 kHz에서의 사인 곡선 파형 또는 직사각형이었으며, 차단을 생산한 대표적인 시그널 진폭은 3 내지 5 Volts 또는 0.5 내지 2.0 밀리 암페어 피크 대 피크였다.
HFAC는 100%의 사용률(duty cycle)에서 1 내지 50 kHz의 주파수에서 전형적으로 적용될 수 있다(Bhadra, N. et al., Journal of Computational Neuroscience, 2007, 22(3), pp 313-326, 이는 본원에 참고로 포함됨). 5 내지 10 kHz의 주파수를 갖는 파형의 적용에 의해 신경의 활동을 선택적으로 차단하는 방법은 제US 7,389,145호(본원에 참고로 포함됨)에 기술되어 있다. 유사하게, 제US 8,731,676호(본원에 참고로 포함됨)는 신경에 5 내지 50 kHz 주파수의 파형을 적용함으로써 감각 신경 통증을 완화시키는 방법을 기술하고 있다.
본 발명은 또한 환자에서 결장염, 특히 IBD를 치료하는 방법을 제공하며, 당해 방법은 시그널을 환자의 비장 신경 및/또는 상부 장간막신경총(SMP)에 적용하여 환자에서 신경의 신경세포 활동을 조절하는 것을 포함한다. 특정의 구현예에서, 제1의 시그널은 비장 신경에 적용되고 제2의 시그널은 SMP에 적용된다.
특정의 구현예에서, 시그널 또는 시그널들은 각각의 시그널에 적용시키도록 구성된 변환기, 바람직하게는 전기 시그널을 적용하기 위한 전극을 포함하는 신경조절 장치에 의해 적용된다. 특정의 바람직한 구현예에서, 신경조절 장치는 환자 내에 적어도 부분적으로 이식된다. 특정의 바람직한 구현예에서, 신경조절 장치는 환자 내에 전체적으로 이식된다.
제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 특정의 구현예에서, 시그널 둘 다는 동일한 신경조절 장치에 의해 적용되며, 당해 장치는 제1의 시그널을 적용시키기 위한 1개 및 제2의 시그널을 적용시키기 위한 1개의, 적어도 2개의 변환기를 갖는다. 특정의 대안적인 구현예에서, 제1의 시그널은 하나의 신경조절 장치에 의해 적용되고 제2의 시그널은 별도의 신경조절 장치에 의해 적용된다.
특정의 구현예에서, 시그널은 이것이 적용되는 신경을 자극하도록 구성된다. 특정의 구현예에서, 시그널은 이것이 적용되는 신경내 신경세포 활동을 증가시키도록 구성된다(전체 신경, 또는 신경의 신경 섬유의 소세트의 총 시그널링 활동에 있어서의 증가는 이러한 신경 또는 이의 소세트내 기본선 신경 활동과 비교된다).
특정의 바람직한 구현예에서, 상기 방법은 IBD를 치료하는 방법이다. 특정의 이러한 구현예에서, 상기 방법은 궤양성 결장염 또는 크론병을 치료하는 방법이다.
특정의 구현예에서, 결장염의 치료는 예방학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 빈도를 감소시키고/시키거나 완화 기간을 연장시킨다.
특정의 구현예에서, 결장염의 치료는 치료학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 중증도를 적어도 부분적으로 경감시키거나 완화시킨다. 예를 들면, 특정의 구현예에서 상기 방법은 발생 동안 증상의 빈도 및/또는 중증도의 완화를 제공하거나, 환자가 완화 상태로 도입되도록 한다. 치료학적 치료는 전적으로 결장염 환자를 치유할 수 있다.
특정의 구현예에서, 결장염의 치료는 측정가능한 생리학적 매개변수에 있어서의 개선, 예를 들면, 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가, 하나 이상의 염증성 마커(예를 들면, 장 조직 및/또는 순환에서의 염증성 사이토킨(예를 들면, TNF알파, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직학에 의해 측정된 것으로서, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 증상 중증도의 감소(복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 체온 증가 및 피로 중 하나 이상의 감소) 중 어느 하나 이상에 의해 나타낸다.
어떠한 제공된 매개변수에 대한 값을 측정하기에 적합한 방법은 숙련가에 의해 인식될 수 있다.
특정의 구현예에서, 상태의 치료는 시그널이 적용되는 신경 또는 신경들내 신경세포 활동의 프로파일에 있어서의 개선으로 나타난다. 즉, 상태의 치료는 건강한 개인에서 신경세포 활동에 도달하는 신경(들)내 신경세포 활동, 즉, 개입 전 보다 건강한 개인에 의해 나타난 보다 근접하게 유사한 신경내 작동 전위의 양식으로 나타난다.
다음의 설명 및 구현예는 시그널이 비장 신경에 적용되는 구현예, 시그널이 SMP에 적용되는 구현예, 및 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예들 각각에 대해 독립적으로 적용된다. 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예에서, 제1 및 제2의 시그널은 독립적으로 선택된다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 일부분에서 기본선 신경세포 활동과 비교하여 신경의 적어도 일부분내 신경세포 활동이 증가되는 것을 가져온다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동등하게 달성될 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널을 적용하는 결과는 전체 신경에 걸쳐 신경세포 활동에 있어서의 증가이다. 결장염의 치료는 비장 신경 또는 SMP, 또는 이들 둘 다에 의한 교감신경 시그널링이 증가되는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 하나 이상의 변환기에 의해 적용된 시그널 또는 시그널들은 전극, 예를 들면, 전압 또는 전류에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 적용된 시그널은 전하가 균형을 이룬 직류(DS) 파형과 같은 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다이다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 전기 시그널은 낮은 주파수의 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내(예를 들면, 비장 신경 또는 SMP 이외의 신경내) 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 시그널이 적용되기 전 신경의 일부분에서 신경세포 활동과 비교하여 감소된 신경의 적어도 일부분내 신경세포 활동을 가져온다. 따라서, 특정의 구현예에서 시그널의 적용 결과는 신경내 신경세포 활동의 적어도 부분적인 억제이다. 특정의 구현예에서, 시그널의 적용 결과는 신경 또는 신경들내 신경세포 활동의 완전한 억제이다.
특정의 구현예에서, 시그널의 적용 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경 또는 신경들내 작동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경 또는 신경들내 활동 전위의 수득되는 양식이 건강한 대상체에서 관찰된 신경(들)내 활동 전위의 양식과 유사하도록 조절된다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 시간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 또는 1시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 대안의 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 특정의 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호되는 이러한 구현예에서, 시그널은 1일에 걸쳐 연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
시그널이 간헐적으로 적용되는 특정의 구현예에서, 시그널은 환자가 특이 상태인 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염 발생을 경험하는 경우에만, 즉, 환자가 결장염 위기와 관련된 하나 이상의 증상, 예를 들면, 복부 통증 또는 불편함, 설사, 체중 감소, 직장 출혈 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면, 이들이 결장염의 발생(결장염 발생)을 경험한 상태)는 환자에 의해 나타낼 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 장치는 환자가 이들의 상태를 나타낼 수 있도록 하는 입력 소자를 추가로 포함할 수 있다. 대안적인 이러한 구현예에서, 환자의 상태는 환자로부터의 어떠한 입력과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용된 특정의 구현예에서, 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함할 수 있으며, 여기서 시그널은 검출기가 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다.
본 발명에 따른 방법의 특정한 구현예에서, 본 발명은 환자의 하나 이상의 생리학적 매개변수를 검출하는 단계를 추가로 포함하며, 여기서 상기 시그널은 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만 적용된다. 하나 이상의 생리학적 매개변수가 검출되는 이러한 구현예에서, 시그널은 검출된 매개변수들 중의 어느 하나 만이 이의 역치 값을 충족하거나 초과하는 경우에만, 대안적으로 검출된 매개변수들 중 어느 모두가 이들의 역치 값을 충족하거나 초과하는 경우에만 적용될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 하나 이상의 생리학적 매개변수가 검출되도록 구성된 적어도 하나의 검출 소자를 추가로 포함한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 혈장 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)의 장 조직 및/또는 혈장 수준으로부터 선택된다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있다. 특정의 이러한 구현예에서, 활동 전위 또는 활동 전위의 양식은 결장염과 관련될 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수 중 어느 2개 이상이 일렬로 또는 연속적으로 검출될 수 있음은 인식될 것이다. 예를 들면, 특정의 구현예에서, SMP에 있어서의 활동 전위의 양식은 장의 노르에피네프린 수준과 동시에 검출될 수 있다.
특정의 구현예에서, 시그널은 영구적으로 적용된다. 즉, 일단 시작하면, 시그널은 신경에 연속적으로 적용된다.
시그널이 일련의 펄스인 경우, 펄스들 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지는 않는다.
방법의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널이 중지하면, 신경내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간 내에 기본선 신경세포 활동으로 실질적으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지시, 신경내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 적어도 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 중지시, 신경내 신경세포 활동은 조절 전 대상체에서보다 건강한 대상체에서 관찰된 활동 전위의 양식과 보다 더 유사하며, 바람직하게는 실질적으로 건강한 대상체에서 관찰된 활동 전위 양식과 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지시 신경 또는 신경들의 활동 전위의 양식은 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중지시, 신경내 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 가져올 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프의 결과인 것으로 추정된다.
특정의 이러한 구현예에서, 일단 처음 적용되면, 시그널은 상기 구현예에서 기술된 바와 같이, 간헐적으로 또는 영구적으로 적용될 수 있다.
특정의 구현예에서, 적용된 시그널은 비-파괴적인 시그널이다.
본 발명에 따른 방법의 특정의 구현예에서, 적용된 시그널은 하나 이상의 전극으로 구성된 신경조절 장치에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 상기 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 낮은 주파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
적용된 시그널이 전기 시그널인 특정의 구현예에서, 당해 시그널은 커프 전극과 같은 전극에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
특정의 대안적 구현예에서, 적용된 시그널은 전자기 시그널(임의로 광학 시그널), 기계적(임의로 초음파) 시그널, 열 시그널, 자기 시그널 또는 어떠한 다른 유형의 시그널이다. 이러한 구현예에서, 시그널은 적어도 하나의 변환기를 포함하는 신경조절 장치에 의해 적용되며, 상기 변환기는 하나 이상의 광원, 하나 이상의초음파 변환기, 하나 이상의 열원, 또는 각각의 시그널이 작동하도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
시그널이 열 시그널인 특정의 구현예에서, 상기 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 상승시킨다(즉, 신경에 열을 가한다). 특정의 구현예에서, 상기 시그널 둘 다는 신경에 열을 가하고 신경을 냉각시킨다.
시그널이 기계적 시그널인 특정의 구현예에서, 상기 시그널은 초음파 시그널이다. 특정의 대안적 구현예에서, 기계적 시그널은 압력 시그널이다.
본 발명의 장치, 시스템 및 방법을 소염제와 결합시키는 것이 특히 유리할 것이다. 스테로이드(예를 들면, 프레드니솔론 및 하이드로코르티손과 같은 코르티코스테로이드), 5-아미노-살리실레이트((5-ASA)(예를 들면, 메살라진), 면역억제제(예를 들면, 메토트렉세이트, 아자티오프린, 및 사이클로스포린); 및 항-종양괴사인자 제제(항-TNF)(예를 들면, 인프릭시마브 및 아달리무마브)는 IBD와 같은 결장염 상태에 대한 치료로서 이미 사용되고 있다. 이들 제제는 단독으로 사용되는 경우 항상 효과적이지 않으며 골 변성, 정신학적 변화 및 감염과 같은 바람직하지 않은 부작용과 관련되어 있다. 그러나, 본 발명의 방법 및 기구 또는 시스템과 함께 사용되는 경우, 상기 배합은 하나의 개입 단독과 비교하여 개선된 치료 효능을 생성하고/하거나 예를 들면, 필요한 소염제의 투여량을 감소시킴으로써, 환자에 의해 경험된 부작용을 감소시킬 것이다.
따라서, 특정의 구현예에서, 상기 방법은 환자에게 소염제를 투여함을 추가로 포함한다. 특정의 구현예에서, 상기 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF제로부터 선택된다. 특정의 바람직한 이러한 구현예에서, 소염제 및 신경세포 활동의 조절은 매우 동일한 효과를 가지는데, 즉, 각각의 개입에 의해 유발된 소염 효과는 다른 개입에 의해 유발된 소염 효과와 실질적으로 동시적이다. 특정의 이러한 구현예에서, 상기 효과는 상승적일 수 있다.
본 발명의 다른 국면은 환자에서 결장염을 치료하는 방법에 사용하기 위한 소염제를 제공하며, 여기서 상기 방법은 (i) 시그널을 환자의 비장 신경 및/또는 상부 장간막신경총에 적용하여 환자내 신경에서 신경세포 활동을 조절하는 단계; 및 (ii) 소염제를 환자에게 투여하는 단계를 포함한다.
특정의 구현예에서, 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF제로부터 선택된다.
특정의 바람직한 구현예에서, 소염제 및 신경세포 활동의 조절은 동시 효과를 갖는데, 즉 각각의 개입에 의해 유발된 소염 효과는 다른 개입에 의해 유발된 소염 효과와 실질적으로 동시이다. 특정의 이러한 구현예에서, 상기 효과는 상승적일 수 있다.
특정의 구현예에서, 제1의 시그널은 비장 신경에 적용되고 제2의 시그널은 SMP에 적용된다.
특정의 구현예에서, 시그널 또는 시그널들은 각각의 시그널을 적용하도록 구성된 변환기를 포함하는 신경조절 장치에 의해 적용된다. 특정의 바람직한 구현예에서, 상기 신경조절 장치는 환자내에 적어도 부분적으로 이식된다. 특정의 바람직한 구현예에서, 상기 신경조절 장치는 환자내에 전체적으로 이식된다.
제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 특정의 구현예에서, 시그널 둘 다는 동일한 신경조절 장치에 의해 적용되는데, 이러한 장치는 제1의 시그널을 적용하기 위한 1개 및 제2의 시그널을 적용하기 위한 1개로서, 적어도 2개의 변환기를 갖는다. 특정의 대안의 구현예에서, 제1의 시그널은 하나의 신경조절 장치에 의해 적용되고 제2의 시그널은 별도의 신경조절 장치에 의해 적용된다.
특정의 바람직한 구현예에서, 시그널 또는 시그널들은 시그널이 적용된 신경 또는 신경들내 신경세포 활동을 증가시키기 위한 자극 시그널이다. 특정의 이러한 구현예에서 시그널 또는 시그널들은 전극을 포함하는 신경조절 장치에 의해 적용된 전기 시그널이다. 적용된 시그널이 전기 시그널인 특정의 이러한 구현예에서, 당해 시그널은 커프 전극과 같은 전극에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
특정의 바람직한 구현예에서, 소염제는 IBD를 치료하기 위한 것이다. 특정의 이러한 구현예에서, 소염제는 궤양성 결장염 또는 크론병을 치료하는데 사용된다.
특정의 구현예에서, 결장염의 치료는 예방학적 치료이다. 즉, 본 발명의 방법은 결장염 발생 빈도를 감소시키고/시키거나 완화 기간을 연장시킨다.
특정의 구현예에서, 결장염의 치료는 치료학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 중증도를 적어도 부분적으로 경감시키거나 완화시킨다. 예를 들면, 특정의 구현예에서 상기 방법은 발생 동안 증상의 빈도 및/또는 중증도의 완화를 제공하거나, 환자가 완화 상태로 도입되도록 할 수 있다. 치료학적 치료는 결장염 환자를 전적으로 치유할 수 있다.
특정의 구현예에서, 결장염의 치료는 측정가능한 생리학적 매개변수에 있어서의 개선, 예를 들면, 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가, 장 조직 및/또는 순환에서의 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, IL-12p70, MCP-1, IL-17, IL-23, C-반응성 단백질, 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 증상 중증도(예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로)에 있어서의 감소에 의해 나타난다.
어떠한 제공된 매개변수에 대한 값을 측정하기에 적합한 방법은 숙련가에게 익숙할 수 있다.
특정의 구현예에서, 상태의 치료는 시그널이 적용되는 신경 또는 신경들내 신경세포 활동의 프로파일에 있어서의 개선에 의해 나타난다. 즉, 상태의 치료는 건강한 개인에서 신경세포 활동에 도달하는 신경(들)내 신경세포 활동, 즉, 개입 전보다 건강한 개인에 의해 나타난 신경내 활동 전위의 양식과 보다 더 근접하게 유사한 신경내 활동 전위의 양식에 의해 나타난다.
특정의 구현예에서, 소염제는 단계 (i)이 단계 (ii) 전에 수행되고, 여기서 단계(ii)는 단계 (i) 전에 수행되거나, 여기서 단계 (i) 및 단계 (ii)가 동시에 수행되는 방법에서 사용하기 위한 것이다. 특정의 바람직한 구현예에서, 단계 (i)의 소염 효과 및 단계 (ii)의 소염 효과는 실질적으로 동시이다. 즉, 특정의 구현예에서, 소염제 및 신경조절은 실질적으로 동시에 이들의 소염 효과를 발휘한다.
다음의 설명 및 구현예는 시그널이 비장 신경에 적용되는 구현예, 시그널이 SMP에 적용되는 구현예, 및 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예 각각에 대해 독립적으로 적용된다. 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예에서, 제1 및 제2의 시그널은 독립적으로 선택된다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 이러한 부분내 기본선 신경세포 활동과 비교하여 증가된 신경의 적어도 일부분내 신경세포 활동을 가져온다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동등하게 달성될 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널의 적용 결과는 전체 신경에 걸친 신경세포 활동의 증가이다. 결장염의 치료는 비장 신경 또는 SMP, 또는 둘 다에 의한 시그널링이 증가하는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 시그널은 저 주파수의 AC 파형을 포함하는 전기 시그널이다. 특정의 구현예에서, 상기 전기 시그널은 저 주파수 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동에 있어서 조절은 시그널이 적용된 신경(예를 들면, 비장 신경 또는 SMP 이외의 신경)내 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 적어도 일부에서 시그널이 적용되기 전 신경의 이러한 부분에서 신경세포 활동과 비교하여 감소된 신경세포 활동을 가져온다. 따라서, 특정의 구현예에서, 시그널을 적용하는 결과는 신경내 신경세포 활동의 적어도 부분적인 억제이다. 특정의 구현예에서, 시그널을 적용시키는 결과는 신경 또는 신경들내 신경세포 활동의 완전힌 억제이다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동의 조절은 시그널이 적용된 신경 또는 신경들내 활동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경 또는 신경들내 활동 전위의 수득되는 양식이 건강한 대상체에서 관찰된 신경(들)내 활동 전위의 양식과 유사하도록 조절된다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 기간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 교호하는 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 특정의 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 동안 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호하는 이러한 구현예에서, 시그널은 1일에 걸쳐 연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
시그널이 간헐적으로 적용되는 특정의 구현예에서, 당해 시그널은 환자가 특이적인 상태에 있는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염의 발생(또한 결장염 발생)을 경험하는 경우에만, 즉, 이들이 결장염 위기 또는 발생과 관련된 하나 이상의 증상, 예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 상승 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면, 이들이 병의 발생을 경험한 상태)는 환자에 의해 나타낼 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 환자가 이들의 상태를 나타내도록 할 수 있는 입력 소자를 추가로 포함할 수 있다. 대안적인 이러한 구현예에서, 환자의 상태는 환자로부터의 어떠한 입력과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용된 특정의 구현예에서, 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함할 수 있으며, 여기서 시그널은 검출기가 환자가 특수 상태(예를 들면, 결장염 발생 또는 갑작스러운 재발)에 있음을 검출하는 경우에만 적용된다.
본 발명에 따른 방법의 특정한 구현예에서, 당해 방법은 환자의 하나 이상의 생리학적 매개변수를 검출하는 단계, 및 임의로 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만, 상기 시그널을 적용하는 단계를 추가로 포함한다. 하나 이상의 생리학적 매개변수가 검출되는 이러한 구현예에서, 시그널은 검출된 매개변수들 중 어느 하나가 이들의 역치 값을 충족하거나 초과하는 경우, 대안적으로, 검출된 매개변수 모두가 이들의 역치 값을 충족하거나 초과하는 경우에만 적용될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 하나 이상의 생리학적 매개변수가 검출되도록 구성된 적어도 하나의 검출기를 추가로 포함한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는: 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)의 장 조직 및/또는 순환하는 수준, 결장 및/또는 비장을 통한 혈류 및/또는 순환으로부터 선택된다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있다. 특정의 이러한 구현예에서, 활동 전위 또는 활동 전위의 양식은 결장염과 관련될 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수중 어느 2개 이상이 일렬로 또는 연속적으로 검출될 수 있음은 인식될 것이다. 예를 들면, 특정의 구현예에서, SMP에 있어서의 활동 전위의 양식은 위 노르에피네프린 수준과 동시에 검출될 수 있다.
특정의 구현예에서, 시그널은 영구적으로 적용된다. 즉, 일단 시작하면, 시그널은 신경에 연속적으로 적용된다. 시그널이 일련의 펄스인 구현예에서, 펄스들 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지는 않는 것으로 인식될 것이다.
방법의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널의 중지는, 신경 또는 신경들내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간 내에 실질적으로 기본선 신경세포 활동으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후의 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안적 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지 시, 신경내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 적어도 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 적용(및 임의로 중지) 시, 신경내 신경세포 활동은 조절 전 대상체에서보다 건강한 대상체에서 관찰된 활동 전위의 양식과 보다 더 유사하며, 바람직하게는 건강한 대상체에서 관찰된 활동 전위 양식과 실질적으로 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지 시 신경 또는 신경들내의 활동 전위의 양식은 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중지 시, 신경내 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 가져올 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프의 결과인 것으로 추정된다.
특정의 이러한 구현예에서, 일단 처음 적용되면, 시그널은 상기 구현예에서 기술된 바와 같이, 간헐적으로 또는 영구적으로 적용될 수 있다.
특정의 구현예에서, 적용된 시그널은 비-파괴적인 시그널이다.
본 발명에 따른 방법의 특정의 구현예에서, 적용된 시그널은 하나 이상의 전극으로 구성된 신경조절 장치에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 상기 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 DC 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각 파형을 갖는다.
특정의 구현예에서 전기 시그널은 낮은 전파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다.
특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 또는 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 대안적 구현예에서, 적용된 시그널은 전자기 시그널(임의로 광학 시그널), 기계적(임의로 초음파) 시그널, 열 시그널, 자기 시그널 또는 어떠한 다른 유형의 시그널이다. 이러한 구현예에서, 시그널은 적어도 하나의 변환기를 포함하는 신경조절 장치에 의해 적용되며, 상기 변환기는 하나 이상의 광원, 하나 이상의초음파 변환기, 하나 이상의 열원, 또는 각각의 시그널이 작동하도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
시그널이 열 시그널인 특정의 구현예에서, 상기 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 상승시킨다(즉, 신경에 열을 가한다). 특정의 구현예에서, 상기 시그널 둘 다는 신경에 열을 가하고 신경을 냉각시킨다.
시그널이 기계적 시그널인 특정의 구현예에서, 상기 시그널은 초음파 시그널이다. 특정의 대안적 구현예에서, 기계적 시그널은 압력 시그널이다.
다른 국면에서, 본 발명은 환자에서 결장염, 예를 들면, IBD를 치료하는데 사용하기 위한 신경조절 전기 파형을 제공하며, 여기서 상기 파형은 환자의 비장 신경 및/또는 SMP에 적용되는 경우, 파형이 신경내 신경세포 시그널링을 증가시키도록 하는, 주파수가 0.01-20 Hz인 교류(AC) 파형이다. 특정한 구현예에서, 파형은, 신경에 적용되는 경우, 결장염을 완화시키거나 예방한다.
다른 국면에서, 본 발명은 환자의 비장 신경 또는 SMP에서 신경세포 활동을 조절함으로써 환자에서 결장염, 예를 들면, IBD를 치료하기 위한 신경조절 장치의 용도를 제공한다.
본 발명의 모든 국면의 바람직한 구현예에서, 환자는 대상체 또는 포유동물 환자, 보다 바람직하게는 사람이다.
본 발명의 모든 국면의 바람직한 구현예에서, 시그널 또는 시그널들은 규정된 신경 또는 신경 섬유와는 실질적으로 배타적으로 적용되며, 다른 신경(예를 들면, 미주 신경) 또는 신경 섬유에는 적용되지 않는다.
앞서의 상세한 설명은 설명 및 예증의 방식으로 제공되었으며, 첨부된 청구범위의 영역을 제한하는 것으로 의도되지 않는다. 본원에 예증된 현재 바람직한 구현예에서의 많은 변화는 당해 분야의 통상의 기술자에게 명백할 것이며, 첨부된 청구범위 및 이들의 등가물의 영역 내에 남아있다.
도 2a 내지 도 2c: 본 발명의 기구, 장치, 시스템 및 방법이 효과를 낼 수 있는 방법을 나타내는 개략도이다.
도 3: 예비 데이타, 마우스에서 DSS 유도된 결장염에 있어서 선택적인 교감신경절제술 및 신경섬유절제술의 효과. 교감신경절제술은 질병 과정을 악화시키지만 신경섬유절제술은 효과가 없다. 나타낸 데이타는 DSS 유도 후 7일째에 ELISA에 의해 측정된, 인터루킨 6 및 인터루킨 1베타 조직 수준이다. 각각의 그룹에 대한 데이타 n=8 SEM. *p<0.05 ANOVA.
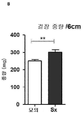
도 4: 상부 장간막 신경(Sx)의 절제 후 및 이어서 16일째의 Rag1-/- 마우스. 도 4a)의 체중을 1일째의 체중과 비교하여 체중의 퍼센트로서 나타낸, 질병의 지표로서 측정하였다.
도 4b) 결장 길이에 대해 표준화한 결장 중량을 결장염의 표시로 측정하였다.
도 4c-4f) 임상 질병 특성의 합으로 나타낸 내시경 병리학 점수. 대변을 0(표준 대변)으로부터 4(혈변의 설사)로 측정하였다. 조직학적 특성은 경험이 있는 병리학자가 평가하였다. 조직학적 점수의 합은 별도의 그래프로서 또한 나타낸, 상이한 특징으로부터 계산한다. 침윤물, 과형성, 배상 세포 고갈을 나타낸다.
도 4g) 회장 노르에피네프린(NE)을 질량 분광법으로 측정하였다. 이는 총 조직 중량(그램) 당 피코그램(picogram)으로 측정된다. Rag1-/- 마우스 모의 수술(sham surgery)의 기본 노르에피네프린 수준을 Sx와 비교하였다.
도 4a - 도 4g의 경우: 데이타는 2개의 독립적인 실험을 대표한다. 샘플 평균 + SEM이 나타나 있다. 만-휘트니(Mann-Withney) U 시험(또는 대변에 대한 카이 자승 검증(Chi Square test), 내시경 및 모든 조직학적 특징)을 통계적 분석에 사용하였다. *P < 0.05, **P < 0.01, ***P < 0.001, Sx를 제공받은 마우스의 경우 n = 17 및 모의 수술(-)을 받은 마우스의 경우 n = 16.
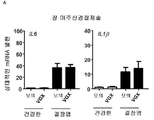
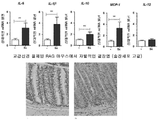
도 5: 종양 괴사 인자(TNF)-α, 인터루킨(IL)1β, IL-6, IL-10, IL-12 및 단핵구 화학주성 단백질(monocyte chemoattractant protein: MCP)-1에 대한 유전자의 qPCR 분석. 하우스키핑 유전자(housekeeping gene) β-액틴, 하이포크산틴-구아닌 포스포리보실트랜스퍼라제(HPRT) 및 유비퀴틴에 대해 표준화됨. 모의 수술된 마우스(-)와 관련된 상대적인 mRNA 발현이 나타나 있다.
B) 모의(좌측) 및 Sx(우측)의 2개의 대표적인 H&E 염샘. 하부 화살표: 침윤물, 상부 화살표: 배상 세포 고갈. 확대: 20x.
도 6: C57BL/6 마우스는 모의 수술(-), 비장 신경의 절개(Sx)를 겪었다. 2주의 회복 후, 급성 결장염을 음료수 중 2%(w/v) DSS, 또는 대조군으로서 비히클을 제공하여 유도시켰다.
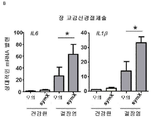
A) IL-1β, IL-6, IL-10, 형질전환 성장 인자(TGF)-β 및 TNF-α에 대한 유전자의 qPCR 분석. 하우스키핑 유전자 β-액틴, HPRT 및 유비퀴틴에 대해 표준화하였다. 비히클로 처리한 모의 수술된 마우스와 관련된 상대적인 mRNA 발현으로 나타낸다.
B) 질병 활성 지수는 질병의 지수로 측정하였다. 섬유증은 0(섬유증 없음) 내지 2(심각한 섬유증)의 거시적 점수로서 질병 활성에 대한 척도로 포함된다. 대변은 0(정상적인 대변)으로부터 4(혈변의 설사)로 측정하였다. 샘플 평균 + SEM이 나타나 있다. 만-휘트니 U 시험(또는 대변, 대장 잠혈 및 섬유증에 대한 카이 자승 시험)을 통계적 분석을 위해 사용하였다. *P < 0.05, **P < 0.01, n = 각각의 그룹에 대해 10마리의 마우스(-, Sx, DSS 결장염의 존재 또는 부재).
도 7: 원위 장 세그먼트에 대한 근위의 노르에피네프린(NE) 수준을 나타내었다. NE 수준을 질량 분광법을 사용하여 측정하였다. 수준은 나타낸 매개변수에서 후크 자극(hook stimulation) 직후 취한, 총 조직 중량(그램) 당 피코롤로 제공된다. 나타낸 데이타는 평균 n=3이다. 자극은 나타낸 매개변수에서 수행하였다.
도 8a 및 도 8b: 복막 근육에서 근전도 기록. 커프 전극(cuff electrode)을 이식하여, 상부 장간막신경총 및 상부 장간막 동맥 주변에 위치시켰다. 이후에, EMG 전극을 측정을 위해 이식시켰다. 랫트에게 A) 200 마이크로Amp 10Hz 자극 또는 B) 400 마이크로Amp(화살표) 10Hz 자극을 겪게 하고 EMG를 나타낸 시간에 대하여 측정하였다.
도 9a 및 도 9b: 상부 장간막신경총 및 동맥 주변에 위치한 전극 커프를 통한 자극 후, 정맥(도 9a) 또는 동맥(도 9b) 장간막 혈관에서 랫트 도플러 순환 유동 측정(Doppler circulation flow measurement). 3마리의 랫트의 측정을 나타낸다. 나타낸 10Hz 자극에서 자극 매개변수는 200, 400, 및 600 마이크로Amp이었다.
도 10: 실험적인 랫트 상부 장간막신경총(SMP) 자극 과정의 프로토콜 세부사항.
도 11: 랫트 내 DSS 결장염에서 파일러트 SMP 자극의 실험 결과. A) DSS 결장염의 9일째에 모의(상부) 및 자극된 결장의 내시경 현미경사진. 섬유종에서 부위의 궤양화에 주목한다(화살표). B) DSS 결장염의 9일째 랫트 결장에서 측정된 결장 중량/길이비. C) 측정된 도 1 매개변수에서와 같이 모의, 또는 SMP의 자극을 겪은 랫트에서 9일째에 결장염의 임상 매개변수는 설사(검은색 바아) 또는 대변 속의 혈액(관측됨; 회색 바아)이다. D) 사이토킨 및 케모킨의 전사를 QPCR로 결장 균질물에서 측정하였다. 선택된 생물지표는 9일째에 랫트 DSS에서 CCL3, CCL12, CCL17, IL1b의 상향조절을 나타낸 QPCR 배열 스크리닝(SA Biosciences 사람 염증 키트)으로부터 유추되었다. 9일째에 DSS에서 모의, 또는 자극 하에 CCL3 및 IL-1β의 수준을 나타낸다. CCL12, CCL17은 동일하게 감소하였으며(나타내지 않음); CCL19 및 COX 2는 자극에 의해 영향받지 않았다. 나타낸 데이타는 치료 그룹 당 평균 +/- SEM n=7-9이다.
도 12: 조직학 점수-SMP 자극. 랫트에서의 DSS 결장염에 있어서 파일러트 SMP 자극의 실험적 결과. 경험한 및 블라인드 처리된(blinded) 병리학자에 의해 평가된 조직학 점수. 나타낸 데이타는 치료 그룹당 평균 +/- SEM n=7-9이다.
도 13: 교감신경 비장 신경자극전달은 DSS-유도된 결장 염증에서 소염 효과를 발휘한다. DSS 투여 전에 수행된 비장 신경제거는 마우스에서 DSS 결장염을 증강시킨다. 결장 전사물의 QPCR 배열 데이타; 염증성 유전자에 대한 상승된 발현 프로파일은 모의 수술과 비교한 것으로서 splx(비장 신경 병변) 후 관찰된다. B) 비장 신경 병변은 DSS 투여에 의해 유도된 질병 활성 지수(C)를 향상시킨다. C). 비장 신경제거는 전-염증성 사이토킨 IL-6 및 TNF-α 및 IL-1β의 발현 수준에 있어서 유의적인 증가를 가져온다. 데이타는 평균±SEM(n = 그룹당 11 내지 15마리의 동물)로서 나타낸다. *p<0.05; **p<0.01; ***p<0.001. DSS 결장염 및 비장 신경 신경제거에 있어서 사이토킨 발현 수준(n=12).
상세한 설명
본원에 사용된 용어는 하기에 달리 정의하지 않는 한, 기술자에 의해 이해된 것으로서 당해 분야에서 이들의 통상적인 정의로 제공된다. 어떠한 불일치 또는 의심이 되는 경우, 본원에 제공된 것으로서의 정의가 우선하여야 한다.
본원에 사용된 것으로서, 시그널의 적용은 에너지의 이동을 적합한 형태로 동일하게 하여 시그널의 의도된 효과를 수행할 수 있다. 즉, 시그널을 신경 또는 들경들에 적용하여 에너지의 이동을 동일하게 함으로써 신경(들)을(또는 로부터) 의도된 효과를 수행하도록 할 수 있다. 예를 들면, 이동된 에너지는 전기, 기계(초음파와 같은 음향을 포함함), 전자기(예를 들면, 광학적), 자기 또는 열 에너지일 수 있다. 본원에 사용된 시그널의 적용은 약제학적 개입을 포함하지 않음에 주목한다.
본원에 사용된 것으로서, "변환기"는 신경 또는 신경총(plexus)에 시그널, 예를 들면, 전극, 다이오드, 펠티어 소자 또는 초음파 변환기를 적용하는 어떠한 소자를 의미하기 위해 사용된다.
본원에 사용된 것으로서, "비-파괴 시그널"은 적용되는 경우 이것이 적용된 신경의 근본적인 신경세포 시그널 전도에 비가역적으로 손상을 입히지 않는, 상기 정의한 바와 같은 시그널이다. 즉, 비-파괴적인 시그널의 적용은 이러한 전도가 비-파괴적인 시그널의 적용 결과로서 실제로 억제되거나 차단되는 경우에도, 시그널의 적용이 중지되는 경우 활동 전위를 수행하는 신경 또는 신경들(또는 이의 섬유)의 능력을 유지한다. 신경의 적어도 일부의 제거 및 소작술(cauterisation)은 파괴적인 시그널의 예이다.
본원에 사용된 것으로서, 신경의 "신경세포 활동"은 신경의 시그널링 활동, 예를 들면, 신경내 활동 전위의 진폭, 진동수 및/또는 양식을 의미하기 위해 사용된다.
본원에 사용된 것으로서, 신경세포 활동의 조절은 신경의 시그널링 활성이 기본 신경세포 활동, 즉, 어떠한 개입 전 환자에서 신경의 시그널링 활동으로부터 변경됨을 의미하기 위해 사용된다. 이러한 조절은 기본 활동과 비교하여 신경세포 활동을 중지하거나, 억제(예를 들면, 차단)하거나, 또는 달리는 변경시킬 수 있다.
신경세포 활동의 조절이 자극성(신경세포 활동의 증가를 가져옴)인 경우, 이는 전체 신경의 총 시그널링 활동에 있어서의 증가일 수 있거나, 이는 신경의 신경 섬유의 소세트의 총 시그널링 활성이 신경의 이러한 부분에서 기본 신경세포 활동과 비교하여 증가되는 것일 수 있다.
신경세포 활동의 조절이 신경세포 활동의 억제인 경우, 이러한 억제는 부분적인 억제일 수 있다. 부분적인 억제는 전체 신경의 총 시그널링 활동이 부분적으로 감소되거나, 신경의 신경 섬유의 소세트의 총 시그널링 활동이 완전히 감소되거나(즉, 신경 섬유의 이러한 소세트내 신경세포 활동이 없음), 또는 신경의 신경 섬유의 소세트의 총 시그널링이 개입 전 신경 섬유의 소세트내 신경세포 활동과 비교하여 부분적으로 감소되는 것일 수 있다. 신경세포 활동의 조절이 신경세포 활동의 억제인 경우, 이는 또한 신경의 신경세포 활동의 완전한 억제를 포함한다.
신경세포 활동의 억제는 신경세포 활동을 차단시킬 수 있다. 이러한 차단은 부분적인 차단, 즉 신경의 신경 섬유의 소세트내 신경세포 활동의 차단일 수 있다. 대안적으로, 이러한 차단은 완전한 차단, 즉, 전체 신경에 걸쳐 신경세포 활동의 차단일 수 있다. 신경세포 활동에 있어서의 차단은 차단 지점을 지나 지속적으로 신경세포 활동을 차단하는 것으로 이해된다. 즉, 차단이 적용되는 경우, 작용 전위는 신경 또는 신경 섬유의 소세트를 따라 차단 지점까지 이동할 수 있으나, 차단 지점을 넘어서지는 않는다.
신경세포 활동의 제어는 또한 활동 전위의 양식에 있어서의 변경일 수 있다. 활동 전위의 양식은 전체적인 빈도 또는 진폭을 필수적으로 변경시키지 않고 조절될 수 있다. 예를 들면, 신경세포 활동의 조절은 활동 전위의 양식이 질병 상태보다는 건강한 상태에 보다 가깝게 유사하도록 하는 것일 수 있다.
신경세포 활동의 조절은 다양한 다른 방식으로 신경세포 활성을 변경시키는 것, 예를 들면, 신경세포 활동의 특수한 부분을 증가시키거나 억제하고/하거나 활동의 새로운 요소를 예를 들면, 특히 시간 간격, 특히 특수한 양식 등에 따라, 주파수 대역에서 자극하는 것을 포함할 수 있다.
신경세포 활동의 조절은 일시적일 수 있다. 본원에 사용된 것으로서, "일시적"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절에 상관없이)이 영구적이지 않음을 의미하기 위해 사용된다. 즉, 시그널의 중지에 따른 신경세포 활동은 시그널이 적용되기 전, 즉, 조절 전 신경세포 활동과 실질적으로 동일하다. 조절 전 신경세포 활동은 본원에서 "기본" 활동으로 언급된다.
신경세포 활동의 조절은 영구적일 수 있다. 본원에 사용된 것으로서, "영구적"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절인지에 상관없이)이 연장된 효과를 가짐을 의미하기 위해 사용된다. 즉, 시그널이 중지되면, 신경에서 신경세포 활동은 시그널이 적용되는 경우와 실질적으로 동일하다(즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다). 연장된 효과는 위에서 기술한 바와 같이, 시그널이 중지된 다음 기간(예를 들면, 분, 예를 들면, 30분 이상, 또는 수 시간, 또는 심지어 수 일) 후, 신경세포 활동이 기본으로 되돌아오거나, 연장된 효과가 무한하게 또는 영구적으로 지속될 수 있도록 일시적일 수 있다.
신경세포 활동의 조절은 수정될 수 있다. 본원에 사용된 것으로서, "수정된"은 조절된 신경세포 활동(이것이 양식 대 기본 활동에 있어서 신경세포 활동 또는 변화의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)이 건강한 개인에서의 신경세포 활동의 양식으로 신경세포 활동을 변경시킴을 의미하기 위해 사용된다. 즉, 시그널의 적용시(및/또는 중지 후), 신경에서 신경세포 활동은 조절 이전 보다 건강한 개인에서 관찰된 신경내 활동 전위의 양식과 매우 근접하게 유사하고, 바람직하게는 건강한 대상체에서 관찰된 신경내 활동 전위의 양식과 실질적으로 완전히 유사하다.
상기 시그널에 의해 유발된 이러한 수정된 조절은 본원에 정의한 바와 같은 어떠한 조절일 수 있다. 예를 들면, 시그널의 적용은 신경세포 활동에 있어서의 변화를 가져올 수 있으며, 시그널의 중지 시, 신경내 활동 전위의 양식은 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하다. 추가의 예로써, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰된 작동 전위의 양식과 유사하도록 하는 조절을 생성할 수 있으며, 시그널이 중지되면, 신경내 활동 전위의 양식은 건강한 개인에서 관찰된 활동 전위의 양식과 유사하다.
본원에 사용된 것으로서, "상부 장간막신경총"은 장간막 동맥과 관련된 신경세포 섬유의 신경총을 나타내기 위해 사용된다. 비장 신경은 숙련가에게 이해되는 것으로서 비장을 신경자극전달하는 신경을 나타낸다.
본원에 사용된 것으로서, "결장염"은 결장의 염증, 특히 점막 염증을 나타내기 위해 사용된다. 결장염을 유발하는 질환은 염증성 장질환(궤양성 결장염(UC) 및 크론병 포함), 허혈성 결장염, 및 감염성 결장염을 포함한다. 결장염은 감염, 자가면역성, 및/또는 약리학적 작용(예를 들면, 비-스테로이드성 소염 약물(NSAID))과 관련될 수 있다.
본원에 사용된 것으로서, "염증성 장질환(IBD)"은 UC 및 크론병을 포함한다. 크론병 및 UC는 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈 및 피로를 포함하나, 이에 한정되지 않는 증상을 특징으로 하는 각각 만성의 재발 및 경감 형태의 염증성 질병이며 또한 빈혈, 오심 및 체온 증가(열)을 또한 포함할 수 있다. 크론병은 위장(GI) 관, 예를 들면, 결장의 특정 부분에 영향을 미칠 수 있으며 고르지 못한, 경점막 및 점막 염증을 특징으로 한다. UC에서, 염증은 직장으로부터 근위적으로 연속하여 연장되어 있으며 일반적으로 결장에 한정된다.
"결장염의 치료" - 본원에 사용된 것으로서, "결장염의 치료"는 결장 질환으로 고생하는 환자가 나타낸 하나 이상의 증상에 있어서의 감소를 특징으로 한다. 예를 들면, 치료는 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와(crypt loss), 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 복부 팽창, 경련 통증 또는 불편함, 설사, 오심, 체온 증가, 체중 감소, 직장 출혈, 빈혈 및 피로 중 하나 이상의 감소 중 어느 하나 이상에 의해 특징화될 수 있다. 증상에 있어서의 이러한 감소는 증상이 빈도가 거의 없어지거나, 거의 심각해지지 않거나, 또는 둘 다에 의해 특징화될 수 있다.
치료는 예방학적 또는 치료학적일 수 있다. 예방학적 치료는 증상의 발병의 예방으로 특징화될 수 있다. 예를 들면, 결장염 환자는 증상 발생과 위기 사이의 완화 기간을 거칠 수 있다. 예방학적 치료는 추가의 증상 발생의 발병을 예방할 수 있거나 완화 기간을 연장할 수 있다. 치료학적 치료는 결장염의 진행중인 증상발생의 완화로 특징화될 수 있다. 예를 들면, 치료학적 치료는 증상발생 동안 증상의 빈도 및/또는 심각성의 완화를 제공할 수 있거나, 환자가 완화 상태로 도입되도록 할 수 있다. 치료학적 치료는 결장염 환자를 전적으로 치유할 수 있다.
본원에 사용된 것으로서, "측정가능한 생리학적 매개변수에 있어서의 개선"은 어떠한 제공된 생리학적 매개변수에 대해, 개선이 정상 값 또는 이러한 값에 대한 정상 범위, 즉, 건강한 개인에서 예측된 값을 향한 환자에서 이러한 매개변수의 값에 있어서의 변화를 의미하기 위해 사용된다.
예를 들면, 결장염으로 고생하는 환자에서, 측정가능한 매개변수에 있어서의 개선은 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는(즉, 혈액/혈장) 노르에피네프린에 있어서의 증가, 장 조직 및/또는 순환에서 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로와 같은 하나 이상의 증상에 있어서의 감소 중 어느 하나일 수 있다.
적합한 생리학적 매개변수는 환자의 신경에서 활동 전위 또는 활동 전위의 양식일 수 있다. 이러한 매개변수에 있어서의 개선은 개입 전보다는 건강한 개인에 의해 나타나는 것에 보다 밀접하게 유사한 신경에서 활동 전위 또는 활동 전위의 양식으로 특징화된다.
본원에 사용된 것으로서, 생리학적 매개변수는 당해 매개변수가 개입이 수행되지 않은 경우 대상체 또는 환자에 의해 나타난 이러한 매개변수의 평균 값으로부터의 조절의 결과로서 변하지 않을 경우, 즉, 이것이 이러한 매개변수에 대해 기본 값에서 멀어지지 않는 경우 신경세포 활동의 조절에 의해 영향받지 않는다.
숙련가는 개인에서 어떠한 신경세포 활동 또는 생리학적 매개변수에 대한 기본선이 고정되거나 특정 값일 필요는 없지만, 정상 범위 내에서 변동을 거듭할 수 있거나 관련된 오차 및 신뢰 구간과 관련된 평균 값일 수 있음을 인식할 것이다. 기본선 값을 측정하기에 적합한 값은 당해 분야의 기술자에게 잘 알려져 있을 수 있다.
본원에 사용된 것으로서, 측정가능한 생리학적 매개변수는 검출 시간에 환자가 나타낸 매개변수에 대한 값이 측정되는 경우 환자에서 "검출"된다. 검출기는 이러한 측정을 가능하도록 하는 어떠한 소자이다.
생리학적 매개변수에 대한 "예정된 역치 값(threshold value)"은 당해 값 또는 초과 값은 개입이 적용되기 전에 대상체 또는 환자가 나타내어야만 하는 이러한 매개변수에 대한 값이다. 어떠한 제공된 매개변수에 대해서도, 역치 값은 결장염의 지표 값일 수 있다. 이러한 예적된 역치 값의 예는 역치 교감신경 활성도 미만의 교감신경 활성도, 예를 들면, 건강한 개인에서의 교감신경 활성도; 역치 NE 수준 이상의 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준, 예를 들면, 건강한 개인에서의 NE 수준; 건강한 개인의 특징보다 더 큰 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)의 장 조직 및/또는 순환하는 수준을 포함한다. 어떠한 제공된 매개변수에 적절한 값도 숙련가에 의해 단순히 측정될 수 있다.
제공된 생리학적 매개변수에 대한 이러한 역치 값은, 환자가 나타낸 값이 역치를 초과하는 경우, 즉, 나타낸 값이 예정된 역치 값보다 이러한 매개변수에 대한 정상 또는 건강한 값에서 크게 벗어난 경우, 초과된다.
본원에 사용된 것으로서, 교감신경 활성도는 교감신경 신경세포 활동으로부터 생성되는 전체적인 생리학적 균형을 의미하기 위해 사용된다. 이러한 교감신경 활성도는 당해 분야에 공지된 방법, 예를 들면, 신경학적 방법, 혈류역학적 방법(예를 들면, 심 박동수, 혈압, 심박 변이) 또는 순환하는 혈장/뇨 생물지표에 의해 측정할 수 있다.
본원에 사용된 것으로서 "신경조절 장치"는 신경의 신경세포 활동을 조절하도록 구성된 장치이다. 본원에 기술된 신경조절 장치는 신경에 시그널을 효과적으로 적용할 수 있는 적어도 하나의 변환기를 포함한다. 신경조절 장치가 환자에 적어도 부분적으로 이식된 이들 구현예에서, 환자에게 이식될 장치의 소자는 이들이 이러한 이식에 적합하도록 구성된다. 이러한 적합한 구성은 숙련가에게 잘 알려져 있을 수 있다. 실제로, 다양한 완전히 이식가능한 신경조절 장치, 예를 들면, SetPoint Medical, in clinical development for the treatment of rheumatoid arthritis (Arthritis & Rheumatism, Volume 64, No. 10 (Supplement), page S195 (Abstract No. 451), October 2012. "Pilot Study of Stimulation of the Cholinergic Anti-Inflammatory Pathway with an Implantable Vagus Nerve Stimulation Device in Patients with Rheumatoid Arthritis", Frieda A. Koopman et al)의 미주 신경 자극기, 및 INTERSTIMTM 장치(Medtronic, Inc), 과민성 방광의 치료시 천골 신경 조절에 활용된 완전히 이식가능한 장치와 같이 현재 이용가능하다. 특정의 구현예에서, 신경조절 장치, 또는 장치 또는 시스템의 이식가능한 부위는 1cm 미만의 크기로 소형화될 수 있다.
본원에 사용된 것으로서, "이식된"은 환자의 체내에서 적어도 부분적으로 위치함을 의미하기 위해 사용된다. 부분 이식은 장치(또는 기구 또는 시스템)의 부분만이 이식되는 것, 즉, 장치의 부분만이 환자의 체내에 위치하고, 장치의 다른 소자는 환자의 신체의 외부에 위치함을 의미한다. 용어 "전체적으로 이식된"은 장치의 전체가 환자의 체내에 위치됨을 의미한다. 의심할 여지없이, "전체적으로 이식된" 장치는 장치와는 독립적이지만 실제로, 환자의 신체와 독립적으로 형성되고 이의 외부에 존재하는, 이의 기능(예를 들면, 원격 무선 충전 유닛 또는 원격 무선 수동 중단 유닛)에 유용한, 추가의 소자를 배제하지 않는다.
본원에 사용된 것으로서, 전류(예를 들면, DC 전류)와 관련하여 "전하-균형된"은 적용되는 전류의 결과로서 어떠한 시스템(예를 들면, 신경) 내로 도입된 양 전하 또는 음 전하가 전체적으로(즉, 순수하게) 중성을 달성하도록 하기 위해 반대 전하의 도입으로 균형을 이루게 하는 것을 의미하기 위해 사용된다.
본원에 나타낸 것으로서, 결장염은 비장 신경 및/또는 상부 장간막신경총의 신경세포 활동의 조절에 의해 완화되고/되거나 예방될 수 있는 것으로 확인되었다.
IBD의 치료에 관한 앞서의 연구는 미주 신경(때때로 미주신경 신경으로 언급됨), 특히 좌측 경부 미주에 촛점을 맞추고 있으며, 이는 콜린성(즉, 부교감신경) 시그널링을 통해 소염 효과를 매개하는 것으로 고려되었다. 그러나, 놀랍게도 본원에서 장에 대한 교감신경(즉, 아드레날린성) 신경세포 시그널링은 결장염 모델에서 소염 반응에 요구됨이 밝혀졌다. 특히, 비장 신경 또는 SMP, 또는 둘 다를 통한 복강 신경절로부터 장에의 교감신경 시그널링은 결장염의 중증도에 조절시 역활을 담당하는 것으로 밝혀져 있다. 이는 어떠한 소염 효과도 이에 의해 매개된 메카니즘으로서 장에 대해 부교감신경성 미주신경 시그널링을 지시하는 것으로 추정된 앞서의 가설과는 대조적이다. 더욱이, 본 발명자는 장에 대한 이러한 교감신경 시그널링이 또한 미주 신경의 소염 효과와는 독립적으로 소염 효과를 매개한다는 것을 밝혀내었다.
비장 신경(또는 비장을 신경자극전달하는 어떠한 신경) 및 SMP 중 하나 또는 둘 다에서 신경세포 활동의 조절이 결장염을 완화시키게 될 것임은 본원에서 추가로 입증된다. 본 개시내용 전체에서, 비장 신경을 참고하는 경우, 이러한 참고는 비장을 신경자극전달하는 어떠한 교감 신경도 포함하는 것으로 이해되어야 한다. 미주 신경보다 장과 더 멀고 보다 구체적으로 관련된 신경의 신경세포 활동을 조절함으로써, 본 발명은 또한 미주 신경 자극(때때로 미주신경 신경 자극으로 언급되며, 본원에 사용된 바와 같이, 당해 용어 미주 신경 및 미주신경 신경은 상호교환적으로 사용될 수 있다)과 흔히 관련된 원치않는 부작용의 위험 없이 결장염을 치료할 수 있다.
따라서, 비장 신경 및/또는 SMP의 신경세포 활동을 조절하는 신경조절 장치는 효과적인 결장염 치료를 제공한다.
따라서, 본 개시내용은 환자의 비장 신경 및/또는 SMP의 신경세포 활동을 조절하기 위한 기구 또는 시스템을 제공하며, 당해 기구 또는 시스템은: 비장 신경 또는 SMP에 제1의 시그널을 적용하도록 구성된 제1의 변환기 및 임의로 제2의 시그널을 SMP 또는 비장 신경의 다른 것에 적용하기 위한 제2의 변환기; 및 변환기 또는 변환기들에 커플링된 제어기(당해 제어기는, 시그널이 이것이 적용된 신경(즉, 적절하게는 비장 신경 및/또는 SMP)의 신경세포 활동을 조절하여 환자에서 생리학적 반응을 생산하도록, 변환기 또는 변환기들에 의해 적용된 시그널을 조절한다)를 포함한다.
기구 또는 시스템이 적어도 2개의 변환기를 갖는 이들 구현예에서, 각각의 변환기가 적용하도록 구성된 시그널이 독립적으로 선택된다. 특정의 구현예에서, 각각의 변환기는 동일한 시그널을 적용하도록 구성된다.
시그널의 다음의 설명 및 구현예는 장치에 의해 적용된 어떠한 시그널에도 적용되는데, 즉, 제1 및 제2의 시그널, 및 장치에 의해 적용된 어떠한 추가의 시그널과는 독립적으로 적용될 수 있다.
특정의 구현예에서, 하나 이상의 변환기에 의해 적용된 시그널은 전기 시그널, 광학 시그널, 초음파 시그널 또는 열 시그널이다.
특정의 구현예에서, 하나 이상의 변환기 각각은 하나 이상의 전극, 하나 이상의 광원, 하나 이상의 초음파 변환기, 하나 이상의 열원, 또는 시그널이 효과적이도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
특정의 구현예에서, 하나 이상의 변환기에 의해 적용된 시그널 또는 시그널들은 전기 시그널, 예를 들면, 전압 또는 전류이다. 특정의 이러한 구현예에서 적용된 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 낮은 전파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 예를 들면 1 내지 15Hz, 바람직하게는 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA, 예를 들면 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형(AC square biphasic form)을 포함한다.
숙련가에게 익숙한 바와 같이, 시그널의 전류 또는 전압은 어떠한 제공된 장치-신경 배열에 대한 다른 매개변수의 의도된 값을 달성하기 위하여 변할 수 있다.
특정의 구현예에서, 시그널은 DC 램프에 이어서 플래토우(plateau) 및 전하-균형에 이어서, 제1의 AC 파형을 포함하며, 여기서 제1의 AC 파형의 크기는 상기 제1의 AC 파형이 적용된 후, 제1의 AC 파형보다 더 낮은 크기 및/또는 더 낮은 주파수를 갖는 제2의 AC 파형이 적용되는 기간 동안 증가한다. 특정의 이러한 구현예에서, DC 램프, 제1의 AC 파형 및 제2의 AC 파형은 실질적으로 연속적으로 적용된다.
특정의 구현예에서, 상기 시그널은 킬로헤르츠 주파수의 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 하나 이상의 AC 파형을 포함하고, 각각의 AC 파형은 5 내지 25 kHz, 임의로 10 내지 25 kHz, 임의로 15 내지 25 kHz, 임의로 20 내지 25 kHz의 AC 파형으로부터 독립적으로 선택된다. 특정의 구현예에서, 시그널은 5 kHz의 AC 파형 시그널을 포함한다. 특정의 대안적 구현예에서, 시그널은 25 kHz의 AC 파형을 포함한다.
적용된 시그널이 전기 시그널인 이들 구현예에서, 하나 이상의 변환기 중 적어도 하나는 전기 시그널을 적용하도록 구성된 전극이다. 특정의 이러한 구현예에서, 모든 변환기는 전기 시그널, 임의로 동일한 전기 시그널을 적용하도록 구성된 전극이다.
적용된 시그널이 전기 시그널인 특정의 구현예에서, 당해 시그널은 커프 전극(cuff electrode)에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
적용된 시그널이 말단 시그널인 특정의 구현예에서, 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 증가시킨다(즉, 신경을 가열한다). 특정의 구현예에서, 상기 시그널은 신경을 가열 및 냉각 둘 다를 수행한다.
적용된 시그널이 열 시그널인 이들 구현예에서, 하나 이상의 변환기 중 적어도 하나는 열 시그널을 적용하도록 구성된 변환기이다. 특정의 이러한 구현예에서, 모든 변환기는 열 시그널, 임의로 동일한 열 시그널을 적용하도록 구성된다.
특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널을 적용하도록 구성된 열전 효과(Peltier element)를 포함하며, 임의로 하나 이상의 변환기 각각은 열전 효과를 포함한다. 특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널(예를 들면, 근적외선(NIR) 다이오드 레이저)를 적용하도록 구성된 레이저 다이오드를 포함하며, 임의로 하나 이상의 변환기 중 모두는 열 시그널을 적용하도록 구성된 레이저 다이오드를 포함한다. 특정의 구현예에서, 하나 이상의 변환기 중 하나 이상은 열 시그널을 적용하도록 구성된 전기 저항 소자를 포함하며, 임의로 하나 이상의 변환 중 각각은 열 시그널을 적용하도록 구성된 전기 저항 소자를 포함한다.
특정의 구현예에서, 적용된 시그널은 기계적 시그널, 임의로 초음파 시그널이다. 특정의 대한적인 구현예에서, 기계적 시그널은 압력 시그널이다.
특정의 구현예에서, 시그널은 전자기 시그널, 임의로 광학 시그널이다. 특정의 이러한 구현예에서, 하나 이상의 변환기는 광학 시그널을 적용하도록 구성된 레이저 및/또는 발광 다이오드(예를 들면, NIR 다이오드 레이저)를 포함한다. 일부 구현예에서, 상기 기구 또는 시스템은 하나 이상의 변환기로부터 적어도 하나의 신경으로 시그널을 적용하도록 구성된 광 섬유 인터페이스(fibre optic interface)를 포함한다.
특정의 구현예에서, 환자에서 생산된 생리학적 반응은 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는/혈장 노르에피네프린에 있어서의 증가, 장 조직 및/또는 혈장에서 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로와 같은 하나 이상의 증상에 있어서의 감소 중 하나 이상이다.
특정의 구현예에서, 환자에서 생산된 생리학적 반응은 환자의 신경내 활동 전위의 양식에 있어서의 개선일 수 있는데, 즉, 개입 전보다 건강한 개인에 의해 나타난 것에 보다 근접하게 유사한 신경내 활동 전위의 양식일 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경, SMP 또는 미주 신경이다.
특정의 구현예에서, 상기 기구 또는 시스템은 환자에서 하나 이상의 생리학적 매개변수를 검출하기 위한 검출기 소자를 추가로 포함한다. 이러한 검출기 소자는 하나 이상의 생리학적 매개변수를 검출하도록 구성될 수 있다. 즉, 이러한 구현예에서, 각각의 검출기는 하나 이상의 생리학적 매개변수, 예를 들면, 모든 검출된 생리학적 매개변수를 검출할 수 있다. 대안적으로, 이러한 구현예에서, 하나 이상의 검출기 소자 각각은 검출된 하나 이상의 생리학적 매개변수 중 별개의 매개변수를 검출하도록 구성된다.
이러한 특정의 구현예에서, 제어기는 하나 이상의 생리학적 매개변수를 검출하도록 구성된 검출기에 커플링되어, 생리학적 매개변수가 예정된 역치 값에 충족하거나 초과하는 것으로 검출되는 경우 변환기 또는 변환기들이 이들의 각각의 시그널을 적용하도록 한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, 칼프로텍틴)의 순환하는 수준 중 하나 이상이다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있으며, 여기서 상기 활동 전위 또는 활동 전위의 양식은 결장염과 관련된다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 상기 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면, 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수 중 어떠한 2개 이상은 나란히 또는 연속해서 검출될 수 있다. 예를 들면, 특정의 구현예에서, 제어기는 SGM에서 활동 전위의 양식 및 또한 교감신경 활성도의 지표로서 환자의 심박수 변동성을 검출하도록 구성된 검출기 또는 검출기들에 커플링된다.
특정의 구현예에서, 시그널의 적용 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 이러한 부분내 기본선 신경세포 활동과 비교하여 증가된 신경의 적어도 일부분에서의 신경세포 활동을 생성한다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동일하게 교차할 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널의 적용 결과는 전체 신경에 따른 신경세포 활동에 있어서의 증가이다. 결장염의 치료는 비장 신경 또는 SMP 중의 하나 또는 둘 다에 의한 교감신경 시그널링이 증가되는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 시그널은 낮은 주파수의 AC 파형을 포함하는 전기 시그널이다. 특정의 구현예에서, 상기 전기 시그널은 저 주파수 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA, 예를 들면 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면, 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 구현예에서, 시그널은 사각형 파형이다.
특정의 구현예에서, 전기 시그널은 20-500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형(biphasic waveform)을 포함한다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 신경내 활동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경내 활동 전위의 수득되는 양식이 시그널이 적용되기 전보다 건강한 대상체에서 관찰된 신경 또는 신경들내 활동 전위의 양식과 더 근접하게 유사하도록 조절된다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경의 부분에서의 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 시그널이 적용되기 전 신경의 이러한 부분에서의 신경세포 활동과 비교하여 감소된 신경세포 활동을 가져온다.
신경세포 활동의 조절은 다양한 다른 방식으로 신경세포 활동을 변경시키는 것, 예를 들면, 활동의 특수한 부분을 증가시키거나 억제하고 활동의 새로운 요인, 예를 들면, 특히 시간 간격, 특히 특수한 양식 등에 따라, 주파수 대역에서 자극하는 것을 포함할 수 있다. 신경세포 활동의 이러한 변경은 예를 들면 기본선 활동과 관련하여 증가 및/또는 감소 둘 다를 나타낼 수 있다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 시간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 교호하는 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 시간의 특정한 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호되는 이러한 구현예에서, 시그널은 1일에 걸쳐 불연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 시그널은 환자가 특정의 생리학적 상태에 있는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염 발생을 경험하는 경우에만, 즉, 이들이 결장염 위기 또는 발생과 관련된 하나 이상의 증상, 예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 상승 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면 이들이 병의 발생을 경험한 상태)는 환자에 의해 나타낼 수 있다. 대안적 구현예에서, 환자의 상태는 환자로부터의 어떠한 조언과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함하며, 여기서 시그널은 검출기가 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 비정상적인(예를 들면, 감소된) 교감신경 활성도를 나타내는 경우에만 적용된다.
특정의 이러한 구현예에서, 기구 또는 시스템은 이를 통해 환자의 상태(예를 들면, 이들이 결장염의 증상을 경험하고 있는 상태)가 환자 또는 주치의에 의해 나타날 수 있는 통신, 또는 조언, 요소를 추가로 포함한다. 대안적 구현예에서, 상기 기구 또는 시스템은 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함한다. 임의로, 시그널은 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다.
특정의 대안적 구현예에서, 제어기는 시그널이 영구적으로 적용되도록 한다. 즉, 일단 시작하면, 시그널은 신경 또는 신경들에 지속적으로 적용된다. 시그널이 일련의 펄스인 구현예에서, 펄스와 펄스 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지 않음이 인식될 것이다.
기구 또는 시스템의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널이 중지하면, 신경 또는 신경들 내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간내에 기본선 신경세포 활동으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안의 구현예에서, 시그널 또는 시그널들의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지시, 신경 또는 신경들내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후에 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 적용(및 임의로 중지)시, 신경 또는 신경들에서의 신경세포 활동은 조절 전 대상체에서 보다 건강한 피험자에서 관찰된 신경(들)에서의 활동 전위의 양식과 유사하며, 바람직하게는 실질적으로 건강한 대상체에서 관찰된 신경(들)에서의 활동 전위 양식과 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지시 신경 또는 신경들의 활동 전위의 양식은 건강한 개인에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중단시, 신경 또는 신경들에서의 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 야기할 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프(feedback loop)의 결과, 즉, 대장염을 유발하는 근본적인 염증 상태는 장치 및 청구된 방법의 사용의 결과인 것으로 취급되며, 이로 인해 원심성의 감각적인 미주신경 활성도가 건강한 개인의 것으로 적어도 부분적으로 회복되도록 장으로부터의 구심성(즉, 감각적인) 시그널(예를 들면, 구심성 미주신경 시그널)이 변경되도록 한다. 이러한 수정 메카니즘은 면역-신경세포 반영을 통해 매개될 수 있다.
특정의 구현예에서, 장치 또는 시스템 (또는 이의 적어도 하나의 부품)은 환자로의 적어도 부분적인 이식에 적합하다. 특정의 이러한 구현예에서, 장치 또는 시스템(또는 이의 부품)은 환자에서 완전히 이식되기에 적합하다.
특정의 구현예에서, 장치 또는 시스템은 하나 이상의 전원 공급 소자, 예를 들면, 배터리 및/또는 하나 이상의 통신 소자를 추가로 포함한다.
본 발명은 환자에서 대장염, 특히 IBD를 치료하는 방법을 제공하며, 당해 방법은 위에서 기술한 바와 같은 장치 또는 시스템의 하나 이상의 구성 부품을 이식하는 단계, 상기 장치 또는 시스템의 제1의 변환기를 환자의 비장 신경 또는 SMP와 시그널 접촉하도록 위치시키는 단계, 및 상기 장치 또는 시스템을 활성화시키는 단계를 포함한다. 이러한 구현예에서, 상기 변환기는 시그널이 신경에 효과적으로 적용될 수 있도록 위치하는 경우 신경과 시그널 접촉한다. 상기 장치 또는 시스템은 당해 장치 또는 시스템이, 상기 시그널이 제어기에 의해 결정된 바와 같이 적용되도록 하는 작동 상태에 있는 경우 활성화된다.
특정의 국면에서, 상기 방법은 상기 장치 또는 시스템의 제 2의 변환기를 환자의 SMP 또는 비장 신경과 시그널 접촉하도록 위치시킴을 포함하며, 이때 어느 하나는 제1의 변환기와 시그널 접촉하지 않는다.
본 발명의 모든 측면의 실행(상기 및 하기 둘 다에서 논의 된 바와 같음)은도 2a 내지 도 2c를 참조하여 더 잘 이해 될 것이다.
도 2a 내지 2c는 본원에 기술된 다양한 방법 중 임의의 것을 수행하기 위해 환자에게 이식되거나, 환자 상에 위치되거나, 그렇지 않으면 배치되는 하나 이상의 신경조절 장치를 사용하여 본 발명이 실행되는 방법을 도시한다. 이러한 방식으로, 하나 이상의 신경조절 장치를 사용하여 환자의 비장 신경 및/또는 SMP, 임의로 비장 신경 및 SMP 둘 다에서 신경세포 활동을 조절함으로써 결장염, 예를 들면 IBD(크론병 또는 UC)를 치료할 수 있다.
도 2b 및 도 2c 각각에서, 별도의 신경조절 장치(100)는, 본원에서 논의된 바와 같이, 장치가 SMP 또는 비장 신경 중 단지 하나와 관련하여 제공되거나 사용될 수 있지만, 비장 신경 및 SMP 각각에 대해 제공된다. 유사하게, 본원에서 논의 된 바와 같이, 하나의 장치는 비장 신경 및 SMP 둘 다와 관련하여 제공되거나 사용될 수 있는데, 즉, 하나의 장치는 신경 둘 다에 시그널을 적용하도록 구성되어 제공된다.
각각의 신경조절 장치(100)는, 각각의 신경 또는 신경들의 신경 조절을 제공하도록, 환자 내에 완전히 또는 부분적으로 이식되거나, 기타의 경우에는 위치할 수 있다. 각각의 신경조절 장치(100)는 독립적으로 작동할 수 있거나, 서로 통신하도록 작동할 수 있다. 도 2a는 또한 이식된 신경조절 장치(100)의 부품을 개략적으로 나타내며, 여기서 상기 장치는 단일 유닛과 함께 그룹화되어 환자에 이식된 수개의 소자, 부품 또는 기능을 포함한다. 제1의 이러한 소자는 제1의 변환기, 바람직하게는 환자의 비장 신경 또는 SMP(90)에 근접하여 나타낸 전극(102)이다. 기술된 바와 같이, 장치(100)는 SMP 또는 비장 신경에 대해 구성되고 근접하게 위치된 제2의 변환기를 포함할 수 있으며, 이중 어느 것은 제1의 변환기와 시그널링 접촉하지 않는다(나타내지 않음). 변환기(102)는 제어기 소자(104)에 의해 작동될 수 있다. 장치는 통신 소자(106), 검출기 소자(108), 전원 소자(110) 등과 같은 하나 이상의 추가의 소자를 포함할 수 있다. 위에서 기술한 바와 같이, 변환기(102)는, 이식되는 경우, 이것이 신경(SMP 또는 비장 신경) 및 관련된 혈관(예를 들면, SMP 및 관련 장간막 동맥)을 포함하도록 구성된 커프 전극 형태일 수 있다.
각각의 신경조절 장치(100)는 하나 이상의 제어 시그널과는 독립적으로, 또는 이에 반응하여 필요한 신경조절을 수행할 수 있다. 이러한 제어 시그널은 하나 이상의 검출기 소자(108)의 출력에 응답하고/하거나 통신 소자를 사용하여 수신된 하나 이상의 외부 공급원으로부터의 통신에 대해 반응하여, 알고리즘에 따라 제어기(104)에 의해 제공될 수 있다. 본원에 논의 된 바와 같이, 검출기 소자(들)은 각종의 상이한 생리학적 매개 변수에 대해 반응성일 수 있다.
도 2b는 도 2a의 장치 또는 시스템이 상이하게 분포될 수 있는 몇 가지 방법을 도시한다. 예를 들어, 도 2B에서 신경조절 장치(100)는 비장 신경 또는 SMP (90)에 근접하게 이식된 변환기(102)를 포함하지만, 제어기(104), 통신 소자(106) 및 전원(110)과 같은 다른 소자는, 또한 이식될 수 있는(도 2b에서와 같이), 또는 기타의 경우에는 환자에 의해 운반될 수 있는 별도의 제어 유닛(130)으로 이식된다. 이후에, 제어 유닛(130)은 예를 들면, 시그널 및/또는 전원을 변환기에 전달하기 위한 전선 및/또는 광섬유를 포함할 수 있는 연결부(132)를 통해 신경조절 장치의 둘 다에서 변환기를 조절한다.
도 2b의 배열에서, 하나 이상의 검출기(108)는, 이러한 검출기 중 하나 이상이 또한 또는 대신 제어 유닛(130) 내에 및/또는 신경조절 장치(100) 중 하나 또는 둘 다에 위치할 수 있다고 해도, 제어 유닛으로부터 별도로 위치한다. 상기 검출기는 환자의 하나 이상의 생리학적 매개변수를 검출하는데 사용될 수 있으며, 이후에 상기 제어기 소자 또는 제어 유닛은 예를 들면, 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만, 검출된 매개변수(들)에 반응하여 시그널을 적용하도록 한다. 이러한 목적을 위해 검출될 수 있는 생리학적 매개 변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)의 순환하는 수준을 포함한다. 유사하게, 검출된 생리학적 매개변수는 환자의 신경, 예를 들면, 비장 신경, SMP 또는 미주 신경에서의 활동 전위 또는 활동 전위이 양식일 수 있다.
다양한 기능성 소자가 신경조절 장치로 위치하여 그룹화될 수 있는 다양한 다른 방식에서, 제어 유닛(130) 및 다른 어느 곳도 물론 가능하다. 예를 들면, 도 2b의 하나 이상의 센서는 도 2a 또는 도 2c의 배열 또는 다른 배열에 사용될 수 있다.
도 2c는 도 2a 또는 2b의 장치 또는 시스템의 일부 기능이 환자에서 이식되지 않은 일부 방식을 도시한다. 예를 들어, 도 2c에서, 당업자에게 친숙한 방식으로 장치 또는 시스템의 이식 소자에 전력을 제공할 수 있는 외부 전원(140)이 제공되고, 외부 제어기(150)는 제어기(104)의 기능 중 일부 또는 모두를 제공하고/하거나 장치 또는 시스템의 제어의 다른 국면을 제공하고/하거나 상기 장치 또는 시스템으로부터의 데이터 판독을 제공하고/하거나 데이터 입력 설비(152)를 제공한다. 데이터 입력 설비는 예를 들면, 환자의 상태(예를 들면, 이들이 복부 통증 또는 불편함을 겪고 있고, 결장염이 발생되고 있는 경우)에 관한 데이터를 입력하기 위해, 다양한 방식으로 환자 또는 다른 운영자가 사용할 수 있다.
각각의 신경조절 장치는 시그널을 비장 신경 및/또는 SMP에 적용하는 것을 전형적으로 포함하는 하나 이상의 물리적 작동 모드를 사용하여 필요한 신경조절을 수행하도록 채택될 수 있으며, 이러한 시그널은 전형적으로 신경(들)로의(또는 이로부터의) 에너지의 전달을 포함한다. 이미 논의된 바와 같이, 그러한 방식은 전기 시그널, 광 시그널, 초음파 또는 다른 기계적 시그널, 열 시그널, 자기 또는 전자기 시그널을 사용하거나, 필요한 조절을 수행하기 위한 일부 다른 에너지를 사용하여 신경 또는 신경들을 조절하는 것을 포함할 수 있다. 이러한 시그널은 비-파괴적 시그널일 수 있다. 이러한 조절은 신경 또는 신경들에서 신경세포 활동의 양식을 증가, 억제, 차단 또는 기타의 경우 변화시키는 것을 포함할 수 있다. 이러한 목적으로, 도 2a에 도시된 변환기(90)는 하나 이상의 전극, 하나 이상의 광원, 하나 이상의 초음파 변환기, 하나 이상의 열원, 또는 필요한 신경조절이 발휘되도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
신경세포 조절 장치 또는 기구 또는 시스템은, 예를 들면, AC 파형과 같은 전압 또는 전류를 적용시키기 위해 변환기(들)를 사용함으로써 비장 신경 및/또는 SMP의 신경세포 활동을 증가시키도록 배열될 수 있다. 상기 장치 또는 기구 또는 시스템은 저주파수 AC 파형, 예를 들어 주파수가 0.01 Hz 내지 1 kHz, 0.01 내지 500 Hz, 0.01 내지 100 Hz, 0.01 Hz 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 적용하기 위해 변환기(들)을 사용하도록 배열될 수 있다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01Hz, 0.05Hz, 0.1Hz, 0.5Hz, 1Hz, 2Hz, 3Hz, 4Hz, 5Hz, 6Hz, 7Hz, 8Hz, 9Hz 또는 10Hz, 예를 들면, 10Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 상기 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 상기 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10mA 예를 들어 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 직사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 갖는다. 특정의 바람직한 구현예에서, 시그널은 직사각형 파형을 갖는다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(㎲)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 ㎲, 30내지 400 ㎲, 40 내지 300 ㎲, 50 내지 200 ㎲, 60 내지 150 ㎲, 70 내지 120 ㎲, 80 내지 100 ㎲의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 0.1 내지 20V의 전압을 갖는 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 0.1 내지 15V, 임의로 0.1 내지 10V의 전압을 갖는다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V 중에서 선택된다.
특정의 구현예에서, 전기 시그널은 10Hz 0.2mA의 AC 정사각형 이상 파형을 포함한다.
신경세포 활동을 자극하기 위한 신경조절 기술은 열적, 물리적, 화학적 및 전자기 기술을 포함한다.
온도 변화는 뉴우런의 막(membrane) 내 이온 채널에 영향을 미쳐서, 흔히 휴지 전위(resting potential) 및 탈분극화율과 같은 특성에 영향을 미친다. 구체적으로, 고양이의 시상하부 내 가열 영역은 증가된 속도의 자발적인 방전(discharge)을 유발하였다(Teruo Nakayama, HT Hammel, JD Hardy, JS Eisenman American Journal of Physiology Published 1 June 1963 Vol.20 204, 1122-1126, 본원에 참고로 포함됨). 적외선(IR) 방사선의 짧은 펄스를 통한 열의 집중적인 적용은 일시적인 국소 온도 증가를 유발하고 또한 뉴런을 탈분극시킬 수 있다(Goyal V,, 2012 Nov; 295(11): 1987-99, 본원에 참고로 포함됨). 전기적 자극을 초과하는 IR 방사선의 장점은 보다 높은 공간-시간 해상도 및 신경세포 시그널 기록을 방해할 수 있는 전기적 인공물의 회피를 포함한다. 레이저 자극을 추가로 향상시키기 위해, 막 근처에 주입된 플라즈몬 금 나노 막대는 근적외선(IR) 에너지를 열로 변환시키는 것으로 밝혀졌다(Eom K, Small. 2014 Oct 15; 10(19):3853-7 (본원에 참고로 포함됨)). 자기장은 또한 인접 뉴우런에서 활동 전위를 생산하기 위해 나노 입자를 가열함이 밝혀졌다(Heng Huang. Nature Nanotechnoliogy 5, 602-606(2010), 본원에 참고로 포함됨).
기계적 변형은 또한 막 전위를 변화시킬 수 있다. 축삭돌기의 신속하고, 짧은 기간의 기계적 압축은 탈분극을 생산한다(Fred J. Julian and David E. Goldman, The General of Physiology: Published November 1, 1962, 본원에 참고로 포함됨). 또한, 축삭돌기를 신장시키기 위해 하중을 적용하는 것은 축삭돌기가 궁극적으로 탈분극되도록 한다. 20%를 초과하는 신장에서, 축삭돌기는 비가역적으로 손상된다(J. A. Galbraith, J Biomech Eng 115 (1), 13-22 (Feb 01, 1993), 본원에 참고로 포함됨). 초음파는 뇌, 망막 및 달팽이관의 영역을 포함하는 신경세포 조직 구조를 자극하는데 사용되어 왔다(King. R, Ultrasound Med. Biol. July 2014, Vol. 40 Issue 7, pl512, 11; Menz, MD, J Neurosci. 2013 Mar 6;33(10):4550-6Q; LR. Gavriiov, Ultrasound Med Biol, 22(1996), pp. 179-192, 이의 모두는 본원에 참고로 포함됨). 시험관 내 해마 제제를 사용한 연구는 유발된 장 전위(evoked field potential)를 변형시키는 동시 기계적 및 열적 메카니즘을 제안하였다(Bachtoid, M. Ultrasound Med Biol. 1998 May; 24(4):557-65, 본원에 참고로 포함됨). 수 밀리미터(few millimeter) 순서의 초음파 자극의 공간 해상도. 초음파 압력 파장은 조직 내에 깊게 침투할 수 있지만, 음향 임피던스가 불일치하는 조직 계면에서 반사된다.
비-침입성 자기 자극은 뇌, 척수, 신경 뿌리 및 말초 신경을 자극하는데 사용되어 왔다(Rossini, PM et al, Clin Neurophysiol. 2015 Feb, 본원에 참고로 포함됨). 신속하게 변화하는 자기장은 신경세포 조직의 축삭돌기내에서 탈분극화를 유발하는 전류를 생산한다.
위에서 논의된 기술은 원칙적으로 뉴우런 활성의 자극에 관한 것이다. 다양한 방식으로 활성을 억제하거나 차단하거나 또한 활성을 변형시킴에 의한 조절이 필요한 경우, 변환기를 하기 기술된 차단 기술 중 하나 이상을 적용하도록 구성시킬 수 있다.
신경조절의 열 방법은 또한 신경의 온도를 조작하여 시그널 전파를 억제할 수 있다. 예를 들면, Patberg 등(Blocking of impulse conduction in peripheral nerves by local cooling as a routine in animal experimentation; Journal of Neuroscience Methods 1984;10:267-75, 이는 본원에 참고로 포함됨)은 신경을 냉각시키는 것이 반응의 발생 없이 시그널 전도를 수십 초 이하로 발생시켜, 가역적으로 및 신속한 작용 둘 다로 차단하는 방법을 논의하고 있다. 신경을 가열하는 것은 또한 전도를 차단하는데 사용될 수 있으며 작은 이식가능하거나 국재화된 변환기 또는 장치 내에서, 예를 들면, 신속하고, 가역적이며, 공간적으로 매우 국재화된 가열 효과를 제공하기 위해 사용될 수 있는, 레이저 다이오드로부터의 적외선 또는 전기적으로 내성인 소자와 같은 열적 열원을 사용하여 실행하기에 일반적으로 더 용이하다(참고: 예를 들면 Duke et al. J Neural Eng. 2012 Jun;9(3):036003. Spatial and temporal variability in response to hybrid electro-optical stimulation., 이는 본원에 참고로 포함됨). 가열, 또는 냉각, 또는 이들 둘 다는 페티에 소자(Peltier element)를 사용하여 제공될 수 있다.
광유전학기술은 광민감성 특징을 발현하도록 세포를 유전적으로 변형시키는 기술이며, 이는 이후 광으로 활성화시켜 세포 기능을 조절할 수 있다. 신경세포 점화를 억제하는데 사용될 수 있는 많은 상이한 광유전학 도구가 개발되어 왔다. 신경세포 활동을 억제하기 위한 광유전학적 도구의 목록은 편집되어 있다(Epilepsia. 2014 Oct 9. doi: 10.1111/epi.12804. WONOEP appraisal: Optogenetic tools to suppress seizures and explore the mechanisms of epileptogenesis. Ritter LM et al., 이는 본원에 참고로 포함됨). 아크릴아민-아조벤젠-4급 암모늄(AAQ)은 많은 유형의 K+ 채널을 차단하는 광색성 리간드이며, 시스(cis) 배열에서, K+ 채널의 경감은 점화를 억제한다(Nat Neurosci. 2013 Jul;16(7):816-23. doi: 10.1038/nn.3424. Optogenetic pharmacology for control of native neuronal signaling proteins Kramer RHet al, 이는 본원에 참고로 포함됨). 채널 로돕신-2를 채택하여 이를 렌티바이러스로 포유동물 뉴우런에 도입시킴으로써, 억제성 시냅스 전달을 제어하는 것이 가능하다(Boyden ES 2005). 레이저 또는 발광 다이오드와 같은 외부 광원을 사용하는 대신에, 광은 개똥벌레 루시퍼라제를 기본으로 하는 유전자를 도입함으로써 내부적으로 생성될 수 있다(Land BB 2014). 내부적으로 발생된 광은 억제를 생성하기에 충분하다.
신경조절의 기계적 형태는 이식된 초음파 변환기 대신에 편리하게 외적으로 실행될 수 있는 초음파의 사용을 포함할 수 있다. 다른 형태의 기계적 신경조절은 압력의 사용을 포함한다(예를 들면, 참고: "The effects of compression upon conduction in myelinated axons of the isolated frog sciatic nerve" by Robert Fern and P. J. Harrison Br.j. Anaesth. (1975), 47, 1123, 본원에 참고로 포함됨).
신경조절의 일부 전기적 형태는 하나 이상의 전극을 사용하여 신경에 적용된 직류(DC), 또는 교류(AC) 파형을 사용할 수 있다. DC 차단은 DC 파형 진폭을 일반적으로 상향 램핑(ramping up)함으로써 달성할 수 있다(Bhadra and Kilgore, IEEE Transactions on Neural systems and rehabilitation engineering, 2004 12(3) pp313-324, 이는 본원에 참고로 포함됨). 일부 AC 기술은 가역적인 차단을 제공하기 위한 HFAC 또는 KHFAC(고-주파수 또는 킬로헤르츠 주파수)를 포함한다(예를 들면, 참고: Kilgore and Badra, 2004, Medical and Biological Engineering and Computing, 이의 내용은 모든 목적을 위해 본원에 참고로 포함됨). Kilgore 및 Bhadra의 작업에서, 제안된 파형은 3 내지 5 kHz에서의 사인 곡선 파형 또는 직사각형이었으며, 차단을 생산한 대표적인 시그널 진폭은 3 내지 5 Volts 또는 0.5 내지 2.0 밀리 암페어 피크 대 피크였다.
HFAC는 100%의 사용률(duty cycle)에서 1 내지 50 kHz의 주파수에서 전형적으로 적용될 수 있다(Bhadra, N. et al., Journal of Computational Neuroscience, 2007, 22(3), pp 313-326, 이는 본원에 참고로 포함됨). 5 내지 10 kHz의 주파수를 갖는 파형의 적용에 의해 신경의 활동을 선택적으로 차단하는 방법은 제US 7,389,145호(본원에 참고로 포함됨)에 기술되어 있다. 유사하게, 제US 8,731,676호(본원에 참고로 포함됨)는 신경에 5 내지 50 kHz 주파수의 파형을 적용함으로써 감각 신경 통증을 완화시키는 방법을 기술하고 있다.
본 발명은 또한 환자에서 결장염, 특히 IBD를 치료하는 방법을 제공하며, 당해 방법은 시그널을 환자의 비장 신경 및/또는 상부 장간막신경총(SMP)에 적용하여 환자에서 신경의 신경세포 활동을 조절하는 것을 포함한다. 특정의 구현예에서, 제1의 시그널은 비장 신경에 적용되고 제2의 시그널은 SMP에 적용된다.
특정의 구현예에서, 시그널 또는 시그널들은 각각의 시그널에 적용시키도록 구성된 변환기, 바람직하게는 전기 시그널을 적용하기 위한 전극을 포함하는 신경조절 장치에 의해 적용된다. 특정의 바람직한 구현예에서, 신경조절 장치는 환자 내에 적어도 부분적으로 이식된다. 특정의 바람직한 구현예에서, 신경조절 장치는 환자 내에 전체적으로 이식된다.
제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 특정의 구현예에서, 시그널 둘 다는 동일한 신경조절 장치에 의해 적용되며, 당해 장치는 제1의 시그널을 적용시키기 위한 1개 및 제2의 시그널을 적용시키기 위한 1개의, 적어도 2개의 변환기를 갖는다. 특정의 대안적인 구현예에서, 제1의 시그널은 하나의 신경조절 장치에 의해 적용되고 제2의 시그널은 별도의 신경조절 장치에 의해 적용된다.
특정의 구현예에서, 시그널은 이것이 적용되는 신경을 자극하도록 구성된다. 특정의 구현예에서, 시그널은 이것이 적용되는 신경내 신경세포 활동을 증가시키도록 구성된다(전체 신경, 또는 신경의 신경 섬유의 소세트의 총 시그널링 활동에 있어서의 증가는 이러한 신경 또는 이의 소세트내 기본선 신경 활동과 비교된다).
특정의 바람직한 구현예에서, 상기 방법은 IBD를 치료하는 방법이다. 특정의 이러한 구현예에서, 상기 방법은 궤양성 결장염 또는 크론병을 치료하는 방법이다.
특정의 구현예에서, 결장염의 치료는 예방학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 빈도를 감소시키고/시키거나 완화 기간을 연장시킨다.
특정의 구현예에서, 결장염의 치료는 치료학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 중증도를 적어도 부분적으로 경감시키거나 완화시킨다. 예를 들면, 특정의 구현예에서 상기 방법은 발생 동안 증상의 빈도 및/또는 중증도의 완화를 제공하거나, 환자가 완화 상태로 도입되도록 한다. 치료학적 치료는 전적으로 결장염 환자를 치유할 수 있다.
특정의 구현예에서, 결장염의 치료는 측정가능한 생리학적 매개변수에 있어서의 개선, 예를 들면, 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가, 하나 이상의 염증성 마커(예를 들면, 장 조직 및/또는 순환에서의 염증성 사이토킨(예를 들면, TNF알파, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직학에 의해 측정된 것으로서, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 증상 중증도의 감소(복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 체온 증가 및 피로 중 하나 이상의 감소) 중 어느 하나 이상에 의해 나타낸다.
어떠한 제공된 매개변수에 대한 값을 측정하기에 적합한 방법은 숙련가에 의해 인식될 수 있다.
특정의 구현예에서, 상태의 치료는 시그널이 적용되는 신경 또는 신경들내 신경세포 활동의 프로파일에 있어서의 개선으로 나타난다. 즉, 상태의 치료는 건강한 개인에서 신경세포 활동에 도달하는 신경(들)내 신경세포 활동, 즉, 개입 전 보다 건강한 개인에 의해 나타난 보다 근접하게 유사한 신경내 작동 전위의 양식으로 나타난다.
다음의 설명 및 구현예는 시그널이 비장 신경에 적용되는 구현예, 시그널이 SMP에 적용되는 구현예, 및 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예들 각각에 대해 독립적으로 적용된다. 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예에서, 제1 및 제2의 시그널은 독립적으로 선택된다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 일부분에서 기본선 신경세포 활동과 비교하여 신경의 적어도 일부분내 신경세포 활동이 증가되는 것을 가져온다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동등하게 달성될 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널을 적용하는 결과는 전체 신경에 걸쳐 신경세포 활동에 있어서의 증가이다. 결장염의 치료는 비장 신경 또는 SMP, 또는 이들 둘 다에 의한 교감신경 시그널링이 증가되는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 하나 이상의 변환기에 의해 적용된 시그널 또는 시그널들은 전극, 예를 들면, 전압 또는 전류에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 적용된 시그널은 전하가 균형을 이룬 직류(DS) 파형과 같은 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다이다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 전기 시그널은 낮은 주파수의 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내(예를 들면, 비장 신경 또는 SMP 이외의 신경내) 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 시그널이 적용되기 전 신경의 일부분에서 신경세포 활동과 비교하여 감소된 신경의 적어도 일부분내 신경세포 활동을 가져온다. 따라서, 특정의 구현예에서 시그널의 적용 결과는 신경내 신경세포 활동의 적어도 부분적인 억제이다. 특정의 구현예에서, 시그널의 적용 결과는 신경 또는 신경들내 신경세포 활동의 완전한 억제이다.
특정의 구현예에서, 시그널의 적용 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경 또는 신경들내 작동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경 또는 신경들내 활동 전위의 수득되는 양식이 건강한 대상체에서 관찰된 신경(들)내 활동 전위의 양식과 유사하도록 조절된다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 시간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 또는 1시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 대안의 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 특정의 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호되는 이러한 구현예에서, 시그널은 1일에 걸쳐 연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
시그널이 간헐적으로 적용되는 특정의 구현예에서, 시그널은 환자가 특이 상태인 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염 발생을 경험하는 경우에만, 즉, 환자가 결장염 위기와 관련된 하나 이상의 증상, 예를 들면, 복부 통증 또는 불편함, 설사, 체중 감소, 직장 출혈 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면, 이들이 결장염의 발생(결장염 발생)을 경험한 상태)는 환자에 의해 나타낼 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 장치는 환자가 이들의 상태를 나타낼 수 있도록 하는 입력 소자를 추가로 포함할 수 있다. 대안적인 이러한 구현예에서, 환자의 상태는 환자로부터의 어떠한 입력과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용된 특정의 구현예에서, 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함할 수 있으며, 여기서 시그널은 검출기가 환자가 특수 상태에 있음을 검출하는 경우에만 적용된다.
본 발명에 따른 방법의 특정한 구현예에서, 본 발명은 환자의 하나 이상의 생리학적 매개변수를 검출하는 단계를 추가로 포함하며, 여기서 상기 시그널은 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만 적용된다. 하나 이상의 생리학적 매개변수가 검출되는 이러한 구현예에서, 시그널은 검출된 매개변수들 중의 어느 하나 만이 이의 역치 값을 충족하거나 초과하는 경우에만, 대안적으로 검출된 매개변수들 중 어느 모두가 이들의 역치 값을 충족하거나 초과하는 경우에만 적용될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 하나 이상의 생리학적 매개변수가 검출되도록 구성된 적어도 하나의 검출 소자를 추가로 포함한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 혈장 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)의 장 조직 및/또는 혈장 수준으로부터 선택된다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있다. 특정의 이러한 구현예에서, 활동 전위 또는 활동 전위의 양식은 결장염과 관련될 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수 중 어느 2개 이상이 일렬로 또는 연속적으로 검출될 수 있음은 인식될 것이다. 예를 들면, 특정의 구현예에서, SMP에 있어서의 활동 전위의 양식은 장의 노르에피네프린 수준과 동시에 검출될 수 있다.
특정의 구현예에서, 시그널은 영구적으로 적용된다. 즉, 일단 시작하면, 시그널은 신경에 연속적으로 적용된다.
시그널이 일련의 펄스인 경우, 펄스들 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지는 않는다.
방법의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널이 중지하면, 신경내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간 내에 기본선 신경세포 활동으로 실질적으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지시, 신경내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 적어도 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 중지시, 신경내 신경세포 활동은 조절 전 대상체에서보다 건강한 대상체에서 관찰된 활동 전위의 양식과 보다 더 유사하며, 바람직하게는 실질적으로 건강한 대상체에서 관찰된 활동 전위 양식과 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지시 신경 또는 신경들의 활동 전위의 양식은 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중지시, 신경내 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 가져올 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프의 결과인 것으로 추정된다.
특정의 이러한 구현예에서, 일단 처음 적용되면, 시그널은 상기 구현예에서 기술된 바와 같이, 간헐적으로 또는 영구적으로 적용될 수 있다.
특정의 구현예에서, 적용된 시그널은 비-파괴적인 시그널이다.
본 발명에 따른 방법의 특정의 구현예에서, 적용된 시그널은 하나 이상의 전극으로 구성된 신경조절 장치에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 상기 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 직류 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 낮은 주파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA, 예를 들면 0.2 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
적용된 시그널이 전기 시그널인 특정의 구현예에서, 당해 시그널은 커프 전극과 같은 전극에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
특정의 대안적 구현예에서, 적용된 시그널은 전자기 시그널(임의로 광학 시그널), 기계적(임의로 초음파) 시그널, 열 시그널, 자기 시그널 또는 어떠한 다른 유형의 시그널이다. 이러한 구현예에서, 시그널은 적어도 하나의 변환기를 포함하는 신경조절 장치에 의해 적용되며, 상기 변환기는 하나 이상의 광원, 하나 이상의초음파 변환기, 하나 이상의 열원, 또는 각각의 시그널이 작동하도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
시그널이 열 시그널인 특정의 구현예에서, 상기 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 상승시킨다(즉, 신경에 열을 가한다). 특정의 구현예에서, 상기 시그널 둘 다는 신경에 열을 가하고 신경을 냉각시킨다.
시그널이 기계적 시그널인 특정의 구현예에서, 상기 시그널은 초음파 시그널이다. 특정의 대안적 구현예에서, 기계적 시그널은 압력 시그널이다.
본 발명의 장치, 시스템 및 방법을 소염제와 결합시키는 것이 특히 유리할 것이다. 스테로이드(예를 들면, 프레드니솔론 및 하이드로코르티손과 같은 코르티코스테로이드), 5-아미노-살리실레이트((5-ASA)(예를 들면, 메살라진), 면역억제제(예를 들면, 메토트렉세이트, 아자티오프린, 및 사이클로스포린); 및 항-종양괴사인자 제제(항-TNF)(예를 들면, 인프릭시마브 및 아달리무마브)는 IBD와 같은 결장염 상태에 대한 치료로서 이미 사용되고 있다. 이들 제제는 단독으로 사용되는 경우 항상 효과적이지 않으며 골 변성, 정신학적 변화 및 감염과 같은 바람직하지 않은 부작용과 관련되어 있다. 그러나, 본 발명의 방법 및 기구 또는 시스템과 함께 사용되는 경우, 상기 배합은 하나의 개입 단독과 비교하여 개선된 치료 효능을 생성하고/하거나 예를 들면, 필요한 소염제의 투여량을 감소시킴으로써, 환자에 의해 경험된 부작용을 감소시킬 것이다.
따라서, 특정의 구현예에서, 상기 방법은 환자에게 소염제를 투여함을 추가로 포함한다. 특정의 구현예에서, 상기 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF제로부터 선택된다. 특정의 바람직한 이러한 구현예에서, 소염제 및 신경세포 활동의 조절은 매우 동일한 효과를 가지는데, 즉, 각각의 개입에 의해 유발된 소염 효과는 다른 개입에 의해 유발된 소염 효과와 실질적으로 동시적이다. 특정의 이러한 구현예에서, 상기 효과는 상승적일 수 있다.
본 발명의 다른 국면은 환자에서 결장염을 치료하는 방법에 사용하기 위한 소염제를 제공하며, 여기서 상기 방법은 (i) 시그널을 환자의 비장 신경 및/또는 상부 장간막신경총에 적용하여 환자내 신경에서 신경세포 활동을 조절하는 단계; 및 (ii) 소염제를 환자에게 투여하는 단계를 포함한다.
특정의 구현예에서, 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF제로부터 선택된다.
특정의 바람직한 구현예에서, 소염제 및 신경세포 활동의 조절은 동시 효과를 갖는데, 즉 각각의 개입에 의해 유발된 소염 효과는 다른 개입에 의해 유발된 소염 효과와 실질적으로 동시이다. 특정의 이러한 구현예에서, 상기 효과는 상승적일 수 있다.
특정의 구현예에서, 제1의 시그널은 비장 신경에 적용되고 제2의 시그널은 SMP에 적용된다.
특정의 구현예에서, 시그널 또는 시그널들은 각각의 시그널을 적용하도록 구성된 변환기를 포함하는 신경조절 장치에 의해 적용된다. 특정의 바람직한 구현예에서, 상기 신경조절 장치는 환자내에 적어도 부분적으로 이식된다. 특정의 바람직한 구현예에서, 상기 신경조절 장치는 환자내에 전체적으로 이식된다.
제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 특정의 구현예에서, 시그널 둘 다는 동일한 신경조절 장치에 의해 적용되는데, 이러한 장치는 제1의 시그널을 적용하기 위한 1개 및 제2의 시그널을 적용하기 위한 1개로서, 적어도 2개의 변환기를 갖는다. 특정의 대안의 구현예에서, 제1의 시그널은 하나의 신경조절 장치에 의해 적용되고 제2의 시그널은 별도의 신경조절 장치에 의해 적용된다.
특정의 바람직한 구현예에서, 시그널 또는 시그널들은 시그널이 적용된 신경 또는 신경들내 신경세포 활동을 증가시키기 위한 자극 시그널이다. 특정의 이러한 구현예에서 시그널 또는 시그널들은 전극을 포함하는 신경조절 장치에 의해 적용된 전기 시그널이다. 적용된 시그널이 전기 시그널인 특정의 이러한 구현예에서, 당해 시그널은 커프 전극과 같은 전극에 의해 적용된다. 특정의 이러한 구현예에서, 커프는 시그널이 적용된 신경 및 임의로 관련 혈관을 포함하도록 구성된다. 예를 들면, 전기 시그널이 SMP에 적용된 특정의 구현예에서, 상기 시그널은 SMP 및 상부 장간막 동맥을 포함하도록 구성된 커프 전극에 의해 적용된다.
특정의 바람직한 구현예에서, 소염제는 IBD를 치료하기 위한 것이다. 특정의 이러한 구현예에서, 소염제는 궤양성 결장염 또는 크론병을 치료하는데 사용된다.
특정의 구현예에서, 결장염의 치료는 예방학적 치료이다. 즉, 본 발명의 방법은 결장염 발생 빈도를 감소시키고/시키거나 완화 기간을 연장시킨다.
특정의 구현예에서, 결장염의 치료는 치료학적 치료이다. 즉, 본 발명의 방법은 결장염 발생의 중증도를 적어도 부분적으로 경감시키거나 완화시킨다. 예를 들면, 특정의 구현예에서 상기 방법은 발생 동안 증상의 빈도 및/또는 중증도의 완화를 제공하거나, 환자가 완화 상태로 도입되도록 할 수 있다. 치료학적 치료는 결장염 환자를 전적으로 치유할 수 있다.
특정의 구현예에서, 결장염의 치료는 측정가능한 생리학적 매개변수에 있어서의 개선, 예를 들면, 교감신경 활성도에 있어서의 증가, 장 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가, 장 조직 및/또는 순환에서의 하나 이상의 염증성 마커(예를 들면, 염증성 사이토킨(예를 들면, TNFα, IL-6, IL-1β, IL-12p70, MCP-1, IL-17, IL-23, C-반응성 단백질, 칼프로텍틴)에 있어서의 감소, 장 병리학(예를 들면, 내시경 및/또는 조직검사, 예를 들면, 치음와, 폴립, 과형성, 배상 세포 고갈에 의해 측정된 것으로서)에 있어서의 감소, 결장 섬유증의 감소, 및 증상 중증도(예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 증가 및 피로)에 있어서의 감소에 의해 나타난다.
어떠한 제공된 매개변수에 대한 값을 측정하기에 적합한 방법은 숙련가에게 익숙할 수 있다.
특정의 구현예에서, 상태의 치료는 시그널이 적용되는 신경 또는 신경들내 신경세포 활동의 프로파일에 있어서의 개선에 의해 나타난다. 즉, 상태의 치료는 건강한 개인에서 신경세포 활동에 도달하는 신경(들)내 신경세포 활동, 즉, 개입 전보다 건강한 개인에 의해 나타난 신경내 활동 전위의 양식과 보다 더 근접하게 유사한 신경내 활동 전위의 양식에 의해 나타난다.
특정의 구현예에서, 소염제는 단계 (i)이 단계 (ii) 전에 수행되고, 여기서 단계(ii)는 단계 (i) 전에 수행되거나, 여기서 단계 (i) 및 단계 (ii)가 동시에 수행되는 방법에서 사용하기 위한 것이다. 특정의 바람직한 구현예에서, 단계 (i)의 소염 효과 및 단계 (ii)의 소염 효과는 실질적으로 동시이다. 즉, 특정의 구현예에서, 소염제 및 신경조절은 실질적으로 동시에 이들의 소염 효과를 발휘한다.
다음의 설명 및 구현예는 시그널이 비장 신경에 적용되는 구현예, 시그널이 SMP에 적용되는 구현예, 및 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예 각각에 대해 독립적으로 적용된다. 제1의 시그널이 비장 신경에 적용되고 제2의 시그널이 SMP에 적용되는 구현예에서, 제1 및 제2의 시그널은 독립적으로 선택된다.
특정의 구현예에서, 시그널을 적용한 결과로서 신경세포 활동에 있어서의 조절은 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 이러한 부분내 기본선 신경세포 활동과 비교하여 증가된 신경의 적어도 일부분내 신경세포 활동을 가져온다. 활동에 있어서의 이러한 증가는 전체 신경에 걸쳐 동등하게 달성될 수 있다. 따라서, 특정의 이러한 구현예에서, 시그널의 적용 결과는 전체 신경에 걸친 신경세포 활동의 증가이다. 결장염의 치료는 비장 신경 또는 SMP, 또는 둘 다에 의한 시그널링이 증가하는 경우 특히 효과적인 것으로 예측된다.
특정의 구현예에서, 신경세포 활동을 증가시키기 위해 적용된 시그널은 저 주파수의 AC 파형을 포함하는 전기 시그널이다. 특정의 구현예에서, 상기 전기 시그널은 저 주파수 AC 파형을 포함한다. 특정의 구현예에서, 상기 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다. 특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 예를 들면 0.5 내지 20Hz, 1 내지 15Hz, 5 내지 10Hz인 AC 파형을 포함한다. 특정의 구현예에서, 상기 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 정사각형 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 구현예에서, 시그널은 정사각형 파형이다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 상기 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동에 있어서 조절은 시그널이 적용된 신경(예를 들면, 비장 신경 또는 SMP 이외의 신경)내 신경세포 활동의 억제이다. 즉, 이러한 구현예에서, 시그널의 적용은 신경의 적어도 일부에서 시그널이 적용되기 전 신경의 이러한 부분에서 신경세포 활동과 비교하여 감소된 신경세포 활동을 가져온다. 따라서, 특정의 구현예에서, 시그널을 적용하는 결과는 신경내 신경세포 활동의 적어도 부분적인 억제이다. 특정의 구현예에서, 시그널을 적용시키는 결과는 신경 또는 신경들내 신경세포 활동의 완전힌 억제이다.
특정의 구현예에서, 시그널을 적용하는 결과로서 신경세포 활동의 조절은 시그널이 적용된 신경 또는 신경들내 활동 전위의 양식에 대한 변경이다. 특정의 이러한 구현예에서, 신경세포 활동은 신경 또는 신경들내 활동 전위의 수득되는 양식이 건강한 대상체에서 관찰된 신경(들)내 활동 전위의 양식과 유사하도록 조절된다.
특정의 구현예에서, 제어기는 시그널이 간헐적으로 적용되도록 한다. 특정의 이러한 구현예에서, 제어기는 시그널이 기간 동안(예를 들면, 처음 기간) 적용되도록 한 후, 제2의 또는 즉시 후속적인 기간을 위해 중지한 후, 재적용되고, 교호하는 양식으로 중지하도록, 예를 들면, 제3의 기간 동안 적용한 후, 제4의 기간 동안 중지하도록 한다. 이러한 구현예에서, 시그널 적용 및 중지의 교호하는 기간(예를 들면, 제1, 제2, 제3 및 제4의 기간 등)은 순차적으로 및 연속적으로 일어난다. 일련의 제1, 제2, 제3 및 제4의 기간(등)은 1회 적용 주기에 이르는 양이다. 특정의 이러한 구현예에서, 이러한 다수의 적용 주기는 시그널이 적용되지 않는 상들 사이에서, 상기 시그널이 상들에 적용되도록, 연속적으로 수행될 수 있다.
이러한 구현예에서, 제1, 제2, 제3 및 제4 기간의 지속 기간은 독립적으로 선택될 수 있다. 즉, 각각의 기간의 지속 기간은 다른 기간 중 어느 것과도 동일하거나 상이할 수 있다. 특정의 이러한 구현예에서, 제1, 제2, 제3 및 제4 기간 각각의 지속 기간은 5초 (5s) 내지 24시간 (24h), 30초 내지 12시간, 1분 내지 12시간, 5분 내지 8시간, 5분 내지 6시간, 10분 내지 6시간, 10분 내지 4시간, 30분 내지 4시간, 1시간 내지 4시간 (또는 이러한 상한 및 하한의 어떠한 조합) 중 어느 시간이다. 특정의 구현예에서, 상기(예를 들면, 제1, 제2, 제3 및 제4) 기간 각각의 지속 기간은 5초, 10초, 30초, 60초, 2분, 5분, 10분, 15분, 20분, 30분, 40분, 50분, 60분, 90분, 2시간, 3시간, 4시간, 5시간, 6시간, 7시간, 8시간, 9시간, 10시간, 11시간, 12시간, 13시간, 14시간, 15시간, 16시간, 17시간, 18시간, 19시간, 20시간, 21시간, 22시간, 23시간, 24시간(또는 앞서의 기간의 한계내 어떠한 기간)이다.
특정의 바람직한 구현예에서, 시그널 적용의 교호하는 기간(예를 들면, 제1 및 제3 기간 등)은 1분 내지 1시간, 예를 들면, 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분, 또는 20분, 또는 30분 시간(또는 이들 사이의 어떠한 기간)이다. 특정의 이러한 구현예에서, 시그널 중지의 교호하는 기간(예를 들면, 제2 및 제4 기간 등)은 1 내지 20분, 1 내지 10분, 2 내지 10분, 예를 들면 2분, 또는 5분, 또는 10분이다. 특정의 이러한 구현예에서, 시그널은 1일에 6회 이하, 1일에 4회 이하, 1일에 3회 이하, 1일에 2회 이하, 1일에 1회 적용된다. 특정의 이러한 구현예에서, 시그널은 24시간, 12시간, 8시간, 및 6시간으로부터 독립적으로 선택된(또는 주행성 반복 양식이 생성되어 유지되도록, 시그널이 적용되는 교호하는 기간의 지속 기간으로부터 이러한 지속 기간이 되도록 선택된) 교호하는 기간 동안 적용되지 않는다. 특정의 이러한 구현예에서, 제2 및 제4의 기간은 제1 및 제3의 기간이 누적적으로 24시간으로부터 감해지면, 24시간 주기의 나머지를 포함한다. 즉, 제1 및 제3의 기간은 예로써 지속 기간이 각각 5분(총 10분)이며, 제2 및 제3의 기간은 총 23시간 40분을 포함하고, 즉 각각 11시간 50분이다. 임의로 이러한 구현예에서, 제1 및 제2의 기간은 누적적으로 12시간의 기간이고, 제3 및 제4의 기간은 누적적으로, 12시간의 기간이다.
제어기가 시그널을 간헐적으로 적용시키는 특정의 구현예에서, 당해 시그널은 1일당 특정의 양으로, 또는 특정 양의 시간으로, 1일 2회 적용된다. 특정의 이러한 구현예에서, 시그널은 1일당 적어도 2분, 적어도 5분, 적어도 10분, 적어도 20분, 적어도 30분, 적어도 40분, 적어도 50분, 적어도 60분, 적어도 90분, 적어도 2시간, 적어도 3시간, 적어도 4시간, 적어도 5시간, 적어도 6시간, 적어도 7시간, 적어도 8시간, 적어도 9시간, 적어도 10시간, 적어도 11시간, 적어도 12시간, 적어도 13시간, 적어도 14시간, 적어도 15시간, 적어도 16시간, 적어도 17시간, 적어도 18시간, 적어도 19시간, 적어도 20시간, 적어도 21시간, 적어도 22시간, 적어도 23시간 동안 적용된다. 특정의 이러한 구현예에서, 시그널은 규정된 양의 시간 동안 연속적으로 적용된다. 특정의 교호하는 이러한 구현예에서, 시그널은 1일에 걸쳐 연속적으로 적용될 수 있으며, 단 총 적용 시간은 규정된 시간에 해당한다. 특수한 구현예에서, 시그널은 1일에 2회 또는 1일에 4회 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분 동안 적용된다.
시그널이 간헐적으로 적용되는 특정의 구현예에서, 당해 시그널은 환자가 특이적인 상태에 있는 경우에만 적용된다. 특정의 이러한 구현예에서, 시그널은 환자가 결장염의 발생(또한 결장염 발생)을 경험하는 경우에만, 즉, 이들이 결장염 위기 또는 발생과 관련된 하나 이상의 증상, 예를 들면, 복부 팽창, 경련, 통증 또는 불편함, 설사, 체중 감소, 직장 출혈, 오심, 빈혈, 체온 상승 및 피로를 경험하는 경우에만 적용된다. 이러한 구현예에서, 환자의 상태(예를 들면, 이들이 병의 발생을 경험한 상태)는 환자에 의해 나타낼 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 환자가 이들의 상태를 나타내도록 할 수 있는 입력 소자를 추가로 포함할 수 있다. 대안적인 이러한 구현예에서, 환자의 상태는 환자로부터의 어떠한 입력과는 독립적으로 검출될 수 있다. 시그널이 신경조절 장치에 의해 적용된 특정의 구현예에서, 장치는 환자의 상태를 검출하도록 구성된 검출기를 추가로 포함할 수 있으며, 여기서 시그널은 검출기가 환자가 특수 상태(예를 들면, 결장염 발생 또는 갑작스러운 재발)에 있음을 검출하는 경우에만 적용된다.
본 발명에 따른 방법의 특정한 구현예에서, 당해 방법은 환자의 하나 이상의 생리학적 매개변수를 검출하는 단계, 및 임의로 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만, 상기 시그널을 적용하는 단계를 추가로 포함한다. 하나 이상의 생리학적 매개변수가 검출되는 이러한 구현예에서, 시그널은 검출된 매개변수들 중 어느 하나가 이들의 역치 값을 충족하거나 초과하는 경우, 대안적으로, 검출된 매개변수 모두가 이들의 역치 값을 충족하거나 초과하는 경우에만 적용될 수 있다. 시그널이 신경조절 장치에 의해 적용되는 특정의 구현예에서, 상기 장치는 하나 이상의 생리학적 매개변수가 검출되도록 구성된 적어도 하나의 검출기를 추가로 포함한다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는: 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 하나 이상의 염증성 마커(예를 들면, TNFα, IL-6, IL-1β, MCP-1, IL-17, C-반응성 단백질, 및 칼프로텍틴)의 장 조직 및/또는 순환하는 수준, 결장 및/또는 비장을 통한 혈류 및/또는 순환으로부터 선택된다.
특정의 구현예에서, 하나 이상의 검출된 생리학적 매개변수는 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함할 수 있다. 특정의 이러한 구현예에서, 활동 전위 또는 활동 전위의 양식은 결장염과 관련될 수 있다. 특정의 이러한 구현예에서, 신경은 비장 신경 또는 SMP이다. 특정의 구현예에서, 활동 전위 또는 활동 전위의 양식은 미주 신경, 예를 들면 미주 신경의 구심성 섬유에서 검출된다.
나타낸 생리학적 매개변수중 어느 2개 이상이 일렬로 또는 연속적으로 검출될 수 있음은 인식될 것이다. 예를 들면, 특정의 구현예에서, SMP에 있어서의 활동 전위의 양식은 위 노르에피네프린 수준과 동시에 검출될 수 있다.
특정의 구현예에서, 시그널은 영구적으로 적용된다. 즉, 일단 시작하면, 시그널은 신경에 연속적으로 적용된다. 시그널이 일련의 펄스인 구현예에서, 펄스들 사이의 갭은 시그널이 연속적으로 적용되지 않음을 의미하지는 않는 것으로 인식될 것이다.
방법의 특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절(이것이 신경세포 활동의 증가, 억제, 차단 또는 다른 조절인 것에 상관없이)은 일시적이다. 즉, 시그널의 중지는, 신경 또는 신경들내 신경세포 활동은 1 내지 60초, 또는 1 내지 60분, 또는 1 내지 24시간, 임의로 1 내지 12시간, 임의로 1 내지 6시간, 임의로 1 내지 4시간, 임의로 1 내지 2시간 내에 실질적으로 기본선 신경세포 활동으로 되돌아간다. 특정의 이러한 구현예에서, 신경세포 활동은 기본선 신경세포 활동으로 실질적으로 완전히 되돌아간다. 즉, 시그널의 중지 후의 신경세포 활동은 시그널이 적용되기 전, 즉 조절 전의 신경세포 활동과 실질적으로 동일하다.
특정의 대안적 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동에 있어서의 조절은 실질적으로 영구적이다. 즉, 시그널의 중지 시, 신경내 신경세포 활동은 시그널이 적용된 경우와 실질적으로 동일한데, 즉, 조절 동안 및 후의 신경세포 활동은 실질적으로 동일하다.
특정의 구현예에서, 시그널의 적용에 의해 유발된 신경세포 활동의 조절은 적어도 부분적으로 수정되고, 바람직하게는 실질적으로 수정된다. 즉, 시그널의 적용(및 임의로 중지) 시, 신경내 신경세포 활동은 조절 전 대상체에서보다 건강한 대상체에서 관찰된 활동 전위의 양식과 보다 더 유사하며, 바람직하게는 건강한 대상체에서 관찰된 활동 전위 양식과 실질적으로 완전히 유사하다. 이러한 구현예에서, 시그널에 의해 유발된 조절은 본 명세서에 정의된 어떠한 조절일 수 있다. 예를 들어, 시그널의 적용은 신경세포 활동의 증가를 초래할 수 있고, 시그널의 중지 시 신경 또는 신경들내의 활동 전위의 양식은 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하다. 추가 예로서, 시그널의 적용은 신경세포 활동이 건강한 대상체에서 관찰되는 활동 전위의 양식과 유사하여 시그널의 중지 시, 신경내 활동 전위의 양식이 건강한 대상체에서 관찰된 활동 전위의 양식과 유사하도록 하는 조절을 가져올 수 있다. 그러한 수정 효과는 긍정적인 피드백 루프의 결과인 것으로 추정된다.
특정의 이러한 구현예에서, 일단 처음 적용되면, 시그널은 상기 구현예에서 기술된 바와 같이, 간헐적으로 또는 영구적으로 적용될 수 있다.
특정의 구현예에서, 적용된 시그널은 비-파괴적인 시그널이다.
본 발명에 따른 방법의 특정의 구현예에서, 적용된 시그널은 하나 이상의 전극으로 구성된 신경조절 장치에 의해 적용된 전기 시그널이다. 특정의 이러한 구현예에서, 상기 시그널은 직류(DC) 파형, 예를 들면, 전하가 균형을 이룬 DC 파형, 또는 교류(AC) 파형, 또는 DC 및 AC 파형 둘 다를 포함한다.
특정의 구현예에서, 전기 시그널은 정사각 파형, 사인 곡선 파형, 톱니바퀴 파형 또는 삼각형 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 정사각 파형을 갖는다.
특정의 구현예에서 전기 시그널은 낮은 전파수 AC 파형을 포함한다. 특정의 구현예에서, 전기 시그널은 주파수가 0.01Hz 내지 1kHz, 0.01 내지 900 Hz, 0.01 내지 800 Hz, 0.01 내지 700 Hz, 0.01 내지 600 Hz, 0.01 내지 500Hz, 0.01 내지 400Hz, 0.01 내지 300 Hz, 0.01 내지 200 Hz, 0.01 내지 100 Hz, 0.01 내지 50 Hz인 AV 파형이다.
특정의 이러한 구현예에서, 시그널은 주파수가 0.01 내지 20 Hz, 바람직하게는 0.5 내지 20Hz, 1 내지 15Hz, 또는 5 내지 10Hz인 AC 파형이다. 특정의 구현예에서, 시그널은 주파수가 0.01 Hz, 0.05 Hz, 0.1 Hz, 0.5 Hz, 1 Hz, 2 Hz, 3 Hz, 4Hz, 5 Hz, 6 Hz, 7 Hz, 8 Hz, 9 Hz 또는 10 Hz, 예를 들면, 10 Hz인 AC 파형을 포함한다.
특정의 구현예에서, 전기 시그널은 전류가 0.1 내지 20 mA, 0.1 내지 10 mA, 0.1 내지 5 mA, 0.1 내지 3 mA, 0.1 내지 1 mA, 0.1 내지 0.5 mA, 0.16 mA 내지 0.6 mA, 0.2 내지 0.4 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 적어도 0.16 mA이다. 특정의 구현예에서, 전기 시그널은 전류가 0.1 mA, 0.15 mA, 0.16 mA, 0.18 mA, 0.2 mA, 0.2 mA, 0.4 mA, 0.6 mA, 1 mA, 2 mA, 3 mA, 5 mA, 10 mA이다.
특정의 구현예에서, 전기 시그널은 20 내지 500 마이크로초(μs)의 펄스 폭을 갖는다. 특정의 구현예에서, 시그널은 20 내지 500 μs, 30 내지 400 μs, 40 내지 300 μs, 50 내지 200 μs, 60 내지 150 μs, 70 내지 120 μs, 80 내지 100 μs의 펄스 폭을 갖는다.
특정의 구현예에서, 전기 시그널은 전압이 0.1 내지 20V인 DC 파형 및/또는 AC 파형을 포함한다. 특정의 바람직한 구현예에서, 시그널은 전압이 0.1 내지 15V, 임의로 0.1 내지 10V이다. 특정의 바람직한 구현예에서, 전압은 0.1V, 0.2V, 0.3V, 0.5V, 0.6V, 0.7V, 0.8V, 0.9V, 1V, 2V, 3V, 5V 및 10V으로부터 선택된다.
특정의 예시적인 구현예에서, 전기 시그널은 10 Hz 0.2 mA의 AC 정사각형 이상 파형을 포함한다.
특정의 대안적 구현예에서, 적용된 시그널은 전자기 시그널(임의로 광학 시그널), 기계적(임의로 초음파) 시그널, 열 시그널, 자기 시그널 또는 어떠한 다른 유형의 시그널이다. 이러한 구현예에서, 시그널은 적어도 하나의 변환기를 포함하는 신경조절 장치에 의해 적용되며, 상기 변환기는 하나 이상의 광원, 하나 이상의초음파 변환기, 하나 이상의 열원, 또는 각각의 시그널이 작동하도록 배열된 하나 이상의 다른 유형의 변환기로 구성될 수 있다.
시그널이 열 시그널인 특정의 구현예에서, 상기 시그널은 신경의 온도를 강하시킨다(즉, 신경을 냉각시킨다). 특정의 대안적 구현예에서, 상기 시그널은 신경의 온도를 상승시킨다(즉, 신경에 열을 가한다). 특정의 구현예에서, 상기 시그널 둘 다는 신경에 열을 가하고 신경을 냉각시킨다.
시그널이 기계적 시그널인 특정의 구현예에서, 상기 시그널은 초음파 시그널이다. 특정의 대안적 구현예에서, 기계적 시그널은 압력 시그널이다.
다른 국면에서, 본 발명은 환자에서 결장염, 예를 들면, IBD를 치료하는데 사용하기 위한 신경조절 전기 파형을 제공하며, 여기서 상기 파형은 환자의 비장 신경 및/또는 SMP에 적용되는 경우, 파형이 신경내 신경세포 시그널링을 증가시키도록 하는, 주파수가 0.01-20 Hz인 교류(AC) 파형이다. 특정한 구현예에서, 파형은, 신경에 적용되는 경우, 결장염을 완화시키거나 예방한다.
다른 국면에서, 본 발명은 환자의 비장 신경 또는 SMP에서 신경세포 활동을 조절함으로써 환자에서 결장염, 예를 들면, IBD를 치료하기 위한 신경조절 장치의 용도를 제공한다.
본 발명의 모든 국면의 바람직한 구현예에서, 환자는 대상체 또는 포유동물 환자, 보다 바람직하게는 사람이다.
본 발명의 모든 국면의 바람직한 구현예에서, 시그널 또는 시그널들은 규정된 신경 또는 신경 섬유와는 실질적으로 배타적으로 적용되며, 다른 신경(예를 들면, 미주 신경) 또는 신경 섬유에는 적용되지 않는다.
앞서의 상세한 설명은 설명 및 예증의 방식으로 제공되었으며, 첨부된 청구범위의 영역을 제한하는 것으로 의도되지 않는다. 본원에 예증된 현재 바람직한 구현예에서의 많은 변화는 당해 분야의 통상의 기술자에게 명백할 것이며, 첨부된 청구범위 및 이들의 등가물의 영역 내에 남아있다.
실시예
실시예 1. 결장염의 동물 모델에서 신경제거의 효과. 결장의 외과적 교감신경 신경제거(교감신경절제술) 및 결장의 미주신경 신경제거와 교감신경 신경제거를 다음과 같이 수행하였다.
마우스
표준의 8 내지 12주령의 C57/Bl6 병원체가 없는 마우스(18 내지 20 그램의 체중 범위)를 챨스 리버 래버러토리즈(Charles River Laboratories)(네덜란드 미즈드레치트 소재)로부터 입수하고 대학 의학 센터(Academic Medical Centre)(네덜란드 암스테르담 소재)의 명시된 병원체가 없는 동물 시설 안에 같이 가두었다. 동물을 일정한 온도(20 +/- 2℃) 및 습도(55%) 조건 하에서 먹이와 물을 자유로이 공급하면서 12/12 명/암 주기로 표준 IVC 조건 하에 가두었다. 모든 실험은 펜타닐-플루아니손(Hypnorm; Janssen, 벨기에 비어스 소재)-미다졸람(Hypnorm; 벨기에 비어스 얀센 소재)(FFM) 하에 수행하였다. 모든 실험은 네덜란드의 실험실 동물 사용 안내서(the guidelines of the Laboratory Animal Use of the Netherlands)에 따라 수행하였으며 암스테르담의 대학 의학 센터의 동물 연구 윤리 위원회(the Ethical Animal Research Committee of the Academic Medical Center of Amsterdam)의 승인을 받았다.
DSS 결장염의 유도
앞서 기술한 바와 같은 단기간 및 장기간 덱스트란 설페이트 나트륨(DSS) 결장염 모델을 사용하였다(Melgar, Karlsson, & Michaelsson 2005, 본원에 참고로 포함됨). 마우스에서 1일 기준으로 변화시킨 자유로이 공급한 음료수 속에 2% DSS를 제공하였다. 급성 및 만성 결장염의 실험 지속 기간은 모두 35일이었다. 실험에 포함된 대조군 동물은 정상의 음료수를 제공하였다. 결장 내 초기 염증 상태를 유도하기 위하여, 단기간(급성) 결장염 모델 마우스을 사용하여 마취 전 지속되는 7일의 실험 동안 DSS를 제공하였다. 초기 염증 상태를 유도한 후 상피 병변의 회복을 위해 회복 상태 이후, 보다 긴 기간(만성)의 결장염 모델을 사용하였다. 당해 모델에서, 마우스에게 DSS를 실험의 처음 5 내지 7일 동안 제공한 후 이들에게 추가로 30일의 기간 동안 정상의 음료수를 제공하였다. 말단에서 유도된 결장염의 중증도를 평가하기 위하여, 결장을 측정하고 마우스를 염증성 및 설사 점수(Melgar et al.(Melgar, Karlsson , & Michaelsson 2005, 본원에 참고로 포함됨)로 지정하였다.
마취
모든 외과 수술은 펜타닐시트레이트/플루아니손(Hypnorm; 벨기에 비어스 얀센 소재) 및 미다졸람(Dormicum; Roche, 네덜란드 미즈드레치트 소재)의 혼합물을 복강내(i.p.) 주사하여 마취된 마우스에서 수행하였다. 수술후 피나딘을 피하 주사하였다. 덱스트란 황산나트륨(DSS) 결장염 실험 전에, 마우스에게 대략 7일의 회복 기간을 주었다.
신경제거 수술
마우스를 동물 시설에서 2주 적응 후 10 내지 12주령에서 수술하였다. 마우스를 펜타닐시트레이트/플루아니손(Hypnorm; 벨기에 비어스 얀센 소재) 및 미도졸람(Dormicum; Roche, 네덜란드 미즈드레치트 소재)의 혼합물을 복강내(i.p.) 주사하여 마취시켰다. 결장의 미주신경 신경전달의 선택적인 신경제거는 Cailotto 등(Cailotto, Costes, van, V, van Bree, van Heerikhuize, Buijs, & Boeckxstaens Neurogastro and Mot, 2012, 본원에 참고로 포함됨)이 기재한 바와 같이, 미주 신경의 우측 복강의 분기점을 절단함으로써 수행하였다.
미주신경 신경제거(
신경섬유절제술
) 확인
소장의 미주신경 외과적 신경제거의 선택성을 확인하기 위하여, 본 발명자들은 뉴우런 트레이서 기술(neuronal tracer technique)을 사용하였다. 요약하면, 본 발명자들은 소장에서 역행하는 뉴우런 트레이서를 주입하였다. 7일 후, 역행하는 트레이서는 미주신경 운동 뉴우런(DMV 내에 위치함) 및 장간막 신경절내 교감 운동 뉴우런의 세포체를 표지하였다.
역행하는 트레이서 주입 전에 소장을 지지하는 미주신경 분기점의 수술적 절단의 수행은 DMV내 표지된 세포체의 부재를 가져왔다(DMV에 도달하는 트레이서의 불가능성이 '미주신경-절단' 섬유에 의해 유발됨). 대조적으로, 본 발명자들은 장간막 신경절내 교감신경 표지된 세포체의 존재를 발견하였으며, 이는 교감신경 섬유가 미주신경 신경제거 후에도 여전히 접촉함을 입증한다.
유사한 기술적 전략을 사용하여 미주신경 신경제거가 결장의 근위 부분에만 영향을 미쳤으며 원위 부분에는 영향을 미치지 않았음을 확인하였다. 근위 결장에서 트레이서를 주입하는 것은 DMV내 미주신경 운동 뉴우런을 표지하도록 한다. 대조적으로, 원위 결장에서의 주입은 DMV내 운동 뉴우런을 표지하지 않았으며, 이는 미주 신경이 근위 결장 만을 신경자극전달함을 입증한다.
역행하는 트레이서 전의 외과적인 미주신경 신경제거는 DMV내 표지된 운동 미주신경 뉴우런의 부재를 가져온다. 특히, 장간막 신경절내 표지된 교감 운동 뉴우런의 존재는 미주신경 신경제거 후에도 여전히 관찰되었으며 미주신경 신경제거가 근위 결장의 교감신경 신경자극전달에 영향을 미치지 않았음을 나타낸다.
결장의 교감신경 신경제거(즉, 교감신경절제술)
교감신경 신경제거는 장간막 동맥을 따라 위치하는 상부 장간막신경총과는 독립된 신경 조직을 횡절단/해부함으로써 달성되었다. 면 스왑(Cottons swap)을 사용하여 소장을 온화하게 밀어내어 복부 대동맥으로부터 드러나는 복강 및 상부 장간막 동맥을 노출시켰다. 장간막 동맥을 혈관의 양쪽 측면 둘 다를 플랭팅(flanking)하는 2개의 림프관으로부터 조심스럽게 분리하였다. 두꺼운 겸자를 사용하여, 동맥 아래에 놓여있는 신경 다발을 혈관으로부터 분리하고/하거나 동맥으로부터 독립되도록 해부하였다.
신경제거의 완성은 소장(즉, 공장 및 회장), 결장의 근위 및 원위 부분에서 노르에피네프린(NE) 함량을 측정함으로써 확인하였다. 신경 다발의 외과적 절제는 소장 및 근위 결장에서만 NE 함량을 원래의 농도의 10 내지 15%까지 하향으로 고갈시켰다. 외과 수술의 효능은 소장내 NE 함량을 측정함으로써 기술된 실험에 포함된 모든 마우스에서 확인하였다. 교감신경절제술은 (Colle, Van, Troisi, & De 2004, 본원에 참고로 포함됨)에 따라서, NE 함량이 신경제거되지 않은 소장내 NE 함량 측정치의 15% 미만인 경우 성공적인 것으로 고려하였다.
비장의 교감신경 신경제거
비장 신경제거는 비장(비장 동맥, 선 동맥)을 제공하는 혈관을 따라 이동하는 노르아드레날린 섬유를 절단하고 앞서 기술한 바와 같이 비장의 각각의 끝에 위치하는 연결 조직에 존재하는 유리 신경 섬유를 절단/해부함으로써 달성하였다(Cailotto et al., (2012) and Costes et al., (2014), 이들 각각은 본원에 참고로 포함됨).
신경제거의 완료는 소장 및 비장 조직에서 타이로신 하이드록실라제 염색으로 평가하였다.
전극 이식
커프 전극을 다음과 같이 치료될 랫트에 이식하였다: 복부의 피부를 가위로 중간선에서 개복하고 피부를 근육으로부터 분리시켰다. 커넥터 와이어(connector wire)를 목 방향으로 가위 및 강철 봉을 사용하여 중간의 우측 옆으로 터널을 뚫었다. 와이어를 동물의 우측을 통해 접근시킨다. 상처를 습윤(0.9% NaCl) 거즈(gauze)로 덮고 랫트를 뒤집는다. 메스(scalpel)를 사용하여 눈들 사이로부터 두개골 너머 귀들 사이까지 두피에 절개부를 만들었다. 와이어링(wiring)을 허용하는 터널(tunnel)을 목을 통한 당해 측면 및 가위와 강철 봉을 사용하여 동물의 우측으로부터 위치시킨다.
동물을 복부 좌측면에 위치시키고 복부 측면(또는 작업자가 선호하는 방식)으로부터 강철봉을 사용하여 터널을 완료하였다. 이어서, 스트리펫(stripet)의 끝을 목 측면 위에 강철 봉 위로 미끌어뜨려 터널을 통과시켰다. 일부 0.9% NaCl을 사용하여, 커프를 스트리펫을 통해 터널을 통과하고 피부 아래의 터널을 통과하였다. 복부를 습윤(0.9% NaCl) 거즈로 덮고 랫트를 복부 측면에서 반대로 돌렸다. 제조된 받침대를 이제 사용하여 마커로 표시하여 4개의 천공 지점을 표시한다. 4개의 구멍을 두개골에서 천공하고(냉각제로서 0.9% NaCl을 사용)(드릴 비트(drill bit) 9를 사용하였다), 4개의 나사를 스크류드라이버(screwdriver)를 사용하여 위치시켰다(첫번째 "그립"시 2회의 전체 라운드).
다음에, 받침대를 풀칠하고(Roti) 두개골에 위치시켰다(두개골을 건조시키고 먼저 세정하였다), 혼합 팔레트 속의 2 성분 치과용 세멘트로부터의 분말 및 유액을 합하고 주걱(spatula)을 사용하여 나사 및 받침대를 덮는 타원형으로 크래프트(craft)하였다. 이는 외부가 부드럽고 둥글게 되도록 보증하였다. 이후에, 두부 상처를 세정하여 화합물질의 접촉기회를 제거하였다. 상처를 받침대 앞에서 1회 및 뒤에서 1회 또는 2회 꿰맸다. 알루미늄 캡을 받침대의 상부에 두었다. 거즈 패드로부터 지지체를 생성시켜 랫트를 이의 역으로 돌려서, 두부 장착부(head mount)를 지지하였다.
다음에, 복강을 백선(linea alba) 위에서 개복하고 습윤된 면 스왑을 적용하여 장을 조심스럽게 꺼내고 장간막 동맥을 실험하고, 소장을 측면(습윤된 거즈 위 및 아래에) 두기 위한 공간을 만들었다. 장간막 동맥을 림프관을 파괴하지 않고, 겸자를 사용하여 조심스럽게 세정하였다. 날카로운 가위를 다음에 적용하여 복부 벽에 구멍을 뚫어 커프 전극을 통해 터널을 만들었다(겸자 사용). 커프를 SMP 및 동맥 주변에 위치시켰다. 커프 덮개(cuff flap)를 1개의 실크 6.0 봉합선으로 밀봉하였다. 장 덩어리를 복강내에 다시 두고 복부 근육을 연속적인 봉합으로 폐쇄하였다(Vycril 3.0). 피부를 U자형 봉합으로 폐쇄하였다. 랫트를 다시 이의 우리에 두어 회복시켰다. 적절한 요양치료, 예를 들면, 수술 후 24시간 무통 및 베이트릴(baytril) 등을 회복 기간의 연속적인 모니터링 동안 제공하였다.
희생 및 샘플 수집
동물을 DSS 노출의 첫날 후의 7 또는 12일 째에 희생시켰다. 동물을 펜토바르비탈(50mg/mL 용액 0.1mL)로 마취하였다. 마우스를 인산염 완충된 염수(PBS)에 이어 4% 파라포름알데하이드(PFA; pH 7.4)를 사용한 경심장 관류(transcardiac perfusion)로 희생시켰다. 결장 조직을 PFA 관류 전에 수집하였다. 결장 길이, 염증 점수(즉, 섬유종의 중증도) 및 설사 점수를 앞서 기술한 바와 같이(Melgar et al., 2005) 맹검 관찰자에 의해 평가하였다. 전체 결장을 이후에 PCR 분석을 위해 스냅-동결(snap-frozen)시켰다. 뇌를 PFA 관류 후 수집하고, 밤새(4℃) 후고정시키고 0.2 mol.L-1 PBS(pH 7.4) 중 30% 슈크로즈를 사용하여 4℃에서 밤새 동결 보호하고 분석할 때까지 4℃로 유지하였다.
RNA 분리, cDNA 합성 및
QPCR
전체 결장으로부터의 총 mRNA를 제조업자의 지시(Roche Applied Science)에 따라 TriPure 분리 시약 속에서 샘플을 균질화한 후 추출하였다. cDNA 합성을Revertaid 제1 쇄 cDNA 합성 키트(Fermentas)를 사용하여 수행하고 실시간 PCR을 SYBR 그린 마스터 믹스(green master mix)(Roche Applied Science)를 사용하여 Lightcycler 480(Roche Applied Science) 위에서 수행하였다. 사용된 프라이머(Invitrogen에서 합성함, 네덜란트 블레이스비즈크 소재)는 표 1에 기술되어 있다. 분석은 LinRegPCR 프로그램(AMC, 네덜란드 암스테르담 소재)을 사용하여 수행하였다(Ruijter et al., 2009). 표적 유전자 발현은 Genorm 소프트웨어를 사용한 분석 후 선택된 2개의 참고 유전자의 발현에 대하여 표준화하였다. 모든 데이타는 AU로 표시하고 대조군 그룹에 대한 상대적인 발현을 나타낸다.
통계적 분석
통계적 분석은 SPSS 19.0 소프트웨어(SPSS Inc, 일리노이주 시카고 소재)를 사용하여 수행하였다. 데이타는 평균±SEM으로 나타낸다. 정규 분포는 Kolmogorov-Smirnov 시험을 사용하여 평가하였다. 제곱근 표준화를 비정상인 데이타 세트에 적용하였다. 데이타의 2개 그룹(즉, Ctrl 대 DSS)을 비교한 경우에는 언제든지, 스튜던트 t-시험(Student t-test)을 수행하였다. 2개의 독립된 변수의 영향(즉, Ctrl/DSS 및 신경제거)을 분석한 경우에는 언제든지, 2-원(two-way) ANOVA를 수행하여 신경제거(Sham 대 Vx/Sx)와 치료(Ctrl 대 DSS) 사이의 상호작용을 측정하였다. 유의성이 관찰되면(즉, p<0.05), 쌍을 이루지 않은 스튜던트 t-시험을 수행하여 Sham 대 Vx/Sx 또는 Ctrl 대 DSS 사이의 유의성을 평가하였다.
랫트
Hsd: 스프라그 다울리(Sprague Dawley) 랫트는 Envigo(네덜란트 호르스트 소재)로부터 구입하였으며 온도(20 ± 2℃) 및 습도(55%)의 일정 조건 하에서 12/12 명/암 주기로 및 음식과 물을 무제한으로 공급하면서 규정된 병원체가 없는 시설에 동시에 가두었다. 모든 실험은 3% 이소플루란/O2 마취 하에 수행하였으며 모든 노력을 수행하여 동물의 고통을 최소화하였다. 모든 실험은 네덜란드의 실험 동물 사용 안내서를 따라 수행하였으며 암스테르담 대학 의학 센터의 동물 연구 윤리 위원회의 승인을 받았다.
상부 장간막 신경 주변의
커프
전극의 삽입
랫트를 3% 이소플루란/O2로 마취시키고 수술 전 메타캄 1 mg/kg (Boehringer, 독일 인겔하임 암 라인 소재) 및 Baytril 10 mg/kg(Bayer Healthcare, 미국 뉴저지주 휘파니 소재)를 피하 제공하였다. 1) 복부 피부를 개복하고 근육을 분리하였다. 메스를 사용하여, 세정된 눈과 두개골 사이까지의 눈 사이의 두부에서 절개하였다. 터널을 등을 통해 목의 측면으로부터 동물의 우측 옆구리를 통해 복부의 피부에 이루어진 절개부를 향해 강철 봉을 사용하여 피하로 만들었다. 전극(500μm 터널커프 트리폴라(tunnelcuff tripolar); CorTec GmbH, 독일 프라이부르크 소재)을 터널을 통해 피하에 위치시켰다. 2) 드릴을 사용하여, 4개의 구멍을 두개골에 천공하고, 4개의 나사를 스크류드라이버를 사용하여 위치시켰다. 전극의 전선을 생성기에 연결시키는 받침대(PlasticsOne, 미국 애리조나주 페닉스 소재; 제품 번호MS303-120)를 나사들 사이의 두개골에 위치시키고 두개골에 치과용 시멘트를 사용하여 단단히 부착시키고 피부 주변을 2회 봉합으로 폐쇄하였다. 3) 복강을 개복하고 장간막 동맥(이를 따라 신경 섬유가 위치한다)을 위치시켰다. 전체는 복부 벽에서 이루었으며 전극을 이를 통해 터널을 만들었다. 전극을 상부 장간막 동맥 주변에 위치시키고 전극의 덮개 속에서 1회 봉합으로 고정시켰다. 배치한 후, 복부 벽 및 피부를 폐쇄시켰다. 수술 24시간 후에, 메타캄 1 mg/kg 및 베이트릴 10 mg/kg을 피하로 제공하였다.
랫트에서
급성 DSS-유도된 결장염
수술 2주 후, 랫트에게 9일 연속으로 음료수 속에 5% (w/v) DSS(TdB Consultancy, 스웨덴 업살라 소재)를 무제한으로 제공하였다. DSS 용액을 매일 교체하였다. 대변, 항문 출혈, 일반적인 거동 및 자세, 및 체중의 일관성을 매일 평가하였다. 동물을 DSS 노출 1일 후 9일째에 희생시켰다.
상부 장간막 신경 자극: DSS 시작 3일 후, 전기 자극을 1일에 2회 5분 동안, 10 Hz, 1 ms 및 200μA로 희생일까지 제공하였다. 생성되었지만 전기 펄스 없이 연결시킨 대조군 랫트를 또한 제공하였다.
내시경
내시경을 위해, 랫트를 3% 이소플루란/O2로 마취시키고 대변을 가능한 많이 제거하였다. Olympus URF V형 내시경을 최대 10 센티미터까지 직장내 삽입하고 내시경을 뺄때, 내시경의 비디오를 Medicap USB200 Medical Digital Video Recorder를 사용하여 기록하였다. 내시경 영상을 보고된 것으로서 0 내지 15로부터의 맹검 관찰자에 의해 결장염 중증도의 쥐 내시경 지수(MEICS; 표 1)에 따라 점수매겼다.
| 점수 | 0 | 1 | 2 | 3 |
| 대변 | 정상/고체 | 여전히 형태있음 | 형태 없음 | 퍼짐 |
| 농밀도 | 명료 | 중간 | 현저함 | 불명료 |
| 혈관질 | 정상 | 중간 | 현저함 | 출혈 |
| 피브린 | 없음 | 거의 없음 | 현저함 | 극심함 |
| 입상도(Granularity) | 없음 | 중간 | 현저함 | 극심함 |
샘플 수집
내시경 후, 동물을 100% CO2로 희생시키고 혈액을 심장천자로 수득하고 혈청으로 저장하였다. 비장 및 결장의 습윤 중량을 결장의 총 길이와 함께 기록하였다. cm당 결장 중량을 질병 매개변수로서 사용하였다. 대변을 다음과 같이 기록하였다: 0) 정상 대변, 1) 부드러운 펠렛(pellet), 2) 묽은 대변, 3) 물이 많은 설사, 4) 혈액이 있는 설사. 비장, 십이지장, 공장, 회장 및 결장을 RNA 및 단백질 분리를 위해 수집하고 스냅 냉동시켰다. 결장의 대부분의 근위 및 원위 부분을 조직학적 평가에 사용하였다.
조직학적 평가
장축으로 개방된 결장을 말아서 4% 포르말린 속에 고정시키고 통상의 조직학을 위해 파라핀 속에 포함시켰다. 경험이 있는 병리학자가 포르말린-고정된 해마톡실린 조직 단면을 현미경으로 맹검 양식으로 평가하였다. 결장을 표 2에 설명된 염증의 6가지 특징을 기준으로 하여 평가하였다. 병리학 점수의 합을 점수매긴 특징의 합으로 계산하였다.
| 점수 | 0 | 1 | 2 | 3 | 4 |
| 단형 및 다형핵 침윤물 | 정상 | 점막에 있어서의 증가 | 점막 및 소점막에 있어서의 증가 | 점막, 소점막, 근육층(tunica muscularis) 및/또는 장막으로 확장 | |
| 배상 세포 | 정상, 대량 | <10%의 고갈 | 10 내지 50%의 고갈 | >50%의 고갈 | |
| 치음와 손실 | 치음와 손실 없음 | <10% 치음와 손실 | 10-50% 치음와 손실 | >50% 치음와 손실 | |
| 상피 과형성 | 정상 | 약간 과형성 | 치음와 길이의 2-3x 증가 | 치음와 길이의 >3x 증가 | |
| 궤양 | 궤양 없음 | 궤양 | |||
| 치음와 농양 | 농양 없음 | 치음와 농양 |
RNA 분리, cDNA 합성 및 정량적
폴리머라제
쇄 반응(
qPCR
)
결장 조직으로부터의 총 mRNA는 TriPure 분리 시약 속에서 제조업자의 지시(Roche Applied Science, 스위스 바젤 소재)에 따라 샘플의 균질화 후 추출하였다. 후속적으로, 50μg의 RNA를 염화리튬으로 처리하고 ISOLATE II RNA Mini Kit(Bioline, 영국 런던 소재; 제품 번호 BIO-52073)의 세정 프로토콜을 수행하였다. 1 μg의 세정된 RNA를 사용하여 올리고(dT) 및 랜덤 프라이머 및 Superscript II 역 트랜스크립타제(Invitrogen)를 사용한 역-전사로 cDNA를 합성하였다. 4 μl의 16회 희석된 cDNA를 Lightcycler 480 (Roche Applied Science, 스위스 바젤 소재)가 장착된 실시간 qPCR에 Lightcycler SYBR Green(Roche Applied Science, 스위스 바젤 소재)를 사용하여 적용시켰다. 분석을 LinRegPCR 프로그램(AMC, 네덜란드 암스테르담 소재)를 사용하여 수행하였다(Ruijter et al., 2009). 표적 유전자 발현을 Genorm 소프트웨어를 사용한 분석 후 선택된 2개의 참고 유전자의 발현에 대하여 표준화하였다.
결장
사이토킨의
단백질 수준의 측정
동결된 조직을 얼음 위에서 그린버거 분해 완충액(Greenberger Lysis Buffer)(150 mM NaCl, 15 mM 트리스, 1 mM MgCl·6H2O, 1 mM CaCl2, 1% 트리톤) 속에서 PBS를 사용하여 1:1로 희석시킨, pH 7.4의 cOmplete 프로테이나제 억제제 칵테일(Protease Inhibitor Cocktail)(Roche Applied Science, 스위스 바젤 소재) 속에서 균질화하였다. 인터루킨(IL-)1 베타, IL-6, 및 종양 괴사 인자(TNF-)α의 단백질 농도를 제조업자의 프로토콜에 따라 샌드위치 효소-연결된 면역흡착성 검정(ELISA; R&D systems, 영국 아빙돈 소재)으로 측정하였다.
통계적 분석
그래프를 Prism 6.0(GraphPad Software Inc., 미국 캘리포니아주 라 졸라 소재)을 사용하여 제조하였다. 통계적 분석을 IBM SPSS Statistics Version 22.0 (IBM Corporation, 미국 뉴욕주 뉴욕 소재)를 사용하여 수행하였다. 그룹들 사이의 통계적인 유의성을 사후 본페로니 분석(post-hoc Bonferroni analysis)을 사용하여 만-휘트니(Mann-Whitney) U 시험 또는 크루스칼-왈리스(Kruskal-Wallis) 시험을 사용하여 평가하였다. P < 0.05를 유의적인 것으로 고려하였다.
결장염 모델에서 신경제거의 효과
도 3은 마우스 DSS 결장염 모델에서 신경섬유절제술 및 교감신경절제술의 효과를 나타낸다. 도 3a는 신경섬유절제술이 결장염 마우스의 장 조직에서 발견된 전-염증성 사이토킨의 수준에 있어서 효과가 없음을 나타낸다. 대조적으로, 도 3b는 교감신경절제술이 완전한 교감신경 위 신경자극전달을 사용한 결장염 마우스와 비교하여 결장염 마우스의 장에서 전-염증성 사이토킨의 유의적으로 보다 높은 수준을 생성함을 나타낸다.
유사하게, 도 4는 결장염의 생리학적 및 조직학적 신호가 교감신경절제술을 겪은 DSS 마우스에서 유의적으로 악화됨을 나타낸다. 교감신경절제술 마우스는 정상의 DSS 마우스와 비교하여 보다 큰 체중 손실, 증가된 결장 중량(병리학의 신호), 과형성, 배상 세포 고갈 및 보다 큰 병리학 점수의 합을 나타낸다.
이들 데이타 모두는, 교감신경절제술이 DSS 모델에서 보다 심각한 결장염 증상으로 이끔을 나타낸다. 증상의 이러한 악화는 교감신경절제술의 결과로서 장에서 노르에피네프린(NE) 수준에 있어서의 감소와 상호 관련되어 있다(도 4g).
염증을 감소시키는데 있어서 NE의 중요성은 결장염의 다른 모델에서 추가로 밝혀져 있다. RAG 마우스(이는 비-RAG 마우스와 비교하여 보다 높은 수준의 조직 NE를 나타낸다)가 교감신경절제술을 겪은 경우, 마우스는 결장염으로 자발적으로 진행되었고 또한 장에서 유의적으로 증가된 전-염증성 사이토킨 수준을 나타내었다(도 5). 이론에 얽메이려는 의도없이, 본 발명자들은, 교감신경절제술 후 RAG 마우스에서의 결장염의 자발적인 진행이 RAG 마우스에서 NE의 정상 수준보다 더 높음에 기인하므로, 교감신경절제술은 점막 항상성 및 주위 NE 수준에서 보다 높은 충격을 가지며, 자발적인 결장염을 이끈다고 추정한다.
장의 직접적인 교감신경 신경자극전달 뿐만 아니라, 본 발명자들은 본원에서 비장의 교감신경 신경자극전달이 장에서 소염 효과에 필요함을 또한 입증하였다. 도 6은 비장 신경 신경제거가 DSS 마우스의 장 조직에서 전-염증성 사이토킨에 있어서의 유의적인 증가를 가져옴을 나타낸다. 도 6b는 또한 질병 활성 지수에 따라 측정한 것으로서, 총 결장염 병리학에 있어서의 증가를 가져옴을 나타낸다.
이들 데이타는 장에서의 염증, 특히 결장에서의 염증을 조절하는데 있어서 NE 방출의 중요성을 명확하게 나타낸다. 더욱이, 이들 데이타는, 장에서의 NE 방출의 소염 효과가 직접 연관되지 않으며 신경섬유절제술이 NE 또는 장의 염증의 수준에 효과가 없으므로, 미주 신경 시그널링과는 적어도 부분적으로 독립적임을 나타낸다. 대신에, NE 방출로 인한 위에서의 소염 효과는 원위 장-신경자극전달 교감신경 신경(SMP), 또는 비장 신경으로부터의 교감신경 시그널링에 의해 개시된 NE 방출의 간접적인 소염 효과로부터의 교감신경 시그널링과 직접 관련되어 있다.
따라서, 장의 염증, 특히 IBD 및 결장염은 SMP 및/또는 비장 신경을 자극함으로써 NE 방출을 유도하여 효과적으로 치료될 것이다. 이러한 목적으로, 신경조절 장치를 랫트 모델에 이식하였다.
실시예
2. 효과적인
시그널
매개변수의 측정
급성의 마취된 제제에서, 랫트 및 마우스를 이극성 후크 전극(bipolar hook electrode)을 사용하여, 비장 신경, 상부 장간막신경총 또는 미주 신경의 정사각형 파장 펄스 전기 자극에 적용시켰다. 자극 주파수는 10Hz, 펄스 폭이 50μs인 이상 펄스에서 일정하게 유지시켰다. 전류는 1mA 내지 10mA로 변하였다. 자극의 지속 기간은 2 또는 10분이었다. 2분 동안 1mA가 NE 방출을 유도하는데 있어서 가장 효과적인 것으로 관찰되었다(도 7 및 하기 참고).
커프 전극을 또한 장간막 동맥과 함께 상부 장간막신경총의 캡슐화를 허용한 상부 장간막 신경에 대해 개발하였다. 커프의 직경은 이러한 해부학과 접속하도록 500μm 내지 5mm 길이에서 최적인 것으로 측정되었다. 전극의 3극 구조는 전류가 주변 조직 밖으로 유의적으로 누출되지 않고 커프의 중심 내에서 전달되도록 한다.
시그널 매개변수의 추가의 최적화를 2 단계 공정에서 커프 전극에 대해 수행하였다. 초기 최적화를 좌골 신경을 사용하여 수행하였다. 1mA 및 10Hz 자극에 노출시킨 좌골 신경을 커프를 사용하여 신경에 적용하였다. 이는 명백한 근육 수축을 유발하였다. 자극은 단지 약간의 근육 운동이 유도될 때까지 감소하였으며, 이는 활성화 역치(반응을 유도하기 위해 최소 160 내지 185μA)인 것으로 측정되었다.
상부 장간막신경총에 대한 적용을 위해 시그널을 최적화하기 위하여, 200μA, 400μA 및 600μA의 시그널을 신경총에 적용하였다. 텔레미터 EMG 기록(도 8) 및 장간막의 동맥 및 정맥 관류의 수준(도 9)을 최소의 부작용과 관련하여 시그널을 최적화하기 위해 측정하였다.
도 8a는 어떠한 경우에도, 최소의, EMG 반응이 자극의 출발 후 추적시 명확한 변화없이, 200 μA 시그널로 관찰됨을 나타낸다. 이는, 개시된 불편함 또는 다른 부작용을 가진 다른 신경으로의 신호 누출이 거의 없거나 전혀 없음을 나타낸다. 도 8b는 400 μA의 시그널의 적용이 EMG 활동에 있어서의 변화를 유도하였음을 나타낸다. 랫트에 있어서 거동 변화를 기준으로 하여, 이러한 변화는 통증에 기여하지 않았다. 그럼에도 불구하고, 시그널은 동물에 의해 명확히 인식가능하였다.
도 9는 200 μA, 400 μA, 및 600 μA의 시그널의 적용 후 장간막의 정맥(A) 및 동맥(B) 관류에 있어서의 변화를 나타낸다. 200 μA 및 400 μA의 시그널은 정맥 또는 동맥 유동에 있어서 최소의 효과를 가졌지만, 600 μA의 시그널은 시그널의 원치않는 부작용의 지표인, 비정상적인 정맥 및 동맥 유동을 생성하였다.
당해 방법을 사용하여 원치않은 부작용을 최소화하면서 효과적으로 자극하기 위하여 상부 장간막신경총에 적용될 최적의 시그널을 확인하였다. 이 경우, 랫트 SMP를 자극하기 위한 최적의 시그널 매개변수는 10Hz, 2분 작업, 160-200 μA 이상 펄스, 펄스 폭 50 μs이다. 유사한 방법을 사용하여 비장 신경의 신경조절 및 사람 환자에서 적절한 시그널 매개변수를 측정하기 위한 시그널을 최적화할 수 있다.
NE 방출의 자극
도 7은 자극된 신경(비장 신경("비장"으로 나타냄) 또는 SMP("mes"로 나타냄))으로부터 NE 방출을 나타내는 제이타를 제공한다. 비장 신경 및 SMP 둘 다의 자극은 비장 및 원위 결장내 증가된 NE 방출을 생성하였다. 최적의 NE 방출은 1mA 및 2분 지속 기간(통상의 미주 신경 자극 패러다임보다 훨씬 더 낮다)에서 발생하였다. 보다 높은 자극 매개변수는 반응에서 추가의 개선을 생성하지 않았다.
비장 신경 SMP의 자극은 미주신경 자극보다 보다 더 강력한 NE 반응을 생성하였고 부작용이 거의 없었다. 실제로, NE는 미주 신경 자극 후 비장에서 방출되지 않았으며, 이는 미주신경 자극의 결과로서 어떠한 소염 효과도 본원에 입증된 것보다 상이한 메카니즘에 기인한 것임을 나타낸다. 결과적으로, 비장 신경 및/또는 SMP 신경세포 활동의 조절은 미주신경 시그널링과 비교하여 원치않은 전신계 효과가 훨씬 적은 것으로 예상될 뿐 아니라, 새로운 치료학적 소염 메카니즘에 대한 접근을 허용한다.
아드레날린 수용체(ARs)의 활성화는 이러한 활성화가 아드레날린성 신경전달물질(에피네프린) 또는 인공 AR 효능제(살부타몰)에 의한 것에 상관없이(Nijhuis. L et al, PLoS One. 2014; 9(1)의 도 1, 본원에 참고로 포함됨), 수지 세포(CD)에 의한 전-염증성 사이토킨 생산에 있어서의 감소를 야기함을 나타내었다. 따라서, SMP 또는 비장 신경의 신경조절에 의해 유도된 조직 NE에 있어서의 증가는 동일한 소염 효과를 갖는 것으로 예측된다.
더욱이, 상부 장간막신경총 및 비장 신경 자극 각각은 비장 및 하부 장관 및 결장에서 유의적인 NE 반응을 생산하였지만, 상부 장 시스템에서는 NE 방출이 거의 관찰되지 않았다. 따라서, 이들 신경의 자극은 하부 장 및 결장에 흔히(크론병) 또는 배타적으로 위치하는, IBD와 같은 장의 염증의 형태를 치료하는데 있어 특히 효과적일 것이다. 장의 이들 부위는 어떠한 미주신경 신경자극전달의 경우에도 거의 가지지 않으므로, 미주신경 자극에 불량하게 반응한다. SMP 또는 비장 신경을 자극함으로써, 장의 이들 부위에서 염증을 표적화하는 것이 새로이 가능하다.
실시예
3. 상부
장간막신경총을
통한 신경조절
SMP의 자극은 장간막 신경에 부착된 이식된 커프 전극을 사용하여 달성하였다. 이식은 실험 전에 외과적으로 수행하였다.
도 10은 외과 이식, 결장염을 유도하기 위한 DSS의 선물, SMP의 전기 자극을 위한 자극 패러다임, 및 희생일 및 질병의 생물지표의 분석의 시간표를 나타낸다.
도 11은 도 10에서와 같이, 랫트에서 DSS 결장내 SMP 자극 개입의 실험 결과를 나타낸다. 모의 및 자극 조건 하에서 DSS 결장염 9일째에 결장의 개선된 내시경 외관의 가시화를 나타낸다. 또한, 도 11b는 DSS 결장염의 9일째에 랫트 결장에서 측정된 개선된 결장 중량/길이 비의 임상 매개변수를 나타낸다. 또한, DSS의 9일째에 결장염의 개선된 임상 매개변수는 설사 및 혈변과 같은 매개변수로서, SMP의 자극을 겪는 랫트에서 관찰되었다. 자극 치료는 QPCR에 의해 측정된 것으로서 결장염 결장 균질화물내 사이토킨 및 케모킨의 전사를 하향 조절하였다. 중요하게도, QPCR에 대한 선택된 생물지표는 9일째에 랫트 DSS에서 CCL3, CCL12, CCL17, IL1b의 상향조절을 나타낸 QPCR 배열 스크리닝(SA Biosciences 사람 염증 키트)로부터 유추되었다. CCL3, IL1b, CCL12, 및 CCL17의 결장 수준의 상향 조절은 동등하게 감소되었지만; CCL19 및 COX 2는 자극에 의해 영향받지 않았다.
도 12는 맹검 경험한 병리학자(S Meijer 박사, AMC, Pathology)가 평가한 랫트 결장내 조직학을 나타낸다. 염증에 대한 결장 조직학 마커는 도 10에 나타낸 바와 같이, SMN 자극에 의해 유의적으로 감소되었다.
실시예
4. 비장의 교감신경 신경제거
도 13은 결장 질병 과정에 대한 비장 신경제거의 결과를 나타낸다. 여기서, 결장염의 과정에서 비장 신경 신경제거의 효과가 가시화된다. 비장 신경제거 수술은 DSS 결장염 전에 수행되었고, 결장 균질물 전사체의 발현이 수행되었다. 다음의 전사체가 측정되었다: 세포외 매트릭스 및 세포 부착: COL14A1, COL1A1, COL1A2, COL3A1, COL4A1, COL4A3, COL5A1, COL5A2, COL5A3, VTN; 리모델링 효소: Ctsg, Ctsk, Ctsl, F13a1, F3(조직 인자), Fga(피브리노겐), Mmp1a, Mmp2, Mmp7, Mmp9, Plat (tPA), Plau (uPA), Plaur (uPAR), Plg, Serpine1 (PAI-1), Timp1; 세포 부착: Cdh1 (E-카드헤린), Itga1, Itga2, Itga3, Itga4, Itga5, Itga6, Itgav, Itgb1, Itgb3, Itgb5, Itgb6; 세포골격: Acta2 (a-SMA), Actc1, Rac1, Rhoa, Tagln; 염증성 사이토킨 및 케모카인: Ccl12, Ccl7 (Mcp-3), Cd40lg (Tnfsf5), Cxcl1, Cxcl11 (I-TAC/IP-9), Cxcl3,Cxcl5 (ENA-78/LIX), Ifng, Il10, Il1B, Il2, Il4, Il6; 성장 인자: Angpt1, Csf2 (GM-CSF), Csf3 (GCSF), Ctgf, Egf, Fgf10, Fgf2, Fgf7, Hbegf (Dtr), Hgf, Igf1, Mif, Pdgfa, Tgfa, Tgfb1, Tnf, Vegfa; 시그널 형질도입: TGFβ: Tgfb1, Tgfbr3, Stat3, WNT: Ctnnb1, Wisp1, Wnt5a; 포스포릴화: Mapk1 (Erk2), Mapk3 (Erk1), Pten, 수용체: Egfr, Il6st (Gp130); 기타: PTGS2. 염증성 유전자의 상승된 발현 프로파일은 모의 수술과 비교하여 splx(비장 신경 손상) 후에 관찰된다. 또한, 비장 신경 병변은 DSS 투여에 의해 유도된 질병 활성 지수(패널 C)을 증진시킨다. 또한, 비장 신경제거는 전-염증성 사이토킨 IL-6 및 TNFα 및 또한 IL-1β의 발현 수준을 유의적으로 증가시킨다.
Claims (69)
- 제1의 자극 시그널을 비장 신경 또는 상부 장간막신경총(SMP) 중의 적어도 하나에 적용하도록 구성된 적어도 제1의 변환기 및 임의로 제2의 자극 시그널을 SMP 또는 비장 신경 중의 다른 것에 적용시키기 위한 제2의 변환기; 및
적어도 하나의 변환기에 커플링된 제어기로서, 상기 제어기는 적어도 하나의 변환기에 의해 적용된 자극 시그널을 제어함으로써, 자극 시그널이 이것이 적용된 신경의 신경세포 활동을 증가시켜 대상체의 비장 및/또는 장에서 국소 교감신경 활성도에 있어서의 증가를 생산하도록 하는 것인 제어기
를 포함하는, 환자의 비장(비장 신경) 및/또는 상부 장간막신경총(SMP)을 신경자극전달(innervating)하는 신경의 신경세포 활동을 조절하기 위한 기구 또는 시스템. - 제1의 자극 시그널을 비장 신경 또는 SMP 중의 적어도 하나에 적용하도록 구성된 제1의 변환기 및 임의로 제2의 자극 시그널을 SMP 또는 비장 신경 중의 다른 것에 적용시키기 위한 제2의 변환기; 및
적어도 하나의 변환기에 커플링된 제어기로서, 상기 제어기는 적어도 하나의 변환기에 의해 적용된 자극 시그널을 제어함으로써, 자극 시그널이 이것이 적용된 신경의 신경세포 활동을 증가시켜 대상체의 비장 및/또는 장에서 국소 교감신경 활성도에 있어서의 증가를 생산하도록 하는 것인 제어기
를 포함하는, 환자에서 염증 질환을 치료하기 위한 기구 또는 시스템. - 청구항 2에 있어서, 상기 염증성 질환은 결장염을 포함하는 기구 또는 시스템.
- 청구항 2 또는 청구항 3에 있어서, 상기 결장염은 궤양성 결장염 또는 크론병(Crohn's Disease)과 같은 염증성 장질환의 증상인 기구 또는 시스템.
- 청구항 1 내지 청구항 4 중 어느 하나의 항에 있어서, 제1의 시그널을 비장 신경에 적용하기 위한 제1의 변환기 및 제2의 시그널을 SMP에 적용하기 위한 제2의 변환기를 포함하는 기구 또는 시스템.
- 청구항 1 내지 청구항 5 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 이들이 적용된 신경에서 신경세포 활동을 증가시키는 기구 또는 시스템.
- 청구항 1 내지 청구항 6 중 어느 하나의 항에 있어서, 각각의 변환기에 의해 적용된 상기 시그널은 독립적으로 선택되는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 시그널 또는 시그널들은 전기 시그널, 광학 시그널, 초음파 시그널 및 열 시그널로부터 선택되는 기구 또는 시스템.
- 청구항 8에 있어서, 상기 시그널 또는 시그널들은 전기 시그널이고, 상기 시그널을 적용하기 위해 구성된 하나 이상의 변환기가 전극인 기구 또는 시스템.
- 청구항 9에 있어서, 상기 시그널은 저 주파수 교류(AC) 파형을 포함하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 시그널은 주파수가 0.01 내지 20Hz인 AC 파형을 포함하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 시그널은 0.1 내지 20mA의 전류를 갖는 전기 시그널을 포함하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 시그널 또는 시그널들은 비장, 장 및/또는 결장에 대한 혈류를 유의적으로 변경시키지 않는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 시그널 또는 시그널들은 미주신경 신경 자극에 독립적인 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 국소 교감신경 활성도에 있어서의 상기 증가가 위(장 및/또는 결장) 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가를 포함하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 국소 교감신경 활성도에 있어서의 상기 증가가 장 조직(창자 및/또는 결장) 및/또는 순환내 하나 이상의 염증성 마커에 있어서의 감소, 장 병리학에 있어서의 감소, 결장 섬유종에 있어서의 감소, 및 결장염의 하나 이상의 증상에 있어서의 감소 중의 적어도 하나를 생산하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 국소 교감신경 활성도에 있어서의 상기 증가가 소장 및/또는 상향 결장내 국소 교감신경 활성도에 있어서의 증가를 포함하는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 환자에서 하나 이상의 생리학적 매개변수를 검출하기 위한 검출 소자를 추가로 포함하는 기구 또는 시스템.
- 청구항 18에 있어서, 제어기는 검출기 소자에 커플링되어 있고, 생리학적 매개변수가 예정된 역치 값(threshold value)을 충족하거나 초과하는 것으로 검출되는 경우 상기 제어기는 하나 이상의 변환기 각각으로 하여금 시그널을 적용하도록 하는 것인 기구 또는 시스템.
- 청구항 18 또는 청구항 19에 있어서, 상기 검출된 생리학적 매개변수 중 하나 이상이 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커의 순환하는 수준으로부터 선택되는 기구 또는 시스템.
- 청구항 18 내지 청구항 20 중 어느 하나의 항에 있어서, 상기 하나 이상의 검출된 생리학적 매개변수가 상기 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함하는 기구 또는 시스템.
- 청구항 21에 있어서, 상기 활동 전위가 상기 환자의 비장 신경, SMP 또는 미주 신경내에 있는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 시그널을 적용하는 하나 이상의 변환기의 결과로서 신경세포 활동에 있어서의 상기 조절이 실질적으로 지속되는 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 신경세포 활동에 있어서의 상기 조절은 일시적인 것인 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 신경세포 활동에 있어서의 상기 조절은 수정하는 것인 기구 또는 시스템.
- 선행하는 항들 중 어느 하나의 항에 았어서, 상기 기구 또는 시스템이 상기 환자 내로의 적어도 부분적인 이식, 임의로 상기 환자 내로의 완전한 이식에 적합한 기구 또는 시스템.
- (i) 선행하는 항들 중 어느 하나의 항에 따른 기구 또는 시스템을 환자에게 이식하는 단계;
(ii) 상기 기구 또는 시스템의 적어도 하나의 제1의 변환기를 상기 환자의 비장 신경 및/또는 SMP 중의 적어도 하나와 시그널링 접촉하도록 위치시키는 단계;
(iii) 적어도 하나의 시그널을 비장 신경 및/또는 SMP에 적용하도록 상기 기구 또는 시스템을 활성화시키는 단계
를 포함함으로써 상기 환자의 비장 신경 및/또는 SMP의 신경세포 활동을 조절하는 것을 포함하는, 상기 환자에서 결장염을 치료하는 방법. - 청구항 27에 있어서, 단계 (ii)는 제2의 변환기를 상기 환자의 SMP 또는 비장 신경과 시그널링 접촉하도록 위치시키는 것을 더 포함하되, 여기서 제2의 변환기와 시그널링 접촉되는 SMP 또는 비장 신경은 어느 한쪽도 제1의 변환기와는 시그널링 접촉되지 않는 것인 방법.
- 청구항 27 또는 청구항 28에 있어서, 염증성 장질환, 임의로 크론병 및/또는 궤양성 결장염을 치료하는 방법인, 방법.
- 시그널을 환자의 비장 신경 및/또는 상부 장간막 신경총(SMP)에 적용하여 상기 환자내 신경의 신경세포 활동을 조절하는 단계를 포함하여, 상기 환자에서 결장염, 특히 IBD를 치료하는 방법.
- 청구항 30에 있어서, 제1의 시그널은 비장 신경에 적용되고 제2의 시그널은 SMP에 적용되는 방법.
- 청구항 27 내지 청구항 31 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 미주신경 신경 자극과는 독립적인 방법.
- 청구항 31 또는 청구항 31에 있어서, 상기 시그널 또는 시그널들은 상기 시그널을 적용하도록 구성된 변환기를 포함하는 신경조절 장치에 의해 적용되는 방법.
- 청구항 33에 있어서, 제1 및 제2의 시그널이 적용되는 경우, 시그널 둘 다가 동일한 신경조절 장치에 의해 적용되는 방법.
- 청구항 27 내지 청구항 34 중 어느 하나의 항에 있어서, 상기 변환기를 포함하는 적어도 하나의 장치 또는 기구가 상기 환자에 적어도 부분적으로 이식되고, 임의로 상기 환자 내에 완전히 이식되는 방법.
- 청구항 27 내지 청구항 35 중 어느 하나의 항에 있어서, 상기 상태의 치료가 상기 비장 및/또는 위내 국소 교감신경 활성도에 있어서의 증가에 의해 나타나는 방법.
- 청구항 27 내지 청구항 36 중 어느 하나의 항에 있어서, 국소 교감신경 활성도에 있어서의 증가가 소장 및/또는 상향 결장내 국소 교감신경 활성도에 있어서의 증가를 포함하는 방법.
- 청구항 27 내지 청구항 37 중 어느 하나의 항에 있어서, 국소 교감신경 활성도에 있어서의 상기 증가가 장 조직 및/또는 순환하는 노르에피네프린에 있어서의 증가를 포함하는 방법.
- 청구항 27 내지 청구항 38 중 어느 하나의 항에 있어서, 국소 교감신경 활성도에 있어서의 상기 증가가 장 조직 및/또는 순환내 염증성 마커에 있어서의 감소, 장 병리학에 있어서의 감소, 결장 섬유증에 있어서의 감소, 결장염의 하나 이상의 증상들의 중증도에 있어서의 감소 중의 적어도 하나를 생성하는 방법.
- 청구항 27 내지 청구항 39 중 어느 하나의 항에 있어서, 상기 시그널의 적용 결과로서 신경세포 활동에 있어서의 상기 조절은 상기 시그널이 적용된 신경내 신경세포 활동에 있어서의 증가인 방법.
- 청구항 27 내지 청구항 40 중 어느 하나의 항에 있어서, 신경세포 활동에 있어서의 상기 조절은 실질적으로 지속되는 방법.
- 청구항 27 내지 청구항 40 중 어느 하나의 항에 있어서, 신경세포 활동에 있어서의 상기 조절은 일시적인 것인 방법.
- 청구항 27 내지 청구항 40 중 어느 하나의 항에 있어서, 신경세포 활동에 있어서의 상기 조절은 수정하는 것인 방법.
- 청구항 28 내지 청구항 43 중 어느 하나의 항에 있어서, 상기 제1 및 제2의 시그널은 독립적으로 선택되는 방법.
- 청구항 27 내지 청구항 44 중 어느 하나의 항에 있어서, 상기 시그널은 전기 시그널, 광 시그널, 또는 초음파 시그널인 방법.
- 청구항 27 내지 청구항 45 중 어느 하나의 항에 있어서, 상기 시그널은 전기 시그널이고 저 주파수 교류(AC) 파형을 포함하는 방법.
- 청구항 27 내지 청구항 46 중 어느 하나의 항에 있어서, 상기 시그널은 주파수가 0.01 내지 20Hz인 AC 파형을 포함하는 방법.
- 청구항 27 내지 청구항 47 중 어느 하나의 항에 있어서, 상기 시그널은 전류가 0.1 내지 20mA인 전기 시그널을 포함하는 방법.
- 청구항 27 내지 청구항 49 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 간헐적으로 적용되는 방법.
- 청구항 27 내지 청구항 49 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 2분, 5분, 10분, 15분, 20분, 30분, 45분 또는 60분의 기간 동안 적용되는 방법.
- 청구항 27 내지 청구항 50 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 1시간에 1회 내지 24시간 마다 1회 사이로, 예를 들면, 12시간 마다 1회, 6시간 마다 1회, 4시간 마다 1회, 3시간 마다 1회, 2시간 마다 1회, 또는 1시간 마다 1회 적용되는 방법.
- 청구항 27 내지 청구항 51 중 어느 하나의 항에 있어서, 상기 환자에서 하나 이상의 생리학적 매개변수를 검출하는 단계를 추가로 포함하는 방법.
- 청구항 27 내지 청구항 52 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은, 검출된 생리학적 매개변수가 예정된 역치 값을 충족하거나 초과하는 경우에만 적용되는 방법.
- 청구항 53에 있어서, 하나 이상의 검출된 생리학적 매개변수는 교감신경 활성도; 장 조직 및/또는 순환하는 노르에피네프린(NE) 수준; 장 조직 및/또는 순환하는 물질 P 수준; 장 조직 및/또는 하나 이상의 염증성 마커의 순환하는 수준으로부터 선택되는 방법.
- 청구항 53 또는 청구항 55에 있어서, 상기 하나 이상의 검출된 생리학적 매개변수는 상기 환자의 신경내 활동 전위 또는 활동 전위의 양식을 포함하는 방법.
- 청구항 55에 있어서, 상기 활동 전위는 상기 환자의 비장 신경, SMP 또는 미주 신경인 방법.
- 청구항 27 내지 청구항 56 중 어느 하나의 항에 있어서, 상기 시그널은 상기 환자에서 결장염 발생에 대한 반응 시 적용되는 방법.
- 청구항 27 내지 청구항 57 중 어느 하나의 항에 있어서, 소염제를 상기 환자에게 투여함을 추가로 포함하는 방법.
- 환자에서 결장염을 치료하는 방법에 사용되기 위한 소염제로서, 상기 방법은 (i) 시그널을 환자의 비장 신경 및/또는 상부 장간막신경총에 적용하여 상기 환자내 신경에서 신경세포 활동을 조절하는 단계; 및 (ii) 소염제를 환자에게 투여하는 단계를 포함하는 것인, 상기 환자에서 결장염을 치료하는 방법에서 사용하기 위한 소염제.
- 청구항 58 또는 청구항 59에 있어서, 상기 소염제는 스테로이드, 5-ASA, 메토트렉세이트, 아자티오프린, 사이클로스포린, 및 항-TNF제로부터 선택되는 소염제.
- 청구항 59 또는 청구항 60에 있어서, 상기 시그널은 비장 신경 또는 SMP 중의 적어도 하나에 적용되는 소염제.
- 청구항 59 내지 청구항 61 중 어느 하나의 항에 있어서, 상기 시그널 또는 시그널들은 상기 시그널 또는 시그널들을 적용하도록 구성된 변환기를 포함하는 신경조절 장치에 의해 적용되는 소염제.
- 청구항 59 내지 청구항 62 중 어느 하나의 항에 있어서, 상기 신경조절 장치가 상기 환자 내에 적어도 부분적으로 이식되는, 예를 들면 상기 환자 내에 완전히 이식되는 소염제.
- 청구항 59 내지 청구항 63 중 어느 하나의 항에 있어서, 적용된 상기 시그널 또는 시그널들은 이것이 적용된 신경내 신경세포 활동을 증가시키는 소염제.
- 청구항 59 내지 청구항 64 중 어느 하나의 항에 있어서, 상기 시그널은 전기 시그널이고, 상기 시그널이 신경조절 장치에 의해 적용되는 경우, 상기 신경조절 장치가 전기 시그널을 적용하도록 구성된 전극을 포함하는 소염제.
- 청구항 65에 있어서, 상기 전기 시그널은 임의로 주파수가 0.01 내지 20Hz인, 저 주파수 AC 파형인 소염제.
- 환자가 포유동물 환자, 임의로 사람 환자인, 선행하는 항들 중 어느 하나의 항에 따른 용도를 위한 장치 또는 시스템, 방법 또는 소염제.
- 비장 신경 또는 SMP에 적용되는 경우 파형이 신경 내에서 신경세포 시그널링을 증가시키도록, 주파수가 0.01 내지 20Hz인 AC 파형으로서, 환자에서 결장염을 치료하는데 사용하기 위한 신경조절 전기 파형.
- 환자의 비장 신경 또는 SMP내 신경세포 활동을 조절함으로써 상기 환자 내에서 결장염을 치료하기 위한, 신경조절 장치의 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562152119P | 2015-04-24 | 2015-04-24 | |
| US62/152,119 | 2015-04-24 | ||
| PCT/IB2016/052307 WO2016170510A1 (en) | 2015-04-24 | 2016-04-22 | Neuromodulation device |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180040516A true KR20180040516A (ko) | 2018-04-20 |
Family
ID=55963419
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177034006A KR20180040516A (ko) | 2015-04-24 | 2016-04-22 | 신경조절 장치 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US10974041B2 (ko) |
| EP (2) | EP3950049A1 (ko) |
| JP (1) | JP2018514354A (ko) |
| KR (1) | KR20180040516A (ko) |
| CN (1) | CN108290041A (ko) |
| AU (1) | AU2016252497A1 (ko) |
| BR (1) | BR112017022941A2 (ko) |
| CA (1) | CA2983652A1 (ko) |
| MA (1) | MA41950A (ko) |
| RU (1) | RU2017140776A (ko) |
| WO (1) | WO2016170510A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023096361A1 (ko) * | 2021-11-26 | 2023-06-01 | 주식회사 뉴라이브 | 동물용 미주신경 자극장치 |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20180193643A1 (en) * | 2015-06-05 | 2018-07-12 | The Johns Hopkins University | Method and device for sacral nerve stimulation |
| PL3481285T3 (pl) | 2016-07-07 | 2021-03-08 | The Regents Of The University Of California | Implanty wykorzystujące fale ultradźwiękowe do stymulacji tkanek |
| WO2019122906A1 (en) | 2017-12-20 | 2019-06-27 | Galvani Bioelectronics Limited | Treatment of acute medical conditions |
| US11633601B2 (en) | 2017-12-20 | 2023-04-25 | Galvani Bioelectronics Limited | Treatment of inflammatory disorders |
| CN111954554A (zh) | 2017-12-20 | 2020-11-17 | 加尔瓦尼生物电子有限公司 | 急性医学病况的治疗 |
| JP2021507759A (ja) * | 2017-12-20 | 2021-02-25 | ガルバニ バイオエレクトロニクス リミテッド | 炎症に関連する疾患の治療 |
| WO2019122903A2 (en) * | 2017-12-20 | 2019-06-27 | Galvani Bioelectronics Limited | Stimulation of a nerve supplying the spleen |
| CN112351812A (zh) * | 2018-04-19 | 2021-02-09 | 艾奧塔生物科技公司 | 用于调节脾神经活动的使用超声通信的植入物 |
| BR112020021383A2 (pt) | 2018-04-19 | 2021-01-26 | Iota Biosciences, Inc. | implantes que usam comunicação ultrassônica para detecção e estimulação neural |
| KR20210053915A (ko) | 2018-08-29 | 2021-05-12 | 아이오타 바이오사이언시즈 인코퍼레이티드 | 이식 가능한 폐회로 뉴로모듈레이션 장치, 시스템 및 사용 방법 |
| US20220347470A1 (en) * | 2018-12-20 | 2022-11-03 | Galvani Bioelectronics Limited | Neurostimulation device for blocking blood flow between electrodes |
| EP3986532A1 (en) * | 2019-06-19 | 2022-04-27 | Galvani Bioelectronics Limited | System for the treatment of disorders associated with inflammation |
| WO2020254798A1 (en) * | 2019-06-19 | 2020-12-24 | Galvani Bioelectronics Limited | Stimulation of a nerve supplying the spleen |
| EP3986531A1 (en) * | 2019-06-19 | 2022-04-27 | Galvani Bioelectronics Limited | Treatment of acute medical conditions |
| WO2022122833A1 (en) * | 2020-12-09 | 2022-06-16 | Galvani Bioelectronics Limited | Physiological effects of activation of the alox15 pathway |
| CN113197587A (zh) * | 2021-04-26 | 2021-08-03 | 中国科学院深圳先进技术研究院 | 一种用于迷走神经刺激和电生理检测的装置及植入方法 |
| WO2023017253A1 (en) * | 2021-08-10 | 2023-02-16 | Galvani Bioelectronics Limited | Neuromodulation device |
| CN114177472A (zh) * | 2021-11-30 | 2022-03-15 | 中国人民解放军总医院第四医学中心 | 一种应用于下肢假肢的植入式电刺激感知反馈系统 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7389145B2 (en) | 2001-02-20 | 2008-06-17 | Case Western Reserve University | Systems and methods for reversibly blocking nerve activity |
| US20060116736A1 (en) * | 2001-07-23 | 2006-06-01 | Dilorenzo Daniel J | Method, apparatus, and surgical technique for autonomic neuromodulation for the treatment of obesity |
| US7418292B2 (en) * | 2003-10-01 | 2008-08-26 | Medtronic, Inc. | Device and method for attenuating an immune response |
| US20050075702A1 (en) * | 2003-10-01 | 2005-04-07 | Medtronic, Inc. | Device and method for inhibiting release of pro-inflammatory mediator |
| US8214047B2 (en) * | 2004-09-27 | 2012-07-03 | Advanced Neuromodulation Systems, Inc. | Method of using spinal cord stimulation to treat gastrointestinal and/or eating disorders or conditions |
| WO2006073484A2 (en) | 2004-12-27 | 2006-07-13 | North Shore-Long Island Jewish Research Institute | Treating inflammatory disorders by electrical vagus nerve stimulation |
| EP1948301B8 (en) * | 2005-11-10 | 2014-03-12 | ElectroCore LLC | Electrical stimulation treatment of bronchial constriction |
| JP2009525805A (ja) * | 2006-02-10 | 2009-07-16 | エレクトロコア、インコーポレイテッド | 電気的変調を用いたアナフィラキシーの治療方法および治療装置 |
| US9539425B2 (en) * | 2006-10-13 | 2017-01-10 | Intelect Medical, Inc. | Systems and methods for treating medical conditions by stimulation of medial thalamic region |
| WO2008096730A1 (ja) * | 2007-02-09 | 2008-08-14 | National University Corporation Nagoya University | 抗炎症剤及びその用途 |
| US20090275997A1 (en) * | 2008-05-01 | 2009-11-05 | Michael Allen Faltys | Vagus nerve stimulation electrodes and methods of use |
| US8788034B2 (en) * | 2011-05-09 | 2014-07-22 | Setpoint Medical Corporation | Single-pulse activation of the cholinergic anti-inflammatory pathway to treat chronic inflammation |
| EP3132827B1 (en) * | 2010-12-28 | 2019-04-03 | Cibiem, Inc. | Endovascular carotid body ablation catheter for sympathetic rebalancing of patient |
| WO2012159002A2 (en) | 2011-05-19 | 2012-11-22 | Neuros Medical, Inc. | High-frequency electrical nerve block |
| AU2012347470B2 (en) | 2011-12-09 | 2017-02-02 | Medtronic Ireland Manufacturing Unlimited Company | Therapeutic neuromodulation of the hepatic system |
| WO2013124541A1 (en) * | 2012-02-24 | 2013-08-29 | Nokia Corporation | Method and apparatus for dynamic server|client controlled connectivity logic |
| US11013549B2 (en) * | 2012-03-08 | 2021-05-25 | Medtronic Ardian Luxembourg S.A.R.L. | Gastrointestinal neuromodulation and associated systems and methods |
| WO2014153223A1 (en) * | 2013-03-14 | 2014-09-25 | Perryman Laura Tyler | Treating inflammation, chronic pain and other disorders with neuromodulation |
-
2016
- 2016-04-22 US US15/568,964 patent/US10974041B2/en active Active
- 2016-04-22 AU AU2016252497A patent/AU2016252497A1/en not_active Abandoned
- 2016-04-22 EP EP21197806.9A patent/EP3950049A1/en active Pending
- 2016-04-22 CA CA2983652A patent/CA2983652A1/en not_active Abandoned
- 2016-04-22 WO PCT/IB2016/052307 patent/WO2016170510A1/en active Application Filing
- 2016-04-22 JP JP2018506492A patent/JP2018514354A/ja not_active Ceased
- 2016-04-22 BR BR112017022941-2A patent/BR112017022941A2/pt not_active Application Discontinuation
- 2016-04-22 KR KR1020177034006A patent/KR20180040516A/ko unknown
- 2016-04-22 EP EP16721943.5A patent/EP3285856A1/en not_active Withdrawn
- 2016-04-22 CN CN201680037057.6A patent/CN108290041A/zh active Pending
- 2016-04-22 MA MA041950A patent/MA41950A/fr unknown
- 2016-04-22 RU RU2017140776A patent/RU2017140776A/ru not_active Application Discontinuation
-
2021
- 2021-02-26 US US17/186,610 patent/US20210393949A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023096361A1 (ko) * | 2021-11-26 | 2023-06-01 | 주식회사 뉴라이브 | 동물용 미주신경 자극장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2983652A1 (en) | 2016-10-27 |
| EP3285856A1 (en) | 2018-02-28 |
| EP3950049A1 (en) | 2022-02-09 |
| US20210393949A1 (en) | 2021-12-23 |
| CN108290041A (zh) | 2018-07-17 |
| MA41950A (fr) | 2018-02-28 |
| BR112017022941A2 (pt) | 2018-07-17 |
| WO2016170510A1 (en) | 2016-10-27 |
| RU2017140776A (ru) | 2019-05-24 |
| US10974041B2 (en) | 2021-04-13 |
| US20180117319A1 (en) | 2018-05-03 |
| AU2016252497A1 (en) | 2017-11-09 |
| JP2018514354A (ja) | 2018-06-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210393949A1 (en) | Neuromodulation device | |
| US9707390B2 (en) | Apparatus for modulation of effector organs | |
| US9707391B2 (en) | Method for modulation of effector organs | |
| US11890471B2 (en) | Vagus nerve stimulation pre-screening test | |
| Zhang et al. | Effectiveness of neuromuscular electrical stimulation on patients with dysphagia with medullary infarction | |
| JP2021507759A (ja) | 炎症に関連する疾患の治療 | |
| JP2018500143A (ja) | 神経調節装置 | |
| Fregni et al. | Pain in chronic pancreatitis: a salutogenic mechanism or a maladaptive brain response? | |
| JP2018525092A (ja) | 神経調節デバイス | |
| JP2021507745A (ja) | 脾臓に分布する神経の刺激 | |
| Qin et al. | Gastric electrical stimulation modulates neuronal activity in nucleus tractus solitarii in rats | |
| JP6796089B2 (ja) | 効果器を調節するための方法および装置 | |
| JP7483694B2 (ja) | 神経調節技術 | |
| RU2318550C1 (ru) | Способ лечения гастроэзофагеальной рефлюксной болезни | |
| US20190201692A1 (en) | Treatment of conditions associated with impaired glucose control | |
| CN111787975B (zh) | 供应脾脏的神经的刺激 |