KR20110042153A - 퓨린 pi3k 억제 화합물 및 사용 방법 - Google Patents
퓨린 pi3k 억제 화합물 및 사용 방법 Download PDFInfo
- Publication number
- KR20110042153A KR20110042153A KR1020107026673A KR20107026673A KR20110042153A KR 20110042153 A KR20110042153 A KR 20110042153A KR 1020107026673 A KR1020107026673 A KR 1020107026673A KR 20107026673 A KR20107026673 A KR 20107026673A KR 20110042153 A KR20110042153 A KR 20110042153A
- Authority
- KR
- South Korea
- Prior art keywords
- purin
- morpholino
- compound
- alkylene
- methyl
- Prior art date
Links
- 0 [*+]c1c(cn[n]2)c2ccc1 Chemical compound [*+]c1c(cn[n]2)c2ccc1 0.000 description 11
- YNAVUWVOSKDBBP-UHFFFAOYSA-N C1NCCOC1 Chemical compound C1NCCOC1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 1
- DFAXHFMCZXCSTQ-UHFFFAOYSA-N CC(C)C[n]1c2nc(Cl)nc(N3CCOCC3)c2nc1 Chemical compound CC(C)C[n]1c2nc(Cl)nc(N3CCOCC3)c2nc1 DFAXHFMCZXCSTQ-UHFFFAOYSA-N 0.000 description 1
- YRPXZCWDXBNPBD-UHFFFAOYSA-N CC1(C)OB(c2cccc3c2cn[nH]3)OC1(C)C Chemical compound CC1(C)OB(c2cccc3c2cn[nH]3)OC1(C)C YRPXZCWDXBNPBD-UHFFFAOYSA-N 0.000 description 1
- ISGQGWFJSBNEEJ-UHFFFAOYSA-N CCC[n]1c(nc(nc2N3CCOCC3)Cl)c2nc1C(C)(C)O Chemical compound CCC[n]1c(nc(nc2N3CCOCC3)Cl)c2nc1C(C)(C)O ISGQGWFJSBNEEJ-UHFFFAOYSA-N 0.000 description 1
- HFCFJYRLBAANKN-UHFFFAOYSA-N Cc(c([N+]([O-])=O)ccc1)c1N Chemical compound Cc(c([N+]([O-])=O)ccc1)c1N HFCFJYRLBAANKN-UHFFFAOYSA-N 0.000 description 1
- KGWPHCDTOLQQEP-UHFFFAOYSA-N Cc1c2[nH]ccc2ccc1 Chemical compound Cc1c2[nH]ccc2ccc1 KGWPHCDTOLQQEP-UHFFFAOYSA-N 0.000 description 1
- UAIKQUZQXSTAKX-UHFFFAOYSA-N Cc1cccc(C2)c1NC2=O Chemical compound Cc1cccc(C2)c1NC2=O UAIKQUZQXSTAKX-UHFFFAOYSA-N 0.000 description 1
- USRZZPHRQZGXFH-UHFFFAOYSA-N Cc1cccc(N2)c1CC2=O Chemical compound Cc1cccc(N2)c1CC2=O USRZZPHRQZGXFH-UHFFFAOYSA-N 0.000 description 1
- CVEAAUAFISZRDR-UHFFFAOYSA-N Cc1ccnc2c1cn[nH]2 Chemical compound Cc1ccnc2c1cn[nH]2 CVEAAUAFISZRDR-UHFFFAOYSA-N 0.000 description 1
- CCHMIEBDQWHKQA-UHFFFAOYSA-N Cc1ncnc2c1cn[nH]2 Chemical compound Cc1ncnc2c1cn[nH]2 CCHMIEBDQWHKQA-UHFFFAOYSA-N 0.000 description 1
- ASNBMEFTEPQHDX-UHFFFAOYSA-N Clc1c2nc[n](C3OCCCC3)c2nc(Cl)n1 Chemical compound Clc1c2nc[n](C3OCCCC3)c2nc(Cl)n1 ASNBMEFTEPQHDX-UHFFFAOYSA-N 0.000 description 1
- RMFWVOLULURGJI-UHFFFAOYSA-N Clc1nc(Cl)nc2c1nc[nH]2 Chemical compound Clc1nc(Cl)nc2c1nc[nH]2 RMFWVOLULURGJI-UHFFFAOYSA-N 0.000 description 1
- DZZKXXUZRAQJQI-UHFFFAOYSA-N Clc1nc(N2CCOCC2)c2nc[n](C3OCCCC3)c2n1 Chemical compound Clc1nc(N2CCOCC2)c2nc[n](C3OCCCC3)c2n1 DZZKXXUZRAQJQI-UHFFFAOYSA-N 0.000 description 1
- MDELYEBAXHZXLZ-UHFFFAOYSA-N Nc1cccc2c1cn[nH]2 Chemical compound Nc1cccc2c1cn[nH]2 MDELYEBAXHZXLZ-UHFFFAOYSA-N 0.000 description 1
- WBTVZVUYPVQEIF-UHFFFAOYSA-N [O-][N+](c1cccc2c1cn[nH]2)=O Chemical compound [O-][N+](c1cccc2c1cn[nH]2)=O WBTVZVUYPVQEIF-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/32—Nitrogen atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
화학식 I의 퓨린 화합물, 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 및 제약상 허용되는 염은 p110 알파 및 그 밖의 PI3K 이소형을 포함하는 지질 키나제를 억제하고, 지질 키나제에 의해 매개되는 장애, 예컨대 암을 치료하는데 유용하다. 포유동물 세포에서의 상기 장애, 또는 관련된 병리학적 증상의 시험관내, 계내 및 생체내 진단, 예방 또는 치료에 화학식 I의 화합물을 사용하는 방법을 개시한다.
Description
관련 출원에 대한 상호 참조
37 CFR §1.53(b)하에 출원된 본 정식 출원은 35 USC §119(e)하에 2008년 5월 30일 출원된 미국 가출원 제61/057,559호의 이점을 청구하며, 이는 전문이 참고로 포함된다.
<발명의 분야>
본 발명은 일반적으로 항암 활성을 갖는 화합물 및 보다 구체적으로 PI3 키나제 활성을 억제하는 화합물에 관한 것이다. 또한, 본 발명은 포유동물 세포, 또는 관련된 병리학적 증상의 시험관내, 계내, 및 생체내 진단 또는 치료에 상기 화합물을 사용하는 방법에 관한 것이다.
포스파티딜이노시톨 (이후 "PI"로 약칭함)은 세포막에서 발견되는 수많은 인지질 중 하나이다. 최근 몇 년 사이에, PI가 세포내 신호 변환에 중요한 역할을 한다는 것이 명백해졌다. 3'-인산화 포스포이노시타이드를 통한 세포 신호전달은 다양한 세포 과정, 예를 들면 악성 형질전환, 성장 인자 신호전달, 염증, 및 면역과 연관되어 있다 (문헌 [Rameh et al. (1999) J. Biol Chem, 274:8347-8350]). 이들 인산화 신호전달 생성물의 생성을 담당하는 효소인 포스파티딜이노시톨 3-키나제 (PI3 키나제, PI 3-키나제 또는 PI3K로도 지칭함)는 원래 바이러스성 종양단백질과 관련된 활성, 및 포스파티딜이노시톨 (PI)을 인산화시키는 성장 인자 수용체 티로신 키나제 및 이노시톨 고리의 3'-히드록실에서의 그의 인산화 유도체를 특징으로 한다 (문헌 [Panayotou et al. (1992) Trends Cell Biol 2:358-60]).
포스포이노시타이드 3-키나제 (PI3K)는 포스포이노시톨의 이노시톨 고리의 3-히드록실 잔기에서 지질을 인산화시키는 지질 키나제이다 (문헌 [Whitman et al. (1988) Nature, 332:664]). PI3-키나제에 의해 생성된 3'-인산화 인지질 (PIP3)은 지질 결합 도메인 (플렉스트린 상동성 (PH) 영역 포함)을 가진 키나제, 예컨대 Akt 및 포스포이노시타이드-의존성 키나제-1 (PDK1)을 동원하는 제2 메신저로서 작용한다. Akt와 PIP3 막의 결합에 의해 Akt가 상기 혈장 막으로 전위되어, Akt가 Akt의 활성화를 담당하는 PDK1과 접촉하게 된다. 종양-저해 포스파타제인 PTEN은 PIP3을 탈인산화시켜, Akt 활성화에 대한 음성 조절자로서 작용한다. PI3-키나제 Akt 및 PDK1은 세포 주기 조절, 증식, 생존, 아팝토시스 및 운동성과 같은 여러 세포 과정의 조절에 중요하며, 암, 당뇨병 및 면역성 염증과 같은 질환의 분자 메카니즘의 중요한 성분이다 (문헌 [Vivanco et al. (2002) Nature Rev. Cancer 2:489]; [Phillips et al. (1998) Cancer 83:41]).
PI3 키나제는 p85 및 p110 서브유닛으로 이루어진 이종이량체이다 (문헌 [Otsu et al. (1991) Cell 65:91-104]; [Hiles et al. (1992) Cell 70:419-29]). 네 가지의 구분되는 제I 부류의 PI3K가 확인되었고, PI3K α (알파), β (베타), δ (델타), 및 γ (감마)로 나타내어지며, 이들은 각각 구분되는 110 kDa의 촉매 서브유닛 및 조절 서브유닛으로 이루어진다. 보다 구체적으로, 촉매 서브유닛 중 3종, 즉 p110 알파, p110 베타 및 p110 델타는 각각 동일한 조절 서브유닛, p85와 상호작용하는 반면에, p110 감마는 구분되는 조절 서브유닛, p101과 상호작용한다. 인간의 세포 및 조직에서 이들 PI3K 각각이 발현되는 패턴도 역시 구분된다.
암에 있어서 주요한 PI3-키나제 이소형은 제I 부류의 PI3-키나제인 p110α(알파)이다 (US 5824492; US 5846824; US 6274327). 다른 이소형은 심혈관 및 면역-염증성 질환과 연관되어 있다 (문헌 [Workman P (2004) Biochem Soc Trans 32:393-396]; [Patel et al. (2004) Proceedings of the American Association of Cancer Research (Abstract LB-247) 95th Annual Meeting, March 27-31, Orlando, Florida, USA]; [Ahmadi K and Waterfield MD (2004) Encyclopedia of Biological Chemistry (Lennarz W J, Lane M D eds) Elsevier/Academic Press]).
PI3 키나제/Akt/PTEN 경로는 그 작용제가 암 세포에서 증식을 억제하고, 아팝토시스의 억압을 역행시키고, 세포독성제에 대한 내성을 극복할 것으로 예상되어, 암 약물 개발에 대한 매력적인 표적이다. PI3 키나제 억제제가 보고되어 있다 (문헌 [Yaguchi et al. (2006) Jour. of the Nat. Cancer Inst. 98(8):545-556]; US 7173029; US 7037915; US 6608056; US 6608053; US 6838457; US 6770641; US 6653320; US 6403588; US 6703414; WO 97/15658; WO 2006/046031; WO 2006/046035; WO 2006/046040; WO 2007/042806; WO 2007/042810; WO 2004/017950; US 2004/092561; WO 2004/007491; WO 2004/006916; WO 2003/037886; US 2003/149074; WO 2003/035618; WO 2003/034997; US 2003/158212; EP 1417976; US 2004/053946; JP 2001247477; JP 08175990; JP 08176070). 특정 티에노피리미딘 화합물은 p110 알파 결합, PI3 키나제 억제 활성을 가지며, 암 세포의 성장을 억제한다 (WO 2006/046031; WO 2007/122410; WO 2007/127183; WO 2007/129161; US 2008/0269210; US 2008/0242665). 특정 퓨린 화합물은 p110 델타 결합, PI3 키나제 억제 활성을 갖는다 (WO 2009/053716).
본 발명은 일반적으로 항암 활성, 및 보다 구체적으로 PI3 키나제 조절 또는 억제 활성을 갖는 화학식 I의 퓨린 화합물에 관한 것이다. 특정한 과다증식성 장애는 PI3 키나제 기능의 조절, 예를 들면 상기 단백질의 돌연변이 또는 과발현을 특징으로 한다. 따라서, 본 발명의 화합물은 암과 같은 과다증식성 장애의 치료에 유용할 수 있다. 상기 화합물은 포유동물에서 종양 성장을 억제할 수 있고, 인간 암 환자를 치료하는데 유용할 수 있다.
본 발명은 또한 포유동물 세포, 유기체, 또는 관련된 병리학적 증상의 시험관내, 계내 및 생체내 진단 또는 치료에 화학식 I의 퓨린 화합물을 사용하는 방법에 관한 것이다.
화학식 I의 화합물에는 하기 화학식 I의 화합물 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염이 포함된다:
<화학식 I>
다양한 치환기 R1, R2, R3, R4는 본원에서 정의하는 바와 같다.
본 발명의 또다른 측면은 화학식 I의 퓨린 화합물 및 제약상 허용되는 담체를 포함하는 제약 조성물을 제공한다. 상기 제약 조성물은 하나 이상의 추가의 치료제를 더 포함할 수 있다.
본 발명의 또다른 측면은 PI3 키나제와 유효 억제량의 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 접촉시키는 것을 포함하는, PI3 키나제 활성의 억제 방법을 제공한다.
본 발명의 또다른 측면은 유효량의 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 PI3 키나제에 의해 조절되는 과다증식성 질환 또는 장애의 치료를 필요로 하는 포유동물에게 투여하는 것을 포함하는, PI3 키나제에 의해 조절되는 과다증식성 질환 또는 장애를 예방 또는 치료하는 방법을 제공한다. 그러한 과다증식성 질환 또는 장애의 예에는 암이 포함되지만, 이것으로 한정되지 않는다.
본 발명의 또다른 측면은 유효량의 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 단독으로 또는 항-과다증식 특성을 갖는 하나 이상의 추가의 화합물과 조합하여 과다증식성 장애의 치료를 필요로 하는 포유동물에게 투여하는 것을 포함하는, 과다증식성 장애를 예방 또는 치료하는 방법을 제공한다.
본 발명의 추가의 측면은 포유동물에서 PI3 키나제에 의해 조절되는 질환 또는 증상을 치료 또는 예방하기 위한 의약의 제조에 있어서 본 발명의 화합물의 용도이다.
본 발명의 또다른 측면은 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 또는 제약상 허용되는 염, 용기, 및 임의로 치료법을 지시하는 포장 삽입물 또는 라벨을 포함하는 키트를 포함한다.
본 발명의 또다른 측면은 화학식 I의 화합물을 제조하는 방법, 분리하는 방법, 및 정제하는 방법을 포함한다.
본 발명의 또다른 측면은 화학식 I의 화합물의 제조에 유용한 신규 중간체를 포함한다.
본 발명의 추가의 이점 및 신규한 특징은 하기 상세한 설명에 일부 기재될 것이고, 일부는 하기 명세서의 심사시에 당업자에게 자명하게 되거나 또는 본 발명의 실시에 의해 습득될 수 있다. 본 발명의 이점은 특히 첨부된 청구항에서 지적된 수단, 조합물, 조성물, 및 방법에 의해 실현 및 달성될 수 있다.
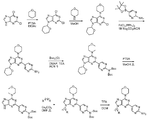
도 1은 다관능화된 퓨린의 일반적인 제조 방법을 보여준다.
도 2는 다관능화된 퓨린의 대안적인 합성 방법을 보여준다.
도 2는 다관능화된 퓨린의 대안적인 합성 방법을 보여준다.
본 발명의 특정 실시양태에 관한 언급이 다음에 상세히 이루어질 것인데, 그의 예들은 수반되는 구조 및 식으로 예시된다. 본 발명이 예시된 실시양태와 연계되어 기재되긴 하였지만, 본 발명이 이들 실시양태로 한정되지 않는다는 것을 인지해야 할 것이다. 이와 달리, 본 발명은 특허청구범위에 규정된 바와 같은 본 발명의 범위 내에 포함될 수 있는 모든 대안, 변형 및 등가물을 포괄한다. 당업자는 본 발명의 실시에 사용될 수 있는, 본원에 기재된 바와 유사하거나 동등한 많은 방법 및 물질을 인식할 것이다. 본 발명은 어떤 방식으로든 기재된 방법 및 물질로 한정되지 않는다. 삽입된 문헌, 특허, 및 유사한 물질 중의 하나 이상이 본 출원과 상이하거나 모순되는 경우에는 (이에는 정의된 용어, 용어 활용, 기재된 기술 등이 포함되지만 이들로 한정되지 않는다), 본 출원이 우선한다.
정의
본원에 사용된 용어 "알킬"은 탄소 원자가 1 내지 12개 (C1-C12)인 포화된 직쇄 또는 분지쇄 1가 탄화수소 라디칼을 나타내며, 상기 알킬 라디칼은 임의로 하기 기재된 하나 이상의 치환기로 독립적으로 치환될 수 있다. 또다른 실시양태에서, 알킬 라디칼은 탄소 원자가 1 내지 8개 (C1-C8)이거나, 또는 탄소 원자가 1 내지 6개 (C1-C6)이다. 알킬기의 예에는 메틸 (Me, -CH3), 에틸 (Et, -CH2CH3), 1-프로필 (n-Pr, n-프로필, -CH2CH2CH3), 2-프로필 (i-Pr, i-프로필, -CH(CH3)2), 1-부틸 (n-Bu, n-부틸, -CH2CH2CH2CH3), 2-메틸-1-프로필 (i-Bu, i-부틸, -CH2CH(CH3)2), 2-부틸 (s-Bu, s-부틸, -CH(CH3)CH2CH3), 2-메틸-2-프로필 (t-Bu, t-부틸, -C(CH3)3), 1-펜틸 (n-펜틸, -CH2CH2CH2CH2CH3), 2-펜틸 (-CH(CH3)CH2CH2CH3), 3-펜틸 (-CH(CH2CH3)2), 2-메틸-2-부틸 (-C(CH3)2CH2CH3), 3-메틸-2-부틸 (-CH(CH3)CH(CH3)2), 3-메틸-1-부틸 (-CH2CH2CH(CH3)2), 2-메틸-1-부틸 (-CH2CH(CH3)CH2CH3), 1-헥실 (-CH2CH2CH2CH2CH2CH3), 2-헥실 (-CH(CH3)CH2CH2CH2CH3), 3-헥실 (-CH(CH2CH3)(CH2CH2CH3)), 2-메틸-2-펜틸 (-C(CH3)2CH2CH2CH3), 3-메틸-2-펜틸 (-CH(CH3)CH(CH3)CH2CH3), 4-메틸-2-펜틸 (-CH(CH3)CH2CH(CH3)2), 3-메틸-3-펜틸 (-C(CH3)(CH2CH3)2), 2-메틸-3-펜틸 (-CH(CH2CH3)CH(CH3)2), 2,3-디메틸-2-부틸 (-C(CH3)2CH(CH3)2), 3,3-디메틸-2-부틸 (-CH(CH3)C(CH3)3), 1-헵틸, 1-옥틸 등이 포함되지만, 이들로 한정되지 않는다.
본원에 사용된 용어 "알킬렌"은 탄소 원자가 1 내지 12개 (C1-C12)인 포화된 직쇄 또는 분지쇄 2가 탄화수소 라디칼을 나타내며, 상기 알킬렌 라디칼은 임의로 하기 기재된 하나 이상의 치환기로 독립적으로 치환될 수 있다. 또다른 실시양태에서, 알킬렌 라디칼은 탄소 원자가 1 내지 8개 (C1-C8)이거나, 또는 탄소 원자가 1 내지 6개 (C1-C6)이다. 알킬렌기의 예에는 메틸렌 (-CH2-), 에틸렌 (-CH2CH2-), 프로필렌 (-CH2CH2CH2-) 등이 포함되지만, 이들로 한정되지 않는다.
용어 "알케닐"은 적어도 하나의 불포화 부위, 즉 탄소-탄소 sp2 이중 결합을 갖는, 탄소 원자가 2 내지 8개 (C2-C8)인 직쇄 또는 분지쇄 1가 탄화수소 라디칼을 나타내며, 상기 알케닐 라디칼은 임의로 치환될 수 있고, "시스" 및 "트랜스" 배향, 또는 다르게는 "E" 및 "Z" 배향을 갖는 라디칼을 포함한다. 예로는 에틸레닐 또는 비닐 (-CH=CH2), 알릴 (-CH2CH=CH2) 등이 포함되지만, 이들로 한정되지 않는다.
용어 "알케닐렌"은 적어도 하나의 불포화 부위, 즉 탄소-탄소 sp2 이중 결합을 갖는, 탄소 원자가 2 내지 8개 (C2-C8)인 직쇄 또는 분지쇄 2가 탄화수소 라디칼을 나타내며, 상기 알케닐렌 라디칼은 임의로 치환될 수 있고, "시스" 및 "트랜스" 배향, 또는 다르게는 "E" 및 "Z" 배향을 갖는 라디칼을 포함한다. 예로는 에틸레닐렌 또는 비닐렌 (-CH=CH-), 알릴 (-CH2CH=CH-) 등이 포함되지만, 이들로 한정되지 않는다.
용어 "알키닐"은 적어도 하나의 불포화 부위, 즉 탄소-탄소 sp 삼중 결합을 갖는, 탄소 원자가 2 내지 8개 (C2-C8)인 선형 또는 분지형 1가 탄화수소 라디칼을 나타내며, 상기 알키닐 라디칼은 임의로 치환될 수 있다. 예로는 에티닐 (-C≡CH), 프로피닐 (프로파르길, -CH2C≡CH) 등이 포함되지만, 이들로 한정되지 않는다.
용어 "알키닐렌"은 적어도 하나의 불포화 부위, 즉 탄소-탄소 sp 삼중 결합을 갖는, 탄소 원자가 2 내지 8개 (C2-C8)인 선형 또는 분지형 2가 탄화수소 라디칼을 나타내며, 상기 알키닐 라디칼은 임의로 치환될 수 있다. 예로는 에티닐렌 (-C≡C-), 프로피닐렌 (프로파르길렌, -CH2C≡C-) 등이 포함되지만, 이들로 한정되지 않는다.
용어 "카르보사이클", "카르보시클릴", "카르보시클릭 고리" 및 "시클로알킬"은 모노시클릭 고리로서 3 내지 12개의 탄소 원자 (C3-C12)를 갖거나 또는 바이시클릭 고리로서 7 내지 12개의 탄소 원자를 갖는, 포화된 또는 부분적으로 불포화된 1가의 비-방향족 고리를 말한다. 7 내지 12개의 원자를 갖는 바이시클릭 카르보사이클은, 예를 들면 바이시클로 [4,5], [5,5], [5,6] 또는 [6,6] 계로 배열될 수 있고, 9 또는 10개의 고리 원자를 갖는 바이시클릭 카르보사이클은 바이시클로 [5,6] 또는 [6,6] 계로 배열되거나, 또는 바이시클로[2.2.1]헵탄, 바이시클로[2.2.2]옥탄 및 바이시클로[3.2.2]노난과 같은 가교된 계로 배열될 수 있다. 모노시클릭 카르보사이클의 예에는 시클로프로필, 시클로부틸, 시클로펜틸, 1-시클로펜트-1-에닐, 1-시클로펜트-2-에닐, 1-시클로펜트-3-에닐, 시클로헥실, 1-시클로헥스-1-에닐, 1-시클로헥스-2-에닐, 1-시클로헥스-3-에닐, 시클로헥사디에닐, 시클로헵틸, 시클로옥틸, 시클로노닐, 시클로데실, 시클로운데실, 시클로도데실 등이 포함되지만, 이들로 한정되지 않는다.
"아릴"은 모 방향족 고리계의 단일 탄소 원자로부터 하나의 수소 원자를 제거하는 것에 의해 유래된, 탄소 원자가 6 내지 20개 (C6-C20)인 1가의 방향족 탄화수소 라디칼을 의미한다. 일부 아릴기는 예시 구조에서 "Ar"로 표시된다. 아릴은 포화된, 부분적으로 불포화된 고리에 융합된 방향족 고리, 또는 방향족 카르보시클릭 고리를 포함하는 바이시클릭 라디칼을 포함한다. 전형적인 아릴기에는 벤젠으로부터 유래된 라디칼 (페닐), 치환된 벤젠, 나프탈렌, 안트라센, 바이페닐, 인데닐, 인다닐, 1,2-디히드로나프탈렌, 1,2,3,4-테트라히드로나프틸 등이 포함되지만, 이들로 한정되지 않는다. 아릴기는 임의로 치환된다.
"아릴렌"은 모 방향족 고리계의 2개의 탄소 원자로부터 2개의 수소 원자를 제거하는 것에 의해 유래된, 탄소 원자가 6 내지 20개 (C6-C20)인 2가의 방향족 탄화수소 라디칼을 의미한다. 일부 아릴렌기는 예시 구조에서 "Ar"로 표시된다. 아릴렌은 포화된, 부분적으로 불포화된 고리에 융합된 방향족 고리, 또는 방향족 카르보시클릭 고리를 포함하는 바이시클릭 라디칼을 포함한다. 전형적인 아릴렌기에는 벤젠으로부터 유래된 라디칼 (페닐렌), 치환된 벤젠, 나프탈렌, 안트라센, 바이페닐렌, 인데닐렌, 인다닐렌, 1,2-디히드로나프탈렌, 1,2,3,4-테트라히드로나프틸 등이 포함되지만, 이들로 한정되지 않는다. 아릴렌기는 임의로 치환된다.
용어 "헤테로사이클," "헤테로시클릴" 및 "헤테로시클릭 고리"는 본원에서 상호교환적으로 사용되고, 포화된 또는 부분적으로 불포화된 (즉, 고리 내에 하나 이상의 이중 및/또는 삼중 결합을 가짐), 3 내지 약 20개의 고리 원자를 갖는 카르보시클릭 라디칼을 나타내며, 이때 적어도 하나의 고리 원자는 질소, 산소, 인 및 황으로부터 선택된 헤테로원자이고, 나머지 고리 원자는 C이며, 여기서 하나 이상의 고리 원자는, 예를 들어 옥소 (=O), 머캅토, 또는 아미노 등에 의해 임의로 치환된다. 헤테로사이클은 3 내지 7개의 고리원을 갖는 모노사이클 (2 내지 6개의 탄소 원자 및 N, O, P 및 S로부터 선택된 1 내지 4개의 헤테로원자) 또는 7 내지 10개의 고리원을 갖는 바이사이클 (4 내지 9개의 탄소 원자 및 N, O, P 및 S로부터 선택된 1 내지 6개의 헤테로원자), 예를 들면 바이시클로 [4,5], [5,5], [5,6] 또는 [6,6] 계일 수 있다. 헤테로사이클은 문헌 [Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968)], 특히 챕터 1, 3, 4, 6, 7 및 9; ["The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present)], 특히 13, 14, 16, 19 및 28 권; 및 [J. Am. Chem. Soc. (1960) 82:5566]에 기재되어 있다. "헤테로시클릴"은 또한 헤테로사이클 라디칼이 포화된, 부분적으로 불포화된 고리, 또는 방향족 카르보시클릭 또는 헤테로시클릭 고리와 융합된 라디칼을 포함한다. 헤테로시클릭 고리의 예에는 피롤리디닐, 테트라히드로푸라닐, 디히드로푸라닐, 테트라히드로티에닐, 테트라히드로피라닐, 디히드로피라닐, 테트라히드로티오피라닐, 피페리디노 (피페리디닐), 모르폴리노 (모르폴리닐), 티오모르폴리노, 티옥사닐, 피페라지닐, 호모피페라지닐, 아제티디닐, 옥세타닐, 티에타닐, 호모피페리디닐, 옥세파닐, 티에파닐, 옥사제피닐, 디아제피닐, 티아제피닐, 2-피롤리닐, 3-피롤리닐, 인돌리닐, 2H-피라닐, 4H-피라닐, 디옥사닐, 1,3-디옥솔라닐, 피라졸리닐, 디티아닐, 디티올라닐, 디히드로피라닐, 디히드로티에닐, 디히드로푸라닐, 피라졸리디닐이미다졸리닐, 이미다졸리디닐, 3-아자바이시클로[3.1.0]헥사닐, 3-아자바이시클로[4.1.0]헵타닐, 아자바이시클로[2.2.2]헥사닐, 3H-인돌릴 퀴놀리지닐 1H-벤조[d]이미다졸-2(3H)-온-5-일, 및 N-피리딜 우레아가 포함되지만, 이들로 한정되지 않는다. 스피로 모이어티 또한 본 정의의 범위 내에 포함된다. 하나 이상의 옥소 (=O) 모이어티로 치환된 헤테로시클릭 기의 예는 피리미디노닐 및 1,1-디옥소-티오모르폴리닐이다.
용어 "헤테로아릴"은 5-원, 6-원 또는 7-원 고리의 1가의 방향족 라디칼을 나타내며, 질소, 산소 및 황으로부터 독립적으로 선택된 하나 이상의 헤테로원자를 함유하는 5 내지 약 20개 고리 원자의 융합된 고리계 (이들 중 적어도 하나는 방향족임)를 포함한다. 헤테로아릴 기의 예는 피리디닐 (예를 들면, 2-히드록시피리디닐을 포함), 이미다졸릴, 이미다조피리디닐, 피리미디닐 (예를 들면, 4-히드록시피리미디닐을 포함), 피라졸릴, 트리아졸릴, 피라지닐, 테트라졸릴, 푸릴, 티에닐, 이속사졸릴, 티아졸릴, 옥사디아졸릴, 옥사졸릴, 이소티아졸릴, 피롤릴, 퀴놀리닐, 이소퀴놀리닐, 테트라히드로이소퀴놀리닐, 인돌릴, 벤즈이미다졸릴, 벤조푸라닐, 신놀리닐, 인다졸릴, 인돌리지닐, 프탈라지닐, 피리다지닐, 트리아지닐, 이소인돌릴, 프테리디닐, 퓨리닐, 옥사디아졸릴, 트리아졸릴, 티아디아졸릴, 티아디아졸릴, 푸라자닐, 벤조푸라자닐, 벤조티오페닐, 벤조티아졸릴, 벤즈옥사졸릴, 퀴나졸리닐, 퀴녹살리닐, 나프티리디닐, 및 푸로피리디닐이다. 헤테로아릴 기는 임의로 치환된다.
헤테로사이클 또는 헤테로아릴 기는 가능한 경우에 탄소 (탄소-연결) 또는 질소 (질소-연결) 결합될 수 있다. 예를 들면, 한정되지는 않지만, 탄소 결합된 헤테로사이클 또는 헤테로아릴은 피리딘의 위치 2, 3, 4, 5 또는 6, 피리다진의 위치 3, 4, 5 또는 6, 피리미딘의 위치 2, 4, 5 또는 6, 피라진의 위치 2, 3, 5 또는 6, 푸란, 테트라히드로푸란, 티오푸란, 티오펜, 피롤 또는 테트라히드로피롤의 위치 2, 3, 4 또는 5, 옥사졸, 이미다졸 또는 티아졸의 위치 2, 4 또는 5, 이속사졸, 피라졸 또는 이소티아졸의 위치 3, 4 또는 5, 아지리딘의 위치 2 또는 3, 아제티딘의 위치 2, 3 또는 4, 퀴놀린의 위치 2, 3, 4, 5, 6, 7 또는 8, 또는 이소퀴놀린의 위치 1, 3, 4, 5, 6, 7 또는 8에서 결합된다.
예를 들면, 한정되지 않지만, 질소 결합된 헤테로사이클 또는 헤테로아릴은 아지리딘, 아제티딘, 피롤, 피롤리딘, 2-피롤린, 3-피롤린, 이미다졸, 이미다졸리딘, 2-이미다졸린, 3-이미다졸린, 피라졸, 피라졸린, 2-피라졸린, 3-피라졸린, 피페리딘, 피페라진, 인돌, 인돌린, 1H-인다졸의 위치 1, 이소인돌 또는 이소인돌린의 위치 2, 모르폴린의 위치 4, 및 카르바졸 또는 β-카르볼린의 위치 9에서 결합된다.
용어 "모노시클릭 헤테로아릴"은 N, O 및 S로부터 독립적으로 선택된 1, 2, 3 또는 4개의 고리 헤테로원자를 함유하는 5-원 또는 6-원 비치환 또는 치환된 모노시클릭 헤테로아릴 라디칼을 나타낸다. 모노시클릭 헤테로아릴은 모노시클릭 헤테로아릴 R3 기의 임의의 탄소 (탄소-연결) 원자에서 화학식 I에 따른 피리미딘 고리의 C-4 및 C-6 위치에 부착될 수 있다. 모노시클릭 헤테로아릴 라디칼에는 2-피리딜, 3-피리딜, 4-피리딜, 3-이속사졸릴, 4-이속사졸릴, 5-이속사졸릴, 2-이미다졸릴, 4-이미다졸릴, 3-피라졸릴, 4-피라졸릴, 2-피롤릴, 3-피롤릴, 2-티아졸릴, 4-티아졸릴, 5-티아졸릴, 3-피리다지닐, 4-피리다지닐, 5-피리다지닐, 2-피리미디닐, 5-피리미디닐, 6-피리미디닐, 2-피라지닐, 2-옥사졸릴, 4-옥사졸릴, 5-옥사졸릴, 2-푸라닐, 3-푸라닐, 2-티에닐, 3-티에닐, 3-트리아졸릴, 1-트리아졸릴, 5-테트라졸릴, 1-테트라졸릴, 및 2-테트라졸릴이 포함되지만, 이들로 한정되지 않는다. 모노시클릭 헤테로아릴은 임의로 치환된다.
질소, 산소 및 황으로부터 독립적으로 선택된 하나 이상의 헤테로원자를 함유하는 "융합된 바이시클릭 C4-C20 헤테로시클릴" 및 "융합된 바이시클릭 C1-C20 헤테로아릴"은 그들의 방향족 특성에 의해서만 상이하며, 서로 융합된 2개의 고리를 가진다 (즉 공동의 결합을 공유한다). 융합된 바이시클릭 헤테로시클릴 및 헤테로아릴 라디칼은 비치환 또는 치환될 수 있고, 융합된 바이시클릭 C4-C20 헤테로시클릴 또는 융합된 바이시클릭 C1-C20 헤테로아릴기 R3 기의 임의의 탄소 (탄소-연결) 원자에서 화학식 I에 따른 피리미딘 고리의 C-4 및 C-6 위치에 부착될 수 있다. 융합된 바이시클릭 헤테로시클릴 및 헤테로아릴 라디칼에는 1H-인다졸, 1H-인돌, 인돌린-2-온, 1-(인돌린-1-일)에타논, 1H-벤조[d][1,2,3]트리아졸, 1H-피라졸로[3,4-b]피리딘, 1H-피라졸로[3,4-d]피리미딘, 1H-벤조[d]이미다졸, 1H-벤조[d]이미다졸-2(3H)-온, 1H-피라졸로[3,4-c]피리딘, 1H-피롤로[2,3-c]피리딘, 3H-이미다조[4,5-c]피리딘, 7H-피롤로[2,3-d]피리미딘, 7H-퓨린, 1H-피라졸로[4,3-d]피리미딘, 5H-피롤로[3,2-d]피리미딘, 2-아미노-1H-퓨린-6(9H)-온, 퀴놀린, 퀴나졸린, 퀴녹살린, 이소퀴놀린, 이소퀴놀린-1(2H)-온, 3,4-디히드로이소퀴놀린-1(2H)-온, 3,4-디히드로퀴놀린-2(1H)-온, 퀴나졸린-2(1H)-온, 퀴녹살린-2(1H)-온, 1,8-나프티리딘, 피리도[3,4-d]피리미딘, 피리도[3,2-b]피라진, 벤조[d][1,3]디옥솔, 및 2,3-디히드로벤조[b][1,4]디옥신이 포함되지만, 이들로 한정되지 않는다.
용어 "치료하다" 및 "치료"는 치유적 치료 및 예방 또는 방지 수단 모두를 나타내며, 이때 그 목적은 바람직하지 않은 생리적 변화 또는 장애, 예컨대 암의 발생 또는 확산을 예방 또는 지연 (감소)시키는 것이다. 본 발명의 목적에 있어서 유익하거나 바람직한 임상적 결과에는, 검출가능하거나 검출불가능한 것에 관계없이, 징후의 경감, 질환 정도의 감소, 질환의 안정화된 (즉, 악화되지 않는) 상태, 질환 진행의 지연 또는 감속, 질환 상태의 개선 또는 완화, 및 진정 (부분적 또는 전체적)이 포함되지만 이들로 한정되지 않는다. "치료"는 또한 치료받지 않은 경우에 예상되는 수명에 비해 연장된 수명을 의미할 수 있다. 치료를 필요로 하는 대상은 이미 증상 또는 장애를 가지고 있는 대상 뿐만 아니라 증상 또는 장애에 걸리기 쉬운 대상 또는 증상 또는 장애가 예방되어야 하는 대상을 포함한다.
어구 "치료 유효량"은 (i) 본원에 기재된 특정 질환, 증상 또는 장애를 치료 또는 방지하거나, (ii) 본원에 기재된 특정 질환, 증상 또는 장애의 하나 이상의 징후를 약화, 경감 또는 제거하거나, 또는 (iii) 본원에 기재된 특정 질환, 증상 또는 장애의 하나 이상의 징후의 발생을 방지 또는 지연시키는, 본 발명의 화합물의 양을 의미한다. 암의 경우에, 치료 유효량의 약물은 암 세포의 수를 감소시킬 수 있고/거나; 종양 크기를 감소시킬 수 있고/거나; 말초 기관으로의 암 세포 침윤을 억제 (즉, 어느 정도 지연시키고, 바람직하게는 정지시킴)할 수 있고/거나; 종양 전이를 억제 (즉, 어느 정도 지연시키고, 바람직하게는 정지시킴)할 수 있고/거나; 종양 성장을 어느 정도 억제할 수 있고/거나; 암과 관련된 하나 이상의 징후를 어느 정도 완화시킬 수 있다. 약물이 기존의 암 세포의 성장을 방지하고/거나, 사멸시킬 수 있다면, 이는 세포 증식 억제성 및/또는 세포독성일 수 있다. 암 요법을 위해, 효능은 예를 들면 질환 진행 시간 (TTP)을 평가하고/거나 반응 속도 (RR)를 결정하여 측정할 수 있다.
용어 "암" 및 "암성"은 전형적으로 조절되지 않는 세포 성장을 특징으로 하는 포유동물의 생리적 증상을 나타내거나 기재한다. "종양"은 하나 이상의 암성 세포를 포함한다. 암의 예에는, 암종, 림프종, 모세포종, 육종, 및 백혈병 또는 악성 림프종이 포함되지만, 이들로 한정되지 않는다. 이러한 암의 보다 구체적인 예에는 편평상피 세포 암 (예를 들면, 상피 편평상피 세포 암), 폐암, 예컨대 소-세포 폐암, 비-소세포 폐암 ("NSCLC"), 폐의 선암종 및 폐의 편평상피 암종, 복막암, 간세포암, 복부암 또는 위암, 예컨대 위장관 암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 간 종양, 유방암, 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 타선 암종, 신장암 또는 신암, 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 뿐만 아니라 두경부암이 포함된다.
"화학요법제"는 작용 기전에 관계없이 암을 치료하는데 유용한 화학적 화합물이다. 화학요법제의 부류에는 알킬화제, 항대사제, 방추체 독 식물 알카로이드, 세포독성/항종양 항생제, 토포이소머라제 억제제, 항체, 광증감제 및 키나제 억제제가 포함되지만, 이들로 한정되지 않는다. 화학요법제에는 "표적화 요법" 및 통상적인 화학요법에 사용되는 화합물이 포함된다. 화학요법제의 예에는 에를로티닙 (타르세바(TARCEVA; 등록상표), 제넨텍(Genentech)/OSI 팜(OSI Pharm.)), 도세탁셀 (탁소테레(TAXOTERE; 등록상표), 사노피-아벤티스(Sanofi-Aventis)), 5-FU (플루오로우라실, 5-플루오로우라실, CAS No. 51-21-8), 겜시타빈 (겜자르(GEMZAR; 등록상표), 릴리(Lilly)), PD-0325901 (CAS No. 391210-10-9, 화이자(Pfizer)), 시스플라틴 (시스-디아민, 디클로로플라티늄(II), CAS No. 15663-27-1), 카르보플라틴 (CAS No. 41575-94-4), 파클리탁셀 (탁솔(TAXOL; 등록상표), 브리스톨-마이어스 스큅 온콜로지(Bristol-Myers Squibb Oncology), 미국 뉴저지주 프린스톤 소재), 트라스투주맙 (헤르셉틴(HERCEPTIN; 등록상표), 제넨텍), 테모졸로미드 (4-메틸-5-옥소-2,3,4,6,8-펜타자바이시클로 [4.3.0] 노나-2,7,9-트리엔-9-카르복스아미드, CAS No. 85622-93-1, 테모다르(TEMODAR; 등록상표), 테모달(TEMODAL; 등록상표), 쉐링 플로우(Schering Plough)), 타목시펜 ((Z)-2-[4-(1,2-디페닐부트-1-에닐)페녹시]-N,N-디메틸-에탄아민, 놀바덱스(NOLVADEX; 등록상표), 이스투발(ISTUBAL; 등록상표), 발로덱스(VALODEX; 등록상표)), 및 독소루비신 (아드리아마이신(ADRIAMYCIN; 등록상표)), Akti-1/2, HPPD, 및 라파마이신이 포함된다.
화학요법제의 추가의 예에는 옥살리플라틴 (엘록사틴(ELOXATIN; 등록상표), 사노피), 보르테조밉 (벨카데(VELCADE; 등록상표), 밀레니엄 팜(Millennium Pharm.)), 수텐트 (수니티닙(SUNITINIB; 등록상표), SU11248, 화이자), 레트로졸 (페마라(FEMARA; 등록상표), 노바르티스(Novartis)), 이마티닙 메실레이트 (글리벡(GLEEVEC; 등록상표), 노바르티스), XL-518 (MEK 억제제, 엑셀리시스(Exelixis), WO 2007/044515), ARRY-886 (MEK 억제제, AZD6244, 어레이 바이오팜(Array Biopharm), 아스트라 제네카(Astra Zeneca)), SF-1126 (PI3K 억제제, 세마폴 파마슈티칼스(Semafore Pharmaceuticals)), BEZ-235 (PI3K 억제제, 노바르티스), XL-147 (PI3K 억제제, 엑셀리시스), PTK787/ZK 222584 (노바르티스), 풀베스트란트 (파슬로덱스(FASLODEX; 등록상표), 아스트라제네카), 류코보린 (폴린산), 라파마이신 (시롤리무스, 라파뮨(RAPAMUNE; 등록상표), 와이어스(Wyeth)), 라파티닙 (타이커브(TYKERB; 등록상표) GSK572016, 글락소 스미쓰 클라인(Glaxo Smith Kline)), 로나파르닙 (사라사르(SARASAR; 상표명), SCH 66336, 쉐링 플로우), 소라페닙 (넥사바르(NEXAVAR; 등록상표), BAY43-9006, 바이엘 랩스(Bayer Labs)), 게피티닙 (이레사(IRESSA; 등록상표), 아스트라제네카), 이리노테칸 (캄프토사르(CAMPTOSAR; 등록상표), CPT-11, 화이자), 티피파르닙 (자르네스트라(ZARNESTRA; 상표명), 존슨 앤 존슨(Johnson & Johnson)), 아브락산(ABRAXANE; 상표명) (크레모포르-무함유), 파클리탁셀의 알부민-가공된 나노입자 제제 (아메리칸 파마슈티칼 파트너스(American Pharmaceutical Partners), 미국 일리노이주 샤움버그 소재), 반데타닙 (rINN, ZD6474, 작티마(ZACTIMA; 등록상표), 아스트라제네카), 클로람부실, AG1478, AG1571 (SU 5271; 수젠(Sugen)), 템시롤리무스 (토리셀(TORISEL; 등록상표), 와이어스), 파조파닙 (글락소스미쓰클라인), 칸포스파미드 (텔시타(TELCYTA; 등록상표), 텔릭(Telik)), 티오테파 및 시클로스포스파미드 (시톡산(CYTOXAN; 등록상표), 네오사르(NEOSAR; 등록상표)); 알킬 술포네이트, 예컨대 부술판, 임프로술판 및 피포술판; 아지리딘, 예컨대 벤조도파, 카르보쿠온, 메투레도파 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예컨대 알트레타민, 트리에틸렌멜라민, 트리에틸렌포스포르아미드, 트리에틸렌티오포스포르아미드 및 트리메틸로멜라민; 아세토게닌 (특히, 불라탁신 및 불라탁시논); 캄프토테신 (합성 유사체 토포테칸 포함); 브리오스타틴; 칼리스타틴; CC-1065 (그의 아도젤레신, 카르젤레신 및 비젤레신 합성 유사체 포함); 크립토피신 (특히 크립토피신 1 및 크립토피신 8); 돌라스타틴; 듀오카르마이신 (합성 유사체, KW-2189 및 CB1-TM1 포함); 엘레우테로빈; 판크라티스타틴; 사르코딕티인; 스폰지스타틴; 질소 머스타드, 예컨대 클로람부실, 클로르나파진, 클로로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥시드 히드로클로라이드, 멜팔란, 노벰비친, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 니트로소우레아, 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴 및 라니무스틴; 항생제, 예컨대 에네디인 항생제 (예를 들면, 칼리키미신, 칼리키미신 감마1I, 칼리키미신 오메가I1 (문헌 [Angew Chem. Intl. Ed. Engl. (1994) 33:183-186]); 다이네미신, 다이네미신 A; 비스포스포네이트, 예컨대 클로드로네이트; 에스페라미신; 뿐만 아니라 네오카르지노스타틴 크로모포르 및 관련 색소 단백질 에네디인 항생제 크로모포르), 아클라시노마이신, 악티노마이신, 아루트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카르미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, 모르폴리노-독소루비신, 시아노모르폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신), 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예컨대 미토마이신 C, 미코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항-대사물질, 예컨대 메토트렉세이트 및 5-플루오로우라실 (5-FU); 엽산 유사체, 예컨대 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체, 예컨대 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예컨대 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 시타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록스우리딘; 안드로겐, 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토락톤; 항-부신 물질, 예컨대 아미노글루테티미드, 미토탄, 트리로스탄; 엽산 보충물, 예컨대 프롤린산; 아세글라톤; 알도포스파미드 글리코시드; 아미노레불린산; 에닐우라실; 암사크린; 베스트라부실; 비산트렌; 에다트렉세이트; 데포파민; 데메콜친; 디아지쿠온; 엘포르니틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 히드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드, 예컨대 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸히드라지드; 프로카르바진; PSK(등록상표) 폴리사카라이드 착체 (JHS 내추럴 프로덕츠(JHS Natural Products), 미국 오리곤주 유진 소재); 라족산; 리족신; 시조피란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2"-트리클로로트리에틸아민; 트리코테센 (특히, T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카르바진; 만노무스틴; 미토브로니톨; 미톨락톨; 피포브로만; 가시토신; 아라비노시드 ("Ara-C"); 시클로포스파미드; 티오테파; 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체, 예컨대 시스플라틴 및 카르보플라틴; 빈블라스틴; 에토포시드 (VP-16); 이포스파미드; 미톡산트론; 빈크리스틴; 비노렐빈 (나벨빈(NAVELBINE; 등록상표)); 노반트론; 테니포시드; 에다트렉세이트; 다우노마이신; 아미노프테린; 카페시타빈 (젤로다(XELODA; 등록상표, 로쉐(Roche)); 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드, 예컨대 레티노산; 및 상기한 것 중 임의의 제약상 허용되는 염, 산 및 유도체가 포함된다.
또한, "화학요법제"의 정의에는: (i) 종양에 대한 호르몬 작용을 조절 또는 억제하는 작용을 하는 항-호르몬제, 예컨대 항-에스트로겐 및 선택적 에스트로겐 수용체 조절제 (SERM), 예를 들면 타목시펜 (놀바덱스(NOLVADEX; 등록상표); 타목시펜 시트레이트 포함), 랄록시펜, 드롤록시펜, 4-히드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤 및 파레스톤(FARESTON; 등록상표) (토레미핀 시트레이트); (ii) 부신에서 에스트로겐 생성을 조절하는 효소인 아로마타제를 억제하는 아로마타제 억제제, 예를 들면 4(5)-이미다졸, 아미노글루테티미드, 메가세(MEGASE; 등록상표) (메게스트롤 아세테이트), 아로마신(AROMASIN; 등록상표) (엑세메스탄; 화이자), 포르메스타니, 파드로졸, 리비솔(RIVISOR; 등록상표) (보로졸), 페마라(FEMARA; 등록상표) (레트로졸; 노바르티스), 및 아리미덱스(ARIMIDEX; 등록상표) (아나스트로졸; 아스트라제네카); (iii) 항-안드로겐; 예컨대 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 뿐만 아니라 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); (iv) 단백질 키나제 억제제, 예컨대 MEK 억제제 (WO 2007/044515); (v) 지질 키나제 억제제; (vi) 안티센스 올리고뉴클레오티드, 특히 비정상적인 세포 증식과 관련된 신호전달 경로에서 유전자의 발현을 억제하는 것, 예를 들면 PKC-알파, Raf 및 H-Ras, 예컨대 오블리메르센 (제나센스(GENASENSE; 등록상표), 젠타 인크.(Genta Inc.)); (vii) 리보자임, 예컨대 VEGF 발현 억제제 (예를 들면, 안지오자임(ANGIOZYME; 등록상표)) 및 HER2 발현 억제제; (viii) 백신, 예컨대 유전자 요법 백신, 예를 들면 알로벡틴(ALLOVECTIN; 등록상표), 류벡틴(LEUVECTIN; 등록상표) 및 백시드(VAXID; 등록상표), 프로류킨(PROLEUKIN; 등록상표) rIL-2; 토포이소머라제 1 억제제, 예컨대 루르토테칸(LURTOTECAN; 등록상표), 아바렐릭스(ABARELIX; 등록상표) rmRH; (ix) 항-혈관신생제, 예컨대 베바시주맙 (아바스틴(AVASTIN; 등록상표), 제넨텍); 및 상기한 것 중 임의의 제약상 허용되는 염, 산 및 유도체가 포함된다.
또한, "화학요법제"의 정의에는 치료용 항체, 예컨대 알렘투주맙 (캄패스(Campath)), 베바시주맙 (아바스틴(등록상표), 제넨텍); 세툭시맙 (에르비툭스(ERBITUX; 등록상표), 임클론(Imclone)); 파니투무맙 (벡티빅스(VECTIBIX; 등록상표), 암젠(Amgen)), 리툭시맙 (리툭산(RITUXAN; 등록상표), 제넨텍/바이오겐 이덱(Biogen Idec)), 페르투주맙 (옴니타르그(OMNITARG; 상표명), 2C4, 제넨텍), 트라스트주맙 (헤르셉틴(HERCEPTIN; 등록상표), 제넨텍), 토시투모맙 (벡살(Bexxar), 코리시아(Corixia)), 및 항체 약물 접합자, 겜투주맙 오조가미신 (밀로타르그(MYLOTARG; 등록상표), 와이어스)이 포함된다.
본 발명의 PI3K 억제제와 조합되어 화학요법제로서 치료상 잠재력을 갖는 인간화된 단클론성 항체에는 알렘투주맙, 아폴리주맙, 아셀리주맙, 아틀리주맙, 바피뉴주맙, 베바시주맙, 비바투주맙 메르탄신, 칸투주맙 메르탄신, 세델리주맙, 세르톨리주맙 페골, 시드푸시투주맙, 시드투주맙, 다클리주맙, 에쿨리주맙, 에팔리주맙, 에프라투주맙, 에를리주맙, 펠비주맙, 폰톨리주맙, 겜투주맙 오조가미신, 이노투주맙 오조가미신, 이필리무맙, 라베투주맙, 린투주맙, 마투주맙, 메폴리주맙, 모타비주맙, 모토비주맙, 나탈리주맙, 니모투주맙, 놀로비주맙, 누마비주맙, 오크렐리주맙, 오말리주맙, 팔리비주맙, 파스콜리주맙, 펙푸시투주맙, 펙투주맙, 페르투주맙, 펙셀리주맙, 랄리비주맙, 라니비주맙, 레슬리비주맙, 레슬리주맙, 레시비주맙, 로벨리주맙, 루플리주맙, 시브로투주맙, 시플리주맙, 손투주맙, 타카투주맙 테트락세탄, 타도시주맙, 탈리주맙, 테피바주맙, 토실리주맙, 토랄리주맙, 트라스투주맙, 투코투주맙 셀모류킨, 투쿠시투주맙, 우마비주맙, 우르톡사주맙, 및 비실리주맙이 포함된다.
"대사산물"은 특정 화합물 또는 그의 염의 체내 대사를 통해 생성된 생성물이다. 화합물의 대사산물은 당업계에 공지된 통상적인 기술을 이용하여 확인할 수 있으며, 이들의 활성은 본원에 기재된 것과 같은 시험을 이용하여 결정할 수 있다. 이러한 생성물은 투여된 화합물의, 예를 들면 산화, 환원, 가수분해, 아미드화, 탈아미드화, 에스테르화, 탈에스테르화, 효소 절단 등으로부터 생성될 수 있다. 따라서, 본 발명은 본 발명의 화합물을 포유동물과 그의 대사 산물이 생성되기에 충분한 시간 동안 접촉시키는 것을 포함하는 과정에 의해 생성된 화합물을 비롯한 본 발명의 화합물의 대사산물을 포함한다.
용어 "포장 삽입물"은 치료학적 생성물의 사용과 관련된 지시 사항, 용법, 투여량, 투여법, 금기사항 및/또는 경고문에 대한 정보를 함유하는, 치료학적 생성물의 시판용 포장에 통상적으로 포함되는 지침을 나타내는데 사용된다.
용어 "키랄"은 거울상 상대의 중첩될 수 없는 특성을 갖는 분자를 나타내고, 용어 "아키랄"은 이들의 거울상 상대에 중첩될 수 있는 분자를 나타낸다.
용어 "입체이성질체"는 동일한 화학적 구성을 갖지만, 원자 또는 기의 공간적인 배열이 상이한 화합물을 나타낸다.
"부분입체이성질체"는 둘 이상의 키랄 중심이 있는 입체이성질체를 나타내며, 이들의 분자는 서로 거울상이 아니다. 부분입체이성질체는 상이한 물리적 성질, 예를 들면 융점, 비점, 분광 특성 및 반응성을 갖는다. 부분입체이성질체의 혼합물은 고분할 분석 절차, 예컨대 전기영동 및 크로마토그래피로 분리할 수 있다.
"거울상이성질체"는 서로 중첩될 수 없는 거울상인, 화합물의 2개의 입체이성질체를 나타낸다.
본원에 사용된 입체화학적 정의 및 관례는 일반적으로 문헌 [S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York]; 및 [Eliel, E. and Wilen, S., "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., New York, 1994]에 따른다. 본 발명의 화합물은 비대칭 또는 키랄 중심을 함유할 수 있으며, 이에 따라 상이한 입체이성질체 형태로 존재할 수 있다. 본 발명의 화합물의 모든 입체이성질체 형태, 예컨대 이들로 한정되지는 않지만, 부분입체이성질체, 거울상이성질체 및 회전장애이성질체, 뿐만 아니라 이들의 혼합물, 예컨대 라세미체 혼합물이 본 발명의 일부를 형성하는 것으로 의도된다. 다수의 유기 화합물은 광학적으로 활성인 형태로 존재하는데, 즉 이들은 평면-편광의 평면을 회전할 수 있는 능력을 갖는다. 광학적으로 활성인 화합물을 설명하는데 있어, 접두어 D 및 L, 또는 R 및 S는 그의 키랄 중심(들) 주변의 분자의 절대적 배열을 나타내는데 사용된다. 접두어 d 및 l 또는 (+) 및 (-)는 화합물에 의한 평면-편광의 회전의 신호를 나타내기 위해 사용되며, 이 때 (-) 또는 l은 화합물이 왼쪽으로 회전함을 의미한다. 접두어 (+) 또는 d가 있는 화합물은 오른쪽으로 회전한다. 주어진 화학적 구조에서 이들 입체이성질체는 이들이 서로 거울상인 것을 제외하고는 동일하다. 특정 입체이성질체는 또한 거울상이성질체로 나타낼 수 있으며, 이러한 이성질체의 혼합물은 거울상이성질체 혼합물로 지칭되기도 한다. 거울상이성질체의 50:50 혼합물은 라세미체 혼합물 또는 라세메이트로 나타내며, 이는 화학 반응 또는 과정에서 입체선택성 또는 입체특이성이 없는 경우에 나타날 수 있다. 용어 "라세미체 혼합물" 및 "라세메이트"는 광학적 활성이 결여된, 2개의 거울상이성질체 종의 등몰량의 혼합물을 나타낸다.
용어 "호변이성질체" 또는 "호변이성질체 형태"는 낮은 에너지 장벽을 통해 상호전환될 수 있는, 상이한 에너지를 갖는 구조적 이성질체를 나타낸다. 예를 들면, 양성자 호변이성질체 (또한, 양성자성 호변이성질체로도 알려져 있음)는 양성자의 이동을 통한 상호전환, 예컨대 케토-에놀 및 이민-엔아민 이성질체화를 포함한다. 원자가 호변이성질체는 결합 전자들 중 일부의 재편성에 의한 상호전환을 포함한다.
본원에 사용된 어구 "제약상 허용되는 염"은 본 발명의 화합물의 제약상 허용되는 유기 또는 무기 염을 나타낸다. 예시적인 염에는 술페이트, 시트레이트, 아세테이트, 옥살레이트, 클로라이드, 브로마이드, 요오다이드, 니트레이트, 바이술페이트, 포스페이트, 산 포스페이트, 이소니코티네이트, 락테이트, 살리실레이트, 산 시트레이트, 타르트레이트, 올레에이트, 탄네이트, 판토테네이트, 바이타르트레이트, 아스코르베이트, 숙시네이트, 말레에이트, 겐티시네이트, 푸마레이트, 글루코네이트, 글루쿠로네이트, 사카레이트, 포르메이트, 벤조에이트, 글루타메이트, 메탄술포네이트 "메실레이트", 에탄술포네이트, 벤젠술포네이트, p-톨루엔술포네이트, 및 파모에이트 (즉, 1,1'-메틸렌-비스(2-히드록시-3-나프토에이트)) 염이 포함되지만, 이들로 한정되지 않는다. 제약상 허용되는 염은 다른 분자, 예컨대 아세테이트 이온, 숙시네이트 이온 또는 다른 반대 이온의 봉입체를 포함할 수 있다. 반대 이온은 모 화합물의 전하를 안정화시키는 임의의 유기 또는 무기 모이어티일 수 있다. 또한, 제약상 허용되는 염은 그의 구조식 내에 하나 초과의 하전된 원자를 가질 수 있다. 다중 하전된 원자가 제약상 허용되는 염의 일부인 경우는 다중의 반대 이온을 가질 수 있다. 따라서, 제약상 허용되는 염은 하나 이상의 하전된 원자 및/또는 하나 이상의 반대 이온을 가질 수 있다.
본 발명의 화합물이 염기인 경우, 바람직한 제약상 허용되는 염은 당업계에서 이용가능한 임의의 적합한 방법, 예를 들면 유리 염기를 무기산, 예컨대 염산, 브롬화수소산, 황산, 질산, 메탄술폰산, 인산 등, 또는 유기산, 예컨대 아세트산, 트리플루오로아세트산, 말레산, 숙신산, 만델산, 푸마르산, 말론산, 피루브산, 옥살산, 글리콜산, 살리실산, 피라노시딜산, 예컨대 글루쿠론산 또는 갈락투론산, 알파 히드록시산, 예컨대 시트르산 또는 타르타르산, 아미노산, 예컨대 아스파르트산 또는 글루탐산, 방향족 산, 예컨대 벤조산 또는 신남산, 술폰산, 예컨대 p-톨루엔술폰산 또는 에탄술폰산 등으로 처리하는 방법에 의해 제조할 수 있다.
본 발명의 화합물이 산인 경우, 바람직한 제약상 허용되는 염은 임의의 적합한 방법, 예를 들면 유리 산을 무기 또는 유기 염기, 예컨대 아민 (1급, 2급 또는 3급), 알칼리 금속 수산화물 또는 알칼리 토금속 수산화물 등으로 처리하는 방법에 의해 제조할 수 있다. 적합한 염의 설명적 예에는 아미노산, 예컨대 글리신 및 아르기닌, 암모니아, 1급, 2급 및 3급 아민, 및 시클릭 아민, 예컨대 피페리딘, 모르폴린 및 피페라진으로부터 유래된 유기 염, 및 나트륨, 칼슘, 칼륨, 마그네슘, 망간, 철, 구리, 아연, 알루미늄 및 리튬으로부터 유래된 무기 염이 포함되지만, 이들로 한정되지 않는다.
어구 "제약상 허용되는"은 물질 또는 조성물이 제제를 포함하는 다른 요소 및/또는 치료될 포유동물과 화학적 및/또는 독성학적으로 상용성이어야 함을 나타낸다.
"용매화물"은 하나 이상의 용매 분자 및 본 발명의 화합물의 연계물 또는 복합체를 나타낸다. 용매화물을 형성하는 용매의 예에는 물, 이소프로판올, 에탄올, 메탄올, DMSO, 에틸 아세테이트, 아세트산 및 에탄올아민이 포함되지만, 이들로 한정되지 않는다. 용어 "수화물"은 용매 분자가 물인 복합체를 나타낸다.
용어 "보호기"는 화합물 상의 다른 관능기가 반응하는 동안 특정 관능기를 차단 또는 보호하는데 통상적으로 사용되는 치환기를 나타낸다. 예를 들면, "아미노-보호기"는 화합물에서 아미노 관능기를 차단 또는 보호하는 아미노기에 부착된 치환기이다. 적합한 아미노-보호기에는 아세틸, 트리플루오로아세틸, t-부톡시카르보닐 (BOC), 벤질옥시카르보닐 (CBZ) 및 9-플루오레닐메틸렌옥시카르보닐 (Fmoc)이 포함된다. 이와 유사하게, "히드록시-보호기"는 히드록시 관능기를 차단 또는 보호하는 히드록시기의 치환기를 나타낸다. 적합한 보호기에는 아세틸 및 실릴이 포함된다. "카르복시-보호기"는 카르복시 관능기를 차단 또는 보호하는 카르복시기의 치환기를 나타낸다. 통상적인 카르복시-보호기에는 페닐술포닐에틸, 시아노에틸, 2-(트리메틸실릴)에틸, 2-(트리메틸실릴)에톡시메틸, 2-(p-톨루엔술포닐)에틸, 2-(p-니트로페닐술페닐)에틸, 2-(디페닐포스피노)-에틸, 니트로에틸 등이 포함된다. 보호기 및 이들의 용도에 대한 일반적 설명은 문헌 [T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991]을 참조한다.
용어 "본 발명의 화합물" 및 "본 발명의 화합물들" 및 "화학식 I의 화합물"은 화학식 I의 화합물 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 및 제약상 허용되는 염 및 전구약물을 포함한다.
퓨린 화합물
본 발명은 PI3 키나제에 의해 조절되는 질환, 증상 및/또는 장애의 치료에 잠재적으로 유용한 퓨린 화합물, 및 그의 제약 제제를 제공한다. 보다 구체적으로, 본 발명은 하기 화학식 I의 화합물, 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 제공하며,
<화학식 I>
상기 식에서,
R1은 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C6-C20 아릴, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 (C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R2는 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 -(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R3은 C6-C20 아릴, 탄소-연결된 C2-C20 헤테로시클릴 및 탄소-연결된 C1-C20 헤테로아릴로부터 선택되고, 이들은 각각 F, Cl, Br, I, -CH3, -CN, -CF3, -CH2OH, -CO2H, -CONH2, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -OH, -OCH3, -SH, -NHC(=O)NHCH3, -NHC(=O)NHCH2CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R4는 -NR10R13, -NR12C(=O)R10, -NR10(C1-C12 알킬)NR10R13, -NR10(C1-C12 알킬렌)OR10, -NR10(C1-C12 알킬렌)C(=O)NR10R13, -NR10(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -NR10(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -NR10(C1-C12 알킬렌)-(C6-C20 아릴), 및 -NR10(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R10, R11 및 R12는 독립적으로 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -CH2OCH3, -CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R11은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
R13은 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -OCH2CH2-N(CH3)2, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R13은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
단 R1이 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)인 경우에는, R3은 비치환되거나 치환된 인돌이 아니다.
R1의 예시적 실시양태에는 H, C1-C12 알킬, 예컨대 CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2CH2CH3, 및 -CH2CH(CH3)2, 하나 이상의 -OH 또는 F로 치환된 C1-C12 알킬, 예컨대 -C(CH3)2OH, -CH2CH2OH, -CH2CH2CH2OH, 및 -CH2CH2CO2H, 및 2-모르폴리노에틸이 포함된다.
R1의 예시적 실시양태에는 또한 임의로 치환된 페닐이 포함된다.
R1의 예시적 실시양태에는 또한 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), 예컨대 -CH2-(피페라진-1-일)이 포함되며, 여기서 피페라진-1-일은 예컨대 -CH2-(4-(메틸술포닐)피페라진-1-일)과 같이 임의로 치환된다.
R2의 예시적 실시양태에는 C1-C12 알킬, 예컨대 CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2CH2CH3, 및 -CH2CH(CH3)2, 하나 이상의 -OH 또는 F로 치환된 C1-C12 알킬, 예컨대 -C(CH3)2OH, -CH2CH2OH, -CH2CH2CH2OH, 및 -CH2CH2CO2H, 및 2-모르폴리노에틸이 포함된다.
R2의 예시적 실시양태에는 또한 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), 예컨대 -CH2-(피페라진-1-일)이 포함되며, 여기서 피페라진-1-일은 예컨대 -CH2-(4-(메틸술포닐)피페라진-1-일)과 같이 임의로 치환된다.
예시적 실시양태에는 R3이 임의로 치환된 C6-C20 아릴인 것이 포함된다. C6-C20 아릴기에는 페닐, 나프탈렌, 안트라센, 바이페닐, 인데닐, 인다닐, 1,2-디히드로나프탈렌, 및 1,2,3,4-테트라히드로나프틸, 예컨대 하나 이상의 -OH로 치환된 페닐이 포함된다.
예시적 실시양태에는 R3이 피리딜, 이속사졸릴, 이미다졸릴, 피라졸릴, 피롤릴, 티아졸릴, 피리다지닐, 피리미디닐, 피라지닐, 옥사졸릴, 옥사디아졸릴, 푸라닐, 티에닐, 트리아졸릴, 및 테트라졸릴로부터 선택된 모노시클릭 헤테로아릴인 것이 포함된다.
예시적 실시양태에는 R3이 아래 구조에서 선택된 모노시클릭 헤테로아릴인 것이 포함되고:
여기서 파선은 부착 부위를 나타낸다.
예시적 실시양태에는 R3이 아래 구조에서 선택된 모노시클릭 헤테로아릴인 것이 포함되고:
여기서 파선은 부착 부위를 나타낸다.
예시적 실시양태에는 R3이 아래 구조에서 선택된 모노시클릭 헤테로아릴인 것이 포함되고:
여기서 파선은 부착 부위를 나타낸다.
예시적 실시양태에는 R3이 F, -CF3, -NH2, -NHCH3, -OH, -OCH3, -NHC(O)CH3, -NHC(=O)NHCH3, -NHC(=O)NHCH2CH3, -CO2H, -CH2OH, -C(=O)NH2, 및 -CH3으로부터 선택된 하나 이상의 기로 치환된 C1-C20 헤테로아릴인 것이 포함된다.
예시적 실시양태에는 R3이
로부터 선택된, 탄소-연결된 융합 바이시클릭 C4-C20 헤테로시클릴 또는 C1-C20 헤테로아릴인 것이 포함되며, 여기서 파선은 부착 부위를 나타낸다.
예시적 실시양태에는 R3이
로부터 선택된 것인 것이 포함되고, 여기서 파선은 부착 부위를 나타내며, R14는 F, Cl, Br, I, -CH3, -CN, -CF3, -CH2OH, -CO2H, -CONH2, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -OH, -OCH3, -SH, -NHC(=O)NHCH3, 및 -S(O)2CH3으로부터 선택된다.
예시적 실시양태에는 R3이
로부터 선택된, 탄소-연결된 융합 바이시클릭 C4-C20 헤테로시클릴 또는 C1-C20 헤테로아릴인 것이 포함되며, 여기서 파선은 부착 부위를 나타낸다.
예시적 실시양태에는 R3이 1H-인다졸-4-일 또는 1H-인돌-4-일인 것이 포함된다.
예시적 실시양태에는 R4가 -NR10R13인 것이 포함되고, 여기서 -NR10R13은 C2-C20 헤테로시클릴 고리, 예컨대 모르폴리닐, 4-메틸피페라진-1-일, 4-메틸술포닐피페라진-1-일, 또는 4-(2-피리딜)피페라진-1-일을 형성한다.
예시적 실시양태에는 아래의 구조가 포함되고:
여기서 R3은
로부터 선택된 모노시클릭 헤테로아릴이며, 여기서 파선은 부착 부위를 나타내고, R1은 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C6-C20 아릴, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 -(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되며, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환된다.
본 발명의 화학식 I의 화합물은 비대칭 또는 키랄 중심을 함유할 수 있으며, 이에 따라 상이한 입체이성질체 형태로 존재할 수 있다. 본 발명의 화합물의 모든 입체이성질체 형태, 예컨대 이들로 한정되지는 않지만, 부분입체이성질체, 거울상이성질체 및 회전장애이성질체, 뿐만 아니라 이들의 혼합물, 예컨대 라세미체 혼합물이 본 발명의 일부를 형성하는 것으로 의도된다.
또한, 본 발명은 모든 기하 및 위치 이성질체를 포함한다. 예를 들어, 화학식 I의 화합물이 이중 결합 또는 융합된 고리를 포함하는 경우, 시스- 및 트랜스-형태 뿐만 아니라 이들의 혼합물은 본 발명의 범위 내에 포함된다. 또한, 단일 위치 이성질체 및 위치 이성질체의 혼합물 모두 본 발명의 범위 내에 포함된다.
본원에 도시된 구조에서, 임의의 특정 키랄 원자의 입체화학이 명시되지 않은 경우에는, 모든 입체이성질체가 고려되며, 본 발명의 화합물로서 포함된다. 입체화학이 특정 형태를 나타내는 굵은선 또는 점선으로 명시되는 경우, 그 입체이성질체가 특정되고 규정된다.
본 발명의 화합물은 비용매화된 형태 뿐만 아니라, 제약상 허용되는 용매, 예컨대 물, 에탄올 등과의 용매화된 형태로 존재할 수 있으며, 본 발명이 용매화된 형태 및 비용매화된 형태 둘 다 포함하는 것으로 의도된다.
본 발명의 화합물은 또한 상이한 호변이성질체 형태로 존재할 수 있으며, 이러한 모든 형태는 본 발명의 범위 내에 포함된다. 용어 "호변이성질체" 또는 "호변이성질체 형태"는 낮은 에너지 장벽을 통해 상호전환될 수 있는, 상이한 에너지를 갖는 구조적 이성질체를 나타낸다. 예를 들면, 양성자 호변이성질체 (또한, 양성자성 호변이성질체로도 알려져 있음)는 양성자의 이동을 통한 상호전환, 예컨대 케토-에놀 및 이민-엔아민 이성질체화를 포함한다. 원자가 호변이성질체는 결합 전자들 중 일부의 재편성에 의한 상호전환을 포함한다.
본 발명은 또한 본원에 나타낸 것과 동일하지만, 하나 이상의 원자가 보통 천연에서 발견되는 원자 질량 또는 질량수와 상이한 원자 질량 또는 질량수를 갖는 원자로 대체된, 동위원소-표지된 본 발명의 화합물을 포함한다. 명시된 임의의 특정 원자 또는 원소의 모든 동위원소는 본 발명의 화합물 및 그의 용도의 범위 내로 고려된다. 본 발명의 화합물에 도입될 수 있는 예시적인 동위원소에는 수소, 탄소, 질소, 산소, 인, 황, 불소, 염소 및 요오드의 동위원소, 예컨대 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I 및 125I가 포함된다. 동위원소-표지된 본 발명의 특정한 화합물 (예를 들면, 3H 및 14C로 표지된 것)은 화합물 및/또는 기질 조직 분포 검정에 유용하다. 삼중수소 (3H) 및 탄소-14 (14C) 동위원소는 제조 및 검출 용이성의 측면에서 유용하다. 또한, 보다 무거운 동위원소, 예컨대 중수소 (즉, 2H)로의 치환은 보다 높은 대사 안정성으로 인해 특정한 치료학적 이점 (예를 들면, 증가된 생체내 반감기, 또는 감소된 필요 투여량)을 제공할 수 있으며, 따라서 일부 상황에 바람직할 수 있다. 양전자 방출 동위원소, 예컨대 15O, 13N, 11C 및 18F는 기질 수용체 점유성을 조사하는 양전자 방출 단층촬영 (PET) 연구에 유용하다. 동위원소 표지된 본 발명의 화합물은 일반적으로 비-동위원소 표지된 시약을 동위원소 표지된 시약으로 치환시킴으로써 본원의 하기 반응식 및/또는 실시예에 개시된 것과 유사한 절차에 따라 제조될 수 있다.
퓨린 화학식 I 화합물의 제조
화학식 I의 퓨린 화합물은 화학 분야에 널리 공지된 것과 유사한 과정을 포함하는 합성 경로에 의해, 특히 본원에 포함된 기재에 비추어 합성될 수 있다. 일반적으로, 출발 물질은 알드리치 케미컬즈(Aldrich Chemicals, 미국 위스콘신주 밀워키 소재)와 같은 시판 공급원으로부터 입수 가능하거나, 당업자에게 널리 공지된 방법을 이용하여 용이하게 제조된다 (예를 들면, 일반적으로 문헌 [Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-23, Wiley, N.Y. (1967-2006 ed.)], 또는 [Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, 부록 포함] (또한, 바일스타인(Beilstein) 온라인 데이타베이스를 통해 입수 가능함)에 기재된 방법에 의해 제조됨).
특정 실시양태에서, 화학식 I의 화합물은 퓨린 (문헌 [Hammarstrom et al. (2007) Tetrahedron Lett. 48(16):2823-2827]; [Cerna et al. (2006) Organic Letters 8(23):5389-5392]; [Chang et al. (2006) J. Med. Chem. 49(10):2861-2867]; [Yang et al. (2005) J. Comb. Chem. 7:474-482]; [Liu et al. (2005) J. Comb. Chem. 7:627-636]; [Hocek et al. (2004) Synthesis 17:2869-2876]; [Hammarstrom et al. (2003) Tetrahedron Lett. 44:8361-8363]; [Hammarstrom et al. (2002) Tetrahedron Lett. 43:8071-8073]; [Booth et al. (1987) J. Chem. Soc, Perkin Trans. 1: Organic and Bio-Organic Chem. 7:1521-1526]; [Booth et al. (1981) J. Chem. Soc., Chemical Communications 15:788-789]; [Yoneda et al. (1976) J. Chem. Soc., Perkin Trans. 1: Organic and Bio-Organic Chem. 14:1547-1550]; [Taylor et al. (1971) J. Org. Chem. 36(21):3211-3217]; [Lister, J. H.; Fenn, M. D. The Purines, Supplementary 1, John Wiley & Sons, 1996, Volume 54]; [The Chemisty of Heterocyclic Compounds, Editors Weissberger, A.; Taylor E. C., Wiley Interscience, 1971, Volume 24]; [Legraverend, M.; Grierson, D. S. (2006) Bioorg. Med. Chem. 14:3987-4006]; [Hocek, M. (2003) Eur. J. Org. Chem. 245-254]; US 7122665; US 6743919; US 5332744; US 4728644; US 3016378; US 2008/0058297; US 2003/0139427; WO 2008/043031); 및 다른 헤테로사이클 (문헌 [Comprehensive Heterocyclic Chemistry II, Editors Katritzky and Rees, Elsevier, 1997, e.g. Volume 3]; [Liebigs Annalen der Chemie, (9):1910-16, (1985)]; [Helvetica Chimica Acta, 41:1052-60, (1958)]; [Arzneimittel-Forschung, 40(12):1328-31, (1990)]에 기재되어 있음) (이들은 각각 분명하게 참고로 포함됨)의 제조를 위해 널리 공지된 절차를 이용하여 용이하게 제조될 수 있다. 퓨린 화합물과 필요한 시약 및 중간체를 합성하는데 유용한 합성 화학 변환법 및 보호기 방법론 (보호 및 탈보호)은 당업계에 알려져 있고, 예를 들어 문헌 [R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989)]; [T. W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999)]; 및 [L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995)] 및 이들의 후속 개정판에 기재되어 있는 것들이 포함된다.
화학식 I의 화합물은 개별적으로, 또는 2종 이상, 예를 들면 5 내지 1,000종의 화합물, 또는 10 내지 100종의 화합물을 포함하는 화합물 라이브러리로서 제조될 수 있다. 화학식 I의 화합물의 라이브러리는 '분할 및 혼합' 조합 접근법에 의해, 또는 용액상 또는 고체상 화학을 이용하는 다중 평행 합성에 의해, 당업자에게 공지된 절차에 따라 제조될 수 있다. 따라서, 본 발명의 또다른 측면에 따르면, 2종 이상의 화합물 또는 그의 제약상 허용되는 염을 포함하는 화합물 라이브러리가 제공된다.
퓨린 화합물은 출발 물질로서 2,4,8-트리클로로퓨린을 이용하여 제조할 수 있다. 3개의 클로로 기는 다양한 치환기로 대체될 수 있다. 보다 구체적으로, 가장 반응성인 클로로 기 (즉, 위치 4의 클로로)는 모르폴리노기로 치환되어 모르폴리노퓨린을 형성한다.
예시의 목적으로, 도 1 및 2는 화학식 I의 퓨린 화합물 뿐만 아니라 핵심 중간체를 제조하는 일반적인 방법을 보여준다. 개별 반응 단계에 대한 보다 상세한 기재는 일반적 절차 및 실시예 단락을 참고한다. 당업자는 본 발명의 화합물을 합성하기 위해 다른 합성 경로를 사용할 수 있음을 잘 알 것이다. 특정 출발 물질 및 시약이 도면, 일반적 절차 및 실시예에서 도시되고 논의되지만, 다양한 유도체 및/또는 반응 조건을 제공하기 위해 다른 출발 물질 및 시약으로 용이하게 치환시킬 수 있다. 또한, 기재된 방법에 의해 제조된 여러 예시 화합물은 당업자에게 널리 공지된 통상적인 화학을 이용하여 본 개시내용에 비추어 추가로 변형될 수 있다.
화학식 I의 화합물의 제조에 있어서, 중간체의 원격 관능기 (예를 들면, 1급 또는 2급 아민)는 보호할 필요가 있을 수 있다. 원격 관능기의 성질 및 제조 방법의 조건에 따라 이러한 보호의 필요성은 달라질 수 있다. 적합한 아미노-보호기에는 아세틸, 트리플루오로아세틸, t-부톡시카르보닐 (BOC), 벤질옥시카르보닐 (CBz) 및 9-플루오레닐메틸렌옥시카르보닐 (Fmoc)이 포함된다. 이러한 보호의 필요성은 당업자에 의해 용이하게 판단될 수 있다. 보호기 및 그들의 용도에 대한 일반적인 기재에 대해서는 문헌 [T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991]을 참조한다.
도 1은 테트라히드로피라닐기 (THP)로서 2,6-디클로로-9H-퓨린의 N-9 질소를 보호하는 것으로 시작하는 다관능화된 퓨린의 일반적인 제조 방법을 보여준다. 보다 반응성인 클로로기를 모르폴린으로 대체하면 4-(2-클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린이 된다. C-8 양성자는 강염기로 제거하고, 다양한 친전자체 (R1)와 반응시킨다. 약산으로 탈보호한 후, 다양한 친전자체 (R2)로 N-9를 알킬화한다. 다양한 보로네이트 시약과 팔라듐 촉매를 이용하여 일반적 절차 A로 C-2 클로로에서 스즈끼 커플링하면 R3으로서 C6-C20 아릴, 탄소-연결된 C2-C20 헤테로시클릴 및 탄소-연결된 C1-C20 헤테로아릴이 된다.
도 2는 다관능화된 퓨린의 대안적인 합성 방법을 보여준다. 2,6-디클로로-9H-퓨린을 THP로서 N-9에서 보호하고, 보다 반응성인 클로로를 모르폴린으로 대체하여 4-(2-클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린을 생성한다. 5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리미딘-2-아민과 팔라듐 촉매작용을 이용한 스즈끼 커플링으로 5-(6-모르폴리노-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-2-일)피리미딘-2-아민을 생성한다. 비스-Boc 아미노로서 피리미딘 아민기를 보호하고, 약산 가수분해 하에 THP를 제거하는 것은 다양한 친전자체 (R2)에 의한 N-9의 알킬화를 가능하게 한다. TFA 처리로 Boc 기를 제거한다.
분리 방법
본 발명의 화합물의 제조 방법에서, 반응 생성물을 서로에게서 및/또는 출발 물질로부터 분리하는 것이 유리할 수 있다. 각 단계 또는 일련의 단계의 목적 생성물을 당업계에 일반적인 기술에 의해 목적하는 균질화 정도로 분리 및/또는 정제한다. 전형적으로, 이러한 분리에는 다상 추출, 용매 또는 용매 혼합물로부터의 결정화, 증류, 승화, 또는 크로마토그래피가 포함된다. 크로마토그래피에는 임의의 수많은 방법, 예를 들면 역상 및 정상; 크기 배제; 이온 교환; 고압, 중압 및 저압 액체 크로마토그래피 방법 및 장치; 소규모 분석; 모의 이동층 (SMB) 및 정제용 박층 또는 후층 크로마토그래피, 뿐만 아니라 소규모 박층 및 플래쉬 크로마토그래피 기술이 포함될 수 있다.
또다른 부류의 분리 방법에는 목적 생성물, 반응하지 않은 출발 물질, 반응 부산물 등에 결합하거나 이들을 달리 분리시키도록 선택되는 시약으로 혼합물을 처리하는 것이 포함된다. 이러한 시약으로는 흡착제 또는 흡수제, 예컨대 활성탄, 분자체, 이온 교환 매질 등이 포함된다. 별법으로, 염기성 물질의 경우에는 상기 시약이 산일 수 있고, 산성 물질의 경우에는 염기일 수 있으며, 결합 시약, 예컨대 항체, 결합 단백질, 선택적인 킬레이터, 예컨대 크라운 에테르, 액체/액체 이온 추출 시약 (LIX) 등일 수 있다. 적절한 분리 방법의 선택은 관련된 물질의 성질, 예컨대 증류 및 승화시의 비점 및 분자량, 크로마토그래피에서 극성 관능기의 존재 또는 부재, 다상 추출의 경우 산성 및 염기성 매질에서 물질의 안정성 등에 따라 달라진다.
부분입체이성질체 혼합물은 당업자에게 널리 공지된 방법, 예컨대 크로마토그래피 및/또는 분별 결정화에 의해, 그들의 물리적 화학적 차이에 기초하여 개별 부분입체이성질체로 분리할 수 있다. 거울상이성질체는 적절한 광학 활성 화합물 (예를 들면, 키랄 보조제, 예컨대 키랄 알코올 또는 모셔(Mosher)의 산 클로라이드)을 이용한 반응에 의해 거울상이성질체 혼합물을 부분입체이성질체 혼합물로 전환시키고, 부분입체이성질체를 분리하고, 개별 부분입체이성질체를 상응하는 순수한 거울상이성질체로 전환 (예를 들면, 가수 분해)시킴으로써 분리할 수 있다. 또한, 본 발명의 일부 화합물은 회전장애이성질체 (예를 들면, 치환된 바이아릴)일 수 있으며, 이는 본 발명의 일부로 고려된다. 거울상이성질체는 또한 키랄 HPLC 컬럼을 사용하여 분리될 수 있다.
그의 입체이성질체를 실질적으로 함유하지 않은 단일 입체이성질체, 예를 들면 거울상이성질체는 광학 활성 분할제를 이용하여 부분입체이성질체를 형성하는 것과 같은 방법을 이용하여 라세미체 혼합물을 분할시킴으로써 수득할 수 있다 (문헌 [Eliel, E. and Wilen, S. "Stereochemistry of Organic Compounds," John Wiley & Sons, Inc., New York, 1994]; [Lochmuller, C. H., (1975) J. Chromatogr., 113(3):283-302]). 본 발명의 키랄 화합물의 라세미체 혼합물은 (1) 키랄 화합물을 이용하여 이온성 부분입체이성질체 염을 형성하고, 분별 결정화 또는 다른 방법으로 분리하는 방법, (2) 키랄 유도체화 시약을 이용하여 부분입체이성질체 화합물을 형성하고, 상기 부분입체이성질체를 분리하고, 이를 순수한 입체이성질체로 전환시키는 방법, 및 (3) 실질적으로 순수한 또는 강화된 입체이성질체를 키랄 조건하에 직접 분리하는 방법을 비롯하여, 임의의 적합한 방법에 의해 분리 및 단리될 수 있다. 문헌 ["Drug Stereochemistry, Analytical Methods and Pharmacology," Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993)]을 참조한다.
방법 (1)의 경우, 부분입체이성질체 염은 거울상이성질체적으로 순수한 키랄 염기, 예컨대 브루신, 퀴닌, 에페드린, 스트리키닌, α-메틸-β-페닐에틸아민 (암페타민) 등을 산성 관능기를 보유하는 비대칭 화합물, 예컨대 카르복실산 및 술폰산과 반응시킴으로써 형성될 수 있다. 부분입체이성질체 염은 분별 결정화 또는 이온성 크로마토그래피에 의해 분리되도록 유도될 수 있다. 아미노 화합물의 광학 이성질체의 분리를 위해, 키랄 카르복실산 또는 술폰산, 예컨대 캄포술폰산, 타르타르산, 만델산, 또는 락트산을 첨가하여, 부분입체이성질체 염을 형성할 수 있다.
별법으로, 방법 (2)의 경우, 분할시키고자 하는 기질을 키랄 화합물의 한 거울상이성질체와 반응시켜, 부분입체이성질체 쌍을 형성한다 (문헌 [E. and Wilen, S. "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., 1994, p. 322]). 부분입체이성질체 화합물은 비대칭 화합물을 거울상이성질체적으로 순수한 키랄 유도체화 시약, 예컨대 멘틸 유도체와 반응시킨 후, 부분입체이성질체를 분리하고, 가수분해하여, 순수한 또는 강화된 거울상이성질체를 수득함으로써 형성할 수 있다. 광학 순도를 측정하는 방법은 염기의 존재하에 라세미체 혼합물의 키랄 에스테르, 예컨대 멘틸 에스테르, 예를 들면 (-) 멘틸 클로로포르메이트, 또는 모셔 에스테르, α-메톡시-α-(트리플루오로메틸)페닐 아세테이트 (문헌 [Jacob III. J. Org. Chem. (1982) 47:4165])를 제조하고, 두가지 회전장애이성질체의 거울상이성질체 또는 부분입체이성질체의 존재에 대해 1H NMR 스펙트럼을 분석하는 것을 포함한다. 회전장애이성질체 화합물의 안정한 부분입체이성질체는 회전장애이성질체 나프틸-이소퀴놀린의 분리 방법에 따라 정상 및 역상 크로마토그래피에 의해 분리 및 단리될 수 있다 (WO 96/15111). 방법 (3)의 경우, 두가지 거울상이성질체의 라세미체 혼합물은 키랄 정지상을 이용하는 크로마토그래피에 의해 분리될 수 있다 (문헌 ["Chiral Liquid Chromatography" (1989) W. J. Lough, Ed., Chapman and Hall, New York]; [Okamoto, J. Chromatogr., (1990) 513:375-378]). 강화된 또는 정제된 거울상이성질체는 비대칭 탄소 원자를 가진 다른 키랄 분자를 구별하는데 사용되는 방법, 예컨대 광학 회전 및 원편광 이색성에 의해 구별될 수 있다.
생물학적 평가
화학식 I의 화합물의 PI3 키나제 활성은 다수의 직접 및 간접 검출 방법에 의해 측정될 수 있다. 본원에 기재된 예시적인 특정 화합물을 그들의 PI3K 결합 활성 (실시예 52) 및 종양 세포에 대한 시험관내 활성 (실시예 53)에 대해 검정하였다. PI3K 결합 활성의 범위는 1 nM (나노몰) 내지 약 10 μM (마이크로몰) 미만이었다. 예시적인 본 발명의 특정 화합물은 PI3K 결합 활성 IC50 값이 약 10 nM 미만이었다. 본 발명의 특정 화합물은 종양 세포-기재 활성 IC50 값이 약 100 nM 미만이었다.
예시적인 화학식 I의 화합물의 세포독성 또는 세포증식 억제 활성은 세포 배양 배지에서 증식하는 포유동물 종양 세포주를 확립하고, 화학식 I의 화합물을 첨가하고, 약 6 시간 내지 약 5 일 동안 세포를 배양하고, 세포 생존율을 측정함으로써 측정하였다 (실시예 53). 세포-기재 시험관내 검정을 이용하여, 생존율, 즉 증식 (IC50), 세포독성 (EC50), 및 아팝토시스 유도 (카스파제 활성화)를 측정하였다.
예시적인 화학식 I의 화합물의 시험관내 효능은 세포 증식 검정인 셀타이터-글로(CellTiter-Glo; 등록상표) 발광 세포 생존율 검정 (프로메가 코퍼레이션(Promega Corp.; 미국 위스콘신주 메디슨 소재)으로부터 상업적으로 입수)에 의해 측정하였다 (실시예 53). 이 균일 검정 방법은 딱정벌레목 (Coleoptera) 루시페라제의 재조합 발현을 기초로 하며 (US 5583024; US 5674713; US 5700670), 대사적으로 활성인 세포의 지표인 ATP 존재의 정량화에 기초하여 배양물 중 생존 세포의 개수를 측정한다 (문헌 [Crouch et al. (1993) J. Immunol. Meth. 160:81-88]; US 6602677). 셀타이터-글로(등록상표) 검정은 96 또는 384 웰 포맷에서 수행하였으며, 이는 자동화 고-처리율 스크리닝 (HTS)에 적용될 수 있다 (문헌 [Cree et al. (1995) AntiCancer Drugs 6:398-404]). 균일 검정 절차는 단일 시약 (셀타이터-글로(등록상표) 시약)을 혈청이 보충된 배지에서 배양된 세포에 직접 첨가하는 것을 포함한다. 세포 세척, 배지 제거, 및 다중 피펫팅 단계는 필요하지 않다. 상기 시스템은 시약을 첨가하고 혼합한 후 10 분 내에 384 웰 포맷에서 15개 세포/웰 정도만을 검출한다.
균일 "첨가-혼합-측정" 포맷은 세포 용해물에서 존재하는 ATP의 양에 비례하여 발광 신호를 발생시킨다. ATP의 양은 배양물에 존재하는 세포의 개수에 직접적으로 비례한다. 셀타이터-글로(등록상표) 검정은 루시페라제 반응에 의해 생성되는 "백열광-유형"의 발광 신호를 발생시키며, 이의 반감기는 일반적으로 사용된 세포 유형 및 배지에 따라 5 시간이 넘는다. 생존 세포는 상대적인 발광 단위 (RLU)에 반영된다. 기질인 딱정벌레 루시페린은 ATP를 AMP로 전환시킴과 동시에 광자를 발생시키는 재조합 개똥벌레 루시페라제에 의해 산화적으로 탈카르복실화된다. 반감기의 연장은 시약 주입기를 사용할 필요성을 없애고, 다중 플레이트의 연속식 또는 배치식 가공에 대한 융통성을 제공한다. 이 세포 증식 검정은 다양한 다중웰 포맷, 예를 들면 96 또는 384 웰 포맷으로 이용될 수 있다. 데이타는 발광측정기 또는 CCD 카메라 영상 장치에 의해 기록될 수 있다. 발광 출력량은 시간에 따라 측정된 상대적인 광 단위 (RLU)로 제시된다.
예시적인 화학식 I의 화합물의 항증식 효과를 여러 종양 세포주, 예컨대 PC3, 디트로이트(Detroit) 562, 및 MDAMB361.1에 대한 셀타이터-글로(등록상표) 검정에 의해 측정하였다 (실시예 53). 시험 화합물에 대한 EC50 값을 확립하였다. 시험관내 세포 효능 활성의 범위는 약 100 nM 내지 약 10 μM이었다.
특정한 ADME 특성을 Caco-2 침투성 (실시예 54), 간세포 클리어런스 (실시예 55), 시토크롬 P450 억제 (실시예 56), 시토크롬 P450 유도 (실시예 57), 혈장 단백질 결합 (실시예 58), 및 hERG 채널 차단 (실시예 59)을 비롯한 검정에 의해 특정한 예시적인 화합물에 대해 측정하였다.
표 1의 예시적인 화학식 I의 화합물 No. 101-156은 본 발명의 방법에 따라 제조하고, 특징짓고, PI3K 활성에 대해 시험하였고, 다음과 같은 구조 및 상응하는 명칭을 갖는다 (켐드로우 울트라(ChemDraw Ultra), 버젼 9.0.1, 캠브릿지소프트 코퍼레이션(Cambridgesoft Corp.), 미국 메사추세츠주 캠브릿지 소재).
화학식 I의 화합물의 투여
본 발명의 화합물을 치료하고자 하는 증상에 적절한 임의의 경로로 투여할 수 있다. 적합한 경로로는 경구, 비경구 (예컨대, 피하, 근육내, 정맥내, 동맥내, 피부내, 수막강내 및 경막외), 경피, 직장, 비강, 국부 (예컨대, 협측 및 설하), 질, 복막내, 폐내 및 비강내가 포함된다. 국소 면역억제제 치료의 경우에는, 화합물을 병변내 투여로 투여할 수 있으며, 예를 들어 이식하기 전에 이식편과 억제제를 관류시키거나 또는 달리 접촉시킬 수 있다. 바람직한 경로가 예를 들면 수용자의 상태에 따라 달라질 수 있음을 잘 알 것이다. 화합물을 경구 투여하는 경우, 이는 제약상 허용되는 담체 또는 부형제와 함께 환제, 캡슐제, 정제 등으로 제제화될 수 있다. 화합물을 비경구 투여하는 경우, 이는 제약상 허용되는 비경구 비히클과 함께 하기 기재된 바와 같은 단위 투여량 주사가능한 형태로 제제화될 수 있다.
인간 환자를 치료하기 위한 투여량은 화학식 I의 화합물 약 10 mg 내지 약 1000 mg 범위일 수 있다. 전형적인 투여량은 화합물 약 100 mg 내지 약 300 mg일 수 있다. 투여량은 약동학적 및 약력학적 특성, 예를 들어 특정 화합물의 흡수, 분포, 대사, 및 분비 특성에 따라 1일 1회 (QID), 1일 2회 (BID), 또는 더욱 자주 투여될 수 있다. 또한, 독성 인자가 투여량 및 투여 섭생법에 영향을 미칠 수 있다. 경구 투여의 경우, 환제, 캡슐제, 또는 정제는 특정 기간 동안 매일 또는 덜 자주 복용될 수 있다. 섭생법은 수많은 치료 주기로 반복될 수 있다.
화학식 I의 화합물을 이용한 치료 방법
본 발명의 화합물은 지질 키나제, 예를 들면 PI3 키나제의 과발현을 특징으로 하는, 이로 한정되지 않는, 과다증식성 질환, 증상 및/또는 장애의 치료에 유용하다. 따라서, 본 발명의 또다른 측면은 지질 키나제, 예컨대 PI3를 억제함으로써 치료 또는 예방될 수 있는 질환 또는 증상의 치료 또는 예방 방법을 포함한다. 일 실시양태에서, 상기 방법은 치료 유효량의 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 그것을 필요로 하는 포유동물에게 투여하는 것을 포함한다. 일 실시양태에서는, 인간 환자를 화학식 I의 화합물 및 제약상 허용되는 담체, 보조제, 또는 비히클을 이용하여 치료하며, 이때 상기 화학식 I의 화합물은 PI3 키나제 활성을 검출가능하게 억제하는 양으로 존재한다.
본 발명의 방법에 따라 치료될 수 있는 암에는 유방암, 난소암, 자궁경부암, 전립선암, 고환암, 비뇨생식관암, 식도암, 후두암, 교모세포종, 신경모세포종, 위암, 피부암, 각화극세포종, 폐암, 표피양 암종, 대세포 암종, 비-소세포 폐암종 (NSCLC), 소세포 암종, 폐 선암종, 골암, 결장암, 선종, 췌장암, 선암종, 갑상선암, 난포 암종, 미분화 암종, 유두상 암종, 정상피종, 흑색종, 육종, 방광 암종, 간 암종 및 담관암, 신장 암종, 골수성 장애, 림프성 장애, 모발 세포암, 구강 및 인두암 (경구), 구순암, 설암, 구강암, 인두암, 소장암, 결장-직장암, 대장암, 직장암, 뇌암 및 중추신경계암, 호지킨 (Hodgkin's)병 및 백혈병이 포함되지만, 이들로 한정되지 않는다.
본 발명의 또다른 측면은 본원에 기재된 질환 또는 증상으로 고통받는 포유동물, 예를 들어 인간에서 상기 질환 또는 증상의 치료를 위해 사용되는 본 발명의 화합물을 제공한다. 또한, 본원에 기재된 장애로 고통받는 온혈동물, 예컨대 포유동물, 예를 들면 인간에서 그러한 질환 및 증상의 치료를 위한 약제의 제조에 있어서 본 발명의 화합물의 용도를 제공한다.
제약 제제
인간을 비롯한 포유동물의 치유적 치료 (예방적 치료 포함)를 위해 본 발명의 화합물을 사용하기 위해, 일반적으로 표준 제약 실무에 따라 제약 조성물로 제제화된다. 본 발명의 이러한 측면에 따라, 본 발명의 화합물과 함께 제약상 허용되는 희석제 또는 담체를 포함하는 제약 조성물이 제공된다.
전형적인 제제는 본 발명의 화합물을 담체, 희석제 또는 부형제와 혼합함으로써 제조된다. 적합한 담체, 희석제 및 부형제는 당업자에게 공지되어 있으며, 탄수화물, 왁스, 수용성 및/또는 수팽창성 중합체, 친수성 또는 소수성 물질, 젤라틴, 오일, 용매, 물 등과 같은 물질이 포함된다. 사용되는 특정한 담체, 희석제 또는 부형제는 본 발명의 화합물이 적용되는 수단 및 목적에 따라 달라질 것이다. 일반적으로, 용매는 포유동물에 투여하기에 안전한 (GRAS) 것으로 당업자에게 인식되는 용매를 토대로 하여 선택된다. 일반적으로, 안전한 용매는 물과 같은 무독성 수성 용매, 및 물에 가용성 또는 혼화성인 다른 무독성 용매이다. 적합한 수성 용매에는 물, 에탄올, 프로필렌 글리콜, 폴리에틸렌 글리콜 (예를 들면, PEG 400, PEG 300) 등 및 이들의 혼합물이 포함된다. 제제는 또한 하나 이상의 완충액, 안정화제, 계면활성제, 습윤제, 윤활제, 유화제, 현탁제, 보존제, 항산화제, 불투명화제, 활택제, 가공 보조제, 착색제, 감미제, 향료, 향미제, 및 약물 (즉, 본 발명의 화합물 또는 그의 제약 조성물)을 고품격으로 제시하거나 제약 생성물 (즉, 의약)의 제조를 보조하는 다른 공지된 첨가제를 포함할 수 있다.
제제는 통상적인 용해 및 혼합 절차를 이용하여 제조될 수 있다. 예를 들면, 벌크 약물 물질 (즉, 본 발명의 화합물 또는 안정화된 형태의 화합물 (예를 들면, 시클로덱스트린 유도체 또는 다른 공지된 착화제와의 착체))을 상기 기재된 하나 이상의 부형제의 존재하에 적합한 용매에 용해시킨다. 전형적으로, 본 발명의 화합물은 제약 투여량 형태로 제제화되어, 용이하게 제어가능한 약물 투여량을 제공하고, 처방된 섭생법에 대해 환자가 순응할 수 있게 한다.
적용가능한 제약 조성물 (또는 제제)은 약물 투여를 위해 사용되는 방법에 따라 다양한 방식으로 포장될 수 있다. 일반적으로, 분배 제품은 적절한 형태로 제약 제제가 들어있는 용기를 포함한다. 적합한 용기는 당업자에게 공지되어 있으며, 병 (플라스틱 및 유리), 샤세, 앰풀, 플라스틱 백, 금속 실린더 등과 같은 물질이 포함된다. 용기는 또한 포장 내용물에 무분별하게 접근하는 것을 방지하기 위해 개봉-방지(tamper-proof) 조립체를 포함할 수 있다. 또한, 용기 내용물을 설명하는 라벨이 용기안에 들어있다. 상기 라벨은 또한 적절한 경고문을 포함할 수 있다.
본 발명의 화합물의 제약 제제는 다양한 투여 경로 및 유형을 위해 제조될 수 있다. 예를 들면, 목적하는 정도의 순도를 갖는 화학식 I의 화합물을 동결건조된 제제, 분쇄된 분말, 또는 수용액의 형태로 제약상 허용되는 희석제, 담체, 부형제 또는 안정화제 (문헌 [Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.])와 임의로 혼합할 수 있다. 주위 온도에서 적절한 pH에서 및 목적하는 정도의 순도에서, 생리학상 허용되는 담체, 즉 사용되는 투여량 및 농도에서 수용자에게 무독성인 담체와 혼합함으로써 제제화될 수 있다. 제제의 pH는 주로 화합물의 특정 용도 및 농도에 의존하지만, 약 3 내지 약 8의 범위일 수 있다. pH 5의 아세테이트 완충액 중의 제제가 적합한 실시양태이다.
화합물은 통상적으로 고체 조성물, 동결건조된 제제 또는 수용액으로서 보관될 수 있다.
본 발명의 제약 조성물은 양호한 의학 실무에 부합하는 방식, 즉 양, 농도, 스케쥴, 과정, 비히클 및 투여 경로로 제제화, 복용 및 투여될 것이다. 본원에서 고려되는 인자에는 치료할 특정 장애, 치료할 특정 포유동물, 개별 환자의 임상적 상태, 장애의 원인, 약제의 전달 부위, 투여 방법, 투여 스케쥴, 및 의사에게 공지된 다른 인자가 포함된다. 투여할 화합물의 "치료 유효량"은 이러한 고려하에 결정되며, 과다증식성 장애를 예방, 경감 또는 치료하는데 필요한 최소량이다.
일반적인 제안으로서, 비경구로 투여되는 억제제의 제약상 유효량은 초기에는 투여 당 약 0.01 내지 100 mg/kg(환자 체중)/일, 즉 약 0.1 내지 20 mg/kg/일일 것이며, 전형적으로 초기에 화합물은 0.3 내지 15 mg/kg/일의 범위로 사용된다.
허용되는 희석제, 담체, 부형제 및 안정화제는 사용되는 투여량 및 농도에서 수용자에게 무독성이며, 완충액, 예컨대 포스페이트, 시트레이트 및 다른 유기산; 항산화제, 예컨대 아스코르브산 및 메티오닌; 보존제 (예컨대, 옥타데실디메틸벤질 염화암모늄; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤즈에토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 시클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 잔기 미만) 폴리펩티드; 단백질, 예컨대 혈청 알부민, 젤라틴, 또는 이뮤노글로불린; 친수성 중합체, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌, 또는 라이신; 단당류, 이당류 및 다른 탄수화물, 예컨대 글루코스, 만노스, 또는 덱스트린; 킬레이팅제, 예컨대 EDTA; 당, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염-형성 카운터-이온, 예컨대 나트륨; 금속 착체 (예를 들면, Zn-단백질 착체); 및/또는 비-이온성 계면활성제, 예컨대 트윈(TWEEN; 상표명), 플루로닉스(PLURONICS; 상표명) 또는 폴리에틸렌 글리콜 (PEG)을 포함한다. 활성 제약 성분은 또한 예를 들면 코아세르베이션 기술 또는 계면 중합에 의해 제조된 마이크로캡슐, 예를 들어 콜로이드성 약물 전달 시스템(예를 들면, 리포솜, 알부민 미세구, 미세에멀젼, 나노입자 및 나노캡슐) 또는 마크로에멀젼 중의 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타실레이트) 마이크로캡슐에 각각 포획될 수 있다. 이러한 기술은 문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]에 기재되어 있다.
화학식 I의 화합물의 서방성 제제를 제조할 수 있다. 서방성 제제의 적합한 예에는 화학식 I의 화합물을 함유하는 고체 소수성 중합체의 반투과성 매트릭스가 포함되며, 상기 매트릭스는 성형된 제품의 형태, 예를 들면 필름 또는 마이크로캡슐 형태이다. 서방성 매트릭스의 예에는 폴리에스테르, 히드로겔 (예를 들면, 폴리(2-히드록시에틸-메타크릴레이트), 또는 폴리(비닐 알코올)), 폴리락티드 (US 3773919), L-글루탐산 및 감마-에틸-L-글루타메이트의 공중합체, 비-분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글리콜산 공중합체, 예컨대 루프론 데포(LUPRON DEPOT; 상표명, 락트산-글리콜산 공중합체 및 류프롤리드 아세테이트로 이루어진 주사가능한 미세구) 및 폴리-D-(-)-3-히드록시부티르산이 포함된다.
제제에는 본원에 상세히 설명된 투여 경로에 적합한 것이 포함된다. 편리하게는, 제제는 단위 투여량 형태로 제시될 수 있으며, 약학 분야에 널리 공지된 임의의 방법에 의해 제조될 수 있다. 일반적으로, 기술 및 제제에 대해서는 문헌 [Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, PA)]에서 확인한다. 이러한 방법은 하나 이상의 보조 성분을 구성하는 담체를 활성 성분과 회합시키는 단계를 포함한다. 일반적으로, 제제는 액체 담체 또는 미분된 고체 담체 또는 이들 둘을 활성 성분과 균일하고 밀접하게 회합시킨 다음, 필요에 따라 생성물을 성형함으로써 제조된다.
경구 투여에 적합한 화학식 I의 화합물의 제제는 구별된 단위로, 예컨대 정해진 양의 화학식 I의 화합물을 각각 함유하는 환제, 캡슐제, 캐쉐 또는 정제로 제조될 수 있다. 압축 정제는 적합한 기계에서 분말 또는 과립과 같은 자유 유동 형태의 활성 성분을 임의로 결합제, 윤활제, 비활성 희석제, 보존제, 표면활성제 또는 분산제와 함께 압축함으로써 제조될 수 있다. 성형 정제는 적합한 기계에서 비활성 액체 희석제로 보습된 분말 활성 성분의 혼합물을 성형함으로서 제조될 수 있다. 정제는 임의로 코팅되거나 눈금이 새겨지고, 임의로 활성 성분의 느린 또는 제어된 방출을 제공하도록 제제화된다. 정제, 트로키제, 로젠지제, 수성 또는 유성 현탁액, 분산가능한 분말 또는 과립, 에멀젼, 경질 또는 연질 캡슐, 예를 들면 젤라틴 캡슐, 시럽 또는 엘릭시르는 경구 용도로 제조될 수 있다. 경구용으로 의도된 화학식 I의 화합물의 제제는 제약 조성물의 제조에 대해 당업계에 공지된 임의의 방법에 따라 제조될 수 있고, 이러한 조성물은 풍미가 좋은 제제를 제공하기 위해 감미제, 향미제, 착색제 및 보존제를 비롯한 하나 이상의 작용제를 함유할 수 있다. 정제의 제조에 적합한 무독성의 제약상 허용되는 부형제와 혼합된 활성 성분을 함유하는 정제가 허용된다. 이들 부형제는 예를 들어 비활성 희석제, 예컨대 탄산칼슘 또는 탄산나트륨, 락토스, 인산칼슘 또는 인산나트륨; 과립화제 및 붕괴제, 예컨대 옥수수 전분, 또는 알긴산; 결합제, 예컨대 전분, 젤라틴 또는 아카시아; 및 윤활제, 예컨대 스테아르산마그네슘, 스테아르산 또는 활석일 수 있다. 정제는 코팅되지 않거나, 위장관에서의 붕괴 및 흡착을 지연시켜 보다 장시간 동안 서방형으로 작용하도록 하는 미세캡슐화를 비롯한 공지된 기술에 의해 코팅될 수 있다. 예를 들면, 시간 지연 물질, 예컨대 글리세릴 모노스테아레이트 또는 글리세릴 디스테아레이트를 단독으로 또는 왁스와 혼합하여 사용할 수 있다.
눈 또는 다른 외부 조직, 예를 들면 입 및 피부를 치료하는 경우, 제제는 바람직하게는 활성 성분(들)을 예를 들면 0.075 내지 20% w/w의 양으로 함유하는 국부 연고 또는 크림으로서 도포된다. 연고로 제제화되는 경우, 활성 성분은 파라핀성 또는 수혼화성 연고 베이스와 함께 사용될 수 있다. 별법으로, 활성 성분은 수-중-유 크림 베이스와 함께 크림으로 제제화될 수 있다. 바람직한 경우, 크림 베이스의 수성 상은 다가 알코올, 즉 2개 이상의 히드록실기를 갖는 알코올, 예컨대 프로필렌 글리콜, 부탄 1,3-디올, 만니톨, 소르비톨, 글리세롤 및 폴리에틸렌 글리콜 (예컨대, PEG 400) 및 이들의 혼합물을 포함할 수 있다. 국부 제제는 바람직하게는 피부 또는 다른 발병 영역을 통한 활성 성분의 흡수 또는 침투를 개선시키는 화합물을 포함할 수 있다. 이러한 피부 침투 개선제의 예에는 디메틸 술폭사이드 및 관련 유사체가 포함된다. 본 발명의 에멀젼의 유성 상은 공지된 방식으로 공지된 성분들로 이루어질 수 있다. 상기 상이 유화제만을 포함할 수 있지만, 바람직하게는 1종 이상의 유화제와 지방 또는 오일 또는 이들 둘 다 와의 혼합물을 포함한다. 바람직하게는, 친수성 유화제는 안정화제로 작용하는 친유성 유화제와 함께 포함된다. 또한 바람직하게는, 오일 및 지방 둘 다를 포함할 수 있다. 또한, 안정화제(들)이 있거나 없는 유화제(들)은 소위 유화 왁스를 구성하고, 오일 및 지방과 함께 왁스는 크림 제제의 유성 분산상을 형성하는 소위 유화 연고 베이스를 구성한다. 본 발명의 제제에 사용하기에 적합한 유화제 및 에멀젼 안정화제에는 트윈(Tween; 등록상표) 60, 스팬(Span; 등록상표) 80, 세토스테아릴 알코올, 벤질 알코올, 미리스틸 알코올, 글리세릴 모노-스테아레이트 및 나트륨 라우릴 술페이트가 포함된다.
화학식 I의 화합물의 수성 현탁액은 수성 현탁액의 제조에 적합한 부형제와 혼합된 활성 물질을 함유한다. 이러한 부형제에는 현탁제, 예컨대 나트륨 카르복시메틸셀룰로스, 크로스카멜로스, 포비돈, 메틸셀룰로스, 히드록시프로필 메틸셀룰로스, 나트륨 알기네이트, 폴리비닐피롤리돈, 검 트래거캔스 및 검 아카시아, 및 분산제 또는 습윤제, 예컨대 천연 발생 포스파티드 (예를 들면, 레시틴), 알킬렌 옥사이드와 지방산의 축합 생성물 (예를 들면, 폴리옥시에틸렌 스테아레이트), 에틸렌 옥사이드와 장쇄 지방족 알코올의 축합 생성물 (예를 들면, 헵타데카에틸렌옥시세탄올), 에틸렌 옥사이드와 지방산 및 헥시톨 무수물로부터 유래된 부분 에스테르의 축합 생성물 (예를 들면, 폴리옥시에틸렌 소르비탄 모노올레에이트)이 포함된다. 수성 현탁액은 또한 하나 이상의 보존제, 예컨대 에틸 또는 n-프로필 p-히드록시벤조에이트, 하나 이상의 착색제, 하나 이상의 향미제 및 하나 이상의 감미제, 예컨대 수크로스 또는 사카린을 함유할 수 있다.
화학식 I의 화합물의 제약 조성물은 멸균 주사가능한 제제, 예컨대 멸균 주사가능한 수성 또는 유성 현탁액의 형태일 수 있다. 이 현탁액은 상기 언급한 적합한 분산제 또는 습윤제 및 현탁제를 이용하여 당업계에 공지된 바에 따라 제제화될 수 있다. 멸균 주사가능한 제제는 또한 무독성의 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 주사가능한 용액 또는 현탁액, 예컨대 1,3-부탄디올 중의 용액일 수 있거나, 또는 동결건조된 분말로서 제조될 수 있다. 사용될 수 있는 허용되는 비히클 및 용매는 물, 링거 용액 및 등장성 염화나트륨 용액이다. 또한, 용매 또는 현탁 매질로서 멸균 고정유가 통상적으로 사용될 수 있다. 이를 위해, 합성 모노- 또는 디글리세라이드를 포함하는 임의의 무난한 고정유를 사용할 수 있다. 또한, 마찬가지로 올레산과 같은 지방산을 주사가능한 제제에 사용할 수 있다.
단일 투여 형태를 생성하기 위해 담체 물질과 조합될 수 있는 활성 성분의 양은 치료할 숙주 및 특정한 투여 방식에 따라 달라질 것이다. 예를 들면, 인간에게 경구 투여하도록 의도된 시간-방출 제제는 대략 1 내지 1000 mg의 활성 물질과 함께 전체 조성물의 약 5 내지 약 95% (중량:중량)일 수 있는 적절하고 편리한 양의 담체 물질을 함유할 수 있다. 제약 조성물은 투여를 위해 용이하게 측정가능한 양을 제공하도록 제조될 수 있다. 예를 들면, 정맥내 주입을 위해 의도된 수용액은 용액 1 mL 당 활성 성분 약 3 내지 500 ㎍을 함유하여, 약 30 mL/hr의 속도의 적합한 부피로 주입될 수 있다.
비경구 투여에 적합한 제제에는 항산화제, 완충액, 살균제, 및 제제가 의도된 수용자의 혈액과 등장성이 되게 하는 용질을 함유할 수 있는 수성 및 비-수성 멸균 주사 용액; 및 현탁제 및 증점제를 포함할 수 있는 수성 및 비-수성 멸균 현탁액이 포함된다.
또한, 눈에 국소 투여하기에 적합한 제제에는 활성 성분이 적합한 담체, 특히 활성 성분용 수성 용매에 용해 또는 현탁된 점안제가 포함된다. 바람직하게는, 활성 성분은 약 0.5 내지 20% w/w, 예를 들면 약 0.5 내지 10% w/w, 예를 들면 약 1.5% w/w의 농도로 제제에 존재한다.
입으로 국소 투여하기에 적합한 제제에는 향미 베이스, 통상적으로 수크로스 및 아카시아 중에 활성 성분을 포함하는 로젠지제 또는 트래거캔스; 비활성 베이스, 예컨대 젤라틴 및 글리세린, 또는 수크로스 및 아카시아 중에 활성 성분을 포함하는 파스틸제; 및 적합한 액체 담체 중에 활성 성분을 포함하는 구강세척제가 포함된다.
직장 투여를 위한 제제는 예를 들어 코코아 버터 또는 살리실레이트를 포함하는 적합한 베이스를 이용하여 좌약으로 제공될 수 있다.
폐내 또는 비강 투여에 적합한 제제는 예를 들어 0.1 내지 500 ㎛ 범위의 입도 (예컨대, 0.5 ㎛, 1 ㎛, 30 ㎛, 35 ㎛ 등과 같은 증분 ㎛로 0.1 내지 500 ㎛ 범위의 입도)를 가지며, 이는 폐포낭에 도달하도록 비강 통로를 통한 신속 흡입에 의해 또는 입을 통한 흡입에 의해 투여된다. 적합한 제제에는 활성 성분의 수성 또는 유성 용액이 포함된다. 에어로졸 또는 건조 분말 투여에 적합한 제제는 통상의 방법에 따라 제조될 수 있으며, 다른 치료제, 예컨대 하기 기재된 바와 같이 장애의 치료 또는 예방에 사용되는 화합물과 함께 전달될 수 있다.
질 투여에 적합한 제제는 활성 성분에 더하여 당업계에 적절한 것으로 공지된 담체를 함유하는 패서리, 탐폰, 크림, 젤, 페이스트, 포움 또는 스프레이 제제로서 제공될 수 있다.
제제는 단위-투여 또는 다중-투여 용기, 예를 들면 밀봉된 앰풀 및 바이알로 포장될 수 있고, 사용하기 직전에 주사하기 위해 물과 같은 멸균 액체 담체에 첨가하기만 하면 되는 냉동-건조(동결건조)된 상태로 보관될 수 있다. 즉석 주사 용액 및 현탁액은 상기 기재한 종류의 멸균 분말, 과립 및 정제로부터 제조된다. 바람직한 단위 투여량 제제는 활성 성분을 상기 기재된 바와 같은 1일 투여량 또는 1일 투여량보다 적은 단위 투여량, 또는 그의 적절한 분획으로 함유하는 것이다.
본 발명은 또한 상기 정의된 하나 이상의 활성 성분을 수의학용 담체와 함께 포함하는 수의학용 조성물을 제공한다. 수의학용 담체는 조성물의 투여 목적에 유용한 물질이며, 수의학 분야에서 비활성이거나 허용되며 활성 성분과 상용가능한 고체, 액체 또는 기체 물질일 수 있다. 이들 수의학용 조성물은 비경구, 경구 또는 임의의 다른 바람직한 경로로 투여될 수 있다.
조합 요법
화학식 I의 화합물은 본원에 기재된 질환 또는 장애, 예컨대 과다증식성 장애 (예를 들면, 암)의 치료를 위해 단독으로 또는 다른 치료제와 조합되어 사용될 수 있다. 특정 실시양태에서, 화학식 I의 화합물은 항과다증식 특성을 갖거나 과다증식성 장애 (예를 들면, 암)의 치료에 유용한 제2 화합물과의 제약 조합 제제로 또는 조합 요법으로서의 투여 섭생법으로 조합된다. 제약 조합물 제제 또는 투여 섭생법의 제2 화합물은 바람직하게는 서로에게 불리한 영향을 미치지 않도록 화학식 I의 화합물에 대한 보완 작용을 갖는다. 이러한 화합물은 적합하게는 조합물 중에 의도된 목적에 유효한 양으로 존재한다. 일 실시양태에서, 본 발명의 조성물은 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 또는 제약상 허용되는 염 또는 전구약물을 본원에 기재된 화학요법제와 함께 포함한다.
조합 요법은 동시 또는 순차 섭생법으로 투여될 수 있다. 순차적으로 투여되는 경우, 조합물은 2회 이상 투여될 수 있다. 조합 투여에는 별도의 제제 또는 단일 제약 제제를 이용하는 공동 투여, 및 어느 하나의 순서로의 연속 투여 (이 경우, 바람직하게는 두가지 (또는 모든) 활성제가 동시에 그들의 생물학적 활성을 발휘하는 시간이 있음)가 포함된다.
상기 공동 투여에 적합한 임의의 작용제의 투여량은 현재 이용되고 있는 것이며, 새로 확인된 작용제 및 다른 화학요법제 또는 치료제의 조합 작용 (상승 작용)으로 인해 감소될 수 있다.
조합 요법은 "상승 작용"을 제공하여 "시너지 효과"를 나타낼 수 있으며, 즉 활성 성분들을 함께 사용할 경우 화합물을 별도로 사용하여 얻는 효과의 합보다 더 큰 효과를 달성하게 된다. 시너지 효과는 활성 성분들을 (1) 공동 제제화하여, 조합된 단위 투여량 제제로 동시에 투여 또는 전달하거나; (2) 별도 제제로서 교대로 또는 함께 전달하거나; 또는 (3) 일부 다른 섭생법에 의할 때 달성될 수 있다. 교대 요법으로 전달하는 경우, 화합물을 예를 들어 별도의 시린지, 별도의 환제 또는 캡슐제, 또는 별도의 주입으로 다르게 주사함으로써 순차적으로 투여 또는 전달할 때, 시너지 효과가 달성될 수 있다. 일반적으로, 교대 요법 동안에는 효과적인 투여량의 각 활성 성분을 순차적으로, 즉 순서대로 투여하는 반면, 조합 요법에서는 효과적인 투여량의 2가지 이상의 활성 성분들을 함께 투여한다.
항암 요법의 특정 실시양태에서, 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 또는 제약상 허용되는 염 또는 전구약물은 본원에 기재된 다른 화학요법제, 호르몬 또는 항체 제제 뿐만 아니라, 수술 요법 및 방사선 요법과 조합될 수 있다. 따라서, 본 발명에 따른 조합 요법은 하나 이상의 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 또는 제약상 허용되는 염 또는 전구약물의 투여, 및 하나 이상의 다른 암 치료법의 사용을 포함한다. 화학식 I의 화합물(들) 및 다른 제약 활성 화학요법제(들)의 양, 및 상대적인 투여 시점은 목적하는 조합 치료 효과를 달성하기 위해 선택될 것이다.
화학식 I의 화합물의 대사산물
본원에 기재된 화학식 I의 생체내 대사 생성물 또한 본 발명의 범위에 속한다. 이러한 생성물은 예를 들어 투여된 화합물의 산화, 환원, 가수분해, 아미드화, 탈아미드화, 에스테르화, 탈에스테르화, 효소적 분할 등에 의해 생성될 수 있다. 따라서, 본 발명은 화학식 I의 화합물의 대사산물, 예를 들어 본 발명의 화합물과 포유동물을 대사 생성물이 수득되기에 충분한 시간 동안 접촉시키는 것을 포함하는 과정에 의해 생성된 화합물을 포함한다.
전형적으로, 대사 생성물은, 본 발명의 화합물의 방사선 표지된 (예를 들면, 14C 또는 3H) 동위원소를 제조하고, 이를 검출가능한 투여량 (예를 들면, 약 0.5 mg/kg 초과)으로 래트, 마우스, 기니피그, 원숭이와 같은 동물 또는 인간에게 비경구 투여하고, 충분한 시간 동안 (전형적으로, 약 30 초 내지 30 시간) 대사가 일어나게 하고, 그의 전환 생성물을 뇨, 혈액 또는 다른 생물학적 샘플로부터 단리함으로써 확인한다. 이들 생성물은 표지되어 있기 때문에 용이하게 단리된다 (다른 생성물들은 대사산물에 남아있는 에피토프에 결합할 수 있는 항체를 사용하여 단리됨). 대사산물의 구조는 통상의 방식으로, 예를 들면 MS, LC/MS 또는 NMR 분석에 의해 측정한다. 일반적으로, 대사산물의 분석은 당업자에게 널리 공지된 통상적인 약물 대사 연구와 동일한 방식으로 수행된다. 대사 생성물은 생체내에서 달리 발견되지 않는 한, 본 발명의 화합물의 치료 투여량을 위한 진단학적 검정에 유용하다.
제조품
본 발명의 또다른 실시양태에서, 상기 기재한 질환 및 장애의 치료에 유용한 물질을 함유하는 제조품 또는 "키트"가 제공된다. 일 실시양태에서, 상기 키트는 화학식 I의 화합물, 또는 그의 입체이성질체, 기하이성질체, 호변이성질체, 용매화물, 대사산물, 또는 제약상 허용되는 염 또는 전구약물이 포함된 용기를 포함한다. 키트는 상기 용기 상에 또는 그와 함께 라벨 또는 포장 삽입물을 더 포함할 수 있다. 용어 "포장 삽입물"은 치료학적 생성물의 사용과 관련된 지시 사항, 용법, 투여량, 투여법, 금기사항 및/또는 경고문에 대한 정보를 함유하는, 치료학적 생성물의 시판용 포장에 통상적으로 포함되는 지침을 나타내는데 사용된다. 적합한 용기에는 예를 들어 병, 바이알, 시린지, 블리스터 팩 등이 포함된다. 상기 용기는 유리 또는 플라스틱과 같은 다양한 물질로 형성될 수 있다. 상기 용기는 증상의 치료에 효과적인 화학식 I의 화합물 또는 그의 제제를 보유할 수 있으며, 멸균성 접근 포트를 가질 수 있다 (예를 들면, 상기 용기는 피하 주사용 바늘로 뚫을 수 있는 마개를 가진 정맥내 용액 백 또는 바이알일 수 있음). 상기 조성물 중 하나 이상의 활성제는 화학식 I의 화합물이다. 상기 라벨 또는 포장 삽입물은, 상기 조성물이 선택된 증상, 예컨대 암의 치료를 위해 사용된다는 것을 지시한다. 또한, 상기 라벨 또는 포장 삽입물은 치료될 환자가 과다증식성 장애, 신경변성, 심장 비대증, 동통, 편두통 또는 신경외상성 질환 또는 사건을 가진 사람임을 지시할 수 있다. 일 실시양태에서, 상기 라벨 또는 포장 삽입물은 화학식 I의 화합물을 포함하는 조성물이 비정상적 세포 성장으로 인한 장애의 치료를 위해 사용될 수 있음을 지시한다. 상기 라벨 또는 포장 삽입물은 또한 상기 조성물이 다른 장애의 치료를 위해 사용될 수 있음을 지시할 수 있다. 별법으로 또는 추가로, 제조품은 제약상 허용되는 완충액, 예컨대 세균발육 저지용 주사용수 (BWFI), 포스페이트-완충된 염수, 링거 용액 및 덱스트로스 용액이 포함된 제2 용기를 더 포함할 수 있다. 다른 완충액, 희석제, 필터, 바늘 및 시린지를 비롯하여 상업적으로 및 사용자 입장에서 바람직한 다른 물질을 더 포함할 수 있다.
키트는 화학식 I의 화합물, 및 존재하는 경우 제2 제약 제제의 투여를 위한 설명서를 더 포함할 수 있다. 예를 들어, 키트가 화학식 I의 화합물을 포함하는 제1 조성물, 및 제2 제약 제제를 포함하는 경우, 키트는 제1 및 제2 제약 조성물을 그것을 필요로 하는 환자에게 동시, 순차 또는 별도 투여하는 것에 대한 설명서를 더 포함할 수 있다.
또다른 실시양태에서, 키트는 화학식 I의 화합물의 경구용 고체 형태, 예컨대 정제 또는 캡슐제의 전달에 적합하다. 바람직하게는, 이러한 키트는 수많은 단위 투여량을 포함한다. 이러한 키트는 의도된 사용 순서로 배향된 투여량을 갖는 카드를 포함할 수 있다. 이러한 키트의 예는 "블리스터 팩"이다. 블리스터 팩은 포장 산업에 널리 공지되어 있으며, 제약 단위 투여량 형태를 포장하기 위해 널리 이용된다. 바람직한 경우, 기억 보조품이 예를 들어 숫자, 문자 또는 다른 표기 형태로, 또는 투여량이 투여될 수 있는 치료 스케쥴에서 날짜가 지정되어 있는 달력 삽입물과 함께 제공될 수 있다.
일 실시양태에 따라, 키트는 (a) 화학식 I의 화합물이 함유된 제1 용기; 및 임의로 (b) 제2 제약 제제가 함유된 제2 용기를 포함할 수 있으며, 상기 제2 제약 제제는 항과다증식 활성을 가진 제2 화합물을 포함한다. 별법으로 또는 추가로, 키트는 제약상 허용되는 완충액, 예컨대 세균발육 저지용 주사용수 (BWFI), 포스페이트-완충된 염수, 링거 용액 및 덱스트로스 용액을 포함하는 제3 용기를 더 포함할 수 있다. 다른 완충액, 희석제, 필터, 바늘 및 시린지를 비롯하여 상업적으로 및 사용자 입장에서 바람직한 다른 물질을 더 포함할 수 있다.
키트가 화학식 I의 조성물 및 제2 치료제를 포함하는 특정한 다른 실시양태에서, 키트는 별도의 조성물을 함유하는 용기, 예컨대 나누어진 병 또는 나누어진 호일 패킷을 포함할 수 있으나, 별도의 조성물은 또한 나누어지지 않은 단일 용기에 함유될 수 있다. 전형적으로, 키트는 별도의 성분의 투여를 위한 설명서를 포함한다. 키트 형태는 별도의 성분을 바람직하게는 상이한 투여 형태 (예를 들면, 경구 및 비경구)로 투여하거나, 상이한 투여 간격으로 투여하거나, 또는 처방의가 조합물의 개별 성분의 적정이 바람직하다고 한 경우에 특히 유리하다.
일반적인 제조 절차
일반적 절차 A 스즈끼 커플링:
스즈끼-유형의 커플링 반응은 2-클로로-퓨린 21의 피리미딘 고리의 2-위치에 모노시클릭 헤테로아릴, 융합된 바이시클릭 헤테로사이클, 융합된 바이시클릭 헤테로아릴, 또는 페닐을 부착시키는데 유용하다. 예를 들어, 21을 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)1H-인다졸 24 1.5 당량과 합하고, 물 및 동 부피의 아세토니트릴 중 1 몰 용액으로서 탄산 나트륨 3 당량에 용해시킬 수 있다. 촉매량 또는 그 이상의 저가 팔라듐 시약, 예컨대 비스(트리페닐포스핀)팔라듐(II) 디클로라이드를 첨가한다. 지시된 인다졸 보론산 에스테르 대신에 다양한 보론산 또는 보론산 에스테르를 사용할 수 있다. 또한 별법으로, 인다졸의 질소를, 예를 들어 N-THP 보호된 화합물 41로 보호할 수 있다. 일부 경우, 수성층의 pH를 조정하기 위해 탄산 나트륨 대신에 아세트산 칼륨을 사용하였다. 이어서, 반응물을 바이오테이지 옵티마이저(Biotage Optimizer) (바이오테이지, 인크.(Biotage, Inc.))와 같은 마이크로파 반응기에서 압력하에 10 내지 30 분 동안 약 140-150℃로 가열한다. 내용물을 에틸 아세테이트 또는 또다른 유기 용매로 추출한다. 유기층을 증발시킨 후, 스즈끼 커플링 생성물, 6,8,9-치환된 2-(1H-인다졸-4-일)-퓨린 22, 또는 6,8,9-치환된 2-(5-피리미딘-2-아민)-퓨린 23을 실리카 상에서 또는 역상 HPLC로 정제할 수 있다. 치환기 R1', R2', R4'는 정의한 바와 같은 R1, R2, R4, 또는 그의 보호된 형태 또는 전구체일 수 있다.
예시적인 실시양태 22 및 23을 비롯한 화합물을 형성하기 위해, 스즈끼 커플링 단계 동안 다양한 팔라듐 촉매를 사용할 수 있다. 스즈끼 커플링은 아릴할라이드, 예컨대 21과 보론산, 예컨대 24 또는 25의 팔라듐 매개 가교 커플링 반응이다. 저가의 Pd(II) 및 Pd(0) 촉매를 스즈끼 커플링 반응에서 사용할 수 있으며, 예컨대 PdCl2 (PPh3)2, Pd(t-Bu)3, PdCl2 dppf CH2Cl2, Pd(PPh3)4, Pd(OAc)/PPh3, Cl2Pd[(Pet3)]2, Pd(DIPHOS)2, Cl2Pd(Bipy), [PdCl(Ph2PCH2PPh2)]2, Cl2Pd[P(o-tol)3]2, Pd2(dba)3/P(o-tol)3, Pd2(dba)/P(푸릴)3, Cl2Pd[P(푸릴)3]2, Cl2Pd(PMePh2)2, Cl2Pd[P(4-F-Ph)3]2, Cl2Pd[P(C6F6)3]2, Cl2Pd[P(2-COOH-Ph)(Ph)2]2, Cl2Pd[P(4-COOH-Ph)(Ph)2]2, 및 캡슐화된 촉매 Pd EnCat™ 30, Pd EnCat™ TPP30, 및 Pd(II)EnCat™ BINAP30 (US 2004/0254066)이 포함된다.
일반적 절차 B C-6 질소 치환
용매, 예컨대 에탄올 중의 2,6-디클로로 퓨린 중간체 27에 1급 또는 2급 아민 (R10R13NH, 1.1 당량) 및 비-친핵성 염기, 예컨대 트리에틸아민 (NEt3, 1.5 당량, 63 ㎕)을 첨가한다. 별법으로, 용매로서 아세토니트릴을 이용할 수 있고, 염기로서 탄산 칼륨을 이용할 수 있다. 반응 혼합물을 실온에서 약 1 시간 또는 밤새 교반하고, 휘발성 물질을 진공하에 제거하고, 잔류물을 DCM 및 염수 사이에 분배시킨다. 혼합물이 불용성일 경우에는 이를 초음파처리할 수 있고, 고체 생성물은 여과에 의해 수집한다. 황산 마그네슘으로 건조시키고 용매를 증발시켜, 종종 결정질 고체로서 또는 연화처리에 의해 N'-(2-클로로 퓨린-6-일)-아민 치환된 중간체 28을 수득한다. 치환기 R1' 및 R2'은 정의한 바와 같은 R1 및 R2, 또는 그의 보호된 형태 또는 전구체일 수 있다.
일반적 절차 C N-9 질소 알킬화
9-H 퓨린 중간체 29를 DMF에 녹이고, 2 당량의 탄산 세슘을 반응 혼합물에 첨가한다. 반응물을 50℃로 가열하고, 3 당량의 알킬 할라이드 R2'-X를 반응 혼합물에 첨가한다. 반응을 TLC 또는 LC/MS로 모니터링하고, 완료될 때까지, 전형적으로 수 시간 교반한다. 반응 혼합물을 EtOAc 및 물로 추출하고, 유기 층을 건조시키고, 여과 및 농축하여 조질의 9-알킬화된 퓨린 30을 수득하고, 이것은 다음 반응에 직접 사용하거나 역상 HPLC로 정제한다. 치환기 R1', R3' 및 R4'은 정의한 바와 같은 R1, R3 및 R4, 또는 그의 보호된 형태 또는 전구체일 수 있다.
일반적 절차 D THP 탈보호
일반적으로, N-9-테트라히드로피라닐 치환된 31은 메탄올 용액 중에서 촉매량의 파라-톨루엔술폰산 (PTSA)으로 처리할 수 있고, 테트라히드로피란 (THP) 기가 제거될 때까지 약 50℃로 가열하여 화합물 32를 수득할 수 있다. 반응은 LC-MS 또는 TLC로 모니터링할 수 있다. 치환기 R1' 및 R3'은 정의한 바와 같은 R1 및 R3, 또는 그의 보호된 형태 또는 전구체일 수 있다.
일반적 절차 E Boc 탈보호
일반적으로, Boc-치환된 33은 TFA 또는 4 N HCl로 처리하여 t-부톡시카르보닐 기(들)을 제거하고, 반응의 완료는 LC-MS로 모니터링한다. 이어서 조 생성물을 농축하고 역상 HPLC에 의해 정제하여, 순수한 고체로서 생성물 34를 수득한다. 치환기 R1' 및 R2'은 정의한 바와 같은 R1 및 R2, 또는 그의 보호된 형태 또는 전구체일 수 있다.
일반적 절차 F 아미드 커플링
2,6,8 치환된, 9-알킬카르복실 퓨린 35 (여기서 n은 1 내지 12임)를 디메틸포름아미드 (DMF) 중의 1.5 당량의 HATU (2-(7-아자-1H-벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트), 과량 (예컨대 3 당량)의 알킬아민 (HNR10R11), 및 과량 (예컨대 3 당량)의 탄산세슘으로 처리한다. 별법으로, 다른 커플링 시약을 사용할 수 있다. 반응이 완료될 때까지 교반하고, 에틸아세테이트 중에서 포화된 바이카르보네이트 용액으로 추출한다. 유기 층을 건조시키고, 여과하고, 농축하여 아실화된 조질의 중간체를 수득하고, 이것을 역상 HPLC를 통해 정제하여 생성물 36을 수득한다. 치환기 R1' 및 R3'은 정의한 바와 같은 R1 및 R3, 또는 그의 보호된 형태 또는 전구체일 수 있다.
실시예
실시예에 기재된 화학 반응은 본 발명의 수많은 여러 PI3K 억제제를 제조하는데 용이하게 적용될 수 있으며, 본 발명의 범위 내에서 본 발명의 화합물을 제조하기 위한 대안적인 방법이 고려된다. 예를 들면, 예시되지 않은 본 발명에 따른 화합물은 당업자에게 자명한 변형에 의해, 예를 들어 반응성 관능기를 적절히 보호하고/거나, 기재된 것 이외에 당업계에 공지된 다른 적합한 시약을 사용하고/거나, 반응 조건을 변형시킴으로써 성공적으로 합성될 수 있다. 별법으로, 본원에 개시되거나 당업계에 공지된 다른 반응을 본 발명의 다른 화합물의 제조를 위해 적용할 수 있음을 인식할 것이다.
하기 기재된 실시예에서, 달리 언급하지 않는 한, 모든 온도는 섭씨 온도이다. 시약은 시판 공급자, 예컨대 시그마 알드리치 케미컬 캄파니(Sigma Aldrich Chemical Company), 랜캐스터(Lancaster), 티씨아이(TCI) 또는 메이브릿지(Maybridge)로부터 구입하여, 달리 언급하지 않는 한 추가로 정제하지 않고 사용하였다. 하기 기재된 반응들은 (달리 명시하지 않는 한) 일반적으로 질소 또는 아르곤의 양압하에 또는 건조 튜브를 이용하여 무수 용매 중에서 수행하였고, 반응 플라스크에는 전형적으로 시린지를 통한 기질 및 시약의 도입을 위해 고무막이 장착되어 있었다. 유리 제품은 오븐 건조 및/또는 열 건조시켰다. 컬럼 크로마토그래피는 실리카겔 컬럼을 갖춘 바이오테이지(Biotage) 시스템 (제조자: 디악스 코포레이션(Dyax Corporation)) 상에서 또는 실리카 SEP PAK® 카트리지 (워터스(Waters)) 상에서 수행하였다. 1H NMR 스펙트럼은 400 MHz에서, 중수소화 CDCl3, d6-DMSO, CH3OD 또는 d6-아세톤 용액 중에서 (ppm으로 기록) 참고 표준으로서 클로로포름 (7.25 ppm)을 이용하여 수득하였다. 다중 피크를 기록하는 경우, 하기 약어를 사용하였다: s (단일선), d (이중선), t (삼중선), m (다중선), br (넓음), dd (이중선의 이중선), dt (삼중선의 이중선). 커플링 상수는 주어지는 경우 헤르쯔 (Hz)로 기록하였다.
실시예 1 2,6-디클로로-9-메틸-9H-퓨린 4
실시예 2 4-(4,4,5,5-테트라메틸-[1,3,2]디옥사보롤란-2-일)-1H-인다졸 24 - 경로 1
클로로포름 (50 mL) 중의 3-브로모-2-메틸 아닐린 (5.0 g, 26.9 mmol) 용액에 아세트산 칼륨 (1.05 당량, 28.2 mmol, 2.77 g)을 첨가하였다. 얼음물 중에서 냉각시키는 동시에 아세트산 무수물 (2.0 당량, 53.7 mmol, 5.07 mL)을 첨가하였다. 이어서, 혼합물을 10 분 동안 실온에서 교반하였고, 이후 백색의 젤라틴성 고체가 형성되었다. 18-크라운-6 (0.2 당량, 5.37 mmol, 1.42 g)에 이어 이소-아밀 니트라이트 (2.2 당량, 59.1 mmol, 7.94 mL)를 첨가하고, 혼합물을 환류 하에 18 시간 동안 가열하였다. 반응 혼합물을 냉각시키고, 클로로포름 (3×100 mL) 및 포화 수성 탄산수소나트륨 (100 mL) 사이에 분배시켰다. 합한 유기 추출물을 염수 (100 mL)로 세척하고, 분리하고, 건조시켰다 (MgSO4).
조 생성물을 실리카 상에서 증발시키고, 20% 내지 40% EtOAc-휘발유로 용출하는 크로마토그래피에 의해 정제하여, 1-(4-브로모-인다졸-1-일)-에타논 A (3.14 g, 49%)를 오렌지색 고체로서, 4-브로모-1H-인다졸 B (2.13 g, 40%)를 연한 오렌지색 고체로서 수득하였다.
MeOH (50 mL) 중의 1-(4-브로모-인다졸-1-일)-에타논 A의 용액 (3.09 g, 12.9 mmol)에 6 N 수성 HCl (30 mL)을 첨가하고, 혼합물을 7 시간 동안 실온에서 교반하였다. MeOH를 증발시키고, 혼합물을 EtOAc (2×50 mL) 및 물 (50 mL) 사이에 분배시켰다. 합한 유기 층을 염수 (50 mL)로 세척하고, 분리하고, 건조시켰다 (MgSO4). 용매를 감압하에 증발에 의해 제거하여 4-브로모-1H-인다졸 B (2.36 g, 93%)를 수득하였다.
DMSO (20 mL) 중의 4-브로모-1H-인다졸 B (500 mg, 2.54 mmol) 및 비스(피나콜레이토)디보론 (1.5 당량, 3.81 mmol) 용액에 아세트산 칼륨 (3.0 당량, 7.61 mmol, 747 mg; 권총 건조기 내에서 건조시킨 것) 및 PdCl2(dppf)2 (3 mol%, 0.076 mmol, 62 mg)를 첨가하였다. 혼합물을 아르곤으로 탈기시키고, 40 시간 동안 80℃에서 가열하였다. 반응 혼합물을 냉각시키고, 물 (50 mL) 및 에테르 (3×50 mL) 사이에 분배시켰다. 합한 유기 층을 염수 (50 mL)로 세척하고, 분리시키고 건조시켰다 (MgSO4). 조 물질을 30% 내지 40% EtOAc-휘발유로 용출하는 크로마토그래피에 의해 정제하여, 분리 불가능한 4-(4,4,5,5-테트라메틸-[1,3,2]디옥사보롤란-2-일)-1H-인다졸 24 (369 mg, 60%) 및 인다졸 (60 mg, 20%)의 3:1 혼합물을 수득하였고, 정치시에 고형화되는 황색 검으로서 단리하여, 회백색 고체로서 수득하였다.
실시예 3 4-(4,4,5,5-테트라메틸-[1,3,2]디옥사보롤란-2-일)-1H-인다졸 24 - 경로 2
아세트산 (60 mL) 중의 2-메틸-3-니트로아닐린 (2.27 g, 14.91 mmol) 용액에 물 (5 mL) 중의 아질산나트륨 용액 (1.13 g, 1.1 당량)을 첨가하였다. 2 시간 후, 짙은 적색 용액을 얼음/물에 붓고, 생성된 침전물을 여과에 의해 수집하여 4-니트로-1H-인다졸 C (1.98 g, 81%)를 수득하였다.
4-니트로-1H-인다졸 C (760 mg, 4.68 mmol), 목탄 상의 팔라듐 (10%, cat.) 및 에탄올 (30 mL)의 혼합물을 수소 풍선 하에 4 시간 동안 교반하였다. 이어서, 반응 혼합물을 셀라이트를 통해 여과하고, 용매를 진공하에 제거하여 1H-인다졸-4-일아민 D (631 mg, 100%)를 수득하였다.
물 (2 mL) 중의 아질산나트륨 (337 mg, 4.89 mmol) 수용액을 0℃ 아래에서 6 M 염산 (7.2 mL) 중의 1H-인다졸-4-일아민 D (631 mg, 4.74 mmol) 현탁액에 적가하였다. 30 분 동안 교반한 후, 나트륨 테트라플루오로보레이트 (724 mg)를 반응 혼합물에 첨가하였다. 점성 용액이 생성되었고, 이것을 여과하고 물로 간략히 세척하여, 짙은 적색 고체로서 1H-인다졸-4-디아조늄 테트라플루오로보레이트 염 E (218 mg, 20%)를 수득하였다.
건조 메탄올 (4 mL)을 아르곤으로 5 분 동안 퍼지하였다. 여기에 1H-인다졸-4-디아조늄 테트라플루오로보레이트 염 (218 mg, 0.94 mmol), 비스-피나콜레이토 디보론 (239 mg, 1.0 당량) 및 [1,1'-비스(디페닐포스피노)페로센]팔라듐 (II) 클로라이드 (20 mg)를 첨가하였다. 반응 혼합물을 5 시간 동안 교반한 다음, 셀라이트를 통해 여과하였다. 잔류물을 플래쉬 크로마토그래피를 이용하여 정제하여 4-(4,4,5,5-테트라메틸-[1,3,2]디옥사보롤란-2-일)-1H-인다졸 24 (117 mg)를 수득하였다.
실시예 4 1-(테트라히드로-2H-피란-2-일)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸 41 (경로 A)
단계 A: 4-클로로-1H-인다졸의 제조: 교반 막대가 장착된 250 ml 플라스크에 2-메틸-3-클로로아닐린 (8.4 ml, 9.95 g, 70.6 mmol), 아세트산 칼륨 (8.3 g, 84.7 mmol) 및 클로로포름 (120 ml)을 첨가하였다. 이 혼합물을 교반하면서 0℃로 냉각시켰다. 냉각된 혼합물에 2 분에 걸쳐 아세트산 무수물 (20.0 ml, 212 mmol)을 적가하였다. 반응 혼합물을 25℃로 가온하고, 1 시간 동안 교반하였다. 이 시점에, 반응물을 60℃로 가열하였다. 이소아밀 니트라이트 (18.9 ml, 141 mmol)를 첨가하고, 반응물을 60℃에서 밤새 교반하였다. 완료되면, 물 (75 ml) 및 THF (150 ml)를 첨가하고, 반응물을 0℃로 냉각시켰다. LiOH (20.7 g, 494 mmol)를 첨가하고, 반응물을 0℃에서 3 시간 동안 교반하였다. 물 (200 ml)을 첨가하고, 생성물을 EtOAc (300 ml, 100 ml)로 추출하였다. 유기 층을 합하고, MgSO4로 건조시키고, 진공하에 농축시켜, 4-클로로-1H-인다졸 11.07 g (100%)를 오렌지색 고체로서 수득하였다.
단계 B: 4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸의 제조: 기계식 교반기가 장착된 1 L 플라스크에 4-클로로-1H-인다졸 (75.0 g, 0.492 mol), 피리디늄 p-톨루엔술포네이트 (1.24 g, 4.92 mmol), CH2Cl2 (500 ml) 및 3,4-디히드로-2H-피란 (98.6 ml, 1.08 mol)을 첨가하였다. 교반하면서, 이 혼합물을 16 시간 동안 45℃로 가열하였다. 반응 혼합물의 분석은 생성물의 이성질체가 둘 다 생성되었음을 나타내었다. 반응물을 25℃로 냉각시키고, CH2Cl2 (200 ml)를 첨가하였다. 용액을 물 (300 ml)로 세척하고, NaHCO3 (250 ml)으로 포화시켰다. 유기물을 MgSO4로 건조시키고, 건고상태로 농축시켰다. 조생성물을 EtOAc/헥산 (4:6, 1 L) 중에 용해시키고 SiO2 (1.2 L)를 첨가하는 것에 의해 정제하였다. 혼합물을 여과하고, 케이크를 EtOAc/헥산 (4:6, 2 L)으로 세척하였다. 유기물을 진공하에 농축시켜 4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 110.2 g (95%)를 오렌지색 고체로서 수득하였다.
단계 C: 1-(테트라히드로-2H-피란-2-일)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸 41의 제조: 교반 막대가 장착된 500 ml 플라스크에 4-클로로-1-(테트라히드로-2H-피란-2-일)-1H-인다졸 (10.0 g, 42.2 mmol), DMSO (176 ml), PdCl2(PPh3)2 (6.2 g, 8.86 mmol), 트리시클로헥실포스핀 (0.47 g, 1.69 mmol), 비스(피나콜레이토)디보론 (16.1 g, 63.4 mmol) 및 아세트산칼륨 (12.4 g, 0.127 mol)을 첨가하였다. 교반하면서, 혼합물을 16 시간 동안 130℃로 가열하였다. 반응물을 25℃로 냉각시키고, EtOAc (600 ml)를 첨가하고, 물 (2×250 ml)로 세척하였다. 유기물을 MgSO4로 건조시키고, 진공 하에 건고상태로 농축시켰다. 조 생성물을 10% EtOAc/헥산 (1 L) 및 30% EtOAc/헥산 (1 L)으로 용출하면서, SiO2 플러그 (120 g)에 의해 정제하였다. 여과액을 진공하에 농축시켜, 에틸 아세테이트 중의 20% (wt/wt) 용액으로서 생성물 41을 13.9 g (100%) 수득하였다. 1H NMR은 비스(피나콜레이토)디보론이 약 20% (wt/wt) 존재함을 보여준다.
실시예 5 1-(테트라히드로-2H-피란-2-일)-4-(4,4,5,5-테트라메틸-1,3,2 디옥사보롤란-2-일)-1H-인다졸 41 (경로 B)
단계 A: 4-니트로-1H-인다졸의 제조: 2-메틸-3-니트로 아닐린 (200 g, 1.315 mol) 및 아세트산 (8000 ml) 혼합물을 15 내지 20℃로 냉각시키고, 물 (200 ml) 중의 아질산나트륨 용액 (90.6 g, 1.315 mol)을 30 분에 걸쳐 천천히 첨가하였다. 첨가 후에, 반응 온도를 25 내지 30℃로 상승시키고, 반응물을 이 온도에서 2 내지 3 시간 동안 교반하였다. 반응의 진행은 TLC로 모니터링하였고, 반응의 완료 후에 생성물을 여과하고 잔류물은 아세트산 (1000 ml)으로 세척하였다. 아세트산을 80℃ 아래에서 진공 (Hg 550 mm) 하에 증류시키고, 물 (8000 ml)을 첨가하고, 25 내지 30℃로 냉각시키고, 30 분 동안 교반하였다. 슬러리를 여과하고 물 (1000 ml)로 세척하였다. 조 생성물을 70 내지 80℃에서의 가열 하에 2 시간 동안 건조시킨 다음, 5% 에틸 아세테이트/n-헥산 (100:2000 ml) 용액에 녹이고, 주위 온도에서 1 내지 1.5 시간 동안 교반하였다. 현탁액을 여과하고, 5% 에틸 아세테이트/n-헥산 혼합물 (25:475 ml)로 세척하였다. 수득된 생성물을 80℃ 아래에서 진공하에 10 내지 12 시간 동안 건조시켜 4-니트로-1H-인다졸을 갈색 고체로서 수득하였다 (150 g, 70%):
단계 B: 4-아미노-1H-인다졸의 제조: EtOH (3000 ml) 중의 4-니트로-1H-인다졸 (200 g, 1.22 mol) 및 탄소 상의 10% 팔라듐 (20.0 g) 혼합물을 주위 온도에서 수소화하였다 (발열 반응이었고 온도가 50℃로 상승함). 반응이 완료된 후, 촉매는 여과에 의해 제거하였다. 용매를 80℃ 아래에서 진공하에 증발시키고, 실온으로 냉각시키고, 잔류물에 n-헥산 (1000 ml)을 첨가하고, 30 분 동안 교반하였다. 단리된 고체를 여과하고, n-헥산 (200 ml)으로 세척하였다. 생성물을 진공하에 70 내지 80℃에서 10 내지 12 시간 동안 건조시켜, 4-아미노-1H-인다졸을 갈색 고체로서 수득하였다 (114 g, 70%).
단계 C: 4-요오도-1H-인다졸의 제조: 물 (100 ml) 및 진한 염산 (182 ml) 중의 4-아미노-1H-인다졸 (50.0 g, 0.375 mol) 혼합물을 -10℃로 냉각시켰다. 여기에 물 (75 ml) 중의 아질산나트륨 (51.7 g, 0.75 mol) 용액을 -10℃에서 약 30 내지 60 분 이내에 적가하였다 (첨가하는 동안 거품이 이는 것이 관찰됨). 다른 플라스크에서 물 (3000 ml) 중의 요오드화 칼륨 (311 g, 1.87 mol) 혼합물을 실온에서 제조하고, 여기에 상기 냉각된 디아조늄 염을 30 내지 40℃에서 약 30 내지 40 분 이내에 첨가하였다. 반응물을 30℃에서 1 시간 동안 유지시키고, 반응이 완료된 후, 에틸 아세테이트 (500 ml)를 첨가하고, 반응 혼합물을 셀라이트를 통해 여과하였다. 층을 분리시키고, 수성층을 에틸 아세테이트 (2×500 ml)로 추출하였다. 합한 유기 층을 5% 하이포 용액 (2×500 ml), 염수 (500 ml)로 세척하고, 건조시키고 (Na2SO4), 농축시켰다. 조 생성물을 크로마토그래피 (실리카 겔, 헥산, 15 내지 20% 에틸 아세테이트/헥산)에 의해 정제하여, 4-요오도-1H-인다졸을 오렌지색 고체로서 수득하였다 (23.0 g, 25%).
단계 D: 4-요오도-1-(2-테트라히드로피라닐) 인다졸의 제조: CH2Cl2 (1250 ml) 중의 4-아미노-1H-인다졸 (250.0 g, 1.024 mol), 3,4-디히드로-2H-피란 (126.0 g, 1.5 mol) 및 PPTS (2.57 g, 0.01 mol) 혼합물을 2 시간 동안 50℃로 가열하였다. 반응물을 실온으로 냉각시키고, 물 (625 ml)에 붓고, 층을 분리시키고, 수성층을 CH2Cl2 (250 ml)로 추출하였다. 합한 유기 층을 물 (625 ml)로 세척하고, 건조시키고 (Na2SO4), 농축시켰다. 조 잔류물을 크로마토그래피 (실리카 겔, 헥산, 5 내지 10% 에틸 아세테이트/헥산)에 의해 정제하여 4-요오도-1-(2-테트라히드로피라닐) 인다졸을 오일로서 수득하였다 (807.0 g, 60%).
단계 E: 1-(테트라히드로-2H-피란-2-일)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸 41의 제조: DMSO (500 ml) 중의 4-요오도-1-(2-테트라히드로피라닐) 인다졸 (100 g, 0.304 mol), 비스피나콜레이토디보란 (96.4 g, 0.381 mol), PdCl2 (dppf) (8.91 g, 0.012 mol) 및 아세트산 칼륨 (85.97 g, 0.905 mol) 혼합물을 2 내지 3 시간 동안 80℃로 가열하였다. 완료된 후, 반응물을 실온으로 냉각시키고, 물 (1500 ml)을 첨가하였다. 반응 질량을 에틸 아세테이트로 추출하고 (3×200 ml), 합한 유기 층을 증발시키고, 건조시키고 (Na2SO4), 농축시켰다. 조 생성물을 컬럼 크로마토그래피 (실리카 겔, 헥산, 5-10% 에틸 아세테이트/헥산)에 의해 정제하여, 41을 점성의 갈색 오일로서 수득하였다 (70.0 g, 70%).
실시예 6 4-메틸-5-(4,4,5,5-테트라메틸(1,3,2-디옥사보롤란-2-일))피리미딘-2-일아민 42
클로로포름 (320 mL) 중의 4-메틸피리미딘-2-일아민 (8.0 g, 0.073 mol) 용액에 N-브로모숙신이미드 (13.7 g, 0.077 mol)를 첨가하였다. 반응 혼합물을 암소에서 18 시간 동안 교반하였다. LC/MS는 반응이 완료되었음을 나타내었다. 혼합물을 DCM으로 희석시킨 다음, 1 N NaOH 수용액 및 염수로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 농축시켜 5-브로모-4-메틸피리미딘-2-일아민 (12 g, 수율: 86%)을 수득하였다.
디옥산 (140 mL) 중의 5-브로모-4-메틸피리미딘-2-일아민 (5.0 g, 26 mmol), 아세트산칼륨 (7.83 g, 79.8 mmol), 4,4,5,5-테트라메틸-2-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1,3,2-디옥사보롤란 (7.43 g, 29.2 mmol) 혼합물을 20 분 동안 질소 하에 교반하였다. 1,1'-비스(디페닐포스피노)페로센 팔라듐 (II) 클로라이드 디클로로메탄 부가물 (1.08 g, 1.33 mmol)을 반응 혼합물에 첨가하였다. 반응 혼합물을 질소하에 18 시간 동안 115℃로 가열하였다. 완료되면, 혼합물을 냉각시키고, EtOAc를 첨가하였다. 생성된 혼합물을 초음파 처리하고, 여과하였다. 추가의 EtOAc를 사용하여 고체를 세척하였다. 합한 유기 추출물을 물로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 농축시켰다. 조 생성물을 20 내지 100% EtOAc/헥산으로 용출하는 크로마토그래피에 의해 정제하여 42를 4.5 g 수득하였다 (수율: 74%).
실시예 7 2-(9-(2-히드록시에틸)-2-(1H-인돌-4-일)-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 101
2-(2-클로로-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)에틸 아세테이트 (165 mg)를 일반적 절차 A를 통해 인돌-4-보론산으로 처리하고, 역상 HPLC를 통해 정제하여, 101을 백색 고체로서 21 mg 수득하였다. MS (Q1) 423.2 (M)+
실시예 8 2-(2-(2-아미노-4-메틸피리미딘-5-일)-9-(2-히드록시에틸)-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 102
2-(2-클로로-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)에틸 아세테이트 (300 mg)를 일반적 절차 A를 통해 4-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리미딘-2-아민으로 처리하고, 역상 HPLC를 통해 정제하여, 102를 백색 고체로서 107 mg 수득하였다. MS (Q1) 415.2 (M)+
실시예 9 2-(2-(2-아미노피리미딘-5-일)-9-부틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 103
2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 100 mg을 일반적 절차 C를 통해 브로모부탄으로 처리하여 조질의 중간체 2-(9-부틸-2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올을 수득하였고, 이것을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르로 처리하고, 역상 HPLC를 통해 정제하여 103을 백색 고체로서 55 mg 수득하였다. MS (Q1) 413.3 (M)+.
실시예 10 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9-프로필-9H-퓨린-8-일)프로판-2-올 104
2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 (100 mg)을 일반적 절차 C를 통해 요오도프로판으로 처리하여 조질의 중간체 2-(2-클로로-6-모르폴리노-9-프로필-9H-퓨린-8-일)프로판-2-올을 수득하였고, 이것을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르로 처리하고, 역상 HPLC를 통해 정제하여 104를 백색 고체로서 34 mg 수득하였다. MS (Q1) 399.3 (M)+.
실시예 11 3-(2-(2-아미노피리미딘-5-일)-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)프로판-1-올 105
2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 100 mg을 일반적 절차 C를 통해 TBDMS-보호된 브로모프로판올로 처리하였다. 조질의 중간체 2-(9-(3-(tert-부틸디메틸실릴옥시)프로필)-2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르로 처리하고, 역상 HPLC를 통해 정제하여 105를 백색 고체로서 36 mg 수득하였다. MS (Q1) 415.2 (M)+.
실시예 12 3-(2-(2-아미노피리미딘-5-일)-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)프로판-1-올 106
2,6-디클로로퓨린 (3 gm)을 20 mL EtOAc에 녹이고, PTSA를 100 mg 첨가하였다. 반응 혼합물이 균질하게 될 때까지 가열하면서 디히드로피란 (3 mL)을 불균질한 혼합물에 천천히 첨가하였다. 이어서, 반응 혼합물을 포화 바이카르보네이트 용액으로 3회 추출하였다. 유기 층을 건조시키고, 여과하고, 건고상태로 농축시켰다. 조질의 2,6-디클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린을 MeOH에 녹이고, 모르폴린 (3 당량)을 첨가하였다. 4-(2-클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린이 다음 3시간에 걸쳐 용액으로부터 천천히 침전되었고, 이어서 여과하고, 수집하고, 건조시켜 백색 고체로서 4.26 g을 수득하였다.
4-(2-클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린 (2.76 gm)을 THF 중에서 -78℃로 냉각시켰다. THF (1.5 당량) 중의 2.5 M n-BuLi 용액을 20 분에 걸쳐 적가하였다. 반응물을 -78℃에서 30 분 동안 교반한 후, 아세톤 (1.56 mL)을 첨가하고, 반응물을 2 시간에 걸쳐 교반하면서 천천히 0℃로 가온하였다. 이어서, 반응 혼합물을 물로 켄칭시키고, 에틸 아세테이트로 추출하였다. 조 생성물 2-(2-클로로-6-모르폴리노-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-8-일)프로판-2-올을 농축시키고, MeOH에 녹였다. 이어서, THP 기를 일반적 절차 D를 통해 제거하였다. 반응 혼합물을 농축시키고, 조질의 고체를 물에 녹이고, 여과하고, 수집하고, 밤새 건조시켜 2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올을 옅은 황색 고체로서 2.23 gm 수득하였다.
2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 100 mg을 일반적 절차 C를 통해 2-브로모에틸 아세테이트로 처리하였다. 조질의 중간체 2-(2-클로로-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)에틸 아세테이트를 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르로 처리하고, 역상 HPLC를 통해 정제하여 106을 백색 고체로서 54 mg 수득하였다. MS (Q1) 401.2 (M)+.
실시예 13 1-(4-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피페리딘-1-일)에타논 107
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (400 mg)을 일반적 절차 C를 통해 tert-부틸 4-(브로모메틸)피페리딘-1-카르복실레이트와 반응시켜 tert-부틸 4-((2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피페리딘-1-카르복실레이트 (554 mg)를 수득하였고, 이것을 일반적 절차 D를 통해 Boc 탈보호하여 5-(6-모르폴리노-9-(피페리딘-4-일메틸)-9H-퓨린-2-일)피리미딘-2-아민 (454 mg)을 황색 고체로서 수득하였다.
5-(6-모르폴리노-9-(피페리딘-4-일메틸)-9H-퓨린-2-일)피리미딘-2-아민 (75 mg)을 DMF 1 mL 중에서 과량의 아세트산, 2 당량의 HOBT, 5 당량의 디이소프로필에틸아민 및 2 당량의 N-(3-디메틸아미노프로필)-N'-에틸카르보디이미드 히드로클로라이드와 반응시켰다. 완료되면, 반응물을 에틸 아세테이트 및 포화 중탄산나트륨 용액으로 추출하였다. 유기 층을 농축하고, 역상 HPLC를 통해 정제하여 107을 백색 고체로서 18.9 mg 수득하였다. MS (Q1) 438.3 (M)+
실시예 14 1-(3-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피롤리딘-1-일)에타논 108
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (400 mg)을 일반적 절차 C를 통해 tert-부틸 3-(브로모메틸)피롤리딘-1-카르복실레이트와 반응시켜 tert-부틸 3-((2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피롤리딘-1-카르복실레이트 (496 mg)를 수득하였고, 이것을 일반적 절차 D를 통해 Boc 탈보호하여 5-(6-모르폴리노-9-(피롤리딘-3-일메틸)-9H-퓨린-2-일)피리미딘-2-아민 352 mg을 황색 고체로서 수득하였다.
5-(6-모르폴리노-9-(피롤리딘-3-일메틸)-9H-퓨린-2-일)피리미딘-2-아민 (75 mg)을 DMF 1 mL 중에서 과량의 아세트산, 2 당량의 HOBT, 5 당량의 디이소프로필에틸아민 및 2 당량의 N-(3-디메틸아미노프로필)-N'-에틸카르보디이미드 히드로클로라이드와 반응시켰다. 완료되면, 반응물을 에틸 아세테이트 및 포화 중탄산나트륨 용액으로 추출하였다. 유기 층을 농축하고, 역상 HPLC를 통해 정제하여 108을 백색 고체로서 40.1 mg 수득하였다. MS (Q1) 424.2 (M)+.
실시예 15 (R)-3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(3-히드록시피롤리딘-1-일)프로판-1-온 109
3-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 (50 mg)을 일반적 절차 F를 통해 (R)-피롤리딘-3-올과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 109를 백색 고체로서 10.9 mg 수득하였다. MS (Q1) 440.2 (M)+
실시예 16 (S)-3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(3-히드록시피롤리딘-1-일)프로판-1-온 110
3-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 (50 mg)을 일반적 절차 F를 통해 (S)-피롤리딘-3-올과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 110을 백색 고체로서 10.1 mg 수득하였다. MS (Q1) 440.2 (M)+
실시예 17 1-(3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로파노일)-N-메틸피페리딘-4-카르복스아미드 111
3-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 (50 mg)을 일반적 절차 F를 통해 N-메틸피페리딘-4-카르복스아미드와 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 111을 백색 고체로서 10.9 mg 수득하였다. MS (Q1) 495.3 (M)+
실시예 18 3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(4-(메틸술포닐)피페라진-1-일)프로판-1-온 112
3-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 (50 mg)을 일반적 절차 F를 통해 1-(메틸술포닐)피페라진과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 112를 백색 고체로서 33.8 mg 수득하였다. MS (Q1) 517.2 (M)+
실시예 19 3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-모르폴리노프로판-1-온 113
3-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 (50 mg)을 일반적 절차 F를 통해 모르폴린과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 113을 백색 고체로서 24.9 mg 수득하였다. MS (Q1) 440.2 (M)+
실시예 20 3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산 114
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (400 mg)을 일반적 절차 C를 통해 메틸 3-브로모프로피오네이트와 반응시켰다. 생성물인 조질의 메틸 3-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로파노에이트 468 mg을 1:1 THF/물 용액 중에서 3 당량의 수산화리튬과 반응시켰다. 완료된 후, THF를 진공하에 제거하고, 진한 HCl 용액을 이용하여 물 용액을 pH 2로 산성화시켰다. 생성물이 백색 고체로서 침전되었고, 이것을 여과하여 3-(2-(2-(tert 부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산을 388 mg 수득하였고, 이중 88 mg을 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 114를 백색 고체로서 15.5 mg 수득하였다. MS (Q1) 371.2 (M)+
실시예 21 5-(9-(4-(메틸술포닐)벤질)-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민 115
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (100 mg)을 일반적 절차 C를 통해 1-(클로로메틸)-4-(메틸술포닐)벤젠과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 115를 백색 고체로서 25.4 mg 수득하였다. MS (Q1) 467.2 (M)+
실시예 22 메틸 4-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)벤조에이트 116
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (100 mg)을 일반적 절차 C를 통해 메틸 4-(브로모메틸)벤조에이트와 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 116을 백색 고체로서 10.2 mg 수득하였다. MS (Q1) 447.2 (M)+
실시예 23 5-(6-모르폴리노-9-(2-모르폴리노에틸)-9H-퓨린-2-일)피리미딘-2-아민 117
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (100 mg)을 일반적 절차 C를 통해 4-(2-브로모에틸)모르폴린과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 117을 백색 고체로서 15.9 mg 수득하였다. MS (Q1) 412.2 (M)+
실시예 24 5-(9-(3-메톡시벤질)-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민 118
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (75 mg)을 일반적 절차 C를 통해 1-(브로모메틸)-3-메톡시벤젠과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 118을 백색 고체로서 50.2 mg 수득하였다. MS (Q1) 419.2 (M)+
실시예 25 메틸 3-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)벤조에이트 119
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (75 mg)을 일반적 절차 C를 통해 메틸 3-(브로모메틸)벤조에이트와 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 119를 백색 고체로서 27.6 mg 수득하였다. MS (Q1) 447.2 (M)+
실시예 26 3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판-1-올 120
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (75 mg)을 일반적 절차 C를 통해 3-브로모프로판-1-올과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 120을 백색 고체로서 19.6 mg 수득하였다. MS (Q1) 357.2 (M)+
실시예 27 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)에탄올 121
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일 (75 mg)을 일반적 절차 C를 통해 2-브로모에틸 아세테이트와 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고 역상 정제하여 121을 백색 고체로서 22 mg 수득하였다. MS (Q1) 343.2 (M)+.
실시예 28 1-(2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세틸)-N-메틸피페리딘-4-카르복스아미드 122
2-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산 (35 mg)을 일반적 절차 F를 통해 N-메틸피페리딘-4-카르복스아미드와 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고, 역상 HPLC를 통해 정제하여 122를 백색 고체로서 10.3 mg 수득하였다. MS (Q1) 481.2 (M)+.
실시예 29 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(4-(메틸술포닐)피페라진-1-일)에타논 123
2-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산 (35 mg)을 일반적 절차 E를 통해 1-(메틸술포닐)피페라진과 반응시킨 다음, 일반적 절차 D를 통해 Boc 탈보호하고, 역상 HPLC를 통해 정제하여 123을 백색 고체로서 9 mg 수득하였다. MS (Q1) 503.2 (M)+.
실시예 30 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-모르폴리노에타논 124
2-(2-(2-(tert-부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산 (35 mg)을 일반적 절차 F를 통해 모르폴린과 반응시킨 다음, 일반적 절차 E를 통해 Boc 탈보호하고, 역상 HPLC를 통해 정제하여 124를 백색 고체로서 3.2 mg 수득하였다. MS (Q1) 426.2 (M)+
실시예 31 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산 125
조질의 2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세테이트 (240 mg)를 1:1 THF/물 용액 중에서 3 당량의 수산화리튬과 반응시켰다. 완료된 후, THF를 진공하에 농축시키고, 진한 HCl 용액을 이용하여 물 용액을 pH 2로 산성화시켰다. 생성물이 미세한 백색 고체로서 침전되었고, 이것을 여과하여 2-(2-(2-(tert 부톡시카르보닐아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산 (145 mg)을 수득하였고, 이중 40 mg을 일반적 절차 E를 거치게 하고 역상 HPLC를 통해 정제하여, 125를 백색 고체로서 19.5 mg 수득하였다. MS (Q1) 357.2 (M)+
실시예 32 메틸 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세테이트 126
4-(2-클로로-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린 (4.05 gm)을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르와 반응시켜 5-(6-모르폴리노-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-2-일)피리미딘-2-아민을 4.75 g 수득하였고, 이것을 아세토니트릴 60 mL 중에서 촉매량의 디메틸아미노피리딘, 4 당량의 Boc-무수물 및 3 당량의 트리에틸아민의 존재하에 환류시켰다. 완료되면, 반응물을 냉각시키고, 건고상태로 농축시키고, 정상 크로마토그래피를 통해 정제하여 2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-2-일을 옅은 황색 고체로서 6.11 g 수득하였다.
2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-2-일 (2 gm)을 일반적 절차 D를 거치게 하여 THP 보호기를 선택적으로 제거하고, 300 mg의 2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-2-일을 일반적 절차 C를 통해 메틸 2-브로모아세테이트와 반응시켜, 메틸 2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세테이트를 수득하였다. 조질의 메틸 2-(2-(2-(비스(tert-부톡시카르보닐)아미노)피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세테이트 (60 mg)의 Boc 기를 일반적 절차 E를 통해 제거하고, 생성물을 역상 HPLC를 통해 정제하여, 126을 백색 고체로서 39 mg 수득하였다. MS (Q1) 371.2 (M)+
실시예 33 5-(9-메틸-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민 127
4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린 (95 mg)을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르와 반응시키고, 역상 HPLC를 통해 정제하여 127을 백색 고체로서 26.1 mg 수득하였다. MS (Q1) 313.2 (M)+
실시예 34 5-(9-메틸-6-모르폴리노-9H-퓨린-2-일)피리딘-2-아민 128
4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린 (20 mg)을 일반적 절차 A를 통해 5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-아민과 반응시키고, 역상 HPLC를 통해 정제하여 128을 백색 고체로서 9.3 mg 수득하였다. MS (Q1) 312.3 (M)+.
실시예 35 4-(2-(1H-인다졸-4-일)-9-메틸-9H-퓨린-6-일)모르폴린 129
4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린 (20 mg)을 일반적 절차 A를 통해 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸과 반응시키고, 역상 HPLC를 통해 정제하여 129를 백색 고체로서 13.8 mg 수득하였다. MS (Q1) 336.2 (M)+
실시예 36 2-(2-(2-아미노피리미딘-5-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 130
2-(2-클로로-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 (100 mg)을 일반적 절차 C를 통해 요오도메탄과 반응시켜 조질의 중간체 2-(2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올을 수득하였고, 이것을 일반적 절차 A를 통해 2-아미노피리미딘-5-보론산, 피나콜 에스테르로 처리하고, 역상 HPLC를 통해 정제하여 130을 백색 고체로서 44 mg 수득하였다. MS (Q1) 371.2 (M)+.
실시예 37 2-(2-(6-아미노피리딘-3-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 131
2-(2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 (95 mg)을 절차 A를 통해 5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-아민과 반응시키고, 역상 HPLC를 통해 정제하여 131을 백색 고체로서 89.3 mg 수득하였다. MS (Q1) 370.3 (M)+
실시예 38 2-(2-(1H-인다졸-4-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 132
4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린 (233 mg)을 5 mL의 무수 THF 중에서 -78℃로 냉각시킨 후, 2.5 M의 n-부틸 리튬 용액을 2 당량 첨가하였다. 반응물을 1 시간 동안 -78℃에서 교반하고, 아세톤을 3 당량 첨가하였다. 이어서 30 분 후에 반응물을 0℃로 가온하였다. 반응물을 물로 켄칭시키고, 에틸 아세테이트로 추출하였다. 유기 층을 농축시켜 조질의 2-(2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올 (95 mg)을 수득하였다.
조질의 2-(2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올을 절차 A를 통해 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸과 반응시키고, 역상 HPLC를 통해 정제하여 132를 백색 고체로서 56.6 mg 수득하였다. MS (Q1) 394.3 (M)+
실시예 39 4-(2-(1H-인다졸-4-일)-9-(2-메톡시에틸)-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 133
4-(2-클로로-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9-(테트라히드로-2H-피란-2-일)-9H-퓨린-6-일)모르폴린 (250 mg)을 일반적 절차 D를 통해 파라-톨루엔술폰산으로 처리하여 4-(2-클로로-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린을 수득하였다.
4-(2-클로로-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (215 mg)을 일반적 절차 C를 통해 2-브로모에틸메틸에테르와 반응시켜 4-(2-클로로-9-(2-메톡시에틸)-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (207 mg)을 수득하였고, 이것을 일반적 절차 A를 통해 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸과 반응시키고, 역상 HPLC를 통해 정제하여 133을 백색 고체로서 21.6 mg 수득하였다. MS (Q1) 556.3 (M)+.
실시예 40 N-(4-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-6-모르폴리노-9H-퓨린-2-일)페닐)아세트아미드 134
4-(2-클로로-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (50 mg)을 일반적 절차 A를 통해 4-아세트아미도페닐보론산과 반응시키고, 역상 HPLC를 통해 정제하여 134를 백색 고체로서 25.9 mg 수득하였다. MS (Q1) 529.3 (M)+.
실시예 41 5-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-6-모르폴리노-9H-퓨린-2-일)피리딘-2-아민 135
4-(2-클로로-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (50 mg)을 일반적 절차 A를 통해 5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2-아민과 반응시키고, 역상 HPLC를 통해 정제하여 135를 백색 고체로서 29.1 mg 수득하였다. MS (Q1) 488.3 (M)+.
실시예 42 4-(2-(2-메톡시피리미딘-5-일)-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 136
4-(2-클로로-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (50 mg)을 일반적 절차 A를 통해 2-메톡시피리미딘-5-일보론산과 반응시키고, 역상 HPLC를 통해 정제하여 136을 백색 고체로서 5.5 mg 수득하였다. MS (Q1) 504.3 (M)+.
실시예 43 4-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-2-(피리딘-3-일)-9H-퓨린-6-일)모르폴린 137
4-(2-클로로-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 (50 mg)을 일반적 절차 A를 통해 피리딘-3-일보론산과 반응시키고, 역상 HPLC를 통해 정제하여 137을 백색 고체로서 33.4 mg 수득하였다. MS (Q1) 473.3 (M)+
실시예 44 4-(2-(1H-인다졸-4-일)-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린 138
4-(2-클로로-9H-퓨린-6-일)모르폴린 (510 mg)을 일반적 절차 C를 통해 메틸 요오다이드와 반응시켜 4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린을 수득하였다. 4-(2-클로로-9-메틸-9H-퓨린-6-일)모르폴린 (100 mg)을 1.5 mL의 무수 THF 중에서 -78℃로 냉각시킨 후, 2.5 M의 n-부틸 리튬 용액을 2 당량 첨가하였다. 반응물을 -78℃에서 1 시간 동안 교반하고, DMF를 3 당량 첨가하였다. 이어서 30 분 후에 반응물을 0℃로 가온하였다. 반응물을 차가운 0.25 M의 HCl 수용액으로 켄칭시키고, 오렌지색 고체를 여과하고, 수집하고, 건조시켜 조질의 중간체 2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-카르브알데히드를 48 mg 수득하였다.
2-클로로-9-메틸-6-모르폴리노-9H-퓨린-8-카르브알데히드를 2 mL의 디클로로에탄 중에서 6 시간 동안 1.1 당량의 1-(메틸술포닐)피페라진, 7 당량의 트리메틸오르토포르메이트, 1 당량의 아세트산으로 처리하고, 반응 혼합물에 1.1 당량의 나트륨 트리아세톡시보로히드라이드를 첨가하였다. 반응 혼합물을 디클로로메탄 및 물로 추출하여 조질의 중간체 4-(2-클로로-9-메틸-8-((4(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린을 수득한 다음, 일반적 절차 A를 통해 1-(테트라히드로-2H-피란-2-일)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인다졸과 반응시키고 역상 HPLC를 통해 정제하여 138을 백색 고체로서 41.8 mg 수득하였다. MS (Q1) 512.2 (M)+.
실시예 45 4-(2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)아세틸)피페라진-2-온 139
조질의 2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)아세트산 (50 mg)을 일반적 절차 F를 통해 피페라진-2-온과 반응시키고, 역상 HPLC를 통해 정제하여 139를 백색 고체로서 1.9 mg 수득하였다. MS (Q1) 438.2 (M)+
실시예 46 2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)-N-메틸아세트아미드 140
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 메틸 2-브로모아세테이트와 반응시켰다. 메틸 2-(2-클로로-6-모르폴리노-9H-퓨린-9-일)아세테이트를 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시켰다. 조질의 2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)아세트산 (50 mg)을 일반적 절차 F를 통해 메틸아민과 반응시키고, 역상 HPLC를 통해 정제하여 140을 백색 고체로서 5.6 mg 수득하였다. MS (Q1) 369.2 (M)+
실시예 47 3-(6-모르폴리노-9-(피리딘-4-일메틸)-9H-퓨린-2-일)페놀 141
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 4 (브로모메틸)피리딘과 반응시켜 4-(2-클로로-9-(피리딘-4-일메틸)-9H-퓨린-6-일)모르폴린을 수득하였고, 이것을 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시키고, 역상 HPLC를 통해 정제하여 141을 백색 고체로서 28.1 mg 수득하였다. MS (Q1) 389.2 (M)+
실시예 48 3-(9-(4-플루오로벤질)-6-모르폴리노-9H-퓨린-2-일)페놀 142
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 1-(브로모메틸)-4-플루오로벤젠과 반응시켜 4-(2-클로로-9-(4-플루오로벤질)-9H-퓨린-6-일)모르폴린을 수득하였고, 이것을 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시키고, 역상 HPLC를 통해 정제하여 142를 백색 고체로서 50 mg 수득하였다. MS (Q1) 406.2 (M)+.
실시예 49 3-(9-벤질-6-모르폴리노-9H-퓨린-2-일)페놀 143
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 (브로모메틸)벤젠과 반응시켜 4-(9-벤질-2-클로로-9H-퓨린-6-일)모르폴린을 수득하였고, 이것을 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시키고, 역상 HPLC를 통해 정제하여 143을 백색 고체로서 92.2 mg 수득하였다. MS (Q1) 388.2 (M)+
실시예 50 3-(9-(2-히드록시에틸)-6-모르폴리노-9H-퓨린-2-일)페놀 144
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 2-브로모에틸 아세테이트와 반응시켜 2-(2-클로로-6-모르폴리노-9H-퓨린-9-일)에틸 아세테이트를 수득하였고, 이것을 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시키고, 역상 HPLC를 통해 정제하여 144를 백색 고체로서 59.4 mg 수득하였다. MS (Q1) 342.2 (M)+
실시예 51 3-(9-이소부틸-6-모르폴리노-9H-퓨린-2-일)페놀 145
4-(2-클로로-9H-퓨린-6-일)모르폴린 (75 mg)을 일반적 절차 C를 통해 1-요오도-2-메틸프로판과 반응시키켰다. 4-(2-클로로-9-이소부틸-9H-퓨린-6-일)모르폴린을 일반적 절차 A를 통해 150 mg tert-부틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐 카르보네이트와 반응시키고, 역상 HPLC를 통해 정제하여 145를 백색 고체로서 62.6 mg 수득하였다. MS (Q1) 354.2 (M)+
실시예 52 p110α (알파) PI3K 결합 검정
결합 검정: 초기 편광 실험은 애널리스트(Analyst) HT 96-384 (몰레큘라 디바이시즈 코퍼레이션(Molecular Devices Corp), 미국 캘리포니아주 서니베일 소재) 상에서 수행하였다. 형광 편광 친화성 측정을 위한 샘플은, 편광 완충액 (10 mM Tris pH 7.5, 50 mM NaCl, 4 mM MgCl2, 0.05% Chaps, 및 1 mM DTT) 중 최종 농도 20 ㎍/mL에서 출발하는 p110알파 PI3K (업스테이트(Upstate) 세포 신호전달 용액, 미국 버지니아주 샤로츠빌 소재)의 1:3 연속 희석액을 최종 농도 10 mM의 PIP2 (에켈론-인크.(Echelon-Inc.), 미국 유타주 솔트 레이크 시티 소재)에 첨가함으로써 제조하였다. 실온에서 30 분 동안 인큐베이션한 후, 각각 최종 농도 100 nM 및 5 nM의 GRP-1 및 PIP3-TAMRA 프로브 (에켈론-인크., 미국 유타주 솔트 레이크 시티 소재)를 첨가하여 반응을 중단시켰다. 384-웰 흑색 저-용적 프록시플레이트(Proxiplate, 퍼킨엘머(PerkinElmer), 미국 메사추세츠주 웰즐리 소재)에서 로다민 형광체 (λex = 530 nm; λem = 590 nm)에 대하여 표준 차단 필터를 이용하여 판독하였다. 형광 편광 값을 단백질 농도의 함수로서 플롯하고, 데이타를 칼레이다그래프(KaleidaGraph) 소프트웨어 (시너지 소프트웨어(Synergy Software), 미국 펜실베니아주 리딩 소재)를 이용하는 4-변수 방정식에 대입하여 EC50 값을 수득하였다. 또한, 이 실험은 억제제를 이용하는 후속 경쟁 실험에 사용하기에 적절한 단백질 농도를 설정한다.
억제제 IC50 값은, PIP2 (10 mM 최종 농도)와 조합된 p110알파 PI3K 0.04 mg/mL (최종 농도)을 편광 완충액 중에서 최종 농도가 25 mM인 ATP (셀 시그널링 테크놀로지, 인크.(Cell Signaling Technology, Inc.), 미국 메사추세츠주 덴버 소재)의 상기 길항제의 1:3 연속 희석액을 함유하는 웰에 첨가함으로써 측정하였다. 실온에서 30 분 동안 인큐베이션한 후, 각각 최종 농도 100 nM 및 5 nM의 GRP-1 및 PIP3-TAMRA 프로브 (에켈론-인크., 미국 유타주 솔트 레이크 시티 소재)를 첨가하여 반응을 중단시켰다. 384-웰 흑색 저-용적 프록시플레이트(퍼킨엘머, 미국 메사추세츠주 웰즐리 소재)에서 로다민 형광체 (λex = 530 nm; λem = 590 nm)에 대하여 표준 차단 필터를 이용하여 판독하였다. 형광 편광 값을 길항제 농도의 함수로서 플롯하고, 데이타를 에세이 익스플로러(Assay Explorer) 소프트웨어 (엠디엘(MDL), 미국 캘리포니아주 샌 래몬 소재)에서 4-변수 방정식에 대입하여 IC50 값을 수득하였다.
별법으로, PI3K의 억제는 정제된 재조합 효소 및 1 μM 농도의 ATP를 이용하는 방사능 검정으로 측정하였다. 화학식 I의 화합물을 100% DMSO로 연속 희석하였다. 키나제 반응물을 실온에서 1 시간 동안 인큐베이션하고, PBS를 첨가하여 반응을 종결시켰다. 그 후, IC50 값은 S자형 투여량-반응 곡선 대입 (가변 기울기)을 이용하여 측정하였다.
실시예 53 시험관내 세포 증식 검정
화학식 I의 화합물의 효능을 하기 프로토콜 (프로메가 코퍼레이션(Promega Corp.), 기술 발표 TB288; 문헌 [Mendoza et al. (2002) Cancer Res. 62:5485-5488])을 이용하는 세포 증식 검정에 의해 측정하였다:
1. 배지 중에 약 104 세포 (PC3, Detroit562, 또는 MDAMB361.1)를 함유하는 세포 배양물 100 ㎕의 분취액을 384-웰 불투명-벽 플레이트의 각 웰에 침착시켰다.
2. 배지를 함유하고 세포는 함유하지 않는 대조군 웰을 제조하였다.
3. 상기 화합물을 실험 웰에 첨가하고, 3 내지 5 일 동안 인큐베이션하였다.
4. 플레이트를 대략 30 분 동안 실온으로 평형화시켰다.
5. 각 웰에 존재하는 세포 배양 배지의 부피와 동일한 부피의 셀타이터-글로(CellTiter-Glo) 시약을 첨가하였다.
6. 궤도 진탕기에서 내용물을 2 분 동안 혼합하여, 세포 용해를 유도하였다.
7. 플레이트를 실온에서 10 분 동안 인큐베이션하여, 발광 신호를 안정화시켰다.
8. 발광을 기록하고, RLU (= 상대적 발광 단위)로서 그래프를 작성하였다.
별법으로, 세포를 최적 밀도로 96 웰 플레이트에 시딩하고, 시험 화합물의 존재하에 4 일 동안 인큐베이션하였다. 그 후, 알라마 블루(Alamar Blue; 상표명)를 검정 배지에 첨가하고, 세포를 6 시간 동안 인큐베이션한 후, 544 nm 여기, 590 nm 방출에서 판독하였다. EC50 값은 S자형 투여량-반응 곡선 대입을 이용하여 계산하였다.
실시예 54 Caco-2 침투성
Caco-2 세포를 밀리포어 멀티스크린(Millipore Multiscreen) 플레이트에 1×105 세포/㎠로 시딩하고, 20 일 동안 배양하였다. 그 후, 화합물 침투성을 평가하였다. 상기 화합물을 세포 단층의 정상 표면 (A)에 적용하여, 기저측면 (B) 구획으로 화합물의 침투를 측정하였다. 이를 역방향 (B-A)으로 수행하여, 활성 수송을 조사하였다. 막을 가로지른 화합물 침투율의 척도인 각 화합물에 대한 침투 계수 값 Papp을 계산하였다. 인간 흡수율이 확립된 대조군 화합물과의 비교에 기초하여, 화합물을 낮은 흡수 포텐셜 (Papp </= 1.0×106 cm/s) 또는 높은 흡수 포텐셜 (Papp >/= 1.0×106 cm/s)로 분류하였다.
활발하게 유출되는 화합물의 능력을 평가하기 위해, 정상 (A)에서 기저측면 (B)으로의 수송에 대한 B에서 A로의 수송의 비를 계산하였다. B-A/A-B 값이 1.0 이상인 것은 활발한 세포 유출이 일어남을 나타낸다.
실시예 55 간세포 클리어런스
저온 보존된 인간 간세포의 현탁액을 사용하였다. 화합물 농도 1 mM 또는 3μM에서 세포 밀도 0.5×106 생존 세포/mL 하에 인큐베이션하였다. 인큐베이션시 최종 DMSO 농도는 약 0.25%이었다. 또한, 세포 부재하에 대조군 인큐베이션을 수행하여, 임의의 비-효소적 분해를 알아내었다. 2벌식 샘플 (50 ㎕)을 0, 5, 10, 20, 40 및 60 분에 인큐베이션 혼합물로부터 제거하고 (대조군 샘플의 경우에는 60 분에서만), 내부 표준 (100 ㎕)을 함유하는 MeOH에 첨가하여, 반응을 종결시켰다. 톨부타미드, 7-히드록시쿠마린, 및 테스토스테론을 대조군 화합물로 사용할 수 있다. 샘플을 원심분리하고, 각 시점에서의 상청액을 LC-MSMS 분석을 위해 모았다. 시간에 대한 ln 피크 면적 비 (모 화합물 피크 면적 / 내부 표준 피크 면적)의 플롯으로부터, 고유 클리어런스 (CLint)를 다음과 같이 계산하였다: CLint (㎕/분/106 세포) = V×k (식 중, k는 제거율 상수이며, 시간에 대해 플롯된 ln 농도 구배로부터 수득함; V는 인큐베이션 부피로부터 유도된 부피 단위이며, ㎕/106 세포로 표현됨).
실시예 56 시토크롬 P450 억제
화학식 I의 화합물을 CYP450 표적 (1A2, 2C9, 2C19, 2D6, 3A4)에 대하여 약 10가지 농도에서 (최고 농도는 약 100 μM임) 2벌식으로 스크리닝할 수 있다. 표준 억제제 (푸라필린, 술파페나졸, 트래닐시프로민, 퀴니딘, 케토코나졸)를 대조군으로 사용할 수 있다. 형광 방식의 비엠쥐 랩테크놀로지즈 폴라스타(BMG LabTechnologies PolarStar)를 이용하여 플레이트를 판독할 수 있다.
실시예 57 시토크롬 P450 유도
단일 공여자로부터 새로 단리된 인간 간세포를 약 48 시간 동안 배양한 후, 세 가지 농도의 화학식 I의 화합물을 첨가하고, 72 시간 동안 인큐베이션할 수 있다. CYP3A4 및 CYP1A2에 대한 프로브 기질을 인큐베이션 종료전에 30 분 및 1 시간 동안 첨가하였다. 72 시간째에, 세포 및 배지를 제거하고, 각 프로브 기질의 대사 정도를 LC-MS/MS에 의해 정량화하였다. 1 가지 농도에서 3벌식으로 인큐베이션한 개별 P450의 유도인자를 사용하여 실험을 제어하였다.
실시예 58 혈장 단백질 결합
화학식 I의 화합물 용액 (5 ㎛, 0.5% 최종 DMSO 농도)을 완충액 및 10% 혈장 (완충액 중 v/v) 중에서 제조하였다. 96 웰 HT 투석 플레이트를 각 웰이 반투과성 셀룰로스 막에 의해 2개로 분리되도록 조립하였다. 완충액을 막의 한 쪽에 첨가하고, 혈장 용액을 다른 쪽에 첨가한 후, 37℃에서 2 시간에 걸쳐 3벌식으로 인큐베이션하였다. 그 후, 세포를 제거하고, 각 화합물 배치를 위한 용액을 두 가지 그룹 (혈장-무함유 및 혈장-함유)에 합한 다음, 혈장-무함유 용액 (6 점) 및 혈장-함유 용액 (7 점)에 대한 2 가지 세트의 보정 표준을 이용하여 LC-MSMS에 의해 분석하였다. 화합물에 대한 비결합 분획 값을 계산하였다.
실시예 59 hERG 채널 차단
확립된 유동 방법을 이용하여 hERG 칼륨 채널을 안정하게 발현하는 HEK-294 세포로부터 루비듐 유출을 조절하는 화학식 I의 화합물의 능력을 평가하였다. RbCl을 함유하는 배지에서 세포를 제조하고, 96-웰 플레이트 상에 플레이팅하고, 밤새 성장시켜, 단층을 형성하였다. 배지를 흡기시키고, 각 웰을 실온에서 예비-인큐베이션 완충액 (낮은 [K+] 함유) 3×100 ㎕으로 세척함으로써, 유출 실험을 시작하였다. 최종 흡기 후, 작업 원액 (2×) 화합물 50 ㎕를 각 웰에 첨가하고, 실온에서 10 분 동안 인큐베이션하였다. 그 후, 자극 완충액 (높은 [K+] 함유) 50 ㎕를 각 웰에 첨가하여, 최종 시험 화합물 농도를 달성하였다. 그 후, 세포 플레이트를 실온에서 10 분 더 인큐베이션하였다. 그 후, 각 웰로부터의 상청액 80 ㎕를 96-웰 플레이트의 동등한 웰에 옮기고, 원자 방출 분광법에 의해 분석하였다. 화합물을 10pt 2벌식 IC50 곡선 (n=2, 100 μM의 최고 농도에서부터)으로서 스크리닝하였다.
상기 기재는 본 발명의 원리를 예시한 것으로만 간주된다. 또한, 다양한 변형 및 변화가 당업자에게 용이하게 명백할 것이기 때문에, 본 발명이 상기 기재된 정확한 구성 및 과정으로 한정되는 것을 바라지 않는다. 따라서, 하기 청구항에 정의된 바와 같이 본 발명의 범위 내에 속하는 모든 적합한 변형 및 등가물이 고려될 수 있다.
본 명세서 및 하기 청구항에 사용된 용어 "포함한다(comprise)", "포함하는(comprising)", "포함한다(include)", "포함하는(including)" 및 "포함한다(includes)"는 언급하는 특징, 정수, 성분 또는 단계의 존재를 구체화하기 위해 의도된 것이지만, 이들은 하나 이상의 다른 특징, 정수, 성분, 단계 또는 기의 존재 또는 추가를 배제하지 않는다.
Claims (43)
- 하기 화학식 I 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염으로부터 선택된 화합물.
<화학식 I>
상기 식에서,
R1은 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C6-C20 아릴, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 (C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R2는 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 -(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R3은 C6-C20 아릴, 탄소-연결된 C2-C20 헤테로시클릴 및 탄소-연결된 C1-C20 헤테로아릴로부터 선택되고, 이들은 각각 F, Cl, Br, I, -CH3, -CN, -CF3, -CH2OH, -CO2H, -CONH2, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -OH, -OCH3, -SH, -NHC(=O)NHCH3, -NHC(=O)NHCH2CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R4는 -NR10R13, -NR12C(=O)R10, -NR10(C1-C12 알킬)NR10R13, -NR10(C1-C12 알킬렌)OR10, -NR10(C1-C12 알킬렌)C(=O)NR10R13, -NR10(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -NR10(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -NR10(C1-C12 알킬렌)-(C6-C20 아릴), 및 -NR10(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R10, R11 및 R12는 독립적으로 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -CH2OCH3, -CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R11은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
R13은 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -OCH2CH2-N(CH3)2, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R13은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
단 R1이 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)인 경우에는, R3은 비치환되거나 치환된 인돌이 아니다. - 제1항에 있어서, R1이 H 또는 임의로 치환된 C1-C12 알킬인 화합물.
- 제2항에 있어서, R1이 CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2CH2CH3, 및 -CH2CH(CH3)2로부터 선택된 것인 화합물.
- 제2항에 있어서, R1이 하나 이상의 -OH로 치환된 C1-C12 알킬인 화합물.
- 제4항에 있어서, R1이 -C(CH3)2OH, -CH2CH2OH, 및 -CH2CH2CH2OH로부터 선택된 것인 화합물.
- 제2항에 있어서, R1이 하나 이상의 -F로 치환된 C1-C12 알킬인 화합물.
- 제1항에 있어서, R1이 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)인 화합물.
- 제7항에 있어서, R1이 -CH2-(피페라진-1-일) (여기서, 피페라진-1-일은 임의로 치환됨)인 화합물.
- 제8항에 있어서, R1이 -CH2-(4-(메틸술포닐)피페라진-1-일)인 화합물.
- 제1항에 있어서, R2가 임의로 치환된 C1-C12 알킬인 화합물.
- 제10항에 있어서, R2가 CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2CH2CH3, 및 -CH2CH(CH3)2로부터 선택된 것인 화합물.
- 제10항에 있어서, R2가 하나 이상의 -OH로 치환된 C1-C12 알킬인 화합물.
- 제10항에 있어서, R2가 -C(CH3)2OH, -CH2CH2OH, 및 -CH2CH2CH2OH로부터 선택된 것인 화합물.
- 제10항에 있어서, R2가 하나 이상의 -F로 치환된 C1-C12 알킬인 화합물.
- 제1항에 있어서, R2가 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)인 화합물.
- 제15항에 있어서, R2가 -CH2-(피페라진-1-일) (여기서, 피페라진-1-일은 임의로 치환됨)인 화합물.
- 제16항에 있어서, R2가 -CH2-(4-(메틸술포닐)피페라진-1-일)인 화합물.
- 제1항에 있어서, R3이 피리딜, 이속사졸릴, 이미다졸릴, 피라졸릴, 피롤릴, 티아졸릴, 피리다지닐, 피리미디닐, 피라지닐, 옥사졸릴, 옥사디아졸릴, 푸라닐, 티에닐, 트리아졸릴, 및 테트라졸릴로부터 선택된 모노시클릭 헤테로아릴인 화합물.
- 제1항에 있어서, R3이 1H-인다졸-4-일인 화합물.
- 제1항에 있어서, R4가 -NR10R13인 화합물.
- 제26항에 있어서, -NR10R13이 C2-C20 헤테로시클릴 고리를 형성하는 것인 화합물.
- 제27항에 있어서, R4가 모르폴리닐인 화합물.
- 제1항에 있어서,
2-(9-(2-히드록시에틸)-2-(1H-인돌-4-일)-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
2-(2-(2-아미노-4-메틸피리미딘-5-일)-9-(2-히드록시에틸)-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
2-(2-(2-아미노피리미딘-5-일)-9-부틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9-프로필-9H-퓨린-8-일)프로판-2-올;
3-(2-(2-아미노피리미딘-5-일)-8-(2-히드록시프로판-2-일)-6-모르폴리노-9H-퓨린-9-일)프로판-1-올;
2-(2-(2-아미노피리미딘-5-일)-9-(2-히드록시에틸)-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
1-(4-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피페리딘-1-일)에타논;
1-(3-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)피롤리딘-1-일)에타논;
(R)-3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(3-히드록시피롤리딘-1-일)프로판-1-온;
(S)-3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(3-히드록시피롤리딘-1-일)프로판-1-온;
1-(3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로파노일)-N-메틸피페리딘-4-카르복스아미드;
3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(4-(메틸술포닐)피페라진-1-일)프로판-1-온;
3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-모르폴리노프로판-1-온;
3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판산;
5-(9-(4-(메틸술포닐)벤질)-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
메틸 4-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)벤조에이트;
5-(6-모르폴리노-9-(2-모르폴리노에틸)-9H-퓨린-2-일)피리미딘-2-아민;
5-(9-(3-메톡시벤질)-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
메틸 3-((2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)메틸)벤조에이트;
3-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)프로판-1-올;
2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)에탄올;
1-(2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세틸)-N-메틸피페리딘-4-카르복스아미드;
2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-(4-(메틸술포닐)피페라진-1-일)에타논;
2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)-1-모르폴리노에타논;
2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세트산;
메틸 2-(2-(2-아미노피리미딘-5-일)-6-모르폴리노-9H-퓨린-9-일)아세테이트;
5-(9-메틸-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
5-(9-메틸-6-모르폴리노-9H-퓨린-2-일)피리딘-2-아민;
4-(2-(1H-인다졸-4-일)-9-메틸-9H-퓨린-6-일)모르폴린;
2-(2-(2-아미노피리미딘-5-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
2-(2-(6-아미노피리딘-3-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
2-(2-(1H-인다졸-4-일)-9-메틸-6-모르폴리노-9H-퓨린-8-일)프로판-2-올;
4-(2-(1H-인다졸-4-일)-9-(2-메톡시에틸)-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린;
N-(4-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-6-모르폴리노-9H-퓨린-2-일)페닐)아세트아미드;
5-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-6-모르폴리노-9H-퓨린-2-일)피리딘-2-아민;
4-(2-(2-메톡시피리미딘-5-일)-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린;
4-(9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-2-(피리딘-3-일)-9H-퓨린-6-일)모르폴린;
4-(2-(1H-인다졸-4-일)-9-메틸-8-((4-(메틸술포닐)피페라진-1-일)메틸)-9H-퓨린-6-일)모르폴린;
4-(2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)아세틸)피페라진-2-온;
2-(2-(3-히드록시페닐)-6-모르폴리노-9H-퓨린-9-일)-N-메틸아세트아미드;
3-(6-모르폴리노-9-(피리딘-4-일메틸)-9H-퓨린-2-일)페놀;
3-(9-(4-플루오로벤질)-6-모르폴리노-9H-퓨린-2-일)페놀;
3-(9-벤질-6-모르폴리노-9H-퓨린-2-일)페놀;
3-(9-(2-히드록시에틸)-6-모르폴리노-9H-퓨린-2-일)페놀;
3-(9-이소부틸-6-모르폴리노-9H-퓨린-2-일)페놀;
5-(8-((4-(디메틸아미노)피페리딘-1-일)메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
5-(8-((4-(아제티딘-1-일)피페리딘-1-일)메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
5-(8-((4-(아제티딘-1-일)피페리딘-1-일)메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)-4-메틸피리미딘-2-아민;
2-(4-((2-(2-아미노-4-메틸피리미딘-5-일)-9-에틸-6-모르폴리노-9H-퓨린-8-일)메틸)피페라진-1-일)-2-메틸프로판아미드;
5-(8-((4-(디메틸아미노)피페리딘-1-일)메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)-4-메틸피리미딘-2-아민;
5-(8-(1,4'-비피페리딘-1'-일메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)-4-메틸피리미딘-2-아민;
5-(8-(1,4'-비피페리딘-1'-일메틸)-9-에틸-6-모르폴리노-9H-퓨린-2-일)피리미딘-2-아민;
5-(9-에틸-6-모르폴리노-8-((4-모르폴리노피페리딘-1-일)메틸)-9H-퓨린-2-일)-4-메틸피리미딘-2-아민;
5-(9-에틸-6-모르폴리노-8-((4-모르폴리노피페리딘-1-일)메틸)-9H-퓨린-2-일)피리미딘-2-아민;
N-(1-((2-(2-아미노-4-메틸피리미딘-5-일)-9-에틸-6-모르폴리노-9H-퓨린-8-일)메틸)피페리딘-4-일)-N-메틸메탄술폰아미드; 및
N-(1-((2-(2-아미노피리미딘-5-일)-9-에틸-6-모르폴리노-9H-퓨린-8-일)메틸)피페리딘-4-일)-N-메틸메탄술폰아미드
로부터 선택된 것인 화합물. - 제30항에 있어서, R1이 H, C1-C12 알킬, 및 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)로부터 선택되고, 여기서 알킬, 알킬렌, 및 헤테로시클릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되는 것인 화합물.
- 제1항의 화합물 및 제약상 허용되는 담체, 활택제, 희석제 또는 부형제를 포함하는 제약 조성물.
- 제32항에 있어서, 화학요법제, 항-염증제, 면역조절제, 신경영양 인자, 심혈관 질환 치료제, 간 질환 치료제, 항-바이러스제, 혈액 장애 치료제, 당뇨병 치료제, 및 면역결핍 장애 치료제로부터 선택된 추가의 치료제를 더 포함하는 제약 조성물.
- 치료 유효량의 제1항의 화합물을 포유동물에게 투여하는 것을 포함하는, 상기 포유동물에서 과다증식성 장애를 치료하는 방법.
- 제34항에 있어서, 과다증식성 장애가 암이고, 여기서 암이 유방암, 난소암, 자궁경부암, 전립선암, 고환암, 비뇨생식관암, 식도암, 후두암, 교모세포종, 신경모세포종, 위암, 피부암, 각화극세포종, 폐암, 표피양 암종, 대세포 암종, 비-소세포 폐암종 (NSCLC), 소세포 암종, 폐 선암종, 골암, 결장암, 선종, 췌장암, 선암종, 갑상선암, 난포 암종, 미분화 암종, 유두상 암종, 정상피종, 흑색종, 육종, 방광 암종, 간 암종 및 담관암, 신장 암종, 췌장암, 골수성 장애, 림프종, 모발 세포암, 구강암, 비인두암(naso-pharyngeal), 인두암, 구순암, 설암, 구강암, 소장암, 결장-직장암, 대장암, 직장암, 뇌암 및 중추신경계암, 호지킨 (Hodgkin's)병 또는 백혈병인 방법.
- 제1항의 화합물과 제약상 허용되는 담체를 합하는 것을 포함하는, 제약 조성물의 제조 방법.
- 암의 예방적 또는 치유적 치료를 위한 의약의 제조에 있어서 제1항에 따른 화합물의 용도.
- 암의 치료에 있어서 제1항에 따른 화합물의 용도.
- 치료 유효량의 제1항에 따른 화합물을 포유동물에게 투여하는 것을 포함하는, 상기 포유동물에서 지질 키나제 활성을 억제 또는 조절하는 방법.
- 제39항에 있어서, 지질 키나제가 PI3K인 방법.
- 제40항에 있어서, PI3K가 p110 알파 서브유닛인 방법.
- a) 제1항의 화합물을 포함하는 제1 제약 조성물; 및
b) 사용 지침서
를 포함하는, PI3K-매개 증상의 치료를 위한 키트. - 화학식 II의 화합물을, C6-C20 아릴, C2-C20 헤테로시클릴 또는 C1-C20 헤테로아릴을 포함하는 보로네이트 화합물과 반응시켜, 화학식 I의 화합물 및 그의 입체이성질체, 기하이성질체, 호변이성질체, 또는 제약상 허용되는 염을 형성하는 것을 포함하는, 화학식 I의 화합물의 제조 방법.
<화학식 II>
<화학식 I>
상기 식에서,
R1은 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C6-C20 아릴, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 (C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R2는 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, -(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-C(=O)-(C2-C20 헤테로시클릴), -(C1-C12 알킬렌)-(C6-C20 아릴), 및 -(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CO2CH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R3은 C6-C20 아릴, 탄소-연결된 C2-C20 헤테로시클릴 및 탄소-연결된 C1-C20 헤테로아릴로부터 선택되고, 이들은 각각 F, Cl, Br, I, -CH3, -CN, -CF3, -CH2OH, -CO2H, -CONH2, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -OH, -OCH3, -SH, -NHC(=O)NHCH3, -NHC(=O)NHCH2CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R4는 -NR10R13, -NR12C(=O)R10, -NR10(C1-C12 알킬)NR10R13, -NR10(C1-C12 알킬렌)OR10, -NR10(C1-C12 알킬렌)C(=O)NR10R13, -NR10(C1-C12 알킬렌)-(C3-C12 카르보시클릴), -NR10(C1-C12 알킬렌)-(C2-C20 헤테로시클릴), -NR10(C1-C12 알킬렌)-(C6-C20 아릴), 및 -NR10(C1-C12 알킬렌)-(C1-C20 헤테로아릴)로부터 선택되고, 여기서 알킬, 알킬렌, 카르보시클릴, 헤테로시클릴, 아릴 및 헤테로아릴은 F, Cl, Br, I, -CH3, -CH2OH, -CN, -CF3, -CO2H, -COCH3, -CONH2, -CONHCH3, -CON(CH3)2, -NO2, -NH2, -NHCH3, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -S(O)2N(CH3)2, -SCH3, -CH2OCH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되며;
R10, R11 및 R12는 독립적으로 H, C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -CH2OCH3, -CH3, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R11은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
R13은 C1-C12 알킬, C2-C8 알케닐, C2-C8 알키닐, C3-C12 카르보시클릴, C2-C20 헤테로시클릴, C6-C20 아릴, 및 C1-C20 헤테로아릴로부터 선택되고, 여기서 알킬, 알케닐, 알키닐, 카르보시클릴, 헤테로시클릴, 아릴, 및 헤테로아릴은 F, Cl, Br, I, -CH2OH, -CH2C6H5, -CN, -CF3, -CO2H, -CONH2, -CONHCH3, -NO2, -N(CH3)2, -NHCOCH3, -NHS(O)2CH3, -OH, -OCH3, -OCH2CH3, -S(O)2NH2, -SCH3, -S(O)CH3, -OCH2CH2-N(CH3)2, 및 -S(O)2CH3으로부터 독립적으로 선택된 하나 이상의 기로 임의로 치환되거나;
또는 R10 및 R13은 이들이 부착되어 있는 질소 원자와 함께 C2-C20 헤테로시클릴 고리를 형성하고;
단 R1이 -(C1-C12 알킬렌)-(C2-C20 헤테로시클릴)인 경우에는, R3은 비치환되거나 치환된 인돌이 아니다.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US5755908P | 2008-05-30 | 2008-05-30 | |
| US61/057,559 | 2008-05-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110042153A true KR20110042153A (ko) | 2011-04-25 |
Family
ID=41017038
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107026673A KR20110042153A (ko) | 2008-05-30 | 2009-05-29 | 퓨린 pi3k 억제 화합물 및 사용 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US8158624B2 (ko) |
| EP (1) | EP2279188B1 (ko) |
| JP (1) | JP2011521968A (ko) |
| KR (1) | KR20110042153A (ko) |
| CN (1) | CN102105474B (ko) |
| AU (1) | AU2009251291B2 (ko) |
| BR (1) | BRPI0909614A2 (ko) |
| CA (1) | CA2721851A1 (ko) |
| ES (1) | ES2533788T3 (ko) |
| IL (1) | IL208838A0 (ko) |
| MX (1) | MX2010012583A (ko) |
| RU (1) | RU2509081C2 (ko) |
| WO (1) | WO2009146406A1 (ko) |
| ZA (1) | ZA201007524B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180011068A (ko) * | 2015-04-21 | 2018-01-31 | 구이저우 바이링 엔터프라이즈 그룹 파마슈티컬 컴퍼니 리미티드 | 퓨리닐-n-하이드록실 피리미딘 포름아미드 유도체, 이의 제조 방법 및 용도 |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104119336B (zh) * | 2007-10-05 | 2016-08-24 | 维拉斯通股份有限公司 | 嘧啶取代的嘌呤衍生物 |
| JP5348725B2 (ja) * | 2007-10-25 | 2013-11-20 | ジェネンテック, インコーポレイテッド | チエノピリミジン化合物の製造方法 |
| JP5638955B2 (ja) * | 2007-10-26 | 2014-12-10 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Pi3キナーゼ阻害剤として有用なプリン誘導体 |
| GB0721095D0 (en) * | 2007-10-26 | 2007-12-05 | Piramed Ltd | Pharmaceutical compounds |
| US8193182B2 (en) | 2008-01-04 | 2012-06-05 | Intellikine, Inc. | Substituted isoquinolin-1(2H)-ones, and methods of use thereof |
| UA119314C2 (uk) | 2008-01-04 | 2019-06-10 | Інтеллікіне Ллк | Спосіб отримання похідних ізохінолінону (варіанти) |
| US8703778B2 (en) | 2008-09-26 | 2014-04-22 | Intellikine Llc | Heterocyclic kinase inhibitors |
| US20100233733A1 (en) * | 2009-02-10 | 2010-09-16 | Nodality, Inc., A Delaware Corporation | Multiple mechanisms for modulation of the pi3 kinase pathway |
| DK2414362T3 (da) | 2009-04-03 | 2014-09-22 | Verastem Inc | Pyrimidinsubstituerede purinforbindelser som kinaseinhibitorer |
| JP5789252B2 (ja) | 2009-05-07 | 2015-10-07 | インテリカイン, エルエルシー | 複素環式化合物およびその使用 |
| CN102459272B (zh) | 2009-05-27 | 2014-08-06 | 健泰科生物技术公司 | 对P110δ具有选择性的为PI3K抑制剂的二环嘧啶化合物和使用方法 |
| EP2451811A1 (en) * | 2009-05-27 | 2012-05-16 | F. Hoffmann-La Roche AG | Bicyclic indole-pyrimidine pi3k inhibitor compounds selective for p110 delta, and methods of use |
| KR101447789B1 (ko) * | 2009-11-12 | 2014-10-06 | 에프. 호프만-라 로슈 아게 | N-7 치환된 퓨린 및 피라졸로피리미딘 화합물, 조성물 및 사용 방법 |
| US8288381B2 (en) * | 2009-11-12 | 2012-10-16 | Genentech, Inc. | N-9 substituted purine compounds, compositions and methods of use |
| WO2011146882A1 (en) | 2010-05-21 | 2011-11-24 | Intellikine, Inc. | Chemical compounds, compositions and methods for kinase modulation |
| CA2802808A1 (en) * | 2010-07-14 | 2012-01-19 | F. Hoffmann-La Roche Ag | Purine compounds selective for pi3k p110 delta, and methods of use |
| EP2616469B1 (en) * | 2010-09-14 | 2016-10-26 | Exelixis, Inc. | 9h-purine compounds as pi3k-delta inhibitors and methods for their manufacture |
| EP2637669A4 (en) | 2010-11-10 | 2014-04-02 | Infinity Pharmaceuticals Inc | Heterocyclic compounds and their use |
| NZ609448A (en) * | 2010-12-16 | 2015-07-31 | Hoffmann La Roche | Tricyclic pi3k inhibitor compounds and methods of use |
| SG10201600179RA (en) | 2011-01-10 | 2016-02-26 | Infinity Pharmaceuticals Inc | Processes for preparing isoquinolinones and solid forms of isoquinolinones |
| WO2012156379A1 (en) | 2011-05-13 | 2012-11-22 | Universität Zürich | PIK3/P110α INHIBITORS FOR PREVENTION OF RESTENOSIS BY APPLICATION AS AN IMPLANT COATING |
| EP2734520B1 (en) | 2011-07-19 | 2016-09-14 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| WO2013012918A1 (en) | 2011-07-19 | 2013-01-24 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| CN104010494B (zh) * | 2011-07-28 | 2017-07-04 | 霍夫曼-拉罗奇有限公司 | Pik3ca h1047r敲入非人动物乳腺癌模型 |
| AU2012302197B2 (en) | 2011-08-29 | 2016-01-07 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| WO2013061305A1 (en) * | 2011-10-28 | 2013-05-02 | Novartis Ag | Novel purine derivatives and their use in the treatment of disease |
| WO2013090725A1 (en) * | 2011-12-15 | 2013-06-20 | Philadelphia Health & Education Corporation | NOVEL PI3K p110 INHIBITORS AND METHODS OF USE THEREOF |
| US8940742B2 (en) | 2012-04-10 | 2015-01-27 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| KR20160027218A (ko) | 2012-05-23 | 2016-03-09 | 에프. 호프만-라 로슈 아게 | 내배엽 및 간세포를 수득하고 사용하는 조성물 및 방법 |
| US8828998B2 (en) | 2012-06-25 | 2014-09-09 | Infinity Pharmaceuticals, Inc. | Treatment of lupus, fibrotic conditions, and inflammatory myopathies and other disorders using PI3 kinase inhibitors |
| WO2014068070A1 (en) | 2012-10-31 | 2014-05-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for preventing antiphospholipid syndrome (aps) |
| CN103936742B (zh) * | 2013-01-17 | 2017-05-03 | 程鹏 | 含嘌呤基的新型pi3k抑制剂及其制备方法和应用 |
| US9481667B2 (en) | 2013-03-15 | 2016-11-01 | Infinity Pharmaceuticals, Inc. | Salts and solid forms of isoquinolinones and composition comprising and methods of using the same |
| PL2991987T3 (pl) * | 2013-05-02 | 2018-10-31 | F. Hoffmann-La Roche Ag | Pochodne purynowe jako agoniści receptora CB2 |
| TW201520215A (zh) * | 2013-05-13 | 2015-06-01 | Daiichi Sankyo Co Ltd | N-□啉基嘌呤衍生物之製造方法 |
| US9751888B2 (en) | 2013-10-04 | 2017-09-05 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| TWI657085B (zh) | 2013-10-04 | 2019-04-21 | 英菲尼提製藥股份有限公司 | 雜環化合物及其用途 |
| MX2016004964A (es) * | 2013-10-16 | 2016-07-11 | Shanghai Yingli Pharm Co Ltd | Compuesto heterociclico fusionado, metodo de preparacion del mismo, composicion farmaceutica, y usos del mismo. |
| CN103804380B (zh) * | 2014-01-24 | 2016-05-18 | 温州医科大学 | 以IKK-β为靶点的2-氨基-8-取代鸟嘌呤衍生物、应用及其制备方法 |
| ES2913486T3 (es) | 2014-03-19 | 2022-06-02 | Infinity Pharmaceuticals Inc | Compuestos heterocíclicos para la utilización en el tratamiento de trastornos mediados por PI3K-gamma |
| WO2015160975A2 (en) | 2014-04-16 | 2015-10-22 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| WO2015188369A1 (en) | 2014-06-13 | 2015-12-17 | Merck Sharp & Dohme Corp. | Purine inhibitors of human phosphatidylinositol 3-kinase delta |
| WO2016054491A1 (en) | 2014-10-03 | 2016-04-07 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| US10172942B2 (en) * | 2014-12-17 | 2019-01-08 | Pfizer Inc. | Formulations of a PI3K/mTor-inhibitor for intravenous administration |
| WO2016157074A1 (en) | 2015-03-30 | 2016-10-06 | Daiichi Sankyo Company, Limited | 6-morpholinyl-2-pyrazolyl-9h-purine derivatives and their use as pi3k inhibitors |
| PL236355B1 (pl) * | 2015-04-02 | 2021-01-11 | Celon Pharma Spolka Akcyjna | Pochodne 7-(morfolin-4-ylo)pirazolo[1,5-α]pirymidyny jako inhibitory kinazy PI3 |
| US10160761B2 (en) | 2015-09-14 | 2018-12-25 | Infinity Pharmaceuticals, Inc. | Solid forms of isoquinolinones, and process of making, composition comprising, and methods of using the same |
| WO2017161116A1 (en) | 2016-03-17 | 2017-09-21 | Infinity Pharmaceuticals, Inc. | Isotopologues of isoquinolinone and quinazolinone compounds and uses thereof as pi3k kinase inhibitors |
| WO2017214269A1 (en) | 2016-06-08 | 2017-12-14 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| EP3474856B1 (en) | 2016-06-24 | 2022-09-14 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| TW201815787A (zh) | 2016-09-23 | 2018-05-01 | 美商基利科學股份有限公司 | 磷脂醯肌醇3-激酶抑制劑 |
| TW201825465A (zh) | 2016-09-23 | 2018-07-16 | 美商基利科學股份有限公司 | 磷脂醯肌醇3-激酶抑制劑 |
| TW201813963A (zh) | 2016-09-23 | 2018-04-16 | 美商基利科學股份有限公司 | 磷脂醯肌醇3-激酶抑制劑 |
| JPWO2018062382A1 (ja) * | 2016-09-29 | 2019-07-11 | 第一三共株式会社 | [2−(1−メチル−1h−ピラゾール−4−イル)−6−(モルホリン−4−イル)−9h−プリン−8−イル][4−(モルホリン−4−イル)ピペリジン−1−イル]メタノン及びその製薬上許容される塩の結晶 |
| KR102399639B1 (ko) | 2016-12-02 | 2022-05-18 | 다이이찌 산쿄 가부시키가이샤 | 신규 엔도-β-N-아세틸글루코사미니다아제 |
| KR20210069664A (ko) * | 2018-09-27 | 2021-06-11 | 상하이 잉리 파마슈티컬 컴퍼니 리미티드 | 모르폴리노 퀴나졸린계 화합물의 결정형태, 이의 제조방법 및 용도 |
| CN111875606B (zh) * | 2020-07-20 | 2023-04-07 | 武汉工程大学 | 一种基于虚拟对接获得的嘌呤类化合物及其制备方法和应用 |
| US11351149B2 (en) | 2020-09-03 | 2022-06-07 | Pfizer Inc. | Nitrile-containing antiviral compounds |
| CN116425751B (zh) * | 2022-12-19 | 2024-01-23 | 艾立康药业股份有限公司 | 作为mat2a抑制剂的多环类化合物 |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3016378A (en) | 1959-07-01 | 1962-01-09 | Thomae Gmbh Dr K | Amino-substituted purine derivatives |
| JPS60260579A (ja) | 1984-01-13 | 1985-12-23 | Yoshitomi Pharmaceut Ind Ltd | プリン誘導体 |
| DE3406533A1 (de) | 1984-02-23 | 1985-08-29 | Boehringer Mannheim Gmbh, 6800 Mannheim | Verwendung von adenosin-derivaten als antiallergica und arzneimittel, die diese enthalten |
| US5332744A (en) | 1989-05-30 | 1994-07-26 | Merck & Co., Inc. | Substituted imidazo-fused 6-membered heterocycles as angiotensin II antagonists |
| US5866702A (en) * | 1996-08-02 | 1999-02-02 | Cv Therapeutics, Incorporation | Purine inhibitors of cyclin dependent kinase 2 |
| US6790958B2 (en) * | 1996-08-02 | 2004-09-14 | Robert T. Lum | Purine inhibitors of cyclin dependent kinase 2 & IKBA |
| GB9817623D0 (en) * | 1998-08-13 | 1998-10-07 | Glaxo Group Ltd | Pharmaceutical compounds |
| JP2003146987A (ja) * | 1999-05-31 | 2003-05-21 | Dainippon Pharmaceut Co Ltd | 2−アリールプリン−9−アセトアミド誘導体 |
| CA2407593C (en) * | 2000-04-27 | 2011-01-11 | Yamanouchi Pharmaceutical Co. Ltd. | Fused heteroaryl derivatives |
| WO2003022274A2 (en) | 2001-09-13 | 2003-03-20 | Synta Pharmaceuticals Corp. | 2-aroylimidazole compounds for treating cancer |
| US6949644B2 (en) | 2001-10-12 | 2005-09-27 | Irm Llc | Methods for the synthesis of substituted purines |
| WO2003031406A2 (en) | 2001-10-12 | 2003-04-17 | Irm Llc | Kinase inhibitor scaffolds and methods for their preparation |
| AU2002357295A1 (en) * | 2001-12-18 | 2003-06-30 | Cv Therapeutics, Inc. | A2a adenosine receptor antagonists |
| US20030139427A1 (en) | 2002-08-23 | 2003-07-24 | Osi Pharmaceuticals Inc. | Bicyclic pyrimidinyl derivatives and methods of use thereof |
| US20050288503A1 (en) * | 2002-09-06 | 2005-12-29 | Adams Jerry L | Novel compounds |
| US7122665B2 (en) | 2002-10-15 | 2006-10-17 | Synta Pharmaceuticals Corp. | Heterocyclic compounds |
| US20080058297A1 (en) | 2003-05-29 | 2008-03-06 | Synta Pharmaceuticals Corp. | Heterocyclic Compounds For Preventing And Treating Disorders Associated With Excessive Bone Loss |
| GB0423653D0 (en) | 2004-10-25 | 2004-11-24 | Piramed Ltd | Pharmaceutical compounds |
| GB2431156A (en) * | 2005-10-11 | 2007-04-18 | Piramed Ltd | 1-cyclyl-3-substituted- -benzenes and -azines as inhibitors of phosphatidylinositol 3-kinase |
| MX2008013583A (es) | 2006-04-26 | 2008-10-31 | Genentech Inc | Compuestos del inhibidor de fosfoinositido 3-cinasa y composiciones farmaceuticas que los contienen. |
| AR063142A1 (es) | 2006-10-04 | 2008-12-30 | Pharmacopeia Inc | Derivados de 2-(bencimidazolil) purina y purinonas 6-sustituidas utiles como inmunosupresores,y composiciones farmaceuticas que los contienen. |
| US20080233127A1 (en) * | 2007-03-21 | 2008-09-25 | Wyeth | Imidazolopyrimidine analogs and their use as pi3 kinase and mtor inhibitors |
| MX2009010122A (es) * | 2007-03-28 | 2009-10-19 | Neurosearch As | Derivados de purinilo y su uso como moduladores del canal de potasio. |
| BRPI0808746B8 (pt) * | 2007-03-28 | 2021-05-25 | Neurosearch As | derivado de purinila como modulador do canal de potássio, composição farmacêutica, e, uso de um derivado de purinila. |
| JP5638955B2 (ja) * | 2007-10-26 | 2014-12-10 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Pi3キナーゼ阻害剤として有用なプリン誘導体 |
| TWI378933B (en) * | 2008-10-14 | 2012-12-11 | Daiichi Sankyo Co Ltd | Morpholinopurine derivatives |
| PE20100362A1 (es) * | 2008-10-30 | 2010-05-27 | Irm Llc | Derivados de purina que expanden las celulas madre hematopoyeticas |
| DK2414362T3 (da) * | 2009-04-03 | 2014-09-22 | Verastem Inc | Pyrimidinsubstituerede purinforbindelser som kinaseinhibitorer |
| CN102459272B (zh) * | 2009-05-27 | 2014-08-06 | 健泰科生物技术公司 | 对P110δ具有选择性的为PI3K抑制剂的二环嘧啶化合物和使用方法 |
| EP2451811A1 (en) * | 2009-05-27 | 2012-05-16 | F. Hoffmann-La Roche AG | Bicyclic indole-pyrimidine pi3k inhibitor compounds selective for p110 delta, and methods of use |
| US8288381B2 (en) * | 2009-11-12 | 2012-10-16 | Genentech, Inc. | N-9 substituted purine compounds, compositions and methods of use |
| CA2802808A1 (en) * | 2010-07-14 | 2012-01-19 | F. Hoffmann-La Roche Ag | Purine compounds selective for pi3k p110 delta, and methods of use |
-
2009
- 2009-05-29 WO PCT/US2009/045603 patent/WO2009146406A1/en active Application Filing
- 2009-05-29 EP EP09755767.2A patent/EP2279188B1/en active Active
- 2009-05-29 MX MX2010012583A patent/MX2010012583A/es active IP Right Grant
- 2009-05-29 JP JP2011511842A patent/JP2011521968A/ja active Pending
- 2009-05-29 CN CN200980129148.2A patent/CN102105474B/zh active Active
- 2009-05-29 US US12/474,613 patent/US8158624B2/en active Active
- 2009-05-29 CA CA2721851A patent/CA2721851A1/en not_active Abandoned
- 2009-05-29 ES ES09755767.2T patent/ES2533788T3/es active Active
- 2009-05-29 KR KR1020107026673A patent/KR20110042153A/ko not_active Application Discontinuation
- 2009-05-29 AU AU2009251291A patent/AU2009251291B2/en not_active Ceased
- 2009-05-29 RU RU2010154428/04A patent/RU2509081C2/ru not_active IP Right Cessation
- 2009-05-29 BR BRPI0909614A patent/BRPI0909614A2/pt not_active Application Discontinuation
-
2010
- 2010-10-20 IL IL208838A patent/IL208838A0/en unknown
- 2010-10-21 ZA ZA2010/07524A patent/ZA201007524B/en unknown
-
2012
- 2012-02-09 US US13/369,941 patent/US8445487B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180011068A (ko) * | 2015-04-21 | 2018-01-31 | 구이저우 바이링 엔터프라이즈 그룹 파마슈티컬 컴퍼니 리미티드 | 퓨리닐-n-하이드록실 피리미딘 포름아미드 유도체, 이의 제조 방법 및 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL208838A0 (en) | 2011-01-31 |
| AU2009251291A1 (en) | 2009-12-03 |
| EP2279188A1 (en) | 2011-02-02 |
| ES2533788T3 (es) | 2015-04-14 |
| AU2009251291B2 (en) | 2013-05-02 |
| US8158624B2 (en) | 2012-04-17 |
| RU2010154428A (ru) | 2012-07-10 |
| US20120135988A1 (en) | 2012-05-31 |
| RU2509081C2 (ru) | 2014-03-10 |
| US20090318411A1 (en) | 2009-12-24 |
| US8445487B2 (en) | 2013-05-21 |
| MX2010012583A (es) | 2011-02-24 |
| ZA201007524B (en) | 2012-01-25 |
| CA2721851A1 (en) | 2009-12-03 |
| CN102105474A (zh) | 2011-06-22 |
| JP2011521968A (ja) | 2011-07-28 |
| CN102105474B (zh) | 2014-01-08 |
| EP2279188B1 (en) | 2015-01-28 |
| BRPI0909614A2 (pt) | 2015-09-22 |
| WO2009146406A1 (en) | 2009-12-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2279188B1 (en) | Purine pi3k inhibitor compounds and methods of use | |
| ES2494365T3 (es) | Compuestos de pirazolopirimidina que inhiben PI3K y métodos de uso | |
| JP5775171B2 (ja) | 三環系pi3k阻害剤化合物及びその使用方法 | |
| JP5736171B2 (ja) | チアゾロピリミジンpi3k阻害剤化合物および使用方法 | |
| ES2392488T3 (es) | Compuestos inhibidores de PI3K de tipo pirazolopiridina y sus procedimientos de uso |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |