WO2017010567A1 - ヒトcrth2に特異的に結合する抗体 - Google Patents
ヒトcrth2に特異的に結合する抗体 Download PDFInfo
- Publication number
- WO2017010567A1 WO2017010567A1 PCT/JP2016/071027 JP2016071027W WO2017010567A1 WO 2017010567 A1 WO2017010567 A1 WO 2017010567A1 JP 2016071027 W JP2016071027 W JP 2016071027W WO 2017010567 A1 WO2017010567 A1 WO 2017010567A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- antibody
- amino acid
- human
- seq
- human crth2
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70596—Molecules with a "CD"-designation not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/02—Preparation of hybrid cells by fusion of two or more cells, e.g. protoplast fusion
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/88—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving prostaglandins or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/92—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving lipids, e.g. cholesterol, lipoproteins, or their receptors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
- C07K2319/43—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation containing a FLAG-tag
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
Definitions
- the present invention relates to an anti-human CRTH2 antibody that specifically recognizes and binds to human CRTH2, the antibody fragment, DNA encoding the amino acid sequence of the antibody, a vector containing the DNA, a hybridoma that produces the antibody, and an antibody-producing cell , A method for producing the antibody, a composition containing the antibody or antibody fragment, an allergic disease using the antibody or antibody fragment, an autoimmune disease, a disease associated with eosinophilia or hyperfunction, an increase in Th2 cells, The present invention relates to a therapeutic method and a diagnostic method for diseases associated with hyperfunction, and a drug and a diagnostic agent containing the antibody or antibody fragment.
- CRTH2 Human CRTH2 (Chemotractant receptor-homomologous molecular on Th2 cells) is a seven-transmembrane G protein-coupled receptor (G protein-coupled receptor, hereinafter known as GPR44, CD294, DP2, etc.) It is known to be one of the receptors for prostaglandin D2 (hereinafter referred to as PGD2) (Non-patent Document 1). CRTH2 was cloned as a human Th2-specific protein in 1996 and disclosed as B19 (Patent Document 1).
- CRTH2 binds to PGD2 metabolites represented by ligands PGD2 and 13,14-dihydro-15-keto prostalandin D2 (hereinafter referred to as DKKGD2), and transmits a signal via G ⁇ i protein in the cell.
- DKKGD2 13,14-dihydro-15-keto prostalandin D2
- Non-patent Documents 1 and 2 Human CRTH2 is expressed in Th2 cells, eosinophils, basophils, and type 2 innate lymphocytes (hereinafter referred to as ILC2) (Non-patent Documents 1 and 2). CRTH2 has been reported to be a surface marker that is specifically expressed in Th2 cytokine-producing cells (Non-patent Document 3).
- ILC2 is a novel cell population involved in allergic response identified in humans in 2011, and CRTH2 is mentioned as a specific surface marker that defines this cell (Non-patent Document 2). It has also been reported that CRTH2 is expressed in nonclassical monocyte and Th2 / Th17 cells (Non-patent Documents 4 and 5).
- Non-patent Document 6 In allergic diseases such as asthma, CRTH2-expressing cells are known to contribute to the pathology. In cells in bronchoalveolar lavage fluid in asthmatic patients, it has been reported that CRTH2-positive T cells are observed more frequently than in healthy individuals (Non-patent Document 6). It has been reported that CRTH2-positive T cells increase in correlation with the degree (Non-patent Document 7).
- Eosinophils contain a granular protein with cytotoxicity, and the deposition of the protein is observed in the airway tissue of patients with chronic bronchial asthma or the lesion site of patients with atopic dermatitis. It is considered to play an important role in the pathogenesis of allergic diseases such as asthma or atopic dermatitis (Non-Patent Documents 8 and 9).
- Basophils accumulate inflammatory molecules such as histamine and leukotriene in the cell, and release these molecules by cross-linking of Fc ⁇ receptors and Fc ⁇ receptors expressed on the cell surface. (Non-Patent Document 10).
- ILC2 is a locally present cell such as airway mucosa and skin, and produces a large amount of Th2 cytokine in response to cytokines such as interleukin (hereinafter referred to as IL) -25 and IL-33 produced by tissue damage. Therefore, it is considered to be involved in the pathogenesis of allergic diseases (Non-patent Document 11).
- IL interleukin
- 301108 (R & D) is commercially available as a monoclonal antibody against CRTH2.
- BM16 is also known (Patent Document 2). These are rodent antibodies and have not been developed as pharmaceuticals.
- the recombinant chimeric antibody and humanized antibody related to clone 19A2 remove CRTH2-expressing cells by effector activity
- the humanized antibody related to clone 8B1 and mouse antibodies related to clones 3C12 and 31A5 have antagonist activity against CRTH2. It has been shown.
- a plurality of human CRTH2 antibodies have been established so far, such as reactivity to various human immune cells, specific binding activity to human CRTH2, or influence on human CRTH2 ligand-dependent activity. Establishment of an anti-human CRTH2 antibody having activity has been desired.
- An object of the present invention is to recognize an anti-human CRTH2 antibody having a desired activity by recognizing and binding to a characteristic epitope of human CRTH2, the antibody fragment, a DNA encoding the amino acid sequence of the antibody, and a vector containing the DNA , Hybridomas and antibody-producing cells that produce the antibodies, methods for producing the antibodies, compositions containing the antibodies or antibody fragments, allergic diseases, autoimmune diseases, eosinophilia and functions using the antibodies or antibody fragments It is to provide a therapeutic method and a diagnostic method for diseases associated with enhancement, diseases associated with increased Th2 cells and hyperfunction, and a medicine and diagnostic agent containing the antibody or antibody fragment.
- the present invention relates to the following (1) to (26).
- An antibody or antibody fragment that recognizes and binds to at least one of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2.
- the antibody is the 12th proline, 13th isoleucine, 14th leucine, 15th glutamic acid, 177th aspartic acid, 178th glycine of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2; 179th arginine, 180th isoleucine, 181st methionine, 182nd cysteine, 183th tyrosine, 184th tyrosine, 185th asparagine, 186th valine, 187th leucine, 188th leucine, An antibody that recognizes and binds to at least one amino acid residue selected from the group consisting of 189th leucine, 195th arginine, 196th aspartic acid, 197th alanine, and 198th threonine (1 Or an antibody thereof Pieces.
- Complementarity determining regions (hereinafter abbreviated as CDR) 1 to 3 of the antibody heavy chain variable region (hereinafter abbreviated as VH) each contain the amino acid sequence represented by SEQ ID NOs: 20 to 22, and An antibody in which CDRs 1 to 3 of the antibody light chain variable region (hereinafter abbreviated as VL) each comprise an amino acid sequence represented by SEQ ID NOs: 23 to 25, (B) the amino acid sequence represented by SEQ ID NO: 49 or the 18th leucine in the amino acid sequence represented by SEQ ID NO: 49 as methionine, the 77th asparagine as serine, the 93rd valine as threonine, and 117 A VH containing an amino acid sequence into which at least one modification selected from a modification replacing threonine with valine is introduced and the second
- the antibody or the antibody fragment thereof according to any one of (1) to (4), wherein the antibody is an antibody having at least one characteristic selected from the group consisting of the following (a) to (h).
- A) the reactivity to human CRTH2 does not decrease in the presence of a ligand for human CRTH2,
- B) has no neutralizing activity;
- C) has antibody-dependent cellular cytotoxicity (ADCC) activity,
- D) does not respond to at least one of mast cells and Th1 cells,
- E It reacts with at least one cell selected from eosinophils, basophils, Th2 cells and type 2 natural lymphocytes (ILC2).
- (F) has no agonist activity
- (G) does not enhance the signal by the ligand of human CRTH2, and (h) does not change the reactivity of activated or inactivated human CRTH2.
- (6) The antibody or the antibody fragment thereof according to any one of (1) to (5), wherein the antibody is an antibody containing a human Fc region.
- (7) The antibody or the antibody fragment thereof according to any one of (1) to (6), wherein the antibody is a monoclonal antibody.
- the hybridoma according to (12) or the transformant according to (15) is cultured in a medium, and the antibody or antibody fragment according to any one of (1) to (11) is cultured in the culture.
- the disease associated with CRTH2 is an allergic disease, an autoimmune disease, a disease associated with at least one of eosinophilia and hyperfunction, a disease associated with at least one of Th2 cell proliferation and hyperfunction, or type 2
- the disease associated with human CRTH2 is an allergic disease, an autoimmune disease, a disease associated with at least one of eosinophilia and hyperfunction, a disease associated with at least one of Th2 cell proliferation and hyperfunction, or ILC2
- a disease associated with human CRTH2 is an allergic disease, an autoimmune disease, a disease associated with at least one of eosinophilia and hyperfunction, a disease associated with at least one of Th2 cell proliferation and hyperfunction, or ILC2
- the disease associated with human CRTH2 is an allergic disease, an autoimmune disease, a disease with at least one of eosinophilia and hyperfunction, a disease with at least one of Th2 cell proliferation and hyperfunction, or ILC2 (25)
- the present invention provides an antibody or antibody fragment that recognizes and binds to at least one of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2.
- the antibody of the present invention specifically reacts with cells expressing CRTH2, such as eosinophils, basophils Th2 cells, and ILC2, and exhibits high reactivity with CRTH2-expressing cells even in the presence of a high concentration of ligand. It does not have agonist activity, neutralization activity, or signal enhancement activity by the ligand of human CRTH2. Therefore, the antibody or antibody fragment of the present invention can exert a therapeutic effect targeting cells expressing CRTH2, such as eosinophils, basophils, Th2 cells, ILC2 and the like, which express CRTH2.
- FIG. 1 shows the amino acid sequences of the Lym2 antibody light chain variable region and the respective humanized Lym2 antibody light chain variable regions (LV0, LV1, LV2a, LV2b, LV2c, LV3a, LV3b and LV4) that do not contain a signal sequence.
- a region surrounded by a frame in each sequence indicates a CDR sequence.
- FIG. 2 shows the amino acid sequences of the Lym2 antibody heavy chain variable region and the respective humanized Lym2 antibody heavy chain variable regions (HV0, HV1, HV2a, HV2b, HV3 and HV4) that do not contain a signal sequence.
- a region surrounded by a frame in each sequence indicates a CDR sequence.
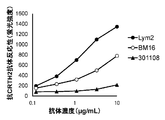
- 3 (A) to (C) show flow cytometry of cytotoxic activity of rat / human chimeric Lym2 antibody (hereinafter sometimes referred to as chLym2) and humanized Lym2 antibody against human eosinophils and human basophils.
- chLym2 human chimeric Lym2 antibody
- FIG. 3 (A) o indicates chLym2
- ⁇ indicates a humanized Lym2 antibody LV0HV0
- ⁇ indicates an isotype control antibody.
- FIG. 3 (B) o represents chLym2, ⁇ represents humanized Lym2 antibody LV0HV1, and ⁇ represents an isotype control antibody.
- FIG. 3 (C) o represents chLym2, ⁇ represents humanized Lym2 antibody LV0HV2a, and ⁇ represents an isotype control antibody.
- FIG. 4 (A) shows the reactivity of humanized Lym2 antibody LV0HV1
- FIG. 4 (B) shows the reactivity of chLym2 to cells expressing each human CRTH2 amino acid substitution product.
- the vertical axis represents the fluorescence intensity of thistle green tag, and the relative fluorescence intensity corrected for the fluorescence intensity of each anti-human CRTH2 monoclonal antibody was defined as a reactivity value of 100% for wild-type human CRTH2-expressing cells. The reactivity value (%) for each amino acid substitution product-expressing cell is shown. On the horizontal axis, WT represents wild-type human CRTH2, and the others indicate the type of amino acid substitution product. * Means that the relative fluorescence intensity decreased by 90% or more from the relative fluorescence intensity of wild-type CRTH2. The same applies to FIGS. 5 to 7 below.
- FIG. 5A shows the reactivity of hu19A2 v52 and FIG.
- FIG. 5B shows the reactivity of hu8B1 v1 with each CRTH2 amino acid substitution product.
- FIG. 6 (A) shows the reactivity of ch3C12 and
- FIG. 6 (B) shows the reactivity of ch31A5 to each CRTH2 amino acid substitution product.
- FIG. 7 shows the reactivity of BM16 against each CRTH2 amino acid substitution product.
- FIG. 8 shows the results of flow cytometry analysis of the reactivity of the anti-human CRTH2 monoclonal antibody to human eosinophils.
- FIG. 9 shows the results of analyzing the reactivity of chLym2 to human basophils by flow cytometry.
- the filled portion indicates the reactivity of the isotype control antibody, the portion surrounded by a solid line indicates the reactivity of chLym2, the vertical axis indicates the number of cells, and the horizontal axis indicates the fluorescence intensity.
- FIG. 10 shows the results of flow cytometry analysis of the reactivity of the humanized Lym2 antibody LV0HV1 against human CD4-positive T cells.
- FIG. 11 (A) and FIG. 11 (B) show the results of analyzing the cytotoxic activity of anti-human CRTH2 monoclonal antibody against human eosinophils and human basophils by flow cytometry.
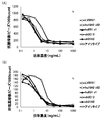
- FIG. 12 (A) and FIG. 12 (B) show the results of analyzing the human Th2 and Th1 cytokine reduction activity of the anti-human CRTH2 monoclonal antibody.
- FIG. 12 (B) show the results of analyzing the human Th2 and Th1 cytokine reduction activity of the anti-human CRTH2 monoclonal antibody.
- FIG. 12 (A) shows the concentration of IL-5 or IL-13, which is a Th2 cytokine, when each antibody is added on the vertical axis.
- FIG. 12B shows the concentration of IFN- ⁇ , which is a Th1 cytokine, when each antibody is added on the vertical axis.
- FIG. 13 (A) to FIG. 13 (C) show the results of flow cytometry analysis of the reactivity change of anti-human CRTH2 monoclonal antibody in the presence of CRTH2 ligand DKKGD2, using human CRTH2-expressing 293EBNA cells. .
- the vertical axis represents the ratio of the fluorescence intensity when the fluorescence intensity in the absence of DKKGD2 is 100%.
- FIG. 14 shows the results of flow cytometry analysis of the reactivity of anti-human CRTH2 monoclonal antibody against human differentiation-induced mast cells stimulated by IgE and cross-linking antibody treatment.
- FIG. 15 shows the results of flow cytometry analysis of the reactivity of the anti-human CRTH2 monoclonal antibody to human differentiation-induced Th1 cells.
- Each figure shows the reactivity of the antibody shown on the top of the figure, with the number of cells on the vertical axis and the fluorescence intensity on the horizontal axis.
- FIG. 16 shows the results of evaluation of antagonistic activity of Lym2 antibody using the morphological change of human eosinophils as an index.
- the percentage of eosinophils detected in the high FSC region in the flow cytometer analysis when DKKGD2 at the concentration shown in the legend was treated in the presence or absence of each antibody shown below the graph is shown in the vertical direction. Shown on the axis.
- FIG. 17 shows the results of evaluating the agonist activity of Lym2 antibody using the morphological change of human eosinophils as an index.
- FIG. 18 (A) to FIG. 18 (C) show the results of the evaluation of the agonist activity, antagonist activity, and enhancement activity of activation by the ligand of the anti-human CRTH2 monoclonal antibody using the morphological change of human eosinophils as an index. Show. FIG. 18A shows the results for humanized antibody or chimeric antibody, FIG. 18B shows the results for rat antibody, and FIG. 18C shows the results for mouse antibody.
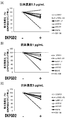
- FIG. 19 shows the results of analysis by ELISA of the effect of CRTH2 conformational change on the reactivity of CRTH2 monoclonal antibody by GTP ⁇ S or GDP treatment of the membrane fraction of CRTH2-expressing cells.
- the vertical axis shows the Fold change when the absorbance when GTP ⁇ S and GDP are not treated is 1.
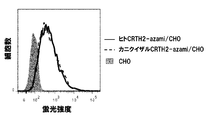
- FIG. 20 shows the results of flow cytometry analysis of thistle green expression in thistle green-fused human CRTH2-expressing CHO / DG44 cells and cynomolgus CRTH2-expressing CHO / DG44 cells.
- the vertical axis represents the number of cells, and the horizontal axis represents the fluorescence intensity of thistle green.
- Fluorescence intensity in CHO / DG44 cells whose solid-filled portion is the parent cell portions surrounded by a solid line are fluorescence intensities in thistle green-fused human CRTH2-expressing CHO / DG44 cells, and portions surrounded by a dotted line are thistle green-fused cynomolgus CRTH2
- the fluorescence intensity in the expressed CHO / DG44 cells is shown respectively.
- ⁇ is the reactivity of LV0HV1 to thistle green fusion human CRTH2-expressing CHO / DG44 cells
- ⁇ is the reactivity of LV0HV1 to thistle green fusion cynomolgus CRTH2 expression CHO / DG44 cells
- ⁇ is the isotype to thistle green fusion human CRTH2 expression CHO / DG44 cells
- Antibody reactivity indicates the reactivity of the isotype antibody to thistle green-fused cynomolgus CRTH2-expressing CHO / DG44 cells
- the vertical axis indicates the fluorescence intensity
- the horizontal axis indicates the antibody concentration of each antibody.
- human CRTH2 in the present invention there may be mentioned a polypeptide comprising an amino acid sequence represented by SEQ ID NO: 2 or GenBank accession number BAA74518.
- a polypeptide having an amino acid sequence and having the function of human CRTH2 is also encompassed by human CRTH2 in the present invention.
- polypeptide having an amino acid sequence in which one or more amino acids are deleted, substituted, inserted and / or added can be obtained by site-directed mutagenesis [Molecular Cloning, A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press (1989), Current Protocols in Molecular Biology, John Wiley & Sons (1987-1997), Nucleic Acids Research, 10, 6487 (1982), Proc. Sci. USA, 79, 6409 (1982), Gene, 34, 315 (1985), Nucleic Acids Research, 13 4431 (1985), Proc. Natl. Acad. Sci.
- the number of amino acids to be deleted, substituted or added is not particularly limited, but is preferably 1 to several tens, for example 1 to 20, more preferably 1 to several, for example 1 to 5 amino acids. It is.
- Examples of the gene encoding human CRTH2 include GenBank Accession No. AB008535 or the base sequence represented by SEQ ID No. 1. Gene comprising DNA encoding a protein having a human CRTH2 function, comprising a base sequence in which one or more bases are deleted, substituted or added in the base sequence represented by GenBank Accession No. AB008535 or SEQ ID No. 1. , GenBank Accession No.
- genes comprising DNA encoding that polypeptide are encompassed gene encoding CRTH2 of the present invention.
- DNA having the nucleotide sequence represented by SEQ ID NO: 1 was used as a probe, colony hybridization method, plaque hybridization method, Southern blot hybridization method, Alternatively, it means a hybridizable DNA obtained by a DNA microarray method or the like.
- 0.7 to 1.0 mol / L of sodium chloride is present using a DNA or DNA derived from a hybridized colony or plaque, or a filter or slide glass on which a PCR product or oligo DNA having the sequence is immobilized.
- the DNA capable of hybridizing is DNA having at least 60% homology with the base sequence represented by GenBank Accession No. AB008535 or SEQ ID No. 1, preferably DNA having 80% or more homology, more preferably Mention may be made of DNA having a homology of 95% or more.
- the gene used in the present invention includes a gene in which a small-scale mutation has occurred in the nucleotide sequence due to such a polymorphism, and is included in the gene encoding human CRTH2 of the present invention.
- the numerical value of homology in the present invention may be a numerical value calculated using a homology search program known to those skilled in the art, but for the base sequence, BLAST [J. Mol. Biol ., 215, 403 (1990)], for amino acid sequences such as numerical values calculated using default parameters, BLAST2 [Nucleic Acids Res., 25, 3389 (1997), Genome Res., 7, 649 (1997) ), Http://www.ncbi.nlm.nih.gov/Education/BLASTinfo/information3.html] and numerical values calculated using default parameters.
- the default parameters are 5 if G (Cost to open gap) is a base sequence, 11 if it is an amino acid sequence, 2 if -E (Cost to extend gap) is a base sequence, and 1 if it is an amino acid sequence.
- -Q (Penalty for nucleotide mismatch) is -3
- -r (reward for nucleotide match) is 1
- -e (expect value) is 10
- 11 residues when -W (wordsize) is a base sequence
- -y [Dropoff (X) for blast extensions in bits] is 20 if blastn, 7 for programs other than blastn
- -X X dropoff value f
- a polypeptide comprising a partial sequence of the amino acid sequence represented by SEQ ID NO: 2 or GenBank accession number BAA74518 can be prepared by methods known to those skilled in the art. For example, it can be produced by culturing a transformant into which a part of DNA encoding the amino acid sequence represented by SEQ ID NO: 2 has been deleted and an expression vector containing the DNA is introduced. Further, based on the polypeptide or DNA produced by the above method, one or more amino acids in the partial sequence of the amino acid sequence represented by SEQ ID NO: 2 or GenBank accession number BAA74518 are deleted by the same method as described above. A polypeptide having a substituted or added amino acid sequence can be obtained.
- polypeptide comprising a partial sequence of the amino acid sequence represented by SEQ ID NO: 2 or GenBank accession number BAA74518, or one or more amino acids in the partial sequence of the amino acid sequence represented by SEQ ID NO: 2 or GenBank accession number BAA74518 is deleted.
- a polypeptide having a substituted or added amino acid sequence can also be produced by a chemical synthesis method such as a fluorenylmethyloxycarbonyl (Fmoc) method or a t-butyloxycarbonyl (tBoc) method.
- Human CRTH2 functions as human CRTH2 include human CRTH2-dependent intracellular signals transmitted by binding to its ligand, for example, PGD2, migration of cells expressing human CRTH2, increased cytokine production from the cells, or cell diameter In other words, cell shape change accompanied by changes in cell surface area is induced.
- the extracellular region of human CRTH2 includes an N-terminal region containing amino acid residues 1 to 33 of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2, a loop 1 region containing amino acid residues 95 to 111, Examples include a loop 2 region containing amino acid residues 169-206 and a loop 3 region containing amino acid residues 264-285 [J Immunol, 1999. 162 (3): p.1278-86.].
- the N-terminal region, loop 1 region, loop 2 region and loop 3 region respectively, the 1st to 33rd, 95th to 111th, 169th to 206th and 264 in the amino acid sequence represented by SEQ ID NO: 2, respectively. Examples thereof include a polypeptide part containing the amino acid residue at position 285.
- the antibody in the present invention may be any antibody such as a monoclonal antibody or a polyclonal antibody, and preferably a monoclonal antibody.
- Specific examples of the antibody of the present invention include an antibody produced by a hybridoma or a gene recombinant antibody produced by a gene recombination technique.
- Examples of genetically engineered antibodies include mouse antibodies, rat antibodies, human chimeric antibodies, humanized antibodies, and human antibodies produced by genetic engineering techniques.
- a monoclonal antibody is an antibody that is secreted by an antibody-producing cell of a single clone, recognizes only one epitope (also referred to as an antigenic determinant), and has a uniform amino acid sequence (primary structure) constituting the monoclonal antibody. .
- the monoclonal antibody includes a recombinant antibody produced by a gene recombination technique such as an antibody produced by a hybridoma or an antibody produced by a transformant transformed with an expression vector containing an antibody gene. be able to.
- a polyclonal antibody is an antibody group including two or more monoclonal antibodies, and a plurality of epitopes can be recognized by a plurality of antibodies constituting the antibody group.
- the epitope includes a single amino acid sequence recognized and bound by a monoclonal antibody and a three-dimensional structure composed of the amino acid sequence, an amino acid sequence modified by post-translational modification, and a three-dimensional structure composed of the amino acid sequence.
- the amino acid sequence modified by post-translational modification includes an O-linked sugar chain bonded to threonine and serine having an OH substituent, an N-linked sugar chain bonded to glutamine and asparagine having an NH 2 substituent, and An amino acid sequence in which a sulfate group bonded to threonine having an OH substituent on the sulfate molecule is bound.
- the epitope of human CRTH2 recognized by the antibody of the present invention includes a deletion in which a part of human CRTH2 is deleted, a mutant in which a part of human CRTH2 is substituted with another amino acid residue, It can be determined by conducting antibody binding experiments using mutants substituted with domains derived from other proteins, partial peptide fragments of human CRTH2, and the like.
- the epitope of human CRTH2 to which the antibody of the present invention binds should be determined by adding the antibody of the present invention to human CRTH2 digested with proteolytic enzyme and performing epitope mapping using known mass spectrometry. Can do.
- amino acid residues contained in the epitope of human CRTH2 recognized by the antibody of the present invention include amino acid residues in which the reactivity of the antibody of the present invention is lost by substitution of the amino acid residue.
- the reactivity of the antibody in the present invention is determined by, for example, the amount of antibody binding to a cell expressing wild type human CRTH2 receptor or amino acid substitution (corrected according to the expression level of the wild type and substitution) by flow cytometry. It can obtain
- the amount of antibody bound can be determined by radioimmunoassay using a solid phase sandwich method or the like, a known immunological detection method for human CRTH2 using enzyme immunoassay (ELISA), or the Biacore system (GE Healthcare). ) Etc. can be confirmed by a method such as surface plasmon resonance.
- the loss of antibody reactivity in the present invention means that the reactivity of an antibody to a cell expressing an amino acid substitution is 70% or more, preferably 80, compared to the reactivity of the antibody to a cell expressing wild type human CRTH2. % Or more, more preferably 90% or more, still more preferably 95% or more.
- Examples of the epitope to which the antibody of the present invention binds include an epitope containing at least one amino acid residue of 192nd glycine and 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2.
- epitope to which the antibody of the present invention binds include the following epitopes (a) to (c).
- the epitope to which the antibody of the present invention binds includes at least one amino acid residue of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2, and SEQ ID NO: 2
- the 12th proline, 14th leucine, 15th glutamic acid, 177th aspartic acid, 178th glycine, 179th arginine, 180th isoleucine, 181th methionine of the amino acid sequence of human CRTH2 represented by 183rd tyrosine, 184th tyrosine, 185th asparagine, 187th leucine, 188th leucine, 189th leucine, 195th arginine, 196th aspartic acid, and 198th threonine Choose from Epitope comprising at least one amino acid residue and the like that.
- the epitope to which the antibody of the present invention binds contains at least one amino acid residue of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2, and the following (a ) To (g).
- amino acid residues contained in the epitope to which the antibody of the present invention binds are present in the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2 when the antibody of the present invention binds to CRTH2, and Any amino acid residue may be used as long as it is a substantially recognized and bound amino acid residue.
- the 12th proline of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2 the 14th leucine, 15th glutamic acid, 177th aspartic acid, 178th glycine, 179th arginine, 180th isoleucine, 181st methionine, 183rd tyrosine, 184th tyrosine, 185th asparagine, 187th leucine 188th leucine, 189th leucine, 192nd glycine, 194
- Antibody molecules are also referred to as immunoglobulins (hereinafter referred to as Ig), and human antibodies are classified into IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 and IgM isotypes according to the difference in molecular structure. Is done. IgG1, IgG2, IgG3, and IgG4 having relatively high amino acid sequence homology are collectively referred to as IgG.
- Antibody molecules are composed of polypeptides called heavy chains (hereinafter referred to as H chains) and light chains (hereinafter referred to as L chains).
- H chains is an H chain variable region (also expressed as VH)
- H chain constant region also expressed as CH
- L chain is also expressed as an L chain variable region (VL) from the N terminal side.
- CL Each region of the L chain constant region (also expressed as CL).
- CH has known ⁇ , ⁇ , ⁇ , ⁇ , and ⁇ chains for each subclass.
- CH is further composed of each domain of the CH1 domain, hinge domain, CH2 domain, and CH3 domain from the N-terminal side.
- a domain refers to a functional structural unit constituting each polypeptide of an antibody molecule.
- the CH2 domain and the CH3 domain are collectively referred to as an Fc region or simply Fc.
- CL C ⁇ chain and C ⁇ chain are known.
- any CH can be used as long as it belongs to Ig, but IgG class is preferable, and any of subclasses such as IgG1, IgG2, IgG3, and IgG4 belonging to IgG class can be used. .
- the amino acid sequence of CL in the antibody of the present invention may be either an amino acid sequence of a human antibody or an amino acid sequence of a non-human animal antibody, but C ⁇ or C ⁇ of an amino acid sequence of a human antibody is preferable.
- the antibody of the present invention is an antibody that recognizes and binds to at least one amino acid residue of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2.
- antibody of the present invention include antibodies selected from the following (a) to (c).
- A an antibody that recognizes and binds to the 192nd glycine of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2
- B an antibody that recognizes and binds to the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2
- C An antibody that recognizes and binds to both the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2.
- the antibody of the present invention recognizes at least one amino acid residue of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2 and is represented by SEQ ID NO: 2.
- the antibody of the present invention recognizes at least one amino acid residue of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2, and the following (a) to ( An antibody that recognizes and binds to at least one of g).
- the antibody of the present invention include antibodies selected from the following (a) to (d).
- the antibody (b) of the present invention refers to an anti-human CRTH2 antibody that inhibits the binding between the antibody (a) and human CRTH2.
- the antibody of (c) of the present invention refers to an epitope containing the first epitope when the antibody described in (a) is the first antibody and the epitope to which the first antibody binds is the first epitope. Indicates an antibody that binds to.
- antibody of the present invention include antibodies selected from the following (a) to (c).
- A the amino acid sequence represented by SEQ ID NO: 49 or the 18th leucine in the amino acid sequence represented by SEQ ID NO: 49 as methionine, the 77th asparagine as serine, the 93rd valine as threonine, and 117
- a VH containing an amino acid sequence into which at least one modification selected from a modification replacing threonine with valine is introduced and the amino acid sequence represented by SEQ ID NO: 33 or the second amino acid in the amino acid sequence represented by SEQ ID NO: 33 Contains a VL comprising an amino acid sequence introduced with at least one modification selected from a modification that substitutes isoleucine for valine, 4th methionine for leucine, 15th proline for leucine, and 85th alanine for proline antibody,
- B A VH containing any one of the amino acid sequences represented by SEQ ID NOs: 49, 51, 53, 55, 57
- Preferred examples of the antibody (b) include antibodies selected from the following (1) to (3).
- An antibody comprising VH comprising the amino acid sequence represented by SEQ ID NO: 49 and VL comprising any one of the amino acid sequences represented by SEQ ID NOs: 33, 35, 37, 39, 41, 43, 45 and 47 (2)
- an antibody comprising VH comprising any one of the amino acid sequences represented by SEQ ID NOs: 51, 53, 55 and 57 and VL comprising the amino acid sequence represented by SEQ ID NO: 33 Particularly preferable examples of the antibody of (b) include an antibody containing VH containing the amino acid sequence represented by SEQ ID NO: 51 and VL containing the amino acid sequence represented by SEQ ID NO: 33.
- Examples of the antibody of the present invention include an antibody that loses reactivity with an amino acid substitution product in which at least one of 192nd glycine and 194th aspartic acid of human CRTH2 is substituted with alanine.
- the antibody of the present invention includes an antibody whose reactivity to human CRTH2 does not decrease in the presence of a ligand of human CRTH2.
- An antibody whose reactivity to human CRTH2 does not decrease in the presence of a ligand for human CRTH2 is a condition where the ligand for human CRTH2 is present at a high concentration, such as in the local area of inflammation, compared to an antibody whose reactivity to human CRTH2 is decreased. But it can show high reactivity. Therefore, it can specifically bind to human CRTH2 independent of human CRTH2 ligand, and can exhibit a medicinal effect.
- the decrease in antibody reactivity in the presence of human CRTH2 ligand means that the antibody reactivity to human CRTH2-expressing cells in the absence of human CRTH2 ligand is higher in the presence of human CRTH2 ligand. It shows that the reactivity of is reduced by at least 5% or more. More strictly, it indicates a decrease of 10% or more.
- the ligand for human CRTH2 includes any ligand that specifically binds to human CRTH2, and preferably includes PGD2 or DKKGD2. More preferably, DKKGD2 is mentioned.
- responsiveness to activated or inactivated human CRTH2 does not change in the presence or absence of guanosine diphosphate (GDP) or GDP analog, or guanosine triphosphate (GTP) or GTP analog.
- GDP guanosine diphosphate
- GDP analog include guanosine 5′-O- ( ⁇ -thio) diphosphate (GDP ⁇ S).
- GTP analog include guanosine 5′-O- ( ⁇ -thio) triphosphate (GTP ⁇ S).
- the antibody of the present invention has an antibody having no neutralizing activity, an antibody having no agonist activity, an antibody that does not enhance the signal by the ligand of human CRTH2, or a change in reactivity to activated or inactivated human CRTH2.
- Non-antibodies are included.
- the neutralizing activity of an antibody refers to an activity that inhibits the biological activity of human CRTH2 possessed by the antibody.
- it refers to an antagonist activity such as an activity that inhibits the binding between human CRTH2 and its ligand and an activity that inhibits signal transduction by human CRTH2.
- agonist activity refers to an activity that mimics the biological activity of a ligand for human CRTH2, and refers to an activity that induces activation of CRTH2 and various reactions associated with the activation.
- Specific examples of the agonist activity in the present invention include cell migration activity and cell shape change inducing activity.
- the signal from the ligand of human CRTH2 refers to a signal associated with the activation of human CRTH2 by binding of the ligand of human CRTH2 to human CRTH2.
- the signal and agonist activity of human CRTH2 ligand can be evaluated by analyzing various reactions associated with the activation of human CRTH2. For example, it can be evaluated by analyzing morphological changes of human CRTH2-expressing cells.
- the human CRTH2-expressing cell may be any cell as long as it expresses human CRTH2.
- eosinophils, basophils, Th2 cells, type 2 natural lymphocytes (ILC2), nonclassical monocyte, Th2 / Th17 Examples include cells.
- the fact that the antibody does not enhance the signal from the ligand of human CRTH2 means that when the human CRTH2 ligand and the antibody are allowed to act on human CRTH2, compared to when the human CRTH2 ligand acts alone. , Refers to activation of human CRTH2 and not to enhance various reactions associated with the activation.
- the antibody of the present invention includes an antibody exhibiting cytotoxic activity against human CRTH2-expressing cells.
- Examples of the cytotoxic activity in the present invention include complement-dependent cytotoxic activity (hereinafter referred to as CDC activity) or antibody-dependent cytotoxic activity (hereinafter referred to as ADCC activity).
- an antibody molecule bound to human CRTH2 on the cell surface binds to C1q of the complement system through the Fc portion, and as a result, each complement component of C1 to C9 is activated, Specifically, there is a reaction in which C5 to C9 form a pore-forming polymer called a membrane attack complex on the cell membrane to cause cell lysis [Immunol Today. 1999 Dec; 20 (12): 576-82.].
- ADCC activity in the present invention includes, for example, natural killer cells (hereinafter referred to as NK cells) in which an antibody molecule bound to human CRTH2 on the cell surface expresses an Fc receptor via the Fc portion.
- Activation may include cytotoxic reactions such as release of cytotoxic molecules such as perforin and granzyme and enhanced phagocytosis [Chemical Immunology, 65, 88 (1997); Immunol ; Today, 20, 576 (1999) )].
- the antibody of the present invention includes an antibody having no cytotoxicity against mast cells. Such an antibody has the advantage that there is no concern of side effects due to the release of inflammatory mediators due to mast cell injury.
- the antibody of the present invention includes an antibody in which an N-glycoside-linked sugar chain is bound to the Fc region of the antibody and fucose is not bound to N-acetylglucosamine at the reducing end of the N-glycoside-bound sugar chain.
- An antibody in which an N-glycoside-linked sugar chain is bound to the Fc region of the antibody and fucose is not bound to N-acetylglucosamine at the reducing end of the N-glycoside-linked sugar chain includes, for example, ⁇ 1,6-fucose transferase gene And antibodies produced using CHO cells deficient in (WO 2005/035586, WO 02/31140).
- the antibody of the present invention in which an N-glycoside-linked sugar chain is bound to the Fc region of the antibody and fucose is not bound to N-acetylglucosamine at the reducing end of the N-glycoside-linked sugar chain has high ADCC activity.
- the antibody of the present invention includes an antibody in which an amino acid residue in the Fc region of the antibody is modified so that the binding activity to the Fc receptor is increased.
- Examples of antibodies in which the amino acid residues in the Fc region of the antibody have been modified so as to increase the binding activity to the Fc receptor include antibody molecules produced by the method described in US Pat. No. 7,317,091. .
- the antibody of the present invention includes an antibody having an increased blood half-life by modifying the surface charge of the polypeptide containing the variable region of the antibody or the antigen binding activity at a pH in the early endosome.
- Examples of antibodies that have an increased blood half-life by modifying the surface charge of the polypeptide containing the variable region of the antibody molecule or the antigen-binding activity at an early endosome pH at pH include, for example, Japanese Patent Application Laid-Open No. 2013-165716, Japan An antibody produced by the method described in JP2012-021004A can be mentioned.
- the antibodies of the present invention include recombinant antibodies such as human chimeric antibodies (hereinafter also simply referred to as chimeric antibodies), human CDR-grafted antibodies (hereinafter also referred to as humanized antibodies), and human antibodies.
- Chimeric antibody refers to an antibody consisting of VH and VL of an antibody from a non-human animal (non-human animal) and CH and CL of a human antibody.
- non-human animal any mouse, rat, hamster, rabbit or the like can be used as long as it can produce a hybridoma.
- the chimeric antibody of the present invention obtains cDNA encoding VH and VL of a non-human animal antibody that specifically reacts with human CRTH2, and has an expression vector for animal cells having genes encoding CH and CL of the human antibody
- the chimeric antibody expression vector can be constructed by inserting each into, and introduced into animal cells for expression and production.
- the humanized antibody means an antibody obtained by grafting CDRs of VH and VL of an antibody of a non-human animal into appropriate positions of VH and VL of a human antibody.
- the humanized antibody of the present invention transplants the VH and VL CDRs of non-human animal antibodies that specifically react with human CRTH2 into the VH and VL frameworks (hereinafter referred to as FR) of any human antibody.
- CDNA encoding the variable region (hereinafter also referred to as V region) is constructed, and inserted into an expression vector for animal cells having DNA encoding CH and CL to construct a humanized antibody expression vector, and the expression vector Can be expressed and produced by introducing it into animal cells.
- human antibody VH and VL FRs any amino acid sequence derived from a human antibody can be used.
- human antibody VH and VL FR amino acid sequences registered in databases such as Protein Data Bank, or human antibody VH and VL FR subgroup common amino acid sequences (Sequencesenceof Proteins of Immunological Interest, US Dept. Health and Human Services, 1991).
- one or more amino acids are deleted, added, substituted or inserted, specifically bind to human CRTH2, and have an equivalent function in biological activities such as cytotoxic activity, for example
- the antibody fragment is also encompassed by the antibody of the present invention.
- the antibody of the present invention includes an antibody that binds to monkey CRTH2.
- monkey CRTH2 include marmoset CRTH2, cynomolgus CRTH2, and rhesus monkey CRTH2.
- cynomolgus monkey CRTH2 is used.
- the antibodies of the present invention include an Fc fusion protein in which Fc and an antibody fragment are bound, an Fc fusion protein in which Fc and a naturally occurring ligand or receptor are bound (also referred to as immunoadhesin), and a plurality of Fc regions. Fc fusion proteins and the like that have been made are also encompassed by the present invention.
- Fc fusion proteins and the like that have been made are also encompassed by the present invention.
- a modified Fc region containing an amino acid residue modification in which an amino acid residue substitution is performed to stabilize the antibody or control the blood half-life can also be used for the antibody of the present invention.
- the antibody fragment includes an antigen-binding domain that recognizes and binds to at least one of the 192nd glycine and the 194th aspartic acid of the amino acid sequence of human CRTH2 represented by SEQ ID NO: 2; It is a fragment having activity.
- the antibody fragment of the present invention include Fab, Fab ′, F (ab ′) 2 , single chain Fv (hereinafter referred to as scFv), diabody, dsFv, and a peptide containing a plurality of CDRs.
- Fab is a fragment obtained by treating IgG with the proteolytic enzyme papain (cleaved at the 224th amino acid residue of the H chain), and about half of the N chain side of the H chain and the entire L chain are disulfide bonds. It is an antibody fragment having an antigen binding activity with a molecular weight of about 50,000.
- the Fab of the present invention can be obtained by treating an antibody that specifically binds to human CRTH2 of the present invention with the proteolytic enzyme papain. Alternatively, it can be produced by inserting a DNA encoding the Fab of the antibody into a prokaryotic expression vector or a eukaryotic expression vector, and introducing the vector into a prokaryotic or eukaryotic organism.
- F (ab ′) 2 is a fragment obtained by treating IgG with the protease pepsin (cleaved at the amino acid residue at position 234 of the H chain), and Fab is bound via a disulfide bond in the hinge region. It is an antibody fragment having an antigen-binding activity having a molecular weight of about 100,000, which is slightly larger than those obtained.
- F (ab ′) 2 of the present invention can be obtained by treating an antibody that specifically binds to human CRTH2 of the present invention with the proteolytic enzyme pepsin.
- Fab ′ described below can be prepared by thioether bond or disulfide bond.
- Fab ′ is an antibody fragment having an antigen-binding activity having a molecular weight of about 50,000, which is obtained by cleaving the disulfide bond in the hinge region of F (ab ′) 2 .
- the Fab ′ of the present invention can be obtained by treating the F (ab ′) 2 composition that specifically binds to the human CRTH2 of the present invention with a reducing agent dithiothreitol.
- the DNA encoding the Fab ′ fragment of the antibody is inserted into a prokaryotic expression vector or a eukaryotic expression vector, and the vector is introduced into prokaryotic or eukaryotic organisms to be expressed and produced. it can.
- scFv uses an appropriate peptide linker (P) such as a linker peptide in which one VH and one VL are connected to an arbitrary number of linkers (G4S) consisting of four Gly and one Ser residue.
- P peptide linker
- G4S linkers
- VH-P-VL or VL-P-VH polypeptide which is an antibody fragment having antigen-binding activity.
- the scFv of the present invention obtains cDNA encoding the VH and VL of an antibody that specifically binds to human CRTH2 of the present invention, constructs a DNA encoding scFv, and uses the DNA as a prokaryotic expression vector or eukaryotic It can be produced by inserting it into a biological expression vector and introducing the expression vector into a prokaryotic or eukaryotic organism.
- Diabody is an antibody fragment obtained by dimerizing scFv and is an antibody fragment having a bivalent antigen-binding activity.
- the bivalent antigen binding activity can be the same, or one can be a different antigen binding activity.
- the diabody of the present invention obtains cDNA encoding the VH and VL of the antibody that specifically binds to human CRTH2 of the present invention, and the amino acid sequence length of the DNA encoding scFv is 8 residues or less
- the DNA is inserted into a prokaryotic expression vector or a eukaryotic expression vector, and the expression vector is introduced into a prokaryotic or eukaryotic organism to be expressed and produced.
- DsFv refers to a polypeptide in which one amino acid residue in each of VH and VL is substituted with a cysteine residue and bonded via a disulfide bond between the cysteine residues.
- the amino acid residue substituted for the cysteine residue can be selected based on the three-dimensional structure prediction of the antibody according to the method shown by Reiter et al. (Protein Engineering, 7, 697-704, 1994).
- the dsFv of the present invention obtains cDNA encoding the VH and VL of an antibody that specifically binds to the human CRTH2 of the present invention, constructs a DNA encoding the dsFv, and uses the DNA to express a prokaryotic expression vector or eukaryotic It can be produced by inserting into an expression vector for living organisms and introducing the expression vector into a prokaryotic or eukaryotic organism.
- the peptide containing CDR is configured to contain at least one region of CDR of VH or VL.
- Peptides containing multiple CDRs can be linked directly or via a suitable peptide linker.
- the peptide comprising the CDR of the present invention constructs DNA encoding the CDRs of the antibody VH and VL that specifically bind to human CRTH2 of the present invention, and the DNA is used as a prokaryotic expression vector or eukaryotic expression vector. And can be expressed and produced by introducing the expression vector into a prokaryotic or eukaryotic organism.
- a peptide containing CDR can also be produced by a chemical synthesis method such as the Fmoc method (fluorenylmethyloxycarbonyl method) or the tBoc method (t-butyloxycarbonyl method).
- Monoclonal antibody or antibody fragment in which one or more amino acids are deleted, substituted, inserted or added in the amino acid sequence constituting the antibody or the antibody fragment and have the same activity as the antibody or the antibody fragment are also encompassed by the antibodies or antibody fragments of the present invention.
- the number of amino acids to be deleted, substituted, inserted or added is one or more, and the number is not particularly limited.
- the number is such that it can be deleted, substituted or added by known techniques such as site-directed mutagenesis, for example, 1 to several tens, preferably Is 1 to 20, more preferably 1 to 10, and still more preferably 1 to 5.
- One or more amino acids in any one or more amino acid sequences in the same sequence means that one or more amino acid residues have been deleted, substituted, inserted or added in the amino acid sequence of human CRTH2 or antibody of the present invention. It means that there is a deletion, substitution, insertion or addition of a residue, and deletion, substitution, insertion or addition may occur simultaneously, and the amino acid residue to be substituted, inserted or added is a natural type and a non-natural type. It doesn't matter.
- natural amino acid residues include L-alanine, L-asparagine, L-aspartic acid, L-glutamine, L-glutamic acid, glycine, L-histidine, L-isoleucine, L-leucine, L-lysine, L -Methionine, L-phenylalanine, L-proline, L-serine, L-threonine, L-tryptophan, L-tyrosine, L-valine, L-cysteine and the like.
- amino acid residues contained in the same group can be substituted for each other.
- Group A leucine, isoleucine, norleucine, valine, norvaline, alanine, 2-aminobutanoic acid, methionine, O-methylserine, t-butylglycine, t-butylalanine, cyclohexylalanine
- B group aspartic acid, glutamic acid, isoaspartic acid, Isoglutamic acid, 2-aminoadipic acid, 2-aminosuberic acid group
- C asparagine, glutamine group
- D lysine, arginine, ornithine, 2,4-diaminobutanoic acid, 2,3-diaminopropionic acid group
- E proline, 3 -Hydroxyproline, 4-hydroxyproline
- F group serine, threonine, homoser
- the transformant of the present invention is a transformant obtained by introducing a DNA encoding an antibody molecule that specifically binds to human CRTH2 into a host cell, the transformant producing the antibody of the present invention. Any transformant, if any, is encompassed.
- a transformant obtained by introducing a DNA encoding an antibody molecule that specifically binds to human CRTH2 into a host cell such as the following (a) to (i) is a good example.
- B Rat myeloma cell line YB2 / 3HL. P2. G11.16 Ag.
- mice 20 cells;
- C mouse myeloma cell line NS0 cells;
- D mouse myeloma cell line SP2 / 0-Ag14 cells;
- E Syrian hamster kidney tissue-derived BHK cells;
- F a hybridoma cell producing an antibody;
- G human leukemia cell line Namalva cells;
- H embryonic stem cells;
- I Fertilized egg cells.
- the transformant of the present invention produces an antibody in which an N-glycoside-linked sugar chain is bound to the Fc region of an antibody and fucose is not bound to N-acetylglucosamine at the reducing end of the N-glycoside-linked sugar chain.
- a host cell in which a DNA encoding an antibody molecule that specifically binds to human CRTH2 is produced by the method described in International Publication Nos. 2005/035586 and 02/31140 with reduced or deficient glycosyltransferase A good example is a transformant obtained by introduction into.
- the method for producing the antibody or the antibody fragment of the present invention includes any antibody production method as long as it is a production method for culturing the transformant producing the antibody of the present invention or the antibody fragment.
- the transformant producing the antibody or the antibody fragment of the present invention is cultured, the antibody or the antibody fragment is produced and accumulated in the culture, and the antibody or the antibody fragment is collected and purified.
- a manufacturing method is mentioned.
- the antibody or the antibody fragment produced by the above production method is also exemplified as the antibody or the antibody fragment of the present invention.
- the composition of the present invention may be any composition as long as it comprises the antibody of the present invention or the antibody fragment thereof, and the composition comprises a single antibody molecule in which the sugar chain that binds to the antibody comprises: Alternatively, it may be a composition containing an antibody molecule having a plurality of sugar chain structures. Moreover, the composition containing a suitable additive, a buffer, etc. may be sufficient.
- the composition of the present invention preferably includes a drug, a diagnostic agent and the like containing the antibody of the present invention or the antibody fragment as an active ingredient.
- the pharmaceutical or diagnostic agent of the present invention includes any pharmaceutical or diagnostic agent as long as it is a pharmaceutical or diagnostic agent containing the antibody of the present invention or the antibody fragment as an active ingredient.
- a good example is a drug or diagnostic agent for a disease associated with human CRTH2-expressing cells.
- the therapeutic method of the present invention includes any therapeutic method, as long as it is a therapeutic method in which an effective amount of the antibody or antibody fragment of the present invention is administered, and preferably includes a therapeutic method for diseases associated with human CRTH2-expressing cells. It is done.
- any antibody or antibody fragment can be used as long as the antibody or the antibody fragment of the present invention is used for producing a therapeutic drug for a disease associated with human CRTH2-expressing cells. Use is also included. Moreover, the antibody or the antibody fragment of the present invention can be used for at least one of treatment and prevention of a disorder or disease associated with human CRTH2-expressing cells.
- disorders or diseases related to human CRTH2-expressing cells include, but are not limited to, for example, allergic diseases, autoimmune diseases, diseases associated with at least one of eosinophilia and hyperfunction, increased Th2 cells And diseases associated with at least one of hyperfunction and diseases associated with at least one of increased ILC2 and hyperfunction.
- Preferred disorders or diseases involving human CRTH2-expressing cells include asthma, childhood asthma, chronic obstructive pulmonary disease, atopic dermatitis, allergic rhinitis and acute or chronic sinusitis.
- the medicament containing the antibody of the present invention or the antibody fragment or derivative thereof may contain only the antibody or the antibody fragment or derivative thereof as an active ingredient.
- Examples of the administration route include oral administration and parenteral administration such as intraoral, intratracheal, rectal, subcutaneous, intramuscular, intravenous, or intraperitoneal.
- Examples of the dosage form include sprays, capsules, tablets, powders, granules, syrups, emulsions, suppositories, injections, ointments, or tapes.
- preparations suitable for oral administration include emulsions, syrups, capsules, tablets, powders, and granules. *
- the antibody of the present invention includes a derivative of an antibody in which a radioisotope, a low molecular drug, a high molecular drug, a protein, a nucleic acid or the like is chemically or genetically bound to the antibody of the present invention or an antibody fragment thereof. To do.
- a preventive method a therapeutic agent or a therapeutic agent, a chemotherapeutic agent, antibody drug, immunostimulant, macromolecular agent is used as a drug that binds to the antibody of the present invention or an antibody fragment thereof.
- examples include drugs.
- proteins include cytokines, growth factors, and toxin proteins.
- examples of the nucleic acid include decoy, antisense, siRNA, miRNA and the like.
- the derivative of the antibody in the present invention includes the N- or C-terminal side of the H chain or L chain of the antibody of the present invention or an antibody fragment thereof, an appropriate substituent or side chain in the antibody or the antibody fragment thereof, and further an antibody.
- a radioisotope, a low molecular weight drug, a high molecular weight drug, a protein, or the like is bound to a sugar chain or the like in the antibody fragment by a chemical method [method of introduction to antibody engineering, method described in Jinjinshokan (1994)]. Can be manufactured.
- the derivative of the antibody in the present invention is obtained by ligating DNA encoding the antibody or antibody fragment of the present invention and DNA encoding the protein to be bound and inserting the expression vector into an appropriate host cell. It can be produced by genetic engineering techniques that are introduced into and expressed.
- radioisotope examples include 131 I, 125 I, 90 Y, 64 Cu, 99 Tc, 77 Lu, and 211 At.
- the radioisotope can be directly bound to the antibody by the chloramine T method or the like.
- a substance that kills the radioisotope may be bound to the antibody.
- the chelating agent for example, 1-isothiocyanate benzyl-3-methyldiethylene sulamine pentaacetic acid (MX-DTPA) and the like can be mentioned.
- low-molecular-weight drugs examples include luminescent materials such as acridinium esters or lophine, or fluorescent materials such as fluorescein isothiocyanate (FITC) or tetramethylrhodamine isothiocyanate (RITC). .
- luminescent materials such as acridinium esters or lophine
- fluorescent materials such as fluorescein isothiocyanate (FITC) or tetramethylrhodamine isothiocyanate (RITC).
- Examples of the method of binding a low molecular weight drug and an antibody include, for example, a method of binding a drug and an amino group of an antibody via glutaraldehyde, or a drug amino group and an antibody carboxyl group via a water-soluble carbodiimide. And the like.
- polymer drug examples include polyethylene glycol (hereinafter referred to as PEG), albumin, dextran, polyoxyethylene, styrene maleic acid copolymer, polyvinylpyrrolidone, pyrancopolymer, hydroxypropyl methacrylamide, and the like.
- PEG polyethylene glycol
- albumin dextran
- polyoxyethylene polyoxyethylene
- styrene maleic acid copolymer polyoxyethylene
- polyvinylpyrrolidone polyvinylpyrrolidone
- pyrancopolymer hydroxypropyl methacrylamide
- the immunological detection or measurement method is a method of detecting or measuring the amount of antibody or the amount of antigen using a labeled antigen or antibody.
- Immunological detection or measurement methods include radiolabeled immunoassay (RIA), enzyme immunoassay (EIA or ELISA), fluorescence immunoassay (FIA), luminescent immunoassay, western blot method Or a physicochemical method etc. are mentioned.
- a disease associated with human CRTH2 can be diagnosed.
- a biological sample to be detected or measured for human CRTH2 includes tissue cells, blood, plasma, serum, pancreatic juice, urine, feces, tissue fluid, alveolar lavage fluid, culture fluid, and the like that are secreted extracellularly. It is not particularly limited as long as it may contain a peptide fragment containing CRTH2 or a part thereof, or a cell expressing human CRTH2.
- the diagnostic agent containing the antibody of the present invention or an antibody fragment thereof, or a derivative thereof may contain a reagent for performing an antigen-antibody reaction and a reagent for detecting the reaction, depending on the target diagnostic method.
- the reagent for performing the antigen-antibody reaction include a buffer and a salt.
- the detection reagent include a labeled secondary antibody that recognizes the antibody or an antibody fragment thereof, or a derivative thereof, or a reagent used in a normal immunological detection or measurement method such as a substrate corresponding to the label. It is done.
- Antibody Production Method Preparation of Antigen Human CRTH2 or human CRTH2 as an antigen is expressed as an expression vector containing cDNA encoding the full length of human CRTH2 or a partial length thereof, E. coli, yeast, insect cells, or It can be obtained by introducing it into animal cells.
- human CRTH2 can also be obtained by purifying human CRTH2 from various human cultured cells, human tissues, etc. that express a large amount of human CRTH2.
- the cultured cells or the tissues can be used as they are as antigens.
- a synthetic peptide having a partial sequence of human CRTH2 can be prepared by a chemical synthesis method such as the Fmoc method or the tBoc method and used as an antigen.
- a known peptide such as FLAG or His may be added to the C-terminus or N-terminus of the synthetic peptide having human CRTH2 or a partial sequence of human CRTH2.
- Human CRTH2 used in the present invention is a method described in MolecularMCloning, A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press (1989) or Current Protocols in molecular Biology, John Wiley & Sons (1987-1997), etc. Can be produced by expressing the DNA encoding human CRTH2 in a host cell by the following method, for example.
- a recombinant vector is prepared by inserting a full-length cDNA containing a portion encoding human CRTH2 downstream of a promoter of an appropriate expression vector.
- a DNA fragment of an appropriate length containing a polypeptide-encoding portion prepared based on the full-length cDNA may be used.
- a transformant producing a polypeptide can be obtained by introducing the obtained recombinant vector into a host cell suitable for the expression vector.
- Any expression vector can be used so long as it can be autonomously replicated in the host cell to be used or integrated into the chromosome, and contains an appropriate promoter at a position where the DNA encoding the polypeptide can be transcribed. Can do.
- any microorganism that belongs to the genus Escherichia such as Escherichia coli, yeast, insect cells, or animal cells can be used so long as it can express the target gene.
- the recombinant vector is capable of autonomous replication in a prokaryote, and at the same time a promoter, a ribosome binding sequence, DNA containing a portion encoding human CRTH2, and a transcription termination sequence. It is preferable that the vector contains
- a transcription termination sequence is not necessarily required for the recombinant vector, but it is preferable to place the transcription termination sequence immediately below the structural gene.
- the recombinant vector may contain a gene that controls the promoter.
- the recombinant vector it is preferable to use a plasmid in which the distance between the Shine-Dalgarno sequence (also referred to as SD sequence), which is a ribosome binding sequence, and the start codon is adjusted to an appropriate distance (eg, 6 to 18 bases).
- SD sequence also referred to as SD sequence
- start codon is adjusted to an appropriate distance (eg, 6 to 18 bases).
- the base sequence of DNA encoding the human CRTH2 can be substituted so that the codon is optimal for expression in the host, thereby improving the production rate of the target human CRTH2.
- Any expression vector can be used as long as it can function in the host cell to be used.
- pBTrp2, pBTac1, pBTac2 hereinafter, Roche Diagnostics
- pKK233-2 Pharmacia
- PSE280 Invitrogen Corp.
- pGEMEX-1 Promega Corp.
- pQE-8 Qiagen Corp.
- pKYP10 Japanese Unexamined Patent Publication No. 58-110600
- pKYP200 [Agricultural Biological Chemistry, 48, 669 (1984) )]
- PLSA1 Agric Biol. Chem. 53, 277 (1989)]
- pGEL1 Proc. Natl. Acad. Sci.
- any promoter can be used as long as it can function in the host cell to be used.
- promoters derived from Escherichia coli or phage such as trp promoter (Ptrp), lac promoter, PL promoter, PR promoter, or T7 promoter can be mentioned.
- An artificially designed and modified promoter such as a tandem promoter, tac promoter, lacT7 promoter, or letI promoter in which two Ptrps are connected in series can also be used.
- Examples of host cells include E. coli XL-1 Blue, E. coli XL2-Blue, E. coli DH1, E. coli MC1000, E. coli KY3276, E. coli W1485, E. coli JM109, E. coli HB101, E. coli No. 49, E. coli W3110, E. coli NY49, or E. coli DH5 ⁇ . *
- any method for introducing DNA into a host cell to be used can be used.
- a method using calcium ion [Proc. Natl. Acad. Sci. USA] , 69, 2110 (1972); Gene, 17, 107 (1982); Molecular & General Genetics, 168, 111 (1979)].
- any expression vector can be used as long as it can function in animal cells.
- pcDNA I, pcDM8 (Funakoshi), pAGE107 Japanese Patent Laid-Open No. 03/1993] No. 22979; Cytotechnology, 3, 133 (1990)]
- pAS3-3 Japanese Unexamined Patent Publication No. 02-227075
- pcDM8 [Nature, 329, 840 (1987)]
- pcDNA I / Amp (Invitrogen) PcDNA3.1 (Invitrogen), pREP4 (Invitrogen), pAGE103 [J.
- CMV cytomegalovirus
- IE immediate early
- SV40 early promoter a retroviral promoter
- Metallothionein promoter a promoter for expressing a cytomegalovirus gene
- heat shock promoter a promoter for expressing a cytomegalovirus gene
- SR ⁇ promoter a promoter for expressing a cytomegalovirus gene
- Moloney murine leukemia virus promoter or enhancer e.g., a promoter of human CMV IE gene may be used together with a promoter.
- an enhancer of human CMV IE gene may be used together with a promoter.
- host cells examples include human leukemia cells Namalwa cells, monkey cells COS cells, Chinese hamster ovary cells CHO cells [Journalourof Experimental Medicine, 108, 945 (1958); Proc. Natl. Acad. Sci. USA, 60, 1275 (1968); Genetics, 55, 513 (1968); Chromosoma, 41, 129 (1973); Methods in Cell Science, 18, 115 (1996); Radiation Research, 148, 260 (1997); Proc. Natl. Acad. Sci. USA, 77, (4216 (1980); Proc. Natl. Acad. Sci. USA, 60, 1275 (1968); Cell, 6, 121 (1975); Molecular Cell Genetics, Appendix I, II (pp.
- Any method can be used for introducing a recombinant vector into a host cell as long as it is a method for introducing DNA into animal cells.
- an electroporation method [Cytotechnology, 3, 133 (1990)]
- a calcium phosphate method Japanese Patent Laid-Open No. 02-227075
- a lipofection method [Proc. Natl. Acad. Sci. USA, 84, 7413 (1987 )] And the like.
- a transformant derived from a microorganism or animal cell having a recombinant vector incorporating a DNA encoding human CRTH2 obtained as described above is cultured in a medium, and the human CRTH2 is produced and accumulated in the culture.
- the human CRTH2 can be produced by collecting from the culture.
- the method of culturing the transformant in a medium can be performed according to a usual method used for culturing a host.
- an inducer may be added to the medium as necessary.
- cultivating a microorganism transformed with a recombinant vector using the lac promoter cultivate a microorganism transformed with isopropyl- ⁇ -D-thiogalactopyranoside or the like using a recombinant vector using the trp promoter.
- indole acrylic acid or the like may be added to the medium.
- Examples of a medium for culturing a transformant obtained using an animal cell as a host include, for example, a commonly used RPMI 1640 medium [The Journal of the American Medical Association, 199, 519 (1967)], Eagle's MEM medium [Science, 122, 501 (1952)], Dulbecco's modified MEM medium [Virology, 8, 396 (1959)], 199 medium [Proc. Soc. Exp. Biol. Med., 73, 1 (1950)], Iscove's Modified Dulbecco 's Medium (IMDM) medium, or a medium obtained by adding fetal bovine serum (FBS) or the like to these mediums.
- RPMI 1640 medium The Journal of the American Medical Association, 199, 519 (1967)]
- Eagle's MEM medium Science, 122, 501 (1952)]
- Dulbecco's modified MEM medium Virology, 8, 396 (1959)]
- 199 medium Proc. Soc. Exp. Biol
- the culture is usually carried out for 1 to 7 days under conditions such as pH 6 to 8, 30 to 40 ° C., and 5% CO 2 .
- Methods for producing human CRTH2 include a method for production into a host cell, a method for secretion outside the host cell, and a method for production on the host cell outer membrane.
- the host cell to be used or the structure of human CRTH2 to be produced is determined. By changing, an appropriate method can be selected.
- the production amount of human CRTH2 can be increased by using a gene amplification system using a dihydrofolate reductase gene or the like (Japanese Patent Application Laid-Open No. 02-227075).
- the obtained human CRTH2 can be isolated and purified as follows, for example.
- human CRTH2 When human CRTH2 is expressed in a dissolved state in the cells, the cells are collected by centrifugation after culturing, suspended in an aqueous buffer, and then subjected to an ultrasonic crusher, French press, Manton Gaurin homogenizer, or dynomill. Use to crush the cells to obtain a cell-free extract.
- a normal protein isolation and purification method that is, a solvent extraction method, a salting-out method using ammonium sulfate, a desalting method, a precipitation method using an organic solvent, diethylamino Anion exchange chromatography using a resin such as ethyl (DEAE) -Sepharose, DIAION HPA-75 (Mitsubishi Chemical), cation exchange chromatography using a resin such as S-Sepharose FF (Pharmacia), A single method such as hydrophobic chromatography using a resin such as butyl sepharose or phenyl sepharose, gel filtration using molecular sieve, affinity chromatography, chromatofocusing, or electrophoresis such as isoelectric focusing Or use it in combination to obtain a purified preparation. Kill. *
- human CRTH2 When human CRTH2 is expressed by forming an insoluble substance in the cell, the cell is collected and then disrupted in the same manner as described above, and centrifuged to collect the insoluble substance of human CRTH2 as a precipitate fraction. The collected insoluble human CRTH2 is solubilized with a protein denaturant. By diluting or dialyzing the solubilized solution, the human CRTH2 is returned to a normal three-dimensional structure, and then a purified polypeptide preparation can be obtained by the same isolation and purification method as described above. *
- the derivative such as human CRTH2 or a modified sugar thereof can be recovered from the culture supernatant.
- a soluble fraction can be obtained by treating the culture by a method such as centrifugation as described above, and a purified preparation can be obtained from the soluble fraction by using the same isolation and purification method as described above. it can.
- human CRTH2 used in the present invention can also be produced by a chemical synthesis method such as the Fmoc method or the tBoc method. Chemical synthesis can also be performed using peptide synthesizers such as Advanced Chemtech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecel-Vega, Perceptive, or Shimadzu. *
- Immunization is carried out by administering the antigen subcutaneously, ridge, intravenously or intraperitoneally, together with an appropriate adjuvant such as Freund's complete adjuvant or aluminum hydroxide gel and pertussis vaccine.
- an appropriate adjuvant such as Freund's complete adjuvant or aluminum hydroxide gel and pertussis vaccine.
- a conjugate with a carrier protein such as BSA (bovine serum albumin) or KLH (Keyhole Limothemoyanin) is prepared and used as an immunogen.
- BSA bovine serum albumin
- KLH Keyhole Limothemoyanin
- the antigen is administered 1 to 10 times every 1 to 2 weeks after the first administration. Three to seven days after each administration, blood is collected from the fundus venous plexus or tail vein, and the antibody titer of the serum is measured using an enzyme immunoassay [Antibodies-A Laboratory Manual, Cold Spring Harbor Laboratory (1988)]. . An animal whose serum shows a sufficient antibody titer against the antigen used for immunization is used as a source of antibody producing cells for fusion.
- tissues containing antibody-producing cells such as the spleen are removed from the immunized animal, and antibody-producing cells are collected.
- the spleen is shredded and loosened, and then centrifuged, and the erythrocytes are removed to obtain antibody producing cells for fusion.
- a cell line obtained from a mouse is used.
- an 8-azaguanine resistant mouse (BALB / c-derived) myeloma cell line P3-X63Ag8-U1 (P3-U1 ) [Current Topics in Microbiology and Immunology, 18, 1 (1978)]
- P3-NS1 / 1Ag41 (NS-1) [European J. Immunology, 6, 511 (1976)]
- P3-X63-Ag8653 (653) J. Immunology, 123, 1548 (1979)]
- P3-X63-Ag8 (X63) [Nature, 256, 495 (1975) )] Etc.
- the myeloma cells were subcultured in normal medium [RPMI 1640 medium supplemented with glutamine, 2-mercaptoethanol, gentamicin, FBS, and 8-azaguanine], and subcultured into normal medium 3-4 days before cell fusion. On the day of fusion, secure a cell count of 2 ⁇ 10 7 or more.
- MEM Minimum Essential Medium
- PBS disodium phosphate 1. 83 g, monopotassium phosphate 0.21 g, sodium chloride 7.65 g, distilled water 1 liter, pH 7.2
- the cells After loosening the precipitated cell group, the cells are gently suspended in the HAT medium [normal medium supplemented with hypoxanthine, thymidine, and aminopterin] on the antibody-producing cells for fusion. This suspension is cultured for 7 to 14 days in a 37 ° C., 5% CO 2 incubator.
- HAT medium normal medium supplemented with hypoxanthine, thymidine, and aminopterin
- a part of the culture supernatant is extracted, and a cell group that reacts with an antigen containing human CRTH2 but does not react with an antigen not containing human CRTH2 by a hybridoma selection method such as reactivity analysis for human CRTH2-expressing cells described later Select.
- cloning was repeated twice by the limiting dilution method [first time using HT medium (medium obtained by removing aminopterin from HAT medium), second time using normal medium], and stable and strong antibody titer was observed. Are selected as monoclonal antibody-producing hybridomas.
- the monoclonal antibody-producing hybridoma obtained in (4) is cultured in an RPMI1640 medium supplemented with 10% FBS, the supernatant is removed by centrifugation, and the suspension is suspended in a Hybridoma-SFM medium and cultured for 3 to 7 days. To do.
- the obtained cell suspension is centrifuged, and the resulting supernatant is purified by a protein A-column or protein G-column, and the IgG fraction is collected to obtain a purified monoclonal antibody.
- 5% Daigo GF21 can be added to the Hybridoma-SFM medium. *
- the antibody subclass is determined by enzyme immunoassay using a sub-clustering kit.
- the amount of protein is calculated from the Raleigh method or absorbance at 280 nm. *
- the monoclonal antibody is selected by analyzing the reactivity with respect to cells expressing human CRTH2 by flow cytometry as shown below.
- Examples of cells that express human CRTH2 include gene-transferred cells obtained by introducing an expression vector containing cDNA encoding human CRTH2 obtained in (1) into animal cells, human eosinophils, and basophils. , Th2, ILC2, non-classical monocyte, Th2 / Th17 cells, and the like.
- a test substance such as serum, hybridoma culture supernatant or purified monoclonal antibody is dispensed as a first antibody and allowed to react.
- the cells after the reaction are thoroughly washed with PBS containing 1 to 10% bovine serum albumin (BSA) (hereinafter referred to as BSA-PBS), and then anti-immunoglobulin antibody labeled with a fluorescent reagent or the like as a second antibody. Dispense and react.
- BSA-PBS bovine serum albumin
- a monoclonal antibody that specifically reacts with the expressed cells is selected by measuring the fluorescence amount of the labeled antibody using a flow cytometer.
- a monoclonal antibody that competes with the monoclonal antibody of the present invention and binds to human CRTH2 can be obtained by adding a test antibody to the above-described binding reaction detection system using flow cytometry and reacting.
- an antibody that binds to the same epitope as that recognized by the monoclonal antibody that binds to the amino acid sequence of human CRTH2 of the present invention or to its three-dimensional structure is an antibody obtained by the above-described binding reaction detection system using flow cytometry. It can be obtained by preparing and immunizing a partial synthetic peptide of the identified epitope or a synthetic peptide mimicking the three-dimensional structure of the epitope.
- a recombinant antibody expression vector is an expression vector for animal cells into which DNAs encoding the CH and CL of a human antibody are incorporated, and the expression vector for animal cells is human. It can be constructed by cloning DNAs encoding antibody CH and CL, respectively.
- Any human antibody CH and CL can be used for the C region of a human antibody.
- ⁇ 1 subclass CH and ⁇ class CL of human antibodies are used.
- cDNA is used for the DNA encoding CH and CL of the human antibody, chromosomal DNA consisting of exons and introns can also be used.
- Any expression vector for animal cells can be used as long as it can incorporate and express a gene encoding the C region of a human antibody.
- pAGE107 [Cytotechnol., 3, 133 (1990)]
- pAGE103 [J. Biochem., 101, 1307 (1987)]
- pHSG274 [Gene, 27, 223 (1984)]
- pKCR Proc. Natl. Acad. Sci. USA, 78, 1527 (1981)]
- pSG1bd2-4 [Cytotechnol., 4, 173 (1990)]
- pSE1UK1Sed1-3 [Cytotechnol., 13, 79 (1993)].
- promoters and enhancers include SV40 early promoter [J. Biochem., 101, 1307 (1987)], Moloney murine leukemia virus LTR [Biochem. Biophys. Res. Commun., 149, 960 ( 1987)] or an immunoglobulin heavy chain promoter [Cell, 41, 479 (1985)] and an enhancer [Cell, 33, 717 (1983)].
- Recombinant antibody expression vectors balance the ease of construction of recombinant antibody expression vectors, the ease of introduction into animal cells, and the balance of expression levels of antibody H and L chains in animal cells.
- a vector for expression of a recombinant antibody J. Immunol. Methods, 167, 271 (1994) in which the antibody H chain and L chain are present on the same vector is used, A separate vector in which the antibody H chain and L chain are present on separate vectors can also be used.
- pKANTEX93 International Publication No. 97/10354
- pEE18 Hybridoma, 17, 559 (1998)] or the like is used.
- MRNA is extracted from hybridoma cells producing non-human antibodies, and cDNA is synthesized.
- the synthesized cDNA is cloned into a vector such as a phage or a plasmid to prepare a cDNA library.
- a recombinant phage or recombinant plasmid having cDNA encoding VH or VL is isolated.
- the entire base sequence of VH or VL of the target mouse antibody on the recombinant phage or recombinant plasmid is determined, respectively, and the total amino acid sequence of VH or VL is estimated from the base sequence, respectively.
- non-human animal for producing a hybridoma cell producing a non-human antibody a mouse, rat, hamster, rabbit or the like is used, but any animal can be used as long as it can produce a hybridoma cell. .
- RNA easy kit For preparation of total RNA from hybridoma cells, a kit such as guanidine thiocyanate-cesium acetate trifluoroacetate method [Methods in Enzymol., 154, 3 (1987)] or RNA easy kit (Qiagen) is used. *
- oligo (dT) -immobilized cellulose column method [Molecular Cloning, A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press (1989)] or Oligo-dT30 ⁇ Super> mRNA Purification Kit
- kit such as (Takara Bio).
- mRNA can also be prepared from hybridoma cells using a kit such as Fast Track mRNA Isolation Kit (Invitrogen) or QuickPrep mRNA Purification Kit (Pharmacia). *
- any vector can be used as a vector into which cDNA synthesized using mRNA extracted from a hybridoma cell as a template is incorporated.
- Escherichia coli into which a cDNA library constructed by a phage or plasmid vector is introduced can be used as long as it can introduce, express and maintain the cDNA library.
- XL-1 Blue MRF [Strategies, 5, 81 (1992)], C600 [Genetics, 39, 440 (1954)], Y1088, Y1090 [Science, 222, 778 (1983)], NM522 [J. Mol. Biol ., 166, 1 (1983)], K802 [J. Mol. Biol., 16, 118 (1966)], JM105 [Gene, 38, 275 (1985)] or the like is used.
- Selection of cDNA clones encoding non-human antibody VH or VL from a cDNA library can be achieved by colony hybridization method using isotope or fluorescently labeled probe, or plaque hybridization method [Molecular Cloning, A Laboratory Laboratory Manual , SecondCEdition, Cold Spring Harbor Laboratory Press (1989)].
- PCR method Molecular® Cloning, A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory (Press (1989) , “Current Protocols in molecular molecular biology, Supplements 1, John Wiley & Sons (1987-1997)] can also be used to prepare cDNA encoding VH or VL.
- the selected cDNA is cleaved with an appropriate restriction enzyme and then cloned into a plasmid such as pBluescript SK (-) (Stratagene), and the base sequence of the cDNA is determined by a commonly used base sequence analysis method or the like.
- the base sequence analysis method includes, for example, a dideoxy method [Proc. Natl. Acad. Sci. USA, 74, 5463 (1977)], ABI PRISM 3700 (PE Biosystems) or A.I. L. F. An automatic base sequence analyzer such as a DNA sequencer (Pharmacia) is used.
- VH and VL complete amino acid sequences
- the BLAST method J. Mol. Biol., 215, 403 (1990)] for any database such as SWISS-PROT or PIR-Protein is used. It is possible to confirm whether the complete amino acid sequences of VH and VL are novel.
- a human chimeric antibody expression vector VH or VL of non-human antibody is respectively upstream of each gene encoding CH or CL of human antibody of the recombinant antibody expression vector obtained in (1).
- a human chimeric antibody expression vector can be constructed by cloning each of the encoded cDNAs.
- the base sequence of the linking portion encodes an appropriate amino acid, and VH and VL cDNAs designed to have appropriate restriction enzyme recognition sequences are prepared.
- the prepared VH and VL cDNAs are cloned so that they are expressed in an appropriate form upstream of each gene encoding the human antibody CH or CL of the humanized antibody expression vector obtained in (1). Then, a human chimeric antibody expression vector is constructed.
- a recombinant antibody expression vector obtained in (1) by amplifying cDNA encoding non-human antibody VH or VL by a PCR method using a synthetic DNA having an appropriate restriction enzyme recognition sequence at both ends, respectively. can also be cloned.
- the amino acid sequence of the VH or VL FR of the human antibody to be transplanted with the VH or VL CDR amino acid sequence of the non-human antibody is selected. Any amino acid sequence can be used as long as it is derived from a human antibody.
- human antibody FR amino acid sequences registered in databases such as Protein Data Bank, or common subsequences of human antibody FR subgroups [ALFDNA, US Dept. Health and Human Services (1991)] Is used.
- an FR amino acid sequence having as high a homology as possible (at least 60% or more) with the VH or VL FR amino acid sequence of the original antibody is selected.
- the amino acid sequence of CDR of the original antibody is transplanted to the amino acid sequence of VH or VL of the selected human antibody, respectively, and the amino acid sequence of VH or VL of the humanized antibody is designed.
- the designed amino acid sequence is converted into a DNA sequence in consideration of the codon usage frequency [ALFDNA, US Dept. Health and Human Services (1991)] found in the base sequence of the antibody gene, and VH or VL of the humanized antibody DNA sequences encoding the amino acid sequences are designed respectively.
- the amplified product is cloned into a plasmid such as pBluescript SK (-) (Stratagene), the base sequence is determined by the same method as described in (2), and the desired humanized antibody
- a plasmid having a DNA sequence encoding the amino acid sequence of the full length of the H chain or the full length of the L chain is obtained.
- a product obtained by synthesizing the full length VH and the full length VL as one long chain DNA based on the designed DNA sequence can be used in place of the PCR amplification product. Furthermore, by introducing a recognition sequence for an appropriate restriction enzyme at both ends of the synthetic long-chain DNA, cDNA encoding the humanized antibody VH or VL can be easily transferred to the humanized antibody expression vector obtained in (1). Can be cloned.
- a humanized antibody can only have its antigen-binding activity by transplanting only the VH and VL CDRs of a non-human antibody into the VH and VL FRs of a human antibody. [BIO / TECHNOLOGY, 9, 266 (1991)].
- the amino acid residues directly involved in binding to the antigen the amino acid residues that interact with the CDR amino acid residues, and the antibody Reduced antigen binding by identifying amino acid residues that maintain conformation and indirectly participate in antigen binding and replace those amino acid residues with the amino acid residues of the original non-human antibody
- the activity can be increased.
- amino acid residues of FR of human antibody VH and VL can be substituted by performing the PCR reaction described in (4) using the synthetic DNA for modification.
- the base sequence is determined by the method described in (2) and it is confirmed that the target modification has been performed.
- the humanized antibody expression vector obtained in (1) is cloned upstream of each gene encoding the human antibody CH or CL so that they are expressed in an appropriate form.
- Any host cell capable of expressing the recombinant antibody can be used as the host cell into which the expression vector is introduced.
- COS-7 cells ATCC number: CRL1651
- CRL1651 Method of introducing an expression vector into COS-7 cells
- the DEAE-dextran method Method of introducing an expression vector into COS-7 cells
- the lipofection method Proc. Natl. Acad. Sci. USA, 84, 7413 ( 1987)].
- the expression level and antigen-binding activity of the recombinant antibody in the culture supernatant are determined by enzyme-linked immunosorbent assay (Monoclonal Antibodies-Principles and practice, Third edition, Academic Press (1996); Antibodies-A Laboratory Manual, Cold Spring Harbor Laboratory (1988), monoclonal antibody experiment manual, Kodansha Scientific (1987)], etc.
- Any host cell capable of expressing a recombinant antibody can be used as a host cell into which the recombinant antibody expression vector is introduced.
- CHO-K1 ATCC number: CCL-61
- DUkXB11 ATCC number: CCL-9096
- Pro-5 ATCC number: CCL-1781
- CHO-S Life Technologies, Cat # 11619
- mouse myeloma cell NS0 mouse myeloma cell SP2 / 0-Ag14 (ATCC number: CRL1581)
- mouse P3-X63-Ag8653 cell ATCC number: CRL1580
- dihydrofolate reductase gene CHO cells [Proc.fNatl. Acad. ⁇ Sci.
- DHFR Dihydroformate Reductase
- a transformant that stably expresses the recombinant antibody is selected by culturing in an animal cell culture medium containing a drug such as G418 sulfate (Japanese Patent Application Laid-Open No. 02-257891). ). *
- Examples of the medium for animal cell culture include RPMI1640 medium (Invitrogen), GIT medium (Nippon Pharmaceutical Co., Ltd.), EX-CELL301 medium (JRH), IMDM medium (Invitrogen), Hybridoma-SFM medium (Invitrogen), Or the culture medium etc. which added various additives, such as FBS, to these culture media are used.
- RPMI1640 medium Invitrogen
- GIT medium Nippon Pharmaceutical Co., Ltd.
- EX-CELL301 medium JRH
- IMDM medium Invitrogen
- Hybridoma-SFM medium Invitrogen
- the culture medium etc. which added various additives, such as FBS, to these culture media are used.
- the resulting transformant is cultured in a medium to express and accumulate the recombinant antibody in the culture supernatant.
- the expression level and antigen-binding activity of the recombinant antibody in the culture supernatant can be measured by ELISA or the like.
- the expression level of the recombinant antibody produced by the transformed strain can be increased using a DHFR amplification system (Japanese Patent Laid-Open No. 02-257891).
- the recombinant antibody is purified from the culture supernatant of the transformant using a protein A-column [Monoclonal-Antibodies-Principles-and-practice, Third-edition, Academic-Press> (1996); Antibodies-A Laboratory, Manual, Cold Spring Harbor Laboratory (1988)].
- methods used in protein purification such as gel filtration, ion exchange chromatography, and ultrafiltration can be combined.
- the molecular weight of the purified recombinant antibody H chain, L chain or whole antibody molecule is determined by polyacrylamide gel electrophoresis [Nature, 227, 680 (1970)] or Western blotting [Monoclonal Antibodies-Principles and practice, Third edition, “Academic” Press (1996); “Antibodies-A” Laboratory “Manual”, “Cold” Spring “Harbor Laboratory” (1988)].
- the binding activity to a human CRTH2-expressing cell line is, for example, 1. (6) It can be measured using a fluorescent antibody method such as a binding reaction detection system using flow cytometry [Cancer Immunol.Immunother., 36, 373 (1993)].
- CDC activity or ADCC activity against a human CRTH2 positive cultured cell line can be measured by a known measurement method [Cancer Immunol. Immunother., 36, 373 (1993); Current protocols in Immunology, Chapter 7. Immunologic studies in humans, Editor, John E, Coligan et al., John Wiley & Sons, Inc., (1993)].
- Method for controlling effector activity of antibody As a method for controlling the effector activity of the monoclonal antibody of the present invention, it exists at the reducing end of the N-linked complex sugar chain that binds to the 297th asparagine (Asn) of the Fc region of the antibody. Method for controlling the amount of fucose (also referred to as core fucose) that binds ⁇ 1,6 to N-acetylglucosamine (GlcNAc) (International Publication No. 2005/035586, International Publication No. 2002/31140, International Publication No. 00/61739) Alternatively, a method of controlling by modifying amino acid residues in the Fc region of an antibody is known. The effector activity can be controlled by any method using the monoclonal antibody of the present invention.
- the effector activity refers to antibody-dependent activity caused through the Fc region of an antibody, and includes ADCC activity, CDC activity, or antibody-dependent phagocytosis by phagocytic cells such as macrophages or dendritic cells (Antibody-dependent phagocytosis). , ADP activity) and the like are known.
- inflammatory cells for example, inflammatory cells as a target, human peripheral blood mononuclear cells (PBMC) as an effector, and inflammatory cell-specific antibodies are mixed and incubated for about 4 hours, and then an indication of cytotoxicity Lactate dehydrogenase (LDH) released as can be measured.
- PBMC peripheral blood mononuclear cells
- LDH cytotoxicity Lactate dehydrogenase
- human PBMC is mixed with an antibody recognizing a blood cell-specific antigen such as CD20, and after incubation, the decrease in the number of cells by measuring free LDH or flow cytometry is measured as effector activity. Can do.
- the effector activity of the antibody can be increased or decreased.
- a method for reducing the content of fucose bound to an N-linked complex sugar chain bound to Fc of an antibody include, for example, a method of expressing an antibody using CHO cells deficient in ⁇ 1,6-fucose transferase gene An antibody to which fucose is not bound can be obtained.
- Antibodies without fucose binding have high ADCC activity.
- an antibody is expressed using a host cell into which an ⁇ 1,6-fucose transferase gene has been introduced. And an antibody to which fucose is bound can be obtained.
- An antibody to which fucose is bound has a lower ADCC activity than an antibody to which fucose is not bound.
- ADCC activity or CDC activity can be increased or decreased by modifying amino acid residues in the Fc region of the antibody.
- the CDC activity of an antibody can be increased by using the amino acid sequence of the Fc region described in US Patent Publication No. 2007/0148165. *
- ADCC activity or CDC activity may be increased or decreased. it can.
- the antibody of the present invention is subjected to amino acid modification described in, for example, Japanese Patent Application Laid-Open No. 2013-165716, Japanese Patent Application Laid-Open No. 2012-021004, etc. in accordance with the amino acid modification and sugar chain modification in the antibody constant region described above. Also included are antibodies whose blood half-life is controlled by controlling reactivity to Fc receptors.
- the antibody of the present invention can be used for treatment of diseases related to human CRTH2.
- the administration route include oral administration, and parenteral administration such as intraoral, intratracheal, rectal, subcutaneous, intramuscular, intravenous, or intraperitoneal.
- parenteral administration such as intraoral, intratracheal, rectal, subcutaneous, intramuscular, intravenous, or intraperitoneal.
- the dosage form include sprays, capsules, tablets, powders, granules, syrups, emulsions, suppositories, injections, ointments, or tapes.
- Suitable formulations for oral administration include, for example, emulsions, syrups, capsules, tablets, powders, or granules.
- Liquid preparations such as emulsions or syrups include water, sugars such as sucrose, sorbitol or fructose, glycols such as polyethylene glycol or propylene glycol, oils such as sesame oil, olive oil or soybean oil, p-hydroxybenzoic acid Manufactured using preservatives such as esters, or flavors such as strawberry flavor or peppermint as additives.
- Capsules, tablets, powders or granules include excipients such as lactose, glucose, sucrose or mannitol, disintegrants such as starch or sodium alginate, lubricants such as magnesium stearate or talc, polyvinyl alcohol, hydroxy A binder such as propylcellulose or gelatin, a surfactant such as a fatty acid ester, or a plasticizer such as glycerin is used as an additive.
- preparations suitable for parenteral administration include injections, suppositories, and sprays.
- Injection is manufactured using a carrier composed of a salt solution, a glucose solution, or a mixture of both.
- Suppositories are produced using a carrier such as cacao butter, hydrogenated fat, or carboxylic acid.
- the propellant is manufactured using a carrier that does not irritate the recipient's oral cavity and airway mucosa, and in which the monoclonal antibody of the present invention or the antibody fragment is dispersed as fine particles to facilitate absorption.
- a carrier for example, lactose or glycerin is used. It can also be produced as an aerosol or dry powder.
- Disease diagnosis method using the antibody of the present invention or the antibody fragment thereof Diseases associated with human CRTH2 by detecting or measuring cells expressing human CRTH2 or human CRTH2 using the antibody or the antibody fragment of the present invention Can be diagnosed.
- Diagnosis of allergic disease which is one of the diseases related to human CRTH2 is performed by, for example, using a flow cytometer to express human CRTH2 expressed in inflammatory cells present in peripheral blood, sputum, nasal discharge or alveolar lavage fluid derived from a patient. It can carry out by detecting using immunological techniques, such as.
- the immunological technique is a method for detecting or measuring the amount of antibody or the amount of antigen using a labeled antigen or antibody.
- a radioactive substance-labeled immunoantibody method an enzyme immunoassay method, a fluorescence immunoassay method, a luminescence immunoassay method, a Western blot method, or a physicochemical method is used.
- the radioactive substance-labeled immunoantibody method is, for example, a method in which an antibody of the present invention or the antibody fragment thereof is reacted with an antigen or a cell expressing the antigen and further reacted with a radiolabeled anti-immunoglobulin antibody or binding fragment. Measure with a scintillation counter.
- an antigen or a cell expressing the antigen is reacted with the antibody of the present invention or the antibody fragment, and further, a labeled anti-immunoglobulin antibody or binding fragment is reacted, and then a coloring dye. Is measured with an absorptiometer. For example, a sandwich ELISA method is used. *
- a known enzyme label [enzyme immunoassay, Medical School (1987)] can be used.
- enzyme immunoassay Medical School (1987)
- alkaline phosphatase label, peroxidase label, luciferase label, biotin label or the like is used.
- the sandwich ELISA method is a method in which after binding an antibody to a solid phase, an antigen to be detected or measured is trapped, and a second antibody is reacted with the trapped antigen.
- the ELISA method two types of antibodies or antibody fragments that recognize an antigen to be detected or measured and having different antigen recognition sites are prepared, and the first antibody or antibody fragment is pre-plated on a plate (for example, 96 Next, the second antibody or antibody fragment is labeled with a fluorescent substance such as FITC, an enzyme such as peroxidase, or biotin.
- the above-mentioned antibody-adsorbed plate is reacted with cells or a lysate thereof, tissue or a lysate thereof, cell culture supernatant, serum, pleural effusion, ascites or ocular fluid, etc.
- the detected monoclonal antibody or antibody fragment is reacted, and a detection reaction corresponding to the labeling substance is performed.
- the antigen concentration in the test sample is calculated from a calibration curve prepared by diluting antigens with known concentrations stepwise.
- an antibody used for the sandwich ELISA method either a polyclonal antibody or a monoclonal antibody may be used, and an antibody fragment such as Fab, Fab ′, or F (ab ′) 2 may be used.
- the combination of two types of antibodies used in the sandwich ELISA method may be a combination of monoclonal antibodies or antibody fragments that recognize different epitopes, or a combination of a polyclonal antibody and a monoclonal antibody or antibody fragment.
- Fluorescence immunoassay is performed by the method described in the literature [Monoclonal Antibodies-Principles and Practices, Third Edition, Academic Press (1996), Monoclonal Antibody Experiment Manual, Kodansha Scientific (1987)].
- a label used in the fluorescence immunoassay for example, a known [fluorescent antibody method, Soft Science (1983)] fluorescent label can be mentioned.
- fluorescent label for example, fluorescein isothiocyanate (FITC), tetramethylrhodamine isothiocyanate (RITC), etc. are mentioned.
- Luminescent immunoassay is performed by the method described in the literature [Bioluminescence and chemiluminescence, clinical examination 42, Yodogawa Shoten (1998)].
- Examples of the label used in the luminescence immunoassay include known phosphor labels, such as acridinium ester and lophine.
- antigens or cells expressing the antigens are fractionated by SDS (sodium dodecyl sulfate) -PAGE [Antibodies-A Laboratory, Cold, Spring, Harbor Laboratory, (1988)], and the gel is then washed with polyvinylidene fluoride (PVDF).
- PVDF polyvinylidene fluoride
- a cell or tissue expressing a polypeptide having the amino acid sequence represented by SEQ ID NO: 2 is lysed, and 0.1 to 30 ⁇ g of protein per lane is electrophoresed by SDS-PAGE under reducing conditions.
- the migrated protein is transferred to a PVDF membrane and reacted with 1-10% BSA-PBS for 30 minutes at room temperature to perform a blocking operation.
- the antibody of the present invention was reacted, washed with PBS containing 0.05 to 0.1% Tween-20 (hereinafter referred to as Tween-PBS), and peroxidase-labeled goat anti-mouse IgG was allowed to stand at room temperature for 2 hours. React.
- the polypeptide having the amino acid sequence represented by SEQ ID NO: 2 is detected by washing with Tween-PBS and detecting the band to which the monoclonal antibody is bound using ECL Western Blotting Detection Reagents (Amersham) or the like.
- ECL Western Blotting Detection Reagents Amersham
- an antibody capable of binding to a polypeptide that does not have a natural three-dimensional structure is used.
- the physicochemical method is performed by, for example, forming an aggregate by binding human CRTH2 as an antigen and the monoclonal antibody or the antibody fragment of the present invention, and detecting the aggregate.
- Other physicochemical methods include, for example, the capillary method, the one-dimensional immunodiffusion method, the immunoturbidimetric method, or the latex immunoturbidimetric method [Presentation of clinical testing method, Kanbara Publishing (1998)].
- Latex immunoturbidimetry is a method in which an antibody or antigen-sensitized carrier such as polystyrene latex having a particle size of about 0.1 to 1 ⁇ m is used to cause an antigen-antibody reaction with the corresponding antigen or antibody. Scattered light increases and transmitted light decreases. By detecting this change as absorbance or integrating sphere turbidity, the antigen concentration or the like in the test sample is measured.
- an antibody or antigen-sensitized carrier such as polystyrene latex having a particle size of about 0.1 to 1 ⁇ m
- Examples of the method for determining the therapeutic efficacy of the antibody before the start of treatment using the antibody of the present invention or the antibody fragment include the following.
- the antibody of the present invention or the antibody fragment is added to the suspension, and after a certain time, inflammatory cells
- the anti-inflammatory cell activity is measured, including the removal activity and the inhibitory activity against biological function molecules such as Th2-type cytokines.
- anti-inflammatory cell activity is detected as a result of the measurement, it is determined before the start of treatment that the antibody of the present invention or the antibody fragment thereof is effective for treating a patient having peripheral blood, sputum, nasal discharge, etc. be able to.
- Example 1 Construction of human CRTH2-expressing cells (1) Preparation of human CRTH2 expression vector The cDNA of human CRTH2 (hereinafter sometimes referred to as CRTH2) was totally synthesized and used in the subsequent tests. The cDNA sequence of human CRTH2 is described in SEQ ID NO: 1, and the amino acid sequence is described in SEQ ID NO: 2.
- the human CRTH2 gene expression pKANTEX93 vector prepared in (1)-(i) was cleaved by restriction enzyme AatII treatment, and the obtained linear DNA was purified and dissolved in sterilized water.
- This DNA was introduced into CHO / DG44 cells by electroporation and cultured in IMDM culture medium from which HT supplement was removed for about 3 days.
- IMDM drug-resistant cells
- IMDM selection medium 10% dFBS, 0.5 mg / mL G418 (Nacalai Tesque) and 50 ⁇ g / mL gentamicin (Nacalai Tesque).
- the selected drug resistant cells were seeded in a 96-well plate at 75 cells / plate and further cultured in IMDM selective medium for about 2 weeks. Each well was observed under a microscope, and single clones were sequentially expanded and cultured.
- the obtained drug-resistant cells were detached with 0.02% EDTA solution (Nacalai Tesque), washed with PBS (phosphate buffered saline), 2% fetal bovine serum (FBS), 0.05% NaN 3 and 1 mM. It was suspended in PBS containing EDTA (Staining Medium, hereinafter abbreviated as SM). Next, it seed
- PE labeled anti-human CRTH2 antibody (Beckman Coulter, Inc.) prepared in SM was added and reacted at 4 ° C. for 1 hour. After washing the cells, the cells were suspended in SM and the fluorescence intensity was analyzed with a flow cytometer (BD Bioscience, FACS Canto II). A clone that highly expresses human CRTH2 was selected, and this cell was designated as a human CRTH2-expressing CHO / DG44 cell.
- the FLAG-fused human CRTH2 gene expression pKANTEX93 vector prepared in (3)-(ii) was cleaved by restriction enzyme AatII treatment, and the resulting linear DNA was purified and dissolved in sterile water.
- This DNA was introduced into 3Y1-B cells by the Lipofection method using Fugene 6 (Promega) and cultured in DMEM culture medium for about 3 days. Thereafter, drug-resistant cells were selected with DMEM (hereinafter, DMEM selective medium) supplemented with 10% FBS, 0.8 mg / mL G418 (Nacalai Tesque) and 50 ⁇ g / mL gentamicin (Nacalai Tesque).
- the obtained drug-resistant cells were detached with 0.05% trypsin solution (Invitrogen), washed with PBS, and suspended in SM. Next, it seed
- the removed iliac lymph nodes were ground with a glass slide to loosen the tissue.
- This iliac lymph node tissue was suspended in Minimum Essential Media (MEM) (Invitrogen) and passed through a cell strainer to remove excess tissue. The supernatant was removed by centrifuging at 1200 rpm for 5 minutes, and then suspended again in MEM to obtain iliac lymph node cells.
- MEM Minimum Essential Media
- the mouse myeloma cell line P3-U1 (ATCC) of 1/5 cells was mixed with the obtained iliac lymph node cells. After removing the supernatant by centrifugation, 1 mL each of 500 ⁇ L of PEG solution [Polyethylene glycol 1000 (Pure Chemical Co., Ltd.) and MEM was mixed while warming in a 37 ° C. warm bath, and DMSO (dimethyl sulfoxide) (Sigma Aldrich). Was added gently, 1 mL of MEM was added 5 times every minute, and then 45 mL of MEM was further added.
- PEG solution Polyethylene glycol 1000 (Pure Chemical Co., Ltd.) and MEM was mixed while warming in a 37 ° C. warm bath, and DMSO (dimethyl sulfoxide) (Sigma Aldrich).
- HAT medium 500 mL of RPMI-1640 (Wako Pure Chemical Industries), 10 mL of HAT (hypoxanthine (H), aminopterin (A)]. , Thymidine (T) solution (GIBCO), 0.5 mL 55 mmol / L 2-Mercaptoethanol (Invitrogen), 50 mL fetal bovine serum (Molegate Biotech), and 0.5 mL 10 mg / mL gentamicin solution (Nacalai) Sustained with Tesque), seeded in a 96-well plate, and cultured.
- the cells were washed, suspended in 100 ⁇ L of Anti-rat IgG (Fc) -Dylight 488 (abcam) diluted 300 times with SM, and reacted at 4 ° C. for 30 minutes. After washing the cells again, the cells were suspended in SM, and the fluorescence intensity was analyzed by flow cytometry (BD Bioscience, FACS Canto II).
- Fc Anti-rat IgG
- abcam Anti-rat IgG-Dylight 488
- Hybridomas in wells in which a reaction specific to human CRTH2-expressing CHO / DG44 cells was observed were mixed with 0.5 mL of a 10 mg / mL gentamicin solution (Nacalai Tesque) in a cloning medium [S-Clone Cloning Medium CM-B (Edia)). Single cell cloning by limiting dilution method was performed twice using 5 ml of HT supplement (Gibco)]. Finally, a hybridoma Lym2 clone (hereinafter referred to as hybridoma Lym2) showing the strongest flow cytometry reactivity in human CRTH2-expressing CHO / DG44 cells was established.
- Lym2 antibody the rat anti-human CRTH2 monoclonal antibody contained in the culture supernatant of the hybridoma Lym2 is a rat IgG2b antibody.
- Hybridoma Lym2 was cultured for 1 week in a medium in which 5% Fetal Bovine Serum Ultra Low IgG (Invitrogen) was added to Hybridoma-SFM (Invitrogen). The culture supernatant was collected and subjected to purification.
- the Lym2 antibody was purified from the culture supernatant using Prosep-G (GE Healthcare). First, the culture supernatant was loaded onto the column, the column was washed with PBS, and then eluted with pH 5.0, 3.5 and 3.0 elution buffers (0.1 M citric acid monohydrate-NaOH / pH 5.0, 3.5 and 3.0) were eluted in order. The eluted fraction was immediately neutralized with a neutralization buffer (2M Tris-HCl / pH 8.5).
- a neutralization buffer (2M Tris-HCl / pH 8.5).
- the absorbance (280 nm) of each fraction was measured, and a continuous fraction having a high measured value was recovered as an antibody fraction. Dialyzed with PBS, and passed through a 0.22 ⁇ m filter as purified protein. The concentration was calculated by setting the extinction coefficient at 280 nm to 1.4.
- Example 3 Antigen binding evaluation of Lym2 antibody by flow cytometry FLAG-fused human CRTH2-expressing 3Y1-B cells were detached with 0.05% trypsin solution (Invitrogen), washed with PBS, and then suspended in SM. Next, it seed
- trypsin solution Invitrogen
- Example 4 Cloning of Lym2 Antibody Heavy Chain and Light Chain Variable Region Genes Using RNAiso plus (Takara Bio Inc.), hybridoma Lym2 washed with PBS was dissolved according to the attached instructions to prepare total RNA. The obtained total RNA was dissolved in DEPC treated water (Invitrogen). Next, using the Oligotex-dT30 ⁇ Super> mRNA Purification Kit (From Total RNA) (Takara Bio Inc.), mRNA was purified from the obtained total RNA according to the attached instructions. Further, cDNA was prepared from the purified mRNA using SMART RACE cDNA Amplification Kit (Clontech) according to the attached instruction.
- the rat IgG2b heavy chain gene was converted into primers Ratk-A (SEQ ID NO: 10) and Ratk-B.
- each rat light chain ( ⁇ chain) gene was amplified by PCR. The amplified gene was subcloned and the nucleotide sequence was analyzed.
- VH and VL base sequences and amino acid sequences of the Lym2 antibody including the signal sequence were identified.
- the nucleotide sequences of VH and VL are shown in SEQ ID NOs: 12 and 14, and amino acid sequences are shown in SEQ ID NOs: 13 and 15, respectively.
- the VH and VL sequences of Lym2 antibody not containing a signal sequence were identified.
- the base sequences of VH and VL excluding the signal sequence are shown in SEQ ID NOs: 16 and 18, and amino acid sequences are shown in SEQ ID NOs: 17 and 19, respectively.
- the amino acid sequences of the VH CDR1, CDR2, and CDR3 of the Lym2 antibody are shown in SEQ ID NOs: 20, 21, and 22, respectively.
- the amino acid sequences of the VL CDR1, CDR2, and CDR3 of the Lym2 antibody are shown in SEQ ID NO: 23, respectively. 24 and 25.
- VH was used using primer chLym2VH-A (SEQ ID NO: 28) and primer chLym2VH-B (SEQ ID NO: 29), primer chLym2VL-A (SEQ ID NO: 30) and primer chLym2VL-B (SEQ ID NO: 31).
- VL was amplified by PCR using primer chLym2VH-A (SEQ ID NO: 28) and primer chLym2VH-B (SEQ ID NO: 29), primer chLym2VL-A (SEQ ID NO: 30) and primer chLym2VL-B (SEQ ID NO: 31).
- VL was amplified by PCR using primer chLym2VH-A (SEQ ID NO: 28) and primer chLym2VH-B (SEQ ID NO: 29), primer chLym2VL-A (SEQ ID NO: 30) and primer chLym2VL-
- the gene fragment was subjected to agarose gel electrophoresis and purified by QIAquick Gel Extraction Kit (QIAGEN). Using this fragment, human ⁇ chain constant region expression vector (BglII / BsiWI treatment) and human heavy chain (IgG1) constant region expression vector (Sal1 / Nhe1 treatment), a vector by In-Fusion HD Cloning Kit (Clontech) Subcloning was performed according to the attached instructions.
- E. coli DH5 ⁇ competent cells (Takara Bio Inc.) were transformed, and plasmid extraction and sequence confirmation were performed to prepare a rat / human chimeric Lym2 antibody (hereinafter referred to as chLym2) expression vector.
- chLym2 antibody expression vector (mixture of light chain expression vector and heavy chain expression vector 1: 2) prepared in (1) was added to 20 mL of Opti-Pro SFM (Invitrogen), and 312. 5 ⁇ L of Freestyle MAX Reagent (Invitrogen) was dissolved in 20 mL of Opti-Pro SFM and left at room temperature for 5 minutes. The two solutions were mixed and left at room temperature for 15 minutes. The total amount of the mixed solution was added to 250 mL of a host cell culture solution (1 ⁇ 10 6 cells / mL) to obtain a chLym2 transient expression cell line.
- a host cell culture solution (1 ⁇ 10 6 cells / mL
- ChLym2 was purified from the prepared culture supernatant using MabSelect SuRe (GE Healthcare). First, the culture supernatant was loaded onto the column, the column was washed with PBS, and then eluted with pH 5.0, 3.5, 3.0 elution buffer (0.1 M citric acid monohydrate-NaOH / pH 5.0, 3.5, 3.0). The eluted fraction was immediately neutralized with a neutralization buffer (2M Tris-HCl / pH 8.5).
- the absorbance at 280 nm (A 280 ) of each fraction was measured, and a continuous fraction having a high measured value was recovered as an antibody fraction.
- the antibody fraction was dialyzed with PBS, and the purified protein was filtered through a 0.22 ⁇ m filter. The concentration was calculated by setting the extinction coefficient at 280 nm to 1.37.
- Example 6 Preparation of humanized antibody (1) Design of humanized Lym2 antibody heavy and light chain variable regions (i) Design of amino acid sequence of VL and VH of humanized Lym2 antibody The amino acid sequence of VL of humanized Lym2 antibody is as follows: Designed. First, the VL FR amino acid sequence of a human antibody suitable for transplantation of the VL CDR1-3 amino acid sequences of the Lym2 antibody (SEQ ID NOs: 23, 24, 25) was selected as follows.
- the amino acid sequence of VH of the humanized Lym2 antibody was designed as follows.
- the FR amino acid sequence of human antibody VH suitable for transplantation of VH CDR1 to 3 amino acid sequences of Lym2 antibody was selected as follows. Similar to VL, a human antibody sequence having high homology with the FR sequence of Lym2's VH was searched from the BLASTP database.
- GeneBank ID: AAY333331.1 was the human antibody sequence with the highest homology, so the FR of this antibody was selected.
- HV0 SEQ ID NO: 49
- the amino acid sequence LV0 of the VL of the humanized Lym2 antibody designed above and the amino acid sequence HV0 of the VH were transplanted only with the amino acid sequence of the CDR derived from the rat monoclonal antibody Lym2 into the FR amino acid sequence of the selected human antibody. Is an array.
- the binding activity is often reduced simply by transplanting the CDR amino acid sequence of a rodent-derived antibody to the FR of a human antibody.
- LV0HV0 the three-dimensional structure of the antibody variable region (hereinafter referred to as LV0HV0) composed of the amino acid sequence LV0 of the VL of the humanized Lym2 antibody designed above and the amino acid sequence HV0 of VH using a computer modeling technique. It was constructed.
- a computer model of the three-dimensional structure of the variable region of Lym2 antibody was also constructed in the same manner. Furthermore, amino acid residues different from the Lym2 antibody are selected from the VL0HV0 VL and VH FR amino acid sequences, and amino acid sequences modified to the Lym2 antibody amino acid residues are prepared. Similarly, a three-dimensional structural model is prepared. Built. The three-dimensional structures of the variable regions of the Lym2 antibody, LV0HV0, and the variant thus produced were compared, and amino acid residues predicted to affect the binding activity of the antibody were identified.
- LV0 has the amino acid sequence of SEQ ID NO: 33. 2nd Ile, 4th Met, 15th Pro, and 85th Ala, in HV0, 18th Leu of amino acid sequence of SEQ ID NO: 49, 77th Asn, 93rd Val, and 117th Of Thr were selected respectively.
- amino acid modification is performed to replace at least one amino acid sequence with an amino acid residue present at the same site of Lym2 antibody, and VL and VH of humanized antibodies having various modifications are changed. Designed. Specifically, for VL, the second Ile of the amino acid sequence of SEQ ID NO: 33 is replaced with Val, the fourth Met is replaced with Leu, the 15th Pro is replaced with Leu, or the 85th Ala is replaced with Pro. Among amino acid modifications, at least one modification was introduced.
- the humanized Lym2 antibodies containing the above-mentioned variable regions are designated as LV0HV0, LV1HV0, LV2aHV0, LV2bHV0, LV2cHV0, V4H4V4 Abbreviated as LV0HV1, LV0HV2a, LV0HV2b, and LV0HV3.
- Light chain variable region LV0 (SEQ ID NO: 33), LV1 (SEQ ID NO: 35), LV2a (SEQ ID NO: 37), LV2b (SEQ ID NO: 39), LV2c (SEQ ID NO: 41), LV3a (SEQ ID NO: 43), LV3b (SEQ ID NO: 43) 45), LV4 (SEQ ID NO: 47), and heavy chain variable region HV0 (SEQ ID NO: 49), HV1 (SEQ ID NO: 51), HV2a (SEQ ID NO: 53), HV2b (SEQ ID NO: 55), HV3 (SEQ ID NO: 57), The amino acid sequence of HV4 (SEQ ID NO: 59) is shown in FIGS. 1 and 2, respectively.
- variable region gene of humanized Lym2 antibody The base sequence encoding the amino acid sequence of the variable region of humanized antibody was designed using codons frequently used in animal cells. Using these base sequences, the following humanized Lym2 antibody expression vector was constructed and the corresponding antibody was expressed.
- a humanized Lym2 antibody expression vector was constructed according to the method described in Example 5- (1). That is, SEQ ID NOs: 32, 34, 36, and 38 encoding the amino acid sequences represented by SEQ ID NOs: 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, and 59, respectively. , 40, 42, 44, 46, 48, 50, 52, 54, 56 and 58, and the corresponding VL and VH gene fragments were synthesized using the primers shown in SEQ ID NOs: 28-31. Amplified by PCR. The gene fragment was subjected to agarose gel electrophoresis and purified by QIAquick Gel Extraction Kit (QIAGEN).
- This VL or VH fragment was expressed in human kappa chain constant region expression vector (BglII / BsiWI treatment) and human heavy chain (IgG1) constant region expression using In-Fusion HD Cloning Kit (Clontech) according to the attached instructions. Subcloning into a vector (Sal1 / Nhe1 treatment) was performed. Escherichia coli DH5 ⁇ competent cell (Takara Bio Inc.) is transformed with the prepared vector, plasmid extraction and sequence confirmation are performed, colonies with the correct sequence inserted are selected, and plasmids are used for transient expression. Mass preparation was performed.
- the culture volume was 200 mL, and the cells were cultured for 5 days under the conditions of 37 ° C., 8% CO 2 and 125 rpm. After the culture, the cell suspension was centrifuged, and the culture supernatant containing the humanized Lym2 antibody was collected through a 0.2 ⁇ m filter (Thermo Scientific).
- Humanized Lym2 antibody was purified by affinity purification using MabSelect SuRe (GE Healthcare) shown below. After the resin was equilibrated with PBS, the culture supernatant obtained in (3) was loaded and washed twice with PBS.
- the antibody was eluted using an elution buffer (20 mM citric acid, 50 mM NaCl, pH 3.4), and neutralized by adding 1/10 volume of neutralization buffer (1M phosphate-NaOH, pH 7.0). . Subsequently, the buffer was replaced with PBS using NAP25 (GE Healthcare). It was concentrated by ultrafiltration using Amicon Ultra-4 Centrifugal Filter Units (Millipore), and measuring the Nanodrop8000 absorbance at 280nm using (Thermo Scientific, Inc.) (A 280), density measurement and preparation of antibody solution Went.
- Example 7 Antigen binding activity of chLym2 and humanized Lym2 antibody FLAG-fused human CRTH2-expressing 3Y1-B cells were detached with 0.25% Trypsin-EDTA (Nacalai Tesque), washed with PBS, and then suspended in SM. The cells are then seeded in 96-well plates at 1 ⁇ 10 5 cells per well, and 50,000, 12500, 3125, 781, 195, 49, 12, and 3 ng / mL final concentrations of chLym2 or humanized, respectively. Lym2 antibody was added and a reaction was performed at 4 ° C. for 60 minutes.
- Example 8 Depletion activity of chLym2 and humanized Lym2 antibody against eosinophils and basophils Human peripheral blood collected by adding heparin sodium injection was centrifuged at 4 ° C. and 1500 rpm for 30 minutes to collect plasma.
- PBS Nacalai Tesque
- erythrocytes erythrocytes
- 1 mL of the suspension is added to a solution for hemolysis [10 ⁇ RBC Lysis buffer (e-bioscience). 10 ml diluted with sterilized water] was added and mixed by inversion. After standing at room temperature for 10 minutes, centrifugation was performed at room temperature, 1500 rpm, and 5 minutes, the supernatant was removed, and the plate was washed twice with PBS.
- the cell pellet is suspended in the collected plasma and seeded on a 48-well plate at 300 ⁇ L / well, 1000, 100, 33, 11, 3.7, 1.2, 0.4 and 0.01 ng / mL.
- DNP dinitrophenol
- PE anti-human Siglec-8 Antibody BioLegend
- PE-Cy7 Mouse Anti-Human CD123 BD Biotechnology for basophil detection
- Anti-Human Fc epsilon Receptor I alpha Fc ⁇ R1 APC (eBioscience) were added at 5 ⁇ L / well and reacted at 4 ° C. for 40 minutes.
- Human eosinophils were detected as a 7-AAD negative single8-PE positive fraction in the granulocyte fraction developed by FSC-SSC. Human basophils were detected as 7-AAD negative, CD123-PC-Cy7 positive, and Fc ⁇ RI-APC positive fractions in the lymphocyte fraction developed by FSC-SSC. Cell depletion activity was assessed by analyzing the count of each cell per count of CountBright counts.
- the evaluated humanized Lym2 antibodies LV0HV0, LV0HV1 and LV0HV2a are all cells against eosinophils and basophils equivalent to the chimeric Lym2 antibody chLym2. It became clear that it showed an injury activity.
- Example 9 Preparation of anti-human CRTH2 antibody for comparison control (1) Preparation of anti-human CRTH2 antibody expression vector for comparison control And VL amino acid sequences (represented in SEQ ID NOs: 57 and 40, 64 and 52, 62 and 50, 63 and 51, and 65 and 53 in WO 2014/144865, respectively) The sequence was fully synthesized.
- Example 5- (1) the above base sequences are incorporated into an antibody expression vector so as to be a combination of VH and VL of each antibody, and five types of humanized or chimeric anti-humans for comparison are used.
- Expression vectors for CRTH2 antibodies (hu19A2, v52, hu8B1, v1, ch8B1, ch3C12 and ch31A5, respectively) were prepared.
- Example 10 Epitope analysis of anti-human CRTH2 monoclonal antibody using human CRTH2 amino acid substitution expression cells (1) Preparation of human CRTH2 amino acid substitution expression vector Partial amino acid residues in the extracellular region of the amino acid sequence of human CRTH2 An expression vector of an amino acid substitution product substituted with another amino acid residue was prepared.
- the symbol for amino acid substitution represents [one-letter code of amino acid residue before substitution] [position of substitution counted from N-terminal] [single-character code of amino acids
- phmAG1-MNLinker (MBL) was used, and by inserting genes encoding various amino acid substitutions in which the stop codon was deleted at the restriction enzyme sites of BamHI and HindIII, the intracellular C-terminal region was inserted. Added thistle green tag.
- the vector expressing the above amino acid substitution is 1) a method in which a gene sequence encoding the amino acid substitution is fully synthesized and inserted into the vector, or 2) the wild type human CRTH2 amino acid sequence represented by SEQ ID NO: 1 is encoded. It was prepared by carrying out site-directed mutagenesis from a vector into which DNA was inserted.
- CHO-S cells (Life Technologies) were used to prepare cell lines expressing human CRTH2 amino acid substitutes. For passage of cells, Free style CHO expression medium (Invitrogen) containing 8 mM L-Glutamine (Invitrogen) was used, and cultured under shaking at 37 ° C. and 5% CO 2 .
- Free style CHO expression medium Invitrogen
- 8 mM L-Glutamine Invitrogen
- 25 ⁇ g of the human CRTH2 amino acid substitution expression vector prepared in (1) was dissolved in 400 ⁇ L of Opti-Pro SFM (Invitrogen), and 25 ⁇ L of Freestyle MAX Reagent (Invitrogen) was dissolved in 400 ⁇ L of Opti-Pro SFM. And left at room temperature for 5 minutes. The two solutions were mixed and left at room temperature for 15 minutes. The mixed solution was added to the above CHO-S culture solution and cultured for 24 hours to obtain a human CRTH2 amino acid substituted expression cell line.
- goat anti-Human IgG alexa 647 (Molecular Probes) diluted with SM is added to wells to which chLym2, LV0HV1, hu19A2, v52, hu8B1, v1, ch3C12 or ch31A5 have been added, and BM16 is added to wells to which BM16 has been added.
- Goat anti-RatIgG alexa647 (Molecular Probes) diluted with SM was added at a final concentration of 10 ⁇ g / mL, and the reaction was performed at 4 ° C. for 1 hour.
- the humanized Lym2 antibody LV0HV1 was produced by P12A, L14A and E15A; D177A, G178A and R179A; I180A and M181A; Y183A, Y184A and N185A; L187A, L188A and L189A; It became clear that the reactivity of D194A; R195A; or D196A and T198A to cells expressing human CRTH2 amino acid substitutions disappeared.
- the other anti-human CRTH2 antibodies compared this time had significantly reduced reactivity to cells expressing human CRTH2 amino acid substitution products at sites different from the anti-human CRTH2 antibody of the present invention. It was revealed that the anti-human CRTH2 antibody recognizes a different epitope from the antibody of the present invention.
- the reactivity of the existing anti-human CRTH2 antibody to the amino acid substitution expression cell containing G192A or D194A does not decrease. Since only the antibody had reduced reactivity to the cells, it was revealed that the anti-human CRTH2 antibody of the present invention binds to an epitope containing at least one amino acid residue of Gly192 and Asp194 of human CRTH2. .
- Example 11 Evaluation of reactivity to human eosinophils An equal amount of physiological saline for injection was added to and mixed with human peripheral blood collected by adding heparin sodium injection. 15 mL of Ficoll-Paque PREMIUM 1.084 (GE Healthcare) was added to a 50 mL centrifuge tube, 30 mL of the above-described human peripheral blood diluted with physiological saline was layered, and centrifuged at 1500 rpm at room temperature for 30 minutes.
- MACS BSA Stock Solution Miltenyi Biotech
- autoMACS Rinsing Solution Miltenyi Biotech
- eosinophils were isolated by the negative selection method using CD16 MicroBeads and human (Miltenyi Biotech) according to the attached instructions.
- the isolated cells were washed with SM, seeded in a 96-well plate at 1 ⁇ 10 5 cells per well, and centrifuged at 2000 rpm for 2 minutes. After removing the supernatant, diluted with SM, 103.3, 1.1, 0.37, and 0.12 ⁇ g / mL final concentrations of Lym2 antibody, commercially available CRTH2 antibody BM16 (Santa cruz) or 301108 (R & D) was added and the reaction was carried out at 4 ° C. for 1 hour.
- CELL LAB Mouse Anti-Rap Kappa (kappa light chain specific) FITC (Beckman Coulter) diluted with SM was added to wells to which Lym2 antibody or BM16 was added.
- CELL LAB Goat Anti-Mouse IgG ( ⁇ chain specific) Fluorescein (FITC) Conjugate (Beckman Coulter, Inc.) diluted with SM was added at a final concentration of 10 ⁇ g / mL and reacted at 4 ° C. for 1 hour. After washing the cells again, the cells were suspended in SM, and the fluorescence intensity was analyzed by flow cytometry (BD Biosciences, FACS Canto II).
- the rat anti-human CRTH2 antibody Lym2 has a stronger reactivity against human eosinophils than the commercially available rat anti-human CRTH2 antibody BM16 and mouse anti-human CRTH2 antibody 301108 (FIG. 8). .
- Example 12 Reactivity of chLym2 to human basophils
- an equal volume of physiological saline for injection was added and mixed.
- 15 mL of Ficoll-Paque PREMIUM 1.084 (GE Healthcare) was added to a 50 mL centrifuge tube, 30 mL of human peripheral blood diluted with physiological saline was layered, and centrifuged at 1500 rpm at room temperature for 30 minutes.
- basophils were isolated by the negative selection method using Basophil Isolation Kit II, human (Miltenyi Biotech) according to the attached instructions.
- the isolated cells were washed with SM, seeded in a 96-well plate at 5 ⁇ 10 4 cells per well, and centrifuged at 2000 rpm for 2 minutes. After removing the supernatant, the cells were suspended in 100 ⁇ L of SM, and labeled according to the attached instructions using Zenon Alexa Fluor 647 Human IgG Labeling Kit (Molecular Probes). Isotype control antibody was added to a final concentration of 10 ⁇ g / mL, and a reaction was performed at 4 ° C. for 1 hour. After washing the cells, the cells were suspended in SM, and the fluorescence intensity was analyzed by flow cytometry (BD Bioscience, FACS Canto II).
- Example 13 Reactivity of humanized Lym2 antibody against human CD4-positive T cells Mononuclear cell layer cells prepared according to Example 12 using Ficoll-Paque PREMIUM (GE Healthcare) instead of Ficoll-Paque PREMIUM 1.084 The suspension was seeded in a 96-well plate at 100 ⁇ L / well, and biotinylated humanized Lym2 antibody LV0HV1 using EZ-Link Sulfo-NHS-LC-Biotin, No-Weight Format (PIERCE) according to the attached instructions. was added to a final concentration of 10 ⁇ g / mL, and the reaction was performed at 4 ° C. for 1 hour.
- Ficoll-Paque PREMIUM GE Healthcare
- the lymphocytes were fractionated by FSC-SSC development, and further, the CD4 antibody was obtained with the fluorescence intensity of fluorescence staining with the humanized Lym2 antibody LV0HV1 on the vertical axis for the cell group fractionated with CD3 positive and CD4 positive cells.
- the ratio of the reactive fraction of the humanized Lym2 antibody LV0HV1 in the CD3-positive CD4-positive cells was calculated by showing the fluorescence intensity of the fluorescence staining by ⁇ on the horizontal axis.
- the humanized Lym2 antibody LV0HV1 reacted with about 2-3% of the CD3 positive CD4 positive T cell fraction (FIG. 10).
- Example 14 Cytotoxic activity against eosinophils and basophils A cell suspension prepared in the same manner as in Example 8 was seeded on a 96-well plate at 95 ⁇ L / well and 1000, 10, 3, 1, 0.3,. A test antibody having a final concentration of 1 ng / mL was added and reacted at 37 ° C. in a 5% CO 2 incubator for 20 hours. As test antibodies, humanized Lym2 antibody LV0HV1, anti-human CRTH2 antibodies hu19A2 v52, hu8B1 v1, ch3C12 and ch31A5 prepared in Example 9 were used. Anti-DNP IgG1 antibody was used as an isotype control antibody.
- SM was added to each well after reaction at 100 ⁇ L / well, and CountBright Absolute Counting Beads, for flow cytometry (Molecular Probes) was added as control beads at 20 ⁇ L / well, and centrifugation was performed at 4 ° C., 2000 rpm for 2 minutes. And the supernatant was removed. After washing with SM twice, 10000 ⁇ g / mL IgG from human serum (Sigma Aldrich) diluted with SM was added at 100 ⁇ L / well and reacted at 4 ° C. for 30 minutes. Thereafter, the same method as in Example 8 was performed.
- humanized anti-human CRTH2 antibody LV0HV1 removed both eosinophil and basophil cells depending on the antibody concentration.
- the existing anti-human CRTH2 antibody ch3C12 had a weaker cell-removing activity than the humanized anti-human CRTH2 antibody LV0HV1 [FIG. 11 (A) and FIG. 11 (B)]. Therefore, it is suggested that the anti-human CRTH2 antibody of the present invention can exert a therapeutic effect targeting eosinophils or basophils expressed by CRTH2.
- Example 15 Cytotoxic activity against Th2 cells A mononuclear cell layer prepared in the same manner as in Example 13 was added to 1/10 volume FBS (Gibco), 200 mM-L-Glutamine Stock Solution (Nacalai Tesque), 10 mM MEM Non-Essential Amino Acids.
- RPMI1MC RPMI1MC (hereinafter referred to as “RPMI1MC”) containing Solution (Gibco), 100 mM Sodium Pyruvate (Gibco), 1M HEPES Buffer Solution (Gibco) and 1/100 volume Penicillin-Streptomycin, Liquid (Gibco) washed twice with "peripheral blood mononuclear cell”) And, to prepare 1 ⁇ 10 7 cells / mL cell suspension.
- RPMI1MC RPMI1MC
- the prepared cell suspension is seeded in a 96-well plate at 100 ⁇ L / well, and chLym2 antibody, humanized anti-human CRTH2 antibody LV0HV1 or the isotype control antibody described in Example 8 is added at a final concentration of 10 ⁇ g / mL, at 37 ° C., 5 ° C. The reaction was allowed to proceed for 20 hours in a% CO 2 incubator.
- the cells after the reaction were washed 7 times with PBMC culture medium, and the test antibody was sufficiently removed, then suspended in 100 ⁇ L of PBMC culture medium, and anti-CD3 antibody OKT3 (Abcam) was immobilized at a concentration of 1 ⁇ g / mL. Seeded on the plate. Thereafter, an anti-CD28 antibody (BD Bioscience) prepared to 2 ⁇ g / mL was added at 100 ⁇ L / well and allowed to react in a 37 ° C., 5% CO 2 incubator for 3 days.
- the chimeric anti-human CRTH2 antibody chLym2 and the humanized anti-human CRTH2 antibody LV0HV1 decreased the production of the Th2 cytokines IL-5 and IL-13, whereas the Th1 cytokine IFN- ⁇ was reduced. Production was not changed. That is, it was suggested that the antibody of the present invention selectively removes Th2 cells [FIG. 12 (A) and FIG. 12 (B)]. Therefore, it was suggested that the anti-human CRTH2 antibody of the present invention can exert a therapeutic effect targeting Th2 cells.
- Example 16 Reactivity evaluation in the presence of ligand (293EBNA)
- the human CRTH2 gene expression pAMoh vector prepared in Example 1- (1)-(ii) was introduced into 293EBNA cells (Invitrogen) using Fugene 6 (Promega), 10% FBS, 0.25 mg / mL G418 (Nacalai Tesque), 100 ⁇ g / mL penicillin, 100 U / mL streptomycin (Nacalai Tesque), and 300 ⁇ g / mL hygromycin B (Wako Pure Chemical Industries, Ltd.). Was established.
- Human CRTH2-expressing 293EBNA cells were detached with 0.02% EDTA solution (Nacalai Tesque), washed with PBS, and suspended in the above medium. Next, it seed
- the antibody of the present invention has high reactivity even in the presence of a high concentration of ligand. Therefore, the anti-human CRTH2 antibody of the present invention can bind to human CRTH2-expressing cells in the presence of a ligand in the same manner as the reactivity in the absence of the ligand, and acts on the human CRTH2-expressing cells. It was suggested to be a useful antibody that can be used.
- Example 17 Analysis of reactivity to differentiation-induced human mast cells Mast cells were prepared according to the method described in Nature Protocols 2006, 1 (4), 2178-2183. Mast cells at 11 weeks from the start of differentiation induction were washed with SM, seeded in a 96-well plate at 5 ⁇ 10 4 cells per well, and PE anti-human CD203c (E-NPP3) Antibody (manufactured by BioLegend) ), Brilliant Violet 421 (trademark) anti-human CD117 (c-kit) Antibody (manufactured by BioLegend), Anti-Human Fc epsilon Receptor I alpha (Fc ⁇ R1) PE (eBioscience) at 4 ° C. The reaction was performed. After washing the cells, the cells were suspended in SM, and the fluorescence intensity was analyzed by flow cytometry (BD Bioscience, FACS Canto II).
- the mast cells that had undergone differentiation induction expressed all of mast cell surface markers CD203c, CD117, and Fc ⁇ RI.
- Human IgE in which the constant region of the anti-DNP IgG1 antibody was recombined to IgE type was added at a final concentration of 10 ⁇ g / mL to the mast cell culture medium at 15 weeks from the start of differentiation induction, and 3% in a 37 ° C., 5% CO 2 incubator. The reaction was allowed for days.
- the mast cells were added at a final concentration of 100 ⁇ g / mL penicillin, 100 U / mL streptomycin (Nacalai Tesque) and 55 ⁇ M ⁇ -ME (Gibco) IMDM (Gibco) (hereinafter abbreviated as basic culture medium). Washed twice, suspended in 4 mL of basic culture medium, added with final concentration of 10 ⁇ g / mL rabbit polyclonal anti human IgEantibody (Dako), and used MACS mix tube rotator (Milteny Biotech) at 37 ° C. using a 37 ° C. rotation. The reaction was allowed to proceed for 1 hour in a 5% CO 2 incubator.
- basic culture medium Washed twice, suspended in 4 mL of basic culture medium, added with final concentration of 10 ⁇ g / mL rabbit polyclonal anti human IgEantibody (Dako), and used MACS mix tube rotator (Milteny Biotech) at 37 ° C. using a
- the cells after the reaction were washed twice with SM, seeded in a 96-well plate at 5 ⁇ 10 4 per well, and centrifuged at 2000 rpm for 2 minutes. After removing the supernatant, 10000 ⁇ g / mL IgG from human serum (Sigma Aldrich) diluted with SM was added at 100 ⁇ L / well, reacted at 4 ° C.
- hu19A2 v52 showed reactivity to mast cells, while antibodies other than hu19A2v52 containing LV0HV1 showed no reactivity.
- Example 18 Analysis of reactivity to differentiation-inducing Th1 (1) Separation of naive T cells from PBMC 20 mL of PBMC culture medium containing frozen PBMC (Allcells) derived from healthy subjects and 50 ⁇ L of DNase I recombinant, RNase-free (Roche Diagnostics) The plate was washed once with, and suspended again in 20 mL of PBMC culture medium containing 50 ⁇ L of DNase I recombinant and RNase-free, and left in a 37 ° C., 5% CO 2 incubator for 2 hours.
- naive CD4 + T cell isolation kit II human (Miltenyi Biotech) was used to perform naive CD4 positive T cells by the negative selection method according to the attached instructions. Isolated. In order to increase the purity of naive CD4 positive T cells, the negative selection was performed twice.
- the cells are collected, and the supernatant is removed by centrifugation. Then, the cells are suspended in culture medium at 1 ⁇ 10 6 cells / mL, and a final concentration of 100 ng / mL recombinant human IL-12 (Peprotech) is used as a growth step. , 10ng / mL recombinant human IL- 2 (peprotech Co.) and 5 [mu] g / mL added to 37 ° C. the anti-IL-4 antibody (BD Biosciences) was allowed to react for 3 days in a 5% CO 2 incubator.
- the differentiation-inducing Th1 cells were established by repeating the above stimulation and proliferation processes three times in total.
- dead cells were stained according to the attached instructions using LIVE / DEAD Fixable Aqua Dead Cell Stain Kit, for 405 nm excitation (Molecular Probes), washed twice with PBS, the supernatant was removed, and Fixation Buffer ( BD Biosciences) for 4 minutes at 4 ° C.
- PEanti-human IFN- ⁇ Antibody (BioLegend) with a final concentration of 2.5 ⁇ L, 5 ⁇ L of APC anti- Human IL-4 Antibody (BioLegend), 10 ⁇ L of anti-IL-5 antibodies APC (Miltenyi Biotech) and 20 ⁇ L of APC anti-human IL-13 Antibody (BioLegend) were added and reacted at 4 ° C. for 30 minutes. I let you.
- the cells were washed twice with 1 ⁇ Perm / Wash Buffer, the cells were suspended in SM, and the fluorescence intensity was analyzed by flow cytometry (BD Bioscience, FACS Canto II).
- Th1 differentiation-inducing Th1 was negative for IL-4 / 5/13 and 90% of the population was IFN ⁇ -positive population, and was confirmed to be a cell that selectively produces Th1 cytokines. .
- Negative Control Mouse IgG2a (Dako) was used.
- the rat anti-human CRTH2 antibody Lym2 and the commercially available rat anti-human CRTH2 antibody BM16 showed no reactivity to differentiation-inducing Th1.
- commercially available mouse anti-human CRTH2 antibody 301108 showed reactivity to differentiation-inducing Th1.
- the anti-human CRTH2 antibody of the present invention reacts with eosinophils, basophils and Th2 cells but does not react with Th1 cells.
- 301108 exhibits non-specific reactivity in addition to cells expressing CRTH2.
- Example 19 Evaluation of antagonistic activity of Lym2 antibody using morphological changes of human eosinophils as an index.
- Eosinophils were separated from human peripheral blood by the same method as in Example 11.
- the isolated human eosinophils were suspended in Dulbecco's phosphate buffered saline (hereinafter referred to as D-PBS ( ⁇ )) (Nacalai Tesque), and the suspension was maintained at 37 ° C. in a 5% CO 2 incubator for 1 hour 30 It was made to react for minutes. Then, it seed
- D-PBS Dulbecco's phosphate buffered saline
- an isotype control antibody [CELL LAB Rat IgG2b Isotype Control (Beckman Coulter)] at a final concentration of 10 ⁇ g / mL, or Lym2 antibody, or OC000459 (Cayman chemical) at a final concentration of 10 ⁇ M CRTH2 small molecule antagonist as a positive control is added.
- the reaction was allowed to proceed for 30 minutes in a 37 ° C., 5% CO 2 incubator.
- DKKGD2 (Cayman chemical) at final concentrations of 0.1, 1, 10, 100, and 1000 nM was added, and further reacted at 37 ° C. in a 5% CO 2 incubator for 60 minutes. After the reaction, the plate was washed twice with ice-cold PBS, FixationBuffer (BD Bioscience) was added at 200 ⁇ L / well, suspended well, and left at 4 ° C. for 30 minutes. Thereafter, the plate was washed twice with SM, and the eosinophil shape change was analyzed by flow cytometry (BD Bioscience, FACS Canto II).
- the change in eosinophil morphology was analyzed using an increase in the Forward Scatter Light (FSC) plot, which is an index of cell size, cell surface area or cell diameter, in the analysis using a flow cytometer.
- FSC Forward Scatter Light
- the ratio (%) of eosinophils detected in the high FSC gate was calculated based on the acid sphere FSC.
- the human CRTH2 ligand DKKGD2 induced a concentration-dependent eosinophil shape change
- the CRTH2 small molecule antagonist OC000459 showed a DKKGD2-dependent eosinophil shape change. Suppressed.
- neither the anti-human CRTH2 antibody Lym2 nor the isotype control antibody of the present invention inhibited DKKGD2-dependent eosinophil shape change. That is, it was suggested that the anti-human CRTH2 antibody of the present invention has no antagonist activity.
- Example 20 Evaluation of agonist activity of Lym2 antibody using morphological change of human eosinophils as an index
- rat anti-rats at 0, 0.01, 0.1, 1 and 10 ⁇ g / mL final concentrations were used.
- Human CRTH2 antibody Lym2 was added and allowed to react for 1 hour to analyze eosinophil shape change.
- the Lym2 antibody did not cause eosinophil shape change even when the antibody concentration was treated in the range of 0-10 ⁇ g / mL. That is, it was suggested that the anti-human CRTH2 antibody of the present invention has no agonist activity.
- Example 21 Evaluation of anti-human CRTH2 antibody agonistic activity, antagonistic activity, and ligand enhancement activity using human eosinophil shape change as an index Separation of eosinophils from human peripheral blood by the same method as in Example 11. went. However, the operation of adding an equal amount of physiological saline for injection to the blood was not performed, and it was directly layered on Ficoll-Paque PREMIUM 1.084 (GE Healthcare). The isolated human eosinophils were suspended in D-PBS ( ⁇ ) (Nacalai Tesque) and reacted at 37 ° C. for 1 hour 30 minutes in a 5% CO 2 incubator.
- hu19A2 v52 and BM16 enhanced the morphological changes induced by DKKGD2.
- hu19A2 v52 was found to enhance the morphological change induced by 100 nM DKKGD2 up to about 2-fold.
- the hu19A2 v52 and BM16 antibodies do not induce morphological changes in the absence of the ligand, suggesting that these antibodies have a signal enhancement activity by DCKGD2 which is a CRTH2 ligand.
- LV0HV1 and 301108 did not show any effect on morphological changes in the absence or presence of DKKGD2, and thus did not have a signal enhancing activity by DKKGD2. It has been suggested.
- the anti-human CRTH2 antibody of the present invention is preferable in that it does not block or enhance physiological signals.
- Example 22 (1) Preparation of horseradish peroxidase (HRP) -labeled antibody Using Peroxidase Labeling Kit-NH2 (Dojindo) according to the package insert, human HRP was directly labeled on the modified Lym2 antibodies LV0HV1 and hu19A2 v52, and then diluted to 1 mg / mL with D-PBS ( ⁇ ) (Nacalai Tesque).
- HRP horseradish peroxidase
- an ELISA reaction solution supplemented with 500 ⁇ M GTP ⁇ S (Roche Diagnostics) or 500 ⁇ M GDP (Sigma-Aldrich) was added at 50 ⁇ L / tube and incubated at 30 ° C. for 1 hour.
- IgG from human serum Sigma-Aldrich
- 30% w / v BSA-PBS fatty acid free Wako
- IgG from human serum Sigma-Aldrich
- 30% w / v BSA-PBS fatty acid free Wako
- IgG from human serum Sigma-Aldrich
- 30% w / v BSA-PBS fatty acid free Wako
- IgG from human serum Sigma-Aldrich
- 30% w / v BSA-PBS fatty acid free Wi-
- the HRP-labeled LV0HV1 or hu19A2 v52 prepared in (1) was diluted to 5 ⁇ g / mL with an ELISA reaction solution, added at 50 ⁇ L / tube, and then incubated at 30 ° C. for 1 hour to obtain a membrane fraction.
- Antibody reaction against was carried out. After centrifugation at 16000 g for 30 minutes at 4 ° C., the supernatant was removed.
- the ELISA reaction solution with 100 ⁇ M GTP ⁇ S added to the tube to which GTP ⁇ S was originally added and the ELISA reaction solution with 100 ⁇ M GDP added to the tube to which GDP was added were each added at 1 mL / tube, and again 16000 g. After centrifugation at 4 ° C. for 30 minutes, the supernatant was removed. After the same operation was repeated 4 times, D-PBS ( ⁇ ) was added at 100 ⁇ L / tube to sufficiently suspend the membrane fraction.
- the suspension was added to a 96-well plate at 30 ⁇ L / well, and 1-Step Ultra TMB-ELISA reagent (Thermo Scientific) was added at 100 ⁇ L / well. After reacting at room temperature for 10 minutes, 0.5 mol / L sulfuric acid (Wako) was added at 100 ⁇ L / well to stop the reaction.
- 1-Step Ultra TMB-ELISA reagent Thermo Scientific
- CRTH2 is a GPCR, and it is generally known that GTP is bound in an activated conformation and GDP is bound in an inactivated conformation. As described above, the anti-human CRTH2 antibody of the present invention did not change the reactivity to CRTH2 regardless of the treatment with GTP analog GTP ⁇ S or GDP. The possibility of showing a certain reactivity was suggested without being influenced.
- Example 23 Preparation of thistle green fusion human and cynomolgus monkey CRTH2 expression phmAG1-MNLinker vector
- Thistle green fusion human CRTH2 expression phmAG1-MNLinker vector The human CRTH2 gene expression pAMoh prepared in (1)-(ii) of Example 1
- the target fragment was amplified by PCR using primers humanCRTH2azami-A (SEQ ID NO: 60) and humanCRTH2azami-B (SEQ ID NO: 61), and ligated with the vector phmAG1-MNLinker (MBL) using restriction enzymes BamHI and HindIII. Then, thistle green fusion human CRTH2 expression phmAG1-MNLinker vector was constructed.
- Example 24 Construction of thistle green fusion human CRTH2 expressing CHO / DG44 cells and cynomolgus monkey CRTH2 expressing CHO / DG44 cells The strand DNA was purified and dissolved in sterilized water. This DNA was introduced into CHO / DG44 cells by electroporation and cultured in IMDM culture medium for about 3 days.
- drug-resistant cells were selected with an IMDM selective medium supplemented with 0.5 mg / mL G418 (Nacalai Tesque).
- the selected drug resistant cells were detached with 0.25% Trypsin-EDTA (Nacalai Tesque), washed with PBS, and suspended in IMDM selective medium.
- Cell Sorter SH800 Cell Sorter SH800 (Sony)
- cell populations showing the same level of thistle green fluorescence in human CRTH2-expressing cells and cynomolgus monkey CRTH2-expressing cells were respectively gated, sorted at 1 cell / well, and expanded.
- Thistle green fusion human CRTH2-expressing CHO / DG44 cells and cynomolgus CRTH2-expressing CHO / DG44 cells were established, respectively.
- Thistle green fusion human CRTH2-expressing CHO / DG44 cells and cynomolgus CRTH2-expressing CHO / DG44 cells were prepared in the same manner as described above, and thistle green expression was performed using flow cytometry (BD Biosciences, FACS CantoII). Confirmed. As a result, as shown in FIG. 20, it was confirmed that the expression of thistle green in each cell was equivalent.
- Example 25 Evaluation of binding activity of humanized Lym2 antibody LV0HV1 to human or cynomolgus monkey CRTH2 Thistle green-fused human or cynomolgus CRTH2-expressing CHO / DG44 cells established in Example 24 were detached with a 0.02% EDTA solution (Nacalai Tesque). After washing with PBS, it was suspended in SM. Next, the cells were seeded in a 96-well plate so that the number of cells was 2 ⁇ 10 5 per well, and humanized Lym2 antibodies at final concentrations of 30000, 7500, 1875, 469, 117, 29, 7 and 2 ng / mL were used. LV0HV1 or anti-DNP IgG1 antibody was added, and the reaction was performed at 4 ° C. for 40 minutes.
- an anti-human CRTH2 antibody having a desired activity by recognizing and binding to a characteristic epitope of human CRTH2, the antibody fragment, a DNA encoding the amino acid sequence of the antibody, a vector containing the DNA, the antibody With a hybridoma and an antibody-producing cell producing the same, a method for producing the antibody, a composition containing the antibody or antibody fragment, an allergic disease using the antibody or antibody fragment, an autoimmune disease, eosinophilia and hyperfunction It is possible to provide a method for treating and diagnosing a disease, a disease associated with an increase in Th2 cells or hyperfunction, and a medicine and a diagnostic agent containing the antibody or antibody fragment.
- SEQ ID NO: 3 Description of artificial sequence: nucleotide sequence of humanCRTH2FLAG-A
- SEQ ID NO: 4 Description of artificial sequence: nucleotide sequence of humanCRTH2FLAG-B
- SEQ ID NO: 5 Description of artificial sequence: Base sequence of human CRTH2 cDNA with FLAG tag
- SEQ ID NO: 6 description of artificial sequence: nucleotide sequence of humanCRTH2FLAG-C
- SEQ ID NO: 7 description of artificial sequence: nucleotide sequence of humanCRTH2FLAG-D
- SEQ ID NO: 9 Description: Base sequence of RatIgG2bH-B
- 10 Description of artificial sequence: Base sequence of Rat-A SEQ ID NO: 11: Description of artificial sequence: Base sequence of Ratk-B SEQ ID NO: 20: Description of artificial sequence: Lym2 antibody VH CDR1 amino acid sequence
Abstract
Description
(1)配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンおよび194番目のアスパラギン酸の少なくとも一方を認識し、結合する抗体または該抗体断片。
(2)抗体が、配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、13番目のイソロイシン、14番目のロイシン、15番目のグルタミン酸、177番目のアスパラギン酸、178番目のグリシン、179番目のアルギニン、180番目のイソロイシン、181番目のメチオニン、182番目のシステイン、183番目のチロシン、184番目のチロシン、185番目のアスパラギン、186番目のバリン、187番目のロイシン、188番目のロイシン、189番目のロイシン、195番目のアルギニン、196番目のアスパラギン酸、197番目のアラニン、および198番目のスレオニンからなる群から選ばれるアミノ酸残基の少なくとも1つを認識し、結合する抗体である(1)に記載の抗体または該抗体断片。
(3)抗体が、以下の(a)~(g)からなる群から選ばれるアミノ酸残基の少なくとも1つを認識する抗体である、(1)または(2)に記載の抗体または該抗体断片。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、14番目のロイシンおよび15番目のグルタミン酸、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の177番目のアスパラギン酸、178番目のグリシン、および179番目のアルギニン、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の180番目のイソロイシンおよび181番目のメチオニン、
(d)配列番号2で表されるヒトCRTH2のアミノ酸配列の183番目のチロシン、184番目のチロシンおよび185番目のアスパラギン、
(e)配列番号2で表されるヒトCRTH2のアミノ酸配列の187番目のロイシン、188番目のロイシンおよび189番目のロイシン、
(f)配列番号2で表されるヒトCRTH2のアミノ酸配列の195番目のアルギニン、並びに
(g)配列番号2で表されるヒトCRTH2のアミノ酸配列の196番目のアスパラギン酸および198番目のスレオニン。
(4)抗体が、以下の(a)~(d)からなる群から選ばれるいずれか1つの抗体である、(1)~(3)のいずれか1に記載の抗体または該抗体断片。
(a)抗体重鎖可変領域(以下、VHと略記する)の相補性決定領域(以下、CDRと略記する)1~3が、それぞれ配列番号20~22で表されるアミノ酸配列を含み、かつ抗体軽鎖可変領域(以下、VLと略記する)のCDR1~3が、それぞれ配列番号23~25で表されるアミノ酸配列を含む抗体、
(b)配列番号49で表されるアミノ酸配列または配列番号49で表されるアミノ酸配列中の18番目のロイシンをメチオニンに、77番目のアスパラギンをセリンに、93番目のバリンをスレオニンに、および117番目のスレオニンをバリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVH並びに配列番号33で表されるアミノ酸配列または配列番号33で表されるアミノ酸配列中の2番目のイソロイシンをバリンに、4番目のメチオニンをロイシンに、15番目のプロリンをロイシンに、および85番目のアラニンをプロリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVLを含む抗体、
(c)配列番号49、51、53、55、57および59で表されるアミノ酸配列のいずれか1つを含むVH並びに配列番号33、35、37、39、41、43、45および47で表されるアミノ酸配列のいずれか1つを含むVLを含む抗体、並びに
(d)配列番号17で表されるアミノ酸配列を含むVHおよび配列番号19で表されるアミノ酸配列を含むVLを含む抗体。
(5)抗体が、下記(a)~(h)からなる群から選ばれる少なくとも1つの特徴を有する抗体である(1)~(4)のいずれか1に記載の抗体または該抗体断片。
(a)ヒトCRTH2のリガンド存在下でヒトCRTH2に対する反応性が低下しない、
(b)中和活性を有しない、
(c)抗体依存性細胞傷害(ADCC)活性を有する、
(d)マスト細胞およびTh1細胞の少なくとも一方に反応しない、
(e)好酸球、好塩基球、Th2細胞および2型自然リンパ球(ILC2)から選ばれる少なくとも一つの細胞に反応する。
(f)アゴニスト活性を有しない、
(g)ヒトCRTH2のリガンドによるシグナルを増強しない、並びに
(h)活性化状態または不活性化状態のヒトCRTH2に対する反応性が変化しない。
(6)抗体が、ヒトFc領域を含む抗体である、(1)~(5)のうちのいずれか1に記載の抗体または該抗体断片。
(7)抗体が、モノクローナル抗体である(1)~(6)のいずれか1に記載の抗体または該抗体断片。
(8)抗体が、遺伝子組換え抗体である(1)~(7)のいずれか1に記載の抗体または該抗体断片。
(9)遺伝子組換え抗体が、ヒト型キメラ抗体、ヒト型CDR移植抗体およびヒト抗体から選ばれるいずれか1つの遺伝子組換え抗体である、(8)に記載の遺伝子組換え抗体または該抗体断片。
(10)抗体が、サルCRTH2に結合する抗体である(1)~(9)のいずれか1つに記載の抗体または該断片。
(11)Fab、Fab’、F(ab’)2、scFv、diabody、dsFvおよびCDRを含むペプチドから選ばれるいずれか1つの抗体断片である(1)~(10)のいずれか1に記載の該抗体断片。
(12)(1)~(11)のいずれか1に記載の抗体または該抗体断片を産生するハイブリドーマ。
(13)(1)~(11)のいずれか1に記載の抗体または該抗体断片をコードするDNA。
(14)(13)に記載のDNAを含有する組換え体ベクター。
(15)(14)に記載の組換え体ベクターを宿主細胞に導入して得られる形質転換株。
(16)(12)に記載のハイブリドーマまたは(15)に記載の形質転換株を培地に培養し、培養物中に(1)~(11)のいずれか1に記載の抗体または該抗体断片を生産蓄積させ、該培養物から抗体または該抗体断片を採取することを特徴とする(1)~(11)のいずれか1に記載の抗体または該抗体断片の製造方法。
(17)(1)~(11)のいずれか1に記載の抗体または該抗体断片を有効成分として含有する、ヒトCRTH2が関係する疾患の治療剤。
(18)(1)~(11)のいずれか1に記載の抗体または該抗体断片を有効成分として含有する、ヒトCRTH2が関係する疾患の診断剤。
(19)CRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、または2型自然リンパ球(ILC2)の増多および機能亢進の少なくとも一方を伴う疾患である(17)または(18)に記載の剤。
(20)(1)~(11)のいずれか1に記載の抗体または該抗体断片の有効量を投与することを含む、ヒトCRTH2が関係する疾患の治療方法。
(21)(1)~(11)のいずれか1に記載の抗体または該抗体断片の有効量を投与することを含む、ヒトCRTH2が関係する疾患の診断方法。
(22)ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である(20)または(21)に記載の方法。
(23)ヒトCRTH2が関係する疾患の治療および診断の少なくとも一方に使用するための、(1)~(11)のいずれか1に記載の抗体または該抗体断片。
(24)ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である(23)に記載の抗体または該抗体断片。
(25)ヒトCRTH2が関係する疾患の治療および診断剤の少なくとも一方の製造のための、(1)~(11)のいずれか1に記載の抗体または該抗体断片の使用。
(26)ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である(25)に記載の使用。
本発明においてエピトープとしては、モノクローナル抗体が認識し、結合する単一のアミノ酸配列およびアミノ酸配列からなる立体構造並びに翻訳後修飾により修飾されたアミノ酸配列および該アミノ酸配列からなる立体構造などが挙げられる。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンを含むエピトープ、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の194番目のアスパラギン酸を含むエピトープ、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンおよび194番目のアスパラギン酸を含むエピトープ。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、14番目のロイシンおよび15番目のグルタミン酸、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の177番目のアスパラギン酸、178番目のグリシン、および179番目のアルギニン、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の180番目のイソロイシンおよび181番目のメチオニン、
(d)配列番号2で表されるヒトCRTH2のアミノ酸配列の183番目のチロシン、184番目のチロシンおよび185番目のアスパラギン、
(e)配列番号2で表されるヒトCRTH2のアミノ酸配列の187番目のロイシン、188番目のロイシンおよび189番目のロイシン、
(f)配列番号2で表されるヒトCRTH2のアミノ酸配列の195番目のアルギニン、並びに
(g)配列番号2で表されるヒトCRTH2のアミノ酸配列の196番目のアスパラギン酸および198番目のスレオニン。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンを認識し結合する抗体、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の194番目のアスパラギン酸を認識し結合する抗体、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンおよび194番目のアスパラギン酸の両方を認識し、結合する抗体。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、14番目のロイシンおよび15番目のグルタミン酸、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の177番目のアスパラギン酸、178番目のグリシン、および179番目のアルギニン、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の180番目のイソロイシンおよび181番目のメチオニン、
(d)配列番号2で表されるヒトCRTH2のアミノ酸配列の183番目のチロシン、184番目のチロシンおよび185番目のアスパラギン、
(e)配列番号2で表されるヒトCRTH2のアミノ酸配列の187番目のロイシン、188番目のロイシンおよび189番目のロイシン、
(f)配列番号2で表されるヒトCRTH2のアミノ酸配列の195番目のアルギニン、および
(g)配列番号2で表されるヒトCRTH2のアミノ酸配列の196番目のアスパラギン酸および198番目のスレオニン。
(a)VHの相補性決定領域(complementary determining region;CDR、以下CDRと略記する)1~3のアミノ酸配列が、それぞれ配列番号20、21および22で表されるアミノ酸配列を含み、かつVLのCDR1~3のアミノ酸配列が、それぞれ配列番号23、24および25で表されるアミノ酸配列を含む抗体、
(b)前記(a)に記載の抗体と競合してヒトCRTH2に結合する抗体、
(c)前記(a)に記載の抗体が結合するエピトープを含むエピトープに結合する抗体、および
(d)前記(a)に記載の抗体が結合するエピトープと同じエピトープに結合する抗体。
(a)配列番号49で表されるアミノ酸配列または配列番号49で表されるアミノ酸配列中の18番目のロイシンをメチオニンに、77番目のアスパラギンをセリンに、93番目のバリンをスレオニンに、および117番目のスレオニンをバリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVHおよび配列番号33で表されるアミノ酸配列または配列番号33で表されるアミノ酸配列中の2番目のイソロイシンをバリンに、4番目のメチオニンをロイシンに、15番目のプロリンをロイシンに、および85番目のアラニンをプロリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVLを含む抗体、
(b)配列番号49、51、53、55、57および59で表されるアミノ酸配列のいずれか1つを含むVH並びに配列番号33、35、37、39、41、43、45および47で表されるアミノ酸配列のいずれか1つを含むVLを含む抗体、並びに
(c)配列番号17で表されるアミノ酸配列を含むVHおよび配列番号19で表されるアミノ酸配列を含むVLを含む抗体。
(1)配列番号49で表されるアミノ酸配列を含むVH並びに配列番号33、35、37、39、41、43、45および47で表されるアミノ酸配列のいずれか1つを含むVLを含む抗体、
(2)配列番号59で表されるアミノ酸配列を含むVH並びに配列番号33、35、37、39、41、43、45および47で表されるアミノ酸配列のいずれか1つを含むVLを含む抗体、並びに
(3)配列番号51、53、55および57で表されるアミノ酸配列のいずれか1つを含むVH並びに配列番号33で表されるアミノ酸配列を含むVLを含む抗体。
上記(b)の抗体として、特に好ましくは、配列番号51で表されるアミノ酸配列を含むVHおよび配列番号33で表されるアミノ酸配列を含むVLを含む抗体が挙げられる。
本発明において、活性化状態または不活性化状態のヒトCRTH2に対する反応性が変化しないとは、グアノシン二リン酸(GDP)もしくはGDPアナログまたはグアノシン三リン酸(GTP)もしくはGTPアナログ存在下と非存在下で、抗体の、ヒトCRTH2に対する反応性が変化しないことをいう。
GDPアナログとしては例えばグアノシン 5'-O-(β-チオ)二リン酸(GDPβS)が挙げられる。GTPアナログとしては、例えばグアノシン 5'-O-(γ-チオ)三リン酸(GTPγS)が挙げられる。
本発明のFab’は、本発明のヒトCRTH2に特異的に結合するF(ab’)2組成物を還元剤ジチオスレイトール処理して得ることができる。または、該抗体のFab’断片をコードするDNAを原核生物用発現ベクターあるいは真核生物用発現ベクターに挿入し、該ベクターを原核生物あるいは真核生物へ導入することにより発現させ、製造することができる。
A群:ロイシン、イソロイシン、ノルロイシン、バリン、ノルバリン、アラニン、2-アミノブタン酸、メチオニン、O-メチルセリン、t-ブチルグリシン、t-ブチルアラニン、シクロヘキシルアラニン
B群:アスパラギン酸、グルタミン酸、イソアスパラギン酸、イソグルタミン酸、2-アミノアジピン酸、2-アミノスベリン酸
C群:アスパラギン、グルタミン
D群:リジン、アルギニン、オルニチン、2,4-ジアミノブタン酸、2,3-ジアミノプロピオン酸
E群:プロリン、3-ヒドロキシプロリン、4-ヒドロキシプロリン
F群:セリン、スレオニン、ホモセリン
G群:フェニルアラニン、チロシン
(a)チャイニーズハムスター卵巣組織由来CHO細胞;
(b)ラットミエローマ細胞株YB2/3HL.P2.G11.16Ag.20細胞;
(c)マウスミエローマ細胞株NS0細胞;
(d)マウスミエローマ細胞株SP2/0-Ag14細胞;
(e)シリアンハムスター腎臓組織由来BHK細胞;
(f)抗体を産生するハイブリドーマ細胞;
(g)ヒト白血病細胞株ナマルバ細胞;
(h)胚性幹細胞;
(i)受精卵細胞。
本発明の抗体もしくは該抗体断片、又はこれらの誘導体を含有する医薬は、有効成分としての該抗体もしくは該抗体断片、又はこれらの誘導体のみを含むものであってもよいが、通常は薬理学的に許容される1以上の担体と一緒に混合し、製剤学の技術分野において公知の方法により製造した医薬製剤として提供される。
抗体の誘導体を検出方法、定量方法、検出用試薬、または定量用試薬として使用する場合には、本発明の抗体またはその抗体断片に結合する薬剤として、通常の免疫学的検出または測定法で用いられる標識体が挙げられる。
(1)抗原の調製
抗原となるヒトCRTH2又はヒトCRTH2を発現させた細胞は、ヒトCRTH2全長又はその部分長をコードするcDNAを含む発現ベクターを、大腸菌、酵母、昆虫細胞、又は動物細胞などに導入することにより、得ることができる。
3~20週令のマウス、ラット又はハムスターなどの動物に、(1)で得られる抗原を免疫して、その動物の脾臓、リンパ節、末梢血中の抗体産生細胞を採取する。また、免疫原性が低く上記の動物で充分な抗体価の上昇が認められない場合には、ヒトCRTH2ノックアウトマウスを被免疫動物として用いることもできる。
骨髄腫細胞としては、マウスから得られる株化細胞を用い、例えば、8-アザグアニン耐性マウス(BALB/c由来)骨髄腫細胞株P3-X63Ag8-U1(P3-U1)[Current Topics in Microbiology and Immunology, 18, 1(1978)]、P3-NS1/1Ag41(NS-1)[European J. Immunology,6, 511(1976)]、SP2/0-Ag14(SP-2)[Nature, 276, 269(1978)]、P3-X63-Ag8653(653)[J. Immunology, 123, 1548(1979)]、又はP3-X63-Ag8(X63)[Nature, 256, 495(1975)]などを用いる。
(2)で得られる融合用抗体産生細胞と(3)で得られる骨髄腫細胞をMinimum Essential Medium(MEM)培地又はPBS(リン酸二ナトリウム1.83g、リン酸一カリウム0.21g、食塩7.65g、蒸留水1リットル、pH7.2)でよく洗浄し、細胞数が、融合用抗体産生細胞:骨髄腫細胞=5~10:1になるよう混合し、遠心分離した後、上清を除く。
プリスタン処理[2,6,10,14-テトラメチルペンタデカン(Pristane)0.5mLを腹腔内投与し、2週間飼育する]した8~10週令のマウス又はヌードマウスに、(4)で得られるモノクローナル抗体産生ハイブリドーマを腹腔内に注射する。10~21日でハイブリドーマは腹水がん化する。このマウスから腹水を採取し、遠心分離して固形分を除去後、40~50%硫酸アンモニウムで塩析し、カプリル酸沈殿法、DEAE-セファロースカラム、プロテインA-カラム又はゲル濾過カラムによる精製を行ない、IgG又はIgM画分を集め、精製モノクローナル抗体とする。
モノクローナル抗体の選択は、以下に示す通り、ヒトCRTH2を発現する細胞に対する反応性をフローサイトメトリーで解析することにより行う。
遺伝子組換え抗体の作製例として、以下にヒト型キメラ抗体及びヒト化抗体の作製方法を示す。
(1)遺伝子組換え抗体発現用ベクターの構築
遺伝子組換え抗体発現用ベクターは、ヒト抗体のCH及びCLをコードするDNAが組み込まれた動物細胞用発現ベクターであり、動物細胞用発現ベクターにヒト抗体のCH及びCLをコードするDNAをそれぞれクローニングすることにより構築することができる。
非ヒト抗体のVH及びVLをコードするcDNAの取得及びアミノ酸配列の解析は以下のようにして行うことができる。
(1)で得られる遺伝子組換え抗体発現用ベクターのヒト抗体のCH又はCLをコードするそれぞれの遺伝子の上流に、それぞれ非ヒト抗体のVH又はVLをコードするcDNAをそれぞれクローニングすることで、ヒト型キメラ抗体発現ベクターを構築することができる。
ヒト化抗体のVH又はVLをコードするcDNAは、以下のようにして構築することができる。
ヒト化抗体は、非ヒト抗体のVH及びVLのCDRのみをヒト抗体のVH及びVLのFRに移植しただけでは、その抗原結合活性は元の非ヒト抗体に比べて低下する[BIO/TECHNOLOGY, 9, 266 (1991)]。ヒト化抗体では、ヒト抗体のVH及びVLのFRのアミノ酸配列の中で、直接抗原との結合に関与しているアミノ酸残基、CDRのアミノ酸残基と相互作用するアミノ酸残基、及び抗体の立体構造を維持し、間接的に抗原との結合に関与しているアミノ酸残基を同定し、それらのアミノ酸残基を元の非ヒト抗体のアミノ酸残基に置換することにより、低下した抗原結合活性を上昇させることができる。
(1)で得られる遺伝子組換え抗体発現用ベクターのヒト抗体のCH又はCLをコードするそれぞれの遺伝子の上流に、構築した遺伝子組換え抗体のVH又はVLをコードするcDNAをそれぞれクローニングし、ヒト化抗体発現ベクターを構築することができる。
(3)及び(6)で得られる遺伝子組換え抗体発現ベクター、又はそれらを改変した発現ベクターを用いて遺伝子組換え抗体の一過性発現を行い、作製した多種類の遺伝子組換え抗体の抗原結合活性を効率的に評価することができる。
COS-7細胞への発現ベクターの導入には、DEAE-デキストラン法[Methods in Nucleic Acids Res., CRC Press(1991)]、又はリポフェクション法[Proc. Natl. Acad. Sci. USA, 84, 7413(1987)]などを用いる。
(3)及び(6)で得られる遺伝子組換え抗体発現ベクターを適当な宿主細胞に導入することにより遺伝子組換え抗体を安定に発現する形質転換株を得ることができる。
精製した本発明のモノクローナル抗体又は該抗体断片の活性評価は、以下のように行うことができる。
本発明のモノクローナル抗体のエフェクター活性を制御する方法としては、抗体のFc領域の297番目のアスパラギン(Asn)に結合するN結合複合型糖鎖の還元末端に存在するN-アセチルグルコサミン(GlcNAc)にα1,6結合するフコース(コアフコースともいう)の量を制御する方法(国際公開第2005/035586号、国際公開第2002/31140号、国際公開第00/61739号)、又は抗体のFc領域のアミノ酸残基を改変することで制御する方法などが知られている。本発明のモノクローナル抗体にはいずれの方法を用いても、エフェクター活性を制御することができる。
本発明の抗体は、ヒトCRTH2が関係する疾患の治療に用いることができる。投与経路としては、例えば、経口投与、又は口腔内、気道内、直腸内、皮下、筋肉内、静脈内、若しくは腹腔内などの非経口投与が挙げられる。投与形態としては、例えば、噴霧剤、カプセル剤、錠剤、散剤、顆粒剤、シロップ剤、乳剤、坐剤、注射剤、軟膏、又はテープ剤などが挙げられる。
乳剤又はシロップ剤のような液体調製物は、水、ショ糖、ソルビトール若しくは果糖などの糖類、ポリエチレングリコール若しくはプロピレングリコールなどのグリコール類、ごま油、オリーブ油若しくは大豆油などの油類、p-ヒドロキシ安息香酸エステル類などの防腐剤、又はストロベリーフレーバー若しくはペパーミントなどのフレーバー類などを添加剤として用いて製造する。
本発明の抗体又は該抗体断片を用いて、ヒトCRTH2又はヒトCRTH2が発現した細胞を検出又は測定することにより、ヒトCRTH2が関連する疾患を診断することができる。
ヒトCRTH2発現細胞の造成
(1)ヒトCRTH2発現ベクターの作製
ヒトCRTH2(以下CRTH2と記すこともある)のcDNAは全合成し、以降の試験に用いた。ヒトCRTH2のcDNA配列を配列番号1に、アミノ酸配列を配列番号2に記載する。
制限酵素EcoRIおよびKpnIを用いて、ヒトCRTH2のcDNAをベクターpKANTEX93(国際公開第97/10354号)と連結し、ヒトCRTH2遺伝子発現pKANTEX93ベクターを構築した。
pAMoh(国際公開第03/087366号)に対しても、制限酵素KpnIおよびHindIIIを用いてヒトCRTH2遺伝子を組み込み、ヒトCRTH2遺伝子発現pAMohベクターを構築した。
DHFR遺伝子欠損CHO(チャイニーズハムスター卵巣)細胞DG44株(CHO/DG44細胞)を、三菱化学株式会社・横浜総合研究所より入手し、ヒトCRTH2発現細胞造成に使用した。培養には10%透析ウシ胎児血清(dFBS)(GIBCO社)、HT[ヒポキサンチン(H)、チミジン(T)]supplement(GIBCO社)、及び50μg/mL ゲンタマイシン(ナカライテスク社)を添加したIMDM(GIBCO社)(以下、IMDM培養培地と略記する)を用いた。
(i)FLAG融合ヒトCRTH2遺伝子発現pAMohベクターの構築
(1)-(ii)で作製されたヒトCRTH2遺伝子発現pAMohから、プライマーhumanCRTH2FLAG-A(配列番号3)及びhumanCRTH2FLAG-B(配列番号4)を用いて、C末端にFLAGタグが付加されたヒトCRTH2(配列番号5)をpolymerase chain reaction(以下、PCRと記す)で増幅し、制限酵素KpnIおよびHindIIIを用いて、ベクターpAMoh(国際公開第03/087366号)と連結し、FLAG融合ヒトCRTH2遺伝子発現pAMohベクターを構築した。
(3)-(i)で構築されたFLAG融合ヒトCRTH2遺伝子発現pAMohベクターから、プライマーhumanCRTH2FLAG-C(配列番号6)及びhumanCRTH2FLAG-D(配列番号7)を用いて、C末端にFLAGタグが付加されたヒトCRTH2をPCRで増幅し、制限酵素EcoRIおよびKpnIを用いて、ベクターpKANTEX93(国際公開第97/10354号)と連結し、FLAG融合ヒトCRTH2遺伝子発現pKANTEX93ベクターを構築した。
ラット3Y1-B細胞を、理研バイオリソースセンターより入手し、FLAG融合ヒトCRTH2発現細胞造成に使用した。培養には10%FBS(GIBCO社)、及び50μg/mL ゲンタマイシン(ナカライテスク社)を添加したDMEM(GIBCO社)(以下、DMEM培養培地と略記する)を用いた。
ヒトCRTH2に対する抗体モノクローナル抗体の作製
(1)ラットへの免疫
ヒトCRTH2に対するモノクローナル抗体を取得するために、初回投与時の週齢が9週齢の雌性WKY/NCrlCrljラット(WKYラット)(チャールスリバー社)に免疫した。
(1)で2回目の免疫を行った3日後に、外科的にWKYラットから腸骨リンパ節を摘出し、細胞融合に供した。
(2)で播種されたハイブリドーマを7日間培養した後、各ウェルの培養上清を採取し、ヒトCRTH2に対する反応性を解析した。陽性対照細胞及び陰性対照細胞は、それぞれヒトCRTH2発現CHO/DG44細胞及びCHO/DG44細胞とした。まず、陽性対照細胞及び陰性対照細胞を0.02%EDTA溶液(ナカライテスク社製)で剥離し、1ウェルあたりそれぞれ1×105cells/50μLとなるように96ウェルプレートに播種し、50μLの培養上清を添加し、4℃で30分間の反応を行った。
ハイブリドーマLym2を3日間培養した培養上清をPBS(ナカライテスク社製)で10倍に希釈し、その希釈液を150μL用いてRat Monoclonal Antibody Isotyping Test Kit(AbD Serotec社)で添付の説明書に従いサブクラスの解析を行った。
Hybridoma-SFM(invitrogen社)に5%のFetal Bovine Serum Ultra Low IgG(invitrogen社)を加えた培地で、ハイブリドーマLym2を1週間培養した。培養上清を回収し精製に供した。
Lym2抗体のフローサイトメトリーによる抗原結合性評価
FLAG融合ヒトCRTH2発現3Y1-B細胞を0.05%トリプシン溶液(invitrogen社)で剥離し、PBSで洗浄した後、SMで懸濁した。次に、1ウェルあたり2×105cellsとなるように96ウェルプレートに播種し、1700rpmで2分間の遠心分離を行った。上清を除いた後、SMで10μg/mLになるように調製したLym2抗体を100μL添加し、4℃で1時間の反応を行った。
Lym2抗体重鎖及び軽鎖可変領域遺伝子のクローニング
RNAiso plus(タカラバイオ社)を用いて、添付の説明書に従い、PBSで洗浄したハイブリドーマLym2を溶解し、total RNAを調製した。得られたtotal RNAは、DEPC treated water(invitrogen社)に溶解した。次に、Oligotex-dT30<Super>mRNA Purification Kit(FromTotal RNA)(タカラバイオ社)を用いて、添付の説明書に従い、得られたtotal RNAからmRNAを精製した。さらに、SMART RACE cDNA Amplification Kit(Clontech社)を用いて、添付の説明書に従い、精製したmRNAからcDNAを調製した。
ラット/ヒトキメラ型Lym2抗体の作製
(1)ラット/ヒトキメラ型Lym2抗体発現ベクターの構築
ラット/ヒトキメラ型Lym2抗体発現ベクターは、以下の方法で、Lym2抗体重鎖及び軽鎖可変領域遺伝子を、それぞれヒトIgG1重鎖及びκ鎖定常領域遺伝子に連結することにより作製した。
chLym2の一過性発現株を作製するため、FreeStyle(商標)MAX CHO Expression System(Lifetechnologies社)を、添付の説明書に従って使用し、以下の方法で、宿主細胞に(1)で作製された発現ベクターを導入した。宿主細胞には、FUT8ノックアウトCHO細胞(国際公開第2005/035586号、国際公開第02/31140号)をFreeStyle(商標)CHO Expression Medium(Lifetechnologies社)に馴化した株を使用した。
(2)で得られたchLym2一過性発現細胞株を、8mMのL-glutamine(invitrogen社)を添加したFree style CHO expression medium(invitrogen社)に懸濁し、三角フラスコで5日間培養した後、培養上清を回収した。回収した培養上清を遠心分離し、0.22μmフィルターを用いてろ過することでchLym2を含む培養上清を調製した。
ヒト化抗体の作製
(1)ヒト化Lym2抗体重鎖及び軽鎖可変領域の設計
(i)ヒト化Lym2抗体のVLおよびVHのアミノ酸配列の設計
ヒト化Lym2抗体のVLのアミノ酸配列を以下のようにして設計した。
まずLym2抗体のVLのCDR1~3のアミノ酸配列(配列番号23、24、25)の移植に適したヒト抗体のVLのFRのアミノ酸配列を、以下のようにして選択した。
ヒト化抗体の可変領域のアミノ酸配列をコードする塩基配列は、動物細胞で高頻度で使用されるコドンを用いて設計した。これら塩基配列を用いて、以下に示すヒト化Lym2抗体発現ベクターの構築および対応する抗体の発現を行った。
実施例5-(1)に記載の方法に準じて、ヒト化Lym2抗体発現ベクターを構築した。すなわち、配列番号33、35、37、39、41、43、45、47、49、51、53、55、57および59で示されるアミノ酸配列をそれぞれコードする、配列番号32、34、36、38、40、42、44、46、48、50、52、54、56および58で示される塩基配列のDNAを全合成し、配列番号28-31で示すプライマーにより、対応するVL、VH遺伝子断片をPCRによって増幅した。遺伝子断片はアガロースゲル電気泳動を行い、QIAquick Gel Extraction Kit(QIAGEN社)によって精製した。
作製したヒト化Lym2抗体の一過性発現は、実施例5-(2)に記載のFreeStyle(商標)CHO Expression Medium(Lifetechnologies社)に馴化したCHO細胞を宿主とし、FreeStyle(商標)MAX CHO Expression System(Lifetechnologies社)を使用して行った。プラスミド導入の方法は添付の説明書に従った。軽鎖発現ベクターと重鎖発現ベクターは、1:2の比率で混合して使用した。
以下に示す、MabSelect SuRe(GE Healthcare社)を用いたアフィニティー精製により、ヒト化Lym2抗体を精製した。レジンをPBSで平衡化した後、(3)で取得された培養上清をロードし、PBSで2回洗浄した。
chLym2およびヒト化Lym2抗体の抗原結合活性
FLAG融合ヒトCRTH2発現3Y1-B細胞を0.25%Trypsin-EDTA(ナカライテスク社)で剥離し、PBSで洗浄した後、SMで懸濁した。次に、細胞数を1ウェルあたり1×105個となるように96ウェルプレートに播種し、50000、12500、3125、781、195、49、12および3ng/mL各最終濃度のchLym2またはヒト化Lym2抗体を添加し、4℃で60分間の反応を行った。
chLym2およびヒト化Lym2抗体の好酸球、好塩基球に対する除去(depletion)活性
へパリンナトリウム注射液を加えて採取したヒト末梢血を4℃、1500rpm、30分間遠心分離し、血漿を回収した。
比較対照用抗ヒトCRTH2抗体の作製
(1)比較対照用抗ヒトCRTH2抗体発現ベクターの作製
国際公開第2014/144865号記載の抗ヒトCRTH2モノクローナル抗体hu19A2 v52、hu8B1 v1、mu8B1、mu3C12およびmu31A5のVHおよびVLのアミノ酸配列(それぞれ、国際公開第2014/144865号中ではSEQ ID NOs:57および40、64および52、62および50、63および51、並びに65および53で表される)をコードする塩基配列を、全合成した。
実施例5-(2)および(3)に記載の方法に準じて、hu19A2 v52、hu8B1 v1、ch8B1、ch3C12またはch31A5の抗体発現ベクターを宿主細胞に一過性発現させ、培養上清からそれぞれの抗体の精製を行った。
ヒトCRTH2アミノ酸置換体発現細胞を用いた、抗ヒトCRTH2モノクローナル抗体のエピトープ解析
(1)ヒトCRTH2アミノ酸置換体発現ベクターの作製
ヒトCRTH2のアミノ酸配列のうち、細胞外領域のアミノ酸残基を部分的に別のアミノ酸残基に置換したアミノ酸置換体の発現ベクターを作製した。具体的には、配列番号2で表されるアミノ酸配列にS2A;N4A;T6AおよびL7A;K8A、P9AおよびL10A;P12A、L14AおよびE15A;Q16E、R19HおよびQ21R;H23A、S24AおよびN25A;T26A、S27AおよびI28A;D171A、T172AおよびI173A;S174A、R175AおよびL176A;D177A、G178AおよびR179A;I180AおよびM181A;Y183A、Y184AおよびN185A;L187A、L188AおよびL189A;N190A;P191A;G192A;P193A;D194A;R195A;D196AおよびT198A;N275A、G277AおよびL278A;P276A;P279AおよびL281A;P280A;またはV282A、R283AおよびR284Aの置換をしたアミノ酸置換体を発現するベクターをそれぞれ作製した。なお、前記アミノ酸置換の記号は[置換前のアミノ酸残基の1文字表記][N末端から数えた置換の位置][置換後のアミノ酸残基の1文字表記]を表す。
ヒトCRTH2アミノ酸置換体の発現細胞株の調製には、CHO-S細胞(LifeTechnologies社)を用いた。細胞の継代には8mM L-Glutamine(invitrogen社)を含むFree style CHO expression medium(invitrogen社)を使用し、37℃、5%CO2条件下で振とう培養した。
(2)で樹立されたヒトCRTH2アミノ酸置換体発現CHO-S細胞を、SMで洗浄した後、1ウェルあたり2×105cellsとなるように96ウェルプレートに播種し、1700rpmで2分間の遠心分離を行った。上清を除いた後、SMで10μg/mLになるように調製したchLym2、LV0HV1、実施例9で作製された抗ヒトCRTH2抗体hu19A2 v52、hu8B1 v1、ch3C12もしくはch31A5、または市販ラット抗ヒトCRTH2抗体BM16(santa cruz社)を添加し、4℃で1時間の反応を行った。
ヒト好酸球に対する反応性評価
へパリンナトリウム注射液を加えて採取したヒト末梢血に対し、等量の注射用生理食塩水を添加し、混和した。50mL容量の遠沈管にFicoll-Paque PREMIUM1.084(GEヘルスケア社)を15mL添加し、生理食塩水で希釈した上記ヒト末梢血を30mL重層し、室温、1500rpmで30分間遠心分離を行った。
ヒト好塩基球に対するchLym2の反応性
へパリンナトリウム注射液を加えて採取したヒト末梢血に対し、等量の注射用生理食塩水を添加し、混和した。50mL容量の遠沈管にFicoll-Paque PREMIUM 1.084(GEヘルスケア社)を15mL添加し、生理食塩水で希釈したヒト末梢血を30mL重層し、室温、1500rpmで30分間遠心分離を行った。
ヒトCD4陽性T細胞に対するヒト化Lym2抗体の反応性
実施例12に準じ、Ficoll-Paque PREMIUM 1.084の代わりにFicoll-Paque PREMIUM(GEヘルスケア社)を用いて調製した単核球層の細胞懸濁液を100μL/wellで96ウェルプレートに播種し、EZ-Link Sulfo-NHS-LC-Biotin,No-Weigh Format(PIERCE社)を用いて添付の説明書に従いビオチン標識したヒト化Lym2抗体LV0HV1を最終濃度10μg/mLになるように添加し、4℃で1時間の反応を行った。
好酸球、好塩基球に対する細胞傷害活性
実施例8と同様にして調製した細胞懸濁液を、95μL/wellで96wellプレートに播種し、1000、10、3、1、0.3、0.1ng/mL各最終濃度の被験抗体を添加し、37℃、5%CO2インキュベーター内で20時間反応させた。被験抗体としては、ヒト化Lym2抗体LV0HV1、実施例9で作製された抗ヒトCRTH2抗体hu19A2 v52、hu8B1 v1、ch3C12およびch31A5を用いた。アイソタイプコントロール抗体としては抗DNP IgG1抗体を用いた。
Th2細胞に対する細胞傷害活性
実施例13と同様にして調製した単核球層を、1/10volume FBS(Gibco社)、200mM-L-Glutamine Stock Solution(ナカライテスク社)、10mM MEM Non-Essential Amino Acids Solution(Gibco社)、100mM Sodium Pyruvate(Gibco社)、1M HEPES Buffer Solution(Gibco社)および1/100volume Penicillin-Streptomycin,Liquid(Gibco社)を添加したRPMI1640(和光純薬社)[以下、PBMC(peripheral blood mononuclear cell)培養培地と記す]で2回洗浄し、1×107cells/mL細胞懸濁液を調製した。
リガンド存在下における反応性評価(293EBNA)
実施例1-(1)-(ii)で作製したヒトCRTH2遺伝子発現pAMohベクターを、Fugene6(プロメガ社)を用いて293EBNA細胞(invitrogen社)に導入し、10%FBS、0.25mg/mL G418(ナカライテスク社)、100μg/mL ペニシリン、100U/mL ストレプトマイシン(ナカライテスク社)および300μg/mL ハイグロマイシンB(和光純薬社)DMEMからなる培地で薬剤耐性細胞を選択し、ヒトCRTH2発現293EBNA細胞を樹立した。
分化誘導ヒトマスト細胞に対する反応性解析
Nature Protocols 2006, 1(4), 2178-2183記載の方法に準じてマスト細胞を調製した。分化誘導開始から11週時点のマスト細胞をSMで洗浄し、1ウェルあたり5×104cellsとなるように96ウェルプレートに播種し、PE anti-human CD203c(E-NPP3)Antibody(BioLegend社製)、Brilliant Violet 421(商標)anti-human CD117(c-kit)Antibody(BioLegend社製)、Anti-Human Fc epsilon Receptor I alpha(FcεR1)PE(eBioscience社製)を添加し、4℃で1時間の反応を行った。細胞を洗浄した後、SMで懸濁し、蛍光強度をフローサイトメトリー(BDバイオサイエンス社製、FACS CantoII)で解析した。
分化誘導Th1に対する反応性解析
(1)PBMCからのナイーブT細胞の分離
健常人由来凍結PBMC(Allcells社)を、DNase I recombinant、RNase-free(Roche Diagnostics社)を50μL含有した20mLのPBMC培養培地で1回洗浄し、再びDNase I recombinant、RNase-freeを50μL含有した20mLのPBMC培養培地に懸濁し、37℃、5%CO2インキュベーター内で2時間放置した。
J Immunol, 2002. 169(5):p. 2498-2506記載の方法に準じて分離したナイーブCD4陽性T細胞を、10%FBS(Gibco社)および2mM グルタミン酸(ナカライテスク社)を添加したRPMI1640(Gibco社)(以下、培養培地と略記する)で1×106cells/mLに懸濁し、刺激の工程として、抗CD3抗体OKT3(Abcam社)を1μg/mLの濃度で固相化したプレートに播種し、最終濃度2μg/mL 抗CD28抗体(BDバイオサイエンス社)、100ng/mL recombinant human IL-12(peprotech社)、10ng/mL recombinant human IL-2(peprotech社)、および5μg/mL 抗IL-4抗体(BDバイオサイエンス社)を添加し、37℃、5%CO2インキュベーター内で4日間反応させた。
(2)の分化誘導Th1細胞培養液に、最終濃度20ng/mLのPhorbol 12-myristate 13-acetate(シグマアルドリッチ社)、1μg/mLのIonomycin calcium salt from Streptomyces(シグマアルドリッチ社)および10μg/mLの Brefeldin A from Penicillium brefeldianum(シグマアルドリッチ社)を添加し、37℃、5%CO2インキュベーター内で6時間反応させた。その後、2×105cells/wellで96ウェルプレートに播種し、PBS(ナカライテスク社)で洗浄した。
(2)において樹立された分化誘導Th1細胞をSMで洗浄した後、1ウェルあたり5×104cellsとなるように96ウェルプレートに播種し、2000rpmで2分間の遠心分離を行った。上清を除いた後、SMで希釈した10μg/mLラット抗ヒトCRTH2抗体Lym2、公知の抗ヒトCRTH2抗体 BM16(santa cruz社)または301108(R&D社)を添加し、4℃で1時間の反応を行った。
ヒト好酸球の形態変化を指標にした、Lym2抗体のアンタゴニスト活性評価
実施例11と同様の方法により、ヒト末梢血から好酸球の分離を行った。単離されたヒト好酸球をダルベッコりん酸緩衝生理食塩水(以下、D-PBS(-)と記す)(ナカライテスク社)で懸濁し、37℃、5%CO2インキュベーター内で1時間30分反応させた。その後、10%FBS含有RPMI1640を用いて2×105cells/wellで96ウェルプレートに播種した。その後、最終濃度10μg/mLのアイソタイプコントロール抗体[CELL LAB Rat IgG2b Isotype Control(ベックマンコールター社)]、もしくはLym2抗体、またはポジティブコントロールとして最終濃度10μM CRTH2低分子拮抗薬OC000459(Cayman chemical社)を添加し、37℃、5%CO2インキュベーター内で30分間反応させた。
ヒト好酸球の形態変化を指標にした、Lym2抗体のアゴニスト活性評価
上述実施例19と同様の実験系において、0、0.01、0.1、1および10μg/mL各最終濃度のラット抗ヒトCRTH2抗体Lym2を加え、1時間反応させて、好酸球の形態変化を解析した。
ヒト好酸球の形態変化を指標にした、抗ヒトCRTH2抗体のアゴニスト活性、アンタゴニスト活性、リガンドによるシグナルの増強活性の評価
実施例11と同様の方法により、ヒト末梢血から好酸球の分離を行った。但し、血液に等量の注射用生理食塩水を添加する操作は行わず、直接Ficoll-Paque PREMIUM 1.084(GEヘルスケア社)に重層した。単離されたヒト好酸球をD-PBS(-)(ナカライテスク社)で懸濁し、5%CO2インキュベーター内で37℃、1時間30分反応させた。
CRTH2活性化状態の変遷に伴うコンフォメーション変化に対するCRTH2モノクローナル抗体の反応性評価
(1)ホースラディッシュペルオキシダーゼ(HRP)標識抗体の作製
Peroxidase Labeling Kit-NH2(Dojindo社)を用いて、添付文書に従い、ヒト化Lym2抗体LV0HV1およびhu19A2 v52にHRPを直接標識した後、D-PBS(-)(ナカライテスク社)で1mg/mLに希釈した。
実施例1で樹立したヒトCRTH2発現CHO/DG44細胞を0.02%EDTA溶液(ナカライテスク社)に剥離し、4℃に冷却したD-PBS(-)を用いて細胞を洗浄した。Minute Plasma Membrane Protein Isolation Kit(Invent Biotechnologies)を用いて、添付文書に従い膜画分を調製した。
50mM HEPES(Gibco社)、5mM MgCl2(ナカライテスク社)、100mM NaCl(ナカライテスク社)および1mM EDTA(invitorgen社)を添加した50mM Tris-HCl buffer pH7.4(ナカライテスク社)(以下、ELISA反応液と記す)を、(2)にて調製した膜画分に加え、1mg/mLになるように調製し、プロテオセーブ1.5mLマイクロチューブ(住友ベークライト社)に、50μL/tubeで添加した。
アザミグリーン融合ヒトおよびカニクイザルCRTH2発現phmAG1-MNLinkerベクターの作製
(1)アザミグリーン融合ヒトCRTH2発現phmAG1-MNLinkerベクターの作製
実施例1の(1)-(ii)で作製されたヒトCRTH2遺伝子発現pAMohに対し、プライマーhumanCRTH2azami-A(配列番号60)及びhumanCRTH2azami-B(配列番号61)を用いて目的断片をPCRで増幅し、制限酵素BamHIおよびHindIIIを用いて、ベクターphmAG1-MNLinker(MBL社)と連結し、アザミグリーン融合ヒトCRTH2発現phmAG1-MNLinkerベクターを構築した。
全合成されたカニクイザルCRTH2のcDNA(cDNA配列:配列番号62、アミノ酸配列:配列番号63)を用い、実施例1の(1)-(ii)と同様の方法で構築したカニクイザルCRTH2発現pMohベクターに対し、プライマーcynoCRTH2azami-A(配列番号64)およびcynoCRTH2azami-B(配列番号65)を用い、(1)と同様にしてアザミグリーン融合カニクイザルCRTH2発現phmAG1-MNLinkerベクターを構築した。
アザミグリーン融合ヒトCRTH2発現CHO/DG44細胞およびカニクイザルCRTH2発現CHO/DG44細胞の造成
実施例23で作製されたヒトおよびカニクイザルCRTH2遺伝子発現phmAG1-MNLinkerベクターを制限酵素BsaI処理によって切断し、得られた直鎖状DNAを精製し、滅菌水に溶解した。このDNAをエレクトロポレーション法により、CHO/DG44細胞に導入し、IMDM培養培地にて3日程度培養した。
ヒトまたはカニクイザルCRTH2に対するヒト化Lym2抗体LV0HV1の結合活性評価
実施例24で樹立されたアザミグリーン融合ヒトまたはカニクイザルCRTH2発現CHO/DG44細胞を、0.02%EDTA溶液(ナカライテスク社)で剥離し、PBSで洗浄した後、SMで懸濁した。次に、細胞数を1ウェルあたり2×105個となるように96ウェルプレートに播種し、30000、7500、1875、469、117、29、7および2ng/mL各最終濃度のヒト化Lym2抗体LV0HV1または抗DNP IgG1抗体を添加し、4℃で40分間の反応を行った。
配列番号4:人工配列の記載:humanCRTH2FLAG-Bの塩基配列
配列番号5:人工配列の記載:FLAGタグ付ヒトCRTH2 cDNAの塩基配列
配列番号6:人工配列の記載:humanCRTH2FLAG-Cの塩基配列
配列番号7:人工配列の記載:humanCRTH2FLAG-Dの塩基配列
配列番号8:人工配列の記載:RatIgG2bH-Aの塩基配列
配列番号9:人工配列の記載:RatIgG2bH-Bの塩基配列
配列番号10:人工配列の記載:Ratk-Aの塩基配列
配列番号11:人工配列の記載:Ratk-Bの塩基配列
配列番号20:人工配列の記載:Lym2抗体 VH CDR1のアミノ酸配列
配列番号21:人工配列の記載:Lym2抗体 VH CDR2のアミノ酸配列
配列番号22:人工配列の記載:Lym2抗体 VH CDR3のアミノ酸配列
配列番号23:人工配列の記載:Lym2抗体 VL CDR1のアミノ酸配列
配列番号24:人工配列の記載:Lym2抗体 VL CDR2のアミノ酸配列
配列番号25:人工配列の記載:Lym2抗体 VL CDR3のアミノ酸配列
配列番号26:人工配列の記載:chLym2発現ベクター用VHの合成DNA
配列番号27:人工配列の記載:chLym2発現ベクター用VLの合成DNA
配列番号28:人工配列の記載:chLym2 VH-Aの塩基配列
配列番号29:人工配列の記載:chLym2 VH-Bの塩基配列
配列番号30:人工配列の記載:chLym2 VH-Cの塩基配列
配列番号31:人工配列の記載:chLym2 VH-Dの塩基配列
配列番号32:人工配列の記載:LV0の塩基配列
配列番号33:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号34:人工配列の記載:LV1の塩基配列
配列番号35:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号36:人工配列の記載:LV2aの塩基配列
配列番号37:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号38:人工配列の記載:LV2bの塩基配列
配列番号39:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号40:人工配列の記載:LV2cの塩基配列
配列番号41:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号42:人工配列の記載:LV3aの塩基配列
配列番号43:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号44:人工配列の記載:LV3bの塩基配列
配列番号45:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号46:人工配列の記載:LV4の塩基配列
配列番号47:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号48:人工配列の記載:HV0の塩基配列
配列番号49:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号50:人工配列の記載:HV1の塩基配列
配列番号51:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号52:人工配列の記載:HV2aの塩基配列
配列番号53:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号54:人工配列の記載:HV2bの塩基配列
配列番号55:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号56:人工配列の記載:HV3の塩基配列
配列番号57:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号58:人工配列の記載:HV4の塩基配列
配列番号59:人工配列の記載:合成コンストラクトのアミノ酸配列
配列番号60:人工配列の記載:human CRTH2 azami-Aの塩基配列
配列番号61:人工配列の記載:human CRTH2 azami-Bの塩基配列
配列番号64:人工配列の記載:cyno CRTH2 azami-Aの塩基配列
配列番号65:人工配列の記載:cyno CRTH2 azami-Bの塩基配列
Claims (26)
- 配列番号2で表されるヒトCRTH2のアミノ酸配列の192番目のグリシンおよび194番目のアスパラギン酸の少なくとも一方を認識し、結合する抗体または該抗体断片。
- 抗体が、配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、13番目のイソロイシン、14番目のロイシン、15番目のグルタミン酸、177番目のアスパラギン酸、178番目のグリシン、179番目のアルギニン、180番目のイソロイシン、181番目のメチオニン、182番目のシステイン、183番目のチロシン、184番目のチロシン、185番目のアスパラギン、186番目のバリン、187番目のロイシン、188番目のロイシン、189番目のロイシン、195番目のアルギニン、196番目のアスパラギン酸、197番目のアラニン、および198番目のスレオニンからなる群から選ばれるアミノ酸残基の少なくとも1つを認識し、結合する抗体である請求項1に記載の抗体または該抗体断片。
- 抗体が、以下の(a)~(g)からなる群から選ばれるアミノ酸残基の少なくとも1つを認識する抗体である、請求項1または2に記載の抗体または該抗体断片。
(a)配列番号2で表されるヒトCRTH2のアミノ酸配列の12番目のプロリン、14番目のロイシンおよび15番目のグルタミン酸、
(b)配列番号2で表されるヒトCRTH2のアミノ酸配列の177番目のアスパラギン酸、178番目のグリシン、および179番目のアルギニン、
(c)配列番号2で表されるヒトCRTH2のアミノ酸配列の180番目のイソロイシンおよび181番目のメチオニン、
(d)配列番号2で表されるヒトCRTH2のアミノ酸配列の183番目のチロシン、184番目のチロシンおよび185番目のアスパラギン、
(e)配列番号2で表されるヒトCRTH2のアミノ酸配列の187番目のロイシン、188番目のロイシンおよび189番目のロイシン、
(f)配列番号2で表されるヒトCRTH2のアミノ酸配列の195番目のアルギニン、並びに
(g)配列番号2で表されるヒトCRTH2のアミノ酸配列の196番目のアスパラギン酸および198番目のスレオニン。 - 抗体が、以下の(a)~(d)からなる群から選ばれるいずれか1つの抗体である、請求項1~3のいずれか1項に記載の抗体または該抗体断片。
(a)抗体重鎖可変領域(以下、VHと略記する)の相補性決定領域(以下、CDRと略記する)1~3が、それぞれ配列番号20~22で表されるアミノ酸配列を含み、かつ抗体軽鎖可変領域(以下、VLと略記する)のCDR1~3が、それぞれ配列番号23~25で表されるアミノ酸配列を含む抗体、
(b)配列番号49で表されるアミノ酸配列または配列番号49で表されるアミノ酸配列中の18番目のロイシンをメチオニンに、77番目のアスパラギンをセリンに、93番目のバリンをスレオニンに、および117番目のスレオニンをバリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVH並びに配列番号33で表されるアミノ酸配列または配列番号33で表されるアミノ酸配列中の2番目のイソロイシンをバリンに、4番目のメチオニンをロイシンに、15番目のプロリンをロイシンに、および85番目のアラニンをプロリンに置換する改変から選ばれる少なくとも1つの改変が導入されたアミノ酸配列を含むVLを含む抗体、
(c)配列番号49、51、53、55、57および59で表されるアミノ酸配列のいずれか1つを含むVH並びに配列番号33、35、37、39、41、43、45および47で表されるアミノ酸配列のいずれか1つを含むVLを含む抗体、並びに
(d)配列番号17で表されるアミノ酸配列を含むVHおよび配列番号19で表されるアミノ酸配列を含むVLを含む抗体。 - 抗体が、下記(a)~(h)からなる群から選ばれる少なくとも1つの特徴を有する抗体である請求項1~4のいずれか1項に記載の抗体または該抗体断片。
(a)ヒトCRTH2のリガンド存在下でヒトCRTH2に対する反応性が低下しない、
(b)中和活性を有しない、
(c)抗体依存性細胞傷害(ADCC)活性を有する、
(d)マスト細胞およびTh1細胞の少なくとも一方に反応しない、
(e)好酸球、好塩基球、Th2細胞および2型自然リンパ球(ILC2)から選ばれる少なくとも一つの細胞に反応する。
(f)アゴニスト活性を有しない、
(g)ヒトCRTH2のリガンドによるシグナルを増強しない、並びに
(h)活性化状態または不活性化状態のヒトCRTH2に対する反応性が変化しない。 - 抗体が、ヒトFc領域を含む抗体である、請求項1~5のうちのいずれか1項に記載の抗体または該抗体断片。
- 抗体が、モノクローナル抗体である請求項1~6のいずれか1項に記載の抗体または該抗体断片。
- 抗体が、遺伝子組換え抗体である請求項1~7のいずれか1項に記載の抗体または該抗体断片。
- 遺伝子組換え抗体が、ヒト型キメラ抗体、ヒト型CDR移植抗体およびヒト抗体から選ばれるいずれか1つの遺伝子組換え抗体である、請求項8に記載の遺伝子組換え抗体または該抗体断片。
- 抗体が、サルCRTH2に結合する抗体である請求項1~9のいずれか1項に記載の抗体または該断片。
- Fab、Fab’、F(ab’)2、scFv、diabody、dsFvおよびCDRを含むペプチドから選ばれるいずれか1つの抗体断片である請求項1~10のいずれか1項に記載の該抗体断片。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片を産生するハイブリドーマ。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片をコードするDNA。
- 請求項13に記載のDNAを含有する組換え体ベクター。
- 請求項14に記載の組換え体ベクターを宿主細胞に導入して得られる形質転換株。
- 請求項12に記載のハイブリドーマまたは請求項15に記載の形質転換株を培地に培養し、培養物中に請求項1~11のいずれか1項に記載の抗体または該抗体断片を生産蓄積させ、該培養物から抗体または該抗体断片を採取することを特徴とする請求項1~11のいずれか1項に記載の抗体または該抗体断片の製造方法。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片を有効成分として含有する、ヒトCRTH2が関係する疾患の治療剤。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片を有効成分として含有する、ヒトCRTH2が関係する疾患の診断剤。
- CRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、または2型自然リンパ球(ILC2)の増多および機能亢進の少なくとも一方を伴う疾患である請求項17または18に記載の剤。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片の有効量を投与することを含む、ヒトCRTH2が関係する疾患の治療方法。
- 請求項1~11のいずれか1項に記載の抗体または該抗体断片の有効量を投与することを含む、ヒトCRTH2が関係する疾患の診断方法。
- ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である請求項20または21に記載の方法。
- ヒトCRTH2が関係する疾患の治療および診断の少なくとも一方に使用するための、請求項1~11のいずれか1項に記載の抗体または該抗体断片。
- ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である請求項23に記載の抗体または該抗体断片。
- ヒトCRTH2が関係する疾患の治療および診断剤の少なくとも一方の製造のための、請求項1~11のいずれか1項に記載の抗体または該抗体断片の使用。
- ヒトCRTH2が関係する疾患がアレルギー性疾患、自己免疫疾患、好酸球増多および機能亢進の少なくとも一方を伴う疾患、Th2細胞の増多および機能亢進の少なくとも一方を伴う疾患、またはILC2の増多および機能亢進の少なくとも一方を伴う疾患である請求項25に記載の使用。
Priority Applications (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201680041608.6A CN107849139B (zh) | 2015-07-15 | 2016-07-15 | 与人crth2特异性结合的抗体 |
| CA2992262A CA2992262A1 (en) | 2015-07-15 | 2016-07-15 | Antibody which specifically binds to human crth2 |
| EP16824547.0A EP3323832A4 (en) | 2015-07-15 | 2016-07-15 | Antibody which specifically binds to human crth2 |
| KR1020187000812A KR20180030030A (ko) | 2015-07-15 | 2016-07-15 | 인간 crth2에 특이적으로 결합하는 항체 |
| AU2016293807A AU2016293807B2 (en) | 2015-07-15 | 2016-07-15 | Antibody which specifically binds to human CRTH2 |
| US15/342,534 US9938349B2 (en) | 2015-07-15 | 2016-11-03 | Antibody which specifically binds to human CRTH2 |
| US15/932,185 US10100120B2 (en) | 2015-07-15 | 2018-02-16 | Antibody which specifically binds to human CRTH2 |
| US16/124,706 US20180371100A1 (en) | 2015-07-15 | 2018-09-07 | Antibody which specifically binds to human crth2 |
| HK18114915.3A HK1255839A1 (zh) | 2015-07-15 | 2018-11-22 | 與人crth2特異性結合的抗體 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015141633 | 2015-07-15 | ||
| JP2015-141633 | 2015-07-15 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US15/342,534 Continuation US9938349B2 (en) | 2015-07-15 | 2016-11-03 | Antibody which specifically binds to human CRTH2 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2017010567A1 true WO2017010567A1 (ja) | 2017-01-19 |
Family
ID=57757419
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2016/071027 WO2017010567A1 (ja) | 2015-07-15 | 2016-07-15 | ヒトcrth2に特異的に結合する抗体 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US9938349B2 (ja) |
| EP (1) | EP3323832A4 (ja) |
| JP (2) | JP6309050B2 (ja) |
| KR (1) | KR20180030030A (ja) |
| CN (1) | CN107849139B (ja) |
| AU (1) | AU2016293807B2 (ja) |
| CA (1) | CA2992262A1 (ja) |
| HK (1) | HK1255839A1 (ja) |
| TW (1) | TWI726897B (ja) |
| WO (1) | WO2017010567A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107779500A (zh) * | 2017-10-25 | 2018-03-09 | 上海药明生物技术有限公司 | 一种快速获取大鼠杂交瘤细胞单克隆抗体序列的测序方法及引物序列 |
| WO2018139404A1 (ja) | 2017-01-24 | 2018-08-02 | 協和発酵キリン株式会社 | 放射線障害の治療又は予防剤並びに治療又は予防方法 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20200128415A (ko) * | 2018-02-27 | 2020-11-12 | 이퀼리엄 아이엔씨 | 중증 천식 치료를 위한 항 cd6 항체 |
| KR20210108961A (ko) * | 2018-12-28 | 2021-09-03 | 쿄와 기린 가부시키가이샤 | TfR에 결합하는 이중 특이적 항체 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997046677A1 (fr) * | 1996-06-05 | 1997-12-11 | Bml, Inc. | PROTEINE SPECIFIQUE DU Th2 HUMAIN, GENE (B19) CODANT POUR CETTE PROTEINE, TRANSFORMANT, VECTEUR DE RECOMBINAISON ET ANTICORPS MONOCLONAL S'Y RAPPORTANT |
| WO2005093092A2 (en) * | 2004-03-26 | 2005-10-06 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with g-protein coupled receptor 44 (gpr44) |
| WO2014144865A2 (en) * | 2013-03-15 | 2014-09-18 | Genentech, Inc. | Anti-crth2 antibodies and methods of use |
-
2016
- 2016-07-15 TW TW105122490A patent/TWI726897B/zh active
- 2016-07-15 WO PCT/JP2016/071027 patent/WO2017010567A1/ja active Application Filing
- 2016-07-15 KR KR1020187000812A patent/KR20180030030A/ko not_active Application Discontinuation
- 2016-07-15 AU AU2016293807A patent/AU2016293807B2/en active Active
- 2016-07-15 CA CA2992262A patent/CA2992262A1/en active Pending
- 2016-07-15 EP EP16824547.0A patent/EP3323832A4/en active Pending
- 2016-07-15 CN CN201680041608.6A patent/CN107849139B/zh active Active
- 2016-07-15 JP JP2016140458A patent/JP6309050B2/ja active Active
- 2016-11-03 US US15/342,534 patent/US9938349B2/en active Active
-
2018
- 2018-02-16 US US15/932,185 patent/US10100120B2/en active Active
- 2018-03-12 JP JP2018044483A patent/JP2018138546A/ja active Pending
- 2018-09-07 US US16/124,706 patent/US20180371100A1/en not_active Abandoned
- 2018-11-22 HK HK18114915.3A patent/HK1255839A1/zh unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997046677A1 (fr) * | 1996-06-05 | 1997-12-11 | Bml, Inc. | PROTEINE SPECIFIQUE DU Th2 HUMAIN, GENE (B19) CODANT POUR CETTE PROTEINE, TRANSFORMANT, VECTEUR DE RECOMBINAISON ET ANTICORPS MONOCLONAL S'Y RAPPORTANT |
| WO2005093092A2 (en) * | 2004-03-26 | 2005-10-06 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with g-protein coupled receptor 44 (gpr44) |
| WO2014144865A2 (en) * | 2013-03-15 | 2014-09-18 | Genentech, Inc. | Anti-crth2 antibodies and methods of use |
Non-Patent Citations (4)
| Title |
|---|
| "CRTH-2/GPR44 Antibody FAB33381N", NOVUS BIOLOGICALS, 26 June 2015 (2015-06-26), XP009508385, Retrieved from the Internet <URL:http://www.funakoshi.co.jp/data/datasheet/NOV/FAB33381N.pdf> [retrieved on 20161004] * |
| "Human CRTH-2 Antibody", R&D SYSTEMS, INC., 13 March 2015 (2015-03-13), XP009508383, Retrieved from the Internet <URL:http://www.funakoshi.co.jp/data/datasheet/RSD/MAB3338.pdf> [retrieved on 20161004] * |
| NAGATA, K. ET AL.: "Selective expression of a novel surface molecule by human Th2 cells in vivo", J. IMMUNOL., vol. 162, no. 3, 1999, pages 1278 - 1286, XP055121136, ISSN: 0022-1767 * |
| See also references of EP3323832A4 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018139404A1 (ja) | 2017-01-24 | 2018-08-02 | 協和発酵キリン株式会社 | 放射線障害の治療又は予防剤並びに治療又は予防方法 |
| CN107779500A (zh) * | 2017-10-25 | 2018-03-09 | 上海药明生物技术有限公司 | 一种快速获取大鼠杂交瘤细胞单克隆抗体序列的测序方法及引物序列 |
Also Published As
| Publication number | Publication date |
|---|---|
| HK1255839A1 (zh) | 2019-08-30 |
| US20170121415A1 (en) | 2017-05-04 |
| US20180222994A1 (en) | 2018-08-09 |
| JP2017038592A (ja) | 2017-02-23 |
| AU2016293807B2 (en) | 2022-03-17 |
| EP3323832A4 (en) | 2018-12-26 |
| JP2018138546A (ja) | 2018-09-06 |
| TWI726897B (zh) | 2021-05-11 |
| KR20180030030A (ko) | 2018-03-21 |
| EP3323832A1 (en) | 2018-05-23 |
| US20180371100A1 (en) | 2018-12-27 |
| CN107849139B (zh) | 2022-05-03 |
| TW201704262A (zh) | 2017-02-01 |
| US10100120B2 (en) | 2018-10-16 |
| CN107849139A (zh) | 2018-03-27 |
| US9938349B2 (en) | 2018-04-10 |
| AU2016293807A1 (en) | 2018-02-08 |
| CA2992262A1 (en) | 2017-01-19 |
| JP6309050B2 (ja) | 2018-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8877913B2 (en) | Anti-CD4 antibody | |
| WO2011155579A1 (ja) | 抗Trop-2抗体 | |
| KR20130132695A (ko) | 항 tim-3 항체 | |
| US10100120B2 (en) | Antibody which specifically binds to human CRTH2 | |
| WO2012074097A1 (ja) | 抗cd33抗体 | |
| US20240026017A1 (en) | Anti-human ccr1 monoclonal antibody | |
| WO2013005649A1 (ja) | 抗ヒトccr6抗体 | |
| KR20120115511A (ko) | 항시스템 asc 아미노산 트랜스포터 2(asct2) 항체 | |
| JP2017511381A (ja) | アゴニスト活性が低減された抗デスレセプター3(dr3)アンタゴニスト抗体 | |
| EP3970743A1 (en) | Bispecific antibody binding to cd40 and fap | |
| JP6803231B2 (ja) | 抗ヒトGas6モノクローナル抗体 | |
| EP3243837A1 (en) | Bispecific antibody binding to trailr2 and psma | |
| EP3971293A1 (en) | Bispecific antibody capable of binding to cd40 and gpc3 | |
| WO2020138487A1 (ja) | TfRに結合するバイスペシフィック抗体 | |
| WO2021261597A1 (ja) | GPC3とTfRに結合するバイスペシフィック抗体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16824547 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 20187000812 Country of ref document: KR Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2992262 Country of ref document: CA |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2016293807 Country of ref document: AU Date of ref document: 20160715 Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2016824547 Country of ref document: EP |