WO2013073667A1 - 腸管線維症処置剤 - Google Patents
腸管線維症処置剤 Download PDFInfo
- Publication number
- WO2013073667A1 WO2013073667A1 PCT/JP2012/079783 JP2012079783W WO2013073667A1 WO 2013073667 A1 WO2013073667 A1 WO 2013073667A1 JP 2012079783 W JP2012079783 W JP 2012079783W WO 2013073667 A1 WO2013073667 A1 WO 2013073667A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- extracellular matrix
- intestinal
- cells
- retinoid
- carrier
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
- A61K9/1272—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers with substantial amounts of non-phosphatidyl, i.e. non-acylglycerophosphate, surfactants as bilayer-forming substances, e.g. cationic lipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/07—Retinol compounds, e.g. vitamin A
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0679—Cells of the gastro-intestinal tract
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/07—Heat shock proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2503/00—Use of cells in diagnostics
- C12N2503/02—Drug screening
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/06—Gastro-intestinal diseases
- G01N2800/065—Bowel diseases, e.g. Crohn, ulcerative colitis, IBS
Definitions
- the present invention relates to a substance delivery carrier that targets extracellular matrix-producing cells in the intestinal tract, a composition for treating intestinal fibrosis using the carrier, and a method for treating intestinal fibrosis.
- the present invention also provides an extracellular matrix-producing cell line derived from a fibrotic intestinal tract, a method for producing the same, a method for screening an intestinal fibrosis treatment using the cell line, and a screening kit for an intestinal fibrosis treatment containing the cell line Also related.
- Intestinal fibrosis is a condition characterized by excessive accumulation of scar tissue in the intestinal wall and is caused by chronic intestinal inflammation, such as chronic inflammatory bowel disease (IBD) or radiation Secondary to tissue damage and the like (Non-Patent Document 1).
- IBD chronic inflammatory bowel disease
- Non-Patent Document 1 Inflammatory bowel disease includes Crohn's disease and ulcerative colitis, but intestinal fibrosis occurs in, for example, about 25-30% of patients in Crohn's disease.
- Intestinal fibrosis forms strictures of the intestinal tract, making it difficult for food to pass through and causing significant damage to the affected subject's QOL.
- the mechanism of intestinal fibrosis has not yet been elucidated, and therefore, a fundamental treatment method has not been established.
- TGF ⁇ 1 vaccine Non-patent Document 2
- pentoxifylline and its metabolite Non-patent Document 3
- phosphodiesterase 4 inhibitor Non-patent document 4
- HMG-CoA reductase inhibitor Non-patent document 5
- Drugs such as Daikenchuto (Non-patent document 6), pravastatin (Non-patent document 7), lipoxin A 4 analog (patent document 1), sulphate transferase inhibitor (patent document 2) are intestinal fibers It has been reported that a certain degree of results have been achieved in animal models of disease. However, none of these drugs is satisfactory yet, and further development of therapeutic agents for intestinal fibrosis has been demanded.
- An object of the present invention is to provide a carrier capable of specifically delivering a substance such as a drug to extracellular matrix-producing cells in the intestinal tract, an agent for treating intestinal fibrosis and a method for treating intestinal fibrosis using the carrier.
- the present inventors succeeded in isolating extracellular matrix-producing cells from fibrotic intestinal tissue, and further, a carrier containing a retinoid as a targeting agent It was found that an extracellular matrix production inhibitor was delivered to cells with high efficiency, and the expression of molecules involved in extracellular matrix production was remarkably suppressed, and the present invention was completed.
- the carrier containing vitamin A is extracellular in hepatic stellate cells (Patent Literature 3, Patent Literature 4), hepatic stellate cell lines (Patent Literature 3, Patent Literature 5), lung (Patent Literature 6), and bone marrow (Patent Literature 7).
- a composition in which a drug is delivered to a matrix-producing cell or a siRNA against HSP47 is carried on the same carrier is liver fibrosis (Patent Document 3), pulmonary fibrosis (Patent Document 6), and myelofibrosis (Patent Document 7). Although it has been known to improve the above, it has not been known at all about the extracellular matrix-producing cells in the intestine and the relationship with intestinal fibrosis.
- the present invention relates to the following.
- a carrier for substance delivery to an extracellular matrix-producing cell in the intestine comprising a retinoid as a targeting agent for the extracellular matrix-producing cell in the intestine.
- the carrier according to (1) above wherein the retinoid contains retinol.
- Carrier comprising a retinoid and a carrier component other than retinoid, wherein the molar ratio of the retinoid to the carrier component other than the retinoid is 8: 1 to 1: 4.
- a pharmaceutical composition for treating intestinal fibrosis comprising the carrier according to any one of (1) to (3) above and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract.
- a normal intestinal tissue from a fibrotic intestinal tissue comprising the carrier according to any one of (1) to (3) above and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract.
- a pharmaceutical composition for regeneration comprising the carrier according to any one of (1) to (3) above and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract.
- Drugs that control the activity or proliferation of extracellular matrix-producing cells in the intestinal tract are substances that inhibit the production / secretion of extracellular matrix components, cytostatic substances, apoptosis-inducing substances, TIMP inhibitors, and ⁇ 1 antitrypsin inhibition
- the pharmaceutical composition according to the above (4) or (5) which is selected from the group consisting of substances.
- the pharmaceutical composition according to (6) above, wherein the substance that inhibits production / secretion of extracellular matrix components is an inhibitor of HSP47.
- a method for producing a carrier for delivering a substance to an extracellular matrix-producing cell in the intestinal tract comprising a step of blending a retinoid as a targeting agent for the extracellular matrix-producing cell in the intestinal tract.
- (11) For treating intestinal fibrosis, comprising a step of incorporating a retinoid as a targeting agent for extracellular matrix-producing cells in the intestine and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestine as active ingredients.
- a method for isolating extracellular matrix-producing cells in the intestinal tract (I) a step of obtaining cells from fibrotic intestinal tissue collected from a subject suffering from intestinal fibrosis; and (ii) selecting cells having vimentin positive, ⁇ SMA negative and GFAP negative phenotypes from the cells obtained in (i). The process of Said method.
- a method for producing an extracellular matrix-producing cell line in the intestinal tract (I) a step of obtaining cells from fibrotic intestinal tissue collected from a subject suffering from intestinal fibrosis; and (ii) selecting cells having vimentin positive, ⁇ SMA negative and GFAP negative phenotypes from the cells obtained in (i).
- a method for screening an intestinal fibrosis treatment factor comprising the step of causing the cell line described in (12) above to coexist with a test factor, and (ii) detecting the change of the cell line due to the coexistence with the test factor.
- a kit for screening an intestinal fibrosis treatment factor comprising the cell line according to (12) above.
- retinoids function as targeting agents for extracellular matrix-producing cells in the intestine, and active ingredients such as It is considered that an anti-intestinal fibrosis effect is achieved by delivering a drug or the like that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract. Therefore, the carrier of the present invention containing a retinoid as a targeting agent can efficiently deliver an active ingredient to a site of action and further to a target cell, so that healing and progression of intestinal fibrosis that has not been fundamentally treated until now. Can be suppressed or prevented, and the contribution to human medicine and veterinary medicine is extremely large.
- the carrier of the present invention can be combined with an arbitrary drug (for example, an existing intestinal fibrosis therapeutic drug) to increase its action efficiency, it has a wide range of pharmaceutical applications and produces an effective therapeutic agent. There is also an advantage that it can be performed easily. Furthermore, since the cell line of the present invention can be used for screening of therapeutic agents for intestinal fibrosis and elucidation of the mechanism of intestinal fibrosis, it contributes to the development of new treatment agents and treatment methods for intestinal fibrosis. It is.
- an arbitrary drug for example, an existing intestinal fibrosis therapeutic drug
- FIG. 1 is a photograph showing the localization of astrocyte-like mesenchymal cells at the intestinal fibrosis site of SAMP1 / Yit mice.
- A shows an Azan stained image
- (b) shows an anti-vimentin antibody
- (c) shows an anti- ⁇ SMA antibody
- (d) shows a fluorescent immunostained image with an anti-GFAP antibody.
- Arrows indicate the location of astrocyte-like mesenchymal cells.
- the scale bar indicates 100 ⁇ m in (a) and 50 ⁇ m in (b) to (d).
- FIG. 1 is a photograph showing the localization of astrocyte-like mesenchymal cells at the intestinal fibrosis site of SAMP1 / Yit mice.
- (A) shows an Azan stained image
- (b) shows an anti-vimentin antibody
- (c) shows an anti- ⁇ SMA antibody
- (d) shows a fluorescent immunostained image with an anti-GFAP antibody.
- Arrows indicate the location of
- FIG. 2 shows vimentin and ⁇ SMA in mesenchymal cell line IC10_F2 (upper) isolated from the intestinal fibrosis site of SAMP1 / Yit mice and vimentin positive, ⁇ SMA negative, GFAP negative cell line IC10_F2_E9 (lower) derived therefrom.
- FIG. The scale bar indicates 50 ⁇ m.
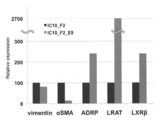
- FIG. 3 is a graph showing the relative expression of vimentin, ⁇ SMA, ADRP, LRAT and LXR ⁇ in IC10_F2 cells and IC10_F2_E9 cells.
- FIG. 4 is a graph showing the relative expression of HSP47 when siRNA against HSP47 is introduced into IC10_F2_E9 cells supported on VA-bound liposomes.
- One aspect of the present invention relates to a carrier for delivering a substance to an extracellular matrix-producing cell in the intestinal tract, which contains a retinoid as a targeting agent for the extracellular matrix-producing cell in the intestinal tract.
- a carrier of the present invention comprises an effective amount of a retinoid for targeting to extracellular matrix-producing cells in the intestine.
- a carrier that is targeted to extracellular matrix-producing cells in the intestine by retinoids is targeted to extracellular matrix-producing cells in the intestine by retinoids.
- the extracellular matrix-producing cells in the intestinal tract are not particularly limited as long as they are cells having an extracellular matrix-producing ability present in the intestinal tract.
- astrocyte-like cells, fibroblasts, peripheral cells present in the intestinal tract. Includes skin cells, fibrosites and myofibroblasts.
- Matrix-producing cells in the intestinal tract are not only derived from cells in the intestinal tract, but also derived from fibrocytes in the circulating blood, and those that have been converted from epithelial cells and endothelial cells by endothelial mesenchymal transdifferentiation (Non-patent Document 1).
- astrocyte-like cells examples include cells having phenotypes identified in the following examples, which are vimentin positive, ⁇ SMA ( ⁇ smooth muscle actin) negative and GFAP (glial fibrillary acidic protein) negative. Such cells are identified by immunostaining using a detectably labeled anti-vimentin antibody, anti- ⁇ SMA antibody and anti-GFAP antibody.
- the cell may express a VA (vitamin A) storage-related gene, for example, ADRP (adipose differentiation-related protein), LRAT (lecithin retinol acyltransferase) and / or LXR ⁇ (liver X receptor ⁇ ).
- hepatic stellate cells are activated when cultured in vitro and become ⁇ SMA positive and GFAP positive, the stellate cell-like cells are not positive for ⁇ SMA and GFAP even when cultured in vitro.
- Myofibroblasts are characterized by vimentin and ⁇ SMA expression, and fibroblasts express vimentin characteristic of mesenchymal cells, but do not express ⁇ SMA, so double staining of vimentin and ⁇ SMA, etc. Can be identified.
- Extracellular matrix-producing cells in the intestine can also be obtained by selecting cells having vimentin positive, ⁇ SMA negative and GFAP negative phenotypes from cells obtained from intestinal tissue.
- the retinoid in the present invention functions as a targeting agent (targeting agent) to extracellular matrix-producing cells in the intestine and promotes specific substance delivery to such cells.
- targeting agent targeting agent
- RBP retinol binding protein
- a retinoid is a member of a group of compounds with a skeleton in which four isoprenoid units are linked in a head-to-tail manner (G. P. Moss, “Biochemical Nomenclature and Related Documents,” 2nd Ed. Portland Press, pp. 247-251 (1992)), vitamin A is a general descriptor of retinoids that qualitatively shows the biological activity of retinol.
- the retinoid that can be used in the present invention is not particularly limited.
- retinol including all-trans retinol
- retinal retinoic acid (including tretinoin)
- ester of retinol and fatty acid aliphatic alcohol and retinoic acid
- retinoid derivatives such as esters, etretinate, isotretinoin, adapalene, acitretin, tazarotene, retinol palmitate, and vitamin A analogs such as fenretinide (4-HPR) and bexarotene.
- retinol, retinal, retinoic acid, esters of retinol with fatty acids (eg retinyl acetate, retinyl palmitate, retinyl stearate, and retinyl laurate) and esters of fatty alcohols with retinoic acid (Eg, ethyl retinoate) is preferred in terms of the efficiency of delivery of specific substances to extracellular matrix-producing cells in the intestine. All isomers, including cis-trans of retinoids, are within the scope of the present invention.
- the retinoid may also be substituted with one or more substituents.
- the retinoid in the present invention includes not only an isolated state but also a retinoid in a state of being dissolved or mixed in a medium capable of dissolving or holding the same.
- the retinoid in the present invention further includes a compound containing a retinoid as a part thereof (a retinoid moiety-containing compound).
- a retinoid moiety-containing compound Such compounds comprise one or more retinoid moieties, eg, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, or 10 May contain many.
- the retinoid may be present in a state in which an RBP binding site (for example, a cyclohexene ring moiety in the case of retinol) can bind to RBP.
- an RBP binding site for example, a cyclohexene ring moiety in the case of retinol
- Such compounds include, but are not limited to, those in which one or more retinoids are bound to PEG or a derivative thereof.
- a retinoid RBP non-binding site (for example, in the case of retinol, a moiety other than a cyclohexene ring moiety, such as an OH group) may be covalently bonded to PEG or a derivative thereof.
- PEG or a derivative thereof may have 1 to 50 repeating units (CH 2 CH 2 O).
- the molecular weight of PEG or a derivative thereof may be 200 to 4000 g / mol.
- PEG or its derivatives may be linear or branched.
- the PEG derivative may have a group suitable for bonding with a retinoid, such as an amino group, at the terminal.
- PEG derivatives have one or more amide groups in the chain, for example 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, or You may have more than ten.
- the carrier of the present invention may be constituted by these retinoids themselves, or may be constituted by binding or including a retinoid in another carrier component. Therefore, the carrier of the present invention may contain carrier components other than retinoids. Such components are not particularly limited, and any of those known in the pharmaceutical and pharmaceutical fields can be used, but those that can include or bind to retinoids are preferred. Examples of such components include lipids, phospholipids such as glycerophospholipids, sphingolipids such as sphingomyelin, sterols such as cholesterol, vegetable oils such as soybean oil and poppy oil, lecithins such as mineral oil and egg yolk lecithin, polymers, etc. However, it is not limited to these.
- liposomes for example, natural phospholipids such as lecithin, semisynthetic phospholipids such as dimyristoyl phosphatidylcholine (DMPC), dipalmitoyl phosphatidylcholine (DPPC), distearoyl phosphatidylcholine (DSPC), and dioleyl phosphatidylethanol Amine (DOPE), dilauroyl phosphatidylcholine (DLPC), cholesterol and the like are preferable.
- natural phospholipids such as lecithin
- semisynthetic phospholipids such as dimyristoyl phosphatidylcholine (DMPC), dipalmitoyl phosphatidylcholine (DPPC), distearoyl phosphatidylcholine (DSPC), and dioleyl phosphatidylethanol Amine (DOPE), dilauroyl phosphatidylcholine (DLPC), cholesterol and the like are preferable.
- Particularly preferred components include components that can avoid capture by the reticuloendothelial system, such as N- ( ⁇ -trimethylammonioacetyl) -didodecyl-D-glutamate chloride (TMAG), N, N ′, N ′′, N ′ ′′-tetramethyl-N, N ′, N ′′, N ′ ′′-tetrapalmitylspermine (TMTPS), 2,3-dioleyloxy-N- [2 (sperminecarboxamido) ethyl] -N , N-dimethyl-1-propanaminium trifluoroacetate (DOSPA), N- [1- (2,3-dioleyloxy) propyl] -N, N, N-trimethylammonium chloride (DOTMA), dioctadecyldimethyl Ammonium chloride (DODAC), didodecyl ammonium bromide (DDAB), 1,2-dioleyloxy-3-tri
- the carrier in the present invention may have a specific three-dimensional structure. Examples of such a structure include, but are not limited to, a linear or branched linear structure, a film-like structure, and a spherical structure. Thus, the carrier may have any three-dimensional form such as, but not limited to, dendrimers, dendrons, micelles, liposomes, emulsions, microspheres, nanospheres.
- a targeting agent including targeting molecules, targeting moieties and the like. Carriers having a three-dimensional morphology and carriers capable of active targeting are well known in the art (eg, Marcucci and Lefoulon, Drug Discov Today. 2004 Mar 1; 9 (5): 219-28, Torchilin, Eur J Pharm Sci. 2000 Oct; 11 Suppl 2: S81-91).
- Binding or inclusion of the retinoid to the carrier of the present invention is also possible by binding or including the retinoid to other components of the carrier by chemical and / or physical methods.
- the retinoid can be bound or included in the carrier of the present invention by mixing the retinoid and other carrier components at the time of producing the carrier.
- the amount of retinoid in the carrier of the present invention can be, for example, 0.01 to 1000 nmol / ⁇ l, preferably 0.1 to 100 nmol / ⁇ l.
- the molar ratio of retinoid and carrier component other than retinoid is not limited, for example, 8: 1 to 1: 4, or 4 : 1 to 1: 2.
- the binding or inclusion of the retinoid to the carrier may be performed before the delivery material is loaded on the carrier, may be performed by mixing the carrier, the retinoid and the delivery material at the same time, or the delivery material You may carry out by mixing the support
- the present invention also includes a step of binding a retinoid to any existing drug-binding carrier or drug-encapsulating carrier, for example, a liposome preparation such as DaunoXome (R) , Doxil, Caelyx (R) , Myocet (R) ,
- a liposome preparation such as DaunoXome (R) , Doxil, Caelyx (R) , Myocet (R)
- the present invention also relates to a method for producing a preparation specific for extracellular matrix-producing cells in the intestine.
- the form of the carrier of the present invention may be any form as long as it can transport a desired substance or substance to the extracellular matrix-producing cells in the target intestinal tract.
- the carrier, the polymer, the dendrimer, the dendron, the high It can take any form of molecular micelles, liposomes, emulsions, microspheres, nanoglobules and the like.
- the form of liposomes is preferred, and among these, cationic liposomes containing cationic lipids are particularly preferred.
- the molar ratio of the retinoid to the other liposome-constituting lipid is preferably 8: 1 to 1: 4, considering the efficiency of binding or inclusion of the retinoid to the carrier.
- the ratio is preferably 4: 1 to 1: 2.
- the retinoid contained therein may contain a transported material inside, or may be attached to the outside of the transported material, It may be mixed with a transported item.
- functioning as a targeting agent means that a carrier containing a retinoid reaches and / or takes up extracellular matrix-producing cells in the intestinal tract that are target cells more rapidly and / or in a larger amount than a carrier that does not contain the retinoid. This can be easily confirmed, for example, by adding a carrier with a label or containing a label to a culture of target cells and analyzing the site of the label after a predetermined time. .
- the retinoid is at least partially exposed to the outside of the carrier (eg, when the carrier has a three-dimensional structure) or a preparation containing the carrier by the time it reaches the target cell at the latest.
- the “formulation” is a concept including the composition of the present invention described later and further having a form. Whether or not the retinoid is exposed to the outside of the preparation is evaluated by contacting the preparation with a substance that specifically binds to the retinoid, for example, retinol binding protein (RBP) and investigating the binding to the preparation. be able to.
- a substance that specifically binds to the retinoid for example, retinol binding protein (RBP)
- At least partially exposing the retinoid to the outside of the carrier or the preparation before reaching the target cell at the latest is achieved, for example, by adjusting the mixing ratio of the retinoid and the carrier component other than the retinoid. be able to.
- the carrier has a form of a lipid structure such as a liposome
- a lipid structure first comprising a carrier component other than retinoid Can be diluted in an aqueous solution and then contacted and mixed with the retinoid.
- the retinoid may be in a state dissolved in a solvent, for example, an organic solvent such as DMSO.
- the lipid structure means a structure having an arbitrary three-dimensional structure, for example, a linear shape, a film shape, a spherical shape, and the like, which includes lipid as a constituent component, and is not limited to liposomes, micelles. , Lipid microspheres, lipid nanoglobules, lipid emulsions and the like.
- the same targeting agent that targeted liposomes can be applied to other drug carriers, e.g. Zhao and Lee, Adv Drug Deliv Rev. 2004; 56 (8): 1193-204, Temming et al., Drug Resist Updat. 2005; 8 (6): 381-402.
- Lipid structures for example, salts, sugars such as sucrose, glucose, maltose, polyhydric alcohols such as glycerin, propylene glycol, etc., preferably osmotic pressure is adjusted using an osmotic pressure regulator such as sucrose or glucose By doing so, it can be stabilized. Moreover, you may adjust pH by adding pH adjusters, such as a moderate salt and a buffer solution. Therefore, the production and storage of lipid structures can be performed in a medium containing these substances. In this case, the concentration of the osmotic pressure adjusting agent is preferably adjusted to be isotonic with blood.
- the concentration in the medium is not limited and may be 3 to 15% by weight, preferably 5 to 12% by weight, more preferably 8 to 10% by weight, particularly 9% by weight.
- the concentration in the medium is not limited and may be 1 to 10% by weight, preferably 3 to 8% by weight, more preferably 4 to 6% by weight, especially 5% by weight.
- the present invention also relates to a method for producing a carrier for substance delivery to extracellular matrix-producing cells in the intestinal tract, comprising a step of blending a retinoid as a targeting agent for extracellular matrix-producing cells in the intestinal tract.
- the retinoid compounding method is not particularly limited as long as the retinoid can function as a targeting agent for extracellular matrix-producing cells in the intestinal tract in the compounded carrier.
- various methods described in the present specification can be used.
- the retinoid formulation involves combining or including the retinoid with other components of the carrier by chemical and / or physical methods, or combining the retinoid and other carrier components during carrier production. It can be performed by mixing.
- the amount of retinoid compounded is as already described for the carrier of the present invention.
- the delivery material of the carrier is not particularly limited, but is preferably sized so that it can be physically moved from the administration site to the lesion site where the target cells are present. Therefore, the carrier of the present invention carries not only substances such as atoms, molecules, compounds, proteins, and nucleic acids but also objects such as vectors, virus particles, cells, drug release systems composed of one or more elements, and micromachines. be able to.
- the delivery product preferably has a property of affecting the target cell in some way, for example, a label for the target cell or a product that controls (for example, enhances or suppresses) the activity or proliferation of the target cell. Including.
- the carrier delivery product includes a “drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract”.
- the activity of extracellular matrix-producing cells in the intestinal tract refers to various activities such as secretion, uptake and migration exhibited by extracellular matrix-producing cells in the intestinal tract.
- it typically, In particular, it means an activity involved in the onset, progression and / or recurrence of intestinal fibrosis.
- Examples of such activities include, but are not limited to, production / secretion of extracellular matrix components such as collagen, proteoglycan, tenascin, fibronectin, thrombospondin, osteopontin, osteonectin, and elastin, and these extracellular matrix components. For example, suppression of the decomposition activity of.
- a drug that regulates the activity or proliferation of extracellular matrix-producing cells in the intestinal tract refers to the physical, chemical and / or cellular properties associated with the onset, progression and / or recurrence of intestinal fibrosis.
- Any drug that directly or indirectly suppresses a physiological action or the like may be used without limitation, a substance that inhibits production / secretion of the extracellular matrix component, a cell growth inhibitor, an apoptosis inducer, Including TIMP (Tissue inhibitor of metalloproteinase) inhibitor, ⁇ 1 antitrypsin inhibitor and the like.
- Substances that inhibit the production and secretion of extracellular matrix components and the like are not limited, for example, the expression of extracellular matrix components such as collagen, proteoglycan, tenascin, fibronectin, thrombospondin, osteopontin, osteonectin, and elastin. Examples thereof include substances that suppress RNAi molecules, ribozymes, antisense nucleic acids, and the like, or substances that have a dominant negative effect such as dominant negative mutants, vectors that express these, and cells transformed with these.
- the drugs that inhibit the production and secretion of collagen are not limited. For example, collagen essential for intracellular transport and molecular maturation common to various types of collagen synthesis processes.
- HSP 47 Heat shock protein 47
- HSP47 expression inhibitors such as RNAi molecules, ribozymes and antisense nucleic acids against HSP47, or dominant negative effects such as dominant negative mutants of HSP47
- dominant negative effects such as dominant negative mutants of HSP47 Examples thereof include substances, vectors expressing them, cells transformed with these, and the like.
- the cell growth inhibitor examples include, but are not limited to, alkylating agents such as ifosfamide, nimustine (for example, nimustine hydrochloride), cyclophosphamide, dacarbazine, melphalan, and ranimustine, gemcitabine (for example, gemcitabine hydrochloride), and inositabine Cytarabine ocphosphate, cytarabine preparation, tegafur uracil, tegafur gimeracil oteracil potassium combination agent (eg TS-1), antimetabolite such as doxyfluridine, hydroxycarbamide, fluorouracil, methotrexate, mercaptopurine, idarubicin (eg Idarubicin hydrochloride), epirubicin (eg epirubicin hydrochloride), daunorubicin (eg daunorubicin hydrochloride, daunorubicin citrate), doxorubicin
- apoptosis inducers include, but are not limited to, compound 861, gliotoxin, atorvastatin, and the like.
- Inhibitors of TIMP are not limited.
- TIMP activity inhibitors such as antibodies against TIMP, RNAi molecules against TIMP, ribozymes, antisense nucleic acids and other TIMP production inhibitors , Vectors expressing these, and cells transformed with these.
- ⁇ 1 antitrypsin inhibitor examples include, but are not limited to, ⁇ 1 antitrypsin activity inhibitors such as antibodies to ⁇ 1 antitrypsin, RNAi molecules against ⁇ 1 antitrypsin, ribozymes, ⁇ 1 antitrypsin production inhibitors such as antisense nucleic acids, Examples thereof include vectors expressing these, and cells transformed with these.
- the “drug that regulates the activity or proliferation of extracellular matrix-producing cells in the intestinal tract” in the present invention refers to the production of extracellular matrix in the intestinal tract directly or indirectly related to the suppression of the onset, progression and / or recurrence of intestinal fibrosis. Any drug that directly or indirectly promotes the physical, chemical and / or physiological actions of cells may be used.
- the carrier of the present invention can deliver one or more of the above drugs.
- RNAi molecules in the present invention include double-stranded RNAs such as siRNA (small interfering RNA), miRNA (micro RNA), shRNA (short hairpin RNA), piRNA (Piwi-interacting RNA), rasiRNA (repeat associated siRNA) and the like. Including variants.
- RNAi molecules and RNAi molecule-expressing vectors can be used in accordance with the teachings of, for example, general texts (eg, experimental medicine separate volume, revised RNAi experiment protocol 2004 Yodosha, RNAi experiment Q & A 2006 Yodosha etc.) it can.
- the RNAi molecule can be designed by a person skilled in the art by referring to the messenger RNA sequence of the target gene and the sequence of a known RNAi molecule, and the general text (Experimental Medicine Separate Volume Revised RNAi Experiment Protocol 2004 Yodosha) The RNAi experiment can be appropriately performed according to the teaching of Q & A 2006 Yodosha).
- the nucleic acid in the present invention includes RNA, DNA, PNA, or a complex thereof.
- the delivery product of the carrier of the present invention is not limited, and includes drugs other than those mentioned above that suppress the onset, progression and / or recurrence of intestinal fibrosis, including, but not limited to, TGF ⁇ 1 inhibitors (including TGF ⁇ 1 vaccine) ), Pentoxifylline and its metabolites, phosphodiesterase 4 inhibitor, HMG-CoA reductase inhibitor, Daikenchuto, pravastatin, lipoxin A 4 analog, sulfate transferase inhibitor, fibrosis promoting factor (eg , EGF, bFGF, FGF2, PDGF, IGF-I, IGF-II, CTGF, IL-1 ⁇ , IL-4, IL-13, MCP-1, MIP-1 ⁇ , MIP-1 ⁇ , MIP-3 ⁇ , NOD1 ligand, Inhibitors of TLR2, 4 and 5 ligands, galectin 3, hyaluronan, laminin, collagen, etc.) and intestinal fibrosis Drugs
- composition of the present invention includes administration of the composition of the present invention and the drug substantially simultaneously, and administration at intervals in time within the same treatment period.
- the composition of the present invention may be mixed with the above drugs or may be continuously administered without mixing.
- the composition of the present invention may be administered before or after the drug.
- the drug that regulates the activity or proliferation of extracellular matrix-producing cells in the intestinal tract includes inhibitors of HSP47, such as siRNA for HSP47.
- the substance or object delivered by the carrier of the present invention may or may not be labeled. By labeling, it becomes possible to monitor the success or failure of delivery to target cells and the increase / decrease of target cells, which is useful not only at the test / research level but also at the clinical level.
- the label may be any substance known to those skilled in the art, for example, any radioisotope, magnetic substance, gas or substance that generates gas under physiological conditions, an element that undergoes nuclear magnetic resonance (eg, hydrogen, phosphorus, sodium, fluorine Etc.), substances that affect the relaxation time of elements that undergo nuclear magnetic resonance (for example, metal atoms or compounds containing them), substances that bind to labeled substances (for example, antibodies), fluorescent substances, fluorophores, chemiluminescent substances , Biotin or a derivative thereof, avidin or a derivative thereof, an enzyme, or the like.
- the label may also be attached to the carrier component or may be carried on the carrier as an independent delivery.
- “for extracellular matrix-producing cells in the intestine” or “for delivering extracellular matrix-producing cells in the intestine” means that the extracellular matrix-producing cells in the intestine are suitable for use as target cells. Includes, for example, the ability to deliver substances to the same cell more rapidly, efficiently and / or in larger quantities than other cells, eg, normal cells.
- the carrier of the present invention is an extracellular matrix-producing cell in the intestinal tract that is 1.1 times or more, 1.2 times or more, 1.3 times or more, 1.5 times or more, 2 times or more compared to other cells.
- the substance can be delivered at a rate and / or efficiency that is three times or more.
- the present invention also provides intestinal fibrosis for controlling the activity or proliferation of extracellular matrix-producing cells in the intestinal tract, comprising the carrier and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract.
- the invention relates to a composition for treating or regenerating normal intestinal tissue from fibrotic intestinal tissue, as well as the use of said carriers for the production of these compositions.
- One embodiment of the composition of the invention comprises an effective amount of a retinoid for targeting to extracellular matrix-producing cells in the intestine.
- one embodiment of the composition of the present invention is targeted to extracellular matrix-producing cells in the intestine by retinoids.
- Intestinal fibrosis in the present invention refers to a pathological condition characterized by excessive accumulation of scar tissue in the intestinal wall, and chronic intestinal inflammation, such as chronic inflammatory bowel disease (drug enteritis, infectious enteritis, etc.
- chronic intestinal inflammation such as chronic inflammatory bowel disease (drug enteritis, infectious enteritis, etc.
- Specific inflammatory bowel diseases with identified causes, and non-specific inflammatory bowel diseases with unknown causes such as Crohn's disease and ulcerative colitis
- tissue damage due to radiation surgery and trauma Including those secondary to intestinal adhesions.
- “regenerating normal intestinal tissue from fibrotic intestinal tissue” means that the intestinal tissue altered by fibrosis is restored to a state where at least mild fibrosis has occurred. In other words, as intestinal fibrosis progresses, the intestinal tissue is replaced with fibrous tissue centered on the extracellular matrix, but this flow can be reversed to replace the increased fibrous tissue with the original normal tissue.
- normal intestinal tissue is regenerated from fibrotic intestinal tissue. Therefore, regeneration of normal intestinal tissue from fibrotic intestinal tissue in the present invention not only restores the fibrotic intestinal tissue completely to the original state but also partially restores the fibrotic intestinal tissue to the original state. Including.
- the degree of regeneration of normal intestinal tissue may be evaluated by histological examination such as a biopsy sample based on normalization of tissue structure, reduction of the area occupied by fibrous tissue, expansion of the area occupied by normal tissue, etc.
- histological examination such as a biopsy sample based on normalization of tissue structure, reduction of the area occupied by fibrous tissue, expansion of the area occupied by normal tissue, etc.
- an abnormality such as a biochemical index due to fibrosis is recognized before the treatment with the present composition, it may be evaluated by improving the index or the like.
- the carrier may contain the delivery product inside or be attached to the outside of the delivery product. It may also be mixed with a delivery product. Thus, depending on the route of administration, mode of drug release, etc., the composition may be coated with a suitable material, such as an enteric coating or a time-disintegrating material, and a suitable drug release system. It may be incorporated. Furthermore, the composition of the present invention may take the form of a complex of liposomes to which a retinoid is bound and a delivery product, that is, a lipoplex. When the carrier is composed only of retinoids, the composition of the present invention may take the form of a complex of a drug and a retinoid that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract.
- compositions of the present invention can be used as medicaments (ie, pharmaceutical compositions), and include various routes including both oral and parenteral, such as, but not limited to, oral, intravenous, intramuscular, subcutaneous, Local, intrapulmonary, intratracheal, intratracheal, intrabronchial, nasal, transgastric, enteral, intrarectal, intraarterial, portal vein, intraventricular, intramedullary, intralymphatic, intralymphatic, intracerebral, medullary It may be administered by routes such as intracavity, intraventricular, transmucosal, transdermal, intranasal, intraperitoneal, and intrauterine, and may be formulated into a dosage form suitable for each administration route.
- oral and parenteral such as, but not limited to, oral, intravenous, intramuscular, subcutaneous, Local, intrapulmonary, intratracheal, intratracheal, intrabronchial, nasal, transgastric, enteral, intrarectal, intraarterial, portal vein, intraventricular
- dosage forms suitable for oral administration include, but are not limited to, powders, granules, tablets, capsules, solutions, suspensions, emulsions, gels, syrups, etc.
- Suitable dosage forms include injections such as solution injections, suspension injections, emulsion injections, and injections prepared at the time of use.
- Formulations for parenteral administration can be in the form of aqueous or non-aqueous isotonic sterile solutions or suspensions.
- the present invention also includes a step of blending a retinoid as a targeting agent for extracellular matrix-producing cells in the intestinal tract and a drug that controls the activity or proliferation of extracellular matrix-producing cells in the intestinal tract as an active ingredient.
- the present invention relates to a method for producing a therapeutic pharmaceutical composition or a composition for regenerating normal intestinal tissue from fibrotic intestinal tissue.
- the method for blending retinoid is not particularly limited as long as the retinoid can function as a targeting agent for extracellular matrix-producing cells in the intestine in the blended composition. For example, various methods described in the present specification can be used. .
- blending method of an active ingredient will not be specifically limited if an active ingredient can have a predetermined effect, Arbitrary well-known methods can be used.
- the active ingredient may be blended simultaneously with the retinoid, or before or after the retinoid is blended.
- the active ingredient may be blended by mixing a carrier in which the retinoid is already blended as a targeting agent and the active ingredient, etc. It may be carried out by mixing the carrier component other than the retinoid and the active ingredient at the same time, or after mixing the active ingredient with the carrier component other than the retinoid and mixing it with the retinoid. Also good.
- the amount of retinoid compounded is as already described for the carrier of the present invention.
- the compounding amount of the active ingredient, when administered as a composition is an amount that can suppress the onset and recurrence of intestinal fibrosis, improve the disease state, reduce the symptoms, or delay or stop the progression, preferably May be an amount capable of preventing or curing the onset and recurrence of intestinal fibrosis, or an amount capable of regenerating normal intestinal tissue from fibrotic intestinal tissue.
- an amount that does not cause adverse effects exceeding the benefits of administration is preferred. Such an amount is known or can be appropriately determined by an in vitro test using cultured cells, or a test in a model animal such as a mouse, rat, dog or pig.
- Such a test method is well known to those skilled in the art.
- intestinal fibrosis animal models include those described in Pizarro et al., Trends Mol Med. 2003 May; 9 (5): 218-22 (eg, TNBS induction model, DSS induction model, oxazolone induction model, CD4 + CD45RB high SCID transfer model, tg ⁇ 26 bone marrow chimeric mouse, IL-10 KO mouse, TNF ⁇ ARE model, C3H-HeJBir mouse, SAMP1 / Yit mouse, SAMP1 / YitFc mouse, etc.).
- the SAMP1 / Yit mouse is useful as a model animal for intestinal fibrosis in human Crohn's disease.
- the compounding amount of the active ingredient may vary depending on the dosage form of the composition.
- the amount of the active ingredient blended in one unit of the composition may be a plurality of the amount of the active ingredient necessary for one administration. it can. Those skilled in the art can appropriately adjust the blending amount.
- the carrier or composition of the present invention may be supplied in any form, but from the viewpoint of storage stability, it is preferably in a form ready for use, for example, at or near the medical site, and / or It can be provided in a form that can be prepared by a pharmacist, nurse, or other paramedical.
- the carrier or composition of the invention is provided as one or more containers comprising at least one of the essential components thereof, and is used before use, for example within 24 hours, preferably 3 Prepared within an hour and more preferably just prior to use. In the preparation, reagents, solvents, dispensing devices and the like that are usually available at the place of preparation can be appropriately used.
- the present invention also provides for the preparation of said carrier or said composition comprising one or more containers comprising retinoids and / or deliverables and / or carrier constituents other than retinoids, alone or in combination. It also relates to kits and the necessary components of the carrier or the composition provided in the form of such a kit.
- the kit of the present invention may contain instructions relating to the preparation method and administration method of the carrier and composition of the present invention, such as instructions and electronic recording media such as CD and DVD.
- the kit of the present invention may contain all of the components for completing the carrier or composition of the present invention, but may not necessarily contain all of the components. Therefore, the kit of the present invention may not contain reagents and solvents that are usually available at medical sites, experimental facilities, etc., such as sterile water, physiological saline, and glucose solution.
- the invention further provides for treating intestinal fibrosis for controlling the activity or proliferation of extracellular matrix-producing cells in the intestinal tract, comprising administering an effective amount of the composition to a subject in need thereof. Or a method for regenerating normal intestinal tissue from fibrotic intestinal tissue.
- the effective amount is, for example, the amount that suppresses the onset or recurrence of intestinal fibrosis, improves the pathological condition, reduces the symptoms, or delays or stops the progression of the latter, preferably the intestinal fibrosis It may be an amount that prevents or cures the onset and recurrence of fibrosis, or an amount that can regenerate normal intestinal tissue from fibrotic intestinal tissue. In addition, an amount that does not cause adverse effects exceeding the benefits of administration is preferred.
- Such an amount can be appropriately determined by an in vitro test using cultured cells or the like and a test in a model animal such as a mouse, rat, dog or pig, and such a test method is well known to those skilled in the art. .
- the doses of retinoid contained in the carrier and the drug used in the method of the present invention are known to those skilled in the art or can be appropriately determined by the above-described tests and the like.
- the model animal for intestinal fibrosis is as described above.
- the specific dose of the composition to be administered in the methods of the present invention can vary depending on various conditions related to the subject in need of treatment, such as severity of symptoms, general health of the subject, age, weight, subject sex, diet, administration It can be determined in consideration of the route, the timing and frequency of administration, the drugs used in combination, the responsiveness to treatment, compliance with treatment, and the like.
- Administration routes include various routes including both oral and parenteral, such as oral, intravenous, intramuscular, subcutaneous, topical, intrapulmonary, intratracheal, intratracheal, intrabronchial, nasal, transgastric, Enteral, intrarectal, intraarterial, portal vein, intraventricular, intramedullary, intralymphatic, intralymphatic, intracerebral, intrathecal, intraventricular, transmucosal, transdermal, intranasal, intraperitoneal and uterus Internal routes are included. The frequency of administration varies depending on the properties of the composition used and the conditions of the subject as described above.
- the term “subject” means any living individual, preferably an animal, more preferably a mammal, more preferably a human individual.
- a subject may be healthy or afflicted with some disease, but when treatment of intestinal fibrosis is contemplated, it typically suffers from intestinal fibrosis.
- a typical example is a subject suffering from a disease causing intestinal fibrosis, such as inflammatory bowel disease, intestinal adhesion due to surgery or trauma, etc. Become.
- treatment is also intended to encompass all types of medically acceptable prophylactic and / or therapeutic interventions intended to cure, temporarily ameliorate or prevent disease.
- treatment refers to a medically acceptable intervention for a variety of purposes, including delaying or stopping the progression of intestinal fibrosis, regression or disappearance of a lesion, preventing or preventing recurrence of intestinal fibrosis, etc. Is included.
- the present invention also relates to a method for delivering a substance to an extracellular matrix-producing cell in the intestinal tract using the carrier.
- This method is not limited, for example, a step of carrying a delivery product on the carrier, and a carrier carrying the delivery product is administered or added to an organism or medium containing extracellular matrix-producing cells in the intestinal tract, such as a culture medium. Including the step of. These steps can be appropriately achieved according to any known method or the method described in the present specification.
- the delivery method can also be combined with other delivery methods, such as other delivery methods targeting the intestinal tract.
- the said method includes the aspect made in vitro, and the aspect which targets the extracellular matrix production cell in the intestinal tract in a body.
- the substance that can be transported by the carrier of the present invention is as described above.
- the present invention also relates to an extracellular matrix-producing cell line in the intestine having a vimentin-positive, ⁇ SMA-negative and GFAP-negative phenotype derived from fibrotic intestinal tissue collected from a subject suffering from intestinal fibrosis.
- intestinal fibrosis-affected subjects include, but are not limited to, subjects diagnosed with intestinal fibrosis and model animals of intestinal fibrosis. Diagnosis of intestinal fibrosis is performed by confirming intestinal stenosis by medical history, barium imaging, etc., and histopathological examination of biopsy samples. Fibrotic intestinal tissue can be collected by any possible technique such as surgery or biopsy using an endoscope or the like.
- the phenotype is not limited, and can be confirmed by, for example, immunostaining with anti-vimentin antibody, anti- ⁇ SMA antibody and anti-GFAP antibody, expression analysis of vimentin, ⁇ SMA and GFAP genes.
- Each of the above-described antibodies may be commercially available, or may be newly prepared by a known technique such as immunizing an animal with each protein.
- the cell line may express HSP47 or a homologue thereof (for example, gp46), collagen, VA storage-related genes such as ADRP, LRAT and / or LXR ⁇ .
- the above cell lines are not positive for ⁇ SMA and GFAP even when cultured in vitro.
- the cell line may also be immortalized by introduction of an immortalizing gene (for example, SV40T, telomerase gene, etc.).
- the cell line can be cultured under normal culture conditions for mesenchymal cells. Such conditions include, but are not limited to, for example, culture in 10% FBS-containing DMEM at 5% CO 2 and 37 ° C.
- the present invention also provides (I) a step of obtaining cells from fibrotic intestinal tissue collected from a subject suffering from intestinal fibrosis; and (ii) selecting cells having vimentin positive, ⁇ SMA negative and GFAP negative phenotypes from the cells obtained in (i).
- the acquisition of cells from fibrotic intestinal tissue is not limited.
- arbitrarily minced tissue may be cultured, and cells that migrate from the tissue may be obtained, or the tissue may be proteolytic enzyme (eg, collagenase). , Protease, etc.), and cells dissociated therefrom may be obtained.
- the selection of cells is not limited.
- the cells may be separated into single cells by limiting dilution or the like, and the phenotype of each clone may be confirmed by immunostaining or gene expression analysis.
- a single cell suspension labeled with vimentin antibody, anti- ⁇ SMA antibody and / or anti-GFAP antibody may be treated by treatment with a cell sorter or the like.
- the present invention also provides a method for producing an extracellular matrix-producing cell line in the intestinal tract, (I) a step of obtaining cells from fibrotic intestinal tissue collected from a subject suffering from intestinal fibrosis; and (ii) selecting cells having vimentin positive, ⁇ SMA negative and GFAP negative phenotypes from the cells obtained in (i).
- Cell immortalization can be performed by introducing an immortalizing gene (for example, SV40T, telomerase gene, etc.). Immortalization may be performed before or after selecting cells of the desired phenotype.
- the constitution other than the step of immortalizing the cells is as described above for the method of isolating extracellular matrix-producing cells in the intestinal tract.
- test factors include various factors such as heat, electromagnetic waves (for example, radio waves, light rays, X-rays, gamma rays, etc.), pressure, and pH in addition to substances such as compounds.
- “Make the cell line and the test factor coexist” means that the cell line and the test factor are placed in the same medium, and it is not always necessary for the cell line and the test factor to contact each other.
- the coexistence of the cell line and the test factor includes, for example, without limitation, placing the cell line and the test factor in the same container.
- the coexistence of the cell line and the test factor may be performed in vivo or in vitro.
- the change of the cell line due to coexistence with the test factor is not limited, for example, suppression or enhancement of cell line activity (for example, suppression or enhancement of gene expression or substance production), suppression or enhancement of cell line proliferation Etc. Therefore, for example, suppression of the growth of a cell line due to coexistence with a test factor and suppression of the activity of the cell line indicate that the test factor is an intestinal fibrosis treatment factor.
- the present invention also includes an intestinal fiber including an extracellular matrix-producing cell line in the intestine having a vimentin-positive, ⁇ SMA-negative, and GFAP-negative phenotype derived from fibrotic intestinal tissue collected from the above-mentioned intestinal fibrosis-affected subject.
- the present invention relates to a kit for screening a disease treatment factor.
- a kit for screening a disease treatment factor in addition to the above cell line, a reagent for detecting changes in the cell line, instructions on a method for screening an intestinal fibrosis treatment factor using this kit, for example, instructions, electronic recording media such as CD, DVD, etc. And the like.
- Example 1 Identification of stellate cell-like cells in the intestinal tract of Crohn's disease model mouse SAMP1 / Yit To examine whether cells corresponding to hepatic stellate cells are involved in fibrosis of Crohn's disease, SAMP1 / Yit, a mouse model of Crohn's disease It was used. SAMP1 / Yit mice are SAMP1 mice created by crossbreeding AKR / J mouse littermates in 24 generations. SAMP1 / Yit mice are naturally occurring model mice obtained by crossing mice with ulcers in their 20s or more between relatives.
- mice Most of the IBD model mice are those that cause colitis, and the SAMP1 / Yit mice having the above characteristics are considered to be the model mice closest to the pathology of Crohn's disease among the existing disease model animals (Pizarro et al. al., Trends Mol Med. 2003 May; 9 (5): 218-22).
- the ileal fibrosis site was examined by tissue immunostaining.
- the ileal tissue of SAMP1 / Yit mice 29 weeks old, provided by Yakult Central Laboratory
- the tissue was fixed with 30% neutral formalin for 24 hours and then embedded in paraffin to prepare a sliced section, which was used as a sample section.
- the sample sections were stained with Azan and the state of fibrosis was observed, accumulation of collagen fibers was observed between the cells of the thickened muscle layer (FIG. 1 (a)).
- immunohistochemical analysis using antibodies against hepatic stellate cell markers was performed on serial sections.
- Anti-vimentin antibodies Anti-vimentin, Abcam, clone RV202, cat. No. ab8978, label: Alexa Fluor 488), anti- ⁇ SMA antibody (Anti-Glial Fibrillary Acidic Protein, Dako, Polyclonal Rabbit, Code. , Label: DyLight 633) and anti-GFAP antibody (Anti- ⁇ -Smooth Muscle Actin, SIGMA, clone 1A4, cat. No. A2547, label: Cy3).
- vimentin (+) / ⁇ SMA ( ⁇ ) / GFAP ( ⁇ ) along the accumulated collagen fibers at the fibrotic lesion site in the ileal muscle layer.
- a large number of cells having the phenotype of FIG. 1 were observed (see arrows in FIGS. 1B to 1D).
- the presence of such cells was not observed in the ileal muscle layer of AKR / J mice, which are background mice. This result suggests that cells having the phenotype of quiescent hepatic stellate cell-like vimentin (+) / ⁇ SMA ( ⁇ ) / GFAP ( ⁇ ) are involved in fibrosis.
- Example 2 Establishment of stellate cell-like cell line from fibrotic small intestine tissue of SAMP1 / Yit mouse In vitro functional analysis of the cells observed in Example 1, and further examination of intestinal fibrosis treatment using it In order to carry out the test, stellate cell-like cells having the phenotype of vimentin (+) / ⁇ SMA (-) / GFAP (-) were isolated and cultured from the fibrotic small intestine tissue of SAMP1 / Yit mice, Established.
- the ileal tissue of a SAMP1 / Yit mouse was collected, cut into 1 mm lengths with scissors, and then 20 mL of an EDTA solution (4.5 mM EDTA solution in HBSS (pH 7.5), hereinafter the same). Soak in and shake gently. After standing at 4 ° C. for 15 minutes, the supernatant was removed and resuspended in fresh EDTA solution. After changing the EDTA solution 5 times, the ileal tissue piece was suspended in 10% FBS-containing DMEM, seeded in a 6-well culture dish, and cultured at 37 ° C. in 5% CO 2 .
- the immortalization gene SV40T was introduced by the retroviral vector pMFG-tsT-IRES-neo (Kawano et al., Blood. 2003 Jan 15; 101 (2): 532-40) to obtain the IC10_F2 cell line (The upper part of FIG. 2).
- the IC10_F2 cell line was subjected to limiting dilution and immunostaining with the above-mentioned anti- ⁇ SMA antibody, anti-GFAP antibody and anti-vimentin antibody, and cells having a phenotype of vimentin (+) / ⁇ SMA ( ⁇ ) / GFAP ( ⁇ )
- an intestine-derived astrocyte-like cell line IC10_F2_E9 having such a phenotype could be established (lower row in FIG. 2).
- RNA-to-cDNA Master Mix RNA-to-cDNA Master Mix
- PCR reagents were used LightCycler (R) 480 Probes Master ( Roche Applied Science, 4707494). Probes included in Universal ProbeLibrary Probes (Roche Applied Science) were used (Vimentin: Probe # 79, 4890220, ⁇ SMA: Probe # 11, 4685105, ADRP: Probe # 79, 4689020, LRAT: Probe # 79, 4689020 , LXR ⁇ : Probe # 106, 4692250).
- F forward primer
- R reverse primer
- F 5 ′ TGCGCCAGCAGTATGAA 3 ′ SEQ ID NO: 1
- R 5′GCTCCAGAGAGGTCCACAAA 3 ′ SEQ ID NO: 2
- ⁇ SMA F 5 ′ TCACCATTGGAAAACGAACG 3 ′
- R 5 ′ ATAGGTGGTTTCGTGGATGC 3 ′ SEQ ID NO: 4
- ADRP F 5 ′ CCTCAGCTCTCCCTGTTAGGC 3 ′ (SEQ ID NO: 5)
- R 5 ′ CACTACTGCTGCTGCCCATT 3 ′ SEQ ID NO: 6)
- LRAT F 5 ′ GAAGGTGGTCTCCAACAAGC 3 ′ (SEQ ID NO: 7)
- R 5 ′ TACTGTGTCCACACGGATGC 3 ′ SEQ ID NO: 8
- LXR ⁇ F 5 ′ GCTCTGCCTACATCGTG
- ADRP is a kind of PAT (perilipin, adipophilin, TIP47) protein that is localized on the lipid droplet membrane and is involved in the biosynthesis and metabolism of lipid droplets (Lee et al., J Cell Physiol. 2010 Jun; 223 (3): 648-57), LRAT is a retinol esterase, which is localized on the endoplasmic reticulum membrane in hepatic stellate cells and is thought to be involved in the storage of VA (Nagatsuma et al., Liver Int.
- LXR ⁇ is a nuclear receptor involved in lipid metabolism and anti-inflammation, and expression at the mRNA level in hepatic stellate cells has been observed (Beaven SW . Et al., Gastroenterology. 2011 Mar; 140 (3): 1052-62).
- IC10_F2_E9 showed 2.4-fold gene expression for ADRP, 27-fold for LRAT, and 2.4-fold for LXR ⁇ as compared to IC10_F2, which is the parent strain (FIG. 3). This result indicates that IC10_F2_E9 has the characteristics of stellate cells.
- siRNA-containing VA-binding liposomes (1) siRNA As siRNA targeting the base sequence of HSP47 (mouse, GenBank Accession No. X60676), which is a common molecular chaperone of collagen (types I to IV), the following was used.
- B UAGUUGUACAGGGCCUGUCC (antisense strand siRNA sequence, SEQ ID NO: 12)
- siRNArandom (sometimes referred to as siRNA scramble (abbreviation: scr)
- C CCUCCAAACCAAUUGGAGG (sense strand siRNA, SEQ ID NO: 13)
- D CCUCCAAAUUGGUUUGGAGG (antisense strand siRNA, SEQ ID NO: 14)
- VA-lip-siRNA As cationic lipids, O, O′-ditetradecanoyl-N- ( ⁇ -trimethylammonioacetyl) diethanolamine chloride (DC-6-14), cholesterol and dioleylphosphatidyl Cationic liposomes (LipoTrust) containing ethanolamine (DOPE) at a molar ratio of 4: 3: 3 were purchased from Hokkaido System Science (Sapporo, Japan). Liposomes were prepared at a concentration of 1 mM (DC-6-14) by adding double-distilled water (DDW) under stirring conditions to the lyophilized lipid mixture prior to use.
- DC-6-14 O, O′-ditetradecanoyl-N- ( ⁇ -trimethylammonioacetyl) diethanolamine chloride (DC-6-14), cholesterol and dioleylphosphatidyl Cationic liposomes (LipoTrust) containing ethanolamine (DOPE) at a molar ratio of 4: 3: 3 were
- VA-bound liposomes 20 nmol of vitamin A (retinol, Sigma, USA) dissolved in DMSO and a liposome suspension (20 nmol as DC-6-14) were stirred at 25 ° C. in a 1.5 ml tube. Mixed.
- VA-bound liposomes carrying siRNA HSP47 (VA-lip-siRNA HSP47)
- siRNA HSP47 solution (3 nmol / ml in DDW) was added to the retinol-bound liposome solution at room temperature with stirring.
- the molar ratio of siRNA to DC-6-14 was 1: 400.
- VA-lip-siRNA was reconstituted with phosphate buffered saline (PBS).
- Example 4 Introduction of siRNA into IC_F2_E9 cells and suppression of HSP47 expression siRNA obtained in Example 3 in a 6-well multi-dish (N140675, Nunc TM ) containing 1 ⁇ 10 4 IC_F2_E9 cells in DMEM containing 10% FBS After adding 100 ⁇ l of the VA-bound liposome containing the solution and incubating at 37 ° C. and 5% CO 2 for 1 hour, the medium was changed, and incubation was further performed at 37 ° C. and 5% CO 2 for 48 hours. Thereafter, the cells were collected, and total RNA was prepared in the same manner as in Example 2.
- results shown in FIG. 4 indicate that the HSP47 gene is expressed in IC10_F2_E9 cells and that the expression of the gene was suppressed only by siRNA-containing VA-bound liposomes.
- siRNA acts intracellularly
- this result indicates that IC10_F2_E9 cells have the ability to produce collagen and that retinoids dramatically uptake the substance into IC10_F2_E9 cells as extracellular matrix-producing cells in the intestine. It shows that it acts as a targeting agent that promotes.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Cell Biology (AREA)
- General Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Dispersion Chemistry (AREA)
- Biophysics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Plant Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Toxicology (AREA)
- Tropical Medicine & Parasitology (AREA)
Abstract
Description
ビタミンAを含む担体が、肝星細胞(特許文献3、特許文献4)や肝星細胞株(特許文献3、特許文献5)、肺(特許文献6)および骨髄(特許文献7)における細胞外マトリックス産生細胞に薬物を送達することや、同担体にHSP47に対するsiRNAを担持させた組成物が肝線維症(特許文献3)、肺線維症(特許文献6)および骨髄線維症(特許文献7)を改善させることは知られていたが、腸管における細胞外マトリックス産生細胞や、腸管線維症との関係についてはこれまで全く知られていなかった。
(1)レチノイドを、腸管における細胞外マトリックス産生細胞への標的化剤として含む、腸管における細胞外マトリックス産生細胞への物質送達用担体。
(2)レチノイドがレチノールを含む、上記(1)に記載の担体。
(3)レチノイドと、レチノイド以外の担体構成要素とを含み、レチノイドと、レチノイド以外の担体構成要素とのモル比が8:1~1:4である、上記(1)または(2)に記載の担体。
(4)上記(1)~(3)のいずれか1つに記載の担体と、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物とを含む、腸管線維症処置用医薬組成物。
(5)上記(1)~(3)のいずれか1つに記載の担体と、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物とを含む、線維化腸管組織から正常腸管組織を再生するための医薬組成物。
(6)腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物が、細胞外マトリックス成分の産生・分泌を阻害する物質、細胞増殖抑制物質、アポトーシス誘導物質、TIMP阻害物質およびα1アンチトリプシン阻害物質からなる群から選択される、上記(4)または(5)に記載の医薬組成物。
(7)細胞外マトリックス成分の産生・分泌を阻害する物質が、HSP47の阻害剤である、上記(6)に記載の医薬組成物。
(8)用時調製形態である、上記(4)~(7)のいずれか1つに記載の医薬組成物。
(10)レチノイドを腸管における細胞外マトリックス産生細胞への標的化剤として配合する工程を含む、腸管における細胞外マトリックス産生細胞への物質送達用担体の製造方法。
(11)レチノイドを腸管における細胞外マトリックス産生細胞への標的化剤として、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物を有効成分としてそれぞれ配合する工程を含む、腸管線維症処置用医薬組成物または線維化腸管組織から正常腸管組織を再生するための医薬組成物の製造方法。
(12)腸管線維症罹患対象から採取した線維化腸組織に由来する、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する、腸管における細胞外マトリックス産生細胞株。
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含む、前記方法。
(14)腸管における細胞外マトリックス産生細胞株を作製する方法であって、
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含み、かつ、工程(i)または(ii)の後に、細胞を不死化する工程を含む、前記方法。
(15)腸管線維症処置因子をスクリーニングする方法であって、
(i)上記(12)に記載の細胞株と、被験因子とを共存させる工程、および
(ii)被験因子との共存による細胞株の変化を検出する工程
を含む、前記方法。
(16)上記(12)に記載の細胞株を含む、腸管線維症処置因子をスクリーニングするためのキット。
したがって、レチノイドを標的化剤として含む本発明の担体により、有効成分を作用部位、さらには標的細胞に効率的に送達できるため、これまで根本的な治療方法がなかった腸管線維症の治癒、進行の抑制または発症の予防が可能となり、ヒト医療および獣医療への貢献は極めて大きい。
また、本発明の担体は、任意の薬剤(例えば、既存の腸管線維症治療薬)と組み合わせてその作用効率を高めることができるため、製剤的な応用範囲が広く、効果的な処置剤の製造を簡便に行うことができるという利点もある。
さらに、本発明の細胞株は、腸管線維症治療薬のスクリーニングや、腸管線維症のメカニズムの解明などに利用することができるため、腸管線維症の新たな処置剤や処置方法の開発に資するものである。
レチノイドのシス-トランスを含む異性体全ては、本発明の範囲内に入る。レチノイドはまた、1または2以上の置換基で置換されることもある。本発明におけるレチノイドは、単離された状態のものはもちろんのこと、これを溶解または保持することができる媒体に溶解または混合した状態のレチノイドをも含む。
このような成分としては、脂質、例えば、グリセロリン脂質などのリン脂質、スフィンゴミエリンなどのスフィンゴ脂質、コレステロールなどのステロール、大豆油、ケシ油などの植物油、鉱油、卵黄レシチンなどのレシチン類、ポリマー等が挙げられるが、これらに限定されない。このうち、リポソームを構成し得るもの、例えば、レシチンなどの天然リン脂質、ジミリストイルホスファチジルコリン(DMPC)、ジパルミトイルホスファチジルコリン(DPPC)、ジステアロイルホスファチジルコリン(DSPC)などの半合成リン脂質、ジオレイルホスファチジルエタノールアミン(DOPE)、ジラウロイルホスファチジルコリン(DLPC)、コレステロールなどが好ましい。
本発明における担体は、特定の3次元構造を有してもよい。かかる構造としては、限定されずに、直鎖状または分枝状の線状構造、フィルム状構造、球状構造などが挙げられる。したがって、担体は、限定されずに、デンドリマー、デンドロン、ミセル、リポソーム、エマルジョン、微小球、ナノ小球などの任意の3次元形態を有してもよい。また、本発明における担体の一態様は、標的化剤(標的化分子、標的化部分などを包含する)によるアクティブターゲティングが可能な担体である。3次元形態を有する担体やアクティブターゲティングが可能な担体は当該技術分野においてよく知られている(例えば、Marcucci and Lefoulon, Drug Discov Today. 2004 Mar 1;9(5):219-28、Torchilin, Eur J Pharm Sci. 2000 Oct;11 Suppl 2:S81-91など参照)。
TIMP(例えば、TIMP1、TIMP2、TIMP3など)の阻害物質としては、限定することなく、例えば、TIMPに対する抗体などのTIMP活性阻害物質、TIMPに対するRNAi分子、リボザイム、アンチセンス核酸などのTIMP産生阻害物質、これらを発現するベクター、およびこれらで形質転換された細胞等が挙げられる。
α1アンチトリプシン阻害物質としては、限定することなく、例えば、α1アンチトリプシンに対する抗体などのα1アンチトリプシン活性阻害物質、α1アンチトリプシンに対するRNAi分子、リボザイム、アンチセンス核酸などのα1アンチトリプシン産生阻害物質、これらを発現するベクター、およびこれらで形質転換された細胞等が挙げられる。
本発明の担体は、上記薬物の1種または2種以上を送達することができる。
RNAi分子の設計は、当業者であれば、標的とする遺伝子のメッセンジャーRNA配列および既知のRNAi分子の配列を参照することにより、一般的なテキスト(実験医学別冊 改訂RNAi実験プロトコール 2004年 羊土社、RNAi実験なるほどQ&A 2006年 羊土社)の教示に従って適宜行なうことができる。
また、本発明における核酸は、RNA、DNA、PNA、またはこれらの複合物を含む。
本発明の一態様において、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物としては、HSP47の阻害剤、例えば、HSP47に対するsiRNAなどが挙げられる。
本発明における腸管線維症は、腸壁における瘢痕組織の過剰な蓄積を特徴とする病態を指し、慢性的な腸管の炎症、例えば、慢性化した炎症性腸疾患(薬剤性腸炎、感染性腸炎などの原因が特定される特異性炎症性腸疾患、および、クローン病、潰瘍性大腸炎などの原因不明の非特異性炎症性腸疾患を含む)や、放射線照射による組織損傷、手術や外傷に伴う腸管癒着などに続発するものを含む。
例えば、経口投与に適した剤形としては、限定することなく、散剤、顆粒剤、錠剤、カプセル剤、液剤、懸濁剤、乳剤、ゲル剤、シロップ剤などが挙げられ、また非経口投与に適した剤形としては、溶液性注射剤、懸濁性注射剤、乳濁性注射剤、用時調製型注射剤などの注射剤が挙げられる。非経口投与用製剤は、水性または非水性の等張性無菌溶液または懸濁液の形態であることができる。
投与経路としては、経口および非経口の両方を包含する種々の経路、例えば、経口、静脈内、筋肉内、皮下、局所、肺内、気道内、気管内、気管支内、経鼻、経胃、経腸、直腸内、動脈内、門脈内、心室内、骨髄内、リンパ節内、リンパ管内、脳内、髄液腔内、脳室内、経粘膜、経皮、鼻内、腹腔内および子宮内等の経路が含まれる。
投与頻度は、用いる組成物の性状や、上記のような対象の条件によって異なるが、例えば、1日多数回(すなわち1日2、3、4回または5回以上)、1日1回、数日毎(すなわち2、3、4、5、6、7日毎など)、1週間に数回(例えば、1週間に2、3、4回など)、1週間毎、数週間毎(すなわち2、3、4週間毎など)であってもよい。
また、用語「処置」は、疾患の治癒、一時的寛解または予防などを目的とする医学的に許容される全ての種類の予防的および/または治療的介入を包含するものとする。例えば、「処置」の用語は、腸管線維症の進行の遅延または停止、病変の退縮または消失、腸管線維症発症の予防または再発の防止などを含む、種々の目的の医学的に許容される介入を包含する。
腸管線維症罹患対象としては、限定されず、例えば、腸管線維症と診断された対象や、腸管線維症のモデル動物が挙げられる。腸管線維症の診断は、病歴、バリウム造影などによる腸管狭窄の確認、生検試料の病理組織検査などにより行われる。線維化腸組織の採取は、外科手術や、内視鏡などを用いた生検などの任意の可能な手法によって行うことができる。表現型は、限定されずに、例えば、抗ビメンチン抗体、抗αSMA抗体および抗GFAP抗体による免疫染色や、ビメンチン、αSMAおよびGFAP遺伝子の発現分析などにより確認することができる。上記各抗体は市販のものを使用してもよいし、動物を各タンパク質で免疫化するなどの既知の手法で新たに作製してもよい。上記細胞株は、HSP47またはそのホモログ(例えばgp46)、コラーゲン、VA貯蔵関連遺伝子、例えば、ADRP、LRATおよび/またはLXRβ等を発現していてもよい。また、上記細胞株は、in vitroで培養してもαSMAおよびGFAPは陽性とならない。上記細胞株はまた、不死化遺伝子(例えば、SV40T、テロメラーゼ遺伝子等)の導入などにより不死化されていてもよい。
上記細胞株は、間葉系細胞のための通常の培養条件で培養することができる。かかる条件としては、限定されず、例えば、10%FBS含有DMEMでの、5%CO2、37℃における培養が挙げられる。
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含む、腸管における細胞外マトリックス産生細胞を単離する方法に関する。
線維化腸組織からの細胞の取得は、限定されずに、例えば、任意に細切した組織を培養し、そこから遊走する細胞を取得してもよいし、組織をタンパク質分解酵素(例えば、コラゲナーゼ、プロテアーゼなど)で処理し、そこから解離した細胞を取得してもよい。
細胞の選択は、限定されずに、例えば、細胞を限界希釈法などで単細胞に分離し、各クローンの表現型を免疫染色や遺伝子発現解析などで確認することにり行ってもよいし、抗ビメンチン抗体、抗αSMA抗体および/または抗GFAP抗体で標識した単細胞懸濁液を、セルソーターなどで処理することにより行ってもよい。
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含み、かつ、工程(i)または(ii)の後に、細胞を不死化する工程を含む方法に関する。
細胞の不死化は、不死化遺伝子(例えば、SV40T、テロメラーゼ遺伝子等)の導入などにより行うことができる。不死化は、所望の表現型の細胞を選択する前に行っても、選択した後に行ってもよい。細胞を不死化する工程以外の構成については、腸管における細胞外マトリックス産生細胞を単離する方法について上記したとおりである。
(i)上記の腸管線維症罹患対象から採取した線維化腸組織に由来する、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する、腸管における細胞外マトリックス産生細胞株と、被験因子とを共存させる工程、および
(ii)被験因子との共存による細胞株の変化を検出する工程
を含む、腸管線維症処置因子をスクリーニングする方法に関する。
本発明において、被験因子は、化合物などの物質のほか、熱、電磁波(例えば、電波、光線、X線、ガンマ線など)、圧力、pHなどの種々の因子を含む。細胞株と被験因子とを「共存させる」とは、細胞株と被験因子とを同一の媒体中に置くことを意味し、両者が互いに接触することを必ずしも要しない。細胞株と被験因子との共存は、例えば、限定されずに、細胞株と被験因子とを同一の容器に入れることなどを含む。細胞株と被験因子との共存はin vivoで行っても、in vitroで行ってもよい。
被験因子との共存による細胞株の変化としては、限定されずに、例えば、細胞株の活性の抑制または亢進(例えば、遺伝子発現や物質産生の抑制または亢進)、細胞株の増殖の抑制または増強などが挙げられる。したがって、例えば、被験因子との共存により細胞株の増殖が抑制されることや、細胞株の活性が抑制されることは、当該被験因子が腸管線維症処置因子であることを示す。
例1 クローン病モデルマウスSAMP1/Yitの腸管における星細胞様細胞の同定
クローン病の線維化に肝星細胞に相当する細胞が関与するのかを検討するために、クローン病モデルマウスであるSAMP1/Yitを使用した。SAMP1/YitマウスはAKR/Jマウスの同腹仔を24代交配して作出されたSAMP1マウスのうち、皮膚に潰瘍を持つマウスをさらに近親間で20代以上交配して得られた自然発症モデルマウスで、20週齢までに自発的に回腸炎を引き起こし(Matsumoto et. al., Gut. 1998 Jul;43(1):71-8)、病理組織的に、(i)クローン病と類似した炎症が回腸終末に好発する、(ii)病変が非連続かつ全層性にわたる、(iii)筋層の肥厚、陰窩の過形成、絨毛の萎縮、粘膜固有層および粘膜下層への炎症細胞浸潤、パネート細胞および杯細胞の過形成、肉芽腫、陰窩膿瘍が観察される、等の特徴を有する(Kosiewicz et al., J Clin Invest. 2001 Mar;107(6):695-702)。IBDモデルマウスのほとんどが大腸炎を生じるモデルであるところ、上記特徴を有するSAMP1/Yitマウスは、既存の疾患モデル動物の中で最もクローン病の病態に近いモデルマウスと考えられている(Pizarro et al., Trends Mol Med. 2003 May;9(5):218-22)。
例1で観察された細胞をin vitroで機能解析し、さらにはそれを利用して腸管線維症治療法などの検討を行うために、SAMP1/Yitマウスの線維化小腸組織からビメンチン(+)/αSMA(-)/GFAP(-)の表現型を有する星細胞様細胞を分離・培養し、星細胞様細胞株を樹立した。
まず、SAMP1/Yitマウス(21週齢)の回腸組織を採取し、ハサミで1mm長程度に細断した後、EDTA溶液(HBSS(pH7.5)中の4.5mM EDTA溶液、以下同じ)20mLに浸し、軽く震盪した。4℃で15分間静置後、上清を除去し、新鮮なEDTA溶液に再懸濁した。EDTA溶液を5回交換した後、回腸組織片を10%FBS含有DMEMに懸濁し、6ウェルカルチャーディッシュに播種し、5%CO2中37℃で培養した。培養開始から5日目には間葉系細胞様形態をした細胞群がディッシュに付着し増殖を開始し始めた。この時に、レトロウィルスベクターpMFG-tsT-IRES-neo(Kawano et al., Blood. 2003 Jan 15;101(2):532-40)により不死化遺伝子SV40Tの導入を行い、IC10_F2細胞系を得た(図2上段)。その後、IC10_F2細胞系を限界希釈法と、上記抗αSMA抗体、抗GFAP抗体および抗ビメンチン抗体による免疫染色法で、ビメンチン(+)/αSMA(-)/GFAP(-)の表現型を有する細胞のクローニングを試みた結果、かかる表現型を有する腸管由来星細胞様細胞株IC10_F2_E9を樹立することができた(図2下段)。
ビメンチン:
F 5’TGCGCCAGCAGTATGAAA 3’(配列番号1)
R 5’GCCTCAGAGAGGTCAGCAAA 3’(配列番号2)
αSMA:
F 5’TCACCATTGGAAACGAACG 3’(配列番号3)
R 5’ATAGGTGGTTTCGTGGATGC 3’(配列番号4)
ADRP:
F 5’CCTCAGCTCTCCTGTTAGGC 3’(配列番号5)
R 5’CACTACTGCTGCTGCCATTT 3’(配列番号6)
LRAT:
F 5’GAAGGTGGTCTCCAACAAGC 3’(配列番号7)
R 5’TACTGTGTCCACACGGATGC 3’(配列番号8)
LXRβ:
F 5’GCTCTGCCTACATCGTGGTC 3’(配列番号9)
R 5’CTCATGGCCCAGCATCTT 3’(配列番号10)
(1)siRNA
コラーゲン(I~IV型)の共通分子シャペロンであるHSP47(マウス、GenBank Accession No. X60676)の塩基配列を標的とするsiRNAは、以下のものを用いた。
A:GGACAGGCCUGUACAACUA(マウスHSP47の塩基配列上の第969塩基から始まるセンス鎖siRNA配列、配列番号11)
B:UAGUUGUACAGGCCUGUCC(アンチセンス鎖siRNA配列、配列番号12)
C:CCUCCAAACCAAUUGGAGG(センス鎖siRNA、配列番号13)
D:CCUCCAAUUGGUUUGGAGG(アンチセンス鎖siRNA、配列番号14)
カチオン性脂質として、O,O’-ジテトラデカノイル-N-(α-トリメチルアンモニオアセチル)ジエタノールアミンクロライド(DC-6-14)、コレステロールおよびジオレイルホスファチジルエタノールアミン(DOPE)を4:3:3のモル比で含むカチオン性リポソーム(LipoTrust)を北海道システム・サイエンス(Sapporo, Japan)から購入した。リポソームは、使用前に、凍結乾燥した脂質混合物に攪拌条件下で再蒸留水(DDW)を添加することによって、1mM(DC-6-14)の濃度で調製した。VA結合リポソームを調製するため、DMSOに溶解した20nmolのビタミンA(レチノール、Sigma, USA)をリポソーム懸濁液(DC-6-14として20nmol)と、1.5mlチューブ中で攪拌しながら25℃で混合した。siRNA HSP47を担持するVA結合リポソーム(VA-lip-siRNA HSP47)を調製するため、siRNA HSP47溶液(DDW中に3nmol/ml)を、レチノール結合リポソーム溶液に攪拌しながら室温下で添加した。siRNAとDC-6-14とのモル比は1:400であった。in vitroでの使用に望ましい用量を得るため、VA-lip-siRNAをリン酸緩衝生理食塩水(PBS)で再構成した。
10%FBS含有DMEM中にIC_F2_E9細胞を1×104個/ウェルで含む6ウェルマルチディッシュ(N140675, NuncTM)に例3で得たsiRNA含有VA結合リポソームを100μl添加し、37℃、CO25%で1時間インキュベートした後、培地を交換し、37℃、CO25%でさらに48時間インキュベートした。その後、細胞を回収し、例2と同様の手法で全RNAを調製した。得られた全RNAに逆転写酵素を反応させてcDNAを作製した後、リアルタイムPCRにて、HSP47の発現抑制を評価した。用いたプライマーは以下のとおりである。
F:5’GAAGGCTGTCGCCATCTC 3’(配列番号15)
R:5’CCCAGTCCTGCCAGATGT 3’(配列番号16)
Claims (16)
- レチノイドを、腸管における細胞外マトリックス産生細胞への標的化剤として含む、腸管における細胞外マトリックス産生細胞への物質送達用担体。
- レチノイドがレチノールを含む、請求項1に記載の担体。
- レチノイドと、レチノイド以外の担体構成要素とを含み、レチノイドと、レチノイド以外の担体構成要素とのモル比が8:1~1:4である、請求項1または2に記載の担体。
- 請求項1~3のいずれか一項に記載の担体と、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物とを含む、腸管線維症処置用医薬組成物。
- 請求項1~3のいずれか一項に記載の担体と、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物とを含む、線維化腸管組織から正常腸管組織を再生するための医薬組成物。
- 腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物が、細胞外マトリックス成分の産生・分泌を阻害する物質、細胞増殖抑制物質、アポトーシス誘導物質、TIMP阻害物質およびα1アンチトリプシン阻害物質からなる群から選択される、請求項4または5に記載の医薬組成物。
- 細胞外マトリックス成分の産生・分泌を阻害する物質が、HSP47の阻害剤である、請求項6に記載の医薬組成物。
- 用時調製形態である、請求項4~7のいずれか一項に記載の医薬組成物。
- 腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物、レチノイド、ならびに、必要に応じてレチノイド以外の担体構成物質を、単独でまたは組み合わせて含む1つまたはそれ以上の容器を含む、請求項4~8のいずれか一項に記載の医薬組成物の調製キット。
- レチノイドを腸管における細胞外マトリックス産生細胞への標的化剤として配合する工程を含む、腸管における細胞外マトリックス産生細胞への物質送達用担体の製造方法。
- レチノイドを腸管における細胞外マトリックス産生細胞への標的化剤として、腸管における細胞外マトリックス産生細胞の活性または増殖を制御する薬物を有効成分としてそれぞれ配合する工程を含む、腸管線維症処置用医薬組成物または線維化腸管組織から正常腸管組織を再生するための医薬組成物の製造方法。
- 腸管線維症罹患対象から採取した線維化腸組織に由来する、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する、腸管における細胞外マトリックス産生細胞株。
- 腸管における細胞外マトリックス産生細胞を単離する方法であって、
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含む、前記方法。 - 腸管における細胞外マトリックス産生細胞株を作製する方法であって、
(i)腸管線維症罹患対象から採取した線維化腸組織から細胞を得る工程、および
(ii)(i)で得た細胞から、ビメンチン陽性、αSMA陰性かつGFAP陰性の表現型を有する細胞を選択する工程、
を含み、かつ、工程(i)または(ii)の後に、細胞を不死化する工程を含む、前記方法。 - 腸管線維症処置因子をスクリーニングする方法であって、
(i)請求項12に記載の細胞株と、被験因子とを共存させる工程、および
(ii)被験因子との共存による細胞株の変化を検出する工程
を含む、前記方法。 - 請求項12に記載の細胞株を含む、腸管線維症処置因子をスクリーニングするためのキット。
Priority Applications (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/359,079 US20140323550A1 (en) | 2011-11-18 | 2012-11-16 | Intestinal fibrosis treatment agent |
| EP12849808.6A EP2781225B1 (en) | 2011-11-18 | 2012-11-16 | Intestinal fibrosis treatment agent |
| CA2856016A CA2856016C (en) | 2011-11-18 | 2012-11-16 | Agent for treating fibrosis of the intestine |
| ES12849808T ES2754054T3 (es) | 2011-11-18 | 2012-11-16 | Agente de tratamiento de la fibrosis intestinal |
| IN908MUN2014 IN2014MN00908A (ja) | 2011-11-18 | 2012-11-16 | |
| KR1020147016650A KR102059054B1 (ko) | 2011-11-18 | 2012-11-16 | 장 섬유증 치료제 |
| CN201280054464.XA CN103917248A (zh) | 2011-11-18 | 2012-11-16 | 肠纤维化处理剂 |
| RU2014124430A RU2637372C2 (ru) | 2011-11-18 | 2012-11-16 | Средство для лечения фиброза кишечника |
| AU2012337691A AU2012337691B2 (en) | 2011-11-18 | 2012-11-16 | Intestinal fibrosis treatment agent |
| US15/062,736 US20160175446A1 (en) | 2009-12-09 | 2016-03-07 | Agent for treating fibrosis of the intestine |
| US15/645,382 US20170314021A1 (en) | 2009-12-09 | 2017-07-10 | Agent for treating fibrosis of the intestine |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011-253085 | 2011-11-18 | ||
| JP2011253085 | 2011-11-18 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US14/924,284 Continuation-In-Part US10093923B2 (en) | 2009-12-09 | 2015-10-27 | Modulation of HSP47 expression |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US14/359,079 A-371-Of-International US20140323550A1 (en) | 2011-11-18 | 2012-11-16 | Intestinal fibrosis treatment agent |
| US15/062,736 Continuation-In-Part US20160175446A1 (en) | 2009-12-09 | 2016-03-07 | Agent for treating fibrosis of the intestine |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013073667A1 true WO2013073667A1 (ja) | 2013-05-23 |
Family
ID=48429720
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/079783 WO2013073667A1 (ja) | 2009-12-09 | 2012-11-16 | 腸管線維症処置剤 |
Country Status (12)
| Country | Link |
|---|---|
| US (3) | US20140323550A1 (ja) |
| EP (1) | EP2781225B1 (ja) |
| JP (1) | JP5873419B2 (ja) |
| KR (1) | KR102059054B1 (ja) |
| CN (1) | CN103917248A (ja) |
| AU (1) | AU2012337691B2 (ja) |
| CA (1) | CA2856016C (ja) |
| ES (1) | ES2754054T3 (ja) |
| IN (1) | IN2014MN00908A (ja) |
| RU (1) | RU2637372C2 (ja) |
| TW (1) | TWI627965B (ja) |
| WO (1) | WO2013073667A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9976142B2 (en) | 2014-04-02 | 2018-05-22 | Nitto Denko Corporation | Targeting molecule and a use thereof |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009221164A (ja) | 2008-03-17 | 2009-10-01 | Nitto Denko Corp | 肺線維症処置剤 |
| US9572886B2 (en) | 2005-12-22 | 2017-02-21 | Nitto Denko Corporation | Agent for treating myelofibrosis |
| JP5950428B2 (ja) | 2010-08-05 | 2016-07-13 | 日東電工株式会社 | 線維化組織から正常組織を再生するための組成物 |
| JP6340162B2 (ja) | 2012-12-20 | 2018-06-06 | 日東電工株式会社 | アポトーシス誘導剤 |
| CA2943733C (en) | 2014-04-07 | 2022-03-01 | Nitto Denko Corporation | Polymer-based hydrotropes for hydrophobic drug delivery |
| WO2015184248A1 (en) * | 2014-05-30 | 2015-12-03 | Concert Pharmaceuticals, Inc. | Methods of treating fibrotic diseases |
| JP6833456B2 (ja) * | 2016-11-02 | 2021-02-24 | 日東電工株式会社 | 皮膚線維症処置剤 |
| KR102404883B1 (ko) | 2020-11-30 | 2022-06-07 | (주)이노보테라퓨틱스 | 벤즈브로마론을 포함하는 켈로이드 또는 비대흉터 예방 또는 치료용 약학 조성물 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006068232A1 (ja) | 2004-12-22 | 2006-06-29 | Sapporo Medical University | 線維化抑制のための薬物担体および薬物担体キット |
| WO2008022807A2 (en) | 2006-08-23 | 2008-02-28 | Bayer Schering Pharma Aktiengesellschaft | Lipoxin a4 analogs for the treatment and prevention of intestinal fibrosis |
| WO2009036368A2 (en) | 2007-09-14 | 2009-03-19 | Nitto Denko Corporation | Drug carriers |
| WO2009084232A1 (ja) | 2007-12-27 | 2009-07-09 | Stelic Institute Of Regenerative Medicine, Stelic Institute & Co. | 糖鎖関連遺伝子、およびその利用 |
| WO2009116257A1 (ja) | 2008-03-17 | 2009-09-24 | 日東電工株式会社 | 肺線維症処置剤 |
| WO2010014117A1 (en) | 2008-07-30 | 2010-02-04 | Nitto Denko Corporation | Drug carriers |
| WO2010026766A1 (ja) | 2008-09-05 | 2010-03-11 | 日東電工株式会社 | 骨髄線維症処置剤 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2286807A3 (en) * | 2005-09-09 | 2012-08-29 | Kemphys Ltd. | Medicament for preventive and/or therapeutic treatment of adhesion of bowel |
| DK1951674T3 (da) * | 2005-10-26 | 2012-01-02 | Merck Serono Sa | Sulfonamidderivater og anvendelse deraf til modulation af metalloproteinaser |
| TWI407971B (zh) * | 2007-03-30 | 2013-09-11 | Nitto Denko Corp | Cancer cells and tumor-related fibroblasts |
| DK2509991T3 (en) * | 2009-12-09 | 2015-12-21 | Nitto Denko Corp | MODULATION OF HSP47 EXPRESSION |
| TWI658830B (zh) * | 2011-06-08 | 2019-05-11 | 日東電工股份有限公司 | Hsp47表現調控強化用類視色素脂質體 |
-
2012
- 2012-11-16 CN CN201280054464.XA patent/CN103917248A/zh active Pending
- 2012-11-16 AU AU2012337691A patent/AU2012337691B2/en not_active Ceased
- 2012-11-16 EP EP12849808.6A patent/EP2781225B1/en active Active
- 2012-11-16 TW TW101142920A patent/TWI627965B/zh not_active IP Right Cessation
- 2012-11-16 RU RU2014124430A patent/RU2637372C2/ru active
- 2012-11-16 US US14/359,079 patent/US20140323550A1/en not_active Abandoned
- 2012-11-16 CA CA2856016A patent/CA2856016C/en active Active
- 2012-11-16 JP JP2012252167A patent/JP5873419B2/ja active Active
- 2012-11-16 WO PCT/JP2012/079783 patent/WO2013073667A1/ja active Application Filing
- 2012-11-16 ES ES12849808T patent/ES2754054T3/es active Active
- 2012-11-16 KR KR1020147016650A patent/KR102059054B1/ko active IP Right Grant
- 2012-11-16 IN IN908MUN2014 patent/IN2014MN00908A/en unknown
-
2016
- 2016-03-07 US US15/062,736 patent/US20160175446A1/en not_active Abandoned
-
2017
- 2017-07-10 US US15/645,382 patent/US20170314021A1/en not_active Abandoned
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006068232A1 (ja) | 2004-12-22 | 2006-06-29 | Sapporo Medical University | 線維化抑制のための薬物担体および薬物担体キット |
| WO2008022807A2 (en) | 2006-08-23 | 2008-02-28 | Bayer Schering Pharma Aktiengesellschaft | Lipoxin a4 analogs for the treatment and prevention of intestinal fibrosis |
| WO2009036368A2 (en) | 2007-09-14 | 2009-03-19 | Nitto Denko Corporation | Drug carriers |
| JP2010539245A (ja) * | 2007-09-14 | 2010-12-16 | 日東電工株式会社 | 薬物担体 |
| WO2009084232A1 (ja) | 2007-12-27 | 2009-07-09 | Stelic Institute Of Regenerative Medicine, Stelic Institute & Co. | 糖鎖関連遺伝子、およびその利用 |
| WO2009116257A1 (ja) | 2008-03-17 | 2009-09-24 | 日東電工株式会社 | 肺線維症処置剤 |
| JP2009221164A (ja) * | 2008-03-17 | 2009-10-01 | Nitto Denko Corp | 肺線維症処置剤 |
| WO2010014117A1 (en) | 2008-07-30 | 2010-02-04 | Nitto Denko Corporation | Drug carriers |
| WO2010026766A1 (ja) | 2008-09-05 | 2010-03-11 | 日東電工株式会社 | 骨髄線維症処置剤 |
| JP2010059124A (ja) * | 2008-09-05 | 2010-03-18 | Nitto Denko Corp | 骨髄線維症処置剤 |
Non-Patent Citations (31)
| Title |
|---|
| "Experimental Medicine Special", 2004, YODOSHA |
| "RNAi Experimental Frequently Asked Questions", 2006, YODOSHA |
| "RNAi Experimental Protocol", 2004, YODOSHA, article "Experimental Medicine Special Edition" |
| BEAVEN SW. ET AL., GASTROENTEROLOGY, vol. 140, no. 3, March 2011 (2011-03-01), pages 1052 - 62 |
| G. P. MOSS: "Biochemical Nomenclature and Related Documents", 1992, PORTLAND PRESS, pages: 247 - 251 |
| HAYDONT ET AL., CLIN CANCER RES., vol. 13, 15 September 2007 (2007-09-15), pages 5331 - 40 |
| HIROSHI NAGANUMA ET AL.: "Shocho Kanmaku yori Hassei shi, Shinkeikei eno Bunka o Shimeshita Akusei Ichokangai Kanshitsu Shuyo no Ichirei", SENDAI SHIRITSU BYOIN IGAKU ZASSHI, vol. 27, 25 June 2007 (2007-06-25), pages 51 - 57, XP008172822, Retrieved from the Internet <URL:http://www.hospital.city.sendai.jp/pdf/pdf-gan09.pdf> * |
| HYOJ; YAKUZAIGAKU ET AL.: "Standard Pharmaceutics", 2003, NANKODO |
| INOUE ET AL., BIOL PHARM BULL, vol. 34, no. 11, 2011, pages 1659 - 65 |
| KAWANO ET AL., BLOOD, vol. 101, no. 2, 15 January 2003 (2003-01-15), pages 532 - 40 |
| KIDD, M. ET AL.: "CTGF, intestinal stellate cells and carcinoid fibrogenesis", WORLD J GASTROENTEROL, vol. 13, no. 39, 2007, pages 5208 - 16, XP055144306 * |
| KOJI KUBOTA ET AL.: "A Case of Gastrointestinal Stromal Tumor of the Mesentery", JAPANESE JOURNAL OF GASTROENTEROLOGICAL SURGERY, vol. 41, no. 4, 1 April 2008 (2008-04-01), pages 435 - 440, XP055144318, Retrieved from the Internet <URL:http://journal.jsgs.or.jp/pdf/041040435.pdf> * |
| KOSIEWICZ ET AL., J CLIN INVEST., vol. 107, no. 6, March 2001 (2001-03-01), pages 695 - 702 |
| LEE ET AL., J CELL PHYSIOL., vol. 223, no. 3, June 2010 (2010-06-01), pages 648 - 57 |
| MA ET AL., INFLAMM BOWEL DIS., vol. 16, no. 6, June 2010 (2010-06-01), pages 1040 - 50 |
| MARCUCCI; LEFOULON, DRUG DISCOV TODAY, vol. 9, no. 5, 1 March 2004 (2004-03-01), pages 219 - 28 |
| MATSUMOTO, GUT, vol. 43, no. 1, July 1998 (1998-07-01), pages 71 - 8 |
| NAGATSUMA ET AL., LIVER INT., vol. 29, no. 1, January 2009 (2009-01-01), pages 47 - 54 |
| PETERSON ET AL., EUR J PHARMACOL., vol. 662, no. 1-3, 15 July 2011 (2011-07-15), pages 47 - 54 |
| PIZARRO ET AL., TRENDS MOL MED., vol. 9, no. 5, May 2003 (2003-05-01), pages 218 - 22 |
| RIEDER; FIOCCHI, NAT REV GASTROENTEROL HEPATOL., vol. 6, no. 4, April 2009 (2009-04-01), pages 228 - 35 |
| SAWAKO YOSHIOKA ET AL.: "Identification of stellate cells in the mouse small intestine", DAI 32 KAI ANNUAL MEETING OF THE MOLECULAR BIOLOGY SOCIETY OF JAPAN, 11 December 2009 (2009-12-11), pages 240, XP008172820 * |
| SAWAKO YOSHIOKA ET AL.: "Isolation of intermediate stellate cells in the mouse small intestine", DAI 33 KAI ANNUAL MEETING OF THE MOLECULAR BIOLOGY SOCIETY OF JAPAN, 10 December 2010 (2010-12-10), XP008172637 * |
| See also references of EP2781225A4 |
| TEMMING ET AL., DRUG RESIST UPDAT., vol. 8, no. 6, 2005, pages 381 - 402 |
| TORCHILIN, EUR J PHARM SCI., vol. 11, no. 2, October 2000 (2000-10-01), pages 81 - 91 |
| VIDELA ET AL., J PHARMACOL EXP THER., vol. 316, no. 2, February 2006 (2006-02-01), pages 940 - 5 |
| YOSHIRO NIITSU: "Kansei Saibo o Hyoteki to shita Kankohen no Chiryo Senryaku", EXPERIMENTAL MEDICINE, vol. 29, no. 13, August 2011 (2011-08-01), pages 2114 - 2122, XP008172815 * |
| YOSHIRO NIITSU: "Treatment of Organ Fibrosis by siRNAHSP47", IBN SEMINAR SERIES: TREATMENT OF ORGAN FIBROSIS BY SIRNAHSP47, 2010, JAPAN, XP055146428, Retrieved from the Internet <URL:http://www.ibn.a-star.edu.sg/mediacentre8.php?expandable=3&eventid=306> * |
| YOSHIRO NIITSU: "Zoki Sen'isho Chiryo no Shintenkai", THE JOURNAL OF THE JAPANESE RESPIRATORY SOCIETY 1343-3490, vol. 47, no. SUPPL., 2009, pages 67, XP008172636 * |
| ZHAO; LEE, ADV DRUG DELIV REV., vol. 56, no. 8, 2004, pages 1193 - 204 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9976142B2 (en) | 2014-04-02 | 2018-05-22 | Nitto Denko Corporation | Targeting molecule and a use thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2012337691B2 (en) | 2017-10-12 |
| EP2781225B1 (en) | 2019-10-09 |
| RU2637372C2 (ru) | 2017-12-04 |
| US20140323550A1 (en) | 2014-10-30 |
| EP2781225A4 (en) | 2015-05-13 |
| CA2856016C (en) | 2020-09-22 |
| TW201336512A (zh) | 2013-09-16 |
| KR20140097405A (ko) | 2014-08-06 |
| KR102059054B1 (ko) | 2019-12-24 |
| JP5873419B2 (ja) | 2016-03-01 |
| US20160175446A1 (en) | 2016-06-23 |
| CN103917248A (zh) | 2014-07-09 |
| ES2754054T3 (es) | 2020-04-15 |
| TWI627965B (zh) | 2018-07-01 |
| JP2013126975A (ja) | 2013-06-27 |
| CA2856016A1 (en) | 2013-05-23 |
| EP2781225A1 (en) | 2014-09-24 |
| IN2014MN00908A (ja) | 2015-04-17 |
| US20170314021A1 (en) | 2017-11-02 |
| AU2012337691A1 (en) | 2014-06-12 |
| RU2014124430A (ru) | 2015-12-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5873419B2 (ja) | 腸管線維症処置剤 | |
| JP5302187B2 (ja) | がん細胞および癌随伴線維芽細胞への標的化剤 | |
| JP5950428B2 (ja) | 線維化組織から正常組織を再生するための組成物 | |
| JP2015205934A (ja) | 核酸および/または他の構成要素を含有している合成ナノ構造体 | |
| JP2009221164A (ja) | 肺線維症処置剤 | |
| JP6833456B2 (ja) | 皮膚線維症処置剤 | |
| JP6023824B2 (ja) | 線維化組織から正常組織を再生するための組成物 | |
| JP5976874B2 (ja) | 肺線維症処置剤 | |
| JP2011105742A (ja) | 肺線維症処置剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12849808 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2856016 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14359079 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012849808 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2012337691 Country of ref document: AU Date of ref document: 20121116 Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 20147016650 Country of ref document: KR Kind code of ref document: A Ref document number: 2014124430 Country of ref document: RU Kind code of ref document: A |