RU2713175C1 - Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза - Google Patents
Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза Download PDFInfo
- Publication number
- RU2713175C1 RU2713175C1 RU2019103048A RU2019103048A RU2713175C1 RU 2713175 C1 RU2713175 C1 RU 2713175C1 RU 2019103048 A RU2019103048 A RU 2019103048A RU 2019103048 A RU2019103048 A RU 2019103048A RU 2713175 C1 RU2713175 C1 RU 2713175C1
- Authority
- RU
- Russia
- Prior art keywords
- solution
- acid
- chloride
- sodium
- magnesium sulfate
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 33
- 210000001035 gastrointestinal tract Anatomy 0.000 title claims abstract description 25
- 238000012937 correction Methods 0.000 title claims abstract description 14
- 230000013632 homeostatic process Effects 0.000 title claims abstract description 10
- 229910052500 inorganic mineral Inorganic materials 0.000 title claims abstract description 8
- 239000011707 mineral Substances 0.000 title claims abstract description 8
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 claims abstract description 44
- 235000002639 sodium chloride Nutrition 0.000 claims abstract description 40
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims abstract description 36
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 claims abstract description 32
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 31
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 claims abstract description 22
- 239000001110 calcium chloride Substances 0.000 claims abstract description 22
- 229910001628 calcium chloride Inorganic materials 0.000 claims abstract description 22
- 235000011148 calcium chloride Nutrition 0.000 claims abstract description 22
- 229910052943 magnesium sulfate Inorganic materials 0.000 claims abstract description 22
- 235000019341 magnesium sulphate Nutrition 0.000 claims abstract description 22
- 150000003839 salts Chemical class 0.000 claims abstract description 22
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid group Chemical class C(CC(O)(C(=O)O)CC(=O)O)(=O)O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 claims abstract description 19
- 239000011780 sodium chloride Substances 0.000 claims abstract description 19
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 claims abstract description 16
- 239000001103 potassium chloride Substances 0.000 claims abstract description 16
- 235000011164 potassium chloride Nutrition 0.000 claims abstract description 16
- 239000001632 sodium acetate Substances 0.000 claims abstract description 16
- 235000017281 sodium acetate Nutrition 0.000 claims abstract description 16
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 claims abstract description 14
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims abstract description 13
- 239000011575 calcium Substances 0.000 claims abstract description 11
- 239000001488 sodium phosphate Substances 0.000 claims abstract description 11
- 229910000162 sodium phosphate Inorganic materials 0.000 claims abstract description 11
- 230000015572 biosynthetic process Effects 0.000 claims abstract description 8
- 235000011009 potassium phosphates Nutrition 0.000 claims abstract description 8
- 239000008213 purified water Substances 0.000 claims abstract description 8
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims abstract description 7
- ZGTMUACCHSMWAC-UHFFFAOYSA-L EDTA disodium salt (anhydrous) Chemical compound [Na+].[Na+].OC(=O)CN(CC([O-])=O)CCN(CC(O)=O)CC([O-])=O ZGTMUACCHSMWAC-UHFFFAOYSA-L 0.000 claims abstract description 7
- 229910052791 calcium Inorganic materials 0.000 claims abstract description 7
- 230000035622 drinking Effects 0.000 claims abstract description 7
- 229910000160 potassium phosphate Inorganic materials 0.000 claims abstract description 7
- 235000015165 citric acid Nutrition 0.000 claims abstract description 5
- 235000019260 propionic acid Nutrition 0.000 claims abstract 8
- 230000033558 biomineral tissue development Effects 0.000 claims abstract 2
- 150000001735 carboxylic acids Chemical class 0.000 claims abstract 2
- 159000000003 magnesium salts Chemical class 0.000 claims abstract 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 claims description 27
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 claims description 21
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 claims description 18
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 claims description 16
- 238000002360 preparation method Methods 0.000 claims description 10
- 239000004310 lactic acid Substances 0.000 claims description 8
- 235000014655 lactic acid Nutrition 0.000 claims description 8
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 claims 12
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 claims 6
- 229960004543 anhydrous citric acid Drugs 0.000 claims 4
- 230000000968 intestinal effect Effects 0.000 abstract description 29
- 230000002496 gastric effect Effects 0.000 abstract description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 15
- 210000004877 mucosa Anatomy 0.000 abstract description 14
- 206010030113 Oedema Diseases 0.000 abstract description 10
- 239000003814 drug Substances 0.000 abstract description 10
- 230000008929 regeneration Effects 0.000 abstract description 9
- 238000011069 regeneration method Methods 0.000 abstract description 9
- 230000006378 damage Effects 0.000 abstract description 8
- 230000004054 inflammatory process Effects 0.000 abstract description 7
- 239000000126 substance Substances 0.000 abstract description 7
- 206010061218 Inflammation Diseases 0.000 abstract description 6
- 208000035475 disorder Diseases 0.000 abstract description 6
- 230000000694 effects Effects 0.000 abstract description 5
- 210000005027 intestinal barrier Anatomy 0.000 abstract description 5
- 230000007358 intestinal barrier function Effects 0.000 abstract description 5
- 230000035699 permeability Effects 0.000 abstract description 4
- 238000004321 preservation Methods 0.000 abstract description 3
- 238000003860 storage Methods 0.000 abstract description 2
- 235000013336 milk Nutrition 0.000 abstract 1
- 239000008267 milk Substances 0.000 abstract 1
- 210000004080 milk Anatomy 0.000 abstract 1
- 235000019198 oils Nutrition 0.000 abstract 1
- 239000000243 solution Substances 0.000 description 144
- 239000011734 sodium Substances 0.000 description 33
- 210000002381 plasma Anatomy 0.000 description 21
- 210000000936 intestine Anatomy 0.000 description 15
- 239000002253 acid Substances 0.000 description 14
- 238000000034 method Methods 0.000 description 14
- 210000004400 mucous membrane Anatomy 0.000 description 14
- 150000007513 acids Chemical class 0.000 description 12
- 230000001154 acute effect Effects 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 238000005406 washing Methods 0.000 description 10
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 9
- 206010012735 Diarrhoea Diseases 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 210000003238 esophagus Anatomy 0.000 description 9
- 235000021391 short chain fatty acids Nutrition 0.000 description 9
- 239000000600 sorbitol Substances 0.000 description 9
- 210000002784 stomach Anatomy 0.000 description 9
- 208000005374 Poisoning Diseases 0.000 description 8
- 150000001768 cations Chemical class 0.000 description 8
- 230000003204 osmotic effect Effects 0.000 description 8
- 231100000572 poisoning Toxicity 0.000 description 8
- 230000000607 poisoning effect Effects 0.000 description 8
- 150000004666 short chain fatty acids Chemical class 0.000 description 8
- 210000004913 chyme Anatomy 0.000 description 7
- 235000016709 nutrition Nutrition 0.000 description 7
- 102000009123 Fibrin Human genes 0.000 description 6
- 108010073385 Fibrin Proteins 0.000 description 6
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 6
- 230000003628 erosive effect Effects 0.000 description 6
- 229950003499 fibrin Drugs 0.000 description 6
- 235000013305 food Nutrition 0.000 description 6
- 239000004615 ingredient Substances 0.000 description 6
- 239000011777 magnesium Substances 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 230000007423 decrease Effects 0.000 description 5
- 239000003792 electrolyte Substances 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 208000025865 Ulcer Diseases 0.000 description 4
- 230000007547 defect Effects 0.000 description 4
- 230000007812 deficiency Effects 0.000 description 4
- 235000005911 diet Nutrition 0.000 description 4
- 230000037213 diet Effects 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 210000001198 duodenum Anatomy 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 238000010438 heat treatment Methods 0.000 description 4
- 230000000544 hyperemic effect Effects 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 230000035764 nutrition Effects 0.000 description 4
- -1 polyethylene Polymers 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 238000011282 treatment Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 208000009043 Chemical Burns Diseases 0.000 description 3
- 208000018380 Chemical injury Diseases 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 206010035664 Pneumonia Diseases 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 231100000313 clinical toxicology Toxicity 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 239000012153 distilled water Substances 0.000 description 3
- 230000002497 edematous effect Effects 0.000 description 3
- 238000001839 endoscopy Methods 0.000 description 3
- 210000002919 epithelial cell Anatomy 0.000 description 3
- 238000002181 esophagogastroduodenoscopy Methods 0.000 description 3
- 230000035876 healing Effects 0.000 description 3
- 230000002475 laxative effect Effects 0.000 description 3
- 230000033001 locomotion Effects 0.000 description 3
- 229960003511 macrogol Drugs 0.000 description 3
- 235000021073 macronutrients Nutrition 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 208000030159 metabolic disease Diseases 0.000 description 3
- 244000005706 microflora Species 0.000 description 3
- 206010034674 peritonitis Diseases 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 208000010444 Acidosis Diseases 0.000 description 2
- 206010001623 Alcoholic hangover Diseases 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 208000027244 Dysbiosis Diseases 0.000 description 2
- 208000007882 Gastritis Diseases 0.000 description 2
- 208000032843 Hemorrhage Diseases 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 208000008589 Obesity Diseases 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- 230000009102 absorption Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000007950 acidosis Effects 0.000 description 2
- 208000026545 acidosis disease Diseases 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 231100000570 acute poisoning Toxicity 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 150000001450 anions Chemical group 0.000 description 2
- 208000034158 bleeding Diseases 0.000 description 2
- 230000000740 bleeding effect Effects 0.000 description 2
- SHWNNYZBHZIQQV-UHFFFAOYSA-L calcium;disodium;2-[2-[bis(carboxylatomethyl)azaniumyl]ethyl-(carboxylatomethyl)azaniumyl]acetate Chemical compound [Na+].[Na+].[Ca+2].[O-]C(=O)C[NH+](CC([O-])=O)CC[NH+](CC([O-])=O)CC([O-])=O SHWNNYZBHZIQQV-UHFFFAOYSA-L 0.000 description 2
- 235000013339 cereals Nutrition 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 201000001883 cholelithiasis Diseases 0.000 description 2
- 230000002016 colloidosmotic effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 230000007140 dysbiosis Effects 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 210000001156 gastric mucosa Anatomy 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 244000005709 gut microbiome Species 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000000004 hemodynamic effect Effects 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 230000002727 hyperosmolar Effects 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 208000003243 intestinal obstruction Diseases 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 208000002551 irritable bowel syndrome Diseases 0.000 description 2
- 239000008141 laxative Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 206010025482 malaise Diseases 0.000 description 2
- 231100000663 medical toxicology Toxicity 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 210000000214 mouth Anatomy 0.000 description 2
- 238000010606 normalization Methods 0.000 description 2
- 235000020824 obesity Nutrition 0.000 description 2
- 230000002980 postoperative effect Effects 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 235000013406 prebiotics Nutrition 0.000 description 2
- 230000035935 pregnancy Effects 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000001603 reducing effect Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 238000011301 standard therapy Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 238000011287 therapeutic dose Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- JFALSRSLKYAFGM-UHFFFAOYSA-N uranium(0) Chemical compound [U] JFALSRSLKYAFGM-UHFFFAOYSA-N 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- 206010033646 Acute and chronic pancreatitis Diseases 0.000 description 1
- 206010067484 Adverse reaction Diseases 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 206010003011 Appendicitis Diseases 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 208000008035 Back Pain Diseases 0.000 description 1
- 208000027775 Bronchopulmonary disease Diseases 0.000 description 1
- 206010007027 Calculus urinary Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 206010008909 Chronic Hepatitis Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 206010012218 Delirium Diseases 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- RPNUMPOLZDHAAY-UHFFFAOYSA-N Diethylenetriamine Chemical compound NCCNCCN RPNUMPOLZDHAAY-UHFFFAOYSA-N 0.000 description 1
- 206010014418 Electrolyte imbalance Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000037487 Endotoxemia Diseases 0.000 description 1
- 206010016803 Fluid overload Diseases 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- 206010072104 Fructose intolerance Diseases 0.000 description 1
- 201000000628 Gas Gangrene Diseases 0.000 description 1
- 208000031220 Hemophilia Diseases 0.000 description 1
- 208000009292 Hemophilia A Diseases 0.000 description 1
- 206010019878 Hereditary fructose intolerance Diseases 0.000 description 1
- 208000034970 Heterotopic Ossification Diseases 0.000 description 1
- 101000642656 Homo sapiens STE20-related kinase adapter protein beta Proteins 0.000 description 1
- 206010020802 Hypertensive crisis Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 208000005016 Intestinal Neoplasms Diseases 0.000 description 1
- 206010022678 Intestinal infections Diseases 0.000 description 1
- 241000186660 Lactobacillus Species 0.000 description 1
- 231100000757 Microbial toxin Toxicity 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 201000002481 Myositis Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 201000009053 Neurodermatitis Diseases 0.000 description 1
- 206010030216 Oesophagitis Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 208000007542 Paresis Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 235000009827 Prunus armeniaca Nutrition 0.000 description 1
- 244000018633 Prunus armeniaca Species 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010037601 Pyelonephritis chronic Diseases 0.000 description 1
- 102100035929 STE20-related kinase adapter protein beta Human genes 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 1
- 208000001871 Tachycardia Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 206010046555 Urinary retention Diseases 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 206010047513 Vision blurred Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000006838 adverse reaction Effects 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000002921 anti-spasmodic effect Effects 0.000 description 1
- 229940124575 antispasmodic agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 208000003770 biliary dyskinesia Diseases 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000009534 blood test Methods 0.000 description 1
- 230000002308 calcification Effects 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 230000002612 cardiopulmonary effect Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 201000006368 chronic pyelonephritis Diseases 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 201000001981 dermatomyositis Diseases 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 235000013325 dietary fiber Nutrition 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 206010013781 dry mouth Diseases 0.000 description 1
- 206010013864 duodenitis Diseases 0.000 description 1
- 239000008151 electrolyte solution Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 208000010227 enterocolitis Diseases 0.000 description 1
- 208000006881 esophagitis Diseases 0.000 description 1
- 235000019441 ethanol Nutrition 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 235000021149 fatty food Nutrition 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 206010016766 flatulence Diseases 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 208000014617 hemorrhoid Diseases 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- NBZBKCUXIYYUSX-UHFFFAOYSA-N iminodiacetic acid Chemical compound OC(=O)CNCC(O)=O NBZBKCUXIYYUSX-UHFFFAOYSA-N 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 208000030603 inherited susceptibility to asthma Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 201000009019 intestinal benign neoplasm Diseases 0.000 description 1
- 210000002490 intestinal epithelial cell Anatomy 0.000 description 1
- 208000011140 intestinal infectious disease Diseases 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 230000003870 intestinal permeability Effects 0.000 description 1
- 210000002011 intestinal secretion Anatomy 0.000 description 1
- 230000002262 irrigation Effects 0.000 description 1
- 238000003973 irrigation Methods 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- JCQLYHFGKNRPGE-FCVZTGTOSA-N lactulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-FCVZTGTOSA-N 0.000 description 1
- 229960000511 lactulose Drugs 0.000 description 1
- PFCRQPBOOFTZGQ-UHFFFAOYSA-N lactulose keto form Natural products OCC(=O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O PFCRQPBOOFTZGQ-UHFFFAOYSA-N 0.000 description 1
- 208000008127 lead poisoning Diseases 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 230000004089 microcirculation Effects 0.000 description 1
- 210000001087 myotubule Anatomy 0.000 description 1
- GBCAVSYHPPARHX-UHFFFAOYSA-M n'-cyclohexyl-n-[2-(4-methylmorpholin-4-ium-4-yl)ethyl]methanediimine;4-methylbenzenesulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1.C1CCCCC1N=C=NCC[N+]1(C)CCOCC1 GBCAVSYHPPARHX-UHFFFAOYSA-M 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- MGFYIUFZLHCRTH-UHFFFAOYSA-N nitrilotriacetic acid Chemical compound OC(=O)CN(CC(O)=O)CC(O)=O MGFYIUFZLHCRTH-UHFFFAOYSA-N 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 150000002482 oligosaccharides Polymers 0.000 description 1
- 230000000771 oncological effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000002357 osmotic agent Substances 0.000 description 1
- 238000013021 overheating Methods 0.000 description 1
- 238000010422 painting Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 210000003800 pharynx Anatomy 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229910001414 potassium ion Inorganic materials 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 201000004193 respiratory failure Diseases 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 230000001523 saccharolytic effect Effects 0.000 description 1
- 230000000276 sedentary effect Effects 0.000 description 1
- 239000013049 sediment Substances 0.000 description 1
- 239000011265 semifinished product Substances 0.000 description 1
- 231100001229 severe poisoning Toxicity 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 206010040882 skin lesion Diseases 0.000 description 1
- 231100000444 skin lesion Toxicity 0.000 description 1
- 235000020994 smoked meat Nutrition 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 230000008337 systemic blood flow Effects 0.000 description 1
- 230000006794 tachycardia Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 230000035922 thirst Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000027 toxicology Toxicity 0.000 description 1
- 230000008359 toxicosis Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 230000000472 traumatic effect Effects 0.000 description 1
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 208000008281 urolithiasis Diseases 0.000 description 1
- 239000005419 vinegar essence Substances 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/194—Carboxylic acids, e.g. valproic acid having two or more carboxyl groups, e.g. succinic, maleic or phthalic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/225—Polycarboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/04—Sulfur, selenium or tellurium; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/06—Aluminium, calcium or magnesium; Compounds thereof, e.g. clay
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/14—Alkali metal chlorides; Alkaline earth metal chlorides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/42—Phosphorus; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
Landscapes
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
Заявленная группа изобретений относится к области медицины и представляет собой состав для получения кислотно-минеральной композиции, предназначенной для приготовления энтерального раствора для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза, включающей натрия хлорид, калия хлорид, кальция хлорид, сульфат магния, а также соль, выбранную из натрия фосфата одно-, или дву-, или трехзамещенного, калия фосфата одно- или двузамещенного, натрия ацетата, взятых в количестве, обеспечивающем минерализацию энтерального раствора от 10,7 г до 14,0 г на 1 л, Na2ЭДТА или Nа3ДТПА в количестве, препятствующем образованию в растворе нерастворимых солей кальция и магния, а также карбоновые кислоты, выбранные из молочной, масляной, пропионовой и лимонной кислот, взятые в общем количестве, достаточном для поддержания рН раствора в диапазоне значений 4,61-5,8, и энтеральный раствор для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза, включающий кислотно-минеральную композицию, полученную из компонентов заявленного состава, и питьевую очищенную воду, при этом очищенная вода содержится в количестве, обеспечивающем осмолярность раствора в интервале значений 280-310 мОсм/л. Использование заявленной группы изобретений обеспечивает длительный срок хранения раствора и сохранение его свойств при нагревании, раствор обеспечивает профилактику отеков после кишечного лаважа, способствует сокращению срока регенерации слизистой оболочки желудочно-кишечного тракта при ее повреждениях и воспалении, снижению частоты внекишечных осложнений, связанных с повышенной проницаемостью кишечного барьера. 2 н. и 1 з.п. ф-лы, 5 ил., 3 табл., 1 пр.
Description
Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно, к гастроэнтерологии, колопроктологии, хирургии, терапии, аллергологии, токсикологии, наркологии, реаниматологии, дерматологии, нефрологии, комбустиологии, восстановительной медицине и др. и может быть использовано с целью проведения кишечного лаважа и энтеральной коррекции нарушений гомеостаза организма, сокращения срока регенерации слизистой оболочки желудочно-кишечного тракта (ЖКТ) при ее повреждениях и воспалении, снижения частоты внекишечных осложнений, связанных с повышенной проницаемостью кишечного барьера, профилактики отеков после кишечного лаважа при различных заболеваниях.
Уровень техники
Из уровня техники известны различные кислотно-минеральные составы для лаважа желудочно-кишечного тракта. В частности, известен полиэтиленгликоль-электролитный водный раствор (торговое название «Фортране», «Лавакол»). Раствор применяют для проведения кишечного лаважа (КЛ) с целью детоксикации организма при острых отравлениях [Tenenbein М. Position Statement: Whole Bowel Irrigation / Clinical Toxicology, 1997. - №35 (7). - P. 753-762.], подготовки толстой кишки к диагностическим и оперативным вмешательствам [Костенко Н.В. Кишечный лаваж как метод подготовки толстой кишки к обследованию и операциям. Автореф. дисс. к.м.н., М, 1998. - 20 с.; Delmotte J.S. et al., Ann. Gastroenterology. Hepatol., 1988, 24, n 4 211-216.]. В основе механизма его действия лежит способность вызывать гиперосмолярную диарею. Входящий в состав раствора макрогол (например, 4000) - осмотически активное вещество, молекулы которого способны притягивать к себе воду, в том числе, в полость ЖКТ из кровеносного русла, создавая избыточный объем в кишке и, как следствие, сокращение ее мышечных волокон, вызывающих диарею.
Недостатком этого раствора является его гиперосмолярность по отношению к плазме, обуславливающая неконтролируемый транспорт воды из кровеносного русла в полость ЖКТ, вследствие которого могут развиваться сгущение крови, нарушение центральной гемодинамики и микроциркуляции. Другим недостатком этого раствора является то, что он содержит неполный набор макроэлементов, поэтому в результате диареи организм теряет недостающие в растворе макроэлементы, что может негативным образом сказываться насостоянии здоровья пациента. Недостатком этого раствора также является то, что значения его рН составляют 7,9-8,5, которые вызывают смещение рН внутренней среды кишки, в норме слабокислой, в щелочную сторону, что создает неблагоприятные условия обитания для нормальной кишечной флоры: бифидум- и лактобактерий, для которых благоприятной является слабокислая среда. Щелочная среда, подавляет рост нормофлоры, что выражается в снижении их численности, и способствует росту условно-патогенных и патогенных микроорганизмов, т.е. щелочной раствор вызывает дисбактериоз кишечника [Шендеров, Б.А. Медицинская микробная экология и функциональное питание: в 3-х т. / Б.А. Шендеров. - М.: ГРАНТЪ, 1998. - Т. I: Микрофлора человека и животных и ее функции. - 288 с.].
Известно средство для кишечного лаважа по патенту RU 2473330, представляющее собой электролитный раствор, основным действующим веществом в котором является сорбит в количестве 60-63 граммов. Сорбит, относящийся к классу шестиатомных спиртов, обладает осмотической активностью, благодаря чему вызывает послабляющее воздействие на кишечник.
Недостатком этого раствора является то, что он вызывает, подобно макроголу, гиперосмолярную диарею со всеми вытекающими представленными выше последствиями. В отличие от макрогола, использование сорбита, кроме того, вызывает слабость, тошноту, рвоту, головокружение, метеоризм, гипергликемию (у больных декомпенсированным сахарным диабетом), синдром раздраженного кишечника и ухудшение всасывания фруктозы, ацидоз, задержку мочеиспускания, сухость во рту и жажду, дегидратацию, застой крови в легких, гипотензию, тахикардию, боли, подобные стенокардитическим, нечеткость зрения, судороги, ринит, озноб, боль в спине, аллергические реакции, включая крапивницу. Сорбит, содержащийся в клетках нервов и глаз, может стать причиной невропатии, а также диабетической ретинопатии. Большие количества сорбита могут значительно изменять сердечно-легочную и почечную функцию. Противопоказаниями к использованию сорбита являются: гиперчувствительность, непереносимость фруктозы; декомпенсированный сахарный диабет, асцит, колит, холелитиаз, синдром раздраженной толстой кишки, ожирение. Не рекомендуется длительное применение в качестве слабительного [Сорбит. Описание вещества // Режим доступа: http://www.neboleem.net/sorbit.php; http://gipocrat.ru/farmacied_d1_22.phtml].
Таким образом, использование раствора с сорбитом для проведения кишечного лаважа чревато возникновением клинически значимых реакций и серьезных осложнений и возможно лишь в качестве слабительного средства в течение непродолжительного времени с учетом противопоказаний и риска побочных реакций.Из литературных источников известно, что все растворы, физико-химические свойства которых отличаются от физико-химических характеристик химуса, при промывании ЖКТ отрицательно влияют на состав крови и состояние микробиоценоза кишки [Гальперин, Ю.М. Пищеварение и гомеостаз / Ю.М. Гальперин, П.И. Лазарев. - М.: Наука, 1986. - 304 с.]. При небольших объемах промывающего раствора типа «Фортранс» (например, до 1,5-2 л), эти нарушения могут оказаться клинически незамеченными благодаря компенсаторным способностям организма. Проблема состоит в том, что для эффективного очищения ЖКТ и детоксикации организма требуется объем промывающего раствора, больший, чем объем ЖКТ. У взрослого человека массой тела 60-70 кг он в среднем равен 3 литрам. Чем больше объем промывающего раствора, тем эффективнее удается очистить кишечник. Так, например, в практике клинической токсикологии существует правило промывания желудка и толстой кишки «до чистых промывных вод». Для этого требуются десятки литров воды. При острых отравлениях применяют КЛ с использованием десятков литров раствора [Маткевич, В.А. Кишечный лаваж при острых пероральных отравлениях / В.А. Маткевич, Е.А. Лужников // Неотложная клиническая токсикология: рук-во для врачей / под ред. Е.А. Лужникова. - М.: Медпрактика-М, 2007. - Гл. VI. - С. 269-276.].
Известно, что состав внутренней среды тонкой кишки (химуса) достаточно жестко стабилизирован [Баклыкова Н.М. Состав и приготовление сред для внутрикишечного введения при перитоните. - Методические рекомендации. М., 1986. - 19 с.; Гальперин Ю.М, Попова Т.С. В кн.: Пути коррекции метаболических расстройств в экстренной и плановой хирургии. - М., 1976.]. Гомеостаз химуса обеспечивается микрофлорой кишечника и интенсивным массообменом между энтеральной средой и плазмой крови. Эти обстоятельства необходимо учитывать при выборе раствора для промывания кишечника. При несоответствии физико-химических характеристик раствора и химуса, при больших объемах раствора изменяется состав внутренней среды кишки и нарушается физиологический градиент концентраций химических веществ в полости кишки и крови, что вызывает их перераспределение, в результате которого возникают водно-электролитные нарушения плазмы крови. Характер и степень таких нарушений находятся в прямой зависимости от объема, характера и степени несбалансированности раствора, используемого для промывания. Так, например, при отсутствии или недостатке в промывающем растворе ионов калия, они из среды, имеющей большую концентрацию, то есть, из плазмы крови перемещаются в среду с меньшей концентрацией, т.е. в полость ЖКТ и с раствором удаляются из организма. При этом концентрация калия в плазме крови снижается. Его потери могут быть опасны для здоровья и жизни пациента. При избыточной концентрации калия в промывающем растворе возникает противоположное состояние. Массообмен других макроэлементов через кишечную стенку подчиняется такой же закономерности.
Изменение концентрационных значений электролитов плазмы крови (в особенности натрия) влечет за собой изменения ее осмоляльности и рН, водного баланса организма.
По этой причине, применение нефизиологичных по отношению к химусу растворов для промывания тонкой кишки в объеме более 3 л, например, фортранса, лавакола или содержащих другие осмотически активные вещества (сорбит, манит, лактулозу и др.), неизбежно приводит к названым нарушениям и негативным образом сказывается на состоянии пациентов [Баклыкова Н.М. / Возможности применения кишечного диализа для коррекции метаболических нарушений при острых хирургических заболеваниях органов брюшной полости // Труды НИИ СП им. Н.В. Склифосовского. Том XXIII. Москва. 1976. С. 152.; Глозман О.С., Касаткина А.П. Современные методы активной терапии острых токсикозов. - М., Медгиз. 1959. 276 с.].
Из уровня техники известен солевой энтеральный раствор (СЭР), созданный в соответствии с качественным составом анионов и катионов, содержащихся в химусе [Баклыкова Н.М. Состав и приготовление сред для внутрикишечного введения при перитоните. Методические рекомендации. М., 1986. - 19 с.]. Этот энтеральный раствор готовят ex tempore по рецепту, имеющему шесть вариантов, путем растворения солей дистиллированной водой. Как указывает автор, независимо от варианта рецепта, ионный состав готового раствора во всех случаях идентичный. В состав этого раствора, по 6-ти вариантам прописи, входят такие соли как: натрия и калия хлорид и фосфат, натрия ацетат, кальция хлорид и магния сульфат, лимонная кислота, а также дистиллированная вода в качестве растворителя солей. Осмолярность раствора составляет порядка 235 мОсм/л, его рН имеет значения 5,5-5,8.
СЭР применяют в качестве энтерального питания при перитоните, а также, для КЛ при функциональной кишечной непроходимости и острых пероральных отравлениях.
Недостатком СЭР является то, что он не подлежит длительному хранению, так как в течение нескольких часов после приготовления мутнеет, а затем, в нем образуется осадок. В целях профилактики тепловой потери тела пациента во время КЛ раствор перед употреблением необходимо подогревать до 37-40°С. Причем, нагревание раствора требует определенных условий и правил (водяная баня или специальное устройство). Быстрое нагревание или его перегревание, даже, немногим более 40°С, также вызывает помутнение. Помутнение раствора и выпадение осадка обусловлены тем, что входящие в состав раствора катионы кальция (Са2+) и магния (Mg2+) вступают в химическую реакцию с анионами SO4 2- и PO4 3- и образуют нерастворимые соли CaSO4, Са3(PO4)2 и MgHPO4. Применение мутного или с осадком раствора недопустимо, так как его ионный состав в этих случаях уже не соответствует исходному составу, и чревато возникновением нарушений электролитного баланса крови во время КЛ. Нестабильность состава раствора снижает его потребительские качества как товара.
Другим недостатком этого раствора является то, что после процедуры КЛ довольно часто развивается гипергидратация организма (отеки) [Маткевич В.А. Кишечный лаваж при острых пероральных отравлениях. - Автореф. дисс. к.м.н., М., 1988]. Этот недостаток связан с тем, что величина осмотического давления раствора (235 мОсм/л) значительно ниже, чем - плазмы крови человека (нормальные значения варьируются в пределах 280-310 мОсм/кг и в среднем составляют 294,1±1,3 мОсм/кг) [Fabian M.J., Proctor K.G. Hemodynamic actions of acute ethanol after resuscitation from traumatic brain injury. J. Trauma. 2002; 53: 864-75]. Известно, что объем и скорость всасывания жидкости в ЖКТ находятся в прямой зависимости от градиента осмотического давления этой жидкости и плазмы крови. Вследствие того, что осмотическое давление СЭР значительно ниже коллоидно-осмотического давления плазмы крови, он легко всасывается из ЖКТ в кровь. Поступление его в избыточном количестве вызывает образование отеков, ухудшающих состояние пациента и требующих специальных лечебных мероприятий.
Недостатком раствора также является то, что для его приготовления в качестве растворителя солей автором рекомендуется использовать дистиллированную воду без других вариантов, что ограничивает технологические возможности данного решения.
Известен также СЭР по патенту на изобретение РФ №2178696, которому присущи недостатки, раскрытые при описании предыдущего аналога.
В качестве прототипа выбран СЭР, величина осмолярности которого соответствует величине осмолярности плазмы крови конкретного больного, что позволяет предупреждать нарушения водного баланса организма при проведении кишечного лаважа [Патент на изобретение РФ №2190412]. Изменение осмолярности раствора как в сторону повышения, так и в сторону уменьшения достигается изменением концентрации в нем солей. Готовить растворы с разной концентрацией можно путем растворения различного количества солей в заданном объеме воды, что в условиях массового производства неудобно, либо растворения заданного количества солей в разном объеме воды, что представляется более эргономичным.
Авторы указанного изобретения для получения раствора, имеющего необходимое значение осмолярности, соответствующее осмолярности плазмы крови, предложили рассчитывать необходимый для растворения заданного количества солей объем воды по формуле. При этом необходимо знать исходную величину коллоидно-осмотического давления плазмы крови. Величина объема воды, необходимого для приготовления раствора, обратно пропорциональна величине коллоидно-осмотического давления плазмы крови.
Недостатком данного технического решения является то, что для приготовления раствора с заданной осмолярностью, соответствующей величине осмоляльности плазмы крови конкретного пациента, в каждом случае необходимо предварительно сделать лабораторный анализ крови пациента для определения этого показателя, что возможно только в условиях медицинского учреждения, оснащенного лабораторией. В амбулаторных, полевых и домашних условиях это невыполнимо. Кроме того, такой подход исключает возможность серийного производства готового к употреблению раствора. Другим недостатком такого раствора является то, что он не стойкий и быстро мутнеет и дает осадок, а при повышении концентрации солей с целью увеличения его осмолярности, срок годности раствора еще больше сокращается. Кроме того, отсутствуют сведения о том, что раствор-прототип способствует ускорению регенерации слизистой оболочки ЖКТ при ее повреждениях и воспалении.
Раскрытие изобретения
Технической проблемой, решаемой заявляемым изобретением, является разработка состава энтерального раствора для лаважа желудочно-кишечного тракта, коррекции нарушений гомеостаза, лишенного недостатков, характерных для перечисленных выше аналогов.
Техническим результатом заявляемого изобретения является сохранение качественных характеристик кислотно-минеральной композиции (КМК) в виде сухого порошка и готового к употреблению раствора в течение длительного срока хранения раствора (не менее 1 года), и при нагревании раствора, при обеспечении возможности его использования в качестве средства, способствующего регенерации слизистой оболочки ЖКТ. Энтеральный раствор также может быть использован для профилактики отеков. Состав КМК и энтерального раствора является универсальным для выполнения пациентам лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза.
Указанный технический результат достигается тем, что для приготовления предлагаемых кислотно-минеральных композиций (КМК) и энтерального раствора, используют натрия фосфат одно- или дву-, или трехзамещенный, или калия фосфат одно- или двузамещенный, натрия хлорид, натрия ацетат или без него, калия хлорид, кальция хлорид, магния сульфат, лимонную кислоту или без нее, а в качестве растворителя солей и кислот для приготовления энтерального раствора из КМК используют питьевую очищенную воду, в таком диапазоне объемов, в котором растворенные соли и кислоты создают осмолярность раствора в интервале значений 280-310 мОсм/л, кроме того, КМК и раствор дополнительно содержат полиаминополикарбоновые кислоты, препятствующие образованию в растворе нерастворимых солей, и короткоцепочные карбоновые (жирные) кислоты в количестве, обеспечивающим рН раствора в интервале значений 4,61-5,8.
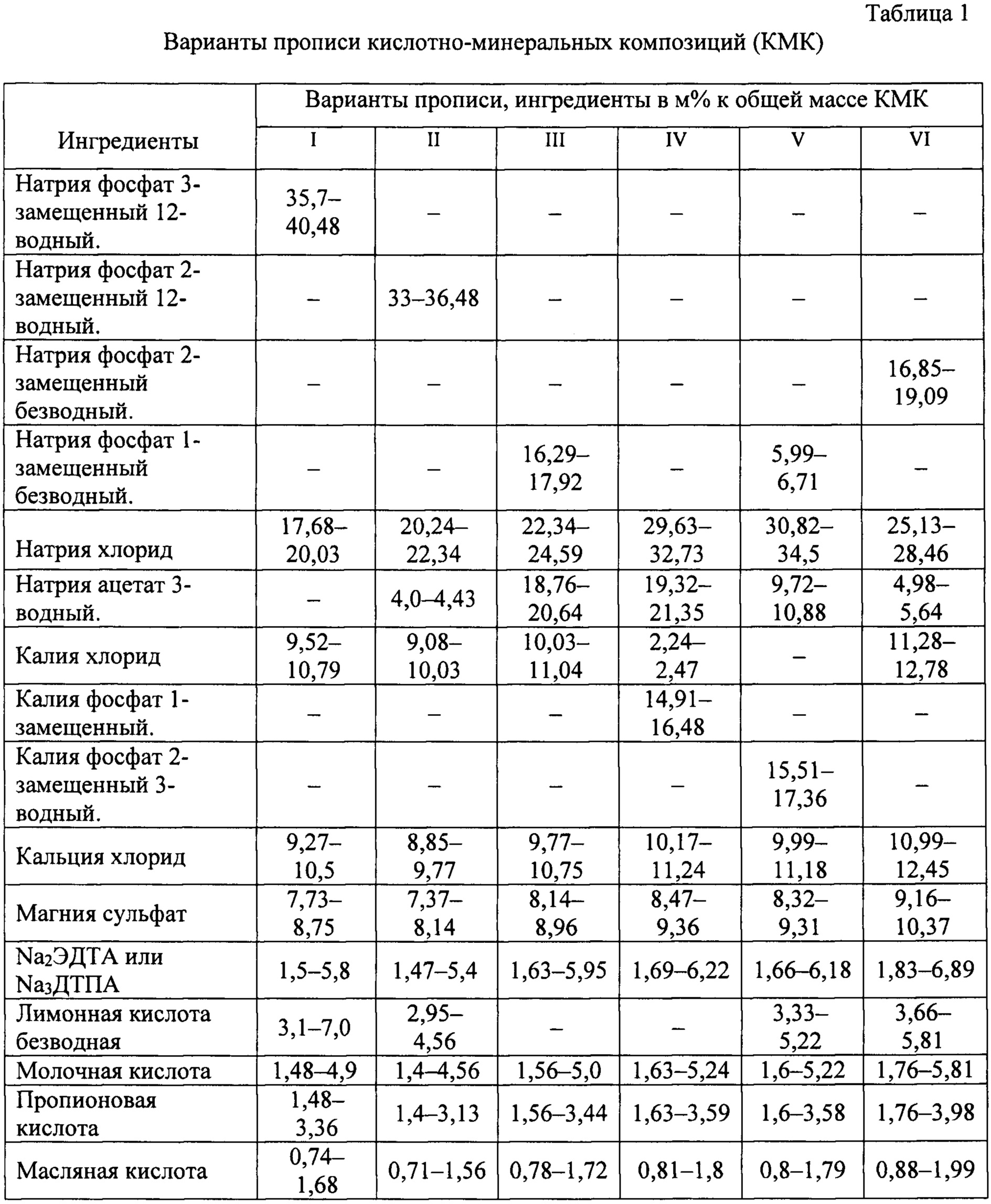
Для приготовления КМК и предлагаемого энтерального раствора используют один из шести равноценных вариантов (см. таблицу 1 и 2):
• по первому варианту КМК и энтеральный раствор содержат натрия фосфат трехзамещенный, натрия хлорид, калия хлорид, лимонную, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДTA или Na3ДТПА, а также, кальция хлорид и магния сульфат;
• по второму варианту КМК и энтеральный раствор содержат натрия фосфат двузамещенный, натрия хлорид, натрия ацетат, калия хлорид, лимонную, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДТА или Na3ДТПА, а также, кальция хлорид и магния сульфат;
• по третьему варианту КМК и энтеральный раствор содержат натрия фосфат однозамещенный, натрия хлорид, натрия ацетат, калия хлорид, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДТА или Na3ДТПА, а также, кальция хлорид и магния сульфат;
• по четвертому варианту КМК и энтеральный раствор содержат калия фосфат однозамещенный, натрия хлорид, натрия ацетат, калия хлорид, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДТА или Na3ДТПА, а также, кальция хлорид и магния сульфат;
• по пятому варианту КМК и энтеральный раствор содержат натрия фосфат однозамещенный, натрия хлорид, натрия ацетат, калия фосфат двузамещенный 3-х водный, лимонную, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДТА или Na3ДТПА, а также, кальция хлорид и магния сульфат;
• по шестому варианту КМК и энтеральный раствор содержат натрия фосфат двузамещенный, натрия хлорид, натрия ацетат, калия хлорид, лимонную, молочную, пропионовую и масляную кислоты, комплексон, например, Na2ЭДТА или Na3ДТПА, а также, кальция хлорид и магния сульфат.
Во всех вариантах КМК кальция хлорид и магния сульфат, изолированы друг от друга и от смеси оставшихся ингредиентов. Соотношения ингредиентов в КМК по всем шести вариантам представлены в Таблице 1, соотношения ингредиентов в энтеральном растворе по всем шести вариантам представлены в Таблице 2, мас. %.
В изобретении использованы безводные кислоты - пропионовая, масляная (жидкости) и лимонная (порошок), а также, молочная кислота 80%.
Предлагаемое техническое решение обеспечивает энтеральному раствору дополнительные свойства, благодаря которым, его использование для КЛ способствует сокращению срока регенерации слизистой оболочки ЖКТ при ее повреждениях и воспалении, и, как следствие ускоренной регенерации слизистой оболочки ЖКТ - снижению частоты внекишечных инфекционных осложнений, вызванных повышенной проницаемостью кишечного барьера.
Заявляемый состав предлагаемого раствора характеризуется увеличением срока хранения энтерального раствора (до срока, отвечающего потребительскому свойству товара) и возможностью нагревания до 37-40°C с сохранением его свойств, что предупреждает его помутнение и образование в нем осадка, при ускорении регенерации эпителиоцитов ЖКТ. Данные свойства обеспечиваются посредством изменения качественного и количественного состава компонентов, в т.ч за счет добавления в раствор короткоцепочных жирных кислот (КЦЖК) и полиаминополикарбоновых кислот, блокирующих взаимодействие катионов и анионов, способных образовывать нерастворимые соли в растворе.
Заявляемый состав не вызывает отеки у пациентов после кишечного лаважа (и может применяться в т.ч. для профилактики отеков) за счет использования квазиосмотичного плазме крови раствора, значения осмолярности которого «покрывают» диапазон физиологических показателей (280-310 мОсм/кг) осмоляльности плазмы крови, что делает необязательным предварительное определение осмоляльности плазмы пациента перед КЛ, необходимое при использовании прототипа.
Энтеральный раствор, изоионичный химусу и квазиосмотичный плазме крови, содержит натрия фосфат одно- или дву-, или трехзамещенный, или калия фосфат одно- или двузамещенный, натрия хлорид, натрия ацетат, калия хлорид, кальция хлорид, магния сульфат, лимонную кислоту (или без нее), очищенную питьевую воду, а также дополнительно содержит комплексоны в достаточном количестве для блокирования в растворе катионов Са2+ и Mg2+, в частности, полиаминополикарбоновые кислоты (ПАПКК) или их соли, например, динатриевую соль этилендиаминтетрауксусной кислоты (Na2ЭДТА, или «Трилон Б»), или тринатриевую соль диэтилентриаминпентоуксусной (Na3ДТПА), или иминодиуксусную, или нитрилотриуксусную кислоты.
ПАПКК, например, Na2ЭДТА и Na3ДТПА, способны образовывать стойкие, мало диссоциирующие комплексы с двух-, трех- и четырехвалентными катионами, в данном случае - с катионами Са2+, соответственно образуя CaNa2ЭДТА (тетацин) и CaNa3ДТПА (пентацин), а также с катионами Mg2+, препятствуя их взаимодействию в солевом растворе с анионами SO4 2- и PO4 3- и, тем самым, предотвращая образование нерастворимых в воде солей: CaSO4, Са3(PO4)2 и MgHPO4. При этом они не изменяют рН раствора и не снижают концентрацию кальция и магния в крови, быстро выводятся из организма с мочой и метаболизируются в почках до образования углекислого газа. Выводят тяжелые металлы и свободные радикалы из организма.
Раствор, содержащий тетацин или пентацин, можно нагревать и длительно хранить. Срок хранения раствора зависит от концентрации этих комплексонов. Для связывания катионов, например, кальция в растворе необходимо эквивалентное количество Na2ЭДТА или Na3ДТПА. Известно, что предлагаемые комплексоны предназначены для парентерального введения, так как плохо всасываются из ЖКТ, а именно, в кровь поступает всего 2-5% от их общего количества, принятого внутрь [Семенов Д.И., Трегубенко И.П. Комплексоны в биологии и медицине / Свердловск: УНЦ АН СССР, 1984. - 281 с. // Режим доступа: https://www.ipae.uran.ru/sites/default/files/Complexones.pdf]. Однократная лечебная доза при внутривенном введении составляет 2 г, а суточная - 4 г [Машковский М.Д. Лекарственные средства. В 2 томах. Т. 2. 11-е изд. стер. - М.: Медицина, 1988. С. 186.]. Предлагаемый раствор, содержащий Na2ЭДТА или Na3ДТПА, предназначен для приема внутрь. Расчеты показывают, что разовой дозе 2 г при внутривенном введении эквивалентна доза 40 г при пероральном приеме Na2ЭДТА или Na3ДТПА.
С целью выяснения зависимости продолжительности срока хранения раствора от концентрации Na2ЭДТА в нем, нами были проведены исследования, которые показали, что концентрация Na2ЭДТА 0,07-0,09%, что соответствует удельному содержанию 0,029-0,118 мас. % в 1-6 вариантах прописей предлагаемого раствора, обеспечивает стабилизацию его в течение 1-4 лет. В период наблюдения раствор оставался прозрачным и не имел осадка. При меньших концентрация Na2ЭДТА в растворе (см. Таб. 3) раствор мутнел и давал осадок. Срок годности 1-4 года при соблюдении стерильности раствора отвечает условиям его серийного производства и массового потребления.
Зависимость сроков хранения энтерального раствора от концентрации в нем Na2ЭДТА представлена в таблице 3.
Примечание: * - указанные сроки хранения раствора определены при комнатной температуре на свету. Срок наблюдения 4 года.
Нагревание раствора, содержащего 0,07-0,09% Na2ЭДТА, до 40°С не вызывало его помутнения, в отличие от раствора-прототипа. Концентрация Na2ЭДТА менее 0,07% не обеспечивала прозрачность раствора при его нагревании.
В зависимости от показаний КЛ проводят в объеме от 4 до 30 л СЭР [Маткевич В.А. Кишечный лаваж // Медицинская токсикология: национальное руководство / Под ред. Е.А. Лужникова. М.: ГЭОТАР-Медицина, 2012. - Гл. 4. - С. 162-186.].
Расчеты показывают, что для приготовления раствора в объеме 30 л для получения концентрации 0,09% потребуется 27,0 г Na2ЭДТА, часть от этого количества, составляющая 5%, которая включается в процесс резорбции, равна 1,35 г, что ниже одноразовой лечебной дозы при ее внутривенном введении. Указанный объем раствора вполне достаточен для проведения процедуры КЛ у больных с тяжелым соматическим статусом. При удовлетворительном состоянии пациента достаточен меньший объем раствора, например, 4,5 л, в котором при концентрации 0,09% содержится 4,05 г Na2ЭДТА, 5% от этого количества составляет 0,2 г. На практике во время кишечного лаважа порядка 90% объема, введенного в ЖКТ раствора, удаляется естественным путем. В оставшейся внутри тела пациента части раствора содержание Na2ЭДТА соответственно составляет 1/10 от общего количества. Такие дозы предлагаемых комплексонов являются безопасными для человека. CaNa2ЭДТА и CaNa3ДТПА хорошо растворимы в воде и, потому, та их часть, которая попадает в кровь, легко выводится из организма через почки [Семенов Д.И., Трегубенко И.П. Комплексоны в биологии и медицине / Свердловск: УНЦ АН СССР, 1984. - 281 с. // Режим доступа: https://www.ipae.uran.ru/sites/default/files/Complexones.pdf; Зорина Л.А. Современное состояние вопроса применения CaNa2ЭДТА при интоксикации свинцом в клинике.- Гиг. Труда. - 1963. - №8. - С. 9-14.].
Кроме того, энтеральный раствор дополнительно содержит комплекс КЦЖК в количестве, обеспечивающем рН раствора в диапазоне значений 4,61-5,8, при их соотношении удельного веса в смеси, близком к физиологическому.
Опытным путем было установлено, что добавление в предлагаемый раствор кислот: молочной, пропионовой и масляной в количестве 0,026-0,092; 0,026-0,063 и 0,013-0,031 мас. % соответственно, закисляют его до значений рН в пределах 4,61-5,8. Добавление указанных кислот больше предлагаемого количества сопряжено со снижением рН раствора ниже 4,61, что является не физиологичным для кишечника, а с учетом использования его больших объемов, необходимых для КЛ, может негативным образом сказаться на состоянии пациента.
Выбор концентраций кислот и их соотношение в смеси сделан с учетом допустимых норм использования этих кислот в пищевой промышленности и их физиологическим содержанием в полости кишечника. По данным Т.Д. Боковой, Н.И. Урсовой и М.Д. Ардатской (2008) референтные значения пропионовой и масляной кислот составляют соответственно 1,79±0,95 и 1,75±0,85 мг/г фекалий [Бокова Т.Д., Урсова Н.И., Ардатская М.Д. Нарушения спектра короткоцепочечных жирных кислот у детей с ожирением и их коррекция с помощью нормофлорина-Д // Режим доступа: http://normoflorin.ru/нарушения-спектра-короткоцепочечных]. При таких концентрационных значениях в результате однократного физиологического опорожнения кишечника удаляется порядка 0,25-0,8 г пропионовой и 0,27-0,78 г масляной кислоты, что составляет всего 5% от их общего пула в кишечнике [Шендеров Б.А. Мишени и эффекты короткоцепочечных жирных кислот // Современная медицинская наука 2013, №1-2 Режим доступа: https://www.researchgate.net/publicatiori/286456237_Effekty_i_miseni_letucih_ztrnyh_kislot].
Молочная (α-оксипропионовая) кислота является натуральным продуктом и может рассматриваться как биологически безопасный продукт, поскольку является естественным метаболитом организма человека, животных и растений, обладает сильным антимикробным действием, способностью подавлять рост гнилостной микрофлоры кишечника, снижать образование токсичных продуктов разложения органических веществ в организме, улучшать обменные процессы, регулировать рН. Пищевая молочная кислота не имеет противопоказаний и разрешена в диете при различных заболеваниях почек, желчного пузыря и поджелудочной железы.
КЦЖК являются естественными метаболитами, образующимися в кишечнике в процессе переработки олиго- и полисахаридов сахаролитической микрофлорой. Закисляя кишечную среду, они тем самым, проявляют свой антагонизм по отношению к протеолитической, в том числе, условно-патогенной флоре, подавляя ее рост [Шендеров, Б.А. Медицинская микробная экология и функциональное питание: в 3-х т. / Б.А. Шендеров. - М.: ГРАНТЪ, 1998. - Т. I: Микрофлора человека и животных и ее функции. - 288 с.]. При уменьшении пула условно-патогенной флоры снижается ее вирулентность и инвазивность. Таким образом, раствор, обогащенный КЦЖК, проявляет пребиотические свойства, способствующие профилактике и устранению воспалительных процессов в кишечнике.
Другим ключевым моментом является то, что в отличие от основной массы эукариотических клеток, которые получают питательные вещества исключительно посредством кровеносной системы, эпителиоциты слизистой оболочки ЖКТ в большей своей части получают питание из полости ЖКТ в виде КЦЖК, являющихся для этих клеток эксклюзивным пищевым (энергетическим) субстратом. Состояния, характеризующиеся дефицитом пищевого субстрата, вызывают атрофию слизистой оболочки ЖКТ. КЦЖК, содержащиеся в предлагаемом энтеральном растворе, могут использоваться эпителиальными клетками кишки в качестве дополнительного энергетического источника. Обеспечение адекватного дополнительного пищевого ресурса в условиях его исходного дефицита способствует росту эпителиоцитов, а, следовательно, ускоренной регенерации слизистой оболочки и заживлению ее дефектов.
В свою очередь, процесс восстановления целостности слизистой оболочки кишечника при ее повреждениях и воспалении чрезвычайно важен в аспекте профилактики и коррекции синдрома избыточной проницаемости кишечного барьера для микробных токсинов и самих патогенов, других биологически активных патологических веществ во внутреннюю среду организма, в том числе, в системный кровоток. Нормализация кишечной проницаемости способствует снижению риска развития внекишечных осложнений воспалительного характера, в том числе, пневмонии.
В предлагаемом растворе масса воды, составляющая в зависимости от прописи из шести вариантов 97,78-98,68 м % от общей массы раствора, обуславливает такую концентрацию солей и кислот, которой соответствует осмолярность раствора в диапазоне 280-310 мОсм/л. Осмолярность раствора зависит от концентрации солей и кислот, при одинаковых весовых значениях которых, их концентрация находится в обратной зависимости от количества воды, необходимого для их растворения. Благодаря осмотическому давлению раствора, близкому (квазиосмотичному) к физиологическим значениям коллоидно-осмотического давления плазмы крови, предупреждается избыточное поступление воды из ЖКТ в сосудистое русло, вследствие чего снижается риск возникновения отеков. Пациентам, склонным к отекам, целесообразно проводить КЛ раствором с максимальной величиной осмолярности - 310 мОсм/л. При значениях осмолярности раствора более 310 мОсм/л, появляется риск образования дефицита воды в организме после КЛ за счет ее перемещения из сосудистого русла в полость ЖКТ, а затем в виде диареи - наружу [Маткевич В.А. Кишечный лаваж // Медицинская токсикология: национальное руководство / Под ред. Е.А. Лужникова. М.: ГЭОТАР-Медицина, 2012. - Гл. 4. - С. 162-186.].
Краткое описание чертежей
Изобретение поясняется иллюстративными материалами, на которых представлена картина ускоренного восстановления слизистой оболочки ЖКТ конкретного пациента (по итогам клинического наблюдения) благодаря применению предлагаемого раствора. На фиг. 1 представлена картина повреждения слизистой оболочки участков пищевода (химический ожог) пациента до начала лечения. На фиг. 2 и 3 представлена картина состояния слизистой оболочки разных отделов пищевода через 5 дней. На фиг. 4 и 5 -состояние слизистой оболочки желудка и 12-типерстной кишки, соответственно, в тот же срок.
Осуществление изобретения
Изготовление КМК и энтерального раствора (ЭР).
Производство предлагаемого раствора может быть осуществлено либо в готовом к употреблению виде, либо в виде полуфабриката - комплекта КМК (концентратов всех ингредиентов, с изолированным размещением от других компонентов магния сульфата (в виде порошка или раствора) и раствора кальция хлорида). Во втором случае, потребитель может приготовить раствор по прилагаемой инструкции сам. КМК может быть изготовлен в виде серии на определенный объем раствора, например, 4,5 или 30 л и т.д. с указанием общей массы ингредиентов и расчетного объема воды.
Энтеральный раствор из КМК готовят следующим образом. КМК, кроме солей магния и кальция, растворяют в 2/3 от заданного объема питьевой очищенной воды, затем добавляют магния сульфат (в виде порошка или раствора) и кальция хлорид в виде раствора. После этого доливают питьевую очищенную воду до заданного объема.
Предлагаемый раствор применяют следующим образом.
I. Кишечный лаваж.
Минимальный объем раствора, необходимый для эффективного промывания ЖКТ взрослого человека, равен 3,0-4,5 л раствора на 1 процедуру. Кишечный лаваж проводится натощак (голодный период должен быть не менее 5-6 часов). Проводить процедуру, особенно первую, лучше утром. Перед употреблением раствор подогревают (до 37-40°C).
Пациент пьет раствор порциями по 150-200 мл через каждые 5 минут. Обычно кишечник начинает самостоятельно опорожняться также порциями после того, как пациенты выпивают 1,5-2,5 л раствора. Процедура продолжается до того момента, когда испражнения становятся прозрачными (они могут быть желтоватого цвета), после чего пациент прекращает пить раствор, но в течение последующих 30-40 минут еще могут быть дефекации, затем кишечные выделения прекращаются. Спустя 1-1,5 часа, пациент должен принять пищу, богатую пищевыми волокнами (предпочтительны каши из цельных нешлифованных зерен на воде без сахара, курага). В дальнейшем пациент питается как обычно, исключая острую, жирную пищу, копчености и алкоголь в течение 2-3 дней.
Средняя продолжительность процедуры составляет 3 часа. После процедуры КЛ пациент может заниматься обычными делами, не опасаясь рецидива диареи.
В случаях, когда пациенты из-за тяжести состояния не могут самостоятельно принимать раствор, специалисты вводят его через зонд.
Показания к кишечному лаважу:
1. Экзо- и эндотоксикоз;
2. Дисбиоз кишечника;
3. Острый и хронический гепатит;
4. Острый и хронический панкреатит;
5. Гастриты, энтероколиты;
6. Дискинезия желчных путей;
7. Запор I-III степени функционального характера;
8. Кишечные инфекционные заболевания;
9. Хронический пиелонефрит;
10. Заболевания с поражением кожи (атопический дерматит, нейродермит, псориаз, экзема, угревая сыпь и др.);
11. Острые и хронические аллергические заболевания;
12. Бронхиальная астма, воспалительные неспецифические бронхолегочные заболевания;
13. Заболевания, связанные с гормональными расстройствами и нарушениями обмена веществ, в том числе, кальциноз (дерматомиозит, склеродермия, оссифицирующий миозит), патологическое окостенение скелета, артриты с отложением солей, отложение кальция в почках;
14. Алкогольный похмельный синдром, запой, абстинентный синдром (в т.ч., алкогольный галлюциноз, делирий);
15. Хронические воспалительные заболевания органов малого таза;
16. Послеоперационные и травматические парезы кишки;
17. Ожоговая болезнь;
18. Лучевая болезнь;
19. Онкологические заболевания;
20. Подготовка к плановым операциям и эндоскопическим исследованиям;
21. Газовая гангрена.
В качестве профилактики заболеваний КЛ рекомендуется лицам:
После стрессов, погрешности в диете, рацион которых содержит недостаточное количество клетчатки, имеющим беспорядочное питание, ведущим малоподвижный образ жизни, склонным к ожирению, подверженным частым простудным заболеваниям, занятым в производстве с вредными для здоровья факторами, имеющим вредные привычки.
Абсолютными противопоказаниями являются кишечная непроходимость механической этиологии (опухоли кишечника, рубцовое сужение кишки, механическое сдавливание кишки извне и др.), желудочно-кишечные и другие внутренние кровотечения, угроза и перфорация полого органа ЖКТ, острый аппендицит, вторая половина беременности, гипертонический криз, острая сердечно-сосудистая патология и легочная недостаточность.
Относительными противопоказаниями являются желче- и мочекаменная болезнь, диабет I типа, обострение геморроя, первая половина беременности, гемофилия.
II. Нутриционная коррекция
Пациент принимает раствор порциями (например, по 200 мл) в течение 1 дня в общем объеме до 1,5 л. При употреблении раствора в объеме более 1,5 литров у взрослого человека может возникнуть диарея, т.е. получиться эффект кишечного лаважа.
Показания:
1. Недостаток электролитов в организме (например, их потеря с обильным потом, при диарее, ассоциированной с кишечной инфекцией и др.);
2. Функциональные расстройства желудочно-кишечного тракта;
3. Ацидоз, в том числе, у спортсменов в период интенсивных физических нагрузок, при алкогольном похмельном синдроме;
4. Шок, в том числе, постгеморрагический;
5. Лучевая болезнь;
6. Послеоперационный период.
Заявленные свойства предлагаемого раствора подтверждаются результатами проведенных исследований.
Под наблюдением находились 19 больных мужского пола в возрасте от 37 до 85 лет с тяжелыми отравлениями прижигающими жидкостями. В 11 случаях отравление было вызвано пероральным приемом щелочи, в 8-и - концентрированной уксусной кислоты. У всех больных с помощью эндоскопического исследования - эзофагогастродуоденоскопии (ЭГДС) был выявлен химический ожог слизистой оболочки рта, глотки, пищевода и желудка. Из общего числа больных у 13-ти имелся ожог желудка 2-3 степени, у 6-ти - 3-4 степени. 11-ти больным, в том числе 3-м с ожогом желудка 3-4 степени, в комплекс лечебных мероприятий был включен КЛ с использованием предлагаемого раствора (наблюдаемая группа). Группу сравнения составили 8 больных, получивших стандартную терапию, которым КЛ осуществляли с помощью СЭР (прототип).
Больным наблюдаемой группы в первые часы химической травмы после назначения обезболивающих и спазмолитических средств и зондового промывания желудка давали пить по 200 мл каждые 5 минут предлагаемый раствор. С учетом специфики отравления (риск кровотечения) в данных случаях раствор не подогревали, его температура составляла 18-22°С. Через 1,5-2 часа у больных появлялась диарея. Промывание ЖКТ проводили до появления из прямой кишки светлых полупрозрачных вод. Общий объем раствора составлял от 3 до 4,5 л. Процедуру КЛ пациенты переносили удовлетворительно, реакций и осложнений не было. В последующие дни в качестве нутриционной коррекции пациентам давали тот же раствор внутрь порциями по 200 мл в общем объеме 1,5-3 л в день.
Сравнительная оценка результатов лечения показала, что у больных наблюдаемой группы на 5-е сутки отмечалась четкая положительная динамика процесса очищения пораженных участков слизистой оболочки пищевода и желудка: исчезли некротические массы, уменьшилась толщина наложений фибрина, появились участки грануляций. В группе сравнения к этому сроку признаков заживления местных дефектов слизистой оболочки пищевода и желудка еще не отмечалось. Частота пневмонии в наблюдаемой и группе сравнения составила 18,2 и 37,5%, соответственно. В группе сравнения умерло 2-е больных, а в наблюдаемой - все остались живы, при этом средний срок госпитализации у них сократился по сравнению с первой группой на 25%.
Таким образом, использование предлагаемого раствора в составе комплексной терапии отравлений прижигающими жидкостями способствует ускорению процессов заживления пораженных участков слизистой оболочки, снижению частоты пневмонии как осложнения отравления на 48,5% и сокращению среднего срока госпитализации.
В качестве примера ускоренного восстановления слизистой оболочки ЖКТ благодаря применению предлагаемого раствора может служить клиническое наблюдение.
Больной Д. 44 лет. Диагноз: Отравление уксусной эссенцией от 17.01.2017 г.
Первое исследование ЭГДС было сделано 18.01.2017 г. при поступлении больного в стационар.
Описание картины ЭГДС: Слизистая пищевода выражено отечная, со сливными циркулярными наложениями светлого фибрина различной плотности. Видны множественные эрозии. Слизистая желудка гиперемирована, отечная с множественными острыми эрозиями до 0,2 см в диаметре с чистым дном. Слизистая 12-перстной кишки со сливными наложениями светлого фибрина. Слизистая постбульбарного отдела также гиперемирована, отечная, определяются множественные линейные язвенные дефекты с чистым дном глубиной до 0,2 см и линейные эрозии с чистым дном.
Заключение: Распространенный эрозивно-язвенный ожоговый эзофагит, распространенный эрозивный ожоговый гастрит, распространенный язвенный ожоговый дуоденит.
На фиг. 1 представлена картина повреждения слизистой оболочки участков пищевода (химический ожог) пациента до начала лечения.
Дополнительно к комплексу стандартной терапии, в первый же день пациенту был проведен КЛ по представленной выше методике, предлагаемым раствором в объеме 4,5 л, приготовленным по второму варианту прописи (удельный вес ингредиентов в м %): Натрия фосфата двузамещенного 12-ти водного - 0,61; натрия хлорида - 0,375; натрия ацетата 3-х водного - 0,074; калия хлорида - 0,168; кислот: лимонной - 0,055, молочной - 0,026, пропионовой - 0,026 и масляной - 0,013; Na2ЭДТА - 0,029, кальция хлорида - 0,164; магния сульфата - 0,137 и питьевой очищенной воды - 98,35.
В последующие 5 дней в качестве нутриционной коррекции пациенту был назначен тот же раствор внутрь порциями по 200 мл в общем объеме 2-3 л в течение дня. Осложнений и побочных явлений не было, переносил прием раствора хорошо. Состояние пациента улучшалось, отмечалась нормализация водно-электролитного баланса. На пятый день лечебных мероприятий пациенту была проведена повторная ЭГДС.
Описание картины ЭГДС от 23.01.2017 г.:
Четкая положительная динамика состояния ожоговой поверхности: пищевод - слизистая умеренно отечная, в верхней трети фибрин фрагментировался, остаются сливные циркулярные наложения светлого фибрина различной плотности в средней трети пищевода, на участке с 35 до 40 см слизистая очистилась от фибрина. Слизистая желудка гиперемирована, умеренна отечная, эрозии эпителизировались. Слизистая 12-перстной кишки гиперемирована, отечная, язвенные дефекты зарубцевались.
На фиг. 2 и 3 представлена картина состояния слизистой оболочки разных отделов пищевода через 5 дней. На фиг. 4 и 5 - состояние слизистой оболочки желудка и 12-типерстной кишки, соответственно, в тот же срок.
Течение заболевания протекало гладко, без осложнений и закончилось выздоровлением.
Предлагаемое техническое решение является новым, так как оно не очевидно из уровня техники. Имеет существенное отличие от прототипа - обеспечивает длительный срок хранения раствора (более 1 года) и сохранение его свойств при нагревании за счет предупреждения образования в нем нерастворимых солей, обеспечивает профилактику отеков после кишечного лаважа без необходимости обязательного лабораторного исследования осмоляльности плазмы крови за счет диапазона осмотического давления раствора, перекрывающего физиологические значения осмоляльности плазмы крови, что исключает избыточное поступление воды во время КЛ из полости ЖКТ в кровь, способствует сокращению срока регенерации слизистой оболочки желудочно-кишечного тракта при ее повреждениях и воспалении, снижению частоты внекишечных осложнений, связанных с повышенной проницаемостью кишечного барьера, за счет пребиотических свойств раствора.
Улучшенные потребительские качества предлагаемого раствора позволяют производить его серийно, длительно хранить и транспортировать, использовать не только в специализированных лечебных учреждениях, но и в других, а также в амбулаторных и полевых условиях, что расширяет сферу его применения, которое более технологично и эргономично в сравнении с прототипом.
Claims (71)
1. Состав для получения кислотно-минеральной композиции, предназначенной для приготовления энтерального раствора для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза, включающей натрия хлорид, калия хлорид, кальция хлорид, сульфат магния, а также соль, выбранную из натрия фосфата одно-, или дву-, или трехзамещенного, калия фосфата одно- или двузамещенного, натрия ацетата, взятых в количестве, обеспечивающем минерализацию энтерального раствора от 10,7 г до 14,0 г на 1 л, Na2ЭДТА или Nа3ДТПА в количестве, препятствующем образованию в растворе нерастворимых солей кальция и магния, а также карбоновые кислоты, выбранные из молочной, масляной, пропионовой и лимонной кислот, взятые в общем количестве, достаточном для поддержания рН раствора в диапазоне значений 4,61-5,8, при следующем соотношении компонентов, мас. %:
Натрия фосфат 3-замещенный 12-водный 35,7-40,48;
Натрия хлорид 17,68-20,03;
Калия хлорид 9,52-10,79;
Кальция хлорид 9,27-10,5;
Магния сульфат 7,73-8,75;
Nа2ЭДТА или Nа3ДТПА 1,5-5,8;
Лимонная кислота безводная 3,1-7,0;
Молочная кислота 1,48-4,9;
Пропионовая кислота 1,48-3,36;
Масляная кислота 0,74-1,68;
или
Натрия фосфат 2-замещенный 12-водный 33,0-36,48;
Натрия хлорид 20,24-22,34;
Натрия ацетат 3-водный 4,0-4,43;
Калия хлорид 9,08-10,03;
Кальция хлорид 8,85-9,77;
Магния сульфат 7,37-8,14;
Nа2ЭДТА или Nа3ДТПА 1,47-5,4;
Лимонная кислота безводная 2,95-4,56;
Молочная кислота 1,4-4,56;
Пропионовая кислота 1,4-3,13;
Масляная кислота 0,71-1,56;
или
Натрия фосфат 1-замещенный безводный 16,29-17,92;
Натрия хлорид 22,34-24,59;
Натрия ацетат 3-водный 18,76-20,64;
Калия хлорид 10,03-11,04;
Кальция хлорид 9,77-10,75;
Магния сульфат 8,14-8,96;
Na2ЭДTA или Nа3ДТПА 1,63-5,95;
Молочная кислота 1,56-5,0;
Пропионовая кислота 1,56-3,44;
Масляная кислота 0,78-1,72;
или
Натрия хлорид 29,63-32,73;
Натрия ацетат 3-водный 19,32-21,35;
Калия хлорид 2,24-2,47;
Калия фосфат 1-замещенный 14,91-16,48;
Кальция хлорид 10,17-11,24;
Магния сульфат 8,47-9,36;
Na2ЭДТА или Na3ДТПА 1,69-6,22;
Молочная кислота 1,63-5,24;
Пропионовая кислота 1,63-3,59;
Масляная кислота 0,81-1,8,
или
Натрия фосфат 1-замещенный безводный 5,99-6,71;
Натрия хлорид 30,82-34,5;
Натрия ацетат 3-водный 9,72-10,88;
Калия фосфат 2-замещенный 3-водный 15,51-17,36;
Кальция хлорид 9,99-11,18;
Магния сульфат 8,32-9,31;
Na2ЭДТА или Na3ДТПА 1,66-6,18;
Лимонная кислота безводная 3,33-5,22;
Молочная кислота 1,6-5,22;
Пропионовая кислота 1,6-3,58;
Масляная кислота 0,8-1,79;
или
Натрия фосфат 2-замещенный безводный 16,85-19,09;
Натрия хлорид 25,13-28,46;
Натрия ацетат 3-водный 4,98-5,64;
Калия хлорид 11,28-12,78;
Кальция хлорид 10,99-12,45;
Магния сульфат 9,16-10,37;
Na2ЭДТА или Na3ДТПА 1,83-6,89;
Лимонная кислота безводная 3,66-5,81;
Молочная кислота 1,76-5,81;
Пропионовая кислота 1,76-3,98;
Масляная кислота 0,88-1,99.
2. Состав по п. 1, характеризующийся тем, что кальция хлорид и магния сульфат изолированы друг от друга и от смеси других компонентов.
3. Энтеральный раствор для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза, включающий кислотно-минеральную композицию, полученную из компонентов по п. 1, и питьевую очищенную воду, при этом очищенная вода содержится в количестве, обеспечивающем осмолярность раствора в интервале значений 280-310 мОсм/л.
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2019103048A RU2713175C1 (ru) | 2019-02-04 | 2019-02-04 | Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза |
| EP19914572.3A EP3845226A4 (en) | 2019-02-04 | 2019-12-27 | ACID-MINERAL COMPOSITION FOR ENTERAL SOLUTION |
| PCT/RU2019/001036 WO2020162788A1 (ru) | 2019-02-04 | 2019-12-27 | Кислотно-минеральная композиция для энтерального раствора |
| US17/419,856 US12246035B2 (en) | 2019-02-04 | 2019-12-27 | Acid-mineral composition for an enteral solution |
| CN201980088572.0A CN113347966A (zh) | 2019-02-04 | 2019-12-27 | 肠溶用酸性矿物组合物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2019103048A RU2713175C1 (ru) | 2019-02-04 | 2019-02-04 | Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2713175C1 true RU2713175C1 (ru) | 2020-02-04 |
Family
ID=69624989
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019103048A RU2713175C1 (ru) | 2019-02-04 | 2019-02-04 | Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US12246035B2 (ru) |
| EP (1) | EP3845226A4 (ru) |
| CN (1) | CN113347966A (ru) |
| RU (1) | RU2713175C1 (ru) |
| WO (1) | WO2020162788A1 (ru) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999064017A1 (en) * | 1998-06-12 | 1999-12-16 | Gordon Ian L | Method and system for production and collection of lavage induced stool (lis) for chemical and biologic tests of cells |
| RU2178696C2 (ru) * | 2000-03-22 | 2002-01-27 | Маткевич Виктор Анатольевич | Энтеральная смесь для кишечного лаважа, коррекции метаболических расстройств организма, профилактики и лечения дисбактериоза кишечника |
| RU2473330C1 (ru) * | 2011-12-09 | 2013-01-27 | Александр Павлович Погромов | Средство для кишечного лаважа |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9007967D0 (en) * | 1990-04-09 | 1990-06-06 | Nycomed As | Compounds |
| RU2190412C2 (ru) | 2000-02-03 | 2002-10-10 | Московский городской научно-исследовательский институт скорой помощи им. Н.В.Склифосовского | Способ детоксикации организма |
| CN101804068B (zh) * | 2006-03-06 | 2012-05-02 | 桑苏君 | 聚乙二醇-电解质口服溶液 |
| US9433660B2 (en) * | 2012-08-03 | 2016-09-06 | Msm Innovations, Inc | Method and kit for bowel preparation |
| AU2014229330B2 (en) * | 2013-03-15 | 2018-08-09 | Allergan Pharmaceuticals International Limited | Composition containing digestive enzymes and nutrients suitable for enteral administration |
| RU2536994C1 (ru) * | 2013-05-17 | 2014-12-27 | Общество С Ограниченной Ответственностью "Нпо "Нефрон" | Концентрированный кислотный компонент, набор для его получения, концентрированный раствор кислотного компонента для получения гемодиализирующего раствора и способ его получения |
| WO2016015055A1 (en) * | 2014-07-25 | 2016-01-28 | Ironwood Pharmaceuticals, Inc. | Colon cleansing compositions |
| CN104997816B (zh) * | 2015-08-04 | 2019-01-25 | 成都普睿法药物研发有限公司 | 改善胃肠道功能的松花粉组合物及其用途 |
| CN109096885A (zh) * | 2018-07-20 | 2018-12-28 | 马玉玲 | 一种零部件表面防腐防锈剂 |
-
2019
- 2019-02-04 RU RU2019103048A patent/RU2713175C1/ru active
- 2019-12-27 CN CN201980088572.0A patent/CN113347966A/zh active Pending
- 2019-12-27 US US17/419,856 patent/US12246035B2/en active Active
- 2019-12-27 WO PCT/RU2019/001036 patent/WO2020162788A1/ru active IP Right Grant
- 2019-12-27 EP EP19914572.3A patent/EP3845226A4/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999064017A1 (en) * | 1998-06-12 | 1999-12-16 | Gordon Ian L | Method and system for production and collection of lavage induced stool (lis) for chemical and biologic tests of cells |
| RU2178696C2 (ru) * | 2000-03-22 | 2002-01-27 | Маткевич Виктор Анатольевич | Энтеральная смесь для кишечного лаважа, коррекции метаболических расстройств организма, профилактики и лечения дисбактериоза кишечника |
| RU2473330C1 (ru) * | 2011-12-09 | 2013-01-27 | Александр Павлович Погромов | Средство для кишечного лаважа |
Non-Patent Citations (1)
| Title |
|---|
| БЕРДНИКОВ Г.А. И ДР. Кишечный лаваж как метод детоксикации в комплексной терапии деструктивного панкреатита// ВЕСТНИК НОВЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ, 2007, т. XIV, N4, с.45. * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220072033A1 (en) | 2022-03-10 |
| US12246035B2 (en) | 2025-03-11 |
| CN113347966A (zh) | 2021-09-03 |
| EP3845226A4 (en) | 2022-06-15 |
| WO2020162788A1 (ru) | 2020-08-13 |
| EP3845226A1 (en) | 2021-07-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9216247B2 (en) | Buffered compositions for dialysis | |
| Cowe et al. | Neonatal convulsions caused by withdrawal from maternal clomipramine | |
| Feriani et al. | Randomized long-term evaluation of bicarbonate-buffered CAPD solution | |
| US4289750A (en) | Therapy of conditions which may be associated with altered renal function and dosage forms therefor | |
| Misel et al. | Sodium benzoate for treatment of hepatic encephalopathy | |
| Onishi et al. | Catharticinduced fatal hypermagnesemia in the elderly | |
| Yu et al. | Acute peritoneal dialysis in very low birth weight neonates using a vascular catheter | |
| RU2713175C1 (ru) | Кислотно-минеральная композиция и энтеральный раствор в.а. маткевича для лаважа желудочно-кишечного тракта и/или коррекции нарушений гомеостаза | |
| Farah | Fatal acute sodium phosphate enemas intoxication | |
| Lobo et al. | Basic concepts of fluid and electrolyte therapy | |
| Yusupov et al. | Features of perioperative management of children with diffuse appendicular peritonitis. | |
| US12251400B2 (en) | Liquid concentrates of calcium and magnesium | |
| Chambers | Fluid and electrolyte problems in renal and urologic disorders | |
| Chesney et al. | Pre-and postoperative fluid management in infancy | |
| Tkachenko et al. | Іntroduction to infusion therapy | |
| Boen | Peritoneal dialysis: a clinical study of factors governing its effectiveness | |
| Aguilar-García et al. | Successful treatment with sodium thiosulfate for calcific uraemic arteriolopathy | |
| Tong et al. | Iron poisoning | |
| Ishchenko et al. | Emergency care kidney disease in children | |
| Ashley | Acute kidney injury | |
| Verrina et al. | Technical aspects of the peritoneal dialysis procedure | |
| RU2250771C2 (ru) | Способ восстановительного лечения больных хроническим пиелонефритом | |
| Chan et al. | Electrolyte and acid‐base disturbances | |
| Koletzko | Nutritional Support in Pediatric Patients | |
| Resontoc et al. | 20 Chronic Peritoneal Dialysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| HE4A | Change of address of a patent owner |
Effective date: 20201221 |