RU2711080C2 - Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение - Google Patents
Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение Download PDFInfo
- Publication number
- RU2711080C2 RU2711080C2 RU2015122789A RU2015122789A RU2711080C2 RU 2711080 C2 RU2711080 C2 RU 2711080C2 RU 2015122789 A RU2015122789 A RU 2015122789A RU 2015122789 A RU2015122789 A RU 2015122789A RU 2711080 C2 RU2711080 C2 RU 2711080C2
- Authority
- RU
- Russia
- Prior art keywords
- composition
- aerosol
- aerosol composition
- volume
- composition according
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/55—Protease inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/44—Oils, fats or waxes according to two or more groups of A61K47/02-A61K47/42; Natural or modified natural oils, fats or waxes, e.g. castor oil, polyethoxylated castor oil, montan wax, lignite, shellac, rosin, beeswax or lanolin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0078—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a nebulizer such as a jet nebulizer, ultrasonic nebulizer, e.g. in the form of aqueous drug solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/008—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy comprising drug dissolved or suspended in liquid propellant for inhalation via a pressurized metered dose inhaler [MDI]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/12—Aerosols; Foams
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/12—Aerosols; Foams
- A61K9/124—Aerosols; Foams characterised by the propellant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Dispersion Chemistry (AREA)
- Pulmonology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Otolaryngology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Gastroenterology & Hepatology (AREA)
- Oncology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к медицине и описывает фармацевтический комбинированный аэрозольный состав пропеллентного типа белковых олигопептидных или полипептидных соединений из группы ингибиторов протеолитических ферментов с антивирусным, противомикробным или противовоспалительным веществом, взятыми в растворе с содержанием воды не более 10% от объема состава и суммарным количеством указанных активных веществ 0,001-50 мг на 1 мл состава. Состав также содержит ингредиенты выталкивающей смеси – глицерол, этанол и озонсберегающий водонерастворимый пропеллент, взятые в объемном соотношении 0,01-40:0,01-7,99:50,0-99,7%, соответственно, от объема состава. Фармацевтический состав получали поэтапным смешиванием указанных активных веществ с каждым последующим ингредиентом выталкивающей смеси, а именно: глицеролом, этанолом и озонсберегающим водонерастворимым препеллентом. Изобретение обеспечивает фармацевтический аэрозольный состав, который позволяет сохранять полезные свойства пропеллентной системы и биологические функции активных веществ. Созданный аэрозольный состав может применяться при лечении заболеваний, сопровождающихся нарушением протеолитического баланса. 9 з.п. ф-лы, 6 ил., 5 табл., 10 пр.
Description
Изобретение относится к медицине и посвящено созданию фармацевтических аэрозолей с активными веществами белковой природы с выталкивающими пропеллентными системами для лечения заболеваний у людей.
Известна трехкомпонентная выталкивающая система «Модулит», состоящая из водонерастворимого пропеллента, глицерола и этанола [Ganderton et al., 2002]. Основными медицинскими пропеллентами нового поколения из группы озон-сберегающих (свободных от хлорсодержащих флюорокарбонов; CFC-free - chlorofluorocarbons free) служат 134А (1,1,1,2-тетрафторэтан) и 227 (1,1,1,2,3,3,3-гептафторпропан). Однако для медицинского применения системы Модулит в аэрозольной композиции не установлено, каким образом и в каком соотношении нужно соединить перечисленные компоненты и/либо каким образом получить замещение водной фазы, чтобы сохранить активное вещество полипептидной природы и создать гомогенную смесь при наличии водной фазы, в которой растворен белковый ингибитор протеаз. Не известно, каким образом предотвратить денатурацию белковой или полипептидной молекулы ингибитора протеаз на разделе фаз под воздействием пропеллента и этанола. Не известно, каким образом устранить токсический эффект раздражения слизистых оболочек органов этанолом, входящим в состав выталкивающей системы.
Молекулы белков плохо растворимы в указанных флюорокарбоновых смесях и быстро денатурируют, теряя нативную структуру и активность при смешивании с указанными поверхностно активными веществами. Для достижения технического результата, заключающегося в создании нетоксичных аэрозолей с физиологически активными белковыми и полипептидными молекулами предложено уникальное соотношение указанных компонентов и активного вещества и специфический порядок их приготовления и смешивания, позволяющий (1) сохранить сорастворимость компонентов, (2) сохранить аэрозоль-генерирующие свойства многокомпонентной композиции, (3) сохранить биологические свойства активного белкового вещества и (4) снизить токсические и воспалительные эффекты генерируемого аэрозоля на органы человека и животных.
Известен способ лечения гриппа и других респираторных инфекций аэрозолем ингибиторов протеаз, преимущественно апротинина, приготовленным из водного раствора или его сухого вещества [патент РФ 2054851]. Апротинин, ингибитор широкого спектра протеаз, который является природным низкомолекулярным полипептидом, состоящим из 58 аминокислот (мол. масса 6 кД) [Trautschold et al., 1983]. Однако в этом патенте не описано каким образом можно приготовить аэрозольный состав, содержащий в качестве активного ингредиента белковый или полипептидный ингибитор протеаз, а в качестве выталкивающей силы водонерастворимый озон-сберегающий пропеллент, чтобы состав гомогенно смешивался, не денатурировал и не инактивировал белковую и полипептидную молекулу ингибитора.
Известен патент РФ №2425691 «Аэрозольный препарат на основе апротинина для лечения вирусных инфекций». Первое, патент не может рассматриваться в качестве прототипа, так как содержит недостоверные и несоответствующие действительности (сфальсифицированные) данные о его медицинской применимости. Второе, в этом патенте соотношения ингредиентов таковы, что его использование ограничено из-за высокого денатурирующего потенциала на высокомолекулярные белки и полипептиды и выраженное воспалительное и токсическое действие на клеточные структуры. Эти задачи решены в настоящем изобретении, которое описывает уникальную композицию и процедуру поэтапного приготовления и смешивания для получения аэрозольного состава, позволяющего повысить сорастворимость компонентов, снизить денатурирующий эффект аэрозольного состава на активное вещество, применить для антипротеазных белков и полипептидов и уменьшить токсичность для клеток и тканей. Для сохранения активного вещества и повышения гомогенности (сорастворимости) аэрозольного состава в изобретении использован новый принцип частичного или полного замещения водной фазы поверхностно-активными веществами.
Известны дозирующие аэрозольные устройства, состоящие из контейнера с покрытием, устойчивым к озон-сберегающим пропеллентам, и дозирующим приспособлением (головкой), выпускающим определенное количество аэрозоля за одно нажатие клапана. Например, устройства такого типа производят фирмы Bespack, Ovar 3М Pharmaceuticals и др. Фармацевтический аэрозольный состав высвобождается из устройства путем его распыления через выходное отверстие под действием выталкивающей силы пропеллента. Задачей изобретения являлось создание универсальной аэрозольной композиции, содержащей активное вещество полипептидной природы из группы ингибиторов протеаз и их комбинаций и выталкивающую систему с пропеллентом, включая водонерастворимые озон-сберегающие пропелленты, пригодную для использования в различных дозирующих аэрозольных устройствах, обладающую низким денатурирующим потенциалом, лишенную токсичности и раздражающего действия на клеточные структуры органов и тканей.
Грипп и другие респираторные инфекции вирусной и бактериальной природы приносят огромный вред здоровью человека. Для лечения гриппа и ОРВИ известен аэрозоль порошка занамивира, ингибитора нейраминидазы, для ингаляций у гриппозных больных [Moscona 2005]. Аэрозольный занамивир ингибирует размножение вируса в респираторном тракте посредством ингибирования его нейраминидазы, но не действует на патогенез самой болезни. Хорошо известно, что в патогенезе респираторных инфекций, включая гриппозную инфекцию, развивается нарушение протеолитического баланса в респираторном тракте [Kido et al., 2007]. Для коррекции этого нарушения предлагается применение новой аэрозольной композиции ингибиторов протеаз белковой и полипептидной природы, состоящей из аминокислот и их дериватов, с использованием озон-сберегающих пропеллентов посредством прямого воздействия на очаг инфекции в респираторном тракте аэрозольной формой ингибиторов протеаз. Воздействие аэрозоля ингибитора протеаз объединяет три действия. Во-первых, блокируется размножение вируса за счет ингибирования протеазной активации вирусных белков. Во-вторых, подавляется патогенез заболевания за счет снижения уровня вредных протеаз непосредственно в очаге и в инфицированном организме. В-третьих, за счет повышения количеств глицерола и снижения спирта усиливаются адгезивные свойства и снижается токсическое воздействие активного вещества на респираторный тракт. В результате, в отличие от сухого аэрозоля занамивира, влажный аэрозоль ингибиторов протеаз оказывает бинарное антивирусное и патогенетическое лечебное действие. Для усиления лечебного эффекта ингибиторов протеаз впервые предлагается их комбинированное использование в аэрозольном составе в смеси с веществами, обладающими антивирусным, противомикробным и/или противовоспалительным действием, такими как, рибавирин, римантадин, релезенза, интерферон, ацетилсалициловая кислота, фавипиравир, триазавирин (группа триазидов), их аналоги и др.
Предлагаемый аэрозольный состав разработан на основе водонерастворимых озон-сберегающих пропеллентов, преимущественно134А (1,1,1,2-тетрафторэтана) и 227 (1,1,1,2,3,3,3-гептафторпропан), не содержащих хлора и поэтому оказывающих сниженное окислительного действия на полипептидные молекулы. Разработанный состав пригоден для использования в аэрозольных устройствах ручного типа, генерирующих влажный нетоксичный аэрозоль активного протеазного ингибитора белковой и полипептидной структуры. Такое аэрозольное устройство позволяет (1) оптимизировать индивидуальное (каждым больным) применение фармацевтического белкового аэрозоля, (2) снижать кросс-контаминацию инфекции среди людей и (3) минимизировать токсическое воздействие аэрозоля на слизистые мембраны органов и тканей.
Разработанный фармацевтический аэрозольный состав ингибиторов протеаз пригоден для широкого медицинского применения, поскольку нарушение протеолитического баланса, требующее коррекции ингибиторами протеаз, развивается при многих заболеваниях человека и животных. В частности, антипротеазный аэрозольный состав найдет применение при таких заболеваниях, как респираторные инфекции, кератоконъюнктивиты вирусной и бактериальной этиологии, герпетические поражения слизистых оболочек и кожи, хроническая обструктивная бронхопневмония, астма, муковисцидоз, заживление ран и других.
Примеры реализации изобретения
Пример 1. Получение аэрозольного состава из водного раствора ингибиторов, их комбинаций и озон-сберегающего пропеллента.
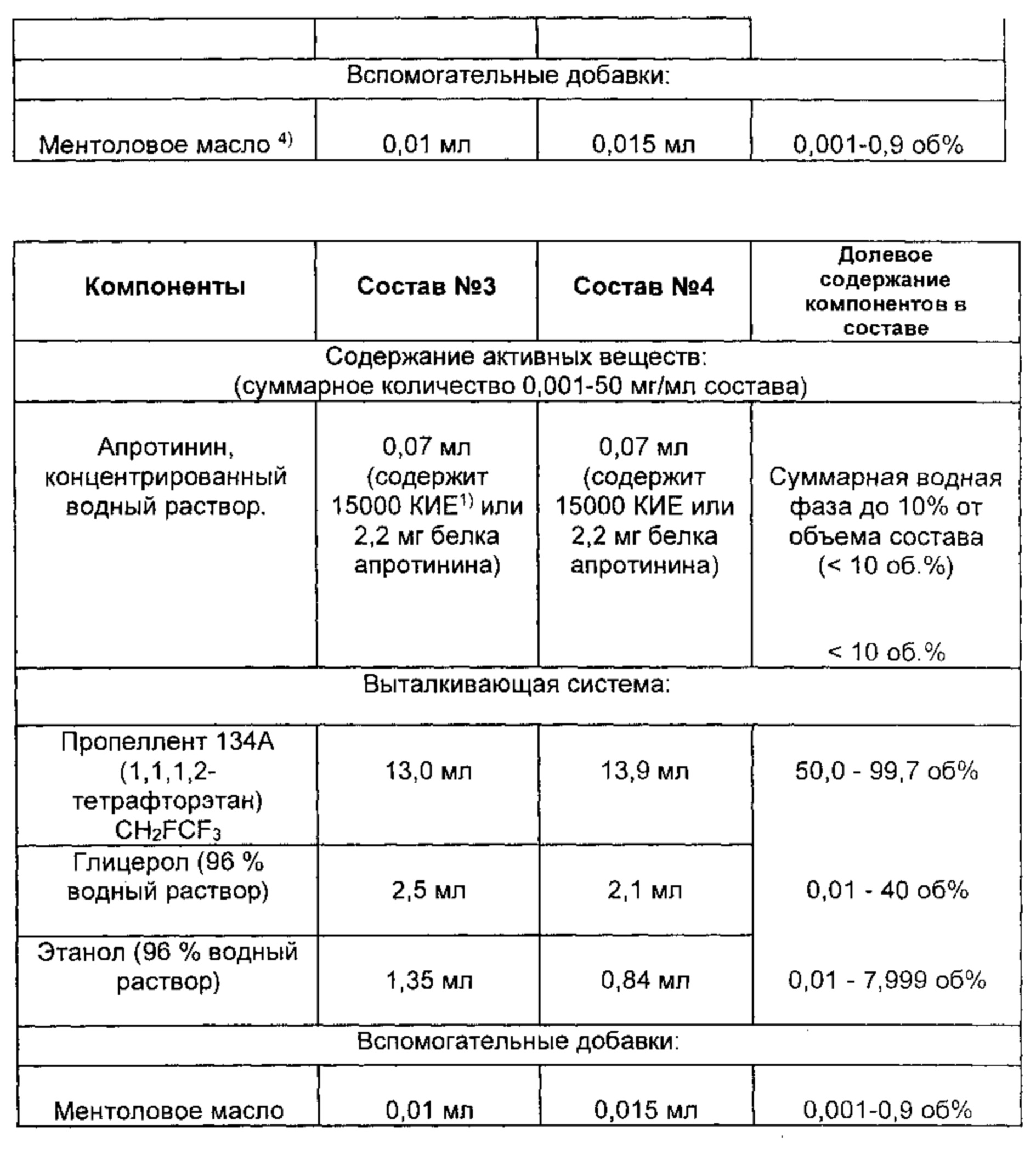
В качестве примера аэрозольного состава приведен состав N1. Для его получения проводят последовательное смешивание, когда раствор активного вещества из группы ингибиторов протеаз и антипротеазных олигопептидов или их комбинаций поэтапно смешивают с каждым последующим ингредиентом выталкивающей смеси. А именно, один за другим смешивают индивидуальные компоненты в следующей последовательности и соотношениях: 0,07 мл водного раствора (или раствора с добавлением этанола, глицерола, диметилсульфоксида и др.), содержащего 2,2 мг белка (или 15000 Калликреин Ингибирующих Единиц (КИЕ)) белка апротинина, в него вносят 2,5 мл 96% водного раствора глицерола и перемешивают; далее в полученную смесь вносят 1,3 мл 96% этанола и к полученной смеси добавляют 0,01 мл ментолового масла и на заключительном этапе при постоянном помешивании добавляют 13,0 мл пропеллента 134А под давлением в герметичной емкости или при пониженной температуре. В качестве дополнительного примера приведен аэрозольный состава N2, который получен смешиванием компонентов в отличающихся пропорциях согласно прописи в таблице 1. В качестве примера комбинаций ингибиторов протеаз приведен состав, приготовленный на основе апротинина и рибавирина -вещества с широким спектром противовирусного действия и ацетилсалициловой кислоты (АСК) - вещества, обладающего противовоспалительным действием. Соотношения ингредиентов в аэрозольном составе показаны в Таблице 1.
Полученный аэрозольный состав разливают либо под давлением, либо при пониженной температуре в баллоны, снабженные выпускным отверстием с диаметром от 0,1 до 0,5 мм и клапаном. Заполненные баллоны хранят при температуре 18-20 град. Цельсия (С) в течение 0,5, 2 или 5 лет. Диапазон необходимой лечебной концентрации ингибитора протеаз в аэрозольном составе установлен экспериментальным путем на основании курсовой дозы аэрозольных ингаляций апротинина в клинических испытаниях, выполненных на пациентах с различными формами гриппа и ОРВИ.
Пример 2. Полипептидные ингибиторы протеаз медицинского назначения и их комбинации.
Пример иллюстрирует список различных ингибиторов протеаз полипептидной природы, а также антипротеазных олигопептидов, состоящих из двух и более аминокислотных остатков, их модифицированных производных или их комбинаций, которые растворяют в водно-глицерино-спиртовой фазе предлагаемого аэрозольного состава, приготовленной согласно изобретения, для использования в качестве активного компонента в фармацевтическом аэрозольном составе. Указанные ингибиторы протеаз могут применяться для коррекции патологических процессов и различных форм воспаления.
Перечисленные антипротеазные ингибиторы используют в аэрозольном составе в комбинации с фармацевтическими веществами, имеющими другой механизм противовирусного и лечебного патогенетического действия. В группу дополнительных фармацевтически активных веществ, включены преимущественно римантадин, рибавирин, фавипиравир, занамивир, триазавирин (группа триазидов), интерферон, ацетилсалициловая кислота, антибиотики и др.
Пример 3. Отсутствие физической денатурации аэрозольного состава.
Чтобы оценить смешиваемость ингредиентов в полученных образцах аэрозольного состава, исследовали оптические свойства, т.е. прозрачность раствора. С этой целью аэрозольный состав выпускали из баллона путем открытия клапана и выпуска аэрозоля в пробирки объемом 15 мл. Сразу после выпуска порцию собранного раствора переносили в кювету для измерения (объемом 0,5 мл) и определяли оптическую плотность раствора в потоке видимого света на спектрофотометре Ultraspec-2 (Pharmacia, Швеция). Оптическую плотность (прозрачность) аэрозольного раствора сравнивают с оптической плотностью дистиллированной воды, которую принимают за нулевое значение. Тестируют три порции аэрозольного состава: из полного баллона (выпуски номер 10-40), выпуски 120-150 (наполовину заполненный баллон); выпуски 190-240 (последняя фракция баллона), которые смешивают. Устройство содержит около 25 мл аэрозольного состава, что позволяет сделать около 250 выпусков объемом 85 мкл каждый. Результаты оптической плотности аэрозольного состава трех фракций приведены в таблице 3.
Аэрозольный раствор, генерированный из ранних и поздних фракций баллона, имеет полную прозрачность подобно дистиллированной воде. Этот результат указывает на хорошую совместимость компонентов и отсутствие преципитации компонентов и взвешенных частиц в аэрозольном составе и в генерируемом аэрозоле.
Пример 4. Биофизическая стабильность ингибитора протеаз в аэрозольном составе.
Биофизические свойства протеазного ингибитора тестируют методом фракционирования белков в полиакриламидном геле в электрическом поле, так называемым электрофорезом полипептидов в полиакриламидном геле (ПАГЭ). Тестированию подвергаются образцы аэрозольного состава, хранившихся 0,5 и 5 лет при температуре 18-22°С. Для проведения тестирования получают порции аэрозольного состава, как описано в разделе 3.
Из собранных порций аэрозольного состава отбирают равные ал и квоты (15 мкл), которые смешивают с 5 мкл диссоциирующего раствора, содержащего 5% додецилсульфата натрия (ДСН) и 200 мкМ дитиотреитола (ДТТ), нагревают в течение 10 мин при 70°С и наносят на гель. Фокусирующий и разделительный гели полимеризуют с помощью системы катализаторов - персульфат аммония (0,05%) и тетраметилэтилен диамина (ТЕМЕД; 0,2%) в буферной системе по методу Laemmli (1970). Электрофорез проводят при 70V на пластину ПАГ шириной 8 см в течение 2 часов. После окончания электрофореза полипептиды в геле окрашивают Кумаси Голубым R-350 (0,1%), который растворяли в смеси вода: этанол: уксусная кислота в соотношении по объему 5:5:1 в течение 2 часов при комнатной температуре. Не связавшуюся краску отмывают из геля в смеси вода: этанол: уксусная кислота с соотношением 88: 5: 7, соответственно. Для сравнения в качестве стандартного образца апротинина используют коммерческий препарат очищенного апротинина, выделенного из легких крупного рогатого скота (фирма Sigma, США).
На фигуре 1 показаны результаты анализа образцов аэрозольного состава №1 и №5, полученных после хранения в течение 0,5 и 5 лет при комнатной температуре (18-22 град. С). Первое, апротинин из аэрозольного состава имел типичный профиль электрофоретической подвижности для полипептида с молекулярной массой около 6 кД, и полностью соответствовал по электрофоретическим характеристикам стандартного апротинина. Второе, в образцах аэрозоля апротинина не обнаружено высокомолекулярных белковых агрегатов в высокомолекулярной зоне (ВМЗ), соответствующей мол. массе150-250 кДа (показана на фигуре 1 в рамке на вершине разделительного геля). В зоне агрегатов не выявлялось заметных количеств белка в образцах, 5 лет. Таким образом, протеазный ингибитор в монокомпонентном и комплексном аэрозольном составе сохраняет свои исходные структурные свойства и не формирует агрегаты в процессе хранения и при его последующем распылении.
После электрофореза проводят количественную оценку белков в геле методом сканирования геля. Для этого гель окрашивают Кумаси голубым и сканируют в видимом свете при помощи сканера ScanJet 6300. Оценку интенсивности белковых пятен на сканограмме определяют с помощью программы, позволяющей регистрировать оптическую плотность (ОП) участков. Используя полученные величины ОП, рассчитывают отношения площадей участков сканируемой зоны для апротинина и примесных белков в высокомолекулярной зоне, соответствующей молекулярным массам от 150 до 250 кДа. Интенсивность основного пика апротинина (молекулярная масса около 6500 дальтон) принимают за 100%.
где: А - оптическая интенсивность высокомолекулярной зоны (ВМЗ);
В - оптическая интенсивность пятна апротинина;
N - процент высокомолекулярных примесей.
Количество белка в высокомолекулярной зоне не превышает 3%.
Пример 5. Иммунологическая стабильность ингибитора протеаз в аэрозольном составе.
Иммунологические свойства протеинового ингибитора протеаз в аэрозольном составе тестируют по его взаимодействию со специфическими антителами по методу «вестерн блот». Исследуют три образца: стандартный апротинин (фирма Sigma, США) и аэрозольный состав из баллона, хранившегося 0,5 и 5 года при температуре 20-22 градуса С (фигура 2). После электрофореза а ПАГе белки из геля переносят на нитроцеллюлозную протрановую мембрану с диаметром пор 0,45 микрон (фирма Shleiher & Schull, Германия) и далее адсорбированный на мембране белок тестируют по взаимодействию со специфическими к апротинину антителами. Взаимодействие на мембране апротинина с антителами идентифицируют методом усиленной хемилюминесценции с помощью коньюгата пероксидазы со вторичным анти-видовым антителом. В качестве субстрата на пероксидазу используют коммерческий препарат фирмы Pierce (США) и его свечение регистрируют на рентгеновской пленке Kodak (США). Первое, апротинин стандарта и обоих исследованных образцов аэрозольного состава хорошо взаимодействует с антителами против апротинина, что указывает на его иммунологическую стабильность в аэрозольном составе. Второе, после 5-летнего хранения белкового ингибитора протеаз сохраняет способность реагировать со специфическими анти-апротининовыми антителами. Этот результат показывает, что ингибитор протеаз сохраняет нативную иммунологическую структуру при хранении аэрозольного состава в течение 5 и более лет.
Пример 6. Сохранение антипротеазной активности ингибиторов протеаз в аэрозольном составе.
Антипротеазную активность аэрозольного состава проверяют по его способности ингибировать гидролитическую функцию трипсина. Для этого устанавливают стандартное количество стандартного препарата трипсина (Sigma; США), которое расщепляет хромогенный субстрат L-ZAPA (Z-Arg-pNA; ВАСНЕМ, Швейцария) с образованием нитроанилида (NA) с интенсивностью желтого окрашивания около 0,8 единиц при длине волны 405 нм (ОП405). Это количество соответствует 100 нг трипсина при общем объеме реакционной смеси 150 мкл. Далее это количество трипсина в объеме 50 мкл смешивают с серийными разведениями образцов аэрозольного состава (объем 50 мкл) и инкубируют 30 мин при температуре 20°С для связывания апротинина с трипсином и его ингибирования. После этого в смесь вносят субстрат L-ZAPA (25 мкл раствора с концентрацией 1 мг/мл), инкубируют 15 мин при 20°С и гидролитическую реакцию останавливают добавлением 25 мкл 1М раствора соляной кислоты и измеряют ОП 405 для определения остаточной активности трипсина (фигура 3). Для расчета молярного соотношения трипсина и ингибитора протеаз, при котором происходит 50% ингибирование трипсина, определяют концентрации белка трипсина и ингибитора в исходных растворах. Для определения концентрации ингибиторного белка используют стандартную методику Брэдфорда, в которой в качестве стандарта берут бычий сывороточный альбумин (Sigma, США) и Кумаси голубой G-250 (Sigma, США). Учитывая фактор разведения тестируемого аэрозольного состава, при котором отмечалось 50% снижение ОП405 высвободившегося субстратного нитроанилида, рассчитывают молярное соотношение трипсин/апротинин.
Кривые титрования протеазного ингибитора в аэрозольном составе сразу после приготовления смеси и через 5 лет хранения приведены на фигуре 3. Как показывают исследования, 50% ингибирование трипсина наблюдается с исходным веществом апротининового ингибитора при молярном соотношении трипсин/ингибитор = 1/1. При тестировании аэрозольного состава наблюдается сходная анти-трипсиновая активность апротинина и 50% ингибирование (на фигуре 3 показано стрелкой) также регистрируется при молярном соотношении трипсин/апротинин = 1/1. Таким образом, это тестирование показывает, что ингибитор протеаз остается стабильным в аэрозольном составе и устойчиво сохраняет антипротеазную активность на исходном уровне в процессе хранения в течение 5 лет.
Пример 7. Аэрозольная композиция ингибиторов протеаз с мульти-фазной смесью поверхностно-активных веществ (ПАВ)
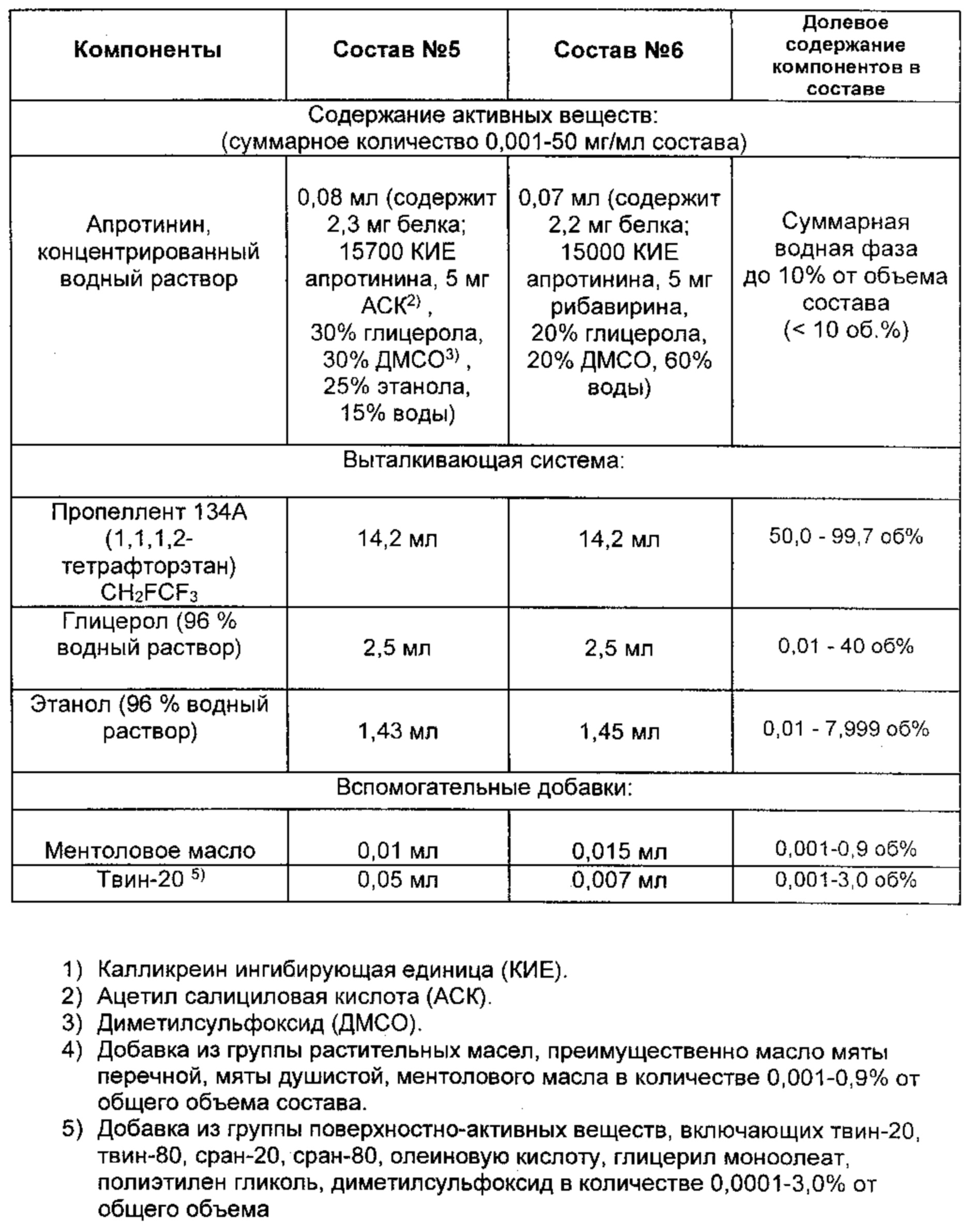
Водный либо диметилсульфоксидный (ДМСО) раствор ингибиторов протеаз, содержащий полипептидный апротинин, леупептин (олигопептидный ингибитор: acetyl-Leu-Leu-Arg-aldehyde, цистатин (Sigma, США)), либо альфа1-антитрипсин (серпин) (Boehringer, Германия) с концентрацией 1 и 2 мг сухого вещества на мл раствора, поэтапно смешивают с водным раствором 99% раствора глицерола (FisherBiotech, США) и 96% этанола медицинской квалификации. Тестируют 4 диапазона соотношения ингредиентов, А-Г. После инкубации в течение 1 часа при 20 град. С определяют антипротеазную активность по ингибированию гидролитической активности трипсина (таблица 4). Гидролитическую активность трипсина (антипротеазная активность) определяют по способности расщеплять хромогенный субстрат L-zapa (фирма ВАСНЕМ, Швейцария) по методике, описанной выше в примере 6. Положительной реакцией ингибирования считают результат, при котором в пробе с тестируемым образцом ингибитора определяют уменьшение оптического сигнала свободного нитроанилида на 20% и более по сравнению с контрольной пробой трипсина без ингибитора. Установлено, что смешивание белковых и полипептидных ингибиторов протеаз с трехфазной водно-глицеро-спиртовой смесью или четырехфазной (водно-глицеро-спирто-диметилсульфоксидной) смесью сохраняет их активность полностью или частично.
Пример 8. Сохранение противовирусной активности ингибитора протеаз в аэрозольном составе.
Антивирусные свойства аэрозольного состава тестировали по главному патогенетическому критерию расщепления вирусного белка НА0 и его ингибированию при размножении вируса гриппа человека A/Puerto Rico/34 (H1N1) и A/Aichi/2/68 (H3N2) в куриных эмбрионах. 9-дневные куриные эмбрионы заражали путем введения вируса в аллантоисную полость эмбриона в количестве около 1000 вирусных частиц. Сразу после заражения в аллантоисную полость эмбриона дополнительно вводили исследуемый аэрозольный состав. После 24 часов инкубации эмбрионов при 37°С получали аллантоисную жидкость из куриных эмбрионов и исследовали количество накопившегося синтезируемого инфекционного вируса и белковый состав вируса.
Чтобы доказать фармацевтическое и антивирусное действие аэрозольного состава исследовали белковый состав вируса, синтезируемого в куриных эмбрионах в присутствии аэрозольного состава. Образцы аллантоисной жидкости (АЖ) подвергали 2-ух этапному центрифугированию для очистки вирусных частиц. Для осаждения вируса образцы АЖ центрифугировали в ультрацентрифуге Spinko L7-50 (ротор SW 55.1) при 27000 об/мин в течение 2,5 часов в пробирке объемом 5,5 мл, на дно которой подслаивали 2 мл 18% раствора сахарозы, приготовленного на фосфатном буфере (ФБ: 10 мМ Na2HPO4/NaH2PO4 рН 7,2; 2,7 мМ KCl; 137 мМ NaCl). Полипептиды вирусных осадков подвергали электрофорезу в ПАГе, по методу Laemmli (1970), описанному выше в разделе 3, и анализировали техникой вестерн-блот (ВБ) с антителами к белку НА. С этой целью белки из геля переносили на нитроцеллюлозную мембрану (Protran; Shleiher & Schull, Германия) в буфере для полусухого переноса белков (0,05 M трис; 0,01 M глицин; рН 9,7; 0,01% ДСН; 17,5% этанол). После переноса мембрану насыщали в течение ночи в 3% растворе обезжиренного молока коров и далее инкубировали в течение 1 часа при температуре 20°С в ФБ, содержащем 0,5% БСА и антитела морской свинки против вирусного белка НА, и образованные на мембране иммунные комплексы идентифицировали с помощью пероксидазного коньюгата против иммуноглобулина свинки («Pierce»; США) методом усиленной хемилюминесценции (ECL) с ECL-субстратом («Pierce; США).
Известно, что полипептид НА0 входит в состав неинфекционных вирионов, тогда как НА1 делает вирионы инфекционными. Переход НА0→НА1 осуществляется трипсиновыми протеазами, на которые направлено действие активного вещества - ингибитора протеаз. Профиль полипептидов НА0 (мол. вес 75 kD) и НА1 (мол. вес 55 kD) в препаратах вируса показан на фигуре 4. апротинина. В эмбрионах, не обработанных аэрозольным составом, в составе вируса выявлялся в активный НА1 (около 95%), что указывало на образование инфекционного вируса в таких эмбрионах. Напротив, в вирусе из эмбрионов, обработанных аэрозольным составом, преобладал нерасщепленный НА0 (около 50%), что показало преимущественное накопление неинфекционного вируса в этих эмбрионах. Аэрозольный состав ингибитора протеаз сохраняет антивирусную функцию и после 5-летнего хранения и блокирует активацию вируса гриппа посредством ингибирования расщепления НА0→HΑ1.
Для оценки влияния аэрозольного состава на размножение вируса сравнивали урожай инфекционного вируса в куриных эмбрионах, обработанных и не обработанных аэрозольным составом. Тестировали аэрозольный состав, хранившийся 5 месяцев и 5 лет при комнатной температуре (18-22°С) (таблица 5). Урожай вируса определяли по общепринятой методике титрования инфекционного вируса методом инфекционных фокусов в клеточной культуре МДСК. Каждый образец аэрозольного состава вводили в 3 эмбриона и исследовали урожай вируса независимо в каждом из эмбрионов. Результаты приведены в таблице 5. Как видно, оба образца аэрозольного состава из баллонов оказывали выраженное вирус-ингибирующее действие и снижали в 100 и более раз накопление инфекционного вируса. Эти результаты доказывают, что аэрозольный состав ингибитора протеаз обладает фармацевтической антивирусной активностью по подавлению размножения инфекционного вируса и эта активность состава сохраняется на высоком исходном уровне в течение, по крайней мере, 5 лет хранения.
Пример 9. Отсутствие токсичности аэрозольного состава
Токсичность аэрозольного состава проверяли на развивающихся куриных эмбрионах. Критерием оценки токсичности служили время вылупления эмбрионов из яйца и наличие геморрагических и анатомических аномалий у эмбрионов. Первое, установлено, что во всех группах эмбрионов, получавших и не получавших аэрозольный состав, все эмбрионы вылуплялись в положенный срок 21-22 дня инкубации при 37 град. С (фигура 5). Второе, у вылупившихся цыплят во всех группах не выявлено каких-либо геморрагий и аномалий развития при наблюдении в течении 10 дней после вылупления. Эти данные показывают отсутствие токсичности у аэрозольного состава ингибитора протеаз, приготовленного согласно изобретения.
Пример 10. Профиль дисперсности аэрозольного облака при распылении аэрозольного состава.
Исследуют пригодность аэрозольного состава для генерирования мелкодисперсного аэрозоля за счет выталкивающей силы пропеллента. Определение проводят микроскопически после выпуска аэрозоля на стекло. Аэрозольный баллон встряхивают и распыляют 1 дозу на чистую обезжиренную матрицу, расположенную перпендикулярно направлению распыления на расстоянии 7 см от выходного отверстия устройства. Определение величины влажных частиц осуществляют с помощью микроскопа при 450-кратном увеличении сразу после напыления аэрозоля на стекло. Диаметр частиц определяют на матрице, имеющей размеченную сетку. Подсчет проводят на 10 полях зрения (фигура 6). Измерение проводят 3 раза из одного баллона на разных сроках выпуска аэрозоля, в испытании используют 3 баллона, рассчитывают распределение частиц по фракциям с определенным диапазоном по диаметру частиц в процентах от общего количества частиц на стекле в поле зрения. Аэрозольное облако, генерированное из аэрозольного состава ингибитора протеаз, имело преимущественный диапазон дисперсности от 0,5 до 240 мкм, пригодный для медицинского применения.
Литературные источники
1. Патент РФ 2054180 «Способ лечения вирусных респираторных инфекций, аэрозоль для его осуществления» приоритет 21 августа 1991 г.
2. Ganderton D, Lewis D, Davies R, Meakin B, Brambilla G, Church T. 2002. Modulite: a means of designing the aerosols generated by pressurized metered dose inhalers. Respir Med. 96 Suppl D:S3-8.
3. Moscona A. 2005. Oseltamivir resistance - disabling our influenza defenses. N Engl J Med. 353(25):2633-6.
4. Патент РФ 2425691 «Аэрозольный препарат на основе апротинина для лечения вирусных респираторных инфекций» приоритет 10 июня 2010 г.
5. Trautschold I., Werle Ε., Zickgraf-Rudel G. 1967. Trasylol. Biochem. Pharmacol. 16: 59-72.
6. Kido H, Okumura Y, Yamada H, Le TQ, Yano M. Proteases essential for human influenza virus entry into cells and their inhibitors as potential therapeutic agents. Curr Pharm Des. 2007; 13(4):405-14. Review. PubMed PMID: 17311557.
7. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15; 227(5259):680-5. PubMed PMID: 5432063.
Перечень и описание фигур
Фигура 1. Структурная стабильность ингибитора протеаз в аэрозольном составе. Пробы стандартного апротининового ингибитора и образцов аэрозольного состава, хранившегося 0,5 и 4 года, подвергали электрофорезу в 15% ПАГе. После фракционирования гели окрашивали Кумаси голубым R350 и фотографировали в обычном свете. Маркерные белки смесь фирмы Fermentas (Латвия) (дорожка 1) показаны стрелками слева. Дорожки 4-11, аэрозольные составы 1,2,3,5, хранившиеся 0,5 и 4 года, соответственно. Дорожки 2,3 -стандартный апротинин, хранившийся 0.5 и 4 года, соответственно. Зона высокомолекулярных агрегатов показана рамкой.
Фигура 2. Иммунологическая стабильность ингибитора протеаз в аэрозольном составе.
Образцы стандартного апротинина (пробы А) и аэрозольного состава (пробы В и С), хранившиеся 0,5 и 5 лет подвергали электрофорезу в 15% ПАГе и анализировали техникой вестерн-блот (ВБ) с антителами к белку апротинина. Количество нанограмм (нг) белка, нанесенное на дорожку геля, указано под дорожками. Для регистрации белков, реагирующих с антителами к апротинину, использовали методику усиленной хемилюминесценции (ECL) с пероксидазным субстратом фирмы Pierce (США). Белковые компоненты апротинина (А) и маркерных стандартов показаны стрелками справа и слева, соответственно. Фигура 3. Антипротеазная активность аэрозольного состава. Различные количества аэрозольного состава в объеме 50 мкл, полученного через 0,5 и 5 лет после хранения, смешивали с 50 мкл 0,15 M фосфатного буфера (ФБ), содержащего 100 нг трипсина, инкубировали в течение 30 мин при температуре 20 град.С и в смесь вносили 25 мкл субстрата L-zapa (1 мг/мл), инкубировали 30 мин при 20 град.С и реакцию останавливали раствором гидрохлористой кислоты. Остаточную активность трипсина в пробе определяли по интенсивности расщепления субстрата по окраске (ОД) высвободившегося нитроанилида при 405 нм. По оси ординат отложены средние значения ОД405 по трем независимым измерениям; по оси абсцисс показаны количества белка (нг) апротинина в пробе. - стандартный апротинин, хранение в течение: - 0,5 года, - 2 года, - 5 лет.
Фигура. 4. Ингибирование протеолиза вирусного белка НА0→HΑ1 аэрозольным составом.
9-дневные куриные эмбрионы заражают вирусом гриппа A/Aichi/68 (H3N2) и вводят 75 мкл аэрозольного состава, полученного через 0,5 (четные дорожки) и 3-летнего хранения (нечетные дорожки). После 24 часов инкубации эмбрионов при 37 град, тестируют белки HA0 и НА1 в вирусе из эмбрионов методом ПАГ и вестерн-блот (ВБ) с антителами к белку НА. Приведены пробы, полученные из 9 эмбрионов (номера сверху). Под фигурой указаны количественное соотношение НА0/НА1 в вирусе, суммарное содержание НА0+НА1 принято за 100%. Дорожка 1 - контрольный эмбрион без аэрозольного состава. Исследовали стандартный апротинин (дор. 2, 3) и аэрозольные составы №1 (4, 5), №3 (6, 7) и №5 (8, 9). Фигура 5. Отсутствие токсичности у аэрозольного состава для развивающихся куриных эмбрионов.
Образцы аэрозольного состава согласно таблице №1 вводили ежедневно в аллантоисную полость 7-дневных куриных эмбрионов в объеме 0,25 мл в течение 7 дней. В каждую группу брали по 10 эмбрионов. Определяли срок вылупления эмбриона в исследуемых группах. Количество вылупившихся эмбрионов показано на оси ординат, номер аэрозольного состава показан на оси абсцисс. №5 - контрольные эмбрионы (без ингибитора). Серый столбик - 21-ый, черный столбик - 22-ой день инкубации.
Фигура 6. Профиль дисперсности аэрозоля.
По оси ординат показано содержание (%) фракции в аэрозольном облаке, состав №3. По оси ординат отложены диапазоны диаметра частиц в аэрозольном облаке: 1 - (0,5-10 мкм); 2 - (10-50 мкм); 3 - 50-100 мкм); 4 - (100-240 мкм); 5 - (>250 мкм).
Claims (10)
1. Фармацевтический комбинированный аэрозольный состав пропеллентного типа, содержащий комбинацию активных веществ, включающую, по меньшей мере, вещество из группы ингибиторов протеаз олигопептидной и полипептидной природы, с добавлением антивирусного, противовоспалительного или противомикробного вещества, взятыми в растворе с содержанием воды не более 10% от объема состава и суммарным количеством указанных активных веществ 0,001-50 мг на 1 мл состава, и ингредиенты выталкивающей смеси - глицерол, этанол и озонсберегающий водонерастворимый пропеллент, взятые в объемном соотношении 0,01-40:0,01-7,99:50,0-99,7%, соответственно, от объема состава, при этом фармацевтический состав получали поэтапным смешиванием указанных активных ингредиентов с каждым последующим ингредиентом выталкивающей смеси, а именно: глицеролом, этанолом и озоноберегающим водонерастворимым пропеллентом, позволяющий за счет выталкивающей силы пропеллента через устройство с клапаном генерировать нетоксичный аэрозоль совместного фармацевтического действия комбинации указанных активных веществ.
2. Состав по п. 1, отличающийся тем, что активное вещество выбрано из группы ингибиторов протеаз полипептидной природы, преимущественно из апротинина, альфа 2-антиплазмина, альфа 1-антитрипсина, антитрипсина, серпина или лейкоцитарного секреторного ингибитора.
3. Состав по п. 1, отличающийся тем, что активное вещество выбрано из группы антипротеазных олигопептидов, состоящих из двух и более аминокислотных остатков и их модифицированных производных.
4. Состав по п. 1, отличающийся тем, что содержит дополнительные антивирусные вещества, преимущественно рибавирин, фавипиравир, занамивир, триазид, римантадин.
5. Состав по п. 1, отличающийся тем, что содержит дополнительные противовоспалительные вещества, преимущественно интерферон, ацетилсалициловую кислоту.
6. Состав по п. 1, отличающийся тем, что содержит дополнительные противомикробные вещества, преимущественно из группы антибиотиков.
7. Состав по п. 1, отличающийся тем, что содержит смесь активных веществ, приготовленную в водосодержащем растворе с количеством воды не более 10% от объема состава и дополнительно одного или нескольких поверхностно-активных веществ, взятых в суммарном количестве до 100% от объема раствора.
8. Состав по п. 1, отличающийся тем, что содержит фторсодержащий озонсберегающий пропеллент, преимущественно А134 или 227.
9. Состав по п. 1, отличающийся тем, что дополнительно содержит одну или несколько добавок из группы растительных масел, включающих ментоловое масло, масло мяты перечной, мяты душистой, в количестве 0,001-0,9% от общего объема.
10. Состав по п. 1, отличающийся тем, что содержит одну или несколько добавок из группы поверхностно-активных веществ, преимущественно твин-20, твин-80, спан-20, спан-80, олеиновую кислоту, глицерил моноолеат, полиэтиленгликоль, диметилсульфоксид, в количестве 0,001-3,0% от общего объема.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015122789A RU2711080C2 (ru) | 2015-06-15 | 2015-06-15 | Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015122789A RU2711080C2 (ru) | 2015-06-15 | 2015-06-15 | Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2015122789A RU2015122789A (ru) | 2017-01-10 |
| RU2015122789A3 RU2015122789A3 (ru) | 2019-03-13 |
| RU2711080C2 true RU2711080C2 (ru) | 2020-01-15 |
Family
ID=57955743
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015122789A RU2711080C2 (ru) | 2015-06-15 | 2015-06-15 | Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2711080C2 (ru) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2738885C1 (ru) * | 2020-04-30 | 2020-12-18 | Андрей Александрович Иващенко | Противо-SARS-CoV-2 вирусное средство Антипровир |
| RU2740657C1 (ru) * | 2020-05-15 | 2021-01-19 | Общество С Ограниченной Ответственностью "Промомед Рус" | Противовирусная композиция |
| RU2742116C1 (ru) * | 2020-08-21 | 2021-02-02 | Общество с ограниченной ответственностью "Авирон" ( ООО "Авирон") | Противокоронавирусное средство для комбинированной терапии COVID-19 (SARS-CoV-2). |
| RU2745986C1 (ru) * | 2020-08-21 | 2021-04-05 | Общество с ограниченной ответственностью "Авирон" (ООО "Авирон") | Противокоронавирусное средство для комбинированной терапии COVID-19 (SARS-CoV-2) и способ лечения |
| RU2746161C1 (ru) * | 2020-08-21 | 2021-04-08 | Общество с ограниченной ответственностью "Авирон" (ООО "Авирон") | Фармацевтический набор для комбинированной терапии COVID-19 (SARS-CoV-2) и способ его применения |
| WO2022039619A1 (ru) * | 2020-08-21 | 2022-02-24 | Александр Васильевич ИВАЩЕНКО | Противовирусное средство для комбинированной терапии covid-19 (sars-cov-2) |
| RU2781097C1 (ru) * | 2021-05-12 | 2022-10-05 | Олег Петрович Жирнов | Фармацевтический аэрозольный состав поливалентного действия |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2054180C1 (ru) * | 1991-08-21 | 1996-02-10 | Жирнов Олег Петрович (н/п) | Способ лечения вирусных респираторных инфекций |
| RU2425691C1 (ru) * | 2010-07-15 | 2011-08-10 | ВАКЕ спол с.р.о. | Аэрозольный препарат на основе апротинина для лечения вирусных респираторных инфекций |
| RU2657523C2 (ru) * | 2011-11-03 | 2018-06-14 | Олег Петрович Жирнов | Фармацевтический аэрозольный состав ингибиторов протеаз с озон-сберегающим пропеллентом и его получение |
-
2015
- 2015-06-15 RU RU2015122789A patent/RU2711080C2/ru not_active Application Discontinuation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2054180C1 (ru) * | 1991-08-21 | 1996-02-10 | Жирнов Олег Петрович (н/п) | Способ лечения вирусных респираторных инфекций |
| RU2425691C1 (ru) * | 2010-07-15 | 2011-08-10 | ВАКЕ спол с.р.о. | Аэрозольный препарат на основе апротинина для лечения вирусных респираторных инфекций |
| RU2657523C2 (ru) * | 2011-11-03 | 2018-06-14 | Олег Петрович Жирнов | Фармацевтический аэрозольный состав ингибиторов протеаз с озон-сберегающим пропеллентом и его получение |
Non-Patent Citations (7)
| Title |
|---|
| Жирнов О.П. и др. Лечебный эффект аэрозольной формы апротинина при гриппе, Эпидемиология и инфекционные болезни, т.19, N 6, 2014, стр.10 - 15. * |
| ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения АЭРУС (AERUS), регистрационный номер ЛСР-000280/10 - 02.07.14. * |
| Н.Н.Мещерякова. Модулит - новая технология в дозированных аэрозольных ингаляторах, Журнал Атмосфера. Пульмонология и аллергология, Ингаляционная терапия, 2, 2006, стр.40-42. * |
| Н.Н.Мещерякова. Оптимизация терапии бронхиальной астмы: принцип Модулит, Журнал "Справочник поликлинического врача", том 04/ N 7/ 2006, стр.38-42. * |
| О.П.Жирнов и др. Апротинин, ингибитор протеаз, - новая альтернатива в лечении гриппа; Российский медицинский журнал, N 2, 2012, стр.52-56. * |
| О.П.Жирнов и др. Апротинин, ингибитор протеаз, - новая альтернатива в лечении гриппа; Российский медицинский журнал, N 2, 2012, стр.52-56. Жирнов О.П. и др. Лечебный эффект аэрозольной формы апротинина при гриппе, Эпидемиология и инфекционные болезни, т.19, N 6, 2014, стр.10 - 15. О.П.Жирнов и др. Патогенетическое лечение гриппа с помощью аэрозольной формы апротинина, ингибитора протеаз, Биопрепараты, Октябрь-Декабрь 2015, стр.59-64. Н.Н.Мещерякова. Оптимизация терапии бронхиальной астмы: принцип Модулит, Журнал "Справочник поликлинического врача", том 04/ N 7/ 2006, стр.38-42. Н.Н.Мещерякова. Модулит - новая технология в дозированных аэрозольных ингаляторах, Журнал Атмосфера. Пульмонология и аллергология, Ингаляционная терапия, 2, 2006, стр.40-42. * |
| О.П.Жирнов и др. Патогенетическое лечение гриппа с помощью аэрозольной формы апротинина, ингибитора протеаз, Биопрепараты, Октябрь-Декабрь 2015, стр.59-64. * |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2738885C1 (ru) * | 2020-04-30 | 2020-12-18 | Андрей Александрович Иващенко | Противо-SARS-CoV-2 вирусное средство Антипровир |
| EP4144360A4 (en) * | 2020-04-30 | 2024-05-15 | Andrey Alexandrovich Ivashchenko | AGENT AGAINST THE SARS-COV-2 VIRUS ANTIPTOVIR |
| RU2740657C1 (ru) * | 2020-05-15 | 2021-01-19 | Общество С Ограниченной Ответственностью "Промомед Рус" | Противовирусная композиция |
| RU2742116C1 (ru) * | 2020-08-21 | 2021-02-02 | Общество с ограниченной ответственностью "Авирон" ( ООО "Авирон") | Противокоронавирусное средство для комбинированной терапии COVID-19 (SARS-CoV-2). |
| RU2745986C1 (ru) * | 2020-08-21 | 2021-04-05 | Общество с ограниченной ответственностью "Авирон" (ООО "Авирон") | Противокоронавирусное средство для комбинированной терапии COVID-19 (SARS-CoV-2) и способ лечения |
| RU2746161C1 (ru) * | 2020-08-21 | 2021-04-08 | Общество с ограниченной ответственностью "Авирон" (ООО "Авирон") | Фармацевтический набор для комбинированной терапии COVID-19 (SARS-CoV-2) и способ его применения |
| WO2022039619A1 (ru) * | 2020-08-21 | 2022-02-24 | Александр Васильевич ИВАЩЕНКО | Противовирусное средство для комбинированной терапии covid-19 (sars-cov-2) |
| RU2781097C1 (ru) * | 2021-05-12 | 2022-10-05 | Олег Петрович Жирнов | Фармацевтический аэрозольный состав поливалентного действия |
| RU2783282C1 (ru) * | 2021-09-06 | 2022-11-11 | Общество С Ограниченной Ответственностью "Промомед Рус" | Противовирусная фармацевтическая композиция, содержащая фавипиравир и аминокислоту, лекарственное средство, ее содержащее, а также их применение для лечения и/или профилактики вирусных инфекций |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2015122789A3 (ru) | 2019-03-13 |
| RU2015122789A (ru) | 2017-01-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2711080C2 (ru) | Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение | |
| KR101660363B1 (ko) | 인플루엔자를 억제하는 조성물 및 방법 | |
| US20090298797A1 (en) | Combination therapy for the treatment of influenza | |
| Ohman et al. | Cytosolic RNA recognition pathway activates 14-3-3 protein mediated signaling and caspase-dependent disruption of cytokeratin network in human keratinocytes | |
| AU2010306840A1 (en) | Recombinant human CC10 protein for treatment of influenza | |
| RU2657523C2 (ru) | Фармацевтический аэрозольный состав ингибиторов протеаз с озон-сберегающим пропеллентом и его получение | |
| Figueira et al. | Mucus-targeting therapies of defective mucus clearance for cystic fibrosis: a short review | |
| PL217628B1 (pl) | Zastosowanie resweratrolu do wytwarzania leku wywierającego działanie inhibitorowe na replikację wirusa grypy do zapobiegania i/lub leczenia infekcji wywołanej wirusem grypy | |
| US8222204B2 (en) | Influenza inhibiting compositions and methods | |
| EA040577B1 (ru) | Комбинированный аэрозольный состав на основе ингибиторов протеаз и его получение | |
| KR20220033450A (ko) | 니클로사마이드를 포함하는 항인플루엔자 바이러스용 조성물 | |
| RU2750933C1 (ru) | Способ тестирования биологической активности аэрозольных препаратов | |
| CZ265896A3 (en) | Tryptase inhibitor, its use and pharmaceutical compositions containing thereof | |
| DE202012013134U1 (de) | Pharmazeutische Aerosolformulierung von Protease-Inhibitoren und deren Zubereitung | |
| KR20080015775A (ko) | 천식 뮤린 모델에서 인슐린 유사 성장 인자 결합단백질-3(igfbp-3)에 의한 기도 과민성 및 염증차단 | |
| US20240293350A1 (en) | Development of an innovative inhalation formulation of nafamostat mesylate for the management of covid-19 | |
| KR102192576B1 (ko) | 다브라페닙을 유효성분으로 포함하는 알레르기 질환 예방, 치료 또는 개선용 조성물 | |
| Canário | Orchestrating Osteoclast Differentiation Through ROS and Mitochondrial Regulation: Developing new approaches for osteoporosis treatment | |
| AU2008269081B2 (en) | Influenza inhibiting compositions and methods | |
| MXPA96004207A (en) | Novedous remedy for tractor pyrrato viral disease | |
| Bulek | Effect of pulmonary surfactant on innate immune responses in influenza virus infected human airway epithelial cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| FA93 | Acknowledgement of application withdrawn (no request for examination) |
Effective date: 20180618 |
|
| FZ9A | Application not withdrawn (correction of the notice of withdrawal) |
Effective date: 20180815 |