RU2665373C2 - Налмефен для уменьшения потребления алкоголя у конкретных целевых популяций - Google Patents
Налмефен для уменьшения потребления алкоголя у конкретных целевых популяций Download PDFInfo
- Publication number
- RU2665373C2 RU2665373C2 RU2014151156A RU2014151156A RU2665373C2 RU 2665373 C2 RU2665373 C2 RU 2665373C2 RU 2014151156 A RU2014151156 A RU 2014151156A RU 2014151156 A RU2014151156 A RU 2014151156A RU 2665373 C2 RU2665373 C2 RU 2665373C2
- Authority
- RU
- Russia
- Prior art keywords
- alcohol
- patient
- nalmefene
- day
- patients
- Prior art date
Links
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 title claims abstract description 205
- WJBLNOPPDWQMCH-MBPVOVBZSA-N Nalmefene Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=C)O)CC1)O)CC1CC1 WJBLNOPPDWQMCH-MBPVOVBZSA-N 0.000 title claims abstract description 124
- 229960005297 nalmefene Drugs 0.000 title claims abstract description 123
- 230000009467 reduction Effects 0.000 title description 4
- 238000011282 treatment Methods 0.000 claims abstract description 38
- 208000007848 Alcoholism Diseases 0.000 claims abstract description 25
- 201000007930 alcohol dependence Diseases 0.000 claims abstract description 23
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 claims description 12
- 208000024891 symptom Diseases 0.000 claims description 12
- 239000002775 capsule Substances 0.000 claims description 10
- 239000006186 oral dosage form Substances 0.000 claims description 9
- 230000001154 acute effect Effects 0.000 claims description 8
- 238000009223 counseling Methods 0.000 claims description 8
- 229940005483 opioid analgesics Drugs 0.000 claims description 8
- 241000995051 Brenda Species 0.000 claims description 7
- 208000026251 Opioid-Related disease Diseases 0.000 claims description 7
- 150000003839 salts Chemical class 0.000 claims description 7
- 206010019663 Hepatic failure Diseases 0.000 claims description 6
- 208000001647 Renal Insufficiency Diseases 0.000 claims description 6
- 238000001784 detoxification Methods 0.000 claims description 6
- NSNHWTBQMQIDCF-UHFFFAOYSA-N dihydrate;hydrochloride Chemical class O.O.Cl NSNHWTBQMQIDCF-UHFFFAOYSA-N 0.000 claims description 6
- 230000001965 increasing effect Effects 0.000 claims description 6
- 201000006370 kidney failure Diseases 0.000 claims description 6
- 208000007903 liver failure Diseases 0.000 claims description 6
- 231100000835 liver failure Toxicity 0.000 claims description 6
- 201000005040 opiate dependence Diseases 0.000 claims description 6
- 206010010904 Convulsion Diseases 0.000 claims description 5
- 206010048010 Withdrawal syndrome Diseases 0.000 claims description 5
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical class N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 claims description 4
- 208000004547 Hallucinations Diseases 0.000 claims description 4
- 239000002253 acid Substances 0.000 claims description 4
- 239000000014 opioid analgesic Substances 0.000 claims description 4
- 206010012225 Delirium tremens Diseases 0.000 claims description 3
- 239000003814 drug Substances 0.000 abstract description 21
- 230000000694 effects Effects 0.000 abstract description 15
- 230000035622 drinking Effects 0.000 abstract description 11
- 239000000126 substance Substances 0.000 abstract description 2
- 235000019441 ethanol Nutrition 0.000 description 212
- 238000000034 method Methods 0.000 description 58
- 230000002354 daily effect Effects 0.000 description 46
- 230000008859 change Effects 0.000 description 32
- 239000000902 placebo Substances 0.000 description 22
- 229940068196 placebo Drugs 0.000 description 22
- 230000001419 dependent effect Effects 0.000 description 19
- 238000012216 screening Methods 0.000 description 18
- 229940079593 drug Drugs 0.000 description 14
- 230000002085 persistent effect Effects 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 10
- 230000003203 everyday effect Effects 0.000 description 10
- 239000008194 pharmaceutical composition Substances 0.000 description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 239000004480 active ingredient Substances 0.000 description 6
- 238000011156 evaluation Methods 0.000 description 6
- 230000036541 health Effects 0.000 description 5
- 208000029650 alcohol withdrawal Diseases 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 239000012458 free base Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000003745 diagnosis Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 230000002459 sustained effect Effects 0.000 description 3
- 206010053164 Alcohol withdrawal syndrome Diseases 0.000 description 2
- 206010012218 Delirium Diseases 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 125000002066 L-histidyl group Chemical group [H]N1C([H])=NC(C([H])([H])[C@](C(=O)[*])([H])N([H])[H])=C1[H] 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 108090000137 Opioid Receptors Proteins 0.000 description 2
- 102000003840 Opioid Receptors Human genes 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 239000012752 auxiliary agent Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000006735 deficit Effects 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 229940126601 medicinal product Drugs 0.000 description 2
- 229960003086 naltrexone Drugs 0.000 description 2
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 208000007232 portal hypertension Diseases 0.000 description 2
- 208000020016 psychiatric disease Diseases 0.000 description 2
- 239000000018 receptor agonist Substances 0.000 description 2
- 229940044601 receptor agonist Drugs 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000004229 Alkannin Substances 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 208000020401 Depressive disease Diseases 0.000 description 1
- 239000004230 Fast Yellow AB Substances 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000004233 Indanthrene blue RS Substances 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- HLMSIZPQBSYUNL-IPOQPSJVSA-N Noroxymorphone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4 HLMSIZPQBSYUNL-IPOQPSJVSA-N 0.000 description 1
- 239000004235 Orange GGN Substances 0.000 description 1
- 239000004237 Ponceau 6R Substances 0.000 description 1
- 239000004236 Ponceau SX Substances 0.000 description 1
- 101100244562 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) oprD gene Proteins 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- 239000004231 Riboflavin-5-Sodium Phosphate Substances 0.000 description 1
- 238000007239 Wittig reaction Methods 0.000 description 1
- 239000004234 Yellow 2G Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 235000019232 alkannin Nutrition 0.000 description 1
- 239000004191 allura red AC Substances 0.000 description 1
- 235000012741 allura red AC Nutrition 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000004176 azorubin Substances 0.000 description 1
- 235000012733 azorubine Nutrition 0.000 description 1
- 239000004161 brilliant blue FCF Substances 0.000 description 1
- 235000012745 brilliant blue FCF Nutrition 0.000 description 1
- 239000004106 carminic acid Substances 0.000 description 1
- 235000012730 carminic acid Nutrition 0.000 description 1
- 239000001679 citrus red 2 Substances 0.000 description 1
- 235000013986 citrus red 2 Nutrition 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 235000019788 craving Nutrition 0.000 description 1
- 239000004148 curcumin Substances 0.000 description 1
- 108700023159 delta Opioid Receptors Proteins 0.000 description 1
- 102000048124 delta Opioid Receptors Human genes 0.000 description 1
- 230000003001 depressive effect Effects 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000004174 erythrosine Substances 0.000 description 1
- 235000012732 erythrosine Nutrition 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 235000019233 fast yellow AB Nutrition 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 235000019239 indanthrene blue RS Nutrition 0.000 description 1
- 239000004179 indigotine Substances 0.000 description 1
- 235000012738 indigotine Nutrition 0.000 description 1
- 102000048260 kappa Opioid Receptors Human genes 0.000 description 1
- 230000002045 lasting effect Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000008450 motivation Effects 0.000 description 1
- 102000051367 mu Opioid Receptors Human genes 0.000 description 1
- 235000019236 orange GGN Nutrition 0.000 description 1
- 239000004177 patent blue V Substances 0.000 description 1
- 235000012736 patent blue V Nutrition 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000004175 ponceau 4R Substances 0.000 description 1
- 235000012731 ponceau 4R Nutrition 0.000 description 1
- 235000019238 ponceau 6R Nutrition 0.000 description 1
- 235000019237 ponceau SX Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 239000004172 quinoline yellow Substances 0.000 description 1
- 235000012752 quinoline yellow Nutrition 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 239000004180 red 2G Substances 0.000 description 1
- 235000012739 red 2G Nutrition 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 235000019234 riboflavin-5-sodium phosphate Nutrition 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000004173 sunset yellow FCF Substances 0.000 description 1
- 235000012751 sunset yellow FCF Nutrition 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000004149 tartrazine Substances 0.000 description 1
- 235000012756 tartrazine Nutrition 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 235000019235 yellow 2G Nutrition 0.000 description 1
- 108020001588 κ-opioid receptors Proteins 0.000 description 1
- 108020001612 μ-opioid receptors Proteins 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Emergency Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Addiction (AREA)
- Psychiatry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Steroid Compounds (AREA)
Abstract
Изобретение относится к применению налмефена в лечении алкогольной зависимости у пациента с алкогольной зависимостью, где указанное применение уменьшает потребление алкоголя, при этом указанный пациент имеет уровень риска, связанный с употреблением алкоголя (DRL), составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин; и у указанного пациента сохраняется высокий DRL, составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после периода наблюдения, следующего за начальным оцениванием, составляющего 1-2 недели. 14 з.п. ф-лы, 12 ил., 6 табл.
Description
Область изобретения
Настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя. Настоящее изобретение также относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется высокий DRL после периода наблюдения, следующего за начальным оцениванием.
Предпосылки изобретения
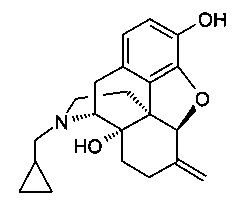
Налмефен [17-(циклопропилметил)-4,5-альфа-эпокси-6-метиленморфинан-3,14-диол] имеет следующую общую формулу:
и может быть получен при помощи способов, хорошо известных в данной области, например, путем первоначального получения налтрексона из нороксиморфона, как описано в WO 2012/059103, и последующего получения налмефена из налтрексона, например, с помощью реакции Виттига, как описано в WO 2010/136039. Полное содержание каждой из WO 2012/059103 и WO 2010/136039 включено в данный документ посредством ссылки.
Налмефен представляет собой известный модулятор опиоидной системы с определенным μ-, δ- и κ-рецепторным профилем, который может ингибировать фармакологические эффекты как вводимых агонистов опиоидных рецепторов, так и эндогенных агонистов, производимых опиоидной системой. Клиническая применимость налмефена основана на его способности быстро и селективно устранять эффекты указанных агонистов опиоидных рецепторов.
Налмефен был разработан в первую очередь для применения в контроле алкогольной зависимости. В двойном слепом плацебо-контролируемом исследовании был показан хороший эффект введения суточной пероральной дозы налмефена, составлявшей 20-80 мг (Mason et al., Arch. Gen. Psychiatry, (1999), Vol. 56: 719-724); тогда как в другом исследовании не сообщалось о доказательствах превосходства налмефена над плацебо в исследовании, в котором оценивали суточные дозы налмефена, составлявшие 5, 20 и 40 мг (Anton et al., J. Clin. Psychopharmacol, (2004), Vol. 24(4): 421-428). В недавнем исследовании был показан хороший эффект налмефена по сравнению с плацебо при приеме дозы налмефена, составлявшей 20 мг, в тот момент, когда пациент испытывал тягу к алкоголю (Karhuvaara et al., Alcohol. Clin. Exp. Res., (2007), Vol. 31 (7): 1179-1187).
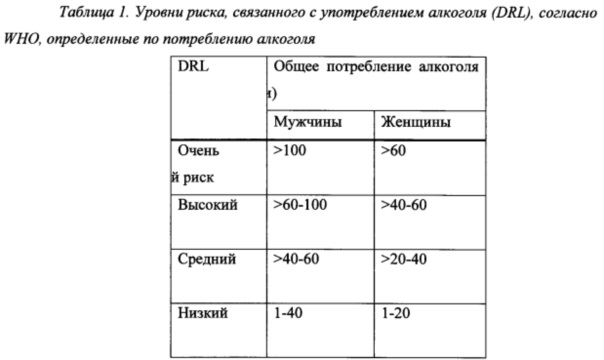
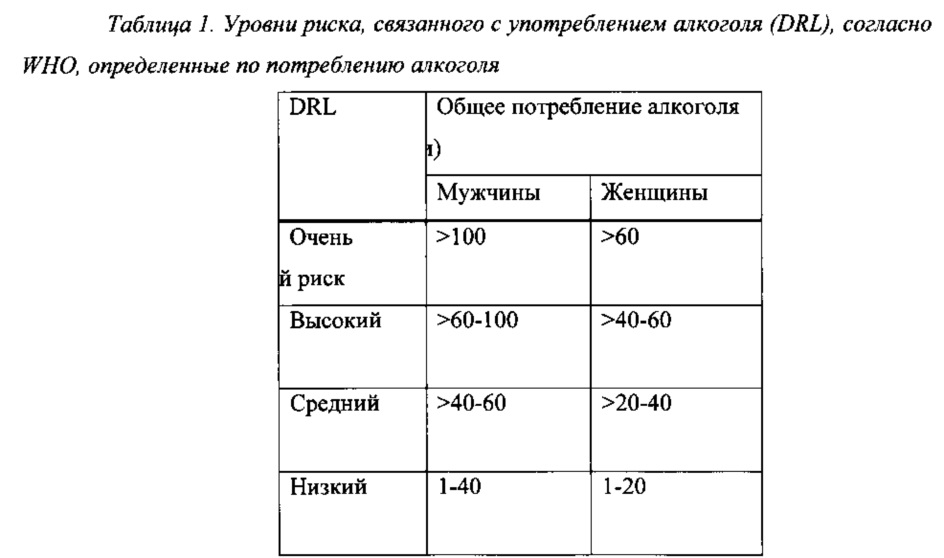
Согласно независимым доказательствам высокие уровни потребления алкоголя связаны с повышенным риском вреда для здоровья, а также нежелательными социальными последствиями. Всемирная организация здравоохранения (WHO) определила уровни риска, связанного с употреблением алкоголя (DRL), исходя из потребления алкоголя в International Guide for Monitoring Alcohol Consumption and Related Harm. 2000. World Health Organization, полное содержание которой включено в данный документ посредством ссылки. См. Таблицу 1.
Уровни риска согласно Таблице 1 можно оценивать, например, путем расчета среднего суточного потребления алкоголя в г/сутки в течение месяца, как, например, в течение 4 недель.
Существует необходимость в новом средстве лечения для применения в уменьшении потребления алкоголя. Уменьшение потребления алкоголя, вероятно, принесет пользу, связанную со снижением риска вреда для здоровья и снижением количества нежелательных социальных последствий.
Краткое описание изобретения
Настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, при этом указанное применение включает следующие этапы:
a) идентификацию пациента с алкогольной зависимостью, i) который имеет высокий DRL и ii) у которого сохраняется высокий DRL после периода наблюдения, следующего за начальным оцениванием, и
b) введение терапевтически эффективного количества налмефена пациенту, идентифицированному на этапе a), при этом указанный налмефен вводят по мере необходимости, в частности, каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Краткое описание графических материалов
На Фигурах 1-12 показано изменение числа суток употребления алкоголя в большом количестве (HDD) и общего потребления алкоголя (ТАС) (г/сутки) за месяц по сравнению с исходным уровнем в каждом исследовании. Результаты показаны для общей исследуемой популяции, для пациентов с высоким DRL на исходном уровне, для общей исследуемой популяции за исключением пациентов, рано уменьшивших потребление (ER), и для пациентов с высоким DRL на исходном уровне и при рандомизации.
На Фигурах 1а-12а показано изменение HDD за месяц по сравнению с исходным уровнем. Ось X: время (месяцы); ось Y: изменение HDD.
На Фигурах 1b-12b показано изменение ТАС (г/сутки) за месяц по сравнению с исходным уровнем. Ось X: время (месяцы); ось Y: изменение ТАС (г/сутки).
(---□--- = плацебо, -■- = налмефен, * = P-значение <0,05). “В” означает исходный уровень, “R” означает рандомизацию.
Фигура 1а: исследование 12014А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 1b: исследование 12014А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 2а: исследование 12014А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 2b: исследование 12014А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 3а: исследование 12014А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 3b: исследование 12014А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 4а: исследование 12014А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 4b: исследование 12014А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Фигура 5а: исследование 12023А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 5b: исследование 12023А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 6а: исследование 12023А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 6b: исследование 12023А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 7а: исследование 12023А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 7b: исследование 12023А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 8а: исследование 12023А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 8b: исследование 12023А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Фигура 9а: исследование 12013А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 9b: исследование 12013А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 10а: исследование 12013А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 10b: исследование 12013А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 11а: исследование 12013А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 11b: исследование 12013А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 12а: исследование 12013А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 12b: исследование 12013А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Определения
На протяжении всего данного описания предполагается, что термин “налмефен” включает любые формы соединения, такие как свободное основание и фармацевтически приемлемые соли. Свободное основание и фармацевтически приемлемые соли включают безводные формы и сольватированные формы, как, например, гидраты. Безводные формы и сольваты включают аморфные и кристаллические формы. В конкретном варианте осуществления налмефен находится в форме гидрохлорида. В более конкретном варианте осуществления налмефен находится в форме дигидрата гидрохлорида. На протяжении всей настоящей заявки в случае, если для налмефена определена доза, указанная доза рассчитана в пересчете на свободное основание, т.е. если доза налмефена составляет 18 мг, то это соответствует 18 мг налмефена в виде свободного основания.
Применяемый в данном документе термин “общее потребление алкоголя”, сокращенно ТАС, означает среднее суточное общее потребление алкоголя, измеряемое в г/сутки в течение месяца (= 28 суток).
Применяемый в данном документе термин “сутки употребления алкоголя в большом количестве”, сокращенно HDD, означает сутки с общим потреблением алкоголя, составляющим ≥60 г чистого спирта для мужчин и ≥40 г для женщин.
Применяемый в данном документе термин “дозирование по мере необходимости” означает, что в каждые сутки, в которые пациент ощущает риск употребления алкоголя, следует принимать одну дозу налмефена, предпочтительно за 1-2 часа до предполагаемого времени употребления. Если пациент начал употреблять алкоголь, не приняв налмефен, пациенту следует принять одну дозу как можно скорее после этого.
Применяемый в данном документе термин “уровень риска, связанного с употреблением алкоголя”, сокращенно DRL, определяется по критериям WHO согласно Таблице 1 ниже.
Уровни риска, связанного с употреблением алкоголя, согласно Таблице 1 можно оценивать, например, путем расчета среднего суточного потребления алкоголя в г/сутки в течение определенного периода, такого как 1 неделя или дольше, такого как 2 недели или дольше, такого как 3 недели или дольше, такого как 4 недели или дольше, такого как 1 месяц или дольше, такого как 2 месяца или дольше, такого как 3 месяца или дольше, такого как 4 месяца или дольше, такого как 5 месяцев или дольше, такого как 6 месяцев или дольше, такого как приблизительно 1 год. Оценивание DRL может быть проведено специалистами и/или врачами, как, например, врачами общей практики и/или другими медицинскими работниками, на основании оценок пациентами потребления ими алкоголя. В трех проводимых Lundbeck исследованиях фазы III, описанных в примерах (12014А, 12023А и 12013А), DRL измеряли посредством оценивания среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода до начального визита. После 1-2-недельного периода наблюдения уровень риска, связанного с употреблением алкоголя, повторно оценивали посредством оценивания среднего суточного потребления алкоголя в г/сутки в течение указанного 1-2-недельного периода наблюдения.
На протяжении всей настоящей заявки предполагается, что термин “высокий риск” или “по меньшей мере высокий риск” включает две группы, определяемые как “высокий риск” и “очень высокий риск” согласно уровням риска, связанного с употреблением алкоголя, по WHO, приведенным в Таблице 1, т.е. пациенты, имеющие уровень риска, связанного с употреблением алкоголя, соответствующий общему потреблению алкоголя, составляющему >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин. В настоящем изобретении не проводится различие между пациентами с высоким и очень высоким уровнями риска, связанного с употреблением алкоголя, и если термины “высокий уровень риска, связанного с употреблением алкоголя” или “высокий DRL” применяются в пункте формулы изобретения или в варианте осуществления настоящего изобретения, то предполагается, что они включают как группу, определяемую как “высокий риск”, так и группу, определяемую как “очень высокий риск” в соответствии с уровнями риска, связанного с употреблением алкоголя, по WHO, приведенными в Таблице 1.
Применяемый в данном документе термин “пациент, рано уменьшивший потребление”, сокращенно ER, означает пациента, включенного в три проводимых Lundbeck исследования фазы III (12014А, 12023А и 12013А), который значительно уменьшил потребление алкоголя в период между скринингом и рандомизацией. Более конкретно, пациенты, определенные как ER, уменьшили потребление ими алкоголя от высокого или среднего DRL до уровня ниже среднего уровня риска, связанного с употреблением алкоголя, т.е. потребление алкоголя указанными пациентами составляло 0-40 г/сутки для мужчин и 0-20 г/сутки для женщин, определенное как среднее суточное потребление алкоголя в 1-2-недельный период между скринингом и рандомизацией.
Применяемый в данном документе термин “период наблюдения в соответствии с клинической практикой” означает наблюдение после начального оценивания DRL. Указанный период составляет предпочтительно 1-2 недели, наиболее предпочтительно приблизительно 2 недели.
Применяемый в данном документе термин “взрослый” означает лицо в возрасте по меньшей мере 16 лет, в частности в возрасте по меньшей мере 18 лет.
Применяемый в данном документе термин “подросток” означает лицо в возрасте 12-18 лет, в частности в возрасте 12-16 лет.
Применяемые в данном документе термины “мотивационная поддержка” и “консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя” означает психологические вмешательства, усиливающие мотивацию, и они могут применяться взаимозаменяемо с терминами “психосоциальная поддержка” или “психосоциальное вмешательство, направленное на приверженность лечению и уменьшение потребления алкоголя”. Указанная мотивационная поддержка может оказываться специалистом и/или врачом, в частности, врачом общей практики и/или другими медицинскими работниками. Одним примером таких вмешательств является модель BRENDA, которая представляет собой ограниченное во времени ориентированное на пациента клиническое мотивационное вмешательство, которое дополняет применение лекарственного препарата и направлено на изменение поведения и повышение приверженности к лечению. Модель BRENDA была описана Starosta et al., J. Psychiatr. Pract. (2006), Vol. 12(2): 80-89, полное содержание которой включено в данный документ посредством ссылки. Термин “начальная мотивационная поддержка” означает, что такие усиливающие мотивацию вмешательства осуществляются в отношении пациента до лечения налмефеном. Термин “текущая мотивационная поддержка” означает, что такие усиливающие мотивацию вмешательства осуществляются в отношении пациента одновременно с лечением налмефеном, например, периодически.
Применяемый в данном документе термин “фармацевтическая композиция” относится к дозированной форме, такой как лекарственная форма для перорального применения, такой как твердая лекарственная форма для перорального применения, обычно таблетки или капсулы. В предпочтительном варианте осуществления указанная лекарственная форма подходит для дозирования по мере необходимости. Указанная фармацевтическая композиция обычно содержит терапевтически эффективное количество налмефена и один или несколько фармацевтически приемлемых носителей. Термин “фармацевтические композиции по настоящему изобретению” относится ко всем фармацевтическим композициям, охватываемым формулой изобретения и описанием.
Применяемый в данном документе термин “стандартная лекарственная форма” относится к составленной единице фармацевтической композиции, например, одной таблетке или капсуле.
Применяемый в данном документе термин “терапевтически эффективное количество” соединения означает количество/дозу соединения или фармацевтической композиции, достаточное/достаточную для того, чтобы вызвать эффективный ответ (т.е. биологический или медицинский ответ ткани, системы, животного или человека, к которому стремится исследователь, ветеринар, врач или другой клиницист) при введении пациенту. “Терапевтически эффективное количество” будет меняться в зависимости, помимо прочего, от заболевания и его тяжести, а также от возраста, веса, физического состояния и ответной реакции пациента, подлежащего лечению. Кроме того, “терапевтически эффективное количество” может меняться в случае, если соединение по настоящему изобретению объединено с одним или несколькими соединениями. В таком случае количество данного соединения может быть меньшим, таким как субэффективное количество. В одном варианте осуществления “терапевтически эффективное количество” налмефена составляет 18 мг.
Применяемые в данном документе термины “лечение” и “осуществление лечения” относятся к контролю пациента и уходу за ним с целью борьбы с состоянием, таким как заболевание или нарушение. Предполагается, что термин включает полный спектр видов лечения данного состояния, от которого страдает пациент, в частности, введение активного соединения для облегчения симптомов или осложнений, для замедления прогрессирования заболевания, расстройства или состояния, для облегчения или смягчения симптомов и осложнений и/или для излечения или устранения заболевания, расстройства или состояния, а также для предупреждения состояния, при этом предупреждение следует понимать как контроль пациента и уход за ним с целью борьбы с заболеванием, состоянием или нарушением, и предусматривает введение активных соединений для предупреждения появления симптомов или осложнений.
Термин “алкогольная зависимость” является общеизвестным термином для специалиста в данной области. В пересмотренной 4-й редакции Диагностического и статистического руководства по психическим расстройствам (DSM-IV-TR) (Diagnostic and Statistical Manual of Mental Disorders, 4th edition text revision, American Psychiatric Publishing, 2000). Применяемый в данном документе термин “алкогольная зависимость” определяется как наличие ухудшения в трех или более из семи сфер жизни, связанного с алкоголем, в одном и том же 12-месячном периоде. Эти ухудшения включают 1) привыкание, 2) абстинентный синдром, 3) алкоголь часто принимается в больших количествах или в течение более длительного периода, чем предполагалось, 4) устойчивое желание или безуспешные попытки сократить или контролировать употребление алкоголя, 5) очень много времени тратится на действия, необходимые для получения алкоголя, употребления алкоголя или избавления от его эффектов, 6) важные социальные, профессиональные или оздоровительные действия прекращаются или сокращаются по причине употребления алкоголя, 7) употребление алкоголя продолжается, несмотря на знание о наличии постоянной или периодически возникающей физической или психологической проблеме, которая, вероятно, была вызвана или усугубилась из-за употребления алкоголя.
Термин “ретроспективная хронологическая шкала” (TLFB) означает способ получения оценок суточного употребления алкоголя. При помощи средств для запоминания, в частности, календарь, пациенты предоставляют ретроспективные оценки количества выпитых стандартных доз алкоголя за каждые сутки. В трех проводимых Lundbeck исследованиях фазы III (12014А, 12023А и 12013А) TLFB характеризовалась следующим подходом. Сутки определяли как 24-часовой период, начинающийся в 6.00 до полудня и заканчивающийся в 6.00 до полудня на следующее утро. Во время скринингового визита каждый пациент должен был предоставить ретроспективную оценку его/ее суточного употребления алкоголя в течение предыдущего месяца (месяц определяли как период продолжительностью 28 последовательных суток). Во время каждого последующего визита пациент должен был предоставить информацию о его/ее употреблении алкоголя со времени предыдущего визита. Если пациент пропускал визит, то TLFB, которую составляли во время следующего визита, продлевали для охвата суток, данные по которым должны были быть зарегистрированы во время пропущенного визита. Пациенты могли применять свои личные календари, помогающие им вспомнить об употреблении ими алкоголя, или они могли применять календарь, предоставленный им исследовательским центром для личного пользования. Календари следовало применять только в качестве средств для запоминания, помогающих пациентам составлять TLFB. Пациентов просили сообщать об употреблении ими алкоголя в расчете на стандартные единицы согласно национальному определению стандартной единицы. Стандартные национальные единицы были определены в картах пересчета стандартных доз алкоголя, выдаваемых пациентам.
“Печеночную недостаточность” можно оценивать с помощью системы балльной оценки по шкале Чайлда-Пью согласно Child and Turcotte JG. Surgery and portal hypertension, в The liver and portal hypertension. Edited by CG Child. Philadelphia: Saunders 1964: 50-64, полное содержание которой включено в данный документ посредством ссылки. Согласно данной системе пациентов можно классифицировать как имеющих, например, “умеренную или тяжелую форму печеночной недостаточности”.
“Почечную недостаточность” можно оценивать путем измерения рассчитанной скорости общей фильтрации (eGFR), как описано в Stevens et al., N. Engl. J. Med. (2006) 354: 2473-2483, полное содержание которой включено в данный документ посредством ссылки. Пациентов классифицируют как имеющих “тяжелую форму почечной недостаточности” при eGFR <30 мл/мин. на 1,73 м2.
Подробное описание изобретения
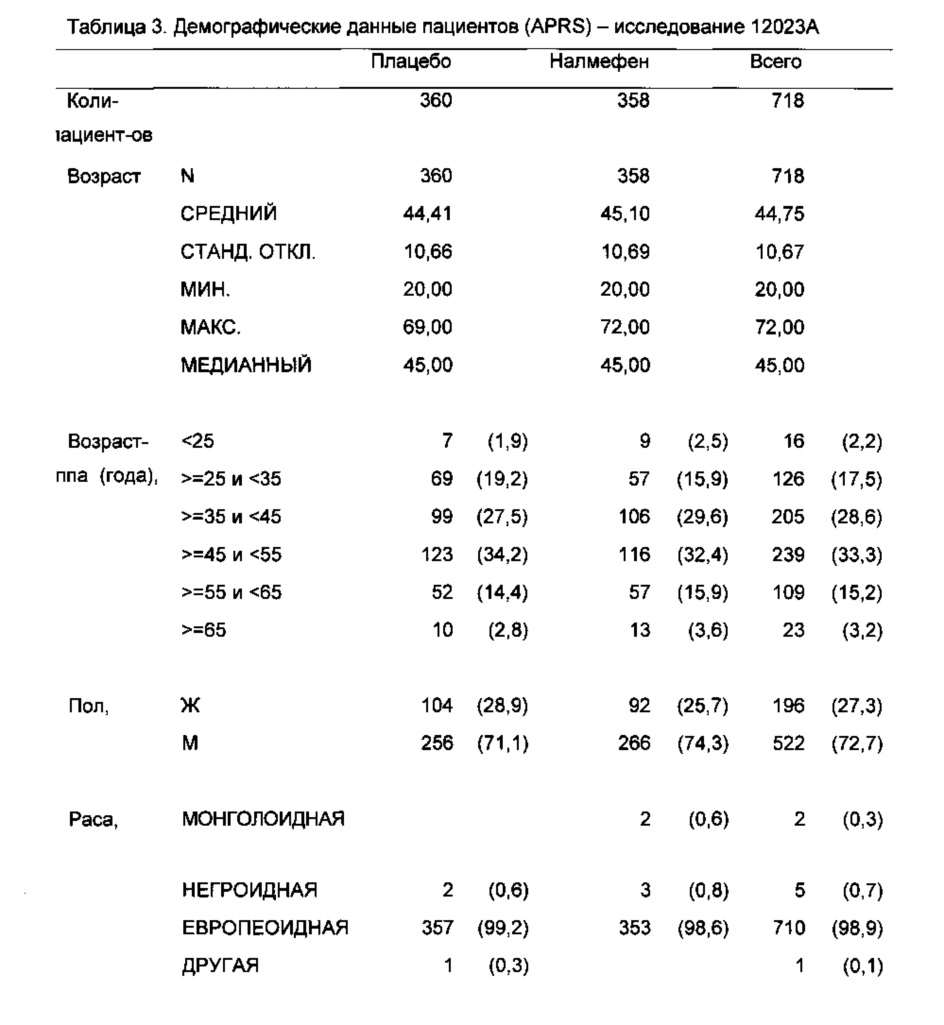
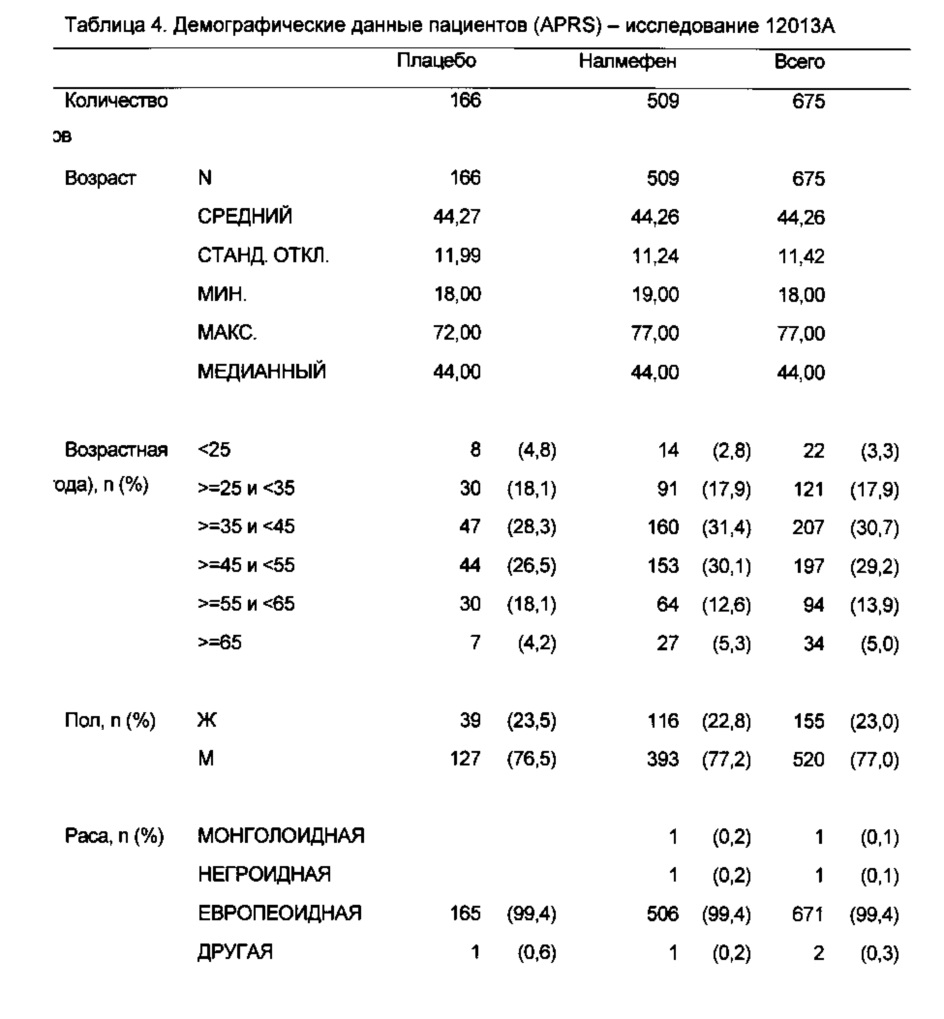
Эффективность налмефена в уменьшении потребления алкоголя у пациентов с алкогольной зависимостью (DSM-IV) была оценена в двух исследованиях эффективности (исследование 12014А и исследование 12023А) и одном исследовании безопасности (исследование 12013А), как описано в примерах. Все три исследования были рандомизированными, двойными слепыми, с параллельными группами и плацебо-контролируемыми.
В исследования включали амбулаторных пациентов в возрасте ≥18 лет с первичным диагнозом “алкогольная зависимость”. Пациент подходил для участия в исследовании, если в течение 4 недель, предшествующих скрининговому визиту (исходный период), он/она имел/имела >6 HDD, по меньшей мере средний DRL (рассчитанный как среднее суточное потребление алкоголя в г/сутки, т.е. составляющее >40 г/сутки для мужчин и >20 г/сутки для женщин, рассчитанное как среднее суточное потребление алкоголя в течение 4-недельного периода, предшествующего скрининговому визиту) и ≤14 последовательных суток отказа от употребления алкоголя. Способ ретроспективной хронологической шкалы (TLFB) применяли для получения оценок суточного употребления алкоголя пациентами.
Во время начального визита (скринингового визита) оценивали клиническое состояние, социальную ситуацию пациентов и особенности потребления ими алкоголя. После 1-2-недельного периода наблюдения уровень риска, связанного с употреблением алкоголя, повторно оценивали путем расчета среднего суточного потребления алкоголя в г/сутки в течение 1-2-недельного периода наблюдения, и лечение налмефеном начинали вместе с консультированием, направленным на мотивирование пациентов к приверженности к лечению и к изменению их поведения, связанного с употреблением алкоголя.
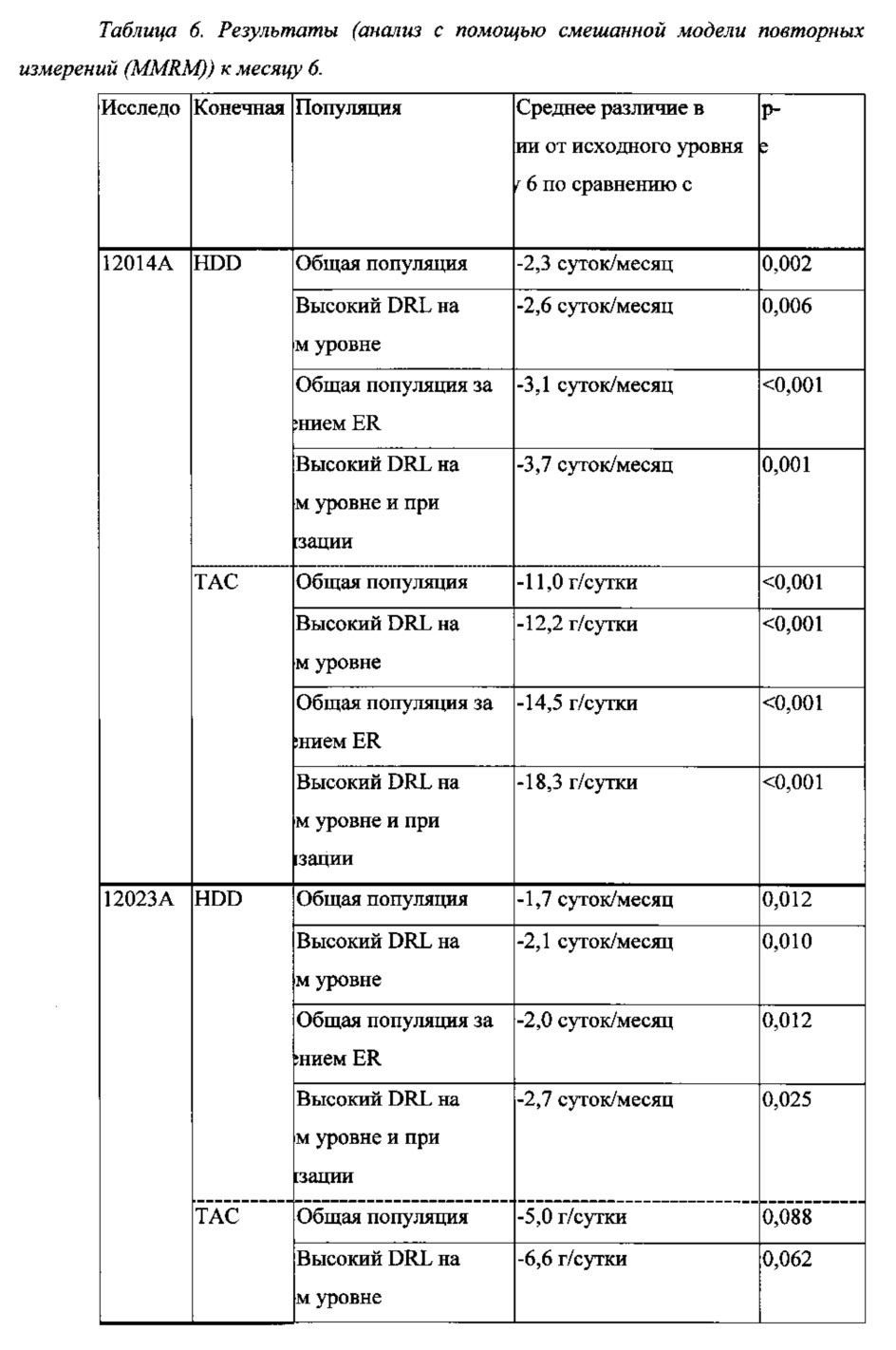
Эффективность налмефена измеряли с применением двух комбинированных первичных конечных точек: изменения числа суток употребления алкоголя в большом количестве (HDD) за месяц и изменения среднего суточного общего потребления алкоголя (ТАС) в расчете на месяц (= 28 суток). В двух 6-месячных исследованиях эффективности и в 12-месячном исследовании безопасности налмефен превосходил плацебо в уменьшении числа HDD и ТАС к месяцу 6 (см. Таблицу 6 и Фигуры 1, 5 и 9).
Авторы настоящего изобретения обнаружили, что у пациентов с высоким DRL на исходном уровне, т.е. с потреблением алкоголя, составляющим >60 г/сутки у мужчин и >40 г/сутки у женщин на исходном уровне (на основе среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода, предшествующего начальному визиту), эффект налмефена в отношении HDD и ТАС был более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал лучшим эффектом в данной группе пациентов, чем в общей исследуемой популяции (см. Таблицу 6 и Фигуры 2, 6 и 10). Таким образом, в одном аспекте настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя, т.е. уровень риска, связанного с употреблением алкоголя, соответствующий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин. В одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет по меньшей мере высокий уровень риска, связанного с употреблением алкоголя, согласно критериям WHO, в частности, высокий или очень высокий уровень риска, связанного с употреблением алкоголя, согласно критериям WHO.
Более того, авторы настоящего изобретения наблюдали, что заметная часть пациентов, включенных в три исследования фазы III (18%, 33% и 39% в исследованиях 12014А, 12023А и 12013А, соответственно), значительно уменьшила потребление ими алкоголя в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией, т.е. эти пациенты уменьшили потребление ими алкоголя от высокого или среднего DRL до DRL ниже среднего в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией. Этих пациентов характеризовали как пациентов, рано уменьшивших потребление (ER). Было обнаружено, что в группе пациентов, не относящихся к ER, эффект налмефена в отношении HDD и ТАС был более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал лучшим эффектом в данной группе пациентов, чем в общей исследуемой популяции (см. Таблицу 6 и Фигуры 3, 7 и 11). Соответственно, в другом аспекте настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели. В одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется по меньшей мере средний DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели.
Было обнаружено, что у пациентов с высоким DRL как на исходном уровне, так и при рандомизации; т.е. у пациентов, которые имели высокий DRL на исходном уровне на основе среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода, предшествующего начальному визиту, и у которых сохранялся высокий DRL в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией; эффект налмефена в отношении HDD и ТАС был еще более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал особенно хорошим эффектом в этой группе пациентов по сравнению с его эффектом в общей исследуемой популяции (см. Таблицу 6 и Фигуры 4, 8 и 12). Соответственно, в одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя, т.е. потребление алкоголя, составляющее >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, и который продолжает иметь высокий уровень риска, связанного с употреблением алкоголя, после периода наблюдения в соответствии с клинической практикой.
В одном варианте осуществления пациенты согласно настоящему изобретению имеют диагноз “алкогольная зависимость” согласно критериям DSM-IV-TR. В одном варианте осуществления пациенты согласно настоящему изобретению имеют диагноз “алкоголизм” согласно критериям DSM-V.
В отдельном аспекте настоящее изобретение относится к способу проведения клинического исследования для оценивания эффективности средства лечения в отношении уменьшения потребления алкоголя, при этом способ включает следующие этапы:
a) скрининг пациентов на основании их уровня риска, связанного с употреблением алкоголя,
b) повторное оценивание уровня риска, связанного с употреблением алкоголя, после периода наблюдения, в частности, 1-2-недельного периода наблюдения, в частности, 2-недельного периода наблюдения,
c) исключение из исследования пациентов, которые значительно уменьшили потребление ими алкоголя в период наблюдения согласно этапу b).
В дополнительном варианте осуществления указанные пациенты, выбранные для скрининга согласно этапу а), имеют первичный диагноз “алкогольная зависимость” по DSM-IV или “алкоголизм” по DSM-V. В другом дополнительном варианте осуществления указанные пациенты, исключаемые на этапе с), уменьшили потребление ими алкоголя по уровню риска, связанного с употреблением алкоголя, от высокого DRL до DRL ниже среднего или от высокого DRL до DRL ниже высокого.
Согласно настоящему изобретению налмефен или его фармацевтически приемлемую соль можно вводить посредством любого подходящего пути, т.е. перорально или парентерально, и они могут быть представлены в любой форме, подходящей для такого введения, например, в форме таблеток, капсул, порошков, сиропов или растворов или дисперсий для инъекции. В другом варианте осуществления и в соответствии с целью настоящего изобретения налмефен вводят в форме твердой фармацевтической единицы, допустимо в виде таблетки или капсулы, или в форме суспензии, раствора или дисперсии для инъекции. Дополнительно, налмефен можно вводить с фармацевтически приемлемым носителем, в частности, вспомогательным средством и/или разбавителем.
Способы получения твердых или жидких фармацевтических препаратов известны в данной области техники. См., например, Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams & Wilkins (2005). Таким образом, таблетки можно изготовить путем смешивания активных ингредиентов с обычным носителем, в частности, вспомогательным средством и/или разбавителем, и последующего прессования смеси в таблеточной машине. Неограничивающие примеры вспомогательных средств и/или разбавителей включают кукурузный крахмал, лактозу, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Также можно применять любые другие вспомогательные средства или добавки, такие как красители, ароматизаторы и консерванты, при условии, что они совместимы с активными ингредиентами. Таким образом, фармацевтические композиции по настоящему изобретению обычно содержат терапевтически эффективное количество налмефена и один или несколько фармацевтически приемлемых носителей. Подходящий состав для перорального применения на основе налмефена описан в WO 2012/059103.
Без ограничения настоящего изобретения каким-либо образом подразумевается, что любой из аспектов или вариантов осуществления этой патентной заявки подходит для лекарственных препаратов или фармацевтических композиций, описанных в данном документе.
Налмефен можно вводить в виде лекарственной формы для перорального применения, в частности, в виде твердой лекарственной формы для перорального применения, обычно таблеток или капсул, или в виде жидкой лекарственной формы для перорального применения. Налмефен можно вводить в лекарственной форме с немедленным высвобождением или в лекарственной форме с контролируемым или замедленным высвобождением. В целях удобства, налмефен можно вводить перорально в стандартных лекарственных формах, в частности, в таблетках или капсулах, содержащих активный ингредиент в количестве от приблизительно 1 до приблизительно 100 мг, в частности, от 5 до 50 мг. Обычно фармацевтическая композиция содержит от 10 мг до 20 мг, в частности, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг или приблизительно 20 мг, налмефена. В предпочтительном варианте осуществления фармацевтическая композиция содержит приблизительно 18 мг налмефена. В одном варианте осуществления стандартная лекарственная форма содержит налмефен в терапевтически эффективном количестве.
В одном варианте осуществления налмефен принимают по мере необходимости, то есть в каждые сутки, в которые пациент ощущает риск употребления алкоголя, следует принимать одну дозу налмефена, предпочтительно за 1-2 часа до предполагаемого времени употребления. В одном варианте осуществления, если пациент начал употреблять алкоголь, не приняв налмефен, пациенту следует принять одну дозу налмефена как можно скорее после этого.
В одном варианте осуществления налмефен находится в форме дигидрата гидрохлорида.
Налмефен согласно настоящему изобретению предназначен для применения в дозировании у людей, являющихся взрослыми или подростками. В одном варианте осуществления налмефен предназначен для применения в дозировании у людей в возрасте 12 лет или старше, в частности, 14 лет или старше, в частности, 16 лет или старше, в частности, 18 лет или старше.
Все литературные источники, в том числе публикации, патентные заявки и патенты, цитируемые в данном документе, настоящим включены посредством ссылки во всей своей полноте и в той же степени, как если бы каждый литературный источник был отдельно и конкретно обозначен как включенный посредством ссылки и приведен во всей своей полноте в данном документе (в максимальной степени, допускаемой законом), вне зависимости от любого другого отдельно сделанного в любом месте данного документа включения конкретных документов.
Использование в контексте описания настоящего изобретения форм единственного числа следует понимать как охватывающие как единственное, так и множественное число, если в данном документе не указано иное или это однозначно не противоречит контексту. Например, выражение “соединение” следует понимать как относящееся к различным “соединениям” согласно настоящему изобретению или конкретному описываемому аспекту, если не указано иное.
Описание в данном документе любого аспекта или аспектов настоящего изобретения с использованием терминов, таких как “включающий”, “имеющий”, “в том числе” или “содержащий” по отношению к элементу или элементам предназначено для подтверждения аналогичного аспекта или аспекта настоящего изобретения, который “состоит из”, “состоит главным образом из” этого конкретного элемента или элементов или “по сути содержит” их, если не указано иное или это однозначно не противоречит контексту (например, композиция, описанная в данном документе как содержащая определенный элемент, должна также пониматься как описывающая композицию, состоящую из этого элемента, если не указано иное или это однозначно не противоречит контексту).
Следует понимать, что различные аспекты, варианты осуществления, реализации и признаки настоящего изобретения, упомянутые в данном документе, могут быть заявлены по отдельности или в любом сочетании.
Варианты осуществления согласно настоящему изобретению
Раскрыты следующие варианты осуществления изобретения. Первый вариант осуществления обозначен Е1, второй вариант осуществления обозначен Е2 и так далее.
Е1. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий DRL.
Е2. Налмефен согласно варианту осуществления 1, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е3. Налмефен согласно любому из вариантов осуществления 1-2, где указанный DRL оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е4. Налмефен согласно любому из вариантов осуществления 1-3, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е5. Налмефен согласно любому из вариантов осуществления 1-4, где указанный пациент продолжает иметь высокий DRL, несмотря на начальную мотивационную поддержку.
Е6. Налмефен согласно любому из вариантов осуществления 1-4, где у указанного пациента сохраняется высокий DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е7. Налмефен согласно любому из вариантов осуществления 1-5, где у указанного пациента сохраняется высокий DRL после периода наблюдения продолжительностью 1-2 недели, следующего за начальным оцениванием DRL, в частности, после периода наблюдения продолжительностью приблизительно 2 недели, следующего за начальным оцениванием DRL.
Е8. Налмефен согласно любому из вариантов осуществления 5-7, где указанный сохраняющийся высокий DRL оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е9. Налмефен согласно любому из вариантов осуществления 5-8, где указанный сохраняющийся DRL соответствует потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е10. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя, несмотря на начальную мотивационную поддержку.
Е11. Налмефен для применения в уменьшении потребления алкоголя у пациента, у которого сохраняется уровень потребления алкоголя после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е12. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется по меньшей мере средний DRL после периода наблюдения, следующего за начальным оцениванием, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е13. Налмефен согласно вариантам осуществления 10-12, где указанный сохраняющийся DRL соответствует потреблению >40 г/сутки чистого спирта для мужчин и >20 г/сутки для женщин.
Е14. Налмефен согласно любому из вариантов осуществления 10-13, где указанный пациент имеет высокий DRL при начальном оценивании.
Е15. Налмефен согласно варианту осуществления 14, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, при начальном оценивании.
Е16. Налмефен согласно любому из вариантов осуществления 14-15, где у указанного пациента сохраняется высокий DRL после указанного периода наблюдения.
Е17. Налмефен согласно любому из вариантов осуществления 10-16, где указанный сохраняющийся DRL оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е18. Налмефен согласно любому из вариантов осуществления 14-17, где указанный высокий DRL при начальном оценивании оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е19. Налмефен согласно любому из вариантов осуществления 14-18, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е20. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию; где у указанного пациента сохраняется DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после периода наблюдения, следующего за начальным оцениванием, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е21. Налмефен согласно варианту осуществления 20, где указанный период, предшествующий оцениванию, составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или в частности, например, 6 месяцев или больше, в частности, приблизительно 1 год.
Е22. Налмефен согласно любому из вариантов осуществления 20-21, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, приблизительно 2 недели.
Е23. Налмефен согласно любому из вариантов осуществления 1-22, где указанный налмефен следует применять по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е24. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, где указанное применение включает следующие этапы:
a) идентификацию пациента с алкогольной зависимостью, i) который имеет высокий DRL и/или ii) у которого сохраняется DRL в отношении потребления алкоголя после периода наблюдения, следующего за начальным оцениванием, и
b) введение налмефена пациенту, идентифицированному на этапе а), где указанный налмефен вводят по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е25. Налмефен согласно варианту осуществления 24, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, приблизительно 2 недели.
Е26. Налмефен согласно любому из вариантов осуществления 21-25, где указанный пациент, идентифицированный на этапе а), имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е27. Налмефен согласно любому из вариантов осуществления 24-26, где указанный высокий DRL, идентифицированный на этапе a), i) оценивался путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е28. Налмефен согласно любому из вариантов осуществления 24-27, где указанный сохраняющийся DRL на этапе a) ii) оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е29. Налмефен согласно любому из вариантов осуществления 1-28, где указанному пациенту не требуется немедленная детоксикация и/или где указанный пациент не имеет физических симптомов абстинентного синдрома.
Е30. Налмефен согласно любому из вариантов осуществления 1-29, где указанному пациенту оказывается текущая мотивационная поддержка.
Е31. Налмефен согласно любому из вариантов осуществления 1-30, где указанному пациенту оказывается консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя.
Е32. Налмефен согласно варианту осуществления 31, где указанное консультирование осуществляют согласно модели BRENDA.
Е33. Налмефен согласно любому из вариантов осуществления 1-32, где указанный пациент является пациентом, целью лечения которого не является немедленный полный отказ от употребления алкоголя.
Е34. Налмефен согласно любому из вариантов осуществления 1-33, где указанный налмефен следует применять в течение периода лечения продолжительностью 6-12 месяцев, как, например, 6 месяцев.
Е35. Налмефен согласно любому из вариантов осуществления 1-34, где указанный пациент является взрослым или подростком.
Е36. Налмефен согласно любому из вариантов осуществления 1-35, где указанный пациент находится в возрасте 12 лет или старше, как, например, 14 лет или старше, как, например, 16 лет или старше, как, например, 18 лет или старше.
Е37. Налмефен согласно любому из вариантов осуществления 1-36, где указанный налмефен применяется в дозе 10-20 мг, в частности, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг или 20 мг.
Е38. Налмефен согласно варианту осуществления 37, где указанный налмефен применяется в дозе 18 мг.
Е39. Налмефен согласно любому из вариантов осуществления 1-38, где указанный налмефен применяется в форме фармацевтически приемлемой кислотно-аддитивной соли.
Е40. Налмефен согласно варианту осуществления 39, где указанный налмефен применяется в форме гидрохлоридной соли.
Е41. Налмефен согласно варианту осуществления 40, где указанный налмефен применяется в форме дигидрата гидрохлорида.
Е42. Налмефен согласно любому из вариантов осуществления 1-41, где указанный налмефен применяется в кристаллической форме.
Е43. Налмефен согласно любому из вариантов осуществления 1-42, где указанный налмефен применяется в лекарственной форме для перорального применения, в частности, таблетки или капсулы.
Е44. Налмефен согласно любому из вариантов осуществления 1-43, где указанный налмефен применяется в комбинации с дополнительным активным ингредиентом.
Е45. Налмефен согласно любому из вариантов осуществления 1-44, где указанный пациент не попадает в одну или несколько следующих категорий: пациенты, принимающие опиоидные аналгетики, пациенты с опиоидной зависимостью без успешной абстиненции, пациенты с острыми симптомами опиоидного абстинентного синдрома, пациенты, предположительно недавно употреблявшие опиоиды, пациенты с умеренной или тяжелой формой печеночной недостаточности, пациенты с умеренной или тяжелой формой почечной недостаточности, пациенты с текущей или недавней опиоидной зависимостью, пациенты с острым алкогольным абстинентным синдромом (в том числе с галлюцинациями, эпилептическими припадками и алкогольным делирием) в ближайшем анамнезе.
Е46. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий DRL, при этом способ включает введение терапевтически эффективного количества налмефена указанному пациенту.
Е47. Способ согласно варианту осуществления 46, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е48. Способ согласно любому из вариантов осуществления 46-47, где указанный DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е49. Способ согласно любому из вариантов осуществления 46-48, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е50. Способ согласно любому из вариантов осуществления 46-49, где указанный пациент продолжает иметь высокий DRL, несмотря на начальную мотивационную поддержку.
Е51. Способ согласно любому из вариантов осуществления 46-50, где у указанного пациента сохраняется высокий DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е52. Способ согласно любому из вариантов осуществления 46-50, где у указанного пациента сохраняется высокий DRL после периода наблюдения продолжительностью по меньшей мере 1 неделя, следующего за начальным оцениванием DRL, в частности, после периода наблюдения продолжительностью приблизительно 2 недели, следующего за начальным оцениванием DRL.
Е53. Способ согласно любому из вариантов осуществления 50-52, где указанный сохраняющийся высокий DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е54. Способ согласно любому из вариантов осуществления 50-53, где указанный сохраняющийся DRL соответствует потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е55. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя, несмотря на начальную мотивационную поддержку, при этом способ включает введение терапевтически эффективного количества налмефена указанному пациенту.
Е56. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели, при этом способ включает введение терапевтически эффективного количества налмефена указанному пациенту.
Е57. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется по меньшей мере средний DRL после периода наблюдения, следующего за начальным оцениванием, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели, при этом способ включает введение терапевтически эффективного количества налмефена указанному пациенту.
Е58. Способ согласно вариантам осуществления 55-57, где указанный сохраняющийся DRL соответствует потреблению >40 г/сутки чистого спирта для мужчин и >20 г/сутки для женщин.
Е59. Способ согласно любому из вариантов осуществления 55-58, где указанный пациент имеет высокий DRL при начальном оценивании.
Е60. Способ согласно варианту осуществления 59, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, при начальном оценивании.
Е61. Способ согласно любому из вариантов осуществления 55-60, где у указанного пациента сохраняется высокий DRL после указанного периода наблюдения.
Е62. Способ согласно любому из вариантов осуществления 55-61, где указанный сохраняющийся DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е63. Способ согласно любому из вариантов осуществления 59-62, где указанный высокий DRL при начальном оценивании оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е64. Способ согласно любому из вариантов осуществления 59-63, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е65. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, который имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где у указанного пациента сохраняется DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после наблюдения, следующего за начальным оцениванием, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения, при этом способ включает введение терапевтически эффективного количества налмефена указанному пациенту.
Е66. Способ согласно варианту осуществления 65, где указанный период, предшествующий оцениванию, составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е67. Способ согласно любому из вариантов осуществления 65-66, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, приблизительно 2 недели.
Е68. Способ согласно любому из вариантов осуществления 46-67, где указанный налмефен вводят по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е69. Способ уменьшения потребления алкоголя у пациента с алкогольной зависимостью, где указанный способ включает следующие этапы:
a) идентификацию пациента с алкогольной зависимостью, i) который имеет высокий DRL и/или ii) у которого сохраняется DRL в отношении потребления алкоголя после периода наблюдения, следующего за начальным оцениванием, и
b) введение терапевтически эффективного количества налмефена пациенту, идентифицированному на этапе а), при этом указанный налмефен вводят по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е70. Способ согласно варианту осуществления 69, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, приблизительно 2 недели.
Е71. Способ согласно любому из вариантов осуществления 69-70, где пациент, идентифицированный на этапе а), имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е72. Способ согласно любому из вариантов осуществления 69-71, где указанный высокий DRL, идентифицированный на этапе a), i) был оценен путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е73. Способ согласно любому из вариантов осуществления 69-72, где указанный сохраняющийся DRL на этапе a) ii) оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е74. Способ согласно любому из вариантов осуществления 46-73, где указанному пациенту не требуется немедленная детоксикация и/или где указанный пациент не имеет физических симптомов абстинентного синдрома.
Е75. Способ согласно любому из вариантов осуществления 46-74, где указанному пациенту оказывают текущую мотивационную поддержку.
Е76. Способ согласно любому из вариантов осуществления 46-76, где указанному пациенту оказывают консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя.
Е77. Способ согласно варианту осуществления 76, где указанное консультирование осуществляют согласно модели BRENDA.
Е78. Способ согласно любому из вариантов осуществления 46-77, где указанный пациент является пациентом, целью лечения которого не является немедленный полный отказ от употребления алкоголя.
Е79. Способ согласно любому из вариантов осуществления 46-78, где указанный налмефен следует применять в течение периода лечения продолжительностью 6-12 месяцев, в частности, 6 месяцев.
Е80. Способ согласно любому из вариантов осуществления 46-79, где указанный пациент является взрослым или подростком.
Е81. Способ согласно любому из вариантов осуществления 46-80, где указанный пациент находится в возрасте 12 лет или старше, в частности, 14 лет или старше, в частности, 16 лет или старше, в частности, 18 лет или старше.
Е82. Способ согласно любому из вариантов осуществления 46-81, где количество налмефена составляет 10-20 мг, в частности, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг или 20 мг.
Е83. Способ согласно варианту осуществления 82, где количество налмефена составляет 18 мг.
Е84. Способ согласно любому из вариантов осуществления 46-83, где указанный налмефен вводят в форме фармацевтически приемлемой соли присоединения кислоты.
Е85. Способ согласно варианту осуществления 84, где указанный налмефен вводят в форме гидрохлоридной соли.
Е86. Способ согласно варианту осуществления 85, где указанный налмефен вводят в форме дигидрата гидрохлорида.
Е87. Способ согласно любому из вариантов осуществления 46-86, где указанный налмефен вводят в кристаллической форме.
Е88. Способ согласно любому из вариантов осуществления 46-87, где указанный налмефен вводят в лекарственной форме для перорального применения, в частности, таблетки или капсулы.
Е89. Способ согласно любому из вариантов осуществления 46-88, где указанный налмефен вводят в комбинации с дополнительным активным ингредиентом.
Е90. Способ согласно любому из вариантов осуществления 46-89, где указанный пациент не попадает в одну или несколько следующих категорий: пациенты, принимающие опиоидные аналгетики, пациенты с опиоидной зависимостью без успешной абстиненции, пациенты с острыми симптомами опиоидного абстинентного синдрома, пациенты, предположительно недавно употреблявшие опиоиды, пациенты с умеренной или тяжелой формой печеночной недостаточности, пациенты с умеренной или тяжелой формой почечной недостаточности, пациенты с текущей или недавней опиоидной зависимостью, пациенты с острым алкогольным абстинентным синдромом (в том числе с галлюцинациями, эпилептическими припадками и алкогольным делирием) в ближайшем анамнезе.
Е91. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий DRL.
Е92. Применение согласно варианту осуществления 91, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е93. Применение согласно любому из вариантов осуществления 91-92, где указанный DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е94. Применение согласно любому из вариантов осуществления 91-93, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е95. Применение согласно любому из вариантов осуществления 91-94, где указанный пациент продолжает иметь высокий DRL, несмотря на начальную мотивационную поддержку.
Е96. Применение согласно любому из вариантов осуществления 91-95, где у указанного пациента сохраняется высокий DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е97. Применение согласно любому из вариантов осуществления 91-95, где у указанного пациента сохраняется высокий DRL после периода наблюдения продолжительностью 1-2 недели, следующего за начальным оцениванием DRL, в частности, после периода наблюдения продолжительностью приблизительно 2 недели, следующего за начальным оцениванием DRL.
Е98. Применение согласно любому из вариантов осуществления 95-97, где указанный сохраняющийся высокий DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е99. Применение согласно любому из вариантов осуществления 95-98, где указанный сохраняющийся DRL соответствует потреблению>60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е100. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя, несмотря на начальную мотивационную поддержку.
Е101. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента, у которого сохраняется уровень потребления алкоголя после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е102. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется по меньшей мере средний DRL после периода наблюдения, следующего за начальным оцениванием, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью 2 недели.
E103. Применение согласно любому из вариантов осуществления 100-102, где указанный сохраняющийся DRL соответствует потреблению >40 г/сутки чистого спирта для мужчин и >20 г/сутки для женщин.
Е104. Применение согласно любому из вариантов осуществления 100-103, где указанный пациент имеет высокий DRL при начальном оценивании.
Е105. Применение согласно варианту осуществления 104, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, при начальном оценивании.
Е106. Применение согласно любому из вариантов осуществления 101-105, где у указанного пациента сохраняется высокий DRL после указанного периода наблюдения.
Е107. Применение согласно любому из вариантов осуществления 101-106, где указанный сохраняющийся DRL оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е108. Применение согласно любому из вариантов осуществления 104-107, где указанный высокий DRL при начальном оценивании оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е109. Применение согласно любому из вариантов осуществления 104-108, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е110. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента с алкогольной зависимостью, который имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение предшествующего оценивания, где у указанного пациента сохраняется DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после периода наблюдения, следующего за начальным оцениванием, оцениваемый путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
E111. Применение согласно варианту осуществления 110, где указанный период, предшествующий оцениванию, составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е112. Применение согласно любому из вариантов осуществления 110-111, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, приблизительно 2 недели.
Е113. Применение согласно любому из вариантов осуществления 91-112, где указанный лекарственный препарат следует принимать по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е114. Применение налмефена для производства лекарственного препарата для уменьшения потребления алкоголя у пациента с алкогольной зависимостью, где указанное применение включает следующие этапы:
a) производство лекарственного препарата, содержащего налмефен,
b) идентификацию пациента с алкогольной зависимостью, i) который имеет высокий DRL и/или ii) у которого сохраняется DRL в отношении потребления алкоголя после периода наблюдения, следующего за начальным оцениванием, и
c) введение указанного лекарственного препарата пациенту, идентифицированному на этапе b), где указанный лекарственный препарат вводят по мере необходимости, в частности, в каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Е115. Применение согласно варианту осуществления 114, где указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели, в частности, 2 недели.
Е116. Применение согласно любому из вариантов осуществления 114-115, где указанный пациент, идентифицированный на этапе b), имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е117. Применение согласно любому из вариантов осуществления 114-116, где указанный высокий DRL у идентифицированного на этапе b) i) был оценен путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е118. Налмефен согласно любому из вариантов осуществления 114-117, где указанный сохраняющийся DRL на этапе b) ii) оценивают путем расчета среднего суточного потребления алкоголя в г/сутки в течение указанного периода наблюдения.
Е119. Применение согласно любому из вариантов осуществления 91-118, где указанному пациенту не требуется немедленная детоксикация и/или где указанный пациент не имеет физических симптомов абстинентного синдрома.
Е120. Применение согласно любому из вариантов осуществления 91-119, где указанному пациенту оказывают текущую мотивационную поддержку.
Е121. Применение согласно любому из вариантов осуществления 91-120, где указанному пациенту оказывают консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя.
Е122. Применение согласно варианту осуществления 121, где указанное консультирование осуществляют согласно модели BRENDA.
El23. Применение согласно любому из вариантов осуществления 91-122, где указанный пациент является пациентом, целью лечения которого не является немедленный полный отказ от употребления алкоголя.
Е124. Применение согласно любому из вариантов осуществления 91-123, где указанный лекарственный препарат следует применять в течение периода лечения продолжительностью 6-12 месяцев, в частности, 6 месяцев.
Е125. Применение согласно любому из вариантов осуществления 91-124, где указанный пациент является взрослым или подростком.
Е126. Применение согласно любому из вариантов осуществления 91-125, где указанный пациент находится в возрасте 12 лет или старше, в частности, 14 лет или старше, в частности, 16 лет или старше, в частности, 18 лет или старше.
Е127. Применение согласно любому из вариантов осуществления 91-126, где указанный лекарственный препарат содержит налмефен в дозе 10-20 мг, в частности, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг или 20 мг.
Е128. Применение согласно варианту осуществления 127, где указанный лекарственный препарат содержит налмефен в дозе 18 мг.
Е129. Применение согласно любому из вариантов осуществления 91-128, где указанный лекарственный препарат содержит налмефен в форме фармацевтически приемлемой соли присоединения кислоты.
Е130. Применение согласно варианту осуществления 129, где указанный лекарственный препарат содержит налмефен в форме гидрохлоридной соли.
Е131. Применение согласно варианту осуществления 130, где указанный лекарственный препарат содержит налмефен в форме дигидрата гидрохлорида.
Е132. Применение согласно любому из вариантов осуществления 91-131, где указанный указанный лекарственный препарат содержит налмефен в кристаллической форме.
Е133. Применение согласно любому из вариантов осуществления 91-132, где указанный лекарственный препарат находится в виде лекарственной формы для перорального применения, такой как таблетки или капсулы.
Е134. Применение согласно любому из вариантов осуществления 91-133, где указанный лекарственный препарат содержит дополнительный активный ингредиент.
Е135. Применение согласно любому из вариантов осуществления 91-134, где указанный пациент не попадает в одну или несколько следующих категорий: пациенты, принимающие опиоидные аналгетики, пациенты с опиоидной зависимостью без успешной абстиненции, пациенты с острыми симптомами опиоидного абстинентного синдрома, пациенты, предположительно недавно употреблявшие опиоиды, пациенты с умеренной или тяжелой формой печеночной недостаточности, пациенты с умеренной или тяжелой формой почечной недостаточности, пациенты с текущей или недавней опиоидной зависимостью, пациенты с острым алкогольным абстинентным синдромом (в том числе с галлюцинациями, эпилептическими припадками и алкогольным делирием) в ближайшем анамнезе.
Примеры
Настоящее изобретение будет проиллюстрировано следующими неограничивающими примерами.
Эффективность налмефена в уменьшении потребления алкоголя у пациентов с алкогольной зависимостью (DSM-IV) оценивали в двух исследованиях эффективности (исследование 12014А и исследование 12023А). Оба исследования были рандомизированными, двойными слепыми, с двумя параллельными группами, плацебо-контролируемыми, и через 6 месяцев лечения пациентов, получавших налмефен, повторно рандомизировали для получения либо плацебо, либо налмефена в течение 1-месячного периода выведения из лечения. Эффективность налмефена также оценивали в рандомизированном, двойном слепом, с двумя параллельными группами, плацебо-контролируемом исследовании безопасности продолжительностью 1 год (исследование 12013А). В исследования включали 1941 пациента, 1144 из которых лечили при помощи 18 мг налмефена в режиме дозирования по мере необходимости.
Исследования проводили с применением амбулаторных условий без предшествующей детоксикации. Более высокие балльные оценки абстинентного синдрома по CIWA (шкала оценки состояния отмены алкоголя Клинического института фонда исследования зависимостей) при скрининге, а также алкогольный делирий и эпилептические припадки в анамнезе должны свидетельствовать о необходимости предварительной детоксикации в стационарных условиях. Пациентов, злоупотребляющих веществом, отличным от алкоголя, а также субъектов со значительным коморбидным депрессивным или психотическим расстройством исключали.
В исследования включали амбулаторных пациентов в возрасте ≥18 лет с первичным диагнозом “алкогольная зависимость”. Пациент подходил для участия в исследовании, если в течение 4 недель, предшествующих скрининговому визиту (исходный период), он/она имел/имела >6 HDD, по меньшей мере средний DRL (рассчитанный как среднее суточное потребление алкоголя в г/сутки, т.е. составляющее >40 г/сутки для мужчин и >20 г/сутки для женщин, рассчитанное как среднее суточное потребление алкоголя в течение 4-недельного периода, предшествующего скрининговому визиту) и ≤14 последовательных суток отказа от употребления алкоголя. Способ ретроспективной хронологической шкалы (TLFB) применяли для получения оценок суточного употребления алкоголя пациентами.
Исследования проводили в течение 34-недельного периода (12 визитов) в целом, и они состояли из четырех последовательных периодов: 2-недельного периода скрининга, 24-недельного периода двойного слепого лечения, 4-недельного периода двойного слепого плацебо-контролируемого выведения из лечения в каждой из групп лечения и, наконец, 4-недельного последующего наблюдения в целях безопасности. Через одну-две недели после скринингового визита пациентов рандомизировали 1:1 для 24-недельного двойного слепого лечения по мере необходимости (основной период лечения; МТР) с помощью налмефена (18 мг) или плацебо. Пациенты, завершившие 24-недельное двойное слепое лечение, вступали в 4-недельный период двойного слепого выведения из лечения (ROP). Пациентов, рандомизированных для получения налмефена, повторно рандомизировали 1:1 для получения налмефена (18 мг, по мере необходимости) или плацебо, а пациенты, рандомизированные для получения плацебо, продолжали получать плацебо.
Способ ретроспективной хронологической шкалы (TLFB) применяли для сбора данных об употреблении алкоголя (потреблении алкоголя), сообщаемых самими пациентами.
Во время начального визита оценивали клиническое состояние, социальную ситуацию пациентов и особенности потребления ими алкоголя (на основании сообщений пациентов). После 1-2-недельного периода наблюдения уровень риска, связанного с употреблением алкоголя, повторно оценивали (т.е. рассчитывали среднее суточное потребление алкоголя в течение 1-2-недельного периода оценивания), и лечение налмефеном начинали вместе с консультированием, направленным на мотивирование пациентов к приверженности к лечению и к изменению их поведения, связанного с употреблением алкоголя. Во всех исследованиях мотивационное и повышающее приверженность вмешательство согласно модели BRENDA применяли по отношению ко всем пациентам для поддержки пациентов в изменении их поведения и для повышения приверженности к лечению.
Употребление алкоголя пациентами (г/сутки) оценивали на основании национальных определений стандартных единиц (впоследствии пересчитываемых в граммы спирта). Для определения стандартных единиц каждому пациенту во время скринингового визита выдавали карту пересчета стандартных доз алкоголя. Каждому пациенту также предоставляли календарь, который он/она мог/могла использовать с целью помощи ему/ей в составлении TLFB, или же он/она мог/могла по желанию использовать личный календарь. Для всех переменных, полученных из данных согласно TLFB, исходный уровень определяли как значение за месяц (то есть 4 недели/28 последовательных суток), предшествующий скрининговому визиту. Исследуемый лекарственный препарат (IMP) принимали по мере необходимости. Каждому пациенту давали указание принимать не более одной таблетки в каждые сутки, в которые пациент ощущал риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления. Если пациент начинал употреблять алкоголь, не приняв налмефен, пациенту следовало принять одну таблетку как можно скорее. Даты, когда принимали/не принимали налмефен, отмечали при помощи способа TLFB. Выбранным препаратом сравнения было плацебо.
Демографические данные для каждого исследования представлены в Таблицах 2-4 ниже. В Таблице 5 обобщено количество пациентов в анализе эффективности для каждой группы пациентов.
Эффективность налмефена измеряли с применением двух комбинированных первичных конечных точек: изменения числа суток употребления алкоголя в большом количестве (HDD) за месяц и изменения среднего суточного общего потребления алкоголя (ТАС) в расчете на месяц (= 28 суток). HDD определяли как сутки с потреблением ≥60 г спирта для мужчин и ≥40 г для женщин. Данные, полученные к месяцу 6, приведены в Таблице 6 ниже. Изменение HDD и ТАС с течением времени у пациентов, получавших лечение налмефеном или плацебо, дополнительно отражены на Фигурах 1-12.
В Таблице 6 указано, что во всех трех исследованиях различие между налмефеном и плацебо, измеренное в HDD и ТАС, было более явно выраженным в группе пациентов с высоким DRL на исходном уровне, чем в общей исследуемой популяции.
В Таблице 6 также указано, что во всех трех исследованиях различие между налмефеном и плацебо, измеренное в HDD и ТАС, было более явно выраженным в группе пациентов за исключением ER, чем в общей исследуемой популяции.
Наконец, в Таблице 6 явно указано, что во всех трех исследованиях различие между налмефеном и плацебо, измеренное в HDD и ТАС, было более явно выраженным в группе пациентов с высоким DRL на исходном уровне и при рандомизации, чем в общей исследуемой популяции.
Claims (18)
1. Применение налмефена в лечении алкогольной зависимости у пациента с алкогольной зависимостью, где указанное применение уменьшает потребление алкоголя, при этом указанный пациент с алкогольной зависимостью:
имеет уровень риска, связанного с употреблением алкоголя (DRL), составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин,
при этом у указанного пациента сохраняется высокий DRL, составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после периода наблюдения, следующего за начальным оцениванием, и
указанный период наблюдения, следующий за начальным оцениванием, составляет 1-2 недели.
2. Применение по п. 1, где указанный период наблюдения, следующий за начальным оцениванием, составляет приблизительно 2 недели.
3. Применение по п. 1, где указанному пациенту не требуется немедленная детоксикация и/или где указанный пациент не имеет физических симптомов абстинентного синдрома.
4. Применение по п. 1, где указанному пациенту оказывают текущую мотивационную поддержку.
5. Применение по п. 1, где указанному пациенту оказывается консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя.
6. Применение по п. 5, где указанное консультирование осуществляется согласно модели BRENDA.
7. Применение по п. 1, где указанный пациент является пациентом, целью лечения которого не является немедленный полный отказ от употребления алкоголя.
8. Применение по п. 1, где указанный налмефен следует применять в течение периода лечения продолжительностью 6-12 месяцев, в частности 6 месяцев.
9. Применение по п. 1, где указанный пациент является взрослым или подростком.
10. Применение по п. 1, где указанный налмефен следует вводить по мере необходимости.
11. Применение по п. 1, где указанный пациент не попадает в одну или несколько следующих категорий: пациенты, принимающие опиоидные аналгетики, пациенты с опиоидной зависимостью без успешной абстиненции, пациенты с острыми симптомами опиоидного абстинентного синдрома, пациенты, предположительно недавно употреблявшие опиоиды, пациенты с умеренной или тяжелой формой печеночной недостаточности, пациенты с умеренной или тяжелой формой почечной недостаточности, пациенты с текущей или недавней опиоидной зависимостью, пациенты с острым алкогольным абстинентным синдромом (в том числе с галлюцинациями, эпилептическими припадками и алкогольным делирием) в ближайшем анамнезе.
12. Применение по п. 1, где указанный налмефен вводят в форме фармацевтически приемлемой кислотно-аддитивной соли.
13. Применение по п. 12, где указанный налмефен вводят в форме гидрохлоридной соли.
14. Применение по п. 13, где указанный налмефен вводят в форме дигидрата гидрохлорида.
15. Применение по п. 1, где указанный налмефен вводят в лекарственной форме для перорального применения, такой как таблетки или капсулы.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261664804P | 2012-06-27 | 2012-06-27 | |
| US61/664,804 | 2012-06-27 | ||
| US201261721539P | 2012-11-02 | 2012-11-02 | |
| US61/721,539 | 2012-11-02 | ||
| US201261736740P | 2012-12-13 | 2012-12-13 | |
| US61/736,740 | 2012-12-13 | ||
| US201361788810P | 2013-03-15 | 2013-03-15 | |
| US61/788,810 | 2013-03-15 | ||
| PCT/EP2013/063461 WO2014001427A1 (en) | 2012-06-27 | 2013-06-27 | Nalmefene for reduction of alcohol consumption in specific target populations |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014151156A RU2014151156A (ru) | 2016-08-20 |
| RU2665373C2 true RU2665373C2 (ru) | 2018-08-29 |
Family
ID=48703496
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014151156A RU2665373C2 (ru) | 2012-06-27 | 2013-06-27 | Налмефен для уменьшения потребления алкоголя у конкретных целевых популяций |
Country Status (35)
| Country | Link |
|---|---|
| US (4) | US20140005216A1 (ru) |
| EP (5) | EP2866808B1 (ru) |
| JP (3) | JP6258933B2 (ru) |
| KR (1) | KR20150023396A (ru) |
| CN (1) | CN104411313A (ru) |
| AU (1) | AU2013283281B2 (ru) |
| BR (1) | BR112014032555A2 (ru) |
| CA (1) | CA2874703C (ru) |
| CL (1) | CL2014003484A1 (ru) |
| CO (1) | CO7160087A2 (ru) |
| CY (3) | CY1118579T1 (ru) |
| DK (3) | DK2866808T3 (ru) |
| EA (1) | EA029908B1 (ru) |
| ES (4) | ES3014068T3 (ru) |
| FI (1) | FI3345604T3 (ru) |
| HK (1) | HK1255683A1 (ru) |
| HR (4) | HRP20161717T1 (ru) |
| HU (4) | HUE063313T2 (ru) |
| IL (1) | IL236035B (ru) |
| LT (3) | LT2866808T (ru) |
| ME (2) | ME03030B (ru) |
| MX (1) | MX371373B (ru) |
| MY (1) | MY166914A (ru) |
| NZ (1) | NZ702191A (ru) |
| PH (1) | PH12014502798A1 (ru) |
| PL (4) | PL3138564T3 (ru) |
| PT (3) | PT3138564T (ru) |
| RS (2) | RS55456B1 (ru) |
| RU (1) | RU2665373C2 (ru) |
| SG (1) | SG11201408704WA (ru) |
| SI (3) | SI3138564T1 (ru) |
| SM (3) | SMT201600471T1 (ru) |
| UA (1) | UA114199C2 (ru) |
| WO (1) | WO2014001427A1 (ru) |
| ZA (1) | ZA201409525B (ru) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140005216A1 (en) | 2012-06-27 | 2014-01-02 | H. Lundbeck A/S | Nalmefene for reduction of alcohol consumption in specific target populations |
| JP6419780B2 (ja) * | 2013-04-17 | 2018-11-07 | ハー・ルンドベック・アクチエゼルスカベット | 睡眠障害患者の治療のためのナルメフェン |
| US20170042887A1 (en) | 2014-04-22 | 2017-02-16 | Otsuka Pharmaceutical. Co., Ltd. | Combination of Brexpiprazole and Nalmefene and Use Thereof for Treating Substance-Related Disorders |
| US20170071590A1 (en) * | 2015-09-10 | 2017-03-16 | Suture Armor Llc | Suture anchor |
| KR102699603B1 (ko) | 2018-04-20 | 2024-08-29 | 삼성전자주식회사 | 반도체 메모리 소자 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003015783A1 (en) * | 2001-08-14 | 2003-02-27 | Biotie Therapies Corporation | Method of treating alcoholism or alcohol abuse |
| WO2010063292A1 (en) * | 2008-12-05 | 2010-06-10 | H. Lundbeck A/S | Nalmefene hydrochloride dihydrate |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3814768A (en) | 1971-11-26 | 1974-06-04 | Lewenstein E | 6-methylene-6-desoxy dihydro morphine and codeine derivatives and pharmaceutically acceptable salts |
| US4535157A (en) | 1983-11-01 | 1985-08-13 | Key Pharmaceuticals, Inc. | Process for making 6-desoxy-6-methylenenaloxone and 6-desoxy-6-methylenenaltrexone |
| US5086058A (en) * | 1990-06-04 | 1992-02-04 | Alko Ltd. | Method for treating alcoholism with nalmefene |
| WO2010136039A1 (en) | 2009-05-25 | 2010-12-02 | H. Lundbeck A/S | Preparation of nalmefene hydrochloride from naltrexone |
| JP6246589B2 (ja) | 2010-11-05 | 2017-12-13 | ハー・ルンドベック・アクチエゼルスカベット | ナルトレキソンの製造方法 |
| TR201803744T4 (tr) | 2011-03-31 | 2018-07-23 | Imuneks Farma Ilac Sanayi Ve Ticaret Anonim Sirketi | Skleroderma tedavisinde kullanım için naltrekson içeren bileşimler. |
| US20140005216A1 (en) | 2012-06-27 | 2014-01-02 | H. Lundbeck A/S | Nalmefene for reduction of alcohol consumption in specific target populations |
-
2013
- 2013-06-26 US US13/928,317 patent/US20140005216A1/en not_active Abandoned
- 2013-06-26 US US13/928,332 patent/US20140005217A1/en not_active Abandoned
- 2013-06-27 EP EP13732471.1A patent/EP2866808B1/en not_active Revoked
- 2013-06-27 ES ES23163177T patent/ES3014068T3/es active Active
- 2013-06-27 HU HUE17206034A patent/HUE063313T2/hu unknown
- 2013-06-27 BR BR112014032555A patent/BR112014032555A2/pt not_active Application Discontinuation
- 2013-06-27 SI SI201330973T patent/SI3138564T1/en unknown
- 2013-06-27 DK DK13732471.1T patent/DK2866808T3/en active
- 2013-06-27 JP JP2015519085A patent/JP6258933B2/ja active Active
- 2013-06-27 EP EP24221142.3A patent/EP4541421A3/en active Pending
- 2013-06-27 LT LTEP13732471.1T patent/LT2866808T/lt unknown
- 2013-06-27 WO PCT/EP2013/063461 patent/WO2014001427A1/en not_active Ceased
- 2013-06-27 ME MEP-2018-68A patent/ME03030B/me unknown
- 2013-06-27 DK DK17206034.5T patent/DK3345604T3/da active
- 2013-06-27 DK DK16187426.8T patent/DK3138564T3/en active
- 2013-06-27 PL PL16187426T patent/PL3138564T3/pl unknown
- 2013-06-27 EP EP16187426.8A patent/EP3138564B1/en not_active Revoked
- 2013-06-27 KR KR1020147035322A patent/KR20150023396A/ko not_active Abandoned
- 2013-06-27 EP EP17206034.5A patent/EP3345604B1/en active Active
- 2013-06-27 HR HRP20161717TT patent/HRP20161717T1/hr unknown
- 2013-06-27 LT LTEP17206034.5T patent/LT3345604T/lt unknown
- 2013-06-27 RS RS20161173A patent/RS55456B1/sr unknown
- 2013-06-27 SI SI201330449A patent/SI2866808T1/sl unknown
- 2013-06-27 HU HUE13732471A patent/HUE031110T2/en unknown
- 2013-06-27 FI FIEP17206034.5T patent/FI3345604T3/fi active
- 2013-06-27 NZ NZ702191A patent/NZ702191A/en not_active IP Right Cessation
- 2013-06-27 HR HRP20250329TT patent/HRP20250329T1/hr unknown
- 2013-06-27 EP EP23163177.1A patent/EP4223296B1/en active Active
- 2013-06-27 HU HUE23163177A patent/HUE070621T2/hu unknown
- 2013-06-27 CN CN201380034056.2A patent/CN104411313A/zh active Pending
- 2013-06-27 PL PL23163177.1T patent/PL4223296T3/pl unknown
- 2013-06-27 LT LTEP16187426.8T patent/LT3138564T/lt unknown
- 2013-06-27 RS RS20180359A patent/RS57046B1/sr unknown
- 2013-06-27 RU RU2014151156A patent/RU2665373C2/ru active
- 2013-06-27 ME MEP-2016-286A patent/ME02587B/me unknown
- 2013-06-27 EA EA201492152A patent/EA029908B1/ru not_active IP Right Cessation
- 2013-06-27 PT PT161874268T patent/PT3138564T/pt unknown
- 2013-06-27 PL PL13732471T patent/PL2866808T3/pl unknown
- 2013-06-27 SI SI201332054T patent/SI3345604T1/sl unknown
- 2013-06-27 HU HUE16187426A patent/HUE036272T2/hu unknown
- 2013-06-27 CA CA2874703A patent/CA2874703C/en active Active
- 2013-06-27 ES ES13732471.1T patent/ES2609122T3/es active Active
- 2013-06-27 PT PT172060345T patent/PT3345604T/pt unknown
- 2013-06-27 AU AU2013283281A patent/AU2013283281B2/en not_active Ceased
- 2013-06-27 ES ES17206034T patent/ES2950492T3/es active Active
- 2013-06-27 UA UAA201500199A patent/UA114199C2/uk unknown
- 2013-06-27 SG SG11201408704WA patent/SG11201408704WA/en unknown
- 2013-06-27 SM SM20160471T patent/SMT201600471T1/it unknown
- 2013-06-27 MX MX2014015488A patent/MX371373B/es active IP Right Grant
- 2013-06-27 HR HRP20230762TT patent/HRP20230762T8/hr unknown
- 2013-06-27 MY MYPI2014003570A patent/MY166914A/en unknown
- 2013-06-27 PT PT137324711T patent/PT2866808T/pt unknown
- 2013-06-27 SM SM20180164T patent/SMT201800164T1/it unknown
- 2013-06-27 ES ES16187426.8T patent/ES2663532T3/es active Active
- 2013-06-27 PL PL17206034.5T patent/PL3345604T3/pl unknown
-
2014
- 2014-12-02 IL IL236035A patent/IL236035B/en active IP Right Grant
- 2014-12-15 PH PH12014502798A patent/PH12014502798A1/en unknown
- 2014-12-22 CO CO14280546A patent/CO7160087A2/es not_active Application Discontinuation
- 2014-12-22 CL CL2014003484A patent/CL2014003484A1/es unknown
- 2014-12-23 ZA ZA2014/09525A patent/ZA201409525B/en unknown
-
2016
- 2016-04-07 US US15/093,097 patent/US9642849B2/en active Active
- 2016-12-27 SM SM201600471T patent/SMT201600471B/it unknown
-
2017
- 2017-01-03 CY CY20171100004T patent/CY1118579T1/el unknown
- 2017-03-22 US US15/466,024 patent/US10034874B2/en active Active
- 2017-09-22 JP JP2017182608A patent/JP2018039810A/ja not_active Withdrawn
-
2018
- 2018-02-28 HR HRP20180363TT patent/HRP20180363T1/hr unknown
- 2018-03-27 CY CY20181100346T patent/CY1120097T1/el unknown
- 2018-11-20 HK HK18114830.5A patent/HK1255683A1/en unknown
-
2019
- 2019-04-25 JP JP2019083718A patent/JP6857684B2/ja active Active
-
2023
- 2023-07-25 CY CY20231100359T patent/CY1126140T1/el unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003015783A1 (en) * | 2001-08-14 | 2003-02-27 | Biotie Therapies Corporation | Method of treating alcoholism or alcohol abuse |
| WO2010063292A1 (en) * | 2008-12-05 | 2010-06-10 | H. Lundbeck A/S | Nalmefene hydrochloride dihydrate |
Non-Patent Citations (1)
| Title |
|---|
| John David Sinclai. Evidence about the use of naltrexone and for different ways of using it in the treatment of alcoholism. Alcohol Alcohol (2001) 36 (1): 2-10. Karhuvaara S et al. Targeted nalmefene with simple medical management in the treatment of heavy drinkers: a randomized double-blind placebo-controlled multicenter study. Alcohol Clin Exp Res. 2007 Jul;31(7):1179-87, PMID 17451401. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6857684B2 (ja) | 特定の標的集団におけるアルコール消費を低減するためのナルメフェン | |
| ES2337622T3 (es) | Uso de composiciones que contienen antagonistas del receptor opioide kappa para el tratamiento de trastornos disociativos. | |
| HK1229720B (en) | Nalmefene for reduction of alcohol consumption in specific target populations | |
| HK1229720A1 (en) | Nalmefene for reduction of alcohol consumption in specific target populations | |
| HK1208185B (en) | Nalmefene for reduction of alcohol consumption in specific target populations | |
| CA3237151A1 (en) | Methods and compositions for treating conditions associated with central hypoventilation | |
| CA2909504C (en) | Nalmefene for treatment of patients with mood disorder | |
| WO2014170353A1 (en) | Nalmefene for treatment of patients with sleep disorder |