RU2661151C1 - Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий - Google Patents
Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий Download PDFInfo
- Publication number
- RU2661151C1 RU2661151C1 RU2017143678A RU2017143678A RU2661151C1 RU 2661151 C1 RU2661151 C1 RU 2661151C1 RU 2017143678 A RU2017143678 A RU 2017143678A RU 2017143678 A RU2017143678 A RU 2017143678A RU 2661151 C1 RU2661151 C1 RU 2661151C1
- Authority
- RU
- Russia
- Prior art keywords
- glyceraldehyde
- phosphate dehydrogenase
- activity
- tuberculosis
- inhibitors
- Prior art date
Links
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 title claims abstract description 45
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 title claims abstract description 6
- 229940124639 Selective inhibitor Drugs 0.000 title description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims abstract description 4
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 claims abstract description 3
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 claims abstract description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims abstract description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 3
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 claims abstract description 3
- 239000003112 inhibitor Substances 0.000 claims description 24
- 230000000694 effects Effects 0.000 abstract description 29
- 102000004190 Enzymes Human genes 0.000 abstract description 20
- 108090000790 Enzymes Proteins 0.000 abstract description 20
- 241001465754 Metazoa Species 0.000 abstract description 10
- 201000008827 tuberculosis Diseases 0.000 abstract description 8
- 241000187479 Mycobacterium tuberculosis Species 0.000 abstract description 5
- 231100000676 disease causative agent Toxicity 0.000 abstract description 3
- 230000005764 inhibitory process Effects 0.000 abstract description 3
- 230000001629 suppression Effects 0.000 abstract description 3
- 239000000126 substance Substances 0.000 abstract 1
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 39
- 150000001875 compounds Chemical class 0.000 description 23
- 229940088598 enzyme Drugs 0.000 description 19
- 229940084102 Glyceraldehyde 3-phosphate dehydrogenase inhibitor Drugs 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 230000002401 inhibitory effect Effects 0.000 description 12
- 239000000243 solution Substances 0.000 description 11
- 241001646725 Mycobacterium tuberculosis H37Rv Species 0.000 description 10
- 230000002365 anti-tubercular Effects 0.000 description 10
- -1 (5,6-dihydro-4H-cyclopenta [b] thiophen-2-yl) piperazine-1-carboxamide Chemical compound 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 229950006238 nadide Drugs 0.000 description 8
- 241000282412 Homo Species 0.000 description 7
- 244000052769 pathogen Species 0.000 description 7
- 241000186359 Mycobacterium Species 0.000 description 6
- 239000005515 coenzyme Substances 0.000 description 5
- BBINVMJRNLNOCP-UHFFFAOYSA-N ethyl 2-[[4-(2-hydroxyethyl)piperazine-1-carbonyl]amino]-5,6-dihydro-4h-cyclopenta[b]thiophene-3-carboxylate Chemical compound S1C=2CCCC=2C(C(=O)OCC)=C1NC(=O)N1CCN(CCO)CC1 BBINVMJRNLNOCP-UHFFFAOYSA-N 0.000 description 5
- 230000017066 negative regulation of growth Effects 0.000 description 5
- 235000018102 proteins Nutrition 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 4
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 4
- 235000011130 ammonium sulphate Nutrition 0.000 description 4
- 210000004027 cell Anatomy 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 210000003205 muscle Anatomy 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- 101710088194 Dehydrogenase Proteins 0.000 description 3
- 101001066129 Homo sapiens Glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 229940072185 drug for treatment of tuberculosis Drugs 0.000 description 3
- 230000034659 glycolysis Effects 0.000 description 3
- 102000047486 human GAPDH Human genes 0.000 description 3
- 230000002779 inactivation Effects 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 3
- BOPGDPNILDQYTO-NNYOXOHSSA-N nicotinamide-adenine dinucleotide Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 BOPGDPNILDQYTO-NNYOXOHSSA-N 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- WRXIXEXEZKJUTP-UHFFFAOYSA-N 1,4,2,5-dioxadiazine Chemical class O1C=NOC=N1 WRXIXEXEZKJUTP-UHFFFAOYSA-N 0.000 description 2
- 241000203069 Archaea Species 0.000 description 2
- 244000026610 Cynodon dactylon var. affinis Species 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 241000187480 Mycobacterium smegmatis Species 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical class C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- YNVOMSDITJMNET-UHFFFAOYSA-M thiophene-3-carboxylate Chemical compound [O-]C(=O)C=1C=CSC=1 YNVOMSDITJMNET-UHFFFAOYSA-M 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- LXJXRIRHZLFYRP-VKHMYHEASA-L (R)-2-Hydroxy-3-(phosphonooxy)-propanal Natural products O=C[C@H](O)COP([O-])([O-])=O LXJXRIRHZLFYRP-VKHMYHEASA-L 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- 230000005730 ADP ribosylation Effects 0.000 description 1
- 241000881711 Acipenser sturio Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 108010062877 Bacteriocins Proteins 0.000 description 1
- 239000002028 Biomass Substances 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- LXJXRIRHZLFYRP-VKHMYHEASA-N D-glyceraldehyde 3-phosphate Chemical compound O=C[C@H](O)COP(O)(O)=O LXJXRIRHZLFYRP-VKHMYHEASA-N 0.000 description 1
- 230000033616 DNA repair Effects 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108091026813 Poly(ADPribose) Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 239000007801 affinity label Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000001355 anti-mycobacterial effect Effects 0.000 description 1
- 229940121383 antituberculosis agent Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229940079919 digestives enzyme preparation Drugs 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000037149 energy metabolism Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000005227 gel permeation chromatography Methods 0.000 description 1
- 230000023266 generation of precursor metabolites and energy Effects 0.000 description 1
- 230000001890 gluconeogenic effect Effects 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 108010045676 holotransferrin Proteins 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 239000008057 potassium phosphate buffer Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- XNSAINXGIQZQOO-SRVKXCTJSA-N protirelin Chemical compound NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H]1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-SRVKXCTJSA-N 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000009919 sequestration Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- YNVOMSDITJMNET-UHFFFAOYSA-N thiophene-3-carboxylic acid Chemical compound OC(=O)C=1C=CSC=1 YNVOMSDITJMNET-UHFFFAOYSA-N 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 239000000814 tuberculostatic agent Substances 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к производным этил 2-[{(пиперазин-1-ил)карбонил}амино]-5,6-дигидро-4Н-циклопента[b]тиофенил-3-карбоксилата общей формулы:
где R1 - (2R)-3-этоксипропан-2-ол или этоксикарбонил или гидроксиэтил или (2S)-2-бутан-1-ол, R2 - Н или метил, которые селективно ингибируюют глицеральдегид-3-фосфатдегидрогеназу микобактерий, при этом не оказывая влияния на активность гомологичных ферментов человека и животных, а также подавляют рост возбудителя туберкулеза Mycobacterium tuberculosis штамм H37Rv. 1 табл., 8 пр.
Description
Область техники
Настоящее изобретение относится к области медицинской химии, фармакологии, медицины и касается применения химических соединений ряда (5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)пиперазин-1-карбоксамида в качестве ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий для подавления роста возбудителя туберкулеза.
Уровень техники
Гликолитический фермент глицеральдегид-3-фосфатдегидрогеназа относится к белкам «домашнего хозяйства» и играет ключевую роль в энергетическом метаболизме всех организмов [Seidler N.W. GAPDH and intermediary metabolism. Adv. Exp. Med. Biol. 2013, 985, c. 37-59], в том числе всех типов бактерий [Ronimus R.S., Morgan H.W. Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism, Archaea, 2003, 1(3), с. 199-221]. В последнее время показано особое значение глицеральдегид-3-фосфатдегидрогеназа в обеспечении жизнедеятельности микобактерий, поскольку для этих микроорганизмов она необходима не только для осуществления гликолиза, но и для транспорта железа из организма хозяина [Boradia V.M., Malhotra Н., Thakkar J.S., Tillu V.A., Vuppala В., Patil P., Sheokand N., Sharma P., Chauhan A.S., Raje M., Raje C.I. Mycobacterium tuberculosis acquires iron by cell-surface sequestration and internalization of human holo-transferrin. Nat Commun. 2014,5, c. 4730, Z. Fanga, S.L. Sampson, R.M. Warren, N.C. Gey van Pittius, M. Newton-Foot, Tuberculosis, 2015, 95, c. 123-130]. С учетом ключевой роли фермента в метаболизме, глицеральдегид-3-фосфатдегидрогеназа представляет интерес в качестве потенциальной мишени для лекарственных препаратов против патогенных организмов.
Из научной и патентной литературы известны ингибиторы глицеральдегид-3-фосфатдегидрогеназ (КФ 1.2.1.12), которые связываются в активном центре ферментов из различных источников и подавляют его активность, при этом основное внимание уделяется глицеральдегид-3-фосфатдегидрогеназам эукариот. Так, например, было изучено ингибирование глицеральдегид-3-фосфатдегидрогеназы из мышц кролика ароматическими тиолами и обнаружены ингибиторы, приводящие к ковалентной модификации критически важного для функционирования фермента аминокислотного остатка цистеина 149 в активном центре, что приводило к потере каталитической активности [Черноризов К.А., Элькина Ю.Л., Семенюк П.И., Швядас В.К., Муронец В.И. "Новые ингибиторы глицеральдегид-3-фосфатдегидрогеназы: ковалентная модификация NAD-связывающего центра ароматическими тиолами", Биохимия, 2010, 75 №12, с. 1662-1669]. Так как обнаруженные ингибиторы способны подавлять активность гомологичных ферментов животных и человека, они принципиально не пригодны для использования в качестве противотуберкулезных препаратов из-за токсичности для организма хозяина.
Также известно инактивирующее действие винилсульфонов на глицеральдегид-3-фосфатдегидрогеназы [Sok D.E., Choi D.S., Kim Y.B., Lee Y.H., Ha S.H. "Selective inactivation of glyceraldehyde-3-phosphate dehydrogenase by vinyl sulfones", Biochem. Biophys. Res. Commun., 1993, 195(3), c. 1224-1229]. Показано, что инактивацию фермента предтотвращает присутствие кофермента НАД+ и субстрата глицеральдегид-3-фосфата, т.е. ингибитор связывается в активном центре и, по сути, конкурирует с субстратом и коферментом. Ингибиторы этого класса также не представляют интереса как антибиотики из-за взаимодействия с другими ферментами и последующей модификации как в организме хозяина, так и самими патогенами.
Известны работы по изучению ингибиторных свойств структурных аналогов кофермента [Woenckhaus С, Jeck R, , Dietz G, Jentsch G. "Inactivation of ADH from yeast and GAPDH from rabbit muscle by structural analogues of NAD+'', FEBS Letters, 1973, 34(2), 175-178; , Branlant G. NAD+ analogue binding to glyceraldehyde-3-phosphate dehydrogenase, Eur. J. Biochem. 1983, 137(1-2), c. 67-73; Tritsch D., Eiler-Samama В., Svircevic J., Albrecht A.M., Branlant G., Biellmann J.F. 4-Chloroacetylpyridine adenine dinucleotide. A highly reactive and chromophoric affinity label of glyceraldehyde-3-phosphate dehydrogenase from sturgeon. Eur. J. Biochem. 1989, 181(1), c. 215-222]. Было показано, что структурные аналоги кофермента глицеральдегид-3-фосфатдегидрогеназы способны эффективно подавлять ферментативную активность NAD-зависимых ферментов, однако это ингибирующее действие не является селективным. Трудность создания селективных ингибиторов этого класса обусловлена тем, что такие ингибиторы подавляют активность целого ряда других ферментов, механизм действия которых основан на участии этого же кофермента. NAD-зависимые ферменты представляют собой ключевые ферменты многих процессов, принципиально важных для существования животных и человека: это, например, NAD-зависимые оксидоредуктазы, катализирующие реакции энергетического обеспечения организма [Эллиот В., Эллиот Д. Биохимия и молекулярная биология, под ред. А.И. Арчакова, М.П. Кирпичникова, А.Е. Медведева, В.П. Скулачева, Москва, Изд-во МАИК, 2002], ферменты, катализирующие реакции переноса ADP-рибозы при посттрансляционной модификации - ADP-рибозилировании [Diefenbach J., Introduction to poly(ADP-ribose) metabolism, Cellular and molecular life sciences, 2005, 62(7-8), c. 721-730], реакции репарации ДНК [ Poly(ADP-ribose]. The most elaborate metabolite of NAD+. FEBS Journal, 2005, 272(18), c. 4576-4589] и ряд других ферментов [Ziegler М. New functions of a long-known molecule. Emerging roles of NAD in cellular signaling. Eur. J. Biochem., 2000, 267(6), с. 1550-1564]. Такие неспецифические ингибиторы не могут быть использованы для подавления жизнедеятельности патогенов, в том числе не могут селективно подавлять рост возбудителя туберкулеза и выполнять роль противотуберкулезных лекарственных препаратов, поскольку ингибируют активность ключевых ферментов гликолиза, а также других ферментов, жизненно необходимых для существования человека и животных.
Наиболее близким аналогом к заявляемому является применение синтезированных производных 1,4,2,5-диоксадиазина в качестве ингибиторов ряда ферментов, в том числе глицеральдегид-3-фосфатдегидрогеназу из мышц кролика [RU 2212409, 20.09.2003]. Однако авторами не показана активность вновь синтетизированных производных 1,4,2,5-диоксадиазина в качестве ингибиторов бактериальных глицеральдегид-3-фосфатдегидрогеназ. Обнаруженная ингибиторная активность в отношении глицеральдегид-3-фосфатдегидрогеназы из мышц кролика не позволяет применять данные соединения в качестве новых антибиотиков ввиду их способности ингибировать гомологичные ферменты животных и человека.
Таким образом, до настоящего времени селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий неизвестны. Кроме того, известные на сегодняшний день ингибиторы глицеральдегид-3-фосфатдегидрогеназ токсичны для человека и животных. В связи с этим поиск селективных и малотоксичных ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий представляет актуальную задачу.
Раскрытие изобретения
Задачей настоящего изобретения является разработка новых ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий для подавления роста возбудителя туберкулеза, которые не влияют на каталитические свойства глицеральдегид-3-фосфатдегидрогеназ человека и животных.
Техническим результатом изобретения является способность химических соединений ряда (5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)пиперазин-1-карбоксамида селективно ингибировать глицеральдегид-3-фосфатдегидрогеназы микобактерий для подавления роста возбудителя туберкулеза, при этом не оказывая влияния на каталитические свойства глицеральдегид-3-фосфатдегидрогеназ человека и животных.
Поставленная задача решается применением химических соединений ряда этил 2-[{(пиперазин-1-ил)карбонил}амино]-5,6-дигидро-4Н-циклопента[b]тиофенил-3-карбоксилатов общей формулы (1):
где R1 - (2R)-3-этоксипропан-2-ол, или этоксикарбонил, или гидроксиэтил, или (2S)-2-бутан-1-ол, R2 – Н, или метил в качестве селективных ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий.
Указанные соединения - производные (5,6-дигидро-4Н-циклопента[b]тиофен-2-ил)пиперазин-1-карбоксамида являются селективными ингибиторами глицеральдегид-3-фосфатдегидрогеназы микобактерий, не ингибируют активность глицеральдегид-3-фосфатдегидрогеназы человека и животных, подавляют рост возбудителя туберкулеза Mycobacterium tuberculosis и могут быть использованы как противотуберкулезные средства.
Осуществление изобретения
Структура соединений известна из базы данных химических соединений ZINC (http://zincl5.docking.org/) под уникальными идентификационными номерами (представлены также соответствующие названия по номенклатуре IUPAC) ZINC611067648 - этил-2-[({4-[(2R)-3-этокси-2-гидроксипропил]пиперазин-l-ил1}карбонил)амино]-5,6-дигидро-4Н-циклопента[b]тиофен-3-карбоксилат, ZINC6757395 - этил 4-{[3-(этоксикарбонил)-5,6-дигидро-4Н-циклопента[b]тиофен-2-ил]карбамоил}пиперазин-1-карбоксилат, ZINC20573457 - этил-2-({[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}амино)-5,6-дигидро-4Н-циклопента[b]тиофен-3-карбоксилат, ZINC611066726 - этил-2-[({4-[(2S)-1-гидроксибутан-2-ил]пиперазин-1-ил}карбонил)амино]-5,6-дигидро-4Н-циклопента[b]тиофен-3-карбоксилат, ZINC614690679 этил-2-({[(3S)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]карбонил}амино)-5,6-дигидро-4Н-циклопента[b]тиофен-3-карбоксилат.
Все используемые реагенты являются коммерчески доступными. Химические соединения для изучения ингибиторных свойств приобретались у компании Vitas-M (каталожные номера STK854863 и STK601560) и компании Enamine-REAL (каталожные номера Z1503993216, Z1503993108, Z1751153291). При этом публикации с описанием свойств указанных соединений отсутствуют. При исследовании свойств указанных соединений была выявлена ингибирующая активность соединений в отношении глицеральдегид-3-фосфат дегидрогеназы микобактерий.
Тестирование противотуберкулезной активности ингибиторов глицеральдегид-3-фосфат дегидрогеназы in vitro проводили по стандартным методикам, используемым в ЦНИИ туберкулеза РАН и описанным ранее [V. Sosunov, V. Mischenko, В. Eruslanov, Е. Svetoch, Y. Shakina, N. Stern, K. Majorov, G. Sorokoumova, A. Selishcheva, A. Apt, Antimycobacterial activity of bacteriocins and their complexes with liposomes, Journal of Antimicrobial Chemotherapy, 2007, 59, 919-925]. При тестировании противотуберкулезной активности соединений использовали Mycobacterium tuberculosis штамм H37Rv из коллекции ЦНИИ туберкулеза РАН. Приготовление суспензии, содержащей практически исключительно отдельные микобактерии, производили по методике, подробно описанной ранее [I. Lyadova, V. Yeremeev, K. Majorov, В. Nikonenko, S. Khaidukov, Т. Kondratieva, N. Kobets, A. Apt, An Ex Vivo Study of T Lymphocytes Recovered from the Lungs of I/St Mice Infected with and Susceptible to Mycobacterium tuberculosis, Infection and Immunity, 1998, 66 (10), 4981-4988]. Препараты микобактерий в аликвотах хранили при температуре -80°С. Микобактерии ресуспендировали в среде RPMI-1640 без антибиотиков с добавлением 2% эмбриональной телячьей сыворотки. Суспензии культивировали в лунках 96-луночного планшета (250×103 микобактерий/лунку). Исследуемые соединения растворяли в DMSO (2 мг/мл) и добавляли в лунки до конечной концентрации через 24 часа после начала культивирования микобактерий.
Методика А. Исследуемые соединения растворяли в диметилсульфоксиде (ДМСО, DMSO) (2 мг/мл) и добавляли в лунки до конечной концентрации через 24 часа после начала культивирования микобактерий. Культуры инкубировали дополнительно 65 ч, при этом последние 18 ч в присутствии [3Н]-урацила (2 μCi/20 μl/лунку). Жизнеспособность микобактерий оценивали по уровню включения радиоактивной метки на сцинтилляционном счетчике.
Методика Б. Для получения бактерий в log-фазе, 50 мкл свежеразмороженной культуры бактерий добавляли к 30 мл бульона Дюбо и инкубировали 14 дней при 37°С в закрытых 300 мл колбах. Перед использованием культуру дважды отмывали в натрий-фосфатном буфере (PBS) с 0,05% Tween80 центрифугированием при +4°С, 20 мин, 3000 g, после чего микобактерии ресуспендировали в среде, применяемой в конкретном эксперименте. Полученную суспензию фильтровали через стерильный фильтр с размером пор 4 мкм для удаления агломератов. Для определения концентрации КОЕ Mycobacterium tuberculosis в фильтрате готовили 5-кратные серийные разведения фильтрата. 20 мкл каждого разведения сеяли на агар Дюбо в виде круглых капель. Капли высушивали и через 3 дня культивирования при 37°С и считали общее количество микроколоний под инвертированным микроскопом. Фильтрованную культуру хранили при +4°С до момента использования в течение 3-4 дней; в течение этих дней не наблюдали уменьшения числа КОЕ в культуре.
Выделение и очистка ферментных препаратов для изучения ингибиторных свойств отобранных соединений. Глицеральдегид-3-фосфатдегидрогеназу микобактерий выделяли из биомассы Mycobacterium smegmatis, полученной из 2 л культуты. Осадок клеток (5,3 г) суспендировали в 25 мл буфера (10 мМ фосфат калия, 2 мМ дитиотреитол, рН 7,0) и разрушали ультразвуком. Разрушенные клетки удаляли центрифугированием. Полученный экстракт бактериальных клеток фракционировали сульфатом аммония, собирая фракции белка, осаждаемые при 0-50, 50-70, 70-80% насыщения. Максимальная дегидрогеназная активность наблюдалась во фракции с насыщением сульфатом аммония 70-80%. Данную фракцию перекристаллизовывали, добавляя к раствору белка сульфат аммония до развития мутности. Активность глицеральдегид-3-фосфатдегидрогеназы в полученном препарате составляла 70 мкмоль восстановленного никотинамидадениндинуклеотида (NADH)/мин мг белка. Анализ полученного препарата методом электрофореза в денатурирующих условиях в присутствии додецилсульфата натрия 0,1% выявил наличие основной полосы с молекулярной массой 40 кДа. Матрично-активированная лазерная десорбционно/ионизационная масс-спектрометрия (МАЛДИ-МС) подтвердила, что полоса с молекулярной массой 40 кДа соответствует глицеральдегид-3-фосфатдегидрогеназе Mycobacterium smegmatis. Полученную активную фракцию использовали для первичного скрининга ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий.
Рекомбинантную глицеральдегид-3-фосфатдегидрогеназу человека выделяли из культуры клеток-продуцентов, используя фракционирование сульфатом аммония и гель-хроматографию на сефадексе G-100 по методике, описанной в работе [Barinova K.V., Eldarov М.А., Khomyakova E.V., Muronetz V.I., Schmalhausen E.V. Isolation of recombinant human untagged glyceraldehyde-3-phosphate dehydrogenase from E.coli producer strain, Protein Expr. Purif. (2017)137, 1-6. doi: 10.1016/j.pep.2017.06.009]. Активность глицеральдегид-3-фосфатдегидрогеназы в полученном препарате составляла 115 мкмоль NADH/мин мг белка. Полученную активную фракцию использовали для проверки ингибирующего действия отобранных соединений на активность глицеральдегид-3-фосфатдегидрогеназы человека.
Измерение активности глицеральдегид-3-фосфатдегидрогеназы при добавлении ингибиторов проводили следующим образом. Ингибирующие свойства соединений тестировали в системе, которая содержала 50 мМ глицин, 50 мМ фосфат калия, 1 мМ ЭДТА, рН 9,0, 0,5 мМ NAD и 0,5 мМ 3-фосфоглицериновый альдегид. Тестируемые соединения растворяли в диметилсульфоксиде для получения растворов концентрации 0,2-2 мМ. Растворы ферментов (глицеральдегид-3-фосфатдегидрогеназу микобактерий или человека в концентрации 0,5-1 мг/мл) перед использованием инкубировали 45 мин в 10 мМ калий-фосфатном буфере, рН 7.0 в присутствии 5 мМ дитиотреитола при комнатной температуре для восстановления SH-групп. В кюветы (1 мл), содержащие все компоненты для измерения активности, кроме 3-фосфоглицеринового альдегида, добавляли 1-2 мкл тестируемых ингибиторов, а также по 1 мкг ферментов. Кюветы без добавления ингибиторов служили контролем. Реакцию начинали добавлением 3-фосфоглицеринового альдегида до конечной концентрации 0,5 мМ. Скорость реакции регистрировали по увеличению оптической плотности раствора при 340 нм в течение 1 мин при помощи спектрофотометра Shimadzu UV-1601.
Результаты изучения ингибирующей активности указанных соединений по отношению к глицеральдегид-3-фосфатдегидрогеназе микобактерий и человека, а также тестирования противотуберкулезной активности ингибиторов глицеральдегид-3-фосфат дегидрогеназы представлены в примерах.
Пример 1. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC20573457 готовили как описано выше и использовали для определения противотуберкулезной активности по методике А. Подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,02 мМ составило 76%.
Пример 2. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC20573457 готовили как описано выше и использовали для определения противотуберкулезной активности по методике Б. Наблюдали полное подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,07 мМ.
Пример 3. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC20573457 готовили как описано выше и использовали для определения противотуберкулезной активности по методике Б. Наблюдали полное подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,2 мМ.
Пример 4. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC6757395 готовили как описано выше и использовали для определения противотуберкулезной активности по методике Б. Наблюдали слабый рост Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,07 мМ.
Пример 5. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC6757395 готовили как описано выше и использовали для определения противотуберкулезной активности по методике А. Подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,2 мМ составило 94%.
Пример 6. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC611067648 готовили как описано выше и использовали для определения противотуберкулезной активности по методике А. Подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,07 мМ составило 83%.
Пример 7. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC611066726 готовили как описано выше и использовали для определения противотуберкулезной активности по методике А. Подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,07 мМ составило 61%.
Пример 8. Раствор ингибитора глицеральдегид-3-фосфат дегидрогеназы ZINC614690679 готовили как описано выше и использовали для определения противотуберкулезной активности по методике А. Подавление роста Mycobacterium tuberculosis штамм H37Rv в присутствии ингибитора глицеральдегид-3-фосфат дегидрогеназы в концентрации 0,07 мМ составило 54%.
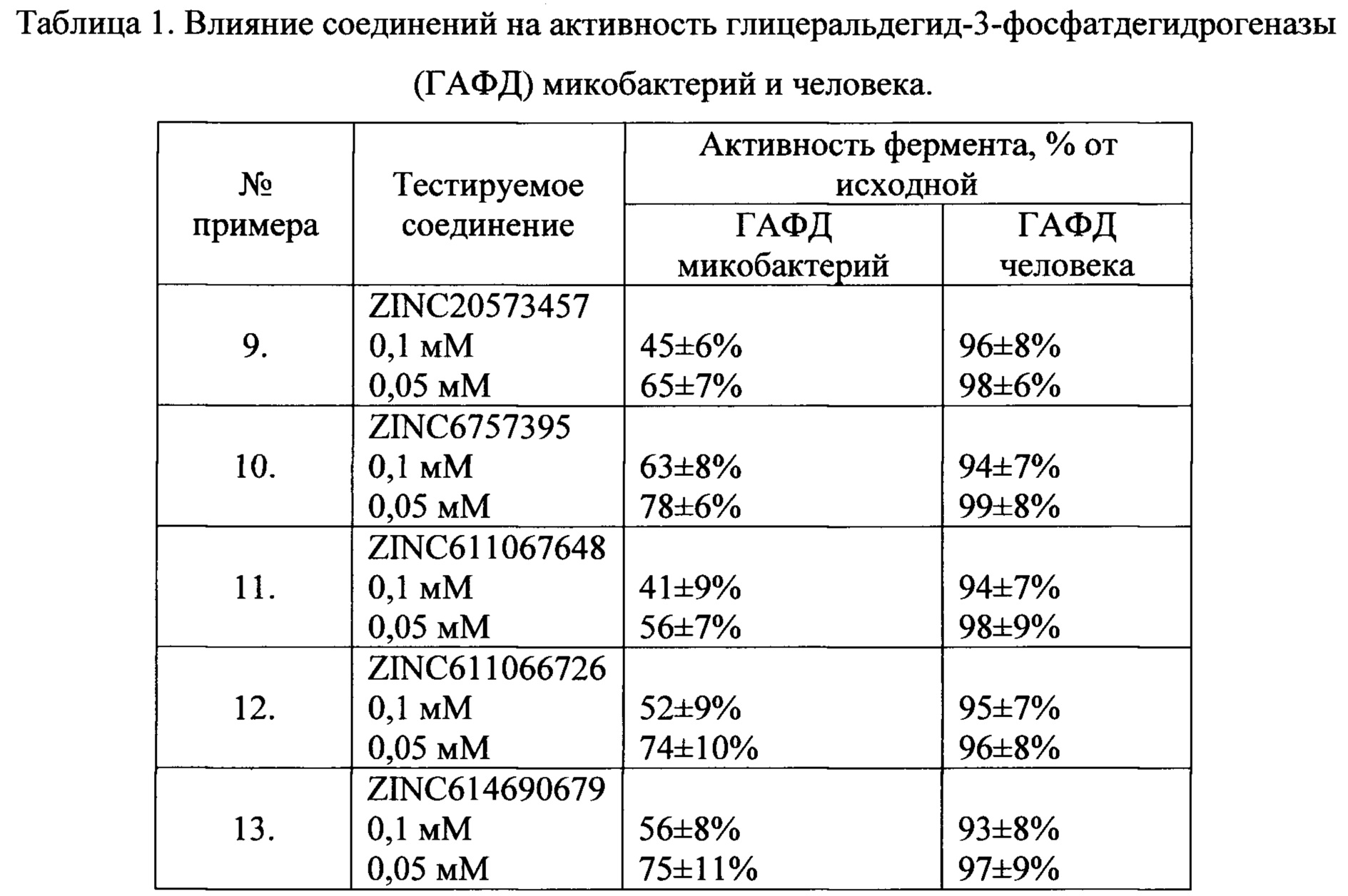
Результаты тестирования ингибиторных свойств соединений, подтверждающих селективность ингибирования, представлены в таблице 1.
Результаты испытаний ингибиторных свойств соединений, представленных в таблице, показали, что данные соединения в концентрации 0,1 мМ ингибируют глицеральдегид-3-фосфатдегидрогеназу микобактерий на 47-59%, при этом не оказывая влияния на глицеральдегид-3-фосфатдегидрогеназу человека.
Обнаруженные ингибиторы характеризуются высоким значением LD50 (доза, летальная для 50% тестируемых животных): диапазон предсказанных значений данного параметра, характеризующего острую токсичность, составляет 1200-2100 мг/кг при пероральном введении и 86-130 мг/кг при внутривенном введении мышам. Биодоступность при пероральном введении при дозе 50 мг 87-99%. Полученные результаты свидетельствуют о безопасности разработанных ингибиторов и позволяют планировать предварительные исследования на животных моделях, а также облегчают выбор подходящих доз.
Представленные примеры свидетельствуют о том, что испытанные соединения способны подавлять рост возбудителя туберкулеза Mycobacterium tuberculosis штамм H37Rv, не ингибируя активность глицеральдегид-3-фосфатдегидрогеназы человека и животных и могут быть использованы как противотуберкулезные средства.
Claims (3)
- Применение производных этил 2-[{(пиперазин-1-ил)карбонил}амино]-5,6-дигидро-4Н-циклопента[b]тиофенил-3-карбоксилата общей формулы (1):
- где R1 - (2R)-3-этоксипропан-2-ол, или этоксикарбонил, или гидроксиэтил, или (2S)-2-бутан-1-ол, R2 – Н, или метил в качестве ингибиторов глицеральдегид-3-фосфатдегидрогеназы микобактерий.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017143678A RU2661151C1 (ru) | 2017-12-14 | 2017-12-14 | Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017143678A RU2661151C1 (ru) | 2017-12-14 | 2017-12-14 | Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2661151C1 true RU2661151C1 (ru) | 2018-07-12 |
Family
ID=62917168
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017143678A RU2661151C1 (ru) | 2017-12-14 | 2017-12-14 | Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2661151C1 (ru) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4649153A (en) * | 1984-07-09 | 1987-03-10 | Lipha, Lyonnaise Industrielle Pharmaceutique | 5,6-Dihydro-4H-cyclopenta(b)thiophene-6-carboxylic acids, preparation processes and medicines containing them |
| RU2212409C1 (ru) * | 2001-12-24 | 2003-09-20 | Биологический факультет Московского государственного университета им. М.В. Ломоносова | Производные 1,4,2,5-диоксадиазина |
| US20060142279A1 (en) * | 2004-12-24 | 2006-06-29 | Marcel Andries Koenraad J L | Treatment of latent tuberculosis |
| RU2629369C1 (ru) * | 2016-10-05 | 2017-08-29 | Федеральное Государственное Унитарное Предприятие "Государственный Ордена Трудового Красного Знамени Научно-Исследовательский Институт Химических Реактивов И Особо Чистых Химических Веществ" | Четвертичные аммонийные производные 2-аминотиофен-3-карбоксилатов, обладающие противотуберкулезной активностью |
-
2017
- 2017-12-14 RU RU2017143678A patent/RU2661151C1/ru active IP Right Revival
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4649153A (en) * | 1984-07-09 | 1987-03-10 | Lipha, Lyonnaise Industrielle Pharmaceutique | 5,6-Dihydro-4H-cyclopenta(b)thiophene-6-carboxylic acids, preparation processes and medicines containing them |
| RU2212409C1 (ru) * | 2001-12-24 | 2003-09-20 | Биологический факультет Московского государственного университета им. М.В. Ломоносова | Производные 1,4,2,5-диоксадиазина |
| US20060142279A1 (en) * | 2004-12-24 | 2006-06-29 | Marcel Andries Koenraad J L | Treatment of latent tuberculosis |
| RU2629369C1 (ru) * | 2016-10-05 | 2017-08-29 | Федеральное Государственное Унитарное Предприятие "Государственный Ордена Трудового Красного Знамени Научно-Исследовательский Институт Химических Реактивов И Особо Чистых Химических Веществ" | Четвертичные аммонийные производные 2-аминотиофен-3-карбоксилатов, обладающие противотуберкулезной активностью |
Non-Patent Citations (1)
| Title |
|---|
| US 20060142279 A1 (29.06.2006. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Lu et al. | Inhibition of bacterial thioredoxin reductase: an antibiotic mechanism targeting bacteria lacking glutathione | |
| Scherman et al. | Screening a library of 1600 adamantyl ureas for anti-Mycobacterium tuberculosis activity in vitro and for better physical chemical properties for bioavailability | |
| Aboul-Fadl et al. | Anti-tubercular activity of isatin derivatives | |
| Rabani et al. | Mesenchymal stem cells enhance NOX2-dependent reactive oxygen species production and bacterial killing in macrophages during sepsis | |
| Munier-Lehmann et al. | On dihydroorotate dehydrogenases and their inhibitors and uses | |
| McGillivray et al. | Pharmacological inhibition of the ClpXP protease increases bacterial susceptibility to host cathelicidin antimicrobial peptides and cell envelope-active antibiotics | |
| US7414139B2 (en) | Catalytic antioxidants and methods of use | |
| JP6798047B2 (ja) | グルタチオンジスルフィド及びグルタチオンジスルフィドs−オキシドを含む医薬組成物 | |
| Asif | A review of antimycobacterial drugs in development | |
| Khan et al. | Biological evaluation of novel substituted chloroquinolines targeting mycobacterial ATP synthase | |
| EP2282733A2 (en) | Protection of normal cells | |
| Pei et al. | Pharmacologic ascorbate as a pro-drug for hydrogen peroxide release to kill mycobacteria | |
| McKell et al. | Promotion of anti-tuberculosis macrophage activity by L-arginine in the absence of nitric oxide | |
| Edens et al. | Histone deacetylase inhibitors induce antigen specific anergy in lymphocytes: a comparative study | |
| RU2661151C1 (ru) | Селективные ингибиторы глицеральдегид-3-фосфатдегидрогеназы микобактерий | |
| WO2014090875A1 (en) | Combination of ethambutol with at least one additional anti-bacterial agent for use in the treatment of bacterial infections | |
| Martin et al. | Analogue synthesis reveals decoupling of antibiofilm and β‐lactam potentiation activities of a lead 2‐aminoimidazole adjuvant against Mycobacterium smegmatis | |
| Huang et al. | Inhibition of S-adenosyl-L-homocysteine hydrolase alleviates alloimmune response by down-regulating CD4+ T-cell activation in a mouse heart transplantation model | |
| Shankaran et al. | Heme arginate potentiates latent HIV-1 reactivation while inhibiting the acute infection | |
| Vasudevan et al. | Biochemical evaluation and molecular docking studies on encapsulated astaxanthin for the growth inhibition of Mycobacterium tuberculosis | |
| Zitko et al. | Old drugs and new targets as an outlook for the treatment of tuberculosis | |
| Lai et al. | Potent and orally active purine-based fetal hemoglobin inducers for treating β-thalassemia and sickle cell disease | |
| Singh et al. | Nsc19723, a thiacetazone-like benzaldehyde thiosemicarbazone improves the efficacy of tb drugs in vitro and in vivo | |
| WO2008027238A2 (en) | Induction of immunosuppression by inhibition of atm | |
| Ganesh et al. | Biofilm-associated Agr and Sar quorum sensing systems of methicillin-resistant Staphylococcus aureus are inhibited by fruit extracts of Illicium verum |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20191215 |
|
| NF4A | Reinstatement of patent |
Effective date: 20211213 |