RU2654695C1 - 8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer - Google Patents
8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer Download PDFInfo
- Publication number
- RU2654695C1 RU2654695C1 RU2017127152A RU2017127152A RU2654695C1 RU 2654695 C1 RU2654695 C1 RU 2654695C1 RU 2017127152 A RU2017127152 A RU 2017127152A RU 2017127152 A RU2017127152 A RU 2017127152A RU 2654695 C1 RU2654695 C1 RU 2654695C1
- Authority
- RU
- Russia
- Prior art keywords
- amino
- cancer
- pharmaceutically acceptable
- diazaspiro
- methyl
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6558—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing at least two different or differently substituted hetero rings neither condensed among themselves nor condensed with a common carbocyclic ring or ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
Abstract
Description
Настоящее изобретение относится к 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-ону и его фармацевтически приемлемым солям - ингибиторам киназы анапластической лимфомы (ALK) и рецептора эпидермального фактора роста (EGFR), предназначенным для лечения рака.The present invention relates to 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one and its pharmaceutically acceptable salts - anaplastic lymphoma kinase (ALK) inhibitors and epidermal growth factor receptor (EGFR), intended for the treatment of cancer.
Протеинкиназы представляют собой большое семейство белков, которые играют центральную роль в регуляции широкого круга клеточных процессов и осуществляют контроль над клеточными функциями. Аномальная активность протеинкиназы связана с несколькими заболеваниями, в том числе псориазом и раковыми заболеваниями.Protein kinases are a large family of proteins that play a central role in the regulation of a wide range of cellular processes and exercise control over cellular functions. The abnormal activity of protein kinase is associated with several diseases, including psoriasis and cancer.
Известны ингибиторы киназы анапластической лимфомы (ALK), представляющие собой производные фосфора, запатентованные ARIAD Pharmaceuticals [США 2014/0066406 A1, WO 2009/143389]. В этой серии соединений самым продвинутым является АР26113, также известный как Бригатиниб (Brigatinib), оральный ингибитор рецепторов тирозинкиназ, таких как киназы анапластической лимфомы (ALK) и рецептора эпидермального фактора роста (EGFR), предназначенный для лечения рака. Двойной ALK/EGFR ингибитор АР26113 связывает и ингибирует ALK и гибридные ALK белки, а также EGFR и его мутантные формыKnown inhibitors of anaplastic lymphoma kinase (ALK), which are phosphorus derivatives, are patented by ARIAD Pharmaceuticals [USA 2014/0066406 A1, WO 2009/143389]. In this series of compounds, the most advanced is AP26113, also known as Brigatinib, an oral inhibitor of tyrosine kinase receptors such as anaplastic lymphoma kinases (ALK) and epidermal growth factor receptor (EGFR), designed to treat cancer. Double ALK / EGFR AP26113 inhibitor binds and inhibits ALK and hybrid ALK proteins, as well as EGFR and its mutant forms
В настоящее время Бригатиниб (АР26113) получил разрешение FDA для лечения ALK-положительного немелкоклеточного рака легких (NSCLC). В связи с большим количеством протеинкиназ и множеством связанных с ними заболеваний, создание новых классов селективных ингибиторов протеинкиназ для лечения заболеваний, обусловленных повышенной активностью протеинкиназ, остается актуальной задачей.Brigatinib (AP26113) has now obtained FDA approval for the treatment of ALK-positive non-small cell lung cancer (NSCLC). Due to the large number of protein kinases and many associated diseases, the creation of new classes of selective protein kinase inhibitors for the treatment of diseases caused by increased activity of protein kinases remains an urgent task.
Ниже приведены определения терминов, которые использованы в описании данного изобретения.The following are definitions of terms that are used in the description of the present invention.
«Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства)."Active component" (drug substance, drug substance, drug-substance) means a physiologically active substance of synthetic or other (biotechnological, plant, animal, microbial and other) origin, having pharmacological activity and is the active principle of the pharmaceutical composition used for the manufacture and manufacture medicinal product (means).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.“Medicinal product (preparation)” - a substance (or a mixture of substances in the form of a pharmaceutical composition) in the form of tablets, capsules, injections, ointments and other formulations intended to restore, correct or alter physiological functions in humans and animals, as well as for treatment and disease prevention, diagnosis, anesthesia, contraception, cosmetology and more.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, такие как мази и кремы, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения."Pharmaceutical composition" means a composition comprising an active component and at least one of the components selected from the group consisting of pharmaceutically acceptable and pharmacologically compatible excipients, solvents, diluents, carriers, excipients, distributing and perceiving means, delivery vehicles such as preservatives, stabilizers, fillers, grinders, moisturizers, emulsifiers, suspending agents, thickeners, sweeteners, perfumes, flavors, antibacterial Gent, fungicides, lubricants, and prolonged delivery controllers, the choice and suitable proportions of which depend on the nature and way of administration and dosage. Examples of suspending agents are ethoxylated isostearyl alcohol, polyoxyethylene, sorbitol and sorbitol ether, microcrystalline cellulose, aluminum metahydroxide, bentonite, agar-agar and tragacanth, as well as mixtures of these substances. Protection against the action of microorganisms can be achieved using a variety of antibacterial and antifungal agents, for example, such as parabens, chlorobutanol, sorbic acid and the like. The composition may also include isotonic agents, for example, sugars, sodium chloride and the like. The prolonged action of the composition can be achieved using agents that slow down the absorption of the active principle, for example aluminum monostearate and gelatin. Examples of suitable carriers, solvents, diluents and delivery vehicles are water, ethanol, polyalcohols, and also mixtures thereof, vegetable oils (such as olive oil) and injectable organic esters (such as ethyl oleate). Examples of excipients are lactose, milk sugar, sodium citrate, calcium carbonate, calcium phosphate and the like. Examples of grinders and distributors are starch, alginic acid and its salts, silicates. Examples of lubricants are magnesium stearate, sodium lauryl sulfate, talc, and high molecular weight polyethylene glycol. The pharmaceutical composition for oral, sublingual, transdermal, intramuscular, intravenous, subcutaneous, local or rectal administration of the active principle, alone or in combination with another active principle, can be administered to animals and humans in a standard administration form in the form of a mixture with traditional pharmaceutical carriers. Suitable unit dosage forms include oral forms such as tablets, gelatine capsules, pills, powders, granules, chewing gums and oral solutions or suspensions, sublingual and buccal administration forms, aerosols, implants, topical, transdermal such as ointments and creams, subcutaneous , intramuscular, intravenous, intranasal or intraocular administration forms and rectal administration forms.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.“Pharmaceutically acceptable salt” means the relatively non-toxic organic and inorganic salts of the acids and bases of the present invention. These salts can be obtained in situ during the synthesis, isolation or purification of the compounds or prepared specially. In particular, base salts can be prepared on the basis of the purified free base of the claimed compound and a suitable organic or inorganic acid. Examples of salts thus obtained are hydrochlorides, hydrobromides, sulfates, bisulfates, phosphates, nitrates, acetates, oxalates, valeriates, oleates, palmitates, stearates, laurates, borates, benzoates, lactates, tosylates, citrates, maleates, fumarates, succinates, tartrates mesylates, malonates, salicylates, propionates, ethanesulfonates, benzenesulfonates, sulfamates and the like (Detailed description of the properties of such salts is given in Berge SM, et al., Pharmaceutical Salts J. Pharm. Sci. 1977, 66: 1-19). Salts of the claimed acids can also be specially prepared by reacting the purified acid with a suitable base, and metal and amine salts can be synthesized. Metal salts include sodium, potassium, calcium, barium, zinc, magnesium, lithium and aluminum salts, the most desirable of which are sodium and potassium salts. Suitable inorganic bases from which metal salts can be obtained are hydroxide, carbonate, sodium bicarbonate and hydride, potassium hydroxide and bicarbonate, potash, lithium hydroxide, calcium hydroxide, magnesium hydroxide, zinc hydroxide. Amines and amino acids having sufficient basicity to form a stable salt suitable for medical use (in particular, they must have low toxicity) are selected as organic bases from which salts of the claimed acids can be obtained. Such amines include ammonia, methylamine, dimethylamine, trimethylamine, ethylamine, diethylamine, triethylamine, benzylamine, dibenzylamine, dicyclohexylamine, piperazine, ethylpiperidine, tris (hydroxymethyl) aminomethane and the like. In addition, tetraalkylammonium hydroxides, for example, such as choline, tetramethylammonium, tetraethylammonium and the like, can be used for salt formation. As amino acids, the main amino acids can be used - lysine, ornithine and arginine.
Цель настоящего изобретения заключается в создании новых ингибиторов киназы анапластической лимфомы ALK и рецептора эпидермального фактора роста EGFR для лечения рака.An object of the present invention is to provide novel kinase inhibitors of anaplastic lymphoma ALK and epidermal growth factor receptor EGFR for the treatment of cancer.
Поставленная цель достигается 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-оном формулы 1 и его фармацевтически приемлемыми солями.The goal is achieved 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) - 1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and its pharmaceutically acceptable salts.
Предметом настоящего изобретения является 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и его фармацевтически приемлемые солиThe subject of the present invention is 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and its pharmaceutically acceptable salts
Более предпочтительным соединением является 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она дихлороацетат формулы 1.1A more preferred compound is 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidine- 2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one dichloroacetate of the formula 1.1
Настоящее изобретение также включает фармацевтически приемлемые соли 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она формулы 1. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, соли минеральных или органических кислот соединения формулы 1, таких как карбоновые кислоты, например, соли дихлоруксусной кислоты, а также соли хлористоводородной кислоты, фосфорной кислоты или сульфокислоты. Фармацевтически приемлемые соли по настоящему изобретению включают обычные нетоксичные соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группу, обычными химическими способами. Как правило, такие соли могут быть получены взаимодействием свободных кислотных и основных форм соединений общей формулы 1 со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси двух растворителей. Как правило, предпочтительны неводные среды, такие как эфир, этилацетат, этанол, изопропанол, ацетон или ацетонитрил (ACN). Списки подходящих солей можно найти в справочнике фармацевтических солей [Р.Н. Stahl, C.G. Wermuth (Eds.). Handbook of Pharmaceutical Salts, Properties, Selection, and Use. VHCA, Verlag Helvetica Chimica Acta, Switzerland, and Wiley-VCH, Weinheim, Germany. 2002.].The present invention also includes pharmaceutically acceptable salts of 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4 -yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1. Examples of pharmaceutically acceptable salts include, but are not limited to, salts of mineral or organic acids of a compound of formula 1, such as carboxylic acids, for example , salts of dichloroacetic acid, as well as salts of hydrochloric acid, phosphoric acid or sulfonic acid. Pharmaceutically acceptable salts of the present invention include the usual non-toxic salts of the parent compound formed, for example, from non-toxic inorganic or organic acids. The pharmaceutically acceptable salts of the present invention can be synthesized from a parent compound that contains a basic or acidic group by conventional chemical methods. Typically, such salts can be prepared by reacting the free acidic and basic forms of the compounds of general formula 1 with a stoichiometric amount of the corresponding base or acid in water or in an organic solvent or in a mixture of two solvents. Non-aqueous media are generally preferred, such as ether, ethyl acetate, ethanol, isopropanol, acetone or acetonitrile (ACN). Lists of suitable salts can be found in the pharmaceutical salts directory [R.N. Stahl, CG Wermuth (Eds.). Handbook of Pharmaceutical Salts, Properties, Selection, and Use. VHCA, Verlag Helvetica Chimica Acta, Switzerland, and Wiley-VCH, Weinheim, Germany. 2002.].
Предметом настоящего изобретения являются модуляторы киназ, в том числе и ALK и EGFR, которые представляют собой 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемые соли.The subject of the present invention are kinase modulators, including ALK and EGFR, which are 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl ) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or its pharmaceutically acceptable salts.
Новое соединение 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и его фармацевтически приемлемые соли, например дихлорацетат формулы 1.1 обладают in vitro активностью по отношению к биомишеням ALK и EGFR, превышающей активность Бригатиниба (Таблицы 1 и 2). Так, например соединение формулы 1.1 в 3,2 раза превышает активность Бригатиниба по отношению к ALK и в 2,1 раза превышает активность Бригатиниба по отношению к EGFR (Таблица 1).New compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1 -methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and its pharmaceutically acceptable salts, for example, dichloroacetate of formula 1.1, have in vitro activity with ALK and EGFR biological targets greater than Brigatinib activity (Tables 1 and 2). So, for example, the compound of formula 1.1 is 3.2 times higher than the activity of Brigatinib in relation to ALK and 2.1 times higher than the activity of Brigatinib in relation to EGFR (Table 1).
Предметом настоящего изобретения являются 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и его фармацевтичеки-приемлемые соли, предназначенные для лечения у пациента рака и других заболеваний, в том числе для лечения немелкоклеточного рака легких (NSCLC), в том числе с метастазами в головном мозге.The subject of the present invention is 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and its pharmaceutically acceptable salts for the treatment of cancer and other diseases in a patient, including for the treatment of non-small cell lung cancer (NSCLC), including with metastases in the brain.
Предметом изобретения является фармацевтическая композиция в форме таблетки, капсулы или инъекции, содержащая, по меньшей мере, одно соединение 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемую соль, и, по меньшей мере, один фармацевтически приемлемый наполнитель или добавку. Такая композиция может быть введена субъекту в случае необходимости подавлять рост, развитие рака и/или метастазов рака, в том числе твердых опухолей (например, рака предстательной железы, рака толстой кишки, поджелудочной железы и яичников, рака молочной железы, немелкоклеточного рака легкого (NSCLS), нейронных опухолей, таких как глиобластомы и нейробластомы; карциномы, рака мягких тканей); различных форм лимфомы, различных форм лейкемии и в том числе раковых заболеваний, устойчивых к другой обработке, в том числе тех, которые устойчивы к обработке другими ингибиторами киназ, и, как правило, для лечения и профилактики заболеваний или нежелательных состояний, обусловленых одной или более киназой, которые ингибируются соединениями по настоящему изобретению.A subject of the invention is a pharmaceutical composition in the form of a tablet, capsule or injection, containing at least one compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidine- 2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof, and at least one a pharmaceutically acceptable excipient or additive. Such a composition may be administered to a subject, if necessary, to suppress the growth, development of cancer and / or cancer metastases, including solid tumors (e.g., prostate cancer, colon cancer, pancreas and ovary, breast cancer, non-small cell lung cancer (NSCLS ), neural tumors such as glioblastomas and neuroblastomas; carcinomas, soft tissue cancers); various forms of lymphoma, various forms of leukemia, including cancers that are resistant to another treatment, including those that are resistant to treatment with other kinase inhibitors, and, as a rule, for the treatment and prevention of diseases or undesirable conditions caused by one or more kinase that are inhibited by the compounds of the present invention.
В соответствии с данным изобретением фармацевтическая композиции может быть в форме, подходящей для перорального применения (например, в виде таблеток, пастилок, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в виде тонкоизмельченного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в виде тонкоизмельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного, внутримышечного введения дозы или в виде суппозиториев для ректального введения дозы).In accordance with this invention, the pharmaceutical composition may be in a form suitable for oral administration (for example, in the form of tablets, lozenges, hard or soft capsules, aqueous or oily suspensions, emulsions, dispersible powders or granules, syrups or elixirs), for topical application (for example, in the form of creams, ointments, gels or aqueous or oily solutions or suspensions), for administration by inhalation (for example, as a finely divided powder or liquid aerosol), for administration by insufflation (for example, in e finely divided powder) or for parenteral administration (for example as a sterile aqueous or oily solution for intravenous, subcutaneous, intramuscular dosing or as a suppository for rectal dosing).
Фармацевтическая композиция по изобретению может быть получена обычными способами с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Таким образом, фармацевтические композиции, предназначенные для перорального применения, могут содержать, например, один или несколько окрашивающих, подслащивающих, вкусовых компонентов и/или консервант.The pharmaceutical composition of the invention may be prepared by conventional methods using conventional pharmaceutical excipients well known in the art. Thus, pharmaceutical compositions intended for oral use may contain, for example, one or more coloring, sweetening, flavoring components and / or preservative.
Соединение 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически-приемлемую соль обычно вводят теплокровному животному в единичной дозе в диапазоне 5-5000 мг/м2 площади тела животного, то есть примерно 0,1-100 мг/кг, и это обычно обеспечивает терапевтически эффективную дозу. Форма единичной дозы, такой как таблетка или капсула, обычно содержит, например, 1-250 мг активного ингредиента. Суточная доза обязательно будет варьироваться в зависимости от пациента, конкретного пути введения и тяжести заболевания, которое лечат. Соответственно, врач, который лечит конкретного пациента, может определить оптимальную дозу, учитывая ингибирующую активность против ALK и EGFR соединений общей формулы 1 и их таутомеров, стереоизомеров, фармацевтически приемлемых солей и сольватов, предназначенных для лечения заболеваний или медицинских состояний, обусловленных активностью ALK и EGFR, например, рака. Типы рака, которые могут быть восприимчивы к лечению с использованием соединений общей формулы 1 и их таутомеров, стереоизомеров, фармацевтически приемлемых солей и сольватов включают, но не ограничиваются лечением пациентов с немелкоклеточным раком легких (NSCLC), в том числе с метастазами в головном мозге.Compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1- methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof is usually administered to a warm-blooded animal in a single dose in the range of 5-5000 mg / m 2 animal body area, i.e. approximately 0.1- 100 mg / kg, and this usually provides a therapeutically effective dose. A unit dosage form, such as a tablet or capsule, usually contains, for example, 1-250 mg of the active ingredient. The daily dose will necessarily vary depending on the patient, the specific route of administration and the severity of the disease being treated. Accordingly, the doctor who is treating a particular patient can determine the optimal dose, taking into account the inhibitory activity against ALK and EGFR of compounds of the general formula 1 and their tautomers, stereoisomers, pharmaceutically acceptable salts and solvates intended for the treatment of diseases or medical conditions caused by ALK and EGFR activity for example cancer. Types of cancer that may be susceptible to treatment using compounds of the general formula 1 and their tautomers, stereoisomers, pharmaceutically acceptable salts and solvates include, but are not limited to treating patients with non-small cell lung cancer (NSCLC), including brain metastases.
Согласно другому аспекту настоящего изобретения соединение 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1, как определено выше, или его фармацевтически приемлемые соли предназначены для использования в качестве лекарственного средства.According to another aspect of the present invention, the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4- il) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1, as defined above, or pharmaceutically acceptable salts thereof are intended for use as a medicine.
В соответствии с настоящим изобретением предлагаются 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и их фармацевтически приемлемые соли для лечения заболевания, обусловленного активностью ALK и EGFR, в том числе для лечения ракового заболевания, обусловленного активностью ALK и EGFR.The present invention provides 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4- il) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and their pharmaceutically acceptable salts for the treatment of diseases caused by ALK and EGFR activity, including for the treatment of cancer caused by ALK and EGFR activity .
Предметом настоящего изобретения является также способ производства лекарственного средства для лечения заболевания, обусловленного ALK и EGFR, предусматривающий использование соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемой соли.The subject of the present invention is also a method for the manufacture of a medicament for the treatment of diseases caused by ALK and EGFR, comprising the use of the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidine- 2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof.
Предметом настоящего изобретения является также способ лечения рака, обусловленного ALK и EGFR, предусматривающй использование соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 и его фармацевтически приемлемой соли.The subject of the present invention is also a method of treating cancer caused by ALK and EGFR, comprising the use of compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 and a pharmaceutically acceptable salt thereof.
Предметом настоящего изобретения является также способ получения противоракового эффекта у пациента, нуждающегося в таком лечении, который включает введение указанному пациенту эффективного количества соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемой соли.A subject of the present invention is also a method for producing an anti-cancer effect in a patient in need of such treatment, which comprises administering to said patient an effective amount of a compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof.
В соответствии с настоящим изобретением предложен способ лечения человека, страдающего от заболевания, в том числе рака, при котором предпочтительно ингибирование ALK и EGFR. Лечение осуществляется путем введения нуждающемуся в этом человеку терапевтически эффективного количества соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемой соли.The present invention provides a method of treating a person suffering from a disease, including cancer, in which inhibition of ALK and EGFR is preferred. Treatment is by administering to a person in need of a therapeutically effective amount of a compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3- methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof.
В любом из аспектов или вариантов упомянутый в данном описании рак, указанный в общем смысле, может быть выбран из твердых опухолей (например, рака предстательной железы, рака толстой кишки, поджелудочной железы и рака яичников, рака молочной железы, немелкоклеточного рака легкого (NSCLS), нейронных опухолей, таких как глиобластомы и нейробластомы; карциномы, рака мягких тканей); различных форм лимфомы, таких как неходжкинская лимфома (NHL), известная как анапластическая крупноклеточная (ALCL), различные формы лейкемии; и в том числе рака, который устойчив к другим лекарствам, в том числе тех, которые устойчивы к ингибированию других киназ, и, как правило, для лечения и профилактики заболеваний или нежелательных состояний, обусловленных одной или более киназами, которые ингибируются соединениями по настоящему изобретению.In any aspect or embodiment, the cancer referred to herein may be selected in a general sense from solid tumors (e.g., prostate cancer, colon cancer, pancreas and ovarian cancer, breast cancer, non-small cell lung cancer (NSCLS) neuronal tumors such as glioblastomas and neuroblastomas; carcinomas, soft tissue cancers); various forms of lymphoma, such as non-Hodgkin's lymphoma (NHL), known as anaplastic large cell (ALCL), various forms of leukemia; and including cancer that is resistant to other drugs, including those that are resistant to the inhibition of other kinases, and, as a rule, for the treatment and prevention of diseases or undesirable conditions caused by one or more kinases that are inhibited by the compounds of the present invention .
Настоящее изобретение относится также к способу лечения рака. Способ включает введение (в виде монотерапии или в комбинации с одним или несколькими другими противораковыми агентами, одним или несколькими агентами для облегчения побочных эффектов, излучение и т.д.) терапевтически эффективного количества соединения по настоящему изобретению, нуждающемуся в этом человеку или животному, чтобы ингибировать, замедлить или уменьшить рост, развитие или распространение рака у реципиента, в том числе твердых опухолей или других форм рака, таких как лейкозы. Такое введение представляет собой способ лечения или профилактики заболеваний, обусловленных одной или несколькими киназами, путем их ингибирования одним из соединений общей формулы 1 или или его таутомером, стереоизомером, фармацевтически приемлемой солью или его сольватом или его фармацевтически приемлемым производным. Термин "введение" включает доставку соединения общей формулы 1 или его пролекарства или другого его фармацевтически приемлемого производного с использованием любого подходящего состава или способа введения. Обычно соединение вводят один или несколько раз в месяц, часто один или более раз в неделю, например, ежедневно, через день, 5 дней/неделя, и т.д. Наиболее предпочтительными являются оральный и внутривенный способы введения.The present invention also relates to a method for treating cancer. The method comprises administering (as monotherapy or in combination with one or more other anti-cancer agents, one or more agents to alleviate side effects, radiation, etc.) a therapeutically effective amount of a compound of the present invention in need of this human or animal, so that inhibit, slow down or reduce the growth, development or spread of cancer in the recipient, including solid tumors or other forms of cancer, such as leukemia. Such administration is a method of treating or preventing diseases caused by one or more kinases by inhibiting them with one of the compounds of general formula 1 or with its tautomer, stereoisomer, pharmaceutically acceptable salt or solvate thereof or a pharmaceutically acceptable derivative thereof. The term “administration” includes the delivery of a compound of general formula 1 or a prodrug thereof or another pharmaceutically acceptable derivative thereof using any suitable composition or route of administration. Typically, the compound is administered one or more times a month, often one or more times a week, for example, daily, every other day, 5 days / week, etc. Most preferred are oral and intravenous routes of administration.
Способ лечения рака, описанный выше, может быть примен в качестве единственной терапии или может включать в дополнение использование соединения по настоящему изобретению к обычной хирургии или лучевой терапии или химиотерапии или иммунотерапии. Такая химиотерапия может вводиться одновременно, одновременно-последовательно или раздельно с лечением соединением по настоящему изобретению и может включать один или более противоопухолевых агентов из следующих категорий: антипролиферативные/противоопухолевые препараты и их комбинации, используемые в медицинской онкологии; цитостатические агенты; агенты анти-вторжение; ингибиторы функции фактора роста; антиангиогенные агенты; сосудистые средства; антагонисты эндотелиновых рецепторов; антисмысловые терапии; подходы генной терапии и подходы иммунотерапии.The cancer treatment method described above may be used as a single therapy or may include, in addition, the use of a compound of the present invention for conventional surgery or radiation therapy or chemotherapy or immunotherapy. Such chemotherapy can be administered simultaneously, simultaneously, sequentially or separately with treatment with a compound of the present invention and may include one or more antitumor agents from the following categories: antiproliferative / antitumor drugs and their combinations used in medical oncology; cytostatic agents; anti-invasion agents; growth factor function inhibitors; antiangiogenic agents; vascular agents; endothelin receptor antagonists; antisense therapies; gene therapy approaches and immunotherapy approaches.
Предметом настоящего изобретения является также фармацевтическая композиция для комбинированного лечения рака, включающая соединение 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемую соль и дополнительно противоопухолевое вещество, как определено выше. Термин "совместное лечение" используют по отношению к комбинированной терапии, причем, это может относиться к одновременному, раздельному или последовательному введению. В одном аспекте изобретения "комбинированное лечение" относится к одновременному введению. В другом аспекте настоящего изобретения "комбинированное лечение" относится к раздельному введению. В третьем аспекте настоящего изобретения "комбинированное лечение" относится к последовательному введению. Если введение последовательное или раздельное, задержка во введении второго компонента должна быть такой, чтобы сохранить эффективность эффекта, возникающего в результате использования комбинации.A subject of the present invention is also a pharmaceutical composition for the combined treatment of cancer, comprising the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) - 3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof and additionally an antitumor substance, as defined above. The term "joint treatment" is used in relation to combination therapy, moreover, this may refer to simultaneous, separate or sequential administration. In one aspect of the invention, “combination treatment” refers to simultaneous administration. In another aspect of the present invention, “combination treatment” refers to separate administration. In a third aspect of the present invention, “combination treatment” refers to sequential administration. If the administration is sequential or separate, the delay in the administration of the second component should be such as to maintain the effectiveness of the effect resulting from the use of the combination.
Таким образом, одним из вариантов изобретения является применение соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или его фармацевтически приемлемой соли и дополнительно противоопухолевого вещества для совместной терапии рака.Thus, one embodiment of the invention is the use of the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt thereof and additionally an antitumor substance for joint cancer therapy.
Предметом настоящего изобретения является также способ получения противоракового эффекта у нуждающегося в таком лечении теплокровного животного и человека, который включает введение указанным млекопитающим соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 или фармацевтически приемлемой соли и одновременное, раздельное или последовательное введение дополнительного противоопухолевого вещества указанному млекопитающему в количествах, совместно обеспечивающих получение противоракового эффекта.The subject of the present invention is also a method for producing an anti-cancer effect in a warm-blooded animal and human being in need of such treatment, which comprises administering to said mammals the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 or a pharmaceutically acceptable salt and simultaneous, separate or sequential administration of an additional antitumor substance to a specified mammal in amounts, s together providing anti-cancer effect.
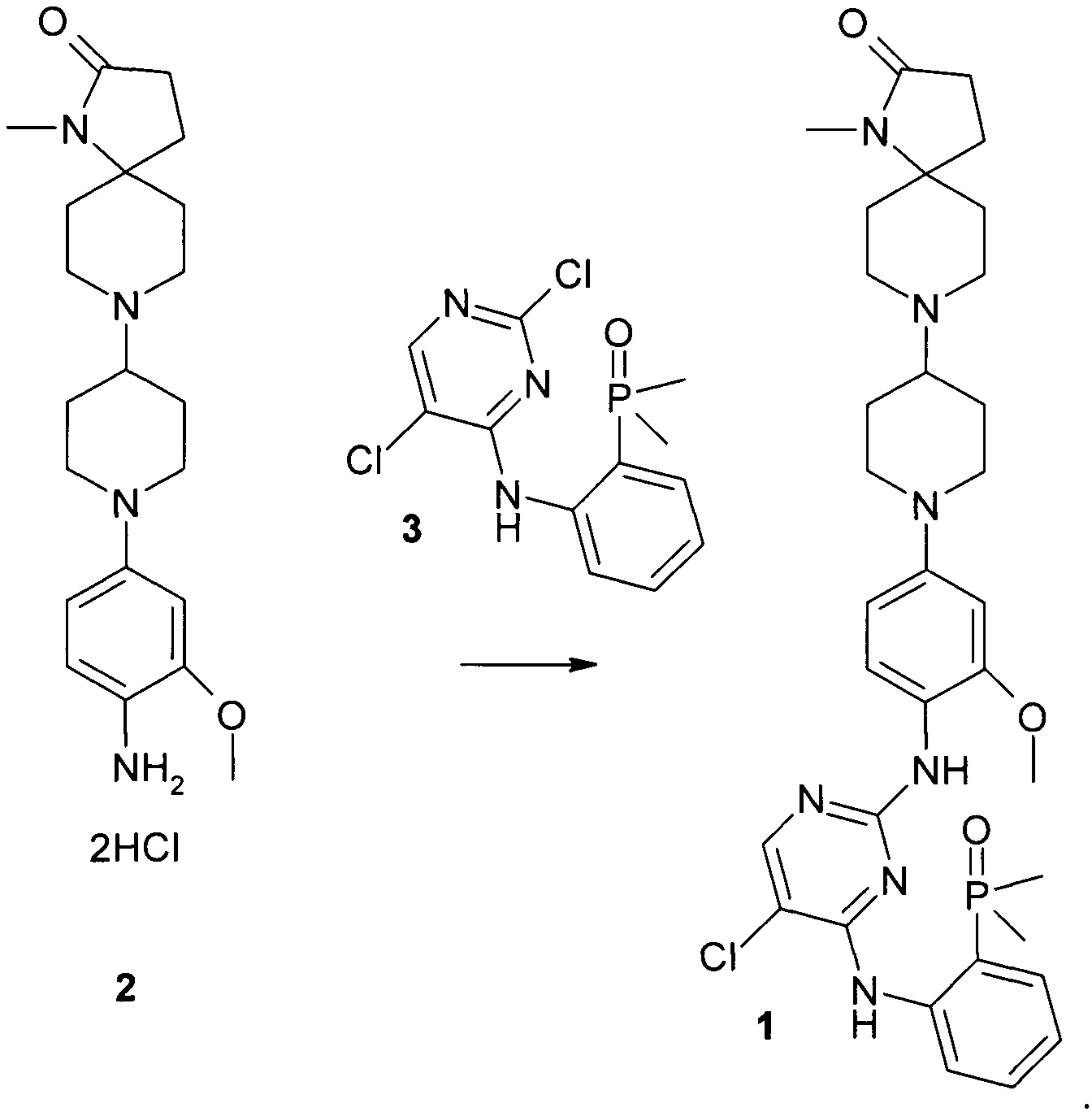
Предметом данного изобретения является способ получения соединения 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 путем взаимодействия соединения общей формулы 2 с 2,5-дихлор-N-[2-(диметилфосфорил)фенил]пиримидин-4-амином формулы 3.The subject of this invention is a method for preparing the compound 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4 -yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 by reacting a compound of general formula 2 with 2,5-dichloro-N- [2- (dimethylphosphoryl) phenyl] pyrimidin-4- an amine of formula 3.
Ниже изобретение описано более подробно с помощью конкретных примеров. Следующие примеры представлены с целью иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Специалисты в данной области техники легко поймут различие некритических параметров, которые могут быть изменены или модифицированы, для получения таких же результатов.Below the invention is described in more detail using specific examples. The following examples are provided for purposes of illustration and are not intended to limit the invention in any way. Specialists in the art will easily understand the difference in non-critical parameters that can be changed or modified to obtain the same results.
Пример 1. Трет-бутил 4-(1-метил-2-оксо-1,8-диазаспиро(4.5)дек-8-ил)пиперидин-1-карбоксилат (2.1) был получен в соответствии со Схемой 1Example 1. Tert-butyl 4- (1-methyl-2-oxo-1,8-diazaspiro (4.5) dec-8-yl) piperidine-1-carboxylate (2.1) was obtained in accordance with Scheme 1
Схема 1Scheme 1
К суспензии 1-метил-1,8-диазаспиро[4.5]декан-2-она (1.64 г, 9.75 ммоль) в 0.1 л дихлорметана были добавлены N-бок-4-пиперидон (1.95 г, 9.75 ммоль) и триацетоксиборогидрид натрия (3.1 г, 14.6 ммоль). Реакционная смесь перемешивалась при комнатной температуре в течение 24 ч. После окончания реакции был добавлен насыщенный водный раствор карбоната натрия, органическая фаза была отделена, промыта брайном, высушена над сульфатом натрия, профильтрована, затем фильтрат был упарен. Остаток после упаривания очищался на колонке с силикагелем, с дихлорметаном в качестве элюэнта. Трет-бутил 4-(1-метил-2-оксо-1,8-диазаспиро(4.5)дек-8-ил)пиперидин-1-карбоксилат (2.1) был получен с выходом 2.5 г (73%). LC-MS (ESI) 352.5 (M+H)+.To a suspension of 1-methyl-1,8-diazaspiro [4.5] decan-2-one (1.64 g, 9.75 mmol) in 0.1 L of dichloromethane were added N-side-4-piperidone (1.95 g, 9.75 mmol) and sodium triacetoxyborohydride ( 3.1 g, 14.6 mmol). The reaction mixture was stirred at room temperature for 24 hours. After completion of the reaction, a saturated aqueous solution of sodium carbonate was added, the organic phase was separated, washed with brine, dried over sodium sulfate, filtered, then the filtrate was evaporated. The evaporation residue was purified on a column of silica gel, with dichloromethane as eluent. Tert-butyl 4- (1-methyl-2-oxo-1,8-diazaspiro (4.5) dec-8-yl) piperidine-1-carboxylate (2.1) was obtained in a yield of 2.5 g (73%). LC-MS (ESI) 352.5 (M + H) + .
Пример 2. 8-(1-{4-амино-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он гидрохлорид формулы 2 был получен в соответствии со Схемой 2.Example 2. 8- (1- {4-amino-3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one hydrochloride of formula 2 was obtained in accordance with Scheme 2.
Схема 2Scheme 2
Раствор трет-бутил 4-(1-метил-2-оксо-1,8-диазаспиро(4.5)дек-8-ил)пиперидин-1-карбоксилата формулы 2.1 (2.5 г, 7.1 ммоль) в 25 мл 3М раствора HCl в диоксане и 15 мл метанола перемешивался при комнатной температуре 3 ч, затем он был частично упарен и выпавший осадок был отфильтрован. К осадку были добавлены 2-нитро-5-фторанизол (1.27 н, 7.45 ммоль) и диизопропилэтиламин (3.5 г, 27 ммоль) в 15 мл диметилформамида. Реакционная смесь перемешивалась при 70°C в течении 16 ч, затем выпаривалась и остаток промывался водой. Осадок отфильтровывался, промывался водой и эфиром и сушился на воздухе. Затем осадок был добавлен к суспензии Pd 10% на активированном угле в 100 мл метанола и подвергнут гидрированию в течение 3 ч при давлении 5 psi. По окончании реакции катализатор был отфильтрован, реакционная смесь обработана 5 мл 3М раствора HCl в диоксане и реакционная масса была выпарена, выход 8-(1-{4-амино-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она гидрохлорида 1.01 г (35%). LC-MS (ESI) 373.5 (M+H)+.A solution of tert-butyl 4- (1-methyl-2-oxo-1,8-diazaspiro (4.5) dec-8-yl) piperidine-1-carboxylate of formula 2.1 (2.5 g, 7.1 mmol) in 25 ml of 3M HCl in dioxane and 15 ml of methanol were stirred at room temperature for 3 hours, then it was partially evaporated and the precipitate was filtered. To the precipitate were added 2-nitro-5-fluoroanisole (1.27 n, 7.45 mmol) and diisopropylethylamine (3.5 g, 27 mmol) in 15 ml of dimethylformamide. The reaction mixture was stirred at 70 ° C for 16 hours, then evaporated and the residue was washed with water. The precipitate was filtered off, washed with water and ether, and dried in air. The precipitate was then added to a suspension of Pd 10% on activated carbon in 100 ml of methanol and hydrogenated for 3 hours at a pressure of 5 psi. At the end of the reaction, the catalyst was filtered, the reaction mixture was treated with 5 ml of a 3M solution of HCl in dioxane and the reaction mixture was evaporated, the yield of 8- (1- {4-amino-3-methoxyphenyl} piperidin-4-yl) -1-methyl-1 , 8-diazaspiro (4.5) decan-2-one hydrochloride 1.01 g (35%). LC-MS (ESI) 373.5 (M + H) + .
Пример 3. 8-(1-{4-{(5-Хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он формулы 1 был получен в соответствии со Схемой 3.Example 3.8- (1- {4 - {(5-Chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) - 1-methyl-1,8-diazaspiro (4.5) decan-2-one of formula 1 was obtained in accordance with Scheme 3.
Схема 3Scheme 3
К суспензии 8-(1-{4-амино-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она гидрохлорида формулы 2 (1 г, 2.25 ммоль) в 10 мл метоксиэтанола был добавлен 2,5-дихлор-N-(2-(диметилфосфорил)фенил)пиримидин-4-амин (0.82 г, 2.6 ммоль) и реакционная масса перемешивалась при кипении 15 ч. По окнчании реакции растворители были отогнаны при пониженном давлении и остаток перетирался с этанолом. Осадок отфильтровывался, промывался холодным этанолом, нейтрализовывался насыщенным водным раствором натрия гидрокарбоната, отфильтровывался и промывался ацетоном. 8-(1-{4-{(5-хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-он был получен в количестве 420 мг (29%) после сушки осадка в вакууме. LC-MS (ESI) 653.2 (M+H)+. 1H NMR (DMSO-d6, 400 MHz) δ 11.16 (s, 1H), 8.49 (br, 1H), 8.07 (s, 1H) 8.04 (s, 1H), 7.53 (m, 1H), 7.35 (m, 2H), 7.10 (t, J=7.6 Hz, 1H), 6.63 (s, 1H), 6.48 (d, 1H), 3.76 (s, 3H), 3.7 (m, 2H), 2.85 (m, 2H), 2.7 (m, 2H), 2.6 (s, 3H), 2.4 (m, 1H), 2.15-2.35 (m, 4H), 1.8-1.9 (m, 6H), 1.78 (s, 3H), 1.74 (s, 3H), 1.6 (m, 2H), 1.34 (m, 2H).To a suspension of 8- (1- {4-amino-3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one hydrochloride of formula 2 (1 g, 2.25 mmol) in 10 ml of methoxyethanol, 2,5-dichloro-N- (2- (dimethylphosphoryl) phenyl) pyrimidin-4-amine (0.82 g, 2.6 mmol) was added and the reaction mixture was stirred at reflux for 15 hours. Upon completion of the reaction, the solvents were distilled off at reduced pressure and the residue was triturated with ethanol. The precipitate was filtered off, washed with cold ethanol, neutralized with saturated aqueous sodium hydrogen carbonate, filtered and washed with acetone. 8- (1- {4 - {(5-chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl -1,8-diazaspiro (4.5) decan-2-one was obtained in an amount of 420 mg (29%) after drying the precipitate in vacuum. LC-MS (ESI) 653.2 (M + H) + . 1 H NMR (DMSO-d 6 , 400 MHz) δ 11.16 (s, 1H), 8.49 (br, 1H), 8.07 (s, 1H) 8.04 (s, 1H), 7.53 (m, 1H), 7.35 (m , 2H), 7.10 (t, J = 7.6 Hz, 1H), 6.63 (s, 1H), 6.48 (d, 1H), 3.76 (s, 3H), 3.7 (m, 2H), 2.85 (m, 2H) , 2.7 (m, 2H), 2.6 (s, 3H), 2.4 (m, 1H), 2.15-2.35 (m, 4H), 1.8-1.9 (m, 6H), 1.78 (s, 3H), 1.74 (s , 3H), 1.6 (m, 2H), 1.34 (m, 2H).
Пример 4. Хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она дихлорацетат формулы 1.1 был получен нейтрализацией хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она дихлоруксусной кислотой.Example 4. Chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan-2-one dichloroacetate of formula 1.1 was obtained by neutralization of chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl- 1,8-diazaspiro (4.5) decan-2-one with dichloroacetic acid.
К раствору хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она (0.1 г, 0.15 ммоль) в смеси ацетона (4 мл) и этанола (4 мл) была добавлена дихлоруксусная кислота (0.02 г, 0.15 ммоль) в ацетоне (1 мл). Реакционная масса перемешивлась 24 часа при 20°C. Выпавшие кристаллы отфильтровывались и сушились в вакууме. Выход хлор-4-{(2-(диметилфосфорил)фенил)амино}пиримидин-2-ил)амино)-3-метоксифенил}пиперидин-4-ил)-1-метил-1,8-диазаспиро(4.5)декан-2-она дихлорацетата - 0.097 г (79%).To a solution of chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decane -2-one (0.1 g, 0.15 mmol) in a mixture of acetone (4 ml) and ethanol (4 ml) was added dichloroacetic acid (0.02 g, 0.15 mmol) in acetone (1 ml). The reaction mass was stirred for 24 hours at 20 ° C. The precipitated crystals were filtered off and dried in vacuum. Yield of chloro-4 - {(2- (dimethylphosphoryl) phenyl) amino} pyrimidin-2-yl) amino) -3-methoxyphenyl} piperidin-4-yl) -1-methyl-1,8-diazaspiro (4.5) decan- 2-dichloroacetate - 0.097 g (79%).
1H NMR (DMSO-d6, 400 MHz) δ 11.21 (s, 1H), 8.52 (br s, 1H), 8.09 (s, 1H) 8.02 (s, 1H), 7.56 (m, 1H), 7.39 (m, 3H), 7.11 (t, J=7.6 Hz, 1H), 6.70 (s, 1H), 6.37 (d, 1H), 6.12 (s, 1H), 3.72 (s, 3H), 3.65 (m, 2H), 2.88 (m, 2H), 2.67 (m, 2H), 2.62 (s, 3H), 2.3 (m, 1H), 2.15-2.35 (m, 4H), 1.7-1.9 (m, 6H), 1.73 (s, 3H), 1.78 (s, 3H), 1.64 (m, 2H), 1.31 (m, 2H). 1 H NMR (DMSO-d 6 , 400 MHz) δ 11.21 (s, 1H), 8.52 (br s, 1H), 8.09 (s, 1H) 8.02 (s, 1H), 7.56 (m, 1H), 7.39 ( m, 3H), 7.11 (t, J = 7.6 Hz, 1H), 6.70 (s, 1H), 6.37 (d, 1H), 6.12 (s, 1H), 3.72 (s, 3H), 3.65 (m, 2H ), 2.88 (m, 2H), 2.67 (m, 2H), 2.62 (s, 3H), 2.3 (m, 1H), 2.15-2.35 (m, 4H), 1.7-1.9 (m, 6H), 1.73 ( s, 3H), 1.78 (s, 3H), 1.64 (m, 2H), 1.31 (m, 2H).
Пример 5. Эссей ALK. Вещества тестировали по влиянию на активность киназы ALK с помощью скрининговой платформы ADP Hunter Plus (DiscoverRX Corporation). Концентрация ДМСО в реакционной смеси составляла 1%. 4 мкл 100-кратных стоков исследуемых веществ в 100% ДМСО разбавляли в 36 мкл киназного буфера (50 мМ HEPES pH 7.5, 0.01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA) и добавляли к 5 мкл 2-кратной смеси Субстрат/Киназа (ALK/Srctide, финальные концентрации - 1 мкг/мл ALK и 20 мкМ Srctide) в 384-луночном планшете (черные, малого объема, производство Corning, кат. #3676). Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 4 мкл 2.5-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси 100 мкМ). После 30 сек инкубации на шейкере реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента А и 10 мкл Реагента В и инкубировали еще 30-60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 530 нм и эмиссии 585 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).Example 5. Essay ALK. Substances were tested for their effect on ALK kinase activity using the ADP Hunter Plus screening platform (DiscoverRX Corporation). The concentration of DMSO in the reaction mixture was 1%. 4 μl of 100-fold stocks of the test substances in 100% DMSO was diluted in 36 μl of kinase buffer (50 mM HEPES pH 7.5, 0.01% BRIJ-35, 10 mM MgCl2, 1 mM EGTA) and added to 5 μl of a 2-fold mixture of Substrate / Kinase (ALK / Srctide, final concentrations 1 μg / ml ALK and 20 μM Srctide) in a 384-well plate (black, small volume, Corning, Cat. # 3676). The substances were preincubated with kinases for 10 min at room temperature. After that, 4 μl of a 2.5-fold ATP solution (final ATP concentration in the reaction mixture of 100 μM) was added to start the reaction. After 30 seconds of incubation on a shaker, the reaction was incubated for 60 minutes at room temperature. After that, 5 μl of Reagent A and 10 μl of Reagent B were added and incubated for another 30-60 min at room temperature. Fluorescence was measured upon excitation with a wavelength of 530 nm and an emission of 585 nm. The degree of phosphorylation of the peptide substrate was calculated using the formula below (if the emission ratio is low, the peptide is phosphorylated, i.e., there is no inhibition of kinase activity, if the ratio is high, the peptide is not phosphorylated, i.e., the kinase is inhibited).
% фосфорилирования рассчитывается как% phosphorylation calculated as
% ингибирования рассчитывается как% inhibition is calculated as
где:Where:
C100%=средний сигнал эмиссии кумарина контроль 100% фосфорилирования,C100% = average coumarin emission signal control 100% phosphorylation,
С0%=средний сигнал эмиссии кумарина контроль 0% фосфорилирования,С0% = average coumarin emission signal control 0% phosphorylation,
F100%=средний сигнал эмиссии флуоресцеина контроль 100% фосфорилирования,F100% = average fluorescein emission signal control 100% phosphorylation,
F0%=средний сигнал эмиссии флуоресцеина контроль 0% фосфорилирования.F0% = average fluorescein emission signal control 0% phosphorylation.
Полученные результаты представлены в Таблице 1.The results obtained are presented in Table 1.
Пример 6. Эссей EGFR. Соединения общей формулы 1 тестировали по влиянию на активность киназ EGFR(L858R/T790M) b EGFR wt (все ферменты предоставлены Invitrogen Corp., каталожные номера PV3872, PV4128 and PV4803, соответственно) с помощью скрининговой платформы Z`-LYTE (производство Life Technologies). Концентрация ДМСО в реакционной смеси составляла 1%. 5 мкл 2-кратной смеси Субстрат/Киназа (Tyr4/EGFRwt или EGFR-L858R или EGFR-T790M, конечные концентрации - 0.5 мкМ для субстрата Tyr 4 и 1000, 250, 1000 нг/мл для EGFRwt или EGFR-L858R или EGFR-T790M соответственно) добавляли в 384-луночные планшеты (черные, малого объема, производство Corning, кат. #3676). 1.5 мкл 100-кратных стоков исследуемых веществ в 100% ДМСО разбавляли в 10 раз в 13.5 мкл киназного буфера (50 мМ HEPES pH 6.5, 0.01% BRIJ-35, 10 мМ MgCl2, 1 мМ EGTA, 0.02% NaN3) и затем 1 мкл разбавленных веществ добавляли к смеси Субстрат/Киназа. Вещества преинкубировали с киназами в течение 10 мин при комнатной температуре. После этого для начала реакции добавляли 4 мкл 2.5-кратного раствора АТФ (конечная концентрация АТФ в реакционной смеси была 180 или 100 или 40 мкМ для EGFRwt, EGFR-L858R и EGFR-T790M соответственно). После 30 сек инкубации на шейкере, реакцию инкубировали в течение 60 мин при комнатной температуре. После этого добавляли 5 мкл Реагента В (разбавленного 1:500) и инкубировали еще 60 мин при комнатной температуре. Измеряли флуоресценцию при возбуждении длиной волны 400 нм и эмиссии при 445 и 520 нм. Степень фосфорилирования пептидного субстрата рассчитывали по формуле ниже (если отношение эмиссии низкое - пептид фосфорилирован, т.е. нет ингибирования активности киназы, если отношение высокое - пептид не фосфорилирован, т.е. киназа ингибирована).Example 6. Essay EGFR. Compounds of general formula 1 were tested for their effect on EGFR kinase activity (L858R / T790M) and EGFR wt (all enzymes were provided by Invitrogen Corp., catalog numbers PV3872, PV4128 and PV4803, respectively) using the Z`-LYTE screening platform (manufactured by Life Technologies) . The concentration of DMSO in the reaction mixture was 1%. 5 μl of a 2-fold substrate / kinase mixture (Tyr4 / EGFRwt or EGFR-L858R or EGFR-T790M, final concentrations 0.5 μM for Tyr 4 and 1000, 250, 1000 ng / ml for EGFRwt or EGFR-L858R or EGFR-T790 respectively) were added to 384-well plates (black, small volume, Corning, Cat # 3676). 1.5 μl of 100-fold stocks of the test substances in 100% DMSO was diluted 10 times in 13.5 μl of kinase buffer (50 mm HEPES pH 6.5, 0.01% BRIJ-35, 10 mm MgCl2, 1 mm EGTA, 0.02% NaN3) and then 1 μl diluted substances were added to the substrate / kinase mixture. The substances were preincubated with kinases for 10 min at room temperature. After that, 4 μl of a 2.5-fold ATP solution was added to start the reaction (the final concentration of ATP in the reaction mixture was 180 or 100 or 40 μM for EGFRwt, EGFR-L858R, and EGFR-T790M, respectively). After 30 sec incubation on a shaker, the reaction was incubated for 60 min at room temperature. After that, 5 μl of Reagent B (diluted 1: 500) was added and incubated for another 60 min at room temperature. Fluorescence was measured upon excitation with a wavelength of 400 nm and emission at 445 and 520 nm. The degree of phosphorylation of the peptide substrate was calculated using the formula below (if the emission ratio is low, the peptide is phosphorylated, i.e., there is no inhibition of kinase activity, if the ratio is high, the peptide is not phosphorylated, i.e., the kinase is inhibited).
% фосфорилирования рассчитывается как% phosphorylation calculated as
% ингибирования рассчитывается как% inhibition is calculated as
где:Where:
С100%=средний сигнал эмиссии кумарина контроль 100% фосфорилирования,С100% = average coumarin emission signal; control of 100% phosphorylation,
С0%=средний сигнал эмиссии кумарина контроль 0% фосфорилирования,С0% = average coumarin emission signal control 0% phosphorylation,
F100%=средний сигнал эмиссии флуоресцеина контроль 100% фосфорилирования,F100% = average fluorescein emission signal control 100% phosphorylation,
F0%=средний сигнал эмиссии флуоресцеина контроль 0% фосфорилирования.F0% = average fluorescein emission signal control 0% phosphorylation.
Концентрационная кривая зависимости активности киназы от концентрации тестируемых веществ была построена с использованием сигмоидной модели. Полученные результаты представлены в Таблице 2.The concentration curve of the kinase activity versus the concentration of test substances was constructed using the sigmoid model. The results obtained are presented in Table 2.
Пример 7. Ингибирование пролиферации клеток.Example 7. Inhibition of cell proliferation.
Клетки выращивали в пластиковых культуральных флаконах Т75 и Т175 (Greiner Bio-One) в среде ДМЕМ или RPMI, содержащей 10% сыворотки (FBS), 1% смесь антибиотиков (AAS) при 37°C и 5% CO2. Пересевали клетки при достижении ~90% конфлюентности. Клетки снимали с культуральных флаконов с помощью раствора TryplExpress. Для этого удаляли из флакона культуральную среду, заливали клетки 2 мл раствора TryplExpress, ополаскивали этим раствором поверхность флакона, инкубировали клетки 5 минут при 37°C. Затем суспендировали клетки в новой культуральной среде. Клетки рассевали в пропорции 1:2-1:8.Cells were grown in T75 and T175 plastic culture bottles (Greiner Bio-One) in DMEM or RPMI medium containing 10% serum (FBS), 1% mixture of antibiotics (AAS) at 37 ° C and 5% CO 2 . Cells were seeded upon reaching ~ 90% confluency. Cells were removed from the culture vials using TryplExpress solution. For this, the culture medium was removed from the vial, the cells were poured with 2 ml of TryplExpress solution, the surface of the vial was rinsed with this solution, and the cells were incubated for 5 minutes at 37 ° C. Then cells were suspended in a new culture medium. Cells were scattered in a ratio of 1: 2-1: 8.
День №1. Посадка клеток.Day number 1. Cell landing.
Клетки сажали в концентрации 500-2000 клеток в лунку в среде RPMI 1640+10% FBS, 40 мкл в лунку. Вертикальный ряд №24 контроль: среда без клеток.Cells were planted at a concentration of 500-2000 cells per well in RPMI 1640 + 10% FBS, 40 μl per well. Vertical row No. 24 control: medium without cells.
Инкубация 24 часа, 37°C, 5% CO2.Incubation 24 hours, 37 ° C, 5% CO 2 .
День №2. Добавление соединений.Day number 2. Adding connections.
Соединения растворяли в ДМСО до концентрации 20 мМ. Затем в зависимости от максимальной тестируемой концентрации разбавляли соединения ДМСО до 400-кратной максимальной концентрации. Далее делали серийные разведения в ДМСО с шагом 3,16. Каждую концентрацию тестировали в двух повторах, каждый эксперимент повторяли как минимум 2 раза. Также в каждой плашке были контроли только с ДМСО без соединений. Затем делали промежуточное разведение соединений в 80 раз в клеточной среде 1640+10% FBS. Далее добавляли 10 мкл этих растворов к 40 мкл клеток. Итоговое разведение соединений в 400 раз и финальная концентрация ДМСО 0,25%.Compounds were dissolved in DMSO to a concentration of 20 mM. Then, depending on the maximum concentration tested, DMSO compounds were diluted to a 400-fold maximum concentration. Next, serial dilutions were made in DMSO in increments of 3.16. Each concentration was tested in duplicate, each experiment was repeated at least 2 times. Also, in each plate there were controls only with DMSO without compounds. Then an intermediate dilution of the compounds was performed 80 times in the cell medium 1640 + 10% FBS. Next, 10 μl of these solutions were added to 40 μl of cells. The final dilution of the compounds is 400 times and the final concentration of DMSO is 0.25%.
Инкубация 72 часа, 37°C, 5% CO2.Incubation 72 hours, 37 ° C, 5% CO 2 .
День №3. Детекция.Day number 3. Detection.
В каждую лунку плашки добавляли 15 мкл реагента CellTiter-Glo, инкубировали 10 минут при комнатной температуре и детектировали люминесцентный сигнал на многофункциональном микропланшетном ридере Tecan Infinite M1000 PRO.15 μl of CellTiter-Glo reagent was added to each well of the plate, incubated for 10 minutes at room temperature and a luminescent signal was detected on a Tecan Infinite M1000 PRO multifunctional microplate reader.
Обсчет результатов.The calculation of the results.
Для обсчета результатов использовали GraphPad Prizm5. Для первичных расчетов в качестве 0% живых клеток использовали лунки без клеток, а лунки с ДМСО без соединений как максимальное количество живых клеток 100%. Полученные результаты представлены в Таблице 2.GraphPad Prizm5 was used to calculate the results. For primary calculations, wells without cells were used as 0% of living cells, and wells with DMSO without compounds as the maximum number of living cells of 100%. The results obtained are presented in Table 2.
Пример 8. Приготовление лекарственного вещества в виде таблеток. Смешивали, а затем спресовывали в брусок 1600 мг крахмала, 1600 мг измельченной лактозой, 400 мг талька и 1000 мг соединения 1.8. Полученный брусок измельчали в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетировали в таблетки, пригодных форм весом 500 мг каждая.Example 8. Preparation of a drug substance in the form of tablets. 1600 mg of starch, 1600 mg of crushed lactose, 400 mg of talc and 1000 mg of compound 1.8 were mixed and then pressed into a block. The resulting bar was crushed into granules and sieved through sieves, collecting granules with a size of 14-16 mesh. The granules obtained were tabletted into tablets of suitable forms weighing 500 mg each.
Пример 9. Приготовление лекарственного вещества в виде капсул. Соединение 1.8 тщательно смешивали с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывали по 600 мг в желатиновые капсулы подходящего размера.Example 9. Preparation of a drug substance in the form of capsules. Compound 1.8 was thoroughly mixed with lactose powder in a 2: 1 ratio. The resulting powdery mixture was packaged in 600 mg in a suitable size gelatin capsule.
Пример 10. Приготовление лекарственного вещества в виде композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивали 500 мг соединения 1.8, 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл воды для инъекций. Раствор фильтровали и помещали в 1 мл в ампулы, которые укупоривали.Example 10. The preparation of a medicinal substance in the form of compositions for intramuscular, intraperitoneal or subcutaneous injection. 500 mg of compound 1.8, 300 mg of chlorobutanol, 2 ml of propylene glycol and 100 ml of water for injection were mixed. The solution was filtered and placed in 1 ml ampoules, which were sealed.
Специалисты в данной области техники легко определят, некритические параметры, которые могут быть изменены или модифицированы для достижения результатов, представленных в изобретении. Различные модификации изобретения, в дополнение к описанным здесь, станут очевидными специалистам в данной области техники из приведенного выше описания.Specialists in the art will easily determine non-critical parameters that can be changed or modified to achieve the results presented in the invention. Various modifications of the invention, in addition to those described herein, will become apparent to those skilled in the art from the above description.
Claims (19)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017127152A RU2654695C1 (en) | 2017-07-28 | 2017-07-28 | 8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2017127152A RU2654695C1 (en) | 2017-07-28 | 2017-07-28 | 8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2654695C1 true RU2654695C1 (en) | 2018-05-22 |
Family
ID=62202364
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017127152A RU2654695C1 (en) | 2017-07-28 | 2017-07-28 | 8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2654695C1 (en) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2463299C2 (en) * | 2007-07-06 | 2012-10-10 | Астеллас Фарма Инк. | Di(arylamino)aryl compounds |
| US9273077B2 (en) * | 2008-05-21 | 2016-03-01 | Ariad Pharmaceuticals, Inc. | Phosphorus derivatives as kinase inhibitors |
| RU2607371C1 (en) * | 2015-11-19 | 2017-01-10 | Закрытое акционерное общество "Р-Фарм"(ЗАО "Р-Фарм") | Substituted n2-(4-amino-2-methoxyphenyl)-n4-[2-(dimethylphosphoryl)-phenyl]-5-chloro-pyrimidine-2,4-diamines as modulators of alk and egfr, applicable for treating cancer |
-
2017
- 2017-07-28 RU RU2017127152A patent/RU2654695C1/en active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2463299C2 (en) * | 2007-07-06 | 2012-10-10 | Астеллас Фарма Инк. | Di(arylamino)aryl compounds |
| US9273077B2 (en) * | 2008-05-21 | 2016-03-01 | Ariad Pharmaceuticals, Inc. | Phosphorus derivatives as kinase inhibitors |
| RU2607371C1 (en) * | 2015-11-19 | 2017-01-10 | Закрытое акционерное общество "Р-Фарм"(ЗАО "Р-Фарм") | Substituted n2-(4-amino-2-methoxyphenyl)-n4-[2-(dimethylphosphoryl)-phenyl]-5-chloro-pyrimidine-2,4-diamines as modulators of alk and egfr, applicable for treating cancer |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2606949C1 (en) | Substituted n-{3-[4-(1-methyl-1h-indol-3-yl)pyrimidin-2-ylamino]-4-methoxyphenyl}-amides as modulators of egfr, applicable for treating cancer | |
| ES2867274T3 (en) | Amino-triazolopyridine compounds and their use in the treatment of cancer. | |
| RU2606951C1 (en) | Dichloroacetates of substituted n4-[2-(dimethylphosphoryl)phenyl]-n2-(2-methoxy-4-piperidin-1-ylphenyl)-5-chloropyrimidine-2,4-diamines as modulators of alk and egfr, intended for treating cancer | |
| RU2607371C1 (en) | Substituted n2-(4-amino-2-methoxyphenyl)-n4-[2-(dimethylphosphoryl)-phenyl]-5-chloro-pyrimidine-2,4-diamines as modulators of alk and egfr, applicable for treating cancer | |
| JP2021098721A (en) | Substituted quinazoline compounds and methods for use thereof | |
| US8440829B2 (en) | PI3 kinase/mTOR dual inhibitor | |
| RU2434851C1 (en) | Cyclic n,n'-diarylthioureas or n,n'-diarylureas - antagonists of androgen receptors, anti-cancer medication, method of obtaining and application | |
| KR20190016976A (en) | Azabenzimidazole derivatives as PI3K beta inhibitors | |
| EP2477496B1 (en) | Novel compounds and therapeutic use thereof for protein kinase inhibition | |
| BR112015010019B1 (en) | SUBSTITUTED TRICYCLIC BENZIMIDAZOLS, THEIR USES, AND PHARMACEUTICAL COMPOSITION | |
| RU2477726C1 (en) | Substituted phenoxyacetic acids, their esters and amides containing 2,6-dioxo-2,3,6,7-tetrahydro-1h-pyrin-8-yl fragments - a2a adenosine receptor antagonists and use thereof | |
| MX2015003276A (en) | Prodrugs of amino quinazoline kinase inhibitor. | |
| KR20220161396A (en) | Preparation, Compositions, and Crystal Forms of Substituted Pyridinone-Pyridinyl Compounds | |
| US9376452B2 (en) | Rab7 GTPase inhibitors and related methods of treatment | |
| RU2654695C1 (en) | 8-(1-{4-{(5-chloro-4-{(2-(dimethylphosphoryl)phenyl)amino}pyrimidin-2-yl)amino)-3-methoxyphenyl}piperidin-4-yl)-1-methyl-1,8-diazaspiro(4.5)decan-2-one and its pharmaceutically acceptable salts as an alk and eger modulator for treatment of cancer | |
| RU2603960C1 (en) | Dichloroacetate of n1,n2-disubstituted n4-[4-(1-methyl-1h-indole-3-yl)-pyrimidine-2-yl]-5-methoxybenzene-1,2,4-triamine as egfr modulator for treating cancer | |
| RU2605400C1 (en) | DERIVATIVES OF 1-(3-AMINOPHENYL)-6,8-DIMETHYL-5-(4-IODO-2-FLUORO-PHENYLAMINO)-3-CYCLOPROPYL-1H,6H-PYRIDO[4,3-d]PYRIMIDINE-2,4,7-TRIONE AS MEK1/2 INHIBITORS | |
| RU2615986C1 (en) | Substituted methyl(2-{4-[3-(3-methanesulfonylamino-2-fluoro-5-chloro-phenyl)-1h-pyrazol-4-yl]pyrimidin-2-ylamino}ethyl) carbamates, process for their preparation and application | |
| EA037939B1 (en) | N-{3-[3-CYCLOPROPYL-5-(2-FLUORO-4-IODOPHENYLAMINO)-6,8-DIMETHYL-2,4,7-TRIOXO-3,4,6,7-TETRAHYDRO-2H-PYRIDO[4,3-d]PYRIMIDIN-1-YL]PHENYL}CYCLOPROPANECARBOXAMIDE DIMETHYL SULPHOXIDE SOLVATE AS AN MEK1/2 INHIBITOR | |
| RU2786524C2 (en) | Inhibitors of epidermal growth factor receptor | |
| CN108239082B (en) | Compound for inhibiting ROCK and application thereof | |
| US20230348462A1 (en) | Imidazo[4,5-c]quinoline compounds and their use as atm kinase inhibitors | |
| MXPA98006850A (en) | Derivatives 4-amino-pyrimidine, medications containing these compounds, their use and process for suproducc |