RU2633085C2 - Antiviral drug as capsules and method for its preparation - Google Patents
Antiviral drug as capsules and method for its preparation Download PDFInfo
- Publication number
- RU2633085C2 RU2633085C2 RU2014120368A RU2014120368A RU2633085C2 RU 2633085 C2 RU2633085 C2 RU 2633085C2 RU 2014120368 A RU2014120368 A RU 2014120368A RU 2014120368 A RU2014120368 A RU 2014120368A RU 2633085 C2 RU2633085 C2 RU 2633085C2
- Authority
- RU
- Russia
- Prior art keywords
- oseltamivir
- antiviral drug
- crospovidone
- povidone
- croscarmellose
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
Landscapes
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
Заявляемое изобретение относится к фармацевтической промышленности, а именно к лекарственным средствам, обладающим противовирусным действием, выпускаемым в твердых желатиновых капсулах, а также к способу их получения.The claimed invention relates to the pharmaceutical industry, namely to medicines having antiviral action, produced in hard gelatin capsules, as well as to a method for their preparation.
Из уровня техники известно значительное количество противовирусных препаратов, таких как арбидол, амиксин (тилорон), рибавирин, римантадин и другие, большинство из которых выпускается в виде таблеток и капсул (1).A significant number of antiviral drugs are known from the prior art, such as arbidol, amixin (tilorone), ribavirin, rimantadine, and others, most of which are available in the form of tablets and capsules (1).
Острые респираторные вирусные инфекции до настоящего времени остаются одними из самых актуальных заболеваний человека из-за чрезвычайно высокого уровня заболеваемости, обычно носящего характер сезонных эпидемий. Эпидемиологические данные говорят о том, что заболеваемость среди взрослых и детей составляет 2-3 и 6-8 эпизодов в год соответственно. В России ежегодно регистрируется порядка 30-40 млн случаев респираторных инфекций, на которые приходится до 40% дней нетрудоспособности (2).Acute respiratory viral infections to this day remain one of the most relevant human diseases due to the extremely high incidence rate, usually of the nature of seasonal epidemics. Epidemiological data suggest that the incidence among adults and children is 2-3 and 6-8 episodes per year, respectively. In Russia, about 30-40 million cases of respiratory infections are recorded annually, which account for up to 40% of disability days (2).
Несмотря на наличие большого количества противовирусных лекарственных средств, радикальных средств для лечения гриппа не существует. Это связано с тем, что вирус гриппа постоянно изменяется. Существует две группы противогриппозных препаратов, обладающих специфическим противовирусным действием с доказанной клинической эффективностью:Despite the presence of a large number of antiviral drugs, there is no radical cure for the flu. This is because the flu virus is constantly changing. There are two groups of anti-influenza drugs with specific antiviral effects with proven clinical efficacy:
- амантадин, римантадин и их аналоги;- amantadine, rimantadine and their analogues;
- занамивир, осельтамивир.- zanamivir, oseltamivir.
Ингибиторы M2-каналов амантадин и ремантадин - препараты, эффективные на ранней стадии гриппа A, не действуют на вирусы гриппа B и могут способствовать развитию вирусной резистентности у лиц, уже получавших эти препараты. Так согласно данным центров по контролю и профилактике заболеваний США римантадин и амантадин не рекомендуются к использованию из-за высокого уровня устойчивости циркулирующих вирусов гриппа A к этим препаратам (3). Кроме того, оба препарата могут вызывать нежелательные явления со стороны ЦНС и желудочно-кишечного тракта, особенно у больных пожилого возраста.Inhibitors of M2 channels amantadine and remantadine - drugs that are effective in the early stages of influenza A, do not act on influenza B viruses and can contribute to the development of viral resistance in people who have already received these drugs. So, according to the US Centers for Disease Control and Prevention, rimantadine and amantadine are not recommended for use because of the high level of resistance of circulating influenza A viruses to these drugs (3). In addition, both drugs can cause adverse effects from the central nervous system and the gastrointestinal tract, especially in elderly patients.
К числу новых лекарственных средств, безопасных и эффективных при гриппе, вызванном вирусами не только A, но и B, относятся ингибиторы нейраминидазы, ключевого фермента вируса гриппа. Препараты осельтамивир и занамивир, ингибируя вирусный фермент - нейраминидазу, предотвращают проникновение вируса в клетки человека. При использовании занамивира необходимый эффект достигается только при ингаляционном применении, поэтому он непригоден для широкого использования в клинической практике, например, для детей дошкольного возраста и пожилых пациентов. Кроме того, возможен целый ряд нежелательных реакций, включая бронхоспазм и отек гортани. Для профилактики гриппа занамивир не применяется (4, 5).New drugs that are safe and effective for influenza caused by viruses not only A but also B include inhibitors of neuraminidase, a key enzyme of the influenza virus. The drugs oseltamivir and zanamivir, inhibiting the viral enzyme neuraminidase, prevent the penetration of the virus into human cells. When using zanamivir, the desired effect is achieved only with inhalation, therefore, it is unsuitable for widespread use in clinical practice, for example, for preschool children and elderly patients. In addition, a number of adverse reactions are possible, including bronchospasm and laryngeal edema. Zanamivir is not used to prevent influenza (4, 5).
Осельтамивир активен по отношению ко всем вирусам гриппа. Он эффективен как против сезонного, так и против птичьего (вирус подтипа H5N1) и свиного гриппа (вирус подтипа H1N1). Доступные материалы клинических испытаний свидетельствуют, что осельтамивир уменьшает тяжелые симптомы инфекции и снижает частоту госпитализаций на 60% (4, 6).Oseltamivir is active against all influenza viruses. It is effective against both seasonal and bird flu (H5N1 subtype virus) and swine flu (H1N1 subtype virus). Available clinical trial data indicate that oseltamivir reduces severe symptoms of infection and reduces the hospitalization rate by 60% (4, 6).
В 2007 году Всемирная Организация Здравоохранения подтвердила статус Тамифлю® (осельтамивира фосфат) в качестве основного противовирусного препарата, рекомендуемого для лечения пациентов, инфицированных вирусом птичьего гриппа - вирус подтипа H5N1 (7).In 2007, the World Health Organization confirmed the status of Tamiflu® (oseltamivir phosphate) as the main antiviral drug recommended for the treatment of patients infected with avian influenza virus - the H5N1 subtype virus (7).
Осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат) эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа A и B - фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме (8).Oseltamivir phosphate is a prodrug, its active metabolite (oseltamivir carboxylate) is an effective and selective inhibitor of neuraminidase of influenza viruses type A and B, an enzyme that catalyzes the release of newly formed virus particles from infected cells, their penetration into the epithelial cells of the respiratory tract and the further spread of the virus in the body (8).
Осельтамивир значительно сокращает период клинических проявлений гриппозной инфекции, уменьшает их тяжесть и снижает частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита), укорачивает время выделения вируса из организма (9).Oseltamivir significantly shortens the period of clinical manifestations of influenza infection, reduces their severity and reduces the incidence of influenza complications that require the use of antibiotics (bronchitis, pneumonia, sinusitis, otitis media), and shortens the time it takes to isolate the virus from the body (9).
Осельтамивира фосфат легко всасывается в ЖКТ и в высокой степени превращается в активный метаболит под действием печеночных и кишечных эстераз. После приема внутрь осельтамивира фосфата его активный метаболит обнаруживался в легких, промывных водах бронхов, слизистой оболочке полости носа, среднем ухе и трахее в концентрациях, обеспечивающих противовирусный эффект. Выводится в виде активного метаболита преимущественно почками. Осельтамивир назначают взрослым и детям старше 1 года для профилактики и лечения гриппа (8, 10).Oseltamivir phosphate is readily absorbed in the digestive tract and is highly converted into an active metabolite by the action of hepatic and intestinal esterases. After ingestion of oseltamivir phosphate, its active metabolite was found in the lungs, lavage waters of the bronchi, nasal mucosa, middle ear and trachea in concentrations providing an antiviral effect. It is excreted as an active metabolite mainly by the kidneys. Oseltamivir is prescribed for adults and children over 1 year of age for the prevention and treatment of influenza (8, 10).
Использование осельтамивира для профилактики в отношении вирусов гриппа A и B показало, что после контакта с больным назначение препарата снижает вероятность заболевания на 60-90%, предсезонная профилактика приводит к сходным результатам (11).The use of oseltamivir for prophylaxis against influenza A and B viruses showed that after contact with the patient, the use of the drug reduces the likelihood of the disease by 60-90%, pre-season prophylaxis leads to similar results (11).
Впервые синтез осельтамивира и фармакологические свойства осельтамивира и его солей были раскрыты в патенте США US 5952375 «Compounds and methods for synthesis and therapy», приоритет от 27 февраля 1995 года, патентообладатель Джилид Сайэнс, Инк., США.The synthesis of oseltamivir and the pharmacological properties of oseltamivir and its salts were first disclosed in US Pat. No. 5,952,375, Compounds and Methods for Synthesis and Therapy, Priority February 27, 1995, patent holder Geelid Science, Inc., USA.
В РФ существует патент на изобретение №2181357 по заявке №97116714 от 26 февраля 1996 года, «Композиция селективных ингибиторов вирусных или бактериальных нейраминидаз (варианты), соединение и способ лечения или профилактики заболевания гриппом», патентообладатель Джилид Сайэнс, Инк., США (международная заявка WO 96/26933).In the Russian Federation there is a patent for invention No. 2181357 according to application No. 97116714 dated February 26, 1996, “Composition of selective inhibitors of viral or bacterial neuraminidases (options), compound and method for treating or preventing the disease of influenza”, patent holder Geelid Science, Inc., USA (international application WO 96/26933).
В патенте раскрыты химическая формула осельтамивира и его применение для лечения и профилактики гриппа терапевтически эффективным количеством указанного соединения.The patent discloses the chemical formula of oseltamivir and its use for the treatment and prevention of influenza with a therapeutically effective amount of the compound.
Существует несколько патентов и заявок, раскрывающих состав лекарственной формы на основе осельтамивира в виде порошка или гранул для приготовления суспензии для приема внутрь.There are several patents and applications disclosing the composition of the oseltamivir dosage form in the form of a powder or granules for the preparation of an oral suspension.
В заявке РФ на изобретение №2008137613 «Фармацевтическая композиция, содержащая озельтамивира фосфат», приоритет от 20 февраля 2007 года, заявители Тугаи Сейяку Кабусики Кайся (JP), Ф. Хоффманн-Ля Рош АГ (СН), раскрыт состав лекарственной формы для приготовления суспензии на основе осельтамивира фосфата, которая является сухим сиропом, порошком или гранулами.In the RF application for invention No. 2008137613 “Pharmaceutical composition containing oseltamivir phosphate”, priority dated February 20, 2007, applicants Tugai Seyaku Kabushiki Kaysya (JP), F. Hoffmann-La Roche AG (CH), disclosed the composition of the dosage form for the preparation of the suspension based on oseltamivir phosphate, which is a dry syrup, powder or granules.
В международной заявке WO 2007112619 «Oseltamivir phosphate granule and preparation mehtod thereof», приоритет 04 апреля 2006 года, заявитель INST PHARM & TOXICOLOGY AMMS (CN), раскрыт состав лекарственной формы также для приготовления суспензии на основе осельтамивира фосфата в виде гранул.In the international application WO 2007112619 "Oseltamivir phosphate granule and preparation mehtod therefore", priority April 4, 2006, Applicant INST PHARM & TOXICOLOGY AMMS (CN) discloses the composition of the dosage form for the preparation of a suspension based on oseltamivir phosphate in the form of granules.
В Евразийском патенте EA 003989 «Композиция (варианты) и способ лечения или профилактики инфекции гриппа у млекопитающего», приоритет от 17 сентября 1997 года, заявитель ДЖИЛИД САЙЭНС, ИНК. (US), предложена композиция для лечения или профилактики инфекции гриппа, содержащая эффективное количество осельтамивира и энтеросолюбильное покрытие.In Eurasian Patent EA 003989, “Composition (Options) and Method for the Treatment or Prevention of Infection of Influenza Infection in a Mammal,” Priority September 17, 1997, Applicant JILID SAYENS, INC. (US), a composition for treating or preventing an influenza infection is provided, comprising an effective amount of oseltamivir and an enteric coating.
На фармацевтическом рынке известно лекарственное средство под торговой маркой Тамифлю® на основе осельтамивира в виде желатиновых капсул производства фирмы Ф. Хоффманн-Ля Рош Лтд, Швейцария.In the pharmaceutical market, a drug under the brand name Tamiflu® based on oseltamivir in the form of gelatin capsules manufactured by F. Hoffmann-La Roche Ltd, Switzerland is known.
Капсула Тамифлю® содержит осельтамивира фосфата 98,5 мг (в пересчете на осельтамивир - 75 мг) и вспомогательные вещества: крахмал прежелатинизированный, повидон K30, натрия кроскармеллоза, тальк, натрия стеарил фумарат (9). Количественное содержание вспомогательных веществ и способ получения массы для заполнения капсул неизвестны.The Tamiflu® capsule contains oseltamivir phosphate 98.5 mg (in terms of oseltamivir 75 mg) and excipients: pregelatinized starch, povidone K30, croscarmellose sodium, talc, sodium stearyl fumarate (9). The quantitative content of excipients and the method of obtaining the mass for filling capsules are unknown.
Капсульная масса должна хорошо дозироваться, иметь незначительную влагосорбционную активность, не должна комковаться при капсулировании, не должна уплотняться, прессоваться и разделяться по фракциям при транспортировании и хранении.The capsule mass should be well dosed, have insignificant moisture sorption activity, should not clump during encapsulation, should not be compacted, pressed and divided into fractions during transportation and storage.
Порошковое заполнение капсул часто имеет преимущество перед заполнением капсул гранулами, но для осельтамивира существенным недостатком такого заполнения является сильная зависимость свойств капсульной массы от физических и технологических свойств активного вещества.Powder filling of capsules often has an advantage over filling capsules with granules, but for oseltamivir, a significant drawback of such filling is the strong dependence of the properties of the capsule mass on the physical and technological properties of the active substance.
Субстанция осельтамивира - (3R,4R,5S)-4-(Ацетиламино)-5-амино-3-(1-этилпропокси)-1-циклогексен-1-карбоновой кислоты этиловый эфир (в виде фосфата) представляет собой кристаллический порошок белого цвета с неоднородным размером частиц. При рассмотрении под микроскопом видны игольчатые кристаллы, при этом длина игольчатых кристаллов превосходит ширину в несколько раз. Кристаллы имеют неровную, как бы занозистую, поверхность. Связанные между собой игольчатые кристаллы образуют агломераты. Такая субстанция имеет низкое значение сыпучести, сильно электризуется, гигроскопична, т.е. является достаточно сложной в работе, и получить капсульную массу в виде порошка, обладающую хорошими технологическими свойствами, проблематично. Такие свойства субстанции не позволяют заполнять капсулы без предварительного приготовления массы для капсулирования.The substance of oseltamivir - (3R, 4R, 5S) -4- (Acetylamino) -5-amino-3- (1-ethylpropoxy) -1-cyclohexene-1-carboxylic acid ethyl ether (in the form of phosphate) is a white crystalline powder with non-uniform particle size. When viewed under a microscope, needle crystals are visible, while the length of the needle crystals exceeds the width by several times. The crystals have an uneven, as if splintery, surface. The interconnected needle crystals form agglomerates. Such a substance has a low flowability value, is highly electrified, hygroscopic, i.e. It is quite difficult to work with and it is problematic to obtain a capsule mass in the form of a powder with good technological properties. Such properties of the substance do not allow filling capsules without first preparing the mass for encapsulation.
При этом даже незначительное допустимое изменение физико-химических свойств осельтамивира оказывает влияние на сыпучесть, способность электризоваться, гигроскопичность, что ведет к непостоянству насыпной массы и увеличивает погрешность дозирования капсульной массы при первоначальном тщательном подборе вспомогательных веществ для введения этого лекарственного вещества в капсулы.Moreover, even an insignificant allowable change in the physicochemical properties of oseltamivir affects the flowability, the ability to electrify, and hygroscopicity, which leads to inconsistency of the bulk density and increases the dosage error of the capsule mass during the initial careful selection of excipients for introducing this drug into capsules.
Целью данного изобретения, устраняющего вышеуказанные недостатки, является создание противовирусного лекарственного препарата на основе осельтамивира в виде капсул и способа их получения.The aim of this invention, which eliminates the above disadvantages, is to create an antiviral drug based on oseltamivir in the form of capsules and a method for their preparation.
Технический результат, получаемый при реализации настоящего изобретения, состоит в том, что получаемое противовирусное лекарственное средство легко высвобождает активное вещество, обеспечивает высокую биодоступность, обладает фармакологической безопасностью при условии полного соответствия требованиям Государственной фармакопеи.The technical result obtained by the implementation of the present invention is that the resulting antiviral drug easily releases the active substance, provides high bioavailability, has pharmacological safety, provided that it fully complies with the requirements of the State Pharmacopoeia.
Технический результат достигается лекарственным средством на основе осельтамивира в виде желатиновых капсул, содержащих гранулы, включающие активное вещество и вспомогательные добавки, при этом в качестве активного вещества используется осельтамивира фосфат, в качестве вспомогательных добавок используется микрокристаллическая целлюлоза или лактоза, повидон, кросповидон или кроскармеллоза, аэросил, стеарилфумарат натрия при следующем соотношении компонентов, масс.%:The technical result is achieved by the drug based on oseltamivir in the form of gelatin capsules containing granules containing the active substance and auxiliary additives, while the active substance is oseltamivir phosphate, microcrystalline cellulose or lactose, povidone, crospovidone or croscarmellose, aerosil are used as auxiliary substances , sodium stearyl fumarate in the following ratio of components, wt.%:
Кроме того, лекарственное средство может дополнительно содержать тальк в количестве 0,5-3,0 мас.%.In addition, the drug may additionally contain talc in an amount of 0.5-3.0 wt.%.
Технический результат также достигается способом получения, заключающимся в том, что измельченный осельтамивира фосфат смешивают с микрокристаллической целлюлозой или лактозой, аэросилом, кросповидоном или кроскармеллозой, увлажняют полученную смесь водноспиртовым раствором повидона, перемешивают, гранулируют, сушат, подвергают сухой грануляции, опудривают смесью стеарилфумарата натрия и кросповидона или кроскармеллозы, капсулируют в твердые желатиновые капсулы.The technical result is also achieved by the production method, which consists in the fact that the crushed oseltamivir phosphate is mixed with microcrystalline cellulose or lactose, aerosil, crospovidone or croscarmellose, moisten the mixture with an aqueous-alcoholic solution of povidone, mix, granulate, dry, dry sodium granulate, dry granulate, crospovidone or croscarmellose are encapsulated in hard gelatin capsules.
Кроме того, для опудривания могут использовать смесь, дополнительно содержащую тальк.In addition, a mixture additionally containing talc can be used for dusting.
Нами получен стабильный при хранении противовирусный лекарственный препарат в виде капсул, включающих гранулы, позволяющий быстро и полностью высвобождаться активному веществу.We have obtained an antiviral drug that is stable during storage in the form of capsules, including granules, which allows the active substance to be quickly and completely released.
Полученная масса для капсулирования в виде гранул обладает хорошими технологическими свойствами в процессе заполнения желатиновых капсул: хорошей сыпучестью, однородностью, стабильностью насыпной массы, практически не электризуется при заполнении капсул.The resulting capsule mass in the form of granules has good technological properties in the process of filling gelatin capsules: good flowability, uniformity, stability of the bulk, practically does not electrify when filling the capsules.
Заявленное соотношение компонентов является оптимальным, найдено экспериментально и обеспечивает необходимое качество лекарственного средства, его соответствие требованиям ГФ XI и срок годности более двух лет.The claimed ratio of components is optimal, found experimentally and provides the necessary quality of the drug, its compliance with the requirements of the Global Fund XI and shelf life of more than two years.
В предложенном пероральном лекарственном средстве применены компоненты, разрешенные для изготовления лекарственных средств в России.In the proposed oral medicinal product, the components approved for the manufacture of medicines in Russia are used.
В качестве наполнителей, придающих массе для наполнения капсул необходимый оптимальный объем, регулируя объемную плотность, используется лактоза (сахар молочный) или микрокристаллическая целлюлоза (МКЦ).Lactose (milk sugar) or microcrystalline cellulose (MCC) is used as fillers, giving the mass for filling capsules the necessary optimal volume, adjusting bulk density.
В качестве антифрикционных веществ, которые уменьшают внутреннее трение между частицами и внешнее трение между частицами композиции и поверхностью оборудования и устраняют эффект электризации, обычно используются стеараты кальция или магния или стеариновая кислота и тальк.As anti-friction substances, which reduce internal friction between particles and external friction between particles of the composition and the surface of the equipment and eliminate the effect of electrification, calcium or magnesium stearates or stearic acid and talc are usually used.
Нами был выбран стеарилфумарат натрия, который является альтернативой стеарату магния, но имеет ряд преимуществ: в отличие от стеарата магния и стеарата кальция совместим со всеми известными активными ингридиентами; более гидрофилен, чем стеараты магния и кальция, ускоряет распадаемость и скорость растворения.We have chosen sodium stearyl fumarate, which is an alternative to magnesium stearate, but has several advantages: unlike magnesium stearate and calcium stearate, it is compatible with all known active ingredients; more hydrophilic than magnesium and calcium stearates, accelerates disintegration and dissolution rate.
Кроме того, в качестве антифрикционного вещества дополнительно может использоваться тальк.In addition, talc may additionally be used as an anti-friction substance.
В качестве дезинтегрирующих агентов, улучшающих распределение компонентов в массе технологической смеси и набухающих при поглощении воды, используется аэросил (кремния диоксид коллоидный) и кросповидон или кроскармеллоза. При этом часть кросповидона или кроскармеллозы добавляется в состав порошковой смеси до влажного гранулирования, другая часть добавляется в опудривающую смесь, содержащую антифрикционное вещество. Наличие кросповидона или кроскармеллозы в опудривающей смеси улучшает растворение гранул.Aerosil (colloidal silicon dioxide) and crospovidone or croscarmellose are used as disintegrating agents that improve the distribution of components in the mass of the technological mixture and swell when water is absorbed. In this case, part of crospovidone or croscarmellose is added to the composition of the powder mixture until wet granulation, the other part is added to the dusting mixture containing an antifriction substance. The presence of crospovidone or croscarmellose in a dusting mixture improves the dissolution of the granules.
В качестве гранулирующей жидкости используется 10% раствор повидона в 50% водноспиртовой смеси. Этот состав был подобран экспериментально. Проводились эксперименты, в которых увлажнение осуществляли водой, или этиловым спиртом, или водноспиртовой смесью как в чистом виде, так и с добавлением повидона, причем содержание повидона в растворе доводилось до 20%. Увлажнение водой или 5%-ным водным раствором повидона сначала давало плохое смачивание, а при увеличении количества жидкости - переувлажнение. Увеличение содержания повидона в гранулирующей жидкости до 20% ухудшало растворимость полученных гранул. Применение этанола или раствора повидона в спирте давало пылевидную сильно электризующуюся капсульную массу. Применение водноспиртового раствора повидона позволило избежать этих недостатков. Причем при применении 10% раствора повидона в 50% водноспиртовой смеси была получена наилучшая сыпучесть полученных гранул.As a granulating liquid, a 10% solution of povidone in a 50% water-alcohol mixture is used. This composition was selected experimentally. Experiments were carried out in which humidification was carried out with water, or ethyl alcohol, or a water-alcohol mixture both in pure form or with the addition of povidone, and the povidone content in the solution was brought to 20%. Moistening with water or a 5% aqueous solution of povidone at first gave poor wetting, and with an increase in the amount of liquid - overmoistening. An increase in the povidone content in the granulating liquid up to 20% impaired the solubility of the obtained granules. The use of ethanol or a solution of povidone in alcohol gave a pulverized, highly electrifying capsule mass. The use of an aqueous alcoholic solution of povidone avoided these disadvantages. Moreover, when using a 10% solution of povidone in a 50% water-alcohol mixture, the best flowability of the obtained granules was obtained.
Капсульная масса имеет следующие технологические характеристики: сыпучесть - 7,6-8,2 г/с, насыпная масса - 0,42-0,44 г/см. Таким образом, предлагаемый состав капсульной массы имеет хорошую сыпучесть, постоянную насыпную массу, не электризуется, что позволяет его легко дозировать с большой точностью.Capsule mass has the following technological characteristics: flowability - 7.6-8.2 g / s, bulk density - 0.42-0.44 g / cm. Thus, the proposed composition of the capsule mass has good flowability, a constant bulk density, is not electrified, which makes it easy to dose with great accuracy.
Противовирусное лекарственное средство в виде капсул и способ его получения успешно прошли испытания и могут быть использованы для серийного выпуска продукции.The antiviral drug in the form of capsules and the method for its preparation have been successfully tested and can be used for serial production.
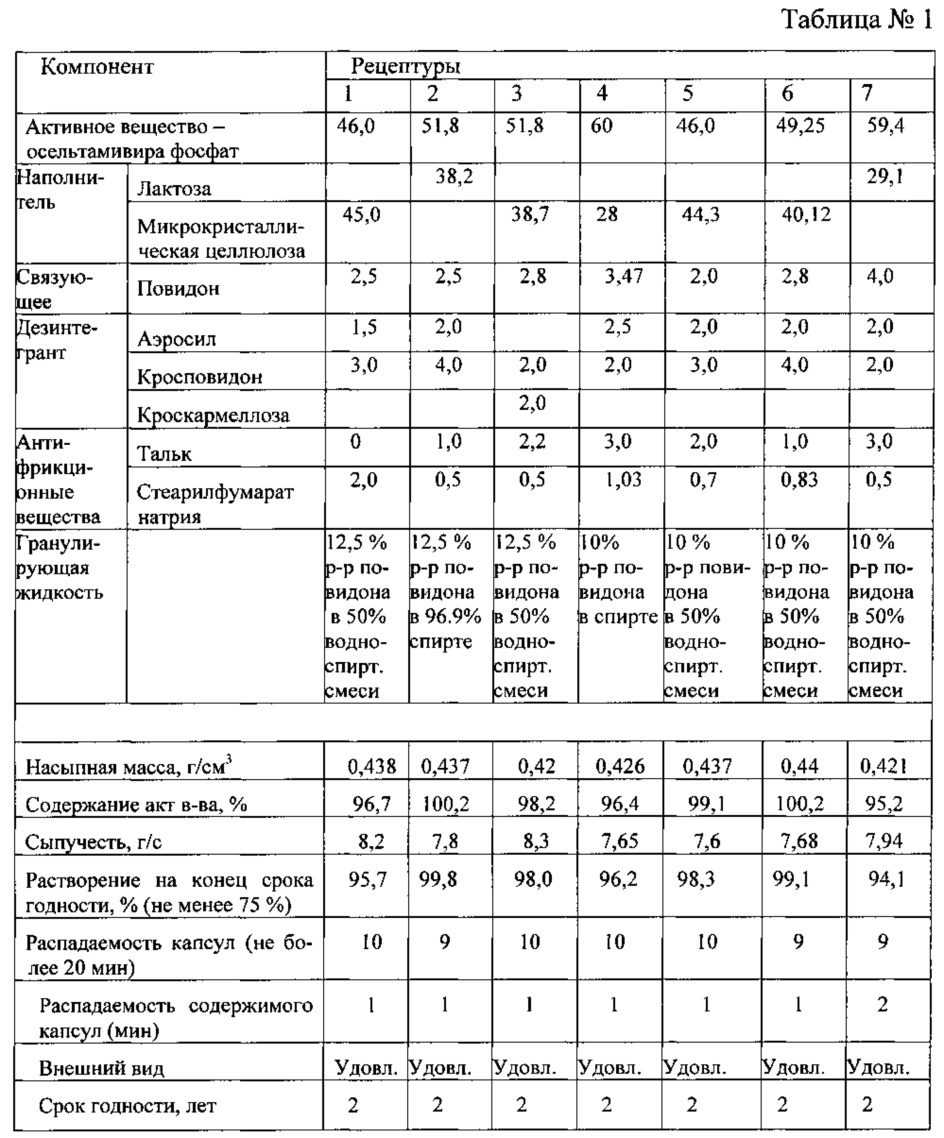
В таблице №1 приведены рецептуры состава капсульной массы.Table No. 1 shows the composition of the capsule mass.
Основной характеристикой биологической доступности пероральных лекарственных форм является скорость растворения. Скорость растворения капсульной массы определяют в приборе "Вращающаяся корзина" по известной методике (12). Средой растворения является вода очищенная, скорость вращения корзинки составляет 75 об/мин, объем среды растворения 500 мл, температура среды 37°C. Было установлено, что через 1-2 минуты происходит практически полный переход лекарственного вещества в воду.The main characteristic of the bioavailability of oral dosage forms is the rate of dissolution. The dissolution rate of the capsule mass is determined in the device "Rotating basket" by a known method (12). The dissolution medium is purified water, the rotation speed of the basket is 75 rpm, the volume of the dissolution medium is 500 ml, the temperature of the medium is 37 ° C. It was found that after 1-2 minutes there is an almost complete transition of the drug into water.
Распадаемость полученных капсул - менее 20 мин, что отвечает требованиям Государственной Фармакопеи XI.The disintegration of the obtained capsules is less than 20 minutes, which meets the requirements of the State Pharmacopoeia XI.
Ниже приведен пример осуществления предлагаемого способа получения капсул осельтамивира.The following is an example implementation of the proposed method for producing capsules of oseltamivir.
Размалывают осельтамивира фосфат на грануляторе через пробивную сетку с диаметром отверстий 0,5 мм. Микрокристаллическую целлюлозу просеивают через сито с размером отверстий 0,5 мм; повидон (пласдон K 29/32), кросповидон (полипласдон XL-10), аэросил (аэроперл 300), тальк и стеарилфумарат натрия просеивают через сито с размером отверстий 0,25 мм. Взвешивают необходимое количество компонентов. В смеситель загружают 295,5 г осельтамивира фосфата, 239,52 г микрокристаллической целлюлозы, 12,0 г аэросила и 12,0 г кросповидона, производят их перемешивание в течение 5 минут. В смеситель загружают 84,0 г увлажнителя - 10% раствора повидона в 50% водноспиртовой смеси. После перемешивания в течение 1 минуты со скоростью 50 об/мин, загружают еще 84,0 г увлажнителя и перемешивают 1-2 минуты. Проверяют степень смачивания - не должно быть пыли при пропуске пробы влажной массы через пробивное сито. При необходимости перемешивают дополнительно 30 секунд. Проводят влажное гранулирование через пробивное сито с диаметром отверстий сетки 2 мм. Сушку влажного гранулята производят при 40°C с промежуточным перемешиванием до остаточной влаги от 1,8 до 2,5%.Grind oseltamivir phosphate on a granulator through a punching mesh with a hole diameter of 0.5 mm. Microcrystalline cellulose is sieved through a sieve with a hole size of 0.5 mm; povidone (plasdon K 29/32), crospovidone (polyplasdone XL-10), aerosil (airport 300), talc and sodium fumarate are sieved through a sieve with a hole size of 0.25 mm. Weigh the required amount of components. 295.5 g of oseltamivir phosphate, 239.52 g of microcrystalline cellulose, 12.0 g of aerosil and 12.0 g of crospovidone are loaded into the mixer, they are mixed for 5 minutes. 84.0 g of a humidifier, a 10% solution of povidone in a 50% water-alcohol mixture, are loaded into the mixer. After stirring for 1 minute at a speed of 50 rpm, another 84.0 g of humidifier are loaded and mixed for 1-2 minutes. Check the degree of wetting - there should be no dust when passing a sample of wet mass through a breakdown sieve. If necessary, mix an additional 30 seconds. Wet granulation is carried out through a breakdown sieve with a mesh diameter of 2 mm. Wet granulate is dried at 40 ° C with intermediate stirring to a residual moisture content of 1.8 to 2.5%.
Сухое гранулирование производят через плетеную сетку с размером отверстий 1×1 мм. Опудривание полученного гранулята производят в смесителе в течение 30 секунд смесью из 12,0 г кросповидона, 6,0 г талька, 4,98 г стеарилфумарата натрия. Капсулируют гранулят на капсульной машине IN-CAP в твердые желатиновые капсулы №1 со средней массой 0,2 г. Готовые капсулы фасуют и упаковывают.Dry granulation is carried out through a woven mesh with a hole size of 1 × 1 mm. The obtained granulate was dusted in a mixer for 30 seconds with a mixture of 12.0 g of crospovidone, 6.0 g of talc, 4.98 g of sodium stearyl fumarate. The granules are encapsulated on an IN-CAP capsule machine in No. 1 hard gelatin capsules with an average weight of 0.2 g. The finished capsules are packed and packaged.
ЛитератураLiterature
1. Машковский М.Д. Лекарственные средства. - 15-е изд. М.: ООО «Новая волна». - 2006 г.1. Mashkovsky M.D. Medicines - 15th ed. M .: New Wave LLC. - 2006
2. По данным отчетов Федерального государственного учреждения здравоохранения «Федеральный центр гигиены и эпидемиологии Роспотребнадзора РФ» или http://www.fcgsen.ru/2. According to the reports of the Federal State Healthcare Institution “The Federal Center for Hygiene and Epidemiology of the Rospotrebnadzor of the Russian Federation” or http://www.fcgsen.ru/
3. Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). Recommendations and Reports. January 21, 2011 / Vol. 60 / No. 1 или http://www.cdc.gov/mmwr/pdf/rr/rr6001.pdf, стр. 33. Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). Recommendations and Reports. January 21, 2011 / Vol. 60 / No. 1 or http://www.cdc.gov/mmwr/pdf/rr/rr6001.pdf, p. 3
4. http://www.lvrach.ru/2009/01/5898073/4. http://www.lvrach.ru/2009/01/5898073/
5. http://www.rmj.ru/articles_4368.htm5. http://www.rmj.ru/articles_4368.htm
6. Малеев В.В. Роль ингибиторов нейраминидазы в профилактике и лечении гриппа // Клин, фармакология и терапия. 2007. Т. 16. №1. С. 1-6.6. Maleev V.V. The role of neuraminidase inhibitors in the prevention and treatment of influenza // Wedge, pharmacology and therapy. 2007. V. 16. No. 1. S. 1-6.
7. http://www.rmj.ru/news_102.htm7.http: //www.rmj.ru/news_102.htm
8. http://www.rlsnet.ru/tn_index_id_15946.htm8.http: //www.rlsnet.ru/tn_index_id_15946.htm
9. http://www.rmj.ru/articles_1656.htm9.http: //www.rmj.ru/articles_1656.htm
10. http://www.rmj.ru/articles_8266.htm10. http://www.rmj.ru/articles_8266.htm
11. Nicholson K.G. et al. Treatment of acute influenza: efficacy and safety of the oral neuraminidase inhibitor oseltamivir // Lancet. 2000. Vol. 355. P. 1845-1850.11. Nicholson K.G. et al. Treatment of acute influenza: efficacy and safety of the oral neuraminidase inhibitor oseltamivir // Lancet. 2000. Vol. 355. P. 1845-1850.
12. Государственная фармакопея СССР. Изд. XI, выпуск 2, Москва: Медицина. - 1990. - С. 159.12. The State Pharmacopoeia of the USSR. Ed. XI, Issue 2, Moscow: Medicine. - 1990. - S. 159.
Claims (5)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2014120368A RU2633085C2 (en) | 2014-05-20 | 2014-05-20 | Antiviral drug as capsules and method for its preparation |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2014120368A RU2633085C2 (en) | 2014-05-20 | 2014-05-20 | Antiviral drug as capsules and method for its preparation |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014120368A RU2014120368A (en) | 2015-11-27 |
| RU2633085C2 true RU2633085C2 (en) | 2017-10-11 |
Family
ID=54753358
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014120368A RU2633085C2 (en) | 2014-05-20 | 2014-05-20 | Antiviral drug as capsules and method for its preparation |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2633085C2 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111297823B (en) * | 2020-03-04 | 2021-06-18 | 石药集团中奇制药技术(石家庄)有限公司 | Preparation method of oseltamivir phosphate capsule |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA003989B1 (en) * | 1997-09-17 | 2003-12-25 | Джилид Сайэнс, Инк. | Compounds (alternatives) and method for treating and prophylaxis of influenza infection in a mammal |
| US20040062801A1 (en) * | 2001-07-17 | 2004-04-01 | Joaquina Faour | Drug delivery device containing neuraminidase inhibitor and an H1 antagonist |
| EP1987825A1 (en) * | 2006-02-20 | 2008-11-05 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition comprising oseltamivir phosphate |
-
2014
- 2014-05-20 RU RU2014120368A patent/RU2633085C2/en active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA003989B1 (en) * | 1997-09-17 | 2003-12-25 | Джилид Сайэнс, Инк. | Compounds (alternatives) and method for treating and prophylaxis of influenza infection in a mammal |
| US20040062801A1 (en) * | 2001-07-17 | 2004-04-01 | Joaquina Faour | Drug delivery device containing neuraminidase inhibitor and an H1 antagonist |
| EP1987825A1 (en) * | 2006-02-20 | 2008-11-05 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition comprising oseltamivir phosphate |
Non-Patent Citations (1)
| Title |
|---|
| Тамифлю. Инструкция по применению, противопоказания, состава и цена. справочник лекарств РЛС. Найдено из Интернета (22.11.2016) URL [http://www.plsnet.ru/tn_index_id_15946.htm] пуб. 31.08.2010. * |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2014120368A (en) | 2015-11-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6273589B2 (en) | Stabilized calisbamate pediatric suspension | |
| US9585845B2 (en) | Oral pharmaceutical composition comprising oseltamivir and method of preparing the same | |
| UA110945C2 (en) | Oral pharmaceutical formulation comprising nalbuphine (variants) | |
| SG191964A1 (en) | Orally dispersible tablet | |
| US20160120802A1 (en) | Orally-disintegrating oseltamivir tablet and method for preparing the same | |
| WO2007119792A1 (en) | Dry direct compression fast disintegrating tablet | |
| RU2633085C2 (en) | Antiviral drug as capsules and method for its preparation | |
| JP2014162743A (en) | Solid preparation | |
| WO2015008825A1 (en) | Orally disintegrating tablet | |
| JP5823592B2 (en) | Formulation with improved stability | |
| JP2007051109A (en) | Compression-molded preparation | |
| TWI644688B (en) | Method for producing orally disintegrating lozenge containing disintegrating particle composition | |
| JP6073231B2 (en) | Stable pharmaceutical composition | |
| RU2590978C1 (en) | Encapsulated preparation for treating cold and method for production thereof | |
| KR20210092202A (en) | Oral pharmaceutical formulations containing ibuprofen | |
| RU2286143C1 (en) | Mucolytic pharmaceutical composition | |
| KR20150096787A (en) | Pharmaceutical formulation of n-[5-[2-(3,5-dimethoxyphenyl)ethyl]-2h-pyrazol-3-yl]-4-[(3r,5s)-3,5-dimethylpiperazin-1-yl]benzamide | |
| RU2245157C2 (en) | Biologically active additive for preventing and treating flu cases | |
| CN105982889B (en) | The pharmaceutical composition and its application of resisiting influenza virus | |
| JP2016117652A (en) | Fast disintegrating tablet suitable for administration to children, and simple production method thereof | |
| JP6159128B2 (en) | Anti-rotavirus agent | |
| RU2503447C1 (en) | Drug preparation in form of orally dispersible tablet and method for making drug preparation | |
| RU2811866C2 (en) | Pharmaceutical composition in form of chewable tablet of diosmin or flavonoid fraction | |
| WO2015087823A1 (en) | Carbonate-containing composition for intraorally disintegrating tablet, and intraorally disintegrating tablet | |
| Bhesaniya et al. | ORODISPERSIBLE MINI-TABLETS: A REVIEW. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| HE9A | Changing address for correspondence with an applicant |