Область, к которой относится изобретение
Изобретение относится к области медицины, а именно производственной и клинической трансфузиологии, и может быть использовано для заготовки тромбоцитов длительного хранения (до 24 месяцев), пригодных к трансфузии.
Уровень техники
Известен способ криоконсервации богатой тромбоцитами плазмы без использования криопротекторов [патент РФ на изобретение «Способ криоконсервации богатой тромбоцитами плазмы» авторы Суханов В.А., Трофимов И.М., Левит А.Л., №2138162, 1999], согласно которому плазму помещают в контейнер с жидким азотом, располагают контейнер между двумя металлическими пластинами, после чего последовательно подвергают процессам замораживания, хранения и размораживания, при этом процесс замораживания плазмы ведут при скорости 2-3°С/с, процесс размораживания - при скорости 1,5-2°С/с, до начала таяния, а затем нагревают плазму при температуре 37°С. Однако этот способ не включает оценку параметров структурной полноценности и функциональной активности тромбоцитов человека.
Известен способ криоконсервирования тромбоцитов в присутствии 10% ДМСО, предусматривающий отмывание тромбоцитов от ДМСО и разведение плазмой тромбоцитов после размораживания [Khuri S.F., Healey N., MacGregor H. et al. Comparison of the effects of transfusions of cryopreserved and liquid-preserved platelets on hemostasis and blood loss after cardiopulmonary bypass J Thorac Cardiovasc Surg 1999; 117: 172-84]. Однако данный способ часто приводит к значительному увеличению содержания в концентрате тромбоцитов активированных клеток, что повышает риск развития тромбоэмболических осложнений при их трансфузии.
Наиболее близкой к заявляемому решению является технология криоконсервирования тромбоцитов с ДМСО и хранение клеток при -80°С [С. Robert Valery, Gina Rango, and Shukri Khuri Freezing human platelets with 6 percent dimethyl sulfoxide with removal of the supernatani solution before freezing and storage at -80°C without postthaw processing // Transfusion 2005; 45: 1890-1898]. Исходные тромбоцитные концентраты (ТК) получают путем аппаратного афереза на сепараторах Cobe Spectra и Amicus, общий объем ТК составляет 200-300 мл, содержание тромбоцитов - от 3,5 до 4,0×1011 клеток в 1 дозе (концентрация 1,3-2,0×109 в мл). Оценка качества клеток ТК проводится перед процедурами криоконсервирования и после размораживания ТК и включает следующие параметры: количество тромбоцитов (109/мл); рН тромбоконцентрата, величину R-периода на тромбоэластограмме, агрегационную активность тромбоцитов (индукторы - 50 мкг/мл арахидоновой кислоты и 2 мкМоль/л АДФ); продукцию тромбоксана В2 после стимуляции 50 мкг/мл арахидоновой кислоты и 2 мкМоль/л АДФ; содержание аннексин-положительных тромбоцитов. Процедура подготовки ТК к криоконсервированию включает 4 технологических этапа: внесение криопротектора в дозу ТК; центрифугирование дозы ТК в присутствии криопротектора; удаление избытка криопротектора с бесклеточной плазмой после центрифугирования; ресуспендирование клеток ТК с криопротектором. В качестве криопротектора используют солевой раствор 27% ДМСО (эндоцитарный криопротектор), который добавляют к ТК при постоянном покачивании с частотой 180 колебаний в минуту до конечной концентрации 6% ДМСО в ТК. Затем ТК центрифугируют при 1250 g в течение 10 минут с целью удаления супернатанта, содержащего избыток ДМСО. Весь супернатантный раствор удаляют. Это снижает остаточное количество ДМСО в замороженном ТК как минимум на 95%. Оставшийся осадок объемом 10-15 мл ресуспендируют покачиванием в течение 3-5 минут, контейнер с суспензией тромбоцитов помещают в защитный полимерный пакет, затем в картонную коробку и замораживают на дне механического морозильника при минус 80°С. Размораживание тромбоцитов проводится в водяной бане (Thermogenesis), при температуре 36°С в течение 5 минут. Размороженную суспензию тромбоцитов разводят 10-20 мл 0,9% раствора NaCl с целью уменьшения общей концентрации клеток, увеличения объема ТК, а также для уменьшения концентрации ДМСО в дозе размороженных тромбоцитов. Трансфузия размороженного ТК проводится через фильтр диаметром 170 микрон.
Однако данный метод для определения качества клеток ТК использует параметры агрегометрии, тромбоэластографии и проточной цитометрии, которые не отражают структурную целостность тромбоцитов, что снижает достоверность общего анализа клеток ТК до и после криоконсервирования и не позволяет оценить сохранность (в %) биологически полноценных клеток в ТК после криоконсервирования; использует только эндоцитарный (внутриклеточный) криопротектор ДМСО, который обладает низкой способностью к сохранению наружных мембранных структур клеток при заморозке, что повышает риск повреждения тромбоцитарных рецепторов; процедура подготовки ТК к криоконсервированию включает 4 последовательных технологических этапа, которые в сумме занимают 25-30 мин, что существенно повышает риск токсического действия ДМСО на тромбоциты; для разведения размороженных тромбоцитов используется 0,9% раствор NaCl, не обладающий буферными свойствами, что приводит к образованию в ТК кислой среды (рН=6.5-6.6) и повышает риск повреждения тромбоцитов; разведение размороженных ТК 0,9% раствором NaCl снижает конечную концентрацию ДМСО в ТК только до 3%, что является недостаточным для достижения концентрации, нетоксичной для тромбоцитов человека (0,5%); размороженная доза ТК обладает очень высокой осмолярностью (800-860 мОсмоль/л при физиологической норме 300-380 мОсмоль/л) и повышает риск развития у пациентов пострансфузионных реакций.
Раскрытие изобретения
Задачей изобретения является разработка технологии криоконсервирования тромбоцитов человека для получения лечебных доз тромбоцитного концентрата длительного хранения с высокой сохранностью биологически полноценных тромбоцитов, обеспечивающей хранение тромбоцитов после размораживания при температуре 20-24°С и нетоксичных для пациентов.
Техническим результатом, на достижение которого направлено заявленное изобретение, является повышение качества получаемых после размораживания криоконсервированных тромбоцитов за счет используемого комплекса: технологических операций, качественных и количественных параметров криопротектора и режимов, позволяющих сократить время контакта тромбоцитов с криопротектором, сохранить гораздо большее число биологически полноценных тромбоцитов (в 1,5-1,8 раза по сравнению с технологией по прототипу), хранить размороженные ТК при комнатной температуре в течение 4 часов без угрозы потери структурной или функциональной полноценности тромбоцитов, получить осмолярность дозы ТК, соответствующей физиологической норме, не вызывающей развития у пациентов посттрансфузионных реакций.
Поставленная задача решается тем, что способ криоконсервирования тромбоцитов включает следующие этапы:
- отбор исходного тромбоцитного концентрата (ТК) объемом от 180 до 220 мл с концентрацией тромбоцитов от 1×109/мл 1,5×109/мл, содержащих от 40% до 70% тромбоцитов с гранулами и тромбоциты с адгезивной активностью от 40% до 70%;
- разделение ТК на тромбоцитсодержащую часть (8-12 мл) и плазму (172-208 мл) центрифугированием с последующим отделением плазмы от тромбоцитсодержащей части;
- приготовление комбинированного криопротектора, содержащего 55% ДМСО и 5% декстран 40, путем разведения криопротектора плазмой до конечной концентрации ДМСО от 10 до 15%;
- ресуспендирование тромбоцитсодержащей части разведенным криопротектором, который вводят в тромбоцитсодержащую часть по 1-3 мл с интервалами 1-3 минуты при постоянном перемешивании и доводят объем суспензии тромбоцитов в криопротекторе от 20 до 24 мл до конечной концентрации ДМСО в суспензии тромбоцитов от 5 до 7%;
- замораживание суспензии тромбоцитов и плазмы со скоростью 1-3°/мин в отдельных контейнерах в морозильной камере при температуре от минус 80 до минус 100°С;
- хранение замороженных тромбоцитов и плазмы при температуре от минус 85°С до минус 196°С;
- размораживание контейнеров с замороженными тромбоцитами и плазмой нагреванием при температуре от 37 до 40°С в течение от 2 до 10 минут;
- ресуспендирование размороженных тромбоцитов плазмой, совместимой по системе АВО, в соотношении 1:9, в течение 10 минут;
- хранение размороженных тромбоцитов до трансфузии при температуре от 20 до 24°С и постоянном перемешивании не более 4 часов.
При этом после размораживания измеряют следующие параметры тромбоцитов: количество тромбоцитов, количество тромбоцитов с гранулами и количество адгезивно активных тромбоцитов. Данную информацию наносят на контейнер для последующего выбора контейнера с необходимыми параметрами для транфузии конкретному пациенту в зависимости от его антропометрических характеристик.
Кроме того, разделение ТК на тромбоцитсодержащую часть и плазму может быть реализовано с помощью центрифугирования со скоростью от 1100 g до 1400 g в течение от 7 до 12 минут. В качестве криопротектора может быть использован DIMETYLSULFOXIDE/DEXTRAN 40 SOLUTION (Cryopreservative Solution) 5 ml. Ресуспендирование тромбоцитсодержащей части криопротектором осуществляют в течение от 9 до 12 минут. Размороженные тромбоциты ресуспендируют добавлением от 172 до 208 мл размороженной плазмы по 20 мл через 1-2 минуты в контейнер с 15-25 мл размороженными тромбоцитами. Качество размороженных тромбоцитов определяется следующими параметрами: объем от 180 до 220 мл, сохранность тромбоцитов не менее 75% от исходного, сохранность тромбоцитов с гранулами и тромбоцитов с адгезивной активностью не менее 50% от исходного. Для приготовления комбинированного криопротектора с конечной концентрации ДМСО от 10 до 15% исходный криопротектор разводят плазмой в объемном соотношении 1:9. Ресуспендирование тромбоцитсодержащей части разведенным криопротектором для получения суспензии тромбоцитов с конечной концентрацией ДМСО от 5 до 7% осуществляют в объемном соотношении 1:1.
Таким образом, поставленная задача решается за счет внедрения в процедуру криоконсервирования адекватных методов параллельного анализа структурной целостности и функциональной активности тромбоцитов человека до и после процедур криоконсервирования, использования комбинированного эндоцитарного и экзоцитарного криопротектора, предварительное разделение ТК путем центрифугирования на тромбоцитный концентрат и бедную тромбоцитами плазму с последующим криоконсервированием тромбоцитного концентрата и бедной тромбоцитами плазмы при минус 80°С, хранения криоконсервированного ТК в жидком азоте при минус 196°С не менее 180 суток до 24 месяцев с целью карантинизации тромбоцитов и плазмы, размораживания при 37°С и ресуспендирование криоконсервированного тромбоцитного концентрата до концентрации тромбоцитов 1,5×109/мл и снижения концентрации ДМСО менее 0,5%, оценки сохранности биологически полноценных тромбоцитов.
Использование адекватного метода морфофункционального анализа тромбоцитов человека позволило оптимизировать оценку качества клеток в ТК на разных этапах криоконсервирования. В качестве такого приема был предложен разработанный ранее способ оценки морфофункционального статуса тромбоцитов человека [Патент РФ на изобретение №2485502 «Способ оценки морфофункционального статуса тромбоцитов человека», авторы Хубутия М.Ш., Макаров М.С., Хватов В.Б., Высочин И.В., Кобзева Е.Н., Боровкова Н.В., Конюшко О.И., 20.06.2013], основанный на витальном (прижизненном) окрашивании тромбоцитов флуорохромным красителем на основе трипафлавина и акридинового оранжевого с последующим их анализом во флуоресцентном микроскопе. Данный метод позволяет параллельно оценить структурную целостность и функциональную активность тромбоцитов независимо от их концентрации в пробе, в том числе - в бесплазменной среде. Таким образом, используя данный метод, появляется возможность оценить общее содержание биологически полноценных тромбоцитов в исследуемом ТК (109/мл), а также оценить сохранность таких клеток после разных процедур криоконсервирования. Проведенные исследования показывают, что биологически полноценными (с нормальной структурой и функциями) являются лишь те тромбоциты, в которых при витальном окрашивании отчетливо выявляются гранулы - не менее 3 гранул диаметром более 300 мкм на клетку во флуоресцентном микроскопе, яркость свечения клетки - не менее 40 фут-кандел (Макаров М.С., Кобзева Е.Н., Высочин И.В., Боровкова Н.В., Хватов В.Б. Морфофункциональный анализ тромбоцитов человека с помощью витального окрашивания // Бюллетень экспериментальной биологии и медицины. - 2013. - №9. - С. 388-391). Следовательно, оценка содержания тромбоцитов с гранулами может быть использована для контроля качества клеток ТК до и после криоконсервирования.
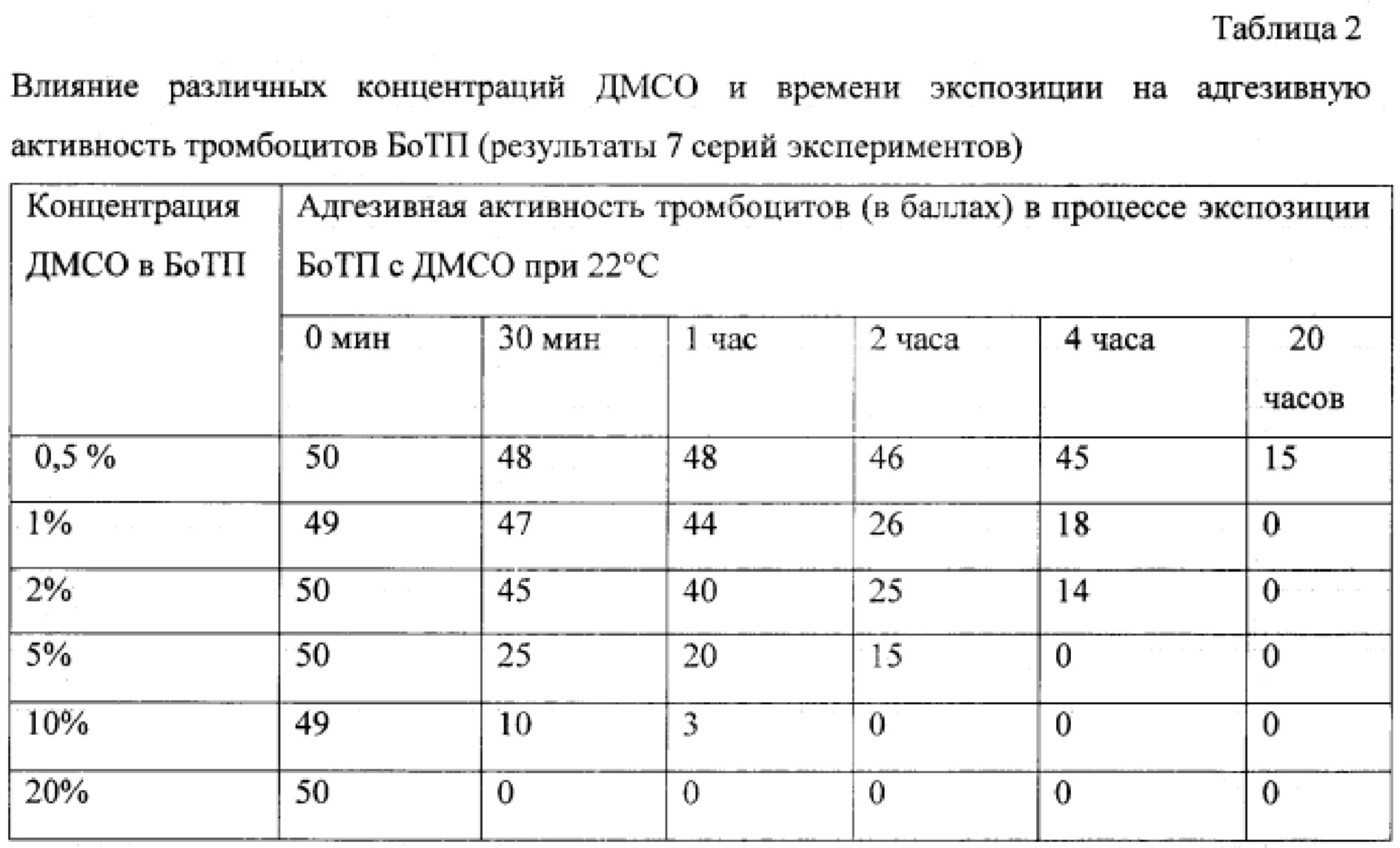
При экспозиции богатой тромбоцитами плазмы (БоТП) с ДМСО в конечной концентрации от 0,5 до 20% при комнатной температуре было установлено, что в процессе контакта с ДМСО биологическая полноценность клеток БоТП снижается, параллельно с этим уменьшается содержание тромбоцитов с гранулами (табл. 1). Так, при 0,5% ДМСО содержание тромбоцитов с гранулами в БоТП практически не менялось в течение 2 часов при комнатной температуре, через 4 часа снижалось на 7-10%, через 20 часов - на 70%. При концентрации ДМСО от 1 до 20% динамика снижения числа тромбоцитов с гранулами была сходной в течение первых двух часов: через 1 час потеря тромбоцитов с гранулами составила 10-20%, через 2 часа - 40-50%, через 4 часа - от 60 до 80%, через 20 часов тромбоциты с гранулами в БоТП полностью отсутствовали. Еще более выраженной динамика снижения тромбоцитов с гранулами была при 10-20% ДМСО: через 2 часа потеря тромбоцитов с гранулами составила 55-65%, через 4 часа - 90-99%. Стоит особо отметить, что при концентрации ДМСО 5% и выше адгезивная активность тромбоцитов с гранулами падает гораздо быстрее, чем их содержание. Этот эффект становится выражен уже при концентрации ДМСО 2% и выше. При использовании 5% ДМСО после 30 мин экспозиции адгезивная активность тромбоцитов снижалась в среднем в 2 раза (табл.2). Таким образом, уже через 30 мин экспозиции БоТП с 5% ДМСО при комнатной температуре в среднем 50% тромбоцитов с гранулами не проявляли функциональной активности. Это указывает на то, что время контакта тромбоцитов с 5% ДМСО при комнатной температуре должно быть минимизировано. С другой стороны, при концентрации 0,3-0,5% ДМСО биологическая полноценность тромбоцитов практически не нарушается в течение нескольких часов. Следовательно, разведение размороженных ДМСО-содержащих ТК до концентрации 0,3-0,5% ДМСО позволит сохранить их структурную и функциональную полноценность в течение 4-6 часов после разморозки.
В процессе проведения научно-исследовательской работы была разработана процедура криоконсервирования ТК, при которой время контакта тромбоцитов под действием ДМСО было минимизировано. Был выбран комбинированный стерильный криоконсервирующий раствор, содержащий 55% ДМСО (эндоцитарный криопротектор) и 5% декстран (экзоцитарный криопротектор), который позволяет адекватно проводить заморозку клеток и межклеточной среды. Вносить криопротектор в ТК предлагается после его центрифугирования и разделения на тромбоцитсодержащую часть и бесклеточную плазму. Для получения бесклеточной плазмы ТК необходимо подвергнуть центрифугированию при ускорении 1250 g. Проведенные ранее исследования показали, что центрифугирование БоТП и ТК с ускорением от 500 до 2000 g значимо не влияет на содержание клеток с гранулами [Макаров М.С., Кобзева Е.Н., Боровкова Н.В., Хватов В.Б. Влияние центрифугирования на биологическую полноценность тромбоцитов человека // Вестник службы крови России. - 2015. - №1. - С. 41-44], т.е. ускорение в 1250 g является адекватным для отделения тромбоцитсодержащей массы от бесклеточной плазмы и не нарушает биологической полноценности тромбоцитов ТК. Как и в прототипе, объем полученной тромбоцитсодержащей массы составлял 10-15 мл, в которую после ресуспендирования вносили комбинированный криопротектор на основе ДМСО и декстрана, а затем замораживали при минус 80°С. Общая продолжительность этой процедуры составляет 8-12 мин, тогда как в прототипе - от 25 до 30 минут. Таким образом, заявляемая технология в 2,5-3,0 раза сокращает время контакта тромбоцитов с криопротектором.
Было проведено сравнение качества тромбоцитов в криоконсервированных ТК, полученных с помощью технологии-прототипа и с помощью заявляемой технологии (табл. 3). Для оценки эффективности криоконсервирования решено было определять сохранность тромбоцитов с гранулами и сохранность их адгезивной активности. Было установлено, что заявляемая технология позволяет сохранить гораздо большее число биологически полноценных тромбоцитов (в 1,5-1,8 раза), чем технология-прототип. Разведение криконсервированных ТК осуществляли с помощью бесклеточной плазмы того же донора, которую параллельно замораживали (без криопротектора), а затем размораживали. Объем размороженной плазмы составлял 90-100 мл, что позволяло развести тромбоцитсодержащую часть ТК в 10 раз, снижая концентрацию ДМСО в ней до 0,4-0,6%. В то же время в прототипе концентрация ДМСО составляет 2,5-3%, осмолярность - более 800 мОсмоль/л, что является токсичным для тромбоцитов человека, при этом для дилюции ТК используется 0,9% раствор хлорида натрия, не обладающий буферными свойствами и не препятствующий закислению среды. В результате хранение размороженных ТК, полученных по технологии-прототипу, сопровождается выраженным снижением структурной и функциональной полноценности тромбоцитов. Так, через 1 час хранения в размороженных ТК адгезивная активность клеток снижается на 70%, через 2 часа - на 90%, через 4 часа - на 95-98% (см. чертеж). Это указывает на неэффективность хранения ТК (в прототипе) при комнатной температуре. Напротив, при разведении тромбоцитсодержащей части ТК бесклеточной плазмой (предлагаемая технология) адгезивная активность тромбоцитов снижается через 4 часа лишь на 10% (см. чертеж). Таким образом, появляется возможность хранения размороженных ТК при комнатной температуре в течение 4 часов без угрозы потери структурной или функциональной полноценности тромбоцитов. Осмолярность полученной дозы ТК составляет 360-380 мОсмоль/л, что соответствует физиологической норме и не вызывает развития у пациентов посттрансфузионных реакций.
Краткое описание чертежей
Изобретение поясняется графиком, на котором представлена динамика изменения адгезивной активности тромбоцитов в размороженных ТК, приготовленных с использованием технологии-прототипа и заявляемой технологии.
Осуществление изобретения
Определение гемокомпонента "криоконсервированные тромбоциты" представлено в Техническом регламенте "Криоконсервированные тромбоциты, полученные методом афереза" (Постановление Правительства РФ от 26 января 2010 г. N 29 "Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии" (с изменениями от 12 октября 2010 г.)).
Ниже представлено подробное описание заявляемого способа получения криоконсервированных тромбоцитов с указанием в некоторых случаях конкретных значений параметров, которые не ограничивают заявляемое изобретение, а представлены лишь для лучшего понимания сущности изобретения. Заявляемый способ включает следующие этапы.
1. Отбор исходного тромбоцитного концентрата (ТК).
Отбор ТК, полученного методом афереза или из дозы крови, проводят по показателям: объем, концентрация и морфофункциональный статус тромбоцитов. Концентрацию тромбоцитов в ТК определяют на геманализаторе. Морфофунциональный статус тромбоцитов (содержание тромбоцитов с гранулами и адгезивно активных тромбоцитов) оценивают методом витального окрашивания. Для этого готовят витальный краситель для тромбоцитов путем разведения 10 мг трипафлавина и 20 мг акридинового оранжевого при комнатной температуре в 100 мл фосфатного буфера (рН - 7,2-7,4), окрашивают пробу ТК из расчета 200 мкл готового красителя на 1 мл пробы в течение 2-5 мин при комнатной температуре, после чего 5 мкл пробы с окрашенными тромбоцитами переносят на предметное стекло и накрывают покровным стеклом. Витально окрашенный препарат анализируют во флуоресцентном микроскопе (объектив ×100, числовая апертура 0.6, λ возбуждения 450-490 нм, λ эмиссии - от 520 нм) в полуавтоматическом режиме. Анализируют изображения 100-200 клеток, определяют содержание тромбоцитов с гранулами (в %) и адгезивную активность тромбоцитов (в баллах). Для криоконсервирования используют ТК: объемом от 180 до 220 мл, содержащих от 1×109/мл до 1,5×109/мл тромбоцитов, имеющих морфофункциональный статус, а именно: тромбоциты с гранулами от 40% до 70% и тромбоциты с адгезивной активностью от 40% до 70%.
2. Фракционирование ТК.
Контейнер, содержащий ТК, центрифугируют со скоростью от 1100 g до 1400 g в течение от 7 до 12 минут. После центрифугирования получают надосадок (плазму бедную тромбоцитами) объемом 172-208 мл и тромбоцитсодержащую часть (объем 8-12 мл).
3. Приготовление (разведение) криопротектора.
Набирают в 10 мл шприц от 1 до 3 мл комбинированного стерильного криопротектора («DIMETYLSULFOXIDE/DEXTRAN 40 SOLUTION (Cryopreservative Solution) 5 ml» содержащего 55% ДМСО и 5% декстран 40. Подсоединяют шприц с криопротектором к контейнеру, содержащему ТК, размещенному в плазмоэкстракторе. Набирают в шприц, содержащий криопротектор, от 10 до 12 мл плазмы. В результате разведения криопротектора концентрация ДМСО снижается в 5 раз.
4. Отделение плазмы от тромбоцитов.
Контейнер, содержащий надосадок (плазму бедную тромбоцитами) и тромбоцитсодержащую часть, помещают в плазмоэкстрактор и удаляют от 160 до 200 мл плазмы, бедную тромбоцитами, в другой контейнер для последующего замораживания.
5. Ресуспендирование тромбоцитов криопротектором.
Тромбоцитсодержащую часть объемом 8 до 12 мл ресуспендируют 10-12 мл разведенного криопротектора. Добавляют криопротектор по 2 мл с интервалами 2 минуты при постоянном перемешивании содержимого мешка. Ресуспендирование тромбоцитов криопротектором проводят в течение 10 минут. Конечная концентрация ДМСО с суспензии тромбоцитов составляет от 5 до 7%.
6. Замораживание и хранение тромбоцитов и плазмы.
Ресуспендированные криопротектором тромбоциты и плазму замораживают со скоростью 1-3°/мин в морозильной камере при температуре от минус 85°С до минус 100°С. Замороженные тромбоциты и плазму хранят при температуре от минус 85°С до минус 196°С.
7. Размораживание тромбоцитов и плазмы.
Контейнеры, содержащие замороженные тромбоциты и плазму, нагревают в программном размораживателе плазмы (например, Barkey Plasmatherm) при температуре от 37 до 40°С в течение от 2 до 10 минут.
8. Ресуспендирование размороженных тромбоцитов плазмой.
Контейнеры с размороженной плазмой и тромбоцитами объединяют в систему методом стерильного соединения трубок этих контейнеров на аппарате CompoDock (Fresenius). Размороженную плазму добавляют по 20 мл через 1-2 минуты к размороженным тромбоцитам. Объем ресуспендированных тромбоцитов составляет от 180 до 220 мл.
9. Контроль качества размороженных тромбоцитов.
Качество размороженных тромбоцитов определяют по параметрам: объем (от 180 до 220 мл), сохранность тромбоцитов не менее 75% от исходного, сохранность тромбоцитов с гранулами и тромбоцитов с адгезивной активностью не менее 50% от исходного.
10. Хранение размороженных тромбоцитов.
Хранят размороженные тромбоциты при температуре от 20 до 24°С и постоянном перемешивании не более 4 часов до трансфузии.
Пример 1.
Для получения криоконсервированных тромбоцитов заготовили тромбоцитный концентрат (ТК) методом афереза на сепараторе крови Trima Accel®. Объем ТК составил 200 мл, содержание тромбоцитов - 218×109/дозе, содержание тромбоцитов с гранулами - 51%, адгезивная активность тромбоцитов - 50%. ТК разделили на две равные части: одну часть (ТК №1) криоконсервировали, используя технологию-прототип, другую (ТК №2) - используя предлагаемую технологию. Параметры качества криоконсервированных тромбоцитов представлены в табл. 4.
Анализ результатов хранения замороженных тромбоцитов показал, что предложенная технология криоконсервирования тромбоцитов по сравнению с прототипом обеспечивает значимо большую сохранность жизнеспособных клеток в размороженных ТК. Так, через 10 минут после размораживания криоконсервированных по предложенной технологии тромбоцитов содержание жизнеспособных клеток было больше, чем в прототипе в 2,5-3 раза, через 4 часа хранения при комнатной температуре - в 40 раз.
Пример 2.
Больной А., 65 лет.
Диагноз: Расслаивающаяся аневризма грудного отдела аорты 2 типа.
Операция с использование аппарата искусственного кровообращения (АИК) - протезирование грудного отдела аорты.
Состояние больного после операции. Кровопотеря за две операции - 2300 мл. После операции в течение первых суток сохраняется геморрагическое отделяемое по дренажам. Тромбоцитопения (концентрация тромбоцитов в крови больного (КТКБ) 59×109. Лейкопения (концентрация лейкоцитов в крови 3,5 тыс/мкл), анемия (гемоглобин 71 г/л и гематокрит 19,5%).
Доля тромбоцитов с гранулами - 5%, адгезивная активность тромбоцитов - 3%, что говорит о низкой биологической полноценности тромбоцитов.
Тактика лечения
С учетом наличия у больного тромбоцитопении и выраженного геморрагического синдрома, развившихся после интраоперационной массивной кровопотери, для коррекции клеточного звена гемостаза проведена лечебная трансфузия тромбоцитного концентрата, размороженного после 9 месяцев криохранения и карантинизации.
Характеристика тромбоконцентрата
Общий объем - 200 мл, общее количество тромбоцитов - 2,4×1011, содержание тромбоцитов с гранулами - 35%, адгезивная активность тромбоцитов - 30%. Трансфузия - лечебная с учетом группы крови и фенотипа О (I) положительный.
Эффективность трансфузии
После переливания ТК геморрагический синдром купирован. В крови больного концентрация тромбоцитов повысилась до 77×109/л через 1 час и до 102×109/л через 24 часа после переливания ТК. Содержание тромбоцитов с гранулами в крови пациента через 1 час составило 15%, через 24 часа - 18%, адгезивная активность тромбоцитов - соответственно 15 и 14%. Скорректированное число прироста тромбоцитов составило через 1 час 16; через 24 часа - 38×109/л, что говорит о высокой эффективности трансфузии ТК. Больной экстубирован, моча светлая, геморрагический синдром купирован.