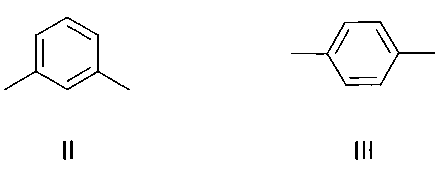RU2603135C1 - Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения - Google Patents
Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения Download PDFInfo
- Publication number
- RU2603135C1 RU2603135C1 RU2015148878/04A RU2015148878A RU2603135C1 RU 2603135 C1 RU2603135 C1 RU 2603135C1 RU 2015148878/04 A RU2015148878/04 A RU 2015148878/04A RU 2015148878 A RU2015148878 A RU 2015148878A RU 2603135 C1 RU2603135 C1 RU 2603135C1
- Authority
- RU
- Russia
- Prior art keywords
- alkali
- formula
- general formula
- compounds
- ammonium
- Prior art date
Links
- 229910052784 alkaline earth metal Inorganic materials 0.000 title abstract description 9
- 150000001768 cations Chemical class 0.000 title abstract description 9
- 239000003513 alkali Substances 0.000 title abstract description 8
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 title abstract description 6
- 238000004519 manufacturing process Methods 0.000 title description 3
- 238000000034 method Methods 0.000 claims abstract description 10
- 229940122361 Bisphosphonate Drugs 0.000 claims abstract description 5
- 150000004663 bisphosphonates Chemical class 0.000 claims abstract description 5
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims abstract description 5
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 11
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 claims description 6
- 150000003983 crown ethers Chemical class 0.000 claims description 5
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 5
- 239000012634 fragment Substances 0.000 claims description 4
- 150000002170 ethers Chemical class 0.000 claims description 3
- 230000003993 interaction Effects 0.000 claims description 2
- 239000004575 stone Substances 0.000 claims description 2
- 150000007529 inorganic bases Chemical class 0.000 claims 1
- 150000007530 organic bases Chemical class 0.000 claims 1
- 150000001875 compounds Chemical class 0.000 abstract description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 abstract description 8
- 150000002500 ions Chemical class 0.000 abstract description 4
- 239000000463 material Substances 0.000 abstract description 4
- 230000003287 optical effect Effects 0.000 abstract description 4
- 239000013060 biological fluid Substances 0.000 abstract description 3
- 239000008235 industrial water Substances 0.000 abstract description 3
- 239000003960 organic solvent Substances 0.000 abstract description 3
- 239000000203 mixture Substances 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract 2
- 238000001514 detection method Methods 0.000 abstract 1
- 230000000694 effects Effects 0.000 abstract 1
- 239000003295 industrial effluent Substances 0.000 abstract 1
- 229910052799 carbon Inorganic materials 0.000 description 48
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 19
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 16
- 239000011541 reaction mixture Substances 0.000 description 16
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 12
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 239000011734 sodium Substances 0.000 description 9
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- 238000003756 stirring Methods 0.000 description 8
- 150000001342 alkaline earth metals Chemical class 0.000 description 6
- -1 ammonium cations Chemical class 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 238000001816 cooling Methods 0.000 description 5
- PNEYBMLMFCGWSK-UHFFFAOYSA-N Alumina Chemical compound [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- RTEXIPZMMDUXMR-UHFFFAOYSA-N benzene;ethyl acetate Chemical compound CCOC(C)=O.C1=CC=CC=C1 RTEXIPZMMDUXMR-UHFFFAOYSA-N 0.000 description 4
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 238000001819 mass spectrum Methods 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 238000002211 ultraviolet spectrum Methods 0.000 description 4
- IJAAWBHHXIWAHM-UHFFFAOYSA-N 1,4-bis(2-phenylethenyl)benzene Chemical class C=1C=CC=CC=1C=CC(C=C1)=CC=C1C=CC1=CC=CC=C1 IJAAWBHHXIWAHM-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 230000000536 complexating effect Effects 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 125000005504 styryl group Chemical group 0.000 description 3
- RFNUIQLYFBCQNQ-UHFFFAOYSA-N 1,3-bis(diethoxyphosphorylmethyl)benzene Chemical compound CCOP(=O)(OCC)CC1=CC=CC(CP(=O)(OCC)OCC)=C1 RFNUIQLYFBCQNQ-UHFFFAOYSA-N 0.000 description 2
- BJZZCHRYTNIBCS-YXLFCKQPSA-N 1,3-bis[(e)-2-phenylethenyl]benzene Chemical compound C=1C=CC=CC=1/C=C/C(C=1)=CC=CC=1\C=C\C1=CC=CC=C1 BJZZCHRYTNIBCS-YXLFCKQPSA-N 0.000 description 2
- IJAAWBHHXIWAHM-PHEQNACWSA-N 1,4-bis[(e)-2-phenylethenyl]benzene Chemical group C=1C=CC=CC=1/C=C/C(C=C1)=CC=C1\C=C\C1=CC=CC=C1 IJAAWBHHXIWAHM-PHEQNACWSA-N 0.000 description 2
- VFTFKUDGYRBSAL-UHFFFAOYSA-N 15-crown-5 Chemical compound C1COCCOCCOCCOCCO1 VFTFKUDGYRBSAL-UHFFFAOYSA-N 0.000 description 2
- XEZNGIUYQVAUSS-UHFFFAOYSA-N 18-crown-6 Chemical compound C1COCCOCCOCCOCCOCCO1 XEZNGIUYQVAUSS-UHFFFAOYSA-N 0.000 description 2
- ALMXRNQJWRGNMG-UHFFFAOYSA-N 2,5,8,11,14,17-hexaoxabicyclo[16.4.0]docosa-1(18),19,21-triene-20-carbaldehyde Chemical compound O1CCOCCOCCOCCOCCOC2=CC(C=O)=CC=C21 ALMXRNQJWRGNMG-UHFFFAOYSA-N 0.000 description 2
- MBJIKIAWNPEHOR-UHFFFAOYSA-N 2,5,8,11,14-pentaoxabicyclo[13.4.0]nonadeca-1(15),16,18-triene-17-carbaldehyde Chemical compound O1CCOCCOCCOCCOC2=CC(C=O)=CC=C21 MBJIKIAWNPEHOR-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- MMEGMOJDCIUJCF-UHFFFAOYSA-N CC1(C)COCC(C)(C)COc(ccc(C=O)c2)c2OCCOCCOCCOC1 Chemical compound CC1(C)COCC(C)(C)COc(ccc(C=O)c2)c2OCCOCCOCCOC1 MMEGMOJDCIUJCF-UHFFFAOYSA-N 0.000 description 1
- 0 CC1(C)COCC(C)(C)COc2cc(C=C*C=C[C@@](C3)C=CC4=C3OCCOCCOCCOCC(C)(C)COCC(C)(C)CO4)ccc2OCCOCCOCCOC1 Chemical compound CC1(C)COCC(C)(C)COc2cc(C=C*C=C[C@@](C3)C=CC4=C3OCCOCCOCCOCC(C)(C)COCC(C)(C)CO4)ccc2OCCOCCOCCOC1 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- AMNPXXIGUOKIPP-UHFFFAOYSA-N [4-(carbamothioylamino)phenyl]thiourea Chemical compound NC(=S)NC1=CC=C(NC(N)=S)C=C1 AMNPXXIGUOKIPP-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 230000000723 chemosensory effect Effects 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000001941 electron spectroscopy Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002678 macrocyclic compounds Chemical class 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 229920005597 polymer membrane Polymers 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D323/00—Heterocyclic compounds containing more than two oxygen atoms as the only ring hetero atoms
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
Abstract
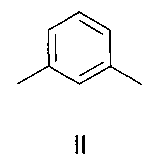
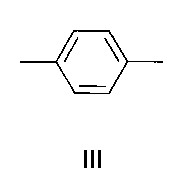
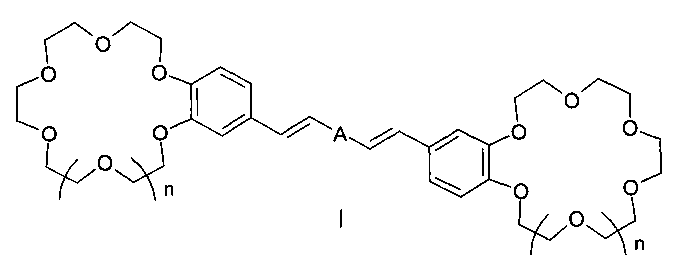
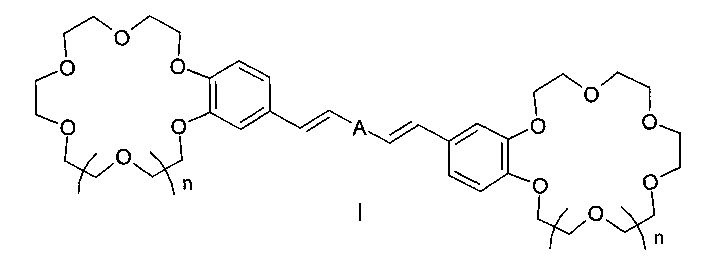
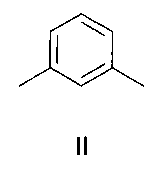
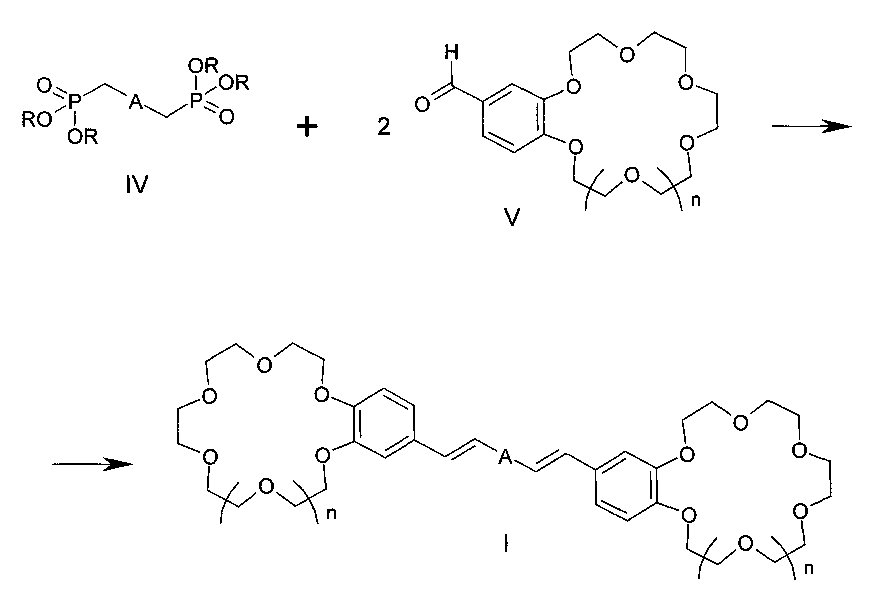
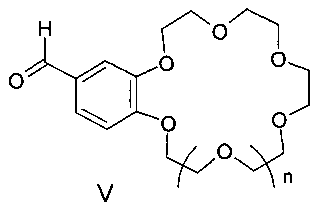
Изобретение относится к органической химии и к области химии материалов, а именно к новому типу соединений - бискраунсодержащим дистирилбензолам общей формулы I, в которой A - бензольный фрагмент формулы II или III:
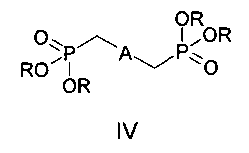
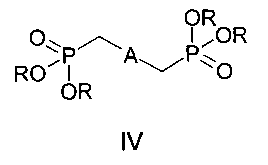
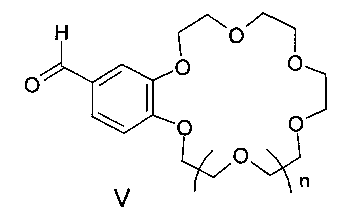
где n=0, 1, а также к способу получения соединений формулы I, заключающемуся в том, что бисфосфонаты общей формулы IV, в которых A имеет вышеуказанные значения, R - низший алкил, подвергают взаимодействию с формильными производными бензокраун-эфиров общей формулы V, где n=0, 1, и процесс проводят в среде органического растворителя или смеси органического растворителя с водой. Соединения формулы I и материалы на их основе могут быть использованы в составе оптических хемосенсоров для флуоресцентного определения катионов щелочных, щелочноземельных металлов и аммония, например для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках. 2 н. и 1 з.п. ф-лы, 2 ил., 4 пр.
Description
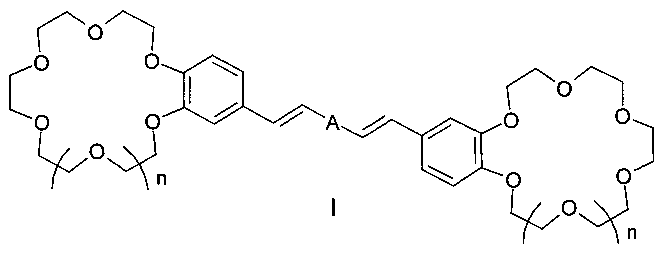
Изобретение относится к органической химии и химии материалов, а именно к новому типу соединений - к дистирилбензолам, имеющим два краун-эфирных фрагмента, общей формулы I:
в которой A- бензольный фрагмент формулы II или III:
где n=0, 1.
Полученные соединения и композитные материалы на их основе могут быть использованы в составе оптических хемосенсоров для люминесцентного определения катионов щелочных, щелочноземельных металлов и аммония, например, для определения микроколичеств указанных ионов в биологических жидкостях, в промышленных водах и стоках, для мониторинга окружающей среды. Изобретение относится также к способу получения таких соединений.
Указанный тип соединений, их свойства и способ получения в литературе не описаны.
Заявляемый новый тип соединений имеет структуру, не относящуюся ни к одному из известных типов структур. Предложенный тип соединений содержит неизвестное ранее сочетание фрагментов незамещенного 1,3- и 1,4-дистирилбензола и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами и в мета- и параположениях к этиленовым группам, что предопределяет их спектральные свойства и позволяет отнести эти соединения к новому типу дистирилбензолов.
Известны 1,3- и 1,4-дистирилбензолы [Haramoto Y., Патент WO 2012108484 A1, 2012; Yanagisawa Т., Tanaka M., Патент US 4371475 A, 1983; Pommer Н., Stilz W., Stolp F., Патент DE 1108220, 1961; Mochida S., Hirano K., Satoh Т., Miura M., J. Org. Chem., 2011, 76, 3024; Ha Y.M., Lee H.J., Park D., Jeong H.O., Park J.Y., Park Y.J., Lee K.J., Lee J.Y., Moon H.R., Chung H.Y., Biol. Pharm. Bull, 2013, 36, 55; Wong M.S., Li Z.H., Shek M.F., Chow К.H., Tao Y., D′Iorio M., J. Mater. Chem., 2000, 10, 1805; Barthram A.M., Cleary R.L., Jeffery J.C., Couchman S.M., Ward M.D., Inorg. Chim. Acta, 1998, 267, 1], особенностью строения которых является симметричное расположение заместителей в стириловых остатках и их отсутствие в центральном бензольном фрагменте и у этиленовых групп. Эти дистирилбензолы не способны к комплексообразованию с катионами щелочных, щелочноземельных металлов и аммония, поскольку не имеют макрогетероциклического фрагмента.
В литературе описаны дистирилбензолы, в которых стириловые остатки соединены с двумя остатками аза-15-краун-5-эфира, атомы азота которых находятся в сопряжении с бензольными циклами [Motoyoshiya J., Fengqiang Z., Nishii Y., Aoyama H., Spectrochim. Acta, A, 2008, 69, 167; Pond S.J.K., Tsutsumi O., Rumi M., Kwon O., Zojer E., Bredas J.L., Marder S.R., Perry J.W., J. Am. Chem. Soc., 2004, 126, 9291]. Для них характерно поглощение в области 420-470 нм и способность к комплексообразованию с катионами щелочных и щелочноземельных металлов. Однако константы устойчивости таких комплексов с катионами металлов невысоки из-за слабого участия атомов азота макроциклов в координации катионов металла и из-за конформационной подвижности аза-15-краун-5-эфирных остатков. Это не позволяет использовать дистирилбензолы с остатками аза-15-краун-5-эфира в качестве эффективных оптических молекулярных сенсоров на катионы металлов и аммония.
Известны 1,4-дистирилбензолы, в которых стириловые остатки соединены с двумя краун-эфирными фрагментами, атомы кислорода которых находятся в сопряжении с бензольными циклами в пара- и метаположениях к этиленовым группам [Strehmel В., Henbest К.В., Sarker А.М., Malpert J.Н., Chen D.Y., Rodgers M.A.J., Neckers D.C., J. Nanosci. Nanotech, 2001, 1, 107; Xia W.-S., Schmehl R.H., Li C.-J., Mague J. Т., Luo C.-P., Guldi D.M., J. Phys. Chem. B, 2002, 106, 833]. Однако они имеют заместители у двойных связей дистирилбензола или в центральном бензольном ядре, синтезируются из более труднодоступных соединений, с невысокими выходами или не были испытаны в качестве флуоресцентных молекулярных сенсоров на катионы металлов и аммония.
Целью настоящего изобретения является новый тип соединений - бискраунсодержащие 1,3- и 1,4-дистирилбензолы, имеющие незамещенный центральный бензольный цикл, в которых атомы кислорода, входящие в состав двух фрагментов 18(15)-краун-6(5)-эфиров, находятся в сопряжении с бензольными циклами в пара- и метаположениях к незамещенным этиленовым группам. Задачей изобретения является также разработка способа получения целевых продуктов, доказательство их строения и изучение комплексообразующих и ионофлуорохромных свойств.
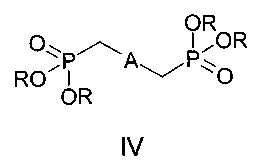
Поставленная цель достигается структурой заявляемого нового типа дистирилбензолов общей формулы I и способом их получения, заключающимся в том, что бисфосфонаты общей формулы IV:
где A имеет указанные выше значения для формулы I, R - низший алкил,
подвергают взаимодействию с формильными производными бензо-18(15)-краун-6(5)-эфиров общей формулы V:
где n имеет указанные выше значения для формулы I.
Процесс проводят в среде органического растворителя, например, диметилформамида, в присутствии оснований, таких как, например, трет-бутилат натрия, гидрид натрия или гидроксид калия, при температурах 0-50°C.
Конденсация указанных бисфосфонатов общей формулы IV с формильными производными бензокраун-эфиров общей формулы V до настоящего времени не была известна. Согласно предлагаемому способу синтез дистирилбензолов общей формулы I осуществляют конденсацией активированных в бисфосфонатах IV α-метиленовых групп с карбонильными группами двух формильных производных бензокраун-эфиров общей формулы V с образованием двух двойных углерод-углеродных связей.
Строение полученных соединений общей формулы I доказано с помощью спектроскопии ЯМР 1H и 13C, электронной спектроскопии, масс-спектрометрии, а также данными элементного анализа (примеры 1-4).
Пример 1. 15,15′-{1,3-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 26 мг (1.11 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 98 мг (0.26 ммоля) тетраэтил[1,3-фениленди(метилен)]бис(фосфоната) в 0.42 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 153 мг (0.52 ммоля) 4′-формилбензо-15-краун-5-эфира в 0.42 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды, высушивают на воздухе. Получают 132 мг (выход 77%) бис(15-краун-5)содержащего 1,3-дистирилбензола в виде светло-бежевых мелких кристаллов, т. пл. 179-180°C. 0.54 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.64-3.73 (м, 16 Н, 5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 3.82-3.89 (м, 8 Н, 3, 3′, 11, 11′-CH2O); 4.08-4.12 (м, 4 Н, 2, 2′-CH2O); 4.12-4.17 (м, 4 Н, 12, 12′-CH2O); 6.85 (д, 2 Н, J=8.1 Гц, С(17)Н, С(17′)Н); 6.99 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.03-7.12 (м, 6 Н, 2 СН=С(1)H, С(14)Н, С(14′)Н, С(16)Н, С(16′)Н); 7.29-7.40 (м, 3 Н, С(4)Н, С(5)Н, С(6)Н); 7.61 (с, 1 Н, C(2)H).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 68.12, 68.25 (2, 2′, 12, 12′-CH2O); 68.70, 68.77 (3, 3′, 11, 11′-CH2O); 69.55, 69.58 (5, 5′, 9, 9′-CH2O); 70.19 (6, 6′, 8, 8′-CH2O); 110.76 (С(14)Н, С(14′)Н); 113.00 (С(17)Н, С(17′)Н); 119.69 (С(16)Н, С(16′)Н); 123.52 (С(2)Н); 124.54 (С(4)Н, С(6)Н); 125.90 (2 C(2)Н=СН); 128.00 (С(5)Н); 128.35 (2 СН=С(1)Н); 130.06 (С(15), С(15′)); 137.34 (С(1), С(3)); 148.59, 148.66 (С(13a), С(13a′), С(17a), С(17a′)).
УФ-спектр (C=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 330 (ε=60500).
Флуоресценция (C=1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 344 нм, λf max 426 нм.
Масс-спектр (m/z): 662.0 [M]+, 685.0 [M+Na]+, 701.0 [M+K]+.
Найдено, %: C 68.70; H 6.69.
C38H46O10.
Вычислено, %: C 68.86; H 7.00.
Пример 2. 18,18′-{1,3-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 29 мг (1.25 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 111 мг (0.30 ммоля) тетраэтил[1,3-фениленди(метилен)]бис(фосфоната) в 0.40 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 200 мг (0.59 ммоля) 4′-формилбензо-18-краун-6-эфира в 0.40 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 10 мл воды, экстрагируют дихлорметаном (3×15 мл), экстракт высушивают Na2SO4 и упаривают в вакууме. Получают 270 мг прозрачного кристаллизующегося масла. Масло промывают 5 мл пентана, затем растирают с 3 мл Et2O. Получают 113 мг (выход 50%) бис(18-краун-6)содержащего 1,3-дистирилбензола в виде светло-бежевых мелких кристаллов, т. пл. 118-119°C. 0.34 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.60 (с, 8 Н, 8, 8′, 9, 9′-CH2O); 3.62-3.72 (м, 16 Н, 5, 5′, 6, 6′, 11, 11′, 12, 12′-CH2O); 3.80-3.92 (м, 8 Н, 3, 3′, 14, 14′-CH2O); 4.15 (м, 4 H, 2, 2′-CH2O); 4.20 (м, 4 Н, 15, 15′-CH2O); 6.85 (д, 2 Н, J=8.1 Гц, С(20)Н, С(20′)Н); 6.99 (д, 2 Н, J=16.3 Гц, 2 C(2)H=СН); 7.03-7.13 (м, 6 Н, 2 СН=С(1)H, С(17)Н, С(17′)Н, С(19)Н, С(19′)Н); 7.29-7.34 (м, 1 Н, С(5)Н); 7.34-7.40 (м, 2 Н, С(4)Н, С(6)Н); 7.61 (с, 1 Н, С(2)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 67.94 (2, 2′, 15, 15′-CH2O); 68.72, 68.76 (3, 3′, 14, 14′-CH2O); 69.69-70.01 (5, 5′, 6, 6′, 8, 8′, 9, 9′, 11, 11′, 12, 12′-CH2O); 110.22 (С(17)Н, С(17′)Н); 112.52 (С(20)Н, С(20′)Н); 119.51 (С(19)Н, С(19′)Н); 123.50 (С(2)Н); 124.52 (С(4)Н, С(6)Н); 125.85 (2 C(2)Н=CH); 128.02 (2 СН=С(1)H); 128.34 (С(5)Н); 129.90 (С(18), С(18′)); 137.35 (С(1), С(3)); 148.24, 148.30 (С(16а), C(16a′), C(20a), C(20a′)).
УФ-спектр (C=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 331 (ε=64500).
Флуоресценция (С=1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 344 нм, λf max 425 нм.
Масс-спектр (m/z): 750.19 [М]+, 773.17 [M+Na]+, 789.17 [M+K]+.
Найдено, %: C 67.37; H 7.15.
C42H54O12.
Вычислено, %: C 67.18; H 7.25.
Пример 3. 15,15′-{1,4-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12-октагидро-1,4,7,10,13-бензопентаоксациклопентадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 27 мг (1.17 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 106 мг (0.28 ммоля) тетраэтил[1,4-фениленди(метилен)]бис(фосфоната) в 0.42 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 165 мг (0.56 ммоля) 4′-формилбензо-15-краун-5-эфира в 0.42 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды. Получают 135 мг (выход 73%) бис(15-краун-5)содержащего 1,4-дистирилбензола в виде ярко-желтых мелких кристаллов, т. пл. 285-289°C. 0.49 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3.64-3.72 (м, 16 Н, 5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 3.82-3.89 (м, 8 Н, 3, 3′, 11, 11′-CH2O); 4.10 (м, 4 Н, 2, 2′-CH2O); 4.15 (м, 4 Н, 12, 12′-CH2O); 6.84 (д, 2 H, J=8.3 Гц, С(17)Н, С(17′)Н); 6.96 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.02-7.08 (м, 6 Н, 2 CH=C(1)H, С(14)Н, С(14′)Н, С(16)Н, С(16′)Н); 7.49 (с, 4 Н, С(2)Н, С(3)H, С(5)Н, С(6)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 68.12, 68.23 (2, 2′, 12, 12′-CH2O); 68.73 (3, 3′, 11, 11′-CH2O); 69.55, 70.14 (5, 5′, 6, 6′, 8, 8′, 9, 9′-CH2O); 110.72 (C(14)H, С(14′)H); 113.04 (С(17)Н, С(17′)Н); 119.66 (С(16)Н, С(16′)Н); 125.72 (2 C(2)Н=CH); 125.92 (С(2)Н, С(3)Н, С(5)Н, С(6)Н); 127.48 (2 CH=C(1)Н); 130.22 (С(15), С(15′)); 136.04 (С(1), С(4)); 147.31,148.60 (С(13a), С(13a′), С(17a), С(17a′)).
УФ-спектр (С=1×10-5 моль·л-1, MeCN - CH2Cl2 (10:1)), нм: 371 (ε=56400).
Флуоресценция (С=1.4×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 367 нм, λf max 442 нм.
Масс-спектр (m/z): 662.0 [M]+, 685.0 [M+Na]+, 701.0 [M+K]+.
Найдено, %: C 68.81; H 6.87.
C38H46O10.
Вычислено, %: C 68.86; H 7.00.
Пример 4. 18,18′-{1,4-Фениленбис[(E)-этен-2,1-диил]}бис-2,3,5,6,8,9,11,12,14,15-декагидро-1,4,7,10,13,16-бензогексаоксациклооктадецин.
В трехгорлую колбу, на 15 мл снабженную обратным холодильником, помещают 14 мг (0.63 ммоля) металлического Na, избыток трет-бутанола и кипятят реакционную смесь при перемешивании в токе аргона до его растворения. Избыток трет-бутанола отгоняют в вакууме. К остатку при охлаждении добавляют раствор 56 мг (0.15 ммоля) тетраэтил[1,4-фениленди(метилен)]бис(фосфоната) в 0.30 мл ДМФА и реакционную смесь перемешивают в течение 45 мин. Затем добавляют по каплям при охлаждении раствор 100 мг (0.30 ммоля) 4′-формилбензо-18-краун-6-эфира в 0.30 мл ДМФА. Температуру реакционной смеси поднимают до комнатной и выдерживают при перемешивании 75 ч. К реакционной смеси добавляют 5 мл воды, выпавший осадок отфильтровывают, промывают 3 мл воды. Получают 71 мг (выход 63%) бис(18-краун-6)содержащего 1,4-дистирилбензола в виде ярко-желтых мелких кристаллов, т. пл. 243-245°C. 0.32 (бензол - EtOAc (1:5) с добавлением 2-3 капель пирролидина, DC-Alufolien Aluminiumoxid 60 F254 neutral, Merck).
Спектр ЯМР 1H (500 МГц, в CD2Cl2, 27°C): 3,61 (с, 8 Н, 8, 8′, 9, 9′-CH2O); 3.62-3.72 (м, 16 H, 5, 5′, 6, 6′, 11, 11′, 12, 12′-CH2O); 3.83-3.89 (м, 8 Н, 3, 3′, 14, 14′-CH2O); 4.13 (м, 4 H, 2, 2′-CH2O); 4.18 (м, 4 Н, 15, 15′-CH2O); 6.85 (д, 2 Н, J=8.3 Гц, С(20)Н, С(20′)Н); 6.96 (д, 2 Н, J=16.3 Гц, 2 C(2)H=CH); 7.02-7.09 (м, 6 Н, 2 CH=C(1)H, С(17)Н, C(17′)H, C(19)H, С(19′)Н); 7.47 (c, 4 Н, С(2)Н, С(3)Н, С(5)Н, С(6)Н).
Спектр ЯМР 13C (125 МГц, в CD2Cl2, 30°C): 67.98 (2, 2′, 15, 15′-CH2O); 68.74, 68.78 (3, 3′, 14, 14′-CH2O); 69.83, 69.95 (5, 5′, 6, 6′, 8, 8′, 9, 9′, 11, 11′, 12, 12′-CH2O); 110.26 (C(17)Н, С(17′)Н); 112.61 (С(20)Н, С(20′)Н); 119.47 (С(19)Н, С(19′)Н); 125.65 (2 C(2)Н=CH); 125.91 (С(2)Н, С(3)Н, С(5)Н, С(6)Н); 127.50 (2 СН=С(1)Н)); 130.04 (С(18), С(18′)); 136.04 (С(1), С(4)); 148.23,148.34 (С(16а), С(16a′), С(20a), С(20a′)).
УФ-спектр (С=1×10-5 моль·л-1, MeCN - CH2Cl2 (10: 1)), нм: 372 (ε=58400).
Флуоресценция (С=1.1×10-6 моль·л-1, MeCN - CH2Cl2 (10:1)): λex 373 нм, λf max 440 нм.
Масс-спектр (m/z): 750.19 [M]+, 773.17 [M+Na]+, 789.17 [M+K]+.
Найдено, %: C 67.16; H 7.15.
C42H54O12.
Вычислено, %: C 67.18; H 7.25.
Изучены комплексообразующие и ионофлуорохромные свойства полученных дистирилбензолов I из примеров 3 и 4 в MeCN - CH2Cl2 (10:1).
Полученные данные, представленные на фиг. 1, 2, убедительно свидетельствуют о том, что бискраунсодержащие дистирилбензолы способны действовать как флуоресцентные сенсоры.
Предварительные результаты исследования бискраунсодержащих дистирилбензолов общей формулы I показали, что в апротонной среде они способны с хорошим флуоресцентным откликом связывать катионы щелочных, щелочноземельных металлов и аммония, то есть проявляют свойства флуоресцентных молекулярных сенсоров. Эти свойства позволяют создать на основе полученных дистирилбензолов флуоресцентные хемосенсорные материалы.
Таким образом, получен новый тип дистирилбензолов - бискраунсодержащие дистирилбензолы, содержащие неизвестное ранее сочетание фрагментов дистирилбензола и двух краун-эфиров, конденсированных таким образом, что атомы кислорода макрогетероциклов находятся в сопряжении с бензольными циклами в мета- и параположениях к этиленовым группам, и обнаружена их выраженная способность к связыванию катионов щелочных, щелочно-земельных металлов и аммония, характеризующаяся существенными изменениями в спектрах испускания. Эти свойства позволяют использовать заявленные соединения в составе оптических хемосенсоров для флуоресцентного определения катионов щелочных, щелочноземельных металлов и аммония, например, в составе полимерных пленок и мембран для определения микроколичеств указанных ионов в биологических жидкостях, а также для определения микроколичеств указанных ионов в промышленных водах и стоках, в том числе для мониторинга окружающей среды. Разработан также способ получения заявленных соединений высокой степени чистоты и с хорошими выходами (до 77%).
Claims (3)
1. Бискраунсодержащие дистирилбензолы общей формулы I:
в которой А - бензольный фрагмент формулы II или III:
где n=0, 1;
отличающиеся тем, что содержат фрагменты незамещенного дистирилбензола и двух краун-эфиров, атомы кислорода которых находятся в сопряжении с бензольными циклами в мета- и параположениях к этиленовым группам.
в которой А - бензольный фрагмент формулы II или III:
где n=0, 1;
отличающиеся тем, что содержат фрагменты незамещенного дистирилбензола и двух краун-эфиров, атомы кислорода которых находятся в сопряжении с бензольными циклами в мета- и параположениях к этиленовым группам.
2. Способ получения бискраунсодержащих дистирилбензолов формулы I по п. 1, отличающийся тем, что он включает взаимодействие бисфосфонатов формулы IV:
в которых А имеет указанные в п. 1 значения, R - низший алкил,
с формильными производными бензокраун-эфиров формулы V:
где n имеют указанные в п. 1 значения.
в которых А имеет указанные в п. 1 значения, R - низший алкил,
с формильными производными бензокраун-эфиров формулы V:
где n имеют указанные в п. 1 значения.
3. Способ по п. 2, отличающийся тем, что процесс проводят в присутствии органического или неорганического основания.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015148878/04A RU2603135C1 (ru) | 2015-11-16 | 2015-11-16 | Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015148878/04A RU2603135C1 (ru) | 2015-11-16 | 2015-11-16 | Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2603135C1 true RU2603135C1 (ru) | 2016-11-20 |
Family
ID=57760172
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015148878/04A RU2603135C1 (ru) | 2015-11-16 | 2015-11-16 | Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2603135C1 (ru) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4371475A (en) * | 1977-05-04 | 1983-02-01 | Showa Kagaku Kogyo Company, Ltd. | 1,4-Bis-styryl-benzene derivatives and a process for the preparation of the same |
| SU1257071A1 (ru) * | 1981-07-09 | 1986-09-15 | Мадьяр Трудоманьош Академиа (Инопредприятие) | Простые краун-эфиры в качестве активных ингредиентов ионо-селективных мембранных электродов |
| RU2008131014A (ru) * | 2008-07-30 | 2010-02-10 | Сергей Пантелеймонович Громов (RU) | Хемосенсорные оптоматериалы для определения катионов металлов большого ионного радиуса и ионов диаммония на основе краунсодержащих бисстириловых красителей, иммобилизованных в полимерные пленки, и способы их получения |
-
2015
- 2015-11-16 RU RU2015148878/04A patent/RU2603135C1/ru active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4371475A (en) * | 1977-05-04 | 1983-02-01 | Showa Kagaku Kogyo Company, Ltd. | 1,4-Bis-styryl-benzene derivatives and a process for the preparation of the same |
| SU1257071A1 (ru) * | 1981-07-09 | 1986-09-15 | Мадьяр Трудоманьош Академиа (Инопредприятие) | Простые краун-эфиры в качестве активных ингредиентов ионо-селективных мембранных электродов |
| RU2008131014A (ru) * | 2008-07-30 | 2010-02-10 | Сергей Пантелеймонович Громов (RU) | Хемосенсорные оптоматериалы для определения катионов металлов большого ионного радиуса и ионов диаммония на основе краунсодержащих бисстириловых красителей, иммобилизованных в полимерные пленки, и способы их получения |
Non-Patent Citations (1)
| Title |
|---|
| Wen-Sheng Xia et al,"Chemosensors for Lead (II) and Alkali Metals Ion Based on Self-Assembling Fluorenscence Enhancement (SAFE)", J.Phys.Chem.B,2002,v.106,p.833-843. Stephanie J.K. Pond et al, "Metal-Ion Sensing Fluorophores with Lange Two-Proton Absorption Cross Section: Aza-Crown Ether Substituted Donor-Acctptor-Donor Distyrybenzenes", JACS,2004,v.126,p.9291-9391. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Rahman et al. | Tuning sensitivity of a simple hydrazone for selective fluorescent “turn on” chemo-sensing of Al3+ and its application in living cells imaging | |
| CN103435603B (zh) | 一类香豆素-氧杂杯[3]芳烃荧光试剂及其制备方法和应用 | |
| CN103342699A (zh) | 一种香豆素-硫杂杯[4]芳烃荧光试剂及其制备方法和应用 | |
| Nie et al. | Two novel six-coordinated cadmium (II) and zinc (II) complexes from carbazate β-diketonate: crystal structures, enhanced two-photon absorption and biological imaging application | |
| JP6675758B2 (ja) | ホスファフルオレセイン化合物若しくはその塩、又はそれを用いた蛍光色素 | |
| Xin et al. | A selective turn-on fluorescent probe for Cd 2+ based on a boron difluoride β-dibenzoyl dye and its application in living cells | |
| Yang et al. | Development of a near-infrared fluorescent sensor with a large Stokes shift for sensing pyrophosphate in living cells and animals | |
| Rai et al. | A new rhodamine derivative as a single optical probe for the recognition of Cu 2+ and Zn 2+ ions | |
| Luo et al. | Synthesis, characterization and fluorescence properties of Eu (III) and Tb (III) complexes with novel mono-substituted β-diketone ligands and 1, 10-phenanthroline | |
| Meng et al. | Synthesis and spectroscopic properties of β, β′-dibenzo-3, 5, 8-triaryl-BODIPYs | |
| KR101539821B1 (ko) | O-페놀살리실이민(psi) 화합물 및 그 유도체를 포함하는 알루미늄 이온 검출제, 이를 이용한 검출 방법 및 검출장치 | |
| Madhu et al. | Synthesis, X-ray structure, spectral and electrochemical properties of a β-meso covalently linked BODIPY–Ru (II) dipyrrin complex | |
| Du et al. | Highly selective ratiometric fluorescent recognition of histidine by tetraphenylethene–terpyridine–Zn (ii) complexes | |
| RU2568614C1 (ru) | Симметричные краунсодержащие диеноны в качестве оптических молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения | |
| KR100963136B1 (ko) | 구리 이온의 선택적 이용이 가능한 쿠마린 유도체 및 그제조 방법 | |
| RU2603135C1 (ru) | Бискраунсодержащие дистирилбензолы в качестве флуоресцентных молекулярных сенсоров для определения катионов щелочных, щелочноземельных металлов, аммония и способ их получения | |
| WO2018181529A1 (ja) | ホスファロドール化合物及びその塩、並びにそれを用いた蛍光色素 | |
| FR2935973A1 (fr) | Complexes de lanthanide et d'un ligand 2,6-bis(n-pyrazolyl) pyridine | |
| CN113666937B (zh) | 一种用于检测锌离子的近红外荧光探针及其制备方法和应用 | |
| Jung et al. | Metal ion induced FRET On–Off in naphthyl-pyrenyl pendent tetrahomodioxacalix [4] arene | |
| Lee et al. | Al {sup 3+} Selective Chemosensor: Pyrenyl Polyether Pentant Calix [4] arene | |
| CN111704557B (zh) | 一种衍生物 | |
| Kostryukova et al. | Synthesis and luminescence-spectral properties of benzoheterocyclic β-diketones and their complexes with europium | |
| JP5636644B2 (ja) | 亜鉛発光プローブ及び発光体 | |
| KR100969958B1 (ko) | 플루오레세인 유도체, 이의 제조 방법 및 이를 이용한음이온 검출방법 |