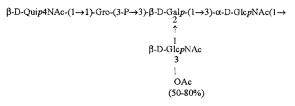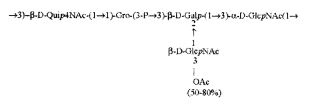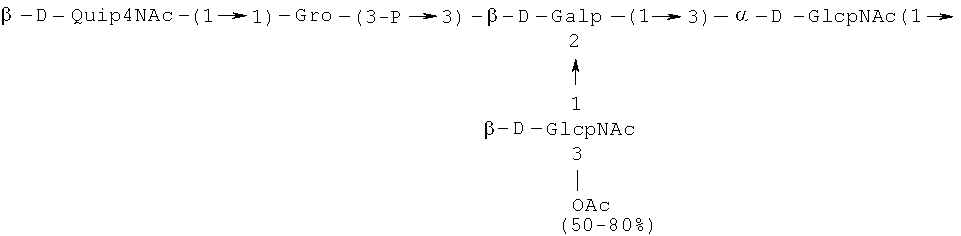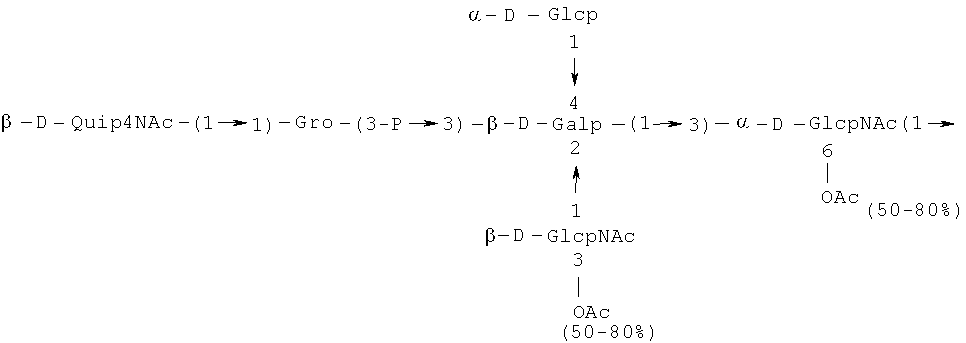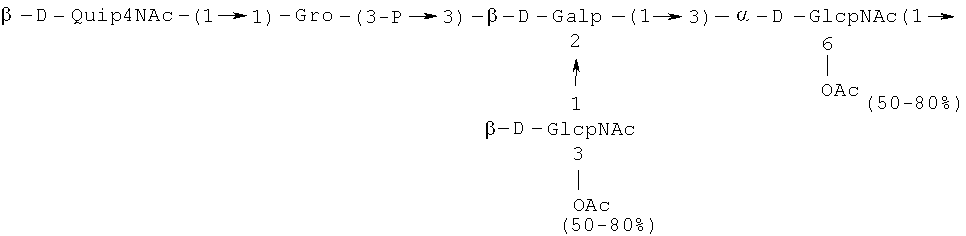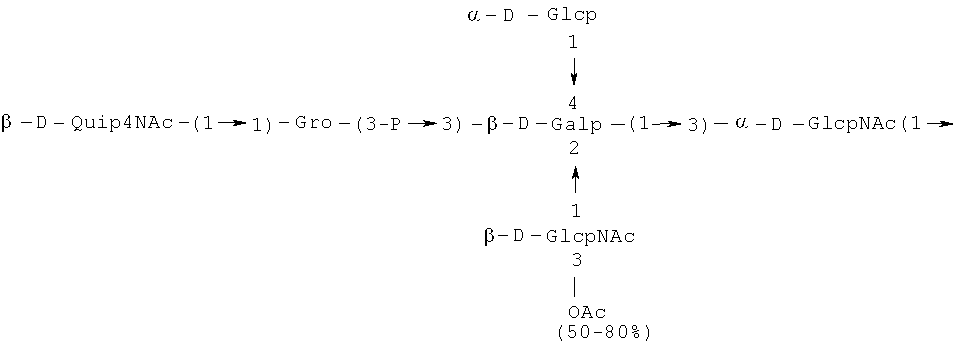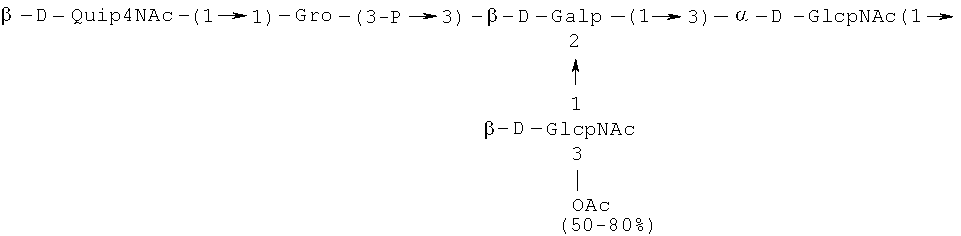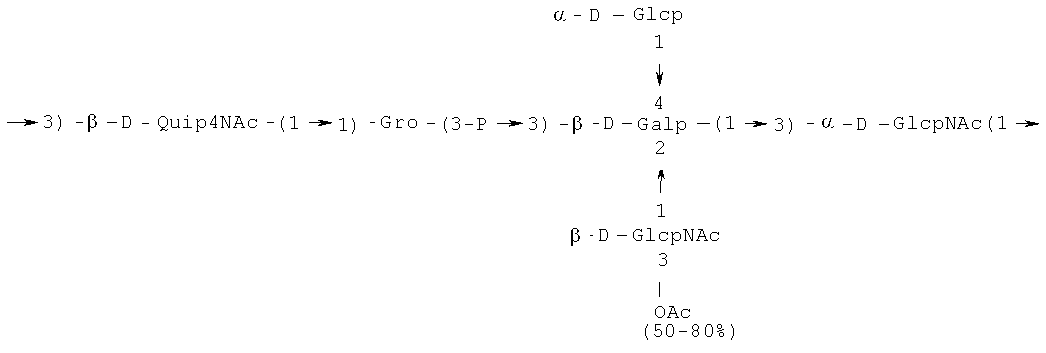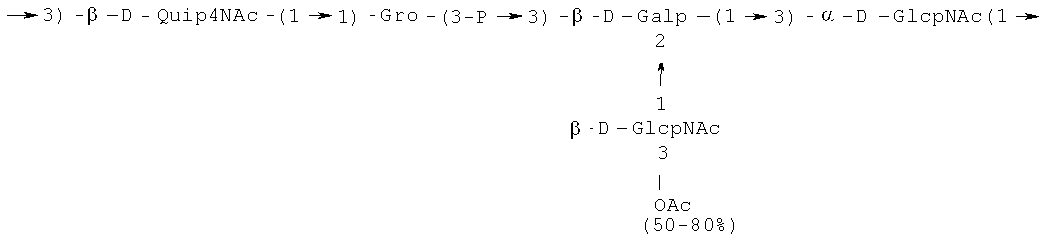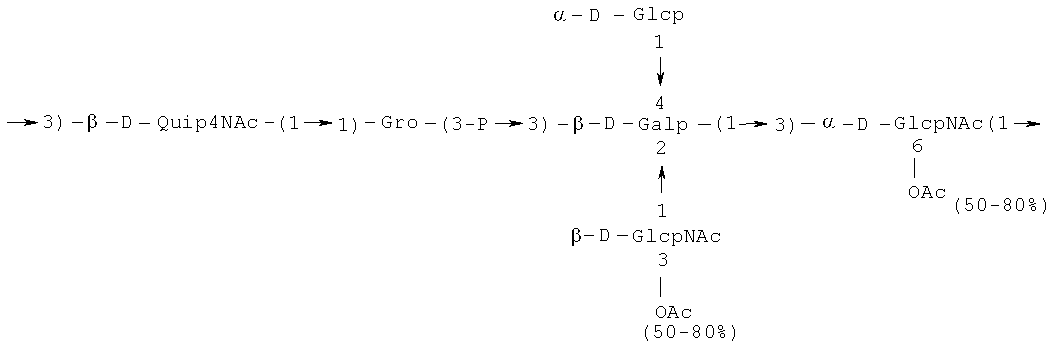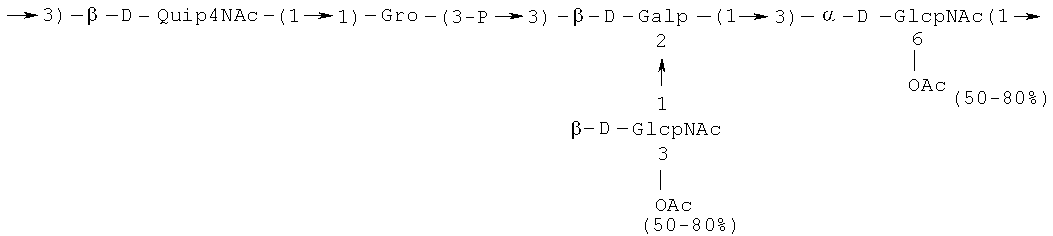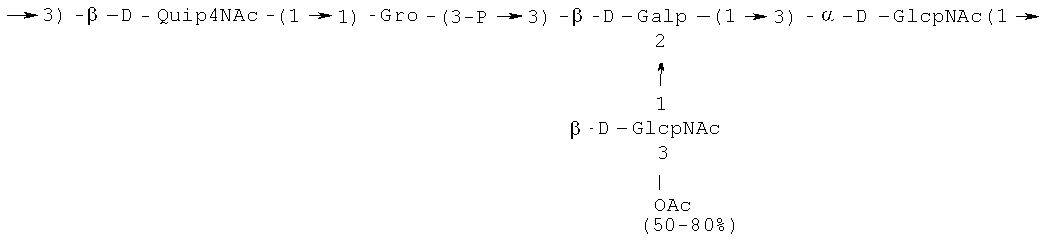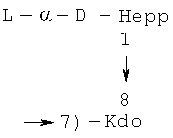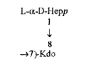RU2575752C2 - Полисахарид и его производные с активностью к фиколину-3, способ получения и применения - Google Patents
Полисахарид и его производные с активностью к фиколину-3, способ получения и применения Download PDFInfo
- Publication number
- RU2575752C2 RU2575752C2 RU2012156708/13A RU2012156708A RU2575752C2 RU 2575752 C2 RU2575752 C2 RU 2575752C2 RU 2012156708/13 A RU2012156708/13 A RU 2012156708/13A RU 2012156708 A RU2012156708 A RU 2012156708A RU 2575752 C2 RU2575752 C2 RU 2575752C2
- Authority
- RU
- Russia
- Prior art keywords
- ficolin
- alvei
- polysaccharide
- strain
- formula
- Prior art date
Links
- 150000004676 glycans Chemical class 0.000 title claims abstract description 118
- 229920001282 polysaccharide Polymers 0.000 title claims abstract description 115
- 239000005017 polysaccharide Substances 0.000 title claims abstract description 115
- 102100024520 Ficolin-3 Human genes 0.000 title claims abstract description 106
- 101710155250 Ficolin-3 Proteins 0.000 title claims abstract description 104
- 238000000034 method Methods 0.000 title claims abstract description 32
- 230000000694 effects Effects 0.000 title claims abstract description 23
- 239000002158 endotoxin Substances 0.000 claims abstract description 164
- 229920006008 lipopolysaccharide Polymers 0.000 claims abstract description 163
- 241000588729 Hafnia alvei Species 0.000 claims abstract description 79
- 150000002482 oligosaccharides Polymers 0.000 claims abstract description 45
- 239000003446 ligand Substances 0.000 claims abstract description 42
- 229920001542 oligosaccharide Polymers 0.000 claims abstract description 37
- 230000001580 bacterial effect Effects 0.000 claims abstract description 17
- 102000014914 Carrier Proteins Human genes 0.000 claims abstract description 12
- 108010078791 Carrier Proteins Proteins 0.000 claims abstract description 12
- 239000012501 chromatography medium Substances 0.000 claims abstract 3
- 210000002966 serum Anatomy 0.000 claims description 39
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 21
- 239000000872 buffer Substances 0.000 claims description 17
- 244000005700 microbiome Species 0.000 claims description 16
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 claims description 12
- 239000000243 solution Substances 0.000 claims description 11
- 210000001124 body fluid Anatomy 0.000 claims description 10
- 239000010839 body fluid Substances 0.000 claims description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 10
- 108091003079 Bovine Serum Albumin Proteins 0.000 claims description 9
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 8
- 238000001514 detection method Methods 0.000 claims description 7
- 238000000746 purification Methods 0.000 claims description 7
- 229920002401 polyacrylamide Polymers 0.000 claims description 6
- 229920000936 Agarose Polymers 0.000 claims description 5
- 229940098773 bovine serum albumin Drugs 0.000 claims description 5
- 108010042484 Mannose-Binding Protein-Associated Serine Proteases Proteins 0.000 claims description 4
- 102000004528 Mannose-Binding Protein-Associated Serine Proteases Human genes 0.000 claims description 4
- 108010022999 Serine Proteases Proteins 0.000 claims description 4
- 102000012479 Serine Proteases Human genes 0.000 claims description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 4
- 238000004587 chromatography analysis Methods 0.000 claims description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 4
- 239000008346 aqueous phase Substances 0.000 claims description 3
- 125000004432 carbon atom Chemical group C* 0.000 claims description 3
- 239000001913 cellulose Substances 0.000 claims description 3
- 229920002678 cellulose Polymers 0.000 claims description 3
- 108010071390 Serum Albumin Proteins 0.000 claims description 2
- 102000007562 Serum Albumin Human genes 0.000 claims description 2
- 239000007864 aqueous solution Substances 0.000 claims description 2
- 238000000605 extraction Methods 0.000 claims description 2
- 150000005846 sugar alcohols Polymers 0.000 claims description 2
- 108010058846 Ovalbumin Proteins 0.000 claims 1
- 229940092253 ovalbumin Drugs 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 15
- 229910000033 sodium borohydride Inorganic materials 0.000 abstract description 2
- 239000012279 sodium borohydride Substances 0.000 abstract description 2
- 238000000926 separation method Methods 0.000 abstract 1
- 108090000062 ficolin Proteins 0.000 description 24
- 108090000623 proteins and genes Proteins 0.000 description 23
- 235000018102 proteins Nutrition 0.000 description 22
- 102000004169 proteins and genes Human genes 0.000 description 22
- 102000004856 Lectins Human genes 0.000 description 21
- 108090001090 Lectins Proteins 0.000 description 21
- 239000002523 lectin Substances 0.000 description 21
- 238000002965 ELISA Methods 0.000 description 19
- 101001052749 Homo sapiens Ficolin-3 Proteins 0.000 description 18
- 102000055676 human FCN3 Human genes 0.000 description 16
- 230000004913 activation Effects 0.000 description 14
- 230000037361 pathway Effects 0.000 description 14
- 210000004027 cell Anatomy 0.000 description 13
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical compound O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 12
- 241000894006 Bacteria Species 0.000 description 11
- 102100026046 Mannan-binding lectin serine protease 2 Human genes 0.000 description 11
- 101710117460 Mannan-binding lectin serine protease 2 Proteins 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 230000004154 complement system Effects 0.000 description 11
- 102100024521 Ficolin-2 Human genes 0.000 description 10
- 101710155249 Ficolin-2 Proteins 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 150000002500 ions Chemical class 0.000 description 10
- 230000007246 mechanism Effects 0.000 description 10
- 230000024203 complement activation Effects 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 102100024508 Ficolin-1 Human genes 0.000 description 8
- 101710155257 Ficolin-1 Proteins 0.000 description 8
- 150000001720 carbohydrates Chemical group 0.000 description 8
- 230000007812 deficiency Effects 0.000 description 8
- 239000012528 membrane Substances 0.000 description 8
- 244000052769 pathogen Species 0.000 description 8
- 235000000346 sugar Nutrition 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 229920002684 Sepharose Polymers 0.000 description 7
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 7
- 150000004804 polysaccharides Polymers 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 150000002016 disaccharides Chemical group 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 230000015788 innate immune response Effects 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 5
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 5
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 229940072221 immunoglobulins Drugs 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- 201000005569 Gout Diseases 0.000 description 4
- 108010087870 Mannose-Binding Lectin Proteins 0.000 description 4
- 102000009112 Mannose-Binding Lectin Human genes 0.000 description 4
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 4
- OVRNDRQMDRJTHS-RTRLPJTCSA-N N-acetyl-D-glucosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-RTRLPJTCSA-N 0.000 description 4
- 238000005903 acid hydrolysis reaction Methods 0.000 description 4
- 239000000427 antigen Substances 0.000 description 4
- 108091007433 antigens Proteins 0.000 description 4
- 102000036639 antigens Human genes 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 238000005227 gel permeation chromatography Methods 0.000 description 4
- 238000001819 mass spectrum Methods 0.000 description 4
- QYSGYZVSCZSLHT-UHFFFAOYSA-N octafluoropropane Chemical compound FC(F)(F)C(F)(F)C(F)(F)F QYSGYZVSCZSLHT-UHFFFAOYSA-N 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 241000305071 Enterobacterales Species 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 241000192125 Firmicutes Species 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 238000001042 affinity chromatography Methods 0.000 description 3
- 230000004520 agglutination Effects 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 239000003480 eluent Substances 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- -1 for example Proteins 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000000770 proinflammatory effect Effects 0.000 description 3
- 238000012916 structural analysis Methods 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- 241000193792 Aerococcus viridans Species 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 108010074051 C-Reactive Protein Proteins 0.000 description 2
- 102100032752 C-reactive protein Human genes 0.000 description 2
- TYDMZADCGUWTCH-UHFFFAOYSA-N CC(CCC1)C1N Chemical compound CC(CCC1)C1N TYDMZADCGUWTCH-UHFFFAOYSA-N 0.000 description 2
- SEIPXSQHCMQCRU-UHFFFAOYSA-N CCCCCCC(C1)C1N Chemical compound CCCCCCC(C1)C1N SEIPXSQHCMQCRU-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108010049003 Fibrinogen Proteins 0.000 description 2
- 102000008946 Fibrinogen Human genes 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 229920001503 Glucan Polymers 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 2
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 2
- 206010061598 Immunodeficiency Diseases 0.000 description 2
- 208000029462 Immunodeficiency disease Diseases 0.000 description 2
- PWKSKIMOESPYIA-BYPYZUCNSA-N L-N-acetyl-Cysteine Chemical compound CC(=O)N[C@@H](CS)C(O)=O PWKSKIMOESPYIA-BYPYZUCNSA-N 0.000 description 2
- 102000007330 LDL Lipoproteins Human genes 0.000 description 2
- 108010007622 LDL Lipoproteins Proteins 0.000 description 2
- 102100026061 Mannan-binding lectin serine protease 1 Human genes 0.000 description 2
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 2
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 2
- 125000003047 N-acetyl group Chemical group 0.000 description 2
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 2
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 2
- OKJIRPAQVSHGFK-UHFFFAOYSA-N N-acetylglycine Chemical compound CC(=O)NCC(O)=O OKJIRPAQVSHGFK-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 239000002033 PVDF binder Substances 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 241001138501 Salmonella enterica Species 0.000 description 2
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 241000295644 Staphylococcaceae Species 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 241000193985 Streptococcus agalactiae Species 0.000 description 2
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 2
- 210000000013 bile duct Anatomy 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 238000002144 chemical decomposition reaction Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 229940012952 fibrinogen Drugs 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 238000003929 heteronuclear multiple quantum coherence Methods 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000003119 immunoblot Methods 0.000 description 2
- 230000007813 immunodeficiency Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000009456 molecular mechanism Effects 0.000 description 2
- 229950006780 n-acetylglucosamine Drugs 0.000 description 2
- 230000014207 opsonization Effects 0.000 description 2
- 244000045947 parasite Species 0.000 description 2
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 2
- 210000002826 placenta Anatomy 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- 201000011461 pre-eclampsia Diseases 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000001896 rotating frame Overhauser effect spectroscopy Methods 0.000 description 2
- 238000003118 sandwich ELISA Methods 0.000 description 2
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 150000004043 trisaccharides Chemical class 0.000 description 2
- 230000007923 virulence factor Effects 0.000 description 2
- 239000000304 virulence factor Substances 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- UDPGUMQDCGORJQ-UHFFFAOYSA-N (2-chloroethyl)phosphonic acid Chemical compound OP(O)(=O)CCCl UDPGUMQDCGORJQ-UHFFFAOYSA-N 0.000 description 1
- XLEYFDVVXLMULC-UHFFFAOYSA-N 2',4',6'-trihydroxyacetophenone Chemical compound CC(=O)C1=C(O)C=C(O)C=C1O XLEYFDVVXLMULC-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- QNTJORIUGGAOBT-UHFFFAOYSA-N 7-[2-hydroxyethyl-(8-nonoxy-8-oxooctyl)amino]heptyl 2-octyldecanoate Chemical compound C(CCCCCCC)C(C(=O)OCCCCCCCN(CCCCCCCC(=O)OCCCCCCCCC)CCO)CCCCCCCC QNTJORIUGGAOBT-UHFFFAOYSA-N 0.000 description 1
- 102100032814 ATP-dependent zinc metalloprotease YME1L1 Human genes 0.000 description 1
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 108020000946 Bacterial DNA Proteins 0.000 description 1
- UZLYVLHHWYUHNU-UHFFFAOYSA-N CCCCCC(C1)C1N Chemical compound CCCCCC(C1)C1N UZLYVLHHWYUHNU-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000004405 Collectins Human genes 0.000 description 1
- 108090000909 Collectins Proteins 0.000 description 1
- 108010028778 Complement C4 Proteins 0.000 description 1
- 150000008480 D-fucoses Chemical class 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 108010014258 Elastin Proteins 0.000 description 1
- 101150067835 FCN2 gene Proteins 0.000 description 1
- 101150014891 FCN3 gene Proteins 0.000 description 1
- 208000002633 Febrile Neutropenia Diseases 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001055956 Homo sapiens Mannan-binding lectin serine protease 1 Proteins 0.000 description 1
- 206010021882 Infections and infestations congenital Diseases 0.000 description 1
- SHZGCJCMOBCMKK-PQMKYFCFSA-N L-Fucose Natural products C[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O SHZGCJCMOBCMKK-PQMKYFCFSA-N 0.000 description 1
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- 101710133652 Lectin-like protein Proteins 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 229920000057 Mannan Polymers 0.000 description 1
- 101710117390 Mannan-binding lectin serine protease 1 Proteins 0.000 description 1
- 108010031099 Mannose Receptor Proteins 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- NISGSNTVMOOSJQ-UHFFFAOYSA-N NC1CCCC1 Chemical compound NC1CCCC1 NISGSNTVMOOSJQ-UHFFFAOYSA-N 0.000 description 1
- 206010049151 Neutropenic sepsis Diseases 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- 208000005107 Premature Birth Diseases 0.000 description 1
- 101800000795 Proadrenomedullin N-20 terminal peptide Proteins 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- 241001222774 Salmonella enterica subsp. enterica serovar Minnesota Species 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- 241000193996 Streptococcus pyogenes Species 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- ZWIJWDCFGVKPGY-RTRLPJTCSA-N [[(3R,4R,5S,6R)-2,4,5-trihydroxy-6-(hydroxymethyl)oxan-3-yl]amino] acetate Chemical compound C(C)(=O)ON[C@H]1C(O)O[C@@H]([C@H]([C@@H]1O)O)CO ZWIJWDCFGVKPGY-RTRLPJTCSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 1
- 229960004373 acetylcholine Drugs 0.000 description 1
- 229960004308 acetylcysteine Drugs 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 108010042854 bacteria histone-like protein HU Proteins 0.000 description 1
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 235000011148 calcium chloride Nutrition 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 230000007882 cirrhosis Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 230000007012 clinical effect Effects 0.000 description 1
- 238000005100 correlation spectroscopy Methods 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 238000004690 coupled electron pair approximation Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 229920002549 elastin Polymers 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical group 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 150000002386 heptoses Chemical class 0.000 description 1
- NAQMVNRVTILPCV-UHFFFAOYSA-N hexane-1,6-diamine Chemical compound NCCCCCCN NAQMVNRVTILPCV-UHFFFAOYSA-N 0.000 description 1
- 150000002402 hexoses Chemical class 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 235000021190 leftovers Nutrition 0.000 description 1
- 150000002632 lipids Chemical group 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000008752 local inflammatory process Effects 0.000 description 1
- 208000018773 low birth weight Diseases 0.000 description 1
- 231100000533 low birth weight Toxicity 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000022275 macrophage chemotaxis Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- LUEWUZLMQUOBSB-GFVSVBBRSA-N mannan Chemical class O[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@H]3[C@H](O[C@@H](O)[C@@H](O)[C@H]3O)CO)[C@@H](O)[C@H]2O)CO)[C@H](O)[C@H]1O LUEWUZLMQUOBSB-GFVSVBBRSA-N 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 230000036438 mutation frequency Effects 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 238000002331 protein detection Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 230000000405 serological effect Effects 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 208000000995 spontaneous abortion Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 150000004044 tetrasaccharides Chemical class 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000001551 total correlation spectroscopy Methods 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 210000002993 trophoblast Anatomy 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Abstract
Предложен полисахарид или его производное. Полисахарид обладает сродством к фиколину-3 и характеризуется наличием олигосахаридного повторяющегося блока общей формулы (I). Причем в формуле (I) n является целым числом от 0 до 100, предпочтительно менее 50; PDt обозначает повторяющийся олигосахаридный блок PD1t формулы (II), повторяющийся олигосахаридный блок PD2t формулы (III) или повторяющийся олигосахаридный блок PD3t формулы (IV); PD обозначает повторяющийся олигосахаридный блок PD1 формулы (V), повторяющийся олигосахаридный блок PD2 формулы (VI) или повторяющийся олигосахаридный блок PD3 формулы (VII); [Hep]-Kdo обозначает повторяющийся олигосахаридный блок формулы (VIII). Способ получения предложенного полисахарида предусматривает культивирование штамма Н. alvei и выделение бактериального липополисахарида. Полученный липополисахарид расщепляют и отделяют полисахаридную фракцию. Выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа. Необязательно полученные полисахариды восстанавливают, в частности в присутствии NaBH4, и предпочтительно конъюгируют с известным белком-носителем или хроматографической средой. Изобретение позволяет получить лиганды, которые специфично связываются с фиколином-3, и тем самым определить концентрацию активных форм фиколина-3 и их активности в организме человека. 4 н. и 10 з.п. ф-лы, 10 ил., 3 табл., 13 пр.
PDt-(PD)n-[Hep]-Kdo (I),
Description
Изобретение относится к бактериальному липополисахариду и его фрагментам, в частности к нативным и химически модифицированным полисахаридам, выделенных из липополисахаридов Hafnia alvei, конъюгатам таких липополисахаридов с носителями и применению полисахаридов в отдельности, а также их конъюгатов в качестве лигандов для фиколина-3 человека (фиколин-H, антиген Hakata) в оценочных тестах. Полисахариды, выделенные из липополисахаридов H. alvei, и их конъюгаты с носителями также можно применять в качестве лигандов для рекомбинантных форм человеческого фиколина-3, гомологов и аналогов человеческого фиколина-3, присутствующих в других видах, рекомбинантных форм гомологов и аналогов человеческого фиколина-3, присутствующих в других видах.
Липополисахариды (ЛПС, эндотоксин), состоящие из полисахаридной и липидной части, представляют собой амфифильные молекулы, находящиеся на поверхности грамотрицательных бактериальных клеток (Rietschel et al., 1996). Липополисахариды являются неотъемлемыми компонентами наружной мембраны оболочки клеток бактерий, которые уникальны и необходимы для функции и выживания грамотрицательных бактерий. Липополисахариды важны как факторы вирулентности грамотрицательных бактерий в случае сепсиса и септического шока (Hoist et al., 1996). Благодаря их биологической активности, ЛПС также называют эндотоксинами.
Вне зависимости от происхождения липополисахаридов, молекула, изолированная из бактерий гладкой (S) формы, характеризуется наличием следующих общих строительных блоков, включающих три области: (1) O-специфическую цепь (O-специфический полисахарид) - полимер, состоящий из повторяющихся олигосахаридных блоков, демонстрирующих высокую структурную изменчивость и определяющих серологического специфичность ЛПС (O-антигенная специфичность); (2) коровый олигосахарид - область с ограниченной структурной межвидовой изменчивостью, которая может быть разделена на сегменты: дистальный - называемый внешним кором, участок гексозы и проксимальный сегмент, называемый внутренним кором, участок гептозы, относящийся к липиду A; (3) липид A - участок, заякоривающий ЛПС в наружной мембране оболочки грамотрицательных бактерий и большинства энтеробактерий, построенный из дисахарида β-D-GlcpN-(1→6)-α-D-GlcpN, замещенного жирными кислотами, фосфатными группами и сахаридом или несахаридными заместителями (Rietschel, Brade et al., 1996). Липид A замещается коровым олигосахаридом через кетозидную связь (ketosidic linkage) между молекулой Kdo корового олигосахарида и остатком β-D-GlcN на невосстанавливающем конце углеводного остова липида A. Биологическая активность, приписываемая липополисахариду, строго связана со структурными особенностями этого участка, который представляет собой центр токсичности липополисахарида.
Аналогично бактериальной ДНК, вирусной РНК, микобактериальным гликолипидам, тейхоевым кислотам, дрожжевым маннанам и липопротеинам грамположительных бактерий, липополисахариды представляют собой так называемый патоген-ассоциированный молекулярный паттерн, ПАМП (pathogen-associated molecular pattern, PAMP). Эти молекулы представляют собой типичные структуры, присутствующие на поверхности патогенов, они не встречаются у высших организмов, но для микроорганизмов они являются важными до такой степени, что они достаточно консервативны в процессе эволюции (Aderem i Ulevitch, 2000). В клетках иммунной системы сформировалась универсальная система рецепторов, способных распознавать такие структуры и запускать быструю защитную реакцию (рецепторы включают в себя Toll-подобные рецепторы, фагоцитарные рецепторы, рецептор маннозы, а также разнообразные растворимые молекулы, узнающие молекулярные паттерны (ПАМП), включающие компоненты системы комплемента, коллектины и антибактериальные пептиды).
Основным участком, ответственным за биологическую активность липополисахаридов, является липид A, участок с низкой структурной изменчивостью. Основным рецептором, вовлеченным в механизмы врожденного иммунитета и в связывание с липидом A, является рецепторный комплекс CD14/TLR4/MD-2, присутствующий на поверхности макрофагов, моноцитов, нейтрофилов и B-лимфоцитов (Aderem i Ulevitch, 2000). Вслед за активацией сигнального пути происходит выработка провоспалительных медиаторов клетками-мишенями ЛПС.
Другие участки ЛПС, O-специфический полисахарид и коровый олигосахарид, представляют собой участки, модулирующие активность липида A после взаимодействия ЛПС с CD14/TLR4/MD-2. Благодаря свойственной им высокой структурной изменчивости, O-специфический полисахарид и коровый олигосахарид активируют механизмы врожденного иммунитета в меньшей степени. Однако, среди всех структур ЛПС, проанализированных на сегодняшний день, были идентифицированы молекулы, способные активировать факторы врожденного иммунитета, помимо описанных выше. Структуры некоторых O-специфических цепей и коровых олигосахаридов могут узнаваться такими компонентами, как, например: маннан-связывающий лектин (МСЛ) и другие человеческие лектин-подобные белки. Пектины связываются со специфическими углеводными структурами на поверхности патогена, а затем они активируют соответствующие эффекторные механизмы, такие как: активация или ингибирование системы комплемента, агглютинация, опсонизация (облегчение эндоцитоза), ингибирование роста микроорганизмов и модуляция провоспалительного или аллергического ответа. Селективность и способность лектинов различать чужеродные и хозяйские структуры основана на пространственных различиях между узнаваемыми углеводами (Thiel, 2007).
Помимо МСЛ, в активацию комплемента, в один из механизмов врожденного иммунитета, вовлечена недавно открытая группа лектинов, называемых фиколинами, лиганды которых охарактеризованы в недостаточной степени. У людей эта группа включает фиколин-1 (M), фиколин-2 (L) и фиколин-3 (H), а у мышей - фиколины A и B (Тиль, 2007).
Система комплемента представляет собой группу из нескольких десятков взаимозависимых белков, присутствующих в крови и других жидкостях организма. Активность комплемента основана на активации каскада ферментов, запускающего серию реакций, которые играют важную роль в возникновении иммунного ответа и провоспалительных реакций. Были выявлены три способа активации комплемента: классический путь, лектиновый путь и альтернативный путь. Они отличаются, прежде всего, по стадиям активации. Активация каждого пути происходит как каскад событий, в конечном счете, приводящих к: (I) опсонизации микроорганизмов (облегчению фагоцитоза), (II) хемотаксису макрофагов к сайту воспаления, (III) элиминации модифицированных или поврежденных клеток-хозяев, (IV) прямому лизису бактериальных клеток, вирусов, паразитов и грибов, и (V) началу воспалительной реакции.
При активации каскада комплемента через лектиновый путь ключевыми молекулами, распознающими патоген-ассоциированный молекулярный паттерн (ПАМП), являются МСЛ, фиколин-1 (M), фиколин-2 (L), фиколин-3 (H). Все эти белки имеют сходную структурную организацию. Они имеют олигомерную структуру, состоящую из базовой субъединицы из трех полипептидных цепей. Каждая цепь включает N-домен, содержащий большое число остатков цистеина, коллаген-подобную область и лиганд-узнающий домен. Для белка МСЛ характерен типичный лектиновый углевод-узнающий домен (англ. - carbohydrate-recognition domain, CRD). Для фиколина характерен фибриноген-подобный домен (англ. - fibrinogen-like region, FBG), который может иметь различную структуру (Thiel, 2007).
Среди перечисленных лектинов в настоящее время лучше всего охарактеризованы белок МСЛ и лиганды, полученные от патогенов, с которыми связывается этот белок. Известно, что МСЛ демонстрирует специфичность в отношении следующих моносахаридов: D-манноза, L-фукоза, N-ацетил-O-глюкозамин, D-глюкоза, которые, как правило, являются компонентами поверхностных структур патогенов, таких как грамотрицательные и грамположительные бактерии, дрожжи, паразиты, микобактерии и вирусы (Degn et al., 2009).
В отличие от молекулярных механизмов активации МСЛ-зависимого лектинового пути, активация комплемента через лектиновый путь фиколинами и, в частности, ее начальные стадии, т.е. взаимодействие фиколинов с ПАМП, является наименее охарактеризованным механизмом в системе комплемента. С точки зрения сывороточных концентраций, фиколины составляют доминирующую долю молекул, ответственных за активацию лектинового пути. В сыворотке средняя концентрация фиколина-3 (H), фиколина-2 (M) и фиколина-1 (L) составляет 25 мкг/мл, 5 мкг/мл и 0,1 мкг/мл, соответственно, а уровень МСЛ составляет около 1-3 мкг/мл (Garred et al., 2009). Специфичность фиколинов к лигандам мало изучена. Знания в этой области ограничиваются наблюдением того, что потенциальными лигандами для фиколинов могут являться N-ацетильные группы природных сахаров, таких как GlcNAc, GalNAc, а также N-ацетилированный глицин. Лиганды для фиколинов также включают искусственно полученные лиганды, такие как N-ацетилированный бычий сывороточный альбумин (BSA-NAc), BSA-GlcNAc и N-ацетилированный липопротеин низкой плотности (LDL-NAc). Было показано, что фиколины также способны связываться с C-реактивным белком (C-reactive protein, CRP) (Thiel, 2007). Все фиколины, а также МСЛ, связываются с сериновыми протеазами MASP (MBL-associated serine proteases, MBL-ассоциированные сериновые протеазы), и это позволяет им запускать активацию комплемента через лектиновый путь. В этом процессе ключевую роль играет фермент MASP-2. Из молекулярных паттернов, ассоциированных с патогенами, узнаваемыми человеческими фиколинами, в литературе описано лишь несколько примеров, которые являются довольно разнообразными по химической структуре. Больше известно о лигандах для фиколина M и L. Среди лигандов для фиколина-1 (M) выявлены липотейхоевые кислоты грамположительных бактерий, бактериальные поверхностные антигены Staphylococcus aureus и Salmonella typhimurium, 1,3-β-O-глюкан грибов, сиаловые кислоты и их производные, O-ацетилированные в положении 9 (Le Gout et al., 2009). Этот лектин обладает сродством к N-ацетил-D-глюкозамину (GlcNAc), N-ацетил-D-галактозамину (GalNAc), и сиаловой кислоте (Neu5Ac), связываясь с их ацетильными группами (Garlatti et al.; Liu et al., 2005; Matsushita, 2007; Runza et al., 2008).
Такая особенность, которая является типичной для фиколинов, облегчает связывание с несахаридными лигандами, такими как N-ацетил-L-цистеин и ацетилированный альбумин (Wittenborn et al., 2010). Сайт связывания, расположенный в фибриногеновом домене, гомологичен сайту S1 тахилектина. Фиколин M узнает поверхностные структуры некоторых штаммов стрептококков, стафилококков, E. coli и S. enterica (Runza, Schwaeble et al., 2008). Фиколин-2 (L) показывает сродство к N-ацетил-D-глюкозамину, N-ацетил-D-галактозамину и сиаловой кислоте, но он также может связываться с несахариными лигандами, такими как N-ацетилцистеин, N-ацетилглицин, ацетилхолин, эластин и некоторые кортикостероиды, а также окисленные и ацетилированные формы ЛНП или ДНК (Matsushita, 2007; Thiel, 2007; Runza, Schwaeble et al., 2008; Garred, Honore et al., 2009; Garred et al., 2010; Matsushita, 2010). Было показано, что фиколин L узнает некоторые из липополисахаридов, капсульные полисахариды, A-1-3-D-глюканы грибов и липотейхоевые кислоты. Благодаря этому он связывается с некоторыми штаммами S. enterica и E. coli, но в первую очередь со стафилококками и стрептококками: Staphylococcus aureus, Streptococcus pneumoniae, S. pyogenes и S. agalactiae (Matsushita, 2007). Возможно, связывание с бета-гемолитическими стрептококками группы B (Streptococcus agalactiae) является особенно важным, поскольку эти бактерии являются наиболее частой причиной менингита и сепсиса у новорожденных. Среди лигандов для этого лектина также описаны трисахариды и тетрасахариды, содержащие на конце LacNAc-(β-Gal[3-O-SO3][6-O-SO3]-(1→4)-(β-GlcNAc-носитель) или GlcNAc, гепарин (его фибриногенный домен) и высоко сульфатированные гликозаминогликаны (Gout, Garlatti et al., 2009).
Фиколин H (также известный как фиколин 3 или антиген Hakata, первоначально описанный как термолабильный макроглобулин β2) синтезируются в гепатоцитах, клетках эпителия желчных протоков, альвеолярных клетках II типа, в эпителии бронхов и глиальных клетках. Низкий уровень экспрессии был выявлен в клетках сердца, почек, поджелудочной железы, селезенки и плаценты. Белок высвобождается в кровь, желчные протоки и слизь, покрывающую дыхательные пути. Поскольку количество фиколина H, синтезируемого в легких, выше, чем в печени, вероятно, этому лектину можно приписать не только системную (поскольку он высвобождается в кровь), но и локальную защитную роль в дыхательных путях. Его концентрация в сыворотке крови здоровых взрослых людей является относительно высокой. Согласно первоначальной широко цитируемой работе (Yae et al., 1991), такая концентрация колеблется от 7 до 23 мкг/мл (в среднем около 18 мкг/мл). Последние данные, опубликованные Андерсеном и соавторами (Andersen et al., 2009) указывают на то, что она может быть даже выше (в среднем выше 32 мкг/мл, в диапазоне от 10 до более 80 мкг/мл). Среди лигандов фиколина-3 (H) был выявлен полисахарид, выделенный из бактерий Aerococcus viridans 86965 (вероятно, капсульный полисахарид) (Tetta et al., 1998; Matsushita et al., 2002), BSA-NAC (Lacroix et al., 2009; Munthe-Fog et al., 2009), BSA-Gal, D-фукозы и D-галактозы (Gout, Garlatti et al., 2009), поверхностные антигены клеточной линии лимфомы T-лимфоцитов (клеточная линия Jurkat) (Gout, Garlatti et al., 2009).
Как показано в тестах на агглютинацию и анализе ингибирования агглютинации человеческих эритроцитов (Sugimoto, Yae et al., 1998), фиколин-3 связывается с ЛПС из Salmonella Minnesota и Typhimurium, а также E. coli. В процитированном выше исследовании Gout и соавторов (Gout, Garlatti et al., 2009) предприняты наиболее точные попытки определить специфичность фиколинов к сахаридным лигандам. В этом исследовании был использован матрикс (гликоматрикс), содержащий 377 родственных гликанов. Анализируемые гликаны как природные, так и синтетические, представляли собой компоненты, встречающиеся в клетках млекопитающих.
Как показано, специфичность фиколина-3 (H) по отношению к лигандам очень слабо охарактеризована. Кроме того, по последовательности аминокислот фиколин-3 (H) существенно отличается от других фиколинов, демонстрируя лишь 45% гомологии с фиколином-1 и фиколином-2 и 58% гомологии с доменом FGB. Что касается различных типов синтетических соединений, недавно было показано, что фиколин-3 также связывается с BSA-NAc (Munthe-Fog, Hummelshoj et al., 2009). Лиганд BSA-NAc был использован в упомянутом исследовании для индукции активации лектинового пути сывороткой крови человека. Взаимодействие фиколина-3 как с BSA-NAc, так и с бактериями штамма A. viridans 86965 и их полисахаридами не были охарактеризованы на молекулярном уровне (Tsujimura et al., 2002). Как уже отмечалось, специфичность фиколинов очень плохо изучена и в настоящее время продолжаются споры о природе химических лигандов, которые они признают. Химическая структура некоторых ПАМП или наличие специфичных антител в крови подтверждает предположение, что они могут активировать систему комплемента одновременно через все пути: классический путь, лектиновый путь и альтернативный путь. Кроме того, эти пути активации системы комплемента взаимозависимы на определенных этапах. На настоящий момент описан механизм усиления классического и лектинового пути через активацию альтернативного пути (Degn, Hansen et al., 2009).
Для исследований, направленных на выяснение механизмов, лежащих в основе таких процессов, проводимых in vitro, in vivo или с использованием изолированных модельных систем типа лиганд-белок, требуется широкий ассортимент экспериментальных инструментов, позволяющих выделять и очищать ключевые белки, определять их уровень в жидкостях организма и тестировать их активность с использованием иммунохимических методов и блокирования их активности. Как показано в большинстве исследований механизмов иммунной системы, комплемент представляет собой сложную систему в отношении применяемых методов исследований.
В настоящее время основной упор делается на получении таких экспериментальных инструментов, которые позволяют оценивать различные способы активации комплемента независимо, в условиях, приближенных к физиологическим (Herpers et al., 2009; Inoshita et al., 2009). В таких тестах важное значение имеет выбор адекватного лиганда, и эта задача является чрезвычайно трудной в случае фиколинов из-за отсутствия соответствующих данных. Был описан конъюгат BSA-NAc, и он используется как лиганд для фиколина-3 (H). Однако он не встречается в природе и был получен в результате химического синтеза.
Определение уровня фиколина, активности и способности активировать систему комплемента является важным в отношении диагностики и определения характеристик иммунодефицитов, связанных с комплементом, что часто связано с полиморфизмом в генах, кодирующих лектин. Как было показано с помощью достаточно хорошо охарактеризованного примера МСЛ человека, последствия мутации могут включать нарушения структуры и функции, более короткий период полужизни и снижение концентрации в сыворотке крови. Для МСЛ последствия такой недостаточности наиболее критичны для людей с незрелой или неисправной иммунной системой, и чаще всего они включают повышенную восприимчивость к инфекции (иногда угрожающую жизни). Можно предположить, что в результате дальнейших исследований значения фиколинов, их роль в иммунном ответе и клинические эффекты, связанные с их дефицитом, будут выяснены и документально подтверждены. Так, по-прежнему крайне мало опубликованных данных о потенциальных рисках, которые могут быть обусловлены недостатком фиколина-2 (L). Более высокая распространенность такой недостаточности (определенная количественно) наблюдается у женщин с рецидивами самопроизвольных выкидышей (Kilpatrick et al., 1999). Значительно более низкие концентрации фиколина L также наблюдались у беременных женщин с преэклампсией, по сравнению со здоровыми беременными женщинами (Wang et al., 2007). В будущем исследование одиночных нуклеотидных полиморфизмов в гене FCN2, кодирующем фиколин-2, и концентрации белка может быть полезным диагностическим инструментом. У детей с недостатком фиколина L наблюдается более высокая частота мутаций в положениях 64 и 6424, по сравнению с детьми с высоким содержанием этого белка. Напротив, частота вариантов аллелей пары -4 и 6359 значительно ниже у детей с недостатком фиколина L (Cedzynski et al., 2007). Также у детей с повторяющимися респираторными инфекциями, сопровождающимися астмой и аллергическим ринитом, наблюдается более высокий показатель распространения дефицита количества фиколина, по сравнению со здоровыми детьми (но без исключения детей с повторяющимися инфекциями и аллергическими заболеваниями) (Atkinson et al., 2004; Cedzynski et al., 2009).
Было показано, что дефицит фиколина L увеличивает риск преждевременных родов, низкого веса при рождении и врожденные инфекции (Swierzko et al., 2009). Физиологическая роль фиколина Н и клиническое значение его недостаточности изучены в незначительной степени. Показано, что у лиц с саркоидозом наблюдаются значительно более низкие концентрации этого лектина, по сравнению с контрольной группой (Svendsen et al., 2008). Попытки выявить, влияет ли дефицит этого фактора на риск возникновения вспышки заболевания, влияет ли заболевание на регуляцию экспрессии гена FCN3, происходит ли потребление активного белка, не увенчались успехом. Более низкие концентрации фиколина H также выявлены у пациентов с системной красной волчанкой, и, как упоминалось ранее, это связано с выработкой аутоантител, направленных против этого белка, но не с генетически детерминированными нарушениями синтеза (Yae, Inaba et al., 1991; Andersen, Munthe-Fog et al., 2009). Концентрация в сыворотке фиколина H резко повышается во время беременности, что может указывать на его важную защитную роль. Однако, как отмечалось выше, значительно более низкие концентрации фиколина L наблюдались у беременных женщин с преэклампсией, по сравнению со здоровыми беременными женщинами. В синцитиотрофобластах из плаценты больных женщин было обнаружено значительное количество фиколина H, что предположительно связано с местным воспалительным процессом и указывает на вероятное участие белка в патологии (Wang, Yim et al., 2007). Недавно Шлапбах с соавторами показал, что низкая концентрация фиколина Н в сыворотке крови детей, перенесших противоопухолевую химиотерапию, увеличивает риск нейтропенической лихорадки и сепсиса (Schlapbach et al., 2009). Фукутоми с соавторами отметил, что концентрация фиколина Н также снижается с развитием цирроза печени, поэтому его концентрация может служить диагностическим маркером, указывающим на уровень дисфункции этого органа (Fukutomi et al., 1996).
Лечение некоторых иммунодефицитов основано на доставке (замещении) соответствующего фактора, полученного от здоровых доноров или его рекомбинантной формы. Рекомбинантный или нативный белок МСЛ в настоящее время проходит клинические испытания как потенциальное лекарственное средство в случаях недостаточности этого лектина.
Отправной точкой для диагностики недостаточности, мониторинга терапии такой недостаточности, а также объяснения ее механизмов являются методы определения концентрации и активности в жидкостях организма. Первым шагом в лечении этого типа недостаточности является получение активных, очищенных препаратов этого белка в нативной или рекомбинантной форме.
Для определения концентрации фиколина-3 в жидкостях организма в основном используются два метода. Один из них («сэндвич»-ИФА) основан на применении моноклональных антител против человеческого фиколина-3 (H), используемых как в качестве так называемых «антител захвата», так и в качестве детектирующих антител для детекции белков. Во втором методе используется бычий альбумин, который химически модифицирован путем N-ацетилирования (BSA-NAc). В настоящее время доступен коммерческий тест, разработанный компанией Hycult, который позволяет определить общую концентрацию фиколина-3 (H) с использованием «сэндвич»-ИФА. Что касается второго способа, в котором используется в качестве лиганда конъюгат BSA-NAc, недавно была описана возможность его применения на практике для оценки активности комплексов фиколина-3-MASP (Munthe-Fog, Hummelshoj et al., 2009).
Первый метод позволяет определить уровень белка в сыворотке, который не обязательно отражает уровень активной формы фиколина-3. Второй метод отличается недостаточно описанным молекулярным механизмом взаимодействия фиколина-3 (H) с N-ацетильными группами. Кроме того, BSA-NAc не является природным лигандом.
Целью в соответствии с настоящим изобретением является предоставление лигандов, которые специфично связываются с фиколином-3, и способа их получения, которые можно применять для определения концентрации активных форм фиколина-3 и их активности. Неожиданно, эта цель была достигнута в настоящем изобретении.
Предметом в соответствии с настоящим изобретением является полисахарид со сродством к фиколину-3 или его производное, отличающийся тем, что его структура описывается общей формулой:
PDt-(PD)n-[Hep]-Kdo
где n является целым числом от 0 до 100, предпочтительно менее 50, более предпочтительно менее 40, а в случае полисахаридов бактериального происхождения обычно менее 30,
PDt обозначает:
- повторяющийся олигосахаридный блок (repeating oligosaccharide unit) PD1t, имеющий формулу:
- повторяющийся олигосахаридный блок PD2t, имеющий формулу:
- повторяющийся олигосахаридный блок PD3t, имеющий формулу:
PD обозначает:
- повторяющийся олигосахаридный блок PD1, имеющий формулу:
- повторяющийся олигосахаридный блок PD2, имеющий формулу:
или
- повторяющийся олигосахаридный блок PD3, имеющий формулу:
- [Hep]-Kdo обозначает дисахарид, имеющий формулу:
Предпочтительно, полисахарид в соответствии с настоящим изобретением отличается тем, что он содержит соединения, выбранные из полисахаридов общей формулы: PD1t-PD1-[Hep]-Kdo, PD2t-PD2-[Hep]-Kdo or PD3t-PD3-[Hep]-Kdo.
В равной мере предпочтительным является производное полисахарида в соответствии с настоящим изобретением, который характеризуется тем, что оно выбрано из группы, включающей восстановленный полисахарид PDt-(PD)n-[Hep]-Kdo, его конъюгат с известным белком-носителем или хроматографическим носителем.
В соответствии с настоящим изобретением фраза «восстановленный полисахарид PDt-(PD)n-[Hep]-Kdo» обозначает соединение, в котором остаток Kdo присутствует в виде линейного полиспирта, 1-карбокси-3-дезоксиоктитола, в котором первый и третий атом углерода заменен карбоксильной и дезокси-группой, соответственно. Такое производное образуется в результате восстановления, в частности с применением боргидрида натрия.
Известные белки-носители, применяемые для получения конъюгата в соответствии с настоящим изобретением, могут представлять собой сывороточный альбумин позвоночных, оваальбумин.
Известные хроматографические носители, которые можно применять для получения конъюгатов в соответствии с настоящим изобретением, предпочтительно представляют собой модифицированную агарозу, целлюлозу или полиакриламид.
Кроме того, изобретение относится к способу получения полисахаридов и их производных со сродством к фиколину-3, отличающийся тем, что:
а) выделяют бактериальный липополисахарид, предпочтительно из штамма H. alvei,
б) полученный липополисахарид расщепляют и отделяют полисахаридную фракцию,
в) выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа,
г) как альтернатива, полученные полисахариды восстанавливают, в частности, в присутствии NaBH4 и, предпочтительно, конъюгируют с известным белком-носителем или хроматографическим носителем.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что культивирование штамма H. alvei осуществляется на этапе (а), и такой штамм H. alvei выбран из штаммов: H. alvei 981, 1200, 1203, 1205, и 1208. Эти штаммы были депонированы 07 июня 2010 г. в Польской коллекции микроорганизмов (Институт иммунологии и экспериментальной терапии Польской академии наук, Вроцлав) в соответствии с Будапештским договором, под номерами, представленными в следующей Таблице:
| Штамм | Номер доступа в Польской коллекции микроорганизмов (PCM) |
| H. alvei 981 | B/00030 |
| H. alvei 1200 | B/00031 |
| H. alvei 1203 | B/00032 |
| H. alvei 1205 | B/00033 |
| H. alvei 1208 | B/00034 |
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что экстрагирование липополисахарида из бактериальной массы осуществляют на этапе (а) в течение примерно 15 минут при температуре около 65°C в водном растворе фенола, предпочтительно растворе фенола в концентрации около 45%, с последующим восстановлением липополисахарида из отделенной водной фазы.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что отделенный полисахарид гидролизуют на этапе (б) в примерно 1-1.5% растворе уксусной кислоты, примерно от 15 до 60 мин при температуре 100°C.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что полисахаридную фракцию разделяют с помощью хроматографии на этапе (в) для отделения O-специфических цепей от более коротких цепей полисахаридов и коровых олигосахаридов, при этом хроматографию предпочтительно проводят на колонке, заполненной полиакриламидным гелем, таким как коммерчески доступный Bio-Gel P-10, уравновешенной буфером, содержащим 0,05 М пиридин/уксусная кислота/вода в соотношении 10/4/986 при pH около 5,6.
Предпочтительно, способ в соответствии с настоящим изобретением отличается тем, что полученные полисахариды восстанавливают и конъюгируют с белком-носителем на этапе (г), при этом такой белок-носитель может, в частности, представлять собой бычий сывороточный альбумин или хроматографический носитель, и особенно предпочтительным является модифицированная агароза, такая как коммерчески доступная сефароза Sepharose ®.
Еще одним аспектом в соответствии с настоящим изобретением является применение бактериального липополисахарида или полисахарида, содержащегося в нем, или их производных в качестве лиганда для фиколин-3, в частности для очистки или детекции фиколина-3 или его производных.
Как используется в настоящей заявке, термин «фиколин-3» или «его производные» относится к человеческому фиколину-3, который может представлять собой природный белок или белок, полученный искусственным путем, в частности рекомбинантный белок, в том числе возможные мутантные формы и другие производные, имеющие по существу активность природного фиколина-3.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что применяют липополисахарид, полученный из штаммов: H. alvei 981, 1200, 1203, 1205, 1208, или полисахарид, содержащийся в нем или его производное. Как описано выше, все штаммы, относящиеся к данной заявке, были депонированы в Польской коллекции микроорганизмов.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что применяют полисахарид или его производное в соответствии с настоящим изобретением, которые определены выше или получены способом в соответствии с настоящим изобретением, как описано выше.
Предпочтительно, применение в соответствии с настоящим изобретением отличается тем, что производное фиколина-3 представляет собой комплекс фиколина-3 с сывороточными или полученными из плазмы сериновыми протеазами, MASP (МСЛ-ассоциированными сериновыми протеазами).
Также предпочтительное применение в соответствии с настоящим изобретением отличается тем, что для определения активности и/или уровня фиколина-3 или его производных в сыворотке крови и других жидкостях организма осуществляют очистку.
Кроме того, предпочтительное применение в соответствии с настоящим изобретением отличается тем, что очистка проводится с целью получения сыворотки или плазмы, лишенной фиколина-3.
В начале подробного описания выбранных предпочтительных вариантах осуществления в соответствии с настоящим изобретением следует отметить, что отправной точкой настоящего изобретения послужило открытие с помощью дот-блот анализа сильного взаимодействия между человеческим фиколином-3 (H) и бактериальными липополисахаридами, в частности, ЛПС, изолированными из штаммов Н. alvei 2, 23, 37, 38, 981, 1200, 1203, 1205 и 1208. Пара ЛПС-фиколин представляет собой еще один пример ключевого взаимодействия, которое является важным для врожденного иммунитета. Липополисахарид (ЛПС) представляет собой один из молекулярных паттернов ПАМП, а также основной поверхностный антиген и фактор вирулентности грамотрицательных бактерий, а фиколин-3 (H) является компонентом системы комплемента (ключевой механизм врожденного иммунитета), который связывается с ЛПС и активирует каскад комплемента через лектиновый путь.
В ходе исследований, которые привели к настоящему изобретению, авторы изобретения идентифицировали и выделили бактериальные лиганды, в которых специфично и прочно связываются, в частности, с человеческим фиколином-3 (H). В предпочтительном варианте реализации в соответствии с настоящим изобретением, лиганды представляют собой полисахаридные фрагменты липополисахаридов Н. alvei, которые получают путем химической деградации липополисахарида. В результате скрининга ЛПС H. alvei было выявлено девять ЛПС, составляющих область, с которой связывается человеческий фиколин-3 (H): ЛПС 2, 23, 37, 38, 981, 1200, 1203, 1205 и 1208. Полная структура этих липополисахаридов на сегодняшний день не была определена и не была опубликована. Единственно доступными были данные, касающиеся структуры повторяющихся блоков O-специфических цепей, присутствующих в ЛПС 2, 23, 38, 1200, 1203, 1205, 1208 (Gamian et al., 1991, Katzenellenbogen et al., 1992, Katzenellenbogen et al., 1999; Dag et al., 2004). Эти структуры были определены с помощью инструментальных и химических анализов высокомолекулярных фракций O-специфических полисахаридов, имеющих число повторяющихся блоков, большее или равное 4. Такие фракции были получены путем кислого гидролиза липополисахарида в присутствии детергента (1,5% CH3COOH, 2% SDS) в течение 15 мин при 100°C. Такие условия обеспечили гидролиз кислотолабильной кетозидной связи между липидом M и сахаром в ЛПС (коровый олигосахарид, замещенный O-специфической цепью). После отделения липида А полученную смесь поли- и олигосахаридов разделяли с помощью гель-фильтрационной хроматографии. Учитывая современные представления об общей структуре липополисахаридов энтеробактерий, наличие гликозидной связи между коровым олигосахаридом и O-специфической цепью, которая не разрушается при таких условиях, как правило, должно приводить к образованию продуктов, включающих коровый олигосахарид и полисахаридные фракции, образованные коровым олигосахаридом, замещенным с помощью различного числа повторяющихся блоков O-специфической цепи. В ходе последующих исследований липополисахаридов H. alvei, которые привели к настоящему изобретению, авторы настощего изобретения выявили необычный структурный элемент, отличающийся от известных ЛПС энтеробактерий: наличие остатка Kdoll в дистальной области корового олигосахарида (Lukasiewicz et al., 2009). Был выделен фрагмент ЛПС H. alvei 32, содержащий сахарную часть липида A, замещенного коровым олигосахаридом, содержащий на конце трисахаридный фрагмент L-α-D-Hepp-(1→4)-[α-D-Galp6OAc-(1→7)]-α-Kdop-(2→]. Наличие двух областей Kdo внутри молекулы ЛПС существенно изменяет состав смеси поли- и олигосахаридов, полученных в результате кислого гидролиза ЛПС. Для ЛПС H. alvei гидролиз связи кетозидной связи происходит в двух местах: (I) между липидом A и остатком Kdol, который замещает липид A, и (II) между остатком Kdoll, присутствующим во внешней части коровой области олигосахарида, и остальной частью коровой области. Для липополисахарида, фрагменты которого представляют предмет одного из аспектов в соответствии с настоящим изобретением, было показано, что остаток Kdoll представляет собой место замещения O-специфической цепи. Таким образом, было возможно получить полисахариды, лишенные почти всей коровой области, с мотивом Hep-Kdo на его восстанавливающих концах в результате кислого гидролиза ЛПС H. alvei 23, 1200, 1203, и 1205. Таким образом, данное сообщение является первым раскрытия присутствия этого элемента в O-специфических полисахаридных фракциях, выделенных из ЛПС H. alvei 1200, 1203 и 1205. Эти полисахариды построены из одного, двух и больше углеводных повторяющихся блоков. Кроме того, настоящее изобретение представляет собой первое сообщение о строении биологических повторяющихся блоков O-специфического полисахарида H. alvei ЛПС 1200, 1203 и 1205. Что касается структурного анализа повторяющихся блоков O-специфических цепей ЛПС H. alvei, структурный элемент Hep-Kdo, описанный в настоящей заявке, не был выявлен в процитированных выше публикациях (Jachymek et al. 1995; Sunday et al., 1996, Petersson et al., 1997; Jachymek et al., 1999, Dag et al., 2004). Эти исследования были проведены для фракций, содержащих полимеры с числом повторяющихся единиц больше чем 4-5. Мотив Hep-Kdo не был обнаружен в связи с преобладанием компонентов повторяющихся блоков. Фрагмент O-специфической цепи, содержащий от 4 до 8 сахарных остатков, характерных для O-специфической цепи и дисахаридом Hep-Kdo на восстанавливающем конце был выделен только в том случае ЛПС H. alvei 2 (Gamian, Romanowska et al., 1991).
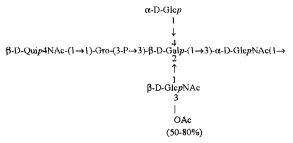
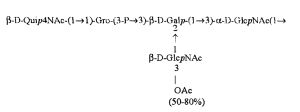
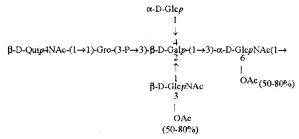
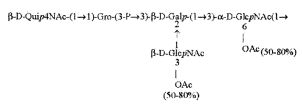
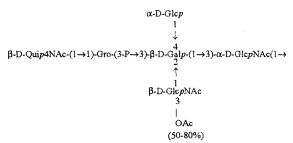
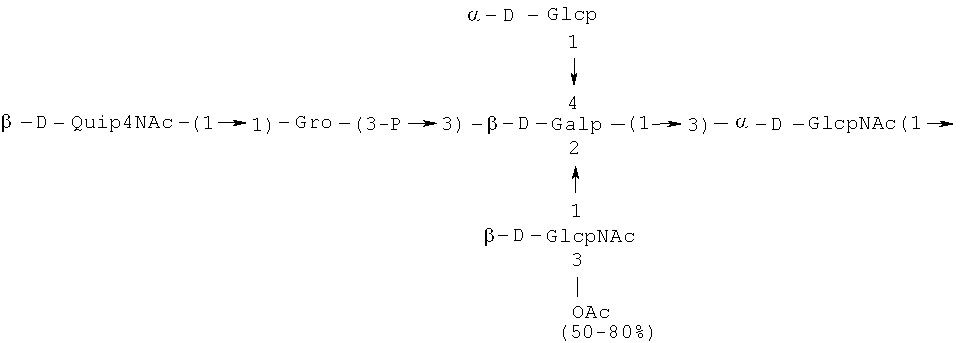
Примерами лигандов фиколина-3, раскрытых в настоящей заявке, являются полисахаридные фрагменты липополисахаридов H. alvei 1200, 1203, 1205, в частности ЛПС 1200, которые получают путем химической деградации липополисахарида. Эти полисахариды имеют структуру общей формулы:
PS1: PD1t-(PD1)n-[Hep]-Kdo,
PS2: PD2t(PD2)n-[Hep]-Kdo,
PS3: PD3t(PD3)n-[Hep]-Kdo,
где символ PD обозначает субъединицу О-специфических цепей, изолированных из липополисахаридов H. alvei 1200 (PD1), 1203 (PD2) и 1205 (PD3), соответственно.
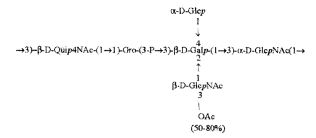
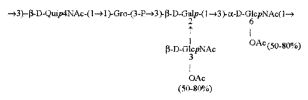
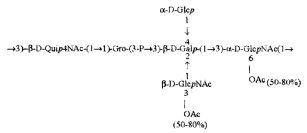
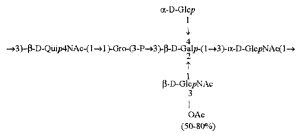
Кроме того, все полисахариды дополнительно O-ацетилированы (Фиг.1). Число n является целым числом, большим или равным 0. Дисахарид, обозначенный символом «[Hep]Kdo», имеет следующую структуру: →7)-[L-глицеро-D-манно-Hep-(1→8)-]-Kdo. Независимо от типа повторяющегося блока (PD1 или PD2, или PD3), этот дисахарид замещен в положении 7 остатка Kdo первым остатком O-специфической цепи повторяющегося блока. →3)-(-D-GlcpNAc является первым остатком в случае PD1, PD2, PD3. Структуры фрагментов PD1t-(PD1)n-[Hep]-Kdo (n=1), PD2t-(PD2)n-[hep]-Kdo (n=1), PD3t(PD3)n-[Hep]-Kdo (n=1) показаны на Фиг.1. Символы PD1t, PD2t и PD3t обозначают концевые повторяющиеся блоки на невосстанавливающем конце каждого полисахарида. В случае PD1t, PD2t и PD3t β-D-Quip4NAc-(1→ является концевым сахаром на невосстанавливающем конце концевой субъединицы.
Все полисахариды, описанные в настоящей заявке (PS1, PS2 и PS3), получают путем химического расщепления липополисахаридов. PS1 получают путем химического расщепления липополисахарида, изолированного из H. alvei 1200 (Пример 5). PS2 получают путем химического расщепления ЛПС, изолированного из H. alvei 1203. PS3 получают путем химического расщепления ЛПС, изолированного из H. alvei 1205. Полисахаридная фракция может содержать один или более повторяющийся блок O-специфической цепи. Полисахарид PS1 и его редуцированная форма, описанные в качестве примера в экспериментальном разделе, содержат по меньшей мере четыре повторяющихся блока O-специфической цепи.
Один из аспектов в соответствии с настоящим изобретением также относится к восстановленным полисахаридам. В одном предпочтительном варианте настоящее изобретение относится к PS1восст, PS2восст, PS3восст, которые сохраняют структурные особенности, обеспечивающие связывание человеческого фиколина-3 и его рекомбинантной формы. По сравнению с нативными полисахаридами, восстановленные полисахариды характеризуются наличием поли-гидрокси-3-дезоксиоктановой кислоты на восстанавливающем конце, образующейся в результате редукции Kdo. Восстановление полисахаридов осуществляли с применением NaBH4. Полученный продукт очищали с помощью гель-проникающей хроматографии. Пример получения восстановленных полисахаридов подробно описан в экспериментальном разделе (Пример 6).
Другой аспект в соответствии с настоящим изобретением относится к применению восстановленных полисахаридов в соответствии с настоящим изобретением, в частности PS1восст, PS2восст, PS3восст, в качестве лигандов человеческого фиколина-3 и его рекомбинантных форм, других компонентов системы комплемента и их рекомбинантных форм со специфичностью, схожей со специфичностью фиколина-3, и белков системы комплемента, полученных от других организмов и имеющих схожую специфику, а также активаторов in vitro и in vivo системы комплемента. Особенно предпочтительным является применение этих молекул в качестве лигандов, исключающих взаимодействие таких полисахаридов с МСЛ, фиколином-L, фиколином-M и IgG.
Еще один аспект в соответствии с настоящим изобретением относится к ковалентным конъюгатам полисахаридов в соответствии с настоящим изобретением, предпочтительно PS1восст, PS2восст, PS3восст, с белками-носителями, такими как, например, БСА и другие носители, которые можно применять для иммобилизации полисахаридов на твердых подложках, таких как поверхность планшета для твердофазного ИФА. Получение типичного конъюгата PS1red с БСА (PS1200-BSA) подробно описано в экспериментальном разделе (Пример 7).
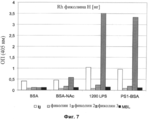
Было показано, что конъюгат такого типа может быть компонентом функционального диагностического теста, теста на измерение концентрации и теста для селективного измерения активности комплекса фиколин-3/МАSР-2 в сыворотке крови и других жидкостях организма, а также для детекции комплексов рекомбинантных форм фиколина-3. Пример такого применения конъюгатов подробно описан в экспериментальном разделе. В Примере 9 описан иммуноферментный анализ связывания по выявлению связывания рекомбинантного фиколина-3 (H) с липополисахаридом H. alvei 1200 и конъюгатом PS1200-BSA. В Примере 10 представлено сравнение связывания сывороточного фиколина-3, -2, -1, МСЛ и природных иммуноглобулинов с различными лигандами (БСА, BSA-Ac, ЛПС 1200 и PS1200-BSA) с применением буфера, включающего Hepes-буфер, или буфера с высокой ионной силой. В Примере 11 описано сравнение детекции сывороточного фиколина-3 (H) с применением твердофазного ИФА и лиганда PS1200-BSA с помощью метода типа «сэндвич».
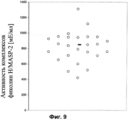
В Примерах 12 и 13 описано измерение концентраций фиколина-3 и активности комплексов фиколин-3/MASP-2 у здоровых взрослых доноров с применением ИФА и лиганда PS1200-BSA, соответственно. Любому специалисту в данной области на основании имеющейся информации понятно, что конъюгаты в соответствии с настоящим изобретением могут быть элементом функционального диагностического теста для селективного измерения активности комплексов фиколин-3/MASP-1, фиколин-3/MASP-3 и комплексов фиколина-3 с любым другим фактором или фактором, модулирующим активность фиколина-3 и гомологов и/или их аналогов, а также комплексов подобного типа, которые формируются с рекомбинантными формами фиколина-3, его аналогов и/или гомологов.
Еще один аспект в соответствии с настоящим изобретением относится к ковалентным конъюгатам полисахаридов в соответствии с настоящим изобретением, в частности PS1восст, PS2восст, PS3восст, с носителями, помимо белков, такими носителями, которые можно применять для иммобилизации восстановленных полисахаридов на твердых носителях, которые можно в дальнейшем применять в качестве лигандов для фиколина-3 и его гомологов и/или аналогов, рекомбинантного фиколина-3 и его гомологов и аналогов, или комплексов подобного типа, которые формируются с рекомбинантными формами фиколина-3 и рекомбинантными формами аналогов и гомологов фиколина-3 в иммуноферментном анализе, иммуноблотинге, методах очистки фиколина-3 из сыворотки крови и других жидкостей организма и методов подготовки бессывороточного фиколина-3 на основании аффинной хроматографии. Такой носитель для получения указанных конъюгатов для аффинной хроматографии может представлять собой модифицированную агарозу, целлюлозу или полиакриламид, например, коммерчески доступный носитель сефарозу Sepharose 4B (Пример 8).
Такие конъюгаты также можно применять в аффинной хроматографии для получения сыворотки/плазмы или других жидкостей организма, лишенных фиколина-3 (H).
Особый вариант реализации в соответствии с настоящим изобретением относится к применению полисахаридов, изолированных из ЛПС, выделенных из других штаммов H. alvei, с которыми связывается фиколин-3 в дот-блот-анализе (Пример 1), для целей, описанных выше. Такие полисахариды включают полисахариды, изолированные из ЛПС H. alvei 2, 23, 37, 38, 981 и 1208.
Другие свойства в соответствии с настоящим изобретением описаны более подробно в следующих примерах и подтверждены экспериментальными результатами, приведенными на прилагаемых чертежах. На Фиг.1 показаны полисахаридные структуры PD1t-PD1-[Hep]-Kdo, PD2t- PD2-[Hep]-Kdo, PD3t-PD3-[Hep]-Kdo, выделенные из ЛПС H. alvei 1200, 1203, 1205, соответственно. На Фигуре 2 показано взаимодействие человеческого фиколина-3 (H) с липополисахаридам из выбранных штаммов H. alvei в дот-блот-анализе. ЛПС представлены в следующем порядке: (1) ЛПС H. alvei 1, (2) ЛПС 1M, (3) ЛПС 2, (4) ЛПС 17, (5) ЛПС 23, (6) ЛПС 31, (7) ЛПС 32, (8) ЛПС 37, (9) ЛПС 38, (10) ЛПС 39, (11) ЛПС 399, (12) ЛПС 481, (13) ЛПС 600, (14) ЛПС 537, (15) ЛПС 744, (16) ЛПС 974, (17) ЛПС 981, (18) ЛПС 1187, (19) ЛПС 1188, (20) ЛПС 1190, (21) ЛПС 1191, (22) ЛПС 1192, (23) ЛПС 1195, (24) ЛПС 1196, (25) ЛПС 1198, (26) ЛПС 1200, (27) ЛПС 1203, (28) ЛПС 1204, (29) ЛПС 1205, (30) ЛПС 1206, (31) ЛПС 1207, (32) ЛПС 1208, (33) ЛПС 1209, (34) ЛПС 1210, (35) ЛПС 1211, (36) ЛПС 1212, (37) ЛПС 1213, (38) ЛПС 1214, (39) ЛПС 1215, (40) ЛПС 1218, (41) ЛПС 1220, (42) ЛПС 1221, (43) ЛПС 1222, (44) ЛПС 1224, (45) ЛПС 114-60, (46) К. pneumoniae 03. На Фиг.3 представлено взаимодействие человеческого фиколина-3 (Н) с разделенными с помощью электрофореза (ДСН-ПААГ) ЛПС, изолированными из выбранных штаммов Н. alvei, в анализе методом Вестерн-блот. Слева: ЛПС 23, 1200, 1203, 1205, 1192. На Фиг.4 показано: (A) связывание человеческого фиколина-3 (Н) липополисахаридами из выбранных штаммов H. alvei в ИФА (ЛПС 23, 1200, 981, 1203); (B) активация комплексов фиколин H/MASP-2 липополисахаридами из выбранных штаммов H. alvei в ИФА (ЛПС 23, 1200, 981, 1203). На Фиг.5 показано связывание рекомбинантного фиколина Н с бактериями Н. alvei 1200 в анализе методом проточной цитометрии. На Фиг.6 показано: (A) связывание рекомбинантного фиколина Не/-/, alvei 1200 в ИФА; (B) связывание рекомбинантного фиколина Н с Н. alvei 1200-BSA в ИФА. На Фиг.7 показано связывание сывороточного фиколина-3 (H), фиколина-2 (L), фиколина-1 (M), маннан-связывающего лектина (МСЛ) и иммуноглобулина с бычьим сывороточным альбумином, его ацетилированными производными, липополисахаридом H. alvei 1200 и полисахаридом H. alvei 1200, конъюгированным с БСА, в буфере B1 (Munthe-Fog, Hummelshoj et al., 2009) и гипертоническом буфере B2 (Petersen, Thiel et al., 2001). Сыворотку крови человека разбавляли 1: 50. На Фиг.8 приведены конкретные значения концентраций фиколина-3 (H) у взрослых здоровых доноров. Черный отрезок соответствует срединному значению (17622 нг/мл). Предметом в соответствии с настоящим изобретением является лиганд для фиколина-3 (H) - высокомолекулярный полисахарид, выделенный из липополисахарида H. alvei 1200, конъюгированный с бычьим альбумином. На Фиг.9 представлены отдельные значения активности комплексов фиколин H/MASP-2 у взрослых здоровых доноров. Черный отрезок соответствует срединному значению (847 мЕ/мл). Предметом в соответствии с настоящим изобретением является лиганд для фиколина-3 (H) - высокомолекулярный полисахарид, выделенный из липополисахарида H. alvei 1200, конъюгированный с бычьим альбумином. На Фиг.10 показана корреляция между концентрацией фиколина -3 (H) и активности его комплекса с MASP-2 (активация элемента C4) у здоровых взрослых людей. Показана линия тренда. Лигандом фиколина-3 (H) является высокомолекулярный полисахарид, выделенный из липополисахарида H. alvei 1200, конъюгированный с бычьим альбумином. R=0,683, p<0,0002.
Примеры, описанные ниже, приведены только для иллюстрации, и они никоим образом не ограничивают объем настоящего изобретения.
ПРИМЕР 1. Связывание человеческого фиколина-3 (H) с ЛПС Н. alvei в дот-блот-анализе. Липополисахариды, выделенные от 45 различных штаммов H. alvei (1 мг/мл), переносили на мембрану из ПВДФ в объеме 3×5 мкл. Мембрану инкубировали по очереди с нормальной человеческой сывороткой (источник фиколина-3), мышиными моноклональными антителами, направленными против фиколина-3 (H) (клон 4H5, HM2089, HyCult Biotechnology) и мечеными пероксидазой хрена кроличьими противомышиными lg антителами (ПХ) (DAKO). Было показано, что человеческий фиколин-3 связывается со следующими ЛПС, выделенными из H. alvei: 2, 23, 37, 38, 981, 1200, 1203, 1205, 1208 (Фиг.2).
ПРИМЕР 2. Связывание человеческого фиколина-3 (Н) с ЛПС из H. alvei в иммуноблот-анализе. Изучаемые липополисахариды (ЛПС 23, 1200, 1203, 1205) разделяли в 15% полиакриламидном геле и затем переносили на мембрану из ПВДФ. Мембрану инкубировали по очереди с нормальной человеческой сывороткой (источник фиколина-3), мышиными моноклональными антителами, направленными против фиколина-3 (H) (клон 4H5, HM2089, HyCult Biotechnology) и мечеными пероксидазой хрена кроличьими противомышиными lg антителами (ПХ) (DAKO). Анализ с помощью ДСН-ПААГ/Вестерн-блота (Фиг.3) показал, что за реакцию ответственны высокомолекулярные фракции указанных выше липополисахаридов, О-специфические полисахариды.
ПРИМЕР 3. Обнаружение методом ИФА связывания фиколина-3 и зависимой от комплексов фиколин-3/МАБР-2 активации C4 элемента системы комплемента с помощью липополисахаридов H. alvei. С помощью ИФА было показано, что ЛПС H. alvei 23, 981, 1200 и 1203 не только связаются с фиколином-3, но также активируют C4 элемент комплемента через комплексы такого лектина с протеазами MASP антитело-независимым способом (Фиг.4B). Липополисахариды наносили на микротитровальные планшеты MaxiSorp U96 (Nunc). После стадии блокировки анализируемую сыворотку крови человека (источник фиколина-3) добавляли в буфер с высокой концентрацией NaCl (Petersen et al., 2001), чтобы исключить активацию комплемента по классическому пути (зависимому от комплекса антиген-антитело). После инкубации в течение 18 ч при 4°C связывание фиколина-3 (H) с ЛПС выявляли с применением специфичных моноклональных антител, направленных против фиколина-3 (H) (клон 4H5, HM2089, HyCult Biotechnology) и меченых пероксидазой хрена кроличьих противомышиных антител (Фиг.4A). Как альтернатива, в качестве источника фактора С4 к индуцированным комплексам фиколин-3/ЛПС добавляли соответствующим образом разбавленную сыворотку. После инкубации в течение 2 часов при 37°C связавшийся продукт активации C4 выявляли с применением кроличьих противочеловеческих антител к C4 (Sigma) и меченых ПХ козьих противокроличьих иммуноглобулинов (Dako) (Фиг.4B).
ПРИМЕР 4. Оценка связывания рекомбинантного Н-фиколина 3 (H) с клетками H. alvei 1200 с помощью проточной цитометрии. Бактериальные клетки H. alvei 1200, инактивированные и фиксированные формальдегидом, инкубировали с рекомбинантным фиколином-3 (H), затем связавшийся белок выявляли с применением селективных мышиных моноклональных антител, а затем с помощью FITC-конъюгированных антител, специфичным к мышиным иммуноглобулинам (Фиг.5B). Реакционную способность оценивали с помощью проточного цитометра Cytomics FC 500 MPL Beckman-Coulter. В качестве контроля использовали бактерии H. alvei PCM 1209, содержащие ЛПС, не связывающийся с фиколином-3 (H) (Фиг.5В). С помощью проточной цитометрии было также обнаружено, что рекомбинантный фиколин-3 (H) связывается с поверхностными структурами клетками штамма Н. alvei 1200 (Фиг.5 В), но не с Н. alvei 1209 (данные не приведены).
ПРИМЕР 5. Получение с помощью химического расщепления и структурный анализ полисахарида PS1, изолированного из ЛПС H. alvei 1200. Получение липополисахарида из штамма H. alvei 1200 описано Дагом с соавторами (Dag, Niedziela et al., 2004). Бактерии выращивали в жидкой среде Дэвиса при 37°C. Через 48 ч роста бактерии инактивировали добавлением 0,5% фенола и центрифугировали с использованием проточной лабораторной центрифуги СЕРА со скоростью 39000 об/мин и промывали 3 л воды. Полученную бактериальную массу ресуспендировали в воде и лиофилизировали. Лиофилизированные бактерии тщательно ресуспендировали в воде (2 г/25 мл) с последующим добавлением равного объема 90% фенола. Полученной таким образом раствор липополисахаридов в 45% феноле экстрагировали при температуре 65°C в течение 15 мин по методу Вестфаля и Янна (Westphal i Jann, 1965). Собранные и объединенные водные фазы затем подвергали диализу против дистиллированной воды. ЛПС отделяли от нуклеиновых кислот с помощью тройного ультрацентрифугирования (105000 xg, 6 часов). Очищенные ЛПС (200 мг) подвергали мягкому кислотному гидролизу с 1,5% уксусной кислотой при 100°C в течение 45 мин. Раствор центрифугировали для отделения осадка липида А, присутствующего в водном растворе, от поли- и олигосахаридов (13000 g, 20 мин). Надосадочную жидкость, содержащую растворенные поли- и олигосахариды, сублимировали, а затем фракционировали с помощью гель-проникающей хроматографии на приборе Bio-Gel P-10, отделяя O-специфические цепи от коротких цепей полисахаридов и коровых олигосахаридов. Колонку уравновешивали с помощью буфера 0,05 M пиридин/уксусная кислота/вода (10/4/986) при pH 5,6. Собирали фракции объемом 1,2 мл (100 капель), непрерывно регистрируя разницу рефракционного индекса для элюента с колонки и контрольного буфера с помощью рефрактометра (Knauer, Germany). Изолированные таким образом фракции 1, 2, 3, 4, 5, 6, 7 подвергали начальному структурному анализу с помощью масс-спектрометрии MALDI-TOF и/или ESI-MS в режиме определения отрицательных ионов. На основе полученных масс-спектров фракции 1, 2, 3, 4 и 5 были выбраны в качестве полисахаридных фракций, содержащих в своей структуре O-специфический полисахарид. Спектры масс-спектрометрии MALDI-TOF (режим определения отрицательных ионов, матрица: 2,4,6-тригидроксиацетофенон), зарегистрированные для фракции 5, содержали молекулярные ионы масс, соответствующих полисахариду PS1, построенному из структуры PD1t-PD1-[Hep] Kdo (Фиг.1). Основной ион при m/z 2452,08 [M-H]- соответствовал структуре, построенной из двух повторяющихся звеньев O-специфических цепей, соединенных с дисахаридом Hep-Kdo, и дополнительно замещенным одной O-ацетильной группой (Фиг.1a), первый повторяющийся блок которого лишен концевой группы α-D-Glcp. Расчетная моноизотопная масса описанной структуры составила 2452,79 Да. Ион при m/z 2494,08 соответствовал описанной структуре, содержащей две O-ацетильные группы. Кроме того, для обоих вышеупомянутых ионов наблюдали варианты структуры [M-H2O-H]- (m/z 2474.05, 2434.09) и [M+Na-H]- (m/z 2516.06, 2474.07). Анализ спектров MALDI-TOF выявил присутствие в исследуемой фракции популяции молекул, лишенный обеих концевых групп D-Glcp и одной или двух O-ацетильных групп. Для компонентов фракции 5 с помощью 1H, 13C- и 1H, 31P-ЯМР-анализа были установлены последовательности остатков сахара в этом полисахариде и аномерные конфигурации связей. Проводили серии одно- и двумерных экспериментов (COSY, TOCSY, HSQC-DEPT, HMQC, НМВС, NOESY, ROESY). Зарегистрированные спектры позволили описать спиновые системы сахарных остатков, составляющих полисахарид фракции 5, результаты анализа представлены в Таблице 1. Интерпретация спектров, полученных в экспериментах НМВС, NOESY и ROESY, проведенных согласно правилам, известным специалистам в данной области, позволили установить последовательности благодаря выявлению связей между остатками с помощью связности 3JH,C и ЯЭО для аномерных протонов и углеродов. Полисахариды, присутствующие во фракции 5, образованы из двух повторяющихся блоков O-специфического полисахарида (Фиг.1), связанных с дисахаридом →7)-L-глицеро-D-манно-Hep-(1→8)-Kdo. Описанная связь образована из α-(1→7) гликозидной связи между первым остатком GlcNAc (остаток C) первого повторяющегося блока O-специфической цепи и углеродом C-7 из Kdo (остаток A) дисахарида (высокое значение химического сдвига для атома C-7, Таблица 1). Структура этого полисахарида представлена на Фиг.1. Наличие O-ацетильных групп в положении C-3 остатков E 'и е является причиной гетерогенности полисахарида, наблюдаемой в масс-спектрах. Кроме того, первый повторяющийся блок лишен концевого остатка α-D-Glcp-(1→(Фиг.1).
Наконец, фракция 5 представляет собой смесь полисахаридов, состоящую из двух повторяющихся блоков O-специфического полисахарида H. alvei PCM 1200 ЛПС, имеющих следующую общую формулу: PD1t-(PD1) N-[Hep] Kdo (где n=1), и структура которого показана на Фиг.1a, а символ «-[Hep]Kdo» обозначает структуру →7) - [L-глицеро-D-манно-Hep-(1→8)-]-Kdo. Аналогичный анализ был проведен для фракции 4. Фракция 4 представляет собой смесь полисахаридов, состоящих из трех повторяющихся звеньев O-специфического полисахарида ЛПС H. alvei PCM 1200, имеющих следующую общую формулу: PD1t-(PD1) N-[Hep] Kdo (где n=2). Масс-спектр, который был зарегистрирован для фракции 4 с помощью MALDI-TOF MS, показал кластер мажорных [MH]- ионов при m/z 3607,8 и m/z 3565,7. Ион при m/z 3607,8 [MH]- соответствует структуре, построенной из трех повторяющихся блоков O-специфичного полисахарида, соединенного с дисахаридом Hep-Kdo и дополнительно замещенного одной O-ацетильной группой (Фиг.1а), одно из повторяющихся звеньев которого не содержит концевой группы α-D-Glcp. Расчетная моноизотопная масса такой указанной выше структуры составляет 3608,17 Да. Ион [M-H] при m/z 3565,7 соответствует описанной структуре с одной O-ацетильной группой. Кроме того, для таких описанных выше ионов также были зарегистрированы ионы типа [M+Na-H]- (m/z 3629,8, 3587,7) и [M-H2O-H]- (m/z 3591, 3547,7). Анализ масс-спектров MALDI-TOF также показал, что изученная фракция содержала менее обильную популяцию молекул, лишенных двух концевых фрагментов α-D-Glcp, а также одной или двух O-ацетильных групп.
Нам не удалось получить спектры MALDI-TOF для фракций 3, 2 и 1, содержащих более 25 остатков сахара. Однако, согласно результатам анализа MALDI-TOF MS и ЯМР для фракции 4 и 5, можно предположить, что эти фракции содержат полисахариды, построенные из более чем 4 повторяющихся блоков O-специфичной цепи, замещающих дисахарид Hep-Kdo, имеющий общую формулу PD1-(PD1)n-[Hep]-Kdo (n≥2), где “-[Hep]-KDO” представляет собой структуру →7)-[L-глицеро-D-манно-Hep-(1→8)-]-Kdo.
ПРИМЕР 6. Получение восстановленного полисахарида PS1. Полисахаридную фракцию PS1 (22 мг) растворяли в 1 мл H2O и восстанавливали с помощью NaBH4 (10 мг) в течение 16 ч при температуре 37°C. Раствор подкисляли концентрированной CH3COOH. Продукт очищали с помощью гель-проникающей хроматографии на колонке Bio-Gel P-2, уравновешенной буфером 0,05 М пиридин/уксусная кислота/вода (10:4:986) при pH 5,6. Собирали фракции объемом 1,2 мл (100 капель), непрерывно регистрируя разницу рефракционного индекса для элюента с колонки и контрольного буфера с помощью рефрактометра (Knauer, Germany). Фракцию, содержащую восстановленный полисахарид, лиофилизировали.
ПРИМЕР 7. Получение конъюгата PS1-BSA. Восстановленный полисахарид PS1 (22 мг) растворяли в H2O (2 мл), и подводили pH раствора до значения 4,75. Затем добавляли 1-этил-3-(диметиламинопропил)-карбодиимида гидрохлорид (50 мг) к непрерывно перемешиваемому раствору PS1 и поддерживали pH 4,75 путем добавления 1 M HCl (Lonngren и Goldstein, 1978). После этого реакцию проводили в течение 1 ч, а затем добавляли 0,4 мл водного раствора БСА (5 мг/мл). Реакционную смесь инкубировали в течение 4 ч при комнатной температуре, а затем нейтрализовали 1 М K2HPO4. Продукт очищали с помощью гель-проникающей хроматографии, выполненные на сефадексе G-100, уравновешенной 5% этанолом в воде. Фракции объемом 1,2 мл собирали, непрерывно регистрируя разницу рефракционного индекса для элюента с колонки и контрольного буфера с помощью рефрактометра (Knauer, Germany). Полученные фракции проверяли на наличие белка с помощью дот-блота. Фракции, содержащие конъюгаты, концентрировали с использованием фильтра Amicon-ultra 15 до объема 1 мл. Половину продукта лиофилизировали, а половину хранили в 0,1% азиде натрия.
ПРИМЕР 8. Химическая иммобилизация восстановленного полисахарида PS1 на сефарозе 4B и его применение для очистки фиколина-3 из сыворотки крови человека. Активацию сефарозы 4B с бромцианом (BrCN) проводили в соответствии с методом, описанным Куатрекасасом и соавторами (Cuatrecasas, 1970). Активированную бромцианом сефарозу 4B связывали с диаминогексаном. После промывки водой гель (сефароза-NH2) ресуспендировали в 0,1 М NaHCO3 (pH 9,0). После этого сефарозу-NH2 конъюгировали с активированным ДХЭ PSвосст, 1200. Реакцию проводили в течение 16 ч, при pH 7,5 и температуре 80°C. Такой гель можно применять для очистки фиколина-3 из сыворотки крови человека и других жидкостей организма.
ПРИМЕР 9. Исследование методом ИФА связывания фиколина-3 (H) с липополисахаридом H. alvei 1200 и конъюгатом PS1200-BSA. На микротитровальные планшеты MaxiSorp U96 (NUNC) наносили липополисахарид 1200 (Фиг.6А) или конъюгат PS1200-BSA (Фиг.6В). После этапа блокировки анализируемый раствор с увеличиающимися концентрациями рекомбинантного фиколина-3 (H) добавляли к буферу с высокой концентрацией NaCl (Petersen et al., 2001), чтобы исключить активацию комплемента по классическому пути (зависимому от комплекса антиген-антитело). После инкубации в течение 18 ч при 4°C связывание фиколина-3 (H) с ЛПС выявляли с помощью специфичных моноклональных антител, направленных против фиколина-3 (H) (клон 4H5, HyCult Biotechnology), и меченых пероксидазой хрена кроличьих противомышиных антител. Рекомбинантный фиколин-3 (H) связывается не только с родными ЛПС, но и с конъюгатом PS1200-BSA (O-специфический полисахарид, полисахаридный продукт гидролиза ЛПС 1200, конъюгированный с БСА). Оба эти антигена связываются как с нативным фиколином-3 (H) из сыворотки крови человека, так и с рекомбинантным белком. (Фиг.6A, 6B).
ПРИМЕР 10. Связывание сывороточного фиколина-3 (H), фиколина-2 (L), фиколина-1 (M), маннан-связывающего лектина (МСЛ) и иммуноглобулинов с бычьим сывороточным альбумином, его ацетилированной формой и липополисахаридом H. alvei 1200, а также с полисахаридом, выделенным из H. alvei 1200, конъюгированным с БСА.
Сравнение связывания сывороточного фиколина-3 (H), фиколина-2 (L), фиколина-1 (M), маннан-связывающего лектина (МСЛ) и нативных иммуноглобулинов с ацетилированным БСА, липополисахаридом и конъюгатом PS1200-BSA (полисахарид, выделенный из H. alvei 1200, конъюгированный с БСА, PS1-BSA) и немодифицированным БСА проводили в двух различных буферах: в буфере, рекомендованном Мунте-Фог с соавторами (Munthe-Fog, Hummelshoj et al., 2009), содержащем Hepes, обозначенном как B1 (25 мМ Hepes, 155 мМ NaCl, 5 мМ CaCl2, 0,1% БСА, pH 7,4), и в гипертоническом буфере согласно Петерсену с соавторами (Petersen, Thiel et al., 2001) (B2: 20 мМ Трис-HCl, 1 М NaCl, 10 мМ CaCl2, 0,05% Triton X100, 0,1% БСА, pH 7,4) (Фиг.7). Было показано значительно более сильное связывание фиколина-3 (H) с ЛПС и PS-BSA H. alvei 1200, по сравнению с ацетилированным альбумином, и отсутствием значимого связывания с другими исследованными элементами сыворотки, что подтверждает высокую специфичность реакции.
ПРИМЕР 11. Сравнение результатов измерений концентрации фиколина-3 (H) у взрослых здоровых доноров с помощью ИФА с применением лиганда PS1200-BSA и метода ИФА типа «сэндвич». В четырех образцах сыворотки, полученных от здоровых взрослых добровольцев, измеряли концентрацию фиколина-3 (H) методом ИФА, используя в качестве стандарта рекомбинантные формы фиколина-3, лигандом которых является PS1200-BSA (полисахарид Н. alvei 1200, конъюгированный с БСА). Были получены следующие значения: 28030 нг/мл; 16926 нг/мл и 9973 нг/мл. При использовании ИФА типа «сэндвич», описанного в литературе (Munthe-Fog, Hummelshoj et al., 2009), были получены следующие результаты: 32700 нг/мл, 19500 нг/мл и 12000 нг/мл, соответственно (авторы выражают благодарность за любезное содействие профессору Йенсу С.Йенсениусу, Университет г.Орхус, Дания). Полученные результаты соответствуют ожидаемым, и значения несколько выше за счет измерения общей концентрации фиколина-3 (H), тогда как предлагаемый метод с использованием конъюгата PS1200-BSA позволяет измерять только биологически активный.
ПРИМЕР 12. Определение концентрации фиколина-3 в сыворотке крови здоровых взрослых доноров с помощью ИФА с применением лиганда BSA-PS1200. Отдельные значения концентрации фиколина-3 определяли методом ИФА в сыворотке крови, полученной от 25 здоровых взрослых доноров. На планшеты (MaxiSorp U96) наносили конъюгат PS1200-BSA (полисахарид Н. alvei 1200, конъюгированный с БСА). После этапа блокировки добавляли анализируемую сыворотку, разбавленную 1:200 в буфере B2 (20 мМ Трис-HCl, 1 М NaCl, 10 мМ CaCl2, 0,05% Triton X-100, 0,1% БСА, pH 7,4). Связанный белок обнаруживали с помощью моноклональных антител против фиколина-3 (H) (клон 4H5) и меченых пероксидазой хрена противомышиных антител. В качестве эталона использовали сыворотку крови человека с заданной (по отношению к рекомбинантному белку) концентрацией фиколина-3 (H). Результаты отдельных измерений концентрации фиколина-3 (H) показаны на Фиг. 8. Средняя концентрация составила 19251 нг/мл (срединное значение: 17622 нг/мл, диапазон: 8751-34675 нг/мл).
ПРИМЕР 13. Определение активности комплексов фиколин-З/МАЗР-2 у здоровых взрослых доноров с помощью ИФА с применением лиганда PS1200-BSA. На планшеты MaxiSorp U96 наносили PS-BSA H alvei 1200, и использовали их для определения способности комплексов фиколин-3/МАSP-2 активировать экзогенный компонент C. В качестве эталона использовали сыворотку с известной концентрацией фиколина-3. Активность комплексов фиколин-3/МАSР-2 в сыворотке крови принимали за 1000 мЕ/мл. Средняя активность комплексов фиколин-3/MASP-2 среди 25 проанализированных сывороток составила 822 мЕ/мл (срединное значение: 847 мЕ/мл, диапазон: 421-1309 мЕ/мл). Результаты отдельных измерений активности комплексов фиколина-3/МАSР-2 S показаны на Фиг.9. В анализируемой сыворотке наблюдалась статистически значимая корреляция между концентрацией фиколина-3 и активностью его комплексов с MASP-2 (коэффициент корреляции Пирсона R=0,683, p<0,0002) (Фиг.10).
| Таблица 1 | ||||||||||
| Значения химического сдвига для 1H и 13C (δС, δн) компонентов фракции 5, изолированной из ЛПС H. alvei PCM 1200 | ||||||||||
| Остатки | JH1,C1 | Химический сдвиг [м.д.] | ||||||||
| H1/C1 | H2/C-2 | H3/C3 (H3ax, H3eq) | H4/C4 (δp) | H5/C5 | H6a, 6b/C6 | H7a, 7b/C7 | H8a, 8b/C8 | |||
| A | →7,8)-α-Kdop-(2→ | - | -/174 | -/96,7 | (1,80, 2,05)/34,2 | 4,05/65,9 | 4,14/66,2 | 4,03/ 69,0a | 4,10/75,7a | 3,51, 3,74/64,4 |
| B | L-глицеро-α-D-манно-Hepp-(1→a | 173 Гц | 4,77/99,3 | 3,89/69,9 | 3,82/70,8 | 3,83/66,2 | 3,59/71,4 | 3,98/69,3 | 3,58, 3,66/ 63,7a | |
| C/[c] | →3)-α-D-GlcpNAc-(1→ | 177 Гц | 5,05/97,3 | 4,03/52,3 | 3,95/79,4 [3,86/82,5] | 3,65/67,7 | 4,20/71,2 | 3,85, 3,78/60,1 | ||
| D | →2,3)-β-D-Galp-(1→ | 168 Гц | 4,58/100,7 | 3,87/75,1 | 4,27/78,6 | 4,10b/67,7 | 3,70c/74,9 | 3,77-3,70d/60,8 | ||
| D' | →2,3)-D-Galp-(1→ | 168 Гц | 4,57/100,8 | 3,91/75,1 | 4,29/78,6 | 4,10b/67,7 | 3,70с/74,9 | 3,77-3,70d/60,9 | ||
| d | →2,3,4)-β-D-Galp-(1→ | 166 Гц | 4,66/100,2 | 3,97/74,6 | 4,36/77,5 | 4,19/76,9 | 3,75a/75,0 | n/60,2 | ||
| E | β-D-GlcpNAc-(1→ | 166 Гц | 4,91/100,4 | 3,76/55,5 | 3,51a/75,0 | 3,45/70,0 | 3,43/76,2 | 3,73, 3,91/60,9 | ||
| E' | β-D-GlcpNAc3OAc-(1→ | 165 Гц | 5,03/99,7 | 3,84/54,0 | 4,93/77,2 | 3,59/68,0 | 3,51/76,1 | 3,72, 3,93/60,9 | ||
| e | β-D-GlcpNAc3OAc-(1→ | 165 Гц | 5,05/99,7 | 3,87/53,9 | 4,98/76,7 | 3,67/67,7 | 3,53/76,1 | 3,76, 3,91/60,9 | ||
| f | β-D-Glcp-(1→ | 173 Гц | 5,00/100,3 | 3,51/72,1 | 3,76/72,4 | 3,48/69,5 | 3,94d/72,2 | 3,84, 3,95d/60,1 | ||
| G | →1)-Gro-(3-P→ | - | 3,70, 3,99/70,8e | 4,07/69,5f | 4,01, 3,93/66,5 | (0,76) | ||||
| g | →1)-Gro-(3-P→ | - | 3,70, 3,99/70,8e | 4,07/69,5f | 4,04, 3,98/66,5 | (0,19) | ||||
| H | →3)-β-D-Quip4NAc-(1→ | 164 Гц | 4,45/102,8 | 3,41/72,5 | 3,68/77,4 | 3,71/56,7 | 3,51/71,2 | 1,16/16,5 | ||
| h | β-D-Quip4NAc-(1→ | 164 Гц | 4,44/102,8 | 3,36/73,8 | 3,50/73,5 | 3,57/56,7 | 3,56/71,2 | 1,20/16,9 | ||
| a Спектры 1H, 13C - ЯМР были получены с помощью спектрометра Bruker Avance II 600 МГц при 303K. Остатки, обозначенные заглавными буквами, относятся к первому повторяющемуся блоку с восстанавливающего конца O-специфичного полисахарида. Остатки, обозначенные строчными буквами, относятся к компонентам второго повторяющегося блока. Внутренний стандарт: ацетон (δH 2.225, δС 31.05); n - значения химического сдвига не определены, a) Предлагаемое распределение соответствует эталону (Dag, Niedziela et al., 2004); b, c, d, e, f) - неразличимые сигналы. | ||||||||||
| Таблица 2 | |||||
| Выбранные межостаточные значения ЯЭО и связность 3J между аномерными протонами и атомами углерода, наблюдаемые для фракции 5, изолированной из ЛПС H. alvei 1200 | |||||
| Остаток | Атом | Связность | Интерпретация сигнала | ||
| δH/δC (м.д.) | δC | δH | |||
| B | L-глицеро-α-D-манно-Hepp-(1→a | 4,77/99,3 | 64,2 | C-8 из A | |
| 71,4 | C-5 из B | ||||
| 70,9 | C-3 из B | ||||
| C | →3)-α-D-GlcpNAc-(1→ | 5,05/97,3 | 77,2 | 3,68* | C-3, H-3 из H |
| D | →2,3)-β-D-Galp-(1→ | 4,58/100,7 | 82,3 | 3,71 | H-5 из D' |
| 3,86 | C-3, H-3 из c | ||||
| D' | →2,3)-β-D-Galp-(1→ | 4,57/100,8 | 82,3 | 3,71 | H-5 из D |
| 3,86 | C-3, H-3 из c | ||||
| d | →2,3,4)-β-D-Galp(1→ | 4,66/100,2 | 79,3 | 3,94* | C-3, H-3 из C |
| 3,74 | H-5 из d | ||||
| E | β-D-GlcpNAc-(1→ | 4,91/100,4 | 75,1 | 3,87/3,91 | C-2, H-2 из D/D' |
| E” | β-D-GlcpNAc3OAc-(1→ | 5,03/99,7 | 75,2 | 3,87/3,91 | C-2, H-2 из D/D' |
| f | α-D-Glcp-(1→ | 5,00/100,3 | 73,0 | 4,19 | C-3 из f |
| H-4 из d | |||||
| G | →1)-Gro-(3-P→b) | H-3a, b/C-3 4,01, 3,93/66,5 δp: 0,76 | 4,28 | H-3 из D,D' | |
| g | →1)-Gro-(3-P→b) | H-3a, b/C-3 4,04, 3,98/66,5 δp: 0,19 | 4,35 | H-3 из d | |
| H | →3)-β-D-Quip4NAc-(1→ | 4,45/102,8 | 70,9 | 3,69, 4,00 | C-1, H-a,b из G |
| h | β-D-Quip4NAc-(1→ | 4,44/102,8 | 70,9 | 3,69, 4,00 | C-1, Н-a,b из g |
| a Спектры 1H, 13C-ЯМР были получены с помощью спектрометра Bruker Avance II 600 МГц при 303K. Остатки, обозначенные заглавными буквами, | |||||
| относятся к первому повторяющемуся блоку с восстанавливающего конца O-специфичного полисахарида. Остатки, обозначенные строчными буквами, относятся к компонентам второго повторяющегося блока. | |||||
| a) Значения, обозначенные звездочками, соответствуют только связности ЯЭО. | |||||
| b) Корреляции 1H, 31P-HMQC, показывающие связь между фосфатными группами и соответствующим атомом для остатков G и g. | |||||
Список литературы
Aderem, A. and R.J.Ulevitch (2000). "Toll-like receptors in the induction of the innate immune response." Nature 406:787.
Andersen, Т., L.Munthe-Fog, P Garred and S.Jacobsen (2009). "Serum levels of фиколин-3 (Hakata antigen) in patients with systemic lupus erythematosus." J Rheumatol 36(4):757-9.
Atkinson, A.P., M.Cedzynski, J.Szemraj, A. St Swierzko, L.Bak-Romaniszyn, M.Banasik, K.Zeman, M.Matsushita, M.L.Turner and D.C.Kilpatrick (2004). "L-фиколин in children with recurrent respiratory infections." Clin Exp Immunol 138(3):517-20.
Cedzynski, M., A.P.Atkinson, A. St Swierzko, S.L.MacDonald, A.Szala, K.Zeman, K.Buczylko, L.Bak-Romaniszyn, M.Wiszniewska, M.Matsushita, J.Szemraj, M.Banasik, M.L.Turner and D.C.Kilpatrick (2009). "L-фиколин (фиколин-2) insufficiency is associated with combined allergic and infectious respiratory disease in children." Mol Immunol 47(2-3):415-9.
Cedzynski, M., L.Nuytinck, A.P.Atkinson, A. St Swierzko, K.Zeman, J.Szemraj, A.Szala, M.L. urner and D.C.Kilpatrick (2007). "Extremes of L-фиколин concentration in children with recurrent infections are associated with single nucleotide polymorphisms in the FCN2 gene." Clin Exp Immunol 150(1):99-104.
Cuatrecasas, P.J. (1970). "Protein purification by affinity chromatography. Derivatizations of Agarose and polyacrylamide Beads." Journal of Biological Chemistry 245:3059-3065.
Dag, S., T.Niedziela, M.Dzieciatkowska, J.Lukasiewicz, W.Jachymek, C.Lugowski and L.Kenne (2004). "The O-acetylation patterns in the O-antigens of Hafnia alvei strains PCM 1200 and 1203, serologically closely related to PCM 1205." Carbohydr Res 339(15):2521-7.
Degn, S.E., A.G.Hansen, R.Steffensen, C.Jacobsen, J.C.Jensenius and S.Thiel (2009). "MAp44, a human protein associated with pattern recognition molecules of the complement system and regulating the lectin pathway of complement activation." J Immunol 183(11):7371-8.
Fukutomi, Т., В.Ando, S.Sakamoto, H.Sakai and H.Nawata (1996). "Thermolabile beta-2 macroglycoprotein (Hakata antigen) in liver disease: biochemical and immunohistochemical study." Clin Chim Acta 255(2):93-106.
Gamian, A., E.Romanowska, U.Dabrowski and J.Dabrowski (1991). "Structure of the O-specific, sialic acid containing polysaccharide chain and its linkage to the core region in lipopolysaccharide from Hafnia alvei strain 2 as elucidated by chemical methods, gas-liquid chromatography/mass spectrometry, and 1H NMR spectroscopy." Biochemistry. 30(20):5032-8.
Garlatti, V., L.Martin, M.Lacroix, E.Gout, G.J.Arlaud, N.M.Thielens and C.Gaboriaud "Structural Insights into the Recognition Properties of Human Фиколинэ." Journal of Innate Immunity 2(1):17-23.
Garred, P., C.Honore, Y.J.Ma, S.Rorvig, J.Cowland, N.Borregaard and T.HummelshAj (2010). "The Genetics of Фиколинз." Journal of Innate Immunity 2(1):3-16.
Garred, P., C.Honore, Y.J.Ma, L.Munthe-Fog and T.Hummelshoj (2009). "MBL2, FCN1, FCN2 and FCN3-The genes behind the initiation of the lectin pathway of complement." Mol Immunol 46(14):2737-44.
Gout, E., V.Garlatti, D.F.Smith, M.M.Lacroix, C.Dumestre-Perard, T.Lunardi, L.Martin, J.Y.Cesbron, G.J.Arlaud, C.Gaboriaud and N.M.Thielens (2010). "Carbohydrate recognition properties of human фиколинэ: Glycan array screening reveals the sialic acid binding specificity of M-фиколин." J Biol Chem. 285(9):6612-22
Herpers, B.L., B.A. de Jong, B.Dekker, P.C.Aerts, H. van Dijk, G. T. Rijkers and H. van Velzen-Blad (2009). "Hemolytic assay for the measurement of functional human mannose-binding lectin: a modification to avoid interference from classical pathway activation." J Immunol Methods 343(1):61-3.
Hoist, O., A.J.Ulmer, H.Brade, H.Flad and E.Rietschel (1996). "Biochemistry and cell biology of bacterial endotoxins." FEMS Immunology and Medical Microbiology 16:83-104.
Inoshita, H., M.Matsushita, S.Koide, G.Kusaba, M.Ishii, K.Onda, M.J.Gi, M.Nakata, I.Ohsawa, S.Horikoshi, H.Ohi and Y.Tomino (2009). "A novel measurement method for activation of the lectin complement pathway via both mannose-binding lectin (MBL) and L-фиколин." Journal of Immunological Methods 349(1-2):9-17.
Jachymek, W., J.Czaja, T.Niedziela, C.Lugowski and L.Kenne (1999). "Structural studies of the O-specific polysaccharide of Hafnia alvei strain PCM 1207 lipopolysaccharide." European Journal of Biochemistry 266(1):53-61.
Jachymek, W., C.Petersson, A.Helander, L.Kenne, C.Lugowski and T.Niedziela (1995). "Structural studies of the O-specific chain and a core hexasaccharide of Hafnia alvei strain 1192 lipopolysaccharide." Carbohydrate Research 269(1):125-38.
Katzenellenbogen, E., N.A.Kocharova, G.V.Zatonsky, M.Bogulska, D.Witkowska, A.S.Shashkov, Y.A.Knirel and E.Romanowska (1999). "Structure of the O-specific polysaccharide of Hafnia alvei 23 having an oligosaccharide-phosphate repeating unit." Journal of Carbohydrate Chemistry 18(5):545-558.
Katzenellenbogen, E., E.Romanowska, N.A.Kocharova, Y.A.Knirel, A.S.Shashkov and N.K.Kochetkov (1992). "The structure of a glycerol teichoic acid-like O-specific polysaccharide of Hafnia alvei 1205." Carbohydr Res. 231:249-60.
Kilpatrick, D.С, T.Fujita and M.Matsushita (1999). "P35, an opsonic lectin of the фиколин family, in human blood from neonates, normal adults, and recurrent miscarriage patients." Immunol Lett 67(2):109-12.
Lacroix, M., C.Dumestre-Perard, G.Schoehn, G.Houen, J.Y.Cesbron, G.J.Arlaud and N.M.Thielens (2009). "Residue Lys57 in the collagen-like region of human L-фиколин and its counterpart Lys47 in H-фиколин play a key role in the interaction with the mannan-binding lectin-associated serine proteases and the collectin receptor calreticulin." J Immunol 182(1):456-65.
Liu, Y., Y.Endo, D.Iwaki, M.Nakata, M.Matsushita, I.Wada, K.Inoue, M.Munakata and T.Fujita (2005). "Human M-фиколин is a secretory protein that activates the lectin complement pathway." J Immunol 175(5):3150-6.
Lonngren, J. and I.J.Goldstein (1978). Carbohydrate antigens: coupling melibionic acid to bovine serum albumin using water-soluble carbodiimide. Methods in Enzymoloov V. Ginsburg. New York, San Francisco, London, Academic Press. 50:160-162.
Lukasiewicz, J., T.Niedziela, W.Jachymek, L.Kenne and C.Lugowski (2009). "Two Kdo-heptose regions identified in Hafnia alvei 32 lipopolysaccharide: the complete core structure and serological screening of different Hafnia О serotypes." J Bacteriol. 191(2) 533-44. Epub 2008 Nov 14.
Matsushita, M. (2007). The фиколин family: an overwiev. Collagen-related lectins in innate immunity. D. Kilpatrick. Kerala, Trivandrum, Research Signpost:17-32.
Matsushita, M. (2010). "Фиколинэ: complement-activating lectins involved in innate immunity." Journal of Innate Immunity 2(1):24-32.
Matsushita, M., M.Kuraya, N.Hamasaki, M.Tsujimura, H.Shiraki and T.Fujita (2002). "Activation of the lectin complement pathway by H-фиколин (Hakata antigen)." J Immunol 168(7):3502-6.
Munthe-Fog, L, T.Hummelshoj, C.Honore, H.O.Madsen, H.Permin and P.Garred (2009). "Immunodeficiency associated with FCN3 mutation and фиколин-3 deficiency." N Engl J Med 360(25):2637-44.
Niedziela, Т., С.Petersson, A.Helander, W.Jachymek, L.Kenne and C.Lugowski (1996). "Structural studies of the O-specific polysaccharide of Hafnia alvei strain 1209 lipopolysaccharide." European Journal of Biochemistry 237(3):635-41.
Petersen, S.V., S.Thiel, L.Jensen, R.Steffensen and J.C.Jensenius (2001). "An assay for the mannan-binding lectin pathway of complement activation." J Immunol Methods. 257(1-2):107-16.
Petersson, C, W.Jachymek, L.Kenne, T.Niedziela and C.Lugowski (1997). "Structural studies of the O-specific chain of Hafnia alvei strain PCM 1190 lipopolysaccharide." Carbohydrate Research 298(3):219-27.
Rietschel, E.Т., H.Brade, O.Hoist, L.Brade and e. al. (1996). Bacterial endotoxin: chemical constitution, biological recognition, host response, and immunological detoxification. Pathology of Septic Shock. E.T.Rietschel and H.Wagner. Berlin, Heidelberg, New York, Springer-Verlag:40-81.
Runza, V.L., W.Schwaeble and D.N.Mannel (2008). "Фиколинэ: novel pattern recognition molecules of the innate immune response." Immunobioloqy 213(3-4):297-306.
Schlapbach, L.J., C.Aebi, A.G.Hansen, A.Hirt, J.C.Jensenius and R.A.Ammann (2009). "H-фиколин serum concentration and susceptibility to fever and neutropenia in paediatric cancer patients." Clin Exp Immunol 157(1):83-9.
Sugimoto, R., Y.Yae, M.Akaiwa, S.Kitajima, Y.Shibata, H.Sato, J.Hirata, K.Okochi, K.Izuhara and N.Hamasaki (1998). "Cloning and characterization of the Hakata antigen, a member of the фиколин/opsonin p35 lectin family." J Biol Chem 273(33):20721-7.
Svendsen, С.В., Т.Hummelshoj, L.Munthe-Fog, N.Milman, P.Garred, I.A.Laursen, M.Christiansen and K.A.Krogfelt (2008). "Фиколинэ and Mannose-Binding Lectin in Danish patients with sarcoidosis." Respir Med 102(9):1237-42.
Swierzko, A.S., A.P.Atkinson, M.Cedzynski, S.L.MacDonald, A.Szala, I.Domzalska-Popadiuk, M.Borkowska-Klos, A.Jopek, J.Szczapa, M.Matsushita, J.Szemraj, M.L.Turner and D.C.Kilpatrick (2009). "Two factors of the lectin pathway of complement, L-фиколин and mannan-binding lectin, and their associations with prematurity, low birthweight and infections in a large cohort of Polish neonates." Mol Immunol 46(4):551-8.
Thiel, S. (2007). "Complement activating soluble pattern recognition molecules with collagen-like regions, mannan-binding lectin, фиколинэ and associated proteins." Mol Immunol 44(16):3875-88.
Tsujimura, M., T.Miyazaki, E.Kojima, Y.Sagara, H.Shiraki, K.Okochi and Y.Maeda (2002). "Serum concentration of Hakata antigen, a member of the фиколинэ, is linked with inhibition of Aerococcus viridans growth." Clin Chim Acta 325(1-2):139-46.
Wang, С.С, K.W.Yim, Т.С.Poon, K.W.Choy, C.Y.Chu, W.T.Lui, T.K.Lau, M.S.Rogers and T.N.Leung (2007). "Innate immune response by фиколин binding in apoptotic placenta is associated with the clinical syndrome of preeclampsia." Clin Chem 53(1):42-52.
Westphal, O. and K.Jann (1965). " Bacterial lipopolysacharides: Extraction with phenol-water and further applications of the procedure." Methods Carbohvdr. Chem. 5:83-89.
Wittenborn, Т., S.Thiel, L.Jensen, H.J.Nielsen and J.C.Jensenius (2010). "Characteristics and biological variations of М-фиколин, a pattern recognition molecule, in plasma." J Innate Immun 2(2):167-80.
Yae, Y., S.Inaba, H.Sato, K.Okochi, F.Tokunaga and S.Iwanaga (1991). "Isolation and characterization of a thermolabile beta-2 macroglycoprotein ('thermolabile substance' or 'Hakata antigen') detected by precipitating (auto) antibody in sera of patients with systemic lupus erythematosus." Biochim Biophvs Acta 1078(3):369-76.
Claims (14)
1. Полисахарид, обладающий сродством к фиколину-3, или его производное, характеризующийся тем, что он содержит олигосахаридный повторяющийся блок общей формулы:
PDt-(PD)n-[Hep]-Kdo,
где n является целым числом от 0 до 100, предпочтительно менее 50, PDt обозначает:
- повторяющийся олигосахаридный блок PD1t, имеющий формулу:
,
- повторяющийся олигосахаридный блок PD2t, имеющий формулу:
,
или
- повторяющийся олигосахаридный блок PD3t, имеющий формулу:
,
PD обозначает:
- повторяющийся олигосахаридный блок PD1, имеющий формулу:
- повторяющийся олигосахаридный блок PD2, имеющий формулу:
или
- повторяющийся олигосахаридный блок PD3, имеющий формулу:
- [Hep]-Kdo обозначает повторяющийся олигосахаридный блок, имеющий формулу:
PDt-(PD)n-[Hep]-Kdo,
где n является целым числом от 0 до 100, предпочтительно менее 50, PDt обозначает:
- повторяющийся олигосахаридный блок PD1t, имеющий формулу:
,
- повторяющийся олигосахаридный блок PD2t, имеющий формулу:
,
или
- повторяющийся олигосахаридный блок PD3t, имеющий формулу:
,
PD обозначает:
- повторяющийся олигосахаридный блок PD1, имеющий формулу:
- повторяющийся олигосахаридный блок PD2, имеющий формулу:
или
- повторяющийся олигосахаридный блок PD3, имеющий формулу:
- [Hep]-Kdo обозначает повторяющийся олигосахаридный блок, имеющий формулу:
3. Полисахарид по п. 1, характеризующийся тем, что полисахарид представляет собой восстановленный полисахарид общей формулы PDt-(PD)n-[Hep]-Kdo, в котором остаток Kdo присутствует на восстанавливающем конце в виде линейного полиспирта, дезокси-1-карбокси-3-дезоксиоктитола, с карбоксильной группой и дезокси-группой у первого и третьего атома углерода, соответственно.
4. Производное полисахарида по пп. 1-3, характеризующееся тем, что оно представляет собой конъюгат полисахарида с известным белком-носителем или хроматографическим носителем, где белок-носитель представляет собой сывороточный альбумин позвоночных, овальбумин, а хроматографический носитель представляет собой модифицированную агарозу, целлюлозу или полиакриламид.
5. Способ получения полисахаридов, обладающих сродством к фиколину-3 или их производных, характеризующийся тем, что:
а) выделяют бактериальный липополисахарид, предпочтительно из штамма Н. alvei, при этом на этапе (а) осуществляют культивирование штамма Н. alvei, и такой штамм Н. alvei выбран из: штамма Н. alvei 981, депонированного в Польской коллекции микроорганизмов под номером В/00030, штамма Н. alvei 1200, депонированного в Польской коллекции микроорганизмов под номером В/00031, штамма Н. alvei 1203, депонированного в Польской коллекции микроорганизмов под номером В/00032, штамма Н. alvei 1205, депонированного в Польской коллекции микроорганизмов под номером В/00033, или штамма Н. alvei 1208, депонированного в Польской коллекции микроорганизмов под номером В/00034,
б) полученный липополисахарид расщепляют и отделяют полисахаридную фракцию,
в) выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа,
г) как альтернатива, полученные полисахариды восстанавливают, в частности в присутствии NaBH4, и предпочтительно конъюгируют с известным белком-носителем или хроматографической средой.
а) выделяют бактериальный липополисахарид, предпочтительно из штамма Н. alvei, при этом на этапе (а) осуществляют культивирование штамма Н. alvei, и такой штамм Н. alvei выбран из: штамма Н. alvei 981, депонированного в Польской коллекции микроорганизмов под номером В/00030, штамма Н. alvei 1200, депонированного в Польской коллекции микроорганизмов под номером В/00031, штамма Н. alvei 1203, депонированного в Польской коллекции микроорганизмов под номером В/00032, штамма Н. alvei 1205, депонированного в Польской коллекции микроорганизмов под номером В/00033, или штамма Н. alvei 1208, депонированного в Польской коллекции микроорганизмов под номером В/00034,
б) полученный липополисахарид расщепляют и отделяют полисахаридную фракцию,
в) выделяют полисахаридную фракцию, содержащую полисахариды, образованные из повторяющихся блоков с молекулярной массой в диапазоне от 2400 до 26000 кДа,
г) как альтернатива, полученные полисахариды восстанавливают, в частности в присутствии NaBH4, и предпочтительно конъюгируют с известным белком-носителем или хроматографической средой.
6. Способ по п. 5, характеризующийся тем, что экстрагирование липополисахарида из бактериальной массы осуществляют на этапе (а) в течение 15 минут при температуре 65°C в водном растворе фенола, предпочтительно растворе фенола в концентрации 45%, с последующим восстановлением липополисахарида из отделенной водной фазы.
7. Способ по п. 5, характеризующийся тем, что отделенный полисахарид гидролизуют на этапе (б) в 1-1,5% растворе уксусной кислоты, от 15 до 60 мин при температуре 100°C.
8. Способ по п. 5, характеризующийся тем, что полисахаридную фракцию разделяют с помощью хроматографии на стадии (в) для отделения O-специфических цепей от более коротких цепей полисахаридов и коровых олигосахаридов, при этом хроматографию предпочтительно проводят на колонке, заполненной полиакриламидным гелем, таким как коммерчески доступный Bio-Gel Р-10, уравновешенной буфером, содержащим 0,05 М пиридин/уксусная кислота/вода в соотношении 10/4/986 при pH 5,6.
9. Способ по п. 5, характеризующийся тем, что полученные полисахариды восстанавливают и конъюгируют с белком-носителем на этапе (г), при этом такой белок-носитель может, в частности, представлять собой бычий сывороточный альбумин или хроматографическую среду, и особенно предпочтительным является модифицированная агароза.
10. Применение бактериального липополисахарида или полисахарида, содержащегося в нем, или их производных в качестве лиганда для фиколина-3, в частности для очистки или детекции фиколина-3 или его производных, характеризующееся тем, что применяемый ЛПС получен от штамма, выбранного из штамма Н. alvei 981, депонированного в Польской коллекции микроорганизмов под номером В/00030, штамма H. alvei 1200, депонированного в Польской коллекции микроорганизмов под номером В/00031, штамма Н. alvei 1203, депонированного в Польской коллекции микроорганизмов под номером В/00032, штамма Н. alvei 1205, депонированного в Польской коллекции микроорганизмов под номером В/00033, или штамма H. alvei 1208, депонированного в Польской коллекции микроорганизмов под номером В/00034.
11. Применение по п. 10, характеризующееся тем, что полисахарид или его производное, как они определены в пп. 1-4, применяют или получают с помощью способа, описанного в пп. 5-9.
12. Применение по п. 10, характеризующееся тем, что производное фиколина-3 представляет собой комплекс фиколина-3 с сывороточными или полученными из плазмы сериновыми протеазами, MASP.
13. Применение по п. 10, характеризующееся тем, что детекцию проводят с целью определения активности и/или уровня фиколина-3 или его производного в сыворотке крови и других жидкостях организма.
14. Применение по п. 10, характеризующееся тем, что очистку проводят с целью получения сыворотки или плазмы, лишенной фиколина-3.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PLPL391475 | 2010-06-11 | ||
| PL391475A PL232187B1 (pl) | 2010-06-11 | 2010-06-11 | Polisacharyd oraz jego pochodne posiadające powinowactwo do fikoliny-3, sposób ich otrzymywania i zastosowania |
| PCT/PL2011/050024 WO2011155859A2 (en) | 2010-06-11 | 2011-06-11 | Polysaccharide and derivatives thereof, showing affinity to ficolin-3, method of preparation and use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012156708A RU2012156708A (ru) | 2014-07-20 |
| RU2575752C2 true RU2575752C2 (ru) | 2016-02-20 |
Family
ID=
Non-Patent Citations (1)
| Title |
|---|
| Tsujimura Misushi et al "Detection of serum thermolabile beta-2 macroglycoprotein (Hakata Antigen) by Enzyme-Linked Immunosorbent Assay Using Polysaccharide Produced by Aerococcus viridans", CLINICAL AND DIAGNOSTIC LABORATORY IMMUNOLOGY, MAR. 2001, vol.2, N3, 6 с. (с.455-456).WO 2005/051662 A1, 09.06.2005. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Geurtsen et al. | Identification of mycobacterial α-glucan as a novel ligand for DC-SIGN: involvement of mycobacterial capsular polysaccharides in host immune modulation | |
| Zähringer et al. | Structure and biological activity of the short-chain lipopolysaccharide from Bartonella henselae ATCC 49882T | |
| Rossez et al. | Almost all human gastric mucin O-glycans harbor blood group A, B or H antigens and are potential binding sites for Helicobacter pylori | |
| Harale et al. | Synthesis and immunochemical evaluation of a novel Neisseria meningitidis serogroup A tetrasaccharide and its conjugate | |
| Man-Kupisinska et al. | Interaction of mannose-binding lectin with lipopolysaccharide outer core region and its biological consequences | |
| Campagnari et al. | Use of pyocin to select a Haemophilus ducreyi variant defective in lipooligosaccharide biosynthesis | |
| Hanisch et al. | Specificity of S fimbriae on recombinant Escherichia coli: preferential binding to gangliosides expressing NeuGc alpha (2-3) Gal and NeuAc alpha (2-8) NeuAc | |
| EP0126043B1 (en) | Carbohydrate derivatives and compositions thereof for therapeutic or diagnostic use | |
| JPWO2014178195A1 (ja) | 糖鎖抗原の免疫誘導剤 | |
| Lillehoj et al. | Mammalian neuraminidases in immune-mediated diseases: mucins and beyond | |
| Deutschmann et al. | The loss of tolerance to CHI3L1–a putative role in inflammatory bowel disease? | |
| Sandal et al. | Identification, structure, and characterization of an exopolysaccharide produced by Histophilus somni during biofilm formation | |
| Smit et al. | Structure of a novel lipid A obtained from the lipopolysaccharide of Caulobacter crescentus | |
| KR20040018329A (ko) | 헬리코박터 파일로리의 신규한 수용체 및 그의 용도 | |
| Swierzko et al. | New functional ligands for ficolin-3 among lipopolysaccharides of Hafnia alvei | |
| US9382338B2 (en) | Polysaccharide and derivatives thereof, showing affinity to ficolin-3, method of preparation and use | |
| Andersen et al. | Synthesis of ganglioside epitopes for oligosaccharide specific immunoadsorption therapy of Guillian-Barré syndrome | |
| RU2575752C2 (ru) | Полисахарид и его производные с активностью к фиколину-3, способ получения и применения | |
| Zheng et al. | Ginseng-derived type I rhamnogalacturonan polysaccharide binds to galectin-8 and antagonizes its function | |
| Beynon et al. | Identification of the common antigenic determinant shared by Streptococcus pneumoniae serotypes 35A and 20 capsular polysaccharides—structural analysis of the Streptococcus pneumoniae serotype 35A capsular polysaccharide | |
| Fudala et al. | Structure and serological characterization of the O-antigen of Proteus mirabilis O18 with a phosphocholine-containing oligosaccharide phosphate repeating unit | |
| Duk et al. | Structure of a neutral glycosphingolipid recognized by human antibodies in polyagglutinable erythrocytes from the rare NOR phenotype | |
| Wu et al. | Recognition factors of Dolichos biflorus agglutinin (DBA) and their accommodation sites | |
| Kondakova et al. | Structural and serological studies of the O-antigen of Proteus mirabilis O-9 | |
| Anderson et al. | Structure of the O-antigen of Escherichia coli 0119lipopolysaccharide |