RU201487U1 - Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала - Google Patents
Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала Download PDFInfo
- Publication number
- RU201487U1 RU201487U1 RU2020119110U RU2020119110U RU201487U1 RU 201487 U1 RU201487 U1 RU 201487U1 RU 2020119110 U RU2020119110 U RU 2020119110U RU 2020119110 U RU2020119110 U RU 2020119110U RU 201487 U1 RU201487 U1 RU 201487U1
- Authority
- RU
- Russia
- Prior art keywords
- analysis
- test
- viral
- membrane
- potato
- Prior art date
Links
- 238000004458 analytical method Methods 0.000 title claims abstract description 57
- 230000003612 virological effect Effects 0.000 title claims abstract description 20
- 230000003321 amplification Effects 0.000 title description 7
- 238000003199 nucleic acid amplification method Methods 0.000 title description 7
- 244000052616 bacterial pathogen Species 0.000 title description 3
- 244000052613 viral pathogen Species 0.000 title description 3
- 238000012360 testing method Methods 0.000 claims abstract description 77
- 235000002595 Solanum tuberosum Nutrition 0.000 claims abstract description 33
- 244000061456 Solanum tuberosum Species 0.000 claims abstract description 33
- 239000012528 membrane Substances 0.000 claims abstract description 32
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims abstract description 29
- 239000010931 gold Substances 0.000 claims abstract description 29
- 229910052737 gold Inorganic materials 0.000 claims abstract description 29
- 239000002105 nanoparticle Substances 0.000 claims abstract description 29
- 244000052769 pathogen Species 0.000 claims abstract description 25
- 239000000427 antigen Substances 0.000 claims abstract description 20
- 102000036639 antigens Human genes 0.000 claims abstract description 20
- 108091007433 antigens Proteins 0.000 claims abstract description 20
- QIGBRXMKCJKVMJ-UHFFFAOYSA-N Hydroquinone Chemical compound OC1=CC=C(O)C=C1 QIGBRXMKCJKVMJ-UHFFFAOYSA-N 0.000 claims abstract description 18
- 230000001580 bacterial effect Effects 0.000 claims abstract description 18
- 241000700605 Viruses Species 0.000 claims abstract description 16
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 claims abstract description 16
- 238000010186 staining Methods 0.000 claims abstract description 14
- 239000000203 mixture Substances 0.000 claims abstract description 11
- 241001136168 Clavibacter michiganensis Species 0.000 claims abstract description 8
- 241001160201 Dickeya solani Species 0.000 claims abstract description 8
- 241000588701 Pectobacterium carotovorum Species 0.000 claims abstract description 8
- 239000003365 glass fiber Substances 0.000 claims abstract description 8
- 229910001961 silver nitrate Inorganic materials 0.000 claims abstract description 8
- 241001148142 Pectobacterium atrosepticum Species 0.000 claims abstract description 7
- 230000009467 reduction Effects 0.000 claims abstract description 7
- 239000000020 Nitrocellulose Substances 0.000 claims abstract description 6
- 229920001220 nitrocellulos Polymers 0.000 claims abstract description 6
- 239000004793 Polystyrene Substances 0.000 claims abstract description 4
- 229920002223 polystyrene Polymers 0.000 claims abstract description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 claims abstract description 3
- 230000015572 biosynthetic process Effects 0.000 claims description 14
- 239000002245 particle Substances 0.000 claims description 9
- 230000001717 pathogenic effect Effects 0.000 claims description 9
- 238000006243 chemical reaction Methods 0.000 claims description 6
- 238000013508 migration Methods 0.000 claims description 6
- 230000005012 migration Effects 0.000 claims description 6
- 229910052709 silver Inorganic materials 0.000 claims description 6
- 239000004332 silver Substances 0.000 claims description 6
- 241000709769 Potato leafroll virus Species 0.000 claims description 5
- 239000007979 citrate buffer Substances 0.000 claims description 5
- 241000709992 Potato virus X Species 0.000 claims description 4
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 4
- 239000007864 aqueous solution Substances 0.000 claims description 4
- 230000001338 necrotic effect Effects 0.000 claims description 4
- 102000028557 immunoglobulin binding proteins Human genes 0.000 claims description 3
- 108091009323 immunoglobulin binding proteins Proteins 0.000 claims description 3
- 238000000926 separation method Methods 0.000 claims description 3
- 239000003463 adsorbent Substances 0.000 claims description 2
- 239000000419 plant extract Substances 0.000 claims description 2
- 239000000758 substrate Substances 0.000 claims description 2
- 229920002678 cellulose Polymers 0.000 claims 1
- 239000001913 cellulose Substances 0.000 claims 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims 1
- 238000001514 detection method Methods 0.000 abstract description 30
- 239000000284 extract Substances 0.000 abstract description 10
- 241000196324 Embryophyta Species 0.000 abstract description 7
- 208000032420 Latent Infection Diseases 0.000 abstract description 7
- 238000013459 approach Methods 0.000 abstract description 7
- 239000000463 material Substances 0.000 abstract description 5
- 239000007788 liquid Substances 0.000 abstract description 4
- 239000002250 absorbent Substances 0.000 abstract description 3
- 230000002745 absorbent Effects 0.000 abstract description 3
- 238000010521 absorption reaction Methods 0.000 abstract description 3
- 239000007787 solid Substances 0.000 abstract description 2
- 239000002131 composite material Substances 0.000 abstract 2
- 238000000605 extraction Methods 0.000 abstract 1
- 238000004451 qualitative analysis Methods 0.000 abstract 1
- 239000000243 solution Substances 0.000 description 15
- 238000006722 reduction reaction Methods 0.000 description 12
- 238000000034 method Methods 0.000 description 11
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 235000012015 potatoes Nutrition 0.000 description 8
- 150000003378 silver Chemical class 0.000 description 8
- 230000009471 action Effects 0.000 description 7
- 238000011161 development Methods 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 5
- 238000009825 accumulation Methods 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- -1 dinary Species 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 230000000984 immunochemical effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 206010061217 Infestation Diseases 0.000 description 2
- 241000710181 Potato virus M Species 0.000 description 2
- 241000723762 Potato virus Y Species 0.000 description 2
- 229910021607 Silver chloride Inorganic materials 0.000 description 2
- 230000008033 biological extinction Effects 0.000 description 2
- 238000004040 coloring Methods 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 208000037771 disease arising from reactivation of latent virus Diseases 0.000 description 2
- 239000011363 dried mixture Substances 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 230000002956 necrotizing effect Effects 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 230000003032 phytopathogenic effect Effects 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 238000011896 sensitive detection Methods 0.000 description 2
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 101710181478 Envelope glycoprotein GP350 Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- FOIXSVOLVBLSDH-UHFFFAOYSA-N Silver ion Chemical compound [Ag+] FOIXSVOLVBLSDH-UHFFFAOYSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000003749 cleanliness Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000011246 composite particle Substances 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000003317 immunochromatography Methods 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 150000007523 nucleic acids Chemical group 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 238000013102 re-test Methods 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/558—Immunoassay; Biospecific binding assay; Materials therefor using diffusion or migration of antigen or antibody
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Medicinal Chemistry (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Food Science & Technology (AREA)
- Virology (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Заявленное устройство предназначено для мультиплексного иммунохроматографического анализа широко распространенных патогенов картофеля вирусной (X, Y, S, М вирусы картофеля) и бактериальной (Dickeya solani, Pectobacterium carotovorum, Pectobacterium atrosepticum, Clavibacter michiganensis) природы в экстрактах листьев и клубней картофеля. Устройство представляет собой мультимембранный композит с предварительно нанесенными и высушенными иммунореагентами (тест-полоску), для проведения анализа не требуется дополнительного оборудования и времязатратных стадий. В состав мультимембранного композита входят пористая нитроцеллюлозная мембрана с предварительно нанесенными иммунореагентами, закрепленная на твердой полистироловой основе, приклеенная стекловолоконная мембрана, содержащая смесь конъюгатов наночастиц золота с кроличьими поликлональными антителами к десяти фитопатогенам вирусной и бактериальной природы, мембрана для впитывания и сепарации компонентов исследуемой пробы и конечной адсорбирующей мембраны для впитывания избытка пробы и поддержания миграции жидкости по тест-полоске за счет капиллярных сил. Отличительной особенностью заявленного устройства является комбинация мультиплексного иммунохроматографического анализа десяти фитопатогенов вирусной и бактериальной природы, и подхода для снижения предела обнаружения, основанного на восстановлении солей серебра на наночастицах золота, включенных в состав иммунных комплексов в тестовых зонах. Предложенный подход позволяет выявлять десять основных патогенов картофеля в рамках одного анализа в низких концентрациях, соответствующих латентным инфекциям. Для проведения анализа не требуется дорогостоящего стационарного оборудования, качественный анализ проводится визуально по наличию окрашенных точечных тестовых зон. Продолжительность анализа составляет 15 минут, включая стадии экстракции растительного материала, проведение анализа с использованием одной тест-полоски, добавления раствора, содержащего нитрат серебра и гидрохинон, для повышения интенсивности регистрируемого колориметрического сигнала. Технической задачей заявленной полезной модели является повышение интенсивности регистрируемого окрашивания в анализе проб с низким содержанием антигенов за счет реакции восстановления нитрата серебра, катализируемой наночастицами золота в составе иммунных комплексов. Технический результат заявленной полезной модели заключается в снижении предела обнаружения иммунохроматографического анализа десяти основных фитопатогенов вирусной и бактериальной природы. 3 табл., 1 ил.
Description
Полезная модель относится к мультиплексному иммунохроматографическому анализу широко распространенных патогенов картофеля вирусной (X, Y, S, М вирусы картофеля) и бактериальной (Dickeya solani, Pectobacterium carotovorum, Pectobacterium atrosepticum, Clavibacter michiganensis) природы, и может быть использована для экспрессного и высокопроизводительного лабораторного и внелабораторного скрининга фитопатогенов в рамках фитосанитарного контроля специализированными службами, контроля зараженности посевного и сортового материала, мониторинга зараженности частными хозяйствами.
Патогены картофеля вирусной и бактериальной природы широко распространены на территории Российской Федерации и часто встречаются в импортируемом материале. Заражение может происходить на всех стадиях выращивания, а также хранения картофеля. Заражение фитопатогенными микроорганизмами приводит к значительным экономическим потерям (до 100% урожая), ухудшает хранимость, потребительские свойства (размер и форма клубня), пищевую ценность клубней. Заражение картофеля несколькими патогенами одновременно приводит к синергетическому эффекту - более выраженным симптомам и увеличению потери урожая по сравнению с растениями, пораженными только одним видом патогена. Из-за отсутствия эффективных методов профилактики и лечения фитопатогенов в промышленных масштабах, своевременный контроль зараженности и отбраковка зараженного материала является единственным способом нивелирования негативных эффектов, вызванных поражением картофеля патогенами.
Детекция низких концентраций вирусов и бактерий, не вызывающих выраженных симптомов (так называемая латентная инфекция), представляет особый интерес для практического использования. Использование посевного материала с латентной инфекцией приведет к накоплению патогена в процессе культивирования растения. Для практических целей основной интерес представляют методы внелабораторной детекции фитопатогенов. Таким образом, разработка методов мультиплексной высокочувствительной детекции основных фитопатогенов вирусной и бактериальной природы актуальна и востребована для практического применения. Согласно нормативной документации - ГОСТ 33996-2016 «Картофель семенной. Технические условия и методы определения качества» - предел обнаружения для иммунохимических методов анализа составляет не менее 104 клеток/см3 для бактериальных и 10 нг/см3 для вирусных фитопатогенов. Однако для диагностики латентных инфекций необходимо достижение меньших пределов обнаружения. Предлагаемый в данной полезной модели мультиплексный иммунохроматографический анализ позволяет минимизировать время и трудозатраты по сравнению с моно-тестами при анализе большого количества проб, а за счет использования реакции восстановления солей серебра достигнуть пределов обнаружения, необходимых для диагностики латентных инфекций. Использование дополнительной стадии с реакцией восстановления серебра не приводит к существенному увеличению времени и усложнению анализа. Простота подготовки проб, проведения анализа и интерпретации результатов позволяет использовать мультиплексный иммунохроматографический анализ неквалифицированными пользователями во внелабораторных условиях.
Для высокочувствительной детекции фитопатогенов в настоящее время широко используются молекулярно-генетические (например, полимеразная цепная реакция) и иммунохимические (например, иммуноферментный анализ) методы анализа. Молекулярно-генетические методы основаны на выявлении специфической последовательности нуклеиновой кислоты патогена. Молекулярно-генетические методы характеризуются высокой специфичностью, низким пределом обнаружения и высокой достоверностью анализа. Однако основными факторами, ограничивающими применение данных методов для внелабораторной диагностики фитопатогенов являются особые требования к чистоте расходных материалов и помещений, наличие специальных навыков персонала для проведения анализа и интерпретации полученных результатов, использование дорогостоящего и стационарного оборудования. Таким образом, применение молекулярно-генетических методов остается ограниченным рамками лабораторного высокочувствительного анализа.
Иммунохимические методы диагностики основаны на высокоспецифичном взаимодействии антител с антигеном (патогеном) и последующей регистрацией иммунных комплексов. Иммунохимические методы диагностики широко используются как для лабораторного анализа фитопатогенов (иммуноферментный анализ), так и для внелабораторного определения (иммунохроматографический анализ). Достоинствами иммунохроматографического анализа являются простота подготовки проб и проведения анализа, малое время анализа и его низкая стоиомость. Иммунохроматографический анализ является одностадийным методом и может выполняться без дополнительных стадий отмывок и инкубации. Благодаря простоте подготовки проб, проведения анализа и интерпретации результатов иммунохроматографический анализ может выполняться неподготовленным пользователем во внелабораторных условиях. Иммунохроматографический анализ позволяет проводить как качественный (наличие/отсутствие окрашенных зон.), так и количественный анализ (регистрация интенсивности колориметрического сигнала). Однако, несмотря на все преимущества иммунохроматографического анализа, недостаточно низкий предел обнаружения ограничивает его применение.
Для снижения предела обнаружения иммунохроматографического анализа может быть использован подход, основанный на увеличении интенсивности регистрируемого колориметрического сигнала. Интенсивность регистрируемого колориметрического сигнала может быть увеличена за счет модификации оптических свойств наноразмерного маркера. Увеличение регистрируемой интенсивности окрашивания связано с формированием на тест-полоске частиц типа ядро@оболочка - Au@Ag при восстановлении солей серебра на затравочных наночастицах золота, выступающих в качестве катализатора в реакции восстановления серебра. Преимуществом данного подхода является его применимость для любых систем иммунохроматографического анализа, основанных на использовании наночастиц золота в качестве метки. Существенным ограничением данного подхода является быстрая скорость реакции восстановления солей серебра на наночастицах золота, что требует тщательного контроля за временем проведения реакции для своевременной визуальной детекции результатов на тест-полоске. Увеличение времени амплификации приводит к формированию неспецифичного фонового окрашивания. Нами разработан ряд решений, позволяющих останавливать реакцию восстановления солей серебра на тест-полоске, что позволяет проводить регистрацию интенсивности колориметрического сигнала по окончании анализа без временных ограничений. Совместное использование данных решений позволяет применять метод, основанный на восстановлении солей серебра, для снижения предела обнаружения иммунохроматографического анализа во внелабораторных условиях.
Мультиплексный иммунохроматографический анализ в точечном формате для детекции фитопатогенов семи патогенов вирусной и одного бактериальной природы был впервые реализован в работе Safenkova и соавт. (Multiarray on a test strip (MATS): Rapid multiplex immunodetection of priority potato pathogens. Analytical and Bioanalytical Chemistry, v. 408, No. 22, p. 6009-6017). Авторами представлена тест-полоска с нанесенным в виде точек массивом из тестовых зон с ииммобилизованными антителами к вирусным и бактериальным патогенам картофеля, а также ряд контрольных зон для подтверждения валидности анализа. Смесь конъюгатов иммобилизована в стекловолоконной мембране и вымывается при миграции анализируемой пробы. Реализованная тест-система основана на классическом формате иммунохроматографического анализа и включает в себя формирование «сэндвич» иммунных комплексов в тестовых зонах, что приводит к развитию окрашивания Интенсивность окрашивания пропорциональна содержанию антигена в пробе. Достигнутые пределы обнаружения для некоторых патогенов (например, 1 нг/мл для X вируса картофеля) являются достаточно низкими для высокочувствительной диагностики. Однако пределы обнаружения ля ряда других патогенов (например, 100 и 300 нг/мл для S и А вирусов картофеля) ограничивают применение представленной системы для выявления низких концентраций фитопатогенов, связанных с развитием латентных инфекций.
Недостатком указанной тест-системы является отсутствие возможности направленного действия на развитие оптического сигнала (окрашивания зон связывания). Поэтому существует потребность в преодолении указанных недостатков.
Технической задачей заявленной полезной модели является повышение интенсивности регистрируемого окрашивания массива точечных зон на тест-полоске за счет реакции восстановления солей серебра в присутствии гидрохинона, происходящей на поверхности нанодисперсных частиц золота, включенных в состав иммунных комплексов.
Технический результат заявленной полезной модели заключается в снижении пределов обнаружения десяти основных патогенов картофеля вирусной (X вирус картофеля, некротический штамм Y вируса картофеля, обыкновенный штамм Y вируса картофеля, S вирус картофеля М вирус картофеля, вирус скручивания листьев картофеля) и бактериальной (Dickeya solani, Pectobacterium carotovorum, Pectobacterium atrosepticum, Clavibacter michiganensis) за счет повышения интенсивности окрашивания тестовых зон, обусловленного формированием частиц Au@Ag, обладающих большим коэффициентом экстинкции, что позволяет регистрировать колориметрическую окраски от меньшего количества частиц по сравнению с нанодисперсным золотом.
Отличительной особенностью предлагаемой полезной модели является использование реакции восстановления солей серебра на поверхности наночастиц золота для снижения предела обнаружения мультиплексного иммунохроматогорафического анализа фитопатогенов вирусной и бактериальной природы. В основе анализа основан лежит миграция аликвоты жидкой пробы по тест-полоске. Миграция пробы происходит под действием капиллярных сил и не требует использования оборудования. При прохождении пробы через иммобилизованные на тест-полоске иммуннореагенты на разных участках мембраны происходит формирование специфических иммунных комплексов в тестовых зонах и связывания избытка свободных конъюгатов в контрольной зоне. Конъюгированные со специфическими антителами (десять поликлональных антител, специфичных к фитопатогенам вирусной и бактериальной природы) нанодисперсные частицы золота являются колориметрическим маркером, визуализирующим формирование иммунных комплексов в тестовых и контрольных зонах. Для снижения предела обнаружения по окончании анализа на тест-полоску наносится усиливающий раствор (20 мкл), состоящий из двух смешанных в равных объемах непосредственного перед использованием компонентов - 0,3% водного раствора нитрата серебра и 3% гидрохинона в цитратном буфере (рН=4,0). Восстановление солей серебра под действием гидрохинона на затравочных наночастицах золота приводит к накоплению частиц ядро-оболочка Au@Ag, обладающих большим коэффициентом экстинкции, что позволяет достигнуть регистрируемого окрашивания на тест-полоске. После двухминутной инкубации усиливающего раствора тест-полоску промывают водным раствором хлорида натрия (2 М). Хлорид ионы взаимодействуют с ионами серебра в составе усиливающего раствора с формированием нерастворимого хлорида серебра. Таким образом промывка тест-полоски раствором хлорида натрия останавливает реакция восстановления ионов серебра на тест-полоске.
Под действием каталитически-активных наночастиц Au@Pt происходит конверсия неокрашенного субстрата в нерастворимый продукт, накопление которого в тестовой и контрольной зонах существенно увеличивает интенсивность регистрируемого колориметрического сигнала. Использование иммунохроматографии для детекции фитопатогенных микроорганизмов обеспечивает достижение ряда преимуществ - проведение эффективного параллельного скрининга большого количества проб во внелабораторных условиях, экспрессность проведения анализа (15-20 минут) при минимальной подготовке проб, простота детектирования и интерпретации результатов анализа. Предложенный подход является универсальным и может быть использован для снижения предела обнаружения любого формата иммунохроматографического анализа, основанного на использовании наночастиц золота в качестве маркера. Предложенный способ остановки реакции восстановления серебра при добавлении хлорид-ионов, также является универсальным и расширяет возможности внелабораторного применения данного анализа.
Заявленная мультиплексная тест-система использует общий принцип иммунохроматографического анализа, основанного на миграции компонентов пробы по пористой мебране, формировании специфических иммунных комплексов в различных частиц мембраны и детекции сформировавшихся комплексов. Тестовая зона представляет собой упорядоченный массив нанесенных в виде отдельных точек антител, специфичных к патогенам. Один ряд включает четыре тестовых зоны с антителами, специфичными к одному патогену. Такая комплектация позволяет увеличить достоверность анализа по сравнению с классическим форматом анализа, поскольку колориметрический сигнал регистрируется не с одной окрашенной тестовой зоны-линии, а сразу с четырех точечных зон.
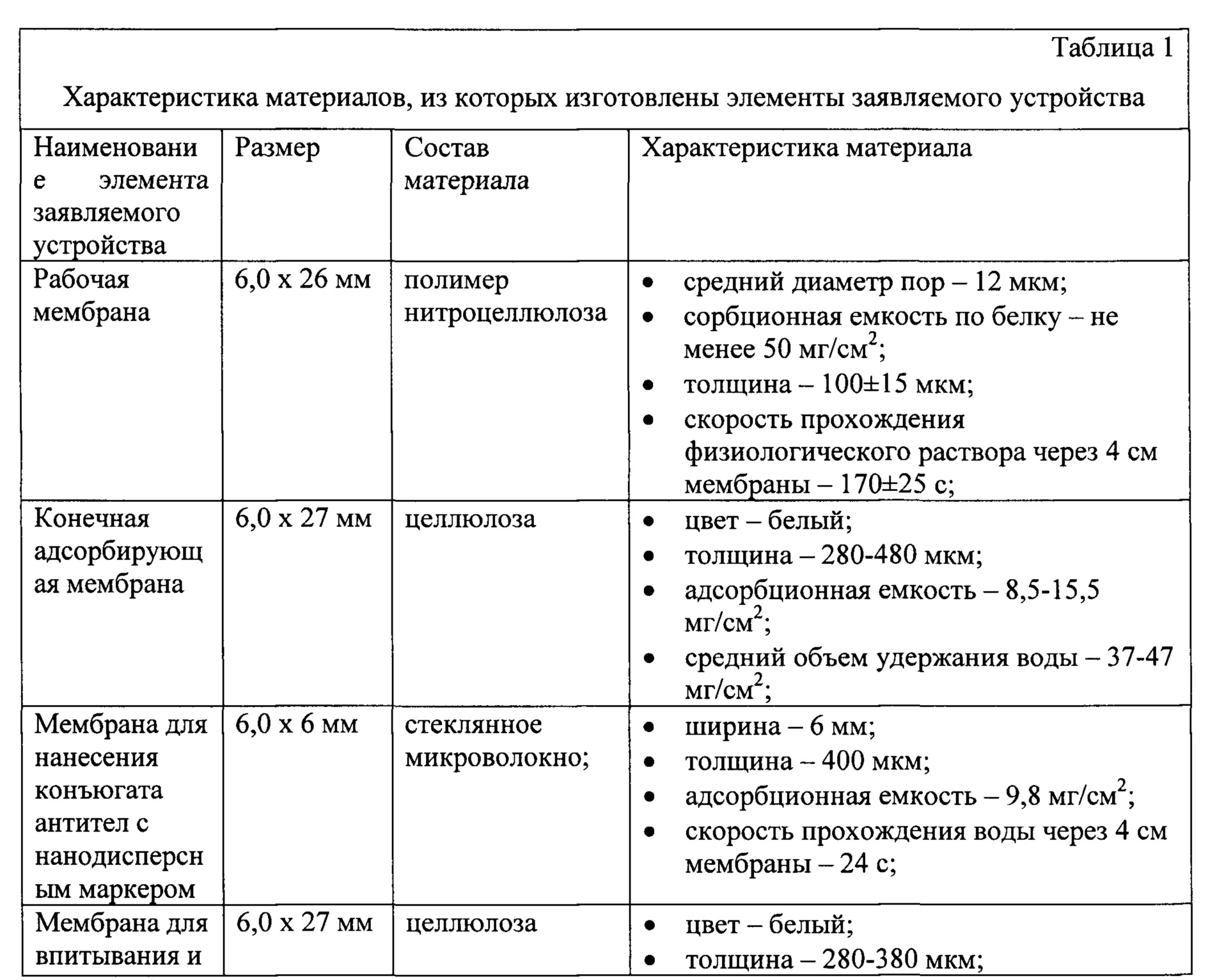
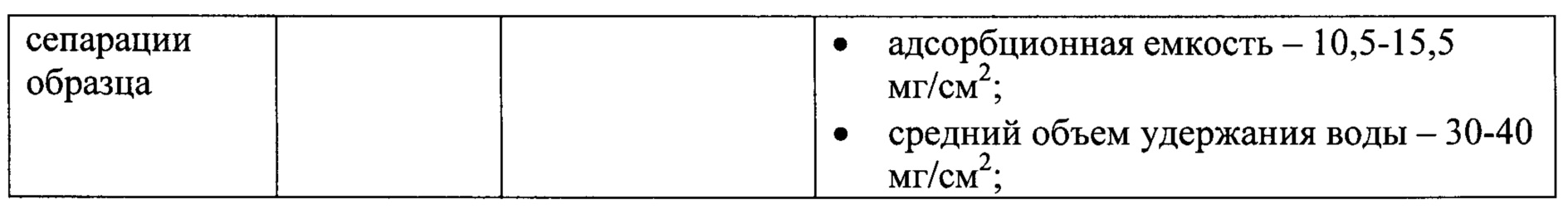
Предлагается устройство для иммунохроматографической внелабораторного выявления основных патогенов картофеля вирусной и бактериальной природы в экстрактах листьев и клубней картофеля. Устройство состоит из нескольких соединенных между собой мембран и включает в себя нанесенные и высушенные иммунореагенты (тест-полоску). В состав тест-полоски входят рабочая нитроцеллюлозная мембрана с предварительно нанесенными в виде отдельных точечных зон с антителами тестовыми и контрольными зонами, закрепленная на твердой полистироловой основе, стекловолоконная мембрана с нанесенной смесью десяти конъюгатов наночастиц золота со специфичными поликлональными антителами, мембрана для впитывания и сепарации компонентов исследуемой растительной пробы и конечной адсорбирующей мембраны для впитывания пробы и поддержания миграции жидкости по тест-полоске.
Указанный технический результат достигается тем, что:
- в контрольную зону (К.З.) нанесен иммуноглобулин-связывающий белок А;
- тестовая зона (Т. З.) представляет собой массив из отдельных точечных зон, содержащих специфичные антитела к патогену. Одна тест-полоска включает в себя 40 тестовых зон, расположенных в виде массива из десяти рядов по четыре точки в ряду.
- на стекловолоконную мембрану нанесена смесь конъюгатов наночастиц золота с антителами, специфичными к патогенам вируснй (X вирус картофеля, некротический штамм Y вируса картофеля, обыкновенный штамм Y вируса картофеля, S вирус картофеля М вирус картофеля, вирус скручивания листьев картофеля) и бактериальной природы (Dickeya solani, Pectobacterium carotovorum, Pectobacterium atrosepticum, Clavibacter michiganensis)
- при погружении тест-полоски в анализируемую растительную пробы происходит миграция жидкости по тест-полоске под действием капиллярных сил. Про прохождении пробы через стекловолоконную мембрану с высушенной смесью десяти конъюгатов наночастиц золота с антителами происходит их регидратация и формирование специфических двойных иммунных комплексов (антиген - антитела, иммобилизованные на наночастицах золота). При прохождении массива тестовых зон происходит формирование тройных иммунных комплексов (иммобилизованные на мембране антитела - антиген - антитела, иммобилизованные на наночастицах золота), что приводит к накоплению наночастиц золота и развитию окраски. При отсутствии антигена в пробе конъюгаты наночастиц золота с антителами мигрируют мимо массива тестовых зон без формирования тройных иммунных комплексов. Не связавшиеся в тестовых зонах конъюгаты реагируют с иммобилизованным в контрольной зоне белком А. Развитие окрашивания тестовых зон свидетельствует о присутствии антигена в пробе. Интенсивность окрашивания тем выше, чем больше концентрация антигена в пробе.
Для повышения интенсивности регистрируемого колориметрического сигнала при низких концентрация антигена в пробе используется реакция восстановления солей серебра в присутствии гидрохинона, протекающая на наночастицах золота, включенных в состав иммунных комплексов в массиве Т.З. и К.З. Для этого на тест-полоску наносится усиливающий раствор (20 мкл) содержащий смешанные в равных объемах растворы 0,3% нитрата серебра и 3% гидрохинона в цитратном буфере (рН=4,0). Усиливающий раствор инкубируется в течение двух минут. Для остановки реакции тест-полоску промывают раствором хлорида натрия (2 М). Формирование нерастворимого осадка хлорида серебра удаляет из системы востанавливающиеся на наночастицах золота ионы серебра. Формирование композитных частиц ядро@оболочка - Au@Ag приводит к существенному повышению интенсивности колориметрического сигнала и позволяет регистрировать окрашивание от меньшего количества частиц, включенных в состав иммунных комплексов.
В таблице 1 приведена характеристика материалов, из которых изготовлены элементы заявляемого устройства.
Анализ проводят следующим образом:
1. 100 мкл анализируемого растительного экстракта (экстракт листьев или клубней картофеля) вносят в пластиковую пробирку (вместимость 1-1,5 мл) или в лунку полистиролового планшета (вместимость 300 мкл)
2. Тест-полоску погружают вертикально нижним концом мембраны для впитывания образца в анализируемый экстракт и выдерживают при комнатной температуре в течение 10 мин.
3. Вынимают тест-полоску и помещают ее на сухую горизонтальную поверхность. Результат фиксируют визуально или с использованием детектора с видео-цифровой регистрацией.
4. Добавляют 20 мкл усиливающего раствора, состоящего из равных объемов 0,3% нитрата серебра и 3% гидрохинона в цитратном буфере (рН=4,0), смешанных непосредственно перед добавлением на тест-полоску, и выдерживают в течение двух минут. Результат фиксируют визуально или с использованием детектора с видео-цифровой регистрацией
Заявляемое устройство функционирует следующим образом (см. рис. 1). Если в образце присутствуют контролируемые патогены вирусной и бактериальной природы, то под действием капиллярных сил они с потоком жидкости перемещаются по впитывающей мембране, доходят до стекловолоконной мембраны и вступают в высокоспецифичную реакцию с поликлональными антителами на поверхности конъюгатов наночастиц золота с образованием двойных иммунных комплексов (антиген - антитела, иммобилизованные на поверхности наночастиц золота). Образовавшиеся двойные иммунные комплексы под действием капиллярных сил движутся вдоль рабочей нитроцеллюлозной мембраны и взаимодействуют с иммобилизованными в виде упорядоченного в Т.З. массива антител с образованием тройных комплексов (иммобилизованные на мембране в Т.З. антитела - антиген - антитела, иммобилизованные на наночастицах золота). Избыток не связавшихся в Т.З. конъюгатов продолжает двигаться вдоль рабочей нитроцеллюлозной мембраны и взаимодействует с белком А, иммобилизованными в К.З., с образованием двойных комплексов.
Интерпретация результатов анализа производится на основании наличия окрашенных рядов в массиве Т.З. и К.З.:
1. Если через 10 мин на рабочей мембране тест-полоски не происходит развитие колориметрического сигнала в К.З., наблюдается окрашивание только рядов в массиве Т.З. или окрашивание не всех точек в ряду массива Т.З., то результат анализа считается недействительным. В таком случае необходимо повторное тестирование с использованием новой тест-полоски.
2. Если через 10 мин на рабочей мембране тест-полоски появляются окрашенные ряды в массиве Т.З. и окрашенная К.З., то результат анализа считается положительным, т.е. в растительной пробе присутствуют антигены. Для определения природы антигена пользователь определяет положение окрашенного ряда в массиве Т.З.
3. Если через 10 мин на рабочей мембране тест-полоски появляется одна окрашенная К.З. при этом окрашивание массива Т.З. не наблюдается, то результат анализа считается или отрицательным, т.е. в растительной пробе не содержится определяемых антигенов, или их количество оказывается меньше предела обнаружения ИХА. В таком случае проводится дополнительная стадия усиления сигнала. Для этого на тест-полоску добавляют 20 мкл усиливающего раствора, после двухминутной инкубации тест-полоска промывается 2М раствором хлорида натрия. Наличие темноокрашенных рядов в массиве Т.З. свидетельствует о присутствии антигена в анализируемой пробе, отсутствие окрашенных рядов в массиве Т.З. и наличие окрашенной К.З. свидетельствует об отсутствии антигенов в анализируемой пробе. Для определения природы антигена пользователь определяет положение окрашенного ряда в массиве Т.З.
Эффективность данного подхода подтверждается следующими примерами:
Пример 1 (мультиплексный иммунохроматографический анализ фитопатогенов вирусной и бактериальной природы без проведения дополнительной стадии амплификации сигнала)
Для определения пределов обнаружения тест-системы проводили анализ искусственно-контаминированных экстрактов с известной концентрацией добавленных патогенов. В качестве отрицательного контроля использовали экстракт здоровых клубней картофеля. Анализ проводили в трех повторностях с использованием тест-систем из различных партий. Тест-полоску погружали в анализируемую пробу (100 мкл), выдерживали в течение 10 минут, после его размещали тест-полоску на горизонтальной поверхности и фиксировали результаты анализа.
Пределом обнаружения считали концентрацию антигена, обеспечивающую колориметрический сигнал в Т.З. превосходящий сумму среднего значения колориметрического сигнала и трех стандартных отклонений для отрицательной пробы (здоровый экстракт). Для ИХА без амплификации сигнала сумма среднего значения колориметрического сигнала и трех стандартных отклонений для отрицательной пробы была равна 0,5. Стандартное отклонение среднего значения колориметрического сигнала, определенное для двенадцати точек, не превышало 30% (табл. 2).
Достигнутые пределы обнаружения (ХВК, МВК, SBК, некротический штамм YBК, вирус скручивания листьев картофеля - 32 нг/мл, обыкновенный штамм Y вируса картофеля - 64 нг/мл. P. carotovorum, D. solani - 106 клеток/мл, P. atrosepticum, С. michiganensis - 104 клеток/мл) являются недостаточными для выявления латентных инфекций.
Пример 2 (мультиплексный иммунохроматографический анализ фитопатогенов вирусной и бактериальной природы с дополнительной стадии амплификации сигнала)
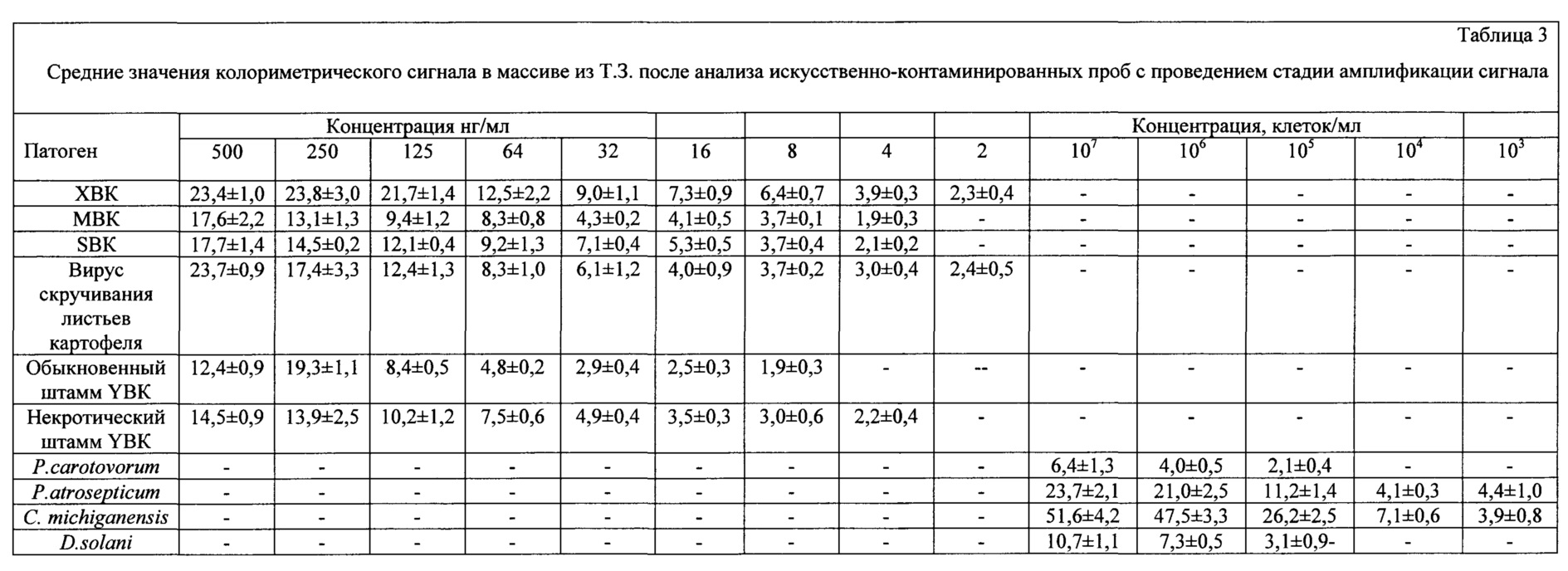
Для определения пределов обнаружения мультиплексной иммунохроматографической тест-системы проводили анализ искусственно-контаминированных экстрактов с известной концентрацией добавленных патогенов. В качестве отрицательного контроля использовали экстракт здоровых клубней картофеля. Анализ проводили в трех повторностях с использованием тест-систем из различных партий. Тест-полоску погружали в анализируемую пробу (100 мкл), выдерживали в течение 10 минут. Тест-полоску размещали на горизонатльной поверхности, после чего добавляли 20 мкл свежеприготовленного усиливающего раствора. Усиливающий раствор состоял из смешанных в равных объемах 3% водного раствора нитрата серебра и 3% гидрохинона в цитратном буфере (рН=4,0). Спустя две минуты тест-полоски промывали 2 М хлоридом натрия и регистрировали интенсивность окрашивания Т.З. и К.З.
Пределом обнаружения ИХА считали концентрацию антигена, обеспечивающую колориметрический сигнал в Т.З. превосходящий сумму среднего значения колориметрического сигнала и трех стандартных отклонений для отрицательной пробы (здоровый экстракт). Для ИХА без проведения амплификации сигнала сумма среднего значения колориметрического сигнала и трех стандартных отклонений для отрицательной пробы была равна 1,2. Стандартное отклонение среднего значения колориметрического сигнала, определенное для двенадцати точек, не превышало 30% (табл. 3).
Достигнутые пределы обнаружения (ХВК, ВСЛК - 2 нг/мл, МВК, SBК, некротический штамм YBК - 4 нг/мл, обыкновенный штамм Y вируса картофеля - 8 нг/мл. P. carotovorum, D. solani - 105 клеток/мл, P. atrosepticum, С. michiganensis - 103 клеток/мл) позволяют проводить высокочувствительную диагностику фитопатогенов во внелабораторных условиях.
Краткое описание чертежей
На рис. 1 представлена схема мультиплексного иммунохроматографического анализа.
А - мембрана для впитывания и сепарации исследуемого образца, Б - рабочая нитроцеллюлозная мембрана с нанесенными и высушенными иммунореагентами, В - конечная адсорбирующая мембрана для впитывания компонентов образца после прохождения реакции, Г - стекловолоконная мембрана с нанесенной и высушенной смесью конъюгатов антител с наночастицами золота, Д - массив из точечных тестовых зон с нанесенными поликлональными кроличьими антителами, специфичными: 1 - ВСЛК; 2 - некротический штамм Y вируса картофеля; 3 - обыкновенный штамм Y вируса картофеля; 4 - SBК; 5 - МВК; 6 - ХВК; 7 - D. solani; 8 - С. michiganensis; 9 - Р. carotovorum; 10 - P. atrosepticum;, Е - К.З. с нанесенным иммуноглобулин-связывающим белком А. 11 - белок А (контрольная зона).
Claims (1)
- Устройство для мультиплексного иммунохроматографического внелабораторного анализа патогенов картофеля вирусной природы, таких как X вирус картофеля, некротический штамм Y вируса картофеля, обыкновенный штамм Y вируса картофеля, S вирус картофеля, М вирус картофеля, вирус скручивания листьев картофеля, и бактериальной природы, таких как Dickeya solani, Pectobacterium carotovorum, Pectobacterium atrosepticum, Clavibacter michiganensis, включающее тест-полоску, состоящую из полистироловой подложки, на которую закреплены нитроцеллюлозная мембрана с предварительно нанесенными и высушенными иммунореагентами, стекловолоконная мембрана с нанесенной и высушенной смесью конъюгатов десяти поликлональных антител с наночастицами золота, мембрана для впитывания и сепарации неспецифических компонентов исследуемого растительного экстракта и конечная адсорбирующая мембрана для впитывания компонентов пробы после прохождения реакции и поддержания потока мигрирующей пробы по тест-полоске, где на нитроцеллюлозную мембрану нанесены контрольная и тестовые зоны, в контрольную зону иммобилизован иммуноглобулинсвязывающий белок А, специфично связывающий антитела, адсорбированные на наночастицах золота, тестовая зона представляет собой массив из тридцати пространственно-разнесенных и упорядоченных точек, включающий десять рядов, каждый из рядов состоит из трех зон, в виде точек, нанесения поликлональных антител одной специфичности, на стекловолоконную мембрану нанесена смесь десяти конъюгатов поликлональных кроличьих антител, специфичным к указанным патогенам вирусной и бактериальной природы, с наночастицами золота, формирующих в результате миграции анализируемой пробы в тестовых зонах тройные иммунные комплексы, такие как антитела в тестовой зоне - патоген - конъюгат антител с наночастицами золота, что приводят к окрашиванию тестовых зон, где наличие окрашивания трех зон в одном ряду свидетельствует о присутствии антигена в пробе, а интенсивность окрашивания пропорциональна концентрации антигена в пробе, при этом тестовая полоска выполнена с возможностью внесения на нее смеси из двух смешенных в равных объемах компонентов, таких как 0,3 % водного раствора нитрата серебра и 3% гидрохинона в цитратном буфере с рН=4,0 для увеличения интенсивности окрашивания тестовых зон за счет восстановления нитрата серебра на поверхности наночастиц и формирования высококонтрастных частиц, состоящих из ядра, представляющего собой наночастицу золота, и серебряной оболочки.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020119110U RU201487U1 (ru) | 2020-06-09 | 2020-06-09 | Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2020119110U RU201487U1 (ru) | 2020-06-09 | 2020-06-09 | Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU201487U1 true RU201487U1 (ru) | 2020-12-17 |
Family
ID=73834792
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2020119110U RU201487U1 (ru) | 2020-06-09 | 2020-06-09 | Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU201487U1 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116106284A (zh) * | 2023-04-11 | 2023-05-12 | 中国人民解放军军事科学院军事医学研究院 | 一种基于氧化石墨烯的比色荧光双模式复合纳米片及其制备方法与应用 |
| RU218447U1 (ru) * | 2022-12-12 | 2023-05-25 | Федеральное государственное учреждение "Федеральный исследовательский центр "Фундаментальные основы биотехнологии" Российской академии наук" | Мультипараметрическая тест-система для одновременного определения антигенов вирусов SARS-CoV-2, гриппа типа А и В методом иммунохроматографии |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1250598B1 (en) * | 2000-01-28 | 2005-10-19 | MP Biomedicals Asia Pacific Pte. Ltd. | Immunochromatographic assay devices with separators |
| US8709826B2 (en) * | 2005-08-23 | 2014-04-29 | Vedalab | Analyte assaying by means of immunochromatography with lateral migration |
| US9739773B1 (en) * | 2010-08-13 | 2017-08-22 | David Gordon Bermudes | Compositions and methods for determining successful immunization by one or more vaccines |
| RU192778U1 (ru) * | 2018-12-26 | 2019-10-01 | Федеральное государственное учреждение "Федеральный исследовательский центр "Фундаментальные основы биотехнологии" Российской академии наук" (ФИЦ Биотехнологии РАН) | Устройство для иммунохроматографической экспрессной внелабораторной диагностики заболевания винограда, вызываемого вирусом скручивания листьев |
-
2020
- 2020-06-09 RU RU2020119110U patent/RU201487U1/ru active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1250598B1 (en) * | 2000-01-28 | 2005-10-19 | MP Biomedicals Asia Pacific Pte. Ltd. | Immunochromatographic assay devices with separators |
| US8709826B2 (en) * | 2005-08-23 | 2014-04-29 | Vedalab | Analyte assaying by means of immunochromatography with lateral migration |
| US9739773B1 (en) * | 2010-08-13 | 2017-08-22 | David Gordon Bermudes | Compositions and methods for determining successful immunization by one or more vaccines |
| RU192778U1 (ru) * | 2018-12-26 | 2019-10-01 | Федеральное государственное учреждение "Федеральный исследовательский центр "Фундаментальные основы биотехнологии" Российской академии наук" (ФИЦ Биотехнологии РАН) | Устройство для иммунохроматографической экспрессной внелабораторной диагностики заболевания винограда, вызываемого вирусом скручивания листьев |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2803155C1 (ru) * | 2021-11-09 | 2023-09-07 | Северо-Западный Институт Экологической Окружающей Среды И Ресурсов Китайской Академии Наук | Тест-карточка и тест-набор для выявления вируса желтизны брассики |
| RU218447U1 (ru) * | 2022-12-12 | 2023-05-25 | Федеральное государственное учреждение "Федеральный исследовательский центр "Фундаментальные основы биотехнологии" Российской академии наук" | Мультипараметрическая тест-система для одновременного определения антигенов вирусов SARS-CoV-2, гриппа типа А и В методом иммунохроматографии |
| CN116106284A (zh) * | 2023-04-11 | 2023-05-12 | 中国人民解放军军事科学院军事医学研究院 | 一种基于氧化石墨烯的比色荧光双模式复合纳米片及其制备方法与应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2909331B1 (en) | Method and device for combined detection of viral and bacterial infections | |
| EP2063269B1 (en) | Chromatography apparatus for detecting Staphylococcus aureus | |
| US10408835B2 (en) | Method and device for combined detection of viral and bacterial infections | |
| CA2190109C (en) | Compositions and methods for control of reactivity between diagnostic reagents and microorganisms | |
| US20100041070A1 (en) | Immunoassay and method of use | |
| US8962260B2 (en) | Method and device for combined detection of viral and bacterial infections | |
| EP2042868A1 (en) | Immunochromatographic test device | |
| US20130084580A1 (en) | Chromatographic kit and chromatography method | |
| WO2007097917A1 (en) | Combination vertical and lateral flow immunoassay device | |
| CN102645536A (zh) | 一种检测金黄色葡萄球菌的方法 | |
| RU191660U1 (ru) | Иммунохроматографическая тест-полоска для проведения экспресс-метода определения четырех групп антибиотиков в молоке с исключением возможной фальсификации образца | |
| EP0896223B1 (en) | Immunoassay method and immunoassay kit | |
| RU201487U1 (ru) | Устройство для мультиплексного иммунохроматографического анализа патогенов вирусной и бактериальной природы с дополнительной стадией усиления сигнала | |
| DE3689557T2 (de) | Verfahren zur immunologischen bestimmung einer biologischen substanz in einer probe. | |
| US7241626B2 (en) | Isolation and confirmation of analytes from test devices | |
| US20080153176A1 (en) | Chromatographic Test Strips for One or More Analytes | |
| JP2017133952A (ja) | 特定の細菌を検出するイムノクロマト方法及びそれに用いるキット | |
| EP0152254A2 (en) | Chromogenic support immunoassay utilizing labeled complement components | |
| RU2545909C2 (ru) | Способ иммунохроматографического определения специфических антител | |
| Byzova et al. | Manufacturing lateral flow tests for tuberculosis diagnosis: choosing a reactants completion and sensing regime | |
| JP2024089206A (ja) | コルチゾールを半定量するためのイムノクロマト測定キット | |
| JP2024089207A (ja) | コルチゾールを半定量するためのイムノクロマト測定キット | |
| Miguez et al. | Preparation of reagents for blood group serology: illustrating basic concepts of the antibody response | |
| JP2000037199A (ja) | 病原微生物及び微量成分の高感度測定法 | |
| Hahn et al. | Universal immuno-stick test for direct rapid identification of microbial antigens within 5 minutes Preliminary report |