KR900008564B1 - 신규한 8α-아실아미노에르고린의 제조방법 - Google Patents
신규한 8α-아실아미노에르고린의 제조방법 Download PDFInfo
- Publication number
- KR900008564B1 KR900008564B1 KR1019850000458A KR850000458A KR900008564B1 KR 900008564 B1 KR900008564 B1 KR 900008564B1 KR 1019850000458 A KR1019850000458 A KR 1019850000458A KR 850000458 A KR850000458 A KR 850000458A KR 900008564 B1 KR900008564 B1 KR 900008564B1
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- formula
- alkyl
- acid addition
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D457/00—Heterocyclic compounds containing indolo [4, 3-f, g] quinoline ring systems, e.g. derivatives of ergoline, of the formula:, e.g. lysergic acid
- C07D457/10—Heterocyclic compounds containing indolo [4, 3-f, g] quinoline ring systems, e.g. derivatives of ergoline, of the formula:, e.g. lysergic acid with hetero atoms directly attached in position 8
- C07D457/12—Nitrogen atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
Claims (3)
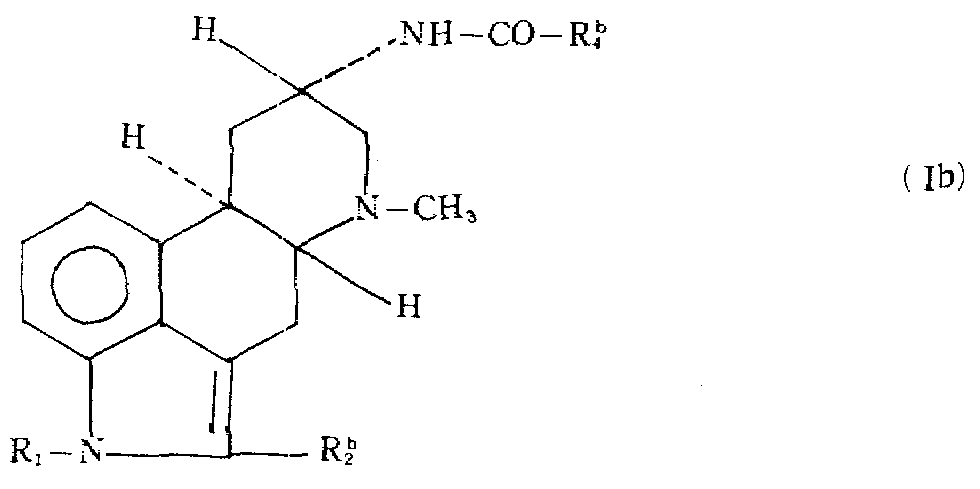
- 하기 일반식(Ⅱ)의 화합물을 하기 일반식(Ⅲ)의 화합물 또는 그것의 반응성 작용 유도체와 반응시키고, 산출된 하기 일반식(Ⅰ)의 화합물을 그 자체 또는 그것의 산부가염 상태로 회수하는 것으로 구성된 일반식(Ⅰ)의 화합물 또는 그것의 산부가염의 제조방법.R4-COOH (Ⅲ)상기식에서 R1은 수소 또는 C1-4알킬이고, R2는 수소, 염소, 브롬 또는 메틸이고, R3는 C1-5알킬 또는 이중결합이 질소원자에 인접한 탄소원자에는 위치하지 않는 C3-5알케닐이며, R4는 C3-7알킬; C3-7시클로알킬; 아다만틸; 페닐; C1-3알킬, C1-3알콕시, C1-3알킬티오, 트리플루오로메틸, 히드록시, 니트로, 아미노 및 모노-와 디-(C1-3알킬)-아미노로 구성된 군에서 선택된 하나 또는 그 이상의 기로 치환된 페닐; 또는 산소 및 황으로 구성된 군에서 선택된 1 또는 2개의 헤테로 원자를 포함하는 5- 또는 6-원의 고리를 갖는 축합된 비방향족 헤테로시클릭 고리를 함유한 페닐이고, 단 R1과 R2가 둘 모두 수소이고 R3가 메틸인 경우 R4는 3급 부틸 이외의 것이다.
- 제1항에 있어서, R1이 수소인 상기 일반식(Ⅰ)의 화합물을 N(C1-4알킬화)반응시켜 R1이 C1-4알킬인 상응하는 일반식(Ⅰ) 화합물을 제조하고, 산출된 일반식(Ⅰ)화합물을 그 자체 또는 그것의 산부가염 상태로 회수하는 것으로 구성된 일반식(Ⅰ) 화합물 및 그것의 산부가염의 제조방법.
- 제1항에 있어서, R2가 수소인 제1항에서 정의된 일반식(Ⅰ) 화합물을 염소화 또는 브롬화 반응시켜 R2가 염소 또는 브롬인 상응하는 일반식(Ⅰ)의 화합물을 제조하고, 이렇게 산출된 일반식(Ⅰ)의 화합물을 그 자체 또는 그것의 산부가염 상태로 회수하는 것으로 구성된 일반식(Ⅰ) 화합물 또는 그것의 산부가염의 제조방법.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1019850000458A KR900008564B1 (ko) | 1985-01-25 | 1985-01-25 | 신규한 8α-아실아미노에르고린의 제조방법 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1019850000458A KR900008564B1 (ko) | 1985-01-25 | 1985-01-25 | 신규한 8α-아실아미노에르고린의 제조방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR860005805A KR860005805A (ko) | 1986-08-13 |
| KR900008564B1 true KR900008564B1 (ko) | 1990-11-24 |
Family
ID=19239506
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019850000458A Expired KR900008564B1 (ko) | 1985-01-25 | 1985-01-25 | 신규한 8α-아실아미노에르고린의 제조방법 |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR900008564B1 (ko) |
-
1985
- 1985-01-25 KR KR1019850000458A patent/KR900008564B1/ko not_active Expired
Also Published As
| Publication number | Publication date |
|---|---|
| KR860005805A (ko) | 1986-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| NL193541C (nl) | 8 Alfa-acylaminoergolinen, werkwijzen voor de bereiding daarvan en preparaten die ze bevatten. | |
| US4086353A (en) | Certain azolinylamino (azolidinylimino) indazoles | |
| US4180581A (en) | N-9,10-dihydrolysergyl-m-aminobenzoic acid amide derivative | |
| EP0000355B1 (en) | New indole derivatives, processes for their preparation, and pharmaceutical compositions containing them. | |
| KR880002042B1 (ko) | 사이프로헵타딘-3-카복실산의 에스테르 및 이의 제조방법 | |
| KR900008564B1 (ko) | 신규한 8α-아실아미노에르고린의 제조방법 | |
| US4333939A (en) | Tetrahydropyridinyl-indoles | |
| EP0402232A1 (fr) | Dérivés de pyridobenzoindole, leur préparation et les compositions qui les contiennent | |
| US4791115A (en) | 2,6-dimethyl-8α-pivaloylamino-9,10-didehydro-ergoline | |
| US4143143A (en) | Substituted imidazo[5,1-a]isoquinolines | |
| US4032640A (en) | 4H-Benzo[4,5]cyclohepta[1,2-b]thiophenes | |
| US4287211A (en) | Derivatives of phenylethylamines, processes for their preparation and related pharmaceutical compositions | |
| KR950014866B1 (ko) | 에르골리닐 헤테로사이클 | |
| US4247697A (en) | 3-Phenoxy morphinans and their derivatives | |
| EP0000151B1 (en) | 1-substituted aminoindolines, process for their production and pharmaceutical compositions containing them | |
| US4313944A (en) | Cycloheptindoles, compositions and use | |
| EP0240986B1 (en) | D-nor-7-ergoline derivatives, process for preparing them, pharmaceutical composition and use | |
| KR0148365B1 (ko) | 4,5,5a,6-테트라하이드로-3H-이소옥사졸로[5,4,3-kl]아크리딘 유도체, 이의 제조방법 및 이를 함유하는 약제학적 조성물 | |
| US3452030A (en) | 4-(n-isobutyrylanilino)-1-benzylpiperidine | |
| US4010161A (en) | Piperazinoethyl-N-(2,3-dimethyl-5-oxo-1-phenyl-3Δ-pyrazolin-4-yl)carbamates | |
| US4318909A (en) | Benzoxazocines | |
| KR800000537B1 (ko) | 아미노-페닐-에탄올아민의 제조방법 | |
| US4182883A (en) | D-6-allyl-8-ergol-I-ylacetamide | |
| US4002617A (en) | Hydrodipyrano-phthalazine compounds | |
| KR790001982B1 (ko) | 1, 2, 3, 4-테트라하이드로벤조 이소퀴놀린류의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0109 | Patent application |
St.27 status event code: A-0-1-A10-A12-nap-PA0109 |
|
| R17-X000 | Change to representative recorded |
St.27 status event code: A-3-3-R10-R17-oth-X000 |
|
| PG1501 | Laying open of application |
St.27 status event code: A-1-1-Q10-Q12-nap-PG1501 |
|
| N231 | Notification of change of applicant | ||
| PN2301 | Change of applicant |
St.27 status event code: A-3-3-R10-R13-asn-PN2301 St.27 status event code: A-3-3-R10-R11-asn-PN2301 |
|
| A201 | Request for examination | ||
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| PA0201 | Request for examination |
St.27 status event code: A-1-2-D10-D11-exm-PA0201 |
|
| R17-X000 | Change to representative recorded |
St.27 status event code: A-3-3-R10-R17-oth-X000 |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
St.27 status event code: A-1-2-D10-D21-exm-PE0902 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| G160 | Decision to publish patent application | ||
| PG1605 | Publication of application before grant of patent |
St.27 status event code: A-2-2-Q10-Q13-nap-PG1605 |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
St.27 status event code: A-1-2-D10-D22-exm-PE0701 |
|
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment |
St.27 status event code: A-2-4-F10-F11-exm-PR0701 |
|
| PR1002 | Payment of registration fee |
St.27 status event code: A-2-2-U10-U11-oth-PR1002 Fee payment year number: 1 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 4 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 5 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 6 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 7 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 8 |
|
| FPAY | Annual fee payment |
Payment date: 19981015 Year of fee payment: 9 |
|
| PR1001 | Payment of annual fee |
St.27 status event code: A-4-4-U10-U11-oth-PR1001 Fee payment year number: 9 |
|
| LAPS | Lapse due to unpaid annual fee | ||
| PC1903 | Unpaid annual fee |
St.27 status event code: A-4-4-U10-U13-oth-PC1903 Not in force date: 19991125 Payment event data comment text: Termination Category : DEFAULT_OF_REGISTRATION_FEE |
|
| PC1903 | Unpaid annual fee |
St.27 status event code: N-4-6-H10-H13-oth-PC1903 Ip right cessation event data comment text: Termination Category : DEFAULT_OF_REGISTRATION_FEE Not in force date: 19991125 |
|
| P22-X000 | Classification modified |
St.27 status event code: A-4-4-P10-P22-nap-X000 |