KR20170046146A - 각막 동종이식 거부 및 신혈관 형성의 예방을 위한 글루코 코르티코이드-로딩된 나노입자 - Google Patents
각막 동종이식 거부 및 신혈관 형성의 예방을 위한 글루코 코르티코이드-로딩된 나노입자 Download PDFInfo
- Publication number
- KR20170046146A KR20170046146A KR1020177006811A KR20177006811A KR20170046146A KR 20170046146 A KR20170046146 A KR 20170046146A KR 1020177006811 A KR1020177006811 A KR 1020177006811A KR 20177006811 A KR20177006811 A KR 20177006811A KR 20170046146 A KR20170046146 A KR 20170046146A
- Authority
- KR
- South Korea
- Prior art keywords
- dsp
- injection
- polymer
- nanoparticles
- glucocorticoid
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
- A61K9/0051—Ocular inserts, ocular implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5146—Organic macromolecular compounds; Dendrimers obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyamines, polyanhydrides
- A61K9/5153—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
Abstract
PEG 또는 PLURONIC® F127과 같은 친수성 폴리머로 조밀하게 코팅된 생분해성 폴리(락트산-글리콜산)(PLGA)과 같은 매트릭스에 덱사메타손 나트륨 인산염(DSP)과 같은 글루코 코르티코이드를 캡슐화한 입자는 DSP 시험관내에서 최대 7일 동안 DSP의 지속적 방출을 나타낸다. 이 나노입자는 각막 이식 거부 또는 각막 신생 혈관 예방에 사용할 수 있다.
Description
본 발명은 하나 이상의 글루코 코르티코이드(glucocorticoid)의 유효량을 눈에 전달하기 위한 폴리머 제어 방출 제형(polymeric controlled release formulations), 특히 질병의 치료 및 예방, 특히 이식편 거부(graft rejection)의 치료 또는 예방을 위한 그의 사용 방법에 관한 것이다.
각막은 무혈관, 투명한 결합 조직으로 눈의 굴절된 표면과 보호 장벽 역할을 한다. 각막 혈관 신생(neovascularization, NV)은 혈관 신생 인자와 항 혈관 형성 인자 사이의 균형을 파괴함으로써 발생한다. 감염, 염증, 외상 및 퇴행성 장애와 같은 병리학적 상태는 각막 윤부(limbus)에서 무혈관 각막으로의 새로운 혈관 침범을 유도할 수 있다. 각막 NV는 지질 삼출(lipid exudation), 지속적인 염증 및 각막 흉터를 유발할 수 있으며 결국에는 각막의 투명성 손실 및 시력 저하를 초래할 수 있다. 각막 이식술은 각막 이식(keratoplasty) 수술에서 각막 이식 실패의 위험 인자로 여겨 졌다.
각막 신생 혈관 치료에는 아르곤 레이저 광 응고, 광 역학 요법, 투열 요법 및 소작술, 비스테로이드 항 염증제, 항 혈관 상피 성장 인자(“VEGF”), 금속 매트릭스 프로테아제(“MMP”) 억제제 및 코르티코 스테로이드가 포함된다. 각막 신생 혈관 치료의 주된 요소는 여전히 국소 부신피질 호르몬제이다. 코르티코 스테로이드는 눈을 포함하여 다양한 면역 및 염증 질환을 치료하는 데 사용되는 강력한 항 염증제이다. 코르티코 스테로이드는 강력한 항 혈관 신생 기능을 갖는 것으로 밝혀졌고, 다양한 코르티코 스테로이드가 안 혈관 신생 혈관 치료에 널리 사용되어 왔다. 스테로이드가 염증을 감소시키고 혈관 내피 성장 인자(VEGF)의 상향 조절을 차단하기 때문에 신생 혈관 내 스테로이드 또는 스테로이드 임플란트가 신생 혈관 연령 관련 황반변성 및 당뇨병성 망막증 치료에 적용되어 왔다(Augustin, et al Current therapies, Clin. Ophthalmol. 3(2009) 175-182; Pai, et al., Saudi J. Ophthalmol. 24(2010) 143-149). 각막 NV에 대한 항 혈관 신생 효과는 상이한 동물 모델 및 임상 실험에서 확인되었다. 소각 유도된 각막 신생 혈관화는 국소 덱사메타손(dexamethasone)에 의해 효과적으로 억제되었다(Proia 등, Exp.Eye.Res.57(1993) 693-698). IL-1β 유도 각막 혈관 신생은 덱사메타손이 각막 신생 혈관 형성을 억제하는 효능에 대한 NF-kB 신호 전달의 차단을 통해 부분적으로 억제되는 것으로 여겨졌다.
국소 코르티코 스테로이드 점안제는 환자에게 가장 널리 사용되고 편리하다. 그러나, 코르티코 스테로이드를 비롯한 국소 도포된 약물의 흡수 및 보유는 안구 표면으로부터의 신속한 제거, 눈꺼풀 올림, 눈물 흘리기, 눈물 회전 및 배액으로 인해 매우 열악하다. 또한, 손상되지 않은 각막 구조는 약물 분자의 침투 및 침투를 손상시킨다. 따라서 안약은 안구의 생체 이용률이 매우 낮으며, 전형적으로 적용된 투여량의 5% 미만이 각막을 관통하여 안구 조직에 도달한다. 따라서 안구 내 약물 농도를 유지하고 치료 효과를 얻으려면 점안액을 자주 점안해야 한다. 그것은 환자의 순응도 및 안구 표면에 대한 독성을 포함하여 다른 잠재적 인 문제를 야기할 수 있다. 덱사메타손 소디움 포스페이트(dexamethasone sodium phosphate)의 결막하 주사를 통해 전방 약제의 최대 약물 농도를 최대 4 시간까지 달성할 수 있다. 나노 기술은 안구 약물 전달을 개선하기 위해 적용되었다 (Vandervoort, Nanomedicine 2(2007) 11-21, Reimondez-Troitino, et al., Eu. J.Pharm. Biopharm March 6, 2015). 나노 기술은 또한 각막 NV의 치료에도 사용되었다 (Gonzalez, et al., J. Ocul. Pharmacol. Ther. 29(2013) 124-134). 나노 기술은 표적화, 안구 장벽 극복, 안구 생물학적 이용 가능성 향상, 방출 조절, 부작용 감소 등의 이점을 제공할 수 있다.
각막 이식은 고형 조직 이식에서 가장 오래되고 가장 흔한 형태이며 각막 부전 치료에 널리 사용된다. 매년 36,000 건의 각막 이식 수술이 미국에서 실시된다. 무혈관 및 비 염증성 "저 위험도" 각막 베드에서 2년 생존율은 90%까지 높을 수 있지만 "고 위험도" 각막 베드의 경우 50% 정도로 낮을 수 있다. 이는 이식 거부 또는 신생 혈관이나 염증을 보여준다. 각막 이식 실패는 이식에 적합한 제한된 각막 조직에 대한 안구 은행의 부담을 크게 증가시킬 수 있다.
면역 거부 반응은 인간 각막 이식 실패의 주요 원인 중 하나이다. "정상 위험" 무혈관 및 비염증성 베드에서 첫 해 거부율은 20%에 가깝고 "고 위험도" 신생 혈관염 및 염증 환자 수위는 50%까지 높아질 수 있다. 각막 이식술 후 각막 이식 생존율을 향상시키는 것은 면역 억제제 치료가 정상적인 전략이다. 글루코 코르티코이드는 클리닉에서 가장 널리 사용되는 면역 억제제이며 그 효능은 널리 받아 들여지고 있다.
글루코 코르티코이드는 전신 투여 또는 국소 점적(instillation) 투여될 수 있다. 그러나 장기적인 전신 스테로이드는 백내장, 녹내장, 포도당 이상, 성장 지연, 기회 감염 및 골다공증과 같은 심각한 부작용을 일으킬 수 있다. 신속한 각막 제거 및 각막 장벽은 국소 점적을 통한 점안제의 효능을 크게 손상시킬 수 있다. 따라서 스테로이드를 자주 국소적으로 사용하면 만족할만한 결과를 얻을 수 있으며, 안압 상승 및 백내장에 대한 추가 위험을 감수할 수 있다.
면역학적 각막 거부는 이식 실패의 주요 원인이다. 글루코 코르티코이드, 대사 물질(즉, 마이코펠로네이트 모페틸(mycophelonate mofetil) 베드), T-세포 억제제(즉, 사이클로스포린 A(cyclosporine A), 타크로리무스(tacrolimus), FK506)를 이용한 면역 억제 요법은 각막 이식 환자에게 전신 또는 안약을 통해 적용되었다. 눈은 약물에 쉽게 접근할 수 있는 장기이며, 면역 억제제의 전신 투여와 관련하여 전신 부작용이 감소되기 때문에 일반적으로 안약이 수 주일에서 수 개월에 이르는 장시간 동안 수술 후 전신 투여보다 바람직하다. 그러나, 안약은 여전히 안구 표면으로부터의 신속한 제거, 전방에서의 낮은 약물 농도, 치료 기간의 짧은 시간 및 빈번한 투여와 같은 문제점을 겪고 있다.
글루코 코르티코이드는 "저 위험도" 각막 이식과 "고 위험도" 각막 이식에서 각막 이식 거부에 널리 사용되었다. 국소적인 글루코 코르티코이드는 각막 이식 거부를 통제하는 "최적 표준"을 유지하지만 백내장, 안압 상승, 상처 열개 및 박테리아 및 곰팡이 감염과 같은 부작용의 위험이 있다. 덱사메타손 소디움 포스페이트(DSP) 용액의 결막하 주사는 안약에 비해 전방에서 높은 수준의 스테로이드 DSP를 전달하는 데 보다 효과적임이 밝혀졌다. 24 시간 후조차도 전방 유방의 DSP 수준은 SC 투여로 인한 디포 효과로 인한 안구 조직에서의 약물 보유가 연장되어 여전히 검출 가능했다. 스테로이드의 결막 주사는 국소 투여 및 전신 투여에 비해 많은 이점을 제공하지만, 안구 조직의 약물은 단일 투여로 양호한 치료 효과를 얻기에는 여전히 너무 짧다.
눈의 만성 질환을 치료하기 위해, 글루코 코르티코이드를 눈에 전달하기 위한 장기간의 작용 방법에 대한 필요성이 존재한다. 확장 전달을 제공하는 제제는 많은 글루코 코르티코이드의 투여와 관련된 독성 가능성을 최소화 할 것이다. 또한 빈번한 주사의 필요성을 줄이면 안내 염의 위험이 줄어들고 병원 방문 빈도가 줄어들어 환자와 그 가족에게 큰 어려움이 될 수 있다.
본 발명의 목적은, 개선된 효능을 갖는 글루코 코르티코이드의 제제를 제공하는 것이다.
글루코 코르티코이드는 각막 제어 거부 반응에서 가장 널리 사용되는 면역 억제제이다. 급성 안구 유출로 인해 글루코 코르티코이드 점안제의 잦은 국소 점적이 필요하다. 환자의 순응도가 낮고 부작용이 심한 경우 문제가 발생할 수 있다. 생분해성 폴리머 입자가 친수성 폴리머로 조밀하게 코팅되고, 나노입자를 형성하는 폴리머에 금속 이온과 인산 또는 카르복실기의 킬레이트화에 의해 착화된 글루코 코르티코이드와 같은 글루코 코르티코이드를 캡슐화하는 것으로 밝혀졌다. 글루코 코르티코이드는 말단의 카르복시 말단 그룹 폴리머 및 글루코 코르티코이드의 수용성 염이 시험관내에서 최대 7일 동안 글루코 코르티코이드의 지속 방출을 제공하고 결막(SC) 주사를 통해 투여될 수 있고 2 주 동안 눈의 결막 조직에 유지된다. 실시예는 PEG 또는 PLURONIC® F127과 같은 친수성 폴리머로 조밀하게 코팅된 생분해성 폴리(락틱-코-글리콜산)(PLGA)과 같은 매트릭스에 덱사메타손 소디움 포스페이트(DSP)와 같은 글루코 코르티코이드를 캡슐화하는 나노입자의 장점을 입증한다. 이는 시험관내에서 최대 7일 동안 DSP의 지속적인 방출을 나타낸다. DSP-로딩된 PLGA 나노입자 (DSP-NP)는 결막하 주사(SC) 주사를 통해 쉽게 투여될 수 있고, 결막 조직에서 2 주까지 장기간 유지될 수 있다. SC 주입 후 유리 DSP(free DSP) 솔루션은 일반적으로 처음 2 시간 내에 제거되며, 24 시간 후에는 안구 조직에 검출 가능한 DSP가 거의 없다. 이에 비해 DSP-NP는 7일간의 연구 기간 동안 전방 및 유리체를 포함한 안구 조직에서 지속적인 수준의 DSP를 제공할 수 있다. 바람직한 실시예에서, 글루코 코르티코이드는 글루코 코르티코이드 내의 인산 또는 카르복실기 및 나노입자 내의 생분해성 폴리머와 금속 이온의 킬레이트화에 의해 복합화된다. 높은 약물 로딩, 느린 방출 등은 다중-카르복시기 함유 폴리머를 사용하여 얻어지고; 및 약물 부하를 크게 증가시키고 방출 속도를 늦추는 것으로 밝혀진 DSP-로딩된 미소 구체(고형-물-오일-에멀젼 방법)를 제조하는 것을 포함한다.
일 실시예에서, 입자는 100 미크론까지의 직경을 갖는 미립자이다. 또 다른 실시예에서, 입자는 나노입자이다.
실시예에 의해 입증된 바와 같이, 쥐 각막 이식 거부 모델에 일주일마다 SC를 주사한 DSP-NP 제제는 식염수 대조군, 빈 입자 및 유리 DSP 용액에 비해 현저히 큰 효능을 보였다. 대부분의 이식편은 생리 식염수 또는 빈 나노입자로 치료했을 때 2주 이내에 거부되었다. 수술 후 4주 후에 DSP 치료군에서 이식편이 모두 거부되었다. 모든 각막 이식편은 DSP-NP로 치료할 때 전체 9주 연구 기간 동안 명확하고 거부되지 않았다. 이러한 결과는 글루코 코르티코이드가 지속적으로 방출되는 나노입자가 SC 투여를 통해 각막 동종 이식 거부를 효과적으로 예방할 수 있음을 보여준다. 각막 거부 용 DSP-PLA2COOH 나노입자의 월 1회 주사.
실시예에 의해 입증된 바와 같이, 코르티코 스테로이드 덱사메타손 소디움 포스페이트(DSP)의 지속 방출을 제공하는 생분해성 나노입자 제제는 각막 신생 혈관 형성, 포도막염의 효과적인 억제를 제공할 수 있으며, 녹내장의 치료를 도울 수 있다. 입자는 수술시에 눈에 주사될 수 있고, 그 후 주기적으로 주사될 수 있다. 각막 신생 혈관 형성을 예방하기 위한 바람직한 실시예에서, 입자는 결막 아래에 주사된다. 포도막염(팬 포도막염 또는 중간/후부 포도막염)의 치료를 위한 바람직한 실시예에서, 입자는 눈 주위 주사되고, 유리체액에서 높은 약물 수준을 허용한다. DSP-NP 결막 주사는 망막 염증성 사이토 카인 수준 측정을 통해 LPS 유발 포도막염을 예방할 수 있다. 중간 및 후부 포도막염은 국소 점안제로 치료하기 어렵고, 침윤성 미만의 눈 주위 주사(결막하 주사 포함)는 보다 많은 침윤성 유리체 내 주사보다 유리하다.
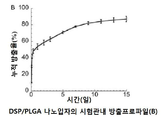
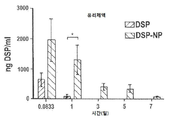
도 1은 DSP/PLGA 나노입자의 시험관내 약물 방출 프로파일의 그래프로서 시간에 대한 누적 방출(%)을 도시한 것이다.
도 2는 쥐에 결막하(SC) 주사 후 PS-PEG 코팅된 비분해성 폴리스티렌 입자(100 nm, 200 nm, 500 nm, 1 마이크론, 5 마이크론)의 시간에 대한 보유율로서, 쥐에게 피하 투여한 후 형광의 Zenogen IVIS 스펙트럼 광학 이미징에 의해 정량화된 보유율 그래프이다.
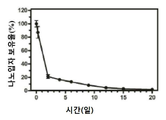
도 3은 SC를 쥐에 주사한 PLGA/F127 나노입자의 시간 경과에 따른 눈에서의 보유율 그래프이다. 이 값은 폴리머 사슬에서 염료가 절단됨으로써 영향을 받을 수 있다.
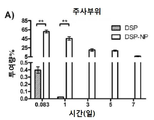
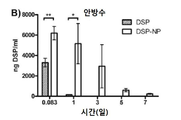
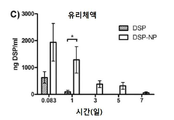
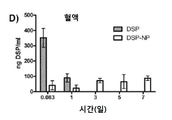
도 4a-4d는 쥐에 피하 투여한 후, 유리 DSP 용액(free DSP) 및 DSP-NP의 약물 동력학(DSP/ml/시간)을 나타낸 그래프이다. 도 4a는 주사 부위에서의 그래프이고; 도 4b는 안방수(aqueous humor)에서의 그래프이고; 4c는 유리체액에서의 그래프이며; 도 4d는 혈액 내의 그래프이다. *, p<0.05; **, p<0.01; ***, p<0.001.
도 5는 안구 조직(안구, 각막, 유리체액 및 안방수 제거 후의 안구 조직)에 단독으로 주사되거나 또는 NP로 캡슐화되고, 모든 조직에서 3H-DSP의 방사능을 측정하여 정량화된, 안구조직에 유지된 DSP 투여량의 그래프이다. 일부 데이터 점에서 값이 없는 것은 레벨을 감지할 수 없음을 의미한다.
도 6은 각막 투명성, 부종 및 새로운 혈관의 관점에서 최종 시점에서, 식염수, NP, DSP 또는 DSP-NP의 SC 주사로 치료된 이식편의 임상 평가의 막대 그래프이다. DSP-NP의 투명성과 부종에 막대가 나타나지 않는 것은 이식편이 완전히 투명하고 부종이 없다는 것을 의미한다.
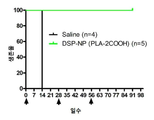
도 7은 식염수 대조군, 빈 NP, 유리 DSP 또는 DSP-NP의 SC 주사로 치료된 이식된 각막 이식편의 생존 곡선이다.
도 8은 각막 이식을 받은 눈에서 IOP를 측정한 후 식염수, 빈 NP, 유리 DSP 또는 DSP-NP로 처리한 후의 안압(IOP) 그래프이다. 정상 눈을 대조군으로 사용하였다.
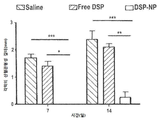
도 9a-9b는 생리 식염수, DSP 및 DSP-NP의 SC 주사로 처리한 후 NV 면적(도 9a) 및 혈관 길이(도 9b)에 대한 각막 신생 혈관의 정량적 분석의 그래프이다.
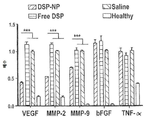
도 10a 및 도 10b는 DSP-NP에 대한 RT-PCR에 의해 측정된 PO 7일 (도 10a) 및 PO 14일(10b)에서의 각막 신생 혈관형성과 관련된 사이토카인 수준의 그래프이다. 유리 DSP; 식염; 건강한.
도 11은 식염수, 유리 DSP 및 DSP-NP의 SC 주사 처리 후 IOP(mmHg)의 그래프이다.
도 12는 DSP-NP의 싱크 조건 하에서 시험관내에서 15일 동안 지속된 약물 방출의 그래프로 8 중량% 약물 탑재량, 200±8 nm의 크기를 나타냈다.
도 13a 및 13b는 전방 챔버(도 13a) 및 유리체액(도 13b) 모두에서 높은 약물 수준을 나타내는 쥐에서 DSP-NP의 SC 투여 후 적어도 7일 동안 지속된 고 안 약물 수준의 그래프이다.
도 14는 LPS의 IP 주입 후 3 시간 및 24 시간에 영상화되고 스코어링된 전 안부의 염증 점수 그래프로서, DSP-NP 예방 군이 대조군보다 유의하게 적은 염증을 나타냄을 보여준다.
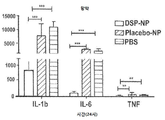
도 15는 24 시간 면역 접종 후 3 그룹의 EIU 모델에서 망막에서 IL-1b, IL-6 및 TNF의 mRNA 발현을 나타낸 그래프로서, 위약 -NP 및 PBS 그룹과 비교하여 DSP-NP 그룹에서 현저하게 감소된 발현을 나타낸다.
도 16a-16d는 DSP-PLA2COOH 나노입자를 쥐에게 결막하 주사하는 약물 동력학(ng DSP/ml/시간)을 나타낸 그래프이다. 도 16a는 안방수; 도 16b는 유리체액; 도 16c는 혈액; 도 16d는 주사 부위 제어를 도시한다.
도 17a-17e는 DSP-PLA2COOH 나노입자 처리군(17a-17c) 및 염수 대조군(17d-17f)에 대한 전체 12주 추적 동안의 이월의 시간 경과에 따른 이식편의 임상 관찰 그래프이다. 화살표는 치료 주사 시점을 나타낸다. 도 17a, 17d는 투명성 스코어; 도 17b, 17e는 부종 점수이고, 17c, 17f는 혈관 신생이다.
도 18은 생리 식염수 대조군 및 DSP-PLA2COOH 나노입자 처리군 둘 다에 대한 생존 곡선(생존율%)이다.
도 19a 및 도 19b는 대조군(19b)과 비교하여 월간 간격(19a)으로 DSP-PLA2COOH 나노입자로 처리된 동물에 대한 시간 경과에 따른 안압의 그래프이다.
도 2는 쥐에 결막하(SC) 주사 후 PS-PEG 코팅된 비분해성 폴리스티렌 입자(100 nm, 200 nm, 500 nm, 1 마이크론, 5 마이크론)의 시간에 대한 보유율로서, 쥐에게 피하 투여한 후 형광의 Zenogen IVIS 스펙트럼 광학 이미징에 의해 정량화된 보유율 그래프이다.
도 3은 SC를 쥐에 주사한 PLGA/F127 나노입자의 시간 경과에 따른 눈에서의 보유율 그래프이다. 이 값은 폴리머 사슬에서 염료가 절단됨으로써 영향을 받을 수 있다.
도 4a-4d는 쥐에 피하 투여한 후, 유리 DSP 용액(free DSP) 및 DSP-NP의 약물 동력학(DSP/ml/시간)을 나타낸 그래프이다. 도 4a는 주사 부위에서의 그래프이고; 도 4b는 안방수(aqueous humor)에서의 그래프이고; 4c는 유리체액에서의 그래프이며; 도 4d는 혈액 내의 그래프이다. *, p<0.05; **, p<0.01; ***, p<0.001.
도 5는 안구 조직(안구, 각막, 유리체액 및 안방수 제거 후의 안구 조직)에 단독으로 주사되거나 또는 NP로 캡슐화되고, 모든 조직에서 3H-DSP의 방사능을 측정하여 정량화된, 안구조직에 유지된 DSP 투여량의 그래프이다. 일부 데이터 점에서 값이 없는 것은 레벨을 감지할 수 없음을 의미한다.
도 6은 각막 투명성, 부종 및 새로운 혈관의 관점에서 최종 시점에서, 식염수, NP, DSP 또는 DSP-NP의 SC 주사로 치료된 이식편의 임상 평가의 막대 그래프이다. DSP-NP의 투명성과 부종에 막대가 나타나지 않는 것은 이식편이 완전히 투명하고 부종이 없다는 것을 의미한다.
도 7은 식염수 대조군, 빈 NP, 유리 DSP 또는 DSP-NP의 SC 주사로 치료된 이식된 각막 이식편의 생존 곡선이다.
도 8은 각막 이식을 받은 눈에서 IOP를 측정한 후 식염수, 빈 NP, 유리 DSP 또는 DSP-NP로 처리한 후의 안압(IOP) 그래프이다. 정상 눈을 대조군으로 사용하였다.
도 9a-9b는 생리 식염수, DSP 및 DSP-NP의 SC 주사로 처리한 후 NV 면적(도 9a) 및 혈관 길이(도 9b)에 대한 각막 신생 혈관의 정량적 분석의 그래프이다.
도 10a 및 도 10b는 DSP-NP에 대한 RT-PCR에 의해 측정된 PO 7일 (도 10a) 및 PO 14일(10b)에서의 각막 신생 혈관형성과 관련된 사이토카인 수준의 그래프이다. 유리 DSP; 식염; 건강한.
도 11은 식염수, 유리 DSP 및 DSP-NP의 SC 주사 처리 후 IOP(mmHg)의 그래프이다.
도 12는 DSP-NP의 싱크 조건 하에서 시험관내에서 15일 동안 지속된 약물 방출의 그래프로 8 중량% 약물 탑재량, 200±8 nm의 크기를 나타냈다.
도 13a 및 13b는 전방 챔버(도 13a) 및 유리체액(도 13b) 모두에서 높은 약물 수준을 나타내는 쥐에서 DSP-NP의 SC 투여 후 적어도 7일 동안 지속된 고 안 약물 수준의 그래프이다.
도 14는 LPS의 IP 주입 후 3 시간 및 24 시간에 영상화되고 스코어링된 전 안부의 염증 점수 그래프로서, DSP-NP 예방 군이 대조군보다 유의하게 적은 염증을 나타냄을 보여준다.
도 15는 24 시간 면역 접종 후 3 그룹의 EIU 모델에서 망막에서 IL-1b, IL-6 및 TNF의 mRNA 발현을 나타낸 그래프로서, 위약 -NP 및 PBS 그룹과 비교하여 DSP-NP 그룹에서 현저하게 감소된 발현을 나타낸다.
도 16a-16d는 DSP-PLA2COOH 나노입자를 쥐에게 결막하 주사하는 약물 동력학(ng DSP/ml/시간)을 나타낸 그래프이다. 도 16a는 안방수; 도 16b는 유리체액; 도 16c는 혈액; 도 16d는 주사 부위 제어를 도시한다.
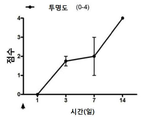
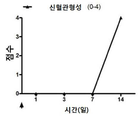
도 17a-17e는 DSP-PLA2COOH 나노입자 처리군(17a-17c) 및 염수 대조군(17d-17f)에 대한 전체 12주 추적 동안의 이월의 시간 경과에 따른 이식편의 임상 관찰 그래프이다. 화살표는 치료 주사 시점을 나타낸다. 도 17a, 17d는 투명성 스코어; 도 17b, 17e는 부종 점수이고, 17c, 17f는 혈관 신생이다.
도 18은 생리 식염수 대조군 및 DSP-PLA2COOH 나노입자 처리군 둘 다에 대한 생존 곡선(생존율%)이다.
도 19a 및 도 19b는 대조군(19b)과 비교하여 월간 간격(19a)으로 DSP-PLA2COOH 나노입자로 처리된 동물에 대한 시간 경과에 따른 안압의 그래프이다.
I. 정의
본원에서 사용되는 "활성제"는 신체에서 국부적으로 및/또는 전신적으로 작용하는 생리학적 또는 약리학적 활성 물질을 의미한다. 활성제는 질환 또는 장애의 치료(예: 치료제), 예방(예: 예방제) 또는 진단(예: 진단제)을 위해 환자에게 투여되는 물질이다. 본원에서 사용된 "안과 약제" 또는 "안과 활성제"는 눈의 질병 또는 장애의 하나 이상의 증상을 경감시키거나, 발병을 지연시키거나 또는 예방하기 위해 환자에게 투여되는 제제 또는 진단제제 이미징 또는 눈을 평가하는 데 유용하다.
본원에 사용된 "유효량" 또는 "치료학적 유효량"은 하나 이상의 증상, 특히 눈의 질병 또는 장애의 완화, 개시 발병 또는 예방에 효과적인 폴리머 나노입자의 양을 지칭한다. 노화 관련 황반변성의 경우, 유효량의 폴리머 나노입자는 환자의 시력 손실을 지연, 감소 또는 예방한다.
본원에서 사용된 "생체 적합성"및 "생물학적으로 상용성"은 일반적으로 수혜자에게 일반적으로 비 독성 인 임의의 대사 산물 또는 분해 생성물과 함께 수령자에게 심각한 부작용을 일으키지 않는 물질을 지칭한다. 일반적으로, 생체 적합성 물질은 환자에게 투여될 때 유의한 염증성 또는 면역 반응을 유도하지 않는 물질이다.
본원에서 사용되는 "생분해성 폴리머"는 일반적으로 생리학적 조건 하에서 효소 작용 및/또는 가수 분해에 의해 분해되어 개체에 의해 대사되거나, 제거되거나 또는 배설될 수 있는 보다 작은 단위 또는 화학 종으로 분해 또는 침식될 폴리머를 지칭한다. 분해 시간은 다공성, 입자 크기 및 환경과 같은 폴리머 조성물, 형태학의 함수이다.
본원에 사용된 "친수성"은 물에 친화력을 갖는 특성을 말한다. 예를 들어, 친수성 폴리머(또는 친수성 폴리머 세그먼트)는 수용액에 주로 가용성이며/또는 물을 흡수하는 경향이 있는 폴리머(또는 폴리머 세그먼트)이다. 일반적으로, 폴리머가 더 친수성일수록, 폴리머는 물에 용해되거나, 섞이거나, 물에 젖어가는 경향이 있다.
본원에서 사용되는 "소수성"은 물에 대한 친화력이 없거나 심지어 물을 몰아내는 특성을 지칭한다. 예를 들어, 폴리머(또는 폴리머 세그먼트)의 소수성이 높을수록 폴리머(또는 폴리머 세그먼트)는 물에 녹지 않거나 물에 젖지 않는 경향이 있다.
소수성 및 소수성은 폴리머 또는 폴리머 세그먼트의 군 내에서의 친수성/소수성의 스펙트럼과 같은(그러나 이에 한정되지는 않음) 상대적인 용어로 말해질 수 있다. 2 개 이상의 폴리머가 논의되는 일부 실시예에서, 용어 "소수성 폴리머"는 또 다른 친수성 폴리머와 비교할 때 폴리머의 상대적 소수성에 기초하여 정의될 수 있다.
본원에 사용된 "나노입자"는 일반적으로 평균 직경과 같은 직경이 약 10 nm 내지 약 1 미크론, 바람직하게는 100 nm 내지 약 1 미크론 인 입자를 지칭한다. 입자는 어떤 모양이든 가질 수 있다. 구형을 갖는 나노입자는 일반적으로 "나노 구체(nanosphere)"라고 불린다.
본원에 사용된 "미세 입자"는 일반적으로 약 1 미크론 내지 약 100 미크론, 바람직하게는 약 1 미크론 내지 약 50 미크론, 보다 바람직하게는 약 1 내지 약 30 미크론의 평균 직경과 같은 직경을 갖는 입자를 의미한다. 미크론. 미립자는 임의의 형상을 가질 수 있다. 구형을 갖는 미립자는 일반적으로 "미소 구(microspheres)"라고 불린다.
본원에서 사용되는 "분자량"은 달리 언급하지 않는 한 일반적으로 벌크 폴리머의 상대적 평균 사슬 길이를 의미한다. 실제적으로, 분자량은 겔 침투 크로마토 그래피(GPC) 또는 모세관 점도 측정법을 포함하는 다양한 방법을 사용하여 추정되거나 특징화될 수 있다. GPC 분자량은 수 평균 분자량(Mn)과 반대로 중량 평균 분자량(Mw)으로 보고된다. 모세관 점도계는 특정 농도, 온도 및 용매 조건을 사용하여 묽은 폴리머 용액에서 결정된 고유 점도로 분자량을 추정한다.
본원에서 사용된 "평균 입자 크기"는 일반적으로 입자 집단 내의 입자의 통계적 평균 입자 크기(직경)를 지칭한다. 본질적으로 구형 인 입자의 직경은 물리적 또는 유체 역학적 지름을 나타낼 수 있다. 비 구형 입자의 직경은 유체 역학적 직경을 우선적으로 지칭할 수 있다. 본 명세서에서 비 구형 입자의 직경은 입자 표면상의 2 점 사이의 최대 직선 거리를 지칭할 수 있다. 평균 입자 크기는 동적 광산란과 같은 당업계에 공지된 방법을 사용하여 측정될 수 있다.
"단분산(monodisperse)"및 "균일한 크기 분포(homogeneous size distribution)"는 본원에서 상호 교환적으로 사용되며 모든 입자가 동일하거나 거의 동일한 크기인 나노입자 또는 미립자의 집단을 기술한다. 본원에 사용된 바와 같이, 단분산 분포는 분포의 90% 이상이 중간 입자 크기의 15% 이내, 더욱 바람직하게는 중간 입자 크기의 10% 이내, 가장 바람직하게는 중간 입자 크기의 5% 이내 인 입자 분포를 지칭한다 크기.
본원에서 사용된 "약학적으로 허용 가능한"은 건전한 의학적 판단의 범위 내에서 과도하게 인간 및 동물의 조직과 접촉하여 사용하기에 적합한 화합물, 담체, 부형제, 조성물 및/또는 투여 형태를 의미한다 독성, 자극, 알레르기 반응 또는 기타 문제 또는 합병증을 유발할 수 있다.
본원에서 사용되는 "분지 점(branch point)"은 다수의 친수성 폴리머 세그멘트를 소수성 폴리머 세그먼트의 하나의 말단 또는 다수의 소수성 폴리머 세그먼트을 친수성 세그먼트의 한 말단에 연결시키는 역할을하는 폴리머 나노입자의 일부를 나타낸다.
본원에 사용된 "글루코 코르티코이드"는 HIF-1의 수준 및/또는 그의 프로모터 영역에 저산소 반응 요소를 함유하는 유전자의 전사를 자극하는 능력을 감소시키는 약물을 의미한다.
본 명세서에서 일반적으로 사용되는 "임플란트"는 신체의 특정 부위에 주입 또는 외과적 이식에 의해, 바람직하게는 주입 또는 외과적 주입에 의해 구조화, 이식 부위에서 하나 이상의 글루코 코르티코이드를 장시간에 걸쳐 방출한다. 예를 들어, 안구 내 임플란트는 바람직하게는 주사 또는 외과적 이식에 의해 안구 내에 배치되도록 구조화되고, 크기가 정해 지거나 또는 다른 방식으로 구성되는 폴리머 장치 또는 요소이며, 하나 이상의 글루코 코리티코이드를 장시간에 걸쳐 방출함으로써 안구의 하나 이상의 질병 또는 장애를 치료한다. 안구 내 임플란트는 일반적으로 눈의 생리 조건과 생체 적합하며 부작용을 일으키지 않는다. 일반적으로 안구 내 임플란트는 눈의 시력을 손상시키지 않고 눈에 삽입될 수 있다.
여기에 정의된 값의 범위는 범위 내의 모든 값과 범위 내의 모든 하위 범위를 포함한다. 예를 들어 범위가 0에서 10까지의 정수로 정의된 경우 범위는 범위 내의 모든 정수와 범위 내의 모든 하위 범위(예: 1-10, 1-6, 2-8, 3-7, 3-9 등)를 포함한다.
II.
폴리머
-
글루코 코르티코이드
입자
일부 실시예에서, 하나 이상의 글루코 코르티코이드가 눈에 전달하기 위해 폴리머 매트릭스에 분산되거나 캡슐화된다. 폴리머 매트릭스는 비-생분해성 또는 생분해성 폴리머로부터 형성될 수 있고; 그러나, 폴리머 매트릭스는 바람직하게는 생분해성이다. 폴리머 매트릭스는 눈으로 전달하기 위해 임플란트, 미세 입자, 나노입자 또는 이들의 조합으로 형성될 수 있다. 투여시, 하나 이상의 글루코 코르티코이드는 폴리머 매트릭스의 분해, 폴리머 매트릭스로부터의 하나 이상의 억제제의 확산 또는 이들의 조합에 의해 연장된 기간에 걸쳐 방출된다. 폴리머 나노입자를 사용함으로써, 입자는 보다 제어된 약물 부하 및 약물 방출 프로파일로 형성될 수 있다.
일부 실시예에서, 제어-방출 제제는 하나 이상의 폴리머 나노입자로부터 형성된 입자를 함유한다. 폴리머 나노입자는 하나 이상의 글루코 코르티코이드를 함유하는 블록 코폴리머다. 전형적으로, 블록 코폴리머는 글루코 코르티코이드 하나 이상의 소수성 폴리머 세그먼트 및 하나 이상의 친수성 폴리머 세그먼트를 함유한다. 특정 경우, 하나 이상의 친수성 폴리머 세그멘트가 하나 이상의 소수성 폴리머 세그멘트에 분지 점에 의해 부착된다. 폴리머 나노입자를 사용함으로써, 입자는 보다 제어된 약물 부하 및 약물 방출 프로파일로 형성될 수 있다. 또한, 복합체의 용해도는 가용성 약물 농도 및 독성을 최소화하도록 제어될 수 있다.
폴리머 나노입자는 하나 이상의 글루코 코르티코이드, 바람직하게는 에스테르 또는 다른 가수 분해 가능한 잔기를 함유하는 폴리머와 같은 생분해성 폴리머의 말단에서 인산기 또는 카르복실기, 가장 바람직하게는 카르복시 말단과 금속 이온의 킬레이트화에 의해 복합화된다. 글루코 코르티코이드는 수용성 염으로 유도체화된 다음 폴리머 나노입자에 혼입될 수 있다.
A. 글루코 코르티코이드
글루코 코르티코이드는 부신피질에 의해 생성되고 탄수화물, 단백질 및 지방 대사에 관여하며 소염제로 사용되는 하이드로코르티손(hydrocortisone)과 같은 항 염증성 스테로이드 유사 화합물 군이다. 다음은 일반적인 글루코 코르티코이드를 상대적인 효능 순서로 나열한 것이다. 사용 가능한 글루코 코리티코이드는 다른 효력을 가지며, 예를 들어 덱사메타손 1mg은 하이드로코르티손 25mg만큼 효과적이다. 다음은 주요 제품의 상대적인 효능을 나타낸다.
[글루코 코르티코이드의 상대적인 효능]
하이드로코르티손
1
프레디손
4
프레드니솔론
4
메틸프레드니솔론
5
트리암시놀론
5
덱사메타손
25
베타메타손
25
코르티바졸
50
아크로메타손(aclometasone), 부데소니드(budesonide), 크로베타솔(clobetasol), 크로베타손(clobetasone), 데소니드(desonide), 플루오시놀론(fluocinolone), 플루오코르톨론(fluocortolone), 플루니솔리드(flunisolide), 플루티카손(fluticasone), 메틸프레드니솔론(methylprednisolone), 모메타손(mometasone), 파라메타손(paramethasone), 리멕솔론(rimexolone) 및 틱소코르톨(tixocortols)를 포함한 많은 다른 글루코 코르티코이드가 있다. 이식 거부와 관련된 대부분의 상황은 덱사메타손이나 베타메타손(betamethasone)과 같은 보다 강력한 화합물을 사용한다.
수용성 글루코 코르티코이드 염은 상업적으로 입수하거나 또는 통상적인 화학반응을 사용하여 합성될 수 있다. 바람직한 염은 덱스메타손 소디움 포스페이트 및 하이드로코르티손 소디움 포스페이트와 같은 포스페이트 및 하이드로코르티손 소디움 숙시네이트 및 메틸프레드니솔론 소디움 숙시네이트와 같은 카르복실레이트를 포함한다.
B. 나노입자를 형성하는
폴리머
폴리머 나노입자는 하나 이상의 폴리머, 단일 폴리머 또는 코폴리머를 함유할 수 있다. 바람직한 실시예에서, 폴리머는 생분해성 폴리머이다. 소수성 폴리머가 생분해성인 경우, 폴리머 분해 프로파일은 생체 내 활성제의 방출 속도에 영향을 주도록 선택될 수 있다. 예를 들어, 폴리머는 7일 내지 2년, 보다 바람직하게는 7일 내지 56주, 더욱 바람직하게는 4주 내지 56주, 가장 바람직하게는 8주 내지 28주 동안 분해되도록 선택될 수 있다.
적합한 소수성 폴리머의 예는 폴리(락트산), 폴리(글리콜산) 및 폴리(락트산-코-글리콜산)과 같은 폴리하이드록시산; 폴리3-하이드록시부티레이트 또는 폴리4-하이드록시부티레이트와 같은 폴리하이드록시알카노에이트; 폴리카프로락톤; 폴리(오르토에스테르); 폴리안하이드라이드; 폴리(포스파젠); 폴리(하이드록시알카노에이트); 폴리(락티드-co-카프로락톤); 티로신폴리카보네이트와 같은 폴리카보네이트; 폴리아미드(합성 및 천연 폴리아미드 포함), 폴리펩타이드 및 폴리(아미노산); 폴리에스테르아미드; 폴리에스테르; 폴리(디옥사논); 폴리(알킬렌 알킬레이트); 소수성 폴리에테르; 폴리우레탄; 폴리에테르 에스테르; 폴리아세탈; 폴리시아노아크릴레이트; 폴리아크릴레이트; 폴리메틸메타크릴레이트; 폴리실록산; 폴리(옥시에틸렌)/폴리(옥시프로필렌) 코폴리머; 폴리케탈; 폴리포스페이트; 폴리하이드록시발레이트; 폴리알킬렌 옥살레이트; 폴리알킬렌 숙시네이트; 폴리(말레산), 및 이들의 코폴리머를 포함한다.
바람직한 실시예에서, 폴리머는 폴리 젖산, 폴리 글리콜산 또는 그의 코폴리머와 같은 폴리하이드록시 에스테르이다. 젖산에 대한 글리콜산의 비율은 분해 속도를 조절하기 위해 최적화될 수 있다.
폴리머는 폴리안하이드라이드일 수 있다. 폴리안하이드라이드는 지방족 폴리안하이드라이드, 불포화 폴리안하이드라이드 또는 방향족 폴리안하이드라이드일 수 있다. 대표적인 폴리안하이드라이드는 폴리아디프산 무수물, 폴리푸말산 무수물, 폴리세바식산 무수물, 폴리말레산 무수물, 폴리프탈산 무수물, 폴리이소프탈산 무수물, 폴리아스파르트산 무수물, 폴리테레프탈산 무수물, 폴리이소프탈산 무수물, 폴리카르복시페녹시프로판 무수물, 폴리카르복시페녹시헥산 무수물뿐만 아니라 다른 몰비로 이들 폴리안하이드라이드를 포함할 수 있다. 다른 적합한 폴리안하이드라이드는 미국 특허 제4,757,128호, 제4,857,311호, 제4,888,176호 및 제4,789,724호에 개시되어 있다. 폴리안하이드라이드는 또한 폴리안하이드라이드 블록을 함유하는 코폴리머일 수 있다. 특정 실시예에서, 폴리머는 폴리 세 박산 무수물이다. 특정 실시예에서, 폴리머는 폴리(1,6-비스(p-카르복시 페녹시) 헥산-코-세바 신산)(폴리(CPH-SA))이다. 프로판-코-세바 스산)(폴리(CPP-SA)).
소수성 폴리머의 분자량은 약물 방출 속도와 같은 특성을 갖는 입자를 형성하는 폴리머 나노입자를 제조하기 위해 다양할 수 있다. 폴리머는 약 150 Da 내지 1 MDa의 분자량을 가질 수 있다. 특정 실시예에서, 폴리머는 약 1kDa 내지 약 100kDa, 보다 바람직하게는 약 1kDa 내지 약 50kDa, 가장 바람직하게는 약 1kDa 내지 약 25kDa의 분자량을 갖는다.
C. 친수성
폴리머
나노입자는 친수성 폴리머로 코팅되어 있다. 이들은 친수성, 생체 적합성(즉, 유의한 염증성 또는 면역 반응을 유도하지 않음), 비 독성 폴리머 또는 코폴리머이어야 한다. 적합한 폴리머의 예로는 폴리에틸렌 글리콜(PEG), 폴리(프로필렌 글리콜)(PPG) 및 에틸렌 글리콜과 프로필렌 글리콜의 코폴리머, 폴리(옥시 에틸화 폴리올), 폴리(올레핀 알코올), 폴리(비닐 알콜), 및 이들의 코폴리머, 삼원 코폴리머 및 이들의 혼합물을 포함한다.
바람직한 실시예에서, 하나 이상의 친수성 폴리머 세그멘트는 폴리(알킬렌 글리콜) 사슬을 함유한다. 폴리(알킬렌 글리콜) 사슬은 8 내지 500 반복 단위, 보다 바람직하게는 40 내지 500 반복 단위를 함유할 수 있다. 적절한 폴리(알킬렌 글리콜)은 폴리에틸렌 글리콜, 폴리 프로필렌 1,2-글리콜, 폴리(프로필렌 옥사이드), 폴리 프로필렌 1,3-글리콜 및 이들의 코폴리머를 포함한다. 특정 실시예에서, 하나 이상의 친수성 폴리머 세그먼트는 PEG 사슬이다. 이러한 경우, PEG 사슬은 미국 특허 제5,932,462호에 기재된 것과 같은 선형 또는 분지형일 수 있다. 특정 실시예에서, PEG 사슬은 선형이다.
하나 이상의 친수성 폴리머 세그먼트 각각은 독립적으로 약 300 Da 내지 1 MDa의 분자량을 가질 수 있다. 친수성 폴리머 세그먼트는 상기 열거된 임의의 분자량 범위의 분자량을 가질 수 있다. 특정 실시예에서, 하나 이상의 친수성 폴리머 세그먼트의 각각은 약 1kDa 내지 약 20kDa, 보다 바람직하게는 약 1kDa 내지 약 15kDa, 가장 바람직하게는 약 1kDa 내지 약 10kDa의 분자량을 갖는다. 바람직한 실시예에서, 하나 이상의 친수성 폴리머 세그먼트의 각각은 약 5kDa의 분자량을 갖는다.
모든 친수성 폴리머가 유효한 것은 아니다. 실시예에 의해 입증된 바와 같이, 바람직한 폴리머는 BASF에 의해 판매되는 PLURONIC® F127이다. PLURONICS®는 두 개의 폴리에틸렌 옥사이드("PEO") 블록에 연결된 하나의 폴리 프로필렌 산화물("PPO") 블록으로 구성된 삼블록 코폴리머다. PEO 블록은 대부분 친수성이기 때문에 수성 매체에서 잘 녹지 만 PPO 블록은 주변 온도에서 대부분 소수성이기 때문에 용해되지 않는다.
III.
폴리머
나노입자의 합성
폴리머 나노입자는 당업계에 공지된 합성 방법을 사용하여 제조될 수 있다. 폴리머 나노입자 제조를 위한 대표적인 방법은 아래에 설명되어 있다. 소정의 폴리머 나노입자의 합성을 위한 적절한 경로는 다수의 인자, 예를 들면, 폴리머 나노입자의 구조, 접합체를 구성하는 폴리머의 동일성, 활성제의 동일성, 뿐만 아니라, 뿐만 아니라 작용기의 양립성, 보호기 전략 및 불안정한 결합의 존재와 관련하여 화합물 전체의 구조를 고려하여 결정될 수 있다.
하나 이상의 글루코 코르티코이드의 제어 전달을 위한 폴리머 임플란트(예를 들어, 막대, 디스크, 웨이퍼 등), 미세 입자 및 나노입자가 매트릭스 내에 제공, 분산 또는 캡슐화된다. 일부 실시예에서, 입자 또는 임플란트는 폴리머 매트릭스에 분산되거나 캡슐화된 하나 이상의 글루코 코르티코이드를 함유한다.
입자는 둘 이상의 상이한 폴리머 나노입자의 혼합물로서 제공될 수 있다. 예를 들어, 입자는 상이한 글루코 코르티코이드를 함유하는 2 종 이상의 폴리머 나노입자로부터 형성될 수 있다. 다른 경우에, 입자는 글루코 코르티코이드의 방출 속도를 변화시키기 위해 동일한 글루코 코르티코이드를 함유하는 2 종 이상의 폴리머 나노입자로부터 형성된다.
10 nm 내지 1000 ㎛의 평균 입자 크기를 갖는 입자는 본원에 기재된 조성물에서 유용하다. 바람직한 실시예에서, 입자는 10 내지 100 미크론, 보다 바람직하게는 약 100 내지 50 미크론, 보다 바람직하게는 약 200 내지 50 미크론의 평균 입자 크기를 갖는다. 특정 실시예에서, 입자는 500 내지 700 nm의 직경을 갖는 나노입자다. 입자는 임의의 형상을 가질 수 있지만 일반적으로 구형이다.
일부 실시예에서, 하나 이상의 폴리머 나노입자로부터 형성된 입자 집단은 단분산 입자 집단이다. 다른 실시예에서, 하나 이상의 폴리머 나노입자로부터 형성된 입자 집단은 다분산 입자 집단이다. 하나 이상의 폴리머 나노입자로부터 형성된 입자의 집단이 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90% 또는 95%보다 큰 입자의 다분산 집단인 일부 경우에, 입자 크기 분포는 중간 입자 크기의 10% 내에 있다.
바람직하게는, 하나 이상의 폴리머 나노입자로부터 형성된 입자는 그 표면에 상당한 양의 친수성 폴리머, 예컨대 PEG를 함유한다.
미립자 및 나노입자는 당업계에 공지된 폴리머 마이크로 또는 나노입자의 형성을 위한 임의의 적합한 방법을 사용하여 형성될 수 있다. 입자 형성에 사용되는 방법은 원하는 입자 크기 및 크기 분포 뿐만 아니라 폴리머 나노입자 또는 폴리머 매트릭스에 존재하는 폴리머의 특성을 비롯한 다양한 인자에 의존할 것이다. 입자에 혼입되는 글루코 코르티코이드(들)의 유형은 일부 글루코 코르티코이드가 특정 용매, 특정 온도 범위 및/또는 특정 pH 범위에서 불안정하므로 요인일 수도 있다.
단분산 입자 집단이 바람직한 상황에서, 입자는 나노입자의 단분산 집단을 생성하는 방법을 이용하여 형성될 수 있다. 다르게는, 다분산 나노입자 분포를 생성하는 방법이 사용될 수 있고, 입자는 원하는 평균 입자 크기 및 입자 크기 분포를 갖는 입자 집단을 제공하기 위해 입자 형성 후에 체질과 같은 당업계에 공지된 방법을 사용하여 분리될 수 있다.
미립자 및 나노입자를 제조하기 위한 통상적인 기술은 용매 증발, 고온 용융 입자 형성, 용매 제거, 분무 건조, 상 전환, 코아세르베이션(coacervation) 및 저온 주조를 포함 하나 이에 한정되지는 않는다. 입자 배합의 적합한 방법을 이하에 간략하게 설명한다. pH 조절제, 붕괴제, 방부제 및 항산화제를 포함하는 약학적으로 허용 가능한 부형제는 입자 형성 중에 선택적으로 입자에 혼입될 수 있다.
폴리머 나노입자는 하나 이상의 글루코 코르티코이드를 함유하며, 바람직하게는 에스테르 또는 다른 가수 분해 가능한 잔기를 함유하는 폴리머와 같은 생분해성 폴리머 말단의 카르복시 말단기, 가장 바람직하게는 인산기 또는 카르복시기와 금속 이온의 킬레이트화에 의해 착화된다. 글루코 코르티코이드는 수용성 염으로 유도체 합성된 다음 폴리머 나노입자에 혼입될 수 있다.
안구 내 임플란트는 구형 또는 비 구형일 수 있다. 구형의 임플란트의 경우, 임플란트는 바늘로 투여하는 경우 약 5 ㎛ 내지 약 2 ㎜, 또는 약 10 ㎛ 내지 약 1 ㎜의 가장 큰 치수(예를 들어, 직경)를 가질 수 있고, 1 ㎜보다 크거나, 외과 이식에 의한 투여의 경우에는 2mm, 예를 들어 3mm 또는 10mm 이하이다. 임플란트가 비 구형 인 경우, 임플란트는 바늘로 투여할 경우 약 5 ㎛ 내지 약 2 ㎜, 또는 약 10 ㎛ 내지 약 1 ㎜일 수 있는 가장 큰 치수 또는 가장 작은 치수를 가질 수 있으며, 1 mm 이상 외과 이식에 의한 투여의 경우, 2 mm보다 크거나, 3 mm 또는 10 mm 이하이다.
인간의 유리체 챔버는, 예를 들어, 1 내지 10 mm의 길이를 갖는 다양한 기하학적 구조의 비교적 큰 임플란트를 수용할 수 있다. 상기 임플란트는 직경이 약 2mm x 0.75mm 인 원통형 펠렛(예 : 로드)일 수 있다. 상기 임플란트는 길이가 약 7mm 내지 약 10mm이고 직경이 약 0.75mm 내지 약 1.5mm 인 원통형 펠렛일 수 있다. 특정 실시예에서, 상기 임플란트는 직경이 약 0.5mm, 길이가 약 6mm 및 중량이 약 1mg 인 압출된 필라멘트 형태이다. 일부 실시예에서, 치수는 바늘을 통한 안내 주사를 위해 이미 승인된 임플란트, 즉 직경 460 미크론 및 길이 6 mm 및 직경 370 미크론 및 길이 3.5 mm 인 임플란트와 유사하거나 유사하다.
안구 내 임플란트는 또한 유리체액과 같은 눈 내 임플란트의 삽입 및 이후의 임플란트의 수용을 용이하게 하도록 다소 유연한 것으로 설계될 수 있다. 임플란트의 총 중량은 일반적으로 약 250 내지 5000 ㎍, 보다 바람직하게는 약 500 내지 1000 ㎍이다. 특정 실시예에서, 안구 내 임플란트는 약 500 ㎍, 750 ㎍ 또는 1000 ㎍의 질량을 갖는다.
임플란트는 당업계에 공지된 임의의 적절한 기술을 사용하여 제조될 수 있다. 임플란트 제조에 적합한 기술의 예는 용매 증발 방법, 상 분리 방법, 계면 방법, 성형 방법, 사출 성형 방법, 압출 방법, 공 압출 방법, 카버 프레스 방법, 다이 절단 방법, 열 압축 및 이들의 조합을 포함한다. 임플란트의 제조를 위한 적절한 방법은 임플란트에 존재하는 폴리머/폴리머 세그멘트의 특성, 임플란트에 존재하는 하나 이상의 글루코 코르티코이드의 특성, 및 원하는 형태 및 크기를 포함하는 많은 인자를 고려하여 선택될 수 있다. 임플란트의 적절한 제조 방법은 예를 들어 미국 특허 제4,997,652 호 및 미국 특허출원공개 번호 US2010/0124565에 기술되어 있다.
어떤 경우에는 임플란트 제조 중에 용매가 필요하지 않도록 압출 방법을 사용할 수 있다. 압출 방법을 사용할 때, 폴리머/폴리머 세그먼트 및 글루코 코르티코이드는 제조에 필요한 온도, 일반적으로 적어도 약 섭씨 85도에서 안정하도록 선택된다. 그러나, 폴리머 성분 및 하나 이상의 글루코 코르티코이드의 성질에 따라, 압출 방법은 섭씨 약 25 ℃ 내지 약 150 ℃, 보다 바람직하게는 약 65 ℃ 내지 약 130 ℃의 온도를 사용할 수 있다. 임플란트는 표면의 전부 또는 일부를 덮는 코팅을 제공하기 위해 공 압출될 수 있다.
IV. 약학적 제제
약학적 제제는 하나 이상의 약학적으로 허용 가능한 부형제와 조합하여 하나 이상의 폴리머 나노입자를 함유한다. 대표적인 부형제는 용매, 희석제, pH 조절제, 방부제, 항산화제, 현탁제, 습윤제, 점도 조절제, 긴장성 제제, 안정화제 및 이들의 조합을 포함한다. 적합한 약학적으로 허용되는 부형제는 바람직하게는 일반적으로 안전하다고 인정되는 물질(GRAS)로부터 선택되며, 바람직하지 않은 생물학적 부작용 또는 원치 않는 상호 작용을 일으키지 않으면서 개인에게 투여될 수 있다.
A. 추가 활성제
폴리머 입자 내에 존재하는 하나 이상의 글루코 코르티코이드에 추가하여, 제제는 하나 이상의 추가의 치료제, 진단제 및/또는 예방제를 함유할 수 있다. 활성제는 소분자 활성제 또는 효소 또는 단백질, 폴리 펩타이드 또는 핵산과 같은 생체 분자일 수 있다. 적합한 소형 분자 활성제는 유기 및 유기 금속 화합물을 포함한다. 일부 예에서, 소분자 활성제는 약 2000 g/mol 미만, 보다 바람직하게는 약 1500 g/mol 미만, 가장 바람직하게는 약 1200 g/mol 미만의 분자량을 갖는다. 소분자 활성제는 친수성, 소수성 또는 양친매성 화합물일 수 있다.
일부 경우에, 하나 이상의 부가적인 활성제는 하나 이상의 폴리머 나노입자로부터 형성된 입자 내에 캡슐화되거나, 분산되거나, 그렇지 않으면 결합될 수 있다. 특정 실시예에서, 하나 이상의 추가 활성제는 또한 약학적으로 허용 가능한 담체에 용해되거나 현탁될 수 있다.
안 질환을 치료하기 위한 약학적 조성물의 경우, 제형은 하나 이상의 안과용 약물을 함유할 수 있다. 특정 실시예에서, 안과용 약물은 후치 세그먼트 눈의 질병 또는 장애를 치료, 예방 또는 진단하는데 사용되는 약물이다. 안과용 약물의 비 제한적 예로는 항 녹내약, 항 혈관 신생 제, 항 감염제, 항 염증제, 성장 인자, 면역 억제제, 항 알러지 제 및 이들의 조합물을 들 수 있다.
대표적인 항 녹내약으로는 프로스타글란딘 유사체(트라보프로스트, 비마토프로스트, 라타노프로스트 등), 베타-안드레나직 수용체 길항제(티몰롤, 베타락콜, 레보베타놀롤, 카르테올롤), 알파-2아드레날린 수용체 작용제(예: 브리모니딘 및 프라클로로니딘)(브린졸아미드, 아세타졸아민 및 도오즐아미드와 같은) 탄산탈수효소 억제제, 미세 소생제(pilocarpine 및 ecothiopate와 같은 부교감 정신증), 세레토네르직 무스카리닌, 도파미네르 길항제 및 아드레날린 길항제(예: 아프라클로니딘 및 브리모니딘)가 포함된다.
대표적인 항-혈관 신생 제로는 베바 시주 맙(AVASTIN®) 및 rhuFAb V2(라니 비주 맙, 루신 티스(RUCENTIS®))와 같은 혈관 내피 성장 인자(VEGF)에 대한 항체 및 아 플리 베 셉트 ); MACUGEN®(페그 캅탄 나트륨, 항 -VEGF 앱 타머 또는 EYE001)(아이 텍(Eyetech) 제약 회사); 안료 상피 유도 인자(들)(PEDF); celecoxib(CELEBREX®) 및 rofecoxib(VIOXX®)와 같은 COX-2억제제; 인터페론알파; 인터루킨-12 (IL-12); 탈리도마이드(THALOMID®) 및 그의 유도체, 예컨대 레날리도미드(REVLIMID®); 스쿠알라민; 엔도스타틴; 안지오스타틴; ANGIOZYME®(Sirna Therapeutics)와 같은 리보자임 억제제; NEOVASTAT®(AE-941)(Aeterna Laboratories, Quebec City, Canada)와 같은 다기능 항 혈관 형성제; 수니티닙(수티트(등록 상표))과 같은 수용체 티로신 키나아제(RTK) 억제제; 소라페니브(Nexavar®) 및 에르포티니브(Tarceva®)와 같은 티로신 키나아제 억제제; 파니투문맙(VECTIBIX®) 및 세툭시맙(ERBITUX®)와 같은 표피 성장 인자 수용체에 대한 항체뿐만 아니라 당업계에 공지된 다른 항-혈관 형성제를 포함한다.
항 감염제에는 항 바이러스제, 항균제, 항 기생충 제 및 항균제가 포함된다. 대표적인 항 바이러스제에는 간시클로비르(ganciclovir)와 아시클로비르(acyclovir)가 포함된다. 대표적인 항생제는 스트렙토마이신, 아미카신, 겐타마이신 및 토브라마이신과 같은 아미노글리코시드, 젤다나마이신 및 헤르비마이신과 같은 안사마이신, 카바세펨, 카파스포필린, 반코마이신, 테이코플라 닌 및 텔라빈신과 같은 글리코펩티드, 링코사미데이트, 닥토마이신과 같은 리포펩타이드, 아지트로마이신페리실린, 바시트라신, 콜리스틴 및 폴리믹신 B와 같은 폴리펩타이드, 퀴놀론, 설폰아미드 및 테트라사이클린을 포함하지만 이에 한정되는 것은 아니다.
일부의 경우, 활성제는 올로빠타딘 및 에피나스틴과 같은 항 알레르기 약제이다.
항 염증제는 비 스테로이드성 및 스테로이드성 소염제 모두를 포함한다. 적합한 스테로이드성 활성제는 글루코 코르티코이드, 프로게스틴, 미네랄 코르티코이드 및 글루코 코르티코이드를 포함한다.
안과용 약물은 그것의 중성 형태 또는 약학적으로 허용되는 염의 형태로 존재할 수 있다. 일부 경우에, 하나 이상의 염의 유리한 물리적 특성, 예컨대 향상된 안정성 또는 바람직한 용해도 또는 용해 프로필로 인해 활성제의 염을 함유하는 제제를 제조하는 것이 바람직할 수 있다.
일반적으로, 약학적으로 허용되는 염은 유리산 또는 활성 형태의 염기 형태를 물 또는 유기 용매 중 또는 이들의 혼합물 중에서 화학량론적 양의 적절한 염기 또는 산과 반응시킴으로써 제조될 수 있으며; 일반적으로, 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토 니트릴과 같은 비 수성 매질이 바람직하다. 약학적으로 허용 가능한 염은 무기산, 유기산, 알칼리 금속 염 및 알칼리 토금속 염뿐만 아니라 약물과 적합한 유기 리간드(예: 4급 암모늄염)의 반응에 의해 형성된 염의 염을 포함한다. 적합한 염의 목록은 예를 들어 Remington 's Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, p.704에 나타나 있다. 약학적으로 허용 가능한 염의 형태로 때때로 투여되는 안과용 약물의 예로는 티몰 롤 말레 에이트, 브리 모니 딘 타르타르 및 나트륨 디 클로 페낙이 포함된다.
일부의 경우, 활성 작용제는 눈을 영상화하거나 평가하는 진단제제이다. 예시적인 진단제제는 상자성 분자, 형광 화합물, 자성 분자 및 방사성 핵종, 엑스레이 이미징제 및 조영제를 포함한다.
특정 실시예에서, 약학 조성물은 하나 이상의 국소 마취제를 함유한다. 대표적인 국소 마취제로는 테트라카인, 리도카인, 아메토카인, 프로파라카인, 리그노카인 및 부피바카인이 포함된다. 일부 경우, 히알루로이다 제 효소와 같은 하나 이상의 추가 약제가 또한 국소 마취제의 촉진 및 촉진을 위해 제제에 첨가된다.
B. 안구 투여용 제제
폴리머 나노입자는 바람직하게는 눈에 주사하기 위한 현탁액으로서 제형화될 것이다. 안구 투여용 약학 제제는 바람직하게는 하나 이상의 폴리머 나노입자로부터 형성된 입자의 멸균 수성 현탁액 형태이다. 수용 가능한 용매는 예를 들어 물, 링거 용액, 인산염 완충된 염수(PBS) 및 등장성 염화나트륨 용액을 포함한다. 제제는 또한 1,3-부탄디올과 같은 비독성, 비경구적으로 허용되는 희석제 또는 용매 중의 멸균 용액, 현탁액 또는 에멀젼일 수 있다.
몇몇 경우, 제형은 액체 형태로 분포되거나 포장된다. 다르게는, 안구 투여용 제제는 예를 들어 적합한 액체 제제의 동결 건조에 의해 고체로 포장될 수 있다. 고체는 투여하기 전에 적절한 담체 또는 희석제로 재구성될 수 있다.
안구 투여용 용액, 현탁액 또는 에멀젼은 안구 투여에 적합한 pH를 유지하는데 필요한 완충액의 유효량으로 완충될 수 있다. 적합한 완충액은 당업자에게 공지되어 있고, 유용한 완충액의 일부 예는 아세테이트, 보레이트, 카보네이트, 시트레이트 및 포스페이트 완충액이다.
안구 투여용 용액, 현탁액 또는 에멀젼은 또한 제제의 등장성 범위를 조정하기 위한 하나 이상의 긴장제를 함유할 수 있다. 적합한 긴장성 제제는 당업계에 널리 공지되어 있으며, 일부 예는 글리세린, 만니톨, 소르비톨, 염화나트륨 및 다른 전해질을 포함한다.
안구 투여용 용액, 현탁액 또는 유제는 또한 안과용 제제의 세균 오염을 방지하기 위해 하나 이상의 방부제를 함유할 수 있다. 적합한 방부제는 당업계에 공지되어 있으며 폴리헥사메틸렌 비구아니딘(PHMB), 염화벤잘코늄(BAK), 안정화된 옥시클로로 복합체(퓨리트(등록상표)로도 공지됨), 페닐메르캅틴아세테이트, 클로로부탄올, 소르브산, 클로르헥시딘, 벤질알코올, 파라벤, 티메로살 이들의 혼합물.
안구 투여용 용액, 현탁액 또는 에멀젼은 또한 분산제, 습윤제 및 현탁제와 같은 공지된 하나 이상의 부형제를 함유할 수 있다.
V. 사용 방법
하나 이상의 글루코 코르티코이드를 전달하기 위한 조절된 방출 투약 제형은 급성 황반 변성, 각막 이식 거부와 같은 염증, 또는 망막염과 같은 혈관 형성과 관련된 환자의 질환 또는 질환을 치료하는데 사용될 수 있다. 투여시, 하나 이상의 글루코 코르티코이드가 치료 효과를 나타낼 만큼 충분히 높지만 세포 독성을 회피하기에 충분히 낮은 농도로 장시간 동안 방출된다.
하나의 바람직한 실시예에서, 약학 조성물은 안 혈관 신생과 관련된 환자에서 질병 또는 장애를 치료 또는 예방하기 위해 투여된다.
다른 바람직한 실시예에서, 제형은 결막하(SC) 주사를 통해 투여되고 결막 조직에서 유지되어 각막 이식 거부를 치료 또는 예방한다.
눈에 투여될 때, 입자는 장기간, 바람직하게는 3, 7, 10, 15, 21, 25, 30 또는 45일 이상 동안 하나 이상의 글루코코스테로이드 및/또는 다른 활성제의 저용량을 방출한다. 투여되는 입자의 폴리머 매트릭스의 구조 또는 폴리머 매트릭스의 구조, 입자 형태 및 투여량은 스콥토픽(scoptopic) ERG b 파 진폭 및/또는 망막 변성의 감소와 같은 부작용을 최소화하면서 장시간 동안 하나 이상의 활성제의 치료적 유효량을 투여하도록 맞춤화될 수 있다.
제형은 유리체 내 주사(예: 전방, 중추 또는 후방 유리체액 주입), 결막하 주사, 전방부 내 주사, 측두엽을 통한 전방 내 주사, 간질 내 주사, 맥락하 내 주사, 각막내 주사에 의해 눈에 국부적으로 투여될 수 있다 주입, 망막 하 주입 및 안내 주사. 바람직한 실시예에서, 약학적 조성물은 유리체 내 주사에 의해 투여된다.
임플란트는 당업계에 공지된 적절한 이식 방법을 사용하여 눈에 투여될 수 있다. 특정 실시예에서, 임플란트는 22-게이지 바늘과 같은 바늘을 사용하여 유리하게 주입된다. 임플란트의 유리체 내 위치는 임플란트 크기, 임플란트 형태 및 치료할 질병 또는 장애를 고려하여 다양할 수 있다.
바람직한 실시예에서, 나노입자는 유리체 내 주사(예를 들어, 전방, 중반 또는 후방 유리체액 주입), 결막하 주사, 전방부 내 주사, 측두엽을 통한 전방 내로의 주입, 간질 내 주사, 맥락하 내로의 주입에 의해 눈에 국부적으로 투여된다 공간, 각막내 주사, 망막하 주사 및 안구내 주사.
바람직한 실시예에서, 나노입자는 신생 혈관 형성, 이식편 거부 또는 포도막염과 같은 염증을 예방 또는 감소시키기에 유효한 양으로 투여된다.
바람직한 실시예에서, 나노입자는 1 주일에 1회, 2 주에 1회, 4 주에 1회, 1 개월에 1회, 2 개월에 1회, 또는 3 개월마다 1회 투여된다.
일부 실시예에서, 본원에 기재된 약학 조성물 및/또는 임플란트는 하나 이상의 추가 활성제와 함께 투여된다. 본원에서 사용된 "병용 투여"는 동일 투여 형태 내 하나 이상의 추가 활성제와 함께 하나 이상의 글루코 코르티코이드의 제어 방출 제제의 투여뿐만 아니라 상이한 투여 형태를 동시에 또는 본질적으로 동일한 투여를 의미한다 시각. 본원에서 사용되는 "본질적으로 동시에"는 일반적으로 10분 이내, 바람직하게는 5분 이내, 더욱 바람직하게는 2분 이내, 가장 바람직하게는 1분 이내를 의미한다.
일부 실시예에서, 본원에 기재된 약학적 조성물 및/또는 임플란트는 신생 혈관 질환 또는 눈의 장애에 대한 하나 이상의 추가 치료제와 함께 투여된다. 일부 실시예에서, 본원에 기재된 약학적 조성물 및/또는 임플란트는 베바시주 맙(bevacizumab)(AVASTIN®), 라니비주맙(ranibizumab), LUCENTIS® 또는 아플 리버셉트(aflibercept)(EYLEA®)와 같은 하나 이상의 항 혈관 형성제와 함께 투여된다.
바람직하게는, 입자는 염증을 예방 또는 감소시키기 위해 장시간에 걸쳐 하나 이상의 글루코 코르티코이드의 유효량을 방출할 것이다. 바람직한 실시예에서, 입자는 2 주 이상, 보다 바람직하게는 4 주 이상, 보다 바람직하게는 6 주 내지 8 주에 걸쳐 하나 이상의 글루코 코르티코이드의 유효량을 방출한다. 일부 실시예에서, 입자는 3 개월 이상의 기간에 걸쳐 하나 이상의 글루코 코르티코이드의 유효량을 방출한다.
본 발명은 다음의 비 제한적인 실시예를 참조로 추가로 이해될 것이다.
글루코 코르티코이드
전달용
PLGA
나노입자의 제조.
재료 및 방법
PLGA 나노입자의 제조
여기 형광 마커로서 사용된, Alexa Fluor 555(AF555) 카다베린(cadaverine)과 Alexa Fluor 647(AF647) 카다베린(cadaverine) (Invitrogen, Carlsbad, CA)을 PLGA(MW 3.2 kDa, LA:GA=50:50)에 화학적으로 접합시켰다(SurModics Pharmaceuticals , Birmingham, AL). 용매로의 확산(또는 나노 석출) 방법에 의해 표지 또는 비 표지된 PLGA 폴리머로 구성된 나노입자를 제조하였다. 간단히, 폴리머 20mg을 테트라 하이드로 푸란(THF) 1mL에 용해시키고, 자기 교반하에 700rpm의 초순수 40㎖에 드롭방식으로 첨가하였다. 약 1 시간 동안 교반한 후, 용액을 30분 동안 회전 증발시켜 잔여 THF를 제거하였다. 입자를 10,000g에서 25분 동안 원심 분리하여 수집하고, 0.2mL의 초순수에 재 현탁시켰다. PLURONICS® F127 코팅 입자의 경우 나노 석출 동안 초순수가 5% F127 수용액으로 대체되었다. F127(PLGA/F127)로 코팅된 PLGA 나노입자를 10,000 g에서 25분 동안 원심 분리하여 1% F127로 세척하고, 0.2 mL의 초순수에 재 현탁시켰다. ZETASIZER NANO® ZS90(Malvern Instruments, Southborough, MA)을 사용하여 동적 광산란 및 레이저 도플러 풍속 측정법을 사용하여 크기 및 제타 전위(표면 전하)를 각각 측정했다.
모델 나노입자의 제조
크기가 100, 200, 500, 1000 nm(Molecular Probes) 및 5μm(Bangs Laborites, Inc.) 인 적색 형광 COOH-변성 PS 입자를 메톡시(MeO) -PEG-아민(NH2)(MW5 PEG화 PS 입자(PS-PEG)를 완전히 씻고 물에 재 현탁하여 + 4℃에서 보관하여 사용할 준비가 되었다. PS-PEG 입자는 표면 전하 및 유체 역학적 직경으로 특징 지어졌으며, 물리 화학적 특성은 표 3에 보고되었다.
DSP-로딩된 PLGA 나노입자의 제조
덱사메타손 21-인산 나트륨 염(DSP)(Sigma Aldrich, St. Louis, MO)을 수정된 용매 확산법에 따라 F127 코팅을 사용하여 PLGA 나노입자로 캡슐화했다. 간단히 말해서, 10mg의 DSP를 함유하는 수용액 0.5mL에 0.5M 아연 아세테이트 수용액 1mL를 첨가함으로써 DSP-아연 킬레이트가 형성되었다. 10,000g에서 5분간 원심 분리한 후 침전된 복합체와 50mg PLGA(MW 3.2kDa, LA:GA=50:50)를 2.5mL의 THF에 녹인 후 20μL의 트리에탄올 아민(TEOA, Sigma Aldrich , St. Louis, MO). 혼합물을 교반하면서 5% F127 용액 100 mL 중에 드롭방식으로 F127(DSP/PLGA/F127 또는 DSP-NP)로 코팅된 DSP-로딩된 PLGA 나노입자를 형성하였다. 용매 증발 및 회전 증발에 의해 THF를 완전히 제거한 후, 0.5M 에틸렌 디아민 테트라 아세트산(EDTA, Sigma Aldrich, St. Louis, MO) 수용액(pH 7.5) 1mL를 나노입자 현탁액에 가하여 아연을 킬레이트시키고 캡슐화되지 않은 DSP-아연 복합체. 나노입자를 10,000g에서 25분간 원심 분리하여 수집하고, 1% F127로 2회 세척한 다음, 0.2mL의 초순수에 재 현탁시켰다. 나노입자의 수력학적 크기와 표면 전하를 상기한 바와 같이 특성화하였다. 입자 형태는 Hitachi H-7600 투과형 전자 현미경(Hitachi Co. Ltd., Tokyo, Japan)을 사용하여 시각화하였다.
약물 로딩 및 시험관내 약물 방출 연구
DSP/PLGA/F127 나노입자의 DSP 함량을 측정하기 위해 약 50μL의 PLGA 나노입자를 동결 건조시키고 무게를 재고 0.5 mL의 아세토 니트릴에 용해시켰다. 이어서, 1 mL의 50 mM EDTA를 첨가하여 아연을 킬레이트하고 캡슐화된 DSP를 용해시키고, 용액 중의 DSP 농도를 역상 HPLC로 측정하였다. Isocratic 분리는 Pursuit 5 C18 컬럼(Varian Inc, Lake Forest, CA)이 장착된 Shimadzu Prominence LC 시스템(교토, 일본) 및 0.1% 인산을 함유하는 아세토 니트릴/물(35/65 v/v) 트리 플루오로 아세트산(유속=1 mL/분). 칼럼 유출 물을 241 nm에서 UV 검출에 의해 모니터링하였다. 약물 로딩(LD) 및 캡슐화 효율(EE)은하기 방정식에 따라 계산되었다 :
DL(%) =(나노입자 중 DSP의 양/나노입자의 중량) × 100
EE(%) =(약물 부하 측정/이론 약물 부하) x100
DSP의 시험관내 방출 프로파일을 측정하기 위해, 투석 튜빙 셀룰로오스 멤브레인(MW 컷오프 : 10 kDa, Sigma Aldrich, St. Louis, MO)에서 나노입자 현탁액 400μL를 밀폐시켰다. 밀봉된 투석 막을 12 mL의 방출 매질(PBS, pH 7.4)이 들어있는 50 mL 원추형 관에 넣고 37 ℃에서 플랫폼 셰이커(140 rpm)에서 배양했다. 전체 방출 매질을 소정 간격으로 수집하고 12 mL의 신선한 PBS로 대체하였다. 수집된 방출 매질에서의 DSP 농도는 전술한 바와 같이 HPLC에 의해 측정하였다.
동물
8주된 수컷 Sprague Dawley, Lewis 및 Brown Norway 쥐를 Harlan(Indianapolis, IN)에서 구입했다. Sprague Dawley 쥐를 생체 내 안전 및 보존 연구에 사용했다. Lewis 쥐를 수용체 동물로 사용하였고 Brown-Norway 쥐를 기증자 동물로 사용하였다. 모든 쥐는 안과 연구에서 동물의 사용에 관한 안과 안과 연구 협회(Association for Vision and Ophthalmology Resolution)에 따라 관리되었다. 실험 절차 전에 동물을 마취시켰다. 모든 실험 프로토콜은 Johns Hopkins Animal Care and Use Committee에 의해 승인되었다.
결막하 투여 후 나노입자의 유지
SC 주입 후 나노입자의 유지는 Xenogen IVIS Spectrum 광학 이미징 시스템(Caliper Life Sciences Inc., Hopkinton, MA)에서 전체 눈을 영상화함으로써 조사되었다. 쥐에게 케타민(Ketamine)(80 mg/kg)과 자일라진(Xylazine)(8 mg/kg)의 혼합물을 근육 내 주사하여 마취시켰다. 적색 형광(100 nm, 200 nm, 500 nm, 1μm 및 5μm)의 비 분해성 모델 입자 인 PS-PEG NP를 Sprague Dawley 쥐에 SC 주사(50μL)하여 26-게이지 바늘. 눈 뚜껑은 이미징하는 동안 45 G 견본(Focus Ophthalmics, LLC, Ontario, CA)으로 확장되었다. 주사 부위의 총 형광 카운트는 550 nm의 여기 파장 및 570 nm의 방출 파장에서 기록되었다. 이미지를 Living Image 소프트웨어로 분석하고, 0 시간에서 나노입자의 SC 주입으로 눈을 비교함으로써 나노입자의 보유량을 정량화했다. 처리하지 않은 쥐 눈을 기준선으로 사용하였다.
SC 주입 후 생분해성 PLGA/F127 나노입자의 잔류 물을 상기와 같은 방법으로 분석하고 분석하였다. 화학적으로 결합된 Alexa Fluo 647(AF647) 염료를 갖는 PLGA/F127 나노입자를 사용하고, 전체 눈을 640 nm의 여기 파장 및 680 nm의 방출 파장으로 이미지화하였다.
무부하 PLGA 나노입자의 in vivo 안전성 프로파일
F127-코팅 및 비 코팅된 빈 PLGA 나노입자는 눈 당 1mg(n=9)의 용량으로 SC 주사에 의해 식염수(50μL)로 투여되었다. 대조군의 눈은 식염수로 치료되었다(n=9). 2일, 7일 및 14일 시점에서 동물을 희생시키고 결막 조직과 함께 눈 전체를 고정 및 H & E로 염색한 후 조직학 연구를 위해 수확했다.
SC 주사 후 in vivo 안구 내 DSP 수준
쥐에서 SC 주사 후 안구 내 DSP 수준을 검출하기 위해 F127이 코팅된 DSP가 장착된 PLGA 나노입자(DSP-NP)를 준비하는 동안 [3H] 표지된 DSP에 DSP(10μCi:1 mg DSP)가 첨가되었다. Nanoparticles은 20μCi/mL의 식염수에 현탁시켰다. 20μCi/mL의 유리 DSP 용액을 동일한 혼합 비율로 준비했다. 동일한 제제(Sprague Dawley rat)의 양안에 40μL(1 눈당 ~ 0.8μCi)의 동일한 제제를 주사했다. 지시된 시간 간격, 주사 후 2 시간, 1일, 3일, 5일 및 7일에, 쥐를 케타민/자일 라진 용액의 근육 주사로 마취시켰다. 동물은 꼬리 정맥에서 혈액 두 방울을 모은 후에 희생되었다.
결막 조직이 있는 안구 공을 쥐에게서 조심스럽게 제거하고 PBS로 씻어내어 Kimwipe 조직으로 말렸다. 전방 액, 각막, 유리체, 망막 및 나머지 안구 조직을 조심스럽게 해부하고 수집하였다. 각막과 망막 조직을 PBS로 씻고 Kimwipe 조직으로 건조시켰다. 모든 시료의 무게를 달아 50 ℃에서 밤새 배양하여 Solvable 2 mL로 용해시켰다. 혈액 샘플을 0.2ml H2O2 및 20μL 0.5M EDTA로 표백하였다. 신틸레이션 카운터에서 방사능을 계수하기 전에 10 ml의 Ultimold 골드 신틸레이션 배지를 첨가했다. 결과는 주사된 선량의 백분율로 표시되었으며 데이터 포인트 당 4 눈(2 마리)의 평균±SD이다. 혈액 내 DSP의 수준은 시간당 2 마리의 동물의 평균이었다. 눈주위 조직에서 주사된 총 투여량과 조직의 mg(또는 mL) 당 방사능의 총 백분율을 계산했다.
각막 이식 수술
쥐를 대상으로 실시한 모든 절차는 존스 홉킨스 대학(Johns Hopkins University) 동물 관리 및 사용위원회의 승인을 받았다. Brown-Norway 공여 쥐를 희생시키고 양쪽 눈의 중앙 각막 단추를 4.0-mm 관상톱(trephine)으로 제거하고 생리학적 용액으로 유지하여 사용 준비를 마쳤다. 수술은 수술 현미경하에 각막 외과의 사(QP)에 의해 수행되었다. 각막 수령인 루이스(Lewis) 쥐를 케타민(80mg/kg)과 크 실라 진(8mg/kg)의 혼합물을 근육 내 주사하여 마취시켰다. 수술 전 총 동공 확장을 위해 0.5% 트로피 마이드 점안제를 반복 투여하여 루이스 쥐에게 사용하였다. 탈장 전에 천자(paracentesis)가 수행되었고, 전방은 hyaluronic acid로 채워졌다. 각막 단추는 3.5-mm 관상톱을 가진 수용체 루이스 쥐에서 제거되었다. 공여체 각막 단추를 8 개의 봉합 점으로 수용체 각막에 봉합하였다.
수술후 각막 이식술(PK )
관통 각막 이식 직후, 동물을 무작위로 50 ㎕ 생리 식염 결막하 주사로 투여한 군 1(4 마리), 빈 NP 50 ㎕를 주사한 군 2(5 례), 군 3(5 쥐) 1 mg/mL 농도의 DSP 용액 50μL와 1 mg DSP/mL 농도의 50μL DSP-로딩된 나노입자(DSP-NP)의 SC 주입으로받은 그룹 4(6 마리의 쥐)를 SC 주사하여 투여하였다. 모든 동물 그룹은 매주 1회 이식 실패 또는 연구 종료 시점(9 주)까지 동일한 치료를 받았다.
슬릿 램프 현미경을 이용한 임상 관찰은 1 군과 2 군에 대해 수술 후(PO) 2 주, 3 군에 대해 4 주, 4 군에 대해 PO 9 주에 2 명의 안과 의사(QP 및 LT)에 의해 수행되었다. 각막 이식편(각막 투명도, 부종 및 신생 혈관)의 검사를 위해 평가되었다. 매개 변수에 대한 채점은 다음과 같다.
안압은 수술 후 2일, 1 주, 2 주, 4 주, 6 주, 8 주 및 9 주에 관찰되었다. 각 안구에 대해 기록된 안압은 세 번의 성공적인 측정의 평균이다. 마지막 시점의 동물들은 CO2로 희생되었고 PK 수술을 한 눈은 핵 누적되었다. 안구 조직을 파라핀에 끼우기 전에 24 시간 동안 10% 포르말린으로 고정시켰다. 단면(5μm)을 광학적 신경 및 각막의 방향으로 절단하고, H & E로 염색하였다.
통계 분석
통계 분석은 Tukey 테스트에 의한 편도 분석(ANOVA)에 의해 수행되었다. 차이는 P<0.05의 수준에서 통계적으로 유의한 것으로 간주되었다.
결과
DSP-로딩된 PLGA 나노입자의 제조 및 특성 규명
덱사메타손과 PLGA의 비 양립성 때문에 소수성 덱사메타손을 PLGA 나노입자로 캡슐화하는 것은 어렵다. 수용성 프로드러그(prodrug)인 덱사메타손 21-포스페이트 디소디움(DSP)은 안구 조직을 포함한 모든 기관에 존재하는 인산 분해 효소(phosphatases)에 의해 주로 촉진되는 생체내 모체 약물 덱사메타손으로 전환될 수 있다. 수용성 DSP는 PLURONICS® F127이 있는 상태에서 아연과 PLGA 나노입자를 함께 효율적으로 캡슐화한다. DSP-로딩된 PLGA 나노입자(DSP-NP)의 물리 화학적 특성을 표 3에 나타내었다. DSP-NP는 소수성 나노입자에 대한 PLURONICS F127의 강한 결합을 특징으로 하는 고밀도 PEG 코팅을 나타내는 -5mV의 표면 전하를 나타냈다. DSP-NP는 TEM 관찰에 의해 확인된 형태학에서 구형이었다. DSP-NP는 약 12 % w/w의 높은 약물 부하량을 나타 냈으며, 이는 ~ 72%의 캡슐화 효율에 해당한다. DSP-NP에서의 DSP 방출은 최대 15일까지 지속되며, 로드된 DSP의 거의 80%가 처음 7일 이내에 방출되었다(도 1). 아연은 캡슐화 효율을 증가시키고 PLGA상의 말단 카르복실기와 약물 분자상의 인산기 사이에 이온 가교를 형성하기 때문에 PLGA 나노입자로부터 수용성 글루코 코르티코이드의 지속적인 방출을 촉진한다고 믿어진다.
SC 투여 후 나노입자의 안구 보유
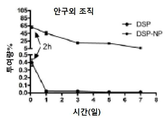
정상적인 쥐 눈의 형광 이미지와 형광 염료로 표지된 나노입자의 SC 주입으로 생체 내 PEG 코팅(PS-PEG)을 한 비 분해성 폴리스티렌 입자가 SC 주사 후 쥐에게 유지되는 것으로 나타났다. PS-PEG 입자의 유지는 Xenogen IVIS Spectrum 광학 이미징으로 정량화되었다. 생체 영상은 쥐에서 SC 투여 후 나노입자의 보유량을 정량화하는데 사용되었다. 첫째, 비 분해성 PS-PEG 입자가 나노입자의 체류에 미치는 크기 영향을 조사하기 위해 적용되었다. 100 nm, 200 nm, 500 nm, 1μm 및 5μm의 크기를 갖는 PS-PEG 입자는 중성 표면 전하 근처에 모두 나타나 고밀도 PEG 코팅을 나타낸다. PS-PEG 입자를 SC 주사를 통해 쥐에 투여하고, 형광 신호를 라이브 영상으로 정량화하였다. 100 nm, 200 nm 및 500 nm 크기의 PS-PEG 입자는 모두 SC 주입 후 처음 6 시간 동안 형광 신호의 약 60% 감소를 보였다. 그 후, 남아있는 2 개월간의 체류 연구에서 일정 수준의 형광이 관찰되었으며, 이는 100 nm 정도로 작은 입자에 대한 SC 주입 후 이들 비 분해성 입자의 일정한 보유를 나타낸다. 큰 입자(1μm와 5μm)의 경우 전체 유지 연구(도 2)를 통해 거의 100% 입자 유지가 관찰되었다. 그러나 26 게이지 바늘을 통해 큰 입자를 주입하는 것이 더 어려웠다. 나노입자의 일부 침전 및 응집은 이들 입자가 PEG화 되었고 주사 전에 잘 정체되어 있음에도 불구하고 관찰되었다.
상이한 시간 지점에서의 대표적인 형광 이미지 및 AF-647로 표지된 PLGA/F127 NP의 SC 주사 후 쥐 눈의 보유 곡선을 사용하여 SC 주사 후 생분해성 PLGA/F127 나노입자(186 nm)의 보유력을 계산하였다. PLGA/F127 나노입자의 제조 전에 형광 염료를 PLGA에 화학적으로 접합시켰다. PO 30일 후에도 형광 신호가 검출되었다. 신호의 점진적인 감소가 30일간의 전체 유지 연구 동안 관찰되었다. 형광 신호의 10% 미만이 PO 8일로 유지되었다.
SC 주사 후
PLGA
나노입자의 안구 안전성
생리 식염수, SCGA/F127 및 코팅되지 않은 PLGA 나노입자의 SC 주사로 치료한 쥐 각막 및 결막 조직의 PO 2일, 7일 및 14일의 샘플 각막 조직학은 만성 염증을 갖는 주입 영역에 인접한 결막 조직을 나타냈다(1 등급 )에서 PLGA/F127 NP 및 PLGA NP에 대한 PO 2일에 관찰되었고 만성 염증은 PO 7일 및 PO 14일(0-1 등급)에서 점차적으로 사라졌다. 식염수 조절 군에서도 유사한 염증 반응이 관찰되었다. 식염수 주사는 PO 2일에 경미한 만성 염증(1 등급)을 나타내 었으며 PO 7일과 PO 14일(0-1 등급)에서 회복되었다.(병리학자인 Dr. Charles Eberhart에 의해 관찰되고 등급화된, 완전한 등급의 염증은 0-3이며 심한 염증에는 염증이 없음).
빈 나노입자 캐리어의 생체내 독성을 결정하기 위해, 생리 식염수에 부유 PLGA(PEG 코팅 없음), PLGA/F127(밀도-PEG 코팅) 나노입자는 SC 주사를 통해 건강한 Sprague Dawley 쥐에 투여되었다. 조직학적 검사를 시행하여 안구 조직의 염증 반응을 측정하였다. 식염수 대조군을 포함한 모든 주사 군에서 2일째에 결막 조직에서 경미한 염증만 관찰되었다. 7일 및 14일에 F127 코팅이 있거나 없는 모든 나노입자는 결막, 각막 및 망막을 포함한 모든 안구 조직에서 염증을 나타내지 않았다. 식염수 조절과 유사하게, PLGA/F127 나노입자는 2일, 7일 및 14일째에 쥐의 눈에 SC 주사 후 매우 경미하거나 염증이 전혀 없는 우수한 안전성 프로파일을 나타냈다. 모든 그룹에서 다른 안구 조직에서 염증은 관찰되지 않았고, 망막, 전방 및 각막이 포함된다. 결과는 도 3에 나타나 있다.
SC 투여 후 DSP-NP는 안구 조직에서 DSP 수준 유지
DSP의 안구 조직 수준은 DSP 유리 약물 또는 DSP-로딩된 PLGA/F127 나노입자(DSP-NP)(양측 ~ 0.08mg DSP를 함유)의 단일 SC 주사 후 비교되었다. 도 4a-4d는 쥐에 피하 투여한 후 유리 DSP 용액 및 DSP-NP의 약물 동력학(DSP/ml/시간)을 나타낸 그래프이다. 도 4a는 주사 부위에서의 그래프; 도 4b는 안방수에서의 그래프; 도 4c는 유리체액에서의 그래프; 4d는 혈액 내의 그래프를 나타낸다.
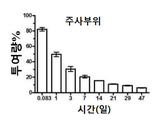
유리 DSP 용액의 총 투여량의 약 0.4%가 결막 조직 PO 2 시간에 유지되었고, PO 1일에 거의 DSP를 검출할 수 없었다. 비교에서 DSP-NP 군은 총 투여량의 약 65%를 보였다 PO 2 시간에 결막 조직, 결막 조직에서 유지된 DSP 수준은 PO 7일째에 서서히 5%로 감소하였다. 안구 조직, 수유, 유리체, 망막 및 각막을 분석하여, 안구 조직에서 DSP 수준을 발견하였다 DSP 유리 약물의 SC 주사에 대한 기준선에 도달하기까지 매우 빨리 감소했다. SC-NP의 SC 주사는 유안과 유리에서 PO 7일까지 DSP의 높은 수준을 상당히 연장시켰다. 망막 및 각막의 DSP 수준은 DSP 및 DSP-NP 그룹 모두에 대해 매우 낮았다. DSP 수준은 또한 다른 시점에서 수집된 혈액 샘플에서 측정되었다. DSP-NP 그룹은 PO 2h에서 PO 7일까지 지속적으로 낮은 수준의 DSP(~ 50ng DSP/ml)를 나타냈다. 이와 대조적으로, DSP 그룹은 PO 2 시간에 혈액 당 1 ml 당 350 ng의 DSP를 보여 주었고 신속하게 기준선으로 감소했다. DSP 수준은 모든 조직에서 3H-DSP의 방사능을 측정함으로써 정량화되었다. 일부 데이터 포인트에서 값이 없는 것은 레벨을 감지할 수 없음을 의미한다. 이것은 도 5에 나와 있다.
SC 투여 후 DSP-NP는 각막 이식 거부를 예방 .
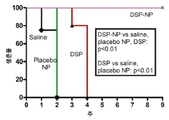
SC를 주입한 각막 이식술 후 슬릿 검사를 시행하였다. 모든 이식편은 식염수를 SC 주사한 군과 PO 2 주에 PLGA/F127(NP)를 주사한 군에서 거부되었다. 모든 이식편은 주 4일째에 SC 주사한 그룹에서 거부되었으며 모든 이식편은 주 9일(E)의 최종 연구 시점에서도 DSP/PLGA/F127(DSP-NP).
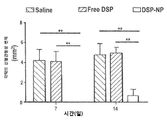
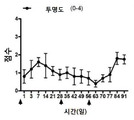
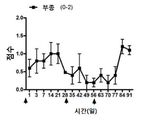
생리 식염수, NP, DSP 및 DSP-NP의 SC 주사로 치료한 이식편은 각막 투명도, 부종 및 새로운 혈관의 관점에서 최종 시점에서 임상적으로 평가되었다. 결과는 도 6과 7에 나와 있다. DSP-NP의 투명성과 부종에 대한 도 6의 막대는 이식편이 완전히 투명하고 부종이 없다는 것을 의미한다. PO 2 주에 식염수를 처리한 후 이식된 각막의 조직학적 이미지, PO 2 주 동안 빈 NP, PO 4 주 동안 유리 DSP, SC 주사 후 9 주에 DSP-NP가 수행되었다. 외과적 시술은 모두 경험 많은 안과 전문의에 의해 성공적으로 이루어졌으며 외과적 합병증은 발생하지 않았다. PK 직후에 동물을 무작위로 4 그룹으로 나누고 각 그룹에 대한 처리를 생리 식염수, NP, DSP 및 DSP-NP의 SC 주사로 시작하였다. 각막 투명성, 부종 및 신생 혈관증을 포함한 세 가지 매개 변수가 이식편을 채점하기 위한 임상 관찰에 사용되었다. 수술 후 2 주째 식염수 조절 군과 NP 대조군에서 심한 부종이 있었고 각막 이식편은 불투명하였고 많은 양의 신생 혈관이 봉합사 주위뿐만 아니라 각막 이식편에도 형성되었다. 그러나 매주 DSP를 주사한 이식편은 부종이 유의하게 적고(p<0.0001), 혈관 신생이 적었다(p<0.001). DSP 그룹의 각막 이식은 염분 조절과 NP 조절 그룹만큼 불투명했다. DSP-NP 처리군은 각막 투명성, 부종 및 신 혈관 형성의면에서 훨씬 우수한 결과를 보였다. DSP-NP 투여군에서는 부종이 없었고, 6 주 째의 모든 각막 이식편은 전체 9 주 동안 명확했다.
봉합 주위에 새로운 혈관이 거의 없었으나 DSP-NP 군에서 신생 혈관 형성이 다른 모든 3 군보다 유의하게 적었다(p<0.05). 심한 부종과 각막 투명성에서의 심한 불투명도로 나타나는 완전한 각막 이식 실패가 관찰되었을 때 동물을 희생시켰다.
생리 식염수 대조군, 빈 NP, 유리 DSP 및 DSP-NP의 SC 주사로 치료한 이식된 각막 이식편의 생존 곡선을 도 7에 나타내었다. 9 주 동안 동일한 샘플에 대한 안압을 도 8에 나타내었다. 2 주간 염분 조절 및 NP 대조군에 대한 PO. DSP 유리 약물의 주 SC 주사에 의해 약간의 개선이 달성되었으며, 각막 이식의 생존율은 각각 2 주 및 3 주에 100% 및 80%였다. 그러나 DSP 그룹의 모든 각막은 주 4 주에 여전히 거부당했다. 연구 종료시(9 주) 100% 생존율을 보이는 DSP-NP 투여군에서 유의하게 높은 생존율이 관찰되었다. PO 9 주에 DSP-NP 그룹의 각막 이식편은 투명하고 투명하며 각막 거부 에피소드가 전혀 없다.
종말점에서 획득한 각막 조직의 조직 검사(생리 식염수와 NP 그룹의 경우 2 주, DSP 그룹의 경우 4 주, DSP-NP 그룹의 경우 9 주)는 식염수, NP 및 DSP의 각막 조직 그룹은 모두 정상적인 건강한 각막보다 부어 오르고 두껍다. 세 군 모두에서 각막과 대 식세포가 각막 조직에서 관찰되었다. 3 개의 모든 대조군의 이식편에 대한 명백한 내피 세포 사멸이 관찰되었고, 각막 이식편의 상피 층은 3 개의 대조군 모두에서 완전성을 잃어 버렸다. 반면, DSP-NP 처리군의 각막은 손상되지 않은 상피층, 간질 및 내피층을 포함한 완전한 각막 구조를 보였으며 각막 조직의 팽창은 없었다. 가장 중요한 것은 DSP-NP로 처리한 각막에서 염증 세포가 발견되지 않았기 때문에 전체 연구에서 SC 주사로 완전 기능을 가진 DSP-NP 치료 후 이식된 각막이 생존하고 이식편이 정상적으로 기능을 시작한다는 것을 알 수 있다.
동일한 군에 대해 14일에 걸친 각막 신생 혈관화를 도 9a 및 9b에 나타내었다.
결과 요약
장기간 면역 억제제를 제공할 수 있는 지속 방출 플랫폼은 임상 적용에 유리하며 환자 순응도를 향상시키고 부작용을 감소시킨다. 나노입자는 약물 방출을 유지할 수 있으며, 유리체 내 주사, 국소 투여 및 결막 주사를 비롯한 다양한 경로로 치료제를 눈에 전달하는데 널리 사용되어 왔다. 결막 나노입자는 응용에 따라 며칠에서 수개월 동안 치료제의 방출을 유지하는 것으로 나타났다. 방출 속도는 상이한 폴리머의 선택 또는 배합의 변화에 의해 변형될 수 있다. 각막 거부를 예방하기 위한 글루코 코르티코이드의 지속적인 방출을 위한 고밀도 PEG 코팅을 갖는 생분해성 나노입자 플랫폼이 개발되었다. F127과 같은 특정 PLURONICS®는 PLGA 나노입자에 쉽게 흡착되어 고밀도 PEG 코팅을 형성하여 입자가 생불활성이 된다. 눈은 매우 민감한 기관이며 염증 반응은 환자의 편안함을 유발하고 심각한 안과 질환을 일으킬 수 있는 안과용 제제에 의해 유발될 수 있다. 따라서 면역 억제제를 투여하는 지속성 있는 플랫폼과 경로가 유리할 수 있다.
PLGA/F127의 약물 전달 플랫폼은 PLDA와 F127로 구성되며 FDA에 의해 GRAS(General Regarded as Safe) 재료로 분류되며 안과용 제제를 비롯한 다양한 약제 제제에 오랫동안 사용되어 왔다. 그러나, 나노입자의 안과적 사용에 관한 안전성 문제는 여전히 주요 관심사이다. 현재 연구에서, PLGA/F127 그룹에 대한 염증 반응은 확인된 모든 시간 지점(PO 2일, 7일 및 14일)을 통한 식염수 대조군의 SC 주사에 필적했다. 건강한 쥐는 7일 이내에 SC 주사 후 첫 2일 동안 SC 주사 후 경미한 안구 염증을 유발했다. 염증을 낮추기 위해 나노입자에 F127의 조밀한 코팅 효과는 BALB/C 마우스 폐 흡인과 CF-1 마우스의 질 투여로 보고되었다. F127로 코팅되거나 코팅되지 않은 PLGA 나노입자의 SC 투여에서 폐 및 질관에서의 연구와 달리 심각한 염증은 관찰되지 않았다. SC 투여의 눈 주위의 결막 조직(주로 근육 및 결합 조직으로 이루어짐)은 폐기도 및 질관에 관련된 상피만큼 민감하지 않을 수 있다. 다른 안구 부품에 다른 코팅을 한 PLGA를 적용하면 안전성이 달라질 수 있다. 비록 F127 코팅이 SC 투여를 위한 PLGA 나노입자에 더 많은 안전상의 이점을 부여하지는 않을지라도, F127의 사용은 코팅되지 않은 PLGA NP와 비교하여 DSP-NP의 수율을 크게 향상시킬 수 있다. 나노입자 수집 동안 F127 코팅없이 PLGA NP에 대해 큰 응집이 발생했다.
비 분해성 모델 PS-PEG 나노입자는 최대 2 개월 동안 SC 주사 후 유지될 수 있다. 100 nm, 200 nm 및 500 nm PS-PEG는 주사 후 누출로 인해 SC 주사 후 처음 6 시간에 40-60%의 저하를 보였다. 단일 주사의 50μL 볼륨은 쥐 결막하 공간에 너무 많이 있다. 나노입자에 친수성 PEG 코팅은 조직에 접착력의 부족 때문에 주사 부위를 통해 입자의 누출 또는 전위를 추가로 도울 수 있다. 크기가 200 nm와 2μm 인 비 PEG화 소수성 PS 입자(카복실레이트 변형)는 20-30μL 체적의 SC 주사 후 결막 아래 조직에 영구적으로 유지되는 것으로 보고되었다. 더 작은 주입 부피 및 소수성 입자 특성은 나노입자의 누출을 거의 또는 전혀 유발하지 않을 수 있다. 큰 입자(1μm와 5μm)에 대해서도 매우 유사한 결과가 관찰되었고, 안구 유지시의 감소는 거의 관찰되지 않았다. 거대 입자는 침강하기 쉬웠으며 주입된 수용액이 새어 나왔을 때 결막 조직 내에서 막힐 수 있었으며 표면 성질이 너무 오래 유지되지 않았다. 생분해성 PLGA 나노입자는 SC 주입 후 처음 6 시간에서 유사한 경향을 보이고 약 40%의 선량은 감소하지만 형광 신호는 신호 분해가 사라질 때까지 15일 동안 계속 감소하여 비 분해성 200 nm PS-PEG 나노입자. 형광 신호의 점진적 감소는 폴리머의 분해 및 화학적으로 접합된 형광 염료의 방출로 인해 발생할 수 있다. 주사 조건을 최적화함으로써, 적절한 양의 나노입자/미세 입자가 치료제의 서방 방출을 위해 SC 공간에 성공적으로 투여될 수 있다.
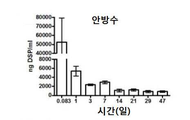
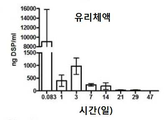
DSP가 전방 및 유리체에 장기간 효율적으로 전달될 수 있음을 확인하기 위해, 건강한 쥐에서 삼중 수소로 표지된 DSP를 갖는 DSP-NP를 사용하여 안약 약동학 연구를 수행하였다. 유리 DSP가 컨트롤로 사용되었다. Weijtens와 동료 연구자들은 SC 주입이 안구주위 주입 또는 경구 투여와 비교하여 환자의 눈의 전방 및 후방 세그먼트 모두에 DSP를 전달하는 가장 효과적인 방법이라는 것을 발견했다. 이전의 보고서는 DSP의 SC 주입이 PO 2 ~ 3 시간에서 최고 유리체액 덱사메타손 농도를 나타냄을 보였다. 현재 연구에서, 유리 DSP와 DSP-NP 모두 주입 후 2 시간 쥐 눈에서 수성 및 유리체 내 DSP의 최고 농도가 관찰되었다. 매우 명확한 경향은 정확한 Tmax가 이 연구에 기초하여 명확하지 않더라도 주사 후 처음 2 시간 이내에 매우 높은 농도의 DSP가 매우 빨리 달성되었음을 보여준다. DSP의 결막 내 주사는 DSP가 전방에 잔류하고 유리체액은 안약과 비교하여 남아있게 한다. 점안약을 자주 투여하면 유리체액 내로의 DSP의 침투는 무시할 만하며 전방의 DSP 농도는 SC 주사보다 훨씬 낮다. 그러나, DSP 유리 약물의 SC 투여는 6 시간 미만 동안 전방 챔버에서만 효과적인 DSP 농도를 제공할 수 있다. SC 주입 후 1일째에 전방 및 유리 체내의 DSP 수준이 거의 기준선까지 감소했다. DSP-NP의 SC 주사 후 1일째 전방 및 유리에서의 DSP 농도는 각각 5157±3952 ng/mL 및 1286±851 ng/mL이었다. SC를 투여한 후 7일째에 전방과 유리에서 높은 농도의 DSP가 DSP-NP에 대해 여전히 검출 가능했지만 DSP의 SC 투여 수준은 검출되지 않았다.
조혈 경로, 공막횡단 경로 및 각막횡단 경로 전립선으로 심지어 SC 주입 후 유리체의 DSP의 침투에 기여할 수 있다. 일부는 처음 6 시간 동안 SC 주사 후 나노입자의 잠재적 누출로 인한 것일 수 있다. 친수성 DSP의 수용액은 주사 부위에서도 누출될 수 있어 주입된 DSP의 머무름 시간을 줄이지 만 SC 주사 후 처음 몇 시간에는 눈물 막에서 DSP 수준을 증가시켜 약물 전달의 전달 각 경로를 눈. SC 주사는 혈관에 약물의 노출 영역을 증가시켜 약물의 혈액 순환에 대한 체계적인 업데이트를 향상시켰다. 예비 타원 표면에서 누출된 높은 DSP 농도와 함께, DSP의 SC 주사에 대한 혈액 DSP 수준은 PO2h에서 매우 높았으며, 이것은 DSP-NP 주입보다 8 배 이상 높았다. DSP-NP는 SC 주입 후 유리 DSP 용액에 비해 더 우수한 유지력을 나타내었고 DSP-NP의 DSP 약물은 지속적으로 방출되었다.
요약하면, 일정 수준의 DSP는 안구 조직 에서뿐만 아니라 SC 주사 후 DSP-NP 혈액(DSP-NP의 SC 주사의 경우 지속적으로 낮은 수준의 혈액 DSP 수준)에서도 달성된다. 고혈압을 피하면 스테로이드의 전신 부작용 가능성을 줄일 수 있다.
주입된 빈 PLGA/F127 나노입자의 약 20%가 PO 7일에 결막 조직에 유지되었고, 나노입자로부터의 형광 수준의 점진적 감소는 나노입자의 분해 및 나노입자 내 PLGA로부터의 형광 염료의 절단에서 유래되었다. 100%에서 60% 로의 첫 번째 큰 하락은 주로 주사된 나노입자의 누출로 인한 것이지만,이 저하는 안구 조직에서 요구되는 높은 수준의 DSP에 영향을 주지 않는다. 신중한 관리 및 주입량 감소를 통해 SC 주입에서 나노입자 누출을 최소화할 수 있다. 각막, 수 수용체, 유리체 망막 및 망막의 해부 후의 외안 조직에서의 DSP 수준의 유사한 점진적인 감소가 또한 관찰되었다. 이는 결막 조직에서 DSP-NP의 유지 후 나노입자로부터의 DSP의 지속적인 방출에 기인할 수 있다.
DSP는 방랑 유방 조영제 DSP가 나타내는 것으로서 만 검출되었지만 유방 및 눈물 막으로부터 물리적으로 흡수된 DSP는 검출되지 않았다. 각막은 상피, 간질 및 내피 층으로 구성된 단단한 조직이다. 적합한 저 분자량 및 친수성을 지닌 약물 만 각막에 침투할 수 있다. DSP는 각막 횡단 침투에 적합하지 않는다. 따라서 눈물 막의 DSP 농도가 극도로 높아지면 처음 시간에만 각막 조직 내에서 낮은 수준의 DSP를 검출할 수 있다. 각막 횡단 침투 이외의 경로는 SC 주사 후 안구 조직의 높은 수준의 DSP에 기여할 수 있다.
DSP의 망막 내 침투는 무시할 수 있다. 글루코 코르티코이드가 대부분의 사이토 카인의 발현 및 작용을 효과적으로 억제할 수 있고, T-세포 사멸을 유도하는 것으로 밝혀졌다. 장기간의 글루코 코르티코이드 점안제는 정상 PK 후 각막 거부를 예방하기 위해 필요하다. 글루코 코르티코이드 점안제의 장기간 사용은 안전 문제를 야기하고 환자의 순응에 대한 도전이 될 수 있다. 본원에 기술된 연구는 SC 주사를 위한 1 주일에 1회 DSP-NP 제제가 각막 동종 이식 거부의 효과적인 예방을 달성하는데 효과적임을 보여준다. DSP-NP의 SC 주사를 사용한 국소 치료에서 관찰된 높은 효능은 AC 유머에서 발견되는 높은 수준의 DSP와 일치했다. 대조군, DSP 및 PLGA/F127 NP 군과 비교하여, DSP-NP 처리군은 조직학적 연구에서 염증 세포가 없었다. 염증 세포는 IL-2, TNF-α, VEGF를 비롯한 다양한 사이토킨을 생산할 수 있다. IL-2, TNF-α는 주요 조직 적합성 복합체 II 항원 발현을 증가시키고, 대 식세포 및 T 림프구를 활성화시켜 보다 많은 사이토 카인 방출을 유도하고 면역 거부를 유발할 수 있다. SC 주사 후 DSP-NP로부터의 고수준 DSP의 지속적인 방출은 염증의 큰 억제 및 대조군과 비교하여 각막 내로의 새로운 혈관 성장의 지연에 기여했다. 각막 무혈관 성질은 각막 이식에서 면역 특이성 상태를 유지하는데 결정적이며, 신생 혈관 형성은 각막 거부의 원동력으로 여겨지고 있다. DSP의 SC 주입은 각막 동종 이식의 신생 혈관 억제에 약간의 효과를 나타내지 만 주당 1회 주파수로 DSP의 SC 주입으로부터의 DSP 수준은 새로운 혈관의 성장을 완전히 억제하기에 충분하지 않다. 덱사메타손이 더 높은 항 염증 효과(prednisone과 비교하여 7:1)를 보였음에도 불구하고, SC 주사 후 높은 DSP 수준의 짧은 보유는 여전히 치료 효능을 크게 손상시켰다.
안압 상승은 DSP-NP의 SC 주사에 대한 전체 9 주 연구 동안 관찰되지 않았다. 캡슐화된 DSP의 대다수(약 80%)는 시험관 방출 연구의 첫 번째 주에 공개되었으며 주사 후 1 주일에 남아있는 DSP는 약 5%로 떨어졌다. 따라서 부작용이 있거나 IOP가 증가하면 DSP-NP의 SC 관리를 통해 DSP를 쉽게 중지할 수 있다. 다른 저장소 장치에 비해 약물 전달 장치를 제거하기 위해 더 이상의 수술은 필요하지 않는다. 1 주 간격으로 신생 혈관을 감소시키고 이식 각막을 깨끗하게 유지하는데 효과적이었다. 이 간격을 임상적으로 실행 가능한 치료 옵션으로 만들기 위해서는 이 간격을 길게 해야 할 수도 있다. 한달.
수용성 글루코 코르티코이드 덱사메타손 소디움 포스페이트(DSP-NP)가 함유된 생분해성 PLGA/F127 나노입자가 성공적으로 구성되었으며, DSP-NP는 DSP를 최대 7일 동안 지속적으로 방출할 수 있다. 결막 조직에서 나노입자의 장기 보존은 쥐에서 SC 주사를 통해 이루어졌으며 안구 조직에서 지속적으로 높은 DSP 수준이 측정되었다. DSP-NP의 SC 주입은 9 주간의 전체 연구를 통해 각막 동종 이식 거부를 효과적으로 방지 하였지만, 유리 DSP를 사용한 대조군은 단지 4 주 만에 이식 실패를 초래하였다. 이 전략은 투여 빈도를 줄이고 잠재적으로 환자 순응도를 향상시킬 수 있는 글루코 코르티코이드의 잠재적 인 전신성 부작용을 피했다.
DSP-NP를 이용한 신생 혈관 예방
쥐의 각막 동종 이식 거부를 예방하는 것으로 입증된 생체 내 및 피하 주사 후 코르티코 스테로이드 덱사메타손 소디움 포스페이트(DSP)의 지속적인 방출을 제공할 수 있는 생분해성 나노입자 제제는 각막 신생 혈관 형성의 효과적인 억제를 제공하는 것으로 나타났다.
재료 및 방법
재료
Lakeshore Biomaterials(Evonik, Birmingham, AL)에서 구입한 폴리(D, L-락트-코-글리코산; 50:50, Mw ~ 3.4 kDa, 산 말단)(PLGA) 덱사메타손 소디움 포스페이트 염(DSP)은 MP Biomedicals(Santa Ana, CA)에서 구입했다. [3H]-표지의 DSP는 미국 방사성 표지 화학물질(American Radiolabeled Chemicals)(St Louis, MO)로부터 구입하였다. Pluronic F127(폴리에틸렌 산화물-폴리 프로필렌 산화물-폴리에틸렌 옥사이드 트리블록 코폴리머 또는 PEO-PPO-PEO), 트리에탄올 아민(TEOA), 에틸렌 디아민 테트라 아세트산(EDTA) 용액(0.5M), 아연 아세테이트 2 수화물 및 기타 모든 유기 용매는 Sigma-Aldrich(St. Louis, MO)에서, Alexa Fluor 647(AF647) 세포는 Invitrogen(Carlsbad, CA)에서 구입했다.
형광 표지된 DSP-NP의 제조
형광 마커 인 Alexa Fluor 647(AF647) 카다베린(cadaverine)을 Xu 등의 J. Control에 의해 기술된 방법을 사용하여 PLGA에 화학적으로 접합시켰다. 방출 170(2013) 279-286. AF647-PLGA로 구성된 나노입자는 용매 확산(또는 나노 석출) 방법에 의해 제조되었다. 간단히 말해서, 10mg의 DSP를 함유하는 수용액 0.5mL에 0.5M 아연 아세테이트 수용액 1mL를 첨가함으로써 DSP-아연 킬레이트가 형성되었다. 10,000g에서 5분간 원심 분리한 후, 침전된 복합체와 50mg PLGA(AF647-PLGA:1:3w/w의 PLGA)를 1.25mL의 THF(tetrahydrofuran)에 부유시키고 용해시킨 다음, 20㎕의 TEOA(triethanolamine)를 첨가하였다. 혼합물을 교반하면서 5% F127 수용액 100 mL 중에 드롭방식으로 첨가하여 DSP-로딩된 PLGA 나노입자(DSP-NP)를 형성하였다. 용매 증발에 의해 THF를 완전히 제거한 후, 0.5 M EDTA 수용액(pH 7.5) 1 mL를 나노입자 현탁액에 첨가하여 과량의 아연을 킬레이트화하고 캡슐화되지 않은 DSP-아연 킬레이트를 용해시켰다. 형광 표지된 DSP-NP를 8,000g에서 25분 동안 원심 분리하여 수집하고, 5% F127로 세척하고, 0.2mL의 초순수에 재 현탁시켰다. 형광 표지가없는 DSP-NP는 PLGA만을 사용한 유사한 방법으로 준비되었다. Zetasizer Nano ZS90(Malvern Instruments, Southborough, MA)을 사용하여 입자 크기 및 ζ-전위를 동적 광산란 및 레이저 도플러 풍속계로 측정하였다. 샘플을 pH 7.2의 10 mM NaCl 용액으로 희석시켰다.
결막하 투여 후의 DSP-NP 보유력
SC 투여 후 DSP-NP의 보존은 Xenogen IVIS Spectrum 광학 영상 시스템(Caliper Life Sciences Inc., Hopkinton, MA)으로 전체 눈을 영상화함으로써 조사되었다. 쥐를 케타민(Ketamine)(80 mg/kg)과 자일라진(Xylazine)(8 mg/kg)의 혼합물을 근육 주사하여 마취시켰다. 형광 표지된 DSP-NP 인 AF647을 27 게이지 바늘을 사용하여 SC 투여(50 ㎕)하여 Sprague Dawley 쥐에게 주사하였다. 주입 절차는 S81 수술 안과용 현미경(Zeiss, Germany) 하에서 수행되었다. 눈꺼풀은 45G 견본(Focus Ophthalmics, LLC, Ontario, CA)으로 촬영하는 동안 수축되었다. 주사 부위의 총 형광 카운트는 640/680 nm에서 기록되었다. Living Image 3.0 소프트웨어(Caliper Lifesciences, Inc.)를 사용하여 이미지를 분석하고 입자 주입 직후 동일한 눈의 형광 카운트와 비교하여 나노입자의 잔류 물을 정량화했다. 입자 주입이없는 쥐 눈을 기준선으로 사용하였다.
생체 내 안구 내 DSP 수준
실시예 1은 SC 주사 후 1 주일 이내에 생체 내 안구 내 DSP 수준을 기술한다. 동일한 방법을 사용하여 POD14에서 쥐의 SC 투여 후 안구 DSP 수준을 검출하였다. [3H] 라벨링된 DSP를 라벨이 부착되지 않은 DSP(10μCi:1 mg DSP)와 혼합하고 DSP-NP의 준비에 사용했다. 동일한 제형의 50μL(1 눈당 ~ 0.8μCi)을 SC 주사를 통해 동일한 동물(Sprague Dawley rat)의 양안에 투여하였다. POD14에서, 꼬리 정맥에서 혈액 두 방울을 모으고 마취하에 쥐를 희생시켰다. 주입 부위를 포함하는 수성, 유리체 및 나머지 안구 조직을 조심스럽게 해부하고 수집하였다. 모든 샘플의 무게를 달아 50 ℃에서 밤새 배양하여 Solvable(Perkin Elmer, Waltham, MA) 2 mL로 용해시켰다. 혈액 샘플을 0.2 mL H2O2 및 20μL 0.5M EDTA로 표백하였다. 섬광 계수기(Perkin Elmer, Waltham, MA)에서 방사능을 계수하기 전에 10 밀리리터의 Ultima 금 섬광 매질(Perkin Elmer, Waltham, MA)을 첨가하였다. 결과는 주사된 선량의 백분율로 표시되었으며 데이터 포인트 당 4 눈의 평균±표준 편차(SD)이다. 혈액 내 DSP의 수준은 시간당 2 마리의 동물의 평균이었다. 주사 부위에서 주사된 총 투여량 및 조직 1 mg 또는 혈액 mL 당 방사능을 계산하였다.
안압 측정
비 침습적 안압(IOP) 측정은 수술 후 매주 Icare® Tonolab(Helsinki, Finland)를 사용하여 수행되었다. 각 안구에 대해 기록된 안압은 평균 3회 연속 측정의 평균±표준 오차(SEM)였다.
각막 병리학 연구
수술 후 7일 및 14일에 모든 동물을 희생시키고 봉합 과정을 거친 눈을 적출했다. 안구 조직을 파라핀에 끼우기 전에 24 시간 동안 10% 포르말린으로 고정시켰다. 전후 방 향(각막에서부터 시신경까지)을 지닌 축 방향 단면(두께 5μm)을 잘라 내고 H & E로 염색하였다.
실시간 정량 역전사 중합 효소 연쇄 반응(RT-PCR)
각막의 VEGF, MMP-2, MMP-9, 염기성 섬유 모세포 성장 인자(bFGF), TNF-α를 포함한 일부 혈관 신생 사이토 카인의 mRNA 발현 수준을 RT-PCR로 측정하였다. 수술 후 7일째와 14일째에 각막을 절개하여 함께 모으고(n=3) 제조업 자의 지시에 따라 총 리보 핵산(RNA)을 TRIzol® 시약(Invitrogen, Grand Island, NY, USA)으로 분리하였다. 그런 다음 RNA를 고용량 cDNA Reverse Transcription Kit(No. 4368814, Applied Biosystems, 미국 캘리포니아 주 포스터 시티 소재)를 사용하여 상보적 DNA로 전사시켰다. Fast SYBR® Green Master Mix(Applied Biosystems, Foster City, CA)를 사용하여 7100 RealTime PCR System(Applied Biosystems, Foster City, CA)을 사용하여 RT-PCR을 수행하였다. 사용된 프라이머를 표 2에 나타내었다. 모든 발현 수준을 GAPDH로 정규화하고 서로 비교하였다. 결과는 3회 반복의 평균±표준 오차(SEM)로 나타내었다.
통계 분석
수집된 모든 데이터는 t 테스트와 다중 비교 테스트(one-way ANOVA, Bonferroni 테스트)를 사용하여 그룹간에 비교되었다. 차이는 P<0.05의 수준에서 통계적으로 유의하다고 간주되었다.
결과
시험관내 및 생체 내에서의 DSP-NP의 특성 규명
수용성 코르티코 스테로이드 덱사메타손 소디움 포스페이트(dexamethasone sodium phosphate)(DSP)는 아연 킬레이트를 사용하여 PLGA 나노입자(DSP-NP)로 성공적으로 캡슐화되었다. 결막하 투여 후 생분해성 DSP-NP의 정량을 정량하기 위해, DSP-NP의 제조 전에 PLGA를 PLGA에 접합시키는 것을 통해 PLGA를 형광 표지하였다. PLGA에 대한 AF-647의 결합은 8% 약물 로딩 및 약 200nm 입자 크기로 DSP-NP의 물리 화학적 성질에 영향을 주었다(표 3). AF-647-표지된 DSP-NP의 SC 투여 후, 살아있는 동물 영상을 사용하여 3 주간의 체류 연구(참조 3) 이상의 형광 신호를 정량화하였다. 처음 2일 동안 원래 신호의 20%까지 형광 신호가 급속히 떨어졌다.
VEGF, MMP-2, MMP-9, bFGF 및 TNF-α의 수준을 도 10a(7일째) 및 10B(14일째)에 나타내었다. 안압은 도 11에 나와 있다.
포도막염 예방
포도막염은 시력을 위협하는 염증성 안 질환이다. 코르티코 스테로이드는 포도막염의 가장 효과적인 치료법이다. 그러나 중간 및 후부 포도막염은 유리체와 망막에 영향을 미치므로 국소 스테로이드로 치료하기가 어렵다. 결막 아래에 주사된 수용성 스테로이드 용액은 매우 빨리 제거되므로 장기간 치료 수준을 유지하기 위해 반복 주입이 필요하다. 덱사메타손 소디움 포스페이트(DSP)가 함유된 나노입자(NP)는 높은 약물 부하와 약물 방출을 연장시킨다. 이들은 쥐의 판막염 모델에서 효능을 테스트했다.
행동 양식:
생분해성 폴리(락틱-코-글리콜 릭 산),(PLGA) 나노입자는 수정된 용매 확산 방법을 사용하여 준비되었다. 6 주된 루이스(Lewis) 쥐에게 liposaccharide(LPS)를 IP 주입하여 endotoxicin으로 유발된 포도막염(EIU) 모델을 24 시간 동안 시험하였다. LPS에 의해 면역화된 쥐에서 염증을 감소시키는 DSP-로딩된 나노입자의 능력을 망막 및 조직 병리학에서 염증성 사이토 카인의 임상적 평가, mRNA 발현 및 단백질 수준에 의해 시험하였다.
결과 :
나노입자는 평균 직경 200 nm, 높은 약물 부하량 8 중량% 및 15일 동안의 조절된 약물 방출 프로파일을 나타냈다. 도 12는 DSP-NP의 싱크 조건 하에서 시험관내에서 15일 동안 지속된 약물 방출의 그래프이다.
이러한 DSP-로딩된 나노입자는 쥐의 눈에 결막 투여 후 지속적인 안구 약물 수준을 제공하였다. 도 13A 및 13b는 전방 챔버(도 13A) 및 유리체액(도 13b) 모두에서 높은 약물 수준을 나타내는 쥐에서 DSP-NP의 SC 투여 후 적어도 7일 동안 지속된 고 안 약물 수준의 그래프이다.
위약 입자, 생리 식염수 또는 유리 약물 용액의 치료군을 대조하는 것과 비교하면, 포도막염 쥐 모델의 DSP-적재된 NP 처리는 염증 점수, mRNA 발현 및 염증성 사이토 카인 단백질 수준이 현저히 낮았다. 도 14는 LPS의 IP 주사 후 3 시간 및 24 시간에 영상화되고 스코어링된 전 안부의 염증 점수의 그래프로서, DSP-NP 예방 군이 대조군보다 유의하게 적은 염증을 나타냄을 보여준다. 도 15는 24 시간 면역 접종 후 3 그룹의 EIU 모델에서 망막에서 IL-1b, IL-6 및 TNF의 mRNA 발현을 나타낸 그래프로서, 위약 -NP 및 PBS 그룹과 비교하여 DSP-NP 그룹에서 현저하게 감소된 발현을 나타낸다.
결론:
덱사메타손 소디움 포스페이트가 함유된 PLGA 나노입자는 코티코 스테로이드의 지속적인 방출을 제공하고 쥐에서 포도막염과 관련된 염증을 효과적으로 감소시킨다. 포도막염이 종종 재발하므로 이 치료법은 투여 빈도를 줄이고 코르티코 스테로이드의 잠재적 인 전신 부작용을 피하며 환자의 순응도를 향상시켜 임상 적용 가능성을 높여야 한다.
쥐의 각막 이식 거부 및 녹내장 치료용
코르티코 스테로이드
나노입자의 매월
결막하
투여
재료 및 방법
실시예 1에 기술된 바와 같이, DSP의 캡슐화를 위해 COOH 그룹을 갖는 폴리 락트산을 사용하여 나노입자를 제조하였다.
매달 결막 아래 주사를 사용하여 각막 신생 혈관 예방을 위해 실시예 2에 기재된 바와 같이 나노입자를 쥐에 투여하였다.
나노입자는 또한 녹내장 모델에 투여되었다.
결과
나노입자의 직경은 338 + 11nm; 0.09 + 0.038의 PDI, ζ-전위(mV) 0f-3 + 1 및 DL%(9.4 + 0.8)를 갖는다.
결과는 시간 경과에 따른 DSP 수준을 보여주는 약동학 연구에 대한도 16A 내지 16d에 도시된다. 도 16A-16d는 DSP-PLA2COOH 나노입자를 쥐에게 결막하 주사하는 약물 동력학(ng DSP/ml/시간)을 나타낸 그래프이다. 도 16A, 수성; 도 16b, 유리체액; 도 16c, 혈액; 도 16d는 주사 부위 제어를 도시한다.
도 17a-17e는 DSP-PLA2COOH 나노입자 처리군(17a-17c) 및 염수 대조군(17d-17f)에 대한 전체 12 주 추적 동안의 이월의 시간 경과에 따른 이식편의 임상 관찰 그래프이다. 화살표는 치료 주사 시간 포인트를 나타낸다. 도 17a, 17d는 투명성 스코어; 도 17b, 17e는 부종 점수이고, 17c, 17f는 혈관 신생이다.
도 18은 생리 식염수 대조군 및 DSP-PLA2COOH 나노입자 처리군 둘 다에 대한 생존 곡선(생존율%)이다.
도 19a 및 도 19b는 대조군(19b)과 비교하여 월간 간격(19a)으로 DSP-PLA2COOH 나노입자로 처리된 동물에 대한 시간 경과에 따른 안압의 그래프이다.
그 결과는 DSP-PLA2COOH 나노입자를 이용한 녹내장 치료뿐 아니라 이식편 거부 예방을 위한 월간 주사로도 비슷한 결과를 얻을 수 있음을 보여준다.
SEQUENCE LISTING
<110> Johns Hopkins University
Hanes, Justin Scot
Pan, Qing
Xu, Qingguo
Boylan, Nicholas J
Stark, Walter J
Wang, Bing
Luo, Lixia
<120> GLUCOCORTICOID-LOADED NANOPARTICLES FOR PREVENTION OF CORNEAL
ALLOGRAFT REJECTION AND NEOVASCULARIZATION
<130> JHU C12604 PCT
<150> 62/139,561
<151> 2015-03-27
<150> 62/037,000
<151> 2014-08-13
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 1
gcccatgaag tggtgaagtt 20
<210> 2
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 2
actccagggc ttcatcattg 20
<210> 3
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 3
agctttgatg gcccctatct 20
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 4
ggagtgacag gtcccagtgt 20
<210> 5
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 5
ccaccgagct atccactcat 20
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 6
gtccggtttc agcatgtttt 20
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 7
gaaccggtac ctggctatga 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 8
ccgttttgga tccgagttta 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 9
actcccagaa aagcaagcaa 20
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 10
cgagcaggaa tgagaagagg 20
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 11
tgccactcag aagactgtgg 20
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Primer
<400> 12
tgggggtagg aacacagaag 20
Claims (18)
- 친수성 폴리머로 조밀하게 코팅되고 나노입자를 형성하는 폴리머에 포스페이트 또는 카르복실기와 금속 이온의 킬레이트화에 의해 착화된 글루코 코르티코이드, 상기 폴리머의 말단의 카르복시 말단 기에 복합된 클루코 코르티코이드, 및 상기 글루코 코르티코이드의 수용성 염으로 이루어진 군으로부터 선택된 글루코코르티코이드를 캡슐화하는 생분해성 폴리머 입자이고, 상기 생분해성 폴리머 입자는 생체 외에서 최대 7일 동안 글루코 코르티코이드의 서방성을 제공하며, 결막(SC) 주사를 통해 투여될 수 있고 2 주 동안 눈의 결막 조직에 보유되는 생분해성 폴리머 입자.
- 제1항에 있어서, 상기 글루코 코르티코이드가 덱사메타손 소디움 포스페이트(DSP)인 생분해성 폴리머 입자.
- 제1항에 있어서, 상기 생분해성 폴리머가, 폴리하이드록시산, 폴리하이드록시 알카노에이트, 폴리안하이드라이드 및 이의 카르복시기 말단 폴리머로 이루어진 군으로부터 선택되는 생분해성 폴리머 입자.
- 제1항에 있어서, 100 내지 1 미크론 사이의 평균 직경을 갖는 나노입자를 포함하는 생분해성 폴리머 입자.
- 제1항에 있어서, PEG, 폴리옥시에틸렌-폴리에틸렌 옥사이드 블록 코폴리머 또는 이들의 조합으로 조밀하게 코팅된 폴리(락틱-코-글리콜산)(PLGA)을 포함하는 생분해성 폴리머 입자.
- 제1항에 있어서, 상기 글루코 코르티코이드가 나노입자를 형성하는 폴리머에 포스페이트 또는 카르복시기와 금속 이온의 킬레이트화에 의해 착화된 생분해성 폴리머 입자.
- 제1항에 있어서, 상기 글루코 코르티코이드가 에스테르 또는 다른 가수 분해 가능한 잔기를 통해 폴리머의 말단에서 카르복시 말단 기와 복합화되는 생분해성 폴리머 입자.
- 제1항에 있어서, 상기 글루코 코르티코이드가 수용성 염으로 유도체화된 다음 폴리머 나노입자에 혼입되는 입자.
- 제1항에 있어서, 눈에 투여하기 위한 약학적으로 허용되는 부형제인 생분해성 폴리머 입자.
- 유효량의 제1항 내지 제9항 중 어느 한 항의 폴리머 입자를 이를 필요로 하는 부위에 투여하는 것을 포함하는, 염증, 이식편 거부 또는 신 혈관 형성을 예방하는 방법.
- 제10항에 있어서, 상기 폴리머 입자는, 전방, 중반 또는 후방 유리체 주사, 결막하 주사, 전방부 주사, 일시적 윤부를 통한 전방 내로의 주사, 간질 내 주사, 맥락하 공간으로의 주사, 각막내 주사, 망막하 주사, 또는 안구내 주사에 의해 눈에 국부적으로 투여되는 것을 특징으로 하는 방법..
- 제10항에 있어서, 상기 폴리머 입자는 혈관 신생을 예방 또는 감소시키기 위해 유리체 내 주사에 의해 투여되는 방법.
- 제10항에 있어서, 상기 폴리머 입자가 결막(SC) 주사에 의해 투여되고 결막 조직에 보유되는 방법.
- 제10항에 있어서, 신생 혈관 형성을 예방 또는 감소시키기 위해 상기 폴리머 입자를 투여하는 방법.
- 제10항에 있어서, 상기 폴리머 입자는 이식편 거부를 방지하기 위해 투여되는 방법.
- 제10항 내지 제15항 중 어느 한 항에 있어서, 상기 폴리머 입자가 1 주일에 1회 이상, 2 주에 1회, 4 주에 1회, 1 개월에 1회, 2 개월에 1회, 또는 3 개월마다 1회 투여되는 방법.
- 제10항 내지 제16항 중 어느 한 항에 있어서, 상기 폴리머 입자는 직경이 1 미크론보다 작은 나노입자 인 방법.
- 제10항 내지 제16항 중 어느 한 항에 있어서, 상기 폴리머 입자는 직경이 100 마이크론 이하인 미립자 인 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462037000P | 2014-08-13 | 2014-08-13 | |
| US62/037,000 | 2014-08-13 | ||
| US201562139561P | 2015-03-27 | 2015-03-27 | |
| US62/139,561 | 2015-03-27 | ||
| PCT/US2015/043478 WO2016025215A1 (en) | 2014-08-13 | 2015-08-03 | Glucocorticoid-loaded nanoparticles for prevention of corneal allograft rejection and neovascularization |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170046146A true KR20170046146A (ko) | 2017-04-28 |
Family
ID=54011072
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177006811A KR20170046146A (ko) | 2014-08-13 | 2015-08-03 | 각막 동종이식 거부 및 신혈관 형성의 예방을 위한 글루코 코르티코이드-로딩된 나노입자 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US10195212B2 (ko) |
| EP (1) | EP3193827A1 (ko) |
| JP (1) | JP2017524712A (ko) |
| KR (1) | KR20170046146A (ko) |
| CN (1) | CN106794152A (ko) |
| CA (1) | CA2957764C (ko) |
| MX (1) | MX2017001863A (ko) |
| WO (1) | WO2016025215A1 (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2729731C2 (ru) | 2014-12-15 | 2020-08-11 | Зе Джонс Хопкинс Юниверсити | Составы на основе сунитиниба и способы их применения для лечения глазных заболеваний |
| AU2016211696B2 (en) | 2015-01-27 | 2018-05-10 | The Johns Hopkins University | Hypotonic hydrogel formulations for enhanced transport of active agents at mucosal surfaces |
| MX2018003462A (es) | 2015-09-22 | 2018-09-06 | Graybug Vision Inc | Compuestos y composiciones para el tratamiento de trastornos oculares. |
| SG11201803663XA (en) | 2015-11-12 | 2018-05-30 | Graybug Vision Inc | Aggregating microparticles for therapy |
| DE102017002454A1 (de) * | 2017-03-14 | 2018-09-20 | Friedrich-Schiller-Universität Jena | Organische Polymerpartikel enthaltend Poly(oxazolin)-Stabilisatoren und Verwendung von Poly(oxazolinen) zur Stabilisierung von organischen Polymerpartikeln |
| BR112019019452A2 (pt) | 2017-03-23 | 2020-04-14 | Graybug Vision Inc | composto, e, uso de um composto |
| CN111201040A (zh) | 2017-05-10 | 2020-05-26 | 灰色视觉公司 | 用于医学疗法的缓释微粒及其悬浮液 |
| WO2019071275A1 (en) * | 2017-10-06 | 2019-04-11 | Aciont Inc. | DEVICES FOR DELIVERY OF NON-INVASIVE OCULAR MEDICINE |
| WO2021168239A1 (en) * | 2020-02-21 | 2021-08-26 | The Johns Hopkins University | Suprachoroidal delivery of drug particles to reduce toxicity |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4432964A (en) * | 1981-08-24 | 1984-02-21 | Alza Corporation | Topical composition containing steroid in two forms released independently from polymeric carrier |
| US4888176A (en) | 1984-05-21 | 1989-12-19 | Massachusetts Institute Of Technology | Controlled drug delivery high molecular weight polyanhydrides |
| US4757128A (en) | 1986-08-01 | 1988-07-12 | Massachusetts Institute Of Technology | High molecular weight polyanhydride and preparation thereof |
| US4789724A (en) | 1986-10-17 | 1988-12-06 | Massachusetts Institute Of Technology | Preparation of anhydride copolymers |
| US4857311A (en) | 1987-07-31 | 1989-08-15 | Massachusetts Institute Of Technology | Polyanhydrides with improved hydrolytic degradation properties |
| US4997652A (en) | 1987-12-22 | 1991-03-05 | Visionex | Biodegradable ocular implants |
| US5932462A (en) | 1995-01-10 | 1999-08-03 | Shearwater Polymers, Inc. | Multiarmed, monofunctional, polymer for coupling to molecules and surfaces |
| WO2004084871A1 (en) * | 2003-03-26 | 2004-10-07 | Ltt Bio-Pharma Co., Ltd. | Intravenous nanoparticles for targenting drug delivery and sustained drug release |
| US20090148527A1 (en) | 2007-12-07 | 2009-06-11 | Robinson Michael R | Intraocular formulation |
| US20050226814A1 (en) | 2004-04-13 | 2005-10-13 | Bausch & Lomb Incorporated | Diagnostic method and kit for implantation of a sustained release drug-delivery implant with a steroid |
| US20060089590A1 (en) * | 2004-10-27 | 2006-04-27 | John Higuchi | Methods and devices for sustained in-vivo release of an active agent |
| JP2007001926A (ja) * | 2005-06-24 | 2007-01-11 | Ltt Bio-Pharma Co Ltd | 吸入・噴霧用ステロイド製剤 |
| US8916206B2 (en) * | 2005-12-26 | 2014-12-23 | Ltt Bio-Pharma Co., Ltd. | Nanoparticles containing water-soluble non-peptide low-molecular weight drug |
| US20100129456A1 (en) * | 2007-05-14 | 2010-05-27 | Ltt Bio-Pharma Co., Ltd. | Sustained-release nanoparticle containing low-molecular-weight drug with negatively charged group |
| JP2011512903A (ja) * | 2008-02-25 | 2011-04-28 | アイゲート ファーマ エスエーエス | イオントフォレシスを介した眼組織への治療薬の向上した送達 |
| US20110206773A1 (en) | 2008-05-20 | 2011-08-25 | Yale University | Sustained delivery of drugs from biodegradable polymeric microparticles |
| US9095506B2 (en) | 2008-11-17 | 2015-08-04 | Allergan, Inc. | Biodegradable alpha-2 agonist polymeric implants and therapeutic uses thereof |
| WO2011041373A1 (en) | 2009-09-29 | 2011-04-07 | Eyegate Pharmaceuticals, Inc. | Positively-charged poly (d,l-lactide-co-glycolide) nanoparticles and fabrication methods of the same |
| EP2755659A2 (en) | 2011-09-13 | 2014-07-23 | Altacor Limited | Pharmaceutical nanoparticle compositions |
| RU2598627C2 (ru) * | 2012-01-19 | 2016-09-27 | Дзе Джонс Хопкинс Юниверсити | Композиции на основе наночастиц с улучшенным проникновением через слизистые оболочки |
| NZ700875A (en) * | 2012-05-03 | 2017-03-31 | Kala Pharmaceuticals Inc | Pharmaceutical nanoparticles showing improved mucosal transport |
-
2015
- 2015-08-03 MX MX2017001863A patent/MX2017001863A/es unknown
- 2015-08-03 JP JP2017507390A patent/JP2017524712A/ja active Pending
- 2015-08-03 WO PCT/US2015/043478 patent/WO2016025215A1/en active Application Filing
- 2015-08-03 CN CN201580053822.9A patent/CN106794152A/zh active Pending
- 2015-08-03 CA CA2957764A patent/CA2957764C/en active Active
- 2015-08-03 EP EP15756267.9A patent/EP3193827A1/en not_active Withdrawn
- 2015-08-03 KR KR1020177006811A patent/KR20170046146A/ko unknown
- 2015-08-03 US US15/502,732 patent/US10195212B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US10195212B2 (en) | 2019-02-05 |
| CA2957764A1 (en) | 2016-02-18 |
| US20170157147A1 (en) | 2017-06-08 |
| MX2017001863A (es) | 2017-07-17 |
| CN106794152A (zh) | 2017-05-31 |
| JP2017524712A (ja) | 2017-08-31 |
| WO2016025215A1 (en) | 2016-02-18 |
| EP3193827A1 (en) | 2017-07-26 |
| CA2957764C (en) | 2019-07-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10195212B2 (en) | Glucocorticoid-loaded nanoparticles for prevention of corneal allograft rejection and neovascularization | |
| US11660349B2 (en) | Non-linear multiblock copolymer-drug conjugates for the delivery of active agents | |
| Gote et al. | Ocular drug delivery: present innovations and future challenges | |
| JP6570513B2 (ja) | 持続的眼内放出のためのマイクロスフェア薬剤送達システム | |
| Liu et al. | Prolonged ocular retention of mucoadhesive nanoparticle eye drop formulation enables treatment of eye diseases using significantly reduced dosage | |
| Pan et al. | Corticosteroid-loaded biodegradable nanoparticles for prevention of corneal allograft rejection in rats | |
| EP3233056B1 (en) | Sunitinib formulations and methods for use thereof in treatment of ocular disorders | |
| Bravo-Osuna et al. | Pharmaceutical microscale and nanoscale approaches for efficient treatment of ocular diseases | |
| JP2015013863A (ja) | 増大した前眼部クリアランス速度を有するα−2アドレナリン受容体アゴニストを用いる眼科治療 | |
| JP2018515529A (ja) | ハイドロゲルからの薬物送達 | |
| US20130237602A1 (en) | Valproic acid drug delivery systems and intraocular therapeutic uses thereof | |
| KR20210013339A (ko) | 개선된 점막 수송을 나타내는 제약 나노입자 | |
| Li et al. | Nanoparticulate drug delivery to the retina | |
| JP2007535367A (ja) | エストラジオール誘導体またはエストラトポン誘導体を含有する徐放性眼内インプラント、ならびに関連する製造法 | |
| Silva et al. | Colloidal nanosystems with mucoadhesive properties designed for ocular topical delivery | |
| Alshamsan et al. | Treatment of endotoxin-induced uveitis by topical application of cyclosporine a-loaded PolyGel™ in rabbit eyes | |
| US11369575B2 (en) | PPARα agonist compositions and methods of use | |
| Pillay et al. | Intraocular drug delivery technologies: advancing treatment of posterior segment disorders of the eye | |
| Schmitt | Design and development of ocular formulations for preclinical and clinical trials | |
| Ramesh | Ocular barriers and ocular drug delivery: Bridging the gap using nanomicelles as drug carriers | |
| WO2023091955A1 (en) | Compositions and methods for the treatment of ocular diseases and injuries | |
| Pimple et al. | Current Insights into Targeting Strategies for the Effective Therapy of Diseases of the Posterior Eye Segment | |
| Virmani et al. | An overview of ocular drug delivery systemsdconventional and novel drug delivery systems | |
| US20190022016A1 (en) | Compositions for sustained release of anti-glaucoma agents to control intraocular pressure | |
| Chowdhury | Development and preliminary in vitro evaluation of nanomicelles laden in situ gel of dexamethasone for ophthalmic delivery |