KR20170013255A - 헤파란 설페이트 - Google Patents
헤파란 설페이트 Download PDFInfo
- Publication number
- KR20170013255A KR20170013255A KR1020167033350A KR20167033350A KR20170013255A KR 20170013255 A KR20170013255 A KR 20170013255A KR 1020167033350 A KR1020167033350 A KR 1020167033350A KR 20167033350 A KR20167033350 A KR 20167033350A KR 20170013255 A KR20170013255 A KR 20170013255A
- Authority
- KR
- South Korea
- Prior art keywords
- tgf
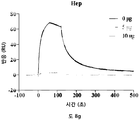
- heparin
- heparan sulfate
- tissue
- cartilage
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/20—Polysaccharides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
- C08B37/0063—Glycosaminoglycans or mucopolysaccharides, e.g. keratan sulfate; Derivatives thereof, e.g. fucoidan
- C08B37/0075—Heparin; Heparan sulfate; Derivatives thereof, e.g. heparosan; Purification or extraction methods thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
- A01N1/0205—Chemical aspects
- A01N1/021—Preservation or perfusion media, liquids, solids or gases used in the preservation of cells, tissue, organs or bodily fluids
- A01N1/0226—Physiologically active agents, i.e. substances affecting physiological processes of cells and tissue to be preserved, e.g. anti-oxidants or nutrients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/726—Glycosaminoglycans, i.e. mucopolysaccharides
- A61K31/727—Heparin; Heparan
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/72—Cosmetics or similar toiletry preparations characterised by the composition containing organic macromolecular compounds
- A61K8/73—Polysaccharides
- A61K8/735—Mucopolysaccharides, e.g. hyaluronic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/44—Medicaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/60—Liquid-swellable gel-forming materials, e.g. super-absorbents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/28—Materials for coating prostheses
- A61L27/34—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/38—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells
- A61L27/3804—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells characterised by specific cells or progenitors thereof, e.g. fibroblasts, connective tissue cells, kidney cells
- A61L27/3834—Cells able to produce different cell types, e.g. hematopoietic stem cells, mesenchymal stem cells, marrow stromal cells, embryonic stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/52—Hydrogels or hydrocolloids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/495—Transforming growth factor [TGF]
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/10—Heparin; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
- A61L2300/414—Growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2420/00—Materials or methods for coatings medical devices
- A61L2420/02—Methods for coating medical devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/06—Materials or treatment for tissue regeneration for cartilage reconstruction, e.g. meniscus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
- C12N2501/15—Transforming growth factor beta (TGF-β)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/90—Polysaccharides
- C12N2501/91—Heparin
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Dermatology (AREA)
- Organic Chemistry (AREA)
- Transplantation (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Molecular Biology (AREA)
- Zoology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Hematology (AREA)
- Materials Engineering (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- Dispersion Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Developmental Biology & Embryology (AREA)
- Biophysics (AREA)
- Wood Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Toxicology (AREA)
- Botany (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Urology & Nephrology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Chemical & Material Sciences (AREA)
- Physical Education & Sports Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biotechnology (AREA)
- Rheumatology (AREA)
Abstract
TGFβ1에 결합하는 헤파란 설페이트가 기술된다.
Description
본 발명은 헤파란 설페이트, 구체적으로, 비록 이로 제한되는 것은 아니지만, TGFβ1에 결합하는 헤파란 설페이트에 관한 것이다.
글리코사미노글리칸은 이들의 기능을 조절하기 위해 광범위한 단백질과 상호작용하는 복합적이고, 선형인, 고도로 하전된 탄수화물로서; 이들은 통상 코어 단백질에 부착되어 합성된다. GAG는 비황산화된 (nonsulfated) (HA) 것과 황산화된 (sulfated) (CS, DS, KS, 헤파린 및 HS) 것으로 분류된다.
GAG 중에서, 헤파란 설페이트 (HS) 패밀리는 그]의 도메인 내부의 특정 서열에 근거하여 표적 단백질과 상호작용하는 이들의 능력으로 인해 특히 주목되고 있다. 이 패밀리 (헤파린 및 HS)는 다양한 패턴의 N-, 및 O-황산화 (sulfation)를 갖는 반복적인 우론산-(1→4)-D-글루코사민 디사카라이드 서브유니트로 이루어진다. 예를 들어, 헤파린의 항-응고 활성은 독특한 펜타사카라이드 배열을 갖는 글루코사민 잔기 내 3-O-황산화를 필요로 한다 (Lindahl U, Backstrom G, Hook M, Thunberg L, Fransson LA, Linker A. Structure of the antithrombin-binding site in heparin Proc Natl Acad Sci U S A. 1979; 76: 3198-202). 독특한 황산화 패턴은 또한 ECM 단백질의 경우에 명백한데; FN에 결합하는 친화성 (avid) 헤파린-결합 변이체는 매우 고도로 하전되고, 요구되는 7 내지 8개의 N-황산화된 디사카라이드를 가지며, 통상보다 더 큰 도메인 (> 14개 잔기)을 갖는다 (Falcone DJ, Salisbury BGJ. Fibronectin stimulates macrophage uptake of low-density lipoprotein-heparin-collagen complexes Arteriosclerosis. 1988; 8: 263-73.; Mahalingam Y, Gallagher JT, Couchman JR. Cellular adhesion responses to the heparin-binding (HepII) domain of fibronectin require heparan sulfate with specific properties. J Biol Chem. 2007; 282: 3221-30). 그러나 HS는 비황산화된 NA 도메인에 의해 분리된 고도로 황산화된 NS 도메인을 가짐으로 인해 이들 황산화된 헤파린과는 다르고; 이러한 성향은 헤파린의 부작용 없이, 단백질에 선택적으로 결합하기 위한 독특한 배열을 제공한다 (Gandhi NS, Mancera RL. The Structure of glucosaminoglycans and their interactions with proteins. Chem. Biol. Drug. Des. 2008; 72: 455-82).
HS의 디사카라이드 조성은 글리코시드 결합을 절단하기 위해 플라보박테리움 헤파리니움 (Flavobacterium heparinium) 효소 헤파리나제 I, II 및 III을 사용하는 일련의 효소적 절단을 통해 설명될 수 있다 (Venkataraman G, Shriver Z, Raman R, Sasisekharan R. Sequencing complex polysaccharides. Science. 1999; 286: 537-42.; Desai UR, Wang HM, Linhardt RJ. Specificity studies on the heparin lyases from Flavobacterium-heparinum Biochemistry. 1993; 32: 8140-5.; Shriver Z, Sundaram M, Venkataraman G, Fareed J, Linhardt R, Biemann K, et al. Cleavage of the antithrombin III binding site in heparin by heparinases and its implication in the generation of low molecular weight heparin. Proc Natl Acad Sci U S A. 2000; 97: 10365-70). 모든 3종의 헤파리나제가 조합하여 사용될 때 헤파린 또는 HS의 90% 초과의 탈중합화 (depolymerization)가 가능하다 (Karamanos NK, Vanky P, Tzanakakis GN, Tsegenidis T, Hjerpe A. Ion-pair high-performance liquid chromatography for determining disaccharide composition in heparin and heparan sulphate. J Chromatogr A. 1997; 765: 169-79.; Vynios DH, Karamanos NK, Tsiganos CP. Advances in analysis of glycosaminoglycans: its application for the assessment of physiological and pathological states of connective tissues. J Chromatogr B. 2002; 781: 21-38.). 그 결과의 디사카라이드 혼합물은 공지의 디사카라이드 표준품에 대해 PAGE (Hampson IN, Gallagher JT. Separation of radiolabeled glycosaminoglycan oligosaccharides by polyacrylamide-gel electrophoresis Biochem J. 1984; 221: 697-705.), SAX-HPLC (Skidmore M AA, Yates E and Turnbull JE. Labelling heparan sulfate saccharides with chromophore, fluorescence and mass tag for HPLC and MS separations. Methods in Molecular biology. 2009; 534: 157-69), 또는 고감도 모세관 전기영동 (CE) (Lamari F, Militsopoulou M, Gioldassi X, Karamanos NK. Capillary electrophoresis: a superior miniaturized tool for analysis of the mono-, di-, and oligosaccharide constituents of glycan moieties in proteoglycans. Fresenius J Anal Chem. 2001;371:157-67.; Karamanos NK, Vanky P, Tzanakakis GN, Hjerpe A. High performance capillary electrophoresis method to characterize heparin and heparan sulfate disaccharides. Electrophoresis. 1996; 17: 391-5.; Sudhalter J, Folkman J, Svahn CM, Bergendal K, Damore PA. Importance of size, sulfation, and anticoagulant activity in the potentiation of acidic fibroblast growth-factor by heparin J Biol Chem. 1989; 264: 6892-7.; Militsopoulou M, Lamari FN, Hjerpe A, Karamanos NK. Determination of twelve heparin- and heparan sulfate-derived disaccharides as 2-aminoacridone derivatives by capillary zone electrophoresis using ultraviolet and laser-induced fluorescence detection. Electrophoresis. 2002; 23: 1104-9)에 의해 분석될 수 있다.
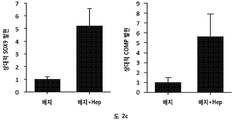
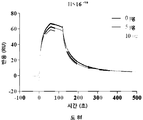
본 발명은 헤파란 설페이트 종 (species) 및 헤파란 설페이트 종을 포함하거나 이로 이루어진 헤파란 설페이트 제제(preparation)에 관한 것이다. 헤파란 설페이트 종은 HS16이라 한다. HS16은 구조적 및 기능적으로 관련된 분리된 헤파란 설페이트의 신규한 부류를 지칭한다.
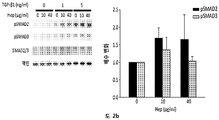
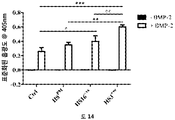
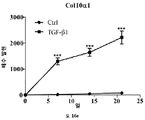
HS16은 TGFβ1에 결합하고, TGFβ1의 열적 안정성을 증강시키고 TGFβ1 시그널링 및 그로써 중간엽 줄기세포의 연골발생 (chondrogenic) 분화를 강화하는 것으로 나타났다.
본 발명의 일 측면에서, 헤파란 설페이트 HS16이 제공된다. HS16은 분리된 형태 또는 실질적으로 정제된 형태로 제공될 수 있다. 이는 헤파란 설페이트 성분이 적어도 80% HS16, 더욱 바람직하게는 적어도 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 중의 하나인, 조성의 제공을 포함할 수 있다.
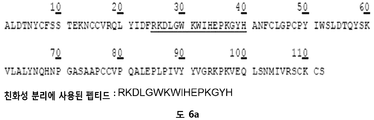
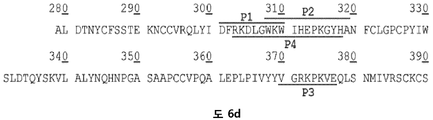
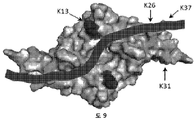
바람직한 실시양태에서, HS16은 RKDLGWKWIHEPKGYH (서열번호: 1)의 아미노산 서열을 갖는 펩티드 또는 폴리펩티드에 결합할 수 있다. 펩티드는 이 서열의 한쪽 또는 양쪽 말단 모두에 하나 이상의 부가적인 아미노산을 가질 수 있다. 예를 들어, 펩티드는 이 서열의 한쪽 또는 양쪽 말단 모두에 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20개 이상의 임의의 아미노산을 가질 수 있다.
다른 실시양태에서, 폴리펩티드는 TGFβ1 단백질이다. 일부 실시양태에서, HS16은 100 μM 미만, 더욱 바람직하게는 50 μM, 40 μM, 30 μM, 20 μM, 10 μM, 1 μM, 500 nM, 100 nM, 50 nM, 10 nM 또는 1 nM 중 하나 미만의 KD로 서열번호: 1의 아미노산 서열을 갖거나 이로 이루어진 펩티드 또는 TGFβ1 단백질에 결합한다.
HS16은, 하기 단계를 포함하는, 본원에 기술된 발명자들의 방법론에 따라서 수득되고, 동정되고, 분리되고, 또는 농축될 수 있다:
(i) 지지체에 부착되고 아미노산 서열 RKDLGWKWIHEPKGYH을 갖는 헤파린-결합 도메인을 포함하는 폴리펩티드 분자를 갖는 고체 지지체를 제공하는 단계;
(ii) 폴리펩티드 분자를 글루코사미노글리칸을 포함하는 혼합물과 접촉시켜, 폴리펩티드-글루코사미노글리칸 복합체가 형성되게 하는 단계;
(iii) 혼합물의 잔류물로부터 폴리펩티드-글루코사미노글리칸 복합체를 분할하는 (partitioning) 단계;
(iv) 폴리펩티드-글루코사미노글리칸 복합체로부터 글루코사미노글리칸을 해리하는 (dissociating) 단계;
(v) 해리된 글루코사미노글리칸을 수집하는 단계.
선택적으로, 본 방법은, 예컨대 단계 (iv) 또는 (v) 후에, 크기 분획화 단계를 추가로 포함한다. 크기 분획화는 선택된 문턱값(threshold), 예컨대, dp4, dp6, dp8, dp10, dp12, dp14, dp16, dp18, dp20, dp22, 또는 dp24의 하나보다 적은 헤파란 설페이트 사슬을 제거하는데 사용될 수 있다.
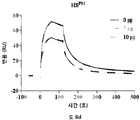
본 발명자의 방법론에서, 혼합물은 상업적으로 이용가능한 공급원으로부터 수득된 글루코사미노글리칸을 포함할 수 있다. 하나의 적합한 공급원은 헤파란 설페이트 분획, 예컨대, 상업적으로 이용가능한 헤파란 설페이트이다. 하나의 적합한 헤파란 설페이트 분획은 돼지 창자 점막으로부터 헤파린의 분리 과정에서 수득될 수 있고, 다른 하나는 돼지 점막 유래의 헤파란 설페이트 [HSPM](예컨대, Celsus Laboratories Inc. 종종 "Celsus HS"로 불림)이다.
헤파란 설페이트의 다른 적합한 공급원은 임의의 포유동물 (인간 또는 비인간)로부터, 특히 신장, 폐 또는 창자 점막으로부터의 헤파란 설페이트를 포함한다. 일부 실시양태에서, 헤파란 설페이트는 돼지 (porcine) 또는 소 (bovine) 창자 점막, 신장 또는 폐로부터 유래한다.
본 발명의 다른 측면에서, 상기 측면의 어느 하나에 따른 HS16 및 TGFβ1 단백질을 포함하는 조성물이 제공된다.
본 발명의 일 측면에서, 상기에 기술된 측면에 따른 HS16을 포함하는 약제학적 조성물 또는 약물이 제공된다. 약제학적 조성물 또는 약물은 약제학적으로 허용가능한 담체, 애주번트 또는 희석제를 추가로 포함할 수 있다.
일부 실시양태에서, 약제학적 조성물은 조직, 예컨대, 결합 조직 (연골, 뼈, 힘줄, 인대, 피부, 각막) 또는 골절된 뼈의 복구 및/또는 재생을 포함하는 치료 방법에 사용하기 위한 것이다. 일부 실시양태에서, 약제학적 조성물 또는 약물은 TGFβ1 단백질을 추가로 포함할 수 있다. 일부 실시양태에서, 약제학적 조성물 또는 약물은 중간엽 줄기세포를 추가로 포함할 수 있다.
본 발명의 다른 실시양태에서, 의학적 치료 방법에 사용하기 위한 HS16이 제공된다. 의학적 치료 방법은 생체 내에서 상처 치유, 조직의 복구 및/또는 재생, 예컨대, 결합 조직 (연골, 뼈, 힘줄, 인대, 피부, 각막)의 복구 및/또는 재생의 방법을 포함할 수 있다. 이러한 복구 및/또는 재생은 포유동물 또는 인간에서일 수 있다.
본 발명의 관련 측면에서, 의학적 치료 방법에 사용하기 위한 약물의 제조에 있어서 HS16의 용도가 제공된다. 일부 실시양태에서, 의학적 치료 방법은 상기에 기술된 바와 같은 조직의 복구 및/또는 재생을 포함한다.
본 발명의 추가의 측면에서, 생체물질 및 HS16을 포함하는 생체적합성 임플란트 또는 보철물이 제공된다. 일부 실시양태에서, 임플란트 또는 보철물은 HS16으로 코팅된다. 일부 실시양태에서, 임플란트 또는 보철물은 HS16으로 함침된다. 임플란트 또는 보철물은 추가로 TGFβ1 단백질 및/또는 중간엽 줄기세포로 코팅되거나 함침될 수 있다.
본 발명의 다른 측면에서, 생체물질을 HS16으로 코팅하거나 이로 함침시키는 단계를 포함하는, 생체적합성 임플란트 또는 보철물을 형성하는 방법이 제공된다. 일부 실시양태에서, 방법은 생체물질을 TGFβ1 단백질 및 중간엽 줄기세포의 하나 또는 둘 모두로 코팅하거나 함침시키는 단계를 추가로 포함한다.
일부 측면에서, 방법은 환자에게 HS16 및 중간엽 줄기세포를 투여하는 것을 포함할 수 있다. 이러한 방법에서, HS16, TGFβ1 단백질 및 중간엽 줄기세포의 적어도 2개가 HS16, TGFβ1 단백질 및 중간엽 줄기세포의 적어도 2개 및 약제학적으로 허용가능한 담체, 애주번트 또는 희석제를 포함하는 약제학적 조성물로 제형화(formulated)될 수 있다.
바람직하게는, HS16, TGFβ1 단백질 및 중간엽 줄기세포는 각각 치료학적 유효량으로 제공된다. 일부 실시양태에서, 방법은 HS16, 및/또는 TGFβ1 단백질 및/또는 중간엽 줄기세포의 치료학적 유효량을 HS16, 및/또는 TGFβ1 단백질 및/또는 중간엽 줄기세포 및 약제학적으로 허용가능한 담체, 애주번트 또는 희석제를 포함하는 약제학적 조성물로 제형화하는 단계를 추가로 포함하고, 이 약제학적 조성물은 환자에 투여된다.
본 발명의 다른 측면에서, 생체적합성 임플란트 또는 보철물을 환자의 조직 또는 골절 부위 주변에 외과적으로 이식하는 것을 포함하는, 환자를 치료하는 방법이 제공되고, 상기 임플란트 또는 보철물은 생체물질 및 HS16을 포함한다.
일부 실시양태에서, 임플란트 또는 보철물은 HS16으로 코팅된다. 일부 실시양태에서, 임플란트 또는 보철물은 HS16으로 함침된다. 일부 실시양태에서, 임플란트 또는 보철물은 추가적으로 TGFβ1 단백질 및 중간엽 줄기세포 중 하나 또는 둘 모두로 함침된다.
본 발명의 다른 측면에서, HS16을 포함하는 배양 배지가 제공된다.
본 발명의 또 다른 측면에서, 세포 배양에 있어 HS16의 용도가 제공된다. 본 발명의 관련된 측면에서, 결합 조직의 시험관 내 성장에 있어서 HS16의 용도가 제공된다. 본 발명의 또 다른 관련 측면에서, 중간엽 줄기세포를 외인성으로 추가된 HS16과 접촉시켜 배양하는 것을 포함하는, 시험관 내에서 결합 조직을 성장시키는 방법이 제공된다.
본 발명의 추가 측면에서, 하기 단계를 포함하는, 이러한 치료를 필요로 하는 인간 또는 동물에서 조직, 예컨대 결합 조직의 복구, 대체 또는 재생의 방법이 제공된다:
(i)
중간엽 줄기세포가 조직을 형성하기에 충분한 기간 동안에 HS16과 접촉시키면서 상기 세포를 시험관 내에서 배양하는 단계;
(ii) 상기 조직을 수집하는 단계;
(iii)
상기 조직을 환자에서 복구, 대체 또는 재생하기 위해 손상 또는 질환 부위에 환자의 신체 내로 상기 조직을 이식하는 단계.
조직은 결합 조직, 예컨대, 뼈, 연골, 힘줄, 피부 또는 지방일 수 있다. 일부 실시양태에서, 본 방법은 배양액 중의 중간엽 줄기세포를 외인성 TGFβ1 단백질과 접촉시키는 것을 추가로 포함한다.
본 발명의 다른 측면에서, HS16의 존재하에서 중간엽 줄기세포의 시험관 내 배양에 의해 수득된 조직이 제공된다. 일부 실시양태에서, 조직은 HS16 및 TGFβ1 단백질의 존재하에서 중간엽 줄기세포의 시험관 내 배양에 의해 수득된다.
본 발명의 추가 측면에서, 줄기세포를 HS16과 접촉시켜 배양하는 것을 포함하는, 줄기세포, 예컨대, 중간엽 줄기세포를 배양하는 방법이 제공된다.
본 발명의 일부 측면에서, 헤파란 설페이트 HS16과 접촉시키면서 줄기세포를 시험관 내 배양하는 것을 포함하는, 시험관 내에서 줄기세포를 배양하는 방법이 제공된다. HS16은 바람직하게는 외인성이고 분리되며, 보충제, 예컨대, 배양 배지의 일부로서 추가된다.
본 발명의 또 다른 추가의 측면에서, 기결정된 양의 HS16 및 기결정된 양의 TGFβ1을 포함하는, 부품의 키트가 제공된다. 키트는 기결정된 양의 HS16을 함유하는 제1 용기 및 기결정된 양의 TGFβ1을 함유하는 제2 용기를 포함할 수 있다. 키트는 기결정된 양의 중간엽 줄기세포를 추가로 포함한다. 의학적 치료 방법에 사용하기 위한 키트가 제공될 수 있다. 의학적 치료 방법은 생체 내 상처 치유, 조직, 예컨대 결합 조직 (예를 들어, 연골, 뼈, 힘줄, 인대, 피부, 각막)의 복구 및/또는 재생 방법을 포함할 수 있다. 복구 및/또는 재생은 포유동물 또는 인간에서일 수 있다. 키트는 의학적 치료를 제공하기 위해 개별적으로, 연속적으로 또는 동시에 HS16, TGFβ1 단백질 및/또는 중간엽 줄기세포의 투여를 위한 지침서와 함께 제공될 수 있다.
본 발명의 추가 측면에서, 의학적 치료 방법에서 개별적, 연속적 또는 동시 사용을 위한 하기의 치료학적 유효량을 함유하는 제품이 제공된다:
(i) HS16; 및 하기의 하나 또는 둘 모두
(ii) TGFβ1 단백질;
(iii) 중간엽 줄기세포.
의학적 치료 방법은 생체 내 상처 치유, 결합 조직의 복구 및/또는 재생의 방법을 포함할 수 있다. 복구 및/또는 재생은 포유동물 또는 인간에서일 수 있다. 제품은 선택적으로 동시-투여용 조합 제제로서 제형화될 수 있다.
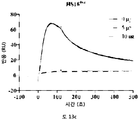
본원에 나타난 바와 같이, HS16은 TGFβ1을 안정화시키고, 그로써 그의 작용을 연장시키는 특성을 갖는다. HS16은 배양 배지에서 TGFβ1이 분해되는 것을 방지한다. 이는 TGFβ1 제제 및 TGFβ1 함유 배양 배지의 제제의 저장에 유용하게 적용될 수 있다.
따라서, 본 발명의 일 측면에서, 성장인자 및 분리된 HS16을 포함하는 조성물이 제공된다. 성장인자는 단백질 성장인자일 수 있고, 바람직하게는 TGFβ1이다. 조성물은 분리된 TGFβ1 및 분리된 HS16을 포함할 수 있다. 일부 실시양태에서, 조성물은 배양 배지일 수 있다. 다른 실시양태에서, 조성물은 TGFβ1을 함유하는 약제학적 조성물 또는 약물일 수 있다.
조성물은 용기 내에 TGFβ1 및 분리된 HS16을 포함하는 TGFβ1 제제일 수 있다. 적합한 용기는 병, 바이알, 튜브 또는 주사기일 수 있다.
성장인자를 분리된 HS16과 접촉시키는 것을 포함하는, 성장인자의 안정성을 증가시키는 방법이 또한 제공된다.
성장인자의 안정성은 그의 반감기, 즉, 소정의 조성물 내에서 성장인자의 절반이 분해되고/되거나 그의 활성을 상실하는데 걸리는 시간의 양에 관하여 측정될 수 있다. 성장인자는 바람직하게는 단백질 성장인자, 더욱 바람직하게는 TGFβ1이다. HS16은 TGFβ1의 반감기를 유지하고 연장시키는 작용을 한다. 본 방법은 분리된 HS16을 시험관 내에서, 예컨대, 성장인자 (예컨대, TGFβ1) 조성물의 제조, 그의 저장 또는 운반의 일부로서, 성장인자 (예컨대, TGFβ1)와 접촉시키는 것을 포함할 수 있다. 대안적으로, 본 방법은, 예컨대, [조직 내에 자연 발생적이거나 조직에 외인성으로 추가된] 성장인자 (예컨대, TGFβ1)가 존재하는 조직에 분리된 HS16을 투여함으로써, 분리된 HS16을 시험관 내에서 성장인자 (예컨대, TGFβ1)와 접촉시키는 것을 포함할 수 있다. 본 방법은 또한 조직에 외인성 성장인자 (예컨대, TGFβ1)를 추가하는 단계를 포함할 수 있다.
분리된 HS16을 함유하는 (또는 그에 분리된 HS16이 첨가되어 있는) 소정의 조성물 또는 조직 내 TGFβ1의 안정성은 HS16을 함유하지 않는 (또는 그에 분리된 HS16이 첨가되어 있지 않은) 상응하는 조성물에 대해 비교될 수 있다. 상기에 기술된 조성물 및 방법에서, HS16은 본원에 기술된 바와 같이 정제될 수 있다. TGFβ1은 분리되고/되거나 정제되고, 비-분리되거나 부분적으로 분리될 수 있으며, 예컨대, 세포외 기질 재료의 일부일 수 있거나, 세포의 조성 내에 존재할 수 있다. 분리 또는 정제된 TGFβ1은 재조합 TGFβ1일 수 있다. 재조합 TGFβ1은 다수의 상업적 제조사로부터 상업적으로 이용가능하다.
일부 측면에서, HS16은 혈액-유래 제품의 생산 동안에 보존 제형 및/또는 방부제로 사용된다. 일부 실시양태에서 혈액-유래 제품에는 혈소판, 혈소판 산물, 혈소판 용해물 및 혈소판-풍부 혈장 (PRP)이 포함된다. 혈액-유래 제품은 혈액 또는 혈청으로부터 분리될 수 있고, 선택적으로 농축되거나 혈액 및/또는 혈청의 다른 성분으로부터 분할될 수 있다.
일부 측면에서, 혈액 유래 산물 및 기결정된 양의 HS16을 포함하는 혈액 유래 산물(들)의 제제가 제공된다. HS16은 바람직하게는 분리되거나 정제된 형태이고 바람직하게는 혈액 유래 산물(들)에 첨가되는, 혈액 유래 산물(들)에 외인성이다. 제제은 HS16이 첨가되어 있는 혈소판 제제, 예컨대, 혈소판, 혈소판 산물, 혈소판 용해물 또는 혈소판-풍부 혈장 (PRP)일 수 있다.
상기에 따르면, 생물학적 물질, 바람직하게는 TGFβ1을 포함하는 생물학적 물질을 보존하는 방법이 제공되고, 이 방법은 생물학적 물질을 기결정된 양의 HS16과 접촉시키는 것을 포함한다. 일부 실시양태에서, 생물학적 물질은 세포성 물질, 조직, 혈액-유래 산물, 세포, 또는 줄기세포로부터 선택될 수 있다.
본 발명의 다른 측면에서, HS16은 줄기세포의 분리 및/또는 가공 동안에 사용하기 위해 제공된다. 일부 실시양태에서, HS16은 줄기세포의 배양 및/또는 증대 동안에 사용하기 위해 제공된다. 따라서, 줄기세포를 기결정된 양의 HS16과 접촉시키는 것을 포함하는, 줄기세포를 분리하고, 가공하고, 배양하거나 증대시키는 방법이 제공될 수 있다. 줄기세포는 선택적으로 TGFβ1을 발현할 수 있다.
선택적으로, 본 발명의 측면 및 실시양태는 문헌 [Manton et al (Journal of Cellular Physiology 209: 219-229 (2006))]에 기술된 바와 같은 HS를 포함하지 않는다.
정의
본 발명자들은 TGFβ1의 헤파린-결합 도메인을 활용하기 위해 서열-기반 친화성 크로마토그래피 플랫폼을 사용하였다. 이는 TGFβ1-결합 헤파란 설페이트 (HS) 분획의 농축을 가능케 하였다.
용어 "황산염 (sulphate)", "황산화된 (sulphated)", 및 "황산화 (sulphation)"는 "황산염 (sulfate)", "황산화된 (sulphated)" 및 "황산화 (sulfation)"와 각각 호환적으로 사용된다.
HS16
본 발명은 HS16으로 불리는 일종의 헤파란 설페이트 분자에 관한 것이다. HS16 분자는 TGFβ1의 헤파린-결합 도메인에 상응하는 폴리펩티드에 결합하는 하나 이상의 글루코사미노글리칸 (GAG)을 함유하는 화합물의 혼합물을 농축하는 방법에 의해 수득 가능하다. 특히, HS16 분자는 아미노산 서열 RKDLGWKWIHEPKGYH를 포함하거나, 이로 이루어진 TGFβ1의 헤파란 결합 도메인에 결합하는 헤파란 설페이트를 농축함으로써 수득될 수 있다. 농축 방법은 HS16을 분리하기 위해 사용될 수 있다.
본 발명은 또한 HS16으로 농축된 화합물의 혼합물, 및 이러한 혼합물을 사용하는 방법에 관한 것이다.
본원에 기술된 방법론에 의해 수득 가능한 것에 추가로, HS16은 또한 기능적 및 구조적으로 정의될 수 있다.
기능적으로, HS16은 아미노산 서열 RKDLGWKWIHEPKGYH (서열번호: 1)을 갖거나, 이로 이루어진 펩티드에 결합할 수 있다. 펩티드는 펩티드의 한쪽 또는 양쪽 말단에 하나 이상의 부가적인 아미노산을 함유할 수 있고, 또는 경우에 따라서 짧은 아미노산 링커 서열 (예컨대, 약 1 내지 5개 아미노산 길이) 및/또는 비오틴과 같은 태그에 부착될 수 있다.
바람직하게는, HS16은 100 Μm 미만, 더욱 바람직하게는 50 μM, 40 μM, 30 μM, 20 μM, 10 μM, 1 μM, 500 nM, 100 nM, 50 nM, 10 nM, 1 nM, 또는 100 pM 중 하나 미만의 KD로 펩티드에 결합한다.
바람직하게는, HS16은 또한 100 μM 미만, 더욱 바람직하게는 50 μM, 40 μM, 30 μM, 20 μM, 10 μM, 1 μM, 500 nM, 100 nM, 50 nM, 10 nM, 1 nM, 또는 100 pM 중 하나 미만의 KD로 TGFβ1 단백질에 결합한다.
HS16과 TGFβ1 단백질 사이의 결합은 하기 분석 방법에 의해 결정될 수 있다.
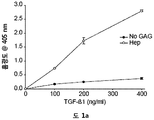
GAG를 각 웰에 고정하고 그 후에 제조사의 지침에 따라서 TGF-β1로 면역성 검사를 하였다(challenged). 간략히는, 3중 (triplicate) 웰을 먼저 표준 분석 완충제 (SAB: 100 mM NaCl, 50 mM 아세트산 나트륨, 0.2% v/v 트윈 20, pH 7.2) 중의 5 μg/ml의 헤파린, HSPM, HS16+ ve 또는 HS16- ve으로 사전-코팅하고, 그 후에 실온에서 밤새 인큐베이션하였다. 다음에 플레이트를 SAB로 3회 세심하게 세척하고, 250 μl의 차단 용액 (0.4% w/v 어피 (fish skin) 젤라틴, Sigma-Aldrich, SAB 중)으로 차단하고 37℃에서 1시간 동안 인큐베이션하였다. TGF-β1을 그 후에 100, 200, 또는 400 ng/ml의 농도로 차단 용액에 용해하였다. 플레이트를 SAB로 3회 세척하고 단백질의 각 희석액 (200 μl)을 3중 웰 내로 분주하고 37℃에서 2시간 동안 인큐베이션하고, SAB으로 세정하고 200 μl의 750 ng/ml 단일클론 마우스 항-TGF-β1 항체 (MAB2401, R&D Systems)를 차단 용액에 첨가하였다. 플레이트를 그 후에 37℃에서 1시간 동안 인큐베이션하고, SAB로 세척하고, 200 μl의 1 μg/ml 다중클론 염소 항-마우스 비오틴화된 항체 (ab6788, Abcam)를 차단 용액에 첨가하였다. 다시, 플레이트를 37℃에서 1시간 동안 인큐베이션하고, SAB로 세척하고, 200 μl의 220 ng/ml ExtrAvidin AP (Sigma-Aldrich)를 차단 용액에 첨가하고, 37℃에서 30분간 인큐베이션한 후, SAB로 세정하였다. 마지막으로, 200 μl의 발색 시약 (SigmaFAST p-니트로페닐 포스페이트, Sigma-Aldrich)을 첨가하고, 37℃에서 40분간 인큐베이션하고, 1시간 이내에 405 nm에서 판독하였다.
이 분석에서, 흡광도를 측정함으로써 결합을 결정할 수 있고 첨가된 헤파란 설페이트 부재의 TGFβ1 단백질, 또는 TGFβ1 단백질에 결합하지 않는 헤파란 설페이트가 첨가된 TGFβ1 단백질과 같은 대조군에 대해 결정될 수 있다.
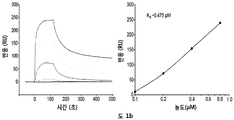
HS16과 TGFβ1의 독특한 상호작용은 표면 플라즈몬 공명 (실험 결과 참조)에 의해, 예컨대, 헤파린, HSPM, HS16+ ve 또는 HS16- ve과의 경쟁 분석에서 분석될 수 있다.
비-특이적 결합과 다르고, HS16이 서열번호: 1과 같은 RKDLGWKWIHEPKGYH를 포함하는 펩티드, 또는 TGFβ1 단백질과 고 친화성 결합 상호작용을 나타내는 헤파란 설페이트의 선별을 포함하는 방법에 의해 다른 헤파란 설페이트 및/또는 GAG로부터 선택될 수 있다는 맥락에서, HS16의 결합은 바람직하게는 특이적이다.
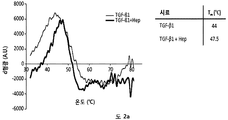
본 발명에 따른 HS16은 바람직하게는 TGFβ1의 열적 안정성을 증강시키고 TGFβ1 시그널링 및 중간엽 줄기세포의 연골발생 분화를 강화한다. HS16은 TGFβ1의 안정화 및/또는 TGFβ1의 분해 방지 및/또는 TGFβ1의 연장이 바람직한 임의의 적용에서 용도를 갖는다. 예를 들어, HS16은 혈소판 산물에서 TGFβ1을 안정화시키기 위한 용도를 갖는다.
헤파린 리아제 I, II 및 III로 완전히 분해한 후 생성된 디사카라이드 단편을 HPLC 분석에 적용하는 경우, HS16의 디사카라이드 조성은 하기를 나타낸다.
본 발명에 따른 HS16은 헤파린 리아제 I, II 및 III로 완전히 분해한 후 생성된 이랑류 단편을 HPLC 분석에 적용함으로써 결정된 바와 같이, HS16 보유 종(HS16+)에 대한 상기 각각의 디사카라이드에 대해 나타난 표준화된 백분율 값의 ±10% (더욱 바람직하게는, ±9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 0.5% 중 하나) 이내의 디사카라이드 조성을 갖는 헤파란 설페이트를 포함한다.
헤파린 리아제 I, II 및 III로 완전히 분해한 후 생성된 디사카라이드 단편을 HPLC 분석에 적용함으로써 결정된 바와 같은, HS16의 디사카라이드 조성은 하기 중 임의의 하나에 따른 디사카라이드 조성을 가질 수 있다:
바람직한 실시양태에서, 열거된 8종의 디사카라이드의 총 중량 퍼센트는 100% (선택적으로 ±3.0% 이하, 또는 ±2.0% 이하, ±1.0% 이하, ±0.5% 이하)이다.
일부 실시양태에서, ΔUA,2SGlcNAc,6S의 표준화된 중량 퍼센트는 상기 프로파일에서와 상이하다. 예를 들어, HS16은, 상이한 표준화된 중량 퍼센트로 존재하거나, 존재하지 않을 수 있는 ΔUA,2SGlcNAc,6S를 제외하고, 상기에 기술된 바와 같은 표준화된 중량 퍼센트로 디사카라이드를 가질 수 있다.
일부 실시양태에서, HS16은 ΔUA,2S-GlcNS,6S, ΔUA,2S-GlcNS, ΔUA-GlcNS,6S, ΔUA-GlcNS, ΔUA,2S-GlcNAc, ΔUA-GlcNAc,6S 및 ΔUA-GlcNAc에 대해 상기 표준화된 중량 퍼센트를 참조하여 정의된다.
헤파린 리아제 효소를 이용한 HS 제제의 분해는 다음과 같이 수행될 수 있다: HS 제제 (1 mg)을 각각 500 μL의 아세트산 나트륨 완충제 (10 mM 칼슘 아세테이트를 함유하는 100 mM, pH 7.0)에 용해시키고 각 2.5 mU의 3종 효소를 첨가하고; 시료 튜브를 부드럽게 뒤집으면서 (9 rpm) 37℃에서 밤새 (24시간) 인큐베이션하고; 추가 2.5 mU의 3종 효소를 각각 시료에 첨가하고 시료 튜브를 부드럽게 뒤집으면서 (9 rpm) 37℃에서 추가 48시간 동안 인큐베이션하고; 가열 (100℃, 5분)에 의해 분해를 중지시킨 후 동결건조하고; 분해물을 500 μL의 물에 재현탁하고 분석을 위해 부분표본 (aliquot) (50 μL)을 취한다.
구체적으로, HS16은 다음과 같이 분해될 수 있다: HSPM, HS16+ ve 및 HS16- ve시료를 물 (1100 μl)에 용해시키고 여과하여 (Minisart RC15, 0.2 μm 주사기 필터 유닛, Sartorius Stedim, #17761) 임의의 미립자 성분을 제거한다. 추가의 세정 (clean-up) 단계로서, 여과된 용액을 원심분리 (4000 rpm, 1시간, 15℃)에 의해 2000 MWCO 막 (Vivaspin 2, Hydrosart, Sartorius Stedim, #VS02H91, 2000 MWCO HY 막, 2 mL 한외여과 스핀 칼럼)을 통과시킨다. 보류물 (retentate)을 물 (3 x 1 ml)로 세척하고, 필터로부터 회수하고 동결건조시킨다. 정제된 HS 시료를 물 (1 mg/ml)에 용해시키고 각 냉동-건조된 시료의 부분표본 (2 x ~1 ml)을 분석을 위해 취한다. HS 시료를, 일부 변형을 포함하지만, 브릭만 등의 방법 [Brickman, Y. G., Ford, M. D., Gallagher, J. T., Nurcombe, V., Bartlett, P. F., and Turnbull, J. E. (1998) J Biol Chem 273, 4350-4359]에 근거한, 헤파린 리아제 효소 (헤파린 리아제 I, II 및 III, Ibex Technologies)의 연속 첨가에 의해 디사카라이드 및 올리고사카라이드로 분해한다. 건식 HS 시료를 분해 완충제 (500 μl; 50 mM 소디움 포스페이트 완충제, pH 7.0)에 재-용해시키고 헤파린 리아제 I (5 μl; 5 mIU)을 각 시료에 첨가한다. 시료를 회전 휠 (rotating wheel, 9 rpm) 위에서 부드럽게 혼합하면서 인큐베이션한다 (37℃, 2시간). 헤파린 리아제 III (5 μl; 5 mIU)를 분해물에 첨가하고 (상기와 같이) 추가 1시간 동안 인큐베이션한다. 헤파린 리아제 II (5 μl; 5 mIU)를 첨가하고 분해물을 상기와 같이 18시간 동안 인큐베이션한다. 마지막으로, 3종의 모든 헤파린 리아제의 부분표본 (5 μl; 5 mIU)을 동시에 첨가하고 분해물을 추가 24시간 동안 인큐베이션한다. 가열 (100℃, 5분)에 의해 효소 분해를 종결한다. 3종의 모든 HS 시료를 2회 반복 분해한다.
일부 실시양태에서, HS16 사슬은 약 12 내지 26개의 사카라이드 단위 (중합도, dp)를 포함한다. 일부 실시양태에서, dp 수는 적어도 12, 적어도 14, 적어도 16, 적어도 18, 적어도 20, 적어도 22, 적어도 24, 또는 적어도 26 중 하나일 수 있다. 선택적으로, 이는 26 미만일 수 있다.
목적하는 크기 범위 (dp로)를 갖는 HS16 사슬의 조성물은 크기 분획화 과정을 HS16에 적용함으로써 제조될 수 있다.
HS16을 동정하기 위하여, 본 발명자들은 헤파린-결합 도메인을 갖는 특정 폴리펩티드에의 결합을 나타내는 글루코사미노글리칸 분자에 대한 농축을 포함하는 방법을 이용하였다. 그 후에 분리된 GAG 혼합물 및/또는 분자가 동정될 수 있고 헤파린-결합 도메인을 함유하는 단백질을 발현하는 세포 및 조직의 성장과 분화를 조절하는 이들의 능력에 대해 시험될 수 있다. 이는 시험관 내 및 생체 내 모두에서, 세포 및 조직의 성장과 분화에 대한 특정 GAG 사카라이드 서열 효과의 제어된 분석을 가능케 한다. 이 방법론은 참조로서 본원에 포함되는 PCT/GB2009/000469 (WO2010/030244)에 기술되어 있다. 본 발명자들은 TGFβ1에 대해 높은 결합능을 갖는 GAG를 분리하고 특성을 분석하기 위해 이 방법론을 TGFβ1에 적용하였다.
따라서, HS16을 동정하기 위하여 본 발명자들은 하기 단계를 포함하는, 헤파린/헤파란-결합 도메인을 갖는 단백질에 결합할 수 있는 글루코사미노글리칸을 분리하는 방법을 제공한다:
(i) 지지체에 부착된, 헤파린-결합 도메인을 포함하는 폴리펩티드 분자를 갖는 고체 지지체를 제공하는 단계;
(ii) 폴리펩티드-글루코사미노글리칸 복합체가 형성되도록 폴리펩티드 분자를 글루코사미노글리칸을 포함하는 혼합물과 접촉시키는 단계;
(iii) 혼합물의 잔여물로부터 폴리펩티드-글루코사미노글리칸 복합체를 분할하는 단계;
(iv) 폴리펩티드-글루코사미노글리칸 복합체로부터 글루코사미노글리칸을 해리하는 단계;
(v) 해리된 글루코사미노글리칸을 수집하는 단계.
본 발명자들은 또한 세포 또는 조직의 성장 또는 분화를 조정하는 이들의 능력에 의해 동정된 분리된 글루코사미노글리칸을 제공한다. 이를 위해, 본 발명자들은 하기 단계를 포함하는, 세포 및/또는 조직의 성장 및/또는 분화를 촉진하거나 억제할 수 있는 글루코사미노글리칸을 동정하는 방법을 제공하였다:
(i) 지지체에 부착된, 헤파린-결합 도메인을 포함하는 폴리펩티드 분자를 갖는 고체 지지체를 제공하는 단계;
(ii) 폴리펩티드-글루코사미노글리칸 복합체가 형성되도록 폴리펩티드 분자와 글루코사미노글리칸을 포함하는 혼합물을 접촉시키는 단계;
(iii) 혼합물의 잔여물로부터 폴리펩티드-글루코사미노글리칸 복합체를 분할하는 단계;
(iv) 폴리펩티드-글루코사미노글리칸 복합체로부터 글루코사미노글리칸을 해리하는 단계;
(v) 해리된 글루코사미노글리칸을 수집하는 단계;
(vi) 수집된 글루코사미노글리칸을 헤파린-결합 도메인의 아미노산 서열을 함유하는 단백질이 존재하는 세포 또는 조직에 첨가하는 단계;
(vii) 세포의 증식, 세포의 분화, 하나 이상의 단백질 마커의 발현 중 하나 이상을 측정하는 단계.
본 발명자들은 TGFβ1에 결합할 수 있는 GAG (HS16으로 명명함)를 동정하기 위해 이들 방법을 이용하였고, 여기서 본 발명자들의 방법론에 사용된 폴리펩티드는 RKDLGWKWIHEPKGYH (서열번호: 1)의 헤파린-결합 도메인을 포함하였다.
본 발명자들의 방법론에서, GAG를 포함하는 혼합물은 합성 글루코사미노글리칸을 함유할 수 있다. 그러나, 세포 또는 조직으로부터 수득된 GAG가 바람직하다. GAG를 포함하는 혼합물은 바람직하게는 HSPM와 같은 헤파란 설페이트 제제가다. 바람직한 실시양태에서, GAG는 헤파란 설페이트이다.
헤파란 설페이트 또는 GAG 성분은 통상의 기술자에게 잘 알려진, 일련의 통상의 분리 단계 (예컨대, 음이온 교환 크로마토그래피)에 의해 조직 또는 세포 시료 또는 추출물로부터 추출될 수 있다.
GAG 혼합물은 덱스트란 설페이트, 콘드로이틴 설페이트 및 헤파란 설페이트를 포함할 수 있는, 상이한 종류의 글루코사미노글리칸의 혼합물을 함유할 수 있다. 바람직하게는, 고체 지지체와 접촉하는 GAG 혼합물은 헤파란 설페이트에 대해 농축된다. 헤파란 설페이트-농축 GAG 분획은 적합한 분획의 선별과 함께, GAG 혼합물에 대해 칼럼 크로마토그래피, 예컨대, 약, 중 또는 강 음이온 교환 크로마토그래피뿐만 아니라 강 음이온 교환 고성능 액체 크로마토그래피 (SAX-HPLC)를 수행함으로써 수득될 수 있다.
수집된 GAG는 GAG를 동정하기 위해, 예컨대, GAG 조성 또는 서열을 결정하거나, GAG의 구조적 특징을 결정하기 위해 추가의 분석에 적용될 수 있다. GAG 구조는 전형적으로 고도로 복잡하고, 현재 이용가능한 분석 기술을 고려할 때, GAG 서열 구조의 정확한 결정은 대부분의 경우에 불가능하다.
그러나, 수집된 GAG 분자는 GAG에 특징적이고 진단적인 사카라이드 단편을 생성하기 위해 부분적 또는 완전한 사카라이드 분해 (예컨대, 아질산에 의해 화학적으로 또는 헤파리나제 III와 같은 리아제를 이용해 효소적으로)에 적용될 수 있다. 구체적으로, 디사카라이드 (또는 테트라사카라이드)를 생성하기 위한 분해는 수득된 각각의 디사카라이드의 비율을 측정하기 위해 사용될 수 있으며 이는 GAG의 특징적인 디사카라이드 "지문 (fingerprint)"을 제공할 것이다.
GAG의 황산화 패턴이 또한 결정될 수 있고 GAG 구조를 결정하기 위해 사용될 수 있다. 예를 들어, 헤파란 설페이트의 경우, 아미노 당류와 C2, C3 및 C6 위치에서의 황산화 패턴은 헤파란 설페이트의 특성을 분석하는데 사용될 수 있다.
디사카라이드 분석, 테트라사카라이드 분석 및 황산화 분석은 GAG에 대해 독특한 스펙트럼을 각각 제공할 수 있는 HPLC, 질량 분석법 및 NMR과 같은 다른 분석적 기법과 함께 사용될 수 있다. 조합하여, 이들 기법은 GAG의 명확한 구조적 특징을 제공할 수 있다.
예를 들어, HSPM (이로부터 HS16이 유래될 수 있음) 및 HS16과 같은 총 HS 제제 대비 HS16의 1H NMR 스펙트럼이 도 7에 나타난다. 본 발명에 따른 HS16은 도 7의 HS16 스펙트럼에 상응하는 1H NMR 스펙트럼을 가질 수 있다.
GAG와 헤파린-결합 도메인 사이의 고 친화성 결합 상호작용은 GAG가 고 친화성 결합 상호작용에 기여하는 특이적 사카라이드 서열을 함유할 것임을 나타낸다. 추가의 단계는 결합 상호작용에 관여하는 GAG의 완전한 또는 부분적 사카라이드 서열, 또는 GAG의 핵심 부분의 결정을 포함할 수 있다.
GAG-폴리펩티드 (예컨대, HS-폴리펩티드) 복합체는 글루코사미노글리칸 사슬을 용해하는 제형, 예컨대, 리아제로의 처리에 적용될 수 있다. 리아제 처리는 폴리펩티드와의 결합 상호작용에 참여하지 않는 결합된 GAG의 일부분을 절단할 수 있다. 폴리펩티드와의 결합 상호작용에 참여하는 GAG의 일부분은 리아제 작용으로부터 보호될 수 있다. 리아제의 제거 후, 예컨대, 세척 단계 후, 폴리펩티드에 결합된 상태로 잔존하는 GAG 분자는 폴리펩티드의 특이적 결합 파트너 ("GAG 리간드")를 나타낸다. 더 짧은 GAG 분자의 더 낮은 복잡성으로 인해, GAG 리간드의 해리 및 수집 후, GAG 리간드의 더 높은 정도의 구조적 특성화가 예상될 수 있다. 예를 들어, 사카라이드 서열 (즉, GAG 리간드 내에 함유된 모노사카라이드의 일차 (선형) 서열), 황산화 패턴, 디사카라이드 및/또는 테트라사카라이드 분해 분석, NMR 스펙트럼, 질량 분석 스펙트럼 및 HPLC 스펙트럼의 임의의 조합이 GAG 리간드의 더 높은 정도의 구조적 특성화를 제공할 수 있다.
본원에 사용된 바와 같이, 용어 "농축하는", "농축", "농축된" 등은 그로 인해 혼합물의 상대적 조성이, 하나 이상의 이들 개체에 의해 주어진 혼합물의 분획은 증가하는 반면, 하나 이상의 다른 개체에 의해 주어진 혼합물의 분획은 감소하는 방식으로 변화하는 과정 (또는 상태)를 기술한다.
농축에 의해 분리된 GAG는 순수할 수 있고, 즉 실질적으로 단 한 종류의 GAG를 함유하거나, 상이한 종류의 GAG의 혼합물인 것으로 계속 진행될 수 있으며, 이 혼합물은 출발 혼합물에 비해 헤파린-결합 도메인에 결합하는 더 높은 비율의 특정 GAG를 갖다.
HS16은 바람직하게는 헤파린-결합 도메인을 함유하는 단백질이 발현되거나 함유된 세포 또는 조직과 접촉할 때 기능적 효과를 발휘한다. 기능적 효과는 조절 또는 강화 효과일 수 있다.
기능적 효과는 특정 유형의 세포의 증식, 또는 한 세포 종류의 다른 종류로의 분화, 또는 하나 이상의 단백질 마커의 발현을 증진 (촉진)시키는 것일 수 있다. 예를 들어, HS16은 줄기세포의 전문화된 세포 유형으로의 분화 (예컨대, 중간엽 줄기세포의 결합 조직으로의 분화)를 촉진할 수 있다.
본원에 사용된 바와 같이, 용어 "조절 효과 (modulating effect)"는 다른 과정 또는 과정들에서 제2 개체의 정상적 기능이 제1 개체의 존재에 의해 변형되는 제2 개체에 대해 제1 개체가 갖는 효과를 의미하는 것으로 이해된다. 조절 효과는 작용성 또는 길항적 중 하나일 수 있다.
조절 효과는 강화 효과일 수 있다. 용어 "강화 효과" (potentiating effect)는 효능을 증가시키는 효과를 의미하는 것으로 이해된다. 본 발명의 바람직한 실시양태에서, 용어 "강화 효과"는 제1 개체가 제2 개체에 갖는 효과를 지칭하는데, 이 효과는 다른 과정 또는 과정들에서 제2 개체의 효능을 증가시킨다. 본 발명의 추가의 바람직한 실시양태에서, 강화 효과는 헤파린-결합 인자에 대한 분리된 GAG의 효과를 의미하는 것으로 이해되고, 여기서 상기 효과는 상기 헤파린-결합 인자의 효능을 증가시킨다.
본원에 사용된 바와 같이, "접촉하는" 과정은 2개 이상의 별개의 개체들의 근접한 물리적 접근을 포함한다. "접촉하는" 과정은 2개 이상의 별개의 개체들의 일부가 분자 수준에서 상호작용하는 것을 허용하기에 충분한 시간 동안 및 조건 하에서 2개 이상의 별개의 개체들의 근접한 물리적 접근을 포함한다. 바람직하게는, 본원에 사용된 바와 같이, "접촉하는" 과정은 하나 이상의 GAG를 포함하는 화합물의 혼합물과 헤파린-결합 인자의 헤파린-결합 도메인에 상응하는 폴리펩티드의 근접한 접근을 초래하는 것을 포함한다. "접촉하는" 과정의 예시는 혼합, 용해, 팽윤, 세척을 포함한다. 바람직한 실시양태에서, GAG 혼합물과 폴리펩티드의 "접촉"은 서로 고 친화성을 나타내는 GAG와 폴리펩티드 사이에, 공유적일 수 있지만 바람직하게는 비-공유적인, 복합체를 형성하기에 충분하다.
폴리펩티드는 헤파린-결합 도메인을 갖는 선택된 단백질의 전장의 또는 거의 전장의 일차 아미노산 서열을 포함할 수 있다. GAG 혼합물로부터 헤파린-결합 도메인의 가능한 차폐 (masking)를 초래하는 더 긴 폴리펩티드에서 일어날 수 있는 중첩으로 인해, 폴리펩티드는 짧은 것이 바람직하다. 바람직하게는, 폴리펩티드는 헤파린-결합 도메인을 포함하거나 이로 이루어지고, 선택적으로 펩티드의 N- 및 C-말단의 하나 또는 각각에 하나 이상의 아미노산을 포함하는 아미노산 서열을 가질 것이다. 이들 부가적인 아미노산은 폴리펩티드를 고체 지지체에 부착시키기 위해 요구되는 폴리펩티드에 링커 또는 부착 분자 (예컨대, 비오틴과 같은 태그)의 첨가를 가능케 할 수 있다.
본 발명자들의 방법론의 바람직한 실시양태에서, 헤파린-결합 도메인 내 아미노산의 수에 추가로, 폴리펩티드는 폴리펩티드의 C- 및/또는 N-말단의 한쪽 또는 양쪽에 1-20개 이하, 더욱 바람직하게는 1-10개, 더 더욱 바람직하게는 1-5개의 부가적인 아미노산, 예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20개 아미노산 중 하나를 함유한다. 일부 실시양태에서, 헤파린-결합 도메인의 아미노산 서열은 폴리펩티드의 아미노산의 적어도 80%, 더욱 바람직하게는 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 하나에 상응한다. 폴리펩티드를 고체 지지체의 표면에 부착시키기 위하여, 폴리펩티드는 분자 태그를 포함하도록 변형되는 것이 바람직하고, 고체 지지체의 표면은 분자 태그에 대해 고 친화성을 갖는 상응하는 분자 프로브를 포함하도록 변형되고, 즉 분자 태그와 프로브는 분자 쌍을 형성한다. 태그 및/또는 프로브는: 항체, 세포 수용체, 리간드, 비오틴, 이들 구조의 임의의 단편 또는 유도체, 전술한 것들의 임의의 조합, 또는 프로브가 그와 결합하거나 다르게는 특이성을 가지고 연합하도록 설계되거나 구상될 수 있는 임의의 다른 구조 중 임의의 하나로부터 선택될 수 있다. 태그와 프로브로 사용하기에 바람직한 결합 쌍은 비오틴과 아비딘이다.
폴리펩티드는, 본 발명의 경우 TGFβ1인, 관심 단백질로부터 유래한다. 폴리펩티드가 관심 단백질 내에 존재하는 헤파린-결합 도메인의 아미노산 서열을 함유하기 때문에, "그로부터 유래한 (derived from)"은 폴리펩티드가 선택되고, 선별되거나 제조되는 것을 의미한다. 헤파린-결합 도메인의 아미노산 서열은, 예컨대, GAG 결합에 대한 헤파린-결합 도메인 서열 내의 변화의 영향을 연구하기 위해, 관심 단백질에서 나타나는 서열로부터 변형될 수 있다.
본 명세서에서, 단백질은 TGFβ1이다. 바람직한 헤파린-결합 도메인의 아미노산 서열은 RKDLGWKWIHEPKGYH (서열번호: 1)이다.
특정 폴리펩티드의 아미노산 서열 내 작은 변화가 해당 부분의 내재적 기능성이 유지되게 할 수 있음이 통상의 기술자에게 이해된다. 또한, 펩티드 내 특정 아미노산 잔기의 등입체적 및/또는 등전적인 다른 아미노산 잔기로의 치환이 비치환된 펩티드의 특정한 특성을 유지시키거나 또는 향상시킬 수 있음이 이해된다. 이들 변화는 또한 본 발명의 범위 내에 포함된다. 예를 들어, 아미노산 알라닌은 때로 펩티드의 하나 이상의 특성을 유지하면서 아미노산 글리신 (및 역으로)으로 치환될 수 있다. 용어 "등입체적 (isosteric)"은 두 개체간의 공간적 유사성을 지칭한다. 온건하게 상승된 온도에서 등입체적인 모이어티의 2가지 예는 이소-프로필 및 터트-부틸 기이다. 용어 "등전적 (isoelectronic)"은 두 개체간의 전기적 유사성을 지칭하고, 두 개체가 동일하거나 유사한 pKa의 기능성을 갖는 경우를 예로 들 수 있다.
헤파린-결합 도메인에 상응하는 폴리펩티드는 합성 또는 재조합일 수 있다.
고체 지지체는 그에 분자가 공유 결합 또는 비-공유 결합 중 하나를 통해서, 직접적으로 또는 간접적으로, 부착될 수 있는 표면을 갖는 임의의 기재일 수 있다. 고체 지지체는 표면에 부착되는 프로브에 대해 물리적 지지력을 제공할 수 있는 임의의 기재 소재를 포함할 수 있다. 이는 매트릭스 지지체일 수 있다. 소재는 일반적으로 분석의 수행 동안 접하게 되는 프로브의 표면에의 부착 및 임의의 후속 처리, 핸들링, 또는 가공 (processing)과 관련된 조건을 견딜 수 있다. 소재는 자연 발생적이거나, 합성 또는 자연 발생적 물질의 변형일 수 있다. 고체 지지체는 플라스틱 소재 (예를 들어, 폴리(비닐 클로라이드), 시클로-올레핀 공중합체, 폴리아크릴아미드, 폴리아크릴레이트, 폴리에틸렌, 폴리프로필렌, 폴리(4-메틸부텐), 폴리스티렌, 폴리메타크릴레이트, 폴리(에틸렌 테레프탈레이트), 폴리테트라플루오로에틸렌 (PTFE 또는 Teflon®), 나일론, 폴리(비닐 부티레이트) 등과 같은 중합체를 포함) 등일 수 있고, 이들 소재 자체가 사용되거나 또는 다른 소재와 함께 사용될 수 있다. 실리카 및, 예를 들어, 생체유리 (Bioglass)로 이용가능한 유리를 추가로 포함하는, 유리와 같은 부가적인 강성 소재 (rigid material)가 고려될 수 있다. 예를 들어, 사용될 수 있는 다른 소재에는 조절된 기공 유리 비드 (controlled pore glass bead)와 같은 기공 소재가 포함된다. 예를 들어, 그의 표면 상에 포함된 임의의 아미노, 카르복실, 티올, 또는 히드록실 관능기와 같이, 하나 이상의 관능기를 가질 수 있는 당업계에 알려진 임의의 다른 소재가 또한 고려될 수 있다.
바람직한 고체 지지체에는 그의 표면 위에 고정된 폴리펩티드를 갖는 칼럼이 포함된다. 표면은 칼럼의 벽일 수 있고/있거나, 칼럼의 중심 공간 내로 패킹된 비드에 의해 제공될 수 있다.
폴리펩티드는 고체 지지체 위에 고정될 수 있다. 고정화 방법의 예시는: 흡착, 공유 결합, 포착 및 막 격리를 포함한다. 본 발명의 바람직한 실시양태에서, 폴리펩티드와 매트릭스 사이의 상호작용은 실질적으로 영구적이다. 본 발명의 추가의 실시양태에서, 펩티드와 매트릭스 사이의 상호작용은 이온-교환 크로마토그래피에 대해 적절히 불활성이다. 바람직한 배열에서, 폴리펩티드는 고체 지지체의 표면에 부착된다. 통상의 기술자가 두 개체를 서로 화학적으로 및/또는 물리적으로 부착하기 위해 선택할 수 있는 다수의 옵션을 가질 수 있음이 이해된다. 이들 옵션은 모두 본 발명의 범위 내에 포함된다. 바람직한 배열에서, 폴리펩티드는 비오틴과 스트렙타비딘의 상호작용을 통해 고체 지지체에 흡착된다. 이 배열의 대표적인 예시에서, 비오틴 분자는 폴리펩티드에 공유적으로 결합되고, 그 위에서 비오틴-폴리펩티드 접합체는 고체 지지체에 공유적으로 결합되어 있는, 스트렙타비딘에 결합한다. 다른 배열에서, 스페이서 또는 링커 모이어티가 비오틴 분자와 폴리펩티드, 및/또는 스트렙타비딘과 매트릭스의 연결에 사용될 수 있다.
GAG 혼합물을 고체 지지체와 접촉시킴으로써 GAG-폴리펩티드 복합체의 형성이 허용된다. 이들은, 고체 지지체로부터 혼합물의 잔여물을 제거함으로써, 예컨대 비-결합 물질을 용출하기 위해 고체 지지체를 세척함으로써 혼합물의 잔여물로부터 분할된다. 칼럼이 고체 지지체로 사용된 경우에는 GAG 혼합물의 비-결합 성분을 칼럼으로부터 용출하여 칼럼에 결합된 GAG-폴리펩티드 복합체를 남겨둘 수 있다.
특정 올리고사카라이드는 비-특이적 방식으로 폴리펩티드와 상호작용할 수 있는 것으로 이해된다. 특정 실시양태에서, 폴리펩티드와 비-특이적 방식으로 상호작용하는 올리고사카라이드는 헤파린-결합 인자의 효과를 조절하는 하나 이상의 GAG로 농축된 화합물의 혼합물 내에 포함되거나 또는 그로부터 배제될 수 있다. 비-특이적 상호작용의 예시는 적절한 크기 및/또는 모양의 분자 포켓 (pocket) 내부에의 일시적인 격리이다. 또한, 이들 올리고사카라이드는 펩티드와 전혀 상호작용을 나타내지 않는 그러한 올리고사카라이드보다 더 느리게 용출될 수 있는 것으로 또한 이해된다. 더욱이 비-특이적으로 결합하는 화합물은 특이적 방식으로 (예를 들어, 이온성 상호작용을 통해) 결합하는 그러한 화합물에 대해서 이들을 용출시키는 동일한 외부 자극의 주입을 요구하지 않을 수 있는 것으로 이해된다. 본 발명자들의 방법론은 올리고사카라이드의 혼합물을 폴리펩티드에 고-친화성 방식으로 결합하는 혼합물의 그러한 성분들; 폴리펩티드에 저-친화성 방식으로 결합하는 성분들; 폴리펩티드에 결합하지 않는 성분들로 분리할 수 있다. 이들 지정은 각각의 GAG-펩티드 쌍에 대해 운영상으로 정의된다.
GAG와 폴리펩티드의 결합이 일어나는 고체 지지체의 표면에 존재하는 조건 (예컨대, 염 농도)을 달리함으로써 헤파린-결합 도메인에 대해 고 친화성 및/또는 특이성을 갖는 그러한 GAG가 선택될 수 있다.
따라서 관심 단백질 및/또는 관심 단백질의 헤파린-결합 도메인에 대해 고 결합 친화성을 갖는 GAG가 수득될 수 있다. 결합 친화성 (Kd)은: 10 μM 미만, 1 μM 미만, 100 nM 미만, 10 nM 미만, 1 nM 미만, 100 pM 미만 중 하나로부터 선택될 수 있다.
기술된 방법에 의해 수득된 HS16은 시험관 내 및/또는 생체 내에서 다양한 적용에 유용할 수 있다. HS16은 시험관 내 세포 또는 조직 배양에서, 또는 생체 내 세포 또는 조직에서 세포 또는 조직의 성장 및/또는 증식 및/또는 분화의 자극 또는 억제에 사용하도록 제공될 수 있다.
HS16은 이러한 목적을 위한 제형로서 제공될 수 있다. 예를 들어, HS16을 포함하는 배양 배지가 제공될 수 있다.
HS16의 존재 하에서 시험관 내 세포 또는 조직 배양으로부터 수득된 세포 또는 조직을 수집하고 치료를 필요로 하는 인간 또는 동물 환자 내로 이식할 수 있다. 따라서, 하기 단계를 포함하는, 세포 및/또는 조직의 이식 방법이 제공된다:
(a) HS16와 접촉시키면서 세포 및/또는 조직을 배양하는 단계;
(b) 세포 및/또는 조직을 수집하는 단계;
(c) 세포 및/또는 조직을 치료를 필요로 하는 인간 또는 동물 개체 내로 이식하는 단계.
세포는 (a) 세포 또는 조직의 성장, 증식 또는 분화를 가능케 하기에 충분한 시간 동안 HS16과 접촉시키면서 어느 정도 배양될 수 있다. 예를 들어, 기간은: 적어도 5일, 적어도 10일, 적어도 20일, 적어도 30일 또는 적어도 40일로부터 선택될 수 있다.
다른 실시양태에서, HS16은 손상 또는 질환의 예방 또는 치료를 비롯한, 의학적 치료 방법에 사용하도록 제형화될 수 있다. HS16 및 약제학적으로 허용가능한 희석제, 담체 또는 애쥬번트를 포함하는 약제학적 조성물 또는 약물이 제공될 수 있다. 이러한 약제학적 조성물 또는 약물이 손상 또는 질환의 예방 또는 치료를 위해 제공될 수 있다. 손상 또는 질환의 예방 또는 치료를 위한 약물의 제조에 있어서 HS16의 용도가 또한 제공된다. 선택적으로, 본 발명에 따른 약제학적 조성물 및 약물은 또한 GAG가 그에 결합하는 헤파린-결합 도메인을 갖는 관심 단백질 (즉, TGFβ1)을 함유할 수 있다. 추가 실시양태에서, 약제학적 조성물 및 약물은 줄기세포, 예컨대, 중간엽 줄기세포를 포함할 수 있다.
손상 또는 질환의 예방 또는 치료는 피부를 비롯한 결합 조직 (예컨대, 뼈, 연골, 근육, 지방, 힘줄, 인대)과 같은 세포 또는 조직의 강화, 복구, 재생 또는 대체를 포함할 수 있다. 조직의 복구를 위해, HS16을 포함하는 약제학적 조성물 또는 약물은, 손상의 복구를 초래하거나 질환 상태를 치유 또는 경감하도록 (예컨대, 이의 증상의 완화를 제공하도록) 새로운 조직의 성장, 증식 및/또는 분화를 자극하기 위해 손상 또는 질환의 부위에 직접적으로 투여될 수 있다. 조직의 복구 또는 재생은 약제학적 조성물 또는 약물에 줄기세포를 조합함으로써 향상될 수 있다.
일부 용도는 피부의 복구 또는 재생 (rejuvenation)의 일부로서 피부에 HS16의 적용을 포함할 수 있다. 이는 피부 장벽의 복구 및/또는 재생, 및/또는 피부 외형의 개선을 포함하는, 치료적 및/또는 미용적 적용일 수 있다. 예를 들어, HS16은 화상 또는 다른 상처의 외형을 복구, 재생 및/또는 개선하기 위해 피부에 적용될 수 있다.
조직의 대체를 위해, 환자 내 손상 또는 질환 부위에의 이식을 위한 세포 및/또는 조직을 생성하도록 HS16을 세포 및/또는 조직의 시험관 내 배양 동안 세포 및/또는 조직과 접촉시킬 수 있다. 세포 또는 조직의 이식은 손상되거나 이환된 조직의 대체에 의해 환자에서 손상되거나 이환된 조직의 복구를 초래하도록 사용될 수 있다. 이는 손상된/이환된 조직의 제거 및 HS16과 접촉하면서 세포 및/또는 조직의 배양에 의해 제조된 새로운 조직의 이식을 포함할 수 있다.
따라서, 본 발명에 따른 약제학적 및 미용적 조성물 및 약물은 하기 중 하나를 포함할 수 있다:
(a) HS16;
(b) 줄기세포와 조합한 HS16;
(c) HS16에 의해 결합된 헤파린-결합 도메인 (예컨대, RKDLGWKWIHEPKGYH)을 함유하는 단백질과 조합한 HS16;
(d) 줄기세포 및 HS16에 의해 결합된 헤파린-결합 도메인 (예컨대, RKDLGWKWIHEPKGYH)을 함유하는 단백질과 조합한 HS16;
(e) HS16과 접촉하는 세포 또는 조직의 배양액으로부터 수득된 조직 또는 세포.
HS16은 신체 조직, 특히 결합 조직의 복구 또는 재생에 사용될 수 있다. 따라서, HS16은 결합 조직에서/에 대한 광범위한 질환 및 손상을 예방 또는 치료하기 위해 사용될 수 있다.
조직의 복구, 재생 또는 대체에 있어 HS16의 용도는 상처 치유, 예컨대, 상처 치유의 촉진, 흉터 또는 골 조직의 치유 및 조직 이식에의 용도를 포함할 수 있다.
일부 측면에서, 본 발명은 HS16의 투여를 포함하는 미용적 처치에 관한 것이다. "미용적"은, 본원에 사용된 바와 같이, 비-치료적이다. 미용적 처치는 피부의 외형 및/또는 감촉을 개선하는데 사용될 수 있다.
일부 측면에서, 본 발명은 HS16의 투여를 포함하는 미용적 처치 방법에 관한 것이다. 본원에 사용된 바와 같이, 용어 "미용적 방법"은 수술 또는 요법에 의해 인간 또는 동물 신체의 치료 방법, 또는 조항 53(c) EPC에 따른 인간 또는 동물 신체에 대해 실시되는 진단적 방법을 포함하지 않는다. 미용적 방법에서, 개체는 HS16의 치료적 투여를 요구하지 않는다.
본 발명은 또한 HS16을 포함하는 미용적 조성물을 제공한다. 조성물은 피부의 외형을 개선하기 위해 사용될 수 있다. 미용적 조성물은 하기에 기술되는 바와 같이, 약제학적 조성물과 유사하게 제형화될 수 있다. HS16의 미용적 유효량, 즉, 미용적 이익을 유도하기에 효과적인 양의 HS16이 개체에 투여될 수 있다. 이는 활성 화합물 또는 활성 화합물을 함유하는 조성물의 적합한 용량이 개체에 따라서 달라질 수 있음을 인식하게 될 관련 전문가의 합리적인 판단 범위 내이다.
다른 측면에서, 본 발명은 HS16을 포함하는 생물학적 스캐폴드를 제공한다. 일부 실시양태에서, 본 발명의 생물학적 스캐폴드는 정형외과, 혈관, 보철, 피부 및 각막 적용에 사용될 수 있다. 본 발명에 의해 제공되는 생물학적 스캐폴드는 연장-방출 약물 전달 장치, 조직 밸브, 조직 밸브 리플릿 (leaflets), 약물-용출 스텐트, 혈관 이식편, 상처 치유 또는 피부 이식편 및 뼈, 인대, 힘줄, 및 연골과 같은 정형외과적 보철물을 포함한다.
본 발명의 다른 측면에서, 조직의 재생 또는 복구에 사용하기 위한 키트가 제공되고, 상기 키트는 (i) 기결정된 양의 HS16, 및 (ii) 기결정된 양의 TGFβ1을 포함한다.
HS16은 이의 약제학적으로 허용가능한 염으로서 개체에 투여될 수 있다. 예를 들어, 본 발명의 농축된 혼합물의 화합물의 염기성 염에는, 이로 제한되는 것은 아니지만, 나트륨, 칼륨, 리튬, 칼슘, 마그네슘, 암모늄 및 알킬암모늄과 같은 약제학적으로 허용가능한 양이온으로 형성된 것들이 포함된다. 본 발명은 그위 범위 내에 나트륨 염 또는 칼륨 염과 같은 양이온성 염을 포함한다.
카르복실산 기를 보유하는 본 발명의 화합물은, 산 모이어티가 (형태 -CO2R'을 갖도록) 에스테르화된, 투여가능한 전구약물의 형태로 전달될 수 있음이 이해될 것이다. 구체적으로 용어 "전구-약물"은 생체 내에서 -OR' 기의 -OH 기로의 전환, 또는 그로부터의 카르복실레이트 음이온으로의 전환에 관한 것이다. 따라서, 본 발명의 전구약물은 약물 흡수 및/또는 세포 내로의 약물 전달을 증강시키도록 작용할 수 있다. 전구약물의 생체 내 전환은 리파제 및 에스터라제와 같은 세포성 효소에 의해 또는 생체 내 에스테르 가수분해와 같은 화학적 절단에 의해 촉진될 수 있다.
본 발명의 측면에 따른 약물 및 약제학적 및 미용적 조성물은, 이로 제한되는 것은 아니지만, 질환 또는 손상 부위에의 주입을 비롯해, 다양한 경로에 의한 투여를 위해 제형화될 수 있다. 약물 및 조성물은 유체 또는 고체 형태로 제형화될 수 있다. 유체 제형은 인간 또는 동물 신체의 선택된 영역으로의 주입에 의한 투여용으로 제형화될 수 있다.
투여는 개인에게 이익을 나타내기에 충분한 "치료학적 유효량"으로 이루어질 수 있다. 투여되는 실제 양, 및 투여의 속도 및 시간적 경과는 치료되는 손상 또는 질환의 성질 및 중증도에 좌우될 것이다. 치료의 처방, 예컨대, 용량에 대한 결정 등은 일반 개업의 및 다른 의사의 책임 범위 내이고, 전형적으로 치료되는 장애, 개인 환자의 상태, 전달 부위, 투여 방법 및 전문의에게 공지된 기타 요인들을 고려한다. 상기에 언급된 기법 및 프로토콜의 예시는 문헌 [Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins]에서 확인할 수 있다.
줄기세포
HS16과 접촉되는 세포는 줄기세포를 포함한다.
HS16은 줄기세포의 증식 및/또는 분화, 및/또는 줄기세포의 계통-위임 (lineage-commitment)에 사용될 수 있다.
본원에서 배양되고 기술된 줄기세포는 임의의 종류의 줄기세포일 수 있다. 이들은 전능성 (totipotent), 만능성 (pluripotent) 또는 다능성 (multipotent)일 수 있다. 이들은 배아 또는 임의의 조직으로부터의 성체 줄기세포일 수 있고 조혈 줄기세포, 신경 줄기세포 또는 중간엽 줄기세포일 수 있다. 바람직하게는, 이들은 성체 줄기세포이다.
본 명세서에서, 줄기세포는 분열 능력을 갖고 (즉, 자가-재생) 전능성, 만능성 또는 다능성을 유지하며 특성화된 세포를 초래하는 임의의 세포 유형을 의미한다.
본 발명에서 배양된 줄기세포는 기존 배양액으로부터 또는 혈액, 뼈, 골수, 피부, 상피 또는 제대 (통상적으로 버려지는 조직)를 비롯한 임의의 성체, 배아 또는 태아 조직으로부터 직접적으로 수득되거나 유래될 수 있다.
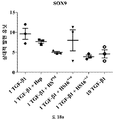
줄기세포의 다능성은 적절한 분석의 사용에 의해 결정될 수 있다. 이러한 분석은 하나 이상의 다능성 마커, 예컨대, 알칼라인 포스파타제 활성의 검출, RUNX2, 오스테릭스 (osterix), 콜라겐 I, II, IV, VII, X, 오스테오폰틴 (osteopontin), 오스테오칼신 (osteocalcin), BSPII, 어그리칸 (aggrecan), ALBP, CCAAT/인핸서 결합 단백질-α (C/EBPα), 지방세포 지질-결합 단백질 (ALBP), 알칼라인 포스파타제 (ALP), 뼈 시알로단백질 2, (BSPII), 콜라겐2a1 (COL2A1) 및 SOX9의 검출을 포함할 수 있다.
일부 바람직한 실시양태에서, 줄기세포는 결합 조직 및/또는 연골세포, 조골세포, 근세포 및 지방세포와 같은 골세포로 분화할 수 있는 중간엽 줄기세포 (MSC)이다.
중간엽 줄기세포는 최소한의 침습적 기법에 의해 골수로부터 용이하게 수득 가능하고 배양액 중에서 증대될 수 있으며, 목적하는 계통으로의 분화가 허용될 수 있다. 분화는 특정 성장인자의 적용에 의해 유도될 수 있다. 골 형태형성 단백질 (BMPs)과 같은 전환 성장인자 베타 (TGF-베타) 슈퍼패밀리 멤버 단백질은 중간엽 줄기세포의 연골발생 및 골형성 분화의 중요 인자이다.
중간엽 줄기세포는 CD34+ 분획으로부터 골수 재증식에 대한 이들의 잠재력을 나타내는 STRO-I과 같은 선택적 마커를 사용하여 분리되고 검출될 수 있다. 이들 세포 표면 마커는 중간엽 줄기세포의 세포 표면에서만 발견되고 세포의 다능성의 표시이다.
적합한 중간엽 줄기세포는 골수 (예컨대, Wexler et al. Adult bone marrow is a rich source of human mesenchymal 'stem' cells but umbilical cord and mobilized adult blood are not. HAEMOPOIESIS AND LEUCOCYTES British Journal of Haematology 121(2):368-374, April 2003) 또는 제대혈의 워튼 젤리 (Wharton's Jelly of the umbilical cord) (예컨대, Ta et al. Long-term Expansion and Pluripotent Marker Array Analysis of Wharton's Jelly-Derived Mesenchymal Stem Cells. Stem Cells Dev . 2009 July 20 (Epub))의 흡인으로부터 수집된 골수 단핵구 세포 (BMMNC)로부터 수득되거나 유래할 수 있다.
중간엽 줄기세포는 당해 분야에 잘 알려진 바와 같이, 적합한 분화 인자의 적용에 의해, 인간 배아 줄기세포와 같은 만능 줄기세포 또는 유도 만능 줄기세포의 분화에 의해 수득될 수 있다.
중간엽 줄기세포는 연골, 뼈, 근육, 힘줄, 인대, 및 지방의 성분을 생성하는 능력을 갖는 다능성 전구세포이다. 이들 원시 전구세포는 출생 후에 존재하고 줄기세포 특성, 즉 낮은 발생률 및 광범위한 재생 잠재성을 나타낸다. 이들의 발달 유연성과 조합하여 이들 특성은 손상된 조직을 대체하기 위한 이들의 잠재적 용도에 있어 엄청난 이익을 생성하고 있다. 본질적으로 이들 줄기세포는 이들의 수를 증대시키도록 배양된 후 손상된 부위에 이식되거나 스캐폴드 내/위에 접종된 후 적합한 조직 구조물을 생성하도록 배양될 수 있다.
따라서, 골격, 근육, 힘줄, 인대 및 혈액의 복구/재생을 위한 대안적인 접근법은, 특이적 조직 성장인자의 신중한 선택과 함께 재생을 지지하고 안내하기 위한 전도성 또는 유도성 스캐폴드와 조합된, 적합한 전구세포 (예컨대, 중간엽 줄기세포, 연골세포)의 선택, 증대 및 조절이다.
줄기세포는 임의의 동물 또는 인간, 예컨대, 비-인간 동물, 예컨대, 토끼, 기니아 피그, 래트, 마우스 또는 기타 설치류 (설치류 목 내 임의의 동물로부터의 세포 포함), 고양이, 개, 돼지, 양, 염소, 소, 말, 비-인간 영장류 또는 기타 비-인간 척추동물 유기체; 및/또는 비-인간 포유동물; 및/또는 인간으로부터 수득될 수 있다. 바람직하게는, 이들은 인간이다. 선택적으로 이들은 비-인간이다. 선택적으로 이들은 비-배아 줄기세포이다. 선택적으로 이들은 비-전능성이다.
본 발명의 또 다른 측면에서, 본 발명의 임의의 방법에 의해 생성된 줄기세포 또는 다른 세포, 또는 이의 단편 또는 산물을 포함하는 약제학적 조성물이 제공된다. 약제학적 조성물은 의학적 치료 방법에 유용할 수 있다. 적합한 약제학적 조성물은 약제학적으로 허용가능한 담체, 애주번트 또는 희석제를 추가로 포함할 수 있다.
본 발명의 다른 측면에서, 본 발명의 임의의 방법에 의해 생성된 줄기세포 또는 다른 세포는 의학적 치료 방법에 사용될 수 있고, 바람직하게는, 상기 약물 또는 약제학적 조성물의 치료학적 유효량을 치료를 필요로 하는 개인에게 투여하는 단계를 포함하는 의학적 치료 방법이 제공된다.
본 발명에 따른 배양 방법 및 기법을 통해 수득된 줄기세포 및 다른 세포는 의학적 치료 방법에 사용하기 위한 또 다른 세포 유형으로의 분화에 사용될 수 있다. 따라서, 분화된 세포 유형은 기술된 배양 방법 및 기법에 의해 수득된, 그후에 분화하도록 허용되었던, 줄기세포로부터 유래될 수 있고, 이의 산물로서 고려될 수 있다. 선택적으로 약제학적으로 허용가능한 담체, 애주번트 또는 희석제와 함께 이러한 분화된 세포를 포함하는 약제학적 조성물이 제공될 수 있다. 이러한 약제학적 조성물은 의학적 치료 방법에 유용할 수 있다.
중간엽 줄기세포
중간엽 줄기세포 (MSC)는 원래 골수로부터 분리되었고 104-105개의 총 골수 단핵구 세포 (BMMNC) 중 단 1개로서 존재한다 (Friedenstein et al. 1966). 이들 세포는, CFU-F (콜로니 형성 단위 섬유모세포) 집단이라고도 불리는, 단일 세포 전구체로부터 유래된 콜로니를 생산할 수 있다. MSC는 현재 지방 조직 (Gimble and Guilak 2003; Zuk et al. 2001), 제대혈 (Bieback et al. 2004; Erices et al. 2000; Goodwin et al. 2001; Kogler et al. 2004; Wagner et al. 2005) 및 근육 (Jiang et al. 2002)을 비롯한 많은 다른 조직에서 동정되어 있다.
다능성 인간 중간엽 기질세포 (MSC)에 대한 최소한의 기준이 국제세포치료협회 (International Society for Cellular Therapy)에 의해 설정되어 있다 (Dominici et al Cytotherapy (2006) Vol. 8, No. 4, 315-317). 이들은 인간 MSC를 정의하기 위한 3가지 기준을 제안한다: 플라스틱에 대한 부착, 특이적 표면 항원 발현 및 다능성 분화능. 특히, 이들은 "첫째, MSC는 조직 배양 플라스크를 사용한 표준 배양 조건에서 유지될 때 플라스틱-부착성이어야 한다. 둘째, MSC 집단의 ≥95%가 유세포분석에 의해 측정되는 바와 같이, CD105, CD73 및 CD90을 발현해야만 한다. 추가적으로, 이들 세포는 CD45, CD34, CD14 또는 CD11b, CD79α 또는 CD19 및 HLA 클래스 II (HLA-DR)의 발현을 결여해야 (≤2% 양성) 한다. 셋째, 세포는 시험관 내 표준 분화 조건에서 조골세포, 지방세포 및 연조골세포로 분화할 수 있어야 한다."고 진술한다.
Dominici 등은, 대부분 MSC를 독특하게 동정하는 생물학적 특성이 시험관 내 표준 조직 배양-분화 조건하에서 조골세포, 지방세포 및 연조골세포로의 3중-계통 (trilineage) 중간엽 분화에 대한 이들의 능력임을 또한 진술한다. 이들은, 조골세포로의 분화가 알리자린 레드 (Alizarin red) 또는 폰 코사 (von Kossa) 염색을 이용한 염색에 의해 입증될 수 있으며, 지방세포 분화가 오일 레드 O (Oil red O)를 이용한 염색에 의해 가장 용이하게 입증될 수 있고 연조골세포 분화가 알시안 블루 (Alcian blue)를 이용한 염색 또는 콜라쥬 (collage) 타입 II에 대한 면역조직화학적 염색에 의해 입증될 수 있음을 확인하였다. Dominici 등은 이러한 분석을 위한 키트가 상업적으로 이용가능하고 분화의 입증이 모든 연구자들에게 실현 가능해야 함을 진술한다.
Dominici 등은 또한 인간 MSC를 정의하는데 사용될 수도 있는 신규한 표면 마커가 미래에 동정될 수 있는 것임을 인식한다. 3종의 이러한 마커가 현재 알려져 있다: CD49a, SSEA-4 및 STRO-1.
Rider 등은 CD49a+ 클론이 비선별 세포에 비해 CD90 및 CD105의 증강된 발현을 나타내었음을 보고하였고, CD49a+ 클론이 비선별 세포에 비해 지방, 뼈 및 연골로의 다중계통 분화가 용이하게 진행되었음을 입증하였으며, 이는 중간엽 줄기세포의 농축을 위한 알파-1 인테그린 (CD49a) 선별의 용도를 지지하고, 골수 단핵구 줄기세포의 이종 풀 (heterogenous pool)로부터 대부분의 다능성 세포를 선별하는 전략을 제공하였다 (Rider et al. J. Mol. Hist (2007) 38: 449-458). Rider 등은 또한, CFU-F 세포가 CD49a의 발현과 연관되어 있고, CD49a 발현 CFU-F 세포 역시 STRO-1을 동시-발현하며, 농축을 위한 보존적 마커일 수 있음을 나타내는, CD49a가 인간에 더하여 래트 및 마우스로부터 MSC를 분리하는데 사용될 수 있음을 보고한다.
Gang 등은, 일반적으로 미분화된 만능성 인간 배아 줄기세포 및 포배 (blastocyst) 단계 배아로의 절단에 대한 마커로서 사용되는 단계 특이적 배아 항원 SSEA-4가 또한 성체 인간 중간엽 줄기세포 집단을 동정하고 MSC를 분리하는데 사용될 수 있음을 보고한다 (Gang et al., Blood 2007; 109:1743-1751).
Gang 등은 또한 클론원성 기질세포 (CFU-F)의 농축 시 표면 마커 STRO-1, 소위 STRO-1+bright에 결합하는 단일클론 항체의 용도를 기술한다.
글루코사미노글리칸
본원에 사용된 바와 같이, 용어 "글루코사미노글리칸" 및 "GAG"는 상호호환적으로 사용되고 올리고사카라이드를 포함하는 분자들의 거대 집합을 지칭하는 것으로 이해되며, 여기서 사카라이드와 결합한 것들의 하나 이상은 아미노 치환, 또는 이의 유도체를 보유한다. GAG의 예시는 콘드로이틴 설페이트, 케라탄 설페이트, 헤파린, 데르마탄 설페이트, 히알루로네이트 및 헤파란 설페이트이다.
본원에 사용된 바와 같이, 용어 "GAG"는 또한 GAG 컨쥬게이트인 그러한 분자를 포함하도록 확장된다. GAG 컨쥬게이트의 예시는 펩티드 성분이 올리고사카라이드 성분에 공유적으로 결합된 프로테오글루코사미노글리칸 (PGAG, 프로테오글리칸)이다.
바람직한 실시양태에서 GAG는 헤파란 설페이트이다.
헤파란 설페이트 (HS)
헤파란 설페이트 프로테오글리칸 (HSPGs)은 프로테오글리칸의 매우 다양한 아집단을 대표하고 단백질 골격에 공유적으로 부착된 헤파란 설페이트 글루코사미노글리칸 측쇄로 구성된다. 코어 단백질은 3종의 주요 형태로 존재한다: 페르리칸 (perlecan)으로 공지된 분비된 형태, 글리피칸 (glypican)으로 알려진 원형질막 내 정착된 형태, 및 신데칸 (syndecan)으로 알려진 막횡단 형태. 이들은 포유동물 세포 표면에 편재하는 구성요소이고 대부분 세포외 기질이다. 아그린 (agrin)과 같은 다른 단백질, 또는 HS 사슬이 덜 일반적으로 발견되는 코어에 부착될 수 있는, 아밀로이드 전구체 단백질이 있다.
본 발명의 바람직한 실시양태는 이들의 코어 단백질로부터 분리된 HS 사슬을 고려한다. HS 사슬은 단백질, 예컨대, 뉴라미다제 (neuramidase) 처리에 의해 코어 단백질로부터 용이하게 구분되고 분리될 수 있다.
"헤파란 설페이트" ("heparan sulfate" 또는 "HS")는 원래 D-글루쿠론산 (GIcA) 및 N-아세틸-D-글루코사민 (GIcNAc)의 일렬 반복으로 이루어진 폴리사카라이드로서 골지체 내에서 합성된다. 초기의 폴리사카라이드는 그 후에 일련의 단계에서 변형될 수 있다: GIcNAc의 N-탈아세틸화/N-황산화, GIcA의 이듀론산 (IdoA)으로의 C5 에피머화, IdoA 및 GIcA의 C2에서의 O-황산화, N-설포글루코사민 (GIcNS)의 C6에서의 O-황산화 및 GIcNS의 C3에서의 드문 O-황산화. HS의 N-탈아세틸화/N-황산화, 2-O-, 6-O- 및 3-O-황산화는 각각 HS N-디아세틸라제/N-설포트랜스퍼라제 (HSNDST), HS 2-O-설포트랜스퍼라제 (HS2ST), HS 6-O-설포트랜스퍼라제 (HS6ST) 및 HS 3-O-설포트랜스퍼라제의 특이적 작용에 의해 매개된다. 각각의 변형 단계에서, 잠재적 기질의 분획만이 변형되어, 상당한 서열 다양성을 초래한다. HS의 이러한 구조적 복합성은 그의 서열을 결정하고 HS 구조와 기능 사이의 관계를 이해하는 것을 어렵게 만들고 있다.
헤파란 설페이트 측쇄는 (1 -> 4) 글리코시드 결합을 통해 연결된, 교대로 배열된 D-글루쿠론산 또는 L-이듀론산 및 D-글루코사민으로 이루어진다. 글루코사민은 종종 N-아세틸화되거나 N-황산화되고 우론산 및 글루코사민 둘 모두 추가적으로 O-황산화될 수 있다. 특정 결합 파트너에 대한 특정 HSPG의 특이성은 글루코사민과 우론산에 부착된 카르복실, 아세틸 및 설페이트 기의 특이적 패턴에 의해 생성된다. 헤파린과 달리, 헤파란 설페이트는 더 적은 N- 및 O-설페이트 기와 더 많은 N-아세틸 기를 함유한다. 헤파란 설페이트 측쇄는 테트라사카라이드 연결 (-글루쿠로노실-β-(1→3)-갈락토실-β-(1→3)-갈락토실-β-(1→4)-크실로실-β-1-O-(세린)) 영역을 통해 코어 단백질의 세린 잔기에 연결된다.
헤파란 설페이트 사슬 및 코어 단백질 둘 모두는 이들의 생물학적 활성에 궁극적으로 영향을 미칠 수 있는 일련의 변형을 거칠 수 있다. HS의 복잡도는 핵산의 복잡도를 능가하는 것으로 고려되고 있다 (Lindahl et al, 1998, J. Biol. Chem. 273, 24979; Sugahara and Kitagawa, 2000, Curr. Opin. Struct. Biol. 10, 518). HS 종 내 변화는 N-아세틸화 글루코사민을 함유하는 디사카라이드의 비황산화된 영역에 의해 분리되는 당 잔기의 비-무작위의, 고도로 황산화된 서열의 합성으로부터 발생한다. N-아세틸글루코사민의 N-설포글루코사민으로의 초기 전환은 글루쿠론산의 이듀론산으로의 에피머화 및 글루코사민 또는 이듀론산에 대한 O-황산화의 복잡한 패턴을 비롯해, 다른 변형에 대한 주의를 집중시킨다. 또한, 비-변형되고, 저 황산화되고, N-아세틸화된 서열 내에서, 헥스우로네이트 (hexuronate) 잔기는 글루쿠로네이트 상태로 남는 반면, 고도로 황산화된 N-황산화된 영역에서는, C-5 에피머 이듀로네이트가 우세하다. 이는 각각의 양 (abundance)이 아닌 임의의 소정의 사슬에서 가능한 잠재적 디사카라이드 변형체의 수를 제한한다. 대부분은 변형은 N-황산화된 도메인 내, 또는 이들에 바로 인접하여 일어나고, 그로써 성숙한 사슬에서 저 황산화 도메인에 의해 구분된 고 황산화의 영역이 존재한다 (Brickman et al. (1998), J. Biol. Chem. 273(8), 4350-4359, 이는 본원에서 그 전체가 참조로서 포함됨).
매우 다양한 헤파란 설페이트 사슬이, 자가분비, 근접분비 (juxtacrine) 및 주변분비 피드백 루프의 복잡한 조합을 통해, 세포에 대한 성장 및 부착 인자의 조절 및 제시를 비롯해, 다수의 세포외 리간드의 작용의 조절에 핵심적인 역할을 담당하고, 그로써 세포 내 시그널링 및 줄기세포의 분화를 제어하는 것으로 가정한다. 예를 들어, 헤파란 설페이트 글루코사미노글리칸이 유전적으로 기술될 수 있다고 하더라도 (Alberts et al. (1989) Garland Publishing, Inc, New York & London, pp. 804 and 805), 단일 공급원으로부터 분리된 헤파란 설페이트 글루코사미노글리칸 종은 생물학적 활성이 다를 수 있다. 문헌 [Brickman et al, 1998, Glycobiology 8, 463]에 기술된 바와 같이, 신경상피 세포로부터 수득된 헤파란 설페이트 글루코사미노글리칸의 2종의 별도의 풀 (pools)이 분열촉진 (mitogenic) 상태에 따라서, FGF-1 또는 FGF-2 중 하나를 특이적으로 활성화할 수 있다. 유사하게, FGF-1 또는 FGF-2 중 하나와 상호작용하는 헤파란 설페이트 (HS)의 능력이 WO 96/23003에 기술되어 있다. 이 특허 출원에 따르면, FGF-1과 상호작용할 수 있는 각각의 HS는 약 11일 내지 약 13일의 배아기에 있는 생쥐 세포로부터 수득될 수 있는 반면, FGF-2와 상호작용할 수 있는 HS는 약 8일 내지 약 10일의 배아기에서 수득 가능하다.
상기에 언급된 바와 같이, HS 구조는 HS간에 고도로 복잡하고 다양하다. 실제로, HS 구조에서의 변화는 세포 성장을 촉진하고 세포 분화를 지시함에 있어 각각의 HS의 상이한 활성에 대해 기여하는데 중요한 역할을 하는 것으로 고려된다. 구조적 복잡도는 핵산의 복잡도를 능가하는 것으로 고려되고, HS 구조가 현재로서는 특이적이고 독특한 황산화 패턴을 갖는 반복적인 디사카라이드 단위 서열로서 특정될 수 있다고 하더라도 핵산 서열분석에 이용가능한 기법과 동등한 어떠한 표준 서열분석 기법도 HS 서열 구조를 결정하는데 이용할 수 없었다. 명확한 HS 서열 구조를 결정하기 위한 단순한 방법의 부재하에서 HS 분자는 다수의 분석적 기법을 이용해 당해 분야의 기술자에 의해 명백하게 동정되고 구조적으로 특정된다. 이들은 디사카라이드 분석, 테트라사카라이드 분석, HPLC 및 분자량 결정의 하나 또는 이들의 조합을 포함한다. 이들 분석적 기법은 당해 분야의 기술자에게 잘 알려져 있고 그들에 의해 사용된다.
HS로부터 디- 및 테트라-사카라이드의 생산을 위한 2종의 기법에는 아질산 분해 및 리아제 분해가 포함된다. 이들 분해 기법을 실시하는 하나의 방식의 서술이 하기에 제공되고, 순전히 예시적으로, 이러한 서술은 본 발명을 제한하지 않는다.
아질산 분해
헤파란 설페이트의 아질산 계 해중합 (depolymerisation)은 완료되었을 때 그의 개별적인 디사카라이드 성분으로의 탄수화물 사슬의 궁극적인 분해를 초래한다.
예를 들어, 아질산은 250 ㎕의 0.5 M H2SO4 및 0.5 M Ba(NO2)2를 각각 얼음 중에서 15분간 냉각시켜 준비할 수 있다. 냉각 후, Ba(NO2)2를 H2SO4와 조합하고 볼텍싱 후 원심분리하여 바륨 설페이트 침전물을 제거한다. 125 ㎕의 HNO2를 20 ㎕의 H2O에 재현탁된 GAG 시료에 첨가하고, 볼텍싱 후 간간이 혼합하면서 25℃에서 15분간 인큐베이션하였다. 인큐베이션 후, 1 M Na2CO3를 시료에 첨가하여 pH가 6이 되게 하였다. 이어서, 0.1 M NaOH 중의 100 ㎕의 0.25 M NaBH4를 시료에 첨가하고 혼합물을 50℃로 20분간 가열하였다. 혼합물을 그 후에 25℃로 냉각시키고 산성화된 빙초산을 첨가하여 시료의 pH를 3으로 맞추었다. 그 후에 혼합물을 10 M NaOH로 중화시키고 부피를 동결 건조에 의해 감소시켰다. 최종 시료를 디- 및 테트라사카라이드를 분리하기 위해 Bio-Gel P-2 칼럼 상에서 런닝하여 분해 정도를 확인한다.
리아제 분해
헤파리나제 III은 글루쿠로니드 연결에서 당쇄를 절단한다. 일련의 헤파리나제 효소 (I, II 및 III)는 각각 특정의 황산화 인식 부위에서 특정의 헤파란 설페이트 서열을 해중합함으로써 상대적으로 특이적인 활성을 보여준다. 헤파리나제 I은 HS 사슬을 따라서 NS 영역을 갖는 HS 사슬을 절단한다. 이는 황산화된 도메인의 파괴를 초래한다. 헤파리나제 III은 NA 도메인을 갖는 HS를 해중합하여, 탄수화물 사슬의 개별적으로 황산화된 도메인으로의 분리를 초래한다. 헤파리나제 II는 주로 다양한 황산화 패턴이 발견되는, HS 사슬의 NS/NS "숄더 (shoulder)" 도메인 내를 절단한다. 헤파란 중합체의 반복적인 디사카라이드 골격이 아미노 당 글루코사민에 연결된 우론산임을 주목한다. "NS"는 C2, C6 및 C3에서 다른 기의 황산화를 가능케 하는 아미노기 상에 설페이트를 운반하는 아미노 당류를 의미한다. "NA"는 아미노기가 황산화되지 않고 아세틸화 상태로 존재하는 것을 나타낸다.
예를 들어, 헤파리나제 III를 이용한 NA 영역에서의 해중합을 위해 효소 및 동결건조된 HS 시료 둘 모두를 20 mM 트리스-HCL, 0.1 mg/ml BSA 및 4 mM CaCl2을 함유하는 pH 7.5의 완충제 중에서 제조한다. 순전히 예시로서, 헤파리나제 III이 1 μg의 HS당 5 mU으로 첨가될 수 있고 37℃에서 16시간 동안 인큐베이션한 후 70℃에서 5분간 가열하여 반응을 중단시켰다.
디- 및 테트라사카라이드는 칼럼 크로마토그래피, 예컨대, HPLC로 용출할 수 있다. 대안적으로 이들은 모세관 전기영동에 의해 분석될 수 있다.
연골 및 결합 조직 형성
본 발명의 다른 측면에서, HS16을 연골 전구세포 또는 연골 줄기세포에 투여하는 것을 포함하는, 연골 조직의 형성 (연골형성)을 촉진하는 방법이 제공된다.
선택적으로 외인성으로 첨가된 TGFβ1 단백질의 존재하에서 뼈 또는 연골 전구세포 또는 줄기세포를 HS16와 접촉시킴으로써, 골형성 또는 연골 조직의 형성을 촉진 또는 억제하는 방법이 시험관 내에서 수행될 수 있다. 전구세포 또는 줄기세포는 중간엽 줄기세포일 수 있다. 조직 형성이 촉진되는 경우, 형성된 조직은 수집되어 동물 또는 인간 환자 내로의 이식에 사용될 수 있다.
따라서, 본 발명의 일 측면에서, HS16의 존재 (즉, 외인성 HS16), 및 선택적으로 TGFβ1의 존재 (즉, 외인성 TGFβ1) 하에서 중간엽 줄기세포의 시험관 내 배양에 의해 수둑된 결합 조직이 제공된다. 결합 조직은 뼈, 연골, 근육, 지방 인대 또는 힘줄일 수 있다.
HS16을 사용한 질환의 예방 또는 치료는 조직, 특히 뼈, 연골, 근육, 지방, 인대 또는 힘줄과 같은 결합 조직의 복구, 재생 또는 대체를 포함할 수 있다.
이들 조직 중 하나의 악화를 갖는 환자에서, 악화 부위로의 HS16의 투여는 그 부위에서의 조직의 성장, 증식 및/또는 분화를 촉진하는데 사용될 수 있다. 예를 들어, 투여 부위에, 또는 그 근처에 존재하는 중간엽 줄기세포의 자극은, 바람직하게는 TGFβ1이 또한 그 부위에 존재하는 경우, 중간엽 줄기세포의 성장 및 적합한 결합 조직으로의 분화를 초래하고, 그로써 손상된 조직의 대체/재생 및 손상의 치료를 제공할 수 있다.
대안적으로, HS16과 접촉하여 중간엽 줄기세포의 시험관 내 배양으로부터 수득된 결합 조직은 수집되어 손상되거나 악화된 조직을 대체하기 위해 손상 또는 질환의 부위에 이식될 수 있다. 손상되거나 악화된 조직은 먼저 손상 또는 질환 부위로부터 선택적으로 절개될 수 있다.
따라서, HS16은 치료를 필요로 하는 환자에서, 선택적으로 TGFβ1 및/또는 줄기세포와 조합하여, HS16의 직접적인 적용에 의해 초래되는, 조직 복구, 재생 및/또는 대체 (예컨대, 흉터 조직 또는 골절의 치유)를 비롯한, 생체 내 상처 치유에 유용하다. HS16은 또한 조직 복구, 재생 및/또는 대체를 필요로 하는 환자로의 이식에 적합한 조직의 시험관 내 생성에 유용하다.
연골 조직의 복구 및/또는 재생
일부 측면에서, 본 발명은 관절 파괴, 연골 변성, 연골 조직에의 손상 또는 연골 조직의 손실 또는 변성을 치료 또는 예방하기 위한 HS16의 치료적 용도 (인간 및/또는 동물)와 관련이 있다.
일부 실시양태에서, 본원에 기술된 바와 같이, HS16의 투여에 의해 치료되는 질환 또는 병태는 관절 파괴, 연골 변성, 연골 조직에의 손상 및 연골 조직의 손실 또는 변성의 하나 이상과 연관된 질환 또는 병태일 수 있다. 연골 변성, 손상 또는 손실은 연골 두께 또는 용적에 있어서의 감소를 포함할 수 있다.
관절 파괴, 연골 변성, 연골 조직에의 손상 및/또는 연골 조직의 손실 또는 변성은 질환 과정, 생리학적 과정의 결과로서 및/또는 손상 또는 외상의 결과로서 일어날 수 있다. 예를 들어, 관절 파괴, 연골 변성, 연골 조직에의 손상 및/또는 연골 조직의 손실 또는 변성은 손상 또는 외상의 결과로서 시작될 수 있고, 이들 과정 중 하나 이상은 그 후에 질환 및/또는 생리학적 과정을 통해 진행될 수 있다.
질환 또는 병태는 관절염, 선택적으로 외상 또는 손상-유도성 관절염, 노화-관련 관절염 또는 비-노화-관련 관절염일 수 있다. 관절염은 골관절염일 수 있다. 골관절염은 관절 통증 및 관절의 감소된 기능 (예를 들어, 경직 및/또는 운동의 감소된 범위)의 임상적 증상이다. 증상에는 관절 통증, 경직 및 관절 운동의 장애가 포함된다. 이는 연골의 국소화된 손실, 뼈 및/또는 염증의 재구성을 병리학적 특징으로 한다. 가장 일반적으로 관절염에 의해 영향을 받는 관절은 무릎 관절, 엉덩이 관절 및 손과 발의 관절이지만, 다른 관절이 또한 영향을 받을 수 있다.
본 발명의 방법에 따라 치료되는 개체는 이들 과정이 아직 시작되지 않았다고 하더라도 관절 파괴, 연골 변성, 연골 조직에의 손상 및 연골 조직의 손실 또는 변성의 하나 이상에 취약할 수 있다. 개체는 관절 파괴, 연골 변성, 연골 조직에의 손상 및 연골 조직의 손실 또는 변성의 하나 이상과 연관된 질환 또는 병태가 발병한 결과로서 취약할 수 있다.
연골은 손상 또는 외상과 같은 생리학적 과정, 또는 기계적 마모 및/또는 질환 및 생리학적 과정과 같은 생물학적 과정의 결과로서 손상되거나 변성될 수 있다. 물리적 과정 및 생물학적 과정은 상호작용하여 연골의 손실, 변성, 분해 또는 손상을 초래한다. 예를 들어, 손상 또는 외상 또는 기계적 마모는, 예를 들어 염증, 연골의 손실, 변성, 분해 또는 손상에 영향을 미치고 가속화하는 생물학적 과정인, 염증을 통해 연골 손상 및 진입을 일으킬 수 있다.
손상 또는 외상은 추락 또는 스포츠-관련 손상 또는 외상의 결과일 수 있다. 기계적 마모는 비만 및/또는 반복적 활동과 연관될 수 있다. 예를 들어, 기계적 마모는 특정 활동의 결과로서 야기될 수 있거나 또는 특정 직업과 연관될 수 있다.
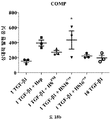
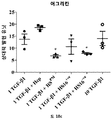
연골의 손실, 변성, 분해 또는 손상을 초래하는 생물학적 과정의 작용인자 (effector)에는 프로테아제, 메탈로프로테아제, 염증성 매개인자에 대해 상향조절된 연골 분해 효소, 어그리카나제 (aggrecanases), 콜라게나제, ADAMTS-4, ADAMTS-5, MMP3 및 MMP13이 포함된다. 연골세포의 증가된 이화작용 활성은 연골의 손실, 변성, 분해 또는 손상을 초래하는 생물학적 과정과 연관이 있다. 연골세포의 대사작용 활성은, 예를 들어, SOX-9, COLII, 어그리칸, COL1 및 TSG-6과 같은 연골 유전자의 발현 분석, 또는 방사성표지의 도입에 의해 분석될 수 있다.
연골의 손실, 변성, 분해, 손상 또는 유지는 시간의 경과에 따른 연골의 영상화 및/또는 연골의 측정에 의해 결정될 수 있다. 연골의 영상화 및/또는 측정은 관심 부위, 예를 들어, 손상 또는 외상 부위, 또는 관절염 관절에서일 수 있다.
연골 손실, 변성, 분해 또는 손상은 당해 분야의 기술자에게 잘 알려진 통상의 방법에 의해 결정될 수 있다. 예를 들어, 연골 내 장애 (즉, 손상) 또는 연골 손실은 자기공명 영상화 (MRI) 또는 관절경검사에 의해 결정될 수 있다.
연골 손실, 변성 또는 분해는 관절 내 또는 위치에서 연골의 양의 이전 측정에 비해 그 관절 내 또는 그 위치에서 연골의 감소된 양의 관찰에 의해 결정될 수 있다. 대안적으로, 연골 손실, 변성 또는 분해는 연골 손실, 변성 또는 분해를 경험하지 않은 동등한 관절 내 또는 위치에 비해 관절 내 또는 위치에서 연골의 감소된 양, 두께 또는 용적의 관찰에 의해 결정될 수 있다.
관절경검사에 의해 관찰되는 연골에 대한 손상은 하기와 같은 국제연골재생학회 (International Cartilage Repair Society, ICRS) 등급 시스템에 따라서 등급이 매겨질 수 있다:
0 = (정상) 건강한 연골;
1 = 연골이 연점 (soft spot) 또는 물집을 가짐
2 = 연골 내 보이는 작은 열상
3 = 병변이 깊은 틈새를 가짐 (연골 층의 50% 초과)
4 = 연골 열상이 기저의 (연골하) 뼈를 노출시킴.
등급 2/3 결함 (defect)의 연골은 섬유화 또는 세절된 외양을 가질 수 있다.
연골에 대한 손상은 또한 문헌 [Pritzker et al., Osteoarthritis Cartilage 2006 14(1): 13-29]에 기술된 국제 골관절염 연구학회 (Osteoarthritis Research Society International, OARSI) 등급 시스템에 따른 조직병리학에 의해 평가될 수 있다.
연골 변성과 연관된 효소, 또는 연골 변성에 대해 상향조절되는 것으로 알려진 유전자 또는 효소의 발현 및/또는 활성이 또한 연골의 손실, 변성, 분해, 손상 또는 유지를 결정하기 위해 사용될 수 있다. 유사하게, 연골세포의 이화작용 활성이 연골의 손실, 변성, 분해, 손상 또는 유지를 조사하기 위해 분석될 수 있다.
본 발명의 폴리펩티드 또는 폴리뉴클레오티드의 치료학적 유효량의 투여 결과로서 관절 파괴 또는 연골 변성의 억제, 또는 연골 조직의 분해 또는 손상 또는 손실의 예방 또는 지연, 또는 유효한 연골 조직의 유지는 관절 내 또는 위치에서 연골의 양의 이전 측정에 비해, 그 관절 내 또는 그 위치에서 연골의 손실, 변성, 분해 또는 손상이 없거나 최소한의 발견에 의해 결정될 수 있다. 대안적으로, 관절 파괴 또는 연골 변성의 억제, 또는 연골 조직의 분해 또는 손상 또는 손실의 예방 또는 지연, 또는 유효한 연골 조직의 유지는 비처리된 대조군 관절 또는 위치에 비해 관절 내 또는 위치에서 연골의 감소되거나 지연된 손실, 변성, 분해 또는 손상의 발견에 의해 결정될 수 있다.
유전자, 예컨대, 연골 손실, 변성, 분해 또는 손상과 연관된 유전자 의 발현은 통상의 기술자에게 잘 알려진 다양한 방법에 의해 결정될 수 있다. 예를 들어, 유전자의 발현 수준은 시료, 예컨대, 생검 또는 조직 시료에서 정량적 실시간 PCR에 의해 결정될 수 있다.
연골 손실과 연관된 유전자에는 프로테아제, 메탈로프로테아제, 염증성 매개인자에 대해 상향조절된 연골 분해 효소, 어그리카나제, 콜라게나제, ADAMTS-4, ADAMTS-5, MMP3 및 MMP13이 포함되지만, 이로 제한되는 것은 아니다.
예컨대, 연골 손실, 변성, 분해 또는 손상과 연관된 단백질 또는 효소의 발현 또는 활성 수준은 통상의 기술자에게 공지된 통상의 방법에 의해 결정될 수 있다. 예를 들어, 시료, 예컨대, 생검 또는 조직 시료 내 단백질의 발현 수준은 면역블롯팅 또는 ELISA에 의해 결정될 수 있다. 효소의 활성 수준은 시료, 예컨대, 생검 또는 조직 시료 내에서 그 효소의 활성에 대한 리포터 분석을 이용하여 결정될 수 있다. 유사하게, 시료, 예컨대, 생검 또는 조직 시료 내 연골세포의 대사작용 활성이 결정될 수 있다.
연골 변성/파괴/손실/손상 및/또는 관절 파괴는 연골 조직에의 손실, 변성, 분해 또는 손상 또는 관절 파괴와 연관된 질환 또는 병태의 임상적 증상과 상관관계가 있을 수 있고, 따라서 이들은 또한 연골 변성/파괴/손실/손상 또는 관절 파괴, 연골세포의 대사작용 활성, 또는 연골 분해 효소의 발현 및/또는 활성을 조사하거나 평가하는데 유용할 수 있다.
뼈 골절
일부 측면에서, 본 발명은 뼈 골절을 치료하기 위한 HS16의 (인간 및/또는 동물) 치료적 용도에 관한 것이다.
뼈 골절은 의학적 병태이다. 이 적용에서 "골절"은 뼈가 금이 가거나, 부러지거나, 깨진 뼈에 대한 손상 또는 부상을 포함한다. 파손 (break)은 뼈에서의 불연속을 지칭한다. 골절은 물리적 충격, 또는 기계적 스트레스, 또는 골다공증 또는 골관절염과 같은 의학적 병태에 의해 야기될 수 있다.
골절의 정형외과적 분류는 폐쇄형 또는 개방형과 단순 또는 다중-단편적 골절을 포함한다. 폐쇄형 골절에서, 피부는 온전한 상태를 유지하는 반면, 개방형 골절에서, 뼈는 상처 부위를 통해 노출될 수 있고, 이는 더 높은 감염 위험성을 초래한다. 단순 골절은 단선을 따라 일어나고, 뼈를 둘로 쪼개는 경향이 있다. 다중-단편적 골절은 뼈를 다수의 조각으로 쪼갠다.
다른 골절 유형에는 압박 골절, 압축 (compacted) 골절, 나선형 골절, 완전 및 불완전 골절, 횡단, 선형 및 사선 골절 및 분쇄 골절이 포함된다.
대부분의 개체에서, 뼈 치유 (골절 유합)는 자연적으로 발생하고 후속 손상이 개시된다. 출혈은 일반적으로 응고 및 백혈구 세포 및 섬유아세포의 유인을 초래하고, 이어서 콜라겐 섬유의 생산을 수반한다. 이는 콜라겐 기질을 뼈로 전환하는 골 기질 (칼슘 히드록시아파타이트) 침착 (광물화)을 수반한다. 미성숙 재-생성된 뼈는 전형적으로 성숙 뼈에 비해 약하고 시간의 경과에 따라서 미성숙 뼈는 성숙 "라멜라" 뼈를 생산하도록 재구성 (remodelling)의 과정을 거친다. 완전한 뼈 치유 과정은 상당한 시간, 전형적으로 수개월이 걸린다.
골절이 일어나고 HS16을 사용한 치료로부터 이익을 볼 수 있는 뼈는 모든 뼈 유형, 특히, 이로 제한 되는 것은 아니지만, 장골 (예컨대, 대퇴골, 상완골, 지골), 단골 (예컨대, 수근골, 족근골), 납작뼈 (예컨대, 두개골, 늑골, 견갑골, 흉골, 골반대), 불규칙뼈 (예컨대, 추골), 종자뼈 (예컨대, 슬개골)를 포함하는, 모든 포유동물 뼈를 포함한다.
골절이 일어나고 HS16을 사용한 치료로부터 이익을 볼 수 있는 뼈는 골격근 (즉, 골격의 임의의 뼈), 두개-안면 영역의 뼈, 축 골격의 뼈 (예컨대, 추골, 늑골), 충수 골격 (예컨대, 사지의), 골반 골격의 뼈 (예컨대, 골반)를 포함한다.
골절이 일어나고 HS16을 사용한 치료로부터 이익을 볼 수 있는 뼈는 또한, 턱, 코 및 뺨과 같은 안면의 뼈들을 비롯해, 머리 (뇌) 및 목의 뼈들을 포함한다. HS16은 치아 또는 안면 또는 두개 수술 시 뼈의 복구 또는 재생을 보조하기 위해 사용될 수 있고, 이는 예컨대, 턱뼈를 비롯해, 얼굴 및/또는 입의 뼈 (치아와는 다름)의 재건을 포함할 수 있다.
뼈 골절은 또한 골다공증을 앓는 개체에 의해 나타나는 바와 같은, 병리학적 다공성을 포함한다.
비록 본 발명으로 제한되는 것이 아니더라도, HS16의 일차적인 작용은 상처 부위 내부, 그에 인접한, 또는 그로 이동하도록 야기된 세포에 대해서일 수 있고 중간엽 줄기세포, 뼈 줄기세포, 전조골세포 또는 조골세포에 대해서, 또는 상처층 (wound bed) 내부에서 발견되거나 그로 이동하도록 야기되는 임의의 보조 또는 혈관형성 세포에 대해서일 수 있다.
포유동물 개체에서 뼈 골절의 치료 방법에 사용하기 위한 HS16 및 HS16을 포함하는 약제학적 조성물 및 약물이 제공된다. 치료는 뼈에서의 상처 치유를 포함할 수 있다. 치료는 뼈의 복구, 재생 및 성장을 포함할 수 있다. HS16은 새로운 뼈 성장을 촉진함으로써 골절 복구를 촉진한다. HS16은 뼈 치유를 가능케 하는 골절 복구의 속도가 더 빨리 일어나게 개선하는 작용을 하고, 이는 손상으로부터의 개선된 회복 시간을 초래한다. 치료는 개선된 뼈 강도를 초래할 수 있다.
치료는 또한 골다공증 또는 골관절염의 치료를 포함할 수 있다.
HS16은 바람직하게는 골절 주변의 조직에 투여된다. 이는 골절이 야기된 뼈 조직으로의 직접적인 투여를 포함할 수 있다. 뼈 또는 골절 주변의 결합 조직에 또는 뼈 근처 및 뼈를 공급하는 맥관구조 (예컨대, 혈관)로 투여될 수 있다. 손상 부위에 직접적으로 투여될 수 있고 상처의 초기 치유에 의해 형성된 캘러스 (callus)로 투여될 수 있다. 본 발명에 따른 약물 및 약제학적 조성물은 다양한 경로에 의한 투여를 위해 제형화될 수 있다. 가장 바람직하게는, HS16은 주입용 유체 또는 액체 형태로 제형화된다.
일부 실시양태에서, HS16은 제어 방출 제형, 예컨대 상처 부위에의 이식용 약물 캡슐로 제형화된다. HS16은 나노섬유 또는 생분해성 종이 또는 섬유와 같은 담체 물질 (예컨대, 생체물질)에 부착되거나, 그에 함침되거나 그 내로 침지될 수 있다.
HS16을 포함하는 약제학적 조성물, 약물, 임플란트 및 보철물은 또한 TGF-β1을 포함할 수 있다. TGF-β1에 결합하는 HS16의 능력으로 인해, HS16은 상처 부위로 TGF-β1의 전달을 보조하는 TGF-β1의 담체로서 작용할 수 있다.
바람직하게는 "치료학적 유효량"이 투여되는데, 이는 상응하는 비처리된 골절에 비해 뼈 골절의 치유를 개선하기에 충분하다. 실제 투여되는 양, 및 투여 속도 및 시간적 추이는 골절의 성질 및 중증도에 좌우될 것이다. 치료의 처방, 예컨대, 용량의 결정 등은 일반 개업의 및 다른 의사의 책임 범위 내이고, 전형적으로 골절의 성질, 개별 환자의 상태, 전달 부위, 투여 방법 및 의사에게 공지된 기타 요인들을 고려할 것이다. HS16 용량의 단일 또는 다중 투여가 처방 의사의 지도에 따라서 투여될 수 있다. 순전히 예시로서, HS16은 적어도 1 ng/ml, 더욱 바람직하게는 적어도 5 ng/ml 및 선택적으로 10 ng/ml 이상의 용량으로 전달될 수 있다. 개별적 HS16 용량은 1 mg 미만 및 1 μg 초과의 순서, 예컨대, 약 5 μg, 약 10 μg, 약 25 μg, 약 30 μg, 약 50 μg, 약 100 μg, 약 0.5 mg, 또는 약 1 mg 중 하나일 수 있다. 상기에 언급된 기법 및 프로토콜의 예시는 문헌 [Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins]에서 확인할 수 있다.
HS16은 통증 완화 또는 항-염증성 약물의 투여, 뼈의 고정 및 응고 (setting), 예컨대, 손상된 팔다리의 석고 붕대로의 고정, 예컨대, 뼈를 재-고정하거나 정확한 전위 (displacement), 경사 및 탈구로 뼈의 이동을 위한 외과 수술과 같은, 다른 치료와 함께 뼈 골절을 치료하기 위해 사용될 수 있다. 수술이 필요한 경우, HS16은 수술 과정 중에 골절에 직접적으로 투여 (예컨대, 그에 적용)될 수 있다.
생체물질 (
Biomaterials
)
본 발명의 약제학적 조성물 및 약물은 HS16으로 코팅되고/되거나 이로 함침된 생체물질의 형태를 취할 수 있다. 임플란트 또는 보철물은 생체물질로부터 형성될 수 있다. 이러한 임플란트 또는 보철물은 조직 재생, 조직 재조정 (restructuring) 및/또는 조직 재형성을 보조하기 위해 외과적으로 이식될 수 있다.
HS16은 임플란트 또는 보철물에 적용되어 목적하는 위치에서 새로운 조직 형성을 촉진시킬 수 있다. 단백질과 달리, 헤파란 설페이트는 특히 강건하며 합성 바이오스캐폴드 (bioscafoold)의 제조 및 임플란트 및 보철물에의 적용에 요구되는 용매를 견디는데 보다 나은 능력을 갖는 것으로 인식될 것이다.
생체물질은 HS16으로 코팅되거나 함침될 수 있다. 함침 (Impregnation)은, 예컨대, 중합화 또는 생체물질 내로 HS16을 흡수시키는 동안 생체물질의 구성적 성분과 HS16을 혼합함으로써 생체물질을 형성하는 것을 포함할 수 있다. 코팅은 생체물질의 표면 위에 HS16을 흡수시키는 것을 포함할 수 있다.
생체물질은 개체에 투여되거나 이식되는 경우, 코팅되거나 함침된 HS16이 생체물질로부터 방출되도록 허용해야 한다. 생체물질 방출 동역학은 생체물질의 구조, 예컨대, 다공성을 변화시킴으로써 달라질 수 있다.
생체물질을 HS16으로 코팅 또는 함침하는 것에 추가로, 하나 이상의 생물학적 활성 분자가 생체물질 위에 함침되거나 코팅될 수 있다. 예를 들어, BMP-2, BMP-4, OP-1, FGF-1, FGF-2, TGF-β1, TGF-β2, TGF-β3; VEGF; 콜라겐; 라미닌; 피브로넥틴; 비트로넥틴으로 이루어진 군으로부터 선택된 적어도 하나. TGF-β1으로의 함침 또는 코팅이 바람직할 수 있다.
HS16으로 코팅 또는 함침된 생체물질은 의학적 및 수의학적 목적 둘 모두에서 유용할 수 있다. 본 발명이 환자의 삶의 질을 개선하거나 또는 동물, 예를 들어 번식에 유용한 귀중한 경주마의 생명을 잠재적으로 연장시킬 수 있음이 인식될 것이다.
생체물질은 스캐폴드 또는 매트릭스 지지체를 제공한다. 생체물질은 조직에 이식하기에 적합할 수 있거나, 또는 (예컨대, 용액 내 마이크로캡슐로서) 투여에 적합할 수 있다.
임플란트 또는 보철물은 생체적합성, 예컨대, 비-독성 및 낮은 면역원성 (가장 바람직하게는, 비-면역원성)이어야 한다. 생체물질은 상처 치유가 일어남에 따라서 생체물질이 분해하고, 궁극적으로 개체의 인 시츄 (in situ)에서 재생된 조직만을 남기도록 생분해성일 수 있다. 대안적으로, 비-생분해성 생체물질은 성공적인 상처 치유 후 선택적 요건인 생체물질의 외과적 제거와 함께, 예컨대, 광범위한 단절에 걸쳐서 조직 재생을 유도하고/하거나 치유 동안 구조적 지지체로서 작용하기 위해 사용될 수 있다.
생체물질은 연성 및/또는 가요성일 수 있고, 예컨대, 하이드로겔, 피브린 웹 또는 메쉬, 또는 콜라겐 스폰지일 수 있다. "하이드로겔"은 천연 또는 합성일 수 있는, 유기 중합체가 고정 또는 고체화되어 물 또는 다른 용액의 분자를 포착하여 겔을 형성하는 3차원 개방형-격자 구조를 생성하는 경우에 형성되는 물질이다. 고체화는 응집, 응고, 소수성 상호작용 또는 가교-결합에 의해 일어날 수 있다.
대안적으로, 생체물질은, 예컨대, 플라스틱과 같은 고체 재료 또는 티타늄과 같은 생물학적 불활성 금속으로부터 형성된, 상대적으로 단단한 구조일 수 있다.
생체물질은 가교-결합된 중합체에 의해 제공될 수 있는 다공성 매트릭스 구조를 가질 수 있다. 매트릭스는 뼈 성장에 요구되는 영양분 및 성장인자에 투과성이다.
매트릭스 구조는 섬유, 예컨대, 피브린 또는 콜라겐을 가교결합하거나, 또는 알긴산 나트륨, 키토산, 또는 다른 폴리사카라이드의 액체 필름과 적합한 가교제, 예컨대, 칼슘 염, 폴리아크릴산, 헤파린과의 가교결합에 의해 형성될 수 있다. 대안적으로, 스캐폴드는 겔로서 형성되거나, 콜라건 또는 알지네이트에 의해 조립되거나, 당해 분야의 숙련자에게 공지된 잘 확립된 방법을 이용하여 가교결합될 수 있다.
매트릭스 형성에 적합한 중합체 물질에는, 아가로스, 콜라겐, 피브린, 키토산, 폴리카프로락톤, 폴리(DL-락타이드-코-카프로락톤), 폴리(L-락타이드-코-카프로락톤-코-글리콜라이드), 폴리글리콜라이드, 폴리락타이드, 폴리히드록시알카노에이트, 이들의 공중합체로 이루어진 군으로부터 선택될 수 있는 생분해성/생흡수성 고분자; 또는 셀룰로오스 아세테이트; 셀룰로오스 부티레이트, 알지네이트, 폴리설폰, 폴리우레탄, 폴리아크릴로니트릴, 설폰화된 폴리설폰, 폴리아마이드, 폴리아크릴로니트릴, 폴리메틸메타아크릴레이트, 이들의 공-중합체로 이루어진 군으로부터 선택될 수 있는 비-생분해성 중합체가 포함되나, 이들로 제한되는 것은 아니다.
콜라겐은 세포 부착 및 기능을 지지하는 생체적합성 및 유리한 특성으로 인해 매트릭스 구축에 유망한 물질이다 (미국특허 제5,019,087호; Tanaka, S.; Takigawa, T.; Ichihara, S. & Nakamura, T. Mechanical properties of the bioabsorbable polyglycolic acid-collagen nerve guide tube Polymer Engineering & Science 2006, 46, 1461-1467). 임상적으로 허용가능한 콜라겐 스폰지가 매트릭스의 일례이며, 당해 분야에 잘 알려져 있다 (예컨대, Integra Life Sciences사 제품).
피브린 스캐폴드 [예를 들어, 피브린 글루 (fibrin glue)]는 대안적인 매트릭스 물질을 제공한다. 피브린 글루는 상처 밀폐제 (wound sealant), 성장인자를 운반하는 저장소 (reservoir)로서, 생물학적 임플란트의 배치 및 확보에 있어 조력자로서 보편화된 임상 적용을 향유한다 (Rajesh Vasita, Dhirendra S Katti. Growth factor delivery systems for tissue engineering: a materials perspective. Expert Reviews in Medical Devices. 2006; 3(1): 29-47; Wong C, Inman E, Spaethe R, Helgerson S. Thromb.Haemost. 2003 89(3): 573-582; Pandit AS, Wilson DJ, Feldman DS. Fibrin scaffold as an effective vehicle for the delivery of acidic growth factor (FGF-1). J. Biomaterials Applications. 2000; 14(3); 229-242; DeBlois Cote MF. Doillon CJ. Heparin-fibroblast growth factor fibrin complex: in vitro and in vivo applications to collagen based materials. Biomaterials . 1994; 15(9): 665-672.).
본원에 참조로서 포함되는, 문헌 [Luong-Van et al (In vitro biocompatibility and bioactivity of microencapsulated heparan sulphate Biomaterials 28 (2007) 2127-2136)]은 폴리카프로락톤 마이크로캡슐로부터 HS의 지속적인 국소 전달을 기술한다.
생체물질의 또 다른 예는 히드록시아파타이트 또는 히알루론산을 포함하는 중합체이다.
생체물질은 추가적인 세포로 보충될 수 있다. 예를 들어, 중간엽 줄기세포, 더욱 바람직하게는 인간 중간엽 줄기세포와 같은 줄기세포와 함께 생체물질을 "접종 (seed)" (또는 이와 동시-합성)할 수 있다.
처치되는 개체는 임의의 동물 또는 인간일 수 있다. 개체는 바람직하게는 포유동물, 더욱 바람직하게는 인간이다. 개체는 비-인간 포유동물 (예컨대, 토끼, 기니아 피그, 래트, 마우스 또는 기타 설치류 (설치 목의 임의의 동물 유래 세포 포함), 고양이, 개, 돼지, 양, 염소, 소 (암소 (cow), 예를 들어 젖소, 또는 보스 (Bos) 속의 임의의 동물 포함), 말 (말과 (Equidae)의 임의의 동물 포함), 당나귀, 및 비인간 영장류)일 수 있다. 비-인간 포유동물은 가정용 애완동물, 또는 상업적 목적을 위해 사육하는 동물, 예를 들어 경주마, 또는 돼지, 양 또는 소와 같은 농업용 가축일 수 있다. 개체는 수컷 또는 암컷일 수 있다. 개체는 환자일 수 있다.
본 발명에 따른 방법은, 지시된 바와 같이, 시험관 내 또는 생체 내에서 수행될 수 있다. 용어 "시험관 내"는 배양물 내 세포를 사용하는 과정을 포함하는 것으로 의도되는 반면, 용어 "생체 내"는 무손상 다세포 유기체를 사용하는 과정을 포함하는 것으로 의도된다.
배양 배지
HS16 (바람직하기로 분리된 HS16)을 포함하는 배양 배지는 임의의 종류일 수 있으나, 바람직하게는 액체 또는 겔이고 다른 영양분 및 성장인자 (예컨대, TGFβ1, FGF-2)를 함유할 수 있다. 배양 배지는 액체 또는 겔로 재구성하기 위한, 건조된 형태, 예컨대 분말화 형태로 제조될 수 있다. HS16은 바람직하게는 비-미량 (non-trace amounts)으로 존재할 것이다. 예를 들어, 배양 배지 내 HS16의 농도는 약 1 ng/ml 배양 배지 내지 약 1000 ng/ml 배양 배지 범위일 수 있다. 바람직하게는, 배양 배지 내 HS16의 농도는 약 500 ng/ml 이하, 더욱 바람직하게는 250 ng/ml 이하, 100 ng/ml 이하, 90 ng/ml 이하, 80 ng/ml 이하, 70 ng/ml 이하, 60 ng/ml 이하, 50 ng/ml 이하, 40 ng/ml 이하, 30 ng/ml 이하, 20 ng/ml 이하, 10 ng/ml 이하, 또는 5 ng/ml 이하 중 하나이다.
헤파란 설페이트의 용량
시험관 내 및 생체 내 사용 둘 모두에서, HS16은 약 500 ng/ml 이하, 더욱 바람직하게는 250 ng/ml 이하, 100 ng/ml 이하, 90 ng/ml 이하, 80 ng/ml 이하, 70 ng/ml 이하, 60 ng/ml 이하, 50 ng/ml 이하, 40 ng/ml 이하, 30 ng/ml 이하, 20 ng/ml 이하, 10 ng/ml 이하, 5 ng/ml 이하; 또는 약 100 mg 이하, 50 mg 이하, 40 mg 이하, 30 mg 이하, 20 mg 이하, 10 mg 이하, 5 mg 이하, 4 mg 이하, 3 mg 이하, 2 mg 이하, 또는 1 mg 이하; 또는 약 0.3-5 μg/ml, 0.3-4, 0.3-3, 0.3-2.5, 0.3-2, 0.3-1.5, 0.3-1.0, 0.3-0.9, 0.3-0.8, 0.3-0.7, 0.3-0.6, 0.3-0.5, 0.3-0.4, 1-2, 1-1.75, 1-1.5, 1-1.25, 1.25-2, 1.5-2, 또는 1.75-2 μg/ml 범위 중 하나의 농도 또는 용량으로 사용될 수 있다.
일부 실시양태에서, HS16의 초회 용량 (priming dose)이 치료적 용량의 투여 전에 투여될 수 있다. 초회 용량은 활성화된 TGFβ1에 사전-결합하도록 작용할 수 있다. 초회 용량 및 치료적 용량은 상기에 주어진 값 또는 범위의 하나로부터 각각 독립적으로 선택될 수 있다.
제형
HS16을 단독으로 투여하는 것이 가능하지만, 이로 제한되는 것은 아니지만, 약제학적으로 또는 미용적으로 허용가능한 담체, 애쥬번트, 부형제, 희석제, 충진제, 완충제, 보존제, 항-산화제, 윤활제, 안정화제, 용해제, 계면활성제 (예컨대, 습윤제), 차폐제, 착색제, 향미제, 및 감미제를 포함하는, 당해 분야의 숙련자에게 잘 알려진 하나 이상의 다른 약제학적으로 또는 미용적으로 허용가능한 성분들과 함께 HSX를 포함하는 약제학적 또는 미용적 제형 (예컨대, 조성물, 제제, 약물)로서 이를 제시하는 것이 바람직하다.
따라서, 본 발명은, 상기와 같이 정의된 바와 같은, 약제학적 또는 미용적 조성물, 및 상기에 정의된 바와 같은, 적어도 하나의 활성 화합물을, 예컨대, 담체, 애쥬번트, 부형제 등과 같이 당해 분야의 숙련자에게 잘 알려진 하나 이상의 다른 약제학적 또는 미용적으로 허용가능한 성분과 혼합하는 것을 포함하는 약제학적 또는 미용적 조성물을 제조하는 방법을 추가로 제공한다. 별개의 단위 (예컨대, 정제 등)로 제형화되는 경우, 각 단위는 활성 화합물의 미리 결정된 양 (용량)을 함유한다.
본원에 사용된 바와 같이, 용어 "약제학적으로 허용가능한"은 화합물, 성분, 물질, 조성물, 투약 형태 등에 관련되며, 이는 건전한 의학적 판단의 범주 내에서, 합리적인 이익/유해 비율에 상응하는, 과도한 독성, 자극, 알러지 반응, 또는 다른 문제 또는 합병증 없이 문제의 개체 (예컨대, 인간)의 조직과 접촉하기에 적합하다. 각각의 담체, 애쥬번트, 부형제 등은 또한 제형의 다른 성분들과 적합하다는 관점에서 "허용가능"해야만 한다.
적합한 담체, 애쥬번트, 부형제 등은 표준 약제학적 교과서, 예를 들어, 문헌 [Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Company, Easton, Pa., 1990; and Handbook of Pharmaceutical Excipients, 2nd edition, 1994]에서 확인할 수 있다.
제형은 약학 분야에 잘 알려진 임의의 방법에 의해 제조될 수 있다. 이러한 방법은 활성 화합물과 하나 이상의 보조 성분을 구성하는 담체의 연합을 초래하는 단계를 포함한다. 일반적으로, 제형은 활성 화합물과 담체 (예컨대, 액체 담체, 미세 분말 고체 담체 등)와의 연합을 균질하고 친밀하게 유발하고, 그 후에 필요에 따라, 산물을 성형함으로써 제조된다.
제형은 적합하게는 액체, 용액 (예컨대, 수성, 비-수성), 선택적으로 염 용액, 현탁액 (예컨대, 수성, 비-수성), 에멀젼 (예컨대, 수중유적형, 유중수적형), 엘릭서, 시럽, 지약 (electuaries), 구강세정제, 점적약제, 정제 (예컨대, 코팅 정제 포함), 과립, 분말, 로젠지, 향정 (pastilles), 캡슐 (예컨대, 경질 및 연질 젤라틴 캡슐), 카세 (cachets), 알약, 앰플, 볼루스, 좌약, 페서리 (pessaries), 팅크제 (tinctures), 겔, 페이스트, 연고, 크림, 로숀, 오일, 포말, 스프레이, 미스트, 또는 에어로졸의 형태일 수 있다.
제형은 하나 이상의 활성 화합물 및 선택적으로, 예를 들어, 침투, 투과, 및 흡수 증강제를 비롯한 하나 이상의 다른 약제학적으로 허용가능한 성분으로 함침된 패치, 부착성 플라스터, 붕대, 드레싱 등으로서 적절히 제공될 수 있다. 제형은 또한 데포 (depot) 또는 저장소의 형태로 적절히 제공될 수 있다.
활성 화합물은 하나 이상의 다른 약제학적으로 또는 미용적으로 허용가능한 성분 중에 용해되거나, 또는 그에 현탁되거나, 또는 그와 혼합될 수 있다.
경구 투여에 적합한 제형 (예컨대, 섭취)에는 액체, 용액 (예컨대, 수성, 비-수성), 현탁액 (예컨대, 수성, 비-수성), 에멀젼 (예컨대, 수중유적형, 유중수적형), 엘릭서, 시럽, 지약, 정제, 과립, 분말, 캡슐, 카세, 알약, 앰플, 볼루스가 포함된다.
비-경구 점막관통 투여에 적합한 제형에는 액체, 용액 (예컨대, 수성, 비-수성), 현탁액 (예컨대, 수성, 비-수성), 에멀젼 (예컨대, 수중유적형, 유중수적형), 좌약, 페서리, 겔, 페이스트, 연고, 크림, 로숀, 오일, 뿐만 아니라 패치, 부착성 플라스터, 데포, 및 저장소가 포함된다.
경피 투여에 적합한 제형에는 겔, 페이스트, 연고, 크림, 로숀, 및 오일, 뿐만 아니라 패치, 부착성 플라스터, 밴드, 드레싱, 데포, 및 저장소가 포함된다.
정제는 선택적으로 하나 이상의 보조 성분과 함께 통상의 수단, 예컨대, 압축 또는 성형에 의해 제조될 수 있다. 연고는 전형적으로 활성 화합물 및 파라핀성 또는 수-혼화성 연고 기재로부터 제조된다. 크림은 전형적으로 활성 화합물 및 수중유적형 크림 기재로부터 제조된다. 바람직하다면, 크림의 수성상은, 예를 들어, 적어도 약 30% w/w의 다가 알코올, 즉 프로필렌 글리콜, 부탄-1,3-디올, 만니톨, 소르비톨, 글리세롤 및 폴리에틸렌 글리콜 및 이들의 혼합물과 같이 2개 이상의 히드록실기를 갖는 알코올을 포함할 수 있다. 국소 제형은 바람직하게는 피부 또는 다른 이환 부위를 통한 활성 화합물의 흡수 또는 침투를 증강시키는 화합물을 포함할 수 있다. 이러한 진피 침투 증강제의 예시에는 디메틸설폭사이드 및 관련 유사체가 포함된다. 에멀젼은 전형적으로 활성 화합물 및 오일상으로부터 제조되는데, 이는 선택적으로 단지 에멀젼화제 (달리는 유화제 (emulgent)로도 알려짐)만을 포함할 수 있거나, 또는 적어도 하나의 에멀젼화제와 지방 또는 오일 또는 지방과 오일 두 모두의 혼합물을 포함할 수 있다. 바람직하게는, 친수성 에멀젼화제가 안정화제로 작용하는 친유성 에멀젼화제와 함께 포함된다. 오일과 지방 둘 모두를 포함하는 것이 또한 바람직하다. 요컨대, 안정화제(들)과 함께 또는 이들 없이 에멀젼화제(들)은 소위 유화 왁스 (emulsifying wax)를 구성하고, 이 왁스는 오일 및/또는 지방과 함께 크림 제형의 유성 분산상을 형성하는 소위 유화 연고 기재를 구성한다. 적합한 유화제 및 에멀젼 안정화제에는 트윈 60, Span 80, 세포스테아릴 알코올, 미리스틸 알코올, 글리세릴 모노스테아레이트 및 소듐 도데실 설페이트가 포함된다. 약제학적 에멀젼 제형에 사용될 가능성이 있는 대부분의 오일에서 활성 화합물의 용해도가 매우 낮을 수 있기 때문에, 제형에 적합한 오일 또는 지방의 선택은 목적하는 미용적 특성의 달성에 근거한다. 따라서, 크림은 바람직하게는 튜브 또는 다른 용기로부터의 누출을 회피하기에 적합한 농도 (consistency)를 갖는 비-지성 (non-greasy), 비-염색 및 세정가능한 제품이어야 한다. 직쇄 또는 분지쇄, 1- 또는 2염기 알킬 에스테르, 예컨대 디-이소아디페이트, 이소세틸 스테아레이트, 코코넛 지방산의 프로필렌 글리콜 디에스테르, 이소프로필 미리스테이트, 데실 올리에이트, 이소프로필 팔미테이트, 부틸 스테아레이트, 2-에틸헥실 팔미테이트 또는 크로다몰 (Crodamol) CAP로 공지된 분지쇄 에스테르의 블렌드가 사용될 수 있고, 마지막 3종이 바람직한 에스테르이다. 이들은 요구되는 특성에 따라서 단독으로 또는 조합하여 사용될 수 있다. 대안적으로, 고 융점 지질, 예컨대 백색 연질 파라핀 및/또는 액체 파라핀 또는 다른 광물유가 사용될 수 있다.
담체가 액체인, 비내 투여에 적합한 제형에는, 예를 들어, 분무기에 의한 에어로졸 투여에 의한 코 스프레이, 코 점안제, 또는 활성 화합물의 수성 또는 지성 용액을 포함한다.
비경구 투여 (예컨대, 주사)에 적합한 제형에는 활성 화합물이 용해되거나, 현탁되거나, 또는 다르게는 (예컨대, 리포좀 또는 다른 미립자 내) 제공되는, 수성 또는 비-수성, 등장의, 발열성 물질-무함유, 살균 액체 (예컨대, 용액, 현탁액, 식염수)가 포함된다. 이러한 액체는 항-산화제, 완충제, 보존제, 안정화제, 정균제, 현탁제, 증점제, 및 제형가 의도된 수용자의 혈액 (또는 다른 관련 체액)과 등장이 되게 하는 용질과 같은, 다른 약제학적으로 허용가능한 성분을 추가적으로 함유할 수 있다. 부형제의 예시에는, 예를 들어, 물, 식염수, 알코올, 폴리올, 글리세롤, 식용유 등이 포함된다. 이러한 제형에 사용하기에 적합한 등장성 담체의 예시에는 염화나트륨 주사액, 링거액, 또는 락테이트 링거 주사액 (Lactated Ringer's Injection)이 포함된다. 전형적으로, 액체 내 활성 화합물의 농도는 약 1 ng/ml 내지 약 10 μg/ml, 예를 들어 약 10 ng/ml 내지 약 1 μg/ml이다. 제형은 단일-용량 또는 다중-용량 밀봉된 용기, 예를 들어, 앰플 및 바이알 내에 제시될 수 있고, 사용 바로 직전에 단지 멸균 액체 담체, 예를 들어 주사용수의 첨가만을 요구하는, 동결-건조된 (동결건조) 상태로 저장될 수 있다. 즉석의 주사 용액 및 현탁액은 살균 분말, 과립 및 정제로부터 제조될 수 있다.
TGFβ1
본 명세서에서, TGFβ1은 전환 성장인자 베타 수퍼패밀리의 멤버인 전환 성장인자 1을 지칭한다.
호모 사피엔스 (Homo sapiens) 유래 TGFβ1의 아미노산 서열은 등재번호 NP_000651.3 (GI:63025222) [서열번호: 2]로 Genbank에서 이용가능하다.
TGFβ1은 그 후에 단백질분해 절단을 거치는 프리-프로-단백질 (pre-pro-protein)로서 합성된다. 단량체는 이황화 결합을 통해 이량체화되어 프로-TGFβ1 이량체를 형성한다. TGFβ1 이량체는 그 후에 절단되어, 잠복기 연관 펩티드 (latency associated peptide, LAP) 및 성숙 펩티드가 비-공유 결합을 통해 연합되는, 작은 잠재성(latent) TGFβ 복합체 (SLC)를 제공한다. 큰 잠재성 TGFβ1 복합체 (LLC)는 큰 잠재성 TGFβ1 결합 단백질 (LTBP)의 SLC에의 공유 부착에 의해 형성된다.
본원에 사용된 바와 같이, "TGFβ1" 또는 "TGFβ1 단백질"은 프리-프로-TGFβ1, 프로-TGFβ1, 성숙 TGFβ1, 및 잠재성 TGFβ1을 포함한다. 프리-프로-TGFβ1, 프로-TGFβ1, 성숙 TGFβ1 및 잠재성 TGFβ1 형태는, 예를 들어, 작은 잠재성 TGFβ1 복합체 또는 큰 잠재성 TGFβ1 복합체와 같은 단백질 복합체 내에 포함될 수 있다.
본 명세서에서, "TGFβ1"은 TGFβ1의 아미노산 서열과 적어도 70%, 더욱 바람직하게는 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% 또는 100% 중 하나의 서열 동일성을 갖는 단백질 또는 폴리펩티드를 포함한다.
TGFβ1 단백질 또는 폴리펩티드는 또한 바람직하게는 서열번호: 1의 아미노산 서열, 또는 서열번호: 1에 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 또는 99% 중 하나의 서열 동일성을 갖는 아미노산 서열을 갖는 헤파린 결합 도메인을 포함한다.
TGFβ1 단백질 또는 폴리펩티드는 전장의 TGFβ1 단백질 또는 폴리펩티드의 단편 또는 절단형 (truncate)일 수 있다. 예를 들어, TGFβ1은 프리-프로-TGFβ1, 프로-TGFβ1 또는 성숙 TGFβ1 폴리펩티드일 수 있다.
TGFβ1 단백질은 임의의 동물 또는 인간, 예컨대, 비-인간 동물, 예컨대, 토끼, 기니아 피그, 래트, 마우스 또는 기타 설치류 (설치류 목 내 임의의 동물로부터의 세포 포함), 고양이, 개, 돼지, 양, 염소, 소 (암소 (cow), 예를 들어 젖소, 또는 보스 (Bos) 속의 임의의 동물 포함), 말 (말과 (Equidae)의 임의의 동물 포함), 당나귀, 및 비인간 영장류 또는 기타 비-인간 척추동물 유기체; 및/또는 비-인간 포유동물; 및/또는 인간으로부터 수득되거나 그로부터 유래될 수 있다.
TGFβ1의 용량
시험관 내 및 생체 내 사용 모두에서, TGFβ1은 HS16과 조합하여 사용될 수 있다. 본 발명의 일부 세포 배양 방법에서, 외인성 HS16이 배양물에 첨가된다. TGFβ1의 적합한 농도 또는 용량은 약 500 ng/ml 이하, 더욱 바람직하게는 250 ng/ml 이하, 100 ng/ml 이하, 90 ng/ml 이하, 80 ng/ml 이하, 70 ng/ml 이하, 60 ng/ml 이하, 50 ng/ml 이하, 40 ng/ml 이하, 30 ng/ml 이하, 20 ng/ml 이하, 10 ng/ml 이하, 5 ng/ml 이하; 또는 약 100 mg 이하, 50 mg 이하, 40 mg 이하, 30 mg 이하, 20 mg 이하, 10 mg 이하, 5 mg 이하, 4 mg 이하, 3 mg 이하, 2 mg 이하, 또는 1 mg 이하 중 하나; 또는 약 범위 0.1-5 ng/ml, 0.1-0.2, 0.1-0.3, 0.1-0.4, 0.1-0.5, 0.1-0.6, 0.1-0.7, 0.1-0.8, 0.1-0.9, 0.1-1.0, 0.1-1.5, 0.1-0.2.0, 0.1-2.5, 0.1-3.0, 0.1-3.5, 0.1-4.0, 0.1-4.5, 0.1-5.0 ng/ml 사이 중 하나를 포함한다.
일부 실시양태에서, HS16의 시험관 내 및 생체 내 사용은 외인성 TGFβ1의 첨가를 배제한다. 예를 들어, 본 발명의 일부 세포 배양 방법에서, 외인성 TGFβ1은 배양물에 첨가되지 않는다.
본 발명은, 이러한 조합이 명백히 허용될 수 없거나 또는 분명히 회피되는 경우를 제외하고는, 기술된 측면 및 바람직한 특징의 조합을 포함한다.
본원에 사용된 항목 머릿글은 단지 구성적 목적을 위한 것이며 기재된 주제로 한정하는 것으로 해석되지 않는다.
본 발명의 측면 및 실시양태는 이하에서 첨부되는 도면을 참조하여 예시로서 설명될 것이다. 추가적인 측면 및 실시양태가 당업자에게 명백할 것이다. 본 명세서에서 언급되는 모든 문헌들은 참조로서 본원에 포함된다.
이어지는 청구범위를 비롯해 본 명세서 전체에서, 맥락이 다르게 요구하지 않는 한, 용어 "포함하다 (comprise)" 및 이의 변형, 예컨대 "포함하다 (comprises)" 및 "포함하는 (comprising)"은 정수 또는 단계의 임의의 다른 정수 또는 단계 또는 그룹의 배제가 아닌, 언급된 정수 또는 단계 또는 그룹의 포함을 의미하는 것으로 이해될 것이다.
본 명세서 및 첨부의 청구범위에서 사용된 바와 같이, 단수 형태 "하나 (a)," "한 (an)" 및 "그 (the)"는 맥락이 명백하게 달리 지시하지 않는 한 복수 지시대상을 포함하는 것임이 주지되어야 한다. 범위는 본원에서 "약" 하나의 특정 값으로부터 및/또는 "약" 다른 하나의 특정 값까지로서 표현될 수 있다. 이러한 범위가 표현되는 경우, 다른 실시양태는 하나의 특정 값으로부터 및/또는 다른 특정 값까지를 포함한다. 유사하게, 값들이 선행하는 "약"의 사용에 의해 대략으로서 표현되는 경우, 특정 값이 또 다른 실시양태를 형성하는 것으로 이해될 것이다.
본 발명의 원리를 설명하는 실시양태 및 실험이 이하에서 첨부되는 도면을 참조하여 논의될 것이다:
도 1A 및 1B. TGF-β1에 결합하는 헤파린을 나타내는 차트. ( A) 헤파린에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( B) 주입된 TGF-β1의 다양한 농도 (50 내지 800 nM)에 대한 결합 반응에 있어서의 변화를 나타내는 SPR 센소그램. 주입된 단백질의 함수로서 결합 반응 (RU)을 플롯팅하여 표준 곡선을 작성하였다. 헤파린에 대한 TGF-β1결합의 Kd는 ~0.475 μM인 것으로 평가되었다.
도 2A 내지 2D. 헤파린 결합은 TGF-β1 활성을 증강시킨다. (A) 헤파린 (25 μM) (TGF-β1+Hep) 함유 또는 헤파린 미함유의 (TGF-β1) TGF-β1 (2.5 μM) 및 DTT (10 mM)의 DSF로부터 수득된 융해 곡선의 1차 도함수 (first derivative)를 나타내는 차트. 각 조건하에서 TGF-β1의 융해 온도가 각 그래프의 피크에서 취해졌다. (B) 상대적 단백질 수준을 나타내는 웨스턴 블롯 및 차트: 세포를 TGF-β1 (1 또는 5 ng/ml)으로 처리하고, 실온에서 10분간 다양한 양 (0, 10 또는 40 μg/ml)의 헤파린 (Hep)으로 사전-인큐베이션하고, 6시간 후 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하고 액틴에 대한 농도계측으로 정량하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다. (C) 연골발생 배지 (Media) 또는 헤파린 (10 μg/ml) (Media+Hep) 함유 연골발생 배지에서 3일간 배양된 연골발생 미세군집 (micromass) 펠렛에서 SOX9 및 COMP의 정량적 PCR의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. (D) DMSO 또는 SB431542 (10 μM) 처리 후, qPCR에 의해 측정되는 바와 같이, 3일째 연골발생 미세군집 펠렛에서 SOX9 및 COMP 발현의 억제를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 3A 내지 3C. TGF-β1 결합 및 활성을 위한 헤파린 길이 요건. (A) 주입 전에 5 또는 10 μg의 헤파린 (Hep) 또는 크기 분획된 헤파린 (dp4 내지 24)으로 사전-인큐베이션되는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. (B) 다양한 헤파린 단편 (dp14-24) 또는 비분획화된 헤파린 (Hep)에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 다양한 헤파린 단편 (dp14-24) 또는 비분화된 헤파린 (Hep)으로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다.
도 4A 내지 4C. TGF-β1 결합 및 활성을 위한 헤파린 황산화 요건. (A) 주입 전에 5 또는 10 μg의 헤파린 (Hep), 2-O-탈황산화된 헤파린 (2-O-de), 6-O-탈황산화된 헤파린 (6-O-de) 또는 N-탈황산화된 헤파린 (N-de) 중 하나와 사전-인큐베이션하는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. (B) 선택적으로 탈황산화되거나 (2-O-de, 6-O-de 또는 N-de) 또는 완전히 황산화된 헤파린 (Hep)에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석을 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 다양한 선택적으로 탈황산화되거나 (2-O-de, 6-O-de 또는 N-de) 또는 완전히 황산화된 헤파린 (Hep)으로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅에 의해 결정하였다.
도 5A 및 5B. TGF-β1 헤파린-결합 부위의 동정. ( A) 프로텍트-앤드-라벨 전략 (Protect-and-Label strategy)에 의해 동정된 TGF-β1 아미노산 서열과 리신의 위치 [서열번호: 3]. TGF-β1의 이미 공개된 헤파린-결합 도메인 (HBD)에는 밑줄이 그어져 있다. 높은 신뢰도 (*) 및 중간 신뢰도 (^)로 동정된 리신이 표시된다. (B) TGF-β1의 예측된 3차원 구조상에 맵핑된 동정된 리신의 위치 (PDB: 1KLC [51]). 맨 윗줄, 리본 다이어그램. 맨 아랫줄, 상응하는 분자 표면. 좌측 칼럼 및 우측 칼럼, 수평 축 주변의 TGF-β1의 180° 회전.
도 6A 내지 6F. 친화성 선택된 TGF-β1-결합 HS (HS16+ ve)의 분리. ( A) 상업적으로 이용가능한 HSPM으로부터 TGF-β1-결합 HS 집단의 분리에 사용된 펩티드를 나타내는 성숙 TGF-β1의 아미노산 서열 [서열번호: 3]. ( B) 3H-헤파린에 결합하는 펩티드의 능력을 결정하기 위한 3H-헤파린 결합 분석의 결과를 나타내는 차트. 펩티드를 니트로셀룰로스 막 상에 흡착시킨 후 3H-헤파린에 결합하게 하였다. 펩티드에 결합된 헤파린의 양을 신틸레이션 계수기 (scintillation counter)를 이용해 정량하였다. PBS를 음성 대조군으로 제공하였다. 오차 막대는 표준 편차 (n = 2)를 나타낸다. ( C) TGF-β1 펩티드를 이용한 친화성 선별 후 수득된 HS 분획의 크로마토그램. 펩티드에 결합하지 않은 HS (HS16- ve)를 먼저 용출한 반면, 펩티드에 결합된 HS (HS16+ ve)는 1.5 M NaCl로 용출하였다. ( D) 상업적으로 이용가능한 HSPM (P4)로부터의 TGF-β1-결합 HS 집단의 분리에 사용된 펩티드 및 또한 검사된 다른 3종의 펩티드 (P1, P2, P3)의 성숙 TGF-β1의 아미노산 서열. ( E) PBS 및 각각의 P1, P2, P3, P4에 대한 HSPM의 상대적 결합을 나타내는 차트. ( F) HS16의 크로마토그래피 분리를 예시하는 다이어그램.
도 7A 내지 7C. HS16+ ve의 특성 분석. ( A) HS16+ ve (상부), HS16- ve (중간) 및 HSPM (하부)의 양성자 NMR 스펙트럼. 화살표는 이들 당류 사이의 스펙트럼의 차이를 나타낸다. ( B) HS16+ ve, HS16- ve 및 HSPM의 크기 배제 크로마토그램. 헤파린 크기 표준품 (dp8, 12, 20 및 26)의 용출 시간이 그래프 위에 표시된다. ( C) 헤파린 리아제 분해된 HS16+ve, HS16-ve 및 HSPM의 디사카라이드 조성을 나타내는 차트.
도 8A 내지 8H. HS16+ ve은 TGF-β1에 결합하여 이의 시그널링을 강화한다. (A) 주입 전에 5 또는 10 μg의 HS16+ ve, HS16- ve 또는 HSPM 중 하나와 함께 사전-인큐베이션되는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. ( B) 겔 전기영동의 제시: 단독으로 또는 지시된 GAG와 인큐베이션된 TGF-β1의 플라스민 분해. 시료를 1.5시간 동안 분해하고, 4-12% SDS-PAGE 상에 용해하고, 은 염색으로 시각화하였다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 헤파린 (Hep), HSPM, HS16+ ve 또는 HS16- ve로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다. 주입 전에 5 또는 10 μg의 (D) HSPM, (E) HS16+ve, (F) HS16-ve 또는 (G) 헤파린 (Hep)으로 사전-인큐베이션하는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. ( H) 막대 차트는 헤파린-코팅된 표면과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타낸다. 명확히는, 임의의 GAG 부재 (즉, 0 μg)의 TGF-β1의 결합 반응은 헤파린에 대해서만 나타난다. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 9. 헤파린/HS와 TGF-β1의 상호작용에 대한 도식적 모델. Lyon 등 (2)에 의해 제안된 모델에 따르면, 헤파린/HS 사슬 (실선)은 어느 하나의 단량체 상의 K26 잔기를 통해 TGF-β1과 상호작용한다. 이 모델은 2개의 단백질 단량체의 접촉면 사이에 그루브 (groove)를 인도하는 헤파린/HS 사슬을 포함할 것이다. K13의 위치는 TGF-β1의 결합에 필요한 이러한 공간적 배향의 채택에서 당쇄를 보조할 것이다. Khan 등 (57)에 의해 최근에 공개된 헤파린 구조와 예측된 TGF-β1 구조의 비교는 또한 dp22 헤파린 단편이 어느 하나의 단량체 상의 K26 잔기를 사이의 거리를 연결하기에 충분할 것임을 제안한다.
도 10A 내지 10C. HS16+ ve는 LTGF-β1 시그널링을 강화한다. ( A) 웨스턴 블롯: 세포를 LTGF-β1 (3.3 ng/ml)로 처리하고, 10 μg/ml의 헤파린 (Hep), HSPM, HS16+ ve 또는 HS16- ve로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다. ( B) 헤파린/HS와 LTGF-β1의 상호작용에 대한 도식적 모델. LTGF-β1 구조에 도 9로부터의 동일한 헤파린-결합 모델을 적용하면 (PDB: 3RJR (60)), K13 잔기는 성숙 TGF-β1에 대한 잠재성 연관 펩티드 (LAP, 채색된 베이지)의 결합을 방해하도록 헤파린/HS 사슬의 배향으로 보조할 수 있다 (적색선). ( C) LAP가 TGF-β1 동종이량체 주위를 감싸는 방법을 입증하는 LTGF-β1의 리본 다이어그램.
도 11. TGF-β1 합성 과정을 나타내는 다이어그램. TGF-β1은 시그널 펩티드 (S), 잠재성-연관 펩티드 (LAP) 및 TGF-β1 자체를 함유하는, 390개 아미노산 프리프로단백질(preproprotein)로서 합성된다. 번역 후, 시그널 펩티드는 절단되고, 이황화 결합이 2개의 단량체 사이에 형성된 후, LAP이 TGF-β1로부터 절단된다. LAP 및 TGF-β1은 그 후에 비-공유적으로 재-연합하여 작은 잠재성 복합체 (SLC)로도 알려진 잠재성 TGF-β1 (LTGF-β1)을 형성한다. 이황화 결합을 황색으로 채색된다.
도 12. HSPM, HS16+ve 및 HS3+ve 조성의 비교. HSPM, HS16+ve 및 HS3+ve, HSPM의 BMP-2-결합 분획 사이의 조성적 차이를 나타내는 막대 차트. HSPM 및 HS16+ve 조성은 HPLC로 결정하였는데, 이는 미량의 (rare) UA,2S-GlcNAc,6S 디사카라이드는 검출할 수 없었던 반면, HS3+ve 조성은 모세관 전기영동으로 결정하였다. 오차 막대는 오차 간격을 나타내는데, 이는 95로 설정된 신뢰 한계 (confidence limits)를 갖는 스튜던츠 t-분포를 이용하여 결정되었다. HS3+ve에 대한 데이터는 문헌 [Murali, S., et al., Affinity-selected heparan sulfate for bone repair. Biomaterials, 2013. 34(22): p. 5594-5605]으로부터 취해져 비교에 사용하였다.
도 13A 내지 13E. BMP-2에 대한 HS16+ve 및 HS3+ve 결합의 비교. 주입 전에 5 또는 10 μg의 (A) HSPM, (B) HS3+ve, (C) HS16+ve 또는 (D) 헤파린 (Hep)으로 사전-인큐베이션되는 경우, 25 nM의 BMP-2의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. ( E) 막대 차트는 헤파린-코팅된 표면과 BMP-2 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타낸다. 명확히는, 임의의 GAG 부재 (즉, 0 μg)의 BMP-2의 결합 반응은 헤파린에 대해서만 나타난다. 데이터를 25 nM BMP-2 단독에 대해 표준화하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 14. HS16+ve의 BMP-2 강화 능력. C2C12 세포에서 알칼라인 포스파타제 (ALP)의 BMP-2-유도성 발현을 증강시키는 HSPM, HS16+ve 및 HS3+ve의 능력을 나타내는 막대 차트. 오차 막대는 SD (n = 4)를 나타낸다. * P < 0.05, ** P < 0.01, ** P < 0.001.
도 15. 분화하는 hMSC에서 습식 중량 변화. 시간의 경과에 따라서 TGF-β1 존재 (TGF-β1) 또는 부재 (Ctrl)로 처리된 연골발생적으로 분화된 펠렛의 중량 변화를 나타내는 그래프. 오차 막대는 SD (n = 3)를 나타낸다. *** P < 0.001, Ctrl 대비 .
도 16A 내지 16E. 분화하는 hMSC에서 연골발생 유전자 발현. 10 ng/mL TGF-β1 존재 (TGF-β1) 또는 부재 (Ctrl)로 처리된 펠렛에서 시간의 경과에 따른 (A) SOX9, (B) COMP, (C) 어그리칸, (D) 콜라겐 타입 2α1, 및 (E) 콜라겐 타입 10α1 mRNA 발현 수준을 나타내는 그래프. 콜라겐 타입 2α1 mRNA는 Ctrl 펠렛에서 검출되지 않았다. 오차 막대는 SD (n = 3)을 나타낸다. * P < 0.05, ** P < 0.01, *** P < 0.001, Ctrl 대비.
도 17A 및 17B. 초기 연골발생 유전자 발현에 대한 헤파린의 효과. 지시된 바와 같이 처리된 연골발생 배지에서 3일의 분화 후 hMSC 내 (A) SOX9 및 (B) COMP mRNA 발현 수준을 나타내는 막대 차트. Ctrl - 대조군; 5 Hep - 5 μg/mL 헤파린; 10 Hep - 10 μg/mL 헤파린; 1 TGF-β1 - 1 ng/mL TGF-β1; 10 TGF-β1 - 10 ng/mL TGF-β1. 오차 막대는 SD (n = 3)을 나타낸다. * P <0.05, *** P <, Ctrl 대비. # P <0.05, ### P < 0.001, 1 TGF-β1 대비.
도 18A 내지 18D. hMSC의 연골발생 유전자 발현에 대한 분리된 HS 분획의 효과. 1 또는 10 ng/mL TGF-β1 (각각, 1 TGF-β1 및 10 TGF-β1) 및 10 μg/mL의 지시된 GAG 함유 연골발생 배지에서 21일간 배양된 펠렛에서 (A) SOX9, (B) COMP, (C) 어그리칸 및 (D) 콜라겐 타입 10α1 mRNA 발현 수준을 나타내는 산점도 (scatterplots). 콜라겐 타입 2α1 mRNA는 10 ng/mL TGF-β1로 처리된 펠렛에서만 유일하게 검출되었다. 중간 선은 평균을 나타내는 반면, 오차 막대는 SD (n = 3)을 나타낸다. * P < 0.05, *** P < 0.001, 1 TGF-β1 대비. 1 TGF-β1+HS16+ve 데이터 세트에 나타난 이상치 (outlier)를 주목한다.
도 19. 성숙 인간 TGF-β1 [서열번호: 3] 및 토끼 TGF-β1 [서열번호: 4]의 서열 정렬. 성숙 인간 TGF-β1의 예측된 헤파린-결합 도메인 내 아미노산 잔기를 밑줄로 나타내고 "프로텍트 앤드 라벨" 기법에 의해 동정된 리신 (K)은 볼드체로 나타낸다.
도 20A 및 20B. 처리군의 거시적 점수 (macroscopic scores). 각 처리군에 대한 ICRS I 점수의 산점도. (A) 중간 선은 평균 점수를 나타내고, 오차 막대는 SE를 나타낸다. (B) 선은 평균 점수를 나타낸다.
도 1A 및 1B. TGF-β1에 결합하는 헤파린을 나타내는 차트. ( A) 헤파린에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( B) 주입된 TGF-β1의 다양한 농도 (50 내지 800 nM)에 대한 결합 반응에 있어서의 변화를 나타내는 SPR 센소그램. 주입된 단백질의 함수로서 결합 반응 (RU)을 플롯팅하여 표준 곡선을 작성하였다. 헤파린에 대한 TGF-β1결합의 Kd는 ~0.475 μM인 것으로 평가되었다.
도 2A 내지 2D. 헤파린 결합은 TGF-β1 활성을 증강시킨다. (A) 헤파린 (25 μM) (TGF-β1+Hep) 함유 또는 헤파린 미함유의 (TGF-β1) TGF-β1 (2.5 μM) 및 DTT (10 mM)의 DSF로부터 수득된 융해 곡선의 1차 도함수 (first derivative)를 나타내는 차트. 각 조건하에서 TGF-β1의 융해 온도가 각 그래프의 피크에서 취해졌다. (B) 상대적 단백질 수준을 나타내는 웨스턴 블롯 및 차트: 세포를 TGF-β1 (1 또는 5 ng/ml)으로 처리하고, 실온에서 10분간 다양한 양 (0, 10 또는 40 μg/ml)의 헤파린 (Hep)으로 사전-인큐베이션하고, 6시간 후 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하고 액틴에 대한 농도계측으로 정량하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다. (C) 연골발생 배지 (Media) 또는 헤파린 (10 μg/ml) (Media+Hep) 함유 연골발생 배지에서 3일간 배양된 연골발생 미세군집 (micromass) 펠렛에서 SOX9 및 COMP의 정량적 PCR의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. (D) DMSO 또는 SB431542 (10 μM) 처리 후, qPCR에 의해 측정되는 바와 같이, 3일째 연골발생 미세군집 펠렛에서 SOX9 및 COMP 발현의 억제를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 3A 내지 3C. TGF-β1 결합 및 활성을 위한 헤파린 길이 요건. (A) 주입 전에 5 또는 10 μg의 헤파린 (Hep) 또는 크기 분획된 헤파린 (dp4 내지 24)으로 사전-인큐베이션되는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. (B) 다양한 헤파린 단편 (dp14-24) 또는 비분획화된 헤파린 (Hep)에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석의 결과를 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 다양한 헤파린 단편 (dp14-24) 또는 비분화된 헤파린 (Hep)으로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다.
도 4A 내지 4C. TGF-β1 결합 및 활성을 위한 헤파린 황산화 요건. (A) 주입 전에 5 또는 10 μg의 헤파린 (Hep), 2-O-탈황산화된 헤파린 (2-O-de), 6-O-탈황산화된 헤파린 (6-O-de) 또는 N-탈황산화된 헤파린 (N-de) 중 하나와 사전-인큐베이션하는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. (B) 선택적으로 탈황산화되거나 (2-O-de, 6-O-de 또는 N-de) 또는 완전히 황산화된 헤파린 (Hep)에 결합하는 TGF-β1의 능력을 결정하기 위한 GAG-결합 플레이트 분석을 나타내는 차트. 오차 막대는 표준 편차 (n = 3)를 나타낸다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 다양한 선택적으로 탈황산화되거나 (2-O-de, 6-O-de 또는 N-de) 또는 완전히 황산화된 헤파린 (Hep)으로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅에 의해 결정하였다.
도 5A 및 5B. TGF-β1 헤파린-결합 부위의 동정. ( A) 프로텍트-앤드-라벨 전략 (Protect-and-Label strategy)에 의해 동정된 TGF-β1 아미노산 서열과 리신의 위치 [서열번호: 3]. TGF-β1의 이미 공개된 헤파린-결합 도메인 (HBD)에는 밑줄이 그어져 있다. 높은 신뢰도 (*) 및 중간 신뢰도 (^)로 동정된 리신이 표시된다. (B) TGF-β1의 예측된 3차원 구조상에 맵핑된 동정된 리신의 위치 (PDB: 1KLC [51]). 맨 윗줄, 리본 다이어그램. 맨 아랫줄, 상응하는 분자 표면. 좌측 칼럼 및 우측 칼럼, 수평 축 주변의 TGF-β1의 180° 회전.
도 6A 내지 6F. 친화성 선택된 TGF-β1-결합 HS (HS16+ ve)의 분리. ( A) 상업적으로 이용가능한 HSPM으로부터 TGF-β1-결합 HS 집단의 분리에 사용된 펩티드를 나타내는 성숙 TGF-β1의 아미노산 서열 [서열번호: 3]. ( B) 3H-헤파린에 결합하는 펩티드의 능력을 결정하기 위한 3H-헤파린 결합 분석의 결과를 나타내는 차트. 펩티드를 니트로셀룰로스 막 상에 흡착시킨 후 3H-헤파린에 결합하게 하였다. 펩티드에 결합된 헤파린의 양을 신틸레이션 계수기 (scintillation counter)를 이용해 정량하였다. PBS를 음성 대조군으로 제공하였다. 오차 막대는 표준 편차 (n = 2)를 나타낸다. ( C) TGF-β1 펩티드를 이용한 친화성 선별 후 수득된 HS 분획의 크로마토그램. 펩티드에 결합하지 않은 HS (HS16- ve)를 먼저 용출한 반면, 펩티드에 결합된 HS (HS16+ ve)는 1.5 M NaCl로 용출하였다. ( D) 상업적으로 이용가능한 HSPM (P4)로부터의 TGF-β1-결합 HS 집단의 분리에 사용된 펩티드 및 또한 검사된 다른 3종의 펩티드 (P1, P2, P3)의 성숙 TGF-β1의 아미노산 서열. ( E) PBS 및 각각의 P1, P2, P3, P4에 대한 HSPM의 상대적 결합을 나타내는 차트. ( F) HS16의 크로마토그래피 분리를 예시하는 다이어그램.
도 7A 내지 7C. HS16+ ve의 특성 분석. ( A) HS16+ ve (상부), HS16- ve (중간) 및 HSPM (하부)의 양성자 NMR 스펙트럼. 화살표는 이들 당류 사이의 스펙트럼의 차이를 나타낸다. ( B) HS16+ ve, HS16- ve 및 HSPM의 크기 배제 크로마토그램. 헤파린 크기 표준품 (dp8, 12, 20 및 26)의 용출 시간이 그래프 위에 표시된다. ( C) 헤파린 리아제 분해된 HS16+ve, HS16-ve 및 HSPM의 디사카라이드 조성을 나타내는 차트.
도 8A 내지 8H. HS16+ ve은 TGF-β1에 결합하여 이의 시그널링을 강화한다. (A) 주입 전에 5 또는 10 μg의 HS16+ ve, HS16- ve 또는 HSPM 중 하나와 함께 사전-인큐베이션되는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. 헤파린 코팅된 칩과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타내는 대표적인 막대 차트. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. ( B) 겔 전기영동의 제시: 단독으로 또는 지시된 GAG와 인큐베이션된 TGF-β1의 플라스민 분해. 시료를 1.5시간 동안 분해하고, 4-12% SDS-PAGE 상에 용해하고, 은 염색으로 시각화하였다. ( C) 웨스턴 블롯: 세포를 TGF-β1 (1 ng/ml)로 처리하고, 10 μg/ml의 헤파린 (Hep), HSPM, HS16+ ve 또는 HS16- ve로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다. 주입 전에 5 또는 10 μg의 (D) HSPM, (E) HS16+ve, (F) HS16-ve 또는 (G) 헤파린 (Hep)으로 사전-인큐베이션하는 경우, 200 nM의 TGF-β1의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. ( H) 막대 차트는 헤파린-코팅된 표면과 TGF-β1 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타낸다. 명확히는, 임의의 GAG 부재 (즉, 0 μg)의 TGF-β1의 결합 반응은 헤파린에 대해서만 나타난다. 데이터를 200 nM TGF-β1 단독에 대해 표준화하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 9. 헤파린/HS와 TGF-β1의 상호작용에 대한 도식적 모델. Lyon 등 (2)에 의해 제안된 모델에 따르면, 헤파린/HS 사슬 (실선)은 어느 하나의 단량체 상의 K26 잔기를 통해 TGF-β1과 상호작용한다. 이 모델은 2개의 단백질 단량체의 접촉면 사이에 그루브 (groove)를 인도하는 헤파린/HS 사슬을 포함할 것이다. K13의 위치는 TGF-β1의 결합에 필요한 이러한 공간적 배향의 채택에서 당쇄를 보조할 것이다. Khan 등 (57)에 의해 최근에 공개된 헤파린 구조와 예측된 TGF-β1 구조의 비교는 또한 dp22 헤파린 단편이 어느 하나의 단량체 상의 K26 잔기를 사이의 거리를 연결하기에 충분할 것임을 제안한다.
도 10A 내지 10C. HS16+ ve는 LTGF-β1 시그널링을 강화한다. ( A) 웨스턴 블롯: 세포를 LTGF-β1 (3.3 ng/ml)로 처리하고, 10 μg/ml의 헤파린 (Hep), HSPM, HS16+ ve 또는 HS16- ve로 실온에서 10분간 사전-인큐베이션하고, 6시간째에 용해하였다. 인산화된 SMAD2 (pSMAD2) 및 SMAD3 (pSMAD3), 총 SMAD2/3 및 액틴 수준을 웨스턴 블롯팅으로 결정하였다. ( B) 헤파린/HS와 LTGF-β1의 상호작용에 대한 도식적 모델. LTGF-β1 구조에 도 9로부터의 동일한 헤파린-결합 모델을 적용하면 (PDB: 3RJR (60)), K13 잔기는 성숙 TGF-β1에 대한 잠재성 연관 펩티드 (LAP, 채색된 베이지)의 결합을 방해하도록 헤파린/HS 사슬의 배향으로 보조할 수 있다 (적색선). ( C) LAP가 TGF-β1 동종이량체 주위를 감싸는 방법을 입증하는 LTGF-β1의 리본 다이어그램.
도 11. TGF-β1 합성 과정을 나타내는 다이어그램. TGF-β1은 시그널 펩티드 (S), 잠재성-연관 펩티드 (LAP) 및 TGF-β1 자체를 함유하는, 390개 아미노산 프리프로단백질(preproprotein)로서 합성된다. 번역 후, 시그널 펩티드는 절단되고, 이황화 결합이 2개의 단량체 사이에 형성된 후, LAP이 TGF-β1로부터 절단된다. LAP 및 TGF-β1은 그 후에 비-공유적으로 재-연합하여 작은 잠재성 복합체 (SLC)로도 알려진 잠재성 TGF-β1 (LTGF-β1)을 형성한다. 이황화 결합을 황색으로 채색된다.
도 12. HSPM, HS16+ve 및 HS3+ve 조성의 비교. HSPM, HS16+ve 및 HS3+ve, HSPM의 BMP-2-결합 분획 사이의 조성적 차이를 나타내는 막대 차트. HSPM 및 HS16+ve 조성은 HPLC로 결정하였는데, 이는 미량의 (rare) UA,2S-GlcNAc,6S 디사카라이드는 검출할 수 없었던 반면, HS3+ve 조성은 모세관 전기영동으로 결정하였다. 오차 막대는 오차 간격을 나타내는데, 이는 95로 설정된 신뢰 한계 (confidence limits)를 갖는 스튜던츠 t-분포를 이용하여 결정되었다. HS3+ve에 대한 데이터는 문헌 [Murali, S., et al., Affinity-selected heparan sulfate for bone repair. Biomaterials, 2013. 34(22): p. 5594-5605]으로부터 취해져 비교에 사용하였다.
도 13A 내지 13E. BMP-2에 대한 HS16+ve 및 HS3+ve 결합의 비교. 주입 전에 5 또는 10 μg의 (A) HSPM, (B) HS3+ve, (C) HS16+ve 또는 (D) 헤파린 (Hep)으로 사전-인큐베이션되는 경우, 25 nM의 BMP-2의 결합 반응에 있어서의 변화를 나타내는 대표적인 SPR 센소그램. ( E) 막대 차트는 헤파린-코팅된 표면과 BMP-2 결합에 대해 경쟁하는 다양한 GAG의 능력을 나타낸다. 명확히는, 임의의 GAG 부재 (즉, 0 μg)의 BMP-2의 결합 반응은 헤파린에 대해서만 나타난다. 데이터를 25 nM BMP-2 단독에 대해 표준화하였다. 오차 막대는 표준 편차 (n = 3)를 나타낸다.
도 14. HS16+ve의 BMP-2 강화 능력. C2C12 세포에서 알칼라인 포스파타제 (ALP)의 BMP-2-유도성 발현을 증강시키는 HSPM, HS16+ve 및 HS3+ve의 능력을 나타내는 막대 차트. 오차 막대는 SD (n = 4)를 나타낸다. * P < 0.05, ** P < 0.01, ** P < 0.001.
도 15. 분화하는 hMSC에서 습식 중량 변화. 시간의 경과에 따라서 TGF-β1 존재 (TGF-β1) 또는 부재 (Ctrl)로 처리된 연골발생적으로 분화된 펠렛의 중량 변화를 나타내는 그래프. 오차 막대는 SD (n = 3)를 나타낸다. *** P < 0.001, Ctrl 대비 .
도 16A 내지 16E. 분화하는 hMSC에서 연골발생 유전자 발현. 10 ng/mL TGF-β1 존재 (TGF-β1) 또는 부재 (Ctrl)로 처리된 펠렛에서 시간의 경과에 따른 (A) SOX9, (B) COMP, (C) 어그리칸, (D) 콜라겐 타입 2α1, 및 (E) 콜라겐 타입 10α1 mRNA 발현 수준을 나타내는 그래프. 콜라겐 타입 2α1 mRNA는 Ctrl 펠렛에서 검출되지 않았다. 오차 막대는 SD (n = 3)을 나타낸다. * P < 0.05, ** P < 0.01, *** P < 0.001, Ctrl 대비.
도 17A 및 17B. 초기 연골발생 유전자 발현에 대한 헤파린의 효과. 지시된 바와 같이 처리된 연골발생 배지에서 3일의 분화 후 hMSC 내 (A) SOX9 및 (B) COMP mRNA 발현 수준을 나타내는 막대 차트. Ctrl - 대조군; 5 Hep - 5 μg/mL 헤파린; 10 Hep - 10 μg/mL 헤파린; 1 TGF-β1 - 1 ng/mL TGF-β1; 10 TGF-β1 - 10 ng/mL TGF-β1. 오차 막대는 SD (n = 3)을 나타낸다. * P <0.05, *** P <, Ctrl 대비. # P <0.05, ### P < 0.001, 1 TGF-β1 대비.
도 18A 내지 18D. hMSC의 연골발생 유전자 발현에 대한 분리된 HS 분획의 효과. 1 또는 10 ng/mL TGF-β1 (각각, 1 TGF-β1 및 10 TGF-β1) 및 10 μg/mL의 지시된 GAG 함유 연골발생 배지에서 21일간 배양된 펠렛에서 (A) SOX9, (B) COMP, (C) 어그리칸 및 (D) 콜라겐 타입 10α1 mRNA 발현 수준을 나타내는 산점도 (scatterplots). 콜라겐 타입 2α1 mRNA는 10 ng/mL TGF-β1로 처리된 펠렛에서만 유일하게 검출되었다. 중간 선은 평균을 나타내는 반면, 오차 막대는 SD (n = 3)을 나타낸다. * P < 0.05, *** P < 0.001, 1 TGF-β1 대비. 1 TGF-β1+HS16+ve 데이터 세트에 나타난 이상치 (outlier)를 주목한다.
도 19. 성숙 인간 TGF-β1 [서열번호: 3] 및 토끼 TGF-β1 [서열번호: 4]의 서열 정렬. 성숙 인간 TGF-β1의 예측된 헤파린-결합 도메인 내 아미노산 잔기를 밑줄로 나타내고 "프로텍트 앤드 라벨" 기법에 의해 동정된 리신 (K)은 볼드체로 나타낸다.
도 20A 및 20B. 처리군의 거시적 점수 (macroscopic scores). 각 처리군에 대한 ICRS I 점수의 산점도. (A) 중간 선은 평균 점수를 나타내고, 오차 막대는 SE를 나타낸다. (B) 선은 평균 점수를 나타낸다.
실시예
실시예
1: 헤파린/
헤파란
설페이트
-전환 성장인자-
β1
상호작용 및 시그널 강화를 위한 구조적 요건
배경: 헤파린은 전환 성장인자-β1 (TGF-β1)에 결합하여 이의 시그널링을 강화할 수 있다.
결과: 헤파린/헤파란 설페이트 (HS)와 TGF-β1의 상호작용의 분자적 결정요인을 동정하였다.
결론: TGF-β1 시그널 강화에 영향을 미치는 헤파린/HS와 TGF-β1의 상호작용을 위한 구조적 요건을 정의한다.
의의: HS-TGF-β1 상호작용의 이해는 TGF-β1 요법 개발을 인도할 수 있다.
요약
전환 성장인자-β1 (TGF-β1)은 인간 중간엽 줄기세포 (hMSC)에 의한 연골형성의 개시를 비롯해, 다수의 생리학적 과정에 관련되어 있는 헤파린 결합 단백질이다. 본원에서 본 발명자들은 헤파린이 TGF-β1에 결합하여 hMSC에 대한 TGF-β1 시그널링을 강화할 수 있음을 보여준다. 이러한 강화는 TGF-β 수용체를 통한 TGF-β1 경로의 조절을 통해서 일어나고 초기 연골발생 유전자의 상향조절을 초래한다. 분자적 상호작용 및 세포-기반 분석은 또한, 18-22개 사카라이드 (dp18-22) 길이이고 2-O-황산화가 결여된 헤파린 사슬이 TGF-β1 결합에 최적임을 입증하였디. 구조 단백질학을 통한 TGF-β1과 헤파린 사이의 상호작용에 대한 의문 (Interrogation)은 헤파린 결합에 관여하는 TGF-β1 상의 신규한 리신 잔기의 동정을 가능케 하였다. 이러한 정보를 이용해 본 발명자들은 TGF-β1에 증가된 친화성을 갖는 돼지 점막 헤파란 설페이트 (HS)의 아-분획을 분리하였다. 이 TGF-β1-결합 HS는 최초 출발 HS에 비해 TGF-β1 및 잠재성 TGF-β1 둘 모두에 더 잘 결합하고 이들의 활성을 더 강화할 수 있었다. 이 연구는 TGF-β1과 헤파린의 상호작용을 위한 구조적 요건에 대한 최초의 보고이다. 이는 또한 외인성 단백질 용량이 그와 함께 감소되거나 면제될 수 있는, 연골 복구를 위한 TGF-β1 시그널링을 조절하기 위해 HS-기반 전략의 개발을 위한 토대를 마련한다.
서론
글루코사미노글리칸 (GAG) 헤파란 설페이트 (HS)1 및 헤파린은 다수의 세포외 단백질 및 성장인자에 결합하여 이들의 기능을 조절하는 것으로 알려진 구조적으로 관련된, 선형의 폴리사카라이드이다 (1). 전환 성장인자-β1 (TGF-β1)은 섬유증 (6,7), 피부 치유 (8), 암전이 (9,10) 및 연골형성 (11-15)에서 역할을 하는 것으로 나타난바 있는 강력한 헤파린-결합 성장인자 (2-5)이다. 인간 중간엽 줄기세포 (hMSC)의 연골발생 분화를 유도하고 연골발생 표현형을 유지하는 TGF-β1의 이 능력은 연골 복구 전략의 개발에 있어 TGF-β1을 특히 주목하게 만들었다 (13,15-18).
초기에는 성공적으로 보였으나, TGF-β1의 초과생리학적 (supraphysiological) 용량이 종종 소거(clearanve)를 극복하기 위해 사용되고, 심지어 적당한 용량에서조차 윤활막 (synovial) 염증 (19,20)과 같은 바람직하지 않은 결과를 초래하는 것으로 나타났기 때문에, 이러한 접근법은 이들의 임상으로의 전환에 중대한 장벽에 직면한다. 비-생리학적 용량의 문제와는 별도로, 섬유증 및 종양발생 (9,10,21)을 비롯한 전신 부작용을 촉발하는 것을 방지하기 위해 치료 부위에 성장인자를 국소화시키려는 요구가 여전히 존재한다. 나아가, TGF-β1에 대한 민감성은 연령에 따라 증가하고 (22), 따라서 적절한 TGF-β1 투여는 노령의 환자에게 훨씬 더 큰 위험을 가져온다. 이들 난제에 대하여, 외인성 성장인자에 대한 요구를 감소시키거나 완전히 제거하고, 치료 부위에서 성장인자의 전달을 더 잘 국소화시키고 제어하며, 성장인자에 대한 세포 민감성 또는 이 인자의 시그널링 효능 중 하나를 진작시키는 새로운 전략이 개발 중이다. 일부 그룹은 자가-조립 펩티드 양친매성 화합물 (amphiphiles) (23,24)의 사용을 통해 처음 2개 장애를 거의 해결하였고, TGF-β1의 내인성 수준이 국소 MSC 분화를 유도하기에 충분함을 입증하였다 (25). 그러나, 합성 펩티드 양친매성 화합물은 중요한 면역원성 위험을 제기하고, 목적하는 세포 표적 내부에서 시그널링 활성의 강화라는 필요성을 해결하지 못하였다. 이상적 요법은 외인성 TGF-β1 적용 없이 TGF-β1 시그널링을 강화하도록 작용할 것이다.
본 그룹은 앞서 HS GAG가 다수의 임상적으로 관련된 성장인자의 효과를 조절할 수 있음을 이미 보여주었다 (26-29). 본원에서 본 발명자들은 TGF-β1과 헤파린 및 HS 연합의 작용 기전, 및 이들의 hMSC 내 시그널링의 증강을 조사한다. 본 발명자들은 TGF-β1에의 헤파린 결합이 TGF-β 타입 I 수용체-SMAD2/3 경로를 통해 이의 활성을 강화하고, 이러한 결합을 위한 구조적 요건에 특정 제약이 있음을 입증한다. 또한, 본 발명자들은 돼지 점막 HS (HSPM)와 조성적으로 다르고 TGF-β1 시그널링의 증강에 있어서 이보다 더욱 효과적인 HS의 TGF-β1-결합 집단을 분리하는데 이 정보를 활용한다. 본원의 결과는 TGF-β1-HS 상호작용의 추가적인 연구를 위한 기반을 닦고, 조직 복구를 위한 hMSC 행위를 조절하는 HS-기반 전략의 개발을 지원한다.
실험 과정
인간
MSC
분리 및 세포 배양
일차 hMSC (Lonza)를 젊고 건장한 성인 인간 공여자의 골수 단핵구 세포로부터 플라스틱 부착 (plastic adherence)에 의해 분리하고 이전에 기술된 바와 같이 특성을 분석하였다 (30,31). 부착성 세포를 10% 송아지 태아 혈청, 100 U/ml 페니실린, 100 μg/ml 스트렙토마이신 및 2 mM L-글루타민이 보충된 DMEM-저 글루코스 (1000 mg/l, DMEM-LG)로 이루어진 기본 배지에서 유지하고, 가습 대기 중의 37℃ 및 5% CO2에서 표준 조건하에 배양하였다. 배지를 3일 마다 교체하였다. 세포가 75-80% 융합성에 도달하면 이를 0.125% 트립신/베르센 (Versene) (pH 7.0)을 이용해 탈착시키고, 동일한 배양 조건하에서 3,000 세포/cm2의 밀도로 재-도말하였다. 모든 실험은 계대 5에서의 세포를 가지고 수행하였다.
연골발생
분화
연골발생 분화를 Zhang 등 (32)에 의해 기술된 바와 같은 변형된 미세군집 배양 시스템을 이용하여 수행하였다. 간략히는, 계대 4의 hMSC를 수확하고 2 x 107세포/ml로 화학적으로 정의된 연골발생 배지 (PT-3003, Lonza)에 재현탁하였다. 12.5 μl의 액적 (Droplet)을 그 후에 24-웰 플레이트의 각 웰의 중앙에 접종하고 37℃에서 2시간 동안 부착되게 방치하고, 그 후에 10 ng/ml의 TGF-β1 (100-21C, PeproTech) 단독 (Media) 또는 TGF-β1과 10 μg/ml의 헤파린 (SigmaAldrich) (Media+Hep) 중 하나가 보충된 500 μl의 연골발생 배지를 각 웰에 첨가하였다. 세포 액적은 24시간 후 구형 덩어리로 뭉쳐지고 (coalesced) 이 미세군집을 3일째에 수확하였다.
TGF-β1-GAG 상호작용의 표면 플라스몬 공명 (SPR)-기반 분석
비오틴화된 헤파린을 Hernaiz 등에 의해 보고된 프로토콜을 토대로 제조하였다 (33). 간략히는, 20 mg의 헤파린을 1 ml의 물 중에서 필터-살균하고 (0.22 μm) 4℃에서 2시간 동안 20 μl의 디메틸 설폭사이드 (DMSO) 중에서 8.6 μmol의 N-히드록시석시니미드-비오틴 (NHS-비오틴) (Pierce)과 함께 인큐베이션하였다. 비오틴화된 헤파린을 그 후에 광범위하게 투석하여 (7000 MWCO) 비반응된 비오틴을 제거하였다. 스트렙타비딘 (SA) 센서 칩 (GE Healthcare) 상에 비오틴화된 헤파린의 고정화를 대략 40 반응 유닛 (RUs)의 표적화된 고정화 수준으로 Biacore T100 (GE Healthcare) 상에 고정화 위저드 (wizard)를 사용하여 실시하였다. HBS-EP 런닝 (running) 완충제 (10 mM HEPES, 150 mM NaCl, 3.0 mM EDTA, 0.05% (v/v) Tween 20, pH 7.4)를 고정화에 사용하였다.
TGF-β1-헤파린 상호작용은 HBS-EP-0.1 런닝 완충제 (0.05% (v/v) Tween 20 대신에 0.1%) 중에 희석된 일련의 TGF-β1 단백질 시료 (50 내지 800 nM 최종 농도)를 제조함으로써 이루어졌다. 경쟁적 결합 실험을 위해, HBS-EP-0.1 중의 200 nM TGF-β1의 최종 농도를 5 또는 10 μg의 하기 GAG 중 하나와 혼합하였다: 헤파린 (Hep); 크기-분획화된 헤파린 (중합도 dp4, 6, 8, 10, 12, 14, 16, 18, 20, 22 및 24) (Iduron); 선택적으로 탈황산화된 헤파린 (2-O-탈황산화된, 6-O-탈황산화된 및 N-탈황산화된) (Iduron); HSPM (HO-03103, CelsusLaboratories); 친화성-분리된 TGF-β1-결합 HS (HS16+ ve); 또는 TGF-β1-비-결합 HS (HS16- ve). 시료 용액을 그 후에 30 μl/분의 유속으로 120초 동안 헤파린-코팅된 칩 위에 주입하였고, 이어서 TGF-β1 해리를 모니터링하기 위해 추가의 1200초 동안 HBS-EP-0.1을 칩 위로 통과시켰다 (passed over). 해리 후, 칩 위의 센서 표면을 60초간 30 μl/분으로 주입된 2 M NaCl로 2번 세척하여 재생하였다. 반응을 25℃에서 시간의 함수 (센소그램)로 측정하였다. 각 조건에 대한 최대 결합 반응을 TGF-β1 단독으로부터 입수된 반응에 대해 표준화하였다.
GAG-결합 플레이트 분석
헤파린에 결합하는 TGF-β1의 능력을 결정하기 위하여, 본 발명자들은 포획 기질로서 양으로-하전된 GAG-결합 플레이트 (Iduron)를 사용하였다. GAG를 각 웰 내에 고정한 후 제조사의 지침에 따라서 TGF-β1으로 시험하였다. 간략히는, 3중 (triplicate) 웰을 먼저 표준 분석 완충제 (SAB: 100 mM NaCl, 50 mM 아세트산 나트륨, 0.2% v/v Tween 20, pH 7.2) 중에 제조된 5 μg/ml의 전장 헤파린, 크기-분획화된 헤파린 (dp14, 16, 18, 20, 22 및 24) 또는 선택적으로 de3ed 헤파린으로 사전-코팅한 후, 실온에서 밤새 인큐베이션하였다. 이어서 플레이트를 SAB로 3회 세심하게 세척하고 250 μl의 차단 용액 (0.4% w/v 어피 젤라틴, Sigma-Aldrich, in SAB)으로 차단하고, 37℃에서 1시간 동안 인큐베이션하였다. 그 후에 TGF-β1을 100, 200, 또는 400 ng/ml의 농도로 차단 용액 중에 용해시켰다. 플레이트를 SAB로 3회 세척하고 단백질의 각 희석액 (200 μl)을 3중 웰 내에 분주하고 37℃에서 2시간 동안 인큐베이션한 후, SAB로 세정하고 200 μl의 750 ng/ml 단일클론 마우스 항-TGF-β1 항체 (MAB2401, R&D Systems)를 차단 용액에 첨가하였다. 플레이트를 그 후에 37℃에서 1시간 동안 인큐베이션하고, SAB로 세척하고, 200 μl의 1 μg/ml 다중클론 염소 항-마우스 비오틴화된 항체 (ab6788, Abcam)를 차단 용액에 첨가하였다. 다시, 플레이트를 37℃에서 1시간 동안 인큐베이션하고, SAB로 세척하고, 200 μl의 220 ng/ml ExtrAvidin AP (Sigma-Aldrich)를 차단 용액에 첨가하고, 37℃에서 30분간 인큐베이션한 후, SAB로 세정하였다. 마지막으로, 200 μl의 발색 시약 (SigmaFAST p-니트로페닐 포스페이트, Sigma-Aldrich)을 첨가하고, 37℃에서 40분간 인큐베이션하고 1시간 이내에 405 nm에서 판독하였다.
감별 주사 열량측정법 (Differential scanning fluorimetry, DSF)
이전에 기술된 바와 같이, 7500 Fast Real PCR 시스템 (소프트웨어 버전 1.4, Applied Biosystems)에서 DSF를 수행하였다 (34,35). TGF-β1 (2.5 μM)을 헤파린 (25 μM) 존재 또는 부재로 시험하였다. TGF-β1의 융해를 촉진하기 위하여, 10 mM의 디티오트레이톨 (DTT)을 반응 혼합물에 첨가하였다. 실험을 이전에 기술된 바와 같이 진행하였다 (34). 융해 곡선의 1차 도함수 (First derivatives)를 Origin 7 (OriginLab Corp.)을 이용하여 계산하여 다양한 조건하에서 TGF-β1의 융점을 결정하였다. 실험은 오직 명확히 하기 위한 목적으로 3회 반복 실시하였으나, 본원에 제시된 데이터는 단지 반복된 실험의 평균을 나타낸다.
세포 용해 및 웨스턴 블롯팅
인간 MSC를 10,000 세포/cm2의 밀도로 24시간 동안 기초 배지 중의 6-웰 플레이트에서 배양하였다. 그 후에 TGF-β1 처리물을 1 ng/ml 또는 5 ng/ml 단독 중 하나로 또는 10 μg/ml 또는 40 μg/ml의 전장 헤파린, 또는 10 μg/ml 크기-분획화된 또는 선택적으로 탈황산화된 헤파린, HSPM, HS16+ 또는 HS16-와 함께 1 ng/ml의 TGF-β1 중 하나의 존재하에서 제조하고, 세포에 첨가하기 전에 10분간 실온에서 인큐베이션하였다. 잠재성 TGF-β1 (LTGF-β1) 처리물을 3.3 ng/ml 단독으로 또는 상기에 기술된 10 μg/ml의 다양한 GAG를 이용해 유사하게 제조하였다. 억제형 연구를 위해, 세포를 TGF-β1로 처리하기 전에 10 μM SB431542 (Sigma-Aldrich) 또는 DMSO로 30분간 사전-처리하였다. 세포를 그 후에 1, 6 또는 24시간 동안 다양한 TGF-β1 처리물에 적용하고 2x Laemmli 완충제 중에서 용해시킨 후, 4-12% SDS-PAGE 겔 상에서 용해시켰다(resolve). 시료를 그 후에 SMAD2/3 (#3102, Cell 시그널링), 인산화된 SMAD2 (pSMAD2, #3108, Cell 시그널링), 인산화된 SMAD3 (pSMAD3, #9520, Cell 시그널링) 및 액틴 (MAB1501R, Millipore)에 대한 항체를 이용해 면역블롯팅하였다. 소프트웨어 (버전 4.6.6, Bio-Rad)를 이용하여 농도계측을 실시하였다.
역전사
및 정량적
PCR
(
qPCR
)
총 RNA를 제조사의 지침에 따라서 TRIZOL 시약 (Invitrogen, Life Technologies)을 사용하여 연골발생 미세군집 펠렛으로부터 분리하였다. 역전사를 1 μg RNA에 대해 제조사의 지침에 따라서 SuperScript® VILOTM cDNA 합성 키트 (Invitrogen, Life Technologies)를 사용하여 실시하였고, 이때 인큐베이션은 1시간이 아닌 2시간 동안 42℃에서 실시하였다. 각각의 qPCR은 20 μl의 최종 부피로 40 ng cDNA, 유전자당 1 μl TaqMan® 프라이머-프로브 믹스, 및 10 μl Taqman® Fast Universal PCR 마스터 믹스 (Applied Biosystems, Life Technologies)를 함유한다. 열 순환 (Thermal cycling) 조건은 95℃에서 20초 후, 95℃에서 3초 및 60℃에서 30초의 45주기가 이어졌다. 각각의 qPCR을 3회 반복 실시하였고 유전자 발현을 HPRT1 발현에 표준화하여 ΔCt 값을 수득하였다. 생물학적 3중체의 평균 값을 취하였다. 헤파린 부재의 배지 (Media)에서 배양된 연골발생 미세군집 펠렛을 대조군 (ΔΔCt)으로 사용하였다. 각 프라이머 세트에 대한 상대적 발현 수준을 2-ΔΔCt 방법에 의한 배수 변화로 표현하였다 (36). 하기 TaqMan® 프라이머-프로브 분석 (Applied Biosystems, Life technologies)을 이용하였다: HPRT1 (Assay ID: Hs01003267_m1), SOX9 (Assay ID: Hs00165814_m1) 및 COMP (Assay ID: Hs00164359_m1).
프로텍트
앤드 라벨 (Protect and Label)
TGF-β1 상의 헤파린-결합 부위를, 1 nmol의 TGF-β1 단백질 및 0.1% (w/v) RapiGestTM SF 계면활성제 (Waters Corporation)를 사용하여 미니-칼럼으로부터 단백질을 용출한 것을 제외하고는, FGF-2에 대해 Ori 등에 의해 기술된 바와 같은 (37), "프로텍트 앤드 라벨" 접근법으로 동정하였다. 분해되고 비오틴화된 펩티드를 C18 ZipTip (Millipore) 상에서 정제한 후 탠덤 질량 분석법 (MS)으로 분석하였다. 최대 2 μg의 비오틴화된 펩티드를 EASY-nLC (Proxeon)를 사용해 LTQ Velos 장치 (Thermo) 내로 주입하였다. 펩티드를 60분 선형 구배 (0.1% 포름산 중의 2-40% (v/v) 아세토니트릴)를 이용해 PicoFritTM 칼럼 (HALO, C18, 90 A, 2.7 μm, 75 μm (ID) x 100 mm length) (New Objectives) 상에서 분리하였다. 측량 (survey) MS 스캔이 이중 압력 선형 이온 트랩 (dual pressure linear ion trap)에서 획득되는 TOP-10 전략을 이용하여 데이터 획득을 수행하였다. MS는 310 내지 1400 m/z 범위, AGC 표적 3e4 및 10 ms의 최대 주입 시간으로 스캔한다. 1000 초과의 이온 강도를 갖고 1개를 제외하고 전하 상태를 갖는 10개의 가장 강력한 이온을 최대 100 ms 동안 4e4의 최대 AGC 표적 값에 대해 연속적으로 분리하고 30%의 표준화된 충돌 에너지를 사용한 충돌 유발 분리 (Collision Induced Dissociation, CID)로 단편화하였다. 500의 배제 리스트 크기, 1 반복 계수, 45초의 반복 기간, 30초의 배제 기간뿐만 아니라 1.0 가로 및 1.5 세로의 군집 넓이를 이용하여 동적 배제 리스트를 적용하였다. 만료는 무효 처리되었다.
ipi.HUMAN.v3.86.decoy 데이터베이스 (183,568 서열)를 이용하고 하기 매개변수를 적용하는 Mascot 검색 (버전 2.3, Matrix Science)을 이용하여 데이터 분석을 수행하였다: 분해, 키모트립신 (FWYL/P); 최대 누락된 절단 (missed cleavages), 2; 고정된 변형, 카르바미도메틸 (Cys); 가능한 변형, 아세틸 (Lys), 아세틸 (단백질 N-말단), 비오틴 (Lys), 산화 (Met); 모체 이온 관용 (parental ion tolerance), 2 Da; 절편 이온 관용, 0.8 Da. 20 초과의 Mascot 점수를 갖는 비오틴화된 펩티드를 수동으로 확인하였다.
3
H-헤파린-결합 분석
TGF-β1-유래 펩티드 (서열 - RKDLGWKWIHEPKGYH-AHX-K(비오틴) [AHX=6-아미노헥사노산]; [서열번호: 7])의 헤파린-결합 능력을 결정하기 위하여, 0.5 mg의 펩티드를 1 ml의 인산염 완충 식염수 (PBS) 중에 재구성하였다. 그 후에 니트로셀룰로스 디스크를 1 ml의 재구성된 펩티드와 실온에서 1시간 동안 일정한 교반하에 인큐베이션함으로써 펩티드를 디스크 상에 흡착시켰다. PBS 단독 중에 인큐베이션된 디스크를 음성 대조군으로 사용하였다. 흡착 후, 디스크를 45분간 80℃ 및 -10 Hg에서 진공 오븐 중에서 건조시키고, PBS로 3회 세척한 후, 1 ml의 0.1 μCi/ml 3H-헤파린과 함께 실온에서 16시간 동안 일정한 교반하에 인큐베이션하였다. 디스크를 그 후에 PBS로 4회 세척하고 결합된 3H-헤파린의 양을 신틸레이션 계수기로 측정하였다.
HS16
+ve
의 친화성 분리
상기에 기술된 TGF-β1 펩티드 서열을 사용하여 이전에 기술된 바와 같이, HS16+ve의 분리를 실시하였다 (29).
간략히는, 3 mg의 펩티드를 HiTrapTM 스트렙타비딘 HP 칼럼 (GE Healthcare, Buckinghamshire, UK)에 결합시키고, 그 후에 이를 상업적으로 이용가능한 돼지 점막 HS (HSPM, Celsus Laboratories Inc, Ohio, USA)를 이용한 친화성 크로마토그래피에 사용하였다. HSPM을 1 mg/mL 농도로 저염 완충제 (20 mM 포스페이트, 150 mM NaCl, pH 7.2)에 용해시키고, 0.2 mL/분의 유속으로 로우딩하고, 232 nm에서의 기저선 흡광도 (A232)가 제로에 이를 때까지 칼럼을 동일한 완충제로 세척하였다. 결합된 HS를 고염 완충제 (20 mM 포스페이트, 1.5 M NaCl, pH 7.2)를 이용해 단일 단계로 용출하고, 피크 분획을 A232에서 모니터링하고, 수집하고, 칼럼을 저염 완충제로 재-평형화하였다. 용출된 (HS16+ve) 및 관류 (flow-through) (HS16-ve) 피크를 별도로 수집하고, 냉동 건조시키며, HiPrepTM 26/10 탈염 칼럼 (GE Healthcare, Buckinghamshire, UK) 상에서 10 mL/분의 유속으로 탈염시키고, 다시 냉동-건조시키고 -20℃에서 보관하였다.
양성자 NMR 분광법
HSPM, HS16+ ve 및 HS16- ve 시료를 풀링하고 (pooled) D2O 중에서 3회 (D2O (0.5 내지 1 mL) 중에서 건조 분말의 용해의 3회 통과 및 완전히 동결건조될 때까지 냉동 건조) 교환하고 건조 중량을 결정하였다. NMR 분석을 D2O 용액으로서 5 mm 튜브 내 30℃에서 실시하고 내부 표준품으로서 tBuOH (0.2 mg/mL)를 포함하였다. HS 제제가 대략 3 mg/mL이었다 하더라도, 포괄적인 데이터-세트를 위한 최적 농도는 ~15 mg/mL (1H)이었다. 양성자 (500 MHz) NMR 스펙트럼을 3 채널 Bruker AvanceIII500 상에 기록하였다. 프로브는 능동 차폐된 (actively shielded) 50G/cm Z-축 Pulsed Field Gradients가 구비된 Bruker 2 채널 5 mm Broadband Nuclei 프로브 (31P-109Ag)이었다. NMR 스펙트럼을 요구되는 바와 같이 상 보정하고 tBuOH (1Hδ 1.24 ppm; 13C(메틸) δ 30.29 ppm)에 대해 참조되었다. 신호에 대한 할당은 Guerrini 등 (38)에 의해 보고된 것들을 토대로 하였다.
네이티브 PAGE에서 GAG의 알시안 블루/은 염색
HSPM, HS16+ve 및 HS16-ve 시료에서 폴리사카라이드 사슬의 크기 분포를 결정하기 위하여, 2 μg의 각 GAG를, 80 V에서 30분간 사전-런닝하여 잔여 암모늄 퍼설페이트 및 테트라메틸에틸렌디아민 (TEMED)을 제거한 후, 12% 네이티브 PAGE 겔 상에 런닝하였다. 시료를 트리스-글리신 완충제 (25 mM Tris, 192 mM Glycine)로 1x 희석된 4x 전기영동 이동도 분석 (electrophoretic mobility shift assay, EMSA) 완충제 (40 mM Tris-HCl, pH 8.0, 40% (v/v) 초순수 글리세롤, 0.4% (v/v) NP40 및 400 mM KCl)를 이용해 25 μL의 최종 부피로 제조하였다. 분자량 사다리 및 BSA를 분자량 마커로 사용하였고, 헤파린을 알시안 블루 염색의 양성 대조군으로 사용하였다. 그 후에 겔을 2% (v/v) 아세트산 중의 0.5% (w/v) 알시안 블루로 45분간 염색하고, 15분간 2% (v/v) 아세트산에서 탈염색하고 MilliQ 워터 중에서 밤새 세척하여 과량의 염료를 제거하였다. 이어서, 겔을 은 염색하여 단백질 마커를 시각화하고 알시안 블루-염색된 GAG의 대조를 증강시킨다.
친화성 분리된 HS의 HPLC-크기 배제 크로마토그래피-굴절률 (HPLC-SEC-RI)
HPLC-SEC-RI 크로마토그램을 Waters 2410 굴절률 모니터 (range 64)가 구비된 Waters 2690 Alliance 시스템 상에서 연속적으로 TSK 겔 G4000PWXL (7.8 mm x 30 cm) 및 TSK 겔 G3000PWXL (7.8 mm x 30 cm) (TOSOH Corp.)을 사용하여 수득하였다. RI로부터의 정량화를 위한 dn/dc를 0.129로 설정하였다 (39). 시료를 주입하고 (50 μg) 50 mM 암모늄 아세테이트를 사용해 실온에서 0.5 ml/분의 유속으로 용출하였다. 데이터를 수집하고 DAWN Astra 소프트웨어 (버전 4.73.04, Wyatt Technology Corp.)를 사용하여 분석하였다. 분자량 (MW) 표준품의 용출 부피는 동일한 조건하에서 런닝된 헤파린 올리고사카라이드의 용출 부피 (Iduron and Dextra Laboratories)를 근거로 하였다. 이들 칼럼의 런닝 타임은 두 경우 모두 100분이었다. 모든 GAG 시료는 물 중에서 1 mg/ml의 농도였다.
헤파린 리아제 효소를 이용한 HS 시료의 분해
HSPM, HS16+ ve 및 HS16- ve 시료를 물 (1100 μl)에 용해하고 여과하여 (Minisart RC15, 0.2 μm 주사기 필터 유닛, Sartorius Stedim, #17761) 임의의 미립자 물질을 제거하였다. 추가의 세정 (clean-up) 단계로서, 여과된 용액을 원심분리 (4000 rpm, 1시간, 15℃)에 의해 2000 MWCO 막 (Vivaspin 2, Hydrosart, Sartorius Stedim, #VS02H91, 2000 MWCO HY 막, 2 mL 한외여과 스핀 칼럼)을 통과시켰다. 잔류물을 물 (3 x 1 ml)로 세척하고, 필터로부터 회수하고 동결건조시켰다. 정제된 HS 시료를 물 (1 mg/ml)에 용해시키고 각각의 냉동-건조된 시료의 부분표본 (2 x ~1 ml)을 분석을 위해 취하였다. HS 시료를 약간 변형된, Brickman 등의 방법 (40)을 토대로 헤파린 리아제 효소 (헤파린 리아제 I, II 및 III, Ibex Technologies)의 연속적 첨가에 의해 디- 및 올리고사카라이드로 분해하였다. 건식 HS 시료를 분해 완충제 (500 μl; 50 mM 소디움 포스페이트 완충제, pH 7.0)에 재-용해하고 헤파린 리아제 I (5 μl; 5 mIU)을 각 시료에 첨가하였다. 시료를 회전 휠 (9 rpm) 상에서 가볍게 혼합하면서 인큐베이션하였다 (37℃, 2시간). 헤파린 리아제 III (5 μl; 5 mIU)을 분해물에 첨가하고 추가로 1시간 동안 (상기와 같이) 인큐베이션하였다. 헤파린 리아제 II (5 μl; 5 mIU)를 분해물에 첨가하고 상기와 같이, 18시간 동안 인큐베이션하였다. 마지막으로, 모든 3종의 헤파린 리아제의 부분표본 (5 μl; 5 mIU)을 동시에 첨가하고 분해물을 추가 24시간 동안 인큐베이션하였다. 효소 분해를 가열 (100℃, 5분)하여 종결시켰다. 모든 3종의 HS 시료를 2중 반복으로 분해하고 UV 검출 (232 nm)을 이용해 HPLC로 분석하였다.
분해된 HS 시료의 HPLC-SEC-RI
HPLC-SEC 크로마토그램을 Waters 2410 굴절률 검출기 (range 64)가 구비된 Waters 2690 Alliance 시스템 상에서, 연속적으로 2종의 Superdex™ 펩티드 10/300 GL 칼럼 (300 x 10 mm, GE Healthcare)을 사용하여 수득하였다. RI로부터의 정량화를 위한 dn/dc를 0.129로 설정하였다 (39). 시료 (2 mg/ml)를 주입하고 (50 μl; 100 μg) 실온에서 50 mM 암모늄 아세테이트 (0.5 ml/분)를 이용해 용출하였다. 헤파린 올리고사카라이드 표준품 (Iduron and Dextra Laboratories)을 동일한 조건하에서 런닝하였다. 이들 칼럼의 런닝 타임은 120분이었다. 데이터를 수집하고 DAWN Astra 소프트웨어 (버전 4.73.04, Wyatt Technology Corp)를 사용하여 분석하였다.
HPLC에 의한 디사카라이드 조성 분석
세균성 헤파리나제에 의한 고-등급 돼지 헤파린의 분해로부터 유래된, 12종의 디사카라이드 표준품을 Iduron사로부터 구매하였다. 각 디사카라이드 표준품의 스톡 용액을 디사카라이드를 물 (1 mg/ml)에 용해시켜 제조하였다. 디사카라이드 표준품에 대한 검정 곡선을 결정하기 위하여, 20 μg/ml의 각각의 디사카라이드를 함유하는 표준품 혼합물을 스톡 용액으로부터 제조하였다. 이 12종의 디사카라이드 표준품 혼합물로부터 20, 10, 5, 2.5, 1.25, 0.625 및 0.3125 μg/ml의 각각의 디사카라이드를 함유하는 희석액 시리즈를 제조하였다. HSPM, HS16+ ve 및 HS16- ve 분해물 (2 mg/ml)을 물로 희석하여 100 μg/ml 용액을 제공한 후 친수성 PTFE 일회용 주사기 필터 유닛 (0.2 μm, 13 mm, Advantec)을 사용하여 여과한다. HPLC 분리 조건은 Skidmore 등 (41)의 조건을 토대로 하였다. 232 nm에서 모니터링되는 Agilent 1260 MWD VL 검출기가 구비된 Agilent 1260 Infinity 액체 크로마토그래피 시스템 (Agilent Technologies) 상에서 분석을 수행하였다. HS-유래 디사카라이드를 가드 (guard) 칼럼을 구비한 ProPac™ PA1 칼럼 (Thermo Scientific, 4 mm x 250 mm) 상에서 분리하였다. 이원 용매 시스템을 이용하여 구배 용출을 수행하였다. 용리제 A는 pH 3.5 (HCl을 이용해 조정됨)의 물이었고, 용리제 B는 pH 3.5 (HCl로 조정됨)의 2 M NaCl이었다. 구배 프로그램은 다음과 같다: 0-1분까지 100% A, 그 후 1-32분까지 0-35% B, 그 후 32-47분까지 35-65% B, 그 후 47-57분까지 100% B, 그 후에 57-60분까지 100% A. 주입 부피는 50 μl이었디. 칼럼을 1.0 ml/분의 유속으로 용출하고 40℃에서 유지하였다. HS 분해물에 존재하는 디사카라이드를 12종의 디사카라이드 표준품 혼합물 중의 디사카라이드의 용출 시간과 비교함으로써 이들의 용출 시간으로부터 동정하였다. HS16+ 및 HS16- 분해물을 중복 분해물당 2회 (총 4회 주입) 주입한 반면, HSPM 시료를 중복 분해물 당 1회 (총 2회 주입) 주입하였다.
플라스민 분해
단백질 분해로부터 TGF-β1을 보호하는 다양한 GAG의 능력을 결정하기 위하여, TGF-β1 (100 ng)을 10 μg의 Hep, HSPM, HS16+ ve 또는 HS16- ve으로 또는 PBS 중에 단독으로 실온에서 10분간 사전-인큐베이션하였다. 0.5 mU의 플라스민을 TGF-β1 시료에 첨가함하고 37℃에서 1.5시간 동안 이들을 인큐베이션함으로써 플라스민 분해를 실시하였다. 이어서 시료를 4-12% SDS-PAGE 겔 상에 런닝하고 은 염색으로 시각화하였다. 모든 시료를 PBS 중에 10 μl의 최종 부피가 되게 만들었다.
알칼라인 포스파타제 (ALP) 분석
BMP-2 활성에 대한 HS16+ve의 효과를 결정하기 위하여, C2C12 마우스 근모세포 (myoblast)를 완전 C2C12 배지 (DMEM-LG, 10% (v/v) FCS, 100 U/mL 페니실린 및 100 μg/mL 스트렙토마이신) 중에 20,000 세포/cm2로 중복 접종하고 24시간 동안 부착되게 하였다. 그 후에 완전 배지를 100 ng/mL BMP-2 및/또는 5 μg/mL HS16+ve, HS3+ve 또는 HSPM 함유 또는 비함유 처리 배지 (DMEM-LG, 5% (v/v) FCS, 100 U/mL 페니실린 및 100 μg/mL 스트렙토마이신)로 교체하고 세포를 3일간 인큐베이션하였다. 이어서 총 세포 용해물을 프로테아제 억제형 칵테일 (Calbiochem, Merck Millipore, MA, USA)을 함유하는 RIPA 완충제 중에 수집하고 단백질 함량을 BCA 단백질 분석 키트 (Thermo Fisher Scientific)를 사용하여 결정하였다. 5 μg의 단백질을 p-니트로페닐 포스페이트 (Sigma-Aldrich)와 37℃에서 1시간 동안 인큐베이션하고 405 nm에서 흡광도 변화를 판독함으로써 ALP 활성을 측정하였다. RIPA 완충제 단독 및 1 μL (10,000 U/mL)의 송아지 창자 포스파타제 (New England Biolabs Ltd, Ontario, Canada)를 각각 음성 및 양성 대조군으로 사용하였다. 각 시료를 중복으로 판독하여 처리군당 총 4회 판독을 제공하였다.
hMSC의 헤파리나제 처리
내인성 HS의 TGF-β1 시그널링에 대한 효과를 평가하기 위하여, hMSC를 기본 배지 중의 12-웰 플레이트에 7,500 세포/cm2의 밀도로 접종하고 밤새 부착되게 하였다. 그 후에 헤파리나제 I, II 및 III의 조합 (각각 1.2 mIU/mL)을 각 웰의 배지에 첨가하고 24시간 동안 인큐베이션하였다. 이어서 세포를 6시간 동안 1 ng/mL 또는 5 ng/mL 단독 중 하나로 제조된 TGF-β1 처리에 노출하거나, 또는 10 μg/mL 또는 40 μg/mL의 전장 헤파린 중 하나와 실온에서 10분간 사전-인큐베이션한 후, 2x Laemmli 완충제 중에서 면역블롯팅을 위해 용해시켰다. 처리물을 무혈청 배지 (100 U/mL 페니실린, 100 μg/mL 스트렙토마이신 및 2 mM L-글루타민이 보충된 DMEM-LG) 중에 제조하여 신선한 혈청이 세포에 첨가되는 경우 보여지는 pSMAD의 배경 수준이 증가되는 것을 방지하였다.
헤파리나제-분해된 세포의 면역형광 염색
헤파리나제 처리가 hMSC로부터 내인성 HS 사슬을 효과적으로 제거함을 입증하기 위하여, 세포를 기본 배지 중에 3,500 세포/cm2의 밀도로 8-웰 챔버 슬라이드에 접종하였다. 세포를 밤새 부착되게 한 후 헤파리나제 I, II 및 III의 조합 (각각 1.2 mIU/mL)으로 처리하고, 24시간 동안, 각 웰에 직접 첨가하였다. 이어서, 세포를 실온에서 10분간 PBS 중의 4% (w/v) 파라포름알데히드에서 고정시키고, 실온에서 30분간 PBS 중의 3% (w/v) 소 혈청 알부민 (BSA)으로 차단한 후 실온에서 3시간 동안 항-HS 10E4 항체 (0.3% (w/v) BSA-PBS 중에서 1:25 희석) (AMS Biotechnology, Abingdon, UK)와 함께 인큐베이션하였다. 그 후에 세포를 실온에서 45분간 항-마우스 IgM-FITC 항체 (0.3% (w/v) BSA-PBS 중에서 1:500 희석) (BD PharmingenTM, Becton, Dickinson and Company, NJ, USA)와 인큐베이션하고 핵을 실온에서 10분간 Hoechst 33342 (PBS 중의 2 μg/mL) (Life Technologies)으로 염색하였다. 시료를 Olympus IX-81 상에서 이미지화하였다.
결과
헤파린은
TGF
-
β1에
결합하여 이의 활성을 강화함
TGF-β1 시그널링에 대한 헤파린의 효과를 결정하기 위하여 본 발명자들은 먼저 헤파린이 TGF-β1에 결합할 수 있는지를 확인하는데 착수하였다. SPR 및 GAG-결합 플레이트 분석 둘 모두는, TGF-β1이 용량-의존적 방식으로 96-웰 플레이트에 고정되거나 (도 1A), 또는 비오틴화되고 Biacore SA-칩 상에 고정된 (도 1B) 헤파린에 각각 결합하였음을 입증하였다. 본 발명의 데이터는 TGF-β1이 대략 ~0.475 μM의 Kd로 헤파린에 결합함 (도 1B)을 나타낸다. 헤파린에의 결합은 DSF에 의해 결정되는 바와 같이 (도 2A), 증강된 열적 안정성을 TGF-β1에 제공하였다. TGF-β1 동종이량체는 9개의 이황화 결합, 4개의 인트라-사슬 (intra-chain) 및 1개의 인터-사슬 (inter-chain)을 포함하는데, 이는 고도의 열적 안정성을 부여한다. 이는 TGF-β1 단독에 대해 관찰된 66℃의 높은 융점으로 입증되었다 (데이터 미제시). 본 발명자들은 TGF-β1에의 헤파린 결합이 새로운, 비-공유적, 분자간 결합의 도입을 통해 이의 열정 안정성을 더욱 증가시킬 것이라는 전제를 시험함에 따라, 분석이 검출할 수 있는 수준까지 단백질의 융점을 감소시키는 것이 요구되었다. 이는 반응물에 10 Mm의 DTT 첨가를 통해 달성되었고, 이는 단백질 내부의 이황화 결합을 감소시키고, 그로써 이의 열적 안정성을 저하시켰다. 이는 66℃에서 44℃로 TGF-β1의 융점 이동을 초래하였다. 헤파린의 첨가 시, TGF-β1의 융점을 나타내는 피크는 우측으로 이동하는 것으로 나타났고 단백질의 융점은 47.5℃로 증가하였다.
다음 단계는 헤파린과 TGF-β1 사이의 상호작용이 TGF-β1 시그널링 경로에 영향을 미치는지 여부를 결정하는 것이었다. 이를 달성하기 위하여, hMSC를 다양한 양의 헤파린 및 TGF-β1으로 처리하고, pSMAD2 및 pSMAD3의 수준을 조사하기 위해 1, 6 및 24시간 처리 후 단백질을 수확하였다 (도 2B). 1시간 처리 후에, pSMAD2 및 pSMAD3 둘 모두의 수준은 TGF-β1 및 헤파린으로 처리된 모든 세포에서 포화되었다 (데이터 미제시). 헤파린 단독으로 처리된 임의의 세포에서 어떠한 식별가능한 수준의 pSMAD2 및 pSMAD3도 관찰되지 않았는데, 이는 헤파린 단독으로는 TGF-β1 시그널링 경로를 활성화시킬 수 없음을 입증한다. 6시간 처리 후, 모든 세포에서 pSMAD 수준은 감소하기 시작하였다. 그러나, 헤파린 및 TGF-β1 둘 모두로 처리된 세포는 헤파린 없이 동일한 용량의 TGF-β1로 처리된 세포에 비해 각각 ~1.6배 및 ~1.35배 더 높은 pSMAD2 및 pSMAD3의 수준을 나타내었다 (도 2B). 유사하게, 24시간째의 pSMAD 수준은 TGF-β1 단독으로 처리된 세포에 비해 헤파린 및 TGF-β1 둘 모두로 처리된 세포에서 계속 더 증가하였다 (데이터 미제시). 첫 번째로, 본 데이터는 더 높은 용량의 TGF-β1 (5 ng/ml vs 1 ng/ml)이 더 긴 시간 동안 지속되는 pSMAD 시그널을 생산함을 입증한다. 두 번째로, 이들은 또한 헤파린이 성장인자 단독에 대해 정상적으로 관찰된 것을 넘어서 pSMAD 시그널의 반감기를 연장시킬 수 있음을 나타낸다.
이 효과를 더욱 조사하기 위하여, 본 발명자들은 hMSC의 연골발생 분화의 초기 단계 동안에 발현되는 TGF-β1 표적 유전자의 전사 수준의 조사를 진행하였다. hMSC의 연골발생 분화를 배지 (TGF-β1 단독) 또는 배지+Hep (TGF-β1+헤파린) 중 하나의 존재하에서 실시하였다. 연골발생 배지에서 3일간의 배양 후, 배지+Hep에서 배양된 미세군집 펠렛은 SOX9 및 COMP mRNA 전사체 둘 모두의 5배 더 높은 수준을 나타내었다 (도 2C). 종합하면, 이 데이터는 헤파린이 TGF-β1에 결합할 수 있고 이러한 결합이 세포 내에서 나타나는 TGF-β1 시그널을 강화함을 제안한다. 헤파린이 실제로 TGF-β1의 활성을 강화하였다는 확립 하에, 본 발명자들은 이어서 헤파린이 TGF-β1 시그널링 경로를 통해서이기 보다는, 일부 간접적 경로를 통해 이들 효과를 발휘하였다는 가능성을 배제하는 시도를 하였다. 이를 위해, TGF-a 타입 I 수용체 억제형인, SB431542를 사용하였다 (42). hMSC의 SB431542로의 처리는 3-일령의 연골발생 미세군집 펠렛에서 SOX9 및 COMP 유전자 발현 둘 모두의 감소를 초래하였다 (도 2D). 이 데이터는 수용체 수준에서 TGF-β1 활성의 억제가 헤파린의 TGF-β1-강화 효과를 상쇄시킴을 제시하고, 이는 다시 헤파린이 TGF-β1 시그널링의 조절을 통해서 TGF-β1 활성에 이들의 효과를 발휘함을 의미한다.
TGF
-
β1
결합 및 활성을 위한 헤파린 길이 요건
본 발명자들은 TGF-β1에 결합하는데 요구되는 헤파린의 최소 길이 결정을 시도하였다. 헤파린 코팅된 SA-칩에 대한 TGF-β1의 결합을 완전히 억제하는 가용성 크기-분획화된 헤파린 단편 (dp4 내지 dp24)의 능력은 이들의 길이에 비례하여 증가하였다 (도 3A). TGF-β1 결합능의 이러한 증가는 비분획화된, 전장의 헤파린 (Hep)에 대해 나타난 것과 유사한 경쟁 수준으로, dp18부터 정체기에 드는 것으로 나타났다. GAG-결합 플레이트 분석으로부터 수득된 결과는 헤파린 사슬의 길이가 14 (dp14)에서 24 (dp24) 사카라이드 유닛으로 증가함에 따라서 헤파린에의 TGF-β1 결합이 향상되었음을 또한 나타낸다 (도 3B). dp14보다 짧은 (즉, dp4 - 12) 헤파린 사슬은 효과적으로 TGF-β1에 결합할 수 없었다 (데이터 미제시). 다양한 길이의 헤파린 단편 및 TGF-β1로 처리된 세포에서 1시간 처리 후 pSMAD2 및 pSMAD3 수준의 웨스턴 블롯 분석은 pSMAD 시그널 둘 모두의 포화를 나타내었다 (데이터 미제시). 그러나, 6시간 처리 후에, 본 발명자들은, 비분획화된 헤파린 (Hep) 및 TGF-β1으로 처리된 세포에서 관찰된 것에 비해 여전히 낮을지라도, dp24-TGF-β1 조합에서 예측된 최대 pSMAD 시그널로, 다양한 (dp14 - 24) 헤파린 단편의 증강 활성에서의 길이-의존적 증가의 관찰을 기대하였다. 그 대신에, 본 발명자들은, dp20-TGF-β1 조합에서 시그널 정점에 도달하면서, TGF-β1 및 dp18과 dp22 사이의 헤파린 단편으로 처리된 세포가 비분획화된 헤파린 및 TGF-β1로 처리된 세포에서 관찰되는 것보다 높은 pSMAD 수준을 나타내었음을 관찰하였다 (도 3C). 이는 헤파린 사슬의 길이가 TGF-β1 시그널을 강화하는 이의 능력에 상당한 영향을 미침을 제시한다.
TGF
-
β1
결합 및 활성을 위한 헤파린
황산화
요건
헤파린-단백질 상호작용의 우세한 이온적 특성이 주어짐에 따라, 본 발명자들은 이어서 헤파린 내 다양한 설페이트기가 그와 TGF-β1 사이의 상호작용에 미치는 영향에 대한 조사를 착수하였다. Biacore 경쟁 분석은, 헤파린으로부터 2-O 설페이트의 손실 (2-O-de)이 고정된 헤파린에의 TGF-β1 결합을 경쟁적으로 억제하는 이들의 능력에 최소한의 영향을 미침을 나타내었다 (도 4A). 6-O 설페이트기의 손실 (6-O-de)은 TGF-β1-결합능의 대략 40% 손실을 초래한 반면, N-설페이트기의 손실은 TGF-β1에 결합하는 헤파린의 능력을 파괴하였다. 반면, GAG-결합 플레이트 분석은, 헤파린으로부터 2-O 설페이트기의 제거 (2-O-de)가 완전히 황산화된, 전장의 헤파린 (Hep)에 비해 약 60% TGF-β1 결합을 감소시켰음을 입증하였다 (도 4B). 6-O 설페이트기의 제거 (6-O-de)는 TGF-β1의 능력을 대략 80% 감소시키고 N-황산화의 결여 (N-de)는 다시 TGF-β1 결합을 본질적으로 파괴하였다. 흥미롭게도, 세포 배양물에서 시험하는 경우, 수득된 결과는 다양한 헤파린 길이를 평가할 때 나타난 것과 같이 가변적이었다. 감소 대신에 본 발명자들은, 본 발명자들이 관찰하였던 완전히 황산화된 헤파린에 비해, 6시간 동안 2-O-탈황산화된 헤파린 (2-O)으로 처리된 세포의 pSMAD 수준에서 헤파린-처리된 세포에서 나타난 것을 넘어서는 수준으로의 증가를 보게 될 것을 기대하였고 (도 4C), 이는 2-O-탈황산화된 헤파린이 완전히 황산화된 헤파린보다 훨씬 더 많이 TGF-β1 시그널링을 강화하였음을 제시한다. 유사하게, 6-O-황산화의 제거 (6-O)는 또한 헤파린-처리된 세포에서 관찰되는 것들에 비해 pSMAD 수준의 안정화를 초래하였다. 그러나, N-황산화의 손실 (N)은 헤파린-처리된 세포의 것들에 비해 pSMAD 수준의 증가를 초래하지 않았다.
종합적으로, 이 데이터는, 헤파린으로부터 2-O-황산화, 및 더 낮은 수준의 6-O-황산화의 손실이 실제로 TGF-β1 시그널을 강화하는 헤파린의 능력을 향상시킴을 나타내고, 이는 결합 강도 및 생체활성의 관계가 선형적이지 않음을 제시한다.
TGF
-
β1
헤파린 결합 부위의 동정
헤파린이 다수의, 감수성 성장인자에 존재하는 염기성 잔기의 형상과 상호작용하는 것으로 공지되어 있기 문에, 본 발명자들의 다음 목표는 TGF-β1 내부의 실제 헤파린-결합 부위(들)을 동정하는 것이었다. TGF-β1 상의 잠정적 헤파린-결합 부위를 동정한 이전 연구는 선형 단백질 서열에 존재하는 헤파린-결합 모티프의 동정을 통해서 이루어졌다 (2,4). 그러나, 이러한 접근법은 단백질의 전체 3-차원 (3D) 형태학적 특성을 고려하지 못하였고, 따라서 오로지 단백질의 4차 구조로부터 명백해질 수 있는 헤파린-결합 부위를 동정하는데 실패하였다. 그래서, 본 발명자들은 이러한 3D 부위가 TGF-β1 내부에 존재하는지 여부를 결정하기 위하여 Ori 등에 의해 개발된 프로텍트-앤드-라벨 전략의 이용을 결정하였다 (37). 본 발명의 분석은 헤파린에의 TGF-β1 결합에 관여하는 것으로 나타난 8개의 리신 (K13, K26, K31, K37, K60, K95, K97 및 K110)을 동정하였다 (도 5A, 표 1). 이들 8종 중에서, 7종이 MS/MS 서열분석을 기준으로 높은 수준의 신뢰도를 갖고 동정되었다. 나머지 리신, K60은 중간 수준의 신뢰도로 동정되었는데, 이는 헤파린과의 이의 상호작용이 간헐적이고 헤파린에의 TGF-β1 결합에 필수적이지 않을 수 있음을 제시하고, 그래서 또한 Lyon 등에 의해 제안된 현행 결합 모델을 지지한다 (2).
2종의 동정된 리신, K13 및 K110을 제외한 모두는 TGF-β1의 헤파린-결합 도메인의 일부로서 이전에 동정된 바 있다 (도 5A). 3D 구조 상에 맵핑하는 경우, K13은 K26으로서 동일한 하부 표면 상에 맵핑되는데, 이는 헤파린 결합에의 필수 잔기인 것으로 제안된 바 있다 (도 5B). K110은 TGF-β1 단량체들 사이의 계면을 따라서 맵핑된다. 그러나, K110은 단백질 내부에 내재된 (embedded) 것으로 나타나고, 그래서 TGF-β1의 "점착성 (sticky)" 성질이 헤파린 미니-칼럼으로부터의 단백질 용출을 위해, 2 M NaCl보다는, 산-민감성 세제 (RapiGestTM SF 계면활성제)의 사용을 요구하기 때문에, 이 결과는 위양성일 가능성이 높다. 용출하기 위한 이 세제의 사용은 표지/비오틴화 단계 전에 단백질의 변성을 초래하여, 보통 단백질 코어 내부에 내재된 잔기가 잘못 표지되도록 단지 노출되게 한다.
친화성 선택된 TGF-β1-결합 HS (HS16
+ve
)의 분리
헤파린 - TGF-β1 상호작용의 구조적 특징 및 요건이 동정됨에 따라, 본 발명자들의 다음 목표는 상업적으로 이용가능한 HSPM 제제를 구성하는 이종의 풀 (heterogeneous pool)로부터 HS의 TGF-β1-결합 분획을 분리하는 것이었다. 이를 위해, 본 발명자들은 먼저 TGF-β1 유래 헤파린-결합 펩티드를 설계하고 (도 6A) 3H-헤파린에 결합하는 이의 능력을 시험하였다 (도 6B). TGF-β1 펩티드를 그 후에 Murali 등에 의해 이전에 기술된 바와 같이 (29), 본 발명의 HS 친화성 분리 플랫폼을 사용하여 HS의 TGF-β1-결합 집단을 분리하는데 사용하였다. 칼럼에 결합하지 않은 HS는 HS16- ve라 명명한 반면, 1.5 M NaCl을 이용해 칼럼으로부터 용출된 TGF-β1-결합 HS는 HS16+ve라 명명하였다 (도 6C).
HSPM, HS16+ ve 및 HS16- ve 사이에 어떠한 체계적인 차이가 존재하는지 여부를 결정하기 위하여, 이어서 양성자 NMR, HPLC-SEC-RI 및 디사카라이드 조성 분석을 실시하였다. 이 3종 HS 시료의 NMR 분석은 몇 가지의 미세한 차이를 나타낸 반면 (화살, 도 7A), SEC로부터의 크로마토그램은 HS16+ ve가 HSPM 및 HS16- ve에서 보여지는 것보다 일관되게 더 큰 HS 사슬로 대부분 구성되었음을 나타내었다 (도 7B).
3종 HS 시료의 NMR 스펙트럼에서 가장 눈에 띄는 차이는 HS16+ve의 ~5.4 ppm에서 시그널 강도의 약간의 감소였는데 (화살표, 도 7A), 이는 Guerrini 등에 의해 이전에 보고된 바와 같은 [Complex glycosaminoglycans: profiling substitution patterns by two-dimensional nuclear magnetic resonance spectroscopy. Anal Biochem, 2005. 337(1): p. 35-47], 글루코사민 아세테이트 메틸 공명으로 배정되었다. 이 감소는 다른 2종의 분획에 비해 HS16+ve에서 N-황산화의 약간 더 높은 수준을 나타내는 것이었다.
몇몇 헤파린 크기 표준품 (dp8, 12, 20 및 26)의 용출 시간을 토대로, 본 발명의 데이터는 또한 HS16+ ve이 26 사카라이드보다 더 긴 HS 사슬로 이루어짐을 나타낸다. 마지막으로, 이 3종 HS 시료 분해의 디사카라이드 조성 분석은, HSPM과 HS16-ve는 유사하였지만, HS16+ ve는 △UA-GlcNS,6S 및 △UA,2S-GlcNS,6S는 풍부하고 △UA-GlcNAc, △UA-GlcNS, △UA,2S-GlcNAc 및 △UA,2S-GlcNS는 더 적게 함유하고 있음을 보여주었다 (도 7C, 표 2). 종합적으로, 본 데이터는 HS16+ ve로 이루어진 HS의 풀이 크기 분포 및 조성 둘 모두에 대해서 HS16- ve 및 HSPM와 상당히 다름을 나타낸다. 추가적으로, HS16+에서 나타난△UA,2S-GlcNAc 및 △UA,2S-GlcNS에서의 상대적 감소는 헤파린으로부터 2-O-설페이트의 손실이 실제로 TGF-β1에 대한 이들의 생체활성을 증가시키는 방법에 대한 본 발명의 이전 발견을 확증시켰다 (도 4).
HS 사슬은 사슬 길이 측면에서 매우 다양한 것으로 알려져 있는데 [Esko, J.D., K. Kimata, and U. Lindahl, Proteoglycans and Sulfated Glycosaminoglycans, in Essentials of Glycobiology, A. Varki, et al., Editors. 2009, Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York], 이는 부분적으로 이러한 다량의 단백질에 결합하는 이들의 능력을 설명한다. 소정의 단백질에 대한 HS 제제의 상대적 특이성을 증강시키기 위하여, 이 변이를 감소시킬 필요가 있다. 본 발명자들은 3종의 HS 시료 내부의 폴리사카라이드 사슬의 크기 분포를 조사하였다. 네이티브 PAGE에 의한 3종 시료 및 헤파린의 해상은 HS16+ve가 HS16-ve 및 HSPM에 비해 주로 더 긴 HS 사슬로 구성되었음을 보여주었다. HS에 비해 상대적으로 더 동종인, 헤파린을 HS 제제에서 나타나는 높은 이질성의 이해를 제공하기 위해 사용하였다. 이들 발견을 입증하기 위하여, 크기 배제 크로마토그래피 (HPLC-SEC-RI)를 수행하였다. SEC로부터의 크로마토그램은 HS16+ve가 대략 dp8 내지 >dp26의 HSPM의 다-분산 아집단으로 이루어짐을 나타내었다 (도 7B). 그러나, HS16+ve 집단은 더 긴 사슬 길이 (>dp26)를 갖는 HS가 풍부하고, 이는 네이티브 PAGE로부터의 본 발명의 데이터 및 TGF-β1에 결합하기 위한 헤파린의 길이 요건에 대한 본 발명의 발견을 확증한다.
본 데이터는 HS16+ve로 구성된 HS의 풀이 크기 분포 및 조성 둘 모두의 측면에서 HS16-ve 및 HSPM과 상당히 다름을 나타낸다. 추가적으로, HS16+ve에서 나타난 △UA,2S-GlcNAc 및 △UA,2SGlcNS에서의 상대적 감소는 헤파린으로부터 2-O 설페이트의 손실이 실제로 TGF-β1에 대한 이들의 생체활성을 증가시키도록 제공되었다는 이전의 관찰을 확증하였다 (도 4C). △UA,2S-GlcNS,6S의 증가된 상대적 비율은, 2-O-황산화의 존재와는 무관하게, N- 및 6-O-황산화를 갖는 사카라이드에 대해 선호적으로 농축된 펩티드로부터 유래되었을 수 있다.
HS16
+
ve
는
TGF
-
β1에
결합하여 이의
시그널링을
강화함
HS16- ve 및 HSPM 대비 HS16+ ve의 조성의 차이를 감안하여, 본 발명자들은 이어서 이들 차이가 임의의 기능적 결과를 초래하는지 여부에 대한 조사를 착수하였다. Biacore 경쟁 분석에서 이들 HS 분획의 TGF-β1에 결합하는 능력의 조사는, HS16+ ve가 HS16- ve 또는 HSPM 보다 훨씬 더 높은 친화성으로 TGF-β1에 결합할 수 있었음을 나타내었다 (도 8A). HS16+ ve가 TGF-β1-유래 펩티드를 사용하여 분리되었기 때문에, 단백질 상의 염기성 잔기를 차폐하는 당류의 능력을 평가하는 것이 중요하였다. 이를 위해, 본 발명자들은 당류 (Hep, HSPM, HS16+ ve 및 HS16- ve)를 TGF-β1과 재-결합시키고 이들을 플라스민 분해에 적용하였다. 플라스민이 리신 및 아르기닌 잔기의 카르복실 측면을 선호적으로 절단하는 것을 감안하여, 본 발명자들은 만약 당류가 TGF-β1에 일정 정도의 특이성을 가지고 결합하였다고 한다면, 이는 플라스민으로부터 일정 정도의 보호를 단백질에 부여할 것이라고 추론하였다. 플라스민 분해 산물의 은 염색은, HS16+ ve (TGF-β1 + HS16+ ve)이 헤파린 (TGF-β1 + Hep)을 비롯해 시험된 임의의 다른 당류에 비해 플라스민 분해로부터 TGF-β1을 더 잘 보호할 수 있었음을 나타내었다 (도 8B). 시험관 내 시스템에서, HS16+ ve는 헤파린과 유사한 수준으로 hMSC에서, pSMAD2 및 pSMAD3을 통해, TGF-β1 시그널링을 강화할 수 있었다 (도 8C). 흥미롭게도, HSPM 및 HS16- ve는 유사한 반응을 촉발할 수 없었는데, 이는 HS16+ ve가 HSPM 및 HS16- ve 둘 모두와 조성적 및 기능적으로 구분된다는 본 발명의 앞선 발견을 보강하는 것이다.
대부분의 TGF-β1이 생체 내에서 잠재성 TGF-β1 (LTGF-β1)로 알려진, 불활성 형태로 발견되고 HS16+ ve가 HSPM의 풀로부터 분리되었기 때문에, 본 발명자들은 이어서 HS16+ ve가 LTGF-β1에 대해 가질 수 있는 효과에 대한 탐구를 착수하였다. 본 발명의 데이터는 재차 HS16+ ve가 헤파린 (Hep), HSPM 및 HS16- ve 보다 더욱 유의미하게 LTGF-β1-유도된 pSMAD 시그널을 강화할 수 있었음을 입증하였다 (도 10A). 종합적으로, 본 발명의 데이터는, HS16+ ve 분리물이 HSPM 출발 물질 및 비-결합 HS16- ve에 비해 TGF-β1에 더 잘 결합하여 TGF-β1에 의해 유도된 시그널링을 더 잘 강화할 수 있음을 보여준다. 또한, HS16+ ve는 HSPM 출발 물질 및 비-결합 HS16-ve에 비해 생리학적으로 더 풍부한 LTGF-β1에 의해 유도된 시그널링을 강화할 수 있었다.
hMSC의
분리 및 특성화
헤파린-TGF-β1 상호작용의 생물학적 효과를 조사하기 위하여, 일차 hMSC를 분리가 요구되다. 상업적으로 이용가능한 골수 세포 (Lonza)를 구입하고 hMSC를 플라스틱 부착을 통해 분리하였다. 계대 0 세포를 이어서 증대시키고 바이알 당 1x106 세포의 배치로 냉동시켰다. 세포를 Dominici 등에 의해 기술된 바와 같이 계대 5에서 MSC 표면 마커 발현에 대해 FACS로 스크리닝하였다 [Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006. 8(4): p. 315-317]. 분리된 hMSC의 95% 초과가 CD73, CD90 및 CD105를 발현한 반면, CD14, CD19, CD34, CD45 및 HLA-DR을 발현하지 않았다. 분리된 세포는 또한 시험관 내에서 조골세포, 지방세포 및 연조골세포로 분화할 수 있었다. 따라서, 플라스틱 부착에 의해 분리된 세포는 hMSC의 최소한의 기준 특성을 충족하는 것으로 간주되었다.
hMSC에서
TGF
-
β1
시그널링에
대한 헤파린의 효과
분리된 일차 hMSC를 가지고, 본 발명자들은 이어서 헤파린과 TGF-β1 사이의 상호작용이 TGF-β1 시그널링에 대한 세포성 반응에 영향을 미칠 수 있는지 여부를 조사하였고, 이는 SMAD2 및 SMAD3의 하류 인산화를 이용해 측정하였다. 헤파린은, 일차 인간 복재 (saphenous) 정맥 (SMCs)이 아닌, 일차 래트 및 소 평활근 세포 (SMCs) 및 CCL64 밍크 폐 상피세포주에서 TGF-β1의 효과를 강화시키는 것으로 나타났다 [McCaffrey, T.A., et al., Transforming growth factor-beta activity is potentiated by heparin via dissociation of the transforming growth factorbeta /alpha 2- macroglobulin inactive complex. J Cell Biol, 1989. 109(1): p.441-44; McCaffrey, T.A., et al., Protection of transforming growth factor β activity by heparin and fucoidan . J Cell Physiol, 1994. 159(1): p. 51-59]. 따라서 본 발명자들은, 헤파린이 hMSC에서 TGF-β1 활성을 강화시켜야만 하고, 이 효과는 오로지 TGF-β1 단독으로부터의 pSMAD2 및 pSMAD3 시그널이 감소하기 시작함에 따라서 나타날 것이라고 가정하였다. 이에, 본 발명의 초기 TGF-β1 투여를 위해 선택된 시점은 6, 12, 24 및 48시간이었다. 계대 5 세포를 일 범위의 TGF-β1 용량으로 처리하고 총 세포 용해물을 처리 후 6, 12, 24 및 48시간째에 수집하였다. 그 후에 용해물 시료를 4-12% (w/v 구배) SDS-PAGE 겔 상에서 용해하고, 니트로셀룰로스 막 상에 이동시키고, 웨스턴 블롯팅에 의해 포스포-SMAD2 (pSMAD2) (138D4, Cell Signlaing Technology), 포스포-SMAD3 (pSMAD3) (C25A9, Cell Signlaing Technology), 총 SMAD2/3 (Cell Signlaing Technology) 및 액틴 (Clone C4, Merck Millipore)에 대해 탐침하였다. 본 발명의 결과는, TGF-β1 (0 ng/mL) 부재 시, pSMAD2 및 pSMAD3 시그널링의 낮은 배경 수준이 존재하였음을 보여주었다. 1 ng/mL 존재 시, pSMAD2 시그널은 처리 후 6시간째에 매우 강력하였고 12시간째부터 계속 감소하기 시작하였다. pSMAD3 시그널은, 더 낮은 강도에서도 불구하고, pSMAD2 시그널의 것을 반영하였다. 5 ng/mL 및 10 ng/mL TGF-β1 존재 둘 모두의 경우에, pSMAD2 시그널은 시험된 모든 시점에 걸쳐서 포화된 상태로 나타났지만, pSMAD3 시그널은 24시간까지는 배경 수준으로 복귀하였다. 따라서, 6시간 시점이 이후의 모든 실험을 위해 선택되었다.
본 발명의 다음 목표는 본 발명의 실험에 사용하기 위한 헤파린의 용량을 결정하는 것이었다. 헤파린의 효과적인 TGF-β1-증강 용량이 1-100 μg/mL 사이라고 McCaffrey 등 (상동)이 이전에 보고한 바와 같이, 본 발명자들은 이 범위 내의 용량 사용을 선택하였다. 10 μg/mL의 헤파린과 사전-인큐베이션된 1 ng/mL의 TGF-β1로 처리된 세포는 동일한 용량의 TGF-β1 단독으로 처리된 세포에 비해 더 강한 pSMAD2 및 pSMAD3 시그널을 유지하였다 (도 3.12). 더 높은 용량의 헤파린 (40 μg/mL)은 1 ng/mL의 TGF-β1을 이용한 경우와 동일한 효과를 촉발할 수 없었다. 5 ng/mL의 TGF-β1과 사전-인큐베이션하는 경우, 어떠한 용량의 헤파린도 성장인자 단독으로부터 수득된 것을 넘어서게 pSMAD 시그널을 증강시킬 수 없었다. 종합하면, 본 발명의 결과는 헤파린이 TGF-β1에 의해 생산된 pSMAD 시그널을 증강시키기 보다는 연장시킴을 제안한다.
본 발명자들은 이어서 세포 표면 HS가 TGF-β1-유도성 SMAD 시그널링에 가질 수 있는 영향에 대한 조사에 착수하였다. 이를 위해, 계대 5 세포를 hMSC 배양 배지에서 24시간 동안 헤파리나제 I, II 및 III (각각 1.2 mIU/mL)로 처리한 후, 무혈청 배지에서 헤파린 존재 또는 부재하에 TGF-β1로 처리하였다. 혈청 중의 성장인자가 SMAD2 및 3의 배경 수준에 가질 수 있는 효과를 회피하기 위하여, 웨스턴 블롯팅에 사용된 6시간 시점은 헤파리나제 처리 후 무혈청 배지의 사용을 요구하였다. 항-HS 10E4 항체와 세포 표면 HS의 면역형광 염색은, 24시간 처리 후, 거의 모든 세포 표면 HS가 제거되었음을 나타내었다. 그러나, 세포 표면 HS의 제거는 세포가 TGF-β1로 처리된 경우에 생산되는 pSMAD 시그널에 영향을 미치는 것으로 나타나지 않았다. 본 발명의 결과는, TGF-β1 시그널링을 강화하는 헤파린에 의해 담당된 역할은 이것이 FGF-2 시그널링에서 담당하는 역할과 상이하다는 것을 제안한다 [Schlessinger, J., et al., Crystal Structure of a Ternary FGF - FGFR -Heparin Complex Reveals a Dual Role for Heparin in FGFR Binding and Dimerization. Molecular Cell, 2000. 6(3): p. 743-750].
HS16+
ve
및 BMP-2-결합 HS (HS3+
ve
)의 비교
HS16+ve가 TGF-β1 시그널링을 증강시키는 것으로 나타나기 때문에, 이것이 HS16+ve가 TGF-β 수퍼패밀리의 다른 멤버들의 활성을 유사하게 증강시킬 수 있는지 여부를 결정하는 것에 관심을 갖게 되었다. 본 발명 그룹은 앞서 BMP-2의 활성을 증강시키는, HS 분획, HS3+ve의 친화성 분리를 보고하였다 [Murali, S., et al., Affinity-selected heparan sulfate for bone repair. Biomaterials, 2013. 34(22): p. 5594-5605; WO2010/030244]. 이들 두 단백질 사이의 구조적 유사성은 HS16+ve 및 HS3+ve의 조성의 비교를 보증하였다 (도 12). HS3+ve 및 HS16+ve 둘 모두는 비슷한 양의 ΔUA-GlcNAc, ΔUA-GlcNS 및 ΔUA,2S-GlcNS를 함유하는 것으로 나타난 반면, HS16+ve는 HS3+ve보다 더 많은 ΔUA-GlcNAc,6S, ΔUA-GlcNS,6S 및 ΔUA,2S-GlcNS,6S와 이보다 더 적은 ΔUA,2S-GlcNAc를 함유하였다. HS3+ve의 조성은 모세관 전기영동 (CE)에 의해 결정된 반면, HS16+ve 및 HSPM의 조성은 HPLC에 의해 결정되었고, 그로써 ΔUA,2S-GlcNAc,6S 디사카라이드가 나중의 두 시료에서 검출되지 않았음에 주목해야만 한다. 이 디사카라이드에 대한 검출 불능이 HS 변이체의 조성 프로파일을 변경시킬 수 있다고 반박할 수 있지만, CE 방법을 이용한 HSPM의 이전 분석은 ΔUA,2S-GlcNAc,6S 디사카라이드 부재의 HPLC를 이용해 수득된 것들과 유사한 조성 프로파일을 나타내었다.
HS16+ve 및 HS3+ve의 조성에서 관찰된 이 차이점은 이들의 활성에 대한 기능적 결과를 가져왔다. 놀랍게도, HS16+ve는 SPR-기반 결합 경쟁 분석에서 HS3+ve보다 더 잘 BMP-2에 결합하는 것으로 나타났다 (도 13). 그러나, 마우스 C2C12 근원세포 세포주에서 알칼라인 포스파타제 (ALP)의 BMP-2 유도성 발현을 강화시키는 이의 능력에 대해 조사하는 경우, HS16+ve 및 BMP-2의 조합은 HS3+ve가 BMP-2와 함께 사용되었을 경우 나타나는 ALP 발현과 동일한 수준을 초래할 수 없었다 (도 14).
종합적으로, 본 데이터는, TGF-β1 펩티드를 사용해 친화성 정제된 HS가 최초 HS 제제과는 다른 조성을 가지고, 전장 단백질에 결합하며, 이의 활성 및 잠재성 형태 둘 모두에서 이의 활성을 강화할 것임을 나타내었다. 또한, TGF-β1 펩티드로 정제된 HS는 BMP-2 펩티드로 정제된 것과 다르며, 이 차이는 TGF-β1에 대한 이의 활성을 변경 또는 조정하고 비분획화된 HSPM의 이질적 효과를 감소시키기에 충분하다.
논의
이 연구에서, 본 발명자들은 헤파린이 TGF-β1에 결합할 수 있고, 그렇게 함으로써, 이 성장인자의 열적 안정성을 증강시키는 것으로 나타났다. 이러한 안정화는 hMSC에서 TGF-β1 시그널링 활성의 반감기를 연장시키는 것으로 보인다. 연골발생 분화 조건하에서, 이 헤파린-매개 강화는 초기 연골발생 유전자의 발현을 증강시켰다. 본 발명의 발견은 연골발생 유전자 발현에 대한 헤파린의 강화 효과가 TGF-β1 시그널링 경로를 통한 헤파린 작용의 결과로서 일어나고, 18-22 사카라이드 길이 사이의 GAG 사슬이 TGF-β1에 최적으로 결합하여 이의 시그널을 강화시키는데 요구된다는 개념을 지지한다. 삼중의 TGF-β1 리간드-수용체 복합체의 조사는, 복합체 형성 동안에 더 긴 헤파린 사슬이 TGF-β1과 TGF-β 타입 II 수용체 (TβRII)의 결합을 방해할 수도 있음을 나타내었다 (43). 2-O 황산화, 및 더 적은 수준의 6-O 황산화의 손실은 실제로 결합 친화성의 감소에도 불구하고 TGF-β1 시그널을 강화하는 헤파린의 능력을 향상시킨다. 헤파린 사슬 길이의 영향에 대한 본 발명의 초기 발견과 종합하면, 이들 결과는 HS의 현재 '당 코드 (sugar code)' 가설에 대한 강력한 증거를 제공하고 (44-47), 결합 강도 및 생체활성 사이의 비-선형 관계의 개념을 보강한다 (48). 본 발명자들은 또한 헤파린 결합에 관여하는 TGF-β1 단량체 상의 새로운 잔기로서 K13을 동정하였다. 이 데이터에 의해 유도되어, 본 발명자들은 돼지 점막 제제로부터 수득된 이종 혼합물로부터 TGF-β1에 선호적으로 결합하는 HS의 집단 (HS16+ ve)의 분리를 진행하였다. HS16+ ve의 특성화는, 이것이 HSPM및 HS16- ve와 조성적으로 상이하였고, 이 차이가 hMSC에서 TGF-β1 및 LTGF-β1 둘 모두에 더 잘 결합하여 이들의 시그널링 모두를 강화시킬 수 있는 것임을 입증하였다.
이전 연구는, 헤파린이 TGF-β1에 결합하여 프로테아제 활성 및 α 2-마크로글로불린 (macroglobulin)에 의한 순환계 소거로부터 이를 보호하고, 그로써 이의 시그널을 강화할 것임을 보여주고 있다 (3,5). 이는 일부 연골 복구 연구에서 TGF-β 담체로서 또는 스캐폴드 재료로서 이의 사용을 유도하였다 (49,50). 일부 연구는 심지어 헤파린을 생쥐 MSC에서 연골발생 유도 동안에 성장인자의 방출을 제어하는데 활용하였다 (51). 그러나, 제어되지 않는 출혈 및 혈소판 감소의 위험 (52) 뿐만 아니라, 헤파린의 과황산화는 포괄적으로 헤파린 상호작용체 (interactome) 또는 헤파라놈 (heparanome)으로 공지된, 200개가 넘는 상이한 세포외 단백질에 무분별하게 결합할 수 있음을 의미하기 때문에 (53,54), 이 당류는 조직 복구 또는 성장인자 조정을 위한 치료제로서 광범위하게 채택될 가능성이 낮다. 이는 헤파린이 성장인자 생산 및 국소화가 용이하게 제어될 수 없는, 생체 내 시스템에서 표적화된 성장인자 조정에 사용하기에 충분한 특이성을 보유하지 않음을 의미한다. 그럼에도 불구하고, 본 발명의 시험관 내 데이터는, 헤파린이 hMSC 연골발생 분화 동안 TGF-β1 활성을 연장하는데 사용될 수 있음을 나타내고, 이는 만약 이들의 내재적 제약이 극복될 수 있다면 실현될 수 있는 치료적 가능성이 있음을 제안한다.
HS가 헤파린의 항응고 활성을 보유하지 않기 때문에 헤파린 대신에 HS의 사용은 이론적으로 이러한 장애를 극복할 수 있다 (55). 그러나, HS는 원 제제의 과변이를 비롯해, 그 자체로 일련의 문제를 초래한다. 그러나, 이러한 난제를 극복하도록 개발된 기법들이 존재하고 (26,27,29), 이들 기법 중 하나를 이용함으로써 (29), 본 발명자들은 특정 성장인자에 선호적으로 결합하는 HS의 선택적 아-집단이 분리될 수 있음을 입증할 수 있었다. HS16+가 TGF-β1-유도성 펩티드를 사용하여 분리된 반면, HS16+ ve가 또한 생체 내에서 TGF-β1의 더욱 생리학적으로 풍부한 형태인 LTGF-β1의 효과를 조절할 수 있음이 주목할 만하였다. 흥미롭게도, 헤파린은 LTGF-β1의 활성화를 억제하는 것으로 보고되었던 반면 (56), HS16+ ve는 그렇지 않았다. 이는 정상 및 변형된 생리학적 상태 동안에 TGF-β1-결합 HS의 생체 내 합성에 대한 흥미로운 질문을 유발한다.
여기에 보고된 본 연구는 장래의 TGF-β1-HS 연구에 대한 토대를 마련하고 Lyon 등에 의해 제안된 결합 모델을 기반으로 한다 (2). 본 발명의 데이터는 단백질 단량체들 사이에 걸치는 그루브 (groove)를 통한 폴리사카라이드의 공간적 정위 (spatial orienting)를 통해 TGF-β1에 대한 헤파린의 결합에 영향을 미치는 것으로 보이는 신규한 잔기로서 K13을 동정한다 (도 9). 추가적으로, 몇몇 거대 헤파린 단편의 최근의 구조적 해법 (57)은 본 발명자들이 본 발명의 시험관 내 발견을 TGF-β1 및 헤파린 구조 둘 모두의 생리적 측정과 비교하고 확증할 수 있게 하였다. LTGF-β1 구조에 대한 현재의 제한된 지식 (58-60)은 또한 이 거대 단백질의 활성 조절을 위해 헤파린 및 HS가 담당하는 역할에 대한 의문을 초래한다 (보충 도 S1B, C).
TGF-β1은 작은 잠재성 복합체 (SLC)를 생산하도록 세포 내에서 절단되는 프로-단백질로서 먼저 합성된다. 성숙 SLC는 이량체의 잠재성-연관 펩티드 (LAP)에 비공유적으로 연결된, TGF-β1 이량체로 구성된다. 지금까지 연구된 대부분의 세포 유형의 경우, SLC가 잠재성 TGF-β1-결합 단백질-1 (LTBP-1)과 함께 분비되어, 그로써 큰 잠재성 복합체 (LLC)를 형성한다 (61). LTBP-1은 다양한 부착성 단백질과 상호작용함으로써 잠재성 TGF-β1을 세포외 기질 (ECM) 내로 밀어 넣고 (62), 그로써 세포-매개 활성화 시 이용 가능하게 만들 수 있는 잠재성 TGF-β1의 침착을 생성한다. LAP가 안정한 것으로 고려되는 구조를 갖는다고 하더라도, 이 분자의 2개 영역은 SLC 내에 TGF-β1을 가두는 그러한 방식으로 언폴딩 (unfolding)될 수 있다 (60). 이들 영역의 형상이 기계적으로 강요되어 완전히 개방되는 경우, 활성 TGF-β1이 LAP로부터 방출된다 (58). 두 도메인의 이러한 동시 언폴딩인, 전장 TGF-β1 방출을 위해 필요한 양자택일의 스냅 기전 (all-or-nothing snap mechanism)은 LAP가 LTBP-1에 결합된 경우에만 가능하다. HS가 이 기계적 힘의 생성 또는 방출 중 하나에 관여하는지 여부 및 관여하는 방법이 흥미로운 질문이다.
모든 이들 고려는 본 발명의 결과를 확증하기 위해 헤파린-TGF-β1 상호작용의 광범위한 인 실리코 (in silico) 모델링에 대한 필요성, 및 HS16+ ve와 같은 HS 제제의 도메인 조직화를 판독하기 위한 컴퓨터 도구의 개발을 지적한다 (63). 이러한 연구는 본 발명의 HS의 친화성-기반 분리 또는 나아가 화학적으로 정의된 TGF-β1-특이적 HS 분자의 합성을 개선할 가능성을 열어둘 것이다 (64).
결론적으로, 본 발명자들은 헤파린, 및 친화성 분리된 HS가 hMSC에 대한 TGF-β1 시그널링의 조절에 사용될 수 있음을 보여준다. 본 발명자들은 또한 헤파린-TGF-β1 상호작용에 대한 구조적 요건을 최초로 보고한다. 종합하면, 이 데이터는 이들 분자 사이의 구조적 상호작용의 이해가 어떻게 요법 개발을 유도할 수 있는지의 중요성을 되풀이한다. 이는 hMSC의 연골발생 분화를 유도하는 TGF-β1 활성을 조절하기 위해 탄수화물 분자를 이용하는, 연골 복구에 대한 신규한 치료적 전략의 개발에 대한 장래성을 제공한다. 이러한 전략은 또한 성장인자의 사용을 포함하는 다른 조직 복구 전략으로 확대될 수 있다.
본 발명의 연구에서, TGF-β1의 헤파린 결합 부위를 함유하는 펩티드가 친화성 정제에 의해 돼지 점막 HS (HSPM)로부터 HS의 TGF-β1-결합 분획을 분리하는데 사용하였다. HS16+ve로 명명된, 분리된 TGF-β1-펩티드 결합 HS는 최초 HSPM 출발 물질인, HS16-ve로 명명된, 비-결합 HS 분획과는 조성이 상이한 것으로 나타났다. 조성에 있어서의 이 차이는 HS16-ve 및 HSPM에 비해 TGF-β1에 결합하고 이의 활성을 조정하는 HS16+ve의 활성을 증강시켰다. 놀랍게도, HS16+ve는 또한 TGF-β1의 불활성, 저장 형태인, LTGF의 활성을 조절할 수 있었다. BMP-2 활성을 증강시키기 위해 개발된 HS 변이체인 HS3+ve와 비교할 때 [Murali, S., et al., Affinity-selected heparan sulfate for bone repair. Biomaterials, 2013. 34(22): p. 5594-5605], HS16+ve는 조성적 차이를 보유하는 것으로 나타났고, 이는 HSPM 및 HS3+ve에 비해 BMP-2 활성을 강화하는 이의 능력을 변경시켰다.
본 연구에서, 사용된 펩티드는 16개 아미노산 길이였던 반면에, 전장의 성숙 TGF-β1은 112개 아미노산 길이이다. 용액 중의 펩티드는 전체 단백질의 일부일 때 추정되는 것들과는 상이한 형상을 채택하는 것으로 알려져 있고, PEPFOLD를 이용한 [Maupetit, J., P. Derreumaux, and P. Tuffery, PEP-FOLD: an online resource for de novo peptide structure prediction. Nucleic Acids Research, 2009. 37(suppl 2): p. W498-W503; Maupetit, J., P. Derreumaux, and P. Tuffery, A fast method for large-scale DeNovo peptide and miniprotein structure prediction. Journal of Computational Chemistry, 2010. 31(4): p. 726-738; and 216. Thevenet, P., et al., PEP-FOLD: an updated de novo structure prediction server for both linear and disulfide bonded cyclic peptides. Nucleic Acids Research, 2012. 40(W1): p. W288-W293], HS16+ve 분리에 사용된 TGF-β1 펩티드의 구조적 예측은 TGF-β1의 천연형 구조와 일치하지 않는다. 이는 펩티드의 단일 스트레치 (single stretch)가 TGF-β1 헤파린-결합 도메인의 공간적 조직화를 재현할 수 있을 것이라고 생각하기 어렵기 때문에, 본 발명의 펩티드-기반 친화성 정제를 유도하는 기전에 의문점을 제기한다. 펩티드-헤파린 상호작용에 대해 거의 확실한 사실인 (본 발명자 그룹의 미공개 데이터), 펩티드와 HS 사이의 상호작용이 일차적으로 이온성 상호작용에 의해 유도된다고 주장할 수 있지만, 상이한 단백질 (BMP-2)로부터의 펩티드의 사용은 분리된 HS 분획의 프로파일을 변경하였기 때문에 본원에서는 이에 해당하는 것으로 보이지 않는다.
헤파린-결합에 관여하는 염기성 잔기의 광범위하게 조사된 보존적 서열은 2개 모티프의 염기성 잔기 중 하나를 채택하는 것으로 제안된다: -X-B-B-BX-X-B-X-X- 또는 -X-B-B-X-B-X-X- (여기서, X는 임의의 중성 또는 산성 아미노산이고 B는 염기성 잔기임) [Cardin, A.D. and H.J. Weintraub, Molecular modeling of protein glycosaminoglycan interactions. Arteriosclerosis, Thrombosis, and Vascular Biology, 1989. 9(1): p. 21-32]. 제3의 모티프가 TGF-β1에 존재하는 것으로 제안되고 있다: -X-BX-X-B-X-X-B-X-X-B-X- [McCaffrey, T.A., D.J. Falcone, and B. Du, Transforming growth factor-β1 is a heparin-binding protein: Identification of putative heparin-binding regions and isolation of heparins with varying affinity for TGF - β1 . J Cell Physiol, 1992. 152(2): p. 430-440]. 흥미롭게도, Pace 및 Scholtz [Nick Pace, C. and J. Martin Scholtz, A Helix Propensity Scale Based on Experimental Studies of Peptides and Proteins. Biophysical Journal, 1998. 75(1): p. 422-427]는, 염기성 잔기가 용액 중에서 α-헬릭스를 형성하는 높은 경향을 가짐을 보고하였다. 이들 제안된 모티프 내 염기성 잔기의 조직화 및 α-헬릭스의 조직화를 고려하면 (회전당 3.6개 아미노산 잔기), 이들 모티프가 동일판 평면을 따라서 배열된 이들의 염기성 잔기와 용액 중에서 헬릭스 구조를 채택한다는 발견은 놀랍지 않을 것이다. 사실이라면, 이러한 조직화는 펩티드에 일정 정도의 선택성을 부여할 수 있다.
HS16+ve의 크기 결정 및 조성 분석은, 이것이 사슬 크기 분포 측면에서 덜 이종인, 더 긴 폴리사카라이드 사슬에 대해 농축되었고, HS16-ve 및 HSPM 둘 모두에 비해 6-O- 및 N-황산화된 디사카라이드에 대해 농축되었음을 보여주었다. 이는 헤파린-TGF-β1 상호작용에 대한 본 연구로부터, 본 발명자들이 해파린 사슬이 적어도 dp22에 상당하고 TGF-β1에 효과적으로 결합하여 이의 활성을 조절하기 위해서는 6-O- 및 N-설페이트기를 보유해야 할 필요성을 규명한, 본 발명자들의 발견을 확증하였다. 더 긴 사슬의 HS에 대한 농축은 TGF-β1 호모이량체 상의 2개의 헤파린/HS 결합 부위를 연결하기 위해 적어도 22개 사카라이드 유닛에 대한 필요성으로 설명될 수 있다. 이러한 사슬은 또한 TGF-β1과 효과적으로 상호작용하기 위한 설페이트 분포 기준을 충족해야만 할 것이고, 이는 본 발명의 정제에 의해 선택된 HS 사슬의 범위를 더욱 한정할 것이다.
HS16+ve는 헤파린과 유사한 정도로 TGF-β1-유도성 SMAD 시그널링을 강화시킬 수 있다. 예상외로, LTGF-β1에 대한 이의 효과는 LTGF-β1에 대한 헤파린의 효과에 비해 더욱 두드러졌다. LTGF-β1이 생체 내에서 TGF-β1의 우세한 형태이고, 이는 TGF-β1 시그널링에서 HS의 합성 및 HS가 담당하는 생리학적 역할에 대해 흥미로운 의문점을 제기한다. LTGF-β1 복합체 내 TGF-β1을 가두는 그러한 방식으로 이 분자의 두 영역이 언폴딩될 수 있다고 하더라도, LTGF의 잠재성-연관 펩티드 (LAP) 부분은 안정한 것으로 간주되는 구조를 갖는다 [Shi, M., et al., Latent TGF -β structure and activation. Nature, 2011. 474(7351): p. 343-349]. 이들 영역의 형상이 기계적으로 강요되어 완전히 개방되는 경우, 활성 TGF-β1이 LAP로부터 방출된다 [Buscemi, L., et al., The Single-Molecule Mechanics of the Latent TGF - β1 Complex. Curr Biol, 2011. 21(24): p. 2046-2054]. 두 도메인의 이러한 동시 언폴딩인, 전장 TGF-β1 방출을 위해 필요한 양자택일의 스냅 기전 (all-or-nothing snap mechanism)은 LAP가 LTGF-결합 단백질-1 (LTBP-1)에 결합된 경우에만 가능하다. LAP 및 LTBP-1 둘 모두가 헤파린과 상호작용하는 것으로 보고되었음이 흥미롭게 주목된다 [Lee, M.J., Heparin Inhibits Activation of Latent Transforming Growth Factor- β1 . Pharmacology, 2013. 92(5-6): p. 238-244; Chen, Q., et al., Potential Role for Heparan Sulfate Proteoglycans in Regulation of Transforming Growth Factor-β ( TGF -β) by Modulating Assembly of Latent TGF -β-binding Protein-1. J Biol Chem, 2007. 282(36): p.26418-26430; and Parsi, M.K., et al., LTBP -2 has multiple heparin/ heparan sulfate binding sites. Matrix Biology, 2010. 29(5): p. 393-401]. 이 증거가 생체 내에서 합성된 HS가 LTGF-β1을 활성화시키기 위해 조정될 수 있음을 제시한다고 하더라도, HS가 이 기계적 힘의 생성 또는 방출 중 하나에 관여하는지 여부 및 어떻게 관여하는지가 타당한 의문점이다.
HS16+ve의 조성과 HS3+ve의 조성의 비교는 이들 조성에 차이가 있음을 나타내었다. BMP-2에 결합하여 이의 활성을 조절하는 어느 하나의 HS 변형체의 능력에서 관찰된 이 차이는 아마도 조성에 있어서의 차이 및 그에 따른 HS 사슬에 구현된 디사카라이드 서열의 차이의 조합의 결과이다. BMP-2-헤파린 상호작용의 모델링 [Gandhi, N.S. and R.L. Mancera, Prediction of heparin binding sites in bone morphogenetic proteins ( BMPs ). Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2012. 1824(12): p. 1374-1381]은 이 연합이 헤파린과 TGF-β1의 상호작용과는 상당히 다름을 제안하고, 이는 HS16+ve 및 HS3+ve의 조성에 있어서의 차이를 설명할 것이며, TGF-β 수퍼패밀리 내부의 헤파린/HS 결합 부위의 다양화를 시사한다 [Rider, C.C., Heparin/ heparan sulphate binding in the TGF -β cytokine superfamily . Biochem Soc Trans, 2006. 34(Pt 3): p. 458-460]. HSPM에 비해 BMP-2 유도성 ALP 발현을 강화하는 HS16+ve의 능력에서 관찰된 중간 수준의 증가는, HSPM 보다는 헤파린에 더 유사하게 만드는, HS16+ve에서 황산화된 HS 사슬의 농축, 또는 HS16+ve 및 HS3+ve 제제 내 HS 사슬의 조성에서의 중복 (overlap) 중 하나에 기인할 수 있다.
HS가 핵산 및 단백질에 나타난 동일한 절대적인 서열 특이성으로 암호화되는 것으로는 보이지 않는다고 하더라도, 본 발명의 결과는 현재 HS "당 코드" 가설에 대한 강력한 증거를 제공하고 [Gama, C.I., et al., Sulfation patterns of glycosaminoglycans encode molecular recognition and activity. Nat Chem Biol, 2006. 2(9): p. 467-473; Duchesne, L., et al., Transport of Fibroblast Growth Factor 2 in the Pericellular Matrix Is Controlled by the Spatial Distribution of Its Binding Sites in Heparan Sulfate. PLoS Biol, 2012. 10(7): p. e1001361; Chang, Z., et al., Differential ability of heparan sulfate proteoglycans to assemble the fibroblast growth factor receptor complex in situ. FASEB J, 2000. 14(1): p. 137-144; and Jastrebova, N., et al., Heparan sulfate domain organization and sulfation modulate FGF2 induced cell signaling. J Biol Chem, 2010], 결합 강도 및 생체활성 사이의 비-선형 관계의 개념을 보강한다 [Rudd, T.R., et al., Comparable stabilisation , structural changes and activities can be induced in FGF by a variety of HS and non-GAG analogues : implications for sequence-activity relationships. Org Biomol Chem, 2010. 8(23): p. 5390-5397]. 여전히 답변이 요구되는 주된 의문점 중의 하나는 소정의 단백질과 상호작용하기 위해 소정의 HS 사슬에 요구되는 엄격성 (stringency)의 수준이다. GAG의 조직화를 해독하기 위한 개선된 컴퓨터 도구의 개발이 이 노력을 지원할 것임을 희망한다 [Spencer, J.L., et al., A Computational Approach for Deciphering the Organization of Glycosaminoglycans . PLoS ONE, 2010. 5(2): p. e9389].
실시예
1을 위한 참조
실시예
2: 시험관 내 및 생체 내
MSC의
연골발생
분화에 대한 HS16+
ve의
효과
서론
관절 연골은 인간의 관절에서 충격 흡수제 및 윤활제 둘 모두로 작용하는 장골의 말단에서 발견되는 조직이다. 이의 무혈관 특성으로 인해, 관절 연골에 의해 지속된 손상은 종종 치유에 실패한다. 연골 복구 전략의 개발에 대한 현재 연구는 활성화된 생체물질의 사용 또는 세포에 유도성 자극의 제공을 통해, 내인성 또는 이식된 세포 중 하나로부터의 반응을 촉진하는데 집중되어 있다 [145. Guo, X., et al., Repair of osteochondral defects with biodegradable hydrogel composites encapsulating marrow mesenchymal stem cells in a rabbit model. Acta Biomaterialia, 2010. 6(1): p. 39-47; Chu, C.R., M. Szczodry, and S. Bruno, Animal Models for Cartilage Regeneration and Repair. Tissue Engineering Part B: Reviews, 2009. 16(1): p. 105-115; Fritz, J., et al., Articular cartilage defects in the knee-basics, therapies and results. Injury, 2008. 39(1, Supplement): p. 50-57; Hunziker, E.B., Articular cartilage repair: basic science and clinical progress. A review of the current status and prospects. Osteoarthritis Cartilage, 2002. 10(6): p. 432-463; Gille, J., et al., Cell-Laden and Cell-Free Matrix-Induced Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage, 2010. 1(1): p. 29-42; Haleem, A.M., et al., The Clinical Use of Human Culture-Expanded Autologous Bone Marrow Mesenchymal Stem Cells Transplanted on Platelet-Rich Fibrin Glue in the Treatment of Articular Cartilage Defects. Cartilage, 2010. 1(4): p. 253-261; Moran, C.J., et al., Restoration of Articular Cartilage. J Bone Joint Surg Am, 2014. 96(4): p. 336-344; Daniovi, L.u., et al., The tissue engineering of articular cartilage: cells, scaffolds and stimulating factors. Exp Biol Med, 2012. 237(1): p. 10-17]. TGF-β1은 MSC의 연골발생 분화를 촉진하고 [Buxton, A.N., et al., Temporal exposure to chondrogenic factors modulates human mesenchymal stem cell chondrogenesis in hydrogels . Tissue Eng Part A, 2011. 17(3-4): p. 371-80; 233. Bosnakovski, D., et al., Chondrogenic differentiation of bovine bone marrow mesenchymal stem cells in pellet cultural system. Experimental Hematology, 2004. 32(5): p. 502-509; Ng, F., et al., PDGF , TGF -β, and FGF signaling is important for differentiation and growth of mesenchymal stem cells (MSC): transcriptional profiling can identify markers and signaling pathways important in differentiation of MSC into adipogenic, chondrogenic , and osteogenic lineages. Blood, 2008. 112(2): p. 295-307], 연골 ECM 분자의 발현을 유도하는 [Li, H., et al., Comparative analysis with collagen type II distinguishes cartilage oligomeric matrix protein as a primary TGFβ -responsive gene. Osteoarthritis Cartilage, 2011. 19(10): p. 1246-1253; Iqbal, J., et al., Age-Related Effects of TGF -β on Proteoglycan Synthesis in Equine Articular Cartilage. Biochem Biophys Res Commun, 2000. 274(2): p.467-471; Grimaud, E., D. Heymann, and F. Redini, Recent advances in TGF -β effects on chondrocyte metabolism: Potential therapeutic roles of TGF -β in cartilage disorders. Cytokine Growth Factor Rev, 2002. 13(3): p. 241-257; Serra, R., et al., Expression of a Truncated, Kinase -Defective TGF -β Type II Receptor in Mouse Skeletal Tissue Promotes Terminal Chondrocyte Differentiation and Osteoarthritis. J Cell Biol, 1997. 139(2): p. 541-552.; Blaney Davidson, E., et al., TGF beta-induced cartilage repair is maintained but fibrosis is blocked in the presence of Smad7 . Arthritis Res Ther, 2006. 8(3): p. R65] 이의 능력으로 인해 연골 복구의 유도에 대한 핵심 작용자로서 부각되었다. 따라서, 지금까지 대부분의 연구는 hMSC 연골발생 분화를 유도하기 위하여, 단독으로 또는 다른 성장인자와 조합하여, 외인성 TGF-β1의 사용을 이용하였다 [Blaney Davidson, E.N., P.M. van der Kraan, and W.B. van den Berg, TGF -β and osteoarthritis. Osteoarthritis Cartilage, 2007. 15(6): p. 597-604; Park, J.S., et al., Heparin-Bound Transforming Growth Factor-β3 Enhances Neocartilage Formation by Rabbit Mesenchymal Stem Cells. Transplantation, 2008. 85(4): p. 589-596; Goepfert, C., et al., Cartilage Engineering from Mesenchymal Stem Cells, in Bioreactor Systems for Tissue Engineering II, C. Kasper, M. van Griensven, and R. Portner, Editors. 2010, Springer Berlin / Heidelberg. p. 163-200; Mara, C.S., et al., Regulation of Chondrogenesis by Transforming Growth Factor-ß3 and Insulin-like Growth Factor-1 from Human Mesenchymal Umbilical Cord Blood Cells. J Rheumatol, 2010. 37(7): p. 1519-1526].
초기에는 성공적으로 보였으나, TGF-β1의 초과생리학적 (supraphysiological) 용량이 종종 사용되고, 심지어 20 ng 용량에서조차 윤활막 염증과 같은 바람직하지 않은 결과를 유발하는 것으로 나타났기 때문에, 이러한 접근법은 이들의 임상으로의 전환에 있어 중대한 장벽에 직면한다 [Leah, E., Osteoarthritis: TGF -β overload at bones of cartilage degeneration. Nat Rev Rheumatol, 2013. 9(7): p. 382-382; Allen, J.B., et al., Rapid onset synovial inflammation and hyperplasia induced by transforming growth factor beta. J Exp Med, 1990. 171(1): p. 231-247]. 비-생리학적 용량의 문제와는 별도로, 섬유증 및 종양발생과 같은, 전신적 부작용을 촉발하는 것을 예방하기 위해 치료 부위에 성장인자를 국소화하는 것이 또한 요구된다 [Jakowlew, S., Transforming growth factor-β in cancer and metastasis. Cancer Metastasis Rev, 2006. 25(3): p. 435-457; Bakker, A.C., et al., Overexpression of active TGF -beta-1 in the murine knee joint: evidence for synovial -layer-dependent chondro - osteophyte formation. Osteoarthritis Cartilage, 2001. 9(2): p. 128-136; Yang, Y.-a., et al., Lifetime exposure to a soluble TGF -β antagonist protects mice against metastasis without adverse side effects. J Clin Invest, 2002. 109(12): p. 1607-1615]. 따라서, TGF-β1에 대한 민감성은 나이가 듬에 따라 감소하고 [Blaney Davidson, E.N., et al., Reduced transforming growth factor-beta signaling in cartilage of old mice: role in impaired repair capacity. Arthritis Res Ther, 2005. 7(6): p. R1338 - R1347], 따라서 적당한 TGF-β1 투여는 노령의 환자에 더욱 심각한 위험성을 나타낸다. 이들 난제에 대하여, 외인성 성장인자에 대한 요구를 감소시키거나 완전히 제거하고; 치료 부위에 성장인자의 전달을 더 잘 국소화하고 제어하며; 성장인자 또는 인자의 시그널링 효능에 대한 세포 민감성 중 하나를 증가시키는 새로운 전략이 고려되고 있다.
HS16+ve의 개발, 및 MSC 단층 배양에서 TGF-β1-유도성 SMAD 반응을 강화하는 이의 능력이 기술됨에 따라서, 본 발명자들은 HS16+ve가 내인성 TGF-β1를 격리시킴으로써 연골 치유를 개선하는데 사용될 수 있다고 가정하였다. 이에 본 발명자들은 (1) 시험관 내에서 hMSC의 연골발생 분화; 및 (2) 토끼 모델에서 연골-치유 반응에 대한 이의 효과를 조사하는데 착수하였다.
이 실시예는 hMSC의 연골발생 분화에 대한 HS16+ve의 시험관 내 효과의 조사를 위한 변형된 미세군집 펠렛 배양 시스템의 사용을 기술한다. 그 후에 연골 복구에 대한 토끼 모델에서 도르래 그루브 (trochlea groove)의 전두께의, 골연골 결손 내부에서, 현행의 임상적 "치료 기준 (standard of care)"과 함께 사용될 때, 앞서 기술된 HS 변형체의 효과를 조사하는 것으로 진행되었다.
재료 및 방법
역전사
및 정량적
PCR
(
qPCR
)
총 RNA를 제조사의 지침에 따라서 TRIZOL 시약 (Life Technologies, CA, USA)을 사용하여 연골발생 미세군집 펠렛으로부터 분리하였다. 역전사를 1 μg RNA에 대해 제조사의 지침에 따라서, 1시간 대신에 2시간 동안 42℃에서 인큐베이션을 실시하면서, SuperScript® VILOTM cDNA 합성 키트 (Life Technologies)를 사용하여 실시하였다. 각각의 qPCR은 40 ng cDNA, 유전자당 1 μL TaqMan® 프라이머-프로브 믹스, 및 10 μL Taqman® Fast Universal PCR 마스터 믹스 (Life Technologies)를 20 μL의 최종 부피로 포함하였다. 열 순환 조건은 95℃에서 20초에 이어서, 95℃에서 1초 및 60℃에서 20초의 45주기였다. 각각의 qPCR을 2회씩 수행하였고 유전자 발현을 HPRT1 발현에 표준화하여 ΔCt 값을 수득하였다. 생물학적 3중체의 평균 값을 취하였다. GAG 또는 TGF-β1 부재의 배지에서 배양된 연골발생 미세군집 펠렛을 대조군 (ΔΔCt)으로 사용하였다. 각 프라이머 세트에 대한 상대적 발현 수준을 2-ΔΔCt 방법에 의해 배수 변화로 표현하였다 [Livak, K.J. and T.D. Schmittgen, Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2ΔΔCT Method. Methods, 2001. 25(4): p. 402-40]. 하기 TaqMan® 프라이머-프로브 분석 (Life technologies)을 이용하였다:
시험관 내 연구 설계
22마리의 골격이 성숙한, 웅성 뉴질랜드 흰토끼 (평균 9개월령 및 3.9 kg 체중)를 이 연구에 사용하였다. 모든 토끼는 대퇴부 도르래 그루브에 양측성 골연골 결함을 입게 되고 각각의 결함은 무작위로 4개 처리군 중의 하나로 배정된다: (1) Gel 단독, (2) Gel + HSPM, (3) Gel + HS16+ve, 및 (4) Gel + HS16-ve. 모든 결함은 60 μL의 히알루론산-계 하이드로겔 (Gel) (AuxiGelTM, Termira AB, Stockholm, Sweden) [Bergman, K., et al., Injectable cell-free template for bone-tissue formation. Journal of Biomedical Materials Research Part A, 2009. 91A(4): p. 1111-1118] 단독으로 또는 10 μg의 HSPM, HS16+ve 또는 HS16-ve와 함께 투여 받았다. 2마리 토끼가 수술후 위 울혈로 사망하였고 분석에 포함되지 않았다.
결함 생성 및 겔 주입
이 연구에 사용된 조사 프로토콜은 국제동물운영관리위원회 (Institutional Animal Care and Use Committee, A*STAR Singapore)에 의해 승인되었고, 모든 적합한 가이드라인을 준수하였다. 모든 외과적 과정은 무균 조건하에서, 케타민 (35 mg/kg) 및 자일라진 (5 mg/kg) 주사와 안면 마스크를 통한 이소플루란의 조합으로 이루어진, 일반적인 마취 상태에서 수행되었다. 15-20 mm의 슬개골 내측 (medial para-patellar) 피부 절개를 만들고 슬개골을 측면으로 탈구시켰다. 하나의 전두께의, 치명적-크기의 (critically-sized) 골연골 결함 (4 mm 직경, 2 mm 깊이)을 석회화 연골의 완전한 괴사 조직 제거술 (debridement)을 이용해 각 대퇴부 도르래 그루브의 중심에 만들었다. 이어서, 3 미세골절 (0.8 mm 직경, 2 mm 깊이)을 정형외과적 드릴을 사용해 각각의 결함 내에 만들고 각각의 지정된 처치를 적용하기 전에 모든 출혈이 멈추었음을 보장하기 위해 수술용 거즈를 이용해 직접적인 압력을 가하였다. 200 μL의 피펫으로 처치를 적용하였고 고정되게 하였다. 모든 결함은 겔 담체가 고정되는 동안 혈액으로 채워지는 것으로 관찰되었다.
일단 겔 담체가 고정되면, 슬개골을 재위치시키고 (repositioned) 관절을 15회 굽혀서 절개가 층상으로 폐쇄되기 전에 처치가 적소에 잔존함을 확인하고, 토끼의 체중이 부하되게(weight-bear) 하였다. 상처 부위를 VetbondTM 조직 접착제 (3M, MN, USA)로 추가 밀봉하였다. 예방적 항생제 (엔로플록사신, 10 mg/kg) 및 진통제 (부프레노르핀, 0.1 mg/kg)를 수술 후 5일간 피하로 투여하였다. 12주째에 모든 토끼를 진정시킨 후 펜토바르비탈 (150 mg/kg)로 안락사시켰다. 원위 대퇴골을 적출하고 현미경으로 이미지화한 후 조직학적 및 면역조직화학적 (IHC) 분석을 위해 가공하였다.
관절의 육안 병리학적 관찰
관절의 이미지를 조사하고 처리군을 알지 못하는 블라인드 관찰자 (blinded observer)에 의해 점수를 매겼다. 거시적 점수매김 (Macroscopic scoring)은 국제연골복구협회 (International Cartilage Repair Society, ICRS) 시각적 평가 등급 (Visual Assessment Scale) (ICRS I 점수매김 시스템)을 근거로 하였다 [Brittberg, M. and L. Peterson, Introduction of an articular cartilage classification. ICRS Newsletter, 1998. 1: p. 5-8].
조직학 분석
적출된 원위 대퇴골 머리 (distal femoral heads)를 진공하에서 10% (v/v) 중성-완충된 포르말린 (NBF)에서 1주일간 고정시키고 평균 6-7일간 실온에서 5% (v/v) 포름산 중에서 탈석회화하였다. 그 후에 시료를 파라핀 왁스에 포매하고 결함의 중앙을 가로질러 절편 (5 μm)을 만들었다. 절편에서 파라핀을 제거하고 메이슨 트리크롬 (Masson's trichrome), 알시안 블루 (pH 1, 뉴트럴 레드로 대비 염색됨) 및 사프라닌-O로 염색하였다.
면역조직화학 (IHC) 분석
Leica BondTM-III 또는 BondTM-Max 자동염색기 (Autostainer) (Leica Nussloch GmbH, Germany) 및 BondTM Refine 검출 키트 (Leica)를 사용하여 IHC 염색을 실시하였다. BondTM Dewax 용액 (Leica)을 이용해 절편에서 파라핀을 제거하고 프로테아제 K (20 μg/mL) (Sigma-Aldrich)와 실온에서 15분간 인큐베이션함으로써 항원 재생 (retrieval)을 수행하였다. 내인성 퍼옥시다제 활성을 3-4% (v/v) H2O2와 15분간 인큐베이션함으로써 차단하였다. 절편을 그 후에 10% (v/v) 염소 혈청 중에서 30분간 차단한 후 BondTM 일차 항체 희석제 (Leica)로 희석된 일차 항체 (콜라겐 타입 I (1:1000), Novus Biologicals, CO, USA 및 콜라겐 타입 II (1:2000), Acris Antibodies, Inc., CA, USA)와 30분간 인큐베이션하였다.
실온에서 30분간 희석제 (Leica). BondTM Refine 검출 기트에 기술된 바와 같이 염색의 검출을 실시하고 핵을 5분간 헤마톡실린으로 대비 염색하였다. 모든 세척은 1x BondTM Wash 용액 (Leica)으로 수행하였다.
조직학적 점수매김
염색된 절편의 조사 및 점수매김을 처리군을 알지 못하는 블라인드 관찰자에 의해 수행하였다. 점수매김은 O'Driscoll [O'Driscoll, S.W., F.W. Keeley, and R.B. Salter, The chondrogenic potential of free autogenous periosteal grafts for biological resurfacing of major full thickness defects in joint surfaces under the influence of continuous passive motion. An experimental investigation in the rabbit. J Bone Joint Surg Am, 1986. 68(7): p. 1017-1035] and ICRS II [Mainil-Varlet, P., et al., A New Histology Scoring System for the Assessment of the Quality of Human Cartilage Repair: ICRS II. The American Journal of Sports Medicine, 2010] 점수매김 시스템을 근거로 하였고, 조직 충진은 연골 및 연골하 (sub-chondral) 공간 내부에서 각각의 조직 유형 (즉, 뼈 조직, 섬유 조직, 섬유연골, 하이브리드 연골 및 유리질 연골)의 비율을 정량함으로써 결정하였다.
결과
시험관 내에서
hMSC의
연골발생
분화에 대한 HS16+
ve의
효과
시험관 내에서 hMSC의 연골발생 분화에 대한 HS16+ve의 효과를 평가하기 위하여, 먼저 TGF-β1 단독의 효과를 확립할 필요가 있었다. 연골발생 분화를 변형된 미세군집 배양 시스템을 사용하여 실시하였다 [Zhang, L., et al., Chondrogenic differentiation of human mesenchymal stem cells: a comparison between micromass and pellet culture systems. Biotechnol Lett, 2010. 32(9): p. 1339-1346]. 간략히는, 계대 4 hMSC를 수확하고 화학적으로 정제된 연골발생 배지 (PT-3003, Lonza, MD, USA)에 2 x 107 세포/mL로 재현탁하였다. 12.5 μL의 부분표본을 그 후에 24-웰 플레이트의 각 웰의 중앙에 접종하고 37℃에서 2시간 동안 부착되게 놔두고, 그 후에, 1 또는 10 ng/mL의 TGF-β1 (100-21C, PeproTech) 단독 중 하나 또는 5 또는 10 μg/mL의 헤파린 (SigmaAldrich), 돼지 점막 HS (HSPM) (Celsus laboratories), HS16+ve 또는 HS16-ve 중 하나가 보충된 500 μL의 연골발생 배지를 각 웰에 첨가하였다. 세포 부분표본은 24시간 후에 구형의 덩어리로 합체하였다. 배지를 3일마다 교환하고 미세군집을 3, 7, 14 및 21일째에 수확하였다.
결과의 대조군 (Ctrl) 및 TGF-β1-처리된 (10 ng/mL) (TGF-β1) 미세군집 펠렛의 건조 중량을 3, 7, 14 및 21일째에 측정하였다 (도 15). 임의의 처리군에서 펠렛의 중량은 시간의 경과에 따라서 감소한 반면, 중량 손실은 대조군 펠렛에 비해 TGF-β1-처리된 펠렛에서 덜 두드러졌다.
3 (SOX9 및 COMP 단독), 7, 14 및 21일째 미세군집 펠렛의 유전자 발현 분석은 10 ng/mL TGF-β1으로의 처리 (TGF-β1)가 비처리 대조군 펠렛 (Ctrl)에 비해 연골발생 마커 SOX9 (도 16A), COMP (도 16B) 및 어그리칸 (도 16C)의 증가된 발현을 일관되게 초래하였음을 나타내었다. 미분화된 hMSC를 0일째 대조군으로 사용하였다. 타입 II 콜라겐 전사물은 단지 TGF-β1-처리된 펠렛 및 미분화된 hMSC에서만 검출되었다 (도 16D). 이는 hMSC가 단층으로 성장하는 경우에는 낮은 수준의 타입 II 콜라겐 전사물을 발현하지만, 이들이 TGF-β1 미함유 연골발생 배지에서 미세군집으로서 배양되는 경우에는 이 발현이 상실됨을 제안하는 것처럼 보인다. 마지막으로, TGF-β1-처리된 펠렛은 연골세포 대조군 펠렛에 비해, 연골세포 비대 (hypertrophy)의 마커인, 타입 X 콜라겐 전사물을 높은 수준으로 발현하는 것으로 나타났다 (도 16E). 이렇게 높은 발현 수준은, 펠렛이 연골내 골화 (endochondral ossification)의 전조로서 연골발생 비대를 거치는 것임을 제안한다 [Shen, G., The role of type X collagen in facilitating and regulating endochondral ossification of articular cartilage. Orthodontics & Craniofacial Research, 2005. 8(1): p. 11-17].
GAG를 청색으로 염색하는, 알시안 블루 염색에 의한 21일째 파라핀-포매된 펠렛의 조직학적 조사는 TGF-β1-처리된 펠렛이 대조군 펠렛에 비해 더 많은 GAG를 함유하고 있음을 나타내었다.
hMSC의 연골발생 분화에 대한 TGF-β1의 효과가 확립됨에 따라서, 본 발명자들은 이어서, HS16+ve의 효과에 대한 조사에 착수하기 전에, 헤파린이 갖는 효과에 대한 조사를 작수하였다. 실시예 1에서, 본 발명자들은 헤파린 처리 후 6시간째에 hMSC에서 TGF-β1-유도성 pSMAD 시그널을 강화할 수 있었음을 보여주었다. 연골발생 분화 과정 동안에 배지를 3일마다 교체해주었기 때문에, 본 발명자들은 둘 모두 초기 연골발생 마커인 SOX9 및 COMP의 발현에 대한 헤파린의 효과를 조사하기 위해 3일째 시점의 사용을 선택하였다 [Barry, F., et al., Chondrogenic Differentiation of Mesenchymal Stem Cells from Bone Marrow: Differentiation-Dependent Gene Expression of Matrix Components. Exp Cell Res, 2001. 268(2): p. 189-200; Li, H., et al., Comparative analysis with collagen type II distinguishes cartilage oligomeric matrix protein as a primary TGFβ -responsive gene. Osteoarthritis Cartilage, 2011. 19(10): p. 1246-1253; Huang, A.H., A. Stein, and R.L. Mauck, Evaluation of the Complex Transcriptional Topography of Mesenchymal Stem Cell Chondrogenesis for Cartilage Tissue Engineering. Tissue Eng Part A, 2010. 16(9): p. 2699-708; Zaucke, F., et al., Cartilage oligomeric matrix protein (COMP) and collagen IX are sensitive markers for the differentiation state of articular primary chondrocytes . Biochem J, 2001. 358(1): p. 17-24]. 본 발명자들은 또한 만약 헤파린이 TGF-β1의 효과를 강화하는 것이라면, 10 ng/mL의 권고된 용량에 대한 추가의 증가가 검출가능하지 않을 수 있다고 추론하였다. 따라서, 더 낮은 용량의 TGF-β1을 권고된 용량과 함께 병렬로 사용하였다. 본 발명의 데이터는 5 μg/mL의 헤파린이 사용된 TGF-β1의 양과 무관하게 SOX9의 발현 수준을 유의미하게 변경하지 않았음을 나타낸다 (도 17A). 반대로, 10 μg/mL의 헤파린은 그 자체로 SOX9 발현에 영향을 미치지 않았지만, 1 ng/mL의 TGF-β1과 협력하여 사용되는 경우, 이는 SOX9의 발현을 증가시킬 수 있었다. 동일한 용량의 헤파린은 10 ng/mL의 TGF-β1과 함께 사용될 때 SOX9 발현에 아무런 변화도 초래할 수 없었는데, 이는 TGF-β1 시그널이 이미 포화되었음을 제안한다. COMP 발현의 경우에, 헤파린의 두 용량은 그 자체로는 이를 약간 감소시키는 것으로 나타났다 (도 17B). 그러나, 1 ng/mL TGF-β1과 조합하여 사용되는 경우, 헤파린은 용량 의존적 방식으로 COMP 발현 수준을 증가시킬 수 있었다. 10 ng/mL의 TGF-β1과 함께 어느 한 용량의 헤파린의 사용은 COMP 발현에서 추가의 발현을 촉발할 수 없었다. 실제로, 더 높은 용량의 헤파린이 COMP 발현 수준을 사실상 감소시켰다. 이는 다시 10 ng/mL의 TGF-β1이 hMSC가 연골발생 분화를 거치게 하는 포화 용량임을 제안한다. 10 μg/mL의 헤파린이 10ng/mL의 TGF-β1과 사용되는 경우에 나타난 COMP 발현의 감소는 과도한 TGF-β1 시그널에 대한 음성적 피드백 기전의 활성화를 제안한다.
10 μg/mL의 GAG 용량이 TGF-β1의 1 ng/mL 용량과 함께 사용되도록 선택되었다. 21일간 1 ng/mL TGF-β1, 1 ng/mL TGF-β1과 10 μg/mL 헤파린 또는 10 ng/mL TGF-β1 중 하나로 배양된 펠렛의 조직학적 분석은, 알시안 블루 염색을 토대로, 더 높은 용량의 TGF-β1이 GAG 생산 및 침착에 있어서의 증가를 초래함을 나타내었다. 헤파린과 TGF-β1의 사용은 1 ng/mL의 TGF-β1 단독에 비해 GAG 침착에 약간의 증가를 초래하지만, 이 증가는 10 ng/mL의 TGF-β1을 이용해 나타난 것보다 여전히 낮았다.
이어서, hMSC를 1 ng/mL TGF-β1 단독 (1 TGF-β1) 또는 10 μg/mL의 GAG (헤파린, HSPM, HS16+ve 또는 HS16-ve)와 조합하여 또는 양성 대조군으로서 10 ng/mL TGF-β1 (10 TGF-β1)의 존재하에서 21일간 분화시켰다.
21일째에서 SOX9 mRNA 발현의 분석은 모든 당류가 유의미한 변화를 나타내지 않았음을 보여주었다 (도 18A). 펠렛을 1 ng/mL TGF-β1과 함께 헤파린 또는 HS16+ve로 배양하는 경우, COMP 발현은 1 ng/mL TGF-β1 단독에 비해, ~2.5배 증가하였다 (P < 0.05) (도 18B). 낮은 (1 ng/mL) TGF-β1 및 HSPM 또는 HS16-ve 중 하나가 보충되거나, 높은 (10 ng/mL) TGF-β1이 보충된 배지에서의 배양은 저 용량의 TGF-β1 단독에 비해 COMP 발현을 유의미하게 변경하지 못하였다. 어그리칸 발현은 21일째에 저 및 고 용량의 TGF-β1 및 헤파린 및 HS16+ve에서 유사하였다 (도 18C). 그러나, HSPM 및 HS16-ve를 이용한 배양은 어그리칸 전사물 수준을 감소시켰다. 높은 TGF-β1은 낮은 TGF-β1에 비해 타입 X 콜라겐 발현에서 유의미한 증가 (P < 0.001)를 유도하였다 (도 18D). GAG로의 처리는 낮은 TGF-β1에 비해 타입 X 콜라겐 발현을 유의미하게 변경시키지 않았다. 타입 II 콜라겐 전사물은 오로지 높은 TGF-β1으로 처리된 펠렛에서만 검출되었고 따라서 본원에 제시하지 않았다. HS16+ve로 처리된 모든 시료에서 나타난 높은 가변성이 데이터세트 내 이상치 (outlier)의 존재로부터 유래하였음에 주목해야만 한다.
21일째 알시안 블루 염색에 의한 펠렛의 조직학적 검사는 낮은 TGF-β1에 비해, 다양한 당류로 배양된 펠렛들 사이에서 유의미한 차이를 나타내지 않았다. 그러나, 높은 TGF-β1은 낮은 TGF-β1에 비해 GAG 생산에서 중간 수준의 증가를 유도하였다.
생체 내에서 MSC의 연골발생 분화에 대한 HS16의 효과
연골 복구 연구에서 이들의 광범위한 사용과 청년기에서 관찰되는 자발적 치유의 회피 둘 모두에 근거하여 골격이 성숙한 성체 뉴질랜드 흰토끼를 본 발명의 생체 내 시험을 위해 선택하였다. 본 발명자들은 연골 복구에 대한 토끼 모델에서 대퇴부 도르래 그루브에 전두께의, 골연골 결함을 포함하는 모델에서 본 발명의 화합물을 시험할 것을 채택하였고, 이때 미세골절은 Reinholz 등에 의해 개요된 가이드라인을 토대로 하는 [Reinholz, G.G., et al., Animal models for cartilage reconstruction. Biomaterials, 2004. 25(9): p. 1511-1521], the ICRS [Hurtig, M.B., et al., Preclinical Studies for Cartilage Repair: Recommendations from the International Cartilage Repair Society. Cartilage, 2011. 2(2): p. 137-152], 상업적으로 이용가능한 히알루로산-계 하이드로겔 (AuxiGelTM, Termira AB) [Bergman, K., et al., Injectable cell-free template for bone-tissue formation. Journal of Biomedical Materials Research Part A, 2009. 91A(4): p. 1111-1118], 및 병원에서 통용되는 치료 기준 실습 [Fritz, J., et al., Articular cartilage defects in the knee-basics, therapies and results. Injury, 2008. 39(1, Supplement): p. 50-57; Hunziker, E.B., Articular cartilage repair: basic science and clinical progress. A review of the current status and prospects. Osteoarthritis Cartilage, 2002. 10(6): p. 432-463]을 이용해 사용된다.
토끼 및 인간 TGF-β1의 서열 정렬은 TGF-β1이 두 종에 걸쳐서 고도로 보존적일 뿐만 아니라 동정된 헤파린-결합 도메인이 거의 동일하였음을 보여주었다 (도 19). 토끼의 관절액 내 TGF-β1의 평균 수준은 어린 토끼에서 112.7 pg/mL 내지 성체 토끼에서 52.3 pg/mL의 범위로 나타난 반면 [Wei, X. and K. Messner, Age- and injury-dependent concentrations of transforming growth factor-β1 and proteoglycan fragments in rabbit knee joint fluid. Osteoarthritis and Cartilage, 1998. 6(1): p. 10-18], 항-응고된 골수 흡인물 내 수준은 성체 토끼에서 190 - 881.8 pg/mL의 범위로 나타났다 (n = 20) (Lim, Z. X. H., 미공개 데이터). 혈소판 활성화 후 나노그램 수준까지의 TGF-β1의 증가 [Coupes, B.M., et al., Plasma transforming growth factor β1 and platelet activation: implications for studies in transplant recipients. Nephrol Dial Transplant, 2001. 16(2): p. 361-367], 및 연골 복구를 촉진하기 위해 상처 내 TGF-β1의 충분한 수준의 존재 [Shah, R.N., et al., Supramolecular design of self-assembling nanofibers for cartilage regeneration. Proc Natl Acad Sci U S A, 2010. 107(8): p. 3293- 3298]가 또한 별도의 연구에서 보고되었다. 따라서, 본 발명의 당류 처리와 함께 외인성 TGF-β1의 사용은 배제되었다.
하기 그룹을 비교하는 12-주 연구를 수행하였다: (1) 결함 당 60 μL의 하이드로겔 (Gel 단독)로 처리된 대조군; (2) 60 μL의 하이드로겔 및 10 μg의 HSPM로 처리된 결합 (HSPM); (3) 60 μL 하이드로겔 및 10 μg의 HS16+ve로 처리된 결함 (HS16+ve), 및 (4) 60 μL 하이드로겔 및 10 μg의 HS16-ve로 처리된 결함 (HS16-ve). 본 발명자들의 초기 연구를 토대로, 10 μg/mL의 GAG를 1 ng/mL의 TGF-β1의 효과를 증강시키기에 최적인 것으로 결정하였다. 따라서, 윤활강 내부에서의 가능한 확산을 설명한 후에도, 10 μg 용량의 GAG가 결함 내에서 이 최적의 농도를 달성하기에 충분할 것이라고 결정되었다. 결함은 상기에 기술된 바와 같이 생성하였다. 2마리의 토끼가 시험의 말기 전에 위 울혈로 사망하였고 따라서 분석으로부터 배제하였다.
시험의 말기에, 전체 대퇴골을 토끼로부터 적출하였고, 10% (v/v) NBF에서 고정하고 거시적으로 이미지화한 후 조직학 분석을 위해 탈석회화하고 가공하였다. 12주 후 결함의 거시적 관찰은 조직 충진과 관련하여 대조군 (Gel 단독)과 처리군 사이에 약간의 차이를 나타내었다. 각 처리군 내부에서 동일한 양의 조직 충진이 관찰된 반면, 대조군에서는 다른 군에서의 결함에 비해 더 많은 결함이 불완전하게 충진되었다. HSPM, HS16+ve 및 HS16-ve으로 처리된 군의 중간 점수는 Gel 단독의 것들보다 더 높았고 (도 20B), 이는 HS16+ve의 사용이 힐링 반응의 일관성을 향상시킬 수 있음을 제안한다.
O'Driscoll 및 ICRS II 점수매김 시스템으로부터의 조직학적 점수는 처리군 사이에 아무런 유의미한 차이를 나타내지 않았다. 결함의 조직 충진은 먼저 연골 및 연골하 공간의 경계를 동정하고, 이미지화된 절편 위에 격자를 중첩한 후, 각각의 조직학적 공간에 대해 충진된 공간의 양을 측정함으로써 결정되었다. 조직 충진의 관점에서, 거의 모든 시료가 완전한 연골하 충진 및 높은 수준의 연골 충진을 나타내었다. 모든 처리군에 대한 조직 충진 점수 사이에는 아무런 통계학적 차이가 존재하지 않았다. 모든 시료에서 연골하 충진의 중간 비율은 유사하였다. 모든 3종의 화합물 (HSPM, HS16-ve 및 HS16+ve)은, 현행의 임상적 치료 기준 처치인, 대조군 시료 (Gel)보다 더 높은 중간 조직 충진 점수를 가졌다.
시험관 내 데이터는, HS16+ve가 HSPM 및 HS16-ve에 비해, 다수의 연골발생 마커의 TGF-β1-유도성 발현을 증강시킬 수 있었음을 나타내었다. 이는 이식 전에, HS 및 TGFβ1을 이용한 겔-구조물을 전부하 (pre-load), 예컨대, 코팅 또는 함침할 필요가 있을 수 있음을 제안한다.
생체 내 데이터는, 미세골절 및 하이드로겔 이식과 함께, 단일 용량의 당류를 이용한 전두께 골연골 결함의 처리가 적어도 현행의 임상적 치료 기준 처치만큼 우수하고, 바람직하지 않은 부작용을 유발하지 않음을 나타낸다. HS16+ve는 현행의 임상적 치료 기준 처치인, 대조군 시료 (Gel)보다 더 높은 생체 내 데이터에서 중간 점수를 가졌다.
SEQUENCE LISTING
<110> Agency for Science, Technology and Research
<120> Heparan Sulphates
<130> IPA161587-GB
<150> SG 10201401967W
<151> 2014-04-30
<160> 17
<170> PatentIn version 3.3
<210> 1
<211> 16
<212> PRT
<213> Homo sapiens
<400> 1
Arg Lys Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly Tyr His
1 5 10 15
<210> 2
<211> 390
<212> PRT
<213> Homo sapiens
<400> 2
Met Pro Pro Ser Gly Leu Arg Leu Leu Pro Leu Leu Leu Pro Leu Leu
1 5 10 15
Trp Leu Leu Val Leu Thr Pro Gly Arg Pro Ala Ala Gly Leu Ser Thr
20 25 30
Cys Lys Thr Ile Asp Met Glu Leu Val Lys Arg Lys Arg Ile Glu Ala
35 40 45
Ile Arg Gly Gln Ile Leu Ser Lys Leu Arg Leu Ala Ser Pro Pro Ser
50 55 60
Gln Gly Glu Val Pro Pro Gly Pro Leu Pro Glu Ala Val Leu Ala Leu
65 70 75 80
Tyr Asn Ser Thr Arg Asp Arg Val Ala Gly Glu Ser Ala Glu Pro Glu
85 90 95
Pro Glu Pro Glu Ala Asp Tyr Tyr Ala Lys Glu Val Thr Arg Val Leu
100 105 110
Met Val Glu Thr His Asn Glu Ile Tyr Asp Lys Phe Lys Gln Ser Thr
115 120 125
His Ser Ile Tyr Met Phe Phe Asn Thr Ser Glu Leu Arg Glu Ala Val
130 135 140
Pro Glu Pro Val Leu Leu Ser Arg Ala Glu Leu Arg Leu Leu Arg Leu
145 150 155 160
Lys Leu Lys Val Glu Gln His Val Glu Leu Tyr Gln Lys Tyr Ser Asn
165 170 175
Asn Ser Trp Arg Tyr Leu Ser Asn Arg Leu Leu Ala Pro Ser Asp Ser
180 185 190
Pro Glu Trp Leu Ser Phe Asp Val Thr Gly Val Val Arg Gln Trp Leu
195 200 205
Ser Arg Gly Gly Glu Ile Glu Gly Phe Arg Leu Ser Ala His Cys Ser
210 215 220
Cys Asp Ser Arg Asp Asn Thr Leu Gln Val Asp Ile Asn Gly Phe Thr
225 230 235 240
Thr Gly Arg Arg Gly Asp Leu Ala Thr Ile His Gly Met Asn Arg Pro
245 250 255
Phe Leu Leu Leu Met Ala Thr Pro Leu Glu Arg Ala Gln His Leu Gln
260 265 270
Ser Ser Arg His Arg Arg Ala Leu Asp Thr Asn Tyr Cys Phe Ser Ser
275 280 285
Thr Glu Lys Asn Cys Cys Val Arg Gln Leu Tyr Ile Asp Phe Arg Lys
290 295 300
Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly Tyr His Ala Asn
305 310 315 320
Phe Cys Leu Gly Pro Cys Pro Tyr Ile Trp Ser Leu Asp Thr Gln Tyr
325 330 335
Ser Lys Val Leu Ala Leu Tyr Asn Gln His Asn Pro Gly Ala Ser Ala
340 345 350
Ala Pro Cys Cys Val Pro Gln Ala Leu Glu Pro Leu Pro Ile Val Tyr
355 360 365
Tyr Val Gly Arg Lys Pro Lys Val Glu Gln Leu Ser Asn Met Ile Val
370 375 380
Arg Ser Cys Lys Cys Ser
385 390
<210> 3
<211> 112
<212> PRT
<213> Homo sapiens
<400> 3
Ala Leu Asp Thr Asn Tyr Cys Phe Ser Ser Thr Glu Lys Asn Cys Cys
1 5 10 15
Val Arg Gln Leu Tyr Ile Asp Phe Arg Lys Asp Leu Gly Trp Lys Trp
20 25 30
Ile His Glu Pro Lys Gly Tyr His Ala Asn Phe Cys Leu Gly Pro Cys
35 40 45
Pro Tyr Ile Trp Ser Leu Asp Thr Gln Tyr Ser Lys Val Leu Ala Leu
50 55 60
Tyr Asn Gln His Asn Pro Gly Ala Ser Ala Ala Pro Cys Cys Val Pro
65 70 75 80
Gln Ala Leu Glu Pro Leu Pro Ile Val Tyr Tyr Val Gly Arg Lys Pro
85 90 95
Lys Val Glu Gln Leu Ser Asn Met Ile Val Arg Ser Cys Lys Cys Ser
100 105 110
<210> 4
<211> 99
<212> PRT
<213> Oryctolagus cuniculus
<400> 4
Phe Ser Thr Asn Tyr Cys Phe Ser Ser Thr Glu Lys Asn Cys Cys Val
1 5 10 15
Arg Gln Leu Tyr Ile Asp Phe Arg Lys Asp Leu Gly Trp Lys Trp Ile
20 25 30
His Glu Pro Lys Gly Tyr His Ala Asn Phe Cys Leu Gly Pro Cys Pro
35 40 45
Tyr Ile Trp Ser Leu Asp Thr Gln Tyr Ser Lys Val Leu Ala Leu Tyr
50 55 60
Asn Gln His Asn Pro Gly Ala Ser Ala Ala Pro Cys Cys Val Pro Gln
65 70 75 80
Ala Leu Glu Ala Thr Ala His Arg Val Thr Thr Leu Gly Arg Lys Pro
85 90 95
Lys Val Glu
<210> 5
<211> 4
<212> PRT
<213> Homo sapiens
<400> 5
Phe Trp Tyr Leu
1
<210> 6
<211> 4
<212> PRT
<213> Homo sapiens
<400> 6
Phe Trp Tyr Pro
1
<210> 7
<211> 18
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic TGF-beta1-derived peptide
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Acp
<220>
<221> SITE
<222> (18)..(18)
<223> Xaa is Lys(Biotin)
<400> 7
Arg Lys Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly Tyr His
1 5 10 15
Lys Lys
<210> 8
<211> 15
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (1)..(1)
<223> Cys(carbamidomethyl) in Peptide 1
<220>
<221> SITE
<222> (7)..(7)
<223> Lys(biotin) in Peptide 1
<220>
<221> SITE
<222> (9)..(9)
<223> Cys(carbamidomethyl) in Peptide 1
<220>
<221> SITE
<222> (10)..(10)
<223> Cys(carbamidomethyl) in Peptide 1
<400> 8
Cys Phe Ser Ser Thr Glu Lys Asn Cys Cys Val Arg Gln Leu Tyr
1 5 10 15
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (5)..(5)
<223> Lys(biotin) in Peptide 2
<400> 9
Ile Asp Phe Arg Lys Asp Leu Gly Trp
1 5
<210> 10
<211> 8
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (2)..(2)
<223> Lys(biotin) in Peptide 3
<220>
<221> SITE
<222> (2)..(2)
<223> Lys(acetyl) in Peptide 4
<220>
<221> SITE
<222> (7)..(7)
<223> Lys(biotin) in Peptide 4
<220>
<221> SITE
<222> (7)..(7)
<223> Lys(acetyl) in Peptide 3
<400> 10
Arg Lys Asp Leu Gly Trp Lys Trp
1 5
<210> 11
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (5)..(5)
<223> Lys(biotin) in Peptide 5
<400> 11
Ile His Glu Pro Lys Gly Tyr
1 5
<210> 12
<211> 10
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (8)..(8)
<223> Lys(biotin) in Peptide 6
<400> 12
Ser Leu Asp Thr Gln Tyr Ser Lys Val Leu
1 5 10
<210> 13
<211> 11
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (5)..(5)
<223> Lys(biotin) in Peptide 7
<220>
<221> SITE
<222> (5)..(5)
<223> Lys(acetyl) in Peptide 8
<220>
<221> SITE
<222> (7)..(7)
<223> Lys(biotin) in Peptide 8
<220>
<221> SITE
<222> (7)..(7)
<223> Lys(acetyl) in Peptide 7
<400> 13
Tyr Val Gly Arg Lys Pro Lys Val Glu Gln Leu
1 5 10
<210> 14
<211> 11
<212> PRT
<213> Homo sapiens
<220>
<221> SITE
<222> (8)..(8)
<223> Cys(carbamidomethyl) in Peptide 9
<220>
<221> SITE
<222> (9)..(9)
<223> Lys(biotin) in Peptide 9
<220>
<221> SITE
<222> (10)..(10)
<223> Cys(carbamidomethyl) in Peptide 9
<400> 14
Ser Asn Met Ile Val Arg Ser Cys Lys Cys Ser
1 5 10
<210> 15
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> Motif of basic residues involved in heparin-binding
<220>
<221> VARIANT
<222> (1)..(1)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (2)..(4)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (5)..(6)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (7)..(7)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (8)..(9)
<223> Xaa is any neutral or acidic amino acid
<400> 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 16
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> Motif of basic residues involved in heparin-binding
<220>
<221> VARIANT
<222> (1)..(1)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (2)..(3)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (4)..(4)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (6)..(7)
<223> Xaa is any neutral or acidic amino acid
<400> 16
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5
<210> 17
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> Motif of basic residues involved in heparin-binding
<220>
<221> VARIANT
<222> (1)..(1)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (2)..(2)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (3)..(4)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (6)..(7)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (8)..(8)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (9)..(10)
<223> Xaa is any neutral or acidic amino acid
<220>
<221> VARIANT
<222> (11)..(11)
<223> Xaa is a basic residue
<220>
<221> VARIANT
<222> (12)..(12)
<223> Xaa is any neutral or acidic amino acid
<400> 17
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
Claims (33)
- 헤파란 설페이트 HS16.
- 분리되거나 실질적으로 정제된 형태의 헤파란 설페이트 HS16.
- 제1항 또는 제2항에 있어서, HS16이 아미노산 서열 RKDLGWKWIHEPKGYH (서열번호: 1)를 갖거나 이로 이루어진 펩티드 또는 폴리펩티드에 결합할 수 있는 것인, 헤파란 설페이트 HS16.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 하기를 포함하는 방법에 의해 수득된, 헤파란 설페이트 HS16 또는 분리되거나 실질적으로 정제된 형태의 헤파란 설페이트 HS16:
(i) 지지체에 부착되고, 아미노산 서열 RKDLGWKWIHEPKGYH을 갖는 헤파린-결합 도메인을 포함하는 폴리펩티드 분자를 갖는 고체 지지체를 제공하는 단계;
(ii) 고체 지지체를 글루코사미노글리칸, 바람직하게는 헤파란 설페이트 제제를 포함하는 혼합물과 접촉시켜, 폴리펩티드-글루코사미노글리칸 복합체가 형성되게 하는 단계;
(iii) 혼합물의 잔류물로부터 폴리펩티드-글루코사미노글리칸 복합체를 분할하는 단계;
(iv) 폴리펩티드-글루코사미노글리칸 복합체로부터 글루코사미노글리칸, 바람직하게는 헤파란 설페이트 종을 해리하는 단계;
(v) 해리된 글루코사미노글리칸, 바람직하게는 하나 이상의 헤파란 설페이트 종을 수집하는 단계. - 제6항에 있어서, 폴리펩티드가 RKDLGWKWIHEPKGYH (서열번호: 1)로부터 선택된 아미노산 서열을 갖거나 이로 이루어지는 것인, 방법.
- 제6항 또는 제7항에 있어서, 글루코사미노글리칸을 포함하는 혼합물이 돼지 점막 (HSPM)으로부터 수득된 헤파란 설페이트 제제인 것인, 방법.
- 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 포함하는 조성물.
- 제9항에 있어서, 성장인자, 바람직하게는 TGFβ1을 추가로 포함하는, 조성물.
- 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 포함하는 미용적 조성물, 약제학적 조성물 또는 약물.
- 제11항에 있어서, 약제학적 조성물 또는 약물이 TGFβ1 단백질 및/또는 중간엽 줄기세포를 추가로 포함하는 것인, 약제학적 조성물 또는 약물.
- 제11항 또는 제12항에 있어서, 의학적 치료 방법에 사용하기 위한 약제학적 조성물 또는 약물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 의학적 치료 방법에 사용하기 위한 헤파란 설페이트 HS16.
- 제14항에 있어서, 의학적 치료 방법이 생체 내 상처 치유 방법을 포함하는 것인, 헤파란 설페이트 HS16.
- 제14항에 있어서, 의학적 치료 방법이 조직, 바람직하게는 결합 조직의 복구 및/또는 재생을 포함하는 것인, 헤파란 설페이트 HS16.
- 조직의 질환, 병태 또는 손상을 치료하기 위한 약물의 제조에 있어서 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16의 용도로서, 방법이 조직, 바람직하게는 결합 조직의 복구 및/또는 재생을 포함하는, 용도.
- 헤파란 설페이트 HS16의 치료학적 유효량을 환자에 투여하여 조직, 바람직하게는 결합 조직의 복구 및/또는 재생을 초래하는 것을 포함하는, 환자에서 조직의 질환, 병태 또는 손상을 치료하는 방법.
- 제18항에 있어서, 방법이 조직의 재생 또는 복구가 요구되는 환자의 신체 상의 상처 또는 위치에 또는 그 주변에의 조직에 헤파란 설페이트 HS16을 투여하는 것을 포함하는 것인, 방법.
- 제18항 또는 제19항에 있어서, 방법이 환자에 TGFβ1 단백질을 투여하는 것을 추가로 포함하는 것인, 방법.
- 생체물질 및 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 포함하는 생체적합성 임플란트 또는 보철물을 질환, 병태 또는 손상 부위에 또는 그 주변의 조직에 외과적으로 이식하여 조직의 복구 및/또는 재생을 초래하는 것을 포함하는, 환자에서 조직의 질환, 병태 또는 손상을 치료하는 방법.
- 생체물질 및 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 포함하는 생체적합성 임플란트 또는 보철물.
- 생체물질을 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16으로 코팅하거나 함침시키는 것을 포함하는, 생체적합성 임플란트 또는 보철물을 형성하는 방법.
- 시험관 내에서 줄기 세포를 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16와 접촉하면서 배양하는 것을 포함하는, 시험관 내에서 줄기 세포를 배양하는 방법.
- 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 포함하는 배양 배지.
- 제25항에 있어서, TGFβ1을 추가로 포함하는, 배양 배지.
- 키트가 기결정된 양의 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16 및 기결정된 양의 TGFβ1을 포함하는, 부품들의 키트.
- 의학적 치료 방법에서 동시, 별도 또는 연속 사용을 위한, 하기의 치료학적 유효량을 함유하는 제품:
(i) 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16; 및 하기의 하나 또는 둘 모두;
(ii) TGFβ1 단백질;
(iii) 중간엽 줄기세포, 또는 섬유아세포 계통의 세포. - 성장인자, 바람직하게는 TGFβ1을 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16와 접촉시키는 것을 포함하는, 성장인자, 바람직하게는 TGFβ1의 안정성을 증가시키는 방법.
- 개체에 제1항 내지 제8항 중 어느 한 항에 따른 헤파란 설페이트 HS16을 투여하는 것을 포함하는 미용 방법.
- 혈액 유래 산물 및 기결정된 양의 헤파란 설페이트 HS16을 포함하는 제제.
- 제31항에 있어서, 제제가 혈소판 제제인 것인, 제제.
- 생물학적 물질을 기결정된 양의 헤파란 설페이트 HS16과 접촉시키는 것을 포함하는, 생물학적 물질을 보존하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SG10201401967W | 2014-04-30 | ||
| SG10201401967W | 2014-04-30 | ||
| PCT/SG2015/050092 WO2015167401A1 (en) | 2014-04-30 | 2015-04-30 | Heparan sulphates |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170013255A true KR20170013255A (ko) | 2017-02-06 |
Family
ID=54358977
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167033350A KR20170013255A (ko) | 2014-04-30 | 2015-04-30 | 헤파란 설페이트 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US10596296B2 (ko) |
| EP (1) | EP3137509A4 (ko) |
| JP (2) | JP2017522392A (ko) |
| KR (1) | KR20170013255A (ko) |
| CN (1) | CN107001488B (ko) |
| AU (1) | AU2015253870B2 (ko) |
| BR (1) | BR112016025443A2 (ko) |
| IL (1) | IL248608A0 (ko) |
| MX (1) | MX2016014202A (ko) |
| SG (1) | SG11201609026UA (ko) |
| WO (1) | WO2015167401A1 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017522392A (ja) * | 2014-04-30 | 2017-08-10 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | ヘパラン硫酸 |
| SG11201705602VA (en) * | 2015-01-09 | 2017-08-30 | Agency Science Tech & Res | Pdgf-b /pdgf-bb binding variants of heparan sulphates |
| JP7296726B2 (ja) | 2015-08-17 | 2023-06-23 | アイコール・システムズ・インク | 流体制御システム |
| CN108508129B (zh) * | 2018-04-03 | 2020-11-27 | 青岛海洋生物医药研究院股份有限公司 | 一种肝素类药物生物效价的测定方法 |
| CN110646548A (zh) * | 2019-10-18 | 2020-01-03 | 福州大学 | 一种提取阿胶中肝素/硫酸类肝素二糖的方法 |
| WO2024080183A1 (ja) * | 2022-10-14 | 2024-04-18 | 国立大学法人東海国立大学機構 | 糖鎖複合体、薬物担体、及びドラッグデリバリーシステム |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5019087A (en) | 1986-10-06 | 1991-05-28 | American Biomaterials Corporation | Nerve regeneration conduit |
| US5843442A (en) * | 1990-10-22 | 1998-12-01 | Corvas International, Inc. | Blood coagulation protein antagonists and uses therefor |
| US5807982A (en) | 1991-04-29 | 1998-09-15 | Cornell Research Foundation, Inc. | Affinity purified heparin |
| WO1996023003A1 (en) | 1995-01-27 | 1996-08-01 | Amrad Operations Pty. Ltd. | A therapeutic molecule |
| JP4033400B2 (ja) * | 2002-03-12 | 2008-01-16 | ティシュージーン,インク | 軟骨細胞とTGF−βを用いた軟骨再生 |
| ITTO20060282A1 (it) * | 2006-04-14 | 2007-10-15 | Univ Degli Studi Torino | Mezzo di coltura e composizione farmaceutica per la rigenerazione del tessuto cartilagineo relativo procedimento relativi usi e prodotti |
| US9498494B2 (en) | 2008-09-11 | 2016-11-22 | Agency For Science, Technology And Research | Glycosaminoglycans |
| GB0818255D0 (en) | 2008-10-06 | 2008-11-12 | Agency Science Tech & Res | Isolation and identification of glycosaminoglycans |
| SG10201407293WA (en) | 2009-11-20 | 2014-12-30 | Agency Science Tech & Res | Heparan Sulphates |
| SG188756A1 (en) | 2011-09-16 | 2013-04-30 | Agency Science Tech & Res | Glycosaminoglycans |
| PL2794665T3 (pl) * | 2011-12-19 | 2018-04-30 | Dilafor Ab | Niewykazujące działania przeciwkrzepliwego glikozaminoglikany zawierające powtarzające się jednostki disacharydowe i ich zastosowanie medyczne |
| JP2017522392A (ja) * | 2014-04-30 | 2017-08-10 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | ヘパラン硫酸 |
-
2015
- 2015-04-30 JP JP2016565146A patent/JP2017522392A/ja active Pending
- 2015-04-30 US US15/307,407 patent/US10596296B2/en active Active
- 2015-04-30 SG SG11201609026UA patent/SG11201609026UA/en unknown
- 2015-04-30 WO PCT/SG2015/050092 patent/WO2015167401A1/en active Application Filing
- 2015-04-30 KR KR1020167033350A patent/KR20170013255A/ko unknown
- 2015-04-30 BR BR112016025443A patent/BR112016025443A2/pt not_active Application Discontinuation
- 2015-04-30 EP EP15786841.5A patent/EP3137509A4/en active Pending
- 2015-04-30 CN CN201580036029.8A patent/CN107001488B/zh active Active
- 2015-04-30 AU AU2015253870A patent/AU2015253870B2/en active Active
- 2015-04-30 MX MX2016014202A patent/MX2016014202A/es unknown
-
2016
- 2016-10-30 IL IL248608A patent/IL248608A0/en unknown
-
2020
- 2020-05-08 JP JP2020082462A patent/JP7145909B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US10596296B2 (en) | 2020-03-24 |
| IL248608A0 (en) | 2016-12-29 |
| BR112016025443A2 (pt) | 2017-12-12 |
| EP3137509A4 (en) | 2018-03-14 |
| AU2015253870A1 (en) | 2016-12-15 |
| SG11201609026UA (en) | 2016-11-29 |
| EP3137509A1 (en) | 2017-03-08 |
| JP2017522392A (ja) | 2017-08-10 |
| JP2020143293A (ja) | 2020-09-10 |
| US20170043053A1 (en) | 2017-02-16 |
| MX2016014202A (es) | 2017-05-03 |
| CN107001488B (zh) | 2020-05-12 |
| JP7145909B2 (ja) | 2022-10-03 |
| CN107001488A (zh) | 2017-08-01 |
| AU2015253870B2 (en) | 2019-08-22 |
| WO2015167401A1 (en) | 2015-11-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10245301B2 (en) | Glycosaminoglycans | |
| US10245281B2 (en) | Glycosaminoglycans | |
| JP7145909B2 (ja) | ヘパラン硫酸 | |
| US9498494B2 (en) | Glycosaminoglycans | |
| EP2997047B1 (en) | Heparan sulphates | |
| JP6709217B2 (ja) | 皮膚の修復および/または再生において使用するためのヘパラン硫酸 | |
| EP2509607B1 (en) | Glycosaminoglycan mixtures | |
| EP3242669B1 (en) | Pdgf-b /pdgf-bb binding variants of heparan sulphates |