KR20160123385A - 개인 맞춤형 통증 관리를 위한 방법 및 조성물 - Google Patents
개인 맞춤형 통증 관리를 위한 방법 및 조성물 Download PDFInfo
- Publication number
- KR20160123385A KR20160123385A KR1020167026246A KR20167026246A KR20160123385A KR 20160123385 A KR20160123385 A KR 20160123385A KR 1020167026246 A KR1020167026246 A KR 1020167026246A KR 20167026246 A KR20167026246 A KR 20167026246A KR 20160123385 A KR20160123385 A KR 20160123385A
- Authority
- KR
- South Korea
- Prior art keywords
- patient
- risk
- morphine
- low
- genotype
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 238000000034 method Methods 0.000 title claims abstract description 168
- 208000002193 Pain Diseases 0.000 title abstract description 56
- 230000036407 pain Effects 0.000 title abstract description 54
- 239000000203 mixture Substances 0.000 title description 15
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 claims description 608
- 229960005181 morphine Drugs 0.000 claims description 304
- 208000004756 Respiratory Insufficiency Diseases 0.000 claims description 200
- 206010038678 Respiratory depression Diseases 0.000 claims description 200
- 230000000694 effects Effects 0.000 claims description 151
- 108700028369 Alleles Proteins 0.000 claims description 115
- 230000002411 adverse Effects 0.000 claims description 112
- 230000002068 genetic effect Effects 0.000 claims description 92
- 208000031649 Postoperative Nausea and Vomiting Diseases 0.000 claims description 88
- 239000000523 sample Substances 0.000 claims description 88
- 102100028162 ATP-binding cassette sub-family C member 3 Human genes 0.000 claims description 85
- 101000986633 Homo sapiens ATP-binding cassette sub-family C member 3 Proteins 0.000 claims description 85
- 239000003814 drug Substances 0.000 claims description 56
- 229940079593 drug Drugs 0.000 claims description 50
- 230000007774 longterm Effects 0.000 claims description 46
- 230000000202 analgesic effect Effects 0.000 claims description 45
- 108090000623 proteins and genes Proteins 0.000 claims description 44
- 102100029111 Fatty-acid amide hydrolase 1 Human genes 0.000 claims description 42
- 102220468397 ATP-dependent translocase ABCB1_N21D_mutation Human genes 0.000 claims description 35
- 239000000730 antalgic agent Substances 0.000 claims description 32
- 102220090100 rs1045642 Human genes 0.000 claims description 31
- 229940035676 analgesics Drugs 0.000 claims description 27
- 229940005483 opioid analgesics Drugs 0.000 claims description 26
- 102000054767 gene variant Human genes 0.000 claims description 25
- 238000003556 assay Methods 0.000 claims description 24
- 230000002035 prolonged effect Effects 0.000 claims description 22
- 238000003205 genotyping method Methods 0.000 claims description 19
- 238000011084 recovery Methods 0.000 claims description 19
- 102200120159 rs1799971 Human genes 0.000 claims description 19
- 102220006123 rs1042713 Human genes 0.000 claims description 18
- 102200126045 rs324420 Human genes 0.000 claims description 18
- 206010047700 Vomiting Diseases 0.000 claims description 11
- 239000008280 blood Substances 0.000 claims description 11
- 238000003752 polymerase chain reaction Methods 0.000 claims description 11
- 101710163270 Nuclease Proteins 0.000 claims description 10
- 210000004369 blood Anatomy 0.000 claims description 10
- 230000002441 reversible effect Effects 0.000 claims description 9
- 230000008673 vomiting Effects 0.000 claims description 9
- 239000003298 DNA probe Substances 0.000 claims description 8
- 238000003745 diagnosis Methods 0.000 claims description 8
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 claims description 6
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 claims description 6
- 239000012472 biological sample Substances 0.000 claims description 6
- 229940124636 opioid drug Drugs 0.000 claims description 5
- 229940121367 non-opioid analgesics Drugs 0.000 claims description 4
- 238000011282 treatment Methods 0.000 claims description 4
- 238000003759 clinical diagnosis Methods 0.000 claims description 3
- 239000003795 chemical substances by application Substances 0.000 claims 15
- 101000937693 Homo sapiens Fatty acid 2-hydroxylase Proteins 0.000 claims 11
- 101000918494 Homo sapiens Fatty-acid amide hydrolase 1 Proteins 0.000 claims 11
- 241000288105 Grus Species 0.000 claims 1
- 239000003612 morphinomimetic agent Substances 0.000 claims 1
- 238000004458 analytical method Methods 0.000 description 55
- 108010047230 Member 1 Subfamily B ATP Binding Cassette Transporter Proteins 0.000 description 54
- 102000054766 genetic haplotypes Human genes 0.000 description 54
- 208000001797 obstructive sleep apnea Diseases 0.000 description 53
- 102100033350 ATP-dependent translocase ABCB1 Human genes 0.000 description 52
- 239000003550 marker Substances 0.000 description 52
- 238000001356 surgical procedure Methods 0.000 description 52
- 230000015572 biosynthetic process Effects 0.000 description 50
- 230000001965 increasing effect Effects 0.000 description 48
- 230000002980 postoperative effect Effects 0.000 description 39
- 239000002207 metabolite Substances 0.000 description 36
- 230000003444 anaesthetic effect Effects 0.000 description 33
- 150000007523 nucleic acids Chemical class 0.000 description 33
- 108010046094 fatty-acid amide hydrolase Proteins 0.000 description 32
- 108020004414 DNA Proteins 0.000 description 31
- 102100035593 POU domain, class 2, transcription factor 1 Human genes 0.000 description 31
- 101710084414 POU domain, class 2, transcription factor 1 Proteins 0.000 description 31
- 229920001184 polypeptide Polymers 0.000 description 30
- 102000004196 processed proteins & peptides Human genes 0.000 description 30
- 108090000765 processed proteins & peptides Proteins 0.000 description 30
- 230000008030 elimination Effects 0.000 description 29
- 238000003379 elimination reaction Methods 0.000 description 29
- 102000039446 nucleic acids Human genes 0.000 description 27
- 108020004707 nucleic acids Proteins 0.000 description 27
- 238000012360 testing method Methods 0.000 description 27
- 238000007483 tonsillectomy Methods 0.000 description 27
- 206010002091 Anaesthesia Diseases 0.000 description 25
- 230000037005 anaesthesia Effects 0.000 description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 24
- 206010057190 Respiratory tract infections Diseases 0.000 description 23
- 230000014509 gene expression Effects 0.000 description 23
- 230000002974 pharmacogenomic effect Effects 0.000 description 23
- 201000010099 disease Diseases 0.000 description 21
- 239000002773 nucleotide Substances 0.000 description 20
- 125000003729 nucleotide group Chemical group 0.000 description 20
- 238000013459 approach Methods 0.000 description 19
- 238000009396 hybridization Methods 0.000 description 19
- 102200012744 rs2229109 Human genes 0.000 description 19
- 238000003066 decision tree Methods 0.000 description 17
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 16
- 230000002829 reductive effect Effects 0.000 description 16
- 230000014759 maintenance of location Effects 0.000 description 15
- 102000054765 polymorphisms of proteins Human genes 0.000 description 15
- 230000003993 interaction Effects 0.000 description 14
- 238000001514 detection method Methods 0.000 description 13
- 238000010586 diagram Methods 0.000 description 13
- 230000004044 response Effects 0.000 description 13
- 208000004550 Postoperative Pain Diseases 0.000 description 12
- 239000003153 chemical reaction reagent Substances 0.000 description 11
- 238000011160 research Methods 0.000 description 11
- 108091034117 Oligonucleotide Proteins 0.000 description 10
- 238000007792 addition Methods 0.000 description 10
- 239000013068 control sample Substances 0.000 description 10
- 239000012634 fragment Substances 0.000 description 10
- 239000000014 opioid analgesic Substances 0.000 description 10
- 102000004169 proteins and genes Human genes 0.000 description 10
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 9
- 238000009826 distribution Methods 0.000 description 9
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 9
- 239000002853 nucleic acid probe Substances 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 8
- 101001122476 Homo sapiens Mu-type opioid receptor Proteins 0.000 description 8
- 102100028647 Mu-type opioid receptor Human genes 0.000 description 8
- 230000036592 analgesia Effects 0.000 description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 8
- 229960004126 codeine Drugs 0.000 description 8
- 238000013461 design Methods 0.000 description 8
- 239000003193 general anesthetic agent Substances 0.000 description 8
- 238000001990 intravenous administration Methods 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 239000001301 oxygen Substances 0.000 description 8
- 229910052760 oxygen Inorganic materials 0.000 description 8
- 238000012163 sequencing technique Methods 0.000 description 8
- 108091028043 Nucleic acid sequence Proteins 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 230000004927 fusion Effects 0.000 description 7
- 210000003494 hepatocyte Anatomy 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 238000012552 review Methods 0.000 description 7
- 238000012502 risk assessment Methods 0.000 description 7
- 238000007619 statistical method Methods 0.000 description 7
- 238000013517 stratification Methods 0.000 description 7
- 206010044008 tonsillitis Diseases 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 208000002847 Surgical Wound Diseases 0.000 description 6
- 229940035674 anesthetics Drugs 0.000 description 6
- 238000004166 bioassay Methods 0.000 description 6
- 238000004422 calculation algorithm Methods 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 230000002596 correlated effect Effects 0.000 description 6
- 230000009931 harmful effect Effects 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 230000000241 respiratory effect Effects 0.000 description 6
- 102200012755 rs2032582 Human genes 0.000 description 6
- DFEYYRMXOJXZRJ-UHFFFAOYSA-N sevoflurane Chemical compound FCOC(C(F)(F)F)C(F)(F)F DFEYYRMXOJXZRJ-UHFFFAOYSA-N 0.000 description 6
- 229960002078 sevoflurane Drugs 0.000 description 6
- 239000000758 substrate Substances 0.000 description 6
- 108091093037 Peptide nucleic acid Proteins 0.000 description 5
- 102100029819 UDP-glucuronosyltransferase 2B7 Human genes 0.000 description 5
- 101710200333 UDP-glucuronosyltransferase 2B7 Proteins 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 238000012252 genetic analysis Methods 0.000 description 5
- 238000012417 linear regression Methods 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 230000004060 metabolic process Effects 0.000 description 5
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 5
- 229960005489 paracetamol Drugs 0.000 description 5
- 230000002085 persistent effect Effects 0.000 description 5
- 230000000069 prophylactic effect Effects 0.000 description 5
- 230000001681 protective effect Effects 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 238000012706 support-vector machine Methods 0.000 description 5
- 238000012549 training Methods 0.000 description 5
- FELGMEQIXOGIFQ-CYBMUJFWSA-N (3r)-9-methyl-3-[(2-methylimidazol-1-yl)methyl]-2,3-dihydro-1h-carbazol-4-one Chemical compound CC1=NC=CN1C[C@@H]1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-CYBMUJFWSA-N 0.000 description 4
- 108010078791 Carrier Proteins Proteins 0.000 description 4
- 101150008770 FAAH gene Proteins 0.000 description 4
- 238000000729 Fisher's exact test Methods 0.000 description 4
- 206010041235 Snoring Diseases 0.000 description 4
- 206010041349 Somnolence Diseases 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 230000000996 additive effect Effects 0.000 description 4
- 201000003462 adenoid hypertrophy Diseases 0.000 description 4
- 230000004075 alteration Effects 0.000 description 4
- 150000001413 amino acids Chemical group 0.000 description 4
- 238000000540 analysis of variance Methods 0.000 description 4
- 230000008499 blood brain barrier function Effects 0.000 description 4
- 210000001218 blood-brain barrier Anatomy 0.000 description 4
- 238000004364 calculation method Methods 0.000 description 4
- 210000000349 chromosome Anatomy 0.000 description 4
- 238000004590 computer program Methods 0.000 description 4
- 230000003111 delayed effect Effects 0.000 description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 4
- 229960003957 dexamethasone Drugs 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 229960002428 fentanyl Drugs 0.000 description 4
- PJMPHNIQZUBGLI-UHFFFAOYSA-N fentanyl Chemical compound C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 PJMPHNIQZUBGLI-UHFFFAOYSA-N 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 208000017169 kidney disease Diseases 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 208000019423 liver disease Diseases 0.000 description 4
- 238000007477 logistic regression Methods 0.000 description 4
- 238000010801 machine learning Methods 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 102000051367 mu Opioid Receptors Human genes 0.000 description 4
- 229960005343 ondansetron Drugs 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000000306 recurrent effect Effects 0.000 description 4
- 230000029058 respiratory gaseous exchange Effects 0.000 description 4
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 4
- 238000005070 sampling Methods 0.000 description 4
- 238000000638 solvent extraction Methods 0.000 description 4
- 230000000153 supplemental effect Effects 0.000 description 4
- 238000012795 verification Methods 0.000 description 4
- 108020001612 μ-opioid receptors Proteins 0.000 description 4
- 206010009152 Chronic tonsillitis Diseases 0.000 description 3
- 108010001237 Cytochrome P-450 CYP2D6 Proteins 0.000 description 3
- 102100021704 Cytochrome P450 2D6 Human genes 0.000 description 3
- 206010012559 Developmental delay Diseases 0.000 description 3
- 208000007590 Disorders of Excessive Somnolence Diseases 0.000 description 3
- 206010020751 Hypersensitivity Diseases 0.000 description 3
- 108091092878 Microsatellite Proteins 0.000 description 3
- 206010029315 Neuromuscular blockade Diseases 0.000 description 3
- 238000012300 Sequence Analysis Methods 0.000 description 3
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- -1 acetaminophen) Chemical compound 0.000 description 3
- 230000000172 allergic effect Effects 0.000 description 3
- 208000010668 atopic eczema Diseases 0.000 description 3
- 230000036772 blood pressure Effects 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 238000004891 communication Methods 0.000 description 3
- 238000012937 correction Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 230000007849 functional defect Effects 0.000 description 3
- 238000001502 gel electrophoresis Methods 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 238000000491 multivariate analysis Methods 0.000 description 3
- 230000000474 nursing effect Effects 0.000 description 3
- 238000002966 oligonucleotide array Methods 0.000 description 3
- 238000001543 one-way ANOVA Methods 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 238000000513 principal component analysis Methods 0.000 description 3
- 238000002271 resection Methods 0.000 description 3
- 230000036387 respiratory rate Effects 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 201000002859 sleep apnea Diseases 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000002627 tracheal intubation Methods 0.000 description 3
- 238000007473 univariate analysis Methods 0.000 description 3
- 238000010200 validation analysis Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- USSIQXCVUWKGNF-UHFFFAOYSA-N 6-(dimethylamino)-4,4-diphenylheptan-3-one Chemical compound C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 USSIQXCVUWKGNF-UHFFFAOYSA-N 0.000 description 2
- 102000017919 ADRB2 Human genes 0.000 description 2
- 102100028161 ATP-binding cassette sub-family C member 2 Human genes 0.000 description 2
- 206010067484 Adverse reaction Diseases 0.000 description 2
- 241001535291 Analges Species 0.000 description 2
- 102000009132 CB1 Cannabinoid Receptor Human genes 0.000 description 2
- 108010073366 CB1 Cannabinoid Receptor Proteins 0.000 description 2
- 208000000094 Chronic Pain Diseases 0.000 description 2
- 206010011469 Crying Diseases 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 108020003215 DNA Probes Proteins 0.000 description 2
- 208000000059 Dyspnea Diseases 0.000 description 2
- 206010013975 Dyspnoeas Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000957299 Homo sapiens Coronin-7 Proteins 0.000 description 2
- 101000800546 Homo sapiens Transcription factor 21 Proteins 0.000 description 2
- GNJCUHZOSOYIEC-GAROZEBRSA-N Morphine-6-glucuronide Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)O)O[C@@H]1[C@]52CCN3C)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O GNJCUHZOSOYIEC-GAROZEBRSA-N 0.000 description 2
- 108010066419 Multidrug Resistance-Associated Protein 2 Proteins 0.000 description 2
- 150000001200 N-acyl ethanolamides Chemical class 0.000 description 2
- 206010028813 Nausea Diseases 0.000 description 2
- 206010028817 Nausea and vomiting symptoms Diseases 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 2
- 208000003251 Pruritus Diseases 0.000 description 2
- 102220599333 Solute carrier family 22 member 1_G401S_mutation Human genes 0.000 description 2
- 102220599350 Solute carrier family 22 member 1_G465R_mutation Human genes 0.000 description 2
- 102220590838 Solute carrier family 22 member 1_R61C_mutation Human genes 0.000 description 2
- 229940123237 Taxane Drugs 0.000 description 2
- 102100033121 Transcription factor 21 Human genes 0.000 description 2
- 108700019146 Transgenes Proteins 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000006838 adverse reaction Effects 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- LGEQQWMQCRIYKG-DOFZRALJSA-N anandamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NCCO LGEQQWMQCRIYKG-DOFZRALJSA-N 0.000 description 2
- LGEQQWMQCRIYKG-UHFFFAOYSA-N arachidonic acid ethanolamide Natural products CCCCCC=CCC=CCC=CCC=CCCCC(=O)NCCO LGEQQWMQCRIYKG-UHFFFAOYSA-N 0.000 description 2
- 238000012098 association analyses Methods 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 230000036760 body temperature Effects 0.000 description 2
- 210000000133 brain stem Anatomy 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000003246 corticosteroid Substances 0.000 description 2
- 229960001334 corticosteroids Drugs 0.000 description 2
- 238000002790 cross-validation Methods 0.000 description 2
- 210000000172 cytosol Anatomy 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 230000001934 delay Effects 0.000 description 2
- 230000001627 detrimental effect Effects 0.000 description 2
- 229960003529 diazepam Drugs 0.000 description 2
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000002621 endocannabinoid Substances 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 239000003925 fat Substances 0.000 description 2
- 230000004907 flux Effects 0.000 description 2
- 230000004547 gene signature Effects 0.000 description 2
- 230000007614 genetic variation Effects 0.000 description 2
- 210000003128 head Anatomy 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000003054 hormonal effect Effects 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 229960001410 hydromorphone Drugs 0.000 description 2
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 229960001797 methadone Drugs 0.000 description 2
- 210000001589 microsome Anatomy 0.000 description 2
- 229950004819 morphine glucuronide Drugs 0.000 description 2
- 239000004081 narcotic agent Substances 0.000 description 2
- 230000008693 nausea Effects 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 239000002751 oligonucleotide probe Substances 0.000 description 2
- 229940124583 pain medication Drugs 0.000 description 2
- 230000008533 pain sensitivity Effects 0.000 description 2
- 238000005192 partition Methods 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 230000003285 pharmacodynamic effect Effects 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 102220066605 rs1128503 Human genes 0.000 description 2
- 206010039722 scoliosis Diseases 0.000 description 2
- 208000019116 sleep disease Diseases 0.000 description 2
- 238000011895 specific detection Methods 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 238000012353 t test Methods 0.000 description 2
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 230000005186 women's health Effects 0.000 description 2
- ABYZSYDGJGVCHS-ZETCQYMHSA-N (2s)-2-acetamido-n-(4-nitrophenyl)propanamide Chemical compound CC(=O)N[C@@H](C)C(=O)NC1=CC=C([N+]([O-])=O)C=C1 ABYZSYDGJGVCHS-ZETCQYMHSA-N 0.000 description 1
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 1
- 101150084750 1 gene Proteins 0.000 description 1
- PIINGYXNCHTJTF-UHFFFAOYSA-N 2-(2-azaniumylethylamino)acetate Chemical group NCCNCC(O)=O PIINGYXNCHTJTF-UHFFFAOYSA-N 0.000 description 1
- 101150119038 ABCB1 gene Proteins 0.000 description 1
- 101150026740 ABCC3 gene Proteins 0.000 description 1
- 101150033809 ADRB2 gene Proteins 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000002381 Brain Hypoxia Diseases 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 1
- 238000009007 Diagnostic Kit Methods 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102000004150 Flap endonucleases Human genes 0.000 description 1
- 108090000652 Flap endonucleases Proteins 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- 108091027305 Heteroduplex Proteins 0.000 description 1
- 101000959437 Homo sapiens Beta-2 adrenergic receptor Proteins 0.000 description 1
- 101000741790 Homo sapiens Peroxisome proliferator-activated receptor gamma Proteins 0.000 description 1
- 101000737828 Homo sapiens Threonylcarbamoyladenosine tRNA methylthiotransferase Proteins 0.000 description 1
- 101000596771 Homo sapiens Transcription factor 7-like 2 Proteins 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 125000002066 L-histidyl group Chemical group [H]N1C([H])=NC(C([H])([H])[C@](C(=O)[*])([H])N([H])[H])=C1[H] 0.000 description 1
- 102000003960 Ligases Human genes 0.000 description 1
- 108090000364 Ligases Proteins 0.000 description 1
- 101150004219 MCR1 gene Proteins 0.000 description 1
- 238000000585 Mann–Whitney U test Methods 0.000 description 1
- 241001508691 Martes zibellina Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 101150042248 Mgmt gene Proteins 0.000 description 1
- 102000010645 MutS Proteins Human genes 0.000 description 1
- 108010038272 MutS Proteins Proteins 0.000 description 1
- IDBPHNDTYPBSNI-UHFFFAOYSA-N N-(1-(2-(4-Ethyl-5-oxo-2-tetrazolin-1-yl)ethyl)-4-(methoxymethyl)-4-piperidyl)propionanilide Chemical compound C1CN(CCN2C(N(CC)N=N2)=O)CCC1(COC)N(C(=O)CC)C1=CC=CC=C1 IDBPHNDTYPBSNI-UHFFFAOYSA-N 0.000 description 1
- 208000012266 Needlestick injury Diseases 0.000 description 1
- 102000007999 Nuclear Proteins Human genes 0.000 description 1
- 108010089610 Nuclear Proteins Proteins 0.000 description 1
- 101150004818 OCT1 gene Proteins 0.000 description 1
- 241000337007 Oceania Species 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 241000282320 Panthera leo Species 0.000 description 1
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 1
- 206010072651 Postoperative respiratory failure Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 108020004518 RNA Probes Proteins 0.000 description 1
- 239000003391 RNA probe Substances 0.000 description 1
- ZTVQQQVZCWLTDF-UHFFFAOYSA-N Remifentanil Chemical compound C1CN(CCC(=O)OC)CCC1(C(=O)OC)N(C(=O)CC)C1=CC=CC=C1 ZTVQQQVZCWLTDF-UHFFFAOYSA-N 0.000 description 1
- 238000012952 Resampling Methods 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 101100206347 Schizosaccharomyces pombe (strain 972 / ATCC 24843) pmh1 gene Proteins 0.000 description 1
- 241000872198 Serjania polyphylla Species 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 102100035310 Threonylcarbamoyladenosine tRNA methylthiotransferase Human genes 0.000 description 1
- 102100035101 Transcription factor 7-like 2 Human genes 0.000 description 1
- 102100033254 Tumor suppressor ARF Human genes 0.000 description 1
- DUDJTRNGXIUJEB-UHFFFAOYSA-N [N].NCC(O)=O Chemical compound [N].NCC(O)=O DUDJTRNGXIUJEB-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 229960001391 alfentanil Drugs 0.000 description 1
- 238000007844 allele-specific PCR Methods 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 210000004727 amygdala Anatomy 0.000 description 1
- 238000001949 anaesthesia Methods 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 230000002547 anomalous effect Effects 0.000 description 1
- 230000009517 anoxic brain damage Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 238000013528 artificial neural network Methods 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 208000029028 brain injury Diseases 0.000 description 1
- 230000001914 calming effect Effects 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 229940124301 concurrent medication Drugs 0.000 description 1
- 230000008094 contradictory effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000007418 data mining Methods 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 1
- 230000036267 drug metabolism Effects 0.000 description 1
- 230000000550 effect on aging Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000009585 enzyme analysis Methods 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 230000001815 facial effect Effects 0.000 description 1
- 230000008921 facial expression Effects 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 238000012224 gene deletion Methods 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 238000002682 general surgery Methods 0.000 description 1
- 238000013412 genome amplification Methods 0.000 description 1
- 229930182480 glucuronide Natural products 0.000 description 1
- 150000008134 glucuronides Chemical class 0.000 description 1
- 239000011544 gradient gel Substances 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 231100000508 hormonal effect Toxicity 0.000 description 1
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 1
- 229960000240 hydrocodone Drugs 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000011337 individualized treatment Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- PYZRQGJRPPTADH-UHFFFAOYSA-N lamotrigine Chemical compound NC1=NC(N)=NN=C1C1=CC=CC(Cl)=C1Cl PYZRQGJRPPTADH-UHFFFAOYSA-N 0.000 description 1
- 229960001848 lamotrigine Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 235000020938 metabolic status Nutrition 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 238000007857 nested PCR Methods 0.000 description 1
- 238000007481 next generation sequencing Methods 0.000 description 1
- 238000007826 nucleic acid assay Methods 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 229940127240 opiate Drugs 0.000 description 1
- 230000001662 opsonic effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 229960002085 oxycodone Drugs 0.000 description 1
- 230000037324 pain perception Effects 0.000 description 1
- 230000037325 pain tolerance Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 238000001558 permutation test Methods 0.000 description 1
- 238000012805 post-processing Methods 0.000 description 1
- 230000007542 postnatal development Effects 0.000 description 1
- 230000003334 potential effect Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000007781 pre-processing Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- OLBCVFGFOZPWHH-UHFFFAOYSA-N propofol Chemical compound CC(C)C1=CC=CC(C(C)C)=C1O OLBCVFGFOZPWHH-UHFFFAOYSA-N 0.000 description 1
- 229960004134 propofol Drugs 0.000 description 1
- 230000010344 pupil dilation Effects 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000000611 regression analysis Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000000246 remedial effect Effects 0.000 description 1
- 229960003394 remifentanil Drugs 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 150000003873 salicylate salts Chemical class 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000010206 sensitivity analysis Methods 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 238000012095 single SNP association test Methods 0.000 description 1
- 208000022925 sleep disturbance Diseases 0.000 description 1
- 208000020685 sleep-wake disease Diseases 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000001148 spastic effect Effects 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000009044 synergistic interaction Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000000123 temperature gradient gel electrophoresis Methods 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000005382 thermal cycling Methods 0.000 description 1
- 229960004380 tramadol Drugs 0.000 description 1
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 1
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 1
- 230000001650 transport into the brain Effects 0.000 description 1
- 102000040811 transporter activity Human genes 0.000 description 1
- 108091092194 transporter activity Proteins 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000003519 ventilatory effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B40/00—ICT specially adapted for biostatistics; ICT specially adapted for bioinformatics-related machine learning or data mining, e.g. knowledge discovery or pattern finding
- G16B40/20—Supervised data analysis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- G06F19/22—
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B40/00—ICT specially adapted for biostatistics; ICT specially adapted for bioinformatics-related machine learning or data mining, e.g. knowledge discovery or pattern finding
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/16—Primer sets for multiplex assays
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Health & Medical Sciences (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medical Informatics (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Epidemiology (AREA)
- Public Health (AREA)
- Data Mining & Analysis (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Software Systems (AREA)
- Evolutionary Computation (AREA)
- Theoretical Computer Science (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Evolutionary Biology (AREA)
- Artificial Intelligence (AREA)
- Bioethics (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Databases & Information Systems (AREA)
- Bioinformatics & Computational Biology (AREA)
- Pathology (AREA)
- Emergency Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
Abstract
본 발명은 개인 맞춤형 통증 관리에 관한 방법, 키트, 및 시스템을 제공한다.
Description
관련 출원에 대한 상호 참조
본 출원은 2014년 2월 24일 출원된 미국 가특허 출원 번호 61/943,944의 이익을 주장하며, 상기 출원의 내용은 그 전문이 참조로 포함된다.
연방 정부 지원 연구에 관한 진술
본 발명은 미국 국립 보건원(National Institutes of Health)에 의해 부여된 RR026314 및 HG00682896 하에 정부 지원으로 이루어졌다. 미국 정부는 본 발명에서 특정 권리를 갖는다.
본 발명의 기술분야
본원에 개시된 본 발명은 일반적으로 통증 관리를 위한 방법 및 조성물에 관한 것이다.
안전하고, 효과적인 무통 (analgesia)이 충족되지 않은 중요한 의학적 요구 사항이다. 예컨대, 문헌 [Sadhasivam and Chidambaran, Pharmacogenomics (2012) 13(15):1719-1740]; [Caldas, J. et al., Paediatr . Anaesth ., 14:910-5 (2004)]; [Duedahl, T. and Hansen, E., Paediatr . Anaesth ., 17:756-74 (2007)]을 참조할 수 있다. 오피오이드는 수술 후 통증을 관리하는 데 보편적으로 사용되는 진통제이다. 비록 상당한 진통제 강도를 가지고 있기는 하지만, 오피오이드는 또한 치료 지수가 좁고, 예를 들어, 호흡 억제, 동공 축소, 졸음, 오심, 구토, 및 변비를 비롯한, 많은 연관된 역효과가 있다. 모르핀은 수술 후 기간 동안 가장 보편적으로 사용되는 오피오이드이다. 오피오이드 반응 및 모르핀의 좁은 치료 지수에 있어서 예측불가능한 환자간의 차이가 모르핀 유도성 호흡 억제의 발생률을 증가시킨다. 오피오이드 유도성 호흡 억제는 오피오이드의 가장 중증 역효과로서, 이는 수술 후 호흡 부전 이벤트의 최대 50%의 원인이 된다 (문헌 [Fecho K. et al., Therapeut. and Clin . Risk Mgmt. 5:961-8 (2009)]). 쌍둥이 연구를 통해 오피오이드로부터의 호흡 억제에 대한 유의적인 유전력 (30%)이 밝혀졌다 (문헌 [Angst M. et al., Anesthesiology 117:22-37 (2012)]). 모르핀에 대한 임상 반응의 개체간 변이성의 대략 50%는 통증 기전 및 오피오이드 대사, 수송, 및 수용체 신호전달에 관여하는 유전자 중의 SNP에 의해 설명될 수 있다. 기여하는 비유전적 위험 인자, 예컨대, 여성 성별, 인종, 의학 동반이환 및 다른 유전적 위험 인자, 예컨대, CYP2D6 변이체 또한 기술되었다 (문헌 [Ramachandran S. et al., J. Clin . Anesth . 23:207-13 (2011)]; [Niesters M. et al., British Journal of Anaesthesia 110:175-82 (2013)]). 오피오이드에 대한 환자 반응을 예측하고자 하는 노력은 임상의가 그의 역효과는 최소화시킴과 동시에, 통증 완화는 최대화시킬 수 있도록 진통제를 개인 맞춤화하는 데 큰 영향을 미칠 수 있다.
편도 절제술은 아동이 받는 가장 일반적이고, 상당한 통증을 일으키는 외과적 처치 중 하나이다. 매년 미국에서만 약 530,000여 건의 편도 절제술이 시술되고 있다 (문헌 [Erickson B. et al., Otolaryngol . Head Neck Surg ., 140:894-901 (2009)]). 대략 미국 아동 8명 중 1명이 편도 절제술을 받을 것이다 (문헌 [Marcus, C. et al., The New England Journal of Medicine, 368:2366-76 (2013)]; [Brouillette, R. The New England Journal of Medicine, 368:2428-9 (2013)]). 모르핀은 입원 환자 환경에서 아동에게 제공되는 상위 10개의 약물 중 하나이고 (문헌 [Lasky, T. et al., Clin . Ther ., 34:720-727 (2012)]), 이는 아동에서 편도 절제술 동안, 및 그 이후에 통증을 관리하는 데 빈번하게 사용된다. 편도 절제술이 필요한 적응증인 폐쇄성 수면 무호흡증이 아동을 특히 호흡 억제를 비롯한, 오피오이드의 주요 억제 효과에 민감하게 만든다 (문헌 [Brown, K. et al., Anesthesiology, 105:665-669 (2006)]). 편도 절제술 후 사망률에 관한 가장 큰 원 보고에 대한 최근 연구를 통하여 오피오이드 통증 약물 사용이 우세한 사망 및 무산소성 뇌 손상의 원인이 되었다는 것이 입증되었다 (문헌 [Goldman, J. et al., The Laryngoscope 123:2544-53 (2013)]). 2013년 2월, 미국 식품 의약품국(Food and Drug Administration)은 CYP2D6 유전자형 및 대사 상태와 상관없이 사망 및 중증 역효과에 관한 다수의 보고에 기초하여, 편도 절제술을 받은 아동에서의 코데인 (모르핀 프로드럭) 사용에 대하여 경고하였다 (문헌 [Food and Drug Administration, "Safety review update of codeine use in children; new boxed warning and contraindication on use after tonsillectomy 및/또는 adenoidectomy," in FDA Drug Safety Communication 2013]).
본 발명의 요약
본 발명은 1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계, 및 적어도 부분적으로는 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 2개의 위험군, 즉, 저위험군 및 고위험군 중 하나로 환자를 배정하는 단계를 포함하는, 진통제 (analgesia)를 필요로 하는 환자를 위한 진통제 약물 (analgesic medication)을 선택하는 방법, 및 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 방법을 제공한다. 한 실시양태에서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 진통제 또는 비-오피오이드 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 또 다른 오피오이드 진통제로부터 선택된다. 한 실시양태에서, 비-오피오이드 진통제는 파라세타몰 (이는 또한 아세트아미노펜으로도 지칭된다) 및 비스테로이드성 항염증성 약물 (NSAID)로 이루어진 군으로부터 선택된다. 한 실시양태에서, 모르핀 이외의 오피오이드 진통제는 펜타닐, 히드로모르폰, 코데인, 옥시코돈, 히드로코돈, 트라마돌, 온단세트론, 덱사메타손, 메타돈, 알펜타닐, 및 레미펜타닐로 이루어진 군으로부터 선택된다. 한 실시양태에서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 환자이다.
한 실시양태에서, 1개 이상의 유전자 변이체로는 ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함한다. 한 실시양태에서, 변이체는 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례는 호흡 억제 [respiratory depression: RD], RD에 기인하는 장기간의 회복실 체류 [prolonged stay in recovery due to RD: 장기간RD], 및 수술 후 오심 및 구토 [post-operative nausea and vomiting: PONV] (이는 또한 불응성 PONV일 수 있다)로부터 선택된다:
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD];
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]; 및
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
한 실시양태에서, 1개 이상의 유전자 변이체는 OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하거나, 또는 추가로 포함한다. 한 실시양태에서, 변이체는 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례는 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV] (이는 또한 불응성 PONV일 수 있다)로부터 선택된다:
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD];
ABCC3 rs739923 GG 널(null), AG 저, AA 저 [장기간RD];
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]; 및
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
한 실시양태에서, 1개 이상의 유전자 변이체는 FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 포함한다. 한 실시양태에서, 변이체는 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례는 호흡 억제 [RD]이다:
FAAH rs2295632 AA 고, CA 고, CC 저;
ABCB1 rs1045642 TT 고, TC 고, CC 저; 및
ADRB2 rs1042713 GG 고, GA 고, AA 저.
상기 기술된 방법들 중 임의의 것에 따라, 배정 단계는 컴퓨터 실행 방법에 의해 수행될 수 있고, 바람직하게는 그에 의해 수행된다. 한 실시양태에서, 컴퓨터 실행 방법은 결정 규칙 (decision rule)을 포함한다. 한 실시양태에서, 컴퓨터 실행 방법은 각 SNP가 쌍을 이루는 2개의 이진 변수를 초래하도록 유전자형을 코딩하는 것을 포함한다. 한 실시양태에서, 배정 단계는 결정 규칙을 포함하는 컴퓨터 실행 방법에 의해 수행되고, 결정 규칙은
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함한다.
또 다른 실시양태에서, 배정 단계는 결정 규칙을 포함하는 컴퓨터 실행 방법에 의해 수행되고, 결정 규칙은
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함한다.
본원에 기술된 방법의 한 실시양태에서, 1개 이상의 추가의 비-유전 인자는 환자의, 2개의 위험군 중 하나로의 배정을 개선시키고/거나, 환자와 동일한 연령, 체중, 성별, 및 인종의 대상체에 대한 표준 용량 이외의 약물의 용량을 선택하는 데 사용된다. 한 실시양태에서, 1개 이상의 추가의 비-유전 인자는 성별, 인종, 연령, 및 진단으로부터 선택된다.
본원에 기술된 방법들 중 임의의 것에 따라, 한 실시양태에서, 환자는 소아 환자이다. 한 실시양태에서, 환자는 백인(Caucasian) 조상의 환자이다.
특정 실시양태에서, 환자는 저위험군으로 배정된 백인 조상의 여아 환자이고, 오피오이드 약물은 전체 투약 용량이 0.15 mg/kg, 0.2 mg/kg, 또는 0.275 mg/kg을 초과하지 않도록 투여된다.
한 실시양태에서, 오피오이드 감수성과 관련된 1개 이상의 추가의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계를 포함하는, 진통제 약물을 선택하는 방법은 저위험군으로 배정된 환자에 맞게 아편제 진통제의 용량을 조정하는 단계를 추가로 포함한다. 한 실시양태에서, 오피오이드 감수성과 관련된 1개 이상의 추가의 유전자 변이체는 ABCB1 rs2229109이다. 본 실시양태에 따라, 아편제 진통제의 용량은 ABCB1 rs2229109 CC 유전자형을 가지는 환자에 대해서는 표준 용량으로부터 상향 조정되고, 용량은 ABCB1 rs2229109 AA 유전자형을 가지는 환자에 대해서는 하향 조정된다. 한 실시양태에서, 용량은 0.04 mg/kg으로 조정된다. 본원에서 사용되는 바, 표준 용량이란, 환자와 같은 연령, 체중, 성별, 인종, 및/또는 진단을 가지는 대상체를 위한 FDA 승인 제품의 라벨 상에 표시된 용량을 의미한다.
본원에 기술된 방법들 중 임의의 것에 따라, 한 실시양태에서, 환자의 유전자형은 환자의 유전자형을 결정하는 데 사용된 장치로부터 직접 수령한다. 한 실시양태에서, 환자의 유전자형은 환자로부터 생물학적 샘플을 직접 수득하거나 수령하고, 샘플로부터 DNA를 추출하며, DNA를 분석하여 패널 중 각 유전자 변이체에서의 환자의 유전자형을 결정하는 단계를 포함하는 방법에 의해 측정된다. 한 실시양태에서, DNA는 유전자형 분석 플랫폼에 기반한 중합효소 연쇄 반응을 사용하여 분석된다. 한 실시양태에서, 유전자형 분석 플랫폼은 특이적인 유전자 변이체를 증폭시키고, 검출하기 위해 5' 뉴클레아제 검정법을 이용한다. 한 실시양태에서, 생물학적 샘플은 혈액 샘플 및 구강 면봉 채취물(buccal swab)로부터 선택된다.
본 발명은 또한 진단용 키트 또는 "생물학적 검정용 키트"를 제공한다. 한 실시양태에서, 생물학적 검정용 키트는 하기 성분 (i) 하기 SNP OPRMI rs1799971, ABCB1 rs9282564, ABCB1 rs1045642, 및 ADRB2 rs1042713 각각을 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함한다. 한 실시양태에서, 생물학적 검정용 키트는 하기 성분 (i) ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로부터 선택되는 하나 이상의 유전자 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함한다. 한 실시양태에서, 생물학적 검정용 키트는 OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로부터 선택되는 하나 이상의 추가의 유전자 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트를 포함하고, 본 발명의 생물학적 검정용 키트는 그를 추가로 포함한다. 한 실시양태에서, 생물학적 검정용 키트는 하기 성분 (i) FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함한다.
도 1. 유의적인 연관성이 있는 영역이 확인된, 46.86 Mb부터 46.89 Mb까지의 확대된 FAAH 영역. 11개의 SNP가 시험되었다. PONV (상단 패널), 호흡 억제 (중간 패널), 및 전체 모르핀 (mg/kg) (하단 패널)과의 단일 SNP 연관성은 -로그10 (p 값)으로 제시되어 있다.
도 2. 아데노이드편도 절제술 (adenotonsillectomy) 군 연구에서 관찰된, OCT1, ABCC3, 및 ABCB1 유전자형에 따른 모르핀 제거 및 M3G/M-6G 형성 제거의 차이.
도 3a. 본 발명자들의 연구에서 관찰된 ABCC3 rs4793665 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4793665 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치(Bayesian estimate)가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 3b. 본 발명자들의 연구에서 관찰된 ABCC3 rs4148412 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4148412 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 4a. 본 발명자들의 연구에서 관찰된 ABCC3 rs739923 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs739923 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 4b. 본 발명자들의 연구에서 관찰된 ABCC3 kgp8560677 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 kgp8560677 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 5. 본 발명자들의 연구에서 관찰된 ABCC3 rs4148412 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4148412 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 6. 척추 후부 유합술 (posterior spine fusion surgery)을 받은 청소년에서 ABCC3 rs733392와 호흡 억제 사이의 연관성 입증. ABCC3 SNP rs733392는 편도 절제술 집단에서 관찰된 연관성과 일관되게, 척추 수술 집단에서 호흡 억제와 연관성이 있었다. ABCC3 rs733392 및 rs733923은 연관 비평형 상태에 있고; 이 둘 모두 편도 절제술 집단에서 호흡 억제와 연관성이 있었다.
도 7a-7c. 그래프는 OPRM1 rs1799971 변이가 수술 후 1일째 및 2일째의 모르핀 유도성 호흡 억제 (MIRD) 및 통증 결과에 미치는 영향을 도시한 것이다. 상이한 유전자형에서의 MIRD 발생률 (a); 상이한 유전자형에서의 MIRD 위험 (b); 상이한 유전자형에 대한 통증 점수 및 모르핀 누적 용량 (c).
도 8a-8b. 수술 후 개입을 필요로 하는 환자들 사이에서 고위험 서브타입 대 저위험 서브타입을 확인하기 위한 SNP 시그너쳐의 용도로서, 여기서, 3개의 SNP를 통해 신호 대부분을 포착할 수 있다. 각 클러스터에서의 RD 사례의 비율(%) (a); 환자를 저위험 계층 대 고위험 계층으로 분류하는 결정 수형도 (decision tree)로서, 여기서, rs2295632_A = 아니오는 A 대립유전자, 즉, CC의 부족을 나타내고, rs2295632 = 예는 CA 및 AA 유전자형에 상응한다 (b).
도 9. 인간 일루미나 옴니5(Illumina Omni5) GWAS 칩으로부터의 ABCC3 SNP와 수술 후 호흡 억제 사이의 연관성.
도 10. RD (RD 발생하지 않은 대상체: 좌측 박스플롯; RD 발생한 대상체: 우측 박스플롯)와 함께, 인종, 성별, OSA (비-OSA: 좌측 박스플롯; OSA: 우측 박스플롯)와 모르핀 용량의 상관관계. OSA 환자의 총 용량은 더 낮았고, RD 위험은 모르핀 용량이 증가함에 따라 증가하였다. 본 결과는 274명의 환자로 이루어진 세트를 포함한다.
도 11. 콘소트 다이어그램은 상기 임상 시험을 거친 연구 참가자의 흐름을 도시한 것이다. 자격이 있는 참가자, 배제 이유, 및 등록한 환자가 기록되어 있다. IRB = 기관 임상 시험 심사 위원회.
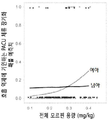
도 12a-12b. 마취 후 회복실 (post-anesthesia recovery unit: PACU)에서의 모르핀 관련 수술 후 오심 및 구토 (PONV)의 성별 특이 차이. a: PACU에서의 모르핀 관련 PONV의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한 모르핀 관련 PONV의 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른 PACU에서의 오피오이드 관련 PONV의 전체 발생률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다. b: PACU에서의 체류를 장기화하는 모르핀 관련 PONV의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한, PONV에 기인하는 PACU 체류 장기화 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른, PACU 체류를 장기화시키는 PONV의 확률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다.
도 13a-13b. PACU에서의 모르핀 관련 호흡 억제 (RD)의 성별 특이 차이.
a: PACU에서의 모르핀 관련 RD의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한 모르핀 관련 호흡 억제의 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른 PACU에서의 오피오이드 관련 호흡 억제의 전체 발생률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다. b: PACU에서의 체류를 장기화하는 모르핀 관련 RD의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한, RD에 기인하는 PACU 체류 장기화 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른, PACU 체류를 장기화시키는 PONV의 확률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다.
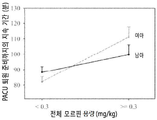
도 14. 전체 모르핀 저용량 (<0.3 mg/kg)과 전체 모르핀 고용량 (≥0.3 mg/kg) 사이의 PACU에의 체류 지속 기간의 성별 특이 차이. 전체 모르핀을 <0.3 mg/kg 받은 여아보다 (82.2±3.3분) 전체 모르핀을 ≥0.3 mg/kg 받은 백인 여아가 PACU에 더 장기간 동안 체류하였다 (111.1±6.6분). 전체 모르핀을 ≥0.3 mg.kg-1 받은 백인 남아는 PACU에 99.7±6.4분 동안 체류한 반면, 모르핀을 <0.3 mg.kg-1 받은 백인 남아는 PACU에 88.3±3.6분 동안 체류하였다. 비록 백인 여아에서는 전체 모르핀 저용량과 전체 모르핀 고용량 사이의 PACU에의 체류 지속 기간의 차이가 약 30분 이상 체류로 임상적으로 유의적이기는 하지만, 이는 연령, 체중, OSA 병력에 대해 조정한 이후에는 통계학적 유의 수준 (p=0.09)에는 도달하지 못했다. 비록 성별에 따라 계층화된 분석에서 고용량을 받은 여아에서의 장기간 PACU 체류가 남아에서의 것과 통계학상 유의적인 수준으로 (p=0.09) 상이하지는 않지만, 고용량을 받은 여아는 저용량을 받은 여아보다 더 장기간 PACU에 체류하였다 (p=0.0002). 그러나, 남아에서의 상기 차이는 통계학상 유의적이지 않다 (p=0.11).
도 15. 콘소트 다이어그램은 상기 임상 시험을 거친 연구 참가자의 흐름을 도시한 것이다. 자격이 있는 참가자, 배제 이유, 및 등록 및 분석된 환자가 기록되어 있다. IRB = 기관 임상 시험 심사 위원회.
도 16a-16c. 5개의 ABCB1 SNP 및 임상 결과의 유전적 연관성. 가산 모델에서 시험단일 SNP 연관의 -로그10 (p 값)을 플롯팅하였다. 참조선은 -로그10 (p 값 =0.05) 수준을 나타낸 것이다. 시험은 백인 (a), 흑인 (b), 및 조합된 혼혈 인종 (c)에서 수행하였다. 상기 두 인종에서, ABCB1 SNP인 rs9282564는 호흡 억제에 기인하는 장기간 PACU 체류와 유의적인 연관성을 가졌고; ABCB1 SNP인 rs2229109는 수술 후 모르핀 요구량과 연관이 있었다. RD = 호흡 억제; PACU = 마취 후 회복실; FLACC = 얼굴 다리 활동 울음 및 진정됨 통증 척도.
도 17. ABCB1 유전자형 및 호흡 억제의 위험. GA 유전자형을 가지는 아동과 비교하였을 때, rs9282564의 GG 유전자형을 가지는 아동은 호흡 억제 오즈가 4.7배 더 높았고, 그 결과로 PACU에의 체류가 장기화되었다 (95% CI: 2.1-10.8, p=0.0002). GA 유전자형을 가지는 아동과 비교하였을 때, rs9282564의 AA 유전자형을 가지는 아동은 호흡 억제 오즈가 더 낮았고 [0.2 (0.1-0.5)], 그 결과로 PACU에의 체류가 장기화되었다. PACU = 마취 후 회복실.
도 18. ABCB1 수송체 구조 및 비-동의 (non-synonymous) 다형성의 맵핑. 마우스 오토로그의 서열 정렬, 2차 구조 및 TM 나선 예측 (http://sable.cchmc.org) 및 분석된 구조를 사용하여, 3개의 비-동의 SNP를 21번 위치 (분석되지 않은 N-말단 단편 내의 적색 부위), 400번 위치 (제1 ATP 결합 부위 부근에 표시된 청색 측쇄 모델), 및 893번 위치 (TM10의 시토졸 연장부 내의 자홍색)에 대해 맵핑한다. 상기 구조의 나머지의 경우, 황색은 소수성 잔기를 나타내는 데 사용되는 반면, 적색, 오렌지색 및 갈색은 각각 하전된 친수성 잔기를 나타내는 데 사용된다. 막은 청색 직사각형 기호로 표시되어 있다. 폴리뷰(Polyview)-3D (http://polyview.cchmc.org)를 사용하여 본 도면을 작성하였다. 구조에 기반한, ABCB1 SNP의 효과 분석: 분석된 ABCB1 SNP 중에서, rs9282564, rs2229109, 및 rs2032582는 비-동의성이고, 이는 각각 21번 위치 (N 대 D), 400번 위치 (S 대 N), 및 893번 위치 (S 대 A 대 T)에서의 아미노산 서열 변이를 일으킨다. 적색, 자홍색, 및 청색 부위로 표지화된 바와 같이, 영향을 받은 3개의 잔기 모두 수송체의 시토졸 "아암" 중 하나 내에 위치한다. 상기 부위 중 첫번째 것 (잔기 21)은 막횡단 나선 TM1로 바로 진행되는 가요성 N-말단 세포질 세그먼트 내에 위치한다. 상기 N-말단 도메인은 고도로 가변성이고, 다중의 양성으로 하전된 잔기를 함유한다. 이는 수송체의 시토졸 부분의 나머지와, 또는 ABCB1 보조인자와 상호작용할 수 있으며, 추가의 서열분석과 함께 상기 상호작용에 관한 구조 데이터는 상기 부위 기능적 역할을 간파하는 데 필요할 것이다. 한편, 두번째 변이체 (청색 부위)의 구조적 맥락에 관한 상세한 분석은 이 변이체가 잠재적으로는 ABCB1 기능을 조절하는 데 있어 직접적인 역할을 할 수 있다고 제안한다. 그 자체가 진화적으로 보존되는 것은 아니지만, 400번 위치는 FSY 모티프를 형성하는, 강력하게 보존되는 2개의 방향족 잔기 측면에 위치한다. 상기의 두 잔기는 잔기 442-445 (RLYD)를 포함하는, 또 다른 보존 부위와 접촉한다. 이와 함께, 상기의 두 용매 노출된 루프는 잔기 427-434 (녹색으로 표시)를 포함하는, ATP 결합 부위(와 직접 접촉하고 있는 것은 아니지만)의 바로 옆 인근을 구성한다. 상기 루프는 ATP 가수분해시 입체구조 변화가 이루어지는 것으로 예측되는 바, Asn400 대립유전자는 이들 변화가 전체 구조를 통해 어떻게 전달되는지에 영향을 줄 수 있고, 수송체의 개방 및 폐쇄에 기여할 수 있다. 남은 두 SNP, 즉, rs1128503 및 rs1045642는 동의성이다. 흥미롭게도, 상기 두 SNP는 서로 뿐만 아니라, 비-동의 rs2032582와 비교적 강력한 연관성을 가진다 (그러나, 다른 두 비-동의 SNP인 rs9282564 및 rs2229109와는 그렇지 않다). 1,000개의 게놈 CEU 코호트에서, rs2032582와 상기 두 비-동의 SNP 사이에 r2는 0.87 및 0.51인 것으로 관찰된다. 이들 SNP 모두 예컨대, ABCB1 단백질 발현에 영향을 주는 것과 같이, 연관 비평형에서 또 다른 다형성의 효과적인 마커일 수 있다. 실제 기능성 마커를 확인하는 데 추가의 서열분석, 구조 및 생화학적 연구가 요구될 것이다.
도 19. 주성분 1 및 2의 산점도. 218개의 조상 정보 마커 (AIM)와 함께 골든 헬릭스 소프트웨어(Golden Helix Software)를 사용하여 주성분 분석을 수행하였다. 연구 코호트 중 자기 보고된 인종 (백인은 적색 동그라미로 표시, 및 흑인은 청색 동그라미로 표시)을 합맵(HapMap) 프로젝트로부터의 참조 집단 (개방형 삼각형)과 함께 플롯팅하였다. 참조 집단은 하기와 같이 하기 약어 및 다른 색상의 개방형 삼각형으로 표시되었다: Δ CEU = 조상이 북유럽인 및 서유럽인인 유타 거주자; Δ ASW = 미국 남서부의 아프리카 조상; Δ LWK = 케냐 웨부이의 루히아족; Δ MKK = 케냐 키냐와의 마사이족; Δ YRI = 나이지리아 이바단의 요루바족; Δ CHD = 미국 콜로라도주 대도시 덴버의 중국인; Δ CHB = 중국 북경의 한족; Δ JPT = 일본 동경의 일본인; 및 Δ GIH = 미국 텍사스주 휴스턴의 구자라트 인도인.
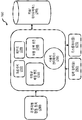
도 20. 본원에 기술된 시스템의 개략도.
도 2. 아데노이드편도 절제술 (adenotonsillectomy) 군 연구에서 관찰된, OCT1, ABCC3, 및 ABCB1 유전자형에 따른 모르핀 제거 및 M3G/M-6G 형성 제거의 차이.
도 3a. 본 발명자들의 연구에서 관찰된 ABCC3 rs4793665 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4793665 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치(Bayesian estimate)가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 3b. 본 발명자들의 연구에서 관찰된 ABCC3 rs4148412 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4148412 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 4a. 본 발명자들의 연구에서 관찰된 ABCC3 rs739923 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs739923 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 4b. 본 발명자들의 연구에서 관찰된 ABCC3 kgp8560677 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 kgp8560677 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 5. 본 발명자들의 연구에서 관찰된 ABCC3 rs4148412 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이성. 상단 패널은 아데노이드편도 절제술을 받은 경우의 연구로부터 얻은 결과를 요약한 것인 반면, 하단 패널은 척추 수술을 받은 경우의 연구로부터 얻은 결과를 요약한 것이다. ABCC3 rs4148412 유전자형은 x축을 따라 달라진다. Nonmem 분석으로부터의 개별 모르핀 CL (ηMor,CL), M3G 형성 CL (ηM3G,FCL) 및 M6G 형성 CL (ηM6G,FCL)의 실험상의 베이지안 추정치가 좌측, 중간 및 우측 패널 각각에 대하여 y축 상에 플롯팅되어 있다.
도 6. 척추 후부 유합술 (posterior spine fusion surgery)을 받은 청소년에서 ABCC3 rs733392와 호흡 억제 사이의 연관성 입증. ABCC3 SNP rs733392는 편도 절제술 집단에서 관찰된 연관성과 일관되게, 척추 수술 집단에서 호흡 억제와 연관성이 있었다. ABCC3 rs733392 및 rs733923은 연관 비평형 상태에 있고; 이 둘 모두 편도 절제술 집단에서 호흡 억제와 연관성이 있었다.
도 7a-7c. 그래프는 OPRM1 rs1799971 변이가 수술 후 1일째 및 2일째의 모르핀 유도성 호흡 억제 (MIRD) 및 통증 결과에 미치는 영향을 도시한 것이다. 상이한 유전자형에서의 MIRD 발생률 (a); 상이한 유전자형에서의 MIRD 위험 (b); 상이한 유전자형에 대한 통증 점수 및 모르핀 누적 용량 (c).
도 8a-8b. 수술 후 개입을 필요로 하는 환자들 사이에서 고위험 서브타입 대 저위험 서브타입을 확인하기 위한 SNP 시그너쳐의 용도로서, 여기서, 3개의 SNP를 통해 신호 대부분을 포착할 수 있다. 각 클러스터에서의 RD 사례의 비율(%) (a); 환자를 저위험 계층 대 고위험 계층으로 분류하는 결정 수형도 (decision tree)로서, 여기서, rs2295632_A = 아니오는 A 대립유전자, 즉, CC의 부족을 나타내고, rs2295632 = 예는 CA 및 AA 유전자형에 상응한다 (b).
도 9. 인간 일루미나 옴니5(Illumina Omni5) GWAS 칩으로부터의 ABCC3 SNP와 수술 후 호흡 억제 사이의 연관성.
도 10. RD (RD 발생하지 않은 대상체: 좌측 박스플롯; RD 발생한 대상체: 우측 박스플롯)와 함께, 인종, 성별, OSA (비-OSA: 좌측 박스플롯; OSA: 우측 박스플롯)와 모르핀 용량의 상관관계. OSA 환자의 총 용량은 더 낮았고, RD 위험은 모르핀 용량이 증가함에 따라 증가하였다. 본 결과는 274명의 환자로 이루어진 세트를 포함한다.
도 11. 콘소트 다이어그램은 상기 임상 시험을 거친 연구 참가자의 흐름을 도시한 것이다. 자격이 있는 참가자, 배제 이유, 및 등록한 환자가 기록되어 있다. IRB = 기관 임상 시험 심사 위원회.
도 12a-12b. 마취 후 회복실 (post-anesthesia recovery unit: PACU)에서의 모르핀 관련 수술 후 오심 및 구토 (PONV)의 성별 특이 차이. a: PACU에서의 모르핀 관련 PONV의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한 모르핀 관련 PONV의 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른 PACU에서의 오피오이드 관련 PONV의 전체 발생률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다. b: PACU에서의 체류를 장기화하는 모르핀 관련 PONV의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한, PONV에 기인하는 PACU 체류 장기화 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른, PACU 체류를 장기화시키는 PONV의 확률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다.
도 13a-13b. PACU에서의 모르핀 관련 호흡 억제 (RD)의 성별 특이 차이.
a: PACU에서의 모르핀 관련 RD의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한 모르핀 관련 호흡 억제의 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른 PACU에서의 오피오이드 관련 호흡 억제의 전체 발생률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다. b: PACU에서의 체류를 장기화하는 모르핀 관련 RD의 성별 특이 차이. 전체 모르핀 용량은 X축에 플롯팅되어 있고, 남아 및 여아에 대한, RD에 기인하는 PACU 체류 장기화 확률은 Y축에 플롯팅되어 있다. 전체 모르핀 용량이 증가함에 따른, PACU 체류를 장기화시키는 PONV의 확률은 남아와 비교하였을 때, 여아에서 상대적으로 더 높았다.
도 14. 전체 모르핀 저용량 (<0.3 mg/kg)과 전체 모르핀 고용량 (≥0.3 mg/kg) 사이의 PACU에의 체류 지속 기간의 성별 특이 차이. 전체 모르핀을 <0.3 mg/kg 받은 여아보다 (82.2±3.3분) 전체 모르핀을 ≥0.3 mg/kg 받은 백인 여아가 PACU에 더 장기간 동안 체류하였다 (111.1±6.6분). 전체 모르핀을 ≥0.3 mg.kg-1 받은 백인 남아는 PACU에 99.7±6.4분 동안 체류한 반면, 모르핀을 <0.3 mg.kg-1 받은 백인 남아는 PACU에 88.3±3.6분 동안 체류하였다. 비록 백인 여아에서는 전체 모르핀 저용량과 전체 모르핀 고용량 사이의 PACU에의 체류 지속 기간의 차이가 약 30분 이상 체류로 임상적으로 유의적이기는 하지만, 이는 연령, 체중, OSA 병력에 대해 조정한 이후에는 통계학적 유의 수준 (p=0.09)에는 도달하지 못했다. 비록 성별에 따라 계층화된 분석에서 고용량을 받은 여아에서의 장기간 PACU 체류가 남아에서의 것과 통계학상 유의적인 수준으로 (p=0.09) 상이하지는 않지만, 고용량을 받은 여아는 저용량을 받은 여아보다 더 장기간 PACU에 체류하였다 (p=0.0002). 그러나, 남아에서의 상기 차이는 통계학상 유의적이지 않다 (p=0.11).
도 15. 콘소트 다이어그램은 상기 임상 시험을 거친 연구 참가자의 흐름을 도시한 것이다. 자격이 있는 참가자, 배제 이유, 및 등록 및 분석된 환자가 기록되어 있다. IRB = 기관 임상 시험 심사 위원회.
도 16a-16c. 5개의 ABCB1 SNP 및 임상 결과의 유전적 연관성. 가산 모델에서 시험단일 SNP 연관의 -로그10 (p 값)을 플롯팅하였다. 참조선은 -로그10 (p 값 =0.05) 수준을 나타낸 것이다. 시험은 백인 (a), 흑인 (b), 및 조합된 혼혈 인종 (c)에서 수행하였다. 상기 두 인종에서, ABCB1 SNP인 rs9282564는 호흡 억제에 기인하는 장기간 PACU 체류와 유의적인 연관성을 가졌고; ABCB1 SNP인 rs2229109는 수술 후 모르핀 요구량과 연관이 있었다. RD = 호흡 억제; PACU = 마취 후 회복실; FLACC = 얼굴 다리 활동 울음 및 진정됨 통증 척도.
도 17. ABCB1 유전자형 및 호흡 억제의 위험. GA 유전자형을 가지는 아동과 비교하였을 때, rs9282564의 GG 유전자형을 가지는 아동은 호흡 억제 오즈가 4.7배 더 높았고, 그 결과로 PACU에의 체류가 장기화되었다 (95% CI: 2.1-10.8, p=0.0002). GA 유전자형을 가지는 아동과 비교하였을 때, rs9282564의 AA 유전자형을 가지는 아동은 호흡 억제 오즈가 더 낮았고 [0.2 (0.1-0.5)], 그 결과로 PACU에의 체류가 장기화되었다. PACU = 마취 후 회복실.
도 18. ABCB1 수송체 구조 및 비-동의 (non-synonymous) 다형성의 맵핑. 마우스 오토로그의 서열 정렬, 2차 구조 및 TM 나선 예측 (http://sable.cchmc.org) 및 분석된 구조를 사용하여, 3개의 비-동의 SNP를 21번 위치 (분석되지 않은 N-말단 단편 내의 적색 부위), 400번 위치 (제1 ATP 결합 부위 부근에 표시된 청색 측쇄 모델), 및 893번 위치 (TM10의 시토졸 연장부 내의 자홍색)에 대해 맵핑한다. 상기 구조의 나머지의 경우, 황색은 소수성 잔기를 나타내는 데 사용되는 반면, 적색, 오렌지색 및 갈색은 각각 하전된 친수성 잔기를 나타내는 데 사용된다. 막은 청색 직사각형 기호로 표시되어 있다. 폴리뷰(Polyview)-3D (http://polyview.cchmc.org)를 사용하여 본 도면을 작성하였다. 구조에 기반한, ABCB1 SNP의 효과 분석: 분석된 ABCB1 SNP 중에서, rs9282564, rs2229109, 및 rs2032582는 비-동의성이고, 이는 각각 21번 위치 (N 대 D), 400번 위치 (S 대 N), 및 893번 위치 (S 대 A 대 T)에서의 아미노산 서열 변이를 일으킨다. 적색, 자홍색, 및 청색 부위로 표지화된 바와 같이, 영향을 받은 3개의 잔기 모두 수송체의 시토졸 "아암" 중 하나 내에 위치한다. 상기 부위 중 첫번째 것 (잔기 21)은 막횡단 나선 TM1로 바로 진행되는 가요성 N-말단 세포질 세그먼트 내에 위치한다. 상기 N-말단 도메인은 고도로 가변성이고, 다중의 양성으로 하전된 잔기를 함유한다. 이는 수송체의 시토졸 부분의 나머지와, 또는 ABCB1 보조인자와 상호작용할 수 있으며, 추가의 서열분석과 함께 상기 상호작용에 관한 구조 데이터는 상기 부위 기능적 역할을 간파하는 데 필요할 것이다. 한편, 두번째 변이체 (청색 부위)의 구조적 맥락에 관한 상세한 분석은 이 변이체가 잠재적으로는 ABCB1 기능을 조절하는 데 있어 직접적인 역할을 할 수 있다고 제안한다. 그 자체가 진화적으로 보존되는 것은 아니지만, 400번 위치는 FSY 모티프를 형성하는, 강력하게 보존되는 2개의 방향족 잔기 측면에 위치한다. 상기의 두 잔기는 잔기 442-445 (RLYD)를 포함하는, 또 다른 보존 부위와 접촉한다. 이와 함께, 상기의 두 용매 노출된 루프는 잔기 427-434 (녹색으로 표시)를 포함하는, ATP 결합 부위(와 직접 접촉하고 있는 것은 아니지만)의 바로 옆 인근을 구성한다. 상기 루프는 ATP 가수분해시 입체구조 변화가 이루어지는 것으로 예측되는 바, Asn400 대립유전자는 이들 변화가 전체 구조를 통해 어떻게 전달되는지에 영향을 줄 수 있고, 수송체의 개방 및 폐쇄에 기여할 수 있다. 남은 두 SNP, 즉, rs1128503 및 rs1045642는 동의성이다. 흥미롭게도, 상기 두 SNP는 서로 뿐만 아니라, 비-동의 rs2032582와 비교적 강력한 연관성을 가진다 (그러나, 다른 두 비-동의 SNP인 rs9282564 및 rs2229109와는 그렇지 않다). 1,000개의 게놈 CEU 코호트에서, rs2032582와 상기 두 비-동의 SNP 사이에 r2는 0.87 및 0.51인 것으로 관찰된다. 이들 SNP 모두 예컨대, ABCB1 단백질 발현에 영향을 주는 것과 같이, 연관 비평형에서 또 다른 다형성의 효과적인 마커일 수 있다. 실제 기능성 마커를 확인하는 데 추가의 서열분석, 구조 및 생화학적 연구가 요구될 것이다.
도 19. 주성분 1 및 2의 산점도. 218개의 조상 정보 마커 (AIM)와 함께 골든 헬릭스 소프트웨어(Golden Helix Software)를 사용하여 주성분 분석을 수행하였다. 연구 코호트 중 자기 보고된 인종 (백인은 적색 동그라미로 표시, 및 흑인은 청색 동그라미로 표시)을 합맵(HapMap) 프로젝트로부터의 참조 집단 (개방형 삼각형)과 함께 플롯팅하였다. 참조 집단은 하기와 같이 하기 약어 및 다른 색상의 개방형 삼각형으로 표시되었다: Δ CEU = 조상이 북유럽인 및 서유럽인인 유타 거주자; Δ ASW = 미국 남서부의 아프리카 조상; Δ LWK = 케냐 웨부이의 루히아족; Δ MKK = 케냐 키냐와의 마사이족; Δ YRI = 나이지리아 이바단의 요루바족; Δ CHD = 미국 콜로라도주 대도시 덴버의 중국인; Δ CHB = 중국 북경의 한족; Δ JPT = 일본 동경의 일본인; 및 Δ GIH = 미국 텍사스주 휴스턴의 구자라트 인도인.
도 20. 본원에 기술된 시스템의 개략도.
본 발명의 상세한 설명
본 발명은 1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계, 및 적어도 부분적으로는 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 2개의 위험군, 즉, 저위험군 및 고위험군 중 하나로 환자를 배정하는 단계를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하는 방법, 및 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 방법을 제공한다. 본 발명은 또한 1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계, 및 본원에 기술된 바와 같이 그에 따라 약물의 투여량을 조정하는 단계를 포함하는, 진통제 약물의 투여량 조정을 필요로 하는 환자를 위해 진통제 약물의 투여량을 조정하는 방법을 제공한다. 한 실시양태에서, 진통제 약물은 오피오이드 진통제이다. 한 실시양태에서, 오피오이드 진통제는 모르핀이다. 한 측면에서, 본 발명은 특정 유전자형을 가지는 환자를 위한, 단독으로, 또는 다른 유전자 변이체 또는 비-유전 인자와 함께 조합하여 하나 이상의 오피오이드 관련 유해 사례의 위험이 더 높다는 것, 또는 통증 관리가 잘 안된다는 것(poor pain control), 또는 그 둘 모두를 나타내는 유전자 변이체를 제공한다. 한 실시양태에서, 유전자 변이체는 단일 뉴클레오티드 다형성, 또는 SNP이다.
본 발명은 또한 유해 사례의 위험을 감소시키고, 진통 효능을 증가시키기 위해, 이 둘 모두를 수행하기 위해, 개인 맞춤형 개입을 제공하는 데 유용한 임상 결과의 예측 모델을 형성하는, 본원에 기술된 유전적 연관성을 도입한 결정 수형도 및 알고리즘을 제공한다. 상기 결정 수형도 및 알고리즘은 또한 오피오이드 및/또는 진통제 투여의 효능 및 안전성을 평가하는 데에도 사용될 수 있다. 본원에 기술된 결정 수형도 및 알고리즘의 사용은 역효과는 최소로 하면서 더 우수한 진통제 뿐만 아니라, 경제적인 결과를 제공함으로써, 장기간 PACU 체류, 부적절한 통증 관리로 인한 응급실 방문, 오피오이드 유도성 구토 이후의 탈수, 및 산소 및 집중 호흡 보조 조치를 필요로 하는 호흡 억제를 감소시킴으로써 수술 전후의 임상 결과를 개선시킬 수 있다. 이러한 임상적 결정 알고리즘은 맞춤식 오피오이드 선택 및 투약을 통해 중증 유해 사례의 위험은 최소화하면서, 통증 완화는 최대화시킬 수 있다. 이러한 결과들은 오피오이드를 필요로 하는 외과적 또는 비외과적 통증이 있는 성인 및 아동에게까지 추정될 수 있다. 달리 언급되지 않는 한, 용어들은 종래 용법에 따라 관련 분야의 통상의 숙련가가 이해하는 것과 같다.
"단일 뉴클레오티드 다형성," 또는 "SNP"는 게놈 특정 위치의 단일 뉴클레오티드가 한 종의 구성원들 사이에, 또는 개체에서의 쌍별 염색체 사이에 차이가 날 때 존재하는 DNA 서열 변이이다. 대부분의 SNP 다형성은 2개의 대립유전자를 가진다. 이러한 경우 각 개체는 다형성의 한 대립유전자에 대해 동형접합성이거나 (즉, 개체의 두 염색체 카피 모두가 SNP 위치에서 동일한 뉴클레오티드를 가지거나), 또는 개체는 이형접합성이다 (즉, 개체의 두 자매 염색체가 상이한 뉴클레오티드를 함유한다). 본원에 보고된 바와 같은 SNP 명명법은 미국 국립 생물공학 정보 센터(National Center for Biotechnological Information: NCBI)가 각각의 독특한 SNP에 배정한 바와 같은 공식 참조 SNP(Reference SNP: rs) ID 식별 태그를 지칭하거나, 또는 확인된 다형성과 관련된 잔기 변이를 식별할 수 있게 한다.
본원에서 사용되는 바, "순람표"라는 용어는 한 형태의 데이터를 또 다른 형태와, 또는 하나 이상의 형태의 데이터를 데이터와 관련이 있는 예측 결과, 예컨대, 표현형 또는 소질과 서로 연관시키는 표이다. 예를 들어, 순람표는 본원에 기술된 바와 같은 유전자 변이체와, 상기 변이체를 보유하는 개체가 보일 가능성이 있는, 또는 상기 변이체를 보유하지 않는 개체보다 보일 가능성이 더 큰 특정 소질 또는 표현형, 예컨대, 약물 관련 유해 사례 또는 표준 용량에서의 불충분한 약물 활성 사이의 상관관계를 포함할 수 있다. 순람표는 다차원일 수 있고, 즉, 다중 유전자 변이체, 예컨대, 대립유전자, SNP, 유전자 결실 또는 삽입에 대한 정보를 함유할 수 있거나, 또는 이는 다중 변이체에 대한 정보를 함유할 수 있고; 이는 또한 환자 특이 임상 데이터, 예컨대, 진단, 성별, 인종, 동반이환 등 뿐만 아니라, 예를 들어, 치료 방법 및 약물을 비롯한, 치료 옵션에 대한 정보를 비롯한, 다른 비유전자 인자를 포함할 수 있다.
본원에서 사용되는 바, "결정 수형도"라는 용어는 다변량 데이터 분석 및 분류를 위한 표준 머신 러닝 기법을 지칭한다 (문헌 [Hastie, T., et al. The Elements of Statistical Learning, Second Edition, Springer (2009)]; [Witten, I. and Frank, E. Data Mining: Practical Machine Learning Tools and Techniques, Second Edition, Morgan Kaufmann, San Francisco (2005)]; [Hothorn, T. Journal of Computational and Graphical Statistics, 15:651-74 (2010)]). 결정 수형도는 결정 지원 시스템을 위한, 쉽게 해석가능하고, 직관적인 규칙을 유도하는 데 사용될 수 있다.
본 발명의 실시양태는 별개로 진단 마커 또는 예후 마커로서의 각 유전자 변이체의 용도, 또는 패널이 표현형 (예컨대, 약물 유도성 또는 약물 관련 유해 사례, 또는 표준 용량에서의 약물의 무효성)에 대하여 더욱 우수한 예측자인 것인, 패널로 조합된 2개 이상의 변이체의 용도를 포함한다.
유전자
변이체
및 비-유전 인자
본 발명은 임상적 결정 지원 방법, 예컨대, 적절한 진통제 약물을 필요로 하는 환자를 위해 적절한 진통제 약물을 선택하는 방법 뿐만 아니라, 중증 약물 유도성 (또는 약물 관련) 유해 사례의 위험이 있는 환자를 확인하는 방법을 제공한다. 본 방법은 환자를 위한 약물의 적절한 선택에 관해 알려주기 위해, 및 중증 약물 유도성 (또는 약물 관련) 유해 사례의 위험이 있는, 특히, 그의 위험이 높은 환자를 확인하기 위해, 특정 유전자 변이체에서의 환자의 유전자형에 대한 정보를 단독으로, 또는 다른 유전 인자 또는 비유전자 인자, 예컨대, 연령, 성별, 인종, 동반이환, 진단 등과 함께 조합하여 사용한다.
ATP 결합 카세트 B1 (
ABCB1
) (
MCR1로도
공지)
뇌 중 모르핀의 농도는 혈액 뇌 장벽의 P-당단백질 수송체인, ABCB1에 의해 영향을 받는다. ABCB1의 다형성인 3435C>T는 성인에서 모르핀의 혈액 뇌 장벽 수송 활성과 연관이 있고, 동형접합성 TT 유전자형은 다른 유전자형보다도 더 높은 최대 CSF 모르핀 농도와 연관이 있었다 (문헌 [Meineke, I. et al., British Journal of Clinical Pharmacology, 54:592-603 (2002)]). 앞서, 같은 ABCB1 다형성인 3435C>T는 또 다른 오피오이드, 펜타닐을 받은 한국인 성인에서의 호흡 억제 증가와 연관이 있었지만 (문헌 [Park, H. et al., Clin . Pharmacol . Ther ., 81:539-546 (2007)]), ABCB1 변이체가 아동에서의 모르핀 유도성 호흡 억제와 연관이 있는지 여부는 실시예 7에 상세하게 기술되어 있는 연구 이전에는 공지된 바 없었다. 상기 실시예에 기술되어 있는 바와 같이, ABCB1 rs9282564는 백인 및 흑인 아동, 둘 모두에서 호흡 억제에 기인하는 장기간 PACU 체류와 강력한 연관성을 가지고 있었다 (어떤 인종 특이 효과도 검출되지는 않았다). 따라서, ABCB1 rs9282564 GG 동형접합체는 호흡 억제 위험을 증가시키고, 이로써, 병원 체류 기간을 연장시킨다. 상기 연구에서는 ABCB1 rs2229109와, PACU에서 구제 용량의 모르핀을 필요로 한 아동에서의 수술 후 모르핀 용량 사이에 또 다른 임상적으로 관련된 연관성이 관찰되었다. ABCB1 rs2229109의 소수의 대립유전자 (A)의 각 추가 카피는 수술 후 모르핀 용량을 0.04 mg/kg만큼 감소시켰다 (95% CI: 0.01-0.07). 따라서, 수술 후 진통제 개입이 요구되었을 때, ABCB1 rs2229109 CC 동형접합체는 더 많은 모르핀을 필요로 한 반면, AA 유전자형을 가진 아동은 모르핀에 대하여 더 감수성이고,더 적은 양을 필요로 한다.
ABCC3
소관 다중특이성 유기 음이온 수송체 2는 간세포의 기저측 표면에서 주로 발현되는 ABCC3 유전자에 의해 코딩되고 (문헌 [Scheffer, G., et al., Lab Invest., 82:193-201 (2002)), 모르핀의 활성 대사산물인, M3G 및 M6G을 비롯한, 글루쿠로니드에 대하여 높은 친화성을 가지는 것으로 보고되었다 (문헌 [Zelcer, N. et al., Proc. Natl . Acad . Sci . U.S.A ., 102:7274-9 (2005)]). 가정컨대, 핵 단백질의, 유전자의 프로모터 영역에의 결합 감소에 기인하여, CC 유전자형보다 -211C>T TT 유전자형을 가지는 대상체가 간 조직에서 감소된 mRNA 발현을 가지는 것으로 보고되었다 (문헌 [Lang, T. et al., Pharmacogenetics, 14:155-64 (2004)]; [Gradhand, U. et al., Life Sci ., 80:1490-4 (2007)]). 실시예 2에 상세하게 기술되어 있는 바와 같이, ABCC3 rs4793665에서 C/C 유전자형을 가지는 아동은 모르핀의 두 활성 대사산물의 형성이 41 내지 46% 더 높았고, 이는 상기 유전자형이 모르핀의 약동학적 성질에 상당한 영향을 미친다는 것을 시사하며, 상기 유전자형은 백인에서 더 빈번하게 존재하기 때문에, 흑인과 비교하였을 때, 백인에서 모르핀 제거가 더 낮고, 모르핀과 관련된 역효과의 발생률이 더 높은 것에 관한 가능한 설명을 한다. 실시예 3에서 논의되는 바와 같이, ABCC3 rs4793665의 약동학적 효과가 확인되었고, 상당한 약동학적 효과가 있는 또 다른 ABCC3 변이체가 확인되었다. 다른 유전자형과 비교하였을 때, ABCC3 rs4148412 AA 유전자형 또한 모르핀의 활성 대사산물의 형성이 더 높은 것과 연관이 있는 것으로 나타났다. 추가로, 다수의 ABCC3 변이체가 유해 사례 (예컨대, 수술 후 오심 및 구토 및 호흡 억제에 기인하는 회복실에의 장기간 체류)를 비롯한 임상 결과 및 전체 모르핀 요구량과 유의적인 연관성이 있는 것으로 확인되었다. 이는 예를 들어, ABCC3 rs4148412, rs739923, 및 kgp8560677을 포함한다. 다른 것은 실시예 3에 기술되어 있다.
지방산 아미드 가수분해효소 (
FAAH
)
지방산 아미드 가수분해효소 (FAAH)는 아난다미드 이화작용을 담당하는 엔도칸나비노이드 시스템의 일부이다. FAAH는 CB1 수용체에 대한 내인성 효능제로서 아난다미드를 분해한다. 칸나비노이드 효능제는 CB1 수용체를 통한 오피오이드에 대해 효과적인 항구토제이다. 실시예 1에 상세하게 기술되어 있는 바와 같이, 백인 환자에서 PONV와 3개의 SNP (rs324420, rs2295632 및 kgp12517369) 사이에, 및 전체 모르핀 용량과 rs647325 사이에 유의적인 연관성이 검출되었다. 그러나, 흑인 환자에서는 상기 결과 중 임의의 것에 대해 오직 명목상의 연관성만이 검출되었다. 백인에서, FAAH rs4141964, FAAH rs3766246, FAAH rs324420, FAAH rs2295632 및 FAAH kgp12517369의 소수의 1 카피의 소수의 대립유전자 부가는 PONV의 오즈를 각각 2.42배, 2.42배, 2.73배, 2.61배 및 2.61배 만큼 증가시켰다 (P<0.0018). 1 카피의 소수의 대립유전자 (A) 부가는 오즈비 (odds ratio) (를 2.0배 증가시켰는 바, FAAH rs324420은 PONV와 유의적인 연관성이 있었고 (P = 0.0053); 이는 또한 1 카피의 소수의 대립유전자 (A) 부가는 오즈비를 2.2배 증가시켰는 바, PONV과 연관성이 있었고, 이로써, PACU 체류는 장기화되었다 (P = 0.0209). 실시예 3에서 논의되는 바와 같이, FAAH rs324420과 PONV의 강력한 연관성은 더 큰 샘플을 이용하여 추가로 입증되었다.
오피오이드 수용체
μ1
(
OPRM1
)
오피오이드 수용체 뮤 1 (OPRM1)을 코딩하는 오피오이드 수용체 뮤 1 유전자는 오피오이드에 대한 반응 및 통증 지각 변동에 대한 후보 유전자일 수 있다 (문헌 [Mogil, J. Proc . Natl . Adac . Sci . U.S.A ., 96:7744-51 (1999)]). OPRM1 rs1799971 (A118G)은 뇌에서 μ-수용체 결합능을 감소시킨다 (문헌 [Ray, R. et al., Proc . Natl . Acad . Sci . U.S.A ., 108:9268-73 (2011)]). GG 동형접합성 유전자형을 가지는 성인 보인자는 AA 변이체보다 최대 2-4배 더 높은 용량의 모르핀을 요구할 수 있다. 실시예 4에는 AG/GG 유전자형의 보인자와 비교하였을 때, OPRM1 AA 유전자형 보인자는 모르핀을 덜 요구한다는 점에도 불구하고, 호흡 억제 위험은 OPRM1 AA 유전자형에서 더 높고, 추가로, G 대립유전자의 존재가 보호 효과가 있다는 것을을 보여주는 제1 전향적 임상 시험이 기술되어 있다. 이러한 연관성은 호흡 억제 위험이 더 높은 아동을 확인하는 데, 및 중증 유해 사례의 가능성을 최소화하면서, 통증 완하를 최대화시키기 위해 아동에서의 모르핀 사용을 개인 맞춤화하는 데 유용하다.
OCT1
OCT1의 기질인 모르핀의 특징이 잘 규명되어 있기는 하지만, 실시예 2에 기술된 바와 같이, 그의 활성 대사산물 흡수에서의 OCT1의 역할에 대해서는 이전에 공지된 바 없었다. 실시예 2에 제시된 결과는 OCT1이 모르핀 제거에 미치는 효과가 현재 16%로 추정되는 것보다 훨씬 더 클 수 있다는 것을 시사하며, 이는 동형접합성 대상체가 모르핀 투약에 대한 반응으로 더 우수한 진통제를 경험하지만, 더욱 악화된 유해 반응을 경험하게 될 것이라는 것을 의미한다.
폐쇄성
수면 무호흡증
(OSA)
폐쇄성 수면 무호흡증 (OSA)은 흑인 환자에게 과도하게 나타나며, 상기 환자는 결국 부적절한 통증 완화의 위험이 더 높을 가능성이 더 크다. 따라서, OSA 및 인종은 중요한 공변량을 나타내며; 이는 ADRB2 및 FAAH 유전자 다형성이 비교적 정확하게 인종을 예측 (예측 정확도 ~80%)하는 데 사용될 수 있다는 결과에 의해 추가로 강조된다. OSA 그 자체도 또한, 비록 이해가 불충분하지만, 비교적 강력한 유전 성분을 가지는 것으로 보인다 (문헌 [Larkin, E. et al. Resp . Crit . Care Med . 182:947-53 (2010)]). OSA는 또한 편도 절제술에 대한 적응증이다.
성별
다수의 임상전 및 실험 연구를 통해 설치류 수컷과 암컷 사이의 통증 조절에서의 차이, 및 여성에서 통증 및 오피오이드 감수성 증가에 의한 성인 인간에서의 차이가 나타났지만, 수술 후 통증 및 성별 차이를 조사한 임상 시험은 일관되지 않는다. 또한, 성인 인간 시험으로부터 얻은 오피오이드 진통제와 관련된 성별 차이에 따른 데이터는 신뢰할 수 있을 정도로 소아를 위한 임상 실시를 가이드하기에는 충분하지 않다 (문헌 [Hurley R. and Adams M. Anesth . Analg ., 107:309-17 (2008)]). 실시예 6에서 상세하게 논의되는 바와 같이, 수술 후 오심 및 구토 (PONV, p=0.001) 및 PONV에 기인하는 장기간 PACU 체류 (p=0.010)에서 유의적인 성별 특이적인 효과가 있는 것이 검출되었다. 여아에서, 상기와 같은 역효과가 발생할 확률은 전체 모르핀 용량이 증가함에 따라 증가하였다.
마커
및
일배체형에
대한 평가
특이 다형성 마커 및/또는 일배체형 검출은 다형성 부위의 서열을 검출하는 당업계에 공지된 방법에 의해 달성될 수 있다. 예를 들어, PCR, LCR, 네스티드(Nested) PCR, 및 핵산을 증폭시키는 다른 기법을 이용하는, SNP 및/또는 미소부수체 마커의 존재에 대하여 유전자형 분석하는 표준 기법, 예컨대, 형광 기반 기법이 사용될 수 있다 (예컨대, 문헌 [Chen, X. et al., Genome Res. 9(5): 492-98 (1999)]; [Kutyavin et al., Nucleic Acid Res. 34:e128 (2006)]). SNP 유전자형을 분석하는 데 상업적으로 이용가능한 구체적인 방법으로는 택맨(TaqMan) 유전자형 분석 검정법 및 SNP렉스(SNPlex) 플랫폼 (어플라이드 바이오시스템즈(Applied Biosystems)), 겔 전기영동 (어플라이드 바이오시스템즈), 질량 분석법 (예컨대, 시쿼넘(Sequenom)으로부터의 매스어레이(MassARRAY) 시스템), 미니서열분석 방법, 실시간 PCR, 바이오-플렉스(Bio-Plex) 시스템 (바이오래드(BioRad)), CEQ 및 SNP트림(SNPtream) 시스템 (베크만(Beckman)), 어레이 하이브리드화 기술 (예컨대, 어피메트릭스 진칩(Affymetrix GeneChip); 펄리전(Perlegen)), 비드어레이 테크놀러지즈(BeadArray Technologies) (예컨대, 일루미나 골든게이트(Illumina GoldenGate) 및 인피니움(Infinium) 검정법), 어레이 태그 기술 (예컨대, 패러렐(Parallele)), 및 엔도뉴클레아제-기반 형광 하이브리드화 기술 (인베이더(Invader); 써드 웨이브(Third Wave))을 포함하나, 이에 제한되지 않는다. 따라서, 상기 방법 또는 당업자에게 이용가능한 다른 방법을 사용함으로써, 미소부수체, SNP, 또는 다른 유형의 다형성 마커를 비롯한 다형성 마커에서의 하나 이상의 대립유전자를 확인할 수 있다.
질환 또는 소질에 대한 감수성이 증가된 (즉, 위험이 증가된) 개체는 질환 또는 소질에 대한 증가된 감수성 (증가된 위험)을 부여하는 하나 이상의 다형성 마커 또는 일배체형 (즉, 위험 마커 대립유전자 또는 일배체형)에서 1개 이상의 특이 대립유전자가 확인되는 개체이다. 위험 마커 또는 일배체형은 질환에 대하여 증가된 위험 (증가된 감수성)을 부여하는 것이다. 일부 실시양태에서, 마커 또는 일배체형과 연관된 유의도는 상대적 위험도 (RR)에 의해 측정된다. 일부 실시양태에서, 마커 또는 일배체형과 연관된 유의도는 오즈비 (OR)에 의해 측정된다. 추가의 실시양태에서, 유의도는 비율(%)에 의해 측정된다.
본원에 기술된 바와 같은 위험 다형성 마커 또는 일배체형은, 1개 이상의 마커 또는 일배체형의 1개 이상의 대립유전자가 비교군 (대조군)에서의 그의 존재 빈도와 비교하였을 때, 소질의 위험이 있는, 예를 들어, 특히, 수술 전후의 통증에 대해 치료하는 동안 진통제, 특히, 오피오이드로부터의 부적절한 통증 완화 또는 역효과 (예컨대, 불응성일 수 있는 수술 후 오심 및 구토, 호흡 억제, 및 호흡 억제에 기인하는 회복실에의 장기간 체류)의 위험이 있는 개체에 더욱 빈번하게 존재하는 것이고, 이로써, 상기 마커 또는 일배체형이 존재한다면, 이는 소질에 대하여 감수성이라는 것을 시사한다. 일부 실시양태에서, 대조군은 집단 샘플, 즉, 일반 집단으로부터의 무작위 샘플일 수 있다. 일부 실시양태에서, 대조군은 하나 이상의 추가의 비유전적 위험 인자, 예를 들어 성별, 연령, 및 인종의 부재를 특징으로 한다. 일부 실시양태에서, 위험 인자는 1개 이상의 추가의 유전적 위험 인자를 포함한다.
본 발명의 일부 실시양태에서, 소질에 대한 감수성이 감소된 (즉, 위험이 감소된) 개체는 감소된 감수성을 부여하는 하나 이상의 다형성 마커 또는 일배체형에서 1개 이상의 특이 대립유전자가 확인되는 개체이다. 감소된 위험을 부여하는 마커 대립유전자 및/또는 일배체형 또한 보호성인 것으로 불린다. 일부 실시양태에서, 보호 마커 또는 일배체형은 소질에 대하여 유의적으로 감소된 위험 (또는 감수성)을 부여하는 것이다.
당업자는 연구된 집단에 존재하는 두 대립유전자를 갖는 마커 (예컨대, SNP)에 대해, 및 하나의 대립유전자가 상기 집단 내에서 소질을 갖는 개체의 군에서 대조군 대비 증가된 빈도로 발견되는 경우, 상기 마커의 나머지 다른 대립유전자는 상기 소질을 갖는 개체의 군에서 대조군 대비 감소된 빈도로 발견될 것이라는 것을 이해할 것이다. 그러한 경우에서, 상기 마커의 하나의 대립유전자 (상기 소질을 갖는 개체에서 증가된 빈도로 발견되는 대립유전자)는 위험 대립유전자이고, 나머지 다른 대립유전자는 보호성 대립유전자(일 것이다.
소질과 연관된 유전자 변이체는 주어진 유전자형에 대한 질환의 위험도를 예측하는 데 단독으로 이용될 수 있다. 예컨대, SNP와 같은 이대립유전자 마커의 경우, 위험 변이체에 대한 동형접합체, 이형접합체, 및 위험 변이체의 비보인자(non-carrier)인 3개의 가능한 유전자형이 존재한다. 다중 유전자좌에서의 변이체와 연관된 위험도는 전체 위험도를 추정하는 데 이용될 수 있다. 다중 SNP 변이체의 경우, k개의 가능한 유전자형이 존재하며, 여기서, k = 3 n x 2 p 이고; 여기서, n은 상염색체 유전자좌의 개수이고, p는 성염색체(gonosomal) (성 염색체(sex chromosomal)) 유전자좌의 개수이다. 복수 개의 위험 변이체에 대한 전체 위험도 평가 계산은 전형적으로 상이한 유전자 변이체의 상대적 위험도를 곱하는 것, 즉, 특정한 유전자형 조합과 연관된 전체 위험도 (예컨대, RR 또는 OR)는 각 유전자좌의 유전자형에 대한 위험도 값의 곱이라고 가정한다. 제시된 위험도가 매칭된 성별 및 인종을 갖는 참조 집단과 비교하였을 때, 개인, 또는 개인에 대한 특이적인 유전자형에 대한 상대적 위험도인 경우, 이때 조합 위험도는 유전자좌-특이 위험도 값의 곱이고, 이는 또한 집단에 대해 상대적인 전체 위험도 추정치에 상응한다. 개인에 대한 위험도가 위험 대립유전자의 비보인자와의 비교에 기초한 경우, 이때 조합 위험도는 모든 유전자좌의 유전자형의 주어진 조합을 갖는 개인을 상기 유전자좌 중 어느 것에서도 위험 변이체를 보유하지 않는 개체 군과 비교하는 추정치에 상응한다. 임의의 위험 변이체의 비보인자 군은 추정된 위험도가 가장 낮고, 그 자체(즉, 비보인자)와 비교하여 1.0의 조합 위험도를 가지지만, 집단과 비교하였을 때에는 1.0 미만의 전체 위험도를 가진다. 비보인자 군은 잠재적으로 매우 작을 수 있고, 특히, 다수의 유전자좌에 대해 매우 작을 수 있으며, 그러한 경우, 그의 관련성은 그만큼 작다는 것에 주의하여야 한다.
승법 모델은 일반적으로 복합 소질의 데이터에 합리적으로 잘 맞는 간명(parsimonious) 모델이다. 승법성(multiplicity)으로부터의 편향은 일반적인 질환에 대한 일반적인 변이체와 관련해서는 드물게 설명되었으며, 보고된 경우에도, 단지 제안적인 것에 불과하며, 이는 전형적으로는 유전자좌 간의 통계적 상호작용을 입증할 수 있기 위해서는 매우 큰 표본 크기가 요구되기 때문이다.
예를 들어, 전립선암과 연관된 것으로 기술된 총 8개의 변이체를 고려한다 (문헌 [Gudmundsson, et al., Nat Genet 39:631-7 (2007)]; [Gudmundsson, et al., Nat Genet 39:977-83 (2007)]; [Yeager, et al., Nat Genet 39:645-49 (2007)]; [Amundadottir, et al., Nat Genet 38:652-8 (2006)]; [Haiman, et al., Nat Genet 39:638-44 (2007)]). 상기 유전자좌들 중 7개는 상염색체 상에 존재하고, 나머지 유전자좌는 염색체 X에 존재한다. 이때, 이론적인 유전자형 조합의 총 개수는 37 x 21 = 4,374이다. 상기 유전자형 부류 중 일부는 매우 희귀하지만, 이는 여전히 가능한 것이고, 이는 전체 위험도 평가를 위해 고려될 수 있다. 다중 유전자 변이체의 경우에 적용된 승법 모델은 또한, 상기 유전자 변이체가 "환경적" 인자와 명백하게 상관관계가 없다고 가정할 때, 비유전적 위험 변이체와의 결합시에 유효할 수 있다. 다시 말하면, 비유전적 위험 인자와 유전적 위험 인자가 상호작용하지 않는다고 가정할 때, 유전적 위험 변이체 및 비유전적 위험 변이체는 조합 위험도를 추정하기 위해 승법 모델하에 평가될 수 있다.
동일한 정량적 접근법을 이용하여, 본원에 개시된 마커 및/또는 다형성, 또는 그와 연관 비평형인 마커들 중 어느 하나의 조합을 비롯한, 유해한 마취 효과와 연관된 복수 개의 변이체와 관련된 조합 위험도 또는 전체 위험도를 평가할 수 있다.
위험도 계산
전체 유전적 위험도 계산을 위한 모델 생성은 2 단계: i) 단일 유전자 변이체에 대한 오즈비를 상대적 위험도로 전환시키는 단계, 및 ii) 상이한 유전적 유전자좌 중의 다중 변이체로부터의 위험도를 단일 상대적 위험도 값으로 조합하는 단계를 포함한다.
오즈비로부터의
위험도 유도
현재까지 권위 있는 저널에 발표된 복합 질환 또는 소질에 대한 대부분의 유전자 발견 연구는 그의 소급적 설정에 기인하여 사례-대조군 디자인을 사용하였다. 이 연구들은 선택된 사례 세트 (특정된 질환 병태를 앓는 개인) 및 대조군 개체를 샘플링하고, 유전자형을 분석한다. 사례와 대조군에서의 그의 빈도가 유의적으로 상이한 유전자 변이체 (대립유전자)가 관심의 대상이 된다.
결과는 전형적으로, 환자군 대 대조군에서 위험 변이체를 가지는 것 (보인자)의 분율 (확률) 대 비위험 변이체를 가지는 것 (비보인자)의 분율 간의 비를 기술하는 오즈비로 보고되고, 즉, 질병 상태 조건부 확률로 표현된다:
OR=(Pr(c|A)/Pr(nc|A))/(Pr(c|C)/Pr(nc|C)).
일부 실시양태에서, 질환 또는 소질에 대한 절대 위험도, 즉, 질환에 걸린, 위험 변이체를 보유하는 개체의 분율, 또는 다시 말해, 그 질환에 걸릴 확률이 측정된다. 부분적으로 사례 대 대조군의 비가 전형적으로 일반 집단에서의 것과 동일하지 않기 때문에, 이 수치는 사례-대조군 연구에서 직접적으로 측정될 수 없다. 그러나, 특정한 가정 하에, 오즈비 값으로부터 위험도를 계산할 수 있다.
다중
마커로부터의
위험도 조합
다수의 SNP 변이체의 유전자형을 사용하여 개체에 대한 위험도를 추정할 때, 달리 언급되지 않는 한, 위험도에 대한 승법 모델이 가정될 수 있다. 이는 집단 대비 조합된 유전적 위험도는 개별적인 마커, 예를 들어, 2개의 마커 g1 및 g2에 대한 상응하는 추정치의 곱으로 계산된다:
RR(g1,g2)=RR(g1)RR(g2).
기본적인 가정은 위험 인자가 독립적으로 일어나고 행동한다는 것, 즉, 결합 조건부 확률이 곱으로 표현될 수 있다는 것이다:
Pr(A|g1,g2)=Pr(A|g1)Pr(A|g2)/Pr(A) 및 Pr(g1,g2)=Pr(g1)Pr(g2).
마커가 게놈 상에 가깝게 이격되어 있는, 즉, 연관 비평형에 있고, 이로써, 2개 이상의 위험 대립유전자의 동시 발생이 상관관계에 있는 실시양태에서, 오즈비가 상관관계에 있는 SNP의 모든 대립유전자 조합에 대하여 정의되어 있는 일배체형 모델링이 사용될 수 있다.
한 예로서, 각 마커에서의 집단에 상대적인 위험과 함께, 2형 당뇨병의 위험과 연관된 4가지 마커에서 하기 유전자형을 가지는 개체를 고려해 보면::
크로모(Chromo ) 3 PPARG CC 계산된 위험도: RR(CC)=1.03
크로모 6 CDKAL1 GG 계산된 위험도: RR(GG)=1.30
크로모 9 CDKN2A AG 계산된 위험도: RR(AG)=0.88
크로모 11 TCF7L2 TT 계산된 위험도: RR(TT)=1.54.
조합하면, 집단에 상대적인 각 개체에 대한 전체 위험도는 1.03 x 1.30 x 0.88 x 1.54 = 1.81이다.
위험도 평가
본 발명의 실시양태는 개체로부터의 게놈 DNA를 포함하는 샘플을 본원에 개술된 변이체 존재가 특히, 구체적으로 오피오이드 및 모르핀인 약물 유해 반응과 연관이 있는 것으로 평가하는 방법에 관한 것이다. 상기 방법은 전형적으로 당업자에게 널리 공지되고, 추가로 본원에 기술된 방법을 사용하여, 및 평가 결과에 기초하여, 1개 이상의 다형성 마커의 1개 이상의 대립유전자의 존재 또는 부재를 검출하는 단계, 샘플의 유래가 되는 개체가 마취제의 유해 효과의 위험이 증가되어 있는지 또는 감소되어 있는지 (감수성이 증가 또는 감소되어 있는지) 측정하는 단계를 포함한다. 일부 실시양태에서, 다형성 마커의 특정 대립유전자를 검출하는 것은 1개 이상의 다형성 마커의 1개 이상의 대립유전자를 확인하는 특정 인간 개체에 대한 핵선 서열 데이터를 수득함으로써 수행될 수 있다. 1개 이상의 마커의 상이한 대립유전자는 인간에서 상기 효과에 대한 상이한 감수성과 연관이 있다. 핵산 서열 데이터를 수득하는 것은 단일 뉴클레오티드 위치에서 핵산 서열을 확인하는 것을 포함할 수 있으며, 이는 SNP에서 대립유전자를 확인하는 데 충분하다. 핵산 서열 데이터는 또한 임의의 다른 번호의 뉴클레오티드 위치에서의 서열 정보를, 특히, 다중 뉴클레오티드 위치를 포함하는 유전자 마커에 대한 것을 포함할 수 있고, 이는 2개의 뉴클레오티드 내지 수십만 개, 가능하게는 심지어, 수백만 개 (특히, CNV인 경우)의 뉴클레오티드 사이의 어느 위치에 있을 수 있다.
일부 실시양태에서, 본 방법은 질환 또는 소질과 연관된 1개 이상의 다형성 마커 (또는 질환 또는 소질과 연관된 1개 이상의 마커와 연관 비평형인 마커)의 유전자형 상태에 대한 정보를 포함하는 데이터세트를 사용하는 것을 포함한다. 다시 말해, 예를 들어, 서열 데이터, 특정의 한 다형성 마커, 또는 복수 개의 마커에서의 유전자형 계수 (예컨대, 특정 위험 대립유전자의 존재 또는 부재 표시), 또는 하나 이상의 마커에 대한 실제 유전자형인 형태로 상기 유전적 상태에 대한 정보를 포함하는 데이터세트는 본원에 개시된 특정 다형성 마커에의 특정 위험 대립유전자의 존재 또는 부재가 질환 또는 소질와 연관이 있는 것으로 질의될 수 있다. 질환 또는 소질과 연관된 변이체 (예컨대, 마커 대립유전자)에 대한 양성 결과는 데이터세트의 유래 기점이 되는 개체가 질환에 대한 감수성이 증가되어 있음 (그의 위험이 증가되어 있음)을 나타낸다.
일부 실시양태에서, 다형성의 1개 이상의 대립유전자와 질환 사이의 상관관계를 포함하는 순람표를 통해 다형성 마커에 대한 유전자형 데이터를 참조함으로써 다형성 마커를 질환 또는 소질과 서로 관련시킨다. 일부 실시양태에서, 상기 순람표는 한 다형성에 대한 상관관계를 포함한다. 일부 실시양태에서, 상기 순람표는 복수 개의 다형성에 대한 상관관계를 포함한다. 마커와 질환 사이의 상관관계를 나타내는 순람표를 통해 참조함으로써, 샘플 유래가 된 개체에서의 질환 또는 소질에 대한 위험, 또는 질환 또는 소질에 대한 감수성을 확인할 수 있다. 일부 실시양태에서, 상관관계는 통계학적 척도로서 기록된다. 통계학적 척도는 위험 척도로서, 예컨대, 상대적 위험도 (RR), 절대적 위험도 (AR), 또는 오즈비 (OR)로서 기록될 수 있다.
본원에 기술된 마커는 단독으로 또는 조합으로 위험도 평가에 및 진단 목적에 유용할 수 있다. 본원에 기술된 마커에 기초한 유해한 마취 효과를 앓을 수 있는 위험도 결과는 또한 유해한 마취 효과에 대한 다른 유전자 마커 또는 위험 인자에 대한 데이터와 조합될 수 있고, 이로써, 전체 위험도를 확립할 수 있다. 따라서, 심지어 개별 마커에 의해 위험 증가가 예컨대, 대략 10-30%로 비교적 별로 크지 않은 경우에도, 연관성은 유의적인 밀접한 관련성을 가질 수 있다. 따라서, 비교적 일반적인 변이체가 전체 위험도에 유의적으로 기여할 수 있거나 (집단 귀속성 위험은 높다), 마커의 조합은 마커의 조합된 위험도에 기초하여 유해한 마취 효과에 기인한 합병증이 발생할 조합된 위험이 유의적인 개체 군을 정의하는 데 사용될 수 있다.
따라서, 일부 실시양태에서, 복수 개의 변이체 (유전자 마커, 바이오마커, 및/또는 일배체형)는 전체 위험도 평가에 사용된다. 일부 실시양태에서, 상기 변이체는 본원에 개시된 변이체로부터 선택될 수 있다. 일부 실시양태에서, 유해한 마취 효과에 대한 감수성을 진단하는 데 유용한 것으로 알려져 있는 다른 변이체와 함께 조합하여 본원에 개시된 변이체를 사용하는 것이 이용된다. 상기 실시양태에서, 복수 개의 마커 및/또는 일배체형의 유전자형 상태는 개체에서 측정되고, 개체의 상태는 임상적으로 건강한 대상체, 예컨대, 연령 매칭된 및 성별 매칭된 대상체에서 연관성이 있는 변이체의 집단 빈도, 또는 변이체의 빈도와 비교된다. 이어서, 당업계에 공지된 방법, 예컨대, 다변량 분석 또는 공동 위험 분석 또는 당업자에 공지된 다른 방법을 이용하여 다중 유전자좌에의 유전자형 상태에 기초하여 부여된 전체 위험도를 측정한다. 이어서, 상기 분석에 기초한 위험도 평가는 본원에 기술된 바와 같은, 본 발명의 방법, 용도, 및 키트에서 사용될 수 있다.
유해한 마취 효과를 앓는 것에 대한 위험 변이체가 동형접합성인 개체는 상기 효과가 발생할 수 있는 위험이 특히 높을 수 있다. 이는 위험 대립유전자의 용량 의존적 효과에 기인하고, 이로써, 동형접합성 보인자에 대한 위험은 일반적으로 각 대립유전자 카피에 대한 위험도의 제곱값으로서 추정된다.
본원에 기술된 SNP 마커의 경우, 환자에서 과도하게 존재하는 것으로 밝혀진 대립유전자 (위험 대립유전자)에 대한 반대 대립유전자는 마취제 및 진통제로부터의 역효과가 관찰되는 상황에서는 빈도가 감소된 것으로 관찰된다. 따라서, LD이고/거나, 또는 연령, 인종 체중 (또는 체질량 지수, BMI)을 비롯한 다른 인자와 함께 상기 마커를 포함하는 이들 마커 및 일배체형은 유해한 마취제 및 진통제 효과에 대하여 보호성을 띠며, 즉, 이는 마취체 및 진통제로부터의 통증 및/또는 역효과를 발생시키는 상기 마커 및/또는 일배체형을 보유하는 개체의 감소된 위험 또는 감수성을 부여한다.
일부 실시양태에서, 특정 일배체형을 비롯한 본원에 개시된 바와 같은 변이체은 각종 유전자 마커, 예컨대, SNP 및 미소부수체의 조합을 포함할 수 있다. 일배체형 검출은 당업계에 공지 및/또는 본원에 기술된, 다형성 부위의 서열을 검출하는 방법에 의해 달성될 수 있다. 추가로, 특정 일배체형 또는 마커 세트와 질환 표현형 사이의 상관관계는 표준 기법을 사용하여 입증될 수 있다. 상관관계에 대한 단순 검정의 대표적인 예는 2 x 2 형식의 표 상의 피셔 정확 검정이 될 것이다.
예측 모델
결정 수형도는 결정 지원 시스템을 위한, 쉽게 해석가능하고, 직관적인 규칙을 유도하는 데 사용될 수 있는, 다변량 데이터 분석 및 분류를 위한 표준 머신 러닝 기법이다. 결정 수형도는 재귀 분할 접근법로으로서 간주될 수 있으며, 여기서, 데이터는 단순 논리 규칙에 의해 계층으로 계층적으로 나뉜다. 결정 수형도의 장점은 그의 간단함, 카테고리별 및 수치 변수 뿐만 아니라, 결측값을 처리할 수 있는 능력, 이상점 및 스케일링에 대한 견고성, 및 특징 선택을 계층화 및 분류와 조합할 수 있는 능력이다. 결정 수형도는 또한 결정 지원 시스템을 위한, 쉽게 해석가능하고, 직관적인 규칙을 유도하는 데에도 사용될 수 있다.
결정 수형도는 가장 예측성이 큰 SNP를 선택하고, 그를 인구 통계, 임상적, 및 다른 입력 특징과 함께, 환자를 분류하고, 역효과를 예측하는 데 사용될 수 있는 단순 논리 규칙으로 조합함으로써, 부적절한 통증 완화 및 오피오이드 관련 역효과에 대한 견고하고, 정확한 현장 진단 예측이 이루어지도록 하는 데 사용된다. 상기 지식 정보를 통해 개별화된 치료를 할 수 있다.
관찰된 상이한 계층 및 복잡한 상호작용 패턴을 통해서 예컨대, 오피오이드 수송, 감지, 및 대사에 관여하는 것과 같은, 유전자의 특이 다형성의 상호작용이 아동에서 모르핀의 역효과에 유의적인 영향을 미치는지 여부를 체계적으로 측정한다. 현 접근법에는 한계가 있기 때문에, 개인 맞춤형 개입을 위해 더욱 견고하고, 정확한 결정 규칙을 제공할 수 있는 적합화된 해결안 및 확장이 요구된다.
먼저 표준 재귀 분할 (또는 결정 수형도 기반) 접근법, 예컨대, CART를 사용하여 역효과, 통증 감수성, 및 다른 임상적 표현형과 관련하여 유전자 대 유전자 사이의 상호작용의 특이적인 패턴과 연관된 상이한 계층을 확인하고, 분석하였다. 이어서, 유전자형 분석, 인구 통계, 및 관련 임상적 데이터를 조합하여 오피오이드 유도성 호흡 억제 결과를 비롯한, 역효과의 위험이 높은 환자 대 낮은 환자를 예측하기 위한 논리 규칙을 유도하였다. 상기 모델의 예측력은 고유한 생물학적 잡음, 제한된 샘플 크기, 및 분자 변이를 유도하고, 결국에는 임상 결과를 유도할 수 있는 다중 기전을 나타내는 복잡한 상호작용 패턴에 의해 제한된다. 오직 특정 계층과 관련해서만 나타낼 수 있는 더 약한 연관성 또한 존재할 수 있지만, 이는 검출하기는 더 어렵다.
결정 수형도 및 연관된 논리 법칙은 대립유전자 (상가), 우성, 및 열성 모델 뿐만 아니라, 분리된 각 유형자형 값 또한 실행을 통해 상이한 계층의 확인 및 분석을 용이하게 하는 삼진 수형도에 의해 증강되었다. 추가로, 페이스(Phase) 및 유사 집단 기반 모델을 사용하여 각 유전자에 대한 일배체형 재구성 (본원에 포함된 수개의 유전자에 대하여 LD의 강력한 패턴이 관찰된다)을 도입하였고, 이로써, 결정 규칙을 단순화하고, 데이터에서 관찰되는 다수의 내포된 상호작용을 설명할 수 있었다. 분류 결정 수형도, 서포트 벡터 머신 (SVM), 및 엑스퍼트의 계층적 혼합 (HME) 모델을 통합하였다.
HME 접근법은 확률적 결정 수형도로서 간주될 수 있다 (문헌 [Hasti et al., chapter 9] 및 상기 문헌 내의 참고 문헌). 예시적인 HME 결정 수형도에서, 단말 노드는 반응 (예컨대, 역효과)을 개별적으로 (및 콘텍스트 의존적으로) 예측하는 "엑스퍼트" (또는 엑스퍼트 네트워크)로 불린다. 상기 개별 예측은 비단말 노드의 결정 모델 ("게이팅 네트워크")에 의해 조합된다. 전형적으로, 유전자 및 다른 예측인자의 함수로서 객관적 수술 후 통증 점수 (P)에 대한 하기 모델에서와 같이 입력의 선형 조합을 사용하여 각 단말 노드에서 선형 또는 로지스틱 회귀 모델을 피팅한다:
E(P|X) =
β0
+
β1연령
+
β2성별
+
β3인종
+
β4GCH1
+
β5COMT
+
β6ABCB1
+ 다른 인자
상기 식에서, E(Y|X)는, 예측인자 변수 (특징)의 벡터를 X라고 가정할 때, 예측값 Y를 나타낸다. 엑스퍼트 모델은 다른 적합한 분류 (또는 회귀) 접근법을 사용하여, 예컨대, 견고한 선형 SVM 예측인자를 사용함으로써 일반화될 수 있다. 상기 접근법에서, 단말 SVM 모델은 콘텍스트에 의존하는 방식으로 최적화된 엑스퍼트 분류기의 앙상블 (적용가능할 경우, 1 클래스 SVM 포함)로서 간주될 수 있다.
이를, 더욱 견고한 결과 및 연관된 신뢰 수준 (앙상블 내에서의 일관성에 의해 정의되는 것)을 제공하기 위해 조합된 (예컨대, 교차 검증과 관련하여) 데이터의 상이한 서브세트로 최적화된 분류기의 앙상블 개발과 비교할 수 있다. 여기서, 표준 결정 수형도를 사용하여 (가능하게는 재샘플링 및 부스팅 또한 사용하여) 수득된 견고한 상이한 계층에 의해 상기 서브세트를 정의하였다. 따라서, 확장된 HME 모델의 수형도 토폴로지가, HME 접근법의 한계들 중 하나, 즉, 우수한 수형도 토폴로지를 찾는 방법의 결여라는 한계를 처리하면서, 원 결정 수형도 분석에서 확인된 안정적인 계층을 나타낼 것으로 기대된다. 그러므로, 생성된 수형도는 정확도는 향상시키면서, 결정 규칙의 해석의 용이성은 보존한다.
뉴럴 네트워크, 프로토타입, 및 커널 기반 접근법을 비롯한, 다른 표준 통계학적 방법 및 머신 러닝 방법 또한 적용하여 유전자 대 유전자의 상호작용의 패턴을 추가로 분석하고, 그의 예측력을 평가하였다 (그리고, 새로운 접근법의 상대적인 이점을 평가하였다). 전체 훈련 코호트를 반복적으로 (및 무작위적으로) 훈련 및 검증 서브세트로 나누는 교차 검증을 사용하여 생성된 결정 규칙 및 관찰된 계층의 정확도를 평가하고, 그의 안정성을 평가하였다. 전체 분류 정확도, 정밀도, 재현율, 및 ROC 곡선하 면적을 비롯한 정확도 표준 척도를 사용하여 제안된 혼합형 재귀 분할 모델에 기반한 결정 규칙의 정확도를 평가하였다.
어드레스할
수 있는 집단
일반적으로, 본 발명의 방법 및 키트는 임의의 공급원으로부터의 및 임의의 개체로부터의 핵산 물질 (DNA 또는 RNA)을 함유하는 샘플로부터, 또는 상기 샘플로부터 유도된 유전자형 데이터로부터 이용될 수 있다. 일부 실시양태에서, 개체는 인간 개체이다. 개체는 성인, 아동 또는 태아일 수 있다. 핵산 공급원은 생물학적 샘플, 또는 그로부터 유래된 핵산을 포함하는 샘플을 비롯한, 핵산 물질을 포함하는 임의의 샘플일 수 있다. 본 발명의 실시양태는 또한 표적 집단의 구성원인 개체에서 마커 및/또는 일배체형을 평가하는 것을 제공한다. 한 실시양태에서, 상기 표적 집단은 다른 파라미터 예컨대, 예를 들어, 유전 인자, 바이오마커, 생물리학적 파라미터, 마취 관련 합병증의 병력, 마취제에 대한 알레르기 반응, 마취 관련 합병증의 가족력 등에 기초하여, 유해한 마취 효과가 발생할 위험이 있는 개체 집단 또는 군이다.
일부 실시양태에서, 표적 집단은 특정 연령의 서브군, 예컨대, 18세 미만, 16세 미만, 또는 12 또는 10세 미만의 개체를 포함한다. 개체는 남성이든 또는 여성이든, 어느 성별의 개체일 수 있다.
본원에 개시된 유해한 진통제 및/또는 오피오이드 효과와 연관이 있는 것으로 밝혀진 마커는 본 연구에서 사용되는 집단 이외의 다른 인간 집단에서 유사한 연관성을 보일 수 있는 것으로 간주된다. 일부 실시양태에서, 인간 대상체는 하나 이상의 인간 집단 또는 인종 군으로부터의 것으로, 이는 백인 집단, 유럽계 집단, 미국계 집단, 유라시아계 집단, 아시아계 집단, 중미/남미계 집단, 동남아계 집단, 중동계 집단, 흑인 집단, 히스패닉계 집단, 및 오세아니아계 집단을 포함하나, 이에 한정되지 않는다.
개별 대상체에서 인종의 기여도 또한 유전적 분석에 의해 측정할 수 있다. 조상의 유전적 분석은 비연관 미소부수체 마커, 예컨대, 문헌 [Smith et al. (Am J Hum Genet 74, 1001-13 (2004))]에 기술되어 있는 것을 사용하여 수행될 수 있다.
달리 정의되지 않는 한, 본원에서 사용된 기술 용어 및 과학 용어는 본 발명이 속하는 당업계의 숙련가가 통상 이해하는 것과 같은 의미를 가진다. 문헌 [Singleton et al., Dictionary of Microbiology and Molecular Biology 3 rd ed., J. Wiley & Sons (New York, NY 2001)]; [March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 5 th ed., J. Wiley & Sons (New York, NY 2001)]; 및 [Sambrook and Russel, Molecular Cloning: A Laboratory Manual 3 rd ed., Cold Spring Harbor Laboratory Press (Cold Spring Harbor, NY 2001)]은 당업자에게 본 출원에서 사용되는 다수의 용어에 대한 일반 가이드를 제공한다.
당업자는 본원에 기술된 것과 유사하거나, 또는 등가인 다수의 방법 및 물질이 본 발명의 실시에서 사용될 수 있다는 것을 이해할 것이다. 실제로, 본 발명은 어느 방식으로든 기술된 방법 및 물질로 제한되지 않는다.
진단 방법
본 발명의 실시양태에서, 투여된 마취제, 진통제, 및/또는 오피오이드로부터 유발된 역효과와 상관관계가 있는 유전자 마커에서의 특정 대립유전자를 검출하는 단계를 포함하는, 상기 역효과를 앓을 위험이 있는 환자를 평가하거나, 또는 그의 평가를 지원하는 방법을 제공한다. 일부 실시양태에서, 1개 이상의 다형성 마커 (예컨대, 본원에 기술된 마커)의 1개 이상의 대립유전자를 검출하는 단계를 포함하는, 투여된 마취제, 진통제, 및/또는 오피오이드에 대한 역효과의 발생에 대한 감수성을 측정하는 방법을 제공한다. 본원에 개시된 바와 같이, 특정 마커 또는 일배체형의 특정 대립유전자는 투여된 진통제로부터 유발되는 역효과를 앓을 수 있는 것에 대한 감수성을 시사한다. 상기 역효과에 대한 환자의 위험 또는 감수성을 평가하기 위한 예후 또는 예측 검정법 또한 마취제, 진통제, 및/또는 오피오이드의 투여를 포함하는 시술 이전 및 그 동안에 대상체를 위한 맞춤형 마취 프로토콜을 개발하는 데 사용될 수 있다.
일부 실시양태에서, 투여된 마취제, 진통제, 및/또는 오피오이드로부터 유발된 역효과를 앓을 위험이 있는 환자를 확인하는 방법은, 1개 이상의 다형성을 포함하는 것인 마이크로어레이 또는 유전자 칩 기술을 사용하여 통증 지각, 지속성 수술 후/만성 통증, 및/또는 마취제, 진통제, 및/또는 오피오이드 관련 역효과와 연관된 1개 이상의 다형성의 존재 또는 부재에 대하여 샘플을 분석함으로써 수행된다.
일부 실시양태에서, 유전자 칩은 저밀도 어레이를 포함한다.
일부 실시양태에서, 본 방법은 통증 요법 및 마취제를 적합화하고, 마취제 및 진통제 약물 관련 역효과를 최소화하기 위해 추가의 임상적 정보를 평가하는 것을 포함한다. 일부 실시양태에서, 본 방법은 통증 요법 및 오피오이드를 적합화하고, 오피오이드 및 진통제 약물 관련 역효과를 최소화하기 위해 추가의 임상적 정보를 평가하는 것을 포함한다. 상기 방법에서 사용하기 위한 추가의 임상적 정보로는 환자 연령, 인종, 체중 (또는 BMI), 수면 장애 호흡, 성별, 알레르기, 민감도, 또는 전달된 마취제, 진통제, 및/또는 오피오이드에 대한 투여 경로에 영향을 미치는 의학적 병태를 포함하나, 이에 한정되지 않는다. 다른 인자, 예컨대, 예를 들어, 인종, 의학적 병력, 약물 상호작용, 심리적 불안감, 스트레스 수준, 및 생활 방식 또흔 방법의 일부로서 평가될 수 있다.
본 발명의 실시양태는 또한 재귀 분할 및 결정 수형도를 사용하여 유전자형-표현형의 연관성을 분석하고, 유전자와 다른 비유전적 변수 사이의 상이한 상호작용 패턴을 이용하여 추정 계층을 확인하는 것에 관한 것이다.
본 발명의 실시양태에서, 본 발명은 분석을 위해 개체로부터 게놈 DNA를 함유하는 샘플을 수득하는 단계를 포함한다. 샘플은 예를 들어, 구강 면봉 채취물, 타액 샘플, 혈액 샘플, 또는 본원에 개시된 것과 같은, 게놈 DNA를 함유하는 다른 적합한 샘플 등일 수 있다. 게놈 DNA는 당업자에게 이용가능한 임의의 일반 기법, 예컨대, 예를 들어, 고처리량 또는 저밀도 어레이 기술 등을 사용하여 분석될 수 있다. 이어서, 상기 유전자형 분석으로부터의 결과를 특정 병태에 대하여 감수성인 변이체인 것으로 공지된 특정 변이체, 예컨대, 본원에 개시된 유전자 변이체의 존재에 대해 분석할 수 있다. 개체에 대한 특정 유전자형에 의해 부여된 위험도를 계산하는 것은 개체의 유전자형을 유전자형에 대하여, 예를 들어, 특정 병태 또는 소질에 대한 (예컨대, 투여된 마취제로부터 유발된 역효과에 대한) 위험 변이체의 이형접합성 보인자에 대한 미리 결정된 위험도 (예를 들어, 상대적 위험도 (RR) 또는 오즈비 (OR)로 표시)에 기초할 수 있다. 개체에 대한 계산된 위험도는 성별 및 인종이 매칭된 평균 집단을 비교하였을 때, 개인에 대한, 또는 개인의 특이 유전자형에 대한 상대적 위험도일 수 있다. 평균 집단 위험도는 참조 집단으로부터의 결과를 사용하여 상이한 유전자형의 위험의 가중 평균으로 표시될 수 있고, 이어서, 집단 대비의 상대적인 유전자형 군의 위험도를 계산하는 데 적절한 계산을 수행할 수 있다. 대안적으로, 개체에 대한 위험도는 특정 유전자형의 비교, 예를 들어, 마커의 위험 대립유전자를 보유하는 이형접합성 보인자를 위험 대립유전자의 비보인자와의 비교에 기초한다. 일부 실시양태에서, 집단 평균을 사용하는 것은 집단에서의 평균과 비교하였을 때, 개체(그/그녀) 유전자형에 기초하여, 사용자가 해석하기 더 쉬운 척도, 즉, 개체에 대하여 위험을 주는 척도를 제공하는 바, 집단 평균을 사용하는 것이 더욱 편리할 수 있다.
다중 위험 변이체에 대한 전체 위험도는 표준 방법을 사용하여 수행될 수 있다. 예를 들어, 승법 모델이라고 가정하였을 때, 즉, 개별 위험 변이체의 위험도를 곱하여 전체 효과를 확립한다고 가정하였을 때, 다중 마커에 대한 전체 위험도를 간단하게 계산할 수 있다.
샘플 중 특정 일배체형을 구성하는 특정 유전자 마커 대립유전자의 검출은 본원에 기술되고/거나, 당업계에 공지된 다양한 방법에 의해 수행될 수 있다. 예를 들어, 유전자 마커는 핵산 수준에서 (예컨대, 직접적인 뉴클레오티드 서열분석에 의해, 또는 당업자에게 공지된 다른 유전자형 분석 수단에 의해), 또는 유전자 마커가 단백질의 코딩 서열에 영향을 미치는 경우, 아미노산 수준에서 (예컨대, 단백질 서열분석에 의해, 또는 상기 단백질을 인식하는 항체를 사용하는 면역검정법에 의해) 검출될 수 있다. 본원에 개시된 마커 대립유전자 또는 일배체형은 투여된 마취제, 진통제, 및/또는 오피오이드의 역효과의 발생과 연관된 게놈 세그먼트 (예컨대, 유전자)의 단편에 상응한다. 상기 단편은 해당 다형성 마커 또는 일배체형의 DNA 서열을 포함할 뿐만 아니라, 마커 또는 일배체형과 강력한 LD (연관 비평형)에 있는 DNA 세그먼트 또한 포함할 수 있다. 일부 실시양태에서, 상기 세그먼트는 r2 값이 0.2 초과이고/거나, |D'|>0.8인 것으로 측정되는, 마커 또는 일배체형과 LD에 있는 세그먼트를 포함한다.
일부 실시양태에서, 투여된 마취제의 역효과의 발생에 대한 감수성 측정은 하이브리드화 방법을 사용하여 수행될 수 있다 (문헌 [Current Protocols in Molecular Biology, Ausubel, F. et al., eds., John Wiley & Sons] (보충물 모두 포함) 참조). 특이 마커 대립유전자의 존재는 특정 대립유전자에 특이적인 핵산 프로브의 서열 특이 하이브리드화에 의해 표시될 수 있다. 1개 초과의 특이 마커 대립유전자 또는 특이 일배체형의 존재는 각각이 특정 대립유전자에 대해 특이적인 것인, 수개의 서열 특이 핵산 프로브를 사용함으로써 표시될 수 있다. 서열 특이 프로브는 게놈 DNA, RNA, 또는 cDNA에 하이브리드화하도록 유도될 수 있다. "핵산 프로브"는 상보적인 서열에 하이브리드화하는 DNA 프로브 또는 RNA 프로브일 수 있다. 특정 대립유전자가 시험 샘플로부터의 게놈 서열 중에 존재할 경우에만 오직 서열 특이 하이브리드화가 발생하도록 상기 프로브를 디자인하는 방법에 대해서 당업자는 알고 있을 것이다. 본 발명은 또한 특정 다형성 마커를 유전자형 분석하기 위한 상업적으로 이용가능한 기술 및 방법을 비롯한, 임의의 편리한 유전자형 분석 방법을 실시하도록 축소될 수 있다.
하이브리드화 샘플은 마취제 역효과와 연관된 핵산을 함유하는 시험 샘플, 예컨대, 게놈 DNA 샘플을 1개 이상의 핵산 프로브와 접촉시킴으로써 형성될 수 있다. mRNA 또는 게놈 DNA를 검출하기 위한 프로브의 비제한적인 예로는 본원에 기술된 mRNA 또는 게놈 DNA 서열에 하이브리드화할 수 있는 표지된 핵산 프로브가 있다. 핵산 프로브는 예를 들어, 전장의 핵산 분자 또는 그의 일부, 예컨대, 엄격한 조건하에서 적절한 mRNA 또는 게놈 DNA에 특이적으로 하이브리드화하는 데 충분한 길이인, 길이가 15, 30, 50, 100, 250, 또는 500개 이상의 뉴클레오티드인 올리고뉴클레오티드일 수 있다. 하이브리드화는 당업자에게 널리 공지된 방법에 의해 수행될 수 있다 (예컨대, 문헌 [Current Protocols in Molecular Biology, Ausubel, F. et al., eds., John Wiley & Sons] (보충물 모두 포함) 참조). 일부 실시양태에서, 하이브리드화란 특이적인 하이브리드화, 즉, 미스매치가 일어나지 않는 하이브리드화 (정확한 하이브리드화)를 의미한다. 일부 실시양태에서, 특이적인 하이브리드화를 위한 하이브리드화 조건은 고도로 엄격한 조건이다.
존재할 경우, 특이적인 하이브리드화는 표준 방법을 사용하여 검출된다. 시험 샘플 중의 핵산과 핵산 프로브 사이에 특이적인 하이브리드화가 일어난다면, 이때 샘플은 핵산 프로브에 존재하는 뉴클레오티드에 상보적인 대립유전자를 함유하는 것이다. 본 과정은 본원에 개시된 바와 같은 임의의 마커에 대하여, 또는 본원에 개시된 바와 같은 일배체형을 구성하는 마커에 대하여 반복될 수 있거나, 또는 다중 프로브는 한번에 1개 초과의 마커 대립유전자를 검출하기 위해 동시에 사용될 수 있다. 프로브가 특정 일배체형의 1개 초과의 마커 대립유전자를 포함하는 것인 (예컨대, 프로브가 특정 일배체형을 구성하는 마커 중 2, 3, 4, 5개 또는 그들 모두에 대해 상보적인 대립유전자를 포함하는 것인) 단일 프로브 또한 디자인될 수 있다. 샘플 중의 일배체형의 특정 마커를 검출하는 것은 샘플 공급원이 특정 일배체형 (예컨대, 일배체형)을 가지며, 따라서, 투여된 마취제로부터 유발되는 역효과를 앓을 수 있는 것에 대한 감수성 또는 위험이 있다는 것을 시사한다.
검출 프로브의 크기는, 비록 프로브는 비교적 짧은 것이 바람직하기는 하지만, 임의의 적합한 크기일 수 있다. 일부 실시양태에서, 프로브 길이는 5-100개의 뉴클레오티드 길이이다. 일부 실시양태에서, 프로브 길이는 10-50개의 뉴클레오티드 길이이다. 일부 실시양태에서, 프로브 길이는 12-30개의 뉴클레오티드 길이이다. 다른 길이의 프로브 또한 고려되며, 이는 당업자의 기술 범주 내에 포함된다.
일부 실시양태에서, SNP 다형성을 함유하는 DNA 주형은 검출 이전에 중합효소 연쇄 반응 (PCR)에 의해 증폭된다. 상기 실시양태에서, 증폭된 DNA는 검출 프로브 및 인핸서 프로브에 대한 주형으로서의 역할을 한다.
일부 실시양태에서, PCR에 의한 주형 증폭에 사용되는 검출 프로브, 인핸서 프로브, 및/또는 프라이머는 변형된 A 및 변형된 G를 비롯한, 변형된 염기의 사용을 포함한다. 변형된 염기 사용은 주형 DNA에 대하여 뉴클레오티드 분자 (프로브 및/또는 프라이머)의 융점을 조정하는 데, 예를 들어, 낮은 비율로 G 또는 C 염기를 함유하는 영역에서 융점을 증가시키는 데 (여기서, A에 대해 상보적인 T에 3개의 수소 결합을 형성할 수 있는 능력을 가진 변형된 A가 사용될 수 있다), 또는 예를 들어, 이중 가닥 DNA 분자에서 G에 대해 상보적인 C 염기에 2개의 수소 결합만을 형성하는 변형된 G 염기를 사용함으로써, 높은 비율로 G 또는 C 염기를 함유하는 영역에서 융점을 감소시키는 데 유용할 수 있다. 일부 실시양태에서, 변형된 염기는 검출 뉴클레오티드 프로브 디자인에 사용된다. 당업자에게 공지된 임의의 변형된 염기는 본 방법에서 선택될 수 있고, 적합한 염기 선택은 본원의 교시, 및 당업자에게 공지된 바와 같은, 상업적 공급원으로부터 이용가능한 공지된 염기에 기초하여 당업자의 범주 내에 잘 포함되어 있다.
일부 실시양태에서, 펩티드 핵산 (PNA) 프로브는 본원에 기술된 하이브리드화 방법에서 핵산 프로브 이외로, 또는 그를 대신하여 사용될 수 있다. PNA는 유기 염기 (A, G, C, T, 또는 U)가 메틸렌 카르보닐 링커를 통해 글리신 질소에 부착되어 있는, 펩티드 유사, 무기 골격, 예컨대, N-(2-아미노에틸)글리신 단위를 가지는 DNA 모방체이다 (예를 들어, 문헌 [Nielsen, P., et al., Bioconjug . Chem . 5:3-7 (1994)] 참조). PNA 프로브는 투여된 마취제의 역효과와 연관된 마커 대립유전자 또는 일배체형 중 하나 이상의 것을 함유하는 것으로 의심되는 샘플 중에서 분자에 특이적으로 하이브리드화하도록 디자인될 수 있다. 따라서, PNA 프로브의 하이브리드화는 상기 효과에 대한 감수성에 대한 진단에 도움이 된다.
본 발명의 실시양태는 또한 유전자 세트 내의 SNP를 검출하는 것에 관한 것으로, 검출 방법은 예를 들어, SNP 마이크로어레이, 유전자 칩, 동적 대립유전자 특이 하이브리드화, 분자 비콘, 제한 단편 길이 다형성 (RFLP) 기반 방법, PCR 기반 방법, 플랩 엔도뉴클레아제 기반 방법, 프라이머 연장, 5'-뉴클레아제 기반 방법, 올리고뉴클레오티드 리가제 검정법, 단일 가닥 입체형태 다형성 방법, 온도 구배 겔 전기영동, 변성 고성능 액체 크로마토그래피, 고해상도 용융 분석, DNA 미스매치 결합 방법, 모세관 전기영동, 및 차세대 서열분석 방법 등을 사용하는 것을 포함하나, 이에 제한되지 않는다.
본 발명의 실시양태에서, 대상체로부터 수득된 게놈 DNA를 함유하는 시험 샘플을 수집하고, PCR을 사용하여 본 발명의 하나 이상의 마커 또는 일배체형을 포함하는 단편을 증폭시킨다. 본원에 개시된 바와 같이, 특정 마커 대립유전자 또는 일배체형의 확인은 다양한 방법 (예컨대, 서열 분석, 제한 분해에 의한 분석, 특이 하이브리드화, 단일 가닥 입체형태 다형성 검정법 (SSCP), 전기영동 분석 등)을 사용하여 달성될 수 있다. 일부 실시양태에서, 진단은 발현 분석, 예를 들어, 정량적 PCR (동적 열 사이클링)에 의해 달성된다. 상기 기법은 예를 들어, 상업적으로 이용가능한 기술, 예컨대, 택맨.RTM (어플라이드 바이오시스템즈: 미국 캘리포니아주 포스터시티)을 사용할 수 있다. 기법은 폴리펩티드 또는 스플라이싱 변이체(들)의 발현 또는 조성에 변경의 존재를 평가할 수 있다. 추가로, 변이체(들) 발현은 물리적으로 또는 기능적으로 상이한 것으로 정량화될 수 있다.
일부 실시양태에서, DNA 주형은 본원에 기술된 특이 다형성 마커의 존재에 대해 평가하기 이전에 전체 게놈 증폭 (WGA) 방법에 의해 증폭될 수 있다. 당업자에게 널리 공지된 WGA 수행을 위한 표준 방법이 사용될 수 있고, 본 발명의 범주 내에 있다.
일부 실시양태에서, 제한 분해에 의한 분석은 참조 서열과 비교하였을 때, 대립유전자를 통해 제한 부위가 생성되었는지 또는 제거되었는지 여부에 대하여 특정 대립유전자를 검출하는 데 사용될 수 있다. RFLP 분석은 예컨대, 문헌 [Current Protocols in Molecular Biology, 상기 문헌 참조]에 기술되어 있는 바와 같이 수행될 수 있다. 관련 DNA 단편의 분해 패턴이 샘플 중 특정 대립유전자의 존재 또는 부재를 나타낸다.
서열 분석 또한 특이 대립유전자 또는 일배체형을 검출하는 데 사용될 수 있다. 따라서, 일부 실시양태에서, 특정 마커 대립유전자 또는 일배체형의 존재 또는 부재를 측정하는 것은 대상체 또는 개체로부터 수득된 DNA 또는 RNA의 시험 샘플의 서열 분석을 포함한다. PCR 또는 다른 적절한 방법은 다형성 마커 또는 일배체형을 함유하는 핵산의 일부를 증폭시키는 데 사용될 수 있고, 이어서, 특이 대립유전자의 존재는 직접 샘플 중 게놈 DNA의 다형성 부위 (또는 일배체형 중 다중 다형성 부위)를 서열분석함으로써 검출될 수 있다.
일부 실시양태에서, 대상체로부터의 표적 핵산 서열 세그먼트에 상보적인 올리고뉴클레오티드 프로브의 어레이는 다형성 부위에서 특정 대립유전자를 확인하는 데 사용될 수 있다. 예를 들어, 올리고뉴클레오티드 어레이가 사용될 수 있다. 올리고뉴클레오티드 어레이는 전형적으로 상이한 공지 위치에 기판 표면에 커플링된 복수 개의 상이한 올리고뉴클레오티드 프로브를 포함한다. 상기 어레이는 일반적으로 포토리소그래피 방법 및 고체상 올리고뉴클레오티드 합성 방법의 조합을 도입한 기계식 합성 방법 또는 광 유도 합성 방법을 사용하여, 또는 당업자에게 공지된 다른 방법에 의해 제조될 수 있다 (예컨대, 문헌 [Bier, et al. Adv Biochem Eng Biotechnol 109:433-53 (2008)]; [Hoheisel, J. D., Nat Rev Genet. 7:200-10 (2006)]; [Fan, et al. Methods Enzymol 410:57-73 (2006)]; [Raqoussis, J. and Elvidge, G., Expert Rev Mol Diagn 6:145-52 (2006)]; 및 [Mockler, et al. Genomics 85:1-15 (2005)] (상기 문헌은 각각 그 전문이 본원에서 참조로 포함된다) 참조). 다형성 검출용 올리고뉴클레오티드 어레이의 제조 및 사용에 관한 다수의 추가 설명은 예를 들어, 미국 특허 번호 6,858,394, 미국 특허 번호 6,429,027, 미국 특허 번호 5,445,934, 미국 특허 번호 5,700,637, 미국 특허 번호 5,744,305, 미국 특허 번호 5,945,334, 미국 특허 번호 6,054,270, 미국 특허 번호 6,300,063, 미국 특허 번호 6,733,977, 미국 특허 번호 7,364,858, EP 619 321, 및 EP 373 203 (상기 특허는 각각 그 전문이 본원에서 참조로 포함된다)에서 살펴볼 수 있다. 당업자에게 이용가능한 다른 핵산 분석 방법을 사용하여 다형성 부위에서 특정 대립유전자를 검출할 수 있다. 대표적인 방법으로는 예를 들어, 직접 수동식 서열분석 (문헌 [Church and Gilbert, Proc . Natl . Acad . Sci . USA, 81: 1991-1995 (1988)]; [Sanger, et al., Proc . Natl . Acad . Sci . USA, 74:5463-5467 (1977)]; 미국 특허 번호 5,288,644 (비비스(Beavis) 등)); 자동 형광 서열분석; 단일 가닥 입체형태 다형성 검정법 (SSCP); 클램프 변성 겔 전기영동 (CDGE); 변성 구배 겔 전기영동 (DGGE) (문헌 [Sheffield, et al., Proc . Natl . Acad . Sci . USA, 86:232-236 (1989)]), 이동 변화 분석 (문헌 [Orita, et al., Proc . Natl . Acad. Sci . USA, 86:2766-2770 (1989)]), 제한 효소 분석 (문헌 [Flavell, et al., Cell, 15:25-41 (1978)]; [Geever, et al., Proc . Natl . Acad . Sci . USA, 78:5081-5085 (1981)]); 이종이중체 분석; 화학적 미스매치 절단 (CMC) (문헌 [Cotton, et al., Proc . Natl . Acad . Sci . USA, 85:4397-4401 (1985)]); RN아제 보호 검정법 (문헌 [Myers, et al., Science, 230:1242-1246 (1985)]); 뉴클레오티드 미스매치를 인식하는 폴리펩티드, 예컨대, 예컨대, E. 콜라이(E. coli ) mutS 단백질 사용; 및 대립유전자 특이 PCR 등을 포함한다. 당업자는 본 목적에 사용될 수 있는 다른 기법을 이해할 수 있다.
본 발명의 실시양태에서, 투여된 마취제, 진통제, 및/또는 오피오이드에 대한 역효과 발생에 대한 감수성 또는 그의 위험은, 본원에 개시된 유전자 마커(들) 또는 일배체형(들)이 폴리펩티드의 조성 또는 발현을 변이시키는 경우에 투여된 마취제에 대한 역효과와 연관된 핵산에 의해 코딩된 폴리펩티드의 발현 및/또는 조성을 조사함으로써 측정할 수 있다. 따라서, 투여된 마취제, 진통제, 및/또는 오피오이드에 대한 역효과 발생에 대한 감수성은, 본 발명의 유전자 마커 또는 일배체형이 폴리펩티드의 조성 또는 발현을 변이시키는 경우에 투여된 마취제에 대한 역효과의 발생과 연관된 핵산에 의해 코딩된 상기 폴리펩티드 또는 또 다른 폴리펩티드 중 하나의 발현 및/또는 조성을 조사함으로써 측정할 수 있다.
예를 들어, 효소 결합 면역흡착 검정법 (ELISA), 웨스턴 블롯, 면역침전, 및 면역형광 등을 비롯한, 다양한 방법이 단백질 발현 수준을 검출하는 데 사용될 수 있다. 대상체로부터의 시험 샘플을 특정 핵산에 의해 코딩된 폴리펩티드의 발현 변경 및/또는 그의 조성 변경의 존재에 대해 평가할 수 있다. 핵산에 의해 코딩된 폴리펩티드의 발현 변경은 예를 들어, 정량적 폴리펩티드 발현 (즉, 제조된 폴리펩티드의 양)의 변경일 수 있다. 핵산에 의해 코딩된 폴리펩티드의 조성 변경은 정량적 폴리펩티드 발현 (예컨대, 돌연변이체 폴리펩티드의, 또는 상이한 스플라이싱 변이체의 발현)의 변경이다. 일부 실시양태에서, 투여된 마취제에 대한 역효과의 발생에 대한 감수성 측정은 상기 역효과 또는 스플라이싱 변이체의 특정 패턴 발생과 연관된 핵산에 의해 코딩된 특정 스플라이싱 변이체를 검출함으로써 수행된다.
상기 두 변경 (정량적 및 정질적 변경) 모두가 또한 존재할 수 있다. 본원에서 사용되는 바, 폴리펩티드 발현 또는 조성의 "변경"은 대조군 샘플 중의 폴리펩티드의 발현 또는 조성과 비교하였을 때, 시험 샘플 중의 발현 또는 조성 변경을 의미한다. 대조군 샘플은 시험 샘플에 상응하고 (예컨대, 같은 유형의 세포로부터의 것이고), 투여된 마취제에 영향을 받지 않고/거나, 투여된 마취제에 대한 역효과의 발생에 대한 감수성이 없는 대상체로부터 유래된 샘플이다. 일부 실시양태에서, 대조군 샘플은 본원에 개시된 바와 같이, 투여된 마취제에 대한 역효과의 발생과 연관된 마커 대립유전자 또는 일배체형을 가지지 않는 대상체로부터 유래된 것이다. 유사하게, 대조군 샘플과 비교하였을 때, 시험 샘플 중 하나 이상의 상이한 스플라이싱 변이체의 존재, 또는 시험 샘플 중 유의적으로 상이한 양의 상이한 스플라이싱 변이체의 존재가 투여된 마취제에 대한 역효과 발생에 대한 감수성을 나타낼 수 있다. 대조군 샘플과 비교하였을 때, 시험 샘플 중 폴리펩티드의 발현 또는 조성 변경은 대조군 샘플 중 참조와 비교하였을 때 대립유전자가 스플라이스 부위를 변경시킨 경우의 특이 대립유전자를 나타낼 수 있다.
분광법, 비색법, 전기영동, 등전점 전기영동, 및 면역검정법 (예컨대, 미국 특허 번호 4,376,110 (데이빗(David) 등), 예컨대, 면역블롯팅 (예컨대, 문헌 [Current Protocols in Molecular Biology, 특히, 10장, 상기 문헌 동일] 참조)을 비롯한, 핵산에 의해 코딩된 폴리펩티드의 발현 또는 조성을 조사하는 다양한 수단이 당업자에게 공지되어 있고, 이는 사용될 수 있다.
예를 들어, 일부 실시양태에서, 투여된 마취제에 대한 역효과의 발생과 연관된 핵산에 의해 코딩된 폴리펩티드에 결합할 수 있는 항체 (예컨대, 검출가능한 표지가 있는 항체)가 사용될 수 있다. 항체는 폴리클로날 또는 모노클로날일 수 있다. 무손상 항체 또는 그의 단편 (예컨대, Fv, Fab, Fab', F(ab')2)이 사용될 수 있다. 프로브 또는 항체와 관련하여 "표지화된"이라는 용어는 검출가능한 물질을 프로브 또는 항체에 커플링시킴으로써 (즉, 물리적으로 연결시킴으로써) 프로브 또는 항체를 직접 표지화하는 것 뿐만 아니라, 직접 표지화된 또 다른 시약과의 반응성에 의해 프로브 또는 항체를 간접적으로 표지화하는 것을 포함한다. 간접 표지화의 예는 표지화된 2차 항체 (예컨대, 형광 표지화된 2차 항체)를 사용하고, 형광 표지화된 스트렙트아비딘으로 검출될 수 있도록 비오틴으로 DNA 프로브 단부 표지화하여 1차 항체를 검출하는 것을 포함한다.
일부 실시양태에서, 시험 샘플 중의 폴리펩티드의 수준 또는 양을 대조군 샘플 중의 폴리펩티드의 수준 또는 양과 비교한다. 시험 샘플 중의 폴리펩티드의 수준 또는 양이 대조군 샘플 중의 폴리펩티드의 수준 또는 양보다 더 높거나, 또는 더 낮고, 상기 차이는 통계학상 유의적일 경우, 이는 핵산에 의해 코딩된 폴리펩티드의 발현 변경을 나타내고, 발현에서의 차이에 원인이 되는 특정 대립유전자 또는 일배체형 진단에 도움이 된다. 대안적으로, 시험 샘플 중 폴리펩티드의 조성을 대조군 샘플 중 폴리펩티드의 조성과 비교한다. 일부 실시양태에서, 폴리펩티드의 수준 또는 양, 및 조성, 둘 모두가 시험 샘플에서 및 대조군 샘플에서 평가될 수 있다.
일부 실시양태에서, 추가의 단백질 기반, RNA 기반, 또는 DNA 기반 검정법과의 조합으로, 본원에 개시된 바와 같은 1개 이상의 마커 또는 일배체형을 검출함으로써 투여된 마취제에 대한 역효과의 발생에 대한 감수성을 측정한다. 일부 실시양태에서, 추가의 단백질 기반, RNA 기반, 또는 DNA 기반 검정법과의 조합으로, 본원에 개시된 바와 같은 1개 이상의 마커 또는 일배체형을 검출함으로써 통증 완화 또는 감수성에 대한 감수성을 측정한다. 일부 실시양태에서, 추가의 단백질 기반, RNA 기반, 또는 DNA 기반 검정법과의 조합으로, 본원에 개시된 바와 같은 1개 이상의 마커 또는 일배체형을 검출함으로써 OSA에 대한 감수성을 측정한다. 일부 실시양태에서, 추가의 단백질 기반, RNA 기반, 또는 DNA 기반 검정법과의 조합으로, 본원에 개시된 바와 같은 1개 이상의 마커 또는 일배체형을 검출함으로써 OSA 발생률을 측정하여 투여된 마취제, 진통제, 및/또는 오피오이드에 대한 역효과의 발생에 대한 감수성을 측정한다.
일부 실시양태에서, 추가의 단백질 기반, RNA 기반, 또는 DNA 기반 검정법과의 조합으로, 본원에 개시된 바와 같은 1개 이상의 마커 또는 일배체형을 검출함으로써 투여된 오피오이드에 대한 역효과의 발생에 대한 감수성을 측정한다. 일부 실시양태에서, 투여된 오피오이드는 모르핀이다. 일부 실시양태에서, 투여된 오피오이드는 코데인이다. 일부 실시양태에서, OCT1 유전자형의 특징 규명은 투여된 오피오이드에 대한 역효과의 발생에 대한 감수성을 측정하는 데 사용된다. 일부 실시양태에서, UGT2B7 rs7438135 대립유전자를 측정한다. 일부 실시양태에서, rs622342 대립유전자의 특징을 규명한다.
키트
본 발명의 방법에서 유용한 키트는, 예를 들어, 핵산 증폭용 프라이머, 하이브리드화 프로브, 제한 효소 (예컨대, RFLP 분석을 위한 제한 효소), 대립유전자 특이 올리고뉴클레오티드, 본원에 개시된 바와 같은 핵산 (예컨대, 본 발명의 1개 이상의 다형성 마커 및/또는 일배체형을 포함하는 게놈 세그먼트)에 의해 코딩된 변경된 폴리펩티드, 또는 본원에 기술된 바와 같은 본 발명의 핵산에 의해 코딩된 비변경된 (천연) 폴리펩티드에 결합하는 항체, 투여된 마취제에 대한 역효과 발생과 연관된 핵산의 증폭을 위한 수단, 투여된 마취제에 대한 역효과 발생과 연관된 핵산의 핵산 서열을 분석하기 위한 수단, 투여된 마취제에 대한 역효과 발생과 연관된 핵산에 의해 코딩된 폴리펩티드의 아미노산 서열을 분석하기 위한 수단 등을 비롯한, 본원에 개시된 방법 중 임의의 것에서 유용한 구성 요소를 포함한다. 키트는 예를 들어, 필요한 완충제, 본 발명의 핵산 (예컨대, 본원에 기술된 바와 같은 다형성 마커 중 하나 이상의 것을 포함하는 핵산 세그먼트)를 증폭시키기 위한 핵산 프라이머, 및 상기 프라이머 및 필요한 효소 (예컨대, DNA 폴리머라제)를 사용하여 증폭된 단편의 대립유전자 특이 검출을 위한 시약 등을 포함할 수 있다. 추가로, 키트는 본원에 개시된 방법과 함께 조합하여 사용되는 검정용 시약, 예컨대, 투여된 마취제에 대한 역효과 발생에 대한 감수성을 측정하기 위한 다른 진단용 검정법과 함께 사용하기 위한 시약을 제공할 수 있다. 일부 실시양태에서, WGA 수행용 시약이 시약 키트에 포함된다.
일부 실시양태에서, 키트는 개체의 게놈 중 본원에 개시된 바와 같은 1개 이상의 다형성의 1개 이상의 대립유전자를 선택적으로 검출하는 데 필요한 시약을 포함하는, 대상체로부터의 샘플을 검정하여 대상체에서 투여된 마취제, 진통제, 및/또는 오피오이드에 대한 역효과 발생에 대한 위험 또는 감수성을 검출하는 키트를 제공한다. 일부 실시양태에서, 시약은 본원에 개시된 바와 같이, 1개 이상의 다형성을 포함하는 개체의 게놈의 단편에 하이브리드화하는 1개 이상의 연속된 올리고뉴클레오티드를 포함한다. 일부 실시양태에서, 시약은, 각 올리고뉴클레오티드 프라이머 쌍은 투여된 마취제에 대한 역효과 발생과 연관된 1개 이상의 다형성을 포함하는 개체의 게놈의 단편을 선택적으로 증폭시키도록 디자인된 것인, 대상체로부터 수득된 게놈 세그먼트의 반대쪽 가닥에 하이브리드화하는 1개 이상의 올리고뉴클레오티드 쌍을 포함한다. 일부 실시양태에서, 시약은, 각 올리고뉴클레오티드 프라이머 쌍은 투여된 오피오이드에 대한 역효과 발생과 연관된 1개 이상의 다형성을 포함하는 개체의 게놈의 단편을 선택적으로 증폭시키도록 디자인된 것인, 대상체로부터 수득된 게놈 세그먼트의 반대쪽 가닥에 하이브리드화하는 1개 이상의 올리고뉴클레오티드 쌍을 포함한다. 일부 실시양태에서, 단편의 크기는 20개 이상의 염기쌍 크기이다. 상기 올리고뉴클레오티드 또는 핵산 (예컨대, 올리고뉴클레오티드 프라이머)은 투여된 마취에 대한 역효과 발생 위험과 연관된 다형성 (예컨대, SNP 또는 미소부수체) 측면에 위치하는 핵산 서열 중 일부를 사용하도록 디자인될 수 있다. 일부 실시양태에서, 키트는 하나 이상의 특이 다형성 마커 또는 일배체형의 대립유전자 특이 검출을 가능하게 하는 하나 이상의 표지화된 핵산 뿐만 아니라, 표지 검출용 시약을 포함한다. 적합한 표지로는 예컨대, 방사성 동위 원소, 형광 표지, 효소 표지, 효소 보조인자 표지, 자기 표지, 스핀 표지, 에피토프 표지 등을 포함한다.
특정 실시양태에서, 키트는 키트를 구성하는 시약 사용 설명서 세트를 추가로 포함한다.
진통제
진통제로는 파라세타몰 (이는 또한 아세트아미노펜으로도 지칭된다), 비스테로이드성 항염증성 약물 (NSAID) (예컨대, 살리실레이트 포함), 및 오피오이드 약물, 예컨대, 모르핀, 펜타닐, 히드로모르폰, 코데인, 옥시코돈, 히드로코돈, 트라마돌, 온단세트론, 덱사메타손, 메타돈, 알펜타닐, 레미펜타닐, 및 그의 유도체, 및 비-오피오이드 진통제 (아세트아미노펜 포함), NSAID, 및 그의 조합 및 유도체를 포함한다.
본 발명을 상세히 기술함하면서, 첨부된 특허청구범위에서 정의된 본 발명으로부터 벗어남 없이, 실시양태의 수정, 변형 및 그다물이 가능하다. 본 개시내용에서의 모든 예는 비제한적인 예로서 제공된다.
시스템
도 20은 본원에 기술된 하나 이상의 특징을 실행할 수 있는 시스템의 한 예를 도시한 것이다. 여기서, 시스템 (200)은 프로세서 (210) 및 메모리 (220)를 포함한다. 시스템 (200)은 또한 시스템이 예를 들어, 하나 이상의 입력 장치 (260) 및 하나 이상의 디스플레이 (270)를 통해 사용자와 소통할 수 있도록 허용하는 사용자 인터페이스 (250)를 포함한다.
시스템 (200)은 또한 본원에 기술된 하나 이상의 특징을 실행하는 하나 이상의 모듈 및/또는 엔진을 포함할 수 있다. 예를 들어, 시스템 (200)은, 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 환자를 위험군으로 배정할 수 있는 것인 위험군 배정 엔진 (230)을 포함할 수 있다. 시스템 (200)은 또한, 배정된 환자의 위험군에 기초하여 환자를 위한 약물을 선택할 수 있는 것이 약물 선택 엔진 (240)을 포함할 수 있다.
일부 실시양태에서, 시스템 (200)은 유전자형 결정 장치 (280)로부터 환자의 데이터를 수신하도록 구성될 수 있다. 일부 실시양태에서, 하나 이상의 환자 데이터는 데이터 연결을 통해 시스템에 연결된 데이터 저장 또는 데이터베이스 (290)에 저장될 수 있다.
본원에 기술된 대상의 하나 이상의 측면 또는 특징은 디지털 전자 회로, 집적 회로, 특수 디자인된 응용 주문형 집적 회로 (ASIC), 필드 프로그램 가능 게이트 어레이 (FPGA) 컴퓨터 하드웨어, 펌웨어, 소프트웨어, 및/또는 그의 조합으로 구현될 수 있다. 이러한 다양한 측면 또는 특징은 저장 시스템, 1개 이상의 입력 장치, 및 1개 이상의 출력 장치로부터 데이터 및 명령어를 수신하도록, 및 데이터 및 명령어를 그에 전송하도록 커플링된, 특수용 또는 범용일 수 있는, 1개 이상의 프로그램 가능 프로세서를 비롯한 프로그램 가능 시스템 상에서 실행가능하고/거나, 번역가능한 하나 이상의 컴퓨터 프로그램으로 실행을 포함할 수 있다. 프로그램 가능 시스템 또는 컴퓨터 시스템은 클라이언트 및 서버를 포함할 수 있다. 클라이언트 및 서버는 일반적으로 서로 원격이고, 이는 전형적으로 통신망을 통해 소통한다. 클라이언트 및 서버의 관계는 각 컴퓨터 상에서 실행되고, 서로 클라이언트-서버 관계를 가지는 컴퓨터 프로그램에 의해 발생한다.
프로그램, 모듈, 모델 제너레이터, 컴퓨터 명령어, 소프트웨어, 소프트웨어 어플리케이션, 어플리케이션, 컴포넌트, 또는 코드로도 지칭될 수 있는 상기 컴퓨터 프로그램은 프로그램 가능 프로세서를 위한 기계 명령어를 포함하고, 고급 절차 언어, 객체 지향 프로그래밍 언어, 함수형 프로그래밍 언어, 논리형 프로그래밍 언어로, 및/또는 어셈블리/기계 언어로 실행될 수 있다. 본원에서 사용되는 바, "기계 판독 가능 매체"라는 용어는 기계 명령어 및/또는 데이터를 프로그램 가능 프로세서에 제공하는 데 사용되는 임의의 컴퓨터 프로그램 제품, 기기 및/또는 장치, 예컨대, 예를 들어, 자기 디스크, 광 디스크, 메모리, 및 프로그램 가능 논리 장치 (PLD)를 지칭하며, 이는 기계 판독 가능 신호로서 기계 명령어를 수신하는 기계 판독 가능 매체를 포함한다. "기계 판독 가능 신호"라는 용어는 기계 명령어 및/또는 데이터를 프로그램 가능 프로세서에 제공하는 데 사용되는 임의의 신호를 지칭한다. 기계 판독 가능 매체는 예컨대, 예를 들어, 비일시적 반도체 메모리(solid-state memory) 또는 자기 하드 드라이브 또는 임의의 등가 저장 매체와 같이, 비일시적으로 상기 기계 명령어를 저장할 수 있다. 대안적으로 또는 추가로, 기계 판독 가능 매체는 예컨대, 예를 들어, 프로세서 캐시 또는 하나 이상의 물리적 프로세서 코어와 연결된 랜덤 액세스 메모리와 같이 일시적인 방식으로 상기 기계 명령어를 저장할 수 있다.
사용자와 소통할 수 있도록 하기 위해, 본원에 기술된 대상의 하나 이상의 측면 또는 특징은 정보를 사용자에게 디스플레이티하기 위한 디스플레이 장치, 예컨대, 예를 들어, 음극선관 (CRT) 또는 액정 디스플레이 (LCD) 또는 발광 다이오드 (LED) 모니터, 및 사용자가 컴퓨터에 입력할 수 있도록 하는 키보드 및 포인팅 장치, 예컨대, 예를 들어, 마우스 또는 트랙볼을 가지는 컴퓨터 상에서 실행될 수 있다. 사용자와 소통할 수 있도록 하는 다른 종류의 장치 또한 사용될 수 있다. 예를 들어, 사용자에게 제공되는 피드백은 임의 형태의 감각 피드백, 예컨대, 예를 들어, 시각 피드백, 청각 피드백, 또는 촉각 피드백일 수 있고; 사용자로부터의 입력은 음향, 음성, 또는 촉각식 입력을 포함하나, 이에 제한되지 않는 임의 형태로 수신될 수 있다. 가능한 다른 입력 장치로는 터치 스크린 또는 다른 접촉 감지 장치, 예컨대, 싱글 또는 멀티 포인트 감압식 또는 정전용량식 트랙패드, 음성 인식 하드웨어 및 소프트웨어, 광학식 스캐너, 광학식 포인터, 디지털 이미지 캡처 장치 및 연관된 해석 소프트웨어 등을 포함하나, 이에 제한되지 않는다.
실시예
본원에 개시된 본 발명의 실시양태를 추가로 예시하기 위해 하기 비제한적인 실시예를 제공한다. 하기 실시예에 개시된 기법은 본 발명의 실시에서 기능을 잘 하는 것으로 밝혀졌고, 이로써, 그의 실시를 위한 모드의 예를 구성하는 것으로 간주될 수 있는 접근법을 나타낸다는 것을 당업자는 이해할 것이다. 그러나, 당업자는 본 개시내용에 비추어 개시된 구체적인 실시양태는 본 발명의 정신 및 범주로부터 벗어남 없이 다수 변형될 수 있으며, 여전히 비슷하거나, 유사한 결과를 수득할 수 있다는 것을 이해할 것이다.
실시예
1:
FAAH
유전자
변이체와
수술 후 중추 오피오이드 관련 유해 사례 사이의 신규한 연관성
본 실시예에서는 게놈와이드 어레이로부터의 지방산 아미드 가수분해효소 (FAAH)의 모든 중요한 유전자 변이체가 아동에서의 수술 전후의 오피오이드 관련 역효과에 미치는 영향을 평가하였다. 본 실시예는 추후 문헌 [Sahasivam et al., The Pharmacogenomics Journal (2015) 1-7]에 공개되었으며, 그의 내용은 본원에서 참조로 포함된다.
연구 디자인, 참가자, 및 절차
이는 표준 수술 전후의 마취, 외과적 치료 및 간호와 함께 외래 아데노이드편도 절제술을 받은 아동으로 이루어진 큰 코호트에서의 전향적, 유전자형 맹검, 임상적 관찰 연구였다. 본 연구는 clinicaltrials.gov, NCT01140724로 등록된, 아동에서의 수술 전후의 모르핀 진통제 개인 맞춤화(Personalizing Perioperative Morphine Analgesia in Children)라는 제목의, 더 큰 규모의 진행 중인 임상 연구의 일부이다. 표준 수술 전후의 관리를 포함하는 (환자의 유전자형에 대해 알지 못하는 임상 치료 팀 포함) 상기 대규모의 전향적 임상 시험은 아동에서의 수술 전후의 오피오이드에 대한 진통 및 역효과 반응에서의 개체간 변이성에 기여하는 인자를 평가하였다. 본 연구는 기관 임상 시험 심사 위원회의 승인을 받았고, 등록 전 부모님으로부터 서면 사전 동의서를 받았고, 적절할 경우, 7세 초과의 아동으로부터 동의를 얻었다.
예정 외래 편도 절제술 또는 아데노이드편도 절제술 중인 6-15세 아동을 본 연구를 위해 수술 당일 동원하였다. 샘플 포함 기준은 재발성 편도염, 아데노이드편도 비대, 또는 폐쇄성 수면 무호흡증 (OSA) 때문에 편도 절제술 또는 아데노이드편도 절제술을 받기로 예정된, 미국 마취과 학회(American Society of Anesthesiologists: ASA) 체격 1 또는 2로 지정된 아동이었다. 수술 전 수술 노트에 기록된 바와 같이, 코골이와 함께, 수면 중 휴지 시간이 10초 초과로 지속되거나, 또는 주간 졸림증의 병력이 있는 수면 장애 호흡을 앓는 아동은 OSA의 임상 증상이 있는 것으로 간주되었고, 상기 아동에서의 편도 절제술에 대한 적응증은 OSA의 임상 진단이었다. 추가로, 소아과 수면 설문지(Pediatric Sleep Questionnaire: PSQ) (문헌 [Chervin R. et al., Sleep Med, 1:21-32 (2000)]; [Chervin R. et al., Arch. Otolaryngol . Head Neck Surg ., 133:216-22 (2007)])는 아동을 수명 장애에 대해 평가하는 사용된 입증 도구였다. 연구 대상인 아동의 부모님이 PSQ의 22개의 문항 중 8개 이상에 대해 "예"라고 기록하였다면, 아동은 OSA를 앓는 것으로 간주되었다.
아동 또는 아동의 부모님이 비영어를 사용할 경우, 그 아동을 배제시켰다. 연구 약물에 대하여 알레르기성이거나, 또는 발달 지연, 간 또는 신장 질환, 또는 진통제를 필요로 하는 수술 전 통증 (예컨대, 만성 편도염)이 있는 아동은 배제시켰다. 본 연구에 대한 연구 코디네이터에 대한 이용가능성에 제한이 있었는 바, 이에 본 연구에서는 편리하게 샘플링할 수 있도록 하는 모든 자격이 있는 대상체를 동원하지 못했다.
모든 참가자들은 표준화된 외과적 및 마취 기법을 비롯한, 동일한 수술 전후의 관리를 받았다. 기관내 삽관을 용이하게 하기 위해 세보플루란에 이어서, 프로포폴 (2 mg/kg) 볼루스를 사용하여 마취를 유도하였다. 신경근 차단을 사용하지 않고, 세보플루란으로 마취를 유지시켰다. 환자는 외과적 절개 이전에 모르핀을 받았다. OSA 병력이 있는 아동은 0.1 mg/kg 모르핀을 받은 반면, OSA 진단을 받지 않은 아동은 0.2 mg/kg을 받았다. 외과적 절개 및 소작술 이후 통증을 시사하는 임의의 징후 (심박수 및 혈압의 임상적으로 유의적인 증가)가 있는 경우, 임상 마취 팀은 필요할 경우, 수술 중에 0.05 mg/kg의 증분량으로 추가의 모르핀을 제공하였다. 모든 아동은 수술 중에 예방적 온단세트론 (0.1 mg/kg) 및 덱사메타손 (0.1 mg/kg)을 받았다. 얼굴 표정; 다리 운동; 활성; 울음; 및 진정됨 (FLACC) 통증 점수 (문헌 [Merkel S. et al., Pediatr. Nurs., 23:293-7 (1997)])가 ≥ 4/10인 것으로 측정된 유의적인 수술 후 통증은 수술 후 마취 회복실 (PACU)에서 구제 용량의 모르핀 (0.05 mg/kg 증분량)으로 관리하였다.
임상 결과 측정
각 참가자에 대하여 진통 효과 및 오피오이드 관련 역효과에 대한 메트릭스를 기록하였다. 본 연구에서는 2개의 오피오이드 관련 역효과 결과: 임상적 호흡 억제 (RD) 및 불응성 PONV에 주력하였다. 진통 효과의 척도로서 전체 모르핀 요구량 (체중 1 kg당 mg 수) 또한 조사하였다. 본 연구에서, RD는 임상적으로 명백한 상기도 폐색의 부재하에서 SpO2 >92%를 유지시키기 위해 보충 산소를 필요로 하는, 지속적인 (>1분) 호흡률이 분당 호흡수 <10회이거나, 또는 산소 탈포화 <92%인 것으로 정의되었다. PONV는 항구토제 개입을 필요로 하는, 구토의 실제 에피소드 및/또는 자기 보고된 지속적 오심의 에피소드로서 정의되었다.
유전적 분석
FAAH SNP의 유전자형 분석을 위하여 마취하에 정맥내 주입선 배치시 수술실에서 DNA를 위해 혈액을 채취하였다. 같은 날 DNA를 단리시키고, -20℃에서 냉동시켰다. 앞서 연구된 6개의 일반 SNP를 선택하여 택맨 대립유전자 식별 시스템 검정법 (라이프 테크놀러지즈(Life Technologies), 어플라이드 바이오시스템즈: 미국 캘리포니아주 포스터시티)을 이용하여 유전자형을 분석하였다. 이는 rs932816, rs4141964, rs3766246, rs324420, rs324419, 및 rs2295632를 포함하였다. 추가로, 일루미나 휴먼 옴니 5 게놈와이드 휴먼 어레이(Illumina Human Omni 5 Genome-Wide Human Array)를 사용하여 게놈와이드 유전자형 분석을 수행하였다. 총 3,097개의 SNP의 유전자형을 분석하고, 이를 사용하여 PLINK 중의 중앙 χ2 통계로부터 게놈 과잉 계수 (λ)를 추정하였다. 3,097개의 SNP 중, rs3766246 및 rs324420을 비롯한 66개가 FAAH 유전자에 있다. 어레이는 또한 244개의 조상 정보 마커 (AIM)의 유전자형을 분석하였고, 이를 사용하여 유전적 조상 마커에 의해 자기 보고된 인종을 입증하고, 집단 계층화 및 확인을 보정하였다.
자기 보고된 백인 및 흑인 인종이 유전적 조상과 잘 매칭되는지 여부를 평가하기 위해, 1,397개의 합맵 대상체를 참조 집단으로서 사용하였다. 유전자형이 분석된 244개의 AIM 중 218개가 합맵 데이터에서 발견되었다. 이에 따라, SVS 7.7.6 (골든 헬릭스: 미국 몬태나주 보즈먼)을 사용하여 218개의 AIM을 이용하여 주성분 분석을 수행하였다. 또한, 통계학적 모델링에서 최대 10대의 PC를 이용하여 집단 계층화에 의한 잠재적 교란을 검정하였다.
통계학적 분석
통계학적 분석 소프트웨어 (SAS), 버전 9.3, JMP 게노믹스, 버전 6.0 (SAS 인스티튜트 인크.(SAS Institute Inc.: 미국 노스캐롤라이나주 캐리), 및 R을 이용하여 통계학적 분석을 수행하였다.
분석 전, 데이터의 품질을 체크하였다. 흑인 및 백인 아동에서 각각 환자의 특징 및 SNP의 특성을 조사하였다. 하디 바인베르크 평형(Hardy weinberg equilibrium: HWE) (문헌 [Stern C., Science, 97:137-8 (1943)])을 검정하였다. 이원 결과 RD 및 PONV를 분석하기 위해, 로지스틱 회귀를 수행하였다. 전체 모르핀 요구량을 분석하기 위해, 선형 회귀를 사용하였다. FAAH 변이체 평가 이전에, 공변량의 효과를 검정하였다. 전체 모르핀 용량에 대하여 연령, 성별, BMI z 점수 및 OSA를 평가하였다. 역효과 결과인 RD 및 PONV의 경우, 전체 모르핀은 추가의 공변량으로 간주하였다. 최적 모델을 선택하기 위해, 로그 우도값, 아카이케(Akaike) 및 베이지안 정보 기준을 비교하였고, 잔차를 조사하였다. 모델 피팅을 유의적으로 개선시킨 (p<0.05) 공변량은 후속 유전적 분석을 위해 그대로 유지시켰다. 단일 SNP와 상기 결과와의 연관성을 평가하기 위해, 가산 모델을 사용하였으며, 여기서, 유전자형을 기록하고, 연속 변수로서 검정하였다. 유전자형을 전체 코호트의 소수의 대립유전자의 개수에 따라 0, 1, 및 2로 기록하였다. 백인 및 흑인 환자에 대하여 따로따로 통계학적 모델링을 수행하였다.
결과
인구 통계. 참가자는 주로 백인이고, 남성보다 여성이 약간 더 많았다. 백인 아동과 비교하였을 때, 흑인 아동의 체중이 약간 더 나가고, OSA 빈도가 높았다. 연구된 269명의 흑인 및 백인 아동에서 자기 보고된 인종은 근원이 되는 유전적 조상과 우수한 상관 관계를 가졌다.
FAAH SNP 특성. 택맨 또는 옴니 5 기법에 의해 FAAH 유전자 중 총 70개의 SNP의 유전자형을 분석하였다. 상기 두 방법에 의해 SNP rs3766246 및 rs324420의 유전자형을 분석하였다; 동일한 유전자형이 관찰되었는데, 이는 유전자형 데이터의 신뢰도를 제안한다. 70개의 SNP 중 39개는 백인 및 흑인 환자, 둘 모두에서 ≥ 0.05의 소수의 대립유전자 빈도 (MAF)를 가졌다. 하디 바인베르크 평형 (HWE) 검정 결과, 상기 39개의 SNP 모두 알파=0.001 수준으로 HWE에 있었다 (39개의 검정의 본페로니(Bonferroni) 보정). 이에 따라, 39개의 SNP를 유전적 연관성 분석에 포함시켰다.
자기 보고된 인종 및 유전적 조상. 218개의 AIM으로부터 추정되는 유전적 조상과 자기 보고된 백인 및 흑인 인종을 비교하였다. 총 259명의 환자 중 250명 (>95%)에서, 자기 보고된 인종은 CEU 및 흑인 조상과 잘 클러스터링되었다. 주성분 (PC) 1 및 2는 백인 및 흑인 인종을 성공적으로 분리하였다. 본 연구에서, 임상의에게 쉽게 이용가능한 바와 같이, AIM와의 비교로 분석은 자기 보고된 인종에 의해 계층화되었다.
임상 결과와의 유전적 연관성. 백인 및 흑인에서 각각 PONV, RD, 및 전체 모르핀 용량과의 단일 SNP 연관성을 검정하였다. 흑인 환자는 더 높은 전체 모르핀 용량 (p<0.05, t 검정)을 요구하였고, PONV (p=0.159, 피셔의 정확 검정(Fisher's exact test))의 발생률은 더 낮은 반면, RD의 발생률은 흑인과 백인 사이에 유사하였다 (p=0.376, 피셔의 정확 검정).
단일 SNP 연관성 검정 결과는 하기 표 1 및 도 1에 요약되어 있다. 백인 환자에서는 PONV와 3개의 SNP (rs324420, rs2295632 및 kgp12517369) 사이에, 및 전체 모르핀 용량과 rs647325 사이에 유의적인 연관성이 검출되었다. 추가로, 수개의 명목 연관성이 관찰되었다. 그러나, 흑인 환자에서는, 상기 결과 중 임의의 것에 대하여 오직 명목 연관성만이 검출되었다 (표 1).
단일 SNP 연관성 검정에 기초하여, 46865040 bp 내지 46882118 bp 범위의 관심 영역을 확인하였다 (도 1). 백인에서는 상기 영역에 포함된 11개의 SNP 중 7개가 PONV와 연관이 있고, 5개가 RD와 연관이 있었다. 연관 분석 결과, 높은 D' 및 R2가 밝혀졌고, 11개의 SNP가 하나의 일배체형 블록에 속한다는 것이 제안되었다.
게놈 과잉. 백인 아동에서 혼합이 PONV와의 유의적인 유전적 연관성에 미치는 효과를 평가하기 위해, 3,097개의 SNP 게놈와이드를 사용하여 게놈 과잉 계수 (λ)를 평가하였다. 상기 분석 결과, λ은 1인 것으로 나타났고, 이는 집단 계층화에 의한 강력한 교란은 존재하지 않는다는 것을 시사한다. 최대 10대의 PC를 사용하여 조정하였을 때, 백인에서는 PONV와의 유전적 연관성이 유의적인 상태 그대로 유지되어 있다.
PONV와의 FAAH 유전적 연관성의 신뢰도. FAAH SNP인 rs324420과 PONV 사이에 생물학적 및 유의적 통계학상 유의적인 연관성이 있기 때문에, 연관성을 입증하기 위해, 본 발명자들은 편도 절제술을 받은 추가의 66명 백인 아동을 이용하여 유사 프로토콜로 연관성을 다시 분석하였다. 더 큰 코호트 (216명의 백인 아동으로 이루어진 원래의 코호트 + 66명 추가의 백인 아동)는 하기의 일관되고 유의적인 연관성을 재현하였다. FAAH SNP인 rs324420은 PONV와 유의적인 연관성이 있었으며 (P = 0.0053), 1 카피의 소수의 대립유전자 (A) 부가는 2.0배 만큼 OR을 증가시켰고; 이는 또한 PONV와도 연관성이 있었고, 이로써, 장기간 PACU 체류를 유도하였으며 (P = 0.0209), 1 카피의 소수의 대립유전자 (A) 부가는 2.2배 만큼 OR을 증가시켰다. 비록 통계학적으로는 유의적이지는 않지만, rs324420 AA 유전자형의 아동은 전반적으로 CC 및 CA 유전자형의 아동 (83.9 (79.9-88.2 분, P = 0.072))보다 더 장기간 (97.9 (84.3-113.6) 분) PACU에 체류하였고, 이는 일반 외래 수술 이후에 임상적으로 및 경제적으로 관련이 있다.
본 발명자들의 연구는 일반 외래 수술인 편도 절제술 이후의 불응성 PONV와 FAAH 다형성 사이의 유의적인 연관성을 밝혔다. 추가로, 백인 아동 군에서 특이 FAAH SNP와, 오피오이드 유도성 RD, 및 PONV에 기인하는 회복실에의 장기간 체류와의 명목 연관성이 확인되었다. 구체적으로, 백인 아동에서, rs4141964, rs3766246, rs324420, rs2295632 및 kgp12517369의 1 카피의 소수의 대립유전자 부가는 PONV의 오즈를 각각 2.42배, 2.42배, 2.73배, 2.61배 및 2.61배 만큼 증가시켰다 (P<0.0018, 표 1). 미스센스 다형성을 포함하는 상기 5개의 FAAH SNP (rs324420)은 오피오이드 관련 RD 및 불응성 PONV에 기인하는 PACU에의 장기간 체류와 명목 연관성이 있었으며, 이는 오피오이드와 엔도칸나비노이드 경로 사이의 가능한 생물학적인 상승적 상호작용을 강조한다.
비공지된 유전적 위험 인자 (예컨대, 초고속 대사자에서 코데인)는 심지어 다른 건강한 환자에서도 호흡 억제, 산소 결핍 및 사망의 위험을 증가시킬 수 있다 (문헌 [Kelly L. et al., Pediatrics, 129:e1343-7 (2012)]; [Sadhasivam S. and Myer C., Pain Med ., 13:982-3, author reply 4 (2012)]). 오피오이드 관련 호흡 억제 및 다른 역효과, 예컨대, PONV의 부정적인 영향을 최소화시키는 데 선제적 위험 확인, 계층화, 및 예방적 조치가 중요하다. 예방적 항구토제에도 불구하고, PONV는 마취 후 큰 문제로 남아있으며, 이는 대개는 오피오이드와 연관이 있다.
요약컨대, 편도 절제술을 받은 아동에서 FAAH 다형성과, 수술 후 오피오이드 관련 호흡 억제, PONV, PACU에의 장기간 체류 사이의 새로운 연관성이 발견되었다. 상기 연관성은 대 척추 유합술을 받은, 나이가 더 많은 다른 청소년 집단에서 입증되었다. 이 결과는 FAAH의 특이적인 유전자 변이체가 아동에서의 수술 후의 오피오이드 유도성 호흡 억제, PONV, 및 PACU에의 장기간 체류와 일관되게 연관이 있음을 입증하며, 이는 인종 및 의학적 배경이 유사한 성인에게로까지 추정될 수 있다. 아동의 통증을 관리할 때, 임상의는 특정의 FAAH 유전자 변이체를 가지는 아동에서 오피오이드 유도성 호흡 억제 및 PONV의 발생률이 잠재적으로 더 높을 것으로 예상하여야 한다.
실시예
2: ABCC3
및
OCT1
유전자형이 모르핀의 약동학적 성질에 영향을 미친다.
본 발명자들은 중요한 수송체 및 효소를 코딩하는 유전자 (OCT1, ABCC3, ABCB1, ABCC2, 및 UGT2B7 포함)의 일반 기능적 결함 유전자 다형성이 모르핀 및 그의 대사산물의 PK를 실질적으로 변경시킬 수 있다는 가설을 세웠다. 상기 전향적 임상 연구의 목표는 중요한 수송체 및 효소의 선택된 유전자 변이체가 편도 절제술을 받은 아동으로 이루어진 확장된 동질 코호트에서 정맥내 모르핀 PK에 미치는 잠재적인 영향에 대하여 평가하는 것이었다. 본 실시예는 추후 문헌 [Venkatasubramanian et al., Pharmacogenomics (2014) 15(10): 1297-1309]에 공개되었다 (상기 문헌의 내용은 본원에서 참조로 포함된다).
연구 디자인, 참가자, 및 절차
본 연구는 clinicaltrials.gov (NCT01140724)에 등록된, "아동에서의 수술 전후의 모르핀 진통제 개인 맞춤화"라는 제목의, 더 큰 규모의 진행 중인 임상 연구의 일부이다. 현 약동학적-약물 유전학적 연구는 앞서 보고된 대상체 이외의 대상체로 이루어진 확장된 코호트를 포함한다 (문헌 [Fukuda, T. et al., Pharmacogenomics, 14:1141-51 (2013)] (상기 문헌은 그 전문이 본원에서 참조로 포함된다)). 본 연구는 외래 아데노이드편도 절제술을 받은 아동으로 이루어진 큰 코호트에서의 수술 전후의 오피오이드에 대한 진통 및 역효과 반응에서의 개체간 변이성에 기여하는 인자를 평가하기 위한, 표준 수술 전후의 관리를 포함하는 전향적, 유전자형-맹검 연구로서 디자인되었다. 본 연구는 신시내티 아동 병원(Cincinnati Children's Hospital Medical Center)에 있는 기관 임상 시험 심사 위원회의 승인을 받았고, 등록 전 부모님으로부터 서면 사전 동의서를 받았고, 적절할 경우, 7세 초과의 아동으로부터 동의를 얻었다.
6-15세이고, 재발성 편도염, 아데노이드편도 비대, 또는 OSA 때문에 편도 절제술 또는 아데노이드편도 절제술을 받기로 예정된, 미국 마취과 학회 체격 1 또는 2를 가지는 청소년 및 아동인 본 연구에 등록하였다. 모르핀 알레르기가 있거나, 출생 후 발달 지연이 있거나, 간/신장 질환이 있거나, 수술 전 통증에 기인하여 만성 진통제를 요구하는 아동 및 영어 소통이 불가능한 아동 또는 부모는 본 연구에서 배제시켰다 (문헌 [Fukuda, T. et al., Pharmacogenomics, 14:1141-51 (2013)]; [Sadhasivam, S., et al., Pediatrics, 129:832-8 (2012)]; [Sadhasivam, S., et al., J. Opioid Manag., 8:217-26 (2012)]). 본 연구에 등록한 아동은 0.2 mg/kg의 수술 중 마취성 모르핀 용량과 함께 표준 수술 전후의 관리를 받았고, 단, 예외적으로, OSA를 앓는 아동은 0.1 mg/kg의 용량으로 받았다.
약동학적 샘플링 및 분석
모르핀, 및 그의 활성 대사산물인 M3G 및 M6G 전신 농도를 정량하기 위해 개별 아동으로부터 연속 혈액 샘플을 수득하였다. IV 모르핀 볼루스 투약 이전에 IV 주입선으로부터 투약전 샘플을 수득하였다. 1차 볼루스 모르핀 정맥내 투약 후 0-5 분, 10-15 분 및 30-45 분째에 독립형 정맥 니들 스틱을 사용하여 추가의 샘플을 수득하였다. 윤리적인 이유에서, 모르핀 투약 후 수득된 혈액 샘플 (1-3번)은 아동이 회복실에서 마취에서 완전히 회복되기 이전에 수집하였다. 확립되고, 입증된, 반자동 액체 크로마토그래피-질량 분석법/질량 분석 검정법을 이용하여 EDTA 혈장 중 모르핀 M3G 및 M6G를 정량화하였다. 분석 방법에 관한 상세한 설명은 다른 곳에도 기술되어 있다 (문헌 [Clavijo, C. et al., Anal. Bioanal. Chem., 400:715-28 (2011)]). 신뢰할 수 있는 정량 한계는 모르핀의 경우, 0.25-1,000 ng/ml (r2 > 0.99)이고, M3G 및 M6G, 둘 모두의 경우, 1-1,000 ng/ml (r2 > 0.99)였다. 전체 부정확도는 15% 미만이었다. 일간 정확도는 85-115% 범위 내에 있었다. 이월, 매트릭스 간섭 또는 피분석물의 정량화를 방해하는 이온 억제/증강은 없었다.
유전자형 분석 및 유전자 샘플링
관련 다형성의 유전자형 분석을 위하여 마취를 위해 배치된 정맥내 주입선을 사용하여 수술실에서 혈액 샘플을 수집하였다. 같은 날 DNA를 단리시키고, -20℃에서 냉동시키고, 상업적으로 이용가능한 택맨 SNP 유전자형 분석 검정법을 사용하여 결정된, 기능상 중요한 유전자 (OCT1, ABCC3, ABCB1, 및 UGT2B7)로 이루어진 사전 선택된 목록 내의 특이적인 SNP에 대해 시험하였다. 휴먼 옴니 5 게놈와이드 휴먼 어레이를 사용하여 상기 선택된 유전자 중의 추가의 중요한 SNP를 확인하였다. Arg61Cys (rs12208357), Gly401Ser (rs34130495), Gly465Arg (rs34059508)를 비롯한, OCT1 수송체 활성의 감소 또는 손실, 및 Met420의 결실 (rs72552763)을 초래하는, OCT1 유전자 중의 4개의 비-동의 SNP에 대해 참가자의 유전자형을 분석하였다. 추가로, mRNA 발현을 변경시켜 핵 인자의 결합에 영향을 미치는 것으로 알려진 ABCC3의 프로모터 영역 중의 SNP인, rs4793665 (-211 C>T)의 유전자형을 분석하였다. 혼합형 만성 통증 집단에서 모르핀 용량 요구가 더 낮고, 암 관련 통증에서 모르핀 진통제가 더 높은 것과 연관이 있는 바, ABCB1 3435T 대립유전자를, 그리고, 유전자형 CC 대상체가 라모트리진 제거 증가와 연관이 있는 바, UGT2B7 -161 C>T 또한 포함하였다.
모르핀 PK 모델 개발 및 평가
인터페이스로서 PsN-툴키트(PsN-Toolkit) (버전 3.5.3)가 장착된 NONMEM (버전 7.2, 아이콘 디브. 솔른.(ICON Dev. Soln.: 미국 메릴랜드주))을 이용하여 모르핀 데이터에 대한 비선형의 혼합 효과, 집단 약동학적 모델을 개발하였다. 통계학적 패키지 R (버전 2.15)을 이용하여 데이터 프리프로세싱, 포스트 프로세싱 및 시각화를 수행하였다. 2 구획 구조를 사용하여 모르핀 농도-시간 프로파일을 기술하였다. 모르핀의 가상 구획으로의 수송에서의 지연에 관한 모델에 지연 구획을 도입하였고, 대사산물 형성은 가상 구획에서 모르핀 농도에 의존하는 것으로 모델링되었다.
먼저 공변량으로서 체중을 사용하였을 때의 효과를 시험하고, 상대 성장 모델과 함께 약동학적 모델에 포함시켰다. 개별 파라미터의 추정치는 로그 정규 분포와 함께 평균 집단 파라미터 및 기본 개체간 변이성에 의존하는 것으로 모델링되었다. 상세한 설명을 위해 문헌 [Venkatasubramanian et al. Pharmacogenomics 2014 15(10):1297-1309]를 참조할 수 있다.
목적 함수 값 (OFV), 잔차 진단, 및 부트스트랩 검증 기법을 이용하는 모델 안정성 고려 사항을 비롯한 다양한 기준을 사용함으로써 모델의 품질을 평가하였다. 상이한 모델 사이의 초기 비교는 내포된 모델 사이의 OFV의 하락=3.84 (p<0.05, DOF=1) (이는 통계학상 유의적인 것으로 간주되었다)인 것에 기초하였다. OFV 향상 이외에도, 모델 지정 오류를 시사하는 것인 가능한 추세를 확인하기 위해 조사된 진단 적합도 플롯, 단일 모드를 보장하기 위해 조사된 η-분포 히스토그램을 이용하여 모델을 평가하였다. 모델을, 1,000개의 무작위로 샘플링된 부트스트랩 데이터세트로 다시 피팅함으로써 최종 모델 안정성을 평가하였다.
약리게놈학적
분석
중량 정규화된 (a) 모르핀 제거; 및 (b) M3G /(c) M6G 형성 제거의 개별 사후 베이지안 추정치에 대한 카테고리별 공변량으로서 선택된 유전자형의 유의도를 검정하기 위해 공변량 분석 또한 수행하였다. 피셔 일원 분산 분석 (p<0.05를 통계학상 유의적인 것으로 간주)을 사용하여 예비 약물 유전학적-약동학적 분석을 수행하였다. 이어서, 유전자형을 모르핀 제거 및 대사산물 형성 제거에 대한 카테고리별 공변량으로서 도입함으로써 유의적인 공변량을 NONMEM으로 공식적으로 검정하였다. 모르핀 PK에서 공변량으로서 유전자형의 유의도는 (a) 내포된 모델 사이의 OFV의 하락=3.84 (p<0.05, 자유도 = 1), 및 (b) 상가 공변량 파라미터 추정치의 정밀도를 포함하는 다양한 기준에 의해 측정하였다.
결과
등록한 대상체의 인구 통계, 본 연구에 등록한 223명의 대상체로부터 모르핀 투약 후 수집된 모르핀, M3G 및 M6G에 대한 시간 및 농도 프로파일, 및 상대 성장 방식으로 (체중)-스케일링된 모르핀 및 대사산물 집단 PK 모델에 대한 NONMEM 모델 파라미터 추정치에 관한 상세한 설명은 문헌 [Venkatasubramanian et al. Pharmacogenomics 2014 15(10):1297-1309]에 기술되어 있다. 간략하면, 등록한 220명의 대상체 중 179명은 백인이고, 38명은 흑인이고, 나머지 6명의 대상체는 아시안계 아동 1명, 아시아 인디언계 아동 1명 및 1명의 백인과 1명의 흑인 부모를 둔 혼혈 아동 4명을 포함한다. 백인과 흑인 코호트 사이에 연령, 체중 또는 신장에 있어서 어떤 유의적인 차이도 관찰되지 않았다.
SNP 유전자형의 분포는 하기 표에 제시되어 있다. 앞서 기술된 바와 같이 (문헌 [Fukuda, T. et al., Pharmacogenomics, 14:1141-51 (2013)]; [Fukuda, T. et al., Clinical Pharmacology & Therapeutics, 93:S49-S49 (2013)]; [Tzvetkov, M. et al., Biochemical Pharmacology, 86:666-678 (2013)]), OCT1 유전자형에 기초하여 대상체를 3개의 군으로 나누었다. 유전자형 분석 결과에 기초하였을 때, 아동 중 58%는 OCT1 야생형이고, 36%는 OCT1 이형접합성이고, 5.4%는 OCT1 동형접합성이었다. 동형접합성 유전자형을 가지는 12명의 아동 중 11명은 백인이고, 1명은 히스패닉이고, 흑인계는 없었다. ABCB1 C3435T 유전자형에서 인종 이질성 또한 관찰되었지만, ABCC3의 -211 C>T 위치에서의 다형성에서는 인종간 차이는 관찰되지 않았다.
모르핀의 약동학적 성질을 그의 전신 제거 (CL)에 대한 개체간 변이성을 포함하는 2 구획 모델을 사용하여 기술하였다. 대사산물 프로파일은 형성 제거에 대한 개체간 변이성을 포함하는 단일 구획 모델을 사용하여 포착하였다. 프로파일은 짧은 샘플링 기간으로 인해 그의 형성에 대한 정보만을 포함하는 바, 선행 보고 (문헌 [Bouwmeester, N. et al., Br. J. Anaesth ., 92:208-17 (2004)])에 기초하여 대사산물에 대한 분포 용적 및 제거를 고정하였다. 모르핀 제거 및 M3G 형성 제거에 대한 η-수축은 낮았지만 (16.5% 및 20%), M6G 형성 제거의 경우, 이는 높았으며 (31.8%), 이는 상기 데이터세트에서 M6G 형성에 관한 정보에는 한계가 있다는 것을 시사한다 (문헌 [Savic, R. and Karlsson, M., AAPS J., 11:558-69 (2009)]). 대사산물의 형성은 가상 구획에서 모르핀 농도에 의존하였으며, 이는 중심 구획에서 지체되었고, 이로써, 대사산물 형성이 지연되었다. 지연 구획을 추가한 결과, 더 이른 조기 시점에서의 대사산물 수준의 과다 예측 및 더 나중의 후기 시점에서의 과소 예측이 제거되었고, 이로써, 유의적으로 더 우수한 모델을 얻었다 (dOFV=-305). 체중이 제거 및 용적에 미치는 효과를 설명하기 위해 지수 0.75 및 1로 상대 성장 스케일링을 도입하였을 때, 이는 모델 피트를 유의적으로 개선시킨 것으로 나타났다 (dOFV=-184) (문헌 [Anderson, B. and Holford, N., Br. J. Clin . Pharmacol., 72:518-20; author reply 521-3 (2011)]). 모르핀 제거에 미치는 인종 효과를 포함함으로써 모델은 개선되었고, 여기서, 흑인이 백인보다 평균 제거가 8% 더 높았다 (문헌 [Sadhasivam, S. et al., J. Opioid Manag ., 8:217-26 (2012)]). 유사하게, 성별은 모르핀 약동학적 성질에 영향을 주며, 여기서, 여아가 남아보다 제거가 5% 더 높았다.
중량 정규화된 모르핀 제거 및 두 대사산물 모두에 대한 형성 제거의 사후 베이지안 추정치에 대한 일원 ANOVA를 사용하여 사전 선택된 기능성 유전자형의 기여에 관한 예비 공변량 분석을 수행하였다. 체중에 기인한 기여를 정규화한 후 수득된 상기 추정치는 교란 인자로서 크기 부재하의 개별 제거 값을 나타낸다. 모르핀 제거에 대한 개별 사후 베이지안 추정치의 시각적 검사 (도 2)는 동형접합성 OCT 유전자형의 대상체가 본 발명자들의 연구 코호트에서 야생형 군 및 조합된 이형접합성 군보다 평균 CLM이 더 낮다는 것을 제안한다. M3G 형성 제거에 대해서도 유사한 추세를 관찰하였는데, 여기서, OCT1 동형접합성 군의 평균 값이 다른 것들보다 ~50% 더 낮았다. 동형접합성 군에서 M-6G 형성 제거가 (~55% 만큼) 더 낮다는 증거는 비록 통계학상 유의적이지는 못하였지만 (p=0.09), 상당하였다. 예비 ANOVA 분석과 일관되게, NONMEM 공변량 분석 결과, OCT1 동형접합성 군은 CLM 및 CLFM3G에 대하여 유의적인 공변량이었고 (dOFV>3.84), 여기서, 동형접합체의 제거가 다른 것들보다 16% 및 48% 더 낮은 것으로 나타났다. (LOQ 미만의 농도 및 분석상의 문제에 기인하여) 12명의 동형접합성 대상체 중 오직 2명에서만 M6G 농도가 정량화되었고, 그 결과로 상이한 군들 간의 M6G 형성 차이에 대하여 제한된 정량적 정보를 얻었다.
ABCC3 -211C>T 유전자형과 관련하여 개별 제거에 대한 사후 베이지안 추정치의 변동에 관한 시각적 검사 (도 2)는 C 대립유전자의 개수가 증가함에 따라 대상체에서 점진적으로 더 높은 대사산물 형성 제거 및 모르핀 제거를 나타낸다. 2개의 대체군, 즉, (1) TT+CT 대 CC & (2) TT 대 CT+CC를 사용하여 예비 일원 ANOVA 분석을 수행하였는데, 이는 모든 변수에 대한 시험에 있어서 전자의 군에 대한 증거가 후자보다도 더 통계학상 유의적이라는 것을 제안하였다 (문헌 [Mizuno, T. et al., Clinical Pharmacology & Therapeutics, 93:S63-S63 (2013)]). NONMEM 모델에서 잠재적 공변량으로서 상기 ABCC3 유전자형을 평가한 결과, CC 유전자형이 통계학상 더 높은 CLFM3G를 가졌고, 그를 포함하는 것이 모델 피트를 상당히 개선시킨 것으로 밝혀졌다 (dOFV=-9). 유사하게, ABCC3 유전자형은 일원 ANOVA (p=0.03) 및 NONMEM 모델에서의 공변량 포함 (dOFV=-4.86)에 기초하였을 때, CLFM6G에 대하여 유의적인 공변량인 것으로 나타났다. NONMEM 모델 추정치에 기초하였을 때, CC 유전자형은 조합된 TT 및 CT 유전자형보다 CLFM3G가 46% (95% CI: 4.3%-88%) 더 높았다. CLFM6G 증가에 대한 추정치는 비록 상기 파라미터에 대한 정밀도는 더 낮았지만, CLFM3G와 유사하였다. 1,000개의 부트스트랩 추정에 기초한 비파라미터 파라미터 신뢰 구간 추정치를 사용하여 실시한 추가의 평가를 통해 47% 및 95% CI의 중앙값은 2%-100%로 CLFM6G의 증가는 적합하게 잘 추정되었음을 확인하였다. 동형접합성 CC 유전자형의 대사산물 형성이 더 높다는 증거가 강력하지만, 그가 모르핀 제거에 미치는 효과는 덜 뚜렷하였다. CC 유전자형의 경우, 모르핀 제거가 다른 것들보다 중간 정도가 더 높은 것으로 (8.1%; 95% CI: -0.7%:16.8%) 추정되는 바, 비록 모델을 유의적으로 개선시키지는 못했지만, 잠재적 공변량으로서 ABCC3 유전자형을 포함하는 것이 모델 피트를 개선시켰다 (dOFV=-2).
개별 제거 (CLM/CLFM6G)에 대한 사후 추정치에서의 변동 (도 2)은 CLM 및 CLFM6G에 대해 미치는 ABCB1 C3435T 유전자형의 어떤 뚜렷한 영향도 보이지 않았다. 그러나, 조합된 CT 및 TT 유전자형을 가지는 대상체는 TT 유전자형을 가지는 대상체보다 CLFM3G가 더 높은 것으로 보였다 (도 2). 이러한 추세는 일원 ANOVA 분석에 기초하여 통계학상 유의적인 것으로 확인되었는데, CT+TT 유전자형이 TT보다 CLFM3G가 18.4% 더 높은 반면 (P=0.04), 그가 CLM에 미치는 효과는 아주 작은 것 (1%)으로 나타났다. 이는 C3435T 유전자형이 CLM 및 CLFM6G가 아닌, CLFM3G (dOFV=-4.32)에 대하여 유의적인 공변량인 것으로 확인된, NONMEM 분석으로부터 얻은 결과와 일치하였다.
논의
최근, 오피오이드 처방이 증가함에 따라, 오피오이드 반응에서의 변이성에 대한 상이한 약물 유전학적 (PG) 인자의 기여도를 정량화하는 것에 대한 관심이 증가하고 있다는 것이 관찰되었다 (문헌 [Branford, R. et al., Clin . Genet., 82:301-10 (2012)]; [Cohen, M. et al., Curr . Opin . Anaesthesiol ., 25:419-27 (2012)]; [Sadhasivam, S. and Myer, C., Pain Med ., 13:982-3, author reply 984 (2012)]; [Eissing, T. et al., Mol . Diagn . Ther ., 16:43-53 (2012)]). 오피오이드 반응에 대한 유전적 변이성의 기여 중 일부는 약역학적 (PD) 인자에 기인하겠지만, 현재 본 연구의 초점은 모르핀 약동학적 성질 (PK)에 대한 PG의 역할을 포착하는 것이다. 여기서, 본 발명자들은 모르핀 및 그의 대사산물에 대한 시간 프로파일을 포착하기 위한 NONMEM 모델을 성공적으로 개발하였다는 것이 밝혀졌다. 사후 개별 추정치와 함께 단순 일원 ANOVA 기반 접근법을 사용함으로써, 사전 선택된 SNP를 CLM, CLFM3G 및 CLFM6G에 대해 미치는 잠재적인 영향에 대해 스크리닝하였다. 이어서, 비록 UGT2B7 또는 ABCC2 유전자형과의 연관성이 발견되지는 않았지만, NONMEM 기반 공변량 분석을 사용하여 모르핀 PK 및/또는 그의 대사산물에 유의적으로 기여하는 3개의 상이한 유전자 (OCT1, ABCC3, 및 ABCB1) 간에 SNP를 확인하였다.
상기의 더 큰 코호트 연구 결과를 통해, OCT1 동형접합성 군이 야생형 및 조합된 이형접합성 군보다 제거가 약 17% 더 낮다는 것을 보여준 본 발명자들의 이전 결과를 확인하였다 (문헌 [Fukuda, T. et al., Pharmacogenomics, 14:1141-51 (2013)]; [Fukuda, T. et al., Clinical Pharmacology & Therapeutics, 93:S49-S49 (2013)]). 본 발명자들의 결과와 일관되게, 2개 이상의 기능적 결함 대립유전자를 가지는 대상체가 다른 것들보다 모르핀 제거가 유의적으로 더 낮다는 것이 별개의 임상 연구를 통해 입증되었다 (문헌 [Tzvetkov, M. et al., Biochemical Pharmacology, 86:666-678 (2013)]). 여기 제시된 결과는 모르핀의 간세포로의 흡수가 제한되어 있고, 기능적 결함 OCT1 유전자형이 모르핀 CL에 직접적으로 영향을 미친다는 추가 증거를 제공한다. CL이 더 낮다는 관찰 결과와 일관되게, 본 연구는 또한 OCT1 동형접합성 대상체에서 두 대사산물, M3G 및 M6G 모두의 형질전환이 더 낮다는 것을 최초로 입증한다. 상기 대상체에서 모르핀의 간세포로의 흡수 제한이 하류의 모르핀 대사 과정에 영향을 미쳤고, 이로써, 모르핀 글루쿠로니드 생성은 저하되었다. 동형접합성 대상체 사이에서 모르핀 CL 뿐만 아니라, M3G/M6G 형성이 더 낮다는 상관 관찰 결과는 모르핀의 간세포로의 OCT1 흡수가 모르핀의 PK에서 중요한 역할을 한다는 것을 더욱 강력하게 입증한다.
생리학적 pH에서, 모르핀은 아미드 기가 하전됨에 따라 (pKa=8.4), 이온화된 상태로 존재할 것으로 예상되며, 이를 통해 OCT1의 적합한 기질이 된다. 시험관내 연구는 모르핀이 낮은 수송체 비의존적 투과성 및 모르핀의 간세포로의 수송체 의존적 흡수 (전체 흡수의 약 60%를 차지)를 가진다는 것을 제안하였다. 추가로, 비록 기능 상실 다형성이 존재할 경우에는 흡수율이 상당히 감소하였지만 (75-100%), 본 연구는 또한 모르핀 흡수는 야생형 OCT1을 과다 발현하는 간세포에서 농도 의존적이라는 것을 보였다. 이러한 결과에 기초하였을 때, 결함 대립유전자의 존재가 미치는 영향은 모르핀 제거 (~16%)에서보다 대사산물 형성 (~45%)에서 더 높았고, 2개 이상의 결함 대립유전자를 가지는 대상체에서 관찰된 37% 더 낮은 AUC와 더욱 일치한다. OCT1의 기질인 모르핀의 특징이 잘 규명되어 있기는 하지만, 지금까지 글루쿠로니드 대사산물 흡수에서의 OCT1의 역할에 대해서는 공지된 바 없다. 상기 결과는 OCT1이 모르핀 제거에 미치는 효과가 현재 16%로 추정되는 것보다 훨씬 더 클 수 있다는 것을 시사하며, 이는 동형접합성 대상체가 모르핀 투약에 대한 반응으로 더 우수한 진통제를 경험하지만, 더욱 악화된 유해 반응을 경험하게 될 것이라는 것을 의미한다.
추가로, 본 연구는 결과, rs4793665 (ABCC3)에서 C/C 유전자형을 가지는 아동은 M6G 형성이 46% 더 높고, M3G 형성이 41% 더 높은 것으로 나타났으며, 이는 조합된 C/T 및 T/T 유전자형과 비교하였을 때, M6G의 혈장으로의 유출이 증가하였음을 나타낸다. 이전 연구에서는 본 연구로부터의 대상체의 서브세트 중 C/T 및 T/T 유전자형을 가지는 가지는 환자에서 M3G 대 모르핀, 및 M6G 대 모르핀의 비가 유의적으로 더 낮았다고 보고되었다 (문헌 [Mizuno, T. et al., Clinical Pharmacology & Therapeutics, 93:S63-S63 (2013)]). 현 NONMEM 기반 분석은 연구 간의 투약 및 체중에 기인한 변동에 대해 이전보다 더욱 잘 설명하며 (문헌 [Mizuno, T. et al., Clinical Pharmacology & Therapeutics, 93:S63-S63 (2013)]), 이로써, 본 결과에 대해서 더 많은 기계론적인 해석을 촉진시킨다. 비록 유전자형이 대사산물 형성을 명백히 변경시키는 것으로 관찰되기는 하였지만, 대상체 사이의 모르핀 제거 증가 또한 관찰되었다. 비록 ABCC3에 의한 모르핀의 혈장 내로의 유출이 추측되기는 하였지만, 모르핀이 ABCC3의 기질이라는 뚜렷한 증거는 존재하지 않는다 (문헌 [Tzvetkov, M. et al., Biochemical Pharmacology, 86:666-678 (2013)]).
모르핀 투약 후 역효과 발생률은 흑인 아동에서보다 백인 아동에서, 및 비라틴계 아동보다 라틴계 아동에서 더 높은 것으로 보고되었다 (문헌 [Sadhasivam S. et al., Pediatrics, 129:832-8 (2012)]; [Sadhasivam S. et al., J. Opioid Manag., 8:217-26 (2012)]; [Jimenez, N. et al., J. Health Care Poor Underserved, 21:229-36 (2010)]). 본 발명자들은 진료소에서 모르핀 요구량에 있어서 인종 간에 차이가 관찰되었다고 보고하였으며, 여기서, 백인 아동과 비교하였을 때, 흑인 아동이 더 많은 모르핀을 요구하였다. 본 발명자들은 백인이 흑인보다 모르핀 CL이 8% 더 낮았고, 이는 OCT1 유전자형을 인종과 함께 공변량으로서 포함시켰을 때, 7%까지 추가로 감소하였다는 것을 발견하였다. 또한, 본 발명자들의 PK/PG 연관성은 다수 인종 (백인: 80%) 사이에 시험되었을 때 일관되게 재현되었고, 이로써, 집단 계층화의 영향을 제한하였다. 본 발명자들이 이전에 보고한 바와 같이, 흑인과 비교하였을 때 백인 사이에서 OCT1 동형접합성 군의 빈도가 더 높은 것은 (약 5%) 백인 아동에서 모르핀 CL이 더 낮은 것에 대한 이유 중 하나가 될 수 있다.
결론적으로, 상기의 큰 소아 약동학적 및 약물 유전학적 연구는 체중 이외에도, OCT1 및 ABCC3 동형접합성 유전자형이 모르핀 및 그의 대사산물의 약동학적 성질에서 중요한 역할을 한다는 것을 입증한다. 구체적으로, ABCC3 rs4793665 동형접합성 C/C 유전자형을 가지는 아동이 야생형 및 조합된 이형접합성 유전자형보다 M6G 형성률이 약 46% 더 높았고, 이로써, 혈장으로의 M6G 수송은 증가되었으며; 일관되게, 동형접합성 C/C 유전자형에서 M3G 형성이 41% 더 높다는 것 또한 관찰되었다. OCT1 동형접합성 유전자형 (n=12)은 모르핀 제거가 유의적으로 더 낮은 것으로 나타났다 (~17%). 백인 집단에서 ABCC3 rs4793665 C/C 및 OCT1 동형접합성 유전자형의 빈도가 더 높은 것으로 관찰되었다. 이러한 관찰 결과는 흑인보다는 백인에서 모르핀 제거가 더 낮고, 모르핀에 따른 역효과의 발생률이 더 높다는 것을 부분적으로 설명한다. 여아와 남아 사이의 모르핀 제거에서의 작은 차이 또한 관찰되었다.
실시예
3: ABCC3
,
ABCB1
, 및
FAAH
변이체
입증
ABCC3에 대한 상기의 결과를 확장하고, 입증하는 추가 연구를 수행하였다. 약동학적 모델 및 분석은 상기 논의된 바와 같았다. 상기 기술된 편도 절제술 코호트 (T&A 연구) 이외에도, 본 연구에서는 척추 후부 유합술을 받은 청소년으로 이루어진 상이한 수술 집단 또한 포함하였다 (척추 연구). 척추 연구군은 척추 후부 유합술을 받은, 특발성 척주측만증을 앓는 88명의 비비만성 청소년을 포함하였다. 수술 후 모든 환자는 모르핀 통증 자가 조절법을 받았고, 48시간 동안 추적 조사되었다. 모르핀 소비, 수술 후 통증 점수, 디아제팜 및 다른 진통제의 사용에 관한 데이터를 기록하였다. 등록한 대상체는 11 내지 19세였고; 59%가 여성이고, 85%가 백인이었다.
상대 성장 스케일링을 이용한 모르핀 및 대사산물 집단 PK 모델에 대한 모델 파라미터 추정치가 하기 표에 제시되어 있다.
도 3a는 본 발명자들의 연구에서 관찰된 ABCC3 rs4793665 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이를 보여주는 것이다. 전반적으로, rs4793665 유전자형은 NONMEM 공변량 분석에 기초하였을 때, FCLM6G 및 FCLM3G에 대해 유의적인 공변량인 것으로 나타났고 (각각 dOFV= -8.41 및 -7.44), 여기서, CC 유전자형은 다른 것들보다 형성이 각각 38% 및 46% 더 높았다. CC 유전자형을 가지는 대상체는 또한 척추 연구에서 M6G 형성 CL이 유의적으로 더 높은 것 (38% 더 높은 것; 29% RSE)으로 나타났다. 비록 유의적이지는 않았지만, 아데노이드편도 절제술을 받은 대상체 사이에서도 유사한 추세가 관찰되었다. 상기 두 연구 간에 CC 유전자형은 더 높은 M3G 형성 CL과 유의적인 연관성이 있었으며, 아데노이드편도 절제술 (46% 더 높은 것; 46% RSE) 및 척추 (57% 더 높은 것; 38% RSE) 연구로부터의 추정치는 유사하였다.
도 3b는 본 발명자들의 연구에서 관찰된 ABCC3 rs4148412 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이를 보여주는 것이다. rs4148412 AA 유전자형은 NONMEM 공변량 분석에 기초하였을 때, FCLM3G에 대해 유의적인 공변량인 것으로 나타났고 (dOFV= -6.54), 여기서, AA 유전자형은 형성이 36% (95% CI [-0.002;0.71]) 더 높았다. rs4148412 AA 유전자형을 가지는 척추 대상체 사이에서 일관된 PK-PG 연관성이 관찰되었는데, 이는 NONMEM을 사용한 공변량 분석에 기초하였을 때, FCLM3G에 대하여 강력한 추세의 공변량 (dOFV= -3.8)임을 나타내었다. 다른 유전자형들보다 rs4148412 AA 유전자형을 가지는 척추 대상체 사이에서 형성이 48% (95% CI[0.21;1.06]) 더 높은 것으로 추정되었다. 요약컨대, AA 유전자형을 가지는 대상체는 아데노이드편도 절제술 연구에서 M3G 형성 CL이 유의적인 더 높은 것 (36% 더 높은 것; 51 % RSE)으로 나타났다. 척추 연구에서 유의적인 경향이 있는 (p=0.06) 유사한 추세가 관찰되었는데, AA 유전자형에서 형성이 52% 더 높았다 (60% RSE). 상기 두 연구 간에 AA 유전자형에서 M6G 형성이 더 높은 추세를 보였다.
도 4a는 본 발명자들의 연구에서 관찰된 ABCC3 rs739923 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이를 보여주는 것이다. rs733392 유전자형은 척추 대상체 사이에서 M3G 형성에 대해 유의적인 공변량이었고, 여기서, AA 대상체가 다른 것들보다 형성이 57% 더 낮았다. 그러나, rs733392 유전자형은 더 큰 T&A 연구에서는 유의적인 공변량이 아니었다. ABCC3 rs739923 유전자형과 모르핀 CL 및 대사산물 형성 CL 사이에는 어떤 유의적인 유전적 연관성도 관찰되지 않았다.
도 4b는 본 발명자들의 연구에서 관찰된 ABCC3 kgp8560677 유전자형에 따른 모르핀 CL 및 대사산물 (M3G/M6G) 형성 제거 (FCLM3G & FCLM6G)에서의 개체간 변이를 보여주는 것이다. ABCC3 kgp8560677 유전자형과 모르핀 CL 및 대사산물 형성 CL 사이에는 어떤 유의적인 유전적 연관성도 관찰되지 않았다.
상기 결과는 하기 표에 요약되어 있다.
한 분포 구획은 각 대사산물에 대한 것이고, 한 구획은 대사산물 형성 지연에 대해 나타내는 것인, 모르핀에 대한 중심 및 주변 구획을 포함하는 같은 구조의 PK 모델을 사용하여 두 연구로부터의 모르핀 및 대사산물 약동학적 성질을 잘 기술하였다. 모르핀 PK 모델에 대한 모델 파라미터는 두 연구 간에 유사한 것으로 나타났으며, 척추 대상체에 대한 모델 파라미터가 T&A 대상체보다 더 높았다. 두 연구로부터 모르핀 모델에서의 차이는 (a) 집단, (b) 공동 투약 및 (c) 약동학적 샘플링 전략법의 차이에 기인하여 발생하는 연구간 변동 때문일 수 있다. M6G 모르핀 제거 추정치 대비 M3G 형성 제거의 비는 척추 연구에서는 7.2이고, T&A 연구에서는 9.6인 것으로 나타났다. 이는 M3G 대사산물 형성이 M6G 형성의 7-10배라는 다른 보고와 일치한다.
선행 연구에서, 본 발명자들은 rs4793665 (ABCC3)의 C/C 유전자형을 가지는 아동에서 M6G 형성이 46% 더 높고, M3G 형성이 41% 더 높다는 것을 밝혔으며, 이는 조합된 C/T 및 T/T 유전자형보다 혈장으로의 대사산물 유출이 증가하였음을 나타낸다. 본 분석에서, 본 발명자들은 ABCC3 rs4148412 AA 유전자형에서 M3G 형성이 더 높다는 것을 발견하였다. rs4148412에서의 유전적 변이가 ABCC3 기능에 미치는 영향에 대한 기계론적인 이유에 대해서는 잘 이해되고 있지 않다. ABCC3은 주로 간세포의 기저측 표면에서 발현되는 것으로 밝혀졌고, 모르핀 글루쿠로니드에 대하여 높은 친화성을 가지는 것으로 보고되었다. 비록 유전자형이 대사산물 형성을 명백히 변경시키는 것으로 관찰되기는 하였지만, 모르핀 제거에 대해 어떤 유의적인 영향도 관찰되지 않았다.
ABCC3 SNP의 유의도를 추가로 측정하기 위해, 본 발명자들은 임상 결과로부터 그를 입증하였다. 도 6은 척추 후부 유합술을 받은 청소년에서 ABCC3 rs733392와 호흡 억제 사이의 연관성 입증을 보여주는 것이다.
하기 표는 임상 결과에 따른 ABCC3의 명시된 변이체의 입증을 나타낸 것이다. chr17:48710 kb 내지 chr17:48770 kb의 총 65개의 SNP를 포함하는, GWAS ABCC3 데이터에 대한 Plink 분석이 품질 관리를 통과하였다. 백인 및 흑인 집단을 조합하고, 모델 뿐만 아니라, 다른 유의적인 공변량에서 조정되었다. 본 분석을 위해, 오즈비는 동형접합성 돌연변이체 대 het/het 대 야생형으로서 계산하였다; PONV = 수술 후 오심 및 구토; 및 장기간RD = PACU 체류를 장기화시키는 호흡 억제.
하기 표는 오즈비 (OR) 및 95% 신뢰 구간으로 표시된 효과와 함께, 중요 영역 중의 ABCC3 SNP에 대한 호흡 억제에 기인하는 장기간 PACU 체류와의 연관성을 보여주는 것이다. 오즈비는 소수의 대립유전자 (인종 조합)가 1 카피에 의해 증가하였을 때의 비를 나타낸다. 도 9는 인간 일루미나 옴니5 GWAS 칩으로부터의 ABCC3 SNP와 수술 후 호흡 억제 사이의 연관성을 보여주는 것이다.
추가로, 본 발명자들은 더 큰 샘플을 이용하여 상기 논의된 ABCB1, FAAH, 및 OPRM1 데이터를 분석하였다. 하기 표에 상세하게 제시된 바와 같이, ABCB1 rs9282564와, PACU 체류를 장기화시키는 호흡 억제 (plongRD)와의 연관성, 및 FAAH rs324420과 수술 후 오심 및 구토 (PONV)와의 연관성의 유의성은 0.0002 및 0.0143인 p 값으로 입증되었다. 본 결과는 오즈비로 제시된 바와 같이, 각 사례에서 소수의 대립유전자를 가지는 환자가 상기 유해 사례에 대하여 위험이 더 높았다는 것을 나타내었다.
실시예
4:
청소년에서의
척추 유합술 이후의 모르핀 유도성 호흡 억제의 위험과
OPRMI
A118G
변이체의
연관성
본 연구는 OPRM1 A118G 변이체가 모르핀 유도성 호흡 억제 (MIRD)에의 감수성에 영향을 줄 수 있는지 여부를 측정하기 위해 수행하였다. 본 실시예는 추후 문헌 [Chidambaran et al. The Pharmacogenomics Journal (2014) 1-8] (상기 문헌은 본원에서 참조로 포함된다)로서 공개되었다.
IRB 승인 및 동의 후, 척추 후부 유합술을 받은, 특발성 척주측만증을 앓는 88명의 비비만성 청소년에서 전향적 유전자형 맹검 연구를 수행하였다. 수술 후 모든 환자는 모르핀 통증 자가 조절법을 받았고, 48시간 동안 추적 조사되었다. MIRD 결과는 >3분 동안 교정 처치를 필요로 하면서, 분당 RR<8회인 것인 수술 후 발생하는 것으로 정의되었다. 모르핀 소비, 수술 후 통증 점수, 디아제팜 및 다른 진통제의 사용에 관한 데이터를 기록하였다. 환자를 OPRM1 A118G 변이체에 대하여 환자의 유전자형을 분석하였다. OIRD에 영향을 미치는 인자에 대한 회귀 분석은 인종, 성별, 모르핀 요구량, 및 유전자형을 포함하였다. 유전자형 서브군에서 통증 점수 및 관련 변수를 비교하였다. 등록한 대상체는 11-19세였고; 59는 여성이고, 85%는 백인이었다. OPRM1 유전자 변이체에 기초하였을 때, 67명은 야생형에 대해 동형접합성 (AA)이고, 21명은 변이체에 대해 이형접합성/동형접합성 (AG/GG)이었다. AA 유전자형을 가지는 37%는 POD1/2째 MIRD를 앓은 반면, GG/AG 유전자형을 가지는 대상체 중 단 9%만이 MIRD를 앓았다 (도 7a). 변수에 대하여 조정한 후, G 대립유전자를 구완하는 환자와 비교하였을 때 AA 유전자형을 가지는 환자에서 MIRD는 유의적으로 더 높았다 (>5배) (OR 95% CI:1.5-40.6, p=0.027) (도 7b). AA 유전자형과 비교하였을 때, AG/GG 유전자형을 가지는 아동이 POD1/2째 통증 점수가 유의적으로 더 높고 (p=0.02), 모르핀 요구량이 더 많았다 (도 7c).
이는 AG/GG 유전자형보다 모르핀 요구량이 더 적음에도 불구하고, 호흡 억제가 OPRM1 AA 유전자형에서 더 높다는 것을 보여주는 최초의 전향적 임상 시험이다. A118G 변이체에의 G 대립유전자의 존재는 MIRD에 대하여 보호성 효과를 가진다. 이러한 유전자형-호흡 억제 연관성은 중증 역효과의 가능성은 최소화하면서, 위험이 더 높은 아동을 예측하고, 통증 완화를 최대화시키기 위해 아동에서의 모르핀 사용을 개인 맞춤화하는 데 있어 중요한 단계이다.
실시예
5: 소아 편도 절제술 이후의 오피오이드 유도성 호흡 억제의 유전적 위험
시그너쳐
유전적 연구 결과를 임상 실시 및 유전적 위험 인자의 중요한 영향에 관한 더욱 우수한 임상적 적응가능성으로 해석하기 위해, 다변량 예측인자에 기초한 용이한 적용가능한 임상적 결정 규칙을 개발하여야 한다. 본 연구의 목적은 유전 인자 및 비-유전 인자를 사용하여 모르핀 유도성 호흡 억제에 대한 감수성을 예측하기 위한 신뢰가능하고, 안정적인 모델을 개발하고자 하는 것이었다. 본 실시예는 추후 문헌 [Biesiada et al., Pharmacogenomics (2014) 15(14): 1749-1762] (상기 문헌은 본원에서 참조로 포함된다)에 공개되었다
호흡 억제에 대한 유전적 위험 인자를 확인하는 것은 유전자 대 유전자 사이의 상호관계 (개별 유전자/마커와 RD 사이의 연관성은 약하다)에 의해, 및 인종 및 조상, 다양한 임상적 병태, 예컨대, OSA, 및 심지어는 문화적 배경에 의해 복잡해지며, 이는 통증 내성 및 그 결과로서 생성된, 통증을 호전시키는 데 사용되는 오피오이드 용량에 영향을 줄 수 있다. 그 결과, 환자를 상이한 서브타입으로 계층화시키는 전략법은 SNP (또는 다른 마커)와 RD 사이의 더욱 강력한 (및 가능하게는 각 서브타입에서의 상이한) 연관성 패턴을 확인하는 데 도움을 줄 수 있다.
본 연구에서, 감독 접근법 및 무감독 접근법을 사용하여 본 목적을 달성하였다. 결정 수형도를 사용하여 재귀 분할은 데이터의 고유 계층화를 제공하고, 예측 SNP (및 그의 조합) 선별 및 전체적인 정확도를 최적화시킨다. 추가로, 결정 수형도는 임상적 결정 지원을 위한 기초로서 사용될 수 있는 결정 규칙을 해석하기 위한 단순물을 제공한다. 무감독 클러스터링 접근법은 코호트를, 다중 SNP에서의 대립유전자 뿐만 아니라, 상기 언급된 복잡한 상호작용을 포착하는 데 관련이 있을 수 있는 다른 특징을 공유하는 환자 클러스터로 계층화하는 대안을 제공한다. 대개는 상이한 클러스터를 정의하는 데 기여하는 SNP (및 임상 변수, 예컨대, OSA)는 예를 들어, 암의 분자 서브타입을 정의하는 유전자 시그너쳐와 유사하게, 상기 클러스터 (서브타입)의 "SNP 시그너쳐"로서 간주될 수 있다.
상보적 분류 (재귀 분할) 및 클러스터링 (SNP 시그너쳐) 전략법을 사용하는 것은 또한 결과 입증을 촉진시키고, 데이터에서 은닉된 구조를 공개할 수 있다. 본 연구에서는 두 접근법 결과를 통해 매우 일관된 결과를 얻었다는 것이 밝혀졌다. 유의적으로 상이한 RD 위험을 특징으로 하는 상이한 클러스터 둘 모두에 기여하는 수개의 SNP가 발견되었다. 특이 계층 내에서 비교적 높은 정확도로 RD를 예측하는 데 사용될 수 있는 결정 규칙 또한 확인되었다. 본 결과는 하기에 요약된다.
연구 디자인, 참가자, 및 절차
적절한 IRB 승인 및 동의 후, 표준 수술 전후의 관리의 일부로서 모르핀을 받은, 편도 절제술을 받은 273명의 6-15세 아동에서 전향적 유전자형-맹검 시험을 수행하였다. 모든 환자를 회복실에서 모르핀 요구량, RD의 통증 결과 및 발생, 연구된 1차 결과에 대해 관찰하였다. RD는 임상적으로 명백한 상기도 폐색의 부재하에서 SpO2 >92%를 유지시키기 위해 보충 산소를 필요로 하는, 호흡률이 분당 호흡수 <10회이거나, 또는 지속적인 산소 탈포화 <92%인 것으로 정의되었다. 택맨 검정법을 사용하여 모든 환자를 모르핀 약동학적 성질 및 호흡 억제에 관여하는 것으로 알려진 15개의 유전자 중 48개의 단일 뉴클레오티드 다형성 (SNP)에 대하여 유전자형을 분석하였다. 유전 인자 및 비-유전 인자 (인종, 성별, OSA)를 RD 위험과의 연관성에 대해 분석하고, 단순 논리 규칙 및 결정 수형도 접근법을 이용하는 단계식 위험 기반 알고리즘을 구성하였다.
결과
본 연구는 그의 통증을 호전시키기 위해 추가의 수술 후 모르핀 투약을 요구한 환자 (273명의 환자 중 170명, 그 중 45명은 RD를 앓았다)에서 RD의 위험을 고려하였다. 이러한 방식으로 분석을 계층화함으로써 분석은 더 높은 통증 감수성, 인종, 및 OSA 사이의 상호작용을 더욱 잘 고려할 수 있게 되었다 (역효과 위험이 더 높은 것에 기인하여 OSA를 앓는 환자는 예방 조치로서 더 낮은 출발 용량의 모르핀을 얻는다). (비-OSA 환자의 경우, 0.2이고, OSA 환자의 경우, 0.1인 기준선과는 대조적으로 0.3 mg/kg 초과인 것으로 정의되는) 고용량의 모르핀을 받은 환자의 서브세트에 대하여 정량적으로 유사한 결과를 얻었는데, RD의 예측된 위험을 고려해 볼 때, 이는 상기 확인된 결정 규칙을 사용하여 모르핀의 추가 투약에 관한 임상적 결정을 가이드할 수 있다는 것을 시사한다.
무감독 클러스터링 접근법 및 본 분석에 포함된 모든 SNP (서로 높은 LD에 있는 것은 배제)를 사용하여, 5개의 클러스터가 확인되었는 데, 여기서, RD 위험은 "저위험 클러스터"의 경우, 약 10%에서부터 "고위험 클러스터"의 경우, 약 40%까지로 점진적으로 증가하였다 (도 8a). 인종, OSA, 및 성별을 비롯한, 수개의 임상적/인구 통계 변수를 상기 단계에서 사용하였다는 점에 주의하여야 한다. 그러나, 클러스터링 결과에 편향하면서, 상기 변수는 확인된 클러스터와 뚜렷한 연관성은 보이지 않았다. 상기 정의된 클러스터의 중심을 사용함으로써 (암 서브타입 분류를 위한 "유전자 시그너쳐" 기반 접근법과 유사; 여기서, SNP 시그너쳐를 사용하여 위험 서브타입을 결정한다) 고위험 대 중간 정도의 위험 대 저위험 배정에 대하여 약 82%의 정확도를 얻었다.
상기 수득된 계층을 분석한 결과, 대부분의 차별적 신호는 단지 소수의 SNP로부터 기원한다는 것이 밝혀졌다. 이는 단변량 분석과 비교하였을 때, 3가지 SNP, 즉, rs2295632 (FAAH), rs1045642 (ABCB1), 및 rs1042713 (ADRB2)의 조합이 RD 사례의 식별을 개선시킨다는 사실에 의해 강조된다. 도 8b에 제시된 결정 수형도로부터 유도된 단순 결정 규칙을 사용함으로써 (상위 식별 SNP rs2295632 단독의 경우, 0.0002인 것과 대조적으로) p 값 = 0.000003을 얻었으며, 이를 통해 저위험 계층 대 고위험 계층을 확인할 수 있게 되었고, 여기서, 수술 후 개입을 요구한 환자 세트에서 균형잡힌 정확도는 약 70%였다:
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, RD=없음 (RD 위험 낮음),
거짓이면, RD=있음 (RD 위험 높음).
상기 결정 규칙은 포함된 3개의 유전자좌 모두에 위험 대립유전자를 가지는 환자로서 고위험 환자를 확인한다 (도 8b의 수형도 가장 우측 리프, 26건의 사례는 RD=있음, 및 24건의 사례는 RD=없음). 본원에서 제시된 "SNP 시그너쳐"는 무감독 접근법 사용으로 유도되었고 (따라서, 훈련 세트에서 모델에서의 파라미터의 최적화를 필요로 하지 않았고), 이는 그의 일반화에 대해 좋은 징조를 나타낸다. 본 데이터의 계층적 클러스터링은 본 연구의 공개된 버전인 문헌 [Pharmacogenomics, 15(14):1749-1762 (2014)]에 제시되어 있다.
이러한 관찰 결과는 SNP 선택, 코딩 대립유전자 (대립유전자 대 우성-열성 기반), 추가의 계층화 기준 포함 (예컨대, 고용량의 모르핀 대 요구되는 개입)의 효과에 대해 시험함으로써 입증되었다. 관찰된 클러스터링 패턴의 안정성을 추가로 평가하기 위해 부트스트랩핑을 수행하는 데 PVCLUST 또한 사용하였다. 5개의 주요 클러스터에 대한 지원은 높지만, 그의 전체 순서는 훨씬 덜 안정적이고, 지원이 낮으며, 이는 추가 개선될 수 있음을 제안한다.
독립 입증을 위해, 제1 단계 프로젝트의 결론 이후로 그의 데이터 이용이 가능해진 74명의 환자로 이루어진 세트를 사용하였다. 274명의 환자로 이루어진 훈련 세트와 함께 이들 새로운 데이터 점을 클러스터링하였을 때, 단지 274명의 환자로 이루어진 훈련 세트에서 관찰된 클러스터링 패턴이 재현되었다. 개입을 요구한 대조군 세트로부터의 새로운 환자의 경우, 고위험 클러스터로 배정된 환자 (30%)와 비교하였을 때, 저위험 클러스터로 배정된 환자는 2배 더 적은 RD 사례 (16%)를 가졌다. 추가로, 가장 끝의 두 클러스터 (RD 위험이 가장 높은 것 및 RD 위험이 가장 낮은 것)가 사실상 다소간 더욱 잘 분리되었고, 더욱더 많은 데이터가 이용가능할 때 추가로 개선될 수 있다는 것을 시사한다 (도 10). 적절한 독립 입증 후에, 유전자형 기반 결정 알고리즘은 선제적으로 기본적 위험을 측정하고, 수술 전후의 관리를 적합화하고, 개인 맞춤형 진통제의 임상적 실시에서 중요한 기초 단계를 형성하는 데 도움을 줄 수 있다.
실시예
6: 수술을 받은 아동에서의 오피오이드 관련 역효과: 여아에서의 불평등한 부담
아동에서 진통 효과 및 역효과에 의해 오피오이드에 대한 성별 특이 반응을 연구한 임상 연구는 없다.
소아 집단에서 모르핀 효과에서의 성별에 따른 차이를 연구하는 것은 특히 중요한데, 그 이유는 그의 기초가 되는 기전이 생리학적, 발생적 및 호르몬 인자에 의해 영향을 받을 가능성이 있기 때문이며, 이는 사춘기 이전의 아동, 청소년 및 성인 사이에서 달라질 수 있다. 다른 수술을 받고, 다른 수술 전후의 약물을 받은, 다른 동반이환 병태를 앓는 성인과 비교하였을 때, 표준화된 수술 전후의 관리를 받은, 1가지 유형의 수술을 받은, 비교적 많은 건강한 아동이 오피오이드와 관련된 개체간 변이를 연구하는 데 있어 더 우수한 집단이다. 본 연구에서는 오피오이드를 사용하였을 때, 아동의 성별이 수술 후 진통 및 유해 결과에 영향을 줄 것이라는 가설을 세웠다. 그러므로, 본 발명자들의 목적은 편도 절제술을 받은 아동에서 모르핀의 진통 특성 및 역효과를 측정하는 데 있어 아동 성별의 역할을 측정하는 것이었다. 다양한 오피오이드 반응에 기여하는 인자에 대한 지식 정보가 오피오이드 투약, 진통 결과를 최적화하고, 추후 역효과 예방 전략법에 대한 정보를 제공하는 데 도움을 줄 것이다.
연구 디자인, 참가자, 및 절차
이는 편도 절제술 집단에서의 표준 수술 전후의 마취 및 수술 실행 및 표준 수술 후 간호와 함께 하는 전향적 임상적 관찰 연구였다. 본 연구는 신시내티 아동 병원 (미국 오하이오주 신시내티)에 있는 기관 임상 시험 심사 위원회의 승인을 받았고, 적절할 경우, 모든 부모님 및 참가 아동으로부터 서면 사전 동의서 및 동의를 받았다. 본 프로젝트에서 특정 인종에 대한 선택은 없었지만, 병원에서 편도 절제술 또는 아데노이드편도 절제술 (T/TA) 수술을 받은 환자의 인구 통계를 고려해 볼 때, 대부분은 백인이었다 (도 11). 다중 인종에 대한 데이터가 이용가능하지만, 흑인 아동에서보다 백인 아동에서 역효과가 상대적으로 더 많다는 이전 연구에서 인종에 의한 아동에서의 오피오이드 관련 유해 사례 차이가 나타났는 바, 이에 비백인 남아 및 여아에 대한 샘플 크기가 작다는 점을 고려하여 본 연구는 백인 아동에 초점을 맞추었고, 백인 아동에서의 성별 효과를 조사하였다 (문헌 [Sadhasivam S. et al., Pediatrics, 129:832-8 (2012)]).
본 연구에 자격이 있는, 선택적 외래 T/TA를 받은 6-15세 아동에서 착수하여 2008년 8월 내지 2012년 2월 사이의 수술 당일에 동원하였다. 인종은 부모님 또는 아동에 의해 자기 보고되었고; 자기 보고는 인종을 확인하는 데 잘 허용된다 (문헌 [Boehmer U. et al., American Journal of Public Health, 92:1471-2 (2002)]; [Dahan A. et al., Anesthesiology, 88:903-13 (1998)]). 샘플 포함 기준은 재발성 편도염, 아데노이드편도 비대, 또는 OSA 때문에 T/TA를 받기로 예정된, 미국 마취과 학회 (ASA) 체격 1 또는 2를 가지는 것으로 지정된 아동이었다. OSA 지정에 대한 임상 기준으로는 코골이와 함께, 수면 중 휴지 시간이 10초 초과로 지속되거나, 또는 주간 졸림증의 병력이 있는 수면 장애 호흡을 앓는 것을 포함하였다. 아동 또는 아동의 부모님이 비영어를 사용할 경우, 그 아동은 연구로부터 배제시켰다. 모르핀에 대하여 알레르기성이거나, 또는 발달 지연, 간 또는 신장 질환, 또는 오피오이드 진통제를 필요로 하는 수술 전 통증 (예컨대, 만성 편도염)이 있는 아동은 배제시켰다. 본 연구에 대한 연구 코디네이터에 대한 이용가능성에 제한이 있었는 바, 자격이 있는 대상체 모두를 동원하지는 못했다 (도 11).
상기 학회의 T/TA 표준 실시의 일부로서 모든 아동은 수술 중에 예방적 온단세트론 (0.1 mg/kg) 및 덱사메타손 (0.1 mg/kg)을 수령한다. 마취는 기관내 삽관을 용이하게 하기 위해 세보플루란 흡입 유도에 이어서, 프로포폴 (2 mg/kg) 볼루스를 통해 유도된다. 신경근 차단을 사용하지 않고, 세보플루란으로 마취를 유지시켰다. 환자는 외과적 절개 이전에 선행 진통제를 위해 모르핀을 수령한다. OSA 병력이 있는 아동은 0.1 mg/kg 모르핀을 받은 반면, OSA 진단을 받지 않은 아동은 0.2 mg/kg을 수령한다. 외과적 절개 및 소작술 이후 통증을 시사하는 임의의 징후 (심박수 및 혈압의 임상적으로 유의적인 증가)가 있는 경우, 임상 마취 팀은 필요할 경우, 수술 중에 추가의 모르핀을 제공한다.
결과
진통 효과 및 오피오이드 관련 역효과에 대한 결과를 수집하였다. 진통 효과 결과는 수술 후 통증 점수, 모르핀 용량 (mg/kg), 정맥내 진통제 개입 요구 여부 (예/아니오), 통증에 기인하는 장기간 PACU 체류 (> 90분) (예/아니오), 및 주어진 진통제 개입 총 횟수를 포함하였다. 추가로, 각각 0 내지 10 숫자 통증 척도(Numerical Rating Scale: NRS) (문헌 [Voepel-Lewis T. et al., Anesth . Analg., 112:415-21 (2011)]) 및 0 내지 10 FLACC (얼굴 표정; 다리 운동; 활동; 울음; 및 진정됨) 척도 (문헌 [Merkel S. et al., Pediatr. Nurs., 23:293-7 (1997)])를 사용하여 주관적 및 객관적 통증 점수를 평가하였다. 유의적인 수술 후 통증 (NRS 또는 FLACC ≥ 4/10)은 PACU에서 구제 용량의 모르핀 (0.05 mg/kg)으로 관리하였다. 최고 NRS 및 FLACC 점수를 조사하였다.
2 세트의 이원 결과: 1) RD, 오심/구토 (PONV) 및 소양증을 비롯한 오피오이드 관련 부작용; 2) 호흡 억제 또는 오심/구토에 이은 장기간 PACU 체류에 의해 역효과를 측정하였다. 본 발명자들의 연구에서, RD는 1분 이상 동안의 임상적으로 명백한 상기도 폐색 및 인공물의 부재하에서 SpO2 >92%를 유지시키기 위해 보충 산소를 필요로 하는, 지속적인 호흡률이 분당 호흡수 <10회이거나, 또는 지속성 산소 탈포화 <92%인 것으로 정의되었다.
PACU 체류 지속 기간 (PACU 퇴원 준비가 될 때까지의 소요 시간)은 하기의 퇴원 기준을 달성하기 전까지 PACU에 있는 지속 기간으로서 정의된다. 의식 수준: 쉽게 각성가능하거나, 깨어 있는 정도, 기도: 공기 교환이 적절한 환자, 심부 체온: ≥ 36.3℃, 허용되는 통증 수준 (통증 점수 <4), 혈역학적으로 안정적, 유의적인 오피오이드 관련 역효과, 예컨대, PONV 및 호흡 억제 없음, 및 어떤 출현도 또는 합병증도 없는 수술 부위. 상기 퇴원 준비 시간은 (예컨대, 차를 기다리는 것 등과 같은) 사회적인 이유에 기인한 지연은 포함되어 있지 않기 때문에, 실제 PACU 퇴원 시간과 다르다.
통계학적 분석
분석에 앞서, 데이터 품질을 조사하였다. 단 44명의 흑인과 10명의 다른 인종만을 포함하였기 때문에, 백인에 대한 분석을 수행하였다. 성별 효과를 평가하기 위해, 결과 측정값을 먼저 OSA 계층화하면서, 및 그를 수행하지 않고 남아 및 여아 사이를 비교하였다. t 검정 또는 윌콕슨의 순위 합 검정(Wilcoxon rank-sum test)을 이용하여 연속 변수를 비교하고, 피셔의 정확 검정을 사용하여 카테고리별 변수를 비교하였다. 모르핀 효과를 분석하기 위해, 수술 중 및 전체 모르핀 용량 (mg/kg)을 저용량, 중간 용량, 및 고용량 (수술 중 모르핀의 경우, ≤0.1, > 0.1 - 0.2, > 0.2, 및 전체 모르핀의 경우, < 0.2, 0.2 - 0.3, 및 > 0.3)으로 분류하였다. 스피어만(Spearman) 상관 계수를 사용하여 모르핀 용량과 성별에 따른 결과 사이의 관계를 평가하였다.
이어서, 다변량 통계학적 모델링을 수행하여 공변량 효과를 설명하면서, 성별 효과, 및 성별과 모르핀 용량의 상호작용을 공식적으로 검정하였다. 진통 효과 결과의 경우, 수술 중 모르핀을 공변량으로 사용하였고; 부작용 결과의 경우, (수술 중 및 수술 후 모르핀 용량의 합계로서 계산된) 전체 모르핀 요구량을 공변량으로 사용하였다. 연령, 체중, BMI z 점수 및 OSA의 효과 또한 모든 결과에 대한 공변량으로서 검정하였다. 유의적인 효과가 검출되었을 때 (p<0.05), 공변량을 최종 모델에 포함시켰다. 로지스틱 회귀를 사용하여 이원 결과를 분석하였다. 선형 회귀를 사용하여 최고 NRS를 분석하였다. 점수의 과잉 빈도가 0이기 때문에, 0 과잉 음 이항 모델(zero-inflated negative binomial model)을 사용하여 최고 FLACC 점수를 분석하였다. 진통제 개입 총 횟수는 푸아송(Poisson) 분포를 따랐고, 일반화된 선형 모델을 사용하여 분석하였다. 개입을 필요로 한 환자에서의 수술 후 모르핀 용량은 선형 회귀를 사용하여 분석하였다.
부작용과 전체 모르핀 용량 사이의 관계가 연령에 따라 다른지 여부를 조사하기 위해, 태너(Tanner) 단계 분류 대신 사춘기전, 사춘기전후, 및 사춘기후로 여성을 분류하기 위해 여성 환자를 8세 미만, 8 내지 13세, 및 13세 초과인 3개의 연령군으로 나누었다. 본 분석에서, 전체 모르핀 요구량은 모르핀의 잠재적인 역치 효과 때문에 ≥ 0.3 또는 <0.3 mg/kg 용량 범위로 이분화되었다. 전체 모르핀과 PONV, RD, PONV 및 RD에 기인하는 장기간 PACU 사이의 선형 추세는 3개의 연령 군에서 따로 평가하였다. 이어서, 다변량 로지스틱 모델을 사용하여 상기 가설을 공식적으로 검정하였다.
통계학적 분석 소프트웨어, 버전 9.3 (SAS 인스티튜트 인크.: 미국 노스캐롤라이나주 캐리)을 사용하여 통계학적 분석을 수행하였다. 평균 스피어만 상관 계수 = 0.26을 이용하여 상관관계가 있는 11개의 결과를 조사하였다. 상관관계로 조정된 본페로니 보정 (http://www.quantitativeskills.com/sisa)을 통해 유의적 역치 = 0.008을 얻었다. 역치 = 0.05에 도달한 연관성 또한 기록하였다. 이는 추후 연구를 위해 잠재적 연관성을 확인하는 데 도움을 줄 수 있지만, 과잉 I형 오차율에 기인하여 상기 결과를 해석할 때는 주의하여야 한다.
결과
콘소트 다이어그램은 자격이 있고, 착수되고, 등록한 연구 대상체를 도시한 것이다 (도 11). 비백인 아동의 샘플 크기가 비교적 작기 때문에 (44명의 흑인 및 10명의 다른 인종 또는 혼혈아), 본 연구는 219명의 백인 아동에 초점을 맞추었다 (114명의 여아 및 105명의 남아). 평균 연령 및 체중은 유사하였지만, 여아에서의 OSA의 발생률이 더 높았다 (50% 대 36%, p=0.04) (표 10). 연령 및 BMI는 남아와 여아 사이에 유사하였다.
모든 용량의 전체 모르핀을 함께 나누었을 때, 단변량 분석 (표 11) 또는 다변량 모델링 (데이터 나타내지 않음)에서 진통제 및 오피오이드 관련 유해 결과 어느 것에서도 유의적인 차이는 검출되지 않았다. OSA에 의한 계층화도 이 결과에 영향을 주지 않았다.
연속 변수로서 전체 모르핀을 사용하여 성별에 의한 모르핀 효과에 대하여 공식적으로 검정된 다변량 모델에 의해 단변량 분석을 지원하였다. PONV (p=0.001) 및 PONV에 기인하는 장기간 PACU 체류 (p=0.010)에서 유의적인 성별-특이 모르핀 효과가 검출되었다. 여아에서, 상기 역효과를 가질 확률은 전체 모르핀 용량이 증가함에 따라 증가한 반면, 남성에서는 역효과를 가질 확률에 있어 전체 모르핀 용량 증가에 따른 유의적인 변화는 검출되지 않았다 (도 12a 및 12b).
표 12에 제시된 데이터는 여아에서 전체 모르핀이 0.3 mg/kg을 초과할 때에는 대부분이 부작용이 발생한 것으로 나타났다. 다변량 모델을 사용하여 역치 모르핀 효과를 검정하였다. 2개의 더 낮은 저용량 모르핀 군 사이에서는 부작용 확률에 있어 차이가 없었다. 그러나, 모르핀이 0.3 mg/kg을 초과할 때에는 소양증을 제외한, 모든 오피오이드 역효과의 확률이 유의적으로 증가하였다 (p<0.05).
여아에서, 호흡 억제를 가질 확률은 전체 모르핀 용량이 증가함에 따라 증가하였다 (p=0.001) (도 13a 및 13b). 남아에서는 RD를 가질 확률에 있어 전체 모르핀 용량 증가에 따른 유의적인 변화는 검출되지 않았다 (p=0.079, 표 12). 더 어린 여아에서 (<8세 내지 8-13세), RD와 더 높은 고용량의 전체 모르핀 용량 (≥ 0.3 mg/kg) 사이에서 통계학상 유의적인 연관성이 검출되었다 (표 13).
≥0.3 mg/kg의 전체 모르핀을 받은 백인 여아 (111±6.6분)는 <0.3 mg/kg의 전체 모르핀을 받은 여아 (82.2±3.3분)보다 더욱 장기간 PACU에 체류하였다 (도 14). ≥0.3 mg/kg의 전체 모르핀을 받은 백인 남아는 99.7±6.4분 동안 PACU에 체류한 반면, <0.3 mg/kg의 모르핀을 받은 남아는 88.3±3.6분 동안 PACU에 체류하였다 (도 13). 비록 연령, 체중, OSA 병력에 대한 조정 후에도 PACU 퇴원 준비 지속 기간에서의 차이가 통계학적 유의도에 도달하지는 못하였지만 (p=0.09), 더 낮은 저용량과 비교하였을 때, 더 높은 고용량의 전체 모르핀 용량을 받은 백인 여아에서 약 30분 더 장기간 체류한 것은 외래 편도 절제술 후 임상적으로 및 경제적으로 중요하다. 비록 성별에 의해 계층화된 분석에서 고용량을 갖는 여아에서의 장기간 PACU 체류가 남아에서의 것과 통계학상 유의적으로 차이가 나지는 않지만 (p=0.09), 고용량을 받은 여아는 저용량을 받은 여아보다 더 장기간 PACU 체류하였고(p=0.0002); 남아에서 그 차이는 통계학상 유의적이지 않다 (p=0.11) (도 14).
단변량 또는 다변량 모델링을 사용하였을 때 진통 결과에 대한 성별 특이 모르핀 효과에 관한 증거는 없었다 (표 13). 성별에 따른 진통 효과와 관련하여 모르핀에 대한 구별적 반응은 없었다.
요약컨대, 여아에서, PONV, RD, PONV 및 RD에 기인하는 장기간 PACU와의 전체 모르핀 용량의 유의적인 연관성이 검출되었다. 상기 연관성이 연령에 의해 영향을 받는지 여부를 검정하기 위해 (즉, 사춘기후 여아에서의 호르몬 효과), 8세 미만, 8 내지 13세, 13세 초과인 여아를 비교하였다 (표 13). 더 어린 여아 (<8세 및 8-13세)는 RD, PONV, 및 장기간 PACU 체류와 연관성을 보였다. 그러나, 다변량 모델에서 연령 효과만을 단독으로 검정하였을 때에는 가능하게는 작은 샘플 크기에 기인하여 통계학상 유의적인 연령에 따른 구별은 검출되지 않았다 (데이터 나타내지 않음).
본 연구는 진통제는 유사하지만, 전체 모르핀 용량이 증가함에 따라 남아보다 백인 여아가 오피오이드 역효과에 더 민감하였다는 것을 입증한다. 남아와 비교하였을 때, 백인 여아는 더 높은 전체 모르핀 용량에 대하여 구별적인 반응을 보이며, 이로써, 외래 수술 후 더 높은 오피오이드 관련 역효과 발생 및 장기화된 병원 체류라는 불평등한 부담을 유도한다. 구체적으로, 남아와 비교하였을 때, 여아에서 모르핀 용량 증가는 RD, PONV 및 오피오이드 관련 호흡 억제 및 PONV에 기인하는 회복실에서의 장기간 체류 증가와 연관이 있었다. 전체 모르핀에 의해 저용량, 중간 용량 및 고용량으로 계층화하지 않았을 때, 아동에서 수술 전후의 모르핀 사용에 따른 안전성 및 진통 결과는 성별에 의해 차이가 나지 않았다. 이러한 관찰 결과는 연령, BMI 및 수술 기법과는 연관성이 없었다. 남아와 비교하였을 때, 여아가 더 높은 고용량의 오피오이드에 따라 더 많은 오피오이드 관련 RD 및 PONV를 가지고, 이로써, 더 장기간의 병원 체류를 유도하게 될 가능성이 있는 바, 상기 관찰 결과는 유의적으로 임상적 및 경제적 영향을 미친다.
남아가 아닌 여아에서 모르핀 용량 증가에 따라 부작용이 증가한 것으로 나타났다. 구체적으로, 높은 카테고리에 있지 않은 여아와 비교하였을 때, 최고 용량의 모르핀 용량 카테고리 (0.3 mg/kg)를 받은 여아는 유의적으로 더 많은 RD, PONV, RD에 기인하는 장기간 PACU 체류, 및 PONV에 기인하는 장기간 PACU 체류를 보였다. 그러나, 남아에서는 모르핀 용량은 부작용과 연관성이 없었다. 중요하게는, 상기 코호트에서 여아에서의 OSA의 발생률이 비교적 더 높음에도 불구하고, 상기 효과는 OSA와는 관련이 없었다. 성인 집단에서, 남성과 비교하였을 때, 여성이 호흡 억제를 비롯한 오피오이드 관련 역효과를 더 높은 비율로 경험한다는 것이 문헌을 통해 지지된다 (문헌 [Fillingim R. et al., J Pain, 6:116-24 (2005)]; [Zacny J. Drug Alcohol Depend., 63:23-8 (2001)]; [Zun L. et al., Am. J. Emerg. Med ., 20:151-4 (2002)]; [Cepeda M. et al., Clin . Pharmacol . Ther ., 74:102-12 (2003)]; [Franconi F. et al., Pharmacol . Res., 55:81-95 (2007)]). 모르핀 유도성 호흡 억제에 따른 성별 차이에 대해서 살펴본 소수의 성인 연구 (문헌 [Sarton E. et al., Anesthesiology, 93:1245-54 (2000)]; [Sarton E. et al., Anesthesiology, 90:1329-38 (1999)])에서는 남성과 비교하였을 때, 여성이 호흡 억제 발생 위험이 더 높다고 나타났다. 그러나, 아동에서 성별이 오피오이드 관련 역효과에 미치는 효과를 연구한 데이터는 거의 존재하지 않는다.
연구 코호트에 대한 확장된 퇴원후 추적 조사에서, 기능성 CYP2D6 표현형을 가지는 여아가 퇴원 전 PACU에 있는 여아 중에서 정맥내 모르핀 용량 관련 역효과가 더 높은 것과 유사하게, 그리고, 그와 일관되게, 수술 후 처음 2-3일 경과하였을 때 자택에서 경구적 코데인 (모르핀 프로드럭) 사용시 역효과의 발생률은 유의적으로 더 높은 것으로 관찰되었다 (문헌 [Prows C. et al., The Laryngoscope, DOI: 10.1002/lary.24454 (2013)]). 관찰 결과를 확인시켜 주는 것 이외에도, 병원 및 자택 환경에 있는 여아 중에서 정맥내 모르핀 및 경구적 코데인 사용시 역효과의 발생률이 더 높다는 상기 일관된 관찰 결과는 오피오이드가 여아에게 미치는 확장되고, 불평등한 임상적 및 잠재적으로 경제적인 영향을 보여준다. 성별과 관련된 호흡 억제에서의 차이는 중심 매개 효과와 반대로 주변 화학 반사에 의해 매개되는 효과에 이어지는 것으로 나타났다 (문헌 [Sarton E. et al., Anesthesiology, 93:1245-54 (2000)]).
본 연구는 성별, 모르핀 용량 및 진통제 사이에 어떤 연관성도 밝혀내지 못했다. 여아에서의 사춘기 연령의 카테고리에 의한 통증의 구별적인 연관성 또한 밝혀내지 못했다. 이는 오피오이드 사용시 여성이 더 우수한 통증 제어를 경험한다고 제안하는 일부 인간 성인 연구와 대조를 이룬다 (문헌 [Campesi I. et al., Handb. Exp . Pharmacol . 265-78 (2012)]). 전체 통증 경험은 성별에 기초하여 다르게 인식할 수 있다 (문헌 [Toomey M. AANA J., 76:355-9 (2008)]). 추가로, 남성과 여성 사이에 약동학적 성질에서의 유의적인 차이 (대략 40%)가 존재하며, 남성보다는 여성에서 총 체수분량이 더 낮고 근육 대비 지방 비율이 더 높은 것에 기인한다 (문헌 [Anderson G. J. Womens Health (Larchmt), 14:19-29 (2005)]). 약물 대사에 필요한 효소의 상이한 발현 또한 이러한 차이의 원인이 될 수 있다 (문헌 [Anderson G. J. Womens Health ( Larchmt ), 14:19-29 (2005)]; [Schwartz J. Clin. Pharmacol . Ther ., 82:87-96 (2007)]; [Franconi F. et al., Curr . Pharm . Des., 17:1095-107 (2011)]). 모르핀 제거를 비롯한, 모르핀의 약동학적 성질은 이전에 보고된 바 있다 (문헌 [Sadhasivam S. et al., J. Opioid Manag., 8:217-26 (2012)]). 성별을 모르핀 제거에 대한 공변량으로서 포함하였지만, 아동에서 모르핀 약동학적 성질에서 변이성의 주요 예측인자인 것으로 나타나지는 않았다 (문헌 [Sadhasivam S. et al., J. Opioid Manag., 8:217-26 (2012)]).
본 연구에서, 오피오이드 관련 역효과는 여아에서는 높은 전체 모르핀 용량 (> 0.3 mg/kg)을 투여받았을 때 더 자주 발생하는 경향이 있었던 반면; 남아에서는 전체 모르핀 용량에 따라 오피오이드 역효과가 증가하는 상기와 같은 선형 추세는 관찰되지 않았다 (표 12). 남아와 여아 사이의 호르몬 차이가 오피오이드 역효과에서의 성별에 따른 차이를 잠재적으로 설명할 수 있다는 가설을 세웠다. 오피오이드 역효과에서의 성별 차이 이외의 기전을 잠재적으로 설명하기 위해, 일반 사춘기 연령의 여아를 사춘기와 연관된 상이한 호르몬 수준에 대한 대용물로서 사용하였고, 여아에 대해 3개의 연령 카테고리: <8세 (사춘기 전), 8-13세 (사춘기 연령); >13세 (사춘기 후)를 분석하였다. 여아에서, PONV, RD 및 PONV 및 RD에 기인하는 장기간 PACU와 전체 모르핀 용량의 유의적인 연관성이 검출되었고; 더 어린 여아는 더 높은 고용량의 모르핀에 따라 유의적으로 더 많은 RD 및 PONV를 보였다 (표 14). 흥미롭게도, 다변량 모델에서 연령 및 OSA 효과를 검정하였을 때, 가능하게는 각 연령 및 전체 모르핀 용량 카테고리에서 여아의 수가 적은 것에 기인하여, 연령 또는 OSA 발생률 (더 어린 여아 및 남아에서 빈도가 더 높다)은 모르핀 용량에 대한 여아의 감수성과 연관성이 없었다. 3개의 연령 카테고리 모두에서 (특히, 더 어린 여아에서) 높은 모르핀 용량 (0.3 mg/kg)에 따라 오피오이드 역효과의 발생률이 높은 것이 자명하기 때문에, 이 데이터는 여아에서의 호르몬 매개 차이를 지지하지 못한다. 그러나, 태너 단계 분류를 수행하지 않았는 바, 상기 연령 카테고리 분류는 사춘기 단계에 대하여 우수한 지표가 아닐 가능성이 있다.
상기 분석은 단일의 자기 보고된 백인 집단으로 제한되었다는 점에 주목하는 것이 중요하다. 이전 연구에서는 부작용의 위험에 있어 인종에 따라 차이가 나는 것으로 입증되었는 바 (문헌 [Sadhasivam S. et al., Pediatrics, 129:832-8 (2012)]), 인종에 따라 분석하는 것이 중요하였다. 비록 인종 그 자체가 본 연구의 주목 대상은 아니지만, 본 발명자들의 연구에서 자기 보고된 인종과 조상 정보 마커 사이에 95% 초과의 상관관계가 있었다. 임상의가 쉽게 이용할 수 있는 바, 조상 기원의 유전자 마커보다 자기 보고된 인종을 사용하는 것이 더 용이하다. 의미있는 중요한 분석에 이용가능한 소수의 아동은 상대적으로 그 수가 적기 때문에, 본 결과는 백인 아동에 초점을 맞추었다. 비백인 집단에서 상기와 같은 차이가 여전히 관찰되는지 여부는 불명확하다. 상기 데이터에 기초하여, 백인 여아는 백인 여아을 위한 좀 더 공격적인 PONV 및 RD 예방 전략법으로부터 이익을 얻을 수 있다.
결론적으로, 용량 관련된 오피오이드 역효과 위험에 대한 성별 차이는 백인 아동에서 존재한다. 수술을 받은 남아보다 백인 여아에서 더 높은 고용량의 모르핀에 따라 오피오이드 관련 호흡 억제 및 PONV, 및 오피오이드 역효과에 기인하는 PACU에의 장기간 체류를 가질 위험이 더 높다. 이러한 차이는 사춘기 연령 또는 OSA를 시사하는 병력으로는 설명되지 못했다. 아동을 치료할 때, 백인 여아가 남아와 유사한 진통제를 경험할 때, 상기 여아는 더 높은 고용량의 오피오이드에 대하여 상대적으로 더 크게 민감하고, 오피오이드 관련 유해 사례가 더 높고, PACU에 더 장기간 체류한다는 점을 명심하여야 하고; 이러한 지식 정보는 아동에서의 바람직하지 못한 임상적 및 경제적인 수술 전후의 결과를 예방하는 데 도움을 줄 수 있다.
실시예
7: 오피오이드
유도성 호흡 억제:
ABCB1
수송체
약물 유전학적 성질
모르핀의 효과는, 진통제 뿐만 아니라, 과탄산증에 대한 환기 반응성을 담당하는 풍부한 mu 수용체를 함유하는 것인 뇌간, 특히, 수질에 위치하는 mu 오피오이드 수용체에 의해 매개된다 (문헌 [Zhang, Z., et al., Anesthesiology, 107:288-297 (2007)]; [Pattinson, K. Br. J. Anaesth ., 100:747-758 (2008)]). 추가로, 오피오이드는 호흡을 제어하는 피질 중심에 지대한 영향을 미치며, 이는 뇌간에서의 그의 작용을 강화시킨다 (문헌 [Pattinson, K. et al., J. Neurosci ., 29:8177-8186 (2009)]). 따라서, 뇌 내로의 모르핀 수송의 변이성이 모르핀에 대한 개체간 반응을 설명하는 데 도움을 줄 수 있다. 뇌 중 모르핀의 농도는 혈액 뇌 장벽의 P-당단백질 수송체인, ABCB1에 의해 영향을 받는다. ABCB1의 다형성인 c.3435C>T는 성인에서 모르핀의 혈액 뇌 장벽 수송 활성과 연관이 있고, 동형접합성 TT 유전자형은 다른 유전자형보다도 더 높은 최대 CSF 모르핀 농도와 연관이 있었다 (문헌 [Meineke, I. et al., British Journal of Clinical Pharmacology, 54:592-603 (2002)]). 앞서, 같은 ABCB1 다형성인 c.3435C>T는 또 다른 오피오이드, 펜타닐을 받은 한국인 성인에서의 호흡 억제 증가와 연관이 있었다 (문헌 [Park, H. et al., Clin.Pharmacol. Ther ., 81:539-546 (2007)]). 그러나, ABCB1 변이체가 아동에서의 모르핀 유도성 호흡 억제와 연관이 있는지 여부는 공지되어 있지 않다.
본 연구에서는 ABCB1의 유전적 변이가 아동에서 모르핀의 안전성 및 임상적 효능에 유의적인 영향을 미칠 것이라는 가설을 세웠다. 본 연구는 수술 후 진통제 이외에 호흡 억제의 임상적 척도를 사용하여, 편도 절제술을 받은 미국인 아동으로 이루어진 큰 동질 집단에서 공통 ABCB1 유전자 변이체와 정맥내 모르핀 유도성 수술 후 호흡 억제 사이의 특이적인 연관성을 측정하는 것이다. 본 실시예는 추후 문헌 [Sadhasivam et al., The Pharmacogenomics Journal (2014) 1-8]에 공개되었으며, 그의 내용은 본원에서 참조로 포함된다.
연구 디자인, 참가자, 및 절차
편도 절제술을 받은 273명의 아동에서의 전향적 임상적 관찰 연구를 표준 수술 전후의 마취 및 수술 실행 및 표준 수술 후 간호와 함께 수행하였다. 본 연구는 신시내티 아동 병원에 있는 기관 임상 시험 심사 위원회의 승인을 받았고, 모든 부모님 및 참가 아동으로부터 서면 사전 동의서 및 동의 (아동 >11세인 아동으로부터)를 받았다. 모든 인종의 아동이 본 연구에 등록하였지만, 본 발명자들의 병원에 있는 편도 절제술에 대한 환자의 인구 통계를 고려할 때, 대다수의 아동은 백인이었다 (도 15).
선택적 외래 편도 절제술을 받은 6-15세 아동은 본 연구에 자격이 있었고, 수술 당일에 동원하였다. 인종은 부모님 또는 아동에 의해 자기 보고되었고; 자기 보고는 인종을 확인하는 데 잘 허용된다 (문헌 [Boehmer, U. et al., American Journal of Public Health, 92:1471-1472 (2002)]; [Lalovic, B. et al., Drug Metab. Dispos ., 32:447-454 (2004)]). 샘플 포함 기준은 재발성 편도염, 아데노이드편도 비대, 또는 OSA 때문에 편도 절제술을 받기로 예정된, 미국 마취과 학회 (ASA) 체격 1 또는 2를 가지는 것으로 지정된 아동이었다. OSA 지정에 대한 임상 기준으로는 코골이와 함께, 수면 중 휴지 시간이 10초 초과로 지속되거나, 또는 주간 졸림증의 병력이 있는 수면 장애 호흡을 앓는 것을 포함하였다. 아동 또는 아동의 부모님이 비영어를 사용할 경우, 그 아동은 연구로부터 배제시켰다. 모르핀에 대하여 알레르기성이거나, 또는 발달 지연, 간 또는 신장 질환, 또는 오피오이드 진통제를 필요로 하는 수술 전 통증 (예컨대, 만성 편도염)이 있는 아동은 배제시켰다.
모든 참가자는 표준 수술 전후의 관리를 받았다. 기관내 삽관을 용이하게 하기 위해 세보플루란에 이어서, 프로포폴 (2 mg/kg) 볼루스를 사용하여 마취를 유도하였다. 신경근 차단을 사용하지 않고, 세보플루란으로 마취를 유지시켰다. 환자는 외과적 절개 이전에 모르핀을 받았다. OSA 병력이 있는 아동은 0.1 mg/kg 모르핀을 받은 반면, OSA 진단을 받지 않은 아동은 0.2 mg/kg을 받았다. 외과적 절개 및 소작술 이후 통증을 시사하는 임의의 징후 (심박수 및 혈압의 임상적으로 유의적인 증가)가 있는 경우, 임상 마취 팀은 필요할 경우, 수술 중에 0.05 mg/kg의 증분량으로 추가의 모르핀을 제공하였다. 모든 아동은 수술 중에 예방적 온단세트론 (0.1 mg/kg) 및 덱사메타손 (0.1 mg/kg)을 받았다. FLACC 통증 점수 (문헌 [Merkel, S. et al., Pediatr . Nurs ., 23:293-297 (1997)])가 ≥ 4/10인 것으로 측정된 유의적인 수술 후 통증은 PACU에서 구제 용량의 모르핀 (0.05 mg/kg 증분량)으로 관리하였다.
PACU 체류 지속 기간 (PACU 퇴원 준비가 될 때까지의 소요 시간)은 하기의 퇴원 기준을 달성하기 전까지 PACU에 있는 지속 기간으로서 정의되었다. 의식 수준: 쉽게 각성가능하거나, 깨어 있는 정도, 기도: 공기 교환이 적절한 환자, 심부 체온: ≥ 36.3℃, 허용되는 통증 수준 (통증 점수 <4), 혈역학적으로 안정적, 유의적인 오피오이드 관련 역효과, 예컨대, PONV 및 호흡 억제 없음, 및 어떤 출현도 또는 합병증도 없는 수술 부위. 상기 퇴원 준비 시간은 (예컨대, 차를 기다리는 것 등과 같은) 사회적인 이유에 기인한 지연은 포함되어 있지 않기 때문에, 실제 PACU 퇴원 시간과 다르다.
동원된 273명의 아동 중, 219명은 백인이고, 44명은 흑인 아동이었다. ABCB1 SNP의 대립유전자 빈도가 상이하고, 다른 인종으로부터의 아동 수가 작기 때문에, 본 분석은 백인 및 흑인 아동에 초점을 맞추었다. 다른 인종의 아동 및 혼혈 아동은 분석하지 않았다 (도 15). 참가자는 주로 백인이고, 남성보다 여성이 조금 더 많았다. 백인 아동과 비교하였을 때, 흑인 아동이 체중이 약간 더 나가고, OSA 빈도가 더 높았다. (표 14).
결과
각 환자에 대하여 진통 효과 및 오피오이드 관련 역효과에 대한 지표를 기록하였다. 오피오이드 관련 역효과에 대한 지표의 경우, 본 연구는 일관되게 연구 코디네이터에 의해 평가된, 임상적으로 및 경제적으로 중요한 2가지 결과: 임상적 RD 및 호흡 억제에 따른 장기간 PACU 체류 (>90분)에 초점을 맞추었다. 본 연구에서, RD는 1분 초과의 기간 동안 지속되고, 임상적으로 명백한 상기도 폐색의 부재하에서 SpO2 >92%를 유지시키기 위해 보충 산소를 필요로 하는, 호흡률이 분당 호흡수 <10회이거나, 또는 산소 탈포화 <92%인 것으로 정의되었다.
진통 효과에 대한 지표로는 최대 수술 후 통증 점수, PACU에서의 정맥내 진통제 개입 여부 (예/아니오) 및 진통제 개입을 필요로 하는 환자에서 수술 후 모르핀 용량 (mg/kg)을 포함하였다. 0 내지 10 FLACC 통증 척도를 사용하여 다중 시점에서 PACU에서 평가된 수술 후 통증 점수로부터 각 아동에 대한 최대 수술 후 통증 점수를 생성하였다 (문헌 [Merkel, S. et al., Pediatr . Nurs ., 23:293-297 (1997)]).
유전자형
수술실에서 마취하에 각 참가자로부터 혈액을 수집하고, 같은 날 DNA를 단리시키고, -20℃에서 냉동시켰다. 모든 연구 참가자에 대한 임상적 데이터를 입력한 후, 배치식 유전자형 분석을 수행하였다. 택맨 대립유전자 식별 시스템 검정법 및 게노타이퍼 소프트웨어(Genotyper Softerware) 버전 1.0.1 (라이프 테크놀러지즈, 어플라이드 바이오시스템즈: 미국 캘리포니아주 포스터시티)을 사용하여 하기 ABCB1 다형성: rs1045642, rs2032582, rs1128503, rs2229109, 및 rs9282564를 분석하고, 기록하였다.
통계학적 분석
분석 전, 데이터의 품질을 조사하였다. ABCB1 변이체의 경우, 대립유전자 및 유전자형 빈도를 백인 및 흑인 환자에서 따라 평가하였고, 하디 바인베르크 평형 (HWE)을 검정하였다. 이원 결과 (RD, 장기간 PACU에 이은 장기간 PACU, 및 진통제 개입 요구)를 분석하기 위해, 로지스틱 회귀를 수행하였다. 수술 후 모르핀 용량에 대해서는, 용량이 정규 분포하였는 바, 이에 선형 회귀를 사용하였다. 최고 FLACC 점수는 0 과잉 음 이항 분포를 보였으며, 여기서, 환자 중 26%는 통증을 경험하지 않았다. 따라서, 영 과잉 음 이항 모델을 사용하여 최고 FLACC 점수를 분석함으로써 상기 변수의 분포를 적절하게 포착하였다. ABCB1 변이체 평가에 앞서, 공변량 (연령, 성별, BMI z 점수, OSA, 수술 중 모르핀 (진통 결과) 및 전체 모르핀 (역효과 결과))의 효과를 평가하였다. 최적 모델을 선택하기 위해, 로그 우도값, 아카이케 및 베이지안 정보 기준을 비교하고, 잔차를 조사하였다. 모델 피팅을 유의적으로 개선시킨 (p<0.05) 공변량은 후속 유전적 분석을 위해 그대로 유지시켰다. 단일 SNP와 상기 결과와의 연관성을 평가하기 위해, 가산 모델을 사용하였으며, 여기서, 유전자형을 기록하고, 연속 변수로서 검정하였다. 4개의 이대립유전자 SNP에 대해, 유전자형을 소수의 대립유전자의 개수에 따라 0, 1, 및 2로 기록하였다. rs2032582의 경우, GG 유전자형은 0으로 기록되었고; GA 및 GT 유전자형은 조합하고, 1로서 기록되었고, TT 및 TA 유전자형은 2로 기록되었다. 통계학적 모델링은 백인 및 흑인 환자를 이용하여 따로따로 수행하고, 조합하였다. 인종을 조합하였을 때, 인종 및 인종*SNP 상호작용의 효과를 검정하였다.
본 연구에서, 2개의 주요 부작용 결과 및 3개의 2차 진통 결과와 5개의 SNP 사이의 연관성을 검정하였다. 5개의 SNP 사이의 평균 상관 계수는 0.40이었다. 주요 결과 사이의, 및 2차 결과 사이의 스피어만 상관 계수는 각각 0.49 및 0.74였다. 다중 검정에 대한 p 값을 수집하기 위해, 결과 중 상관관계가 있는 성질 및 SNP를 설명하였다. 상관관계로 조정된 본페로니 보정 (http://www.quantitativeskills.com/sisa)을 통해 주요 부작용 결과에 대한 검정의 경우, 유의적 역치 = 0.013, 및 2차 결과에 대한 검정의 경우, 역치 = 0.014를 얻었다. 역치 = 0.05에 도달한 연관성 또한 명목상 연관된 것으로서 기록한다. 통계학적 분석 소프트웨어 (SAS), 버전 9.3 및 JMP 게노믹스, 버전 6.0 (SAS 인스티튜트 인크.: 미국 노스캐롤라이나주 캐리)을 사용하여 통계학적 분석을 수행하였다.
순열 검정: 유전적 연관성 연구에서, 낮은 대립유전자 빈도 (<0.1)는 소수의 개체에서 연관성을 유도할 수 있다. 따라서, 소수의 대립유전자 빈도가 0.1 미만인 것과 유의적으로 연관된 것으로 확인된 변이체에 대해, 조합된 두 인종을 사용하여 순열 검정을 수행하였다. R 프로그래밍 언어를 사용하여, 공변량과 결과 사이의 연관성은 변화시키지 않고 그대로 유지시키면서, 유전자형을 무작위로 셔플링시켜 1,000개의 데이터 복제물을 생성하였다. 이어서, 상기 기술된 바와 같이 조정된 같은 공변량을 이용하여 같은 방법을 사용하여 각 복제물을 분석하였다.
자기 확인된 인종 및 유전적 조상 사이의 상관관계 - 민감도 분석: 자기 보고된 백인 및 흑인 인종이 유전적 조상과 잘 매칭되는지 여부를 평가하기 위해, 골든 헬릭스 소프트웨어를 사용하여 218개의 조상 정보 마커 (AIM)를 이용하여 주성분 분석을 수행하였다. 1,397개의 합맵 대상체를 참조 집단으로서 사용하였다.
검정력 분석: 본 연구 분석에 앞서, 유전적 효과를 검출하는 통계학적 검정력을 콴토(Quanto)를 사용하여 추정하였다. 소수의 대립유전자 빈도 (MAF)는 본 발명자들의 변이체의 변이성을 포착하기 위해 0.03 내지 0.5로 달리 하였고, 다중 검정을 설명하기 위해 α는 0.013으로 유지시켰다. 주요 결과 역효과 결과인, 호흡 억제를 유도하는 호흡 억제 (빈도 11%)의 경우, 263명의 아동으로 이루어진 본 발명자들의 전체 샘플을 사용하였을 때, 80% 검정력을 사용하여 오즈비 = 2.6 (MAF ≥ 0.3), 2.8 (MAF = 0.2), 3.6 (MAF = 0.10), 및 7.3 (MAF = 0.03)을 검출하였다. 주요 진통제 결과, 수술 후 모르핀 요구량의 경우, 오직 진통제 개입을 필요로 한 개체만을 포함시켰다 (n = 162). 80% 검정력을 사용하여 9% 정도로 작은 변동을 차지하는 (베타 범위 0.37 -1.09 표준 편차 단위) 효과를 검출하였다.
결과
ABCB1 SNP 및 대립유전자 빈도. 조사된 5개의 SNP 중에서 하나 (rs2032582)는 삼대립유전자이고; 하나 (rs2229109)는 백인 및 흑인 둘 모두에서 저빈도이고; 하나 (rs1045642)는 공통적이며, 여기서, 다수 및 소수의 대립유전자는 뒤바뀌었다. 모든 SNP HWE에 있었고 (문헌 [Stern, C. Science, 97:137-138 (1943)]), 높은 연관 비평형을 보였다 (표 15 및 16).
ABCB1 및 호흡 억제. 263명의 환자 중 51명은 RD (19%)를 가졌고, 30명은 RD에 기인하는 장기간 PACU 체류 (11%)를 가졌다. ABCB1 SNP의 유전적 효과를 평가하기 위해, 원시 결과 측정값을 먼저 유전자형에 의해 요약하였다. 백인 및 흑인, 둘 모두에서 수개의 잠재적 연관성, 특히, 호흡 억제에 기인하는 장기간 PACU 체류와 rs9282564 사이에 이 관찰되었다 (표 17 및 18). 유전적 효과를 추가로 확인하기 위해, 통계학적 모델링을 수행하였고, 여기서, 결과에 대하여 유의적인 영향을 보인 공변량을 조정하였다. rs9282564의 통계학적으로 유의적인 효과는 백인에서 호흡 억제에 기인하는 장기간 PACU 체류에서 검출되었다 (p=0.0012) (도 16a). 상기 관찰 결과는 흑인에서도 재현되었다 (p=0.0251) (도 16b). 인종을 조합하고, 조정하였을 때, ABCB1 SNP인 rs9282564는 호흡 억제에 기인하는 장기간 PACU 체류와 강한 연관성을 가졌다 (p=0.0002) (도 16c). rs9282564의 1 카피의 소수의 대립유전자 (G) 부가는 백인 및 흑인에서 각각 장기간 PACU 체류의 오즈를 4.1배 (95% CI: 1.7-9.9) 및 13.9배 (95% CI: 1.1-175.8) 증가시켰다. 인종을 조합하였을 때, 1 카피의 소수의 대립유전자 (G) 부가는 장기간 PACU 체류의 오즈를 4.7배 (95% CI: 2.1-10.8) 증가시켰다 (도 17). 호흡 억제에 기인하는 장기간 PACU 체류에 대해서 어떤 인종 특이 rs9282564 효과도 검출되지 않았다. 어떤 다른 변이체도 인종 특이 또는 조합 분석에서 RD 또는 RD에 기인하는 장기간 PACU와의 명목 연관성에 도달하지 못했다. rs9282564와 RD에 기인하는 장기간 PACU 체류 사이의 연관성의 경우, 1,000개의 복제물 중 단 1개의 검정만이 관찰된 p 값 = 0.0002보다 작은 p 값을 보였으며, 이로써, 실험상 p 값 = 0.002를 얻었고, 이는 상기 관찰 결과의 유의성을 지지한다.
ABCB1 및 진통제 결과: 3개의 진통 결과: 최고 FLACC 점수, 개입 요구 및 개입(들)을 요구한 환자에서 수술 후 모르핀 용량을 조사하였다. 최고 FLACC 점수의 중앙값은 3이고, 여기서, IQR은 6이었다. 263명의 환자 중 162명 (62%)은 진통제 개입(들)을 요구하였다. 평균적으로, 수술 후 모르핀 개입을 요구한 환자는 0.10±0.05 mg/kg 모르핀을 가졌다. rs2229109와, 구제 용량의 모르핀을 받은 환자에서의 수술 후 모르핀 용량 사이에 연관성이 검출되었다. 비록 백인에서는 명목상이었지만 (p=0.05), 흑인에서의 연관성은 통계학적으로 유의적이었다 (p=0.01). 인종을 조합하였을 때, rs2229109와 수술 후 모르핀 사이에 연관성이 여전히 검출되었고 (p=0.02); 1 카피의 소수의 대립유전자 (A) 부가가 수술 후 모르핀 용량을 0.04 mg/kg 만큼 (95%CI: 0.01-0.07) 감소시켰다. 어떤 인종 특이 효과도 검출되지 않았다. rs2229109와 수술 후 모르핀 용량 사이의 연관성의 경우, 1,000개의 복제물 중 13개가 p 값 < 0.02을 보였으며, 이로써, 실험상 p 값 = 0.014를 얻었고, 이는 상기 관찰 결과의 유의성을 지지한다.
자기 보고된 인종 및 유전적 조상: 자기 보고된 백인 및 흑인 인종을 218개의 AIM으로부터 추정된 유전적 조상과 비교하였다. 도 19에 제시된 바와 같이, 250명의 (>95%) 아동에서, 자기 보고된 인종은 CEU 및 흑인 조상으로 클러스터링되었다. 주성분 (PC) 1 및 2는 백인 및 흑인 인종을 성공적으로 분리시켰다 (도 19). 본 연구에서는, AIM과 비교하였을 때 자기 보고된 인종이 임상의가 쉽게 이용할 수 있는 바, 이에 자기 보고된 인종을 사용하였다. 그러나, 유전적 조상을 사용하여 자기 보고된 인종 및 유의적인 임상 결과 사용시에 관찰된 상관관계를 확인하였다. PC1 및 2에 대해 조정된 모델을 사용하여, 수술 후 모르핀 요구량과 rs2229109 사이의 연관성 (p=0.03) 이외에, PACU 체류를 장기화시키는 호흡 억제와 rs9282564 사이의 연관성 (p<0.0001)을 추가로 확인하였다.
본 연구는 전신 마취하에 일반 외과적 처치를 받은 263명의 미국 아동으로 이루어진 동질 군에서의 ABCB1 다형성 및 회복실 체류를 장기화시키는 임상적으로 관련된 오피오이드 관련 호흡 억제, 및 수술 후 모르핀 요구량 사이의 연관성을 보였다. 중요하게, 본 연구는 백인 (p=0.0012), 흑인 (p=0.0251) 및 두 인종이 조합된 경우 (p=0.0002)에서 ABCB1 SNP인 rs9282564가 호흡 억제에 기인하는 장기간 PACU 체류와 연관이 있다는 것을 입증하였다. ABCB1 SNP인 rs9282564의 각 추가 카피의 소수의 대립유전자 (G)를 보유하는 효과는 PACU 체류를 장기화시키는 호흡 억제의 오즈를 4.7배 만큼 (95% CI: 2.1-10.8) 증가시켰다. 이는 오피오이드 유도성 호흡 억제와의 연관성에 관한 새로운 보고이며, 이러한 효과의 크기는 약물 유전학적 임상 시험을 위해 사용된 공지의 유전자 변이체에서의 효과 크기와 유사하다.
본 연구에서는 ABCB1 SNP인 rs2229109와 PACU에서 구제 용량의 모르핀을 필요로 한 아동에서의 수술 후 모르핀 용량 사이의 또 다른 임상적으로 관련된 연관성이 관찰되었다. ABCB1 SNP인 rs2229109의 각 추가 카피의 소수의 대립유전자 (A)는 수술 후 모르핀 용량을 0.04 mg/kg 만큼 (95%CI: 0.01-0.07) 감소시켰으며; 이는 AA 유전자형을 가지는 아동이 모르핀에 민감하고, 모르핀을 덜 요구한다는 것을 시사한다. ABCB1 SNP인 rs2229109 또한 미스센스 다형성이며; 핵산 상의 1692번 위치의 G를 A로 대립유전자를 변이시키면, ABCB1 단백질에서 아미노산 잔기가 (Ser에서 Asn으로) 변이된다. 상기 변이체는 최근 본 연구에 포함된 다른 변이체와 연관된 일배체형의 일부로서 메타돈 약동학적 성질에 영향을 주는 것으로 연루되었다 (문헌 [Barratt, D. et al., Pharmacogenomics and Personalized Medicine, 5:53-62 (2012)]).
앞서, 비교적 크고, 동질의 미국인 집단, 특히, 아동에서 ABCB1 유전자의 다형성이 모르핀 관련 유해한 결과에 미치는 효과에 대해 조사된 바는 없었다. 본 연구는 다수의 이전 한계를 최소화하면서, 이전 연구상에서 구축하고자 시도하였고 (문헌 [Leschziner, G. et al., The Pharmacogenomics Journal, 7:154-179 (2007)]), 공통 ABCB1 SNP 이외의, 추가의 비-동의 SNP를 포함하였다 (도 18).
본 연구에도 어느 정도의 한계는 있다. 대상체 동원의 지리적 위치에 기인하여, 본 관찰 결과를 다른 인종으로 일반화시키기에는 비백인 아동이 많지 않았다. 그럼에도 불구하고, 본 관찰 결과는 여전히 흑인에서 재현된다. 사용이 용이하고, 임상의가 이를 쉽게 이용할 수 있기 때문에, 자기 보고된 인종이 사용되었다. 그러나, 자기 보고된 인종과 유전적 조상 사이에 매우 높은 상관관계 (>95%)가 관찰되었다 (도 19). 상이한 조상으로부터의 아동을 포함하는, 대규모 다기관 시험이 상이한 인종에서의 ABCB1 유전자형의 효과를 연구하는 데 도움을 줄 것이다. 본 연구에서 임상 결과와 연관된 ABCB1 SNP는 비-동의이고, 아미노산 변이와 연관이 있지만, 호흡 억제의 인과적 마커 및 수술 후 모르핀 용량과 연관되어 있기 보다는 인과적이지 않을 수 있다 (도 18). ABCB1의 서열분석 또는 조밀한 SNP 분석은 다른 변이체가 고위험 대 저위험을 보다 잘 결정할 수 있는지 여부를 측정하는 데 도움을 줄 수 있다.
결론적으로, 편도 절제술을 받은 아동에서 ABCB1 다형성과 수술 후 오피오이드 관련 호흡 억제 및 오피오이드 요구 사이에 신규한 연관성이 밝혀졌다. ABCB1 rs9282564 GG 동형접합체는 호흡 억제 위험을 증가시켰고, 이로써, 병원 체류 기간은 장기화되었으며, ABCB1 rs2229109 CC 동형접합체는 수술 후 진통제 개입이 요구되었을 때, 더 많은 모르핀을 요구하였다. 이러한 관찰 결과는 소아 수술 환자에서 수술 후 통증 관리를 위해 중요한 의미를 가진다. 오피오이드 관련 호흡 억제의 부정적인 영향을 최소화하는 데 있어 선제적 위험 확인, 계층화 및 예방적 조치가 중요하다. 상기 ABCB1 유전적 연관성 데이터를 임상 실시에 적용시키기 전에 잠재적 유전자 대 유전자 상호작용에 대한 추가 검증 및 조사가 필요할 것이다.
상기 기술된 다양한 방법 및 기법은 본 출원을 수행하기 위한 다수의 방법을 제공한다. 기술된 모든 목표 또는 이점이 본원에 기술된 임의의 특정 실시양태에 따라 반드시 달성될 수 있는 것은 아니라는 것을 이해하여야 한다. 따라서, 예를 들어, 본 방법은 본원에 교시되거나, 또는 제안된 다른 목표 또는 이점을 반드시 달성해야 할 필요 없이, 본원에 교시된 바와 같은 하나의 이점 또는 이점들의 군을 달성하거나, 최적화시키는 방식으로 수행될 수 있다는 것을 당업자는 이해할 것이다. 다양한 대안이 본원에서 언급된다. 일부 바람직한 실시양태는 하나의, 또 다른, 또는 수개의 특징을 구체적으로 포함하는 반면, 다른 바람직한 실시양태는 하나의, 또 다른, 또는 수개의 특징을 구체적으로 배제하고, 추가의 다른 바람직한 실시양태는 하나의, 또 다른, 또는 수개의 유익한 특징을 포함함으로써 특정의 특징을 완화시킨다는 것을 이해하여야 한다.
추가로, 당업자는 상이한 실시양태로부터의 다양한 특징들의 적용가능성을 이해할 것이다. 유사하게, 상기 논의된 다양한 요소, 특징, 및 단계 뿐만 아니라, 상기의 각 요소, 특징 또는 단계에 대한 다른 공지의 등가물은 당업계의 숙련가에 의해 본원에 기술된 원리에 따라 방법을 수행하는 데 다양한 조합으로 사용될 수 있다. 다양한 요소, 특징, 및 단계 중에서 일부는 구체적으로 포함될 것이고, 다른 것은 다양한 실시양태에서 구체적으로 배제될 것이다.
비록 본 출원이 특정 실시양태 및 실시예와 관련하여 개시되기는 하였지만, 본 출원의 실시양태는 구체적으로 개시된 실시양태를 너머 다른 대안적 실시양태 및/또는 그의 용도 및 변형 및 등가물까지 확장된다는 것을 당업자는 이해할 것이다.
일부 실시양태에서, 본 출원의 특정 실시양태를 기술하고, 주장하는 데 사용된, 예컨대, 분자량, 반응 조건 등과 같은 성분, 특성의 양을 표현한 수치는 일부 경우에 "약"이라는 용어로 수식될 수 있다는 것으로 이해하여야 한다. 따라서, 일부 실시양태에서, 작성된 설명서 및 첨부된 특허청구범위에 기재된 수치 파라미터는 특정 실시양태에 의해 수득되어야 하는 원하는 특성에 의존하여 달라질 수 있는 근사값이다. 일부 실시양태에서, 수치 파라미터는 보고된 유효 숫자의 개수를 고려하여, 및 통상의 반올림 기법을 적용함으로써 해석되어야 한다. 본 출원의 일부 실시양태의 광범위한 범주를 기재하는 수치 범위 및 파라미터가 근사치임에도 불구하고, 구체적인 실시예에 기재된 수치 값은 실행가능한 대로 정확하게 기록된다.
일부 실시양태에서, "하나"("a" 및 "an") 및 "그"라는 용어 및 본 출원의 특정 실시양태를 기술하는 것과 관련하여 (특히 하기 특허청구범위 중 특정의 것과 관련하여) 사용되는 유사 어구는 단수 및 복수의 것, 둘 모두를 포함하는 것으로 해석되어야 한다. 본원에서 값을 범위로 언급하는 것은 단지 상기 범위 내에 포함된 각각의 개별 값을 개별적으로 언급하는 속기 방법으로서의 역할을 하는 것으로 한다. 본원에서 달리 명시되지 않는 한, 각각의 개별 값은 마치 그가 본원에서 개별적으로 언급된 것과 같이 명세서에 포함된다. 본원에 달리 명시되지 않는 한, 또는 문맥상 명백하게 모순되지 않는 한, 본원에 기술된 모든 방법은 임의의 적합한 순서로 수행될 수 있다. 본원에서 특정 실시양태와 관련하여 제공되는 임의의 및 모든 예, 또는 예시적인 표현 (예를 들어, "예컨대")을 사용하는 것은 단지 본 출원을 더욱 잘 설명하기 위한 것이며, 달리 청구되는 본 출원의 범주를 제한하고자 하는 것이 아니다. 본 명세서에서는 어떤 표현도 본 출원의 실시에 필수적인 임의의 비청구 요소를 명시하는 것으로 해석되지 않아야 한다.
본 출원을 수행하기 위한, 본 발명자들에게 공지된 최상의 모드를 비롯한, 본 출원의 바람직한 실시양태가 본원에 기술되어 있다. 상기 바람직한 실시양태에 대한 변형은 상기 설명서를 읽음으로써 당업계의 숙련가에게 자명해질 것이다. 당업자는 적절할 경우, 상기와 같은 변형을 이용할 수 있고, 본 출원은 본원에 구체적으로 기술된 것과 다르게 실시될 수 있다는 것이 고려된다. 따라서, 본 출원의 다수의 실시양태는 준거법에 의해 허용되는, 본원에 첨부된 특허청구범위에서 언급된 대상의 모든 변형 및 등가물을 포함한다. 또한, 본원에 달리 명시되지 않는 한, 또는 문맥상 명백하게 모순되지 않는 한, 상기 기술된 요소는 그의 모든 가능한 변형으로 그의 임의의 조합이 본 출원에 포함된다.
본원에서 참조된 모든 특허, 특허 출원, 특허 출원 공보, 및 다른 자료, 예컨대, 논문, 서적, 명세서, 공개 문헌, 문헌, 유형물, 및/또는 기타 등은 그 전문이 본원에서 모든 목적을 위해 참조로 포함되지만, 단, 예외적으로, 상기의 것, 본 명세서와 일관되지 않거나, 의견상 대립되는 상기 것 중 임의의 것, 또는 현재 또는 추후에 본 명세서와 연관된 특허청구범위의 가장 광범위한 범주로서 제한된 효과를 가질 수 있는 상기 것 중 임의의 것과 연관된 임의의 기소 파일 이력은 제외된다. 예로서, 포함된 자료 중 임의의 것과 연관된 용어의 설명, 정의, 및/또는 용법과, 본 명세서와 연관된 것 사이에 임의의 불일치 또는 의견상 대립이 존재한다면, 본 명세서의 용어의 설명, 정의, 및/또는 용법이 우선하여 적용되어야 한다.
끝으로, 본원에 개시된 본 출원의 실시양태는 본 출원의 실시양태의 원리를 예시하는 것임을 이해하여야 한다. 사용될 수 있는 다른 변형도 본 출원의 범주 내에 포함될 수 있다. 따라서, 예를 들어, 제한하는 것은 아니지만, 본 출원의 실시양태의 대안적 구성이 본원의 교시에 따라 사용될 수 있다. 따라서, 본 출원의 실시양태는 정확하게 제시되고, 기술된 것으로 제한되지 않는다.
Claims (74)
1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계,
1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계, 및
환자의 배정된 위험군에 기초하여 환자를 위한 약물을 선택하는 단계로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 비-오피오이드 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 또 다른 오피오이드 진통제로부터 선택되는 것인 단계
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하는 방법.
1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계, 및
환자의 배정된 위험군에 기초하여 환자를 위한 약물을 선택하는 단계로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 비-오피오이드 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 또 다른 오피오이드 진통제로부터 선택되는 것인 단계
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하는 방법.
1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계,
패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 단계
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 방법.
패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 단계
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 방법.
제1항 또는 제2항에 있어서, 1개 이상의 유전자 변이체가 ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하는 것인, 방법.
제3항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 방법:
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD];
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]; 및
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD];
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]; 및
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
제1항 내지 제4항 중 어느 한 항에 있어서, 1개 이상의 유전자 변이체가 OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하거나 추가로 포함하는 것인, 방법.
제5항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 방법:
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD];
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD];
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]; 및
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD];
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD];
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]; 및
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
제4항 내지 제6항 중 어느 한 항에 있어서, PONV가 불응성인 것인, 방법.
제1항 또는 제2항에 있어서, 1개 이상의 유전자 변이체가 FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 포함하는 것인, 방법.
제8항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD]인 것인, 방법:
FAAH rs2295632 AA 고, CA 고, CC 저;
ABCB1 rs1045642 TT 고, TC 고, CC 저; 및
ADRB2 rs1042713 GG 고, GA 고, AA 저.
FAAH rs2295632 AA 고, CA 고, CC 저;
ABCB1 rs1045642 TT 고, TC 고, CC 저; 및
ADRB2 rs1042713 GG 고, GA 고, AA 저.
제1항 내지 제9항 중 어느 한 항에 있어서, 배정 단계가 컴퓨터 실행 방법에 의해 수행되는 것인, 방법.
제10항에 있어서, 컴퓨터 실행 방법이 결정 규칙을 포함하는 것인, 방법.
제10항 또는 제11항에 있어서, 컴퓨터 실행 방법이 각 SNP가 쌍을 이루는 2개의 이진 변수를 초래하도록 유전자형을 코딩하는 것을 포함하는 것인, 방법.
제3항에 있어서, 배정 단계가 결정 규칙을 포함하는 컴퓨터 실행 방법에 의해 수행되고, 결정 규칙이
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 방법.
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 방법.
제8항에 있어서, 배정 단계가 결정 규칙을 포함하는 컴퓨터 실행 방법에 의해 수행되고, 결정 규칙은
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 방법.
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 방법.
제1항 내지 제14항 중 어느 한 항에 있어서, 1개 이상의 추가의 비-유전 인자를 사용하여 환자의 2개의 위험군 중 하나로의 배정을 개선시키거나 약물의 용량을 선택하는 것인, 방법.
제15항에 있어서, 1개 이상의 추가의 비-유전 인자가 성별, 인종, 연령, 및 진단으로부터 선택되는 것인, 방법.
제1항 내지 제16항 중 어느 한 항에 있어서, 환자가 소아 환자인 것인, 방법.
제1항 내지 제17항 중 어느 한 항에 있어서, 환자가 백인 조상인 것인, 방법.
제16항에 있어서, 환자가 저위험군으로 배정된 백인 조상의 여아 환자이고, 오피오이드 약물은 전체 투약 용량이 0.15 mg/kg, 0.2 mg/kg, 또는 0.275 mg/kg을 초과하지 않도록 투여되는 것인, 방법.
제1항 내지 제19항 중 어느 한 항에 있어서, 환자의 유전자형을 환자의 유전자형을 결정하는 데 사용된 장치로부터 직접 수령하는 것인, 방법.
제1항 내지 제20항 중 어느 한 항에 있어서, 환자의 유전자형이 환자로부터 생물학적 샘플을 수득하거나 수령하고, 샘플로부터 DNA를 추출하며, DNA를 분석하여 패널 중 각 유전자 변이체에서의 환자의 유전자형을 결정하는 단계를 포함하는 방법에 의해 결정되는 것인, 방법.
제21항에 있어서, DNA를 유전자형 분석 플랫폼에 기반한 중합효소 연쇄 반응을 사용하여 분석하는 것인, 방법.
제22항에 있어서, 유전자형 분석 플랫폼이 특이적인 유전자 변이체를 증폭시키고 검출하기 위해 5' 뉴클레아제 검정법을 이용하는 것인, 방법.
제21항 내지 제23항 중 어느 한 항에 있어서, 생물학적 샘플이 혈액 샘플 및 구강 면봉 채취물로부터 선택되는 것인, 방법.
하기 성분 (i) 하기 SNP OPRMI rs1799971, ABCB1 rs9282564, ABCB1 rs1045642, 및 ADRB2 rs1042713 각각을 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함하는, 생물학적 검정용 키트.
하기 성분 (i) ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로부터 선택되는 하나 이상의 유전자 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함하는, 생물학적 검정용 키트.
제26항에 있어서, OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로부터 선택되는 하나 이상의 추가의 유전자 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트를 추가로 포함하는 것인, 생물학적 검정용 키트.
하기 성분 (i) FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 증폭시키는 데 효과적인 서열 특이 정방향 및 역방향 프라이머 세트; (ii) 각각이 SNP의 상이한 대립유전자에 하이브리드화하는 데 효과적인, 표지화된 2개의 DNA 프로브; 및 (iii) 5' 뉴클레아제 활성을 가지는 DNA 폴리머라제를 포함하는, 생물학적 검정용 키트
1개 이상의 데이터 프로세서에 의해, 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계, 및
1개 이상의 데이터 프로세서에 의해, 환자의 배정된 위험군에 기초하여, 환자를 위한 약물을 선택하는 단계로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 다른 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 모르핀-기반 오피오이드로부터 선택되는 것인 단계
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하는 컴퓨터 실행 방법.
1개 이상의 데이터 프로세서에 의해, 환자의 배정된 위험군에 기초하여, 환자를 위한 약물을 선택하는 단계로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 다른 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 모르핀-기반 오피오이드로부터 선택되는 것인 단계
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하는 컴퓨터 실행 방법.
1개 이상의 데이터 프로세서에 의해, 1개 이상의 유전자 변이체에 대한 환자의 유전자형을 결정하거나 수령하는 단계,
1개 이상의 데이터 프로세서에 의해, 패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 단계
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 컴퓨터 실행 방법.
1개 이상의 데이터 프로세서에 의해, 패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여, 중증 오피오이드 유도성 유해 사례에 대한 저위험군 및 고위험군으로 정의된 2개의 위험군 중 하나로 환자를 배정하는 단계로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 단계
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하는 컴퓨터 실행 방법.
제29항 또는 제30항에 있어서, 1개 이상의 유전자 변이체가 ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하는 것인, 컴퓨터 실행 방법.
제30항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 컴퓨터 실행 방법:
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD]
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD]
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
제29항 내지 제32항 중 어느 한 항에 있어서, 1개 이상의 유전자 변이체가 OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하거나 추가로 포함하는 것인, 컴퓨터 실행 방법.
제33항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 컴퓨터 실행 방법:
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD]
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD]
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD]
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD]
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
제32항 내지 제34항 중 어느 한 항에 있어서, PONV가 불응성인 것인, 컴퓨터 실행 방법.
제29항 또는 제30항에 있어서, 1개 이상의 유전자 변이체가 FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 포함하는 것인, 컴퓨터 실행 방법.
제36항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD]인 것인, 컴퓨터 실행 방법:
FAAH rs2295632 AA 고, CA 고, CC 저
ABCB1 rs1045642 TT 고, TC 고, CC 저
ADRB2 rs1042713 GG 고, GA 고, AA 저.
FAAH rs2295632 AA 고, CA 고, CC 저
ABCB1 rs1045642 TT 고, TC 고, CC 저
ADRB2 rs1042713 GG 고, GA 고, AA 저.
제29항 내지 제37항 중 어느 한 항에 있어서, 배정 단계가 결정 규칙에 기초하는 것인, 컴퓨터 실행 방법.
제29항 내지 제38항 중 어느 한 항에 있어서, 각 SNP가 쌍을 이루는 2개의 이진 변수를 초래하도록 유전자형을 코딩하는 단계를 추가로 포함하는 것인, 컴퓨터 실행 방법.
제38항에 있어서, 결정 규칙이
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 컴퓨터 실행 방법.
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 컴퓨터 실행 방법.
제38항에 있어서, 결정 규칙이
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 컴퓨터 실행 방법.
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 컴퓨터 실행 방법.
제29항 내지 제41항 중 어느 한 항에 있어서, 1개 이상의 추가의 비-유전 인자를 사용하여 환자의 2개의 위험군 중 하나로의 배정을 개선시키거나 약물의 용량을 선택하는 단계를 추가로 포함하는 것인, 컴퓨터 실행 방법.
제42항에 있어서, 1개 이상의 추가의 비-유전 인자가 성별, 인종, 연령, 및 임상 진단으로부터 선택되는 것인, 컴퓨터 실행 방법.
제29항 내지 제43항 중 어느 한 항에 있어서, 환자가 소아 환자인 것인, 컴퓨터 실행 방법.
제29항 내지 제44항 중 어느 한 항에 있어서, 환자가 백인 조상인 것인, 컴퓨터 실행 방법.
제29항 내지 제45항 중 어느 한 항에 있어서, 환자가 저위험군으로 배정된 백인 조상의 여아 환자이고, 모르핀-기반 오피오이드 약물은 전체 모르핀 투약 용량이 0.15 mg/kg, 0.2 mg/kg, 또는 0.275 mg/kg을 초과하지 않도록 투여되는 것인, 컴퓨터 실행 방법.
제29항 내지 제46항 중 어느 한 항에 있어서, 환자의 유전자형을 환자의 유전자형을 결정하는 데 사용된 장치로부터 직접 수령하는 것인, 컴퓨터 실행 방법.
제29항 내지 제47항 중 어느 한 항에 있어서, 환자의 유전자형이 환자로부터 생물학적 샘플을 수득하거나 수령하고, 샘플로부터 DNA를 추출하며, DNA를 분석하여 패널 중 각 유전자 변이체에서의 환자의 유전자형을 결정하는 단계를 포함하는 방법에 의해 결정되는 것인, 컴퓨터 실행 방법.
제48항에 있어서, DNA를 유전자형 분석 플랫폼에 기반한 중합효소 연쇄 반응을 사용하여 분석하는 것인, 컴퓨터 실행 방법.
제49항에 있어서, 유전자형 분석 플랫폼이 특이적인 유전자 변이체를 증폭시키고 검출하기 위해 5' 뉴클레아제 검정법을 이용하는 것인, 컴퓨터 실행 방법.
제48항 내지 제50항 중 어느 한 항에 있어서, 생물학적 샘플이 혈액 샘플 및 구강 면봉 채취물로부터 선택되는 것인, 컴퓨터 실행 방법.
환자의 유전자형, 및 중증 오피오이드 유도성 유해 사례에 대한, 저위험군 및 고위험군을 포함하는 위험군에 대한 약물을 저장하는 데이터베이스;
1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여 위험군 중 하나로 환자를 배정하고, 환자의 배정된 위험군에 기초하여 환자를 위한 약물을 선택하도록 설정된 프로세서로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 다른 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 모르핀-기반 오피오이드로부터 선택되는 것인 프로세서
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하기 위한 시스템.
1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여 위험군 중 하나로 환자를 배정하고, 환자의 배정된 위험군에 기초하여 환자를 위한 약물을 선택하도록 설정된 프로세서로서, 여기서, 환자가 고위험군으로 배정되었다면, 약물은 비-모르핀 오피오이드 또는 다른 진통제로부터 선택되고, 환자가 저위험군으로 배정되었다면, 약물은 모르핀 또는 모르핀-기반 오피오이드로부터 선택되는 것인 프로세서
를 포함하는, 진통제를 필요로 하는 환자를 위한 진통제 약물을 선택하기 위한 시스템.
환자의 유전자형, 및 중증 오피오이드 유도성 유해 사례에 대한, 저위험군 및 고위험군을 포함하는 위험군에 대한 약물을 저장하는 데이터베이스;
패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여 위험군 중 하나로 환자를 배정하도록 설정된 프로세서로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 프로세서
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하기 위한 시스템.
패널의 1개 이상의 유전자 변이체에 대한 환자의 유전자형에 기초하여 위험군 중 하나로 환자를 배정하도록 설정된 프로세서로서, 여기서, 고위험군으로 배정된 환자는 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자로서 확인되는 것인 프로세서
를 포함하는, 중증 오피오이드 유도성 유해 사례의 위험이 있는 환자를 확인하기 위한 시스템.
제52항 또는 제53항에 있어서, 1개 이상의 유전자 변이체가 ABCB1 rs9282564, ABCC3 rs4148412, 및 ABCC3 kgp8560677로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하는 것인, 시스템.
제54항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 시스템:
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD]
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
ABCB1 rs9282564 GG 고, AG 고, AA 저 [RD]
ABCC3 rs4148412 AA 고, AG 고, GG 저 [장기간RD]
ABCC3 kgp8560677 AA 고, AG 고, GG 저 [PONV].
제52항 내지 제55항 중 어느 한 항에 있어서, 1개 이상의 유전자 변이체가 OPRM1 rs1799971, ABCC3 rs739923, FAAH rs 324420, 및 ABCB1 rs1045642로 이루어진 군으로부터 선택되는 1개 이상의 변이체를 포함하거나 추가로 포함하는 것인, 시스템.
제56항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD], RD에 기인하는 장기간의 회복실 체류 [장기간RD], 및 수술 후 오심 및 구토 [PONV]로부터 선택되는 것인, 시스템:
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD]
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD]
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
OPRM1 rs1799971 GG 고, AG 고, AA 저 [RD]
ABCC3 rs739923 GG 널, AG 저, AA 저 [장기간RD]
FAAH rs324420 AA 고, AC 고, CC 저 [PONV]
ABCB1 rs1045642 TT 고, TC 고, CC 저 [RD].
제55항 내지 제57항 중 어느 한 항에 있어서, PONV가 불응성인 것인, 시스템.
제52항 또는 제53항에 있어서, 1개 이상의 유전자 변이체가 FAAH rs2295632, ABCB1 rs1045642, 및 ADRB2 rs1042713으로 이루어진 3개 이상의 변이체를 포함하는 것인, 시스템.
제59항에 있어서, 변이체가 하기와 같이 2개의 위험군 중 하나로 배정되고, 중증 오피오이드 유도성 유해 사례가 호흡 억제 [RD]인 것인, 시스템:
FAAH rs2295632 AA 고, CA 고, CC 저
ABCB1 rs1045642 TT 고, TC 고, CC 저
ADRB2 rs1042713 GG 고, GA 고, AA 저.
FAAH rs2295632 AA 고, CA 고, CC 저
ABCB1 rs1045642 TT 고, TC 고, CC 저
ADRB2 rs1042713 GG 고, GA 고, AA 저.
제52항 내지 제60항 중 어느 한 항에 있어서, 프로세서가 결정 규칙에 기초하여 배정하도록 설정된 것인, 시스템.
제52항 내지 제61항 중 어느 한 항에 있어서, 프로세서가 각 SNP가 쌍을 이루는 2개의 이진 변수를 초래하도록 유전자형을 코딩하도록 추가로 설정된 것인, 시스템.
제61항에 있어서, 결정 규칙이
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 시스템.
[(rs9282564=AA) 또는 (rs4148412=GG) 또는 (kgp8560677=GG)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 시스템.
제61항 내지 제63항 중 어느 한 항에 있어서, 결정 규칙이
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 시스템.
[(rs2295632=CC) 또는 (rs1045642=CC) 또는 (rs1042713=AA)]가 참이면, 위험=없음 (낮음),
거짓이면, 위험=있음 (높음)을 포함하는 것인, 시스템.
제52항 내지 제64항 중 어느 한 항에 있어서, 프로세서가 1개 이상의 추가의 비-유전 인자를 사용하여 환자의 2개의 위험군 중 하나로의 배정을 개선시키거나 약물의 용량을 선택하도록 추가로 설정된 것인, 시스템.
제65항에 있어서, 1개 이상의 추가의 비-유전 인자가 성별, 인종, 및 임상 진단으로부터 선택되는 것인, 시스템.
제52항 내지 제66항 중 어느 한 항에 있어서, 환자가 소아 환자인 것인, 시스템.
제52항 내지 제67항 중 어느 한 항에 있어서, 환자가 백인 조상인 것인, 시스템.
제66항에 있어서, 환자가 저위험군으로 배정된 백인 조상의 여아 환자이고, 모르핀-기반 오피오이드 약물은 전체 모르핀 투약 용량이 0.15 mg/kg, 0.2 mg/kg, 또는 0.275 mg/kg을 초과하지 않도록 투여되는 것인, 시스템.
제52항 내지 제69항 중 어느 한 항에 있어서, 환자의 유전자형을 환자의 유전자형을 결정하는 데 사용된 장치로부터 직접 수령하는 것인, 시스템.
제52항 내지 제70항 중 어느 한 항에 있어서, 환자의 유전자형이 환자로부터 생물학적 샘플을 수득하거나 수령하고, 샘플로부터 DNA를 추출하며, DNA를 분석하여 패널 중 각 유전자 변이체에서의 환자의 유전자형을 결정하는 단계를 포함하는 방법에 의해 결정되는 것인, 시스템.
제71항에 있어서, DNA를 유전자형 분석 플랫폼에 기반한 중합효소 연쇄 반응을 사용하여 분석하는 것인, 시스템.
제72항에 있어서, 유전자형 분석 플랫폼이 특이적인 유전자 변이체를 증폭시키고 검출하기 위해 5' 뉴클레아제 검정법을 이용하는 것인, 시스템.
제71항 내지 제73항 중 어느 한 항에 있어서, 생물학적 샘플이 혈액 샘플 및 구강 면봉 채취물로부터 선택되는 것인, 시스템.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461943944P | 2014-02-24 | 2014-02-24 | |
| US61/943,944 | 2014-02-24 | ||
| PCT/US2015/017134 WO2015127379A1 (en) | 2014-02-24 | 2015-02-23 | Methods and compositions for personalized pain management |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160123385A true KR20160123385A (ko) | 2016-10-25 |
Family
ID=52597325
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167026246A Withdrawn KR20160123385A (ko) | 2014-02-24 | 2015-02-23 | 개인 맞춤형 통증 관리를 위한 방법 및 조성물 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US10878939B2 (ko) |
| EP (1) | EP3110968B1 (ko) |
| JP (1) | JP6581117B2 (ko) |
| KR (1) | KR20160123385A (ko) |
| CN (1) | CN106460042A (ko) |
| AU (1) | AU2015218692A1 (ko) |
| CA (1) | CA2940422A1 (ko) |
| IL (1) | IL247389A0 (ko) |
| SG (1) | SG11201607035YA (ko) |
| WO (1) | WO2015127379A1 (ko) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008085857A2 (en) | 2007-01-04 | 2008-07-17 | Children's Hospital Medical Center | Processing text with domain-specific spreading activation methods |
| US9944985B2 (en) | 2011-11-30 | 2018-04-17 | Children's Hospital Medical Center | Personalized pain management and anesthesia: preemptive risk identification and therapeutic decision support |
| EP3110968B1 (en) | 2014-02-24 | 2019-04-17 | Children's Hospital Medical Center | Methods and compositions for personalized pain management |
| WO2016023026A1 (en) | 2014-08-08 | 2016-02-11 | Children's Hospital Medical Center | Diagnostic method for distinguishing forms of esophageal eosinophilia |
| JP6702686B2 (ja) * | 2015-10-09 | 2020-06-03 | 株式会社エムティーアイ | 表現型推定システム及び表現型推定プログラム |
| WO2017123401A1 (en) | 2016-01-13 | 2017-07-20 | Children's Hospital Medical Center | Compositions and methods for treating allergic inflammatory conditions |
| US20200024662A1 (en) * | 2016-11-23 | 2020-01-23 | Assurex Health, Inc. | Methods for treating opioid addiction |
| EP3571309A4 (en) | 2017-01-20 | 2020-11-25 | Children's Hospital Medical Center | METHODS AND COMPOSITIONS RELATED TO THE METHYLATION OF OPRM1 DNA TO MANAGE PAIN IN PEOPLE |
| CN113570064A (zh) * | 2017-05-05 | 2021-10-29 | 第四范式(北京)技术有限公司 | 利用复合机器学习模型来执行预测的方法及系统 |
| US11859250B1 (en) | 2018-02-23 | 2024-01-02 | Children's Hospital Medical Center | Methods for treating eosinophilic esophagitis |
| JP7078458B2 (ja) * | 2018-05-30 | 2022-05-31 | 株式会社Soken | 操舵角決定装置、および、自動運転車 |
| CN108929913A (zh) * | 2018-08-21 | 2018-12-04 | 潍坊德诺泰克生物科技有限公司 | 用于检测rs2032582的引物探针组及其应用 |
| AU2019370896A1 (en) * | 2018-10-31 | 2021-06-17 | Ancestry.Com Dna, Llc | Estimation of phenotypes using DNA, pedigree, and historical data |
| CN109741826B (zh) * | 2018-12-13 | 2022-09-13 | 华中科技大学鄂州工业技术研究院 | 麻醉评估决策树构建方法及设备 |
| AU2019414963A1 (en) * | 2018-12-28 | 2021-08-19 | Xing-Liang Liu | Methods and systems for providing a personalized cannabinoid treatment regimen |
| US12297501B2 (en) | 2019-02-25 | 2025-05-13 | Children's Hospital Medical Center | Methods for diagnosing and treating eosinophilic gastritis |
| US11216742B2 (en) | 2019-03-04 | 2022-01-04 | Iocurrents, Inc. | Data compression and communication using machine learning |
| CN111312387A (zh) * | 2020-01-16 | 2020-06-19 | 安徽医科大学第一附属医院 | 一种男性慢性前列腺炎/慢性盆腔痛综合征疼痛严重程度预测模型及其建立 |
| US20210407643A1 (en) * | 2020-06-25 | 2021-12-30 | Greenway Dna Inc. | Methods and systems for providing a personalized treatment regimen using cannabinoid or psychedelic compounds |
| US12243629B2 (en) * | 2022-09-30 | 2025-03-04 | Cilag Gmbh International | Capacity to adjust patient consent |
| CN115976190B (zh) * | 2022-11-15 | 2024-08-27 | 苏州吉赛基因测序科技有限公司 | 剖宫产患者术后镇痛用药相关基因分型检测的产品及用途 |
Family Cites Families (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US5976081A (en) | 1983-08-11 | 1999-11-02 | Silverman; Stephen E. | Method for detecting suicidal predisposition |
| US5148483A (en) | 1983-08-11 | 1992-09-15 | Silverman Stephen E | Method for detecting suicidal predisposition |
| US4675904A (en) | 1983-08-11 | 1987-06-23 | Compusonics, Inc. | Method for detecting suicidal predisposition |
| GB8810400D0 (en) | 1988-05-03 | 1988-06-08 | Southern E | Analysing polynucleotide sequences |
| US5700637A (en) | 1988-05-03 | 1997-12-23 | Isis Innovation Limited | Apparatus and method for analyzing polynucleotide sequences and method of generating oligonucleotide arrays |
| US6054270A (en) | 1988-05-03 | 2000-04-25 | Oxford Gene Technology Limited | Analying polynucleotide sequences |
| US5744101A (en) | 1989-06-07 | 1998-04-28 | Affymax Technologies N.V. | Photolabile nucleoside protecting groups |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US5288644A (en) | 1990-04-04 | 1994-02-22 | The Rockefeller University | Instrument and method for the sequencing of genome |
| EP0695941B1 (en) | 1994-06-08 | 2002-07-31 | Affymetrix, Inc. | Method and apparatus for packaging a chip |
| US6287850B1 (en) | 1995-06-07 | 2001-09-11 | Affymetrix, Inc. | Bioarray chip reaction apparatus and its manufacture |
| US6300063B1 (en) | 1995-11-29 | 2001-10-09 | Affymetrix, Inc. | Polymorphism detection |
| EP2369007B1 (en) | 1996-05-29 | 2015-07-29 | Cornell Research Foundation, Inc. | Detection of nucleic acid sequence differences using coupled ligase detection and polymerase chain reactions |
| US6429027B1 (en) | 1998-12-28 | 2002-08-06 | Illumina, Inc. | Composite arrays utilizing microspheres |
| US8301468B2 (en) | 2000-05-15 | 2012-10-30 | Optuminsight, Inc. | System and method of drug disease matching |
| WO2002006536A2 (en) | 2000-07-11 | 2002-01-24 | Kirk Hogan | Methods and compositions for perioperative genomic profiling |
| US7062443B2 (en) | 2000-08-22 | 2006-06-13 | Silverman Stephen E | Methods and apparatus for evaluating near-term suicidal risk using vocal parameters |
| US7139699B2 (en) | 2000-10-06 | 2006-11-21 | Silverman Stephen E | Method for analysis of vocal jitter for near-term suicidal risk assessment |
| US20030092019A1 (en) | 2001-01-09 | 2003-05-15 | Millennium Pharmaceuticals, Inc. | Methods and compositions for diagnosing and treating neuropsychiatric disorders such as schizophrenia |
| AU2002366713A1 (en) | 2001-12-20 | 2003-07-09 | Incyte Genomics, Inc. | Nucleotide polymorphisms associated with osteoarthritis |
| US7716207B2 (en) | 2002-02-26 | 2010-05-11 | Odom Paul S | Search engine methods and systems for displaying relevant topics |
| WO2005105093A2 (en) | 2003-08-26 | 2005-11-10 | Duke University | METHOD OF ARRESTING THE SIDE EFFECTS OF µ-OPIOID RECEPTOR AGONISTS DURING THEIR ADMINISTRATION |
| EP2078749A1 (en) * | 2004-03-31 | 2009-07-15 | Tokyo Metropolitan Organization for Medical Research | Method of evaluating drug sensitivity by analyzing the mu-opioid receptor gene |
| WO2006119343A1 (en) | 2005-05-03 | 2006-11-09 | Children's Hospital Medical Center | Determination of eosinophilic esophagitis |
| US20090253585A1 (en) * | 2005-11-30 | 2009-10-08 | Luda Diatchenko | Identification of Genetic Polymorphic Variants Associated With Somatosensory Disorders and Methods of Using the Same |
| US7754428B2 (en) | 2006-05-03 | 2010-07-13 | The Chinese University Of Hong Kong | Fetal methylation markers |
| JP5308644B2 (ja) | 2006-08-31 | 2013-10-09 | 公益財団法人東京都医学総合研究所 | Girkチャネル遺伝子解析による薬物感受性の評価方法 |
| US7899764B2 (en) | 2007-02-16 | 2011-03-01 | Siemens Aktiengesellschaft | Medical ontologies for machine learning and decision support |
| WO2008133329A1 (ja) | 2007-04-25 | 2008-11-06 | Tokyo Metropolitan Organization For Medical Research | Pomc遺伝子解析による薬物感受性の評価方法 |
| WO2009067473A2 (en) | 2007-11-20 | 2009-05-28 | Wisconsin Alumni Research Foundation | Method of improving palliative care |
| US8249225B2 (en) | 2008-03-14 | 2012-08-21 | International Business Machines Corporation | Identifying caller preferences based on voice print analysis |
| EP2367951B1 (en) | 2008-11-26 | 2014-06-11 | Merck Serono S.A. | Compositions and methods for treating growth hormone deficiency |
| US8497066B2 (en) | 2008-12-04 | 2013-07-30 | Rush University Medical Center | DNA methylation based test for monitoring efficacy of treatment |
| WO2010126867A1 (en) | 2009-04-27 | 2010-11-04 | Cincinnati Children's Hospital Medical Center | Computer implemented system and method for assessing a neuropsychiatric condition of a human subject |
| GB2483108A (en) | 2010-08-27 | 2012-02-29 | Walid Juffali | Monitoring neurological electrical signals to detect the onset of a neurological episode |
| JP6053267B2 (ja) | 2010-09-03 | 2016-12-27 | 公益財団法人東京都医学総合研究所 | アドレナリン受容体遺伝子解析による薬物感受性および疾患脆弱性の評価方法 |
| US8694335B2 (en) | 2011-02-18 | 2014-04-08 | Nuance Communications, Inc. | Methods and apparatus for applying user corrections to medical fact extraction |
| US9928344B2 (en) | 2011-06-21 | 2018-03-27 | Children's Hospital Medical Center | Diagnostic methods of eosinophilic esophagitis |
| US9944985B2 (en) | 2011-11-30 | 2018-04-17 | Children's Hospital Medical Center | Personalized pain management and anesthesia: preemptive risk identification and therapeutic decision support |
| CA2865154A1 (en) | 2012-02-24 | 2013-08-29 | Children's Hospital Medical Center | Esophageal microrna expression profiles in eosinophilic esophagitis |
| WO2013155010A1 (en) | 2012-04-09 | 2013-10-17 | Children's Hospital Medical Center | Non-invasive biomarkers for eosinophilic esophagitis |
| US8377657B1 (en) | 2012-05-15 | 2013-02-19 | Predictive Biosciences Corporation | Primers for analyzing methylated sequences and methods of use thereof |
| US10132809B2 (en) | 2012-10-10 | 2018-11-20 | Rhote Island Hospital | Differential expression of protein markers for the diagnosis and treatment of eosinophilic esophagitis |
| US9691411B2 (en) | 2013-05-24 | 2017-06-27 | Children's Hospital Medical Center | System and method for assessing suicide risk of a patient based upon non-verbal characteristics of voice data |
| WO2015017731A1 (en) | 2013-08-01 | 2015-02-05 | Children's Hospital Medical Center | Identification of surgery candidates using natural language processing |
| EP3110968B1 (en) | 2014-02-24 | 2019-04-17 | Children's Hospital Medical Center | Methods and compositions for personalized pain management |
| WO2016023026A1 (en) | 2014-08-08 | 2016-02-11 | Children's Hospital Medical Center | Diagnostic method for distinguishing forms of esophageal eosinophilia |
| EP3571309A4 (en) | 2017-01-20 | 2020-11-25 | Children's Hospital Medical Center | METHODS AND COMPOSITIONS RELATED TO THE METHYLATION OF OPRM1 DNA TO MANAGE PAIN IN PEOPLE |
| EP3813814B1 (en) | 2018-06-28 | 2024-11-27 | Children's Hospital Medical Center | Methods and compositions relating to personalized pain management |
-
2015
- 2015-02-23 EP EP15707526.8A patent/EP3110968B1/en active Active
- 2015-02-23 SG SG11201607035YA patent/SG11201607035YA/en unknown
- 2015-02-23 JP JP2016570925A patent/JP6581117B2/ja not_active Expired - Fee Related
- 2015-02-23 KR KR1020167026246A patent/KR20160123385A/ko not_active Withdrawn
- 2015-02-23 CA CA2940422A patent/CA2940422A1/en not_active Abandoned
- 2015-02-23 US US15/120,087 patent/US10878939B2/en active Active
- 2015-02-23 CN CN201580021042.6A patent/CN106460042A/zh active Pending
- 2015-02-23 WO PCT/US2015/017134 patent/WO2015127379A1/en active Application Filing
- 2015-02-23 AU AU2015218692A patent/AU2015218692A1/en not_active Abandoned
-
2016
- 2016-08-21 IL IL247389A patent/IL247389A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US20170061073A1 (en) | 2017-03-02 |
| AU2015218692A1 (en) | 2016-09-15 |
| EP3110968B1 (en) | 2019-04-17 |
| SG11201607035YA (en) | 2016-09-29 |
| CA2940422A1 (en) | 2015-08-27 |
| US10878939B2 (en) | 2020-12-29 |
| WO2015127379A1 (en) | 2015-08-27 |
| IL247389A0 (en) | 2016-11-30 |
| JP6581117B2 (ja) | 2019-09-25 |
| EP3110968A1 (en) | 2017-01-04 |
| CN106460042A (zh) | 2017-02-22 |
| JP2017512069A (ja) | 2017-05-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3110968B1 (en) | Methods and compositions for personalized pain management | |
| US12077821B2 (en) | Personalized pain management and anesthesia: preemptive risk identification and therapeutic decision support | |
| Hayes et al. | Genome-wide association of polycystic ovary syndrome implicates alterations in gonadotropin secretion in European ancestry populations | |
| Enoch | Genetic influences on the development of alcoholism | |
| do Rego Borges et al. | Genetic risk factors for nonsyndromic cleft lip with or without cleft palate in a Brazilian population with high African ancestry | |
| Rouvinen-Lagerström et al. | µ-Opioid receptor gene (OPRM1) polymorphism A118G: lack of association in Finnish populations with alcohol dependence or alcohol consumption | |
| Hubacek et al. | The FTO variant is associated with chronic complications of diabetes mellitus in Czech population | |
| O ‘Doherty et al. | Association of DHODH haplotype variants and response to leflunomide treatment in rheumatoid arthritis | |
| Dias et al. | Genetic variations at the human growth hormone receptor (GHR) gene locus are associated with idiopathic short stature | |
| Randesi et al. | Dopamine gene variants in opioid addiction: comparison of dependent patients, nondependent users and healthy controls | |
| Liu et al. | DRD3 Ser9Gly polymorphism and treatment response to antipsychotics in schizophrenia: A meta-analysis | |
| Zheng et al. | Evaluation of the MC3R gene pertaining to body weight and height regulation and puberty development | |
| Gervasini et al. | Variability of the L‐Histidine decarboxylase gene in allergic rhinitis | |
| JP2006518206A (ja) | 処置中の自殺傾向を予測するための方法 | |
| Severinsen et al. | Association analyses suggest GPR24 as a shared susceptibility gene for bipolar affective disorder and schizophrenia | |
| EP1651774B1 (en) | Use of polymorphisms in human oatp-c associated with an effect on statin pharmacokinetics in humans in statin therapy | |
| Xiao et al. | A genome-wide association study identifies a novel association between SDC3 and apparent treatment-resistant hypertension | |
| Chung et al. | Beta2 adrenergic receptor (ADRβ2) haplotype pair (2/4) is associated with severe asthma | |
| Briant et al. | Evidence for association of two variants of the nociceptin/orphanin FQ receptor gene OPRL1 with vulnerability to develop opiate addiction in Caucasians | |
| Xu et al. | OPRM1 gene is associated with BMI in Uyghur population | |
| Liou et al. | Genetic analysis of the human ENTH (Epsin 4) gene and schizophrenia | |
| WO2011104730A1 (en) | Genetic variants predictive of lung cancer risk | |
| Zareef et al. | Genetic association study for three single nucleotide polymorphisms related to type 2 diabetes in Egyptian population | |
| Clarka et al. | Genome-wide association study of patient and clinician rated global impression severity during antipsychotic treatment |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20160922 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| PC1203 | Withdrawal of no request for examination |