KR20150088890A - Assays for detecting neutralizing autoantibodies to biologic therapy - Google Patents
Assays for detecting neutralizing autoantibodies to biologic therapy Download PDFInfo
- Publication number
- KR20150088890A KR20150088890A KR1020157017311A KR20157017311A KR20150088890A KR 20150088890 A KR20150088890 A KR 20150088890A KR 1020157017311 A KR1020157017311 A KR 1020157017311A KR 20157017311 A KR20157017311 A KR 20157017311A KR 20150088890 A KR20150088890 A KR 20150088890A
- Authority
- KR
- South Korea
- Prior art keywords
- tnf
- drug
- labeled
- alpha
- sample
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/525—Tumor necrosis factor [TNF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Chemical & Material Sciences (AREA)
- Urology & Nephrology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Rehabilitation Therapy (AREA)
- Rheumatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Toxicology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
본 발명은 시료 내 항-TNFα 약물 치료요법과 같은 생물제제에 대한 중화 및 비-중화 자가항체의 존재 또는 수준을 검출 및 측정하기 위한 검정을 제공한다. 본 발명은 대상체가 생물제제 치료요법 중인 동안 시간 경과에 따른 중화 및/또는 비-중화 항-약물 항체의 형성을 모니터링하기에 유용하다. 본 발명은 또한 대안적인 생물제제 치료요법을 받는 대상체의 시료 내 중화 항-약물 항체의 교차-반응성을 예측 및/또는 결정하기에 유용하다. 이로써, 본 발명은 생물학적 제제로의 치료요법을 받는 대상체를 위한 치료 결정 안내 정보를 제공하고, 치료요법을 최적화하고, 독성을 경감하고 및/또는 생물학적 치료요법에 대한 치료학적 치료의 효능을 모니터링하는 데 있어서 정확도를 개선시킨다.The present invention provides assays for detecting and measuring the presence or level of neutralizing and non-neutralizing autoantibodies to biologics such as anti-TNFa drug therapy in a sample. The present invention is useful for monitoring the formation of neutralizing and / or non-neutralizing anti-drug antibodies over time while subjects are being treated with biologics. The invention is also useful for predicting and / or determining the cross-reactivity of neutralizing anti-drug antibodies in a sample of a subject receiving an alternative biologic therapy. Thus, the present invention provides therapeutic decision guidance information for a subject being treated with a biological agent, optimizing therapy therapy, alleviating toxicity and / or monitoring the efficacy of therapeutic treatment for biological therapy regimens To improve accuracy.
Description
관련 출원의 상호 참조Cross reference of related application
본 출원은 2011 년 7 월 6 일에 출원한 미국 가출원 번호 61/505,031, 2011 년 8 월 26 일에 출원한 미국 가출원 번호 61/528,072 및 2011 년 9 월 16 일에 출원한 미국 가출원 번호 61/535,884 에 대해 우선권을 주장하는, 2012 년 7 월 6 일에 출원한 PCT 출원 번호 PCT/US2012/045794 의 일부계속출원인 2013 년 3 월 13 일에 출원한 미국 출원 번호 13/802,117 에 대해 우선권을 주장한다. 본 출원은 또한 2012 년 11 월 30 일에 출원한 미국 가출원 번호 61/732,251 에 대해 우선권을 주장한다. 이러한 각 출원의 개시물은 그 어떤 목적으로든 그 전체가 본원에 참고문헌으로 포함된다. This application claims the benefit of U.S. Provisional Application No. 61 / 505,031, filed July 6, 2011, U.S. Provisional Application No. 61 / 528,072, filed August 26, 2011, and U.S. Provisional Application No. 61 / 535,884, filed September 16, 13 / 802,117, filed March 13, 2013, which is a continuation-in-part of PCT Application No. PCT / US2012 / 045794, filed July 6, 2012, This application also claims priority to U.S. Provisional Application No. 61 / 732,251 filed on November 30, 2012. The disclosures of each of these applications are incorporated herein by reference in their entirety for any purpose.
자가면역 장애는 심각하고 만연되어 있는 의학적인 과제이다. 예를 들면, 류마티스 관절염 (RA) 은 약 2백만 이상의 미국인에게 영향을 미치고 있는 자가면역 질환이다. RA 는 관절의 만성 염증을 야기하고 전형적으로 관절 파괴 및 기능적 불능을 야기할 수 있는 잠재성이 있는 진행성 질병이다. 비록 유전적 소인, 감염 인자 및 환경적 인자가 모두 상기 질병의 병인에 상관있지만, 류마티스 관절염의 원인은 알려져 있지 않다. 활성 RA 에서, 증상은 피로, 식욕 부진, 미열, 근육 및 관절의 통증 및 뻣뻣함을 포함할 수 있다. 질병이 발병되는 동안, 관절은 활막 (synovium) 의 염증으로 인해, 종종 붉게 부풀어오르고, 통증을 느끼며 약해진다. 또한, RA 는 전신적인 질병이기 때문에, 염증이 눈과 입의 샘, 폐 라이닝 (lining), 심낭막 및 혈관을 포함하는, 관절 이외의 다른 신체의 장기 및 영역에 영향을 줄 수 있다. Autoimmune disorders are a serious and rampant medical challenge. For example, rheumatoid arthritis (RA) is an autoimmune disease affecting over two million Americans. RA is a progressive disease that causes chronic inflammation of the joints and typically has the potential to cause joint destruction and functional disability. Although genetic predisposition, infectious agents, and environmental factors all contribute to the pathogenesis of the disease, the cause of rheumatoid arthritis is unknown. In active RA, symptoms may include fatigue, anorexia, mild fever, muscle and joint pain and stiffness. During the onset of the disease, joints become inflamed, often reddened, inflamed, and painful, due to inflammation of the synovium. In addition, since RA is a systemic disease, inflammation can affect the organs and areas of the body other than the joints, including the eyes and mouth fissure, the lung lining, the pericardium, and the blood vessels.
RA 및 다른 자가면역 장애를 관리하기 위한 통상적인 치료방법은 "1 차 약물" 로 먼저 조치를 취하고 "2 차 약물" 로 후속 조치를 취하는 것을 포함한다. 1 차 약물은 통증 및 염증을 경감시킨다. 그러한 1 차 약물의 예는 아스피린, 나프록센, 이부프로펜, 에토도락 및 다른 비-스테로이드성 항-염증 약물 (NSAID) 뿐만 아니라 코르티코스테로이드를 포함하고, 상기 약물은 경구적으로 또는 조직 및 관절로 직접 주입된다. 2 차 약물은 질병을 완화시키고 진행성 관절 파괴를 방지하며 또한 질병-변형 항-류마티스 약물 또는 DMARD 로 지칭된다. 상기 2 차 약물의 예는 금, 히드로클로로퀴닌, 아줄피딘 및 면역억제제, 예를 들면 메토트렉세이트, 아자티오프린, 시클로포스파미드, 클로람부실 및 시클로스포린을 포함한다. 그러나, 상기 약물의 대부분은 치명적인 부작용을 가질 수 있다. 따라서, 류마티스 관절염 및 다른 자가면역 장애에 대한 추가적인 치료요법이 모색되고 있다. Conventional treatments for managing RA and other autoimmune disorders include taking the first action with a "first drug" and taking follow-up actions with a "second drug". Primary drugs relieve pain and inflammation. Examples of such primary drugs include aspirin, naproxen, ibuprofen, etodolac, and other non-steroidal anti-inflammatory drugs (NSAIDs) as well as corticosteroids, which are administered either orally or directly into tissues and joints . The secondary drug alleviates the disease and prevents progressive joint destruction and is also referred to as a disease-modified anti-rheumatic drug or DMARD. Examples of such secondary drugs include gold, hydrochlorocholine, azulpidine and immunosuppressants such as methotrexate, azathioprine, cyclophosphamide, chlorambucil and cyclosporin. However, most of the drugs may have fatal side effects. Thus, additional therapies for rheumatoid arthritis and other autoimmune disorders are being sought.
종양 괴사 인자 알파 (TNF-α) 는 단핵구 및 대식세포를 비롯한 많은 세포 유형에 의해 생성된 사이토카인으로, 본래 특정 마우스 종양의 괴사를 유도하는 능력을 기반으로 밝혀졌다. 그 다음 악액질 (cachexia) 과 관련된 카켁틴 (cachectin) 으로 불리는 인자들이 TNF-α 와 동일한 것으로 나타났다. TNF-α 는 쇼크, 패혈증, 감염, 자가면역 질환, RA, 크론병, 이식 거부반응 및 이식편대숙주 질병을 포함하는, 다양한 인간 질병 및 장애의 병리생리학에 관여한다. Tumor necrosis factor alpha (TNF-a) is a cytokine produced by many cell types including monocytes and macrophages, originally based on the ability to induce necrosis of certain mouse tumors. Next, factors called cachectin associated with cachexia were found to be identical to TNF-α. TNF-a is involved in the pathophysiology of a variety of human diseases and disorders, including shock, sepsis, infection, autoimmune disease, RA, Crohn's disease, transplant rejection and graft versus host disease.
다양한 인간 장애에서의 인간 TNF-α (hTNF-α) 의 해로운 역할로 인해, hTNF-α 활성을 억제하거나 중화시키기 위한 치료적 전략이 고안되어 왔다. 특히, hTNF-α 에 결합하고, 이를 중화시키는 항체가 hTNF-α 활성을 억제하기 위한 수단으로서 모색되어 왔다. 가장 최초의, 그러한 항체 중 일부는 hTNF-α 로 면역화된 마우스의 림프구로부터 제조된 하이브리도마에 의해 분비된, 마우스 모노클로날 항체 (mAbs) 였다 (예를 들어, Moeller 등에 허여된 미국 특허 제 5,231,024 호 참조). 이러한 마우스 항-hTNF-α 항체는 hTNF-α 에 대한 높은 친화성을 나타내고 hTNF-α 활성을 중화시킬 수 있으나, 생체내에서의 그들의 사용은 짧은 혈청 반감기, 특정 인간 효과기 기능의 유발 불능, 및 인간 내의 마우스 항체에 대한 원치않는 면역 반응 ("인간 항-마우스 항체" (HAMA) 반응) 과 같은 인간에 대한 마우스 항체의 투여와 관련된 문제로 인해 제한적이었다. Due to the detrimental role of human TNF-a (hTNF-a) in various human disorders, therapeutic strategies have been devised to inhibit or neutralize hTNF-a activity. In particular, antibodies that bind to and neutralize hTNF-a have been sought as means for inhibiting hTNF-a activity. Some of the earliest such antibodies were murine monoclonal antibodies (mAbs) secreted by hybridomas prepared from lymphocytes of mice immunized with hTNF-α (see, for example, 5,231,024). These mouse anti-hTNF-a antibodies exhibit high affinity for hTNF-a and neutralize hTNF-a activity, but their use in vivo is associated with a short serum half-life, inability to induce specific human effector function, ("Human anti-mouse antibody" (HAMA) response) to the mouse antibody in mice.
더욱 최근에는, 생물학적 치료요법이 류마티스 관절염과 같은 자가면역 장애의 치료에 적용되어 왔다. 예를 들어, 4 개의 TNFα 억제제, REMICADE™ (인플릭시마브; infliximab), 키메라 항-TNFα mAb, ENBREL™ (etanercept; 에타네르셉트), TNFR-Ig Fc 융합 단백질, HUMIRA™ (아달리무마브; adalimumab), 인간 항-TNFα mAb, 및 CIMZIA® (certolizumab pegol; 세르톨리주마브 페골), PEG화된 Fab 단편이 류마티스 관절염의 치료를 위해 FDA 의 승인을 받았다. CIMZIA®는 또한 경증 내지 중증 크론병 (CD) 의 치료용으로 사용된다. 그러한 생물학적 치료요법이 류마티스 관절염 및 CD 와 같은 다른 자가면역 장애의 치료에 성공적임이 입증되었지만, 모든 치료받은 환자들이 그러한 치료에 반응을 하거나 잘 반응하는 것은 아니다. 게다가, TNFα 억제제의 투여는 약물에 대한 면역 반응을 유도할 수 있고, 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 와 같은 자가항체의 생산을 야기할 수 있다. 그러한 HACA, HAHA, 또는 HAMA 면역 응답 반응은 과민감성 반응 및 약물을 이용한 추가적인 치료를 막는 면역치료학적 TNFα 억제제의 약동학 및 생체분배에서의 급격한 변화와 관련될 수 있다. 따라서, 당해 기술분야에서는 생물학적 치료요법을 모니터링하고 치료 결정을 안내하기 위하여, 환자 시료 중의 항-TNFα 약물과 같은 생물학적 제제에 대한 자가항체의 존재를 검출할 검정의 필요성이 요구되고 있다. 본 발명은 그러한 필요를 충족시키며, 관련된 장점도 제공한다.More recently, biological therapies have been applied to treat autoimmune disorders such as rheumatoid arthritis. For example, four TNFa inhibitors, REMICADE ™ (infliximab), chimeric anti-TNFα mAb, ENBREL ™ (etanercept; etanercept), TNFR-Ig Fc fusion protein, HUMIRA ™ ; adalimumab), human anti-TNFα mAb, and CIMZIA® (certolizumab pegol), PEGylated Fab fragments have been approved by the FDA for the treatment of rheumatoid arthritis. CIMZIA® is also used for the treatment of mild to severe Crohn's disease (CD). Although such biological therapies have proven successful in the treatment of other autoimmune disorders such as rheumatoid arthritis and CD, not all treated patients respond to or respond well to such treatment. In addition, administration of a TNFa inhibitor may induce an immune response to the drug and may include administration of an autoantibody such as a human anti-chimeric antibody (HACA), human anti-humanized antibody (HAHA), and human anti-mouse antibody Can be produced. Such HACA, HAHA, or HAMA immune response responses may be associated with rapid changes in pharmacokinetics and bioequivalence of immunotherapeutic TNF [alpha] inhibitors that inhibit hypersensitivity reactions and additional treatment with the drug. Thus, there is a need in the art for an assay to detect the presence of autoantibodies to biological agents, such as anti-TNFa drugs, in patient samples in order to monitor biotherapeutic regimens and guide therapeutic decisions. The present invention fulfills such needs and provides related advantages.
본 발명은 시료 내 항-TNFα 약물 치료요법과 같은 생물제제에 대한 중화 및 비(非)-중화 자가항체의 존재 또는 수준을 검출 및 측정하기 위한 검정을 제공한다. 본 발명은 대상체가 생물학적 치료요법 (예를 들어, 항-TNFα 약물 치료요법) 을 받는 동안, 시간 경과에 따른 중화 및/또는 비-중화 항-약물 항체의 형성을 모니터링하기에 유용하다. 본 발명은 또한 대안적인 생물학적 치료요법 (예를 들어, 대안적인 항-TNFα 치료요법) 을 받는 대상체의 시료 내에서 중화 항-약물 항체의 교차-반응성을 예측 및/또는 측정하기에 유용하다. 이로써, 본 발명은 생물학적 제제로 치료 받는 대상체를 위한 치료 결정의 안내 정보를 제공하고, 치료요법을 최적화하고, 독성을 경감시키고 및/또는 생물학적 치료요법으로의 치료요법적 처치의 효능을 모니터링하는데 있어서 정확도를 개선한다.The present invention provides assays for detecting and measuring the presence or level of neutralizing and non-neutralizing autoantibodies to biologics such as anti-TNFa drug therapy in a sample. The present invention is useful for monitoring the formation of neutralizing and / or non-neutralizing anti-drug antibodies over time, while the subject is undergoing biotherapeutic therapy (e. G. Anti-TNFa drug therapy). The present invention is also useful for predicting and / or measuring the cross-reactivity of neutralizing anti-drug antibodies in a sample of a subject receiving an alternative biological therapy (e. G., Alternative anti-TNFa therapy). Accordingly, the present invention provides a method of treating a subject suffering from a biological agent, comprising providing a guide to treatment decisions for a subject to be treated with a biological agent, optimizing therapeutic regimens, alleviating toxicity and / or monitoring the efficacy of treatment regimens with biological therapies Improves accuracy.
한 측면에서, 본 발명은, 하기를 포함하는, 시료 내 생물제제에 대한 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출하는 방법을 제공한다:In one aspect, the invention provides a method of detecting the presence of an autoantibody in the form of a neutralized and / or non-neutralized form of a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가 항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분들은 서로 공유 결합되지 않음);(ii) the labeled biological agent, a labeled biological binding portion and a self-labeled complex of a second antibody (that is, immune-complex or conjugate) (in other words, the component of the labeled conjugate of the second are not covalently bonded to each other );
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비(非)결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them into free (i.e., non-bound) labeled biological binding moieties, free labeled biologics, and / Or a complex of a labeled biological agent and a labeled biological binding moiety;
(c) 자유 표지된 생물학적 결합 부분의 수준을 크기 배제 크로마토그래피 이후 측정함 (예를 들어 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) Levels of free labeled biological binding moieties are measured after size exclusion chromatography (e.g., by measuring the area under the curve (AUC) of free labeled biologically bound partial peaks after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교하여 (예를 들어, 오로지 자유 표지된 생물학적 결합 부분만을 함유하는 기준 시료의 SEC 후, 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출함.(d) The level of the free labeled biological binding moiety measured in step (c) can be compared to the level of the free labeled biological binding moiety in the control sample (e. G., The SEC of the reference sample containing only the free labeled biologically binding moiety Followed by measuring the AUC of the free labeled biologically binding partial peak), thereby detecting the presence of autoantibodies in the neutralized and / or non-neutralized form.
특정 구현예에서, 중화 형태의 자가항체는, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준이, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 동일하거나 실질적으로 동일한 경우 검출된다. 특정 기타 구현예에서, 비-중화 형태의 자가항체는, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준이, 대조군 시료에서 자유 표지된 생물학적 결합 부분의 수준과 비교시 감소되거나 (예를 들어 실질적으로 감소) 또는 부재인 경우 (예를 들어 검출되지 않음) 에 검출된다.In certain embodiments, the autoantibody in neutralized form is detected when the level of the free labeled biological binding moiety measured in step (c) is the same or substantially the same as the level of the free labeled biological binding moiety in the control sample. In certain other embodiments, the autoantibody of the non-neutralizing form is characterized in that the level of the free labeled biological binding moiety measured in step (c) is reduced in comparison to the level of the free labeled biological binding moiety in the control sample (E.g., substantially reduced) or absent (e.g., not detected).
또 다른 측면에서, 본 발명은 하기를 포함하는, 시료 내 생물제제에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정하는 방법을 제공한다:In another aspect, the invention provides a method for determining the level or percentage of autoantibodies in neutralized form to a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled biologic agent, the labeled biological binding moiety and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용하여, 이들을 자유 (즉, 비결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex may be subjected to size exclusion chromatography to convert them into a free (i.e., unbound) labeled biological binding moiety, a free labeled biologic, and / or a labeled Separating from the complex of the biological agent and the labeled biological binding moiety;
(c) 크기 배제 크로마토그래피 후 자유 표지된 생물학적 결합 부분의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled biological binding moiety is measured (e.g., by measuring the area under the curve (AUC) of the free labeled biologically bound partial peak after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율과 비교함 (예를 들어, 오로지 자유 표지된 생물학적 결합 부분만을 함유하는 기준 시료의 SEC 후 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정 및 정규화해, 자유 표지된 생물학적 결합 부분의 수준 또는 백분율을 산출하는 것에 의함), 이때 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율은 중화 형태의 자가항체의 수준 또는 백분율에 상응함.(d) The level of the free labeled biological binding moiety measured in step (c) is compared to the normalized level or percentage of the free labeled biological binding moiety in the control sample (e. G., Only the free labeled biologically binding moiety Measuring and normalizing the AUC of the free labeled biologically binding moiety peak after SEC of the reference sample and calculating the level or percentage of the free labeled biologically binding moiety), wherein the normalized The level or percentage corresponds to the level or percentage of autoantibodies in neutralization form.
또 다른 구현예에서, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율과 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준간 차이는, 비-중화 형태의 자가항체의 수준 또는 백분율에 해당한다.In another embodiment, the difference between the normalized level or percentage of the free labeled biological binding moiety in the control sample and the level of the free labeled biological binding moiety measured in step (c) is greater than the level of the non-neutralizing form of the autoantibody Or percentage.
또 다른 측면에서, 본 발명은 하기를 포함하는, 시료 내 생물제제에 대한 중화 형태의 자가항체의 백분율 또는 수준을 측정하는 방법을 제공한다:In another aspect, the invention provides a method for determining the percentage or level of autoantibody in neutralized form to a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled biologic agent, the labeled biological binding moiety and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용하여, 이들을 자유 (즉, 비결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex may be subjected to size exclusion chromatography to convert them into a free (i.e., unbound) labeled biological binding moiety, a free labeled biologic, and / or a labeled Separating from the complex of the biological agent and the labeled biological binding moiety;
(c) 크기 배제 크로마토그래피 후 자유 표지된 생물학적 결합 부분의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled biological binding moiety is measured (e.g., by measuring the area under the curve (AUC) of the free labeled biologically bound partial peak after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교하여 (예를 들어, 기준 시료의 SEC 후, 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 형태의 자가항체의 백분율 또는 수준을 측정함.(d) The level of the free labeled biological binding moiety measured in step (c) is compared to the level of the free labeled biological binding moiety in the control sample (e. G., After SEC of the reference sample, AUC), thereby measuring the percentage or level of autoantibodies in neutralized form.
또 다른 측면에 있어서, 본 발명은 하기를 포함하는, 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 생물제제와 교차-반응성인지 여부를 결정하는 방법을 제공한다:In yet another aspect, the invention provides a method for determining whether a neutralizing form of an autoantibody to a first biologic agent is cross-reactive with a second (i.e., different) biological agent, comprising :
(a) 본원에서 기재된 검정에 따라 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정하여, 시료가 중화 형태의 자가항체에 대해 양성 또는 음성인지 여부를 결정함; 및(a) Detect or measure the presence, level or percentage of autoantibody in neutralization form in the sample according to the assays described herein to determine whether the sample is positive or negative for neutralizing forms of autoantibodies; And
시료가 중화 형태의 자가항체에 대해 양성인 경우:If the sample is positive for neutralizing autoantibodies:
(b) 시료를 표지된 제 2 의 생물제제와 접촉시켜, 표지된 제 2 의 생물제제 및 중화 형태의 자가형체의 표지된 복합체를 형성함 (즉, 표지된 복합체의 성분들은 서로 공유 결합되지 않음);(b) The sample is contacted with a labeled second biocide to form a labeled second biochemical and a neutralized form of the labeled complex of the autologous form (i.e., the components of the labeled complex are not covalently bound to each other);
(c) 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 표지된 복합체를 분리시킴 (예를 들어 자유 표지된 제 2 의 생물제제로부터); 및(c) The labeled complex is applied to size exclusion chromatography to separate the labeled complexes (e.g., from a second biologically labeled free biocide); And
(d) 표지된 복합체를 검출하여, 이로써 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 의 생물제제와 교차-반응성인지 여부를 결정함.(d) Thereby detecting whether the neutralizing form of the autoantibody to the first biologic agent is cross-reactive with the second biological agent.
특정 구현예에서, 표지된 복합체의 존재는, 제 1 의 생물제제에 대항하는 중화 자가항체가 제 2 의 생물제제와 교차-반응성이라는 것을 표시하는 것으로, 즉 중화 자가항체가 제 1 의 생물학적 약물과 제 2 의 생물학적 약물 모두의 활성을 억제할 것이다.In certain embodiments, the presence of the labeled conjugate indicates that the neutralizing autoantibody against the first biological preparation is cross-reactive with the second biological agent, i.e., the neutralizing autoantibody is conjugated to the first biological drug Will inhibit the activity of all of the second biological drugs.
특정 기타 구현예에서, 표지된 복합체의 부재는 제 1 의 생물제제에 대항하는 중화 자가항체가 제 2 의 생물제제와 교차-반응성이 아니라는 것을 표시하는 것으로, 즉 중화 자가항체는 제 2 의 생물학적 약물의 활성을 억제하지 않을 것이다.In certain other embodiments, the absence of the labeled conjugate indicates that the neutralizing antibody against the first biological agent is not cross-reactive with the second biological agent, i.e., the neutralizing autoantibody is a second biological agent Lt; / RTI >
일부 구현예에서, 생물제제는 항체 (예, 항-TNFα 모노클로날 항체), 항체 단편, 단백질 (예를 들어 사이토카인, 예컨대 인터류킨), 폴리펩티드, 펩티드, 융합 단백질, 다가 결합 단백질, 항체-약물 컨쥬게이트, 백신, 핵산, 당, 이의 재조합 형태, 이의 가공된 (engineered) 형태 및 그의 조합물을 포함한다.In some embodiments, the biological agent is selected from the group consisting of an antibody (e.g., an anti-TNFa monoclonal antibody), an antibody fragment, a protein (e.g., a cytokine such as an interleukin), a polypeptide, a peptide, Conjugates, vaccines, nucleic acids, sugars, recombinant forms thereof, engineered forms thereof, and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 생물학적 치료요법을 수여받은 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어 류마티스 관절염), 염증성 질환 (예를 들어 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)), 또는 암 등의 질환 또는 장애를 갖는다.In other embodiments, the sample is a whole blood, serum, or plasma sample, for example, a whole blood, serum, or plasma sample of a subject who has received a biologic therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a subject suffering from a disease such as autoimmune disease (e.g., rheumatoid arthritis), inflammatory disease (such as inflammatory bowel disease (IBD) such as Crohn's disease (CD) or ulcerative colitis (UC) Or disorder.
특정 구현예에서, 시료는 생물제제에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 생물학적 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the biological agent. In other embodiments, biological autologous antibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies (HAMA) as well as combinations thereof .
특정 구현예에서, 본 발명의 검정 방법은, 시료를 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉하기 이전, 동안 및/또는 이후에, 상기 시료를 산과 접촉시키는 것을 포함하는 산 해리 단계를 추가로 포함한다.In certain embodiments, the assay method of the present invention further comprises an acid dissociation step comprising contacting the sample with an acid prior to, during, and / or after contacting the labeled biological agent and the labeled biological binding moiety .
특정 기타 측면에서, 본 발명의 검정 방법은 시료 내 생물제제에 대한 중화 및/또는 비-중화 형태의 자가항체의 하나 이상의 아형 (isotype) 의 존재 또는 수준을 검출하는 것을 포함한다.In certain other aspects, the assay method of the present invention comprises detecting the presence or level of one or more isotypes of autoantibodies in neutralized and / or non-neutralized form to a biological agent in a sample.
한 특정 측면에 있어서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출하는 방법을 제공한다:In one particular aspect, the invention provides a method for detecting the presence of an autoantibody in the form of a neutralized and / or non-neutralized form of an anti-TNF [alpha] drug in a sample,
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) (I.e., the components of the first labeled complex are not covalently bonded to each other); the first labeled complex (i.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody; And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα, 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug, the labeled TNF [alpha], and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them to free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug and / or labeled anti -TNFa < / RTI > drug and a labeled TNFa complex;
(c) 크기 배제 크로마토그래피 후 자유 표지된 TNFα 의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled TNF [alpha] is measured (for example, by measuring the area under the curve (TNF [alpha]) of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 을, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교하여 (예를 들어, 오로지 자유 표지된 TNFα 만을 함유하는 기준 시료의 SEC 후 자유 표지된 TNFα 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출함.(d) The free labeled TNF [alpha] measured in step (c) is compared to the level of the free labeled TNF [alpha] in the control sample (e.g., the AUC of the free labeled TNF [alpha] peak after SEC of a reference sample containing only free TNFa , Thereby detecting the presence of autoantibodies in neutralized and / or non-neutralized form.
특정 구현예에서, 중화 형태의 자가항체는, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준이 대조군 시료 내 자유 표지된 TNFα 의 수준과 동일하거나 실질적으로 동일한 경우에 검출된다. 특정 기타 구현예에서, 비-중화 형태의 자가항체는, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준이, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교시 감소되거나 (예를 들어 실질적으로 감소됨) 또는 부재인 (예를 들어 검출되지 않음) 경우에 검출된다.In certain embodiments, the autoantibody in neutralized form is detected when the level of free labeled TNF [alpha] measured in step (c) is the same or substantially the same as the level of free labeled TNF [alpha] in the control sample. In certain other embodiments, the autoantibody of the non-neutralizing form is characterized in that the level of the free labeled TNF [alpha] measured in step (c) is reduced (e.g., substantially reduced compared to the level of free labeled TNF [ Reduced) or absent (e.g., undetected).
또 다른 특정 측면에 있어서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정하는 방법을 제공한다:In another particular aspect, the invention provides a method of determining the level or percentage of autoantibodies in neutralization form to an anti-TNF [alpha] drug in a sample, comprising:
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 상기 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled complex (i.e., immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα, 및 자가 항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug, the labeled TNF [alpha], and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물, 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them to free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug, and / Separating from the complex of anti-TNF [alpha] drug and labeled TNF [alpha];
(c) 크기 배제 크로마토그래피 후 자유 표지된 TNFα의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled TNF [alpha] is measured (for example, by measuring the area under the curve (TNF [alpha]) of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율과 비교함 (예를 들어, 오로지 자유 표지된 TNFα 만을 함유하는 기준 시료의 SEC 후 자유 표지된 TNFα 피크의 AUC 를 측정 및 정규화하여, 자유 표지된 TNFα 의 수준 또는 백분율을 산출하는 것에 의함), 이때 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율은 중화 형태의 자가항체의 수준 또는 백분율에 상응함.(d) The level of free labeled TNF [alpha] measured in step (c) is compared to the normalized level or percentage of free labeled TNF [alpha] in the control sample (e.g., after SEC of a reference sample containing only free TNF [alpha] Measuring and normalizing the AUC of the labeled TNFa peak to yield the level or percentage of free labeled TNFa), wherein the normalized level or percentage of free labeled TNFa in the control sample is the level of autoantibody in neutralized form or Corresponds to the percentage.
일부 구현예에서, 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율과 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준의 차이는 비-중화 형태의 자가항체의 수준 또는 백분율에 상응한다.In some embodiments, the difference between the normalized level or percentage of free labeled TNF [alpha] in the control sample and the level of free labeled TNF [alpha] measured in step (c) corresponds to the level or percentage of the autoantibody in the non-neutralized form.
또 다른 특정 측면에 있어서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정하는 방법을 제공한다:In another particular aspect, the invention provides a method of determining the level or percentage of autoantibodies in neutralization form to an anti-TNF [alpha] drug in a sample, comprising:
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 상기 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled complex (i.e., immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα, 및 자가 항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug, the labeled TNF [alpha], and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물, 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them to free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug, and / Separating from the complex of anti-TNF [alpha] drug and labeled TNF [alpha];
(c) 크기 배제 크로마토그래피 후 자유 표지된 TNFα 의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled TNF [alpha] is measured (for example, by measuring the area under the curve (TNF [alpha]) of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교하여 (예를 들어, 기준 시료의 SEC 후 자유 표지된 TNFα 의 AUC 를 측정하는 것에 의함), 이로써 중화 형태의 자가항체의 백분율 또는 수준을 측정함.(d) The level of the free labeled TNF [alpha] measured in step (c) is compared to the level of the free labeled TNF [alpha] in the control sample (for example, by measuring the AUC of free labeled TNF [alpha] after SEC of the reference sample) This measures the percentage or level of neutralizing autoantibodies.
또 다른 특정 측면에 있어서, 본 발명은 하기를 포함하는, 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 항-TNFα 약물과 교차-반응성인지 여부를 결정하는 방법을 제공한다:In another particular aspect, the invention provides a method for determining whether an autoantibody in neutralization form to a first anti-TNF alpha drug is cross-reactive with a second (i.e., different) anti-TNF alpha drug, It provides a way to:
(a) 본원에서 기재된 검정에 따라 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정해, 시료가 중화 형태의 자가항체에 대해 양성 또는 음성인지 여부를 결정함; 및(a) Detect or measure the presence, level or percentage of autoantibody in neutralization form in a sample according to the assays described herein to determine whether the sample is positive or negative for autoantibodies in neutralized form; And
시료가 중화 형태의 자가항체에 대해 양성인 경우, 이때:If the sample is positive for neutralizing autoantibodies, then:
(b) 시료를, 표지된 제 2 의 항-TNFα 약물과 접촉시켜, 표지된 제 2 의 항-TNFα 약물 및 중화 형태의 자가항체의 표지된 복합체를 형성함 (즉, 이때 표지된 복합체의 성분은 서로 공유 결합되지 않음);(b) A sample is contacted with a labeled second anti-TNFα drug to form a labeled conjugate of the labeled second anti-TNFα drug and neutralizing form of the autoantibody (ie, the components of the labeled conjugate Unbound);
(c) 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 표지된 복합체를 분리시킴 (예를 들어, 자유 표지된 제 2 의 항-TNFα 약물로부터); 및(c) The labeled complex is applied to size exclusion chromatography to separate the labeled complexes (e.g., from a second labeled anti-TNFα drug); And
(d) 표지된 복합체를 검출하여, 이로써 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성인지 여부를 결정함.(d) Labeled complex to thereby determine whether the neutralizing form of the autoantibody to the first anti-TNF [alpha] drug is cross-reactive with the second anti-TNF [alpha] drug.
특정 구현예에서, 표지된 복합체의 존재는 제 1 의 항-TNFα 약물에 대항하는 중화 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성이라는 것을 표시하는 것으로, 즉, 중화 자가항체는 제 1 의 항-TNFα 약물 및 제 2 의 항-TNFα 약물 양자 모두의 활성을 억제할 것이다.In certain embodiments, the presence of the labeled complex indicates that the neutralizing autoantibody against the first anti-TNF alpha drug is cross-reactive with the second anti-TNF alpha drug, i.e., the neutralizing autoantibody is the first TNF < alpha > drug and the second anti-TNF alpha drug.
특정 기타 구현예에 있어서, 표지된 복합체의 부재는 제 1 의 항-TNFα 약물에 대항하는 중화 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성이 아니라는 것을 표시하는 것으로, 즉, 중화 자가항체가 제 2 의 항-TNFα 약물의 활성을 억제할 것이다. In certain other embodiments, the absence of the labeled complex indicates that the neutralizing autoantibody against the first anti-TNF alpha drug is not cross-reactive with the second anti-TNF alpha drug, i.e., the neutralizing autoantibody Will inhibit the activity of the second anti-TNF [alpha] drug.
일부 구현예에서, 항-TNFα 약물은 REMICADE™ (인플릭시마브), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무마브), CIMZIA® (세르톨리주마브 페골), SIMPONI® (골리무마브 (golimumab); CNTO 148), 및 그 조합물로 이루어진 군으로부터 선택된다.In some embodiments, the anti-TNFa drug is selected from the group consisting of REMICADE ™ (infliximab), ENBREL ™ (etanercept), HUMIRA ™ (adalimumab), CIMZIA® (Sertoli marbella), SIMPONI® (golimumab) (CNTO 148), and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 항-TNFα 약물 치료요법을 받는 대상체로부터의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 TNFα-매개성 질환 또는 장애, 예컨대 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)) 을 갖는다.In other embodiments, the sample is a whole blood, serum, or plasma sample, e. G., A whole blood, serum, or plasma sample from a subject undergoing anti-TNFa drug therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a subject having a TNFa-mediated disease or disorder, such as an autoimmune disease (e.g., rheumatoid arthritis) or an inflammatory disease (such as inflammatory bowel disease (IBD) Colitis (UC)).
특정 구현예에서, 시료는 항-TNFα 약물에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 항-TNFα 약물 자가항체에는, 이에 제한되는 것은 아니나, 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐만 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the anti-TNF [alpha] drug. In other embodiments, anti-TNF alpha drug autoantibodies include, but are not limited to, human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti- Combinations are included.
특정 측면에서, 본 발명의 검정 방법은, 표지된 항-TNFα 약물 및 표지된 TNFα 와 시료를 접촉하기 이전, 동안 및/또는 이후에, 상기 시료를 산과 접촉시키는 것을 포함하는 산 해리 단계를 추가로 포함한다.In a particular aspect, the assay method of the present invention further comprises an acid dissociation step comprising contacting the sample with an acid before, during and / or after contacting the sample with labeled anti-TNF [alpha] drug and labeled TNF [alpha] .
특정 기타 측면에서, 본 발명의 검정 방법은, 시료 내 항-TNFα 약물에 대한 중화 및/또는 비-중화 형태의 자가항체 중 하나 이상의 아형의 존재 또는 수준을 검출하는 것을 포함한다.In certain other aspects, the assay methods of the invention include detecting the presence or level of one or more subtypes of autoantibodies in neutralized and / or non-neutralized form for the anti-TNF [alpha] drug in a sample.
추가 측면에서, 본 발명은 하기를 포함하는, 생물제제로의 치료요법 과정을 받는 대상체에서, 생물제제에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공한다:In a further aspect, the present invention provides a method for monitoring and / or optimizing therapeutic regimens for a biological agent, in a subject undergoing a biotherapeutic treatment regimen, comprising:
(a) 본원에서 기재된 검정에 따라 생물제제에 대한 중화 형태의 자가항체의 존재, 수준 또는 백분율을 복수의 시간 지점에서 치료요법 과정 동안 검출 또는 측정함;(a) The presence, level or percentage of neutralizing forms of autoantibodies to biologics in accordance with the assays described herein are detected or measured during the therapeutic regimen at a plurality of time points;
(b) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율 변화를 검출함; 및(b) Detecting the presence, level, or percentage change of neutralizing form of autoantibodies over time; And
(c) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율 변화를 근거로, 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정을 대상체에 적용해야 하는지 여부를 결정함.(c) Based on changes in the presence, level or percentage of neutralizing autoantibodies over time, determine whether subsequent doses of the therapeutic regimen for the subject or different therapeutic regimens should be applied to the subject.
한 특정 측면에 있어서, 본 발명은 하기를 포함하는, 생물제제로의 치료요법 과정을 받는 대상체에서 생물제제에 대한 치료요법을 모니터링하고/하거나 최적화하기 위한 방법을 제공한다:In one particular aspect, the invention provides a method for monitoring and / or optimizing therapy for a biological agent in a subject undergoing a biotherapeutic treatment regimen, comprising:
(a) 시간 지점 t0 에서, 본원에서 기재된 바와 같은 대상체로부터의 제 1 의 시료 내 생물제제에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(a) measuring, at a time point t 0 , the level or percentage of autoantibody in neutralized form to a biological agent in a first sample from a subject as described herein;
(b) 시간 지점 t1 에서, 본원에서 기재된 바와 같은 대상체로부터의 제 2 의 시료 내 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(b) measuring, at time point t 1 , the level or percentage of autoantibody in neutralization form in a second sample from a subject as described herein;
(c) 임의로는, 시간 지점 tn+1 에서, 대상체로부터 n 개의 추가적인 시료로 단계 (b) 를 반복함, 이때 n 은 1 내지 약 25 의 정수임 (예를 들어, n 은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 또는 25, 또는 임의의 그 내부의 범위임).(c) optionally repeating step (b) from the subject to n additional samples at time point t n + 1 , wherein n is an integer from 1 to about 25 (e.g., n is 1, 2, 3 , 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, Internal range).
(d) 시간 지점 t0 내지 t1 또는 시간 지점 t0 내지 tn+1 에서 중화 형태의 자가항체의 수준 또는 백분율 변화를 검출함; 및(d) detecting a change in the level or percentage of autoantibodies in neutralization form at time points t 0 to t 1 or at time points t 0 to t n + 1 ; And
(e) 시간 경과에 따른 중화 형태의 자가항체의 수준 또는 백분율 변화를 근거로, 대상체에 대한 치료요법의 과정의 후속적인 용량 또는 상이한 치료요법 과정을 대상체에 적용해야 하는지 여부를 결정함.(e) Based on changes in the level or percentage of neutralizing autoantibodies over time, a determination is made as to whether subsequent doses of the therapeutic regimen for the subject or different therapeutic regimens should be applied to the subject.
추가적인 측면에서, 본 발명은 하기를 포함하는, 제 1 의 생물제제로의 치료요법 과정을 받는 대상체에서 치료요법을 최적화하고/하거나 독성을 경감시키기 위한 방법을 제공한다:In a further aspect, the present invention provides a method for optimizing therapy and / or alleviating toxicity in a subject undergoing a therapy with a first biologic agent, comprising:
(a) 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 생물제제와 교차-반응성인지 여부를, 본원에서 기재된 검정에 따라 대상체로부터의 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함으로써 결정함; 및(a) Whether the neutralizing form of an autoantibody to a first biologic agent is cross-reactive with a second (i.e., different) biological agent is determined by the presence of an autoantibody in neutralized form in the sample from the subject according to the assays described herein, By detecting or measuring a level or a percentage; And
(b) 중화 형태의 자가항체가 제 2 의 생물제제와 교차-반응성인 경우 상이한 치료요법 과정을 대상체에 적용해야 하는지 결정함.(b) If the neutralizing form of the autoantibody is cross-reactive with the second biological agent, determine whether different therapeutic regimens should be applied to the subject.
한 특정 측면에 있어서, 본 발명은 하기를 포함하는, 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서 항-TNFα 약물에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공한다:In one particular aspect, the invention provides a method of monitoring and / or optimizing therapeutic regimens for an anti-TNF [alpha] drug in a subject undergoing a therapeutic regimen with an anti-TNF [alpha] drug,
(a) 치료요법 과정 전반에 걸쳐 복수의 시간 지점에서 본원에서 기재된 검정에 따라 항-TNFα 약물에 대한 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함;(a) Detecting or measuring the presence, level or percentage of autoantibodies in the form of neutralization to an anti-TNF alpha drug according to the assays described herein at multiple time points throughout the course of therapy;
(b) 시간 경과에 따라 중화 형태의 자가항체의 존재, 수준 또는 백분율 변화를 검출함; 및(b) Detecting the presence, level or percentage change of neutralizing form of autoantibodies over time; And
(c) 시간 경과에 따라 중화 형태의 자가항체의 존재, 수준 또는 백분율 변화를 근거로, 대상체에 상이한 치료요법 과정을 적용해야하는지 여부 또는 대상체를 위한 치료요법 과정의 후속 용량을 결정함.(c) Based on changes in the presence, level, or percentage of neutralizing autoantibodies over time, determine whether different therapeutic regimens should be applied to the subject, or determine the follow-up dose of the therapeutic regimen for the subject.
또 다른 특정 측면에서, 본 발명은 하기를 포함하는, 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서, 항-TNFα 약물에 대한 치료요법의 최적화 및/또는 모니터링 방법을 제공한다:In another particular aspect, the invention provides a method of optimizing and / or monitoring therapeutic therapy for an anti-TNF [alpha] drug in a subject undergoing a therapeutic regimen with an anti-TNF [alpha] drug,
(a) 시간 지점 t0 에서 본원에서 기재된 바와 같은 대상체로부터의 제 1 의 시료에서 항-TNFα 약물에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(a) measuring the level or percentage of autoantibody in neutralized form to an anti-TNFα drug in a first sample from a subject as described herein at time point t 0 ;
(b) 시간 지점 t1 에서 본원에서 기재된 바와 같은 대상체로부터의 제 2 의 시료에서 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(b) measuring the level or percentage of autoantibody in neutralized form in a second sample from a subject as described herein at time point t 1 ;
(c) 임의로는, 시간 지점 tn+1 에서 대상체로부터의 n 개의 추가 시료로 단계 (b) 를 반복함 (이때, n 은 1 내지 약 25 의 정수 (예를 들어, n 은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 또는 25, 또는 그 내부의 임의의 범위임) 임);(c) optionally repeating step (b) with n additional samples from the subject at time point t n + 1 , wherein n is an integer from 1 to about 25 (e.g., n is 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, ); ≪ / RTI >
(d) 시간 지점 t0 내지 t1 또는 시간 지점 t0 내지 tn+1 에서 중화 형태의 자가항체의 수준 또는 백분율 변화를 검출함, 및(d) detecting a change in the level or percentage of autoantibodies in neutralization form at time points t 0 to t 1 or at time points t 0 to t n + 1 ; and
(e) 시간 경과에 따라 중화 형태의 자가항체의 수준 또는 백분율 변화를 근거로, 대상체를 위한 치료요법 과정의 후속적인 용량 또는 상이한 치료요법 과정을 대상체에 적용해야하는지 여부를 결정함.(e) Based on changes in the level or percentage of neutralizing autoantibodies over time, determine whether subsequent doses of the therapeutic regimen for the subject or different therapeutic regimens should be applied to the subject.
또 다른 특정 측면에서, 본 발명은 하기를 포함하는, 제 1 의 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서 치료요법의 최적화 및/또는 독성 경감 방법을 제공한다:In another particular aspect, the invention provides a method of optimizing treatment and / or alleviating toxicity in a subject undergoing a therapeutic regimen with a first anti-TNF alpha drug, comprising:
(a) 본원에서 기재된 검정에 따라, 대상체로부터의 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함으로써, 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 항-TNFα 약물과 교차-반응성인지 여부를 결정함; 및(a) By detecting or measuring the presence, level or percentage of autoantibodies in neutralization form in the sample from a subject according to the assays described herein, the neutralizing form of the autoantibody to the first anti-TNFa drug is detected or measured in a second (i. Determining whether the compound is cross-reactive with an anti-TNF [alpha] drug; And
(b) 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성인 경우, 대상체에 상이한 치료요법 과정을 적용해야 하는지 결정함.(b) If the neutralizing form of the autoantibody is cross-reactive with the second anti-TNFα drug, determine if a different therapeutic regimen should be applied to the subject.
본 발명의 기타 목적, 특징 및 장점은 하기의 상세한 설명 및 도면으로부터 당업자에게 자명할 것이다. Other objects, features and advantages of the present invention will be apparent to those skilled in the art from the following detailed description and drawings.
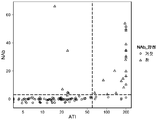
도 1 은 NAb 백분율 (y 축) 및 ATI 수준 사이의 분명한 상호관계가 존재함을 나타낸다.
도 2 는 ATI 농도 ≥ 60 U/ml 는 NAb+ 을 예측한다는 점을 나타낸다.
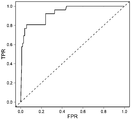
도 3 은 ATI 가 0.931 의 ROC AUC 를 갖는 NAb 를 예측한다는 점을 나타낸다.
도 4 는 본 발명의 유체 상 이동성 변동 검정 (fluid phase mobility shift assay) 에 의한 ATI 의 검출을 나타낸다.
도 5 는 본 발명의 예시적 ATI/IFX 유체 상 이동성 변동 검정을 나타낸다.
도 6 은 본 발명의 비-중화 항-약물 항체 (ADA) 검정을 나타낸다.
도 7 은 본 발명의 중화 ADA 검정을 나타낸다.
도 8 은 1, 2, 또는 3 개월째에 취한 UC 환자로부터의 5 가지 시료의 시간 경과에 따른 IFX 및 AIT 의 수준을 나타낸다.
도 9 는 UC 환자에게서 시간 경과에 따른 자유 TNFα 의 백분율을 결정하기 위한 피크 분석을 나타낸다.
도 10 은 IFX 로 스파이크되고 2 또는 3 개월째에 취한 UC 환자로부터의 3 가지의 시료에서 예시되는 바와 같이, 시간 경과에 따른 비-중화 자가항체로부터 중화 자가항체로의 존재 변동을 나타낸다.
도 11 은 IFX 로 스파이크된 UC 환자 시료에서 시간 경과에 따른 자유 TNFα 의 백분율을 측정하는 피크 분석을 나타낸다.
도 12 는 비-중화 항체 (Ab) 대조군으로서의 토끼 항-인간 IgG1 Fc 의 용도를 나타낸다.
도 13 은 혼합 중화 항체 (NAb)/비-중화 항체 (Ab) 대조군으로서의 ATI 양성 혈청의 용도를 나타낸다.
도 14 는 ATI 양성 혈청으로부터의 ATI 정제 결과, 약 친화성 NAb 의 손실이 초래된다는 것을 나타낸다.
도 15 는 이들 각종 대조군에서 자유 TNFα 의 백분율을 측정하기 위한 UC 환자 케이스 연구로부터의 피크 분석을 나타낸다.
도 16 은 30 주 기간 동안 7 또는 8 주째에 취한 4 가지 시료의 시간 경과에 따른 자유 TNFα 의 백분율을 측정하기 위한, CD 환자 케이스 연구로부터의 피크 분석을 나타낸다.
도 17 은 50 주 기간 동안 취한 3 가지의 시료의 시간 경과에 따른 자유 TNFα 의 백분율을 측정하기 위한 또 다른 CD 환자 케이스 연구로부터의 피크 분석을 나타낸다.
도 18 은 치료요법 유도 또는 유지 동안 또는 이후의 특정 주에 시료 내 자유 TNFα 의 백분율을 측정하기 위한 추가 4 가지의 CD 환자 케이스 연구로부터의 피크 분석을 나타내다.
도 19 는 이동성 변동 검정을 통한 비-중화 항체 활성의 검출을 나타낸다.
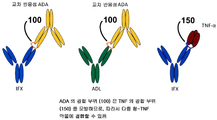
도 20 은 IFX 및 ADL 양자 모두에 대한 ADA 의 교차-반응성을 나타내며, 이때 ADA 의 결합 부위는 TNFα 의 결합 부위를 모방하고 그리하여 다중 항-TNF 약물에 결합될 수 있음을 나타낸다.
도 21 은 하나의 항-TNF 약물에 대해 반응해 생성되는 NAb 의, 다른 항-TNF 약물에 대한 교차-반응성을 측정하는 두 환자의 예시 (환자 1 및 2) 를 나타낸다. 특히, 환자가 Remicade (IFX) 치료 중인 경우에 발달된 (develop) NAb 를 Humira (ADL) 에 대해 시험하였다.
도 22 는 IFX 또는 ADL 등의 약물에 대한 비-중화 항체 (비-NAb) (상단) 또는 중화 항체 (NAb) (하단) 의 존재를 검출하기 위한 본 발명의 검정의 예시적 구현예를 나타낸다.
도 23 은 NAb 표준 곡선의 제작 및 용도를 나타낸다.
도 24 는 ADL 에 대한 IFX 에 대항해 제조된 NAb 의 교차-반응성을 측정하기 위해, IFX 로 치료하였으나 IFX 에 대한 응답성이 결실된 환자 3 에 대한 케이스 연구의 결과를 제공한다.
도 25 는 IFX 에 대항해 제조된 NAb 의 ADL 에 대한 교차-반응성을 측정하기 위해, IFX 로 치료하였으나 IFX 에 대한 응답성이 결실된 환자 4 의 케이스 연구 결과를 제공한다.
도 26 은 교차-반응성 ATI 의 발달 및 ATI 친화도 성숙을 증명하는 환자 연구의 비제한적인 예시를 나타낸다.
도 27 은 본 발명의 경쟁적 리간드 결합 NAb 검정의 한 구현예를 나타낸다. 자유 TNF-532 는 최대 검정 신호를 나타낸다. ATI 를 함유하지 않는 TNF-532/IFX-488 음성 대조군은 최소 검정 신호를 나타낸다. (A) 검정 신호에 영향을 주지 않는 결합 ATI. (B) 검정 신호를 회복시키는 중화 ATI 환자 혈청.
도 28 은 본 발명의 중화 검정의 임상적 효용성을 나타낸다.
도 29 는 본 발명의 중화 검정의 성능 특징을 나타낸다. Figure 1 shows that there is a clear correlation between the NAb percent (y-axis) and ATI levels.
Figure 2 shows that ATI concentration ≥ 60 U / ml predicts NAb +.
Figure 3 shows that ATI predicts NAb with ROC AUC of 0.931.
Figure 4 shows the detection of ATI by the fluid phase mobility shift assay of the present invention.
Figure 5 illustrates an exemplary ATI / IFX fluid phase mobility variation assay of the present invention.
Figure 6 shows a non-neutralizing anti-drug antibody (ADA) assay of the invention.
Figure 7 shows the neutralization ADA assay of the present invention.
Figure 8 shows the levels of IFX and AIT over time for five samples from UC patients taken at 1, 2, or 3 months.
Figure 9 shows a peak analysis for determining the percentage of free TNF [alpha] over time in UC patients.
Figure 10 shows the presence variation from non-neutralizing autoantibodies to neutralizing autoantibodies over time as illustrated in the three samples spiked with IFX and taken at 2 or 3 months from UC patients.
Figure 11 shows a peak analysis that measures the percentage of free TNF [alpha] over time in IFX spiked UC patient samples.
Figure 12 shows the use of rabbit anti-human IgGl Fc as a non-neutralizing antibody (Ab) control.
Figure 13 shows the use of ATI positive sera as a mixed neutralizing antibody (NAb) / non-neutralizing antibody (Ab) control.
Figure 14 shows that ATI purification from ATI positive sera results in loss of weak affinity NAb.
Figure 15 shows a peak analysis from a UC patient case study to determine the percentage of free TNF [alpha] in these various control groups.
Figure 16 shows a peak analysis from a CD patient case study to determine the percentage of free TNF [alpha] over time for four samples taken at 7 or 8 weeks for a 30 week period.
Figure 17 shows a peak analysis from another CD patient case study to determine the percentage of free TNFa over time for three samples taken over a 50 week period.
Figure 18 shows a peak analysis from an additional four CD patient case studies for determining the percentage of free TNF [alpha] in a sample during or after treatment regimen induction or maintenance.
Figure 19 shows the detection of non-neutralizing antibody activity through mobility variation assays.
Figure 20 shows the cross-reactivity of ADA to both IFX and ADL, where the binding site of ADA mimics the binding site of TNFa and thus can bind to multiple anti-TNF drugs.
Figure 21 shows examples of two patients (
Figure 22 shows an exemplary embodiment of the assay of the invention for detecting the presence of a non-neutralizing antibody (non-NAb) (top) or neutralizing antibody (NAb) (bottom) against a drug such as IFX or ADL.
Figure 23 shows the fabrication and use of the NAb standard curve.
Figure 24 provides the results of a case study of
Figure 25 provides case study results of
Figure 26 shows a non-limiting example of a patient study demonstrating the development of cross-reactive ATI and ATI-affinity maturation.
Figure 27 shows one embodiment of the competitive ligand binding NAb assay of the present invention. Free TNF-532 represents the maximum black signal. A TNF-532 / IFX-488 negative control without ATI represents the minimum assay signal. (A) Combined ATI that does not affect the test signal. (B) neutralized ATI patient serum to restore the test signal.
Figure 28 shows the clinical utility of the neutralization assay of the present invention.
Figure 29 shows the performance characteristics of the neutralization assay of the present invention.
발명의 상세한 설명DETAILED DESCRIPTION OF THE INVENTION
I. 도입부I. INTRODUCTION
본 발명은 부분적으로는 면역 복합체의 평형화를 가능하게 하는 크기 배제 크로마토그래피 및 임의로는 산 해리를 이용한 균질 이동성 변동 검정법이 항-TNFα 약물과 같은 생물제제에 대해 생성되는 중화 및 비-중화 형태의 자가항체 (예를 들어 HACA, HAHA 등) 의 존재 또는 수준을 측정하기에 특히 유리하다는 발견을 근거로 한다. 그러한 자가항체는 항-약물 항체 또는 ADA 로도 공지되어 있고, 이의 중화 및 비-중화 형태도 또한 각각 NAb 및 비-NAb 로서 공지되어 있다.The present invention is based in part on the use of size exclusion chromatography, which allows equilibration of immune complexes, and, optionally, homogeneous mobility shift assays using acid dissociation, as the neutralizing and non-neutralizing forms of the neutralizing and non-neutralizing forms produced for biologics such as anti- Is particularly advantageous for determining the presence or level of an antibody (e. G., HACA, HAHA, etc.). Such autoantibodies are also known as anti-drug antibodies or ADA, and their neutralized and non-neutralized forms are also known as NAb and non-NAb, respectively.
특정 구현예에서, 본 발명의 균일한 이동성 변동 검정법을 (예를 들어 형광) 표지된 생물제제 (예를 들어 항-TNFα 약물) 및 (예를 들어 형광) 표지된 생물학적 결합 부분 (예를 들어 TNFα) 과 대상체의 시료를 접촉시켜 수행한다. 본원에서 기재된 검정법은, 적어도 하기의 이유로 유리하다: 저 친화도 ADA 를 제거하는 세정 단계에 대한 필요성을 배제함; 백그라운드 및 혈청 간섭 문제점을 감소시키는, 가시, IR 및/또는 근 IR (NIR) 스펙트럼에서 검출을 허용하는 형광단과 같은 뚜렷한 표지자를 이용함; 형광 표지 검출의 고민감성으로 인해 낮은 역가를 갖는 대상체에서 중화 및/또는 비-중화 ADA 를 검출할 능력을 증가시킴; 및 액체 상 반응이므로, ELISA 플레이트 등의 고체 표면으로의 부착에 의한 에피토프 내 임의의 변화 가능성을 감소시킴.In certain embodiments, the homogeneous mobility shift assay of the present invention can be used to detect a biological agent (e. G., An anti-TNFa drug) and a biological binding moiety (e. G. ) And the sample of the object. The assays described herein are advantageous for at least the following reasons: the need for a cleaning step to remove low affinity ADA is eliminated; Using distinct markers such as fluorophore to allow detection in the visible, IR and / or near IR (NIR) spectrum, reducing background and serum interference problems; Increase the ability to detect neutralized and / or non-neutralized ADA in subjects with low titers due to the sensitive sensitivity of fluorescent label detection; And since it is a liquid phase reaction, it reduces the possibility of any change in the epitope by attachment to a solid surface such as an ELISA plate.
예시적 구현예에서, 본 발명의 검정법은 상이한 시간 지점에서 다중의 시료 내 중화 및/또는 비-중화 항-약물 항체의 형성을 모니터링하기 위한 항-TNFα 약물 치료요법 중인 IBD 환자의 시간 경과적 케이스 연구를 가능하게 하기 때문에 유리하다. 본 발명의 검정법은 또한 대상체가 항-TNFα 약물 치료요법 중인 동안 시간 경과에 따른 비-중화에서 중화 항-약물 항체로의 변동이 존재하는지 결정 가능하기 때문에 유리하다. 임의의 특정 이론에 구애 받지 않고, 중화 항-약물 항체는 유의미한 음성 임상적 결과를 낳을 수 있는데, 그 이유는 이것이 항-TNFα 약물과 TNFα 간 결합을 방해하므로, 그리하여 효능 손실을 유도하기 때문이다.In an exemplary embodiment, the assays of the present invention include time-course cases of IBD patients undergoing anti-TNFa drug therapy for monitoring the formation of multiple neutralizing and / or non-neutralizing anti-drug antibodies in samples at different time points It is advantageous because it enables research. The assays of the present invention are also advantageous because the subject is able to determine whether there is a change from non-neutralization to neutralizing anti-drug antibody over time during the anti-TNFa drug therapy. Regardless of any particular theory, neutralizing anti-drug antibodies can result in significant negative clinical outcomes, since this interferes with the binding of the anti-TNFα drug to TNFα, thus leading to loss of efficacy.
추가적인 예시적 구현예에서, 본 발명의 검정법은 대안적인 생물학적 약물, 예컨대 기타 항-TNF 약물로 대상체 시료 내 중화 항-약물 항체의 교차-반응성을 예측 및/또는 측정하는데 유용한 것으로 발견된다. 단지 예시 목적으로, 시료가 하나의 항-TNFα 약물에 대한 중화 ADA 를 함유하는 경우, 이들 중화 ADA 는 다른 항-TNFα 약물에 대해 교차-반응 가능하고 이들에 대해 중화적일 가능성이 있으므로, 대상체를 위해 권고되는 치료 조정은 상이한 작용 메카니즘을 갖는 약물 (예를 들어, 비-항-TNF 제제) 로 전환될 것이다. 그러나, 시료가 하나의 항-TNFα 약물에 대한 비-중화 ADA 를 함유하는 경우에는, 대상체에 권고되는 치료 조정은 또 다른 항-TNFα 약물로 전환될 수 있을 것이다.In a further exemplary embodiment, the assay of the present invention is found to be useful in predicting and / or measuring the cross-reactivity of neutralizing anti-drug antibodies in a sample of an object with an alternative biological drug, such as other anti-TNF drugs. For illustrative purposes only, if the sample contains neutralizing ADA for one anti-TNF [alpha] drug, then these neutralizing ADAs are cross-reactive against other anti-TNF [alpha] drugs and are likely to be neutralized against them, The recommended treatment modality will be converted to a drug with a different mechanism of action (e.g., a non-anti-TNF agent). However, if the sample contains a non-neutralizing ADA for one anti-TNF alpha drug, the therapeutic adjustments recommended for the subject may be converted to another anti-TNF alpha drug.
따라서, 본 발명은 부분적으로는 항-TNFα 약물 치료요법을 제공받고 있는 대상체에 있어서 치료 결정을 안내하기에 유용한 정보를 제공함으로써, 항-TNFα 약물, 예컨대 인플릭시마브 및 아달리무마브의 투여와 연관된 현재의 제약점을 해결하고 극복한다. 본 발명의 방법은 항-TNFα 약물을 받는 상기 대상체를 모니터링하여, 중화 ADA 의 형성 및/또는 발달을 (예를 들어, 항-TNFα 약물 치료요법 과정 동안 시간 경과에 따라) 검출 또는 측정하는데 특히 유용하고, 또한 대상체가 항-TNFα 약물 치료요법 중인 동안 시간 경과에 따른 비-중화 ADA 와 비교하여 중화 ADA 의 양, 백분율 또는 비율 변화 (예를 들어, 증가) 를 검출 또는 측정하는데 역시 유용하다.Accordingly, the present invention is directed to the use of an anti-TNF alpha drug such as infliximab and adalimumab in the treatment of an anti-TNF alpha drug therapy by providing information useful for guiding a therapeutic decision in a subject being provided anti- And overcomes the current constraints associated with. The methods of the present invention are particularly useful for monitoring the subject receiving the anti-TNF [alpha] drug to detect or measure the formation and / or development of neutralizing ADA (e.g., over time during the anti-TNFa drug therapy regimen) And is also useful for detecting or measuring a change (e.g., an increase) in the amount, percentage, or ratio of neutralizing ADA compared to non-neutralizing ADA over time while the subject is on anti-TNFa drug therapy.
이로써, 본 발명은 (1) 중화 ADA 의 존재, 수준 또는 백분율 측면에서, 항-TNFα 약물의 후속 투여량을 조절 또는 개질 (예를 들어, 증가 또는 감소) 하여 치료적 효능을 최적화하고/하거나 독성을 감소시키기 위한, (2) 항-TNFα 약물 (예를 들어, 최초에, 증가, 감소 또는 동일한 투여량) 을 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 과 같은 하나 이상의 면역억제제와, 중화 ADA 의 존재, 수준 또는 백분율의 측면에서 병용하기 위한, 및/또는 (3) 중화 ADA 의 존재, 수준 또는 백분율 측면에서 현 치료요법 과정을 변경하기 위한 (예를 들어, 상이한 항-TNFα 약물 또는 상이한 메카니즘을 표적하는 약물로 전환) 시기 및/또는 방법을 결정하는 방법을 제공한다. 이러한 방법은 항-TNFα 약물을 받는 대상체가 올바른 용량을 취하고 있는지, 약물에 대한 면역 반응을 일으키지 않는지, 초기 약물 이용시 실패로 인해 상이한 약물로 전환해야 하는지 (예를 들어, 초기 항-TNFα 약물에 대한 교차-반응성 중화 ADA 의 발달) 를, 확실히 보장하는데 유용하다.Thus, the present invention provides a method for the treatment or prophylaxis of (1) modulating or modifying (e.g., increasing or decreasing) a subsequent dose of an anti-TNFa drug in terms of the presence, level or percentage of neutralizing ADA to optimize therapeutic efficacy and / (MTX) or azathioprine (AZA) with one or more immunosuppressive agents, such as methotrexate (MTX) or azathioprine (AZA), with a neutralizing ADA Level or percentage of neutralizing ADA, and / or (3) altering the current therapeutic regimens in terms of the presence, level or percentage of neutralizing ADA (e.g., different anti-TNFa drugs or different mechanisms ≪ / RTI > to a drug that targets < RTI ID = 0.0 > and / or < / RTI > This method can be used to determine whether the subject receiving the anti-TNFa drug is taking the correct dose, does not cause an immune response to the drug, should switch to a different drug due to failure at the time of initial drug use (e.g., The development of cross-reactive neutralizing ADA).
II.II. 정의Justice
명세서에서 사용되는 바와 같이, 하기의 용어들은 달리 구체화되어 있지 않는 한, 그들 본래의 의미를 갖는다. As used in the specification, the following terms have their original meanings unless otherwise specified.
본원에서 사용된 용어 "생물제제 (biologic)" 또는 "생물학적 제제 (biologic agent)" 또는 "생물학적 약물 (biologic drug)" 은, 생물계 (예를 들어, 살아 있는 유기체) 로부터 생성되거나 추출된 생성물 및 물질을 포함한다. 생물제제의 비제한적인 예에는, 항체, 항체 단편, 단백질, 폴리펩티드, 펩티드, 융합 단백질 (예를 들어 Ig 융합 단백질 또는 Fc 융합 단백질), 다가 결합 단백질 (예를 들어 DVD Ig), 항체-약물 컨쥬게이트, 백신, 핵산, 당, 그의 재조합 형태, 그의 가공된 형태 및 그의 조합물이 포함된다.The term "biologic" or "biologic agent ", or" biologic drug ", as used herein, refers to a product or substance that is produced or extracted from a biological system (e. . Non-limiting examples of biological agents include antibodies, antibody fragments, proteins, polypeptides, peptides, fusion proteins (e.g., Ig fusion proteins or Fc fusion proteins), polyvalent binding proteins (e.g. DVD Ig), antibody- Gates, vaccines, nucleic acids, sugars, recombinant forms thereof, processed forms thereof, and combinations thereof.
용어 "생물학적 결합 부분" 은 생물제제와 (특이적으로) 결합 또는 상호작용하는 임의의 분자, 작용제 또는 물질을 포함한다. 특정 예에서, 중화 형태의 자가항체는 생물학적 결합 부분과 생물제제 사이에서의 결합을 방해한다. 특정 기타 예에서, 비-중화 형태의 자가항체는 생물학적 결합 부분과 생물제제 사이의 결합을 방해하지 않는다. 하나의 비제한적인 예로서, 생물학적 결합 부분은, 생물제제가 항-TNFα 약물을 포함하는 경우 TNFα 를 포함한다. 또 다른 비제한적인 예로서, 생물학적 결합 부분은, 생물제제가 IL-2 와 같은 인터류킨을 포함하는 경우 인터류킨 수용체 (예를 들어, 인터류킨 수용체의 가용성 세포외 단편) 을 포함한다.The term "biological binding moiety" includes any molecule, agent or substance that (specifically) binds or interacts with a biological agent. In certain instances, autoantibodies in neutralized form interfere with binding between the biological binding moiety and the biological agent. In certain other instances, autoantibodies in the non-neutralized form do not interfere with the binding between the biological binding moiety and the biological agent. As one non-limiting example, the biological binding moiety comprises TNFa when the biological agent comprises an anti-TNF [alpha] drug. In another non-limiting example, the biological binding moiety comprises an interleukin receptor (e. G., A soluble extracellular fragment of an interleukin receptor) when the biological agent comprises an interleukin such as IL-2.
본 명세서에서 사용된, 용어 "항-TNFα 약물 (anti-TNFα drug)" 또는 "TNFα 억제제 (TNFα inhibitor)" 는 단백질, 항체, 항체 단편, 융합 단백질 (예를 들어 Ig 융합 단백질 또는 Fc 융합 단백질), 다가 결합 단백질 (예를 들어 DVD Ig), 소분자 TNFα 안타고니스트 및 유사한 자연발생 또는 비-자연발생 분자, 및/또는 재조합체 및/또는 이의 가공된 형태와 같이, 직접적으로 또는 간접적으로, 예를 들어 TNFα 와 TNFα 에 대한 세포 표면 수용체와의 상호작용을 억제하는 것에 의해, TNFα 단백질 생산을 억제하는 것에 의해, TNFα 유전자 발현을 억제하는 것에 의해, 세포로부터의 TNFα 분비를 억제하는 것에 의해, 대상체 내의 TNFα 활성을 감소시키는 TNFα 수용체 신호전달 또는 다른 임의의 수단을 억제시키는 것에 의해, TNFα 활성을 억제시키는 작용제를 포함하는 것으로 의도된다. 상기 용어 "항-TNFα 약물" 또는 "TNFα 억제제"는 바람직하게는 TNFα 활성을 방해하는 작용제를 포함한다. TNFα 억제제의 예는 제한없이, 인플릭시마브 (REMICADE™, Johnson and Johnson), 인간 항-TNF 모노클로날 항체 아달리무마브 (D2E7/HUMIRA™, Abbott Laboratories), 에타네르셉트 (ENBREL™, Amgen), 세르톨리주마브 페골 (CIMZIA®, UCB, Inc.), 골림무마브 (SIMPONI®; CNT0148), CDP 571 (Celltech), 및 CDP 870 (Celltech), 뿐만 아니라 TNFα 활성이 유해한 장애 (예를 들어 RA) 로 고생하고 있거나 고생할 위험이 있는 대상체에 투여시 장애가 치료되도록 하는, TNFα 활성을 억제하는 다른 화합물을 포함한다. As used herein, the term "anti-TNFα drug" or "TNFα inhibitor" refers to a protein, antibody, antibody fragment, fusion protein (eg, Ig fusion protein or Fc fusion protein) , Directly or indirectly, such as, for example, a multivalent binding protein (e. G. DVD Ig), a small molecule TNF alpha antagonist and similar naturally occurring or non-naturally occurring molecules, and / or recombinants and / By inhibiting the TNF alpha gene expression by inhibiting TNF alpha protein production by inhibiting TNF alpha and TNF alpha interaction with cell surface receptors, TNF alpha secretion from the cells is suppressed by inhibiting TNF alpha gene expression, Is intended to include agents that inhibit TNF [alpha] activity by inhibiting TNF [alpha] receptor signaling or any other means that decrease activity. The term " anti-TNFa drug "or" TNFa inhibitor "preferably includes an agent that interferes with TNFa activity. Examples of TNFa inhibitors include, but are not limited to, infliximab (REMICADE ™, Johnson and Johnson), human anti-TNF monoclonal antibody adalimumab (D2E7 / HUMIRA ™, Abbott Laboratories), etanercept (ENBREL ™, Amgen, CIMZIA®, UCB, Inc., SIMPONI® CNT0148, CDP 571 (Celltech), and CDP 870 (Celltech), as well as TNFα activity with deleterious disorders And other compounds that inhibit TNF [alpha] activity, such that the disorder is treated upon administration to a subject at risk of suffering or suffering from RA.
용어 "TNFα" 는 17 kDa 의 분비된 형태 및, 26 kDa 의 막 결합 형태로서 존재하는, 비공유적으로 결합된 17 kDa 분자들의 삼량체로 이루어진 생물학적 활성 형태인 인간 사이토카인을 포함하는 것으로 의도된다. TNFα 의 구조는 예를 들어 문헌 [Jones et al., Nature, 338:225-228 (1989)] 에 추가로 기재되어 있다. 용어 TNFα 는 인간 TNFα, 재조합 인간 TNFα (rhTNF-a), 또는 인간 TNFα 단백질과 약 80% 이상 동일한 TNFα 를 포함하는 것으로 의도된다. 인간 TNFα 는 35 아미노산 (aa) 세포질 도메인, 21 aa 막통과 분절, 및 177 aa 세포외 도메인 (ECD) 으로 이루어진다 (Pennica, D. et al. (1984) Nature 312:724). ECD 에서는, 인간 TNFα 는 붉은털원숭이 TNFα 와는 97% aa 서열 동일성을, 소, 개, 코튼 랫트, 말, 고양이, 마우스, 돼지 및 랫트 TNFα 와는 71% 내지 92% 의 동일성을 공유한다. TNFα 는 표준 재조합 발현 방법으로 제조될 수 있거나 또는 시판하여 입수가능하다 (R & D Systems, 카탈로그 번호 210-TA, Minneapolis, Minn.). The term "TNFa" is intended to include human cytokines, which are a biologically active form of a 17 kDa secreted form and a trimer of noncovalently associated 17 kDa molecules present as a 26 kDa membrane bound form. The structure of TNFa is described, for example, in Jones et al. , Nature, 338: 225-228 (1989). The term TNF [alpha] is intended to include human TNF [alpha], recombinant human TNF [alpha] (rhTNF-a), or TNF [alpha] that is at least about 80% identical to human TNF [alpha] protein. Human TNFa consists of a 35 amino acid (aa) cytosolic domain, 21 aa transmembrane segment, and 177 aa extracellular domain (ECD) (Pennica, D. et al. (1984) Nature 312: 724). In ECD, human TNFα shares 97% to 99% identity with rhesus monkey TNFα, and 71% to 92% identity with cow, dog, cotton rat, horse, cat, mouse, pig and rat TNFα. TNFa can be produced by standard recombinant expression methods or commercially available (R & D Systems, catalog number 210-TA, Minneapolis, Minn.).
특정 구현예에서, "TNFα" 는 "항원" 으로서, 항-TNF-α 약물이 결합될 수 있는 분자 또는 그 분자의 일부분을 포함하는 것이다. TNFα 는 하나 이상의 에피토프를 가질 수 있다. 특정한 예에서, TNFα 는 매우 선별적인 방식으로 항-TNFα 항체와 반응한다. 항-TNFα 항체의 항체, 단편 및 영역에 결합하는 바람직한 항원은 인간 TNFα 의 5 개 이상의 아미노산을 포함한다. 특정한 예에서, TNFα 는 항-TNFα 항체, 그의 절편 및 영역에 결합할 수 있는 TNFα 의 에피토프를 갖는 충분한 길이의 것이다. In certain embodiments, "TNFa" is an "antigen ", which comprises a molecule or a portion of the molecule to which an anti-TNF-alpha drug can be bound. TNFa may have one or more epitopes. In a particular example, TNF [alpha] reacts with anti-TNF [alpha] antibodies in a highly selective manner. Preferred antigens that bind to antibodies, fragments and regions of anti-TNF [alpha] antibodies comprise at least five amino acids of human TNF [alpha]. In a particular example, TNF [alpha] is of sufficient length to have an epitope of TNF [alpha] that is capable of binding to the anti-TNF [alpha] antibody, its fragments and regions.
용어 "크기 배제 크로마토그래피" 또는 "SEC" 는 용액 내의 분자들이 그들의 크기 및/또는 유체역학적 부피를 바탕으로 분리되는 크로마토그래피 방법을 포함하는 것이다. 그것은 단백질 및 그들의 컨쥬게이트와 같은 큰 분자 또는 거대분자 복합체에 적용된다. 통상적으로, 수용액이 칼럼을 통한 시료의 이동에 사용되는 경우, 상기 기술은 겔 여과 크로마토그래피로 알려져 있다. The term " size exclusion chromatography "or" SEC "includes chromatographic methods in which molecules in a solution are separated based on their size and / or hydrodynamic volume. It is applied to large molecules or macromolecular complexes such as proteins and their conjugates. Typically, when the aqueous solution is used for the transfer of the sample through the column, the technique is known as gel filtration chromatography.
용어 "복합체 (complex)", "면역-복합체 (immuno-complex)", "컨쥬게이트 (conjugate)", 및 "면역컨쥬게이트 (immunoconjugate)" 는 항-TNFα 약물에 (예를 들어 비-공유결합 수단에 의해) 결합된 TNFα, 항-TNFα 약물에 대한 자가항체 (예를 들어 중화 또는 비-중화 항-약물 항체) 에 (예를 들어 비-공유결합 수단에 의해) 결합된 항-TNFα 약물, 및 TNFα 및 항-TNFα 약물 양자에 대한 자가항체 (예를 들어 중화 또는 비-중화 항-약물 항체) 에 (예를 들어 비-공유결합 수단에 의해) 결합된 항-TNFα 약물을 포함하지만, 이에 제한되는 것은 아니다.The terms "complex," "immuno-complex," "conjugate," and "immunoconjugate" refer to the administration of an anti-TNFα drug (eg, (E.g., by means of non-covalent attachment) to an autoantibody (e. G., A neutralized or non-neutralized anti-drug antibody) to an anti-TNFa drug, TNFa drugs conjugated (e.g., by non-covalent means) to an autoantibody (e. G., A neutralized or non-neutralized anti-drug antibody) to both TNFa and an anti-TNFa drug, But is not limited to.
본 명세서에서 사용된 바와 같이, 용어 "표지된 (labeled)" 에 의해 변형된 개체는 임의의 개체, 분자, 단백질, 효소, 항체, 항체 단편, 사이토카인, 또는 경험적으로 검출가능한 다른 분자 또는 화학물질과 컨쥬게이트된 관련 종을 포함한다. 표지된-개체의 표지물질로서 적합한 화학 종은 형광 염료, 예를 들어 Alexa Fluor® 647 과 같은 Alexa Fluor® 염료, 양자점, 광학 염료, 발광 염료, 및 방사선, 예를 들어 125I 를 포함하지만, 이에 제한되는 것은 아니다. As used herein, an entity modified by the term "labeled" refers to any entity, molecule, protein, enzyme, antibody, antibody fragment, cytokine, or other molecule or chemical that is empirically detectable Lt; / RTI > and related species that are conjugated with the wild type. The cover - species suitable as a marker of the object is a fluorescent dye, e.g., Alexa Fluor® dye, such as Alexa Fluor® 647, a quantum dot, an optical dye, a luminescent dye, and radiation, including, for example 125 I, but this But is not limited to.
어구 "형광 표지 검출 (fluorescence label detection)" 은 형광 표지물질을 검출하기 위한 수단을 포함한다. 검출 수단은 예를 들어 Agilent-1200 HPLC System 이 있으나, 이에 제한되지 않는, 예를 들어 크기 배제-고성능 액체 크로마토그래피가 있으나, 이에 제한되는 것은 아닌, 크로마토그래피 기구에 공통적으로 통합된, 분광광도계, 형광계, 광도계 및 검출기구를 포함하나, 이에 제한되는 것은 아니다.The phrase "fluorescence label detection" includes means for detecting a fluorescent labeling substance. Detecting means may be, for example, an Agilent-1200 HPLC System, including, but not limited to, size exclusion-high performance liquid chromatography, including, but not limited to, a spectrophotometer, Fluorescence spectrometers, photometers, and detection devices.
어구 "치료요법의 최적화 (optimize therapy)" 는 특정 치료요법의 용량 (예를 들어, 유효량 또는 수준) 및/또는 유형을 최적화하는 것을 포함한다. 예를 들어, 항-TNFα 약물의 용량의 최적화는 대상체에 후속적으로 투여되는 항-TNFα 약물의 양을 증가시키거나 감소시키는 것을 포함한다. 특정 예에서, 항-TNFα 약물의 유형의 최적화는 하나의 약물로부터의 상이한 약물 (예를 들어, 상이한 항-TNFα 약물 또는 상이한 메카니즘을 표적으로 하는 약물) 로 전환하는 것을 포함한다. 다른 예에서, 치료요법의 최적화는 하나 이상의 면역억제성 약물과 함께, 용량의 항-TNFα 약물 (예를 들어, 이전의 투여량에 비해 증가되거나, 감소되거나, 또는 동일한 용량으로) 을 병용-투여하는 것을 포함한다. The phrase "optimize therapy" includes optimizing the dosage (e.g., an effective amount or level) and / or type of a particular therapy. For example, optimization of the dose of anti-TNF [alpha] drug includes increasing or decreasing the amount of anti-TNF [alpha] drug that is subsequently administered to the subject. In certain instances, optimization of the type of anti-TNF [alpha] drug involves converting from one drug to a different drug (e.g., a drug that targets a different anti-TNF [alpha] drug or a different mechanism). In another example, the optimization of treatment regimens may be combined with one or more immunosuppressive drugs in combination with a dose of an anti-TNF [alpha] drug (e.g., increased, decreased, or the same dose relative to a previous dose) .
용어 "병용-투여 (co-administer)" 는 하나의 활성 작용제의 생리학적 효과의 지속 기간이 제 2 활성 작용제의 생리학적 효과의 지속 기간과 겹쳐지도록, 하나 초과의 활성 작용제를 투여하는 것을 포함한다. The term " co-administer "includes administration of more than one active agent such that the duration of the physiological effect of one active agent overlaps with the duration of the physiological effect of the second active agent .
용어 "대상체 (subject)", "환자 (patient)", 또는 "개체 (individual)" 는 통상적으로 인간을 의미하는 것이지만, 다른 동물 예를 들어, 다른 영장류, 설치류, 개과, 고양이과, 말과, 양과, 돼지과 등을 포함한다. The term "subject," " patient, "or" individual "means typically a human, but may also refer to other animals such as other primates, rodents, canines, , Pigs, and the like.
용어 "치료요법 과정 (course of therapy)" 은 질병 또는 장애와 연관된 하나 이상의 증상을 완화 또는 예방하도록 취한 임의의 치료적 접근법을 포함한다. 상기 용어는 질환 또는 장애를 가진 개체의 건강을 개선하기에 유용한 임의의 화합물, 약물, 절차, 및/또는 요법의 적용을 포함하는 것으로, 본 명세서에 기술된 임의의 치료제를 포함한다. 비제한적인 예로서, 치료요법 과정 또는 현 치료요법 과정의 용량은 TNFα, 항-TNFα 약물 및/또는 항-약물 항체의 존재 또는 농도 수준에 따라 (예를 들어, 본 발명의 방법을 이용해 측정된 중화 및/또는 비-중화 항-약물 항체의 존재, 수준 또는 백분율) 바뀔 수 있다 (예를 들어, 증가되거나 감소될 수 있음).The term " course of therapy "includes any therapeutic approach taken to alleviate or prevent one or more symptoms associated with a disease or disorder. The term encompasses any of the therapeutic agents described herein, including the application of any compound, drug, procedure, and / or therapy useful for improving the health of an individual having the disease or disorder. As a non-limiting example, the dosages of the therapeutic regimens or current therapeutic regimens are determined by the presence or concentration level of the TNFα, anti-TNFα drug and / or anti-drug antibody (eg, Level or percentage of neutralizing and / or non-neutralizing anti-drug antibodies) can be altered (e.g., increased or decreased).
용어 "면역억제성 약물" 또는 "면역억제제" 는 면역억제 효과 예를 들어, 방사선 또는 항-대사산물, 항-림프구 혈청, 항체 등과 같은 약물의 투여에 의해 면역 반응의 예방 또는 경감을 달성할 수 있는 임의의 성분을 포함한다. 면역억제성 약물의 예는 아자티오프린 (AZA) 과 같은 티오퓨린 약물 및 그것의 대사산물; 메토트렉세이트 (MTX) 와 같은 항-대사산물; 시롤리무스 (라파마이신); 템시로리무스; 에베로리무스; 타크로리무스 (FK-506); FK-778; 항-림프구 글로불린 항체, 항-흉선 글로불린 항체, 항-CD3 항체, 항-CD4 항체, 및 항체-독성 컨쥬게이트; 시클로스포린; 마이코페놀레이트; 미조리빈 모노포스페이트; 스코파론; 글라티라머 아세테이트; 그것의 대사산물; 그것의 약학적으로 허용가능한 염; 그것의 유도체; 그것의 전구약물; 및 그것의 조합물을 포함하나, 이에 제한되는 것은 아니다. The term "immunosuppressive drug" or "immunosuppressive agent" can be used to achieve the prevention or amelioration of an immune response by the administration of a medicament such as an immunosuppressive effect, e.g., radiation or anti-metabolites, anti-lymphocyte serum, ≪ / RTI > Examples of immunosuppressive drugs include thiopurine drugs such as azathioprine (AZA) and its metabolites; Anti-metabolites such as methotrexate (MTX); Sirolimus (rapamycin); Temsirolimus; Everolimus; Tacrolimus (FK-506); FK-778; Anti-lymphocyte globulin antibody, anti-thymocyte globulin antibody, anti-CD3 antibody, anti-CD4 antibody, and antibody-toxic conjugate; Cyclosporine; Mycophenolate; Mizoribine monophosphate; Scoparone; Glatiramer acetate; Its metabolites; A pharmaceutically acceptable salt thereof; Its derivatives; Its prodrug drugs; ≪ / RTI > and combinations thereof.
용어 "티오퓨린 약물 (thiopurine dug)" 은 아자티오프린 (AZA), 6-머캅토퓨린 (6-MP), 또는 치료적 효능을 갖는 임의의 대사산물로서의 6-티오구아닌 (6-TG), 6-메틸머캅토퓨린 리보사이드, 6-티오인노신 뉴클레오티드 (예를 들어, 6-티오이노신 모노포스페이트, 6-티오이노신 디포스페이트, 6-티오이노신 트리포스페이트), 6-티오구아닌 뉴클레오티드 (예를 들어, 6-티오구아노신 모노포스페이트, 6-티오구아노신 디포스페이트, 6-티오구아노신 트리포스페이트), 6-티오산토신 뉴클레오티드 (예를 들어, 6-티오산토신 모노포스페이트, 6-티오산토신 디포스페이트, 6-티오산토신 트리포스페이트), 그것의 유도체, 그것의 유사체, 및 그것의 조합물을 포함하나, 이에 제한되는 것은 아니다. The term "thiopurine dug" refers to azathioprine (AZA), 6-mercaptopurine (6-MP), or 6-thioguanine (6-TG) as any metabolite with therapeutic efficacy, (E.g., 6-thioinosine monophosphate, 6-thioinosine diphosphate, 6-thioinosine triphosphate), 6-thioguanine nucleotides For example, 6-thioguanosine monophosphate, 6-thioguanosine triphosphate, 6-thioguanosine triphosphate), 6-thioantosine nucleotides But are not limited to, thiophosphate, neodiphosphate, 6-thioctosine triphosphate), derivatives thereof, analogs thereof, and combinations thereof.
용어 "시료" 는 개체로부터 수득되는 임의의 생물학적 시편을 포함한다. 시료에는 전혈, 혈청, 혈장, 적혈구, 백혈구 (예를 들어, 말초혈 단핵 세포 (PBMC), 다형상성핵 (PMN) 세포), 도관 세정액, 유두 흡입물, 림프 (예를 들어, 림프절의 유포된 종양 세포), 골수 흡입물, 타액, 뇨, 변 (예를 들어, 대변), 담, 기관지 세정액, 눈물, 세침 흡입물 (예를 들어, 무작위적인 유선염 세침 흡입물), 임의의 기타 체액, 조직 시료, 예컨대 염증 부위의 생검 (예를 들어, 천자 생검), 그의 세포 추출물 및 하나 이상의 상기 체액 또는 조직으로부터 유도된 면역글로불린 풍부화 분획물을 포함하나, 이에 제한되지 않는다. 일부 구현예에서, 시료는 전혈, 그의 부분 성분, 예컨대 혈장, 혈청 또는 세포 펠릿 또는 그의 면역글로불린 풍부한 분획물이다. 당업자는 혈청 시료와 같은 적절한 시료가 분석 전에 희석될 수 있음을 알 수 있을 것이다. 특정 구현예에서, 시료는 당업계에 공지된 임의의 기법을 이용해 PBMC 및/또는 PMN 세포를 단리함으로써 수득된다. 특정한 다른 구현예에서, 시료는 예를 들어 위장관 또는 윤활 조직의 일부분과 같은 염증 부위 유래의 것과 같은 조직 생검이다. The term "sample" includes any biological specimen obtained from an individual. The samples may include whole blood, serum, plasma, red blood cells, leukocytes (e.g., peripheral blood mononuclear cells (PBMC), polymorphonuclear (PMN) cells), catheter rinses, nipple inhalants, lymph (e.g., Tumor cells), bone marrow aspirates, saliva, urine, feces (e.g., feces), feces, bronchial rinses, tears, fine needle aspirates (e.g., random mastitis fine needle aspirates) But are not limited to, a sample, for example, a biopsy (e.g., a puncture biopsy) of an inflammatory site, an extract thereof, and an immunoglobulin-enriched fraction derived from one or more of said body fluids or tissues. In some embodiments, the sample is whole blood, a portion thereof, such as plasma, serum or cell pellet or an immunoglobulin rich fraction thereof. Those skilled in the art will appreciate that suitable samples such as serum samples may be diluted prior to analysis. In certain embodiments, the sample is obtained by isolating PBMC and / or PMN cells using any technique known in the art. In certain other embodiments, the sample is a tissue biopsy, such as, for example, from an inflammatory site such as the gastrointestinal tract or a portion of a lubrication tissue.
본 발명의 방법의 단계는 이것들이 제시된 특별한 순서로 수행되어야 하는 것은 아니다. 당업자는 본 발명의 방법의 단계의 다른 순서배치도 본 발명의 범주 내에 포함된다는 것을 이해할 것이다. The steps of the method of the present invention need not be performed in the specific order in which they are presented. Those skilled in the art will appreciate that other sequence arrangements of steps of the method of the present invention are also included within the scope of the present invention.
괄호 "[ ]" 는 괄호 내부의 종류에 대한 그들의 농도를 의미한다. Parentheses "[]" refer to their concentration in the type inside parentheses.
III.III. 구현예의 설명Description of Implementation Example
본 발명은 시료 내 항-TNFα 약물 치료제와 같은 생물제제에 대한 중화 및 비-중화 자가항체의 존재 또는 수준을 검출 및 측정하기 위한 검정법을 제공한다. 본 발명은 대상체가 생물제제 치료요법 중인 (예를 들어, 항-TNFα 약물 치료요법) 동안 시간 경과에 따른 중화 및/또는 비-중화 항-약물 항체의 형성을 모니터링하기에 유용하다. 본 발명은 또한 대안적인 생물학적 치료요법 (예를 들어, 대안적인 항-TNFα 치료요법) 으로 대상체의 시료 내 중화 항-약물 항체의 교차-반응성을 예측 및/또는 결정하기에 유용하다. 이로써, 본 발명은 생물학적 제제로의 치료요법을 받는 대상체를 위한 치료 결정의 안내 정보를 제공하고, 치료요법을 최적화하고, 독성을 경감시키고 및/또는 생물학적 치료요법에 대한 치료요법적 치료의 효능을 모니터링하는데 있어서 정확도를 개선시킨다.The present invention provides assays for detecting and measuring the presence or level of neutralizing and non-neutralizing autoantibodies to biologics such as anti-TNF alpha drug therapies in a sample. The present invention is useful for monitoring the formation of neutralizing and / or non-neutralizing anti-drug antibodies over time during which the subject is being biologically treated (e. G., Anti-TNFa drug therapy). The present invention is also useful for predicting and / or determining the cross-reactivity of neutralizing anti-drug antibodies in a sample of an object with alternative biological therapy (e. G., Alternative anti-TNFa therapy). Thus, the present invention provides guidance information on treatment decisions for subjects receiving therapeutic treatment with a biological agent, optimizing treatment regimens, alleviating toxicity and / or improving the efficacy of therapeutic regimens for biologic therapy Improves accuracy in monitoring.
한 측면에서, 본 발명은 하기를 포함하는, 시료 내 생물제제에 대한 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출하는 방법을 제공한다:In one aspect, the invention provides a method of detecting the presence of a neutralizing and / or non-neutralizing form of an autoantibody to a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled biologic agent, the labeled biological binding moiety and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용해 이들을 자유 (즉, 비결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리함;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them into free (i.e., unbound) labeled biological binding moieties, free labeled biologics, and / Separation from the complex of the agent and the labeled biological binding moiety;
(c) 크기 배제 크로마토그래피 이후 자유 표지된 생물학적 결합 부분의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled biological binding moiety is measured (e.g., by measuring the area under the curve (AUC) of the free labeled biologically bound partial peak after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교하고 (예를 들어, 오로지 자유 표지된 생물학적 결합 부분만을 함유하는 기준 시료의 SEC 후 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출함.(d) The level of the free labeled biological binding moiety measured in step (c) is compared to the level of the free labeled biological binding moiety in the control sample (e. G., The SEC of the reference sample containing only the free labeled biologically binding moiety) Followed by measuring the AUC of the free labeled biologically binding partial peak), thereby detecting the presence of autoantibodies in the neutralized and / or non-neutralized form.
일부 구현예에서, 중화 형태의 자가항체는 생물제제 및 생물학적 결합 부분 사이의 결합을 방해한다. 기타 구현예에서, 비-중화 형태의 자가항체는 생물제제 및 생물학적 결합 부분 사이의 결합을 방해하지 않는다.In some embodiments, autoantibodies in neutralized form interfere with binding between the biological agent and the biological binding moiety. In other embodiments, the autoantibody of the non-neutralizing form does not interfere with the binding between the biological agent and the biological binding moiety.
일부 예에서, 자유 표지된 생물학적 결합 부분은 결합된 생물제제 (예를 들어, 표지된 및/또는 비표지된 생물제제) 가 실질적으로 없는 표지된 생물학적 결합 부분으로 이루어진다.In some instances, a free labeled biological binding moiety consists of a labeled biological binding moiety that is substantially free of the bound biological agent (e.g., labeled and / or unlabeled biological agent).
특정 구현예에서, 중화 형태의 자가항체는 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준이 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 동일하거나 또는 실질적으로 동일한 경우에 검출된다. 특정 기타 구현예에서, 비-중화 형태의 자가항체는, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분이 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교시 감소되거나 (예를 들어, 실질적으로 감소됨) 또는 부재인 (예를 들어, 검출되지 않음) 경우에, 검출된다.In certain embodiments, the autoantibody in neutralized form is detected when the level of the free labeled biological binding moiety measured in step (c) is the same or substantially the same as the level of the free labeled biological binding moiety in the control sample. In certain other embodiments, the autoantibody of the non-neutralizing form is characterized in that the free labeled biological binding moiety measured in step (c) is reduced in comparison to the level of the free labeled biological binding moiety in the control sample (e. G. Substantially reduced) or absent (e.g., not detected).
특정 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은, 이것이 대조군 시료 내 측정된 자유 표지된 생물학적 결합 부분의 수준의 적어도 약 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 인 경우에, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 실질적으로 동일한 것으로 간주된다. 특정 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은, 이것이 대조군 시료 내 측정된 자유 표지된 생물학적 결합 부분의 수준보다 적어도 약 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 또는 95% 미만인 경우에, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교시 실질적으로 감소된 것으로 간주된다. In certain embodiments, the level of the free labeled biological binding moiety measured in step (c) is at least about 70%, 75%, 80%, 81%, or 80% of the level of the free labeled biological binding moiety measured in the control sample , 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% %, Or 99%, is considered to be substantially equal to the level of the free labeled biological binding moiety in the control sample. In certain embodiments, the level of the free labeled biological binding moiety measured in step (c) is at least about 50%, 55%, 60%, 65% or more than the level of the free labeled biological binding moiety measured in the control sample. , 70%, 75%, 80%, 85%, 90%, or 95% of the free labeled biological binding moiety in the control sample.
일부 구현예에서, 자유 표지된 생물학적 결합 부분의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터의 용출 시간의 함수로서, 신호 강도의 플롯으로부터, 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다.In some embodiments, the level of the free labeled biological binding moiety is determined from a plot of signal intensity, as a function of elution time from size exclusion chromatography (e.g., SEC-HPLC), of a free labeled biological binding moiety peak Is measured by integrating the area under the curve (AUC).
일부 구현예에서, 생물제제는 항체 (예를 들어, 항-TNFα 모노클로날 항체), 항체 단편, 단백질 (예를 들어, 사이토카인, 예컨대 인터류킨), 폴리펩티드, 펩티드, 융합 단백질, 다가 결합 단백질, 항체-약물 컨쥬게이트, 백신, 핵산, 당, 그의 재조합 형태, 그의 가공된 형태, 및 그의 조합물을 포함한다.In some embodiments, the biological agent is selected from the group consisting of an antibody (e.g., an anti-TNFa monoclonal antibody), an antibody fragment, a protein (e.g., a cytokine such as an interleukin), a polypeptide, a peptide, Antibody-drug conjugates, vaccines, nucleic acids, sugars, recombinant forms thereof, processed forms thereof, and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 생물학적 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염), 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)), 또는 암 등의 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample, for example, a whole blood, serum, or plasma sample of a subject undergoing biotherapeutic therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is an autoimmune disease (e.g., rheumatoid arthritis), an inflammatory disease (e.g., inflammatory bowel disease (IBD) such as Crohn's disease (CD) or ulcerative colitis (UC) Of the disease or disorder.
특정 구현예에서, 시료는 생물제제에 대한 자가항체를 갖거나 또는 갖는 것으로 의심된다. 기타 구현예에서, 생물학적 자가항체는 이에 제한되는 것은 아니나, 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 이의 조합물을 포함한다.In certain embodiments, the sample is suspected of having or having an autoantibody to the biological agent. In other embodiments, the biological autologous antibody includes but is not limited to human anti-chimeric antibody (HACA), human anti-humanized antibody (HAHA), and human anti-mouse antibody (HAMA) do.
또 다른 측면에서, 본 발명은 하기를 포함하는, 시료 내 생물제제에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정하는 방법을 제공한다:In another aspect, the invention provides a method for determining the level or percentage of autoantibodies in neutralized form to a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled biologic agent, the labeled biological binding moiety and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용해 이들을 자유 (즉, 비결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리함;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them into free (i.e., unbound) labeled biological binding moieties, free labeled biologics, and / Separation from the complex of the agent and the labeled biological binding moiety;
(c) 크기 배제 크로마토그래피 이후 자유 표지된 생물학적 결합 부분의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled biological binding moiety is measured (e.g., by measuring the area under the curve (AUC) of the free labeled biologically bound partial peak after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율과 비교함 (예를 들어, 오로지 자유 표지된 생물학적 결합 부분만을 함유하는 기준 시료의 SEC 후 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정 및 정규화해, 자유 표지된 생물학적 결합 부분의 수준 또는 백분율을 산출하는 것에 의함), 이때 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율은 중화 형태의 자가항체의 수준 또는 백분율에 상응함.(d) The level of the free labeled biological binding moiety measured in step (c) is compared to the normalized level or percentage of the free labeled biological binding moiety in the control sample (e. G., Only the free labeled biologically binding moiety Measuring and normalizing the AUC of the free labeled biologically binding moiety peak after SEC of the reference sample and calculating the level or percentage of the free labeled biologically binding moiety), wherein the normalized The level or percentage corresponds to the level or percentage of autoantibodies in neutralization form.
일부 구현예에서, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 정규화된 수준 또는 백분율과 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준간 차이는 비-중화 형태의 자가항체의 수준 또는 백분율에 상응한다.In some embodiments, the difference between the normalized level or percentage of the free labeled biological binding moiety in the control sample and the level of the free labeled biological binding moiety measured in step (c) is greater than the level or percentage of the non- ≪ / RTI >
일부 예시에서, 자유 표지된 생물학적 결합 부분은 결합된 생물제제 (예를 들어, 표지 및/또는 비표지된 생물제제) 가 실질적으로 부재인 표지된 생물학적 결합 부분으로 이루어진다. In some instances, a free labeled biological binding moiety consists of a labeled biological binding moiety that is substantially absent of the bound biological agent (e.g., a label and / or unlabeled biological agent).
특정 구현예에서, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준 또는 백분율은 표지된 생물제제와 표지된 생물학적 결합 부분 사이에서 형성된 복합체 (예를 들어, "표지된 복합체") 의 피크 면적을 측정하고 (예를 들어, AUC 측정에 의함), 이후, 표지된 복합체의 측정된 피크 면적을, 자유 표지된 생물학적 결합 부분의 피크 면적 (예를 들어, 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정하는 것에 의함) 에서 차감함으로써 정규화된다.In certain embodiments, the level or percentage of the free labeled biological binding moiety in the control sample is determined by measuring the peak area of the complex formed (e. G., "Labeled complex") between the labeled biological agent and the labeled biological binding moiety (For example, by measuring the AUC), the measured peak area of the labeled complex is then compared to the peak area of the free labeled biological binding moiety (e. G., By measuring the AUC of the free labeled biologically binding partial peak Quot;). ≪ / RTI >
특정 구현예에서, 자유 표지된 생물학적 결합 부분의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다. 기타 구현예에서, 표지된 생물제제와 표지된 생물학적 결합 부분 사이에서 형성된 복합체의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 생물학적 결합 부분 피크의 AUC 를 적분함으로써 측정된다.In certain embodiments, the level of the free labeled biological binding moiety is determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e.g., SEC-HPLC) under the curve area of the free labeled biologically binding moiety peak (AUC). In other embodiments, the level of complexes formed between labeled biologics and labeled biologically binding moieties can be determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e. G., SEC-HPLC) Is determined by integrating the AUC of the peak of the biological binding moiety.
특정 구현예에서, 생물제제에 대한 자가항체 (예를 들어, ADA) 의 부분 모집단은 중화 형태의 자가항체 (예를 들어, NAb) 이다. 일부 구현예에서, 시료 내 생물제제에 대한 자가항체의 총 수준은, 본 발명의 방법에 따라 측정된, 중화 형태의 자가항체의 수준 및 비-중화 형태의 자가항체의 수준을 모두 더함으로써 산출될 수 있다.In certain embodiments, the partial population of autoantibodies (e.g., ADA) to a biological agent is an autoantibody in neutralization form (e.g., NAb). In some embodiments, the total level of autoantibody to a biological agent in the sample is calculated by adding both the level of autoantibody in neutralized form and the level of autoantibody in non-neutralized form, measured according to the methods of the invention .
일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 음성 대조군, 양성 대조군 또는 그의 조합물과 추가 비교된다. 추가 구현예에서, 단계 (d) 에서 측정된 중화 형태의 자가항체 (예를 들어, NAb) 의 백분율은 건강한 대조군 (예를 들어, 정상 인간 혈청) 으로부터 확립된 컷오프 (cutoff) 값 또는 기준 범위와 비교된다. 일부 구현예에서, 컷오프 값 또는 기준 범위는 시료가 NAb 에 대해 양성인 것으로 고려되기 위해 반드시 가져야 하는 NAb 의 역치 백분율로서 표시된다. 이러한 구현예에서, 시료는 단계 (d) 에서 측정된 NAb 의 백분율이 건강한 대조군에서 확립된 컷오프 값 또는 기준 범위 이상인 경우, NAb 에 대해 양성이다. 다른 구현예에서, 시료는 단계 (d) 에서 측정된 NAb 의 백분율이 건강한 대조군에서 확립된 컷오프 값 또는 기준 범위 미만인 경우, NAb 에 대해 음성이다. 컷오프 값 또는 기준 범위의 비제한적인 예에는 예를 들어 적어도 약 0.25%, 0.50%, 0.75%, 1.00%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80%, 2.90%, 3.00%, 3.01%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, 또는 임의의 그 내부의 범위가 포함된다.In some embodiments, the level of the free labeled biological binding moiety measured in step (c) is further compared with a negative control, a positive control, or a combination thereof. In a further embodiment, the percentage of neutralizing forms of autoantibodies (e.g., NAb) determined in step (d) is greater than the cutoff value or reference range established from a healthy control (e. G., Normal human serum) . In some embodiments, the cutoff value or reference range is expressed as a percentage threshold of NAb that the sample must have to be considered positive for NAb. In this embodiment, the sample is positive for NAb if the percentage of NAb measured in step (d) is greater than or equal to the cutoff value established in a healthy control or reference range. In another embodiment, the sample is negative for NAb when the percentage of NAb measured in step (d) is less than the cutoff value or reference range established in a healthy control. Non-limiting examples of cutoff values or reference ranges include at least about 0.25%, 0.50%, 0.75%, 1.00%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80%, 2.90% 3.0%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 3.50%, 4.00%, 4.50% 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, or any range therein.
일부 구현예에서, 생물제제에 대한 자가항체 모두는 중화 항체이고, 시료는 100% 중화 항-약물 항체 (NAb) 및/또는 0% 비-중화 항-약물 항체 (비-NAb) 를 갖는 것으로서 정의된다. 일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 일반적으로, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 동일하고, 자가항체는 생물제제 및 생물학적 결합 부분 간 결합을 완전히 차단 또는 방해하는 것으로 예측된다.In some embodiments, the autoantibodies to the biological agent are all neutralizing antibodies and the sample is defined as having 100% neutralizing anti-drug antibody (NAb) and / or 0% non-neutralizing anti-drug antibody (non- do. In some embodiments, the level of the free labeled biological binding moiety measured in step (c) is generally equal to the level of the free labeled biological binding moiety in the control sample, and the autoantibody is bound to the biological agent and the biological binding moiety Lt; RTI ID = 0.0 > and / or < / RTI >
기타 구현예에서, 생물제제에 대한 자가항체의 어떤 것도 중화 항체가 아니며, 시료는 100% 비-NAb 및/또는 0% NAb 를 갖는 것으로 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 일반적으로 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교시 부재이고 (예를 들어, 검출불가능함), 자가항체는 생물제제 및 생물학적 결합 부분 간 결합을 완전히 차단 또는 방해하는 것은 아닌 것으로 예측된다.In other embodiments, none of the autoantibodies to the biological agent are neutralizing antibodies, and the sample is defined as having 100% non-NAb and / or 0% NAb. In these embodiments, the level of the free labeled biological binding moiety measured in step (c) is generally non-existent (e. G., Undetectable) compared to the level of the free labeled biological binding moiety in the control sample, Antibodies are not expected to completely block or interfere with binding between biologics and biological binding moieties.
추가 구현예에서, 중화 및 비-중화 형태 모두의 자가항체가 시료에 존재하는 경우, 각 종류의 백분율은 그 자체 단독으로 (예를 들어, 50% NAb 또는 50% 비-NAb 는 시료 내 NAb 및 비-NAb 의 등비로서 정의됨) 또는 비율로서 표시될 수 있다. 특정 예에서, 상기 비율은 NAb 의 백분율을 비-NAb 의 백분율로 또는 그 반대로 나눔으로써 산출된다. 기타 예에서, 상기 비율은 NAb 의 수준을 비-NAb 의 수준으로 나누거나 또는 그 반대로 나눔으로써 산출된다.In a further embodiment, when both the neutralizing and non-neutralizing forms of the autoantibody are present in the sample, the percentages of each species may be measured by itself (e.g., 50% NAb or 50% non- (Defined as an iso-ratio of non-NAb) or as a ratio. In a particular example, the ratio is calculated by dividing the percentage of NAb by the percentage of non-NAb or vice versa. In other examples, the ratio is calculated by dividing the level of NAb by the level of non-NAb or vice versa.
일부 구현예에서, 생물제제에는 항체 (예를 들어, 항-TNFα 모노클로날 항체), 항체 단편, 단백질 (예를 들어, 사이토카인, 예컨대 인터류킨), 폴리펩티드, 펩티드, 융합 단백질, 다가 결합 단백질, 항체-약물 컨쥬게이트, 백신, 핵산, 당, 그의 재조합 형태, 그의 가공된 형태, 및 그의 조합물이 포함된다.In some embodiments, the biologics may include antibodies (e.g., anti-TNFa monoclonal antibodies), antibody fragments, proteins (e.g., cytokines such as interleukins), polypeptides, peptides, fusion proteins, Antibody-drug conjugates, vaccines, nucleic acids, sugars, recombinant forms thereof, processed forms thereof, and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 생물학적 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염), 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)), 또는 암 등의 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample, for example, a whole blood, serum, or plasma sample of a subject undergoing biotherapeutic therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is an autoimmune disease (e.g., rheumatoid arthritis), an inflammatory disease (e.g., inflammatory bowel disease (IBD) such as Crohn's disease (CD) or ulcerative colitis (UC) Of the disease or disorder.
특정 구현예에서, 시료는 생물제제에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 생물학적 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the biological agent. In other embodiments, biological autologous antibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies (HAMA) as well as combinations thereof .
또 다른 측면에서, 본 발명은 하기를 포함하는, 시료 내 생물제제에 대한 중화 형태의 자가항체의 백분율 또는 수준을 측정하는 방법을 제공한다:In another aspect, the invention provides a method for determining the percentage or level of autoantibody in neutralized form to a biological agent in a sample, comprising:
(a) 시료를, 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled biologic agent and a labeled biological binding moiety to form:
(i) 표지된 생물제제 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) The first labeled conjugate of the labeled biologic agent and autoantibody (i.e., the immunoconjugate or conjugate) (i.e., the components of the first labeled conjugate are not covalently bonded to each other); And / or
(ii) 표지된 생물제제, 표지된 생물학적 결합 부분 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the immunoconjugate or conjugate) of the labeled biologic agent, the labeled biological binding moiety and the autoantibody (i.e., the components of the second labeled conjugate are not covalently bonded to each other);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용해 이들을 자유 (즉, 비결합된) 표지된 생물학적 결합 부분, 자유 표지된 생물제제, 및/또는 표지된 생물제제 및 표지된 생물학적 결합 부분의 복합체로부터 분리함;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them into free (i.e., unbound) labeled biological binding moieties, free labeled biologics, and / Separation from the complex of the agent and the labeled biological binding moiety;
(c) 크기 배제 크로마토그래피 이후 자유 표지된 생물학적 결합 부분의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) After the size exclusion chromatography, the level of the free labeled biological binding moiety is measured (e.g., by measuring the area under the curve (AUC) of the free labeled biologically bound partial peak after size exclusion chromatography (SEC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준을, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교하고 (예를 들어, 기준 시료의 SEC 후 자유 표지된 생물학적 결합 부분 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 형태의 자가항체의 백분율 또는 수준을 측정함.(d) The level of the free labeled biological binding moiety measured in step (c) is compared with the level of the free labeled biological binding moiety in the control sample (e. G., The AUC of the free labeled biologically binding partial peak after SEC of the reference sample , Thereby measuring the percentage or level of autoantibodies in neutralization form.
일부 구현예에서, 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 은 시료 (예를 들어 환자로부터의) 및 대조군 시료에 대해 산출된다. 특정 구현예에서, 표지된 생물제제는 표지된 생물학적 결합 부분에 결합하며 검정 신호를 감소시킨다 (예를 들어, 대조군 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 와 비교시 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 를 감소시킴). 다른 구현예에서, 중화 형태의 자가항체 (NAb) 는 표지된 생물제제를 중화시키며 검정 신호를 회복시킨다 (예를 들어, 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 를 대조군 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 와 비교가능한 수준으로 복원 또는 회복시킴). 일부 구현예에서, NAb 활성은 측정된 검정 신호에 직접적으로 비례한다. 특정 구현예에서, 시료 내 NAb 백분율은 검정 신호의 회복 백분율과 동등하다. 특정한 예에서, NAb 백분율은 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 대 대조군 시료의 자유 표지된 생물학적 결합 부분 피크의 AUC 의 비율로서 산출된다. 제한이 없는 예로서, NAb 백분율은 하기 식에 따라 산출된다: 회복 % = (시료의 자유 표지된 생물학적 결합 부분AUC - BKGD)/(대조군 시료의 자유 표지된 생물학적 결합 부분AUC - BKGD)*100.In some embodiments, the under-curve area (AUC) of the free labeled biological binding moiety peak is calculated for a sample (e.g., from a patient) and a control sample. In certain embodiments, the labeled biologic agent binds to the labeled biological binding moiety and reduces the assay signal (e. G., The free labeled biological binding of the sample as compared to the AUC of the free labeled biological binding moiety peak of the control sample Reducing the AUC of the partial peak). In another embodiment, the neutralizing form of the autoantibody (NAb) neutralizes the labeled biochemical agent and restores the assay signal (e.g., the AUC of the free labeled biologically bound portion peak of the sample is determined by the free labeled biological Restoring or recovering to a level comparable to the AUC of the binding site peak). In some embodiments, the NAb activity is directly proportional to the measured assay signal. In certain embodiments, the percentage of NAb in the sample is equivalent to the recovery percentage of the black signal. In a specific example, the percentage of NAb is calculated as the ratio of the AUC of the free labeled biologically binding portion peak of the sample to the AUC of the free labeled biologically binding portion peak of the control sample. As a non-limiting example, the percentage of NAb is calculated according to the following equation:% recovery = (free labeled biologically binding portion of sample AUC -BKGD) / (free labeled biologically binding portion of control sample AUC -BKGD) * 100.
일부 예에서, 자유 표지된 생물학적 결합 부분은 결합된 생물제제 (예를 들어, 표지 및/또는 비표지된 생물제제) 가 실질적으로 없는 표지된 생물학적 결합 부분으로 이루어진다. In some instances, the free labeled biological binding moiety consists of a labeled biological binding moiety that is substantially free of the bound biological agent (e.g., a label and / or unlabeled biological agent).
특정 구현예에서, 자유 표지된 생물학적 결합 부분의 수준은 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터의 용출 시간의 함수로서, 신호 강도의 플롯으로부터 자유 표지된 생물학적 결합 부분 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다. 기타 구현예에서, 표지된 생물제제와 표지된 생물학적 결합 부분 사이에서 형성된 복합체의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 생물학적 결합 부분 피크의 AUC 를 적분함으로써 측정된다. In certain embodiments, the level of the free labeled biological binding moiety is determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e. G., SEC-HPLC) to a curve of the free labeled biologically- Is measured by integrating the area (AUC). In other embodiments, the level of complexes formed between labeled biologics and labeled biologically binding moieties can be determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e. G., SEC-HPLC) Is determined by integrating the AUC of the peak of the biological binding moiety.
특정 구현예에서, 생물제제에 대한 자가항체 (예를 들어, ADA) 의 부분 모집단은 중화 형태의 자가항체 (예를 들어, NAb) 이다. 일부 구현예에서, 시료 내 생물제제에 대한 자가항체의 총 수준은, 본 발명의 방법에 따라 측정된, 중화 형태의 자가항체의 수준 및 비-중화 형태의 자가항체의 수준을 모두 더함으로써 산출될 수 있다. 특정 구현예에서, 중화 형태의 자가항체는 중화 자가항체 및 비-중화 자가항체 모두를 포함하는 자가항체의 모집단에서 존재한다.In certain embodiments, the partial population of autoantibodies (e.g., ADA) to a biological agent is an autoantibody in neutralization form (e.g., NAb). In some embodiments, the total level of autoantibody to a biological agent in the sample is calculated by adding both the level of autoantibody in neutralized form and the level of autoantibody in non-neutralized form, measured according to the methods of the invention . In certain embodiments, autoantibodies in neutralized form are present in a population of autoantibodies in which both neutralizing autoantibodies and non-neutralizing autoantibodies are included.
일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 음성 대조군, 양성 대조군 또는 그의 조합물과 추가 비교된다. 추가 구현예에서, 단계 (d) 에서 측정된 중화 형태의 자가항체 (예를 들어, NAb) 의 백분율은 예를 들어 자가항체에 대해 낮은 양성을 갖는 시료로부터 확립된 컷오프 값 또는 기준 범위와 비교된다. 일부 구현예에서, 컷오프 값 또는 기준 범위는 시료가 NAb 에 대해 양성인 것으로 고려되기 위해 반드시 가져야 하는 NAb 의 역치 백분율로서 표시된다. 이러한 구현예에서, 시료는 단계 (d) 에서 측정된 NAb 의 백분율이 확립된 컷오프 값 또는 기준 범위 초과 (또는 동일) 인 경우, NAb 에 대해 양성이다. 다른 구현예에서, 시료는 단계 (d) 에서 측정된 NAb 의 백분율이 확립된 컷오프 값 또는 기준 범위 미만 (또는 동일) 인 경우, NAb 에 대해 음성이다. 컷오프 값 또는 기준 범위의 비제한적인 예에는 예를 들어 적어도 약 0.10%, 0.20%, 0.30%, 0.40%, 0.50%, 0.60%, 0.70%, 0.80%, 0.90%, 1.00%, 1.10%, 1.15%, 1.20%, 1.21%, 1.22%, 1.23%, 1.24%, 1.25%, 1.26%, 1.27%, 1.28%, 1.29%, 1.30%, 1.40%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80%, 2.90%, 3.00%, 3.01%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, 또는 임의의 그 내부의 범위가 포함된다.In some embodiments, the level of the free labeled biological binding moiety measured in step (c) is further compared with a negative control, a positive control, or a combination thereof. In a further embodiment, the percentage of neutralizing forms of autoantibodies (e.g., NAb) determined in step (d) is compared to a cutoff value or reference range established, for example, from a sample having a low positive for autoantibodies . In some embodiments, the cutoff value or reference range is expressed as a percentage threshold of NAb that the sample must have to be considered positive for NAb. In this embodiment, the sample is positive for NAb if the percentage of NAb measured in step (d) is greater than the established cutoff value or reference range (or the same). In other embodiments, the sample is negative for NAb if the percentage of NAb measured in step (d) is less than the established cutoff value or reference range (or the same). Non-limiting examples of cutoff values or reference ranges include at least about 0.10%, 0.20%, 0.30%, 0.40%, 0.50%, 0.60%, 0.70%, 0.80%, 0.90%, 1.00%, 1.10% 1.20%, 1.21%, 1.22%, 1.23%, 1.24%, 1.25%, 1.26%, 1.27%, 1.28%, 1.29%, 1.30%, 1.40%, 1.50%, 2.00%, 2.50%, 2.60% 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 2.70%, 2.80%, 2.90%, 3.00% , 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, Range.
일부 구현예에서, 생물제제에 대한 자가항체 모두는 중화 항체이고, 시료는 100% 중화 항-약물 항체 (NAb) 및/또는 0% 비-중화 항-약물 항체 (비-NAb) 를 갖는 것으로서 정의된다. 일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 일반적으로, 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 동일하고, 자가항체는 생물제제 및 생물학적 결합 부분 간 결합을 완전히 차단 또는 방해하는 것으로 예측된다.In some embodiments, the autoantibodies to the biological agent are all neutralizing antibodies and the sample is defined as having 100% neutralizing anti-drug antibody (NAb) and / or 0% non-neutralizing anti-drug antibody (non- do. In some embodiments, the level of the free labeled biological binding moiety measured in step (c) is generally equal to the level of the free labeled biological binding moiety in the control sample, and the autoantibody is bound to the biological agent and the biological binding moiety Lt; RTI ID = 0.0 > and / or < / RTI >
기타 구현예에서, 생물제제에 대한 자가항체의 어떤 것도 중화 항체가 아니며, 시료는 100% 비-NAb 및/또는 0% NAb 를 갖는 것으로 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 생물학적 결합 부분의 수준은 일반적으로 대조군 시료 내 자유 표지된 생물학적 결합 부분의 수준과 비교시 부재이고 (예를 들어, 검출불가능함), 자가항체는 생물제제 및 생물학적 결합 부분 간 결합을 완전히 차단 또는 방해하는 것은 아닌 것으로 예측된다.In other embodiments, none of the autoantibodies to the biological agent are neutralizing antibodies, and the sample is defined as having 100% non-NAb and / or 0% NAb. In these embodiments, the level of the free labeled biological binding moiety measured in step (c) is generally non-existent (e. G., Undetectable) compared to the level of the free labeled biological binding moiety in the control sample, Antibodies are not expected to completely block or interfere with binding between biologics and biological binding moieties.
추가 구현예에서, 중화 및 비-중화 형태 모두의 자가항체가 시료에 존재하는 경우, 각 종류의 백분율은 그 자체 단독으로 (예를 들어, 50% NAb 또는 50% 비-NAb 는 시료 내 NAb 및 비-NAb 의 등비로서 정의됨) 또는 비율로서 표시될 수 있다. 특정 예에서, 상기 비율은 NAb 의 백분율을 비-NAb 의 백분율로 또는 그 반대로 나눔으로써 산출된다. 기타 예에서, 상기 비율은 NAb 의 수준을 비-NAb 의 수준으로 나누거나 또는 그 반대로 나눔으로써 산출된다.In a further embodiment, when both the neutralizing and non-neutralizing forms of the autoantibody are present in the sample, the percentages of each species may be measured by itself (e.g., 50% NAb or 50% non- (Defined as an iso-ratio of non-NAb) or as a ratio. In a particular example, the ratio is calculated by dividing the percentage of NAb by the percentage of non-NAb or vice versa. In other examples, the ratio is calculated by dividing the level of NAb by the level of non-NAb or vice versa.
일부 구현예에서, 생물제제에는 항체 (예를 들어, 항-TNFα 모노클로날 항체), 항체 단편, 단백질 (예를 들어, 사이토카인, 예컨대 인터류킨), 폴리펩티드, 펩티드, 융합 단백질, 다가 결합 단백질, 항체-약물 컨쥬게이트, 백신, 핵산, 당, 그의 재조합 형태, 그의 가공된 형태, 및 그의 조합물이 포함된다.In some embodiments, the biologics include antibodies (e.g., anti-TNFa monoclonal antibodies), antibody fragments, proteins (e.g., cytokines such as interleukins), polypeptides, peptides, fusion proteins, Antibody-drug conjugates, vaccines, nucleic acids, sugars, recombinant forms thereof, processed forms thereof, and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 생물학적 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염), 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)), 또는 암 등의 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample, for example, a whole blood, serum, or plasma sample of a subject undergoing biotherapeutic therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is an autoimmune disease (e.g., rheumatoid arthritis), an inflammatory disease (e.g., inflammatory bowel disease (IBD) such as Crohn's disease (CD) or ulcerative colitis (UC) Of the disease or disorder.
특정 구현예에서, 시료는 생물제제에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 생물학적 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the biological agent. In other embodiments, biological autologous antibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies (HAMA) as well as combinations thereof .
또 다른 측면에서, 본 발명은 하기를 포함하는, 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 생물제제와 교차-반응성인지 여부를 결정하는 방법을 제공한다:In another aspect, the invention provides a method for determining whether a neutralizing form of an autoantibody to a first biologic agent is cross-reactive with a second (i.e., different) biologic agent, comprising:
(a) 본원에서 기재된 검정에 따라 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정하여, 시료가 중화 형태의 자가항체에 대해 양성 또는 음성인지 여부를 결정함; 및(a) Detect or measure the presence, level or percentage of autoantibody in neutralization form in the sample according to the assays described herein to determine whether the sample is positive or negative for neutralizing forms of autoantibodies; And
시료가 중화 형태의 자가항체에 대해 양성인 경우, 이때:If the sample is positive for neutralizing autoantibodies, then:
(b) 시료를, 표지된 제 2 의 생물제제와 접촉시켜, 표지된 제 2 의 생물제제 및 중화 형태의 자가항체의 표지된 복합체를 형성함 (즉, 표지된 복합체의 성분은 서로 공유 결합되지 않음);(b) A sample is contacted with a labeled second biocide to form a labeled second biochemical and a labeled conjugate of an autoantibody in neutralized form (i.e., the components of the labeled conjugate are not covalently bound to each other);
(c) 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 표지된 복합체를 분리시킴 (예를 들어, 자유 표지된 제 2 의 생물제제로부터); 및(c) The labeled complex is applied to size exclusion chromatography to separate the labeled complexes (e.g., from a second biologically labeled free biocide); And
(d) 표지된 복합체를 검출하여, 이로써 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 의 생물제제와 교차-반응성인지 여부를 결정함.(d) Thereby detecting whether the neutralizing form of the autoantibody to the first biologic agent is cross-reactive with the second biological agent.
특정 구현예에서, 표지된 복합체의 존재는 제 1 의 생물제제에 대항하는 중화 자가항체가 제 2 의 생물제제와 교차-반응성이라는 것을 표시하는 것으로, 즉, 중화 자가항체는 제 1 의 생물학적 약물 및 제 2 의 생물학적 약물 양자 모두의 활성을 억제할 것이다.In certain embodiments, the presence of the labeled complex indicates that the neutralizing autoantibody against the first biological preparation is cross-reactive with the second biological agent, i.e., the neutralizing autoantibody is a first biological agent and Will inhibit the activity of both the second biological drug.
특정 기타 구현예에서, 표지된 복합체의 부재는 제 1 의 생물제제에 대항하는 중화 자가항체가 제 2 의 생물제제와 교차-반응성이 아니라는 것을 표시하는 것으로, 즉 중화 자가항체는 제 2 의 생물학적 약물의 활성을 억제하지 않을 것이다.In certain other embodiments, the absence of the labeled conjugate indicates that the neutralizing antibody against the first biological agent is not cross-reactive with the second biological agent, i.e., the neutralizing autoantibody is a second biological agent Lt; / RTI >
일부 구현예에서, 제 1 및 제 2 의 생물제제는 독립적으로 항체 (예를 들어, 항-TNFα 모노클로날 항체), 항체 단편, 단백질 (예를 들어, 사이토카인, 예컨대 인터류킨), 폴리펩티드, 펩티드, 융합 단백질, 다가 결합 단백질, 항체-약물 컨쥬게이트, 백신, 핵산, 당, 그의 재조합 형태, 그의 가공된 형태, 및 그의 조합물로 이루어진 군으로부터 선택된다.In some embodiments, the first and second biological agents are independently selected from the group consisting of an antibody (e.g., an anti-TNFa monoclonal antibody), an antibody fragment, a protein (e. G., A cytokine such as an interleukin), a polypeptide, , A fusion protein, a polyvalent binding protein, an antibody-drug conjugate, a vaccine, a nucleic acid, a sugar, a recombinant form thereof, a processed form thereof, and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 생물학적 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염), 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)), 또는 암 등의 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample, for example, a whole blood, serum, or plasma sample of a subject undergoing biotherapeutic therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is an autoimmune disease (e.g., rheumatoid arthritis), an inflammatory disease (e.g., inflammatory bowel disease (IBD) such as Crohn's disease (CD) or ulcerative colitis (UC) Of the disease or disorder.
특정 구현예에서, 시료는 생물제제에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 생물학적 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다. In certain embodiments, the sample is suspected to have or have an autoantibody to the biological agent. In other embodiments, biological autologous antibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies (HAMA) as well as combinations thereof .
특정 측면에서, 본 발명의 검정법은 시료를 표지된 생물제제 및 표지된 생물학적 결합 부분과 접촉하기 이전, 동안 및/또는 이후에, 상기 시료를 산과 접촉하는 것을 포함하는 산 해리 단계를 추가로 포함한다.In certain aspects, the assay of the present invention further comprises an acid dissociation step comprising contacting the sample with an acid before, during and / or after contacting the labeled biological agent and the labeled biological binding moiety .
특정 기타 측면에서, 본 발명의 검정법은 시료 내 생물제제에 대한 중화 및/또는 비-중화 형태의 자가항체의 하나 이상의 아형의 존재 또는 수준을 검출하는 것을 포함한다.In certain other aspects, the assays of the invention include detecting the presence or level of one or more subtypes of autoantibodies in the neutralized and / or non-neutralized form of the biological agent in the sample.
한 특정 측면에서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출하는 방법을 제공한다:In one aspect, the invention provides a method of detecting the presence of an autoantibody in the form of a neutralized and / or non-neutralized form of an anti-TNF [alpha] drug in a sample,
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) (I.e., the components of the first labeled complex are not covalently bonded to each other); the first labeled complex (i.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody; And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα 및 자가 항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음);(ii) a labeled anti-drug -TNFα, a labeled complex of the labeled second and TNFα autoantibodies (i. e., immune-complex or conjugate) (in other words, the component of the labeled conjugate of the second share is not in combination with each other );
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them to free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug and / or labeled anti -TNFa < / RTI > drug and a labeled TNFa complex;
(c) 자유 표지된 TNFα 의 수준을 크기 배제 크로마토그래피 이후 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) The level of free labeled TNF [alpha] was measured after size exclusion chromatography (for example, by measuring the area under the curve of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC) (AUC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교해 (예를 들어, 오로지 자유 표지된 TNFα 만을 함유하는 기준 시료의 SEC 후, 자유 표지된 TNFα 피크의 AUC 를 측정하는 것에 의함), 이로써 중화 및/또는 비-중화 형태의 자가항체의 존재를 검출함.(d) The level of the free labeled TNF [alpha] measured in step (c) is compared to the level of free labeled TNF [alpha] in the control sample (e.g., after SEC of a reference sample containing only free TNFa, , Thereby detecting the presence of autoantibodies in the neutralized and / or non-neutralized form.
일부 구현예에서, 중화 형태의 자가항체는 항-TNFα 약물과 TNFα 간 결합을 방해한다. 기타 구현예에서, 비-중화 형태의 자가항체는 항-TNFα 약물과 TNFα 간 결합을 방해하지 않는다.In some embodiments, autoantibodies in neutralized form inhibit binding between anti-TNF [alpha] drug and TNF [alpha]. In other embodiments, autoantibodies in the non-neutralizing form do not interfere with the binding between the anti-TNF [alpha] drug and TNF [alpha].
일부 예에서, 자유 표지된 TNFα 는 결합된 항-TNFα 약물 (예를 들어, 표지된 및/또는 비표지된 항-TNFα 약물) 이 실질적으로 부재한 표지된 TNFα 로 이루어진다.In some instances, the free labeled TNFa consists of a labeled TNFa substantially absent of the bound anti-TNF [alpha] drug (e.g., labeled and / or unlabeled anti-TNFa drug).
특정 구현예에서, 중화 형태의 자가항체는 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준이 대조군 시료 내 자유 표지된 TNFα 의 수준과 동일하거나 또는 실질적으로 동일한 경우에 검출된다. 특정 기타 구현예에서, 비-중화 형태의 자가항체는 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준이 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교시 감소 (예를 들어, 실질적으로 감소) 되거나, 또는 부재인 (예를 들어, 검출되지 않음) 경우에 검출된다.In certain embodiments, the autoantibody in neutralized form is detected when the level of free labeled TNF [alpha] measured in step (c) is the same or substantially the same as the level of free labeled TNF [alpha] in the control sample. In certain other embodiments, the autoantibody of the non-neutralizing form has a reduced (e.g., substantially reduced) level of free labeled TNF [alpha] measured in step (c) compared to the level of free labeled TNF [ Or is absent (e.g., not detected).
특정 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은, 이것이 대조군 시료에서 측정된 자유 표지된 TNFα 수준의 적어도 약 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 인 경우에, 대조군 시료 내 자유 표지된 TNFα 수준과 실질적으로 동일한 것으로 고려된다. 특정 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은, 이것이 대조군 시료 내 측정된 자유 표지된 TNFα 의 수준보다 적어도 약 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 또는 95% 미만인 수준인 경우, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교시 실질적으로 감소된 것으로 고려된다.In certain embodiments, the level of free labeled TNF [alpha] measured in step (c) is at least about 70%, 75%, 80%, 81%, 82%, 83% 97%, 98%, 99%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96% , It is considered to be substantially equal to the level of free labeled TNF [alpha] in the control sample. In certain embodiments, the level of the free labeled TNF [alpha] measured in step (c) is at least about 50%, 55%, 60%, 65%, 70%, or more than the level of the free labeled TNF [ , 75%, 80%, 85%, 90%, or 95%, is considered to be substantially reduced when compared to the level of free labeled TNF [alpha] in the control sample.
특정 구현예에서, 자유 표지된 TNFα 의 수준은 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다.In certain embodiments, the level of free labeled TNF [alpha] is determined by integrating the area under the curve (AUC) of the free labeled TNF [alpha] peak from a plot of signal intensity as a function of elution time from size exclusion chromatography (e.g., SEC- .
일부 구현예에서, 항-TNFα 약물은 REMICADE™ (인플릭시마브), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무마브), CIMZIA® (세르톨리주마브 페골), SIMPONI® (골리무마브; CNTO 148), 및 그의 조합물로 이루어진 군으로부터 선택된다.In some embodiments, the anti-TNF [alpha] drug is selected from the group consisting of REMICADE ™ (Infliximab), ENBREL ™ (etanercept), HUMIRA ™ (adalimumab), CIMZIA® (sertoli marbella), SIMPONI Muramov; CNTO 148), and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 항-TNFα 약물 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)) 등의 TNFα-매개성 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample of a subject receiving a whole blood, serum, or plasma sample, for example, an anti-TNFa drug therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a mammal such as a human, a human, a human, a human, a human, a human, a human, a human, a human, a human, Mediated diseases or disorders.
특정 구현예에서, 시료는 항-TNFα 약물에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 항-TNFα 약물 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the anti-TNF [alpha] drug. In other embodiments, anti-TNF alpha drug autoantibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies .
또 다른 특정 측면에서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정하는 방법을 제공한다:In another particular aspect, the invention provides a method for determining the level or percentage of autoantibodies in neutralization form to an anti-TNF [alpha] drug in a sample, comprising:
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) (I.e., the components of the first labeled complex are not covalently bonded to each other); the first labeled complex (i.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody; And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα 및 자가항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); (ii) (I.e., the components of the second labeled complex are not covalently linked to each other); the second labeled complex of the labeled anti-TNF [alpha] drug, labeled TNF [alpha] and autoantibody (i.e., the immunoconjugate or conjugate);
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용해 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물, 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리함;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them into free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug, and / or labeled anti -TNFa < / RTI > drug and a labeled TNFa complex;
(c) 크기 배제 크로마토그래피 이후 자유 표지된 TNFα 의 수준을 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) Following the size exclusion chromatography, the level of free labeled TNF [alpha] is determined (e.g., by measuring the area under the curve (TNF [alpha]) of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율과 비교함 (예를 들어, 오로지 자유 표지된 TNFα 만을 함유하는 기준 시료의 SEC 후 자유 표지된 TNFα 피크의 AUC 를 측정 및 정규화하여 자유 표지된 TNFα 의 수준 또는 백분율을 산출하는 것에 의함), 이때, 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율은 중화 형태의 자가항체의 수준 또는 백분율에 상응함.(d) The level of free labeled TNF [alpha] measured in step (c) is compared to the normalized level or percentage of free labeled TNF [alpha] in the control sample (e.g., after SEC of a reference sample containing only free TNF [alpha] Measuring or normalizing the AUC of the labeled TNF [alpha] peak to yield the level or percentage of free labeled TNF [alpha]), wherein the normalized level or percentage of free labeled TNF [alpha] in the control sample is the level of autoantibody in neutralization form Corresponds to the percentage.
일부 구현예에서, 대조군 시료 내 자유 표지된 TNFα 의 정규화된 수준 또는 백분율과 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준간 차이는 비-중화 형태의 자가항체의 수준 또는 백분율에 상응한다.In some embodiments, the difference between the normalized level or percentage of free labeled TNF [alpha] in the control sample and the level of free labeled TNF [alpha] measured in step (c) corresponds to the level or percentage of the autoantibody in the non-neutralized form.
일부 예에서, 자유 표지된 TNFα 는 결합된 항-TNFα 약물 (예를 들어, 표지된 및/또는 비표지된 항-TNFα 약물) 이 실질적으로 부재인 표지된 TNFα 로 이루어진다.In some instances, the free labeled TNFa consists of a labeled TNFa substantially absent of the bound anti-TNF [alpha] drug (e.g., labeled and / or unlabeled anti-TNFa drug).
특정 구현예에서, 대조군 시료 내 자유 표지된 TNFα 의 수준 또는 백분율은 표지된 항-TNFα 약물과 표지된 TNFα 사이에서 형성된 복합체 (예를 들어, "표지된 복합체") 의 피크 면적을 측정하고 (예를 들어, AUC 측정에 의함), 이후, 표지된 복합체의 측정된 피크 면적을, 자유 표지된 TNFα 의 피크 면적 (예를 들어, 자유 표지된 TNFα 피크의 AUC 를 측정하는 것에 의함) 에서 차감함으로써 정규화된다.In certain embodiments, the level or percentage of free labeled TNF [alpha] in the control sample is determined by measuring the peak area of the complex formed (e. G., The labeled complex) between the labeled anti-TNFa drug and the labeled TNFa (For example, by measuring the AUC of the free labeled TNF [alpha] peak), and then subtracting the measured peak area of the labeled complexes from the peak area of the free labeled TNF [alpha] do.
특정 구현예에서, 자유 표지된 자유 표지된 TNFα 의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다. 기타 구현예에서, 표지된 항-TNFα 약물과 표지된 TNFα 사이에서 형성된 복합체의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 TNFα 피크의 AUC 를 적분함으로써 측정된다.In certain embodiments, the level of the free labeled TNF [alpha] labeled is determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e.g., SEC-HPLC), the area under the curve of the free labeled TNF [ AUC). In other embodiments, the level of complex formed between the labeled anti-TNF [alpha] drug and the labeled TNF [alpha] is determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e.g., SEC- RTI ID = 0.0 > TNFa < / RTI >
특정 구현예에서, 항-TNFα 약물에 대한 자가항체 (예를 들어, ADA) 의 부분 모집단은 중화 형태의 자가항체 (예를 들어, NAb) 이다. 일부 구현예에서, 시료 내 항-TNFα 약물에 대한 자가항체의 총 수준은, 본 발명의 방법에 따라 측정된, 중화 형태의 자가항체의 수준 및 비-중화 형태의 자가항체의 수준을 모두 더함으로써 산출될 수 있다.In certain embodiments, the partial population of autoantibodies (e.g., ADA) to an anti-TNF [alpha] drug is an autoantibody in neutralization form (e.g., NAb). In some embodiments, the total level of autoantibody to the anti-TNF [alpha] drug in the sample is increased by adding both the level of autoantibody in neutralized form and the level of autoantibody in non-neutralized form, measured according to the methods of the invention Can be calculated.
일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은, 음성 대조군, 양성 대조군 또는 그의 조합물과 추가로 비교된다. 음성 대조군의 비제한적인 예에는, 마우스 모노클로날 항-인간 IgG1 Fc 시료 및/또는 토끼 모노클로날 항-인간 IgG1 Fc 시료가 포함된다. 양성 대조군의 비제한적인 예에는 항-TNFα 약물의 F(ab')2 단편에 대한 토끼 폴리클로날성 항체의 시료 및/또는 풀링된 (pooled) ADA-양성 환자 혈청 시료가 포함된다.In some embodiments, the level of free labeled TNF [alpha] measured in step (c) is further compared with a negative control, a positive control, or a combination thereof. Non-limiting examples of negative controls include mouse monoclonal anti-human IgG 1 Fc samples and / or rabbit monoclonal anti-human IgG 1 Fc samples. Non-limiting examples of positive controls include samples of rabbit polyclonal antibody to the F (ab ') 2 fragment of the anti-TNFa drug and / or serum samples of pooled ADA-positive patients.
추가 구현예에서, 단계 (d) 에서 측정된 중화 형태의 자가항체 (예를 들어, NAb) 의 백분율은 건강한 대조군 (예를 들어, 정상 인간 혈청) 으로부터 확립된 컷오프 값 또는 기준 범위와 비교된다. 특정 구현예에서, 컷오프 값 또는 기준 범위는 시료가 NAb 에 대해 양성인 것으로 고려되기 위해 반드시 가져야 하는 NAb 의 역치 백분율로서 표시된다. 이러한 구현예에서, 시료는, 단계 (d) 에서 측정된 NAb 의 백분율이 건강한 대조군에서 확립된 컷오프 값 또는 기준 범위 이상인 경우, NAb 에 대해 양성이다. 다른 구현예에서, 시료는, 단계 (d) 에서 측정된 NAb 의 백분율이 건강한 대조군에서 확립된 컷오프 값 또는 기준 범위 미만인 경우, NAb 에 대해 음성이다. 컷오프 값 또는 기준 범위의 비제한적인 예에는, 예를 들어 적어도 약 0.25%, 0.50%, 0.75%, 1.00%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80%, 2.90%, 3.00%, 3.01%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, 또는 그 내부의 임의의 범위가 포함된다. 일부 구현예에서, 컷오프 값 또는 기준 범위는 약 3.00% NAb 또는 약 3.06% NAb 또는 약 3.00%-3.10% NAb 사이이다. In a further embodiment, the percentage of neutralizing form of autoantibodies (e.g., NAb) determined in step (d) is compared to a cutoff value or reference range established from a healthy control (e.g., normal human serum). In certain embodiments, the cutoff value or reference range is expressed as a percentage threshold of NAb that the sample must have to be considered positive for NAb. In this embodiment, the sample is positive for NAb when the percentage of NAb measured in step (d) is greater than or equal to a cutoff value established in a healthy control. In another embodiment, the sample is negative for NAb when the percentage of NAb measured in step (d) is below the cutoff value or reference range established in a healthy control. Non-limiting examples of cutoff values or reference ranges include, for example, at least about 0.25%, 0.50%, 0.75%, 1.00%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80% 3.00, 3.01, 3.02, 3.03, 3.04, 3.05, 3.06, 3.07, 3.08, 3.09, 3.10, 3.20, 3.30, 3.40, 3.50, 4.00, 4.50% , 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb or any range therein. In some embodiments, the cutoff value or reference range is between about 3.00% NAb or about 3.06% NAb or between about 3.00% and -3.10% NAb.
일부 구현예에서, 항-TNFα 약물에 대한 자가항체 모두는 중화 항체이고, 시료는 100% 중화 항-약물 항체 (NAb) 및/또는 0% 비-중화 항-약물 항체 (비-NAb) 를 갖는 것으로서 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은 일반적으로, 대조군 시료 내 자유 표지된 TNFα 의 수준과 동일하고, 자가항체는 항-TNFα 약물과 TNFα 간 결합을 완전히 차단 또는 방해하는 것으로 예측된다.In some embodiments, all autoantibodies to the anti-TNF [alpha] drug are neutralizing antibodies, and the sample comprises 100% neutralizing anti-drug antibody (NAb) and / or 0% non-neutralizing anti- drug antibody . In these embodiments, the level of free labeled TNF [alpha] measured in step (c) is generally equal to the level of the free labeled TNF [alpha] in the control sample, and the autoantibody completely blocks or inhibits binding between the anti- TNF [alpha] It is predicted to interfere.
특정 기타 구현예에서, 항-TNFα 약물에 대한 자가항체의 어떤 것도 중화 항체가 아니며, 시료는 100% 비-NAb 및/또는 0% NAb 를 갖는 것으로 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은 일반적으로 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교시 부재이고 (예를 들어, 검출불가능함), 자가항체는 항-TNFα 약물과 TNFα 간 결합을 완전히 차단 또는 방해하는 것은 아닌 것으로 예측된다.In certain other embodiments, none of the autoantibodies to the anti-TNFa drug are neutralizing antibodies, and the sample is defined as having 100% non-NAb and / or 0% NAb. In these embodiments, the level of free labeled TNF [alpha] measured in step (c) is generally non-existent (e.g., undetectable) compared to the level of free labeled TNF [alpha] in the control sample, It is not expected to completely block or interfere with the binding between the TNF [alpha] drug and TNF [alpha].
추가의 구현예에서, 중화 및 비-중화 형태의 자가항체 양자 모두가 시료 내 존재하는 경우, 각 종류의 백분율은 그 자체 단독으로 (예를 들어, 50% NAb 또는 50% 비-NAb 는 시료 내 NAb 및 비-NAb 의 등비로서 정의됨) 또는 비율로서 표시될 수 있다. 특정 예에서, 상기 비율은 NAb 의 백분율을 비-NAb 의 백분율로 또는 그 반대로 나눔으로써 산출된다. 기타 예에서, 상기 비율은 NAb 의 수준을 비-NAb 의 수준으로 나누거나 또는 그 반대로 나눔으로써 산출된다.In a further embodiment, if both the neutralizing and non-neutralizing forms of the autoantibody are present in the sample, the percentages of each species may be used alone (e.g., 50% NAb or 50% non- NAb and non-NAb) or as a ratio. In a particular example, the ratio is calculated by dividing the percentage of NAb by the percentage of non-NAb or vice versa. In other examples, the ratio is calculated by dividing the level of NAb by the level of non-NAb or vice versa.
일부 구현예에서, 항-TNFα 약물은 REMICADE™ (인플릭시마브), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무마브), CIMZIA® (세르톨리주마브 페골), SIMPONI® (골리무마브; CNTO 148), 및 그의 조합물로 이루어진 군으로부터 선택된다.In some embodiments, the anti-TNF [alpha] drug is selected from the group consisting of REMICADE ™ (Infliximab), ENBREL ™ (etanercept), HUMIRA ™ (adalimumab), CIMZIA® (sertoli marbella), SIMPONI Muramov; CNTO 148), and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 항-TNFα 약물 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)) 등의 TNFα-매개성 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample of a subject receiving a whole blood, serum, or plasma sample, for example, an anti-TNFa drug therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a mammal such as a human, a human, a human, a human, a human, a human, a human, a human, a human, a human, Mediated diseases or disorders.
특정 구현예에서, 시료는 항-TNFα 약물에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 항-TNFα 약물 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the anti-TNF [alpha] drug. In other embodiments, anti-TNF alpha drug autoantibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies .
또 다른 특정 측면에서, 본 발명은 하기를 포함하는, 시료 내 항-TNFα 약물에 대한 중화 형태의 자가항체의 백분율 또는 수준을 측정하는 방법을 제공한다:In another particular aspect, the invention provides a method of determining the percentage or level of autoantibody in neutralized form to an anti-TNF [alpha] drug in a sample, comprising:
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:(a) A sample is contacted with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 1 의 표지된 복합체의 성분은 서로 공유 결합되지 않음); 및/또는 (i) (I.e., the components of the first labeled complex are not covalently bonded to each other); the first labeled complex (i.e., the immunoconjugate or conjugate) of the labeled anti-TNF [alpha] drug and autoantibody; And / or
(ii) 표지된 항-TNFα 약물, 표지된 TNFα 및 자가 항체의 제 2 의 표지된 복합체 (즉, 면역-복합체 또는 컨쥬게이트) (즉, 제 2 의 표지된 복합체의 성분은 서로 공유 결합되지 않음);(ii) a labeled anti-drug -TNFα, a labeled complex of the labeled second and TNFα autoantibodies (i. e., immune-complex or conjugate) (in other words, the component of the labeled conjugate of the second share is not in combination with each other );
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 (즉, 비결합된) 표지된 TNFα, 자유 표지된 항-TNFα 약물 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;(b) The first labeled complex and / or the second labeled complex can be applied to size exclusion chromatography to convert them to free (i.e., unbound) labeled TNF ?, free labeled anti-TNF? Drug and / or labeled anti -TNFa < / RTI > drug and a labeled TNFa complex;
(c) 자유 표지된 TNFα 의 수준을 크기 배제 크로마토그래피 이후 측정함 (예를 들어, 크기 배제 크로마토그래피 (SEC) 후 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 측정하는 것에 의함); 및(c) The level of free labeled TNF [alpha] was measured after size exclusion chromatography (for example, by measuring the area under the curve of the free labeled TNF [alpha] peak after size exclusion chromatography (SEC) (AUC)); And
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교해 (예를 들어, 기준 시료의 SEC 후, 자유 표지된 TNFα 의 AUC 를 측정하는 것에 의함), 이로써 중화 형태의 자가항체의 백분율 또는 수준을 측정함.(d) The level of free labeled TNF [alpha] measured in step (c) is compared to the level of free labeled TNF [alpha] in the control sample (for example, by measuring the AUC of free labeled TNFa after SEC of the reference sample) This measures the percentage or level of neutralizing autoantibodies.
일부 구현예에서, 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 은 시료 (예를 들어 환자로부터의) 및 대조군 시료에 대해 산출된다. 특정 구현예에서, 표지된 항-TNFα 약물은 표지된 TNFα 에 결합하며 검정 신호를 감소시킨다 (예를 들어, 대조군 시료의 자유 표지된 TNFα 피크의 AUC 와 비교시 시료의 자유 표지된 TNFα 피크의 AUC 를 감소시킴). 다른 구현예에서, 중화 형태의 자가항체 (NAb) 는 표지된 항-TNFα 약물을 중화시키며 검정 신호를 회복시킨다 (예를 들어, 시료의 자유 표지된 TNFα 피크의 AUC 를 대조군 시료의 자유 표지된 TNFα 피크의 AUC 와 비교가능한 수준으로 복원 또는 회복시킴). 일부 구현예에서, NAb 활성은 측정된 검정 신호에 직접적으로 비례한다. 특정 구현예에서, 시료 내 NAb 백분율은 검정 신호의 회복 백분율과 동등하다. 특정한 예에서, NAb 백분율은 시료의 자유 표지된 TNFα 피크의 AUC 대 대조군 시료의 자유 표지된 TNFα 피크의 AUC 의 비율로서 산출된다. 제한이 없는 예로서, NAb 백분율은 하기 식에 따라 산출된다: 회복 % = (시료의 자유 표지된 TNFαAUC - BKGD)/(대조군 시료의 자유 표지된 TNFαAUC - BKGD)*100. In some embodiments, the under-curve area (AUC) of the free labeled TNF [alpha] peak is calculated for a sample (e.g., from a patient) and a control sample. In certain embodiments, the labeled anti-TNF [alpha] drug binds to the labeled TNF [alpha] and decreases the assay signal (e.g., the AUC of the free labeled TNF [alpha] peak of the sample as compared to the AUC of the free labeled TNF [ . In another embodiment, the neutralizing form of the autoantibody (NAb) neutralizes the labeled anti-TNFα drug and restores the assay signal (eg, the AUC of the free labeled TNFα peak of the sample is compared to the free labeled TNFα Restoring or recovering to a level comparable to the AUC of the peak). In some embodiments, the NAb activity is directly proportional to the measured assay signal. In certain embodiments, the percentage of NAb in the sample is equivalent to the recovery percentage of the black signal. In a particular example, the percentage of NAb is calculated as the ratio of the AUC of the free labeled TNF [alpha] peak of the sample to the AUC of the free labeled TNF [alpha] peak of the control sample. As a non-limiting example, the percentage of NAb is calculated according to the following equation:% Recovery = (Free labeled TNFα AUC -BKGD of sample) / (Free labeled TNFα AUC -BKGD of control sample) * 100.
일부 예에서, 자유 표지된 TNFα 는 결합된 항-TNFα 약물 (예를 들어, 표지 및/또는 비표지된 항-TNFα 약물) 이 실질적으로 없는 표지된 TNFα 로 이루어진다. In some instances, the free labeled TNFa consists of a labeled TNFa substantially free of bound anti-TNF [alpha] drug (e.g., a label and / or unlabeled anti-TNFa drug).
특정 구현예에서, 자유 표지된 TNFα 의 수준은 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터의 용출 시간의 함수로서, 신호 강도의 플롯으로부터 자유 표지된 TNFα 피크의 곡선하 면적 (AUC) 을 적분함으로써 측정된다. 기타 구현예에서, 표지된 항-TNFα 약물과 표지된 TNFα 사이에서 형성된 복합체의 수준은, 크기 배제 크로마토그래피 (예를 들어, SEC-HPLC) 로부터 용출 시간의 함수로서 신호 강도의 플롯으로부터 자유 표지된 TNFα 피크의 AUC 를 적분함으로써 측정된다. In certain embodiments, the level of the free labeled TNF [alpha] is measured as a function of elution time from size exclusion chromatography (e.g., SEC-HPLC) . In other embodiments, the level of complex formed between the labeled anti-TNF [alpha] drug and the labeled TNF [alpha] is determined from a plot of signal intensity as a function of elution time from size exclusion chromatography (e.g., SEC- RTI ID = 0.0 > TNFa < / RTI >
특정 구현예에서, 항-TNFα 약물에 대한 자가항체 (예를 들어, ADA) 의 부분 모집단은 중화 형태의 자가항체 (예를 들어, NAb) 이다. 일부 구현예에서, 시료 내 항-TNFα 약물에 대한 자가항체의 총 수준은, 본 발명의 방법에 따라 측정된, 중화 형태의 자가항체의 수준 및 비-중화 형태의 자가항체의 수준을 모두 더함으로써 산출될 수 있다. 특정 구현예에서, 중화 형태의 자가항체는 중화 자가항체 및 비-중화 자가항체 모두를 포함하는 자가항체의 모집단에서 존재한다.In certain embodiments, the partial population of autoantibodies (e.g., ADA) to an anti-TNF [alpha] drug is an autoantibody in neutralization form (e.g., NAb). In some embodiments, the total level of autoantibody to the anti-TNF [alpha] drug in the sample is increased by adding both the level of autoantibody in neutralized form and the level of autoantibody in non-neutralized form, measured according to the methods of the invention Can be calculated. In certain embodiments, autoantibodies in neutralized form are present in a population of autoantibodies in which both neutralizing autoantibodies and non-neutralizing autoantibodies are included.
일부 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은, 음성 대조군, 양성 대조군 또는 그의 조합물과 추가로 비교된다. 음성 대조군의 비제한적인 예에는, 마우스 모노클로날 항-인간 IgG1 Fc 시료 및/또는 토끼 모노클로날 항-인간 IgG1 Fc 시료가 포함된다. 양성 대조군의 비제한적인 예에는 항-TNFα 약물의 F(ab')2 단편에 대한 토끼 폴리클로날성 항체의 시료 및/또는 풀링된 (pooled) ADA-양성 환자 혈청 시료가 포함된다.In some embodiments, the level of free labeled TNF [alpha] measured in step (c) is further compared with a negative control, a positive control, or a combination thereof. Non-limiting examples of negative controls include mouse monoclonal anti-human IgG 1 Fc samples and / or rabbit monoclonal anti-human IgG 1 Fc samples. Non-limiting examples of positive controls include samples of rabbit polyclonal antibody to the F (ab ') 2 fragment of the anti-TNFa drug and / or serum samples of pooled ADA-positive patients.
추가 구현예에서, 단계 (d) 에서 측정된 중화 형태의 자가항체 (예를 들어, NAb) 의 백분율은 예를 들어 자가항체에 대해 낮은 양성을 갖는 시료로부터 확립된 컷오프 값 또는 기준 범위와 비교된다. 특정 구현예에서, 컷오프 값 또는 기준 범위는 시료가 NAb 에 대해 양성인 것으로 고려되기 위해 반드시 가져야 하는 NAb 의 역치 백분율로서 표시된다. 이러한 구현예에서, 시료는, 단계 (d) 에서 측정된 NAb 의 백분율이 건강한 대조군에서 확립된 컷오프 값 또는 기준 범위 초과 (또는 동일) 인 경우, NAb 에 대해 양성이다. 다른 구현예에서, 시료는, 단계 (d) 에서 측정된 NAb 의 백분율이 확립된 컷오프 값 또는 기준 범위 미만 (또는 동일) 인 경우, NAb 에 대해 음성이다. 컷오프 값 또는 기준 범위의 비제한적인 예에는, 예를 들어 적어도 약 0.10%, 0.20%, 0.30%, 0.40%, 0.50%, 0.60%, 0.70%, 0.80%, 0.90%, 1.00%, 1.10%, 1.15%, 1.20%, 1.21%, 1.22%, 1.23%, 1.24%, 1.25%, 1.26%, 1.27%, 1.28%, 1.29%, 1.30%, 1.40%, 1.50%, 2.00%, 2.50%, 2.60%, 2.70%, 2.80%, 2.90%, 3.00%, 3.01%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30%, 3.40%, 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% NAb, 또는 그 내부의 임의의 범위가 포함된다. 일부 예에서, 컷오프 값 또는 기준 범위는 약 1.28% NAb 또는 약 1.25%-1.30% NAb 사이이다. In a further embodiment, the percentage of neutralizing forms of autoantibodies (e.g., NAb) determined in step (d) is compared to a cutoff value or reference range established, for example, from a sample having a low positive for autoantibodies . In certain embodiments, the cutoff value or reference range is expressed as a percentage threshold of NAb that the sample must have to be considered positive for NAb. In this embodiment, the sample is positive for NAb if the percentage of NAb measured in step (d) is greater than or equal to the cutoff value established in a healthy control. In another embodiment, the sample is negative with respect to NAb if the percentage of NAb measured in step (d) is less than or equal to the established cutoff value. Non-limiting examples of cutoff values or reference ranges include, for example, at least about 0.10%, 0.20%, 0.30%, 0.40%, 0.50%, 0.60%, 0.70%, 0.80%, 0.90%, 1.00% 1.30%, 1.20%, 1.21%, 1.22%, 1.23%, 1.24%, 1.25%, 1.26%, 1.27%, 1.28%, 1.29%, 1.30%, 1.40%, 1.50%, 2.00%, 2.50% , 2.70%, 2.80%, 2.90%, 3.00%, 3.01%, 3.02%, 3.03%, 3.04%, 3.05%, 3.06%, 3.07%, 3.08%, 3.09%, 3.10%, 3.20%, 3.30% %, 3.50%, 4.00%, 4.50%, 5.00%, 5.50%, 6.00%, 6.50%, 7.00%, 7.50%, 8.00%, 8.50%, 9.00%, 9.50%, 10.00% ≪ / RTI > In some examples, the cutoff value or reference range is between about 1.28% NAb or about 1.25% -1.30% NAb.
일부 구현예에서, 항-TNFα 약물에 대한 자가항체 모두는 중화 항체이고, 시료는 100% 중화 항-약물 항체 (NAb) 및/또는 0% 비-중화 항-약물 항체 (비-NAb) 를 갖는 것으로서 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은 일반적으로, 대조군 시료 내 자유 표지된 TNFα 의 수준과 동일하고, 자가항체는 항-TNFα 약물과 TNFα 간 결합을 완전히 차단 또는 방해하는 것으로 예측된다.In some embodiments, all autoantibodies to the anti-TNF [alpha] drug are neutralizing antibodies, and the sample comprises 100% neutralizing anti-drug antibody (NAb) and / or 0% non-neutralizing anti- drug antibody . In these embodiments, the level of free labeled TNF [alpha] measured in step (c) is generally equal to the level of the free labeled TNF [alpha] in the control sample, and the autoantibody completely blocks or inhibits binding between the anti- TNF [alpha] It is predicted to interfere.
특정 기타 구현예에서, 항-TNFα 약물에 대한 자가항체의 어떤 것도 중화 항체가 아니며, 시료는 100% 비-NAb 및/또는 0% NAb 를 갖는 것으로 정의된다. 이들 구현예에서, 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준은 일반적으로 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교시 부재이고 (예를 들어, 검출불가능함), 자가항체는 항-TNFα 약물과 TNFα 간 결합을 완전히 차단 또는 방해하는 것은 아닌 것으로 예측된다.In certain other embodiments, none of the autoantibodies to the anti-TNFa drug are neutralizing antibodies, and the sample is defined as having 100% non-NAb and / or 0% NAb. In these embodiments, the level of free labeled TNF [alpha] measured in step (c) is generally non-existent (e.g., undetectable) compared to the level of free labeled TNF [alpha] in the control sample, It is not expected to completely block or interfere with the binding between the TNF [alpha] drug and TNF [alpha].
추가의 구현예에서, 중화 및 비-중화 형태의 자가항체 양자 모두가 시료 내 존재하는 경우, 각 종류의 백분율은 그 자체 단독으로 (예를 들어, 50% NAb 또는 50% 비-NAb 는 시료 내 NAb 및 비-NAb 의 등비로서 정의됨) 또는 비율로서 표시될 수 있다. 특정한 예에서, 상기 비율은 NAb 의 백분율을 비-NAb 의 백분율로 또는 그 반대로 나눔으로써 산출된다. 기타 예에서, 상기 비율은 NAb 의 수준을 비-NAb 의 수준으로 나누거나 또는 그 반대로 나눔으로써 산출된다.In a further embodiment, if both the neutralizing and non-neutralizing forms of the autoantibody are present in the sample, the percentages of each species may be used alone (e.g., 50% NAb or 50% non- NAb and non-NAb) or as a ratio. In a particular example, the ratio is calculated by dividing the percentage of NAb by the percentage of non-NAb or vice versa. In other examples, the ratio is calculated by dividing the level of NAb by the level of non-NAb or vice versa.
일부 구현예에서, 항-TNFα 약물은 REMICADE™ (인플릭시마브), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무마브), CIMZIA® (세르톨리주마브 페골), SIMPONI® (골리무마브; CNTO 148), 및 그의 조합물로 이루어진 군으로부터 선택된다.In some embodiments, the anti-TNF [alpha] drug is selected from the group consisting of REMICADE ™ (Infliximab), ENBREL ™ (etanercept), HUMIRA ™ (adalimumab), CIMZIA® (sertoli marbella), SIMPONI Muramov; CNTO 148), and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 항-TNFα 약물 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)) 등의 TNFα-매개성 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample of a subject receiving a whole blood, serum, or plasma sample, for example, an anti-TNFa drug therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a mammal such as a human, a human, a human, a human, a human, a human, a human, a human, a human, a human, Mediated diseases or disorders.
특정 구현예에서, 시료는 항-TNFα 약물에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 항-TNFα 약물 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the anti-TNF [alpha] drug. In other embodiments, anti-TNF alpha drug autoantibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies .
또 다른 특정 측면에서, 본 발명은 하기를 포함하는 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 (즉, 상이한) 항-TNFα 약물과 교차-반응성인지 여부를 결정하는 방법을 제공한다:In another particular aspect, the invention provides a method of determining whether an autoantibody of neutralization form to a first anti-TNF alpha drug comprises cross-reactivity with a second (i.e., different) anti-TNF alpha drug, Lt; / RTI >
(a) 본원에서 기재된 검정에 따라 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정해 중화 형태의 자가항체에 대해 시료가 양성 또는 음성인지 여부를 결정함; 및(a) Detecting or measuring the presence, level or percentage of autoantibody in neutralization form in the sample according to the assays described herein to determine whether the sample is positive or negative for autoantibodies in neutralized form; And
시료가 중화 형태의 자가항체에 대해 양성인 경우, 이때:If the sample is positive for neutralizing autoantibodies, then:
(b) 시료를, 표지된 제 2 의 항-TNFα 약물과 접촉시켜, 표지된 제 2 의 항-TNFα 약물 및 중화 형태의 자가항체의 표지된 복합체를 형성함 (즉, 표지된 복합체의 성분은 서로 공유 결합되지 않음);(b) A sample is contacted with a labeled second anti-TNF alpha drug to form a labeled second anti-TNF alpha drug and a labeled conjugate of an autoantibody in neutralized form (i.e., Not);
(c) 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 표지된 복합체를 분리시킴 (예를 들어, 자유 표지된 제 2 의 항-TNFα 약물로부터); 및(c) The labeled complex is applied to size exclusion chromatography to separate the labeled complexes (e.g., from a second labeled anti-TNFα drug); And
(d) 표지된 복합체를 검출시켜, 이로써 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 항-TNFα 약물와 교차-반응성인지 여부를 결정함.(d) Labeled conjugate, thereby determining whether the neutralizing form of the autoantibody to the first anti-TNF [alpha] drug is cross-reactive with the second anti-TNF [alpha] drug.
특정 구현예에서, 표지된 복합체의 존재는 제 1 의 항-TNFα 약물에 대항하는 중화 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성이라는 것을 표시하는 것으로, 즉 중화 자가항체는 제 1 의 항-TNFα 약물 및 제 2 의 항-TNFα 약물 양자 모두의 활성을 억제할 것이다.In certain embodiments, the presence of the labeled complex indicates that the neutralizing autoantibody against the first anti-TNF alpha drug is cross-reactive with the second anti-TNF alpha drug, that is, the neutralizing autoantibody is the first Will inhibit the activity of both the anti-TNF [alpha] drug and the second anti-TNF [alpha] drug.
특정 기타 구현예에서, 표지된 복합체의 부재는 제 1 의 항-TNFα 약물에 대항하는 중화 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성이 아니라는 것을 표시하는 것으로, 즉 중화 자가항체는 제 2 의 항-TNFα 약물의 활성을 억제하지 않을 것이다.In certain other embodiments, the absence of the labeled complex indicates that the neutralizing autoantibody against the first anti-TNF alpha drug is not cross-reactive with the second anti-TNF alpha drug, i.e., 2 < / RTI > anti-TNFa drug.
특정 구현예에서, 제 1 및 제 2 의 항-TNFα 약물은 독립적으로 REMICADE™ (인플릭시마브), ENBREL™ (에타네르셉트), HUMIRA™ (아달리무마브), CIMZIA® (세르톨리주마브 페골), SIMPONI® (골리무마브; CNTO 148), 및 그의 조합물로 이루어진 군으로부터 선택된다.In certain embodiments, the first and second anti-TNFa drugs are independently selected from the group consisting of REMICADE ™ (infliximab), ENBREL ™ (etanercept), HUMIRA ™ (adalimumab), CIMZIA® ≪ / RTI > Marbella), SIMPONI® (colloidal mab; CNTO 148), and combinations thereof.
기타 구현예에서, 시료는 전혈, 혈청 또는 혈장 시료, 예를 들어 항-TNFα 약물 치료요법을 받는 대상체의 전혈, 혈청 또는 혈장 시료이다. 바람직한 구현예에서, 시료는 혈청이다. 특정 구현예에서, 대상체는 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장질환 (IBD), 예컨대 크론병 (CD) 또는 궤양대장염 (UC)) 등의 TNFα-매개성 질환 또는 장애가 있다.In other embodiments, the sample is a whole blood, serum, or plasma sample of a subject receiving a whole blood, serum, or plasma sample, for example, an anti-TNFa drug therapy. In a preferred embodiment, the sample is serum. In certain embodiments, the subject is a mammal such as a human, a human, a human, a human, a human, a human, a human, a human, a human, a human, Mediated diseases or disorders.
특정 구현예에서, 시료는 항-TNFα 약물에 대한 자가항체를 갖거나 또는 이를 갖는 것으로 의심된다. 기타 구현예에서, 항-TNFα 약물 자가항체에는 이에 제한되는 것은 아니나 인간 항-키메라성 항체 (HACA), 인간 항-인간화 항체 (HAHA), 및 인간 항-마우스 항체 (HAMA) 뿐 아니라 그의 조합물이 포함된다.In certain embodiments, the sample is suspected to have or have an autoantibody to the anti-TNF [alpha] drug. In other embodiments, anti-TNF alpha drug autoantibodies include but are not limited to human anti-chimeric antibodies (HACA), human anti-humanized antibodies (HAHA), and human anti-mouse antibodies .
특정 측면에서, 본 발명의 검정법은 시료를 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉하기 이전, 동안 및/또는 이후에, 상기 시료를 산과 접촉하는 것을 포함하는 산 해리 단계를 추가로 포함한다.In certain aspects, the assay of the present invention further comprises an acid dissociation step comprising contacting the sample with an acid before, during and / or after contacting the labeled anti-TNF [alpha] drug and labeled TNF [alpha] .
산 해리를 이용하는 항-약물 항체의 검출 방법은 본원에서 및 본원에서 어떤 목적이든 그 전문이 참조로 포함되는 2012 년 2 월 16 일에 출원한 PCT 출원 번호 PCT/US2012/025437 에 기재되어 있다.Methods for the detection of anti-drug antibodies using acid dissociation are described in PCT Application No. PCT / US2012 / 025437, filed February 16, 2012, which is hereby incorporated by reference in its entirety and for any purpose herein.
특정 기타 측면에서, 본 발명의 검정법은 시료 내 항-TNFα 약물에 대한 중화 및/또는 비-중화 형태의 자가항체의 하나 이상의 아형의 존재 또는 수준을 검출하는 것을 포함한다. 비제한적인 예로서, 본 발명의 검정은 REMICADE™ (인플릭시마브) 또는 HUMIRA™ (아달리무마브) 와 같은 항-TNFα 약물을 받는 ADA-양성 환자로부터의 시료 내 상이한 중화 및/또는 비-중화 ADA 아형을 측정하는데 사용할 수 있다. 특정 구현예에서, 하나 이상의 아형은 복수의 적어도 2, 3, 4, 5 이상의 아형을 포함한다. 기타 구현예에서, 하나 이상의 아형은 IgA, IgD, IgE, IgG, 및 IgM 아형, 그의 하부부류, 및 그의 조합물로 이루어진 군으로부터 선택된다. 특정 구현예에서, 각 자가항체 아형은 그의 체류 시간에 의해 분석, 식별 및/또는 검출된다. 기타 구현예에서, 각 자가항체 아형은 상이한 항체 아형에 대해 특이적인 표지된 항-Ig 항체 및 표지된 항-TNFα 약물과 같은 검출자 부분의 근접 결합에 의해 나타난 신호로 분석, 식별 및/또는 검출된다. 특정한 예에서, 신호는 형광 공명 에너지 전달 (FRET) 에 의해 검출될 수 있는 형광 신호를 포함한다. In certain other aspects, the assays of the invention include detecting the presence or level of one or more subtypes of autoantibodies in the neutralized and / or non-neutralized form of the anti-TNF [alpha] drug in the sample. As a non-limiting example, the assays of the present invention may be used to determine the presence of different neutralization and / or non-toxicity in samples from ADA-positive patients receiving anti-TNFa drugs such as REMICADE (infliximab) or HUMIRA - Can be used to measure neutralizing ADA subtypes. In certain embodiments, the at least one subtype comprises a plurality of at least 2, 3, 4, 5 or more subtypes. In other embodiments, the at least one subtype is selected from the group consisting of IgA, IgD, IgE, IgG, and IgM subtypes, subgroups thereof, and combinations thereof. In certain embodiments, each autoantibody subtype is analyzed, identified and / or detected by its residence time. In other embodiments, each autoantibody subtype is analyzed, identified and / or detected as a signal by proximate binding of a detector moiety, such as a labeled anti-Ig antibody specific for a different antibody subtype and a labeled anti-TNFa drug do. In a particular example, the signal comprises a fluorescent signal that can be detected by fluorescence resonance energy transfer (FRET).
항-약물 항체 (ADA) 아형의 검출 방법은 추가로 PCT 공보 WO 2012/054532 에 추가 기재되어 있으며, 이의 개시물은 본원에서 그 전문이 어떤 목적이든 참조로서 포함된다.Methods for detecting anti-drug antibody (ADA) subtypes are further described in PCT Publication No. WO 2012/054532, the disclosure of which is incorporated herein by reference in its entirety for any purpose.
생물제제 (예를 들어, 항-TNFα 약물) 또는 생물학적 결합 부분 (예를 들어, TNFα) 은 각종 탐지가능한 기(들) 중 임의의 것으로 표지될 수 있다. 바람직한 구현예에서, 생물제제 (예를 들어, 항-TNFα 약물) 및 생물학적 결합 부분 (예를 들어, TNFα) 은 상이한 표지를 포함한다. 특정 구현예에서, 생물제제 (예를 들어, 항-TNFα 약물) 또는 생물학적 결합 부분 (예를 들어, TNFα) 은 형광단 또는 형광 염료로 표지된다. 형광단 또는 형광 염료의 비제한적인 예에는, 본원에서 참조로서 삽입된 Molecular Probes Catalogue 에서 열거된 것이 포함된다 (R. Haugland, The Handbook-A Guide to Fluorescent Probes and Labeling Technologies, 10th Edition, Molecular probes, Inc. (2005) 참조). 상기 예의 형광단 또는 형광 염료에는 이에 제한되는 것은 아니나 하기가 포함된다: Alexa Fluor® 염료 예컨대 Alexa Fluor® 350, Alexa Fluor® 405, Alexa Fluor® 430, Alexa Fluor® 488, Alexa Fluor® 514, Alexa Fluor® 532, Alexa Fluor® 546, Alexa Fluor® 555, Alexa Fluor® 568, Alexa Fluor® 594, Alexa Fluor® 610, Alexa Fluor® 633, Alexa Fluor® 635, Alexa Fluor® 647, Alexa Fluor® 660, Alexa Fluor® 680, Alexa Fluor® 700, Alexa Fluor® 750, 및/또는 Alexa Fluor® 790, 및 이에 제한되는 것은 아니나 하기를 비롯한 기타 형광단: Biologic agents (e. G., Anti-TNFa drugs) or biological binding moieties (e. G., TNFa) may be labeled as any of the various detectable group (s). In a preferred embodiment, the biological agent (e. G., Anti-TNFa drug) and the biological binding moiety (e. G., TNFa) comprise different labels. In certain embodiments, a biological agent (e. G., An anti-TNFa drug) or a biological binding moiety (e. G., TNFa) is labeled with a fluorophore or fluorescent dye. Non-limiting examples of fluorophores or fluorescent dyes, include those listed in the Molecular Probes Catalogue incorporated by reference herein (R. Haugland, The Handbook-A Guide to Fluorescent Probes and Labeling Technologies, 10 th Edition, Molecular probes , ≪ / RTI > Inc. (2005)). Fluorescent dyes or fluorescent dyes of the above examples include, but are not limited to, Alexa Fluor® dyes such as
Dansyl 클로라이드 (DNS-Cl), 5-(요오도아세타미다)플루오로세인 (5-IAF), 플루오로세인 5-이소티오시아네이트 (FITC), 테트라메틸로다민 5- (및 6-)이소티오시아네이트 (TRITC), 6-아크릴로일-2-디메틸아미노나프탈렌 (아크릴로단), 7-니트로벤조-2-옥사-1,3,-디아졸-4-일 클로라이드 (NBD-Cl), 에티듐 브로마이드, 루시퍼 옐로우 (Lucifer Yellow), 5-카르복시로다민 6G 히드로클로라이드, 리싸민 (Lissamine) 로다민 B 술포닐 클로라이드, Texas Red™ 술포닐 클로라이드, BODIPY™, 나프탈아민 술폰산 (예를 들어, 1-아닐리노나프탈렌-8-술폰산 (ANS), 6-(p-톨루이디닐)나프탈렌-e-2-술폰산 (TNS), 등), 안트로일 지방산, DPH, 파리나르산, TMA-DPH, 플루오레닐 지방산, 플루오레세인-포스파티딜에탄올아민, Texas Red-포스파티딜에탄올아민, 피레닐-포파티딜콜린, 플루오레닐-포스포티딜콜린, 메로시아닌 540,1-(3-술포나토프로필)-4-[β-[2[(디-n-부틸아미노)-6 나프틸]비닐]피리디늄 베타인 (나프틸 스티릴), 3,3'디프로필티아디카르보시아닌 (디S-C3-(5)), 4-(p-디펜틸 아미노스티릴)-l-메틸피리디늄 (디-5-ASP), Cy-3 요오도 아세타미드, Cy-5-N-히드록시숙신이미드, Cy-7-이소티오시아네이트, 로다민 800, IR-125, 티아졸 오렌지, Azure B, Nile Blue, Al 프탈로시아닌, 옥삭신 1, 4', 6-디아미디노-2-페닐인돌 (DAPI), Hoechst 33342, TOTO, 아크리딘 오렌지, 에티듐 Homodimer, N(에톡시카르보닐메틸)-6-메톡시퀴놀리늄 (MQAE), Fura-2, 칼슘 그린, 카르복시 SNARF-6, BAPTA, 쿠마린, 피토플루오르 (phytofluors), 코로넨 (Coronene), 금속-리간드 복합체, IRDye®700DX, IRDye®700, IRDye®800RS, IRDye®800CW, IRDye®800, Cy5, Cy5.5, Cy7, DY 676, DY680, DY682, DY780, 및 그의 혼합물. 추가 적합한 형광단에는 효소-공동인자; 란타니드, 그린 형광 단백질, 옐로우 형광 단백질, 레드 형광 단백질, 또는 그의 돌연변이 및 유도체가 포함된다. 본 발명의 한 구현예에서, 특이적 결합쌍의 제 2 일원은 그에 부착된 탐지가능한 기를 갖는다.Dansyl chloride (DNS-Cl), 5- (iodoacetamid) fluorocaine (5-IAF), fluorocaine 5-isothiocyanate (FITC), tetramethylrhodamine 5- Nitrobenzo-2-oxa-1,3, -diazol-4-yl chloride (NBD-Cl), 6-acryloyl-2-dimethylaminonaphthalene (acryloyl) , Ethylidene bromide, Lucifer Yellow, 5-carboxydodamine 6G hydrochloride, Lissamine rhodamine B sulfonyl chloride, Texas Red (TM) sulfonyl chloride, BODIPY (TM), naphthalaminesulfonic acid For example, 1-anilino naphthalene-8-sulfonic acid (ANS), 6- (p-toluidinyl) Phosphatidylcholine, fluorescein-phosphatidylethanolamine, Texas Red-phosphatidylethanolamine, pyrenyl-papyridylcholine, fluorenyl-phosphatidylcholine, Vinylpyridinium betaine (naphthylstyryl), 3,3 ', 3', 4'- dipropyl thiazol not when dicarbonate (di-SC 3 - (5)), 4- (p- dipentyl-amino-styryl) -l- methyl-pyridinium (di -5-ASP), Cy-3-iodo-O theta Mead , Cy-5-N-hydroxysuccinimide, Cy-7-isothiocyanate, Rhodamine 800, IR-125, Thiazole Orange, Azure B, Nile Blue, Al phthalocyanine, (DAPI), Hoechst 33342, TOTO, acridine orange, ethidium homodimer, N (ethoxycarbonylmethyl) -6-methoxyquinolinium (MQAE), Fura- 2, calcium green, carboxy SNARF-6, BAPTA, coumarin, phytofluors, Coronene, metal-ligand complex, IRDye ® 700DX, IRDye ® 700, IRDye ® 800RS, IRDye ® 800CW, IRDye ® 800 , Cy5, Cy5.5, Cy7, DY676, DY680, DY682, DY780, and mixtures thereof. Additional suitable fluorescent moieties include enzyme-cofactors; Lanthanide, green fluorescent protein, yellow fluorescent protein, red fluorescent protein, or mutants and derivatives thereof. In one embodiment of the invention, the second member of the specific binding pair has a detectable group attached thereto.
전형적으로, 형광기는 폴리메틴, 프탈로시아닌, 시아닌, 잔텐, 플루오렌, 로다민, 쿠마린, 플루오레세인 및 BODIPY™ 을 포함하는 염료 카테고리로부터 선택된 형광단이다.Typically, the fluorophore is a fluorophore selected from the category of dyes including polymethine, phthalocyanine, cyanine, xanthene, fluorene, rhodamine, coumarin, fluororesin and BODIPY (TM).
한 구현예에서, 형광기는 약 650 내지 약 900 nm 범위에서 발광하는 근-적외선 (NIR) 형광단이다. 근적외선 형광 기술의 이용은 그것이 실질적으로 생체기질의 자동 형광으로부터 배경 (background) 을 없애거나 경감시키기 때문에 생물학적 검정에서 이점을 가진다. 근-IR 형광 기술의 다른 이점은 산란 강도가 파장의 여기원으로부터의 산란된 빛의 역 4 제곱에 비례하기 때문에, 여기원으로부터 산란된 빛이 크게 감소된다는 점이다. 낮은 배경 형광 및 낮은 산란은 높은 민감도 검출에 필수적인, 높은 신호 대 노이즈 비율을 제공한다. 더욱이, 생물학적 조직 내의 근-IR 영역 (650 nm 내지 900 nm)에서 시각적으로 투명한 창은 NIR 형광을 생물학적 성분을 통한 빛의 통과를 요구하는 생체내 이미지 및 세포아세포 검출 적용하기에 유용하다. 상기 구현예의 측면에서, 형광기는 바람직하게 IRDye®700DX, IRDye®700, IRDye®800RS, IRDye®800CW, IRDye®800, Alexa Fluor®660, Alexa Fluor®680, Alexa Fluor®700, Alexa Fluor®750, Alexa Fluor®790, Cy5, Cy5.5, Cy7, DY 676, DY680, DY682, 및 DY780 로 이루어진 군으로부터 선택된다. 특정 구현예에서, 근 적외선 기는 IRDye®800CW, IRDye®800, IRDye®700DX, IRDye®700, 또는 Dynomic DY676 이다.In one embodiment, the fluorophore is a near-infrared (NIR) fluorophore emitting from about 650 to about 900 nm. The use of near-infrared fluorescence technology has advantages in biological assays because it substantially eliminates or alleviates the background from autobodies in living bodies. Another advantage of near-IR fluorescence techniques is that the scattered light from the excitation source is greatly reduced because the scattering intensity is proportional to the
형광 표지는 형광단의 화학적 반응성 유도체를 사용하여 달성된다. 통상적인 반응기는 FITC 및 TRITC와 같은 이소티오시아네이트 유도체 (플루오레세인 및 로다민의 유도체), NHS-플루오레세인과 같은 아민 반응성 숙시니미딜 에스테르, 및 플루오레세인-5-말레이미드와 같은 술프히드릴 반응성 말레이미드 활성화된 플루오르를 포함하는 것으로, 상기 물질들은 시판중이다. 생물제제 (예를 들어, 항-TNFα 약물) 또는 생물학적 결합 부분 (예를 들어, TNFα) 과 임의의 이들 반응성 염료의 반응은 형광단과 생물제제 (예를 들어, 항-TNFα 약물) 또는 생물학적 결합 부분 (예를 들어, TNFα) 사이에 형성되는 안정한 ?유 결합을 초래한다.Fluorescent labels are achieved using chemically reactive derivatives of the fluorophore. Typical reactors include isothiocyanate derivatives such as FITC and TRITC (derivatives of fluorescein and rhodamine), amine-reactive succinimidyl esters such as NHS-fluorescein, and sulfone-5-maleimide These materials are commercially available, including phyryl-reactive maleimide-activated fluorine. The reaction of a biologic agent (e. G., An anti-TNFa drug) or a biological binding moiety (e. G., TNFa) with any of these reactive dyes can be achieved using a fluorescent moiety and a biologic agent (e. G., An anti- TNFa drug) (E. G., TNFa). ≪ / RTI >
특정 예에서, 형광 표지 반응 이후에, 종종 표지된 표적 분자들로부터 임의의 비반응된 형광단을 제거하는 것이 요구된다. 이것은 종종 형광단과 표지된 단백질 사이의 크기 차이의 이점을 갖는, 크기 배제 크로마토그래피에 의해 달성된다. In certain instances, after the fluorescent labeling reaction, it is often desirable to remove any unreacted fluorophore from labeled target molecules. This is often achieved by size exclusion chromatography, which has the advantage of a size difference between the fluorophore and the labeled protein.
반응성 형광 안료는 많은 공급원으로부터 이용가능하다. 그들은 표적 분자 내부의 다양한 관능기에 부착하기 위해 다수의 반응기로 수득될 수 있다. 그들은 또한 표지 반응을 수행하기 위해 모든 성분들을 함유하는 표지 키트에서 이용가능하다. 한 바람직한 국면에서, Invitrogen로부터의 Alexa Fluor® 647 C2 말레이미드가 사용된다 (Cat. No. A-20347).Reactive fluorescent pigments are available from many sources. They can be obtained in a number of reactors for attachment to various functional groups within the target molecule. They are also available in a label kit containing all components to perform the label reaction. In one preferred aspect, Alexa Fluor 647 C2 maleimide from Invitrogen is used (Cat. No. A-20347).
중화 및/또는 비-중화 항-약물 항체 (예를 들어, NAb 및/또는 비-NAb) 의 생물제제 (예를 들어, 항-TNFα 약물) 및/또는 생물학적 결합 부분 (예를 들어, TNFα) 와의 특이적 면역 결합은 직접적으로 또는 간접적으로 검출될 수 있다. 직접적 표지는 항체에 부착하는, 형광 또는 발광 태그, 금속, 염료, 방사성핵종 등을 포함한다. 특정 예에서, 상이한 방사성핵종으로 표지된 생물제제 (예를 들어, 항-TNFα 약물) 또는 생물학적 결합 부분 (예를 들어, TNFα) 이 시료 중의 NAb 및/또는 비-NAb 의 존재 또는 수준을 측정하는데 사용될 수 있다. 다른 예에서, 화학발광 생물제제 (예를 들어, 항-TNFα 약물) 및 생물학적 결합 부분 (예를 들어, TNFα) 을 이용한 화학발광 검정은 시료 중 NAb 및/또는 비-NAb 의 존재 또는 수준의, 민감하고, 비-방사성인 검출에 적합하다. 특정 사례에서, 상이한 형광색소로 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 생물학적 결합 부분 (예를 들어, TNFα) 은 시료 중 NAb 및/또는 비-NAb 의 존재 또는 수준의 검출에 적합하다. 형광색소의 예에는 제한 없이 하기가 포함된다: Alexa Fluor®염료, DAPI, 플루오레세인, Hoechst 33258, R-피코시아닌, B-피코에리트린, R-피코에리트린, 로다민, Texas red, 및 리싸민. 형광색소에 연결된 2차 항체는 시중에서 입수가능하며, 예를 들어 염소 F(ab')2 항-인간 IgG-FITC 가 Tago Immunologicals (Burlingame, CA) 로부터 이용가능하다.(E. G., Anti-TNFa drugs) and / or biological binding moieties (e. G., TNFa) of neutralizing and / or non-neutralizing anti-drug antibodies (e. G., NAb and / or non- Can be detected either directly or indirectly. Direct labeling includes fluorescent or luminescent tags, metals, dyes, radionuclides, and the like, which attach to the antibody. In certain instances, a biological agent (e.g., an anti-TNFa drug) or a biological binding moiety (e.g., TNFa) labeled with a different radionuclide is used to determine the presence or level of NAb and / or non- Can be used. In another example, chemiluminescent assays using chemiluminescent biologics (e. G., Anti-TNFa drugs) and biological binding moieties (e. G., TNFa) can be used to determine the presence or level of NAb and / Sensitive, non-radioactive detection. In certain instances, biologic agents (e. G., Anti-TNFa drugs) and biological binding moieties (e. G., TNFa) labeled with different fluorescent color are suitable for detection of the presence or level of NAb and / or non- Do. Examples of fluorescent dyes include, without limitation, to: Alexa Fluor ® dye, DAPI, fluorescein, Hoechst 33258, R- Pico when not, B- phycoerythrin, R- phycoerythrin, rhodamine, Texas red, And lysamin. Secondary antibodies linked to fluorescent dyes are commercially available, for example, chlorine F (ab ') 2 anti-human IgG-FITC is available from Tago Immunologicals (Burlingame, Calif.).
간접 표지에는 당업계에 널리 공지된 각종 효소, 예컨대 호스래디쉬 (horseradish) 퍼옥시다아제 (HRP), 알칼리 포스파타아제 (AP), β-갈락토시다아제, 우레아제 등이 포함된다. 호스래디쉬-퍼옥시다아제 검출 시스템은, 예를 들어 450 nm 에서 검출가능한 과산화수소의 존재 하에서 가용성 생성물을 생성하는 발색 기질 테트라메틸벤지딘 (TMB) 이 사용될 수 있다. 알칼리 포스파타아제 검출 시스템은, 예를 들어 405 nm 에서 용이하게 검출가능한 가용성 생성물을 생성하는 발색 기질 p-니트로페닐 포스페이트가 사용될 수 있다. 유사하게, β-갈락토시다아제 검출 시스템은 410 nm 에서 검출가능한 가용성 생성물을 생성하는 발색 기질 o-니트로페닐-β-D-갈락토피라노시드 (ONPG) 가 사용될 수 있다. 우레아제 검출 시스템은 우레아-브로모크레졸 퍼플 (Sigma Immunochemicals; St. Louis, MO) 과 같은 기질이 사용될 수 있다. 효소에 연결된 유용한 2차 항체는 다수의 상업적 공급원으로부터 수득될 수 있으며, 예를 들어 염소 F(ab')2 항-인간 IgG-알칼리 포스파타아제는 Jackson ImmunoResearch (West Grove, PA.) 로부터 입수될 수 있다.Indirect labeling includes various enzymes well known in the art such as horseradish peroxidase (HRP), alkaline phosphatase (AP), beta -galactosidase, urease, and the like. The horseradish peroxidase detection system can be, for example, a chromogenic substrate tetramethylbenzidine (TMB) which produces a soluble product in the presence of hydrogen peroxide detectable at 450 nm. The alkaline phosphatase detection system can be, for example, a chromogenic substrate p-nitrophenyl phosphate which produces a soluble product readily detectable at 405 nm. Similarly, a chromogenic substrate o-nitrophenyl-beta-D-galactopyranoside (ONPG), which produces a soluble product detectable at 410 nm, can be used for the? -Galactosidase detection system. A urease detection system may be a substrate such as urea-bromocresol purple (Sigma Immunochemicals; St. Louis, Mo.). Useful secondary antibodies linked to enzymes can be obtained from a number of commercial sources, for example, chlorine F (ab ') 2 anti-human IgG-alkaline phosphatase can be obtained from Jackson ImmunoResearch (West Grove, Pa. .
직접 또는 간접 표지로부터의 신호는, 예를 들어 발색 기질로부터 색을 검출하는 분광광도계; 방사선을 검출하는 방사선 계수기, 예컨대 125I 의 검출용 감마 계수기; 또는 특정 파장의 빛의 존재 하에서 형광을 검출하는 형광계를 사용하여 분석될 수 있다. 효소-연결 항체의 검출을 위하여, NAb 및/또는 비(非)-NAb 수준의 정량적 분석이 제조업자의 지시에 따라 분광광도계, 예컨대 EMAX 마이크로플레이트 판독기 (Molecular Devices; Menlo Park, CA) 를 사용하여 수행될 수 있다. 원하는 경우, 본 발명의 검정은 자동화되거나 또는 로봇식으로 수행될 수 있고, 다수의 시료로부터의 신호가 동시에 검출될 수 있다.Signals from direct or indirect markers include, for example, a spectrophotometer that detects color from a chromogenic substrate; A radiation counter for detecting radiation, such as a 125 I gamma counter for detection; Or may be analyzed using a fluorometer to detect fluorescence in the presence of light of a particular wavelength. Quantitative analysis of NAb and / or non-NAb levels was performed using a spectrophotometer, such as an EMAX microplate reader (Molecular Devices, Menlo Park, Calif.) According to the manufacturer's instructions for the detection of enzyme-linked antibodies . If desired, the assays of the present invention can be automated or robotic, and signals from multiple samples can be detected simultaneously.
특정 구현예에서, 크기 배제 크로마토그래피가 사용된다. SEC 의 기본 원리는 상이한 크기의 입자들이 상이한 속도로 고정상을 통하여 용리 (여과) 될 수 있다는 것이다. 이는 크기를 기준으로 입자의 용액을 분리한다. 모든 입자들이 동시에 또는 거의 동시에 로딩되면, 동일한 크기의 입자들이 함께 용리된다. 각각의 크기 배제 칼럼은 분리될 수 있는 분자량의 범위를 갖는다. 배제 한도는 분자가 고정상에서 포획되기에 너무 큰 범위의 상한에서의 분자량을 제한한다. 투과 한계는 충분히 작은 크기의 분자가 고정상의 공극으로 완전히 투과될 수 있는 분리 범위의 하한에서 분자량을 제한하고, 이러한 분자량 미만의 모든 분자들은 단일 밴드로 용출되기에는 너무 작다.In certain embodiments, size exclusion chromatography is used. The basic principle of SEC is that particles of different sizes can be eluted (filtered) through the stationary phase at different rates. This separates the solution of particles by size. When all the particles are loaded simultaneously or nearly simultaneously, particles of the same size are eluted together. Each size exclusion column has a range of molecular weights that can be separated. The exclusion limit limits the molecular weight at the upper limit of the range which is too great for the molecule to be trapped on the immobilized phase. The permeability limit limits the molecular weight at the lower end of the separation range where molecules of sufficiently small size can be completely permeated into the pores of the fixed bed, and all molecules below this molecular weight are too small to be eluted into a single band.
특정 측면에서, 용리액은 일정한 부피, 또는 분획으로 수집된다. 입자들의 크기가 보다 유사할수록, 이들은 동일한 분획 내에 존재하고 개별적으로 검출되지 않는 경향이 있다. 바람직하게는, 수집된 분획을 분광 기술로 평가하여, 용리된 입자들의 농도를 측정한다. 통상적으로, 본 발명에서 유용한 분광 검출 기술에는, 비제한적으로, 형광분석법, 굴절율 (RI) 및 자외선 (UV) 이 포함된다. 특정 예에서, 용리 부피는 분자의 유체역학적 부피의 로그에 대략 선형으로 감소한다 (즉, 무거운 부분이 먼저 나온다).In certain aspects, the eluent is collected in a certain volume, or fraction. The more similar the particles are, the more likely they are in the same fraction and not individually detected. Preferably, the collected fractions are evaluated by spectroscopic techniques to determine the concentration of eluted particles. Typically, spectroscopic detection techniques useful in the present invention include, but are not limited to, fluorescence analysis, refractive index (RI), and ultraviolet (UV). In certain instances, the elution volume decreases approximately linearly with the logarithm of the hydrodynamic volume of the molecule (i. E., The heavy portion emerges first).
추가의 측면에서, 본 발명은 생물제제로의 치료요법 과정을 받는 대상체에서 생물제제에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다:In a further aspect, the present invention provides a method for monitoring and / or optimizing a therapy for a biological agent in a subject undergoing a therapeutic treatment with a biological agent, said method comprising:
(a) 치료요법 과정에 걸쳐 다수의 시간 지점에서 본원에 기재된 검정에 따라 생물제제에 대한 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함;(a) detecting or measuring the presence, level or percentage of neutralizing forms of autoantibodies to the biologics according to the assays described herein at multiple time points throughout the course of the therapy;
(b) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 검출함; 및(b) detecting the change in the presence, level or percentage of autoantibodies in neutralization form over time; And
(c) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 기준으로 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정이 대상에게 투여되어야 하는지의 여부를 결정함.(c) determining whether a subsequent dose of the therapeutic regimen or a different therapeutic regimen for the subject should be administered to the subject, based on the change in the presence, level or percentage of the neutralizing form of the autoantibody over time.
특정 구현예에서, 상기 다수의 시간 지점은 적어도 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 시간 지점을 포함한다.In certain embodiments, the plurality of time points are at least 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, or more time points.
한 특정 측면에서, 본 발명은 생물제제로의 치료요법 과정을 받는 대상체에서 생물제제에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다:In one particular aspect, the invention provides a method of monitoring and / or optimizing a therapy for a biological agent in a subject undergoing a therapeutic treatment with a biological agent, said method comprising:
(a) 시간 지점 t0 에서, 본원에 기재된 바와 같은 대상체로부터의 제 1 시료 내 생물제제에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(a) measuring, at a time point t 0 , the level or percentage of autoantibody in neutralized form to a biological agent in the first sample from a subject as described herein;
(b) 시간 지점 t1 에서, 본원에 기재된 바와 같은 대상체로부터의 제 2 시료 내 생물제제에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(b) measuring, at time point t 1 , the level or percentage of autoantibody in neutral form to the biological agent in the second sample from a subject as described herein;
(c) 시간 지점 tn+1 에서, 대상체로부터의 n 개의 부가적인 시료로 단계 (b) 를 임의로 반복함, 여기서 n 은 1 내지 약 25 (예를 들어, n 은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 또는 25, 또는 그 안의 임의의 범위임) 의 정수임;(c) optionally repeating step (b) with n additional samples from the subject at time point t n + 1 , where n is from 1 to about 25 (e.g., n is 1, 2, 3, 4 , 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 or 25, );
(d) t0 에서 t1 까지의 시간 지점 또는 t0 에서 tn+1 까지의 시간 지점의 중화 형태의 자가항체의 수준 또는 백분율의 변화를 검출함; 및(d) detecting a change in the level or percentage of autoantibodies in neutralization form at time points from t 0 to t 1 or from time t 0 to time t n + 1 ; And
(e) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 기준으로 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정이 대상에게 투여되어야 하는지의 여부를 결정함.(e) determining whether a subsequent dose of the therapeutic regimen or a different therapeutic regimen for the subject should be administered to the subject, based on the change in the presence, level or percentage of neutralizing autoantibodies over time.
다른 특정 구현예에서, 상기 중화 형태의 자가항체 (예를 들어, NAb) 의 수준 또는 백분율은 생물제제 약물 치료요법 과정 중 하나 이상의 (예를 들어, 복수) 하기 주에서 측정된다: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80, 90, 100 등.In another specific embodiment, the level or percentage of autoantibodies (e.g., NAb) in the neutralized form is measured in one or more (e.g., plurality) of the biologic drug therapy regimens in the following week: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80,
일부 구현예에서, 상기 대상체를 위한 치료요법 과정의 후속 용량의 결정은 대상체를 위한 치료요법 과정의 후속 용량을 유지, 증가 또는 감소시키는 것을 포함한다. 다른 구현예에서, 상기 대상체를 위한 상이한 치료요법 과정의 결정은 상이한 생물제제 약물로의 치료를 포함한다. 다른 구현예에서, 상기 대상체를 위한 상이한 치료요법 과정의 결정은 또 다른 치료제와 함께인 현 치료요법 과정으로의 치료를 포함한다. 추가 구현예에서, 상기 대상체를 위한 상이한 과정의 치료요법의 결정은 현 치료요법 과정을 변화시키는 것 (예를 들어, 상이한 생물제제 또는 상이한 메카니즘을 표적으로 하는 약물로의 변경) 을 포함한다.In some embodiments, determining the subsequent dose of the therapeutic regimen for the subject comprises maintaining, increasing or decreasing the subsequent dose of the therapeutic regimen for the subject. In another embodiment, the determination of the different therapeutic regimens for the subject comprises treatment with different biologic drugs. In another embodiment, the determination of the different therapeutic regimens for the subject comprises treatment with a current therapeutic regimen that is in conjunction with another therapeutic agent. In a further embodiment, the determination of the therapeutic regimen of the different processes for the subject comprises altering the current therapeutic regimen (e.g., altering into a different biologic or drug targeting a different mechanism).
특정한 구현예에서, 상기 시간 경과에 따른 중화 형태의 자가항체 (예를 들어, NAb) 의 수준 또는 백분율의 증가는 대상체를 위해 치료 조정이 권장되어야 한다는 것을 의미한다. 다른 특정 구현예에서, 상기 시간 경과에 따른 중화 형태의 자가항체 (예를 들어, NAb) 의 부재에서 이의 존재로의 변화는 대상체를 위해 치료 조정이 권장되어야 한다는 것을 의미한다. 이러한 구현예에서, 상기 대상체는 하나 이상의 다른 치료제와 함께 현 치료요법 과정 (예를 들어, 기존의 생물제제를 택함) 으로 치료될 수 있다. 특정한 대안적인 구현예에서, 상기 대상체는 상이한 생물제제로 변경될 수 있다. 다른 특정한 대안적인 구현예에서, 상기 대상체는 상이한 메카니즘을 표적으로 하는 약물 (예를 들어, 생물제제 및/또는 비(非)-생물제제) 로 변경될 수 있다.In certain embodiments, autoantibodies in the form of a neutralization over time, such as, for example, NAb) levels or percentages indicate that treatment modalities should be recommended for the subject. In another particular embodiment, the autoantibody in neutralization form over time (e.g., Changes in the presence of NAb from its presence indicate that treatment adjustment should be recommended for the subject. In such embodiments, the subject may be treated with a current therapeutic regimen (e. G., Selecting an existing biological agent) with one or more other therapeutic agents. In certain alternative embodiments, the subject can be changed to a different biologic agent. In another specific alternative embodiment, the subject can be changed to a drug (e. G., A biological and / or non-biological agent) targeting a different mechanism.
부가적인 측면에서, 본 발명은 제 1 의 생물제제로의 치료요법 과정을 받는 대상체에서 치료요법을 최적화하고/하거나 독성을 감소시키는 방법을 제공하며, 상기 방법은 하기를 포함한다:In a further aspect, the present invention provides a method of optimizing treatment and / or reducing toxicity in a subject undergoing a therapeutic treatment with a first biocide, the method comprising:
(a) 본원에 기재된 검정에 따라 대상체로부터의 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함으로써 제 1 의 생물제제에 대한 중화 형태의 자가항체가 제 2 (즉, 상이한) 생물제제와 교차-반응성인지의 여부를 결정함; 및(a) detecting or measuring the presence, level or percentage of autoantibody in neutralization form in the sample from a subject according to the assays described herein to detect the presence or absence of a second (ie, different) autoantibody of neutralizing form to the first biological agent, Determine whether it is cross-reactive with the biological agent; And
(b) 상기 중화 형태의 자가항체가 제 2 의 생물제제와 교차-반응성인 경우, 상이한 치료요법 과정이 대상에게 투여되어야 하는지를 결정함.(b) if the neutralizing form of the autologous antibody is cross-reactive with the second biological agent, determining whether a different therapeutic regimen should be administered to the subject.
특정 구현예에서, 상기 상이한 과정의 치료요법이 투여되어야 하는지의 결정은 상이한 메카니즘을 표적으로 하는 약물 (예를 들어, 생물제제 및/또는 비-생물제제) 로 변경하는 것을 포함한다.In certain embodiments, the determination of whether the different course of treatment regimen should be administered includes altering to a drug (e.g., a biological agent and / or a non-biological agent) targeting a different mechanism.
일부 구현예에서, 상기 중화 형태의 자가항체가 제 2 의 생물제제와 교차-반응을 일으킬 수 없는 경우, 상기 방법은 추가로 현 치료요법 과정의 후속 용량이 증가 또는 감소되어야 하는지 또는 상기 대상에게 상이한 치료요법 과정이 투여되어야 하는지를 결정하는 것을 포함한다. 특정 예에서, 상기 상이한 치료요법 과정은 제 2 의 생물제제로의 치료를 포함한다. 다른 특정 예에서, 상기 상이한 치료요법 과정은 하나 이상의 다른 치료제와 함께 제 1 또는 제 2 의 생물제제로의 치료를 포함한다.In some embodiments, if the neutralizing form of the autoantibody can not cross-react with the second biological agent, the method further comprises determining whether the subsequent dose of the current therapeutic regimen should be increased or decreased, And determining if the therapeutic regimen should be administered. In certain instances, the different therapeutic regimens include treatment with a second biological agent. In another specific example, the different therapeutic regimens include treatment with a first or second biological agent together with one or more other therapeutic agents.
한 특정 측면에서, 본 발명은 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서 항-TNFα 약물에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다:In one particular aspect, the invention provides a method of monitoring and / or optimizing a therapeutic regimen for an anti-TNF alpha drug in a subject undergoing a therapeutic regimen with an anti-TNF alpha drug, the method comprising:
(a) 치료요법 과정에 걸쳐 다수의 시간 지점에서 본원에 기재된 검정에 따라 항-TNFα 약물에 대한 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함;(a) detecting or measuring the presence, level or percentage of autoantibodies in the form of neutralization to the anti-TNFa drug according to the assays described herein at multiple time points throughout the course of the treatment;
(b) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 검출함; 및(b) detecting the change in the presence, level or percentage of autoantibodies in neutralization form over time; And
(c) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 기준으로 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정이 대상에게 투여되어야 하는지의 여부를 결정함.(c) determining whether a subsequent dose of the therapeutic regimen or a different therapeutic regimen for the subject should be administered to the subject, based on the change in the presence, level or percentage of the neutralizing form of the autoantibody over time.
특정 구현예에서, 상기 다수의 시간 지점은 적어도 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 또는 그 이상의 시간 지점을 포함한다.In certain embodiments, the plurality of time points are at least 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, or more time points.
또 다른 특정 측면에서, 본 발명은 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서 항-TNFα 약물에 대한 치료요법을 모니터링하고/하거나 최적화하는 방법을 제공하며, 상기 방법은 하기를 포함한다:In another particular aspect, the invention provides a method of monitoring and / or optimizing a therapeutic regimen for an anti-TNF [alpha] drug in a subject undergoing a therapeutic regimen with an anti-TNF [alpha] drug, the method comprising:
(a) 시간 지점 t0 에서, 본원에 기재된 바와 같은 대상체로부터의 제 1 시료 내 항-TNFα 약물에 대한 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(a) measuring the level or percentage of autoantibody in neutralized form to the anti-TNFα drug in the first sample from a subject as described herein, at time point t 0 ;
(b) 시간 지점 t1 에서, 본원에 기재된 바와 같은 대상체로부터의 제 2 시료 내 중화 형태의 자가항체의 수준 또는 백분율을 측정함;(b) measuring, at time point t 1 , the level or percentage of autoantibody in neutralized form in the second sample from a subject as described herein;
(c) 시간 지점 tn+1 에서, 대상체로부터의 n 개의 부가적인 시료로 단계 (b) 를 임의로 반복함, 여기서 n 은 1 내지 약 25 (예를 들어, n 은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 또는 25, 또는 그 안의 임의의 범위임) 의 정수임;(c) optionally repeating step (b) with n additional samples from the subject at time point t n + 1 , where n is from 1 to about 25 (e.g., n is 1, 2, 3, 4 , 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 or 25, );
(d) t0 에서 t1 까지의 시간 지점 또는 t0 에서 tn+1 까지의 시간 지점의 중화 형태의 자가항체의 수준 또는 백분율의 변화를 검출함; 및(d) detecting a change in the level or percentage of autoantibodies in neutralization form at time points from t 0 to t 1 or from time t 0 to time t n + 1 ; And
(e) 시간 경과에 따른 중화 형태의 자가항체의 존재, 수준 또는 백분율의 변화를 기준으로 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정이 대상에게 투여되어야 하는지의 여부를 결정함.(e) determining whether a subsequent dose of the therapeutic regimen or a different therapeutic regimen for the subject should be administered to the subject, based on the change in the presence, level or percentage of neutralizing autoantibodies over time.
다른 특정 구현예에서, 상기 중화 형태의 자가항체 (예를 들어, NAb) 의 수준 또는 백분율은 항-TNFα 약물 치료요법의 과정 중 하나 이상의 (예를 들어, 복수) 하기 주에서 측정된다: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80, 90, 100 등.In another specific embodiment, the level or percentage of autoantibodies (e.g., NAb) of the neutralized form is measured in one or more (e.g., multiple) of the following courses of anti-TNFa drug therapy: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 80, 90, 100, etc.
일부 구현예에서, 상기 대상체를 위한 치료요법 과정의 후속 용량의 결정은 대상체를 위한 치료요법 과정의 후속 용량을 유지, 증가 또는 감소시키는 것을 포함한다. 다른 구현예에서, 상기 대상체를 위한 상이한 치료요법 과정의 결정은 상이한 항-TNFα 약물로의 치료를 포함한다. 다른 구현예에서, 상기 대상체를 위한 상이한 치료요법 과정의 결정은, 비제한적으로, 항-TNF 치료요법, 면역억제제, 코르티코스테로이드, 상이한 메카니즘을 표적으로 하는 약물, 영양 치료요법 및 다른 조합 치료를 포함하는 또 다른 치료제와 함께 현 치료요법 과정으로의 치료를 포함한다. 추가 구현예에서, 상기 대상체를 위한 상이한 치료요법 과정의 결정은 현 치료요법 과정을 변화시키는 것 (예를 들어, 상이한 항-TNFα 약물 또는 상이한 메카니즘을 표적으로 하는 약물, 예컨대 IL-6 수용체-억제 모노클로날 항체, 항-인테그린 분자 (예를 들어, 티사브리 (Tysabri), 베달루자마브 (Vedaluzamab)), JAK-2 억제제 및 티로신 키나아제 억제제, 또는 영양 치료요법 (예를 들어, 특정한 탄수화물 식이) 으로의 변경) 을 포함한다.In some embodiments, determining the subsequent dose of the therapeutic regimen for the subject comprises maintaining, increasing or decreasing the subsequent dose of the therapeutic regimen for the subject. In another embodiment, the determination of the different therapeutic regimens for the subject comprises treatment with different anti-TNF alpha drugs. In other embodiments, the determination of the different therapeutic regimens for such a subject includes, but is not limited to, anti-TNF therapy, immunosuppressants, corticosteroids, drugs targeting different mechanisms, nutritional therapies and other combination therapies As well as treatment with current therapies. In a further embodiment, the determination of the different therapeutic regimens for the subject can be accomplished by altering the current therapeutic regimen (e. G., By administering a different anti-TNFa drug or a different mechanism targeting drug such as IL-6 receptor- (E. G., A particular carbohydrate diet), a monoclonal antibody, an anti-integrin molecule (e. G. Tysabri, Vedaluzamab), a JAK-2 inhibitor and a tyrosine kinase inhibitor, ). ≪ / RTI >
특정 구현예에서, 상기 시간 경과에 따른 중화 형태의 자가항체 (예를 들어, NAb) 의 수준 또는 백분율의 증가는 대상체를 위해 치료 조정이 권장되어야 한다는 것을 의미한다. 다른 특정 구현예에서, 상기 시간 경과에 따른 중화 형태의 자가항체 (예를 들어, NAb) 의 부재에서 이의 존재로의 변화는 대상체를 위해 치료 조정이 권장되어야 한다는 것을 의미한다. 이러한 구현예에서, 상기 대상체는 하나 이상의 면역억제제, 예컨대 메토트렉세이트 (methotrexate (MTX)) 또는 아자티오프린 (azathioprine (AZA)) 과 함께 현 치료요법 과정 (예를 들어, 기존의 항-TNFα 약물을 택함) 으로 치료될 수 있다. 특정한 대안적인 구현예에서, 상기 대상체는 상이한 항-TNFα 약물로 변경될 수 있다. 다른 특정한 대안적인 구현예에서, 상기 대상체는 상이한 메카니즘을 표적으로 하는 약물 (예를 들어, 비(非)항-TNFα 약물) 로 변경될 수 있다.In certain embodiments, autoantibodies in the form of neutralization over time (e. G., ≪ RTI ID = 0.0 & NAb) levels or percentages indicate that treatment modalities should be recommended for the subject. In another particular embodiment, the autoantibody in neutralization form over time (e.g., Changes in the presence of NAb from its presence indicate that treatment adjustment should be recommended for the subject. In such embodiments, the subject may be treated with a current therapeutic regimen (e.g., selecting an existing anti-TNFa drug) with one or more immunosuppressants such as methotrexate (MTX) or azathioprine (AZA) ). ≪ / RTI > In certain alternative embodiments, the subject can be changed to a different anti-TNF [alpha] drug. In another specific alternative embodiment, the subject can be changed to a drug (e.g., a non-anti-TNF alpha drug) that targets a different mechanism.
또 다른 특정 측면에서, 본 발명은 제 1 의 항-TNFα 약물로의 치료요법 과정을 받는 대상체에서 치료요법의 최적화 및/또는 독성을 감소시키는 방법을 제공하며, 상기 방법은 하기를 포함한다:In another particular aspect, the invention provides a method of reducing the optimization and / or toxicity of a therapeutic regimen in a subject undergoing a therapeutic regimen with a first anti-TNF alpha drug, the method comprising:
(a) 본원에 기재된 검정에 따라 대상체로부터의 시료 내 중화 형태의 자가항체의 존재, 수준 또는 백분율을 검출 또는 측정함으로써 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 (즉, 상이한) 항-TNFα 약물과 교차-반응성인지의 여부를 결정함; 및(a) detecting or measuring the presence, level or percentage of an autoantibody in neutralized form in a sample from a subject according to the assays described herein to detect or measure the neutralization form of the autoantibody to the first anti-TNFa drug, Determining whether the compound is cross-reactive with an anti-TNF [alpha] drug; And
(b) 상기 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성인 경우, 상이한 치료요법 과정이 대상에게 투여되어야 하는지를 결정함.(b) if the neutralizing form of the autoantibody is cross-reactive with the second anti-TNFα drug, a different therapeutic regimen is to be administered to the subject.
특정 구현예에서, 상기 상이한 치료요법 과정이 투여되어야 하는지의 결정은 상이한 메카니즘을 표적으로 하는 약물 (예를 들어, 비-항-TNFα 약물) 로 변경하는 것을 포함한다. 상기와 같은 약물의 비제한적 예로는 IL-6 수용체-억제 모노클로날 항체, 항-인테그린 분자 (예를 들어, 티사브리 (Tysabri), 베달루자마브 (Vedaluzamab)), JAK-2 억제제, 티로신 키나아제 억제제, 영양 치료요법 (예를 들어, 특정한 탄수화물 식이) 및 이의 혼합물이 포함된다.In certain embodiments, the determination of whether the different therapeutic regimens should be administered involves altering to a drug targeting a different mechanism (e. G., A non-anti-TNF alpha drug). Non-limiting examples of such drugs include, but are not limited to, IL-6 receptor-inhibiting monoclonal antibodies, anti-integrin molecules (e.g., Tysabri, Vedaluzamab), JAK-2 inhibitors, tyrosine kinase Inhibitors, nutritional therapies (e. G., Specific carbohydrate diets), and mixtures thereof.
일부 구현예에서, 상기 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응을 일으킬 수 없는 경우, 상기 방법은 추가로 현 치료요법 과정의 후속 용량이 증가 또는 감소되어야 하는지 또는 상기 대상에게 상이한 치료요법 과정이 투여되어야 하는지를 결정하는 것을 포함한다. 특정 예에서, 상기 상이한 과정의 치료요법은 제 2 의 항-TNFα 약물로의 치료를 포함한다. 다른 특정 예에서, 상기 상이한 치료요법 과정은 하나 이상의 면역억제제, 예컨대 MTX 또는 AZA 와 함께 제 1 또는 제 2 의 항-TNFα 약물로의 치료를 포함한다.In some embodiments, if the neutralizing form of autoantibodies can not cross-react with a second anti-TNF alpha drug, the method further includes determining whether the subsequent dose of the current therapeutic regimen should be increased or decreased, Lt; RTI ID = 0.0 > a < / RTI > different therapy regimen. In certain instances, the therapeutic regimens of the different processes include treatment with a second anti-TNF alpha drug. In another specific example, the different therapeutic regimens include treatment with a first or second anti-TNF alpha drug in combination with one or more immunosuppressive agents such as MTX or AZA.
항-TNFα 약물 및 항-약물 항체의 검출 방법은 추가로 PCT 공보 제 WO 2011/056590 호에 기재되어 있고, 이의 개시는 어떤 목적이든 이의 전체가 본원에 참조로서 인용된다.Methods for the detection of anti-TNFa drugs and anti-drug antibodies are further described in PCT Publication No. WO 2011/056590, the disclosure of which is incorporated herein by reference in its entirety for any purpose.
특정 예에서, 본 발명은 추가로 TNFα 매개 질환 또는 장애 (예를 들어, CD 또는 UC 와 같은 IBD) 와 관련된 하나 이상의 증상을 치료하는데 유용한 상이한 메카니즘을 표적으로 하는 약물 (예를 들어, 비-항-TNFα 약물) 또는 항-TNF α 약물과 같은 치료요법 과정의 치료적 유효량을 대상에게 투여하는 것을 포함할 수 있다. 치료적 적용을 위하여, 치료요법 과정은 단독으로 투여되거나 또는 본원에 기재된 바와 같은 하나 이상의 부가적인 제제와 조합으로 공동 투여될 수 있다. 상기와 같이, 본 발명은 유리하게는 올바른 약물이 올바른 시간에 올바른 환자에게 제공되도록 하기 위하여, 치료 결정의 안내 및 항-TNFα 약물에 대한 치료요법 선택 및 최적화에 대한 정보를 제공함으로써 임상의가 "개인 맞춤형 약" 을 실행하는 것을 가능하게 한다.In certain instances, the invention further provides a method of treating a disorder or disorder (e. G., A non-hematopoietic agent) that targets a different mechanism useful for treating one or more symptoms associated with a TNFa mediated disease or disorder (e. G., IBD such as CD or UC) -TNF [alpha] drug) or an anti-TNF [alpha] drug, to a subject. For therapeutic applications, the therapeutic regimens may be administered alone or co-administered in combination with one or more additional agents as described herein. As described above, the present invention advantageously provides clinicians with information on the selection of therapeutic regimens and optimization of anti-TNF alpha drugs, as well as guidance of treatment decisions, in order to ensure that the correct drug is provided to the right patient at the right time. Personalized medicine ". < / RTI >
IV. 산 해리IV. San Harry
특정 측면에서, 본 발명의 검정 방법은 추가로, 예를 들어 항-TNFα 약물과 같은 생물제제에 대항하여 생성되는 중화 자가항체 (NAb), 비(非)-중화 자가항체 (non-NAb) 및/또는 이의 아형의 존재 또는 수준을 측정하기 위한 면역 복합체의 평형을 가능하게 하는 산 해리 단계를 포함한다. 그 결과, 이를 필요로 하는 대상에게 투여되는 생물제제 (예를 들어, 항-TNFα 약물) 에 대한 NAb 및/또는 비-NAb 의 존재 또는 수준은 대상체의 시료 내 또한 존재하는 투여된 생물제제로부터의 유의한 개입 없이 측정될 수 있다. 특히, 대상체의 시료는 높은 생물제제 약물 수준으로부터의 유의한 개입 없이, 생물제제 (예를 들어, 항-TNFα 약물) 존재 하에서의 NAb 및/또는 비-NAb 의 존재 또는 수준을 측정하기 위해 제공되는 충분한 양의 산으로 인큐베이션될 수 있다.In a particular aspect, the assay method of the invention further comprises the step of administering to the subject a therapeutically effective amount of a neutralizing autoantibody (NAb), a non-neutralizing autoantibody (non-NAb) and a neutralizing autoantibody / RTI > and / or < / RTI > an immune complex for measuring the presence or level of its subtype. As a result, the presence or level of NAb and / or non-NAb relative to a biological agent (e. G., An anti-TNFa drug) administered to a subject in need thereof can be determined from the presence Can be measured without significant intervention. In particular, a sample of a subject is a sufficient amount to provide for the presence or level of NAb and / or non-NAb in the presence of a biological agent (e.g., anti-TNFa drug) without significant intervention from a high biological agent drug level Can be incubated with a positive acid.
일부 구현예에서, 본 발명의 검정 방법의 단계 (a) 는 하기를 포함할 수 있다:In some embodiments, step (a) of the assay method of the invention may comprise:
(a') 자가항체 (예를 들어, 중화 및/또는 이의 비-중화 형태 포함) 및 생물제제 (예를 들어, 항-TNFα 약물) 의 사전형성 복합체를 해리하기 위하여 시료를 산과 접촉시킴;contacting the sample with an acid to dissociate the preformed complex of (a ') autoantibodies (including, for example, neutralization and / or its non-neutralized form) and biologics (e. g., anti-TNFa drug);
(b') 사전형성 복합체의 해리 후, 시료를 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 표지된 생물제제 결합 부분 (예를 들어, TNFα) 와 접촉시킴; 및(b ') after dissociation of the preformed complex, contacting the sample with a labeled biologic agent (eg, an anti-TNFα drug) and a labeled biologic agent binding moiety (eg, TNFα); And
(c') 시료 내 산을 중화시켜 하기를 형성함:(c ') neutralizing the acid in the sample to form:
(i) 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 자가항체의 제 1 의 표지된 복합체; 및/또는(i) a first labeled conjugate of a labeled biologic agent (e. g., an anti-TNFa drug) and an autoantibody; And / or
(ii) 표지된 생물제제 (예를 들어, 항-TNFα 약물), 표지된 생물제제 결합 부분 (예를 들어, TNFα) 및 자가항체의 제 2 의 표지된 복합체.(ii) a second labeled conjugate of a labeled biologic agent (eg, an anti-TNFα drug), a labeled biologic agent binding moiety (eg, TNFα), and an autoantibody.
일부 대안적인 구현예에서, 단계 (a') 및 (b') 는 동시에 수행되며, 예를 들어 상기 시료가 산, 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 표지된 생물제제 결합 부분 (예를 들어, TNFα) 와 동시에 접촉된다. 다른 대안적인 구현예에서, 단계 (b') 는 단계 (a') 전에 수행되며, 예를 들어 상기 시료는 우선 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 표지된 생물제제 결합 부분 (예를 들어, TNFα) 와 접촉된 후, 산과 접촉된다. 추가 구현예에서, 단계 (b') 및 (c') 는 동시에 수행되며, 예를 들어 상기 시료는 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 표지된 생물제제 결합 부분 (예를 들어, TNFα) 와 접촉되고, 동시에 중화된다 (예를 들어, 시료를 하나 이상의 중화 제제와 접촉시킴).In some alternative embodiments, steps (a ') and (b') are performed concurrently, for example when the sample is contacted with an acid, a labeled biologic agent (eg , an anti- TNFα drug) (E. G., TNFa). ≪ / RTI > In another alternative embodiment, step (b ') is performed prior to step (a'), for example the sample is first incubated with a labeled biological agent (eg, an anti- TNFα drug) (E. G., TNFa) and then contacted with the acid. In a further embodiment, steps (b ') and (c') are performed concurrently, for example the sample is labeled with a labeled biologic (e. G., An anti- TNFa drug) and a labeled biologic agent binding moiety (E. G., Contacting the sample with one or more neutralizing agents). ≪ / RTI >
특정 구현예에서, 상기 표지된 생물제제 결합 부분 (예를 들어, TNFα), 표지된 생물제제 (예를 들어, 항-TNFα 약물), 비표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 생물제제 (예를 들어, 항-TNFα 약물) 에 대한 자가항체가 평형을 이루고 이들 사이에 복합체를 형성할 수 있도록, 상기 시료는 자가항체 및 생물제제 (예를 들어, 항-TNFα 약물) 의 사전형성 복합체를 해리하기에 충분한 양의 산과 접촉된다. 특정 구현예에서, 상기 시료는 높은 수준의 생물제제 (예를 들어, 항-TNFα 약물) 의 존재 하에서의 자가항체의 검출 및/또는 측정을 가능하게 하는 충분한 양의 산과 접촉될 수 있다.In certain embodiments, the labeled biologic agent binding moiety (e. G., TNFa), labeled biologic agent (e. G., Anti-TNFa drug), unlabeled biologic agent (e. G., Anti- TNFa drug) (E. G., An anti-TNFa drug) such that the autoantibodies against the biological agent (e. G., Anti-TNFa drug) are in equilibrium and form a complex between them. Contacting the preformed composite with an amount of acid sufficient to dissociate. In certain embodiments, the sample can be contacted with a sufficient amount of acid to enable detection and / or measurement of the autoantibody in the presence of a high level of biological agent (e. G., Anti-TNFa drug).
일부 구현예에서, 용어 "높은 수준의 생물제제", 예컨대 높은 수준의 항-TNFα 약물에는 약 10 내지 약 100 ㎍/mL, 약 20 내지 약 80 ㎍/mL, 약 30 내지 약 70 ㎍/mL, 또는 약 40 내지 약 80 ㎍/mL 의 약물 수준이 포함된다. 다른 구현예에서, 용어 "높은 수준의 생물제제", 예컨대 높은 수준의 항-TNFα 약물에는 약 10, 20, 30, 40, 50, 60, 70, 80, 90 또는 100 ㎍/mL 이상의 약물 수준이 포함된다.In some embodiments, the term "high level biologic agent ", such as a high level of anti-TNFa drug, comprises about 10 to about 100 ug / mL, about 20 to about 80 ug / mL, about 30 to about 70 ug / Or from about 40 to about 80 < RTI ID = 0.0 > pg / mL. ≪ / RTI > In other embodiments, the term "high level of biological agent ", such as a high level of anti-TNFa drug, comprises a drug level of greater than about 10,20,30,40,50,60,70,80,90 or 100 占 퐂 / .
일부 구현예에서, 상기 산은 유기산을 포함한다. 다른 구현예에서, 상기 산은 무기산을 포함한다. 추가 구현예에서, 상기 산은 유기산 및 무기산의 혼합물을 포함한다. 유기산의 비제한적인 예로는 시트르산, 이소시트르산, 글루탐산, 아세트산, 락트산, 포름산, 옥살산, 요산, 트리플루오로아세트산, 벤젠 술폰산, 아미노메탄술폰산, 캠퍼-10-술폰산, 클로로아세트산, 브로모아세트산, 요오도아세트산, 프로판산, 부탄산, 글리세린산, 숙신산, 말산, 아스파르트산 및 이의 조합물이 포함된다. 무기산의 비제한적인 예로는 염산, 질산, 인산, 황산, 붕산, 불화수소산, 브롬화수소산 및 이의 조합물이 포함된다.In some embodiments, the acid comprises an organic acid. In another embodiment, the acid comprises an inorganic acid. In a further embodiment, the acid comprises a mixture of an organic acid and an inorganic acid. Non-limiting examples of the organic acid include citric acid, isocitric acid, glutamic acid, acetic acid, lactic acid, formic acid, oxalic acid, uric acid, trifluoroacetic acid, benzenesulfonic acid, aminomethanesulfonic acid, camphor- Propionic acid, butanoic acid, glyceric acid, succinic acid, malic acid, aspartic acid, and combinations thereof. Non-limiting examples of inorganic acids include hydrochloric acid, nitric acid, phosphoric acid, sulfuric acid, boric acid, hydrofluoric acid, hydrobromic acid, and combinations thereof.
특정 구현예에서, 상기 산의 양은 산 또는 산의 혼합물의 약 0.01M 내지 약 10M, 약 0.1M 내지 약 5M, 약 0.1M 내지 약 2M, 약 0.2M 내지 약 1M, 또는 약 0.25M 내지 약 0.75M 의 농도에 해당한다. 다른 구현예에서, 상기 산의 양은 산 또는 산의 혼합물의 약 0.01M, 0.05M, 0.1M, 0.2M, 0.3M, 0.4M, 0.5M, 0.6M, 0.7M, 0.8M, 0.9M, 1M, 2M, 3M, 4M, 5M, 6M, 7M, 8M, 9M 또는 10M 이상의 농도에 해당한다. 상기 산의 pH 는, 예를 들어 약 0.1, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 5.5, 6.0 또는 6.5 일 수 있다.In certain embodiments, the amount of acid is from about 0.01M to about 10M, from about 0.1M to about 5M, from about 0.1M to about 2M, from about 0.2M to about 1M, or from about 0.25M to about 0.75M, M < / RTI > In other embodiments, the amount of acid is about 0.01M, 0.05M, 0.1M, 0.2M, 0.3M, 0.4M, 0.5M, 0.6M, 0.7M, 0.8M, 0.9M, 1M , 2M, 3M, 4M, 5M, 6M, 7M, 8M, 9M or 10M or more. The pH of the acid may be, for example, about 0.1, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 5.5, 6.0 or 6.5.
일부 구현예에서, 상기 시료는 자가항체 및 생물제제 (예를 들어, 항-TNFα 약물) 의 사전형성 복합체를 해리하기에 충분한 시간 동안 산과 접촉된다. 특정 예에서, 상기 시료는 약 0.1 시간 내지 약 24 시간, 약 0.2 시간 내지 약 16 시간, 약 0.5 시간 내지 약 10 시간, 약 0.5 시간 내지 약 5 시간, 또는 약 0.5 시간 내지 약 2 시간 범위의 시간 기간 동안 산과 접촉된다 (예를 들어, 인큐베이션된다). 다른 예에서, 상기 시료는 약 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 7, 8, 9 또는 10 시간 이상의 시간 기간 동안 산과 접촉된다 (예를 들어, 인큐베이션된다). 상기 시료는 4℃, 실온 (RT) 또는 37℃ 에서 산과 접촉될 수 있다.In some embodiments, the sample is contacted with the acid for a time sufficient to dissociate the preformed complex of the autoantibody and the biological agent (e. G., Anti-TNFa drug). In certain instances, the sample is heated to a temperature ranging from about 0.1 hours to about 24 hours, from about 0.2 hours to about 16 hours, from about 0.5 hours to about 10 hours, from about 0.5 hours to about 5 hours, or from about 0.5 hours to about 2 hours (E. G., Incubated) for a period of time. In another example, the sample may be about 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1, 1.5, 2.5, 3.5, 4.5, (E. G., Incubated) for a period of time of 9 or 10 hours or more. The sample can be contacted with acid at 4 占 폚, room temperature (RT) or 37 占 폚.
특정 구현예에서, 상기 산의 중화 단계는 본원에 기재된 제 1 및/또는 제 2 표지된 복합체의 형성이 가능하도록 시료의 pH 를 증가시키는 것을 포함한다. 일부 구현예에서, 상기 산은 하나 이상의 중화제, 예컨대 강염기, 약염기, 완충 용액 및 이의 조합물의 첨가에 의해 중화된다. 당업계의 기술자는 중화 반응이 반드시 수득된 pH 가 7 을 의미하는 것이 아니라는 것을 이해할 것이다. 일부 예에서, 산 중화는 염기성인 시료를 결과로 얻는다. 다른 예에서, 산 중화는 산성인 (하지만, 중화제 첨가 전 시료의 pH 보다 더 높음) 시료를 결과로 얻는다. 특정 구현예에서, 상기 중화제는 pH 약 7.3 의 완충액, 예컨대 인산 완충 식염수 (예를 들어, 10x PBS) 를 포함한다.In certain embodiments, the neutralization step of the acid comprises increasing the pH of the sample to enable formation of the first and / or second labeled complexes described herein. In some embodiments, the acid is neutralized by the addition of one or more neutralizing agents such as strong bases, weak bases, buffer solutions and combinations thereof. It will be appreciated by those skilled in the art that the neutralization reaction does not necessarily mean that the pH obtained is 7. In some instances, acid neutralization results in a sample that is basic. In another example, acid neutralization results in a sample that is acidic (but higher than the pH of the sample prior to addition of the neutralizer). In certain embodiments, the neutralizing agent comprises a buffer at a pH of about 7.3, such as phosphate buffered saline (e.g., 10x PBS).
일부 구현예에서, 단계 (b') 는 추가로 내부 대조군을 표지된 생물제제 (예를 들어, 항-TNFα 약물) 및 표지된 생물제제 결합 부분 (예를 들어, TNFα) (예를 들어, 사전형성 복합체의 해리 전에, 중에 또는 후에) 과 함께 시료와 접촉시키는 것을 포함한다. 특정 예에서, 상기 내부 대조군은 표지된 내부 대조군, 예를 들어 Biocytin-Alexa 488 을 포함한다. 다른 특정 예에서, 상기 표지된 내부 대조군의 양은 분석된 시료의 100 μL 당 약 1 ng 내지 약 25 ng, 약 5 ng 내지 약 25 ng, 약 5 ng 내지 약 20 ng, 약 1 ng 내지 약 20 ng, 약 1 ng 내지 약 10 ng, 또는 약 1 ng 내지 약 5 ng 범위이다. 추가의 예에서, 상기 표지된 내부 대조군의 양은 분석된 시료의 100 μL 당 약 1 ng, 5 ng, 10 ng, 15 ng, 20 ng 또는 25 ng 이상이다.In some embodiments, step (b ') further comprises contacting the internal control with a labeled biologic agent (e.g., an anti-TNFa drug) and a labeled biologic agent binding moiety (e. G., TNFa) Forming complex, prior to, during, or after dissociation of the complex. In certain examples, the internal control comprises a labeled internal control, e. G., Biocytin-
본 발명의 방법의 비제한적인 일례로서, 시료, 예컨대 혈청 시료 (예를 들어, 레미케이드 (IFX) 와 같은 항-TNFα 약물로의 치료요법을 받는 대상체로부터의 혈청) 은 0.5M 시트르산, pH 3.0 으로 실온에서 1 시간 동안 인큐베이션될 수 있다. (비표지된) 항-TNFα 약물 및 항-TNFα 약물에 대한 자가항체 (예를 들어, 항-IFX 항체 (ATI) 와 같은 항-약물 항체) 사이의 사전형성 복합체의 해리 후, 표지된 항-TNFα 약물 (예를 들어, IFX-Alexa 488), 표지된 TNFα (예를 들어, TNFα Alexa 532) 및 임의로 내부 대조군이 첨가되고, 상기 반응 혼합물 (예를 들어, 즉시) 은 중화제, 예컨대 10x PBS, pH 7.3 으로 중화될 수 있다. 중화 후, 상기 반응 혼합물을 실온에서 (예를 들어, 플레이트 진탕기 상에서) 또 다른 1 시간 동안 인큐베이션시켜 평형을 이루게하고, 표지된 TNFα, 표지된 항-TNFα 약물, 비표지된 항-TNFα 약물, 및/또는 항-TNFα 약물에 대한 자가항체 사이의 면역 복합체의 재형성을 완결할 수 있다. 그 후, 상기 시료는 여과되어, 본원에 기재된 바와 같은 SEC-HPLC 로 분석될 수 있다.As a non-limiting example of the method of the invention, a sample, such as a serum sample (e.g., serum from a subject receiving treatment with an anti-TNF.alpha. Drug such as Remicade (IFX) And incubated at room temperature for 1 hour. After dissociation of the preformed complex between the (unlabeled) anti-TNFα drug and the anti-TNFα drug, an autoantibody (eg, anti-drug antibody such as anti-IFX antibody (ATI) (E.g., IFX-Alexa 488), a labeled TNF alpha (e.g., TNF alpha Alexa 532) and optionally an internal control are added and the reaction mixture (e. G., Immediate) pH < / RTI > 7.3. After neutralization, the reaction mixture is incubated for another hour at room temperature (e.g., on a plate shaker) to equilibrate and the labeled TNFa, labeled anti-TNFa drug, unlabeled anti-TNFa drug, And / or to re-establish the immune complexes between autoantibodies to the anti-TNF [alpha] drug. The sample can then be filtered and analyzed by SEC-HPLC as described herein.
특정 구현예에서, 본 발명의 방법 (예를 들어, 산 해리 후 균일한 용액상 결합 키네틱 포함) 은 NAb 및/또는 비-NAb ATI 가 약 60 ㎍/mL 이하의 IFX 의 존재 하에서 측정될 수 있도록 하기 위하여, IFX 약물 내성을 유의하게 증가시킨다. 다시 말해서, 본 발명의 방법은 ATI 와 같은 항-TNFα 약물에 대한 NAb 및/또는 비-NAb 의 존재 또는 수준 뿐 아니라 높은 수준의 항-TNFα 약물 (예를 들어, IFX) 의 존재 하에서, 이로부터의 유의한 개입 없이, 다른 항-TNFα 약물에 대한 자가항체의 존재 또는 수준을 검출할 수 있다.In certain embodiments, the methods of the invention (e.g., Including dissociation kinetic kinetics after acid dissociation, significantly increase IFX drug resistance, so that NAb and / or non -NAb ATI can be measured in the presence of IFX at about 60 / / mL or less. In other words, the method of the present invention can be used for the treatment or prevention of an anti-TNFa drug such as ATI, in the presence or absence of NAb and / or non-NAb as well as a high level of anti-TNFa drug (e.g., IFX) The presence or level of an autoantibody to another anti-TNF [alpha] drug can be detected without significant intervention of the anti-TNF [alpha] drug.
산 해리를 사용하는 항-약물 항체의 검출 방법은 추가로 2012 년 2 월 16 일자 제출된 PCT 출원 제 PCT/US2012/025437 호에 기재되어 있고, 이의 개시는 어떤 목적이든 본원에 참조로서 인용된다.Methods for the detection of anti-drug antibodies using acid dissociation are further described in PCT Application No. PCT / US2012 / 025437 filed February 16, 2012, the disclosure of which is incorporated herein by reference for any purpose.
V. 생물제제 치료요법V. BIOLOGICAL TREATMENT THERAPY
본 발명의 검정은 대상 (예를 들어, 생물제제 치료요법을 받는 대상) 으로부터의 시료 내 임의의 생물제제에 대한 중화 및/또는 비-중화 자가항체의 존재 또는 부재 (예를 들어, 양성 또는 음성), 수준 또는 백분율의 검출 및/또는 측정에 적합하다. 생물제제의 비제한적인 예로는 항체, 항체 단편, 단백질, 폴리펩티드, 펩티드, 융합 단백질 (예를 들어, Ig 융합 단백질 또는 Fc 융합 단백질), 다가 결합 단백질 (예를 들어, DVD Ig), 항체-약물 컨쥬게이트, 백신, 핵산, 당류, 이의 재조합 형태, 이의 가공된 형태 및 이의 조합물이 포함된다.The assays of the present invention may be used to determine the presence or absence (e.g., positive or negative) of neutralizing and / or non-neutralizing autoantibodies to any biological agent in a sample from an object (e.g., a subject undergoing biotherapeutic treatment) ), Levels or percentages. Non-limiting examples of biological agents include antibodies, antibody fragments, proteins, polypeptides, peptides, fusion proteins (e.g., Ig fusion proteins or Fc fusion proteins), polyvalent binding proteins (e.g. DVD Ig) Conjugates, vaccines, nucleic acids, sugars, recombinant forms thereof, processed forms thereof, and combinations thereof.
항체-기반 생물제제의 예로는, 비제한적으로, 치료적 모노클로날 항체 및 이의 항원-결합 단편이 포함된다. 특정 구현예에서, 상기 항체는 항-TNFα 약물, 예컨대 REMICADE™ (인플릭시마브), HUMIRA™ (아달리무마브 (adalimumab)), CIMZIA® (세르톨리주마브 페골 (certolizumab pegol)), SIMPONI® (골리무마브 (golimumab); CNTO 148) 또는 이의 조합물을 포함한다. 항체-기반 생물제제의 부가적인 예로는 항체-약물 컨쥬게이트, 예컨대 Adcetris™ (아드세트리스) (브렌툭시마브 베도틴 (brentuximab vedotin)) 가 포함된다. 표 1 은 승인되었거나 또는 현재 개발 중인 치료적 모노클로날 항체의 대표적인 목록을 제공한다. 임상 개발 중인 및 승인된 제품 중 모노클로날 항체 치료제의 광범위한 목록은 2006 PhRMA 보고서, "418 Biotechnology Medicines in Testing Promise to Bolster the Arsenal Against Disease" 에 제공되어 있고, 이의 개시는 어떤 목적이든 본원에 참조로서 인용된다.
Examples of antibody-based biologics include, but are not limited to, therapeutic monoclonal antibodies and antigen-binding fragments thereof. In certain embodiments, the antibody is anti--TNFα drugs such as REMICADE ™ (an in-flight rigs during MAB), HUMIRA ™ (Ah otherwise free MAB (adalimumab)), CIMZIA ® (Sergio toll riju MAB pegol (certolizumab pegol)), SIMPONI and; (CNTO 148 goaltender free MAB (golimumab)) or including a combination thereof ®. Additional examples of antibody-based biological agents include antibody-drug conjugates such as Adcetris (TM) (bortuximab vedotin). Table 1 provides a representative list of therapeutic monoclonal antibodies that have been approved or are currently under development. An extensive list of monoclonal antibody therapeutics in clinical development and in approved products is provided in the 2006 PhRMA report, " 418 Biotechnology Medicines in Testing Promise to Bolster the Arsenal Against Disease ", the disclosure of which is incorporated herein by reference Quoted.
단백질-기재 또는 폴리펩티드-기재 생물제제의 비제한적 예는 사이토카인 (예를 들어, 인터류킨), 케모카인, 성장 인자, 혈액-생성 자극 단백질 (예를 들어, 에리트로포이에틴), 호르몬 (예를 들어, Elonva® (여포 자극 호르몬), 성장 호르몬), 효소 (예를 들어, Pulmozyme® (도르나아제 알파)), 응혈 인자, 인슐린, 알부민, 이의 단편, 이의 보존적 개질 변이체, 이의 유사체, 및 이의 조합을 포함한다.Non-limiting examples of protein-based or polypeptide-based biological agents include, but are not limited to, cytokines (such as interleukins), chemokines, growth factors, blood-forming stimulating proteins (e.g., erythropoietin), hormones (Eg, Elonva®, growth hormone), enzymes (eg, Pulmozyme® (Dornaya Alpha)), clotting factors, insulin, albumin, fragments thereof, conservative modifications thereof, analogues thereof, and combinations thereof .
사이토카인의 예는 비제한적으로, TNFα, 세포자멸사의 TNF-관련 약한 유도제 (TWEAK), 오스테오프로테게린 (OPG), IFN-α, IFN-β, IFN-γ 인터류킨 (예를 들어, IL-1α, IL-1β, IL-1 수용체 길항제 (IL-1ra), IL-2, IL-4, IL-5, IL-6, 가용성 IL-6 수용체 (sIL-6R), IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-15, IL-17, IL-23 및 IL-27), 아디포사이토카인 (예를 들어, 렙틴, 아디포넥틴, 레시스틴, 활성 또는 전체 플라스미노겐 활성화제 억제제-1 (PAI-1), 비스파틴 및 레티놀 결합 단백질 4 (RBP4)) 및 이의 조합을 포함한다. 특정 구현예에서, 인터류킨은 IL-2 예컨대 Proleukin® (알데스류킨; 재조합체 IL-2) 을 포함한다. Examples of cytokines include, but are not limited to, TNFa, TNF-related weak inducers of TNF-related weak inducers (TWEAK), osteoprotegerin (OPG), IFN- ?, IFN- ?, IFN-? Interleukins IL-1 receptor antagonist (IL-lra), IL-2, IL-4, IL-5, IL-6, soluble IL-6 receptor (sIL- IL-17, IL-23, and IL-27), adipocytokines (e.g., leptin, adiponectin, lecithin , Active or total plasminogen activator inhibitor-1 (PAI-1), non-spontaneous and retinol binding protein 4 (RBP4), and combinations thereof. In certain embodiments, the interleukin comprises IL-2, such as Proleukin® (Aldethsu leukin; recombinant IL-2).
케모카인의 예는 비제한적으로, CXCL1/GRO1/GROα, CXCL2/GRO2, CXCL3/GRO3, CXCL4/PF-4, CXCL5/ENA-78, CXCL6/GCP-2, CXCL7/NAP-2, CXCL9/MIG, CXCL10/IP-10, CXCL11/I-TAC, CXCL12/SDF-1, CXCL13/BCA-1, CXCL14/BRAK, CXCL15, CXCL16, CXCL17/DMC, CCL1, CCL2/MCP-1, CCL3/MIP-1α, CCL4/MIP-1β, CCL5/RANTES, CCL6/C10, CCL7/MCP-3, CCL8/MCP-2, CCL9/CCL10, CCL11/에오탁신, CCL12/MCP-5, CCL13/MCP-4, CCL14/HCC-1, CCL15/MIP-5, CCL16/LEC, CCL17/TARC, CCL18/MIP-4, CCL19/MIP-3β, CCL20/MIP-3α, CCL21/SLC, CCL22/MDC, CCL23/MPIF1, CCL24/에오탁신-2, CCL25/TECK, CCL26/에오탁신-3, CCL27/CTACK, CCL28/MEC, CL1, CL2, CX3CL1, 및 이의 조합을 포함한다.Examples of chemokines include, but are not limited to, CXCL1 / GRO1 / GROa, CXCL2 / GRO2, CXCL3 / GRO3, CXCL4 / PF4, CXCL5 / ENA-78, CXCL6 / GCP-2, CXCL7 / NAP- CXCL10 / IP-10, CXCL11 / I-TAC, CXCL12 / SDF-1, CXCL13 / BCA-1, CXCL14 / BRAK, CXCL15, CXCL16, CXCL17 / DMC, CCL1, CCL2 / MCP- CCL4 / MCP-4, CCL4 / MCP-2, CCL9 / MIP-1 ?, CCL5 / RANTES, CCL6 / C10, CCL7 / MCP-3, CCL8 / MCP-2, CCL9 / CCL10, CCL11 / 1, CCL15 / MIP-5, CCL16 / LEC, CCL17 / TARC, CCL18 / MIP-4, CCL19 / MIP-3 ?, CCL20 / MIP-3 ?, CCL21 / SLC, CCL22 / MDC, CCL23 / MPIF1, CCL24 / Thaksin -2,2 include CCL25 / TECK, CCL26 / eotaxin -3, CCL27 / CTACK, CCL28 / MEC, CL1, CL2, CX 3 CL1, and combinations thereof.
성장 인자의 비제한적 예는 상피 성장 인자 (EGF), 헤파린-결합 상피 성장 인자 (HB-EGF), 혈관 내피 성장 인자 (VEGF), 색소 상피-유래 인자 (PEDF; 또한 SERPINF1 로도 공지됨), 엠피레귤린 (AREG; 또한 신경초종-유래 성장 인자 (SDGF) 로도 공지됨), 염기성 섬유모세포 성장 인자 (bFGF), 헤파토사이트 성장 인자 (HGF), 형질전환 성장 인자-α (TGF-α), 형질전환 성장 인자-β (TGF-β1, TGF-β2, TGF-β3 등), 엔도텔린-1 (ET-1), 케라티노사이트 성장 인자 (KGF; 또한 FGF7 로도 공지됨), 골 형성 단백질 (예를 들어, BMP1-BMP15), 혈소판-유래 성장 인자 (PDGF), 신경 성장 인자 (NGF), β-신경 성장 인자 (β-NGF), 신경영양 인자 (예를 들어, 뇌-유래 신경영양 인자 (BDNF), 뉴로트로핀 3 (NT3), 뉴로트로핀 4 (NT4) 등), 성장 분화 인자-9 (GDF-9), 과립구-콜로니 자극 인자 (G-CSF), 과립구-대식세포 콜로니 자극 인자 (GM-CSF), 마이오스타틴 (GDF-8), 에리트로포이에틴 (EPO), 트롬보포이에틴 (TPO), 및 이의 조합을 포함한다.Non-limiting examples of growth factors include epithelial growth factor (EGF), heparin-binding epithelial growth factor (HB-EGF), vascular endothelial growth factor (VEGF), pigment epithelium-derived factor (PEDF; also known as SERPINF1) (AGF), regulatory (AREG), also known as schwannoma-derived growth factor (SDGF), basic fibroblast growth factor (bFGF), hepatocyte growth factor (HGF), transforming growth factor- (ETF-1), keratinocyte growth factor (KGF; also known as FGF7), osteogenic proteins (e.g., TGF-beta1, TGF- (Eg, BMP1-BMP15), platelet-derived growth factor (PDGF), nerve growth factor (NGF), β-nerve growth factor BDNF), neurotrophin 3 (NT3), neurotrophin 4 (NT4), etc.), growth differentiation factor-9 (GDF-9), granulocyte colony stimulating factor (G-CSF), granulocyte macrophage colony stimulating factor ( GM-CSF), myostatin (GDF-8), erythropoietin (EPO), thrombopoietin (TPO), and combinations thereof.
수용체 구성물-기재 또는 융합 단백질-기재 생물제제의 예는 비제한적으로, 면역글로불린 프레임에 연결된 자연 발생적 수용체, 예를 들어, Orencia® (아바타셉트 (abatacept); 면역글로빈 CTLA-4 융합 단백질), Amevive® (알레파셉트 (alefacept); IgG1 융합 단백질), ENBRELTM (에타네르셉트 (etanercept); 재조합 인간 TNF-수용체 융합 단백질), 두 가지 상이한 폴리펩티드 종류를 조합한 조작 단백질 (예를 들어, Ontak® (데니류킨 디프티톡스 (denileukin diftitox); 인터류킨-2 및 디프테리아 (diphtheria) 독소를 포함하는 조작 단백질), 및 이의 조합을 포함한다.Examples of receptor construct-based or fusion protein-based biological agents include, but are not limited to, naturally occurring receptors linked to immunoglobulin frames such as Orencia® (abatacept; immunoglobulin CTLA-4 fusion protein), Amevive® (Alefacept; an IgG1 fusion protein), ENBREL ™ (etanercept; a recombinant human TNF-receptor fusion protein), an engineered protein combining two different polypeptide classes (for example, Ontak® Denileukin diftitox; an engineered protein comprising an interleukin-2 and a diphtheria toxin), and combinations thereof.
그러므로 본 발명은 하기 중 하나 이상을 포함하는, 본원 및 표 1 에서 나타낸 질환 또는 장애 중 하나 이상에 대한 생물학적 치료요법을 받는 대상체로부터의 시료에서의 항-TNFα 약물 치료제와 같은 생물제제에 대한 중화 및 비-중화 자가항체의 존재 또는 수준을 검출 및 측정하는 방법에서 사용될 수 있다:Therefore, the present invention relates to a method for neutralizing and / or treating a biological agent, such as an anti-TNFa drug treatment, in a sample from a subject receiving a biotherapeutic treatment for one or more of the diseases or disorders listed herein and in Table 1, Can be used in methods of detecting and measuring the presence or level of non-neutralizing autoantibodies:
염증성 질환, 예컨대 염증성 장 질환 (IBD) (예를 들어, 크론병 (CD) 및 궤양성 대장염 (UC)), 포도막염, 유육종증, 베게너 육아종증 및 중심 특징으로서 염증을 갖는 기타 질환;Inflammatory diseases such as inflammatory bowel disease (IBD) (e.g., Crohn's disease (CD) and ulcerative colitis (UC)), uveitis, sarcoidosis, Wegener's granulomatosis and other diseases with inflammation as a central feature;
자가면역 질환, 예컨대 류마티스 관절염 (RA), 다발성 경화증 (MS), 전신 홍반성 낭창 (SLE), 강직성 척추염 (베크테레프병 (Bechterew's disease)), 루푸스, 건선성 관절염, 소아 특발성 관절염, 건선 및 홍반; The present invention relates to the use of a compound of formula (I) or a pharmaceutically acceptable salt or solvate thereof for the manufacture of a medicament for the treatment of autoimmune diseases such as rheumatoid arthritis (RA), multiple sclerosis (MS), systemic lupus erythematosus (SLE), ankylosing spondylitis (Bechterew's disease), lupus, Erythema;
암, 예컨대 소화기 및 위장암 (예를 들어, 직장암, 소장 (작은 창자) 암; 위장관 기질 종양, 위장관 유암종, 결장암, 직장암, 항문암, 담관암, 위암 (gastric (stomach) cancer); 식도암; 충수암 등); 쓸개암; 간암; 췌장암; 유방암; 폐암 (예를 들어, 비-소세포 폐암); 전립선암; 난소암; 신장암 (예를 들어, 신세포암); 중추신경계 암; 피부암; 융모암; 두경부암; 혈액학상 악성종양 (예를 들어, 백혈병, 림프종 예컨대 B-세포 비-호지킨 림프종); 골육종 (예를 들어, 에윙 육종); 연조직 육종 (예를 들어, 융기성 피부섬유육종 (DFSP), 횡문근육종); 기타 연조직 악성종양 및 유두상 갑상선암;Cancer, such as gastrointestinal cancer and gastrointestinal cancer (e.g., rectal cancer, small intestine cancer, gastrointestinal stromal tumor, gastrointestinal carcinoma, colon cancer, rectal cancer, gastric (stomach) cancer, Etc); Gall bladder cancer; Liver cancer; Pancreatic cancer; Breast cancer; Lung cancer (e.g., non-small cell lung cancer); Prostate cancer; Ovarian cancer; Kidney cancer (e.g., renal cell carcinoma); Central nervous system cancer; cutaneous cancer; Choriocarcinoma; Head and neck cancer; Hematological malignancies (e.g., leukemia, lymphoma such as B-cell non-Hodgkin's lymphoma); Osteosarcoma (e. G., Ewing sarcoma); Soft tissue sarcoma (e.g., dermal fibrosarcoma (DFSP), rhabdomyosarcoma); Other soft tissue malignancies and papillary thyroid cancer;
감염성 질환, 예컨대 C. 디피실레 (C. difficile) 질환, 호흡기 세포융합 바이러스 (RSV), HIV, 탄저병, 칸디다증, 스타필로코쿠스 감염 및 C 형 감염; Infectious diseases, such as C. difficile silane (C. difficile) disorders, respiratory syncytial virus (RSV), HIV, anthrax, candida, Staphylococcus infection and hepatitis C;
혈액 장애, 예컨대 패혈증, 패혈증성 쇼크, 발작야간혈색소뇨증 및 용혈성 요독증 증후군;Blood disorders such as sepsis, septic shock, seizure haemagglutination and hemolytic uremic syndrome;
심혈관 질환, 예컨대 죽상동맥경화증, 급성 심근경색증, 심폐 바이패스 및 협심증;Cardiovascular diseases such as atherosclerosis, acute myocardial infarction, cardiopulmonary bypass and angina pectoris;
대사 장애, 예컨대 당뇨병, 예를 들어, I 형 당뇨병;Metabolic disorders such as diabetes, for example, type I diabetes;
유전 장애, 예컨대 발작야간혈색소뇨증 (PNH);Genetic disorders such as seizure night hemochioroencephalopathy (PNH);
신경 장애, 예컨대 골관절염 통증 및 알츠하이머병;Neurological disorders such as osteoarthritis pain and Alzheimer's disease;
호흡기 장애, 예컨대 천식, 만성 폐쇄성 폐 질환 (COPD), 비용종 (nasal polyposis) 및 소아 천식;Respiratory disorders such as asthma, chronic obstructive pulmonary disease (COPD), nasal polyposis and pediatric asthma;
피부 질환, 예컨대 만성 중등도에서 중증 판상형 건선을 포함하는 건선; Psoriasis including psoriasis, such as chronic moderate to severe psoriasis;
이식 거부, 예컨대 급성 콩팥 이식 거부, 심장 및 간 이식 거부의 역전 (reversal), 신장 이식 거부의 방지, 급성 콩팥 이식 거부의 예방, 및 신장 이식 거부; 및/또는 Transplant rejection, such as acute renal transplant rejection, reversal of heart and liver transplant rejection, prevention of renal transplant rejection, prevention of acute renal transplant rejection, and kidney transplant rejection; And / or
기타 장애, 예컨대 콩팥 염증, 폐경기후 골다공증 (골 장애), 과호산구 증후군, 호산구성 식도염 및 땅콩 알레르기.Other disorders such as kidney inflammation, postmenopausal osteoporosis (bone disorder), eosinophilic syndrome, eosinophilic esophagitis and peanut allergy.
특정 구현예에서, 대상체는 TNFα-매개 질환 또는 장애, 예를 들어, 자가면역 질환 (예를 들어, 류마티스 관절염) 또는 염증성 질환 (예를 들어, 염증성 장 질환 (IBD) 예컨대 크론병 (CD) 또는 궤양성 대장염 (UC)) 을 갖는다.In certain embodiments, the subject is treated with a TNFa-mediated disease or disorder, e. G., An autoimmune disorder (e. G., Rheumatoid arthritis) or an inflammatory disorder (e. G., Inflammatory bowel disease Ulcerative colitis (UC)).
VI. 실시예VI. Example
본 발명을 특정 실시예에 의해 보다 상세히 기재할 것이다. 하기 실시예는 설명의 목적으로 제공되며, 어떠한 식으로도 본 발명을 제한하는 것으로 의도되지 않는다. 당업자는 본질적으로 동일한 결과를 제공하도록 변화되거나 변형될 수 있는 중요하지 않은 다양한 매개변수를 쉽게 인지할 것이다. The invention will now be described in more detail by means of specific examples. The following examples are provided for illustrative purposes and are not intended to limit the invention in any way. Those skilled in the art will readily recognize a variety of non-critical parameters that may be varied or modified to provide essentially the same result.
2012 년 2 월 16 일에 출원한 PCT 출원 번호 PCT/US2012/025437 은 어떤 목적이든 그 전체가 참조로 본원에 포함된다.PCT Application No. PCT / US2012 / 025437, filed February 16, 2012, is incorporated herein by reference in its entirety for all purposes.
실시예 1. IBD 환자에서의 중화 항-약물 항체 형성을 모니터링하기 위한 신규한 검정의 개발Example 1. Development of a novel assay for monitoring neutralizing anti-drug antibody formation in IBD patients
이 실시예는 표지된 (예를 들어, 형광 표지된) 항-TNFα 약물 및 표지된 TNFα 의 존재 하 크기 배제 크로마토그래피를 사용하여 환자 시료 (예를 들어, 혈청) 에서의 중화 및/또는 비-중화 항-약물 자가항체 (ADA) 의 존재 또는 수준을 검출 또는 측정하기 위한 신규한 동질 검정을 설명한다. 특정 구현예에서, 상기 검정이 유리한데, 저 친화성 ADA 를 제거하는 세정 단계를 필요 없게 하고, 가시 및/또는 IR 스펙트럼에서의 검출을 가능하게 하는 별개의 표지 (예를 들어, 형광단) 를 사용하여 배경 및 혈청 간섭 문제를 감소시키고, 형광 표지 검출의 높은 민감도로 인해 낮은 역가로 환자에서의 중화 및/또는 비-중화 ADA 를 검출하는 능력을 증가시키고, 액체상 반응으로서 발생하여, 그에 따라 ELISA 플레이트와 같은 고체 표면에 대한 부착에 의한 에피토프에 있어서의 어떠한 변화 기회도 감소시키기 때문이다.This example illustrates the use of neutralizing and / or non-neutralizing agents in patient samples (e.g., sera) using size exclusion chromatography in the presence of labeled (e.g., fluorescently labeled) anti- TNF [alpha] Describes a novel homogeneity assay for detecting or measuring the presence or level of neutralizing anti-drug autoantibodies (ADA). In certain embodiments, the assay is advantageous in that a separate label (e. G., Fluorophore), which eliminates the step of rinsing to remove the low affinity ADA and allows detection in the visible and / or IR spectrum To increase the ability to detect neutralized and / or non-neutralized ADA in patients with low reverse owing to the high sensitivity of fluorescent label detection, and to occur as a liquid phase reaction, thereby resulting in an ELISA Because it reduces any chance of change in the epitope by attachment to a solid surface such as a plate.
인플릭시마브 (IFX) 및 아달리무마브 (ADL) 는 염증성 장 질환 (IBD) 의 치료를 위해 처방되는 항-TNF 모노클로날 항체이다. 항-약물 항체 (ADA) 는 종종 치료요법 과정 동안 발달된다. 이들 ADA 의 부분은 중화 항체 (NAb) 이다. ADA 가 약물 약동학에 부정적으로 영향을 주는 한편, NAb 의 존재는 약물의 결합 부위의 차폐를 통한 약물 효능의 손실을 추가적으로 유발할 것이다. 이 실시예는 동질 이동성 변동 검정 (homogenous mobility shift assay (HMSA)) 플랫폼을 기반으로 하여 IFX 치료를 받는 IBD 환자에서의 NAb 의 발달을 모니터링하는 검정을 기술하며, 항체-대-인플릭시마브 (ATI) 성숙 및 NAb 형성 사이의 상관관계를 나타낸다.Infliximab (IFX) and adalimumab (ADL) are anti-TNF monoclonal antibodies that are prescribed for the treatment of inflammatory bowel disease (IBD). Anti-drug antibodies (ADA) are often developed during the course of therapy. Portions of these ADA are neutralizing antibodies (NAb). While ADA negatively affects drug pharmacokinetics, the presence of NAb will additionally cause a loss of drug efficacy through the occlusion of the binding site of the drug. This example describes an assay that monitors the development of NAb in patients with IBD who are receiving IFX therapy based on a homogenous mobility shift assay (HMSA) platform, and tests for antibody-to-infliximab ATI) maturation and NAb formation.
방법: IFX 및 ATI 의 혈청 농도를, 예를 들어 2012 년 2 월 16 일에 출원한 PCT 출원 번호 PCT/US2012/025437 및 PCT 공개 번호 WO 2011/056590 (이들 개시 내용 전체는 어떤 목적이든 본원에 참조로 포함됨) 에서 기재된 바와 같이 HMSA 에 의해 측정하였다. NAb 검정을 위해서, ATI 를 함유하는 환자 혈청을 먼저 산 해리시킨 후, 2 개의 표지된 단백질 (예를 들어, IFX-Alexa488 및 TNF 알파-Alexa532) 을 추가한 후 중화시켰다. 용액을 2% 혈청으로 희석하고, 크기 배제 칼럼 상에 HPLC 에 의해 주입하고, 형광에 의해 복합체를 모니터링하였다. 각각의 스펙트럼에서의 자유 TNF-Alexa532 피크의 곡선하 면적 (AUC) (예를 들어, 플롯 또는 크로마토그램) 을 대조군 및 환자 시료에 대해 산출한 후, NAb 백분율을 산출하였다. 항원 결합을 완전히 차단하는 ATI 를 100% NAb 로서 정의하고, 50% 는 시료에서 동일 비율의 ATI 가 비-NAb 라는 것을 의미하고, 0% 는 모든 ATI 가 비-NAb 라는 것을 의미한다. 75 명의 건강한 자원자로부터의 혈청을 사용하여 기준 범위를 확립하였다. IFX 및 ATI 수준에 대해 스크리닝한 132 명의 남은 IBD 환자 혈청으로부터의 ATI 양성 혈청 시료 (>3.13 U/mL) 을 NAb 에 대해 분석하였다. 풀링한 (pooled) ATI 양성 환자 혈청을 사용하여 양성 대조군을 제작하였다. Methods: Serum concentrations of IFX and ATI are measured, for example, in PCT Application No. PCT / US2012 / 025437 and PCT Publication No. WO 2011/056590, filed Feb. 16, 2012 (the entire disclosures of which are incorporated herein by reference in their entirety for all purposes) ≪ / RTI > as determined by HMSA. For NAb assays, patient serum containing ATI was first acid-dissociated and then neutralized after addition of two labeled proteins (e.g., IFX-Alexa488 and TNFalpha-Alexa532). The solution was diluted with 2% serum, injected by HPLC on a size exclusion column, and the complexes were monitored by fluorescence. The area under the curve (AUC) (e.g., plot or chromatogram) of the free TNF-Alexa532 peak in each spectrum was calculated for the control and patient samples, and the NAb percentage was calculated. ATI completely blocking antigen binding is defined as 100% NAb, 50% means that the same proportion of ATI is non-NAb in the sample, and 0% means that not all ATIs are non-NAb. Serum from 75 healthy volunteers was used to establish baseline ranges. ATI positive serum samples (> 3.13 U / mL) from 132 remaining IBD patient sera screened for IFX and ATI levels were analyzed for NAb. A positive control group was prepared using pooled ATI positive patient serum.
데이터 분석을 위해, 피크 검출 알고리즘을 실험 당 각각의 스펙트럼에서의 모든 피크 및 트로프 (trough) 를 발견하는데 사용한다. 입방체 평활 스플라인 (cubic smoothing spline) 을 각각의 스펙트럼에 맞추고, 피크 및 트로프를 신호의 제 1 파생물에서의 변화로서 정의한다. 피크는 양성에서 음성으로의 스펙트럼의 기울기의 사인 변화이다. 반대로, 트로프는 음성에서 양성으로의 사인 변화로서 정의된다. 자유 TNF-Alexa532 피크의 예측 부위에서의 윈도우 내 최고 피크 (예를 들어, 11.5 내지 13 분) 는 자유 피크 자체인 것으로 선택된다. 검출된 자유 피크 바로 위 및 아래의 트로프는 피크 자체의 상한치 및 하한치를 정의한다. 결합된, 자유 (TNF 및 IFX) 및 음성 대조군 피크 하 면적은 사다리꼴 (trapezoid) 규칙을 사용하여 상기 기재한 한계치 내의 피크 영역을 적분함으로써 발견된다. TNF-Alexa532 피크 영역의 % 를 이후 하기 식을 사용하여 각 시료에 대해 산출한다:For data analysis, a peak detection algorithm is used to find all the peaks and troughs in each spectrum per experiment. A cubic smoothing spline is fitted to each spectrum and the peaks and troughs are defined as changes in the first derivative of the signal. The peak is a change in the sign of the slope of the spectrum from positive to negative. Conversely, a trough is defined as a sine change from negative to positive. The peak in the window at the predicted site of the free TNF-Alexa532 peak (for example, 11.5 to 13 minutes) is chosen to be the free peak itself. The troughs just above and below the detected free peak define the upper and lower limits of the peak itself. The bound, free (TNF and IFX) and negative control peak areas are found by integrating the peak regions within the limits described above using trapezoidal rules. The% of the TNF-Alexa532 peak region is then calculated for each sample using the following equation:
% = [(a-b)/c]*100% = [(a-b) / c] * 100
상기 식 중에서 a = 미상의 시료에서의 TNF-Alexa532 피크의 AUC 이고, b = NAb 음성 대조군으로부터의 TNF-Alexa532 피크의 AUC 이고 (예를 들어, 정상 인간 혈청에서의 IFX-Alexa488 + TNF-Alexa532), c = 정상 인간 혈청에서의 자유 TNF-Alexa532 의 AUC 이다. 산출을 위해서는, 반응 조건을 기준으로 가변적일 수 있으나 "c" 는 100% 로 설정하고 "b" 는 최대한 0% 에 가깝다. "b" 와 "c" 사이의 범위는 민감도의 최대 윈도우를 정의한다. (In IFN-Alexa488 + TNF-Alexa532 in normal human serum), where a = the AUC of the TNF-Alexa532 peak in the untreated sample and b = the AUC of the TNF- Alexa532 peak from the negative NAb negative control , c = the AUC of free TNF-Alexa532 in normal human serum. For calculation, "c" is set to 100% and "b" is as close as possible to 0%, although it can be variable based on reaction conditions. The range between "b" and "c" defines the maximum window of sensitivity.
결과: 본 발명의 NAb 검정은 높은 재현성, 정확도 및 정밀도를 입증한다. 검정 내 및 검정 간 정밀도는 CV 의 20% 미만이고, 검정의 정확도는 25% 미만이다. 본 발명의 NAb 검정으로 수득한 정밀도 및 정확도는 실질적으로 세포-기반 검정 또는 ELISA 보다 양호하다. IFX 약물 내성은 ~6 μg/mL 인 한편, TNFα 는 1.0 ng/mL 초과에서 간섭한다. 풀링한 ATI 양성 환자 혈청으로부터의 양성 대조군을 40-5% NAb 로부터 선형으로 희석한다. 건강한 대조군의 분석은, ≥3% (예를 들어, 3.06%) 의 값으로 복귀하는 시료가 NAb 양성으로 간주된다는 것을 나타낸다. 30 개 초과의 ATI 양성 환자 혈청 시료 (3.12-199.43 U/mL) 을 NAb 에 대해 스크리닝하였고, 132 개의 ATI 양성 환자 혈청 시료 중에서 26 개 (19.7%) 가 NAb 양성이었다 (평균 22.47%, 범위 3.29-51.63%). 60 U/mL 초과의 ATI 수준은 고도 중화 Ab 에 상응한다. NAb 양성 시료의 추가 분석으로, ATI 역가와 NAb 양성률 (positivity) 사이의 선형 상관관계가 밝혀진다. 특히, 도 1 은 NAb % (y-축) 와 ATI 수준 사이에 명백한 관계가 있었다는 것을 설명한다 (스피어만 등위 상관계수 (Spearman Rank Correlation), rho=0.564, p << 0.0001). 도 2 는 60 U/ml 이상의 ATI 농도로 NAb 양성률 (NAb+) 이 예측된다는 것을 설명한다. 민감도 = 77.8%; 특이성 = 98.1%; 오즈비 = 63.6, p << 0.0001, 피셔 정확 검정 (Fisher's Exact Test). 도 3 은 ATI 컷오프 (cutoff) 분석을 설명하며 ATI 가 0.931 의 ROC AUC 를 갖는 NAb 를 예측한다는 것을 입증한다. 진양성률 (TPR) = 민감도; 위양성률 (FPR) = 1 - 특이성. Results: The NAb assay of the present invention demonstrates high reproducibility, accuracy and precision. The inter-and inter-interlaced precision is less than 20% of the CV and the accuracy of the test is less than 25%. The precision and accuracy obtained with the NAb assay of the present invention is substantially better than cell-based assays or ELISAs. IFX drug resistance is ~ 6 μg / mL while TNFα interferes above 1.0 ng / mL. Positive controls from pooled ATI positive patient sera are linearly diluted from 40-5% NAb. Analysis of a healthy control indicates that the sample returning to a value of ≥3% (eg, 3.06%) is considered NAb positive. Twenty-six ATI positive patient serum samples (3.12-199.43 U / mL) were screened against NAb and 26 (19.7%) of the 132 ATI positive patient sera samples were NAb positive (mean 22.47%, range 3.29- 51.63%). ATI levels above 60 U / mL correspond to highly neutralized Ab. Further analysis of NAb-positive samples reveals a linear correlation between ATI titers and NAb positivity. In particular, Figure 1 illustrates that there was a clear relationship between NAb% (y-axis) and ATI levels (Spearman Rank Correlation, rho = 0.564, p << 0.0001). FIG. 2 illustrates that the NAb positive rate (NAb +) is predicted with an ATI concentration of 60 U / ml or more. Sensitivity = 77.8%; Specificity = 98.1%; Oz ratio = 63.6, p << 0.0001, Fisher's Exact Test. Figure 3 illustrates ATI cutoff analysis and demonstrates that ATI predicts NAb with ROC AUC of 0.931. True positive rate (TPR) = sensitivity; False positive rate (FPR) = 1 - specificity.
결론: 약물 및 ADA 수준 이외에, NAb 의 모니터링은 ADA 응답성에 대한 필수 정보를 제공하여 조기 치료 개입의 안내를 도와준다. 이 방법은 임의의 생물학적 치료요법에 대한 ADA 의 분석에 적용될 수 있다. Conclusion: In addition to drug and ADA levels, monitoring of NAb provides essential information about ADA responsiveness and helps guide early intervention interventions. This method can be applied to the analysis of ADA for any biological therapy.
실시예 2. 시간 경과에 따른 중화 항-약물 항체의 형성을 모니터링하기 위한 환자 케이스 연구Example 2. A patient case study to monitor the formation of neutralizing anti-drug antibodies over time
이 실시예는 표지된 (예를 들어, 형광 표지된) 항-TNFα 약물 및 표지된 TNFα 의 존재 하에 크기 배제 크로마토그래피를 이용하여 환자 시료 (예를 들어, 혈청) 에서 중화 및/또는 비-중화 항-약물 자가항체 (ADA) 의 존재 또는 수준을 검출 또는 측정하기 위한 신규한 균일 검정의 추가적인 구현예를 나타낸다. 또한, 이 실시예는 환자가 치료요법으로 진행 중일 때 중화 및/또는 비-중화 항-약물 항체의 형성 및/또는 비-중화로부터 중화 항-약물 항체로의 변동을 모니터링하기 위한 항-TNFα 약물 치료요법에 대한 IBD 환자의 시간 경과 케이스 연구를 증명한다.This example illustrates the use of size exclusion chromatography in the presence of labeled (e. G., Fluorescently labeled) anti-TNFa drug and labeled TNFa to neutralize and / or non-neutralize (e.g., Lt; RTI ID = 0.0 > (ADA) < / RTI > This example also illustrates the use of anti-TNF alpha drugs to monitor changes from neutralizing and / or non-neutralizing anti-drug antibodies formation and / or non-neutralization to neutralizing anti-drug antibodies when the patient is ongoing therapy therapies Demonstrate time-lapse case studies of IBD patients for therapeutic therapy.
1. 약물 및 항-약물 항체 검정 1. Drug and anti-drug antibody assay
도 4 는 본원에 기재된 유체 상 이동성 변동 검정에 의해 ATI (즉, IFX 에 대한 항체; "HACA") 의 검출을 나타낸다. 예를 들어, 444 ng 의 Alexa488 표지된 IFX (100% 혈청 중 18.8 μg/ml) 를 시료 내에 스파이크하여 자유 IFX 를 완패시킨다 (outcompete). 특정 구현예에서, IFX 및 ATI 의 복합체를 함유하는 환자 혈청 시료는 산 해리에 적용될 수 있으며, 산 해리에 의한 평형화 및 표지 첨가 이후 중화가 수행된다.Figure 4 shows the detection of ATI (i.e., antibody to IFX; "HACA") by the fluid phase mobility assay described herein. For example, 444 ng of Alexa488-labeled IFX (18.8 μg / ml in 100% serum) is spiked into the sample to outcompete free IFX. In certain embodiments, patient serum samples containing complexes of IFX and ATI may be applied to acid dissociation, followed by equilibration by acid dissociation and neutralization after addition of the label.
도 5 는 본 발명의 예시적인 ATI/IFX 유체 상 이동성 변동 검정을 나타낸다. 예를 들어, 형광 표지된 인플릭시마브 (IFX-488) 로 평형화된 각종 농도의 ATI (표준물 또는 미지의 것) 를 함유하는 시료를 2% 혈청 중에서 크기 배제 칼럼 상에 주입하였다. 도 5 는 대형 IFX-488/ATI 복합체가 먼저 용출된 후, 이어서 보다 작은 복합체 및 그 다음 미결합된 IFX-488 및 Alexa-488 로딩 대조군이 용출되었음을 나타낸다. 미지의 농도는 표준 곡선으로부터 내삽 (interpolation) 에 의해 구하였다. IFX 의 검출은 유사한 방법론을 따랐다.Figure 5 illustrates an exemplary ATI / IFX fluid phase mobility variability assay of the present invention. For example, samples containing various concentrations of ATI (standard or unknown) equilibrated with fluorescently labeled infliximab (IFX-488) were injected onto size exclusion columns in 2% serum. Figure 5 shows that the larger IFX-488 / ATI complex first eluted and then the smaller complex and then the unbound IFX-488 and Alexa-488 loading controls eluted. The unknown concentration was determined by interpolation from a standard curve. Detection of IFX followed a similar methodology.
2. 중화 및 비-중화 항-약물 항체 검정 2. Neutralizing and non-neutralizing anti-drug antibody test
도 6 및 7 은 형광 표지된 TNFα 의 존재 하에 형광 표지된 항-TNFα 약물에의 이들 자가항체의 결합을 검출하기 위하여 크기 배제 크로마토그래피를 이용하여 ATI 등의 항-약물 항체가 중화 또는 비-중화 자가항체인지 여부를 결정하기 위한 본 발명의 검정을 나타낸다. 한 예시적 구현예에서, 항-TNFα 약물, 예컨대 IFX 은 형광단 "F1" 로 표지되며, 이때 형광단은 가시 및 IR 스펙트럼 중 어느 하나 또는 둘 모두에서 검출될 수 있다. 유사하게, TNFα 는 형광단 "F2" 로 표지되며, 이때 형광단은 가시 및 IR 스펙트럼 중 어느 하나 또는 둘 모두에서 검출될 수 있고, 여기서 "F1" 및 "F2" 는 상이한 형광단이다. 표지된 항-TNFα 약물 및 표지된 TNFα 를 액상 반응으로 인간 혈청과 함께 인큐베이션하여 혈청 내에 존재하는 표지된 항-TNFα 약물 (예를 들어, IFX), 표지된 TNFα, 및/또는 항-약물 항체 (예를 들어, ATI) 간에 복합체 (예를 들어, 면역 복합체) 가 형성되도록 한다.Figures 6 and 7 illustrate the use of size exclusion chromatography to detect binding of these autoantibodies to fluorescently labeled anti-TNFa drugs in the presence of fluorescently labeled < RTI ID = 0.0 > TNFa < / RTI > ≪ / RTI > is an autoantibody. In one exemplary embodiment, the anti-TNF [alpha] drug, e.g., IFX, is labeled with fluorophore "F1 ", wherein the fluorophore may be detected in either or both of the visible and IR spectra. Similarly, TNFa is labeled with a fluorophore "F2 ", wherein the fluorophores can be detected in either or both of the visible and IR spectra, where" F1 " and "F2" The labeled anti-TNF [alpha] drug and the labeled TNF [alpha] are incubated with human serum in a liquid phase reaction to detect the presence of labeled anti-TNF [alpha] drugs (e.g., IFX), labeled TNFa, and / (E. G., ATI) to form a complex (e. G., An immune complex).
인큐베이션 후, 시료를 크기 배제 칼럼 상에 직접 로딩하고, HPLC 이동성 변동 검정에 적용한다. 도 6 은 표지된 항-TNFα 약물 (예를 들어, Alexa488 표지된 IFX; "IFX-488") 에의 항-약물 항체 (예를 들어, ATI) 및 표지된 TNFα (예를 들어, Alexa532 표지된 TNFα; "TNF-532") 둘 모두의 결합 결과 자유 TNF-532 수준이 저하되는 본 발명의 비-중화 항-약물 항체 (ADA) 검정을 나타낸다. 도 7 은 표지된 TNFα (예를 들어, TNF-532) 의 결합 없이 표지된 항-TNFα 약물 (예를 들어, IFX-488) 에의 항-약물 항체 (예를 들어, ATI) 의 결합 결과 TNF-532 대조군과 실질적으로 동량의 자유 TNF-532 수준이 얻어짐을 나타낸다.After incubation, the sample is loaded directly onto the size exclusion column and applied to the HPLC mobility assay. Figure 6 is a graphical representation of an anti-drug antibody (e. G., ATI) and labeled TNFa (e. G., Alexa532 labeled TNFa ; "TNF-532") results in a decrease in free TNF-532 levels. Figure 7 shows the binding of an anti-drug antibody (e. G., ATI) to a labeled anti-TNFa drug (e. G., IFX-488) without binding of the labeled TNF? 532 < / RTI > control and a substantially equivalent amount of free TNF-532 level is obtained.
3. 중화 및 비-중화 항-약물 항체의 모니터링을 위한 시간 경과 연구 3. Time-course study for monitoring neutralizing and non-neutralizing anti-drug antibodies
도 8 - 11 은 본 발명의 이동성 변동 검정을 이용하여 항-약물 항체, 예컨대 ATI 가 중화 또는 비-중화 자가항체인지 여부를 결정하기 위한 UC 환자 케이스 연구로부터의 데이터를 나타낸다. 예를 들어, 도 8 은 1, 2 또는 3 개월째에 취한 5 가지 시료의 시간 경과에 따른 IFX 및 ATI 의 수준을 나타낸다. 도 9 는 시간 경과에 따른 자유 TNFα 의 백분율을 결정하기 위한 피크 분석을 나타낸다. 특히, TNF-532/IFX-488 복합체의 피크 면적을 모든 시료의 자유 표지된 TNFα 면적으로부터 뺀 다음, 자유 TNFα 의 % 를 산출하였다. 특히, 도 9 는 1, 2 또는 3 개월째에 취한 5 가지 시료의 시간 경과에 따른 자유 TNFα 의 수준의 증가를 나타내고 있는데, 이는 중화 자가항체 수준의 증가를 시사한다. 도 10 은 2 또는 3 개월째에 취한 IFX 로 스파이크된 3 가지 시료에서 예시되는 바와 같이 시간 경과에 따른 비-중화 자가항체의 존재로부터 중화 자가항체로의 변동을 나타낸다. "제 1 년 11 월" 시료의 경우, 비-중화 항체는 스파이크된 IFX 에 결합하여 TNF-532 피크의 감소를 보인다. "제 2 년 1 월" 시료의 경우, 중화 항체 (NAb)/비-중화 항체 (Ab) 의 혼합물은 초기 복합체의 수준에 비하여 TNF-532 피크에서 약간의 감소를 나타낸다. ATI 가 거의 완전히 중화됨에 따라 ("제 2 년 4 월" 시료), 높은 IFX 수준은 IFX 에의 ATI 결합을 극복할 수 없어, 모든 TNFα 결합을 막는다. 이와 같이, 도 10 은 IFX 치료요법 과정에 걸치는 동안 ATI 프로파일이 비-중화 ATI 프로파일로부터 중화 ATI 와 비-중화 ATI 의 혼합물을 함유하는 프로파일로, 그 다음 중화 ATI 프로파일로 변동하는 UC 환자 ATI 프로파일을 나타낸다. 도 11 은 IFX 로 스파이크된 시료에서 시간 경과에 따른 자유 TNFα 의 백분율을 결정하기 위한 피크 분석을 나타낸다. 특히, TNF-532/IFX-488 복합체의 피크 면적을 모든 시료의 자유 TNFα 면적으로부터 뺀 후, 자유 TNFα 의 백분율 (%) 을 산출하였다. 특히, 도 11 은 UC 환자로부터 취한 시료의 시간 경과에 따른 자유 TNFα 의 수준의 증가를 나타내고 있는데, 이는 환자가 IFX 치료요법으로 진행 중일 때 중화 자가항체 수준의 증가 및 비-중화 ATI 로부터 중화 ATI 로의 변동을 시사한다.Figures 8-11 show data from a UC patient case study to determine whether an anti-drug antibody, e. G., ATI, is neutralizing or non-neutralizing autoantibodies using the mobility shift assay of the present invention. For example, Figure 8 shows the levels of IFX and ATI over time for five samples taken at 1, 2 or 3 months. Figure 9 shows a peak analysis for determining the percentage of free TNF [alpha] over time. Specifically, the peak area of the TNF-532 / IFX-488 complex was subtracted from the free labeled TNF alpha area of all samples, and then the% of free TNFα was calculated. In particular, Figure 9 shows an increase in the level of free TNF [alpha] over time for the five samples taken at 1, 2 or 3 months, suggesting an increase in neutralizing antibody levels. Figure 10 shows the variation from the presence of non-neutralizing autoantibodies to neutralizing autoantigens over time as illustrated in the three samples spiked with IFX taken at 2 or 3 months. In the "First Year of November" sample, the non-neutralizing antibody binds to spiked IFX and shows a decrease in TNF-532 peak. For the "second year of January" sample, the mixture of neutralizing antibody (NAb) / non-neutralizing antibody (Ab) shows a slight decrease in the TNF-532 peak relative to the level of the initial complex. As ATI is almost completely neutralized (the "April 2" sample), high IFX levels can not overcome the ATI binding to IFX and block all TNFα binding. Thus, Figure 10 shows that the ATI profile during the course of the IFX therapy regimen is a profile containing a mixture of neutralized ATI and non-neutralized ATI from a non-neutralized ATI profile, followed by a neutralized ATI profile, . Figure 11 shows a peak analysis for determining the percentage of free TNF [alpha] over time in IFX-spiked samples. Specifically, the percentage of free TNFα was calculated after subtracting the peak area of the TNF-532 / IFX-488 complex from the free TNFα area of all samples. In particular, Figure 11 shows an increase in the level of free TNF [alpha] over time for samples taken from patients with UC, indicating that the neutralizer increases antibody levels from non-neutralized ATI to neutralized ATI when the patient is undergoing IFX therapy Suggests a change.
도 12 -14 는 본 발명의 이동성 변동 검정을 이용하여 수행된 각종 대조군을 나타낸다. 특히, 도 12 는 비-중화 항체 (Ab) 대조군으로서의 토끼 항-인간 IgG1 Fc 의 용도를 나타낸다. 도 13 은 혼합 중화 항체 (NAb)/비-중화 항체 (Ab) 대조군으로서의 ATI 양성 혈청의 용도를 나타낸다. 도 14 는 ATI 양성 혈청으로부터의 ATI 정제 결과 약 친화성 NAb 의 손실을 나타낸다. 도 15 는 이들 각종 대조군에서 자유 TNFα 의 백분율을 결정하기 위한 UC 환자 케이스 연구로부터의 피크 분석을 나타낸다. 특히, TNF-532/IFX-488 복합체의 피크 면적을 모든 시료의 자유 TNFα 면적으로부터 뺀 다음 자유 TNFα 의 백분율 (%) 을 산출하였다.Figures 12-14 show various control groups performed using the mobility variability assay of the present invention. In particular, Figure 12 shows the use of rabbit anti-human IgGl Fc as a non-neutralizing antibody (Ab) control. Figure 13 shows the use of ATI positive sera as a mixed neutralizing antibody (NAb) / non-neutralizing antibody (Ab) control. Figure 14 shows the loss of weak affinity NAb as a result of ATI purification from ATI positive sera. Figure 15 shows a peak analysis from a UC patient case study to determine the percentage of free TNFa in these various control groups. Specifically, the peak area of the TNF-532 / IFX-488 complex was subtracted from the free TNF alpha area of all samples and then the percentage of free TNF alpha was calculated.
도 16 - 18 은 본 발명의 이동성 변동 검정을 이용하여 항-약물 항체, 예컨대 ATI 가 중화 또는 비-중화 자가항체인지 여부를 결정하기 위한 CD 환자 케이스 연구로부터의 데이터를 나타낸다. 예를 들어, 도 16 은 30 주 기간 동안 7 또는 8 주째 취한 4 가지 시료의 시간 경과에 따른 자유 TNFα 의 백분율을 결정하기 위한 CD 환자 케이스 연구로부터의 피크 분석을 나타낸다. 또한, 도 17 은 50 주 기간 동안 취한 3 가지 시료의 시간 경과에 따른 자유 TNFα 의 백분율을 결정하기 위한 또 다른 CD 환자 케이스 연구로부터의 피크 분석을 나타낸다. 또한, 도 18 은 치료요법의 유도 또는 유지 동안 또는 이후 특정 주에 시료 내 자유 TNFα 의 백분율을 결정하기 위한 4 가지 추가 CD 환자 케이스 연구로부터의 피크 분석을 나타낸다.Figures 16-18 show data from a CD patient case study to determine whether an anti-drug antibody, e. G. ATI, is neutralizing or non-neutralizing autoantibodies using the mobility shift assay of the present invention. For example, Figure 16 shows a peak analysis from a CD patient case study to determine the percentage of free TNF [alpha] over time for four samples taken at 7 or 8 weeks for a 30 week period. Figure 17 also shows a peak analysis from another CD patient case study to determine the percentage of free TNFa over time for the three samples taken over a 50 week period. Figure 18 also shows peak analysis from four additional CD patient case studies to determine the percentage of free TNF [alpha] in a sample during induction or maintenance of therapeutic regimens, or after certain weeks.
실시예 3: HPLC 이동성 변동 경쟁적 리간드-결합 검정을 통한 중화 항체 (NAb) 활성의 검출Example 3: HPLC mobility variation Detection of neutralizing antibody (NAb) activity through competitive ligand-binding assays
이 실시예는 HPLC 크기 배제 크로마토그래피 검정을 이용한 환자 시료 (예를 들어, 혈청) 내 중화 및/또는 비-중화 항-약물 자가항체 (ADA) 의 존재 또는 수준을 검출 또는 결정하기 위한 신규한 균일 검정의 또다른 추가적인 구현예를 나타낸다. 또한, 이 실시예는 다른 항-TNF 약물 등의 대안적인 생물학적 약물과의 NAb 의 교차-반응성을 예측 및/또는 결정하기 위한 방법을 나타낸다.This example describes a novel homogeneous assay for detecting or determining the presence or level of neutralizing and / or non-neutralizing anti-drug autoantibodies (ADA) in a patient sample (e.g., serum) using HPLC size exclusion chromatography assays Another additional implementation of the test is shown. This example also illustrates a method for predicting and / or determining the cross-reactivity of NAb with alternative biological drugs such as other anti-TNF drugs.
일부 구현예에서, 면역원성 시험에 대한 다중 단계 (multi-tiered) 접근법은 우선 신속하고 민감한 스크리닝 검정에 의해 약물 및 항-약물 항체 둘 모두를 스크리닝하는 것을 포함한다. 이러한 접근법은 FDA 및 EMEA 둘 모두에 의해 추천되며, 환자 1 명당 대규모 임상 시험 및 다중의 시점을 위한 유용한 관리 수단이다. ADA, 예컨대 ATI 의 존재를 확인한 후, 환자 시료를 상당히 부정적인 임상적 결과를 가질 수 있는 중화 항체의 존재에 관해 추가 조사한다. 중화 항체는 활성 부위에 또는 그 근방에 결합함으로써 또는 구조 변화를 유발함으로써 생물학적 활성을 방해하여, 효능 손실을 야기한다. ATI 를 포함하는 시료는 또한 아형 및 에피토프 특이성에 대하여 스크리닝될 수 있다. 환자들의 임상적 응답성을 ADA 발달 전후에 제품과 비교하는 것은 ADA 발달 (및 항체 특징) 및 임상적 응답성 간의 상호관계에 관한 정보를 제공할 수 있다.In some embodiments, a multi-tiered approach to immunogenicity testing involves first screening both drug and anti-drug antibodies by rapid and sensitive screening assays. This approach is recommended by both FDA and EMEA and is a useful management tool for large-scale clinical trials and multiple views per patient. After confirming the presence of ADA, such as ATI, the patient sample is further investigated for the presence of neutralizing antibodies which may have significant negative clinical results. Neutralizing antibodies interfere with biological activity by binding to or near the active site or by inducing structural changes, resulting in loss of efficacy. Samples containing ATI can also be screened for subtype and epitope specificity. Comparing patients' clinical responses to those before and after ADA development can provide information on the interrelationships between ADA development (and antibody characteristics) and clinical response.
HPLC 이동성 변동 검정을 이용하는 NAb 검정은 본원에 개시된 바와 같이 발달되었다. 특정 구현예에서, 다중 단계 접근법 또는 시험은 이하의 단계 중 임의의 1 개, 2 개, 또는 3 개 모두를 포함하거나 이로 이루어진다: (1) 시료가 NAb 양성 (정상 인간 혈청의 분석으로부터 확립된 절단점 (cutpoint) 에 기초하는 예/아니오) 인지 여부를 정성적으로 결정하기 위한 스크리닝; (2) 시료가 NAb 양성인지를 예컨대 면역경쟁 및/또는 면역결핍을 이용하여 확인하는 것; 및/또는 (3) 대안적인 생물학적 약물과의 NAb 의 교차-반응성을 예측 및/또는 결정하는 것.NAb assays using HPLC mobility variability assays were developed as disclosed herein. In certain embodiments, a multi-step approach or test comprises or consists of any one, two, or all of the following steps: (1) the sample is incubated with a NAb positive (cut from an assay of normal human serum Screening to qualitatively determine whether the data is yes or no based on a cutpoint; (2) identifying whether the sample is NAb positive using, for example, immune competition and / or immunodeficiency; And / or (3) predicting and / or determining the cross-reactivity of NAb with an alternative biological drug.
I. 스크리닝 단계I. Screening steps
환자 시료는 ADA 에 대해 양성으로서 확인된 후, NAb 에 대해 스크리닝될 수 있다. 특정 양태에서, ADA 의 하위집단은 NAb 이다. 특정 구현예에서, ADA (예를 들어, IFX 에 대한 항체, 또한 "ATI" 또는 "HACA" 로서도 알려짐) 를 함유하는 환자 혈청을 먼저 HPLC 물 중에서 1 시간 동안 실온 (RT) 에서 0.5 M 시트르산으로 산 해리시킨다. 시료를 96 웰 플레이트에서 제조하여 플레이트 진탕기 상에서 암소에서 인큐베이션을 수행하다. 다음으로, 2 개의 표지된 단백질 (예를 들어, 0.1% BSA 를 함유하는 HPLC 물 중의 약물-Alexa488 (예를 들어, IFX-Alexa488) 및 TNFα-Alexa532) 을 첨가한다. 시료를 10X PBS, pH 7.3 를 첨가함으로써, 및 플레이트 쉐이커 상에서 1 시간 동안 RT 에서 암소에서 인큐베이션함으로써 중화한다. 시료를 추가의 10X 완충액 및 HPLC 물을 이용해 2% 혈청으로 희석한다. 그 후, 시료를 크기 배제 칼럼 상의 HPLC 에 의해 주입한다. 상이한 크기의 복합체 또는 종을 분리하여 형광에 의해 예컨대 자유 TNFα-Alexa532 ("TNF532"), 자유 IFX-Alexa488 ("IFX488"), TNF532/IFX488 복합체, TNF532/IFX488/ATI 복합체 (비-중화 Ab), 및 ATI/IFX488 복합체 (NAb) 를 모니터링한다. 결과를 정상 인간 혈청으로부터 확립된 컷오프 (예를 들어, 3.06% NAb 의 기준 범위) 에 따라 음성 (예를 들어, 도 12, 19 참조) 및 양성 (예를 들어, 도 13 참조) 대조군과 비교한 후, 시료를 NAb 에 대한 양성 또는 음성으로서 지정할 수 있고, 역가를 구할 수 있다.The patient sample can be screened against NAb after being identified as positive for ADA. In certain embodiments, the subset of ADA is NAb. In certain embodiments, patient serum containing ADA (e.g., an antibody to IFX, also known as "ATI" or "HACA") is first incubated in HPLC water for 1 hour at room temperature (RT) with 0.5 M citric acid Dissociate. Samples were prepared in 96 well plates and incubated in the dark on a plate shaker. Next, two labeled proteins (e. G., Alexa488 (e. G., IFX-Alexa488) and TNFa-Alexa532 in HPLC water containing 0.1% BSA) are added. The sample is neutralized by adding 10X PBS, pH 7.3, and incubating in a dark place on a plate shaker for 1 hour at RT. Samples are diluted with 2% serum with additional 10X buffer and HPLC water. The sample is then injected by HPLC on a size exclusion column. (TNF532), free IFX-Alexa488 (IFX488), TNF532 / IFX488 complex, TNF532 / IFX488 / ATI complex (non-neutralized Ab) , And ATI / IFX488 complex (NAb). Results are compared to negative (see, e.g., Figures 12 and 19) and positive (see, e.g., Figure 13) control groups according to cutoffs established from normal human serum (e.g., a baseline range of 3.06% NAb) , The sample can be designated as positive or negative for NAb, and potency can be determined.
도 19 는 이동성 변동 검정을 통한 비-중화 항체 활성의 검출을 나타낸다. TNF532 와 IFX488 의 조합시, 대략 8 분의 체류 시간으로의 변동이 존재하는데, 이는 고분자량 복합체의 형성을 시사한다. 자유 IFX-488 피크 (대략 10.5 분) 는 완전히 사라지고, 자유 TNF-532 피크 (대략 12 분) 도 또한 거의 완전히 사라진다 (ATI/IFX/TNF 3 원 복합체의 형성을 시사함). IFX 의 활성 부위로부터 결합해 나간 비-중화 Ab 는 유사한 패턴을 따른다. 마우스 모노클로날 항체 (예를 들어, 대략 7 분) 는 경우에 따라 수행한다.Figure 19 shows the detection of non-neutralizing antibody activity through mobility variation assays. Upon combination of TNF532 and IFX488, there is variation in retention time of approximately 8 minutes, suggesting the formation of high molecular weight complexes. The free IFX-488 peak (approximately 10.5 min) completely disappeared and the free TNF-532 peak (approximately 12 min) also almost completely disappeared (suggesting the formation of the ATI / IFX / TNF ternary complex). Non-neutralizing Ab bound from the active site of IFX follows a similar pattern. Mouse monoclonal antibodies (e.g., approximately 7 minutes) are optionally performed.
도 13 은 이동성 변동 검정을 통한 중화 항체 활성의 검출을 나타낸다. 완전 중화 Ab 는 (예컨대 활성 부위의 차단에 인해) IFX 의 TNF 에의 결합 능력을 막는다. 이는 크로마토그램에서 고분자량 종의 형성과 함께 IFX-488 피크의 사라짐으로서 확인된다. TNF-532 피크는 변하지 않을 것이다. 실제로, 대부분의 환자들은 도 13 에서의 환자 혈청 풀에서 보이는 바와 같이 비-중화/중화 Ab 의 조합을 경험한다 (ATI 양성 혈청 (Pos. Serum), 검은색 실선). 개선된 NAb 양성 대조군으로서의 IFX/Humira의 F(ab')2 단편에 대항한 토끼 다중클론 항체가 또한 유용하다.Figure 13 shows the detection of neutralizing antibody activity through mobility variation assays. A fully neutralized Ab prevents the binding ability of IFX to TNF (e.g., due to blocking of the active site). This is confirmed by the disappearance of the IFX-488 peak along with the formation of high molecular weight species in the chromatogram. The TNF-532 peak will not change. Indeed, most patients experience a combination of non-neutralizing / neutralizing Ab as shown in the patient serum pool in Figure 13 (Pos. Serum, black solid line). Rabbit polyclonal antibodies against IFN / Humira F (ab ') 2 fragments as an improved NAb positive control are also useful.
도 8 은 IFX 치리 과정에서 환자에 있어서 시간 경과에 따른 NAb 응답성의 발달을 나타낸다. 이들은 모든 시점에서 ATI 에 대해 양성이나, NAb 가 발달되는 제 2 년 1 월 (밝은 회색 화살표, 위에서 3 번째 ~12 분) 시점까지 그런 것은 아니다. ATI/IFX-488 복합체는 약간 상이한 체류 시간 (~7.8 분) 으로 변동하는데, 이는 TNF532/IFX488/ATI 의 복합체 (~8.2 및 8.8 분) 와 비교하여 크기가 상이한 복합체를 시사한다. 무관한 단백질에 대비한 추가 IFX 존재 하의 중화 활성의 확인 (면역경쟁) 이 또한 행해질 수 있다. 이러한 환자는 치료 조정을 위한 이상적인 후보일 수 있다.Figure 8 shows the development of NAb responsiveness over time in patients during IFX treatment. They are positive for ATI at all times, but not until the second January (light gray arrow, third to 12 minutes above) when the NAb develops. The ATI / IFX-488 complexes vary in slightly different residence times (~ 7.8 minutes), suggesting complexes of different sizes compared to the complexes of TNF532 / IFX488 / ATI (~ 8.2 and 8.8 minutes). Confirmation of neutralizing activity in the presence of additional IFX as opposed to irrelevant protein (immune competition) can also be done. Such a patient may be an ideal candidate for treatment adjustment.
도 9 는 자유 TNF 피크의 잔존률 % 의 AUC 의 바 그래프로서 데이터를 플롯팅한 것으로서, 시간 경과에 따라 환자가 NAb 를 발달시키고 있는지를 명확히 입증해준다. 심지어 이른 시점에서 관찰된 낮은 수준의 NAb 발달은 질환 재발을 예측할 수 있는데; 이러한 활성을 나타내는 환자에 대해서는 치료 조정이 요구된다. 예를 들어, 환자는 기존의 항-TNF 약물을 섭취하면서 메토트렉세이트 (MTX) 또는 아자티오프린 (AZA) 등의 하나 이상의 면역억제제로 다루어져야 하고/하거나 상이한 항-TNF 약물로 전환되어야 한다.Figure 9 plots the data as a bar graph of the AUC of the percent survival of the free TNF peak, demonstrating clearly that the patient develops NAb over time. Even low-level NAb development observed at an early point can predict disease recurrence; Treatment adjustment is required for patients exhibiting this activity. For example, a patient should be treated with one or more immunosuppressive agents, such as methotrexate (MTX) or azathioprine (AZA), and / or converted to a different anti-TNF drug, while ingesting existing anti-TNF drugs.
II. 확인 단계II. Check step
확인 단계에서, 약물 (예를 들어, 항-TNFα 항체) 을 각종 농도 (예를 들어, 1 - 50 μg/mL) 의 시료에 스파이크하여 시료의 중화 능력을 결정한다. 병행하여, 비-특이적 IgG 를 유사한 수준으로 스파이크한다. 약물로 스파이크된 시료는 약물에 대한 투여량 응답을 나타내어야 하며, NAb 의 EC50 이 산출될 수 있다. 비-특이적 IgG 는 효과를 갖지 않아야 한다. 필요한 경우, 매트릭스의 효과를 배제시키기 위하여 면역결핍이 또한 수행될 수 있다.In the identification step, the drug (e. G., Anti-TNFa antibody) is spiked to samples of various concentrations (e. G. 1-50 pg / mL) to determine the ability of the sample to neutralize. In parallel, non-specific IgG is spiked to similar levels. The sample spiked with the drug should show the dose response for the drug and the EC50 of NAb can be calculated. Non-specific IgG should have no effect. If necessary, immunodeficiency may also be performed to exclude the effect of the matrix.
도 10 은 IFX 로 스파이크된 2 또는 3 개월째에 취한 3 가지 시료에서 예시되는 바와 같이 시간 경과에 따른 비-중화 자가항체로부터의 중화 자가항체로의 존재 변동을 나타낸다. 각 시점으로부터의 환자 혈청은 스파이크된 IFX 에 응답하는데, 이는 반응의 특이성을 나타낸다. 시간 경과에 따라, NAb 는 더욱 중화되어, 마침내 > 20μg/mL IFX 를 중화할 수 있다 (제 2 년 4 월 시료는 IFX 가 스파이크되지 않을 경우 저하되지 않는다). 각 시점에서의 NAb 의 EC50 을 결정하기 위해 완전 적정이 수행될 수 있다.Figure 10 shows the variation in the presence of neutralizing autoantibodies from non-neutralizing autoantibodies over time as illustrated in the three samples taken at 2 or 3 months spiked with IFX. The patient serum from each time point responds to spiked IFX, indicating the specificity of the reaction. Over time, the NAb becomes more neutral and can finally neutralize> 20 μg / mL IFX (the second April sample does not deteriorate if the IFX is not spiked). A full titration can be performed to determine the EC50 of NAb at each time point.
III. 교차-반응성 단계III. Cross-reactive step
교차-반응성 단계는 환자가 예컨대 항-TNFα 약물 또는 치료요법과 같은 약물 또는 치료요법에 응답할 것인지 여부를 예측하는데 있어서 특히 유용하다.The cross-reactive step is particularly useful in predicting whether a patient will respond to a drug or therapeutic regimen, such as an anti-TNFa drug or therapeutic regimen.
일부 구현예에서, 본 발명은 항-약물 항체 (ADA) 의 일련의 상이한 항-TNF 치료제와 교차-반응하는 능력에 기초하여 환자 (예를 들어, 크론병, 궤양성 대장염, 또는 류마티스 관절염 환자) 에 있어서 치료 약물이 작용할 것인지 작용하지 않을 것인지를 빠르게 결정하는 방법을 제공한다. 비제한적 예로서, 하나 이상의 이하의 약물을 Remicade (인플릭시마브); Enbrel (에타네르셉트); Humira (아달리무마브); Cimzia (세르톨리주마브 페골); 및 Simponi (골리무마브) 에 대한 NAb 를 갖는 환자 (예를 들어, 크론병, 궤양성 대장염, 또는 류마티스 관절염 환자) 에서 시험할 수 있다. 특정 약물 (예를 들어, IFX) 에 의한 NAb 에 대한 양성 시험 후, 상기 기재된 초기 NAb 시험 방법을 이용하여 일련의 다른 약물 (예를 들어, 형광-표지된 약물) 에 의해 NAb 검정을 수행할 수 있다.In some embodiments, the invention provides a method of treating a patient (e.g., Crohn's disease, ulcerative colitis, or a rheumatoid arthritis patient) based on the ability to cross-react with a series of different anti-TNF therapeutic agents of an anti- Lt; RTI ID = 0.0 > and / or < / RTI > As a non-limiting example, one or more of the following drugs may be administered: Remicade (infliximab); Enbrel (etanercept); Humira (Adalmumab); Cimzia (Sartorius marbella); And patients with NAb for Simponi (collimate) (e.g., patients with Crohn's disease, ulcerative colitis, or rheumatoid arthritis). After a positive test for NAb by a particular drug (e. G., IFX), NAb assays may be performed by a series of other drugs (e. G., Fluorescence-labeled drug) using the initial NAb test method described above have.
본 발명의 예측 시험은 환자의 항체에 의해 중화될 약물 (예를 들어, 항-TNFα 약물) 의 사용을 막음으로써 환자 치료의 관리에 있어 유용하다. 임의의 특정 이론에 구속됨 없이, 중화 ADA 의 결합 부위의 순서는 아마도 TNFα 와 유사한 방식으로 발달되었을 것이다 (도 20 참조). NAb 가 임의의 다른 항-TNF 약물을 중화한다면, 다른 항-TNF 약물 이외의 것들은 아마도 환자가 면역 응답성을 가질 것이기 때문에 이미 투여된 약물의 불량한 대안일 것이다. 일부 구현예에서, 정상 인간 혈청으로부터 확립된 컷오프는 환자로부터의 시험 시료가 양성 또는 음성인지 여부를 결정하는데 이용될 수 있다. 상기 시험은 실험실내 세팅으로 빠르고 비용-효과적인 방식으로 실시될 수 있다.The predictive test of the present invention is useful in the management of patient care by preventing the use of drugs (e.g., anti-TNF alpha drugs) to be neutralized by the antibody of the patient. Without being bound by any particular theory, the sequence of the binding sites of neutralizing ADA would probably have been developed in a manner similar to TNFa (see FIG. 20). If the NAb neutralizes any other anti-TNF drug, other than the other anti-TNF drug will probably be a poor alternative to the drug already administered since the patient will have immune response. In some embodiments, the cutoff established from normal human serum can be used to determine whether the test sample from the patient is positive or negative. The test can be conducted in a fast and cost-effective manner with laboratory settings.
이하의 비제한적 케이스 연구는 Remicade (인플릭시마브) 로 치료되었으나, 이후 Remicade 에 대한 응답성이 결실된 환자 1 및 2 를 포함하였다. 환자 1 은 UC 환자였고, 환자 2 는 CD 환자였다. 본원에 기재된 이동성 변동 검정은 명백히 항-Remicade 항체 (예를 들어, ATI) 를 발달시킴에 따라 환자 1 및 2 가 Remicade 에 대한 응답성이 결실되었음을 나타내었다. 이후, 이들 항-Remicade 항체는 중화 항체 (예를 들어, NAb) 인 것으로 확인되었다.The following non-limiting case study included
도 21 은 환자 1 및 2 가 중화 항체 (NAb) 를 발달시켰음을 예시한다. 이들 NAb 는 Remicade 결합 부위에 대하여 TNFα 와 경쟁한다. 중요하게, 이들 NAb 는 다른 항-TNF 치료제와 교차-반응할 수 있다. NAb 가 다른 항-TNF 치료제와 교차-반응할 경우, 또 다른 항-TNF 치료제로 변경하는 것은 이들 환자에게 도움이 되지 않을 것이다. 이와 같이, 본 발명의 예측적인 검정은, 또 다른 항-TNF 제제로 변경함으로써 양성 HACA (검출가능한 항체) 가 관리되고 있는, Remicade 에 대한 응답성이 결실된 환자를 관리하는 현 방법에 비하여 이점을 제공한다 (예컨대, Afif et al., Am. J. Gastroenterol., 105(5):1133-9 (2010) 참조).Figure 21 illustrates that
하나의 항-TNF 약물에 응답하여 생성된 NAb 의 다른 항-TNF 약물과의 교차-반응성을 결정하기 위하여, 환자가 Remicade (IFX) 로 치료 중일 경우에 발달된 NAb 를 Humira (아달리무마브) 에 대해 시험하였다. 도 21 에 제시된 데이터는 명백히 IFX 에 대항해 발생된 NAb 가 Humira 와 교차-반응한다는 것을 입증한다. 도 21 은 자유 Humira 피크 (10 과 11 분 사이, 각 환자 연구의 하단 패널) 가 NAb 를 함유하는 환자 혈청이 첨가될 때 (~12 분, 환자 연구 #1; ~12 분, 환자 연구 #2; 각 환자 연구의 하단 패널) 보다 높은 분자량으로 완전히 변동된다는 것을 나타낸다. 이들 결과는, 어느 정도 TNFα 가 Humira 의 항원-결합 부위에 접근하는 것을 NAb 가 막는 방식으로 Humira 에 결합한다는 것을 시사한다. 도 22 는 이것을 NAb 및 비-NAb 측정 둘 모두에 대하여 개략적으로 나타낸다.In order to determine the cross-reactivity of NAb produced in response to one anti-TNF drug with other anti-TNF drugs, the developed NAb when the patient was being treated with Remicade (IFX) Lt; / RTI > The data presented in Figure 21 clearly demonstrate that the NAb generated against IFX cross-reacts with Humira. Figure 21 shows that when the patient's serum containing NAb was added (~ 12 minutes,
특정 구현예에서, 본 발명의 검정 방법은 이들 환자가 Humira 또는 임의의 다른 항-TNF 치료제에 응답하지 않을 것을 예측한다. 환자는 항-TNF 치료요법으로 치료되어서는 안 되며, 류마티즘 관절염 (RA) 의 경우 악템라 (Actemra), 키너렛 (Kineret), 오렌시아 (Orencia), 리툭산 (Rituxan), 및/또는 아즈레라 (Arzerra), 또는 크론병 (CD) 의 경우 타이사브리 (Tysabri) 및/또는 스테로이드제를 포함하지만 이에 제한되지는 않는 대안적인 치료제 방안으로 전환되어야 한다.In certain embodiments, the assays of the invention predict that these patients will not respond to Humira or any other anti-TNF therapeutic. Patients should not be treated with anti-TNF therapy, and should be treated with Actemra, Kineret, Orencia, Rituxan, and / or Arzerra in the case of rheumatoid arthritis (RA) ), Or in the case of Crohn's disease (CD), Tysabri and / or steroids.
따라서, 본 발명의 방법은 특히 환자로부터의 시료 중에 중화 항체 (NAb) 및/또는 비-NAb 의 존재 및/또는 농도 수준을 결정 또는 측정함으로써 항-TNFα 치료요법에 응답할지 여부를 예측하는 데 있어 유리하다. 한 구현예에서, 시료가 하나의 항-TNF 약물에 대한 NAb 를 함유할 경우, 이들 NAb 는 다른 항-TNFα 약물과 교차-반응하여 중화될 것이므로, 환자에게 추천되는 치료 조정은 상이한 작용 기작을 갖는 약물 (예를 들어, 비-항-TNF 제제) 로 전환하는 것이 될 것이다. 또다른 구현예에서, 시료가 하나의 항-TNFα 약물에 대한 비-중화 ADA 를 함유할 경우에는, 환자에게 추천되는 치료 조정이 또다른 항-TNFα 약물로 전환하는 것이 될 것이다.Thus, the method of the present invention is particularly useful for predicting whether or not to respond to anti-TNFα therapy by determining the presence and / or concentration level of neutralizing antibodies (NAb) and / or non-NAbs in a sample from a patient It is advantageous. In one embodiment, when the sample contains NAb for one anti-TNF drug, these NAbs will be neutralized by cross-reacting with other anti-TNFa drugs, so that the recommended treatment adjustments for the patient are those that have a different mechanism of action To a drug (e. G., A non-anti-TNF agent). In another embodiment, where the sample contains a non-neutralizing ADA for one anti-TNF [alpha] drug, the recommended treatment adjustment for the patient would be to switch to another anti-TNF [alpha] drug.
실시예 4: 중화 항-약물 항체 (NAb) 의 존재 및 교차-반응성을 검출하기 위한 검정Example 4: Assay for the presence and cross-reactivity of neutralizing anti-drug antibody (NAb)
이 실시예는 시료가 NAb 양성인지 여부를 결정하기 위한 스크리닝 및 NAb 의 대안적인 생물학적 약물과의 교차-반응성을 예측 및/또는 측정하는 것 (예를 들어, 실시예 3 참조) 에 대한 본 발명의 검정 방법에 관한 추가적인 구현예를 나타낸다. 특정 구현예에서, 본원에 기재된 검정 방법은 대상체로부터 수득된 시료가 NAb 에 대하여 양성 또는 음성인지 여부를 결정함으로써 제 1 의 항-TNFα 약물을 받는 대상체가 대안적인 항-TNFα 치료요법에 응답할지 여부를 예측하는데 있어 유용하다. 시료가 NAb 에 대하여 양성일 경우, 상기 방법은 NAb 가 제 2 의 항-TNFα 약물과 교차-반응할지 여부를 결정하는 것 및 NAb 가 제 2 의 TNFα 약물과 교차-반응하는 경우 대상체가 비-항-TNFα 약물로 전환되는 것을 추천하는 것을 포함한다. 시료가 NAb 에 대하여 음성일 경우에는, 상기 방법은 대상체가 제 2 의 항-TNFα 약물로 전환되는 것을 추천하는 것을 포함한다.This example demonstrates the ability of the present invention to predict and / or measure the cross-reactivity of an alternative biological drug with screening to determine whether the sample is NAb positive and NAb (see, e.g., Example 3) ≪ / RTI > In certain embodiments, the assays described herein determine whether a subject receiving the first anti-TNF alpha drug responds to an alternative anti-TNF alpha treatment regimen by determining whether the sample obtained from the subject is positive or negative for NAb . ≪ / RTI > If the sample is positive for NAb, the method comprises determining whether the NAb cross-reacts with the second anti-TNFa drug, and determining if the NAb cross-reacts with the second TNFa drug, RTI ID = 0.0 > TNFa < / RTI > drug. If the sample is negative for NAb, the method includes recommending that the subject be converted to a second anti-TNF alpha drug.
도 23 은 본 발명의 예시적인 NAb 표준 곡선의 제작 및 용도를 나타낸다. 형광 표지된 TNF-532/IFX-488 로 평형화된 각종 농도의 토끼 (Rb) 항-IFX 항체 (ATI) 혈청 (즉, 표준물 또는 미지의 것) 을 함유하는 시료를 2% 혈청 중에서 크기 배제 칼럼 상에 주입하였다. 대형 면역 복합체가 먼저 용출된 후, 보다 작은 복합체 및 이어서 미결합 IFX-488 및 TNF-532 가 용출된다. 미지의 농도는 표준 곡선으로부터 내삽에 의해 구할 수 있다. NAb 및 비-NAb 의 상이한 혼합물을 함유하는 토끼 혈청을 조합하여 대조군을 만들 수 있다. 본원에 기재된 NAb 검정은 11.63% 의 과거의 컷-오프에 비하여 2.72% 의 개선된 컷-오프를 가진다 (N = 50 정상 시료). 표 2 는 환자에 의한 NAb 임상적 연구의 요약을 제공한다.23 shows the fabrication and use of an exemplary NAb standard curve of the present invention. A sample containing various concentrations of rabbit (Rb) anti-IFX antibody (ATI) serum (i. E., Standard or unknown) equilibrated with fluorescently labeled TNF-532 / IFX-488 was diluted in 2% Lt; / RTI > After the large immune complexes are first eluted, the smaller complexes and subsequently unbound IFX-488 and TNF-532 are eluted. The unknown concentration can be determined from the standard curve by interpolation. A rabbit serum containing different mixtures of NAb and non-NAb can be combined to create a control. The NAb assay described herein has an improved cut-off of 2.72% compared to the past cut-off of 11.63% (N = 50 normal sample). Table 2 provides a summary of NAb clinical studies by patients.
n=154
(290 개의 시료)Research 1
n = 154
(290 samples)
n=328
(952 개의 시료)
n = 328
(952 samples)
n=64
(812 개의 시료)
n = 64
(812 samples)
(전체 %)ATI +
(all %)
(28%)43
(28%)
(22%)73
(22%)
(91%)58
(91%)
(ATI + 시험 %)NAB +
(ATI + exam%)
(28%)12
(28%)
(64%)9
(64%)
(60%)3 (23 samples)
(60%)
(17%)5
(17%)
(전체 %)
(NAB+ %)High Nab activity (20 μg / mL)
(all %)
(NAB +%)
(2.6%)
(33%)4
(2.6%)
(33%)
(1.2%)
(44%)4
(1.2%)
(44%)
(3.1%)
(66%)2
(3.1%)
(66%)
(80%)4
(80%)
본 발명의 교차-반응성 검정 방법은 특히 또 다른 생물학적 치료로 전환하는 것이 유익할지 여부를 예측하는데 있어 유용하다. 환자가 하나의 약물에 대하여 NAb 양성인 것을 발견한 후, 형광-표지된 대안적인 약물이 검정에 사용될 수 있다. 환자 혈청이 여전히 중화 능력을 보이는 경우, 새로운 약물은 성공적이지 않을 것이다. 이러한 방법은 최선의 치료 방안의 제시 또는 시사를 가능하게 하는 비용-효과적 및 적시의 방식으로 약물의 패널을 스크리닝하는데 유용하게 될 것이기 때문에 유리하다.The cross-reactivity assay method of the present invention is particularly useful in predicting whether it would be beneficial to switch to another biological treatment. After finding that the patient is NAb positive for one drug, fluorescence-labeled alternative drugs can be used for the assay. If the patient's serum is still capable of neutralizing, the new drug will not be successful. This method is advantageous because it will be useful for screening the panel of drugs in a cost-effective and timely manner that allows for the presentation or suggestion of the best treatment option.
도 24 및 25 는 실시예 3 에 기재된 및 도 21 에 제시된 환자 연구에 대한 추가 케이스 연구를 제공한다. 특히, Remicade (인플릭시마브, IFX) 로 치료되었지만 이후 IFX 에 대한 응답성이 결실된 환자 3 및 4 는, 환자가 IFX 로 진행 중일 경우 발달된 NAb 가 ADL 과 교차-반응성인 것으로 결정되었기 때문에 Humira (아달리무마브, ADL) 에 응답하지 않을 환자로서 식별되었다.24 and 25 provide additional case studies for the patient study described in Example 3 and shown in FIG. In particular,
도 26 은 ATI 친화도 성숙 및 교차-반응성 ATI 의 발달을 증명하는 환자 연구의 비제한적 예시를 나타낸다. Figure 26 shows a non-limiting example of a patient study demonstrating the development of ATI-affinity maturation and cross-reactive ATI.
실시예 5: IBD 환자에서의 중화 항-약물 항체 형성을 모니터링하기 위한 신규한 검정의 개발Example 5: Development of a novel assay for monitoring neutralizing anti-drug antibody formation in IBD patients
배경 및 목적Background and Purpose
항-TNF 모노클로날 항체, 예컨대 인플릭시마브 (IFX), 아달리무마브 (ADL) 및 기타의 것들은 염증성 장 질환 (IBD) 치료용으로 처방된다. 특정 환자는 약물 효능의 손실 및 역반응을 일으킬 수 있는 항-약물 항체 (ADA) 를 생성할 것이다. 중화 ADA (NAb) 는 항원 결합 부위에 결합하여, TNF 에 대한 접근을 막고 약물 효능을 직접적으로 감소시키거나 방지한다. 결합 ADA 는 항원 결합 부위 외에 구조적 성분과 상호작용하며, 약물 동태학을 변형시킬 수 있음에도 불구하고 약물 효능에 직접적으로 영향을 주지 않는다. 본 출원인은 균일 이동성 변동 검정 (homogenous mobility shift assay, HMSA) 플랫폼을 기반으로 한 IFX 또는 ADL 치료를 받는 IBD 환자에서의 NAb 의 발달을 모니터링하는 검정을 개발하였고, ATI/ATA 성숙과 NAb 형성 사이의 상관관계를 나타내었다.Anti-TNF monoclonal antibodies such as infliximab (IFX), adalimumab (ADL), and others are prescribed for the treatment of inflammatory bowel disease (IBD). Certain patients will produce anti-drug antibodies (ADA) that can cause loss of drug efficacy and reverse reactions. Neutralized ADA (NAb) binds to the antigen binding site, blocking access to TNF and directly reducing or preventing drug efficacy. Binding ADA interacts with structural components outside the antigen binding site and does not directly affect drug efficacy, although it may alter pharmacokinetics. Applicants have developed a test to monitor the development of NAb in patients with IBD who are receiving IFX or ADL therapy based on the homogeneous mobility shift assay (HMSA) platform, Respectively.
방법Way
I. ATI 에 대한 경쟁적 리간드 결합 NAb 검정의 원리 I. Competitive ligand binding to ATI Principle of NAb assay
ㆍ ATI 양성 환자 혈청을 산 해리시킨다. ㆍ The ATI-positive patient serum is acid-dissociated.
ㆍ IFX-Alexa488 및 TNF-Alexa532 를 첨가하고 용액을 중화시킨다.ㆍ IFX-Alexa488 and TNF-Alexa532 are added and the solution is neutralized.
ㆍ 용액을 2% 혈청으로 희석하고, 크기 배제 칼럼 상에서 HPLC 에 의해 주입하고, 형광에 의하여 복합체를 모니터링한다.ㆍ The solution is diluted with 2% serum, injected by HPLC on a size exclusion column, and the complexes are monitored by fluorescence.
ㆍ 자유 TNF-Alexa532 피크의 곡선하 면적 (AUC) 을 대조군 및 환자 시료에 대해 산출한다.ㆍ The area under the curve (AUC) of the free TNF-Alexa532 peak is calculated for the control and patient samples.
ㆍ IFX-Alexa488 은 TNF-Alexa532 에 결합하여, 검정 신호를 감소시킨다.ㆍ IFX-Alexa488 binds to TNF-Alexa532 and reduces the test signal.
ㆍ
NAb 는 IFX-Alexa488 을 중화시키고 검정 신호를 회복시킨다.ㆍ
NAb neutralizes IFX-
ㆍ NAb 활성은 측정된 검정 신호에 직접적으로 비례한다. ㆍ The NAb activity is directly proportional to the measured assay signal.
ㆍ 회복 % = (TNFAUC_시료-BKGD)/(TNFAUC_자유 표지-BKGD)*100, 예를 들어, (시료의 자유 표지된 TNFαAUC-BKGD (즉, "배경"))/(대조군 시료의 자유 표지된 TNFαAUC-BKGD)*100.(TNFα AUC - BKGD) / (TNF AUC - free label - BKGD) * 100, for example , free labeled TNFα AUC - Free labeled TNFα AUC- BKGD) * 100.
ㆍ 도 27 은 본 발명의 경쟁적 리간드 결합 검정의 실례를 제공한다.ㆍ Figure 27 provides an illustration of a competitive ligand binding assay of the present invention.
II. 약물 및 ADA 수준 측정 II. Measure drug and ADA levels
ㆍ 인플릭시마브, 아달리무마브 및 연관된 ADA 의 혈청 농도를 이전에 기재된 바와 같이 HMSA 에 의해 측정하였다 (Wang et al., J. Immunol. Methods, 2012, 382:177 참고). Serum concentrations of infliximab, adalimumab and associated ADA were measured by HMSA as previously described (Wang et al. , J. Immunol. Methods , 2012, 382: 177).
III. 시료 III. sample
ㆍ 혈청은 잔여 시료 또는 IBD 환자의 IRB 승인 연구로부터의 것이었으며 건강한 대조군은 Golden West Biologics, Inc. 사로부터 구매하였다. ㆍ Serum was from IRB-approved studies of residual samples or IBD patients, and healthy controls were obtained from Golden West Biologics, Inc. Purchased from the company.
ㆍ 인플릭시마브 또는 아달리무마브로 면역화된 랫트로부터 단리된 혈청을 사용하여 인플릭시마브 및 아달리무마브에 대항하는 폴리클로날 항체를 생성시켰다. 면역글로불린 분획물을 친화성 크로마토그래피에 의해 정제하였고 농도를 UV/VIS 분광술에 의해 측정하였다. 민감도 및 특이성 실험을 위해, 정제된 ATI 및 ATA 를 정상 인간 혈청에 스파이크하였다. ㆍ Isolated serum from immunized rats with infliximab or adalimumab was used to generate polyclonal antibodies against infliximab and adalimumab. The immunoglobulin fractions were purified by affinity chromatography and the concentration was determined by UV / VIS spectroscopy. For sensitivity and specificity experiments, purified ATI and ATA were spiked into normal human serum.
결과result
도 28 은 중화 검정의 임상적 유용성을 설명한다. (좌측) 일상적 시험을 거치는 환자로부터의 130 개 ATI 양성 잔여 혈청 시료를 중화 능력에 대해 분석하였다 (0.0-430 U/mL, 평균값 = 49.22 U/mL, 중간값 = 19.10 U/mL). 낮은 ATI 양성을 갖는 33 명의 환자 부분집합 중에서 NAb 수준을 측정하여, 검정 컷오프를 결정하였다. 99% 일면 (one-side) 신뢰 한계를 갖는 컷오프를, 평균값 + 2.33 x SD 의 식에 의해 1.28% 인 것으로 산출하였다. 남아 있는 환자 중에서, 37/97 (38.1%) 은 NAb 양성이었다 (평균값 = 7.43% 회복). (우측) 아달리무마브 치료요법에 대한 반응 손실을 겪는 환자의 횡단면 연구로부터의 11 개 ATA 양성 혈청 시료를 중화 능력에 대해 시험하였다 (7.93-147.9 U/ml, 평균값 = 36.97 U/mL, 중간값 = 16.39 U/mL). 검정 컷오프를 상기와 같이 1.28% 로 설정하였다. 혈청 시료의 5/11 (45.5%) 는 NAb 양성이었다 (평균값 = 8.19% 회복). 이러한 부분 모집단에서의 더 높은 백분율의 NAb 는 이러한 환자에서 나타난 반응 손실을 반영할 수 있다.Figure 28 illustrates the clinical utility of neutralization assays. (Left) A total of 130 ATI positive residual serum samples from patients undergoing routine testing were analyzed for neutralizing capacity (0.0-430 U / mL, mean value = 49.22 U / mL, median = 19.10 U / mL). NAb levels were measured in a subset of 33 patients with low ATI positivity to determine the black cutoff. The cut-off with 99% one-side confidence limit was calculated to be 1.28% by the equation of mean + 2.33 x SD. Of the remaining patients, 37/97 (38.1%) were NAb positive (mean value = 7.43% recovery). (right) Eleven ATA positive serum samples from cross-sectional studies of patients suffering a response loss to Adalimumab therapy were tested for neutralizing capacity (7.93-147.9 U / ml, mean value = 36.97 U / mL, median = 16.39 U / mL). The black cutoff was set at 1.28% as described above. 5/11 (45.5%) of the serum samples were NAb positive (mean value = 8.19% recovery). A higher percentage of NAb in this subpopulation may reflect the response loss seen in these patients.
도 29 는 중화 검정의 성능 특징을 설명한다. ATI 및 ATA 는 방법 섹션에서 기재한 바와 같이 토끼 혈청으로부터 정제하였다.Figure 29 illustrates the performance characteristics of the neutralization test. ATI and ATA were purified from rabbit serum as described in the Methods section.
(A) NAb 검정의 민감도 및 특이성. 정제된 ATI (19.3 μg/mL, 좌측), 정제된 ATA (49.1 μg/mL, 우측) 및 모노클로날 마우스 항-인간 Fc (36.8 μg/mL) 를, 2-배 연속 희석을 수행한 50% 정상 인간 혈청에 스파이크하고, 중화 검정에서 시험하였다. 검정 민감도를, NAb 검정에서 양성 결과를 생성시키는 순 (neat) 혈청 중 NAb 의 최저 농도로서 정의한다 (즉, 1.28% 초과, 수평 점선). ATI 및 ATA 중화 검정의 검정 민감도는 각각 0.15 및 0.914 μg/mL 인 것으로 측정되었다 (순 혈청, 수직 점선). 두 검정 모두는 ATI (좌측) 또는 ATA (우측) 에 대해 특이적이다. (A) Sensitivity and specificity of NAb assay. The purified ATI (19.3 μg / mL, left), purified ATA (49.1 μg / mL, right) and monoclonal mouse anti-human Fc (36.8 μg / mL) Spiked to normal human serum and tested in neutralization assay. The sensitivity of the test is defined as the lowest concentration of NAb in the neat serum producing a positive result in the NAb assay (i.e., greater than 1.28%, horizontal dashed line). The sensitivity of the ATI and ATA neutralization assays was measured to be 0.15 and 0.914 μg / mL, respectively (pure serum, vertical dotted line). Both tests are specific for ATI (left) or ATA (right).
(B) NAb 검정에서의 인플릭시마브의 간섭. 이러한 실험에서, 인플릭시마브의 2-배 연속 희석물 (50 μg/mL 에서 시작) 의 존재 하에 높은 대조군을 시험하였다. 데이터를 대조군 최대 신호에 대해 정규화하고 신호의 억제% (억제% = 100 - 회복Norm %) 로서 플롯팅하였다. 가장 좌측의 수직 점선은 CV 를 25% 초과로 증가시키는 인플릭시마브 (4 μg/mL) 의 농도를 나타낸다. 가장 우측의 수직 점선은 9.9 μg/mL 의 IC50 을 나타낸다. (B) Interference of Infliximab with NAb black. In these experiments, a high control was tested in the presence of a two-fold serial dilution of infliximab (starting at 50 μg / mL). Data were normalized to the control maximal signal and plotted as% inhibition of the signal (inhibition% = 100 - Recovery Norm %). The leftmost vertical dotted line represents the concentration of infliximab (4 μg / mL), which increases CV by more than 25%. The rightmost vertical dotted line represents an IC 50 of 9.9 μg / mL.
(C) NAb 양성 대조군의 정밀도. 풀링된 ATI 양성 환자 혈청 (HMSA 에 의해 측정된 바와 같이 200 U/mL ATI) 을 정상 인간 혈청으로 2-배 희석함으로써 높은, 중간, 및 낮은 양성 대조군을 제작하였다. 각각의 대조군을 상이한 다수 일자 (n=20) 에 걸쳐 시험하였다. 각각의 대조군에 대한 평균값 (CV%) 은 높은, 중간, 및 낮은 대조군에 대해 각각 51.35 (10.4%), 28.50 (15.03%) 및 10.38 (24.22%) 이었다.(C) Precision of NAb positive control. A high, medium, and low positive control was generated by two-fold dilution of pooled ATI positive patient serum (200 U / mL ATI as measured by HMSA) with normal human serum. Each control was tested over a number of different days (n = 20). The mean values (CV%) for each control were 51.35 (10.4%), 28.50 (15.03%) and 10.38 (24.22%) for the high, medium and low control, respectively.
결론conclusion
균질한, 유체상 NAb 검정은 중화 능력을 갖는 ATI 및 ATA 모두를 검출할 수 있다. 최소 0.15 및 0.914 μg/mL 의 중화 ATI 또는 ATA 각각이 높은 특이성으로 검출될 수 있다. 상기 검정은 대부분의 세포 기반 또는 기타 경쟁적 리간드 결합 검정보다 높은 수준의 약물 (4.0 μg/mL 이하) 의 존재 하에 NAb 를 검출할 수 있다. NAb 검정은 확장된 동적 범위에 걸쳐 높은 정확도 및 정밀도 (CV <25%) 를 갖는다. 중화 항체의 존재는 인플릭시마브 또는 아달리무마브 치료요법을 거치는 환자에서의 반응 손실을 예측할 수 있다. 약물 및 ADA 수준에 추가로 NAb 의 모니터링은, ADA 반응에 대한 필요 정보를 제공하며 초기 치료적 개입 유도를 도울 것이다. A homogeneous, fluid phase NAb assay can detect both ATI and ATA with neutralization capability. At least 0.15 and 0.914 μg / mL of neutralized ATI or ATA, respectively, can be detected with high specificity. The assay can detect NAb in the presence of a higher level of drug (less than 4.0 μg / mL) than most cell-based or other competitive ligand binding assays. The NAb test has high accuracy and precision (CV <25%) over the extended dynamic range. The presence of neutralizing antibodies can predict the loss of response in patients undergoing infliximab or adalimumab therapy. Monitoring of NAb in addition to drug and ADA levels will provide the necessary information on the ADA response and help induce initial therapeutic intervention.
실시예 6: 항-TNF 치료요법에 대한 반응 손실을 갖는 환자에서의 중화 항-약물 항체 반응의 분석Example 6: Analysis of neutralizing anti-drug antibody responses in patients with a response loss to anti-TNF therapy
항-TNF 모노클로날 항체, 예컨대 인플릭시마브 (IFX) 및 아달리무마브 (ADL) 는 염증성 장 질환의 치료용으로 처방된다. 특정 환자는 약물 효능의 손실 및 역반응을 일으킬 수 있는 항-약물 항체 (ADA) 를 생성할 것이다. 중화 ADA (NAb) 는 항원 결합 부위에 결합하여, TNF 에 대한 접근을 막고 약물 효능을 직접적으로 방지한다. 결합 ADA 는 항원 결합 부위 외에 구조적 성분과 상호작용하며, 약물 동태학을 변형시킬 수 있음에도 불구하고 약물 효능에 직접적으로 영향을 주지 않는다. 본 출원인은 균일 이동성 변동 검정 (HMSA) 플랫폼을 기반으로 한 IFX 또는 ADL 치료를 받는 IBD 환자에서의 NAb 의 발달을 모니터링하는 검정을 개발하였고, ATI/ATA 성숙과 NAb 형성 사이의 상관관계를 나타내었다.Anti-TNF monoclonal antibodies such as infliximab (IFX) and adalimumab (ADL) are prescribed for the treatment of inflammatory bowel disease. Certain patients will produce anti-drug antibodies (ADA) that can cause loss of drug efficacy and reverse reactions. Neutral ADA (NAb) binds to the antigen binding site, blocking access to TNF and directly preventing drug efficacy. Binding ADA interacts with structural components outside the antigen binding site and does not directly affect drug efficacy, although it may alter pharmacokinetics. Applicants have developed a test to monitor the development of NAb in patients with IBD who are receiving IFX or ADL therapy based on a uniform mobility shift assay (HMSA) platform and have shown a correlation between ATI / ATA maturation and NAb formation .
방법: 141 명의 ATI 또는 ATA 양성 환자를 IBD 환자의 IRB 승인 연구로부터 모았다. IFX, ADL 및 연관된 ADA 의 혈청 농도를 이전에 기재한 바와 같이 HMSA 에 의해 측정하였다 (Wang et al., J. Immunol. Methods, 2012, 382:177). 건강한 대조군을 Golden West Biologics, Inc. 사로부터 구매하였다. IFX 또는 ADL 로 면역화된 토끼로부터 단리한 혈청을 사용하여 IFX 및 ADL 에 대항하는 폴리클로날 항체를 생성시켰다. 민감도 및 특이성 실험을 위해, 정제된 토끼 ATI 및 ATA 를 정상 인간 혈청에 스파이크하였다. NAb 검정에 대해, ATI 양성 환자 혈청이 처음으로 산 해리된다. IFX-Alexa488 및 TNF-Alexa532 를 첨가하고 용액을 중화시킨다. 용액을 2% 혈청으로 희석하고, 크기 배제 칼럼 상에서 HPLC 에 의해 주입하고, 형광에 의하여 복합체를 모니터링한다. 자유 TNF-Alexa532 피크의 곡선하 면적 (AUC) 을 대조군 및 환자 시료에 대해 산출한다. IFX-Alexa488 은 TNF-Alexa532 에 결합하여, 검정 신호를 감소시킨다. NAb 는 IFX-Alexa488 을 중화시키고 검정 신호를 회복시킨다. NAb 활성은 측정된 검정 신호에 직접적으로 비례한다.
METHODS: 141 ATI or ATA-positive patients were recruited from IRB-approved studies in IBD patients. Serum concentrations of IFX, ADL and associated ADA were measured by HMSA as previously described (Wang et al. , J. Immunol. Methods , 2012, 382: 177). A healthy control was obtained from Golden West Biologics, Inc. Purchased from the company. Polyclonal antibodies against IFX and ADL were generated using serum isolated from rabbits immunized with IFX or ADL. For sensitivity and specificity experiments, purified rabbit ATI and ATA were spiked into normal human serum. For the NAb assay, ATI positive patient serum is first acid dissociated. IFX-Alexa488 and TNF-Alexa532 are added and the solution is neutralized. The solution is diluted with 2% serum, injected by HPLC on a size exclusion column, and the complexes are monitored by fluorescence. The area under the curve (AUC) of the free TNF-Alexa532 peak is calculated for the control and patient samples. IFX-Alexa488 binds to TNF-Alexa532 and reduces the test signal. NAb neutralizes IFX-
결과: NAB 검정의 검증으로, 확장된 동적 범위에 걸친 높은 정확도 및 정밀도 (CV <25%) 가 입증되었다. 130 명의 ATI 양성 환자를 중화 능력에 대해 분석하였다 (0.0-430 U/mL, 평균값 = 49.22 U/mL, 중간값 = 19.10 U/mL). 낮은 ATI 양성을 갖는 33 명의 환자 부분집합 중에서 NAb 수준을 측정하여, 검정 컷오프를 결정하였다. 99% 일면 신뢰 한계를 갖는 컷오프를, 평균값 + 2.33 x SD 의 식에 의해 1.28% 인 것으로 산출하였다. 남아 있는 환자 중에서, 37/97 (38.1%) 은 NAb 양성이었다 (평균값 = 7.43% 회복). 아달리무마브 치료요법에 대한 반응 손실을 겪는 11 명 ATA 양성 환자를 중화 능력에 대해 시험하였다 (7.93-147.9 U/ml, 평균값 = 36.97 U/mL, 중간값 = 16.39 U/mL). 검정 컷오프를 상기와 같이 1.28% 로 설정하였다. 혈청 시료의 5/11 (45.5%) 는 NAb 양성이었다 (평균값 = 8.19% 회복). Results: Verification of the NAB test proved high accuracy and accuracy (CV <25%) over extended dynamic range. A total of 130 ATI patients were analyzed for neutralizing capacity (0.0-430 U / mL, mean value = 49.22 U / mL, median = 19.10 U / mL). NAb levels were measured in a subset of 33 patients with low ATI positivity to determine the black cutoff. The cutoff with a 99% one-sided confidence limit was calculated to be 1.28% by the equation of mean + 2.33 x SD. Of the remaining patients, 37/97 (38.1%) were NAb positive (mean value = 7.43% recovery). A total of 11 ATA-positive patients who underwent a response loss to treatment with adalimumab were tested for neutralization ability (7.93-147.9 U / ml, mean value = 36.97 U / mL, median = 16.39 U / mL). The black cutoff was set at 1.28% as described above. 5/11 (45.5%) of the serum samples were NAb positive (mean value = 8.19% recovery).
결론: 중화 항체의 존재는 인플릭시마브 또는 아달리무마브 치료요법을 거치는 환자에서의 반응 손실을 예측할 수 있다. 약물 및 ADA 수준에 추가로 NAb 의 모니터링은, ADA 반응에 대한 필요 정보를 제공하며 초기 치료적 개입 유도를 도울 것이다. Conclusion: The presence of neutralizing antibodies can predict response loss in patients undergoing infliximab or adalimumab therapy. Monitoring of NAb in addition to drug and ADA levels will provide the necessary information on the ADA response and help induce initial therapeutic intervention.
실시예 7: 인플릭시마브 또는 아달리무마브로 치료한 IBD 환자에서의 중화 항체 (Nab) 의 검출을 위한 개선된 균질 이동성 변동 검정법 (HMSA)Example 7: Improved Homogeneous Mobility Assay (HMSA) for the Detection of Neutralizing Antibodies (Nab) in IBD Patients Treated with Infliximab or Adalimumab
배경: 인플릭시마브 (IFX) 및 아달리무마브 (ADA) 로 치료시, 특정 환자는 약물 효능의 손실 및 역반응을 일으킬 수 있는 항체-대-인플릭시마브 또는 아달리무마브 (ATI/ATA) 를 생성할 것이다. ATI 및 ATA 는 약물의 항원 결합 부위에 결합하여 TNF 에 대한 접근을 막고 약물 효능을 직접적으로 방지하는 중화 항체 (NAb) 일 수 있다. 이 실시예는 개선된 민감도 및 특이성에 대해 최적화된 본 발명의 NAb HMSA 를 기재하며, 환자 시료에서의 약물 수준과 CRP 와의 상관관계를 보여준다. Background: When treated with infliximab (IFX) and adalimumab (ADA), certain patients may develop antibody-versus-infliximab or adalimumab (ATI / ATA). ATI and ATA may be a neutralizing antibody (NAb) that binds to the antigen binding site of the drug to prevent access to TNF and directly prevents drug efficacy. This example describes the NAb HMSA of the present invention optimized for improved sensitivity and specificity and shows the correlation of CRP with drug levels in patient samples.
방법: IFX, ADA 및 연관된 항-약물 항체의 혈청 농도를 일상적 시험으로부터 건강한 대조군 및 남아 있는 환자 시료에서 HMSA 에 의해 측정하였다 (예를 들어, Wang et al., J. Immunol. Methods, 382:177-88 (2012) 참고). IFX 또는 ADA 로 면역화된 토끼로부터 단리된 혈청을 사용하여 IFX 및 ADA 에 대항하는 폴리클로날 항체를 생성시키고, 정제하고, 정상 인간 혈청에 스파이크하여 양성 대조군을 제작하였다. NAb 검정에 대해서, ATI 양성 환자 혈청을 먼저 산 해리시키고, IFX-Alexa488 을 첨가하고 용액을 중화시킨 후 TNF-Alexa488 을 첨가한다. 용액을 4% 혈청으로 희석하고, 크기 배제 칼럼 상에 HPLC 에 의해 주입하고, 형광에 의해 복합체를 모니터링한다. 자유 TNF-Alexa488 피크의 곡선하 면적을 대조군 및 환자 시료에 대해 산출한다. IFX-Alexa488 은 TNF-Alexa488 에 결합하여 검정 신호를 감소시킨다. NAb 는 IFX-Alexa488 을 중화시키며 검정 신호를 회복시킨다. NAb 활성은 측정된 검정 신호에 직접적으로 비례한다. Methods: Serum of IFX, ADA and associated anti-drug antibodies Concentrations were determined by HMSA in healthy controls and remaining patient samples from routine testing (see, for example , Wang et al., J. Immunol. Methods , 382: 177-88 (2012)). Polyclonal antibodies against IFX and ADA were generated using sera isolated from rabbits immunized with IFX or ADA, purified and spiked into normal human serum to generate positive controls. For the NAb assay, ATI-positive patient serum is first acid-dissociated, IFX-Alexa488 is added, the solution is neutralized and TNF-Alexa488 is added. The solution is diluted with 4% serum, injected by HPLC on a size exclusion column, and the complexes monitored by fluorescence. The area under the curve of the free TNF-
결과: 실시예 6 에서 기재된 NAb 검정은 1.28% 회복의 양성 컷오프를 갖는 (29.8 ng/mL) 확장된 동적 범위에 걸친 높은 정확도 및 정밀도 (CV <25%) 를 입증하였다. 검정의 최적화로 인해 환자 혈청에서 10 ng/mL 미만의 NAb 을 검출할 수 있게 되고 정확도가 개선되었다 (CV <15%). 검정 최적화는 실시예 6 에서 기재된 NAb 검정에 대한 다음의 변화를 포함하였다: (1) TNF-Alexa488 로의 전환 (IFX-Alexa488 유지); (2) Ex510_Em540 에서 Ex494_Em525 로의 형광 검출기 파장 변화 (Ex=여기, Em=방출); (3) PMT (즉, 광전증배관 (photomultiplier tube)) 이득값의 14 에서 18 로의 변화; (4) TNF:IFX 몰비의 조정 및 검정에서의 IFX/TNF 양 감소; 및 (5) 인큐베이션 조건 조정, 즉 IFX 첨가, 30 분 동안 중화, 이후 30 분 동안 TNF 첨가. 실시예 6 에서 기재된 검정과 비교하여, 본원에 기재된 최적화 검정을 사용하여 중화 능력 (3.1- 200 U/mL) 에 대해 ATI 양성 환자를 분석하였다. 2 가지 검정 포맷은 잘 상호연관되었으나; 최적화 검정은 더 넓은 범위의 중화 항체를 검출해내었다 (R2=0.998). 검출가능한 중화 항체의 존재는 CRP 상승 및 약물 수준 감소 모두와 연관되었다 (p<0.001). Results: The NAb assay described in Example 6 demonstrated a high accuracy and precision (CV < 25%) over an extended dynamic range with a positive cutoff of 1.28% recovery (29.8 ng / mL). The optimization of the assay allowed detection of NAb <10 ng / mL in patients' sera and improved accuracy (CV <15%). The assay optimization involved the following changes to the NAb assay described in Example 6: (1) conversion to TNF-Alexa488 (IFX-Alexa488 maintenance); (2) Fluorescence detector wavelength change from Ex510_Em540 to Ex494_Em525 (Ex = excitation, Em = emission); (3) PMT (i.e., photomultiplier tube) change in gain value from 14 to 18; (4) adjustment of TNF: IFX molar ratio and reduction of IFX / TNF amount in assay; And (5) adjustment of incubation conditions, i.e. IFX addition, neutralization for 30 minutes, followed by addition of TNF for 30 minutes. Compared to the assays described in Example 6, ATI positive patients were analyzed for neutralizing capacity (3.1-200 U / mL) using the optimization assays described herein. The two assay formats are well correlated; Optimization assays detected a broader range of neutralizing antibodies (R 2 = 0.998). The presence of detectable neutralizing antibodies was associated with both CRP elevation and drug level reduction (p < 0.001).
결론: 중화 항체 (NAb) 의 존재로 인해 인플릭시마브 또는 아달리무마브 치료요법을 거치는 환자에서의 반응 손실, CRP 상승 및 약물 수준 감소가 예측된다. 약물 및 항-약물 항체 수준에 추가로 NAb 의 모니터링은, 면역 반응에 대한 필요 정보를 제공하며 초기 치료적 개입 유도를 돕는다. Conclusion: The presence of neutralizing antibody (NAb) predicts loss of response, elevated CRP and reduced drug levels in patients undergoing infliximab or adalimumab therapy. Monitoring of NAb in addition to drug and anti-drug antibody levels provides the necessary information on the immune response and assists in inducing initial therapeutic intervention.
이전의 본 발명은 이해의 명확성을 위하여 설명 및 예시를 들어 어느 정도 상세히 설명하였지만, 당업자는 특정 변경 및 수정이 첨부된 청구범위의 범위 내에서 실시될 수 있다는 것을 이해할 것이다. 또한, 본원에 제시된 각 참고문헌은 각 참고문헌이 개별적으로 본원에 참고로 포함된 것과 동일한 정도로 그 전체 내용이 참조로 포함된다.
While the foregoing invention has been described in some detail by way of illustration and example for purposes of clarity of understanding, those skilled in the art will appreciate that certain changes and modifications may be practiced within the scope of the appended claims. Also, each reference provided herein is incorporated by reference in its entirety to the same extent as if each reference were individually incorporated herein by reference.
Claims (33)
(a) 시료를, 표지된 항-TNFα 약물 및 표지된 TNFα 와 접촉시켜 하기를 형성시킴:
(i) 표지된 항-TNFα 약물 및 자가항체의 제 1 의 표지된 복합체; 및/또는
(ii) 표지된 항-TNFα 약물, 표지된 TNFα 및 자가 항체의 제 2 의 표지된 복합체;
(b) 제 1 의 표지된 복합체 및/또는 제 2 의 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 이들을 자유 표지된 TNFα, 자유 표지된 항-TNFα 약물 및/또는 표지된 항-TNFα 약물 및 표지된 TNFα 의 복합체로부터 분리시킴;
(c) 자유 표지된 TNFα 의 수준을 크기 배제 크로마토그래피 이후 측정함; 및
(d) 단계 (c) 에서 측정된 자유 표지된 TNFα 의 수준을, 대조군 시료 내 자유 표지된 TNFα 의 수준과 비교해, 이로써 중화 형태의 자가항체의 백분율 또는 수준을 측정함.A method for determining the percentage or level of autoantibody in neutralized form to an anti-TNF [alpha] drug in a sample, comprising:
(a) contacting the sample with a labeled anti-TNF [alpha] drug and labeled TNF [alpha] to form:
(i) a first labeled conjugate of a labeled anti-TNF [alpha] drug and an autoantibody; And / or
(ii) a second labeled complex of labeled anti-TNF [alpha] drug, labeled TNF [alpha] and autoantibody;
(b) applying a first labeled complex and / or a second labeled conjugate to size exclusion chromatography and comparing them to free labeled TNF ?, free labeled anti-TNF? drug and / or labeled anti-TNF? drug and Gt; TNFa < / RTI >complex;
(c) the level of free labeled TNF [alpha] was measured after size exclusion chromatography; And
(d) comparing the level of the free labeled TNF [alpha] measured in step (c) with the level of free labeled TNF [alpha] in the control sample, thereby determining the percentage or level of autoantibody in neutralized form.
(a) 제 1 항 내지 제 13 항 중 어느 한 항의 방법에 따라 시료 내 중화 형태의 자가항체의 백분율 또는 수준을 측정하여 중화 형태의 자가항체에 대해 시료가 양성 또는 음성인지 여부를 결정함; 및
시료가 중화 형태의 자가항체에 대해 양성인 경우, 이때:
(b) 시료를, 표지된 제 2 의 항-TNFα 약물과 접촉시켜, 표지된 제 2 의 항-TNFα 약물 및 중화 형태의 자가항체의 표지된 복합체를 형성함;
(c) 표지된 복합체를 크기 배제 크로마토그래피에 적용시켜, 표지된 복합체를 분리시킴; 및
(d) 표지된 복합체를 검출시켜, 이로써 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 항-TNFα 약물와 교차-반응성인지 여부를 결정함.A method for determining whether an autoantibody in neutralization form to a first anti-TNF [alpha] drug is cross-reactive with a second anti-TNF [alpha] drug,
(a) determining the percentage or level of autoantibody in neutralization form in the sample according to the method of any one of claims 1 to 13 to determine whether the sample is positive or negative for the autoantibody in neutralization form; And
If the sample is positive for neutralizing autoantibodies, then:
(b) contacting the sample with a labeled second anti-TNF [alpha] drug to form a labeled second anti-TNF [alpha] drug and a labeled conjugate of an autoantibody in neutralized form;
(c) applying labeled conjugates to size exclusion chromatography to separate the labeled complexes; And
(d) detecting the labeled complex, thereby determining whether the neutralizing form of the autoantibody to the first anti-TNF alpha drug is cross-reactive with the second anti-TNF alpha drug.
(a) 치료요법의 과정에 걸쳐 다수의 시간 지점에서 제 1 항 내지 제 13 항 중 어느 한 항의 방법에 따라 항-TNFα 약물에 대한 중화 형태의 자가항체의 백분율 또는 수준을 측정함;
(b) 시간 경과에 따른 중화 형태의 자가항체의 백분율 또는 수준의 변화를 검출함; 및
(c) 시간 경과에 따른 중화 형태의 자가항체의 백분율 또는 수준의 변화를 기준으로 대상체를 위한 치료요법 과정의 후속 용량 또는 상이한 치료요법 과정이 대상체에게 투여되어야 하는지의 여부를 결정함.A method of monitoring or optimizing a therapeutic regimen for an anti-TNFα drug in a subject undergoing a therapeutic regimen with an anti-TNFα drug, comprising:
(a) determining the percentage or level of neutralizing forms of autoantibodies to the anti-TNFa drug according to the method of any one of claims 1 to 13 at multiple time points throughout the course of the treatment regimen;
(b) detecting a change in the percentage or level of neutralizing autoantibodies over time; And
(c) determine whether subsequent doses of the therapeutic regimen for the subject or different therapeutic regimens should be administered to the subject, based on a change in the percentage or level of neutralizing autoantibodies over time.
(a) 제 1 항 내지 제 13 항 중 어느 한 항의 방법에 따라 대상체로부터의 시료 내 중화 형태의 자가항체의 백분율 또는 수준을 측정함으로써 제 1 의 항-TNFα 약물에 대한 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성인지 여부를 결정함; 및
(b) 상기 중화 형태의 자가항체가 제 2 의 항-TNFα 약물과 교차-반응성인 경우, 상이한 치료요법 과정이 대상체에게 투여되어야 하는지를 결정함.A method of optimizing therapy and / or reducing toxicity in a subject undergoing a therapeutic treatment with a first anti-TNFα drug, comprising:
(a) measuring the percentage or level of neutralizing autoantibodies in the sample from a subject according to the method of any one of claims 1 to 13 to determine the neutralizing form of the autoantibody to the first anti-TNFa drug 2 < / RTI > anti-TNFa drug; And
(b) if the neutralizing form of the autologous antibody is cross-reactive with the second anti-TNFα drug, a different therapeutic regimen is to be administered to the subject.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261732251P | 2012-11-30 | 2012-11-30 | |
| US61/732,251 | 2012-11-30 | ||
| US13/802,117 | 2013-03-13 | ||
| US13/802,117 US20130266963A1 (en) | 2011-07-06 | 2013-03-13 | Assay for detecting neutralizing autoantibodies to biologic therapy |
| PCT/IB2013/060458 WO2014083520A2 (en) | 2012-11-30 | 2013-11-27 | Assays for detecting neutralizing autoantibodies to biologic therapy |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150088890A true KR20150088890A (en) | 2015-08-03 |
Family
ID=50828561
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157017311A KR20150088890A (en) | 2012-11-30 | 2013-11-27 | Assays for detecting neutralizing autoantibodies to biologic therapy |
Country Status (13)
| Country | Link |
|---|---|
| EP (1) | EP2926136A2 (en) |
| JP (1) | JP2016502091A (en) |
| KR (1) | KR20150088890A (en) |
| CN (1) | CN105074461A (en) |
| AU (1) | AU2013350817A1 (en) |
| BR (1) | BR112015012482A2 (en) |
| CA (1) | CA2892766A1 (en) |
| HK (1) | HK1215969A1 (en) |
| IL (1) | IL238995A0 (en) |
| MX (1) | MX2015006852A (en) |
| RU (1) | RU2015125739A (en) |
| SG (2) | SG10201703210XA (en) |
| WO (1) | WO2014083520A2 (en) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112012009855A2 (en) | 2009-10-26 | 2018-06-26 | Prometheus Laboratoires Inc | methods for determining an effective amount of a drug, for optimizing therapy and / or reducing drug toxicity, for determining the presence or level of a drug, for optimizing the therapeutic amount of a drug, and for determining the presence or level of a drug. an autoantibody for a drug, and kit |
| SG189391A1 (en) | 2010-10-18 | 2013-05-31 | Nestec Sa | Methods for determining anti-drug antibody isotypes |
| RU2013158256A (en) | 2011-07-06 | 2015-07-10 | Нестек С.А. | ANALYSIS FOR DETECTING NEUTRALIZING AUTOANTIBODIES FOR BIOLOGICAL THERAPY TNFα |
| WO2016088104A2 (en) | 2014-12-05 | 2016-06-09 | Nestec S.A. | Indirect homogeneous mobility shift assays for the detection of biologics in patient samples |
| WO2016110595A1 (en) | 2015-01-09 | 2016-07-14 | Atonomics A/S | A UNIVERSAL ASSAY FOR DETERMINING THE QUANTITY OF TNFα INHIBITORY DRUGS AND THEIR CORRESPONDING ANTI-DRUG-ANTIBODIES |
| US11119096B2 (en) | 2016-07-08 | 2021-09-14 | W. Health L.P. | Universal assay for determining the quantity of therapeutic monoclonal antibodies and their corresponding anti-drug-antibodies in samples |
| US20220099682A9 (en) * | 2017-03-31 | 2022-03-31 | Ablynx N.V. | Improved immunogenicity assays |
| CN111024958B (en) * | 2020-03-11 | 2020-06-23 | 同昕生物技术(北京)有限公司 | Reagent for detecting monoclonal antibody drug and monoclonal antibody drug antibody and application thereof |
| CN112730846B (en) * | 2020-12-18 | 2023-12-15 | 安渡生物医药(杭州)有限公司 | Method for detecting immune complex by using mouse blood sample |
| CN114047343B (en) * | 2022-01-13 | 2022-05-31 | 美迪西普亚医药科技(上海)有限公司 | Immunogenicity analysis kit of double-tolerance anti-IgE monoclonal antibody medicine and use method and application thereof |
| CN117871856A (en) * | 2023-12-15 | 2024-04-12 | 首都医科大学附属北京地坛医院 | Application of soluble factor in asymptomatic neurosyphilis detection |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112012009855A2 (en) * | 2009-10-26 | 2018-06-26 | Prometheus Laboratoires Inc | methods for determining an effective amount of a drug, for optimizing therapy and / or reducing drug toxicity, for determining the presence or level of a drug, for optimizing the therapeutic amount of a drug, and for determining the presence or level of a drug. an autoantibody for a drug, and kit |
| EP2564202B1 (en) * | 2010-04-29 | 2015-07-01 | Theradiag SA | Methods for detecting anti-drug antibodies |
| SG189391A1 (en) * | 2010-10-18 | 2013-05-31 | Nestec Sa | Methods for determining anti-drug antibody isotypes |
| SG192770A1 (en) * | 2011-02-17 | 2013-09-30 | Nestec Sa | Assays for detecting autoantibodies to anti-tnfalpha drugs |
| RU2013158256A (en) * | 2011-07-06 | 2015-07-10 | Нестек С.А. | ANALYSIS FOR DETECTING NEUTRALIZING AUTOANTIBODIES FOR BIOLOGICAL THERAPY TNFα |
-
2013
- 2013-11-21 BR BR112015012482A patent/BR112015012482A2/en not_active IP Right Cessation
- 2013-11-27 EP EP13820955.6A patent/EP2926136A2/en not_active Withdrawn
- 2013-11-27 AU AU2013350817A patent/AU2013350817A1/en not_active Abandoned
- 2013-11-27 RU RU2015125739A patent/RU2015125739A/en not_active Application Discontinuation
- 2013-11-27 JP JP2015544592A patent/JP2016502091A/en active Pending
- 2013-11-27 KR KR1020157017311A patent/KR20150088890A/en not_active Application Discontinuation
- 2013-11-27 CA CA2892766A patent/CA2892766A1/en not_active Abandoned
- 2013-11-27 WO PCT/IB2013/060458 patent/WO2014083520A2/en active Application Filing
- 2013-11-27 SG SG10201703210XA patent/SG10201703210XA/en unknown
- 2013-11-27 CN CN201380071748.4A patent/CN105074461A/en active Pending
- 2013-11-27 MX MX2015006852A patent/MX2015006852A/en unknown
- 2013-11-27 SG SG11201504097PA patent/SG11201504097PA/en unknown
-
2015
- 2015-05-25 IL IL238995A patent/IL238995A0/en unknown
-
2016
- 2016-04-05 HK HK16103834.6A patent/HK1215969A1/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201504097PA (en) | 2015-06-29 |
| EP2926136A2 (en) | 2015-10-07 |
| CN105074461A (en) | 2015-11-18 |
| CA2892766A1 (en) | 2014-06-05 |
| WO2014083520A2 (en) | 2014-06-05 |
| BR112015012482A2 (en) | 2017-07-11 |
| AU2013350817A1 (en) | 2015-06-11 |
| JP2016502091A (en) | 2016-01-21 |
| RU2015125739A (en) | 2017-01-13 |
| IL238995A0 (en) | 2015-07-30 |
| WO2014083520A3 (en) | 2014-07-31 |
| SG10201703210XA (en) | 2017-06-29 |
| HK1215969A1 (en) | 2016-09-30 |
| MX2015006852A (en) | 2015-09-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6181646B2 (en) | Assay for detection of neutralizing autoantibodies against biological therapy with TNF alpha | |
| KR20150088890A (en) | Assays for detecting neutralizing autoantibodies to biologic therapy | |
| JP6063398B2 (en) | Assays for detecting autoantibodies against anti-TNFα drugs | |
| KR101934247B1 (en) | Methods for determining anti-drug antibody isotypes | |
| US20130266963A1 (en) | Assay for detecting neutralizing autoantibodies to biologic therapy | |
| US11846642B2 (en) | Indirect homogeneous mobility shift assays for the detection of biologics in patient samples |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |