KR20110063537A - 전이성 악성 흑색종 및 기타 암에 대한 항암 약물 및 이와 관련한 용도 - Google Patents
전이성 악성 흑색종 및 기타 암에 대한 항암 약물 및 이와 관련한 용도 Download PDFInfo
- Publication number
- KR20110063537A KR20110063537A KR1020117008490A KR20117008490A KR20110063537A KR 20110063537 A KR20110063537 A KR 20110063537A KR 1020117008490 A KR1020117008490 A KR 1020117008490A KR 20117008490 A KR20117008490 A KR 20117008490A KR 20110063537 A KR20110063537 A KR 20110063537A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- dimethylamino
- diazenyl
- formula
- solution
- Prior art date
Links
- 0 CC(c1c(*)[s]c(C(OC)=O)c1*)=C Chemical compound CC(c1c(*)[s]c(C(OC)=O)c1*)=C 0.000 description 3
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/26—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D333/38—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/26—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D333/38—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D333/40—Thiophene-2-carboxylic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Heterocyclic Compounds Containing Sulfur Atoms (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Abstract
본 발명은 전이성 악성 흑색종 및 림프종, 육종, 암종, 및 신경아교종을 포함하나 이에 제한되지 않는 기타 암에 대한 화학식 (I) 및 화학식 (II)의 트리아젠 유사체, 그의 토토머 형태(tautomeric forms), 입체이성체, 다형체, 수화물, 용매화물, 및 그의 약학적으로 허용가능한 염을 개시한다. 본 발명은 또한 상기 화학식 (I) 및 화학식 (II)의 트리아젠 유사체, 및 그의 약학적으로 허용가능한 조성물의 제조 방법을 개시한다.
Description
본 발명은 전이성 악성 흑색종 및 림프종, 육종, 암종, 및 신경아교종을 포함하나 이에 제한되지 않는 기타 암에 대한 화학식 (I) 및 화학식 (II)의 트리아젠 유사체, 그의 토토머 형태(tautomeric forms), 입체이성체, 다형체, 수화물, 용매화물, 및 그의 약학적으로 허용가능한 염에 관한 것이다.
본 발명은 또한 상기 화학식 (I) 및 화학식 (II)의 트리아젠 유사체, 및 그의 약학적으로 허용가능한 조성물의 제조방법에 관한 것이다.
악성 종양인 흑색종은 멜라닌을 형성할 수 있는 세포로부터 유도되며, 신체의 어느 부위든 피부에 가장 일반적으로 발생하고, 눈, 또는 드물게는 생식기관, 항문, 구강의 점막, 또는 기타 부위에서 발생한다. 흑색종은 대부분 성인에서 발생하며, 새롭게 발생되거나 색소성 모반(pigmented nevus) 또는 악성 흑색점(lentigo maligna)으로부터 유래될 수 있다. 초기 단계에서, 피부의 형태는 진피-표피 경계부위에서 세포가 증식하여 곧 주변 조직을 침범하는 것을 특징으로 한다. 상기 세포는 세포질의 양과 색소침착에 있어서 다양하다; 핵은 비교적 크고, 종종 모양이 괴상하며 뚜렷한 호산성 핵소체를 가지며; 유사분열 형태가 매우 많은 경향이 있다. 흑색종은 종종 광범위하게 전이되며; 국소 림프절, 피부, 간, 폐, 그리고 뇌가 포함될 수 있다.
1985년 1월, 환경 보호국(Environmental Protection Agency, EPA)은 우주로부터의 자외선(UV) 조사(radiation)에 대한 보호층인 지구의 오존층 감소가 세계적으로, 흑색종을 포함하여, 피부암 발병 빈도의 증가를 야기할 것이라고 예측하였다. 인간 활동 - 주로 장기간 지속되는(long-lived) 클로로플루오로카본의 대기중으로의 방출(현재 대부분의 선진국에서 금지된)로 인하여, EPA는 오존층이 10% 감소할 것으로 예측되는 2050년까지 매년 2백만 건의 증가를 예측한 바 있다. 공중 보건 노력은 사람들에게 선크림을 사용하고, 최대 노출 시간 동안 야외 활동을 피하고, 피부의 자기점검(self-checks)을 자주 행하고, 이상 징후가 있을 때 피부과 전문의를 방문하도록 권장하는데 초점을 맞추고 있다. 높은 수준의 자외선 조사에 노출되면 또한 백내장 및 면역 시스템 기능이상이 촉진될 수 있다.
UV 조사는, 특히 노출이 붉은 머리 및 하얀 피부와 같은 특정한 기본적인 유전적 특성과 조합될 때, 피부암에 대한 결정적인 위험 요소를 나타낸다(1). 피부의 색소 침착은 색소-생성 세포, 즉 멜라닌 세포에서의 멜라닌 합성 및 이어지는 색소 과립의 주변 각질세포로의 분포 및 전이에 의해 유발된다. 일반적으로 멜라닌은 UV에 의해 세포질 내에서 생성되는 자유 라디칼의 흡수를 위해 중요하며, UV 및 가시광선으로부터 직접적인 방패 역할을 하는 것으로 믿어지고 있다(2, 3).
UV로 유도된 색소 침착(선탠(sun tanning))은 각질세포에 의해 α-멜라닌세포-자극 호르몬(α-MSH) 분비의 유도를 필요로 한다. α-MSH 및 다른 생활성 펩티드는 프로-오피오멜라노코르틴(Pro-Opiomelanocortin, POMC)의 분해산물이다(4). p53 종양 억제 유전자는 암에서 유전자 변이에 대한 가장 빈번한 표적 중 하나이다. p53은 POMC 유전자의 전사조절인자로서, 멜라닌 세포가 멜라닌을 생성하도록 유도하는 단백질로 번역하며, UV 방사선을 흡수함으로써 피부암을 피하도록 한다. p53의 직접적인 돌연변이적 불활성화는 모든 인간의 종양의 절반 가까이에서 관찰된다(5).
악성 흑색종은 피부암으로서, 현재까지, 오늘날 가장 치료하기 어려운 암 중 하나이다. 다카르바진(Dacarbazine, DTIC)은 전이성 악성 흑색종 치료를 위해 사용되는 유일한 물질이다. 그러나, 임상적 셋팅(setting)에서, 다카르바진에 대한 완전 반응(Complete Response, CR) 비율은 10% 아래이며, 따라서 아직 충족되지 못한 의학적인 필요성이 있으며, 더욱 우수한 물질에 대한 요구가 존재한다. 또한, 다카르바진은, 다른 유효한 약물과 조합하여 사용될 때, 2차적인 치료법으로서 호지킨 림프종(Hodgkin's lymphoma)에 대하여도 사용된다. 화학적으로, DTIC는 하기 구조식을 갖는, 5-(3,3-디메틸-l-트리제노)-이미다졸-4-카르복사미드이다.
그러나, 다카르바진은 간에 의한 생체내 생활성화(bioactivation)를 필요로 한다. 디메틸트리아제노 관능기의 메틸기 중 하나는 간 미세소체효소(liver microsomal enzymes), 특히, 시토크롬 P450에 의해 산화되어 히드록시메틸기로 되어 활성화된다. 따라서, 디메틸트리아제노 관능기의 산화적 모노-탈메틸화(mono demethylation)는 모노-메틸트리아젠을 생성한다. 모노메틸트리아젠 대사체인 3-메틸-(트리아젠-1-일)-이미다졸-4-카르복사미드(MTIC)는 추가로, 퓨린 및 핵산 생합성의 중간체로 알려져 있는 5-아미노-이미다졸-4-카르복사미드(AIC) 및 활성 알킬화 종(alkylating species)으로 여겨지는 메틸히드라진으로 가수분해된다. 상기 시토크롬 P450 효소는 MTIC의 대사에 단지 작은 역할을 할 뿐이다.
테모졸로미드(Temozolomide) 또한 친핵성 부위에서 DNA를 메틸화하는 유사한 이미다조테트라진 알킬화제(alkylator)이다. 테모졸로미드는 경구적으로 생체이용가능하고, 더욱 친유성이며, 자발적으로 MTIC로 변환되고, 또한 구역질을 덜 나게 하는 것으로 보여진다(6). O6-메틸구아닌 부가물은 DNA 복제 동안에 미스매치(mismatch)의 원인이 되고, 새롭게 형성된 DNA의 가닥에 시토신 대신 티미딘 부가를 야기한다(7). 우수한 CNS 생분포(biodistribution) 때문에, 테모졸로미드는 원발성 뇌종양 및 CNS 전이 모두에서 방사선 민감제(radiosensitizer)로서 유용하다(8-11). 테모졸로미드의 약물동태학(pharmacokinetics)이 어린이에게서 연구된 바 있으며, 클리어런스(clearance)는 신체 표면 면적과 관련된다(12). 테모졸로미드는 뇌로 전이된 환자에 있어서 방사선과 함께 사용될 때 삶의 질을 개선시킨다. 다카르바진과 달리, 테모졸로미드는 육종(sarcoma)에 대하여 활성을 갖는다(13-15). 따라서, 테모졸로미드는, 원발성 조절 뿐만 아니라 전이의 치료를 위하여, 육종의 방사선 민감화에 있어서 유용할 수 있다. 테모졸로미드는 잘 허용되는(tolerated) 방사선 민감제이고 또한 중간 정도의 부작용을 갖는다. 테모졸로미드와 이리노테칸의 조합은 일부 암에 대하여 상가(additive) 이상이다(16). 논문저자들은 그들의 경험이 재발된 유잉 육종(Ewing's sarcoma) 및 DSRCT에 있어서 높은 반응율을 확인해 주고 있으며, 이는 문헌에 보고된 것보다 더욱 높을 것이라고 보고한 바 있다(17-19). 테모졸로미드과 이리노테칸의 조합은 표준 사이클로포스파마이드-함유 요법보다 덜 면역 억제적이다(20). 이들 저자 및 다른 이들이 림프구 회복(즉, 화학 요법의 첫 번째 사이클 후 15 일째에 절대 림프구수 > 500)이 유잉 육종(Ewing's sarcoma)에 있어서 유의성있게 높은 생존과 연관되어 있다는 것을 보여준 바 있으므로, 이는 유잉 육종에 있어서 특히 중요할 수 있다(21,22). 테모졸로미드 또는 다카르바진은 또한 젬시타빈 및 독소루비신 리포좀을 포함한 다른 약물과 조합된 바 있다(23,24). 혈장으로부터 DTIC의 소실은 초기 반감기 19분 및 최종 반감기 5시간으로 이상(biphasic)이다. 신장 및 간 기능장애를 갖는 환자에서, 상기 반감기는 각각 55분 및 7.2 시간으로 길어졌다. 뇨중 비-변환 DTIC의 평균 누적 배설량은 6시간 내에 주입된 용량의 40%이다. DTIC는 사구체 여과보다는 오히려 신 세뇨관 분비를 받는다. 치료 농도에서, DTIC는 인간 혈장 단백질에 뚜렷하게 결합되지 않는다.
인체에서, DTIC는 광범위하게 분해된다. 비-변환된 DTIC뿐만 아니라, AIC는 뇨 중에서 배설된 DTIC의 주요 대사산물이다. 비록 DTIC 활성의 정확한 메카니즘은 알려지지 않으나, 세 가지 가설이 제안되고 있다:
1. 퓨린 유사체로서 작용함으로써 DNA 합성을 억제
2. 알킬화제로서 작용
3. SH기와 상호작용
따라서, 세포독성이 생체내에서 메틸카르보니움 이온의 생성과 관련되는 생성된 MTIC 활성 종(reactive species)의 생화학적 작용 메카니즘은 주로 DNA의 알킬화 때문으로 생각된다. 알킬화(메틸화)는 주로 구아닌의 O6 및 N7 위치에서 발생한다.
선택적으로, DTIC는 모노메틸트리아젠으로 대사되기 전에, 초기에 모노히드록시메틸로 산화되고 최종적으로 알데히드로 산화된다. 산화적 모노메틸화 전에, 알데히드 형태의 모노메틸트리아젠은 시클릭 화합물로 폐환되며(반응식 1에 나타낸 바와 같이), 이는 이중 나선 DNA 구조를 방해하며, 암세포의 복제를 차단한다. 그리고, 최종적으로, 2차 대사체인 AIC는 불활성화된다.
반응식 1. 다카르바진의 생화학적 작용 메카니즘
다카르바진의 이미다졸 고리 시스템은 본래 친수성이다. 그러므로, 분자의 세포 독성 기능성이 100 퍼센트 효과적이도록, 멜라닌에 효과적으로 결합할 수 있는 필요성이 본 기술분야에 존재한다. 따라서, 본 발명자들은 증가된 친유성을 갖는 신규의 화합물을 제공함으로써, 더욱 많은 표적 특이성을 제공하는 것을 목적으로 하였다. 따라서, 5원환의 헤테로사이클릭 고리 시스템을 갖는 티오펜은 본래 친유성이고, 멜라닌에 대하여 증가된 활성으로 효과적인 결합을 할 수 있으며, 그 결과 유의성있게 낮은 용량에서 동일한 치료 효과를 얻을 수 있고, 따라서 독성을 최소화할 수 있다. 이는 또한 넓은 범위의 치료 지수(Therapeutic Index, TI)와 함께 높은 특이성을 제공하게 된다. 일반적으로, 암환자의 치료를 위하여, 넓은 치료 지수가 바람직하다. 이는, 암세포가 첫번째 화학요법 자체로 크게 타격을 받게 되도록, 환자가 매우 높은 최대내약용량(Maximum Tolerated Dose, MTD)을 사용한 치료 요법을 시작하기를 원하기 때문이다. 한편, 살아남은 암세포는 손상된 DNA를 수선하고, 이어서 다른 장기로 전이되게 된다. 또한, 첫번째 치료에서 살아남은 암세포는 필요한 경우 다시 시행된 두번째 화학요법에 대하여 저항하게 된다. 게다가, 첫번째 화학요법으로 면역 시스템이 약화되기 때문에, 적정(suboptimal) 용량이 두번째 치료에서 주어지게 되며, 이는 독성에 기여하게 된다.
반응식 1에 나타낸 바와 같이, DTIC와 달리, 티오펜 고리 시스템과 종양 항원 표면 상의 -SH기와의 더욱 우수한 상호작용은 효능의 증가를 야기한다. 이는 큰 원자인 황(S) 때문이며, 5원환의 헤테로사이클릭 방향족 티오펜 고리 시스템은 공간에서 페닐 고리와 비슷하여, 종양 부위에서 설프히드릴과 더욱 우수한 상호작용을 위하여 고리의 나머지에 비공유 전자쌍을 제공하게 된다. 또한, 그의 전자 배열(electronic configuration)로 인하여, 헤테로사이클릭 방향족 티오펜 고리 시스템은 알킬화제로서 작용할 뿐만 아니라 퓨린 유사체로서 작용하여, DNA 합성을 억제함으로써 DTIC 보다 우수할 수 있다. 또한, DTIC와 달리, 아미노 이미다졸 카르복사미드(AIC)가 불활성화되는 반면, 증가된 활성을 위하여, 대응되는 아미노 이미다졸 카르복사미드(AIC)는, 고리의 황(sulfur)로부터 전자의 비편재화를 통하여, 생체내에서 매우 잘 활성적일 것이다. 따라서, 다카르바진에 비해, 증가된 활성을 위하여, 신규의 트리아제노 티오펜 유사체는 그 구조에 있어서 본질적으로 몇가지 추가적인 장점을 갖는다.
생화학적 작용 메카니즘에 추가하여, 최근 문헌에 다카르바진을 다른 화학요법제와 조합하여 사용함으로써, 다카르바진의 효능을 유의성있게 증가시키는 것에 대한 몇가지 보고가 있다(25,26). 또한, 전-임상적 셋팅(setting)에서, 이종이식 마우스 흑색종 모델에서 다카르바진의 나노에멀젼 제제가 다카르바진의 효능을 유의성있게 증가시키는데 사용된 바 있다(27). 유사하게, 면역 치료, 타이로신 키나아제 억제제 및 혈관신생 억제제를 포함하여, 많은 혁신적 치료 전략이 그 성과를 개선하기 위하여 연구되어 오고 있다(28). 문헌은 인터페론과 조합하여 다카르바진을 사용한 전이성 흑색종의 치료가 빈약하다고 보고하고 있다(29).
상기에서 설명한 바와 같이, 현재, 다카르바진 및 테모졸로미드가 전이성 악성 흑색종을 치료하기 위한 화학요법제로 널리 사용된다. 그러나, 성공율이 낮고 부작용이 높다. 따라서, 전이성 악성 흑색종의 치료를 위한 효과적인 물질 및 치료방법의 개발에 대한, 아직 충족되지 못한 의학적인 필요성이 커다란 도전으로 남아 있다.
발명의 요약
본 발명은 여기에서 '트리아젠 유사체'로 지칭되는 화학식 (I)의 화합물을 제공한다.
식 중,
R은 H, CH3, CH2OH로부터 독립적으로 선택되고;
R1은 OH, NHR4, NR4R5, SH로부터 독립적으로 선택되고;
R2 및 R3 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3 등의 전자 끄는 기(electron withdrawing group) 및 전자 공여기(electron donating group)로부터 선택된다.
R4 및 R5 는 독립적으로 H, C1-C10 알킬, 알케닐, 알킬올(alkylol), 알킬아민 등으로부터 선택된다.
X, Y, 및 Z는, 얻어지는 헤테로사이클릭 방향족 모이어티의 5원환 고리 시스템이 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택된다.
다른 태양에서, 본 발명은 또한 화학식 (II)의 화합물을 제공한다.
R1 및 R2 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONH2, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3, 등의 전자 끄는 기 및 전자 공여기로부터 독립적으로 선택된다.
R4 및 R5 는 독립적으로 H, C1-C10 알킬, 알케닐, 알킬올, 알킬아민 등으로부터 선택된다.
X, Y, 및 Z는, 융합된 바이사이클릭 시스템의 헤테로사이클릭 방향족 5원환 고리가 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택된다. 화학식 (II)의 화합물은 3-메틸티오페노[3,2-d]1,2,3-트리아진-4-온(X=Y=C; Z=S; R1=R2=H)이 아니다.
또다른 태양에서, 본 발명은 화학식 (I) 및 (II)의 화합물의 약학적으로 허용가능한 염, 예를 들어 유기산 또는 무기산 부가염을 포함한다.
또다른 태양에서, 본 발명은 적어도 하나의 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체 또는 그의 약학적으로 허용가능한 염 및 약학적으로 허용가능한 희석제 또는 담체를 포함하는 조성물을 제공한다.
또다른 태양에서, 본 발명은 적어도 하나의 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체 또는 그의 약학적으로 허용가능한 염, 및 적어도 하나의 화학요법제 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함하는 조성물을 제공한다.
또다른 태양에서, 본 발명은 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체 또는 그의 약학적으로 허용가능한 염, 및 적어도 하나의 화학요법제 및 적어도 하나의 생물학적 반응 변형제(biologic response modifying agent) 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함하는 조성물을 제공한다.
또다른 태양에서, 본 발명은 암세포 성장의 억제 또는 암세포 사멸을 필요로 하는 환자에게, 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체 또는 이를 포함하는 조성물의 암세포를 사멸시키는데 유효한 양으로 투여하거나 또는 다른 화학요법제와 조합하여 투여함으로써, 환자에 있어서 암세포 성장을 억제하거나 암세포를 사멸하는 방법을 제공한다.
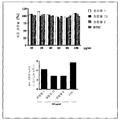
도 1은 다양한 농도의 화합물 1, 화합물 6, 화합물 13 및 DTIC로 처리된, A2058 인간 흑색종 세포로부터 누출된 락테이트 데하이드로게나아제(latate dehydrogenase, LDH)의 퍼센트 증가를 보여주는 선그래프를 나타낸다. 각각의 점은 4개의 웰(quadruplicate wells)의 평균으로부터 계산된, 비히클 대조군 배지에 대한 누출된 LDH의 퍼센트 증가를 나타낸다.
도 2는 상이한 농도의 DTIC 및 관련 시험 화합물로 처리된 HS.531.sk 정상 인간 피부 상피 세포의 세포 생존율의 퍼센트를 보여주는 막대 그래프를 나타낸다(상부 패널). 하부 패널의 막대 그래프는, 표시된 바와 같이, 120㎍/ml에서 다양한시험 화합물에 의한 HS.531.sk 세포 생존율의 손실(퍼센트로)을 나타낸다.
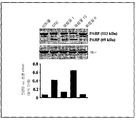
도 3은 DTIC 및 시험 생성물인 화합물 1, 화합물 6, 화합물 13을 100㎍/ml로 처리한 A2058 세포에서 PARP 절단을 나타내는 웨스턴 면역블롯 이미지를 나타낸다. 대조군 배지는 비히클로서 0.5% DMSO를 처리하였다. 액틴 단백질의 발현은 로딩 컨트롤(loading control)로서 나타낸다. 89 kDa의 절단된 PARP 단백질의 발현은 액틴 발현으로 정상화시켰고(임의의 단위로), 하부 패널에 막대 그래프로서 나타내었다.
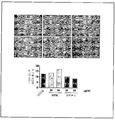
도 4는 시험관내로(in vitro) DTIC 및 화합물 6의 존재하에서 B16F0 콜로니 형성의 억제를 보여주는 이미지를 나타낸다. B16F0 세포는 0.1% DMSO(A) 또는 DTIC 100㎍/ml(B) 또는 화합물 6 50㎍/ml(C) 또는 100㎍/ml(D)로 처리하였다. 0.1% DMSO(a) 또는 DTIC 100㎍/ml(b) 또는 화합물 6 50㎍/ml(c) 또는 100㎍/ml(d)로 처리된 배양액 중 평균 콜로니 수 및 콜로니의 평균 면적을 각각 막대 그래프 E 및 F에 나타낸다.
도 5는 화합물 6에 의한 G2/M 단계에서 세포주기정지(cell cycle arrest)의 유도를 나타낸다. B16FO 세포는, 표시된 바와 같이, 상이한 농도에서 24시간 동안 비히클(0.1% DMSO) 또는 DTIC 또는 화합물 6의 표시된 농도로 처리하였다. 요오드화프로피디움(propidium iodide)으로 염색한 세포를 FACS 칼리버(calibur)에 의해 세포주기의 분포를 분석하고, 다른 단계의 세포주기에서의 분포 퍼센트를 ModFIT 소프트웨어를 사용하여 결정하였다. 데이터는 적어도 3회의 독립된 실험 중 대표적인 하나로서 나타낸다.
도 6은 대조군(A), DTIC 100 ㎍/ml(B), 화합물 6(C)으로 처리된 배양액 중에 침입된 B16F0 세포를 보여주는 현미경사진(photomicrographs)을 나타낸다. 막대 그래프(D)는 20X 대물렌즈로 관찰된 20개의 독립된 부위로부터 계수된 침입된 세포의 평균값을 나타낸다.
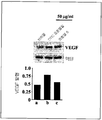
도 7은 화합물 6으로 처리된 B16F0 세포에서 VEGF 단백질의 하향-조절을 보여주는 면역블롯 이미지를 나타낸다. 막대 그래프는 VEGF 단백질의 정상화시킨 발현을 임의의 단위로 나타낸다. 각각의 막대는 적어도 3회의 독립된 실험으로부터 계산된 평균 발현량을 나타낸다.
도 8은 인간 내피세포 이동에 대한 화합물 6의 억제 효과를 나타낸다. 현미경사진은 DTIC(패널 B 및 C에서 각각 25 및 50 ㎍/ml) 또는 화합물 6(패널 E 및 F에서 각각 25 및 50㎍/ml)의 존재하에 HUVECs의 이동을 나타낸다. 패널 A 및 D는 0.1% DMSO로 처리된 비히클 대조군 웰에서의 세포의 이동을 나타낸다. 막대 그래프는 각각의 막대 아래에 표시된 바와 같이 상이한 배양조건 하에서 이동된 세포의 수를 나타낸다. 각 막대는 20X 대물렌즈 하에서 적어도 20개 부위로부터 계산된 이동된 세포의 평균을 나타낸다.
도 9는 화합물 6에 의한 유사 모세혈관(capillary-like tube) 형성의 억제를 나타낸다. 제대혈관내피세포(HUVECs)를 DTIC(패널 B 및 C에서 각각 25 및 50 ㎍/ml) 또는 화합물 6(패널 E 및 F에서 각각 25 및 50㎍/ml)의 존재하에서 Cultrex로 코팅된 플레이트에 도말하고, 37℃에서 16 시간 동안 내피 모세혈관을 형성시켰다. 패널 A 및 D는 0.1% DMSO로 처리된 비히클 대조군 웰에서의 유사 모세혈관 형성을 나타낸다.
도 10은 생체내에서(in vivo) C57B6J 마우스의 B16F0 종양 성장에 대한 화합물 6 및 DTIC의 효능을 나타낸다. 상부 패널은 각각 비히클 대조군(A 및 D), 50 및 100 mg/kg의 DTIC로 처리된 군(B 및 C), 및 50 및 100 mg/kg의 화합물 6로 처리된 군(E 및 F)에 포함된 치사시킨 동물로부터 잘라낸 종양의 크기를 나타내는 사진이다. 하부 패널의 표는, 표시된 바와 같이, 각각의 군(n=6)에서 평균 종양 무게를 나타낸다. 각각의 군에서 달성된 종양 성장의 퍼센트 억제를 비히클 대조군과 비교하여 계산하였다.
본 발명의 상기 구현예 및 다른 구현예들은 하기 상세한 실시예 및 첨부된 도면을 참조할 때 명확해질 것이다.
도 2는 상이한 농도의 DTIC 및 관련 시험 화합물로 처리된 HS.531.sk 정상 인간 피부 상피 세포의 세포 생존율의 퍼센트를 보여주는 막대 그래프를 나타낸다(상부 패널). 하부 패널의 막대 그래프는, 표시된 바와 같이, 120㎍/ml에서 다양한시험 화합물에 의한 HS.531.sk 세포 생존율의 손실(퍼센트로)을 나타낸다.
도 3은 DTIC 및 시험 생성물인 화합물 1, 화합물 6, 화합물 13을 100㎍/ml로 처리한 A2058 세포에서 PARP 절단을 나타내는 웨스턴 면역블롯 이미지를 나타낸다. 대조군 배지는 비히클로서 0.5% DMSO를 처리하였다. 액틴 단백질의 발현은 로딩 컨트롤(loading control)로서 나타낸다. 89 kDa의 절단된 PARP 단백질의 발현은 액틴 발현으로 정상화시켰고(임의의 단위로), 하부 패널에 막대 그래프로서 나타내었다.
도 4는 시험관내로(in vitro) DTIC 및 화합물 6의 존재하에서 B16F0 콜로니 형성의 억제를 보여주는 이미지를 나타낸다. B16F0 세포는 0.1% DMSO(A) 또는 DTIC 100㎍/ml(B) 또는 화합물 6 50㎍/ml(C) 또는 100㎍/ml(D)로 처리하였다. 0.1% DMSO(a) 또는 DTIC 100㎍/ml(b) 또는 화합물 6 50㎍/ml(c) 또는 100㎍/ml(d)로 처리된 배양액 중 평균 콜로니 수 및 콜로니의 평균 면적을 각각 막대 그래프 E 및 F에 나타낸다.
도 5는 화합물 6에 의한 G2/M 단계에서 세포주기정지(cell cycle arrest)의 유도를 나타낸다. B16FO 세포는, 표시된 바와 같이, 상이한 농도에서 24시간 동안 비히클(0.1% DMSO) 또는 DTIC 또는 화합물 6의 표시된 농도로 처리하였다. 요오드화프로피디움(propidium iodide)으로 염색한 세포를 FACS 칼리버(calibur)에 의해 세포주기의 분포를 분석하고, 다른 단계의 세포주기에서의 분포 퍼센트를 ModFIT 소프트웨어를 사용하여 결정하였다. 데이터는 적어도 3회의 독립된 실험 중 대표적인 하나로서 나타낸다.
도 6은 대조군(A), DTIC 100 ㎍/ml(B), 화합물 6(C)으로 처리된 배양액 중에 침입된 B16F0 세포를 보여주는 현미경사진(photomicrographs)을 나타낸다. 막대 그래프(D)는 20X 대물렌즈로 관찰된 20개의 독립된 부위로부터 계수된 침입된 세포의 평균값을 나타낸다.
도 7은 화합물 6으로 처리된 B16F0 세포에서 VEGF 단백질의 하향-조절을 보여주는 면역블롯 이미지를 나타낸다. 막대 그래프는 VEGF 단백질의 정상화시킨 발현을 임의의 단위로 나타낸다. 각각의 막대는 적어도 3회의 독립된 실험으로부터 계산된 평균 발현량을 나타낸다.
도 8은 인간 내피세포 이동에 대한 화합물 6의 억제 효과를 나타낸다. 현미경사진은 DTIC(패널 B 및 C에서 각각 25 및 50 ㎍/ml) 또는 화합물 6(패널 E 및 F에서 각각 25 및 50㎍/ml)의 존재하에 HUVECs의 이동을 나타낸다. 패널 A 및 D는 0.1% DMSO로 처리된 비히클 대조군 웰에서의 세포의 이동을 나타낸다. 막대 그래프는 각각의 막대 아래에 표시된 바와 같이 상이한 배양조건 하에서 이동된 세포의 수를 나타낸다. 각 막대는 20X 대물렌즈 하에서 적어도 20개 부위로부터 계산된 이동된 세포의 평균을 나타낸다.
도 9는 화합물 6에 의한 유사 모세혈관(capillary-like tube) 형성의 억제를 나타낸다. 제대혈관내피세포(HUVECs)를 DTIC(패널 B 및 C에서 각각 25 및 50 ㎍/ml) 또는 화합물 6(패널 E 및 F에서 각각 25 및 50㎍/ml)의 존재하에서 Cultrex로 코팅된 플레이트에 도말하고, 37℃에서 16 시간 동안 내피 모세혈관을 형성시켰다. 패널 A 및 D는 0.1% DMSO로 처리된 비히클 대조군 웰에서의 유사 모세혈관 형성을 나타낸다.
도 10은 생체내에서(in vivo) C57B6J 마우스의 B16F0 종양 성장에 대한 화합물 6 및 DTIC의 효능을 나타낸다. 상부 패널은 각각 비히클 대조군(A 및 D), 50 및 100 mg/kg의 DTIC로 처리된 군(B 및 C), 및 50 및 100 mg/kg의 화합물 6로 처리된 군(E 및 F)에 포함된 치사시킨 동물로부터 잘라낸 종양의 크기를 나타내는 사진이다. 하부 패널의 표는, 표시된 바와 같이, 각각의 군(n=6)에서 평균 종양 무게를 나타낸다. 각각의 군에서 달성된 종양 성장의 퍼센트 억제를 비히클 대조군과 비교하여 계산하였다.
본 발명의 상기 구현예 및 다른 구현예들은 하기 상세한 실시예 및 첨부된 도면을 참조할 때 명확해질 것이다.
현재까지 흑색종은 화학요법에 저항성이 있고, 치료하기 매우 어려운 것으로 간주된다. 최근, 다카르바진 및 테모졸라미드는 전이성 악성 흑색종 치료를 위한 화학요법제로 광범위하게 사용되고 있다. 그러나, 그 성공률이 낮고, 부작용은 높다.
전이성 악성 흑색종은 대략 8개월의 평균 생존기간을 갖는 불치병이며, 진단 후 5년간 생존 가능성은 5% 미만이다. 조합 치료법(combination regimen)에 대한 반응률은 표준 다카르바진에 비하여 재현성있게 더욱 높다. 그러나, 전이성 악성 흑색종의 치료에 있어서 명백한 차이를 만들기 위해서는, 더욱 높은 퍼센트의 완전 반응(complete remission, CR)을 달성하기 위한 첫번째 약물 단독의 유의성 있는 효능을 입증하는 것이 필요한다. 그런 다음에라야, 화학요법제, 인터루킨, 인터페론, 및 생물학적 반응 변형제(biologic response modifying agent) 등을 포함한 다른 조합 투여 요법(combination dose regimens)이 악성 흑색종 치료를 더욱 관리가능하고 조절되도록 하게될 것이다.
그러므로, 효과적인 투여 요법을 위해서, 친유성 티오펜 시스템과 같이 높을 가능성이 있는(possibly high) 멜라닌 결합 모이어티는, 완전 반응을 얻는데 있어서 유의성 있는 증가로 이어지는 긍정적인 성과와 함께, DTIC(다카르바진) 보다 우수한 모든 세가지 생화학적 작용 메카니즘을 갖는 치료학적인 치료를 제공할 수 있을 것이다.
따라서, 본 발명자들이 전략을 위하여 초기에 선택한 분자 구조는 5원환의 헤테로사이클릭 티오펜 고리 시스템을 포함하였으며, 이는 페닐 고리와 유사하고 또한 페닐 고리와 유사한 형태 및 크기를 차지하며, 본래 친유성이다. 또한, 티오펜 고리 구조는 자체적으로 분자의 효능 증가에 도움을 줄 수 있는 내부적으로 가지고 있는(internally built) 추가적인 장점을 갖는다.
따라서, 본 발명은 표적인 흑색종 세포에 선택적으로 결합하고 정상세포에 위해를 가하지 않음으로써 비-표적에 대한 표적 세포 비율을 증가시키고, 여기에서 설명된 바와 같은 다른 관련된 장점을 추가로 제공하는, 아직 충족되지 못한 의학적인 필요성을 실현하는 것을 목적으로 한다. 따라서, 멜라닌 결합을 증가시키기 위한 노력으로, 골격(backbone)으로서 헤테로사이클릭 티오펜 고리 시스템을 포함하는 초기 몇가지 화합물이 고려되었다. 큰 크기의 황원자의 존재로 인하여, 5원환 티오펜 고리 시스템은 공간에서 친유성인 6원환 페닐 고리 시스템과 유사한 크기와 형태를 달성할 수 있다. 따라서, 그의 방향족 성질에 추가하여, 치환된 티오펜 고리 시스템은 고리에서 전자의 공명 비편재화(resonance delocalization)를 제공하게 되며, 이는 증가된 효능에 기여할 수 있다. 따라서, 몇 가지 티오펜에 기초한 트리아젠 유사체의 시험 모드로, 합성하였으며 시험관내에서(in vitro) 이들의 효능에 대하여 DTIC와 함께 평가하였다. 초기에 설계된 화합물의 DTIC 보다 더욱 우수한 시험관내 효능 때문에, 생체내 효능 및 작용 기전을 포함한 특성을 추가로 평가하였다. 본 발명의 신규의 트리아젠 유사체, 이를 포함하는 조성물, 및 치료학적 적용에 있어서의 상기 유사체 및 조성물의 용도가 아래에서 설명된다.
본 발명의 목적을 위해, 상기 '티오펜 트리아젠 유사체' '멜라닌 결합 유사체' '신규 유사체'의 어구/표현은 화학식 (I) 및 화학식 (II)의 화합물을 언급하는 것으로 본 명세서 전체를 통하여 상호교환되어 하기에서 사용된다. 본 발명의 화학식 (I) 및 (II)의 화합물은 티오펜 트리아젠 유사체로서, 멜라닌에 대해 높은 친화성을 가짐으로써, 효능을 더욱 효율적으로 향상시킨다. 또한, 바람직한 구현예에서, 본 발명의 신규의 유사체는 표적 대 비-표적 비율이 증가될 수 있도록 멜라닌에 더욱 효율적으로 결합하도록 특이적으로 설계되어 있어, 독성을 감소시킬 수 있다.
일 구현예에서, 상기 멜라닌 결합 유사체는 하기와 같이 나타낼 수 있다:
식 중,
R은 H, CH3, CH2OH로부터 독립적으로 선택되고;
R1은 OH, NHR4, NR4R5, SH로부터 독립적으로 선택되고;
R2 및 R3 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3 등의 전자 끄는 기 및 전자 공여기로부터 선택되고;
R4 및 R5 는 독립적으로 H, C1-C10 알킬, 알케닐, 알킬올(alkylol), 알킬아민등으로부터 선택되고;
X, Y, 및 Z는, 얻어지는 헤테로사이클릭 방향족 모이어티의 5원환 고리 시스템이 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택된다.
다른 구현예에서, 본 발명은 또한 화학식 (II)의 화합물을 제공한다:
식 중,
R1 및 R2 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONH2, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3, 등의 전자 끄는 기 및 전자 공여기로부터 독립적으로 선택되고;
R4 및 R5 는 독립적으로 H, CH3, C1-C10 알킬, 알케닐, 알킬올, 알킬아민 등으로부터 선택되고;
X, Y, 및 Z는, 융합된 바이사이클릭 시스템의 헤테로사이클릭 방향족 5원환 고리가 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택된다. 화학식 (II)의 화합물은 3-메틸티오페노[3,2-d]1,2,3-트리아진-4-온(X=Y=C; Z=S; R1=R2=H)이 아니다.
본 발명은, 화학식 (I) 및 화학식 (II)의 화합물의 정의와 일치하는, 상기에 기술된 본 발명의 특정 구현예의 모든 조합을 포함하는 것으로 이해되어야 한다.
본 발명에 따른 화학식 (I) 및 화학식 (II)의 바람직한 티오펜 트리아젠 유사체 중 일부는 다음과 같으나, 이에 제한되지 않는다:
3-[(디메틸아미노)디아제닐]티오펜-2-카르복사미드(화합물 No. 1)
3-[(디메틸아미노)디아제닐]-4-브로모티오펜-2-카르복사미드(화합물 No. 2)
3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복사미드(화합물 No. 3)
4-[(디메틸아미노)디아제닐]-3-메톡시티오펜-2,5-디카르복사미드(화합물 No. 4)
3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복사미드(화합물 No. 5)
3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산(화합물 No. 6)
3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복실산(화합물 No. 7)
3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복실산(화합물 No. 8)
{3-[(디메틸아미노)디아제닐](2-티에닐)}-N-(2-히드록시에틸)-카르복사미드(화합물 No. 9)
{3-[(디메틸아미노)디아제닐](2-티에닐)}-N-메틸카르복사미드(화합물 No. 10)
N-(2-아미노에틸){3-[(디메틸아미노)디아제닐](2-티에닐)}-카르복사미드(화합물 No. 11)
4-[(디메틸아미노)디아제닐]티오펜-2-카르복사미드(화합물 No. 12)
4-[(디메틸아미노)디아제닐]티오펜-3-카르복사미드(화합물 No. 13)
3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산의 칼륨염(화합물 No. 14)
3-메틸티오페노[2,3-d]1,2,3-트리아진-4-온(화합물 No. 15)
3-메틸-6-니트로티오페노[2,3-d]1,2,3-트리아진-4-온(화합물 No. 16)
6-아미노-3-메틸티오페노[2,3-d]1,2,3-트리아진-4-온(화합물 No. 17)
3-메틸-6-페닐티오페노[3,2-d]1,2,3-트리아진-4-온(화합물 No. 18)
본 발명에서, 화학식 (I) 및 (II)의 화합물은 그들의 구조적 유사성 때문에 함께 개시된다. 예를 들어, 화학식 (I)의 비활성 화합물은 간 미세소체 효소(시토크롬 P450)에 의한 생체내 활성화 및 이어지는 산화적 탈메틸화에 의하여 활성의 모노메틸트리아젠 유사체를 제공한다. 유사하게, 화학식 (II)의 화합물은 생체내 가수분해(hydrolysis)에 의하여, 화학식 (I)로부터 유래된 효소적으로 활성인 종(species)의 유사한 모노메틸트리아젠 유사체를 제공한다. 따라서, 이들 생체내 대사체들의 유사성으로 인하여, 일 구현예에서는 화학식 (I)의 화합물이 개시되고, 다른 구현예에서는 화학식 (II)의 화합물이 개시되었다. 그러므로, 화학식 (I) 및 화학식 (II)의 화합물이 편의상 개시되었고, 생물학적인 이유로 인하여 구조적으로 유사한 것으로 간주되어야 한다.
트리아젠
유사체의 합성
본 발명의 다른 태양에 따라, 반응식으로 나타낸 바와 같이, 화학식 (I) 및 화학식 (II)의 트리아젠 유사체의 제조방법이 제공되며, 식중 모든 기는 상기에서 정의된 바와 같다.
화학식 (I)의 화합물(1-8)은 반응식 A에 나타낸 바와 같이, 하기 방법에 따라 제조될 수 있다.
<반응식 A>
시약 및 조건: (i) HCl, NaNO2, 디메틸아민, O℃ (ii) NH3, 실온 (iii) 수성 NaOH, 메탄올, 실온
아질산나트륨을 사용한 메틸 3-아미노티오펜-2-카르복실레이트 또는 그의 전구체의 디아조화 및 이어지는 디메틸아민으로의 처리는 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트 또는 그의 유도체를 높은 수율로 제공한다. 암모니아로 상기 에스테르의 처리는 화학식 (I)의 트리아젠 유사체(3-[(디메틸아미노)디아제닐]티오펜-2-카르복사미드 (화합물 No. 1), 화합물 No. 2, 화합물 No. 3, 화합물 No. 4, 화합물 No. 5)를 제공하였다.
메탄올 중에서 수성 수산화나트륨을 사용한 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트 또는 그의 유도체의 가수분해는 화학식 (I)의 트리아젠산 유사체(화합물 No. 6, 화합물 No. 7 및 화합물 No. 8)를 생성하였다.
반응식 A에서 사용되는 상기 전구체 화합물은 하기 방법으로 제조되었다: 메틸 3-아미노-4-브로모티오펜-2-카르복실레이트는 메틸 3-아미노티오펜-2카르복실레이트(알드리치)의 브롬화에 의해 제조된다.
메틸 4-히드록시-5-(메톡시카르보닐)티오펜-2-카르복실레이트(30)의 니트로화는 메틸 4-히드록시-5-(메톡시카르보닐)-3-니트로티오펜-2-카르복실레이트를 생성하였고, 이는 디메틸 설페이트를 사용하여 메틸화시켜 메틸 4-메톡시-5-(메톡시카르보닐)-3-니트로티오펜-2-카르복실레이트를 생성하였다. 철 및 HCl을 사용한 니트로기의 환원은 메틸 3-아미노-4-메톡시-5-(메톡시카르보닐)티오펜-2-카르복실레이트를 제공하였다. 메틸 3-아미노-5-페닐티오펜-2-카르복실레이트는 공지된 방법에 따라 제조된다(31, 32).
화학식 (I)의 화합물(9-11)은 반응식 B에 나타낸 바와 같이, 하기 방법에 따라 제조될 수 있다.
<반응식 B>
시약 및 조건: (i) NH2CH2CH2OH 또는 NH2CH3 또는 NH2CH2CH2NH2, 실온
메틸 아민, 에탄올 아민 및 에틸렌디아민과 같은 다양한 아민을 사용한 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트의 처리는 상응하는 화학식 (I)의 트리아젠 아미드 유사체(화합물 No. 9, 화합물 No. 10, 및 화합물 No. 11)를 제공한다.
화학식 (I)의 화합물(12)는 반응식 C에 나타낸 바와 같이 하기 방법에 따라 제조될 수 있다.
<반응식 C>
시약 및 조건: (i) HCl, NaNO2, 디메틸아민, O℃ (ii) NH3, 실온
아질산나트륨을 사용한 메틸 4-아미노티오펜-2-카르복실레이트의 디아조화 및 이어지는 디메틸아민으로의 처리는 메틸 4-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트를 제공한다. 암모니아로 상기 에스테르의 처리는 필요한 4-[(디메틸아미노)디아제닐]티오펜-2-카르복사미드(화합물 No. 12)를 제공하였다. 전구체 화합물인, 메틸 4-아미노티오펜-2카르복실레이트는 상업적으로 구입가능한 티오펜-2-카르복실산으로부터 제조된다. 티오펜-2-카르복실산의 니트로화는 4-니트로티오펜-2-카르복실산 및 5-니트로티오펜-2-카르복실산의 분리할 수 없는 혼합물을 제공하며, 이를 에스테르화하여 대응하는 에스테르를 얻는다. 상기 니트로 관능기는 철 분말을 사용하여 아민으로 환원시키고, 상기 혼합물을 실리카 겔 컬럼 크로마토그래피로 분리하여 메틸 4-아미노티오펜-2-카르복실레이트를 얻는다.
화학식 (I)의 화합물(13)은 반응식 D에 나타낸 바와 같이 하기 방법에 따라 제조될 수 있다.
<반응식 D>
시약 및 조건: (i) HCl, NaNO2, 디메틸아민, O℃ (ii) NH3, 실온
아질산나트륨을 사용한 메틸 4-아미노티오펜-3-카르복실레이트의 디아조화 및 이어지는 디메틸아민으로의 처리는 메틸 4-[(디메틸아미노)디아제닐]티오펜-3-카르복실레이트를 제공한다. 암모니아로 상기 에스테르의 처리는 필요한 4-[디메틸아미노)디아제닐]티오펜-3-카르복사미드(화합물 No. 13)를 제공하였다. 상기 메틸 4-아미노티오펜-3-카르복실레이트는 선행문헌에 공지된 방법을 사용하여 제조된다(33, 34, 35). 이리하여, 메틸 티오글리콜레이트에 메틸 아크릴레이트의 첨가는 메틸 3-[(메톡시카르보닐)메틸티오]프로파노에이트를 정량적인 수율로 제공하였으며, 이를 소듐 메톡사이드 존재하에서 폐환시켜 메틸 4-옥소-2,3,5-트리히드로티오펜-3-카르복실레이트를 생성시켰다. 히드록실아민을 사용한 메틸 4-옥소-2,3,5-트리히드로티오펜-3-카르복실레이트의 처리 및 이어지는 암모니아를 사용한 염기성화는 메틸 4-아미노티오펜-3-카르복실레이트를 제공하였다.
화학식 (I)의 화합물(14)는 반응식 E에 나타낸 바와 같이 하기 방법에 따라 제조될 수 있다.
<반응식 E>
메탄올 존재하에 수산화칼륨을 사용한 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산의 처리는 화학식 (I)의 트리아젠 유사체의 상응하는 칼륨염, 즉, 화합물 No. 14를 제공하였다.
화학식 (II)의 화합물(15-17)은 반응식 F에 나타낸 바와 같이 하기 방법에 따라 제조될 수 있다.
<반응식 F>
시약 및 조건: (i) H2SO4, NaNO2, O℃ (ii) K2CO3, CH3I, 아세톤, 실온
진한 황산 존재하에서 아질산나트륨을 사용한 2-아미노티오펜-3-카르복사미드 또는 그의 유도체의 디아조화는 3H-티오페노[2,3-d]1,2,3-트리아진-4-온 또는 그의 유도체를 생성하였다. 탄산칼륨 존재하에서 요오도메탄을 사용한 3H-티오페노[2,3-d]1,2,3-트리아진-4-온 또는 그의 유도체의 메틸화는 상응하는 화학식 (II)의 트리아젠 유사체(화합물 No. 15, 또는 화합물 No. 16 또는 화합물 No. 17)를 생성하였다. 2-아미노티오펜-3-카르복사미드는 선행문헌(36, 37)에 공지된 방법으로 제조되고, 상기 니트로 유도체는 니트로화 혼합물의 처리에 의해 제조된다.
화학식 (II)의 화합물(18)은 반응식 G에 나타낸 바와 같이 하기 방법에 따라 제조될 수 있다.
< 반응식 G >
시약 및 조건: (i) H2SO4, NaNO2, 0℃ (ii) K2CO3, CH3I, 아세톤, 실온
진한 황산 존재하에서 아질산나트륨을 사용한 3-아미노-5-페닐티오펜-2-카르복사미드의 디아조화는 6-페닐-3H-티오페노[3,2-d]1,2,3-트리아진-4-온을 생성하였다. 탄산칼륨 존재하에서 요오도메탄을 사용한 6-페닐-3H-티오페노[3,2-d]1,2,3-트리아진-4-온의 메틸화는 상응하는 화학식 (II)의 트리아젠 유사체, 즉 화합물 No. 18을 생성하였다.
또다른 구현예에서, 화학식 (I)의 트리아젠 유사체의 합성 방법은 금속 질산염(metal nitrate) 및 산을 사용한 상응하는 아민 화합물의 디아조화를 포함하며; 생성된 디아조화된 생성물은 염기 존재하에서 아민과 반응시킬 수 있으며; 최종적으로 상기 트리아젠 에스테르는 카르복실산 또는 카르복실 아미드로 전환될 수 있다.
상기 화학식 (I)의 트리아젠 유사체의 합성방법에서, 디아조화 단계에서 사용되는 금속 질산염은 아질산나트륨 또는 아질산칼륨으로부터 선택되고, 산은 무기산 또는 유기산으로부터 선택된다. 상기 무기산은 염산, 황산 등일 수 있고, 상기 유기산은 벤조산, 파라-톨루엔설폰산 등일 수 있다.
상기 화학식 (I)의 트리아젠 유사체의 합성방법에서, 상기 디아조화된 생성물은 아민과 반응시킬 수 있고, 상기 아민은 메틸 아민, 에틸 아민 등과 같은 1차 아민, 또는 디메틸 아민, 디에틸 아민 등과 같은 2차 아민으로부터 선택된다.
상기 화학식 (I)의 트리아젠 유사체의 합성방법에서, 상기 카르복실산의 유사체는 용매 존재하에 금속 수산화물을 사용하여 상응하는 에스테르의 가수분해에 의해 제조될 수 있다. 상기 금속 수산화물은 수산화나트륨 또는 수산화칼륨 등으로부터 선택될 수 있고, 상기 용매는 물, 메탄올, 에탄올, 또는 이들의 혼합물로부터 선택된다.
상기 화학식 (I)의 트리아젠 유사체의 합성방법에서, 상기 카르복사미드의 유사체는 염기 존재하에서, 용매 중에서, 주위 온도(ambient temperature)에서 아민을 사용한 상응하는 에스테르의 처리에 의해 제조될 수 있다. 상기 아민은 암모니아, 메틸 아민, 에탄올 아민, 에틸렌 디아민 등으로부터 선택될 수 있고, 상기 염기는 탄산칼륨, 탄산나트륨, 수산화나트륨, 수산화칼륨, 피리딘, 트리에틸 아민 등으로부터 선택되며, 상기 용매는 테트라하이드로퓨란, 메탄올, 에탄올, 아세톤, 물 또는 이들의 혼합물로부터 선택된다.
또다른 구현예에서, 본 발명은 화학식 (I) 및 화학식 (II)의 화합물의 약학적으로 허용가능한 염을 포함하며, 예를 들어 유기산 또는 무기산 부가염을 포함한다. 상기 화학식 (I) 및 화학식 (II)의 트리아젠 유사체 및 그의 유도체는, 용매 화물 또는 약학적으로 허용가능한 염 예를 들어 산 부가염 또는 염기 부가염의 형태일 수 있다. 상기 염은 염산염, 황산염(sulfate), 인산염(phosphate), 구연산염(citrate), 푸마르산염(fumarate), 메탄술폰산염(methansulfonate), 아세트산염(acetate), 타르트산염(tartrate), 말레산염(maleate), 젖산염(lactate), 만델산염(mandelate), 숙신산염(succinate), 옥살산염(oxalate), 아미노산염, 및 기타 문헌에 공지된 적합한 염을 포함한다.
또다른 구현예에서, 본 발명은 화학식 (I) 및 화학식 (II)의 광학적으로 활성인 화합물인 광학이성질체 또는 디아스테레오머를 포함한다.
트리아젠
유사체를 함유하는 조성물
본 발명은, 약학적으로 허용가능한 담체 또는 희석제와 함께, 상기한 바와 같은 멜라닌 표적화된 유사체를 함유할 수 있는 약학적 또는 수의과용 조성물(이하, 약학 조성물로 간단히 언급된다)을 제공한다. 본 발명은, 약학적으로 허용가능한 담체 또는 희석제와 함께, 상기한 바와 같은 멜라닌 표적화된 유사체를 함유할 수 있는 약학 조성물을 제공한다.
본 발명의 약학 조성물은 환자에게 투여될 수 있는 모든 형태일 수 있다. 예를 들어, 상기 조성물은 고체, 액체 또는 가스(에어로졸) 형태일 수 있다. 전형적인 투여 경로는 경구, 국소, 비경구, 설하, 및 직장 투여를 제한 없이 포함한다. 여기에서 사용되는 용어 '비경구' 투여는 피하 주사, 정맥 주사, 근육내 주사, 흉골내 주사(intrasternal injection) 또는 주입 기술(infusion techniques)을 포함한다. 본 발명의 약학 조성물은, 환자에게 조성물의 투여시 함유된 활성 성분이 생체이용가능할 수 있도록, 제제화된다. 환자에게 투여되는 조성물은 하나 이상의 투여 단위(dosage units) 형태를 취할 수 있으며, 예를 들어 정제는 단일의 투여 단위일 수 있고, 국소 형태의 트라아젠의 용기는 복수의 투여 단위들을 가질 수 있다.
약학 조성물을 제조하는데 사용되는 물질은, 사용된 함량에서, 약학적으로 순수하고 무-독성이어야 한다. 약학 조성물 중의 활성 성분(들)의 최적 투여량(optimal dosage)은 다양한 인자에 의존한다는 것은 당업자에게 명백하다. 관련된 인자는 대상자의 종류(예를 들어, 인간), 활성 성분의 특정 형태, 투여 방법, 및 사용된 조성물을, 제한 없이 포함한다.
일반적으로, 상기 약학 조성물은, 하나 이상의 담체와 함께, 여기에 기술된 바와 같은 멜라닌 표적화된 유사체 또는 그의 유도체를 포함할 수 있다. 상기 담체(들)은 입자일 수 있으며, 따라서 상기 조성물은 예를 들어 정제 또는 분말 형태이다. 상기 담체(들)은 액체일 수 있으며, 상기 조성물은 예를 들어 경구용 시럽 또는 주사가능한 액체일 수 있다. 또한, 상기 담체(들)은 기체일 수 있으며, 예를 들어 흡입 투여에 유용한 에어로졸 조성물을 제공할 수 있다.
경구 투여를 목적으로 할 때, 상기 조성물은 바람직하게는 고체 또는 액체 형태이고, 여기서 반-고체, 반-액체, 현탁제 및 겔 형태는 고체 또는 액체로서 여기에서 고려된 형태에 포함된다.
경구 투여를 위한 고체 조성물로서, 상기 조성물은 산제, 과립제, 압축 정제, 환제, 캡슐제, 저작껌(chewing gum), 물 등의 형태로 제제화될 수 있다. 이러한 고체 조성물은 전형적으로 하나 이상의 불활성 희석제 또는 식용가능한 담체를 포함한다. 또한, 하나 이상의 하기 아주반트가 존재할 수 있다: 카르복시메틸셀룰로오즈, 에틸 셀룰로오즈, 미결정 셀룰로오즈, 또는 젤라틴과 같은 결합제; 전분, 락토오즈 또는 덱스트린, 시클로덱스트린와 같은 부형제, 알긴산, 알긴산나트륨, 프리모겔, 옥수수 전분 등과 같은 붕해제; 마그네슘 스테아레이트 또는 스테로텍스(sterotex)와 같은 윤활제; 콜로이드성 이산화규소와 같은 유동화제(glidants); 수크로오즈 또는 사카린과 같은 감미제, 페퍼민트, 메틸 살리실레이트 또는 오렌지향과 같은 향료(flavoring agent) 및 착색제.
상기 조성물이 캡슐제, 예를 들어 젤라틴 캡슐제의 형태일 때, 상기 조성물은 또한, 상기 형태의 물질에 추가하여, 폴리에틸렌 글리콜 또는 지방 오일(fatty oil)과 같은 액체 담체를 포함할 수 있다.
상기 조성물은 액체 형태, 예를 들어 엘릭서제, 시럽, 용액, 에멀젼 또는 현탁제의 형태일 수 있다. 상기 액체는 두 가지 예로서 경구 투여 또는 주사에 의해 송달될 수 있다. 경구 투여를 목적으로 할 때, 바람직한 조성물은, 상기 화합물에 추가하여, 하나 이상의 감미제, 보존제, 염료/착색제, 향 증진제(flavor enhancer)를 포함한다. 주사에 의해 투여되는 것을 목적으로 하는 조성물에 있어서, 하나 이상의 계면활성제, 보존제, 습윤제, 분산제, 현탁화제, 완충제, 안정화제 및 등장화제가 포함될 수 있다.
본 발명의 상기 액체 약학 조성물은, 용액, 현탁액, 또는 기타 유사한 형태이든, 하나 이상의 하기 아주반트를 포함할 수 있다: 주사용수, 식염수, 바람직하게는 생리 식염수, 링거액(Ringer's solution)과 같은 멸균 희석제, 등장성 염화나트륨, 용매 또는 분산매(suspending medium)로 작용할 수 있는 합성 모노 또는 디글리세라이드와 같은 고정 오일(fixed oils), 폴리에틸렌 글리콜, 글리세린, 프로필렌 글리콜 또는 기타 용매; 벤질 알콜 또는 메틸 파라벤과 같은 항균제; 아스코르브산 또는 황산수소나트륨(sodium bisulfate)과 같은 항산화제; 에틸렌디아민테트라아세트산과 같은 킬레이트화제; 아세테이트, 시트레이트 또는 포스페이트와 같은 완충제 및 염화나트륨 또는 덱스트로오즈와 같은 등장 조절제. 상기 비경구용 제제는 앰플, 일회용 주사기 또는 유리나 플라스틱으로 제조된 다중 용량 바이알(multiple dose vials)에 함유될 수 있다. 생리 식염수가 바람직한 아주반트이다. 주사용 약학 조성물은 바람직하게는 멸균된 것이다.
비경구 또는 경구 투여를 목적으로 하는 액체 조성물은, 적합한 투여량이 얻어지게 되도록 하는, 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체의 함량을 포함하여야 한다. 전형적으로, 상기 함량은 조성물 중 적어도 0.1%의 본 발명의 화합물이다. 경구 투여를 목적으로 할 때, 상기 함량은 조성물 중량의 0.1 및 80% 사이에서 변화될 수 있다. 바람직한 경구용 조성물은 4% 및 약 50% 사이의 활성 트리아젠 화합물을 함유한다. 본 발명에 따른 바람직한 조성물 및 제제는, 비경구 투여 단위가 적어도 0.01 중량% 내지 1 중량%의 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체를 함유하도록, 제조된다.
상기 약학 조성물은 국소 투여를 목적으로 할 수 있으며, 이 경우 상기 담체는 용액, 에멀젼, 연고, 또는 겔 기제(gel base)를 적합하게 포함할 수 있다. 상기 기제는 예를 들어 하나 이상의 하기 물질을 포함할 수 있다: 페트롤라툼(petrolatum), 라놀린, 폴리에틸렌 글리콜, 밀랍(beeswax), 미네랄 오일, 물 및 알콜과 같은 희석제, 및 유화제 및 안정화제. 점증제가 국소 투여를 위한 약학 조성물에 존재할 수 있다. 경피 투여를 목적으로 할 경우, 상기 조성물은 경피용 패치(transdermal patch) 또는 이온도입 장치(ionophoresis device)를 포함할 수 있다. 국소 제제는 적어도 0.1 내지 약 10% w/v (단위 체적당 중량) 농도의 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체를 포함할 수 있다.
상기 조성물은 직장 투여를 목적으로 할 수 있으며, 예를 들어 직장내에서 녹아 약물을 방출하는 좌제 형태일 수 있다. 직장 투여용 조성물은 적합한 무자극성 부형제로서 유성 기제(oleaginous base)를 포함할 수 있다. 이러한 기제는 라놀린, 코코아 버터 및 폴리에틸렌 글리콜을 제한없이 포함한다.
상기 조성물은 고체 또는 액체 투여용량 단위의 물리적 형태를 변경시키는 다양한 물질을 포함할 수 있다. 예를 들어, 상기 조성물은 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체의 주위에 코팅 층을 형성하는 물질을 포함할 수 있다. 상기 코팅 층을 형성하는 물질은 전형적으로 불활성이고, 예를 들어 당(sugar), 쉘락, 및 기타 장용 코팅제로부터 선택될 수 있다. 선택적으로, 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체는 젤라틴 캡슐 내에 함유될 수도 있다.
본 발명의 상기 약학 조성물은 가스(gaseous) 투여용량 단위로 구성될 수 있으며, 예를 들면 에어로졸의 형태일 수 있다. 상기 용어 '에어로졸'은 콜로이드 성질의 시스템에서 가압 패키지로 구성된 시스템까지 다양한 시스템을 나타내기 위하여 사용된다. 송달은 액화되거나 또는 압축된 가스에 의할 수 있거나, 또는 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체를 분배하는(dispense)하는 적절한 펌프 시스템에 의할 수도 있다. 본 발명의 화합물의 에어로졸은 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체를 송달하기 위한 단일상, 2상, 또는 3상 시스템으로 송달될 수 있다. 에어로졸의 송달은 필요한 용기, 활성화제(activator), 밸브, 서브-컨테이너(sub-container), 스페이서 등을 포함하며, 이들은 함께 키트를 형성할 수도 있다. 바람직한 에어로졸은, 과도한 실험 없이, 당업자에 의해 결정될 수 있다.
또다른 구현예에서, 본 발명의 약학 조성물은 화학식 (I) 및/또는 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염, 및 적어도 하나의 화학요법제 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함한다.
상기한 조성물에서, 상기 화학요법제는 다카르바진(DTIC), 테모졸라미드, 메토트렉세이트, 독소루비신, 사이톡산, 5-플루오로우라실, 시스플라틴, 카보플라틴, 옥살리플라틴, 빈크리스틴, 빈블라스틴, 에토포시드, 이리노테칸, 토포테칸, 파클리탁셀, 도세탁셀, 탁소테르, 탁솔, 타목시펜, 게피티닙, 아드리아마이신, 젬시타빈, 멜팔란, 스트렙토조신, 플록스우리딘, 6-머캅토퓨린, 블레오마이신, 다우노루비신, 마이토마이신-C, 암사크린, 프로카바진, 카페시타빈, 아바스틴, 허셉틴, 벡사르, 벨케이드, 제발린, 젤로다, 얼비툭스(세툭시맵), 리툭시맵, 캠파스(알렘투주맵) 등으로 이루어진 군으로부터 선택된다.
주사에 의해 투여되는 것을 목적으로 하는 조성물은 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체 및 물을 조합하여 용액을 형성함으로써 제조될 수 있다. 계면활성제가 균질한 용액 또는 현탁액의 형성을 촉진하기 위하여 가해질 수 있다. 계면활성제는 상기 트리아젠 유사체 또는 유도체와 비-공유적으로 상호작용하여 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체의 용출 또는 균질한 현탁을 촉진하는 화합물이다.
유효한 양의 본 발명의 화합물 또는 조성물은 흑색종 및 기타 암 세포 질환을 치료하기 위하여 사용된다. 이러한 세포는 전형적으로 포유동물 세포이다. 유효한 양의 화학식 (I) 및/또는 화학식 (II)의 트리아젠 유사체의 투여방법은 당업계에 잘 알려져 있고, 흡입, 경구 또는 비경구 형태의 투여를 포함한다. 이러한 투여 형태는 비경구 용액, 정제, 캡슐제, 서방성 이식제 및 경피 송달 시스템; 또는 건조 분말 흡입기 또는 가압 다중-용량 흡입 장치를 사용한 흡입 투여용량 시스템(inhalation dosage systems)을 포함하나, 이에 제한되지 않는다. 상기 투여량 및 횟수는 해로운 효과(harmful effects) 없이 효과적인 수준의 물질을 얻도록 선택된다. 일반적으로 유효성(efficacy)을 위하여, 경구 또는 정맥내로 투여될 경우 약 0.01 내지 100 mg/kg/day, 전형적으로는 약 2 내지 10 mg/kg/day의 투여량 범위를 가질 수 있고, 경비 또는 흡입에 의해 투여될 경우 약 0.1 내지 4 mg/kg/day의 투여량 범위를 가질 수 있다.
본 발명의 약학 조성물은 적어도 하나의 화학식 (I) 및/또는 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염, 및 적어도 하나의 화학요법제 및 적어도 하나의 생체 반응 개선제(biologic response modifying agent) 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함한다.
상기한 바와 같은 적어도 하나의 생체 반응 개선제를 함유하는 조성물에서, 상기 생물학적 반응 변형제는 단일클론항체, 인터페론(인터페론-γ), 인터루킨(IL-1, IL-2, IL-9, IL-11, IL-12), 다양한 형태의 콜로니 자극인자(CSF, GM-CSF, G-CSF), TNF-α 수용체 차단제(TNF-α) 등으로 이루어진 군으로부터 선택된다.
트리아젠
유사체를 함유하는
키트
, 및 그의 제조방법 및 그의 용도
본 발명의 또다른 구현예에서, 상기한 바와 같은 트리아젠 유사체는 약학적 사용을 위한 본 발명의 트리아젠 유사체(멜라닌 표적화된 유사체)를 제공하기 위한 키트내에 포함될 수 있다. 이러한 키트는 일반적으로 병원, 의원, 또는 매일 이용할 수 있는 다른 의료 시설에서 상기의 제제를 제제화하기 위하여 사용되게 된다. 환자에게 치료학적으로 유효한 양의 화학식 (I) 및 화학식 (II)의 화합물을 투여함으로써, 환자에 있어서 암세포 성장을 억제하거나 암세포를 사멸하는 방법이 제공된다.
암 질환으로 고통받는 환자의 치료방법에서, 상기 암질환은 전이성 악성 흑색종, 림프종(호지킨 및 비-호지킨), 육종(유잉 육종(Ewing's sarcoma)), 암종, 뇌종양, 중추신경계(CNS) 전이암, 신경아교종(gliomas), 유방암, 전립선암, 폐암(소세포 및 비-소세포), 대장암, 췌장암, 두경부암(Head and Neck cancers), 구인두 편평세포암종(oropharyngeal squamous cell carcinoma)을 포함하나 이에 제한되지 않은 임의 형태(고형, 액상 및 림프 유래)이며, 화학식 (I) 및/또는 화학식 (II)의 화합물의 유효한 양을 상기 환자에게 투여하는 단계를 포함한다.
환자에 있어서 암세포 성장을 억제하거나 암세포를 사멸하는 방법에서, 상기 암세포는 인체의 모든 부위로부터 유래되고, 뇌, 폐, 부신 샘(adrenal glands), 뇌하수체, 유방, 전립선, 췌장, 난소, 위장관, 신장, 간, 비장, 고환, 자궁경부, 상부, 하부, 또는 중간부 식도와 같은 인체의 임의 기관으로부터 유래하나 이에 제한되지 않으며, 모든 유형의 원발성 또는 전이성 종양이다.
환자에게 화학식 (I) 및/또는 화학식 (II)의 화합물을 투여하는 방법은 복강내(IP), 정맥(IV), 경구(PO), 근육내(IM), 피부내(IC), 피내(intradermal, ID), 자궁내, 직장내 투여 등을 포함하는 임의의 형태의 송달일 수 있으나, 이에 제한되지는 않는다.
환자에게, 에멀젼 중의 상이한 크기의 나노입자를 사용하여, 화학식 (I) 및/또는 화학식 (II)의 화합물을 투여하는 방법이 제공된다.
항-종양 활성
본 발명자들은 화학식 (I) 및 화학식 (II)의 트리아젠 유사체의 항-종양 활성(poential)을 평가하였다. A2058 세포에서 MTT 흡수(incorporation)를 기반으로 하는 세포 증식 분석은 화학식 (I) 및 화학식 (II)의 트리아젠 유사체가 DTIC와 비교할 때 종양 세포 증식의 억제에 있어서 더욱 우수한 효능을 나타낸다는 것을 보여주었다(표 1). 화학식 (I) 및 화학식 (II)의 트리아젠 유사체 일부의 50% 억제 농도(IC50)는 표준 약물(DTIC)에 의해 나타난 것에 비교할 때 더욱 우수한 활성을 나타내는 것으로 밝혀졌다.
유사하게, 화학식 (I)의 화합물 6은 C57B6J 마우스의 B16FO 흑색종 이종이식 모델에서 DTIC 보다 더욱 우수한 항-종양 활성을 나타냈다. 또한, 화합물 6은 시험된 두개의 용량 수준에서 용량-반응 억제를 나타냈다. 그러나, DTIC는 시험된 동일한 두개의 용량 수준에서 통계학적으로 유의성있는 용량 반응을 나타내지 못하였다(도 10). DTIC가 용량 반응을 입증하지 못한 것은 문헌 보고와 일치하며, DTIC가 혈관신생 촉진제(angiogenesis promoter)임을 나타내는데 반해, 본 발명자들의 발견은 화합물 6이 혈관형성 억제제(angiogenesis inhibitor)임을 나타낸다(도 7, 9).
본 발명은 하기의 실시예에 의해 제공되며, 이들 실시예는 단지 설명을 위하여 제공된 것이고, 본 발명의 범위를 제한하는 것으로 간주되어서는 안된다. 당업자에게 명백한 변형 및 변경은 본 발명의 범위 및 특성내에 있는 것으로 의도되는 것이며, 본 발명은 첨부된 특허청구범위에서 정의된다.
실시예
실시예
1: 3-[(디메틸아미노)
디아제닐
]티오펜-2-
카르복사미드
(화합물 1)의 합성
단계 a:
메틸 3-[(디메틸아미노) 디아제닐 ]티오펜-2- 카르복실레이트 : H2O(7.5 mL) 중의 메틸 3-아미노티오펜-2-카르복실레이트(0.5 g, 3.18 mmol) 및 진한 HCl(1.3 mL, 12.73 mmol)의 용액에, NaNO2(0.24 g, 3.50 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0.5 시간 동안 0-5℃에서 교반한 후, 상기 반응 혼합물을 H2O(9 mL) 중의 K2CO3(1.66 g, 12.09 mmol) 및 디메틸아민(1.3 mL, 40%, 11.46 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-5℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 30 mL). CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고, 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(80:20)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 오렌지색 고체로서 얻었다(600 mg, 88%), mp 74-76℃. 1H NMR (400 MHz, CDCl3): δ 7.33 (1H, d, J=5.6 Hz), 7.24 (1H, d, J=5.6 Hz), 3.87 (3H, s), 3.52 (3H, s), 3.29 (3H, s); LC-MS (양이온 모드): m/z 214 (M+H)+.
단계 b:
3-[(디메틸아미노) 디아제닐 ]티오펜-2- 카르복사미드 : 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(20 mL)에, THF(5 mL)중의 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(600 mg)의 용액을 5분 동안 가하고, 실온에서 20시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 침전된 고체를 여과하고, 건조하여 조 생성물(crude product)을 얻은 다음, 이를 용리액으로서 클로로포름-메탄올(98:2)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(400 mg, 72%), mp 168-170℃. IR (neat) νmax 3337, 3172, 2923, 1636, 1599, 1348, 1219, 1117, 884, 771 cm-1, 1H NMR (400 MHz, CDCl3): δ 8.28 (2H, br s), 7.35 (1H, d, J=5.6 Hz), 7.31 (1H, d, J=5.6 Hz), 3.58 (3H, br s), 3.20 (3H, br s); LC-MS (양이온 모드): m/z 221 (M+Na)+.
실시예
2: 3-[(디메틸아미노)
디아제닐
]-4-
브로모티오펜
-2-
카르복사미드(화합물 2)의
합성
단계 a:
메틸 3-아미노-4- 브로모티오펜 -2- 카르복실레이트: 아세트산(10 mL) 중의 메틸 3-아미노티오펜-2-카르복실레이트(1 g, 6.36 mmol)의 용액에, 아세트산(1 mL) 중의 브롬(0.32 mL, 6.36 mmol)의 용액을 5분 동안 실온에서 천천히 가하고 동일한 온도에서 16시간 동안 교반하였다. 상기 반응 혼합물을 차가운 얼음물에 붓고 클로로포름으로 추출하였다(3 x 100 mL). 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 황색 고체로서 얻었다(0.5 g, 33%), mp 58-60℃. 1H NMR (400 MHz, CDCl3): δ 7.29 (1H, s), 5.63 (2H, br s), 3.85 (3H, s).
단계 b:
메틸 3-[(디메틸아미노) 디아제닐 ]-4- 브로모티오펜 -2- 카르복실레이트: H2O(5 mL) 중의 메틸 3-아미노-4-브로모티오펜-2-카르복실레이트(0.5 g, 2.11 mmol) 및 진한 HCl(0.85 mL, 8.47 mmol)의 용액에, NaNO2(160 mg, 2.33 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0-5℃에서 0.5시간 교반 후에, 상기 반응 혼합물을 H2O(6 mL) 중의 K2CO3(1.1 g, 8.04 mmol) 및 디메틸아민(0.85 mL, 40%, 7.6 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-10℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 30 mL). CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(90:10)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 오렌지색 오일로서 얻었다(0.5 g, 81%). 1H NMR (400 MHz, CDCl3): δ 7.38 (1H, s), 3.80 (3H, s), 3.53 (3H, br s), 3.28 (3H, br s).
단계 c:
3-[(디메틸아미노) 디아제닐 ]-4- 브로모티오펜 -2- 카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(10 mL)에, THF(5 mL)중의 메틸 3-[(디메틸아미노)디아제닐]-4-브로모티오펜-2-카르복실레이트(500 mg)의 용액을 5분 동안 가하고 실온에서 20 시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 에틸 아세테이트로 추출하였다(3 x 50 mL). 상기 EtOAc 층을 모아 물, 소금물로 세척하고 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(98:2)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(250 mg, 53%), mp 194-196℃. 1H NMR (400 MHz, DMSO-d6): δ 7.85 (1H, s), 7.75 (1H, br s), 7.56 (1H, br s), 3.56 (3H, br s), 3.21 (3H, br s); LC-MS (양이온 모드): m/z 277, 279 (M+H)+.
실시예
3: 3-[(디메틸아미노)
디아제닐
]-5-
니트로티오펜
-2-
카르복사미드(화합
물 3)의 합성
단계 a:
메틸 3-[(디메틸아미노) 디아제닐 ]티오펜-2- 카르복실레이트: H2O(30 mL) 중의 메틸 3-아미노티오펜-2-카르복실레이트(2.0 g, 12.7 mmol) 및 진한 HCl(5 mL, 50.8 mmol)의 용액에, NaNO2(0.96 g, 14.08 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0.5시간 동안 0-5℃에서 교반한 후에, 상기 반응 혼합물을 H2O(36 mL) 중의 K2CO3(6.65 g, 48.26 mmol) 및 디메틸아민(5.14 mL, 40%, 45.7 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-10℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 100 mL). 상기 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(80:20)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 오렌지색 고체로서 얻었다(2.5 mg, 91%), mp 74-76℃.
단계 b:
메틸 3-[(디메틸아미노) 디아제닐 ]-5- 니트로티오펜 -2- 카르복실레이트: 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(2 g, 9.38 mmol)을 진한 황산 (20 mL)에 15분 동안 0 내지 -5℃에서 천천히 가하였다. 이후, 진한 질산(0.54 mL, 70%, 10.7 mmol)을 상기 반응 혼합물에 10분 동안 가하고, 동일한 온도에서 1시간 동안 교반한 후 실온에서 16시간 동안 교반하였다. 상기 혼합물을 얼음으로 냉각시킨 물에 붓고, 수산화암모늄으로 염기성화하였다. 상기 용액을 클로로포름으로 추출하고(3 x 100 mL), 유기층을 모아 물, 소금물로 세척한 후, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(80:20)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 황색 고체로서 얻었다(450 mg, 26%), mp 128-130℃.
단계 c:
3-[(디메틸아미노) 디아제닐 ]-5- 니트로티오펜 -2- 카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(35 mL)에, THF(10 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복실레이트(400 mg)의 용액을 5분 동안 가하고 실온에서 20시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 에틸 아세테이트로 추출하였다(3 x 100 mL). 상기 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(50:50)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 황색 고체로서 얻었다(90 mg, 26%), mp 240-246℃. 1H NMR (400 MHz, DMSO-d6): δ 8.22 (1H, s), 8.05 (1H, s), 7.91 (1H, s), 3.63 (3H, s), 3.26 (3H, s); LC-MS (양이온 모드): m/z 266 (M+Na)+.
실시예
4: 4-[(디메틸아미노)
디아제닐
]-3-
메톡시티오펜
-2,5-디
카르복사미드(화합물 4)의
합성
단계 a:
메틸 4-히드록시-5-( 메톡시카르보닐 )-3- 니트로티오펜 -2- 카르복실레이트: 메틸 4-히드록시-5-(메톡시카르보닐)티오펜-2-카르복실레이트(5 g, 23.14 mmol)를 진한 황산(25 mL)에 15분 동안 0 내지 -5℃에서 천천히 가하였다. 이후, 진한 질산(3.2 mL, 70%, 34.7 mmol)을 10분 동안 상기 반응 혼합물에 가하고, 동일한 온도에서 1시간 동안 교반하였다. 상기 혼합물을 얼음으로 냉각시킨 물에 붓고, 에틸 아세테이트로 추출하였다(3 x 100 mL). 상기 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 황색 반-고체로서 얻었다(1.2 g, 20%).
단계 b:
메틸 4- 메톡시 -5-( 메톡시카르보닐 )-3- 니트로티오펜 -2- 카르복실레이트: 아세톤(20 mL) 중의 메틸 4-히드록시-5-(메톡시카르보닐)-3-니트로티오펜-2-카르복실레이트(650 mg, 2.5 mmol)의 용액에, 탄산칼륨(0.68 g, 5 mmol)을 실온에서 가하였다. 디메틸 설페이트(0.36 mL, 3.73 mmol)를 상기 반응 혼합물에 천천히 교반하면서 가하고, 촉매량의 KI를 가하였다. 상기 혼합물을 4시간 동안 환류시키고, 냉각시킨 반응 혼합물을 여과하고, 고체를 아세톤으로 세척하였다. 아세톤을 감압하에서 제거하고, 잔사를 용리액으로서 헥산-에틸 아세테이트(90:10)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 황색 고체로서 얻었다(0.3 g, 45%), mp 80-82℃. 1H NMR (400 MHz, CDCl3): δ 4.08 (3H, s), 3.94 (3H, s), 3.92 (3H, s).
단계 c:
메틸 3-아미노-4- 메톡시 -5-( 메톡시 카르보닐)티오펜-2- 카르복실레이트: 메탄올(20 mL) 중의 메틸 4-메톡시-5-(메톡시카르보닐)-3-니트로티오펜-2-카르복실레이트(0.9 g, 3.27 mmol)의 용액에, 진한 염산(0.3 mL)을 가하였다. 상기 용액에 철분말(0.91 g, 16.36 mmol)을 가한 후, 염화암모늄 수용액(0.87 g, 16.3 mmol, 물: 5 mL)을 실온에서 가하였다. 상기 반응 혼합물을 교반하고, 70℃로 1시간 동안 가온한 후, 실온으로 냉각시켰다. 상기 용액을 여과하고, 포화 중탄산나트륨 용액으로 염기성화하였다. 상기 용액을 에틸 아세테이트로 추출하였다(4 x 100 mL). 상기 유기층을 모아 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켜 생성물을 옅은 황색 고체로서 얻었다(0.65 g, 81%), mp 120-124℃. 1H NMR (400 MHz, CDCl3): δ 5.39 (2H, br s), 4.01 (3H, s), 3.87 (3H, s), 3.85 (3H, s); LC-MS (양이온 모드): m/z 246 (M+H)+.
단계 d:
메틸 3-[(디메틸아미노) 디아제닐 ]-4-메톡시-5-( 메톡시카르보닐 )티오펜-2- 카 르복실레이트: H2O(10 mL) 및 아세톤(10 mL) 중의 메틸 3-아미노-4-메톡시-5-(메톡시카르보닐)티오펜-2-카르복실레이트(0.6 g, 2.44 mmol), 진한 HCl(1 mL, 9.8 mmol)의 용액에, NaNO2(0.19 g, 2.7 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0.5시간 동안 0-5℃에서 교반한 후에, 상기 반응 혼합물을 H2O(8 mL) 중의 K2CO3(1.28 g, 9.3 mmol) 및 디메틸아민(1 mL, 40%, 8.78 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-10℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 100 mL). 상기 CHCl3 층을 모아 물, 소금물로 세척하고 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc (80:20)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 오렌지색 오일로서 얻었다(0.45 g, 62%). 1H NMR (400 MHz, CDCl3): δ 3.93 (3H, s), 3.88 (3H, s), 3.82 (3H, s), 3.53 (3H, br s), 3.26 (3H, br s); LC-MS (양이온 모드): m/z 324 (M+Na)+.
단계 e:
4-[(디메틸아미노) 디아제닐 ]-3- 메톡시티오펜 -2,5- 디카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(20 mL)에, THF(5 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]-4-메톡시-5-(메톡시카르보닐)티오펜-2-카르복실레이트(400 mg)의 용액을 5분 동안 가하고, 실온에서 20 시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 에틸 아세테이트로 추출하였다(10 x 50 mL). 상기 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 클로로포름-메탄올로부터 결정화하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(80 mg, 22%), mp 226-228℃. 1H NMR (400 MHz, DMSO-d6): δ 7.86 (1H, s), 7.81 (1H, s), 7.73 (1H, s), 7.35 (1H, s), 3.72 (3H, s), 3.59 (3H, br s), 3.21 (3H, br s); LC-MS (양이온 모드): m/z 294 (M+Na)+.
실시예
5: 3-[(디메틸아미노)
디아제닐
]-5-
페닐티오펜
-2-
카르복사미드(화합물 5)의
합성
단계 a:
3- 클로로 -3- 페닐프로프 -2- 엔니트릴: 무수 디메틸포름아미드의 얼음-냉각시킨(0-5℃) 용액(25.6 mL, 333.2 mmol)에, 포스포러스 옥시클로라이드(15.6 mL, 166.6 mmol)를 교반하면서 15분 동안 적가하였다. 상기 차가운 혼합물에, 아세토페논(10 g, 83 mmol)을 반응 혼합물의 온도를 45-55℃ 사이로 유지하면서 10분 동안 적가하였다. 반응 혼합물을 천천히 실온으로 가져오고, 30분 동안 방치하였다. 상기 반응 혼합물에, 무수 DMF(33 mL) 중의 히드록실아민 염산염(23.1 g, 333.2 mmol)의 총 용액 중 7 mL를 가하고, 상기 혼합물을 70-80℃에서 5분 동안 교반하였다. 이후, DMF 중의 히드록실아민 염산염의 나머지 용액을, 반응 혼합물의 온도가 145-155℃ 이상으로 상승하는 속도로, 가하였다. 첨가 종료 후에, 반응 혼합물을 실온으로 30분 동안 가져오고, 차가운 물(0.5 L)로 희석하였다. 상기 용액을 클로로포름으로 추출하고, 클로로포름 층을 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(98:2)를 사용하여 실리카 겔 상에서 크로마토그래피하여 생성물을 오일로서 얻었다(7 g, 52%). 1H NMR (400 MHz, CDCl3): δ 7.64-7.67 (2H, m), 7.43-7.53 (3H, m), 6.02 (1H, s).
단계 b:
메틸 3-아미노-5- 페닐티오펜 - 카르복실레이트: 메탄올(5 mL) 중의 메틸 티오글리콜레이트(1 g, 9.43 mmol)의 용액에, 메탄올(5 mL) 중의 소듐 메톡사이드(0.5 g, 9.43 mmol)의 용액을 가하고, 0.5 시간 동안 교반하였다. 상기 혼합물에, DMF (3.5 mL) 중의 3-클로로-3-페닐프로프-2-엔니트릴(1.22 g, 7.5 mmol)의 용액을 10분 동안 실온에서 적가하고, 상기 혼합물을 60℃에서 2시간 동안 교반하였다. 이후, 메탄올(10 mL) 중의 소듐 메톡사이드(1 g, 18.6 mmol)의 용액을 실온에서 적가하고, 60℃에서 2시간 동안 교반을 계속하였다. 상기 혼합물을 실온으로 가져오고, 차가운 물에 붓고, 15분 동안 교반하였다. 상기 용액을 클로로포름으로 추출하고(3 x 100 mL), 클로로포름 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(92:8)를 사용하여 실리카 겔 상에서 크로마토그래피하여 생성물을 옅은 황색 고체로서 얻었다(1.1 g, 50%), mp 130-132℃. 1H NMR (400 MHz, DMSO-d6): δ 7.62-7.65 (2H, m), 7.38-7.48 (3H, m), 7.00 (1H, s), 4.29 (2H, br s), 3.74 (3H, s); LC-MS (양이온 모드): m/z 234 (M+H)+.
단계 c:
메틸 3-[(디메틸아미노) 디아제닐 ]-5- 페닐티오펜 -2- 카르복실레이트: H2O(51 mL) 중의 메틸 3-아미노-5-페닐티오펜-2-카르복실레이트(5 g, 21.4 mmol) 및 진한 HCl(9 mL, 85.8 mmol)의 용액에, 아세톤(30 mL)을 가하여 생성물을 용해시켰다. 이후, NaNO2(1.7 g, 23.6 mmol)를 15분 동안 0℃에서 조금씩 가하였다. 0-5℃에서 1시간 동안 교반한 후에, 상기 반응 혼합물을 H2O(60 mL) 중의 K2CO3(11.2 g, 81.5 mmol) 및 디메틸아민(8.5 mL, 40%, 77.2 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-5℃에서 1시간 동안 교반하고 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 100 mL). CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(90:10)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 갈색 고체로서 얻었다(3.8 g, 76%), mp 92-94℃. 1H NMR (400 MHz, DMSO-d6): δ 7.78-7.80 (2H, m), 7.64 (1H, s), 7.46-7.52 (3H, m), 3.84 (3H, s), 3.60 (3H, s), 3.28 (3H, s); LC-MS (양이온 모드): m/z 290 (M+H)+.
단계 d:
3-[(디메틸아미노) 디아제닐 ]-5- 페닐티오펜 -2- 카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(80 mL)에, THF(15 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복실레이트(2.2 g)의 용액을 5분 동안 가한 다음, 촉매량의 PEG-400을 가하고, 상기 혼합물을 실온에서 36시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 클로로포름으로 추출하였다. 상기 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(94:6)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 얻었다. 상기 조 생성물을 클로로포름-헥산으로부터 재결정하여 생성물을 황색 고체로서 얻었다(170 mg, 8%), mp 220-222℃. IR (neat) νmax 3343, 2922, 2855, 1642, 1595, 1221, 1023, 880, 841 cm- 1; 1H NMR (400 MHz, CDCl3): δ 8.30 (1H, br s), 7.64-7.66 (2H, m), 7.53 (1H, s), 7.30-7.41 (3H, m), 6.34 (1H, br s), 3.59 (3H, s), 3.20 (3H, s); 13C NMR (100 MHz, CDCl3): δ 164.7, 151.1, 146.7, 133.9, 128.9, 128.5, 125.8, 125.4, 114.7, 43.6, 36.5; LC-MS (양이온 모드): m/z 297 (M+Na)+.
실시예
6: 3-[(디메틸아미노)
디아제닐
]티오펜-2-
카르복실산
(화합물 6)의 합성
메탄올(10 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(200 mg, 0.93 mmol)의 용액에, 물(2 mL) 중의 수산화나트륨(93 mg, 2.3 mmol)의 용액을 가하고, 실온에서 2시간 동안 교반하였다. 상기 혼합물을 차가운 얼음물로 희석하고 묽은 염산으로 산성화한 후, 클로로포름으로 추출하였다. 클로로포름 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(80:20)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(70 mg, 38%), mp 108-110℃. IR (neat) νmax 3402, 3082, 2923, 1708, 1218, 1116, 1066, 1016, 880, 773 cm-1; 1H NMR (400 MHz, CDCl3): δ 12.21 (1H, s), 7.47 (1H, d, J=5.2 Hz), 7.30 (1H, d, J=5.2 Hz), 3.65 (3H, s), 3.28 (3H, s); LC-MS (양이온 모드): m/z 200 (M+H)+.
실시예
7: 3-[(디메틸아미노)
디아제닐
]-5-
니트로티오펜
-2-
카르복실산(화합물 7)의
합성
메탄올(10 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복실레이트(550 mg)의 용액에, 수산화나트륨 수용액(물 5 mL 중 0.25 g)을 실온에서 가하고, 상기 혼합물을 14시간 동안 교반하였다. 과량의 메탄올을 감압하에 증발시키고, 잔사를 차가운 얼음물로 희석하였다. 상기 용액을 묽은 HCl로 산성화하고, 분리된 고체를 여과하고, 물로 세척한 후에 건조하여 생성물을 황색 고체로서 얻었다(450 mg, 86%). 상기 조 생성물을 클로로포름-메탄올로부터 재결정하였다(290 mg), mp 184-186℃. 1H NMR (400 MHz, DMSO-d6): δ 13.26 (1H, br s), 8.00 (1H, s), 3.59 (3H, s), 3.25 (3H, s); LC-MS (양이온 모드): m/z 245 (M+H)+.
실시예
8: 3-[(디메틸아미노)
디아제닐
]-5-
페닐티오펜
-2-
카르복실산(화합물
8)의 합성
메탄올(50 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복실레이트(1.8 g, 6.22 mmol)의 용액에, 물(15 mL) 중의 수산화나트륨(1.24 g, 31.1 mmol)의 용액을 가하고, 실온에서 16시간 동안 교반하였다. 상기 혼합물은 차가운 얼음물로 희석하고, 묽은 HCl로 산성화하였다. 상기 혼합물을 30분 동안 교반하고, 침전된 고체를 여과하고, 물로 세척 후 건조하였다. 상기 고체를 용리액으로서 헥산-에틸 아세테이트(70:30)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 얻었다. 상기 조(crude) 고체를 헥산-클로로포름으로부터 재결정하여 생성물을 옅은 분홍색 고체로서 얻었다(1.1 g, 61%), mp 162-166℃. IR (neat) νmax 2923, 2853, 1708, 1260, 1220, 1173, 1042, 1020, 879, 836 cm-1; 1H NMR (400 MHz, CDCl3): δ 12.15 (1H, br s), 7.58-7.60 (2H, m), 7.44 (1H, s), 7.32-7.40 (3H, m), 3.65 (3H, s), 3.25 (3H, s); 13C NMR (100 MHz, CDCl3): δ 162.8, 153.3, 149.7, 133.3, 129.1, 129.0, 125.9, 120.1, 113.4, 44.3, 37.0; LC-MS (양이온 모드): m/z 298 (M+Na)+.
실시예
9: {3-[(디메틸아미노)
디아제닐
](2-
티에닐
)}-N-(2-히드록시에틸)-카르복사미드(
화합물 9)의
합성
THF(5 mL) 중의 에탄올 아민(5 mL)의 얼음-냉각시킨(0-5℃) 용액에, THF(5 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(500 mg)의 용액을 5분 동안 가하고, 실온에서 20시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 그 용액을 에틸 아세테이트로 추출하였다(3 x 50 mL). 상기 EtOAc 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 얻었고, 이를 클로로포름-헥산으로부터 재결정하여 생성물을 옅은 오렌지색 고체로서 얻었다(430 mg, 77%), mp 118-122℃. IR (neat) νmax 3397, 3278, 2926, 1621, 1353, 1298, 1220, 1083, 1007, 882, 775 cm-1; 1H NMR (400 MHz, CDCl3): δ 8.86 (1H, br s), 7.31 (1H, d, J=5.6 Hz), 7.28 (1H, d, J=5.2 Hz), 3.78-3.82 (2H, m), 3.60-3.64 (2H, m), 3.57 (3H, br s), 3.23 (3H, br s), 2.76 (1H, t, J=5.0 Hz); LC-MS (양이온 모드): m/z 243 (M+H)+.
실시예
10: {3-[(디메틸아미노)
디아제닐
](2-
티에닐
)}-N-
메틸카르복사미드(화합물 10)의
합성
THF(5 mL) 중의 메틸 아민(3 mL)의 얼음-냉각시킨(0-5℃) 용액에, THF(5 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(500 mg)의 용액을 5분 동안 가하고, 실온에서 36시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 그 용액을 클로로포름으로 추출하였다(3 x 100 mL). 클로로포름 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(98:2)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 얻고, 이를 클로로포름-헥산으로부터 재결정하여 생성물을 옅은 오렌지색 고체로서 얻었다(380 mg, 76%), mp 98-102℃. IR (neat) νmax 3297, 3082, 2929, 1637, 1380, 1348, 1299, 1221, 1109, 1016, 882, 776 cm- 1; 1H NMR (400 MHz, CDCl3): δ 8.35 (1H, br s), 7.29 (1H, d, J=5.2 Hz), 7.27 (1H, d, J=5.2 Hz), 3.57 (3H, br s), 3.21 (3H, br s), 3.00 (3H, d, J=4.8 Hz); LC-MS (양이온 모드): m/z 213 (M+H)+.
실시예
11: N-(2-
아미노에틸
){3-[(디메틸아미노)
디아제닐
](2-
티에닐
)}-
카르복사미드(화합물 11)의
합성
에탄올(5 mL) 중의 에틸렌디아민(5 mL)의 얼음-냉각시킨(0-5℃) 용액에, 에탄올(5 mL) 중의 메틸 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(250 mg)의 용액을 5분 동안 가하고, 실온에서 24시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 염화나트륨으로 포화시켰다. 상기 용액을 THF로 추출하였다(3 x 100 mL). 상기 THF 층을 모아 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(90:10)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(60 mg, 22%), mp 98-100℃. 1H NMR (400 MHz, CDCl3): δ 8.65 (1H, br s), 7.30 (1H, d, J=5.2 Hz), 7.28 (1H, d, J=5.2 Hz), 3.50-3.57 (5H, m), 3.24 (3H, br s), 2.91 (2H, t, J=6.0 Hz).
실시예
12: 4-[디메틸아미노)
디아제닐
]티오펜-2-
카르복사미드
(화합물 12)의 합성
단계 a:
4- 니트로티오펜 -2- 카르복실산: 황산(3.0 mL, 5.505 g, 56.17 mmol)을 질산 (2.0 mL, 2.98 g, 49.6 mmol)에 0-10℃에서 천천히 가하였다. 첨가 종료 후에, 티오펜-2-카르복실산(2.8 g, 21.87 mmol)을 상기 질산화 혼합물에 동일한 온도에서 15분 동안 천천히 가하고, 그 혼합물을 1시간 동안 교반하였다. 상기 반응 혼합물을 차가운 얼음물에 붓고, 30분 동안 교반하였다. 침전된 고체를 여과하고 차가운 물로 세척한 후, 건조하였다. 상기 여액을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 생성물을 모아 헥산(2 x 50 mL)과 함께 교반하고, 고체를 여과한 후 건조하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(2.8 g, 75%), mp 110-118℃. 상기 생성물은 HPLC 및 1H NMR에 의해 두가지 화합물의 혼합물이었으며, 다음 단계를 진행하였다.
단계 b:
메틸 4- 니트로티오펜 -2- 카르복실레이트: 메탄올(50 mL) 중의 니트로티오펜-2-카르복실산(6.8 g, 39.3 mmol)의 용액에, 티오닐 클로라이드(6 mL, 78.6 mmol)를 실온에서 교반하면서 적가하였다. 상기 반응 혼합물을 2시간 동안 환류시키고, 실온에 도달시켰다. 상기 혼합물을 얼음으로 냉각시킨 물에 붓고, 15분 동안 교반하였다. 침전된 고체를 여과하고, 차가운 물로 세척한 후 건조하여 생성물을 오프화이트색(off-white)의 고체로서 얻었다(6.2 g, 85%). 1H NMR은 생성물이 두 개의 화합물의 혼합물임을 나타내었으며, 상기 조 생성물은 다음 단계를 진행하였다.
단계 c:
메틸 4- 아미노티오펜 -2- 카르복실레이트: 물(150 mL) 및 메탄올(50 mL)의 혼합물 중의 메틸 니트로티오펜-2-카르복실레이트(7 g, 37.43 mmol)의 용액에, 진한 염산(4.5 mL)을 가하였다. 상기 용액에 철 분말(10.5 g, 188 mmol)을 가한 다음, 염화암모늄(1O g, 187 mmol)을 실온에서 가하였다. 상기 반응 혼합물을 교반한 후 70℃로 1시간 동안 가온한 후, 실온으로 냉각시켰다. 상기 용액을 여과하고 포화 중탄산나트륨 용액으로 염기성화하였다. 상기 용액을 클로로포름으로 추출하였다(4 x 100 mL). 유기층을 모아 소듐 설페이트 상에서 건조하고, 여과하였다. 용매를 증발시키고, 잔사를 용리액으로서 헥산-에틸 아세테이트(90:10 및 소량의 트리에틸 아민)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 메틸 4-아미노티오펜-2-카르복실레이트를 얻었다(1.8 g, 31%), mp 76-78℃. 1H NMR (400 MHz, CDCl3): δ 7.31 (1H, d, J=1.6 Hz), 6.40 (1H, d, J=1.6 Hz), 3.85 (3H, s), 3.63 (2H, br s).
동일한 용매 시스템으로 컬럼을 추가 용리시켜 메틸 5-아미노티오펜-2-카르복실레이트를 얻었다(0.5 g, 8.5%), mp 70-72℃. 1H NMR (400 MHz, CDCl3): δ 7.45 (1H, d, J=4.0 Hz), 6.09 (1H, d, J=4.0 Hz), 4.29 (2H, br s), 3.81 (3H, s).
단계 d:
메틸 4-[(디메틸아미노) 디아제닐 ]티오펜-2- 카르복실레이트: H2O(20 mL) 중의 메틸 4-아미노티오펜-2-카르복실레이트(1.7 g, 10.82 mmol) 및 진한 HCl(4.6 mL, 43.5 mmol)의 용액에, NaNO2(0.84 g, 12.17 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0-5℃에서 0.5 시간 동안 교반한 후에, 상기 반응 혼합물을 H2O(30 mL) 중의 K2CO3(5.8 g, 42 mmol) 및 디메틸아민(4.6 mL, 40%, 40.9 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-5℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 100 mL). CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(80:20)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 밝은 적색(light red) 고체로서 얻었고(250 mg), 이를 클로로포름-헥산으로부터 재결정하였다(110 mg), mp 90-92℃. 1H NMR (400 MHz, CDCl3): δ 7.93 (1H, d, J=1.6 Hz), 7.31 (1H, d, J=1.6 Hz), 3.88 (3H, s), 3.31 (6H, br s).
단계 e:
4-[디메틸아미노) 디아제닐 ]티오펜-2- 카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(5 mL)에, THF(2 mL) 중의 메틸 4-[(디메틸아미노)디아제닐]티오펜-2-카르복실레이트(110 mg)의 용액을 5분 동안 가하고, 실온에서 20시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 클로로포름으로 추출하였다. 상기 유기층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(99:1)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 적색 고체로서 얻었다(60 mg, 60%), mp 128-130℃. IR (neat) νmax 3372, 3189, 1648, 1609, 1219, 1120, 1088, 865, 772 cm- 1; 1H NMR (400 MHz, CDCl3): δ 7.68 (1H, d, J=1.2 Hz), 7.28 (1H, d, J=1.2 Hz), 6.18 (2H, br s), 3.29 (6H, br s); LC-MS (양이온 모드): m/z 199 (M+H)+.
실시예
13: 4-[(디메틸아미노)
디아제닐
]티오펜-3-
카르복사미드
(화합물 13)의 합성
단계 a:
메틸 3-[( 메톡시카르보닐 ) 메틸티오 ] 프로파노에이트: 메틸 아크릴레이트(4.25 g, 49.5 mmol)를 메틸 티오글리콜레이트(5 g, 47.16 mmol) 및 피페리딘(0.10 mL)을 교반시킨 용액에 실온에서 20분에 걸쳐 적가하였다. 상기 아크릴레이트를 반 정도 넣었을 때, 피페리딘(0.10 mL)를 추가로 가하였다. 상기 아크릴레이트의 첨가 종료 후에, 반응 혼합물을 1시간 동안 실온에서 교반하였다. 상기 혼합물을 클로로포름 100 mL로 희석하였다. 상기 클로로포름 층을 물, 소금물로 세척하고, Na2SO4 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켜 생성물을 오일로서 얻었다(9 g, 100%).
단계 b:
메틸 4-옥소-2, 3 ,5- 트리히드로티오펜 -3- 카르복실레이트: 무수 THF(15 mL) 중의 소듐 메톡사이드(1.68 g, 31.25 mmol)의 교반된 슬러리에, THF(10 mL) 중의 디메틸 3-티아헥산디오에이트(5 g, 26.03 mmol)의 용액을 실온에서 5분 동안 가하였다. 상기 반응 혼합물을 2시간 동안 가열 환류시키고, 실온으로 냉각한 후, 차가운 얼음물에 붓고, 묽은 HCl로 산성화하였다. 상기 용액을 클로로포름으로 추출하고, 클로로포름 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 황색 오일로서 얻었다(1.6 g, 39%).
단계 c:
메틸 4- 아미노티오펜 -3- 카르복실레이트 염산염: 4-옥소-3-메톡시카르보닐테트라히드로티오펜(6.5 g, 40.62 mmol), 히드록실아민 염산염(2.84 g, 40.62 mmol) 및 아세토니트릴(30 mL)의 혼합물을 1시간 동안 환류하에서 교반하였다. 이후, 상기 혼합물을 냉각시키고, 분리된 고체를 여과한 후 무수 에테르로 세척하여 표제 화합물을 얻었다(4.9 g, 62%), mp 192-196℃.
단계 d:
메틸 4- 아미노티오펜 -3- 카르복실레이트: 메틸 4-아미노티오펜-3-카르복실레이트 염산염(290 mg)을 물(20 mL)에 용해시키고, 암모니아 용액으로 염기성화하였다. 상기 용액을 클로로포름으로 추출하고, 클로로포름 층을 모아 물, 소금물로 세척한 후, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고, 용매를 증발시켜 생성물을 옅은 황색 오일로서 얻었다(150 mg, 65%). 1H NMR (400 MHz, CDCl3): δ 7.92 (1H, d, J=3.6 Hz), 6.08 (1H, d, J=3.6 Hz), 4.79 (2H, br s), 3.85 (3H, s).
단계 e:
메틸 4-[(디메틸아미노) 디아제닐 ]티오펜-3- 카르복실레이트: H2O(5 mL) 중의메틸 4-아미노티오펜-3-카르복실레이트(200 mg, 1.27 mmol) 및 진한 HCl(0.5 mL, 5.09 mmol)의 용액에, NaNO2(96 mg, 1.39 mmol)를 5분 동안 0℃에서 조금씩 가하였다. 0.5시간 동안 0-5℃에서 교반한 후에, 상기 반응 혼합물을 H2O(5 mL) 중의 K2CO3(665 mg, 4.8 mmol) 및 디메틸아민(0.5 mL, 40%, 4.57 mmol)의 용액에 0℃에서 가하였다. 상기 혼합물을 0-5℃에서 1시간 동안 교반하고, 차가운 얼음물에 부었다. 상기 용액을 클로로포름으로 추출하였다(3 x 30 mL). CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-EtOAc(90:10)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 적색 오일로서 얻었다(20 mg, 8%). 1H NMR (400 MHz, CDCl3): δ 8.00 (1H, d, J=2.8 Hz), 6.97 (1H, d, J=3.6 Hz), 3.85 (3H, s), 3.34 (6H, br s).
단계 f:
4-[(디메틸아미노) 디아제닐 ]티오펜-3- 카르복사미드: 수산화암모늄의 얼음-냉각시킨(0-5℃) 용액(5 mL)에, THF(2 mL) 중의 메틸 4-[(디메틸아미노)디아제닐]티오펜-3-카르복실레이트(110 mg)의 용액을 5분 동안 가하고, 실온에서 36시간 동안 교반하였다. 상기 용액을 얼음으로 냉각시킨 물에 붓고, 클로로포름으로 추출하였다. 클로로포름 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(98:2)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 적색 고체로서 얻었다(25 mg, 25%), mp 168-172℃. IR (neat) νmax 3324, 3125, 2917, 2851, 1655, 1600, 1367, 1336, 1090 cm- 1; 1H NMR (400 MHz, CDCl3): δ 8.55 (1H, br s), 8.19 (1H, d, J=3.6 Hz), 7.15 (1H, d, J=3.6 Hz), 5.84 (1H, br s), 3.56 (3H, br s), 3.19 (3H, br s); LC-MS (양이온 모드): m/z 199 (M+H)+.
실시예
14: 3-[(디메틸아미노)
디아제닐
]티오펜-2-
카르복실산의
칼륨염(화합물 14)의 합성
메탄올(15 mL) 중의 3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산(실시예 4: 300 mg, 1.50 mmol)의 용액에, 메탄올(5 mL) 중의 수산화칼륨(84 mg, 1.50 mmol)의 용액을 실온에서 가하고, 상기 혼합물을 1시간 동안 동일한 온도에서 교반하였다. 상기 용액을 여과하여 불순물을 제거하고, 감압하에 증발시켜 상기 화합물을 갈색 고체로서 얻었다(290 mg, 81%), mp 274-280℃. 1H NMR (400 MHz, D2O): δ 7.36 (1H, d, J=5.6 Hz), 7.10 (1H, d, J=5.6 Hz); LC-MS (양이온 모드): m/z 238 (M+H)+.
실시예
15: 3-
메틸티오페노
[2,3-d]1,2,3-
트리아진
-4-온(화합물 15)의 합성
단계 a:
2- 아미노티오펜 -3- 카르복사미드: 에탄올(200 mL) 및 트리에틸아민(2 mL) 중의 2,5-디히드록시-l,4-디티안(10 g, 65.78 mmol)의 용액에, 시아노아세트아미드(5.52 g, 65.78 mmol)를 실온에서 5분 동안 가하였다. 상기 반응 혼합물을 3시간 동안 환류시키고, 실온에 도달시켰다. 에탄올(약 150 mL)을 감압하에 제거하고, 내용물을 차가운 얼음물에 붓고, 15분 동안 교반하였다. 상기 용액을 에틸 아세테이트로 추출하고(3 x 100 mL), EtOAc 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 황색 고체로서 얻었다(4.9 g, 53%), mp 150-152℃.
단계 b:
3H- 티오페노 [2,3-d]1,2,3- 트리아진 -4-온: 진한 황산(40 mL) 중의 2-아미노티오펜-3-카르복사미드(5 g, 35.21 mmol)의 얼음-냉각시킨(0℃) 용액에, 진한 황산(30 mL) 중의 아질산나트륨(2.5 g, 35.21 mmol)의 차가운(0℃) 용액을 30분 동안 가하였다(첨가하는 동안, 온도를 -5 내지 0℃ 사이로 유지시켰다). 첨가 후에, 상기 혼합물을 동일한 온도(0℃)에서 3시간 동안 교반하였다. 상기 혼합물을 분쇄된 얼음에 15분 동안 교반하면서 천천히 붓고, 동일한 온도에서 15분 동안 교반하였다. 상기 용액을 에틸 아세테이트로 추출하고(4 x 200 mL), EtOAc 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(95:5)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 적색 고체로서 얻었다(1.0 g, 18%), mp 175-176℃. 1H NMR (400 MHz, DMSO-d6): δ 15.18 (1H, s), 8.16 (1H, d, J=5.6 Hz), 7.64 (1H, d, J=5.6 Hz); 13C NMR (100 MHz, DMSO-d6): δ 159.1, 153.8, 132.0, 126.1, 121.2; LC-MS (음이온 모드): m/z 152 (M-H)-.
단계 c:
3- 메틸티오페노 [2,3-d]1,2,3- 트리아진 -4-온: 아세톤(50 mL) 중의 3H-티오페노[2,3-d]1,2,3-트리아진-4-온(80 mg, 0.522 mmol)의 용액에, 탄산칼륨(144 mg, 1.04 mmol), 요오도메탄(0.04 mL, 0.627 mmol) 및 요오드화칼륨(촉매)을 실온에서 차례로 가하고, 상기 혼합물을 실온에서 3시간 동안 교반하였다. 상기 용액을 여과하고, 고체를 아세톤으로 세척하였다. 아세톤을 감압하에 증발시키고, 차가운 얼음물로 희석한 후, 10분 동안 교반하였다. 상기 용액을 클로로포름으로 추출하고(4 x 75 mL), CHCl3 층을 모아 물, 소금물로 세척한 후, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 헥산-에틸 아세테이트(90:10)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여, 생성물을 오프화이트색(off-white)의 고체로서 얻었다(50 mg, 57%), mp 104-108℃. 1H NMR (400 MHz, DMSO-d6): δ 8.17 (1H, d, J=5.6 Hz), 7.64 (1H, d, J=5.6 Hz), 3.95 (3H, s); 13C NMR (100 MHz, CDCl3): δ 159.4, 153.9, 130.7, 125.6, 121.7, 37.3.
실시예
16: 3-
메틸
-6-
니트로티오페노
[2,3-d]1,2,3-
트리아진
-4-온(화합물 16)의 합성
진한 황산의 얼음-냉각시킨(-10℃) 용액(5 mL)에, 3-메틸티오페노[2,3-d]1,2,3-트리아진-4-온(0.6 g, 3.6 mmol)을 10분 동안 가하고, 질산(0.4 mL, 9 mmol)을 상기 반응 혼합물에 5분 동안 가한 후, 상기 혼합물을 실온에 도달시키고, 1시간 동안 교반하였다. 상기 혼합물을 차가운 얼음물에 붓고 15분 동안 교반하였다. 침전된 고체를 여과하고, 용리액으로서 헥산-클로로포름(1:1)을 사용하여 실리카 겔 컬럼 크로마토그래피로 정제하여 생성물을 옅은 황색 고체로서 얻었다(390 mg, 51%), mp 164-168℃. 1H NMR (400 MHz, DMSO-d6): δ 8.60 (1H, s), 3.99 (3H, s).
실시예
17: 6-아미노-3-
메틸티오페노
[2,3-d]1,2,3-
트리아진
-4-온(화합물 17)의 합성
메탄올(50 mL) 중의 3-메틸-6-니트로티오페노[2,3-d]1,2,3-트리아진-4-온 (1.25 g, 5.9 mmol)의 용액에, 진한 염산(0.6 mL)을 가하였다. 상기 용액에 철 분말(1.67 g, 29.5 mmol)을 가한 다음, 물(10 mL) 중의 염화암모늄(1.57 g, 29.5 mmol)의 용액을 실온에서 가하였다. 상기 반응 혼합물을 교반하고, 70℃로 1시간 동안 가온한 다음, 실온으로 냉각시켰다. 상기 용액을 여과하고 포화 중탄산나트륨 용액으로 염기성화하였다. 상기 용액을 에틸 아세테이트로 추출하였다(4 x 100 mL). 유기층을 모아 소듐 설페이트 상에서 건조하고, 여과하였다. 용매를 증발시키고, 잔사를 용리액으로서 헥산-에틸 아세테이트(60:40)를 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 옅은 황색 고체로서 얻었다(80 mg, 7.5%), mp 190-194℃. 1H NMR (400 MHz, DMSO-d6): δ 7.40 (2H, s), 6.11 (1H, s), 3.82 (3H, s); LC-MS (음이온 모드): m/z 181 (M-H)-.
실시예
18: 3-
메틸
-6-
페닐티오페노
[3,2-d]1,2,3-
트리아진
-4-온(화합물 18)의 합성
단계 a:
3-아미노-5- 페닐티오펜 -2- 카르보니트릴: DMF(12.5 mL) 중의 소듐 설파이드 (0.95 g, 12.23 mmol)의 현탁액에, DMF(5 mL) 중의 3-클로로-3-페닐프로프-2-엔니트릴(2 g, 12.23 mmol)의 용액을 실온에서 5분 동안 가하고, 상기 혼합물을 60-70℃에서 2시간 동안 교반하였다. 이후, 클로로아세토니트릴(0.77 mL, 12.23 mmol)을 상기 반응 혼합물에 적가하고, 다시 60-70℃에서 2시간 동안 교반하였다. 이후, 메탄올(5 mL) 중의 소듐 메톡사이드(0.66 g, 12.23 mmol)의 용액을 적가하고, 1시간 동안 동일한 온도에서 교반을 계속하였다. 상기 혼합물을 실온으로 가져오고, 차가운 물에 붓고, 15분 동안 교반하였다. 분리된 고체를 여과하고, 물로 세척한 후, 건조하였다. 상기 고체를 헥산-클로로포름으로부터 재결정하여 생성물을 옅은 갈색 고체로서 얻었다(150 mg, 8%), mp 158-160℃. 1H NMR (400 MHz, CDCl3): δ 7.52-7.54 (2H, m), 7.37-7.41 (3H, m), 6.75 (1H, s), 4.48 (2H, s); LC-MS (음이온 모드): m/z 199 (M-H)-.
단계 b:
3-아미노-5- 페닐티오펜 -2- 카르복사미드: 수산화나트륨 수용액(20 mL, 10%) 중의 3-아미노-5-페닐티오펜-2-카르보니트릴(150 mg)의 현탁액에, 에탄올(10 mL)을 가하고, 상기 혼합물을 1시간 동안 환류시켰다. 상기 반응 혼합물을 실온에 도달시키고, 분리된 결정을 여과해 내고, 차가운 물로 세척하고, 건조하여 생성물을 황금색(golden yellow color) 고체로서 얻었다(70 mg, 45%), mp 180-182℃. 1H NMR (400 MHz, CDCl3): δ 7.56-7.58 (2H, m), 7.33-7.41 (3H, m), 6.79 (1H, s), 5.68 (1H, s), 5.21 (1H, s); LC-MS (양이온 모드): m/z 241 (M+Na)+.
단계 c:
6- 페닐 -3H- 티오페노 [3,2-d]1,2,3- 트리아진 -4-온: 진한 황산(20 mL) 중의 3-아미노-5-페닐티오펜-2-카르복사미드(0.37 g, 1.7 mmol)의 얼음-냉각시킨(0℃) 용액에, 진한 황산(8 mL) 중의 아질산나트륨(120 mg, 1.86 mmol)의 차가운(0℃) 용액을 10분 동안 가하였다 (첨가하는 동안, 온도는 -5 내지 0℃ 사이로 유지시켰다). 첨가 후에, 상기 혼합물을 0℃에서 1시간 동안 및 실온에서 1시간 동안 교반하였다. 상기 반응 혼합물을 냉각시키고, 분쇄된 얼음에 15분 동안 교반하면서 천천히 부은 후, 15분 동안 동일한 온도에서 교반하였다. 상기 용액을 에틸 아세테이트로 추출하고(3 x 50 mL), EtOAc 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고, 용매를 증발시켜 생성물을 오프화이트색(off-white)의 고체로서 얻었다(200 mg, 39%), mp 178-180℃. 1H NMR (400 MHz, CDCl3): δ 12.30 (1H, br s), 7.86 (1H, s), 7.73-7.75 (2H, m), 7.49-7.54 (3H, m); LC-MS (음이온 모드): m/z 228 (M-H)-.
단계 d:
3- 메틸 -6- 페닐티오페노 [3,2-d]1,2,3- 트리아진 -4-온: 아세톤(25 mL) 중의 6-페닐-3H-티오페노[3,2-d]1,2,3-트리아진-4-온(250 mg, 1.1 mmol)의 용액에, 탄산 칼륨(300 mg, 2.18 mmol), 요오도메탄(0.08 mL, 1.31 mmol) 및 요오드화칼륨(촉매)을 실온에서 차례로 가하고, 상기 혼합물을 실온에서 16시간 동안 교반하였다. 상기 용액을 여과하고, 고체를 아세톤으로 세척하였다. 아세톤을 감압하에 증발시키고, 차가운 얼음물로 희석하고, 10분 동안 교반하였다. 상기 용액을 클로로포름으로 추출하고(4 x 75 mL), CHCl3 층을 모아 물, 소금물로 세척하고, 소듐 설페이트 상에서 건조하였다. 상기 용액을 여과하고 용매를 증발시켰다. 잔사를 용리액으로서 클로로포름-메탄올(95:05)을 사용하여 실리카 겔 컬럼 상에서 크로마토그래피하여 생성물을 황색 고체로서 얻었다(110 mg, 42%), mp 220-222℃. IR (KBr) νmax 3095, 2924, 1680, 1298, 1248, 1102, 977, 829 cm- 1; 1H NMR (400 MHz, CDCl3): δ 7.78 (1H, s), 7.70-7.73 (2H, m), 7.45-7.51 (3H, m), 4.09 (3H, s); 13C NMR (100 MHz, CDCl3): δ 155.1, 153.8, 153.3, 132.2, 130.2, 129.4, 126.7, 125.4, 119.5, 37.4; LC-MS (양이온 모드): m/z 244 (M+H)+.
시험관내
및
생체내
항-흑색종 종양 성장 활성(potential) 평가
실시예
19:
MTT-기반
분석을 사용한 세포 증식 분석
MTT[3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸리움 브로마이드] 혼입(incorporation)에 근거한 세포 증식 분석을 몇가지 변형과 함께 표준 방법을 이용하여 수행하였다(38). 시험 화합물의 세포독성 효능을 인간의 악성 흑색종 A2058 세포에서 MTT 세포증식분석키트(Roche Applied Sciences, 독일)로 평가하였다. 상기 분석은 제조자에 의해 제공된 지시서에 따라 수행하였다. 즉, 동일한 수의 세포를 바닥이 평평한 96-웰 플레이트에, 100 ㎕의 배양액 중에 도말(plate)하고, 3일 동안 150 ㎍/ml까지 다양한 농도로 DTIC 또는 그의 유도체 화합물에 노출시켰다. 비히클 대조군 배양 웰은 최대 0.5% DMSO만을 처리하였다. 이후, MTT 시약 0.5 mg/ml을 각 웰에 첨가하고, 상기 마이크로플레이트를 5% CO2 존재하에서 37℃에서 4시간 동안 추가로 배양하였다. 최종적으로, 가용화 용액을 가하여 상기 세포를 용해시키고, 37℃에서 밤새 배양하였다. 포르마잔 결정(formazan crystals)의 완전한 용해 후에, 마이크로플레이트 리더(BioRad, USA)로 540 nm에서 흡광도를 읽어냈다. 4개의 웰(quadruplicate wells)로부터 얻어진 결과(평균 OD±SD)를 계산에 사용하여, 시험 화합물의 세포증식 억제(50% 억제 농도, IC50)를 결정하였다.
| 시험 화합물 | A2058 세포에서의 IC50 (㎍/mL) |
| 화합물 1 | 78.701 |
| 화합물 2 | 113.3 |
| 화합물 6 | 53.6 |
| 화합물 9 | 214.2 |
| 화합물 10 | 178.7 |
| 화합물 11 | 164.3 |
| 화합물 12 | 165.01 |
| 화합물 13 | 48.8 |
| 화합물 17 | 146.7 |
| DTIC | 68.08 |
실시예
20:
LDH
누출 분석을 이용한 세포독성
MTT 분석으로부터 얻어진 데이터(표 1)로부터, 화합물 1, 화합물 6 및 화합물 13을 선택하여, LDH 누출 분석으로 이들의 세포독성 활성을 추가로 검증하였다. 도 1은 DTIC 및 표시된 다른 시험 화합물의 상이한 농도에서, 누출된 LDH에 있어서의 % 증가 측면에서 세포 생존율의 손실을 나타낸다.
DTIC 및 그의 유도체 화합물의 세포독성 활성은 배양 상등액으로 누출된 락테이트 데하이드로게나아제(latate dehydrogenase, LDH)를 측정함으로써 평가하였다(LDH 세포독성 검출 키트플러스(LDH Cytotoxicity Detection Kit)Plus, Roche Applied Sciences, 독일). 누출된 LDH는 세포독성 화합물에 의한 세포 손상에 직접적으로 비례한다. 요약하면, 세포를 다양한 농도로 시험 화합물로 처리하고, 48시간 동안 배양하였다. 비히클 대조군 배양 웰은 최대 0.5% DMSO만을 처리하였다. 무세포(cell free) 배양 상등액을 촉매 및 염색 용액과 혼합하고, 실온에서 15분 동안 배양하였다. 최종적으로, 상기 반응을 종료시키고, 광학밀도를 마이크로플레이트 리더(BioRad, USA)로 492 nm에서 측정하였다. 4개의 웰(quadruplicate wells)로부터 얻어진 결과(평균 OD±SD)를 계산에 사용하여, 시험 화합물의 세포독성 활성(50% 억제 농도, IC50)를 결정하였다. LDH 누출 대 약물 농도에 의해 표시된 세포 생존율의 손실에 관한 플롯(plot)을 도 1에 도시한다.
실시예
21: 종양 선택성
다음으로, DTIC 유도체 화합물들이 정상 세포에 영향을 주지 않거나 최소한으로 영향을 주면서 선택적으로 흑색종 세포를 사멸시킬 수 있는지를 확인하기 위하여, 정상 인간 피부 상피 HS.531.sk 세포에 대하여 시험 화합물의 효과를 평가하였다. LDH 누출 분석은, DTIC 및 그의 유도체 화합물들이 100 ㎍/ml의 용량까지 정상 세포 피부 세포 성장에 영향을 미치지 않는다는 것을 나타냈다. 반면에, 120㎍/ml의 DTIC, 화합물 1, 화합물 3 및 화합물 4는 정상 세포의 생존율에 있어서 각각 5.8%, 4.2%, 2.4%, 및 2.4%의 감소를 야기하였다. 따라서, 이러한 관찰결과로부터, 정상 세포에 영향을 주지 않거나 최소한으로 영향을 주면서 흑색종 세포를 사멸시키기 위하여, 화합물 3 및 화합물 4가 DTIC 보다 더욱 우수한 선택성을 갖는다는 것은 명백하다(도 2).
실시예
22: A20S8 인간 흑색종 세포에서 세포자멸사적(
apoptotic
) 세포 사멸 활성에 대한
트리아젠
화합물의 효과
카스파아제에 의한 PARP의 단백분해성(proteolytic) 절단은 세포자멸사의 특징으로 간주된다. 카스파아제-3는 113-kDa PARP를 절단하여 89- 및 24-kDa 폴리펩타이드를 생성한다(39). 다음으로, DTIC 및 시험 생성물 화합물 1, 화합물 6 및 화합물 13의 세포자멸사적 활성 비교를 평가하기 위하여, A2058 세포에서 PARP 절단 분석을 수행하였다. PARP 절단을 이미 기술된 바와 같이 웨스턴 면역블롯 분석에 의해 측정하였다(40). 도 3은 100 ㎍/ml의 고정된 용량에서 시험 화합물에 의한 PARP 절단의 비교 효능을 나타낸다. 웨스턴 블롯 이미지는 화합물 3으로 처리된 A2058 세포에서 89 kDa의 PARP의 절단된 서브유닛의 발현이, 동일한 농도에서 DTIC로 처리된 세포에서 보다, 56.6% 더 많다는 것을 보여준다. 이러한 관찰결과는 화합물 3이 A2058 인간 흑색종 세포에서 더욱 우수한 세포자멸사적 세포 사멸 활성을 나타낸다는 것을 시사한다.
실시예
23: B16F0
마우스 흑색종
세포 및 A375 인간 흑색종 세포에서
DTIC
및 화합물 6의 세포 증식 억제의
효능
비교
DTIC 및 화합물 6의 항-종양 성장 활성 비교를 B16F0 마우스 흑색종 세포 및 A375 인간 흑색종 세포에서, 이미 기술된 방법(실시예 19)에 따라 MTT-기반 세포 증식 분석을 사용하여 추가로 시험하였다. 즉, 동일한 수의 B16F0 또는 A375 세포를 바닥이 평평한 96-웰 플레이트에, 100 ㎕의 배양액 중에 도말(plate)하고, 3일 동안 상이한 농도로 DTIC 또는 화합물 6로 처리하였다. 비히클 대조군 배양 웰은 최대 0.5% DMSO만을 처리하였다. MTT 시약 첨가 후, 세포를 용해시키고, 세포간(intracelluar) 포르마잔 형성을 마이크로플레이트 리더(BioRad, USA)로 540 nm에서 열량측정법으로(calorimetrically) 읽어냈다. 4개의 웰(quadruplicate wells)로부터 얻어진 결과(평균 OD±SD)를 계산에 사용하여, 시험 화합물의 세포증식 억제(50% 억제 농도, IC50)를 결정하였다.
| 시험 화합물 | 50% 억제 농도, IC50 (㎍/mL) | |
| B16FO 세포 | A375 세포 | |
| DTIC | 360.4 | 70.1 |
| 화합물 6 | 57.6 | 46.5 |
실시예
24: B16F0
마우스 흑색종
세포 및 A375 인간 흑색종 세포에서
DTIC
및 화합물 6의 세포독성 활성 비교
B16F0 마우스 흑색종 세포 및 A375 인간 흑색종 세포에서 DTIC 및 화합물 6의 세포독성 활성 비교는, 이미 기술된 방법(실시예 20)에 따라, 배양 상등액으로 누출된 락테이트 데하이드로게나아제(LDH)를 측정함으로써 평가하였다(LDH 세포독성 검출 키트플러스(LDH Cytotoxicity Detection KitPlus, Roche Applied Sciences, 독일). 4개의 웰(quadruplicate wells)로부터 얻어진 결과(평균 OD±SD)를 계산에 사용하여, 시험 화합물의 세포독성 활성(50% 억제 농도, IC50)을 결정하였다(표 3).
| 시험 화합물 |
처리 농도 (㎍/mL) |
비히클 처리된 대조군에 대한 LDH 분비의 % 증가 | |
| B16F0 세포 | A375 세포 | ||
| DTIC | 100 | 5.7 | 246 |
| 화합물 6 | 100 | 61.5 | 331 |
실시예
25:
MCF
-7 인간 유방암 세포,
MIA
-
PaCa2
인간 췌장암 세포 및
DU145
인간 전립선암 세포에서 화합물 1 및 화합물 6의 항-종양 효능
MCF-7 인간 유방암 세포, MIA-PaCa2 인간 췌장암 세포 및 DU145 인간 전립선암 세포에서 화합물 1 및 화합물 6의 항-종양 성장 활성을, 이미 기술된 바와 같이(실시예 19), MTT-기반 세포 증식 시험을 사용하여 평가하였다. 4개의 웰(quadruplicate wells)로부터 얻어진 결과(평균 OD±SD)를 계산에 사용하여, 시험 화합물의 세포 증식 억제(50% 억제 농도, IC50)를 결정하였다(표 4).
| 시험 화합물 | 50% 억제 농도, IC50 (㎍/ml) | ||
| MCF-7 | MIA-PaCa2 | DU145 | |
| DTIC | 135.1 | 202.9 | 87.2 |
| 화합물 1 | 130.3 | 168.5 | 153.2 |
| 화합물 6 | 91.7 | 81.9 | 62.6 |
실시예
26: B16
FO
마우스 흑색종 세포의
콜로니
형성 분석
화합물 6 및 DTIC의 클론 형성 효능을 몇가지 변형과 함께 이미 기술된 방법에 따라 수행하였다(41). 즉, B16F0 세포를 수확하고, 6-웰 플레이트에 접종하였다(100 cells/ml). 상기 세포를 2일 동안 성장시킨 후, 상기 세포를 0.1% DMSO 또는 100 ㎍/ml DTIC 또는 50 ㎍/ml 및 100 ㎍/ml의 화합물 6을 함유한 DMEM과 함께 추가로 8일 동안 배양하였다. 테스트 시약을 함유한 신선한 배지로 24시간 마다 교체하였다. 최종적으로, 상기 웰을 PBS로 3회 세척하고, 15분 동안 메탄올에 고정시켰다. 상기 세포를 김사 염색(Giemsa stain)으로 염색하고, 현미경으로 관찰하였다. 염색된 웰의 이미지를 디지털 방식으로 캡쳐하고(Kodak Image Station 4000MM, Carestream Health Inc., New Haven, CT), 콜로니의 수를 세고, NIH 이미지 J 소프트웨어(NIH Image J software)를 사용하여 분석하였다. 도 4는 DTIC 및 화합물 6로 처리된 웰에서 Bl6 콜로니 성장의 억제를 나타낸다. 화합물 6는 DTIC에 비하여 B16 종양 세포 콜로니 성장에 있어서 유의성있는 억제를 나타냈다. 37.6%, 55.2% 및 68.7% 성장 억제가 각각 100 ㎍/ml의 DTIC, 50 ㎍/ml 및 100 ㎍/ml의 화합물 6에 의해 달성되었다.
실시예
27: 화합물
6으로
처리된 B16
FO
마우스 흑색종
세포의 세포 주기 분석
화합물 6 및 DTIC로 처리된 B16F0 세포의 세포 주기 분석을 몇가지 변형과 함께 이미 기술된 바에 따라 유세포 분석에 의해 분석하였다(42). 즉, B16F0 세포를 4.5 g/l D-글루코오즈 존재하에서 10% 우태아혈청(FBS)을 함유한 DMEM에서 배양하였다. 서브 컨플루언트(sub confluent) 세포를 DTIC 또는 화합물 6로 처리하고, 24시간 동안 배양하였다. 세포를 수확하고, 완충액(PBS+2%FBS) 중에서 단일 세포 현탁액을 제조하였다. 상기 세포를 차가운 PBS로 2회 세척한 다음, 차가운 70% 에탄올로 30분 동안 고정하였다. 에탄올을 원심분리에 의해 제거하고, 세포를 현탁시키고, 세포 수를 ml 당 106 세포로 조절하였다. 상기 세포를 PBS로 2회 세척한 다음, RNase 존재하에서 37℃에서 30분 동안 요오드화프로피디움(propidium iodide)으로 염색하였다. 최종적으로, 상기 세포를 FACS 칼리버 유세포 분석기(FACS Calibur flow cytometry)(BD Biosciences, USA)상에서 분석하였다. 도 5는 DTIC 및 화합물 6에 의해 조절된 세포주기의 다른 단계(phases)에서의 세포의 분포를 나타낸다.
실시예
28: B16F0 마우스 흑색종 세포 침입(
invasion
) 분석
B16F0의 시험관내(in vitro) 침입능(invasive ability)에 대한 DTIC 및 화합물 4의 억제 효과를, 8 ㎛-포어 막을 갖는 마트리겔(BME - Cultrex® R&D Systems, USA)로 코팅된 세포 배양 인서트(insert)(Becton Dickinson, USA)를 사용하여 수행된 세포 침입 분석법으로 시험하였다. 동일한 수(50,000)의 B16F0 세포를 각각의 인서트 웰에 가하고, 37℃에서 2시간 동안 5% CO2 존재하에서 부착시켰다. 이후, 마트리겔 층을 통과한 세포 침입을 시험 화합물의 존재하에서 또는 비존재하에서 수행하였다. 100 ㎍/ml의 DTIC 또는 화합물 6을 침입 어셈블리의 하부 챔버에 가하였다. 0.1% DMSO를 비히클 대조군 배양 챔버에 가하였다. 처리 24시간 후에, 세포를 포함하는 마트리겔 층을 코튼 플러그(cotton plug)로 제거하고, 맴브레인의 반대 쪽에 있는 침입된 세포를 메탄올로 5분 동안 고정시킨 다음, 김사(Giemsa)로 염색하였다. 염색된 막을 유리 슬라이드에 올리고, 침입된 세포 수를 광학 현미경 (Nikon Eclipse TS 100)으로 20개의 무작위 부위(2OX 대물렌즈)에서 계수하였다. 시험관내 B16 흑색종 세포 배양 실험에서, 화합물 6은, 비히클 또는 DTIC와 비교할 때, 악성 종양 세포 침입을 유의성있게 감소시켰다(도 6).
실시예
29: 화합물 6은 B16F0 세포에서 혈관내피성장인자(
VEGF
) 생성을 억제한다
B16F0 세포를 10% 우태아혈청(FBS) 및 4.5 g/1 D-글루코오즈를 함유한 둘베코의 변형된 이글즈 레드 배지(Dulbecco's modified Eagle's red medium, DMEM) (Sigma Life Science, USA)에서 배양하였다. 동일한 수의 세포(5x104)를 배양 접시(35x10 mm, 11.7 cm2)에 접종하였다. 상기 세포를 24시간 동안 50 ㎍/ml의 DTIC 또는 화합물 4로 처리하였다. 0.1% DMSO 만으로 배양된 세포를 비히클 대조군으로 간주하였다. 24시간 후에, 세포 용해물(lysates)을 제조하고, 적절한 변형과 함께 이미 기술된 바와 같이, 웨스턴 블롯 분석에 의해 혈관내피성장인자(VEGF) 발현을 분석하였다(43). 웨스턴 블롯 분석을 위해, 동일한 양의 B16F0 세포 용해 단백질을 환원 조건(reducing condition)하에서 12.5% SDS-PAGE에서 분리하고, 니트로셀룰로오즈 막(Bio-Rad, USA)에 전사하였다. 상기 막을 슈퍼블락(SuperBlock)(Thermo scientific, USA)으로 차단하고, 이어서 4℃에서 밤새 VEGF 항체(Abcam, UK)와 반응시켰다. 결합된 항체를 호스래디시 퍼옥시다아제(horseradish peroxidase)가 컨쥬게이션된 2차 항체로 표지하고(probed), 특이적인 면역반응을 인핸스드 화학발광(enhanced chemiluminescence)(Thermo scientific, USA)으로 전개시켰다. 스트립된(stripped) 막을 내부 로딩 콘트롤로서 항-액틴 항체를 사용하여 다시 전개시켰다. 면역반응성 밴드의 이미지를 코닥 이미지 스테이션 4000MM(Kodak Image Station 400MM)(Carestream Health Inc., New Haven, CT)으로 캡쳐하고, 코닥 분자 이미지 소프트웨어(버젼 4.5)에 의해 밀도계측적으로(densitometrically) 분석하였다. 도 7은 화합물 6으로 처리된 B16F0 세포에서 VEGF 단백질의 하향 조절(down regulation)을 보여주는 대표적인 면역블롯 이미지를 나타낸다.
실시예
30: 혈관 내피 세포 이동(migration) 분석
내피세포 이동 분석 방법은 몇가지 변형과 함께 이미 기술된 방법과 실질적으로 동일하였다(43). PET 막에 8 ㎛-포어를 갖는 팔콘(FALCONTM) 세포 배양 인서트(inserts)(Becton Dickinson, USA)를 콜라겐 0.1 mg/ml로 코팅하였다. 인간 제대혈관내피세포(HUVEC)를 5x104 세포/인서트의 밀도로 상기 세포 배양 인서트(Becton Dickinson)에 가하였다. 세포를 상이한 농도의 DTIC 또는 화합물 6의 존재하에서 18시간 동안 인서트를 통과하여 이동시켰다. 이동 어셈블리를 함유하는 대조군 배지는 0.1% DMSO만을 처리하였다. 이동하지 않은 세포를 코튼 플러그(cotton plug)로 스크래이핑하여 제거하고, 이동된 세포를 5분 동안 메탄올로 고정한 다음, 김사로 염색했다. 이후, 상기 인서트의 막을 유리 슬라이드에 올렸다. 막 포어를 통과하여 이동된 세포를 니콘 이클립스(Nikon Eclipse) TS 100 현미경으로 2OX 대물렌즈로 20개의 무작위 부위에서 계수하였다. 도 8은 화합물 6으로 처리된 내피 세포의 유의성있는 이동 억제를 나타낸다.
실시예
31: 시험관내 모세혈관 형성 분석
시험관내(in vitro) 모세혈관 형성 분석을, 10 mg/ml 기저막 추출물(BME -Cultrex®, R&D Systems, USA) 베드(bed) 상에서 배양된, 인간 제대혈관내피세포(HUVEC)를 사용하여 수행하였다. 시험관내 내피 관(endothelial tube) 형성 분석의 프로토콜은 몇가지 변형을 갖는 이미 기술된 방법과 동일하였다(44). 즉, 400 마이크로리터의 Cultrex를 24-웰 배양 플래이트의 각 웰에 4℃에서 코팅하고, 37℃에서 1시간 동안 겔화시켰다. HUVEC를 10% 우태아혈청 및 4.5 g/l D-글루코오즈로 보충된 DMEM 400㎕와 함께, 웰당 7.5x104 세포의 밀도로 도말하였다. 이후, 상기 세포를 표시된 바와 같은 원하는 농도의 DTIC 또는 화합물 6으로 16시간 동안 처리하였다. 비히클 대조군 배지는 0.1% DMSO만을 처리하였다. 니콘 쿨픽스(Nikon Coolpix) 카메라가 장착된 니콘 이클립스(Nikon Eclipse) TS 100 현미경 하에서 사진을 찍었다. 화합물 6은 용량 의존적으로 모세혈관 형성의 억제를 나타냈으나, 이와 대조적으로, DTIC는 시험관내 배양 조건에서 인간 내피 세포와 모세혈관 형성을 촉진시켰다(도 9).
실시예
32:
C57B6J
마우스의 B16
FO
흑색종 이종이식(xenograft) 모델에서 화합물 6의
항-종양
성장 활성
흑색종 성장에 대한 화합물 6의 생체내 효능을 C57B6J 마우스의 B16FO 흑색종 이종이식 모델에서 평가했다(45). 6주령의 C57B6J 마우스(체중 18-22 g)를 인도 하이데라바드(Hyderabad) 소재의 국립영양연구원(National Institute of Nutrition, NIN)으로부터 구입했다. 동물 시험 프로토콜은 기관윤리위원회(Institutional Ethics Committee)(IAEC)에 의해 승인받았다. 모든 시험은 동물실험에 관한 관리 및 감독을 위한 위원회(Committee for the Purpose of Control and Supervision of Experiments on Animals, CPCSEA)의 가이드라인 및 OECD 가이드라인을 준수하여 수행하였다. 동물들은 표준 사료에 자유로운 접근을 허용하였고, 챠콜로 여과시키고 UV에 노출시킨 물을 임의로(ad libitum) 제공했다. 상기 동물은 조절된 온도(24-26℃), 습도(45-70%), 12h/12h의 명/암 주기로 유지시켰다.
흑색종 종양 형성을 유도하기 위하여, 서브-콘플루언트(sub-confluent) B16F0 세포를 잠시 동안의 트립신화(brief trypsinization)에 의해 수확하고, 0.2 ml 인산완충식염수 중의 1x1O6 세포를 피하 주사하였다. 약물 처리는 뚜렷한 종양의 형성후(세포 이식 후 3-5일)에 시작하였다. 약물은 인산완충식염수(10% DMSO, v/v)중에서 조제하였고, 상이한 용량의 DTIC 또는 화합물 6을 매일 복강을 통하여 투여하였다. 비히클 처리된 대조군 동물은 10% DMSO만을 투여했다. 처리 14일 후에, 상기 동물을 CO2 흡입에 의해 치사시키고, 종양을 잘라내어 칭량하였다. 도 10은 C57B6J 마우스의 B16FO 흑색종 이종이식 모델에서 다양한 농도에서의 DTIC 및 화합물 6에 의한 종양 성장을 억제하는 효능 비교를 나타낸다.
참고문헌
1. Fitzpatrick, T.B., Sober, A.J. Sunlight and skin cancer. N. Engl. J. Med., 1985, 313, 818-820.
2. Pathak, M.A., Fanselow, D.L. Photobiology of melanin pigmentation: dose/response of skin to sunlight and its contents. J. Am. Acad. Dermatol., 1983, 9, 724-733.
3. Riley, P.A. Melanin. Int. J. Biochem. Cell Biol, 1997, 29, 1235-1239.
4. Rutao, C, Hans R., Widlund, E.F., Jennifer, Y. L., Dara, L.W., Viven, E.I., John, D. O., Claire, Y.F., Carl, F. S., Scott, R.G., David, E.F., Cell, 2007, 128, 853-864.
5. Moshe, O., Jiri, B. Cell, 2007, 128, 826-828.
6. Danson, S.J., Middleton, M.R. Temozolomide: a novel oral alkylating agent. Expert Rev. Anticancer Ther., 2001, 1, 13-19.
7. Ngasubramanian, R., DoIa, M.E. Tomozolamide: Realizing the promise and potential. Curr. Opin. Oncol, 2003, 15, 412-418.
8. Lanzetta, G., Campanella, C, Razzi, A., et al. Temozolomide in radio-chemotherapy combined treatment for newly-diagnosed glioblastoma multi-forme: Phase - II clinical trial. Anticancer Res., 2003, 23, 5159-5164.
9. Stripp, R., Mason, W.P., Van den Bent, MJ., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N. Engl. J. Med., 2005, 352, 987-996.
10. Gilbert, M.R. Advances in the treatment of brain tumors: dawn of a new era? Curr. Oncol. Rep., 2006, 8, 45-49.
11. Atallah, E., Flaherty, L. Treatment of metastatic malignant melanoma. Curr. Treat. Options Oncol, 2005, 6, 185-193.
12. Panetta, J.C., Kirstein, M.N., Gajjar, A., et al. Population of temezolomide and metabolites in infants and children with primary central nervous system tumors. Cancer Chemother. Pharmacol, 2003, 52, 435-441.
13. Houghton, P.J., Stewart, C.F., Cheshire, PJ., et al. Anti-tumor activity of tomozolomide combined with irinotecan is partly independent of 06 - methylguanine -DNA methyltransferase and mismatch repair phenotypes in xenograft models. Clin. Cancer Res., 2000, 6, 4110-4118.
14. Middlemas, D.S., Stuart, C.F., Kirstein, M.N., et al. Biochemical correlates of temozolomide sensitivity in pediatric solid tumor xenograft models. Clin. Cancer Res., 2000, 6, 998-1007.
15. Aksoy, S., Abali, H., Kilickap, S., et al. Successful treatment of a chemoresistant tumor with temozolomide in an adult patient: report of a recurrent intracranial mesenchymal chondrosarcoma. J. Neurooncol, 2005, 71, 333-334.
16. Patel, V.J., Elion, G.B., Houghton, P.J., et al. Schedule-dependent activity of temozolomide plus CPT-I l against a human central nervous system tumor-derived xenograft. Clin. Cancer Res., 2000, 6, 4154-4157.
17. Anderson, P.M., Pearson, M. Novel therapeutic approaches in pediatric and young adult sarcoma. Curr. Oncol. Rep., 2006, 8, 310-315.
18. Wagner, L.M., McAllister, N., Goldsby, R.E., et al. Temozolomide and intravenous irinotecan for treatment of advanced Ewing's sarcoma. Pediatr. Blood Cancer, 2007, 48, 132-139.
19. Wagner, L.M., Crews, K.R., Iacono, L.C., et al. Phase I trial of temozolomide and protracted irinotecan in pediatric patients with refractory solid tumors. Clin. Cancer Res., 2004, 10, 840-848.
20. Kushner, B.H., Kramer, K., Modak, S., et al. Irinotecan plus temozolomide for relapsed or refractory neuroblastoma. J. Clin. Oncol., 2006, 24, 5271-5276.
21. De Angulo, G., Hermandez, M., Morales-Arias, J., et al. Early lymphocyte recovery as a prognostic indicator for High-risk Ewing's sarcoma. J. Pediatr. Hematol. Oncol., 2007, 29, 48-52.
22. DuBois, S.G., Elterman, K., Grier, H.E. Early lymphocyte recovery in Ewing sarcoma. J. Pediatr. Hematol. Oncol, 2007, 29, 351-352.
23. Losa, R., Fra, J., Lopez-Pousa, A., et al. Phase II study with the combination of gemcitabine and DTIC in patients with advanced soft tissue sarcoma. Cancer Chemother. Pharmacol, 2007, 59, 251-259.
24. Awada, A., Gil, T., Sales, F., et al. Prolonged schedule of temozolomide (Temodal) plus liposomal doxorubicin (Caelyx) in advanced solid cancers. Anticancer Drugs, 2004, 15, 499-502.
25. Cruz-Munoz, W., Man, S., Kerbel, R.S. Effective treatment of Advanced human melanoma metastases in immunodefficient mice using combination metronomic chemotherapy regimens. Clin. Cancer Res., 2009, 15, 4867-74.
26. Ott, P.A., Chang, J.L., Oratz, R., Jones, A., Farrell, K., Muggia, F., Pavlick, A.C. Phase II trial of dacarbazine and thalidomide for the treatment of malignant melanoma. Chemotherapy, 2009, 55, 221-7.
27. Tagne, J.B., Kakumanu, S., Nicolosi, RJ. Nanoemulsion preparations of the anticancer drug dacarbazine significantly increase its efficacy in a xenograft mouse melanoma model. Mol. Pharm., 2008, 5, 1055-63.
28. Mansfield, A.S., Markovic, S.N. Novel therapeutics for the treatment of metastatic melanoma. Future Oncol., 2009, 5, 543-57.
29. Lui, P., Cashin, R., Machado, M., Hemels, M., Corey-Lisle, P.K., Einarson, T.R. Treatments for metastatic melanoma: synthesis of evidence from randomized trials. Cancer Treat. Rev., 2007, 33, 665-80.
30. Fiesselmann, H. Method for the preparation of 3-Oxythiophen-2-carboxylic acids derivatives. DE 1020641 (1957).
31. Hartmann, H., Liebscher, J. A simple method for the synthesis of 5-aryl-3-aminoalkoxycarbonylthiophenes. Synthesis, 1984, 275-276.
32. Shishoo, C.J., Pathak, U.S., Jain, K.S., Devani, I.T., Chhabria, M.T. Synthesis of some 2-substituted-6-phenyl- and 7-phenyl-thieno[3,2-d]pyrimidin-4(3H)-ones. Indian J. Chem., 1994, 33B, 436-440.
33. Barker, J.M., Huddleston, P.R., Wood, M.L. A rapid conversion of 3-oxothiolanes into 3-aminothiolanes. Synth. Commun., 2002, 32, 2565-2568.
34. Dowd, P., Choi, S.-C. Free radical ring-expansion leading to novel six- and seven membered heterocycles. Tetrahedron, 1991, 47, 4847-4860.
35. Woodward, R.B., Eastman, R.H. Tetrahydrothiophene derivatives. J. Am. Chem. Soc, 1946, 68, 2229-2235.
36. Hesse, S., Perspicace, E., Kirsch, G. Microwave-assisted synthesis of 2-aminothiophene-3-carboxylic acid derivatives, 3H-thieno[2,3-d]pyrimidin-4-one and 4-chlorothieno[2,3-d]pyrimidine. Tetrahedron Letts., 2007, 48, 5261-5264.
37. Dumaitre, B., Dodic, N. Synthesis and cyclic GMP phosphodiesterase inhibitory activity of a series of 6-phenylpyrazolo[3,4-d]pyrimidones. J. Med. Chem., 1996, 39, 1635-1644.
38. Banerjee, S., Mehta, S., Haque, I., Sengupta, K., Dhar, K., Kambhampati, S., Van Veldhuizen, P.J., Banerjee, S.K. VEGF-A 165 induces human aortic smooth muscle cell migration by activating neuropilin-l-VEGFRl-PI3K axis. Biochemistry, 2008, 47, 3345-51.
39. Tewari, M., L.T. Quan., O'Rourke, K., Desnoyers, S., Zeng, Z., Beidler, D.R., Poirier, G.G., Salvesen, G.S., Dixit, V.M. Yama/CPP32B, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase. Cell, 1995, 81, 801-809.
40. Sengupta, K., Banerjee, S., Dhar, K., Saxena, N.K., Mehta, S., Campbell, D.R., Banerjee, S.K. WISP-2/CCN5 is involved as a novel signaling intermediate in Phorbol ester protein kinase Calpha-mediated breast tumor cell proliferation. Biochemistry, 2006, 45, 10698-709.
41. Wu, K., Yuan, L.H., Xia, W. Inhibitory effects of apigenin on the growth of gastric carcinoma SGC-7901 cells. World. J. Gastroenterol, 2005, 11, 4461-4464.
42. Ray, G., Dhar, G., Van Veldhuizen, PJ., Banerjee, S., Saxena, N.K., Sengupta, K., Banerjee, S.K. Modulation of cell-cycle regulatory signaling network by 2-Methoxyestradiol in prostate cancer cells is mediated through multiple signal transduction pathways. Biochemistry, 2006, 45, 3703-3713.
43. Sengupta, K., Banerjee, S., Saxena, N.K., Banerjee, S.K. Thombospondin-1 Disrupts Estrogen-Induced Endothelial Cell Proliferation and Migration and its Expression Suppressed by Estradiol. Mol. Cancer Res., 2004, 2, 150-158.
44. Diana, G., Chalupowicz, Z., Chowdhury, A., Tami, L.B., Carl, B., Jose, M. Fibrin II Induces Endothelial Cell Capillary Tube Formation. J. Cell Biol., 1995, 130, 207-215.
45. Michelle, L.R., Johnathan, M., Hartwig, B., Ronald, G.T. Dietary glycine inhibits the growth of B16 melanoma tumors in mice. Carcinogenesis, 1999, 20, 793-798.
Claims (14)
- 화학식 (I)의 화합물 또는 그의 약학적으로 허용가능한 염:
식 중, R은 H, CH3, CH2OH로부터 독립적으로 선택되고;
R1은 OH, NHR4, NR4R5, SH로부터 독립적으로 선택되고;
R2 및 R3 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3 등의 전자 끄는 기 및 전자 공여기로부터 선택되고;
R4 및 R5 는 독립적으로 H, C1-C10 알킬, 알케닐, 알킬올, 알킬아민등으로부터 선택되고;
X, Y, 및 Z는, 얻어지는 헤테로사이클릭 방향족 모이어티의 5원환 고리 시스템이 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택된다. - 제1항에 있어서,
3-[(디메틸아미노)디아제닐]티오펜-2-카르복사미드;
3-[(디메틸아미노)디아제닐]-4-브로모티오펜-2-카르복사미드;
3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복사미드;
4-[(디메틸아미노)디아제닐]-3-메톡시티오펜-2,5-디카르복사미드;
3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복사미드;
3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산;
3-[(디메틸아미노)디아제닐]-5-니트로티오펜-2-카르복실산;
3-[(디메틸아미노)디아제닐]-5-페닐티오펜-2-카르복실산;
{3-[(디메틸아미노)디아제닐](2-티에닐)}-N-(2-히드록시에틸)-카르복사미드;
{3-[(디메틸아미노)디아제닐](2-티에닐)}-N-메틸카르복사미드;
N-(2-아미노에틸){3-[(디메틸아미노)디아제닐](2-티에닐)}-카르복사미드;
4-[디메틸아미노)디아제닐]티오펜-2-카르복사미드;
4-[(디메틸아미노)디아제닐]티오펜-3-카르복사미드;
3-[(디메틸아미노)디아제닐]티오펜-2-카르복실산의 칼륨염
을 특이적으로 포함하는 화합물. - 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염:
식 중, R1 및 R2 중 적어도 하나는 H, N=N-N(CH3)2, N=N-NHCH3, N=N-N(CH3)CH2OH, CONH2, CONHR4, CONR4R5, CONHNH2, CONHNHR4, CONHNR4R5, COOCH3, COOCH2CH3, COOH, COSH, CN, C≡CH, SO2NH2, SO2NHR4, SO2NR4R5, SO3H, SO2CH3, SO2CH2CH2NH2, NHCH2COOH, NHCH(CH3)COOH, NO2, CF3, Cl, Br, F, I, CCl3, Ph (C6H5), CH3, C2H5, n-C3H7, 이소-C3H7, n-C4H9, 이소-C4H9, tert-C4H9, OH, OCH3, NH2, NHCH3, 등의 전자 끄는 기 및 전자 공여기로부터 독립적으로 선택되고;
R4 및 R5 는 독립적으로 H, C1-C10 알킬, 알케닐, 알킬올, 알킬아민 등으로부터 선택되고;
X, Y, 및 Z는, 융합된 바이사이클릭 시스템의 헤테로사이클릭 방향족 5원환 고리가 비-치환 및 치환된 티오펜, 퓨란, 티아졸, 이소티아졸, 및 퓨라졸이 되도록, C, N, O, 및 S 로부터 독립적으로 선택되고; 화학식 (II)의 화합물은 3-메틸티오페노[3,2-d]1,2,3-트리아진-4-온(X=Y=C; Z=S; R1=R2=H)이 아니다. - 제3항에 있어서,
3-메틸티오페노[2,3-d]1,2,3-트리아진-4-온;
3-메틸-6-니트로티오페노[2,3-d]1,2,3-트리아진-4-온;
6-아미노-3-메틸티오페노[2,3-d]1,2,3-트리아진-4-온;
3-메틸-6-페닐티오페노[3,2-d]1,2,3-트리아진-4-온;
을 특이적으로 포함하는 화합물. - 적어도 하나의 제1항 및 제3항에 따른 화학식 (I) 및/또는 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염, 및 약학적으로 허용가능한 희석제 또는 담체를 포함하는 약학 조성물.
- 적어도 하나의 제1항 및 제3항에 따른 화학식 (I) 및/또는 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염, 및 적어도 하나의 화학요법제 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함하는 약학 조성물.
- 제6항에 있어서, 상기 화학요법제가 다카르바진(DTIC), 테모졸라미드, 메토트렉세이트, 독소루비신, 사이톡산, 5-플루오로우라실, 시스플라틴, 카보플라틴, 옥살리플라틴, 빈크리스틴, 빈블라스틴, 에토포시드, 이리노테칸, 토포테칸, 파클리탁셀, 도세탁셀, 탁소테르, 탁솔, 타목시펜, 게피티닙, 아드리아마이신, 젬시타빈, 멜팔란, 스트렙토조신, 플록스우리딘, 6-머캅토퓨린, 블레오마이신, 다우노루비신, 마이토마이신-C, 암사크린, 프로카바진, 카페시타빈, 아바스틴, 허셉틴, 벡사르, 벨케이드, 제발린, 젤로다, 얼비툭스(세툭시맵), 리툭시맵, 캠파스(알렘투주맵) 등으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 조성물.
- 적어도 하나의 제1항 및 제3항에 따른 화학식 (I) 및/또는 화학식 (II)의 화합물 또는 그의 약학적으로 허용가능한 염, 및/또는 적어도 하나의 화학요법제 및 적어도 하나의 생물학적 반응 변형제 및 선택적으로 약학적으로 허용가능한 희석제 또는 담체를 포함하는 약학 조성물.
- 제8항에 있어서, 상기 생물학적 반응 변형제가 단일클론항체, 인터페론(인터페론-γ), 인터루킨(IL-1, IL-2, IL-9, IL-11, IL-12), 다양한 형태의 콜로니 자극인자(CSF, GM-CSF, G-CSF), TNF-α 수용체 차단제(TNF-α) 등으로 이루어진 군으로부터 선택되는 것을 특징으로 하는 조성물.
- 환자에 있어서 암세포 성장을 억제하거나 암세포를 사멸하는 방법으로서, 상기 방법이 상기 환자에게 치료학적으로 유효한 양의 제1항 내지 제9항의 화합물을 투여하는 것을 포함하는 방법.
- 제10항에 있어서, 상기 암질환이 전이성 악성 흑색종, 림프종(호지킨 및 비-호지킨), 육종(유잉 육종(Ewing's sarcoma)), 암종, 뇌종양, 중추신경계(CNS) 전이암, 신경아교종(gliomas), 유방암, 전립선암, 폐암(소세포 및 비-소세포), 대장암, 췌장암, 두경부암(Head and Neck cancers), 구인두 편평세포암종(oropharyngeal squamous cell carcinoma)을 포함하나 이에 제한되지 않는 임의 형태(고형, 액상 및 림프 유래)인 것을 특징으로 하는, 암 질환으로 고통받는 환자의 치료방법.
- 제10항에 있어서, 상기 암세포가 뇌, 폐, 부신 샘(adrenal glands), 뇌하수체, 유방, 전립선, 췌장, 난소, 위장관, 신장, 간, 비장, 고환, 자궁경부, 상부, 하부, 또는 중간부 식도와 같은 인체의 임의 기관으로부터 유래하나 이에 제한되지 않거나, 모든 유형의 원발성 또는 전이성 종양인 것을 특징으로 하는, 환자에 있어서 암세포 성장을 억제하거나 암세포를 사멸하는 방법.
- 특히 복강내(IP), 정맥(IV), 경구(PO), 근육내(IM), 피부내(IC), 피내(ID), 자궁내, 직장내 투여 등을 포함하는 임의의 형태로, 환자에게 제1항 내지 제9항의 화합물을 투여하는 방법.
- 환자에게, 에멀젼 중의 상이한 크기의 나노입자를 사용하여, 제1항 내지 제9항의 화합물을 투여하는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN2230/CHE/08 | 2008-09-15 | ||
| IN2230CH2008 | 2008-09-15 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110063537A true KR20110063537A (ko) | 2011-06-10 |
Family
ID=41565903
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117008490A KR20110063537A (ko) | 2008-09-15 | 2009-09-14 | 전이성 악성 흑색종 및 기타 암에 대한 항암 약물 및 이와 관련한 용도 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US8258119B2 (ko) |
| EP (1) | EP2324006B1 (ko) |
| JP (1) | JP2012502900A (ko) |
| KR (1) | KR20110063537A (ko) |
| CN (1) | CN102149703B (ko) |
| AU (1) | AU2009290365B2 (ko) |
| BR (1) | BRPI0913485A2 (ko) |
| CA (1) | CA2736732A1 (ko) |
| IL (1) | IL211366A0 (ko) |
| NZ (1) | NZ591394A (ko) |
| WO (1) | WO2010029577A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230067281A (ko) | 2021-11-09 | 2023-05-16 | 공주대학교 산학협력단 | 항암 활성을 갖는 인데노피라졸론 유도체 화합물, 그의 제조방법 및 그의 용도 |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5571168B2 (ja) * | 2009-04-27 | 2014-08-13 | カシナ ライラ イノバ ファーマシューティカルズ プライベート リミテッド | 抗癌剤ならびに悪性黒色腫および他の癌に関連する使用 |
| NO2686520T3 (ko) | 2011-06-06 | 2018-03-17 | ||
| US20120329836A1 (en) * | 2011-06-06 | 2012-12-27 | The Ohio State University | Methods for stabilizing hypoxia inducible factor-2 alpha as a method for treating cancer |
| RU2019134558A (ru) | 2013-06-13 | 2020-02-20 | Экебиа Терапьютикс, Инк. | Композиции и способы лечения анемии |
| US9593095B2 (en) | 2013-06-14 | 2017-03-14 | Duke University | Methods for the treatment of bacterial infections |
| WO2015197096A1 (en) * | 2014-06-27 | 2015-12-30 | Ecole Polytechnique Federale De Lausanne (Epfl) | Preparation and medical use of triazenes |
| BR112017015852A2 (pt) | 2015-01-23 | 2018-03-27 | Akebia Therapeutics Inc | forma de cristal, sal hemicálcico, sal hemicálcico di-hidratado, sal monossódico hidratado, sal bissódico monoidratado, sal monossódico anidro e método para preparar o composto 1 |
| UA123308C2 (uk) | 2015-04-01 | 2021-03-17 | Екебіа Терапьютікс, Інк. | Композиції і способи для лікування анемії |
| BR112017024727A2 (pt) | 2015-05-18 | 2018-07-31 | Syn Nat Products Entpr Llc | cocristal, composição farmacêutica, método de tratamento de uma doença em um indivíduo e processo de produção de um cocristal |
| JP2018517759A (ja) | 2015-06-19 | 2018-07-05 | シン−ナット プロダクツ エンタープライズ エルエルシー | カルボプラチンを含む組成物及び用途 |
| WO2016205785A1 (en) | 2015-06-19 | 2016-12-22 | Syn-Nat Products Enterprise LLC | Pharmaceutical composition of carboplatin based co-crystals and use thereof |
| CN107847521A (zh) | 2015-06-25 | 2018-03-27 | 新纳特产品公司 | 药物共晶组合物及其用途 |
| CA3097219A1 (en) | 2018-05-09 | 2019-11-14 | Akebia Therapeutics, Inc. | Process for preparing 2-[[5-(3-chlorophenyl)-3-hydroxypyridine-2-carbonyl]amino]acetic acid |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1020641B (de) | 1955-10-15 | 1957-12-12 | Basf Ag | Verfahren zur Herstellung von Derivaten der 3-Oxythiophen-2-carbonsaeure |
| CA968347A (en) * | 1968-09-09 | 1975-05-27 | John F. Gerster | Substituted pyrazoles and process |
-
2009
- 2009-09-14 JP JP2011526634A patent/JP2012502900A/ja active Pending
- 2009-09-14 KR KR1020117008490A patent/KR20110063537A/ko not_active Application Discontinuation
- 2009-09-14 AU AU2009290365A patent/AU2009290365B2/en not_active Ceased
- 2009-09-14 WO PCT/IN2009/000504 patent/WO2010029577A2/en active Application Filing
- 2009-09-14 NZ NZ591394A patent/NZ591394A/xx not_active IP Right Cessation
- 2009-09-14 CN CN200980135652.3A patent/CN102149703B/zh not_active Expired - Fee Related
- 2009-09-14 BR BRPI0913485A patent/BRPI0913485A2/pt not_active IP Right Cessation
- 2009-09-14 CA CA2736732A patent/CA2736732A1/en not_active Abandoned
- 2009-09-14 EP EP09760623.0A patent/EP2324006B1/en not_active Not-in-force
- 2009-09-15 US US12/559,811 patent/US8258119B2/en not_active Expired - Fee Related
-
2011
- 2011-02-23 IL IL211366A patent/IL211366A0/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230067281A (ko) | 2021-11-09 | 2023-05-16 | 공주대학교 산학협력단 | 항암 활성을 갖는 인데노피라졸론 유도체 화합물, 그의 제조방법 및 그의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2012502900A (ja) | 2012-02-02 |
| WO2010029577A3 (en) | 2010-05-06 |
| IL211366A0 (en) | 2011-04-28 |
| EP2324006B1 (en) | 2014-08-13 |
| NZ591394A (en) | 2013-03-28 |
| WO2010029577A2 (en) | 2010-03-18 |
| AU2009290365B2 (en) | 2014-08-14 |
| CA2736732A1 (en) | 2010-03-18 |
| BRPI0913485A2 (pt) | 2016-06-07 |
| CN102149703B (zh) | 2014-09-10 |
| EP2324006A2 (en) | 2011-05-25 |
| US20100068178A1 (en) | 2010-03-18 |
| AU2009290365A1 (en) | 2010-03-18 |
| CN102149703A (zh) | 2011-08-10 |
| US8258119B2 (en) | 2012-09-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2324006B1 (en) | Anti-cancer drugs and uses relating thereto for metastatic malignant melanoma and other cancers | |
| US7166639B2 (en) | NF-κB inhibitors | |
| JP5571168B2 (ja) | 抗癌剤ならびに悪性黒色腫および他の癌に関連する使用 | |
| Hafez et al. | Design and synthesis of 3-pyrazolyl-thiophene, thieno [2, 3-d] pyrimidines as new bioactive and pharmacological activities | |
| US10315990B2 (en) | Isothiocyanate compounds and isothiocyanate XPO1 protein inhibitor drugs thereof | |
| JP2004523476A (ja) | NF−κB阻害剤 | |
| US7375131B2 (en) | NF-κB inhibitors | |
| CN109836434B (zh) | 噻吩并环类化合物及其合成方法和应用 | |
| JP2002513026A (ja) | ホスホジエステラーゼv阻害作用を有する凝縮チエノピリミジン類 | |
| CN114080389A (zh) | Nrf2活性化化合物 | |
| US7300952B2 (en) | NF-κb inhibitors | |
| EP1499605B1 (en) | NF-KappaB INHIBITORS | |
| US20060030596A1 (en) | NF-kappaB inhibitors | |
| KR101576235B1 (ko) | 신규한 이치환 아다만틸 유도체 또는 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 유효성분으로 함유하는 암 전이 억제용 약학적 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |