KR100839265B1 - 치환된 티오아세트아미드 - Google Patents
치환된 티오아세트아미드 Download PDFInfo
- Publication number
- KR100839265B1 KR100839265B1 KR1020027015408A KR20027015408A KR100839265B1 KR 100839265 B1 KR100839265 B1 KR 100839265B1 KR 1020027015408 A KR1020027015408 A KR 1020027015408A KR 20027015408 A KR20027015408 A KR 20027015408A KR 100839265 B1 KR100839265 B1 KR 100839265B1
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- alkyl
- phenyl
- delete delete
- compounds
- Prior art date
Links
- 0 CN(*)C1=NCCN1 Chemical compound CN(*)C1=NCCN1 0.000 description 2
- JPBOCIIWQYIQLT-UHFFFAOYSA-N CCC/N=C(/C)\NC Chemical compound CCC/N=C(/C)\NC JPBOCIIWQYIQLT-UHFFFAOYSA-N 0.000 description 1
- PSOZJOZKEVZLKZ-UHFFFAOYSA-N Cc1c[o]c(C)n1 Chemical compound Cc1c[o]c(C)n1 PSOZJOZKEVZLKZ-UHFFFAOYSA-N 0.000 description 1
- OBSLLHNATPQFMJ-UHFFFAOYSA-N Cc1c[s]c(C)n1 Chemical compound Cc1c[s]c(C)n1 OBSLLHNATPQFMJ-UHFFFAOYSA-N 0.000 description 1
- KYSNFMVXIDMBFD-UHFFFAOYSA-N Cc1n[s]nc1C Chemical compound Cc1n[s]nc1C KYSNFMVXIDMBFD-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/50—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton
- C07C323/51—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton
- C07C323/60—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and carboxyl groups bound to the same carbon skeleton having the sulfur atoms of the thio groups bound to acyclic carbon atoms of the carbon skeleton with the carbon atom of at least one of the carboxyl groups bound to nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/16—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/34—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/36—Oxygen or sulfur atoms
- C07D207/40—2,5-Pyrrolidine-diones
- C07D207/416—2,5-Pyrrolidine-diones with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to other ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/80—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D211/84—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen directly attached to ring carbon atoms
- C07D211/86—Oxygen atoms
- C07D211/88—Oxygen atoms attached in positions 2 and 6, e.g. glutarimide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/32—Sulfur atoms
- C07D213/34—Sulfur atoms to which a second hetero atom is attached
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D219/00—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems
- C07D219/04—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/54—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/08—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/08—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D263/16—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/30—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D263/32—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/30—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D263/34—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D275/00—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings
- C07D275/02—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/22—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D277/26—Radicals substituted by sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/56—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/56—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/68—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/78—Ring systems having three or more relevant rings
- C07D311/80—Dibenzopyrans; Hydrogenated dibenzopyrans
- C07D311/82—Xanthenes
- C07D311/84—Xanthenes with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 9
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/14—Radicals substituted by singly bound hetero atoms other than halogen
- C07D333/18—Radicals substituted by singly bound hetero atoms other than halogen by sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D335/00—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom
- C07D335/04—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D335/10—Dibenzothiopyrans; Hydrogenated dibenzothiopyrans
- C07D335/12—Thioxanthenes
- C07D335/14—Thioxanthenes with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 9
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/02—Ortho- or ortho- and peri-condensed systems
- C07C2603/04—Ortho- or ortho- and peri-condensed systems containing three rings
- C07C2603/06—Ortho- or ortho- and peri-condensed systems containing three rings containing at least one ring with less than six ring members
- C07C2603/10—Ortho- or ortho- and peri-condensed systems containing three rings containing at least one ring with less than six ring members containing five-membered rings
- C07C2603/12—Ortho- or ortho- and peri-condensed systems containing three rings containing at least one ring with less than six ring members containing five-membered rings only one five-membered ring
- C07C2603/18—Fluorenes; Hydrogenated fluorenes
Abstract
본 발명은 치환된 티오아세트아미드를 포함하는 조성물 및, 졸음증의 치료, 각성 상태의 촉진, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애의 치료, 식욕 및 체중 증가의 자극, 주의력결핍 과잉행동 장애 (ADHD)의 치료, 우울증, 정신 분열증, 피로, 특히, 다발성 경화증과 같은 신경병과 연관된 피로, 만성 피로 증후군을 포함하나, 이에 제한되지 않는 대뇌 피질의 기능 감퇴와 연관된 장애에서 기능의 증진 및 인지 장애의 개선을 포함하는 질병의 치료에서 이들의 용도에 관한 것이다.
치환된 티오아세트아미드, 각성 상태, 수면, 졸음증
Description
본 발명은 화학 조성물, 그의 제조 방법 및 조성물의 용도에 관한 것이다. 구체적으로, 본 발명은 치환된 티오아세트아미드를 포함하는 조성물 및, 졸음증의 치료, 각성 상태의 촉진, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애의 치료, 식욕 및 체중 증가의 자극, 주의력결핍 과잉행동 장애 (ADHD)의 치료, 우울증, 정신 분열증, 피로, 특히, 다발성 경화증과 같은 신경병과 연관된 피로, 만성 피로 증후군을 포함하나, 이에 제한되지 않는 대뇌 피질의 기능 감퇴와 연관된 장애에서 기능의 증진 및 인지 장애의 개선을 포함하는 질병의 치료에서 이들의 용도에 관한 것이다.
본원에서 기술하고 있는 화합물들은 모다피닐의 생물학 및 화학적 유사체와 관련된 것들이다. C15H15NO2S, 또는 2-(벤즈히드릴술피닐)아세트아미드 또는 2-[(디페닐메틸)술피닐]아세트아미드로도 공지되어 있는 모다피닐은 각성을 촉진시키는 활성이 있는 아세트아미드 합성 유도체이며, 이들의 구조는 프랑스 특허 제78 05 510호 및 미국 특허 제4,177,290호에 기술되어 있으며, 기면 발작과 연관된 주간 수면과다증의 치료제로서 미국 식약청에서 승인을 받았다. 모다피닐은 상기 인용 한 특허에서 기술하고 있는 바와 같이 아포모르핀, 암페타민, 레세르핀, 옥소트레모린, 히프노틱스, 요힘빈, 5-히드록시트립토판 및 모노아민 산화효소 억제제를 포함하는 다양한 약제와 조합하여 몇몇 행동 상태의 치료제로서 시험해 왔다. 라세미 혼합물의 제조 방법은 상기 특허 제4,177,290호에 기술되어 있으며, 좌선성 이성질체의 제조 방법은 본원에서 참고로 인용하고 있는 미국 특허 제4,927,855호에 기술되어 있다. 좌선성 이성질체는 수면과다증, 우울증, 알츠하이머병의 치료에 유용하며, 특히 노인들의 치매 및 기억력 감퇴 증상에 대해 활성을 갖고 있는 것으로 보고되어 있다.
모다피닐의 주요 약물학적 활성은 각성 상태를 촉진시키는 것이다. 모다피닐은 래트 (Touret et al., 1995; Edgar and Seidel, 1997), 고양이 (Lin et al., 1992), 개(canine) (Shelton et al., 1995) 및 인간이 아닌 영장류 (Hernant et al, 1991)에서뿐 아니라, 수면 무호흡증 (영국 불독의 수면 장애로 인한 호흡 모델) (Panckeri et al., 1996) 및 기면 발작 (기면발작한 개)(Shelton et al., 1995)과 같이 임상적 상황이 유사한 모델에서도 각성 상태를 촉진시킨다.
또한, 모다피닐은 중추신경계에서 활성인 약제이며, 파킨슨병의 치료에 유용한 약제이며 (미국 특허 제5,180,745호), 허혈로부터 뇌조직을 보호하고 (미국 특허 제5,391,576호), 대소변 실금의 치료에 유용하고 (미국 특허 제5,401,776호), 수면 무호흡증 및 중추 기원 질병을 치료하는 데 유용한 (미국 특허 제5,612,379호) 약제로서 기술되어 있다. 미국 특허 제5,618,845호는 약 200 미크론 미만으로 정의된 입도의 모다피닐 제제를 기술하고 있다. 또한, 모다피닐은 인간 또는 동물 의 식사 장애의 치료 또는 체중 증가를 촉진시키거나 식욕을 자극하거나 (본원에서 참고 문헌으로 인용하고 있는 미국 가출원 제60/150,071호), 또는 주의력결핍 과잉행동 장애 (ADHD), 피로, 특히 다발성 경화증과 연관된 피로의 치료 (본원에서 참고 문헌으로 인용하고 있는 미국 가출원 제60/149,612호)에 유용한 약제이다.
몇몇 공개된 특허 출원들은 모다피닐의 유도체 형태 및 각종 질병의 치료에 있어서의 모다피닐 유도체의 용도를 기술하고 있다. 예를 들어, PCT 공개 공보 WO99/25329호는 페닐기가 F, Cl, Br, CF3, NO2, NH2, C1-C4
알킬, C1-C4 알콕시 또는 메틸렌디옥시로 치환되고, 아미드가 OH, C1-C4 알킬, C1-C4 히드록시알킬 또는 C1-C4 탄화수소 라디칼로 치환된 모다피닐의 유사체를 기술하고 있다. 이들 조성물은 약물 유발된 졸음, 특히 암환자에게 모르핀을 투여하여 유발시키는 것과 연관된 졸음을 치료하는 데 유용하다.
유사하게, 미국 특허 제4,066,686호는 술피닐기와 카르보닐기 사이가 알킬쇄로 연장되어 있고, NR3R4가 NHOH인 모다피닐 유도체를 포함하는 벤즈히드릴술피닐 유도체를 기술하고 있다. 이들 화합물은 중추 신경계의 장애를 치료하는 치료법에 유용한 것으로 기술되어 있다.
PCT 공개 공보 WO95/01333호는 식습관을 변화시키는 데 유용한 모다피닐 유도체를 기술하고 있다. 기술된 모다피닐에 대한 변형은 페닐기 중 한 개의 3 위치에 클로로기가 있고, 제2 페닐이 피리딜로 치환되고, 2-탄소 위치에서 수소가 1 또는 2 개의 메틸기로 치환되고, 아미드 수소가 H, 피리딜-메틸 또는 에틸기에서 선 택된 1 또는 2 개의 기로 치환될 수 있으며, 황은 산화될 수 없다.
또한, PCT 공개 공보 WO95/01171호도 식습관을 변화시키는 데 유용한 변형된 모다피닐 화합물을 기술하고 있다. 기술된 화합물은 제1 페닐기의 4-플루오로-, 3-플루오로- 및 4-클로로- 및 제2 페닐의 4-플루오로- 또는 3-플루오로-가 치환된 것을 포함한다. 또한, 이러한 치환은 아미드가 OH 또는 이소프로필기로 치환되는 것을 포함하는 것으로 기술하고 있다.
데라우찌, 에이치 등은 ATP-효소 억제제로서 유용한 니코틴아미드 유도체를 기술하고 있다 (Terauchi, H, et al, J.Med.Chem., 1997, 40, 313-321). 특히, 몇몇의 N-알킬 치환된 2-(벤즈히드릴술피닐)니코틴아미드가 기술되어 있다.
미국 특허 제4,980,372호 및 동 제4,935,240호는 벤조일아미노페녹시부탄산 유도체를 기술하고 있다. 특히, 술피드와 카르보닐 사이에 페닐 및 치환된 페닐 결합기, 및 말단 아미드 위치에 치환된 아릴을 함유하는 모다피닐의 술피드 유도체를 기술하고 있다.
말단 페닐기가 결합기로 제한되어 있는 다른 모다피닐 유도체가 기술되어 있다. 예를 들어, 미국 특허 제5,563,169호는 말단 아미드 위치에 치환된 아릴을 갖는 특정의 크산테닐 및 티아크산테닐 유도체를 보고하고 있다.
다른 크산테닐 및 티아크산테닐 유도체는 문헌 [Annis, I; Barany, G. Pept. Proc. Am. Pept. Symp. 15th (Meeting Date 1997) 343-344, 1999] (펩티드 합성에서 시약으로서 유용한 엘만(Ellman) 시약의 크산테닐 유도체의 제법); 문헌 [Han, Y.; Barany, G. J. Org. Chem., 1997, 62, 3841-3848] (펩티드 합성에서 시약으로 유용한 S-크산테닐 보호된 시스테인 유도체의 제법); 및 문헌 [El-Sakka, I. A., et al. Arch. Pharm. (Weinheim), 1994, 327, 133-135] (티오글리콜산의 티아크산테놀 유도체)에 기술되어 있다.
이에, 유용한 특성을 갖는 신종의 화합물이 요구된다. 본원에서 치환된 티오아세트아미드로 언급되는 이러한 종류의 화합물은 졸음증의 치료, 각성 상태의 촉진, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애의 치료, 식욕 및 체중 증가의 자극, 주의력결핍 과잉행동 장애 (ADHD)의 치료, 우울증, 정신 분열증, 피로, 특히, 다발성 경화증과 같은 신경병과 연관된 피로, 만성 피로 증후군을 포함하나, 이에 제한되지 않는 대뇌 피질의 기능 감퇴와 연관된 장애에서 기능의 증진, 및 인지 장애의 개선을 포함하는 질병 또는 질환을 치료하고 예방하는 시약으로서 유용하다는 것을 밝혀냈다. 본 발명은 상기 뿐 아니라 기타 중요한 목적에 관한 것이다.
<발명의 요약>
본 발명의 한 측면은 다양한 신규 치환된 티오아세트아미드를 일부 제공하는 것이다. 또한, 본 발명의 다른 측면은 이들의 제약 조성물, 제조 방법, 및 질병을 치료하는 화합물의 용도를 포함한다.
본 발명의 한 측면에 있어서, 하기 화학식 I-A의 화합물을 제공한다.
구성 원소 및 바람직한 실시양태는 하기에 상세하게 기술한다.
본 발명의 다른 측면에 있어서, 하기 화학식 I의 화합물을 제공한다.
구성 원소 및 바람직한 실시양태는 하기에 상세하게 기술한다.
본 발명의 다른 측면에 있어서, 하기 화학식 II-A의 화합물을 제공한다.
구성 원소 및 바람직한 실시양태는 하기에 상세하게 기술한다.
본 발명의 다른 측면에 있어서, 하기 화학식 II의 화합물을 제공한다.
구성 원소 및 바람직한 실시양태는 하기에 상세하게 기술한다.
본 발명의 다른 목적은 졸음증의 치료, 각성 상태의 촉진, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애의 치료, 식욕 및 체중 증가의 자극, 주의력결핍 과잉행동 장애 (ADHD)의 치료, 우울증, 정신 분열증, 피로, 특히, 다발성 경화증과 같은 신경병과 연관된 피로, 만성 피로 증후군을 포함하나, 이에 제한되지 않는 대뇌 피질의 기능 감퇴와 연관된 장애에서 기능의 증진, 및 인지 장애의 개선을 포함하는 질병 또는 질환의 치료 또는 예방 방법에 관한 것이다.
본 발명의 다른 목적은 1종 이상의 제약상 허용되는 부형제와 치료 유효량의 1종 이상의 본 발명의 화합물 또는 그의 제약상 허용되는 염 또는 에스테르 형태를 포함하는 제약 조성물을 제공하는 것이다.
치환된 티오아세트아미드의 상기 및 기타 목적, 특성 및 잇점들은 후술하는 특허 명세서의 상세한 설명에서 기술한다.
도 1은 화합물 I-9 (100 mg/kg, 정맥내 투여, 직선) 또는 메틸셀룰로스 비히클 (점선)으로 처리한 래트에서 EEG로 측정된 각성 상태를 나타내는 데이타의 그래 프이다. 각성 상태는 5 분 단위로 정량하였다. N=13 마리 래트/그룹. *p <0.05 대 비히클 처리된 동물.
도 2는 화합물 II-23 (100 mg/kg, 정맥내 투여, 직선) 또는 메틸셀룰로스 비히클 (점선)으로 처리한 래트에서 EEG로 측정된 각성 상태를 나타내는 데이타의 그래프이다. 각 점은 연속해서 30 분 동안 깨어있는 시간의 평균(%)을 나타낸다. *p <0.05 대 비히클 처리된 동물.
한 실시양태에서, 본 발명은 하기 화학식 I-A의 신규한 화합물 및 그의 입체이성질체 형태, 입체이성질체 형태의 혼합물 또는 제약상 허용되는 염 및 에스테르 형태를 제공한다.
<화학식 I-A>
상기 식에서,
Ar1 및 Ar2는 각각 독립적으로 C6-C10 아릴 또는 헤테로아릴에서 선택되고;
여기서, Ar1 또는 Ar2 는 각각 독립적으로
a) H, C6-C10 아릴, 헤테로아릴, F, Cl, Br, I, -CN, -CF3, -NO2, -OH, -OR7, -O(CH2)pNR9R10, -OC(=O)R7, -OC(=O)NR9R
10, -O(CH2)pOR8, -CH2OR8, -NR9
R10, -NR8S(=O)2R7, -NR8C(=O)R7 또는 -NR8C(=S)R
7;
b) -CH2OR11;
c) -NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -CO2R12, -C(=O)R13, -C(=O)NR9R10, -C(=S)NR9R10, -CH=NOR12, -CH=NR7, -(CH2)p
NR9R10, -(CH2)pNHR11, -CH=NNR12R
12A, -C(=NR8)NR8AR8B, -NR8C(=NH)R8A, -NR8C(=NH)NR
8AR8B, ;
d) -S(O)yR7, -(CH2)pS(O)yR7, -CH2
S(O)yR7; 및
e) C1-C8 알킬, C2-C8 알케닐 또는 C2-C8 알키닐
[여기서, 1) 알킬, 알케닐 또는 알키닐기는 각각 비치환되거나; 또는
2) 알킬, 알케닐 또는 알키닐기는 각각 독립적으로 C6-C10 아릴, 헤테로아릴, F, Cl, Br, I, CF3, -CN, -NO2, -OH, -OR7, -CH2OR8
, -NR9R10, -O-(CH2)p-OH, -S-(CH2)p-OH, -X1(CH2)pOR7, X1
(CH2)pNR9R10, -X1(CH2)p
C(=O)NR9R10, -X1(CH2)pC(=S)NR9R
10, -X1(CH2)pOC(=O)NR9R10, -X1(CH2
)pCO2R8, -X1(CH2)pS(O)y
R7, -X1(CH2)pNR8C(=O)NR9R10
, -C(=O)R13, -CO2R12, -OC(=O)R7, -C(=O)NR9R10
, -OC(=O)NR12R12A, O-테트라히드로피라닐, -C(=S)NR9R10, -CH=NNR12R12A, -CH=NOR12, -CH=NR
7, -CH=NNHCH(N=NH)NH2, -NR8CO2R7, - NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -NHC(=NH)NH
2, -NR8C(=O)R7, -NR8C(=S)R7, -NR8S(=O)2R7, -S(O)yR7, -S(=O)2NR12
R12A, -P(=O)(OR8)2, -OR11, 및 C5-C7
단당류 (이때, 단당류의 히드록실기는 각각 독립적으로 치환되지 않거나, H, C1-C4 알킬, C1
-C4 알콕시 또는 -O-C(=O)R7로 치환된다)에서 독립적으로 선택된 1 내지 3 개의 치환기로 치환된다]에서 독립적으로 선택된 1 내지 3 개의 치환기로 임의로 치환될 수 있고;
X1은 -O-, -S-, -N(R8)-이고;
Y는 C1-C4 알킬렌, C6-C10 아릴렌, 헤테로아릴렌, C3-C
8 시클로알킬렌, 헤테로시클릴렌, -O-, -N(R8)-, -S(O)y, -CR8A=CR8B-, -CH=CH-CH(R
8)-, -CH(R8)-CH=CH- 또는 -C≡C-에서 선택되나, 단, Y가 -O-, -N(R8)- 또는 -S(O)y일 때, m 및 n은 0일 수 없고;
R3 및 R4는 동일하거나 상이하고, 각각 H, C1-C6 알킬, -OH, 및 -CH(R6)-CONR8AR8B에서 선택되나, R3 및 R4는 동시에 OH가 아니며; 또는 R3 및 R4는 이들이 결합한 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;
R6은 H, C1-C4 알킬 또는 α-아미노산의 측쇄이고;
R7은 C1-C6 알킬, C6-C10 아릴 또는 헤테로아릴이고;
R8, R8A 및 R8B는 각각 독립적으로 H, C1-C4 알킬 또는 C6-C10 아릴이고;
R9 및 R10은 독립적으로 H, C1-C4 알킬, 및 C6-C
10 아릴에서 선택되거나; 또는 R9 및 R10은 이들이 결합되어 있는 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;
R11은 카르복실기의 히드록실기가 제거된 아미노산 잔기이고;
R12 및 R12A는 각각 독립적으로 H, C1-C6 알킬, 시클로알킬, C6-C10 아릴, 및 헤테로아릴에서 선택되거나; 또는 R12 및 R12A는 이들이 결합되어 있는 질소와 함께 5원 내지 7원 헤테로시클릴 고리를 형성하고;
R13은 H, C1-C6 알킬, 시클로알킬, C6-C10 아릴, 헤테로아릴, -C(=O)R7, -C(=O)NR9R10 또는 -C(=S)NR9R10이고;
m은 0, 1, 2 또는 3이고;
n은 0, 1, 2 또는 3이고;
p는 1, 2, 3 또는 4이고;
q는 0, 1 또는 2이고;
t는 2, 3 또는 4이고;
y는 0, 1 또는 2이되, 단,
Ar1이 페닐이고, Ar2가 페닐 또는 피리딜일 때, Y는 C1-C4 알킬렌일 수 없고;
본 발명의 추가의 실시양태에 있어서, 하기 화학식 I의 화합물 및 그의 입체이성질체 형태, 입체이성질체 형태의 혼합물 또는 제약상 허용되는 염 및 에스테르 형태를 제공한다.
<화학식 I>
상기 식에서,
Ar1 및 Ar2는 동일하거나 상이하고, 각각 티오펜, 이소티아졸, 페닐, 피리딜, 옥사졸, 이속사졸, 티아졸, 이미다졸 및 -N-, -O- 또는 -S-로 이루어진 1 내지 3 개의 원자를 포함하는 다른 5원 또는 6원 헤테로사이클에서 선택되나, Ar1 및 Ar2는 동시에 페닐이 아니며, Ar1이 페닐일 때, Ar2은 피리딜이 아니고;
R1 내지 R4는 동일하거나 상이하고, 각각 H, 저급 알킬, -OH, -CH(R6)-CONR6AR6B에서 선택되거나, 또는 R1 내지 R4 중에서 임의의 것들이 함께 결합하여 3원 내지 7원 카르보시클릭 또는 헤테로시클릭 고리를 형성할 수 있으나, R3 및 R4는 동 시에 OH가 아니며;
R6A 및 R6B는 독립적으로 H 또는 저급 알킬이고;
n은 0, 1 또는 2이고;
또한, Ar1 또는 Ar2는 각각 독립적으로
a) H, 아릴, 헤테로시클릴, F, Cl, Br, I, -CN, -CF3, -NO2, -OH, -OR7, -O(CH2)pNR9R10, -OC(=O)R7, -OC(=O)NR9R
10, -O(CH2)pOR8, -CH2OR8, -NR9
R10, -NR8S(=O)2R7, -NR8C(=O)R7 또는 -NR8C(=S)R7;
b) -CH2OR11 (여기서, R11은 카르복실기의 히드록실기가 제거된 아미노산의 잔기임);
c) -NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -CO2R12, -C(=O)R12, -C(=O)NR9R10, -C(=S)NR9R10, -CH=NOR12, -CH=NR7, -(CH2)p
NR9R10, -(CH2)pNHR11 또는 -CH=NNR12
R12A (여기서, R12 및 R12A는 동일하거나 상이하고, 각각 독립적으로 H, 탄소수 1 내지 4의 알킬, -OH, 탄소수 1 내지 4의 알콕시, -OC(=O)R7, -OC(=O)NR9R10, -OC(=S)NR
9R10, -O(CH2)pNR9R10, -O(CH2)pOR8, 탄소수 6 내지 10의 치환 또는 비치환 아릴알킬 및 치환 또는 비치환 헤테로시클릴알킬에서 선택됨);
d) -S(O)yR12, -(CH2)pS(O)yR7, -CH
2S(O)yR11 (여기서, y는 0, 1 또는 2임)이고;
e) 탄소수 1 내지 8의 알킬, 탄소수 2 내지 8의 알케닐 또는 탄소수 2 내지 8의 알키닐
[여기서, 1) 알킬, 알케닐 또는 알키닐기는 각각 비치환되거나; 또는
2) 알킬, 알케닐 또는 알키닐기는 각각 탄소수 6 내지 10의 아릴, 헤테로시클릴, 아릴알콕시, 헤테로시클로알콕시, 히드록실알콕시, 알킬옥시-알콕시, 히드록시알킬티오, 알콕시-알킬티오, F, Cl, Br, I, -CN, -NO2, -OH, -OR7, -X2(CH2)pNR9R10, -X2(CH2)
pC(=O)NR9R10, -X2(CH2)pC(=S)NR9
R10, -X2(CH2)pOC(=O)NR9R10, -X2(CH2)pCO2R7, -X2(CH2)
pS(O)yR7, -X2(CH2)pNR8C(=O)NR
9R10, -OC(=O)R7, -OC(=O)NR12, O-테트라히드로피라닐, -NR9R10, -NR8CO2R7, -NR8
C(=O)NR9R10, -NR8C(=S)NR9R10, -NHC(=NH)NH2, -NR8C(=O)R7, -NR8C(=S)R7, -NR8
S(=O)2R7, -S(O)yR7, -CO2R12, -C(=O)NR9R10, -C(=S)NR9R10, -C(=O)R12, -CH2
OR8, -CH=NNR12R12A, -CH=NOR12, -CH=NR7, -CH=NNHCH(N=NH)NH2, -S(=O)2NR12R12A, -P(=O)(OR8)
2, -OR11, 및 탄소수 5 내지 7의 단당류 (이때, 단당류의 히드록실기는 각각 독립적으로 치환되지 않거나 H, 탄소수 1 내지 4의 알킬, 탄소수 2 내지 5의 알킬카르보닐옥시 또는 탄소수 1 내지 4의 알콕시로 치환된다)에서 선택된 1 내지 3 개의 치환기로 치환된다]에서 독립적으로 선택된 1 개 이상의 치환기로 임의로 치환될 수 있고;
여기서 X2는 O, S 또는 NR8이고;
R7은 치환 또는 비치환 알킬, 치환 또는 비치환 아릴, 또는 치환 또는 비치환 헤테로시클릴이고;
R8은 H 또는 탄소수 1 내지 4의 알킬이고;
p는 1 내지 4이고;
1) R9 및 R10은 각각 독립적으로 H, 탄소수 1 내지 4의 비치환 알킬, 또는 치환 알킬; 또는
2) R9 및 R10은 함께 화학식 -(CH2)2-X1-(CH2
)2- (여기서, X1은 -O-, -S-, 및 -CH2-에서 선택됨)의 결합기를 형성한다.
본 발명의 바람직한 실시양태에서, Ar1 및 Ar2가 동일하거나 상이하고, 각각 티오펜, 이소티아졸, 페닐, 옥사졸, 이속사졸, 티아졸, 이미다졸 또는 -N-, -O-, 또는 -S-로 이루어진 1 내지 3 개의 원자를 포함하는 다른 5 또는 6원 헤테로사이클에서 선택되나, Ar1 및 Ar2가 동시에 페닐이 아니고;
R1 내지 R4는 동일하거나 상이하고, 각각 H, 저급 알킬, -OH, -CH(R6)-CONR6AR6B에서 선택되거나, 또는 R1 내지 R4 중에서 임의의 것들이 함께 결합하여 3 내지 7원 카르보시클릭 또는 헤테로시클릭 고리를 형성하나, R3 및 R4는 동시에 OH가 아니고; R6A 및 R6B는 독립적으로 H 또는 저급 알킬이고;
n은 0, 1 또는 2이고;
또한, Ar1 또는 Ar2가 각각 독립적으로
a) H, 아릴, 헤테로시클릴, F, Cl, Br, I, -CN, -CF3, -NO2, -OH, -OR7, -O(CH2)pNR9R10, -OC(=O)R7, -OC(=O)NR9R
10, -O(CH2)pOR8, -CH2OR8, -NR9
R10, -NR8S(=O)2R7, -NR8C(=O)R7 또는 -NR8C(=S)R7;
b) -CH2OR11 (여기서, R11은 카르복실기의 히드록실기가 제거된 아미노산의 잔기임);
c) -NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -CO2R12, -C(=O)R12, -C(=O)NR9R10, -C(=S)NR9R10, -CH=NOR12, -CH=NR7, -(CH2)p
NR9R10, -(CH2)pNHR11 또는 -CH=NNR12
R12A (여기서, R12 및 R12A는 동일하거나 상이하고, 각각 독립적으로 H, 탄소수 1 내지 4의 알킬, -OH, 탄소수 1 내지 4의 알콕시, -OC(=O)R7, -OC(=O)NR9R10, -OC(=S)NR
9R10, -O(CH2)pNR9R10, -O(CH2)pOR8, 탄소수 6 내지 10의 치환 또는 비치환 아릴알킬 및 치환 또는 비치환 헤테로시클릴알킬에서 선택됨);
d) -S(O)yR12, -(CH2)pS(O)yR7, -CH
2S(O)yR11 (여기서, y가 0, 1 또는 2임)이고;
e) 탄소수 1 내지 8의 알킬, 탄소수 2 내지 8의 알케닐, 또는 탄소수 2 내지 8의 알키닐,
[여기서, 1) 알킬, 알케닐, 또는 알키닐기는 각각 비치환되거나; 또는
2) 알킬, 알케닐 또는 알키닐기는 각각 탄소수 6 내지 10의 아릴, 헤 테로시클릴, 아릴알콕시, 헤테로시클로알콕시, 히드록실알콕시, 알킬옥시-알콕시, 히드록시알킬티오, 알콕시-알킬티오, F, Cl, Br, I, -CN, -NO2, -OH, -OR7, X2(CH2)pNR9R10, -X2(CH2)
pC(=O)NR9R10, -X2(CH2)pC(=S)NR9
R10, -X2(CH2)pOC(=O)NR9R10, -X2(CH2)pCO2R7, -X2(CH2)
pS(O)yR7, -X2(CH2)pNR8C(=O)NR
9R10, -OC(=O)R7, -OC(=O)NR12, O-테트라히드로피라닐, -NR9R10, -NR8CO2R7, -NR8
C(=O)NR9R10, -NR8C(=S)NR9R10, -NHC(=NH)NH2, -NR8C(=O)R7, -NR8C(=S)R7, -NR8
S(=O)2R7, -S(O)yR7, -CO2R12, -C(=O)NR9R10, -C(=S)NR9R10, -C(=O)R12, -CH2
OR8, -CH=NNR12R12A, -CH=NOR12, -CH=NR7, -CH=NNHCH(N=NH)NH2, -S(=O)2NR12R12A, -P(=O)(OR8)
2, -OR11, 및 탄소수 5 내지 7의 단당류 (이때, 단당류의 히드록실기는 각각 독립적으로 치환되지 않거나 H, 탄소수 1 내지 4의 알킬, 탄소수 2 내지 5의 알킬카르보닐옥시 또는 탄소수 1 내지 4의 알콕시로 치환된다)에서 독립적으로 선택된 1 내지 3 개의 치환기로 치환된다]에서 독립적으로 선택된 1 개 이상의 치환기로 임의로 치환될 수 있고;
X2는 O, S, 또는 NR8이고;
R7은 치환 또는 비치환 알킬, 치환 또는 비치환 아릴, 또는 치환 또는 비치환 헤테로시클릴이고;
R8은 H 또는 탄소수 1 내지 4의 알킬이고;
p는 1 내지 4이고;
1) R9 및 R10은 각각 독립적으로 H, 탄소수 1 내지 4의 비치환 알킬, 또는 치환 알킬; 또는
2) R9 및 R10은 함께 화학식 -(CH2)2-X1-(CH2
)2-, (여기서, X1은 -O-, -S-, 및 -CH2-에서 선택됨)의 결합기를 형성하는 화학식 I의 화합물 및 그의 입체이성질체 형태, 입체이성질체 형태의 혼합물 또는 제약상 허용되는 염 및 에스테르 형태를 제공한다.
본 발명의 다른 실시양태에 있어서, 하기 화학식 II-A의 신규한 화합물 및 그의 입체이성질체 형태, 입체이성질체 형태의 혼합물 또는 제약상 허용되는 염 및 에스테르 형태를 제공한다.
<화학식 II-A>
상기 식에서,
X는 결합, -CH2CH2-, -O-, -S(O)y-, -N(R8)-, -CHN(R8
)-, -CH=CH-, -CH2-CH=CH-, C(=O), -C(R8)=N-, -N=C(R8)-, -C(=O)-N(R8)- 또는 -NR8-C(=O)-이고,
고리 A와 B는 이들이 결합한 탄소 원자들과 함께 결합하여 각각 독립적으로
a) 탄소수 1 내지 3의 6원 방향족 카르보시클릭 고리 (이때, 이들은 산소, 질소 및 황에서 선택된 헤테로원자들로 치환될 수 있다); 및
b) 5원 방향족 카르보시클릭 고리
(이때, 이들은
i) 1 개의 탄소 원자가 산소, 질소 또는 황 원자로 치환될 수 있거나;
ii) 2 개의 탄소 원자가 황과 질소 원자, 산소와 질소 원자 또는 2 개의 질소 원자로 치환될 수 있거나; 또는
iii) 3 개의 탄소 원자가 3 개의 질소 원자, 1 개의 산소와 2 개의 질소 원자, 또는 1 개의 황과 2 개의 질소 원자로 치환될 수 있다)에서 선택된 고리를 형성하고,
R1과 R2는 각각 독립적으로
a) H, C6-C10 아릴, 헤테로아릴, F, Cl, Br, I, -CN, -CF3, -NO2, -OH, -OR7, -O(CH2)pNR9R10, -OC(=O)R7, -OC(=O)NR9R
10, -O(CH2)pOR8, -CH2OR8, -NR9
R10, -NR8S(=O)2R7, -NR8C(=O)R7, 또는 -NR8C(=S)R
7,
b) -CH2OR11,
c) -NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -CO2R12, -C(=O)R13, -C(=O)NR9R10, -C(=S)NR9R10, -CH=NOR12, -CH=NR7, -(CH2)p
NR9R10, -(CH2)pNHR11, -CH=NNR12R
12A, - C(=NR8)NR8AR8B-NR8C(=NH)R8A, -NR8C(=NH)NR
8AR8B, ;
d) -S(O)yR7, -(CH2)pS(O)yR7, -CH2
S(O)yR7; 및
e) C1-C8 알킬, C2-C8 알케닐, 또는 C2-C8
알키닐
[여기서, 1) 알킬, 알케닐, 또는 알키닐기는 각각 비치환되거나; 또는
2) 알킬, 알케닐 또는 알키닐기는 각각 독립적으로 C6-C10 아릴, 헤테로아릴, F, Cl, Br, I, CF3, -CN, -NO2, -OH, -OR7, -CH2OR8
, -NR9R10, -O-(CH2)p-OH, -S-(CH2)p-OH, -X1(CH2)pOR7, X1
(CH2)pNR9R10, -X1(CH2)p
C(=O)NR9R10, -X1(CH2)pC(=S)NR9R
10, -X1(CH2)pOC(=O)NR9R10, -X1(CH2
)pCO2R8, -X1(CH2)pS(O)y
R7, -X1(CH2)pNR8C(=O)NR9R10
, -C(=O)R13, -CO2R12, -OC(=O)R7, -C(=O)NR9R10
, -OC(=O)NR12R12A, O-테트라히드로피라닐, -C(=S)NR9R10, -CH=NNR12R12A, -CH=NOR12, -CH=NR
7, -CH=NNHCH(N=NH)NH2, -NR8CO2R7, -NR8C(=O)NR9R10, -NR8C(=S)NR9R10, -NHC(=NH)NH
2, -NR8C(=O)R7, -NR8C(=S)R7, -NR8S(=O)2R7, -S(O)yR7, -S(=O)2NR12
R12A, P(=O)(OR8)2, -OR11, 및 C5-C7
단당류 (이때, 단당류의 히드록실기는 각각 독립적으로 치환되지 않거나, H, C1-C4 알킬, C1
-C4 알콕시, 또는 -O-C(=O)R7로 치환된다)에서 독립적으로 선택된 1 내지 3 개의 치환기로 치환된다]에서 선택되고;
R3 및 R4는 동일하거나 상이하고, 각각 H, C1-C6 알킬, -OH, -CH(R6)-CONR8AR8B에서 선택되고, R3 및 R4는 동시에 OH가 아니며; 또는 R3 및 R4
는 이들이 결합한 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;
R6은 H, C1-C4 알킬 또는 α-아미노산의 측쇄이고;
R7은 C1-C6 알킬, C6-C10 아릴, 또는 헤테로아릴이고;
R8, R8A 및 R8B는 각각 독립적으로 H, C1-C4 알킬, 또는 C6-C10 아릴이고;
R9 및 R10은 독립적으로 H, C1-C4 알킬, 및 C6-C
10 아릴에서 선택되거나; 또는 R9 및 R10은 이들이 결합되어 있는 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;
R11은 카르복실기의 히드록실기가 제거된 아미노산 잔기이고;
R12 및 R12A는 각각 독립적으로 H, C1-C6 알킬, 시클로알킬, C6-C10 아릴, 및 헤테로아릴에서 선택되거나; 또는 R12 및 R12A는 이들이 결합되어 있는 질소와 함께 5원 내지 7원 헤테로시클릴 고리를 형성하고;
R13은 H, C1-C6 알킬, 시클로알킬, C6-C10 아릴, 헤테로아릴, -C(=O)R7, -C(=O)NR9R10 또는 -C(=S)NR9R10이고;
X1은 -O-, -S-, -N(R8)-이고;
Y는 C1-C4 알킬렌, C6-C10 아릴렌, 헤테로아릴렌, C3-C
8 시클로알킬렌, 헤테로시클릴렌, -O-, -N(R8)-, -S(O)y, -CR8A=CR8B-, -CH=CH-CH(R
8)-, -CH(R8)-CH=CH-, 또는 -C≡C-에서 선택되며, Y가 -O-, -N(R8)-, 또는 -S(O)y일 때, m 및 n은 0일 수 없고;
m은 0, 1, 2 또는 3이고;
n은 0, 1, 2 또는 3이고;
p는 1 내지 4이고;
q는 0, 1 또는 2이고;
r은 0, 1, 2 또는 3이고;
s는 0, 1, 2 또는 3이고;
t는 2, 3 또는 4이고;
y는 0, 1 또는 2이다.
추가의 실시양태에 있어서, 하기 화학식 II의 화합물 및 그의 입체이성질체 형태, 입체이성질체 형태의 혼합물 또는 제약상 허용되는 염 및 에스테르 형태를 제공한다.
<화학식 II>
상기 식에서,
X는 -(CH2)m-, -O-, -S(O)n-, -N(R5)-, -CH=CH- 또는 -CH2
-CH=CH-이고;
m은 0, 1, 2 또는 3이고;
n은 0, 1 또는 2이고;
R1 내지 R4는 동일하거나 상이하고, 각각 H, 저급 알킬, -OH, -CH(R6)-CONR
7R8에서 선택되거나, 또는 R1 내지 R4 중에서 임의의 것들이 함께 결합하여 3원 내지 7원 카르보시클릭 또는 헤테로시클릭 고리를 형성하고;
R5는 H, 저급 알킬, 또는 -OH이고;
R6, R7 및 R8은 H, 저급 알킬이고;
고리 A는 고리 A가 결합되어 있는 탄소 원자와 함께 결합하여
a) 탄소수 1 내지 3의 6원 카르보시클릭 고리 (이때, 이들은 산소, 질소 및 황에서 선택된 헤테로 원자들로 치환될 수 있다); 및
b) 5원 카르보시클릭 고리
(이때, 이들은
i) 1 개의 탄소 원자가 산소, 질소 또는 황 원자로 치환될 수 있거나;
ii) 2 개의 탄소 원자가 황과 질소 원자, 산소와 질소 원자 또는 2 개의 질소 원자로 치환될 수 있거나; 또는
iii) 3 개의 탄소 원자가 3 개의 질소 원자, 1 개의 산소와 2 개의 질소 원 자, 또는 1 개의 황과 2 개의 질소 원자로 치환될 수 있다)에서 선택된 고리를 형성한다.
특정 용도를 갖는 구조적으로 관련된 화합물의 임의의 기에 있어서, 특정기 및 배열이 그들의 최종 용도에서 본 발명의 화합물에 바람직하다.
화학식 I-A 또는 II-A의 특정 실시양태에 있어서, Y는 -C(R1)(R2) (여기서, R1 및 R2는 각각 독립적으로 H 또는 C1-C6 알킬에서 선택되고, 임의로 R1 또는 R2 중 하나가 R3 또는 R4 중 하나와 결합하여 5 내지 7원 헤테로시클릭 고리를 형성함)이다. 바람직하게는, R1 중 하나가 R3 또는 R4와 결합하여 각각 를 형성한다.
화학식 I-A의 특정 실시양태에 있어서, Ar1 및 Ar2는 각각 독립적으로 -N-, -O- 또는 -S-로 이루어진 1 내지 3 개의 원자를 포함하는 5 또는 6원 헤테로아릴에서 선택된다. 바람직하게는 q=1이다. 바람직한 실시양태에 있어서, Ar1 및 Ar2는 각각 독립적으로 티에닐, 이소티아졸릴, 피리딜, 옥사졸릴, 이속사졸릴, 티아졸릴 및 이미다졸릴에서 선택되며, 더욱 바람직하게는 Ar1 및 Ar2는 티에닐이고, 특히 Ar1 및 Ar2는 3-티에닐이다. 다른 바람직한 실시양태에 있어서, Y가 -O-, -S(O)y
- 또는 -N(R8)-이다. 다른 바람직한 실시양태에 있어서, Y가 C1-C4 알킬렌이다. 추가 의 실시양태에 있어서, Y가 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8
)-CH=CH- 또는 -C≡C-이다. 특정 바람직한 실시양태에 있어서, Y가 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게는 m=0 또는 1이고, n=0 또는 1이다. 더욱 바람직하게는, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게, Y는 페닐렌이다. 다른 더욱 바람직한 실시양태에 있어서, Y는 이다.
또다른 실시양태에 있어서, Y는 푸라닐렌이다. 더욱 바람직한 실시양태에 있어서, Y가 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게는 Y는
화학식 I-A의 다른 실시양태에 있어서, Ar1은 페닐이고, Ar2는 -N-, -O- 또는 -S-로 이루어진 1 내지 3 개의 원자를 포함하는 5 또는 6원 헤테로아릴이다. 바람 직하게는 q=1이다. 다른 바람직한 실시양태에 있어서, Ar1 및 Ar2는 각각 독립적으로 페닐, 티에닐, 이소티아졸릴, 피리딜, 옥사졸릴, 이속사졸릴, 티아졸릴 및 이미다졸릴이다. 더욱 바람직한 실시양태에 있어서, Ar1은 페닐이고, Ar2는 티에닐, 이소티아졸릴, 피리딜, 옥사졸릴, 이속사졸릴, 티아졸릴 및 이미다졸릴이고, 더욱 바람직하게는 Ar1은 페닐이고, Ar2는 티에닐이고, 특히 Ar2는 3-티에닐이다. 다른 바람직한 실시양태에 있어서, Y가 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에 있어서, Y가 C1-C4 알킬렌이다. 추가의 실시양태에 있어서, Y가 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH- 또는 -C≡C-이다. 특정 바람직한 실시양태에 있어서, Y가 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게는 m=0 또는 1이고, n=0 또는 1이다. 더욱 바람직하게는, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게는 Y가 페닐렌이다. 다른 더욱 바람직한 실시양태에 있어서, Y는 이다.
또다른 실시양태에 있어서, Y는 푸라닐렌이다. 더욱 바람직한 실시양태에 있어서, Y가 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게는 Y는
화학식 I-A의 다른 실시양태에 있어서, Ar1 및 Ar2는 페닐이다. 바람직하게는 q=1이다. 다른 바람직한 실시양태에 있어서, Y가 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에 있어서, Y가 C1-C4 알킬렌이다. 추가의 실시양태에 있어서, Y가 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH- 또는 -C≡C-이다. 특정 바람직한 실시양태에 있어서, Y가 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게는 m=0 또는 1이고, n=0 또는 1이다. 더욱 바람직하게는, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각 각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게는, Y가 페닐렌이다. 다른 더욱 바람직한 실시양태에 있어서, Y는 이다.
또다른 실시양태에 있어서, Y는 푸라닐렌이다. 더욱 바람직한 실시양태에 있어서, Y가 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게는, Y는
화학식 I-A의 화합물의 추가의 실시양태에서, Y는 -O-, -S(O)y-, -N(R8)-, C1-C4 알킬렌, -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R
8)-CH=CH-, -C ≡C-,
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 다른 바람직한 실시양태에서, Y는 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에서, Y는 C1-C
4 알킬렌이다. 추가의 실시양태에서, Y는 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8
)-CH=CH- 또는 - C ≡C-이다. 특정 바람직한 실시양태에서, Y는 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게, m은 0 또는 1이고 n은 0 또는 1이다. 더욱 바람직하게, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게, Y는 페닐렌이다. 다른 더욱 바람직한 실시양태에서, Y는
추가의 다른 실시양태에서, Y는 푸라닐렌이다. 추가의 바람직한 실시양태에서, Y는 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게, Y는
화학식 I-A의 화합물의 추가의 다른 실시양태에서, q는 1이다.
화학식 I-A의 화합물의 실시양태에서, Ar1 및 Ar2는 각각 독립적으로 페닐 및 티에닐에서 선택되고, q는 1이다. 바람직하게 Ar1 및 Ar2는 각각 독립적으로 페닐 및 3-티에닐에서 선택되고, q는 1이다. 다른 바람직한 실시양태에서, Y는 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에서, Y는 C1-C4
알킬렌이다. 추가의 실시양태에서, Y는 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH- 또는 -C ≡C-이다. 특정 바람직한 실시양태에서, Y는 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게, m은 0 또는 1이고 n은 0 또는 1이다. 더욱 바람직하게, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게, Y는 페닐렌이다. 다른 더욱 바람직한 실시양태에서, Y는
추가의 다른 실시양태에서, Y는 푸라닐렌이다. 추가의 바람직한 실시양태에 서, Y는 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게, Y는
화학식 I-A의 화합물의 바람직한 실시양태는 Ar1 및 Ar2가 동일하거나 상이하고, 각각 티오펜, 이소티아졸, 페닐, 피리딜, 옥사졸, 이속사졸, 티아졸, 이미다졸로부터 선택되며, Ar1 및 Ar2가 동시에 페닐이 아니고, Ar1이 페닐일 때, Ar2가 피리딜이 아닌 화합물이다.
화학식 I의 화합물의 바람직한 실시양태는 Ar1 및 Ar2가 동일하거나 상이하고, 각각 티오펜, 이소티아졸, 페닐, 옥사졸, 이속사졸, 티아졸, 이미다졸에서 각각 선택되며, Ar1 및 Ar2가 동시에 페닐이 아닌 화합물이다. 다른 바람직한 실시양태는 Ar1 및 Ar2가 각각 독립적으로 치환된 화합물이다.
화학식 I의 화합물의 추가의 바람직한 실시양태는 하기와 같다:
1) Ar1, Ar2 또는 둘 다가 티오펜인 화합물;
2) Ar1, Ar2 또는 둘 다가 이소티아졸인 화합물;
3) Ar1, Ar2 또는 둘 다가 피리딜인 화합물;
4) Ar1, Ar2 또는 둘 다가 옥사졸인 화합물;
5) Ar1, Ar2 또는 둘 다가 이속사졸인 화합물;
6) Ar1, Ar2 또는 둘 다가 티아졸인 화합물;
7) Ar1, Ar2 또는 둘 다가 이미다졸인 화합물,
8) Ar1이 페닐이고 Ar2가 티오펜인 화합물.
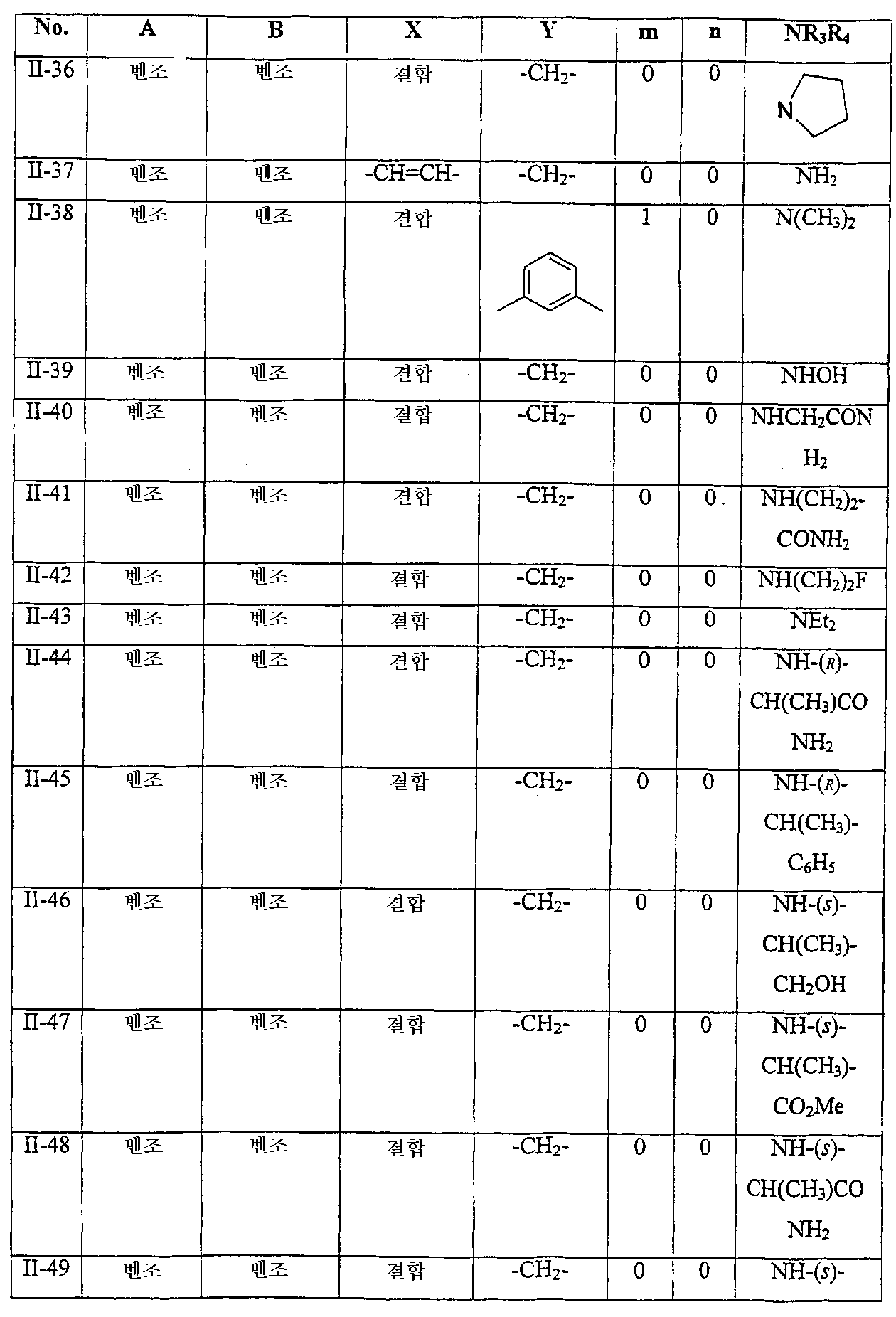
화학식 I-A의 화합물의 바람직한 실시양태에서, 하기 표 1에 나타낸 바와 같은 화합물을 제공한다:
본 발명의 특정 바람직한 실시양태에서, q가 1인 화학식 II 또는 II-A의 화합물을 제공한다.
화학식 I-A의 화합물의 다른 실시양태에서, X는 결합, -CH2CH2-, -O-, -N(CH3)- 또는 -CH=CH-이고, 바람직하게 X는 결합이다.
화학식 II-A의 화합물의 특정 실시양태에서, Y는 -O-, -S(O)y-, -N(R8)-, C1-C4 알킬렌, -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R
8)-CH=CH-, -C ≡C-,
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; 및 X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 다른 바람직한 실시양태에서, Y는 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에서, Y는 C1-C
4 알킬렌이다. 추가의 실시양태에서, Y는 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8
)-CH=CH- 또는 -C ≡C-이다. 특정 바람직한 실시양태에서, Y는 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게, m은 0 또는 1이고 n은 0 또는 1이다. 더욱 바람직하게, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게, Y는 페닐렌이다. 다른 더욱 바람직한 실시양태에서, Y는
추가의 바람직한 실시양태에서, Y는 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게, Y는
화학식 II-A의 화합물의 추가의 실시양태에서, 고리 A 및 B는 이들이 결합된 탄소 원자와 함께 각각 독립적으로 페닐렌, 티에닐렌, 이소티아졸릴렌, 피리딜렌, 옥사졸릴렌, 이속사졸릴렌, 티아졸릴렌, 이미다졸릴렌에서 선택된다. 바람직한 실시양태에서, 고리 A는 페닐렌이고, 더욱 바람직하게, 고리 A 및 B는 페닐렌이다. 다른 바람직한 실시양태에서, 고리 A 및 B는 티에닐렌이고, 더욱 바람직하게, 고리 A 및 B는 2,3-티에닐렌이다. 바람직한 실시양태에서, q는 1이다. 추가의 바람직한 실시양태에서, 고리 A는 페닐렌이고, 고리 B는 2,3-티에닐렌이다. 다른 바람직한 실시양태에서, X는 결합, -CH2CH2-, -O-, -N(CH3)- 또는 -CH=CH-이다. 더욱 바람직한 실시양태에서, Y는 -O-, -S(O)y-, -N(R8)-, C1-C4 알킬렌, -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH-, -C ≡C-,
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 다른 바람직한 실시양태에서, Y는 -O-, -S(O)y- 또는 -N(R8)-이다. 다른 바람직한 실시양태에서, Y는 C1-C
4 알킬렌이다. 추가의 실시양태에서, Y는 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8
)-CH=CH- 또는 -C ≡C-이다. 특정 바람직한 실시양태에서, Y는 C6-C10 아릴렌 또는 헤테로아릴렌이고, 바람직하게, m은 0 또는 1 이고 n은 0 또는 1이다. 더욱 바람직하게, Y는
상기 식에서, X2는 -CH2-, -O-, -S(O)y- 또는 -N(R8)-이고; X3, X4 및 X5는 각각 독립적으로 -CH- 또는 -N-에서 선택된다. 가장 바람직하게, Y는 페닐렌이다. 다른 더욱 바람직한 실시양태에서, Y는
추가의 바람직한 실시양태에서, Y는 C3-C8 시클로알킬렌 또는 헤테로시클릴렌이다. 바람직하게, Y는
특히 바람직한 실시양태에서, X는 결합이고, Y는 -CH2-이고 n은 0이다.
화학식 II의 화합물의 바람직한 실시양태는 고리 A가 티오펜, 이소티아졸, 페닐, 옥사졸, 이속사졸, 티아졸 및 이미다졸에서 선택된 화합물이다. 다른 바람직한 실시양태는 벤조 고리 및 고리 A가 각각 독립적으로 치환된 화합물이다.
화학식 II의 화합물의 다른 바람직한 실시양태는 하기와 같다:
1) A가 벤조이고 X가 결합, 즉 -(CH2)m-이고, 이 때 m은 0인 화합물;
2) A가 벤조이고 X가 -O-인 화합물;
3) A가 벤조이고 X가 -NCH3인 화합물;
4) A가 벤조이고 X가 -S-인 화합물; 및
5) R3 및 R4가 이들이 결합된 질소와 함께 모르폴린 고리를 형성하는 화합물.
화학식 II-A의 화합물의 특히 바람직한 실시양태에서, 하기 표 2에 나타낸 바와 같은 화합물을 제공한다:
예를 들어, 화합물 II-1 및 II-22는 하기 구조를 갖는다:
<화합물 II-1>
<화합물 II-22>
정의
본원에서 사용된, 용어 "알킬"은 1 개의 수소 원자를 제거함으로써 형성된, 탄소수 1 내지 8의 치환 또는 비치환된, 분지쇄 또는 직쇄 탄화 수소를 나타낸다. 특정 바람직한 실시양태에서, 알킬기의 탄소수는 1 내지 6이다. 다른 바람직한 실 시양태에서, 알킬기의 탄소수는 1 내지 4이다. "C1-C4 알킬"이라는 표현은 탄소수 1 내지 4의 알킬 라디칼을 나타낸다. 예로는 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, sec-부틸, t-부틸, 펜틸, 2-메틸펜틸, 헥실, 2-메틸헥실, 2,3-디메틸헥실, 헵틸, 옥틸 등이 있다.
본원에서 사용된, 용어 "저급 알킬"은 임의로 치환된 C1 내지 C6 포화된 직쇄, 분지쇄 또는 시클릭 탄화수소를 나타낸다. 저급 알킬기는 메틸, 에틸, n-프로필, 이소프로필, n-부틸, 이소부틸, t-부틸, n-펜틸, 시클로펜틸, 이소펜틸, 네오펜틸, n-헥실, 이소헥실, 시클로헥실, 3-메틸펜틸, 2,2-디메틸부틸, 2,3-디메틸부틸 등을 포함하나 이에 제한되지 않는다.
본원에서 사용된, "알케닐"은 쇄를 따라 임의의 안정한 지점에서 1 개 이상의 탄소-탄소 이중 결합을 가지며, 1 개의 수소 원자를 제거함으로써 형성되는, 탄소수 2 내지 8의 치환 또는 비치환된, 직쇄 또는 분지쇄 탄화수소쇄를 나타낸다. "C2-C8 알케닐"이라는 표현은 탄소수 2 내지 8의 알케닐 라디칼을 나타낸다. 예로는 에테닐, 프로페닐, 이소프로페닐, 2,4-펜타디에닐 등이 있다.
본원에서 사용된, "알키닐"은 쇄를 따라 임의의 안정한 지점에서 1 개 이상의 탄소-탄소 삼중 결합을 가지며, 1 개의 수소 원자를 제거함으로써 형성되는, 탄소수 2 내지 8의 치환 또는 비치환된, 직쇄 또는 분지쇄 탄화수소 라디칼을 나타낸다. "C2-C8 알키닐"이라는 표현은 탄소수 2 내지 8의 알키닐 라디칼을 나타낸다. 예로는 에티닐, 프로피닐, 이소프로피닐, 3,5-헥사디이닐 등이 있다.
본원에서 사용된, "카르보사이클" 또는 "카르보시클릭"은 포화, 부분 불포화 또는 불포화되고, 탄소수 3 내지 10의 치환 또는 비치환된, 안정한 모노시클릭 또는 비시클릭 탄화 수소 고리를 나타낸다. 따라서 카르보시클릭기는 방향족 또는 비-방향족일 수 있다. 카르보시클릭기의 엔도시클릭 탄소 원자를 연결하는 결합은 단일, 이중, 삼중 또는 융합된 방향족 잔기의 부분일 수 있다. 카르보사이클은 본원에 정의된 "시클로알킬" 및 "아릴" 화합물을 포함하려는 의도이다.
본원에서 사용된, 용어 "시클로알킬"은 1 개의 수소 원자를 제거하여 형성된, 탄소수 3 내지 7의 치환 또는 비치환된 탄화수소 고리를 나타낸다. "C5-C7 시클로알킬"이라는 표현은 탄소수 5 내지 7의 시클로알킬 라디칼을 나타낸다. 예로는 시클로프로필, 시클로펜틸, 시클로헥실, 시클로헵틸 등이 있다.
본원에서 사용된, 용어 "헤테로사이클" 또는 "헤테로시클릭"은 치환 또는 비치환되고, 포화, 부분 불포화 또는 불포화되며, 안정한 3 내지 10원 모노시클릭 또는 비시클릭 고리 (이 때, 고리의 1종 이상의 원소가 헤테로 원자이다)를 나타낸다. 따라서 헤테로시클릭기는 방향족 또는 비-방향족일 수 있다. 일반적으로, 헤테로원자는 산소, 질소, 황, 셀레늄 및 인 원자를 포함하나 이에 제한되지 않는다. 바람직한 헤테로원자는 산소, 질소 및 황이다. 질소 및 황 헤테로원자는 임의로 산화될 수 있고, 질소는 비-방향족 고리에서 임의로 치환될 수 있다. 헤테로시클릭기의 엔도시클릭 원자를 연결하는 결합은 단일, 이중, 삼중 또는 융합된 방향족 잔기의 부분일 수 있다. 헤테로사이클은 본원에 정의된 "헤테로시클릴" 및 "헤테 로아릴" 화합물을 포함하려는 의도이다.
본원에서 사용된, "헤테로시클릴"은 1 개의 수소 원자를 제거함으로써 형성된, 치환 또는 비치환되고, 포화 또는 부분 불포화되며, 안정한 3 내지 7원 헤테로시클릭 고리이다. 예로는 에폭시에틸, 피롤리딜, 피라졸리디닐, 피페리딜, 피라닐, 옥사졸리닐, 모르폴리노, 모르폴리닐, 피페라지닐 등이 있다.
헤테로사이클의 예로는 2-피롤리디닐, 2H-피롤릴, 4-피페리디닐, 6H-1,2,5-티아디아지닐, 2H,6H-1,5,2-디티아지닐, 푸라닐, 푸라자닐, 이미다졸리디닐, 이미다졸리닐, 이미다졸릴, 이속사졸릴, 모르폴리닐, 옥사디아졸릴, 1,2,3-옥사디아졸릴, 1,2,4-옥사디아졸릴, 1,2,5-옥사디아졸릴, 1,3,4-옥사디아졸릴, 옥사졸리디닐, 옥사졸릴, 피페라지닐, 피페리디닐, 프테리디닐, 피페리도닐, 4-피페리디닐, 푸리닐, 피라닐, 피라지닐, 피라졸리디닐, 피라졸리닐, 피라졸릴, 피리다지닐, 피리디닐, 피리딜, 피리미디닐, 피롤리디닐, 피롤리닐, 피롤릴, 테트라히드로푸라닐, 6H-1,2,5-티아디아지닐, 1,2,3-티아디아졸릴, 1,2,4-티아디아졸릴, 1,2,5-티아디아졸릴, 1,3,4-티아디아졸릴, 티아졸릴, 티에닐, 티에노티아졸릴, 티에노옥사졸릴, 티에노이미다졸릴, 트리아지닐, 1,2,3-트리아졸릴, 1,2,4-트리아졸릴, 1,2,5-트리아졸릴, 1,3,4-트리아졸릴 및 테트라졸이 있으나 이에 제한되지 않는다. 또한, 적합한 헤테로사이클은 본원에서 참고 문헌으로 인용한 문헌 [The Handbook of Chemistry and Physics, 76th Edition, CRC Press, Inc., 1995-1996, pages 2-25 to 2-26]에 개시되어 있다.
질소 원자로 형성된 바람직한 헤테로시클릭기는 피롤리디닐, 피페리디닐, 피 페리디노, 모르폴리닐, 모르폴리노, 티오모르폴리노, N-메틸피페라지닐, 인돌릴, 이소인돌릴, 이미다졸, 이미다졸린, 옥사졸린, 옥사졸, 트리아졸, 티아졸린, 티아졸, 이소티아졸, 티아디아졸, 트리아진, 이속사졸, 옥스인돌, 인독실, 피라졸, 피라졸론, 피리미딘, 피라진, 퀴놀린, 이소퀴놀린 및 테트라졸 기를 포함하나 이에 제한되지 않는다.
산소 원자로 형성된 바람직한 헤테로시클릭기는 푸란, 테트라히드로푸란, 피란, 벤조푸란, 이소벤조푸란 및 테트라히드로피란 기를 포함하나 이에 제한되지 않는다. 황 원자로 형성된 바람직한 헤테로시클릭기는 티오펜, 티아나프텐, 테트라히드로티오펜, 테트라히드로티아피란 및 벤조티오펜을 포함하나 이에 제한되지 않는다.
바람직한 방향족 헤테로시클릭기는 피리딜, 피리미딜, 피롤릴, 푸릴, 티에닐, 이미다졸릴, 트리아졸릴, 테트라졸릴, 퀴놀릴, 이소퀴놀릴, 벤조이미다졸릴, 티아졸릴, 피라졸릴 및 벤조티아졸릴 기를 포함하나 이에 제한되지 않는다.
본원에서 사용된, 용어 "치환된"은 지시된 기의 1 개 이상의 수소 원자를 본원에서 "치환체"라 부르는 선택된 기로 대체하는 것을 말하며, 이때 치환은 치환된 원자의 원자가를 초과하지 않고, 이 치환으로 안정한 화합물을 생성한다. 치환된 기는 1 내지 5 개, 바람직하게는 1 내지 3 개, 더욱 바람직하게는 1 개의 독립적으로 선택된 치환체를 갖는다. 바람직한 치환체는 F, Cl, Br, I, OH, OR, NH2, NR2, NHOH, NO2, CN, CF3, CF2CF3, C1-C6 알킬, C2-C6 알케닐, C2-C6 알키닐, C1-C6
알콕시, C3-C7 시클로알킬, 헤테로시클릴, C6-C10 아릴, 헤테로아릴, 아릴알킬, C(=O)R, COOH, CO2R, O-C(=O)R, C(=O)NRR', NRC(=O)R', NRCO2R', OC(=O)NRR', -NRC(=O)NRR', -NRC(=S)NRR' 및 -SO2NRR'(이 때, R 및 R'은 각각 독립적으로 수소, C1-C6 알킬 또는 C6-C10 아릴임)을 포함하나 이에 제한되지 않는다.
본원에서 사용된, 용어 "아릴"은 1 개의 수소 원자를 제거하여 형성된, 탄소수 6 내지 10의 치환 또는 비치환된, 방향족 카르보시클릭 고리를 나타낸다. 예로는 페닐, 나프틸, 인데닐 등이 있다.
본원에서 사용된, 용어 "헤테로아릴"은 1 개의 수소 원자를 제거하여 형성된 치환 또는 비치환된 5 내지 10원 방향족 헤테로시클릭 고리를 나타낸다. 예로는 피롤릴, 피리딜, 피리미디닐, 피라지닐, 테트라졸릴, 인돌릴, 퀴놀리닐, 푸리닐, 이미다졸릴, 티에닐, 티아졸릴, 벤조티아졸릴, 푸라닐, 벤조푸라닐, 1,2,4-티아디졸릴, 이소티아졸릴, 트리아졸릴, 테트라졸릴, 이소퀴놀릴, 벤조티에닐, 이소벤조푸릴, 피라졸릴, 카르바졸릴, 벤즈이미다졸릴, 이속사졸릴 등이 있다.
본원에서 사용된, 용어 "알킬렌"은 2 개의 수소 원자를 제거하여 형성된, 탄소수 1 내지 8의 치환 또는 비치환된, 분지쇄 또는 직쇄 탄화수소를 나타낸다. "C1-C4 알킬렌"이라는 표현은 탄소수 1 내지 4의 알킬렌 라디칼을 나타낸다. 예로는 메틸렌 (-CH2-), 프로필리덴 (CH3CH2CH=), 1,2-에탄디일 (-CH2
CH2-) 등이 있다.
본원에서 사용된, 용어 "시클로알킬렌"은 2 개의 수소 원자를 제거하여 형성 된, 탄소수 3 내지 8의 치환 또는 비치환된 카르보시클릭 고리를 나타낸다. "C3-C8
시클로알킬렌"이라는 표현은 탄소수 3 내지 8의 시클로알킬렌 라디칼을 나타낸다. 예로는 시클로프로필렌 (-C3H4-), 시클로펜틸렌 (-C5H8-), 시클로헥실렌 (-C6H10-) 등이 있다.
본원에서 사용된, 용어 "헤테로시클릴렌"은 2 개의 수소 원자를 제거하여 형성된, 치환 또는 비치환된, 포화 또는 부분 불포화된, 안정한 3 내지 7원 헤테로시클릭 고리를 나타낸다. 예로는 에폭시에틸렌, 피롤리딜렌, 피롤리딜리덴, 피라졸리디닐렌, 피페리딜렌, 피라닐렌, 모르폴리닐리덴 등이 있다.
본원에서 사용된, 용어 "아릴렌"은 2 개의 수소 원자를 제거하여 형성된, 탄소수 6 내지 10의 치환 또는 비치환된 방향족 카르보시클릭 고리를 나타낸다. 예로는 페닐렌 (-C6H4-), 나프틸렌 (-C10H6-) 등이 있다. "페닐렌" 기는 하기 구조를 갖는다:
본원에서 사용된, 용어 "헤테로아릴렌"은 2 개의 수소 원자를 제거하여 형성된, 치환 또는 비치환된 5 내지 10 원 방향족 헤테로시클릭 고리를 나타낸다. 예로는 전술한 각각의 헤테로아릴 화합물에 상응하는 헤테로아릴렌기, 특히, 티에닐렌 (-C4H2S-), 피리딜렌 (-C5H3N-), 피리미디닐렌 (-C3
H2N2-), 퀴놀리닐렌 (-C9H5N-), 티아졸릴렌 (-C3HNS-) 등이 있다. "티에닐렌" 기는 하기 구조를 갖는다:
"피리딜렌" 기는 하기 구조를 갖는다:
본원에서 사용된, 용어 "알콕시"는 알킬기로 치환된 산소 라디칼을 나타낸다. 바람직하게, 알콕시기의 탄소수는 1 내지 6이다. "C1-C4 알콕시"라는 표현은 탄소수 1 내지 4의 알콕시를 나타낸다. 예로는 메톡시, 에톡시, n-프로필, 이소프로폭시, n-부톡시, 이소부톡시, sec-부톡시, t-부톡시 등이 있다.
본원에서 사용된, 용어 "아릴알킬"은 아릴-치환된 알킬기를 나타내고, 벤질, 브로모벤질, 디페닐메틸, 트리페닐메틸, 페닐에틸, 디페닐에틸 등을 포함한다.
본원에서 사용된, "C5-C7 단당류"는 n이 5 내지 7인 화학식 (CH2O)
n의 간단한 당을 나타낸다. 단당류는 직쇄 또는 고리 시스템일 수 있고, 화학식 -CH(OH)-C(=O)-의 사카로스 단위를 포함할 수 있다. 예로는 에리트로스, 트레오스, 리보스, 아라비노스, 크실로스, 릭소스, 알로스, 알트로스, 글루코스, 만노스, 굴로스, 이도스, 갈락토스, 탈로스, 에리툴로스, 리불로스, 크시울로스, 사이코스, 프럭토스, 소르보스, 타가토스, 에리트로펜툴로스, 트레오펜툴로스, 글리세로테트룰로스, 글루코피라노스, 프럭토푸라노스 등이 있다.
본원에서 사용된, 용어 "아미노산"은 아미노기 및 카르복실기 둘 다를 함유 하는 분자를 나타낸다. 아미노산의 실시양태는 α-아미노산, β-아미노산, γ-아미노산을 포함한다. α-아미노산의 일반식은 HOOC-CH(측쇄)-NH2이다. 아미노산은 그의 D, L 또는 라세미 배열일 수 있다. 아미노산은 천연 잔기 및 합성 잔기를 포함한다. 천연 아미노산은 단백질에서 발견되는 표준 20 개 α-아미노산, 예를 들어 글리신, 세린, 티로신, 프롤린, 히스티딘, 글루타민 등을 포함한다. 또한, 천연 아미노산은 비-α-아미노산 (예를 들어, β-알라닌, γ-아미노부티르산, 호모시스테인 등), 희귀 아미노산 (예를 들어, 4-히드록시프롤린, 5-히드록시리신, 3-메틸히스티딘 등) 및 비-단백질 아미노산 (예를 들어, 시트룰린, 오르니틴, 카나바닌 등)을 포함할 수 있다. 합성 아미노산은 당업계에 공지되어 있고, 천연 아미노산의 유사체를 포함한다. 본원에서 참고 문헌으로 인용한 문헌 [Lehninger, A. L. Biochemistry, 2nd ed.; Worth Publishers: New York, 1975; 71-77]을 참조. 또한, 합성 아미노산은 측쇄가 합성 유도체로 치환된 α-아미노산을 포함한다. 천연 α-아미노산 및 합성 α-아미노산의 대표적인 측쇄를 하기 표 A에 나타낸다.
본원에서 사용된, 용어 "환자"는 본원에 기재된 1종 이상의 질병 및 상태를 겪거나, 겪을 가능성이 있는 온혈 동물, 예를 들어 포유동물, 바람직하게는 인간 또는 유아를 나타낸다.
본원에서 사용된, "치료 유효량"은 본원에 기재된 질병 및 상태의 증상을 감 소, 제거, 치료 또는 조절하는 데 효과적인 본 발명의 화합물의 양을 나타낸다. 용어 "조절"은 본원에 기재된 질병 및 상태의 진행을 지연, 방해, 저지 또는 정지시킬 수 있지만, 모든 질병 및 상태의 증상을 완전히 제거하는 것을 가리키는 것은 아니며, 예방적 치료를 포함하려는 의도인 모든 방법을 말한다.
본원에서 사용된, 용어 "제약상 허용되는"이란 안전한 의학적 판단의 범위내에서 인간 및 동물의 조직에 접촉하기에 적합하고 과도한 독성, 자극, 알레르기 반응 또는 다른 합병증 없이 합리적인 이익/위험 비를 가진 상기 화합물, 물질, 조성물 및(또는) 투약 형태를 나타낸다.
본원에서 사용된, "제약상 허용되는 염"은 모 화합물이 그의 산 또는 염기의 염을 제조함으로써 개질된, 개시된 화합물의 유도체를 나타낸다. 제약상 허용되는 염은 예를 들어, 무독성 무기산 또는 유기산으로부터 형성된 모 화합물의 통상적인 무독성 염 또는 사차 암모늄 염을 포함한다. 상기 통상적인 무독성 염의 예로는 염산, 황산, 술팜산, 인산, 질산 등의 무기산으로부터 유도된 염; 아세트산, 프로피온산, 숙신산, 타르타르산, 시트르산, 글루탐산, 벤조산, 살리실산, 톨루엔술폰산, 옥살산 등과 같은 유기산으로부터 제조된 염이 있다.
본 발명의 제약상 허용되는 염은 통상적인 화학적 방법에 의해 염기성 또는 산성 잔기를 함유하는 모 화합물로부터 합성할 수 있다. 일반적으로, 상기 염들은 이들 화합물들의 유리산 또는 염기 형태를 물 또는 유기 용매 중에서, 또는 이들의 혼합물 중에서 화학양론적 양의 적절한 염기 또는 산과 반응시킴으로써 제조할 수 있다. 일반적으로, 에테르, 에틸 아세테이트, 에탄올, 이소프로판올 또는 아세토 니트릴과 같은 비수성 매질이 바람직하다. 적합한 염의 목록은 본원에서 참고 문헌으로 인용하고 있는 문헌 [Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418]에 기재되어 있다.
본원에서 사용된, "전구약물"은 포유 동물 대상에게 투여될 때 본 발명의 화합물에 상응하는 활성 모 약물을 생체내에서 방출시키는 임의의 공유 결합된 담체를 포함하는 것을 의미한다. 전구약물은 제약의 여러 바람직한 특성 (예, 용해도, 생체이용율, 생산성 등)을 향상시키기 때문에, 본 발명의 화합물은 전구약물 형태로 전달될 수 있다. 따라서, 본 발명은 청구된 화합물의 전구약물, 그를 포함하는 조성물, 그의 전달 방법을 포함한다. 본 발명의 화합물의 전구약물은, 화합물에 존재하는 관능기를 통상적으로 조작하거나 또는 생체내에서 분해되어 모 화합물로 변형되도록 하는 방법으로 변형시킴으로써 제조될 수 있다. 따라서, 전구약물은 예를 들어 전구약물이 포유 동물 대상에게 투여될 때 분해되어 각각 유리 히드록실, 유리 아미노 또는 카르복실산을 형성하는 임의의 기에 히드록시, 아미노 또는 카르복시기가 결합된 본 발명의 화합물을 포함한다. 예로는 알콜 및 아민 관능기의 아세테이트, 포르메이트 및 벤조에이트 유도체; 및 알킬, 시클로알킬, 아릴 및 알킬아릴 에스테르, 예를 들어 메틸, 에틸, 시클로프로필, 페닐, 벤질 및 페네틸 에스테르 등을 포함하나, 이에 제한되지 않는다.
본 발명은 치료 유효량의 화학식 I, I-A, II 또는 II-A의 화합물을 이를 필요로 하는 대상에게 투여하는 것을 포함하는, 치료가 필요한 대상에서의 질병 및 상태의 치료 방법을 제공한다. 예를 들어, 화학식 I, I-A, II 또는 II-A의 화합물은 졸음증 (바람직하게는 수면 발작증과 연관된 졸음증)의 치료, 각성 상태의 촉진, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애 (바람직하게는 질병, 특히 신경성 식욕부진과 연관된 섭식 장애)의 치료, 식욕 및 체중 증가의 자극, 주의력결핍 과잉행동 장애의 치료, 우울증, 정신분열증, 피로, 특히, 다발성 경화증과 같은 신경 질병과 관련된 피로, 만성 피로 증후군을 포함하나, 이에 제한되지 않는 대뇌 피질의 기능 감퇴와 관련된 장애에서 기능의 증진, 및 인지 장애의 개선에 사용될 수 있다.
본원에 기술된 질병 및 상태의 치료를 필요로 하는 대상의 확인은 당업계의 숙련자의 능력 및 지식 범위내에 있다. 당업계의 숙련된 임상 의사는 임상 시험, 건강 진단 및 병력/가족력을 사용하여 이러한 치료를 필요로 하는 대상들을 쉽게 확인할 수 있다.
치료 유효량은 당업계의 숙련자로서 진단 의사가 통상적인 기술을 사용하여 유사한 환경에서 얻은 결과를 관찰함으로써 쉽게 결정할 수 있다. 치료 유효량을 결정할 때, 진단 의사는 대상의 종; 대상의 크기, 연령 및 일반적인 건강; 관련된 특정 질병; 질병의 관련 정도 또는 중증도; 개별 대상의 반응; 투여할 특정 화합물; 투여 방식; 투여할 제제의 생체이용율 특성; 선택한 투여 요법; 함께 사용하는 의약; 및 다른 관련된 환경을 포함하지만 이에 제한되지 않는 여러가지 인자들을 고려한다.
바람직한 생물학적 효과를 달성하는데 필요한 화학식 I, I-A, II 또는 II-A 의 화합물의 양은 투여할 약물의 투여량, 사용되는 화합물의 화학적 특성 (예, 소수성), 화합물의 효능, 질병의 유형, 환자의 질병 상태, 및 투여 경로를 포함하는 여러 인자들에 따라 변화될 것이다. 일반적으로, 본 발명의 화합물은 비경구 투여용 화합물을 약 0.1 내지 10 w/v% 함유하는 생리학적 완충수용액으로 제공될 수 있다. 전형적인 투여량 범위는 하루에 체중 1 kg 당 약 1 ㎍ 내지 약 1 g이고, 바람직한 투여량 범위는 하루에 체중 1 kg 당 약 0.01 mg 내지 100 mg이다. 성인 인간에 대한 바람직한 1일 투여량은 약 25, 50, 100 및 200 mg이며, 인간 유아에서의 투여량도 동일하다. 투여할 약물의 바람직한 투여량은 질병 또는 질환의 진행 유형 및 범위, 특정 환자의 전반적인 건강 상태, 선택할 화합물의 상대적인 생물학적 효능, 부형제 화합물 제형 및 그의 투여 경로와 같은 변수에 따라 변할 수 있다.
본 발명의 화합물은 단위 투여 형태로 투여될 수 있으며, 여기서 "단위 투여량"이란 용어는 환자에게 투여될 수 있는 단독 투여량을 의미하고, 이는 활성 화합물 그 자체 또는 후술하는 바와 같은 제약상 허용되는 조성물을 포함하는 물리적 및 화학적으로 안정한 단위 투여량으로 존재하면서 다루기 쉽고, 쉽게 포장할 수 있는 투여량이다. 이와 같이, 전형적인 1일 투여량 범위는 체중 1 kg 당 약 0.1 내지 100 mg이다. 일반적인 지침에 의해, 인간에 대한 단위 투여량은 하루에 약 0.1 mg 내지 약 1000 mg의 범위이다. 바람직하게는 단위 투여량 범위는 약 1 내지 약 500 mg을 하루에 1 내지 4회 투여하는 것이고, 훨씬 바람직하게는 약 10 mg 내지 약 300 mg을 하루에 2회 투여하는 것이다. 유효 투여량을 설명하는 다른 방법으로, 바람직한 경구 단위 투여량은 대상에서 약 0.05 내지 20 ㎍/ml, 더욱 바람직 하게는 약 1 내지 약 20 ㎍/ml의 혈청 농도를 달성하는데 필요한 양이다.
본원에 제공된 화합물은 1종 이상의 제약상 허용되는 부형제와의 혼합물로 제약 조성물로 제형화될 수 있다. 이러한 조성물들은 경구 투여에 사용하기 위해 특히 정제 또는 캡슐제의 형태로; 또는 비경구 투여에 사용하기 위해 특히 액상 용액제, 현탁액제 또는 에멀젼제의 형태로; 또는 비강내에서 사용하기 위해 특히 산제, 점비제 또는 에어로졸제의 형태로; 또는 피부에, 예를 들어 국소적으로 또는 경피적인 패치제를 통해 사용하기 위해 제조될 수 있다.
조성물은 편리하게 단위 투여량 형태로 투여될 수 있고, 제약 업계에 공지된 임의의 방법, 예를 들어 문헌 [Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro, A. R., Ed.; Lippincott Williams & Wilkins: Philadelphia, PA, 2000]에 기재된 방법에 의해 제조될 수 있다. 제약상 적합한 결합제 및(또는) 보조제 물질은 조성물의 일부로 포함될 수 있다. 경구 조성물은 일반적으로 불활성 희석제 담체 또는 식용 담체를 포함할 것이다.
정제, 환제, 산제, 캡슐제, 트로키제 등은 1종 이상의 임의의 하기 성분 또는 유사한 특성의 화합물을 함유할 수 있다: 결합제, 예를 들어 미세결정성 셀룰로오스, 또는 트라가칸트 고무; 희석제, 예를 들어 전분 또는 락토스; 붕해제, 예를 들어 전분 및 셀룰로오스 유사체; 윤활제, 예를 들어 마그네슘 스테아레이트; 활주제 (glidant), 예를 들어 콜로이드성 이산화규소; 감미제, 예를 들어 수크로스 또는 사카린; 또는 착향제, 예를 들어 페퍼민트 또는 메틸 살리실레이트. 캡슐은 전 분 캡슐 뿐만 아니라, 일반적으로 임의로는 가소제와 블렌딩된 젤라틴 블렌드로 제조되는 경질 캡슐 또는 연질 캡슐의 형태일 수 있다. 또한, 투여 단위 형태는 투여 단위의 물리적 형태를 변형시키는 다양한 다른 물질들, 예를 들어 당류의 코팅제, 셀락 또는 장용제를 함유할 수 있다. 다른 경구 투여 형태의 시럽 또는 엘릭시르는 감미제, 보존제, 염료, 착색제 및 향신제를 함유할 수 있다. 또한, 활성 화합물은 속효성 (fast dissolve), 조절-방출성 또는 서방성 제제 및 제형에 혼입될 수 있고, 상기 서방성 제형은 바람직하게 이정점을 가진다.
바람직한 제형은 본 발명의 화합물의 경구 또는 비경구 투여를 위해 제형화되거나, 또는 더욱 바람직하게는 본 발명의 화합물이 정제로 제형화된 제약 조성물을 포함한다. 바람직한 정제는 락토스, 옥수수전분, 마그네슘 실리케이트, 크로스카르멜로스 나트륨, 포비돈, 마스네슘 스테아레이트 또는 활석을 임의의 조합으로 포함한다. 또한, 본 발명의 한 측면은 본 발명의 화합물이 음식물 또는 액체에 혼입될 수 있다는 것을 개시하고 있다.
투여를 위한 액체 제제는 멸균된 수성 또는 비수성 용액, 현탁액 및 에멀젼을 포함한다. 액체 조성물은 또한 결합제, 완충액, 보존제, 킬레이트제, 감미제, 착향제 및 착색제 등을 포함할 수 있다. 비수성 용매는 알콜, 프로필렌 글리콜, 폴리에틸렌 글리콜, 식물성 오일, 예를 들어 올리브 오일 및 유기 에스테르, 예를 들어 에틸 올리에이트를 포함한다. 수성 담체는 알콜과 물의 혼합물, 완충된 매질 및 식염수를 포함할 수 있다. 특히, 생체적합성이며 생분해성인 락티드 중합체, 락티드/글리콜라이드 공중합체 또는 폴리옥시에틸렌-폴리옥시프로필렌 공중합체가 활성 화합물의 방출을 조절하는데 유용한 부형제일 수 있다. 정맥내 비히클은 유체 및 영양 보충액, 전해질 보충액, 예를 들어 링거 덱스트로스 등을 포함할 수 있다. 상기 활성 화합물을 위한 다른 잠재적으로 유용한 비경구 전달 시스템은 에틸렌-비닐 아세테이트 공중합체 입자, 삼투압 펌프, 이식가능한 주입 시스템 및 리포좀을 포함한다.
다른 투여 방법은 건조 산제, 에어로졸 또는 점적제와 같은 수단을 포함하는 흡입용 제형을 포함한다. 이들은 예를 들어 폴리옥시에틸렌-9-라우릴 에테르, 글리코콜레이트 및 데옥시콜레이트를 함유하는 수성 용액, 또는 점비제 형태로 투여하기 위한 오일성 용액, 또는 비강내로 투여하기 위한 젤일 수 있다. 협측 투여를 위한 제형은 예를 들어 로젠지 또는 향과 (pastille)를 포함하고, 수크로스 또는 아카시아와 같은 착향화된 염기, 및 글리콜레이트와 같은 다른 부형제도 또한 포함할 수 있다. 직장 투여에 적합한 제형은 바람직하게는 코코아 버터와 같은 고상 기재의 담체가 있는 단위-투여량 좌제로 제공되고, 살리실레이트를 포함할 수 있다. 피부에의 국소 도포를 위한 제형은 바람직하게는 연고, 크림, 로션, 페이스트, 젤, 스프레이, 에어로졸 또는 오일의 형태를 취한다. 사용될 수 있는 담체는 바셀린, 라놀린, 폴리에틸렌 글리콜, 알콜 또는 이들의 조합물을 포함한다. 경피성 투여에 적합한 제형은 분리성 패치로 제공될 수 있고, 친지성 에멀젼 또는 완충되고, 중합체에 용해되고(되거나) 분산된 수성 용액 또는 접착제일 수 있다.
본 발명의 화합물들은 제약 조성물 중에서 유일한 활성 성분으로 사용될 수 있다. 다르게는, 이들은 조합물로 사용되거나, 다른 질병 상태와 관련된 다른 제 약상 약품과 조합될 수 있다. 특히, 화학식 I, I-A, II 또는 II-A의 화합물들은, 이에 제한되지는 않지만 노화, 외상, 스트레스, 또는 화학적 불균형 또는 독성으로 인한 일시적인 장애, 수면과다증, 우울증, 알츠하이머병, 비-알츠하이머성 치매 (루이 소체 치매, 뇌혈관성 치매 및 빈스완거 치매 (Binswanger's dementia)를 포함), 정신분열증 등의 다양한 질병 상태와 관련된 손상된 인지력의 치료에 유용한 약품과 조합될 수 있다. 따라서, 본 발명은 본 발명의 화합물과 에부르난 유사체 (eburnane analog), 티로신 히드록실라제의 헤테로시클릭 유도물질, 3,4-디페닐 크로만, 타크린 대사물질, 아자-시클릭 화합물, 폴리아민 화합물 또는 티아민; 비-항콜린작용성 항우울제, 예를 들어 벤조디아제핀; 페노티아진 지방족, 예를 들어 클로로프로마진; 피페리딘, 예를 들어 티오리다진; 피페라진, 예를 들어 트리플루오페라진, 플루페나진 및 페르페나진; 디벤즈옥사제핀, 예를 들어 록사핀; 디히드로인돌론, 예를 들어 몰린돈; 티옥산텐, 예를 들어 티오틱센; 부티로페논, 예를 들어 할로페리돌; 디페닐부틸-피페리딘, 예를 들어 피모지드; 디벤조디아제핀, 예를 들어 클로자핀; 벤즈이속사졸, 예를 들어 리스페리돈; 티에노벤조디아제핀, 예를 들어 올란자핀; 디벤조티아제핀, 예를 들어 퀘티아핀; 이미다졸리디논, 예를 들어 세르틴돌, 벤즈이소티아졸릴-피페라진, 예를 들어 지프라지돈 등과의 조합물을 포함할 것이다.
합성
본 발명의 화합물은 당업자들에게 공지된 여러 방법으로 제조될 수 있다. 화합물은 예를 들어 하기 기재된 방법 또는 숙련된 기술자가 인식하는 그에 대한 변형에 의해 합성될 수 있다. 적절한 변형 및 치환은 당업자에게 매우 명백하며 잘 공지되어 있고, 기술 문헌으로부터 쉽게 얻을 수 있는 것이다.
본 발명의 화합물은 하나 이상의 비대칭 치환된 탄소 원자를 포함할 수 있으며, 광학 활성 형태 또는 라세미체 형태로 단리될 수 있다는 것은 이해될 것이다. 따라서, 구체적인 입체화학 또는 이성질체 형태가 표시되지 않을 경우에는 구조의 모든 키랄, 부분입체이성질체, 라세미체 형태 및 모든 기하학적 이성질체 형태를 의미한다. 상기 광학 활성 형태의 제조 및 단리 방법은 당업계에 잘 공지되어 있다. 예를 들어, 입체이성질체의 혼합물은 이에 제한되지는 않지만 라세미체 형태의 분리, 정상, 역상 및 키랄 크로마토그래피, 선택적인 염 형성, 재결정 등과 같은 표준 기술에 의해, 또는 키랄 출발 물질로부터의 키랄 합성에 의해, 또는 표적 키랄 중심의 계획적인 합성에 의해 분리될 수 있다.
쉽게 이해할 수 있는 바와 같이, 본 발명의 화합물에 존재하는 관능기는 합성하는 동안에 보호기를 포함할 수 있다. 예를 들어, 화학식 I, I-A, II 또는 II-A의 화합물의 아미노산 측쇄 치환기는 벤질옥시카르보닐 또는 t-부톡시카르보닐기와 같은 보호기로 치환될 수 있다. 보호기들은 그 자체로 히드록실기 및 카르복실기와 같은 관능기에 선택적으로 부가될 수 있거나 그로부터 제조될 수 있는 화학적 관능기로서 공지되어 있다. 이들 기들은 화학적 화합물에 존재하여 상기 관능기를 화합물이 노출된 화학적 반응 조건에서 불활성이 되게 만든다. 본 발명에서 임의의 다양한 보호기를 사용할 수 있다. 바람직한 보호기는 벤질옥시카르보닐 ("Cbz") 기, tert-부틸옥시카르보닐 ("Boc") 기 및 토실(p-톨루엔술포닐, "Tos") 기를 포함한다. 본 발명에 따른 다른 바람직한 보호기를 문헌 [Greene, T. W. and Wuts, P. G. M., Protective Groups in Organic Synthesis 2d. Ed., Wiley & Sons, 1991]에서 찾을 수 있다.
본 발명의 화합물은 하기 반응식에 계략한 바와 같이 제조할 수 있다. 시약 및 출발 물질은 상업적으로 입수가능하거나, 또는 당업계의 보통의 기술을 가진 기술자가 공지된 기술에 의해 쉽게 합성할 수 있다. 달리 표시되지 않은 경우, 모든 치환기는 상기 정의된 바와 같다.
화학식 I (식 중, Y = C(R1)(R2) 및 m, n = 0) 또는 화학식 I-A의 화합물을 제조하기 위한 일반적인 합성 공정이 반응식 A에 기재되어 있다.
반응식 A, 단계 1: 일반식 c의 화합물의 합성:
단계 1a에서, 적절한 아릴 할라이드 a를 유기금속 화합물과 금속 교환 반응시켜 상응하는 메탈로아릴 화합물을 얻는다. 예를 들어, 적절한 할로방향족 또는 할로헤테로방향족 (화합물 a)를 비양자성 용매 중 -78 ℃의 온도에서 적절한 알킬 리튬 화합물과 반응시킨다. 적절한 할로방향족 또는 할로헤테로방향족 화합물은 Ar1이 최종 생성물에서 정의된 것과 같은 화합물이다. 적절한 알킬 리튬 화합물은 금속-할로겐 교환을 일으키는 것이다.
단계 1b에서, 적절한 아릴 알데히드 b를 미리 형성된 메탈로아릴 화합물에 첨가하여 목적하는 디-아릴 알콜 c를 얻는다. 예를 들어, 비양자성 용매 중의 적절한 방향족 알데히드 또는 헤테로방향족 알데히드 (화합물 b)를 단계 1a의 반응 생성물에 첨가한다. 적절한 헤테로방향족 알데히드는 Ar2가 최종 생성물에서 정의된 것과 같은 화합물이다. 완료 시, 반응 혼합물을 적절한 급냉제에 의해 급냉시키고 생성물 (화합물 c)를 당업자가 일반적으로 사용하는 통상의 방법으로 단리한다.
예를 들어, 무수 에테르 중 적절한 할로방향족 또는 할로헤테로방향족 (화합물 a)의 냉각 용액 (-70 ℃ 내지 -78 ℃)을 n-부틸리튬 (1.1 당량)과 반응시킨다. 추가의 시간 동안 교반하여 할로겐-금속 교환 반응을 완결시킨 후, 다음 시약인 에테르 중 적절한 헤테로방향족 알데히드 (화합물 b)를 반응 플라스크에 천천히 첨가한다. 저온에서 2 시간 내지 3 시간 더 교반을 계속한다. 냉각조를 제거하고 반응 혼합물을 천천히 주변 온도가 되도록 한 후, 바람직하게는 NH4Cl 포화용액으로 급냉한다. 혼합물을 유기 용매 (에테르 또는 에틸 아세테이트)로 추출한다. 유기층을 염수로 세척하고 MgSO4 또는 Na2SO4로 건조시키고, 농축시켜 조 생성물을 얻는다. 공지된 정제 기술을 사용하여, 바람직하게는 컬럼 크로마토그래피 및(또는) 재결정으로 정제하여 순수한 화합물 c를 제공한다. 상기 방법은 본원에서 전문을 참고 문헌으로 인용하는 문헌 [Gronowitz, S.; Eriksson, B. Arkiv Kemi 1963, 335]에 이미 기술되어 있는 절차의 변형이다. 별법으로, Ar1이 Ar2와 동일한 화합 물은 본원에서 전문을 참고 문헌으로 인용하는 문헌 [Nenajdenko, V. G.; Baraznenok, I. L.; Balenkova, E. S. J. Org. Chem. 1998, 6132]에 기재된 바와 같이, 2 당량의 적절한 할로헤테로방향족을 2 당량의 n-부틸리튬으로 처리한 후, 1 당량의 에틸 포르메이트로 처리하여 제조할 수 있다.
반응식 A, 단계 2: 화학식 d의 화합물의 합성:
단계 2a에서, 화합물 c의 알콜 잔기는 상응하는 티올로 변환된다. 단계 2b에서 티올은 화학식 Br-(CH2)m-Y-(CH2)n-COOH의 적절한 할로겐-치환된 알킬카르복실산을 사용하여 치환 반응되어 화합물 d를 생성한다. 예를 들어, 디-아릴 알콜 c를 산의 존재하에서 티오우레아와 반응시켜 티오우로늄 잔기로 변환시킨 후 알칼리성 염기의 존재하에서 가수분해시켜 적절한 할로겐-치환된 알킬카르복실산과 반응시켜 화합물 d를 생성한다 (단계 2b). 적절한 산 유도체는 m, n, Y가 최종 생성물에서 정의된 바와 같은 화합물이다.
예를 들어, 단계 2a에서, 적절한 양의 티오우레아를 48 % HBr 및 물에 첨가한다. 혼합물을 가온시키고 (바람직하게는 60 내지 70 ℃) 화합물 c를 첨가한다. 반응 혼합물의 온도를 승온시키고 (바람직하게 90 내지 95 ℃) 교반을 추가의 시간 동안 계속하여 반응을 완결시킨다. 반응 혼합물을 실온으로 냉각시키고 (몇몇 경우 빙조가 필요할 수 있음), 침전된 고체를 여과하여 물로 완전히 세척하여야 한다.
단계 2b에서, 이전 단계로부터의 습윤 고체를 추가의 물에 첨가하여 수성 염 기, 바람직하게는 수산화나트륨 용액으로 처리한다. 혼합물을 가온시키고 (바람직하게는 70 내지 80 ℃이지만, 몇몇 경우 더 높은 온도가 필요할 수 있음), 여기에 물 (또는 몇몇 경우에는 알콜성 용매) 중에 적절한 양의 할로겐-치환된 알킬카르복실산 유도체를 첨가한다. 반응 혼합물을 승온 (바람직하게는 100 내지 110 ℃)에서 적절한 기간의 시간 동안 유지하고, 냉각하고 물에 용해하여 유기 용매 (바람직하게는 에테르)로 세척한다. 염기성 수성층을 무기산 용액 (예, 수성 HCl 용액)으로 산성화시킨다. 수성 (산성) 용액을 이어서 유기 용매 (예, 에테르 또는 에틸 아세테이트)로 수회 추출한다. 합한 유기층을 염수로 세척하고, MgSO4 또는 Na2SO
4로 건조시키고, 농축시켜 조 생성물을 얻고, 이는 다음 단계에 직접 사용할 수 있다. 그러나, 공지된 정제 기술을 사용하여, 예를 들어, 재결정으로 정제하여 순수한 화합물 d를 제공할 수 있다.
이 방법은 본원에서 전문을 참고 문헌으로 인용하는 미국 특허 제4,177,290호에 이미 기술되어 있는 절차의 변형이다.
반응식 A, 단계 3: 화학식 e의 화합물의 합성:
단계 3a에서, 카르복실산을 적절한 산 유도체로 변환시키고, 적절한 아민과 반응시켜 화합물 e를 제공한다. 예를 들어, 단계 3a에서, 화합물 d를 상응하는 산 클로라이드 또는 상응하는 활성화 에스테르로 변환시킬 수 있다. 방향족 탄화수소 용매 중 환류 조건하에서 화합물 d를 염화 티오닐과 반응시킴으로써 산 클로라이드를 얻을 수 있다. 별법으로, 당업계에 공지된 다양한 시약, 예를 들어 2-(1H-벤조 트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트 (TBTU), N-메틸모르폴린 (NMM) 및 디메틸 포름아미드 (DMF)을 사용함으로써 활성화 에스테르를 얻을 수 있다. 단계 3b에서, 단계 3a의 생성물을 NHR3R4 구조의 적절한 아민과 반응시켜 목적하는 화합물 e를 얻는다. 적절한 아민은 R3 및 R4가 최종 생성물에서 정의된 바와 같은 화합물이다.
예를 들어, 벤젠 또는 톨루엔 중에 적절한 카르복실산 (화합물 d)의 용액을 환류 온도가 되게 하고, 여기에 적절한 양의 염화 티오닐을 천천히 첨가한다. 분석 기술로 확인하여 출발 물질이 사라질 때까지, 혼합물을 환류하고 냉각시켜 용매를 제거한다. 얻어진 잔류물을 적절한 유기 용매 (바람직하게는 테트라히드로푸란 또는 염화메틸렌)에 첨가하고 암모니아 가스 (또는 28 % 수산화 암모니아 수용액) 또는 적절한 아민으로 처리한다. 이어서, 반응 혼합물을 물 및 유기 용매 (바람직하게는 에틸 아세테이트) 사이에 분배한다. 분리된 유기층을 물, 희석된 산, 희석된 염기 및 염수로 세척하고, MgSO4 또는 Na2SO4 등의 건조제 상에서 건조시키고 농축시켜 조 생성물을 얻고, 컬럼 크로마토그래피 및(또는) 재결정에 의해 정제하여 화합물 e를 제조할 수 있다.
반응식 A, 임의의 단계 4: 화학식 f의 화합물의 합성:
화학식 e의 화합물을 임의로 산화시켜 화학식 f의 화합물을 생성할 수 있다. 따라서, 화합물 e를 적절한 용매 중에서 적절한 산화제와 반응시킴으로써 화합물 f가 제조된다. 적절한 산화제는 화합물 e의 술피드 기를 산화시키는 것이다. 상응 하는 생성물을 단리하고 당업계에 공지된 방법에 의해 정제한다.
예를 들어, 유기 용매 (바람직하게는 염화 메틸렌 또는 클로로포름) 중에 화합물 e의 -15 ℃ 내지 -25 ℃로 냉각시킨 용액에, 동일한 용매 중에 적절한 산화제 (예, m-클로로퍼옥시벤조산 ["m-CPBA"], 1 당량)를 천천히 첨가한다. 다양한 분석 기술로 확인하여 출발 물질이 사라질 때까지, 저온에서 교반을 계속한다. 이어서, 반응 혼합물을 각각 중탄산나트륨 포화 용액, 물 및 염수로 완전히 세척하고, MgSO4 또는 Na2SO4 등의 건조제 상에서 건조시키고 농축시킨다. 목적 생성물 (화합물 f)를 필요하다면 공지된 정제 기술을 사용하여, 바람직하게는 컬럼 크로마토그래피 및(또는) 재결정으로 정제한다. 몇몇 경우, 빙초산 용매 중에 50 % H2O2를 사용함으로써 산화반응을 수행한다.
화학식 II (식 중, A는 페닐렌이고; Y=C(R1)(R2) 및 m, n, r, s=0) 및 화학식 II-A의 화합물을 제조하기 위한 일반적인 합성 공정을 반응식 B에 기재한다.
반응식 B, 단계 1, 2 및 3: 화학식 dd, ee 및 ff의 화합물의 합성.
반응식 B의 합성 단계는 반응식 A에 기재된 바와 동일한 다단계의 일반적인 방법을 포함하고, 여기서 반응식 B의 단계 1 내지 3은 각각 반응식 A의 단계 2 내지 4에 상응한다.
반응식 C, 단계 1 및 2: 화학식 ddd 및 eee의 화합물의 합성.
반응식 C, 단계 1 및 2에서 합성 단계들은 각각 반응식 A, 단계 2 내지 3에 기재된 바와 동일한 다단계의 일반적인 방법을 포함하고, 화학식 eee의 화합물을 제공한다.
반응식 C, 단계 3: 화학식 fff의 화합물의 합성.
적절한 황-전환 시약을 사용하여 화합물 eee의 아미드 잔기를 상응하는 티오아미드 잔기 fff로 변환시킨다. 예를 들어, 적합한 용매 (디메톡시에탄 또는 테트라히드로푸란) 중 화합물 eee 및 로웨슨 시약 (1.05 당량)을 출발 물질이 사라질때까지 환류시키며 가열한다. 냉각 후, 목적 생성물 (화합물 fff)을 공지된 정제 기술을 사용하여, 바람직하게는 컬럼 크로마토그래피 및(또는) 재결정으로 얻는다.
반응식 C, 단계 4: 반응식 ggg의 화합물의 합성.
화합물 fff의 티오아미드 잔기를 상응하는 티아졸 잔기로 고리화시킨다. 예를 들어, 적합한 용매 (예, 에탄올) 중에 화합물 fff 및 적절한 브로모메틸 케톤 (1.1 당량)의 혼합물을 출발 물질이 사라질 때까지 환류시키며 가열한다. 냉각 후, 공지된 정제 기술을 사용하여, 바람직하게는 컬럼 크로마토그래피 및(또는) 재결정으로 목적 생성물 (화합물 ggg)을 얻는다.
반응식 C, 단계 5 내지 6: 화학식 hhh 및 iii의 화합물의 합성.
반응식 C의 단계 5 및 6에서 합성 단계들은 각각 반응식 A의 단계 3 및 4에 기재된 바와 동일한 다단계의 일반적인 방법을 포함하고, 화학식 hhh 및 iii의 화합물을 제공한다.
반응식 D, 단계 1 내지 6: 화학식 hhhh 및 iiii의 화합물의 합성.
반응식 D에서 합성 단계들은 반응식 C에 기재된 바와 동일한 다단계의 일반적인 방법을 포함하고, 화학식 hhhh 및 iiii의 화합물을 제공한다.
화학식 I 또는 I-A (식 중, R1 또는 R2는 R3 또는 R4와 함께 3원 내지 7원 헤테로시클릭 고리를 형성할 수 있음)의 화합물을 제조하기 위한 합성 공정을 반응식 E에 기재한다. 이후, 형성된 고리를 반응식 E에서 "G"로 나타낸다. 본 반응식에서, R1은 R3과 함께 헤테로시클릭 고리 "G"를 형성한다. R1은 또한 R4와 함께 고리 "G"를 형성할 수 있거나, 또는 R2는 또한 R3과 함께 고리 "G"를 형성할 수 있거나, 또는 R2는 R4와 함께 고리 "G"를 형성할 수 있다는 것을 이해한다. 시약 및 출발 물질들은 상업적으로 입수가능하거나, 당업계의 숙련자들에게 공지된 기술에 의해 쉽게 합성된다. 반응식 E에서, 달리 표시되지 않는다면 모든 치환기들은 상기 정의된 바와 같다.
반응식 E, 단계 1 및 2: R1 또는 R2가 R3 또는 R4와 함께 3원 내지 7원 헤테로시클릭 고리 "G"를 형성하는 화학식 I의 화합물을 함유하는 화학식 60의 화합물의 합성.
제1 단계에서, 메탄올 탄소에서 친핵성 치환에 영향을 주기 위해 약한 산의 존재하에서 적절한 머르캅토락탐 59를 적절한 디아릴메탄올 (화합물 27)과 반응시 켜 상응하는 티오에테르를 형성한다. 적절한 머르캅토락탐 59 및 적절한 디아릴- 또는 디헤테로아릴메탄올 27은 Ar1, Ar2, R2 및 R4가 최종 생성물에 정의된 바과 같은 화합물이다.
제2 단계에서는, 제1 단계에서 형성된 티오에테르를 적절한 산화제를 사용하여 임의로 산화시켜 화합물 60을 제공한다. 적절한 산화제는 티오에테르를 그의 상응하는 술폭시드 또는 술폰으로 산화시키는 것이다.
R1 또는 R2가 R3 또는 R4와 함께 3원 내지 7원 헤테로시클릭 고리를 형성할 수 있는 화학식 II-A의 화합물을 제조하기 위한 합성 공정을 반응식 F에 기재한다. 유사한 공정을 사용하여 상응하는 화학식 II-A의 화합물을 제조할 수 있다. 이 후, 형성된 고리는 반응식 E에서 "G"를 나타낸다. 본 반응식에서, R1은 R3과 함께 고리 "G"를 형성한다. R1은 또한 R4와 함께 고리 "G"를 형성할 수 있거나, 또는 R2는 또한 R3과 함께 고리 "G"를 형성할 수 있거나, 또는 R2는 또한 R4와 함께 고리 "G"를 형성할 수 있다는 것을 이해한다. 시약 및 출발 물질들은 상업적으로 입수가능하거나, 당업계의 숙련자들에게 공지된 기술에 의해 쉽게 합성된다. 반응식 F에서, 달리 표시되지 않는다면 모든 치환기들은 상기 정의된 바와 같다.
반응식 F, 단계 1 및 2: R1 또는 R2가 R3 또는 R4와 함께 3원 내지 7원 헤테로시클릭 고리 "G"를 형성하는 화합물을 함유하는 화학식 62의 화합물의 합성.
제1 단계에서, 메탄올 탄소에서 친핵성 치환에 영향을 주기 위해 약한 산의 존재하에서 적절한 머르캅토락탐 59를 적절한 디아릴- 또는 디헤테로아릴메탄올 27a와 반응시켜 상응하는 티오에테르를 형성한다. 적절한 머르캅토락탐 61 및 적절한 디아릴- 또는 디헤테로아릴메탄올 27a는 A, X, R2 및 R4가 최종 생성물에 정의된 바와 같은 화합물이다.
제2 단계에서, 제1 단계에서 형성된 티오에테르를 적절한 산화제로 산화시켜 화합물 62를 제공한다. 적절한 산화제는 티오에테르를 그의 상응하는 술폭시드 또는 술폰으로 산화시키는 것이다.
본 발명의 다른 특성들은 하기 예시하는 실시 양태에 따라 명백해질 것이다. 이 실시예들은 본 발명을 예시하는 것일뿐 본 발명을 제한하는 것으로 의도하지 않는다. 하기 실시예 1 내지 6은 반응식 1에 따라 합성하였다.
화합물 C의 제조
70 내지 75 ℃에서 티오우레아 (화합물 B, 5 g, 0.066 몰), 48 % HBr (30 mL) 및 물 (5 mL)의 격렬히 교반한 혼합물에 9-히드록시플루오렌 (화합물 A, 9.28 g, 0.051 몰)을 소량으로 첨가한 후, 추가 량의 물 (30 mL)을 첨가하였다. 그 다음 반응 혼합물을 100 내지 105 ℃ (욕조 온도)로 가열하고, 그대로 다시 30분 동안 유지시키고 실온으로 냉각시켰다. 침전된 고체를 여과하고 물 및 에테르로 연속하여 세척하고 진공하에 건조시켜 14 g의 상응하는 티오우로늄 염을 얻고 이를 추가의 정제 없이 다음 단계에서 사용하였다.
60 내지 65 ℃에서 10 N NaOH (10.26 mL) 및 물 (25 mL) 중에 전술한 티오우로늄 염 (10.47 g)의 격렬히 교반한 혼합물에 물 (20 mL) 중의 3-브로모프로피온산 (5.24 g, 0.034 몰)을 천천히 첨가하였다. 그 다음 반응 혼합물을 105 내지 110 ℃ (욕조 온도)로 가열하고, 그대로 다시 30분 동안 유지시키고 실온으로 냉각시키고 물 (25 mL)로 희석하고 에테르 (3×50 mL)로 세척하였다. 염기성 수성층을 진한 HCl로 산성화 (pH 2 내지 3)하고 에틸 아세테이트 (3×100 mL)로 추출하였다. 합한 유기층을 건조 (MgSO4)시키고 농축시켜 7.80 g의 화합물 C를 얻고 이를 추가의 정제 없이 다음 단계에서 사용하였다.
화합물 D의 제조
이 화합물은, 알킬화 단계에서 3-브로모프로피온산 대신에 4-브로모부티르산을 사용하는 것을 제외하고는 화합물 D 합성에 대하여 전술한 바와 동일한 방법에 따라 화합물 A로부터 제조하였다.
화합물 E의 제조
벤젠 (40 mL) 중에 화합물 C (7.8 g, 0.029 몰)의 환류 용액에 티오닐 클로라이드 (5.3 mL)를 천천히 첨가하였다. 혼합물을 다시 2시간 동안 환류시키고 냉각시키고 여과하고 감압 하에 농축시켜 8 g의 화합물 E를 얻고 이를 추가의 정제 없이 즉시 다음 단계에 투입하였다.
화합물 F의 제조
이 화합물은, 화합물 C에서 화합물 E를 합성하는 것에 대하여 전술한 바와 동일한 방법에 따라 화합물 D로부터 제조하였다.
실시예 1: 화합물 G의 합성
이전 단계의 화합물 E (8 g)를 염화 메틸렌 (20 mL)에 용해시키고, 격렬히 교반하고 냉각 (0 ℃)시킨 28 % NH4OH 용액 (50 mL)에 첨가하였다. 빙조를 제거하고 다시 한시간 동안 교반을 계속하였다. 반응 혼합물을 물 (30 mL)로 희석시키고 염화 메틸렌 (2×30 mL)으로 추출하였다. 합한 유기층을 물 (2×20 mL), 3 % NaHCO3 용액 (2×30 mL), 염수 (1×30 mL)로 세척하고, 건조 (Na2SO4)시키고 농축시켜 잔류물을 얻고 이를 에테르로 분쇄하여 6.30 g의 화합물 G를 얻었다;
실시예 2: 화합물 H의 합성
이 화합물은, 아민화 단계에서 28 % NH4OH 대신에 디메틸아민을 사용하는 것을 제외하고는 화합물 G의 합성에 대하여 전술한 바와 동일한 방법에 따라 화합물 F로부터 제조하였다;
실시예 3: 화합물 I의 합성
이 화합물은, 화합물 E에서 화합물 G를 합성하는 것에 대하여 전술한 바와 동일한 방법에 따라 화합물 F로부터 제조하였다;
실시예 4: 화합물 II-1의 합성
실온에서 빙초산 (20 mL) 중에 화합물 G (5.15 g, 0.019 몰)의 용액에 50 % H2O2 (1.2 당량)을 천천히 첨가하였다. 혼합물을 1시간 동안 교반하고 빙수에 붓고 여과하였다. 침전된 고체를 물로 완전히 세척한 후에 에테르로 세척하고 고진공하에 건조시켜 4.42 g의 화합물 II-1을 얻었다; 백색 고체; 융점 163 내지 164 ℃; Rt 7.57분.
실시예 5: 화합물 II-2의 합성
이 화합물은, 화합물 G에서 화합물 II-1를 합성하는 것에 대하여 전술한 바와 동일한 방법에 따라 화합물 H로부터 제조하였다; 백색 고체; 융점 110 내지 112 ℃; Rt 8.64분.
실시예 6: 화합물 II-3의 합성
이 화합물은, 화합물 G에서 화합물 II-1을 합성하는 것에 대하여 전술한 바 와 동일한 방법에 따라 화합물 I로부터 제조되었다; 백색 고체; 융점 161 내지 162 ℃; Rt 7.61분.
하기 실시예 7 내지 8은 반응식 2에 따라 합성하였다.
실시예 7; 화합물 J의 합성
0 ℃에서 무수 DMF (20 mL) 중에 화합물 C (1.9 g, 0.007 몰)의 교반한 용액에 N-메틸모르폴린 (NMM)(1.92 mL)을 첨가한 후에 2-(1H-벤조트라이졸-1-일)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트 (TBTU)(3.38 g. 0.0105 몰)를 첨가하였다. 혼합물을 10분간 교반하고 이 혼합물에 무수 DMF (5 mL) 중의 (L)-알라닌아미드를 히드로클로라이드 염으로서 (1.3 g, 0.0105 몰) 첨가하였다. 냉각조를 제거하고 혼합물을 다시 2시간 동안 교반하였다. 그 다음 냉수 (25 mL)에 붓고 에틸 아세테이트 (3×50 mL)로 추출하였다. 합한 유기층을 물, 2 % 시트르산, 3 % 중탄산 나트륨, 물 그리고 염수로 연속하여 세척하였다. 건조 (MgSO4)시키고 용매를 증발시켜 잔류물을 얻고 이를 차가운 에테르로 분쇄하여 1.93 g의 화합물 J을 얻었다;
실시예 8: 화합물 II-4의 합성
이 화합물은, 화합물 G에서 화합물 II-1을 합성하는 것에 대하여 전술한 바 (반응식 1)와 동일한 방법에 따라 화합물 J로부터 제조하였다; 백색 고체 (부분입체이성질체 혼합물); Rt 7.16 분.
하기 실시예 9 내지 18은 반응식 3에 따라 합성하였다.
화합물 33의 제조
반응식 3, 단계 1: 단계 1a에서는, -70 ℃ 내지 -78 ℃에서 무수 에테르 중의 3-브로모티오펜 (10.22 g)(화합물 31)을 n-부틸리튬 (25 ml, 2.5 M, 1.1 당량)과 반응시켰다. 추가의 시간 동안 교반하여 할로겐-금속 교환 반응을 완결시킨 후에, 에테르 중에 3-티오펜카르복스알데히드 (6.39 g)(화합물 32)를 반응 플라스크 에 천천히 첨가하였다. 저온에서 추가의 2 내지 3시간 동안 교반을 계속하였다. 냉각조를 제거하고 반응 혼합물의 온도를 주변 온도로 천천히 올리고 급냉, 바람직하게는 50% NH4Cl 수용액으로 급냉하였다. 혼합물을 유기 용매 (에테르 또는 에틸 아세테이트)로 추출하였다. 유기층을 염수로 세척하고 건조 (MgSO4 또는 Na2SO4
)시키고 농축시켜 조 생성물을 얻었다. 공지된 정제 기술을 사용하여, 바람직하게는 컬럼 크로마토그래피 및(또는) 재결정으로 정제하여 순수한 화합물 33을 얻었다.
방법은 본원에서 전문을 참고 문헌으로 인용하는 문헌 [Gronowitz, S.; Eriksson, B. Arkiv Kemi 1963, 335]에 기술된 절차로부터 변형시킨 것이었다.
화합물 34 제조
반응식 3, 단계 2; 첫번째 단계에서는, 티오우레아 (5 g, 1.3 당량)을 48 % HBr 및 물에 넣었다. 혼합물을 가온 (바람직하게는 60 ℃ 내지 70 ℃)한 후에 화합물 33 (10 g)을 첨가하였다. 반응 혼합물의 온도를 올리고 (바람직하게는 90 ℃ 내지 95 ℃), 추가의 시간 동안 교반을 계속하여 반응을 완결시켰다. 그 다음 반응 혼합물을 실온으로 냉각시키고 (몇몇의 경우, 빙조가 필요할 수 있음) 침전된 고체를 여과하고 물로 완전히 세척하였다.
그 다음 습윤 고체를 추가의 물에 넣고 염기 수용액, 바람직하게는 수산화 나트륨 용액으로 처리하였다. 혼합물을 가온 (바람직하게는 70 ℃ 내지 80 ℃, 그러나 몇몇의 경우, 더 높은 온도가 필요할 수 있음)하고 이 혼합물에 물 중의 염화 아세트산(4.8 g, 1.1 당량)을 첨가하였다. 반응 혼합물을 적당한 시간 동안 상승 온도 (바람직하게는 100 ℃ 내지 110 ℃)에서 유지시키고 냉각시키고 물에 붓고 유기 용매 (바람직하게는 에테르)로 세척하였다. 염기 수성 층을 무기산 용액(예를 들면 HCl 수용액)으로 산성화하였다. 그 다음 (산성) 수용액을 유기 용매 (예를 들면 에테르 또는 에틸 아세테이트)로 수회 추출하였다. 합한 유기층을 염수로 세척하고 건조 (MgSO4 또는 Na2SO4)시키고 농축시켜 다음 단계에 직접 사용할 수 있는 조 생성물 34를 얻었다. 그러나 공지된 정제 기술을 사용하여, 예를 들면 재결정으로 정제하여 순수한 화합물 34를 얻을 수도 있다.
방법은 본원에서 전문을 참고 문헌으로 인용하는 미국 특허 제4,177,290호 (1979년 12월 4일 허여됨)에 기술된 절차로부터 변형시킨 것이었다.
화합물 35의 제조
반응식 3, 단계 3: 벤젠 중에 티오산 34 (9.0 g)의 용액을 환류 온도가 되게 하고, 이 용액에 1.1 당량의 티오닐 클로라이드를 첨가하였다. 분석 기술로 확인하여 출발 물질이 보이지 않을 때까지, 혼합물을 환류시키고 냉각하고 용매를 제거하여 다음 단계에서 직접 사용할 수 있는 조 생성물 35를 얻었다. 그러나, 공지된 정제 기술을 사용하여, 예를 들면 재결정으로 정제하여 순수한 화합물 35 얻을 수도 있다.
실시예 9: 화합물 36의 합성
반응식 3, 단계 4; 이전 단계로부터 생성된 티오산 클로라이드 35 (9.5 g)를 적절한 유기 용매 (바람직하게는 테트라히드로푸란 또는 염화 메틸렌)에 넣고 암모니아 기체 (또는 28 % 수용액)로 처리하였다. 그 다음 반응 혼합물을 물과 에틸아세테이트 사이에 분배하였다. 분리된 유기층을 물로 세척하고 산 및 염수로 희석하고 건조제 (예를 들면. MgSO4 또는 Na2SO4)상에서 건조시키고 농축시켜 6.40 g의 화합물 36을 얻었다. 분석 데이타: 백색 고체; 융점 88.5 내지 89.5 ℃; Rt 9.61 분.
실시예 10: 화합물 37의 합성.
실시예 9와 유사한 방법으로, 2.15 g의 새로 제조된 화합물 35를 2.2 g의 n-프로필아민으로 처리하여 조 생성물을 제조하고 이를 플래시 컬럼 크로마토그래피 (용출액: 헥산 중의 30 % 에틸 아세테이트)에 의해 정제하여 1.71 g의 화합물 37을 제조하였다. 분석 데이타: 점성 오일, Rt 12.30분.
실시예 11: 화합물 38의 합성
실시예 9와 유사한 방법으로, 2.56 g의 새로 제조된 화합물 35를 디메틸아민 기체로 처리하여 조 생성물을 제조하고 이를 플래시 컬럼 크로마토그래피 (용출액: 헥산 중의 30 % 에틸 아세테이트)로 정제하여 1.96 g의 화합물 38을 제조하였다. 분석 데이타: 백색 고체, Rt 11.08분.
실시예 12: 화합물 39의 합성
실시예 9와 유사한 방법으로, 2.15 g의 새로 제조된 화합물 35를 2.74 g의 디에틸아민으로 처리하여 조 생성물을 제조하고 이를 플래시 컬럼 크로마토그래피 (용출액: 헥산 중의 25 % 에틸 아세테이트)로 정제하여 1.56 g의 화합물 39를 제조하였다. 분석 데이타: 백색 고체, 융점 83 내지 84 ℃; Rt 13.37분.
실시예 13: 화합물 40의 합성
실시예 9와 유사한 방법으로, 2.15 g의 새로 제조된 화합물 35를 4 g의 모르폴린으로 처리하여 조 생성물을 제조하고 이를 플래시 컬럼 크로마토그래피 (용출액: 헥산 중의 50 % 에틸 아세테이트)로 정제하여 2.02 g의 화합물 40을 제조하였다. 분석 데이타: 백색 고체, 융점 75.5 내지 78 ℃; Rt 11.21분.
실시예 14: 화합물 I-9의 합성
염화 메틸렌 또는 클로로포름 중에 화합물 36 (5.50 g)의 -15 ℃ 내지 -25 ℃로 냉각된 용액에 같은 용매 중의 산화제 m-클로로퍼옥시벤조산 (m-CPBA) 1 당량을 천천히 첨가하였다. 다양한 분석 기술에 의해 입증하여 출발 물질이 보이지 않을 때까지 저온에서 교반을 계속하였다. 그 다음 반응 혼합물을 중탄산 나트륨 포화 용액, 물 및 염수로 각각 철저하게 세척하고 건조제 (예를 들면 MgSO4 또는 Na2SO4) 상에서 건조시키고 농축시켰다. 그 다음 생성된 물질을 컬럼 크로마토그래피 및(또는) 재결정으로 정제하여 화합물 I-9 (5.50 g)를 얻었다. 분석 데이타: 백색 고체, 융점 131 내지 132 ℃.
실시예 15: 화합물 I-10의 제조
실시예 14와 유사한 방법으로, 화합물 37 (1.67 g)을 1 당량의 산화제 m-클로로퍼옥시벤조산 (m-CPBA)으로 산화시킨 다음 정제하여 화합물 I-10 (1.40 g)을 얻었다. 분석 데이타: 반고체; Rt 8.95분.
실시예 16: 화합물 I-11의 합성
실시예 14와 유사한 방법으로, 화합물 38 (1.91 g)을 1 당량의 산화제 m-클로로퍼옥시벤조산 (m-CPBA)으로 산화시킨 다음 정제하여 화합물 I-11 (1.63 g)을 얻었다. 분석 데이타: 백색 고체; 융점 93 내지 96 ℃. Rt 7.79분.
실시예 17: 화합물 I-12의 합성
실시예 14와 유사한 방법으로, 화합물 39 (1.53 g)를 1 당량의 산화제 m-클로로퍼옥시벤조산 (m-CPBA)으로 산화시킨 다음 정제하여 화합물 I-12 (1.35 g)를 얻었다. 분석 데이타: 백색 고체; 융점 93 내지 95 ℃. Rt 9.70분.
실시예 18: 화합물 I-13의 합성
실시예 14와 유사한 방법으로, 화합물 40 (2.00 g)을 1 당량의 산화제 m-클로로퍼옥시벤조산 (m-CPBA)으로 산화시킨 다음 정제하여 화합물 I-13 (1.60 g)을 얻었다. 분석 데이타: 백색 고체; 융점 59 내지 73 ℃. Rt 8.03분.
실시예 19: 화합물 I-22의 합성
화합물 I-22는, 반응식 A에 기술한 바와 동일한 다단계의 일반 방법에 따라 단계 1에서 3-브로모티오펜 및 벤즈알데히드를 사용하여 제조하였다. (M+H)=280.
실시예 20 내지 실시예 39: 화합물 I-1 내지 I-7 및 I-26 내지 I-38의 합성
화합물 I-1 내지 I-7 및 I-26 내지 I-38은, 반응식 A에 개시된 바와 동일한 다단계의 일반 방법에 따라 단계 3b에서 적절히 치환된 아민 NHR3R4를 사용하여 제조하였다. 분석 데이타는 각각의 화합물의 질량 스펙트럼 (M+H)을 하기 표 3과 같이 나타내었다.
하기 실시예 40 내지 41은 반응식 4에 따라 합성하였다.
화합물 43의 제조:
화합물 41 (0.75 g)(문헌[Dondoni, A. et. al. J. Org. Chem. 1988, pp. 1748-1761]), 아세트산 무수물 (3 당량) 및 무수 피리딘 (알콜 2 내지 3 mL/mmol)의 혼합물을 실온에서 밤새 또는 박층 크로마토그래피에 의해 반응이 완결될 때까지 교반하였다. 그 다음 반응 혼합물을 냉수에 붓고 에틸 아세테이트 (3×25 mL)로 추출하였다. 합한 유기층을 중탄산 나트륨 포화 용액, 물, 염수로 연속하여 세척하고 황산 나트륨으로 건조시키고 농축시켜 목적한 생성물인 화합물 43 (0.84 g)을 얻었다. 분석 데이타: Rf=0.6 (2.5 % 메탄올/에틸 아세테이트); 1H-NMR (CDCl3) δ7.72 (s, 1H), 7.47 (m, 1H), 7.38-7.22 (m, 5H), 7.11 (s, 1H), 2.17 (s, 3H).
화합물 44의 제조
화합물 42 (0.92 g)를 화합물 41의 제조에서 전술한 바와 유사한 방식으로 반응시켰다. 생성된 조 에스테르를 플래시 크로마토그래피 (용출액: 4:1 헥산/에틸 아세테이트)에 의해 정제하여 0.41 g의 화합물 44를 얻었다. 분석 데이타: Rf=0.32 (4:1 헥산/에틸 아세테이트);
화합물 45의 제조
0 ℃에서 무수 디클로로메탄 (4 내지 5 mL/mmol) 중에 화합물 43 (0.84 g) 및 메틸 티오글리콜레이트 (1.2 당량)의 교반한 용액에 트리메틸실릴 트리플루오로메탄 (TMS-트리플레이트, 1 당량)을 아르곤 하에 첨가하였다. 반응 혼합물을 실온으로 가온하고 완결 (2 내지 6 시간)될 때까지 교반하였다. 그 다음 디클로로메탄으로 희석시키고 중탄산 나트륨 포화 용액으로 세척하고 건조 (황산 나트륨)시키고 농축시키고 고진공하에 건조시켜 화합물 45 (1.01 g)를 얻고 이를 추가의 정제없이 다음 단계에 직접 사용하였다. 분석 데이타: Rf=0.62 (2.5 % 메탄올/에틸 아세테이트);
화합물 46의 제조
화합물 44 (0.41 g)를 화합물 45의 제조에서 전술한 바와 유사한 방식으로 반응시켜 화합물 46 (0.30 g)을 얻었다. 분석 데이타: Rf=0.62 (2.5 % 메탄올/에틸 아세테이트);
화합물 47의 제조
0 ℃에서 5 내지 10분 동안 무수 암모니아를 메탄올 (10 mL/mmol) 중에 화합물 45 (1.0 g)의 교반한 용액에 버블링시켰다. 반응 혼합물을 실온으로 가온하고 추가의 5 내지 7시간 동안 교반하고 감압 하에 농축시키고 진공하에 건조시켰다. 조 생성물을 플래시 크로마토그래피 (용출액: 5 % 메탄올/에틸 아세테이트)로 정제하여 0.48 g의 화합물 47을 얻었다. 분석 데이타: Rf=0.20 (5 % 메탄올/에틸 아세테이트);
화합물 48의 제조
화합물 46 (0.30 g)을 화합물 47의 제조에서 전술한 바와 유사한 방식으로 반응시켜 화합물 48 (0.25 g)을 얻었다. 분석 데이타: Rf=0.20 (5 % 메탄올/에틸 아세테이트);
실시예 40: 화합물 I-39의 합성
-78 ℃에서 무수 디클로로메탄 (10 mL/mmol) 중에 화합물 47 (0.48)의 교반한 용액에 디클로로메탄 (5 내지 8 mL/mmol) 중에 m-CPBA (1.0 당량)의 용액을 첨가하였다. 1시간 동안 추가로 교반한 후에 반응 혼합물을 -30 내지 -40 ℃로 가온하고 10 % Na2S2O3 수용액으로 급냉하였다. 분리된 유기층을 중탄산 나트륨 포화 수용액, 물, 그리고 염수로 연속하여 세척하고 건조 (황산 나트륨)시키고 농축시켜 화합물 I-39 (0.31 g)을 얻었다. 분석 데이타: Rf=0.13 (5 % 메탄올/에틸 아세테이트);
실시예 41: 화합물 I-40의 합성
화합물 48 (0.25 g)을 화합물 47의 제조에서 전술한 바와 유사한 방식으로 반응시켜 화합물 I-40 (0.105 g) (부분입체이성질체 혼합물)을 얻었다.
실시예 42: 화합물 II-9의 합성
9-히드록시플루오렌으로 출발하여, 상기 반응식 3에서 전술한 바와 동일한 다단계 일반 방법에 따라서 아민화 단계에서 L-알라닌-NH2을 사용하여 이 화합물을 제조하였다. 분석 데이타: 백색 고체 (부분입체이성질체 혼합물); Rt 7.27분 및 7.41분.
실시예 43: 화합물 II-23의 합성
9-히드록시플루오렌으로 출발하여, 상기 반응식 3에서 전술한 바와 동일한 다단계의 일반 방법에 따라서 아민화 단계에서 28 % 암모니아 수용액을 사용하여 이 화합물을 제조하였다. 분석 데이타: 백색 고체; 융점 178.5 내지 180 ℃; Rt 7.48분.
실시예 44: 화합물 II-25의 합성
디벤조수베롤로 출발하여, 상기 반응식 3에서 전술한 바와 동일한 다단계의 일반 방법에 따라서 아민화 단계에서 28 % 암모니아 수용액을 사용하여 이 화합물을 제조하였다. 분석 데이타: 백색 고체; 융점 182 내지 190 ℃; Rt 8.43분.
실시예 45: 화합물 II-26의 합성
디벤조수베롤로 출발하여, 상기 반응식 3에서 전술한 바와 동일한 다단계의 일반 방법에 따라서 아민화 단계에서 디메틸아민을 사용하여 이 화합물을 제조하였 다. 분석 데이타: 백색 고체; 융점 112.5 내지 115 ℃; Rt 10.36분.
실시예 46 내지 91: 화합물 II-6 내지 II-8, II-10 내지 II-15, II-24
, II-27, II-30 내지 II-54, II-56 내지 II-91의 합성
화합물 II-6 내지 II-8, II-10 내지 II-15, II-24, II-27, II-30 내지 II-54, II-56 내지 II-91은 반응식 B에서 전술한 바와 동일한 다단계의 일반 방법에 따라 적절한 반응물을 사용하여 목적한 생성물을 형성함으로써 제조하였다. 분석 데이타는 하기 표 4에 나타낸 바와 같이 각각의 화합물의 질량 스펙트럼 (M+H)으로 나타냈다.
하기 실시예 92는 반응식 5에 따라 합성하였다.
화합물 M의 제조
디메틸 프탈레이트 (화합물 K, 10 g, 0.51 mol), 3,4-디메톡시아세토페논 (화합물 L, 9.74 g, 0.054 mol) 및 나트륨 메톡시드 분말 (2.76 g, 0.051 mol)의 혼합물을 밤새 환류 하에 가열하고 실온으로 냉각시키고 진공하에 농축시켰다. 황색 슬러리를 물 (100 mL)에 현탁시키고 10분간 교반하고 6N HCl (pH 약 1 내지 2)로 산성화하고 여과하였다. 잔류물을 에탄올 (200 mL)에 넣고 30분간 환류 하에 가열하고, 실온으로 냉각시키고 여과하였다. 잔류물을 차가운 에탄올로 세척하고 진공하에 건조시켜 화합물 M을 밝은 황색 플러피 고체 (4.1 g)를 제조하고 이를 추가의 정제 없이 사용하였다.
화합물 N의 제조
화합물 M (3.37 g, 0.011 mol), 히드라진 (0.41 mL, 0.013 mol) 및 에탄올 (250 mL)의 혼합물을 질소 하에 6시간 동안 환류 하에 가열하고 실온으로 냉각시키고 여과하였다. 잔류물을 에탄올로 세척하고 건조시켜 화합물 N을 황색 고체 (2.0 g)로 얻었다.
화합물 O의 제조
실온에서 THF/H2O (3:1, 8 mL) 중에 화합물 N (0.084 g, 0.27 mmol)의 교반한 용액에 고상 나트륨 보로히드라이드 (0.029 g, 0.63 mmol)를 질소하에 한번에 첨가하였다. 반응 혼합물을 0 ℃로 냉각시키고 1 시간 동안 교반하고 실온으로 가온하고 에틸 아세테이트로 희석시키고 물로 세척하였다. 유기층을 건조 (황산 마그네슘)시키고 진공하에 농축시켰다. 잔류물을 에테르로 분쇄하여 화합물 O (0.077 g)를 황색 고체로 얻고 이를 추가의 정제 없이 사용하였다.
화합물 P의 제조
0 ℃에서 CH2Cl2 (40 mL) 중에 화합물 O (1.55 g, 0.005 mol)의 교반한 혼합물에 메틸 티오글리콜레이트 (0.54 mL, 0.006 mmol)를 질소 하에 첨가하였다. 그 다음 트리플루오로아세트산 무수물 (1.42 mL, 0.01 mol)을 반응 혼합물에 적가하였다. 반응 혼합물을 0 ℃에서 0.5 시간 동안 교반하고 실온으로 가온하고 밤새 교반하고 중탄산 나트륨 포화 수용액으로 급냉하고 에틸 아세테이트 (3×25 mL)로 추출하였다. 유기층을 물, 염수로 세척하고 건조 (황산 마그네슘)시키고 진공하에 농축시켜 화합물 P를 노란색 고체 (1.75 g)로 제조하고 이를 추가의 정제 없이 사용하였다.
실시예 92: 화합물 II-66의 합성
화합물 P로부터 출발하여, 화합물 47의 제조에 대하여 전술한 절차 및 화합물 I-37의 합성에 대하여 실시예 35에 전술한 바에 따라서 이 화합물을 제조하였다. 이에, 제1 단계에서 암모니아로 0.050 mg의 화합물 P를 처리한 후 m-CPBA로 다음 단계에서 산화시켜 0.011 g의 화합물 II-66을 수득하였다.
실시예 93: 화합물 I-9의 각성 증진 활성의 입증.
사용한 방법은 본원에서 전문을 참고 문헌으로 인용하고 있는 에드가 및 세이델의 문헌[Journal of Pharmacology and Experimental Therapeutics, 283:757-769, 1997]에 기술되어 있다.
동물 수술: 성숙한 수컷 비스타르(Wistar) 래트 (275 내지 320 g, 미국 마이애미 윌밍턴 찰스 리버 소재 레버러토리스에서 입수)를 마취시키고 (넴부탈(Nembutal), 60 mg/kg, 정맥내), 만성 EEG 및 EMG 기록을 위한 기록용 이식편을 외과적으로 제조하였다. EEG 이식편은 스테인레스 강 스크류 (전두골에 2 개 (시상에서 +3.9 AP, ±2.0 ML) 및 후두골에 3 개 (-6.4 AP, ±5.5 ML))로 구성되어 있다. 2 개의 테플론으로 코팅한 스테인레스 강선을 EMG 기록용으로 목덜미 사다리꼴 근육에 넣었다. 모든 리드(lead)를 소형 연결관에 납땜하고 (미국 팬실바니아주 부스윈 소재 마이크로테크), 수술하기 전에 에틸렌 옥시드로 기상 멸균시켰다. 이식편 어셈블리를 EEG 기록 스크류를 결합 점착시켜 두개골에 부착시키고, 용접 밀봉한 이식편 연결관과 두개골 및 치과용 아크릴 사이에 시아노아크릴레이트를 도포하였다. 항생제 (젠타마이신)를 수술후 3 내지 5 일 동안 투여하였다. 수술후 회복기는 3 주 이상 소요되었다.
기록 환경: 래트를 토크가 낮은 슬립-고리 정류기 (미국 캘리포니아주 어빈 소재 비엘라 엔지니어링; Biella Engineering) 및 맞춤형 폴리카르보네이트 필터-탑 라이저가 장착된 특수하게 변형시킨 날진(Nalgene) 미세격리기 우리에 각각 가뒀다. 이 우리를 스테인레스 강으로 제조된 수면-각성 기록 챔버의 별도의 통풍되는 구획으로 나눴다. 사료 및 물을 자유롭게 공급하고, 주변 온도는 24±1 ℃였다. 각 우리의 위쪽으로 약 5 cm 떨어져 위치한 4 와트의 형광등으로 연구내내 24 시간 명-암 주기 (명/암 12 시간-12 시간)를 유지하였다. 빛의 세기는 우리안의 중간 위치에서 30 내지 35 럭스가 되게 했다. 처치전후 3 일 동안 동물들을 안정 시켰다.
자동 데이타 수집: 마이크로컴퓨터에 따라 수면-각성 및 생리 상태를 모니터링하는 시스템인 스코어(SCORE)(상표명)로 수면 및 각성 상태를 측정하였다. 스코어의 설계상 특성, 설치류에서의 효능 및 임상전 약물의 유용성 평가는 다른 문헌에 보고되었다 (본원에서 전문을 참고 문헌으로 인용한 문헌 [Van Gelder, et al., 1991; Edgar, et al., 1991, 1997; Seidel, et al, 1995] 참조). 본 발명의 연구에서, 시스템은 증폭된(10,000 배) EEG (1 내지 30 Hz 대역, 디지탈화 속도 100 Hz) 및 적분된 EMG (1 내지 100 Hz 대역, 평균 자승 제곱근(root mean square) 적분법)를 모니터링하였다. 각성 상태는 EEG 주기 및 깊이 중에서 특색있는 것을 뽑아서 매 10초 마다 NREM 수면, REM 수면, 각성 또는 쎄타-우세 각성으로 온라인으로 분류하고, 집합, 연산으로 등급화시켰다. 개체별로 교시된 EEG-각성 상태를 템플레이트(template)하고, EMG 표준에 대해 쎄타-우세 각성 상태와 REM 수면을 구분하였다 (본원에서 전문을 참고 문헌으로 인용하고 있는 문헌 [Welsh, et al., 1985] 참조). EEG 및 EMG 신호를 수시로 온라인 검사하여 데이타 특성을 확인하였다. 원 데이타 특성 및 수면-각성 스코어는 원 EEG 파동 형태 및 적분한 EMG 값의 분포의 시각적 검사뿐 아니라 데이타의 그래프 및 통계적 평가를 조합하여 더욱 철저하게 검사하였다.
약물 투여 및 연구 설계: 멸균 0.25% 메틸셀룰로스 (pH=6.2, 미국 마이애미주 칼라마주 소재 업존 컴파니)에 현탁시킨 화합물 I-9 또는 메틸셀룰로스 비히클 단독을 1 ml/kg의 부피로 복막내에 주사하였다. 표본 크기 (n)는 처리군 당 동물 13 마리였다.
EEG 분포 분석: 매 10 초 기간의 원 EEG 신호를 24 시간 동안 디지탈화시키고 (100 Hz), 본원에서 전문을 참고 문헌으로 인용하고 있는 에드가 및 세이델 (1996)의 문헌에서 전술한 바와 같이 스코어화하였다.
데이타 분석 및 통계: 기록한 주요 변수는 각성의 시간 당 분이었다. 처리군을 ANOVA를 반복 측정함으로써 처리후와 비교하였다. 현저한 주요 효과가 있는 경우, 달리 설명하지 않는 한, 던넷 제한인자 (a=0.05)로 활성 처리군 및 비히클 대조군의 차를 평가하였다.
결과: 도 1은 시간=0일 때 화합물 I-9 (직선) 또는 메틸셀룰로스 비히클 (점선)을 100 mg/kg으로 정맥내 투여하여 처리한 래트에서의 각성 상태의 정도를 예시한다. 화합물 I-9는 비히클-처리된 동물에서 관찰된 것 이상의 각성 상태를 투여 후 약 110 분까지 지속적으로 나타냈다.
실시예 94: 화합물 II-23의 각성 증진 활성의 입증
사용한 방법은 본원에서 전문을 참고 문헌으로 인용하고 있는 에드가 및 세이델의 문헌[Journal of Pharmacology and Experimental Therapeutics, 283:757-769, 1997]에 기술되어 있다.
동물 수술: 성숙한 수컷 비스타르 래트 (275 내지 320 g, 미국 마이애미 윌밍턴 소재 찰스 리버 레버러토리스에서 입수)를 마취시키고 (넴부탈, 45 mg/kg, 정맥내), 만성 EEG 및 EMG 기록을 위한 기록용 이식편을 외과적으로 제조하였다. EEG 이식편을 시판 성분(미국 버지니아주 로아노크 소재 플라스틱스 원)으로부터 제조하였다. EEG를 스테인레스 강 스크류 전극 (전두골에 2개 (시상에서 +3.0 mm, ±2.0 mm ML) 및 후두골에 2개 (-4.0 mm AP, ±2.0 mm ML))으로부터 기록하였다. 2 개의 테플론으로 코팅한 스테인레스 강선을 EMG 기록용으로 목덜미 사다리꼴 근육에 넣었다. 모든 전극 리드를 연결관 받침대와 받침대, 스크류에 삽입하고, 치과용 아클릴로 도포하여 두개골에 전선을 부착시켰다. 수술후 항생제를 투여하고, 감염을 예방하기 위해 상처 가장자리에 항생제 크림을 발랐다. 수술하고 1 주일 이상이 경과한 후, 기록하였다. 동물을 약 6 내지 8 주 동안 시험한 후 사망시켰다.
기록 환경: 수술후, 래트를 격실 안에 각각 가두었다. 24 시간 이후, 기록 전에, 위에 전선-철망을 갖는 날젠 컨테이너 (31 ×31 ×31 cm)에 넣고, 투여할 때를 제외하고는 기록이 끝날 때까지 격실 안에 감금시켰다. 컨테이너를 2 개의 선반 위에 놓고, 선반 당 4 개의 컨테이너를 두었다. 사료 및 물을 자유롭게 공급하고, 주변 온도는 21 ℃이고 습도는 55%였다. 주변 소리를 감추기 위한 화이트 노이즈(noise)를 배경 (컨테이너 안에서 68 db)으로 제공했다. 격실 위의 형광등은 24 시간 동안 명/암 주기 (오전 7시에 점등하고, 오후 7시에 소등함)로 세팅하였다. 컨테이너 안의 빛의 양은 상부 및 바닥 선반에서 각각 38 및 25 럭스였다.
데이타 인식: EEG 및 EMG 신호를 정류기 (플라스틱스 원)와 전치 증폭기 (모델 1700, 미국 워싱턴주 칼스보그 소재 A-M 시스템)를 케이블로 연결하여 판독하였다. EEG 및 EMG 신호를 증폭시키고 (각각 10 K 및 1K), EEG의 대역은 0.3 및 500 Hz, EMG의 대역은 10 및 500 Hz로 여파시켰다. 이 신호를 Labview 5.1 소프트웨어 로 구동되는 ICELUS 수면 연구 소프트웨어 (본원에서 전문을 참고 문헌으로 인용한 문헌 [M. Opp, U. Texas; see Opp, Physiology and Behavior 63:67-74, 1998, and Imeri, Mancia, and Opp, Neuroscience 92:745-749, 1999] 참조) 및 데이타 인식 하드웨어 (PCI-MIO-16E-4; 미국 텍사스주 오스틴 소재 내쇼날 인스트루먼츠)를 사용하여 초 당 128 개의 표본을 디지탈화시켰다. 투여하는 날, 데이타를 오전 11시에서 오후 6 시까지 기록하였다.
수면/각성 스코어: 수면 및 각성 상태를 ICELUS 소프트웨어를 사용하여 수동으로 측정하였다. 이 프로그램은 EEG-FFT에 따라서 6 초 간격으로 EEG 및 EMG 데이타를 나타냈다. 각성 상태는 EEG 진동수 및 진폭의 특성과 EMG 활성을 시각적으로 분석하여 각성(WAK), 빠른 눈놀림(REM), 또는 저주파 수면 또는 비-REM 수면(NREM)으로 스코어화하였다 (본원에서 전문을 참고 문헌으로 인용한 문헌 [Opp and Krueger, American Journal of Physiology 266:R688-95, 1994; Van Gelder, et al., 1991; Edgar, et al., 1991, 1997; Seidel, et al, 1995] 참조). 필수적으로, 각성 활성은 중간 내지 고수준의 EMG에 의해 수반되는 0.5 내지 6 Hz의 낮은 진동수 대역에서 상대적으로 낮은 파워를 갖는 상대적으로 적은 진폭의 EEG 활성으로 구성된다. 특히 각성 상태 (쎄타-각성)에서, EEG 파워는 상대적으로 6 내지 9 Hz(쎄타)에 맞춰져 있으며, 현저한 EMG 활성이 항상 존재한다. NREM 수면은 EMG 활성이 거의 없거나 전혀 없는 0.5 내지 6 Hz의 낮은 진동수 대역에서 상대적으로 큰 파워를 갖는 상대적으로 큰 진폭의 EEG 활성을 특징으로 한다. REM 수면은 쎄타 각성 상태와 유사하게 세타(6 내지 9 Hz)에 맞춰진 EEG를 중간정도로 일정한 진 폭으로 유지하지만 EMG 활성은 전혀 없는 것을 특징으로 한다.
약물 투여 및 연구 설계: 화합물을 2 일 이상의 간격으로 2 개의 기간 동안 시험한 4 또는 8 마리의 래트로 구성된 군에서 평가하였다. 초기 연구는 크로스오버 설계를 사용하여 래트가 각 기간 동안 비히클 또는 시험 화합물을 수용하였다. 동물을 슈도-랜덤화(pseudo-randomized)하여 동일한 약물을 2회 수용하지 않도록 하였다. 화합물 II-23을 멸균 0.25% 메틸셀룰로스 (pH=6.2, 미국 마이애미주 칼라마주 소재 업존 컴파니)에 30 mg/ml로 현탁시켰다. 이 연구를 5 일 간격으로 2 개의 기간으로 시험한 8 마리의 래트에서 수행하였다 (전부, 7 마리 래트는 화합물 II-23 수용, 6 마리는 메틸셀룰로스 비히클 수용). 정오에 투여하였으며, 그 동안 래트는 전반적으로 수면상태에 있었다. 각각의 래트를 컨테이너에서 꺼내어 3.33 ml/kg의 부피로 복막내 주사하고, 다시 제자리에 두었다. 투여에는 약 8 분이 소요되었다.
데이타 분석 및 통계: 주요 결과 측정값은 각성의 시간 당 분이었다. 이 시험에서 활성을 측정하기 위한 주요 결과 측정값은 비히클 대조군에 비하여 투여 후 처음 3 시간 동안의 총 각성 시간의 합으로 구성된다. 이에, 비히클 처치한 동물은 전형적으로 기록 기간 동안 평균 20% 각성되거나, 또는 총 0.2*180 = 36 분 동안 각성되었다. 2-테일(tailed), 언페어(unpaired) t-시험 (Statview 5.0, 미국 노쓰캐롤라이나주 캐리 소재 SAS 인스티튜트, 인크)을 약물 및 비히클 처리 동물에 대한 각성 시간 값에 대하여 수행하였으며, p<0.05인 화합물은 현저한 각성 상태 촉진으로 간주하였다. 또한, 투여할 때부터 시작하여 연속하여 30 분 동안 각성 활성을 평가하고, 각각의 시간마다 t-시험을 수행하여 현저한 각성 촉진 활성 기간을 확립하였다.
결과: 도 2는 정오에 화합물 II-23 (직선) 또는 메틸셀룰로스 비히클 (개환)을 100 mg/kg으로 정맥내 투여하여 처리한 래트에서의 각성 상태의 정도를 예시한다. 각 점은 연속하는 30 분 동안 각성 시간의 평균(%)을 나타낸다. 투여 절차는 투여전 기준 활성과 비교하여 처리군 둘다에서 일시적인 (약 20 분) 상승된 각성 상태 기간을 제공하였다. 화합물 II-23은 비히클 처리된 동물에서 관찰된 것 보다 현저하게 큰 각성 상태를 나타냈다 (p<0.05).
참고문헌: 하기 참고 문헌들은 본원에서 기술하고 있는 바에 대한 절차상 예시 또는 다른 보충 설명을 제공하는 정도로 본원에서 이들의 전문을 참고 문헌으로 구체적으로 인용하고 있다.
1. Touret, et al., Neuroscience Letters, 189:43-46, 1995.
2. Van Gelder, R. N. et al., Sleep 14:48-55, 1991.
3. Edgar, D. M., J. Pharmacol. Exp. Ther. 282:420-429, 1997.
4. Edgar and Seidel, J. Pharmacol. Exp. Ther., 283:757-69, 1997.
5. Hernant et al., Psychopharmacology, 103:28-32, 1991.
6. Lin et al., Brain Research, 591:319-326, 1992.
7. Opp and Krueger, American Journal of Physiology 266:R688-95, 1994.
8. Panckeri et al., Sleep, 19(8):626-631, 1996.
9. Seidel, W. F., et al., J. Pharmacol. Exp. Ther. 275:263-273, 1995.
10. Shelton et al., Sleep 18(10):817-826, 1995.
11. Welsh, D. K., et al., Physiol. Behav. 35:533-538, 1985.
본 발명을 상당히 상세하게 기술하였으나, 당업계의 숙련자들은 본 발명의 실시양태 및 바람직한 실시양태를 다양하게 변화 및 변형시킬 수 있으며, 또한 이는 본 발명의 범주로부터 이탈함이 없이 변화 및 변형할 수 있음을 이해할 것이다. 그러므로, 첨부한 특허 청구 범위는 본 발명의 범위내에 있는 모든 변형들을 포괄하는 것으로 이해해야 한다.
Claims (37)
- 하기 화학식 I-A의 화합물, 또는 그의 제약상 허용되는 염 형태.<화학식 I-A>상기 식에서,Ar1 및 Ar2는 각각 독립적으로 C6-C10 아릴 또는 헤테로아릴에서 선택되고;Y는 C1-C4 알킬렌, -C(R1)(R2)- (여기서, R1 및 R2는 각각 독립적으로 H 또는 C1-C6알킬이거나, R1 또는 R2가 R3 또는 R4와 함께 5원 내지 7원 헤테로시클릴 고리를 형성함), C6-C10 아릴렌, 헤테로아릴렌, C3-C8 시클로알킬렌, 헤테로시클릴렌, -O-, -N(R8)-, -S(=O)y, -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH- 및 -C≡C-에서 선택되나, 단, Y가 -O-, -N(R8)- 또는 -S(=O)y일 때, m 및 n은 0일 수 없고;R3 및 R4는 동일하거나 상이하고, 각각 H, C1-C6 알킬, -OH, 및 -CH(R6)-CONR8AR8B에서 선택되나, 단, R3 및 R4는 동시에 OH가 아니며; 또는 R3 및 R4는 이들이 결합한 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;R6은 H, C1-C4 알킬 또는 α-아미노산의 측쇄이고;R8, R8A 및 R8B는 각각 독립적으로 H, C1-C4 알킬 또는 C6-C10 아릴이고;m은 0, 1, 2 또는 3이고;n은 0, 1, 2 또는 3이고;q는 0, 1 또는 2이고;y는 0, 1 또는 2이되, 단,Ar1이 페닐이고, Ar2가 페닐 또는 피리딜일 때, Y는 C1-C4 알킬렌 또는 C(R1)(R2)[여기서, R1 및 R2는 H 또는 C1-C6 알킬임]일 수 없고;
- 제1항에 있어서, 하기 화학식 I의 화합물, 또는 그의 제약상 허용되는 염 형태.<화학식 I>상기 식에서,Ar1 및 Ar2는 동일하거나 상이하고, 각각 티에닐, 이소티아졸릴, 페닐, 피리딜, 옥사졸릴, 이속사졸릴, 티아졸릴, 이미다졸릴 및 -N-, -O- 또는 -S- 중 1 내지 3 개의 원자를 포함하는 다른 5원 또는 6원 헤테로사이클에서 선택되나, Ar1 및 Ar2는 동시에 페닐이 아니며, Ar1이 페닐일 때, Ar2은 피리딜이 아니고;R1 및 R2는 각각 독립적으로 H 또는 C1-C6 알킬이거나; R1 또는 R2는 R3 또는 R4와 함께 5-7원 헤테로시클릴 고리를 형성하고;R3 및 R4는 동일하거나 상이하고, 각각 H, C1-C6 알킬, -OH, 및 -CH(R6)-CONR6AR6B에서 선택되나, 단, R3 및 R4는 동시에 OH가 아니며; 또는 R3 및 R4는 이들이 결합한 질소와 함께 3원 내지 7원 헤테로시클릴 고리를 형성하고;R6은 H, C1-C4알킬, 또는 α-아미노산의 측쇄이고;R6A 및 R6B는 독립적으로 H 또는 C1-C4알킬이고;n은 0, 1 또는 2이다.
- 삭제
- 삭제
- 제1항에 있어서, Ar1 및 Ar2가 각각 독립적으로 -N-, -O- 또는 -S- 중 1 내지 3 개의 원자를 포함하는 5원 또는 6원 헤테로아릴에서 선택된 것인 화합물.
- 제5항에 있어서, Ar1 및 Ar2가 3-티에닐인 화합물.
- 제1항에 있어서, Ar1이 페닐이고, Ar2가 -N-, -O- 또는 -S- 중 1 내지 3 개의 원자를 포함하는 5원 또는 6원 헤테로아릴인 화합물.
- 제1항에 있어서, Ar1 및 Ar2가 각각 독립적으로 페닐, 티에닐, 이소티아졸릴, 피리딜, 옥사졸릴, 이속사졸릴, 티아졸릴 및 이미다졸릴에서 선택된 것인 화합물.
- 제8항에 있어서, Ar1 및 Ar2가 페닐인 화합물.
- 제1항에 있어서, Y가 -O-, -S(=O)y- 또는 -N(R8)-인 화합물.
- 제1항에 있어서, Y가 -CR8A=CR8B-, -CH=CH-CH(R8)-, -CH(R8)-CH=CH- 또는 -C≡C-인 화합물.
- 제1항에 있어서, Y가 C6-C10 아릴렌 또는 헤테로아릴렌인 화합물.
- 제12항에 있어서, Y가 페닐렌인 화합물.
- 제1항에 있어서, Y가 C1-C4 알킬렌인 화합물.
- 제1항에 있어서, Y가 C(R1)(R2) (여기서, R1 및 R2가 각각 독립적으로 H 또는 C1-C6 알킬임)이고, m 및 n=0인 화합물.
- 제1항에 있어서, Y가 C(R1)(R2)이고, m 및 n이 0이고, R1 또는 R2가 R3 또는 R4와 함께 5원 내지 7원 헤테로시클릭 고리를 형성할 수 있는 것인 화합물.
- 제1항에 있어서, q=1인 화합물.
- 제1항에 있어서, Ar1 및 Ar2가 각각 독립적으로 페닐 및 3-티에닐에서 선택되고, q=1인 화합물.
- 제2항에 있어서, Ar1 및 Ar2가 동일하거나 상이하고, 각각 티에닐, 이소티아졸릴, 페닐, 옥사졸릴, 이속사졸릴, 티아졸릴 및 이미다졸릴에서 선택된 것인 화합물.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 1 종 이상의 제약학적으로 허용되는 담체와 함께 제1항 또는 제2항의 화합물을 포함하는, 졸음증, 권태감, 파킨슨병, 대뇌 허혈, 졸중, 수면 무호흡증, 식사 장애, 주의력결핍 과잉행동 장애, 인지 장애 또는 피로의 치료; 또는 각성 상태의 증진, 식욕 자극 또는 체증 증가 자극용 제약 조성물.
- 삭제
- 1 종 이상의 제약학적으로 허용되는 담체와 함께 제1항 또는 제2항의 화합물을 포함하는, 우울증, 정신 분열증 및 만성 피로 증후군의 치료용 제약 조성물.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US20478900P | 2000-05-16 | 2000-05-16 | |
| US60/204,789 | 2000-05-16 | ||
| US26828301P | 2001-02-13 | 2001-02-13 | |
| US60/268,283 | 2001-02-13 | ||
| US09/855,228 US6492396B2 (en) | 2000-05-16 | 2001-05-15 | Substituted thioacetamides |
| US09/855,228 | 2001-05-15 | ||
| PCT/US2001/015752 WO2001087830A2 (en) | 2000-05-16 | 2001-05-16 | Substituted thioacetamides |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077014424A Division KR100836300B1 (ko) | 2000-05-16 | 2001-05-16 | 치환된 티오아세트아미드 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20030029047A KR20030029047A (ko) | 2003-04-11 |
| KR100839265B1 true KR100839265B1 (ko) | 2008-06-17 |
Family
ID=27394698
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077014424A KR100836300B1 (ko) | 2000-05-16 | 2001-05-16 | 치환된 티오아세트아미드 |
| KR1020027015408A KR100839265B1 (ko) | 2000-05-16 | 2001-05-16 | 치환된 티오아세트아미드 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077014424A KR100836300B1 (ko) | 2000-05-16 | 2001-05-16 | 치환된 티오아세트아미드 |
Country Status (23)
| Country | Link |
|---|---|
| US (2) | US6492396B2 (ko) |
| EP (2) | EP2186803A3 (ko) |
| JP (1) | JP2004515458A (ko) |
| KR (2) | KR100836300B1 (ko) |
| CN (1) | CN1429210A (ko) |
| AR (1) | AR030061A1 (ko) |
| AT (1) | ATE493385T1 (ko) |
| AU (2) | AU6316501A (ko) |
| BG (1) | BG66080B1 (ko) |
| BR (1) | BR0111358A (ko) |
| CA (1) | CA2409116A1 (ko) |
| CZ (1) | CZ20023753A3 (ko) |
| DE (1) | DE60143746D1 (ko) |
| EA (1) | EA006135B1 (ko) |
| HK (1) | HK1054544A1 (ko) |
| HU (1) | HUP0302297A3 (ko) |
| IL (1) | IL152811A0 (ko) |
| MX (1) | MXPA02011288A (ko) |
| NO (1) | NO329201B1 (ko) |
| NZ (1) | NZ522589A (ko) |
| PL (1) | PL207492B1 (ko) |
| SK (1) | SK16162002A3 (ko) |
| WO (1) | WO2001087830A2 (ko) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6670358B2 (en) * | 2000-05-16 | 2003-12-30 | Cephalon, Inc. | Substituted thioacetamides |
| US6492396B2 (en) * | 2000-05-16 | 2002-12-10 | Cephalon, Inc. | Substituted thioacetamides |
| US20080058424A1 (en) * | 2002-05-23 | 2008-03-06 | Cephalon, Inc. | Novel pharmaceutical formulations of modafinil |
| KR100911779B1 (ko) * | 2001-05-25 | 2009-08-12 | 세파론, 인코포레이티드 | 모다피닐을 포함하는 고형 제약 제제 |
| US7229644B2 (en) * | 2002-05-23 | 2007-06-12 | Cephalon, Inc. | Pharmaceutical formulations of modafinil |
| US6992219B2 (en) * | 2002-08-09 | 2006-01-31 | Cephalon France | Modafinil polymorphic forms |
| US20040116532A1 (en) | 2002-09-13 | 2004-06-17 | Craig Heacock | Pharmaceutical formulations of modafinil |
| FR2849029B1 (fr) * | 2002-12-20 | 2005-03-18 | Lafon Labor | Procede de preparation et formes cristallines des enantiomeres optiques du modafinil. |
| WO2004075841A2 (en) * | 2003-02-24 | 2004-09-10 | Mallinckrodt Inc. | Process for preparing benzhydrylthioacetamide |
| US7943632B2 (en) * | 2003-03-17 | 2011-05-17 | Neurohealing Pharmaceuticals, Inc. | High potency dopaminergic treatment of neurological impairment associated with brain injury |
| CA2519117C (en) * | 2003-03-17 | 2010-03-02 | Neurohealing Pharmaceuticals, Inc. | High potency dopaminergic treatment of neurological impairment associated with brain injury |
| US20050031688A1 (en) * | 2003-08-04 | 2005-02-10 | Ayala William J. | Positive wakeup pharmaceutical sleep system with compatible pre-bedtime administration |
| CN101972240B (zh) * | 2003-09-04 | 2012-07-25 | 赛福伦公司 | 莫达芬尼组合物 |
| US8153159B2 (en) | 2003-09-18 | 2012-04-10 | Cephalon, Inc. | Modafinil modified release pharmaceutical compositions |
| US20050137264A1 (en) * | 2003-12-22 | 2005-06-23 | Patel Ashish A. | Modafinil compositions |
| EP1586561A1 (en) * | 2004-04-13 | 2005-10-19 | Cephalon, Inc. | Bicyclic aromatic sulfinyl derivatives |
| US7297817B2 (en) * | 2004-04-13 | 2007-11-20 | Cephalon France | Thio-substituted arylmethanesulfinyl derivatives |
| US7449481B2 (en) * | 2004-04-13 | 2008-11-11 | Cephalon, Inc. | Thio-substituted biaryl-methanesulfinyl derivatives |
| US7423176B2 (en) * | 2004-04-13 | 2008-09-09 | Cephalon, Inc. | Bicyclic aromatic sulfinyl derivatives |
| US7314875B2 (en) * | 2004-04-13 | 2008-01-01 | Cephalon, Inc. | Tricyclic aromatic and bis-phenyl sulfinyl derivatives |
| EP1586560A1 (en) * | 2004-04-13 | 2005-10-19 | Cephalon, Inc. | Thio-substituted arylmethanesulfinyl derivatives |
| US7119214B2 (en) * | 2004-04-13 | 2006-10-10 | Cephalon France | Thio-substituted tricyclic and bicyclic aromatic methanesulfinyl derivatives |
| EP1589001A1 (en) * | 2004-04-13 | 2005-10-26 | Cephalon, Inc. | Tricyclic aromatic and bis-phenyl sulfinyl derivatives |
| EP1586559A1 (en) * | 2004-04-13 | 2005-10-19 | Cephalon, Inc. | Biaryl-methanethio-, -sulphinyl- and sulphonyl derivatives |
| EP1589016A1 (en) * | 2004-04-13 | 2005-10-26 | Cephalon France | Thio-substituted tricyclic and bicyclic aromatic methanesulfinyl derivatives |
| US20050240166A1 (en) * | 2004-04-26 | 2005-10-27 | Microsolutions, Inc. | Implantable device, formulation and method for anti-psychotic therapy using risperidone |
| EP1973873A2 (en) * | 2005-12-09 | 2008-10-01 | Mallinckrodt Inc. | Processes for the preparation of modafinil and analogs thereof |
| US20100010092A1 (en) * | 2006-12-19 | 2010-01-14 | Arless Ltd. | Use of modafinil to treat restless leg syndrome |
| AU2008275918B2 (en) | 2007-07-17 | 2014-01-30 | Rigel Pharmaceuticals, Inc. | Cyclic amine substituted pyrimidinediamines as PKC inhibitors |
| WO2012078800A2 (en) | 2010-12-08 | 2012-06-14 | Codexis, Inc. | Biocatalysts and methods for the synthesis of armodafinil |
| WO2017049211A1 (en) | 2015-09-17 | 2017-03-23 | Micromidas, Inc. | Oxidation chemistry on furan aldehydes |
| CN107522693B (zh) * | 2017-08-15 | 2018-12-04 | 北京豪思生物科技有限公司 | 一种6-元芳香环或杂芳香环化合物及其制备方法和应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4177290A (en) | 1977-03-31 | 1979-12-04 | Laboratoire L. Lafon | Acetamide derivatives |
| WO1995001333A1 (fr) * | 1993-06-30 | 1995-01-12 | Laboratoire L. Lafon | Derives d'acetamide et leur utilisation comme modificateurs du comportement de prise alimentaire |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US612379A (en) * | 1898-10-11 | Claffey and orie p | ||
| GB1520812A (en) | 1975-10-02 | 1978-08-09 | Lafon Labor | Benzhydrylsulphinyl derivatives |
| DE2708449C3 (de) * | 1977-02-26 | 1981-01-08 | Hoechst Ag, 6000 Frankfurt | Verfahren zum gleichmäßigen Färben von bahnförmigen Textilien aus modifizierten Polyesterfasern auf Baumfärbeapparaten |
| FR2528041A1 (fr) | 1982-06-04 | 1983-12-09 | Lafon Labor | Acides halogenobenzhydrylsulfinylacetohydroxamiques, procede de preparation et utilisation en therapeutique |
| FR2528038B2 (fr) * | 1982-06-04 | 1985-08-09 | Lafon Labor | Derives de benzhydrylsulfinylacetamide et leur utilisation en therapeutique |
| FR2593809B1 (fr) | 1986-01-31 | 1988-07-22 | Lafon Labor | Benzhydrylsulfinylacetamide, procede de preparation et utilisation en therapeutique |
| US4965893A (en) * | 1986-03-24 | 1990-10-30 | Henkin Melvyn Lane | Hydrotherapy massage method and apparatus |
| US4964893A (en) | 1986-04-17 | 1990-10-23 | Monsanto Company | Benzhydryl compounds as herbicide antidotes |
| FR2601673B2 (fr) * | 1986-07-21 | 1989-06-02 | Lafon Labor | Derives de l'acetamide et medicaments qui en contiennent |
| US4980372A (en) | 1987-05-11 | 1990-12-25 | Ono Pharmaceutical Co., Ltd. | Benzoylaminophenoxybutanoic acid derivatives |
| ATE110712T1 (de) | 1987-06-04 | 1994-09-15 | Ono Pharmaceutical Co | Benzoylaminophenoxybuttersäure-derivate. |
| US5204358A (en) | 1987-11-25 | 1993-04-20 | Merck Frosst Canada, Inc. | Hetaryl styryl quinolines as leukotriene inhibitors |
| NZ233752A (en) * | 1989-05-24 | 1993-05-26 | Merck Frosst Canada Inc | Substituted quinoline derivatives, preparation and pharmaceutical compositions thereof |
| FR2663225B1 (fr) | 1990-06-14 | 1994-11-04 | Lafon Labor | Nouvelle utilisation du modafinil. |
| ES2036926B1 (es) | 1991-08-08 | 1994-01-16 | Uriach & Cia Sa J | "procedimiento para la obtencion de derivados de la (2-alquil-3-piridil)metilpiperazina". |
| WO1993006096A1 (en) | 1991-09-13 | 1993-04-01 | Sankyo Company, Limited | Tricyclic heterocyclic compound |
| FR2684875B1 (fr) | 1991-12-13 | 1995-05-24 | Lafon Labor | Utilisation du modafinil pour la fabrication d'un medicament ayant un effet anti-ischemique. |
| FR2697162B1 (fr) | 1992-10-23 | 1995-01-13 | Lafon Labor | Utilisation du modafinil pour la fabrication d'un médicament pour le traitement de l'incontinence urinaire et des troubles sphinctériens urétro vésicaux. |
| FR2706767B1 (ko) | 1993-06-22 | 1995-09-08 | Lafon Labor | |
| FR2708201B1 (fr) | 1993-06-30 | 1995-10-20 | Lafon Labor | Utilisation de dérivés d'acétamide pour la fabrication de médicaments. |
| US5618845A (en) | 1994-10-06 | 1997-04-08 | Cephalon, Inc. | Acetamide derivative having defined particle size |
| US5571825A (en) | 1995-03-31 | 1996-11-05 | Warner-Lambert Company | Method of selectively inhibiting prostaglandin G/H synthase-2 |
| EP0848004B1 (en) | 1995-07-31 | 2003-04-02 | Shionogi & Co., Ltd. | Pyrrolidine derivatives having phospholipase a2 inhibitory activity |
| WO1997032854A1 (fr) | 1996-03-04 | 1997-09-12 | Dainippon Pharmaceutical Co., Ltd. | Derives de 2-sulfinylnicotinamide, intermediaire de ces derives, procede pour produire ces derives et composition medicinale contenant ces derives comme ingredient actif |
| FR2771004B1 (fr) | 1997-11-19 | 2000-02-18 | Inst Curie | Utilisation de derives de benzhydryl sulfinyle pour la fabrication de medicaments ayant un effet eveillant dans des situations de troubles de la vigilance d'origine medicamenteuse |
| US6670358B2 (en) * | 2000-05-16 | 2003-12-30 | Cephalon, Inc. | Substituted thioacetamides |
| US6492396B2 (en) * | 2000-05-16 | 2002-12-10 | Cephalon, Inc. | Substituted thioacetamides |
-
2001
- 2001-05-15 US US09/855,228 patent/US6492396B2/en not_active Ceased
- 2001-05-16 HU HU0302297A patent/HUP0302297A3/hu unknown
- 2001-05-16 KR KR1020077014424A patent/KR100836300B1/ko not_active IP Right Cessation
- 2001-05-16 IL IL15281101A patent/IL152811A0/xx unknown
- 2001-05-16 BR BR0111358-5A patent/BR0111358A/pt not_active Application Discontinuation
- 2001-05-16 EP EP10002284A patent/EP2186803A3/en not_active Withdrawn
- 2001-05-16 MX MXPA02011288A patent/MXPA02011288A/es active IP Right Grant
- 2001-05-16 AU AU6316501A patent/AU6316501A/xx active Pending
- 2001-05-16 EA EA200201214A patent/EA006135B1/ru not_active IP Right Cessation
- 2001-05-16 PL PL365181A patent/PL207492B1/pl not_active IP Right Cessation
- 2001-05-16 NZ NZ522589A patent/NZ522589A/en unknown
- 2001-05-16 JP JP2001584227A patent/JP2004515458A/ja active Pending
- 2001-05-16 SK SK1616-2002A patent/SK16162002A3/sk not_active Application Discontinuation
- 2001-05-16 KR KR1020027015408A patent/KR100839265B1/ko not_active IP Right Cessation
- 2001-05-16 WO PCT/US2001/015752 patent/WO2001087830A2/en active IP Right Grant
- 2001-05-16 EP EP01937424A patent/EP1292573B1/en not_active Expired - Lifetime
- 2001-05-16 CN CN01809625A patent/CN1429210A/zh active Pending
- 2001-05-16 CA CA002409116A patent/CA2409116A1/en not_active Abandoned
- 2001-05-16 CZ CZ20023753A patent/CZ20023753A3/cs unknown
- 2001-05-16 AT AT01937424T patent/ATE493385T1/de not_active IP Right Cessation
- 2001-05-16 AU AU2001263165A patent/AU2001263165B2/en not_active Ceased
- 2001-05-16 DE DE60143746T patent/DE60143746D1/de not_active Expired - Lifetime
- 2001-05-17 AR ARP010102335A patent/AR030061A1/es not_active Application Discontinuation
-
2002
- 2002-11-15 NO NO20025508A patent/NO329201B1/no not_active IP Right Cessation
- 2002-12-10 BG BG107367A patent/BG66080B1/bg unknown
-
2003
- 2003-09-18 HK HK03106713.0A patent/HK1054544A1/zh unknown
-
2004
- 2004-11-23 US US10/996,325 patent/USRE39575E1/en not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4177290A (en) | 1977-03-31 | 1979-12-04 | Laboratoire L. Lafon | Acetamide derivatives |
| WO1995001333A1 (fr) * | 1993-06-30 | 1995-01-12 | Laboratoire L. Lafon | Derives d'acetamide et leur utilisation comme modificateurs du comportement de prise alimentaire |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100839265B1 (ko) | 치환된 티오아세트아미드 | |
| KR100965640B1 (ko) | 치환된 티오아세트아미드 | |
| AU2002349923A1 (en) | Substituted thioacetamides | |
| AU2001263165A2 (en) | Substituted thioacetamides | |
| AU2001263165A1 (en) | Substituted thioacetamides | |
| JP4989460B2 (ja) | チオ置換三環式および二環式芳香族メタンスルフィニル誘導体 | |
| CA2080949A1 (en) | Therapeutic agents | |
| ZA200209278B (en) | Substituted thioacetamides. | |
| UA74577C2 (en) | Substituted thioacetamides, a pharmaceutical composition and a method for the treatment of diseases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| A107 | Divisional application of patent | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| G170 | Re-publication after modification of scope of protection [patent] | ||
| LAPS | Lapse due to unpaid annual fee |