JP7698658B2 - がん治療のための置換オキソイソインドリン化合物 - Google Patents
がん治療のための置換オキソイソインドリン化合物 Download PDFInfo
- Publication number
- JP7698658B2 JP7698658B2 JP2022557736A JP2022557736A JP7698658B2 JP 7698658 B2 JP7698658 B2 JP 7698658B2 JP 2022557736 A JP2022557736 A JP 2022557736A JP 2022557736 A JP2022557736 A JP 2022557736A JP 7698658 B2 JP7698658 B2 JP 7698658B2
- Authority
- JP
- Japan
- Prior art keywords
- dione
- piperidine
- oxo
- dihydro
- isoindol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
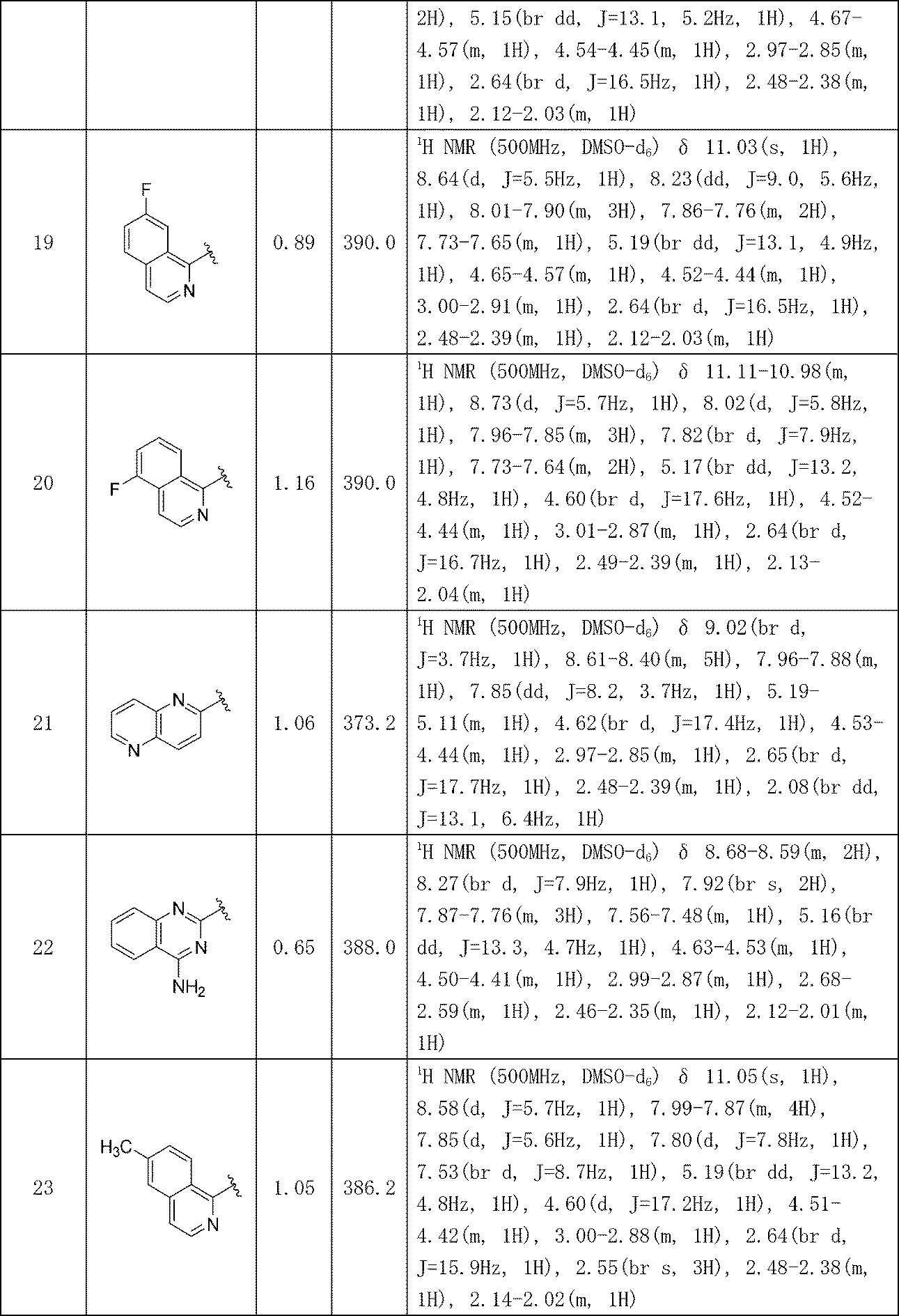
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
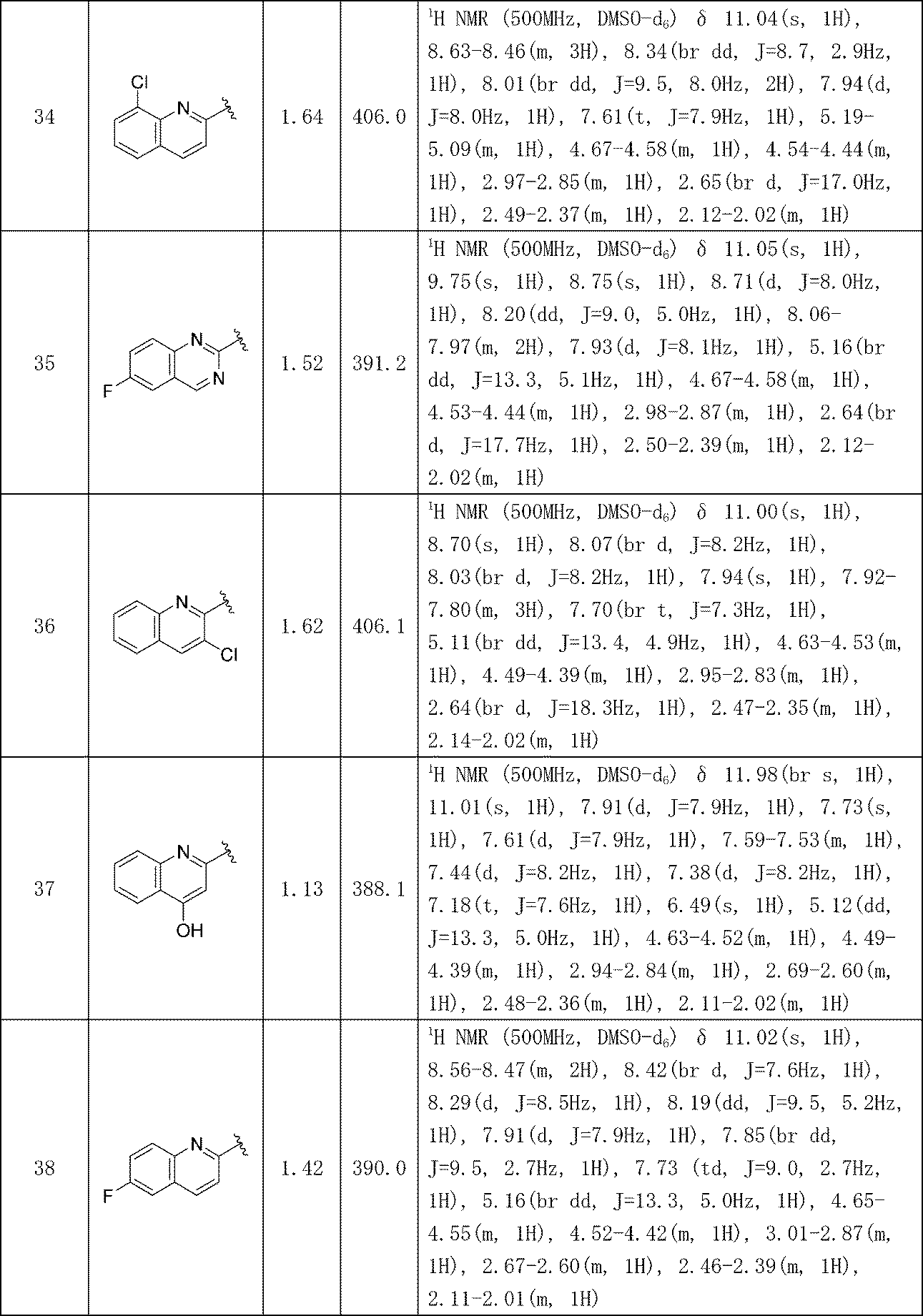
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
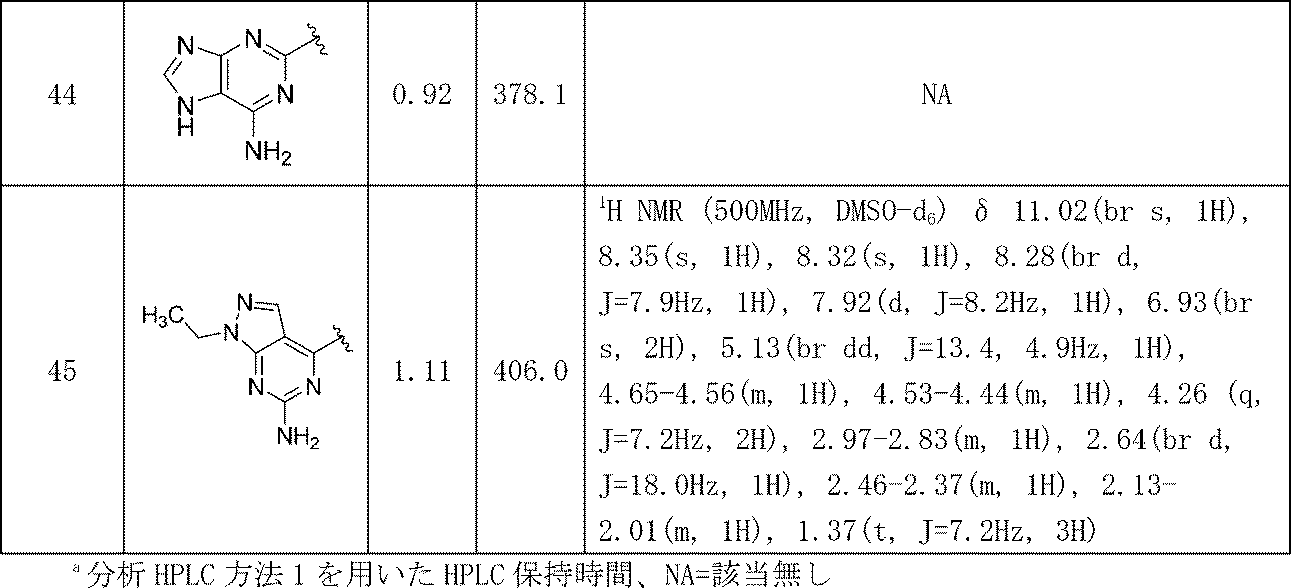
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/32—Nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/052—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being six-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
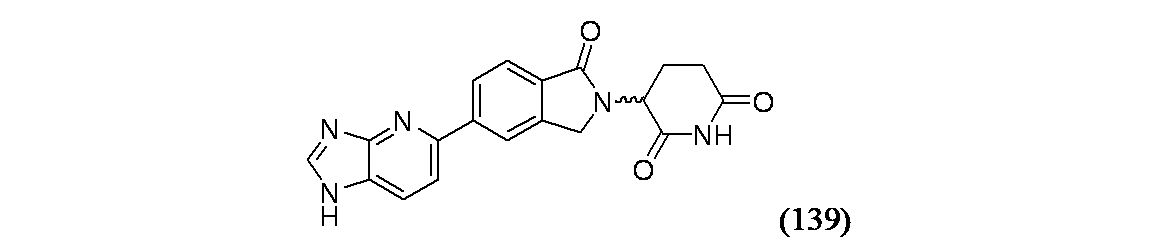
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
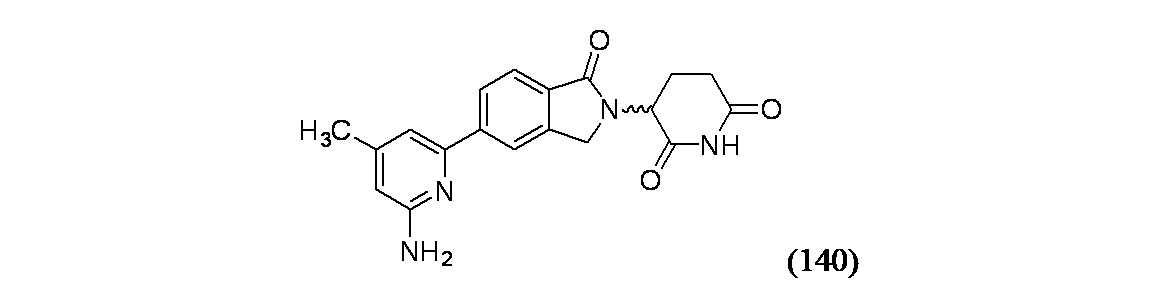
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
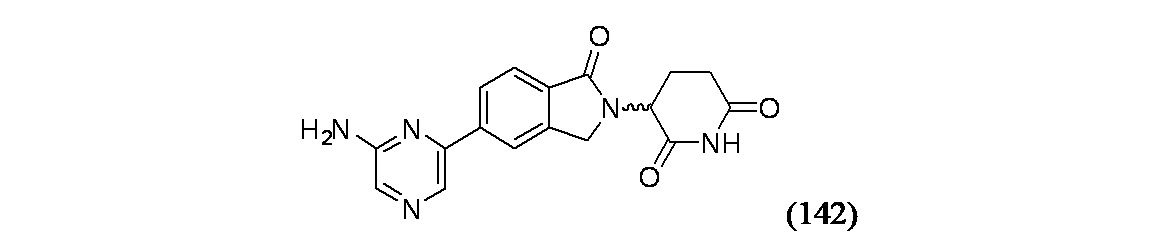
- Indole Compounds (AREA)
Description
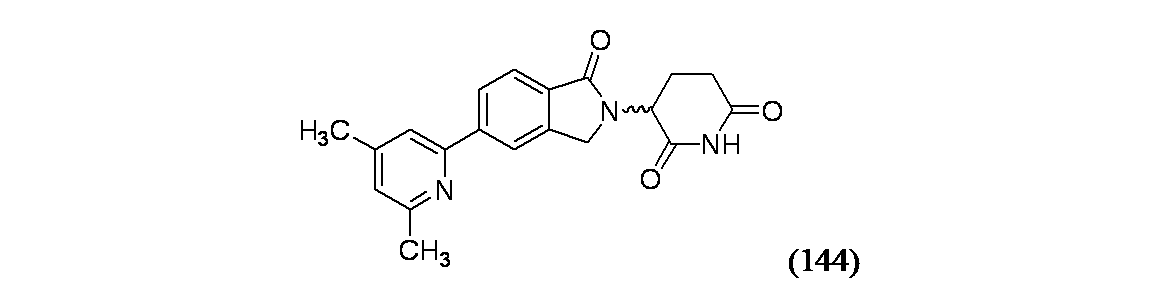
本出願は、2020年3月23日出願の米国仮出願番号第62/993,144号の優先権を主張するものであって、その全てを参照により本明細書に組み込むものである。
本発明は、総じてHeliosタンパク質を阻害する置換オキソイソインドリン化合物に関する。本発明は、置換オキソイソインドリン化合物、当該化合物を含む組成物、およびそれらの使用方法を提供する。さらに本発明は、増殖性疾患(例えばがん)、およびウイルス感染症の治療に有効な、本発明に記載の少なくとも1つの化合物を含む医薬組成物に関するものである。
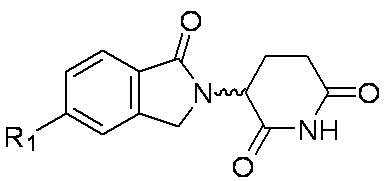
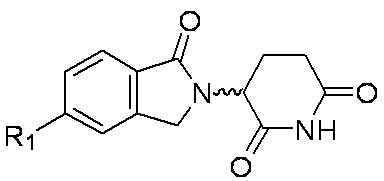
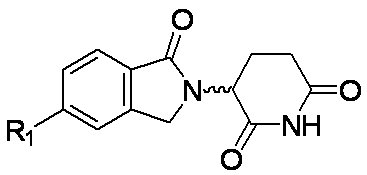
本発明は、細胞中のHeliosタンパク質レベルおよびHelios活性レベルを低下させ、および/またはHelios発現レベルを抑制するのに有用な、式(I)の置換オキソイソインドリン化合物またはその塩を提供する。
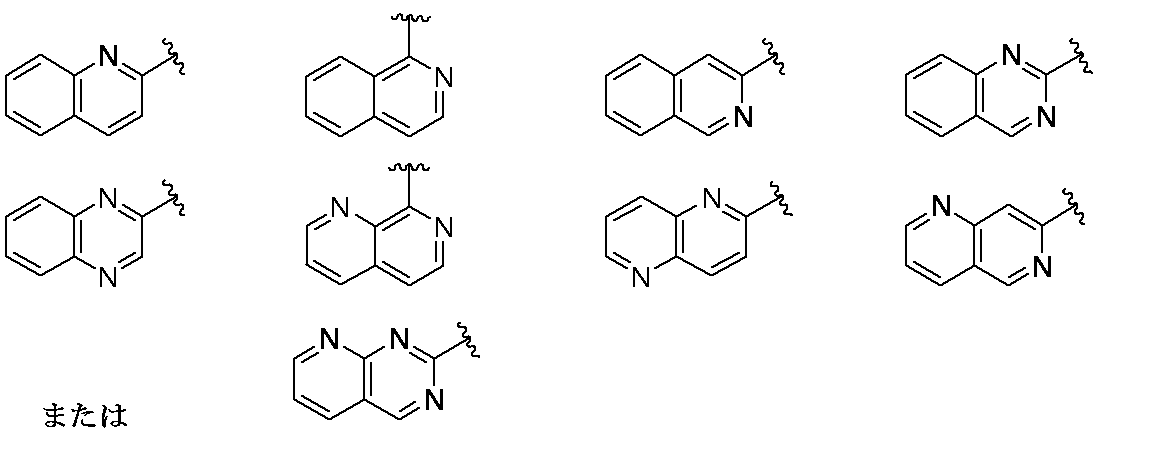
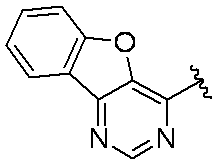
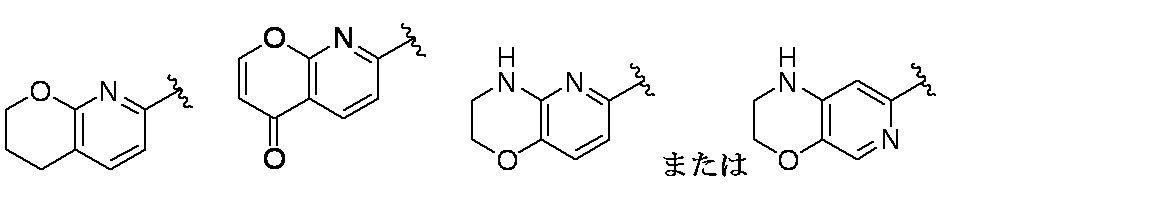
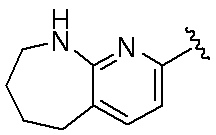
環Aは、
であり;
各R1は、独立してF、Cl、Br、-CN、-OH、-NO2、0~6個のR1aで置換されたC1-6アルキル、0~6個のR1aで置換されたC1-3アルコキシ、-CRxRxOCRxRx(フェニル)、-NRyRy、-NRxC(O)H、-NRxC(O)(C1-2アルキル)、-NRxC(O)NRxRx、-C(O)H、-C(O)OH、-C(O)O(C1-3アルキル)、-C(O)NRxRx、-C(O)NRx(C3-6シクロアルキル)、-OC(O)(C1-3アルキル)、-SO2(C1-3アルキル)、-NHN(C1-2アルキル)2、-CH2CH2Si(CH3)3であるか、またはC3-6シクロアルキル、フェニル、ピリジニル、ピペリジニル、ピペラジニル、ピロリジニル、モルホリニル、およびジオキシドチオモルホリニルから選択される環状基であり、前記環状基は0~4個のR1bで置換され;
各R1aは、独立してF、Cl、-CN、-OH、C1-2アルコキシ、C1-2フルオロアルコキシ、-SO2(C1-3アルキル)、またはフェニルであり;
各R1bは、独立してF、Cl、C1-2アルキル、C1-2フルオロアルキル、C1-2アルコキシ、C1-2フルオロアルコキシ、-C(O)(C1-3アルキル)、または-SO2(C1-3アルキル)であり;
各Rxは、独立してHまたは-CH3であり;
各Ryは、独立してHまたはC1-6アルキルであり;および
nは、0、1、2、3、または4である]
の化合物またはその塩を提供する。
各R1は、独立してF、Cl、-CN、-OH、-CH3、-OCH3、-OCH2(フェニル)、-NH2、-N(CH3)2、-CH2CH3、-CH(CH3)2、-CH2C(CH3)3、-CF3、-CH2Cl、-CH2CN、-CH2(フェニル)、-CH2OH、-CH2OCH2(フェニル)、-OCH2CH3、-NH(CH3)、-NH(CH2CH3)、または-NHC(O)CH3であり;および
nが、0、1、または2である、式(I)の化合物またはその塩を提供する。
各R1が、独立してCl、-CN、-CH3、-OCH3、-OCH2CH3、-NH2、-NH(CH3)、-N(CH3)2、-NHC(O)CH3、-N(CH3)C(O)CH3、-C(O)NH2、-C(O)N(CH3)2、またはシクロプロピルであり;および
nが、0、1、または2である、式(I)の化合物またはその塩を提供する。
各R1が、独立してF、Cl、-OH、-CH3、-OCH3、-NH2、-C(O)OCH3、-C(O)NH(シクロプロピル)、またはフェニルであり;および
nが、0、1、または2である、式(I)の化合物またはその塩を提供する。
各R1が、独立してF、Cl、-NH2、-OCH3、-N(CH2CH3)2、または-C(O)OCH3であり;および
nが、0、1、2、または3である、式(I)の化合物またはその塩を提供する。
各R1が、独立してCl、-OH、-CH(CH3)2、-OCH3、-NH2、-NH(CH2CH3)、-C(O)OCH3、シクロプロピル、またはである、式(I)の化合物またはその塩を提供する。
各R1が、独立してF、Cl、Br、-CN、-OH、-NO2、-CH3、-OCH3、-NH2、-NH(CH3)、-NH(CH2CH3)、-NHC(O)CH3、-NHN(CH3)2、シクロプロピル、フェニル、(ベンジル)モルホリニル、(メチルスルホニル)ピペラジニル、またはアセチルピペラジニルであり;および
nが、0、1、2、または3である、式(I)の化合物またはその塩を提供する。
各R1が、独立して-CN、-NH2、-C(O)NH2、フェニル、またはピリジニルであり;および
nが、0、1、または2である、式(I)の化合物またはその塩を提供する。
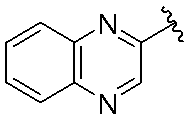
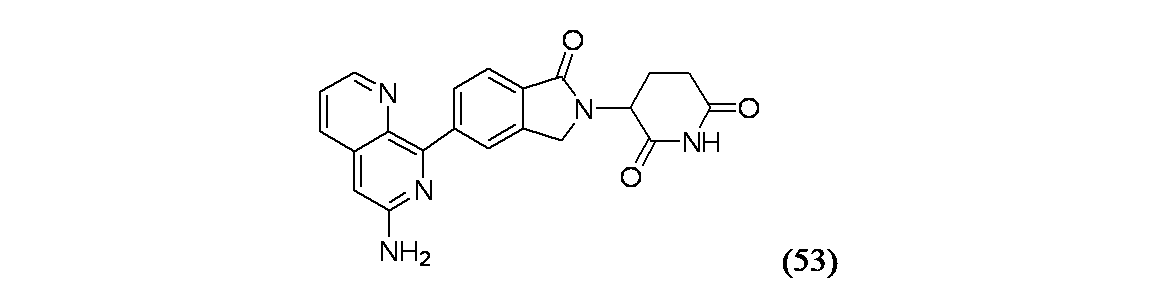
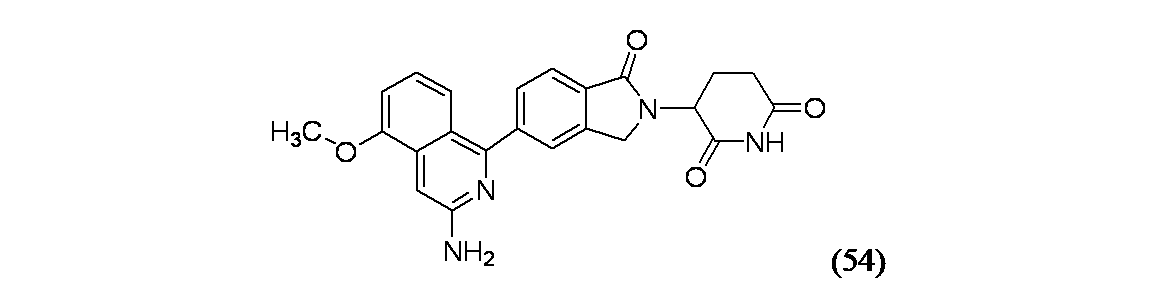
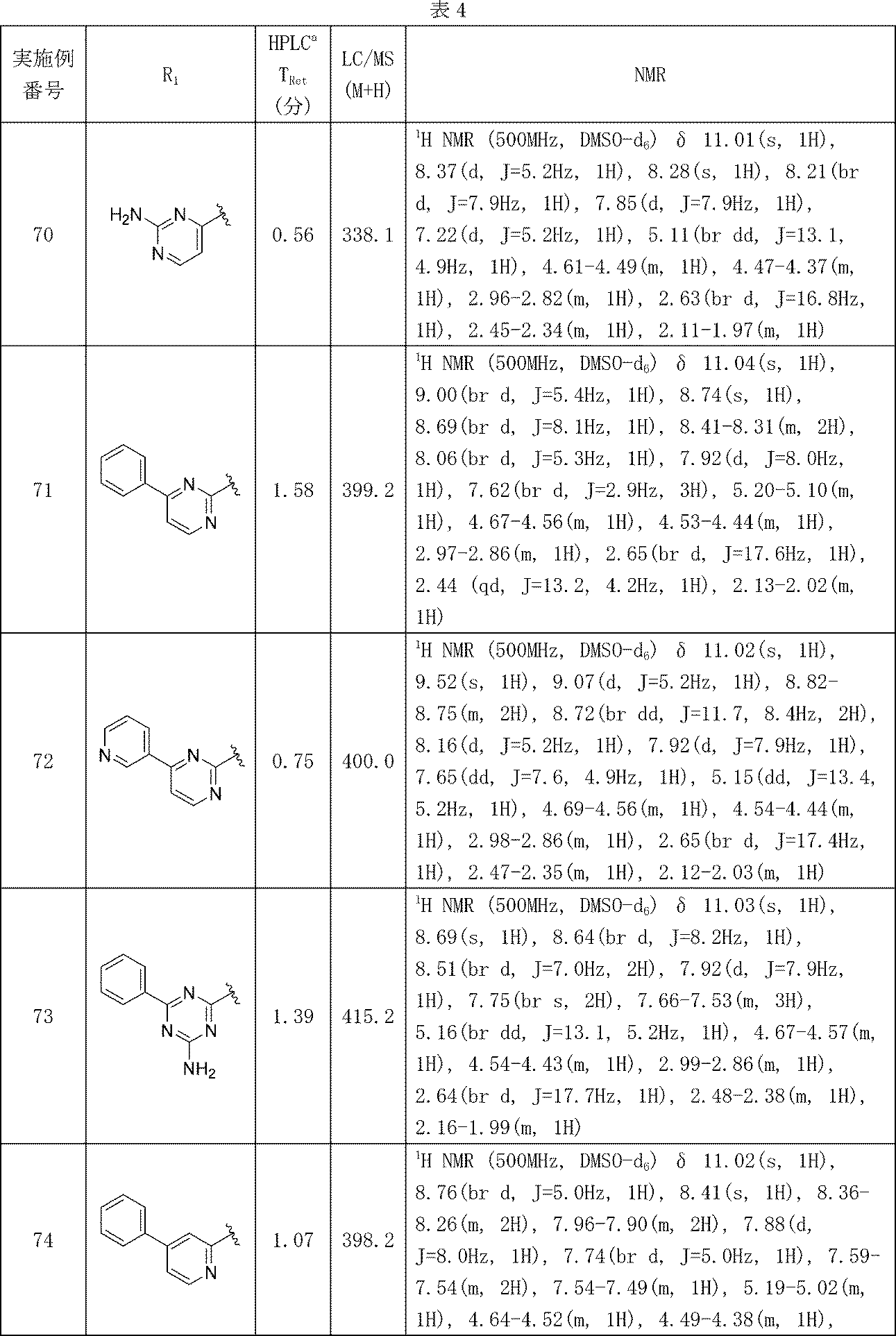
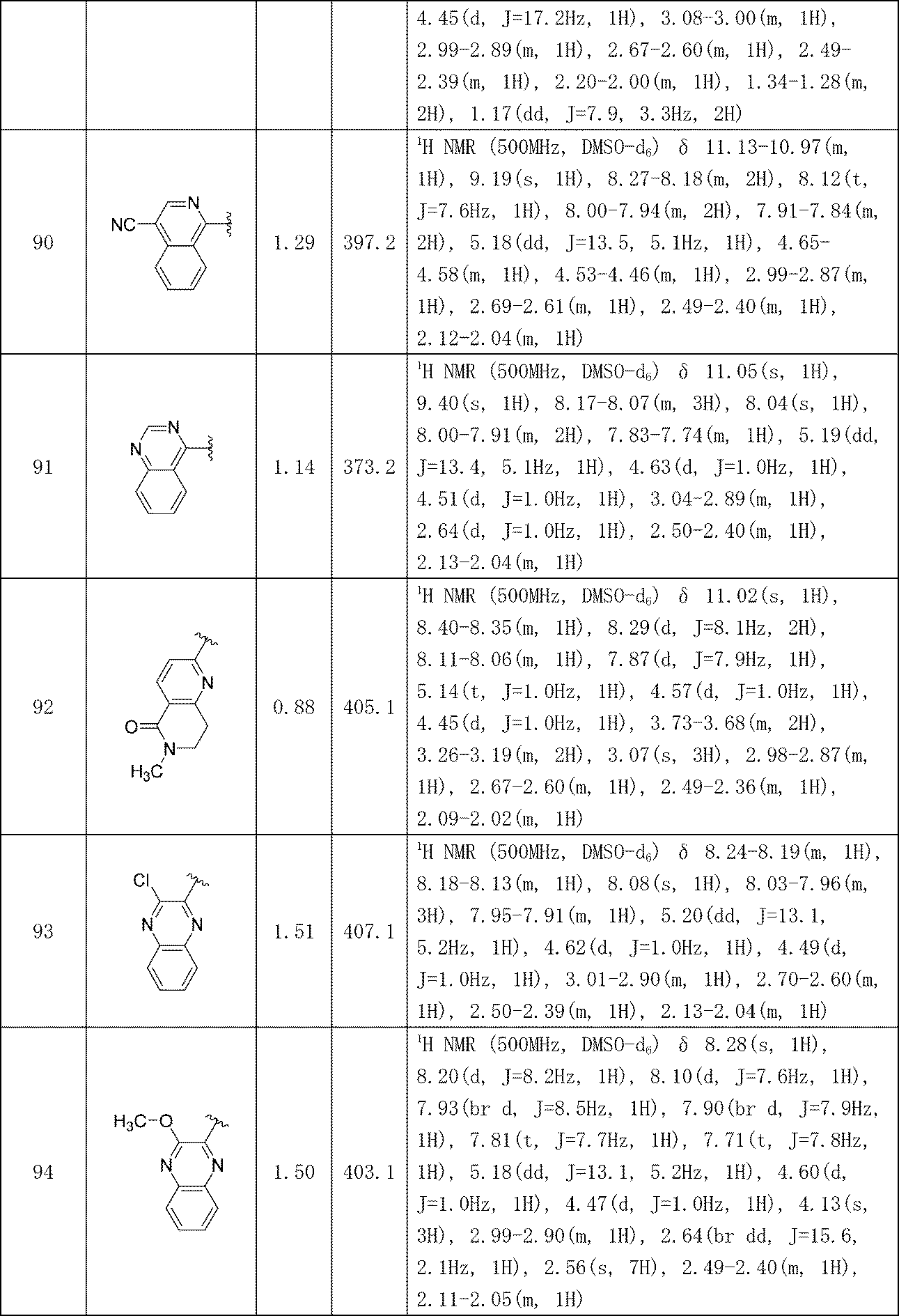
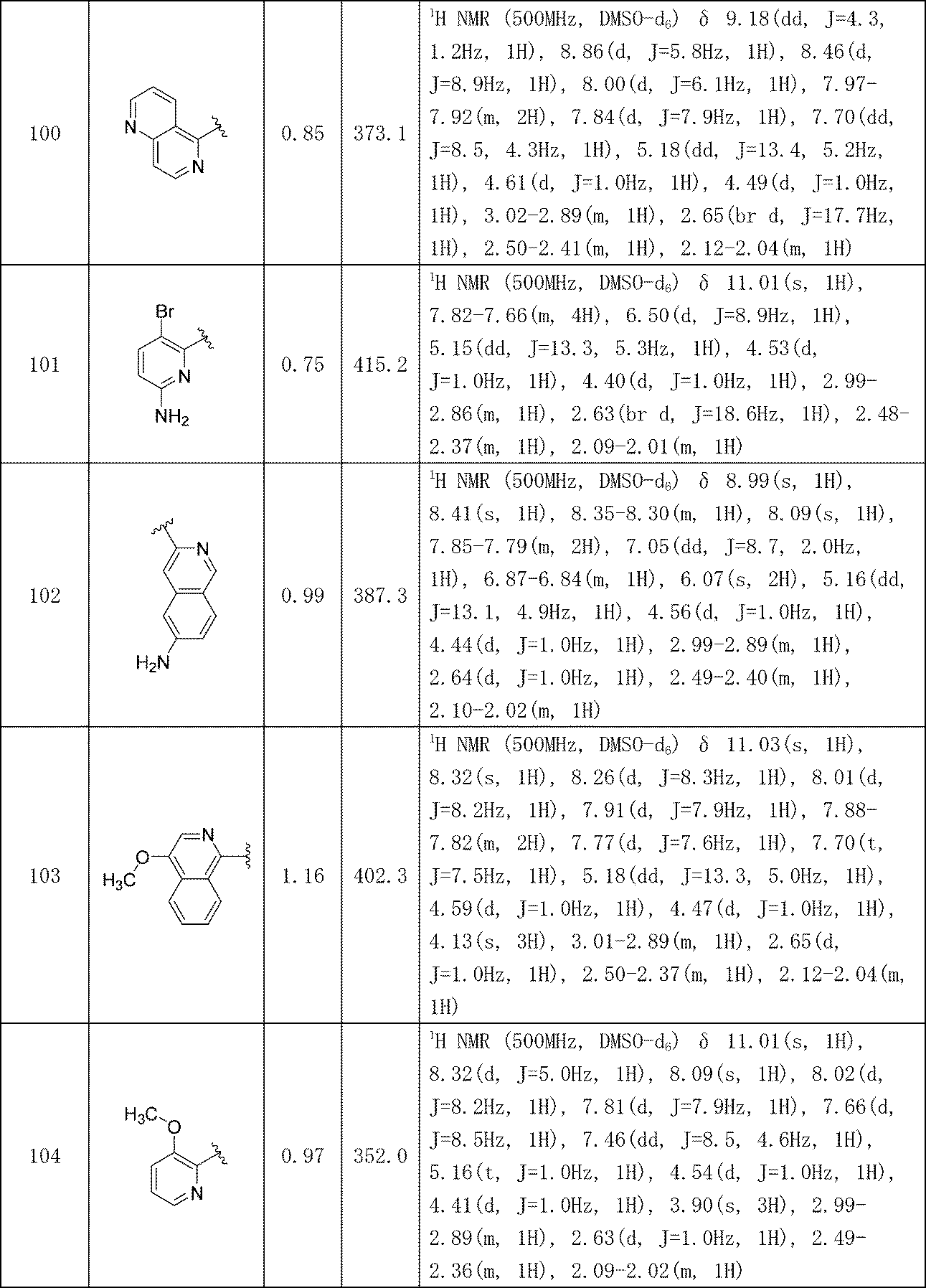
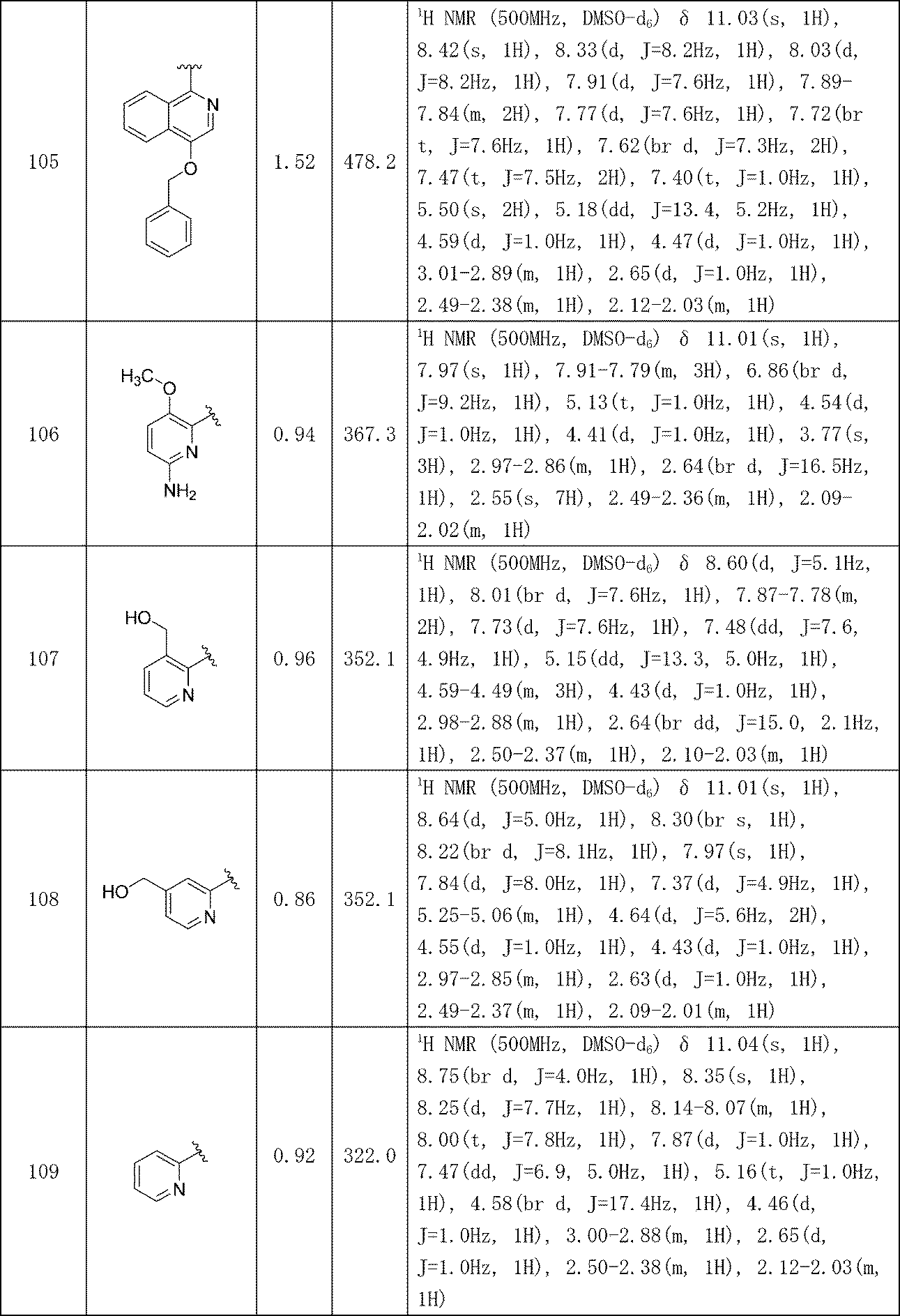
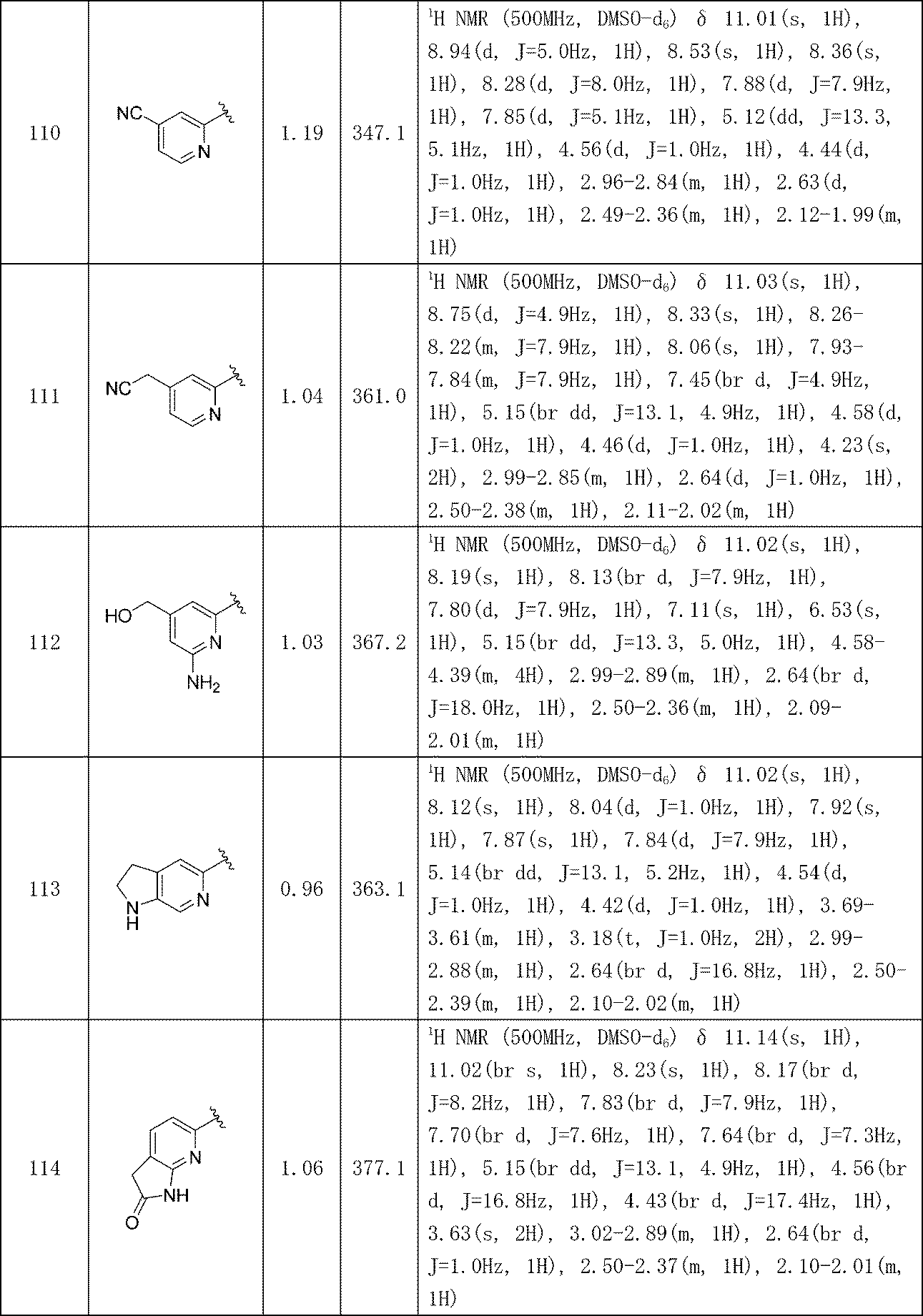
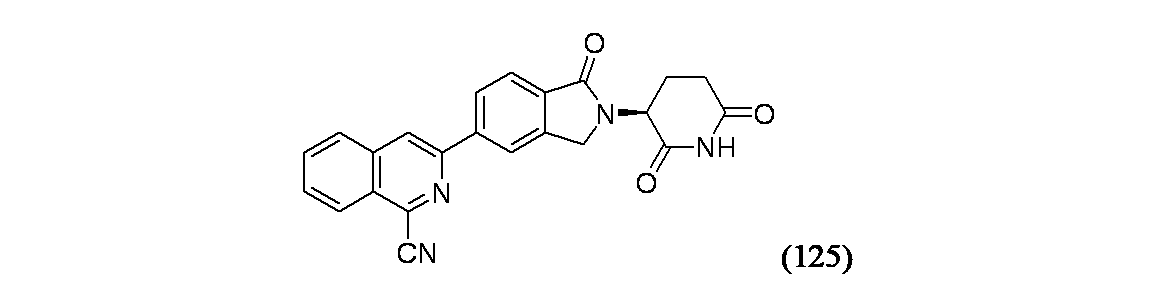
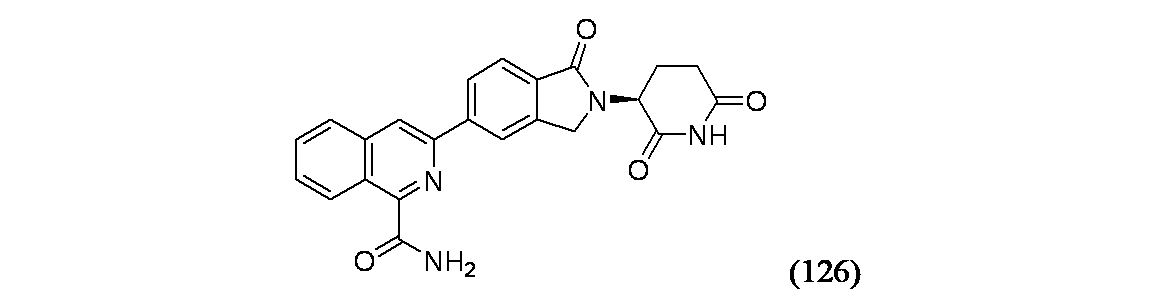
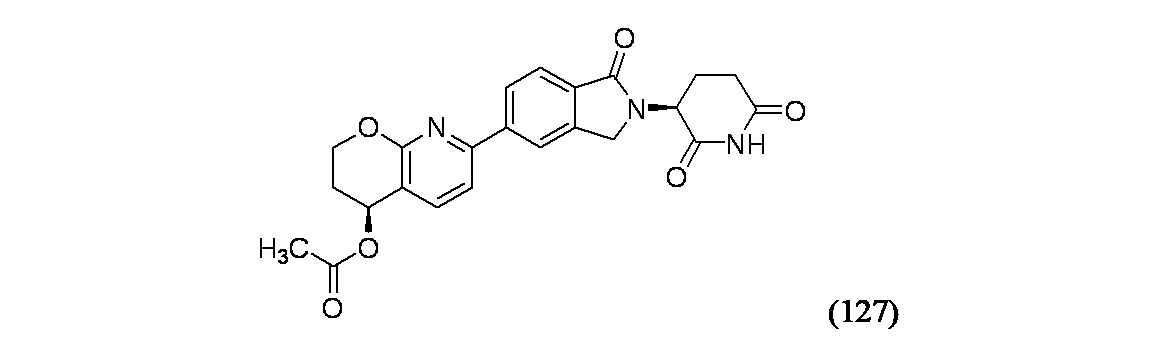
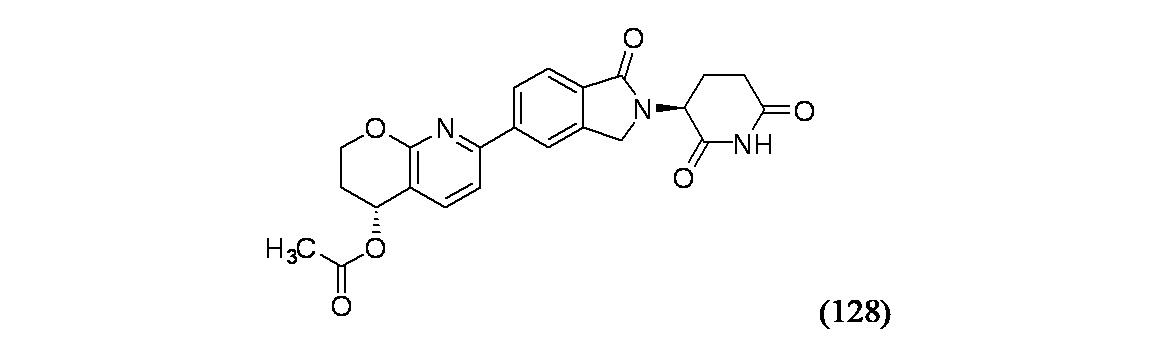
イソキノリン-4-カルボニトリル(90); 3-(1-オキソ-5-(キナゾリン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(91); 3-(5-(6-メチル-5-オキソ-5,6,7,8-テトラヒドロ-1,6-ナフチリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(92); 3-(5-(3-クロロキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(93); 3-(5-(3-メトキシキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(94); 3-(5-(3-(エチルアミノ)キノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(95); 3-(5-(3-ヒドロキシキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(96); 3-(5-(3-シクロプロピルキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(97); 3-(5-(3-イソプロピルキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(98); 3-(1-オキソ-5-(3-フェニルキノキサリン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(99); 3-(5-(1,6-ナフチリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(100); 3-(5-(6-アミノ-3-ブロモピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(101); 3-(5-(6-アミノイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(102); 3-(5-(4-メトキシイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(103); 3-(5-(3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(104); 3-(5-(4-(ベンジルオキシ)イソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(105); 3-(5-(6-アミノ-3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(106); 3-(5-(3-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(107); 3-(5-(4-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(108); 3-(1-オキソ-5-(ピリジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(109); 2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソニコチノニトリル(110); 2-(2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-4-イル)アセトニトリル(111); 3-(5-(6-アミノ-4-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(112); 3-(5-(2,3-ジヒドロ-1H-ピロロ[2,3-c]ピリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(113); 3-(1-オキソ-5-(2-オキソ-2,3-ジヒドロ-1H-ピロロ[2,3-b]ピリジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(114); 3-(1-オキソ-5-(5,6,7,8-テトラヒドロイソキノリン-3-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(115); 3-(5-(6-アミノ-5-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(116); 3-(5-(5,6-ジアミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(117); 3-(1-オキソ-5-(1,2,3,4-テトラヒドロピリド[2,3-b]ピラジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(118); 3-(5-(5-アミノ-4,6-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(119); 3-(5-(6-アミノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(120); 3-(5-(4,5-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(121); (3S)-3-[5-(1,8-ナフチリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(122); (S)-3-(5-(3-アミノイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(123); (S)-N-(1-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソキノリン-3-イル)アセトアミド(124); 3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボニトリル(125); 3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボキサミド(126); (4S)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート(127); (4R)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート(128); 3-{5-[7-クロロ-4-(ジメチルアミノ)イソキノリン-1-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(129); 1-アミノ-3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]-N,N-ジメチルイソキノリン-4-カルボキサミド(130); 3-[5-(1-アミノ-4-メチルイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(131); 3-[5-(6-アミノ-3-シクロプロピルピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(132); 3-[5-(6-アミノイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(133); N-{1-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-6-イル}アセトアミド(134); 3-{5-[6-アミノ-4-(クロロメチル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(135); 3-(1-オキソ-5-{5H,6H,7H,8H,9H-ピリド[2,3-b]アゼピン-2-イル}-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(136); 3-[1-オキソ-5-(5,6,7,8-テトラヒドロ-1,8-ナフチリジン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(137); 3-{5-[6-(2,2-ジメチルヒドラジン-1-イル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(138); 3-(5-(1H-イミダゾ[4,5-b]ピリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(139); 3-(5-(6-アミノ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(140); 3-(5-(3,4-ジヒドロ-2H-ピリド[3,2-b][1,4]オキサジン-6-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(141); 3-(5-(6-アミノピラジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(142); 3-(5-(2-アミノ-6-メチルピリミジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(143); 3-(5-(4,6-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(144); 3-(5-(5-クロロ-3-ヒドロキシイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(145); 3-(5-(6-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(146); 3-(5-(6-ヒドロキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(147); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル(148); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソニコチノニトリル(149); 3-(5-(1-アミノ-5,6,7,8-テトラヒドロイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(150); 3-(5-(6-アミノ-4,5-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(151); 6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル(152); 3-(5-(6-アミノ-5-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(153); 3-(5-(6-アミノ-5-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(154); 3-[5-(6-メトキシピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(155); 3-[5-(1-メトキシイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(156); 3-[1-オキソ-5-(1-オキソ-1,2-ジヒドロイソキノリン-3-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(157); 3-(5-{1-ベンジル-1H-ピロロ[3,2-c]ピリジン-6-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(158); 3-(1-オキソ-5-(1H-ピロロ[3,2-c]ピリジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(159); 3-(1-オキソ-5-(1H-ピロロ[3,2-c]ピリジン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(160); 3-(5-(1-ベンジル-1H-ピロロ[3,2-c]ピリジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(161); 6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピコリノニトリル(162); 3-(5-(6-アミノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(163); 3-(5-(6-アミノ-4-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(164); 3-(5-(6-アミノ-4-クロロピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(165); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(166); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-3,5-ジカルボニトリル(168); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-フルオロニコチノニトリル(169); 3-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(170); 6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル(171); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル(172); 6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル(173); 6-アミノ-4-(ジフルオロメチル)-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(174); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-(トリフルオロメチル)ニコチン-ニトリル(175); 2-アミノ-4-(ジフルオロメチル)-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(176); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル(177); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル(178); 6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル(179); 6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メチルニコチノニトリル(180); 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メトキシニコチノニトリル(181); 6-アミノ-5-シクロプロピル-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(182); 2-アミノ-5-シクロプロピル-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(183); 3-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(184); 3-(5-(6-アミノ-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオ
ン(185); 3-(5-(4-(4-アセチルピペラジン-1-イル)-6-アミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(186); 3-(5-(4-メチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(187); 3-(5-(6-(エチルアミノ)-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(188);または3-(5-(4,5-ジメチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(189)である、式(I)の化合物またはその塩を提供する。
アイソフォーム1(UniProt Q9UKS7-1)
METEAIDGYITCDNELSPEREHSNMAIDLTSSTPNGQHASPSHMTSTNSVKLEMQSDEECDRKPLSREDEIRGHDEGSSLEEPLIESSEVADNRKVQELQGEGGIRLPNGKLKCDVCGMVCIGPNVLMVHKRSHTGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCSYACRRRDALTGHLRTHSVGKPHKCNYCGRSYKQRSSLEEHKERCHNYLQNVSMEAAGQVMSHHVPPMEDCKEQEPIMDNNISLVPFERPAVIEKLTGNMGKRKSSTPQKFVGEKLMRFSYPDIHFDMNLTYEKEAELMQSHMMDQAINNAITYLGAEALHPLMQHPPSTIAEVAPVISSAYSQVYHPNRIERPISRETADSHENNMDGPISLIRPKSRPQEREASPSNSCLDSTDSESSHDDHQSYQGHPALNPKRKQSPAYMKEDVKALDTTKAPKGSLKDIYKVFNGEGEQIRAFKCEHCRVLFLDHVMYTIHMGCHGYRDPLECNICGYRSQDRYEFSSHIVRGEHTFH(配列番号: 1)
アイソフォーム2(UniProt Q9UKS7-2)
METEAIDGYITCDNELSPEREHSNMAIDLTSSTPNGQHASPSHMTSTNSVKLEMQSDEECDRKPLSREDEIRGHDEGSSLEEPLIESSEVADNRKVQELQGEGGIRLPNGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCSYACRRRDALTGHLRTHSVGKPHKCNYCGRSYKQRSSLEEHKERCHNYLQNVSMEAAGQVMSHHVPPMEDCKEQEPIMDNNISLVPFERPAVIEKLTGNMGKRKSSTPQKFVGEKLMRFSYPDIHFDMNLTYEKEAELMQSHMMDQAINNAITYLGAEALHPLMQHPPSTIAEVAPVISSAYSQVYHPNRIERPISRETADSHENNMDGPISLIRPKSRPQEREASPSNSCLDSTDSESSHDDHQSYQGHPALNPKRKQSPAYMKEDVKALDTTKAPKGSLKDIYKVFNGEGEQIRAFKCEHCRVLFLDHVMYTIHMGCHGYRDPLECNICGYRSQDRYEFSSHIVRGEHTFH(配列番号: 2)
アイソフォーム4(UniProt Q9UKS7-4)
METEAIDGYITCDNELSPEREHSNMAIDLTSSTPNGQHASPSHMTSTNSVKLEMQSDEECDRKPLSREDEIRGHDEGSSLEEPLIESSEVADNRKVQELQGEGGIRLPNGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCSYACRRRDALTGHLRTHSVGKPHKCNYCGRSYKQRSSLEEHKERCHNYLQNVSMEAAGQVMSHHGEKLMRFSYPDIHFDMNLTYEKEAELMQSHMMDQAINNAITYLGAEALHPLMQHPPSTIAEVAPVISSAYSQVYHPNRIERPISRETADSHENNMDGPISLIRPKSRPQEREASPSNSCLDSTDSESSHDDHQSYQGHPALNPKRKQSPAYMKEDVKALDTTKAPKGSLKDIYKVFNGEGEQIRAFKCEHCRVLFLDHVMYTIHMGCHGYRDPLECNICGYRSQDRYEFSSHIVRGEHTFH(配列番号: 3)
アイソフォーム6(UniProt Q9UKS7-6)
METEAIDGYITCDNELSPEREHSNMAIDLTSSTPNGQHASPSHMTSTNSVKLEMQSDEECDRKPLSREDEIRGHDEGSSLEEPLIESSEVADNRKVQELQGEGGIRLPNGKLKCDVCGMVCIGPNVLMVHKRSHTGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCSYACRRRDALTGHLRTHSVGKPHKCNYCGRSYKQRSSLEEHKERCHNYLQNVSMEAAGQVMSHHDS(配列番号: 4)
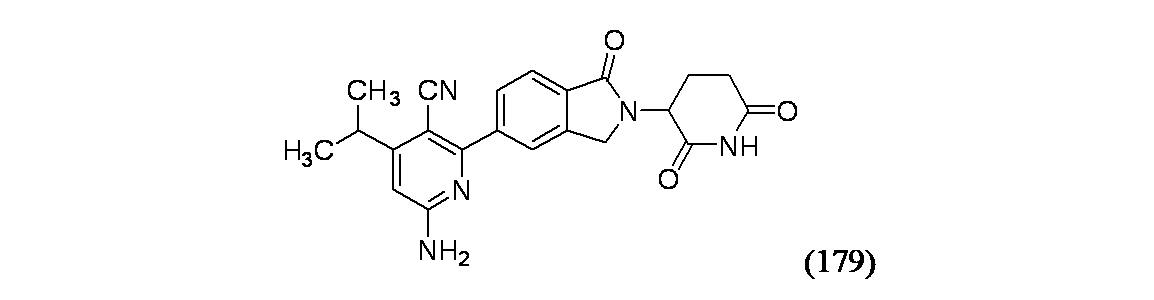
アイソフォーム7(UniProt Q9UKS7-7)
METEAIDGYITCDNELSPEREHSNMAIDLTSSTPNGQHASPSHMTSTNSVKLEMQSDEECDRKPLSREDEIRGHDEGSSLEEPLIESSEVADNRKVQELQGEGGIRLPNGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCSYACRRRDALTGHLRTHSVPPMEDCKEQEPIMDNNISLVPFERPAVIEKLTGNMGKRKSSTPQKFVGEKLMRFSYPDIHFDMNLTYEKEAELMQSHMMDQAINNAITYLGAEALHPLMQHPPSTIAEVAPVISSAYSQVYHPNRIERPISRETADSHENNMDGPISLIRPKSRPQEREASPSNSCLDSTDSESSHDDHQSYQGHPALNPKRKQSPAYMKEDVKALDTTKAPKGSLKDIYKVFNGEGEQIRAFKCEHCRVLFLDHVMYTIHMGCHGYRDPLECNICGYRSQDRYEFSSHIVRGEHTFH(配列番号: 5)
アイソフォーム1(UniProt Q9H2S9-1)
MHTPPALPRRFQGGGRVRTPGSHRQGKDNLERDPSGGCVPDFLPQAQDSNHFIMESLFCESSGDSSLEKEFLGAPVGPSVSTPNSQHSSPSRSLSANSIKVEMYSDEESSRLLGPDERLLEKDDSVIVEDSLSEPLGYCDGSGPEPHSPGGIRLPNGKLKCDVCGMVCIGPNVLMVHKRSHTGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCNYACRRRDALTGHLRTHSVSSPTVGKPYKCNYCGRSYKQQSTLEEHKERCHNYLQSLSTEAQALAGQPGDEIRDLEMVPDSMLHSSSERPTFIDRLANSLTKRKRSTPQKFVGEKQMRFSLSDLPYDVNSGGYEKDVELVAHHSLEPGFGSSLAFVGAEHLRPLRLPPTNCISELTPVISSVYTQMQPLPGRLELPGSREAGEGPEDLADGGPLLYRPRGPLTDPGASPSNGCQDSTDTESNHEDRVAGVVSLPQGPPPQPPPTIVVGRHSPAYAKEDPKPQEGLLRGTPGPSKEVLRVVGESGEPVKAFKCEHCRILFLDHVMFTIHMGCHGFRDPFECNICGYHSQDRYEFSSHIVRGEHKVG(配列番号: 7)
アイソフォーム2(UniProt Q9H2S9-2)
MDSRYLQLQLYLPSCSLLQGSGDSSLEKEFLGAPVGPSVSTPNSQHSSPSRSLSANSIKVEMYSDEESSRLLGPDERLLEKDDSVIVEDSLSEPLGYCDGSGPEPHSPGGIRLPNGKLKCDVCGMVCIGPNVLMVHKRSHTGERPFHCNQCGASFTQKGNLLRHIKLHSGEKPFKCPFCNYACRRRDALTGHLRTHSVSSPTVGKPYKCNYCGRSYKQQSTLEEHKERCHNYLQSLSTEAQALAGQPGDEIRDLEMVPDSMLHSSSERPTFIDRLANSLTKRKRSTPQKFVGEKQMRFSLSDLPYDVNSGGYEKDVELVAHHSLEPGFGSSLAFVGAEHLRPLRLPPTNCISELTPVISSVYTQMQPLPGRLELPGSREAGEGPEDLADGGPLLYRPRGPLTDPGASPSNGCQDSTDTESNHEDRVAGVVSLPQGPPPQPPPTIVVGRHSPAYAKEDPKPQEGLLRGTPGPSKEVLRVVGESGEPVKAFKCEHCRILFLDHVMFTIHMGCHGFRDPFECNICGYHSQDRYEFSSHIVRGEHKVG(配列番号: 8)
式(I)の化合物は、がんの治療に有用である。
また、本発明は、治療上有効量の1以上の式(I)の化合物を含み、1以上の医薬的に許容される担体(添加剤)および/または希釈剤、および適宜上述した1以上のさらなる治療剤と共に製剤化される医薬組成物も提供する。
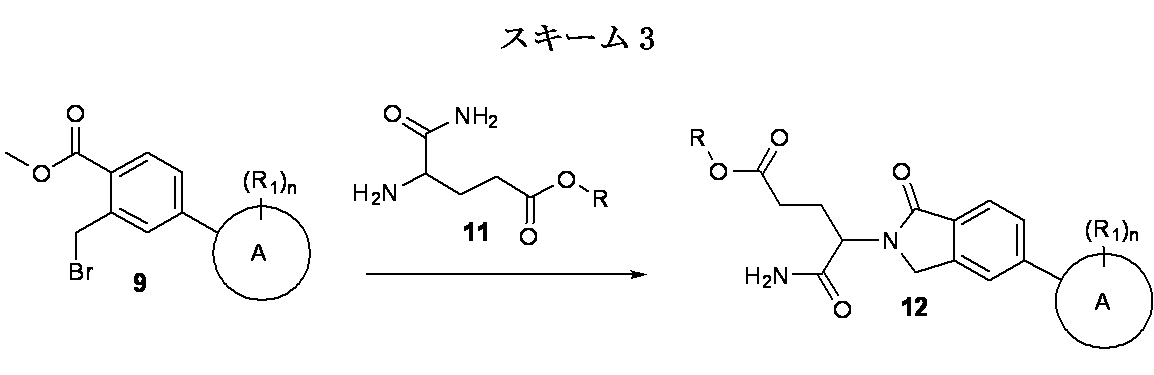
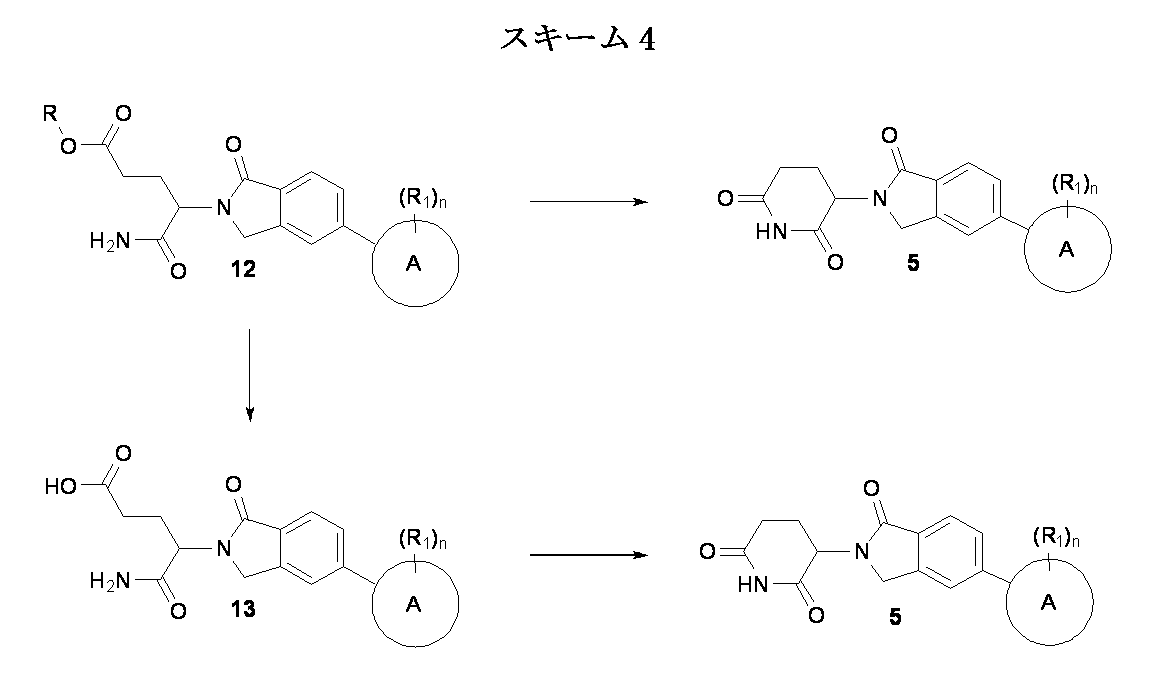
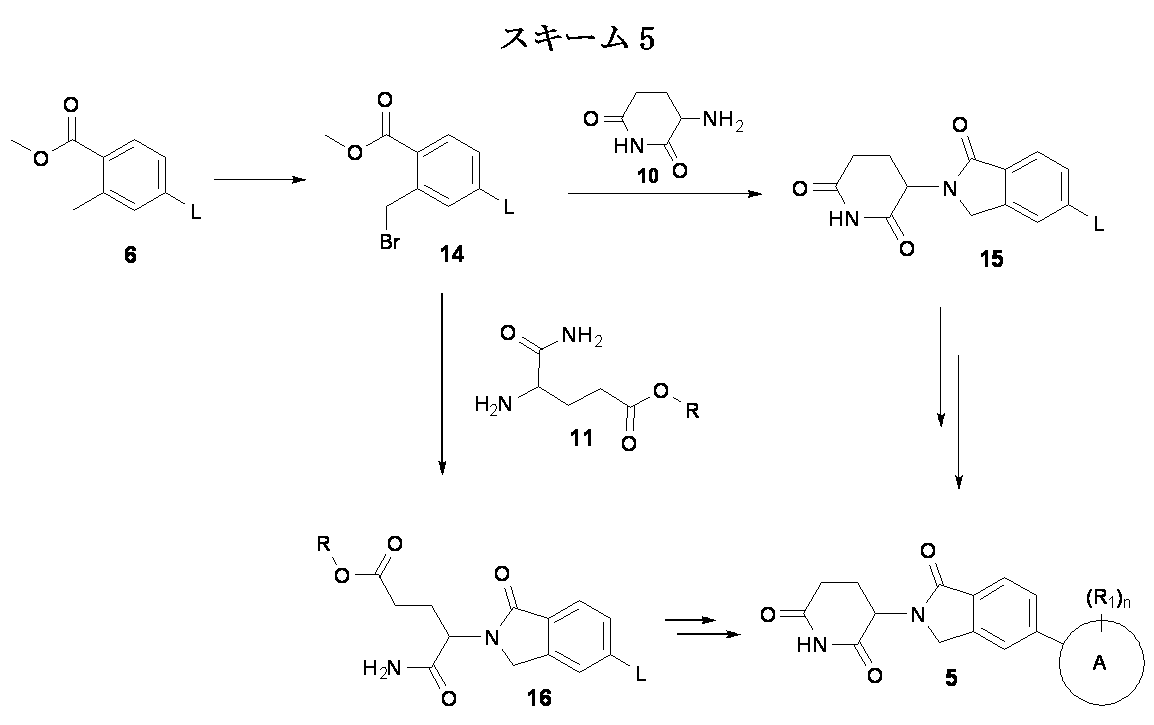
本発明の化合物は、有機合成の分野の当業者に公知の、多くの方法によって製造され得る。本発明の化合物は下記の方法を、有機合成化学の技術において公知の合成方法を用いて、または該当業者に評価されているそれらの類似合成方法を用いて合成出来る。好ましい方法としてはこれらに限定されないが、下記の方法が挙げられる。本明細書で引用する全ての文献はその全てが援用される。
下記の実施例は特定の本発明の実施態様を説明するものであり、本発明の範囲を制限するものではない。化学的略語および記号、並びに科学的略語および記号は、特に断りが無いない限りその一般的および慣用的意味をもつ。実施例および本明細書の各所に用いられる、さらなる略語は上記で定義される。共通の中間体は、一般に1つ以上の実施例の製造に有用である。実施例の化合物は、それらが製造される実施例およびステップにより特定され(例えば、「1-A」は実施例1のステップAを表す)、または化合物が実施例の表題化合物である場合のみ、実施例により特定される(例えば、「1」は実施例1の表題化合物を表す)。ある場合には、中間体または実施例の代替製造方法が記載される。合成分野の熟練の化学者は頻繁に、1つ以上の検討(例えば、より短い反応時間、より安価な出発物質、操作および精製の容易さ、より高い収率、触媒の容易さ、毒性試薬の回避、特殊な機器での利用可能性、およびステップ数の削減など)に基づいて望ましい代替製造方法を考案しうる。代替製造方法を記載する意図は、本発明の実施例をさらに製造し易くするためである。ある場合には、概略した実施例および請求項におけるいくつかの官能基は、当業者に公知の生物学的等比体積置換(例えば、カルボン酸基をテトラゾールまたはホスフェート部分と置換)により置換されてもよい。
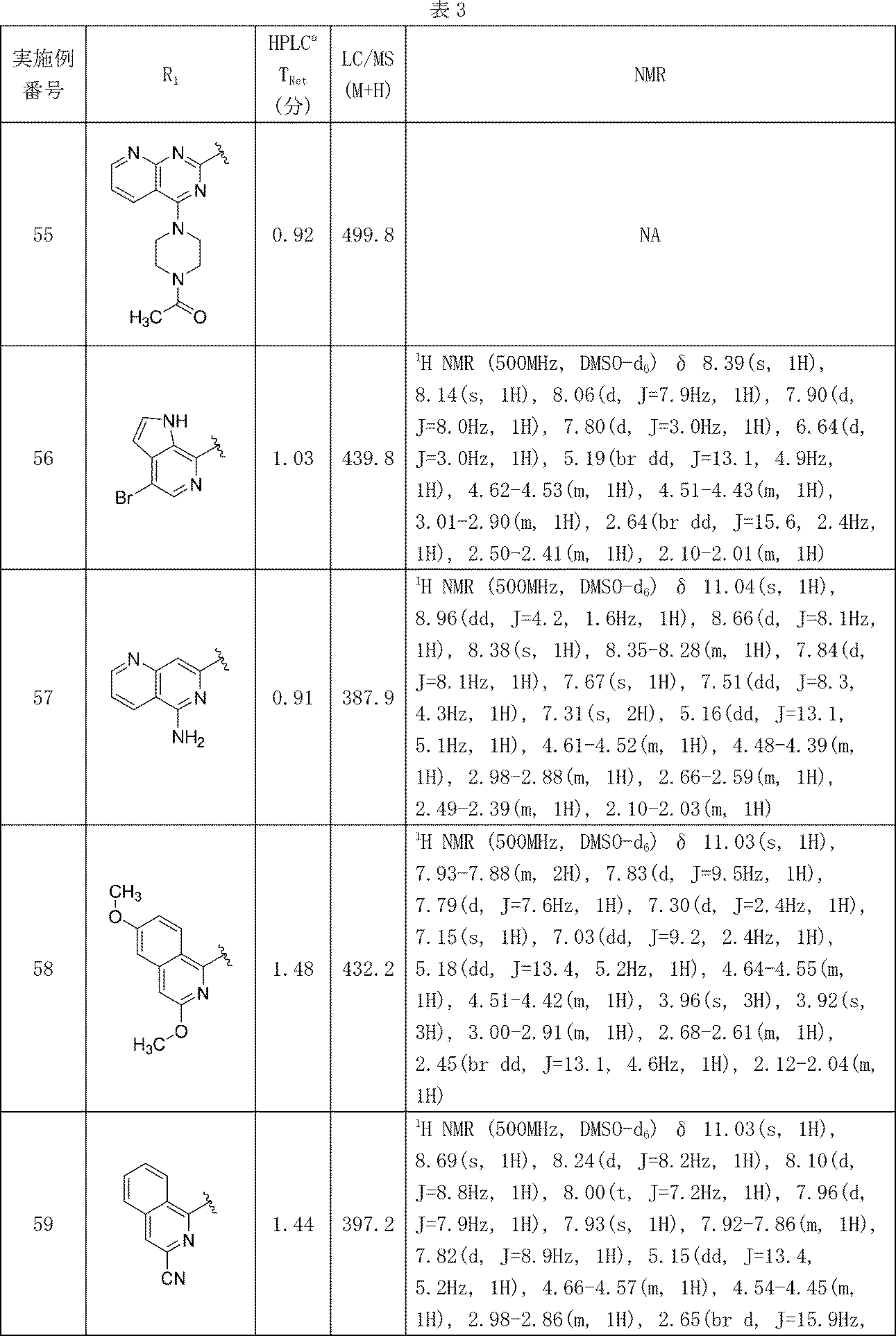
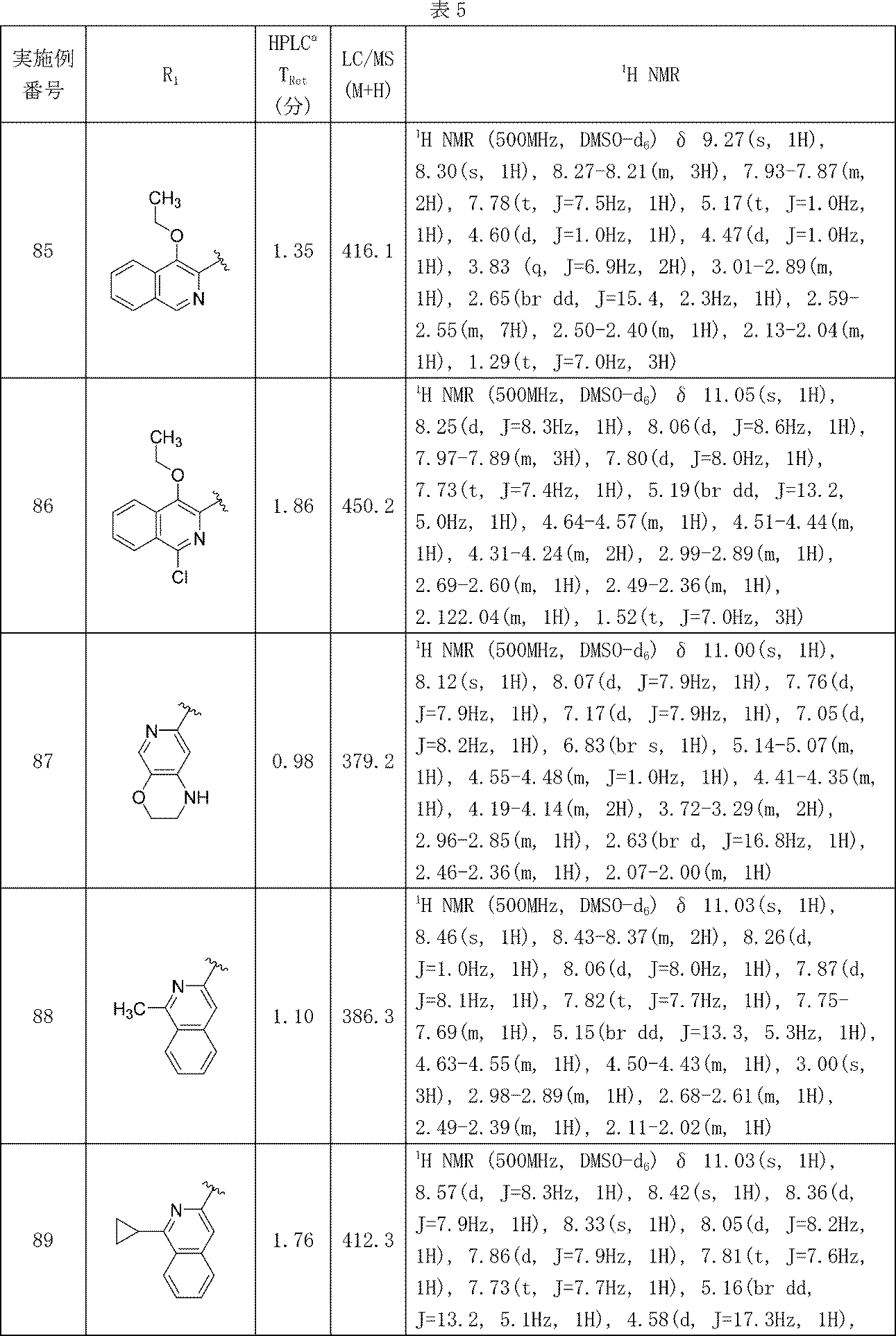
分析HPLC方法1: Waters XBridge C18、2.1mm x50mm、粒子径: 1.7μm; 移動相A: 5:95 アセトニトリル:水(0.1%トリフルオロ酢酸); 移動相B: 95:5 アセトニトリル:水(0.1%トリフルオロ酢酸); 温度: 50℃; グラジエント: 0%B~100%Bで3分かけて溶出後、次いで100%Bで0.50分間溶出; 流速: 1mL/分; 検出: MSおよびUV(220nm)
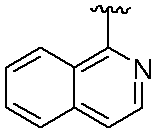
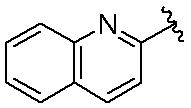
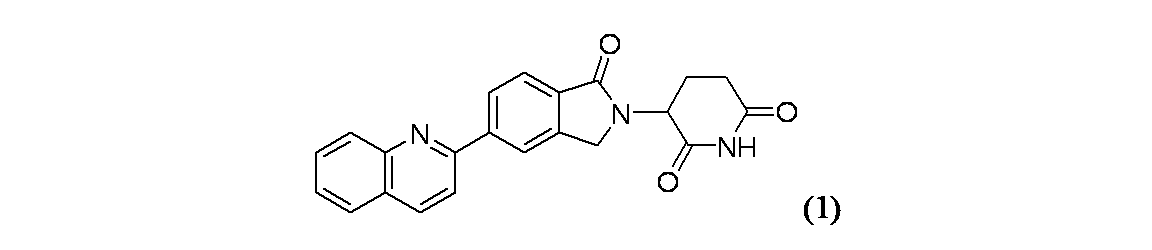
3-(1-オキソ-5-(キノリン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン
tert-ブチル(S)-4,5-ジアミノ-5-オキソペンタノエート塩酸塩(14.46g、60.6mmol)/アセトニトリル(231mL)の懸濁液に、DIEA(20.2mL、115mmol)を0℃で加えた。15分間撹拌後、この反応混合物を固体の4-ブロモ-2-(ブロモメチル)安息香酸メチル(22g、57.7mmol)で複数回に分けて5分かけて処理し、0℃で30分間撹拌した。次いで室温で終夜撹拌し、還流冷却器をつけてこの反応混合物をオイルバスで60℃に加温し、終夜同温度で保持した。この反応混合物を撹拌しながら室温に冷却し、室温に冷却後、沈殿が形成された。そのフラスコを0℃の水浴に撹拌しながら加えた。30分後、固体を濾過により回収し、最小限の冷アセトニトリルで濯ぎ、風乾し、20.13g(88%収率)を白色固体として得た。キラル分析HPLC解析にて、この物質がee>98%であることが示された。MS(ES): m/z=397.1 [M+H]+; 1H NMR(400MHz、CDCl3) δ 7.76-7.71(m, 1H), 7.68-7.62(m, 2H), 6.22(br s, 1H), 5.31(br s, 1H), 4.91(dd, J=8.7, 6.3Hz, 1H), 4.62-4.53(m, 1H), 4.51-4.40(m, 1H), 2.47-2.10(m, 4H), 1.44(s, 9H)
乾燥したフラスコに生成物1A(10.0g、25.2mmol)、4,4,4',4',5,5,5',5'-オクタメチル-2,2'-ビ(1,3,2-ジオキサボロラン)(7.67g、30.2mmol)、および酢酸カリウム(7.41g、76mmol)を加え、窒素で置換した。固体をジオキサン(100mL)に懸濁し、窒素気流下で5分間撹拌しながら脱気した。この反応混合物を[1,1'-ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(0.737g、1.007mmol)で処理し、5分間脱気し、密封し、60℃で18時間加熱した。この反応混合物をEtOAcで希釈し、セライト濾過し、さらにEtOAcで濯いだ。濾液を濃縮し、ISCO(220gシリカゲルカラム、0%→20%B/DCM、B=15%EtOH/EtOAc+0.1%TEA)で精製し、生成物1B(9.9g、89%収率)を白色固体として得た。MS(ES): m/z=445.3 [M+H]+; 1H NMR(400MHz、CDCl3) δ 7.99-7.90(m, 2H), 7.88-7.83(m, 1H), 6.32(br s, 1H), 5.36(br s, 1H), 4.97-4.88(m, 1H), 4.58-4.41(m, 2H), 2.48-2.13(m, 4H), 1.44(s, 9H), 1.39(s, 12H)
バイアルに生成物1B(30mg、0.068mmol)および2-クロロキノリン(16.57mg、0.101mmol)を加え、窒素で置換した。固体をジオキサン(540μL)に懸濁し、炭酸セシウム(2M水溶液、101μL、0.203mmol)で処理し、窒素気流下で5分間撹拌しながら脱気した。この反応混合物を[1,1'-ビス(ジフェニルホスフィノ)フェロセン]ジクロロパラジウム(II)(4.94mg、6.75μmol)で処理し、5分間脱気し、密封し、90℃で終夜加熱した。この反応混合物をセライトで処理し、EtOAcで希釈し、濾過し、濃縮した。この混合物を2つのTeflonライン入りスクリューキャップバイアル中に同体積で分け、このバイアルの片方にアセトニトリル(0.3mL)およびベンゼンスルホン酸(10.7mg、0.068mmol)を加えた。反応バイアルを密封し、90℃に予熱した湯浴中に置き、同温度で1.25時間維持した。この反応混合物を窒素気流下で濃縮し、DMFで2mLに希釈し、分取HPLC方法1で精製し、実施例1(7.1mg、28%収率)を得た。光学純度は決定していない。MS(ES): m/z=372.0 [M+H]+; 1H NMR(400MHz、DMSO-d6) δ 11.05(s, 1H), 8.58-8.49(m, 2H), 8.44(br d, J=8.0Hz, 1H), 8.25(br d, J=8.5Hz, 1H), 8.13(d, J=8.5Hz, 1H), 8.05(d, J=8.1Hz, 1H), 7.92(d, J=8.0Hz, 1H), 7.83 (t, J=7.5Hz, 1H), 7.71-7.61(m, 1H), 5.17(br dd, J=13.2, 4.5Hz, 1H), 4.68-4.42(m, 2H), 3.00-2.89(m, 1H), 2.64(br d, J=18.3Hz, 1H), 2.49-2.39(m, 1H), 2.12-2.01(m, 1H)
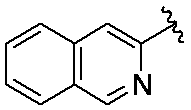
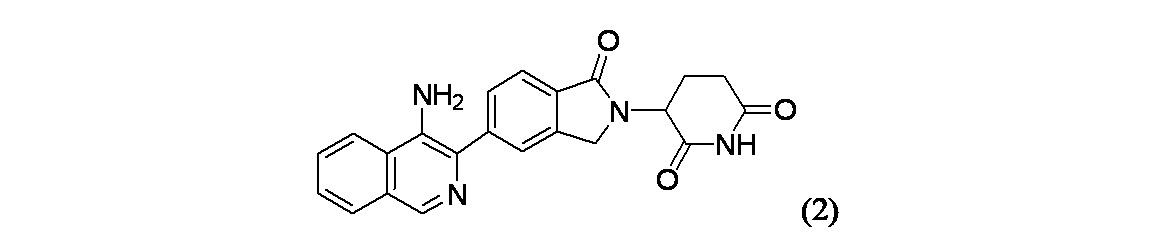
3-(5-(4-アミノイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-{5-[5-アミノ-1-(2,2-ジメチルプロピル)-4-オキソ-1,4-ジヒドロ-1,6-ナフチリジン-7-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
3-[5-(5-アミノ-4-オキソ-1,4-ジヒドロ-1,6-ナフチリジン-7-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
N-{3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-1-イル}アセトアミド
10mLのバイアルに、3-クロロイソキノリン-1-アミン(30mg、0.168mmol)、DCM(5mL)、および塩化アセチル(65.9mg、0.840mmol)、続いてヒューニッヒ塩基(0.044mL、0.252mmol)を加え、室温で1時間撹拌した。メタノール(1mL)を加えて反応をクエンチし、反応溶液を濃縮した。得られた粗製生成物は精製せずに用いた。MS(ES): m/z=221.0 [M+H]+
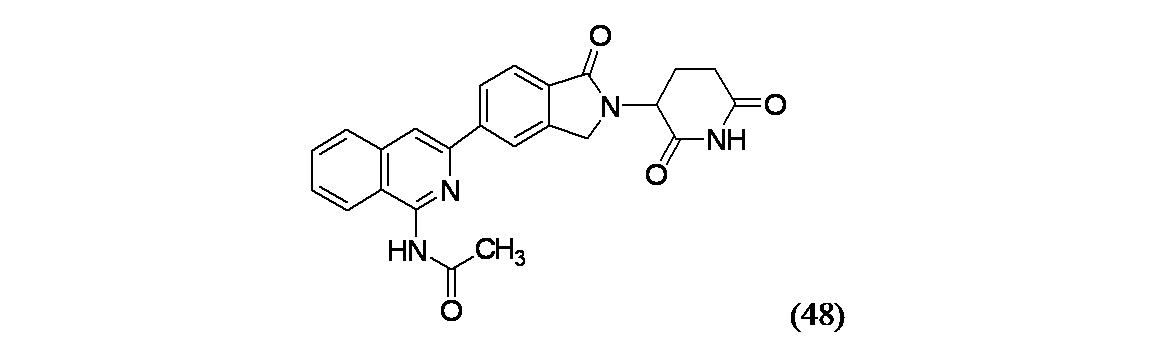
バイアルに生成物48A(21.85mg、0.099mmol)、生成物1B(44mg、0.099mmol)、Pd(PPh3)4(11.44mg、9.90μmol)、およびジオキサン(1mL)を加え、これにNaHCO3(0.5M水溶液、0.594mL、0.297mmol)を加えた。バイアルを密封し、窒素置換した。この混合物を150℃で15分間マイクロ波により加熱し、反応混合物を濃縮乾固し、ベンゼンスルホン酸溶液(0.72g/ACN(20mL))を2mL加えた。バイアルを密封し、130℃で7分間マイクロ波により加熱した。溶媒を除去し、得られた残渣をDMSO(2mL)に溶解した。この混合物を濾過し、分取HPLC方法4で精製し、実施例48(4.8mg、11%収率)を得た。MS(ES): m/z=430.3 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 10.65(s, 1H), 8.47(s, 1H), 8.44(s, 1H), 8.37(d, J=7.9Hz, 1H), 8.10(d, J=8.3Hz, 1H), 8.08(d, J=8.3Hz, 1H), 7.89(d, J=8.0Hz, 1H), 7.82(t, J=7.4Hz, 1H), 7.68(t, J=7.7Hz, 1H), 5.16(dd, J=13.2, 5.1Hz, 1H), 4.59(d, J=17.4Hz, 1H), 4.50-4.42(m, 1H), 2.99-2.88(m, 1H), 2.64(br dd, J=16.5, 2.7Hz, 1H), 2.48-2.41(m, 1H), 2.29(s, 3H), 2.10-2.01(m, 1H)
3-{5-[1-(ジメチルアミノ)イソキノリン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
バイアルに3-クロロイソキノリン-1-アミン(25mg、0.140mmol)、THF(2mL)、およびヨードメタン(49.7mg、0.350mmol)、続いてNaH(56.0mg、1.400mmol)を加え、室温で1時間撹拌した。メタノール(1mL)を加えて反応をクエンチし、この反応混合物を濃縮乾固し、得られた粗製生成物49A(39mg、定量)を精製せずに用いた。
MS(ES): m/z=207.1 [M+H]+
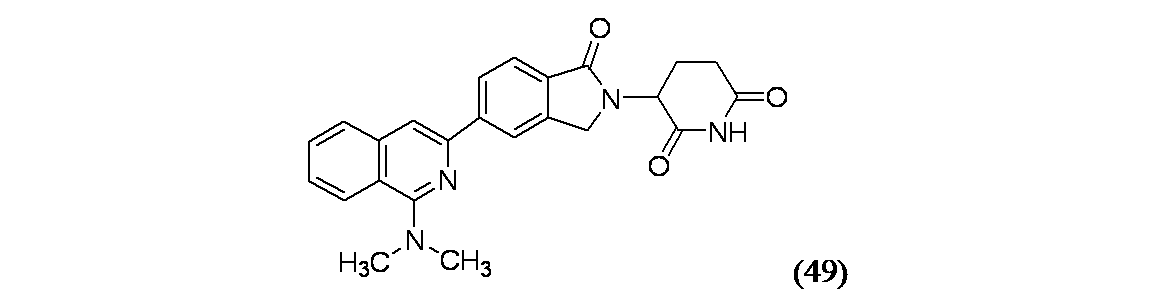
生成物49A(20.5mg、0.099mmol)、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(55.1mg、0.124mmol)、Pd(PPh3)4(11.46mg、9.92μmol)およびジオキサン(1mL)をバイアルに加え、続いてNaHCO3(0.5M水溶液、0.595mL、0.298mmol)を加えた。バイアルを密封し、窒素置換した。この混合物をマイクロ波により140℃で10分間加熱し、反応混合物を濃縮乾固し、2mLのベンゼンスルホン酸溶液(0.72g/ACN(20mL))で処理し、130℃で7分間マイクロ波により加熱した。溶媒を除去し、得られた残渣をDMSO(2mL)に溶解し、濾過し、分取HPLC方法5で精製し、実施例49(15.4mg、38%収率)を得た。MS(ES): m/z=415.4 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.02(s, 1H), 8.43(s, 1H), 8.38(d, J=7.9Hz, 1H), 8.16(d, J=8.5Hz, 1H), 8.00(s, 1H), 7.95(d, J=8.2Hz, 1H), 7.85(d, J=7.9Hz, 1H), 7.71(t, J=7.6Hz, 1H), 7.58(t, J=7.6Hz, 1H), 5.15(dd, J=13.4, 5.2Hz, 1H), 4.62-4.53(m, 1H), 4.49-4.41(m, 1H), 3.17(s, 6H), 2.98-2.87(m, 1H), 2.64(br d, J=17.7Hz, 1H), 2.44 (qd, J=13.2, 4.4Hz, 1H), 2.12-2.00(m, 1H)
3-{5-[1-(メチルアミノ)イソキノリン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
バイアルに3-クロロイソキノリン-1-アミン(60mg、0.336mmol)、THF(2mL)、およびヨードメタン(52.4mg、0.370mmol)、続いてNaH(67.2mg、1.680mmol)を加え、室温で1時間撹拌した。メタノール(1mL)を加えて反応をクエンチし、この反応混合物を濃縮乾固した。得られた物質を分取HPLC方法6で精製し、生成物50A(23mg、36%収率)を得た。MS(ES): m/z=193.1 [M+H]+
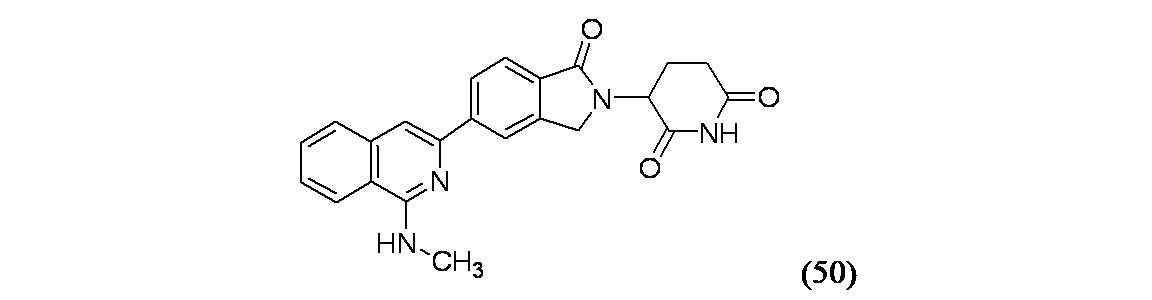
この化合物を、生成物50Aを用いて3-{5-[1-(ジメチルアミノ)イソキノリン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオンを製造する一般的な方法に従って製造した。MS(ES): m/z=401.3 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 8.43(s, 1H), 8.38(br d, J=7.8Hz, 1H), 8.22(br d, J=8.1Hz, 1H), 7.86-7.79(m, 2H), 7.70-7.62(m, 2H), 7.52(br t, J=7.5Hz, 1H), 5.16(br dd, J=13.0, 4.5Hz, 1H), 4.62-4.53(m, 1H), 4.48-4.37(m, 1H), 3.13(br d, J=2.5Hz, 3H), 2.93(br dd, J=12.8, 4.2Hz, 1H), 2.68-2.60(m, 1H), 2.48-2.39(m, 1H), 2.10-2.02(m, 1H)
3-{5-[5-(メチルアミノ)-1,6-ナフチリジン-7-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
バイアルに5,7-ジクロロ-1,6-ナフチリジン(250mg、1.256mmol)およびメタンアミン(40%水溶液、2mL)を加え、バイアルを密封し、40℃で終夜加熱した。この反応混合物を濃縮乾固し、分取HPLC方法7で精製し、生成物51A(121mg、50%収率)を得た。MS(ES): m/z=194.1 [M+H]+; 1H NMR(400MHz、DMSO-d6) δ 8.90(dd, J=4.2, 1.3Hz, 1H), 8.67(d, J=8.2Hz, 1H), 8.28(br d, J=3.5Hz, 1H), 7.49(dd, J=8.4, 4.3Hz, 1H), 6.95(s, 1H), 2.96(d, J=4.5Hz, 3H)
バイアルに生成物1B(40mg、0.090mmol)、生成物51A(14.53mg、0.075mmol)、Pd(PPh3)4(8.67mg、7.50μmol)およびジオキサン(0.5mL)、続いてNaHCO3(0.5M水溶液、0.450mL、0.225mmol)を加え、密封し、窒素置換した。この混合物を130℃で15分間マイクロ波により加熱し、EtOAcおよび食塩水で希釈した。有機層を分離し、MgSO4で乾燥し、濃縮した。得られた残渣を1mLのベンゼンスルホン酸溶液(0.72g/ACN(20mL))に溶解し、130℃で10分間マイクロ波により加熱した。溶媒を除去し、得られた残渣をDMSO(2mL)に溶解し、濾過し、分取HPLC方法8で精製し、実施例51(9.0mg、30%収率)を得た。MS(ES): m/z=402.3 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 9.00-8.94(m, 1H), 8.68(br d, J=8.3Hz, 1H), 8.46(s, 1H), 8.40(d, J=8.2Hz, 1H), 7.85(d, J=8.0Hz, 1H), 7.67(s, 1H), 7.55(dd, J=8.3, 4.4Hz, 1H), 5.16(br dd, J=13.3, 4.9Hz, 1H), 4.58(d, J=17.3Hz, 1H), 4.49-4.39(m, 1H), 3.14(br s, 3H), 2.99-2.87(m, 1H), 2.69-2.59(m, 1H), 2.48-2.38(m, 1H), 2.12-2.00(m, 1H)
N-{3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-1-イル}-N-メチルアセトアミド
バイアルに3-クロロ-N-メチルイソキノリン-1-アミン(13mg、0.067mmol)、DCM(5mL)、および無水酢酸(344mg、3.37mmol)、続いてヒューニッヒ塩基(0.018mL、0.101mmol)を加え、80℃で1時間加熱した。この反応混合物を濃縮し、粗製生成物52Aは精製せずに用いた。
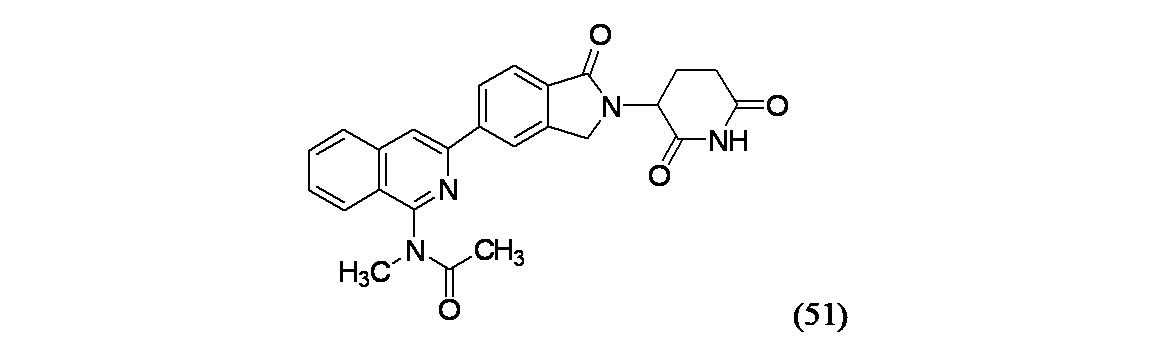
バイアルに生成物1B(35mg、0.079mmol)、生成物52A(12.0mg、0.051mmol)、Pd(PPh3)4(7.59mg、6.56μmol)、およびジオキサン(0.5mL)、続いてNaHCO3(0.5M水溶液、0.394mL、0.197mmol)を加え、密封し、窒素置換した。この反応混合物を130℃で15分間マイクロ波により加熱し、EtOAcおよび食塩水で希釈し、有機層を分離し、MgSO4で乾燥し、濾過し、濃縮した。得られた残渣を1mLのベンゼンスルホン酸溶液(0.72g/ACN(20mL))に溶解し、130℃で10分間マイクロ波により加熱し、次いで155℃で15分間加熱した。この反応混合物を濃縮し、DMSO(2mL)に溶解し、濾過し、分取HPLC方法8で精製し、実施例52(6.5mg、22%収率)を得た。MS(ES): m/z=442.9 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.10-10.99(m, 1H), 8.68(br d, J=0.9Hz, 1H), 8.44(s, 1H), 8.36(br d, J=8.1Hz, 1H), 8.20(br d, J=6.7Hz, 1H), 8.03(br d, J=7.8Hz, 1H), 7.96-7.86(m, 2H), 7.85-7.76(m, 1H), 5.16(br dd, J=13.3, 5.0Hz, 1H), 4.63-4.55(m, 1H), 4.51-4.42(m, 1H), 3.47(br s, 3H), 2.93(br d, J=3.5Hz, 1H), 2.68-2.60(m, 1H), 2.47-2.40(m, 1H), 2.10-2.02(m, 1H), 1.76(br s, 3H)
3-[5-(6-アミノ-1,7-ナフチリジン-8-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
バイアルに酢酸(0.1mL)および臭化水素(30%/酢酸、170mg、0.629mmol)を加え、0℃に冷却し、これに3-(シアノメチル)ピコリノニトリル(30mg、0.210mmol)を加えた。この混合物を0℃で10分間撹拌し、室温に加温し、1時間撹拌した。この反応混合物をEtOAc(10mL)で希釈し、NaHCO3飽和水溶液を加えてクエンチした。層を分離し、有機層を濃縮し、生成物53A(33mg、70%収率)を得た。MS(ES): m/z=224.0 [M+H]+; 1H NMR(400MHz、DMSO-d6) δ 8.60(dd, J=4.0, 1.5Hz, 1H), 8.03(dd, J=8.5, 1.3Hz, 1H), 7.49(dd, J=8.5, 4.0Hz, 1H), 7.26-6.83(br, 2H), 6.61(s, 1H)
バイアルに生成物1B(44.1mg、0.099mmol)、生成物53A(18.5mg、0.083mmol)、Pd(PPh3)4(9.56mg、8.27μmol)、およびジオキサン(0.5mL)、続いてNaHCO3(0.5M水溶液、0.496mL、0.248mmol)を加え、バイアルを密封し、窒素置換した。この混合物を130℃で15分間マイクロ波により加熱し、EtOAcおよび食塩水で希釈した。有機層を分離し、MgSO4で乾燥し、濾過し、濃縮した。得られた残渣を1mLのベンゼンスルホン酸溶液(0.72g/ACN(20mL))に溶解し、130℃で15分間マイクロ波により加熱した。この反応混合物を濃縮し、DMSO(2mL)に溶解し、濾過し、分取HPLC方法9で精製し、実施例53(12.2mg、38%収率)を得た。MS(ES): m/z=388.2 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 8.57(dd, J=3.9, 1.6Hz, 1H), 8.19(s, 1H), 8.11(d, J=8.3Hz, 1H), 8.06(dd, J=8.6, 1.4Hz, 1H), 7.84(d, J=7.9Hz, 1H), 7.46(dd, J=8.5, 3.9Hz, 1H), 6.71(s, 1H), 5.17(dd, J=13.4, 5.0Hz, 1H), 4.57(d, J=17.3Hz, 1H), 4.47-4.38(m, 1H), 2.99-2.88(m, 1H), 2.68-2.59(m, 1H), 2.49-2.39(m, 1H), 2.11-2.01(m, 1H)
3-[5-(3-アミノ-5-メトキシイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
バイアルに1-ブロモ-3-メトキシ-2-メチルベンゼン(800mg、3.98mmol)、N-ブロモスクシンイミド(744mg、4.18mmol)、およびCCl4(10mL)、続いてAIBN(16.33mg、0.099mmol)を加え、バイアルを密封し、75℃で終夜加熱した。この反応混合物を室温に冷却し、液体をピペットで除き、真空下で微量の溶媒を除くことにより沈殿を単離し、スクシンイミドを不純物として含む生成物を得た。得られた粗製生成物54Aは精製せずに用いた。1H NMR(400MHz、CDCl3) δ 7.22-7.14(m, 2H), 6.85(d, J=8.1Hz, 1H), 4.76(s, 2H), 3.92(s, 3H), 0.04-0.03(m, 1H)
バイアルに生成物54A(1150mg、4.11mmol)、シアン化カリウム(401mg、6.16mmol)、およびEtOH(10mL)、続いて水(3mL)を加え、1時間75℃で撹拌した。反応を飽和NaHCO3水溶液でクエンチし、この反応混合物をEtOAcで希釈した。有機層を分離し、濃縮し、ISCO(40gカラム、溶出溶媒: 1~35%EtOAc/Hex)で精製し、生成物54B(799mg、86%収率)を得た。1H NMR(400MHz、CDCl3) δ 7.25-7.18(m, 2H), 6.89(dd, J=7.2, 2.0Hz, 1H), 3.92(s, 3H), 3.91(s, 2H)
バイアルに生成物54B(250mg、1.106mmol)、ジシアノ亜鉛(78mg、0.664mmol)、キサントホス(19.20mg、0.033mmol)、およびPd2(dba)3(30.4mg、0.033mmol)、続いてDMF(5mL)を加え、窒素置換し、この混合物を130℃で1時間加熱した。冷却後、反応をLiCl水溶液でクエンチし、反応混合物をEtOAcで希釈した。有機層を分離し、濃縮し、分取HPLC方法10で精製し、生成物54C(115mg、60%収率)を得た。1H NMR(400MHz、CDCl3) δ 7.47(t, J=8.1Hz, 1H), 7.32(dd, J=7.8, 1.0Hz, 1H), 7.20(d, J=8.5Hz, 1H), 3.99(s, 3H), 3.91(s, 2H)
バイアルに酢酸(0.2mL)および臭化水素(30%/酢酸、329mg、1.22mmol)を加え、0℃に冷却した。これに生成物54C(35mg、0.203mmol)を加え、バイアルを密封し、0℃で10分間撹拌した。氷浴を除去し、反応混合物を1時間撹拌し、EtOAc(20mL)で希釈した。飽和NaHCO3水溶液を加えて反応をクエンチした。有機層を分離し、濃縮し、生成物54D(48mg、84%収率)を得た。1H NMR(400MHz、CDCl3) δ 7.67(d, J=8.7Hz, 1H), 7.23(t, J=8.1Hz, 1H), 7.10(d, J=0.8Hz, 1H), 6.87(d, J=7.5Hz, 1H), 4.51(br s, 2H), 3.99(s, 3H)
バイアルに生成物1B(39.5mg、0.089mmol)、生成物54D(18mg、0.071mmol)、Pd(PPh3)4(8.22mg、7.11μmol)およびジオキサン(0.5mL)、続いてNaHCO3(0.5M水溶液、0.427mL、0.213mmol)を加え、バイアルを密封し、窒素置換した。この混合物を130℃で15分間マイクロ波により加熱した。反応混合物をEtOAcおよび食塩水で希釈し、層を分離した。有機層をMgSO4で乾燥し、濾過し、濃縮した。得られた残渣を2mLのベンゼンスルホン酸溶液(0.72g/ACN(20mL))に溶解し、130℃で15分間マイクロ波により加熱した。溶媒を除去し、得られた残渣をDMSO(2mL)に溶解し、濾過し、分取HPLC方法8で精製し、実施例54(5.1mg、17%収率)を得た。MS(ES): m/z=417.1 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.03(s, 1H), 7.96(s, 1H), 7.89(d, J=7.6Hz, 1H), 7.81(s, 1H), 7.72(d, J=7.0Hz, 1H), 7.27(d, J=8.5Hz, 1H), 7.05(t, J=7.9Hz, 1H), 7.01(s, 1H), 6.94(d, J=7.3Hz, 1H), 5.17(br dd, J=13.1, 4.9Hz, 1H), 4.63-4.54(m, 1H), 4.49-4.41(m, 1H), 3.96(s, 3H), 2.98-2.93(m, 1H), 2.65(br dd, J=16.3, 2.0Hz, 1H), 2.47-2.39(m, 1H), 2.12-2.04(m, 1H)
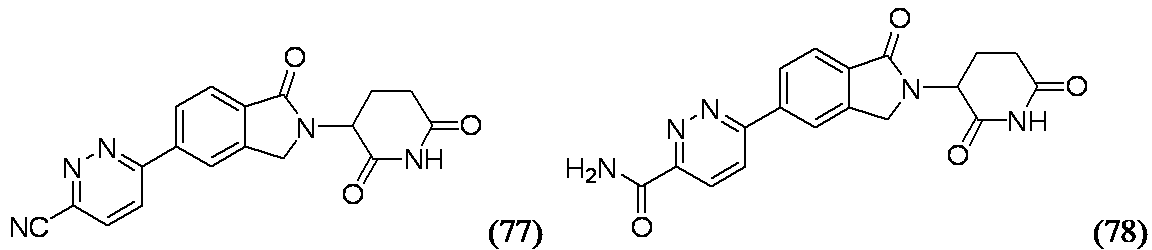
6-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリダジン-3-カルボニトリル(77)および6-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリダジン-3-カルボキサミド(78)
実施例77: MS(ES): m/z=348.1 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.00(s, 1H), 8.51(d, J=8.9Hz, 1H), 8.43(s, 1H), 8.38(d, J=8.9Hz, 1H), 8.32(br d, J=8.2Hz, 1H), 7.95(d, J=7.9Hz, 1H), 5.10(br dd, J=13.1, 4.6Hz, 1H), 4.66-4.56(m, 1H), 4.53-4.42(m, 1H), 2.94-2.82(m, 1H), 2.65(br d, J=16.2Hz, 1H), 2.43(br dd, J=12.7, 4.4Hz, 1H), 2.14-2.01(m, 1H)
実施例78: MS(ES): m/z=366.0 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 8.62(br s, 1H), 8.48(dt, J=8.8, 1.8Hz, 1H), 8.43(s, 1H), 8.38-8.27(m, 2H), 7.95(d, J=8.1Hz, 1H), 5.18-5.07(m, 1H), 4.66-4.56(m, 1H), 4.53-4.44(m, 1H), 2.95-2.85(m, 1H), 2.65(br d, J=16.3Hz, 1H), 2.44(br dd, J=13.9, 4.1Hz, 1H), 2.14-2.01(m, 1H)
3-[5-(6-アミノ-3-ニトロピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
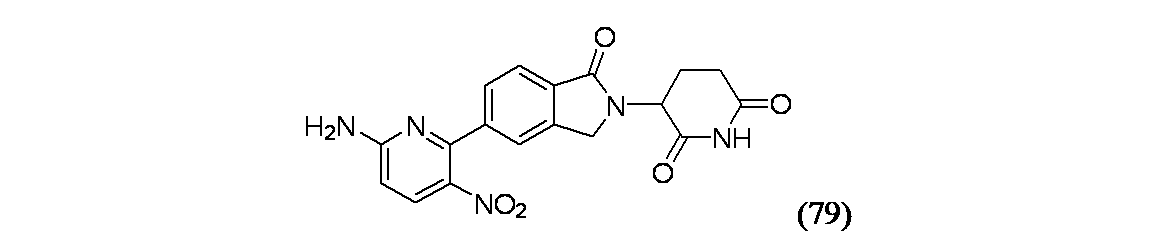
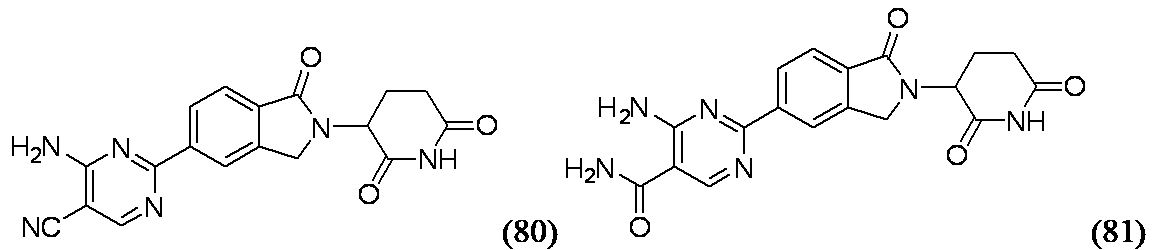
4-アミノ-2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリミジン-5-カルボニトリル(80)および4-アミノ-2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリミジン-5-カルボキサミド(81)
実施例80: MS(ES): m/z=363.0[M+H]+; 1H NMR(500MHz、DMSO-d6) δ 10.99(s, 1H), 8.73(s, 1H), 8.51(s, 1H), 8.46(br d, J=7.9Hz, 1H), 8.14-7.90(m, 2H), 7.86(br d, J=7.9Hz, 1H), 5.08(br dd, J=13.1, 5.2Hz, 1H), 4.63-4.51(m, 1H), 4.46-4.38(m, 1H), 2.93-2.82(m, 1H), 2.63(br dd, J=14.8, 2.3Hz, 1H), 2.46-2.32(m, 1H), 2.04(br dd, J=12.1, 5.6Hz, 1H)
実施例81: MS(ES): m/z=381.0[M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 8.85(s, 1H), 8.54(s, 1H), 8.50(d, J=8.1Hz, 1H), 8.18(br s, 1H), 7.86(d, J=8.1Hz, 1H), 7.56(br s, 1H), 5.20-5.12(m, 1H), 4.57(br d, J=17.3Hz, 1H), 4.50-4.38(m, 1H), 2.98-2.88(m, 1H), 2.69-2.59(m, 1H), 2.47-2.36(m, 1H), 2.12-2.00(m, 1H)
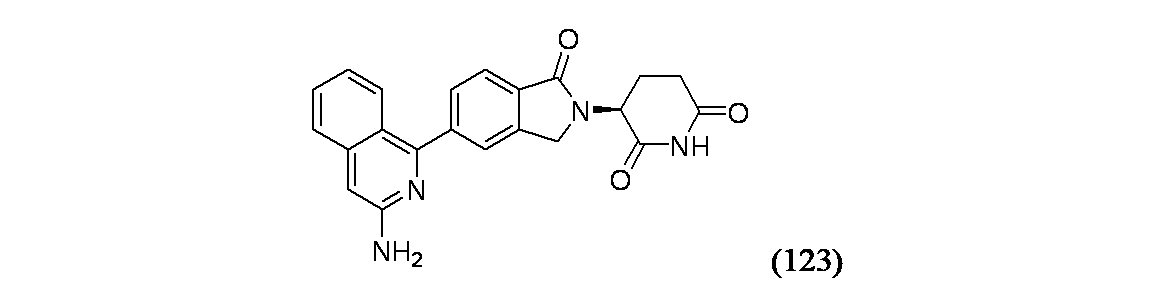
(3S)-3-[5-(1-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
tert-ブチル(S)-4,5-ジアミノ-5-オキソペンタノエート塩酸塩(4.16g、17.43mmol)/アセトニトリル(54.1mL)の懸濁液に、DIEA(6.09mL、34.9mmol)を加え、5分間撹拌後、この反応混合物を固体の4-ブロモ-2-(ブロモメチル)安息香酸メチル(5.78g、15.16mmol)で少しずつ処理した。室温で1時間撹拌後、還流冷却器をつけて反応混合物を70℃のオイルバスで終夜加温した。LCMSにて、完全に生成物に変換されたことが明確に示された。この混合物を室温に冷却し、EtOAcで希釈し、1M HCl(2X)、次いで1.5M K2HPO4(2X)、次いで食塩水で洗浄し、MgSO4で乾燥し、濾過し、濃縮した。得られた残渣をカラムクロマトグラフィー(50~100%EtOAc/Hex)で精製し、生成物82A(82%収率)を得た。1H NMR(400MHz、クロロホルム-d) δ 7.76-7.71(m, 1H), 7.68-7.62(m, 2H), 6.22(br s, 1H), 5.31(br s, 1H), 4.91(dd, J=8.7, 6.3Hz, 1H), 4.62-4.53(m, 1H), 4.51-4.40(m, 1H), 2.47-2.10(m, 4H), 1.44(s, 9H)
乾燥した丸底フラスコ(250mL)にtert-ブチル(S)-5-アミノ-4-(5-ブロモ-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(9.07g、22.83mmol)、4,4,4',4',5,5,5',5'-オクタメチル-2,2'-ビ(1,3,2-ジオキサボロラン)(6.96g、27.4mmol)、および酢酸カリウム(6.72g、68.5mmol)を加え、窒素置換した。この固体をジオキサン(90mL)に懸濁し、窒素気流下で撹拌しながら5分間脱気した。この反応混合物をPd(dppf)Cl2(0.668g、0.913mmol)で処理し、5分間脱気し、密封し、窒素雰囲気下、60℃で18時間加熱した。LCMSにて完全に変換されたことが明確に示された(LCMSにはエステルおよび酸の両方が示された)。この反応混合物をEtOAcで希釈し、食塩水で洗浄し、MgSO4で乾燥した。濾液を濃縮し、ISCO(220gシリカゲルカラム、0~20%B/DCM、B=15%EtOH/EtOAc+0.1%TEA)で精製し、生成物82B(7.7g、17.33mmol、76%収率)を灰白色固体として得た。1H NMRは生成物と一致した。
生成物82B(7.47g、16.81mmol)、3-ブロモイソキノリン-1-アミン(3g、13.45mmol)、PdCl2(dtbpf)(0.263g、0.403mmol)およびTEA(9.37mL、67.2mmol)を丸底フラスコ(100mL)、続いて2%TPGS水溶液(40mL)に加え、そのフラスコを密封し、窒素置換し、40℃で終夜加熱した。LCMSにて、環化していない生成物が主なピークとして示された。この反応混合物を5%EtOH/EtOAcで希釈し、セライト濾過した。粘性のあるケーキを5%EtOH/EtOAcで完全に洗浄し、次いで有機層を分離し、食塩水で洗浄し、MgSO4で乾燥し、濾過した。濾液を濃縮し、220gシリカゲルカラム(平衡化: 10%DCM/ヘキサン、溶出溶媒: 0~80%B/DCM(B=15%EtOH/EtOAc+0.1%TEA))を用いて精製し、生成物82Cを得た。1H NMR(400MHz、メタノール-d4) δ 8.21(s, 1H), 8.14(dd, J=13.4, 8.2Hz, 2H), 7.86(d, J=7.7Hz, 1H), 7.81(d, J=7.7Hz, 1H), 7.67(t, J=7.2Hz, 1H), 7.57-7.49(m, 2H), 5.05-4.96(m, 1H), 4.75(d, J=17.4Hz, 1H), 4.63(d, J=17.5Hz, 1H), 4.12 (q, J=7.2Hz, 1H), 2.38-2.19(m, 4H), 1.41(s, 9H), 0.92(d, J=6.7Hz, 1H)
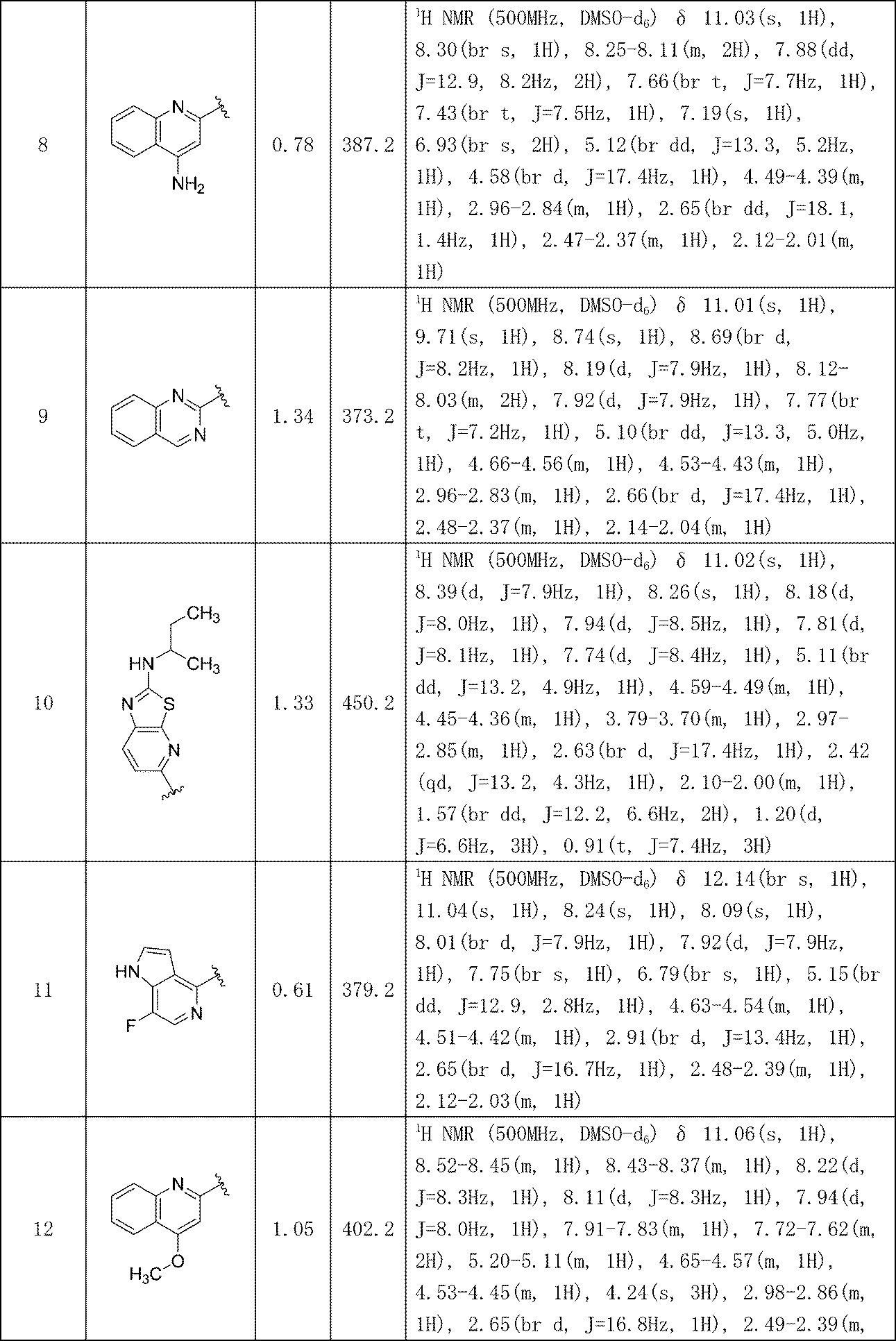
生成物82C(2.71g、5.88mmol)、およびベンゼンスルホン酸(1.862g、11.77mmol)および酢酸(75mL)を丸底フラスコに加え、そのフラスコを密封し、100℃で加熱した。6.5時間後、フラスコを室温で水に加え、約5分後、沈殿を濾過し、室温の酢酸(80mL)で洗浄し、続いて室温のMeCN(40mL)で洗浄し、次いでさらにMeCN(40mL)で洗浄した。固体を風乾し、実施例82(1.9g、79%収率)を得た。エナンチオ純度測定にて、キラル純度>99%e.e.であることが示された。MS(ES): m/z=387.1[M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.05(s, 1H), 8.50(br d, J=8.4Hz, 1H), 8.17(s, 1H), 8.08(d, J=8.0Hz, 1H), 8.01-7.96(m, 1H), 7.96-7.91(m, 2H), 7.78-7.70(m, 2H), 5.16(br dd, J=13.0, 4.1Hz, 1H), 4.62-4.54(m, 1H), 4.51-4.42(m, 1H), 3.00-2.87(m, 1H), 2.69-2.60(m, 1H), 2.49-2.36(m, 1H), 2.10-2.03(m, 1H)
(3R)-3-[5-(1-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
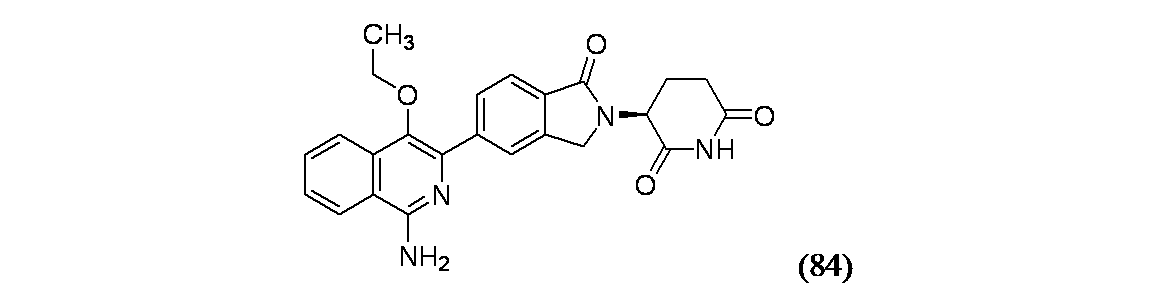
(3S)-3-[5-(1-アミノ-4-エトキシイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
4-ブロモイソキノリン(2.3g、11.05mmol)/DMPU(30mL)の溶液に、カリウムエトキシド(1.023g、12.16mmol)を加え、105℃で予熱済のホットプレート上に反応フラスコを20分間静置した。この反応混合物を室温に冷却し、水で希釈した。生成物をエーテルで複数回抽出し、セライト濾過した。有機層を濃縮し、ISCO(80gシリカゲルカラム、溶出溶媒: 0~100%エーテル/ヘキサン)で精製し、生成物84Aを得た。1H NMR(400MHz、クロロホルム-d) δ 8.91(s, 1H), 8.26(d, J=8.5Hz, 1H), 8.09(s, 1H), 7.95(d, J=8.1Hz, 1H), 7.71(ddd, J=8.3, 7.0, 1.3Hz, 1H), 7.67-7.60(m, 1H), 4.32 (q, J=7.0Hz, 2H), 1.59(t, J=7.0Hz, 3H)
丸底フラスコ中の生成物84A(385mg、2.223mmol)および1-ブロモピロリジン-2,5-ジオン(475mg、2.67mmol)の混合物に、DCE(30mL)を加え、60℃に加熱した。16時間後、微量の出発物質のみが残った。過剰のNBS(47.5mg)を加え、さらに1時間反応させた。この反応混合物を濃縮乾固し、ISCO(24gシリカゲルカラム、溶出溶媒: 0~100%エーテル/ヘキサン)で精製し、生成物84B(560mg、77%)を得た。1H NMR(400MHz、クロロホルム-d) δ 8.86(s, 1H), 8.13(dd, J=8.5, 0.8Hz, 1H), 8.01(d, J=8.2Hz, 1H), 7.77(ddd, J=8.3, 7.0, 1.2Hz, 1H), 7.70-7.63(m, 1H), 4.27 (q, J=7.1Hz, 2H), 1.60(t, J=7.1Hz, 3H)
生成物84B(400mg、1.587mmol)の混合物を室温でDCM(20mL)に溶解し、3-クロロ過安息香酸(412mg、1.840mmol)を加え、室温で5時間撹拌した。この反応混合物を濃縮乾固し、EtOAcで希釈し、食塩水で洗浄し、MgSO4で乾燥し、濾過し、次いで濃縮乾固し、生成物84C(437mg)を得た。MS(ES): m/z=268.1 [M+H]+and 270.1 [M+H]+
生成物84C(200mg、0.746mmol)に、塩化ホスホリル(3.49mL、37.3mmol)を加え、得られた混合物を室温で撹拌した。3日後、LCMSにて、生成物が主なピークとして示された。この反応混合物を濃縮し、ISCO(24gシリカゲルカラム、溶出溶媒: 2~100%DCM/ヘキサン)で精製し、生成物84Dを得た。1H NMR(400MHz、クロロホルム-d) δ 8.31(dt, J=8.4, 0.9Hz, 1H), 8.18-8.12(m, 1H), 7.83(t, J=7.6Hz, 1H), 7.74(t, J=7.6Hz, 1H), 4.31-4.23(m, 2H), 1.65-1.58(m, 3H)
生成物84D(40mg、0.140mmol)および28%NH3水溶液(1.942mL、13.96mmol)を密封したチューブに加え、続いてMeOH(0.5mL)を加えた。チューブを密封し、140℃で2時間加熱した。LCMSにて、生成物が示されたが、反応は完了していなかった。この反応混合物を分取HPLC方法1で精製し、生成物84E(13mg)を得た。
生成物84E(23.95mg、0.054mmol)、3-ブロモ-4-エトキシイソキノリン-1-アミン(12mg、0.045mmol)、PdCl2(dtbpf)(1.464mg、2.246μmol)および1,4-ジオキサン(1mL)をバイアルに加え、続いてCs2CO3(1M水溶液)(0.135mL、0.135mmol)を加え、密封して、窒素置換した。この混合物を40℃で16時間加熱した。LCMSにて、環化していない生成物が主なピークとして示された。この反応混合物をEtOAcで希釈し、食塩水で洗浄し、有機層を分離し、濃縮した。得られた粗製物質をAcOH(0.5mL)に溶解し、PhSO3H(2当量)を加えた。この反応混合物を120℃で10分間マイクロ波により加熱し、反応混合物を濃縮乾固した。得られた残渣をDMSO(1.8mL)に溶解し、分取HPLC方法1で精製し、実施例84(1.9mg、10%収率)を得た。MS(ES): m/z=431.3 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 8.29-8.20(m, 3H), 8.05-7.98(m, J=8.2Hz, 1H), 7.85-7.79(m, J=8.1Hz, 1H), 7.76(t, J=7.6Hz, 1H), 7.57(t, J=7.6Hz, 1H), 6.75(br s, 2H), 5.14(br dd, J=13.5, 4.4Hz, 1H), 4.56(d, J=17.3Hz, 1H), 4.45-4.39(m, 1H), 3.73-3.58(m, 2H), 3.00-2.90(m, 1H), 2.69-2.61(m, 1H), 2.49-2.36(m, 1H), 2.10-2.02(m, 1H), 1.24(t, J=6.9Hz, 3H)
一般的方法1:マイクロ波バイアル(2mL)に、アリールハライド(1.0当量)、生成物1B(1.25当量)、3mol%PdCl2(dtbpf)、ジオキサン(1mL)、および3M K3PO4水溶液(5当量)を加えた。このバイアルを密封し、窒素置換した。混合物を10分間120℃でマイクロ波により加熱し、反応混合物をEtOAcおよび食塩水で希釈した。有機層を分離し、MgSO4で乾燥し、濃縮した。粗製物質を別のマイクロ波バイアル(2mL)に移し、PhSO3H(2当量)およびMeCN(1mL)を加え、120℃で10分間マイクロ波により加熱した。この混合物を濃縮し、得られた残渣をDMSO(1.8mL)に溶解し、分取HPLC方法1で精製した。
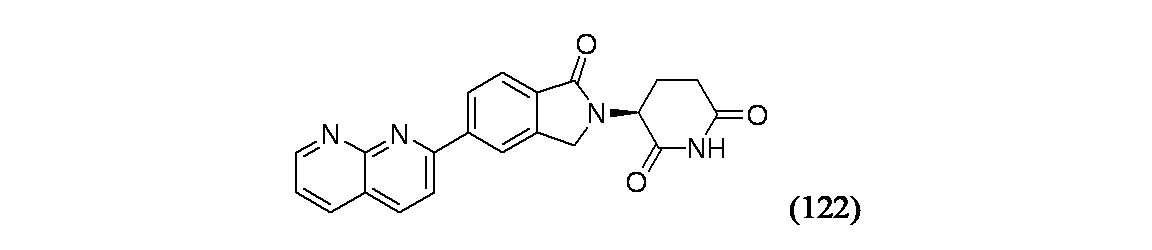
(3S)-3-[5-(1,8-ナフチリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
(S)-3-(5-(3-アミノイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
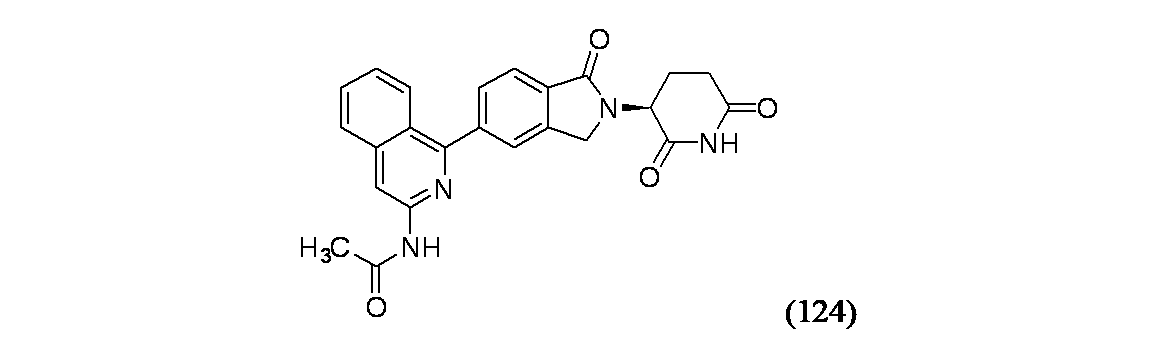
(S)-N-(1-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソキノリン-3-イル)アセトアミド
3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボニトリル
3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボキサミド
(4S)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート
(4R)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート
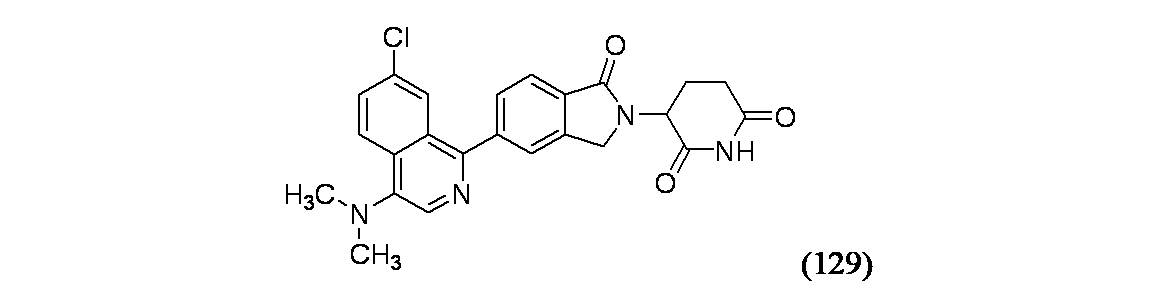
3-{5-[7-クロロ-4-(ジメチルアミノ)イソキノリン-1-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
4-ブロモ-1,7-ジクロロイソキノリン(2.15g、7.76mmol)/THF(40mL)のスラリーに、-78℃でBuLi(12.13mL、19.41mmol)を滴下して加えると、暗褐色溶液となった。30分後、ジフェニルホスホリルアジド(1.678mL、7.76mmol)を加えた。1時間後、この混合物にVitrideTM(9.47mL、31.1mmol)を加え、次いで反応容器を0℃に加温した。30分後、この反応混合物を氷水(10mL)でクエンチし、濾過した。ケーキを水で洗浄し、次いで酢酸エチルで洗浄した。有機層を合わせて飽和NaCl水溶液で洗浄し、Na2SO4で乾燥し、濾過し、濃縮し、生成物129Aを赤色固体(210mg)として得た。
生成物128A(450mg、2.1mmol)を0℃でDMF(10mL)に溶解し、水素化ナトリウム(152mg、6.34mmol)を1度に加え、20分間撹拌し、次いでヨードメタン(0.224mL、3.59mmol)を滴下して加えた。この反応混合物を1時間撹拌し、反応を水でクエンチした。この反応混合物を酢酸エチルで抽出し、飽和NaCl水溶液で洗浄し、硫酸ナトリウムで乾燥した。生成物をISCO(シリカゲルカラム、溶出溶媒: 1~2%EtOAc/ヘキサン)で精製し、生成物129Bを収率79%で得た。1H NMR(400MHz、クロロホルム-d) δ 8.20(d, J=2.3Hz, 1H), 8.05(d, J=9.1Hz, 1H), 7.85(s, 1H), 7.61(dd, J=9.1, 2.0Hz, 1H), 2.87(s, 6H)
続く生成物129Bおよび生成物1Bを用いた一般的方法1によって鈴木カップリングおよび環化が起こった。MS(ES): m/z=449.2 [M+H]+; HPLCa TRet=1.31分; 1H NMR(500MHz、DMSO-d6) δ 11.04(s, 1H), 8.32(s, 1H), 8.25(d, J=8.7Hz, 1H), 7.96-7.89(m, 2H), 7.87(s, 1H), 7.83(dd, J=9.0, 2.1Hz, 1H), 7.77(d, J=7.8Hz, 1H), 5.19(t, J=1.0Hz, 1H), 4.60(d, J=1.0Hz, 1H), 4.47(d, J=1.0Hz, 1H), 3.02-2.91(m, 7H), 2.67-2.61(m, 1H), 2.50-2.39(m, 1H), 2.14-2.03(m, 1H)
1-アミノ-3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]-N,N-ジメチルイソキノリン-4-カルボキサミド
1,3-ジクロロイソキノリン(2g、10.10mmol)/THF(40mL)の溶液に、-78℃でLDA(5.55mL、11.11mmol)を滴下して加えた。30分間撹拌後、この温度で、クロロギ酸メチル(1.017mL、13.13mmol)を加え、さらに1時間撹拌し、次いで室温にゆっくりと加温した。反応を氷水でクエンチした。この反応混合物をEtOAcで希釈し、有機層を分離し、食塩水で洗浄し、硫酸ナトリウムで乾燥した。溶媒を減圧除去し、得られた残渣をISCO(80gシリカゲルカラム、溶出溶媒: 5~100%DCM/ヘキサン)を用いて精製し、生成物130A(2.34g、9.14mmol、90%収率)を得た。1H NMR(400MHz、クロロホルム-d) δ 8.41(d, J=8.2Hz, 1H), 7.90-7.82(m, 2H), 7.79-7.74(m, 1H), 4.11(s, 3H)
生成物130A(1.00g、3.90mmol)および28%NH3水溶液(10.86mL、78mmol)を密封したチューブに加え、続いてMeOH(0.5mL)を添加し、140℃で4時間加熱し、冷却した。ロータリーエバポレーターで混合物からほとんどのメタノールを除去し、氷水で希釈した。沈殿(生成物)を濾過し、風乾した。固体残渣を分取HPLC方法2で精製し、生成物130Bを収率50%で得た。
生成物130B(30mg、0.135mmol)、HATU(64.0mg、0.168mmol)およびDMF(1mL)を密封したチューブに加え、続いてトリエチルアミン(0.038mL、0.270mmol)を加えた。10分後、ジメチルアミン(6.68mg、0.148mmol)を加え、チューブを密封し、50℃で2時間加熱した。この反応混合物を15%EtOH/EtOAcで希釈し、10%LiCl水溶液で洗浄し、有機層を濃縮し、分取HPLC方法2を用いて精製し、生成物130C(14mg、42%収率)を得た。
続く生成物130Cおよび生成物1Bを用いた一般的方法1により鈴木カップリングおよび環化が起こった。MS(ES): m/z=458.1 [M+H]+; HPLCa TRet=0.92分; 1H NMR(500MHz、DMSO-d6) δ 11.03(s, 1H), 8.58(br d, J=7.9Hz, 1H), 7.98-7.93(m, 1H), 7.90(d, J=7.9Hz, 1H), 7.87(s, 1H), 7.83-7.77(m, 2H), 7.66(d, J=8.5Hz, 1H), 5.20-5.14(m, 1H), 4.62-4.52(m, 1H), 4.48-4.39(m, 1H), 3.00-2.93(m, 1H), 2.92(d, J=5.5Hz, 3H), 2.69-2.61(m, 1H), 2.59(d, J=1.8Hz, 3H), 2.48-2.40(m, 1H), 2.12-2.03(m, 1H)
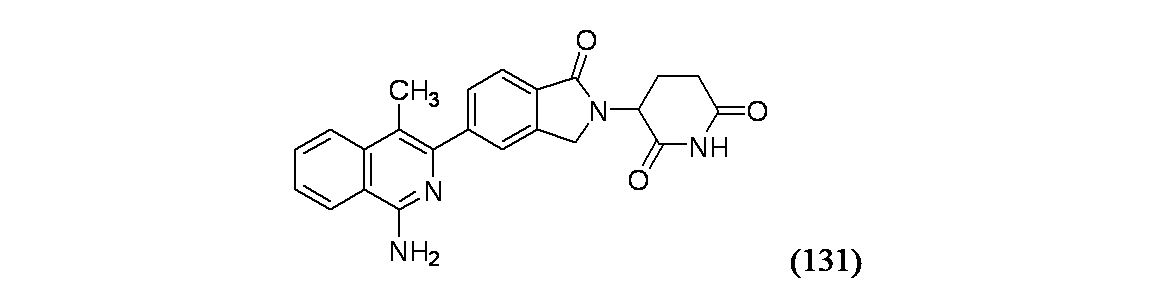
3-[5-(1-アミノ-4-メチルイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
1-アミノ-3-クロロイソキノリン-4-カルボン酸(40mg、0.180mmol)/THF(10mL)の溶液を氷水浴に加え、ボラン-THF(0.359mL、0.359mmol)を滴下して加えた。90分後、(ヒドロキシ基が無い)重要な副生成物の存在を観測した。ホルムアルデヒド数滴を加えて反応をクエンチし、反応混合物を濃縮し、粗製物質を分取HPLC方法2を用いて精製し、1-アミノ-3-クロロイソキノリン-4-イル)メタノールおよび3-クロロ-4-メチルイソキノリン-1-アミンの混合物(比率2:1)として生成物131Aを得た。
続く生成物131Aおよび生成物1Bを用いた一般的方法1により鈴木カップリングおよび環化が起こり、実施例131を得た。MS(ES): m/z=401.3 [M+H]+; HPLCa TRet=1.24分; 1H NMR(500MHz、DMSO-d6) δ 8.27(d, J=8.2Hz, 1H), 7.94(d, J=8.2Hz, 1H), 7.80(d, J=7.8Hz, 1H), 7.77-7.71(m, 2H), 7.65(d, J=7.9Hz, 1H), 7.55(t, J=7.4Hz, 1H), 6.74(s, 2H), 5.17(dd, J=13.5, 5.2Hz, 1H), 4.54(d, J=17.5Hz, 1H), 4.41(d, J=17.1Hz, 1H), 2.99-2.90(m, 1H), 2.67-2.60(m, 1H), 2.48-2.41(m, 1H), 2.40(s, 3H), 2.10-2.02(m, 1H)
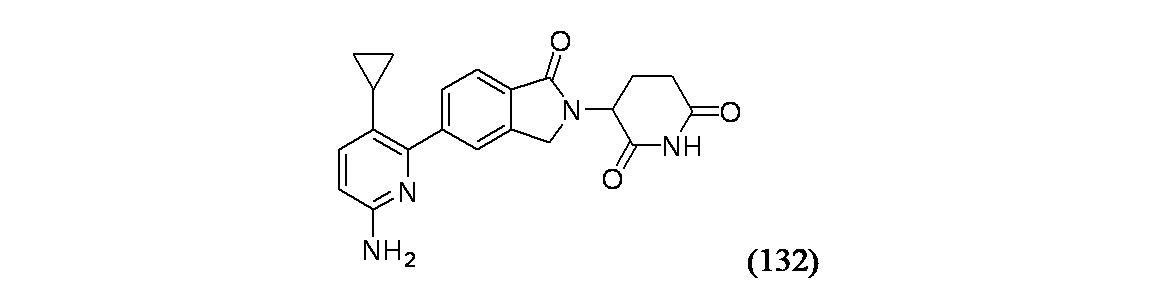
3-[5-(6-アミノ-3-シクロプロピルピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
5,6-ジブロモピリジン-2-アミン(135mg、0.536mmol)/メタノール(1mL)およびトルエン(10mL)の混合溶媒の撹拌溶液に、生成物1B(250mg、0.563mmol)を加え、続いてNa2CO3水溶液(2.143mL、1.072mmol)を加えた。この混合物を窒素で5分間パージし、次いでPd(PPh3)4(18.58mg、0.016mmol)を加えた。この反応混合物を110℃で2日間加熱し、室温に冷却し、水(20mL)で希釈した。この混合物をEtOAc(3X10mL)で抽出し、有機層を合わせて水(2X10mL)で洗浄し、無水Na2SO4で乾燥した。この混合物を減圧濃縮し、得られた粗製生成物をフラッシュシリカゲルカラムクロマトグラフィー(2~80%B/DCM[B=15%EtOH/EtOAc+0.1%TEA])で精製し、生成物132A(69mg)を得た。MS(ES): m/z=489.1 [M+H]+
マイクロ波バイアル(2mL)にシクロプロピルボロン酸(3.95mg、0.046mmol)、生成物132A(15mg、0.031mmol)、PdCl2(dtbpf)(0.599mg、0.920μmol)、1,4-ジオキサン(1mL)およびK2CO3水溶液(0.092mL、0.092mmol)を加えた。バイアルを密封し、窒素置換した。この混合物をマイクロ波により130℃で10分間加熱し、反応混合物をEtOAcで希釈し、食塩水で洗浄し、有機層を分離し、濃縮した。得られた粗製生成物をPhSO3H/MeCN溶液(0.228M、0.5mL)に溶解し、マイクロ波により120℃で10分間加熱した。この混合物を濃縮乾固し、分取HPLC方法1で精製し、実施例132を得た。MS(ES): m/z=377.0 [M+H]+; HPLCa TRet=1.05分; 1H NMR(500MHz、DMSO-d6) δ 7.78(d, J=8.5Hz, 2H), 7.75-7.70(m, 1H), 7.15(d, J=8.5Hz, 1H), 6.45(d, J=8.5Hz, 1H), 5.89-5.78(m, 2H), 5.16(br dd, J=13.3, 5.0Hz, 1H), 4.53(d, J=1.0Hz, 1H), 4.41(d, J=1.0Hz, 1H), 2.99-2.89(m, 1H), 2.67-2.60(m, 1H), 2.47-2.37(m, 1H), 2.10-2.00(m, 1H), 1.84-1.77(m, 1H), 0.79-0.72(m, 2H), 0.56-0.47(m, 2H)
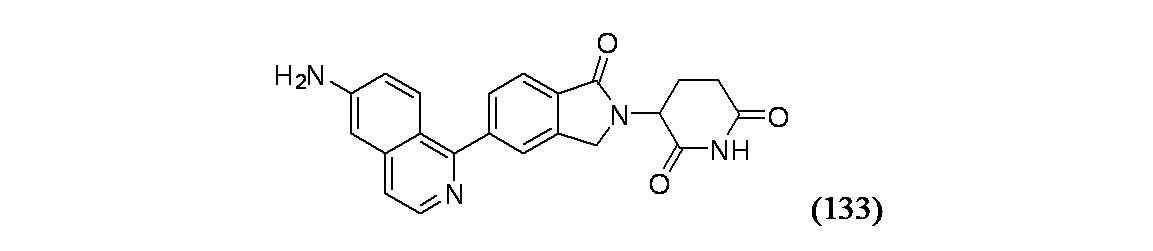
3-[5-(6-アミノイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
粗製中間体の他方のサンプルをPhSO3H/AcOH溶液(0.228M、1mL)に懸濁し、マイクロ波により10分間120℃で加熱し、濃縮乾固した。得られた残渣をDMSO(1.8mL)に溶解し、分取HPLC方法1で精製し、実施例134を得た。
N-{1-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-6-イル}アセトアミド
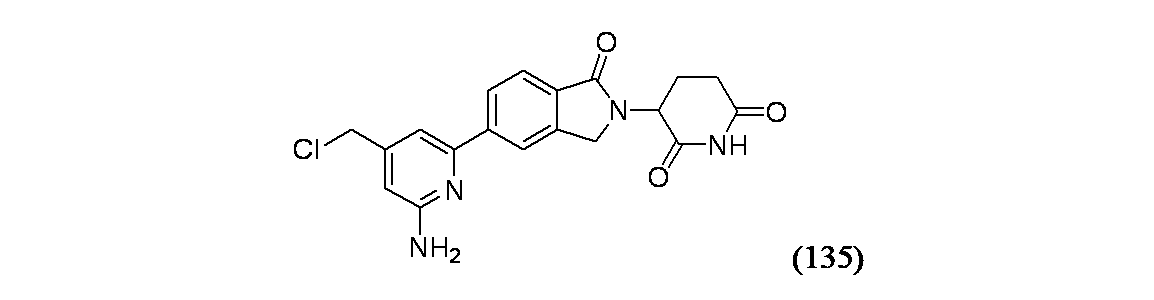
3-{5-[6-アミノ-4-(クロロメチル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
マイクロ波バイアル(20mL)に(2-アミノ-6-クロロピリジン-4-イル)メタノール(211mg、1.331mmol)、生成物1B(739mg、1.663mmol)、PdCl2(dtbpf)(43.4mg、0.067mmol)、ジオキサン(10mL)およびK3PO4水溶液(2.218mL、6.65mmol)を加え、バイアルを密封し、窒素置換した。この混合物をマイクロ波により130℃で30分間加熱し、EtOAcで希釈し、食塩水で洗浄し、有機層を分離し、濃縮した。粗製物質をISCO(40gカラム、溶出溶媒: 0~100%B/DCM[B=15%EtOH/EtOAc+0.1%TEA])を用いて精製し、生成物135A(267mg)を得た。
生成物135A(140mg、0.318mmol)をDCM(15mL)に溶解し、氷水浴で冷却し、続いて塩化チオニル(0.461mL、6.36mmol)を滴下して加えた。5分後、氷浴を除去し、この反応混合物を室温に加温し、1時間後、この反応混合物を濃縮乾固し、生成物135B(100%収率)を得た。
マイクロ波バイアル(2mL)に生成物136B(30mg)およびPhSO3H/アセトニトリル溶液(0.228M、1mL)を加え、マイクロ波により30分間120℃で加熱した。この反応混合物を濃縮乾固し、得られた残渣を分取HPLC方法1で精製し、実施例135を得た。MS(ES): m/z=385.0 [M+H]+; HPLCa TRet=1.02分; 1H NMR(500MHz、DMSO-d6) δ 11.02(s, 1H), 8.20-8.15(m, 1H), 8.09(br d, J=8.5Hz, 1H), 7.85(br d, J=7.9Hz, 1H), 7.27-7.21(m, 1H), 6.73-6.68(m, 1H), 5.15-5.09(m, 1H), 4.72(s, 2H), 4.59-4.53(m, 1H), 4.47-4.40(m, 1H), 2.95-2.87(m, 1H), 2.68-2.63(m, 1H), 2.49-2.37(m, 1H), 2.09-2.02(m, 1H)
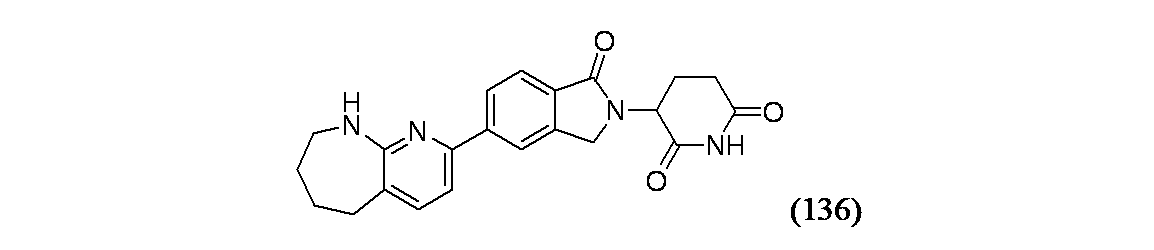
3-(1-オキソ-5-{5H,6H,7H,8H,9H-ピリド[2,3-b]アゼピン-2-イル}-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン
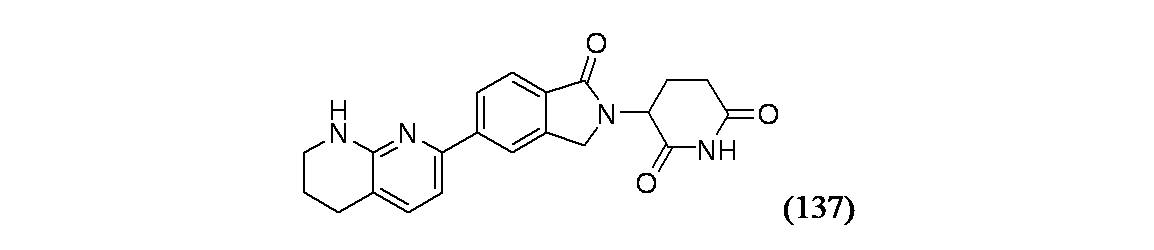
3-[1-オキソ-5-(5,6,7,8-テトラヒドロ-1,8-ナフチリジン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
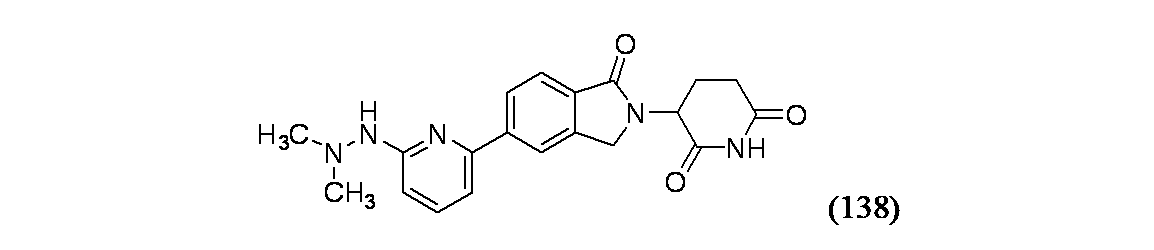
3-{5-[6-(2,2-ジメチルヒドラジン-1-イル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン
パラホルムアルデヒド(50.0mg、1.666mmol)および2-クロロ-6-ヒドラジニルピリジン・HCl塩(50mg、0.278mmol)/DCE(10mL)の撹拌溶液に、AcOH(0.3mL)を加え、この反応混合物を60℃で10分間撹拌しながら加熱した。次に、NaBH(OAc)3(177mg、0.833mmol)を加え、室温で1時間撹拌し、EtOAcで希釈し、1N KOH水溶液で洗浄し、MgSO4で乾燥し、濃縮した。粗製物質を分取HPLC方法2で精製し、生成物138A(16mg、34%収率)を得た。1H NMR(400MHz、クロロホルム-d) δ 7.61(t, J=8.1Hz, 1H), 7.29(s, 1H), 6.95(d, J=8.5Hz, 1H), 6.84(d, J=7.6Hz, 1H), 3.12-3.07(m, 6H)
実施例138を一般的方法1に従って、ハロゲン化アリールとして2-クロロ-6-(2,2-ジメチルヒドラジニル)ピリジンを用いて製造した。MS(ES): m/z=380.3 [M+H]+; HPLCa TRet=1.05分; 1H NMR(500MHz、DMSO-d6) δ 11.01(s, 1H), 8.29(s, 1H), 8.24(br d, J=8.0Hz, 1H), 7.86-7.78(m, 2H), 7.49(br d, J=7.2Hz, 1H), 6.87(d, J=8.3Hz, 1H), 5.15(br dd, J=13.4, 5.1Hz, 1H), 4.54(d, J=17.2Hz, 1H), 4.42(d, J=17.1Hz, 1H), 3.00-2.92(m, 1H), 2.68-2.59(m, 1H), 2.57-2.53(m, 6H), 2.49-2.39(m, 1H), 2.09-2.01(m, J=10.9, 5.2Hz, 1H)
3-(5-(1H-イミダゾ[4,5-b]ピリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(6-アミノ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(3,4-ジヒドロ-2H-ピリド[3,2-b][1,4]オキサジン-6-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(6-アミノピラジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(2-アミノ-6-メチルピリミジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(4,6-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
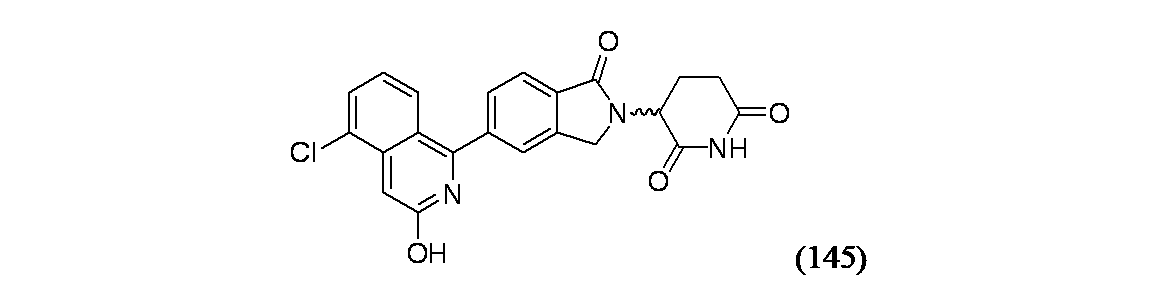
3-(5-(5-クロロ-3-ヒドロキシイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
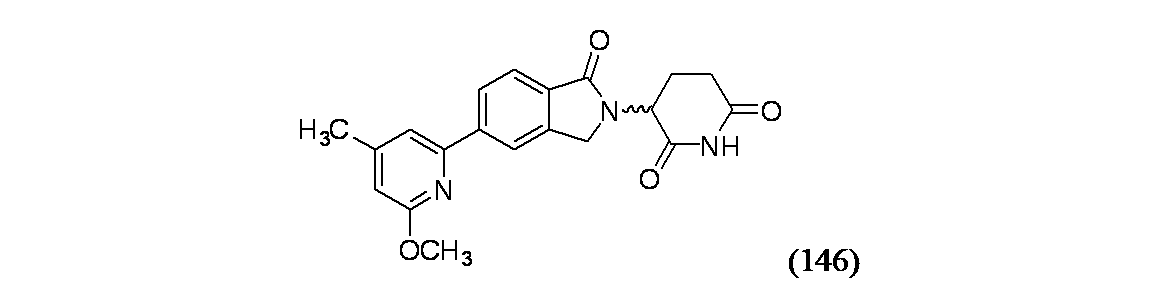
3-(5-(6-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-(5-(6-ヒドロキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル
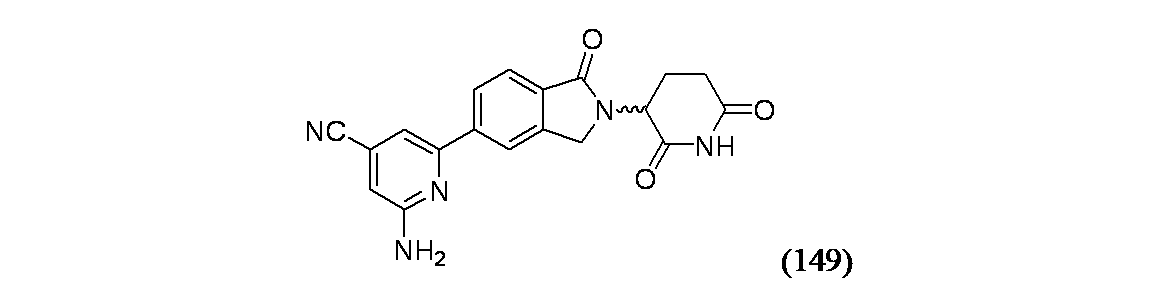
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソニコチノニトリル
3-(5-(1-アミノ-5,6,7,8-テトラヒドロイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
5,6,7,8-テトラヒドロイソキノリン-1-アミン(150mg、1.012mmol)およびイソベンゾフラン-1,3-ジオン(150mg、1.012mmol)/AcOH(5060μL)の溶液を90℃で終夜加熱し、飽和水溶液で反応をクエンチした。この反応混合物をEtOAcで希釈し、層を分離し、水相をEtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、黄色残渣を得た。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、40gカラム、40mL/分、14分かけて0~100%EtOAc/ヘキサンで溶出、tr=11分)により精製し、生成物150A(23.4mg、0.084mmol、8.31%収率)を白色固体として得た。ESI MS(M+H)+=279.3
生成物150A(23.4mg、0.084mmol)/CH2Cl2(420μL)の溶液に、m-CPBA(29.0mg、0.168mmol)を加え、室温で終夜撹拌した。さらにm-CPBA(29.0mg、0.168mmol)およびDCM(1mL)を加え、室温で終夜撹拌した。反応を飽和Na2S2O3水溶液でクエンチし、反応混合物をCH2Cl2で希釈した。層を分離し、水相をCH2Cl2(3X)で抽出し、有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、生成物150B(25mg、100%)を灰白色固体として得た。ESI MS(M+H)+=295.1
生成物150B(37.3mg、0.134mmol)/POCl3(1722μL、18.47mmol)の溶液に、Et3N(18.66μL、0.134mmol)を加え、80℃で2時間加熱し、次いで室温に冷却した。この反応混合物を慎重に氷冷飽和NaHCO3水溶液に注ぎ、次いでEtOAc(3X)で抽出し、有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、12gカラム、30mL/分、14分かけて0~100%EtOAc/ヘキサンで溶出、tr=9分)により精製し、生成物150C(3.8mg、10.94μmol、8.17%収率)を白色フィルムとして得た。ESI MS(M+H)+=313.2
生成物150C(33.5mg、0.107mmol)/EtOH(536μL)の溶液に、トリエチルアミン(16.42μL、0.118mmol)、続いてヒドラジン(3.70μL、0.118mmol)を加えた。この反応混合物を室温で撹拌し、水で希釈し、EtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、12gカラム、30mL/分、15分かけて0~100%EtOAc/ヘキサンで溶出、tr=9分)により精製し、生成物150D(9.7mg、0.050mmol、47.1%収率)を白色固体として得た。ESI MS(M+H)+=183.1
バイアルに生成物150D(26.0mg、0.058mmol)、3-クロロ-5,6,7,8-テトラヒドロイソキノリン-1-アミン(9.7mg、0.053mmol)、Pd(PPh3)4(6.14mg、5.31μmol)およびNaHCO3(0.5M水溶液、0.319mL、0.159mmol)、続いてジオキサン(0.5mL)を加え、バイアルを密封し、真空にし、N2を充填した。この反応混合物をマイクロ波により130℃で15分間加熱し、EtOAc(2X)で抽出した。有機層を合わせて濃縮し、高真空下で乾燥し、次いでAcOH(0.5mL)に溶解し、ベンゼンスルホン酸(9.24mg、0.058mmol)を加えた。反応バイアルを密封し、マイクロ波により10分間155℃で加熱した。この反応混合物を濃縮し、粗製物質を分取LC/MS(条件: カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(0.05%トリフルオロ酢酸含有); 移動相B: 95:5 アセトニトリル:水(0.05%トリフルオロ酢酸含有); グラジエント: 0%Bで0分間溶出後、0~50%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、生成物を含むフラクションを合わせて遠心エバポレーターで乾燥し、実施例150(1.3mg、6%)を得た。ESI MS(M+H)+=391.3; HPLCピークtr=1.50分; 純度=100%(分析HPLC方法2)
3-(5-(6-アミノ-4,5-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3,4-ジメチルピリジン-2-アミン(150mg、1.228mmol)およびイソベンゾフラン-1,3-ジオン(182mg、1.228mmol)/AcOH(6139μL)の溶液を90℃で終夜加熱し、反応を飽和NaHCO3水溶液でクエンチした。この反応混合物をEtOAcで希釈し、層を分離し、水相をEtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、黄色残渣を得た。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、40gカラム、40mL/分、21分かけて0~100%EtOAc/ヘキサンで溶出、tr=11分)により精製し、生成物153A(63.8mg、0.253mmol、20.60%収率)を白色固体として得た。ESI MS(M+H)+=253.2
生成物151A(63.8mg、0.253mmol)/CH2Cl2(1265μL)の溶液に、m-CPBA(87mg、0.506mmol)を加え、室温で終夜を撹拌した。反応を飽和Na2S2O3水溶液でクエンチし、CH2Cl2で希釈し、層を分離し、水相をCH2Cl2(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、生成物151B(68mg、100%)を灰白色固体として得た。ESI MS(M+H)+=269.3
生成物151B(67.8mg、0.253mmol)/POCl3(3251μL、34.9mmol)の溶液に、TEA(35.2μL、0.253mmol)を加え、80℃で2時間加熱し、次いで室温に冷却した。この反応混合物を慎重に氷冷飽和NaHCO3水溶液に注ぎ、次いでEtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、24gカラム、35mL/分、15分かけて0~100%EtOAc/ヘキサンで溶出、tr=9分)により精製し、生成物151C(31mg、0.108mmol、42.8%収率)を白色固体として得た。ESI MS(M+H)+=287.1
生成物151C(31mg、0.108mmol)/EtOH(541μL)の溶液に、トリエチルアミン(16.58μL、0.119mmol)、続いてヒドラジン(3.73μL、0.119mmol)を加え、室温で2時間撹拌した。この反応混合物を水で希釈し、EtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、12gカラム、30mL/分、14分かけて0~100%EtOAc/ヘキサンで溶出、tr=9.5分)により精製し、生成物151D(5.8mg、0.035mmol、32.5%収率)を白色固体として得た。ESI MS(M+H)+=156.9
バイアルにtert-ブチル5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(61.8mg、0.139mmol)、生成物151D(21.8mg、0.139mmol)、Pd(PPh3)4(161mg、0.139mmol)およびNaHCO3(0.5M水溶液、0.835mL、0.418mmol)、続いてジオキサン(0.5mL)を加え、バイアルを密封し、真空にし、N2を充填した。この反応混合物を130℃で15分間マイクロ波により加熱し、EtOAc(2X)で抽出した。有機層を合わせて濃縮し、高真空下で乾燥し、次いでAcOH(0.5mL)に溶解し、ベンゼンスルホン酸(22.02mg、0.139mmol)を加えた。反応バイアルを密封し、マイクロ波により155℃で10分間加熱した。この反応混合物を濃縮し、粗製物質を分取LC/MS(条件: カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(酢酸アンモニウム含有); グラジエント: 8%Bで2分間溶出後、8~48%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、生成物を含むフラクションを合わせて遠心エバポレーターで乾燥し、実施例151(2.2mg、4%)を得た。ESI MS(M+H)+=365.2; HPLCピークtr=1.35分; 純度=100%(分析HPLC方法2)
6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル
3-(5-(6-アミノ-5-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
3-メトキシ-4-メチルピリジン-2-アミン(350mg、2.53mmol)およびイソベンゾフラン-1,3-ジオン(375mg、2.53mmol)/AcOH(5.730mL)の溶液を90℃で終夜加熱し、反応を飽和NaHCO3水溶液でクエンチした。この反応混合物をEtOAcで希釈し、層を分離し、水相をEtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、黄色残渣を得た。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、40gカラム、40mL/分、22分かけて0~100%EtOAc/ヘキサンで溶出、tr=12分)により精製し、生成物153A(243mg、0.861mmol、34.0%収率)を白色固体として得た。ESI MS(M+H)+=269.4
生成物153A(243mg、0.906mmol)/CH2Cl2(4529μL)の溶液に、m-CPBA(313mg、1.812mmol)を加え、室温で終夜撹拌した。反応を飽和Na2S2O3水溶液でクエンチし、CH2Cl2で希釈し、層を分離し、水相をCH2Cl2(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、生成物153B(257mg、100%)を灰白色固体として得た。ESI MS(M+H)+=285.3
生成物153B(243mg、0.904mmol)/POCl3(11.628mL、125mmol)の溶液に、TEA(0.126mL、0.904mmol)を加え、80℃で2時間加熱し、次いで室温に冷却した。この反応混合物を慎重に氷冷飽和NaHCO3水溶液に注ぎ、次いでEtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、40gカラム、40mL/分、15分かけて0~100%EtOAc/ヘキサンで溶出、tr=9分)により精製し、生成物153C(217mg、0.717mmol、79%収率)を白色固体として得た。ESI MS(M+H)+=303.1
生成物153C(217mg、0.717mmol)/EtOH(3584μL)の溶液に、トリエチルアミン(110μL、0.789mmol)、続いてヒドラジン(24.75μL、0.789mmol)を加え、室温で2時間撹拌した。この反応混合物を水で希釈し、EtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過した。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、40gカラム、40mL/分、0~100%EtOAc/ヘキサン15分かけて、tr=9.5分)により精製し、生成物153D(85.1mg、0.493mmol、68.8%収率)を白色固体として得た。ESI MS(M+H)+=173.0
バイアルに生成物1B(122mg、0.274mmol)、生成物153D(43mg、0.249mmol)、Pd(PPh3)4(28.8mg、0.025mmol)およびNaHCO3(0.5M水溶液、1495μL、0.747mmol)、続いてジオキサン(1246μL)を加え、バイアルを密封し、真空にし、N2を充填した。この反応混合物をマイクロ波により130℃で15分間加熱し、EtOAc(3X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、橙色残渣を得た。これをさらに高真空下で乾燥し、得られた粗製物質をAcOH(1.6mL)に溶解し、ベンゼンスルホン酸(43.3mg、0.274mmol)を加えた。反応バイアルを密封し、マイクロ波により10分間155℃で加熱した。溶媒を蒸発させ、粗製物質を分取LC/MS(条件: カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(酢酸アンモニウム含有); グラジエント: 7%Bで0分間溶出後、7~43%Bで30分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製した。生成物を含むフラクションを合わせて遠心エバポレーターで乾燥し、実施例153(4.9mg、5%)を得た。ESI MS(M+H)+=381.2; HPLCピークtr=1.22分; 純度=100%(分析HPLC方法2)
3-(5-(4-((ベンジルオキシ)メチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
(2-クロロピリジン-4-イル)メタノール(0.100g、0.697mmol)、塩化メタンスルホニル(0.109mL、1.393mmol)、およびトリエチルアミン(0.204mL、1.463mmol)/DMF(1.393mL)の溶液を室温で1.5時間撹拌すると、溶液が濁り、固体が沈殿した。反応を水でクエンチし、EtOAcで希釈し、層を分離し、水相をEtOAc(2X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、残渣を得た。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、24gカラム、35mL/分、15分かけて0~100%EtOAc/ヘキサンで溶出、tr=8分)により精製し、生成物154A(65.6mg、0.405mmol、58.1%収率)を無色の液体として得た。ESI MS(M+H)+=161.9
フェニルメタノール(100μL、0.966mmol)/DMF(966μL)の溶液に、NaH(39.4mg、0.985mmol)を加え、室温で15分間撹拌し、次いで生成物156A(31.3mg、0.193mmol)を加えた。2時間後、反応を水でクエンチし、EtOAcで希釈し、層を分離し、水相をEtOAc(2X)で抽出した。有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、残渣を得た。得られた粗製物質を最小限のCH2Cl2に溶解し、クロマトグラフィーを行った。シリカゲルクロマトグラフィー(ISCO、12gカラム、30mL/分、19分かけて0~100%EtOAc/ヘキサンで溶出、tr=8.5分)により精製し、生成物154B(26.3mg、0.113mmol、58.3%収率)を得た。ESI MS(M+H)+=234.4
バイアルにtert-ブチル5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(54.4mg、0.122mmol)、生成物154B(26mg、0.111mmol)、Pd(PPh3)4(12.86mg、0.011mmol)およびNaHCO3(0.5M水溶液、668μL、0.334mmol)、続いてジオキサン(556μL)を加え、バイアルを密封し、真空にし、N2を充填し、マイクロ波により130℃で15分間加熱した。この反応混合物をEtOAc(3X)で抽出し、有機層を合わせてNa2SO4で乾燥し、濾過し、濃縮し、橙色残渣を得た。これをさらに高真空下で乾燥し、得られた粗製物質をAcOH(1.6mL)に溶解し、ベンゼンスルホン酸(19.36mg、0.122mmol)を加えた。この反応混合物を密封し、マイクロ波により10分間155℃で加熱した。この反応混合物を濃縮し、粗製物質を分取LC/MS(条件: カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(0.05%トリフルオロ酢酸含有); 移動相B: 95:5 アセトニトリル:水(0.05%トリフルオロ酢酸含有); グラジエント: 8%Bで0分間溶出後、8~48%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、生成物を含むフラクションを合わせて遠心エバポレーターで乾燥し、実施例154(1.2mg、2%)を得た。ESI MS(M+H)+=442.2; HPLCピークtr=1.76分; 純度=99%(分析HPLC方法2)
3-[5-(6-メトキシピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン
4-アミノ-2-メチル安息香酸メチル(4.5g、27.2mmol)/DMSO(75mL)の溶液に、室温で固体硝酸ナトリウム(3.76g、54.5mmol)を加え、オイルバスで40℃に加温した。これにヨウ化水素(55%水溶液、25.3g、109mmol)/DMSO(38mL)溶液を滴下して加え、添加完了後、40℃で15分間撹拌した。この反応混合物を室温に冷却し、水/エーテル(300mL/300mL)に注ぎ、混合物が脱色し、層が分離するまで撹拌しながらチオ硫酸ナトリウムをゆっくりと加えた。水層を再度エーテルで抽出し、有機層を合わせてチオ硫酸ナトリウム水溶液(~2g/水(100mL))の希釈溶液で再度洗浄し、次いで水(100mL)、次いで食塩水で洗浄した。有機層をMgSO4で乾燥し、濾過し、濃縮した。反応を同じスケールで繰り返し、同じプロトコールでワークアップした。両方から得られた粗製生成物を合わせてISCO(330gカラム、5%EtOAc/Hexの定組成)で精製し、生成物155A(13.44g、89%収率)を油状物として得た。1H NMR(400MHz、CDCl3) δ 7.69-7.66(m, 1H), 7.64-7.61(m, 2H), 3.91(s, 3H), 2.57(s, 3H)
生成物155A(17.85g、64.7mmol)/酢酸イソプロピル(211mL)の溶液に、N-ブロモスクシンイミド(14.96g、84mmol)およびAIBN(0.265g、1.616mmol)を加えた。得られた懸濁液を予熱した70℃浴に入れ、臭素を除去するため、この反応混合物にシリンジで非常にゆっくりと窒素を吹き込み続けた(別のシリンジを介してバブラーに排気した)。この反応混合物を70℃で5時間加熱し、室温に冷却し、濃縮した。得られた固体をエーテル中で撹拌し、濾過し、固体を除去し、エーテルで濯いだ。固体を除去し、エーテルを含む液体を亜硫酸ナトリウム(5g)/水(400mL)の溶液で洗浄し、2つの洗浄物に分け、次いで水、次いで食塩水で洗浄した。有機層をMgSO4で乾燥し、濾過し、濃縮した。得られた物質をIsco(2%EtOAc/Hex; 5分間溶出後、次いで7%の定組成にして溶出)で精製し、不純物を含む生成物を粘着性固体として得た。この物質を最小限のヘキサンに懸濁し、得られた固体をブフナー漏斗で回収し、生成物155B(13.3g、58%収率)を得た。1H NMR(400MHz、CDCl3) δ 7.86(d, J=1.8Hz, 1H), 7.78-7.73(m, 1H), 7.72-7.67(m, 1H), 4.89(s, 2H), 3.96(s, 3H)
3-アミノピペリジン-2,6-ジオン塩酸塩(5.15g、31.3mmol)/アセトニトリル(95mL)の懸濁液に、ヒューニッヒ塩基(10.9mL、62.5mmol)を加え、5分間撹拌後、この反応混合物を固体の生成物157B(10.09g、28.4mmol)で5分かけて少しずつ処理した。1時間室温で撹拌後、還流冷却器を取り付けた反応容器をオイルバスでゆっくりと70℃に加温し、同温度で2日間保持した。この反応混合物を室温に冷却し、終夜撹拌した。得られた沈殿をブフナー漏斗で回収し、さらにアセトニトリルで洗浄した。得られた固体を風乾し、生成物155Cを白色粉末として得た(8.9g、85%収率)。1H NMR(400MHz、DMSO-d6) δ 10.99(s, 1H), 8.06(s, 1H), 7.89(d, J=6.8Hz, 1H), 7.52(d, J=8.0Hz, 1H), 5.11(dd, J=13.4, 5.2Hz, 1H), 4.49-4.41(m, 1H), 4.36-4.28(m, 1H), 2.98-2.84(m, 1H), 2.70-2.56(m, 1H), 2.43-2.29(m, 1H), 2.06-1.96(m, 1H)
生成物155C(18.5mg、50μmol)、2-メトキシ-6-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)ピリジン(23.5mg、100μmol)、およびXPhos Pd G2(2.0mg、2.5μmol)/DMF(500μL、脱気済)の懸濁液を含む窒素置換したバイアルに、リン酸三カリウム(21.2mg、100μmol)を加えた。この反応混合物を90℃のマイクロ波反応装置で撹拌し、3時間後、この反応混合物を濾過し、EtOAc(5mL)で希釈し、飽和塩化アンモニウム水溶液(2mL)で洗浄し、水相をEtOAc(5mL)で逆抽出し、有機層を合わせて減圧濃縮した。粗製物質を分取HPLC(カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(酢酸アンモニウム含有); グラジエント: 13%Bで0分間溶出後、13~53%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、実施例155(4.9mg、28%収率)を得た。LCMS(分析HPLC方法1): TRet=1.44分; m/z=352.1 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.01(s, 1H), 8.32(s, 1H), 8.26(d, J=7.9Hz, 1H), 7.89-7.78(m, 2H), 7.67(d, J=7.5Hz, 1H), 6.85(d, J=8.2Hz, 1H), 5.14(br dd, J=13.2, 4.9Hz, 1H), 4.55(d, J=17.4Hz, 1H), 4.42(d, J=17.1Hz, 1H), 3.98(s, 3H), 2.98-2.86(m, 1H), 2.67-2.58(m, 1H), 2.48-2.37(m, 1H), 2.10-1.98(m, 1H)
3-[5-(1-メトキシイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(156)および3-[1-オキソ-5-(1-オキソ-1,2-ジヒドロイソキノリン-3-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(157)
1,3-ジブロモイソキノリン(215mg、750μmol)およびナトリウムメトキシド(40.5mg、750μmol)/トルエン(3.0mL)の懸濁液を110℃のヒーターブロックで撹拌し、さらにナトリウムメトキシド(203mg、3750μmol)を1.5時間および5時間の時点で分けて加えた。計20.5時間後、この反応混合物を室温に冷却し、水(0.1mL)でクエンチし、減圧濃縮した。得られた粗製生成物を少量のDCMに溶解し、SiO2のプラグに吸着させ、フラッシュクロマトグラフィー(SiO2、40gカラム、1%EtOAc/ヘキサンの定組成、40mL/分)で精製し、生成物156Aを白色固体として得た(160mg、90%収率)。MS(ES): m/z=238.1、240.1 [M+H]+; 1H NMR(500MHz、クロロホルム-d) δ 8.19(dd, J=8.3, 1.0Hz, 1H), 7.69-7.62(m, 2H), 7.53(ddd, J=8.3, 5.9, 2.3Hz, 1H), 7.44(d, J=0.8Hz, 1H), 4.14(s, 3H)
生成物156A(40.0mg、0.168mmol)および生成物1B(149mg、0.336mmol)/1,4-ジオキサン(0.50mL)の溶液に、炭酸カリウム(46.4mg、0.336mmol)/水(336μL)の溶液を加え、反応容器を3回真空にし、窒素を充填し、次いでPdCl2(dppf)(6.2mg、8.4μmol)を加えた。得られた混合物を100℃で撹拌し、45分後、この反応混合物を濾過し、EtOAc(5mL)で希釈し、飽和塩化アンモニウム水溶液(2mL)で洗浄した。水相をEtOAc(5mL)で逆抽出し、有機層を合わせて減圧濃縮し、得られた粗製中間体をアセトニトリル(840μL)に懸濁し、次いでベンゼンスルホン酸(26.6mg、168μmol)を加えた。この混合物を90℃で撹拌し、3時間後、再度ベンゼンスルホン酸(26.6mg、168μmol)を加え、再度90℃で撹拌を再開した。計4.5時間後、この反応混合物を室温に冷却し、減圧濃縮した。粗製物質を分取HPLC(カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(酢酸アンモニウム含有); グラジエント: 7%Bで0分間溶出後、7~69%Bで30分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、実施例156(14.8mg、22%収率)を得た。LCMS(分析HPLC方法1): TRet=1.9分; m/z=402.2 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.03(s, 1H), 8.45(s, 1H), 8.40(br d, J=8.4Hz, 1H), 8.20(br d, J=8.2Hz, 1H), 8.17(s, 1H), 8.00(d, J=8.4Hz, 1H), 7.86(d, J=7.9Hz, 1H), 7.80(t, J=7.6Hz, 1H), 7.65(t, J=7.9Hz, 1H), 5.15(br dd, J=13.5, 4.7Hz, 1H), 4.58(d, J=17.1Hz, 1H), 4.44(d, J=16.9Hz, 1H), 4.21(s, 3H), 2.98-2.88(m, 1H), 2.67-2.59(m, 1H), 2.47-2.39(m, 1H), 2.10-1.99(m, 1H)
実施例157を同じ製造物から単離した(14.3mg、22%収率)。LCMS(分析HPLC方法1): TRet=1.26分; m/z=388.2 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.65(br s, 1H), 11.03(s, 1H), 8.23(d, J=8.1Hz, 1H), 8.01(s, 1H), 7.91(d, J=7.6Hz, 1H), 7.84(d, J=8.0Hz, 1H), 7.80-7.72(m, 2H), 7.54(ddd, J=8.1, 5.1, 3.1Hz, 1H), 7.04(s, 1H), 5.13(br dd, J=13.4, 4.7Hz, 1H), 4.54(d, J=17.5Hz, 1H), 4.42(d, J=17.6Hz, 1H), 2.97-2.85(m, 1H), 2.68-2.60(m, 1H), 2.49-2.39(m, 1H), 2.11-2.00(m, 1H)
3-(5-{1-ベンジル-1H-ピロロ[3,2-c]ピリジン-6-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン
6-クロロ-1H-ピロロ[3,2-c]ピリジン(76mg、500μmol)および炭酸カリウム(138mg、1.00mmol)/アセトニトリル(5.0mL)の懸濁液に、臭化ベンジル(65μL、550μmol)を加え、80℃で撹拌した。20時間後、再度臭化ベンジル(24μL、200μmol)を加え、次いで80℃で撹拌を再開した。計24時間後、この反応混合物を室温に冷却し、濾過し、減圧濃縮した。粗製物質を分取HPLC(カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(0.05%トリフルオロ酢酸含有); 移動相B: 95:5 アセトニトリル:水(0.05%トリフルオロ酢酸含有); グラジエント: 13%Bで0分間溶出後、13~53%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、生成物を含むフラクションを合わせて遠心エバポレーターで乾燥した。得られた物質をさらに分取HPLC(カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(酢酸アンモニウム含有); グラジエント: 28%Bで0分間溶出後、28~68%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、生成物158Aを得た(20.1mg、17%収率)。MS(ES): m/z=243.3 [M+H]+; 1H NMR(500MHz、クロロホルム-d) δ 8.68(d, J=0.8Hz, 1H), 7.37-7.29(m, 3H), 7.22(t, J=0.9Hz, 1H), 7.14(d, J=3.3Hz, 1H), 7.12-7.07(m, 2H), 6.63(dd, J=3.3, 0.9Hz, 1H), 5.27(s, 2H)
生成物158A(20.1mg、0.083mmol)および生成物1B(55.2mg、0.124mmol)/1,4-ジオキサン(0.50mL)の溶液に、炭酸カリウム(22.9mg、0.166mmol)/水(0.33mL)の溶液を加えた。反応容器を3回真空にし、窒素を充填し、次いでXPhos Pd G2(3.3mg、4.14μmol)を加え、100℃で撹拌した。4.5時間後、この反応混合物を濾過し、EtOAc(5mL)で希釈し、飽和塩化アンモニウム水溶液(2mL)で洗浄した。水相をEtOAc(5mL)で逆抽出し、有機層を合わせて減圧濃縮した。得られた粗製残渣をアセトニトリル(1.0mL)に懸濁し、次いでベンゼンスルホン酸(26.2mg、0.166mmol)を加え、90℃で撹拌した。15時間後、この反応混合物を室温に冷却し、減圧濃縮し、粗製物質を分取HPLC(カラム: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(0.05%トリフルオロ酢酸含有); 移動相B: 95:5 アセトニトリル:水(0.05%トリフルオロ酢酸含有); グラジエント: 4%Bで0分間溶出後、4~44%Bで20分かけて溶出し、次いで100%Bで0分間溶出; 流速: 20mL/分; カラム温度: 25℃)で精製し、実施例158を得た(15.9mg、40%収率)。LCMS(分析HPLC方法1): TRet=1.25分; m/z=451.2 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 11.02(s, 1H), 9.20(s, 1H), 8.57(s, 1H), 8.24(s, 1H), 8.14(br d, J=8.3Hz, 1H), 7.99-7.91(m, 2H), 7.40-7.23(m, 5H), 7.02(d, J=2.8Hz, 1H), 5.68(s, 2H), 5.15(dd, J=13.1, 5.1Hz, 1H), 4.59(d, J=17.9Hz, 1H), 4.47(d, J=17.3Hz, 1H), 2.98-2.86(m, 1H), 2.69-2.58(m, 1H), 2.48-2.38(m, 1H), 2.10-2.01(m, 1H)
N-(6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-3,4-ジメチルピリジン-2-イル)アセトアミド
分取HPLC方法: XBridge C18、200mm x19mm、粒子径: 5μm; 移動相A: 5:95 アセトニトリル:水(10mM酢酸アンモニウム含有); 移動相B: 95:5 アセトニトリル:水(10mM酢酸アンモニウム含有); グラジエント: 15%Bで0分間溶出後、15~50%Bで25分かけて溶出し、次いで100%Bで6分間溶出した; 流速: 20mL/分; カラム温度: 25℃
MS(ES): m/z=407.1 [M+H]+; 1H NMR(500MHz、DMSO-d6) δ 10.01-10.09(m, 1H) 8.27(s, 1H) 8.21(br d, J=7.96Hz, 1H) 7.79-7.85(m, 2H) 5.10-5.17(m, 1H) 4.51-4.58(m, 1H) 4.38-4.46(m, 1H) 2.88-2.99(m, 1H) 2.63(br d, J=18.66Hz, 1H) 2.41-2.46(m, 1H) 2.39(s, 3H) 2.10-2.10(m, 1H) 2.10(br s, 2H) 2.09(s, 3H) 2.00-2.07(m, 1 H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-3,5-ジカルボニトリル
密封したチューブ中、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(750mg、1.688mmol)/1,4-ジオキサン(5mL)の撹拌溶液に、室温で2-アミノ-6-クロロピリジン-3,5-ジカルボニトリル(271mg、1.519mmol)を加え、続いて炭酸カリウム(583mg、4.22mmol))/水(1mL)を加えた。この反応混合物を大気圧の窒素雰囲気下、15分間脱気し、これに窒素雰囲気下、室温でPdCl2(dppf)-CH2Cl2付加物(68.9mg、0.084mmol)を加え、再度5分間脱気した。チューブを密封し、100℃で加熱し、2時間撹拌した。反応の進行をTLCでモニターし、反応混合物を室温に冷却し、ブフナー漏斗でセライト濾過した。濾液を減圧濃縮し、粗製物(950mg)を得た。これをシリカゲルカラムクロマトグラフィー(Isolera、溶離剤:50~80%EtOAc/ヘキサン)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3,5-ジシアノピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(500mg、1.003mmol、59.4%)を薄黄色固体として得た。
マイクロ波バイアル中のtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3,5-ジシアノピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(500mg、1.086mmol)/アセトニトリル(5mL)の撹拌溶液に、ベンゼンスルホン酸(172mg、1.086mmol)を加えた。この反応混合物を密封し、マイクロ波反応装置中、30分間120℃で照射した。LCMSでモニターし、反応完了後、室温に冷却し、固体が沈殿した。得られた固体をブフナー漏斗で濾過し、真空乾燥し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-3,5-ジカルボニトリル(195mg、0.484mmol、44.6%)を薄黄色固体として得た。
LCMS: カラム: Kinetex XB-C18(75x30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム; 移動相B: ACN; 流速: 1.0mL/分; 純度=96.95%(RT=1.07分)
HPLC: カラム: Kinetex Biphenyl(100 X 4.6)mm、2.6μm、移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; 純度=95.9%(RT=5.95分)
1H-NMR(400MHz、DMSO-d6) δ 11.04(s, 1H), 8.62(s, 1H), 8.10(m, 2H), 8.00(s, 1H), 7.90(d, J=1.20Hz, 2H), 5.17(dd, J=5.20, 13.20Hz, 1H), 4.56(d, J=17.60Hz, 1H), 4.43(d, J=17.60Hz, 1H), 2.89-2.98(m, 1H), 2.53-2.68(m, 1H), 2.41-2.50(m, 1H), 2.03-2.08(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-フルオロニコチノニトリル
tert-ブチル(S)-5-アミノ-4-(5-ブロモ-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(5g、12.59mmol)/1,4-ジオキサン(80mL)の撹拌溶液に、酢酸カリウム(3.71g、37.8mmol)およびビス(ピナコラト)ジボロン(4.79g、18.88mmol)を窒素雰囲気下で加え、10分間N2ガスで脱気し、続いてPdCl2(dppf)-CH2Cl2付加物(1.028g、1.259mmol)を加えた。得られた反応混合物を80℃で4時間加熱し、室温に冷却し、セライト濾過し、濾液をEtOAc(450mL)および水(200mL)で希釈し、層を分離した。有機層を食塩水(50mL)で洗浄し、Na2SO4で乾燥し、減圧濃縮し、粗製物(15g)を得た。これをシリカゲルカラムクロマトグラフィー(Isolera、溶離剤:50~60%EtOAc/ヘキサン)で精製し、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(4.6g、8.38mmol、66.6%)を帯紅色固体として得た。
密封したチューブ中、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(500mg、1.125mmol)/1,4-ジオキサン(4mL)の撹拌溶液に、室温で2-アミノ-6-クロロ-5-フルオロニコチノニトリル(174mg、1.013mmol)、続いて炭酸カリウム(389mg、2.81mmol))/水(0.8mL)を加え、15分間窒素で脱気した。これに窒素雰囲気下、室温でPdCl2(dppf)-CH2Cl2付加物(45.9mg、0.056mmol)を加え、5分間再度脱気した。チューブを密封し、100℃で加熱し、2時間撹拌した。反応の進行をTLCおよびLCMSでモニターした。この反応混合物を室温に冷却し、セライト濾過し、濾液を減圧濃縮し、粗製物(650mg)を得た。これをシリカゲルカラムクロマトグラフィー(Isolera、溶離剤: 50~80%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-フルオロピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(300mg、0.604mmol、53.6%)を帯黄色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-フルオロピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(300mg、0.662mmol)/アセトニトリル(3mL)の撹拌溶液に、ベンゼンスルホン酸(105mg、0.662mmol)を加え、反応バイアルを密封し、マイクロ波反応装置中、30分間120℃で照射した。反応の進行をLCMSでモニターし、反応完了後、混合物を減圧濃縮し、粗製物(400mg)を得た。これを分取HPLCで精製し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-フルオロニコチノニトリル・ギ酸塩(56mg、0.127mmol、19.20%収率)を灰白色固体として得た。
分取HPLC方法詳細: カラム: YMC C18(250 X 20)mm、5μm、移動相A: 0.1%ギ酸水溶液、移動相B: アセトニトリル、流速:15mL/分
分析データ: HPLC: カラム: Kinetex Biphenyl(100 X 4.6)mm、2.6μm、移動相A:0.05%TFA水溶液、移動相B: ACN、流速: 1.0mL/分; RT=7.243分; 純度=96.46%LCMS: カラム: Kinetex XB-C18(75 x 30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム、移動相B: ACN、流速: 1.0mL/分; RT=1.11分、純度=98.01%; 1HNMR(400MHz、DMSO-d6) δ 11.03(s, 1H), 8.01(d, J=10.80Hz, 1H), 7.94(s, 1H), 7.85(t, J=9.60Hz, 2H), 5.16(dd, J=5.20, 13.20Hz, 1H), 4.55(d, J=17.60Hz, 1H), 4.41(d, J=17.60Hz, 1H), 2.89-2.98(m, 1H), 2.60-2.68(m, 1H), 2.41-2.50(m, 1H), 2.03-2.08(m, 1H)
3-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
密封したチューブ中、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.5g、1.125mmol)、6-クロロ-4-フェニルピリジン-2-アミン(0.184g、0.900mmol)および炭酸カリウム(0.389g、2.81mmol)の混合物を予め脱気した1,4-ジオキサン(16mL)および水(4mL)(4:1)で処理し、N2で10分間パージし、続いてPdCl2(dppf)-CH2Cl2付加物(0.046g、0.056mmol)を加えた。チューブを直ちに密封し、100℃で3時間撹拌した。反応完了後、反応容器を周囲温度に冷却した。この反応混合物を酢酸エチル(50mL)で希釈し、セライト濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填シリカゲル(230~400mesh)、溶出溶媒: 0~20%酢酸エチル/石油エーテル)で精製した。所望のフラクションを回収し、減圧濃縮し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.291g、0.549mmol、48.8%)を薄茶色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(125mg、0.257mmol)/アセトニトリル(1.6mL)の撹拌溶液に、ベンゼンスルホン酸(40.6mg、0.257mmol)を加え、バイアルを密封し、マイクロ波反応装置で30分間120℃で照射した。反応完了後、この混合物を減圧濃縮し、粗製物(350mg)を得た。これを分取HPLCで精製し、3-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(13mg、0.030mmol、11.8%)を灰白色固体として得た。
分取精製方法詳細: カラム: YMC C18(250 X 20)mm、5μm、移動相A: 0.1%ギ酸水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: HPLC: カラム: Kinetex Biphenyl(100 X 4.6)mm、2.6μm、移動相A: 0.05%TFA水溶液、移動相B: ACN、流速:1.0mL/分; RT=5.248分; 純度=96.4%; LCMS: カラム: Kinetex XB-C18(75 x 30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム、移動相B: ACN、流速: 1.0mL/分; RT=1.10分、純度=92.45%; 1HNMR(400MHz、DMSO-d6) δ 11.03(s, 1H), 8.30(s, 1H), 8.23(d, J=8.00Hz, 1H), 7.79-7.84(m, 3H), 7.51-7.56(m, 4H), 6.84(s, 1H), 6.45 (bs, 2H), 5.15(dd, J=5.20, 13.20Hz, 1H), 4.55(d, J=17.60Hz, 1H), 4.42(d, J=17.60Hz, 1H), 2.88-2.96(m, 1H), 2.65-2.69(m, 1H), 2.39-2.43(m, 1H), 2.02-2.05(m, 1H)
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(600mg、1.350mmol)および6-アミノ-2-クロロ-4-(トリフルオロメチル)ニコチノニトリル(171B、299mg、1.350mmol)の溶液を含むマイクロ波バイアル(30mL)に、重炭酸ナトリウム水溶液(284mg、3.38mmol、2M、1mL)を周囲温度で加えた。得られた反応混合物を窒素ガスでバブリングして10分間脱気し、次いでこの反応混合物に、テトラキス(トリフェニルホスフィン)パラジウム(0)(46.8mg、0.041mmol)を加え、マイクロ波反応装置で1時間120℃で加熱した。室温に冷却後、この反応混合物を水(30mL)に注ぎ、EtOAc(2x50mL)で抽出した。有機層を合わせて食塩水(30mL)で洗浄し、無水Na2SO4で乾燥し、減圧濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 50%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(401mg、0.755mmol、55.9%)を褐色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(400mg、0.794mmol)/無水アセトニトリル(4.0mL)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、周囲温度でベンゼンスルホン酸(126mg、0.794mmol)を加え、マイクロ波反応装置で120℃で2時間加熱した。反応完了後、この反応混合物から過剰溶媒を減圧除去し、粗製化合物を得た。分取HPLCを用いて精製を行い、6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチノニトリル(177.94mg、0.413mmol、52.0%)を白色固体として得た。
分取HPLC方法詳細: カラム: XBridge C18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム: XBridge C8(50 x 4.6mm)、5μm、波長: 220nm; 移動相; 0.1%TFA水溶液およびアセトニトリル; RT=1.96分; MS(ES): m/z= 430.0(M+H)+; 純度99.42%; HPLC: Kinetex EVO C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT=7.14分、純度: 99.69%; 1H NMR(400MHz、DMSO-d6) δ 11.02(s, 1H), 7.97-7.84(m, 5H), 6.96(s, 1H), 5.17(dd, J=4.80, 13.40Hz, 1H), 4.58-4.41(m, 2H), 2.97-2.89(m, 1H), 2.52-2.61(m, 1H), 2.43-2.42(m, 1H), 2.08-2.05(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル
密封したチューブ中、KOH(3.55g、63.2mmol)を、3-オキソヘキサン酸エチル(10g、63.2mmol)および2-シアノアセトアミド(5.31g、63.2mmol)/エタノール(100mL)の撹拌溶液にゆっくりと加え、85℃で18時間撹拌した。反応完了後、この反応混合物を室温に冷却し、得られた沈殿固体を濾過し、温水(100mL)に溶解させた。この溶液を4N HCl(40mL)を用いて酸性化し、灰白色残渣を得てこれを濾過し、水および冷ジエチルエーテルで洗浄した。得られた固体残渣を真空乾燥し、6-ヒドロキシ-2-オキソ-4-プロピル-1,2-ジヒドロピリジン-3-カルボニトリル(7.5g、41.8mmol、66.2%)を灰白色粉末として得た。
密封したチューブ中、窒素雰囲気下、室温で塩化ホスホリル(10mL)を6-ヒドロキシ-2-オキソ-4-プロピル-1,2-ジヒドロピリジン-3-カルボニトリル(3g、16.84mmol)およびテトラメチル塩化アンモニウム(3.69g、33.7mmol)の混合物に滴下して加え、次いで145℃で20時間加熱した。20時間後、TLC分析により、出発物質が完全に消費されたことが示された。この反応混合物を次いで室温に冷却し、砕氷に注ぎ、2時間撹拌した。溶液を酢酸エチル(150mL)で抽出し、硫酸ナトリウムで乾燥し、濃縮し、2,6-ジクロロ-4-プロピルニコチノニトリル(2.6g、12.07mmol、71.7%)を濃厚なシロップとして得た。
よく撹拌した2,6-ジクロロ-4-プロピルニコチノニトリル(2.0g、9.30mmol)/エタノール(25mL)の溶液を含むティニクレーブフラスコ(50mL)に、NH3水溶液(15mL)を周囲温度で加え、次いで50℃で16時間加熱した。反応完了後、溶媒を減圧濃縮し、生成物を位置異性体混合物として得た。粗製物質をフラッシュシリカゲル(230~400mesh、溶出: 10~15%EtOAc/石油エーテル)で精製し、2-アミノ-6-クロロ-4-プロピルニコチノニトリル(171C、170mg、0.864mmol、9.29%収率)を白色固体として得た。30%EtOAcで第2異性体を溶出し、6-アミノ-2-クロロ-4-プロピルニコチノニトリルを白色固体として得た(171D、340mg、1.732mmol、18.62%収率)。
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(250mg、0.562mmol)および2-アミノ-6-クロロ-4-プロピルニコチノニトリル(100mg、0.511mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(10mL)に、窒素雰囲気下、炭酸水素ナトリウム(129mg、1.533mmol)/水(1mL)を周囲温度で加えた。得られた反応混合物を窒素ガスで10分間バブリングして脱気し、次いでテトラキス(トリフェニルホスフィン)パラジウム(0)(59.1mg、0.051mmol)を加えた。この混合物をMW反応装置中、120℃で1時間マイクロ波を照射して加熱し、次いで水(20mL)に注ぎ、EtOAc(2x50mL)で抽出した。有機層を合わせて食塩水(20mL)で洗浄し、合わせた有機層を無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製残渣を得た。粗製物質をフラッシュシリカゲルカラム(230~400mesh、50~60%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-プロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(130mg、0.152mmol、29.8%)を灰白色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-プロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(75mg、0.157mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(24.84mg、0.157mmol)を加えた。反応バイアルを密封し、マイクロ波反応装置中、130℃で1時間照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル・TFA(55mg、0.106mmol、67.5%収率)を白色固体として得た。
分取HPLC方法詳細: カラム: XSelect C18(150x19)mm、5μm; 移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム: Kinetex XB-C18(75x3.0)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム; 移動相B: ACN、流速: 1.0mL/分; RT=1.826、MS(ES): m/z=404.2 [M+H]+; HPLC 純度: カラム: Kinetex EVO C18(100X4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT= 6.927分; HPLC純度: 99.68%; 1HNMR: 400MHz(DMSO): δ 11.01(s, 1H), 8.28-8.21(m, 2H), 7.93(d, J=8.0Hz, 1H), 7.31(s, 1H), 6.93(br s, 1H), 5.15(dd, J=5.20, 13.20Hz, 1H), 5.15(dd, J=5.20, 13.20Hz, 1H), 2.90(m, 1H), 2.70-2.50(m, 3H), 2.46-2.33(m, 3H), 2.08-2.01(m, 1H), 1.74-1.68(m, 2H), 0.97(t, J=7.60Hz, 3H); 19FNMR: 400MHz(DMSO): δ -74.52
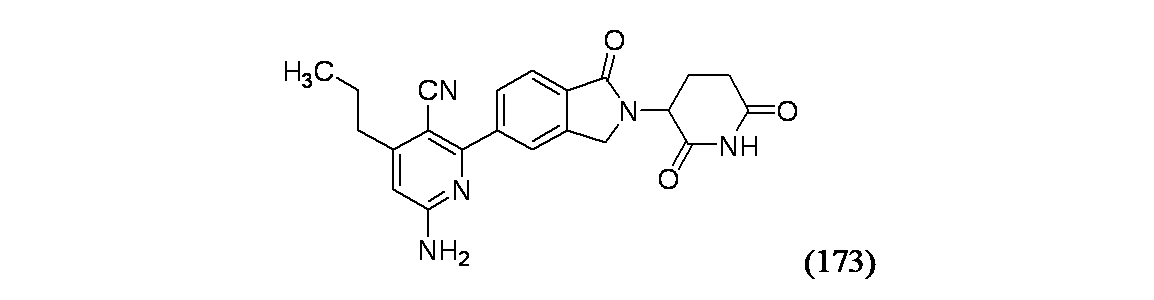
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(250mg、0.562mmol)および6-アミノ-2-クロロ-4-プロピルニコチノニトリル(172D、100mg、0.511mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(30mL)に、炭酸水素ナトリウム(129mg、1.533mmol)/水(1mL)を窒素雰囲気下、周囲温度で加え、得られた反応混合物を窒素ガスでバブリングして10分間脱気し、次いでこの反応混合物に、テトラキス(トリフェニルホスフィン)パラジウム(0)(59.1mg、0.051mmol)を加え、MW反応装置中、マイクロ波を照射して120℃で1時間加熱した。この反応混合物を次いで水(30mL)に加え、EtOAc(2x50mL)で抽出し、有機層を合わせて食塩水(20mL)で洗浄した。合わせた有機層を無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製残渣を得た。粗製物質をフラッシュシリカゲルカラム(230~400mesh、50~60%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-プロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(205mg、0.388mmol、76%)を灰白色固体として得た。
マイクロ波バイアル中、N2雰囲気下でtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-プロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(200mg、0.419mmol)/無水アセトニトリル(4.0mL)の撹拌溶液にベンゼンスルホン酸(66.2mg、0.419mmol)を加えた。反応バイアルを密封し、130℃で1時間マイクロ波照射した。反応完了後、反応物を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル・TFA(49mg、0.093mmol、22.3%)を白色固体として得た。
分取HPLC方法詳細: カラム: XSelect C18(150x19)mm、5μm; 移動相A: 0.1%TFA水溶液; 移動相B: アセトニトリル; 流速: 15mL/分
分析データ: LCMS: カラム: Kinetex XB-C18(75x3.0)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム; 移動相B: ACN; 流速: 1.0mL/分; RT=1.340、MS(ES): m/z=404.2[M+H]+; HPLC純度: カラム: XBridge C8(50x4.6)mm、3.5μm; 移動相: A:0.1%TFA水溶液; 移動相B: アセトニトリル; 流速: 2.0mL/分; RT= 2.788分; 純度: 99.83%; 1HNMR: 400MHz(DMSO): δ 11.03(s, 1H), 7.93(s, 1H), 7.84(s, 2H), 7.12(br s, 2H), 6.44(s, 1H), 5.16(dd, J=4.80, 13.40Hz, 1H), 4.48(dd, J=17.20, 52.80Hz, 2H), 2.94(m, 1H), 2.60-2.66(m, 3H), 2.50(m, 1H), 2.05(m, 1H), 1.66 (q, J=7.20Hz, 2H), 0.97(t, J=7.20Hz, 3H); 19FNMR: 400MHz(DMSO): δ -74.73
6-アミノ-4-(ジフルオロメチル)-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(300mg、0.614mmol)および6-アミノ-2-クロロ-4-(ジフルオロメチル)ニコチノニトリル(125mg、0.675mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(30mL)に、炭酸水素ナトリウム(155mg、1.842mmol)/水(1mL)を周囲温度で加えた。この混合物を窒素ガスでバブリングして10分間脱気し、次いでテトラキス(トリフェニルホスフィン)パラジウム(0)(71.0mg、0.061mmol)を加え、得られた混合物をMW反応装置中、120℃で1時間マイクロ波照射により加熱した。この反応混合物を次いで水(30mL)に加え、EtOAc(2x50mL)で抽出し、有機層を合わせて食塩水(20mL)で洗浄した。合わせた有機層を無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製残渣を得た。得られた粗製をフラッシュシリカゲルカラム(230~400mesh、40~50%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-(ジフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(195mg、0.367mmol、59.7%)を濃厚な褐色シロップとして得た。
tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-(ジフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(200mg、0.412mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、マイクロ波バイアル中、N2雰囲気下でベンゼンスルホン酸(65.2mg、0.412mmol)を加えた。反応バイアルを密封し、マイクロ波により1時間130℃で照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、6-アミノ-4-(ジフルオロメチル)-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(55mg、0.133mmol、32.4%)を白色固体として得た。
分取HPLC方法詳細: カラム: XBridge C18(250x19)mm、5μm; 移動相A: 0.1%ギ酸水溶液; 移動相B: アセトニトリル; 流速: 15mL/分
分析データ: LCMS: カラム: Kinetex XB-C18(75 x 3.0)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム; 移動相B: ACN: 流速: 1.0mL/分; RT=1.153、MS(ES): m/z=412.2 [M+H]+; HPLC純度: カラム: Kinetex EVO C18(100x4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速:1.0mL/分; RT= 5.230分; 純度: 99.85%; 1HNMR: 400MHz(DMSO): δ 11.02(s, 1H), 7.95(s, 1H), 7.90-7.83(m, 2H), 7.64(s, 2H), 7.15(t, J=53.60Hz, 1H), 6.80(s, 1H), 5.17(dd, J=5.20, 13.20Hz, 1H), 4.49(dd, J=17.60, 52.00Hz, 2H), 2.98-2.88(m, 1H), 2.70-2.62(m, 1H), 2.50-2.42(m, 1H), 2.09-2.03(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-(トリフルオロメチル)ニコチン-ニトリル
2,6-ジクロロ-5-(トリフルオロメチル)ニコチノニトリル(800mg、3.32mmol)/エタノール(15mL)の撹拌溶液に、水酸化アンモニウム(10mL、257mmol)を加え、耐圧容器中、50℃で加熱した。48時間後、この混合物を氷浴で冷却し、得られた混合物を減圧濃縮し、粗製物(1g)を得た。これをシリカゲルカラムクロマトグラフィー(Isolera、溶離剤:10~20%EtOAc/ヘキサン)で精製し、2-アミノ-6-クロロ-5-(トリフルオロメチル)ニコチノニトリルおよび6-アミノ-2-クロロ-5-(トリフルオロメチル)ニコチン-ニトリルの位置異性体混合物(250mg、71.0%)を白色固体として得た。
tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(400mg、0.900mmol)/1,4-ジオキサン(2mL)の撹拌溶液に、室温で2-アミノ-6-クロロ-5-(トリフルオロメチル)ニコチノニトリル(180mg、0.810mmol)、続いて炭酸カリウム(311mg、2.251mmol))/水(0.5mL)を加えた。この反応混合物を15分間窒素で脱気し、窒素雰囲気下、PdCl2(dppf)-CH2Cl2付加物(36.8mg、0.045mmol)を加え、再度5分間脱気した。チューブを密封し、100℃で加熱し、2時間撹拌した。反応の進行をTLCでモニターし、この反応混合物を室温に冷却し、セライト濾過した。濾液を減圧濃縮し、粗製物(850mg)を得てシリカゲルカラムクロマトグラフィー(Isolera、溶離剤: 60~70%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(150mg、0.281mmol、31.2%)の混合物を褐色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエートおよびtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-5-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(150mg、0.397mmol)/アセトニトリル(3mL)の撹拌溶液に、ベンゼンスルホン酸(62.8mg、0.397mmol)を加えた。反応バイアルを密封し、マイクロ波反応装置で1時間120℃で照射した。この混合物を減圧濃縮し、粗製物(250mg)を得て分取HPLCで精製し、両位置異性体を得た。
分取HPLC方法詳細: カラム: Sunfire C18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
位置異性体1の分析データ: 2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-(トリフルオロ-メチル)ニコチノニトリル(7mg、0.016mmol、4.0%); 薄黄色固体; HPLC: カラム: Kinetex Biphenyl(100 x 4.6)mm、2.6μm、移動相A: 0.05%TFA水溶液、移動相B: ACN、流速: 1.0mL/分; RT=6.891分; 純度=97.63%LCMS: カラム: Kinetex XB-C18(75 x 30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム、移動相B: ACN、流速: 1.0mL/分; RT=1.51分、純度=99.47%; 1H-NMR(400MHz、DMSO-d6) δ 11.01(s, 1H), 8.41(s, 1H), 7.82(d, J=8.00Hz, 1H), 7.74 (bs, 2H), 7.65(s, 1H), 7.54(d, J=8.00Hz, 1H), 5.11(dd, J=4.80, 13.40Hz, 1H), 4.53(d, J=17.60Hz, 1H), 4.39(d, J=17.60Hz, 1H), 2.85-2.93(m, 1H), 2.61-2.65(m, 1H), 2.40-2.43(m, 1H), 2.06-2.07(m, 1H)
2-アミノ-4-(ジフルオロメチル)-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(475mg、1.069mmol)および2-アミノ-6-クロロ-4-(ジフルオロメチル)ニコチノニトリル(218mg、1.069mmol)/無水1,4-ジオキサン(9.0mL)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、2.0M重炭酸ナトリウム(225mg、2.67mmol)/水(1.0mL)を加え、得られた反応混合物を窒素ガスでバブリングして10分間脱気した。次いでこの反応混合物にテトラキス(トリフェニルホスフィン)パラジウム(0)(37.1mg、0.032mmol)を加え、反応混合物をマイクロ波反応装置で1時間120℃で加熱した。反応完了後、この反応混合物を水(20mL)に加え、EtOAc(2x50mL)で抽出し、有機層を合わせて食塩水(30mL)で洗浄し、無水Na2SO4で乾燥し、減圧濃縮し、粗製残渣を得た。これを前述の粗製物(102mg)と合わせてシリカゲルカラムクロマトグラフィー(Biotage、0~100%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-(ジフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(301mg、0.447mmol、41.8%)を褐色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-(ジフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(300mg、0.618mmol)/無水アセトニトリル(3.0mL)の溶液を含むマイクロ波バイアル(30mL)に、ベンゼンスルホン酸(98mg、0.618mmol)を窒素雰囲気下、周囲温度で加え、マイクロ波反応装置中、120℃で2時間加熱した。反応完了後、この反応混合物から過剰溶媒を減圧除去し、粗製化合物を得た。分取HPLCを用いて精製し、2-アミノ-4-(ジフルオロメチル)-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(101.20mg、0.244mmol、39.5%)を灰白色固体として得た。
分取精製方法詳細: カラム: XBridge C18(250x19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム: Kinetex XB-C18(75x30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム、移動相B: ACN、流速: 1.0mL/分; RT=1.49分、純度=92.25%MS(ES): m/z= 412.2(M+H)+; HPLC: Kinetex EVO C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT=7.14分、純度: 99.29%; 1H-NMR(400MHz、DMSO-d6) δ 11.03(s, 1H), 8.33(s, 1H), 8.26(dd, J=1.20, 8.00Hz, 1H), 7.88(d, J=8.40Hz, 1H), 7.55(s, 1H), 7.43(s, 2H), 7.17(t, J=54.00Hz, 1H), 5.18-5.14(m, 1H), 4.56(d, J=17.60Hz, 1H), 4.43(d, J=17.20Hz, 1H), 2.98-2.89(m, 1H), 2.68-2.64(m, 1H), 2.40-2.33(m, 1H), 2.08-2.05(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル
ティニクレーブ(50mL)中、よく撹拌した2,6-ジクロロ-4-(トリフルオロメチル)ニコチノニトリル(2.0g、8.30mmol)および水酸化アンモニウム(1.616mL、41.5mmol)/エタノール(20mL)の溶液を50℃で12時間加熱した。反応完了後、溶媒を減圧濃縮し、粗製物質を得た。これをフラッシュシリカゲルカラムクロマトグラフィー(230~400mesh、溶出: 10~30%EtOAc/石油エーテル)で精製し、2-アミノ-6-クロロ-4-(トリフルオロメチル)ニコチノニトリル(177A、61mg、0.265mmol、3.20%)を白色固体として得た。
よく撹拌した2-アミノ-6-クロロ-4-(トリフルオロメチル)ニコチノニトリル(90mg、0.406mmol)およびtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(180mg、0.406mmol)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、周囲温度で2.0M重炭酸ナトリウム(85mg、1.015mmol)/水(0.2mL)を加えた。得られた反応混合物を窒素ガスでバブリングして10分間脱気し、次いでこの混合物にテトラキス(トリフェニルホスフィン)パラジウム(0)(14.08mg、0.012mmol)を加え、マイクロ波反応装置中、120℃で1時間加熱した。室温に冷却後、この反応混合物を水(30mL)に注ぎ、EtOAc(2x50mL)で抽出し、有機層を合わせて食塩水(30mL)で洗浄し、無水Na2SO4で乾燥し、減圧濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 90%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(130mg、0.167mmol、41.1%)を薄茶色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(130mg、0.258mmol)/無水アセトニトリル(2.0mL)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、周囲温度でベンゼンスルホン酸(40.8mg、0.258mmol)を加え、マイクロ波反応装置中、120℃で2時間加熱した。LCMSにより反応完了が示された後、この反応混合物から過剰溶媒を減圧除去し、粗製化合物を得た。得られた粗製化合物を分取HPLCを用いて精製し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチノニトリル(45mg、0.101mmol、39.0%)を灰白色固体として得た。
分取HPLC方法詳細: カラム: Sunfire C18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム: Kinetex XB-C18(75 x 3.0)mm、2.6μm、移動相A: 5mMぎ酸アンモニウムおよび移動相B: ACN; RT=1.96分; MS(ES): m/z= 428.2(M-H)+; LCMS純度99.91%HPLC: Kinetex EVO C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT=7.14分、純度: 96.11%; 1H-NMR(400MHz、DMSO-d6): δ 11.02(s, 1H), 8.33-8.30(m, 2H), 7.88(d, J=8.00Hz, 1H), 7.66(d, J=10.40Hz, 3H), 5.18-5.14(m, 1H), 4.58-4.42(m, 2H), 2.97-2.89(m, 1H), 2.65-2.53(m, 1H), 2.48-2.41(m, 1H), 2.07-2.02(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル
よく撹拌した2,6-ジクロロ-4-イソプロピルニコチノニトリル(1.0g、4.65mmol)/エタノール(10mL)の溶液を含むティニクレーブフラスコ(50mL)に、水酸化アンモニウム水溶液(40mL、1027mmol)を周囲温度で加え、50℃で16時間加熱した。反応完了後、溶媒を減圧濃縮し、位置異性体混合物として粗製物を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 20%酢酸エチル/石油エーテル)で精製し、2-アミノ-6-クロロ-4-イソプロピルニコチノニトリル(178A、0.1g、0.504mmol、10.8%)および6-アミノ-2-クロロ-4-イソプロピルニコチノニトリル(178B、0.24g、1.173mmol、25.2%)を白色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.2g、0.45mmol)、2-アミノ-6-クロロ-4-イソプロピルニコチノニトリル(0.088g、0.45mmol)および2-アミノ-6-クロロ-4-プロピルニコチノニトリル(100mg、0.511mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(10mL)に、窒素雰囲気下、周囲温度で重炭酸ナトリウム(0.095g、1.13mmol)/水(1mL)を加え、窒素ガスでバブリングして10分間脱気した。テトラキス(トリフェニルホスフィン)パラジウム(0)(0.052g、0.045mmol)を加え、得られた反応混合物をMWにより120℃で1時間加熱した。冷却後、この反応混合物を水(20mL)に注ぎ、EtOAc(2X50mL)で抽出した。有機層を合わせて食塩水(20mL)で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製残渣を得た。得られた粗製物をフラッシュシリカゲルカラムクロマトグラフィー(230~400mesh、Biotage、溶出: 50~60%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-イソプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.12g、0.174mmol、38.7%)を薄茶色液体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-4-イソプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.12g、0.251mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(0.040g、0.251mmol)を加え、バイアルを密封し、マイクロ波により1時間130℃で照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。生成物を分取HPLCで精製し、フラクションを凍結乾燥し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル・TFA(35mg、0.062mmol、24.87%収率)を得た。
分取HPLC方法詳細: カラム: XBridge C-18(150x19)mm 5μm; 移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: RT=1.78分; ACN/H2O(ぎ酸アンモニウム含有)、Kinetex XB-C18(75 x 3.0)mm、2.6μm、(波長=220nm); MS(ES): m/z= 404.2 [M+1]+; HPLC: 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; Kinetex EVO C18(100 x 4.6)mm、2.6μm、RT=6.75分、純度: 95.55%; Kinetex Biphenyl(100 x 4.6)mm、2.6μm、RT=7.20分、純度: 92.39%; 1HNMR(400MHz、DMSO-d6) δ 11.02(s, 1H), 8.32(s, 1H), 8.25(d, J=7.60Hz, 1H), 7.84(d, J=8.00Hz, 1H), 7.32(s, 1H), 6.94 (bs, 2H), 5.14-5.18(m, 1H), 4.53-4.57(m, 1H), 4.40-4.44(m, 1H), 3.10-3.17(m, 1H), 2.89-2.97(m, 1H), 2.60-2.68(m, 1H), 2.34-2.43(m, 1H), 2.03-2.10(m, 1H), 1.30(d, J=1.60Hz, 6H)
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.2g、0.450mmol)および6-アミノ-2-クロロ-4-イソプロピルニコチノニトリル(0.088g、0.450mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、重炭酸ナトリウム(0.095g、1.125mmol)/脱気水(2mL)を周囲温度で加えた。この混合物をさらに窒素ガスでバブリングして10分間脱気し、次いでテトラキス(トリフェニルホスフィン)パラジウム(0)(0.052g、0.045mmol)を加え、MWを照射して120℃で1時間加熱した。室温に冷却後、この反応混合物を水(30mL)に加え、EtOAc(2 x 50mL)で抽出し、有機層を合わせて食塩水(20mL)で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製残渣を得た。得られた粗製物をフラッシュシリカゲルカラムクロマトグラフィー(230~400mesh、Biotage、溶出: 50~60%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-イソプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.13g、0.220mmol、48.9%)を薄茶色液体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-4-イソプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.13g、0.272mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(0.043g、0.272mmol)を加え、反応バイアルを密封し、MWを照射して130℃で1時間加熱した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製を行い、純粋なフラクションを凍結乾燥し、6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル(23mg、0.056mmol、20.43%収率)を白色固体として得た。
分取HPLC方法詳細: カラム: XBridge C-18(150x19)mm; 5μm; 移動相A: 0.1%ギ酸水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム- Kinetex XB-C18(75 x 3.0)mm、2.6μm、波長=220nm; 移動相: 5mMぎ酸アンモニウム/水およびアセトニトリル; RT=1.43分; MS(ES): m/z=404.2 [M+1]+; HPLC: 移動相A: 0.05%TFA水溶液; 移動相B: ACN:0.05%TFA水溶液; 流速: 1.0mL/分; Kinetex EVO C18(100 x 4.6)mm、2.6μm、RT=5.14分、純度: 95.55%; Kinetex Biphenyl(100 x 4.6)mm、2.6μm、RT=5.78分、純度: 92.39%; 1HNMR 400MHz(DMSO) δ 11.02(s, 1H), 7.93(s, 1H), 7.84(s, 2H), 7.12(s, 2H), 6.50(s, 1H), 5.15-5.17(m, 1H), 4.52-4.56(m, 1H), 4.39-4.43(m, 1H), 3.07-3.12(m, 1H), 2.97-2.98(m, 1H), 2.64- 2.68(m, 1H), 2.51-2.60(m, 1H), 2.04-2.07(m, 1H), 1.27(d, J=6.40Hz, 6H)
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メチルニコチノニトリル
よく撹拌した6-クロロ-5-メチルニコチノニトリル(2.0g、13.11mmol)/乾燥ジクロロメタン(20mL)の溶液を含む一ツ口丸底フラスコ(100mL)に、トリフルオロ無水酢酸(1.851mL、13.11mmol)および過酸化尿素(1.233g、13.11mmol)を窒素雰囲気下、0℃で加え、この混合物を周囲温度で12時間撹拌し、反応の進行をTLCでモニターした。反応完了後、10%飽和重炭酸塩溶液(50mL)で反応をクエンチし、水層をジクロロメタン(2x100mL)で抽出し、有機層を合わせて無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製化合物を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 60%EtOAc/石油エーテル)で精製し、2-クロロ-5-シアノ-3-メチルピリジン1-オキシド(1.01g、5.32mmol、40.6%)を黄色固体として得た。
2-クロロ-5-シアノ-3-メチルピリジン1-オキシド(1.0g、5.93mmol)/POCl3(5.53mL、59.3mmol)の溶液を90℃で3時間加熱し、反応の進行をTLCでモニターした。反応完了後、この混合物を室温に冷却し、減圧濃縮し、過剰なPOCl3を除去した。得られた残渣を砕氷(50mL)に注ぎ、EtOAc(2 x 50mL)で抽出した。有機層を合わせて飽和炭酸水素ナトリウム溶液(50mL)、食塩水(50mL)で洗浄し、無水Na2SO4で乾燥し、濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 20%EtOAc/石油エーテル)で精製し、2,6-ジクロロ-5-メチルニコチノニトリル(0.890g、4.03mmol、67.9%)を褐色固体として得た。
ティニクレーブ(50mL)中、よく撹拌した2,6-ジクロロ-4-(トリフルオロメチル)ニコチノニトリル(2.0g、8.30mmol)および水酸化アンモニウム(1.616mL、41.5mmol)/エタノール(20mL)の溶液を50℃で12時間加熱し、反応完了後、溶媒を減圧除去し、粗製物質を得た。これをフラッシュシリカゲルカラムクロマトグラフィー(230~400mesh、10~30%EtOAc/石油エーテル)で精製し、6-アミノ-2-クロロ-5-メチルニコチノニトリル(135mg、0.746mmol、15.5%)および2-アミノ-6-クロロ-5-メチルニコチノニトリル(181B、25mg、0.115mmol、2.4%)を白色固体として得た。
よく撹拌した6-アミノ-2-クロロ-5-メチルニコチノニトリル(180B、130mg、0.776mmol)およびtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(345mg、0.776mmol)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、2.0M重炭酸ナトリウム(163mg、1.939mmol)/水(0.3mL)を加え、この混合物を窒素ガスでバブリングして10分間脱気した。次いでこの混合物に、テトラキス(トリフェニルホスフィン)パラジウム(0)(26.9mg、0.023mmol)を加え、マイクロ波反応装置中、120℃で1時間加熱した。反応の進行をTLCおよびLCMSでモニターし、この反応混合物を次いで水(20mL)に加え、EtOAc(2 x 30mL)で抽出した。有機層を合わせて食塩水(30mL)で洗浄し、無水Na2SO4で乾燥し、減圧濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 90%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-5-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(302mg、0.629mmol、81%)を褐色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-5-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(300mg、0.667mmol)/無水アセトニトリル(3.0mL)の溶液を含むマイクロ波バイアル(30mL)に、窒素雰囲気下、周囲温度でベンゼンスルホン酸(106mg、0.667mmol)を加え、マイクロ波反応装置中、120℃で2時間加熱した。反応完了がLCMSで示された後、反応混合物から過剰溶媒を減圧除去し、粗製化合物を得た。粗製物質を分取HPLCで精製し、6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メチルニコチノニトリル・TFA(121mg、0.244mmol、36.5%)を灰白色固体として得た。
分取HPLC方法詳細: カラム: XSelect C18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速:15mL/分
分析データ: LCMS: カラム: XBridge C8(50 x 4.6 mm)、3.5μm、移動相A: 0.1%TFA水溶液; 移動相B: 0.1%TFA/ACN; RT=1.38分; MS(ES): m/z= 376.1(M+H)+; LCMS純度93.53%; HPLC: Kinetex Biphenyl(100 x 4.6)mm、2.6μm; 移動相A:0.05%TFA水溶液; 移動相B: 0.05%TFA/ACN; 流速: 1.0mL/分; RT: 4.88分、純度: 98.65%; 1H-NMR(400MHz、DMSO-d6) δ 11.03 (bs, 1H), 7.96(s, 1H), 7.89-7.84(m, 2H), 7.74(d, J=0.80Hz, 1H), 7.03(s, 2H), 5.16(dd, J=5.20, 13.20Hz, 1H), 4.55(d, J=17.60Hz, 1H), 4.41(d, J=17.60Hz, 1H), 2.98-2.89(m, 1H), 2.68-2.67(m, 1H), 2.51-2.34(m, 1H), 2.12(s, 3H), 2.08-2.03(m, 1H)
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メトキシニコチノニトリル
2,6-ジクロロ-5-メトキシニコチノニトリル(500mg、2.463mmol)/エタノール(10mL)の撹拌溶液に、水酸化アンモニウム(5mL、128mmol)を加え、耐圧容器中、50℃で加熱した。48時間後、この混合物を氷浴で冷却し、得られた混合物を減圧濃縮し、粗製物(620mg)を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Isolera、溶離剤: 5~10%EtOAc/ヘキサン)で精製し、2-アミノ-6-クロロ-5-メトキシニコチノニトリル(100mg、0.426mmol、17.3%)および6-アミノ-2-クロロ-5-メトキシニコチノニトリル(80mg、0.42mmol、17.2%)を白色固体として得た。
tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(250mg、0.563mmol)/1,4-ジオキサン(2mL)の撹拌溶液に、室温で2-アミノ-6-クロロ-5-メトキシニコチノニトリル(93mg、0.506mmol)、続いて炭酸カリウム(194mg、1.407mmol))/水(0.5mL)を加えた。この混合物を15分間窒素で脱気し、窒素雰囲気下、これにPdCl2(dppf)-CH2Cl2付加物(22.97mg、0.028mmol)を加えた。チューブを密封し、100℃で加熱し、2時間撹拌した。この反応混合物を室温に冷却し、セライト濾過し、濾液を減圧濃縮し、粗製物を得た。これをシリカゲルカラムクロマトグラフィー(Isolera、溶離剤: 60~70%EtOAc/ヘキサン)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(80mg、0.079mmol、14.0%)を褐色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(80mg、0.172mmol)/無水アセトニトリル(3mL)の撹拌溶液に、ベンゼンスルホン酸(27.2mg、0.172mmol)を加えた。反応バイアルを密封し、マイクロ波反応装置で1時間120℃で照射した。反応完了後、この混合物を減圧濃縮し、粗製物(150mg)を得た。得られた残渣を分取HPLCで精製し、2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メトキシニコチノニトリル・TFA(14mg、0.027mmol、15.9%)を白色固体として得た。
分取HPLC方法詳細: カラム: Sunfire C18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: HPLC: カラム: Kinetex Biphenyl(100 x 4.6)mm、2.6μm、移動相A: 0.05%TFA水溶液、移動相B: ACN、流速: 1.0mL/分; RT=4.98分; 純度=98.58%; LCMS: カラム: Kinetex XB-C18(75 x 30)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム、移動相B: ACN、流速:1.0mL/分; RT= 2.597分、MS(ES): m/z=392.0 [M+1]+; 純度=98.98%; 1H NMR(400MHz、DMSO-d6) δ 11.04(s, 1H), 8.46(s, 1H), 8.06(s, 1H), 7.99(d, J=8.00Hz, 1H), 7.85(d, J=7.60Hz, 1H), 7.51 (bs, 2H), 5.16(dd, J=5.20, 13.40Hz, 1H), 4.55(d, J=17.60Hz, 1H), 4.42(d, J=17.60Hz, 1H), 3.41(s, 3H), 2.90-2.94(m, 1H), 2.60-2.68(m, 1H), 2.41-2.45(m, 1H), 2.03-2.06(m, 1H)
6-アミノ-5-シクロプロピル-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル
よく撹拌した2,6-ジクロロ-5-シクロプロピルニコチノニトリル(500mg、2.347mmol)/エタノール(12mL)の溶液を含むティニクレーブフラスコ(100mL)に、周囲温度でNH3水溶液(8mL)を加え、50℃で48時間加熱した。出発物質の完全消費後、溶媒を減圧濃縮し、粗製生成物を位置異性体混合物として得た。この粗製物質をシリカゲルカラムクロマトグラフィー(230~400mesh; 5~30%EtOAc/石油エーテル)で精製し、2-アミノ-6-クロロ-5-シクロプロピルニコチノニトリル(182A、35mg、0.175mmol、7.47%)および6-アミノ-2-クロロ-5-シクロプロピルニコチノニトリル(182B1、95mg、1.003mmol、42.7%)を灰白色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(252mg、0.568mmol)および6-アミノ-2-クロロ-5-シクロプロピルニコチノニトリル(182B、100mg、0.516mmol)/1,4-ジオキサン(8mL)の溶液を含むマイクロ波バイアル(30mL)に、周囲温度で炭酸水素ナトリウム(130mg、1.549mmol)/水(2mL)を加え、窒素ガスでバブリングして10分間脱気した。次いでこの混合物にテトラキス(トリフェニルホスフィン)パラジウム(0)(59.7mg、0.052mmol)を加え、MW反応装置中、マイクロ波照射により混合物を120℃で90分間加熱した。この反応混合物をEtOAc(25mL)で希釈し、セライト濾過し、濾液を減圧濃縮し、粗製化合物を得た。粗製物質をフラッシュシリカゲルカラム(230~400mesh、80~90%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-5-シクロプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(195mg、0.373mmol、72.3%収率)を帯薄褐色固体として得た。
マイクロ波バイアル中、N2雰囲気下でtert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-3-シアノ-5-シクロプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(190mg、0.400mmol)/無水アセトニトリル(7.0mL)の撹拌溶液に、ベンゼンスルホン酸(63.2mg、0.400mmol)を加え、反応バイアルを密封し、マイクロ波により130℃で90分間照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、6-アミノ-5-シクロプロピル-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル・TFA(107mg、0.207mmol、51.7%)を白色固体として得た。
分析データ: LCMS: カラム: Kinetex XB-C18(75 x 3.0)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム水溶液; 移動相B: ACN; 流速:1.0mL/分; RT=1.595、MS(ES): m/z=402.0 [M+H]+; HPLC: カラム: Kinetex EVO C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速:1.0mL/分; RT= 5.598分; 純度: 99.51%; 1HNMR: 400MHz(DMSO) δ 11.02(s, 1H), 7.95(s, 1H), 7.90-7.83(m, 2H), 7.54(s, 1H), 7.15(br s, 2H), 5.16(dd, J=4.80, 13.40Hz, 1H), 4.55(d, J=17.60Hz, 1H), 4.41(d, J=17.60Hz, 1H), 2.90(m, 1H), 2.63(m, 1H), 2.45(m, 1H), 2.05(m, 1H), 1.70(m, 1H), 0.92(m, 2H), 0.67(m, 2H); 19FNMR: 400MHz(DMSO): δ -74.49
2-アミノ-5-シクロプロピル-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(126mg、0.284mmol)および2-アミノ-6-クロロ-5-シクロプロピルニコチノニトリル(182A、50mg、0.258mmol)/1,4-ジオキサン(4mL)の溶液を含むマイクロ波バイアル(10mL)に、窒素雰囲気下、周囲温度で炭酸水素ナトリウム(65.1mg、0.775mmol)/水(1mL)を加え、窒素ガスでバブリングして混合物を10分間脱気した。次いでこの混合物にテトラキス(トリフェニルホスフィン)パラジウム(0)(29.8mg、0.026mmol)を加え、MW反応装置中、マイクロ波照射により120℃で90分間加熱した。次いでこの反応混合物をEtOAc(20mL)で希釈し、セライト濾過し、濾液を減圧濃縮し、粗製化合物を得た。得られた粗製物質をフラッシュシリカゲルカラム(230~400mesh、80~90%EtOAc/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-シクロプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(65mg、0.112mmol、43.2%)を淡褐色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-5-シアノ-3-シクロプロピルピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(60mg、0.126mmol)/無水アセトニトリル(3.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(19.96mg、0.126mmol)を加え、反応バイアルを密封し、マイクロ波により130℃で90分間照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、2-アミノ-5-シクロプロピル-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル・TFA(31mg、0.060mmol、47.5%)を灰白色固体として得た。
分取HPLC方法詳細: カラム: XSelect C18(150 x 19)mm、5μm; 移動相A: 0.1%TFA水溶液; 移動相B: アセトニトリル; 流速: 15mL/分
分析データ:(LCMS: カラム: Kinetex XB-C18(75 x 3.0)mm、2.6μm; 移動相A: 5mMぎ酸アンモニウム水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT=1.420、MS(ES): m/z=404.2 [M+H]+; HPLC 純度: カラム: Kinetex EVO C18(100 X 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速: 1.0mL/分; RT= 6.09分; 純度: 99.63%; 1HNMR: 400MHz(DMSO): δ 11.02(s, 1H), 7.83-7.80(m, 2H), 7.74(d, J=9.20Hz, 1H), 7.63(s, 1H), 6.82(br s, 2H), 5.16(dd, J=4.80, 13.40Hz, 1H), 4.53(d, J=17.60Hz, 1H), 4.41(d, J=17.60Hz, 1H), 2.91(m, 1H), 2.63(m, 1H), 2.45(m, 1H), 2.05(m, 1H), 1.73(m, 1H), 0.78(m, 2H), 0.62(m, 2H); 19FNMR: 400MHz(DMSO): δ -74.48
3-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
マイクロ波バイアル(Biotage)中の2,6-ジクロロ-4-ヨードピリジン(5.0g、18.26mmol)/NMP(10mL)の溶液に、連続してDIPEA(9.57mL、54.8mmol)および4-メトキシベンジルアミン(2.62mL、20.08mmol)を加え、マイクロ波照射により120℃で2時間加熱した。この反応混合物を氷冷水(50mL)で希釈し、酢酸エチル(50mL×3)で抽出した。有機層を合わせて水(50mL)、飽和食塩水(50mL)で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、100g snap、乾燥充填、シリカゲル(230~400mesh)、溶出溶媒: 5~30%酢酸エチル/石油エーテル)で精製し、所望のフラクションを回収し、減圧濃縮し、6-クロロ-4-ヨード-N-(4メトキシベンジル)ピリジン-2-アミン(3.0g、7.86mmol、43.1%)を灰白色固体として得た。
6-クロロ-4-ヨード-N-(4-メトキシベンジル)ピリジン-2-アミン(0.5g、1.335mmol)、炭酸セシウム(1.305g、4.00mmol)および1-ベンジルピペラジン(0.235g、1.335mmol)を脱気した1,4-ジオキサン(15.0mL)と混合し、N2で10分間パージした。続いてXPhos Pd G4(0.053g、0.067mmol)を加え、この混合物を70℃で16時間撹拌した。反応容器を周囲温度に冷却し、酢酸エチル(150mL)で希釈し、セライト濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填シリカゲル(230~400mesh)、溶出溶媒: 50~100%酢酸エチル/石油エーテル)で精製し、所望のフラクションを回収し、減圧濃縮し、4-(4-ベンジルピペラジン-1-イル)-6-クロロ-N-(4-メトキシベンジル)ピリジン-2-アミン(0.4g、0.801mmol、60.0%)を薄茶色固体として得た。
4-(4-ベンジルピペラジン-1-イル)-6-クロロ-N-(4-メトキシベンジル)ピリジン-2-アミン(0.4g、0.946mmol)/ジクロロメタン(10.0mL)の撹拌溶液に、TFA(3.0mL、38.9mmol)を0℃で加え、周囲温度で5時間撹拌した。溶媒を減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填、シリカゲル(230~400mesh)、溶出溶媒: 5~20%メタノール/ジクロロメタン)で精製し、所望のフラクションを回収し、減圧濃縮し、4-(4-ベンジルピペラジン-1-イル)-6-クロロピリジン2-アミン・TFA(0.350g、1.089mmol、11%)を薄茶色固体として得た。
tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.323g、0.727mmol)、4-(4-ベンジルピペラジン-1-イル)-6-クロロピリジン-2-アミン(0.2g、0.660mmol)、リン酸三カリウム(1.761mL、5.28mmol)を予め脱気した1,4-ジオキサン(10.0mL)および水(0.5mL)に混合し、この混合物をN2で10分間パージした。続いて混合物にXPhos Pd G4(0.026g、0.033mmol)を加え、70℃で16時間撹拌した。反応容器を周囲温度に冷却し、酢酸エチル(150mL)で希釈し、セライト濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填、シリカゲル(230~400mesh)、溶出溶媒: 5~20%メタノール/ジクロロメタン)で精製し、回収した所望のフラクションを減圧濃縮し、tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.13g、0.155mmol、23.5%)を薄茶色固体として得た。
tert-ブチル(S)-5-アミノ-4-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.12g、0.205mmol)/アセトニトリル(2.0mL)の撹拌溶液に、TFA(1.0mL)を室温で加え、マイクロ波反応装置中、130℃で30分間加熱した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、続いて純粋なフラクションを凍結乾燥し、3-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン・TFA(35mg、0.062mmol、24.9%)を白色固体として得た。
分取HPLC 条件: カラム: Xbridge C-18(150 x 19)mm、5μm、移動相A: 0.1%TFA水溶液、移動相B: アセトニトリル、流速: 15mL/分
分析データ: LCMS: カラム: XBridge C8(50 x 4.6mm)、5μm、波長=220nm; 移動相: 0.1%TFA水溶液およびアセトニトリル; RT=1.30分; MS(ES): m/z= 511.2 [M+1]+; HPLC: Kinetex EVO C18(100 x 4.6)mm、2.6μm; 移動相A: 10mM酢酸アンモニウム水溶液; 移動相B: アセトニトリル; RT=4.59分、純度: 99.70%(300nm); 1HNMR(400MHz、DMSO-d6): δ 11.03(s, 1H), 8.38(s, 1H), 8.20(s, 1H), 8.13(d, J=1.20Hz, 1H),7.74(d, J=8.00Hz, 1H), 7.34-7.36(m, 4H), 7.26-7.30(m, 1H), 6.82-6.83(m, 1H), 5.88(s, 1H), 5.69(s, 1H), 5.13-5.15(m, 1H), 4.48-4.52(m, 2H), 4.35-4.39(m, 1H), 2.67-2.68(m, 2H), 2.52-2.53(m,1H), 2.40-2.45(m, 1H), 2.33-2.34(m, 2H), 1.98-2.02(m,2H), 1.68-1.70(m, 1H), 1.49-1.50(m, 1H),1.38-1.25(m, 3H), 0.84-0.86(m, 1H)
3-(5-(6-アミノ-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
6-クロロ-4-ヨード-N-(4-メトキシベンジル)ピリジン-2-アミン(0.5g、1.335mmol)、6-クロロ-4-ヨード-N-(4-メトキシベンジル)ピリジン-2-アミン(0.5g、1.335mmol)、炭酸セシウム(1.31g、4.00mmol)および1-(メチルスルホニル)ピペラジン(0.263g、1.602mmol)を脱気した1,4-ジオキサン(10.0mL)に混合し、N2で10分間パージした。続いてこれにXPhos Pd G4(0.053 g,0.067mmol)を加え、70℃で16時間撹拌した。反応容器を周囲温度に冷却し、酢酸エチル(20mL)で希釈し、セライト濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填、シリカゲル(230~400mesh)、溶出溶媒: 50~100%酢酸エチル/石油エーテル)で精製し、所望のフラクションを回収し、減圧濃縮し、6-クロロ-N-(4-メトキシベンジル)-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-アミン(0.23g、0.514mmol、38.5%)を薄茶色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.274g、0.616mmol)、および6-クロロ-N-(4-メトキシベンジル)-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-アミン(0.23g、0.560mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(10mL)に、窒素雰囲気下、周囲温度でリン酸三カリウム(1.493mL、4.48mmol)/水(1mL)を加えた。得られた反応混合物を窒素ガスでバブリングして10分間脱気し、次いでXPhos Pd G4(0.022g、0.028mmol)を加え、70℃で16時間加熱した。室温に冷却後、この反応混合物を減圧濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 50%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(6-((4-メトキシベンジル)アミノ)-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)オキソイソ-インドリン-2-イル)-5-オキソペンタノエート(0.320g、0.288mmol、51.4%)を薄茶色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-5-アミノ-4-(5-(6-((4-メトキシベンジル)アミノ)-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(0.30g、0.433mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(0.068g、0.433mmol)を加えた。反応バイアルを密封し、マイクロ波反応装置中、130℃で1時間照射した。反応完了後、反応物質を濃縮し、灰白色固体を得た。分取HPLCを用いて精製し、フラクションを凍結乾燥して3-(5-(6-アミノ-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(23.0mg、0.046mmol、10.6%)を白色固体として得た。
分取HPLC方法詳細: カラム: XBridge C18(250 x 19)mm、5μm、移動相A: 5mMぎ酸アンモニウム水溶液、移動相B: アセトニトリル、流速:15mL/分
LCMS: カラム: XBridge C8(50 x 4.6mm)5μm、波長=220nm; 移動相: 0.1%TFA水溶液およびアセトニトリル; RT=1.33分; MS(ES): m/z=499.1[M+1]+
HPLC: Kinetex Biphenyl C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速:1.0mL/分; RT=4.59分、純度:99.50%(300nm); 1HNMR: 400MHz(DMSO): δ 11.03(s, 1H), 8.21(s, 1H), 8.14(t, J=4.00Hz, 1H), 7.78(d, J=8.00Hz, 1H), 6.90-6.90(m, 1H), 5.90-5.95(m, 3H), 5.13-5.17(m, 1H), 4.50-4.54(m, 1H), 4.37-4.41(m,1H), 3.25-3.50(m, 4H), 3.23-3.24(m, 4H), 2.90-2.97(m, 4H), 2.51-2.68(m, 1H), 2.43-2.46(m, 1H), 2.02-2.05(m, 1H)
3-(5-(4-(4-アセチルピペラジン-1-イル)-6-アミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
密封したチューブ中、6-クロロ-4-ヨード-N-(4-メトキシベンジル)ピリジン-2-アミン(0.5g、1.335mmol)、炭酸セシウム(1.305 g,4.00mmol)および1-(ピペラジン-1-イル)エタン-1-オン(0.205g、1.602mmol)を脱気した1,4-ジオキサン(10.0mL)に混合し、この反応混合物をN2で10分間パージし、続いてXPhos Pd G4(0.053g、0.067mmol)を加えた。チューブを密封し、70℃で16時間加熱した。反応容器を周囲温度に冷却した後、酢酸エチル(20mL)で希釈し、セライト濾過し、減圧濃縮し、粗製生成物を得た。得られた粗製生成物をカラムクロマトグラフィー(Grace、25g snap、乾燥充填、シリカゲル(230~400mesh)、溶出溶媒: 50~100%酢酸エチル/石油エーテル)で精製した。所望のフラクションを回収し、減圧濃縮し、1-(4-(2-クロロ-6-((4-メトキシベンジル)アミノ)ピリジン-4-イル)ピペラジン-1-イル)エタン-1-オン(0.17g、0.351mmol、26.3%)を薄茶色固体として得た。
よく撹拌したtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(0.22g、0.499mmol)、1-(4-(2-クロロ-6-((4-メトキシベンジル)アミノ)ピリジン-4-イル)ピペラジン-1-イル)エタン-1-オン(0.17g、0.453mmol)/1,4-ジオキサン(5mL)の溶液を含むマイクロ波バイアル(10mL)に、窒素雰囲気下、周囲温度でリン酸三カリウム(1.209mL、3.63mmol))/水(1mL)を加えた。得られた反応混合物を窒素ガスでバブリングして10分間脱気し、次いでXPhos Pd G4(0.018g、0.023mmol)を加え、70℃で16時間加熱した。室温に冷却後、この反応混合物を減圧濃縮し、粗製残渣を得た。得られた残渣をシリカゲルカラムクロマトグラフィー(Biotage、溶出: 50%酢酸エチル/石油エーテル)で精製し、tert-ブチル(S)-4-(5-(4-(4-アセチルピペラジン-イル)-6-((4-メトキシベンジル)アミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-アミノ-5-オキソペンタノエート(0.25g、0.273mmol、60.2%)を薄茶色固体として得た。
マイクロ波バイアル中、tert-ブチル(S)-4-(5-(4-(4-アセチルピペラジン-1-イル)-6-((4-メトキシベンジル)アミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-アミノ-5-オキソペンタノエート(0.25g、0.381mmol)/無水アセトニトリル(4.0mL)の撹拌溶液に、N2雰囲気下でベンゼンスルホン酸(0.06g、0.381mmol)を加えた。反応容器を密封し、マイクロ波により130℃で1時間照射した。反応完了後、反応物質を濃縮し、粗製生成物を灰白色固体として得た。分取HPLCを用いて精製し、フラクションを凍結乾燥し、3-(5-(4-(4-アセチルピペラジン-1-イル)-6-アミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(25.0mg、0.052mmol、13.6%)を白色固体として得た。
分取HPLC方法詳細: カラム: XBridge C18(250 x 19)mm、5μm、移動相A: 5mMぎ酸アンモニウム水溶液、移動相B: アセトニトリル、流速: 15mL/分
LCMS: カラム: XBridge C8(50 x 4.6 mm)、5μm、波長: 220nm; 移動相: 0.1%TFA水溶液およびアセトニトリル; RT=1.21分; MS(ES): m/z=499.1 [M+1]+
HPLC: Kinetex Biphenyl C18(100 x 4.6)mm、2.6μm; 移動相A: 0.05%TFA水溶液; 移動相B: ACN; 流速:1.0mL/分; RT=7.14分、純度: 95.69%
1HNMR: 400MHz(DMSO): δ 11.03(s, 1H), 8.15-8.22(m, 3H), 7.75(d, J=8.00Hz, 1H), 6.86-6.87(m, 1H), 5.90-5.92(m, 1H), 5.72-5.74(m, 2H),5.12-5.16(m, 1H), 4.40-4.49(m, 1H), 4.35(d, J =8.40Hz, 1H), 3.48-3.59(m, 4H), 3.31-3.43(m, 3H), 2.89-2.97(m, 1H), 2.60-2.68(m, 2H), 2.33-2.34(m, 1H), 2.01-2.06(m, 4H)
分析LCMS条件(実施例187~189)
方法A: ACQUITY UPLC(登録商標) BEH C18(3.0 x 50mm)、1.7μm; 移動相A: 95:5 水:アセトニトリル(2.5mM NH4OAc含有); 移動相B: 5:95 水:アセトニトリル(2.5mM NH4OAc含有); 温度: 40℃; グラジエント: 20%B~100%Bで2分かけて溶出; 流速: 0.7mL/分; 検出: MSおよびUV(220nm)
方法B: カラム: XBridge BEH XP C18(50 x 2.1)mm、2.5μm; 移動相A: 95:5 水:アセトニトリル(10mM NH4OAc含有); 移動相B: 5:95 水:アセトニトリル(10mM NH4OAc含有); 温度: 50℃; グラジエント: 0%B~100%Bで3分かけて溶出後; 流速: 1.1mL/分; 検出: MSおよびUV(220nm)
3-(5-(4-メチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
NaH(60%鉱油、21.4mg、0.54mmol)/無水THF(2mL)の撹拌した懸濁液に、6-ブロモ-4-メチルピリジン-2-アミン(100mg、0.54mmol)を室温で加え、10分間室温で撹拌し、0℃に冷却した。ヨウ化メチル(0.067mL、1.07mmol)を加え、この反応混合物をゆっくりと室温に加温し、16時間撹拌した。反応を飽和NH4Cl溶液でクエンチし、EtOAc(5mL×4)で抽出し、有機抽出物を合わせて食塩水で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮した。得られた残渣をフラッシュクロマトグラフィー(SiO2、12gカラム、0~30%EtOAc/石油エーテル)で精製し、6-ブロモ-N,4-ジメチルピリジン-2-アミン(70mg、65%収率)を得た。LCMS(方法A): 保持時間 1.04分、[M+H]+ 201.1; 1H NMR(300MHz、クロロホルム-d) δ=6.60(s, 1H), 6.10(s, 1H), 4.69(br s, 1H), 2.88(d, J=5.3Hz, 3H), 2.22(s, 3H)
6-ブロモ-N,4-ジメチルピリジン-2-アミン(70mg、0.35mmol)およびtert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(186mg、0.41mmol)/ジオキサン(1.4mL)およびH2O(0.3mL)の撹拌溶液に、炭酸カリウム(121mg、0.88mmol)を加え、アルゴンで5分間パージし、[1,1'-ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロリドジクロロメタン錯体(18g、0.022mmol)を加えた。この反応混合物を100℃で2時間加熱し、室温に冷却し、EtOAcで希釈し、食塩水で洗浄した。有機層を無水Na2SO4で乾燥し、濾過し、減圧濃縮し、得られた残渣をフラッシュクロマトグラフィー(SiO2、12gカラム、0~100%EtOAc/DCM)で精製し、tert-ブチル(S)-5-アミノ-4-(5-(4-メチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)-5-オキソペンタノエート(70mg)をオレンジ色油状物として得た。これをアセトニトリル(1.5mL)に溶解し、p-TSA一水和物(46mg、0.24mmol)を加え、マイクロ波反応装置中、120℃で1時間加熱した。この反応混合物を減圧濃縮し、逆相分取LCMS(カラム: Waters XBridge C18、19 x 150mm、粒子径: 5μm; 移動相A: 0.1%トリフルオロ酢酸水溶液; 移動相B: アセトニトリル; グラジエント: 10~40%Bで20分かけて溶出し、次いで100%Bで5分間溶出; 流速: 15mL/分)で精製し、3-(5-(4-メチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(5.3mg、4%収率)を得た。LCMS(方法B): 保持時間 0.78分、[M+H]+ 365.2; 1H NMR(400MHz、DMSO-d6) δ=10.99(s, 1H), 8.23(s, 1H), 8.20-8.14(m, 1H), 7.77(d, J=8.3Hz, 1H), 7.04(s, 1H), 6.52-6.43(m, 1H), 6.30(s, 1H), 5.13(dd, J=5.1, 13.1Hz, 1H), 4.58-4.47(m, 1H), 4.44-4.32(m, 1H), 2.98-2.83(m, 5H), 2.65-2.57(m, 1H), 2.42(dd, J=4.6, 13.1Hz, 1H), 2.25(s, 4H), 2.06-1.99(m, 1H)
ハロゲン化アリール(1eq.)、tert-ブチル(S)-5-アミノ-5-オキソ-4-(1-オキソ-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)イソインドリン-2-イル)ペンタノエート(1.2eq.)、炭酸カリウム(2eq.)、ジオキサン(4mL/mmol)および水(0.4mL/mmol)の混合物をアルゴンを用いて室温で5分間パージした。[1,1'-ビス(ジフェニルホスフィノ)フェロセン]パラジウム(II)ジクロリドジクロロメタン錯体(0.05eq.)を加え、この混合物を100℃で2時間加熱した。この反応混合物を室温に冷却し、EtOAcで希釈し、セライト濾過し、濾液を食塩水で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮した。得られた残渣をフラッシュクロマトグラフィーで精製し、単離した生成物をアセトニトリルに溶解し、pTSA・H2O(1.5eq)を加え、マイクロ波反応装置中、120℃で1時間加熱した。この反応混合物を室温に冷却し、減圧濃縮し、得られた粗製生成物を分取HPLCで精製し、所望の生成物を得た。
3-(5-(6-(エチルアミノ)-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
NaH(60%鉱油、141mg、3.53mmol)/無水THF(9mL)の撹拌懸濁液に、6-ブロモ-4-メチルピリジン-2-アミン(600mg、3.21mmol)を室温で加え、室温で10分間撹拌し、次いで0℃に冷却した。ヨウ化メチル(0.2mL、3.21mmol)を加え、この混合物をゆっくりと室温に加温し、16時間撹拌した。反応を飽和NH4Cl溶液でクエンチし、EtOAc(10mL×4)で抽出した。有機抽出物を合わせて食塩水で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮した。得られた残渣をフラッシュクロマトグラフィー(SiO2、24gカラム、0~30%EtOAc/石油エーテル)で精製し、6-ブロモ-N-エチル-4-メチルピリジン-2-アミン(550mg、80%収率)を得た。LCMS(方法A): 保持時間 1.66分、[M+H]+ 215.1; 1H NMR(300MHz、クロロホルム-d) δ 1.19-1.28(m, 3H) 2.20(s, 3H) 3.16-3.30(m, 2H) 4.56(br s, 1H) 6.08(s, 1H) 6.58(s, 1H)
3-(5-(6-(エチルアミノ)-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオンを6-ブロモ-N-エチル-4-メチルピリジン-2-アミンから一般的方法Iを用いて合成した。得られた粗製生成物を分取LCMS(カラム: Waters XBridge C18、19 x 150mm、粒子径: 5μm; 移動相A: 0.1%トリフルオロ酢酸水溶液; 移動相B: アセトニトリル; グラジエント: 10~40%Bで20分かけて溶出し、次いで100%Bで5分間溶出; 流速: 15mL/分)で精製した。LCMS(方法B): 保持時間 1.54分、[M+H]+ 379.1; 1H NMR(400MHz、DMSO-d6) δ=10.99(br s, 1H), 8.22(s, 1H), 8.18(d, J=8.0Hz, 1H), 7.77(d, J=8.0Hz, 1H), 7.03(s, 1H), 6.48(br t, J=5.5Hz, 1H), 6.30(s, 1H), 5.14(dd, J=5.0, 13.6Hz, 1H), 4.58-4.30(m, 2H), 3.37(br dd, J=5.5, 7.0Hz, 3H), 2.99-2.87(m, 1H), 2.70-2.58(m, 1H), 2.47-2.36(m, 2H), 2.24(s, 2H), 2.09-1.99(m, 1H), 1.22-1.17(m, 2H)
3-(5-(4,5-ジメチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン
NaH(60%鉱油、61mg、1.53mmol)/無水THF(7mL)の撹拌懸濁液に、6-クロロ-3,4-ジメチルピリジン-2-アミン(200mg、1.28mmol)を室温で加え、室温で10分間を撹拌し、次いで0℃に冷却した。ヨウ化メチル(0.18mL、2.81mmol)を加え、この混合物をゆっくりと室温に加温し、16時間撹拌した。反応を飽和NH4Cl溶液でクエンチし、EtOAc(10mL×4)で抽出した。有機抽出物を合わせて食塩水で洗浄し、無水Na2SO4で乾燥し、濾過し、減圧濃縮した。得られた残渣をフラッシュクロマトグラフィー(SiO2、24gカラム、0~30%EtOAc/石油エーテル)で精製し、6-クロロ-N,3,4-トリメチルピリジン-2-アミン(164mg、75%収率)を得た。LCMS(方法A): 保持時間 1.47分、[M+H]+ 170.9; 1H NMR(300MHz、クロロホルム-d) δ 6.45(s, 1H), 4.17-4.34(m, 1H), 3.02(d, J=4.91Hz, 3H), 2.14-2.23(m, 3H), 1.96(s, 3H)
3-(5-(4,5-ジメチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオンを6-クロロ-N,3,4-トリメチルピリジン-2-アミンから一般的方法Iにより合成した。得られた粗製生成物を分取LCMS(カラム: Waters XBridge C18、19 x 150mm、粒子径: 5μm; 移動相A: 0.1%トリフルオロ酢酸水溶液; 移動相B: アセトニトリル; グラジエント: 10~40%Bで20分かけて溶出し、次いで100%Bで5分間溶出; 流速: 15mL/分)で精製した。LCMS(方法B): 保持時間 0.62分; [M+H]+ 379.1; 1H NMR(400MHz、DMSO-d6) δ 10.97(br s, 1H), 8.16-8.33(m, 2H), 7.77(d, J=8.03Hz, 1H), 7.12(s, 1H), 6.03(br d, J=4.52Hz, 1H), 5.14(br dd, J=13.55, 5.02Hz, 1H), 4.34-4.59(m, 2H), 2.96(br d, J=4.02Hz, 4H), 2.64(br s, 1H), 2.37-2.46(m, 1H), 2.25(s, 3H), 1.96-2.06(m, 4H)
本発明の化合物の薬理学的特性は、多数の生物学的アッセイにより確認され得る。下記の生物学的アッセイを、本発明の化合物を用いて実施した。
調査する化合物を音響分注技術で予め添加した384ウェル細胞培養プレートに、1ウェルあたりJurkat細胞を80,000細胞/RPMI(40μL)+10%FBSで播種した。細胞を37℃および5%CO2で72時間インキュベートし、培養した。分析を円滑に進めるために、培養細胞を200rpmで5分間遠沈し、上清を除去した。細胞ペレットを剥がすためにプレートを揺すった後、細胞を固定用緩衝液(50μL、eBioScience FoxP3緩衝液セット、00-5523-00)に60分間室温で再懸濁した。遠心分離して上清を除去した後、細胞を透過用緩衝液(50μL、eBioScience FoxP3緩衝液セット、00-5523-00)中、10分間室温で透過処理した。透過処理後、細胞を遠沈し、上清を、Helios、イカロスおよびAiolosまたは対応するアイソタイプコントロールに対する蛍光標識抗体(20μL)/1倍の透過用緩衝液(Ikaros-Alexa488[Biolegend、Cat #368408、1:50]、Helios-PE[CST、Cat #29360、1:50]、Aiolos-Alexa647[Biolegend、Cat #371106、1:25])で置換し、染色反応を遮光して1時間室温でインキュベートした。次に、1倍の透過用緩衝液(30μL)を加え、細胞を遠心分離し、上清を除去した。染色細胞をフローサイトメトリー染色緩衝液(25μL、PBS+0.2%BSA)に再懸濁し、intellicyt iQue Plusフローサイトメーターを用いて分析した。
Claims (17)
- 式(I)
環Aは、
各R1は、独立してF、Cl、Br、-CN、-OH、-NO2、0~6個のR1aで置換されたC1-6アルキル、0~6個のR1aで置換されたC1-3アルコキシ、-CRxRxOCRxRx(フェニル)、-NRyRy、-NRxC(O)H、-NRxC(O)(C1-2アルキル)、-NRxC(O)NRxRx、-C(O)H、-C(O)OH、-C(O)O(C1-3アルキル)、-C(O)NRxRx、-C(O)NRx(C3-6シクロアルキル)、-OC(O)(C1-3アルキル)、-SO2(C1-3アルキル)、-NHN(C1-2アルキル)2、-CH2CH2Si(CH3)3であるか、またはC3-6シクロアルキル、フェニル、ピリジニル、ピペリジニル、ピペラジニル、ピロリジニル、モルホリニル、およびジオキシドチオモルホリニルから選択される環状基であり、前記環状基は0~4個のR1bで置換され;
各R1aは、独立してF、Cl、-CN、-OH、C1-2アルコキシ、C1-2フルオロアルコキシ、-SO2(C1-3アルキル)、またはフェニルであり;
各R1bは、独立してF、Cl、C1-2アルキル、C1-2フルオロアルキル、C1-2アルコキシ、C1-2フルオロアルコキシ、-C(O)(C1-3アルキル)、-SO2(C1-3アルキル)、または-CH2(フェニル)であり;
各Rxは、独立してHまたは-CH3であり;
各Ryは、独立してHまたはC1-6アルキルであり;および
nは、0、1、2、3、または4である]
の化合物またはその塩。 - 式中、
各R1が、独立してF、Cl、Br、-CN、-OH、-NO2、0~6個のR1aで置換されたC1-5アルキル、0~5個のR1aで置換されたC1-2アルコキシ、-CRxRxOCH2(フェニル)、-NRyRy、-NRxC(O)CH3、-NRxC(O)NRxRx、-C(O)H、-C(O)OH、-C(O)O(C1-2アルキル)、-C(O)NRxRx、-C(O)NRx(シクロプロピル)、-OC(O)(C1-2アルキル)、-SO2(C1-2アルキル)、-NHN(CH3)2、-CH2CH2Si(CH3)3であるか、またはC3-6シクロアルキル、フェニル、ピリジニル、ピペリジニル、ピペラジニル、ピロリジニル、モルホリニル、およびジオキシドチオモルホリニルから選択される環状基であり、前記環状基は0~3個のR1bで置換され;
各R1bが、独立してF、Cl、C1-2アルキル、-CH2F、-CHF2、-CF3、C1-2アルコキシ、-OCF3、-C(O)(C1-2アルキル)、または-SO2(C1-2アルキル)であり;および
nが、0、1、2、または3である、
請求項1に記載の化合物またはその塩。 - 式中、
各R1が、独立してF、Cl、Br、-CN、-OH、-NO2、-CH3、-CH2CH3、-CHCH2CH3、-CH(CH3)2、-CH2C(CH3)3、-CF3、-CH2Cl、-CH2CN、-CH2(フェニル)、-CH2OH、-CH2OCH2(フェニル)、-OCH3、-OCH2CH3、-OCH2(フェニル)、-NH2、-NH(CH3)、-NH(CH2CH3)、-NH(CH(CH3)CH2CH3)、-N(CH3)2、-N(CH2CH3)2、-NHC(O)CH3、-N(CH3)C(O)CH3、-C(O)H、-C(O)OCH3、-C(O)NH(シクロプロピル)、-C(O)NH2、-C(O)N(CH3)2、-CH2CH2Si(CH3)3、-OC(O)CH3、-NHN(CH3)2、シクロプロピル、フェニル、ピリジニル、(ベンジル)モルホリニル、(メチルスルホニル)ピペラジニル、またはアセチルピペラジニルであり;および
nが、0、1、2、または3である、
請求項1に記載の化合物またはその塩。 - 前記化合物が、
3-[1-オキソ-5-(キノリン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(1);
3-[5-(4-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(2);
3-(5-{8-オキサ-3,5-ジアザトリシクロ[7.4.0.02,7]トリデカ-1(9),2,4,6,10,12-ヘキセン-6-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(3);
3-[5-(1-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(4);
3-[5-(3-アミノキノキサリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(5);
3-(1-オキソ-5-{7H-ピロロ[2,3-c]ピリダジン-3-イル}-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(6);
3-[1-オキソ-5-(キノキサリン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(7);
3-[5-(4-アミノキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(8);
3-[1-オキソ-5-(キナゾリン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(9);
3-(5-{2-[(ブタン-2-イル)アミノ]-[1,3]チアゾロ[5,4-b]ピリジン-5-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(10);
3-(5-{7-フルオロ-1H-ピロロ[3,2-c]ピリジン-4-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(11);
3-[5-(4-メトキシキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(12);
3-[1-オキソ-5-(4-フェニルキノリン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(13);
N-シクロプロピル-2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]キノリン-4-カルボキサミド(14);
3-{5-[6-クロロ-4-(ジエチルアミノ)キナゾリン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(15);
3-[5-(4-アミノ-6,7-ジメトキシキナゾリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(16);
3-[5-(6-メトキシイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(17);
3-[5-(6-クロロキノキサリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(18);
3-[5-(7-フルオロイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(19);
3-[5-(5-フルオロイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(20);
3-[5-(1,5-ナフチリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(21);
3-[5-(4-アミノキナゾリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(22);
3-[5-(6-メチルイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(23);
3-[5-(4-メチルキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(24);
3-[5-(3-アミノイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(25);
3-[5-(6-フルオロキノキサリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(26);
3-[5-(6-クロロキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(27);
3-[5-(7-クロロキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(28);
3-[5-(6-メトキシキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(29);
3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]キノキサリン-2-カルボン酸エチル(30);
2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]キノリン-6-カルボン酸メチル(31);
3-[5-(3-メチルキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(32);
3-[5-(8-メトキシキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(33);
3-[5-(8-クロロキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(34);
3-[5-(6-フルオロキナゾリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(35);
3-[5-(3-クロロキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(36);
3-[5-(4-ヒドロキシキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(37);
3-[5-(6-フルオロキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(38);
3-[5-(6-メチルキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(39);
3-[5-(6-ヒドロキシキノリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(40);
2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]キナゾリン-7-カルボン酸メチル(41);
3-(5-{5-アミノ-3-[2-(トリメチルシリル)エチル]-3H-[1,2,3]トリアゾロ[4,5-d]ピリミジン-7-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(42);
3-[5-(2-アミノ-9H-プリン-6-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(43);
3-[5-(6-アミノ-7H-プリン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(44);
3-(5-{6-アミノ-1-エチル-1H-ピラゾロ[3,4-d]ピリミジン-4-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(45);
3-{5-[5-アミノ-1-(2,2-ジメチルプロピル)-4-オキソ-1,4-ジヒドロ-1,6-ナフチリジン-7-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(46);
3-[5-(5-アミノ-4-オキソ-1,4-ジヒドロ-1,6-ナフチリジン-7-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(47);
N-{3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-1-イル}アセトアミド(48);
3-{5-[1-(ジメチルアミノ)イソキノリン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(49);
3-{5-[1-(メチルアミノ)イソキノリン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(50);
3-{5-[5-(メチルアミノ)-1,6-ナフチリジン-7-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(51);
N-{3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-1-イル}-N-メチルアセトアミド(52);
3-[5-(6-アミノ-1,7-ナフチリジン-8-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(53);
3-[5-(3-アミノ-5-メトキシイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(54);
3-(5-(4-(4-アセチルピペラジン-1-イル)ピリド[2,3-d]ピリミジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(55);
3-(5-{4-ブロモ-1H-ピロロ[2,3-c]ピリジン-7-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(56);
3-[5-(5-アミノ-1,6-ナフチリジン-7-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(57);
3-[5-(3,6-ジメトキシイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(58);
1-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-3-カルボニトリル(59);
4-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]チエノ[3,2-c]ピリジン-2-カルボアルデヒド(60);
3-{5-[1-メチル-4-(メチルアミノ)-1H-イミダゾ[4,5-c]ピリジン-6-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(61);
3-(5-{2-メチル-4-オキソ-4H-ピラノ[2,3-b]ピリジン-7-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(62);
3-{5-[5,7-ジクロロ-3-(ジメチルアミノ)イソキノリン-1-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(63);
3-[5-(1,7-ナフチリジン-8-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(64);
3-(5-{2-アミノイミダゾ[1,2-b]ピリダジン-6-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(65);
3-[5-(イソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(66);
3-[5-(イソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(67);
3-(5-(2-アミノ-6-メトキシピリミジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(68);
3-(5-(6-アミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(69);
3-(5-(2-アミノピリミジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(70);
3-(1-オキソ-5-(4-フェニルピリミジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(71);
3-(1-オキソ-5-(4-(ピリジン-3-イル)ピリミジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(72);
3-(5-(4-アミノ-6-フェニル-1,3,5-トリアジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(73);
3-(1-オキソ-5-(4-フェニルピリジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(74);
3-(1-オキソ-5-(4-(ピリジン-2-イル)ピリミジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(75);
3-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリダジン-4-カルボニトリル(76);
6-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリダジン-3-カルボニトリル(77);
6-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリダジン-3-カルボキサミド(78);
3-[5-(6-アミノ-3-ニトロピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(79);
4-アミノ-2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリミジン-5-カルボニトリル(80);
4-アミノ-2-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]ピリミジン-5-カルボキサミド(81);
(3S)-3-[5-(1-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(82);
(3R)-3-[5-(1-アミノイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(83);
(3S)-3-[5-(1-アミノ-4-エトキシイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(84);
3-(5-(4-エトキシイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(85);
3-(5-(1-クロロ-4-エトキシイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(86);
3-(5-(2,3-ジヒドロ-1H-ピリド[3,4-b][1,4]オキサジン-7-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(87);
3-(5-(1-メチルイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(88);
3-(5-(1-シクロプロピルイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(89);
1-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソキノリン-4-カルボニトリル(90);
3-(1-オキソ-5-(キナゾリン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(91);
3-(5-(6-メチル-5-オキソ-5,6,7,8-テトラヒドロ-1,6-ナフチリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(92);
3-(5-(3-クロロキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(93);
3-(5-(3-メトキシキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(94);
3-(5-(3-(エチルアミノ)キノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(95);
3-(5-(3-ヒドロキシキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(96);
3-(5-(3-シクロプロピルキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(97);
3-(5-(3-イソプロピルキノキサリン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(98);
3-(1-オキソ-5-(3-フェニルキノキサリン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(99);
3-(5-(1,6-ナフチリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(100);
3-(5-(6-アミノ-3-ブロモピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(101);
3-(5-(6-アミノイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(102);
3-(5-(4-メトキシイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(103);
3-(5-(3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(104);
3-(5-(4-(ベンジルオキシ)イソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(105);
3-(5-(6-アミノ-3-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(106);
3-(5-(3-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(107);
3-(5-(4-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(108);
3-(1-オキソ-5-(ピリジン-2-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(109);
2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソニコチノニトリル(110);
2-(2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-4-イル)アセトニトリル(111);
3-(5-(6-アミノ-4-(ヒドロキシメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(112);
3-(5-(2,3-ジヒドロ-1H-ピロロ[2,3-c]ピリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(113);
3-(1-オキソ-5-(2-オキソ-2,3-ジヒドロ-1H-ピロロ[2,3-b]ピリジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(114);
3-(1-オキソ-5-(5,6,7,8-テトラヒドロイソキノリン-3-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(115);
3-(5-(6-アミノ-5-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(116);
3-(5-(5,6-ジアミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(117);
3-(1-オキソ-5-(1,2,3,4-テトラヒドロピリド[2,3-b]ピラジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(118);
3-(5-(5-アミノ-4,6-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(119);
3-(5-(6-アミノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(120);
3-(5-(4,5-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(121);
(3S)-3-[5-(1,8-ナフチリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(122);
(S)-3-(5-(3-アミノイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(123);
(S)-N-(1-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソキノリン-3-イル)アセトアミド(124);
3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボニトリル(125);
3-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}イソキノリン-1-カルボキサミド(126);
(4S)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート(127);
(4R)-7-{2-[(3S)-2,6-ジオキソピペリジン-3-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル}-2H,3H,4H-ピラノ[2,3-b]ピリジン-4-イルアセテート(128);
3-{5-[7-クロロ-4-(ジメチルアミノ)イソキノリン-1-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(129);
1-アミノ-3-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]-N,N-ジメチルイソキノリン-4-カルボキサミド(130);
3-[5-(1-アミノ-4-メチルイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(131);
3-[5-(6-アミノ-3-シクロプロピルピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(132);
3-[5-(6-アミノイソキノリン-1-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(133);
N-{1-[2-(2,6-ジオキソピペリジン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-5-イル]イソキノリン-6-イル}アセトアミド(134);
3-{5-[6-アミノ-4-(クロロメチル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(135);
3-(1-オキソ-5-{5H,6H,7H,8H,9H-ピリド[2,3-b]アゼピン-2-イル}-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(136);
3-[1-オキソ-5-(5,6,7,8-テトラヒドロ-1,8-ナフチリジン-2-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(137);
3-{5-[6-(2,2-ジメチルヒドラジン-1-イル)ピリジン-2-イル]-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル}ピペリジン-2,6-ジオン(138);
3-(5-(1H-イミダゾ[4,5-b]ピリジン-5-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(139);
3-(5-(6-アミノ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(140);
3-(5-(3,4-ジヒドロ-2H-ピリド[3,2-b][1,4]オキサジン-6-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(141);
3-(5-(6-アミノピラジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(142);
3-(5-(2-アミノ-6-メチルピリミジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(143);
3-(5-(4,6-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(144);
3-(5-(5-クロロ-3-ヒドロキシイソキノリン-1-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(145);
3-(5-(6-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(146);
3-(5-(6-ヒドロキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(147);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル(148);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)イソニコチノニトリル(149);
3-(5-(1-アミノ-5,6,7,8-テトラヒドロイソキノリン-3-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(150);
3-(5-(6-アミノ-4,5-ジメチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(151);
6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-メチルニコチノニトリル(152);
3-(5-(6-アミノ-5-メトキシ-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(153);
3-(5-(4-((ベンジルオキシ)メチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(154);
3-[5-(6-メトキシピリジン-2-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(155);
3-[5-(1-メトキシイソキノリン-3-イル)-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(156);
3-[1-オキソ-5-(1-オキソ-1,2-ジヒドロイソキノリン-3-イル)-2,3-ジヒドロ-1H-イソインドール-2-イル]ピペリジン-2,6-ジオン(157);
3-(5-{1-ベンジル-1H-ピロロ[3,2-c]ピリジン-6-イル}-1-オキソ-2,3-ジヒドロ-1H-イソインドール-2-イル)ピペリジン-2,6-ジオン(158);
3-(1-オキソ-5-(1H-ピロロ[3,2-c]ピリジン-6-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(159);
3-(1-オキソ-5-(1H-ピロロ[3,2-c]ピリジン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン(160);
3-(5-(1-ベンジル-1H-ピロロ[3,2-c]ピリジン-4-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(161);
6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピコリノニトリル(162);
3-(5-(6-アミノ-4-(トリフルオロメチル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(163);
3-(5-(6-アミノ-4-メトキシピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(164);
3-(5-(6-アミノ-4-クロロピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(165);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(166);
N-(6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-3,4-ジメチルピリジン-2-イル)アセトアミド(167);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ピリジン-3,5-ジカルボニトリル(168);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-フルオロニコチノニトリル(169);
3-(5-(6-アミノ-4-フェニルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(170);
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル(171);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル(172);
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-プロピルニコチノニトリル(173);
6-アミノ-4-(ジフルオロメチル)-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(174);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-(トリフルオロメチル)ニコチン-ニトリル(175);
2-アミノ-4-(ジフルオロメチル)-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(176);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-(トリフルオロメチル)ニコチン-ニトリル(177);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル(178);
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-4-イソプロピルニコチノニトリル(179);
6-アミノ-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メチルニコチノニトリル(180);
2-アミノ-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)-5-メトキシニコチノニトリル(181);
6-アミノ-5-シクロプロピル-2-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(182);
2-アミノ-5-シクロプロピル-6-(2-(2,6-ジオキソピペリジン-3-イル)-1-オキソイソインドリン-5-イル)ニコチノニトリル(183);
3-(5-(6-アミノ-4-(4-ベンジルピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(184);
3-(5-(6-アミノ-4-(4-(メチルスルホニル)ピペラジン-1-イル)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(185);
3-(5-(4-(4-アセチルピペラジン-1-イル)-6-アミノピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(186);
3-(5-(4-メチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(187);
3-(5-(6-(エチルアミノ)-4-メチルピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(188);または
3-(5-(4,5-ジメチル-6-(メチルアミノ)ピリジン-2-イル)-1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン(189)
である、請求項1に記載の化合物またはその塩。 - 請求項1~11のいずれか一項に記載の化合物またはその医薬的に許容される塩;および医薬的に許容される担体を含む、医薬組成物。
- がんの治療のための、請求項1~11のいずれか一項に記載の化合物またはその医薬的に許容される塩を含む、医薬組成物。
- 前記がんが、結腸がん、胃がん、膵臓がん、乳がん、前立腺がん、肺がん、卵巣がん、子宮頸がん、腎臓がん、頭頸部がん、リンパ腫、白血病および黒色腫から選択される、請求項13の医薬組成物。
- Heliosタンパク質に、請求項1~11のいずれか一項に記載の化合物またはその医薬的に許容される塩を接触させることを特徴とする、インビトロまたはエクスビボの細胞中のHeliosタンパク質レベル、Helios活性レベル、またはHelios発現レベルを減少させる方法。
- Heliosタンパク質が、配列番号1、2、3、4、または5のアミノ酸配列によってコードされている、請求項15に記載の方法。
- 請求項1~11のいずれか一項に記載の化合物またはその医薬的に許容される塩を含む、Heliosタンパク質レベル、Helios活性レベル、またはHelios発現レベルを減少させるための医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202062993144P | 2020-03-23 | 2020-03-23 | |
| US62/993,144 | 2020-03-23 | ||
| PCT/US2021/023382 WO2021194914A1 (en) | 2020-03-23 | 2021-03-22 | Substituted oxoisoindoline compounds for the treatment of cancer |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2023520759A JP2023520759A (ja) | 2023-05-19 |
| JPWO2021194914A5 JPWO2021194914A5 (ja) | 2024-04-02 |
| JP7698658B2 true JP7698658B2 (ja) | 2025-06-25 |
Family
ID=75478287
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022557736A Active JP7698658B2 (ja) | 2020-03-23 | 2021-03-22 | がん治療のための置換オキソイソインドリン化合物 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20230322803A1 (ja) |
| EP (1) | EP4126843A1 (ja) |
| JP (1) | JP7698658B2 (ja) |
| KR (1) | KR20220158256A (ja) |
| CN (1) | CN115605466B (ja) |
| AR (1) | AR121600A1 (ja) |
| AU (1) | AU2021241458A1 (ja) |
| BR (1) | BR112022018706A2 (ja) |
| CA (1) | CA3172626A1 (ja) |
| IL (1) | IL296676B2 (ja) |
| MX (1) | MX2022011601A (ja) |
| TW (1) | TW202140441A (ja) |
| WO (1) | WO2021194914A1 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4188549A1 (en) * | 2020-08-03 | 2023-06-07 | Novartis AG | Heteroaryl substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| MX2023004374A (es) * | 2020-10-14 | 2023-07-06 | C4 Therapeutics Inc | Ligandos tricíclicos para la degradación de la familia ikaros 2 o la familia ikaros 4. |
| RS66982B1 (sr) * | 2021-04-06 | 2025-07-31 | Bristol Myers Squibb Co | Piridinil supstituisana oksoizoindolinska jedinjenja |
| WO2023283425A1 (en) | 2021-07-09 | 2023-01-12 | Plexium, Inc. | Aryl compounds and pharmaceutical compositions that modulate ikzf2 |
| EP4452414A2 (en) * | 2021-12-22 | 2024-10-30 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| CA3237577A1 (en) | 2021-12-22 | 2023-06-29 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| CN116640122A (zh) * | 2022-02-16 | 2023-08-25 | 苏州国匡医药科技有限公司 | Ikzf2降解剂及包含其的药物组合物和用途 |
| WO2023178181A1 (en) | 2022-03-17 | 2023-09-21 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| US20250214991A1 (en) * | 2022-03-25 | 2025-07-03 | Oncopia Therapeutics, Inc. D/B/A/ Sk Life Science Labs | Bicyclic heteroaryl-containing compounds as ikzf2 degraders |
| CN114702440B (zh) * | 2022-04-26 | 2024-06-18 | 永农生物科学有限公司 | 一种氨氯吡啶酸的制备方法及制备的氨氯吡啶酸 |
| WO2024096753A1 (en) | 2022-11-02 | 2024-05-10 | Captor Therapeutics S.A. | Nek7 degraders and methods of use thereof |
| EP4626878A1 (en) | 2022-12-02 | 2025-10-08 | Neumora Therapeutics, Inc. | Methods of treating neurological disorders |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019038717A1 (en) | 2017-08-23 | 2019-02-28 | Novartis Ag | 3- (1-OXOISOINDOLIN-2-YL) PIPERIDINE-2,6-DIONE DERIVATIVES AND USES THEREOF |
| WO2020012334A1 (en) | 2018-07-10 | 2020-01-16 | Novartis Ag | 3-(5-hydroxy-1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and their use in the treatment of ikaros family zinc finger 2 (ikzf2)-dependent diseases |
| WO2020012337A1 (en) | 2018-07-10 | 2020-01-16 | Novartis Ag | 3-(5-amino-1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and their use in the treatment of i karos family zinc finger 2 (ikzf2)-dependent diseases |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI380996B (zh) | 2004-09-17 | 2013-01-01 | Hoffmann La Roche | 抗ox40l抗體 |
| ES2657443T3 (es) | 2005-03-25 | 2018-03-05 | Gitr, Inc. | Anticuerpos anti-GITR y usos de los mismos |
| AU2006244068B9 (en) | 2005-05-10 | 2012-10-25 | Incyte Holdings Corporation | Modulators of indoleamine 2,3-dioxygenase and methods of using the same |
| KR101411165B1 (ko) | 2005-07-01 | 2014-06-25 | 메다렉스, 엘.엘.시. | 예정 사멸 리간드 1 (피디-엘1)에 대한 인간 모노클로날항체 |
| CA2634198C (en) | 2005-12-20 | 2014-06-03 | Incyte Corporation | N-hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase |
| JP5319532B2 (ja) | 2006-09-19 | 2013-10-16 | インサイト・コーポレイション | インドールアミン2,3−ジオキシゲナーゼのモジュレーターとしてのn−ヒドロキシアミジノヘテロサイクル |
| CL2007002650A1 (es) | 2006-09-19 | 2008-02-08 | Incyte Corp | Compuestos derivados de heterociclo n-hidroxiamino; composicion farmaceutica, util para tratar cancer, infecciones virales y desordenes neurodegenerativos entre otras. |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| US8591886B2 (en) | 2007-07-12 | 2013-11-26 | Gitr, Inc. | Combination therapies employing GITR binding molecules |
| EP2044949A1 (en) | 2007-10-05 | 2009-04-08 | Immutep | Use of recombinant lag-3 or the derivatives thereof for eliciting monocyte immune response |
| CA2932121A1 (en) | 2007-11-30 | 2009-06-11 | Newlink Genetics Corporation | Ido inhibitors |
| EP2296789A1 (fr) | 2008-05-29 | 2011-03-23 | Saint-Gobain Centre de Recherches et d'Etudes Européen | Structure en nid d'abeille a base de titanate d'aluminium |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| WO2010077634A1 (en) | 2008-12-09 | 2010-07-08 | Genentech, Inc. | Anti-pd-l1 antibodies and their use to enhance t-cell function |
| CA2772613C (en) | 2009-09-03 | 2020-03-10 | Schering Corporation | Anti-gitr antibodies |
| US8722720B2 (en) | 2009-10-28 | 2014-05-13 | Newlink Genetics Corporation | Imidazole derivatives as IDO inhibitors |
| PL2949670T3 (pl) | 2009-12-10 | 2019-07-31 | F. Hoffmann-La Roche Ag | Przeciwciała wiążące się preferencyjnie z zewnątrzkomórkową domeną 4 ludzkiego CSF-1R i ich zastosowanie |
| US9150656B2 (en) | 2010-03-04 | 2015-10-06 | Macrogenics, Inc. | Antibodies reactive with B7-H3, immunologically active fragments thereof and uses thereof |
| US9221910B2 (en) | 2010-03-05 | 2015-12-29 | Hoffmann-La Roche Inc. | Antibodies against human CSF-1R |
| US9169323B2 (en) | 2010-03-05 | 2015-10-27 | Hoffmann-La Roche Inc. | Antibodies against human CSF-1R |
| AU2011248083B2 (en) | 2010-05-04 | 2015-09-10 | Five Prime Therapeutics, Inc. | Antibodies that bind CSF1R |
| MX337040B (es) | 2010-09-09 | 2016-02-09 | Pfizer | Moleculas de union a 4-1bb. |
| NO2694640T3 (ja) | 2011-04-15 | 2018-03-17 | ||
| PL2699264T3 (pl) | 2011-04-20 | 2018-08-31 | Medimmune, Llc | Przeciwciała i inne cząsteczki wiążące B7-H1 i PD-1 |
| EP2785375B1 (en) | 2011-11-28 | 2020-07-22 | Merck Patent GmbH | Anti-pd-l1 antibodies and uses thereof |
| CA2853889A1 (en) | 2011-12-15 | 2013-06-20 | F. Hoffmann-La Roche Ag | Antibodies against human csf-1r and uses thereof |
| BR112014018961A8 (pt) | 2012-02-06 | 2017-07-11 | Genentech Inc | Anticorpo isolado, anticorpo biespecífico, fragmento, ácido nucleico isolado, vetor, célula hospedeira, método de produção de anticorpos, composição farmacêutica, uso do anticorpo, método de tratamento, método de inibição e artigo industrializado |
| AR090263A1 (es) | 2012-03-08 | 2014-10-29 | Hoffmann La Roche | Terapia combinada de anticuerpos contra el csf-1r humano y las utilizaciones de la misma |
| HK1208233A1 (en) | 2012-05-11 | 2016-02-26 | 戊瑞治疗有限公司 | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (csf1r) |
| AR091649A1 (es) | 2012-07-02 | 2015-02-18 | Bristol Myers Squibb Co | Optimizacion de anticuerpos que se fijan al gen de activacion de linfocitos 3 (lag-3) y sus usos |
| EP2890398A4 (en) | 2012-08-31 | 2016-03-09 | Five Prime Therapeutics Inc | METHODS OF TREATING DISEASES WITH ANTIBODIES THAT BIND COLONY STIMULATING FACTOR RECEIVER 1 (CSF1R) |
| CN104230787B (zh) * | 2014-08-20 | 2016-08-24 | 华东师范大学 | N-(1,3-二氧代异吲哚啉)芳酰胺类化合物及其制备方法和应用 |
| IL297717A (en) * | 2016-12-01 | 2022-12-01 | Arvinas Operations Inc | History of tetrahydronaphthalene and tetrahydroisoquinoline as estrogen receptor antagonists |
| BR112020007576A2 (pt) * | 2017-10-18 | 2020-09-24 | Novartis Ag | composições e métodos para degradação de proteína seletiva |
| IL293027A (en) * | 2019-11-19 | 2022-07-01 | Bristol Myers Squibb Co | Compounds useful as inhibitors of Helios protein |
-
2021
- 2021-03-17 TW TW110109618A patent/TW202140441A/zh unknown
- 2021-03-18 AR ARP210100671A patent/AR121600A1/es not_active Application Discontinuation
- 2021-03-22 IL IL296676A patent/IL296676B2/en unknown
- 2021-03-22 MX MX2022011601A patent/MX2022011601A/es unknown
- 2021-03-22 EP EP21718401.9A patent/EP4126843A1/en active Pending
- 2021-03-22 JP JP2022557736A patent/JP7698658B2/ja active Active
- 2021-03-22 BR BR112022018706A patent/BR112022018706A2/pt unknown
- 2021-03-22 CN CN202180022533.8A patent/CN115605466B/zh active Active
- 2021-03-22 CA CA3172626A patent/CA3172626A1/en active Pending
- 2021-03-22 WO PCT/US2021/023382 patent/WO2021194914A1/en not_active Ceased
- 2021-03-22 KR KR1020227036360A patent/KR20220158256A/ko active Pending
- 2021-03-22 AU AU2021241458A patent/AU2021241458A1/en active Pending
- 2021-03-22 US US17/913,206 patent/US20230322803A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019038717A1 (en) | 2017-08-23 | 2019-02-28 | Novartis Ag | 3- (1-OXOISOINDOLIN-2-YL) PIPERIDINE-2,6-DIONE DERIVATIVES AND USES THEREOF |
| WO2020012334A1 (en) | 2018-07-10 | 2020-01-16 | Novartis Ag | 3-(5-hydroxy-1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and their use in the treatment of ikaros family zinc finger 2 (ikzf2)-dependent diseases |
| WO2020012337A1 (en) | 2018-07-10 | 2020-01-16 | Novartis Ag | 3-(5-amino-1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and their use in the treatment of i karos family zinc finger 2 (ikzf2)-dependent diseases |
Also Published As
| Publication number | Publication date |
|---|---|
| US20230322803A1 (en) | 2023-10-12 |
| IL296676B2 (en) | 2025-10-01 |
| WO2021194914A1 (en) | 2021-09-30 |
| EP4126843A1 (en) | 2023-02-08 |
| JP2023520759A (ja) | 2023-05-19 |
| CN115605466A (zh) | 2023-01-13 |
| IL296676B1 (en) | 2025-06-01 |
| AU2021241458A1 (en) | 2022-11-24 |
| MX2022011601A (es) | 2022-10-18 |
| CA3172626A1 (en) | 2021-09-30 |
| TW202140441A (zh) | 2021-11-01 |
| IL296676A (en) | 2022-11-01 |
| BR112022018706A2 (pt) | 2022-11-01 |
| AR121600A1 (es) | 2022-06-22 |
| CN115605466B (zh) | 2024-11-01 |
| KR20220158256A (ko) | 2022-11-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7698658B2 (ja) | がん治療のための置換オキソイソインドリン化合物 | |
| JP7629459B2 (ja) | Heliosタンパク質の阻害剤として有用な化合物 | |
| JP7373512B2 (ja) | T細胞アクティベーターとして有用なナフチリジノン化合物 | |
| CN109476641B (zh) | Cbp/ep300的杂环抑制剂及其在治疗癌症中的用途 | |
| CN103038233B (zh) | 吡啶酮和氮杂吡啶酮化合物及使用方法 | |
| TWI867287B (zh) | 經吡啶基取代之側氧基異吲哚啉化合物 | |
| CN111527084A (zh) | 可用作hpk1抑制剂的异呋喃酮化合物 | |
| JP2024515545A (ja) | がん治療のためのピリジニル置換オキソイソインドリン化合物 | |
| CN117157286A (zh) | 经吡啶基取代的氧代异吲哚啉化合物 | |
| EA048870B1 (ru) | Замещенные оксоизоиндолины | |
| EA048753B1 (ru) | Пиридинилзамещенные оксоизоиндолиновые соединения | |
| EA048583B1 (ru) | Пиридинил-замещенные оксоизоиндолиновые соединения для лечения злокачественной опухоли | |
| HK1212689A1 (zh) | 布鲁顿氏酪氨酸激酶抑制剂 | |
| HK1212689B (en) | Inhibitors of bruton's tyrosine kinase |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240321 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240321 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20241115 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20250305 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20250227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20250314 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250610 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250613 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7698658 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |