JP7586894B2 - 共有結合リガンドのプロテオームワイドな発見のための方法およびその組成物 - Google Patents
共有結合リガンドのプロテオームワイドな発見のための方法およびその組成物 Download PDFInfo
- Publication number
- JP7586894B2 JP7586894B2 JP2022505603A JP2022505603A JP7586894B2 JP 7586894 B2 JP7586894 B2 JP 7586894B2 JP 2022505603 A JP2022505603 A JP 2022505603A JP 2022505603 A JP2022505603 A JP 2022505603A JP 7586894 B2 JP7586894 B2 JP 7586894B2
- Authority
- JP
- Japan
- Prior art keywords
- protein
- compound
- group
- probe
- sample
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6803—General methods of protein analysis not limited to specific proteins or families of proteins
- G01N33/6848—Methods of protein analysis involving mass spectrometry
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- Urology & Nephrology (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Cell Biology (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Microbiology (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Computational Biology (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Description
本出願は、米国特許法第119条(e)の下で、2019年8月5日出願の米国特許第62/882,757号(その全内容は、参照によりその全体が組み込まれる)の優先権の利益を主張する。
本発明は、概して、標的発見、より具体的には、プロテオーム中のタンパク質と求電子化合物との共有結合相互作用を同定および定量化するための、比較質量分析法分析に基づくプロファイリング方法に関する。
多くの薬物および薬物候補は、細胞内の特定のタンパク質中のアミノ酸残基の共有結合修飾によって作用する。かかる共有結合修飾の主な形態は、薬物または薬物候補中の求電子部分と、タンパク質中の求核性アミノ酸との間で生じる。特定のタンパク質を共有結合的に修飾することができるさらなる化学プローブおよび薬物の発見は、天然の生物学的系における様々なタンパク質との化合物反応性を全体的にマッピングする一般的な方法から利益を得るであろう。
[本発明1001]
タンパク質標的を同定するための方法であって、
(a)プロテオミック試料を、求電子部分およびクリック可能なタグを含むプローブ化合物と接触させることであって、前記求電子部分が、前記タンパク質標的中の求核性アミノ酸残基に共有結合する、ことと、
(b)前記プロテオミック試料を分析して、前記タンパク質標的を検出し、それによって前記タンパク質標的を同定することと
を含む、前記方法。
[本発明1002]
前記クリック可能なタグが、検出可能な標識にさらに共有結合的に連結される、本発明1001の方法。
[本発明1003]
タンパク質標的を同定するための方法であって、
(a)第1のタンパク質含有試料を、求電子部分を有しかつ末端のクリック可能なタグを欠く競合化合物と接触させることと、
(b)(a)の前記試料を、前記求電子部分および前記末端のクリック可能なタグを含むプローブ化合物と接触させることと、
(c)第2のタンパク質含有試料を前記プローブ化合物と接触させることであって、前記求電子部分が、前記タンパク質標的中の求核性アミノ酸残基と結合する、ことと、
(d)前記第1のタンパク質含有試料中のプローブ化合物で修飾されたタンパク質の量を、前記第2のタンパク質含有試料中のプローブ化合物で修飾されたタンパク質の量と比較して検出することによって、前記タンパク質標的を同定することと
を含む、前記方法。
[本発明1004]
前記プローブ化合物が、共有結合的に誘導体化されて前記クリック可能なタグから外れた検出可能な標識をさらに含む、本発明1003の方法。
[本発明1005]
前記検出可能な標識が、ビオチンを含む、本発明1002または1004の方法。
[本発明1006]
前記求核性アミノ酸残基が、アルギニン、リジン、ヒスチジン、システイン、メチオニン、アスパラギン酸、グルタミン酸、セリン、トレオニン、チロシン、トリプトファン、およびそれらの誘導体からなる群から選択される、本発明1001~1005のいずれかの方法。
[本発明1007]
前記クリック可能なタグが、アルキン基である、本発明1001~1006のいずれかの方法。
[本発明1008]
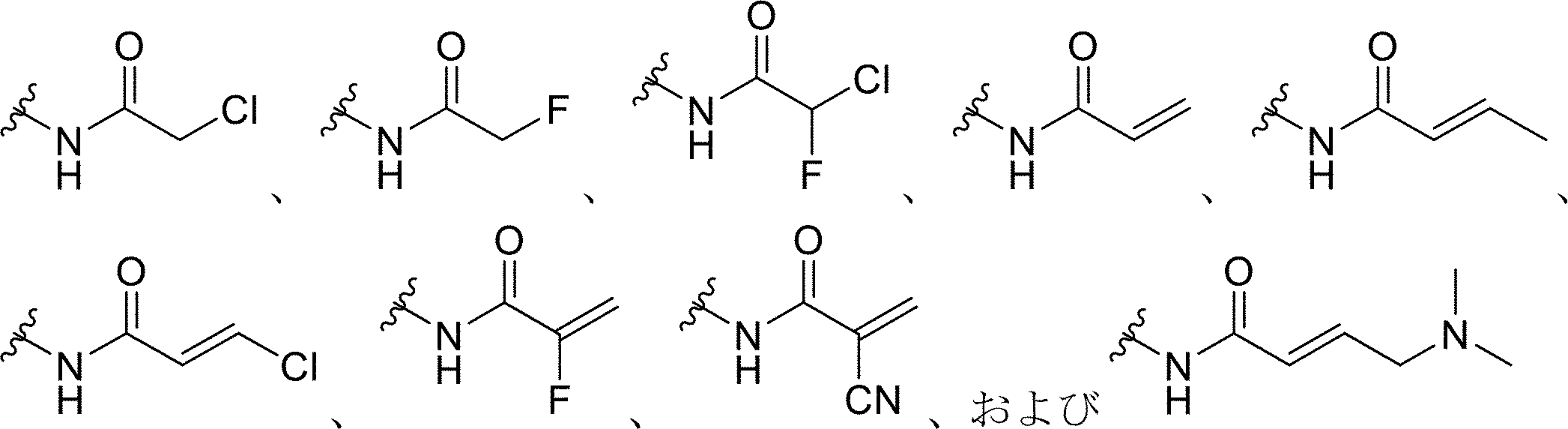
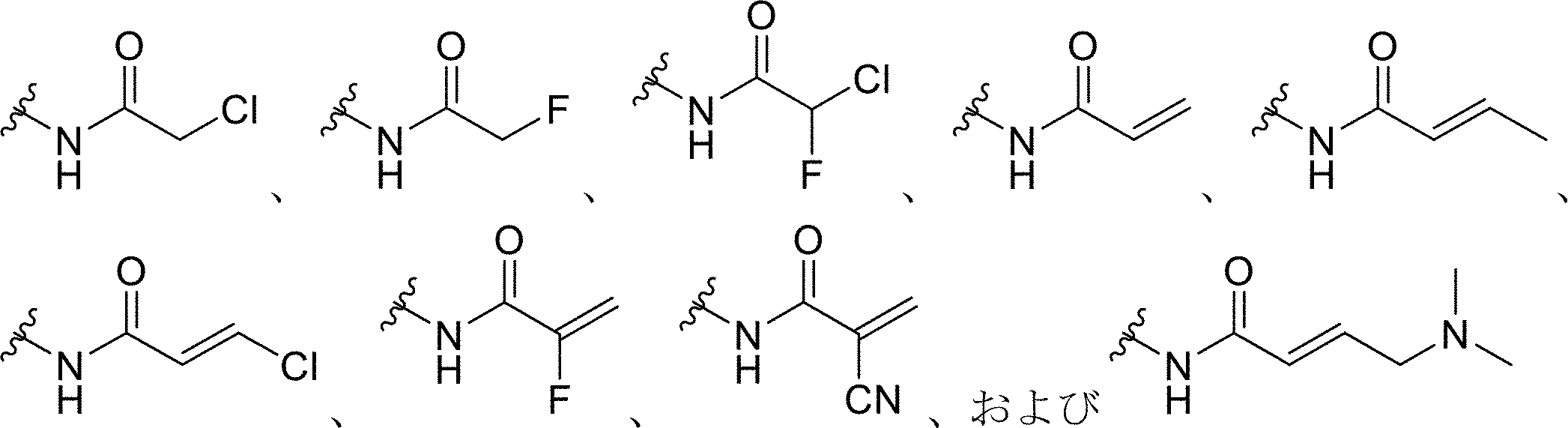
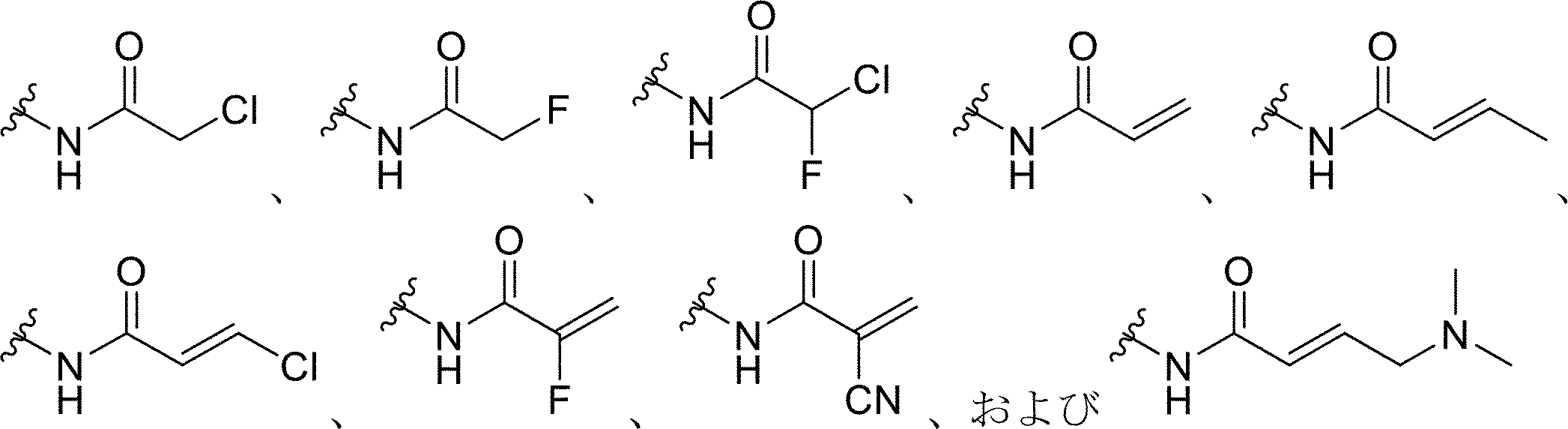
前記プローブ化合物上の前記求電子基が、ハロゲン化アルキル、ハロアセチル、マレイミド、アジリジン、アクリロイルハロゲン、マレイミド、イソチオシアネート、イソシアネート、アシルアジド、N-ヒドロキシスクシンイミドエステル、スルホニルクロリド、エポキシド、オキシラン、カルボネート、イミドエステル、カルボジイミド、無水物、ジアゾアルカン、ジアゾアセチル、カルボニジルミダゾール、およびカルボジイミドからなる群から選択される、本発明1001~1007のいずれかの方法。
[本発明1009]
前記プローブ化合物上の前記求電子基が、
[化1]
からなる群から選択される、本発明1001~1008のいずれかの方法。
[本発明1010]
前記第1のタンパク質含有試料および前記第2のタンパク質含有試料を、前記プローブ化合物中の前記クリック可能なタグとの反応性を有するリンカー基を含む検出可能な標識と反応させることをさらに含む、本発明1003の方法。
[本発明1011]
前記検出可能な標識をタグ付けされたタンパク質標的を富化することをさらに含む、本発明1010の方法。
[本発明1012]
前記富化したタンパク質標的のプロテアーゼ消化を実施することをさらに含む、本発明1011の方法。
[本発明1013]
前記第1のタンパク質含有試料および前記第2のタンパク質含有試料中の、プローブ化合物に結合したタンパク質の量を定量化および比較することをさらに含む、本発明1012の方法。
[本発明1014]
前記定量化および比較を、タンデム質量タグ(TMT)を用いる液体クロマトグラフィー-質量分析法(LC-MS)を使用して実施する、本発明1013の方法。
[本発明1015]
クリック可能なタグを含むプローブ化合物に共有結合した求核性アミノ酸残基を含む、修飾された非天然型タンパク質。
[本発明1016]
前記求核性アミノ酸残基が、アルギニン、リジン、ヒスチジン、システイン、メチオニン、アスパラギン酸、グルタミン酸、セリン、トレオニン、チロシン、トリプトファン、およびそれらの誘導体からなる群から選択される、本発明1015のタンパク質。
[本発明1017]
ハロゲン化アルキル、ハロアセチル、マレイミド、アジリジン、アクリロイルハロゲン、マレイミド、イソチオシアネート、イソシアネート、アシルアジド、N-ヒドロキシスクシンイミドエステル、スルホニルクロリド、エポキシド、オキシラン、カルボネート、イミドエステル、カルボジイミド、無水物、ジアゾアルカン、ジアゾアセチル、カルボニジルミダゾール、およびカルボジイミドからなる群から選択される求電子部分と、クリック可能なタグとを含む、プローブ化合物。
[本発明1018]
前記クリック可能なタグが、検出可能な標識に共有結合的に連結される、本発明1017のプローブ化合物。
[本発明1019]
前記検出可能な標識が、ビオチンである、本発明1018のプローブ化合物。
[本発明1020]
生物学的アッセイを実施するための、本発明1017~1019のいずれかのプローブ化合物の使用。
本発明は、複合体プロテオーム中の様々なタンパク質との共有結合相互作用について、求電子化合物をプロファイリングするための革新的な方法に基づく。本方法は、全細胞プロテオーム中の数千のタンパク質との共有結合薬物または共有結合薬物候補の相互作用を同時に並行して同定および定量化することができる。
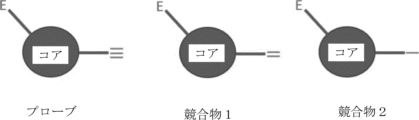
R1C≡CH
式(I)
IMTAC(商標)を使用するプロテオームワイドな共有結合リガンドの発見
複合体プロテオーム中の様々なタンパク質との共有結合相互作用について、求電子小分子をプロファイリングするための方法について記載する。本方法は、求電子化合物と全細胞プロテオーム中の様々なタンパク質との間の共有結合相互作用を同定および定量化し、潜在的な療法を開発するためにさらに利用され得る新しい貴重なデータを提供することができる。
SK-MEL-28細胞プロテオームのIMTACスクリーニング
ヒトがん細胞プロテオームの調製。SK-MEL-28細胞を、37℃の5%の二酸化炭素(CO2)インキュベーターで、10%のウシ胎仔血清を補充したATCC配合Eagle’s Minimum Essential Medium(カタログ番号30-2003)中で培養した。インビトロ標識実験用に、細胞を90%のコンフルエンシーまで増殖させ、PBSで3回洗浄し、冷たいPBS中で破壊した。1400×gで3分間の遠心分離によって細胞ペレットを単離し、さらなる使用まで、細胞ペレットを-80℃で保管した。収集した細胞ペレットを、PBS緩衝液中での超音波処理によって溶解させた。各実験の前に、凍結細胞パレットから新たにプロテオームを調製した。
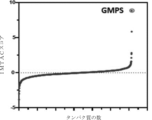
化合物1とGMPSとの間の結合の特徴評価
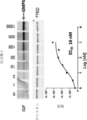
GMPSに対する化合物1の標的係合を測定するために、HEK293細胞を、10%のFBSを含有する適切な培地を含む6ウェルプレート中で約90%のコンフルエンスまで増殖させた。増殖培地を除去し、様々な濃度のプローブ(DMSO中1,000倍のストック溶液)またはビヒクル対照を含有する新鮮な培地で30分間、細胞を処理した。IC50測定のために、まず、30分間間隔で3回1nM~1000nMの37℃の化合物2でインキュベートし、次いで、さらに20分間37℃の100nMの化合物1で細胞を処理した。プローブ処理後、培地を除去し、細胞を氷冷したDulbeccoのPBS(DPBS)で2回洗浄した。細胞を収集し、プロテアーゼ阻害剤カクテル(Roche)を含む80μLのNP40溶解緩衝液(50mMのHEPES、pH7.4、1%のNP-40、150mMのNaCl)に、ペレットを再懸濁させた。溶解物を氷上で20分間インキュベートし、18,000×gで10分間、4℃で遠心分離することによって分画した。BCAアッセイ(Pierce)によって上清試料の各々からタンパク質濃度を測定し、1mg/mlに調節した。100μLの総体積中、25μMのTAMRA-アジド(Click Chemistry Tools)、1mMのトリス(2-カルボキシエチル)ホスフィン(TCEP、Thermo-Scientific)、100μMのトリス[(1-ベンジル-1H-1,2,3-トリアゾール-4-イル)メチル]アミン(TBTA、TCI)、および1mMのCuSO4(Sigma-Aldrich)の最終濃度で、CuACCを実施した。反応を室温の暗所で1時間実施した後、40μlの4×Laemmli試料緩衝液(Bio-Rad)を添加し、5分間煮沸することによって終了させた。30μlの試料を、4~20%のSDS-PAGEに充填し、分解した後、ChemiDoc MP画像化システム(Bio-Rad)で、532nmで励起させ、610nmで発光させて可視化した。図4に示されるように、蛍光画像を灰色スケールで表示し、ChemiDoc定量化ソフトウェアを使用して、蛍光シグナルの強度を定量化した。図4は、蛍光に基づくアッセイを使用した、SK-Mel-28細胞における、化合物1によるGMPSの用量依存的係合を示すグラフである。GraphPad Prismソフトウェア(GraphPad Software、La Jolla,CA)を用いて、EC50(16nM)値を計算した。
化合物1の療法的効果のインビボ特徴評価
メラノーマCDXモデルを使用して、プリンサルベージデノボ経路を標的化することを通じて、化合物1の療法的潜在性のインビボ確認を提供した。このモデルには、SK-MEL-28腫瘍細胞(0.1mLのPBSおよびMatigel中5×106、1:1)をBALB/cヌードマウスに皮下接種(sc)した。腫瘍サイズがおよそ150mm3(100~250mm3)に達したら、化合物1の治療を開始し、5日間1日2回、続いて9日間1日1回、皮下で与えた。治療期間を通じて、腫瘍サイズを記録した。対照と比較して、化合物1は腫瘍サイズを低減することが可能であり、開始した8日目には、図7に示されるように、治療期間の終わりまで低減増加に差がある。化合物1は、SK-ML-28腫瘍増殖を阻害した。60mg/kgの化合物1を、5日間1日2回、続いて9日間1日1回皮下で与えた。ビヒクル対照は、5%のDMSOおよび95%の20%の2-ヒドロキシプロピル-ベータ-シクロデキストリン溶液からなった。各群は8匹の雌マウスを含んだ。t検定は、GraphPad Softwareを使用して行った。図6は、SK-ML-28腫瘍増殖の化合物1阻害を示すグラフである。図6に示される全体的な傾向は、インビトロ活性がインビボ環境に転換した証拠を提供し、インビボ有効性の統計的に顕著な実証を達成するために化合物1の効力を向上させる必要があることを示した。
Claims (11)
- タンパク質標的を同定するための方法であって、
(a)第1のタンパク質含有試料を、コア構造および求電子部分を含むが末端のクリック可能なタグを欠く競合化合物と接触させて、前記競合化合物で処理した試料を得る工程であって、前記クリック可能なタグが末端アルキン部分であり、前記求電子部分が前記タンパク質標的中の求核性アミノ酸残基に結合する、工程と、
(b)工程(a)の前記競合化合物で処理した試料を、同じコア構造、同じ求電子部分および前記クリック可能なタグを含むプローブ化合物と接触させる工程と、
(c)第2のタンパク質含有試料を前記競合化合物と接触させる工程なく、前記第2のタンパク質含有試料を前記プローブ化合物と接触させる工程と、
(d)前記第1のタンパク質含有試料中のプローブ化合物で修飾されたタンパク質の量を、前記第2のタンパク質含有試料中のプローブ化合物で修飾されたタンパク質の量と比較して検出することによって、前記タンパク質標的を同定する工程と
を含む、前記方法。 - 工程(d)が、前記競合化合物と前記タンパク質標的との間の結合相互作用を定量化することをさらに含む、および/または工程(d)が、タンデム質量タグ(TMT)を用いるLC-MS/MSを使用して実施される、請求項1に記載の方法。
- 工程(a)の前に、プロテオームを2つの同等のタンパク質含有試料に分割して、前記第1のタンパク質含有試料および前記第2のタンパク質含有試料を得る工程をさらに含む、請求項2に記載の方法。
- 前記プローブ化合物で修飾されたタンパク質が、前記クリック可能なタグを介して検出可能な標識でさらに誘導体化されている、請求項1~3のいずれか一項に記載の方法。
- 前記検出可能な標識が、ビオチンを含む、請求項4に記載の方法。
- 前記タンパク質標的中の前記求核性アミノ酸残基が、アルギニン、リジン、ヒスチジン、システイン、メチオニン、アスパラギン酸、グルタミン酸、セリン、トレオニン、チロシン、およびトリプトファンからなる群から選択される、請求項1~5のいずれか一項に記載の方法。
- 前記求電子部分が、ハロゲン化アルキル、ハロアセチル、マレイミド、アジリジン、アクリロイルハロゲン、マレイミド、イソチオシアネート、イソシアネート、アシルアジド、N-ヒドロキシスクシンイミドエステル、スルホニルクロリド、エポキシド、オキシラン、カルボネート、イミドエステル、カルボジイミド、無水物、ジアゾアルカン、ジアゾアセチル、カルボニジルミダゾール、およびカルボジイミドからなる群から選択される求電子基である、請求項1~6のいずれか一項に記載の方法。
- 前記第1のタンパク質含有試料および前記第2のタンパク質含有試料をそれぞれ、検出可能な標識および前記プローブ化合物中の前記クリック可能なタグとの反応性を有する基を含む化合物と反応させて、検出可能な標識をタグ付けされたタンパク質標的を形成することをさらに含む、請求項1に記載の方法。
- 前記検出可能な標識をタグ付けされたタンパク質標的を富化することをさらに含む、請求項9に記載の方法。
- 前記富化したタンパク質標的のプロテアーゼ消化を実施することをさらに含む、請求項10に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962882757P | 2019-08-05 | 2019-08-05 | |
| US62/882,757 | 2019-08-05 | ||
| PCT/US2020/044897 WO2021026162A1 (en) | 2019-08-05 | 2020-08-04 | Method for proteome-wide discovery of covalent ligands and compositions thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022543560A JP2022543560A (ja) | 2022-10-13 |
| JP7586894B2 true JP7586894B2 (ja) | 2024-11-19 |
Family
ID=74502511
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022505603A Active JP7586894B2 (ja) | 2019-08-05 | 2020-08-04 | 共有結合リガンドのプロテオームワイドな発見のための方法およびその組成物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US12392778B2 (ja) |
| EP (1) | EP4010459A4 (ja) |
| JP (1) | JP7586894B2 (ja) |
| CN (1) | CN114174492A (ja) |
| AU (1) | AU2020326694A1 (ja) |
| CA (1) | CA3148610A1 (ja) |
| WO (1) | WO2021026162A1 (ja) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140193831A1 (en) | 2011-01-28 | 2014-07-10 | Gautier Semences | Seed trait prediction by activity-based protein profiling |
| WO2017070611A1 (en) | 2015-10-22 | 2017-04-27 | The Scripps Research Institute | Cysteine reactive probes and uses thereof |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3033625B1 (en) * | 2013-08-13 | 2020-01-22 | The Scripps Research Institute | Cysteine-reactive ligand discovery in proteomes |
| WO2017173035A1 (en) * | 2016-04-01 | 2017-10-05 | Chromacode Inc. | Competitive probes for engineering signal generation |
| CN109923216B (zh) * | 2016-08-31 | 2024-08-02 | 哈佛学院董事及会员团体 | 将生物分子的检测组合到使用荧光原位测序的单个试验的方法 |
| CN109863136A (zh) * | 2016-10-04 | 2019-06-07 | 南加利福尼亚大学 | 用于发现蛋白靶标的共价配体的化学蛋白质组学方法 |
| AU2017363390A1 (en) * | 2016-11-28 | 2019-06-13 | Dana-Farber Cancer Institute, Inc. | Reagents and methods for analysis of proteins and metabolites targeted by covalent probes |
| CN108627647B (zh) * | 2017-03-24 | 2020-06-19 | 四川大学 | 一种翻译后修饰蛋白质组学的检测和定量方法 |
| US11912664B2 (en) * | 2017-06-06 | 2024-02-27 | President And Fellows Of Harvard College | Determining small molecule-protein and protein-protein interactions |
| EP3924348A4 (en) * | 2019-03-21 | 2023-03-22 | University of Virginia Patent Foundation | SULFUR HETEROCYCLENE EXCHANGE CHEMISTRY AND ITS USES |
-
2020
- 2020-08-04 JP JP2022505603A patent/JP7586894B2/ja active Active
- 2020-08-04 AU AU2020326694A patent/AU2020326694A1/en active Pending
- 2020-08-04 US US17/630,815 patent/US12392778B2/en active Active
- 2020-08-04 EP EP20850895.2A patent/EP4010459A4/en active Pending
- 2020-08-04 WO PCT/US2020/044897 patent/WO2021026162A1/en not_active Ceased
- 2020-08-04 CN CN202080052454.7A patent/CN114174492A/zh active Pending
- 2020-08-04 CA CA3148610A patent/CA3148610A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140193831A1 (en) | 2011-01-28 | 2014-07-10 | Gautier Semences | Seed trait prediction by activity-based protein profiling |
| WO2017070611A1 (en) | 2015-10-22 | 2017-04-27 | The Scripps Research Institute | Cysteine reactive probes and uses thereof |
| JP2019501363A (ja) | 2015-10-22 | 2019-01-17 | ザ・スクリップス・リサーチ・インスティテュート | システイン反応性プローブとその使用 |
Non-Patent Citations (3)
| Title |
|---|
| BACKUS, Keriann M., et al.,Proteome-wide covalent ligand discovery in native biological systems,Nature,Springer Nature,2016年,534(7608),570-574,https://doi.org/10.1038/nature18002,ESR D2 |
| ERDJUMENT-BROMAGE, Hediye; HUANG, Fang-Ke; NEUBERT, Thomas A.,A. Sample preparation for relative quantitation of proteins using tandem mass tags (TMT) and mass spectrometry (MS).,Methods and Protocols,Springer Nature,2018年,1741,135-149,https://doi.org/10.1007/978-1-4939-7659-1_11,ISR D3 |
| ROBERTS, Allison M., et al.,Chemoproteomic screening of covalent ligands reveals UBA5 as a novel pancreatic cancer target,ACS Chemical Biology,ACS,2017年,12(4),899-904,https://doi.org/10.1021/acschembio.7b00020,ESR D1 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220276253A1 (en) | 2022-09-01 |
| JP2022543560A (ja) | 2022-10-13 |
| CN114174492A (zh) | 2022-03-11 |
| EP4010459A1 (en) | 2022-06-15 |
| CA3148610A1 (en) | 2021-02-11 |
| EP4010459A4 (en) | 2023-09-06 |
| US12392778B2 (en) | 2025-08-19 |
| WO2021026162A1 (en) | 2021-02-11 |
| AU2020326694A1 (en) | 2022-03-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Remsberg et al. | ABHD17 regulation of plasma membrane palmitoylation and N-Ras-dependent cancer growth | |
| An et al. | pSILAC mass spectrometry reveals ZFP91 as IMiD-dependent substrate of the CRL4CRBN ubiquitin ligase | |
| US11789025B2 (en) | Reagents and methods for analysis of proteins and metabolites targeted by covalent probes | |
| Deprey et al. | Quantitative measurement of cytosolic penetration using the chloroalkane penetration assay | |
| Njomen et al. | Multi-tiered chemical proteomic maps of tryptoline acrylamide–protein interactions in cancer cells | |
| Liu et al. | Development and application of novel electrophilic warheads in target identification and drug discovery | |
| Gabizon et al. | A simple method for developing lysine targeted covalent protein reagents | |
| Sun et al. | Chemoproteomics reveals chemical diversity and dynamics of 4-oxo-2-nonenal modifications in cells | |
| US20220260583A1 (en) | Chemoproteomic profiling of protein electrophilic and oxidative post-translational modifications | |
| Lenz et al. | Probing small molecule–protein interactions: A new perspective for functional proteomics | |
| Zhong et al. | A new rapid in vitro assay for assessing reactivity of acyl glucuronides | |
| US12493045B2 (en) | Multi-target crosslinkers and uses thereof | |
| Waghorn et al. | High sensitivity HPLC method for determination of the allysine concentration in tissue by use of a naphthol derivative | |
| JP7586894B2 (ja) | 共有結合リガンドのプロテオームワイドな発見のための方法およびその組成物 | |
| Liu et al. | Chemical proteomic profiling of UTP-binding proteins in human cells | |
| Wu et al. | Research progress in isotope labeling/tags-based protein quantification and metrology technologies | |
| Walpurgis et al. | Myostatin inhibitory peptides in sports drug testing | |
| EP3929587A1 (en) | Crosslinking reagent for bioconjugation for use in crosslinking proteomics, in particular crosslinking mass spectrometry analysis | |
| Pol et al. | Induced degradation of SNAP-fusion proteins | |
| Chavas et al. | Unbiased mass spectrometry elucidation of the targets and mechanisms of activity-based probes: a case study involving sulfonyl fluorides | |
| Lai et al. | N-Acryloylindole-alkyne (NAIA) enables profiling new ligandable hotspots in chemoproteomics experiments and imaging thiol oxidation | |
| Meng et al. | Decoding the protein methylome: Identification, validation, and functional insights | |
| US20240103005A1 (en) | N-acryloylindoles and methods of use | |
| US20250369981A1 (en) | Phenylglyoxal-Based Alkyne (PGA) Chemical Tag for Protein Citrullination Analysis | |
| Song | Investigate the Substrate Specificity of Protein Post-translational Modifications With Bioorthogonal Chemical Probes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230707 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20231108 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240229 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240402 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240702 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241101 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241107 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7586894 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |