JP7576293B2 - ファーバー病を治療するための組成物及び方法 - Google Patents
ファーバー病を治療するための組成物及び方法 Download PDFInfo
- Publication number
- JP7576293B2 JP7576293B2 JP2019538173A JP2019538173A JP7576293B2 JP 7576293 B2 JP7576293 B2 JP 7576293B2 JP 2019538173 A JP2019538173 A JP 2019538173A JP 2019538173 A JP2019538173 A JP 2019538173A JP 7576293 B2 JP7576293 B2 JP 7576293B2
- Authority
- JP
- Japan
- Prior art keywords
- rhac
- pharmaceutical composition
- mice
- subject
- farber
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 158
- 208000001948 Farber Lipogranulomatosis Diseases 0.000 title claims description 106
- 208000033149 Farber disease Diseases 0.000 title claims description 105
- 239000000203 mixture Substances 0.000 title description 17
- CRJGESKKUOMBCT-VQTJNVASSA-N N-acetylsphinganine Chemical compound CCCCCCCCCCCCCCC[C@@H](O)[C@H](CO)NC(C)=O CRJGESKKUOMBCT-VQTJNVASSA-N 0.000 claims description 124
- 229940106189 ceramide Drugs 0.000 claims description 123
- WWUZIQQURGPMPG-KRWOKUGFSA-N sphingosine Chemical compound CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](N)CO WWUZIQQURGPMPG-KRWOKUGFSA-N 0.000 claims description 102
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 claims description 101
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 claims description 101
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 claims description 101
- 239000008194 pharmaceutical composition Substances 0.000 claims description 88
- WWUZIQQURGPMPG-UHFFFAOYSA-N (-)-D-erythro-Sphingosine Natural products CCCCCCCCCCCCCC=CC(O)C(N)CO WWUZIQQURGPMPG-UHFFFAOYSA-N 0.000 claims description 84
- 101000975753 Homo sapiens Acid ceramidase Proteins 0.000 claims description 48
- 102000047408 human ASAH1 Human genes 0.000 claims description 46
- 210000000952 spleen Anatomy 0.000 claims description 46
- 239000013598 vector Substances 0.000 claims description 22
- 239000003636 conditioned culture medium Substances 0.000 claims description 16
- 238000007912 intraperitoneal administration Methods 0.000 claims description 13
- 206010049940 Lipogranuloma Diseases 0.000 claims description 10
- 239000000243 solution Substances 0.000 claims description 10
- 238000010253 intravenous injection Methods 0.000 claims description 7
- 241000699802 Cricetulus griseus Species 0.000 claims description 6
- 210000001672 ovary Anatomy 0.000 claims description 6
- 239000013603 viral vector Substances 0.000 claims description 4
- 239000013612 plasmid Substances 0.000 claims description 3
- 241000699670 Mus sp. Species 0.000 description 313
- 210000001519 tissue Anatomy 0.000 description 124
- 210000004027 cell Anatomy 0.000 description 111
- 239000007924 injection Substances 0.000 description 78
- 238000002347 injection Methods 0.000 description 78
- 230000003442 weekly effect Effects 0.000 description 57
- 238000011282 treatment Methods 0.000 description 56
- 108090000623 proteins and genes Proteins 0.000 description 55
- 235000018102 proteins Nutrition 0.000 description 49
- 102000004169 proteins and genes Human genes 0.000 description 49
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 48
- 230000000694 effects Effects 0.000 description 48
- 239000002953 phosphate buffered saline Substances 0.000 description 48
- 102000004190 Enzymes Human genes 0.000 description 41
- 108090000790 Enzymes Proteins 0.000 description 41
- 229940088598 enzyme Drugs 0.000 description 41
- 239000000284 extract Substances 0.000 description 40
- 239000000463 material Substances 0.000 description 40
- 210000004185 liver Anatomy 0.000 description 39
- 230000037396 body weight Effects 0.000 description 36
- 239000007928 intraperitoneal injection Substances 0.000 description 36
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 33
- 230000002829 reductive effect Effects 0.000 description 29
- 230000009467 reduction Effects 0.000 description 28
- 108020005296 Acid Ceramidase Proteins 0.000 description 27
- 241001465754 Metazoa Species 0.000 description 26
- 102000006772 Acid Ceramidase Human genes 0.000 description 25
- 241000699666 Mus <mouse, genus> Species 0.000 description 25
- 210000004556 brain Anatomy 0.000 description 24
- 150000001783 ceramides Chemical class 0.000 description 22
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 19
- 102000000018 Chemokine CCL2 Human genes 0.000 description 19
- 210000003734 kidney Anatomy 0.000 description 19
- 210000004072 lung Anatomy 0.000 description 19
- 201000010099 disease Diseases 0.000 description 18
- 210000002540 macrophage Anatomy 0.000 description 18
- 210000001185 bone marrow Anatomy 0.000 description 17
- 238000002641 enzyme replacement therapy Methods 0.000 description 17
- 230000008595 infiltration Effects 0.000 description 17
- 238000001764 infiltration Methods 0.000 description 17
- 239000002609 medium Substances 0.000 description 17
- 108090000765 processed proteins & peptides Proteins 0.000 description 17
- 230000008859 change Effects 0.000 description 16
- 210000001612 chondrocyte Anatomy 0.000 description 16
- 210000002216 heart Anatomy 0.000 description 16
- 208000035475 disorder Diseases 0.000 description 15
- 150000002632 lipids Chemical class 0.000 description 15
- 102000004196 processed proteins & peptides Human genes 0.000 description 15
- 230000004083 survival effect Effects 0.000 description 15
- 229920001184 polypeptide Polymers 0.000 description 14
- 238000004458 analytical method Methods 0.000 description 13
- 210000000988 bone and bone Anatomy 0.000 description 13
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- 210000004349 growth plate Anatomy 0.000 description 11
- 101100380291 Caenorhabditis elegans asah-1 gene Proteins 0.000 description 10
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 10
- 230000014509 gene expression Effects 0.000 description 10
- 230000035772 mutation Effects 0.000 description 10
- 239000002773 nucleotide Substances 0.000 description 10
- 125000003729 nucleotide group Chemical group 0.000 description 10
- 230000007170 pathology Effects 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 206010015548 Euthanasia Diseases 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 9
- 238000001802 infusion Methods 0.000 description 9
- 150000007523 nucleic acids Chemical class 0.000 description 9
- 210000004872 soft tissue Anatomy 0.000 description 9
- 241000282414 Homo sapiens Species 0.000 description 8
- 231100000673 dose–response relationship Toxicity 0.000 description 8
- 229940079593 drug Drugs 0.000 description 8
- 108020004707 nucleic acids Proteins 0.000 description 8
- 102000039446 nucleic acids Human genes 0.000 description 8
- 238000011002 quantification Methods 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 108010076504 Protein Sorting Signals Proteins 0.000 description 7
- 108010061312 Sphingomyelin Phosphodiesterase Proteins 0.000 description 7
- 150000001413 amino acids Chemical group 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 210000000845 cartilage Anatomy 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 239000000902 placebo Substances 0.000 description 7
- 229940068196 placebo Drugs 0.000 description 7
- 238000010186 staining Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 239000003643 water by type Substances 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 206010061218 Inflammation Diseases 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 102000014962 Monocyte Chemoattractant Proteins Human genes 0.000 description 6
- 108010064136 Monocyte Chemoattractant Proteins Proteins 0.000 description 6
- 102000010126 acid sphingomyelin phosphodiesterase activity proteins Human genes 0.000 description 6
- 210000000577 adipose tissue Anatomy 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 230000002068 genetic effect Effects 0.000 description 6
- 239000001963 growth medium Substances 0.000 description 6
- 230000004054 inflammatory process Effects 0.000 description 6
- 230000003902 lesion Effects 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 210000003462 vein Anatomy 0.000 description 6
- 208000015439 Lysosomal storage disease Diseases 0.000 description 5
- 230000003110 anti-inflammatory effect Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 239000000835 fiber Substances 0.000 description 5
- 230000002440 hepatic effect Effects 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- ZIPLKLQPLOWLTM-UHFFFAOYSA-N naphthalene-2,3-dicarbaldehyde Chemical compound C1=CC=C2C=C(C=O)C(C=O)=CC2=C1 ZIPLKLQPLOWLTM-UHFFFAOYSA-N 0.000 description 5
- 210000001541 thymus gland Anatomy 0.000 description 5
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 102000016284 Aggrecans Human genes 0.000 description 4
- 108010067219 Aggrecans Proteins 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 238000011529 RT qPCR Methods 0.000 description 4
- 206010067868 Skin mass Diseases 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 125000000539 amino acid group Chemical group 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 229920001436 collagen Polymers 0.000 description 4
- 210000003275 diaphysis Anatomy 0.000 description 4
- 210000003238 esophagus Anatomy 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 4
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 4
- 210000003701 histiocyte Anatomy 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 238000010172 mouse model Methods 0.000 description 4
- 210000005259 peripheral blood Anatomy 0.000 description 4
- 239000011886 peripheral blood Substances 0.000 description 4
- 210000002027 skeletal muscle Anatomy 0.000 description 4
- 210000001626 skin fibroblast Anatomy 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 238000002054 transplantation Methods 0.000 description 4
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 101100096242 Mus musculus Sox9 gene Proteins 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 230000000975 bioactive effect Effects 0.000 description 3
- 239000013592 cell lysate Substances 0.000 description 3
- 239000007979 citrate buffer Substances 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 210000002745 epiphysis Anatomy 0.000 description 3
- 230000005284 excitation Effects 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000002757 inflammatory effect Effects 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 239000007972 injectable composition Substances 0.000 description 3
- 210000003041 ligament Anatomy 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 239000003094 microcapsule Substances 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- -1 sphingosines Lipid Chemical class 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 210000003437 trachea Anatomy 0.000 description 3
- 210000000689 upper leg Anatomy 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 230000004580 weight loss Effects 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 102000004201 Ceramidases Human genes 0.000 description 2
- 108090000751 Ceramidases Proteins 0.000 description 2
- 102100024308 Ceramide synthase Human genes 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 206010058314 Dysplasia Diseases 0.000 description 2
- 238000008157 ELISA kit Methods 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 206010018691 Granuloma Diseases 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 229930182816 L-glutamine Natural products 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 101150106167 SOX9 gene Proteins 0.000 description 2
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 2
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 2
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 239000005667 attractant Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 229910021538 borax Inorganic materials 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- KXZJHVJKXJLBKO-UHFFFAOYSA-N chembl1408157 Chemical compound N=1C2=CC=CC=C2C(C(=O)O)=CC=1C1=CC=C(O)C=C1 KXZJHVJKXJLBKO-UHFFFAOYSA-N 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 239000003405 delayed action preparation Substances 0.000 description 2
- 108010061814 dihydroceramide desaturase Proteins 0.000 description 2
- 229910001873 dinitrogen Inorganic materials 0.000 description 2
- 230000002327 eosinophilic effect Effects 0.000 description 2
- 210000000521 femorotibial joint Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 238000003205 genotyping method Methods 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 201000008298 histiocytosis Diseases 0.000 description 2
- 230000001506 immunosuppresive effect Effects 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 230000013190 lipid storage Effects 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 238000007431 microscopic evaluation Methods 0.000 description 2
- 230000004899 motility Effects 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000004789 organ system Anatomy 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 210000003800 pharynx Anatomy 0.000 description 2
- 230000010287 polarization Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000003762 quantitative reverse transcription PCR Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 235000010339 sodium tetraborate Nutrition 0.000 description 2
- 150000003408 sphingolipids Chemical class 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 2
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 1
- ZDRVLAOYDGQLFI-UHFFFAOYSA-N 4-[[4-(4-chlorophenyl)-1,3-thiazol-2-yl]amino]phenol;hydrochloride Chemical compound Cl.C1=CC(O)=CC=C1NC1=NC(C=2C=CC(Cl)=CC=2)=CS1 ZDRVLAOYDGQLFI-UHFFFAOYSA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 235000006491 Acacia senegal Nutrition 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101150082216 COL2A1 gene Proteins 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- 238000012695 Interfacial polymerization Methods 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 1
- 239000004907 Macro-emulsion Substances 0.000 description 1
- 101000845615 Mus musculus Deoxyribonuclease gamma Proteins 0.000 description 1
- 101100335387 Mus musculus Fpr-s1 gene Proteins 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 208000014060 Niemann-Pick disease Diseases 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010009736 Protein Hydrolysates Proteins 0.000 description 1
- 238000011530 RNeasy Mini Kit Methods 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 102000011971 Sphingomyelin Phosphodiesterase Human genes 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 238000010162 Tukey test Methods 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 1
- 229960000836 amitriptyline Drugs 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 208000015100 cartilage disease Diseases 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- YRQNKMKHABXEJZ-UVQQGXFZSA-N chembl176323 Chemical compound C1C[C@]2(C)[C@@]3(C)CC(N=C4C[C@]5(C)CCC6[C@]7(C)CC[C@@H]([C@]7(CC[C@]6(C)[C@@]5(C)CC4=N4)C)CCCCCCCC)=C4C[C@]3(C)CCC2[C@]2(C)CC[C@H](CCCCCCCC)[C@]21C YRQNKMKHABXEJZ-UVQQGXFZSA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- CRQQGFGUEAVUIL-UHFFFAOYSA-N chlorothalonil Chemical compound ClC1=C(Cl)C(C#N)=C(Cl)C(C#N)=C1Cl CRQQGFGUEAVUIL-UHFFFAOYSA-N 0.000 description 1
- 230000002648 chondrogenic effect Effects 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 230000003413 degradative effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 230000005584 early death Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000009088 enzymatic function Effects 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 206010016165 failure to thrive Diseases 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 231100000008 high dose toxicity Toxicity 0.000 description 1
- 238000010842 high-capacity cDNA reverse transcription kit Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 239000000413 hydrolysate Substances 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 229960003299 ketamine Drugs 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 210000001259 mesencephalon Anatomy 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 210000004129 prosencephalon Anatomy 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000009613 pulmonary function test Methods 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 210000001202 rhombencephalon Anatomy 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 235000002639 sodium chloride Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000002732 sphingomyelin phosphodiesterase inhibitor Substances 0.000 description 1
- 108010035597 sphingosine kinase Proteins 0.000 description 1
- 150000003410 sphingosines Chemical class 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 210000005222 synovial tissue Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 239000003104 tissue culture media Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 210000004885 white matter Anatomy 0.000 description 1
- BPICBUSOMSTKRF-UHFFFAOYSA-N xylazine Chemical compound CC1=CC=CC(C)=C1NC1=NCCCS1 BPICBUSOMSTKRF-UHFFFAOYSA-N 0.000 description 1
- 229960001600 xylazine Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/50—Hydrolases (3) acting on carbon-nitrogen bonds, other than peptide bonds (3.5), e.g. asparaginase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/78—Hydrolases (3) acting on carbon to nitrogen bonds other than peptide bonds (3.5)
- C12N9/80—Hydrolases (3) acting on carbon to nitrogen bonds other than peptide bonds (3.5) acting on amide bonds in linear amides (3.5.1)
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/072—Animals genetically altered by homologous recombination maintaining or altering function, i.e. knock in
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0306—Animal model for genetic diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y305/00—Hydrolases acting on carbon-nitrogen bonds, other than peptide bonds (3.5)
- C12Y305/01—Hydrolases acting on carbon-nitrogen bonds, other than peptide bonds (3.5) in linear amides (3.5.1)
- C12Y305/01023—Ceramidase (3.5.1.23)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Microbiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Virology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Enzymes And Modification Thereof (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
本出願は、2017年1月13日出願の米国仮特許出願第62/446,166号の優先権の恩典を主張するものであり、これは参照によりその全体が本明細書に組み込まれる。
ファーバー病、リソソーム蓄積症(LSD)は、複数の関節の肉芽腫病変及び脂質貯蔵の証拠を有する14ヶ月齢の乳児において、1952年に最初に記載された疾患である。続く10年間にわたって、他の同様の症例が記載され、全てが同様の病変を有し、多くの場合、咽頭上の病変の存在に起因する特徴的な「かすれた」泣き声または声を呈した。これらの患者の一部における、肺、肝臓、脾臓、及び中枢神経系(CNS)を含む他の器官系の関与もまた言及された。
本明細書に開示される実施形態は、ファーバー病及び/またはその関連疾患の治療を、それを必要とする対象において行う方法を提供し、該方法は、有効量の組換えヒト酸性セラミダーゼを含む薬学的組成物を対象に投与することを含む。いくつかの態様では、投与される組換えヒト酸性セラミダーゼは、検出可能なスフィンゴミエリナーゼ活性を有しない。
[本発明1001]
ファーバー病の治療を、それを必要とする対象において行う方法であって、有効量の約0.1mg/kg~約50mg/kgの組換えヒト酸性セラミダーゼを含む薬学的組成物を前記対象に投与することを含む、前記方法。
[本発明1002]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象における脂肪肉芽腫の低減方法であって、有効量の約0.1mg/kg~約50mg/kgの組換えヒト酸性セラミダーゼを含む薬学的組成物を前記対象に投与することを含む、前記方法。
[本発明1003]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象における脾臓重量の低減方法であって、有効量の約0.1mg/kg~約50mg/kgの組換えヒト酸性セラミダーゼを含む薬学的組成物を前記対象に投与することを含む、前記方法。
[本発明1004]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象におけるセラミドの低減方法であって、有効量の約0.1mg/kg~約50mg/kgの組換えヒト酸性セラミダーゼを含む薬学的組成物を前記対象に投与することを含む、前記方法。
[本発明1005]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象におけるスフィンゴシンの増加方法であって、有効量の約0.1mg/kg~約50mg/kgの組換えヒト酸性セラミダーゼを含む薬学的組成物を前記対象に投与することを含む、前記方法。
[本発明1006]
前記有効量が、約0.1mg/kg~約10mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1007]
前記有効量が、約10mg/kg~約50mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1008]
前記有効量が、約10mg/kg~約20mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1009]
前記有効量が、約20mg/kg~約30mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1010]
前記有効量が、約30mg/kg~約40mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1011]
前記有効量が、約40mg/kg~約50mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1012]
前記有効量が、約1、2、3、4、5、6、7、8、9、または10mg/kgである、本発明1001~1005のいずれかの方法。
[本発明1013]
前記有効量が、前記対象に週1回投与される、本発明1001~1012のいずれかの方法。
[本発明1014]
前記薬学的組成物が、溶液である、本発明1001~1013のいずれかの方法。
[本発明1015]
前記薬学的組成物が、rhACを含む細胞馴化培地を含む、本発明1014の方法。
[本発明1016]
前記投与が、前記薬学的組成物を前記対象の皮膚と接触させることを含む、本発明1001~1015のいずれかの方法。
[本発明1017]
前記投与が、前記薬学的組成物を前記対象に非経口投与することを含む、本発明1001~1016のいずれかの方法。
[本発明1018]
前記投与が、前記薬学的組成物を前記対象に注入することを含む、本発明1017の方法。
[本発明1019]
前記投与が、腹腔内注入または静脈内注入である、本発明1017の方法。
[本発明1020]
ファーバー病の治療を、それを必要とする対象において行う方法であって、
a.組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.有効量の約0.1mg/kg~約50mg/kgの前記単離された発現rhACを含む薬学的組成物を前記対象に投与することと
を含む、前記方法。
[本発明1021]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象における脂肪肉芽腫の低減方法であって、
a.組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.有効量の約0.1mg/kg~約50mg/kgの前記単離された発現rhACを含む薬学的組成物を前記対象に投与することと
を含む、前記方法。
[本発明1022]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象における脾臓重量の低減方法であって、
a.組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.有効量の約0.1mg/kg~約50mg/kgの前記単離された発現rhACを含む薬学的組成物を前記対象に投与することと
を含む、前記方法。
[本発明1023]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象におけるセラミドの低減方法であって、
a.組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.有効量の約0.1mg/kg~約50mg/kgの前記単離された発現rhACを含む薬学的組成物を前記対象に投与することと
を含む、前記方法。
[本発明1024]
ファーバー病を有する対象またはファーバー病を有すると疑われる対象におけるスフィンゴシンの増加方法であって、
a.組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.有効量の約0.1mg/kg~約50mg/kgの前記単離された発現rhACを含む薬学的組成物を前記対象に投与することと
を含む、前記方法。
[本発明1025]
前記組換えヒト酸性セラミダーゼ(rhAC)を細胞中で発現させることが、rhACをコードするベクターを前記細胞に導入することを含む、本発明1020~1024のいずれかの方法。
[本発明1026]
前記ベクターが、ウイルスベクターである、本発明1025の方法。
[本発明1027]
前記ベクターが、プラスミドである、本発明1025の方法。
[本発明1028]
前記ベクターが、前記rhACに操作可能に結合されたプロモーターを含む、本発明1025の方法。
[本発明1029]
前記ベクターが、前記細胞に導入される、本発明1025の方法。
[本発明1030]
前記ベクターを、前記細胞に感染させる、本発明1025の方法。
[本発明1031]
前記細胞が、チャイニーズハムスター卵巣(CHO)細胞またはNS0である、本発明1025の方法。
[本発明1032]
前記有効量が、約0.1mg/kg~約10mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1033]
前記有効量が、約10mg/kg~約50mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1034]
前記有効量が、約10mg/kg~約20mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1035]
前記有効量が、約20mg/kg~約30mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1036]
前記有効量が、約30mg/kg~約40mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1037]
前記有効量が、約40mg/kg~約50mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1038]
前記有効量が、約1、2、3、4、5、6、7、8、9、または10mg/kgである、本発明1020~1031のいずれかの方法。
[本発明1039]
前記有効量が、前記対象に週1回投与される、本発明1020~1038のいずれかの方法。
[本発明1040]
前記薬学的組成物が、溶液である、本発明1020~1039のいずれかの方法。
[本発明1041]
前記薬学的組成物が、前記rhACを含む細胞馴化培地を含む、本発明1040の方法。
[本発明1042]
前記投与が、前記薬学的組成物を前記対象の皮膚と接触させることを含む、本発明1020~1041のいずれかの方法。
[本発明1043]
前記投与が、前記薬学的組成物を前記対象に非経口投与することを含む、本発明1020~1042のいずれかの方法。
[本発明1044]
前記投与が、前記薬学的組成物を前記対象に注入することを含む、本発明1043の方法。
[本発明1045]
前記投与が、腹腔内注入または静脈内注入である、本発明1043の方法。
本明細書で使用される場合、「1つ(a)」または「1つ(an)」という用語は、文脈が別段に明確に示さない限り、「少なくとも1つ」または「1つ以上」を意味する。
本明細書に記載されるように、本明細書に提供される実施形態は、ファーバー病の治療方法を提供する。いくつかの実施形態では、方法は、治療的または予防的に有効な量の、本明細書に記載の1つ以上のタンパク質を、ファーバー病を有する対象またはファーバー病を有すると疑われる対象に投与することを含む。
・28週間のrhACによる治療後の正味結節数(≧5mm)におけるベースラインからの変化率、
・28週間のrhACによる治療後の正味結節数(≧10mm)におけるベースラインからの変化率及びプラセボとの比較、
・28週間のrhACによる治療後の全結節数(サイズにかかわらず)におけるベースラインからの変化率及びプラセボとの比較、
・28週間のrhACによる治療後の、選択された関節における関節可動域のベースラインからの変化及び変化率、ならびにプラセボとの比較、
・28週間のrhACによる治療後の、6分歩行距離のベースラインからの変化及び変化率、ならびにプラセボとの比較、
・28週間のrhACによる治療後の、肺機能試験のベースラインからの変化及び変化率、ならびにプラセボとの比較、
・28週間のrhACによる治療後の、FDTスコアのベースラインからの変化及び変化率、ならびにプラセボとの比較、
・28週間にわたるrhACまたはプラセボによる治療中の年齢に対する体重及び身長のZスコアのベースラインからの変化及び変化率。
材料及び方法
rhACの産生及び特徴付け
ヒトAC cDNA(NM_177924.3由来、ASAH1変異形1)を、Selexis SURE CHO-M細胞株(商標)(Selexis SA,Switzerland)に導入し、AC活性を過剰発現するクローンを選択した。1つの過剰発現するクローン(MST-cp07-cp47)をさらに拡張し、バイオリアクターシステム(GE Healthcare Life Sciences Inc.)中で成長させた。ろ過後、連続イオン交換及びサイズ分画クロマトグラフィーによって、rhACを培地から精製した。動物におけるその使用前に、インビトロ物理的及び生化学的特徴(例えば、最適pH、等電点、分子量、サブユニット会合)を、確立された方法によって、以前に記載されたCHO由来のrhAC(He et al.,2003)と比較した。産生されたrhACは、検出可能な酸性スフィンゴミエリナーゼ活性を有しないことが決定された。
asah1P361R/P361R変異体マウス(すなわち、ファーバー病マウス)のコロニーを、以前に記載されているように(Alayoubi et al.,2013)、ヘテロ接合体交配対を飼育することによって、混合された遺伝的背景(W4/sv129/C57Bl)上で維持した。別段の記載がない限り、離乳時(3週間)におけるトゥクリップDNAの分析によって、遺伝子型決定を行った。全ての実験は、Institutional Animal Care and Use Committee(動物実験及び使用委員会)によって承認されたプロトコル(番号98-0089)の下、Icahn School of Medicineにおいて行った。野生型マウスを対照として使用し、コロニー内から誘導した。動物に食餌及び水を自由に与え、ケタミン/キシラジン注入によって安楽死させた後、NIHガイドラインに従って頸椎脱臼を行った。
ファーバー病患者からの以前に特徴付けられた(Chatelut et al.,1997)EBV形質転換線維芽細胞株は、Dr.Thierry Levade(Toulouse,France)の厚意で提供された。10%の熱不活化ウシ胎仔血清(FBS)(v/v)、1%のペニシリン/ストレプトマイシン(v/v)、1%のL-グルタミン(v/v)、及び0.1%のフンギゾン(v/v)を含有するRPMI培養培地(Sigma-Aldrich)中で細胞を成長させた。MST-cp07-cp47培地に分泌されたrhACを評価するために、シェーカーフラスコ中で48時間成長させたCHO細胞クローンから馴化培地を収集した。形質転換されたファーバー病線維芽細胞を、約80%の培養密度まで成長させ、標準RPMI培地を馴化培地と交換した。次いで、血清の不在下でさらに48時間細胞を成長させ、その後にそれらをトリプシン化し、ラバーポリスマンで採取した。細胞ペレットをPBSで3回洗浄し、下記のように細胞溶解物上で脂質アッセイを行った。
MST-cp07-cp47 CHO細胞クローンの培地から得られた精製されたrhACを、滅菌PBS中10mg/mLの濃度で維持し、-20℃で貯蔵した。それを使用前に1回だけ解凍サイクルに供した。ファーバーマウスへの酵素投与は、別段の記載がない限り、腹腔内(i.p.)注入によるものであった。マウスに投与される酵素の量は、所望の用量(μg/g)及び動物の体重に基づいていた。必要な場合、投与前に酵素を滅菌PBS中に希釈した。対照ファーバー病マウスにPBSを単独で注入した。
クロロホルム/メタノール(2:1)を使用して、伝統的なFolch法(Folch et al.,1957)によって組織ホモジネートまたは細胞溶解物から脂質抽出物を調製した。次いで、窒素ガス下で脂質抽出物を乾燥させ、2%のIgepal溶液中に再溶解した。セラミド決定の場合、セラミド加水分解緩衝液(0.3MのNaCl及び0.2μg/μLのrhACを含有する0.2Mのクエン酸/リン酸緩衝液、pH4.5)を、全脂質抽出物溶液と混合し(1:1、v/v)、37℃で60分間インキュベートした。標準反応の場合、各2μLの脂質抽出物及びセラミド加水分解緩衝液を使用した。次いで、この混合物を、1.25mMのシアン化ナトリウム及び1.25mMのナフタレン-2,3-ジカルボキシアルデヒド(NDA)を含有する56μLの蛍光発生反応緩衝液(25mMのホウ酸ナトリウム緩衝液、pH9)を用いて50℃でさらに10分間インキュベートして、スフィンゴシンを誘導体化した。
試料(組織ホモジネートまたは細胞溶解物)を、基質緩衝液(0.2mM NBD-C12セラミド、0.2Mのクエン酸/リン酸緩衝液(pH4.5)、0.3MのNaCl、10%のFBS、及び0.2%のIgepal)を用いて、37℃で30分間インキュベートした(1:1、v/v)。NBD-C12セラミドは、Avanti Polar Lipidsから購入した。エタノール(10x)によって反応を停止させ、遠心分離して(13,000xg/10分)、Acquity H-Class UPLCシステム(Waters)を使用して上清(5μL)を分析した。未分解のNBD-C12セラミド基質及びNBD-C12脂肪酸反応産生物の分離は、Waters Acquity UPLC BEH C18カラム(2.0×30mm、1.7μm)を使用して達成された。勾配系の移動相組成物は、移動相Aについては13mMの酢酸アンモニウム緩衝液(pH7.2)、移動相Bについては100%のアセトニトリルであった。勾配プログラムは、1.2mL/分の流量で0~0.1分 68~0% A、32~100% B、0.1~0.4分 0~68% A、100~32% B、0.4~0.8分 68% A、32% Bであった。蛍光産生物(NBD-C12脂肪酸)を、それぞれ435nm及び525nmの励起及び放出波長でモニタリングした。産生物ピークの定量は、市販のNBD-C12脂肪酸(Avanti)から誘導された標準曲線に従って、Waters Empowerソフトウェアを使用して計算した。
安楽死の直後に、心臓穿刺によってマウスから血液を収集し、血漿を-20℃で冷凍した。血漿単球化学吸引性タンパク質(MCP)-1を、製造元によって供給されるプロトコルに従って市販のキット(番号MJE00、R&D Systems)を使用し、ELISAによって決定した。
7日または14日の拡張後、rhACを補充した軟骨細胞及び補充していない軟骨細胞を、培養フラスコから採取した(約1×106細胞/ペレット)。qiaShredder及びRNeasyミニキット(Qiagen,Limburg,Netherlands)を使用してRNAを抽出し、Nanodrop 1000(Thermo Scientific,Walthman,MA)を使用して定量した。各群から同量のRNAを使用し、高容量cDNA逆転写キット(Life Technologies,Grand Island,NY)及びBio-Rad S1000熱循環器(Bio-Rad,Hercules,CA)を使用して、相補性DNAを合成した。コラーゲンII(Col2a1、Rn01637087_m1)、アグリカン(Agg,Rn00573424_m1)、Sox9(Sox9、Rn01751069_mH)、及びGAPDH(ハウスキーピング遺伝子としてのRn01775763_g1)に特異的な高速ユニバーサルPCR Master Mix及びプライマー(Life Technologies,Grand Island,NY)を使用し、7900HT qPCR機(Life Technologies、Grand Island、NY)を稼働して、RT-qPCRを完了させた。ΔΔct法を使用してデータを分析し、結果を相対量(RQ)倍増として提示した。
安楽死に続いて、マウスから組織を採取し、10%のホルマリン中で24時間固定した後、分析の準備ができるまでエタノール中で貯蔵した。H&E染色の場合、それらをパラフィン包埋し、マイクロトームで切片化(5μ)した。
2つの群間の比較は、スチューデントt検定を用いて行った。3つ以上の群を互いに比較する場合、一元配置分散分析(ANOVA)に続いてターキーのHSD検定を使用した。SPSS統計ソフトウェア を使用して、全ての統計分析を行った。
rhACのインビトロアセスメント
この研究に使用したrhACは、過剰発現するCHO細胞クローン(MST-cp07-cp47)の培地から精製した。図11に示されるように、酵素は高度に精製され、それぞれ予想されるα-及びβ-サブユニットに対応して、非還元SDS PAGE条件下で約50kDaのバンド、及び還元条件下で約13kDa及び40kDaのバンドを呈した。この分泌された酵素の生理活性を確認するために、MST-cp07-cp47細胞から馴化培地を収集し、ファーバー病患者から得られたEBV形質転換線維芽細胞に添加した(Chatelut et al.,1997)。24時間後に細胞を採取し、全セラミド及びスフィンゴシンを定量した。図1A及び図1Bは、馴化培地(CM)中で成長した細胞が、標準培地(M)中で成長した細胞と比較して、著しく低減したセラミド(図1A)及び上昇したスフィンゴシン(図1B)を有していたことを示し、分泌されたrhACが細胞によって内在化され、触媒的に活性であったことを実証する。
ファーバーマウスにおける初期研究は、4つの異なる用量(0.1、1、10、及び50mg/kg)での約9週齢の動物への精製rhACの単回投与を評価した。この年齢で罹患したマウスは、組織中の大量のセラミド貯蔵を呈する(Alayoubi et al.,2013)。マウスが極めて小さいサイズであり、かつ高用量(50mg/kg)注入に必要な量が比較的大きい量(約75μL)であるために、尾静脈ではなく腹腔内(i.p.)注入を使用した。
次に、ファーバー病マウスの群に3用量のrhAC(1、3、及び10mg/kg)を、約3週齢で開始して週1回腹腔内注入した。IACUCプロトコルに従って安楽死が必要とされるまで(1週間以内に10%超の体重喪失)、マウスを酵素処置して維持した。したがって、この研究の主なエンドポイントは生存であった。
上記のように、マクロファージで充填された結節(「脂肪肉芽腫」)は、全てのまたは大部分のファーバー病患者の軟骨部位において形成し、衰弱する軟骨疾患につながる。ファーバー病マウスは、目に見える結節を形成しないため、ヒト障害のこの特徴は、これらのERT研究では評価することができなかった。しかしながら、我々は、罹患したマウスから軟骨細胞を単離し、それらをrhACによりインビトロで処置して、この重要な細胞型による酵素取り込み及び効能を査定した。図10A~10Cに示されるように、未処置のファーバー病マウスからの軟骨細胞は、いくつかの軟骨細胞マーカー遺伝子(コラーゲン2(図10A)、アグリカン(図10B)、及びSox-9(図10C))の非常に低い発現を呈し、培養培地へのrhACの添加は、発現を顕著に強化した。これらの発見は、この重要な病理学的細胞型による酵素の取り込み及び軟骨細胞表現型を訂正する可能性を実証した。
これらの実験の目的は、ファーバー病患者における今後のERT研究のための概念証明を確立するために、ファーバー病のマウスモデルを使用することであった。ファーバー病マウスは、深刻なヒトファーバー病変異(P362R)のノックインであり、対応してそのマウスは、約7~13週齢の死をもたらす深刻な疾患を呈する。罹患したマウスは、例外的に小さく生まれ、成長障害及び約4~5週齢で開始する急速な衰弱を呈する。患者と同様に、マウスは、大部分の組織においてセラミドを蓄積し、マクロファージ浸潤を呈する。マウスはまた、高レベルのいくつかの炎症性バイオマーカーを有し、これらのうちMCP-1は、最も重要であり、一貫している。患者とは異なり、ファーバー病マウスは、軟骨部位に目に見える結節を発達させないが、軟骨及び滑膜組織におけるマクロファージ浸潤の組織学的証拠が存在する。マウスが結節を発達させないという事実は、それらの顕著に短縮された寿命に起因し得る。
方法
rhAC薬物供給及び調製
rhACは、GE Healthcare Life Sciences,Inc.(Marlborough,MA)におけるcGMP条件下、rhACを過剰発現するCHO-Mクローン細胞系の反応器培地から精製された(MST-cp07-cp47)(He et al.,2003)。rhACバルク薬物(Batch EN753-01-15-001)は、9.91mg/mLの濃度で滅菌リン酸緩衝生理食塩水(PBS)中の溶液として提供され、0.9%の滅菌生理食塩水を使用して注入のために希釈された。滅菌PBSは、ビヒクル対照として用いた。
asah1P361R/P361R変異についてホモ接合性のファーバー病ノックインマウスは、以前に記載されているように、混合された遺伝的背景コロニー(W4/129Sv/CD1)から誘導された(Alayoubi et al.,2013)。野生型同腹子(asah1WT/WT)を健康な対照として用いた。ファーバーホモ接合性またはWTホモ接合性同腹子の遺伝子確認は、離乳直前、3週齢で起こった。全ての生存中実験は、Icahn School of Medicineの動物実験及び使用委員会により、プロトコル番号98-0089の下で承認された。マウスに標準食餌及び水を自由に与え、現行のNIHガイドラインに従って安楽死させた。
ファーバーマウスは、それらの遺伝子型が確認されると、ローリングベースで6つの処置群のうちの1つに、1群当たり全8動物で割り当てられた。ファーバーマウスに、0(PBS、疾患対照)、0.1、1、3、または10mg/kgのrhACを腹腔内(i.p.)注入によって、およそ3週齢で開始して週1回、6週間にわたって投与した(全6用量)。PBS単独で処置された野生型マウスは、健康な対照として用いた。最終用量後48時間で動物を安楽死させ、末梢血を収集し、サイトカイン分析のための血漿に処理して、以下の組織、肝臓、脾臓、肺、脳、腎臓、気管、大腿骨(無傷の大腿脛骨関節)、心臓、筋肉、及び胸腺を均等に分割し、半分を組織脂質分析のために急速冷凍し、もう半分を組織病理学的処理のためにホルマリン中に固定した。研究の最後に、各研究動物について体重及び各単離組織の重量を記録した。
全組織セラミド及びスフィンゴシンの定量
最終用量のrhACの48時間後に収集された各組織の半分を急速冷凍し、使用まで-20℃で貯蔵した。第6の最終用量のrhACから48時間後に収集された急速冷凍組織からの全セラミド及びスフィンゴシンの定量は、以前に記載されているように実行した(He et al.,2017)。全セラミドは、セラミドをスフィンゴシンに加水分解し、スフィンゴシン加水分解物を誘導体化し、誘導体化されたスフィンゴシン産生物を定量することによって間接的に定量した。要するに、クロロホルム/メタノール(2:1、v/v)を使用し、伝統的なFolch法によって組織を均質化及び抽出し(Folch et al.,1957)、次いで脂質抽出物を窒素ガス下で乾燥させ、2%のIgepal溶液(Sigma-Aldrich)中で再構成した。各試料中の全セラミドを、2μLの各試料1:1(v/v)を、0.3MのNaCl及び0.2mg/mLのrhAC(pH4.5)を含有する0.2Mのクエン酸/リン酸緩衝液で希釈することによってスフィンゴシンに加水分解し、37℃で1時間インキュベートした。25mMのホウ酸ナトリウム、1.25mMのシアン化ナトリウム、及び1.25mMのナフタレン-2,3-ジカルボキシアルデヒド(pH9)を含有する56μLの蛍光発生緩衝液を添加し、混合物を50℃で10分間インキュベートして、スフィンゴシン加水分解物を誘導体化した。全セラミド(誘導体化されたセラミド加水分解物)の間接的定量は、RP18カラム(20×50mm、1.7マイクロメートル)を備えるWaters Acquity UPLCを使用して達成され、それぞれ252nm及び483nmの励起及び放出波長を使用して検出された(He et al.,2017によって以前に記載されている)。スフィンゴシン定量は、加水分解緩衝液を使用せずに、同じ誘導体化プロトコルに従った。
最終用量のrhACの48時間後及び安楽死の直後に収集された末梢血を、ルーチン方法を使用して血漿に処理し、使用まで-20℃で貯蔵した。血漿単球化学吸引性タンパク質(MCP)-1を、製造元のプロトコルに従って市販のキット(番号MJE00、R&D Systems)を使用し、ELISAによって定量した。血漿MCP-1は、pg/mL血漿として提示される。
最終用量のrhACの48時間後に収集された各組織の半分をホルマリン中に固定し、使用まで10%エタノール中、室温で貯蔵した。顕微鏡評価に必要な組織を切り取り、ルーチン的に処理し、パラフィンに包埋し、Charles River Laboratories,Inc.,Durhamによるヘマトキシリン及びエオシンで染色した。顕微鏡評価は、委員会認定の獣医病理学者によって、群1~6(群1=WT対照、群2~6=0(疾患対照)、0.1、1、3、または10mg/kgのrhACでそれぞれ処置されたファーバーマウス)の全ての動物からの全てのプロトコル特定された組織に対して行われた。処置群は盲検ではなかった。全ての利用可能な組織を、光学顕微鏡によって評価した。検査に利用可能である場合、組織は、各研究動物からの6つの脳切片、ならびに肺、気管、食道、甲状腺、骨格筋、胸腺、心臓、脾臓、肝臓、腎臓、及び大腿脛骨関節の各々1切片を含んでいた。
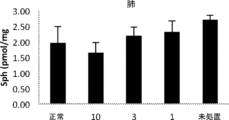
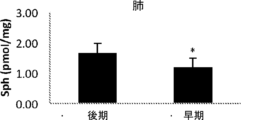
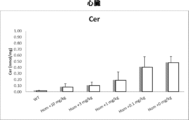
約3週齢で開始した4つの異なる用量(0.1、1、3、及び10mg/kg/用量)で6週間にわたるrhAC(rhAC)による処置後に、ファーバーマウスを評価した。図16A~16Gは、第6用量の注入後24時間におけるファーバー病マウスのそれぞれ肝臓、心臓、筋肉、脾臓、肺、腎臓、及び脳中の全セラミド(Cer)に対する異なるrhAC用量の効果を示す。全体として、rhAC投与は、複数の組織において、特に肝臓、脾臓、腎臓、及び心臓において組織セラミド蓄積の阻止につながった。肺、脳、及び骨格筋において、効果は決定的でなかったが、0.1mg/kg/用量でいくらかの薬物関連変化が見られた。
Claims (24)
- ファーバー病の治療を、それを必要とする対象において行う方法において使用するための、0.1mg/kg~50mg/kgの有効量の組換えヒト酸性セラミダーゼを含む薬学的組成物であって、前記方法が前記薬学的組成物を前記対象に投与することを含む、前記薬学的組成物。
- 前記ファーバー病の治療を行うことが、ファーバー病を有する対象またはファーバー病を有すると疑われる対象において、脂肪肉芽腫を低減すること、または脾臓重量を低減すること、またはセラミドを低減すること、またはスフィンゴシンを増加することを含む、請求項1に記載の薬学的組成物。
- 前記有効量が、約0.1mg/kg~約10mg/kg、または約10mg/kg~約50mg/kg、または約10mg/kg~約20mg/kg、または約20mg/kg~約30mg/kg、または約30mg/kg~約40mg/kg、または約40mg/kg~約50mg/kgである、請求項1または2に記載の薬学的組成物。
- 前記有効量が、約1、2、3、4、5、6、7、8、9、または10mg/kgである、請求項1または2に記載の薬学的組成物。
- 前記薬学的組成物が、前記対象に週1回投与される、請求項1または2に記載の薬学的組成物。
- 前記薬学的組成物が、溶液である、請求項1~5のいずれか1項に記載の薬学的組成物。
- 前記薬学的組成物が、組換えヒト酸性セラミダーゼを含む細胞馴化培地を含む、請求項1または2に記載の薬学的組成物。
- 前記投与が、前記薬学的組成物を前記対象の皮膚と接触させることを含む、請求項1または2に記載の薬学的組成物。
- 前記投与が、前記薬学的組成物を前記対象に非経口投与することを含む、請求項1~6のいずれか1項に記載の薬学的組成物。
- 前記投与が、前記薬学的組成物を前記対象に注入することを含む、請求項1~6のいずれか1項に記載の薬学的組成物。
- 前記投与が、腹腔内注入または静脈内注入である、請求項1~6のいずれか1項に記載の薬学的組成物。
- ファーバー病の治療を、それを必要とする対象において行う方法において使用するための、約0.1mg/kg~約50mg/kgの有効量の単離された発現組換えヒト酸性セラミダーゼ(rhAC)を含む薬学的組成物であって、前記方法が、
a.rhACを細胞中で発現させることと、
b.前記発現したrhACを前記細胞から単離することと、
c.前記薬学的組成物を前記対象に投与することと
を含む、前記薬学的組成物。 - 前記ファーバー病の治療を行うことが、ファーバー病を有する対象またはファーバー病を有すると疑われる対象において、脂肪肉芽腫を低減すること、または脾臓重量を低減すること、またはセラミドを低減すること、またはスフィンゴシンを増加することを含む、請求項12に記載の薬学的組成物。
- 前記組換えヒト酸性セラミダーゼを細胞中で発現させることが、組換えヒト酸性セラミダーゼをコードするベクターを前記細胞に導入することを含む、請求項12または13に記載の薬学的組成物。
- 前記ベクターが、ウイルスベクターまたはプラスミドである、請求項14に記載の薬学的組成物。
- 前記ベクターが、前記組換えヒト酸性セラミダーゼに操作可能に結合されたプロモーターを含む、請求項14に記載の薬学的組成物。
- 前記ベクターを、前記細胞に導入する、または前記細胞に感染させる、請求項14に記載の薬学的組成物。
- 前記細胞が、チャイニーズハムスター卵巣(CHO)細胞またはNS0である、請求項12または13に記載の薬学的組成物。
- 前記有効量が、約0.1mg/kg~約10mg/kg、または約10mg/kg~約50mg/kg、または約10mg/kg~約20mg/kg、または約20mg/kg~約30mg/kg、または約30mg/kg~約40mg/kg、または約40mg/kg~約50mg/kgである、請求項12または13に記載の薬学的組成物。
- 前記有効量が、約1、2、3、4、5、6、7、8、9、または10mg/kgである、請求項12または13に記載の薬学的組成物。
- 前記薬学的組成物が、前記対象に週1回投与される、請求項12または13に記載の薬学的組成物。
- 前記薬学的組成物が、溶液である、請求項12~21のいずれか1項に記載の薬学的組成物。
- 前記投与が、前記薬学的組成物を前記対象に非経口投与することを含む、請求項22に記載の薬学的組成物。
- 前記投与が、前記薬学的組成物を前記対象に注入することを含む、請求項22に記載の薬学的組成物。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022181240A JP2023011938A (ja) | 2017-01-13 | 2022-11-11 | ファーバー病を治療するための組成物及び方法 |
| JP2024159770A JP2024169509A (ja) | 2017-01-13 | 2024-09-17 | ファーバー病を治療するための組成物及び方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762446166P | 2017-01-13 | 2017-01-13 | |
| US62/446,166 | 2017-01-13 | ||
| PCT/US2018/013509 WO2018132667A1 (en) | 2017-01-13 | 2018-01-12 | Compositions and methods for treating farber disease |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022181240A Division JP2023011938A (ja) | 2017-01-13 | 2022-11-11 | ファーバー病を治療するための組成物及び方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020514305A JP2020514305A (ja) | 2020-05-21 |
| JP2020514305A5 JP2020514305A5 (ja) | 2021-02-12 |
| JP7576293B2 true JP7576293B2 (ja) | 2024-10-31 |
Family
ID=62839661
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019538173A Active JP7576293B2 (ja) | 2017-01-13 | 2018-01-12 | ファーバー病を治療するための組成物及び方法 |
| JP2022181240A Pending JP2023011938A (ja) | 2017-01-13 | 2022-11-11 | ファーバー病を治療するための組成物及び方法 |
| JP2024159770A Pending JP2024169509A (ja) | 2017-01-13 | 2024-09-17 | ファーバー病を治療するための組成物及び方法 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022181240A Pending JP2023011938A (ja) | 2017-01-13 | 2022-11-11 | ファーバー病を治療するための組成物及び方法 |
| JP2024159770A Pending JP2024169509A (ja) | 2017-01-13 | 2024-09-17 | ファーバー病を治療するための組成物及び方法 |
Country Status (8)
| Country | Link |
|---|---|
| US (4) | US20190343936A1 (ja) |
| EP (2) | EP3568154B1 (ja) |
| JP (3) | JP7576293B2 (ja) |
| AU (2) | AU2018207564A1 (ja) |
| CA (1) | CA3049771A1 (ja) |
| JO (1) | JOP20190164B1 (ja) |
| MX (1) | MX2019008038A (ja) |
| WO (1) | WO2018132667A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2024169509A (ja) * | 2017-01-13 | 2024-12-05 | アイカーン スクール オブ メディシン アット マウント サイナイ | ファーバー病を治療するための組成物及び方法 |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019009979A1 (en) * | 2017-07-06 | 2019-01-10 | The Medical College Of Wisconsin, Inc. | NEW IN VITRO AND IN VIVO ENRICHMENT STRATEGY TARGETING CSH-DERIVED LYMPHOCYTES TRANSDUCED BY A VECTOR FOR DISEASE THERAPY |
| US20190240298A1 (en) * | 2018-02-02 | 2019-08-08 | Enzyvant Farber Gmbh | Methods for treating farber disease |
| WO2019210301A1 (en) | 2018-04-27 | 2019-10-31 | The Medical College Of Wisconsin, Inc. | Use of lentivector-transduced t-rapa cells for amelioration of lysosomal storage disorders |
| WO2020152532A1 (en) | 2019-01-23 | 2020-07-30 | Enzyvant Therapeutics Gmbh | Method of ameliorating a pro-inflammatory immunophenotype in farber disease subjects by repeated administration of a recombinant human acid ceramidase |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015518054A (ja) | 2012-06-01 | 2015-06-25 | アイカーン スクール オブ メディシン アット マウント サイナイ | 感染の治療および予防におけるセラミドレベル |
| JP2016520519A (ja) | 2013-03-14 | 2016-07-14 | アイカーン スクール オブ メディシン アット マウント サイナイ | 治療用酸性セラミダーゼ組成物ならびにそれを作製および使用する方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7576293B2 (ja) * | 2017-01-13 | 2024-10-31 | アイカーン スクール オブ メディシン アット マウント サイナイ | ファーバー病を治療するための組成物及び方法 |
| WO2019060837A1 (en) * | 2017-09-25 | 2019-03-28 | Enzyvant Farber Gmbh | PROCESS FOR PRODUCING RECOMBINANT HUMAN ACID CERAMIDASE |
| US20190240298A1 (en) * | 2018-02-02 | 2019-08-08 | Enzyvant Farber Gmbh | Methods for treating farber disease |
-
2018
- 2018-01-12 JP JP2019538173A patent/JP7576293B2/ja active Active
- 2018-01-12 US US16/477,710 patent/US20190343936A1/en not_active Abandoned
- 2018-01-12 AU AU2018207564A patent/AU2018207564A1/en not_active Abandoned
- 2018-01-12 WO PCT/US2018/013509 patent/WO2018132667A1/en not_active Ceased
- 2018-01-12 JO JOP/2019/0164A patent/JOP20190164B1/ar active
- 2018-01-12 MX MX2019008038A patent/MX2019008038A/es unknown
- 2018-01-12 EP EP18739237.8A patent/EP3568154B1/en active Active
- 2018-01-12 EP EP23184825.0A patent/EP4295903A3/en active Pending
- 2018-01-12 CA CA3049771A patent/CA3049771A1/en active Pending
-
2022
- 2022-05-31 US US17/828,131 patent/US20220313800A1/en not_active Abandoned
- 2022-11-11 JP JP2022181240A patent/JP2023011938A/ja active Pending
-
2023
- 2023-11-13 US US18/507,791 patent/US20240075113A1/en not_active Abandoned
-
2024
- 2024-06-26 US US18/755,376 patent/US20250170225A1/en active Pending
- 2024-09-17 JP JP2024159770A patent/JP2024169509A/ja active Pending
-
2025
- 2025-01-14 AU AU2025200254A patent/AU2025200254A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015518054A (ja) | 2012-06-01 | 2015-06-25 | アイカーン スクール オブ メディシン アット マウント サイナイ | 感染の治療および予防におけるセラミドレベル |
| JP2016520519A (ja) | 2013-03-14 | 2016-07-14 | アイカーン スクール オブ メディシン アット マウント サイナイ | 治療用酸性セラミダーゼ組成物ならびにそれを作製および使用する方法 |
Non-Patent Citations (2)
| Title |
|---|
| Biochimica et Biophysica Acta、2016、1862、1459-1471 |
| EMBO Molecular Medicine、2013、5、827-842 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2024169509A (ja) * | 2017-01-13 | 2024-12-05 | アイカーン スクール オブ メディシン アット マウント サイナイ | ファーバー病を治療するための組成物及び方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3568154A1 (en) | 2019-11-20 |
| US20250170225A1 (en) | 2025-05-29 |
| JP2020514305A (ja) | 2020-05-21 |
| WO2018132667A1 (en) | 2018-07-19 |
| CA3049771A1 (en) | 2018-07-19 |
| JP2024169509A (ja) | 2024-12-05 |
| EP4295903A3 (en) | 2024-03-27 |
| EP3568154A4 (en) | 2020-11-18 |
| JP2023011938A (ja) | 2023-01-24 |
| EP4295903A2 (en) | 2023-12-27 |
| JOP20190164A1 (ar) | 2019-07-02 |
| AU2018207564A1 (en) | 2019-08-08 |
| MX2019008038A (es) | 2020-02-05 |
| JOP20190164B1 (ar) | 2023-09-17 |
| US20240075113A1 (en) | 2024-03-07 |
| AU2025200254A1 (en) | 2025-01-30 |
| US20190343936A1 (en) | 2019-11-14 |
| US20220313800A1 (en) | 2022-10-06 |
| EP3568154B1 (en) | 2023-07-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2024169509A (ja) | ファーバー病を治療するための組成物及び方法 | |
| JP7778392B2 (ja) | 病的石灰化状態を治療するための組成物およびそれを使用する方法 | |
| KR101710026B1 (ko) | Cas9 단백질 및 가이드 RNA의 혼성체를 함유하는 나노 리포좀 전달체 조성물 | |
| US11400109B2 (en) | Subcutaneous delivery of messenger RNA | |
| CN1750834A (zh) | 用于治疗蛋白质缺乏病的联合治疗 | |
| CN101466399B (zh) | 稳定的胰岛素样生长因子多肽 | |
| JP2017035091A (ja) | 促進されたプロセシングを備えた修飾された酸性アルファグルコシダーゼ | |
| US11628226B2 (en) | Methods and gene therapy constructs for treating GM2 gangliosidoses | |
| JP2020523035A (ja) | タウ凝集阻害剤 | |
| US20090038022A1 (en) | IGF-1 Novel peptides | |
| CN101214249A (zh) | 尼曼-皮克病的基于陪伴分子的治疗 | |
| US20220088158A1 (en) | Method of ameliorating a pro-inflammatory immunophenotype in farber disease subjects by repeated administration of a recombinant human acid ceramidase | |
| HK40105998A (en) | Compositions and methods for treating farber disease | |
| US9839671B2 (en) | Peptide and uses therefor | |
| JP2023159164A (ja) | ファーバー病マーカーおよびその使用 | |
| TW201408321A (zh) | 治療癌症之協同組合 | |
| CN1501976A (zh) | 用于联合治疗的crf2配体 | |
| US20240000753A1 (en) | Methods and compositions to increase lifespan and healthspan by mimicking the effects of time-restricted feeding | |
| CN1863548A (zh) | 治疗细胞外基质紊乱的方法和组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201224 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201224 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210324 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220323 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220713 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20221111 |
|
| C116 | Written invitation by the chief administrative judge to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C116 Effective date: 20221124 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20221124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230104 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230824 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241011 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7576293 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |