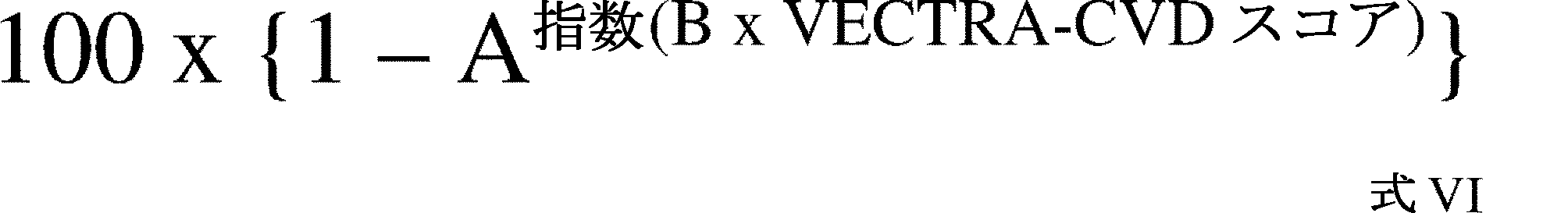開示の詳細な説明
本発明は、炎症性疾患、例えば関節リウマチ(RA)を有する対象における心血管疾患(CVD)のリスクを評価および治療するための方法を含む。CVDおよび/またはRAの予後および治療のための、RAにおけるCVDについて有利に正確であるリスク分析方法が開示される。
本発明の方法は、CVDリスクおよび/またはRAをさらに評価および治療するために、アッセイを実施して、対象の炎症性疾患活動性のバイオマーカーおよびさらなる臨床変数の定量的データに基づいてリスク分析を生成することを含む。
本発明の態様は、心血管疾患または心筋梗塞のリスクを決定するための生物情報学的方法をさらに提供する。心血管疾患のリスクは、一般集団においてだけでなく、関節リウマチなどの炎症性疾患を有する患者についても決定することができる。
本開示の方法は、炎症性疾患活動性のバイオマーカー、ならびに対象に関連する様々な臨床変数に基づいてCVDリスクスコアを提供することができる。方法は、RAの影響および炎症を含むその特徴を考慮に入れることができる。そのような態様では、炎症の影響を考慮することにより、RA患者におけるCVDリスクの驚くほど正確な測定および予後が提供される。
本開示は、RAにおけるCVDのリスクを評価および治療するための様々な方法を提供する。方法は、特定の臨床変数と組み合わせて、調整されたマルチバイオマーカー疾患活動性スコア、例えば調整MBDAスコアを生成し、利用することができる。
本明細書で使用される場合、「調整MBDAスコア」という用語は、調整されたVECTRAスコアを指すことができる。
いくつかの局面では、本発明は、心血管疾患のリスクを決定するために様々なバイオマーカーを利用することができる。
さらなる局面では、本発明は、炎症性および/または自己免疫疾患、例えばRAを有する対象に関連し得る様々なバイオマーカーを利用することができる。
特定の局面では、本発明は、炎症性および/または自己免疫疾患、例えばRAを有する対象における心血管疾患(CVD)リスクを決定または評価するために様々なバイオマーカーを利用することができる。
さらなる局面では、本発明は、炎症性疾患治療および/またはCVD治療への応答に際してRA患者のCVDリスクを決定するために、様々なバイオマーカーを利用することができる。
いくつかの態様では、本開示は、RA患者におけるCVD事象リスクを予測するための効率的かつ正確なアルゴリズムを提供することができる。CVD事象リスクを予測するためのアルゴリズムは、全身性炎症の影響を考慮に入れることができる。
さらなる態様では、本発明は、RA患者のケアを容易にすることができる、利用しやすいリスク層別化アルゴリズムを含む。本開示は、CVDおよび/またはRAのポイントオブケアに効率的に導入され得る方法を含む。
さらなる態様では、本開示は、RA疾患活動性を反映するバイオマーカーの使用を通じた、全身性炎症を評価する方法を記載する。
本発明の特定の態様では、調整MBDAスコアなどの調整されたマルチバイオマーカー疾患活動性スコアを使用して、RAにおけるCVDの可能性またはリスクを予測することができる。
いくつかの局面では、本開示は、RAでのCVD事象リスクは、より低いRA疾患活動性を有する患者において低下し得ることを示す。したがって、本発明の態様は、炎症経路に直接介入してCVDリスクを下げることによるRA患者の管理を企図している。
さらなる局面では、本発明は、免疫学的手段を介して全身性炎症を軽減するための方法において、RA患者に恩恵を示すことができる。いくつかの態様では、上昇したC反応性タンパク質(CRP)を有する患者は、全身性炎症を直接低減させてCVD事象リスクを下げることによって治療され得る。
さらなる局面では、本発明は、医学的治療のために高リスク患者を特定するために使用することができる、RAにおけるCVDリスク層別化のための方法を提供することができる。CVDリスク層別化は、CVDリスクスコアの検証によって決定された閾値を臨床転帰とともに包含することができる。
本発明の特定の局面では、CVDリスクを決定するための方法は、リアルタイムでおよび/またはポイントオブケアで臨床医によって使用され得る。
さらなる局面では、CVDリスクを評価するための本発明の方法を使用して、RAの影響および炎症を含むその特徴を考慮することができる。CVDリスクの方法は、独立したリスク因子としてRAを含めることによって、RA患者のCVDリスクを正確に推定することができる。
さらなる局面では、CVDリスク予測を評価および利用するための本発明の方法は、全身性炎症を定量化し、分析要素としてCRPを含み得る。いくつかの態様では、CVDリスク予測を評価および利用するための方法は、全身性炎症の影響を含めることによって、RA患者における驚くほど正確なCVD事象リスク値を提供することができる。そのような方法は、リスク層別化をより利用しやすくするのを助け、RA患者のケアを容易にすることができる。
さらなる態様では、全身性炎症は、RA疾患活動性を反映する1つまたは複数のバイオマーカーを使用することによってRAのCVDリスクを評価するための方法に含まれ得る。ある特定の態様では、調整MBDAスコアなどの調整されたマルチバイオマーカー疾患活動性スコアを使用して、他のスコアの中でも、28関節の疾患活動性スコア(DAS28)によって測定されるRA疾患活動性と高度に相関する結果を提供することができる。
本発明の態様は、臨床医にとって有用であり得る、CVDリスク評価のための方法およびアルゴリズムをさらに企図する。より具体的には、本発明は、疾患マーカーの測定のための、ならびにマーカーおよび臨床変数を使用してRA疾患活動性を評価するアルゴリズムのトレーニングおよび検証のための方法を含む。
CVDリスクを評価するための本開示の方法およびアルゴリズムは、臨床医がアクセスできる、または電子システムで利用可能である様々な臨床データを使用して、CVDリスクスコアを決定および検証することを含み得る。例えば、臨床的特徴およびデータは、電子健康記録または健康保険請求データに含まれ得る。
本開示の方法およびアルゴリズムは、予後および/または転帰予測の有用性を有する、検証されたCVDリスクスコアを提供し得る。CVDリスクスコアのためのそのような方法およびアルゴリズムは、臨床的特徴またはデータの使用をRAバイオマーカーと組み合わせてもよい。CVDリスクスコアは、RA患者のCVDリスクを評価するため、治療を推奨するため、治療から恩恵を受ける対象を特定するため、治療に対する患者の応答を監視するため、または患者を予後判定するため、ならびに炎症性疾患および/またはCVDについて患者を治療するために使用され得る。
RA患者のCVDリスクを決定するための本発明の方法は、驚くほど正確なCVDリスク評価を提供することができる。
特定の態様では、正確なCVDリスク評価は、CVDおよび/またはRAの治療を受ける患者の集団を有利に拡大することができる。CVDおよび/またはRAの治療を受ける患者の集団を拡大することによって、本発明は、CVDリスクについて従来の方法またはモダリティでは治療されていなかった可能性がある患者に治療を提供することができる。CVDおよび/またはRAについて治療を受ける患者の集団の拡大は、本発明のCVDリスクスコア閾値に従った患者の再分類によって示すことができる。
CVDリスクに寄与するRAの重要な要素である全身性炎症を包含することによって、本発明の方法は、CVDおよび/またはRAについて評価または治療され得る患者の集団を拡大することができる。本発明の方法は、一般的なCVDリスク、特にRA患者のCVDリスクに対する医学および治療モダリティの実践を大幅に改善することができる。
本明細書で使用される場合、「疾患」という用語は、例えば、身体の無秩序または不適切に機能する器官、部分、構造、または系に現れ、例えば、遺伝的もしくは発達上のエラー、感染、毒物、栄養不足もしくは平衡異常、毒性、または好ましくない環境要因から生じる任意の障害、状態、疾患、病気を指す。
本明細書で使用される場合、「自己免疫疾患」という用語は、体内に通常存在する物質および組織に対する免疫応答から生じる任意の疾患を包含する。疑いのある、または既知の自己免疫疾患の例としては、関節リウマチ、早期関節リウマチ、軸性脊椎関節炎、若年性特発性関節炎、血清反応陰性脊椎関節症、強直性脊椎炎、乾癬性関節炎、抗リン脂質抗体症候群、自己免疫性肝炎、ベーチェット病、水疱性類天疱瘡、セリアック病、クローン病、皮膚筋炎、グッドパスチャー症候群、グレーブス病、橋本病、特発性血小板減少性紫斑病、IgA腎症、川崎病、全身性エリテマトーデス、混合性結合組織病、多発性硬化症、重症筋無力症、多発性筋炎、原発性胆汁性肝硬変、乾癬、強皮症、シェーグレン症候群、潰瘍性大腸炎、血管炎、ウェゲナー肉芽腫症、側頭動脈炎、高安動脈炎、ヘノッホ-シェーライン紫斑病、白血球性血管炎、結節性多発動脈炎、チャーグ-ストラウス症候群、および混合型クリオグロブリン血症性血管炎が含まれる。
本明細書で使用される場合、「炎症性疾患」という用語は、これらに限定されないが、病原体、損傷細胞、刺激物、抗原、ならびに、自己免疫疾患の場合、体内に通常存在する物質および組織などの刺激を含む、有害刺激に対する血管組織の生物学的応答から生じる任意の疾患を指す。
炎症性疾患のいくつかの例として、関節リウマチ(RA)、若年性特発性関節炎、強直性脊椎炎、乾癬性関節炎、アテローム性動脈硬化症、喘息、自己免疫疾患、慢性炎症、慢性前立腺炎、糸球体腎炎、過敏症、炎症性腸疾患、骨盤内炎症性疾患、再灌流傷害、移植拒絶反応および血管炎が挙げられる。
本明細書で使用される場合、「心血管疾患」、「心血管障害」、および「CVD」という用語は、一般に、身体の心臓、心臓弁、および血管系、例えば動脈および静脈に影響を及ぼす様々な状態を分類することができ、これらに限定されないが動脈硬化、アテローム性動脈硬化症、心筋梗塞(MI)、急性冠動脈症候群、狭心症、うっ血性心不全、大動脈瘤、大動脈解離、腸骨または大腿動脈瘤、肺塞栓症、原発性高血圧症、心房細動、脳卒中、一過性虚血発作、収縮機能不全、拡張期機能不全、心筋炎、心房性頻拍、心室細動、心内膜炎、動脈症、血管炎、アテローム性プラーク、脆弱性プラーク、急性冠動脈症候群、急性虚血発作、心臓突然死、末梢血管疾患、冠動脈疾患(CAD)、末梢動脈疾患(PAD)、および脳血管疾患を含む状態、転帰または事象を包含する。
本開示の疾患および医学的状態には、関節リウマチ(RA)および心血管疾患(CVD)が含まれる。CVDには、アテローム性動脈硬化症、冠動脈アテローム性動脈硬化症、頸動脈アテローム性動脈硬化症、高血圧症が含まれ得る。例えば、CVDには、肺高血圧症、動揺性高血圧症、特発性高血圧症、低レニン高血圧症、食塩感受性高血圧症、低レニン高血圧症、血栓塞栓性肺高血圧症、妊娠誘発性高血圧症、腎血管性高血圧症、高血圧症依存性末期腎疾患、心血管外科手術に関連する高血圧、および左心室(LV)肥大を伴う高血圧、LV拡張機能障害、非閉塞性冠状動脈性心臓病、心筋梗塞、脳梗塞、末梢血管疾患、脳血管疾患、脳虚血、慢性狭心症、安定狭心症、不安定狭心症、異型(プリンツメタル)狭心症を含む狭心症、動脈瘤、虚血性心疾患、血栓症、血小板凝集、血小板接着、平滑筋細胞増殖、医療機器の使用に関連する血管または非血管合併症、医療機器の使用に関連する創傷、血管壁または非血管壁損傷、末梢血管疾患、経皮経管冠動脈造影後の新生内膜過形成、血管移植、冠動脈バイパス手術、血栓塞栓性事象、血管形成術後の再狭窄、冠状動脈プラーク炎症、高コレステロール血症、高トリグリセリド血症、塞栓症、脳卒中、衝撃、不整脈、心房細動または心房粗動、血栓性閉塞および隔絶(reclusion)脳血管インシデント、左心室機能不全、心肥大、および左心室肥大および/または非閉塞性CVDを伴う高血圧症が含まれる。
CVDの例には、酸化ストレス、微小血管冠動脈心疾患、冠動脈内皮機能不全、左室肥大、呼吸困難、炎症、糖尿病および慢性腎不全に関連する状態が含まれ得る。他のCVD医学的状態は、当業者に一般的に知られている。
本明細書で使用される場合、「寛解」という用語は、通常治癒することができない慢性疾患を有することが知られている患者において、疾患活動性が欠如している状態を指す。本明細書で使用される「持続的臨床的寛解」または「SC-REM」という用語は、臨床評価、例えばDAS28に基づいて評価した場合に少なくとも6ヶ月間持続する臨床的寛解の状態を指す。本明細書で使用される「機能的寛解」という用語は、限定されないが、HAQなどの機能的評価基準を使用して評価される寛解の状態を指す。持続的寛解は、維持的寛解と交換可能に使用することができる。
疾患および医学的状態を臨床的に診断するための方法を、当業者は知ることができる。
一般に、頸動脈内膜中膜複合体厚(IMT)の超音波測定値は、CVD、例えばアテローム性動脈硬化症の測定値として、および/またはアテローム性CVD、特に頸動脈アテローム性動脈硬化症の退行または進行を決定するための代用エンドポイントとして使用することができる。
一般に、頸動脈IMT(CIMT)は、アテローム性動脈硬化症またはアテローム性動脈硬化症負担の存在およびアテローム性動脈硬化症の進行を検出するために頸動脈壁の厚さを測定し、アテローム性CVDの存在および進行を評価するための代用エンドポイントとすることができる。頸動脈IMT測定値は、頸動脈の、すなわち総頸動脈、分岐部、または内頸動脈における1つまたは複数のセグメントから得ることができる。特に、総頸動脈(CCA)のIMTは、アテローム性動脈硬化症のリスクマーカーとして有用であり得る。例えば、E.Vicenzini et al.,J.Ultrasound Med.2007,26:427-432を参照されたい。頸動脈IMTによって測定される動脈内のアテローム性動脈硬化症負担は、CVDリスクに関連付けられ得、致命的な冠動脈死を予測するために示され得る。例えば、JT Salonen and R.Salonen,Arterioscler.Thromb.1991,11:1245-1249;LE Chambless et al.,Am.J.Epidemiol.1997,146:およびHN Hodis et al.,Ann.Intern.Med.1998,128:262-269を参照されたい。絶対内膜中膜複合体厚は、臨床的冠動脈事象のリスクに関連する。したがって、頸動脈IMT測定値を使用して、対象のアテローム性動脈硬化症負荷を決定することができ、IMTの変化を使用して、アテローム性動脈硬化症負担の変化およびアテローム性動脈硬化症の進行を評価することもできる。
本発明の態様は、RAの治療に加えて、RAにおけるCVDの治療方法をさらに企図する。
RAにおけるCVDを治療するための方法は、CVD薬を投与するための、コレステロール低下薬を投与するための、血流増加薬を投与するための、心調律調節薬を投与するための、心調律安定化薬を投与するための、および/または血液閉塞を低減する薬剤を投与するための1つまたは複数の工程を含み得る。
RAにおけるCVDを治療するための方法は、対象に施されている治療レジメンを含み得る。
RAにおけるCVDの治療レジメンの例には、試料が得られた時点で施されていた治療レジメンが含まれ得る。施されていた治療レジメンは、RA、CVD、またはその両方の治療レジメンであった可能性がある。
RAにおけるCVDの治療レジメンの例には、試料が得られた時点で対象に施されていた治療レジメンの停止が含まれ得る。施されていた治療レジメンは、RA、CVD、またはその両方の治療レジメンであった可能性がある。
RAにおけるCVDの治療レジメンの例には、試料が得られた時点で対象に施されていた治療レジメンのテーパリングが含まれ得る。施されていた治療レジメンは、RA、CVD、またはその両方の治療レジメンであった可能性がある。
CVD薬の例としては、ベータ遮断剤、ACE阻害剤、アルドステロン阻害剤、アンジオテンシンII受容体遮断剤、カルシウムチャネル遮断剤、コレステロール低下薬、利尿剤、変力薬、電解質サプリメント、PCSK9阻害剤、および血管拡張剤が挙げられる。
CVD薬の例としては、メトプロロール、アセブトロール、アテノロール、ビソプロロールおよびプロプラノロールが挙げられる。
CVD薬の例としては、リシノプリル、エナラプリル、フォシノプリル、モエキシプリル、ペリンドプリル、キナプリル、ラミプリルおよびトラノラプリルが挙げられる。
CVD薬の例としては、スピロノラクトンおよびエプレレノンが挙げられる。
CVD薬の例としては、アジルサルタン、エプロサルタン、イルベサルタン、テルミサルタン、カンデサルタン、ロサルタン、オルメサルタンおよびバルサルタンが挙げられる。
CVD薬の例としては、アムロジピン、フェロジピン、イスラジピン、ニカルジピン、ニフェジピン、ジルチアゼム、ニソルジピンおよびベラパミルが挙げられる。
CVD薬の例としては、アトルバスタチン、フルバスタチン、ロバスタチン、ピタバスタチン、プラバスタチン、ロスバスタチンおよびシンバスタチンが挙げられる。
CVD薬の例としては、ブメタニド、エタクリン酸、フロセミド、トルセミド、クロロチアジド、クロルタリドン、ヒドロクロロチアジド、メトラゾン、インダパミド、アミロリドおよびトリアムテレンが挙げられる。
CVD薬の例としては、アムリノン、ジゴキシン、ドブタミン、ドーパミン、イナムリノン、イノトロピン(inotropin)、ラノキシンおよびミルリノンが挙げられる。
CVD薬の例としては、アリロクマブおよびエボロクマブが挙げられる。
CVD薬の例としては、アルプロスタジル、リオシグアト、ヒドララジン、ミノキシジル、ネシリチド、およびニトロプルシドが挙げられる。
CVD薬の例としては、アスピリン、クロピドグレル、ワルファリン、カリウムサプリメント、およびカルシウムサプリメントが挙げられる。
RAにおけるCVDを治療するための方法は、手術、経皮的冠動脈インターベンション、冠動脈バイパス手術、心臓弁修復もしくは置換手術の実施、および/または肥満外科手術の実施のうちの1つまたは複数の工程を含み得る。
RAにおけるCVDを治療するための方法は、心臓リハビリテーション、治療的身体プログラム、および/または食事の改変もしくは制限の実施うち1つまたは複数の工程を含み得る。
RAにおけるCVDを治療するための方法は、禁煙、糖尿病治療、および/または高血圧症治療の1つまたは複数を含む、CVDのリスク因子の治療のための工程を含むことができる。
RAにおけるCVDを治療するための方法は、1つまたは複数の症候緩和を実施する工程、再発のリスクを低減する工程、再発の重症度を低減する工程、心不全もしくは心臓発作を低減する工程、および/または脳卒中を低減する工程を含み得る。
RAを治療するための方法は、RA薬を投与するための工程を含み得る。RA薬の例には、NSAID薬の投与、ステロイド薬の投与、疾患修飾性抗リウマチ薬DMARDの投与、および生物学的DMARDの投与が含まれる。
RA薬の例には、イブプロフェン、ナプロキセン、およびメロキシカムが含まれる。
RA薬の例には、プレドニゾンが含まれる。
RA薬の例には、メトトレキサート、レフルノミド、ヒドロキシクロロキンおよびスルファサラジンが含まれる。
RA薬の例には、アバタセプト、アダリムマブ、アナキンラ、バリシチニブ、セルトリズマブ、エタネルセプト、ゴリムマブ、インフリキシマブ、リツキシマブ、サリルマブ、トシルズマブ、およびトファシチニブが含まれる。
RAを治療するための方法は、手術、滑膜切除術、腱修復手術、関節癒合手術、関節置換手術および肥満外科手術を実施するための工程を含み得る。
RAを治療するための方法は、治療的身体プログラム、および/または食事の改変もしくは制限を実施するための工程を含み得る。
RAを治療するための方法は、治療に対する対象の応答を監視するための工程を含み得る。
CVDの治療には、限定されないが、抗凝固剤、抗血小板剤、血栓溶解剤、抗血栓剤、抗不整脈剤、再分極を延長する薬剤、降圧性薬剤、血管拡張剤、降圧剤、利尿剤、変力剤、抗狭心症剤などが含まれ得る。
抗凝固剤の例としては、アセノクマロール、アンクロッド、アニシンジオン、ブロミンジオン、クロリンジオン、クメタロール、シクロクマロール、デキストラン硫酸ナトリウム、ジクマロール、ジフェナジオン、エチルビスクマアセテート、エチリデンジクマロール、フルインジオン、ヘパリン、ヒルジン、リアポラートナトリウム、オキサジジオン、ポリ硫酸ペントサン、フェニンジオン、フェンプロクモン、ホスビチン、ピコタミド、チオクロマロールおよびワルファリンが挙げられる。
抗血小板剤の例としては、アスピリン、デキストラン、ジピリダモール(ペルサンチン)、ヘパリン、スルフィンピラノン(アンツーラン)、クロピドロゲルおよびチクロピジン(ticlid)が挙げられる。
血栓溶解剤の例としては、組織プラミノゲン活性化因子(アクチバーゼ)、プラスミン、プロウロキナーゼ、ウロキナーゼ(アボキナーゼ)ストレプトキナーゼ(streptase)、アニストレプラーゼ/APSAC(eminase)が挙げられる。
特定の対象に適した追加の治療薬または薬物を特定するために、対象からの試験試料を治療薬または薬物に曝露することもでき、1つまたは複数のバイオマーカーのレベルを決定することができる。1つまたは複数のバイオマーカーのレベルは、治療または治療剤もしくは薬物への曝露の前後の対象から得られた試料と比較することができ、またはそのような治療または曝露の結果として炎症性疾患の状態または活動性(例えば、臨床パラメータまたは従来の実験室リスク因子)の改善を示した、1人または複数の対象から得られた試料と比較することができる。
本明細書で使用される「投与する」という用語は、限定されないが、所望の効果が生じるように、所望の部位での組成物の少なくとも部分的な局在化をもたらす方法または経路による対象への組成物の配置を含む。投与経路には、局所投与および全身投与の両方が含まれる。一般に、局所投与は、対象の全身よりも特定の位置へのより多くの組成物送達をもたらすが、全身投与は、本質的に対象の全身への送達をもたらす。「投与すること」はまた、マッサージ、理学療法などを含む、対象の身体に対する身体的行為を実施することを含む。
さらなる態様では、本発明は、炎症性疾患を有する患者における心血管疾患の特定のリスクを評価するための方法を企図する。炎症性疾患はRAであり得る。RAであり得かつ心血管疾患(CVD)のリスクのあり得る炎症性疾患を有する対象に特定の治療を推奨するためのさらなる方法が開示される。さらなる方法は、炎症性疾患を有しかつ心血管疾患(CVD)のリスクのある対象であって治療から恩恵を受ける特定の対象を特定することを含む。本開示は、炎症性疾患を有しかつ心血管疾患(CVD)の治療を必要とする対象におけるCVDを治療するための特定の方法を含む。さらなる方法は、炎症性疾患を有する対象であってCVDを有するリスクのある対象の、治療に対する特定の応答を監視することを含む。さらなる方法は、炎症性疾患を有する対象であってCVDを有するリスクのある対象を予後判定することを含む。
本発明の方法は、RA患者におけるCVD事象リスクを予測するための効率的かつ正確な方法を含むことができる。方法は、関連するCVDリスクを含む、RAの疾患活動性および複雑性を反映するバイオマーカーおよび他の因子の使用によって全身性炎症を評価する工程を含むことができる。本明細書に開示される方法は、RAのポイントオブケアに効率的に導入することができ、治療に包含される患者の集団を拡大することができる。
本発明の態様は、対象のCVDリスク値を決定することによって、炎症性疾患を有する対象におけるCVDのリスクを評価することを企図する。
CVDリスク値ならびにその基礎となるVECTRA-CVDスコアは、バイオマーカーレベルをアッセイすること、およびRA患者の臨床患者データを収集することによって決定することができる。バイオマーカーレベルは、解釈関数の適用によって臨床データと組み合わせて、CVDリスク値、ならびにその基礎となるVECTRA-CVDスコアを導出することができるスコアを提供する。
いくつかの局面では、CVDリスク値は、VECTRA-CVDスコアを使用して決定することができる。VECTRA-CVDスコアは、臨床パラメータ、ならびにレプチン、TNFRI、およびMMP3バイオマーカーのそれぞれの追加の調整条件と組み合わせることができる調整VECTRAスコアに基づいて決定することができる。調整VECTRAスコアは、特定の臨床変数、およびレプチンバイオマーカーの追加の調整条件とともに、いくつかのVECTRAバイオマーカーを利用するMBDAスコアに基づいて決定することができる。
いくつかの局面では、炎症性疾患を有する対象におけるリスクの定量的尺度は、対象からの試料中の2つ以上のVECTRAバイオマーカーのレベルを決定し、次に解釈関数を適用して、バイオマーカーレベルをMBDAスコアに変換することによって測定することができる。MBDAスコアは、特定の臨床変数、およびレプチンバイオマーカーの追加の調整条件を使用して調整され、調整VECTRAスコアを得ることができる。調整VECTRAスコアは、臨床パラメータ、ならびにレプチン、TNFRI、およびMMP3バイオマーカーのそれぞれの追加の調整条件と組み合わせて、全体的なVECTRA-CVDスコアを提供することができる。対象のCVDリスク値は、VECTRA-CVDスコアから導出することができる。
CVDリスク値ならびにその基礎となるVECTRA-CVDスコアは、トレーニング段階において決定することができ、RA患者の臨床患者データを使用した検証段階が続く。
広範囲の候補変数を評価して、CVDリスク値の決定に使用することができる。トレーニングおよび/または検証段階は、CVDリスク値の決定に使用される最終変数を広範囲の候補変数の中から決定することができる。
トレーニング段階では、RA患者の臨床患者データを使用した一変量および二変量解析を介して解釈関数を適用して、CVDリスク値およびその基礎となるVECTRA-CVDスコアと、RA患者の臨床転帰との関連を提供することができる。
検証段階では、RA患者の臨床患者データを使用した一変量および二変量解析を介して解釈関数を適用して、CVDリスク値およびその基礎となるVECTRA-CVDスコアの検証をRA患者の臨床転帰に関して提供することができる。CVDリスク値の検証で、CVDリスク値、ならびにその基礎となるVECTRA-CVDスコアの精度を確認することができる。
トレーニング段階および/または検証段階では、解釈関数の使用または適用により、使用される最終変数を決定することができる。解釈関数は、使用される最終変数を候補変数のセットから選択することができる。解釈関数は、選択された変数の各々に適用される重みを選択することができる。
特定の局面では、本明細書に記載のように導出されたMBDAスコアは、専門家によって選択された値のセットに基づいて変えることができる。例えば、値に0~100の範囲を指定できるように、かつ2つのスコアの差が少なくとも1ポイントの値になるようにスコアを設定することができる。専門家は、次に患者データとの関連を確立することによって、値に基づいてリスクを割り当てることができる。
本明細書で使用される場合、「試料」という用語は、対象から単離され得る生物学的試料を指すことができる。試料は、限定されないが、単一細胞または複数の細胞、細胞の断片、体液のアリコート、全血、血小板、血清、血漿、赤血球、白血球(white blood cell)または白血球(leucocyte)、内皮細胞、組織生検、滑液、リンパ液、腹水、および間質液または細胞外液を含むことができる。「試料」という用語はまた、滑液、歯肉溝滲出液、骨髄、脳脊髄液(CSF)、唾液、粘膜、痰、精液、汗、尿、または任意の他の体液を含む、細胞間の空間中の流体を包含する。「血液試料」という用語は、全血、または血球、赤血球、白血球(white blood cell)または白血球(leucocyte)、血小板、血清および血漿を含むその任意の画分を指すことができる。試料は、これらに限定されないが、静脈穿刺、排泄、射精、マッサージ、生検、針吸引、洗浄、掻き取り、外科的切開、または介入、または当技術分野で知られている他の手段を含む手段によって対象から得ることができる。
本明細書で使用される場合、「対象」という用語は、例えばヒトまたは哺乳動物であり得る。「患者」という用語は、対象であり得るヒト患者を指すことができる。本明細書で使用される「哺乳動物」という用語は、ヒト、非ヒト霊長類、イヌ、ネコ、マウス、ラット、ウシ、ウマ、およびブタを含むが、これらに限定されない。ヒト以外の哺乳動物を、炎症の動物モデルを表す対象として有利に使用することができる。対象は、男性であっても女性であってもよい。対象は、炎症性疾患を有すると以前に診断または特定された者であり得る。対象は、炎症性疾患の治療的介入を既に受けたことがあるか、または受けている者であり得る。対象はまた、炎症性疾患を有すると以前に診断されたことがない者であり得る。例えば、対象は、炎症状態の1つまたは複数の症状もしくはリスク因子を示す者、または炎症状態の症状もしくはリスク因子を示さない対象、または炎症性疾患に対して無症候性の可能性がある対象であり得る。
本明細書で使用される場合、「解釈関数」という用語は、患者のリスクおよび/または転帰を評価するための予測方法を提供し得る1つまたは複数の生物統計学的ツールを指すことができる。生物統計学的ツールは、患者の臨床データおよび/またはバイオマーカーデータを利用して、患者の転帰とリスク値との有意な関連を反映する正確なリスクアルゴリズムを特定または導出することができる。
生物統計学的ツールは、参照群からの臨床データおよび/またはバイオマーカーデータに基づいて患者の疾患リスクを正確に予測するリスクアルゴリズムを生成することができる。
参照群は、疾患の活動性を有する患者を含み得る。特定の態様では、参照群は、疾患の活動性を有さない患者を含み得る。
さらなる態様では、参照群は、疾患の活動性を有する患者、疾患の活動性を有さない患者、および疾患と診断されていない患者を含み得る。
特定の態様では、参照群は、疾患の活動性について試験された患者を含み得る。
さらなる態様では、参照群は、関節リウマチ(RA)の活動性について試験された患者を含み得る。試験は、定期的な試験として、臨床研究試験として、遺伝子試験として、またはMBDA試験として実施された可能性がある。
さらなる態様では、参照群は、関節リウマチ(RA)および/または心血管疾患(CVD)の活動性について試験された患者を含み得る。試験は、定期的な試験として、臨床研究試験として、遺伝子試験として、またはMBDA試験として実施された可能性がある。
特定の態様では、参照群は、メディケア患者であり得る。
ある特定の態様では、参照群は、ヘルスケアデータベースの患者であり得る。
解釈関数は、予測臨床方法を計算および検証するために当技術分野で既知であり得る。
さらなる態様では、参照群は、臨床トレーニングデータおよび/または臨床検証データであり得る。
本明細書で使用される場合、「スコア」という用語は、変数の定量的尺度もしくは対象の状態の特性を提供するように、および/または対象の状態を識別、区別、もしくは他の方法で特徴付けるように選択された値または値のセットを指すことができる。スコアを含む値は、例えば、対象から、または臨床パラメータから、または臨床評価から、またはそれらの任意の組み合わせから得られた1つまたは複数の試料成分の測定量につながる定量的データに基づくことができる。特定の態様では、スコアは、単一の構成要素、パラメータまたは評価から導出することができるが、他の態様では、スコアは、複数の構成要素、パラメータおよび/または評価から導出することができる。スコアは、解釈関数を使用して決定することができる。「スコアの変化」は、例えば、ある時点から次の時点までのスコアの絶対的な変化、またはスコアのパーセント変化、または単位時間当たりのスコアの変化(例えば、スコア変化の速度)を指すことができる。
本明細書で使用される場合、「データセット」という用語は、所望の条件下での試料(または試料の集団)の評価から得られる数値のセットを指すことができる。データセットの値は、例えば、試料から測定値を実験的に取得し、これらの測定値からデータセットを構築することによって;または代わりとして、実験室などのサービスプロバイダから、またはデータセットが保存されているデータベースもしくはサーバからデータセットを取得することによって取得することができる。
本明細書で使用される場合、「差」という用語は、増加または減少を指すことができる。
本明細書で使用される場合、「統計的に有意」という用語は、偶然のみによって生じると予想されるものよりも大きい、観察された変化を指すことができる。統計的有意性は、当技術分野で知られている様々な方法のいずれかによって決定することができる。一般的に使用される統計的有意性の尺度の例は、p値である。結果は、0.05以下のp値、またはいくつかの態様では0.01以下のp値で統計的に有意である(偶然ではない)と見なされ得る。一般に、p値は、結果を得る確率の尺度であり得、p値は、同様の状況で得られる場合の異なる結果について比較することができる。
本発明の方法は、「マルチバイオマーカー疾患活動性スコア」(MBDAスコア)の使用を企図する。本明細書で使用される場合、MBDAスコアは、様々なバイオマーカーを使用して、対象の炎症性疾患活動性または炎症性疾患の状態の定量的尺度を提供することができる。本教示に従って解釈関数を使用して、バイオマーカーを使用してMBDAスコアを導出することができる。2つ以上のバイオマーカーは、単独で、または本明細書に記載の臨床パラメータおよび/または臨床評価と組み合わせて使用することができる。いくつかの態様では、MBDAスコアは、自己免疫疾患活動性の定量的尺度であり得る。特定の態様では、MBDAスコアは、RA疾患活動性の定量的尺度であり得る。
MBDAスコアの導出に有用であり得るバイオマーカーとしては、レプチン(LEP)、腫瘍壊死因子受容体スーパーファミリー,メンバー1A(TNFRSF1A発現TNFR1)、マトリックスメタロペプチダーゼ3(ストロメリシン1、プロゼラチナーゼ)(MMP3)、C反応性タンパク質,ペントラキシン関連(CRP)、インターロイキン6(インターフェロン、ベータ2)(IL6)、血清アミロイドA1(SAA1)、キチナーゼ3様1(軟骨糖タンパク質-39)(CHI3L1)、上皮成長因子(ベータ-ウロガストロン)(EGF)、血管細胞接着分子1(VCAM1)、マトリックスメタロペプチダーゼ1(間質性コラゲナーゼ)(MMP1)、レジスチン(RETN)、および血管内皮成長因子A(VEGFA)を挙げることができるが、これらに限定されない。
MBDAスコアは、12の血清タンパク質バイオマーカーを定量化して、関節リウマチ(RA)を有する成人患者の疾患活動性を評価する臨床的に検証されたツールであり得る。Curtis JR,et al.,Arthritis Care Res.2012,Vol.64,pp.1794-803を参照のこと。12のMBDA血清タンパク質バイオマーカーは、レプチン、TNFR1、MMP-3、CRP、IL-6、SAA、YKL-40、EGF、VCAM-1、MMP-1、レジスチン、およびVEGF-Aであり得る。
MBDAスコア「MDBA 1.0」と呼ばれる量は、参照によりその全体が本明細書に組み込まれる米国特許第9,200,324号に記載されている。「MBDA 2.0」または「調整MBDA」は、参照によりその全体が本明細書に組み込まれる、Curtis et al.、Rheumatology、Vol.58(5)、May 2019、pp.874-883に記載されている。ここで本発明者らは、式I:
によって示されるCurtis et al.の「レプチン調整MBDA」スコアであるような「調整MBDA」スコアに言及する。式中、性別は、患者が男性の場合は1、女性の場合は0に等しい。調整MBDAスコアは、最も近い整数に丸められる。MBDAおよび調整MBDAスコアは、1~100の範囲である。
本開示の調整MBDAスコアは、レプチン、TNFR1、MMP-3、CRP、IL6、SAA、YKL40、EGF、VCAM1、MMP1、レジスチン、およびVEGFAを含むがこれらに限定されないセットのうち3つ以上のバイオマーカーからのバイオマーカーデータを含み得る。
本明細書で使用される場合、遺伝子の名称、例えばTNFRSF1Aは、発現されたタンパク質マーカー、TNFR1、ならびにmRNAも指す。
いくつかの態様では、本発明は、対象からの試料中のバイオマーカーレベルを測定して、臨床データとともに調整MBDAスコアと組み合わせるLEP、TNFR1、およびMMP3のタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFR1、MMP3の、ならびにCRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される1つまたは複数のさらなるタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、CVDリスクを決定するために年齢、喫煙、糖尿病、高血圧症、および/またはCVDの病歴を含む臨床データと組み合わせることができる、LEP、TNFR1、およびMMP3のタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、CVDリスクを決定するために年齢、喫煙、糖尿病、高血圧症、および/またはCVDの病歴を含む臨床データと組み合わせることができる、LEP、TNFR1、MMP3の、ならびにCRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される1つまたは複数のさらなるタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
いくつかの態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される1つまたは複数のタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される少なくとも2つのタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される少なくとも3つのタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
いくつかの態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される少なくとも4つのタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
さらなる態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される少なくとも5つのタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
特定の態様では、本発明は、対象からの試料においてバイオマーカーを測定して、LEP、TNFRSF1A、MMP3、CRP、IL6、SAA1、CHI3L1、EGF、VCAM1、MMP1、RETNおよびVEGFAを含むセットから選択される少なくとも6つのタンパク質マーカーのタンパク質レベルデータを生成する方法を含む。
バイオマーカーの上記のセットのいずれも、CVDリスクを決定するために、年齢、喫煙、糖尿病、高血圧症および/またはCVDの病歴を含む臨床データと組み合わせることができる。
一般に、心筋梗塞(MI)を含むハードエンドポイントを研究するRAにおける集団ベースの研究は、RAの有病率が比較的低いために困難であり得、転帰事象率が統計的検定力を制限する。いくつかの態様では、健康保険および保険者からの管理データが、RA患者の大規模なコホートを研究するための高い有効性を有し得る。これらのデータソースは、RAの臨床評価を欠くことが多いが、RA疾患活動性を測定する実験室試験の結果は、請求データを増強できる客観的な測定値を提供し得る。
本明細書で使用される場合、「性能」という用語は、例えば、モデル、アルゴリズム、または診断もしくは予後検査の品質および全体的な有用性を指すことができる。モデルまたは試験性能において考慮される要因には、試験の臨床的および分析的精度、使用特性、例えば試薬および様々な構成要素の安定、モデルまたは試験の使いやすさ、健康または経済的価値、ならびに試験の様々な試薬および構成要素の相対的コストが含まれるが、これらに限定されない。実施するとは、機能を実行する行為を意味し得る。
本明細書で使用される場合、「集団」という用語は、指定された同様の特徴を持った対象のグループ化を指すことができる。グループ化は、例えば、限定されないが、臨床パラメータ、臨床評価、治療レジメン、疾患状態(例えば、罹患または健康)、疾患活動性のレベル、およびCVDリスクのレベルに従うことができる。集団間のリスクの比較においてMBDAスコアを使用する状況では、例えば、長期研究の特定の時点において、集団の対象の観察されたMBDAスコアに基づいて集計値を決定することができる。集計値は、例えば、個々のデータポイント(例えば、平均値、中央値、平均値の中央値)の収集から意味のある集計値に到達するために有用であり、当技術分野で知られている任意の数式または統計式に基づくことができる。
本明細書で使用される場合、「予測モデル」という用語は、統計的アルゴリズムまたはデータセットを分類するためのアルゴリズムを使用して開発された数学的構造であり得る、「多変量モデル」または「モデル」を指すことができる。本明細書で使用される場合、「予測する」という用語は、そのデータポイントを生成するために通常またはそれ以外で必要とされる臨床診断手順を実際に実行することなく、データポイントの値を生成することを指すことができる。モデリングの文脈で使用される場合、「予測する」は、特定の転帰を予測するモデルの検定力を指すだけであると理解されるべきではない。予測モデルは、解釈関数を含むことができる。例えば、予測モデルは、1つまたは複数の統計ツールまたは方法論を利用して、観察されたデータのデータセットを、対象の疾患状態に関連するリスクスコアの予測に変換することによって作成することができる。
本明細書で使用される場合、「予後」という用語は、疾患の起こり得る転帰に関する予測を指すことができる。予後推定は、例えば、対象の適切な治療レジメンを決定するのに有用である。
本明細書で使用される場合、「推奨する」という用語は、対象に治療レジメンを推奨すること、特定の治療レジメンを除外する(すなわち、推奨しない)ことを指すことができる。そのような推奨は、他の情報とともに、臨床医が個々の対象に特定の治療レジメンを適用するための基礎として役立ち得る。
いくつかの態様では、解釈関数は、様々な生物統計学的ツールの1つまたは複数を使用することができる。いくつかの生物統計学的ツールおよび方法論が当技術分野で知られている。
生物統計学的ツールの例は、特に、生存回帰分析、Cox比例ハザード、Box-Cox変換、クラスタリング機械学習、階層的クラスタリング分析、セントロイドクラスタリング、分布クラスタリング、密度クラスタリング、クラスターデータマイニング、分散分析(ANOVA)、アダブースティング、分類および回帰木(CART)、ブーステッドCART、ランダムフォレスト(RF)、再帰分割木(RPART)、カードアンドホエイ(CW)、カードアンドホエイ-Lasso、主成分分析(PCA)、因子回転分析、線形判別分析(LDA)、Eigengene線形判別分析(ELDA)、二次判別分析、判別関数分析(DFA)、隠れマルコフモデル、カーネル密度推定、カーネル部分最小二乗アルゴリズム、カーネルマッチング追跡アルゴリズム、カーネルフィッシャーの判別分析アルゴリズム、カーネル主成分分析アルゴリズム;線形回帰、段階的回帰、変数増減段階的回帰、Lasso縮小選択法、Elastic Net正則化および選択、LassoおよびElastic Net正則化一般化線形モデル、ロジスティック回帰(LogReg)、K近傍法(KNN)、非線形回帰、分類、ニューラルネットワーク、部分最小二乗、規則に基づく分類、縮小セントロイド(SC)、層別逆回帰、製品モデルデータ交換規格アプリケーション翻案構成体(StepAIC)、スーパー主成分(SPC)回帰、サポートベクターマシン(SVM)、および再帰的サポートベクターマシン(RSVM)、ならびにそれらの組み合わせを含む。
さらに、当技術分野で知られているクラスタリングアルゴリズムは、対象のサブグループを決定するのに有用であり得る。クラスタリングアルゴリズムの例には、クラスタリング機械学習、階層的クラスタリング分析、セントロイドクラスタリング、分布クラスタリング、密度クラスタリング、クラスターデータマイニング、およびそれらの組み合わせが含まれる。
生物統計学的ツールの例には、二分応答変数、例えば、治療1と治療2に使用することができるロジスティック回帰が含まれる。ロジスティック回帰は、データ変数の線形局面および非線形局面の両方に使用することができ、解釈可能なオッズ比を提供する。
生物統計学的ツールの例には、分析物のセットを変数(ルート)として使用して2つ以上の自然発生群を区別することができる、判別関数分析(DFA)が含まれる。DFAを使用して、群間で大幅に異なる分析物を試験することができる。前進ステップワイズDFAを使用して、調査した群間を最大限に区別する分析物のセットを選択することができる。具体的には、各工程で全ての変数を見直して、どれが最大限に群間を区別するかを決定することができる。この情報は次に、群のメンバーシップの予測のための分析物濃度の線形結合からなる式であり得る、ルートを表示された判別関数に含まれてもよい。最終式の判別可能性は、各群について得られたルート値の線プロットとして観察することができる。このアプローチは、濃度レベルの変化を使用してプロファイルを描写し、治療有効性を診断および評価することができる分析物の群を特定することができる。DFAモデルはまた、新しい対象を「健康」または「罹患」のいずれかに分類することができる任意のスコアを作成することができる。医学界でのこのスコアの使用を容易にするために、0の値が健康な個人を示し、0より大きいスコアがリスクの増加を示すようにスコアを再スケールすることができる。
生物統計学的ツールの例には、分類および回帰木(CART)が含まれ、データの論理分割(if/then)を実行して決定木を作成することができる。所与のノードに入る全ての観測値は、そのノードでの最も一般的な転帰に従って分類することができる。CART結果は、分類が帰着するまで一連のif/then木分岐を辿ることによって解釈され得る。
生物統計学的ツールの例には、サポートベクターマシン(SVM)が含まれ、対象を2つ以上のクラスに分類することができる。クラスの例には、治療選択肢のセット、診断選択肢のセット、または予後選択肢のセットが含まれる。各対象は、各対象の正しいクラス割り当てが知られ得るトレーニングデータセットの対象との類似性(または隔たり)に基づいてクラスに割り当てることができる。既知の対象と新しい対象との類似性の尺度は、潜在的に高次元の空間(>R6)内の領域を定義するサポートベクターを使用して決定され得る。
生物統計学的ツールの例には、ブートストラップ凝集または「バギング」のプロセスを含み得る、本発明で使用される方法が含まれる。最初の工程では、所与のデータセットを指定された回数(例えば、数千)ランダムにリサンプリングして、その数の新しいデータセットを効果的に提供することができる。これは、データの「ブートストラップリサンプル」と呼ばれ得、その各々をその後使用してモデルを構築することができる。その後、分類モデルの例では、最初の工程で作成された分類モデルの数によって、全ての新しい観測値のクラスを予測することができる。最終的なクラス決定は、分類モデルの「多数決」に基づき得る。すなわち、新しい観測値が所与のグループに分類された回数をカウントし、過半数の分類(3クラスシステムでは33%+)を取ることによって、最終的な分類呼び出し(classification call)を決定することができる。ロジスティック回帰モデルの例では、ロジスティック回帰が1000回バギングされる場合、1000個のロジスティックモデルが存在し、それぞれがクラス1または2に属する試料の確率を提供する。
生物統計学的ツールの例には、予測モデリング方法として最小二乗法(OLS)を使用するカードアンドホエイ(CW)を含み得る、本発明の方法が含まれる。L.Breiman and JH Friedman,J.Royal.Stat.Soc.B1997,59(1):3-54を参照されたい。この方法は、応答変数間の相関を利用して予測精度を、予測因子変数Xの共通セットに対して各応答変数の個々の回帰を実行する通常の手順と比較して改善することができる。CWでは、Y=XB*Sであり、式中、Y=(ykj)であり、kはk番目の患者、jはj番目の応答(TJCの場合はj=1、SJCの場合はj=2など)、BはOLSを使用して取得することができ、Sは正準座標系から計算された縮小マトリックスであり得る。別の方法は、組み合わせたカードアンドホエイおよびLasso(CW-Lasso)であってもよい。CWのようにOLSを使用してBを取得する代わりに、ここではLassoを使用することができ、Lassoアプローチに応じてパラメータを調整することができる。
生物統計学的ツールの例には、組み合わせて使用されても、または所与のサイズの全ての潜在的なパネルの完全な列挙のために使用されてもよいバイオマーカー選択技術(例えば、前進的選択法、後退的選択法、またはステップワイズ選択法など)、または遺伝的アルゴリズムが含まれ、またはそれら自体が、それらの独特の技術にバイオマーカー選択方法論を含むことができる。これらの技術は、情報量規準、例えば、赤池情報量規準(AIC)、ベイズ情報量規準(BIC)、または交差検証と組み合わせて、追加のバイオマーカーの包含とモデル改善との間のトレードオフを定量化し、過剰適合を最小限に抑えることができる。得られた予測モデルは、他の研究で検証することができ、または例えばLeave-One-Out(LOO)および10分割交差検証(10-Fold CV)などの技術を使用して、元々訓練されている研究で交差検証することができる。
一例として、解釈関数は、上記の1つまたは複数の生物統計学的ツールを使用して導出されたMBDAスコアを提供することができ、これは、バイオマーカー1(BM1)~5(BM5)を参照して、式IIによって表すことができる:
既知の臨床評価(例えばDAS28スコア)によって得られたRA対象のMBDAスコアを次にそれらの既知の評価と比較して、2つの評価間の相関レベルを決定することができ、よってMBDAスコアおよびその基礎となる予測モデルの精度を決定することができる。
一例として、本発明の方法の1つまたは複数の工程は、以下の1つまたは複数の工程によって導出され得る:対象のバイオマーカーデータを取得する工程、バイオマーカー結果と組み合わせるための臨床パラメータを選択する工程、臨床パラメータと組み合わせるための追加のバイオマーカー条件を選択する工程、解釈関数を使用して、対象のリスクスコアを臨床トレーニングデータとともに1つまたは複数のバイオマーカーおよび1つまたは複数の臨床条件から計算する工程、1つまたは複数の生物統計学的ツールを使用して、対象のリスクスコアアルゴリズムを、臨床トレーニングデータとともにバイオマーカーおよび1つまたは複数の臨床条件から計算および導出する工程、解釈関数を使用して、臨床検証データとともにバイオマーカーおよび1つまたは複数の臨床条件から対象のリスクスコアを計算する工程、1つまたは複数の生物統計学的ツールを使用して、臨床検証データとともにバイオマーカーおよび1つまたは複数の臨床条件から対象のリスクスコアアルゴリズムを計算および導出する工程、ならびに/またはリスクスコアアルゴリズムを、それを必要とする対象からの臨床および/もしくはバイオマーカーデータに適用する工程。
一例として、本発明の方法の1つまたは複数の工程は、炎症性疾患を有する患者の心血管疾患の特定のリスクを評価するためにリスクスコアを使用すること、炎症性疾患を有する対象に対する特定の治療を推奨するためにリスクスコアを使用すること、炎症性疾患を有しかつ心血管疾患(CVD)のリスクのある対象であって治療から恩恵を受ける特定の対象を特定するためにリスクスコアを使用すること、炎症性疾患を有しかつ心血管疾患(CVD)の治療を必要とする対象におけるCVDを治療するためにリスクスコアを使用すること、炎症性疾患を有する対象であってCVDを有するリスクのある対象の、治療に対する特定の応答を監視するためにリスクスコアを使用すること、および炎症性疾患を有する対象であってCVDを有するリスクのある対象を予後判定するためにリスクスコアを使用することであり得る。
本教示のいくつかの態様では、MBDAスコアが対象のリスクの定量的尺度を提供するために、MBDAスコアを任意の所定の「参照」、「正常」、「対照」、「標準」、「健康」、「疾患前」または他の同様の指標と比較する必要はない可能性がある。
本教示のさらなる態様では、バイオマーカーの量は試料中で測定され得、MBDAスコアを導出するために使用され得、そのMBDAスコアは、その後、CVDリスクのカットオフポイントおよび/または異常値を定義するために、例えば、参照または識別限界またはリスク定義閾値などの技術を利用して、「正常」または「対照」レベルまたは値と比較することができる。正常レベルは、この場合、評価中の炎症性疾患に罹患していない対象に典型的に見られる1つまたは複数のバイオマーカー、または組み合わせたバイオマーカー指数のレベルであり得る。「正常」または「対照」の他の用語は、例えば、「参照」、「指標」、「ベースライン」、「標準」、「健康」および「疾患前」である。そのような正常レベルは、スコアを出力するためにバイオマーカーを単独で使用するか、または他のバイオマーカーと組み合わせた式で使用するかに基づいて変動し得る。あるいは、正常レベルは、臨床的に関連する期間にわたって評価中の炎症性疾患に変換しなかった、以前に試験された対象からのバイオマーカーパターンのデータベースであり得る。参照(正常、対照)値はまた、例えば、リスクが知られている対照の対象または集団から導出され得る。
本教示のいくつかの態様では、参照値は、疾患の治療に曝露された1人または複数の対象から、またはリスクの低い1人または複数の対象から、または治療への曝露の結果として改善を示した対象から導出され得る。いくつかの態様では、参照値は、治療に曝露されていない1人以上の対象から導出され得る。例えば、試料を(a)最初の治療を受けた対象および(b)その後の治療を受けた対象から収集して、治療の進行を監視することができる。参照値は、リスクアルゴリズムまたは集団研究から計算された指標から導出することもできる。
本明細書で使用される「正常」、「対照」、および「健康」という用語は、一般に、特定の疾患または障害を有さない、診断されていない/されたことがない、または無症候性である対象または個人を指すことができる。この用語は、そのような対象または個人から得られた試料を指すこともできる。分析または比較中の疾患または障害は、対象がその状況において「対照」であるかどうかを決定するものであり得る。例えば、特定の血清マーカーのレベルが、RAを有することが知られているが、CVDであると診断されておらず、CVDについて無症候性である個人から得られる場合、その対象は「RA対象」であり得る。このようにしてRA対象から得られたマーカーのレベルは、RAと診断されているが、一般的なCVDを有さず、CVD進行者ではないことが知られている対象、すなわち、「正常対象」からの同じマーカーのレベルと比較することができる。したがって、この例における「正常」とは、RA状態ではなく、対象のCVD状態を指す。
本明細書で使用される場合、「精度」という用語は、測定値または計算値がその実際の値に一致する程度を指すことができる。臨床試験では、「精度」は、実際の結果(真陽性または真陰性、対象は疾患を有する、または健康/正常としてそれぞれ正しく分類された)の、誤って分類された結果(偽陽性または偽陰性、対象は疾患を有する、または健康/正常として誤って分類される)に対する割合に関連し得る。
本明細書で使用される場合、「感度」、「特異度」、「陽性的中率(PPV)」、「AUC」、「陰性的中率(NPV)」、「尤度」、および「オッズ比」という用語は、医学的精度を反映し得る数学的特徴を指すことができる。本開示の文脈における「分析精度」は、測定プロセスの再現性および予測可能性を指すことができる。分析精度は、例えば変動係数(CV)などの測定値、ならびに異なる時間における、または異なる評価者、ユーザ、機器、および/もしくは試薬による同じ試料または対照の一致および較正の試験において集約され得る。例えば、R.Vasan,Circulation 2006,113(19):2335-2362を参照されたい。
いくつかの態様では、MBDA試験は、様々なRA療法で治療された血清陽性および血清陰性の患者からなる複数のRAコホートにおいて、DAS28に対して検証された12のバイオマーカーのパネルであり得る。
MBDAに含まれるバイオマーカーは、RAの生物学を反映することができ、サイトカイン、急性期反応物、成長因子、マトリックスメタロプロテイナーゼ、およびアディポカインを含み得る。
12のバイオマーカーは、公開されているアルゴリズム(Vectra 2.0)に従って線形結合として重み付けされ得、1~100のスケールで単一のスコアを生成する。
臨床的解釈のために、この数値スコアを、低、中および高疾患活動性の、または低、境界、中および高のRA疾患活動性カテゴリーにマッピングすることができる。
全体的なMBDAスコアおよびその構成要素である12のバイオマーカーの両方に加えて、様々な臨床パラメータを、CVDリスクとの予想される関連に基づいて予測モデルに含めることができる。
CVDリスクの候補パラメータには、年齢、性別、人種、糖尿病の診断および薬物治療、高血圧症、高脂血症、タバコの使用、MIまたは脳卒中以外の心血管疾患、例えばMIを伴わない狭心症または急性冠動脈症候群の病歴、心房細動、末梢血管疾患、メトトレキサートなどの特定のRA薬、他の従来の合成疾患修飾性抗リウマチ薬、生物製剤、ヤヌスキナーゼ阻害剤、グルココルチコイド、および非ステロイド性抗炎症薬の使用が含まれ得る。
さらなる局面では、本発明は、CVDリスクを特定、アッセイ、決定および予測するための様々な方法を提供する。正確な最終治療予後の開発には、いくつかの段階の開発、スクリーニング、および/または中間的な結論を描くことが必要となり得る。
いくつかの局面では、正確な最終治療予後または予測モデルの開発は、トレーニングデータセットを使用した特徴選択およびモデル構築を含み得る。
いくつかの態様では、モデル構築は、個別予後または診断のための多変量予測モデルの明白な報告(Transparent Reporting of a multivariable prediction model for Individual Prognosis or Diagnosis(TRIPOD))ガイドラインに従って行われる選択を含み得る。
さらなる態様では、コホートは、2:1で別々のトレーニングおよび試験データセットにランダムに分割され得る。特徴選択およびモデル構築は、トレーニングデータに対して実行することができる。
さらなる態様では、候補特徴を記述的に特性決定することができる。
特徴の特性決定では、連続的な予測因子について平均(SD)を計算することができ、カテゴリー予測因子についてパーセンテージを計算することができ、これにより、CVD事象を有するか否かによって患者を層別化することができる。
さらなる局面では、VECTRA-CVDスコアは、双曲線正接関数を含むことができる。双曲線正接変換のパラメータは、最尤推定に基づいて選択され得る。双曲線正接変換のパラメータは、モデル構築の各工程で更新され得る。
さらなる局面では、0.05のアルファ値を有する変数減少法を最初に使用して、特徴をスクリーニングすることができる。特徴は、一変量解析の結果との関連に基づいて優先順位付けされ得る。
いくつかの態様では、最終モデルは、その性能をトレーニングデータのみを使用して開発されたモデルと比較して調べることによって、選択することができる。モデルの識別、較正、節約、および日常的な臨床ケア設定で必要な共変量収集の予想される実現可能性を含む、いくつかの要因を最終モデルの選択に使用することができる。
特定の態様では、統計分析は、様々なリスク群へのリスクのカテゴリー化によって実行することができる。
例えば、いくつかの態様では、患者は、3年でのCVDの予測リスクによって3つのリスク群にグループ化することができる。
特定の局面では、CVDリスクスコアとして使用するための独自のアルゴリズムを開発することができる。
いくつかの態様では、CVDリスクスコアを得るための方法は、VECTRA-CVDスコアを計算するための工程を有し得る。
例えば、VECTRA-CVDスコアは、式IIIに従って計算することができる:
式中、調整MBDAは、MBDAスコアを臨床パラメータの年齢および性別と組み合わせ、さらに追加のLEP調整条件と組み合わせる、上記のバイオマーカー/臨床スコアである。係数C1~C9は、本明細書に記載の多段階統計モデル開発および分析解釈関数によって決定することができる。
「喫煙」では、患者が喫煙者として指定されている場合、喫煙は1であり、そうでない場合は0である。
「糖尿病」では、患者が糖尿病である場合は1、そうでない場合は0。
「高血圧」では、患者が高血圧である場合は1、そうでない場合は0。
「CVDの病歴」では、患者がCVDの病歴を有する場合は1、そうでない場合は0。
特定の態様では、VECTRA-CVDスコアの計算において、レプチン、TNFR1およびMMP3は、ng/mLで測定されるこれらのバイオマーカーの血清濃度を指すが、MBDA 2.0からの調整MBDAスコアの計算では、レプチン濃度はpg/mLで測定される。
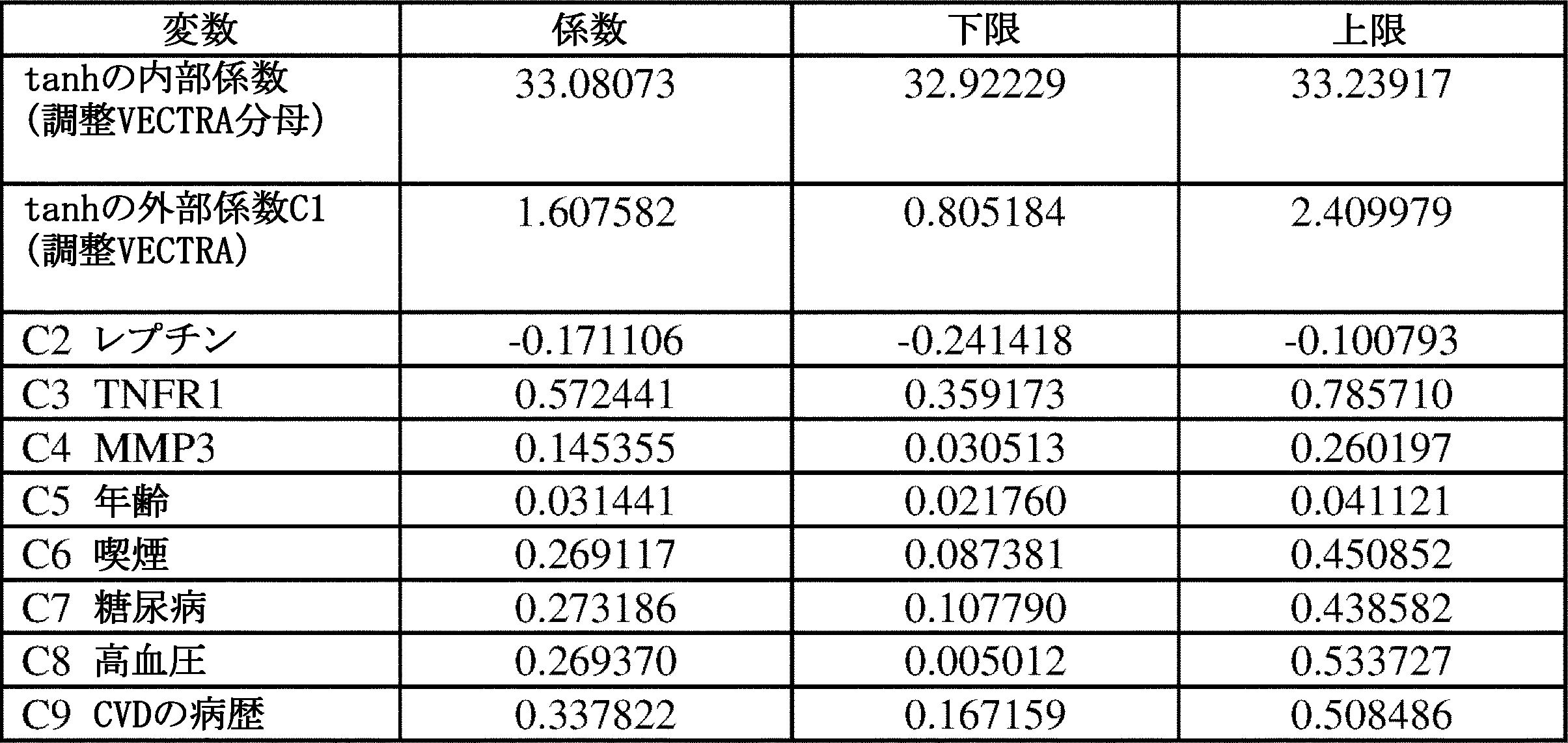
いくつかの態様では、VECTRA CVDスコアの係数C1~C9は、表1に示す範囲であり得る。
いくつかの態様では、tanhの内部係数(調整VECTRA分母)は、32.92229~33.23917、好ましくは33.08073±0.16の範囲であり得る。
いくつかの態様では、tanhの内部係数(調整VECTRA分母)は、32.9223~33.2392、好ましくは33.0807±0.15の範囲であり得る。
いくつかの態様では、tanhの内部係数(調整VECTRA分母)は、32.922~33.239、好ましくは33.081±0.15の範囲であり得る。
いくつかの態様では、tanhの内部係数(調整VECTRA分母)は、32.92~33.24、好ましくは33.08±0.15の範囲であり得る。
いくつかの態様では、tanhの内部係数(調整VECTRA分母)は、32.9~33.2、好ましくは33.1±0.2の範囲であり得る。
いくつかの態様では、C1は、0.80、または0.90、または1.00、または1.10、または1.20、または1.30、または1.40、または1.50、または1.60、または1.70、または1.80、または1.90、または2.00、または2.10、または2.20、または2.30、または2.41であり得る。
いくつかの態様では、C1は、0.805184~2.409979、好ましくは1.607582±0.8の範囲であり得る。
いくつかの態様では、C1は、1.61±0.80、または1.607±0.802、または1.6076±0.8024であり得る。
いくつかの態様では、C1は、0.8~2.4、好ましくは1.6±0.8であり得る。
いくつかの態様では、C1は、0.80~2.41、好ましくは1.61±0.8であり得る。
いくつかの態様では、C1は、0.805~2.410、好ましくは1.607±0.8であり得る。
いくつかの態様では、C1は、0.8052~2.4100、好ましくは1.6076±0.8であり得る。
いくつかの態様では、C2は、-0.10、または-0.11、または-0.12、または-0.13、または-0.14、または-0.15、または-0.16、または-0.17、または-0.18、または-0.19、または-0.20、または-0.21、または-0.22、または-0.23、または-0.24であり得る。
いくつかの態様では、C2は、-0.17±0.07、または-0.171±0.070、または
-0.1711±0.0703であり得る。
いくつかの態様では、C2は、-0.24~-0.10、好ましくは-0.17±0.07であり得る。
いくつかの態様では、C2は、-0.241~-0.101、好ましくは-0.171±0.07であり得る。
いくつかの態様では、C2は、-0.2414~-0.1008、好ましくは-0.1711±0.07であり得る。
いくつかの態様では、C3は、0.36~0.78、または0.359~0.786、または0.3592~0.7857であり得る。
いくつかの態様では、C3は、0.57±0.21、または0.572±0.213、または0.5724±0.2133であり得る。
いくつかの態様では、C3は、0.36~0.78、好ましくは0.57±0.2であり得る。
いくつかの態様では、C3は、0.359~0.786、好ましくは0.572±0.2であり得る。
いくつかの態様では、C3は、0.3592~0.7857、好ましくは0.5724±0.2であり得る。
いくつかの態様では、C4は、0.03~0.26、または0.030~0.260、または0.0304~0.2602であり得る。
いくつかの態様では、C4は、0.14±0.11、または0.145±0.115、または0.1453±0.1148であり得る。
いくつかの態様では、C4は、0.03~0.26、好ましくは0.14±0.1であり得る。
いくつかの態様では、C4は、0.030~0.260、好ましくは0.145±0.1であり得る。
いくつかの態様では、C4は、0.0305~0.2602、好ましくは0.1453±0.1であり得る。
いくつかの態様では、C5は、0.02~0.04、または0.021~0.041、または0.0218~0.0411であり得る。
いくつかの態様では、C5は、0.03±0.01、または0.031±0.010、または0.0314±0.0097であり得る。
いくつかの態様では、C5は、0.02~0.04、好ましくは0.03±0.01であり得る。
いくつかの態様では、C5は、0.022~0.041、好ましくは0.031±0.01であり得る。
いくつかの態様では、C5は、0.0218~0.0411、好ましくは0.0314±0.01であり得る。
いくつかの態様では、C6は、0.08~0.45、または0.087~0.451、または0.0874~0.4508であり得る。
いくつかの態様では、C6は、0.26±0.18、または0.269±0.182、または0.2691±0.1817であり得る。
いくつかの態様では、C6は、0.08~0.45、好ましくは0.26±0.2であり得る。
いくつかの態様では、C6は、0.087~0.451、好ましくは0.269±0.2であり得る。
いくつかの態様では、C6は、0.0874~0.4508、好ましくは0.2691±0.2であり得る。
いくつかの態様では、C7は、0.10~0.44、または0.108~0.438、または0.1078~0.4386であり得る。
いくつかの態様では、C7は、0.27±0.16、または0.273±0.165、または0.2732±0.1654であり得る。
いくつかの態様では、C7は、0.11~0.44、好ましくは0.27±0.2であり得る。
いくつかの態様では、C7は、0.108~0.438、好ましくは0.273±0.2であり得る。
いくつかの態様では、C7は、0.1078~0.4386、好ましくは0.2732±0.2であり得る。
いくつかの態様では、C8は、0.01~0.53、または0.005~0.534、または0.0050~0.5337であり得る。
いくつかの態様では、C8は、0.27±0.26、または0.269±0.264、または0.2694±0.2643であり得る。
いくつかの態様では、C8は、0.005~0.53、好ましくは0.27±0.3であり得る。
いくつかの態様では、C8は、0.005~0.533、好ましくは0.269±0.3であり得る。
いくつかの態様では、C8は、0.0050~0.5337、好ましくは0.2694±0.3であり得る。
いくつかの態様では、C9は、0.17~0.51、または0.167~0.508、または0.1671~0.5084であり得る。
いくつかの態様では、C9は、0.34±0.17、または0.338±0.167、または0.3378±0.1671であり得る。
いくつかの態様では、C9は、0.17~0.51、好ましくは0.34±0.2であり得る。
いくつかの態様では、C9は、0.167~0.508、好ましくは0.338±0.2であり得る。
いくつかの態様では、C9は、0.1671~0.5085、好ましくは0.3378±0.2であり得る。
特定の態様では、個々のマーカー条件が欠損している場合にVECTRA CVDリスクスコアを計算するために、欠損している条件をトレーニングデータセットから得られた平均値で置き換えることができる。例えば、「喫煙」データが利用できない場合、「+C6×喫煙」という用語は、トレーニングデータセットから得られた平均値に置き換えることができる。
いくつかの態様では、RA患者の最終的なVECTRA-CVDスコアは、式IVに従って計算することができる:
さらなる態様では、VECTRA-CVDスコアは、式Vに従って計算することができる:
いくつかの態様では、CVDリスクスコア予測因子試験のアルゴリズムは、VECTRA-CVDスコアをパーセントリスクに変換する工程を有し得る。
さらなる態様では、式VIを使用して、VECTRA-CVDスコアをパーセントリスクCVDリスクスコアに変換することができる:
式中、Aは、VECTRA-CVDスコアが0であれば3年以内にCVD事象が発生しない確率であるベースラインリスクを反映し、Bは、トレーニングデータセットに適用される較正定数である。
解釈関数は、バイオマーカースコアの双曲線正接または指数関数を含むCVDスコアのアルゴリズムを提供することができる。解釈関数は、VECTRA-CVDスコアであるCVDスコアのアルゴリズムを提供することができる。
解釈関数の例は、式VIを含む。
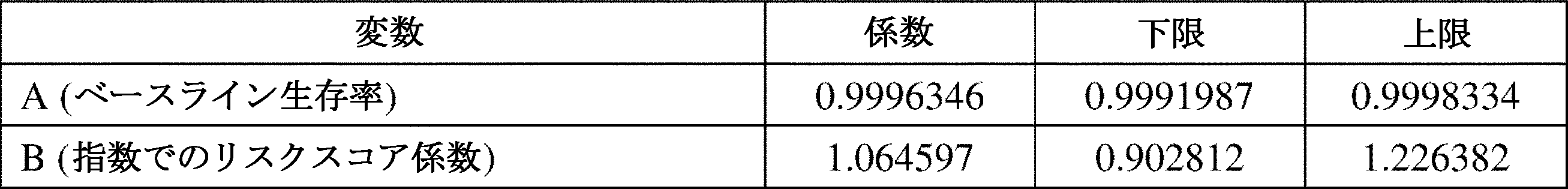
ベースライン生存率は、VECTRA-CVDスコアが唯一の予測因子であるCox比例ハザード回帰モデルからの検証データセットで推定される。
例えば、特定の態様では、ベースライン生存率であり、VECTRA-CVDスコアが0の場合に3年以内にCVD事象が起こらない確率であるAは、0.9996であり、係数を推定したトレーニングから、リスクを推定した検証への調整であるBは、1.0646である。
さらなる態様では、ベースライン生存率であり、VECTRA-CVDスコアが0の場合に3年以内にCVD事象が起こらない確率であるAは、0.99963462142575399であり、係数を推定したトレーニングから、リスクを推定した検証への調整であるBは、1.064597である。
さらなる態様では、VECTRA-CVDスコアから計算されたパーセントリスクでの数量AおよびBの範囲を表2に示す。
(表2)VECTRA CVDスコアから計算されたパーセントリスクでの数量AおよびBの範囲
さらなる態様では、ln(-ln(A))スケールでのAの値は、-8.699876~-7.128912の範囲で、-7.914394であり得る。
いくつかの態様では、Aは、または0.9992~0.9998、または0.99920~0.99983、または0.999198~0.999833、または0.9991987~0.9998334であり得る。
いくつかの態様では、Aは、0.9996±0.0003、または0.99963±0.0003、または0.999635±0.0003、または0.9996346±0.0003であり得る。
いくつかの態様では、Aは、0.9992~0.9998、好ましくは0.9996±0.0003であり得る。
いくつかの態様では、Aは、0.99920~0.99983、好ましくは0.99963±0.0003であり得る。
いくつかの態様では、Aは、0.999199~0.999833、好ましくは0.999635±0.0003であり得る。
いくつかの態様では、Aは0.9991987~0.9998334、好ましくは0.9996346±0.0003であり得る。
いくつかの態様では、Bは、0.90~1.23、または0.903~1.226、または0.9028~1.2264、または0.90281~1.22638、または0.902812~1.226382であり得る。
いくつかの態様では、Bは、1.06±0.16、または1.064±0.162、または1.0646±0.1618、または1.06460±0.16178、または1.064597±0.161785であり得る。
いくつかの態様では、Bは0.90~1.23、好ましくは1.06±0.2であり得る。
いくつかの態様では、Bは0.903~1.226、好ましくは1.064±0.2であり得る。
いくつかの態様では、Bは0.9028~1.2264、好ましくは1.0646±0.2であり得る。
例えば、調整VECTRAスコア46、年齢70、レプチン濃度3.7 ng/mL、MMP3濃度21 ng/mL、TNFR1濃度2.8 ng/mL、非糖尿病、喫煙者であり、高血圧、およびCVDの病歴を有する例示的な患者について、CVDリスクスコアを式VIIに示す:
この例示的な患者のCVD 3年リスク%としてのパーセントリスクを式VIIIに示す:
本発明の態様は、本開示のCVD期間リスク%値の予測能力を臨床的に検証することによってRAにおけるCVDリスクを評価および治療するための方法をさらに企図する。RA患者の生存率を使用して、本発明の予測CVD期間リスク%値について3つまたは4つのCVDリスク群閾値を検証することができる。
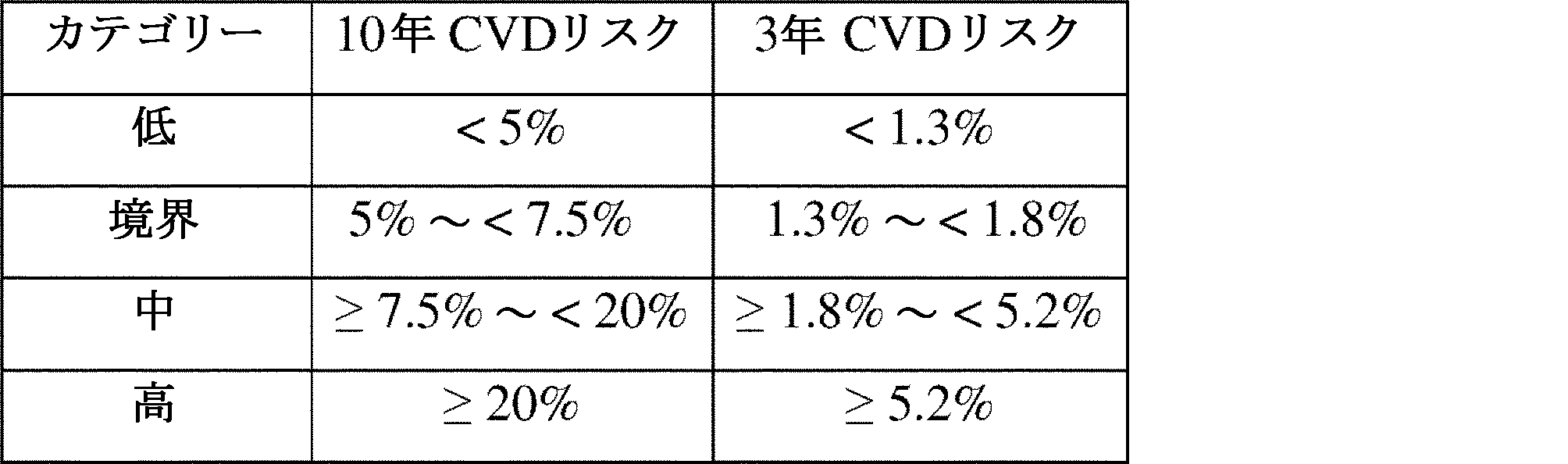
いくつかの態様では、閾値は、低、中、および高CVDリスクであり得る。さらなる態様では、閾値は、低、境界、中、および高CVDリスクであり得る。
さらなる局面では、CVD期間リスク%値の予測能力を臨床的に検証することによってRAにおけるCVDリスクを評価および治療するための方法は、広範囲にわたるリスク期間を含むことができる。特定の態様では、CVD期間リスク%の期間は、1~20年であり得る。特定の態様では、CVD期間リスク%は、CVD 1年リスク%、またはCVD 2年リスク%、またはCVD 3年リスク%、またはCVD 4年リスク%、またはCVD 5年リスク%、またはCVD 6年リスク%、またはCVD 7年リスク%、またはCVD 8年リスク%、またはCVD 9年リスク%、またはCVD 10年リスク%であり得る。特定の態様では、CVD期間リスク%の期間は、例えば、時間、日、月、または年に基づく任意の期間であり得る。
本明細書に開示される方法は、治療に包含される患者の集団を拡大することができる。いくつかの態様では、本発明は、驚くほど改善された精度を有するCVD 3年リスク%値を提供し、これにより、患者を予想よりも高いリスクを有するとして再分類することができる。別の方法では治療されなかったであろう再分類された患者が、治療を受けることができる。治療に包含される患者の集団は、RAにおけるCVDのリスクを正確に評価する本発明の方法によって拡大することができる。患者の集団に適用されるCVDまたはRAの治療の種類は、RAにおけるCVDのリスクを正確に評価する本発明の方法で患者リスクが再分類されるので、変更することができる。
いくつかの態様では、本発明のCVD 3年リスク%の閾値となり得るリスクカテゴリーは、患者の臨床転帰における実際の発生率から検証することができる。
さらなる態様では、本発明のCVDリスク%の閾値となり得るリスクカテゴリーは、心血管疾患の一次予防に関する2019年のACC/AHAガイドラインを考慮に入れることができる。
特定の態様では、本発明のCVDリスク%の閾値となり得るリスクカテゴリーは、5%(±0.1%)、7.5%(±0.1%)、および20%(±0.1%)リスクの10年ACC/AHA閾値を考慮に入れることができる。閾値は、累積リスクに基づいて選択することができる。
閾値は、低リスク、境界リスク、中リスク、および高リスクとして説明することができる。特定の態様では、低リスクと境界リスクとを組み合わせることができる。
いくつかの態様では、本発明のCVD 3年リスク%は、RAにおけるCVDリスクに基づいて患者を再分類するために使用することができる。
3年の時間枠の例では、カテゴリー化のために閾値を選択することができる。
特定の態様では、閾値は、低リスク(累積リスク0~1.8%未満)、中リスク(1.8~5.2%未満)、および高リスク(5.2%以上)であり得る。
特定の態様では、閾値は、7.5%(+-0.1%)および20%(+-0.1%)リスクの10年ACC/AHA閾値に対応し得る。
追加の態様では、閾値は、表3~5のいずれか1つのように選択することができる。
本教示の1つまたは複数のバイオマーカーの量は、値として示すことができる。値は、試料の評価から生じる1つまたは複数の数値であり得、例えば、実験室で行われるアッセイによって試料中の1つまたは複数のバイオマーカーのレベルを測定することによって、または実験室などのプロバイダから得られたデータセットから、またはサーバに保管されたデータセットから導出され得る。バイオマーカーレベルは、当技術分野で知られているいくつかの技術のいずれかを使用して測定することができる。本教示は、そのような技術を包含し、バイオマーカーを測定するための全ての対象の絶食および/または時間ベースの試料採取手順をさらに含む。
本開示の文脈における「バイオマーカー(単数)」、「バイオマーカー(複数)」、「マーカー(単数)」または「マーカー(複数)」は、限定されないが、サイトカイン、ケモカイン、成長因子、タンパク質、ペプチド、核酸、オリゴヌクレオチド、および代謝産物、ならびにそれらの関連する代謝産物、突然変異体、アイソフォーム、バリアント、多型体、修飾、断片、サブユニット、分解産物、要素、および他の分析物、または試料から導出された測定値を包含する。バイオマーカーはまた、変異タンパク質、変異核酸、コピー数の変動および/または転写バリアントを含み得る。バイオマーカーはまた、健康状態の非血液媒介因子および非分析物生理学的マーカー、および/または試料(例えば、体液などの生物学的試料)から測定されない他の因子もしくはマーカー、例えば臨床パラメータおよび臨床評価のための従来の因子などを包含する。バイオマーカーはまた、数学的に計算および/または作成された任意の指標を含むことができる。バイオマーカーはまた、時間的傾向および差を含む、前述の測定値のいずれか1つまたは複数の組み合わせを含むことができる。本教示の特定の態様のバイオマーカーがタンパク質である場合、本明細書で使用される遺伝子略号および名称は、これらの遺伝子のタンパク質産物を指すと理解されるべきであり、これらの遺伝子のタンパク質産物は、これらの遺伝子の任意のタンパク質アイソフォームを、そのようなアイソフォーム配列が本明細書に具体的に記載されているか否かにかかわらず含むことが意図される。バイオマーカーが核酸である場合、本明細書で使用される遺伝子略号および名称は、これらの遺伝子の核酸(DNAまたはRNA)を指すものであり、これらの遺伝子の核酸は、これらの遺伝子の任意の転写バリアントを、そのような転写バリアントが本明細書に具体的に記載されているか否かにかかわらず含むことが意図される。
本教示における「サイトカイン」という用語は、細胞間でシグナルを伝達し、よって他の細胞に影響を及ぼす免疫系のものであり得る特定の細胞によって分泌される任意の物質を指す。「サイトカイン」という用語は、「成長因子」を包含する。「ケモカイン」もサイトカインである。それらは、細胞において走化性を誘発することができるサイトカインのサブセットである。したがって、それらは「走化性サイトカイン」としても知られている。
本開示の文脈における「測定する」または「測定」ならびに「検出する」または「検出」は、臨床または対象由来の試料中の物質の存在、不存在、量、含量もしくは有効量(そのような物質の濃度レベルを含む)を決定すること、または対象の臨床パラメータの値もしくはカテゴリー化を評価することを指す。
本明細書で使用される「マルチプレックスアッセイ」は、アッセイの1回の実行またはサイクルで複数の分析物、例えばタンパク質分析物を同時に測定するアッセイを指す。
本教示で使用される「定量的データセット」または「定量的データ」は、例えば、対象試料中の複数のバイオマーカー(すなわち、2つ以上)の発現の検出および複合測定から得られるデータを指す。定量的データセットを使用して、疾患状態の特定、監視および治療のためのスコアを生成し、対象の生物学的状態を特徴付けることができる。目的の疾患状態または生理学的状態によって、異なるバイオマーカーを検出することが可能である。
本開示の文脈における「分析物」という用語は、測定される任意の物質を意味することができ、バイオマーカー、マーカー、核酸、電解質、代謝産物、タンパク質、糖、炭水化物、脂肪、脂質、サイトカイン、ケモカイン、成長因子、タンパク質、ペプチド、核酸、オリゴヌクレオチド、代謝産物、突然変異体、バリアント、多型体、修飾、断片、サブユニット、分解産物および他の要素を包含することができる。簡潔にするために、標準的なタンパク質略号を使用するのではなく、標準的な遺伝子略号を全体を通して使用して、遺伝子だけでなく遺伝子産物/タンパク質に言及してもよい。例えば、本明細書で使用されるAPOA1は、遺伝子APOA1およびタンパク質ApoAIを指すことができる。一般に、本明細書の分析物および略号は、ハイフンが省略されている(IL-6=IL6)。
「分析する」ことは、試料中の分析物レベルの測定によって試料に関連する値または値のセットを決定することを含む。「分析する」は、そのレベルを、参照レベルを含む、同じ対象または別の対象からの試料または試料セット中の成分レベルと比較することをさらに含み得る。本教示のバイオマーカーは、当技術分野の様々な方法のいずれかによって分析することができる。いくつかのそのような方法には、血清タンパク質または糖または代謝産物または他の分析物レベルの測定、酵素活性の測定、および遺伝子発現の測定が含まれるが、これらに限定されない。いくつかの技術には、イムノアッセイ、質量分析などが含まれる。本明細書で使用される「イムノアッセイ」は、1つまたは複数の抗体を使用して生物学的試料中の分析物またはバイオマーカーの存在または濃度を測定する生化学的アッセイを指す。
バイオマーカーのレベルの実際の測定は、当技術分野で知られている任意の方法を使用して、タンパク質または核酸レベルで決定することができる。「タンパク質」検出は、全長タンパク質、成熟タンパク質、プレタンパク質、ポリペプチド、アイソフォーム、突然変異体、バリアント、翻訳後修飾タンパク質およびそのバリアントの検出を含み、任意の適切な方法で検出することができる。バイオマーカーのレベルは、タンパク質レベルで、例えば、本明細書に記載の遺伝子産物によってコードされるペプチドの血清レベルを測定することによって、またはこれらのタンパク質バイオマーカーの酵素活性を測定することによって決定することができる。そのような方法は当技術分野で周知であり、例えば、遺伝子、アプタマーまたは分子インプリントによってコードされるタンパク質への抗体に基づくイムノアッセイを含む。タンパク質またはその活性の検出/定量化のために、任意の生物学的材料を使用することができる。あるいは、適切な方法を選択して、分析される各タンパク質の活性によってバイオマーカー遺伝子にコードされるタンパク質の活性を決定することができる。酵素活性を有することが知られているバイオマーカータンパク質、ポリペプチド、アイソフォーム、突然変異体、およびそれらのバリアントについて、当技術分野で知られている酵素アッセイを使用して、活性をインビトロで決定することができる。そのようなアッセイには、とりわけ、プロテアーゼアッセイ、キナーゼアッセイ、ホスファターゼアッセイ、レダクターゼアッセイが含まれるが、これらに限定されない。酵素活性の動態の調節は、ヒルプロット、ミカエリス-メンテン式、ラインウィーバー-バーク解析などの線形回帰プロット、およびスキャッチャードプロットなどの既知のアルゴリズムを使用して、速度定数KMを測定することによって決定することができる。
「抗体」という用語は、必要な選択性によって別のものに可逆的に結合する、任意の免疫グロブリン様分子を指す。したがって、この用語は、本教示のバイオマーカーに選択的に結合することができる任意のそのような分子を含む。この用語は、抗原上に存在するエピトープに結合することができる免疫グロブリン分子を含む。この用語は、例えばモノクローナル抗体およびポリクローナル抗体などの完全な免疫グロブリン分子だけでなく、抗体アイソタイプ、組換え抗体、二重特異性抗体、ヒト化抗体、キメラ抗体、抗特発性(抗ID)抗体、一本鎖抗体、Fab断片、F(ab’)断片、融合タンパク質抗体断片、免疫グロブリン断片、Fv断片、一本鎖Fv断片、および免疫グロブリン配列を含むキメラ、ならびに必要な選択性の抗原認識部位を含む前述の任意の修飾も包含することを意図する。
バイオマーカーの公開データベースエントリによって提供される配列情報を使用して、当業者に周知の技術を使用してバイオマーカーの発現を検出および測定することができる。例えば、バイオマーカーの核酸に対応する配列データベース内の核酸配列を使用して、バイオマーカー核酸を検出および/または測定するためのプライマーおよびプローブを構築することができる。これらのプローブは、例えば、ノーザンもしくはサザンブロットハイブリダイゼーション分析、リボヌクレアーゼ保護アッセイ、および/または特定の核酸配列を定量的に増幅する方法において使用することができる。別の例として、配列データベースからの配列を使用して、例えば、逆転写ベースのポリメラーゼ連鎖反応(RT-PCR)およびPCRなどの増幅ベースの検出および定量化方法で、バイオマーカー配列を特異的に増幅するためのプライマーを構築することができる。遺伝子発現の変化が遺伝子増幅、ヌクレオチド欠失、多型体、翻訳後修飾および/または突然変異体に関連する場合、試験集団および参照集団における配列比較は、試験集団および参照集団の検査されたDNA配列の相対量を比較することによって行うことができる。
一例として、これらの配列の1つまたは複数を特異的に認識するプローブを使用するノーザンハイブリダイゼーション分析を使用して、遺伝子発現を決定することができる。あるいは、発現はRT-PCRを用いて測定することができる。例えば、差次的に発現されたバイオマーカーmRNA配列に特異的なポリヌクレオチドプライマーは、mRNAをDNAに逆転写し、それは次にPCRで増幅され、可視化および定量化することができる。バイオマーカーRNAは、例えば、TMA、SDA、およびNASBAなどの他の標的増幅法、またはシグナル増幅法(例えば、bDNA)などを用いて定量化することもできる。リボヌクレアーゼ保護アッセイもまた、1つまたは複数のバイオマーカーmRNA配列を特異的に認識するプローブを使用して、遺伝子発現を決定するために使用することができる。
あるいは、バイオマーカータンパク質および核酸代謝産物を測定することができる。「代謝産物」という用語は、代謝プロセスの任意の化学的または生化学的生成物、例えば生物学的分子(例えば、タンパク質、核酸、炭水化物、または脂質)のプロセシング、切断または消費によって生成される任意の化合物を含む。代謝産物は、屈折率分光法(RI)、紫外分光法(UV)、蛍光分析、放射化学分析、近赤外分光法(近IR)、核磁気共鳴分光法(NMR)、光散乱分析(LS)、質量分析、熱分解質量分析、比濁分析、分散ラマン分光法、質量分析と組み合わせたガスクロマトグラフィー、質量分析と組み合わせた液体クロマトグラフィー、質量分析と組み合わせたマトリックス支援レーザー脱離イオン化飛行時間型(MALDI-TOF)、質量分析と組み合わせたイオンスプレー分光法、キャピラリー電気泳動、NMRおよびIR検出を含む、当業者に知られている様々な方法で検出することができる。例えば、国際公開第04/056456号および国際公開第04/088309号を参照されたい。これらの各々は、参照によりその全体が本明細書に組み込まれている。これに関して、他のバイオマーカー分析物は、上述の検出方法、または当業者に知られている他の方法を使用して測定することができる。例えば、循環カルシウムイオン(Ca2+)は、とりわけFluoシリーズ、Fura-2A、Rhod-2などの蛍光色素を使用して試料中で検出することができる。他のバイオマーカー代謝産物は、そのような代謝産物を検出するために特別に設計または調整された試薬を使用して同様に検出することができる。
いくつかの態様では、バイオマーカーは、対象試料を試薬と接触させ、試薬と分析物との複合体を生成し、複合体を検出することによって検出される。「試薬」の例には、核酸プライマーおよび抗体が含まれるが、これらに限定されない。
本教示のいくつかの態様では、抗体結合アッセイを使用してバイオマーカーを検出する。例えば、対象からの試料を、バイオマーカー分析物を結合する抗体試薬と接触させ、抗体試薬および分析物を含む反応生成物(または複合体)を生成し、複合体の存在(または非存在)または量を決定する。バイオマーカー分析物を検出するのに有用な抗体試薬は、上記で詳細に論じたように、モノクローナル、ポリクローナル、キメラ、組換え体、または前述の断片であり得、反応生成物を検出する工程は、任意の適切なイムノアッセイで実施することができる。対象からの試料は、典型的には、上記のような生体液であり、上記の方法を実施するために使用されるものと同じ生体液の試料であり得る。
本教示に従って実行されるイムノアッセイは、均一アッセイまたは不均一アッセイであり得る。本教示に従って実行されるイムノアッセイは、多重化することができる。均一アッセイでは、免疫学的反応は、特異的抗体(例えば、抗バイオマーカータンパク質抗体)、標識された分析物、および目的の試料を含み得る。標識はシグナルを生成し、標識から生じるシグナルは、標識された分析物が抗体に結合すると直接的または間接的に修飾される。結合の免疫学的反応、および結合の程度の検出の両方を均一な溶液中で実行することができる。使用され得る免疫化学標識には、フリーラジカル、放射性同位体、蛍光色素、酵素、バクテリオファージ、および補酵素が含まれるが、これらに限定されない。イムノアッセイには、競合アッセイが含まれる。
不均一アッセイアプローチでは、試薬は、目的の試料、抗体、および検出可能なシグナルを生成するための試薬であり得る。上記のような試料を使用することができる。抗体は、ビーズ(プロテインAおよびプロテインGアガロースビーズなど)、プレートまたはスライドなどの支持体上に固定化され、液相中にバイオマーカーを含有すると疑われる試料と接触させることができる。支持体は液相から分離され、支持体相または液相のいずれかが、当技術分野で知られているシグナルを検出するための方法を使用して検査される。シグナルは、試料中の分析物の存在に関連する。検出可能なシグナルを生成するための方法には、放射性標識、蛍光標識または酵素標識の使用が含まれるが、これらに限定されない。例えば、検出される抗原が第2の結合部位を含む場合、その部位に結合する抗体は、検出可能な(シグナル生成)基にコンジュゲートされ、分離工程の前に液相反応溶液に添加され得る。固体支持体上の検出可能な基の存在は、試験試料中のバイオマーカーの存在を示す。適切なイムノアッセイの例としては、オリゴヌクレオチド、イムノブロッティング、免疫沈降、免疫蛍光法、化学ルミネセンス法、電気化学ルミネセンス(ECL)、および/または酵素結合イムノアッセイ(ELISA)が挙げられるが、これらに限定されない。
当業者は、本明細書に開示される方法を実施するのに有用であり得る、多数の特定のイムノアッセイ様式およびその変形に精通しているであろう。例えば、E.Maggio,Enzyme-Immunoassay(1980)、CRC Press,Inc.,Boca Raton,FLを参照されたい。「Novel Methods for Modulating Ligand-Receptor Interactions and their Application」と題された、C.Skold et al.による米国特許第4,727,022号;「Immunoassay of Antigens」と題された、GC Forrest et al.による米国特許第4,659,678号;「Immunometric Assays Using Monoclonal Antibodies」と題された、GS David et al.による米国特許第4,376,110号;「Macromolecular Environment Control in Specific Receptor Assays」と題された、D.Litman et al.による米国特許第4,275,149号;「Reagents and Method Employing Channeling」と題された、E.Maggio et al.による米国特許第4,233,402号;および「Heterogenous Specific Binding Assay Employing a Coenzyme as Label」と題された、R.Boguslaski et al.の米国特許第4,230,797号も参照されたい。
抗体は、受動的結合などの既知の技術に従って、診断アッセイに適した固体支持体(例えば、プロテインAまたはプロテインGアガロースなどのビーズ、ラテックスまたはポリスチレンなどの材料から形成されたミクロスフェア、プレート、スライドまたはウェル)にコンジュゲートさせることができる。本明細書に記載される抗体は、同様に、既知の技術に従って、放射性標識(例えば、35S、125I、131I)、酵素標識(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ)、および蛍光標識(例えば、フルオレセイン、Alexa、緑色蛍光タンパク質、ローダミン)などの検出可能な標識または基にコンジュゲートすることができる。
抗体は、バイオマーカーの翻訳後修飾を検出するのにも有用であり得る。翻訳後修飾の例としては、チロシンリン酸化、トレオニンリン酸化、セリンリン酸化、シトルリン化およびグリコシル化(例えば、O-GlcNAc)が挙げられるが、これらに限定されない。そのような抗体は、目的の1つまたは複数のタンパク質中のリン酸化アミノ酸を特異的に検出し、本明細書に記載のイムノブロッティング、免疫蛍光、およびELISAアッセイに使用することができる。これらの抗体は当業者に周知であり、市販されている。翻訳後修飾は、リフレクターマトリックス支援レーザー脱離イオン化飛行時間型質量分析(MALDI-TOF)において、準安定イオンを使用して決定することもできる。U.Wirth et al.、Proteomics 2002,2(10):1445-1451を参照されたい。
本発明は、治療レジメンからの離脱、テーパリングまたは停止を含む、治療レジメンを推奨するための方法を提供することができる。治療レジメンを推奨するための方法は、本明細書に開示されるバイオマーカーの発現の差の決定に従うことができる。治療レジメンを推奨するための方法は、本発明のCVDリスクスコアの決定に基づくことができる。
本明細書に開示されるバイオマーカーの発現レベルから導出されるスコアを一定期間にわたって測定することにより、臨床医は、対照の生物学的状態の動的画像を得ることができる。したがって、本教示のこれらの態様は、治療決定に有益であり、治療応答の監視を容易にするであろう、対象特異的な生物学的情報を提供し、より迅速な最適化された治療、疾患のより優れた制御、および寛解を達成する対象の割合の増加につながるはずである。
「生物製剤」または「生物療法」または「バイオ医薬品」は、生物学的物質から製造または抽出された医薬療法製品であり得る。生物製剤は、ワクチン、血液または血液成分、アレルゲン性物質、体細胞、遺伝子治療、組織、組換えタンパク質、および生細胞を含み得、糖、タンパク質、核酸、生細胞もしくは組織、またはそれらの組み合わせから構成され得る。生物製剤薬物の例は、腫瘍壊死因子(TNF)-アルファ分子を標的とする生物学的薬剤およびTNF阻害剤、例えばインフリキシマブ、アダリムマブ、エタネルセプトおよびゴリムマブを含み得るが、これらに限定されない。他のクラスの生物製剤薬物には、アナキンラなどのIL1阻害剤、アバタセプトなどのT細胞モジュレーター、リツキシマブなどのB細胞モジュレーター、およびトシリズマブなどのIL6阻害剤が含まれる。
自己免疫障害を有する患者用のCVDの治療戦略は、RAなどのいくつかの自己免疫障害が、フレア(flare)するかまたは寛解に至る可能性がある、多様な一連の関連症状を有する対象の群に与えられる分類であり得るという事実によって混乱する。これは、RAの特定のサブタイプが特定の細胞型またはサイトカインによって駆動されることを示唆する。可能性のある結果として、単一の治療法が治療に最適であることは証明されていない。利用可能な治療選択肢の数が増加していることを考えると、治療転帰の免疫学的予後因子によって導かれる、個別に調整された治療の必要性が求められる可能性がある。
本明細書で使用される「フレア」という用語は、限定されないが、SJCの増加、TJCの増加、炎症の血清学的マーカー(例えば、CRPおよびESR)の増加、対象の機能(例えば、基本的な日常活動を行う能力)の低下、朝のこわばりの増加、および一般に治療的介入および潜在的には治療の強化につながる疼痛の増加を含む症状および臨床症状が、突然かつ重度を増して発症することを指し得る。
いくつかの態様では、治療からうまく離脱するかまたは治療を中止することができる、特にRA患者におけるCVDリスクの予測は、MBDAスコアに基づくことができる。いくつかの態様では、本明細書に記載されるベースラインでの高いMBDAスコアは、治療の中止後の一定期間内のリスクの独立した予測因子であり得る。いくつかの態様では、本明細書に記載されるベースラインでの中程度のMBDAスコアは、治療の中止後の一定期間内のリスクの独立した予測因子であり得る。いくつかの態様では、本明細書に記載されるベースラインでの低いMBDAスコアは、治療の中止後の一定期間内のリスク、または寛解の独立した予測因子であり得る。
本明細書に記載の「治療レジメン」、「療法」または「治療」は、生物学的、化学的、物理的、またはそれらの組み合わせを問わず、対象の状態を持続、回復、改善、さもなければ変化させることを意図した、対象の全ての臨床管理および介入を含む。これらの用語は、本明細書では同義的に使用され得る。治療には、限定されないが、予防薬または治療化合物(従来型DMARD、生物製剤DMARD、COX-2選択的阻害剤などの非ステロイド性抗炎症薬(NSAID)、およびコルチコステロイドを含む)の投与、運動レジメン、理学療法、食事の改変および/または補充、肥満外科的介入、医薬品および/または抗炎症薬(処方箋またはOTC)の投与、ならびに疾患の予防、発症の遅延または改善に有効であると当技術分野で既知の任意の他の治療が含まれる。「治療への応答」には、生物学的、化学的、物理的、または前述の組み合わせであるかを問わず、上記の治療のいずれかに対する対象の応答が含まれる。「治療過程」は、特定の治療または治療レジメンの投与量、期間、程度などに関する。本明細書で使用される初期治療レジメンは、治療のファーストラインであり得る。
DMARDは、従来型または生物製剤であり得る。一般に従来型であると考えられているDMARDの例には、MTX、アザチオプリン(AZA)、ブシラミン(BUC)、クロロキン(CQ)、シクロスポリン(ciclosporin)(CSA、またはシクロスポリン(cyclosporine)、またはシクロスポリン(cyclosporin))、ドキシサイクリン(DOXY)、ヒドロキシクロロキン(HCQ)、筋肉内金(IM金)、レフルノミド(LEF)、レボフロキサシン(LEV)、およびスルファサラジン(SSZ)が挙げられるが、これらに限定されない。他の従来型DMARDの例としては、フォリン酸、D-ペンシラミン、金オーラノフィン、金アウロチオグルコース、金チオマレート、シクロホスファミドおよびクロラムブシルが挙げられるが、これらに限定されない。生物製剤DMARD(生物製剤薬物)の例としては、腫瘍壊死因子(TNF)-アルファ分子を標的とする生物学的薬剤、例えばインフリキシマブ、アダリムマブ、エタネルセプトおよびゴリムマブを含み得るが、これらに限定されない。他のクラスの生物製剤DMARDには、アナキンラなどのIL1阻害剤、アバタセプトなどのT細胞モジュレーター、リツキシマブなどのB細胞モジュレーター、およびトシリズマブなどのIL6阻害剤が含まれる。
自己免疫障害を有する患者のCVDの治療戦略は、表6の薬物の1つまたは複数を含み得る。
本明細書で使用される「時点」は、時間を説明する方法を指し、それは、単一の点で実質的に説明することができる。時点は、検出可能な最小単位の時間範囲として説明することもできる。時点は、時間の局面の状態、または特定の期間を説明する方法を指すことができる。そのような時点または範囲は、例えば、秒、分から、時間、または日までの単位を含むことができる。
いくつかの態様では、試料中の1つまたは複数の分析物バイオマーカーのレベルまたは分析物バイオマーカーの特定のパネルのレベルは、治療の決定を指示するために参照標準(「参照標準」または「参照レベル」または「対照」)と比較される。1つまたは複数のバイオマーカーの発現レベルは、リスクを表すことができるスコアに組み合わせることができる。
本明細書に開示される任意の態様に使用される参照標準は、対照集団中の1つまたは複数の分析物バイオマーカーの平均値(average)、平均値(mean)、もしくは中央値レベル、または分析物バイオマーカーの特定のパネルのレベルを含み得る。
参照標準は、同じ対象についての以前の時点をさらに含み得る。例えば、参照標準は第1の時点を含むことができ、1つまたは複数の分析物バイオマーカーのレベルは、第2、第3、第4、第5、第6の時点などで再び検査することができる。特定の時点よりも前の任意の時点を参照標準と見なすことができる。
参照標準は、対照集団のカットオフ値もしくは任意の他の統計的属性、または同じ対象の以前の時点、例えば1つまたは複数の分析物バイオマーカーの平均レベルまたは分析物バイオマーカーの特定のパネルのレベルからの標準偏差をさらに含み得る。
いくつかの態様では、対照集団は、健康な個人または任意の治療の投与前の同じ対象を含み得る。
参照標準は、本開示の方法で使用される臨床トレーニングおよび/または検証データに本質的に反映され得る。
いくつかの態様では、参照時点からスコアを取得してもよく、後の時点から異なるスコアを取得してもよい。最初の時点は、初期治療レジメンが開始されるときであり得る。最初の時点は、最初のイムノアッセイが実施されるときでもあり得る。時点は、時間、日、月、年などであり得る。いくつかの態様では、時点は1ヶ月である。いくつかの態様では、時点は2ヶ月である。いくつかの態様では、時点は3ヶ月である。いくつかの態様では、時点は4ヶ月である。いくつかの態様では、時点は5ヶ月である。いくつかの態様では、時点は6ヶ月である。いくつかの態様では、時点は7ヶ月である。いくつかの態様では、時点は8ヶ月である。いくつかの態様では、時点は9ヶ月である。いくつかの態様では、時点は10ヶ月である。いくつかの態様では、時点は11ヶ月である。いくつかの態様では、時点は12ヶ月である。いくつかの態様では、時点は2年である。いくつかの態様では、時点は3年である。いくつかの態様では、時点は4年である。いくつかの態様では、時点は5年である。いくつかの態様では、時点は10年である。
スコアの差は、リスクの減少として解釈することができる。例えば、より低いスコアは、より低いリスクのレベルを示すことができる。このような状況では、参照スコアまたは第1のスコアよりも低いスコアを有する第2のスコアは、対象のリスクが最初の期間と2番目の期間との間で低下(改善)されたことを意味する。あるいは、より高いスコアは、より低いレベルのリスクを示すことができる。このような状況では、参照スコアまたは第1のスコアよりも高いスコアを有する第2のスコアも、対象のリスクが最初の期間と2番目の期間との間で改善されたことを意味する。
スコアの差は、リスクの増加と解釈することもできる。例えば、より低いスコアは、より高いリスクのレベルを示すことができる。このような状況では、参照スコアまたは第1のスコアよりも低いスコアを有する第2のスコアは、対象のリスクが最初の期間と2番目の期間との間で増加(悪化)されたことを意味する。あるいは、より高いスコアは、より高いレベルのリスクを示すことができる。このような状況では、参照スコアまたは第1のスコアよりも高いスコアを有する第2のスコアも、対象のリスクが最初の期間と2番目の期間との間で悪化したことを意味する。
差は変数であり得る。例えば、スコアの差がリスクの減少として解釈される場合、大きな差は、より低いまたは中程度の差よりもリスクの大きな減少を意味し得る。あるいは、スコアの差がリスクの増加として解釈される場合、大きな差は、より低いまたは中程度の差よりもリスクの大きな増加を意味し得る。
いくつかの態様では、患者は、スコアの差に基づいて、参照療法よりも積極的にまたは消極的に治療され得る。参照療法は、治療のためのケアの標準である任意の療法である。ケアの標準は、時間的および地理的に変化する可能性があり、当業者は、関連する医学文献を参照することによって適切なケアの標準を容易に決定することができる。
さらなる態様では、標準治療よりも積極的な治療は、標準治療よりも早く治療を開始することを含む。いくつかの態様では、標準治療よりも積極的な治療は、標準治療よりも追加された治療を施すことを含む。いくつかの態様では、標準治療よりも積極的な治療は、標準治療と比較して加速されたスケジュールで治療することを含む。いくつかの態様では、標準治療よりも積極的な治療は、標準治療では要求されない追加の治療を施すことを含む。
さらなる態様では、標準治療よりも消極的な治療は、標準治療と比較して治療を遅らせることを含む。いくつかの態様では、標準治療よりも消極的な治療は、標準治療よりも少ない治療を施すことを含む。いくつかの態様では、標準治療よりも消極的な治療は、標準治療と比較して減速されたスケジュールで治療を施すことを含む。いくつかの態様では、標準的な治療よりも消極的な治療は、治療を施さないことを含む。
いくつかの態様では、専門家は、スコアが低い場合、治療レジメンを中止してもよい。特定の態様では、専門家は、スコアが高い場合、治療レジメンを変更することはできない。
一態様では、専門家は、異なるスコア間の比較に基づいて、または初期予測スコアに基づいて治療を調整する。一態様では、専門家は、異なる薬物を選択して投与することによって治療を調整する。一態様では、専門家は、薬物の異なる組み合わせを選択して投与することによって治療を調整する。
一態様では、専門家は、薬物投与量を調整することによって治療を調整する。一態様では、専門家は、投与スケジュールを調整することによって治療を調整する。一態様では、専門家は、治療の期間を調整することによって治療を調整する。一態様では、専門家は、異なる薬物の組み合わせを選択して投与すること、および薬物投与量を調整することによって治療を調整する。
一態様では、専門家は、異なる薬物の組み合わせを選択して投与すること、および投与スケジュールを調整することによって治療を調整する。一態様では、専門家は、異なる薬物の組み合わせを選択して投与すること、および治療期間を調整することによって治療を調整する。一態様では、専門家は、薬物投与量および投与スケジュールを調整することによって治療を調整する。一態様では、専門家は、薬物投与量を調整すること、および治療期間を調整することによって治療を調整する。
一態様では、専門家は、投与スケジュールを調整すること、および治療期間を調整することによって治療を調整する。一態様では、専門家は、異なる薬物を選択して投与すること、薬物投与量を調整すること、および投与スケジュールを調整することによって治療を調整する。一態様では、専門家は、異なる薬物を選択して投与すること、薬物投与量を調整すること、および治療期間を調整することによって治療を調整する。
一態様では、専門家は、異なる薬物を選択して投与すること、投与スケジュールを調整すること、および治療期間を調整することによって治療を調整する。一態様では、専門家は、薬物投与量を調整すること、投与スケジュールを調整すること、および治療期間を調整することによって治療を調整する。一態様では、専門家は、異なる薬物を選択して投与すること、薬物投与量を調整すること、投与スケジュールを調整すること、および治療期間を調整することによって治療を調整する。
一態様では、より消極的な治療は、治療レジメンの変更を含まない。一態様では、より消極的な治療は、治療の遅延を含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与することを含む。一態様では、より消極的な治療は、治療の回数を減らすことを含む。一態様では、より消極的な治療は、治療期間を短縮することを含む。
一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、および薬物投与量を減らすことを含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、および投与スケジュールを減速することを含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、および治療期間を短縮することを含む。
一態様では、より消極的な治療は、薬物投与量を減らすこと、および投与スケジュールを減速することを含む。一態様では、より消極的な治療は、薬物投与量を減らすこと、および治療期間を短縮することを含む。一態様では、より消極的な治療は、投与スケジュールを減速すること、および治療期間を短縮することを含む。
一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、薬物投与量を減らすこと、および投与スケジュールを減速することを含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、薬物投与量を減らすこと、および治療期間を短縮することを含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、投与スケジュールを減速すること、および治療期間を短縮することを含む。一態様では、より消極的な治療は、薬物投与量を減らすこと、投与スケジュールを減速すること、および治療期間を短縮することを含む。一態様では、より消極的な治療は、効力の低い薬物を選択して投与すること、薬物投与量を減らすこと、投与スケジュールを減速すること、および治療期間を短縮することを含む。いくつかの態様では、より消極的な治療は、非薬物ベースの治療のみを投与することを含む。
本明細書の別の局面では、治療は、参照治療よりも積極的な治療を含む。一態様では、より積極的な治療は、治療期間を延長することを含む。一態様では、より積極的な治療は、治療回数を増やすことを含む。一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、および薬物投与量を増やすことを含む。
一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、および投与スケジュールを加速することを含む。一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、および治療期間を延長することを含む。一態様では、より積極的な治療は、薬物投与量を増やすこと、および投与スケジュールを加速することを含む。一態様では、より積極的な治療は、薬物投与量を増やすこと、および治療期間を延長することを含む。一態様では、より積極的な治療は、投与スケジュールを加速すること、および治療期間を延長することを含む。
一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、薬物投与量を増やすこと、および投与スケジュールを加速することを含む。一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、薬物投与量を増やすこと、および治療期間を延長することを含む。一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、投与スケジュールを加速すること、および治療期間を延長することを含む。一態様では、より積極的な治療は、薬物投与量を増やすこと、投与スケジュールを加速すること、および治療期間を延長することを含む。一態様では、より積極的な治療は、より強力な薬物を選択して投与すること、薬物投与量を増やすこと、投与スケジュールを加速すること、および治療期間を延長することを含む。いくつかの態様では、より積極的な療法は、薬物ベースの療法の組み合わせ、非薬物ベースの療法、または薬物ベースの療法のクラスの組み合わせを投与することを含む。
本開示のいくつかの態様では、MBDAスコアは、集団、エンドポイントまたは臨床評価、および/または意図される使用に合わせて調整される。例えば、MBDAスコアを使用して、一次予防および診断、ならびに二次予防および管理のために対象を評価することができる。一次評価では、MBDAスコアは、将来の状態または疾患の続発症の予測およびリスク層別化、炎症性疾患およびCVDリスクの診断、疾患活動性および変化率の予後、ならびに将来の診断および治療レジメンの指示に使用することができる。二次予防および臨床管理では、MBDAスコアを予後およびリスク層別化に使用することができる。MBDAスコアは、介入または治療を延期するどうか、リスクのある患者の予防的検査を推奨するかどうか、往診回数の増加を推奨するかどうか、検査の増加を推奨するかどうか、および介入を推奨するかどうかの決定などの臨床判断の支援に使用することができる。MBDAスコアはまた、治療法の選択、治療に対する応答の決定、治療の調整および投与、進行中の治療効率の監視、治療離脱の監視、および治療レジメンの変更の指示に有用であり得る。
本教示のいくつかの態様では、MBDAスコアを使用して、炎症性疾患の診断およびCVDリスクの予測、および炎症性疾患の重症度の決定を援助することができる。MBDAスコアはまた、例えばRAにおいて、介入の将来の状態を決定するため、例えば、治療有りもしくは無しでの将来の関節びらん、または治療有りもしくは無しでのCVDリスクの予後を決定するために使用することができる。本教示の特定の態様は、特定の治療または治療の組み合わせに合わせて調整することができる。
MBDAスコアを調整するために使用することができる臨床変数は、例えば、ジェンダー/性別、喫煙状態、年齢、人種/民族、疾患期間、拡張期および収縮期血圧、安静時心拍数、身長、体重、脂肪過多、肥満度指数、血清レプチン、家族歴、CCP状態(すなわち、対象が抗CCP抗体について陽性であるか陰性であるか)、CCP力価、RF状態、RF力価、ESR、CRP力価、閉経状態、および喫煙者/非喫煙者かどうかを含むことができる。
本開示の文脈における「臨床変数」または「臨床パラメータ」という用語は、対象の健康または生理学的状態の全ての尺度を包含する。臨床パラメータを使用して、対象の疾患活動性の臨床評価を導出することができる。臨床パラメータには、限定されないが、治療レジメン(従来型であるか生物製剤であるかを問わないDMARD、ステロイドなどを含むがこれらに限定されない)、TJC、SJC、朝のこわばり、3つ以上の関節領域の関節炎、手関節の関節炎、対称性関節炎、リウマチ結節、X線写真の変化および他の画像化、ジェンダー/性別、喫煙状態、年齢、人種/民族、疾患期間、拡張期および収縮期血圧、安静時心拍数、身長、体重、脂肪過多、肥満度指数、血清レプチン、家族歴、CCP状態(すなわち、対象が抗CCP抗体について陽性であるか陰性であるか)、CCP力価、RF状態、RF力価、ESR、CRP力価、閉経状態、および喫煙者/非喫煙者かどうかが含まれ得る。
「臨床評価」および「臨床パラメータ」は、相互に排他的な用語ではない。2つのカテゴリーのメンバーに重複があってもよい。例えば、CRP濃度は、疾患活動性の臨床評価として使用することができる。または、それは対象の健康状態の尺度として使用することができるので、臨床パラメータとして役立つ。
本教示の文脈における「臨床評価」または「臨床データポイント」または「臨床エンドポイント」は、疾患活動性または重症度の尺度を指すことができる。臨床評価は、決定された条件下での1人または複数の対象からの試料(または試料の集団)の評価から得ることができるスコア、値、または値のセットを含むことができる。臨床評価はまた、対象によってもれなく記入されたアンケートであってもよい。臨床評価はまた、バイオマーカーおよび/または他のパラメータによって予測することができる。RAの臨床評価は、例として、これらに限定されないが、DAS(本明細書で定義)、DAS28、DAS28-ESR、DAS28-CRP、健康評価質問表(HAQ)、修正HAQ(mHAQ)、多次元HAQ(MDHAQ)、視覚的アナログスケール(VAS)、医師全体評価VAS、患者全体評価VAS、疼痛VAS、疲労VAS、全体的VAS、睡眠VAS、単純化疾患活動性指数(SDAI)、臨床疾患活動性指数(CDAI)、患者指数データのルーチン評価(RAPID)、RAPID3、RAPID4、RAPID5、米国リウマチ学会(ACR)、ACR20、ACR50、ACR70、SF-36(全般的な健康状態の十分に検証された尺度)、RA MRIスコア(RAMRIS;またはRA MRIスコアリングシステム)、総Sharpスコア(TSS)、van der Heijde-modified TSS、van der Heijde-modified Sharpスコア(またはSharp-van der Heijdeスコア(SHS))、Larsenスコア、TJC、腫脹関節数(SJC)、CRP力価(またはレベル)および赤血球沈降速度(ESR)のうちの1つまたは複数を含み得ることを当業者は認識するであろう。
「DAS」は、対象におけるRAの活動性の尺度である疾患活動性スコアを指し、当業者によく知られている。D.van der Heijde et al.,Ann.Rheum.Dis.1990,49(11):916-920を参照されたい。本明細書で使用される「DAS」は、この特定の疾患活動性スコアを指す。「DAS28」には、28の特定の関節の評価が含まれる。それは、研究および臨床診療においてよく認識されている現在の標準であり得る。DAS28はよく認識された標準であり得るため、「DAS」と呼ばれてもよい。「DAS」は、66/68または44の関節数に基づく計算を指すことができるが、特に明記しない限り、本明細書の「DAS」はDAS28を包含する。本明細書で特に指定しない限り、本教示で使用される「DAS28」という用語は、上記の4つの式のいずれかによって得られるDAS28-ESRまたはDAS28-CRPを指すことができる。または、DAS28は、当技術分野で知られ得る別の信頼できるDAS28式を指すことができる。
DAS28は、オランダのナイヘーメンにあるUniversity Medical CentreのDepartment of Rheumatologyによって維持されている、das-score.nlウェブサイトに概説されているような基準に従ってRA対象について計算することができる。腫脹した関節の数、または総数28のうちの腫脹した関節の数(SJC28)、および圧痛のある関節、または総数28のうちの圧痛のある関節の数(TJC28)を各対象において評価する。いくつかのDAS28の計算では、対象の全体的な健康(GH)も要因であり、100 mm視覚的アナログスケール(VAS)で測定することができる。GHは、本明細書では「患者の全体的な健康評価」(または単に「患者の全体的な評価」)のために、PGまたはPGAとも呼ばれ得る。「患者の全体的な健康評価VAS」は、その場合、視覚的アナログスケールで測定されるGHである。
「DAS28-CRP」(または「DAS28CRP」)は、ESRの代わりにCRPを用いて計算されるDAS28評価である(下記参照)。CRPは肝臓で産生される。通常、個人の血清中を循環するCRPはほとんど、または全く存在しない。CRPは一般に、急性炎症または感染症のエピソード中に体内に存在するので、血清中のCRPの量の上昇または増加は、急性感染症または炎症と関連付けることができる。1 mg/dLを超えるCRPの血清レベルは、通常、高いと見なされる。ほとんどの炎症および感染症は、10 mg/dLを超えるCRPレベルをもたらす。対象の血清中のCRPの量は、例えば、Diagnostics Systems Laboratories,Inc.(Webster、TX)によって開発されたDSL-10-42100 ACTIVE(登録商標)US C-Reactive Protein Enzyme-Linked Immunosorbent Assay(ELISA)を用いて定量化することができる。CRP産生は、RAの放射線学的な進行に関連付けられる。M.Van Leeuwen et al.,Br.J.Rheum.1993,32(suppl.):9-13)を参照されたい。したがって、CRPは、RA疾患活動性の測定においてESRの適切な代替と考えられる。R.Mallya et al.,J.Rheum.1982,9(2):224-228、およびF.Wolfe,J.Rheum.1997,24:1477-1485を参照されたい。
GH因子を含む、または含まないDAS28-CRPは、以下の式のいずれかに従って計算することができ、式中、「CRP」は対象の血清中に存在するこのタンパク質のmg/L単位の量を表し、「sqrt」は平方根を表し、「ln」は自然対数を表す:
(a)GHを含むDAS28-CRP(またはDAS28-CRP4)=(0.56*sqrt(TJC28)+0.28*sqrt(SJC28)+0.36*ln(CRP+1))+(0.014*GH)+0.96;または、
(b)GHを含まないDAS28-CRP(またはDAS28-CRP3)=(0.56*sqrt(TJC28)+0.28*sqrt(SJC28)+0.36*ln(CRP+1))*1.10+1.15。
「DAS28-ESR」は、各対象のESR(mm/時間単位)も測定されるDAS28評価である。DAS28-ESRは、以下の式に従って計算することができる:
(a)GHを含むDAS28-ESR(またはDAS28-ESR4)=0.56*sqrt(TJC28)+0.28*sqrt(SJC28)+0.70*ln(ESR)+0.014*GH;または、
(b)GHを含まないDAS28-ESR=0.56*sqrt(TJC28)+0.28*sqrt(SJC28)+0.70*ln(ESR)*1.08+0.16。
図20は、各DAS28-CRP要素を予測するために使用されるバイオマーカーを示す。
本教示の様々な態様によるリスクを測定するための試験は、試験結果、例えば免疫学的または核酸検出アッセイからの結果を得るために典型的に使用される様々なシステムで実施することができる。そのようなシステムは、試料調製を自動化するモジュール、バイオマーカーレベルの測定などの試験を自動化するモジュール、複数の試料の試験を容易にするモジュール、および/または各試料に対して同じ試験または異なる試験をアッセイするようにプログラムされたモジュールを含み得る。いくつかの態様では、試験システムは、1つのプラットフォーム上に、試料調製モジュール、臨床化学モジュール、およびイムノアッセイモジュールのうちの1つまたは複数を含む。試験システムは、典型的には、ハードウェア上に存在するデータベースに接続して利用することなどによって、結果を収集、保存、および追跡するためのモジュールも含むように設計される。これらのモジュールの例には、ハードドライブ、フラッシュメモリ、および磁気テープなどの、当技術分野で周知の物理的および電子的データ記憶装置が含まれる。試験システムは、一般に、結果を報告および/または視覚化するためのモジュールも含む。報告モジュールのいくつかの例は、可視ディスプレイもしくはグラフィカルユーザインターフェース、データベースへのリンク、またはプリンタを含む。
「コンピュータ」という用語は、当技術分野で一般的に知られている意味を有する。すなわち、一連の指示に従ってデータを操作するためのマシンである。本明細書で使用される場合、「モジュール」という用語は、指定された機能を提供するために利用されるコンピュータプログラムロジックを指す。したがって、モジュールは、ハードウェア、ファームウェア、および/またはソフトウェアで実装することができる。本明細書に記載の実体の態様は、本明細書に記載のものとは別のモジュールおよび/または異なるモジュールを含むことができる。加えて、モジュールに起因する機能は、他の態様では他のまたは異なるモジュールによって実行することができる。さらに、この説明は、明確さおよび利便性のために「モジュール」という用語を省略する場合がある。
いくつかの態様では、本発明は、対象のCVDリスクを決定するためのシステムを含み得る。いくつかの態様では、システムは、本明細書に記載されるように、パネル内のバイオマーカーの測定されたレベルを含む入力に式を適用し、スコアを出力するためのモジュールを使用する。いくつかの態様では、測定されたバイオマーカーレベルは、式を適用するようにプログラムされたコンピュータへの入力として役立つ試験結果である。システムは、出力スコアを導出するために、バイオマーカー結果に加えて、またはそれと組み合わせて他の入力、例えば、治療レジメン、TJC、SJC、朝のこわばり、3つ以上の関節領域の関節炎、手関節の関節炎、対称性関節炎、リウマチ結節、X線写真の変化および他の画像化、ジェンダー/性別、年齢、人種/民族、疾患期間、身長、体重、肥満度指数、家族歴、CCP状態、RF状態、ESR、喫煙者/非喫煙者などの、1つまたは複数の臨床パラメータを含んでもよい。いくつかの態様では、システムは、バイオマーカーレベル入力に式を適用し、次いで他の入力、例えば他の臨床パラメータと併せて分析され得るリスクスコアを出力することができる。他の態様では、システムは、式をバイオマーカーおよび非バイオマーカー入力(臨床パラメータなど)に一緒に適用し、次いで複合出力リスク指標を報告するように設計される。
本教示の様々な態様を実施するために使用することができる、多くの試験システムが現在利用可能である。例えば、ARCHITECTシリーズの統合免疫化学システム-自動化されたハイスループット臨床化学分析装置を参照されたい(ARCHITECTは、Abbott Laboratories(Abbott Park,Ill.60064)の登録商標である)。Wilson et al.,「Clinical Chemistry Analyzer Sub-System Level Performance」、American Association for Clinical Chemistry Annual Meeting,Chicago,Ill.,Jul.23-27,2006;および、HJ Kisner、「Product development:the making of the Abbott ARCHITECT」、Clin.Lab.Manage.Rev.1997 Nov.-Dec.,11(6):419-21;A.Ognibene et al.,「A new modular chemiluminescence immunoassay analyzer evaluated」、Clin.Chem.Lab.Med.2000 March,38(3):251-60;JW Park et al.,「Three-year experience in using total laboratory automation system」、Southeast Asian J.Trop.Med.Public Health 2002,33 Suppl 2:68-73;D.Pauli et al.,「The Abbott Architect c8000:analytical performance and productivity characteristics of a new analyzer applied to general chemistry testing」、Clin.Lab.2005,51(1-2):31-41を参照されたい。
本教示の態様に有用な別の試験システムは、血液および他の体液から試験結果を生成するために使用される研究所および診療所のための化学分析用の装置である、VITROSシステム(VITROS、Johnson&Johnson Corp.,New Brunswick,NJ)である。別の試験システムは、分析装置を操作するため、および分析装置によって生成されたデータを分析するためのコンピュータソフトウェアおよびハードウェアを含む、体液の分析用のシステムであるDIMENSIONシステム(DIMENSION,Dade Behring Inc.,Deerfield Ill.)である。
本教示の様々な態様に必要とされる試験、例えば、バイオマーカーレベルの測定は、研究所、例えば臨床検査室改善法(42 U.S.C.セクション263(a))の下で認定されたものによって、または他の任意の連邦法もしくは州法、もしくは臨床目的で試料を分析する研究所の作業を管理する他の任意の国、州もしくは省の法律の下で認定された研究所によって行うことができる。そのような研究所には、例えば、Laboratory Corporation of America、358 South Main Street、Burlington、NC 27215(本社);Quest Diagnostics、3 Giralda Farms、Madison、NJ 07940(本社);ならびに他のレファレンスラボラトリーおよび臨床化学研究所が含まれる。
本発明のさらなる態様は、本教示のアッセイのいずれかを実施するためのキットの形態で一緒にパッケージングされたバイオマーカー検出試薬を含む。特定の態様では、キットは、バイオマーカー核酸との相同性および/または相補性に基づいて1つまたは複数のバイオマーカー核酸を特異的に同定するオリゴヌクレオチドを含む。オリゴヌクレオチド配列は、バイオマーカー核酸の断片に対応し得る。例えば、オリゴヌクレオチドの長さは、200、200、150、100、50、25、10を超えるか、または10ヌクレオチド未満であり得る。他の態様では、キットは、バイオマーカー核酸によってコードされるタンパク質に対する抗体を含む。本教示のキットは、アプタマーも含むことができる。キットは、核酸または抗体(固体マトリックスに結合された抗体、またはマトリックスに結合するための試薬と別々に包装された抗体のいずれか)、対照製剤(陽性および/または陰性)、および/または検出可能な標識、例えば限定されないが、とりわけ、フルオレセイン、緑色蛍光タンパク質、ローダミン、シアニン色素、Alexa色素、ルシフェラーゼおよび放射性標識を別々の容器に含むことができる。場合によりMBDAスコアを生成するための説明書を含む、アッセイを実行するための、例えば、文書、テープ、VCR、またはCD-ROMでの説明書をキットに含めることができる。アッセイは、例えば、当該分野で公知のノーザンハイブリダイゼーションまたはサンドイッチELISAの形態であり得る。
本教示のいくつかの態様では、バイオマーカー検出試薬は、多孔質ストリップなどの固体マトリックス上に固定化されて、少なくとも1つのバイオマーカー検出部位を形成することができる。いくつかの態様では、多孔質ストリップの測定または検出領域は、核酸を含有する複数の部位を含むことができる。いくつかの態様では、試験ストリップは、陰性および/または陽性対照のための部位も含むことができる。あるいは、対照部位は、試験ストリップとは別のストリップ上に配置することができる。場合により、異なる検出部位は、異なる量の固定化核酸、例えば、最初の検出部位ではより多い量、その後の部位ではより少ない量を含み得る。試験試料を添加すると、検出可能なシグナルを表示する部位の数が、試料中に存在するバイオマーカーの量を定量的に示す。検出部位は、適切に検出可能な任意の形状に構成することができ、例えば、試験ストリップの幅にまたがる棒または点の形状であり得る。
本教示の他の態様では、キットは、1つまたは複数の核酸配列を含む核酸基質アレイを含むことができる。アレイ上の核酸は、MBDAマーカーによって表される1つまたは複数の核酸配列を特異的に同定する。様々な態様では、MBDAマーカーによって表される1つまたは複数の配列の発現は、アレイへの結合の効果によって同定することができる。いくつかの態様では、基質アレイは、「チップ」として知られるものなどの固体基質上にあってもよい。例えば、米国特許第5,744,305号を参照されたい。いくつかの態様では、基質アレイは溶液アレイ、例えば、xMAP(Luminex、Austin,TX)、Cyvera(Illumina,San Diego,CA)、RayBio Antibody Arrays(RayBiotech,Inc.,Norcross,GA)、CellCard(Vitra Bioscience、Mountain View,CA)およびQuantum Dots’Mosaic(Invitrogen、Carlsbad,CA)であり得る。
機械可読記憶媒体は、例えば、機械可読データまたはデータアレイで符号化されたデータ記憶材料を含むことができる。データおよび機械可読記憶媒体は、前記データを使用するための命令でプログラムされた機械を使用する場合、様々な目的で使用することができる。そのような目的は、限定されないが、経時的な対象もしくは集団のリスク、または治療に応答したリスク、または炎症性疾患のための創薬などに関する情報の保存、アクセスおよび操作を含む。本教示のバイオマーカーの測定値、および/またはこれらのバイオマーカーからのCVDリスクの評価を含むデータは、プロセッサ、データ記憶システム、1つまたは複数の入力装置、1つまたは複数の出力装置などを含むプログラム可能なコンピュータ上で実行しているコンピュータプログラムに実装することができる。プログラムコードを入力データに適用して、本明細書に記載の機能を実行し、出力情報を生成することができる。次いでこの出力情報を、当技術分野で周知の方法に従って、1つまたは複数の出力装置に適用することができる。コンピュータは、例えば、従来の設計のパーソナルコンピュータ、マイクロコンピュータ、またはワークステーションであり得る。
コンピュータプログラムは、コンピュータシステムと通信するために、高水準の手続き型またはオブジェクト指向プログラミング言語で実装することができる。プログラムは、マシン言語またはアセンブリ言語で実装することもできる。プログラミング言語は、コンパイル言語またはインタプリタ言語であってもよい。各コンピュータプログラムは、記憶媒体、またはROM、磁気ディスケットなどの装置に記憶することができ、記憶媒体または装置がコンピュータによって読み取られて記載された手順を実行する場合に、コンピュータを構成し動作するためにプログラム可能なコンピュータによって読み取り可能であり得る。本教示のいずれかの健康関連データ管理システムは、コンピュータプログラムで構成されたコンピュータ可読記憶媒体として実装されるものと見なすことができ、記憶媒体は、本明細書で説明されるように、コンピュータを特定の方法で動作させて様々な機能を実行する。
本明細書に開示されるバイオマーカーを使用して、炎症性疾患を有する対象から採取された「対象バイオマーカープロファイル」を生成することができる。次いで、CVDリスクが高い対象を診断または特定するために、対象バイオマーカープロファイルを参照バイオマーカープロファイルと比較することができる。本教示の態様の参照および対象のバイオマーカープロファイルは、機械可読媒体、例えば特に、CD-ROMまたはUSBフラッシュ媒体によって読み取り可能なものなど、アナログテープに含めることができる。そのような機械可読媒体はまた、追加の試験結果、例えば、臨床パラメータの測定値および臨床評価を含むことができる。機械可読媒体はまた、対象の情報、例えば、対象または家族の病歴を含むことができる。機械可読媒体はまた、本明細書に記載されているような、他の疾患活動性アルゴリズムおよび計算されたスコアまたは指数に関する情報を含むことができる。
本教示の実行は、タンパク質化学、生化学、組換えDNA技術および薬理学の方法を使用することができる。例えば、T.Creighton,Proteins:Structures and Molecular Properties,1993,W.Freeman and Co.;A.Lehninger,Biochemistry,Worth Publishers,Inc.(現行の追加);J.Sambrook et al.,Molecular Cloning:A Laboratory Manual,2nd Edition,1989;Methods In Enzymology,S.Colowick and N.Kaplan,eds.,Academic Press,Inc.;Remington’s Pharmaceutical Sciences,18th Edition,1990,Mack Publishing Company,Easton,PA;Carey and Sundberg,Advanced Organic Chemistry,Vols.A and B,3rd Edition,1992,Plenum Pressを参照されたい。
本教示の実行は、生物統計学的分析の方法を使用することができる。例えば、J.Little and D.Rubin,Statistical Analysis with Missing Data,2nd Edition 2002,John Wiley and Sons,Inc.,NJ;M.Pepe,The Statistical Evaluation of Medical Tests for Classification and Prediction(Oxford Statistical Science Series)2003,Oxford University Press,Oxford,UK;X.Zhoue et al.,Statistical Methods in Diagnostic Medicine 2002,John Wiley and Sons,Inc.,NJ;T.Hastie et.al,The Elements of Statistical Learning:Data Mining,Inference,and Prediction,Second Edition 2009,Springer,NY;W.Cooley and P.Lohnes,Multivariate procedures for the behavioral science 1962,John Wiley and Sons,Inc.NY;E.Jackson,A User’s Guide to Principal Components 2003,John Wiley and Sons,Inc.,NYを参照されたい。
本明細書で具体的に言及される全ての刊行物、特許および文献は、あらゆる目的のためにその全体が参照により本明細書に組み込まれる。
本明細書で具体的に定義される単語は、全体として本開示の文脈で提供される意味を有し、当業者によって典型的に理解される。本明細書で使用される場合、単数形「a」、「an」および「the」は複数を含む。
本開示は様々な態様に関連して説明されているが、本開示はそのような態様に限定されることを意図するものではない。それどころか、本開示は、当業者によって理解されるように、様々な代替物、修正物、および同等物を包含する。
他に定義されない限り、本明細書で使用される全ての技術用語および科学用語は、本発明が属する技術分野の当業者によって一般的に理解されるのと同じ意味を有する。本明細書に記載のものと類似または同等の方法および材料を本発明の実施または試験に使用することができるが、適切な方法および材料を以下に記載する。加えて、本明細書の材料、方法、および実施例は例示にすぎず、限定することを意図するものではない。
前述の開示は、理解を明確にする目的で例示および例としてある程度詳細に説明されているが、本発明および添付の特許請求の範囲内で様々な変更および修正が実施され得ることは当業者には理解されよう。
実施例1:関節リウマチ患者のVECTRAバイオマーカー心血管疾患スコア
後向きRAコホートは、2001年から2016年の間に市販のMBDA試験による試験を受けた個人の、出来高払い(fee-for-service)メディケアデータ2011-2016のデータソース100%試料を使用して作成した。データを、患者の生年月日、性別、および手順コード(Crescendo BiosciencesまたはMyriad Geneticsによって提出されたCurrent Procedural Terminologyコード81479、83520、84999、86140および81490)によって定義されるMBDA試験コードおよびMBDA試験日、ならびに治療するリウマチ専門医の国立プロバイダ識別番号(NPI)にリンクさせた。以前に公開された方法を使用して、データを決定論的にリンクさせた。UAB施設内審査委員会は、研究を承認した。
参加適格者
適格な患者は、
1)年齢40歳以上であること;
2)リウマチ専門医からの少なくとも1つのRA診断コード(ICD9 714.0;ICD10 M05.*、M06.*(M06.4およびM06.1を除く))を有すること;
3)最初のMBDA試験の期日までの(当日を含む)いずれかの時間に処方されたRA特異的治療(例えば、生物製剤、腫瘍壊死因子阻害剤、アバタセプト、リツキシマブ、IL-6R、ヤヌスキナーゼ阻害剤、従来の合成疾患修飾性抗リウマチ薬、例えば、メトトレキサート、スルファサラジン、レフルノミド、およびヒドロキシクロロキンなど)を受けていること;ならびに
4)少なくとも1つの関連するMBDA研究室試験
が求められた。
参加者はまた、メディケアパートA(入院補償)、パートB(外来診療補償)およびパートD(処方薬補償)で、少なくとも少なくとも365日間継続的に補償されることが必要であった。
RAを特定するための、この請求ベースのアルゴリズムの精度は85%を超え、MBDA試験がRAを有することが分かっている患者への使用のみ承認された(すなわち、RAの診断を補助するためのスクリーニング試験ではなかった)ことを考慮すると、MBDA試験との連携によってさらに向上した。
ベースラインは、最初のMBDA試験日に固定され、利用可能な以前のメディケアデータを全て含んだ;最低1年が必要であった。ベースライン期間中に悪性腫瘍(非黒色腫皮膚癌以外)、過去のMIまたは脳卒中の診断コードを有する患者は除外した。全ての適格要件が満たされた後、最初のMBDA試験の日に追跡調査を開始する可能性があった。追跡調査は、CVD転帰、悪性腫瘍の発生、非致命的CVD事象(最初は競合リスクとして扱われ、後に結果への影響が最小限であったため除去された)、または研究終了(12/31/2016)のうち一番早いものをもって終了した。
CVDの転帰
複合CVDの転帰には、入院中の心筋梗塞(MI)、脳卒中および致命的なCVDが含まれた。MIは、病院で少なくとも一晩続いた入院患者の入院から、または患者が死亡した場合に、ICD-9診断コード410.x1またはICD-10診断コードI21.*(任意の1桁を与えた、*は任意の桁の数字または文字を意味する)として定義した。脳卒中は、ICD-9診断コード430.*、431.*、433.x1、434.x1、436.*またはICD-10診断コードI60.*、I61.*、I63.*またはI67.89を使用して退院から特定した。このアプローチを使用したMIの陽性予測値は約93%以上であり、脳卒中については約80~85%(18~20)である。公開されているPPV≧80%のアルゴリズムを使用して、致命的なCVDを特定した。
MBDAバイオマーカースコア
VECTRA MBDA試験は、様々なRA療法で治療された血清陽性および血清陰性の患者からなる複数のRAコホートにおいて、DAS28-CRPに対して以前に繰り返し検証された12のタンパク質バイオマーカーのパネルであった。MBDAに含まれるバイオマーカーは、RAの生物学を反映しており、サイトカイン(IL-6、TNFRI)、急性期反応物(血清アミロイドA、C反応性タンパク質)、成長因子(VCAM-1、EGF、VEGF-A)、マトリックスメタロプロテイナーゼ(MMP-1、MMP-3)、およびアディポカイン(レジスチン、レプチン)からなる。MBDAスコアとDAS28-CRPとの相関に基づいて開発および検証された公開アルゴリズムで、12のバイオマーカーを重み付けした。本研究に先立ち、本研究とは無関係に、年齢、性別およびレプチン(脂肪過多の代用として)の影響についてMBDAスコアを調整するためのアルゴリズムが開発された。元のMBDAスコアと同様に、この調整MBDAスコアは、1~100のスケール、ならびに低(<30)、中(30~44)、および高(>44)のRA疾患活動性カテゴリーを有していた。この調整は、2017年12月から慣例的に使用されている。本研究で使用するために、MBDAスコアを調整MBDAスコアに変換した。本明細書で使用される場合、「MBDAスコア」という用語は、調整MBDAスコアを指す。全てのMBDAスコアは、日常的なケアの一部として専門家によって注文され、商用の研究所で実行された。
個人のMBDA試験結果は、退院後14日以内に外れた場合は無視した。IL-6R治療がCVDリスク予測を混乱させ得る方法でMBDAスコアに影響を及ぼすことを考慮して、患者が過去90日間にサリルマブまたはトシリズマブを使用した場合も、MBDA試験結果を無視した。
MBDAスコアおよび対数変換されたその構成要素の12バイオマーカーの両方に加えて、様々な人口統計学的および臨床的予測因子も、対象分野の専門知識および医学文献によって知らされたそれらの予想されるCVDリスクとの関連に基づいて、予測モデルに含めることが検討された。候補予測因子には、年齢、性別、人種、糖尿病の診断および薬物治療、高血圧症、高脂血症、タバコの使用、MIまたは脳卒中以外の心血管疾患[例えばMIを伴わない狭心症または急性冠動脈症候群、心房細動、末梢血管疾患]の病歴、上記のRA薬、グルココルチコイド、および非ステロイド性抗炎症薬の使用が含まれ得る。バイオマーカーを除く全ての候補予測因子は、メディケアデータを使用して得られた。MBDA試験結果およびその構成要素バイオマーカー以外の研究室結果は、メディケアデータでは入手できなかった。
事前に指定された分析計画に基づいて、個別予後または診断のための多変量予測モデルの明白な報告(TRIPOD)ガイドラインに従ったモデル構築および選択の原則的なアプローチを行った。まず、コホートを2:1でランダムに、別々のトレーニングデータセットと試験(すなわち、内的検証)データセットとに分けた。全ての特徴選択およびモデル構築は、トレーニングデータセットに対してのみ実行した。
次に、全ての候補特徴を記述的に特徴付けた。モデル構築のために考慮される予測因子には、確立されたCVDリスク因子、人口統計学的変数およびバイオマーカー変数の診断コードが含まれた。連続予測因子については平均(SD)を計算し、カテゴリー予測因子についてはパーセンテージを計算し、CVD事象を有していたか否かによって患者を層別化した。
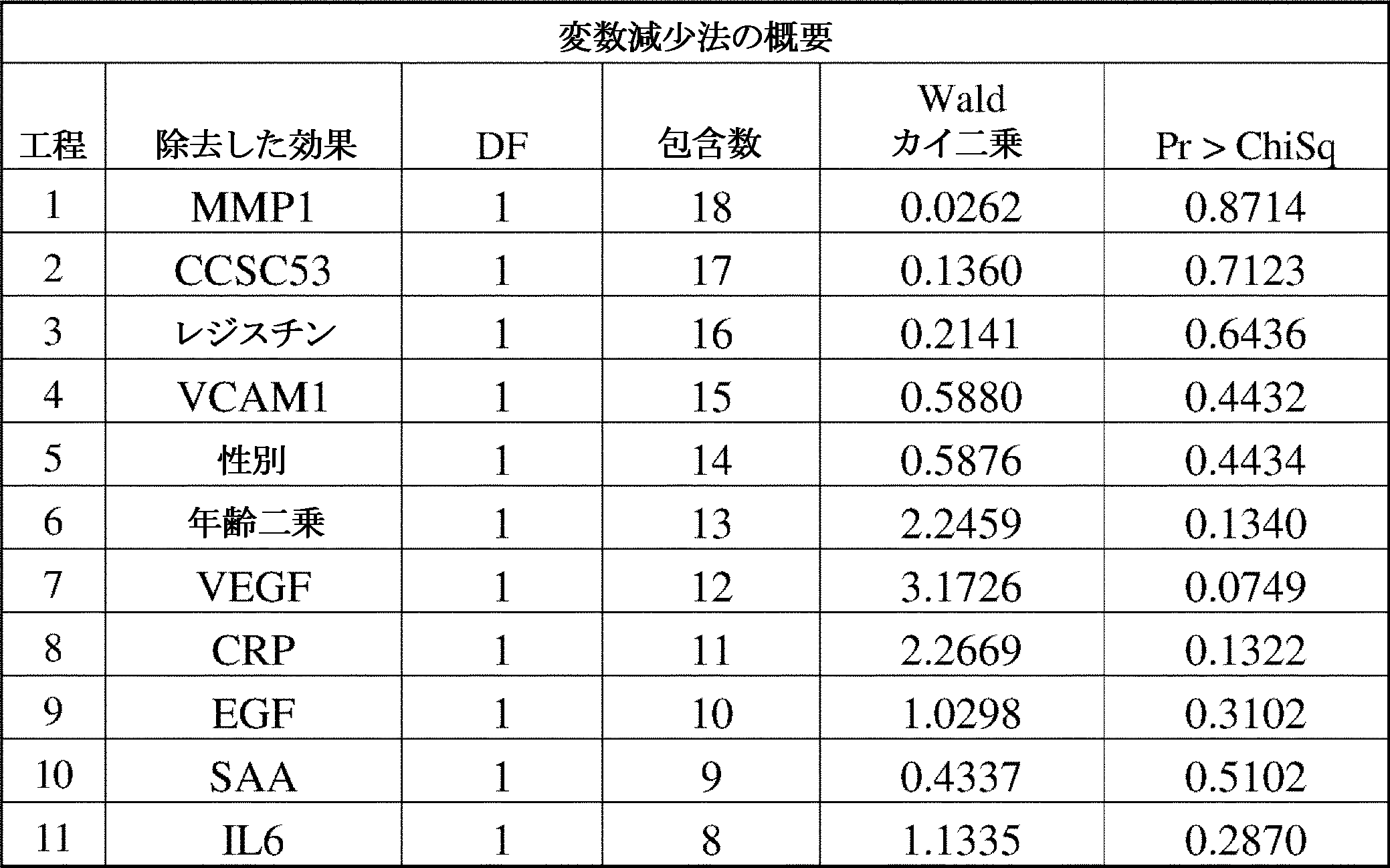
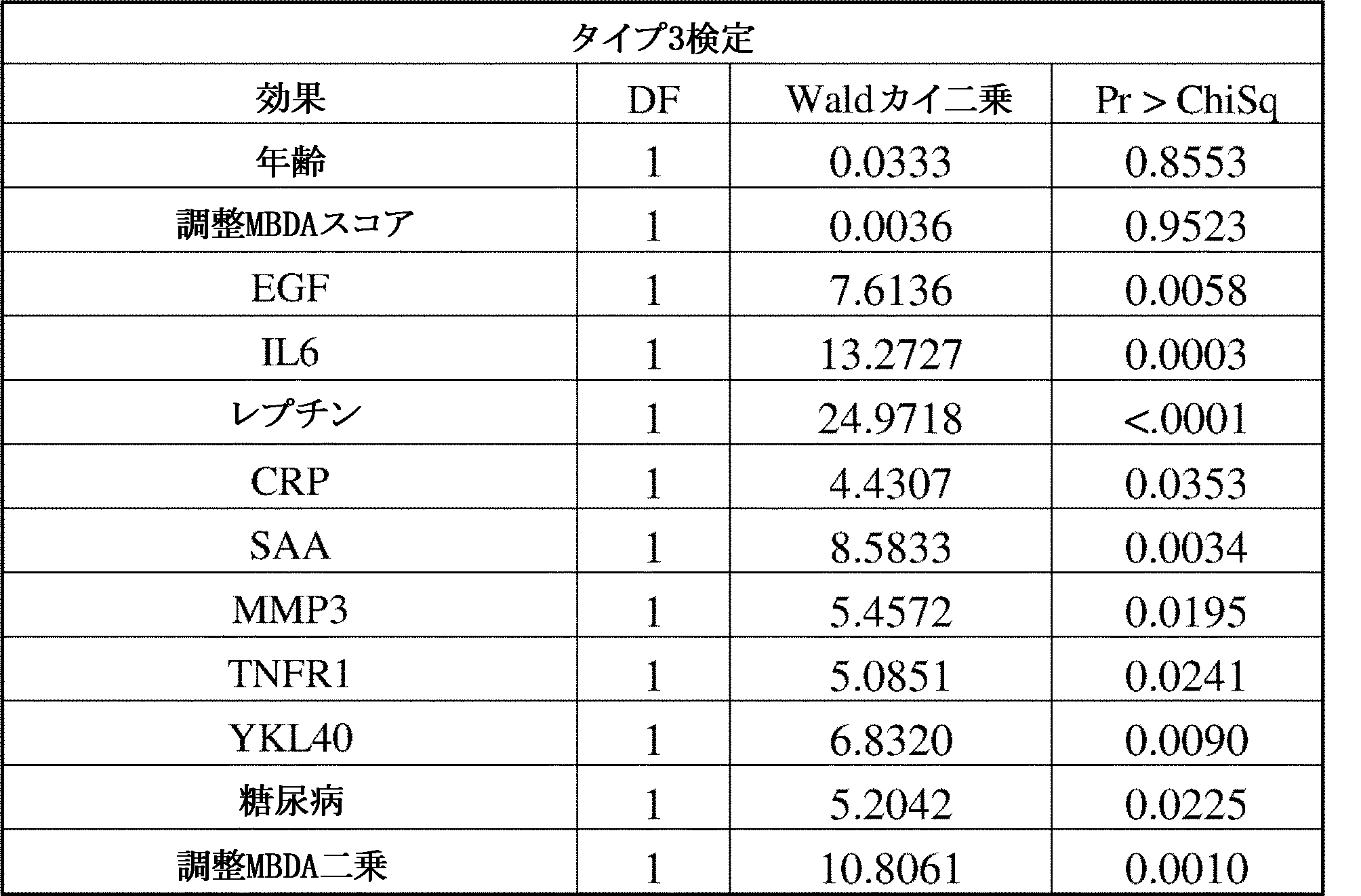
本発明の方法の一部である統計モデルの構築において、CVDの患者リスクを、Cox比例ハザード回帰をトレーニングデータのみに使用して予測因子の関数として推定した。個々のバイオマーカー濃度を自然対数変換した。可能性のある非線形性を説明するために、年齢の二乗項を候補予測因子として含めた。MBDAスコアは、双曲線正接変換され、双曲線正接変換のパラメータは、最尤推定に基づいて選択され、モデル構築の各工程で更新された。TRIPODガイダンスに記載されているオプションの1つと一致して、モデルは変数減少法を使用して構築された。最初の工程では、全ての候補予測因子が含まれた。その後の各工程において、最も有意性の低い変数(最大のp値)が削除され、モデルは残りの変数で再度適合された。残りの全ての変数のp値が閾値0.05を下回るまで、これを行った。
トレーニングデータセットを使用して、合計5つの予測方法を比較した。これらの5つの方法は以下の通りであった:
1)年齢+性別;
2)年齢+性別+CRP;
3)倹約的臨床モデル(年齢+性別+タバコ使用+糖尿病+高血圧+他のCVD状態の病歴);
4)倹約的臨床モデル(上記の3番)+CRP;および
5)最終的なVECTRA-CVDスコアMBDAベースの方法。
最終的なVECTRA-CVDスコア法を選択する際の考慮事項は、モデルの識別、較正、節約、および日常的な臨床ケア設定で必要とされる共変量の収集の予想される実現可能性に基づいた。
30,000人を超えるRA患者のこの大規模なコホートにおいて、バイオマーカーベースのCVD予測モデルが導出され、RA患者での使用が検証された。MBDAによって測定される全身性炎症の寄与を反映することに加えて、方法には、ポイントオブケアで臨床医が容易に利用できるはずの4つの臨床予測因子が組み込まれた。モデルは、それを導出するために使用される患者の群、および様々な重要な患者サブグループ全体の両方で、内的検証に使用されるランダムに分割された試料と同様に正確であることが示された。このようなリスク評価ツールの目標は、CVDリスク上昇に活動性RAがもたらす重要な寄与を反映し、リウマチ専門医およびその患者にポイントオブケアで有用なツールを提供して、共同の意思決定を容易にすることであった。これらの議論は、RA疾患活動性の寄与を緩和する方法を含むトピックを包含することができ、患者とともに取り組む必要があり得る従来のCVリスク因子を強調することもできる。
本発明の検証されたCVDリスク予測スコアおよび方法は、ポイントオブケアでCVDリスクを評価するための使いやすい尺度を臨床医に提供することができる。方法は、年齢、および血清バイオマーカーに基づくRA関連疾患活動性と組み合わせた、いくつかの容易に利用可能な従来のCVDリスク因子に基づく。本発明の方法は、実施可能なリスクCVD因子、RA関連疾患活動性、ならびにタバコ使用および肥満(例えば、レプチンバイオマーカーによって表される)を強調するが、高血圧症および糖尿病などの他の従来のCVDリスク因子も含まれる。
実施例2:関節リウマチ患者のVECTRAバイオマーカー心血管疾患スコアのリスクカテゴリー化。関節リウマチ患者のためのVECTRAバイオマーカーCVD 3年リスク%決定
トレーニングデータセットの患者は、3年でのCVDの予測リスクによって3つのリスク群にグループ化した。3年の推定リスクを100×(1-Aexp[B×VECTRA-CVDスコア])として計算し、式中、Aはベースラインリスク、すなわち全ての共変量を0に設定した3年以内にCVD事象が発生しない確率を反映し、Bは試験データセットに適用される較正定数である(以下を参照)。3年の時間枠は、データの利用可能性に基づいて選択した。リスク値をカテゴリー化する目的で、5%(+-0.1%)、7.5%(+-0.1%)および20%(+-0.1%)リスクの10年ACC/AHA閾値に対応する3年カットポイントをブートストラップによって得た。手短に言えば、10年のデータが利用可能であったが(2006~2016)、関連するバイオマーカー情報は、2010年に初めて利用可能になったMBDA試験の利用可能性に先行したために利用できなかったRA患者のコホートにおいて、年齢および性別モデルを推定した。カテゴリー化のために選択されたカットポイントは、低(0~<1.3%)、境界リスク(累積リスク≧1.3%~<1.8%)、中リスク(≧1.8~<5.2%)、および高リスク(≧5.2%)であった。
例えば、VECTRA-CVDスコアは、式IXに従って計算することができる:
生物統計学的ツールを使用して、臨床データを用いて得られたVECTRAバイオマーカーセットおよびVECTRA-CVDスコアに基づいて、RA患者のCVD 3年リスク%を計算した。
患者は、3年でのCVDの予測リスクによって3つのリスク群にグループ化した。3年リスク推定%は、式Xに従って計算した:
式中、Aは、全ての共変量を0に設定した3年以内にCVD事象が起こらない確率であるベースラインリスクを反映し、Bは、試験臨床データに適用される較正定数である。
試験および内的検証
上記の5つの方法のトレーニングデータからのリスクスコアを、それらの3年でのcインデックス(識別)、較正、および適合度(予測リスクの十分位数カテゴリーにおける3年での予想に対する観察)、MBDAベースのCVDリスクスコア法の増分寄与、および純再分類改善度(Net Reclassification Index)(NRI)に関して比較した。NRI表の目的は、より複雑な方法が、リスクカテゴリー(低、中、高など)に関して個々の患者を分類したやり方を有意義に変化させるかどうかを評価することであった。さらに、3つの予測リスク群の各々について生存曲線を作成した。
データの調製にはSAS 9.4を使用し、モデル性能の評価、NRIおよびCインデックスの計算、ならびにプロットの生成には、Rバージョン2.4およびRパッケージsurvival、nricensおよびpecを使用した。
感度分析
様々な感度分析を実施して、最終的な方法の性能が患者の重要なサブグループで一貫していることを確認した。これらには、65歳未満、75歳未満、糖尿病を有するおよび有さない、スタチンを服用しているおよび服用していない、CVD関連症状の病歴の有するおよび有さない患者が含まれた。感度分析は、生物製剤の追加またはそれへの切り替え時に打ち切った患者にも実施して、バイオマーカーによって測定されたRA疾患活動性が時間の経過によって有意に誤分類され得る可能性に対処した。
実施例3:関節リウマチ患者のためのVECTRA-CVDスコア決定の有利な性能
コホート選択
包含基準および除外基準を適用した後、合計30,751人のRA患者がコホートに適格であった。ベースライン特徴は以下の通りであった:平均年齢69歳、患者の23%が65歳未満、18%が男性。8%が黒人であった。様々なCVD関連併存症の有病率は、糖尿病(40%)および高血圧症(79%)など、スタチン使用(42%)同様に高かった。患者の約60%はメトトレキサートを服用しており、33%はTNF阻害剤(TNFi)を服用しており、15%は非TNFi生物製剤を投与されていた。CRP値の中央値は1.5 mg/L、MBDAスコアの中央値は41であり、中等度のRA疾患活動性の上限と解釈された。指標日後の追跡調査期間の中央値(IQR)は、1.7(1.3,2.7)年であった。併存症を含む、12ヶ月のベースラインおよび全ての利用可能な先行データを使用した、RAコホートにおけるベースライン候補予測因子の分布を表7に示す。
(表7)RAコホートにおけるベースライン候補予測因子の分布
†自然対数変換
*ACEI=アンジオテンシン変換酵素阻害剤;ARB=アンジオテンシン受容体遮断薬
MBDAベースのモデルのトレーニング
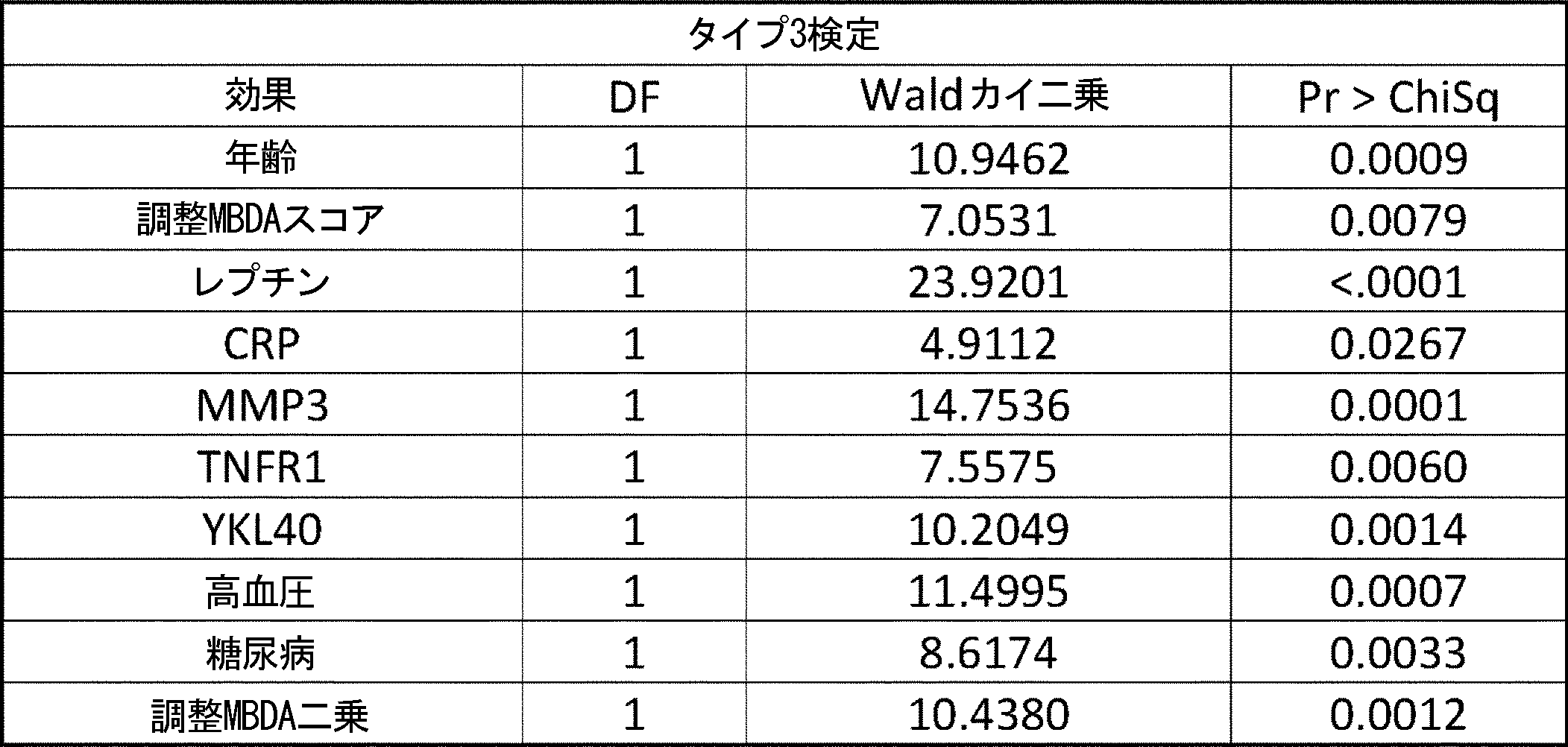
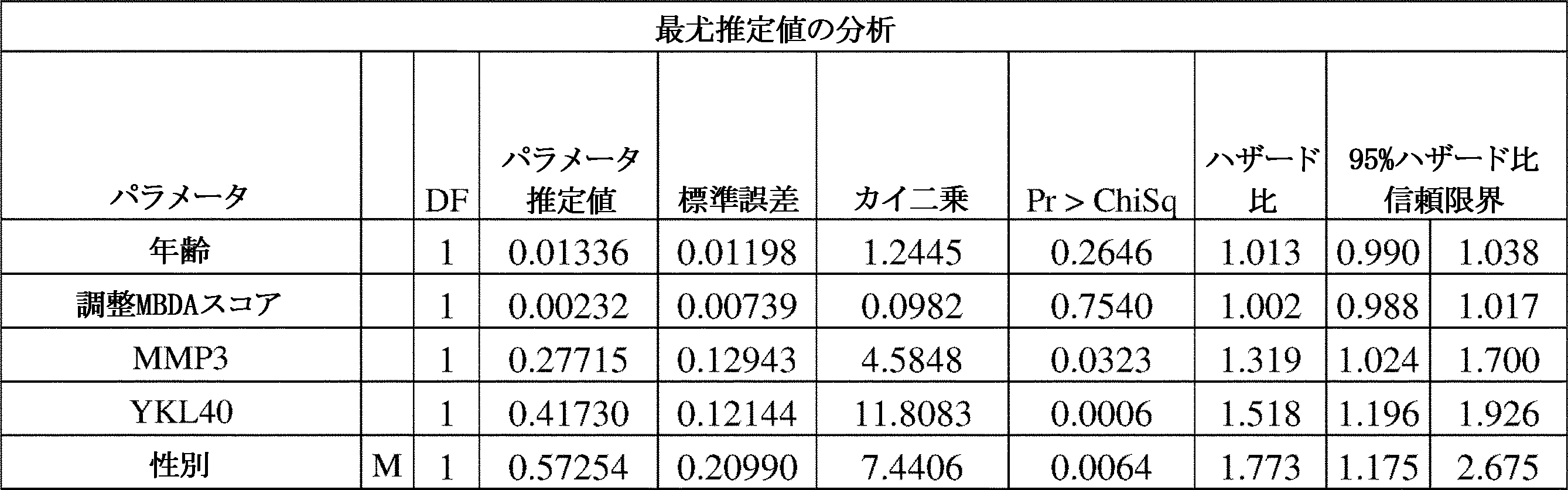
糖尿病、高血圧症、他のCVD事象の病歴、および喫煙を含む様々な予想される併存症と同様に、年齢および性別パラメータのみは、有意であった。しかしながら、最終的なMBDAベースモデルでは、VECTRA-CVDスコア、男性およびCRPは驚くべきことに、もはや有意ではなく、最終的なCVDリスクスコア式は、1.6076×tanh(VECTRA/33.0807)-0.1711×ln(レプチン)+0.5724×ln(TNFRI)+0.1454×ln(MMP3)+0.0314×年齢+0.2691×喫煙+0.2732×糖尿病+0.2694×高血圧+0.3378×CVDの病歴であり、式中、レプチン、TNFR1およびMMP3は、それぞれのバイオマーカーのng/ml単位の血清濃度を意味する。
図1は、RA患者における予測VECTRA CVDスコア(x軸)とCVD 3年リスク%(y軸)との関係を示す。図1では、低+境界、中、および高のCVD 3年リスク%カテゴリーに分類される患者の割合は、それぞれ15.1%、54.3%、および30.6%であった。
図2は、図1の関係についての患者の分布を示す。図2の分布は、予測VECTRA-CVDスコアの全てのレベルについて、広範囲のCVD 3年リスク%を有する患者が見つかったことを示している。この分布および関係は、スコアが予測的に有効であり、幅広いリスクレベルの患者にとって有意義であることを示す。
図3は、予測CVDリスクスコアリング(x軸)とCVDリスク患者の転帰(y軸)との間の相関を示す。内的検証データセットの十分位数全体の最終CVD 3年リスク%の適合度を図3に示す。図3に示すように、最終モデルの較正は十分位数全体で良好であり、適合度検定統計量は妥当な適合を示した(p=0.13)。実際の観察されたリスクは、ほぼ全ての十分位数群の予測リスクの信頼限界内であった。全体として、予測CVD 3年リスク%の中央値(IQR)は3.4%であった。データ点の破線への適合度は、CVD 3年リスク%と患者の転帰との間に非常に強い相関が存在することを示す。
内的検証データセットにおける比較および評価
3年でのCVDリスクを予測するためのcインデックス(AUROC)は、モデル全体で増加し、共変量が追加されるにつれて増加した。年齢+性別モデルでは0.66、年齢、性別およびCRPでは0.67、CRPを含まない倹約的臨床モデルでは0.69、CRPを含む倹約的臨床モデルでは0.70、最終的なCVD 3年リスク%法では0.72であった。特に、最終的なCVDの3年リスク%法に基づく予測は、驚くほど変動が少なく、年齢および性別のみを使用する従来の方法よりも患者間で驚くほど良好に識別された。
CVD 3年リスク%法は、共変量としてVECTRAスコアを含めることによって、RA関連炎症がCVDリスクに与える寄与を有利に説明した。図4は、炎症とCVDリスクとの関係を示す。図4では、内的検証データセットでのCVD 3年リスク%法の結果をVECTRAスコアに従ってプロットしている。VECTRAスコアの増加と予測CVDリスクとの間に正の関連が観察された。VECTRAスコアの全てのレベルで、コホートにおける他の共変量の様々な寄与と一致して、広範囲のCVDリスク値が観察された。
生存率チャート
CVD事象なしの生存率のプロットを使用して、VECTRA-CVDスコアおよび最終的なCVD 3年リスク%法を使用した低リスク群、中リスク群、および高リスク群カテゴリーの有利な分離を経時的に示した。
図5は、本発明のCVD 3年リスク%値の予測能力を臨床的に検証するための方法の結果を示す。図5は、RA対象のCVD事象なしの生存率を示す。プロットされた線は、本発明の予測CVD 3年リスク%値の低、中、および高CVDリスク群閾値に対応する生存率を示す(n=10,275)。
図6は、本発明のCVDの3年リスク%値の予測能力を臨床的に検証するための方法の結果を示す。図6は、RA対象のCVD事象なしの生存率を示す。プロットされた線は、本発明の予測CVD 3年リスク%値の低/境界、中、および高CVDリスク群閾値に対応する生存率を示す(n=10,275)。
図7は、本発明のCVD 3年リスク%値の予測能力を臨床的に検証するための方法の結果を示す。図7は、RA対象のCVD事象なしの生存率を示す。プロットされた線は、本発明の予測CVD 3年リスク%値の低、境界、中、および高CVDリスク群閾値に対応する生存率を示す(n=10,275)。
実施例4:関節リウマチ患者のためのVECTRA-CVDスコア決定の性能と従来の方法との比較
VECTRA-CVDスコアおよびCVD 3年リスク%法の性能を、関節リウマチ患者のCVDリスクの決定について従来の方法と比較した。
図8は、本発明の方法の、RA対象のCVD 3年リスク%値の評価における予想外に優れた精度を示している。図8の棒グラフは、VECTRA-CVDスコアに基づく(「MBDAベース」)本発明の方法が、VECTRA-CVDスコアを含まない様々な方法よりも驚くほどはるかに正確であったことを示している。これは、図8の左から右への尤度比検定(LRT)(y軸、陰影部分の高さ)の漸増的な増加によって見ることができる。
図8では、左側の棒は、臨床パラメータ年齢+性別のみ(第1のモデル)に基づくCVDリスクの決定が、最初に計算に入力されたときに、VECTRA-CVDスコア(第2のモデル)に漸増的に寄与したことを示す。
同様に、左から2番目、3番目および4番目の棒も、それぞれ、パラメータ年齢+性別+CRP(バイオマーカー)、CRPを含まない臨床パラメータのセット、およびCRPを含む臨床パラメータのセットのみに基づくCVDリスクの決定が、最初に計算に入力されたときに、VECTRA CVDスコア(第2のモデル)に漸増的に寄与したことを示す。臨床パラメータのセットは、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴であった。
重要なことに、図8では、右側の棒は、VECTRA-CVDスコア法(第1のモデル)において、最初に計算に入力された場合の、他の方法の増分寄与(第2のモデル、棒上部の小さな陰影部分)が無視できることを示している。これは、本明細書中に開示されるVECTRA-CVDスコア法が、RA対象のCVD 3年リスク%値の評価について、従来の方法よりも予想外に優れた精度を示したという事実の統計学的証明である。
要約すると、図8は、二変量解析によって、本発明のVECTRA-CVDスコアの使用が、RA対象のCVD 3年リスク%値の決定において従来の方法を上回る非常に高いレベルの精度を達成したことを示す。
同様に、図9は、本発明の方法の、RA対象のCVD 3年リスク%値の評価における予想外に優れた精度を示している。図9の棒グラフは、VECTRA-CVDスコアに基づく(「MBDAベース」)本発明の方法が、VECTRAスコアを含まない様々な方法よりも驚くほどはるかに正確であったことを示している。これは、図9の左から右への尤度比検定(LRT)(y軸、陰影部分の高さ)の漸増的な増加によって見ることができる。
図9では、左側の棒は、臨床パラメータ年齢+性別+CRPのみ(第1のモデル)に基づくCVDリスクの決定が、最初に計算に入力されたときに、VECTRA-CVDスコア(第2のモデル)に漸増的に寄与したことを示す。
同様に、左から2番目、および3番目の棒も、それぞれ、CRPを含まない臨床パラメータのセット、およびCRPを含む臨床パラメータのセット(第1のモデル)のみに基づくCVDリスクの決定が、最初に計算に入力されたときに、VECTRA CVDスコア(第2のモデル)に漸増的に寄与したことを示す。臨床パラメータのセットは、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴であった。
重要なことに、図9では、右側の棒は、VECTRA-CVDスコア法(第1のモデル)において、最初に計算に入力された場合の、他の方法の増分寄与(第2のモデル、棒上部の小さな陰影部分)が無視できることを示している。これは、本明細書中に開示されるVECTRA-CVDスコア法が、RA対象のCVD 3年リスク%値の評価について、従来の方法よりも予想外に優れた精度を示したという事実の統計学的証明である。
要約すると、図9は、二変量解析によって、本発明のVECTRA-CVDスコアの使用が、RA対象のCVD 3年リスク%値の決定において従来の方法を上回る非常に高いレベルの精度を達成したことを示す。
さらに、感度分析の結果は、所見が目的の全ての重要なサブグループで一貫していることを示した。これらには、65歳未満の患者、75歳未満の患者、糖尿病を有する患者および有さない患者、スタチンを服用している患者および服用していない患者、CVDの病歴がある患者およびない患者が含まれ、患者が生物製剤を追加、または切り替えたかは問わなかった。
実施例5:関節リウマチ患者のための従来の方法に対するVECTRA-CVDスコアおよびCVD 3年リスク%決定の性能の二変量解析による比較
関節リウマチ患者のCVDリスクの決定について従来の方法と比較した最終VECTRA-CVDスコア法の性能の二変量解析を表8に示す。
(表8)最終VECTRA-CVDスコア法の性能の二変量解析
本発明の方法は、従来の非VECTRA法と比較して、RA対象のCVD 3年リスク%をVECTRA-CVDスコア値を使用して驚くほど正確に評価した。不確実性および予測不可能性に起因
表8は、VECTRA-CVDスコア値を使用してRA対象のCVD 3年リスク%を評価する本発明の方法の、従来の非VECTRA法と比較した予想外に優れた精度を示している。
表8は、二変量解析によって、VECTRA-CVDスコアに基づく(「MBDAベース」)本発明の方法が、VECTRA-CVDスコアを含まない様々な方法よりも驚くほどはるかに正確であったことを示している。
例えば、表8は、二変量解析により、従来の非VECTRA法のp値が非常に大きく、0.084~0.526であったことを示す。これは、従来の非VECTRA法およびそれらの対応する変数のセットが、VECTRA-CVDスコアによって得られた結果に本質的にほとんど何も加えないことを意味する。VECTRA-CVDスコアのp値は、約10-9~10-20とはるかに低く、VECTRA-CVDスコアおよび対応する変数、例えばVECTRAバイオマーカーを使用する方法の精度がはるかに高いことを表している。
要約すると、表8は、二変量解析によって、従来の変数のセット(年齢+性別、年齢+性別+CRPなど)がVECTRA-CVDスコアの予想外に優れた精度の原因ではないことを証明している。
要約すると、表8は、二変量解析によって、本発明のVECTRA-CVDスコアの使用が、RA対象のCVD 3年リスク%値の決定において従来の方法を上回る驚くほど高いレベルの精度を達成したことを示す。
実施例6:関節リウマチ患者のための従来の方法に対するVECTRA-CVDスコアおよびCVD 3年リスク%決定の性能の再分類分析による比較。マルチバイオマーカー疾患活動性および臨床変数を用いたRA患者のCVDリスクのカテゴリーの検証
純再分類表は、本発明の方法がRAのCVDのリスクを正確に評価するので、治療に包含される患者の集団を拡大することを示すことができる。
下記の表9~20において、多数の患者が再分類されたことは、RAにおけるCVDのリスクを正確に評価する本発明の方法によって、治療に包含される患者の集団を拡大することができることを示す。
下記の表9~20において、多数の患者が再分類されたことは、RAにおけるCVDのリスクを正確に評価する本発明の方法における患者リスクの再分類により、患者の集団に適用されるCVDまたはRAの治療の種類が変更され得ることを示す。
下記の表9~20において、「観察」%値は、観察されたCVD事象の累積発生率である。
下記の表9~20において、患者の1/3超、75%ほどが本発明の最終CVD 3年リスク%法によって再分類された。このデータは、本発明のCVD 3年リスク%法の驚くほど向上した精度を示す。本発明のCVD 3年リスク%法は、患者のかなりの割合を予測CVDリスクのより高いカテゴリーに有利に再分類し、それによって、CVD-RA患者の治療、予後、および監視を改善することができる。
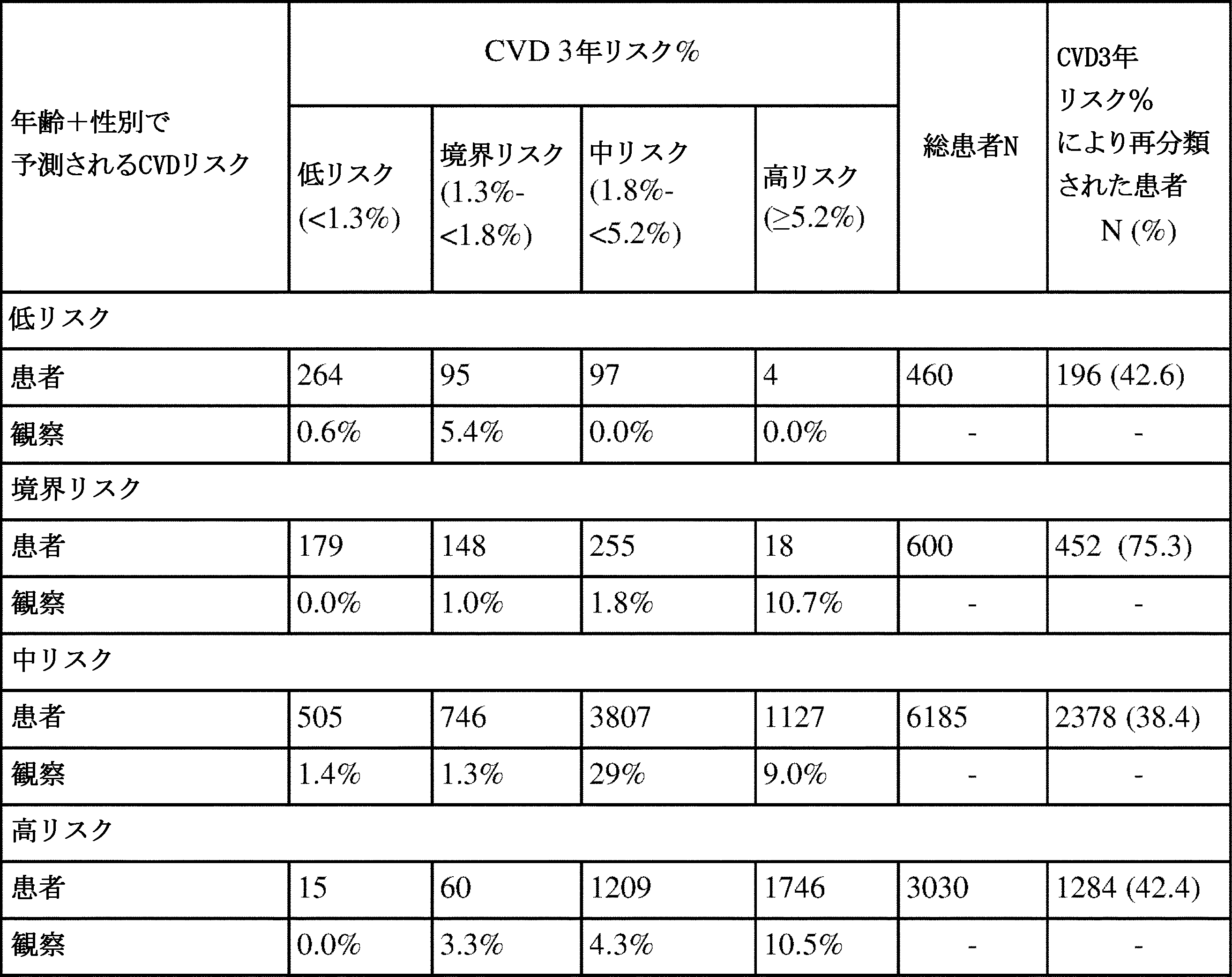
表9は、年齢+性別のみの方法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクのより高いカテゴリーに再分類したことを示す。
(表9)本発明のCVD 3年リスク%、および年齢+性別法と比較したRAのCVDリスクに基づく患者の再分類
表10は、年齢+性別+CRPの方法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低/境界、中、および高の3つのカテゴリーを使用した。
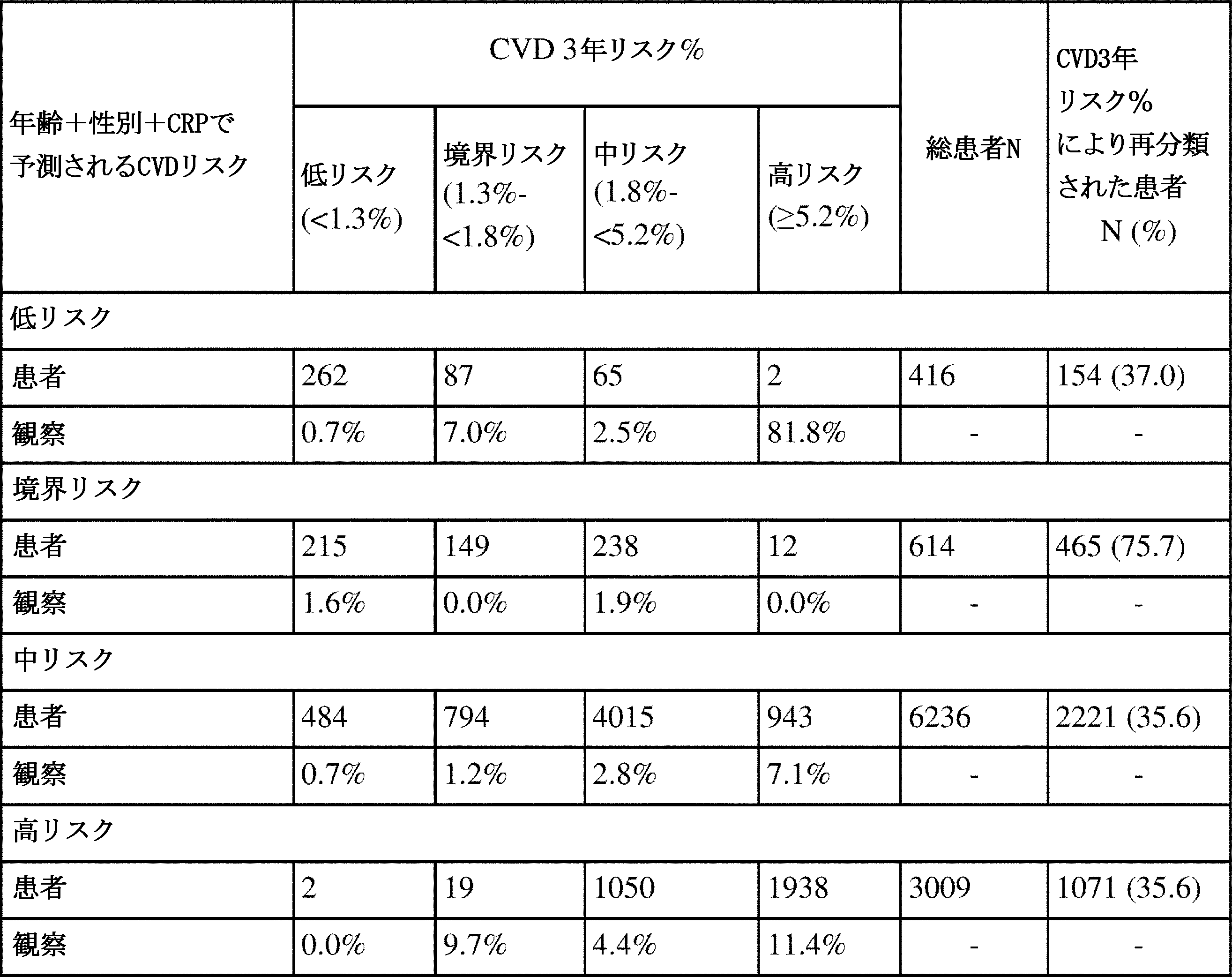
(表10)本発明のCVD 3年リスク%、および年齢+性別+CRP法の使用と比較したRAのCVDリスクに基づく患者の再分類
表11は、CRPを含まない臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低/境界、中、および高の3つのカテゴリーを使用した。
(表11)本発明のCVD 3年リスク%、およびCRPを含まない臨床変数を使用する方法と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴であった。
表12は、CRPを含む臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低/境界、中、および高の3つのカテゴリーを使用した。
(表12)本発明のCVD 3年リスク%、およびCRPを含む臨床変数を使用する方法と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴である
表13は、年齢+性別法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、中、および高の3つのカテゴリーを使用した。
(表13)本発明のCVD 3年リスク%、および年齢+性別法の使用と比較したRAのCVDリスクに基づく患者の再分類
表14は、年齢+性別+CRP法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、中、および高の3つのカテゴリーを使用した。
(表14)本発明のCVD 3年リスク%、および年齢+性別+CRP法の使用と比較したRAのCVDリスクに基づく患者の再分類
表15は、CRPを含まない臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、中、および高の3つのカテゴリーを使用した。
(表15)本発明のCVD 3年リスク%、およびCRPを含まない臨床変数を使用する方法と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴である
表16は、CRPを含む臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、中、および高の3つのカテゴリーを使用した。
(表16)本発明のCVD 3年リスク%、およびCRPを含む臨床変数の使用と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴である
表17は、年齢+性別法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、境界、中、および高の4つのカテゴリーを使用した。
(表17)本発明のCVD 3年リスク%、および年齢+性別変数の使用と比較したRAのCVDリスクに基づく患者の再分類
表18は、年齢+性別+CRP法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、境界、中、および高の4つのカテゴリーを使用した。
(表18)本発明のCVD 3年リスク%、および年齢+性別+CRP法の使用と比較したRAのCVDリスクに基づく患者の再分類
表19は、CRPを含まない臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、境界、中、および高の4つのカテゴリーを使用した。
(表19)本発明のCVD 3年リスク%、およびCRPを含まない臨床変数を使用する方法と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴である
表20は、CRPを含む臨床変数法と比較して、本発明の最終CVD 3年リスク%法が、かなりの割合の患者を予測CVDリスクの異なるカテゴリーに再分類したことを示す。低、境界、中、および高の4つのカテゴリーを使用した。
(表20)本発明のCVD 3年リスク%、およびCRPを含む臨床変数の使用と比較したRAのCVDリスクに基づく患者の再分類
*臨床変数は、年齢、性別、糖尿病、高血圧症、喫煙、およびCVDの病歴である
実施例7:関節リウマチ患者のための従来の方法に対するVECTRA-CVDスコアおよびCVD 3年リスク%決定の性能のハザード比分析による比較。マルチバイオマーカー疾患活動性および臨床変数を用いたRA患者のCVDリスクのカテゴリーの検証
様々な方法のハザード比は、本発明の方法がRAのCVDのリスクを正確に評価するので、治療に包含される患者の集団を拡大することを示すことができる。
RAにおけるCVDリスク上昇を緩和するために、介入の標的として高リスク患者を特定するために適切なリスク層別化が必要とされ得る。本発明の方法は、有利には、最もアクショナブル(actionable)なポイントオブケアで、リアルタイムで臨床医が利用できるようにすることができる。RA患者では特に、本発明の方法は、RAに存在するCVDリスク全体を完全に特徴付けるために、疾患の影響およびその特徴(疾患活動性および全身性炎症を含む)を考慮に入れることができる。したがって本発明の方法は、リスク予測のための集団を拡大して、RA患者のCVDリスクを正確に決定した。
RA疾患活動性および関連する全身性炎症の規模を反映する、RA患者のCVD事象リスクを予測するための正確な方法は、CVDリスクの層別化をより正確かつ利用しやすくすることができる。したがって、本発明の方法は、従来の方法では別段治療されなかったであろうRA患者をCVD予防ケアのために治療することができる。
全身性炎症は、RA疾患活動性を反映する1つまたは複数のバイオマーカーによって評価されている。マルチバイオマーカー疾患活動性(MBDA)スコアを使用することができ、これは、28の関節における疾患活動性スコア(DAS28)によって測定されるRA疾患活動性と高度に相関する。横断的研究および縦断的研究の両方において、MBDAスコアはRA疾患活動性を追跡した。
本発明のバイオマーカー臨床方法は、RAのためにポイントオブケアで実施することができる。本開示では、臨床変数のデータと併せてRA関連バイオマーカーを使用してCVDリスクを予測する、RA固有のCVD予測スコアであるVECTRA-CVDスコアが提供される。臨床データは、臨床医が容易に利用可能な臨床所見を使用して取得でき、または電子システム(例えば、電子健康記録、または集団健康管理に使用される健康保険請求データ)から抽出することができる。本発明の方法は、予後、ならびにRAにおける予防的CVDケアを提供することができ、特にRAにおける過剰なCVDリスクに寄与するRA関連の全身性炎症の構成要素を含む。
本発明の方法と比較した様々な方法のハザード比を表21に示す。CVDリスク用の様々な方法のハザード比をトレーニングデータを用いて取得した(n=20,476)。
(表21)本発明のCVD 3年リスク%法のハザード比比較分析
CRP:C反応性タンパク質;CVD:心血管疾患;MMP3;TNFRI
†血清濃度(CRPはug/mL、レプチン、MMP3およびTNFR1はng/mL)、自然対数変換
‡双曲線正接変換(tanh(a*調整VECTRAスコア:a:1/33.08073)
実施例8:VECTRA-CVDスコア法の性能の比較
TRIPODからの参照情報
1つの手順は、多変量モデリングにおいて自動変数選択方法を適用することであり得る。最新のソフトウェアでは、前進的選択法、変数減少法、およびそれらの組み合わせを含むいくつかの変形が利用可能である。変数減少法は、全ての潜在的な予測因子を含む完全なモデルから始まる。変数は、予め指定された停止規則(P値や赤池情報量規準[AIC]など)が満たされるまで、モデルから順次除去される。前進的選択法は空のモデルから始まり、予め指定された停止規則が満たされるまで予測因子が順次追加される。
自動化された予測因子選択手順が使用される場合、予測因子間の全ての相関がモデリング手順で考慮されるため、変数減少法が一般に好ましい可能性がある。多変量モデリング中に自動予測因子選択戦略を使用すると、特に試料サイズが小さい場合、過剰適合した楽観的なモデルが得られる可能性がある。しかしながら、予測因子選択戦略の使用による過剰適合の程度は推定され得、いわゆる内的検証手順で考慮され得る。
TRIPOD声明は、多変量モデル構築のための自動予測因子選択手順(変数減少法が好ましい可能性がある)またはLASSOのような縮小法の検討、および過剰適合を説明するための注意を提案している。lassoがするように、既知の強力な予測因子(CVDにおける年齢のような)の係数にペナルティを課すことは望ましくない可能性がある。さらに、サブセット選択手順は、信号対雑音比が高い状況(すなわち、貧弱な特徴)で、lassoよりも良好な予測精度を提供することができる。可能な限り倹約的なモデルを有することは、臨床的に実用的であり得る。これらの理由から、本発明者らは、変数選択の包含基準として0.05の有意水準を用いる変数減少法を使用した。
これらの自動化された予測因子選択手順における1つの問題は、モデルに含めるために選択される予測因子の基準であり得る。予測因子の有意水準(α)は、仮説検定で一般的であるように、0.05に設定されることがある。しかしながら、シミュレーション研究は、特に小さいデータセットにおいては、より高い値が考慮されるべきであることを示している。そのような場合、選択のためのAICの使用は魅力的な選択肢となり得る。これは、推定されるパラメータの数にペナルティを課しながらモデル適合を説明し、α=0.157を使用することに対応する。
実施例9:VECTRA-CVDスコア法の臨床因子と組み合わせたマルチバイオマーカー疾患活動性(MBDA)試験を使用した、RA患者のCVDリスクのための方法の比較
この実施例は、関節リウマチ(RA)患者の臨床因子と組み合わせた代替マルチバイオマーカー疾患活動性スコア(MBDA)を使用してCVDリスクを予測するための複数のモデルを実証する。
分析は、関節リウマチ患者の心血管疾患リスクのための方法を開発し、検証することであった。RA患者のサブ集団のセットのための方法も別に開発した(例えば、年齢で65歳以上と65歳未満とで層別化)。MBDA関連メディケアデータを使用して、CVDリスク予測アルゴリズムを開発および検証した。MBDAデータは、患者の生年月日、性別、NPIおよびMBDA試験日によってメディケアに関連付けた。メディケアにおけるMBDA試験日は、特定および非特定のCurrent Procedural Terminology(CPT)コードによって特定された。患者の適格基準は、上記実施例1で記載した。
主な転帰/従属変数:主な転帰は、心筋梗塞(MI)、脳卒中、および致命的CVDのいずれかを含む複合CVD事象までの時間であった。致命的CVDは、Xie et al.、Pharmacoepidemiology and drug safety(2018)27:740-750に記載されている、請求ベースのアルゴリズムによって特定された。
予測因子または層別化変数(下記参照):CVDの潜在的予測因子と考えられる変数には、年齢、性別、12のMBDAバイオマーカーおよび様々なMBDAスコア、人種、医師による糖尿病、高脂血症、高血圧症、肥満、喫煙、慢性腎臓疾患の診断;スタチン、他の脂質低下薬、降圧薬(ARB、ACEI、CCB、ベータ遮断剤)、グルココルチコイド使用、MTXを含むRA薬、他のcsDMARD、NSAIDおよび生物製剤の処方が含まれる。
統計的考察:Cox回帰をモデル構築に使用した。Lassoが初期変数選択に使用される。追加の変数選択は、変数ハザード比、部分尤度比検定統計量およびp値、ならびに商用試験依頼書へ含める実用的な事柄に基づいて行われる。
全体が参照により本明細書に組み込まれる、Curtis JR,Xie F,Chen L,et al.,Biomarker-related risk for myocardial infarction and serious infections in patients with rheumatoid arthritis:a population-based study,Annals of the Rheumatic Diseases 2018;Vol.77,pp.386-392も参照されたい。
CVD事象の定義:複合CVDには、MI、脳卒中および致命的CVDが含まれる。これらは以下のように定義される:MI:任意の位置(一次または二次の位置)の入院患者病院診断コードからの1つまたは複数の病院診断コード(410.x1);患者が死亡しない限り、少なくとも一晩の入院も要する;脳卒中:入院患者の退院(一次または二次の位置)からの出血性または虚血性脳卒中についての1つまたは複数の病院診断コード(430.*、431.*、433.x1,434.x1,436.*、I60.xx,I61.xx,I63.xx,I67.89);致命的なCVD:致命的なCVDは、請求ベースのアルゴリズムをPPV>=0.80(Xie et al.,Pharmacoepidemiology and drug safety(2018)27:740-750)で使用して特定される。
エンドポイント/転帰評価:複合CVD事象までの時間を、最初の適格なMBDA試験の日付と、MIもしくは脳卒中での入院または致命的CVDによる死亡の日付との差として計算した。追跡調査中に複合CVD事象を経験しなかった患者については、複合CVD事象までの時間を、最初の適格なMBDA試験の日付と最後の追跡調査の日付との差で打ち切った。
結果:以下に、実施例1のRA患者におけるCVDリスクを決定するための16の代替方法の結果を報告する。方法は、データの異なるサブセットを使用し、各モデルの変数は、MBDA(または調整MBDA)、MBDA二乗(または調整MBDA二乗)、個々のMBDAバイオマーカー、年齢、年齢二乗、および性別;および高血圧症、高脂血症または糖尿病の診断から始まる変数減少法を使用して選択された。
性別が変数である各場合、「M」は「男性」を意味し、報告されたハザード比は、女性と比較した男性のCVDリスクを反映する。いくつかの方法では、高血圧症および/またはスタチン薬の服用を有する患者を分析から除外したが、必ずしも方法の使用から除外する必要はない。
各方法では、その方法の構成要素または変数は、対応する表に列挙された「パラメータ」であり、各変数の係数を「パラメータ推定値」と呼び、各変数の統計的有意性(すなわち、p値)を「Pr>ChiSq」と呼ぶ。
例示的なROCを図10~図19に示す。
40歳以上の患者におけるMBDAおよび二乗MBDAを使用したCVDリスク法:
(表22)CVDリスクモデル
40~75歳の患者におけるMBDAおよび二乗MBDAを使用したCVDリスク法:
(表25)CVDリスクモデル
40歳以上の患者における調整MBDAおよび二乗調整MBDAを使用したCVDリスク法:
(表28)タイプ3検定
40~75歳の患者における調整MBDAおよび二乗調整MBDAを使用したCVDリスク法:
(表31)タイプ3検定
高血圧を有する患者を分析から除外した、40歳以上の患者におけるMBDAを使用したCVDリスク法:
(表34)タイプ3検定
スタチン薬を服用している患者を分析から除外した、40歳以上の患者におけるMBDAを使用したCVDリスク法:
(表37)タイプ3検定
高血圧を有するかまたはスタチン薬を服用している患者を分析から除外した、40歳以上の患者におけるMBDAを使用したCVDリスク法:
(表40)タイプ3検定
高血圧を有する患者を分析から除外した、40~75歳の患者におけるMBDAを使用したCVDリスク法:
(表43)タイプ3検定
スタチン薬を服用している患者を分析から除外した、40~75歳の患者におけるMBDAを使用したCVDリスク法:
(表46)タイプ3検定
高血圧を有するかまたはスタチン薬を服用している患者を分析から除外した、40~75歳の患者におけるMBDAを使用したCVDリスク法:
(表49)タイプ3検定
高血圧を有する患者を分析から除外した、40歳以上の患者における調整MBDAを使用したCVDリスク方法:
(表52)タイプ3検定
スタチン薬を服用している患者を分析から除外した、40歳以上の患者における調整MBDAを使用したCVDリスク法:
(表55)タイプ3検定
高血圧を有するかまたはスタチン薬を服用している患者を分析から除外した、40歳以上の患者における調整MBDAを使用したCVDリスク法:
(表58)タイプ3検定
高血圧を有する患者を分析から除外した、40~75歳の患者における調整MBDAを使用したCVDリスク法:
(表61)タイプ3検定
スタチン薬を服用している患者を分析から除外した、40~75歳の患者における調整MBDAを使用したCVDリスク法:
(表64)タイプ3検定
高血圧を有するかまたはスタチン薬を服用している患者を分析から除外した、40~75歳の患者における調整MBDAを使用したCVDリスク法:
(表67)タイプ3検定
40~75歳の患者における、年齢、性別、およびCRPを含むCVDリスクモデル:
(表70)タイプ3検定
40歳以上の患者における、年齢、性別、およびCRPを含むCVDリスクモデル:
(表72)タイプ3検定