膜貫通孔(例えば、タンパク質ナノポア又は固体ナノポア)は、バイオポリマーを検出又は特徴付けるためのセンサーとして有用であるが、膜貫通孔を用いた検出方法の精度及び/又は効率を高めるという課題は依然として存在する。例えば、ナノポアを通るヘアピンによって連結された二本鎖ポリヌクレオチドの鋳型鎖及び相補鎖の両方の転座には様々な欠点がある。このように両方の鎖を測定することは、二つの相補結合鎖からの情報を組み合わせて使用し、鋳型鎖のみの測定から得られるものより高い精度を提供することができるため、有利であるが、そのようなヘアピン結合ポリヌクレオチドの製造は、より複雑で時間がかかり、貴重な検体の損失をもたらすおそれがある。さらに、ヘアピン結合鋳型及び補体ポリヌクレオチド鎖のナノポアを通る転座は、ナノポアの反対側(トランス)での鎖の再ハイブリダイゼーションを引き起こすおそれがある。これは転座速度を変えて配列決定の精度を低下させるおそれがある。ヘアピン構造を有する鎖はまた、単一直鎖のように速く転座することがより困難である。さらに、鋳型鎖と相補鎖の現在時刻データが異なるため、二つのアルゴリズムが計算に使用される。そのため、計算をより複雑で集中的にする。
検体検出のために、通常は、一つの検体の転座と次の検体の転座との間に時間遅延がある。この遅延は数秒から数分のオーダーであり得、これはより遅い特徴付け、参照電極をより急速に消耗するより高いポア開放電流、及び/又はポアが開放される際にナノポアが塞がれる可能性の増大をもたらすおそれがある。したがって、ナノポアを用いて検体を特徴付けるための精度及び/又は効率又はスループットを向上させる方法及び組成物を開発する必要がある。
本開示は、部分的には、ヘアピンループ構造などの架橋部分を介して二本の鎖を共有結合させる必要がなく、二本鎖ポリヌクレオチドの両方の鎖が順次ナノポアを通って転座して、配列情報を提供することができるという予想外の発見に基づいている。例えば、一態様では、本発明者らは、膜貫通孔を通る一本の鎖の動きを制御しながら、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を用いて二本の鎖ポリヌクレオチドの二本鎖を分離する場合、ポアを通る第一鎖の転座の後に、第二鎖はポアの近傍にとどまってもよく、第二鎖はポアによって捕捉することができ、ポリヌクレオチド結合タンパク質はポアを通る第二鎖の動きを制御するために使用してもよいことを発見した。
別の態様では、本発明者らは、ナノポアに接合したポアタグに相補的な捕捉配列を含む二本鎖ステム付きアダプターは、二本鎖ポリヌクレオチドの各末端に提供され得、捕捉配列は鎖の分離又は巻き戻し時にのみ明らかにされることを発見した。したがって、二本鎖ポリヌクレオチドの第一鎖がタグ修飾ナノポアを通過するときに、それはアダプターの二本鎖ステムを解離して二本鎖ポリヌクレオチドの第二鎖上の捕捉配列を露出させ、次いでナノポアのポアタグで捕捉する。そのような方法は、そうでなければ通常は拡散する第二鎖を、配列決定される鋳型に続く配列決定のためにナノポアに接近するように保つ。特に、本明細書に記載の方法は、典型的なナノポア配列決定における、典型的に観察される時間の0.1%~1%と比較して、鋳型転座後の補体の後続転座の可能性を、少なくとも時間の約60%まで大幅に高めることができる。
検体をナノポアによって特徴付ける間に、一つ以上の検体が結合部位を介してナノポアに結合することができるように、複数の検体のための複数の結合部位を含むナノポアの修飾は、検体を特徴付けるための感度及び/又はスループットを高めることができることも発見された。理論に縛られることを望むことなく、ナノポアの外縁での検体の結合又は捕捉は、ポアにおける検体の局所濃度を高めることができる。さらに、特徴付けのためのナノポアの近傍の少なくとも一つ以上の検体は、次々にナノポアに容易に入ることができるため、各検体の特徴付けの間の時間遅延を減少し、その結果開孔電流時間を減少する。
したがって、本明細書の様々な態様は、ナノポア及び本明細書に記載の方法で使用することができるアダプター及びナノポアを含む組成物及びシステムを用いて、一つ以上の検体を特徴付ける方法に関する。いくつかの態様は、例えば、鋳型と二本鎖ポリヌクレオチドの補体とを接続するヘアピンを使用せずに、ナノポアを用いて二本鎖ポリヌクレオチドを特徴付けるための方法及び組成物を特徴とする。他の態様は、増大した感度及び/又はより高いスループットを有するタグ修飾ナノポアを用いて検体を特徴付けるための方法及び組成物を特徴とする。
検体(例えば、二本鎖ポリヌクレオチド)を特徴付けるための方法
一態様では、開示は標的ポリヌクレオチドを配列決定する方法を提供し、以下を含む:
(a)膜貫通孔を以下のものと接触させること:
(i)それぞれ一本鎖リーダー配列を含む標的ポリヌクレオチド及び標的ポリヌクレオチドに相補的なポリヌクレオチドが含まれている二本鎖ポリヌクレオチド、並びに
(ii)二本鎖ポリヌクレオチドの鎖を分離し、膜貫通孔を通るポリヌクレオチドの動きを制御することができるポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素);
(b)ポアを通って転座するポリヌクレオチドを検出するために、ポアを通るイオンの流れに対応する信号を検出すること;
(c)標的ポリヌクレオチドの転座に対応する信号及び標的ポリヌクレオチドに相補的なポリヌクレオチドの別個の転座に対応する配列信号を同定すること;
(d)(c)で同定された信号を解析すること、
それによって標的ポリヌクレオチドを配列決定すること。
該方法は、ステップ(a)の前に、一本鎖リーダー配列を標的及び相補的ポリヌクレオチドに付着させるステップをさらに含んでもよい。該方法は、ステップ(a)の前に、標的ポリヌクレオチドの一端を消化して相補鎖上にリーダー配列を生成するステップ、及び/又は相補ポリヌクレオチドの一端を消化して標的鎖上にリーダー配列を生成するステップをさらに含んでもよい。該方法は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)をリーダー配列に結合させることをさらに含んでもよい。(a)(ii)中のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、(a)(i)中のリーダー配列に結合されてもよい。
この態様では、第一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、二本鎖ポリヌクレオチドの標的鎖と相補鎖を分離し、膜貫通孔を通る標的ポリヌクレオチド又は相補ポリヌクレオチドのいずれかの動きを制御する。第二のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、第一のポリヌクレオチド結合タンパク質と同一種類の別のタンパク質(例えば、ポリヌクレオチド巻き戻し酵素)であってもよい、又は異なる種類のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)であってもよく、相補的ポリヌクレオチドが既にポアを通って転座した標的ポリヌクレオチド、又は標的ポリヌクレオチドが既にポアを通って転座した相補的ポリヌクレオチドのいずれかの膜貫通孔を通る動きを制御する。二本鎖ポリヌクレオチドの二本の鎖はすでに分離しているので(第一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、一本の鎖をポアに通過させながら二本の鎖を分離した)、第二のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、標的ポリヌクレオチドと相補的ポリヌクレオチドを分離する必要はない。第一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、通常は、二本鎖ポリヌクレオチドを処理するものである。第二ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、通常は、一本鎖ポリヌクレオチドを処理するものである。第一及び/又は第二のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、二本鎖ポリヌクレオチド及び一本鎖ポリヌクレオチドを処理することが可能であってもよい。
本明細書に記載の別の態様は、ナノポアを通って二つの非共有結合分子を逐次転座させるための方法を特徴とする。該方法は、ナノポアを通る非共有結合分子対の第一のメンバーの転座を促進する条件下で、一対の非共有結合分子をナノポアに接触させることを含む。ここで、ナノポアを通る第一のメンバーの転座の間に、一対の第二メンバー上の結合部位は露出し、露出した結合部位はナノポア上に存在しているタグ又はテザーに結合する。第二メンバー上の結合部位は、ナノポアを通る第一のメンバーの転座の前に露出されていない(又は遮蔽されている)。
本明細書では、用語「非共有結合分子」とは、第一のメンバー及び第二のメンバーを含む分子を指す。ここで、第一のメンバー及び第二メンバーは非共有付着方式で相互に関連しており、別個の実体として相互に分離することができる。第一のメンバーと第二メンバーとの間の分離及び結合過程は可逆的である。非共有付着の手段の例として、相補的塩基対合、イオン相互作用、疎水性相互作用、及び/又はファンデルワールス相互作用が挙げられるが、これらに限定されない。
いくつかの実施形態では、非共有結合分子は相補的ポリヌクレオチド鎖を含む。
いくつかの実施形態では、ナノポア上のタグはオリゴヌクレオチドであり、第二メンバー上の結合部位はタグに相補的な配列を有する核酸の一部である。
いくつかの実施形態では、一対の非共有結合分子は、アダプター核酸に結合した標的核酸(例えば、標的二本鎖ポリヌクレオチド)を含み、結合部位はアダプター核酸上にある。
一例としてのみ、図9Bは、相補的ポリヌクレオチド鎖(例えば、鋳型鎖及び相補鎖)及び各末端に結合したアダプター(例えば、アダプター核酸)を含む非共有結合分子を示す。図9Aに示すように、アダプターは、二本鎖ステム(5)及び二本鎖ステムの鋳型鎖から延伸する第一の一本鎖ポリヌクレオチド(1)を含む。二本鎖ステム(5)は第一の一本鎖ポリヌクレオチド(1)と整列している鎖上の捕捉配列を含む。ここで、捕捉配列はナノポアの外縁に接合したタグ(例えば、捕捉ポリヌクレオチド)に相補的である。いくつかの実施形態では、第一の一本鎖ポリヌクレオチド(1)はリーダー配列をも含んでもよい。図9Aは、二本鎖ステムの相補鎖(例えば、相補鎖)から延伸する第二一本鎖ポリヌクレオチドを示すが、必須ではない。しかしながら、いくつかの実施形態では、固体基板、例えば、膜又はビーズ、及び/又はナノポアのための一つ以上のテザーを含む一つ以上の第二一本鎖ポリヌクレオチドを有することが望ましい可能性がある。第二一本鎖ポリヌクレオチドが第一の一本鎖ポリヌクレオチドと相補的でない場合、例えば図9Aに示すように、Y-アダプターが形成される。
図9Aは、固体基板(例えば、膜又はビーズ)用の少なくとも一つのアンカーを含む例示的なアダプターを示し、図15は、少なくとも二つのアンカーを含む例示的なアダプターを示す。第一のアンカーは固体基板、例えば、膜又はビーズに係留することができ、第二のアンカーはナノポアに係留することができる。ナノポアに結合したタグに結合するように、ナノポア用の第二アンカーを構成することができる。いくつかの実施形態では、ナノポアに結合したタグに直接結合するように、ナノポア用の第二アンカーを構成することができる。例えば、ナノポア用の第二アンカーは、ナノポアに結合した捕捉ポリヌクレオチドタグに相補的な配列を含むことができる。代替的な実施形態では、ナノポアに接合したタグに間接的に結合するように、ナノポア用の第二のテザーを構成することができる。例えば、図36は、検体に付着したアダプターは、微粒子を介してナノポア上のタグに結合することができることを示し、それは以下の「微粒子」の節でさらに詳細に説明される。
本明細書に記載のアダプターは、二本鎖ポリヌクレオチドの一方又は両方の末端に付着することができることに留意すべきである。いくつかの実施形態では、同一のアダプターが二本鎖ポリヌクレオチドの両端に付着している。いくつかの実施形態では、二本鎖ポリヌクレオチドの末端に異なるアダプターを付着することができる。例えば、異なるアダプターの複数の個体群を二本鎖ポリヌクレオチドと一緒に混合することによって、二本鎖ポリヌクレオチドの末端への異なるアダプターの付着を達成することができる。通常は、異なるアダプターと付着した二本鎖ポリヌクレオチドの混合物が形成されるが、所望のヘテロアダプター混合物(例えば、精製によるか、又は二本鎖ポリヌクレオチドの末端へのアダプターの付着を制御することによる)を取得するための方法もある。
いくつかの実施形態では、二本鎖ポリヌクレオチドは、その3´末端又は5´末端にアダプターを有することができる。
平滑末端二本鎖ポリヌクレオチドは、ナノポア内に捕捉されて解離することができる。したがって、いくつかの実施形態では、アダプターを持たない平滑末端構築物(例えば、本明細書に記載のもの)は、本明細書に記載の方法の任意の態様に使用することができる。必須ではないが、いくつかの実施形態では、例えば、ナノポアによって捕捉効率を高めるために、二本鎖ポリヌクレオチドの少なくとも一端に結合したリーダー配列を有することが望ましい。
アダプターが二本鎖ポリヌクレオチドの両端に付着しているいくつかの実施形態では、当業者であれば、一つのアダプターの第一の一本鎖ポリヌクレオチドが二本鎖ポリヌクレオチドの一端で鋳型鎖に結合している場合、別のアダプターの第一の一本鎖ポリヌクレオチドは、二本鎖ポリヌクレオチドの反対側の末端で相補鎖に結合していることを容易に認識するであろう。
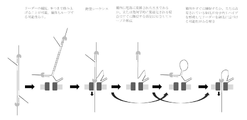
いくつかの実施形態では、アダプターは、標的ポリヌクレオチドの各末端にあらかじめ結合したポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を有することができる。いくつかの実施形態では、該方法は、標的ポリヌクレオチドの各末端でアダプターに結合するように、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を溶液中に添加することをさらに含むことができる。図10に示すように、二本鎖ポリヌクレオチドの各末端は本明細書に記載のようにアダプターに付着され、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)はアダプターにロードされる。アダプターは、ナノポアに結合したタグに相補的な捕捉配列を有する二本鎖ステムを含む(例えば、アダプターの例として図9Aを参照)。二本鎖ポリヌクレオチドを含む構築物から延伸する一本鎖ポリヌクレオチド(任意でリーダー配列を含んでもよい)がナノポア(パネルA)に入る。ナノポアに入る第一の鎖は鋳型(T)として標識付けされ、捕捉された第一の鎖の逆相補鎖は補体(C)として標識付けされる。第一の鋳型鎖がポリヌクレオチド結合タンパク質(例えば、ヘリカーゼモーターなどのポリヌクレオチド巻き戻し酵素)の制御下でポアを通過すると、補体は徐々に解離される。パネルBは、鋳型鎖の末端に向き、補体上の二本鎖ステム内の捕捉配列は解離によって露出し、それにより、ナノポア上のタグ(例えば、捕捉ポリヌクレオチド)に結合することを示す。パネルCにおいて、鋳型鎖が最終的にナノポアを通過し、酵素が解離するとき、相補鎖はナノポア上のタグ(例えば、捕捉ポリヌクレオチド)への結合を介してナノポアに結合したままである。しばらくして、相補鎖はそのリーダー配列によって捕捉される。パネルDにおいて、相補鎖は、第二ロードポリヌクレオチド結合タンパク質、例えば、ヘリカーゼモーターなどのポリヌクレオチド巻き戻し酵素の制御下でナノポアを通過する。相補鎖がナノポアを通過しているときに、捕捉配列はある時点でナノポアのタグ(例えば、捕捉ポリヌクレオチド)から解離され、その結果、次の鎖に利用可能となるように、ナノポアのタグ(例えば、捕捉ポリヌクレオチド)を放出する。この実施形態では、両方のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は二本鎖ポリヌクレオチドを処理することができる。いくつかの実施形態では、両端にロードされるポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、同一でも異なっていてもよい。
図10(パネルB)は、二本鎖内の捕捉配列(ナノポア上のタグへの結合用)は鋳型鎖の転座の終わりに向かって露出され(例えば、遠端アダプターを捕捉し、それを局所的にポアに保持する)、より一般的には、二本鎖ポリヌクレオチドのナノポアへの結合(例えば、端部又は尾部を介して)が解離プロセスの開始時にすぐに起こり得るように、鎖を設計することができることを示す。この場合、捕捉配列は、解離の全期間又は解離期間の前にナノポアへの結合のために捕捉配列が露出するように、アダプター(例えば、Yアダプター部分の非相補的アームとして)内に配置することができる。
いくつかの実施形態では、標的ポリヌクレオチドに付着したアダプターにポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を結合させる代わりに、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)をナノポアのルーメン内に固定することができる。それによって、ナノポアを通る両方の鎖の動きを制御するために、単一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を使用することができる。
いくつかの実施形態では、一方の鎖がナノポアを通って転座するときの鎖の巻き戻し又は分離は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)によって制御される。いくつかの実施形態では、一方の鎖がナノポアを通って転座するときの鎖の巻き戻し又は分離は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)の非存在下で起こる。ポリヌクレオチドの両方の鎖の動き及び/又は分離を制御するような酵素遊離方法は、当該分野において既知である。例えば、Wendell et al.「膜適合型φ29モータータンパク質ナノポアを通る二本鎖DNAの転座」Nat Nanotechnol、4(2009)、765~772頁、に記載されている、φ29モータータンパク質ナノポアを含むモータータンパク質ナノポア、及び/又は米国特許第8,986,528号に記載されているナノポアなど、特定のナノポア自体がポリヌクレオチドを巻き戻すための力を提供することができ、それぞれの内容は参照により本明細書に全体的に組み込まれる。
本明細書では、用語「転座する」又は「転座」は、ナノポアの少なくとも一部に沿った動きを指す。いくつかの実施形態では、転座はナノポアのシス側からナノポアのトランス側への動きである。
標的ポリヌクレオチドは、通常は、標的ポリヌクレオチドの複数のコピーを含む試料中及び/又は複数の異なるポリヌクレオチドを含む試料中に存在する。いくつかの実施形態では、本明細書に記載の任意の態様の方法は、試料中の一つ以上の標的ポリヌクレオチドの配列を決定することを含んでもよい。該方法は、ポアを複数の二本鎖ポリヌクレオチドと接触させることを含んでもよい。例えば、該方法は、実質的に全ての二本鎖ポリヌクレオチドがそれらの二本鎖のそれぞれに一本鎖リーダー配列を有する試料とポアを接触させることを含んでもよい。いくつかの実施形態では、二本鎖ポリヌクレオチドは相補的塩基対合を介してのみ相互に結合している。これらの実施形態では、二本鎖ポリヌクレオチドはポリヌクレオチド鎖の末端である四つの遊離端を有することができる。ポリヌクレオチド鎖の末端は、一本鎖、例えば一本鎖オーバーハング又は別のポリヌクレオチド鎖に対合する塩基であってもよい。いくつかの実施形態では、配列決定されている二本鎖ポリヌクレオチドの二本の鎖は共有付着していない(例えば、ヘアピン又は他の共有付着がない)。しかしながら、鋳型及び補体ポリヌクレオチドを架橋しない部分は、一つ以上の遊離端に付加されてもよい。
本明細書に記載の様々な態様のいくつかの実施形態では、該方法は、ナノポアと接触させる前に、試料中の実質的に全ての二本鎖ポリヌクレオチドの両方の鎖に一本鎖リーダー配列を生成する又は付着するステップをも含んでもよい。付加されたリーダー配列は、それに付着した一つ以上のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を有してもよい。それにより、二本鎖ポリヌクレオチドの個体群はそれぞれポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)がその二本の鎖のそれぞれの片端に付着したリーダー配列を含む。
標的ポリヌクレオチド(例えば、鋳型)及び標的ポリヌクレオチドに相補的なポリヌクレオチド(例えば、相補体)を含む二本鎖ポリヌクレオチドは、その各末端に付着した一本鎖リーダー配列を含むアダプターを有してもよい。いくつかの実施形態では、様々な態様の方法は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を含む。該方法は、同一でも異なっていてもよい複数のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)とポアを接触させることを含んでもよい。異なるポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、同一でも異なっていてもよい別個のリーダー配列に結合していてもよい。例えば、5´から3´への方向に作用するポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、標的ポリヌクレオチドの5´末端及び/又は相補的ポリヌクレオチドの5´末端でリーダー配列に結合していてもよい。3´から5´への方向に作用するポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、標的ポリヌクレオチドの3´末端及び/又は相補的ポリヌクレオチドの3´末端でリーダー配列に結合していてもよい。
本明細書に記載の様々な態様の方法で使用されるアダプターは、特徴付け方法の感度及び/又はスループットを向上させるために、検体(例えば、標的ポリヌクレオチド又は非共有結合分子)のナノポアへの結合を可能にするように、さらに構成されてもよい。これは、アダプターの二本鎖ステム内の捕捉配列が、非共有結合分子の第二メンバー(例えば、二本鎖ポリヌクレオチドの相補鎖)の結合を可能にするために露出している実施形態とは目的が異なり、例えば、図10に示すように、鋳型転座後の補体転座の可能性を高め、それにより配列決定情報の精度を高める。図16に示すように、アダプターは、例えば、検体の捕捉を容易にするために、ナノポアに結合するためのテザーを含むようにさらに構成されている。したがって、検体の第一のメンバー(例えば、二本鎖ポリヌクレオチドの鋳型鎖)がナノポアに入る前に、検体はそのナノポアに結合した第一のタグに結合する。第一のメンバーがポアを通って転座し、二本鎖ステムを解離して第二のメンバー上の捕捉配列を露出させるときに、第一のメンバーの後続の特徴付けのためにナノポアの近傍に保持されるように、第二のメンバーはナノポアに接合した第二のタグに結合する。アダプターの設計に応じて、ナノポア上の第一のタグと第二タグは異なっていてもよく(例えば、図16に示すように)、又は同一であってもよい(例えば、図17Aに示すように)。
したがって、本明細書で提供されるさらなる態様は、ナノポアを用いた検体の特性を決定するための方法に関し、それは以下を含む:(a)ナノポアのルーメンの外側に少なくとも複数のタグを含むように修飾されたナノポアを提供し、タグは少なくとも複数の検体に対する結合部位を提供すること、及び(b)複数の検体からの一つがナノポアを通って転座している間に、少なくとも一つ以上(例えば、少なくとも一つ、少なくとも二つ、少なくとも三つ、少なくとも四つ、少なくとも五つ、少なくとも六つ、少なくとも七つ、少なくとも八つ、少なくとも九つ、又はそれ以上)の検体がナノポア上のタグに結合するような条件下で、複数の検体をナノポアに接触させること。
例えば、ナノポアのルーメン内のアミノ酸の電荷及び/又は疎水性を変えることによって標的検体とナノポアの相互作用を改善するように修飾されたナノポアと異なり、本明細書に記載のナノポアは、特徴付けのために検体がナノポアを通って転座している間に、複数の検体を捕捉するための複数のタグを提供するように修飾されている。これにより、各検体の特徴付けの間の開孔時間を短縮し、また、検体の局所的濃度も増加し、それによって該方法の感度を向上させる。いくつかの実施形態では、下記「タグ又はテザー修飾ナノポア(例えば、ポリヌクレオチド捕捉などの検体捕捉を促進するための)」の部分に記載のタグ修飾ナノポアは、そのような目的を達成するために使用することができる。
いくつかの実施形態では、検体は、ナノポア上のタグに結合するように修飾されてもよい。いくつかの実施形態では、検体は本明細書に記載のアダプター、例えば、ナノポア用のアンカーを含むアダプターを含む。
ナノポア上のタグと検体上の結合部位(例えば、検体に付着したアダプター中にある結合部位であり、結合部位はアダプターのアンカー若しくはリーダー配列によって、又はアダプターの二本鎖ステム内の捕捉配列によって提供することができる)との間の相互作用は可逆的であってもよい。例えば、検体は、例えばそのアダプターを介してナノポア上のタグに結合し、例えばナノポアによる検体の特徴付け中のある時点で放出することができる。強い非共有結合(例えば、ビオチン/アビジン)は依然として可逆的であり、本明細書に記載の方法のいくつかの実施形態において有用である。例えば、鋳型の転座に続く二本鎖ポリヌクレオチドの補体の転座を確実にするために、補体が(ナノポアから分離してテンプレートの移動中に拡散することなく)ナノポアの近傍に保持されるが、ナノポアを通って転座するときにナノポアから放出できるように、二本鎖ポリヌクレオチドの補体(又はその補体に結合しているアダプターの一部)とナノポアとの間の十分な相互作用を提供するために、タグと検体アダプターのペアを設計することが望ましいかもしれない。
したがって、いくつかの実施形態では、本明細書に記載の方法で使用される一対のポアタグと検体アダプターは、検体上の結合部位(例えば、検体に付着したアダプターに存在する結合部位であって、結合部位は、アダプターのアンカー又はリーダー配列によって、又はアダプターの二本鎖ステム内の捕捉配列によって提供することができる)のナノポア上のタグへの結合強度又は親和性が、加えられた力がかかり結合した検体をナノポアから放出するまでの間、ナノポアと検体の間の結合を維持するのに十分であるように、構成することができる。いくつかの実施形態では、検体が二本鎖ポリヌクレオチドである場合、加えられた力はナノポアを通る相補鎖の末端の転座であってもよい。
本明細書に記載の様々な態様のいくつかの実施形態では、該方法は、膜をわたる電位の印加時に、ナノポアを通過する検体(例えば、ポリヌクレオチド)に応答して信号を検出することを更に含んでもよい。いくつかの実施形態では、電位差をイオン流をもたらす浸透圧の不均衡によって引き起こすことができる。いくつかの実施形態では、ナノポアの両側に配置された二つの電極間のナノポアにわたって電位差を印加してもよい。信号は電気測定及び/又は光学的測定であってもよい。利用可能な電気測定は、電流測定、電気抵抗測定、トンネリング又は電子トンネリング測定(Ivanov AP et al., Nano Lett.2011年1月12日;11(1):279-85)、及びFET測定(国際出願第WO2005/124888号)、例えば、電圧FET測定を含む。いくつかの実施形態では、信号は固体ナノポアを横切る電子トンネリング又は固体ナノポアを横切る電圧FET測定であってもよい。光学的測定は電気測定と組み合わせてもよい(Soni GV et al.,Rev Sci Instrum.2010年1月;81(1):014301)。測定はポアを通過するイオン電流の測定などの膜貫通電流測定であってもよい。図11A~11Bは、本明細書に記載の方法を用いてポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)の制御下でナノポアを通って二本鎖ポリヌクレオチドを配列決定する間に経時的に測定される典型的な電流信号を示す。
あるいは、測定は、Heron et al.,J.Am.Chem.Soc.,2009,131(5),1652-1653によって開示されているようなチャネルを通るイオン流を示す蛍光測定、又はFETを用いた膜を横切る電圧の測定であってもよい。いくつかの実施形態では、該方法は、膜を横切る電位を印加すると、ポリヌクレオチドがナノポアと相互作用する及び/又はナノポアを通って動く際にナノポアをイオン電流を検出することをも含んでもよい。いくつかの実施形態では、該方法はパッチクランプ又は電圧クランプを用いて実行してもよい。いくつかの実施形態では、該方法は電圧クランプを用いて実行してもよい。電気測定はStoddart D et al.,Proc Natl Acad Sci、12; 106(19):7702-7、Lieberman KR et al.,J Am Chem Soc.2010;132(50):17961-72、及び国際出願第WO2000/28312号に記載の標準的な単一チャネル記録装置を用いて実行してもよい。任意選択で、電気測定は、例えば、国際出願第WO2009/077734号及び国際出願第WO2011/067559号に記載のマルチチャネルシステムを用いて実行してもよい。
スループットを向上させ、そして内容が参照により本明細書に組み込まれる国際出願第WO2014/064443号に開示されているものなどのポリヌクレオチド鎖の測定を向上させるために、ナノポアのアレイを設けてもよい。
信号測定の解析
いくつかの実施形態では、該方法は相互作用、例えば、ポアを通るポリヌクレオチドの転座を示すポアを通るイオン流に対応する信号を検出することを含む。いくつかの実施形態では、電位差はイオン流をもたらす浸透圧の不均衡によって引き起こすことができる。いくつかの実施形態では、ポアの両側に配置される二つの電極間で膜貫通孔を横切る電位差を印加してもよい。あるいは、測定は、Heron et al.,J.Am.Chem.Soc.,2009,131(5),1652-1653によって開示されているようなチャネルを通るイオン流を示す蛍光測定であってもよい。WO2014064443に開示されているように、スループットを向上させ、そしてポリヌクレオチド鎖の測定を向上させるために、ナノポアのアレイを設けてもよい。図4は酵素制御下でナノポアを通るポリヌクレオチドの転座中に経時的に測定された典型的な電流信号を示す。ポリヌクレオチドがヘアピン、非ヌクレオチド又は修飾ヌクレオチドで結合されている場合、ヘアピンを示す信号を提供するために、ヘアピン中で提供してもよい。電流信号は、それがナノポアを転座するときにポリヌクレオチドの配列を過剰に反映する。したがって、信号のどの部分が鋳型及び相補を表すのかを決定することが可能である。通常は、酵素はナノポアを通るポリヌクレオチドをラチェットして特徴的な電流レベルを上昇させる。経時的な信号の大きさはナノポアの性質に依存し、複数のヌクレオチドが特定の時間に電流に影響を与えることができる。
いくつかの実施形態では、特定の時間に電流に影響を与えるヌクレオチドの数は、k個のヌクレオチド単位の群に依存してもよい。ここで、kは複数の整数であり、以下「k-mer」という。これはナノポアが測定されているポリマー単位よりも大きい「鈍いリーダーヘッド」を有すると概念的に考えられるかもしれない。そのような状況では、分解されるべき異なるk-merの数はkの累乗に増加する。例えば、n個の可能なポリマー単位がある場合、分解されるべき異なるk-merの数はnkである。多数のk-merを用いると、異なるk-merによって生成された測定値を処理することが困難になり、ポリマー単位の基礎となる配列を推定することを損ねる可能性がある。
電流対サンプリングデータ点は、信号の局所平均の変化を見つけようと試みる、実行中の「t-test」などの既知の解析技法を実行することによって、隣接するグループに関連付けてもよい。これらのグループはイベントと呼ばれる。特定のk-merを示すイベントは図6に示すように決定してもよい。イベントは、いくつかの要約特徴(関連するグループ内のデータ点の平均電流及びその平均電流に関する標準偏差)で表される。
いくつかの実施形態では、ポリヌクレオチド配列を決定するために、k-mer間の可能な遷移の数を考慮に入れても、また電流レベルも考慮に入れるモデルを参照してもよい。そのような解析技術は、WO2013041878に開示されており、参照により本明細書に組み込まれる。ここで、隠れマルコフモデル(HMM)などの確率論的解析技術を参照し、可能な遷移の総数を決定するために用いられる。最も可能性の高い遷移はその後ビタビアルゴリズムなどの解析技術によって決定される。リカレントニューラルネットワーク(RNN)は、HMMに代わるものとして使用してもよく、それは例えば、イベントとイベントを起こすヌクレオチドの数との潜在的な関係を記述することにおいて、HMMよりも数学的表現の自由度が高い。RNNを用いたそのような方法は、図7の例で示されており、そこでは、イベントから、他の隣接するイベントからの情報を組み込む特徴が導き出される。これは、RNN(出力が一連のデータの以前の計算に依存する数学モデル)に追加情報を提供する。最も可能性の高い遷移を通る経路を決定するためにビタビアルゴリズムがどのように使用されるかの例を図8に概略的かつ素朴に示す。
k-mer間の最も可能性の高い遷移は、k-mer配列、従ってヌクレオチド鎖のヌクレオチド配列を決定するために用いてもよい。用いられる数学的方法の性質のため、ヌクレオチド配列は多くの場合、%精度の観点から述べられる。
鋳型鎖のみの測定を含む方法では、鋳型配列を決定するために上記方法を用いてもよい。だだし、鋳型及びその逆相補体が測定される場合には、鋳型とその相補体との間の対合関係は、配列決定測定にさらなる力を提供する可能性がある。この関係を利用する特定の技術の例は、WO2013041878に開示されており、鋳型イベントti対可能なk-mer状態sk及び補体イベントcj対可能なk-mer状態の二つの行列を組み合わせて、三次元マトリクス(2D)モデルを形成する。2Dモデルは、これらの観察を説明するk-merとともに、二つの一連のイベントの最も可能性の高いアラインメントを見出す。このモデルは鋳型と相補配列の組み合わせを考慮する。
原則として、2Dベースコール側は必ず、(t i 、c j 、s k )の全てのトリプルと、鋳型イベント、補体パス、及びk-mer間の可能な関連付けの数を調べなければならない。WO201514035に開示されているように、実際には、完全な2D計算はかなり時間がかかり計算上非実用的になるため、有用な近似は2Dモデルを制約することである。
あるいは、ヌクレオチド配列は、鋳型及び補体のイベントデータ又はヌクレオチド配列を比較し、鋳型と補体との間の最適な関連付けを決定することによって決定することができる。しかしながら、該方法は、鋳型鎖と相補鎖との間の組み合わせの最も高い可能性を考慮しないので、2Dモデルの改善された精度を提供しないことになる。鋳型ベースコールと補体ベースコールを比較するコンセンサス方式の例は開示されている。
鋳型鎖及び相補鎖がヘアピンによって結合されている場合とは異なり、相補鎖は常にナノポア内へ逐次鋳型鎖をたどるとは限らない。例えば、二本鎖構築物の鋳型鎖の転座に続き、第二二本鎖構築物からの鋳型鎖がナノポアを転位させる可能性がある。さらに、鋳型(第一)鎖の転座に続き、相補(第二)鎖がナノポアの結合部位によって捕捉されない可能性がある。それは、例えば、ナノポアの一つ以上の結合部位が一つ以上の相補鎖によって既に占有されているため、結合部位が相補鎖に利用可能ではないことが原因である可能性がある。ナノポアによって捕捉されていない任意の相補鎖は、ナノポアから離れて拡散し、ナノポアによって捕捉されない可能性が高い。したがって、鋳型及び相補鎖の付加された力を利用するために、信号測定値が鋳型及びその対応する補体に対応するか否かを判断することは不可欠な第一歩である。
本明細書に記載の様々な態様のいくつかの実施形態では、該方法は標的ポリヌクレオチドの転座に対応する信号及び標的ポリヌクレオチドに相補的なポリヌクレオチドの別個の転座に対応する配列信号を同定すること、及びこうして同定された信号を解析することをも含んでもよい。上記の数学的方法で同定されたそれらの信号は、標的のヌクレオチド配列を決定するために使用してもよく、該方法は標的(鋳型)の情報及びそれに関連する利点を伴う補体の両方を利用する。
標的に対応する信号(例えば、配列信号)及びその補体であるか否かを同定するために、アラインメントの程度を決定するためにイベントを相互に位置合わせてもよい。アラインメントの程度に応じて、信号が実際に標的及びその補体に対応するか否かを決定してもよい。正の相関を作るために使用されるアラインメント%は任意に選択してもよく、例えば、95%を超えてもよい。Smith-Waterman又はNeedleman-Wunschアルゴリズムのような既知のペアワイズ整列法を用いてもよい。使用可能な整列法の適切な例は、WO2015/140535又はWO2016/059427に開示されている。
一般的には、相補鎖はその鋳型鎖を逐次的な順序でナノポア内にたどること、又はナノポアから離れて拡散することが観察されている。その特定の相補鎖と関連付けられていない更なる鎖がナノポアに入った後に相補鎖がその鋳型鎖に続く可能性ははるかに低い。鋳型と補体の対には独特の特性がある。例えば、鋳型/補体対は一般に同一の長さのヌクレオチド(イベント数)を共有する傾向がある。また、対の後続鎖は、新しい鎖よりもはるかに速くナノポアに入る可能性があり、及び/又は補体の配列決定はより速くなるなどの傾向がある。一つ以上のこれらの特性は複雑な計算解析がなくて鋳型/補体対を同定するために使用することができる。
いくつかの実施形態では、計算上の要求を減らすために、整列を鎖の隣接した測定値に制限してもよい。鎖間の鋳型-補体関係が確立されると、配列の決定は鋳型又は相補鎖の測定値、あるいは鋳型及び相補鎖の測定値を利用することができる。例えば、配列決定の精度は十分に高いとは考えられない、鋳型鎖の配列を決定し得る。そのような状況下では、該方法は、鋳型配列のみの決定によって得られるものよりも高い配列精度を提供するために、鋳型及び相補配列データの両方を考慮して配列を決定することを選択してもよい。あるいは、鋳型鎖の配列精度は十分に良いと考えられるため、鋳型及び相補配列データの両方を考慮する必要がないと考えられる。鋳型配列データが使用されているか否か、又は鋳型及び相補配列データの両方が使用されているか否かを決定する要因は、例えば、基礎となる配列に正確に呼び出すのが難しい塩基又は塩基のグループがあるか否か、又は特定の塩基が一塩基多型変異体であるか否かであってもよい。
イベントで順序関係が決定されない場合には、その特定の鎖の配列は、鋳型のみの鎖の測定に用いられるのと同一の方法で決定してもよい。イベントは順序関係が決定された場合には、その特定の鎖の配列は、鋳型鎖及び相補鎖の測定に用いられるのと同じ方法で決定してもよい。全体的な配列決定を提供するために、この情報を組み合わせてもよい。
いくつかの実施形態では、本明細書に記載の方法は、第一鎖に相補的な第二鎖が同一のナノポアを通って転座するときに生じる信号とともに、第一鎖(例えば、標的ポリヌクレオチド)が膜貫通孔を通って転座するときに生じる信号を解析することをも含んでもよい。第一鎖(例えば、標的ポリヌクレオチド)及びその相補鎖(第二鎖)は、塩基対合によって結合されている。したがって、一旦第一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)が二本鎖ポリヌクレオチドの長さに沿って移動したなら、第一鎖と第二鎖はもはや結合されない。例えば、図10を参照のこと。したがって、ナノポアを通る第二鎖の転座は、例えば、図11に示すように、ナノポアを通る第一鎖の転座とは別個のイベントであり、ここで、第一鎖と第二鎖の転座の間に約200pAの開孔電流(電流を遮断する鎖はない)が観察された。必須ではないが、第二鎖の転座は例えば、第一鎖の転座後すぐに、例えば直ちに(例えば、1秒未満)、起こることが望ましい。例えば、図13を参照のこと。
該方法は、標的ポリヌクレオチド及び標的ポリヌクレオチドに相補的なポリヌクレオチドの逐次転座に対応する信号を同定するステップを含む。逐次転座は、相補的ポリヌクレオチドが標的ポリヌクレオチドと同一のポアを通って転座する場所を含む。標的ポリヌクレオチド及び相補的ポリヌクレオチドは、どちらか一方の順序でポアを通って転座してもよい。1、2、3、4又は5~約10個のポリヌクレオチドなどの他のポリヌクレオチドは、標的ポリヌクレオチドと相補的ポリヌクレオチドとの間のポアを通過してもよい。好ましくは、標的ポリヌクレオチド及び相補的ポリヌクレオチドはどちらか一方の順序で連続的にポアを通過する。ポアは、好ましくは、ポアを通る第一の標的ポリヌクレオチド及び相補的ポリヌクレオチドの転座と、ポアを通る第二の標的ポリヌクレオチド及び相補的ポリヌクレオチドの転座との間で開放状態に戻る。
標的及び相補的ポリヌクレオチドがポアを通って連続的に通過することは、標的ポリヌクレオチド及び/又は相補的ポリヌクレオチドを膜及び/又はポアにつなぐことによって促進してもよい。二本鎖ポリヌクレオチドの二本鎖の連続的な転座を促進する他の方法は、標的ポリヌクレオチド及び/又は相補的ポリヌクレオチドを微粒子に付着させること、及び/又はポアを修飾してポリヌクレオチド捕捉を増加/増強することを含む。
標的ポリヌクレオチドの転座に対応する信号及び標的ポリヌクレオチドに相補的なポリヌクレオチドの別個の転座に対応する配列信号の同定は、バーコードを用いて促進してもよい。通常は、二本鎖バーコードは二本鎖ポリヌクレオチドに含まれる、又は二本鎖ポリヌクレオチドに付着する。標的ポリヌクレオチドと相補的ポリヌクレオチドが分離されている場合(ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)によって)、バーコードは標的ポリヌクレオチドと相補的ポリヌクレオチドの両方に保持されている。膜貫通孔を通るバーコードの転座は、そのバーコードに信号特性を作ることになる。ポアを通って転座するバーコードの二回目以降の検出は、標的ポリヌクレオチド及びその補体がポアを通って逐次転座したことを決定するために使用することができる。それによって、標的ポリヌクレオチドの転座及び標的ポリヌクレオチドに相補的なポリヌクレオチドの別個の転座に対応する信号を同定してもよい。
タグ-又はテザー-修飾ナノポア(例えば、ポリヌクレオチド捕捉などの検体捕捉を増強するため)
本明細書に記載する方法で使用するためのナノポアは、一つ以上の検体に結合するための一つ以上の結合部位を含むように修飾されている。いくつかの実施形態では、ナノポアは、検体に付着したアダプターに結合するための一つ以上の結合部位を含むように修飾してもよい。例えば、いくつかの実施形態では、ナノポアは、検体に結合したアダプターのリーダー配列に付着してもよい。いくつかの実施形態では、ナノポアは、検体に結合したアダプター中の一本鎖配列に付着してもよい。いくつかの実施形態では、ナノポアは、検体に結合したアダプターの二本鎖ステム内の捕捉配列に付着してもよく、ここで、捕捉配列は二本鎖ステムの巻き戻し時にのみ明らかにされる。
いくつかの実施形態では、ナノポアは、例えば、膜貫通孔を通る第一鎖及び第二鎖の逐次転座を容易にするために、二本鎖オリゴヌクレオチドの第一鎖又は第二鎖に付着したアダプターに結合するための一つ以上の結合部位を含むように修飾してもよい。
いくつかの実施形態では、ナノポアは、一つ以上のタグ又はテザーを含むように修飾されており、各タグ又はテザーは検体に対する結合部位を含む。
いくつかの実施形態では、ナノポアは、複数のタグ又はテザーを含むように修飾されている。例えば、ポリヌクレオチドなどの検体を特徴付ける方法(「感度タグ」)の感度を高めるために、一つのタグ又はテザーを設けることができ、一方、ポリヌクレオチドの鋳型鎖に続く相補鎖の配列決定の可能性を高めるために、別のタグ又はテザーを設けることができる(「後続タグ」)。図15に示すように、ポアタグは、いくつもの方法で構成することができる。一例として、いくつかの実施形態では、オリゴマーポアの各モノマーは、(例えば、タグA及びタグBで示されるように、複数の結合部位を有する)同じタイプのタグ構成を有することができる。タグAとタグBを単一のタグを形成するように組み合わせることができ、少なくとも一つ以上のモノマーがタグA/タグB複合タグを含む。あるいは、少なくとも一つのモノマーが他のモノマーからの異なるタグ構成を有するように、オリゴマーポアは異なるタグが付着した混合モノマーを含むことができる。別の例では、タグA及びタグBは別個のタグのままにすることができ、少なくとも一つ以上のモノマーは両方の個々のタグを含むことができる。本明細書に記載のように、感度タグ及び後続タグは、アダプターで使用される一意の配列に相補的である場合、別々に組み合わせることができる。
図16は二つの異なるタグタイプを有するナノポアを用いて溶液から鎖を捕捉する方法(感度向上のため)の概略図である。二本鎖ポリヌクレオチドの末端に付着しているアダプターは、第一のポアタグと結合するために利用可能な捕捉配列(例えば、Yアダプターの非相補的アームを形成する)を含む。解離した場合にのみ明らかになる二本鎖ステム内の別個の捕捉配列は、補体が第二のポアタグに結合することを可能にし、そして後続の配列決定のための補体捕捉を可能にする。
ナノポア上のタグと検体上の結合部位(例えば、検体に付着したアダプター中にある結合部位。ここで、結合部位はアダプターのアンカー若しくはリーダー配列によって、又はアダプターの二本鎖ステム内の捕捉配列によって提供することができる)との間の相互作用は可逆的であってもよい。例えば、検体は、例えばそのアダプターを介してナノポア上のタグに結合し、例えばナノポアによる検体の特徴付け中のある時点で放出することができる。強い非共有結合(例えば、ビオチン/アビジン)は依然として可逆的であり、本明細書に記載の方法のいくつかの実施形態において有用である。例えば、鋳型の転座に続く二本鎖ポリヌクレオチドの補体の転座を確実にするために、補体が(ナノポアから分離してテンプレートの移動中に拡散することなく)ナノポアの近傍に保持されるが、ナノポアを通って転座するときにナノポアから放出できるように、二本鎖ポリヌクレオチドの補体(又はその補体に付着しているアダプターの一部)とナノポアとの間の十分な相互作用を提供するために、タグと検体アダプターのペアを設計することが望ましいかもしれない。
したがって、本明細書に記載の様々な態様のいくつかの実施形態では、一対のポアタグと検体アダプターは、ナノポア上のタグへの検体上の結合部位(例えば、検体に付着したアダプターに存在する結合部位であって、結合部位はアダプターのアンカー又はリーダー配列、又はアダプターの二本鎖ステム内の捕捉配列によって提供することができる)のナノポア上のタグへの結合強度又は親和性が、加えられた力がかかり結合した検体をナノポアから放出するまで、ナノポアと検体の間の結合を維持するのに十分であるように、構成することができる。いくつかの実施形態では、検体が二本鎖ポリヌクレオチドである場合、加えられた力はナノポアを通る相補鎖の末端の転座であってもよい。
いくつかの実施形態では、タグ又はテザーは荷電されていない。これにより、電位差の影響下でタグ又はテザーがナノポア内に引き込まれないことを確実にすることができる。
ポリヌクレオチド又はアダプターを、引き付ける又は結合する一つ以上の分子はポアに結合していてもよい。アダプター及び/又は標的ポリヌクレオチドにハイブリダイズする任意の分子を用いてもよい。ポアに付着した分子は、PNAタグ、PEGリンカー、短いオリゴヌクレオチド、正荷電アミノ酸及びアプタマーから選択してもよい。そのような分子がポアに結合していることは当該分野において既知である。例えば、短いオリゴヌクレオチドが付着したポアは、Howarkaら(2001)Nature Biotech.19:636~639及びWO2010/086620に開示されている。ポアのルーメン内に付着したPEGを含むポアは、Howarkaら(2000)J.Am.Chem.Soc.122(11):2411-2416に記載されている。
本明細書に記載の任意の態様の方法において、オリゴヌクレオチドがリーダー配列内の配列に相補的な配列又はアダプター内の別の一本鎖配列を含む膜貫通孔に付着した短いオリゴヌクレオチドは、標的ポリヌクレオチド及び/又は相補的ポリヌクレオチドの捕捉を増強するために用いてもよい。
いくつかの実施形態では、タグ又はテザーは、オリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)を含んでも、又はそれであってもよい。オリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)は、長さが約10~30ヌクレオチド又は約10~20ヌクレオチドを有することができる。例示的なオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)は、配列番号8に記載の配列を含んでもよい。いくつかの実施形態では、タグ又はテザーに使用するためのオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)は、他の修飾箇所又は例えばビーズを含む固体基材表面への接合のために修飾された少なくとも一つの末端(例えば、3´-又は5´-末端)を有することができる。末端修飾剤は、結合に使用することができる反応性官能基を付加してもよい。付加することができる官能基の例としては、アミノ、カルボキシル、チオール、マレイミド、アミノオキシ、及びそれらの任意の組合わせが挙げられるが、これらに限定されない。官能基は、オリゴヌクレオチド配列の末端から官能基の物理的距離を加えるために、異なる長さのスペーサー(例えば、C3、C9、C12、スペーサー9及び18)と組み合わせることができる。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する5´-マレイミド修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-マレイミド修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する5´-C9-チオール修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-C9-チオール修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する5´-チオール修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-チオール修飾されたオリゴヌクレオチド(例えば、DNA、RNA、LNA、BNA、PNA又はモルフォリノ)であってもよい。
いくつかの実施形態では、タグ又はテザーは、モルフォリノオリゴヌクレオチドを含んでもよい、又はモルフォリノオリゴヌクレオチドであってもよい。モルフォリノオリゴヌクレオチドは、約10~30ヌクレオチド又は約10~20ヌクレオチドの長さを有することができる。例示的なモルフォリノオリゴヌクレオチドは、配列番号8に記載の配列を含んでもよい。モルフォリノオリゴヌクレオチドは、修飾されていても修飾されていなくてもよい。例えば、いくつかの実施形態では、モルフォリノオリゴヌクレオチドは、オリゴヌクレオチドの3´及び/又は5´末端で修飾されてもよい。モルフォリノオリゴヌクレオチドの3´及び/又は5´末端修飾の例としては、化学結合のための3´親和性タグ及び官能基(例えば、3´-ビオチン、3´-第一級アミン、3´-ジスルフィドアミド、3´-ピリジルジチオ、及びそれらの任意の組み合わせを含む)、5´末端修飾(例えば、5´-第一級アンミン、及び/又は5´-ダブチルを含む)、クリックケミストリーのための修飾(例えば、3´-アジド、3´-アルキン、5´-アジド、5´-アルキンを含む)、及びそれらの任意の組合わせが挙げられるが、これらに限定されない。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する5´-アジド修飾されたモルフォリノオリゴヌクレオチドであってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-アジド修飾されたモルフォリノオリゴヌクレオチドであってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する5´-アルキン修飾されたモルフォリノオリゴヌクレオチドであってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-アルキン修飾されたモルフォリノオリゴヌクレオチドであってもよい。いくつかの実施形態では、タグ又はテザーは、配列番号8に記載の配列を有する3´-ピリジルジチオ修飾されたモルフォリノオリゴヌクレオチドであってもよい。
いくつかの実施形態では、タグ又はテザーは、例えば、ナノポアへの結合を容易にするために、ポリマーリンカーをさらに含んでもよい。例示的なポリマーリンカーは、ポリエチレングリコール(PEG)を含むが、これに限定されない。ポリマーリンカーは、約500Da~約10kDa(両端を含む)、又は約1kDa~約5kDa(両端を含む)の分子量を有してもよい。ポリマーリンカー(例えば、PEG)は、例えば、これらに限定されないが、マレイミド、NHSエステル、ジベンゾシクロオクチン(DBCO)、アジド、ビオチン、アミン、アルキン、アルデヒド、及びそれらの任意の組合わせを含む異なる官能基で官能化することができる。いくつかの実施形態では、タグ又はテザーは、5´-マレイミド基及び3´-DBCO基を有する1kDaのPEGをも含んでもよい。いくつかの実施形態では、タグ又はテザーは、5´-マレイミド基及び3´-DBCO基を有する2kDaのPEGをさらに含んでもよい。いくつかの実施形態では、タグ又はテザーは、5´-マレイミド基及び3´-DBCO基を有する3kDaのPEGをさらに含んでもよい。いくつかの実施形態では、タグ又はテザーは、5´-マレイミド基及び3´-DBCO基を有する5kDaのPEGを更に含んでもよい。
タグ又はテザーの他の例には、Hisタグ、ビオチン又はストレプトアビジン、検体に結合する抗体、検体に結合するアプタマー、DNA結合ドメインなどの検体結合ドメイン(例えば、ロイシンジッパーのようなペプチドジッパー、一本鎖DNA結合タンパク質(SSB)を含む)、及びそれらの任意の組合わせが含まれるが、これらに限定されない。
当分野で既知の任意の方法を用いて、タグ又はテザーをナノポアの外面、例えば、膜のシス側上に付着させてもよい。例えば、一つ以上のタグ又はテザーは、一つ以上のシステイン(システイン結合)、一つ以上のリジンなどの第一級アミン、一つ以上の非天然アミノ酸、一つ以上のヒスチジン(Hisタグ)、一つ以上のビオチン又はストレプトアビジン、一つ以上の抗体に基づいたタグ、エピトープの一つ以上の酵素修飾(例えば、アセチルトランスフェラーゼを含む)、及びそれらの任意の組み合わせを介してナノポアに付着することができる。そのような修飾を実施するための適切な方法は当技術分野において既知である。適切な非天然アミノ酸は、4-アジド-L-フェニルアラニン(Faz)及びLiu C.C.及びSchultz P.G.,Annu.Rev.Biochem.,2010,79,413-444の図1における1~71が附番されたいずれかのアミノ酸を含むが、これらに限定されない。
いくつかの実施形態では、一つ以上のタグ又はテザーがシステイン結合(複数可)を介してナノポアに付着している場合、一つ以上のシステインを置換によりナノポアを形成する一つ以上のモノマーに導入することができる。いくつかの実施形態では、ナノポアは、以下の付着によって化学的に修飾してもよい:(i)4-フェニルアゾマレイナニル、1.N-(2-ヒドロキシエチル)マレイミド、N-シクロヘキシルマレイミド、1.3-マレイミドプロピオン酸、1.1-4アミノフェニル-1H-ピロール,2,5,ジオン、N-エチルマレイミド、N-メトキシカルボニルマレイミド、N-tert-ブチルマレイミド、N-(2-アミノエチル)マレイミド、3-マレイミド-プロキシル、N-(4-クロロフェニル)マレイミド、1-[4-(ジメチルアミノ)-3,5-ジニトロフェニル]-1H-ピロール-2,5-ジオン、N-[4-(2-ベンズイミダゾリル)フェニル]マレイミド、N-[4-(2-ベンゾオキサゾリル)フェニル]マレイミド、N-(1-ナフチル)-マレイミド、N-(2,4-キシリル)マレイミド、N-(2,4-ジフルオロフェニル)マレイミド、N-(3-クロロ-パラ-トリル)-マレイミド、1-(2-アミノ-エチル)-ピロール-2,5-ジオンヒドロクロリド、1-シクロペンチル-3-メチル-2,5-ジヒドロ-1H-ピロール-2,5-ジオン、1-(3-アミノプロピル)-2,5-ジヒドロ-1H-ピロール-2,5-ジオンヒドロクロリド、3-メチル-1-[2-オキソ-2-(ピペラジン-1-イル)エチル]-2,5-ジヒドロ-1H-ピロール-2,5-ジオンヒドロクロリド、1-ベンジル-2,5-ジヒドロ-1H-ピロール-2,5-ジオン、3-メチル-1-(3,3,3-トリフルオロプロピル)-2,5-ジヒドロ-1H-ピロール-2,5-ジオン、1-[4-(メチルアミノ)シクロヘキシル]-2,5-ジヒドロ-1H-ピロール-2,5-ジオントリフルオロ酢酸、SMILES O=C1C=CC(=O)N1CC=2C=CN=CC2、SMILES O=C1C=CC(=O)N1CN2CCNCC2、1-ベンジル-3-メチル-2,5-ジヒドロ-1H-ピロール-2,5-ジオン、1-(2-フルオロフェニル)-3-メチル-2,5-ジヒドロ1H-ピロール-2,5-ジオン、N-(4-フェノキシフェニル)マレイミド、N-(4-ニトロフェニル)マレイミドなどのジアブロモマレイミドを含むマレイミド、(ii)3-(2-ヨードアセトアミド)-プロピル、N-(シクロプロピルメチル)-2-ヨードアセトアミド、2-ヨード-N-(2-フェニルエチル)アセトアミド、2-ヨード-N-(2,2,2-トリフルオロエチル)アセトアミド、N-(4-アセチルフェニル)-2-ヨードアセトアミド、N-(4-(アミノスルホニル)フェニル)-2-ヨードアセトアミド、N-(1,3-ベンゾチアゾール-2-YL)-2-ヨードアセトアミド、N-(2、6-(ジエチルフェニル)-2-ヨードアセトアミド、N-(2-ベンゾイル-4-クロロフェニル)-2-ヨードアセトアミドなどのヨードアセトアミド、(iii) N-(4-(アセチルアミノ)フェニル)-2-ブロモアセトアミド、N-(2-アセチルフェニル)-2-ブロモアセトアミド、2-ブロモ-N-(2-シアノフェニル)アセトアミド、2-ブロモ-N-(3-((トリフルオロメチル)フェニル)アセトアミド、N-(2-ベンゾイルフェニル)-2-ブロモアセトアミド、2-ブロモ-N-(4-フルオロフェニル)-3-メチルブタンアミド、N-ベンジル-2-ブロモ-N-フェニルプロピオンアミド、N-(2)-ブロモ-ブチル)-4-クロロ-ベンゼンスルホンアミド、2-ブロモ-N-メチル-N-フェニルアセトアミド、2-ブロモ-N-フェネチル-アセトアミド、2-アダマンタン-1-イル-2-ブロモ-N-シクロヘキシル-アセタミド、2-ブロモ-N-(2-メチルフェニル)ブタンアミド、モノブロモアセトアニリドなどのブロモアセトアミド、(iv)アルドリチオール-2、アルドリチオール-4、イソプロピルジスルフィ、1-(イソブチルジスルファニル)-2-メチルプロパン、ジベンジルジスルフィド、4-アミノフェニルジスルフィド、3-(2-ピリジルジチオ)プロピオン酸、3-(2-ピリジルジチオ)プロピオン酸ヒドラジド、3-(2-ピリジルジチオ)プロピオン酸N-スクシンイミジルエステル、am6amPDP1-βCDなどのジスルフィド、
及び(v)4-フェニルチアゾール-2-チオール、プルパルド、5,6,7,8-テトラキノゾリン-2-チオールなどのチオール。
いくつかの実施形態では、タグ又はテザーは、ナノポアに直接又は一つ以上のリンカーを介して付着してもよい。タグ又はテザーは、WO2010/086602に記載のハイブリリンカーを用いてナノポアに付着してもよい。あるいは、ペプチドリンカーを使用してもよい。ペプチドリンカーはアミノ酸配列である。ペプチドリンカーの長さ、可撓性及び親水性は、通常は、モノマー及びポアの機能を妨げないように設計される。好ましい可撓性ペプチドリンカーは2~20個、例えば、4、6、8、10又は16個のセリン及び/又はグリシンアミノ酸のストレッチである。より好ましい可撓性リンカーとしては、(SG)1、(SG)2、(SG)3、(SG)4、(SG)5及び(SG)8であって、Sはセリンであり、Gはグリシンである。好ましい剛性リンカーは、2~30個、例えば4、6、8、16又は24個のプロリンアミノ酸のストレッチである。より好ましい剛性リンカーは、Pがプロリンである、(P)12を含む。
膜貫通孔は、ポリヌクレオチドの捕捉を増強するように修飾されてもよい。例えば、ポアは、ポアの入口内及び/又はポアのバレル内にある正電荷を増加させるように修飾されてもよい。そのような修飾は当技術分野において既知である。例えば、WO2010/055307はポアのバレル内の正電荷を増加させるα溶血素の突然変異を開示している。
ポリヌクレオチド捕捉を増強する突然変異を含む修飾MspA、リセニン及びCsgGポアはそれぞれWO2012/107778、WO2013/153359及びWO2016/034591に開示されている。これらの刊行物に開示されている修飾ポアはいずれも本明細書で用いてもよい。
いくつかの実施形態では、CsgGナノポアは、本明細書に記載のように、一つ以上のタグ又はテザーを含むように修飾してもよい。一つ以上のタグ又はテザー(複数可)は、以下の一つ以上のアミノ酸修飾により、CsgGナノポアの一つ以上(例えば、1、2、3、4、5、6、7、8、9、又はそれ以上)のモノマーに付着することができる:配列番号7のT3、K7、R11、Q19、K22、A29、T31、R76、N102、G103、N108、R110、Q114、E170、C215、L216、D238、A243、D248、及びH255。いくつかの実施形態では、一つ以上のタグ又はテザー(複数可)は、以下の一つ以上のアミノ酸置換により、CsgGナノポアの一つ以上のモノマー(例えば、1、2、3、4、5、6、7、8、9、又はそれ以上)に付着することができる:配列番号7のT3C、K7C、R11C、Q19C、K22C、A29C、T31C、R76C、E170C、D238C、A243C、D248C、H255C、C215A/T/S/M/G/I/L、L216V。
いくつかの実施形態では、CsgGナノポアは、ナノポアを通る検体の捕捉及び/又は転座を改善し、検体(例えば、ポリヌクレオチド)認識又は識別を改善し、ポリヌクレオチド巻き戻し酵素との相互作用を改善し、及び/又は信号対雑音比を改善するために、更に修飾することができる。例えば、いくつかの実施形態では、CsgGナノポアを形成するモノマーのうちの少なくとも一つは、WO2016/034591に開示されているように、一つ以上の突然変異を含むことができる。
いくつかの実施形態では、CsgGナノポアは、アミノ酸置換の以下の組合わせのうちの一つ(配列番号7を参照)を含むことができる:(T3C);(K7C);(R11C);(Q19C);(K22C);(A29C);(T31C);(R76C);(E170C);(D238C);(A243C);(D248C);(H255C);(C215A);(C215T);(C215S);(C215M);(C215G);(C215I);(C215L);(C215A,L216V);(A29C,C215T);(T31C,C215T);(R76C,C215T);(T3C,C215A);(K7C,C215A);(R11C,C215A);(Q19C,C215A);(K22C,C215A);(A29C,C215A);(T31C,C215A);(R76C,C215A);(E170C,C215A);(C215A,D238C);(C215A,A243C);(C215A,D248C);(C215A,H255C);(R76C,N91R,C215A);(R76C,N91R,C215A);(R76C,C215A);及び(R76C,C215T)。
ポリヌクレオチド
ポリヌクレオチドはデオキシリボ核酸(DNA)又はリボ核酸(RNA)などの核酸であり得る。標的ポリヌクレオチドは、一本鎖DNAにハイブリダイズした一本鎖RNAを含むことができる。ポリヌクレオチドは、ペプチド核酸(PNA)、グリセロール核酸(GNA)、トレオース核酸(TNA)、ロックド核酸(LNA)、又はヌクレオチド側鎖を有する他の合成ポリマーなどの当該技術分野において既知の任意の合成核酸であってもよい。PNA骨格はペプチド結合によってリンクした繰り返しN-(2-アミノエチル)-グリシン単位からなる。GNA骨格はホスホジエステル結合によってリンクした繰り返しグリコール単位からなる。TNA骨格はホスホジエステル結合によって相互にリンクした繰り返しトレオース糖からなる。LNAは、上記のように、リボース部分における2´酸素及び4´炭素を連結する余分な架橋を有するリボヌクレオチドから形成される。
ポリヌクレオチドは、好ましくはDNA、RNA、又はDNA若しくはRNAハイブリッド、最も好ましくはDNAである。標的ポリヌクレオチドは二本鎖であってもよい。標的ポリペプチドは、一本鎖領域及びヘアピンループ、三重鎖及び/又は四重鎖などの他の構造を有する領域を含んでもよい。DNA/RNAハイブリッドは同一鎖上にDNA及びRNAを含んでもよい。好ましくは、DNA/RNAハイブリッドはRNA鎖にハイブリダイズした一本のDNA鎖を含む。
いくつかの実施形態では、標的ポリヌクレオチドはヘアピン構造又は鋳型と補体を連結するためのいかなる共有結合も含まない。いくつかの実施形態では、標的ポリヌクレオチド(例えば、鋳型)及び標的ポリヌクレオチドに相補的なポリヌクレオチド(例えば、補体)は、ヘアピンループ構造などの架橋部分によってリンクされていない。しかしながら、いくつかの実施形態では、一本鎖(例えば、鋳型又は補体)がナノポアを通って転座するとき、鎖自体はその両端でのアダプターの相互作用によってヘアピン構造を形成することができる。例えば、図19を参照のこと。そのようなアダプター設計は、例えば、鎖の他端をナノポアの近傍に維持することによって、長いポリヌクレオチドを特徴付けるのに有益である。
標的ポリヌクレオチドは任意の長さであり得る。例えば、ポリヌクレオチドは、少なくとも10、少なくとも50、少なくとも100、少なくとも150、少なくとも200、少なくとも250、少なくとも300、少なくとも400、又は少なくとも500のヌクレオチド又はヌクレオチド対の長さであり得る。標的ポリヌクレオチドは、1000以上のヌクレオチド若しくはヌクレオチド対、又は5000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は100000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は500,000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は1,000,000以上のヌクレオチド又はヌクレオチド対の長さ、又は10,000,000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は100,000,000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は200,000,000以上のヌクレオチド若しくはヌクレオチド対の長さ、又は染色体の全長であり得る。標的ポリヌクレオチドはオリゴヌクレオチドであってもよい。オリゴヌクレオチドは、通常は、50以下のヌクレオチド、例えば40以下、30以下、20以下、10以下、又は5以下のヌクレオチドを有する短いヌクレオチドポリマーである。標的オリゴヌクレオチドは、好ましくは、約15~約30ヌクレオチド長、例えば約20~約25ヌクレオチド長である。例えば、オリゴヌクレオチドは、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、又は約30ヌクレオチド長であり得る。
標的ポリヌクレオチドはより長い標的ポリヌクレオチドの断片であってもよい。この実施形態では、より長い標的ポリヌクレオチドは、通常は、複数のより短い標的ポリヌクレオチドなどの、複数に断片化される。本発明の方法は、2、3、4、5又はそれ以上のそのようなより短い標的ポリヌクレオチドなどの一つ以上を配列決定するために使用することができる。
いくつかの実施形態では、本明細書に記載の様々な態様の方法を、試料中の2、3、4又は5~10、15、20又はそれ以上のポリヌクレオチドなどの複数の標的ポリヌクレオチドをサンプリングするために使用してもよい。
いくつかの実施形態では、本明細書に記載の様々な態様の方法を、試料中に二本鎖の形で存在しているポリヌクレオチドを配列決定するために使用してもよい。
いくつかの実施形態では、二本鎖ポリヌクレオチドを生成するように、一本鎖ポリヌクレオチドの補体の最初の合成によって一本鎖ポリヌクレオチドを配列決定するために、本明細書に記載の様々な態様の方法を使用してもよい。例えば、一本鎖ポリヌクレオチドはmRNAなどのRNAであってもよく、本発明の方法における配列決定用の二本鎖ポリヌクレオチドを生成するために、相補的cDNA鎖を合成してもよい。例えば、一本鎖ポリヌクレオチドはDNAであってもよく、本発明の方法における配列決定用の二本鎖DNAポリヌクレオチドを生成するために、相補鎖を合成してもよい。
いくつかの実施形態では、ポリヌクレオチドは連結されたポリヌクレオチドであってもよい。ポリヌクレオチドを連結する方法はPCT/GB2017/051493に記載されている。一実施形態では、ポリヌクレオチドを結合するために使用される付着方法はクリックケミストリーである。この実施形態では、第一の二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)は、鋳型及び補体が共有結合していないときにナノポアを用いて特徴付けられる。鋳型及び補体が分離されると、第一の二本鎖ポリヌクレオチドに連結された後続アダプター中のポアテザーに相補的な配列が補体中に露出され、補体はナノポアに付着したポアテザーに結合する。この実施形態では、相補鎖が第二の二本鎖ポリヌクレオチドに連結することができるように、連結アダプターもまた第一の二本鎖ポリヌクレオチドに連結される。
モータータンパク質と放出タンパク質を含む連結アダプター複合体を製造してもよい。この連結アダプターは、標的ポリヌクレオチドの両端に連結してもよい。モータータンパク質及び放出タンパク質の両方は、ポリヌクレオチドがポアによって捕捉されるまで、連結アダプター複合体上に失速し得る。第一のポリヌクレオチドが捕捉されると、ブロッキングケミストリーは両タンパク質によって克服され、モータータンパク質は以前のように、ポリヌクレオチドとポアとの相互作用を制御する。モータータンパク質よりも速く転座することができる放出タンパク質は、連結アダプター複合体のリーダー鎖の5´核酸配列に相補的なハイブリダイゼーション部位を放出するために第一のポリヌクレオチドの3´に達する。このハイブリダイゼーション部位が明らかになると、第二のポリヌクレオチドが、次いで、明らかにされた部位にハイブリダイズし、第一のポリヌクレオチドの3´末端から第二のポリヌクレオチドの5´への共有結合が起こり得る(図43)。標的ポリヌクレオチドの更なる連結のために、次いで、このプロセスを繰り返す。
一実施形態では、二本鎖標的ポリヌクレオチドを特徴付けかつ連結する方法を提供し、ここで、付着方法は非共有的である。この実施形態では、第一の二本鎖標的ポリヌクレオチドの相補鎖は、第二の二本鎖標的ポリヌクレオチドを補充し、それをポアに局所的に集中させる。次に、第一の相補鎖が配列決定されると、補充された第二の二本鎖標的ポリヌクレオチドは相補鎖から脱ハイブリダイズし、代わりにポアテザーにハイブリダイズする。これにより、第一及び第二(及びそれに続く、第三、第四、第五など)の二本鎖標的ポリヌクレオチドが鎖間が最短時間でポアを通って相次いで続くことを可能にする。第一の標的ポリヌクレオチドが配列決定されている間に第二標的ポリヌクレオチドを補充することができるため、二本鎖標的ポリヌクレオチドの濃度が低い場合、これは特に有用である。
別の実施形態では、二本鎖標的ポリヌクレオチドを特徴付け、連結する方法は、例えば、付着方法が非共有的である場合は、二成分型フィッシングテザーを用いて実行してもよい。それは観察されるイベントの割合を増やすために、後続の配列及びポアテザーのための第二のハイブリダイゼーション部位を提供する。
一実施形態では、例えば、付着方法が非共有的である場合に、多くの二本鎖標的ポリヌクレオチドを特徴付け連結する方法を、2~20個、例えば4、5、6、8、10、12又は15個などの複数の二本鎖標的ポリヌクレオチドをポアにもたらすために、使用してもよい。第一の二本鎖標的ポリヌクレオチドの相補鎖は、他の二本鎖標的ポリヌクレオチドを補充し、それらをポアの近傍に集中させ得る。これは、一般的なバルク溶液中よりもポアの周りにより高い局所濃度を提供し、その結果、二本鎖標的ポリヌクレオチドは鎖間の最短時間で開放ポアを通って相次いで追従する。これは二本鎖標的ポリヌクレオチドの濃度が低い場合に特に有用である。この実施形態では、一本鎖結合タンパク質に結合したオリゴからなるテザーを使用してもよい。第一の二本鎖標的ポリヌクレオチドの鋳型鎖を配列決定するとき、相補鎖をssDNAとして溶液中に放出する。他の二本鎖標的ポリヌクレオチドの一本鎖結合タンパク質はssDNAに結合することができる。後続プロセスの一部として、相補鎖を配列決定するとき、相補鎖の3´をポアに向かって引き戻す。ssDNA相補鎖上の一本鎖結合タンパク質は、ポアを通る補体の動きを制御するモータータンパク質に遭遇したとき、相補鎖から置換され、そしてポアの周囲に堆積して局所濃度を増加させる。これを図44に示す。標的ポリヌクレオチドの配列が既知の場合、相補鎖のタイル部分に使用することができるポアテザーの3´にも相補的配列が付加されている限り、そのような検体のトロールを実行することができる。
試料
検体(タンパク質、ペプチド、分子、ポリペプチド、ポリヌクレオチドなどを含む)は試料中に存在してもよい。試料は任意の適切な試料であってもよい。試料は生体試料であってもよい。本明細書に記載される方法の任意の実施形態は、任意の有機体又は微生物から得られた又は抽出された試料に対してインビトロで実施してもよい。有機体又は微生物は、通常は、古細菌、原核生物、又は真核生物であり、通常は、植物界、動物界、真菌界、モネラ界、及び原生生物界の五界のうちの一つに属する。本明細書に記載の様々な態様の方法は、任意のウイルスから得られた又は抽出された試料に対してインビトロで実施してもよい。
試料は、好ましくは、流体試料である。試料は、通常は、体液を含む。体液はヒト又は動物から取得してもよい。ヒト又は動物は、疾患を有する、疾患を有する疑いがある、又は疾患の危険性があるものであってもよい。試料は尿、リンパ液、唾液、粘液、精液、又は羊水であってもよいが、好ましくは、全血、血漿、又は血清である。通常は、試料はヒト由来のものであるが、代わりに、別の哺乳動物由来のもの、例えば、ウマ、ウシ、ヒツジ又はブタなどの商業的に飼育されている動物由来のもの、あるいはネコ又はイヌなどのペットであってもよい。
あるいは、植物由来の試料は、通常は、穀物、豆類、果物、又は野菜などの市販の作物、例えば、小麦、大麦、オート麦、セイヨウアブラナ、トウモロコシ、大豆、米、バナナ、リンゴ、トマト、ジャガイモ、ブドウ、タバコ、豆、レンズ豆、サトウキビ、ココア、綿、茶又はコーヒーから取得する。
試料は非生体試料であってもよい。非生体試料は、好ましくは、液状試料である。非生体試料の例には、外科用流体、飲料水、海水又は河川水などの水、及び臨床検査用の試薬が含まれる。
アッセイする前に、例えば、遠心分離によって、又は赤血球などの不要な分子又は細胞を除去する膜を通過させることによって、試料を処理してもよい。採取した直後に試料を測定してもよい。試料はまた、通常は、アッセイ前に、好ましくは-70°以下で保存してもよい。
いくつかの実施形態では、試料はゲノムDNAを含んでもよい。ゲノムDNAは断片化してもよく、本明細書に記載の方法はいずれもゲノムDNAを断片化することをさらに含んでもよい。DNAは任意の適当な方法によって断片化してもよい。例えば、DNAを断片化する方法は当該技術分野において既知である。そのような方法は、MuAトランスポザーゼなどのトランスポザーゼ又は市販のGチューブを使用してもよい。
リーダー配列
リーダー配列は、通常は、ポリマーを含む。ポリマーは、好ましくは、負に荷電されている。ポリマーは、好ましくは、DNA又はRNAなどのポリヌクレオチド、(無塩基DNAなどの)修飾ポリヌクレオチド、PNA、LNA、ポリエチレングリコール(PEG)又はポリペプチドである。リーダーは、好ましくは、ポリヌクレオチドを含み、より好ましくは、一本鎖ポリヌクレオチドを含む。一本鎖リーダー配列は、最も好ましくは、ポリdT切片などのDNAの一本鎖を含む。リーダー配列は、好ましくは、一つ以上のスペーサーを含む。
リーダー配列は任意の長さであり得るが、通常は、20~150ヌクレオチド長などの10~150ヌクレオチド長である。リーダーの長さは、通常は、該方法で使用される膜貫通孔に依存する。
リーダー配列は、膜貫通孔中に優先的に入り、それによってポアを通るポリヌクレオチドの移動を促進する。リーダー配列は、また、本明細書で論じるように、ポリヌクレオチドを一つ以上のアンカーにリンクするために使用することができる。
通常は、リーダー配列は、標的ポリヌクレオチドの一端及び標的ポリヌクレオチドに相補的なポリヌクレオチドの一端にある。リーダー配列は、標的ポリヌクレオチドの5´末端及び標的ポリヌクレオチドの補体の5´末端に存在してもよい。あるいは、リーダー配列は、標的ポリヌクレオチドの3´末端及び標的ポリヌクレオチドの補体の3´末端に存在してもよい。リーダー配列は、標的ポリヌクレオチドの5´末端及び相補的ポリヌクレオチドの3´末端に存在してもよく、又はその逆でもよい。これらの後者の実施形態では、二つの異なるポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)が通常は、使用され、ここで、第一のポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は5´から3´の方向にポリヌクレオチドに沿って移動する。ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、3´から5´の方向にポリヌクレオチドに沿って移動する。
リーダー配列は、任意の適切な方法によって二本鎖ポリヌクレオチドに付着してもよい。例えば、リーダー配列は、標的ポリヌクレオチド及び/又はその補体に連結してもよい。あるいは、リーダー配列は、他方の鎖上に一本鎖オーバーハングを生成するように二本鎖ポリヌクレオチドの一方の鎖を消化することによって、生成してもよい。
ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、標的ポリヌクレオチド又はその補体への付着の前に、リーダー配列に結合してもよい。ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、二本鎖ポリヌクレオチド中に存在するリーダー配列に結合してもよい。リーダー配列に結合したポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)の活性は、ポリヌクレオチドが膜貫通孔に接触するまで失速し得る。ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を失速させる方法は、当技術分野において、例えばWO2014/135838で知られている。
アダプター
リーダー配列はアダプター中に存在してもよく、ここで、アダプターは二本鎖領域(例えば、二本鎖ステム)及び少なくとも一つの一本鎖領域を含む。一本鎖領域の少なくとも一つはリーダー配列であってもよい。アダプターは少なくとも一つの非ポリヌクレオチド領域を含んでもよい。標的二本鎖ポリヌクレオチドの両端に付着したアダプターは同一でも異なっていてもよい。好ましくは、対となるアダプターは同一である。
リーダー配列はアダプターの一方の鎖の5´末端(又は3´末端)の第一の一本鎖領域に存在するのが好ましい。第二の一本鎖の領域は、アダプターの他方の鎖の3´末端(又は5´末端)に存在してもよい。第一及び第二の一本鎖領域は相補的ではない。この実施形態では、アダプターはYアダプターと呼ばれることがある。
Yアダプターは、通常は、(a)二本鎖領域(例えば、二本鎖ステム)、及び(b)一本鎖領域又は他方の末端に相補的ではない領域を含む。Yアダプターは、一本鎖領域を含む場合、オーバーハングを有すると記載してもよい。二本鎖部分と異なり、二本の鎖が通常は相互にハイブリダイズしないので、Yアダプター中の非相補領域の存在はアダプターにそのY形状を与える。Yアダプターは一つ以上のアンカーを含んでもよい。
いくつかの実施形態では、アダプターは、ナノポア上の一つ以上(例えば、少なくとも一つ、少なくとも二つ、少なくとも三つ又はそれ以上)のタグに対する一つ以上(例えば、少なくとも一つ、少なくとも二つ、少なくとも三つ又はそれ以上)の結合部位を含んでもよい。いくつかの実施形態では、ナノポア上のタグに対する結合部位は、二本鎖領域の二本の鎖の分離時に結合部位が露出するように、二本鎖領域(例えば、二本鎖ステム)内にあってもよい。例えば、図10を参照のこと。追加的又は代替的に、ナノポア上のタグに対する結合部位は、アダプターの一本鎖部分上にあってもよい。一例としてのみ、図9Aは固体基板、例えば膜又はビーズ用の少なくとも一つのアンカーを含む例示的なアダプターを示す一方、図15は少なくとも二つのアンカーを含む例示的なアダプターを示し、第一のアンカーは固体膜、例えば膜又はビーズに結合することができ、第二のアンカーはナノポアに結合することができる。ナノポアに接合したタグに結合するように、ナノポア用の第二アンカーを構成することができる。
Yアダプターは、好ましくは、ポア内に優先的に入るリーダー配列を含む。
Yアダプターは当該分野で既知の任意の方法を用いてポリヌクレオチドに付着していてもよい。例えば、T4 DNAリガーゼ、大腸菌DNAリガーゼ、Taq DNAリガーゼ、Tma DNAリガーゼ及び9°N DNAリガーゼなどのリガーゼなどを用いて、アダプターの一方又は両方を連結してもよい。
好ましい実施形態では、二本鎖ポリヌクレオチド、例えば、試料中の二本鎖ポリヌクレオチドは、両端にYアダプターを含むために修飾される。任意の修飾方法を使用することができる。該方法は、アダプターを付加することによって二本鎖標的ポリヌクレオチドを修飾することを含んでもよい。
二本鎖ポリヌクレオチドは、ポリヌクレオチドをMuAトランスポザーゼ及び二本鎖MuA基質の個体群と接触させることによって、Yアダプターなどのアダプター、又はアンカーを備えていてもよい。トランスポザーゼは二本鎖ポリヌクレオチドを断片化し、MuA基質を断片の一方又は両方の末端に連結する。これにより、アダプター又はアンカーを含む複数の修飾二本鎖ポリヌクレオチドを生成する。次いで、本発明の方法を用いて修飾二本鎖ポリヌクレオチドを調査してもよい。
これらのMuAに基づく方法はWO2015/022544及びWO2016/059363に開示されている。それらは、WO2015/150786でも詳論されている。
アダプターは、標的ポリヌクレオチドを含む二本鎖ポリヌクレオチドを結合するためのアンカー及び/又は膜貫通孔又は孔を含む膜に対するその補体をも含んでもよい。すなわち、アダプターは膜テザー又はポアテザーをも含んでもよい。アンカーは、好ましくは、リーダー配列ではない一本鎖領域に付着している。
ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)はアダプター中のリーダー配列に結合していてもよく、又はポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)はアダプターが二本鎖ポリヌクレオチドに付着された後に付加してもよい。リーダー配列に結合したポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)の活性は、ポリヌクレオチドが膜貫通孔に接触するまで失速する可能性がある。
リーダー配列又はアダプターは、任意の適切な方法によって二本鎖ポリヌクレオチドに付着してもよい。例えば、リーダー配列は標的ポリヌクレオチド及び/又はその補体に連結してもよく、又はアダプターは二本鎖ポリヌクレオチドに連結してもよい。
いくつかの実施形態では、二本鎖バーコード配列は、標的二本鎖ポリヌクレオチドの一方又は両方の末端に連結してもよい。バーコード配列は、リーダー配列又はアダプターが付加される前に、二本鎖ポリヌクレオチドに付加してもよい。例えば、バーコード配列は、標的二本鎖ポリヌクレオチドの末端とアダプターとの間に位置してもよい。好ましくは、バーコード配列はアダプターに含まれている。
一意のバーコード配列は、試料中の各二本鎖ポリヌクレオチドに付着、例えば、連結してもよい。バーコード配列は、標的ポリヌクレオチド及び標的ポリヌクレオチドに相補的なポリヌクレオチドのポアを通る逐次転座に対応する信号を同定するために用いてもよい。
いくつかの実施形態では、本明細書に記載のアダプターは、あらかじめ結合したポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)が、二本鎖ポリヌクレオチドに沿って移動したり巻き戻したりするのを防ぐための一つ以上のスペーサーを含むことができる。これらのスペーサーは、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)がポアに位置し、ポアを横切って電位差を印加するまで、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)の更なる動きを防ぐ。電位差による追加の力は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)をスペーサー上に押し、巻き戻してナノポアを通るポリヌクレオチドの動きを制御することを可能にする。したがって、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)による動きは、通常は、ポリヌクレオチドがナノポア内に場合にのみ起こり、それ以前では起こらない。ポリヌクレオチドがナノポア内に入るまで、あらかじめ結合したポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)が二本鎖ポリヌクレオチドに沿って移動したり巻き出したりするのを防ぐためのスペーサー及び方法の例は、例えば、WO2015/110813に記載されており、その内容全体が参照により本明細書に組み込まれる。
バーコード
ポリヌクレオチドバーコードは、当該技術分野において既知である(Kozarewa,I.et al.,(2011),Methods Mol.Biol.733,p279-298)。バーコードは、特定の既知の方法でポアを通る電流に影響を与えるポリヌクレオチドの特定の配列である。
バーコードはヌクレオチド配列を含んでもよい。ヌクレオチドは、通常は、核酸塩基、糖、及び少なくとも一つのリン酸基を含む。核酸塩基は、通常は、複素環である。核酸塩基は、プリン及びピリミジン、より具体的にはアデニン、グアニン、チミン、ウラシル及びシトシンを含むが、これらに限定されない。糖は、通常は、ペントース糖である。ヌクレオチド糖は、リボース及びデオキシリボースを含むが、これらに限定されない。ヌクレオチドは、通常は、リボヌクレオチド又はデオキシリボヌクレオチドである。ヌクレオチドは、通常は、一リン酸、二リン酸、又は三リン酸を含む。リン酸は、ヌクレオチドの5´又は3´側に付着してもよい。
ヌクレオチドは、アデノシン一リン酸(AMP)、アデノシン二リン酸(ADP)、アデノシン三リン酸(ATP)、グアノシン一リン酸(GMP)、グアノシン二リン酸(GDP)、グアノシン三リン酸(GTP)、チミジン一リン酸(TMP)、チミジン二リン酸(TDP)、チミジン三リン酸(TTP)、ウリジン一リン酸(UMP)、ウリジン二リン酸(UDP)、ウリジン三リン酸(UTP)、シチジン一リン酸(CMP)、シチジン二リン酸(CDP)、シチジン三リン酸(CTP)、5-メチルシチジン一リン酸、5-メチルシチジン二リン酸、5-メチルシチジン三リン酸、5-ヒドロキシメチルシチジン一リン酸、5-ヒドロキシメチルシチジン二リン酸、5-ヒドロキシメチルシチジン三リン酸、環状アデノシン一リン酸(cAMP)、環状グアノシン一リン酸(cGMP)、デオキシアデノシン一リン酸(dAMP)、デオキシアデノシン二リン酸(dADP)、デオキシアデノシン三リン酸(dATP)、デオキシグアノシン一リン酸(dGMP)、デオキシグアノシン二リン酸(dGDP)、デオキシグアノシン三リン酸(dGTP)、デオキシチミジン一リン酸(dTMP)、デオキシチミジン二リン酸(dTDP)、デオキシチミジン三リン酸(dTTP)、デオキシウリジン一リン酸(dUMP)、デオキシウリジン二リン酸(dUDP)、デオキシウリジン三リン酸(dUTP)、デオキシシチジン一リン酸(dCMP)、デオキシシチジン二リン酸(dCDP)、デオキシシチジン三リン酸(dCTP)、5-メチル-2´-デオキシシチジン一リン酸、5-メチル-2´-デオキシシチジン二リン酸、5-メチル-2´-デオキシシチジン三リン酸、5-ヒドロキシメチル-2´-デオキシシチジン一リン酸、5-ヒドロキシメチル-2´-デオキシシチジン二リン酸、及び5-ヒドロキシメチル-2´-デオキシシチジン三リン酸を含むが、これらに限定されない。アダプター中のヌクレオチドは、好ましくは、AMP、TMP、GMP、UMP、dAMP、dTMP、dGMP又はdCMPから選択される。ヌクレオチドは脱塩基(すなわち、核酸塩基を欠く)であってもよい。ヌクレオチドは追加の修飾を含んでもよい。特に、適切な修飾ヌクレオチドは、2´-アミノピリミジン(例えば、2´-アミノシチジン及び2´-アミノウリジン)、2´-ヒドロキシルプリン(例えば、2´-フルオロピリミジン(例えば、2´-フルオロシチジン及び2´フルオロウリジン)、ヒロドキシルピリミジン(例えば、5´-α-P-ボラノウリジン)、2´-O-メチルヌクレオチド(例えば、2´-O-メチルアデノシン、2´-O-メチルグアノシン、2´-O-メチルシチジン、及び2´-O-メチルウリジン)、4´-チオピリミジン(例えば、4´-チオウリジン及び4´-チオシチジン)を含むが、これらに限定されない。ヌクレオチドは核酸塩基の修飾を有する(例えば、5-ペンチニル-2´-デオキシウリジン、5-(3-アミノプロピル)-ウリジン及び1,6-ジアミノヘキシル-N-5-カルバモイルメチルウリジン)。
バーコードは、一つ以上の異なるヌクレオチド種を含んでもよい。例えば、T k-mers(すなわち、中心ヌクレオチドがチミンベースであるk-mer、例えば、TTA、GTC、GTG、及びCTAなど)は、通常は、最も低い電流状態を有する。Tヌクレオチドの修飾版は、電流状態を更に低下させ、それによってアダプターがポアを通過する際に見られる全電流範囲を広げるために、修飾ポリヌクレオチドに導入してもよい。
G k-mer(すなわち、中心ヌクレオチドがグアニンベースであるk-mer、例えば、TGA、GGC、TGT、及びCGAなど)は、k-mer中の他のヌクレオチドから影響を強く受ける傾向があるため、修飾ポリヌクレオチド中のGヌクレオチドを修飾することはそれらがより多くの独立した電流位置を有するのを助け得る。
三つの異なる種の代わりに同一のヌクレオチド種の三つのコピーを含むことは、例えば、修飾ポリヌクレオチド中の3ヌクレオチドk-merをマッピングすることのみ必要であるため、特徴付けを容易にするかもしれない。しかし、そのような修飾はバーコードによる情報を確実に減らす。
一つ以上の無塩基ヌクレオチドがバーコードに含まれてもよい。一つ以上の無塩基ヌクレオチドを使用すると、特徴的な電流スパイクが発生する。それにより、バーコード中の一つ以上のヌクレオチド種の位置の明確な強調表示を可能にする。
バーコード中のヌクレオチド種はプロピニル基、チオ基、オキソ基、メチル基、ヒドロキシメチル基、ホルミル基、カルボキシ基、カルボニル基、ベンジル基、プロパルギル基又はプロパルギルアミン基などの化学原子又は化学基を含んでもよい。化学基又は原子は蛍光分子、ビオチン、ジゴキシゲニン、DNP(ジニトロフェノール)、光不安定基、アルキン、DBCO、アジド、遊離アミノ基、レドックス染料、水銀原子又はセレン原子であってもよく、又はそれらを含んでもよい。
バーコードは、ハロゲン原子を含むヌクレオチド種を含んでもよい。ハロゲン原子は、核酸塩基及び/又は糖などの異なるヌクレオチド種上の任意の位置に付着してもよい。ハロゲン原子は、好ましくは、フッ素(F)、塩素(Cl)、臭素(Br)、又はヨウ素(I)である。ハロゲン原子は、最も好ましくは、F又はIである。
アンカー
標的ポリヌクレオチドはアンカー(膜テザー)を用いて膜に結合していてもよい。一つ以上のアンカーを用いて標的ポリヌクレオチドを膜に結合してもよい。通常は、一つ以上のアンカーは標的ポリヌクレオチドの各鎖に付着している。アンカーはアダプターの一部であってもよい。
膜がトリブロックコポリマー膜のような両親媒性層である場合、一つ以上のアンカーは、好ましくは、膜に挿入することができるポリペプチドアンカー及び/又は疎水性アンカーを含む。疎水性アンカーは、好ましくは、脂質、脂肪酸、ステロール、カーボンナノチューブ、ポリペプチド、タンパク質又はアミノ酸、例えばコレステロール、パルミテート又はトコフェロールである。好ましい実施形態では、一つ以上のアンカーはポアではない。
両親媒性分子、コポリマー又は脂質などの膜の成分は、一つ以上のアンカーを形成するために、化学的に修飾又は官能化されてもよい。膜の成分を官能化するための適切な化学修飾及び適切な方法の例は、以下に更に詳細に説明されている。任意の割合、例えば、少なくとも0.01%、少なくとも0.1%、少なくとも1%、少なくとも10%、少なくとも25%、少なくとも50%又は100%の膜成分を官能化してもよい。
一つ以上のアンカーは、好ましくは、リンカーを含む。一つ以上のアンカーは、一つ以上、例えば二つ、三つ、四つ又はそれ以上のリンカーを含んでもよい。
好ましいリンカーはポリマー、例えばポリヌクレオチド、ポリエチレングリコール(PEG)、多糖類、及びポリペプチドを含むが、これらに限定されない。これらのリンカーは直鎖状、分岐状又は環状であってもよい。例えば、リンカーは環状ポリヌクレオチドであってもよい。ポリヌクレオチドは、環状ポリヌクレオチドリンカー上の相補的配列にハイブリダイズしてもよい。
一つ以上のアンカー又は一つ以上のリンカーは、例えば制限部位又は光解離性基などの切断又は分解することができる成分を含んでもよい。
官能化リンカー及びそれらが分子を結合することができる方法は、当該技術分野において既知である。例えば、マレイミド基で官能化されたリンカーはタンパク質中のシステイン残基と反応して付着する。
ポリヌクレオチドの架橋は「ロックアンドキー」配置を用いて回避することができる。各リンカーの一方の末端のみが相互に反応してより長いリンカーを形成し、リンカーの他方の末端はポリヌクレオチド又は膜とそれぞれ反応する。そのようなリンカーはWO2010/086602に記載されている。
リンカーの使用は本発明の配列決定方法において好ましい。ポアと相互作用するときに分離しないという意味で、ポリヌクレオチドが永久的に膜に直接結合している場合、膜とポアとの間の距離のために、配列決定実行がポリヌクレオチドの末端まで続くことができないので、いくつかの配列データは失われることになる。リンカーが使用された場合、ポリヌクレオチドは完全に処理され得る。
結合は恒久的又は安定的であってもよい。言い換えれば、結合はポアと相互作用するときにポリヌクレオチドが膜に結合したままのものであってもよい。
結合は一時的であってもよい。言い換えれば、結合はポアとの相互作用のときにポリヌクレオチドが膜から分離可能なものであってもよい。ポリヌクレオチド配列決定のためには、結合の一時的性質が好ましい。恒久的又は安定的なリンカーがポリヌクレオチドの5´又は3´末端のいずれかに直接付着し、リンカーが膜と膜貫通孔のチャネルとの間の距離よりも短い場合、配列決定実行はポリヌクレオチドの末端まで継続することができないので、いくらかの配列データは失われることになる。結合が一時的である場合、結合した末端がランダムに膜から分離されると、ポリヌクレオチドは完全に処理され得る。恒久的/安定的又は一時的なリンクを形成する化学基は以下でより詳細に説明されている。標的ポリヌクレオチド及び/又はその補体は、両親媒性層などの膜、例えば、コレステロール又は脂肪アシル鎖を用いたトリブロックコポリマー膜又は脂質膜に一時的に結合していてもよい。ヘキサデカン酸などの6~30個の炭素原子の長さを有する任意の脂肪アシル鎖を用いてもよい。
好ましい実施形態では、アンカーは標的ポリヌクレオチド及び/又はその補体をトリブロックコポリマー膜又は脂質二分子層などの両親媒性層に結合させる。合成脂質二分子層への核酸の結合は様々な異なるテザリング戦略で以前から実施されてきた。これらを以下の表1にまとめる。
合成ポリヌクレオチド及び/又はリンカーは、コレステロール、トコフェロール、パルミテート、チオール、脂質及びビオチン基などの適切な固定基の直接付加に容易に適合する、合成反応での修飾ホスホルアミダイトを用いて官能化することができる。これらの異なる付着化学はポリヌクレオチドへの付着のための一連の選択肢を与える。各異なる修飾基はわずかに異なる方法でポリヌクレオチドを結合し、結合は常に恒久的ではないため、膜へのポリヌクレオチドに異なる滞留時間を与える。
ポリヌクレオチドのリンカー又は官能化膜への結合はまた、相補的反応性基又はアンカー基がポリヌクレオチドに付加することができることを条件とするいくつかの他の手段によって達成することができる。ポリヌクレオチドのいずれかの末端への反応性基の付加は以前に報告されている。T4ポリヌクレオチドキナーゼ及びATPγSを用いて、チオール基をssDNA又はdsDNAの5´に付加することができる(Grant, G.P.and P.Z.Qin (2007)。「核酸の5´末端にニトロキシドスピンの標識付けをするための簡単な方法」Nucleic Acids Res 35(10):e77)。T4 ポリヌクレオチドキナーゼ及びγ-[2-アジドエチル]-ATP又はγ-[6-アジドヘキシル]-ATPを用いて、アジド基をssDNAのdsDNAの5´-リン酸に付加することができる。チオール又はクリックケミストリーを用いて、チオール、ヨードアセトアミドOPSS又はマレイミド基(チオールに対して反応性)又はDIBO(ジベンゾシクロオキシン)若しくはアルキン基(アジドに対して反応性)のいずれかを含むテザーは、ポリヌクレオチドに共有的に付着され得る。ビオチン、チオール、及びフルオロフォアなどの化学基のより多様な選択は、末端トランスフェラーゼを用いて、修飾オリゴヌクレオチドをssDNAの3´に組み込むために付加することができる(Kumar,A.,P.Tchen et al.(1988)。「末端デオキシヌクレオチジルトランスフェラーゼによる合成オリゴヌクレオチドプローブの非放射性の標識付け」Anal Biochem 169(2):376-82)。ストレプトアビジン/ビオチン及び/又はストレプトアビジン/デスチオビオチンの結合は、他の任意のポリヌクレオチドに使用してもよい。また、適切に修飾されたヌクレオチド(例えば、コレステロール又はパルミチン酸)を有する末端トランスフェラーゼを用いて、アンカーをポリヌクレオチドに直接付加することが、可能かもしれない。
一つ以上のアンカーは、ハイブリダイゼーションを介して標的ポリヌクレオチド及び/又はその補体を膜に結合してもよい。ハイブリダイゼーションは、一つ以上のアンカーと標的ポリヌクレオチド及び/又はその補体との間、一つ以上のアンカー内、又は一つ以上のアンカーと膜との間であってもよい。一つ以上のアンカーにおけるハイブリダイゼーションは上述したように一時的な結合を可能にする。例えば、リンカーは、一緒にハイブリダイズした3、4又は5個のポリヌクレオチドなどの2個以上のポリヌクレオチドを含んでもよい。一つ以上のアンカーは、標的ポリヌクレオチド又は標的ポリヌクレオチドに相補的なポリヌクレオチドにハイブリダイズしてもよい。一つ以上のアンカーは、標的ポリヌクレオチド及び/又はその補体に付着したYアダプター及び/又はリーダー配列に直接ハイブリダイズしてもよい。あるいは、一つ以上のアンカーは、2つ又は3つなどの一つ以上の中間ポリヌクレオチド又は「スプリント」)、標的ポリヌクレオチド及び/又はその相補体に付着したYアダプター及び/又はリーダー配列にハイブリダイズしてもよい。
一つ以上のアンカーは一本鎖又は二本鎖ポリヌクレオチドを含んでもよい。アンカーの一部は一本鎖又は二本鎖ポリヌクレオチド検体に連結してもよい。ssDNAの短い断片の連結はT4 RNAリガーゼIを用いて報告されている(Troutt,A.B.,M.G.McHeyzer-Williams et al.(1992)。「連結アンカーPCR:片側特異性を有する単純な増幅技術」Proc Natl Acad Sci USA 89(20):9823-5)。あるいは、一本鎖又は二本鎖ポリヌクレオチドのいずれかを二本鎖ポリヌクレオチドに連結し、次いで二本鎖を熱変性又は化学変性によって分離することができる。二本鎖ポリヌクレオチドに対して、片方の一本鎖ポリヌクレオチドを二本鎖の一方又は両方の末端に付加する、又は二本鎖ポリヌクレオチドを一方又は両方の末端に付加することが可能である。一本鎖ポリヌクレオチドの二本鎖ポリヌクレオチドへの付加については、これは一本鎖ポリヌクレオチドの他の領域への連結のためのT4 RNAリガーゼIを用いて達成することができる。二本鎖ポリヌクレオチドの二本鎖ポリヌクレオチドへの付加については、次いで、ポリヌクレオチド及び付加されたポリヌクレオチドにそれぞれ相補的な3´dA/dTテイル(コンカテマー又はダイマーの形成を防ぐために多くの試料製造用途で日常的に行われているように)、又はポリヌクレオチドの制限消化及び適合性アダプターの連結によって生成された「粘着末端」を用いて、連結を「平滑末端」にすることができる。次いで、二本鎖が融解したとき、各一本鎖は、一本鎖ポリヌクレオチドを連結に使用した場合の5´又は3´のいずれかの修飾、あるいは二本鎖ポリヌクレオチドを連結に使用した場合の5´端、3´端、又はその両方での修飾を有する。
アダプター、又は標的ポリヌクレオチドの補体が合成鎖である場合、アダプター又は補体の化学合成中に一つ以上のアンカーを組み込むことができる。例えば、アダプター又は補体は、反応基が付着したプライマーを用いて合成することができる。
アデニル化ポリヌクレオチドは、アデノシン一リン酸がポリヌクレオチドの5´-リン酸に付着している連結反応における中間体である。この中間体の生成には、NEBの5´DNA Adenylation Kitなど、様々なキットが利用可能である。反応中に修飾ヌクレオチド三リン酸をATPで置換することによって、ポリヌクレオチドの5´に反応性基(例えば、チオール、アミン、ビオチン、アジドなど)を付加することも可能である。また、好適に修飾されたヌクレオチド(例えば、コレステロール又はパルミチン酸)を有する5´DNAアデニル化キットを用いて、アンカーをポリヌクレオチドに直接付加してもよい。
ゲノムDNAの一部を増幅するための一般的な技術は、ポリメラーゼ連鎖反応(PCR)を使用することである。この場合、二つの合成オリゴヌクレオチドプライマーを用いてDNAの同一部分の多数のコピーを生成することができる。各コピーについて、二本鎖中の各鎖の5´が合成ポリヌクレオチドであることになる。ポリメラーゼを用いることにより、単一又は複数のヌクレオチドを一本鎖又は二本鎖DNAの3´末端に付加することができる。使用できるポリメラーゼの例としては、ターミナルトランスフェラーゼ、クレノウ、及び大腸菌ポリAポリメラーゼが挙げられるが、これらに限定されない。反応中に修飾ヌクレオチド三リン酸をATPで置換することにより、コレステロール、チオール、アミン、アジド、ビオチン又は脂質などのアンカーを二本鎖ポリヌクレオチドに組み込むことができる。したがって、増幅ポリヌクレオチドの各コピーはアンカーを含むことになる。
理想的には、ポリヌクレオチドは、ポリヌクレオチドを官能化することを必要とせずに膜に結合する。これは、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)又は化学基などの一つ以上のアンカーを膜に結合し、そして一つ以上のアンカーをポリヌクレオチドと相互作用させることによって、又は膜を官能化することによって達成することができる。一つ以上のアンカーは本明細書に記載の方法のいずれかによって膜に結合してもよい。特に、一つ以上のアンカーは、マレイミド官能化リンカーなどの一つ以上のリンカーを含んでもよい。この実施形態では、ポリヌクレオチドは、通常は、RNA、DNA、PNA、TNA、又はLNAであり、二本鎖であっても一本鎖であってもよい。この実施形態はゲノムDNAポリヌクレオチドに特に適している。
一つ以上のアンカーは、一本鎖又は二本鎖ポリヌクレオチド、ポリヌクレオチド内の特定のヌクレオチド配列、又はポリヌクレオチド内の修飾ヌクレオチドのパターンに結合する(couple)、結合する(bind)、若しくは相互作用する任意の基、又はポリヌクレオチド上に存在する任意の他のリガンドを含んでもよい。
アンカーに使用するのに適した結合タンパク質は、大腸菌一本鎖結合タンパク質、P5一本鎖結合タンパク質、T4 gp32一本鎖結合タンパク質、TOPO V dsDNA結合領域、ヒトヒストンタンパク質、大腸菌HU DNA結合タンパク質及び他の古細菌、原核生物、又は真核生物の一本鎖又は二本鎖ポリヌクレオチド(又は核酸)結合タンパク質、下記のリストに含まれるもの、が含まれるが、これらに限定されない。
特定のヌクレオチド配列は、転写因子、リボソーム、エンドヌクレアーゼ、トポイソメラーゼ又は複製開始因子によって認識される配列であり得る。修飾ヌクレオチドのパターンはメチル化又は損傷のパターンであり得る。
一つ以上のアンカーは、ポリヌクレオチドに結合する(couple)、結合する(bind)、挿入する、又はポリヌクレオチドと相互作用する任意の基を含むことができる。基は静電気、水素結合、又はファンデルワールス相互作用を介してポリヌクレオチドに挿入してもよく、又はポリヌクレオチドと相互作用してもよい。そのような基にはリジンモノマー、ポリ-リジン(ssDNA又はdsDNAと相互作用することになる)、臭化エチジウム(dsDNAにインターカレートすることになる)、ユニバーサル塩基又はユニバーサルヌクレオチド(任意のポリヌクレオチドにハイブリダイズすることができる)、及びオスミウム錯体(メチル化塩基と反応することができる)が含まれる。したがって、ポリヌクレオチドは膜に付着した一つ以上のユニバーサルヌクレオチドを用いて膜に結合してもよい。各ユニバーサルヌクレオチドは一つ以上のリンカーを用いて膜に結合してもよい。ユニバーサルヌクレオチドは、好ましくは、以下の核酸塩基のうちの一つを含む:ヒポキサンチン、4-ニトロインドール、5-ニトロインドール、6-ニトロインドール、ホルミルインドール、3-ニトロピロール、ニトロイミダゾール、4-ニトロピラゾール、4-ニトロベンゾイミダゾール、5-ニトロインダゾール、4-アミノベンゾイミダゾール又はフェニル(C6芳香族環)。ユニバーサルヌクレオチドは、より好ましくは、以下のヌクレオシドのうちの一つを含む:2´-デオキシイノシン、イノシン、7-デアザ-2´-デオキシイノシン、7-デアザ-イノシン、2-アザ-デオキシイノシン、2-アザ-イノシン、2-O´-メチルイノシン、4-ニトロインドール2´-デオキシリボヌクレオシド、4-ニトロインドールリボヌクレオシド、5-ニトロインドール 2´-デオキシリボヌクレオシド、5-ニトロインドールリボヌクレオシド、6-ニトロインドール 2´-デオキシリボヌクレオシド、6-ニトロインドールリボヌクレオシド、3-ニトロピロール2´-デオキシリボヌクレオシド、3-ニトロピロールリボヌクレオシド、ヒポキサンチンの非環状糖、ニトロイミダゾール2´-デオキシリボヌクレオシド、ニトロイミダゾールリボヌクレオシド、4-ニトロピラゾール2´-デオキシリボヌクレオシド、4-ニトロピラゾールリボヌクレオシド、4-ニトロベンゾイミダゾール2´-デオキシリボヌクレオシド、4-ニトロベンゾイミダゾールリボヌクレオシド、5-ニトロインダゾール2´-デオキシリボヌクレオシド、5-ニトロインダゾールリボヌクレオシド、4-アミノベンゾイミダゾール2´-デオキシリボヌクレオシド、4-アミノベンゾイミダゾールリボヌクレオシド、フェニルC-リボヌクレオシド、フェニルC-2´-デオキシリボシルヌクレオシド、2´-デオキシネブラリン、2´-デオキシイソグアノシン、K-2´-デオキシリボース、P-2´-デオキシリボース及びピロリジン。ユニバーサルヌクレオチドは、より好ましくは、2´-デオキシイノシンを含む。ユニバーサルヌクレオチドは、より好ましくは、IMP又はdIMPである。ユニバーサルヌクレオチドは、最も好ましくは、dPMP(2´-デオキシ-P-ヌクレオシド一リン酸)又はdKMP(N6-メトキシ-2,6-ジアミノプリン一リン酸)である。
一つ以上のアンカーは、フーグスティーン水素結合(二つの核酸塩基が水素結合によって結合している場合)、又は逆フーグスティーン水素結合(一方の核酸塩基が他方の核酸塩基に対して180°回転している場合)を介して、ポリヌクレオチドに結合(couple)(又は結合(bind))してもよい。例えば、一つ以上のアンカーは、ポリヌクレオチドとフーグスティーン水素結合又は逆フーグスティーン水素結合を形成する一つ以上のヌクレオチド、一つ以上のオリゴヌクレオチド、又は一つ以上のポリヌクレオチドを含んでもよい。これらの種類の水素結合は、第三ポリヌクレオチド鎖が二本鎖ヘリックスに巻き付き、三本鎖を形成することを可能にする。一つ以上のアンカーは、二本鎖構造とともに三本鎖を形成することによって、二本鎖ポリヌクレオチドに結合(couple)(又は結合(bind))してもよい。
この実施形態では、膜成分の少なくとも1%、少なくとも10%、少なくとも25%、少なくとも50%、又は100%の膜成分は官能化することができる。
一つ以上のアンカーがタンパク質を含む場合、それらは、例えば、膜と適合可能である外部疎水性領域を既に有する場合、更に官能化することなく膜中に直接アンカリングできるかもしれない。そのようなタンパク質の例としては、膜貫通タンパク質、膜内タンパク質、及び膜タンパク質が挙げられるが、これらに限定されない。あるいは、タンパク質は膜と適合性のある遺伝的に融合した疎水性領域で表現してもよい。そのような疎水性タンパク質領域は当技術分野において既知である。
一つ以上のアンカーは、好ましくは、膜への送達の前にポリヌクレオチドと混合されるが、一つ以上のアンカーは、膜と接触し、続いてポリヌクレオチドと接触してもよい。
別の態様では、特異的結合基によって認識できるように、上記の方法を用いてポリヌクレオチドを官能化してもよい。具体的には、ビオチン(ストレプトアビジンへの結合用)、アミロース(マルトース結合タンパク質又は融合タンパク質への結合用)、Ni-NTA(ポリヒスチジン又はポリヒスチジンタグ付きタンパク質への結合用)などのリガンド、又はペプチド(抗原など)でポリヌクレオチドを官能化してもよい。
好ましい実施形態によれば、ポリヌクレオチドが優先的にポアに入り込むリーダー配列に付着している場合、ポリヌクレオチドを膜に結合させるように、一つ以上のアンカーを用いてもよい。好ましくは、ポリヌクレオチドは、ポア内に優先的に入るリーダー配列に付着(例えば連結)している。そのようなリーダー配列はホモポリマーポリヌクレオチド又は無塩基領域を含んでもよい。リーダー配列は、通常は、直接又は一つ以上の中間ポリヌクレオチド(若しくはスプリント)を介して一つ以上のアンカーにハイブリダイズするように設計される。そのような場合、一つ以上のアンカーは、通常は、リーダー配列中の配列又は一つ以上の中間ポリヌクレオチド(若しくはスプリント)中の配列に相補的なポリヌクレオチド配列を含む。そのような場合、一つ以上のスプリントは、通常は、リーダー配列中の配列に相補的なポリヌクレオチド配列を含む。
以上に論じられた、ポリヌクレオチドを両親媒性層などの膜に結合するための方法のいずれも、もちろん、他のポリヌクレオチド及び膜の組み合わせに適用することができる。いくつかの実施形態では、アミノ酸、ペプチド、ポリペプチド、又はタンパク質はトリブロックコポリマー層又は脂質二分子層などの両親媒性層に結合している。そのようなポリヌクレオチドの化学的付着のための様々な方法論が利用可能である。化学的付着に使用される分子の例は、EDC1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩である。市販のキット(Thermo Pierce、品番22980)を用いて反応性基をポリヌクレオチドの5´に付加することもできる。適切な方法には、ヒスチジン残基及びNi-NTAを用いた一時的親和性付着、並びに反応性システイン、リジン又は非天然型アミノ酸によるより強固な共有付着が含まれるが、これらに限定されない。
微粒子
微粒子は、通常はビーズであり、検体(例えば、ポリヌクレオチド又はポリペプチド)を膜貫通孔に送達するために使用してもよい。これはWO2016/059375に記載されており、その内容全体が参照により本明細書に組み込まれる。本発明の方法では、任意の数の微粒子を使用することができる。例えば、本発明の方法は単一の微粒子、又は2、3、4、5、6、7、8、9、10、20、30、50、100、1,000、5,000、10,000、100,000、500,000若しくは1,000,000個以上の微粒子を使用してもよい。複数の微粒子が使用される場合、微粒子は同一であってもよい。あるいは、異なる微粒子の混合物を使用してもよい。
各微粒子は、付着した一つの検体(例えば、ポリヌクレオチド又はポリペプチド)を有してもよい。あるいは、各微粒子は付着した二つ以上の検体(例えば、ポリヌクレオチド又はポリペプチド)、例えば、三つ以上、四つ以上、五つ以上、六つ以上、七つ以上、八つ以上、九つ以上、10個以上、20個以上、30個以上、50個以上、100個以上、500個以上、1,000個以上、5,000個以上、10,000個以上、100,000個以上、1,000,000個以上又は5,000,000個以上の検体を有してもよい。微粒子は、検体(例えば、ポリヌクレオチド又はポリペプチド)で実質的に又は完全にコーティング又は被覆してもよい。微粒子は、その表面の実質的に全部又は全部に付着した検体(例えば、ポリヌクレオチド又はポリペプチド)を有してもよい。微粒子は、アダプターを介して検体(例えば、ポリヌクレオチド又はポリペプチド)に付着してもよい。アダプターは、例えば図36に示すように、Yアダプターであってもよい。
適切な結合部分の例は、タンパク質結合タグ(ストレプトアビジンタグ、フラッグタグなど)、共役付着(ポリヌクレオチド、ポリマー、ビオチン、ペプチド)及びアミノ酸(システイン、Fazなど)を含む。
いくつかの実施形態では、ポリヌクレオチドは、二つ以上の微粒子に付着してもよい。
微粒子は、そのサイズが通常はマイクロメートル(μm)で測定される微小粒子である。微粒子は、マイクロスフェア又はマイクロビーズとしても知られている場合がある。微粒子はナノ粒子であってもよい。ナノ粒子は、そのサイズが通常はナノメートル(nm)で測定される微小粒子である。
微粒子は、通常は、約0.001μm~約500μmの粒径を有する。例えば、ナノ粒子は、約0.01μm~約200μm又は約0.1μm~約100μmの粒径を有してもよい。より多くの場合、微粒子は、約0.5μm~約100μm、又は例えば約1μm~約50μmの粒径を有する。微粒子は、約1nm~約1000nm、例えば約10nm~約500nm、約20nm~約200nm、又は約30nm~約100nmの粒径を有してもよい。
微粒子は球状又は非球状であってもよい。球状微粒子はマイクロスフェアと呼ばれることがある。非球状粒子は、例えば板状、針状、不規則又は管状であってもよい。本明細書で使用される語「粒径」は、粒子が球状である場合は粒子の直径を意味し、粒子が非球状である場合は体積基準の粒小サイズを意味する。体積基準の粒径は問題の非球状粒子と同一の体積を有する球の直径である。
この方法において二つ以上の微粒子が使用される場合、微粒子の平均粒径は、約0.5μm~約500μmなどの、上述の粒径のいずれでもよい。複数の微粒子の個体群は、好ましくは、5%以下又は2%以下などの、10%以下の変動係数(平均に対する標準偏差の比率)を有する。
微粒子のサイズを決定するために任意の方法を使用してもよい。適切な方法としては、フローサイトメトリーが挙げられるが、これに限定されない(例えば、Chandler et al.,J Thromb Haemost.2011年6月;9(6):1216-24参照)。
微粒子は任意の材料から形成してもよい。微粒子は、好ましくは、セラミック、ガラス、シリカ、ポリマー又は金属から形成される。ポリマーはポリヒドロキシアルカノエート、デキストラン、ポリラクチド、アガロース、セルロース、デンプン又はキトサンなどの天然ポリマー、又はポリウレタン、ポリスチレン、ポリ(塩化ビニル)、シラン又はメタクリレートなどの合成ポリマーであってもよい。適切な微粒子は、当技術分野において既知であり、市販されている。セラミック及びガラスマイクロスフェアは、3M(登録商標)から市販されている。シリカ及びポリマー微粒子は、EPRUI Nanoparticles&Microspheres Co.Ltdから市販されている。微粒子は、Polysciences Inc.、Bangs Laboratories Inc.及びLife Technologiesからも市販されている。
微粒子は固体であってもよい。微粒子は中空であってもよい。微粒子はポリマー繊維から形成してもよい。
微粒子は検体(例えば、ポリヌクレオチド又はポリペプチド)を抽出及び単離するために使用されるキットに由来してもよい。
微粒子の表面は検体と相互作用して付着してもよい。表面は、官能化せずに、ポリヌクレオチドなどの検体と自然に相互作用する可能性がある。微粒子の表面は、通常は、検体の付着を容易にするために官能化される。適切な官能化は当技術分野において既知である。例えば、微粒子の表面は、ポリヒスチジンタグ(ヘキサヒスチジンタグ、6×Hisタグ、His6タグ又はHis-tag(登録商標))、Ni-NTA、ストレプトアビジン、ビオチン、オリゴヌクレオチド、ポリヌクレオチド(DNA、RNA、PNA、GNA、TNA、又はLNAなど)、カルボキシル基、第四級アミン基、チオール基、アジド基、アルキン基、DIBO、脂質、FLAG-タグ(FLAGオクタペプチド、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素))(後述のもののいずれかを含む)、ペプチド、タンパク質、抗体又は抗体断片で官能化してもよい。微粒子はまた、本明細書で論じられるリンカー又は基のいずれかで官能化してもよい。
微粒子は、ポリヌクレオチドに特異的に結合する分子又は基で官能化してもよい。この場合、微粒子に付着し、膜貫通孔に送達されることになるポリヌクレオチドは、標的ポリヌクレオチドと呼ばれることがある。これにより、微粒子は他のポリヌクレオチドを含む試料から標的ポリヌクレオチドを選択又は捕捉することが可能になる。分子又は基は、標的ポリヌクレオチドに優先的に又は高い親和性で結合するが、他のポリヌクレオチド又は異なるポリヌクレオチドには結合しない、又は低い親和性でのみ結合する場合、標的ポリヌクレオチドに特異的に結合する。分子又は基は、1×10-6M以下、より好ましくは1×10-7M以下、5×10-8M以下、より好ましくは1×10-8M以下、又はより好ましくは5×10-9M以下のKdで結合する場合、優先的に又は高い親和性で結合する。分子又は基は、1×10-6M以上、より好ましくは1×10-5M以上、より好ましくは1×10-4M以上、より好ましくは1×10-3M以上、さらにより好ましくは1×10-2M以上のKdで結合する場合、低い親和性で結合する。
好ましくは、分子又は基は、他のポリヌクレオチドについてその親和性よりも大きい、少なくとも50、少なくとも100、少なくとも200、少なくとも300、少なくとも400、少なくとも500、少なくとも1000、又は少なくとも10,000倍などの、少なくとも10倍の親和性で標的ポリヌクレオチドに結合する。親和性は、蛍光及び放射性同位体を利用するものなどの既知の結合アッセイを用いて測定することができる。競合結合アッセイも当該分野において既知である。ペプチド又はタンパク質とポリヌクレオチドとの間の結合強度は、Hornblower et al.,Nature Methods.4:315-317.(2007)に記載されているように、ナノポア力分光法を用いて測定することができる。
微粒子は、標的ポリヌクレオチド若しくはガイドポリヌクレオチドに特異的にハイブリダイズ、又は標的ポリヌクレオチド若しくはガイドポリヌクレオチドの一部若しくは領域、又はアダプターに相補的な部分又は領域を含む、オリゴヌクレオチド又はポリヌクレオチドで官能化してもよい。これにより、微粒子は他のポリヌクレオチドを含む試料から標的ポリヌクレオチドを選択又は捕捉することが可能になる。
オリゴヌクレオチド又はポリヌクレオチドは、標的ポリヌクレオチドに対して優先的に又は高い親和性でハイブリダイズするが、他のポリヌクレオチドに実質的にハイブリダイズしない、ハイブリダイズしない、又は低い親和性でハイブリダイズするとき、標的ポリヌクレオチドに特異的にハイブリダイズする。オリゴヌクレオチド又はポリヌクレオチドは、他の配列のTmよりも、少なくとも2℃、例えば少なくとも3℃、少なくとも4℃、少なくとも5℃、少なくとも6℃、少なくとも7℃、少なくとも8℃、少なくとも9℃、又は少なくとも10℃高い融解温度(Tm)で標的ポリヌクレオチドにハイブリダイズする場合、特異的にハイブリダイズする。より好ましくは、オリゴヌクレオチド又はポリヌクレオチドは、他の核酸のTmよりも、少なくとも2℃、例えば少なくとも3℃、少なくとも4℃、少なくとも5℃、少なくとも6℃、少なくとも7℃、少なくとも8℃、少なくとも9℃、少なくとも10℃、少なくとも20℃、少なくとも30℃、又は少なくとも40℃高いTmで標的ポリヌクレオチドにハイブリダイズする。好ましくは、オリゴヌクレオチド又はポリヌクレオチドは、1、2、3、4又は5以上のヌクレオチドなどの一つ以上のヌクレオチドによる標的ポリヌクレオチドと異なる配列のTmよりも、少なくとも2℃、例えば少なくとも3℃、少なくとも4℃、少なくとも5℃、少なくとも6℃、少なくとも7℃、少なくとも8℃、少なくとも9℃、少なくとも10℃、少なくとも20℃、少なくとも30℃、又は少なくとも40℃高いTmで標的ポリヌクレオチドにハイブリダイズする。オリゴヌクレオチド又はポリヌクレオチドは、通常は、少なくとも90℃、例えば少なくとも92℃又は少なくとも95℃のTmで標的ポリヌクレオチドにハイブリダイズする。Tmは、DNAマイクロアレイの使用を含む既知の技術を用いて実験的に測定することができ、又はインターネット上で入手可能なものなどの公的に入手可能なTm計算機を用いて計算することができる。
ハイブリダイゼーションを可能にする条件は、当該技術分野において既知である(例えば、Sambrook et al.,2001,Molecular Cloning: 実験室マニュアル、第3版、Cold Spring Harbour Laboratory Press、及びCurrent Protocols in Molecular Biology,第2章,Ausubel et al.,Eds.,Greene Publishing and Wiley-lnterscience,New York(1995))。ハイブリダイゼーションは、低ストリンジェンシー条件下、例えば37℃の30~35%ホルムアミド、1M NaCl及び1%のSDS(ドデシル硫酸ナトリウム)の緩衝液の存在下で実施し、続いて50℃で1×(0.1650M Na+)から2×(0.33M Na+)のSSC(標準クエン酸ナトリウム)の20洗浄を実施することができる。ハイブリダイゼーションは、中程度のストリンジェンシー条件下、例えば37℃の40~45%ホルムアミド、1M NaCl及び1%SDSの緩衝液の存在下で実施し、続いて55℃の0.5×(0.0825M Na+)から1×(0.1650M Na+)のSSCで洗浄することができる。ハイブリダイゼーションは、高ストリンジェンシー条件下、例えば37℃の50%ホルムアミド、1M NaCl、1%のSDSの緩衝液の存在下で実施し、続いて60℃の0.1×(0.0165M Na+)のSSCで洗浄することができる。
オリゴヌクレオチド又はポリヌクレオチドは、標的ポリヌクレオチド又はガイドポリヌクレオチドの一部又は領域に実質的に相補的な一部又は領域を含んでもよい。したがって、オリゴヌクレオチド又はポリヌクレオチドの領域又は一部は、標的ポリヌクレオチド中の一部又は領域と比較し、5、10、15、20、21、22、30、40又は50ヌクレオチドの領域にわたって1、2、3、4、5、6、7、8、9、10又はそれ以上のミスマッチを有してもよい。
領域の一部は、通常は、50ヌクレオチド以下、例えば40ヌクレオチド以下、30ヌクレオチド以下、20ヌクレオチド以下、10ヌクレオチド以下、又は5ヌクレオチド以下である。
微粒子は、好ましくは、常磁性又は磁性である。微粒子は、好ましくは、常磁性又は超常磁性材料、又は鉄などの常磁性又は超常磁性金属を含む。任意の適切な磁性微粒子を使用してもよい。例えば、Clontech、Promega、Invitrogen ThermoFisher Scientific、及びNEBから市販されている磁気ビーズを使用してもよい。いくつかの実施形態では、微粒子はニトリロ三酢酸(NTA)などの金属キレート基などの有機基が付着した磁性粒子を含む。有機成分は、例えば、-C(=O)O-、-C-O-C-、-C(=O)-、-NH-、-C(=O)-NH、-C(=O)-CH2-I、-S(=O)2-及び-S-から選択される基を含んでもよい。有機成分は、NTA(ニトリロ三酢酸)などの金属キレート基を含んでもよい。通常、金、鉄、ニッケル、又はコバルトなどの金属も金属キレート基に付着している。この種の磁性ビーズは、Hisタグ付きタンパク質を捕捉するために一般的に使用されているが、本発明での使用にも適している。
微粒子は、最も好ましくは、Life Technologiesから市販されているHis-Tag Dynabead(登録商標)、IBAからのMag Strepビーズ、NEBからのストレプトアビジン磁性ビーズ、又はBeckman Coulter又はDynabeads(登録商標)MyOneTMストレプトアビジンC1(ThermoFisher Scientific)からの固相可逆的固定化(SPRI)ビーズ又はAgencourt AMPure XPビーズである。
ポリヌクレオチド結合タンパク質(例、ポリヌクレオチド巻き戻し酵素)
ポリヌクレオチド結合タンパク質は、ポリヌクレオチドに結合し、かつポアを通るその動きを制御することができる任意のタンパク質であってもよい。タンパク質がポリヌクレオチドに結合するか否かを判定することは、当該技術分野において容易である。タンパク質は、通常は、ポリヌクレオチドの少なくとも一つの特性と相互作用し、それを修飾する。タンパク質は、個々のヌクレオチド又はヌクレオチドのより短い鎖、例えばジヌクレオチド又はトリヌクレオチドを形成するために、ポリヌクレオチドを切断することによってポリヌクレオチドを修飾してもよい。該部分は、ポリヌクレオチドを配向する又は特定の位置に移動させることによって、すなわちその動きを制御することによって、ポリヌクレオチドを修飾してもよい。
ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)は、好ましくは、ポリヌクレオチドハンドリング酵素に由来する。ポリヌクレオチドハンドリング酵素は、の少なくとも一つの特性と相互作用すること、かつそれを修飾することができるポリペプチドである。酵素は、個々のヌクレオチド又はヌクレオチドのより短い鎖、例えばジ-又はトリヌクレオチドを形成するために、ポリヌクレオチドを切断することによってポリヌクレオチドを修飾してもよい。酵素は、それを配向する又はそれを特定の位置に移動させることによって、ポリヌクレオチドを修飾してもよい。ポリヌクレオチドハンドリング酵素は、ポリヌクレオチドを結合し、ポアを通るその動きを制御することができる限り、酵素活性を示す必要はない。例えば、酵素を、その酵素活性を除去するために修飾してもよく、又は酵素として作用することを防ぐ条件下で使用してもよい。そのような条件は以下でより詳論される。
ポリヌクレオチドハンドリング酵素は、好ましくは、核酸分解酵素に由来する。酵素の構築物に使用されるポリヌクレオチドハンドリング酵素は、より好ましくは、酵素分類(EC)群3.1.11、3.1.13、3.1.14、3.1.15、3.1.16、3.1.21、3.1.22、3.1.25、3.1.26、3.1.27、3.1.30及び3.1.31のいずれかのメンバーに由来する。酵素は、WO2010/086603に開示されているもののいずれかであってもよい。
好ましい酵素は、ポリメラーゼ、ヘリカーゼ、トランスロカーゼ及びトポイソメラーゼ、例えばジャイレースである。ポリメラ(登録商標)ゼは、PyroPhage(登録商標)3173 DNAポリメラーゼ(これはLucigen(登録商標)Corporationから市販されている)、SDポリメラーゼ(Bioron(登録商標)から市販されている)又はそれらの変異体であってもよい。酵素は、好ましくは、Phi29 DNAポリメラーゼ又はその変異体である。トポイソメラーゼは、好ましくは、部分分類(EC)群5.99.1.2及び5.99.1.3のいずれかのメンバーである。
酵素は、最も好ましくは、ヘリカーゼに由来する。ヘリカーゼは、Hel308ヘリカーゼ、TraIヘリカーゼ又はTrwCヘリカーゼなどのRecDヘリカーゼ、XPDヘリカーゼ又はDdaヘリカーゼであっても、又はそれに由来するものであってもよい。ヘリカーゼは、Hel308 Mbu、Hel308 Csy Hel308 Tga、Hel308 Mhu、TraI Eco、XPD Mbu、又はそれらの変異体であっても、又はそれに由来するものであってもよい。
ヘリカーゼは、WO2013/057495、WO2013/098562、WO2013/098561、WO2014/013260、WO2014/013259、WO2014/013262、及びWO/2015/055981に開示されているヘリカーゼ、修飾ヘリカーゼ又はヘリカーゼ構築物のいずれかであってもよい。
Ddaヘリカーゼは、好ましくは、WO/2015/055981、及びWO2016/055777に開示されている修飾のいずれかを含む。
本発明に従い、任意の数のヘリカーゼを使用してもよい。例えば、1、2、3、4、5、6、7、8、9、10又はそれ以上のヘリカーゼを使用してもよい。いくつかの実施形態では、異なる数のヘリカーゼを使用してもよい。上記ヘリカーゼのうちの複数の任意の組み合わせを使用してもよい。複数のヘリカーゼは、複数のDdaヘリカーゼであってもよい。二つ以上のヘリカーゼは、一つ以上のDdaヘリカーゼ及び一つ以上のTrwCヘリカーゼであってもよい。二つ以上のヘリカーゼは同一のヘリカーゼの異なる変異体であってもよい。
二つ以上のヘリカーゼは、好ましくは、互いに付着している。二つ以上のヘリカーゼは、より好ましくは、互いに共有的に付着している。ヘリカーゼは任意の順序で任意の方法を用いて付着してもよい。本発明で使用される好ましいヘリカーゼ構築物は、WO2014/013260、WO2014/013259、WO2014/013262、及びWO2015/055981に記載されている。
いくつかの実施形態では、ポリヌクレオチド結合タンパク質は、ポリヌクレオチド巻き戻し酵素である。ポリヌクレオチド巻き戻し酵素は、二本鎖ポリヌクレオチドを一本鎖に巻き戻すことができる酵素である。いくつかの実施形態では、ポリヌクレオチド巻き戻し酵素は、二本鎖DNAを一本鎖に巻き戻すことができる。いくつかの実施形態では、ポリヌクレオチド巻き戻し酵素はヘリカーゼ活性を有する酵素である。ポリヌクレオチド巻き戻し酵素の例には、例えば、本明細書に記載のヘリカーゼが含まれる。
ポリヌクレオチド結合能は、当該技術分野において既知の任意の方法を用いて測定することができる。例えば、タンパク質をポリヌクレオチドと接触させることができ、ポリヌクレオチドに結合してポリヌクレオチドに沿って移動する能力を測定することができる。タンパク質は、ポリヌクレオチドの結合を促進する修飾、及び/又は高塩濃度及び/又は室温でその活性を促進する修飾を含んでもよい。タンパク質は、ポリヌクレオチドに結合する(すなわち、ポリヌクレオチド結合能を保持する)が、ヘリカーゼとして機能しない(すなわち、移動を促進するために必要な全ての構成要素、例えばATP及びMg2+を備えている場合、ポリペプチドに沿って移動しない)ように修飾してもよい。そのような修飾は当技術分野において既知である。例えば、ヘリカーゼにおけるMg2+結合ドメインの修飾は、通常は、ヘリカーゼとして機能しない変異体をもたらす。これらの種類の変異体は分子ブレーキとして作用してもよい。
酵素はポアに共有的に付着していてもよい。任意の方法を用いて酵素をポアに共有的に結合させてもよい。
鎖配列決定において、ポリヌクレオチドは印加電位とともに又はそれに対向し、ポアを通って転座する。二本鎖ポリヌクレオチドに漸進的又は進行的に作用するエキソヌクレアーゼを、印加電位下で残りの一本鎖を通過させるために、ポアのシス側、又は逆電位下でトランス側で使用することができる。同様に、二本鎖DNAを巻き戻すヘリカーゼも類似の方法で使用することができる。ポリメラーゼを使用してもよい。印加電位に対する鎖転座を必要とする配列決定用途の可能性もあるが、DNAは最初に逆電位又は非電位下で酵素によって「捕捉され」なければならない。結合後に元に戻る可能性がある中で、鎖は、シスからトランスへポアを通過し、電流の流れによって伸長した配座に保持される。一本鎖DNAエキソヌクレアーゼ又は一本鎖DNA依存性ポリメラーゼは、印加電位に対して、直近の転座した一本鎖を、制御された段階的様式でポアを通ってトランスからシスへと引き戻すように、分子モーターとして作用することができる。
本発明において、任意のヘリカーゼを使用してもよい。ヘリカーゼは、ポアに関して二つのモードで動作してもよい。まず、該方法は、好ましくは、印加電位から生じる電界でポアを通ってポリヌクレオチドを移動させるように、ヘリカーゼを用いて実施される。このモードでは、ポリヌクレオチドの5´末端が最初にポアに捕捉され、ヘリカーゼは、それが最後に膜のトランス側を通って転座するまで電界でポアを通るように、ポリヌクレオチドをポア内に移動させる。あるいは、該方法は、好ましくは、ヘリカーゼが印加電位から生じる電界に対して、ポリヌクレオチドをポアを通って移動させるように実施される。このモードでは、ポリヌクレオチドの3´末端が最初にポアに捕捉され、ヘリカーゼは、膜のシス側に戻って最終的に排出されるまで、印加された電界に対してポアから引き出されるように、ポアを通ってポリヌクレオチドを移動させる。
この方法はまた、逆方向に実施してもよい。ポリヌクレオチドの3´末端が最初にポア内に捕捉されてもよく、ヘリカーゼは、それが最後に膜のトランス側を通って移行するまで、電界でポアを通るように、ポリヌクレオチドをポアに移動させてもよい。
ヘリカーゼは、移動を促進するために必要な構成要素を備えてない場合、又はその移動を妨げるか若しくは妨げるように修飾されている場合、ポリヌクレオチドに結合することができ、印加電界によってポアに引き込まれる際に、ポリヌクレオチドの動きを遅くするブレーキとして作用する。不活性モードでは、ポリヌクレオチドが3´又は5´下のいずれに捕捉されるかにかかわらず、酵素がブレーキとして機能し、ポリヌクレオチドをトランス側に向かってポア内に引き込むのは印加電界である。不活性モードにあるとき、ヘリカーゼによるポリヌクレオチドの移動制御は、ラチェット、スライド及びブレーキを含むいくつかの方法で説明することができる。ヘリカーゼ活性を欠くヘリカーゼ変異体もまたこのように使用することができる。
ポリヌクレオチドは、任意の順序でポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)及びポアと接触させてもよい。ポリヌクレオチドがヘリカーゼなどのポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)及びポアと接触しているとき、ポリヌクレオチドは最初にポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)と複合体を形成することが好ましい。ポアを横切って電圧が印加されると、ポリヌクレオチド/ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)複合体は、ポアと複合体を形成し、かつポアを通るポリヌクレオチドの移動を制御する。
ポリヌクレオチド結合タンパク質を使用する方法における任意のステップは、通常は、遊離ヌクレオチド又は遊離ヌクレオチド類似体及びポリヌクレオチド結合タンパク質の作用を促進する酵素補因子の存在下で実施される。遊離ヌクレオチドは上述の各ヌクレオチドのいずれかの一つ以上であってもよい。遊離ヌクレオチドには、アデノシン一リン酸(AMP)、アデノシン二リン酸(ADP)、アデノシン三リン酸(ATP)、グアノシン一リン酸(GMP)、グアノシン二リン酸(GDP)、グアノシン三リン酸(GTP)、チミジン一リン酸(TMP)、チミジン二リン酸(TDP)、チミジン三リン酸(TTP)、ウリジン一リン酸(UMP)、ウリジン二リン酸(UDP)、ウリジン三リン酸(UTP)、シチジン一リン酸(CMP)、シチジン二リン酸(CDP)、シチジン三リン酸(CTP)、環状アデノシン一リン酸(cAMP)、環状グアノシン一リン酸(cGMP)、デオキシアデノシン一リン酸(dAMP)、デオキシアデノシン二リン酸(dADP)、デオキシアデノシン三リン酸(dATP)、デオキシグアノシン一リン酸(dGMP)、デオキシグアノシン二リン酸(dGDP)、デオキシグアノシン三リン酸(dGTP)、デオキシチミジン一リン酸(dTMP)、デオキシチミジン二リン酸(dTDP)、デオキシチミジン三リン酸(dTTP)、デオキシウリジン一リン酸(dUMP)、デオキシウリジン二リン酸(dUDP)、デオキシウリジン三リン酸(dUTP)、デオキシシチジン一リン酸(dCMP)、デオキシシチジン二リン酸(dCDP)、及びデオキシシチジン三リン酸(dCTP)が挙げられるが、これらに限定されない。遊離ヌクレオチドは、好ましくは、AMP、TMP、GMP、CMP、UMP、dAMP、dTMP、dGMP、又はdCMPから選択される。遊離ヌクレオチドは、好ましくは、アデノシン三リン酸(ATP)である。酵素補因子は、構築物が機能することを可能にする因子である。酵素補因子は、好ましくは、二価金属カチオンである。二価金属カチオンは、好ましくは、Mg2+、Mn2+、Ca2+、又はCo2+である。酵素補因子は、最も好ましくは、Mg2+である。
分子ブレーキは、ポリヌクレオチドに結合し、かつポアを通るポリヌクレオチドの移動を遅くする任意の化合物又は分子であってもよい。分子ブレーキは上記に論じられるもののいずれかであってもよい。分子ブレーキは、好ましくは、ポリヌクレオチドに結合する化合物を含む。化合物は、好ましくは、大員環化合物である。適切な大員環化合物には、シクロデキストリン、カリックスアレーン、環状ペプチド、クラウンエーテル、ククルビツリル、ピララレン、それらの誘導体又はそれらの組み合わせが挙げられるが、これらに限定されない。シクロデキストリン又はその誘導体は、Eliseev,A. V.,及びSchneider, H-J.(1994)J.Am.Chem.Soc.116、6081~6088.に開示されているもののいずれかであってもよい。シクロデキストリンは、より好ましくは、ヘプタキス-6-アミノ-β-シクロデキストリン(am7-βCD)、6-モノデオキシ-6-モノアミノ-β-シクロデキストリン(am1-βCD)、又はヘプタキス-(6-デオキシ-6-グアニジノ)-シクロデキストリン(gu7-βCD)である。
膜
本明細書に記載の様々な態様に従って、任意の膜を使用してもよい。適切な膜は当技術分野において既知である。膜は、好ましくは、両親媒性層又は固体層である。
両親媒性層は、親水性と親油性の両方の特性を有するリン脂質などの両親媒性分子から形成される層である。両親媒性分子は合成又は天然であってもよい。天然に存在しない両親媒性物質及び単分子層を形成する両親媒性物質は、当該分野において既知であり、例えば、ブロックコポリマーを含む(Gonzalez-Perez et al.,Langmuir,2009,25,10447-10450)。ブロックコポリマーは、二つ以上のモノマーサブユニットがともに重合されて単一高分子鎖を形成するポリマー材料である。ブロックコポリマーは、通常は、各モノマーサブユニットによって寄与される特性を有する。しかしながら、ブロックコポリマーは、個々のサブユニットから形成されたポリマーを保有していないという一意の性質を有し得る。ブロックコポリマーは、一方のモノマーサブユニットが疎水性(すなわち、親油性)であり、他方のサブユニットが水性媒体中で親水性であるように操作することができる。この場合、ブロックコポリマーは両親媒性を有してもよく、生体膜を模倣する構造を形成してもよい。ブロックコポリマーはジブロック(二つのモノマーサブユニットからなる)であってもよいが、両親媒性物質として作用するより複雑な配置を形成するように、二つ以上のモノマーサブユニットから構築してもよい。コポリマーはトリブロック、テトラブロック又はペンタブロックコポリマーであってもよい。膜は、好ましくは、トリブロックコポリマー膜である。
古細菌二極性テトラエーテル脂質は、脂質が単分子層膜を形成するように構築される天然型脂質である。これらの脂質は一般的に過酷な生物学的環境で生き残る極限微生物、好熱菌、好塩菌、及び好酸菌に見られる。それらの安定性は、最終的な二分子層の融合した性質に由来すると考えられる。一般的なモチーフ親水性-疎水性-親水性を有するトリブロックポリマーを生成することによって、これらの生物学的実体を模倣するブロックコポリマー材料を構築することは簡単である。この材料は、脂質二分子層と同様に挙動し、ベシクルから層状膜までの範囲の相挙動を包含する単量体膜を形成してもよい。これらのトリブロックコポリマーから形成された膜は、生体脂質膜に対していくつかの利点を有する。トリブロックコポリマーは合成されているので、膜を形成するためかつポア及び他のタンパク質と相互作用するために必要な正しい鎖長及び特性を提供するように、慎重に制御することができる。
ブロックコポリマーはまた、脂質サブ材料として分類されないサブユニットから構築してもよい。例えば、疎水性ポリマーはシロキサン又は他の非炭化水素系モノマーから生成してもよい。ブロックコポリマーの親水性サブセクションはまた、低いタンパク質結合特性も保有することができ、それは生の生体試料にさらされた際に高度な耐性である膜の生成を可能にする。この頭部基単位はまた、非古典的な脂質頭部基に由来してもよい。
トリブロックコポリマー膜はまた、生体脂質膜と比較して増大した機械的安定性及び環境安定性、例えば、はるかに高い動作温度又はpH範囲を有する。ブロックコポリマーの合成性質は、幅広い用途向けにポリマーベースの膜をカスタマイズするためのプラットフォームを提供する。
膜は、最も好ましくは、WO2014/064443、又はWO2014/064444に開示されている膜の一つである。
両親媒性分子はポリヌクレオチドの結合を促進するために化学修飾又は官能化してもよい。
両親媒性層は、単分子層又は二分子層であってもよい。両親媒性層は、通常は、平面状である。両親媒性層は湾曲していてもよい。両親媒性層は支持されていてもよい。両親媒性層は凹面であってもよい。両親媒性層は両親媒性層の周辺領域(ピラーに付着している)が両親媒性層領域よりも高くなるように、隆起ピラーから吊り下げてもよい。これにより、上記のように微粒子が膜に沿って進み、移動する、スライドする、又は転動することが可能になる。
両親媒性膜は、通常は、自然に移動可能であり、本質的に、脂質拡散速度が約10-8cm s-1の二次元流体として作用する。これは、ポア及び結合したポリヌクレオチドが、通常は、両親媒性膜内で移動できることを意味する。
膜は脂質二分子層であってもよい。脂質二分子層は細胞膜のモデルであり、一連の実験研究のための優れたプラットフォームとして機能する。例えば、脂質二分子層は、シングルチャネル記録による膜タンパク質のin vitro研究に使用することができる。あるいは、脂質二分子層は、幅広い物質の存在を検出するためのバイオセンサーとして使用することができる。この脂質二分子層は任意の脂質二分子層であってもよい。適切な脂質二分子層としては、平面脂質二分子層、支持二分子層、又はリポソームが挙げられるが、これらに限定されない。脂質二分子層は、好ましくは、平面脂質二分子層である。適切な脂質二分子層はWO2008/102121、WO2009/077734、及びWO2006/100484に開示されている。
脂質二分子層を形成するための方法は当該技術分野において既知である。脂質二分子層は、一般に、Montal and Mueller(Proc.Natl.Acad.Sci.USA.,1972;69:3561-3566)の方法で形成される。該方法において、脂質一分子層はその界面に対して垂直な開口部のいずれかの側を通過して水溶液/空気界面上に担持される。脂質は通常、最初にそれを有機溶媒に溶解し、次に少量の溶媒を開口部の両側にある水溶液の界面上で蒸発させることによって、電解質水溶液の表面に添加される。有機溶媒が蒸発すると、開口部の両側の溶液/空気界面は二分子層が形成されるまで開口部を通過して物理的に上下に移動する。平面脂質二分子層は、膜の開口部を横切って又は陥凹部への開口部を横切って形成されてもよい。
Montal&Muellerの方法は、タンパク質ポア挿入に適した良質の脂質二分子層を形成するための費用対効果が高く、比較的簡単な方法であるので、人気がある。二分子層形成の他の一般的な方法には、先端浸漬(tip-dipping)、二分子層の塗装(painting bilayers)、及びリポソーム二分子層のパッチクランプが含まれる。
先端浸漬二分子層形成は、脂質の単分子層を担持している試験溶液の表面上に開口面(例えば、ピペットチップ)を接触させることを伴う。ここでも、脂質一分子層は、有機溶媒中に溶解した少量の脂質を溶液表面で蒸発させることによって最初に溶液/空気界面で生成される。次いで、二分子層はラングミュア-シェーファー法によって形成され、溶液表面に対して開口部を移動させるための機械的自動化を必要とする。
二分子層の塗装については、有機溶媒中に溶解した少量の脂質を試験水溶液に浸されている開口部に直接適用する。脂質溶液は絵筆又は同等物を用いて開口部の上に薄く広げられる。溶媒を薄くすることは脂質二分子層の形成につながる。しかしながら、二分子層から溶媒を完全に除去することは困難であり、その結果、この方法によって形成された二分子層は安定性が低く、電気化学的測定中にノイズを生じやすい。
パッチクランプは、一般的に、生体細胞膜の研究に使用されている。細胞膜は吸引によりピペットの端部に留められ、膜のパッチが開口部の上に付着するようになる。該方法は、リポソームを留めてから破裂させて脂質二分子層をピペットの開口部を覆って密封することにより、脂質二分子層を生成するために採用されてきた。該方法は、安定している巨大で単分子層のリポソーム、及びガラス表面を有する材料に小さな開口部を作製することを必要とする。
リポソームは超音波処理、押出、又はMozafari法によって形成することができる(Colas et al.(2007) Micron 38:841-847)。
好ましい実施形態では、脂質二分子層はWO2009/077734に記載のように形成される。この方法では有利に、脂質二分子層は乾燥脂質から形成される。最も好ましい実施形態では、脂質二分子層は、WO2009/077734に記載されるように、開口部を横切って形成される。
脂質二分子層は脂質の二つの対向する層から形成される。二つの脂質層は、それらの疎水性尾部基が互いに向き合って疎水性内部を形成するように配置される。脂質の親水性ヘッド基は、二分子層の両側で水性環境に向かって外側に向いている。二分子層は、液体無秩序相(流体層状)、液体秩序相、固体秩序相(ラメラゲル相、櫛型ゲル相)、及び平面二分子層結晶(ラメラサブゲル相、ラメラ結晶相)を含むがこれらに限定されない、いくつかの脂質相に存在してもよい。
脂質二分子層を形成する任意の脂質組成物を使用してもよい。脂質組成物は、表面電荷、膜タンパク質を支持する能力、充填密度又は機械的性質などの必要な性質を有する脂質二分子層が形成されるように選択される。脂質組成物は一つ以上の異なる脂質を含んでもよい。例えば、脂質組成物は100個までの脂質を含んでもよい。脂質組成物は、好ましくは、1~10個の脂質を含む。脂質組成物は、天然型脂質及び/又は人工脂質を含んでもよい。
脂質は、通常は、ヘッド基、界面部分、及び同一でも異なってもよい二つの疎水性尾部基を含む。適切なヘッド基には、ジアシルグリセリド(DG)及びセラミド(CM)などの中性頭部基、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)及びスフィンゴミエリン(SM)などの双性イオン頭部基、ホスファチジルグリセロール(PG)などの負に帯電した頭部基、ホスファチジルセリン(PS)、ホスファチジルイノシトール(PI)、ホスファチジン酸(PA)及びカルジオリピン(CA)、並びにトリメチルアンモニウム-プロパン(TAP)などの正に帯電した頭部基が含まれるが、これらに限定されない。適切な界面部分には、グリセロール系又はセラミド系部分などの天然に存在する界面部分が含まれるが、これらに限定されない。適切な疎水性尾部基には、ラウリン酸(n-ドデカノール酸)、ミリスチン酸(n-テトラデコン酸)、パルミチン酸(n-ヘキサデカン酸)、ステアリン酸(n-オクタデカン酸)、アラキジン酸(n-エイコサン酸)などの飽和炭化水素鎖、オレイン酸(シス-9-オクタデカン)などの不飽和炭化水素鎖、及びフィタノイルなどの分岐炭化水素鎖が含まれるが、これらに限定されない。不飽和炭化水素鎖中の鎖の長さ、並びに二重結合の位置及び数は変更することができる。分岐炭化水素鎖中の鎖の長さ並びにメチル基などの分岐の位置及び数は変更することができる。疎水性尾部基は、エーテル又はエステルとして界面部分に結合することができる。脂質はミコール酸であってもよい。
脂質は化学的に修飾することもできる。脂質の頭部基又は尾部基は化学的に修飾してもよい。頭部基が化学的に修飾されている適切な脂質には、1,2-ジアシル-sn-グリセロ-3-ホスホエタノールアミン-N-[メトキシ(ポリエチレングリコール)-2000]などのPEG修飾脂質、1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン-N-[ビオチニル(ポリエチレングリコール)2000]などの官能化PEG脂質、及び1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン-N-(スクシニル)かつ1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン-N-(ビオチニル)などの共役のために修飾された脂質が含まれるが、これらに限定されない。尾部基が化学的に修飾されている適切な脂質には、1,2-ビス(10,12-トリコサジイノイル)-sn-グリセロ-3-ホスホコリンなどの重合性脂質、1-パルミトイル-2-(16-フルオロパルミトイル)-sn-グリセロ-3-ホスホコリンなどのフッ素化脂質、1,2-ジパルミトイル-D62-sn-グリセロ-3-ホスホコリンなどの重水素化脂質、及び1,2-ジ-O-フィタニル-sn-グリセロ-3-ホスホコリンなどのエーテル結合脂質が含まれるが、これらに限定されない。脂質はポリヌクレオチドの結合を促進するために化学的に修飾又は官能化されてもよい。
両親媒性層、例えば、脂質組成物は、通常は、層の特性に影響を与える一つ以上の添加剤を含む。適切な添加剤には、パルミチン酸、ミリスチン酸、オレイン酸などの脂肪酸、パルミチンアルコール、ミリスチンアルコール及びオレインアルコールなどの脂肪アルコール、コレステロール、エルゴステロール、ラノステロール、シトステロール及びスチグマステロールなどのステロール、1-アシル-2-ヒドロキシ-sn-グリセロ-3-ホスホコリンなどのリゾリン脂質、及びセラミドが含まれるが、これらに限定されない。
固体層は、マイクロ電子材料、Si3N4、A12O3及びSiOなどの絶縁材料、ポリアミドなどの有機及び無機ポリマー、テフロン(登録商標)などのプラスチック又は二成分付加硬化型シリコーンゴムなどのエラストマー、及びガラスを含むがこれらに限定されない有機材料及び無機材料の両方から形成することができる。固体層はグラフェンから形成してもよい。適切なグラフェン層は、WO2009/035647に開示されている。Yusk et al.,Nature Nanotechnology,2011;6:253-260、及び米国特許出願第2013/0048499号は、微粒子を使用しない固体層中の膜貫通孔へのタンパク質の送達を記載している。本発明の方法は、これらの文献に開示されている方法での送達を改善するために使用してもよい。
該方法は、通常は、(i)ポアを含む人工両親媒性層、(ii)ポアを含む単離された天然に存在する脂質二分子層、又は(iii)ポアが内部に挿入された細胞を用いて実施される。該方法は、通常は、人工トリブロックコポリマー層などの人工両親媒性層を用いて実施される。層は、ポアに加えて、他の膜貫通タンパク質及び/又は膜内タンパク質、並びに他の分子を含んでもよい。適切な装置及び条件は以下に詳論される。本発明の方法は、通常は、インビトロで実施される。
本発明の方法に従ってポリヌクレオチドが送達される膜は液体に含まれている。液体は、膜を「濡れた」状態に保ち、乾燥するのを止める。液体は、通常は、水溶液である。水溶液は、通常は、水と同一の密度を有する。水溶液の密度は、通常は、約1g/cm3である。溶液の密度は、溶液の温度及び正確な組成に応じて変わる。水溶液は、通常は、約0.97~約1.03g/cm3の密度を有する。
膜は、通常は、二つの体積の水溶液を分離する。膜は、体積間の電流の流れに抵抗する。膜中に挿入された膜貫通孔は、膜をわたるイオンの通過を選択的に可能にし、これは二つの体積の水溶液中の電極によって検出された電気信号として記録することができる。標的ポリヌクレオチドの存在は、イオンの流れを調節し、得られる電気信号の変動を観察することによって検出される。
アレイ
膜は、通常は、膜のアレイの一部であって、各膜は好ましくは膜貫通孔を含む。したがって、本発明は膜のアレイを用いて標的ポリヌクレオチドを検出する方法を提供する。
膜は、アレイが試験試料から並行して測定する多くの個々のセンサーと同等であるように、それぞれ独自の電極を用いて個別にアドレスされる、電気的に絶縁した膜のアレイを有する装置に含まれてもよい。膜は比較的高密度に充填されていてもよく、それにより、所定量の試験試料に多数の膜を使用することを可能にする。膜及び装置の適切なアレイは、当該技術分野、例えばWO2009/077734、及びWO2012/042226に記載されている。WO2009/077734は、例えば、マイクロウェル開口部のアレイを横切って形成された複数の個別にアドレス可能な脂質二分子層を開示し、各マイクロウェルは脂質二分子層と接触する電極及び水性媒体を含む。
装置は、通常は、膜及び膜貫通孔があらかじめ挿入されている「準備完了」状態でエンドユーザーに提供される。「準備完了」状態で提供される典型的な装置は、各膜が膜貫通孔を含み、液体を含むウェルを横切って提供される、両親媒性膜のアレイを含む。そのような装置及びその製造方法はWO2014/064443に開示されている。解析対象の試験液は両親媒性膜の上面に塗布される。
ただし、装置を「準備完了」状態で提供するには、性能の損失又はセンサーの損傷をもたらすおそれがあるため、センサーが乾燥しない、すなわち、両親媒性膜を通過することによって液体がウェルから失われないように注意する必要があるという追加の考慮事項がある。センサーの乾燥の問題に対処するための一つの解決策は、膜の表面からの蒸発を最小限に抑え、膜のいずれかの側に提供される液体が浸透効果を低減するために同一のイオン強度を有するように、両親媒性膜の表面上に緩衝液を有する装置を提供することである。使用時に、緩衝液を両親媒性膜の表面から除去してもよい、そして解析対象の試験液を表面に接触するように導入する。
いくつかの用途は、膜を横切る電気的特性、例えばイオン電流の流れの測定を用いてもよい。そのような測定を提供するために、装置は、極性媒体を含む容積と電気的に接触する各区画内の各電極をさらに含んでもよい。他の種類の測定、例えば、蛍光測定及びFET測定などの光学的測定を実施してもよい。光学的測定及び電気測定を同時に実施してもよい(Heron AJ et al.,J Am Chem Soc.2009;131(5):1652-3)。
装置は共通電極をさらに含んでもよい。装置は、共通電極と各区画内の各電極との間に接続された電気回路をさらに含んでもよい。電気回路は電気測定を行うように配置されている。そのような電気測定は、膜で起こるプロセス又は膜を通って起こるプロセスに依存してもよい。
装置はナノポアアレイの測定を行うためのFETアレイを含んでもよい。
膜貫通ポア
膜貫通ポアは膜をある程度横切る構造である。それは印加電位によって駆動される水和イオンが膜を横切って流れる又は膜内に流れることを可能にする。膜貫通孔は、通常は、水和イオンが膜の片側から膜の反対側へ流れるように膜全体を横切る。しかしながら、膜貫通孔は膜を横切る必要はない。一方の末端は閉じていてもよい。例えば、ポアは、それに沿って又はその中に水和イオンが流れてもよい膜中のウェル、ギャップ、チャネル、トレンチ、又はスリットであってもよい。
本発明では任意の膜貫通孔を使用してもよい。ポアは生物学的又は人工的であってもよい。適切なポアには、タンパク質ポア、ポリヌクレオチドポア、及び固体ポアが含まれるが、これらに限定されない。ポアはDNA折り紙ポアであってもよい(Langecker et al.,Science,2012;338:932-936)。ポアはモータータンパク質ナノポア、例えば、二本鎖ポリヌクレオチドの転座を可能にするナノポアであってもよい。いくつかの実施形態では、モータータンパク質ナノポア、二本鎖ポリヌクレオチドを巻き戻すことができる。例示的なモータータンパク質ナノポアは、例えば、Wendell et al.、「膜適合型φ29モータータンパク質ナノポアを通る二本鎖DNAの転座」Nat Nanotechnol、4(2009)、765~772頁に記載されているように、φ29モータータンパク質ナノポアを含むが、これに限定されない。いくつかの実施形態では、Fengら「ナノポアベースの第4世代DNA配列決定技術」Genomics、Proteomics&Bioinformatics(2015)第13巻、第1号、4~16頁に記載又は参照されている任意のナノポアは、本明細書に記載の様々な態様に使用することができる。
膜貫通孔は、好ましくは、膜貫通タンパク質ポアである。膜貫通タンパク質ポアは、ポリヌクレオチドなどの水和イオンが膜の片側から反対側へ流れることを可能にするポリペプチド又はポリペプチドの集合体である。本発明では、膜貫通タンパク質ポアは、印加電位によって駆動される水和イオンが膜の片側から反対側へ流れることを可能にするポアを形成することができる。膜貫通タンパク質ポアは、好ましくは、ポリヌクレオチドがトリブロックコポリマー膜などの膜の片側から反対側へ流れることを可能にする。膜貫通タンパク質ポアは、DNA又はRNAなどのポリヌクレオチドがポアを通って移動することを可能にする。
膜貫通タンパク質ポアはモノマー又はオリゴマーであってもよい。ポアは、好ましくは、少なくとも六つ、少なくとも七つ、少なくとも八つ、少なくとも九つ、少なくとも10個、少なくとも11個、少なくとも12個、少なくとも13個、少なくとも14個、少なくとも15個、又は少なくとも16個のサブユニットなどのいくつかの繰り返しサブユニットからなる。ポアは、好ましくは、六量体、七量体、八量体又は九量体のポアである。ポアは、ホモオリゴマー又はヘテロオリゴマーであってもよい。
膜貫通タンパク質ポアは、通常は、イオンが流れてもよいバレル又はチャネルを含む。ポアのサブユニットは、通常は、中心軸を取り囲み、鎖を膜貫通βバレル若しくはチャネル又は膜貫通α-ヘリックスバンドル若しくはチャネルに寄与する。
膜貫通タンパク質ポアのバレル又はチャネルは、通常は、ヌクレオチド、ポリヌクレオチド又は核酸との相互作用を促進するアミノ酸を含む。これらのアミノ酸は、好ましくは、バレル又はチャネルの狭窄部の近傍に位置する。膜貫通タンパク質ポアは、通常は、アルギニン、リジン、若しくはヒスチジンなどの一つ以上の正電荷アミノ酸、又はチロシン若しくはトリプトファンなどの芳香族アミノ酸を含む。これらのアミノ酸は、通常は、ポアとヌクレオチド、ポリヌクレオチド、又は核酸との間の相互作用を促進する。
本発明に従って使用するための膜貫通タンパク質ポアは、β-バレルポア又はα-ヘリックスバンドルポアに由来することができる。β-バレルポアは、β-鎖から形成されるバレル又はチャネルを含む。適切なβ-バレルポアとしては、α-ヘモリシン、炭疽菌毒素、及びロイコシジンなどのβ-毒素、並びにMycobacterium smegmatis ポリン(Msp)、例えばMspA、MspB、MspC、又はMspD、CsgG、外膜ポリンF(OmpF)、外膜ポリンG(OmpG)、外膜ホスホリパーゼA及びNeisseriaオートトランスポーターリポタンパク質(NalP)などの細菌の外膜タンパク質/ポリン、並びにリセニンなどの他のポアが挙げられるが、これらに限定されない。α-ヘリックスバンドルポアは、α-ヘリックスから形成されるバレル又はチャネルを含む。適切なα-ヘリックスバンドルポアは、WZA及びClyA毒素などの内膜タンパク質及びα外膜タンパク質を含むが、これらに限定されない。
膜貫通孔は、Msp、α-溶血毒(α-HL)、リセニン、CsgG、ClyA、Sp1、及び溶血性タンパク質フラガセトキシンC(FraC)に由来しても、又はそれらに基づいてもよい。膜貫通タンパク質ポアは、好ましくはCsgG、より好ましくは大腸菌Str.K-12亜種MC4100からのCsgGに由来する。CsgG由来の適切なポアは、WO2016/034591に開示されている。膜貫通孔はリセニンに由来してもよい。リセニン由来の適切なポアは、WO2013/153359に開示されている。
野生型α溶血毒ポアは、七つの同一のモノマー又はサブユニット(すなわち、七量体である)からなる。α-溶血毒-NNの一つのモノマー又はサブユニットの配列は、例えば、WO2016/059375に開示されている。
膜貫通タンパク質ポアは、好ましくはMsp、より好ましくはMspAに由来する。MspA由来の適切なポアは、WO2012/107778に開示されている。
膜貫通タンパク質ポアなどの本明細書に記載のタンパク質はいずれも、例えば、ヒスチジン残基(hisタグ)、アスパラギン酸残基(aspタグ)、ストレプトアビジンタグ、フラッグタグ、SUMOタグ、GSTタグ、若しくはMBPタグの付加によって、又はポリペプチドがそのような配列を天然に含まない場合、細胞からのそれらの分泌を促進するための信号配列の付加によって、同定又は精製を補助するために修飾してもよい。遺伝子タグを導入する代わりの方法は、ポア又は構築物上の天然位置又は操作位置上にタグを化学的に反応させることである。この一つの例は、ゲルシフト試薬をポアの外側に操作されたシステインに反応させることである。これは、溶血毒ヘテロオリゴマーを分離するための方法として実証されている(Chem Biol.1997年7月.4(7):497-505)。
ポアは、リピーリング標識で標識付けすることができる。リピーリング標識は、ポアを検出することを可能にする任意の適切な標識であってもよい。適切な標識としては、蛍光分子、放射性同位体、例えば125I、35S、酵素、抗体、抗原、ポリヌクレオチド、及びビオチンなどのリガンドが挙げられるが、これらに限定されない。
膜貫通タンパク質ポアなどの本明細書に記載のタンパク質はいずれも、合成的に又は組み換え手段によって生成してもよい。例えば、ポアは、インビトロ翻訳及び転写(IVTT)によって合成してもよい。ポアのアミノ酸配列は、非自然発生のアミノ酸を含む、又はタンパク質の安定性を高めるために修飾してもよい。タンパク質が合成手段によって生成される場合、そのようなアミノ酸は生成中に導入してもよい。ポアはまた、合成生成又は組換え生成のいずれかの後に変更してもよい
膜貫通タンパク質ポアなどの本明細書に記載のタンパク質はいずれも、当該技術分野において既知の標準的な方法を用いて生成することができる。ポア又は構築物をコードするポリヌクレオチド配列は、当該技術分野における標準的な方法を用いて誘導及び複製してもよい。ポア又は構築物をコードするポリヌクレオチド配列は、当該技術分野における標準的な方法を用いて細菌宿主細胞において発現させてもよい。ポアは、組み換え発現ベクターからのポリペプチドのin situ発現によって細胞中に生成してもよい。発現ベクターは、ポリペプチドの発現を制御するために場合により誘導性プロモーターを担持する。これらの方法は、Sambrook、J.and Russell、D.(2001).Molecular Cloning:A Laboratory Manual、第3版.Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NYに記載されている。
ポアは、タンパク質生成有機体からの任意のタンパク質液体クロマトグラフィーシステムによる精製後に、又は組み換え発現後に大規模に生成されてもよい。典型的なタンパク質液体クロマトグラフィーシステムには、FPLC、AKTAシステム、Bio-Cadシステム、Bio-Rad BioLogicシステム、及びGilson HPLCシステムが含まれる。
イオン流の測定
膜貫通孔を通るイオン流は、電気測定及び/又は光学的測定を用いて監視されてもよい。
電気測定は、電流測定、インピーダンス測定、トンネル効果測定、又は電界効果トランジスタ(FET)測定であってもよい。
ポリペプチドがポアを通って転座するときに膜貫通孔を通るイオン流の変化は、電流、抵抗又は光学特性の変化として検出してもよい。測定された効果は、膜貫通孔を横切る電子のトンネル効果であり得る。測定された効果は、ポリヌクレオチドと膜貫通孔との相互作用による電位の変化であり得る。ここで、効果は、FET測定における局所電位センサーを用いて監視される。
様々な異なる種類の測定を行ってもよい。これは電気測定及び光学的測定を含むが、これらに限定されない。蛍光の測定を含む適切な光学的方法はJ.Am.Chem.Soc.2009,131 1652-1653によって開示されている。利用可能な電気測定は以下を含む:電流測定、インピーダンス測定、トンネル効果測定(Ivanov AP et al., Nano Lett.2011年1月12日;11(1):279-85)、及びFET測定(国際出願第WO2005/124888号)。光学的測定は電気測定と組み合わせてもよい(Soni GV et al.,Rev Sci Instrum.2010年1月;81(1):014301)。測定はポアを通過するイオン電流の測定などの膜貫通電流測定であってもよい。
電気測定は標準的な単一チャンネル記録を用いて行ってもよい。
電気測定は、Stoddart D et al.,Proc Natl Acad Sci,12;106(19):7702-7、Lieberman KR et al.,J Am Chem Soc.2010年132(50):17961-72、及び国際出願第WO2000/28312号に記載されているような標準的な単一チャネル記録装置を用いて行ってもよい。あるいは、例えば、WO2009/077734及びWO2011/067559に記載されているようなマルチチャネルシステムを用いて電気測定を行ってもよい。
該方法は、好ましくは、膜を横切って電位が印加される状態で実施される。印加電位は電圧電位であってもよい。あるいは、印加電位は化学的電位であってもよい。いくつかの実施形態では、印加電位は浸透圧の不均衡によって引き起こされてもよい。この例は、両親媒性層などの膜を横切る塩勾配を使用することである。塩勾配は、Holden et al.,J Am Chem Soc.2007年7月11日;129(27):8650-5に開示されている。いくつかの実例では、ポリヌクレオチドの配列を推定又は判定するために、ポリヌクレオチドがポアに対して移動するときにポアを通過する電流を使用する。
ポリヌクレオチドの特徴付け
本明細書に記載の様々な態様のいくつかの実施形態では、方法は標的ポリヌクレオチドをさらに特徴付けることを含んでもよい。標的ポリヌクレオチドがポアと接触するとき、標的ポリヌクレオチドの一つ以上の特徴を示す一つ以上の測定は、ポリヌクレオチドがポアに対して転座する際に行われる。
該方法は、ポリヌクレオチドが修飾されているか否かを決定することに関与してもよい。いかなる修飾の有無を測定してもよい。該方法は、好ましくは、メチル化によって、酸化によって、損傷によって、一つ以上のタンパク質、又は一つ以上の標識、タグ、若しくはスペーサーでポリヌクレオチドが修飾されているか否かを判定することを含む。特異的修飾は、ポアとの特異的相互作用をもたらすことになり、それは下記の方法を用いて測定することができる。例えば、メチルシトシンを、各ヌクレオチドとの相互作用中にポアを通るイオン流に基づいて、シトシンと区別してもよい。
装置
該方法はポアが膜中にある膜/ポアシステムを調査するのに適した任意の装置を用いて実施してもよい。該方法は膜貫通孔センシングに適した任意の装置を用いて実施してもよい。例えば、装置は水溶液を含むチャンバ、及びチャンバを二つの部分に分ける障壁を備える。障壁は、通常は、ポアを含む膜が形成される開口部を有する。あるいは、障壁がポアが存在する膜を形成する。
該方法は、WO2008/102120に記載されている装置を用いて実施してもよい。
様々な異なる種類の測定を行ってもよい。これは電気測定及び光学的測定を含むが、これらに限定されない。蛍光測定を含む適切な光学的方法は、J.Am.Chem.Soc.2009,131 1652-1653によって開示されている。利用可能な電気測定は以下を含む:電流測定、インピーダンス測定、トンネル効果測定(Ivanov AP et al., Nano Lett.2011年1月12日;11(1):279-85)、及びFET測定(国際出願第WO2005/124888号)。光学的測定を電気測定と組み合わせてもよい(Soni GV et al.,Rev Sci Instrum.2010年1月;81(1):014301)。測定はポアを通過するイオン電流の測定などの膜貫通電流測定であってもよい。
電気測定はStoddart D et al.,Proc Natl Acad Sci,12;106(19):7702-7、Lieberman KR et al.,J Am Chem Soc.2010;132(50):17961-72、及び国際出願第WO2000/28312号に記載されているように、標準シングルチャンネル記録装置を用いて行ってもよい。任意選択で、電気測定を、例えば、国際出願第WO2009/077734号、及び国際出願第WO2011/067559号に記載のマルチチャネルシステムを用いて実行してもよい。
該方法は、好ましくは、膜を横切って電位が印加される状態で実施される。印加電位は電圧電位であってもよい。あるいは、印加電位は化学的電位であってもよい。この例は両親媒性層などの膜を横切る塩勾配を使用することである。塩勾配は、Holden et al.,J Am Chem Soc.2007年7月11日;129(27):8650-5に開示されている。いくつかの実例では、ポリヌクレオチドの配列を推定又は判定するために、ポリヌクレオチドがポアに対して移動するときにポアを通過する電流を使用する。
該方法は、ポリヌクレオチドがポアに対して移動するときにポアを通過する電流の測定に関与してもよい。したがって、装置はまた、電位を印加し、膜及びポアを横切って電気信号を測定することができる電気回路を含んでもよい。該方法は、パッチクランプ又は電圧クランプを用いて実施してもよい。該方法は、好ましくは、電圧クランプの使用を含む。
本発明の方法は、ポリヌクレオチドがポアに対して移動するときにポアを通過する電流を測定に関与してもよい。膜貫通タンパク質ポアを通るイオン電流を測定するために適切な条件は、当該技術分野において既知であり、実施例に開示されている。該方法は、通常は、膜及びポアを横切って電圧が印加される状態で実施される。使用される電圧は、通常は、+4V~-4V、+3V~-3V、又は+2V~-2Vなどの、+5V~-5Vである。使用される電圧は、通常は、-600 mV~+600mV、又は-400mV~+400mVである。使用される電圧は、好ましくは、-400mV、-300mV、-200mV、-150mV、-100mV、-50mV、-20mV、及び0mVから選択される下限と、+10mV、+20mV、+50mV、+100mV、+150mV、+200mV、+300mV、及び+400mVから独立して選択される上限とを有する範囲内にある。使用される電圧は、より好ましくは100mV~240mVの範囲、最も好ましくは120mV~220mVの範囲である。増加された印加電位を用いることにより、ポアごとに異なるヌクレオチド間の識別性を高めることが可能である。
該方法は、通常は、金属塩、例えばアルカリ金属塩、ハロゲン塩、例えばアルカリ金属塩化物塩などの塩化物塩のような任意の電荷担体の存在下で実施される。電荷担体は、イオン性液体又は有機塩、例えば、塩化テトラメチルアンモニウム、塩化トリメチルフェニルアンモニウム、塩化フェニルトリメチルアンモニウム、又は1-エチル-3-メチルイミダゾリウムクロリドを含んでもよい。上述の例示的な装置では、塩はチャンバ内の水溶液中に存在する。通常は、塩化カリウム(KCl)、塩化ナトリウム(NaCl)、塩化セシウム(CsCl)、又はフェロシアン化カリウムとフェリシアン化カリウムとの混合物を使用する。KCl、NaCl、及びフェロシアン化カリウムとフェリシアン化カリウムとの混合物が好ましい。電荷担体は膜を横切って不斉であってもよい。例えば、電荷担体の種類及び/又は濃度は膜の各側で異なっていてもよい。
塩濃度は飽和状態にあってもよい。塩濃度は、3M以下であってもよく、好ましくは、0.1~2.5 M、0.3~1.9 M、0.5~1.8 M、0.7~1.7 M、0.9~1.6 M、又は1 M~1.4 Mである。塩濃度は、好ましくは、150mM~1Mである。該方法は、好ましくは少なくとも0.3M、例えば少なくとも0.4M、少なくとも0.5M、少なくとも0.6M、少なくとも0.8M、少なくとも1.0M、少なくとも1.5M、少なくとも少なくとも2.0M、少なくとも少なくとも2.5M、又は少なくとも3.0Mの塩濃度を用いて行われる。高い塩濃度は高い信号対雑音比をもたらし、ヌクレオチドの存在を示す電流を通常の電流変動の背景に対して同定することを可能にする。
該方法は、通常は、緩衝液の存在下で実施される。上述の例示的な装置では、緩衝液はチャンバ内の水溶液中に存在する。本発明の方法において、任意の緩衝液を使用してもよい。通常は、緩衝液はリン酸緩衝液である。他の適切な緩衝液はHEPES及びTris-HCl緩衝液である。該方法は、通常は、4.0~12.0、4.5~10.0、5.0~9.0、5.5~8.8、6.0~8.7、又は7.0~8.8、又は7.5~8.5のpHで実施される。使用されるpHは、好ましくは、約7.5である。
該方法は、0℃~100℃、15℃~95℃、16℃~90℃、17℃~85℃、18℃~80℃、19℃~70℃、又は20℃~60℃で実施される。該方法は、通常は、室温で実施される。該方法は、約37℃などの酵素機能をサポートする温度で任意に実施される。
遊離ヌクレオチド及び補因子
該方法は、遊離ヌクレオチド若しくは遊離ヌクレオチド類似体、及び/又はポリヌクレオチド結合タンパク質の作用を促進する酵素補因子の存在下で実施してもよい。該方法はまた、遊離ヌクレオチド又は遊離ヌクレオチド類似体の非存在下で及び酵素補因子の非存在下で実施してもよい。遊離ヌクレオチドは上述の各ヌクレオチドのいずれか一つ以上であってもよい。遊離ヌクレオチドとしては、アデノシン一リン酸(AMP)、アデノシン二リン酸(ADP)、アデノシン三リン酸(ATP)、グアノシン一リン酸(GMP)、グアノシン二リン酸(GDP)、グアノシン三リン酸(GTP)、チミジン一リン酸(TMP)、チミジン二リン酸(TDP)、チミジン三リン酸(TTP)、ウリジン一リン酸(UMP)、ウリジン二リン酸(UDP)、ウリジン三リン酸(UTP)、シチジン一リン酸(CMP)、シチジン二リン酸(CDP)、シチジン三リン酸(CTP)、環状アデノシン一リン酸(cAMP)、環状グアノシン一リン酸(cGMP)、デオキシアデノシン一リン酸(dAMP)、デオキシアデノシン二リン酸(dADP)、デオキシアデノシン三リン酸(dATP)、デオキシグアノシン一リン酸(dGMP)、デオキシグアノシン二リン酸(dGDP)、デオキシグアノシン三リン酸(dGTP)、デオキシチミジン一リン酸(dTMP)、デオキシチミジン二リン酸(dTDP)、デオキシチミジン三リン酸(dTTP)、デオキシウリジン一リン酸(dUMP)、デオキシウリジン二リン酸(dUDP)、デオキシウリジン三リン酸(dUTP)、デオキシシチジン一リン酸(dCMP)、デオキシシチジン二リン酸(dCDP)、及びデオキシシチジン三リン酸(dCTP)が挙げられるが、これらに限定されない。遊離ヌクレオチドは、好ましくは、AMP、TMP、GMP、CMP、UMP、dAMP、dTMP、dGMP、又はdCMPから選択される。遊離ヌクレオチドは、好ましくは、アデノシン三リン酸(ATP)である。酵素補因子は、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)が機能することを可能にする因子である。酵素補因子は、好ましくは、二価金属カチオンである。二価金属カチオンは、好ましくは、Mg2+、Mn2+、Ca2+、又はCo2+である。酵素補因子は、最も好ましくは、Mg2+である。
キット
本発明はまた、二本鎖バーコード配列、一本鎖リーダー配列、及び二本鎖ポリヌクレオチドの鎖を分離し、ポリヌクレオチドの移動を制御することができるポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)を含むアダプターの個体群を提供する。ここで、個体群中の各アダプターのバーコード配列は一意のものである。
本発明は、本発明の方法において使用するためのキットをも提供する。キットは、通常は、本発明によるアダプターの個体群を含む。キットは、一つ以上の膜アンカー、ポリヌクレオチド結合タンパク質(例えば、ポリヌクレオチド巻き戻し酵素)(これはアダプターに予め結合されていてもよい)、リガーゼ、ポリメラーゼ及び/又は遊離ヌクレオチド若しくは補因子を追加的に含んでもよい。
キットは、両親媒性層又はトリブロックコポリマー膜などの、上に開示された膜のいずれかの構成要素を含んでもよい。キットは、膜貫通孔をさらに含んでもよい。本発明の方法を参照して上述した実施形態は、いずれもキットに同様に適用される。
本発明のキットは、上述の実施形態のいずれかを実行することを可能にする一つ以上の他の試薬又は器具を追加的に含んでもよい。係る試薬又は器具は以下の一つ以上を含む:適切な緩衝液(複数可)(水溶液)、対象から試料を得るための手段(容器又は針を含む器具など)、ポリヌクレオチドを増幅及び/又は発現させるための手段、上記に定義された膜、又は電圧若しくはパッチクランプ装置。試薬は、試薬を再懸濁するために流体試料が使用されるように乾燥状態でキット中に存在してもよい。キットはまた、任意選択で、キットを本発明の方法において使用することを可能にするための説明書を含んでもよい。キットは磁石又は電磁石を含んでもよい。キットは、必要に応じて、ヌクレオチドを含んでもよい。
以下の実施例は、本出願の非限定的な態様を例を挙げて説明する。
[実施例1]
この実施例は、鋳型鎖及び相補鎖に付着した一本鎖リーダー配列を有する二本鎖ゲノムDNAをCsgGナノポアと接触させると、鋳型鎖及び相補鎖が、Ddaヘリカーゼの制御下で、ナノポアを通って逐次しかし別々に(鋳型はヘアピンを介して相補体に結合されない)転座することを示す。ヘアピンによって一緒に結合されたとき、同一の鋳型/補体配列の転座と比較して、配列決定精度の向上が観察された。
材料及び方法
試料の製造
ゲノムDNAを以下のように断片化した。46μL中の1μgのゲノムDNAをCovaris g-TUBEに移した。次いで、製造元のプロトコルの推奨に従って、必要とされるフラグメントサイズの速度で、g-TUBEを室温で1分間回転させた。そして、g-TUBEを反転させ、更に1分間回転させて断片化されたDNAを回収した。断片化したDNAを清潔な1.5mlのエッペンドルフDNA LoBindチューブに移した。製造元のプロトコルに従い、Agilent Bioanalyzer 12000 DNAチップを用いて1μLの試料を解析することにより、断片化プロセスの成功を評価した。
回収したDNAをNEBのFFPE修復キットで製造元のプロトコルに従って62μLの容量で処理し、1xAgencourt AMPure XPビーズを用いてDNAを精製した後、46μLのヌクレアーゼフリー水で溶出した。
次いで、FFPE修復DNAをNEBのUltra II End-prepモジュールで処理して、断片化DNAの各末端に5´リン酸及びシングルdA-ヌクレオチドを付加した。製造元のプロトコルに従い、45μLのFFPE修復DNAを用いて60μLの容量で反応を行い、その後1×Agencourt AMPure XPビーズを用いて精製し、31μLのヌクレアーゼフリー水で溶出した。QuBit蛍光光度計を用いて1μLの回収した末端プレップDNAを定量した。
次に、30μLの末端プレップDNAを清潔な1.5mlのエッペンドルフDNA LoBindチューブに添加した。次に、Ddaヘリカーゼが付着した図3Aに示すアダプターを含む溶液(図3Aに示すように、各アダプターにDdaヘリカーゼが付着した、20μlのOxford NanoporeのSQK-LSK108 Adapter Mix(Oxford Nanopore Technologiesから市販されているLigation Sequencing Kit 1D(R9.4)の成分))を添加し(Adapter Mixのこの量は8 kb以上のフラグメントサイズを有する約350 ngのDNAに最適化されている)、続いて、5倍の反転で混合する前に、50μlのNEB’s Blunt/TAライゲーションマスターミックスを添加した。次いで反応物を室温で10分間放置した。
DNAを精製するために、40μLのAMPure XPビーズを前の工程からのアダプター連結反応に添加し、そして5倍の反転により混合した。次いで、回転ミキサー(フラミキサー)上でチューブを室温で5分間インキュベートした。次いでチューブを磁気ラックに置き、上清をピペットで除去する前に、ビーズをペレット化した。アダプタービーズ結合緩衝液(Oxford Nanopore Technologiesから市販されている140μLのOxford NanoporeのSQK-LSK108アダプタービーズ結合緩衝液(Ligation Sequencing Kit 1D(R9.4)の構成要素))を添加する前に、チューブをラックから取り出した。次いで、チューブを軽く叩くことによってビーズを再懸濁した。その後、チューブを磁気ラックに戻し、上清をピペット操作で除去する前に、ビーズをペレット化した。このステップをもう一度繰り返した。洗浄ステップの後、チューブを磁気ラックから取り出し、ペレットを溶出緩衝液に再懸濁した(25μlのOxford NanoporeのSQK-LSK108 Elution Buffer)(Oxford Nanopore Technologiesから市販されているLigation Sequencing Kit 1D(R9.4)の構成要素)。その後、チューブを室温で10分間インキュベートし、ビーズをペレット化するために磁気ラックに戻した。溶出液を清潔な1.5mlのエッペンドルフDNA LoBindチューブに移した。
次に配列決定反応混合物を製造し、図3Bに示すゲノムDNA構築物を生成した。配列決定反応混合物は、オックスフォードナノポアのSQK-LSK108キット(Oxford Nanopore Technologiesから市販されているLigation Sequencing Kit 1D(R9.4)の構成要素)からの37.5μLのRBFと25.5μLのLLBを、12.0μLの回収ライブラリーに加えることによって製造した。
鋳型を補体に結合するヘアピンを有する二本鎖ゲノムDNAを生成するために(図1Aの構築物の概略図を参照)、上記と同様の手順に従った。同様の手順で、上記のアダプター混合物の代わりに、Oxford Nanopore SQK-LSK 102 Adapter Mix及びSQK-LSK 208 HP Adapter(Oxford Nanopore Technologiesから市販されているLigation Sequencing Kit 2D(R9.4)の構成要素)を使用した。他の全てのステップ及び使用した成分は上記と同一である。
ナノポア配列決定
電気測定値は、Oxford Nanopore MinION R9.4フローセルを用いて取得した。二本鎖ゲノムDNA(鋳型を補体に結合するヘアピンの有無にかかわらず)をナノポアシステムに添加した。実験を行い、かつヘリカーゼ制御DNA移動を監視した。
解析
イベントの整列
WO2016059427に開示されている方法を用いて信号の整列を行った。95%以上のアラインメント値は、それぞれのイベントが鋳型及びそのそれぞれの補体を示していることを示していた。
整列信号の解析
ヌクレオチド配列を決定するために、整列信号のその後の解析を上記のように2D法を用いて実施した。
結果
図1は、酵素の制御下でY-アダプター及びナノポアを通って転座するヘアピンに付着した鋳型及び相補DNA配列を含むDNA構築物の概略図(図1A)、及び得られた配列決定精度を示すグラフ(図1B)を含む。図2A及び図2Bは、酵素の制御下でナノポアを通って転座するリーダー配列に付着した鋳型及び相補DNA配列を含むDNA構築物の漫画表現(図2A)、及び得られた配列決定精度を示すグラフ(図2B)を含む。図1B及び図2Bは、鋳型単独、補体単独、並びに鋳型及び補体からの組み合わされた情報を用いた配列決定精度を説明するピークを示す。図1Bと図2Bを比較することにより、鋳型と補体がヘアピンループ構造を介して結合されていない場合、補体単独の精度が向上し(~75%から>85%まで)、さらに鋳型と補体からの情報が組み合わされたときも、鋳型と補体が結合していない場合に精度が向上したことが明らかに分かった。
[実施例2]
(対照:修飾ポア、検体に結合部位を付加しない)
この実施例は、鋳型と補体が共有結合していない場合に二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)を特徴付ける方法を説明する。後述のようにデータ解析の後に決定された鋳型及び補体の同定は、実施例において「後続対」として言及される。いくつかの実施形態では、対が互いに1分以内に起こる>80%の重複があるときに、潜在的な後続対が同定される。いくつかの実施形態では、潜在的な後続対は、後続対がすぐに発生したときに同定され、95~100%の重複がある。
鋳型のみの鎖(すなわち、後続対に属すると分類されなかったもの)は、本明細書において「T」と呼ばれる。後続対に属する鋳型鎖は本明細書において「Tn」と呼ばれ、後続対に属する相補鎖は本明細書において「Cn」と呼ばれる。「n」は後続対のTn及びCn構成要素を同定するために使用することができ、例えば、T1及びC1は後続対である。
この例では、修飾ナノポアに付着したポアタグ(例えば、捕捉ポリヌクレオチド)に相補的ではないポリヌクレオチド配列を含む対照アダプターは、修飾ナノポアを用いて後続対を検出する頻度を説明するために使用される。
例示的な材料及び方法
ゲノムDNAへの対照アダプターの連結
対照アダプターは、バーコードトップ鎖(配列番号1)及びバーコードボトム鎖(配列番号2)を含むNB01(ネイティブバーコード1)である。
配列番号1
/5Phos/AAGGTTAACACAAAGACACCGACAACTTTCTTCAGCACCT
配列番号2
/5Phos/GGTGCTGAAGAAAGTTGTCGGTGTCTTTGTGTTAACCTTAGCAAT
ゲノムDNAへの対照アダプターの連結は、Oxford Nanopore Technologies配列決定キットを用いて、操作ガイドラインに従って行った。1000ngの末端修復OdAテイル大腸菌ゲノムDNAを1×Brunt/TAマスターミックス(NEB M0367L)中において、100°μLで5.5μLの640nM対照アダプターと、室温で20分間連結した。試料のSPRI精製を以下のように実施した:40μLのAgencourt AMPureビーズ(Beckman Coulter)を添加し、試料をピペットで混合し、室温で5分間インキュベートした。70%エタノール溶液を、ヌクレアーゼフリー水(AmbionTM)及びAbsoluteエタノール(FisherScientific)を用いて製造し、この溶液を氷上で保存した。
ビーズを磁気ラック上でペレット化し、上清を除去した。ペレットを乱すことなく、ペレット化したビーズを上記の500μLの70%エタノール溶液で洗浄した。上清を除去し、ペレット化したビーズを500μLの70%エタノール溶液で再度洗浄した。70%エタノール溶液を除去し、ペレットを遠心分離機で短時間パルスしてから磁気ラックに戻した後、70%エタノール溶液の最後の残留物を除去した。
ペレットを50μLのヌクレアーゼフリー水(AmbionTM)にピペットで混合することによって再懸濁し、試料を氷上で10分間ビーズから溶出させた。ビーズをペレット化し、試料を含む上清を新しいDNA LoBindチューブ(Eppendorf)に移した。この試料は対照-アダプター-ゲノム-DNAと呼ばれる。
制御アダプターゲノムDNAへの酵素アダプター複合体の連結
Oxford Nanopore Technologiesから市販されている配列決定キットBAM(Barcode Adapter Mix)のアリコートを氷上で解凍した。20μLのBAMを、50μLの対照アダプターゲノムDNA、20μLのNEBNextクイック連結反応緩衝液及び10μLのクイックT4 DNAリガーゼ(E6056L)とともに、100μL中、室温で10分間連結した。SPRI精製2を以下のように実施した。40μLのAgencourt AMPureビーズ(Beckman Coulter)を添加し、試料をピペットで混合し、室温で5分間インキュベートした。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを140μLのアダプタービーズ結合緩衝液で洗浄し、磁気ラック上のエッペンドルフチューブを二回連続して180°回転させることによってビーズをアダプタービーズ結合緩衝液中に再懸濁した。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを再度140μLの緩衝液で洗浄し、磁気ラック上でエッペンドルフチューブを2回連続して180°回転させることによりビーズを緩衝液に再懸濁した。ビーズを磁気ラック上でペレット化し、緩衝液を除去し、ペレットを磁気ラックに戻す前に遠心分離機で短時間パルスし、次いで緩衝液の最後の残余物を除去した。
ペレットを25μLのヌクレアーゼフリー水(AmbionTM)にピペットで混合することによって再懸濁し、このライブラリーを氷上で10分間ビーズから溶出させた。
タグ修飾ナノポアの製造
ポアタグの接合を可能にするように、修飾CsgGナノポアを製造した。例えば、システイン、非天然塩基などのようなCsgGモノマーが(例えば、アミノ酸置換によって)修飾され、ポアタグの接合のために提供される。修飾CsgGモノマーを、本明細書に記載のように、一つ以上のアミノ酸置換を有するアミノ酸配列番号7をコード化するプラスミドを含むPT7ベクターを用いて製造した。
配列番号7:信号配列を含まない野生型大腸菌CsgGのアミノ酸配列(ユニポート受入番号P0AEA2)
CLTAPPKEAARPTLMPRAQSYKDLTHLPAPTGKIFVSVYNIQDETGQFKPYPASNFSTAVPQSATAMLVTALKDSRWFIPLERQGLQNLLNERKIIRAAQENGTVAINNRIPLQSLTAANIMVEGSIIGYESNVKSGGVGARYFGIGADTQYQLDQIAVNLRVVNVSTGEILSSVNTSKTILSYEVQAGVFRFIDYQRLLEGEVGYTSNEPVMLCLMSAIETGVIFLINDGIDRGLWDLQNKAERQNDILVKYRHMSVPPES
プラスミドをBL21誘導体細胞系に形質転換し、内因性CsgG遺伝子をカナマイシン耐性で置換するように突然変異させた。細胞をアンピシリン(100μg/ml)及びカナマイシン(30μg/ml)を含有する寒天プレート上に播種し、37℃で16時間インキュベートした。シングルコロニーを、カルベネシリン(100μg/ml)及びカナマイシン(30μg/ml)を含有する100mlのLB培地を植菌するために使用し、そしてスターター培養物を37℃/250rpmで16時間増殖させた。4×25mlのスターター培養物を用いてカルベネシリン(100μg/ml)、カナマイシン(30μg/ml)3mM ATP、15mM MgSO4、及び0.5mMラムノースを植菌4×500mlのLBに植菌した。培養物を定常期に達するまで増殖させ、そして37℃/250rpmで更に2時間増殖させた。グルコースを0.2%になるまで添加して、温度を18℃に低下させ、培養物が18℃になると、1%α-ラクトース一水和物を添加することによってタンパク質発現を誘導した。培養物を18℃/250rpmで16時間インキュベートした。
細胞を遠心分離により採取し、そして界面活性剤溶解(Bugbuster)にかけた。溶解したら、試料は初期連鎖球菌精製(5ミmlのHPの連鎖球菌トラップ)のために持ち越した。溶出した画分を60℃に加熱し、回転させ、上清をqIEX精製(1ml Hi trap Q HP)のために持ち越した。正しいタンパク質を含む画分をプールし、濃縮し、そして24mlのSuperdexで最終磨きのために持ち越した。
上記のナノポアのアリコートを、以下のように、モルフォリノオリゴ(配列番号8)で修飾した。
配列番号8:GeneToolsから提供されたモルフォリノオリゴ。
/5´/-GGAACCTCTCTGACAA/-3´-ピリジル-ジチオ/
1.3μLの1M DTT(ジチオトレイトール)を、約9.75μgのナノポアを含む130μLの上からのナノポアに添加し、室温で1時間インキュベートした。製造元のガイドラインに従い、0.5mLの7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いてこの試料を反応緩衝液(25mM Tris、150mM NaCl、2mM EDTA、0.1%SDS及び0.1%Brij58、pH7)に緩衝液交換した。製造元のガイドラインに従って7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いてこの試料を再び反応緩衝液に緩衝液交換した。モルフォノオリゴ(配列番号8)の2mMストックは、GeneToolsが提供する300nmolのモルフォノオリゴを150μLのヌクレアーゼフリー水(AmbionTM)に溶解することによって製造した。これを上記緩衝液交換試料に添加して最終濃度を500μMとし、室温で一晩インキュベートした。これは修飾ナノポアとして知られている。
電気測定
電気測定値は、リン酸緩衝液(例えば、フェロシアン化カリウム(II)及びフェリシアン化カリウム(III)を含む、pH8.0)中のブロックコポリマーに挿入された単一修飾ナノポアから取得した。ブロックコポリマー中に挿入された単一の修飾ナノポアを達成した後、2mLの緩衝液ですすぐことによって過剰の修飾ナノポアを除去した。
プライミング緩衝液をナノポアシステムに流した。シークエンシングミックス、400nMテザー(配列番号9)、回収されたビーズ精製ライブラリー、及びライブラリーローディングビーズを、製造元の指示に従って緩衝液中で混合した。その後、配列決定混合物をナノポアシステムに添加した。実験は180mVで行い、ヘリカーゼ制御DNAの移動を監視した。
配列番号9
/5Chol-TEG/TT/iSp18//iSp18//iSp18//iSp18/TTGACCGCTCGCCTC
データ解析
DNA鎖が修飾ナノポアを通過する際に、ナノポアを通る電流の変化を測定し収集した。次に、fastqデータを得るために、ベースコールアルゴリズム、例えば再帰型ニューラルネット(RNN)アルゴリズムを用いて鎖の配列を決定した。その後、当技術分野で既知の配列位置合せツールを用いてfastq配列データを参照ゲノムに整列させた。
相互に相補的である鎖の対(鋳型と相補鎖の対)を同定するために、鎖間の分数重複を計算した。分数重複は、二本の鎖がまたがる(必ずしも重複することなく)ゲノムの部分の長さ(塩基単位)によって正規化された、二本の鎖が共有するゲノム内の塩基の隣接する部分の長さ(塩基単位)として定義される。各鎖の最大分数重複は、1分以内にポアを通過した鎖の他の全てのものと鎖との間の最大重複として計算した。したがって、高い最大分数は所与の鎖(鋳型又は相補物として)が相補対に属したことを示し、一方、低い分数重複は鎖が相補対に属していなかったことを示す。
表2は、本明細書に記載の未修飾又は修飾ナノポアを用いた、異なる最大分数重複値を有する鎖のパーセントを示す。
結果
その内容全体が参照により本明細書に組み込まれている国際特許出願公開第2015/055981号パンフレットに記載されているようなヘリカーゼ、例えばDdaヘリカーゼを、修飾ナノポア(例えば、その内容全体が参照により本明細書に組み入れられる、国際PCT公開番号WO 2016/034591に記載の修飾CsgGナノポア)を通るポリヌクレオチドの移動を制御するために使用した。表3は本明細書に記載の実施例2~5からのデータを示す。それは、上記のデータ解析の節で説明したように、T、Tn及びCn分類に属するように割り当てられた(例えば、当技術分野で既知のマッピング方法を用いて)マッピングされた鎖の数の一覧である。以下の表3の2行目は、実施例2からの対照アダプターを用いた実施例におけるデータ解析によって割り当てられたT、Tn及びCn鎖の数を示す。鎖の2.9%が後続対として分類されている。
非修飾ナノポアを用いた実施例5では、後続対の頻度はより低く(表3、列5)、わずか0.6%であった。このことは、検体が正確な配列を含まない場合でも、ナノポア上のタグの使用が後続のイベントを増強することを示している。理論に束縛されることを望むものではないが、これはおそらく、ポアタグが補体の露出されたssDNAに対して(規定された部位に対して)低効率で結合することができるからであろう。
[実施例3]
(修飾ポア及び後続アダプターの実施形態1)
この実施例は、鋳型と補体が共有結合していない場合に、二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)を特徴付ける方法を説明する。後述のようにデータ解析の後に決定された鋳型及び補体の同定は、実施例において「後続対」として言及される。いくつかの実施形態では、対が互いに1分以内に起こる>80%の重複がある際に、潜在的な後続対が同定される。いくつかの実施形態では、潜在的な後続対は、後続対がすぐに発生した際に同定され、95~100%の重複がある。
鋳型のみの鎖(すなわち、後続対に属すると分類されなかったもの)は、本明細書において「T」と呼ばれる。後続対に属する鋳型鎖は本明細書において「Tn」と呼ばれ、後続対に属する相補鎖は本明細書において「Cn」と呼ばれる。「n」は後続対のTn及びCn構成要素を同定するために使用することができ、例えば、T1及びC1は後続対である。
この例では、後続対を検出する頻度の増加は、本明細書に記載の一実施形態による後続アダプターの連結によって達成される。図9~10に示すように、アダプターは、捕捉ポリヌクレオチド配列が鎖の巻き戻し時にのみ明らかにされるように、二本鎖ステム内の捕捉ポリヌクレオチド配列を含む。捕捉ポリヌクレオチド配列は修飾ナノポアに付着したポリヌクレオチド配列と相補的である。この実施例では、捕捉ポリヌクレオチド配列は二本鎖ステム内にスペーサー、例えば、sp18を含まず、そのようなアダプターは約10%の追跡効率(すなわち、全鎖の後続%~約10%)を生じた。
材料及び方法
ゲノムDNAへの後続アダプターの連結
後続アダプターの一実施形態は、50mM HEPES pH8、100mM酢酸カリウム中、それぞれ10μM及び11μMで、毎分2℃で、95℃から22℃まで一緒にアニールされたバーコードトップ鎖(配列番号3)及びバーコードボトム鎖(配列番号4)を含む。ハイブリダイズしたDNAは、バーコードアダプター2として知られている。640nMに希釈した後続アダプター1を製造するために、6.4μLのフォローオンアダプターを、93.6μLの50mMトリス-HCl pH7.5、20 mM塩化ナトリウムに添加した。
配列番号3
/5Phos/GGCGTCTGCTTGGGTGTTTAACCTTTTTGTCAGAGAGGTTCCAAGTCAGAGAGGTTCCT
配列番号4
/5Phos/GGAACCTCTCTGACTTGGAACCTCTCTGACAAAAAGGTTAAACACCCAAGCAGACGCCAGCAAT
ゲノムDNAへの後続アダプターの連結は、Oxford Nanopore Technologies配列決定キットを用いて操作ガイドラインに従って行った。1000ngの末端修復及びdAテイル大腸菌ゲノムDNAを、1×Blunt/TAマスターミックス(NEB M0367L)中で、上記からの5.5μLの640nMの後続アダプターとともに100μL中に室温で20分間連結した。次に、実施例2に記載の通りSPRI精製を実施した。この試料は後続アダプターゲノムDNAと呼ばれる。
後続アダプターゲノムDNAへの酵素-アダプター複合体の連結
Oxford Nanopore Technologiesから市販されている配列決定キットBAM(Barcode Adapter Mix)のアリコートを氷上で解凍した。20μLのBAMを、50μLの後続アダプターゲノムDNA、20μLのNEBNextクイック連結反応緩衝液及び10μLのクイックT4DNAリガーゼ(E6056L)とともに100μL中で、室温で10分間連結した。次に、実施例2に記載の通りSPRI精製2を実施した。
タグ修飾ナノポアの生成
アダプターの捕捉ポリヌクレオチド配列に相補的なポリヌクレオチド配列を含むように修飾されているナノポアを生成する方法は、上記の実施例2に記載したのと同様の方法で実施した。
電気測定
鎖がナノポアを通過する際に電気測定値を測定し取得する方法は、上記の実施例2に記載したのと同様の方法で実施した。
データ解析
収集した電気測定値のデータ処理及び解析は、上記の実施例2に記載したのと同様の方法で実施した。
結果
その内容全体が参照により本明細書に組み込まれている国際PCT公開番号WO2015/055981に記載されているようなヘリカーゼ、例えばDdaヘリカーゼを、修飾ナノポア、例えばその内容全体が参照により本明細書に組み入れられる国際PCT公開番号WO 2016/034591に記載の修飾CsgGナノポアを通るポリヌクレオチドの動きを制御するために使用した。表3の3行目は、この実施例に記載されている後続アダプターを用いて実施例におけるデータ解析によって割り当てられたT、Tn及びCn鎖の数を示す。全鎖の7.7%が後続対として分類されている。
[実施例4]
(修飾ポア及び後続アダプター実施形態2)
この実施例は、鋳型と補体が共有結合していない場合に、二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)を特徴付ける方法を説明する。後述のようにデータ解析の後に決定された鋳型及び補体の同定は、実施例において「後続対」として言及される。いくつかの実施形態では、対が互いに1分以内に起こる>80%の重複がある際に、潜在的な後続対が同定される。いくつかの実施形態では、潜在的な後続対は、後続対がすぐに発生した際に同定され、95~100%の重複がある。
鋳型のみの鎖(すなわち、後続対に属すると分類されなかったもの)は、本明細書において「T」と呼ばれる。後続対に属する鋳型鎖は本明細書において「Tn」と呼ばれ、後続対に属する相補鎖は本明細書において「Cn」と呼ばれる。「n」は後続対のTn及びCn構成要素を同定するために使用することができ、例えば、T1及びC1は後続対である。
この例では、後続対を検出する頻度の増加は、本明細書に記載の一実施形態に係る後続アダプターの連結によって達成される。アダプターは、捕捉ポリヌクレオチド配列が鎖の巻き戻し時にのみ明らかにされるような二本鎖ステム内の捕捉ポリヌクレオチド配列を含む。捕捉ポリヌクレオチド配列は、修飾ナノポアに結合したポリヌクレオチド配列と相補的である。このアダプターはまた、Cnの捕捉効率を高める化学的性質も含む。例えば、この実施例では、捕捉ポリヌクレオチド配列は、二本鎖ステム内にスペーサー、例えばsp18、を含み、そのようなアダプターは約60%の追跡効率(すなわち、全鎖の追跡%~約60%)を生じた。理論に束縛されることを望むものではないが、この向上は、sp18に遭遇すると酵素は短時間休止し、結合のためのより長い時間を与え、従って捕捉ポリヌクレオチド配列の修飾ナノポア上の相補的配列タグへのハイブリダイゼーション効率を高めるため、及び/又はsp18は結合の配置の柔軟性を高めるため、及び/又はsp18sの付加された長さはより良い幾何学的構造であり、ポアタグにより近い配列を表示するため(例えば、捕捉効率が改善され、及び/又はTが捕捉されないように閉塞/停止されるようにCnの向きが変わる)、などのいくつかの理由に起因し得る。
材料及び方法
ゲノムDNAへの後続アダプターの連結
後続アダプターの一実施形態は、50mM HEPES pH8、100mM酢酸カリウム中、それぞれ10μM及び11μMで、毎分2℃で、95℃~から2℃まで、一緒にアニールされたバーコードトップ鎖(配列番号5)及びバーコードボトム鎖(配列番号6)を含む。ハイブリダイズしたDNAはバーコードアダプター2として知られている。640nMに希釈した後続アダプター2を製造するために、6.4μLの後続アダプターを93.6μLの50mM Tris-HCl pH7.5、20mM塩化ナトリウムに添加した。
配列番号5
/5Phos/GGCGTCTGCTTGGGTGTTTAACC/iSp18//iSp18//iSp18//iSp18/TTTTTGTCAGAGAGGTTCCAAGTCAGAGAGGTTCCT
配列番号6
/5Phos/GGAACCTCTCTGACTTGGAACCTCTCTGACAAAAA/iSp18//iSp18//iSp18//iSp18/GGTTAAACACCCAAGCAGACGCCAGCAAT
ゲノムDNAへの後続アダプターの連結は、Oxford Nanopore Technologies配列決定キットを用いて操作ガイドラインに従って行った。1000ngの末端修復及びdAテイル大腸菌ゲノムDNAを、1×Blunt/TAマスターミックス(NEB M0367L)中、5.5μLの上記からの640nMの後続アダプターを用いて100μL中で、室温で20分間連結した。次に、実施例2に記載の通りにSPRI精製を実施した。この試料は後続アダプターゲノムDNAと呼ばれる。
後続アダプターゲノムDNAへの酵素-アダプター複合体の連結
Oxford Nanopore Technologiesから市販されている配列決定キットBAM(Barcode Adapter Mix)のアリコートを氷上で解凍した。20μLのBAMを、50μLの後続アダプターゲノムDNA、20μLのNEBNextクイック連結反応緩衝液及び10μLのクイックT4DNAリガーゼ(E6056L)とともに100μL中で、室温で10分間連結した。次に、実施例2に記載の通りにSPRI精製2を実施した。
タグ修飾ナノポアの生成
アダプターの捕捉ポリヌクレオチド配列に相補的なポリヌクレオチド配列を含むように修飾されているナノポアを生成する方法は、上記の実施例2に記載したのと同様の方法で実施した。
電気測定
鎖がナノポアを通過する際に電気測定値を測定し取得する方法は、上記の実施例2に記載したのと同様の方法で実施した。
データ解析
収集した電気測定値のデータ処理及び解析は、上記実施例2に記載したのと同様の方法で実施した。
結果
その内容全体が参照により本明細書に組み込まれている国際PCT公開番号WO2015/055981に記載されているようなヘリカーゼ、例えばDdaヘリカーゼを、修飾ナノポア、例えばその内容全体が参照により本明細書に組み込まれている国際PCT公開番号WO2016/034591に記載の修飾CsgGナノポアを通るポリヌクレオチドの動きを制御するために使用した。表3の4行目は、この実施例に記載したような後続アダプターを用いた実施例におけるデータ解析によって割り当てられたT、Tn及びCn鎖の数を示す。45.1%の鎖が後続対として分類されている。
図11A~11Bは、この実施例に記載された実験からの電流トレースを示す。T、Tn及びCnは、下記の表4に示されるデータと一致するように標識付けされる。以下の表4に示されるデータは、データ解析の節に記載される通りに得られたものであり、実施例2、3及び4について表3に要約されるデータの例示的部分である。
図12A~12Dは、修飾ナノポアを通って転座したときの後続対ポリヌクレオチドの鋳型(Tn)及び補体(Cn)の電流トレースを示す。ナノポアは、図12Aにおいて配列決定されている鋳型と補体との間の開放ポアに戻り(図12Cを参照)、鋳型と相補鎖が共有結合していないという事実を説明している。
配列番号10及び配列番号11は、図12A~12DからのポリヌクレオチドのRNNアルゴリズムをベースとするOxford Nanopore Technologiesに由来する配列である。ランダムに断片化された二本鎖ポリヌクレオチド断片からの鋳型及び補体が、修飾ナノポアによって配列決定されたことを実証するために、これらを高い忠実度で整列させることができる。
図12A~図12Dにおいて、*で印を付けた位置は、配列番号5及び配列番号6に見られるSp18スペーサーであり、このモチーフの存在は、この実施例に記載の後続アダプターがポリヌクレオチドに連結されることと、この後続アダプターの存在が(表3に見られるように)後続対の割合を非常に高めることを示す。
図13は対数目盛での「鎖間の時間」を秒単位で示す。標識「鎖」は、ナノポアを通るポリヌクレオチド配列のヘリカーゼ制御移動の電気信号を分類するために使用される。これは当業界で知られている方法を用いて分類される。鎖は開放ポアに戻ることによって容易に分割される。この実施例に記載されているように後続アダプターを用いて、矢印は実施例4からのデータ内の顕著な個体群を示す。実施例2及び4では、TnとCnの間の時間がTとT、又はbTとTn、又はCnとTの間の時間より一般に短いので、この個体群は後続対の割合の増加を示している。これは、鎖間の時間が短縮されるので、後続アダプターを用いてスループットを向上させることもできることを示している。
[実施例5]
この実施例は、鋳型と補体が共有結合していない場合に二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)を特徴付ける方法を説明する。後述のようにデータ解析の後に決定された鋳型及び補体の同定は、実施例において「後続対」として言及される。いくつかの実施形態では、対が互いに1分以内に起こる>80%の重複がある際に、潜在的な後続対が同定される。いくつかの実施形態では、潜在的な後続対は、後続対がすぐに発生した際に同定され、95~100%の重複がある。
鋳型のみの鎖(すなわち、後続対に属すると分類されなかったもの)は、本明細書において「T」と呼ばれる。後続対に属する鋳型鎖は本明細書において「Tn」と呼ばれ、後続対に属する相補鎖は本明細書において「Cn」と呼ばれる。「n」は後続対のTn及びCn構成要素を同定するために使用することができ、例えば、T1及びC1は後続対である。
この実施例では、Oxford Nanopore Technologies配列決定キットからの標準的な構成要素を、Minion and Flowcell(本明細書に記載のポアタグを含むように修飾されていないナノポアのアレイを含むSpotONフローセル)とともに、本明細書中に記載されるように、修飾ナノポア及び後続アダプターの非存在下で、後続対の検出の頻度を実証するために使用した。
材料及び方法
ゲノムDNAへの制御アダプターの連結
対照アダプターのゲノムDNAへの連結(例えば、実施例2に記載されているように)は、Oxford Nanopore Technologies配列決定キットを用いて製造ガイドラインに従って行った。1000ngの末端修復及びdAテイル大腸菌ゲノムDNAを、1×Blunt/TAマスターミックス(NEB M0367L)中、5.5μLの上記からの640nMの後続アダプターを用いて100μL中で、室温で20分間連結した。次に、実施例2に記載の通りSPRI精製を実施した。この試料は後続アダプターゲノムDNAと呼ばれる。
後続アダプターゲノムDNAへの酵素-アダプター複合体の連結
Oxford Nanopore Technologiesから市販されている配列決定キットBAM(Barcode Adapter Mix)のアリコートを氷上で解凍した。20μLのBAMを、50μLの対照アダプターゲノムDNA、20μLのNEBNextクイック連結反応緩衝液及び10μLのクイックT4DNAリガーゼ(E6056L)とともに100μL中で、室温で10分間連結した。次に、実施例2に記載の通りSPRI精製2を実施した。
電気測定
鎖がナノポアを通過する際に電気測定値を測定し取得する方法は、上記の実施例2に記載したのと同様の方法で実施した。
データ解析
収集した電気測定値のデータ処理及び解析は、上記の実施例2に記載したのと同様の方法で実施した。
結果
その内容全体が参照により本明細書に組み入れられる、国際PCT公開番号WO2015/055981に記載されているようなヘリカーゼ、例えばDdaヘリカーゼを、修飾ナノポアを通るポリヌクレオチドの動きを制御するために使用した。例えば、国際PCT公開番号WO2016/034591に記載の修飾CsgGナノポアであり、その内容全体が参照により本明細書に組み入れられる。以下の表3の行5は、この例におけるデータ解析によって割り当てられたT、T
n及びC
n鎖の数を示す。全鎖の0.6%は後続対として分類されている。
表3は、本明細書中の実施例2~5における、鋳型のみ(その相補対が続かない)、鋳型-n(後続対の第一鎖)及び相補-n(後続対の逆相補体)であると決定された鎖の数を示す。
表4は図11に示されている、MinION後続実行のシングルチャンネル(チャンネル241)からの鎖の解析データを含む。表には、次の列が含まれている。
Fast5=MinION実行中にfast5の出力に保存される、鎖の一意のファイル名
開始/秒=鎖の開始時間(秒)
終了/秒=鎖の終了時間(秒)
期間/秒=鎖の持続期間(秒)
ゲノム_開始_位置=ベースとなる鎖を大腸菌基準に整列させた後、鎖の部分が整列したゲノム基準の開始位置。
ゲノム_終了_位置=ベースとなる鎖を大腸菌基準に整列させた後、鎖の部分が整列したゲノム基準の終了位置。
時間間隔/秒=対の場合、鎖間の時間(秒)
重複率=対の場合、整列のオーバーラップを比較する重複率(各対のゲノム_開始_位置とゲノム_終了_位置の間)
対は、鎖間の非常に短い時間で同定され、基準に整列されたときに重複する。
[実施例6]
この実施例は、低濃度のDNAが配列決定装置に添加されたときに、配列決定されたDNA分子の数を増加させる方法を記載する。
この実施例では、これは修飾型ナノポアに付着したポリヌクレオチド配列に相補的なDNA配列を含む修飾型DNA酵素アダプターの生成によって達成される。この実施例で使用された例示的なアダプターは図32A~35に示されている。
例示的な材料及び方法
アダプターの準備(例えば、図32Aに示すような、アダプター設計A)
トップ鎖(配列番号12)、ブロッカー鎖(配列番号13)及びボトム鎖(配列番号14)を、50mMのHepes、100mMのKOAc、pH8(総容量40μL)中で、それぞれ10μM、11μM及び11μMで、毎分2℃で温度を95℃から22℃に調節することによってアニールした。アニールした鎖を800μLの2.8μMヘリカーゼ(例えば、当該技術分野において既知の野生型又はその変異体を含むDdaヘリカーゼ)と混合し、室温で5分間インキュベートした。10μLの8.1mMのテトラメチルアゾジカルボキサミドを溶液に添加し、35℃で1時間インキュベートした。最終濃度500mMになるようにNaClを添加し、MgCl2を最終濃度10mMまで添加し、ATPを最終濃度1mMまで添加し、そして溶液を室温で30分間インキュベートした。試料をHPLCで精製した。
配列番号12
/5SpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3/GGCGTCTGCTTGGGTGTTTAACC TTTTTTTTTT/iSp18/AATGTACTTCGTTCAGTTACGTATTGCT
配列番号13
/5BNA-G//iBNA-G//iBNA-T//iBNA-T//iBNA-A/AACACCCAAGCAGACGCC TAAGTCAGAGAGGTTCC
配列番号14
/5Phos/GCAAT ACGTAACTGAACGAAGT/iBNA-A//iBNA-meC//iBNA-A//iBNA-T//iBNA-T/TTT GAGGCGAGCGGTCAA
アダプターの準備(例えば、図34Aに示すような、アダプター設計B)
トップ鎖(配列番号12)、ブロッカー鎖(配列番号15)及びボトム鎖(配列番号16)を、50mM Hepes、100mM KOAc、pH 8(総容量40μL)中で、毎分2℃で、95℃から22℃に温度を調節することによって、それぞれ10μM、11μM及び11μMでアニールした。アニールした鎖を800μLの2.8μMヘリカーゼ(例えば、当技術分野で既知の野生型又はその変異体を含むDdaヘリカーゼ)と混合し、室温で5分間インキュベートした。10μLの8.1mMテトラメチルアゾジカルボキサミドを溶液に添加し、そして35℃で1時間インキュベートした。NaClを500mM最終濃度まで添加し、MgCl2を10mM最終濃度まで添加し、ATPを1mM最終濃度まで添加し、そして溶液を室温で30分間インキュベートした。試料をHPLCで精製した。
配列番号15
GGTTAAACACCCAAGCAGACGCC TTT GAGGCGAGCGGTCAA
配列番号16
/5Phos/GCAAT ACGTAACTGAACGAAGT/iBNA-A//iBNA-meC//iBNA-A//iBNA-T//iBNA-T/TTT TAAGTCAGAGAGGTTCC
連結の準備
アダプター設計Aは、75μLの7k MWCOゼバスピンカラム、カラムあたり10μLの2カラムを用いて、製造元のプロトコルに従って、50mMトリス、20mM NaCl、pH8に交換した緩衝液である。試料をQubit(登録商標)dsDNA HS Assay Kitを用いて測定して2.65 ng/μLに希釈した。以下の成分を1.5mLのDNA低結合チューブ(エッペンドルフにより供給)中で組み合わせ、混合し、そして室温で10分間インキュベートした:11.3μLのアダプター(50mMのトリス、20mMのNaCl、pH8、2.65ng/μL中)、8.7μLの50mMのトリス、20mMNaCl、pH8、0.9μLの3.6kb dA-tailed DNA(40ng/μL;配列番号26))、29.1μLの蒸留水、及び50μLのTAリガーゼマスターミックス(New England Biolabs(UK)により供給)。
次に、40μLのAgencourt AMPureビーズ(Beckman Coulter)を添加し、試料をピペットで混合し、室温で5分間インキュベートした。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを140μLのアダプタービーズ結合緩衝液で洗浄し、磁気ラック上でエッペンドルフチューブを2回連続して180°回転させることによってビーズをアダプタービーズ結合緩衝液中に再懸濁した。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを再度140μLの緩衝液で洗浄し、磁気ラック上でエッペンドルフチューブを2回連続して180°回転させることによりビーズを緩衝液に再懸濁した。ビーズを磁気ラック上でペレット化し、緩衝液を除去し、ペレットを磁気ラックに戻す前に遠心分離機中で短時間パルスし、そして緩衝液の最後の残留物を除去した。
ペレットを、テザー(配列番号9)を含有する25μLの溶出緩衝液中でピペット混合することによって再懸濁し、このライブラリーを氷上で10分間ビーズから溶出させるために放置した。
ポア修飾
ポアタグの結合を可能にするように修飾CsgGナノポアを生成した。例えば、システイン、非天然塩基などのようなCsgGモノマーが(例えば、アミノ酸置換によって)修飾され、ポアタグの接合のために提供される。修飾CsgGモノマーを、本明細書に記載のように、一つ以上のアミノ酸置換を有するアミノ酸配列番号7をコード化するプラスミドを含むPT7ベクターを用いて生成した。プラスミドをBL21誘導体細胞系に形質転換し、内因性CsgG遺伝子をカナマイシン耐性で置換するように突然変異させた。細胞を、アンピシリン(100μg/ml)及びカナマイシン(30μg/ml)を含む寒天プレート上でプレーティングし、37℃で16時間インキュベートした。カルベネシリン(100μg/ml)及びカナマイシン(30μg/ml)を含有する100mlのLB培地を植菌するために、シングルコロニーを使用し、そしてスターター培養物を37℃/250rpmで16時間増殖させた。4×25mlのスターター培養物を用いて、カルベネシリン(100μg/ml)、カナマイシン(30μg/ml)3mM ATP、15mM MgSO 4、0.5mMラムノースを含む4×500ml LBに植菌した。培養物を定常期に達するまで増殖させ、次いで37℃/250rpmで更に2時間増殖させた。グルコースを0.2%になるまで添加して温度を18℃に低下させ、培養物が18℃になると、1%α-ラクトース一水和物を添加することによってタンパク質発現を誘導した。培養物を18℃/250rpmで16時間インキュベートした。
細胞を遠心分離により採取し、そして界面活性剤溶解(Bugbuster)にかけた。溶解したら、試料を初期連鎖球菌精製(5ml HPの連鎖球菌トラップ)のために繰り越し、溶出画分を60℃に加熱し、回転させ、上清をqIEX精製のために繰り越した(1ml Hi trap Q HP)。正しいタンパク質を含む画分をプールし、濃縮し、そして24mlのSuperdexで最終磨きのために繰り越した。
上記のナノポアのアリコートを以下のようにモルフォリノオリゴ(配列番号8)で修飾した。1.3μLの1M DTT(ジチオトレイトール)を、上からの約9.75μgのナノポアを含有する130μLのナノポアに添加し、室温で1時間インキュベートした。製造元のガイドラインに従い、0.5mLの7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いてこの試料を反応緩衝液(25mM Tris、150mM NaCl、2mM EDTA、0.1%SDS及び0.1%Brij58、pH7)に緩衝液交換した。製造元のガイドラインに従って7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いてこの試料を再び反応緩衝液に緩衝液交換した。2mMのモルフォリノオリゴヌクレオチド(配列番号8)のストックを、GeneToolsによって供給された300nmolのモルフォリノオリゴを150μLのヌクレアーゼフリー水(AmbionTM)に溶解することによって製造した。これを上記の緩衝液交換試料に添加して最終濃度を500μMにし、室温で一晩インキュベートした。これは修飾ナノポアとして知られている。
電気測定
電気測定値は、緩衝液(25mM Kリン酸緩衝液、150mM フェロシアン化カリウム(II)、150mM フェリシアン化カリウム(III)、pH8.0)中のブロックコポリマーに挿入された単一修飾ナノポアから取得した。ブロックコポリマーに挿入された単一修飾ナノポアを達成した後に、2mLの緩衝液(25mM Kリン酸緩衝液、150mM フェロシアン化カリウム(II)、及び150mM フェリシアン化カリウム(III)、pH8.0)をシステムに流して過剰の修飾ナノポアを除去した。
プライミング緩衝液をナノポアシステムに流した。配列決定ミックスを製造するために、プライミング緩衝液、ライブラリー(Qubit(登録商標)のdsDNA HSアッセイキットを用いて測定した場合)及び蒸留水を一緒に混合した。その後、配列決定混合物をナノポアシステムに添加した。
結果
ヘリカーゼ(例えば、当技術分野で既知の野生型又はその変異体を含むDdaヘリカーゼ)を用いて修飾ナノポアを通るポリヌクレオチドの動きを制御した。図38は、未修飾ナノポアを通って転座するときのポリヌクレオチドの電流トレースを示す。すなわち、これはナノポアと検体との間にオリゴヌクレオチドのハイブリダイゼーションがないシステムである。このシステムでは、鎖間の時間は約1秒に均等に分布する(図40を参照)。
図39は、それらが配列番号8で修飾ナノポアを通って転座するときのポリヌクレオチドの現在の電流トレースを示す。すなわち、これはナノポアと検体との間のハイブリダイゼーションを可能にするシステムである。このシステムでは、鎖間に(a)約1秒に均等に分布した(b)検体の迅速な捕捉(<0.1秒)の二つの時間個体群がある(図40を参照)。これは、ポアが別の鎖を配列決定している間に検体がポアにハイブリダイズすることを示す。
二つのシステム(ポアと検体の間にハイブリダイゼーションがないもの、ポアと検体の間にハイブリダイゼーションを可能にするもの)間のこの違いは図40にまとめられており、それは二つのシステムの鎖間時間のヒストグラムを示す。これは、ハイブリダイゼーションの非存在下で一つの捕捉タイプのみが観察され、検体がポアにハイブリダイズできる場合、検体が前の検体の後に迅速に捕捉される(<0.1秒)更なる捕捉タイプがあることを実証する。鎖間のこの短縮された時間は、図41に配列決定された鎖の総数を増加させた。
検体の両端はポアに繋がることができる。
[実施例7]
以下は、ピリジルジチオモルフォリノを用いてナノポア(例えば、CsgGナノポア)をナノポアの外面に付着させるための修飾のための例示的なプロトコルである。
タグ修飾ナノポアの生成
ポアタグの結合を可能にするために修飾ナノポア(例えば、CsgGナノポア)を生成した。例えば、システイン、非天然塩基などのようなCsgGモノマーが(例えば、アミノ酸置換によって)修飾され、ポアタグの結合のために提供される。修飾CsgGモノマーを、本明細書に記載のように、一つ以上のアミノ酸置換を有するアミノ酸配列番号7をコード化するプラスミドを含むPT7ベクターを用いて生成した。プラスミドをBL21誘導体細胞系に形質転換し、内因性CsgG遺伝子をカナマイシン耐性で置換するように突然変異させた。細胞をアンピシリン(100μg/ml)及びカナマイシン(30μg/ml)を含有する寒天プレート上に播種し、37℃で16時間インキュベートした。カルベネシリン(100μg/ml)及びカナマイシン(30μg/ml)を含有する100mlのLB培地に植菌するために、シングルコロニーを使用し、そしてスターター培養物を37℃/250rpmで16時間増殖させた。カルベネシリン(100μg/ml)、カナマイシン(30μg/ml)3mM ATP、15mM MgSO4、及び0.5mMラムノースを植菌4×500mlのLBに植菌するために、4×25mlのスターター培養物を使用した。培養物を定常期に達するまで増殖させ、そして37℃/250rpmで更に2時間増殖させた。グルコースを0.2%になるまで添加して温度を18℃に低下させ、培養物が18℃になると、1%α-ラクトース一水和物を添加することによってタンパク質発現を誘導した。培養物を18℃/250rpmで16時間インキュベートした。
細胞を遠心分離により採取し、そして界面活性剤溶解(Bugbuster)にかけた。溶解したら、試料は初期連鎖球菌精製(5ミmlのHPの連鎖球菌トラップ)のために持ち越した。溶出した画分を60℃に加熱し、回転させ、上清をqIEX精製(1ml Hi trap Q HP)のために持ち越した。正しいタンパク質を含む画分をプールし、濃縮し、そして24mlのSuperdexで最終磨きのために持ち越した。
上記のナノポアのアリコートを、以下のようにモルフォリノオリゴなどのポアタグで(例えば、配列番号8に示すように)修飾した。1.3μLの1M DTT(ジチオトレイトール)を、約9.75μgのナノポアを含む130μLの上記からのナノポアに添加し、室温で1時間インキュベートした。製造元のガイドラインに従い、0.5mLの7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いてこの試料を反応緩衝液(25mM Tris、150mM NaCl、2mM EDTA、0.1%SDS及び0.1%Brij58、pH7)に緩衝液交換した。製造元のガイドラインに従って、7MWCO Zeba脱塩カラム(Thermo Fisher Scientific)を用いて、この試料を再び反応緩衝液に緩衝液交換した。モルフォリノオリゴヌクレオチド(例えば、配列番号8に示されるような)などの2mMのポアタグのストックを、ヌクレアーゼフリー水(AmbionTM)中で製造した。これを上記緩衝液交換試料に最終濃度500μMまで添加し、室温で一晩インキュベートしたままにして修飾ナノポアを得た。
解析と品質管理
SDS-PAGE-プロトコル
2μLの修飾及び未修飾ナノポアを8μLの反応緩衝液に添加した。試料をPCRブロックで95℃に4分間加熱して、試料をオリゴマーからモノマーに分解した。10μLの2×Laemmli試料緩衝液(65.8mMのTris-HCl、pH6.8、26.3%(w/v)グリセロール、2.1%SDS、0.01%ブロモフェノールブルー)を各試料に添加した。試料を4~20%TGXゲル上で300mVで23分間泳動させ、そしてSYPRO Ruby Protein Gelを用いて染色した。ゲルの結果を図27Aに示す。
ピリジル-ジチオモルフォリノ修飾ポアへのハイブリダイゼーション-プロトコル
10μLの修飾ナノポアは、修飾ナノポアに対して2倍過剰で付加された対応する蛍光ハイブリダイゼーション配列を有した。試料は総量20μLであった。各試料を室温で1時間放置した。5μLの5×無色素ローディング(50mM Tris-HCl、pH8.0、25%グリセロール、5mM EDTA)を添加した。試料を4~20%TBEゲル上で160mVで80分間泳動させた。ゲルをCy3蛍光用ゲルスキャナーで泳動させ、SYBRゴールド核酸ゲル染色を用いて染色し、そしてSYPROルビープロテインゲルを用いて染色した。ゲルの結果を図28~30に示す。
[実施例7]
この実施例は、ポリヌクレオチドを一緒に結合するために使用される付着方法がクリックケミストリーである場合の連結ポリヌクレオチドを特徴付ける方法を記載している。この実施例では、鋳型及び補体が共有結合していない場合、第一の二本鎖ポリヌクレオチドの鋳型(捕捉された第一鎖)及び補体(第一鎖の逆相補体)は、ナノポアを用いて特徴付けられる。鋳型及び補体が分離されると、第一の二本鎖ポリヌクレオチドに連結された後続アダプター中のポアテザーに相補的な配列が補体中に露出され、補体はナノポアに付着したポアテザーに結合する。相補鎖が第二の二本鎖ポリヌクレオチドに連結することができるように、連結アダプターも第一の二本鎖ポリヌクレオチドに連結される。
材料及び方法
ゲノムDNAへの後続アダプターの連結
後続アダプターは、50mMのHEPES pH8、100mMの酢酸カリウム中で、毎分2℃で95℃から22℃まで、それぞれ10μM及び11μMで一緒にアニールされたバーコードトップ鎖(配列番号17)及びバーコードボトム鎖(配列番号18)を含む。ハイブリダイズしたDNAは後続アダプターとして知られている。6.4μLの後続アダプターを、後続アダプターの640nM希釈物を生成するために、93.6μLの50mM トリス塩酸 pH7.5、20mM 塩化ナトリウムに添加した。
配列番号17:後続アダプタートップ鎖
/5Phos/TAACGAGGTTGTTTCTATCTCGGCGTCTGCTTGGGTGTTTAACC/iSp18//iSp18//iSp18//iSp18/TTTTTGTCAGAGAGGTTCCAAGTCAGAGAGGTTCCT
配列番号18:後続アダプターボトム鎖
/5Phos/GGAACCTCTCTGACTTGGAACCTCTCTGACAAAAA/iSp18//iSp18//iSp18//iSp18/GGTTAAACACCCAAGCAGACGCCGAGATAGAAACAACCCATCAGATTGTGTTTGTTAGTCGCT/iSp18//iSp18//iSp18//iSp18/AGCGACTAACAAACACAATCTGATG/DBCO/
ゲノムDNAへの後続アダプターの連結は、Oxford Nanopore Technologies配列決定キットを用いて操作ガイドラインに従って行った。1000ngの末端修復及びdAテイル大腸菌ゲノムDNAを、1×Blunt/TAマスターミックス(NEB M0367L)中、5.5μLの上記からの640nMの後続アダプターを用いて100μL中で、室温で20分間連結した。試料のSPRI精製を実施例2に記載の通りに行った。この試料は後続アダプターゲノムDNAと呼ばれる。
後続アダプターゲノムDNAへの連結酵素-アダプター複合体の連結
リーダー鎖(配列番号19)、ブロッカー鎖(配列番号20)及びボトム鎖(配列番号21)を50mM HEPES pH8、100mM酢酸カリウム中で、それぞれ5.5μM、6μM及び6μMで、毎分2℃で、95℃から22℃までアニールした。ハイブリダイズしたDNAは連結酵素-アダプター複合体として知られている。
配列番号19:連結配列決定アダプタートップ鎖
/Azide/GGTTGTTTCTATCTC/iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3/GGCGTCTGCTTGGGTGTTTAACCTTTTTTTTTT/iSp18/AATGTACTTCGTTCAGTTACGT
配列番号20:連結配列決定アダプターブロッカー鎖
GGTTAAACACCCAAGCAGACGCCTTTGAGGCGAGCGGTCAA
配列番号21:連結配列決定アダプターボトム鎖
/5Phos/TCGTTAACGTAACTGAACGAAGT/iBNA-A//iBNA-meC//iBNA-A//iBNA-T//iBNA-T/
製造元の指示に従って、T4Ddaのアリコート-(E94C/F98W/C109A/C136A/A360C)(配列番号24:突然変異E94C/F98W/C109A/C136A/A360C、次いで(ΔM1)G1G2(ここで(ΔM1)G1G2=M1の欠失、次いで付加G1及びG2))を氷上で解凍した後、0.5mlのZebaカラムを通して50μlを50mM HEPES pH8、100mM 酢酸カリウム、2mM EDTAに緩衝液交換した。A280nm値を用いて回収したタンパク質を定量し、同一の緩衝液を用いて0.25mg ml-1に調整した。
27μLの緩衝液交換タンパク質を、DNA低結合エッペンドルフ中で3μLの連結酵素-アダプター複合体と混合し、そして35℃で10分間インキュベートした。次に、0.37μLの8.1mM TMADを添加し、試料を35℃で60分間インキュベートした。そして、30μLの50mM HEPES pH8、1M NaCl、2mM MgCl2、2mM rATPを添加し、室温でさらに20分間放置した。
222μLのAgencourt AMPureビーズ(Beckman Coulter)を添加し、回転子上で試料を室温で5分間インキュベートした。ビーズを磁気ラック上でペレット化し、上清を除去した。まだ磁気ラック上にある間に、ビーズを500ulの50mMのトリスpH7.5、2.5MのNaCl、20%PEG(重量/体積)8,000で洗浄し、360°回転させてラック上でペレットを浸した。洗浄緩衝液を除去し、ペレットを遠心分離機で短時間パルスした後、溶液の最後の残留物を除去するために磁気ラックに戻した。ペレットを、プレロード連結酵素-アダプター複合体として知られている精製アダプターを回収するために磁気ラック上に置く前に、30μlの50mM トリス pH7.5、20mM NaClで室温で5分間再懸濁した。
20μLのプレロード連結酵素-アダプター複合体を、50μLの後続アダプターゲノム-DNA、20μLのNEBNext Quick Ligation Reaction緩衝液及び10μLのQuick T4 DNA リガーゼ(E6056L)とともに100μL中、室温で10分間連結した。SPRI精製を以下のように実施した。40μLのAgencourt AMPureビーズ(Beckman Coulter)を添加し、試料をピペットで混合し、室温で5分間インキュベートした。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを140μLのアダプタービーズ結合緩衝液で洗浄し、磁気ラック上のエッペンドルフチューブを二回連続して180°回転させることによってビーズをアダプタービーズ結合緩衝液中に再懸濁した。ビーズを磁気ラック上でペレット化し、上清を除去した。ペレット化したビーズを再度140μLの緩衝液で洗浄し、磁気ラック上でエッペンドルフチューブを2回連続して180°回転させることによりビーズを緩衝液に再懸濁した。ビーズを磁気ラック上でペレット化し、緩衝液を除去し、ペレットを磁気ラックに戻す前に遠心分離機で短時間パルスし、次いで緩衝液の最後の残余物を除去した。
ペレットを25μLのヌクレアーゼフリー水(AmbionTM)にピペットで混合することによって再懸濁し、このライブラリーを氷上で10分間ビーズから溶出させた。
タグ修飾ナノポアの生成
アダプターの捕捉ポリヌクレオチド配列に相補的なポリヌクレオチド配列を含むように修飾されているナノポアを生成する方法は、上記の実施例2に記載したのと同様の方法で実施した。
電気測定
鎖がナノポアを通過する際に電気測定値を測定し取得する方法は、上記の実施例2に記載したのと同様の方法で実施した。
データ解析
DNA鎖が修飾ナノポアを通過する際に、ナノポアを通る電流の変化を測定し収集した。次に、fastqデータを得るために、ベースコールアルゴリズム、例えばリカレントニューラルネットワーク(RNN)アルゴリズムを用いて鎖の配列を決定した。その後、当技術分野で既知の配列位置合せツールを用いてfastq配列データを参照ゲノムに整列させた。
[実施例8]
この実施例は、付着方法が非共有的である、二本鎖標的ポリヌクレオチドを特徴付け、連結する方法を記載している。第一の二本鎖標的ポリヌクレオチドの相補鎖は第二の二本鎖標的ポリヌクレオチドを補充し、それをポアに局所的に集中させる。次に、第一の相補鎖が配列決定されると、補充された第二の二本鎖標的ポリヌクレオチドは、実施例2で生じるのと同様の方法で、相補鎖から脱ハイブリダイズし、代わりにポアテザーにハイブリダイズする。これにより、第一及び第二(及びそれに続く、第三、第四、第五など)の二本鎖標的ポリヌクレオチドが、鎖間の最短時間でポアを通って相互に続くことを可能にする。第一の標的ポリヌクレオチドが配列決定されている間に第二標的ポリヌクレオチドを補充することができるため、二本鎖標的ポリヌクレオチドの濃度が低い場合、これは特に有用である。
検体は実施例7に記載したのと同じ方法で生成した。ただし配列番号17~21ではなく、配列番号5、6、22、15及び23のものを用いた。他の全ての手順、試薬及び条件は実施例7に記載のものと同じである。
配列番号5:後続アダプタートップ鎖
/5Phos/GGCGTCTGCTTGGGTGTTTAACC/iSp18//iSp18//iSp18//iSp18/TTTTTGTCAGAGAGGTTCCAAGTCAGAGAGGTTCCT
配列番号6:後続アダプターボトム鎖
/5Phos/GGAACCTCTCTGACTTGGAACCTCTCTGACAAAAA/iSp18//iSp18//iSp18//iSp18/GGTTAAACACCCAAGCAGACGCCAGCAAT
配列番号22:フィッシングアダプタートップ鎖
/5SpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3/TTGTCAGAGAGGTTCC/iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3//iSpC3/GGCGTCTGCTTGGGTGTTTAACCTTTTTTTTTT/iSp18/AATGTACTTCGTTCAGTTACGT
配列番号15:フィッシングアダプターブロッカー鎖
GGTTAAACACCCAAGCAGACGCCTTTGAGGCGAGCGGTCAA
配列番号23:フィッシングアダプターボトム鎖
/5Phos/ACGTAACTGAACGAAGT/iBNA-A//iBNA-meC//iBNA-A//iBNA-T//iBNA-T/
[実施例9]
これは付着方法が非共有的である、二本鎖標的ポリヌクレオチドを特徴付け、連結する方法を記載する別の実施例である。該方法は実施例8と全く同様に実施されるが、配列番号9に異なる結合鎖を用いる。二成分フィッシングテザーは、見られるイベントの割合を増加させるために、後続の配列及びポアテザーのための第二の除湿部位を提供する。
配列決定ミックスを形成するとき、配列番号9は400nMのアニールされた配列番号24及び配列番号25で置き換えられる。他の全ての手順、試薬及び条件は実施例8に記載のものと同一である。
配列番号24:フィッシングテザートップ鎖
TTGTCAGAGAGGTTCCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTGGTTGTTTCTGTTGGTGCTGATATTGCTTTTTTGACCGCTCGCCTC
配列番号25:フィッシングテザーボトム鎖
GCAATATCAGCACCAACAGAAACAACCTT/iSp18//iSp18//iSp18//iSp18//iSp18//iSp18/TT/3CholTEG/
[実施例10]
この実施例は、付着方法が非共有的である、多くの二本鎖標的ポリヌクレオチドを特徴付け、連結する方法を記載している。第一の二本鎖標的ポリヌクレオチドの相補鎖は他の多くの二本鎖標的ポリヌクレオチドを補充し、それらをポアの近傍に集中させる。これは、一般的なバルク溶液中よりもポアの周りにより高い局所濃度を提供し、したがって、二本鎖標的ポリヌクレオチドは鎖間の最短時間で開放ポアを通って相互に追従する。これは二本鎖標的ポリヌクレオチドの濃度が低い場合に特に有用である。この実施例は実施例8と同様に実施される。しかしながら、配列番号9をアニーリングするよりもむしろ、一本鎖結合タンパク質に結合したオリゴからなるテザーが使用される。
第一の二本鎖標的ポリヌクレオチドの鋳型鎖を配列決定するとき、相補鎖をssDNAとして溶液中に放出する。他の二本鎖標的ポリヌクレオチドの一本鎖結合タンパク質はssDNAに結合することができる。後続プロセスの一部として、相補鎖を配列決定すると、相補鎖の3´がポアに向かって引き戻される。ssDNA相補鎖上の一本鎖結合タンパク質は、ポアを通る補体の動きを制御するモータータンパク質に遭遇したとき、相補鎖から追放され、そしてポアの周囲に堆積して局所濃度を増加させる。
他の実施形態
本明細書に開示されている全ての特徴は、任意の組合わせで組み合わせてもよい。本明細書に開示されている各特徴は、同一の、同等の、又は類似の目的を果たす代替特徴によって置き換えてもよい。したがって、他に明示的に述べられていない限り、開示された各特徴は、包括的な一連の同等の又は類似の特徴の一例にすぎない。
上記の説明から、当業者は本開示の本質的な特徴を容易に確認することができ、そして本開示の趣旨及び範囲から逸脱することなく、本開示を様々な使用及び条件に適合させるために様々な変更及び修正を加えることができる。したがって、他の実施形態も特許請求の範囲内にある。
等価物
本開示のいくつかの実施形態を本明細書で記載及び図示してきたが、当業者は、機能を実行し、及び/又は結果を得るための様々な他の手段及び/又は構造及び/又は説明した利点のいずれか又は複数を容易に想到するであろう。そのような変形及び/又は修正の各々は、本明細書に記載の発明の実施形態の範囲内にあるとみなされる。より一般的には、当業者は、本明細書に記載された全てのパラメータ、寸法、材料、及び構成が例示的であることを意味し、実際のパラメータ、寸法、材料、及び/又は構成は、本開示の教示が使用されている特定の用途に依存することを容易に理解するであろう。当業者であれば、本明細書に記載の特定の発明の実施形態に対する多くの等価物を認識し、又は日常的な実験のみを用いて確かめることができるであろう。したがって、前述の実施形態は実施例としてのみ提示されており、添付の特許請求の範囲及びその等価物の範囲内で、本発明は具体的に記載及び特許請求されている以外にも実施され得ることを理解すべきである。本開示の発明の実施形態は本明細書に記載の個々の特徴、システム、物品、材料、キット、及び/又は方法に関する。さらに、そのような特徴、システム、物品、材料、及び/又は方法が互いに矛盾しない場合、二つ以上のそのような特徴、システム、物品、材料、キット、及び/又は方法の任意の組合わせは本開示の発明の範囲内に含まれる。
本明細書で定義及び使用される全ての定義は、辞書の定義、参照により組み込まれる文書中の定義、及び/又は定義された語の通常の意味を支配すると理解されるべきである。
本明細書に開示されている全ての参考文献、特許及び特許出願は、それぞれが引用されている主題に関して参照により組み込まれており、それは場合によっては文書の全体を包含することがある。
本明細書及び特許請求の範囲で使用される不定冠詞「a」及び「an」は、そうでないことが明確に示されていない限り、「少なくとも一つ」を意味すると理解されるべきである。
本明細書及び特許請求の範囲で使用される「及び/又は」という句は、そのように結合された要素、すなわち場合によっては接続的に存在し、他の場合には非接続的にある要素の「いずれか又は両方」を意味すると理解されるべきである。「及び/又は」で列挙される複数の要素は、同じように解釈されるべきであり、すなわち、そのように結合される要素の「一つ又は複数」である。具体的に特定される要素に関連するか無関係であるかにかかわらず、「及び/又は」節によって具体的に特定される要素以外の他の要素が任意に存在してもよい。したがって、非限定的な例として、「含む」などの開放型言語とともに使用されたときの「A及び/又はB」への言及は、一つの実施形態では、Aのみ(場合によりB以外の要素を含む)を指すことができる。別の実施形態では、Bのみ(場合によりA以外の要素を含む)を指すことができる。さらに別の実施形態では、AとBの両方(場合により他の要素を含む)などを指すことができる。
本明細書及び特許請求の範囲で使用されるように、「又は」は上で定義された「及び/又は」と同一の意味を有すると理解されるべきである。例えば、リスト内の項目を分離するとき、「又は」又は「及び/又は」は包括的、すなわち、少なくとも一つの、しかし複数の要素のリストの包含も含むものとして解釈されるものとする。また、任意に、リストに含まれていない追加の項目もある。「の一つのみ」又は「ちょうど一つの」、又は請求項で使用されている場合は「からなる」など、反対のことを明確に示している語のみ、多数又はリストされた要素のうちのちょうど一つの要素のみを含むことを示す。一般に、本明細書で使用される「又は」という語は、「いずれか」、「一つ」、「一つのみ」、又は「ちょうど一つの」などの排他性の語が先行する場合にのみ排他的な選択肢を示すものとして解釈される。「から本質的になる」は、特許請求の範囲で使用されるとき、特許法の分野で使用されるその通常の意味を有するものとする。
本明細書及び特許請求の範囲で使用されるように、「少なくとも一つ」という句は、一つ以上の要素のリストを参照し、要素のリスト中の任意の一つ以上の要素から選択された少なくとも一つの要素を意味すると理解されるべきであり、必ずしも、要素リスト内に具体的にリストされた全ての要素の各々を少なくとも一つ含む必要はなく、要素リスト中の要素の任意の組合わせを除外しない。この定義はまた、「少なくとも一つ」という句が言及する要素リスト中で具体的に同定されている要素以外に、具体的に同定される要素と関連するか関連しないかに関わらず、要素が任意に存在し得ることを可能にする。非限定的な例として、「A及びBの少なくとも一方」(又は、同等に、「A又はBの少なくとも一方」、又は同等に「A及び/又はBの少なくとも一方」)を指すことができる。一実施形態では、少なくとも一つの、場合により複数のAを含む、Bを含まない(そして場合によりB以外の元素を含む)。別の実施形態では、Aが存在しない(そして場合によりA以外の元素を含む)少なくとも一つ、場合により複数Bを含む。さらに別の実施形態では、少なくとも一つの、場合により複数のAを含む、少なくとも一つの、場合により複数を含むB(及び場合により他の元素を含む)。など。
そうでないことが明確に示されていない限り、複数のステップ又は行為を含む本明細書で請求される方法において、方法のステップ又は行為の順序は、必ずしも方法のステップ又は行為が列挙されている順序に限定されないことも理解されるべきである。
本発明の様々な実施形態を以下に示す。
1.ポリヌクレオチドを特徴付ける方法であって、
(i)溶液中で、
a)共有結合していない鋳型鎖及び相補鎖を有する二本鎖ポリヌクレオチドを含む構築物と、
b)前記構築物の一部に結合する一つ以上のタグが、ナノポアに接合しているナノポアと、を組み合わせることであって、
前記構築物が前記ナノポアに結合する条件下で、前記構築物と前記ナノポアが組み合わされる、組み合わせることと、
(ii)前記構築物の前記鋳型鎖が前記ナノポアに入ることを可能し、前記鋳型鎖の分離及び前記ナノポアを通る前記鋳型鎖の少なくとも一部の転座を可能にするような条件を提供することと、
(iii)前記ナノポアを介して前記鋳型鎖の転座を示す性質の変化を測定することと、(iv)鋳型鎖がナノポアを通って転座する際に測定された特性の変化に基づいてポリヌクレオチドを特徴付けることと、を含む方法。
2.前記溶液がイオン性であり、測定された特性が前記ナノポアを通るイオン電流の流れである上記1に記載の方法。
3.アダプターが前記二本鎖ポリヌクレオチドの両端の一方又は両方に付着され、各アダプターが二本鎖ステム及び前記二本鎖ステムから延伸する第一の一本鎖を含み、一つのアダプターの第一の一本鎖は鋳型鎖と隣接し、もう一つのアダプターの第一の一本鎖は相補鎖と隣接する、上記1又は2に記載の方法。
4.一つ以上のタグが前記ナノポアの外縁に結合している、上記1~3のいずれかに記載の方法。
5.条件が前記ナノポアを横切る電位差である、上記1~4のいずれかに記載の方法。
6.前記ナノポアが膜内に配置している、上記1~5のいずれかに記載の方法。
7.前記アダプターの一部に結合する一つ以上のタグが前記ナノポアに接合している、上記3~6のいずれかに記載の方法。
8.前記一つ以上のタグが前記ナノポアの外縁に接合している上記7に記載の方法。
9.ステップii)が、前記構築物の前記鋳型鎖と隣接する前記第一の一本鎖が前記ナノポアに入ることを可能にするように、膜を横切って電位差を印加することと、前記鋳型鎖の分離及び前記鋳型鎖の少なくとも一部のナノポアを通る転座を可能にするように、十分な期間にわたってナノポアを横切る電位差を維持することと、を含む、上記3~8のいずれかに記載の方法。
10.ステップiii)が、前記鋳型鎖が前記ナノポアを通って転座するときのナノポアを通るイオン電流の変化を測定することを含む、上記1~9のいずれかに記載の方法。
11.ステップiv)が、前記鋳型鎖が前記ナノポアを通って転座するときに測定される、ナノポアを通る前記イオン電流の変化に基づいてポリヌクレオチドを特徴付けることを含む、上記10に記載の方法。
12.ポリヌクレオチド巻き戻し酵素が、前記溶液中の前記ナノポアのシス開口側に存在する、上記1~11のいずれかに記載の方法。
13.一つ以上のポリヌクレオチド巻き戻し酵素が、前記ポリヌクレオチドにあらかじめ結合している、上記1~11のいずれかに記載の方法。
14.ポリヌクレオチド巻き戻し酵素が両方のアダプターのうちの一つ又は両方にあらかじめ結合している、上記3~13のいずれかに記載の方法。
15.ポリヌクレオチド巻き戻し酵素が前記ナノポアのルーメン内に設けられている、上記1~14のいずれかに記載の方法。
16.前記ナノポアがまた、前記ポリヌクレオチドを巻き戻すように機能する、上記1~15のいずれかに記載の方法。
17.前記ナノポアがモータータンパク質ナノポアであり、任意選択でφ29である、上記1~16のいずれかに記載の方法。
18.各アダプターについて、ポリヌクレオチド巻き戻し酵素が前記二本鎖ステムから延伸する第一の一本鎖に結合している、上記3~17のいずれか記載の方法。
19.前記鋳型鎖の巻き戻しがその対応する結合ポリヌクレオチド巻き戻し酵素によって促進される、上記18に記載の方法。
20.前記構築物の一部に結合する一つ又は複数のタグの少なくとも一つが、前記構築物の一部に対して配列相補性を有する核酸である、上記1~19のいずれかに記載の方法。
21.前記アダプターの一部に結合する一つ以上のタグのうちの少なくとも一つが、前記アダプターの一部に対して配列相補性を有する核酸である、上記3から20のいずれか記載の方法。
22.前記核酸が非荷電である、上記20又は21に記載の方法。
23.前記核酸が、PNA又はモルフォリノである、上記22に記載の方法。
24.前記ポリヌクレオチドがRNA及び/又はDNAを含む、上記1~23のいずれかに記載の方法。
25.前記ポリヌクレオチドの巻き戻しがタグとのハイブリダイゼーションのための相補鎖の一部を明らかにする、上記1~24のいずれかに記載の方法。
26.前記オリゴヌクレオチドが相補性を有する前記アダプターの部分が、第一の一本鎖と隣接する鎖上の二本鎖ステム内にあり、前記相補鎖と隣接する第一の一本鎖を有する前記アダプターの一部が、タグとのハイブリダイゼーションに利用可能である程度まで、前記ポリヌクレオチドの巻き戻しを可能にするのに十分な時間にわたって電位差を維持する、上記9から25のいずれかに記載の方法。
27.前記ナノポアを通る前記鋳型鎖の転座に続き、前記相補鎖が前記ナノポアに入り、転座するのを可能にするのに十分な時間条件を維持することをさらに含む、上記25又は26に記載の方法。
28.前記ナノポアを通る前記鋳型鎖の転座に続き、前記相補鎖と隣接する第一の一本鎖が前記ナノポアに入り、前記ナノポアを通る前記相補鎖の転座を可能にするのに十分な時間にわたって電位差を維持することを更に含む、上記26に記載の方法。
29.前記ナノポアを通る前記相補鎖の転座を示す特性の変化を測定することをさらに含む上記28に記載の方法。
30.前記特性が、前記相補鎖が前記ナノポアを通って転座するときに前記ナノポアを通るイオン電流である、上記29に記載の方法。
31.前記ナノポアを介して前記相補鎖の転座の指標と測定された特性の変化に更に基づいて、前記ポリヌクレオチドを特徴付けることをさらに含む、上記29又は30に記載の方法。
32.前記ナノポアを通る前記相補鎖と前記鋳型鎖の両方の転座を示す測定された特性を示すデータが得られ、前記ポリヌクレオチドを特徴付けるために使用される、上記31に記載の方法。
33.前記ポリヌクレオチドを特徴付けるために、鋳型鎖データを相補鎖データと比較する又は組み合わせる、上記32に記載の方法。
34.前記ナノポアが第一のタグと第二のタグを含み、前記第一のタグと前記第二のタグが、前記鋳型鎖に隣接する前記アダプターの第一の一本鎖の部分、及び前記相補鎖に隣接する前記アダプターの第一の一本鎖の部分にそれぞれ結合する、上記1~33のいずれかに記載の方法。
35.各アダプターが前記二本鎖ステムから延伸する第二一本鎖を含み、一方のアダプターの第二の一本鎖が前記相補鎖と隣接し、及び/又は他方のアダプターの第二の一本鎖が前記鋳型鎖と隣接する、上記3~34のいずれかに記載の方法。
36.前記アダプターの一部に結合する一つ以上のタグのうちの少なくとも一つが、第二の一本鎖内の前記アダプターの一部に対して配列相補性を有するオリゴヌクレオチドである、上記35に記載の方法。
37.前記アダプターの一部に結合する複数のタグのうち二つ以上が、第二一本鎖内の前記アダプターの一部に対して配列相補性を有するオリゴヌクレオチドである、上記36に記載の方法。
38.前記鋳型鎖が前記ポアを通って転座する際に、前記測定された特性の変化の測定に基づいて前記鋳型鎖の配列を決定することと、
前記相補鎖が前記ポアを通って転座する際に、前記測定された特性の変化の測定に基づいて相補鎖の配列を決定することと、及び
鋳型鎖の配列を相補鎖の配列と比較してポリヌクレオチドの配列を確立することと、を更に含む、上記1から37のいずれかに記載の方法。
方法。
39.ポリヌクレオチドを特徴付けるためのシステムであって、該システムが、
(i)鋳型鎖と相補鎖を有するポリヌクレオチドを含む構築物と、
(ii)アダプターの一部と配列相補性を有する少なくとも一つの核酸と接合している外縁を含む膜内に配置されたナノポアと、を含むシステム。
40.前記鋳型鎖と前記相補鎖が共有結合しておらず、
前記アダプターが前記ポリヌクレオチドの各両端に付着しており、
各アダプターが二本鎖ステム及び二本鎖ステムから延伸する第一の一本鎖を含み、
一方のアダプターの第一の一本鎖が前記鋳型鎖と隣接し、他方のアダプターの第一の一本鎖が前記相補鎖と隣接し、
各アダプターについて、ポリヌクレオチド巻き戻し酵素が前記二本鎖ステムから延伸する第一の一本鎖に結合している、上記39に記載のシステム。
41.前記アダプターの一部が前記第一の一本鎖と隣接する鎖上の前記二本鎖ステム内にある、上記40に記載のシステム。
42.前記各アダプターが前記二本鎖ステムから延伸する第二一本鎖を含み、一方のアダプターの第二の一本鎖が前記相補鎖と隣接し、他方のアダプターの第二の一本鎖が前記鋳型鎖と隣接する、上記40に記載のシステム。
43.前記アダプターの一部が第二の一本鎖内にある、上記40に記載のシステム。
44.少なくとも一つの核酸が、
(a)第一の一本鎖と隣接する鎖上の二本鎖ステム内にあるアダプターの一部と配列相補性を有し、及び
(b)第二一本鎖内にあるアダプターの一部と更なる配列相補性を有する、上記42に記載のシステム。
45.少なくとも二つの核酸が前記ナノポアに接合しており、少なくとも前記二つの核酸のうちの一つが第一の一本鎖と隣接する鎖上の二本鎖ステム内にあるアダプターの一部と配列相補性を有し、少なくとも二つの核酸の他方が第二の一本鎖内にある前記アダプターの一部と配列相補性を有する、上記42に記載のシステム。
46.前記少なくとも二つの核酸が前記ナノポアの外縁に接合している、上記45に記載のシステム。
47.ポリヌクレオチドを特徴付けるためのシステムを製造するための方法であって、該方法が、
(i)鋳型鎖及び相補鎖が共有結合していない鋳型鎖及び相補鎖を有するポリヌクレオチドを含む構築物を取得することと、
(ii)アダプターの一部と配列相補性を有する少なくとも一つの核酸が結合しているナノポアの外縁に構築物が露出される条件下で、構築物を膜中に配置されたナノポアと組み合わせることと、を含む方法。
48.アダプターが前記ポリヌクレオチドの各両端に付着しており、
各アダプターが二本鎖ステム及び前記二本鎖ステムから延伸する第一の一本鎖を含み、一方のアダプターの第一の一本鎖が鋳型鎖と隣接し、他方のアダプターの第一の一本鎖が相補鎖と隣接し、
各アダプターについて、ポリヌクレオチド巻き戻し酵素が前記二本鎖ステムから延伸する第一の一本鎖に結合している、上記47に記載の方法。
49.複合体であって、
i.タグを有するナノポアと、
ii.タグを介して前記ナノポアに結合した相補ポリヌクレオチド鎖と、
iii.前記相補ポリヌクレオチド鎖と部分的にハイブリダイズし、前記ナノポアのルーメン内に部分的に配置されている鋳型ポリヌクレオチド鎖と、を含む、複合体。
50.複合体であって、
i.二つ以上のタグを有するナノポアと、
ii.各鎖が二つ以上のタグのうちの一つに結合している鋳型鎖及び相補鎖を含む二本鎖ポリヌクレオチドと、を含む、複合体。
51.前記タグがそのルーメンの外側の外縁にある、上記49又は50に記載の複合体。
52.検体を特徴付けるためのシステムであって、該システムが、
(i)膜内に配置されたナノポアであって、少なくとも一つの共通のタグが存在する外縁を含む、ナノポアと、
(ii)複数の異なる検体であって、各異なる検体が少なくとも一つのタグの結合パートナーに付着している検体と、を含むシステム。
53.各検体がバイオポリマーである、上記52に記載のシステム。
54.前記バイオポリマーがポリヌクレオチド、ポリペプチド、多糖、及び脂質から選択される、上記52に記載のシステム。
55.各検体がポリヌクレオチドである、上記54に記載のシステム。
56.結合パートナーが前記ポリヌクレオチドに付着しているアダプターのヌクレオチド配列であり、少なくとも一つの共通のタグが、前記アダプターの前記ヌクレオチド配列と配列相補性を有する核酸である、上記55に記載のシステム。
57.ナノポアを用いた検体の特性を決定するための方法であって、該方法が、
i.検体を提供することと、
ii.一つ以上の前記検体を前記ナノポアのルーメンの外側にあるナノポアの外縁に結合させることと、
iii.前記ナノポアに対して前記検体を移動させながら、前記ナノポアに結合した検体の測定値を取得することであって、前記測定値が前記検体の一つ以上の特性を示す、取得することと、
iv.ステップiiiで得られた前記測定値に基づいて前記検体を特徴付けることと、を含む方法。
58.一つ以上の検体が、前記ナノポアのルーメンの外側にあるナノポアの外縁に結合する、上記57に記載の方法。
59.複数の検体が前記ナノポアに接合した複数のタグにそれぞれ結合する、上記58に記載の方法。
60.一つ以上のタグがナノポアのルーメンの外側にあるナノポアの外縁に接合されている、上記59に記載の方法。
61.第一の検体がポリヌクレオチドである、上記57~60のいずれかに記載の方法。
62.前記ナノポアに対して第二の検体を移動させながら、前記ナノポアに結合した前記第二の検体の測定値を取得することであって、前記第二の検体について得られた前記測定値が、前記第二の検体の一つ以上の特性を示す、取得することと、
得られた前記第二の検体の前記測定値に基づいて、前記第二の検体を特徴付けることと、をさらに含む、上記57~61のいずれかに記載の方法。
63.前記ナノポアに対する前記第一の検体の移動中に、第二の検体が前記ナノポアに結合している、上記57に記載の方法。
64.前記第二の検体がポリヌクレオチドである、上記62又は63に記載の方法。
65.複合体であって、
複数のタグを有するナノポアであって、前記ナノポアのルーメン内に部分的に存在する第一の検体及び第二検体が、捕捉部分の一つに結合している、ナノポア、を含む、複合体。
66.複数のタグがそのルーメンの外側にある外縁上にある、上記65に記載の複合体。
67.前記第一の検体及び前記第二検体がポリヌクレオチドである、上記65又は66に記載の複合体。
68.ナノポアを通って二つの非共有結合分子を逐次転座させるための方法であって、該方法が、
前記ナノポアを通る一対の非共有結合分子の第一のメンバーの転座を促進する条件下で、一対の非共有結合分子をナノポアに接触させることを含み、
前記ナノポアを通る第一のメンバーの転座中に、前記一対の第二のメンバー上の結合部位が露出され、
前記結合部位が前記ナノポア上に存在するタグに可逆的に結合する、方法。
69.非共有結合分子が相補的核酸鎖である、上記68に記載の方法。
70.前記ナノポア上のタグがオリゴヌクレオチドであり、第二メンバー上の結合部位がタグと相補的な配列を有する核酸の一部である、上記68に記載の方法。
71.一対の非共有結合分子がアダプターに付着した標的核酸を含み、結合部位がアダプター上に存在する、上記68に記載の方法。
72.ポリヌクレオチドを特徴付ける方法であって、該方法が、
一対の非共有結合分子の第二メンバーの転位が後に続く、前記一対の非共有結合分子の第一のメンバーのナノポアを通る転座を促進する条件下で、一対の非共有結合分子をナノポアに接触させることと、
前記一対の第一及び第二のメンバーの転座を示す特性を測定し、そして測定された特性を示すデータを取得することと、
第一及び第二のメンバーの両方の得られたデータに基づいて、特性を決定することと、を含む方法。
73.標的ポリヌクレオチドを配列決定する方法であって、該方法が、
(a)膜貫通孔を、
(i)標的ポリヌクレオチド及び標的ポリヌクレオチドに相補的なポリヌクレオチドを含む二本鎖ポリヌクレオチドであって、前記標的ポリヌクレオチド及び前記標的ポリヌクレオチドに相補的なポリヌクレオチドが、それぞれ一本鎖リーダー配列を含む、二本鎖ポリヌクレオチドと、
(ii)前記二本鎖ポリヌクレオチドの鎖を分離し、かつ膜貫通孔を通るポリヌクレオチドの動きを制御することができるポリヌクレオチド結合タンパク質と、に接触させることと、
(b)前記ポアを通って転座するポリヌクレオチドを検出するために、前記ポアを通るイオン流に対応する信号を検出することと、
(c)前記標的ポリヌクレオチドの転座に対応する信号及び前記標的ポリヌクレオチドに相補的なポリヌクレオチドの別個の転座に対応する配列信号を同定することと、
(d)(c)で同定された信号を解析することと、
それによって前記標的ポリヌクレオチドを配列決定することと、を含む、方法。