JP7007813B2 - Oxidizing proteolytic enzyme activity enhancer and glycation stress inhibitor - Google Patents
Oxidizing proteolytic enzyme activity enhancer and glycation stress inhibitor Download PDFInfo
- Publication number
- JP7007813B2 JP7007813B2 JP2017100806A JP2017100806A JP7007813B2 JP 7007813 B2 JP7007813 B2 JP 7007813B2 JP 2017100806 A JP2017100806 A JP 2017100806A JP 2017100806 A JP2017100806 A JP 2017100806A JP 7007813 B2 JP7007813 B2 JP 7007813B2
- Authority
- JP
- Japan
- Prior art keywords
- extract
- fenugreek
- water extract
- present disclosure
- hibiscus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Description
本開示は、酸化タンパク質分解酵素活性増強剤、糖化ストレス抑制剤、及びそれらを含む飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に関する。 The present disclosure relates to an oxidative proteolytic enzyme activity enhancer, a saccharification stress inhibitor, and a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug or a pharmaceutical product containing them.
生体内における酸化反応及び糖化反応は、細胞及び組織に悪影響を及ぼすことが知られている。酸化タンパク質及び糖化タンパク質は、その生成及び蓄積が、糖尿病合併症、アルツハイマー病、白内障、動脈硬化等の疾病、及び皮膚等の組織の老化及び機能低下の原因となっている。通常、これらのタンパク質は、酸化タンパク質分解酵素(Oxidized Protein hydrolase:OPH)及びプロテアソーム等のタンパク質分解酵素により分解除去されるが、これらの酵素活性は、加齢と共に低下することが知られている。
OPH活性を増強する物質として、ローマカミツレ、ドクダミ、セイヨウサンザシ、ブドウ及びヒシ等の植物の抽出物が提案されている(特許文献1及び2)
Oxidation and glycation reactions in vivo are known to have adverse effects on cells and tissues. The production and accumulation of oxidized and glycated proteins cause diabetic complications, Alzheimer's disease, cataracts, arteriosclerosis and other diseases, and aging and functional deterioration of tissues such as skin. Normally, these proteins are degraded and removed by proteolytic enzymes such as Oxidized Protein hydride (OPH) and proteasomes, but it is known that the activity of these enzymes decreases with aging.
Extracts of plants such as Roman chamomile, Houttuynia cordata, hawthorn, grape and Hishi have been proposed as substances for enhancing OPH activity (Patent Documents 1 and 2).
「糖化ストレス」とは、還元糖やアルデヒド負荷による生体へのストレス、及びその後の反応を総合的にとらえた概念である。糖化ストレスによって生成した異常蛋白質は、生活習慣病等の疾病及び老化に関係しているとして着目されている。
異常蛋白質は、一般的には加齢等により、酸化、糖化又はアルデヒド修飾等を受けた蛋白質である。これらが生体内に蓄積することにより、機能性タンパク質の機能低下や、炎症等を引き起こし、その結果、糖尿病合併症、アルツハイマー病、白内障、動脈硬化等の疾病、並びに皮膚等の組織の老化及び機能低下を引き起こすと考えられている。
異常蛋白質が生成される原因の一つとして、生体内におけるメイラード反応が考えられている。例えば、生体内における糖化反応(メイラード反応)によって、コラーゲン等のタンパク質が糖化されてタンパク質中のアミノ酸がAGEs(終末糖化産物)となったり、AGEsによるタンパク質間に架橋構造が形成されること等により、異常蛋白質となる。
"Glycation stress" is a concept that comprehensively captures the stress on the living body due to the loading of reducing sugars and aldehydes, and the subsequent reaction. Abnormal proteins produced by glycation stress are attracting attention as being associated with diseases such as lifestyle-related diseases and aging.
The abnormal protein is generally a protein that has undergone oxidation, saccharification, aldehyde modification, or the like due to aging or the like. Accumulation of these in the body causes functional deterioration and inflammation of functional proteins, resulting in diabetic complications, Alzheimer's disease, cataracts, arteriosclerosis and other diseases, as well as aging and function of tissues such as skin. It is believed to cause a decline.
The Maillard reaction in the living body is considered to be one of the causes of the production of abnormal proteins. For example, by a glycation reaction (Maillard reaction) in the living body, proteins such as collagen are saccharified and amino acids in the proteins become AGEs (advanced glycation end products), or a crosslinked structure is formed between proteins by AGEs. , Becomes an abnormal protein.
AGEsによるタンパク質間における架橋構造を分解する薬剤として、N-phenacylthiazolium bromide(PTB)及びN-phenacyl-4,5-dimethylthiazolium bromide(ALT-711)が知られている(非特許文献1及び2)。しかしながら、これらは安定性や副作用の点で利用されていない。その他には、ハス葉エキス及びアカショウマエキス等が検討されている(特許文献3)。 N-phenacylthiazolium bromide (PTB) and N-phenacyl-4,5-dimethylthiazolium bromide (ALT-711) are known as agents for degrading the cross-linked structure between proteins by AGEs (Non-Patent Documents 1 and 2). However, they have not been utilized in terms of stability and side effects. In addition, lotus leaf extract, red pepper extract and the like have been studied (Patent Document 3).
AGEs及びALEs(脂質過酸化最終生成物)は、グルコース等の還元糖や脂質のβ酸化及び過酸化等によるアルデヒド基及びケトン基等の反応基と、生体中のタンパク質又は脂質とが反応(メイラード反応)することにより生成される。これらが生体内で生成され蓄積することにより、機能性タンパク質の機能障害、及びAGEs受容体の活性化等が生じることが明らかになってきている。そして、これらは、機能低下、炎症、生活習慣病及び老化等をもたらす要因の一つとして考えられ、これらの一連の現象及び症状を総合的にとらえた概念が糖化ストレスやカルボニルストレスと呼ばれている。 In AGEs and ALEs (advanced glycation end products of lipids), reactive groups such as reducing sugars such as glucose and aldehyde groups and ketone groups due to β-oxidation and peroxidation of lipids react with proteins or lipids in the living body (Maillard). It is produced by reacting). It has become clear that the dysfunction of functional proteins and the activation of AGEs receptors occur when these are produced and accumulated in vivo. These are considered as one of the factors that cause functional deterioration, inflammation, lifestyle-related diseases, aging, etc., and the concept that comprehensively captures these series of phenomena and symptoms is called saccharification stress or carbonyl stress. There is.
また、メイラード反応により機能性タンパク質が糖化され機能障害を起こすと、活性酸素が過剰に発生したり、生体内における活性酸素の消去作用が十分に機能しなくなり、その結果、酸化ストレスを引き起こすと考えられている。糖化ストレスと同様、酸化ストレスも生活習慣病をはじめとする様々な疾病及び老化の要因の一つとして考えられている。 In addition, when the functional protein is saccharified by the Maillard reaction and causes dysfunction, it is thought that active oxygen is excessively generated and the scavenging action of active oxygen in the living body does not function sufficiently, resulting in oxidative stress. Has been done. Like glycation stress, oxidative stress is considered to be one of the causes of various diseases including lifestyle-related diseases and aging.
アンチエイジング及び生活習慣病の予防等の観点から、上記の異常蛋白質の抑制、分解又は除去等を行い、糖化ストレス及び酸化ストレスを抑制又は低減可能な新たな物質及び方法が求められている。 From the viewpoint of anti-aging and prevention of lifestyle-related diseases, there is a demand for new substances and methods capable of suppressing, decomposing or removing the above-mentioned abnormal proteins and suppressing or reducing glycation stress and oxidative stress.
また、OPH等の酵素の活性を増強させることによる、前記疾病、前記組織の老化及び組織の機能低下の治療ならびに予防の可能性に期待が寄せられている。 In addition, there are high expectations for the possibility of treating and preventing the disease, aging of the tissue, and functional deterioration of the tissue by enhancing the activity of enzymes such as OPH.
そこで、本開示は、一態様において、OPH活性を増強可能な新たな物質、及び糖化ストレスを抑制又は低減可能な新たな物質を提供する。 Therefore, the present disclosure provides, in one embodiment, a new substance capable of enhancing OPH activity and a new substance capable of suppressing or reducing glycation stress.
本開示は、一態様において、フェヌグリークの抽出物を有効成分として含む、酸化タンパク質分解酵素活性増強剤に関する。 The present disclosure relates to, in one embodiment, an oxidative proteolytic enzyme activity enhancer comprising an extract of fenugreek as an active ingredient.
本開示は、その他の態様において、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を有効成分として含む、酸化タンパク質分解酵素活性増強剤に関する。 The present disclosure relates to, in other embodiments, an oxidative proteolytic enzyme activity enhancer comprising an extract of one or more plants selected from the group consisting of fenugreek, fennel and hibiscus as an active ingredient.
本開示は、その他の態様として、フェヌグリーク及びフェネルの抽出物を有効成分として含む、糖化ストレス抑制剤に関する。 The present disclosure relates to, as another aspect, a glycation stress inhibitor containing fenugreek and fenugreek extracts as active ingredients.
本開示は、その他の態様として、フェヌグリーク及びフェネルの抽出物を有効成分として含む、糖化ストレスを抑制するための飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に関する。 The present disclosure, in other aspects, is a beverage composition, food composition, functional food, cosmetics, supplement, quasi-drug or pharmaceutical product containing fenugreek and fenugreek extract as an active ingredient for suppressing saccharification stress. Regarding.
本開示は、その他の態様において、本開示の酸化タンパク質分解酵素活性増強剤及び本開示の糖化ストレス抑制剤の少なくとも一方を有効成分とする、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に関する。 In other embodiments, the present disclosure comprises a beverage composition, a food composition, a functional food, a cosmetic product, which comprises at least one of the oxidative proteolytic enzyme activity enhancer of the present disclosure and the saccharification stress inhibitor of the present disclosure as an active ingredient. Regarding supplements, quasi-drugs or pharmaceutical products.
本開示によれば、一態様において、新たなOPH活性増強剤、及びOPH活性を増強可能な飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品を提供できる。 According to the present disclosure, in one embodiment, it is possible to provide a new OPH activity enhancer and a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi drug or a pharmaceutical product capable of enhancing the OPH activity.
本開示によれば、一態様において、新たな糖化ストレス抑制剤、及び糖化ストレスを抑制可能な飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品を提供できる。 According to the present disclosure, in one embodiment, it is possible to provide a new saccharification stress inhibitor and a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug or a pharmaceutical product capable of suppressing the saccharification stress.
[OPH活性増強剤]
本開示は、フェヌグリーク(学名Trigonella foenum-graecum)、フェネル(学名Foeniculum vulgare)及びハイビスカス(学名Hibiscus sabdariffa)の水抽出物、とりわけ熱水抽出物が、OPHとして知られているAcylamino-acid-releasing enzyme(AARE)の酵素活性を増強できるという新たな知見に基づく。
[OPH activity enhancer]
In the present disclosure, water extracts of fenugreek (scientific name: Trigonella foenum-glaecum), fenugreek (scientific name: Foenicularum vulgare) and hibiscus (scientific name: Hibiscus sabdarifa), particularly hot water extracts, are known as OPH. Based on the new finding that the enzyme activity of (AARE) can be enhanced.
OPHは、生体内に広く分布し、酸化タンパク質及び糖化タンパク質といった生体内における糖化ストレスや酸化ストレスに起因する物質を優先的に分解することが知られている。このため、OPHの酵素活性を増強させることによって、酸化タンパク質及び糖化タンパク質の分解効率を向上でき、それにより、糖化ストレスや酸化ストレスを抑制又は軽減できることが期待できる。本開示のOPH活性増強剤によれば、OPHの酵素活性を増強できることから、一又は複数の実施形態において、酸化タンパク質を分解除去したり、酸化タンパク質の蓄積を抑制することができる。本開示のOPH活性増強剤によれば、一又は複数の実施形態において、糖化ストレス及び/又は酸化ストレスを抑制又は軽減することができうる。本開示のOPH活性増強剤によれば、一又は複数の実施形態において、糖化ストレス又は酸化ストレスに起因する疾病、組織の老化及び組織の機能低下の予防、改善、又は治療を行うことができうる。本開示のOPH活性増強剤によれば、一又は複数の実施形態において、新陳代謝を向上させることができうる。 It is known that OPH is widely distributed in the living body and preferentially decomposes substances caused by glycation stress and oxidative stress in the living body such as oxidative protein and glycated protein. Therefore, by enhancing the enzymatic activity of OPH, it is expected that the decomposition efficiency of the oxidized protein and the glycated protein can be improved, thereby suppressing or reducing the glycated stress and the oxidative stress. According to the OPH activity enhancer of the present disclosure, since the enzyme activity of OPH can be enhanced, the oxidized protein can be decomposed and removed or the accumulation of the oxidized protein can be suppressed in one or more embodiments. According to the OPH activity enhancer of the present disclosure, glycation stress and / or oxidative stress can be suppressed or reduced in one or more embodiments. According to the OPH activity enhancer of the present disclosure, in one or more embodiments, it is possible to prevent, improve, or treat diseases, tissue aging, and tissue dysfunction caused by glycation stress or oxidative stress. .. According to the OPH activity enhancer of the present disclosure, metabolism can be improved in one or more embodiments.
本開示は、一態様において、フェヌグリークの抽出物を有効成分として含むOPH活性増強剤に関する。本開示のOPH活性増強剤は、一又は複数の実施形態において、フェネルの抽出物をさらに含んでいてもよい。本開示のOPH活性増強剤は、一又は複数の実施形態において、ハイビスカスの抽出物をさらに含んでいてもよい。本開示のOPH活性増強剤は、一又は複数の実施形態において、フェヌグリークの抽出物と、フェネル及びハイビスカスの少なくとも一方の抽出物とを有効成分として含む。また、本開示は、その他の態様において、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を有効成分として含むOPH活性増強剤に関する。 The present disclosure relates to, in one aspect, an OPH activity enhancer comprising an extract of fenugreek as an active ingredient. The OPH activity enhancer of the present disclosure may further comprise an extract of Fennell in one or more embodiments. The OPH activity enhancer of the present disclosure may further comprise an extract of Shoeblackplant in one or more embodiments. The OPH activity enhancer of the present disclosure comprises, in one or more embodiments, an extract of fenugreek and at least one extract of fenugreek and hibiscus as an active ingredient. The present disclosure also relates to OPH activity enhancers, in other embodiments, comprising an extract of one or more plants selected from the group consisting of fenugreek, fenugreek and hibiscus as an active ingredient.
本開示のOPH活性増強剤は、一又は複数の実施形態において、糖化ストレスを抑制するために使用できる。本開示のOPH活性増強剤は、一又は複数の実施形態において、糖化ストレス又は酸化ストレスに起因する疾病、組織の老化及び組織の機能低下の予防、改善、又は治療のために使用できる。本開示のOPH活性増強剤は、一又は複数の実施形態において、アンチエイジング、又は新陳代謝の向上のために使用できる。 The OPH activity enhancer of the present disclosure can be used to suppress glycation stress in one or more embodiments. The OPH activity enhancer of the present disclosure can be used in one or more embodiments for the prevention, amelioration, or treatment of diseases, tissue aging, and tissue dysfunction caused by glycation stress or oxidative stress. The OPH activity enhancers of the present disclosure can be used in one or more embodiments for anti-aging or improving metabolism.
本開示のOPH活性増強剤がフェヌグリーク以外の植物の抽出物を含む場合、それらは、同じ比率(フェヌグリークの抽出物1重量部に対して1重量部)で配合されていてもよいし、異なる比率で配合されていてもよい。 When the OPH activity enhancers of the present disclosure contain extracts of plants other than fenugreek, they may be blended in the same ratio (1 part by weight to 1 part by weight of the extract of fenugreek) or in different ratios. It may be blended with.
本開示のOPH活性増強剤は、一又は複数の実施形態において、フェヌグリークの抽出物及びフェネルの抽出物を含む。本態様において、フェヌグリークの抽出物とフェネルの抽出物との配合比(乾燥重量比)は、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.1~10重量部であり、OPH活性増強の点からは、フェネルの抽出物が0.2~5重量部である。 The OPH activity enhancers of the present disclosure include, in one or more embodiments, an extract of fenugreek and an extract of fenugreek. In this embodiment, the blending ratio (dry weight ratio) of the fenugreek extract and the fenugreek extract is 0.1 to 10 parts by weight of the fenugreek extract per 1 part by weight of the fenugreek extract, and the OPH activity. From the point of view of enhancement, the extract of fenugreek is 0.2-5 parts by weight.
本開示のOPH活性増強剤は、一又は複数の実施形態において、フェヌグリークの抽出物及びハイビスカスの抽出物を含む。本態様において、フェヌグリークの抽出物とハイビスカスの抽出物との配合比(乾燥重量比)は、フェヌグリークの抽出物1重量部当たり、ハイビスカスの抽出物が0.1~10重量部であり、OPH活性増強の点からは、ハイビスカスの抽出物が0.2~5重量部である。 The OPH activity enhancer of the present disclosure comprises, in one or more embodiments, an extract of fenugreek and an extract of hibiscus. In this embodiment, the blending ratio (dry weight ratio) of the fenugreek extract and the hibiscus extract is 0.1 to 10 parts by weight of the hibiscus extract per 1 part by weight of the fenugreek extract, and the OPH activity. From the point of view of enhancement, the hibiscus extract is 0.2-5 parts by weight.
本開示のOPH活性増強剤は、一又は複数の実施形態において、フェヌグリークの抽出物、フェネルの抽出物及びハイビスカスの抽出物を含む。本態様において、フェヌグリークの抽出物とフェネルの抽出物とハイビスカスの抽出物との配合比(乾燥重量比)は、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.05~20重量部、ハイビスカスの抽出物が0.05~20重量部であり、OPH活性増強の点からは、フェネルの抽出物が0.1~10重量部、ハイビスカスの抽出物が0.1~10重量部である。 The OPH activity enhancers of the present disclosure include, in one or more embodiments, an extract of fenugreek, an extract of fenugreek and an extract of hibiscus. In this embodiment, the blending ratio (dry weight ratio) of the phenuglique extract, the phenell extract and the hibiscus extract is 0.05 to 20 parts by weight per part by weight of the phenuglique extract. , The hibiscus extract is 0.05 to 20 parts by weight, and from the viewpoint of enhancing OPH activity, the phenel extract is 0.1 to 10 parts by weight, and the hibiscus extract is 0.1 to 10 parts by weight. be.
抽出物は、どの部位から抽出したものであってもよい。使用部位としては、一又は複数の実施形態において、全草、花、葉、種子、果実、枝、茎、根、萼(がく)、及び苞(ほう)等が挙げられる。使用部位は1種類であってもよく、2種類以上の部位を組み合わせて使用してもよい。フェヌグリークは、一又は複数の実施形態において、種子が好ましい。フェネルは、一又は複数の実施形態において、種子が好ましい。ハイビスカスは、一又は複数の実施形態において、蕚及び苞が好ましい。 The extract may be extracted from any part. Examples of the site of use include whole plants, flowers, leaves, seeds, fruits, branches, stems, roots, calyxes, bracts and the like in one or more embodiments. The site to be used may be one type, or two or more types of sites may be used in combination. Fenugreek is preferably seeds in one or more embodiments. Phenels are preferably seeds in one or more embodiments. The hibiscus is preferably a shoeblackplant and a bract in one or more embodiments.
抽出方法は、特に制限されず、一又は複数の実施形態において、溶媒抽出等が挙げられる。抽出溶媒としては、一又は複数の実施形態において、水、メタノール及びエタノール等のアルコール、エーテル等が挙げられる。抽出物は、一又は複数の実施形態において、水抽出物及び有機溶媒抽出物等が挙げられる。水抽出物としては、一又は複数の実施形態において、熱水抽出物等が挙げられる。溶媒抽出の温度は、一又は複数の実施形態において、60~100℃、70~90℃又は80℃等が挙げられる。溶媒抽出の時間は、一又は複数の実施形態において、30分~5時間、1~5時間、2~5時間、3~5時間又は1時間等が挙げられる。熱水抽出の温度は、一又は複数の実施形態において、60~100℃、70~90℃又は80℃等が挙げられる。熱水抽出の時間は、一又は複数の実施形態において、30分~5時間、1~5時間、2~5時間、3~5時間又は1時間等が挙げられる。抽出物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。乾燥は、一又は複数の実施形態において、溶媒抽出によって得られた抽出物を加熱処理することにより行うことができる。加熱温度は、一又は複数の実施形態において、70~150℃又は110℃である。加熱時間は、一又は複数の実施形態において、1~10時間又は4時間である。
本開示のメイラード反応生成物分解剤の製造に適した方法としては、一又は複数の実施形態において、以下のとおりである。適量のフェヌグリーク粉末(例えば、2g)及びフェネル粉末(例えば、2g)を、適量の蒸留水(例えば、40mL)で80℃で1時間抽出し、ついで室温にまで冷却した後、得られたスラリーを濾過して、得られた濾過物は植物抽出物として使用される。乾燥植物抽出物を使用する場合、得られた植物抽出物は、アルミニウムトレイに配置し、例えば、110℃にセットしたインキュベータで4時間乾燥させる。
The extraction method is not particularly limited, and examples thereof include solvent extraction and the like in one or more embodiments. Examples of the extraction solvent include water, alcohols such as methanol and ethanol, ether and the like in one or more embodiments. Examples of the extract include a water extract, an organic solvent extract, and the like in one or more embodiments. Examples of the water extract include hot water extracts and the like in one or more embodiments. The temperature of the solvent extraction may be 60 to 100 ° C., 70 to 90 ° C., 80 ° C. or the like in one or more embodiments. In one or more embodiments, the solvent extraction time may be 30 minutes to 5 hours, 1 to 5 hours, 2 to 5 hours, 3 to 5 hours, 1 hour, or the like. The temperature of hot water extraction may be 60 to 100 ° C., 70 to 90 ° C., 80 ° C. or the like in one or more embodiments. In one or more embodiments, the hot water extraction time may be 30 minutes to 5 hours, 1 to 5 hours, 2 to 5 hours, 3 to 5 hours, 1 hour, or the like. The form of the extract may be an aqueous solution, a concentrated solution, a dried product or the like in one or more embodiments. Drying can be performed in one or more embodiments by heat-treating the extract obtained by solvent extraction. The heating temperature is 70-150 ° C or 110 ° C in one or more embodiments. The heating time is 1-10 hours or 4 hours in one or more embodiments.
Suitable methods for the production of the Maillard reaction product degrading agent of the present disclosure are as follows in one or more embodiments: An appropriate amount of phenuglique powder (eg, 2 g) and fennel powder (eg, 2 g) are extracted with an appropriate amount of distilled water (eg, 40 mL) at 80 ° C. for 1 hour, then cooled to room temperature, and then the obtained slurry is obtained. After filtration, the resulting filtrate is used as a plant extract. When using dried plant extracts, the resulting plant extracts are placed on aluminum trays and dried, for example, in an incubator set at 110 ° C. for 4 hours.
本開示のOPH活性増強剤の形態は、特に制限されず、一又は複数の実施形態において、固形、顆粒、粉末、ペースト、及び液状等が挙げられる。 The form of the OPH activity enhancer of the present disclosure is not particularly limited, and examples thereof include solids, granules, powders, pastes, and liquids in one or more embodiments.
本開示のOPH活性増強剤は、一又は複数の実施形態において、有効成分のOPH活性増強機能を阻害しない範囲で、その他の食品の抽出物及びその他成分を含んでいてもよい。 In one or more embodiments, the OPH activity enhancer of the present disclosure may contain extracts of other foods and other ingredients as long as the active ingredient does not interfere with the OPH activity enhancer function.
本開示のOPH活性増強剤は、一又は複数の実施形態において、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、飼料、医薬部外品又は医薬品等の原料として使用できる。原料としての形態は、特に制限されず、一又は複数の実施形態において、固形、顆粒、粉末、ペースト、及び液状等が挙げられる。
本開示は、一又は複数の実施形態として、本開示のOPH活性増強剤を含む、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、飼料、医薬部外品又は医薬品に関する。
The OPH activity enhancer of the present disclosure can be used as a raw material for beverage compositions, food compositions, functional foods, cosmetics, supplements, feeds, quasi-drugs, pharmaceuticals and the like in one or more embodiments. The form as a raw material is not particularly limited, and examples thereof include solids, granules, powders, pastes, and liquids in one or more embodiments.
The present disclosure relates, as one or more embodiments, to beverage compositions, food compositions, functional foods, cosmetics, supplements, feeds, quasi-drugs or pharmaceuticals comprising the OPH activity enhancers of the present disclosure.
本開示のOPH活性増強剤の一日当たりの摂取量は、特に限定されるものではなく、一又は複数の実施形態において、5mg以上であり、又は2000mg以下である。 The daily intake of the OPH activity enhancer of the present disclosure is not particularly limited, and in one or more embodiments, it is 5 mg or more, or 2000 mg or less.
[OPH活性増強剤の製造方法]
本開示は、その他の態様において、OPH活性を増強させるためのOPH活性増強剤を製造する方法(本開示のOPH活性増強剤の製造方法)に関する。本開示のOPH活性増強剤の製造方法は、一又は複数の実施形態において、フェヌグリークを溶媒抽出することを含む。本開示のOPH活性増強剤の製造方法は、一又は複数の実施形態において、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物を溶媒抽出することをさらに含んでいてもよい。
また、本開示のOPH活性増強剤の製造方法は、一又は複数の実施形態において、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物を溶媒抽出することを含む、OPH活性を増強させるためのOPH活性増強剤を製造する方法に関する。本開示のOPH活性増強剤の製造方法によれば、本開示のOPH活性増強剤を製造できる。
[Manufacturing method of OPH activity enhancer]
The present disclosure relates to, in other embodiments, a method for producing an OPH activity enhancer for enhancing OPH activity (method for producing an OPH activity enhancer according to the present disclosure). The method for producing an OPH activity enhancer of the present disclosure comprises, in one or more embodiments, solvent extraction of fenugreek. The method for producing an OPH activity enhancer of the present disclosure may further comprise, in one or more embodiments, solvent extraction of one or more plants selected from the group consisting of phenel and hibiscus. ..
In addition, the method for producing an OPH activity enhancer according to the present disclosure comprises, in one or more embodiments, solvent extraction of one or more plants selected from the group consisting of fenugreek, phenel and hibiscus. The present invention relates to a method for producing an OPH activity enhancer for enhancing OPH activity. According to the method for producing an OPH activity enhancer of the present disclosure, the OPH activity enhancer of the present disclosure can be produced.
溶媒抽出は、一又は複数の実施形態において、乾燥状態の植物を溶媒抽出することを含んでいてもよい。 Solvent extraction may include, in one or more embodiments, solvent extraction of a dry plant.
本開示のOPH活性増強剤の製造方法は、一又は複数の実施形態において、溶媒抽出して得られた抽出物を、濾過又は遠心分離することを含んでいてもよい。 The method for producing an OPH activity enhancer of the present disclosure may include, in one or more embodiments, filtering or centrifuging the extract obtained by solvent extraction.
本開示のOPH活性増強剤の製造方法は、一又は複数の実施形態において、得られた抽出物を乾燥させることを含んでいてもよい。 The method for producing an OPH activity enhancer of the present disclosure may include drying the obtained extract in one or more embodiments.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物と、フェヌグリーク以外の植物の抽出物とを混合して抽出物の混合物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、同じ比率(フェヌグリークの抽出物1重量部に対して1重量部)であってもよいし、異なる比率であってもよい。 The production method of the present disclosure may include, in one or more embodiments, mixing an extract of fenugreek with an extract of a plant other than fenugreek to obtain a mixture of the extracts. The mixing ratio may be the same ratio (1 part by weight with respect to 1 part by weight of the fenugreek extract) or different ratios in one or more embodiments.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.1~10重量部となるようにこれらの抽出物を混合することを含んでもよく、OPH活性をさらに増強可能なOPH活性増強剤を製造する点からは、フェネルの抽出物が0.2~5重量部となるようにこれらの抽出物を混合することを含んでいてもよい。 The production method of the present disclosure comprises mixing these extracts in one or more embodiments so that the extract of fenugreek is 0.1-10 parts by weight per part by weight of the extract of fenugreek. However, from the viewpoint of producing an OPH activity enhancer capable of further enhancing OPH activity, it may be included to mix these extracts so that the extract of fenugreek is 0.2 to 5 parts by weight. good.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、ハイビスカスの抽出物が0.1~10重量部となるようにこれらの抽出物を混合することを含んでもよく、OPH活性をさらに増強可能なOPH活性増強剤を製造する点からは、ハイビスカスの抽出物が0.2~5重量部となるようにこれらの抽出物を混合することを含んでいてもよい。 The production method of the present disclosure comprises mixing these extracts in one or more embodiments so that the hibiscus extract is 0.1-10 parts by weight per 1 part by weight of the fenugreek extract. However, from the viewpoint of producing an OPH activity enhancer capable of further enhancing OPH activity, it may be included to mix these extracts so that the hibiscus extract is 0.2 to 5 parts by weight. good.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.05~20重量部、ハイビスカスの抽出物が0.05~20重量部となるようにこれらの抽出物を混合することを含んでもよく、OPH活性をさらに増強可能なOPH活性増強剤を製造する点からは、フェネルの抽出物が0.1~10重量部、ハイビスカスの抽出物が0.1~10重量部となるようにこれらの抽出物を混合することを含んでいてもよい。 In one or more embodiments, the production method of the present disclosure comprises 0.05 to 20 parts by weight of the phenus extract and 0.05 to 20 parts by weight of the hibiscus extract per 1 part by weight of the phenuglique extract. It may be included to mix these extracts so as to be, and from the viewpoint of producing an OPH activity enhancer capable of further enhancing OPH activity, the phenel extract is 0.1 to 10 parts by weight, and the hibiscus is extracted. It may include mixing these extracts so that the product is 0.1 to 10 parts by weight.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークと、フェヌグリーク以外の植物とを混合し、得られた混合物を溶媒抽出して混合抽出物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、同じ比率(フェヌグリーク1重量部に対して1重量部)であってもよいし、異なる比率であってもよい。また、得られた混合抽出物における各植物の抽出物の比率が同じ比率(フェヌグリークの抽出物1重量部に対して1重量部)となるように混合してもよいし、異なる比率となるように混合してもよい。 The production method of the present disclosure may include, in one or more embodiments, mixing fenugreek with a plant other than fenugreek and solvent-extracting the resulting mixture to obtain a mixed extract. The mixing ratio may be the same ratio (1 part by weight with respect to 1 part by weight of fenugreek) or different ratios in one or more embodiments. Further, the mixture may be mixed so that the ratio of the extract of each plant in the obtained mixed extract is the same ratio (1 part by weight with respect to 1 part by weight of the extract of fenugreek), or the ratio is different. May be mixed with.
[OPH活性増強方法]
本開示は、一態様において、フェヌグリークの抽出物を生体に投与することを含むOPH活性を増強する方法に関する。本開示は、一態様において、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を生体に投与することを含むOPH活性を増強する方法に関する。本開示は、一態様において、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物をヒト又はヒト以外の生物に摂取させることを含むOPH活性を増強する方法に関する。本開示のOPH活性増強方法は、一又は複数の実施形態において、上記抽出物に替えて、本開示のOPH活性増強剤、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品を使用してもよい。
[Method for enhancing OPH activity]
The present disclosure relates to a method for enhancing OPH activity, which comprises administering an extract of fenugreek to a living body in one embodiment. The present disclosure relates to a method of enhancing OPH activity comprising administering to a living body an extract of one or more plants selected from the group consisting of fenugreek, fenugreek and hibiscus, in one embodiment. The present disclosure, in one embodiment, is a method of enhancing OPH activity comprising feeding a human or non-human organism an extract of one or more plants selected from the group consisting of fenugreek, fenugreek and hibiscus. Regarding. The OPH activity enhancing method of the present disclosure, in one or more embodiments, replaces the above extract with the OPH activity enhancing agent, beverage composition, food composition, functional food, cosmetics, supplement, quasi-drug of the present disclosure. Foreign products or medicines may be used.
[OPH活性増強させるための、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法]
本開示は、その他の態様において、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法(本開示の飲料組成物等の製造方法)に関する。本開示の飲料組成物等の製造方法は、OPH活性増強効果を付与するために、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に、フェヌグリークの抽出物を添加することを含む。本開示の飲料組成物等の製造方法は、OPH活性増強効果を付与するために、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を添加することを含む。
[Manufacturing method of beverage composition, food composition, functional food, cosmetics, supplement, quasi-drug or pharmaceutical product for enhancing OPH activity]
The present disclosure relates to, in other aspects, a method for producing a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical product (a method for producing the beverage composition, etc. of the present disclosure). The method for producing a beverage composition or the like of the present disclosure is an extract of fenugreek in a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical product in order to impart an OPH activity enhancing effect. Includes the addition of. The method for producing a beverage composition or the like of the present disclosure includes fenugreek, phenel and pharmaceutical products in a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug or a pharmaceutical product in order to impart an OPH activity enhancing effect. It involves adding one or more plant extracts selected from the group consisting of hibiscus.
抽出物は、一又は複数の実施形態において、前記植物の水抽出物及び有機溶媒抽出物等が挙げられる。水抽出物としては、一又は複数の実施形態において、熱水抽出物等が挙げられる。抽出物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。 Examples of the extract include a water extract and an organic solvent extract of the plant in one or more embodiments. Examples of the water extract include hot water extracts and the like in one or more embodiments. The form of the extract may be an aqueous solution, a concentrated solution, a dried product or the like in one or more embodiments.
[OPH活性増強させるための、抽出物組成物]
本開示は、その他の態様において、酸化タンパク質分解酵素活性を増強させるための、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出組成物に関する。本開示において「抽出組成物」とは、植物を抽出処理して得られる液状物又は固形物をいう。抽出組成物としては、一又は複数の実施形態において、植物を溶媒抽出して得られる上清及び濾液等が挙げられる。抽出溶媒としては、一又は複数の実施形態において、水、メタノール及びエタノール等のアルコール、エーテル等が挙げられる。抽出組成物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。本開示の抽出物組成物は、一又は複数の実施形態において、食品原料として使用することができる。本開示において「食品原料」とは、加工食品及び健康食品等の食品やサプリメント等の製造に用いられる素材又は原料をいう。食品原料の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。
[Extract composition for enhancing OPH activity]
The present disclosure relates to, in other embodiments, an extraction composition of one or more plants selected from the group consisting of fenugreek, phenel and hibiscus for enhancing oxidative proteolytic enzyme activity. In the present disclosure, the "extracted composition" refers to a liquid or solid obtained by extracting a plant. Examples of the extraction composition include, in one or more embodiments, a supernatant and a filtrate obtained by solvent-extracting a plant. Examples of the extraction solvent include water, alcohols such as methanol and ethanol, ether and the like in one or more embodiments. In one or more embodiments, the form of the extract composition includes an aqueous solution, a concentrated solution, a dried product, and the like. The extract compositions of the present disclosure can be used as food ingredients in one or more embodiments. In the present disclosure, the "food raw material" means a material or raw material used for manufacturing foods such as processed foods and health foods and supplements. Examples of the form of the food raw material include an aqueous solution, a concentrated solution, a dried product, and the like in one or a plurality of embodiments.
本開示は、以下の一又は複数の実施形態に関しうる。
[A1] フェヌグリークの抽出物を有効成分として含む、酸化タンパク質分解酵素活性増強剤。
[A2] さらに、フェネル及びハイビスカスの少なくとも一方の抽出物を含む、[A1]記載の酸化タンパク質分解酵素活性増強剤。
[A3] フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を有効成分として含む、酸化タンパク質分解酵素活性増強剤。
[A4] フェヌグリーク、フェネル及びハイビスカスの抽出物を有効成分として含む、[A1]から[A3]のいずれかに記載の酸化タンパク質分解酵素活性増強剤。
[A5] 前記抽出物は、水抽出物及び有機溶媒抽出物の少なくとも一方である、[A1]から[A4]のいずれかに記載の酸化タンパク質分解酵素活性増強剤。
[A6] 前記抽出物の乾燥物を有効成分として含む、[A1]から[A5]のいずれかに記載の酸化タンパク質分解酵素活性増強剤。
[A7] [A1]から[A6]のいずれかに記載の酸化タンパク質分解酵素活性増強剤を有効成分とする、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品。
[A8] フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を有効成分として含む、酸化タンパク質分解酵素活性を増強させるための飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品。
[A9] フェヌグリークを溶媒抽出することを含む、酸化タンパク質分解酵素活性増強剤の製造方法。
[A10] 酸化タンパク質分解酵素活性増強効果を付与するために、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に、フェヌグリーク、フェネル及びハイビスカスからなる群から選択される1種類又は2種類以上の植物の抽出物を添加することを含む、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法。
The present disclosure may relate to one or more of the following embodiments:
[A1] An oxidative proteolytic enzyme activity enhancer containing an extract of fenugreek as an active ingredient.
[A2] The oxidative proteolytic enzyme activity enhancer according to [A1], which further comprises an extract of at least one of phenel and hibiscus.
[A3] An oxidizing proteolytic enzyme activity enhancer containing an extract of one or more kinds of plants selected from the group consisting of fenugreek, fenugreek and hibiscus as an active ingredient.
[A4] The oxidative proteolytic enzyme activity enhancer according to any one of [A1] to [A3], which comprises an extract of fenugreek, fenugreek and hibiscus as an active ingredient.
[A5] The oxidative proteolytic enzyme activity enhancer according to any one of [A1] to [A4], wherein the extract is at least one of a water extract and an organic solvent extract.
[A6] The oxidative proteolytic enzyme activity enhancer according to any one of [A1] to [A5], which comprises a dried product of the extract as an active ingredient.
[A7] Beverage compositions, food compositions, functional foods, cosmetics, supplements, quasi-drugs or products containing the oxidative proteolytic enzyme activity enhancer according to any one of [A1] to [A6] as an active ingredient. Pharmaceuticals.
[A8] A beverage composition, a food composition, for enhancing the activity of oxidative proteolytic enzyme, which comprises an extract of one or more kinds of plants selected from the group consisting of fenugreek, fenugreek and hibiscus as an active ingredient. Functional foods, cosmetics, supplements, quasi-drugs or pharmaceuticals.
[A9] A method for producing an oxidative proteolytic enzyme activity enhancer, which comprises extracting fenugreek with a solvent.
[A10] In order to impart the effect of enhancing the activity of oxidative proteolytic enzyme, a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug or a pharmaceutical product is selected from the group consisting of phenuglique, phenel and hibiscus. A method for producing a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical, which comprises adding one or more kinds of plant extracts.
[糖化ストレス抑制剤]
本開示は、フェヌグリーク(学名Trigonella foenum-graecum)及びフェネル(学名Foeniculum vulgare)の水抽出物、とりわけ熱水抽出物の混合物が、酸化タンパク質及び糖化タンパク質等の生体内における酸化ストレスや糖化ストレスに起因する物質を優先的に分解することが知られている酸化タンパク質分解酵素(Oxidized Protein hydrolase:OPH)を活性化する作用と、AGEs分解剤として公知のPTBよりも高いAGEs分解能とを有するという新たな知見に基づく。
本開示は、フェヌグリークの水抽出物、とりわけ熱水抽出物は、アミラーゼ及びα-グルコシダーゼ阻害活性を有するという新たな知見に基づく。
また、本開示は、フェヌグリークの抽出物とフェネルの抽出物とを組み合わせて使用することによって、一又は複数の実施形態において、異常蛋白質を低減できるという新たな知見に基づく。
本開示は、フェヌグリークの抽出物とフェネルの抽出物とを組み合わせて使用することによって、一又は複数の実施形態において、糖化ストレスを多面的に抑制できうるという新たな知見に基づく。
[Glycation stress inhibitor]
In the present disclosure, a mixture of water extracts of Fenuglique (scientific name: Trigonella foenum-glaecum) and Fennell (scientific name: Foenicularum vulgare), particularly hot water extracts, is caused by oxidative stress and glycation stress in vivo such as oxidative protein and glycated protein. It has a new action of activating an oxidative protein-degrading enzyme (OPH), which is known to preferentially decompose an AGEs-degrading agent, and has a higher AGEs resolution than PTB known as an AGEs-degrading agent. Based on knowledge.
The present disclosure is based on the new finding that fenugreek water extracts, especially hot water extracts, have amylase and α-glucosidase inhibitory activity.
The present disclosure is also based on the new finding that the use of fenugreek extract and fenugreek extract in combination can reduce aberrant proteins in one or more embodiments.
The present disclosure is based on the new finding that glycation stress can be multifacetedly suppressed in one or more embodiments by using a fenugreek extract and a fenugreek extract in combination.
糖化ストレスは、還元糖やアルデヒド負荷による生体へのストレスと、その後の反応を総合的にとらえた概念であるとされている。本開示において「糖化ストレスを抑制する」とは、異常蛋白質の生成を抑制すること、異常蛋白質を分解及び/又は除去すること、及び高血糖を抑制することを含む。また、糖化ストレスを抑制することとしては、一又は複数の実施形態において、異常蛋白質生成の原因となる酸化物質の生成を抑制すること若しくは酸化物質を分解又は消去することを含んでいてもよい。 Glycation stress is considered to be a concept that comprehensively captures the stress on the living body due to the loading of reducing sugars and aldehydes and the subsequent reaction. In the present disclosure, "suppressing glycation stress" includes suppressing the production of abnormal protein, degrading and / or removing the abnormal protein, and suppressing hyperglycemia. In addition, suppressing glycation stress may include, in one or more embodiments, suppressing the production of an oxidizing substance that causes abnormal protein production, or decomposing or eliminating the oxidizing substance.
「異常蛋白質」とは、酸化、糖化又はアルデヒド修飾等を受けた蛋白質をいう。異常蛋白質は、一又は複数の実施形態において、メイラード反応による生成物(メイラード反応生成物)が挙げられる。メイラード反応生成物としては、一又は複数の実施形態において、メイラード反応によって生成される中間体、及びメイラード反応によって生成される最終産物を含む。メイラード反応生成物としては、一又は複数の実施形態において、AGEsを含むポリペプチド及びタンパク質、AGEsによる架橋構造を有するポリペプチド及びタンパク質、並びにメイラード反応によって生成される糖化タンパク質等が挙げられる。異常蛋白質としては、一又は複数の実施形態において、シッフ塩基を有する/シッフ塩基が形成されたポリペプチド及びタンパク質、アマドリ化合物(ケトアミン、糖化タンパク質)、αジカルボニル化合物を有するポリペプチド及びタンパク質、及びAGEsを有するポリペプチド及びタンパク質等が挙げられる。 "Abnormal protein" means a protein that has undergone oxidation, saccharification, aldehyde modification, or the like. The abnormal protein may be a product of a Maillard reaction (Maillard reaction product) in one or more embodiments. Maillard reaction products include, in one or more embodiments, intermediates produced by the Maillard reaction and end products produced by the Maillard reaction. Examples of the Maillard reaction product include polypeptides and proteins containing AGEs, polypeptides and proteins having a crosslinked structure by AGEs, and glycated proteins produced by the Maillard reaction in one or more embodiments. Abnormal proteins include, in one or more embodiments, polypeptides and proteins with Schiff bases / Schiff bases formed, Amadori compounds (ketoamines, glycated proteins), polypeptides and proteins with α-dicarbonyl compounds, and Examples thereof include polypeptides and proteins having AGEs.
異常蛋白質の生成を抑制することとしては、一又は複数の実施形態において、異常蛋白質の生成に直接又は間接的に関与する物質の生成を抑制することを含む。該物質の生成を抑制することとしては、一又は複数の実施形態において、アミラーゼ阻害及びα-グルコシダーゼ阻害等が挙げられる。異常蛋白質の生成に直接又は間接的に関与する物質としては、一又は複数の実施形態において、還元糖、グリオキサール、メチルグリオキサール及びグリセルアルデヒド等のαジカルボニル化合物、シッフ塩基を有する化合物、アマドリ化合物、アルデヒド並びにAGEs等が挙げられる。AGEsとしては、一又は複数の実施形態において、メイラード反応によって糖化されたアミノ酸及びジペプチド等が挙げられ、限定されない例としては、ペントシジン、クロスリン、ピロピリジン、ピラリン、カルボキシメチルリジン(CML)、カルボキシエチルリジン、カルボキシメチルアルギニン(CMA)、アルグピリミジン、イミダゾロン化合物、glyoxal-lysine dimer(GOLD)及びmethyl glyoxal-lysine dimer(MOLD)等が挙げられる。 Suppressing the production of an abnormal protein includes, in one or more embodiments, suppressing the production of a substance that is directly or indirectly involved in the production of the abnormal protein. Suppressing the production of the substance includes, in one or more embodiments, amylase inhibition, α-glucosidase inhibition and the like. Substances directly or indirectly involved in the production of abnormal proteins include, in one or more embodiments, α-dicarbonyl compounds such as reducing sugars, glyoxal, methylglyoxal and glyceraldehyde, compounds having a shift base, and amadori compounds. , Aldehydes, AGEs and the like. Examples of AGEs include amino acids and dipeptides saccharified by the Maillard reaction in one or more embodiments, and examples include, but are not limited to, pentosidine, crosline, pyropyridine, pyrarinine, carboxymethyllysine (CML), and carboxyethyllysine. , Carboxymethylarginine (CMA), argpyrimidine, imidazolone compounds, glyoxal-lysine dimer (GOLD), methyl glyoxal-lysine dimer (MOLD) and the like.
異常蛋白質を分解及び/又は除去することとしては、一又は複数の実施形態において、メイラード反応生成物を分解することが挙げられる。メイラード反応生成物を分解することとしては、一又は複数の実施形態において、メイラード反応に伴い形成されたAGEsによるポリペプチド及び/又はタンパク質間の架橋構造を切断することを含む。メイラード反応生成物を分解することとしては、一又は複数の実施形態において、その他に、AGEsを含むポリペプチド及びタンパク質、AGEsによる架橋構造を有するポリペプチド及びタンパク質、又はメイラード反応によって生成される糖化タンパク質を分解することを含んでいてもよい。また、特に限定されない一又は複数の実施形態において、AGEsを含むポリペプチド及びタンパク質、AGEsによる架橋構造を有するポリペプチド及びタンパク質、又はメイラード反応によって生成される糖化タンパク質に含まれるジケトン構造のC-C結合を切断することを含んでいてもよい。 Degradation and / or removal of anomalous proteins includes, in one or more embodiments, degradation of the Maillard reaction product. Degrading the Maillard reaction product comprises, in one or more embodiments, cleaving the crosslinked structure between the polypeptide and / or protein by AGEs formed with the Maillard reaction. Degrading the Maillard reaction product includes, in one or more embodiments, other polypeptides and proteins containing AGEs, polypeptides and proteins having a crosslinked structure with AGEs, or glycated proteins produced by the Maillard reaction. May include disassembling. Further, in one or a plurality of embodiments without particular limitation, CC of a diketone structure contained in a polypeptide and protein containing AGEs, a polypeptide and protein having a crosslinked structure by AGEs, or a glycated protein produced by the Maillard reaction. It may include breaking the bond.
血糖値の急激な上昇を抑制することとしては、一又は複数の実施形態において、アミラーゼを阻害すること、α-グルコシダーゼを阻害すること、及びこれらの阻害等によって還元糖の生成を抑制することが挙げられる。還元糖としては、一又は複数の実施形態において、グルコース及びフルクトース等の単糖、ラクトース及びマルトース等のマルトース型二糖・オリゴ糖等が挙げられる。 Suppressing the rapid rise in blood glucose level includes, in one or more embodiments, inhibiting amylase, inhibiting α-glucosidase, inhibiting the production of reducing sugars, and the like. Can be mentioned. Examples of the reducing sugar include monosaccharides such as glucose and fructose, maltose-type disaccharides and oligosaccharides such as lactose and maltose in one or more embodiments.
高血糖を抑制することとしては、一又は複数の実施形態において、血糖値の急激な上昇を抑制することを含んでよい。 Suppressing hyperglycemia may include, in one or more embodiments, suppressing a rapid rise in blood glucose levels.
酸化ストレスを抑制することとしては、抗酸化力の高い成分を有するものを用いること等が挙げられる。 Examples of suppressing oxidative stress include the use of a substance having a component having high antioxidant power.
本開示は、一態様において、フェヌグリーク及びフェネルの抽出物を有効成分として含む糖化ストレス抑制剤(本開示の糖化ストレス抑制剤)に関する。 The present disclosure relates to a glycation stress inhibitor (the glycation stress inhibitor of the present disclosure) containing fenugreek and fenugreek extracts as active ingredients in one embodiment.
本開示の糖化ストレス抑制剤は、少なくともメイラード反応生成物分解活性(AGEs分解活性ともいう)とOPH活性増強能とを有するものをいう。本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、さらなる機能として、アミラーゼ阻害作用、α-グルコシダーゼ阻害作用、及び抗酸化活性等の機能を一又は複数有していてもよい。また、本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、異常蛋白質生成の原因となる物質の生成抑制、分解若しくは除去、及び異常蛋白質の分解、除去若しくは生成抑制の少なくとも一つを行うことができる。 The glycation stress inhibitor of the present disclosure refers to an agent having at least Maillard reaction product decomposing activity (also referred to as AGEs degrading activity) and OPH activity enhancing ability. The saccharification stress inhibitor of the present disclosure may have one or more functions such as amylase inhibitory action, α-glucosidase inhibitory action, and antioxidant activity as additional functions in one or more embodiments. In addition, the saccharification stress inhibitor of the present disclosure suppresses, decomposes or removes, and decomposes, removes or suppresses the production of a substance that causes abnormal protein production in one or more embodiments. It can be carried out.
本開示の糖化ストレス抑制剤は、フェヌグリーク及びフェネルの抽出物を有効成分として含む。このため、本開示の糖化ストレス抑制剤によれば、一又は複数の実施形態において、OPHの酵素活性を増強させることや架橋切断をすること等によって、酸化タンパク質及び糖化タンパク質の分解効率を向上できうる。本開示の糖化ストレス抑制剤によれば、一又は複数の実施形態において、生体内で生成されたAGEsに起因するポリペプチド及び/又はタンパク質間の架橋構造の分解を促進させることによって、AGEsの蓄積を抑制できる。本開示の糖化ストレス抑制剤によれば、一又は複数の実施形態において、アミラーゼ又はα-グルコシダーゼ阻害作用を有することから、血糖値の急激な上昇を抑制し、還元糖と蛋白質との非酵素的な反応、過剰なブドウ糖の存在に伴うTCA回路の反応不良等を抑制でき、その結果、異常蛋白質の生成を抑制することができる。また本開示の糖化ストレス抑制剤は抗酸化作用を有することから、糖化ストレス及び酸化ストレスに関係する様々な異常蛋白質の生成及び蓄積を多面的に抑制することができる。よって、本開示の糖化ストレス抑制剤によれば、一又は複数の実施形態において、糖化ストレス及び/又は酸化ストレスを多面的に抑制又は低減することができる。また、本開示の糖化ストレス抑制剤によれば、一又は複数の実施形態において、アンチエイジング、老化防止効果又は生活習慣病の予防効果が期待できる。したがって、本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、抗酸化ストレス剤、アンチエイジング剤、老化防止剤又は生活習慣病予防剤ということもできる。 The saccharification stress inhibitor of the present disclosure contains fenugreek and an extract of fenugreek as active ingredients. Therefore, according to the saccharification stress inhibitor of the present disclosure, in one or more embodiments, the decomposition efficiency of the oxidized protein and the saccharified protein can be improved by enhancing the enzymatic activity of OPH, performing cross-linking cleavage, and the like. sell. According to the glycation stress inhibitor of the present disclosure, in one or more embodiments, the accumulation of AGEs is promoted by promoting the decomposition of the cross-linked structure between the polypeptide and / or the protein caused by the AGEs produced in vivo. Can be suppressed. According to the glycation stress inhibitor of the present disclosure, since it has an amylase or α-glucosidase inhibitory action in one or more embodiments, it suppresses a rapid increase in blood glucose level and is non-enzymatic of reducing sugar and protein. It is possible to suppress the reaction failure of the TCA circuit due to the presence of excessive glucose and the like, and as a result, the production of abnormal protein can be suppressed. Further, since the glycation stress inhibitor of the present disclosure has an antioxidant effect, it is possible to suppress the production and accumulation of various abnormal proteins related to glycation stress and oxidative stress from various aspects. Therefore, according to the saccharification stress inhibitor of the present disclosure, saccharification stress and / or oxidative stress can be suppressed or reduced in a multifaceted manner in one or more embodiments. Further, according to the glycation stress inhibitor of the present disclosure, anti-aging, anti-aging effect or preventive effect of lifestyle-related diseases can be expected in one or more embodiments. Therefore, the glycation stress inhibitor of the present disclosure can also be referred to as an antioxidant stress agent, an anti-aging agent, an antiaging agent or a lifestyle-related disease preventive agent in one or more embodiments.
本開示の糖化ストレス抑制剤は、フェヌグリーク及びフェネルといった植物由来の抽出物を有効成分として使用しているため、安全性に優れ、また生産性に優れるという効果を奏しうる。 Since the saccharification stress inhibitor of the present disclosure uses plant-derived extracts such as fenugreek and fennel as active ingredients, it can have the effects of being excellent in safety and productivity.
本開示の糖化ストレス抑制剤において、フェヌグリークの抽出物とフェネルの抽出物とは、同じ比率(フェヌグリークの抽出物1重量部に対してフェネルの抽出物1重量部)で配合されていてもよいし、異なる比率で配合されていてもよい。 In the glycation stress inhibitor of the present disclosure, the fenugreek extract and the fenugreek extract may be blended in the same ratio (1 part by weight of the fenugreek extract to 1 part by weight of the fenugreek extract). , May be blended in different proportions.
本開示の糖化ストレス抑制剤におけるフェヌグリークの抽出物とフェネルの抽出物との配合比(乾燥重量比)は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.1~10重量部であり、糖化ストレス抑制効果をさらに向上させる点からは、フェネルの抽出物が0.2~5重量部である。 The blending ratio (dry weight ratio) of the fenugreek extract and the fenugreek extract in the saccharification stress inhibitor of the present disclosure is, in one or more embodiments, the fenugreek extract per part by weight of the fenugreek extract. The amount is 0.1 to 10 parts by weight, and the extract of fenugreek is 0.2 to 5 parts by weight from the viewpoint of further improving the saccharification stress suppressing effect.
本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、抗酸化力及びアミラーゼ阻害作用をさらに向上させる点から、さらなる有効成分としてハイビスカス(学名Hibiscus sabdariffa)の抽出物を含んでいてもよい。本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、フェヌグリーク、フェネル及びハイビスカスの抽出物を有効成分として含む。 The saccharification stress inhibitor of the present disclosure may contain an extract of hibiscus (scientific name: Hibiscus sabdariffa) as a further active ingredient from the viewpoint of further improving the antioxidant power and the amylase inhibitory action in one or more embodiments. .. The saccharification stress inhibitor of the present disclosure comprises, in one or more embodiments, an extract of fenugreek, phenel and hibiscus as an active ingredient.
本開示の糖化ストレス抑制剤が、さらにハイビスカスの抽出物を含む場合、ハイビスカスの抽出物は、フェヌグリークの抽出物及び/又はフェネルの抽出物と同じ比率(フェヌグリークの抽出物又はフェネルの抽出物1重量部に対して1重量部)で配合されていてもよいし、異なる比率で配合されていてもよい。 When the saccharification stress inhibitor of the present disclosure further comprises an extract of hibiscus, the extract of hibiscus is in the same proportion as the extract of fenugreek and / or the extract of fenugreek (1 weight of extract of fenugreek or extract of fenugreek). It may be blended in 1 part by weight with respect to the portion), or may be blended in different ratios.
本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、フェヌグリークの抽出物、フェネルの抽出物及びハイビスカスの抽出物を含む。本態様において、フェヌグリークの抽出物とフェネルの抽出物とハイビスカスの抽出物との配合比(乾燥重量比)は、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.05~20重量部、ハイビスカスの抽出物が0.05~20重量部であり、抗酸化力及びアミラーゼ阻害作用をさらに向上させる点からは、フェネルの抽出物が0.1~10重量部、ハイビスカスの抽出物が0.1~10重量部である。 The saccharification stress suppressants of the present disclosure include, in one or more embodiments, an extract of fenugreek, an extract of fenugreek and an extract of hibiscus. In this embodiment, the blending ratio (dry weight ratio) of the phenuglique extract, the phenell extract and the hibiscus extract is 0.05 to 20 parts by weight of the phenus extract per 1 part by weight of the phenuglique extract. , The hibiscus extract is 0.05 to 20 parts by weight, and the phenel extract is 0.1 to 10 parts by weight, and the hibiscus extract is 0 from the viewpoint of further improving the antioxidant power and the amylase inhibitory action. .1 to 10 parts by weight.
本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、AGEs分解能をさらに向上させる点から、更なる有効成分として、レモンバーム(学名Melissa officinalis)及びローズマリー(学名Rosmarinus officinalis)の少なくとも一方を含んでいてもよい。 The glycation stress inhibitor of the present disclosure contains at least one of lemon balm (scientific name: Melissa officeis) and rosemary (scientific name: Rosmarinus officeis) as further active ingredients from the viewpoint of further improving the resolution of AGEs in one or more embodiments. It may be included.
抽出物は、どの部位から抽出したものであってもよい。使用部位としては、一又は複数の実施形態において、全草、花、葉、種子、果実、枝、茎、根、萼(がく)、及び苞(ほう)等が挙げられる。使用部位は1種類であってもよく、2種類以上の部位を組み合わせて使用してもよい。フェネルは、一又は複数の実施形態において、種子が好ましい。フェヌグリークは、一又は複数の実施形態において、種子が好ましい。ハイビスカスは、一又は複数の実施形態において、蕚及び苞が好ましい。ローズマリーは、一又は複数の実施形態において、葉が好ましい。レモンバームは、一又は複数の実施形態において、葉が好ましい。 The extract may be extracted from any part. Examples of the site of use include whole plants, flowers, leaves, seeds, fruits, branches, stems, roots, calyxes, bracts and the like in one or more embodiments. The site to be used may be one type, or two or more types of sites may be used in combination. Phenels are preferably seeds in one or more embodiments. Fenugreek is preferably seeds in one or more embodiments. The hibiscus is preferably a shoeblackplant and a bract in one or more embodiments. Rosemary is preferably leaves in one or more embodiments. Lemon balm is preferably leaves in one or more embodiments.
抽出方法は、特に制限されず、一又は複数の実施形態において、溶媒抽出等が挙げられる。抽出溶媒としては、一又は複数の実施形態において、水、メタノール及びエタノール等のアルコール、エーテル等が挙げられる。抽出物は、一又は複数の実施形態において、水抽出物及び有機溶媒抽出物等が挙げられる。水抽出物としては、一又は複数の実施形態において、熱水抽出物等が挙げられる。溶媒抽出の温度は、一又は複数の実施形態において、60~100℃、70~90℃又は80℃等が挙げられる。溶媒抽出の時間は、一又は複数の実施形態において、30分~5時間、1~5時間、2~5時間、3~5時間又は1時間等が挙げられる。熱水抽出の温度は、一又は複数の実施形態において、60~100℃、70~90℃又は80℃等が挙げられる。熱水抽出の時間は、一又は複数の実施形態において、30分~5時間、1~5時間、2~5時間、3~5時間又は1時間等が挙げられる。抽出物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。乾燥は、一又は複数の実施形態において、溶媒抽出によって得られた抽出物を加熱処理することにより行うことができる。加熱温度は、一又は複数の実施形態において、70~150℃又は110℃である。加熱時間は、一又は複数の実施形態において、1~10時間又は4時間である。
本開示の糖化ストレス抑制剤の製造に適した方法としては、一又は複数の実施形態において、以下のとおりである。適量のフェヌグリーク粉末(例えば、2g)及びフェネル粉末(例えば、2g)を、適量の蒸留水(例えば、40mL)で80℃で1時間抽出し、ついで室温にまで冷却した後、得られたスラリーを濾過して、得られた濾過物は植物抽出物として使用される。乾燥植物抽出物を使用する場合、得られた植物抽出物は、アルミニウムトレイに配置し、例えば、110℃にセットしたインキュベータで4時間乾燥させる。
The extraction method is not particularly limited, and examples thereof include solvent extraction and the like in one or more embodiments. Examples of the extraction solvent include water, alcohols such as methanol and ethanol, ether and the like in one or more embodiments. Examples of the extract include a water extract, an organic solvent extract, and the like in one or more embodiments. Examples of the water extract include hot water extracts and the like in one or more embodiments. The temperature of the solvent extraction may be 60 to 100 ° C., 70 to 90 ° C., 80 ° C. or the like in one or more embodiments. In one or more embodiments, the solvent extraction time may be 30 minutes to 5 hours, 1 to 5 hours, 2 to 5 hours, 3 to 5 hours, 1 hour, or the like. The temperature of hot water extraction may be 60 to 100 ° C., 70 to 90 ° C., 80 ° C. or the like in one or more embodiments. In one or more embodiments, the hot water extraction time may be 30 minutes to 5 hours, 1 to 5 hours, 2 to 5 hours, 3 to 5 hours, 1 hour, or the like. The form of the extract may be an aqueous solution, a concentrated solution, a dried product or the like in one or more embodiments. Drying can be performed in one or more embodiments by heat-treating the extract obtained by solvent extraction. The heating temperature is 70-150 ° C or 110 ° C in one or more embodiments. The heating time is 1-10 hours or 4 hours in one or more embodiments.
Suitable methods for producing the saccharification stress inhibitor of the present disclosure are as follows in one or more embodiments. An appropriate amount of phenuglique powder (eg, 2 g) and fennel powder (eg, 2 g) are extracted with an appropriate amount of distilled water (eg, 40 mL) at 80 ° C. for 1 hour, then cooled to room temperature, and then the obtained slurry is obtained. After filtration, the resulting filtrate is used as a plant extract. When using dried plant extracts, the resulting plant extracts are placed on aluminum trays and dried, for example, in an incubator set at 110 ° C. for 4 hours.
本開示の糖化ストレス抑制剤の形態は、特に制限されず、一又は複数の実施形態において、固形、顆粒、粉末、ペースト、及び液状等が挙げられる。 The form of the saccharification stress inhibitor of the present disclosure is not particularly limited, and examples thereof include solids, granules, powders, pastes, and liquids in one or more embodiments.
本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、有効成分の糖化ストレス抑制機能を阻害しない範囲で、その他の抽出物及びその他成分を含んでいてもよい。 The saccharification stress inhibitor of the present disclosure may contain other extracts and other components in one or more embodiments as long as the active ingredient does not inhibit the saccharification stress suppression function.
本開示の糖化ストレス抑制剤は、一又は複数の実施形態において、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、飼料、医薬部外品又は医薬品等の原料として使用できる。原料としての形態は、特に制限されず、一又は複数の実施形態において、固形、顆粒、粉末、ペースト、及び液状等が挙げられる。
本開示は、一又は複数の実施形態として、本開示の糖化ストレス抑制剤を含む、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、飼料、医薬部外品又は医薬品に関する。
The saccharification stress inhibitor of the present disclosure can be used as a raw material for beverage compositions, food compositions, functional foods, cosmetics, supplements, feeds, quasi-drugs, pharmaceuticals and the like in one or more embodiments. The form as a raw material is not particularly limited, and examples thereof include solids, granules, powders, pastes, and liquids in one or more embodiments.
The present disclosure relates, as one or more embodiments, to beverage compositions, food compositions, functional foods, cosmetics, supplements, feeds, quasi-drugs or pharmaceuticals comprising the saccharification stress suppressors of the present disclosure.
本開示の糖化ストレス抑制剤の一日当たりの摂取量は、特に限定されるものではなく、一又は複数の実施形態において、5mg以上であり、又は2000mg以下である。 The daily intake of the glycation stress inhibitor of the present disclosure is not particularly limited, and is 5 mg or more or 2000 mg or less in one or more embodiments.
[糖化ストレス抑制剤の製造方法]
本開示は、その他の態様において、フェヌグリーク及びフェネルを溶媒抽出することを含む、糖化ストレス抑制剤を製造する方法に関する。本開示の製造方法によれば、本開示の糖化ストレス抑制剤を製造できる。
[Manufacturing method of glycation stress inhibitor]
The present disclosure relates to, in other embodiments, a method for producing a glycation stress inhibitor, which comprises solvent extraction of fenugreek and fenugreek. According to the production method of the present disclosure, the saccharification stress inhibitor of the present disclosure can be produced.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物と、フェネルの抽出物とを混合して抽出物の混合物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、同じ比率(フェヌグリークの抽出物1重量部に対してフェネルの抽出物1重量部)であってもよいし、異なる比率であってもよい。 The production method of the present disclosure may include, in one or more embodiments, mixing an extract of fenugreek with an extract of fenugreek to obtain a mixture of the extracts. The mixing ratio may be the same ratio (1 part by weight of fenugreek extract to 1 part by weight of fenugreek extract) or different ratios in one or more embodiments.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.1~10重量部となるようにこれらの抽出物を混合することを含んでもよく、糖化ストレス抑制効果をさらに向上可能な糖化ストレス抑制剤を製造する点からは、フェネルの抽出物が0.2~5重量部となるようにこれらの抽出物を混合することを含んでもよい。 The production method of the present disclosure comprises mixing these extracts in one or more embodiments so that the extract of fenugreek is 0.1-10 parts by weight per part by weight of the extract of fenugreek. However, from the viewpoint of producing a saccharification stress inhibitor capable of further improving the saccharification stress suppressing effect, it may be included to mix these extracts so that the extract of fenugreek is 0.2 to 5 parts by weight. good.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークと、フェネルとを混合し、得られた混合物を溶媒抽出して混合抽出物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、同じ比率(フェヌグリーク1重量部に対してフェネル1重量部)であってもよいし、異なる比率であってもよい。また、得られた混合抽出物における各植物の抽出物の比率が同じ比率(フェヌグリークの抽出物1重量部に対してフェネルの抽出物1重量部)となるように混合してもよいし、異なる比率となるように混合してもよい。 The production method of the present disclosure may include, in one or more embodiments, mixing fenugreek and fenugreek and solvent-extracting the resulting mixture to obtain a mixed extract. The mixing ratio may be the same ratio (1 part by weight of fenugreek to 1 part by weight of fenugreek) or different ratios in one or more embodiments. Further, the mixture may be mixed so that the ratio of the extract of each plant in the obtained mixed extract is the same ratio (1 part by weight of the extract of fenugreek to 1 part by weight of the extract of fenugreek), or different. It may be mixed so as to be a ratio.
本開示の糖化ストレス抑制剤の製造方法は、一又は複数の実施形態において、さらに、ハイビスカス、レモンバーム、及びローズマリーからなる群から選択される少なくとも一つの植物を溶媒抽出することを含んでいてもよい。 The method for producing a glycation stress inhibitor of the present disclosure further comprises, in one or more embodiments, solvent extraction of at least one plant selected from the group consisting of hibiscus, lemon balm, and rosemary. good.
本開示の製造方法は、一又は複数の実施形態において、乾燥状態の植物を溶媒抽出することを含んでいてもよい。 The production method of the present disclosure may include, in one or more embodiments, solvent extraction of a dry plant.
本開示の製造方法は、一又は複数の実施形態において、溶媒抽出して得られた抽出物を、濾過又は遠心分離することを含んでいてもよい。 The production method of the present disclosure may include, in one or more embodiments, filtering or centrifuging the extract obtained by solvent extraction.
本開示の製造方法は、一又は複数の実施形態において、得られた抽出物を乾燥させることを含んでいてもよい。 The production method of the present disclosure may comprise, in one or more embodiments, drying the resulting extract.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物と、フェネルの抽出物と、これら以外の植物の抽出物とを混合して抽出物の混合物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、フェヌグリークの抽出物及び/又はフェネルの抽出物と同じ比率(フェヌグリークの抽出物又はフェネルの抽出物1重量部に対して1重量部)であってもよいし、異なる比率であってもよい。 The production method of the present disclosure comprises, in one or more embodiments, mixing an extract of fenugreek, an extract of fenugreek, and an extract of a plant other than these to obtain a mixture of extracts. May be good. The mixing ratio is, in one or more embodiments, the same ratio as the fenugreek extract and / or the fenugreek extract (1 part by weight with respect to 1 part by weight of the fenugreek extract or fenugreek extract). It may be a different ratio.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークの抽出物1重量部当たり、フェネルの抽出物が0.05~20重量部、ハイビスカスの抽出物が0.05~20重量部となるようにこれらの抽出物を混合することを含んでもよく、抗酸化力及びアミラーゼ阻害作用をさらに向上可能な糖化ストレス抑制剤を製造する点からは、フェネルの抽出物が0.1~10重量部、ハイビスカスの抽出物が0.1~10重量部となるようにこれらの抽出物を混合することを含んでいてもよい。 In one or more embodiments, the production method of the present disclosure comprises 0.05 to 20 parts by weight of the extract of amylase and 0.05 to 20 parts by weight of the extract of hibiscus per 1 part by weight of the extract of phenuglique. From the viewpoint of producing a saccharification stress inhibitor capable of further improving the antioxidant power and the amylase inhibitory effect, the Fennell extract may be 0.1 to 10 weight by weight. Parts may include mixing these extracts so that the hibiscus extract is 0.1 to 10 parts by weight.
本開示の製造方法は、一又は複数の実施形態において、フェヌグリークと、フェネルと、これら以外の植物とを混合し、得られた混合物を溶媒抽出して混合抽出物を得ることを含んでいてもよい。混合する比率は、一又は複数の実施形態において、フェヌグリーク及び/又はフェネル同じ比率(フェヌグリーク又はフェネル1重量部に対して1重量部)であってもよいし、異なる比率であってもよい。また、得られた混合抽出物における各植物の抽出物の比率が同じ比率(フェヌグリークの抽出物又はフェネルの抽出物1重量部に対して1重量部)となるように混合してもよいし、異なる比率となるように混合してもよい。 The production method of the present disclosure may include, in one or more embodiments, mixing fenugreek, fennel, and plants other than these, and solvent-extracting the resulting mixture to obtain a mixed extract. good. The mixing ratio may be the same ratio of fenugreek and / or fenugreek (1 part by weight to 1 part by weight of fenugreek or fenugreek) or different ratios in one or more embodiments. Further, the mixture may be mixed so that the ratio of the extract of each plant in the obtained mixed extract is the same (1 part by weight with respect to 1 part by weight of the extract of fenugreek or the extract of fenugreek). They may be mixed in different proportions.
[糖化ストレス抑制方法]
本開示は、一態様において、フェヌグリーク及びフェネルの抽出物を生体に投与することを含む糖化ストレスを抑制する方法に関する。本開示の糖化ストレス抑制方法は、一又は複数の実施形態において、さらに、ハイビスカス、レモンバーム、及びローズマリーからなる群から選択される少なくとも一つの植物の抽出物を生体に投与することを含んでいてもよい。本開示の糖化ストレス抑制方法は、一又は複数の実施形態において、上記抽出物に替えて、本開示の糖化ストレス抑制剤、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品を使用してもよい。
[Method of suppressing glycation stress]
The present disclosure relates to, in one embodiment, a method for suppressing glycation stress, which comprises administering an extract of fenugreek and fenugreek to a living body. The saccharification stress suppression method of the present disclosure comprises, in one or more embodiments, further administering to the living body an extract of at least one plant selected from the group consisting of hibiscus, lemon balm, and rosemary. May be good. The saccharification stress suppression method of the present disclosure, in one or more embodiments, replaces the above extract with the saccharification stress inhibitor, beverage composition, food composition, functional food, cosmetics, supplement, quasi-drug of the present disclosure. Foreign products or medicines may be used.
[糖化ストレス抑制機能を付与するための、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法]
本開示は、その他の態様において、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法(本開示の第2の飲料組成物等の製造方法)に関する。本開示の第2の飲料組成物等の製造方法は、糖化ストレス抑制効果を付与するために、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に、フェヌグリーク及びフェネルの抽出物を添加することを含む。
[Beverage composition, food composition, functional food, cosmetics, supplement, quasi-drug or pharmaceutical manufacturing method for imparting glycation stress suppressing function]
The present disclosure relates to, in other aspects, a method for producing a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical product (a method for producing a second beverage composition, etc. of the present disclosure). .. The second method for producing a beverage composition, etc. of the present disclosure is to add fenugreek to a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical product in order to impart a saccharification stress suppressing effect. And adding an extract of fenugreek.
本開示の第2の飲料組成物等の製造方法は、一又は複数の実施形態において、さらに、ハイビスカス、レモンバーム、及びローズマリーからなる群から選択される少なくとも一つの植物の抽出物を、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に添加することを含んでいてもよい。 The method for producing the second beverage composition and the like of the present disclosure further comprises, in one or more embodiments, an extract of at least one plant selected from the group consisting of hibiscus, lemon balm, and rosemary. It may include additions to products, food compositions, functional foods, cosmetics, supplements, quasi-drugs or pharmaceuticals.
抽出物は、一又は複数の実施形態において、前記植物の水抽出物及び有機溶媒抽出物等が挙げられる。水抽出物としては、一又は複数の実施形態において、熱水抽出物等が挙げられる。抽出物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。 Examples of the extract include a water extract and an organic solvent extract of the plant in one or more embodiments. Examples of the water extract include hot water extracts and the like in one or more embodiments. The form of the extract may be an aqueous solution, a concentrated solution, a dried product or the like in one or more embodiments.
[糖化ストレス抑制機能を付与するための抽出物組成物]
本開示は、その他の態様において、糖化ストレス抑制機能を付与するための、フェヌグリーク及びフェネルの抽出組成物に関する。抽出組成物としては、一又は複数の実施形態において、植物を溶媒抽出して得られる上清及び濾液等が挙げられる。抽出溶媒としては、一又は複数の実施形態において、水、メタノール及びエタノール等のアルコール、エーテル等が挙げられる。抽出組成物の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。本開示の抽出物組成物は、一又は複数の実施形態において、食品原料として使用することができる。食品原料の形態は、一又は複数の実施形態において、水溶液、濃縮液及び乾燥物等が挙げられる。
[Extract composition for imparting glycation stress suppressing function]
The present disclosure relates to other embodiments relating to fenugreek and fenugreek extract compositions for imparting a glycation stress-suppressing function. Examples of the extraction composition include, in one or more embodiments, a supernatant and a filtrate obtained by solvent-extracting a plant. Examples of the extraction solvent include water, alcohols such as methanol and ethanol, ether and the like in one or more embodiments. In one or more embodiments, the form of the extract composition includes an aqueous solution, a concentrated solution, a dried product, and the like. The extract compositions of the present disclosure can be used as food ingredients in one or more embodiments. Examples of the form of the food raw material include an aqueous solution, a concentrated solution, a dried product, and the like in one or a plurality of embodiments.
本開示の抽出物組成物は、一又は複数の実施形態において、ハイビスカス、レモンバーム、及びローズマリーからなる群から選択される少なくとも一つの植物の抽出物を含んでいてもよい。 The extract composition of the present disclosure may comprise, in one or more embodiments, an extract of at least one plant selected from the group consisting of hibiscus, lemon balm, and rosemary.
本開示は、以下の一又は複数の実施形態に関しうる。
[B1] フェヌグリーク及びフェネルの抽出物を有効成分として含む、糖化ストレス抑制剤。
[B2] さらに、有効成分としてハイビスカスの抽出物を含む、[B1]記載の糖化ストレス抑制剤。
[B3] 前記抽出物は、水抽出物及び有機溶媒抽出物の少なくとも一方である、[B1]又は[B2]に記載の糖化ストレス抑制剤。
[B4] 前記抽出物の乾燥物を有効成分として含む、[B1]から[B3]のいずれかに記載の糖化ストレス抑制剤。
[B5] [B1]から[B4]のいずれかに記載の糖化ストレス抑制剤を有効成分とする、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品。
[B6] フェヌグリーク及びフェネルの抽出物を有効成分として含む、糖化ストレスを抑制するための飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品。
[B7] フェヌグリーク及びフェネルを溶媒抽出することを含む、糖化ストレス抑制剤の製造方法。
[B8] 糖化ストレス抑制機能を付与するために、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品に、フェヌグリーク及びフェネルの抽出物を添加することを含む、飲料組成物、食品組成物、機能性食品、化粧品、サプリメント、医薬部外品又は医薬品の製造方法。
The present disclosure may relate to one or more of the following embodiments:
[B1] A glycation stress inhibitor containing fenugreek and fenugreek extracts as active ingredients.
[B2] The saccharification stress inhibitor according to [B1], which further comprises an extract of hibiscus as an active ingredient.
[B3] The saccharification stress inhibitor according to [B1] or [B2], wherein the extract is at least one of a water extract and an organic solvent extract.
[B4] The saccharification stress inhibitor according to any one of [B1] to [B3], which comprises a dried product of the extract as an active ingredient.
[B5] A beverage composition, a food composition, a functional food, a cosmetic, a supplement, a quasi-drug, or a pharmaceutical product containing the saccharification stress inhibitor according to any one of [B1] to [B4] as an active ingredient.
[B6] Beverage compositions, food compositions, functional foods, cosmetics, supplements, quasi-drugs or pharmaceuticals for suppressing saccharification stress containing fenugreek and fenugreek extracts as active ingredients.
[B7] A method for producing a glycation stress inhibitor, which comprises extracting fenugreek and fenugreek with a solvent.
[B8] The present invention comprises adding an extract of phenuglique and phenell to a beverage composition, a food composition, a functional food, a cosmetic, a supplement, a non-pharmaceutical product or a pharmaceutical product in order to impart a saccharification stress suppressing function. Beverage composition, food composition, functional food, cosmetics, supplements, non-pharmaceutical products or methods for manufacturing pharmaceutical products.
以下に、実施例を用いて本開示をさらに説明する。但し、本開示は以下の実施例に限定して解釈されない。 Hereinafter, the present disclosure will be further described with reference to examples. However, this disclosure is not construed as being limited to the following examples.
[植物抽出物の調製]
下記表1に示す植物の乾燥粉末2gを、80℃の蒸留水40mlで1時間抽出した後、常温まで冷却後、濾過を行い、得られた濾液を植物抽出物として用いた。
各サンプルの固形分濃度は、得られた濾液5mLをアルミトレイに入れ、110℃に設定したインキュベータ内で4時間乾燥させた後の残留量を測定して算出した。その結果を下記表1に示す。
[Preparation of plant extract]
2 g of the dry powder of the plant shown in Table 1 below was extracted with 40 ml of distilled water at 80 ° C. for 1 hour, cooled to room temperature, filtered, and the obtained filtrate was used as a plant extract.
The solid content concentration of each sample was calculated by placing 5 mL of the obtained filtrate in an aluminum tray and drying it in an incubator set at 110 ° C. for 4 hours, and then measuring the residual amount. The results are shown in Table 1 below.
[OPH活性化確認試験(その1)]
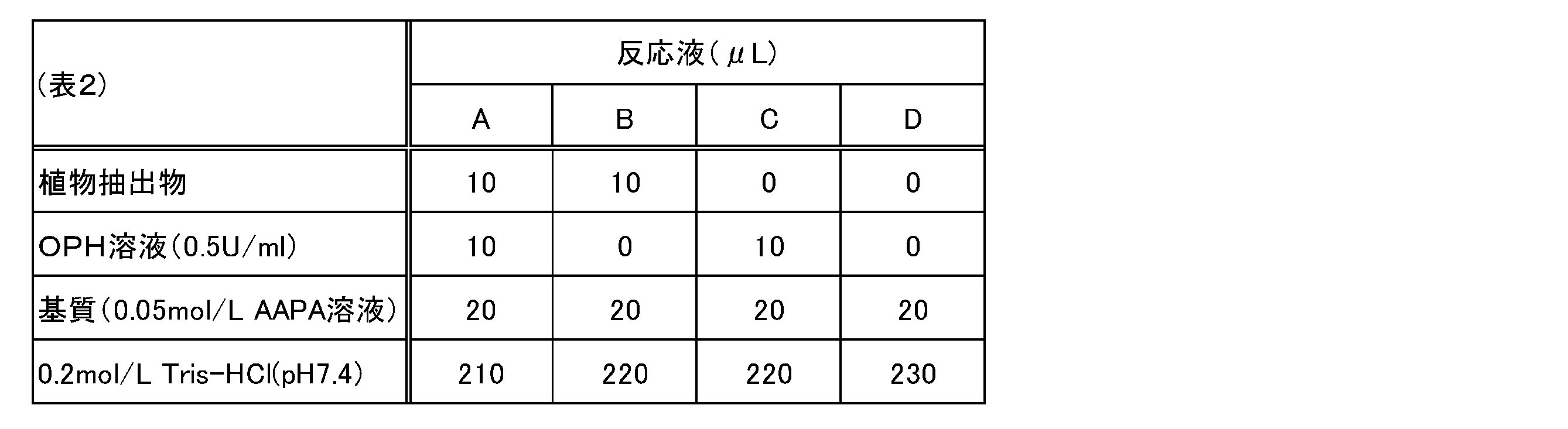
OPHとしては、Acylamino-acid releasing enzyme(AARE)(タカラバイオ社製)を使用し、付属のリン酸ナトリウム緩衝液に溶解して0.5U/mlに調整した後、0.2mol/L Tris-HCl(pH7.4)で500倍に希釈して使用した。OPHの反応基質としては0.05mol/L N-acetyl-L-alanine p-nitroanilide(AAPA) 50% ethanol溶液を使用した。
下記表2に示す配合量となるように、下記表1の植物の抽出物、OPH溶液、AAPA溶液及びTris-HClを、96ウェルマイクロプレート(Perkin Elmer)に添加した。マイクロプレートを37℃に温調したマイクロプレートリーダー(SpectraMax Paradigm Multi-Mode Microplate Reader)(Molecular Devise製)内で48時間(2880分間)反応させ、継時的に波長405nmにおける吸光度を測定した。
[OPH activation confirmation test (1)]
As OPH, Acylamino-acid releasing enzyme (AARE) (manufactured by Takara Bio Inc.) was used, dissolved in the attached sodium phosphate buffer to adjust to 0.5 U / ml, and then 0.2 mol / L Tris-. It was used after being diluted 500-fold with HCl (pH 7.4). As a reaction substrate for OPH, a 0.05 mol / L N-actyl-L-alanine p-nitroaniline (AAPA) 50% ethanol solution was used.
The plant extract, OPH solution, AAPA solution and Tris-HCl of Table 1 below were added to a 96-well microplate (PerkinElmer) so as to have the blending amounts shown in Table 2 below. The microplate was reacted in a microplate reader (SpectraMax Paradigm Multi-Mode Microplate Reader) (manufactured by Molecular Device) whose temperature was adjusted to 37 ° C. for 48 hours (2880 minutes), and the absorbance at a wavelength of 405 nm was measured over time.
OPH活性は24時間反応の結果で評価した。OPHによるAAPAの分解活性(植物抽出物無添加)を100%とする相対値として、各反応液A,B、C及びDの吸光度を用いて下記式より各植物抽出物のOPH活性化率(%)を算出した。その結果を、レモンバームの活性化率を100とする相対値として下記表1に示す。
OPHの活性化率(%)=(A-B)/(C-D)×100
OPH activity was assessed by the results of the 24-hour reaction. OPH activation rate of each plant extract from the following formula using the absorbance of each reaction solution A, B, C and D as a relative value with the decomposition activity of AAPA by OPH (without addition of plant extract) as 100% ( %) Was calculated. The results are shown in Table 1 below as relative values with the activation rate of lemon balm as 100.
OPH activation rate (%) = (AB) / (CD) × 100
表1に示すように、フェネル、ハイビスカス及びフェヌグリークは、レモンバームと比較して5倍以上のOPH活性増加作用を示した。 As shown in Table 1, fenugreek, hibiscus and fenugreek showed a 5-fold or more OPH activity-increasing effect as compared with lemon balm.
[植物抽出粉末の調製]
下記表3の各植物に15倍量の加水、100℃達温で30分間抽出し、固液分離・濃縮した後、100℃以上30分以内で殺菌したものを噴霧乾燥して植物抽出粉末とした。
[Preparation of plant extract powder]
Each plant in Table 3 below is extracted with 15 times the amount of water and at a temperature of 100 ° C for 30 minutes, solid-liquid separated and concentrated, and then sterilized within 100 ° C or more and within 30 minutes is spray-dried to obtain a plant-extracted powder. did.
[試料溶液の調製]
上記各植物抽出粉末を5mg/mlとなるように蒸留水で希釈し、試料溶液とした。
[Preparation of sample solution]
Each of the above plant extract powders was diluted with distilled water to a concentration of 5 mg / ml to prepare a sample solution.
[OPH活性化確認試験(その2)]
Acylamino-acid releasing enzyme(AARE)(タカラバイオ社製)を付属のリン酸ナトリウム緩衝液に溶解し、0.2mol/L Tris-HCl(pH7.4)で、0.01U/ml、0.005U/ml又は0.001U/mlのOPH溶液を調製した。OPHの反応基質としては0.05mol/L N-acetyl-L-alanine p-nitroanilide(AAPA) 50% ethanol溶液を使用した。
96ウエルマイクロプレートの各ウエルにOPH溶液、AAPA溶液、及び試料溶液(5mg/ml)を混合添加し、37℃に設定したインキュベータ内で24時間反応させた。反応液の405nmにおける吸光度をマイクロプレートリーダーで測定した。
[OPH activation confirmation test (2)]
Acylamino-acid releasing enzyme (AARE) (manufactured by Takara Bio Inc.) is dissolved in the attached sodium phosphate buffer solution, and 0.2 mol / L Tris-HCl (pH 7.4) is used at 0.01 U / ml, 0.005 U. / Ml or 0.001 U / ml OPH solution was prepared. As a reaction substrate for OPH, a 0.05 mol / L N-actyl-L-alanine p-nitroaniline (AAPA) 50% ethanol solution was used.
OPH solution, AAPA solution, and sample solution (5 mg / ml) were mixed and added to each well of the 96-well microplate, and the mixture was reacted in an incubator set at 37 ° C. for 24 hours. The absorbance of the reaction solution at 405 nm was measured with a microplate reader.
OPHの酵素活性は、1時間当たりの吸光度変化量(反応速度)として求めた(試料のOPH反応速度)。同時に、reference(Ref)として試料溶液を添加せずに同様の測定を行い、反応速度を求めた(RefのOPH反応速度)。試料のOPH反応速度とRefのOPH反応速度とを用いて下記式よりOPH活性化率(%)を算出した(n=3)。その結果を下記表3に示す。
OPH活性化率(%)=[(試料のOPH反応速度)/(RefのOPH反応速度)]×100
The enzyme activity of OPH was determined as the amount of change in absorbance (reaction rate) per hour (OPH reaction rate of the sample). At the same time, the same measurement was performed without adding the sample solution as a reference (Ref), and the reaction rate was determined (OPH reaction rate of Ref). The OPH activation rate (%) was calculated from the following formula using the OPH reaction rate of the sample and the OPH reaction rate of Ref (n = 3). The results are shown in Table 3 below.
OPH activation rate (%) = [(OPH reaction rate of sample) / (OPH reaction rate of Ref)] × 100
ネガティブコントロールとして、エピガロカテキンガレート(EGCg)(5mg/ml)を使用し、同様の測定を行った。その結果を下記表3に示す。 Epigallocatechin gallate (EGCg) (5 mg / ml) was used as a negative control and similar measurements were performed. The results are shown in Table 3 below.
表3に示すように、いずれも、170%を超えるOPH活性増加作用が確認できた。また、フェネル、ハイビスカス及びフェヌグリークを併用した場合であっても、単独と同程度又はそれ以上のOPH活性増加作用が確認できた。 As shown in Table 3, it was confirmed that the OPH activity increasing effect exceeded 170% in each case. In addition, even when fenugreek, hibiscus and fenugreek were used in combination, it was confirmed that the OPH activity increasing effect was equal to or higher than that of fenugreek alone.
[AGEs架橋切断作用確認試験(その1)]
Sara Vasan et al.Nature,382,pp275-278(1996)の記載に準じて行った。
基質としては、αジケトン構造を有するAGEs架橋モデルの反応基質である1-Phenyl-1,2-propanedione(PPD)、ポジティブコントロールとしては、N-phenacylthiazolium bromide(PTB)を使用した。
植物抽出液、10mmol/L PPD、及び0.2mol/Lリン酸緩衝液(pH7.4)を5:1:4の割合で混合し、37℃で8時間反応させた(n=3)。反応終了後、塩酸を加えて反応停止させて反応液を得た。
反応液を20℃で3,000×gで10分間遠心分離し、上清中の安息香酸量を逆相HPLCで分析した。反応液中の安息香酸量は、別途測定した植物抽出液中の安息香酸量を差し引いて求めた。1molのPPDは1molの安息香酸を生成することから、下記式より架橋切断率を算出した。その結果を下記表4に示す。
架橋切断率(%)={(A-B)/C}×100
A:反応液中の安息香酸量
B:植物抽出液中の安息香酸量
C:反応に供したPPD量(基質量)
[AGEs Crosslink Cutting Action Confirmation Test (Part 1)]
The procedure was performed according to the description of Sara Vasan et al. Nature, 382, pp275-278 (1996).
As a substrate, 1-Phenyl-1,2-propanedione (PPD), which is a reaction substrate of an AGEs cross-linking model having an α-diketone structure, was used, and as a positive control, N-phenacylthiazolium bromide (PTB) was used.
The plant extract, 10 mmol / L PPD, and 0.2 mol / L phosphate buffer (pH 7.4) were mixed at a ratio of 5: 1: 4 and reacted at 37 ° C. for 8 hours (n = 3). After completion of the reaction, hydrochloric acid was added to terminate the reaction to obtain a reaction solution.
The reaction mixture was centrifuged at 3,000 × g at 20 ° C. for 10 minutes, and the amount of benzoic acid in the supernatant was analyzed by reverse phase HPLC. The amount of benzoic acid in the reaction solution was determined by subtracting the amount of benzoic acid in the separately measured plant extract. Since 1 mol of PPD produces 1 mol of benzoic acid, the cross-linking cleavage rate was calculated from the following formula. The results are shown in Table 4 below.
Crosslink cutting rate (%) = {(AB) / C} × 100
A: Amount of benzoic acid in the reaction solution B: Amount of benzoic acid in the plant extract C: Amount of PPD subjected to the reaction (base mass)
コントロールとして、植物抽出液に替えて10mmol/L PTBを使用して行った。 As a control, 10 mmol / L PTB was used instead of the plant extract.
表4に示すように、フェネル、レモンバーム及びローズマリーのいずれも、AGEsが関与する架橋構造を分解する化合物として報告されているPTBよりも高い架橋切断率を示した。特にフェネルは、PTBの2倍近い架橋切断率を示した。 As shown in Table 4, all of Fennell, Lemon Balm and Rosemary showed higher cross-linking cleavage rates than PTB reported as a compound that degrades cross-linking structures involving AGEs. In particular, Fennell showed a cross-linking cleavage rate nearly twice that of PTB.
[AGEs架橋切断作用確認試験(その2)]
Sara Vasan et al.Nature,382,pp275-278(1996)の記載に準じて行った。
予めコラーゲンコートした市販の96穴マイクロプレートにSuperBlock T20 (PBS) Blocking Bufferを300μL/wellで添加し、37℃で1時間反応させた。反応後、0.05% Polyethylene (20) sorbitan monolaurate (Tween 20)/PBS(-)で洗浄し、その後、予めAGEs化した牛血清アルブミン(AGE-BSA)をマイクロプレートの各wellに添加し、37℃で4時間架橋反応させた。反応後、Tween 20/PBS(-)で洗浄し、その後、各wellに植物抽出液を添加し、37℃で18時間切断反応させた。その後、Tween 20/PBS(-)で洗浄し、一次抗体(anti-albumin bovine serum rabbit-polyclonal)を添加して30分間室温で反応させた。さらに、Tween 20/PBS(-)で洗浄後、二次抗体(goat anti-rabbit IgG horseradish peroxidase (HRP) conjugate)を添加して30分間室温で反応させた。その後、Tween 20/PBS(-)で洗浄し、TMB One Component HRP Microwell Substrateを加えた。さらにPEG6000溶液を添加し、20分間反応させた。反応停止液として1N HClを添加し、450nm(主波長)/630nm(副波長)の吸光度をマイクロプレートリーダーで測定した。AGE-BSAの残存量は、AGE-BSA量を変化させた検量線より求めた。また、AGE-BSA分解率(コラーゲン架橋分解率)は、下記式を用いて求めた。その結果を下記表5に示す。
AGE-BSAs分解率={(添加AGE-BSA量-残存AGE-BSA量)/添加AGE-BSA量}×100
[AGEs Crosslink Cutting Action Confirmation Test (Part 2)]
The procedure was performed according to the description of Sara Vasan et al. Nature, 382, pp275-278 (1996).
SuperBlock T20 (PBS) Blocking Buffer was added to a commercially available 96-well microplate coated with collagen at 300 μL / well and reacted at 37 ° C. for 1 hour. After the reaction, the cells were washed with 0.05% Polyethylene (20) sorbitan monolaurate (Tween 20) / PBS (-), and then pre-AGEs bovine serum albumin (AGE-BSA) was added to each well of the microplate at 37 ° C. The cross-linking reaction was carried out for 4 hours. After the reaction, the cells were washed with Tween 20 / PBS (-), and then a plant extract was added to each well, and the cleavage reaction was carried out at 37 ° C. for 18 hours. Then, it was washed with Tween 20 / PBS (-), a primary antibody (anti-albumin bovine serum rabbit-polyclonal) was added, and the mixture was reacted at room temperature for 30 minutes. Furthermore, after washing with Tween 20 / PBS (-), a secondary antibody (goat anti-rabbit IgG horseradish peroxidase (HRP) conjugate) was added and reacted at room temperature for 30 minutes. After that, it was washed with Tween 20 / PBS (-), and TMB One Component HRP Microwell Substrate was added. Further, a PEG6000 solution was added and the reaction was carried out for 20 minutes. 1N HCl was added as a reaction stop solution, and the absorbance at 450 nm (main wavelength) / 630 nm (secondary wavelength) was measured with a microplate reader. The residual amount of AGE-BSA was determined from the calibration curve in which the amount of AGE-BSA was changed. The AGE-BSA decomposition rate (collagen crosslink decomposition rate) was determined using the following formula. The results are shown in Table 5 below.
AGE-BSAs decomposition rate = {(added AGE-BSA amount-residual AGE-BSA amount) / added AGE-BSA amount} x 100
コントロールとして、植物抽出液に替えて、メイラード反応活性阻害効果を有することが知られている5mmol/L punicalaginを使用し同様の試験を行った。 As a control, a similar test was conducted using 5 mmol / L punicalagin, which is known to have a Maillard reaction activity inhibitory effect, instead of the plant extract.
表5に示すように、フェネル、レモンバーム及びフェヌグリークは、コラーゲン架橋分解活性を有することが確認できた。特に、レモンバームは、punicalaginと同等のコラーゲン架橋分解活性を有することが確認できた。 As shown in Table 5, it was confirmed that fenugreek, lemon balm and fenugreek had collagen cross-linking degrading activity. In particular, it was confirmed that lemon balm has collagen cross-linking decomposition activity equivalent to that of punicalagin.
[AGEs架橋切断作用確認試験(その3)]
下記表6に示す植物抽出液の混合液を使用した以外は、AGEs架橋切断作用確認試験(その1)と同様の測定を行った。その結果を下記表6に示す。
[AGEs Crosslink Cutting Action Confirmation Test (Part 3)]
The same measurement as in the AGEs cross-linking cleavage action confirmation test (No. 1) was performed except that the mixed solution of the plant extracts shown in Table 6 below was used. The results are shown in Table 6 below.
表6に示すように、フェネル、ハイビスカス及びフェヌグリークの混合液は、PTBの約2倍近いAGEs架橋切断率を示した。 As shown in Table 6, the mixed solution of fenugreek, hibiscus and fenugreek showed an AGEs cross-linking cleavage rate nearly twice that of PTB.
[アミラーゼ阻害作用確認試験]
Enzy Chrom α-Amylase Assay Kit(BioAssay System)及びα-Amylase from Porcine pancreas(シグマ)を使用した。
マイクロプレートの各ウエルにキット付属の酵素、Assay Buffer、Glucose Standardを10μLずつ分注した。その後、各ウエルに、下記表7に示す植物抽出液を含む反応液を40μLずつ分注し、撹拌後15分間反応させた。その後、各ウエルに発色試薬を150μL分注し、室温で20分間反応させた後、585nmの吸光度を測定し、阻害率及びIC50を求めた(n=3)。得られたIC50を下記表7に示す。
[Amylase inhibitory effect confirmation test]
The Enzy Chrom α-Amylase Assay Kit (BioAssay System) and α-Amylase from Porcine pancreas (Sigma) were used.
10 μL of the enzyme, Assay Buffer, and Glucose Standard included in the kit was dispensed into each well of the microplate. Then, 40 μL of the reaction solution containing the plant extract shown in Table 7 below was dispensed into each well, and the mixture was reacted for 15 minutes after stirring. Then, 150 μL of the color-developing reagent was dispensed into each well, reacted at room temperature for 20 minutes, and then the absorbance at 585 nm was measured to determine the inhibition rate and IC50 (n = 3). The obtained IC50s are shown in Table 7 below.
表7に示す通り、フェヌグリーク及びハイビスカスのIC50はいずれも0.1mg/mL未満であり、フェヌグリーク及びハイビスカスは、アミラーゼの高い阻害活性を有することが確認できた。これにより、フェヌグリーク及びハイビスカスは、血糖値の急激な上昇を抑制でき、その結果、異常蛋白質の生成の原因となりうるジカルボニル化合物及びAGEs等の生成を抑制可能であることが示唆された。 As shown in Table 7, the IC50s of fenugreek and hibiscus were both less than 0.1 mg / mL, and it was confirmed that fenugreek and hibiscus had high inhibitory activity on amylase. This suggests that fenugreek and hibiscus can suppress the rapid rise in blood glucose level, and as a result, can suppress the production of dicarbonyl compounds and AGEs that can cause the production of abnormal proteins.
[α-グルコシダーゼ阻害作用確認試験]
QuantiChrom α-Glucosidase Assay Kit DAGD-100(Bio Assay Sytem)、及びラット小腸アセトンパウダー(シグマ、α-Glucosidase)を使用した。
マイクロプレートリーダーの測定部温度を30℃に設定した後、マイクロプレートの各ウエルに下記表8に示す植物抽出液を含む試料溶液200μL(基質溶液8uLを含む)と及びα-グルコシダーゼ溶液20μLとを分注して撹拌して反応を開始させ、405nmの吸光度変化を30分間測定した。阻害作用のポジティブコントロールとしてはα-ルコシダーゼ阻害薬のアカルボース(acarbose)を使用し、α-グルコシダーゼ活性阻害率(%)は下記の式に従って算出し(n=3)、IC50を求めた。
α-グルコシダーゼ活性阻害率(%) = {1-(A /B)} × 100
A:サンプル、ポジティブコントロールの各濃度の値(ΔAbs 30min)
B:TOTAL(全発色)の値(ΔAbs 30min)
[Α-Glucosidase inhibitory effect confirmation test]
QuantiChrom α-Glucosidase Assay Kit DAGD-100 (Bio Assay Sytem) and rat small intestinal acetone powder (Sigma, α-Glucosidase) were used.
After setting the temperature of the measuring part of the microplate reader to 30 ° C, 200 μL of the sample solution (including 8 uL of the substrate solution) containing the plant extract shown in Table 8 below and 20 μL of the α-glucosidase solution were added to each well of the microplate. The reaction was started by dispensing and stirring, and the change in absorbance at 405 nm was measured for 30 minutes. As a positive control of the inhibitory action, the α-glucosidase inhibitor acarbose was used, and the α-glucosidase activity inhibition rate (%) was calculated according to the following formula (n = 3), and IC50 was determined.
α-Glucosidase activity inhibition rate (%) = {1- (A / B)} × 100
A: Value of each concentration of sample and positive control (ΔAbs 30 min)
B: TOTAL (total color development) value (ΔAbs 30 min)
表8に示す通り、フェヌグリーク及びフェネルはα-グルコシダーゼ阻害活性を有することが確認できた。これにより、フェヌグリーク及びフェネルは、血糖値の急激な上昇を抑制でき、その結果、異常蛋白質の生成の原因となりうるジカルボニル化合物及びAGEs等の生成を抑制可能であることが示唆された。 As shown in Table 8, it was confirmed that fenugreek and fenugreek have α-glucosidase inhibitory activity. This suggests that fenugreek and fenugreek can suppress a rapid increase in blood glucose level, and as a result, can suppress the production of dicarbonyl compounds and AGEs that can cause the production of abnormal proteins.
[抗酸化力確認試験]
アークレイ社のスポットケム(商標)i-Pack Oxystress Test(商標)を使用した。
チオシアン酸塩を含むスポットケム試薬r1 90μLと塩化鉄IIIを含むスポットケム試薬r2 36μLとを混合した。この混合液126μLに、下記表9の植物抽出液18μLを添加し、スポットケムを用いて465nmの吸光度を測定し、抗酸化力(μmol/L)を求めた。
他方、植物抽出液に替えて、標準試薬アスコルビン酸を使用し、同様に吸光度測定を行い、アスコルビン酸濃度と吸光度との相関関係を示す検量線を作成した。そして、植物抽出液の吸光度と検量線とから、抗酸化力をアスコルビン酸当量(mg/L)に換算した。その結果を下記表9に示す。
[Antioxidant confirmation test]
Arkray's Spotchem ™ i-Pack Oxystress Test ™ was used.
90 μL of the spotchem reagent r1 containing thiocyanate and 36 μL of the spotchem reagent r2 containing iron (iron) chloride III were mixed. To 126 μL of this mixed solution, 18 μL of the plant extract shown in Table 9 below was added, and the absorbance at 465 nm was measured using a spot chem to determine the antioxidant power (μmol / L).
On the other hand, the standard reagent ascorbic acid was used instead of the plant extract, and the absorbance was measured in the same manner to prepare a calibration curve showing the correlation between the ascorbic acid concentration and the absorbance. Then, the antioxidant power was converted into ascorbic acid equivalent (mg / L) from the absorbance of the plant extract and the calibration curve. The results are shown in Table 9 below.
表9に示す通り、ハイビスカスが、高い抗酸化力を有することが確認できた。これにより、ハイビスカスは、異常蛋白質生成の原因となる酸化物質を消去可能であることが示唆された。 As shown in Table 9, it was confirmed that hibiscus has high antioxidant power. This suggests that hibiscus can eliminate the oxidizing substances that cause abnormal protein production.
Claims (13)
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15/601,746 US20170335304A1 (en) | 2016-05-23 | 2017-05-22 | Oxidized protein hydrolase activity enhancing agent and glycation stress inhibitor |
| EP17172420.6A EP3248606A1 (en) | 2016-05-23 | 2017-05-23 | Oxidized protein hydrolase activity enhancing agent and glycation stress inhibitor |
| CN201710371404.5A CN107432475A (en) | 2016-05-23 | 2017-05-23 | Activity enhancer for oxidized protein hydrolase and saccharification stress inhibitor |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016102697 | 2016-05-23 | ||
| JP2016102697 | 2016-05-23 | ||
| JP2016102702 | 2016-05-23 | ||
| JP2016102702 | 2016-05-23 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017210473A JP2017210473A (en) | 2017-11-30 |
| JP7007813B2 true JP7007813B2 (en) | 2022-01-25 |
Family
ID=60475190
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017100806A Active JP7007813B2 (en) | 2016-05-23 | 2017-05-22 | Oxidizing proteolytic enzyme activity enhancer and glycation stress inhibitor |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7007813B2 (en) |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1726952A (en) | 2004-07-27 | 2006-02-01 | 中国人民解放军军事医学科学院毒物药物研究所 | Extract product of fenugreek seeds, its extracting method, and treatment diabetes and complication purposes thereof |
| JP2011032176A (en) | 2009-07-30 | 2011-02-17 | Kao Corp | Melanin production promoter |
| JP2014218476A (en) | 2013-05-10 | 2014-11-20 | 丸善製薬株式会社 | Hyaluronidase activity inhibitor, hydrogen peroxide eraser, whitening agent, anti-aging agent and hair tonic |
| JP2014221739A (en) | 2013-05-13 | 2014-11-27 | 丸善製薬株式会社 | Type vii collagen expression promoter |
| JP2015086168A (en) | 2013-10-30 | 2015-05-07 | 株式会社ブルーム・クラシック | Lipase inhibitor, and skin cosmetic for sebum control |
| JP2015178489A (en) | 2014-02-25 | 2015-10-08 | 日本メナード化粧品株式会社 | External preparation or internal preparation for skin containing extract of fenugreek which is raised by being irradiated with light having a specific wavelength range |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4205188B2 (en) * | 1997-10-01 | 2009-01-07 | 一丸ファルコス株式会社 | Maillard reaction inhibitor |
-
2017
- 2017-05-22 JP JP2017100806A patent/JP7007813B2/en active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1726952A (en) | 2004-07-27 | 2006-02-01 | 中国人民解放军军事医学科学院毒物药物研究所 | Extract product of fenugreek seeds, its extracting method, and treatment diabetes and complication purposes thereof |
| JP2011032176A (en) | 2009-07-30 | 2011-02-17 | Kao Corp | Melanin production promoter |
| JP2014218476A (en) | 2013-05-10 | 2014-11-20 | 丸善製薬株式会社 | Hyaluronidase activity inhibitor, hydrogen peroxide eraser, whitening agent, anti-aging agent and hair tonic |
| JP2014221739A (en) | 2013-05-13 | 2014-11-27 | 丸善製薬株式会社 | Type vii collagen expression promoter |
| JP2015086168A (en) | 2013-10-30 | 2015-05-07 | 株式会社ブルーム・クラシック | Lipase inhibitor, and skin cosmetic for sebum control |
| JP2015178489A (en) | 2014-02-25 | 2015-10-08 | 日本メナード化粧品株式会社 | External preparation or internal preparation for skin containing extract of fenugreek which is raised by being irradiated with light having a specific wavelength range |
Non-Patent Citations (2)
| Title |
|---|
| Hypertension,2014年,Vol.63, No.6,pp. e166-e167,Abstract Number: A-013 |
| J Ethnopharmacol,2004年,Vol.93,pp.289-294 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2017210473A (en) | 2017-11-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Adisakwattana et al. | Mesona Chinensis Benth extract prevents AGE formation and protein oxidation against fructose-induced protein glycation in vitro | |
| US11452706B2 (en) | Methods and compositions for attenuating allergenicity in protein products | |
| JP5538611B2 (en) | Maillard reaction inhibitor | |
| WO2011004733A1 (en) | Activity enhancer for oxidized protein hydrolase | |
| KR20070119296A (en) | Agent having effects of skin aging resister and skin whitening, manufactured using extract of pine tree as its main ingredient | |
| JP2015209420A (en) | Advanced glycation end products production inhibitor | |
| KR20160021734A (en) | Antioxidative composition comprising extract of red tea stem | |
| JP7007813B2 (en) | Oxidizing proteolytic enzyme activity enhancer and glycation stress inhibitor | |
| JP6411403B2 (en) | Protein saccharification reaction inhibitor | |
| JP2010178627A (en) | Food and drink | |
| JP6122200B1 (en) | Anti-glycation composition | |
| JP2020143034A (en) | Maillard reaction inhibitor and ages cross-link cleavage accelerator | |
| JP6948833B2 (en) | Maillard reaction product degrading agent | |
| US20170333509A1 (en) | Maillard reaction product-decomposing agent | |
| JP4944372B2 (en) | Acrolein adduct formation inhibitor, and skin external preparation and health supplement containing the same | |
| JP7282350B2 (en) | METHOD FOR PRODUCING PROTEIN GLYCATION INHIBITOR | |
| KR20050029898A (en) | Functional food containing persimmon vinegar powder | |
| JP2012067061A (en) | Maillard reaction inhibitor and aging improving agent | |
| EP3248606A1 (en) | Oxidized protein hydrolase activity enhancing agent and glycation stress inhibitor | |
| JP2014108931A (en) | Inhibitor of production of advanced glycation end product | |
| JP6673864B2 (en) | Advanced saccharification product formation inhibitor | |
| JP2012171909A (en) | Glycation inhibitor | |
| KR100626336B1 (en) | Pharmaceutical compositions and functional food comprising Extract of Hypericum erectum | |
| JP6731240B2 (en) | Protein cross-linking agent | |
| JP2021181425A (en) | Advanced glycation end-product formation suppressing agent |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200127 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210204 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210405 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210624 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211116 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211203 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220104 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220107 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7007813 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |