JP6957844B2 - 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 - Google Patents
核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 Download PDFInfo
- Publication number
- JP6957844B2 JP6957844B2 JP2016163274A JP2016163274A JP6957844B2 JP 6957844 B2 JP6957844 B2 JP 6957844B2 JP 2016163274 A JP2016163274 A JP 2016163274A JP 2016163274 A JP2016163274 A JP 2016163274A JP 6957844 B2 JP6957844 B2 JP 6957844B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- acid amplification
- reaction solution
- contained
- concentration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Plant Pathology (AREA)
- Analytical Chemistry (AREA)
- Immunology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Description
この方法では、例えば核酸増幅産物と相補的な塩基配列を有する核酸(以下、プローブと称する場合がある)を予めDNAチップに固定化しておき、PCRによって得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、核酸増幅産物をプローブと結合させるハイブリダイゼーションを行うことにより、検出対象の核酸が検出される。
しかしながら、このような方法では、ハイブリダイゼーションを行うために、ハイブリダイゼーション用バッファーを別途調製して、PCR反応液に混合する必要があった。このようなバッファー調製や混合の作業は煩雑であるのみならず、混合液に気泡が混入してハイブリダイゼーションが阻害されたり、バッファーの添加忘れによる検査ミスが生じる場合があるという問題があった。
さらに、核酸増幅産物を含むPCR反応液をそのままDNAチップ上に直接滴下してハイブリダイゼーションを行うことができれば、検査工程を簡略化することも可能になる。
その理由は、ハイブリダイゼーションを十分に進行させるためには、DNAチップ上に滴下する溶液の塩濃度(陽イオン濃度)を、通常のPCR反応液よりも高くすることが好ましいためである。
そこで、従来は、一般に、PCR反応液にハイブリダイゼーション用バッファーを混合して塩濃度を高めてからDNAチップに滴下することにより、ハイブリダイゼーションを進行し易くすることが行われていた。
その理由は、ハイブリダイゼーション用バッファーは塩濃度が高く、また一般に界面活性剤が含まれているが、PCRは核酸合成酵素を用いて行われるため、PCR反応液の塩濃度が高くなり、界面活性剤が混合されると、核酸合成酵素の活性が阻害されて、核酸増幅反応を適切に行うことができないためである。
しかしながら、これらはいずれもPCRなどの反応液に金属塩及び/又は水溶性高分子を混合した後、核酸増幅反応を行い、得られた核酸増幅産物を含む反応液をそのまま用いて、ハイブリダイゼーションを十分に行うことを可能にするものではなかった。
まず、生体試料からからゲノムDNAを抽出する。ゲノムDNAの抽出は、CTAB法(Cetyl trimethyl ammonium bromide)による方法やDNA抽出装置を用いる方法など、一般的な手法により行うことができる。
次に、抽出したゲノムDNAにおける特定の遺伝子などを標的領域として、PCR法などによって増幅し、核酸増幅産物を得る。核酸増幅法としては、PCR法に限定されず、例えばRT−PCR、NASBA(Nucleic Acid Sequence-Based Amplification)、TMA(Transcription Mediated Amplification)、LCR(ligase chain reaction)等のその他の方法を用いても良い。
PCR法では、標的領域を増幅させるためのプライマーセットを含有するPCR反応液を用いて、標的領域を増幅させる。PCR装置としては、一般的なサーマルサイクラーなどを用いることができる。
(a)95℃ 2分、(b)95℃(DNA変性工程) 10秒、(c)60℃(アニーリング工程) 20秒、(d)72℃(DNA合成工程) 30秒((b)〜(d)を40サイクル)、(e)72℃ 2分
すなわち、本実施形態の核酸増幅及び検出用溶液は、本実施形態の核酸増幅及び検出方法において用いられる、金属塩及び/又は水溶性高分子を含有する核酸増幅用の反応液に相当する。
ポリエチレングリコールの誘導体としては、例えばTween系界面活性剤(非イオン性界面活性剤の一種、ポリオキシエチレンソルビタン脂肪酸エステル)や、Triton系界面活性剤(非イオン性界面活性剤の一種、ポリオキシエチレンアルキルフェニルエーテル)などを挙げることができる。
核酸増幅産物を蛍光標識する場合、例えば蛍光色素のCy5を用いて、リバースプライマー及び/又はフォワードプライマーの5’末端に標識を行うことができる。
すなわち、PCRにより得られた核酸増幅産物を含むPCR反応液などを、当該核酸増幅産物と相補的な塩基配列を有するプローブが固定化されたDNAチップ等に滴下して、核酸増幅産物をプローブに結合させる。
このとき、本実施形態の核酸増幅及び検出方法では、核酸増幅産物を含むPCR反応液を、そのままハイブリダイゼーションに使用するのであり、従来のように、ハイブリダイゼーション用に別途バッファーを調製して、該PCR反応液に混合することは行わない。
まず、検査対象の生物のDNAにおける標的領域を増幅して得られる核酸増幅産物と相補的な塩基配列を有するプローブを、予めDNAチップに固定化する。
このとき、プローブは、一般的なDNA合成装置により合成できる。また、DNAチップとして、貼り付け型のDNAチップを作成する場合は、DNAスポッターによりプローブをガラス基板上に固定化して、各プローブに対応するスポットを形成することにより作成することができる。また、合成型DNAチップを作成する場合は、光リソグラフィ技術により、ガラス基板上で上記配列を備えた一本鎖オリゴDNAを合成することにより作成することができる。さらに、基板はガラス製に限定されず、プラスチック基板やシリコンウエハー等を用いることもできる。また、基板の形状は平板状のものに限定されず、様々な立体形状のものとすることもでき、その表面に化学反応が可能となるように官能基を導入したものなどを用いることもできる。
また、バッファーの添加忘れによる検査ミスを防止できると共に、バッファーを反応液に混合する場合に生じ得る気泡の混入によるハイブリダイゼーションの阻害を防止でき、バッファーによって核酸増幅産物が希釈されないという効果を得ることも可能になる。
さらに、このように核酸増幅産物を含む反応液をそのままDNAチップ上に直接滴下してハイブリダイゼーションを行うことができるため、検査工程を簡略化することも可能になる。
以下に示す条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。具体的には、以下のように行った。
この大腸菌の菌株を入れたアンプルに、ニュートリエントブロス(日本ベクトン・ディッキソン株式会社)を注ぎ、均一な菌液になるまで静かなピペッティング操作で懸濁した。得られた菌懸濁液をハートインヒュージョン寒天培地(日水製薬株式会社)に塗抹し、37℃で一晩好気培養して復生、増菌した。増菌した菌のコロニーを白金耳でかき集め、これをDNA抽出用菌体とした。
次に、DNeasy Blood&Tissue Kit(株式会社キアゲン)を用い、マニュアルに記載のグラム陰性菌の抽出方法に従って、上記DNA抽出用菌体からDNAを抽出した。このDNA抽出液をPCRにおいて使用するテンプレートとした。
2.dNTP Mixture(各2.5mM) 2.0μl
3.フォワードプライマー(10μM) 0.28μl
4.リバースプライマー(10μM)(Cy5) 0.56μl
5.TaKaRa Ex Taq HotStart DNA polymerase 0.13μl
6.Template DNA(20pg/μl) 5.0μl
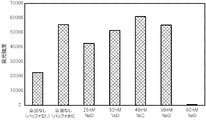
7.NaCl(塩化ナトリウム) (終濃度が0, 25, 30, 40, 50, 60 mMとなるよう添加)
8.水(全体が25.0μlになるまで加水)
(a)95℃ 2分
(b)95℃ 10秒
(c)60℃ 20秒
(d)72℃ 30秒((b)〜(d)を40サイクル)
(e)72℃ 2分
このプローブは、検出対象生物のDNAにおけるvtx1遺伝子領域から選択されたものであり、PCRにより得られた核酸増幅産物と相補的に結合することができるものである。
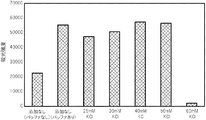
PCR反応液に、金属塩としてNaClに替えて、KCl(和光純薬工業株式会社製)を様々な濃度で添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
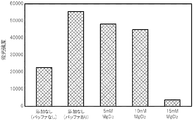
PCR反応液に、金属塩としてNaClに替えて、MgCl2(ライフテクノロジーズジャパン株式会社製)を様々な濃度で添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
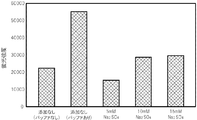
PCR反応液に、金属塩としてNaClに替えて、Na2SO4(和光純薬工業株式会社製)を様々な濃度で添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
PCR反応液に、金属塩としてNaClに替えて、CH3COONa(和光純薬工業株式会社製)を様々な濃度で添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
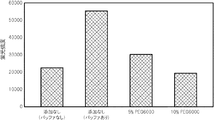
PCR反応液に、金属塩を添加せず、水溶性高分子としてPEG6000(和光純薬工業株式会社製)を様々な濃度で添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
PCR反応液に、金属塩を添加せず、様々な水溶性高分子を添加した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
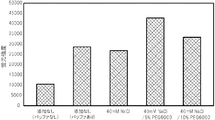
PCR反応液に、金属塩及び水溶性高分子の両方を添加した場合の効果を確認するために、本試験を行った。
具体的には、金属塩を添加したPCR反応液と、金属塩及び水溶性高分子の両方を添加したPCR反応液とを準備した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
PCR反応液に、金属塩及び水溶性高分子の両方を添加した場合であって、水溶性高分子として様々なものを使用した場合の効果を確認するために、本試験を行った。
具体的には、金属塩を添加したPCR反応液と、金属塩及び様々な水溶性高分子を添加したPCR反応液とを準備した点以外は、試験1と同じ条件で、PCRによる核酸増幅反応を行い、得られた核酸増幅産物を含むPCR反応液をDNAチップに滴下して、ハイブリダイゼーションが十分に行われるか否かを確認した。
例えば、上記の実施例では、核酸増幅反応による標的領域をvtx1の一領域のみとしているが、その他の領域を対象としても良く、また複数の標的領域を対象として、核酸増幅反応によってこれらを同時に増幅する場合に適用することもでき、適宜変更することが可能である。
Claims (12)
- 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、前記核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを行うことによって検出する核酸増幅及び検出方法であって、
核酸増幅用の反応液に金属塩を含有させて、前記反応液を用いて核酸増幅反応を行い、
核酸増幅反応により得られた核酸増幅産物を含む前記反応液をそのまま用いてハイブリダイゼーションを行うにあたり、
前記金属塩が、ナトリウム塩、カリウム塩、マグネシウム塩からなる群から選択されたいずれかであり、
前記ナトリウム塩にあっては、前記核酸増幅用の反応液中のナトリウムイオン濃度が0mM超であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整し、
前記カリウム塩にあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が0mM超であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整し、又は、
前記マグネシウム塩にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が2mM超であり、かつ、10mM以下となるように前記マグネシウム塩が含有されるように調整する
ことを特徴とする核酸増幅及び検出方法。 - 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、当該核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを行うことによって検出する核酸増幅及び検出方法であって、
核酸増幅用の反応液に水溶性高分子を含有させて、前記反応液を用いて核酸増幅反応を行い、
核酸増幅反応により得られた核酸増幅産物を含む前記反応液をそのまま用いてハイブリダイゼーションを行うにあたり、
前記水溶性高分子が、ポリビニルピロリドン、ポリエチレングリコール、及びこれらの誘導体からなる群から選択されたいずれかであり、
前記水溶性高分子が、前記核酸増幅用の反応液中に0%(w/v)超であり、かつ、10%(w/v)未満の濃度で含有されるように調整する
ことを特徴とする核酸増幅及び検出方法。 - 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、当該核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを行うことによって検出する核酸増幅及び検出方法であって、
核酸増幅用の反応液に金属塩及び水溶性高分子を含有させて、前記反応液を用いてPCRを行い、
核酸増幅反応により得られた核酸増幅産物を含む前記反応液をそのまま用いてハイブリダイゼーションを行うにあたり、
前記金属塩が、ナトリウム塩、カリウム塩、マグネシウム塩からなる群から選択されたいずれかであり、
前記ナトリウム塩にあっては、前記核酸増幅用の反応液中のナトリウムイオン濃度が0mM超であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整し、
前記カリウム塩にあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が0mM超であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整し、又は、
前記マグネシウム塩にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が2mM超であり、かつ、10mM以下となるように前記マグネシウム塩が含有されるように調整し、
前記水溶性高分子が、ポリビニルピロリドン、ポリエチレングリコール、及びこれらの誘導体からなる群から選択されたいずれかであり、
前記水溶性高分子が、前記核酸増幅用の反応液中に0%(w/v)超であり、かつ、10%(w/v)未満の濃度で含有されるように調整する
ことを特徴とする核酸増幅及び検出方法。 - 前記ナトリウム塩にあっては、前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整し、
前記カリウム塩にあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が25mM以上であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整し、
前記マグネシウム塩にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が5mM以上及び10mM以下となるように前記マグネシウム塩が含有されるように調整する
ことを特徴とする請求項1又は3記載の核酸増幅及び検出方法。 - 前記金属塩が、NaCl、KCl、MgCl2、Na2SO4、及びCH3COONaからなる群から選択されたいずれかであり、
前記NaClにあっては、前記核酸増幅用の反応液中のナトリウムイオン濃度が25mM以上であり、かつ、50mM以下となるように前記NaClが含有されるように調整し、
前記KClにあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が25mM以上であり、かつ、30mM未満となるように前記KClが含有されるように調整し、
前記MgCl2にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が5mM以上及び10mM以下となるように前記MgCl2が含有されるように調整し、
前記Na2SO4にあっては、前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、30mM以下となるように前記Na2SO4が含有されるように調整し、又は、
前記CH3COONaにあっては、前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、50mM以下となるように前記CH3COONaが含有されるように調整する
ことを特徴とする請求項1又は3記載の核酸増幅及び検出方法。 - 前記水溶性高分子が、前記核酸増幅用の反応液中に5%(w/v)以上であり、かつ、10%(w/v)未満の濃度で含有されるように調整することを特徴とする請求項2又は3記載の核酸増幅及び検出方法。
- 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、前記核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを、前記核酸増幅産物を含む核酸増幅用の反応液をそのまま用いて行うことにより、検出するために用いる核酸増幅及び検出用溶液であって、前記反応液に金属塩を含有させてなり、
前記金属塩が、ナトリウム塩、カリウム塩、マグネシウム塩からなる群から選択されたいずれかであり、
前記ナトリウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のナトリウムイオン濃度が0mM超であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整され、
前記カリウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のカリウムイオンの濃度が0mM超であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整され、又は、
前記マグネシウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のマグネシウムイオンの濃度が2mM超であり、かつ、10mM以下となるように前記マグネシウム塩が含有されるように調整されている
ことを特徴とする核酸増幅及び検出用溶液。 - 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、前記核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを、前記核酸増幅産物を含む核酸増幅用の反応液をそのまま用いて行うことにより、検出するために用いる核酸増幅及び検出用溶液であって、前記反応液に水溶性高分子を含有させてなり、
前記水溶性高分子が、ポリビニルピロリドン、ポリエチレングリコール、及びこれらの誘導体からなる群から選択されたいずれかであり、
前記水溶性高分子が、前記核酸増幅用の反応液中に0%(w/v)超であり、かつ、10%(w/v)未満の濃度で含有されるように調整されている
ことを特徴とする核酸増幅及び検出用溶液。 - 試料中に含まれる核酸における標的領域を核酸増幅反応により増幅させ、得られた核酸増幅産物を、DNAチップに滴下して、前記核酸増幅産物と相補的な塩基配列を有する核酸と結合させるハイブリダイゼーションを、前記核酸増幅産物を含む核酸増幅用の反応液をそのまま用いて行うことにより、検出するために用いる核酸増幅及び検出用溶液であって、前記反応液に金属塩及び水溶性高分子を含有させてなり、
前記金属塩が、ナトリウム塩、カリウム塩、マグネシウム塩からなる群から選択されたいずれかであり、
前記ナトリウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のナトリウムイオン濃度が0mM超であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整され、
前記カリウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のカリウムイオンの濃度が0mM超であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整され、又は、
前記マグネシウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のマグネシウムイオンの濃度が2mM超であり、かつ、10mM以下となるように前記マグネシウム塩が含有されるように調整され、
前記水溶性高分子が、ポリビニルピロリドン、ポリエチレングリコール、及びこれらの誘導体からなる群から選択されたいずれかであり、
前記水溶性高分子が、前記核酸増幅用の反応液中に0%(w/v)超であり、かつ、10%(w/v)未満の濃度で含有されるように調整されている
ことを特徴とする核酸増幅及び検出用溶液。 - 前記ナトリウム塩にあっては、前記核酸増幅反応に使用される前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、50mM以下となるように前記ナトリウム塩が含有されるように調整され、
前記カリウム塩にあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が25mM以上であり、かつ、30mM未満となるように前記カリウム塩が含有されるように調整され、
前記マグネシウム塩にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が5mM以上及び10mM以下となるように前記マグネシウム塩が含有されるように調整されている
ことを特徴とする請求項7又は9記載の核酸増幅及び検出用溶液。 - 前記金属塩が、NaCl、KCl、MgCl2、Na2SO4、及びCH3COONaからなる群から選択されたいずれかであり、
前記NaClにあっては、前記核酸増幅用の反応液中のナトリウムイオン濃度が25mM以上であり、かつ、50mM以下となるように前記NaClが含有されるように調整され、
前記KClにあっては、前記核酸増幅用の反応液中のカリウムイオンの濃度が25mM以上であり、かつ、30mM未満となるように前記KClが含有されるように調整され、
前記MgCl2にあっては、前記核酸増幅用の反応液中のマグネシウムイオンの濃度が5mM以上及び10mM以下となるように前記MgCl2が含有されるように調整され、
前記Na2SO4にあっては、前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、30mM以下となるように前記Na2SO4が含有されるように調整され、又は、
前記CH3COONaにあっては、前記核酸増幅用の反応液中のナトリウムイオンの濃度が20mM以上であり、かつ、50mM以下となるように前記CH3COONaが含有されるように調整されている
ことを特徴とする請求項7又は9記載の核酸増幅及び検出用溶液。 - 前記水溶性高分子が、前記核酸増幅用の反応液中に5%(w/v)以上であり、かつ、10%(w/v)未満の濃度で含有されるように調整されていることを特徴とする請求項8又は9記載の核酸増幅及び検出用溶液。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016163274A JP6957844B2 (ja) | 2016-08-24 | 2016-08-24 | 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 |
| PCT/JP2017/029891 WO2018038088A1 (ja) | 2016-08-24 | 2017-08-22 | 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016163274A JP6957844B2 (ja) | 2016-08-24 | 2016-08-24 | 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018029510A JP2018029510A (ja) | 2018-03-01 |
| JP6957844B2 true JP6957844B2 (ja) | 2021-11-02 |
Family
ID=61244961
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016163274A Active JP6957844B2 (ja) | 2016-08-24 | 2016-08-24 | 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP6957844B2 (ja) |
| WO (1) | WO2018038088A1 (ja) |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AT410218B (de) * | 1999-08-20 | 2003-03-25 | Baxter Ag | Verfahren zur herstellung eines qualitätsgesicherten pools biologischer proben |
| EP2077337A1 (en) * | 2007-12-26 | 2009-07-08 | Eppendorf Array Technologies SA | Amplification and detection composition, method and kit |
| EP2441520A1 (en) * | 2010-10-12 | 2012-04-18 | Eppendorf AG | Real-time amplification and micro-array based detection of nucleic acid targets in a flow chip assay |
| JP6387606B2 (ja) * | 2013-11-27 | 2018-09-12 | 東ソー株式会社 | 核酸の検出方法 |
| JP6467829B2 (ja) * | 2014-09-03 | 2019-02-13 | 東洋紡株式会社 | 改良されたrt−pcr反応 |
| JP6584986B2 (ja) * | 2016-03-18 | 2019-10-02 | 株式会社東芝 | 核酸検出方法 |
-
2016
- 2016-08-24 JP JP2016163274A patent/JP6957844B2/ja active Active
-
2017
- 2017-08-22 WO PCT/JP2017/029891 patent/WO2018038088A1/ja not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| WO2018038088A1 (ja) | 2018-03-01 |
| JP2018029510A (ja) | 2018-03-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Henson et al. | The C-Circle Assay for alternative-lengthening-of-telomeres activity | |
| US8673595B2 (en) | Sample analysis method and assay kit used therein | |
| Tsui et al. | Molecular techniques for pathogen identification and fungus detection in the environment | |
| JP2019201658A (ja) | 非干渉性、ノイズキャンセル性のポリヌクレオチド識別タグを用いたマルチプレックスパイロシーケンシング | |
| US20080160527A1 (en) | One-tube nested PCR for detecting Mycobacterium tuberculosis | |
| US10870894B2 (en) | Methods for measuring enzyme activity useful in determining cell viability in non-purified samples | |
| Vasylyeva | Identification of Bordetella bronchiseptica bacteria with the help of polymerase chain reaction in monoand multyplex format | |
| CN107109402B (zh) | 用于减少核酸扩增抑制的组合物 | |
| CN107980065B (zh) | 用于减少核酸扩增抑制的组合物 | |
| Uda et al. | Comparison of whole genome amplification methods for detecting pathogenic bacterial genomic DNA using microarray | |
| JP6957844B2 (ja) | 核酸増幅及び検出方法、並びに核酸増幅及び検出用溶液 | |
| US20160083776A1 (en) | Methods for Measuring Polymerase Activity Useful for Sensitive, Quantitative Measurements of Any Polymerase Extension Activity and for Determining the Presence of Viable Cells | |
| RU2455364C2 (ru) | Способ идентификации микобактерий с помощью полимеразной цепной реакции | |
| US20240240262A1 (en) | Viable cell detection and protocol implementing the same | |
| US20240150819A1 (en) | Protected isothermal nucleic acid amplification (pina) methods for point-of-need diagnosis of emerging infectious diseases | |
| JP4576489B2 (ja) | 新規ポリヌクレオチド、それを用いた深在性輸入真菌症原因菌ペニシリウム・マルネッフェイ(Penicilliummarneffei)の検出用マーカ、プローブ、プライマー、検出方法およびキット | |
| Zhang | Analysis of Schizosaccharomyces pombe heterochromatin-associated short interfering RNAs | |
| Kiuluku | Development of Mycobacterium Tuberculosis Ribosomal RNA as a Drug Target | |
| AU2021290161A1 (en) | Isothermal real-time PCR method for determining presence of a pre-determined nucleic acid sequence of a bacterium of the mollicutes class in a sample | |
| TR2024011827A2 (tr) | Lactococcus garvieae?NİN İZOTERMAL AMPLİFİKASYON (LAMP) TEMELLİ TESPİTİNİ SAĞLAYAN YÖNTEM VE TEŞHİS KİTİ | |
| Chen et al. | 21 In situ PCR/RT-PCR Coupled with in situ Hybridization for | |
| JP2021048785A (ja) | 内部コントロール核酸、内部コントロールキット及び核酸検出方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190717 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200630 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201029 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210316 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210514 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210907 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210920 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6957844 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |