JP6919119B2 - A compressed solid pharmaceutical composition containing a γ-aminobutyric acid derivative substituted at the 3-position. - Google Patents
A compressed solid pharmaceutical composition containing a γ-aminobutyric acid derivative substituted at the 3-position. Download PDFInfo
- Publication number
- JP6919119B2 JP6919119B2 JP2018009249A JP2018009249A JP6919119B2 JP 6919119 B2 JP6919119 B2 JP 6919119B2 JP 2018009249 A JP2018009249 A JP 2018009249A JP 2018009249 A JP2018009249 A JP 2018009249A JP 6919119 B2 JP6919119 B2 JP 6919119B2
- Authority
- JP
- Japan
- Prior art keywords
- tablet
- per tablet
- hpc
- prototype
- solid preparation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本発明は、γ−アミノ酪酸(GABA)の誘導体を含有する固形医薬組成物もしくは圧縮固形医薬組成物、好ましくは3位が置換されたγ−アミノ酪酸誘導体を含有する固形医薬組成物もしくは圧縮固形医薬組成物、及び当該固形医薬組成物もしくは圧縮固形医薬組成物の製造方法に関する。
本発明は、γ−アミノ酪酸(GABA)の誘導体を安定に保持する固形医薬組成物もしくは圧縮固形医薬組成物、好ましくは3位が置換されたγ−アミノ酪酸誘導体を安定に保持する圧縮固形医薬組成物、及び当該固形医薬組成物もしくは圧縮固形医薬組成物の製造方法に関する。
The present invention is a solid pharmaceutical composition or compressed solid pharmaceutical composition containing a derivative of γ-aminobutyric acid (GABA), preferably a solid pharmaceutical composition or compressed solid containing a γ-aminobutyric acid derivative substituted at the 3-position. The present invention relates to a pharmaceutical composition and a method for producing the solid pharmaceutical composition or a compressed solid pharmaceutical composition.
The present invention is a solid pharmaceutical composition or a compressed solid pharmaceutical composition that stably retains a derivative of γ-aminobutyric acid (GABA), preferably a compressed solid pharmaceutical composition that stably retains a γ-aminobutyric acid derivative substituted with a 3-position. The present invention relates to a composition and a method for producing the solid pharmaceutical composition or the compressed solid pharmaceutical composition.
本発明は、γ−アミノ酪酸(GABA)の誘導体、好ましくは3位が置換されたγ−アミノ酪酸誘導体の苦みを感じさせず、当該誘導体の溶出性に優れ、十分な硬度を保持し、成形性に優れ、付着性が少なく、粉流れが良く、当該誘導体が十分な保存安定性を有しており、高品質な医薬製剤を製造しうる固形医薬組成物もしくは圧縮固形医薬組成物、及び当該固形医薬組成物もしくは圧縮固形医薬組成物の製造方法に関する。 The present invention does not cause the bitterness of a derivative of γ-aminobutyric acid (GABA), preferably a γ-aminobutyric acid derivative in which the 3-position is substituted, is excellent in elution of the derivative, maintains sufficient hardness, and is molded. A solid pharmaceutical composition or a compressed solid pharmaceutical composition having excellent properties, low adhesiveness, good powder flow, sufficient storage stability of the derivative, and capable of producing a high-quality pharmaceutical preparation, and the said The present invention relates to a method for producing a solid pharmaceutical composition or a compressed solid pharmaceutical composition.
γ−アミノ酪酸誘導体の代表的な医薬として、プレガバリン、ガバペンチン、バクロフェンが知られている。プレガバリン、ガバペンチン、バクロフェンの構造は、夫々、順に、下記の式I〜式IIIのとおりである。
式I プレガバリンの構造式
式II ガバペンチンの構造式
式III バクロフェンの構造式
Pregabalin, gabapentin, and baclofen are known as typical pharmaceuticals for γ-aminobutyric acid derivatives. The structures of pregabalin, gabapentin, and baclofen are, respectively, in the following formulas I to III, respectively.
Formula I Structural formula of pregabalin
Formula II Structural formula of gabapentin
Equation III Structural formula of baclofen
プレガバリンは、日本では、神経障害性疼痛及び線維筋痛症に伴う疼痛の治療用に、ファイザー社から「リリカ」の商品名で硬カプセル剤として販売されている。リリカのインタビューフォームによれば、その使用期限は3年間である。
ガバペンチンは、日本では、癲癇の治療用に、ファイザー社から「ガバペン」の商品名で錠剤及びシロップ剤として販売されている。「ガバペン」のインタビューフォームによれば、ガバペンの錠剤及びシロップ剤の使用期限は、ともに3年間である。
Pregabalin is marketed in Japan as a hard capsule under the trade name "Lyrica" by Pfizer for the treatment of neuropathic pain and pain associated with fibromyalgia. According to Lyrica's interview form, its expiration date is three years.
Gabapentin is marketed in Japan as tablets and syrups under the trade name "Gabapent" by Pfizer for the treatment of epilepsy. According to the "Gabapentin" interview form, both gabapentin tablets and syrups have a three-year expiration date.
バクロフェンは、日本では、痙性麻痺の治療用に、ノバルティス社からは「リオレサール」の商品名で、第一三共株式会社からは「ギャバロン」の商品名で、夫々錠剤として販売されている。また、バクロフェンは、脳脊髄疾患に由来する重度の痙性麻痺の治療用に、第一三共株式会社から髄腔内注射用の液剤として販売されている。インタビューフォームによれば、リオレサールの錠剤の使用期限は3年間、ギャバロンの髄腔内注射剤の使用期限は3年間、ギャバロンの錠剤の使用期限は5年間である。 In Japan, baclofen is sold as tablets for the treatment of spastic paralysis under the trade name of "Rioresal" by Novartis and "Gabalon" by Daiichi Sankyo Co., Ltd. Baclofen is marketed by Daiichi Sankyo Co., Ltd. as a liquid for intrathecal injection for the treatment of severe spastic paralysis caused by cerebrospinal diseases. According to the interview form, Rioresal tablets are valid for 3 years, Gavalon intrathecal injections are valid for 3 years, and Gavalon tablets are valid for 5 years.
プレガバリンとガバペンチンは、γ−アミノ酪酸(GABA)の脂溶性を高めて血液脳関門を通過するようにしたGABA誘導体である。プレガバリンとガバペンチンは、γ−アミノ酪酸(GABA)に類似する構造を有しているが、GABA(GABAA、GABAB、ベンゾジアゼピン)受容体との結合、GABAの代謝や再取り込みへの阻害作用は認められていない。また、既存鎮痛薬の作用機序である電位依存性ナトリウムチャンネル遮断、オピオイド受容体活性化、NMDA受容体遮断、シクロオキシゲナーゼ阻害、モノアミン再取り込み阻害等の作用は有さない。 Pregabalin and gabapentin are GABA derivatives that increase the lipophilicity of gamma-aminobutyric acid (GABA) to cross the blood-brain barrier. Pregabalin and gabapentin have a structure similar to gamma-aminobutyric acid (GABA), but their binding to GABA (GABA A , GABA B , benzodiazepine) receptors and their inhibitory effect on GABA metabolism and reuptake Not allowed. In addition, it does not have actions such as potential-dependent sodium channel blockade, opioid receptor activation, NMDA receptor blockade, cyclooxygenase inhibition, and monoamine reuptake inhibition, which are the mechanisms of action of existing analgesics.
電位依存性カルシウムチャンネルは電気生理学的な違いに基づき、P型、Q型、N型、L型、R型、T型に分類されている。これらは、いずれも、α1、α2、β、δ、γの5つのサブユニットから構成される。
これらのうち、N型カルシウムチャンネルは、神経伝達物質を放出し、痛みの感作に影響していると考えられている。プレガバリンとガバペンチンは、N型カルシウムチャンネルの補助的サブユニットであるα2δサブユニットと結合して、神経終末内へのカルシウムの流入を減少させ、細胞内カルシウムイオン濃度上昇に依存する興奮性神経伝達物質の放出を抑制する。
Voltage-gated calcium channels are classified into P-type, Q-type, N-type, L-type, R-type, and T-type based on electrophysiological differences. Each of these is composed of five subunits, α1, α2, β, δ, and γ.
Of these, N-type calcium channels are thought to release neurotransmitters and affect pain sensitization. Pregabalin and gabapentin combine with the α2δ subunit, an auxiliary subunit of N-type calcium channels, to reduce the influx of calcium into nerve endings and are excitatory neurotransmitters that depend on elevated intracellular calcium ion levels. Suppresses the release of calcium.
一方、主に高血圧症治療薬として使用されるカルシウム阻害薬はL型カルシウムチャンネルに作用して効果を発揮しているため、N型カルシウムチャンネルにのみ拮抗するプレガバリンとガバペンチンは、血圧や心機能に影響しない。 On the other hand, calcium inhibitors, which are mainly used as therapeutic agents for hypertension, act on L-type calcium channels and exert their effects. Therefore, pregabalin and gabapentin, which antagonize only N-type calcium channels, affect blood pressure and cardiac function. It does not affect.
プレガバリンとガバペンチンは、いずれも神経障害性疼痛の第一選択薬である。プレガバリンとガバペンチンは、皮膚等の痛覚を伝達するC線維やAδ線維などの痛覚一次ニューロンが脊髄後角の膠様質に投射して二次ニューロンとシナプス形成する際に、N型の電位依存性カルシウムチャンネルのα2δサブユニットと結合して神経終末内へのカルシウムの流入を阻害して興奮性神経伝達物質の遊離を抑制することにより神経障害性疼痛に対する鎮痛作用を生ずる。プレガバリンは、帯状疱疹後神経痛及び有痛性糖尿病性ニューロパチー患者を対象とする臨床試験において統計学的に有意な鎮痛効果が認められている。 Both pregabalin and gabapentin are first-line drugs for neuropathic pain. Pregabalin and gabapentin are N-type voltage-gated when primary nociceptive neurons such as C fibers and Aδ fibers that transmit pain sensation in the skin project onto the glio-like substance of the posterior horn of the spinal cord to form synapses with secondary neurons. It binds to the α2δ subunit of the calcium channel to inhibit the influx of calcium into nerve endings and suppress the release of excitatory neurotransmitters, thereby producing an analgesic effect on neuropathy pain. Pregabalin has been shown to have a statistically significant analgesic effect in clinical trials in patients with postherpetic neuralgia and painful diabetic neuropathy.
ガバペンチンとプレガバリンの鎮痛力価は1:5であり、ガバペンチンは、プレガバリンの5〜6倍の量を服用する必要がある。プレガバリンとガバペンチンはいずれも、眠気、ふらつき、転倒、末梢性浮腫、体重増加の副作用があるので、服用量の細かい調節が必要である。 The analgesic potency of gabapentin and pregabalin is 1: 5, and gabapentin should be taken in 5 to 6 times the amount of pregabalin. Both pregabalin and gabapentin have side effects of drowsiness, light-headedness, falls, peripheral edema, and weight gain, so fine-tuning of the dose is required.
GABA作動性神経系の神経終末は、シナプス後細胞を過分極させ、活動電位の発生を抑制するので抑制性神経系と呼ばれる。
ガバペンチンは、中枢神経系に広く分布するGABA作動性神経系の神経終末に存在するGABAトランスポーターを活性化させてGABA作動性神経系の機能を維持・増強することによって神経系の過活動を抑制するので、癲癇の治療に用いることができる。
The nerve endings of the GABAergic nervous system are called inhibitory nervous systems because they hyperpolarize postsynaptic cells and suppress the generation of action potentials.
Gabapentin suppresses nervous system overactivity by activating GABA transporters present at the nerve endings of the GABAergic nervous system, which are widely distributed in the central nervous system, and maintaining and enhancing the function of the GABAergic nervous system. Therefore, it can be used for the treatment of epilepsy.
バクロフェンは、GABAB受容体の作動薬として働き、筋弛緩作用があるので、多発性硬化症、脊髄損傷、脳脊髄疾患などにおける痙縮による疼痛に対して鎮痛効果を有する。 Baclofen acts as an agonist of GABA B receptor and has a muscle relaxant effect, so that it has an analgesic effect on pain caused by spasticity in multiple sclerosis, spinal cord injury, cerebrospinal disease and the like.
プレガバリンとガバペンチンの薬物動態には違いがみられ、ガバペンチンはL−アミノ酸輸送体によって吸収されるが、プレガバリンはD−、L−いずれのアミノ酸輸送体によっても吸収される。そのため、ガバペンチンは高用量になると生物学的利用能が低下し、血中濃度の予測が難しいが、プレガバリンは生物学的利用能が90%以上で用量依存性の薬物動態を示すので血中濃度を予測しやすい。また、ガバペンチンが服用後約3時間で血中濃度のピークに達するのに比べ、プレガバリンは約1時間でピークに達するため速やかに効果が得られる。 There is a difference in the pharmacokinetics of pregabalin and gabapentin, where gabapentin is absorbed by the L-amino acid transporter, while pregabalin is absorbed by either the D- or L-amino acid transporter. Therefore, the bioavailability of gabapentin decreases at high doses and it is difficult to predict the blood concentration, but pregabalin has a bioavailability of 90% or more and shows dose-dependent pharmacokinetics, so the blood concentration. Is easy to predict. In addition, while gabapentin reaches its peak in blood concentration about 3 hours after administration, pregabalin reaches its peak in about 1 hour, so that the effect can be obtained quickly.
排泄に関しては、プレガバリンは血漿タンパクと結合せず、肝臓での代謝を受けないため、薬物相互作用を引き起こしにくい。また、プレガバリンの尿中排泄の99%が未変化体である。プレガバリン及びガバペンチンの血漿中濃度半減期は用量増加や反復投与に関わらず、およそ6時間とされている。プレガバリンとガバペンチンの吸収は、食事の影響をほとんど受けず、また、肝で代謝されないため、肝臓の酵素を増やしたり阻害したりしないことから、薬物相互作用が非常に少ない薬物である。健康成人のプレガバリンの全身クリアランスは60〜100mL/min であり、ガバペンチンの全身クリアランスの平均値は、116mL/min であり、いずれも糸球体濾過速度と一致し、未変化体の尿中排泄率はほぼ100%であったとする報告がある。 Regarding excretion, pregabalin does not bind to plasma proteins and is not metabolized in the liver, so it is unlikely to cause drug interactions. In addition, 99% of the urinary excretion of pregabalin is unchanged. The half-life of plasma concentrations of pregabalin and gabapentin is approximately 6 hours regardless of dose increase or repeated administration. The absorption of pregabalin and gabapentin is largely unaffected by diet and is not metabolized in the liver, so it does not increase or inhibit hepatic enzymes, so it is a drug with very little drug interaction. The systemic clearance of pregabalin in healthy adults is 60-100 mL / min, and the average systemic clearance of gabapentin is 116 mL / min, both of which are consistent with the glomerular filtration rate and the urinary excretion rate of unchanged form. There is a report that it was almost 100%.
プレガバリンとガバペンチンに最もよくみられる副作用は、眠気とふらつきである。用量が増えるにしたがって、また高齢になるにつれてその頻度は増加する。プレガバリンの副作用の頻度は承認までの国内試験において約20%前後である。プレガバリンには突然の意識消失の報告もある。その他のプレガバリンの副作用としては、浮腫が15%程度報告されている。 The most common side effects of pregabalin and gabapentin are drowsiness and light-headedness. The frequency increases as the dose increases and as the elderly age. The frequency of side effects of pregabalin is around 20% in domestic studies up to approval. Pregabalin has also been reported to suddenly lose consciousness. As another side effect of pregabalin, edema has been reported in about 15%.
ガバペンチンの副作用の頻度は承認までの国内試験において約59%である。その他のガバペンチンの副作用としては、頭痛(約9%)、複視(約5%)、倦怠感(約4%)であった。
バクロフェンの副作用の頻度は承認までの国内試験において約37%である。主な副作用は、眠気(約10%)、悪心(約5%)、食欲不振(約3%)、脱力感(約7%)、ふらつき(3%)等であった。
The frequency of side effects of gabapentin is about 59% in domestic studies up to approval. Other side effects of gabapentin were headache (about 9%), diplopia (about 5%), and malaise (about 4%).
The frequency of side effects of baclofen is about 37% in domestic studies up to approval. The main side effects were drowsiness (about 10%), nausea (about 5%), loss of appetite (about 3%), weakness (about 7%), and light-headedness (3%).
プレガバリン及びガバペンチンは、他の薬物と有害な相互作用を来しにくいが、プレガバリンとオピオイドを併用するとオピオイドによる呼吸抑制が増強されたとする報告があり、注意を要する。 Pregabalin and gabapentin are less likely to cause harmful interactions with other drugs, but it should be noted that the combined use of pregabalin and opioids has been reported to enhance respiratory depression by opioids.
これらのγ−アミノ酪酸誘導体は、共通の構造に基づく共通の特性があり、製剤化した場合にも共通の構造に基づく共通する課題がある。 These γ-aminobutyric acid derivatives have common properties based on a common structure, and even when formulated, there are common problems based on the common structure.
特開2000−034227(特許文献1)には、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体は、非常に苦みを有する薬物であること、圧縮成形性及び流動性が極めて乏しいことが記載されている。また、特許文献1には、安全性の観点から使用期限中のラクタム体の含有許容量は1.0%以下とされていること、多くの助剤がガバペンチン、プレガバリン又はバクロフェンと経時的に反応してラクタム体(γ−アミノ酪酸構造を有する化合物の分子内に存在するアミノ基とカルボキシル基の分子内脱水縮合生成物)を形成し、圧密状態になればなるほど脱水縮合反応が加速され、製剤化における水または有機溶媒の使用により更に加速されることが記載されている。プレガバリンのラクタム体、ガバペンチンのラクタム体、バクロフェンのラクタム体の構造は、夫々順に、下記の式IV〜式VIのとおりである。
Japanese Patent Application Laid-Open No. 2000-034227 (Patent Document 1) describes that γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen are extremely bitter drugs and have extremely poor compressibility and fluidity. ing. Further, in
式IV プレガバリンのラクタム体の構造式
式V ガバペンチンのラクタム体の構造式
式VI バクロフェンのラクタム体の構造式
Equation IV Structural formula of the lactam body of pregabalin
Formula V Structural formula of the lactam body of gabapentin
Formula VI Structural formula of the lactam body of baclofen
そして、特許文献1は、上記の問題の解決方法として、γ−アミノ酪酸誘導体に、安定化剤として、エチレングリコール、プロピレングリコール、ブチレングリコール、ソルビトール、グリセリンおよびこれらの脂肪酸エステルを保水剤として配合することによる、γ−アミノ酪酸誘導体の安定化された固形組成物を提案している。
特許文献1の分割出願である特開2003−055211(特許文献2)及びさらにその分割出願である特開2004−043506(特許文献3)についても同様の記載がある。
As a solution to the above problem,
The same description is given to Japanese Patent Application Laid-Open No. 2003-055211 (Patent Document 2), which is a divisional application of
特開2000−034226(特許文献4)にも、特許文献1〜3と同じ問題点が記載されており、その解決方法として、γ−アミノ酪酸誘導体にアミノ酸を添加することにより、γ−アミノ酪酸誘導体のアミノ基およびカルボキシル基を封鎖して、水溶液状態及び固体状態においてγ−アミノ酪酸誘導体を安定化しうることが記載されている。
Japanese Patent Application Laid-Open No. 2000-034226 (Patent Document 4) also describes the same problems as those of
特表2009−514847(特許文献5)にも、プレガバリン製剤は、プレガバリンの分子内に存在するアミノ基とカルボキシル基が脱水縮合して、ラクタム体を形成する場合があることが記載されている。また、特許文献5には、プレガバリンは小腸及び上行結腸において吸収され、右結腸曲を超えると吸収されにくいことから、単純に6時間以上にわたって活性成分を放出する徐放性製剤では、6時間後以降には右結腸曲を超えて移動してしまって吸収されにくくなるので、1日1回服用の徐放性製剤とはなりえないことが記載されている。
Japanese Patent Application Laid-Open No. 2009-514847 (Patent Document 5) also describes that the pregabalin preparation may form a lactam form by dehydration condensation of an amino group and a carboxyl group existing in the molecule of pregabalin. Further, in
その解決方法として、特許文献5は、プレガバリン、ポリ酢酸ビニル、ポビドン、及び架橋型ポビドンを含有することにより、長期間にわたって胃に滞留し、胃に滞留している間、持続的にプレガバリンを放出する1日1回服用の持続放出性医薬製剤を提案している。
As a solution to this,
特表2014−521639(特許文献6)にも、プレガバリンの平均吸収ウィンドウは6時間以下であることが記載されており、その解決方法として「プレガバリンまたはその塩およびヒドロキシプロピルメチルセルロースを含む」ことによりプレガバリンの放出制御及び浮遊性の向上を目的とした第1の放出制御相と、「膨潤性ポリマーとしてポリエチレンオキサイドを含む」ことにより膨潤性及び浮遊性の両方を有する第2の放出制御相が均一に分散している、徐放錠を提案している。 Japanese Patent Application Laid-Open No. 2014-521639 (Patent Document 6) also states that the average absorption window of pregabalin is 6 hours or less, and as a solution thereof, pregabalin by "containing pregabalin or a salt thereof and hydroxypropylmethyl cellulose". The first release control phase for the purpose of controlling the release and improving the floating property and the second release control phase having both the swelling property and the floating property by "containing polyethylene oxide as the swelling polymer" are uniformly made. We are proposing a dispersed, sustained-release tablet.
特表2003−504324(特許文献7)には、味がマスクされ、活性成分を即時放出する被覆された顆粒を製造するという課題の解決手段として、まず、カルボキシメチルセルロースナトリウム(カルメロースナトリウム)、クロスポビドン、カルボキシメチルデンプンなどの崩壊剤を活性成分の粉末と最初に乾燥混合し、結合剤とともに湿式造粒した後に、カルボキシメチルセルロースナトリウム、クロスポビドン、カルボキシメチルデンプンなどの膜崩壊剤と被覆剤とを含む懸濁液で噴霧して被覆した後に乾燥することを提案している。 In Japanese Patent Application Laid-Open No. 2003-504324 (Patent Document 7), as a means for solving the problem of producing coated granules in which the taste is masked and the active ingredient is immediately released, first, sodium carboxymethyl cellulose (sodium carmellose) and cloth are used. Disintegrants such as povidone and carboxymethyl starch are first dried and mixed with the active ingredient powder, wet granulated with a binder, and then film disintegrants such as sodium carboxymethyl cellulose, crospovidone and carboxymethyl starch and a coating agent. It is proposed to spray and coat with the containing suspension and then dry.
そして、特許文献7の実施例3には、プレガバリン、クロスポビドン、アセスルファムカリウム、沈殿シリカ、エチルセルロース及びクロスポビドンを含有する顆粒を、マンニトール、クロスポビドン、アスパルテーム、香料、ステアリン酸マグネシウムと混合し打錠する速崩錠が記載されている。
特許文献7の実施例3には、味マスキングと溶出特性を確認した旨の記載はあるが、保存安定性については何ら記載されていない。
Then, in Example 3 of Patent Document 7, granules containing pregabalin, crospovidone, acesulfame potassium, precipitated silica, ethyl cellulose and crospovidone are mixed with mannitol, crospovidone, aspartame, fragrance and magnesium stearate and tableted. A quick-disintegrating tablet is described.
In Example 3 of Patent Document 7, there is a description that taste masking and dissolution characteristics have been confirmed, but there is no description about storage stability.
WO2015/007890(特許文献8)は、プレガバリンの服用時にビタミンB欠乏が生じて神経の損傷と貧血が生じることを防ぐために、プレガバリンとビタミンB12を含有するカプセル剤を提案している。 WO2015 / 007890 (Patent Document 8) proposes capsules containing pregabalin and vitamin B12 in order to prevent vitamin B deficiency from occurring when taking pregabalin, resulting in nerve damage and anemia.
WO2015/114656(特許文献9)には、プレガバリンが上部消化管においてのみ吸収されることが記載されている。
そのため、特許文献9は、プレガバリンの1日1回の徐放性製剤を作製するという課題の解決方法として、胃粘膜に粘着する錠剤を提案している。特許文献9の実施例1の直打処方にはプレガバリン、微結晶セルロース、ステアリン酸マグネシウム、及び粘膜粘着性添加物としてポリエチレングリコール、トラガカント、ポリメタクリレート誘導体、又はポリエチレンオキサイドを含有する各種のフィルムコーティング錠が記載されている。
しかし、特許文献9には、これらの製剤を実際に製造した旨の記載はなく、何らかの試験を行ったことの記載もない。
WO2015 / 114656 (Patent Document 9) describes that pregabalin is absorbed only in the upper gastrointestinal tract.
Therefore, Patent Document 9 proposes a tablet that adheres to the gastric mucosa as a solution to the problem of preparing a once-daily sustained release preparation of pregabalin. Various film-coated tablets containing pregabalin, microcrystalline cellulose, magnesium stearate, and polyethylene glycol, tragacanth, polymethacrylate derivative, or polyethylene oxide as mucosal adhesive additives in the direct formulation of Example 1 of Patent Document 9. Is described.
However, Patent Document 9 does not describe that these preparations are actually manufactured, nor does it describe that any test has been performed.
WO2015/114655(特許文献10)には、プレガバリンが上部消化管においてのみ吸収されることが記載されている。
そのため、特許文献10は、プレガバリンの1日1回の徐放性製剤を製造するという課題の解決方法として、密度の低い添加剤を添加することによって、胃に滞留する期間、錠剤が断片化せずに元の形状を保つ“物理的統一性”を保つともに、かつ、錠剤が沈んだり幽門を通過したりせずに胃液に浮遊する“水力学的平衡状態”を保つ錠剤を提案している。特許文献10の実施例1の直打処方にはプレガバリン、微結晶セルロース、コロイド状二酸化ケイ素、及びエチルセルロースを含有する各種のフィルムコーティング錠が記載されている。
しかし、特許文献10には、これらの製剤を実際に製造した旨の記載はなく、何らかの試験を行ったことの記載もない。
WO2015 / 114655 (Patent Document 10) describes that pregabalin is absorbed only in the upper gastrointestinal tract.
Therefore, in
However,
EP2343055(特許文献11)には、プレガバリンを含有する安定な製剤、特に安定なカプセル剤を製造するという課題の解決方法として、プレガバリン又は薬学的に許容可能なその塩、コロイド状二酸化ケイ素、リン酸水素カルシウム、及びコーンスターチを含有する固形製剤を提案している。特許文献11の実施例1のカプセル剤は、これらの成分からなっており、40℃75%相対湿度の条件下において6か月間経過した後も溶出性及び安定性が良好であったことが記載されている。
しかし、特許文献11には、圧縮固形製剤を製造した旨の記載はない
EP2343055 (Patent Document 11) describes pregabalin or a pharmaceutically acceptable salt thereof, colloidal silicon dioxide, and phosphoric acid as a solution to the problem of producing a stable preparation containing pregabalin, particularly a stable capsule. We propose a solid formulation containing calcium hydrogen hydrogen and corn starch. It is described that the capsule of Example 1 of Patent Document 11 was composed of these components and had good elution and stability even after 6 months under the condition of 40 ° C. and 75% relative humidity. Has been done.
However, Patent Document 11 does not describe that the compressed solid preparation is produced.
特開2011−173881(特許文献12)には、イヌはヒトよりも胃の筋力が強いこと、及び胃腸管の長さが人の約半分しかなく、そのため、1日1回の投与で済む徐放性錠剤の製造が困難であることが記載されている。
特許文献12は、その解決方法として、イヌの胃腸管の筋力に耐えるのに十分な高分子量または高粘度ポリマーを使用すること、及び、錠剤がイヌの胃の底部に沈降し、迅速に水和して、長時間にわたって胃に貯留する錠剤を提案している。
According to Japanese Patent Application Laid-Open No. 2011-173881 (Patent Document 12), dogs have stronger gastric muscles than humans, and the length of the gastrointestinal tract is only about half that of humans. It is stated that the production of release tablets is difficult.
特許文献12の請求項1〜19は、活性成分を特定する発明ではない。しかしながら、特許文献12の請求項20は、適用可能な活性成分としてプレガバリン、アモキシシリン、及びトラマドールが記載されており、特許文献12の実施例3には、プレガバリン、及び高分子量または高粘度ポリマーとしてヒプロメロース2208を含有する錠剤が記載されている。同様に、特許文献12の実施例4には、プレガバリン、及び高分子量または高粘度ポリマーとしてポリエチレンオキシドWSR N−60K NFを含有する錠剤が記載されている。
そして、特許文献12の図3には、実施例3及び実施例4のプレガバリン錠の徐放性の溶出プロファイルが記載されている。さらに、特許文献12の図8には、実施例3及び実施例4のプレガバリン錠及び放出カプセル剤をイヌに単回投与した時の血漿プレガバリン濃度の経時推移が示されている。
しかし、特許文献12には、プレガバリンを含有する圧縮固形製剤の保存安定性については何ら記載されていない。
And FIG. 3 of
However,
特開2008−528494(特許文献13)には、ガバペンチン又はプレガバリンを徐放性製剤化するために、(a)pH非依存性可溶性ポリマーで被覆されたガバペンチン又はプレガバリンと、(b)pH非依存性不溶性ポリマーで被覆されたガバペンチン又はプレガバリンと、(c)pH依存性可溶性ポリマーで被覆されたガバペンチン又はプレガバリンとを含む組成物を提案している。 Japanese Patent Application Laid-Open No. 2008-528494 describes (a) gabapentin or pregabalin coated with a pH-independent soluble polymer and (b) pH-independent in order to formulate gabapentin or pregabalin in a sustained-release formulation. We propose a composition containing gabapentin or pregabalin coated with a sex-insoluble polymer and (c) gabapentin or pregabalin coated with a pH-dependent soluble polymer.
特表2013−535477(特許文献14)には、プレガバリンが腸上部内でのみ吸収されることが記載されており、プレガバリンを徐放性製剤化するために、マトリクス形成剤、膨潤剤、及び浮力剤又は沈降剤を含むマトリクス内にプレガバリンを含有することによって、胃内で膨潤するだけでなく、胃内で浮遊するかまたは胃内に沈降して、胃内に滞留する製剤を提案している。 Japanese Patent Application Laid-Open No. 2013-535477 (Patent Document 14) describes that pregabalin is absorbed only in the upper intestine, and a matrix-forming agent, a swelling agent, and buoyancy for the sustained release formulation of pregabalin. We propose a formulation that not only swells in the stomach but also floats in the stomach or settles in the stomach and stays in the stomach by containing pregabalin in a matrix containing the agent or precipitant. ..
特表2010−524991(特許文献15)には、ラクトース分解酵素等の不足によってラクトース等の糖類が分解できずに、ラクトースを摂取すると下痢になってしまうラクトース不耐性の患者も服用しうるプレガバリン製剤として、プレガバリンの安定化のためにプレガバリン以外のアミノ酸を必要とせず、ラクトース等の糖類も本質的に含まないプレガバリン含有医薬組成物を提案している。 According to Japanese Patent Application Laid-Open No. 2010-524991 (Patent Document 15), a pregabalin preparation that can be taken by lactose-intolerant patients who cannot decompose saccharides such as lactose due to lack of lactose-degrading enzyme and the like, resulting in diarrhea when lactose is ingested. Therefore, we have proposed a pregabalin-containing pharmaceutical composition that does not require amino acids other than pregabalin for stabilization of pregabalin and essentially does not contain saccharides such as lactose.
特表2002−522375(特許文献16)には、ガバペンチン及びプレガバリンが、水溶液中で分解して分子内環化によってラクタム体を生成しがちであること、及び、ガバペンチン及びプレガバリンが苦みを有することが記載されている。 According to Japanese Patent Application Laid-Open No. 2002-522375 (Patent Document 16), gabapentin and pregabalin tend to decompose in an aqueous solution to form a lactam by intramolecular cyclization, and gabapentin and pregabalin have bitterness. Have been described.
特許文献16は、その解決方法として、オイドラギットE、アミノエチルメタクリラートコポリマー、エチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、セルロースアセトフタラートなどのポリマーを、アセトン、エタノール、イソプロパノールなどの有機溶媒に溶解して、ガバペンチン又はプレガバリンの粒子表面にスプレーして被覆粒子を調製し、必要に応じて他の添加物と混合して打錠することを提案している。 As a solution thereof, Patent Document 16 dissolves a polymer such as Eudragit E, aminoethylmethacrylate copolymer, ethylcellulose, hydroxypropylmethylcellulose, hydroxypropylcellulose, and celluloseacetophthalate in an organic solvent such as acetone, ethanol, and isopropanol. It is proposed that the coated particles be prepared by spraying on the particle surface of gabapentin or pregavalin, and if necessary, mixed with other additives and tableted.
WO2011/107812(特許文献17)には、プレガバリン等のGABA誘導体が、アミノ基とカルボキシル基の分子内脱水縮合によるラクタム体を形成しがちであることの解決方法として、プレガバリンのGABA誘導体の製剤に、イソマルト(isomalt)、水素化されたマルツロース(hydrogenated maltulose)、ラクチトール(lactitol)、マルチトール(maltitol)、イソマルチトール(isomaltitol)などの二糖類、あるいは、マルトトリイトール(maltotriitol)、マルトテトライトール(maltotetraitol)、澱粉の加水分解とそれに続く水素添加によって得られる水素化された多糖類、セロビイトール(cellobiitol)、セロトリイトール(cellotriitol)、キシロビイトール(xylobiitol)、キシロトリイトール(xylotriitol)、イヌロトリイトール(inulotriitol)、あるいは、セルロース(cellulose)、キシラン類(xylans)、フルクタン類(fructans)の加水分解とそれに続く水素添加によって得られる水素化された多糖類を添加することを提案している。 According to WO2011 / 107812 (Patent Document 17), as a solution to the problem that GABA derivatives such as pregabalin tend to form lactams by intramolecular dehydration condensation of amino groups and carboxyl groups, a GABA derivative of pregabalin is prepared. , Isomalt, hydrogenated maltulose, lactitol, maltitol, isomaltitol and other polysaccharides, or maltotriitol, maltotriitol, Maltoteroitol, a hydrogenated polysaccharide obtained by hydrolysis of starch and subsequent hydrogenation, cellobiitol, cellulose, xylobiitol, xylotiitol, It is proposed to add inulotriitol or hydrogenated polysaccharides obtained by hydrolysis of cellulose, xylans, fructans and subsequent hydrogenation. ing.
しかし、特許文献17の実施例1〜5は、単に混合した状態(実施例1)及びカプセル剤(実施例2〜5)の実施例であり、しかも、実際に実施例1〜3においてラクタム体の生成について測定した添加剤は、乳糖水和物、タルク、二酸化ケイ素(Aerosil 200P)、イソマルト(galenIQ960)、部分アルファー化デンプン、トウモロコシデンプンのみである。
特許文献17に圧縮固形製剤を製造した旨の記載はなく、当然ながら圧縮固形製剤の状態での保存安定性は検討していない。また、特許文献17は、D−ソルビトール及びD−マンニトールがプレガバリンの圧縮固形製剤の保存安定性に及ぼす影響は検討していない。
However, Examples 1 to 5 of Patent Document 17 are merely examples of a mixed state (Example 1) and a capsule (Examples 2 to 5), and moreover, the talc form in Examples 1 to 3 is actually used. The only additives measured for the production of were lactose hydrate, talc, silicon dioxide (Aerosil 200P), isomalt (galenIQ960), partially pregelatinized starch, and corn starch.
Patent Document 17 does not describe that the compressed solid preparation was produced, and of course, the storage stability of the compressed solid preparation in the state of the compressed solid preparation has not been examined. Further, Patent Document 17 does not examine the effect of D-sorbitol and D-mannitol on the storage stability of a compressed solid preparation of pregabalin.
Huda&Toshniwal(非特許文献1)には、プレガバリンが猛烈に苦い薬物であると記載されている。
非特許文献1は、プレガバリンの口腔内崩壊錠においてプレガバリンの苦い味をマスクするために、弱い陽イオン交換樹脂であるKyron T134とプレガバリンの複合体を製剤化することを提案している。
非特許文献1は、プレガバリンの保存安定性については何ら記載していない。
Huda & Toshnival (Non-Patent Document 1) describes that pregabalin is a fiercely bitter drug.
しかし、上記の公知文献のいずれにも、ヒドロキシプロピル置換セルロース以外のセルロース系添加物が、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤において経時的にラクタム体の生成を促進して保存安定性を損なうことは記載されていない。また、上記の公知文献のいずれにも、メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチンデンプン部分アルファー化デンプン、リン酸二水素カルシウムが、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤において経時的にラクタム体の生成を促進して保存安定性を損なうことは記載されていない。 However, in any of the above-mentioned publicly known documents, cellulosic additives other than hydroxypropyl-substituted cellulose are added to lactams over time in solid preparations or compressed solid preparations containing γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen. It is not described that it promotes the production of and impairs storage stability. In addition, in any of the above-mentioned known documents, magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, gelatin starch partial pregelatinization. It is described that starch and calcium dihydrogen phosphate promote the production of lactams over time in solid preparations or compressed solid preparations containing γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen, and impair storage stability. It has not been.
また、上記の公知文献のいずれにも、α化デンプン、白糖、アラビアゴム、ゼラチン、D−ソルビトールによって、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤の硬度が経時的に損なわれることは記載されていない。 Further, in any of the above-mentioned known documents, the hardness of a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc. over time is determined by pregelatinized starch, sucrose, gum arabic, gelatin, and D-sorbitol. It is not stated that it is impaired.
また、上記の公知文献のいずれにも、単に圧密状態によってではなく、打錠の衝撃によってガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤におけるラクタム体の経時的な生成が促進されて保存安定性が損なわれ、一旦打錠した後は、解砕して圧密状態を解いてもラクタム体の経時的な生成が促進されたままであることは記載されていない。 In addition, in any of the above-mentioned publicly known documents, lactams are produced over time in compressed solid preparations containing γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen by the impact of tableting, not simply by consolidation. It is not stated that it is promoted and the storage stability is impaired, and that once the tablet is beaten, the production of lactams over time remains promoted even when the lactams are crushed to release the consolidation state.
また、上記の文献のいずれにも、打錠圧の強さを変えてもラクタム体が同程度に生成することは記載されておらず、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有する、γ−アミノ酪酸誘導体を含有する圧縮固形製剤において、「圧密状態になればなるほど」ラクタム体の生成が「加速」するわけではないことは記載されていない。 Further, neither of the above documents describes that lactams are produced to the same extent even if the strength of tableting pressure is changed, and contains cellulosic additives other than hydroxypropyl-substituted cellulose. It is not stated that in compressed solid formulations containing γ-aminobutyric acid derivatives, "the more compacted" the production of lactams does not "accelerate".
また、上記の公知文献のいずれにも、エリスリトール、マンニトール、キシリトール、イソマルト、還元水飴、還元パラチノース、還元麦芽糖水アメ、マルチトールなどの糖アルコール、ヒドロキシプロピルスターチ、デンプングリコール酸ナトリウムなどのカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンが、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤において経時的なラクタム体の生成を抑制して保存安定性を改善することは記載されていない。 Further, in any of the above-mentioned publicly known documents, sugar alcohols such as erythritol, mannitol, xylitol, isomalt, reduced starch syrup, reduced palatinose, reduced maltose water candy, and maltitol, and carboxymethyl groups such as hydroxypropyl starch and sodium starch glycolate are included. Alternatively, starch modified with a hydroxypropoxyl group suppresses the formation of lactams over time in solid preparations or compressed solid preparations containing γ-aminobutyric acid derivatives such as gabapentin, pregavalin, and bacrophen to improve storage stability. There is no mention of what to do.
また、上記の公知文献のいずれにも、アルミラミネート袋などで密封保存することによって、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤における経時的なラクタム体の生成が促進されて保存安定性が損なわれることは記載されておらず、γ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤を、ポリ塩化ビニル、ポリプロピレン、ポリエチレン等とアルミシートを圧着して得られる気密状態のブリスター包装中に保存することによって、経時的なラクタム体の生成が抑制されることは記載されていない。 Further, in any of the above-mentioned publicly known documents, the lactam form over time in a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregavalin, baclofen, etc., by being sealed and stored in an aluminum laminate bag or the like. It is not described that the formation is promoted and the storage stability is impaired, and a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative is crimped with an aluminum sheet with polyvinyl chloride, polypropylene, polyethylene or the like. It is not described that the formation of lactams over time is suppressed by storing in the resulting airtight blister package.
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤用の打錠用顆粒を撹拌造粒によって製造した場合には当該圧縮固形製剤の硬度が経時的に損なわれてしまうこと、及び、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤用の打錠用顆粒を流動層造粒によって製造した場合には当該圧縮固形製剤の硬度が経時的に損なわれないことは記載されていない。 Further, in any of the above-mentioned publicly known documents, when the granules for tableting for a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregavalin, and baclofen are produced by stirring granulation, the compressed solid preparation is used. When the hardness is impaired over time and the granules for tableting for a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregavalin, and bacrophen are produced by fluidized layer granulation, the compression thereof. It is not stated that the hardness of the solid preparation is not impaired over time.
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤の溶出性が良くないことは記載されていない。
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体は付着性が高く、摩擦係数が大きいことは記載されていない。
Further, none of the above-mentioned publicly known documents describes that the dissolution property of the solid preparation or the compressed solid preparation containing the γ-aminobutyric acid derivative such as gabapentin, pregabalin, and baclofen is not good.
Further, neither of the above-mentioned publicly known documents describes that γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen have high adhesiveness and a large friction coefficient.
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体は、長さ1mm近い針状結晶であり、嵩高いことは記載されていない。 Further, none of the above-mentioned publicly known documents describes that γ-aminobutyric acid derivatives such as gabapentin, pregabalin, and baclofen are acicular crystals having a length of nearly 1 mm and are bulky.
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤の圧縮成形性が悪く、キャッピング、スティッキング、ラミネーションなどの打錠障害を生じやすいことは記載されていない。 Further, in any of the above-mentioned publicly known documents, a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, and baclofen has poor compressibility and is prone to locking disorders such as capping, sticking, and lamination. Is not listed.
また、上記の公知文献のいずれにも、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤において、保存安定性、溶出性、及び錠剤硬度の維持を両立させることが困難であることは記載されていない。 Further, in any of the above-mentioned publicly known documents, it is difficult to achieve both storage stability, dissolution property, and maintenance of tablet hardness in a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, and baclofen. It is not stated that there is.
したがって、本発明の目的は、良好な保存安定性を有する、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤を提供することである。
本発明の目的は、特に、使用期限内のラクタム体の含有量が1.0%以下である、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する、保存安定な固形製剤もしくは圧縮固形製剤を提供することである。
Therefore, an object of the present invention is to provide a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which has good storage stability.
An object of the present invention is particularly a storage-stable solid preparation or compressed solid containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which has a lactam content of 1.0% or less within the expiration date. To provide a formulation.
本発明の目的は、また、良好な保存安定性を有する、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤の包装形態を提供することである。 An object of the present invention is also to provide a packaging form of a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which has good storage stability.
本発明の目的は、また、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤の硬度が経時的に損なわれにくく、使用期限までの期間を通じて十分な硬度を保持する、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤を提供することである。 Another object of the present invention is gabapentin, in which the hardness of a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen is not easily impaired over time, and the hardness is maintained sufficiently throughout the period until the expiration date. , Pregabalin, baclofen and the like, to provide a compressed solid preparation containing a γ-aminobutyric acid derivative.
本発明の目的は、さらに、付着性が高く、摩擦係数が大きく、嵩高い性質を有し、圧縮成形性及び流動性が極めて乏しいというプレガバリン、ガバペンチン、バクロフェン等のγ−アミノ酪酸誘導体の性質に関わらず、圧縮前の紛体が良好な流動性を有し、歩留まり良く安定的に生産しうる、γ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤を提供することである。 An object of the present invention is further to the properties of γ-aminobutyric acid derivatives such as pregabalin, gabapentin, and baclofen, which have high adhesiveness, a large coefficient of friction, bulky properties, and extremely poor compressibility and fluidity. Regardless of this, it is an object of the present invention to provide a solid preparation containing a γ-aminobutyric acid derivative or a compressed solid preparation, in which the powder before compression has good fluidity and can be stably produced with good yield.
本発明の目的は、また、速やかに崩壊し、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤の活性成分の溶出性が良好な固形製剤もしくは圧縮固形製剤を提供することである。 An object of the present invention is to provide a solid preparation or a compressed solid preparation having a good dissolution of the active ingredient of a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which disintegrates rapidly. To provide.
本発明の目的は、また、キャッピング、スティッキング、ラミネーションなどの打錠障害を実質的に生じない、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する圧縮固形製剤を提供することである。
本発明の目的は、さらに、プレガバリン、ガバペンチン、バクロフェン等のγ−アミノ酪酸誘導体の苦みをマスクした固形製剤もしくは圧縮固形製剤を提供することである。
An object of the present invention is also to provide a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which does not substantially cause locking disorders such as capping, sticking, and lamination.
An object of the present invention is to further provide a solid preparation or a compressed solid preparation that masks the bitterness of γ-aminobutyric acid derivatives such as pregabalin, gabapentin, and baclofen.
本発明の目的は、また、良好な含量均一性を有する、ガバペンチン、プレガバリン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤を提供することである。
本発明の目的は、また、上記の、課題の1つ、2つ、3つ、あるいは4つ以上を同時に解決しうる、γ−アミノ酪酸誘導体を含有する固形製剤もしくは圧縮固形製剤を提供することである。
An object of the present invention is also to provide a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative such as gabapentin, pregabalin, baclofen, etc., which has good content uniformity.
An object of the present invention is also to provide a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative, which can solve one, two, three, or four or more of the above-mentioned problems at the same time. Is.
本発明者は、プレガバリン、ガバペンチン、バクロフェン等のγ−アミノ酪酸誘導体を含有する固形医薬組成物もしくは圧縮固形医薬組成物を提供すべく鋭意研究を行った結果、上記の課題が存在することを初めて認識し、これを解決すべく試行錯誤を重ね、洞察に基づいて自らその解決手段を見出し、本発明を完成するに至った。
本発明は、具体的には下記のとおりである。
As a result of diligent research to provide a solid pharmaceutical composition or a compressed solid pharmaceutical composition containing a γ-aminobutyric acid derivative such as pregabalin, gabapentin, and baclofen, the present inventor is the first to have the above-mentioned problems. After recognizing and repeating trial and error to solve this problem, he found the solution by himself based on his insight, and completed the present invention.
Specifically, the present invention is as follows.
〔1〕
γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分を含有し、ヒドロキシプロピル置換セルロース以外のセルロース系添加物から選択される1、2、又は3以上のセルロース系添加物を含有しないか、又は、該活性成分が前記のセルロース系添加物と接触しない製剤構造を有する、固形製剤又は圧縮固形製剤。
[1]
Contains one or more active ingredients selected from the group consisting of compounds having a γ-aminobutyric acid structure and pharmaceutically acceptable salts thereof, and is selected from cellulosic additives other than hydroxypropyl-substituted
〔2〕
γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分を含有し、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒からなる群から選択される1、2、又は3以上のセルロース系添加物を含有しないか、又は、該活性成分が前記のセルロース系添加物と接触しない製剤構造を有する、〔1〕に記載の固形製剤又は圧縮固形製剤。
[2]
Contains one or more active ingredients selected from the group consisting of compounds having a γ-aminobutyric acid structure and pharmaceutically acceptable salts thereof, crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carme Loin potassium, croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, hydroxyethyl methyl cellulose, hydroxypropyl methyl cellulose, hypromellose acetate succinate, cellulose acetate, phthalate acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, It does not contain 1, 2, or 3 or more cellulosic additives selected from the group consisting of methyl cellulose, ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules, or the active ingredient is the above-mentioned cellulose. The solid preparation or compressed solid preparation according to [1], which has a preparation structure that does not come into contact with system additives.
〔3〕
プレガバリン、ガバペンチン、バクロフェン及び薬学的に許容可能なこれらの塩からなる群から選択される1以上の活性成分を含有し、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒からなる群から選択される1、2、又は3以上のセルロース系添加物を含有しないか、又は、該活性成分が前記のセルロース系添加物と接触しない製剤構造を有する、〔1〕又は〔2〕に記載の固形製剤又は圧縮固形製剤。
[3]
Contains one or more active ingredients selected from the group consisting of pregabalin, gabapentin, baclofen and pharmaceutically acceptable salts thereof, crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carmellose potassium. , Croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, hydroxyethyl methyl cellulose, hydroxypropyl methyl cellulose, hypromellose acetate succinate, cellulose acetate, phthalate acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, methyl cellulose, Does not contain 1, 2, or 3 or more cellulosic additives selected from the group consisting of ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules, or the active ingredient is the above-mentioned cellulose-based additive. The solid preparation or compressed solid preparation according to [1] or [2], which has a preparation structure that does not come into contact with an object.
〔4〕
メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチン、デンプン、部分アルファー化デンプン、リン酸二水素カルシウムからなる群から選択される1、2、又は3以上の添加物を含有しないか、又は、γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分が前記の添加物と接触しない製剤構造を有する、〔1〕〜〔3〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[4]
Consists of magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, gelatin, starch, partially pregelatinized starch, and calcium dihydrogen phosphate. One or more activities selected from the group consisting of compounds having a γ-aminobutyric acid structure and pharmaceutically acceptable salts thereof that do not contain one, two, or three or more additives selected from the group. The solid preparation or compressed solid preparation according to any one of [1] to [3], which has a preparation structure in which the component does not come into contact with the above-mentioned additive.
〔5〕
α化デンプン、白糖、アラビアゴムからなる群から選択される1、2、又は3以上の添加物を含有しない、〔1〕〜〔4〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[5]
The solid preparation or compressed solid preparation according to any one of [1] to [4], which does not contain 1, 2, or 3 or more additives selected from the group consisting of pregelatinized starch, sucrose, and gum arabic. ..
〔6〕
ヒドロキシプロピル置換セルロースを含有する、〔1〕〜〔5〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[6]
The solid preparation or compressed solid preparation according to any one of [1] to [5], which contains hydroxypropyl-substituted cellulose.
〔7〕
カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン又は薬学的に許容可能なこれらの塩、及び糖アルコールから選択される1以上の成分を含有する、〔1〕〜〔6〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[7]
Any one of [1] to [6] containing one or more components selected from starch modified with a carboxymethyl group or a hydroxypropoxyl group or a pharmaceutically acceptable salt thereof, and a sugar alcohol. The solid preparation or compressed solid preparation described in the section.
〔8〕
カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン又は薬学的に許容可能なこれらの塩、及び糖アルコールを含有する、〔1〕〜〔7〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[8]
The solid preparation or compression according to any one of [1] to [7], which contains starch modified with a carboxymethyl group or a hydroxypropoxyl group or a pharmaceutically acceptable salt thereof, and a sugar alcohol. Solid formulation.
〔9〕
カルボキシメチルスターチナトリウム、及びヒドロキシプロピルスターチからなる群から選択される1以上の修飾されたデンプンを含有する、〔1〕〜〔8〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[9]
The solid preparation or compressed solid preparation according to any one of [1] to [8], which contains one or more modified starches selected from the group consisting of sodium carboxymethyl starch and hydroxypropyl starch.
〔10〕
エリスリトール、マンニトール、キシリトール、イソマルト、還元水飴、還元パラチノース、還元麦芽糖水飴、マルチトール、ソルビトール、からなる群から選択される1、2、又は3以上の糖アルコールを含有する、〔1〕〜〔9〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[10]
[1] to [9] containing 1, 2, or 3 or more sugar alcohols selected from the group consisting of erythritol, mannitol, xylitol, isomalt, reduced starch syrup, reduced palatinose, reduced maltose starch syrup, maltitol, and sorbitol. ] The solid preparation or the compressed solid preparation according to any one of the items.
〔11〕
即時放出性である、〔1〕〜〔10〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
〔12〕
密封包装されていない、〔1〕〜〔11〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
〔13〕
気密包装されている、〔1〕〜〔12〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[11]
The solid preparation or compressed solid preparation according to any one of [1] to [10], which is an immediate release property.
[12]
The solid preparation or compressed solid preparation according to any one of [1] to [11], which is not hermetically packaged.
[13]
The solid preparation or compressed solid preparation according to any one of [1] to [12], which is airtightly packaged.
〔14〕
ポリ塩化ビニル、ポリプロピレン、又はポリエチレンを使用したブリスター包装を用いて気密包装されている、〔1〕〜〔13〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
〔15〕
錠剤である、〔1〕〜〔14〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
〔16〕
フィルムコーティングされた錠剤である、〔1〕〜〔15〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[14]
The solid preparation or compressed solid preparation according to any one of [1] to [13], which is airtightly packaged using a blister package using polyvinyl chloride, polypropylene, or polyethylene.
[15]
The solid preparation or compressed solid preparation according to any one of [1] to [14], which is a tablet.
[16]
The solid preparation or compressed solid preparation according to any one of [1] to [15], which is a film-coated tablet.
〔17〕
20N以上の硬度を有する、〔1〕〜〔16〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
〔18〕
20℃で測定した2%水溶液の粘度が2〜400mPa・sであるヒドロキシプロピル置換セルロースを含有する、〔1〕〜〔17〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[17]
The solid preparation or compressed solid preparation according to any one of [1] to [16], which has a hardness of 20 N or more.
[18]
The solid preparation or compressed solid preparation according to any one of [1] to [17], which contains hydroxypropyl-substituted cellulose having a viscosity of a 2% aqueous solution measured at 20 ° C. of 2 to 400 mPa · s.
〔19〕
圧縮固形製剤1個当たりのヒドロキシプロピル置換セルロースの含有量が圧縮固形製剤全体の質量の1〜15質量%である、〔1〕〜〔18〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[19]
The solid preparation or compressed solid according to any one of [1] to [18], wherein the content of hydroxypropyl-substituted cellulose per compressed solid preparation is 1 to 15% by mass of the total mass of the compressed solid preparation. pharmaceutical formulation.
〔20〕
ヒドロキシプロピル置換セルロースと、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの量比が、1質量部のヒドロキシプロピル置換セルロースに対して0.1〜10質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンである、〔1〕〜〔19〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[20]
The amount ratio of hydroxypropyl-substituted cellulose to starch modified with a carboxymethyl group or hydroxypropoxyl group is 0.1 to 10 parts by mass of carboxymethyl group or hydroxypropoxyl with respect to 1 part by mass of hydroxypropyl-substituted cellulose. The solid preparation or compressed solid preparation according to any one of [1] to [19], which is a starch modified with a group.
〔21〕
γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分と、ヒドロキシプロピル置換セルロースと、所望により任意の添加物を含有する湿式造粒物を含有する、〔1〕〜〔20〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[21]
Wet granulated product containing one or more active ingredients selected from the group consisting of a compound having a γ-aminobutyric acid structure and a pharmaceutically acceptable salt thereof, hydroxypropyl-substituted cellulose, and optionally any additive. The solid preparation or compressed solid preparation according to any one of [1] to [20], which comprises.
〔22〕
γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分と、ヒドロキシプロピル置換セルロースと、所望により任意の添加物を含有する流動層造粒物を含有する、〔1〕〜〔21〕のいずれか一項に記載の固形製剤又は圧縮固形製剤。
[22]
Flow layer granulation containing one or more active ingredients selected from the group consisting of a compound having a γ-aminobutyric acid structure and a pharmaceutically acceptable salt thereof, hydroxypropyl-substituted cellulose, and optionally any additive. The solid preparation or compressed solid preparation according to any one of [1] to [21], which contains a substance.
〔23〕
〔1〕〜〔22〕のいずれか一項に記載の固形製剤又は圧縮固形製剤の製造方法であって、以下の工程を含む方法:
(1) γ−アミノ酪酸構造を有する化合物または薬学的に許容可能なこれらの塩から選択される1以上の活性成分を、任意の添加剤とともに混合する工程、
(2) 混合物をヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程、
(3) 任意に、造粒物を1以上の任意の添加剤もしくは造粒物とともに混合する工程。
[23]
The method for producing a solid preparation or a compressed solid preparation according to any one of [1] to [22], which comprises the following steps:
(1) A step of mixing one or more active ingredients selected from a compound having a γ-aminobutyric acid structure or these pharmaceutically acceptable salts with an arbitrary additive.
(2) A step of spraying a hydroxypropyl-substituted cellulose solution to granulate the mixture.
(3) Arbitrarily, a step of mixing the granulated product with one or more arbitrary additives or the granulated product.
〔24〕
〔1〕〜〔23〕のいずれか一項に記載の固形製剤又は圧縮固形製剤の製造方法であって、以下の工程を含む方法。
(1) γ−アミノ酪酸構造を有する化合物または薬学的に許容可能なこれらの塩から選択される1以上の活性成分を、任意の添加剤とともに混合する工程、
(2) 混合物をヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程、
(3) 任意に、造粒物をカルボキシメチル基で修飾されたデンプンを含む1以上の任意の添加剤もしくは造粒物とともに混合する工程。
〔25〕
〔1〕〜〔24〕のいずれか一項に記載の固形製剤又は圧縮固形製剤の製造方法であって、以下の工程を含む方法。
(1) γ−アミノ酪酸構造を有する化合物または薬学的に許容可能なこれらの塩から選択される1以上の活性成分を、メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチン、デンプン、部分アルファー化デンプン、リン酸二水素カルシウム、及びヒドロキシプロピル置換セルロース以外のセルロース系添加物からなる群から選択される1、2、又は3以上の添加物を含有しない任意の添加剤とともに混合する工程、
(2) 混合物をヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程、
(3) 任意に、造粒物を1以上の任意の添加剤もしくは造粒物とともに混合する工程。
〔26〕
〔23〕〜〔25〕のいずれか一項に記載の製造方法によって製造された固形製剤又は圧縮固形製剤。
[24]
The method for producing a solid preparation or a compressed solid preparation according to any one of [1] to [23], which comprises the following steps.
(1) A step of mixing one or more active ingredients selected from a compound having a γ-aminobutyric acid structure or these pharmaceutically acceptable salts with an arbitrary additive.
(2) A step of spraying a hydroxypropyl-substituted cellulose solution to granulate the mixture.
(3) Optionally, a step of mixing the granulated product with one or more optional additives or granulated products containing starch modified with a carboxymethyl group.
[25]
The method for producing a solid preparation or a compressed solid preparation according to any one of [1] to [24], which comprises the following steps.
(1) One or more active ingredients selected from compounds having a γ-aminobutyric acid structure or pharmaceutically acceptable salts thereof, such as magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, and the like. Selected from the group consisting of cellulosic additives other than povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, gelatin, starch, partially pregelatinized starch, calcium dihydrogen phosphate, and hydroxypropyl substituted
(2) A step of spraying a hydroxypropyl-substituted cellulose solution to granulate the mixture.
(3) Arbitrarily, a step of mixing the granulated product with one or more arbitrary additives or the granulated product.
[26]
A solid preparation or a compressed solid preparation produced by the production method according to any one of [23] to [25].
本発明の圧縮固形製剤は、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する圧縮固形製剤であるにもかかわらず、打錠の衝撃を契機として生じる経時的なラクタム体の生成がほとんどない。本発明の固形製剤又は圧縮固形製剤は、40℃相対湿度75%の保存条件で6か月以上にわたってラクタム体の生成を1.0%以下に保つことができ、3年間の使用期限までの期間を通じて保存安定である。また、本発明の圧縮固形製剤は、これを、分割したり、解砕したりして、非圧縮状態にした後でもラクタム体の生成を1.0%以下に保つことができる。 Although the compressed solid preparation of the present invention is a compressed solid preparation containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, the formation of lactams over time triggered by the impact of tableting There is almost no. The solid preparation or compressed solid preparation of the present invention can maintain the production of lactams at 1.0% or less for 6 months or more under the storage condition of 40 ° C. and 75% relative humidity, and the period until the expiration date of 3 years. It is stable and preserved through. In addition, the compressed solid preparation of the present invention can maintain the production of lactam at 1.0% or less even after it is divided or crushed to make it in an uncompressed state.
本発明の圧縮固形製剤の包装形態によれば、γ−アミノ酪酸誘導体または薬学的に許容可能なこれらの塩を含有する圧縮固形製剤であるにもかかわらず、打錠の衝撃を契機として生じる経時的なラクタム体の生成がほとんどない。本発明の固形製剤又は圧縮固形製剤の包装形態によれば、3年間の使用期限までの期間を通じて保存安定であり、ラクタム体の生成を1.0%以下に保つことができる。 According to the packaging form of the compressed solid preparation of the present invention, although it is a compressed solid preparation containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, the time lapse caused by the impact of tableting is generated. There is almost no generation of typical lactam. According to the packaging form of the solid preparation or the compressed solid preparation of the present invention, the storage is stable throughout the period up to the expiration date of 3 years, and the production of lactams can be kept at 1.0% or less.
本発明の圧縮固形製剤は、経時的な硬度の低下がほとんど生じない。本発明の圧縮固形製剤は、製造から3年間の使用期限までの期間を通じて十分な硬度を保つことができる。
本発明の固形製剤又は圧縮固形製剤は、経時的な溶出性の低下が生じない。製造から3年間の使用期限までの期間を通じて十分な溶出性を保つことができる。また、本発明の圧縮固形製剤は、速やかに崩壊する。
The compressed solid preparation of the present invention hardly decreases in hardness with time. The compressed solid preparation of the present invention can maintain sufficient hardness throughout the period from production to the expiration date of 3 years.
The solid preparation or compressed solid preparation of the present invention does not cause a decrease in elution with time. Sufficient elution can be maintained throughout the period from production to the expiration date of 3 years. In addition, the compressed solid preparation of the present invention rapidly disintegrates.
γ−アミノ酪酸誘導体は、付着性が高く、摩擦係数が大きく、嵩高い性質を有し、圧縮成形性及び流動性が極めて乏しいにも拘らず、本発明の固形製剤又は圧縮固形製剤は、圧縮前の紛体が良好な流動性を有し、キャッピング、スティッキング、ラミネーションなどの打錠障害が生じにくく、歩留まり良く安定的に製造することができる。
本発明の固形製剤又は圧縮固形製剤は、γ−アミノ酪酸誘導体の苦みをマスクすることができる。
本発明の固形製剤又は圧縮固形製剤は、良好な含量均一性を有する。
本発明の圧縮固形製剤は、同一の主薬含量を有するカプセル剤よりも小さく、しかも、のどに付着しにくく、飲みやすい。
本発明の圧縮固形製剤は、フィルムコーティングすることができ、分割も可能である。
本発明の固形製剤又は圧縮固形製剤は、γ−アミノ酪酸誘導体の苦みをマスクすることができると同時に、良好な溶出性を有する。
本発明の固形製剤又は圧縮固形製剤が口腔内崩壊錠である場合には、良好な口腔内崩壊性及び口腔内の触感(マウスフィール)を有する。
本発明の固形製剤又は圧縮固形製剤は、爽快な服用感を有する。
本発明の固形製剤又は圧縮固形製剤は、上記の効果の1つ、2つ、3つ、あるいは4つ以上を同時に奏することができる。
Although the γ-aminobutyric acid derivative has high adhesiveness, a large coefficient of friction, and bulky properties, and has extremely poor compression moldability and fluidity, the solid preparation or compressed solid preparation of the present invention is compressed. The previous powder has good fluidity, is less likely to cause locking problems such as capping, sticking, and lamination, and can be stably produced with good yield.
The solid preparation or compressed solid preparation of the present invention can mask the bitterness of the γ-aminobutyric acid derivative.
The solid preparation or compressed solid preparation of the present invention has good content uniformity.
The compressed solid preparation of the present invention is smaller than a capsule having the same active ingredient content, and is less likely to adhere to the throat and is easy to swallow.
The compressed solid preparation of the present invention can be film-coated and can be divided.
The solid preparation or compressed solid preparation of the present invention can mask the bitterness of the γ-aminobutyric acid derivative and at the same time has good dissolution property.
When the solid preparation or the compressed solid preparation of the present invention is an orally disintegrating tablet, it has good orally disintegrating property and an oral texture (mouth feel).
The solid preparation or compressed solid preparation of the present invention has a refreshing feeling of ingestion.
The solid preparation or compressed solid preparation of the present invention can simultaneously exert one, two, three, or four or more of the above-mentioned effects.
本発明において、固形製剤とは、圧縮固形製剤のほか、散剤、顆粒剤、細粒剤、ドライシロップ、顆粒をカプセルに充填したカプセル剤、湿製錠、加熱溶融押出成型物等の固形の製剤をいう。固形製剤は、圧縮固形製剤の上位概念である。 In the present invention, the solid preparation is not only a compressed solid preparation but also a solid preparation such as a powder, a granule, a fine granule, a dry syrup, a capsule in which granules are filled in a capsule, a wet tablet, and a heat-melt extrusion molded product. say. The solid product is a superordinate concept of the compressed solid product.
本発明において、活性成分が添加物と接触しない製剤構造とは、活性成分と添加物とが接触して化学的な変化を生じない物理的または化学的な製剤構造をいう。活性成分が添加物と接触しない製剤構造は、例えば、複数の顆粒ないし造粒物(以下、「顆粒等」という。)を含有する製剤において、活性成分を含有する顆粒等及び添加物を含有する顆粒等のいずれか又は両方がコーティング剤により被覆されていることにより、活性成分と添加物とが接触して化学的な変化を生じない物理的または化学的な製剤構造である。複数の顆粒等を含有する製剤の例としては、複数の顆粒等を含有する錠剤、複数の顆粒等を含有するカプセル剤、複数の顆粒等を含有する散剤、複数の顆粒等を含有する顆粒剤、複数の顆粒等を含有するドライシロップなどがある。また、例えば、有核錠の内核又は外殻のいずれか一方に活性成分が存在し、他の一方に添加物が存在する製剤構造もまた、活性成分が添加物と接触しない製剤構造である。同様に、2層錠のいずれか一方に活性成分が存在し、他の一方に添加物が存在する製剤構造もまた、活性成分が添加物と接触しない製剤構造である。活性成分が保存安定性を損なう添加物と接触しない製剤構造は、また、例えば、保存安定性を損なう添加物を含有しないことにより、活性成分が保存安定性を損なう添加物と接触しない製剤構造である。活性成分が、セルロース系添加物と接触しない製剤構造は、例えば、活性成分とセルロース系添加物が接触して化学的な変化を生じない物理的または化学的な製剤構造の他に、セルロース系添加物を含有しないことにより活性成分とセルロース系添加物が接触しない製剤構造がある。同様に、活性成分が、メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチン、デンプン、部分アルファー化デンプン、リン酸二水素カルシウムからなる群から選択される添加物と接触しない製剤構造には、これらの添加物と活性成分が接触して化学的な変化を生じない物理的または化学的な製剤構造の他に、これらの添加物を含有しないことによりこれらの添加物と活性成分が接触しない構造がある。 In the present invention, the pharmaceutical structure in which the active ingredient does not come into contact with the additive refers to a physical or chemical pharmaceutical structure in which the active ingredient and the additive do not come into contact with each other and cause a chemical change. The pharmaceutical structure in which the active ingredient does not come into contact with the additive is, for example, in a pharmaceutical product containing a plurality of granules or granules (hereinafter, referred to as “granule or the like”), which contains granules or the like containing the active ingredient and the additive. Since either or both of the granules and the like are coated with a coating agent, the active ingredient and the additive do not come into contact with each other to cause a chemical change, which is a physical or chemical pharmaceutical structure. Examples of a preparation containing a plurality of granules include a tablet containing a plurality of granules, a capsule containing a plurality of granules, a powder containing a plurality of granules, and a granule containing a plurality of granules. , Dry syrup containing a plurality of granules and the like. Further, for example, a pharmaceutical structure in which the active ingredient is present in either the inner core or the outer shell of the nucleated tablet and the additive is present in the other one is also a pharmaceutical structure in which the active ingredient does not come into contact with the additive. Similarly, a pharmaceutical structure in which the active ingredient is present in one of the two-layer tablets and the additive is present in the other is also a pharmaceutical structure in which the active ingredient does not come into contact with the additive. A formulation structure in which the active ingredient does not come into contact with an additive that impairs storage stability is also a formulation structure in which the active ingredient does not come into contact with an additive that impairs storage stability, for example, by not containing an additive that impairs storage stability. be. The formulation structure in which the active ingredient does not come into contact with the cellulosic additive is, for example, a cellulosic addition in addition to a physical or chemical formulation structure in which the active ingredient and the cellulose additive do not come into contact with each other to cause a chemical change. There is a formulation structure in which the active ingredient and the cellulosic additive do not come into contact with each other because the substance is not contained. Similarly, the active ingredients are magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, gelatin, starch, partially pregelatinized starch, In addition to the physical or chemical formulation structure in which these additives and the active ingredient do not come into contact with each other and cause no chemical change, the formulation structure selected from the group consisting of calcium dihydrogen phosphate does not come into contact with the additives. In addition, there is a structure in which the active ingredient does not come into contact with these additives because they are not contained.
本発明の固形製剤又は圧縮固形製剤は、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有し、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有しない、固形製剤又は圧縮固形製剤である。
ここで、γ−アミノ酪酸誘導体とは、γ−アミノ酪酸の構造を有する化合物である限り特に限定されない。γ−アミノ酪酸構造を有する化合物とは、望ましくは、γ−アミノ酪酸の3位が置換されたγ−アミノ酪酸誘導体であり、プレガバリン、ガバペンチン、又はバクロフェンがさらに望ましい。
The solid or compressed solid product of the present invention is a solid or compressed solid product containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof and containing no cellulosic additives other than hydroxypropyl-substituted cellulose. be.
Here, the γ-aminobutyric acid derivative is not particularly limited as long as it is a compound having a structure of γ-aminobutyric acid. The compound having a γ-aminobutyric acid structure is preferably a γ-aminobutyric acid derivative in which the 3-position of γ-aminobutyric acid is substituted, and pregabalin, gabapentin, or baclofen is more preferable.
γ−アミノ酪酸誘導体は、その構造的特徴によって、いずれも分子内のアミノ基とカルボキシル基が脱水縮合してラクタム体を形成しやすいという共通した特質があり、医薬品として製剤化するためには、使用期限内のラクタム体の生成を1.0%以下に保たなければならないという点で、共通の課題を有しており、かかる課題は、本願発明の課題解決手段によって共通して解決しうるものである。 Due to their structural characteristics, γ-aminobutyric acid derivatives all have the common characteristic that intramolecular amino groups and carboxyl groups are easily dehydrated and condensed to form lactams. It has a common problem in that the production of lactams within the expiration date must be kept at 1.0% or less, and such a problem can be solved in common by the problem-solving means of the present invention. It is a thing.
γ−アミノ酪酸誘導体の薬学的に許容可能な塩は、製剤化可能である限り特に限定されない。
セルロース骨格とは、下記式VIIのような構成単位が任意の数(n個)連結したポリマーをいう。
The pharmaceutically acceptable salt of the γ-aminobutyric acid derivative is not particularly limited as long as it can be formulated.
The cellulose skeleton refers to a polymer in which an arbitrary number (n) of structural units are linked, such as the formula VII below.
式VII セルロース骨格
Formula VII Cellulose Skeleton
ヒドロキシプロピルセルロース(以下、「HPC」ともいう。)とは、セルロースのブドウ糖残基のアルコールの一部をヒドロキシプロポキシル基(−OC3H6OH)で置換したセルロースであって、乾燥重量中の53.4%〜77.5%がヒドロキシプロポキシル基であるセルロースである。HPCは、セルロースの水酸基を酸化プロピレンでエーテル化することで得られる。HPCは、セルロースと異なり、水、アルコール類に溶ける。HPCは、水を加えると粘り気のある液となり、フィルム形成能が高いためフィルムコーティング剤として用いられる。また、HPCは、錠剤や顆粒剤の結合剤として使用される。 Hydroxypropylcellulose (hereinafter, also referred to as "HPC".) And is a cellulose obtained by substituting a part of the alcohol of glucose residues Cellulose hydroxypropoxyl group (-OC 3 H 6 OH), dry weight in 53.4% to 77.5% of the cellulose is a hydroxypropoxyl group. HPC is obtained by etherifying the hydroxyl groups of cellulose with propylene oxide. Unlike cellulose, HPC is soluble in water and alcohols. HPC becomes a viscous liquid when water is added, and is used as a film coating agent because of its high film-forming ability. HPC is also used as a binder for tablets and granules.
HPCは、例えば、日本曹達株式会社から、HPC−SSL、HPC−SL、HPC−L、HPC−M、HPC−Hの商品名で各種のグレードの製品が市販されている。
HPC−SSLは、フィルムコーティング及び造粒・結合用のグレードであり、20℃で測定した2%水溶液の粘度が2〜2.9mPa・s、GPC法により測定した分子量は約40KDaである。HPC−SSLは、50%粒子径(D50)が85〜185μmである通常粒子タイプと、50%粒子径(D50)が20μmである超微粒子タイプの2種類が市販されている。
As for HPC, for example, products of various grades are commercially available from Nippon Soda Co., Ltd. under the trade names of HPC-SSL, HPC-SL, HPC-L, HPC-M, and HPC-H.
HPC-SSL is a grade for film coating and granulation / bonding. The viscosity of a 2% aqueous solution measured at 20 ° C. is 2 to 2.9 mPa · s, and the molecular weight measured by the GPC method is about 40 kDa. Two types of HPC-SSL are commercially available: a normal particle type having a 50% particle size (D50) of 85 to 185 μm and an ultrafine particle type having a 50% particle size (D50) of 20 μm.
HPC−SLは、フィルムコーティング用及び造粒・結合用のグレードであり、20℃で測定した2%水溶液の粘度が3〜5.9mPa・s、GPC法により測定した分子量は約100KDaである。HPC−SLは、50%粒子径(D50)が85〜185μmである通常粒子タイプと、50%粒子径(D50)が80〜110μmである微粒子タイプの2種類が市販されている。 HPC-SL is a grade for film coating and granulation / bonding. The viscosity of a 2% aqueous solution measured at 20 ° C. is 3 to 5.9 mPa · s, and the molecular weight measured by the GPC method is about 100 kDa. Two types of HPC-SL are commercially available: a normal particle type having a 50% particle size (D50) of 85 to 185 μm and a fine particle type having a 50% particle size (D50) of 80 to 110 μm.
HPC−Lは、フィルムコーティング用及び造粒・結合用のグレードであり、20℃で測定した2%水溶液の粘度が6〜10mPa・s、GPC法により測定した分子量は約140KDaである。HPC−Lは、50%粒子径(D50)が85〜185μmである通常粒子タイプと、50%粒子径(D50)が80〜110μmである微粒子タイプの2種類が市販されている。 HPC-L is a grade for film coating and granulation / bonding. The viscosity of a 2% aqueous solution measured at 20 ° C. is 6 to 10 mPa · s, and the molecular weight measured by the GPC method is about 140 kDa. Two types of HPC-L are commercially available: a normal particle type having a 50% particle size (D50) of 85 to 185 μm and a fine particle type having a 50% particle size (D50) of 80 to 110 μm.
HPC−Mは、造粒・結合用及び徐放性製剤用のグレードであり、20℃で測定した2%水溶液の粘度が150〜400mPa・s、GPC法により測定した分子量は約620KDaである。HPC−Mは、50%粒子径(D50)が85〜185μmである通常粒子タイプと、50%粒子径(D50)が80〜110μmである微粒子タイプの2種類が市販されている。 HPC-M is a grade for granulation / binding and sustained release preparation, and the viscosity of a 2% aqueous solution measured at 20 ° C. is 150 to 400 mPa · s, and the molecular weight measured by the GPC method is about 620 kDa. Two types of HPC-M are commercially available: a normal particle type having a 50% particle size (D50) of 85 to 185 μm and a fine particle type having a 50% particle size (D50) of 80 to 110 μm.
HPC−Hは、徐放性製剤用のグレードであり、20℃で測定した2%水溶液の粘度が1000〜4000mPa・s、GPC法により測定した分子量は約910KDaである。HPC−Hは、50%粒子径(D50)が85〜185μmである通常粒子タイプと、50%粒子径(D50)が20μmである超微粒子タイプがある。 HPC-H is a grade for sustained release preparation, and the viscosity of a 2% aqueous solution measured at 20 ° C. is 1000 to 4000 mPa · s, and the molecular weight measured by the GPC method is about 910 kDa. HPC-H includes a normal particle type having a 50% particle size (D50) of 85 to 185 μm and an ultrafine particle type having a 50% particle size (D50) of 20 μm.
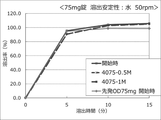
本発明の固形製剤又は圧縮固形製剤に用いるHPCのグレードは、HPC−SSL、HPC−SL、HPC−L、又はHPC−Mに相当するグレードのHPCが好ましく、HPC−SL又はHPC−Lに相当するグレードのHPCがより好ましく、HPC−Lに相当するグレードのHPCが特に好ましい。したがって、本発明の固形製剤又は圧縮固形製剤に用いるHPCの2%水溶液を20℃で測定したときの粘度は、好ましくは2〜400mPa・sであり、より好ましくは3〜10mPa・sであり、特に好ましくは6〜10mPa・sである。
本発明の固形製剤又は圧縮固形製剤に用いるHPCの粒子径としては、50%粒子径(D50)が85〜185μmである通常粒子タイプが好ましい。
The grade of HPC used in the solid preparation or compressed solid preparation of the present invention is preferably HPC-SSL, HPC-SL, HPC-L, or HPC of a grade corresponding to HPC-M, and corresponds to HPC-SL or HPC-L. HPC of the grade to be used is more preferable, and HPC of the grade corresponding to HPC-L is particularly preferable. Therefore, the viscosity of the 2% aqueous solution of HPC used in the solid preparation or the compressed solid preparation of the present invention measured at 20 ° C. is preferably 2 to 400 mPa · s, more preferably 3 to 10 mPa · s. Particularly preferably, it is 6 to 10 mPa · s.
As the particle size of HPC used in the solid preparation or the compressed solid preparation of the present invention, a normal particle type having a 50% particle size (D50) of 85 to 185 μm is preferable.
式VIII ヒドロキシプロピルセルロースの構造
Structure of Formula VIII Hydroxypropyl Cellulose
低置換度ヒドロキシプロピルセルロース(以下、「L−HPC」ともいう。)とは、セルロースのブドウ糖残基のアルコールの一部をヒドロキシプロポキシル基(−OC3H6OH)で置換したセルロースであって、乾燥重量の5.0%〜16.0%のヒドロキシプロポキシル基(−OC3H6OH)を含有するセルロースである。L−HPCは、セルロースのブドウ糖1単位当たり0.1〜0.4のヒドロキシプロピル基を含有する。HPCとL−HPCとは、ヒドロキシプロポキシル基による置換率が異なるが、それ以外の点は共通する。HPCとL−HPCの性質の違いとしては、HPCが水溶性であるのに対し、L−HPCは水には不溶性であるが、吸水して膨潤する。この性質を利用して、L−HPCは経口固形医薬製剤の崩壊剤として利用しうる。また、L−HPCは繊維状であるため、錠剤の硬度を高める作用を有し、水との練合物が結合性を持つことから結合剤としても用いうる。 Low-substituted hydroxypropylcellulose (hereinafter, also referred to as "L-HPC".) And is a cellulose obtained by substituting a part of the alcohol of glucose residues Cellulose hydroxypropoxyl group (-OC 3 H 6 OH) Te, cellulose containing dry weight 5.0% 16.0% of hydroxypropoxy (-OC 3 H 6 OH). L-HPC contains 0.1-0.4 hydroxypropyl groups per unit of glucose glucose in cellulose. HPC and L-HPC differ in the substitution rate due to the hydroxypropoxyl group, but other points are common. The difference in properties between HPC and L-HPC is that HPC is water-soluble, whereas L-HPC is insoluble in water, but absorbs water and swells. Taking advantage of this property, L-HPC can be used as a disintegrant for oral solid pharmaceutical preparations. Further, since L-HPC is fibrous, it has an effect of increasing the hardness of tablets, and since the kneaded product with water has a binding property, it can also be used as a binder.
本明細書においては、ヒドロキシプロポキシル基(−OC3H6OH)で置換されたセルロースを、その置換の割合に関わらず、ヒドロキシプロピル置換セルロース(以下、「HP置換セルロース」ともいう。)と呼ぶ。本明細書においては、HPCとL−HPCを区別して別の物として扱い、HPCとL−HPCの両方を包含する上位概念としてヒドロキシプロピル置換セルロース(又は「HP置換セルロース」)の用語を用いる。
本発明において使用するヒドロキシプロピル置換セルロースのヒドロキシプロポキシル基の乾燥重量%は、好ましくは4.0%〜80.0%であり、より好ましくは5.0%〜77.5%であり、さらに好ましくは53.0%〜81.0%であり、よりさらに好ましくは53.4%〜77.5%であり、特に好ましくは50.0%〜75.0%である。
In this specification, the cellulose substituted with hydroxypropoxyl group (-OC 3 H 6 OH), regardless the percentage of the substitution, hydroxypropyl-substituted cellulose (hereinafter also referred to as "HP-substituted celluloses.") And Call. In the present specification, HPC and L-HPC are treated as different substances, and the term hydroxypropyl-substituted cellulose (or "HP-substituted cellulose") is used as a superordinate concept including both HPC and L-HPC.
The dry weight% of the hydroxypropoxyl group of the hydroxypropyl-substituted cellulose used in the present invention is preferably 4.0% to 80.0%, more preferably 5.0% to 77.5%, and further. It is preferably 53.0% to 81.0%, even more preferably 53.4% to 77.5%, and particularly preferably 50.0% to 75.0%.
ヒドロキシプロピル置換セルロース以外のセルロース系添加物は、γ−アミノ酪酸構造を有する化合物を含有する固形製剤又は圧縮固形製剤において経時的なラクタム体の生成を促進して、その保存安定性を損なう。したがって、本発明の固形製剤又は圧縮固形製剤は、γ−アミノ酪酸構造を有する化合物が、ヒドロキシプロピル置換セルロース以外のセルロース系添加物から選択される1、2、または3以上のセルロース系添加物と接触しないことを特徴とする。 Cellulose-based additives other than hydroxypropyl-substituted cellulose promote the formation of lactams over time in solid preparations or compressed solid preparations containing compounds having a γ-aminobutyric acid structure, and impair their storage stability. Therefore, in the solid preparation or the compressed solid preparation of the present invention, the compound having a γ-aminobutyric acid structure is one, two, or three or more cellulosic additives selected from cellulosic additives other than hydroxypropyl-substituted cellulose. It is characterized by not touching.
ここで、γ−アミノ酪酸構造を有する化合物が、ヒドロキシプロピル置換セルロース以外のセルロース系添加物から選択される1、2、または3以上のセルロース系添加物と接触しない固形製剤又は圧縮固形製剤の好ましい態様は、以下のとおりである。 Here, a solid preparation or a compressed solid preparation in which the compound having a γ-aminobutyric acid structure does not come into contact with one, two, or three or more cellulosic additives selected from cellulosic additives other than hydroxypropyl-substituted cellulose is preferable. The aspects are as follows.
本発明の固形製剤又は圧縮固形製剤は、ヒドロキシプロピル置換セルロース以外のセルロース系添加物から選択される1、2、または3以上のセルロース系添加物を含有しないか、全く含有しない態様が好ましい。また、本発明の固形製剤又は圧縮固形製剤が、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有する場合には、γ−アミノ酪酸構造を有する化合物とヒドロキシプロピル置換セルロース以外のセルロース系添加物とが、接触しない構造となっていることが好ましい。γ−アミノ酪酸構造を有する化合物とヒドロキシプロピル置換セルロース以外のセルロース系添加物とが接触しない構造の具体例としては、γ−アミノ酪酸構造を有する化合物又はγ−アミノ酪酸構造を有する化合物を含有する造粒物を被覆することが好ましい。あるいは、γ−アミノ酪酸構造を有する化合物とヒドロキシプロピル置換セルロース以外のセルロース系添加物とが接触しない構造の具体例としては、ヒドロキシプロピル置換セルロース以外のセルロース系添加物又はヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有する造粒物を被覆することが好ましい。γ−アミノ酪酸構造を有する化合物又はγ−アミノ酪酸構造を有する化合物、並びに、ヒドロキシプロピル置換セルロース以外のセルロース系添加物又はヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有する造粒物の、双方を被覆することがさらに好ましい。γ−アミノ酪酸構造を有する化合物とヒドロキシプロピル置換セルロース以外のセルロース系添加物とが接触しない構造の具体例としては、また、γ−アミノ酪酸構造を有する化合物を内核に含有し、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を外核に含有する有核錠、又は、γ−アミノ酪酸構造を有する化合物を外核に含有し、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を内核に含有する有核錠が好ましい。 The solid preparation or compressed solid preparation of the present invention preferably does not contain, or does not contain at all, 1, 2, or 3 or more cellulosic additives selected from cellulosic additives other than hydroxypropyl-substituted cellulose. When the solid preparation or compressed solid preparation of the present invention contains a cellulosic additive other than hydroxypropyl-substituted cellulose, a compound having a γ-aminobutyric acid structure and a cellulosic additive other than hydroxypropyl-substituted cellulose are used. However, it is preferable that the structure does not come into contact with each other. Specific examples of the structure in which the compound having a γ-aminobutyric acid structure and the cellulosic additive other than hydroxypropyl-substituted cellulose do not come into contact include a compound having a γ-aminobutyric acid structure or a compound having a γ-aminobutyric acid structure. It is preferable to coat the granulated product. Alternatively, as a specific example of the structure in which the compound having a γ-aminobutyric acid structure and the cellulosic additive other than hydroxypropyl-substituted cellulose do not come into contact with each other, a cellulosic additive other than hydroxypropyl-substituted cellulose or a cellulose other than hydroxypropyl-substituted cellulose It is preferable to coat the granulated product containing the system additive. Both a compound having a γ-aminobutyric acid structure or a compound having a γ-aminobutyric acid structure, and a granulated product containing a cellulosic additive other than hydroxypropyl-substituted cellulose or a cellulosic additive other than hydroxypropyl-substituted cellulose. Is more preferred. As a specific example of a structure in which a compound having a γ-aminobutyric acid structure and a cellulosic additive other than hydroxypropyl-substituted cellulose do not come into contact with each other, a compound having a γ-aminobutyric acid structure is contained in the inner core and hydroxypropyl-substituted cellulose is used. A nucleated tablet containing a cellulosic additive other than that in the outer nucleus, or a nucleated tablet containing a compound having a γ-aminobutyric acid structure in the outer nucleus and containing a cellulosic additive other than hydroxypropyl-substituted cellulose in the inner nucleus. Tablets are preferred.
ヒドロキシプロピル置換セルロース以外のセルロース系添加物の具体例としては、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒が挙げられる。 Specific examples of cellulosic additives other than hydroxypropyl-substituted cellulose include crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carmellose potassium, croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, and hydroxy. Ethylmethyl cellulose, hydroxypropyl methyl cellulose, hypromellose acetate succinate, cellulose acetate, cellulose acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, methyl cellulose, ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules Can be mentioned.
したがって、本発明の固形製剤又は圧縮固形製剤は、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒からなる群から選択される1、2、または3以上のセルロース系添加物が、γ−アミノ酪酸構造を有する化合物と接触しないことを特徴とする。 Therefore, the solid preparation or compressed solid preparation of the present invention includes crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carmellose potassium, croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, hydroxyethyl methyl cellulose, A group consisting of hydroxypropylmethyl cellulose, hypromellose acetate succinate, cellulose acetate, phthalate acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, methyl cellulose, ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules. One, two, or three or more cellulosic additives selected from the above are not in contact with a compound having a γ-aminobutyric acid structure.
したがって、本発明の固形製剤又は圧縮固形製剤は、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒からなる群から選択される1、2、または3以上のセルロース系添加物を含有しないことを特徴とする。 Therefore, the solid preparation or compressed solid preparation of the present invention includes crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carmellose potassium, croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, hydroxyethyl methyl cellulose, A group consisting of hydroxypropylmethyl cellulose, hypromellose acetate succinate, cellulose acetate, phthalate acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, methyl cellulose, ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules. It is characterized by not containing 1, 2, or 3 or more cellulosic additives selected from.
本発明の固形製剤又は圧縮固形製剤は、結晶セルロース、酢酸セルロース、カルメロース、カルメロースカルシウム、カルメロースナトリウム、カルメロースカリウム、クロスカルメロースナトリウム、クロスカルメロースカルシウム、ヒドロキシエチルセルロース、ヒドロキシエチルメチルセルロース、ヒドロキシプロピルメチルセルロース、ヒプロメロース酢酸エステルコハク酸エステル、酢酸セルロース、酢酸フタル酸セルロース、ヒプロメロースフタル酸エステル、カルボキシメチルエチルセルロース、メチルセルロース、エチルセルロース、微結晶セルロース、粉末セルロース、乳糖・結晶セルロース球状顆粒からなる群から選択されるセルロース系添加物のいずれも含有しないことが、特に好ましい。 The solid preparation or compressed solid preparation of the present invention includes crystalline cellulose, cellulose acetate, carmellose, carmellose calcium, carmellose sodium, carmellose potassium, croscarmellose sodium, croscarmellose calcium, hydroxyethyl cellulose, hydroxyethyl methyl cellulose, hydroxypropyl. Select from the group consisting of methyl cellulose, hypromellose acetate succinate, cellulose acetate, phthalate acetate, hypromellose phthalate, carboxymethyl ethyl cellulose, methyl cellulose, ethyl cellulose, microcrystalline cellulose, powdered cellulose, lactose / crystalline cellulose spherical granules. It is particularly preferable that it does not contain any of the cellulosic additives to be produced.
最も好ましくは、本発明の固形製剤又は圧縮固形製剤は、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を全く含有しないことを特徴とする。 Most preferably, the solid or compressed solid preparation of the present invention is characterized by containing no cellulosic additives other than hydroxypropyl-substituted cellulose.
メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、及びゼラチン、デンプン、部分アルファー化デンプン、リン酸二水素カルシウムは、γ−アミノ酪酸誘導体を含有する固形製剤又は圧縮固形製剤において経時的なラクタム体の生成を促進して、その保存安定性を損なう。したがって、本発明の固形製剤又は圧縮固形製剤は、これらの添加物から選択される1、2、または3以上の添加物を含有しないことを特徴とする。 Magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, and gelatin, starch, partially pregelatinized starch, calcium dihydrogen phosphate In a solid preparation or a compressed solid preparation containing a γ-aminobutyric acid derivative, the formation of lactams over time is promoted, and the storage stability thereof is impaired. Therefore, the solid preparation or the compressed solid preparation of the present invention is characterized by containing no one, two, or three or more additives selected from these additives.
なお、メタケイ酸アルミン酸マグネシウムは、ノイシリン(商標、富士化学工業株式会社)の商品名で市販されている。 Magnesium aluminate metasilicate is commercially available under the trade name of Neucillin (trademark, Fuji Chemical Industries, Ltd.).
γ−アミノ酪酸誘導体を含有する圧縮固形製剤に、α化デンプン、白糖、アラビアゴム、及びゼラチンを微量(例えば1.7%)添加しただけで、圧縮固形製剤を40℃相対湿度75%で7日間保存した後の錠剤の硬度がゼロになってしまう。
したがって、本発明の圧縮固形製剤は、α化デンプン、白糖、アラビアゴム、及びゼラチンからなる群から選択される1、2、または3以上の添加物を1.7%以上含有しないことを特徴とする。より好ましくは、本発明の圧縮固形製剤は、α化デンプン、白糖、アラビアゴム、及びゼラチンからなる群から選択される1、2、または3以上の添加物を全く含有しないことを特徴とする。さらに好ましくは、本発明の圧縮固形製剤は、α化デンプン、白糖、アラビアゴム、及びゼラチンからなる群から選択される添加物のいずれも含有しないことを特徴とする。
By simply adding a small amount (for example, 1.7%) of pregelatinized starch, sucrose, gum arabic, and gelatin to the compressed solid preparation containing the γ-aminobutyric acid derivative, the compressed solid preparation is added at 40 ° C. and 75% relative humidity 7 The hardness of the tablet after storage for days becomes zero.
Therefore, the compressed solid preparation of the present invention is characterized by containing 1.7% or more of 1, 2, or 3 or more additives selected from the group consisting of pregelatinized starch, sucrose, gum arabic, and gelatin. do. More preferably, the compressed solid preparation of the present invention is characterized by containing no one, two, or three or more additives selected from the group consisting of pregelatinized starch, sucrose, gum arabic, and gelatin. More preferably, the compressed solid preparation of the present invention is characterized by containing no additive selected from the group consisting of pregelatinized starch, sucrose, gum arabic, and gelatin.
本発明の固形製剤又は圧縮固形製剤は、ヒドロキシプロピル置換セルロースを含有してもよい。当該ヒドロキシプロピル置換セルロースは、HPC又はL−HPCであることが好ましい。
ヒドロキシプロピル置換セルロースとしてHPCを用いる場合には主薬顆粒の造粒液として用いられることが望ましい。ヒドロキシプロピル置換セルロースを含有する造粒液は、水溶液、エタノール溶液、又はこれらの混合溶媒液として用いることが望ましい。
The solid preparation or compressed solid preparation of the present invention may contain hydroxypropyl-substituted cellulose. The hydroxypropyl-substituted cellulose is preferably HPC or L-HPC.
When HPC is used as the hydroxypropyl-substituted cellulose, it is desirable to use it as a granulation solution for the main drug granules. The granulation solution containing hydroxypropyl-substituted cellulose is preferably used as an aqueous solution, an ethanol solution, or a mixed solvent solution thereof.
本発明の固形製剤又は圧縮固形製剤の活性成分である、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩は、ヒドロキシプロピル置換セルロース溶液を噴霧しながら湿式造粒することが望ましい。ここで、ヒドロキシプロピル置換セルロースは、HPC又はL−HPCが好ましく、HPCがより好ましい。 It is desirable that the γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, which is the active ingredient of the solid preparation or the compressed solid preparation of the present invention, is wet-granulated while spraying a hydroxypropyl-substituted cellulose solution. Here, as the hydroxypropyl-substituted cellulose, HPC or L-HPC is preferable, and HPC is more preferable.
本発明の固形製剤又は圧縮固形製剤の活性成分である、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩は、ヒドロキシプロピル置換セルロース溶液を噴霧しながら流動層造粒法により製造することが望ましい。ここで、ヒドロキシプロピル置換セルロースは、HPC又はL−HPCが好ましく、HPCがより好ましい。 The γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, which is the active ingredient of the solid preparation or the compressed solid preparation of the present invention, can be produced by a fluidized bed granulation method while spraying a hydroxypropyl-substituted cellulose solution. desirable. Here, as the hydroxypropyl-substituted cellulose, HPC or L-HPC is preferable, and HPC is more preferable.
本発明の固形製剤又は圧縮固形製剤は、ヒドロキシプロピル置換セルロースを含有しても良く、ヒドロキシプロピル置換セルロースを添加することによって、良好な硬度を保つことができる。また、本発明の固形製剤又は圧縮固形製剤は、L−HPCを添加することによって、良好な溶出性を保つことができる。但し、ヒドロキシプロピル置換セルロースの量が多すぎると、経時的にラクタム体の量が増加する。したがって、本発明の固形製剤又は圧縮固形製剤中のヒドロキシプロピル置換セルロースの量は、所定の範囲内であることが望ましい。 The solid preparation or compressed solid preparation of the present invention may contain hydroxypropyl-substituted cellulose, and good hardness can be maintained by adding hydroxypropyl-substituted cellulose. Further, the solid preparation or the compressed solid preparation of the present invention can maintain good dissolution property by adding L-HPC. However, if the amount of hydroxypropyl-substituted cellulose is too large, the amount of lactam is increased over time. Therefore, it is desirable that the amount of hydroxypropyl-substituted cellulose in the solid preparation or the compressed solid preparation of the present invention is within a predetermined range.
本発明の固形製剤又は圧縮固形製剤1個当たりのヒドロキシプロピル置換セルロースの含有量は、好ましくは1.4〜14.8質量%(約1〜約15質量%)であり、さらに好ましくは1.4〜8.8質量%(約1〜約9質量%)であり、さらに好ましくは1.7〜8.4質量%(約1〜約8質量%)であり、よりさらに好ましくは1.9〜4.4質量%(約2〜約4質量%)であり、最も好ましくは4.2〜4.6質量%である。
ここで、ヒドロキシプロピル置換セルロースとしてはHPCがより好ましく、本発明の固形製剤又は圧縮固形製剤1個当たりのHPCの含有量は、好ましくは1.4〜9.6質量%(約1〜約10質量%)であり、さらに好ましくは1.7〜8.4質量%(約2〜約8質量%)であり、さらに好ましくは1.5〜5.9質量%(約2〜約6質量%)であり、よりさらに好ましくは1.9〜4.4質量%(約2〜約4質量%)であり、最も好ましくは4.2〜4.6質量%である。
The content of hydroxypropyl-substituted cellulose per solid preparation or compressed solid preparation of the present invention is preferably 1.4 to 14.8% by mass (about 1 to about 15% by mass), and more preferably 1. It is 4 to 8.8% by mass (about 1 to about 9% by mass), more preferably 1.7 to 8.4% by mass (about 1 to about 8% by mass), and even more preferably 1.9. It is ~ 4.4% by mass (about 2 to about 4% by mass), and most preferably 4.2 to 4.6% by mass.
Here, HPC is more preferable as the hydroxypropyl-substituted cellulose, and the content of HPC per solid preparation or compressed solid preparation of the present invention is preferably 1.4 to 9.6% by mass (about 1 to about 10%). Mass%), more preferably 1.7 to 8.4 mass% (about 2 to about 8 mass%), still more preferably 1.5 to 5.9 mass% (about 2 to about 6 mass%). ), More preferably 1.9 to 4.4% by mass (about 2 to about 4% by mass), and most preferably 4.2 to 4.6% by mass.
本発明の固形製剤又は圧縮固形製剤におけるラクタム体の生成は、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン、及び糖アルコールからなる群から選択される1以上の成分を含有することによって抑制することができる。したがって、本発明の固形製剤又は圧縮固形製剤は、カルボキシメチル基で修飾されたデンプン、ヒドロキシプロポキシル基で修飾されたデンプン、及び糖アルコールからなる群から選択される1以上の成分を含有することが望ましい。 The formation of lactams in the solid or compressed solids of the present invention is suppressed by containing one or more components selected from the group consisting of starch modified with a carboxymethyl group or a hydroxypropoxyl group, and a sugar alcohol. can do. Therefore, the solid preparation or the compressed solid preparation of the present invention contains one or more components selected from the group consisting of starch modified with a carboxymethyl group, starch modified with a hydroxypropoxyl group, and a sugar alcohol. Is desirable.
本発明の固形製剤又は圧縮固形製剤は、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンを含有することによって、経時的なラクタム体の生成を抑制することができる。経時的なラクタム体の生成抑制のために好ましい修飾されたデンプンは、ヒドロキシプロピルスターチ、又はカルボキシメチル基で修飾されたデンプンであり、カルボキシメチル基で修飾されたデンプンとしては、カルボキシメチルスターチのナトリウム塩(以下、「CMS・Na」ということがある。)が好ましい。カルボキシメチルスターチのナトリウム塩は、別名として、デンプングリコール酸ナトリウムとも呼ばれ、例えば、プリモジェル(商標)の商品名で販売されている。 The solid preparation or compressed solid preparation of the present invention can suppress the formation of lactams over time by containing starch modified with a carboxymethyl group or a hydroxypropoxyl group. The preferred modified starch for suppressing the production of lactams over time is hydroxypropyl starch or starch modified with a carboxymethyl group, and the starch modified with a carboxymethyl group is sodium carboxymethyl starch. A salt (hereinafter, may be referred to as "CMS / Na") is preferable. The sodium salt of carboxymethyl starch is also known as sodium starch glycolate, and is sold under the trade name of Primogel ™, for example.
本発明の固形製剤又は圧縮固形製剤においては、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する湿式造粒物を別途作製し(以下、「主薬顆粒」と言うことがある。)、これを、カルボキシメチル基で修飾されたデンプンを含有する組成物(以下、「後添加物(あとてんかぶつ)」と言うことがある。)と混合して打錠することが好ましく、前記湿式造粒物は、流動層造粒物であることがさらに好ましい。なお、主薬顆粒と混合して用いる成分を「後添加物(あとてんかぶつ)」ということがある。 In the solid preparation or compressed solid preparation of the present invention, a wet granule containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof is separately prepared (hereinafter, may be referred to as “base drug granule”. ), This is preferably mixed with a composition containing starch modified with a carboxymethyl group (hereinafter, may be referred to as "post-additive (post-tenkabutsu)") and tableted. The wet granulated product is more preferably a fluidized layer granulated product. In addition, the component used by mixing with the main ingredient granules is sometimes called "post-additive (post-tenkabutsu)".
本発明の固形製剤又は圧縮固形製剤において好ましい糖アルコールの例としては、マンニトール、ソルビトール、エリスリトール、キシリトール、イソマルト、オリゴ糖アルコール、還元水飴、還元パラチノース、還元麦芽糖水飴、マルチトール、が挙げられる。本発明の固形製剤又は圧縮固形製剤において用いるより好ましい糖アルコールとしては、ソルビトール、イソマルト、D−マンニトール、還元麦芽糖水飴、マルチトールがより好ましく、還元麦芽糖水飴又はD−マンニトールが特に好ましい。 Examples of preferable sugar alcohols in the solid preparation or compressed solid preparation of the present invention include mannitol, sorbitol, erythritol, xylitol, isomalt, oligosaccharide alcohol, reduced starch syrup, reduced palatinose, reduced maltose starch syrup, and maltitol. As the more preferable sugar alcohol used in the solid preparation or the compressed solid preparation of the present invention, sorbitol, isomalt, D-mannitol, reduced maltose starch syrup, and maltitol are more preferable, and reduced maltose starch syrup or D-mannitol is particularly preferable.
ここで、イソマルトとは、α−D−グルコピラノース−1,6−ソルビトール(グルコースとソルビトールが結合した二糖)とα−D−グルコピラノシド−1,6−マンニトール(グルコースとマンニトールが結合した二糖)が1対1の比率で混じっている等モル混合物をいう。イソマルトには、糖衣用タイプ(例えばBENEO−Palatinit 社のgalenIQ980)、直打用タイプ(例えば同社のgalenIQ720)、トローチ用タイプ(例えば同 社のgalenIQ990)、カプセル充填用タイプ(例えば同社のgalenIQ960)、湿式造粒用タイプ(例えば同社のgalenIQ800)などの各種があり、本発明に用いるイソマルトは湿式造粒用タイプのイソマルトが好ましい。 Here, isomalt is α-D-glucopyranose-1,6-sorbitol (disaccharide in which glucose and sorbitol are bound) and α-D-glucopyranoside-1,6-mannitol (disaccharide in which glucose and mannitol are bound). ) Is a mixture of isomalts mixed in a ratio of 1: 1. Isomalt includes sugar coating type (for example, BENEO-Palatinit's galenIQ980), direct hit type (for example, the same company's galenIQ720), troche type (for example, the same company's galenIQ990), and capsule filling type (for example, the same company's galenIQ960). There are various types such as a wet granulation type (for example, galenIQ800 of the same company), and the isomalt used in the present invention is preferably a wet granulation type isomalt.
本発明のγ−アミノ酪酸誘導体を含有する固形製剤又は圧縮固形製剤は、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン、及び糖アルコールからなる群から選択される1以上の成分を含有することによって、圧縮後の経時的なラクタム体の生成を抑制することができる。本発明の固形製剤又は圧縮固形製剤において、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン、及び糖アルコールからなる群から選択される1以上の成分は、主薬顆粒中に添加しても、後添加物中に添加しても良い。主薬顆粒に添加する場合には、主薬顆粒の結合性γ−アミノ酪酸誘導体または薬学的に許容可能なその塩とともに湿式造粒することが好ましく、流動層造粒することがさらに好ましい。後添加物中に添加する場合には、粉末のままで他の添加物と混合して用いることができる。 The solid preparation or compressed solid preparation containing the γ-aminobutyric acid derivative of the present invention contains one or more components selected from the group consisting of starch modified with a carboxymethyl group or a hydroxypropoxyl group, and a sugar alcohol. This makes it possible to suppress the formation of lactams over time after compression. In the solid preparation or compressed solid preparation of the present invention, one or more components selected from the group consisting of starch modified with a carboxymethyl group or a hydroxypropoxyl group and a sugar alcohol may be added to the main ingredient granules. It may be added in the post-additive. When added to the main drug granules, wet granulation is preferable with the binding γ-aminobutyric acid derivative of the main drug granules or a pharmaceutically acceptable salt thereof, and fluidized bed granulation is more preferable. When added to a post-additive, it can be used as a powder by mixing with other additives.
本発明の固形製剤又は圧縮固形製剤は、湿式造粒物を含有することが好ましく、当該湿式造粒物は、所望により任意の添加物を含有することができる。ここで、含有しても良い任意の添加物は、以下に列挙する好ましくない添加物以外の添加物であれば特に限定されない。すなわち、ヒドロキシプロピル置換セルロース以外のセルロース系添加物、メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、ポビドン、クロスポビドン、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチン、デンプン、部分アルファー化デンプン、リン酸二水素カルシウム、白糖、又はアラビアゴム以外の添加物であれば特に限定されず、賦形剤、崩壊剤、結合剤、滑沢剤、着色剤、pH調整剤、界面活性剤、安定化剤、矯味剤、香料、流動化剤、コーティング基剤、コーティング添加剤等が挙げられる。これらの添加剤は、特に述べない限り、製剤分野において慣用の量が用いられる。 The solid preparation or compressed solid preparation of the present invention preferably contains a wet granulated product, and the wet granulated product can contain any additive if desired. Here, any additive that may be contained is not particularly limited as long as it is an additive other than the unfavorable additives listed below. That is, cellulosic additives other than hydroxypropyl-substituted cellulose, magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, titanium oxide, povidone, crospovidone, macrogol, sucrose fatty acid ester, stearic acid, gelatin, starch. , Partially pregelatinized starch, calcium dihydrogen phosphate, sucrose, or additives other than gum arabic are not particularly limited, and excipients, disintegrants, binders, lubricants, colorants, pH adjusters, Examples thereof include surfactants, stabilizers, flavoring agents, fragrances, fluidizing agents, coating bases, coating additives and the like. Unless otherwise specified, these additives are used in amounts commonly used in the pharmaceutical field.
賦形剤の例としては、ラクトース、マンニトール、キシリトール、エリスリトール、ソルビトール、マルチトール、フルクトース、乳糖、デキストロース、デキストリン/デキストレート、マルトデキストリン及び圧縮用糖類等の炭水化物;クエン酸カルシウム、リン酸カルシウム、炭酸カルシウム、リン酸二カルシウム及び硫酸カルシウム等の無機塩が挙げられる。 Examples of excipients are carbohydrates such as lactose, mannitol, xylitol, erythritol, sorbitol, martitol, fructose, lactose, dextrose, dextrin / dextrate, maltodextrin and saccharides for compression; calcium citrate, calcium phosphate, calcium carbonate. , Inorganic salts such as dicalcium phosphate and calcium sulfate.
崩壊剤の好適な例としては、カルボキシメチルスターチナトリウム、ヒドロキシプロピルセルロース、低置換度ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ等が挙げられる。なかでも、カルボキシメチルスターチナトリウム、低置換度ヒドロキシプロピルセルロースがより好ましい。 Preferable examples of the disintegrant include sodium carboxymethyl starch, hydroxypropyl cellulose, low-substituted hydroxypropyl cellulose, hydroxypropyl starch and the like. Of these, sodium carboxymethyl starch and low-substituted hydroxypropyl cellulose are more preferable.
結合剤の好適な例としては、ヒドロキシプロピルセルロースが挙げられる。 Preferable examples of the binder include hydroxypropyl cellulose.
滑沢剤の好適な例としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、フマル酸ステアリルナトリウム等が挙げられる。なかでも、ステアリン酸マグネシウム及びステアリン酸カルシウムがより好ましい。 Preferable examples of the lubricant include magnesium stearate, calcium stearate, talc, sodium stearyl fumarate and the like. Of these, magnesium stearate and calcium stearate are more preferable.
着色剤の好適な例としては、カロチノイド、酸化鉄、クロロフィル、及び着色料が挙げられる。着色料の例には、また、食用色素赤色第2号及び第3号、食用色素黄色第4号及び第5号、食用色素緑色第3号、食用色素青色第1及び第2号、これらの食用色素のアルミニウムレーキ、三二酸化鉄ならびに黄色三二酸化鉄等が挙げられる。 Preferable examples of colorants include carotenoids, iron oxides, chlorophyll, and colorants. Examples of colorants also include edible pigments red Nos. 2 and 3, edible pigments yellow Nos. 4 and 5, edible pigments green No. 3, edible pigments blue Nos. 1 and 2, these. Examples include food coloring aluminum lake, iron sesquioxide and yellow iron sesquioxide.
pH調整剤の好適な例としては、クエン酸、炭酸マグネシウム、酸化マグネシウム、水酸化マグネシウム、水酸化カリウム、水酸化ナトリウム、炭酸水素ナトリウム、炭酸ナトリウム、リン酸二水素ナトリウム、リン酸二水素カリウム、酢酸ナトリウム等が挙げられる。これらは1種又は2種以上を組み合わせて用いてもよい。 Suitable examples of pH adjusters include citric acid, magnesium carbonate, magnesium oxide, magnesium hydroxide, potassium hydroxide, sodium hydroxide, sodium hydrogen carbonate, sodium carbonate, sodium dihydrogen phosphate, potassium dihydrogen phosphate, Examples thereof include sodium acetate. These may be used alone or in combination of two or more.
界面活性剤の好適な例としては、ラウリル硫酸ナトリウム、ステアリン酸ナトリウム、ポリオキシエチレンソルビタンモノオレエート等が挙げられる。 Preferable examples of the surfactant include sodium lauryl sulfate, sodium stearate, polyoxyethylene sorbitan monooleate and the like.
安定化剤の好適な例としては、アスコルビン酸、エデト酸ナトリウム、エリソルビン酸、トコフェロール等が挙げられる。 Preferable examples of the stabilizer include ascorbic acid, sodium edetate, erythorbic acid, tocopherol and the like.
矯味剤の好適な例としては、クエン酸、リンゴ酸、酢酸、酒石酸、フマル酸、アスコルビン酸等の酸味料、サッカリン及びアスパルテーム等の甘味料が挙げられる。 Preferable examples of the flavoring agent include acidulants such as citric acid, malic acid, acetic acid, tartaric acid, fumaric acid and ascorbic acid, and sweeteners such as saccharin and aspartame.
香料の好適な例としては、メントール、ハッカ油、オレンジ油及びレモン油等が挙げられる。 Preferable examples of the fragrance include menthol, peppermint oil, orange oil, lemon oil and the like.
流動化剤の好適な例としては、タルク等が挙げられる。 Preferable examples of the fluidizing agent include talc and the like.
コーティング基剤の好適な例としては、糖衣基剤、水溶性フィルムコーティング基剤、腸溶性フィルムコーティング基剤、徐放性フィルムコーティング基剤等が挙げられる。 Preferable examples of the coating base include sugar coating bases, water-soluble film coating bases, enteric film coating bases, sustained release film coating bases and the like.
糖衣基剤としては、例えば、エリスリトール等の糖アルコールが用いられ、さらに、タルク、沈降炭酸カルシウム、プルラン、カルナウバロウ等から選ばれる1種又は2種以上を併用してもよい。 As the sugar coating base, for example, a sugar alcohol such as erythritol is used, and one or more selected from talc, precipitated calcium carbonate, pullulan, carnauba wax and the like may be used in combination.
水溶性フィルムコーティング基剤としては、例えば、ヒドロキシプロピルセルロース;ポリビニルアセタールジエチルアミノアセテート、アミノアルキルメタアクリレートコポリマーE等の合成高分子;プルラン等の多糖類等が挙げられる。 Examples of the water-soluble film coating base include hydroxypropyl cellulose; synthetic polymers such as polyvinyl acetal diethylaminoacetate and aminoalkyl methacrylate copolymer E; and polysaccharides such as pullulan.
腸溶性フィルムコーティング基剤としては、例えば、メタアクリル酸コポリマーL、メタアクリル酸コポリマーLD、メタアクリル酸コポリマーS等のアクリル酸系高分子;セラック等の天然物等が挙げられる。 Examples of the enteric film coating base include acrylic acid-based polymers such as methacrylic acid copolymer L, methacrylic acid copolymer LD, and methacrylic acid copolymer S; and natural products such as cellac.
徐放性フィルムコーティング基剤としては、例えば、アミノアルキルメタアクリレートコポリマーRS、アクリル酸エチル・メタアクリル酸メチル共重合体懸濁液等のアクリル酸系高分子等が挙げられる。 Examples of the sustained-release film coating base include acrylic acid-based polymers such as aminoalkyl methacrylate copolymer RS and ethyl acrylate / methyl methacrylate copolymer suspension.
コーティング添加剤の好適な例としては、タルク等の流動化剤、及び/又は三二酸化鉄、黄色三二酸化鉄等の着色剤;プロピレングリコール、クエン酸トリエチル、ヒマシ油、ポリソルベート類等の可塑剤;クエン酸、酒石酸、リンゴ酸、アスコルビン酸等の有機酸等が挙げられる。 Preferable examples of coating additives are fluidizers such as talc and / or colorants such as iron sesquioxide, yellow iron sesquioxide; plasticizers such as propylene glycol, triethyl citrate, castor oil, polysorbates; Examples thereof include organic acids such as citric acid, tartaric acid, malic acid and ascorbic acid.
上記した添加剤は、2種以上を適宜の割合で混合して使用してもよい。 The above-mentioned additives may be used by mixing two or more kinds in an appropriate ratio.
本発明の固形製剤又は圧縮固形製剤においてカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンを含有する場合には、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンをより多く添加することによって、ラクタム体の生成を抑制することができるとともに、良好な溶出性を得ることができる。一方で、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンをより多く添加することによって、経時的に硬度が低下する傾向が認められる。 When the solid preparation or compressed solid preparation of the present invention contains starch modified with a carboxymethyl group or a hydroxypropoxyl group, by adding more starch modified with a carboxymethyl group or a hydroxypropoxyl group, , The formation of lactam form can be suppressed, and good dissolution property can be obtained. On the other hand, by adding more starch modified with a carboxymethyl group or a hydroxypropoxyl group, the hardness tends to decrease with time.
したがって、本発明の固形製剤又は圧縮固形製剤においてカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンを含有する場合には、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの量は、所定の範囲内であることが好ましい。より好ましくは、カルボキシメチル基で修飾されたデンプンの量が所定の範囲内であることが好ましく、さらに好ましくは、カルボキシメチルスターチの量が所定の範囲内であることがより好ましく、よりさらに好ましくは、CMS・Naの量が所定の範囲内であることが特に好ましい。 Therefore, when the solid preparation or the compressed solid preparation of the present invention contains starch modified with a carboxymethyl group or a hydroxypropoxyl group, the amount of starch modified with a carboxymethyl group or a hydroxypropoxyl group is predetermined. It is preferably within the range of. More preferably, the amount of starch modified with a carboxymethyl group is preferably within a predetermined range, and even more preferably, the amount of carboxymethyl starch is more preferably within a predetermined range, even more preferably. It is particularly preferable that the amount of CMS / Na is within a predetermined range.
本発明の固形製剤又は圧縮固形製剤1個当たりのカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの量は、好ましくは2.2質量%〜4.6質量%であり、より好ましくは3.3質量%〜4.5質量%であり、さらに好ましくは4.2質量%〜4.6質量%である。 The amount of starch modified with a carboxymethyl group or a hydroxypropoxyl group per solid preparation or compressed solid preparation of the present invention is preferably 2.2% by mass to 4.6% by mass, and more preferably 3. It is .3% by mass to 4.5% by mass, and more preferably 4.2% by mass to 4.6% by mass.
本発明の固形製剤又は圧縮固形製剤においてHPCをより多く添加することによって、経時的な錠剤硬度の低下を抑制することができる。一方で、打錠による経時的なラクタム体の生成を最小限にするためには、HPCは少ないに越したことはない。
本発明の固形製剤又は圧縮固形製剤においてヒドロキシプロピル置換セルロースと、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンとを含有する場合には、ヒドロキシプロピル置換セルロースと、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの質量比が所定の範囲内であることが望ましい。
By adding a larger amount of HPC in the solid preparation or the compressed solid preparation of the present invention, it is possible to suppress a decrease in tablet hardness over time. On the other hand, in order to minimize the production of lactams over time by tableting, it is better to have less HPC.
When the solid preparation or compressed solid preparation of the present invention contains hydroxypropyl-substituted cellulose and starch modified with a carboxymethyl group or a hydroxypropoxyl group, the hydroxypropyl-substituted cellulose and carboxymethyl group or hydroxypropoxyl It is desirable that the mass ratio of the starch modified with the group is within a predetermined range.
本発明の固形製剤又は圧縮固形製剤においてHP置換セルロースと、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンを共に含有する場合には、ヒドロキシプロピル置換セルロースと、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの量比は、1質量部のヒドロキシプロピル置換セルロースに対して、夫々、好ましくは0.1〜10質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、より好ましくは0.25〜4.0質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、さらに好ましくは、0.25〜2.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、よりさらに好ましくは0.75〜2.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、なおさらに好ましくは0.25〜1.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、最も好ましくは0.75〜1.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンである。 When the solid preparation or compressed solid preparation of the present invention contains both HP-substituted cellulose and starch modified with a carboxymethyl group or a hydroxypropoxyl group, the hydroxypropyl-substituted cellulose and a carboxymethyl group or a hydroxypropoxyl group are used. The amount ratio of the starch modified with is 1 part by mass of hydroxypropyl substituted cellulose, preferably 0.1 to 10 parts by mass of starch modified with a carboxymethyl group or a hydroxypropoxyl group. More preferably, it is starch modified with 0.25 to 4.0 parts by mass of carboxymethyl group or hydroxypropoxyl group, and further preferably 0.25 to 2.3 parts by mass of carboxymethyl group or hydroxypropoxyl. Group-modified starch, more preferably 0.75 to 2.3 parts by mass of carboxymethyl group or hydroxypropoxyl group-modified starch, even more preferably 0.25 to 1.3. It is a starch modified with a carboxymethyl group or a hydroxypropoxyl group by mass, and most preferably a starch modified with 0.75 to 1.3 parts by mass of a carboxymethyl group or a hydroxypropoxyl group.
ここで、ヒドロキシプロピル置換セルロースとしてはHPCがより好ましく、本発明の固形製剤又は圧縮固形製剤においてカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンを含有する場合には、HPCとカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンの量比は、1質量部のHPCに対して、夫々、好ましくは0.1〜10質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、より好ましくは0.25〜4.0質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、さらに好ましくは、0.25〜2.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、よりさらに好ましくは0.75〜2.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、なおさらに好ましくは0.25〜1.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンであり、最も好ましくは0.75〜1.3質量部のカルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンである。 Here, HPC is more preferable as the hydroxypropyl-substituted cellulose, and when the solid preparation or compressed solid preparation of the present invention contains starch modified with a carboxymethyl group or a hydroxypropoxyl group, HPC and a carboxymethyl group or The amount ratio of the hydroxypropoxyl group-modified starch is preferably 0.1 to 10 parts by mass of carboxymethyl group or hydroxypropoxyl group-modified starch with respect to 1 part by mass of HPC. , More preferably 0.25 to 4.0 parts by mass of carboxymethyl group or hydroxypropoxyl group, still more preferably 0.25 to 2.3 parts by mass of carboxymethyl group or hydroxypropoxy. It is a starch modified with a ru group, more preferably 0.75 to 2.3 parts by mass of a carboxymethyl group or a hydroxypropoxyl group, and even more preferably 0.25 to 1. It is a starch modified with 3 parts by mass of carboxymethyl group or hydroxypropoxyl group, and most preferably 0.75 to 1.3 parts by mass of carboxymethyl group or hydroxypropoxyl group modified starch.
また、ここで、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンとしては、カルボキシメチル基で修飾されたデンプンが好ましく、CMSまたはCMS・Naがより好ましく、CMS・Naが特に好ましい。したがって、本発明の固形製剤又は圧縮固形製剤においてCMS又はCMS・Naを含有する場合には、HPCに対するCMS又はCMS・Naの量比は、1質量部のHPCに対して、夫々、好ましくは0.1〜10質量部のCMS又はCMS・Naであり、より好ましくは0.25〜4.0質量部のCMS又はCMS・Naであり、さらに好ましくは、0.25〜2.3質量部のCMS又はCMS・Naであり、よりさらに好ましくは0.75〜2.3質量部のCMS又はCMS・Naであり、なおさらに好ましくは0.25〜1.3質量部のCMS又はCMS・Naであり、最も好ましくは0.75〜1.3質量部のCMS又はCMS・Naである。 Further, as the starch modified with a carboxymethyl group or a hydroxypropoxyl group, starch modified with a carboxymethyl group is preferable, CMS or CMS / Na is more preferable, and CMS / Na is particularly preferable. Therefore, when CMS or CMS / Na is contained in the solid preparation or compressed solid preparation of the present invention, the amount ratio of CMS or CMS / Na to HPC is preferably 0 with respect to 1 part by mass of HPC, respectively. .1 to 10 parts by mass of CMS or CMS · Na, more preferably 0.25 to 4.0 parts by mass of CMS or CMS · Na, still more preferably 0.25 to 2.3 parts by mass. It is CMS or CMS · Na, more preferably 0.75 to 2.3 parts by mass of CMS or CMS · Na, and even more preferably 0.25 to 1.3 parts by mass of CMS or CMS · Na. Most preferably, it is 0.75 to 1.3 parts by mass of CMS or CMS · Na.
本発明の固形製剤又は圧縮固形製剤においては、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプン、及び糖アルコールをともに含有することが望ましい。 It is desirable that the solid preparation or the compressed solid preparation of the present invention contains both starch modified with a carboxymethyl group or a hydroxypropoxyl group and a sugar alcohol.
プレガバリンは、すみやかに吸収されて速やかに作用し、代謝されずにすみやかに排泄されることから、本発明の固形製剤又は圧縮固形製剤は、即時放出性の固形製剤又は圧縮固形製剤であることが望ましく、即時放出性の錠剤であることがさらに望ましい。ここで、即時放出性の固形製剤又は圧縮固形製剤とは、日本薬局方の溶出試験液中で15分以内に85%以上溶出する固形製剤又は圧縮固形製剤をいう。本発明の溶出性の確認に用いる日本薬局方の試験液とは、溶出試験第1液(pH1.2)、酢酸・酢酸ナトリウム緩衝液(pH4.0)、溶出試験第2液(pH6.8)、及び水の各溶出試験液をいう。本発明の固形製剤又は圧縮固形製剤は、チュアブル錠、フィルムコーティング錠、糖衣錠であっても良い。 Since pregabalin is rapidly absorbed, acts rapidly, and is rapidly excreted without being metabolized, the solid preparation or compressed solid preparation of the present invention may be an immediate release solid preparation or a compressed solid preparation. It is desirable and even more desirable is an immediate release tablet. Here, the immediate release solid preparation or compressed solid preparation refers to a solid preparation or a compressed solid preparation that elutes 85% or more within 15 minutes in the dissolution test solution of the Japanese Pharmacopoeia. The test solutions of the Japanese Pharmacopoeia used for confirming the dissolution property of the present invention are the dissolution test first solution (pH 1.2), the acetic acid / sodium acetate buffer solution (pH 4.0), and the dissolution test second solution (pH 6.8). ), And each elution test solution of water. The solid preparation or compressed solid preparation of the present invention may be a chewable tablet, a film-coated tablet, or a sugar-coated tablet.
あるいは、本発明の圧縮固形製剤の代わりに、圧縮前の顆粒又は粉末をそのまま用いても良い。
本発明の固形製剤又は圧縮固形製剤は、使用期限までの期間にわたって安定であり、使用期限内に発生するラクタム体の量は1.0%以下、好ましくは0.5%以下である。
本発明の固形製剤又は圧縮固形製剤の使用期限は、最低でも製造日から3年間、好ましくは製造日から5年間である。
Alternatively, instead of the compressed solid preparation of the present invention, the granules or powder before compression may be used as they are.
The solid preparation or compressed solid preparation of the present invention is stable over the period up to the expiration date, and the amount of lactam compound generated within the expiration date is 1.0% or less, preferably 0.5% or less.
The expiration date of the solid or compressed solid product of the present invention is at least 3 years from the date of manufacture, preferably 5 years from the date of manufacture.
本発明の固形製剤又は圧縮固形製剤は、気体難透過性の素材を使用した密封包装用素材(例えば、アルミラミネート袋)を用いて密封包装するのではなく、ポリ塩化ビニル、ポリプロピレン、ポリエチレン等の気体透過性の素材を使用した容器中に気密包装することにより、ラクタム体の生成が抑えられる。例えば、本発明の固形製剤又は圧縮固形製剤は、ポリ塩化ビニル、ポリプロピレン、ポリエチレン等の素材と、アルミシートを圧着したPTP包装(ブリスター包装)に気密包装することによって、より安定性を保つことができる。また、気密包装の包材として、ポリ塩化ビニリデンを用いることもでき、この場合、ポリ塩化ビニル、ポリプロピレン、及びポリエチレンよりも気体難透過性であるので、γ−アミノ酪酸誘導体の保存安定性を保つためにはポリ塩化ビニル、ポリプロピレン、及びポリエチレンよりも不利であるが、高湿度環境下でγ−アミノ酪酸誘導体の保存安定性を保つことができるという点ではメリットがある。 The solid preparation or compressed solid preparation of the present invention is not sealed and packaged using a material for sealing and packaging using a material that is impervious to gas (for example, an aluminum laminated bag), but is made of polyvinyl chloride, polypropylene, polyethylene, etc. By airtightly packaging in a container made of a gas permeable material, the formation of lactam is suppressed. For example, the solid formulation or compressed solid formulation of the present invention can be more stable by airtightly packaging a material such as polyvinyl chloride, polypropylene, polyethylene, etc. in PTP packaging (blister packaging) in which an aluminum sheet is crimped. can. Polyvinylidene chloride can also be used as the packaging material for airtight packaging. In this case, since it is more permeable to gas than polyvinyl chloride, polypropylene, and polyethylene, the storage stability of the γ-aminobutyric acid derivative is maintained. Therefore, it is disadvantageous compared to polyvinyl chloride, polypropylene, and polyethylene, but it has an advantage in that the storage stability of the γ-aminobutyric acid derivative can be maintained in a high humidity environment.
本発明において、密閉包装とは、通常の取扱い、運搬又は保存状態において、固形の異物が混入しない包装を意味する。紙袋、箱などは密閉包装である。
本発明において、気密包装とは、通常の取扱い、運搬又は保存状態において、固形又は液状の異物は侵入しないが、気体は通過することもやむを得ない包装を意味する。プラスチック製の包装はほとんどが気密包装に属する。
In the present invention, the closed packaging means a packaging in which solid foreign substances are not mixed under normal handling, transportation or storage. Paper bags, boxes, etc. are sealed.
In the present invention, the airtight packaging means a packaging in which solid or liquid foreign matter does not invade but gas must pass through in a normal handling, transportation or storage state. Most plastic packaging belongs to airtight packaging.
本発明において、密封包装とは、通常の取扱い、運搬又は保存状態において、気体の侵入しない包装を意味する。アンプル、バイアル、アルミラミネート袋は、密封包装である。
本発明において、密閉包装、気密包装、密封包装は互いに重複することがない概念であり、気密包装からは、密閉包装及び密封包装は除外される。
In the present invention, the sealed packaging means packaging that does not allow gas to enter under normal handling, transportation, or storage conditions. Ampoules, vials and aluminum laminated bags are sealed packaging.
In the present invention, airtight packaging, airtight packaging, and airtight packaging are concepts that do not overlap with each other, and airtight packaging and airtight packaging are excluded from airtight packaging.
本発明に用いる気密包装は、好ましくは気体難透過性ではない気密包装である。例えば、環状オレフィン重合体や、環状オレフィン共重合体などの気体難透過性の素材は、本発明の包装素材としては好ましくない。本発明の固形製剤又は圧縮固形製剤の包装に用いる気密包装の素材としては、好ましくは、ポリ塩化ビニル、ポリプロピレン、ポリエチレン等の素材である。 The airtight packaging used in the present invention is preferably an airtight packaging that is not impermeable to gas. For example, a gas-impermeable material such as a cyclic olefin polymer or a cyclic olefin copolymer is not preferable as the packaging material of the present invention. The material for the airtight packaging used for packaging the solid preparation or the compressed solid preparation of the present invention is preferably a material such as polyvinyl chloride, polypropylene, or polyethylene.
本発明の圧縮固形製剤は、使用期限中、好ましくは20N以上、より好ましくは25N以上、さらに好ましくは30N以上、よりさらに好ましくは35N以上、最も好ましくは40N以上の硬度を保つことができる。 The compressed solid preparation of the present invention can maintain a hardness of preferably 20 N or more, more preferably 25 N or more, still more preferably 30 N or more, still more preferably 35 N or more, and most preferably 40 N or more during the expiration date.
本発明の固形製剤又は圧縮固形製剤の好ましい製造方法は、以下の工程を含む。
(1)γ−アミノ酪酸誘導体または薬学的に許容可能なこれらの塩から選択される1以上の活性成分を、任意の添加剤とともに混合する工程、
(2)混合物をヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程、
(3)任意に、造粒物を少なくともカルボキシメチル基で修飾されたデンプンとともに混合する工程、
(4)任意に、前記(3)で得た混合物を圧縮して固形製剤を製造する工程。
A preferred method for producing a solid or compressed solid product of the present invention includes the following steps.
(1) A step of mixing one or more active ingredients selected from γ-aminobutyric acid derivatives or pharmaceutically acceptable salts thereof together with any additive.
(2) A step of spraying a hydroxypropyl-substituted cellulose solution to granulate the mixture.
(3) Optionally, a step of mixing the granulated product with starch modified with at least a carboxymethyl group,
(4) Arbitrarily, a step of producing a solid preparation by compressing the mixture obtained in (3) above.
ここで、工程(1)における任意の添加剤は、セルロース系添加物(ただし、ヒドロキシプロピル置換セルロースは使用しても良い)、メタケイ酸アルミン酸マグネシウム、軽質無水ケイ酸、含水二酸化ケイ素、酸化チタン、クロスポビドン、ポビドン、アラビアゴム、マクロゴール、ショ糖脂肪酸エステル、ステアリン酸、ゼラチン、リン酸二水素カルシウム、デンプン、α化デンプン、部分α化デンプン、白糖からなる群から選択される1以上の添加剤は使用しないことが好ましい。工程(1)における任意の添加剤は糖アルコールであることが好ましく、特に好ましい糖アルコールの例としては、マンニトール、ソルビトール、エリスリトール、キシリトール、オリゴ糖アルコール、還元水飴、還元パラチノース、還元麦芽糖水飴及びマルチトールからなる群から選択される1又は2以上の糖アルコールであり、より好ましくは、マンニトール、オリゴ糖アルコール、還元麦芽糖水飴及びマルチトールからなる群から選択される1又は2以上の糖アルコールであり、さらに好ましくは還元麦芽糖水飴である。なお、ビタミンB欠乏による神経の損傷を防止するために、任意の添加剤としてビタミンB類、特にビタミンB12を含有しても良いが、ビタミンB類を併用してもビタミンB欠乏による神経の損傷を防止しうるので、ビタミンB類(特にビタミンB12)を添加しない製剤とすることもできる。 Here, any additive in the step (1) is a cellulosic additive (however, hydroxypropyl-substituted cellulose may be used), magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, and titanium oxide. , Crospovidone, povidone, gum arabic, macrogol, sucrose fatty acid ester, stearic acid, gelatin, calcium dihydrogen phosphate, starch, pregelatinized starch, partially pregelatinized starch, one or more selected from the group consisting of sucrose. It is preferable not to use additives. The optional additive in step (1) is preferably a sugar alcohol, and examples of particularly preferable sugar alcohols include mannitol, sorbitol, erythritol, xylitol, oligosaccharide alcohol, reduced water candy, reduced palatinose, reduced maltsaccharide water candy and maltitol. One or more sugar alcohols selected from the group consisting of tall, more preferably one or two or more sugar alcohols selected from the group consisting of mannitol, oligosaccharide alcohol, reduced maltitol sugar candy and maltitol. , More preferably a reduced maltitol maltitol. In addition, in order to prevent nerve damage due to vitamin B deficiency, vitamin Bs, especially vitamin B12, may be contained as an optional additive, but even if vitamin Bs are used in combination, nerve damage due to vitamin B deficiency may be contained. Therefore, it is possible to prepare a preparation to which vitamin Bs (particularly vitamin B12) are not added.
また、工程(2)のヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程は、流動層造粒することが好ましく、撹拌造粒ではなく流動層造粒によって、γ−アミノ酪酸誘導体及び薬学的に許容可能なその塩にヒドロキシプロピル置換セルロース溶液を噴霧することにより、原薬の物性を打ち消して良好な打錠性(成形性、付着性)を確保することができる。したがって、工程(2)は、「混合物をヒドロキシプロピル置換セルロース溶液を噴霧して流動層造粒する工程、」とすることが好ましい。 Further, in the step of spraying and granulating the hydroxypropyl-substituted cellulose solution in step (2), fluidized bed granulation is preferable, and γ-aminobutyric acid derivative and pharmaceuticals are used by fluidized bed granulation instead of stirring granulation. By spraying the hydroxypropyl-substituted cellulose solution onto the salt which is acceptable to the product, the physical properties of the drug substance can be canceled and good tableting property (moldability, adhesiveness) can be ensured. Therefore, the step (2) is preferably "a step of spraying the mixture with a hydroxypropyl-substituted cellulose solution to granulate the fluidized bed".
また、工程(2)のヒドロキシプロピル置換セルロースとしては、経時的なラクタム体の生成の抑制及び経時的な硬度低下の抑制の観点からヒドロキシプロピルセルロースさらに好ましい。したがって、工程(2)は、「混合物をヒドロキシプロピルセルロース溶液を噴霧して流動層造粒する工程、」とすることがさらに好ましい。 Further, the hydroxypropyl-substituted cellulose in the step (2) is more preferably hydroxypropyl cellulose from the viewpoint of suppressing the formation of lactams over time and suppressing the decrease in hardness over time. Therefore, it is more preferable that the step (2) is "a step of spraying the mixture with a hydroxypropyl cellulose solution to granulate the fluidized bed".
本発明は、上記の製造方法により製造された固形製剤又は圧縮固形製剤を包含する。 The present invention includes a solid preparation or a compressed solid preparation produced by the above-mentioned production method.
以下のすべての実施例において、プレガバリンの原薬は、不純物0.1%、D10(積算10%の粒子径)が2.2μm、D50(同じく50%粒子径)が13.1μm、D90(同じく90%粒子径)が89.4μmの粒度のフリー体の原薬を用いた。
プレガバリン原薬の安息角は、50°〜55°であり、摩擦係数が大きいことが観察された。
In all of the following examples, the drug substance of pregabalin was 0.1% impurities, 2.2 μm for D10 (10% integrated particle size), 13.1 μm for D50 (also 50% particle size), and D90 (also 50% particle size). A free drug substance having a particle size of 89.4 μm (90% particle size) was used.
The angle of repose of the pregabalin drug substance was 50 ° to 55 °, and a large coefficient of friction was observed.
また、プレガバリン原薬は、原薬を包装しているポリエチレン袋にも多量に付着しており、付着性が高いこともわかった。
また、プレガバリン原薬は、0.2g/mLのゆるめ嵩密度であったことから、嵩高いことがわかった。
It was also found that the pregabalin drug substance adhered to the polyethylene bag containing the drug substance in a large amount and had high adhesion.
In addition, the pregabalin drug substance had a loose bulk density of 0.2 g / mL, indicating that it was bulky.
配合変化試験;
プレガバリン原薬と添加物の配合変化試験を行った。
プレガバリン原薬と添加物を1対1の質量比で混合したのち、30℃75%相対湿度、40℃75%相対湿度、60℃湿度コントロールなしの各条件下で保存し、保存開始時、及び2週間保存後のラクタム体の質量の、初期のプレガバリン原薬の質量に対する質量比(%)を測定した(表1)。測定は1連又は2連で行った。
Formulation change test ;
A combination change test of pregabalin drug substance and additives was conducted.
After mixing the pregavalin drug substance and the additive in a mass ratio of 1: 1, store them under the conditions of 30 ° C. 75% relative humidity, 40 ° C. 75% relative humidity, and 60 ° C. without humidity control. The mass ratio (%) of the mass of the lactam body after storage for 2 weeks to the mass of the initial pregavalin drug substance was measured (Table 1). The measurement was performed in 1 or 2 stations.
ラクタム体の定量は、内径4.6mm、長さ25cmのステンレス管に5μmのオクタデシルシリル化シリカゲルを充てんしたカラムを用いた高速液体クロマトグラフィーを用いた。移動相は、移動相Aと移動相Bの混合溶媒(※)を用い、流速毎分1mLで、OD210nmで検出し、プレガバリンのラクタム体の標準品で相対保持時間を確認し、プレガバリンを内標準物質とした場合の相対保持時間2.7のピークをラクタム体と同定した。ラクタム体の定量は、0.15gのプレガバリンのピーク下面積を基準として、相対保持時間2.7のピーク下面積によって計算した。以下、すべての試験において、同じ方法でラクタム体を定量した。 The lactam form was quantified by high performance liquid chromatography using a column in which a stainless steel tube having an inner diameter of 4.6 mm and a length of 25 cm was filled with 5 μm octadecylsilylated silica gel. The mobile phase is detected at an OD of 210 nm at a flow rate of 1 mL / min using a mixed solvent (*) of mobile phase A and mobile phase B, the relative retention time is confirmed with a standard lactam of pregabalin, and pregabalin is internally standardized. The peak with a relative retention time of 2.7 when used as a substance was identified as a lactam form. The quantification of the lactam form was calculated based on the sub-peak area of 0.15 g of pregabalin with a relative retention time of 2.7. Below, in all the tests, the lactam body was quantified by the same method.
※混合溶媒:
移動相A:リン酸水素二アンモニウム5.28gを水1000mLに溶かし、リン酸を加えてpH6.5に調整し、この液800mLにメタノール200mLを加えたもの。
移動相B:アセトニトリル/メタノール混液(9:1)
混合比:0〜10分(A:B = 98:2)、10〜21分(A:B = 98:2から80:20に変化する直線濃度勾配)、21〜45分(A:B = 80:20)
* Mixed solvent:
Mobile phase A: 5.28 g of diammonium hydrogen phosphate was dissolved in 1000 mL of water, phosphoric acid was added to adjust the pH to 6.5, and 800 mL of this solution was added with 200 mL of methanol.
Mobile phase B: Acetonitrile / methanol mixed solution (9: 1)
Mixing ratio: 0-10 minutes (A: B = 98: 2), 10-21 minutes (A: B = linear concentration gradient changing from 98: 2 to 80:20), 21-45 minutes (A: B =) 80:20)
配合変化試験の対象とした添加物は、乳糖水和物〔Pharmatose(商標) 200M、DFE Pharma社〕、トウモロコシデンプン〔日食コーンスターチ(商標)、日本食品化工株式会社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、結晶セルロース〔セオラスPH−101(商標)、旭化成株式会社〕、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、イソマルト〔galenIQ800(商標)、BENEO−Palatinit GmbH〕、クロスポビドン〔Kollidon CL−F(商標)、BASFジャパン株式会社〕、クロスポビドン〔Polyplasdone Ultra−10(商標)、Ashland Inc.〕、軽質無水ケイ酸〔アドソリダー101(商標)、フロイント産業株式会社〕、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、ポビドン〔K30、BASFジャパン株式会社〕、ステアリン酸マグネシウム〔太平化学産業株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、ショ糖脂肪酸エステル〔三栄源エフ・エフ・アイ株式会社〕、タルク〔リスプラン(商標)、三栄源エフ・エフ・アイ株式会社〕、ヒプロメロース〔TC−5R、信越化学工業株式会社〕、マクロゴール6000〔三洋化成工業株式会社〕、酸化チタン〔A−HR、フロイント産業株式会社〕、含水二酸化ケイ素B型〔フロイント産業株式会社〕を用いた。 Additives subject to the compounding change test were lactose hydrate [Pharmatose ™ 200M, DFE Pharma], corn starch [Nissho Corn Starch ™, Nippon Foods Chemicals Co., Ltd.], D-mannitol [Mannit]. P (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], Crystalline cellulose [Theoras PH-101 (trademark), Asahi Kasei Co., Ltd.], Crystalline cellulose [Theoras KG-802 (trademark), Asahi Kasei Co., Ltd.], Isomalt [galenIQ800 (trademark)) ), BENEO-Palatinit GmbH], Crosspovidon [Kollidon CL-F ™, BASF Japan Co., Ltd.], Crosspovidon [Polyplasmone Ultra-10 ™, Ashland Inc. ], Light Silica Silica [Adsolider 101 ™, Freund Sangyo Co., Ltd.], Hydroxypropyl Cellulose [HPC-L ™ Normal Particle Type, Nippon Soda Co., Ltd.], Povidon [K30, BASF Japan Co., Ltd.], Stear Magnesium acid [Taipei Chemical Industries, Ltd.], Calcium stearate [Taipei Chemical Industries, Ltd.], Sucrose fatty acid ester [Sanei Gen FFI Co., Ltd.], Tarku [Risplan (trademark), Sanei Gen FFI Co., Ltd.] Co., Ltd.], Hypromerose [TC-5R, Shin-Etsu Chemical Industries, Ltd.], Macrogol 6000 [Sanyo Chemical Industries, Ltd.], Titanium oxide [A-HR, Freund Sangyo Co., Ltd.], Hydrous silicon dioxide B type [Freund Sangyo Co., Ltd.] Company] was used.
※ イソマルトは、6−O−α−D−glucopyranosyl−D−sorbitolと1−O−α−D−glucopyranosyl−D−mannitol dihydrateが1対1の比率で混じっている混合物である。 * Isomalt is a mixture of 6-O-α-D-glucoppyranosyl-D-sorbitol and 1-O-α-D-glucoppyranosyl-D-mannitol dihydrate in a ratio of 1: 1.
表1から分かるとおり、プレガバリン原薬の粉末を含水二酸化ケイ素もしくは軽質無水ケイ酸のいずれかと混合して60℃乾燥条件に2週間置くことによって、極めて著しい量のラクタム体の生成が確認された。酸化チタン、結晶セルロース、ヒプロメロース、クロスポビドンについても、これらのいずれかとプレガバリン原薬の粉末を混合して60℃乾燥条件に2週間置くことによって、著しい量のラクタム体が生じることが確認された。結晶セルロースについては、30℃75%相対湿度、40℃75%相対湿度の各保存条件でも同様に、2週間保存後に一定量のラクタム体の生成が確認された。 As can be seen from Table 1, extremely significant amounts of lactams were confirmed by mixing the pregabalin drug substance powder with either hydrous silicon dioxide or light anhydrous silicic acid and placing it in a dry condition at 60 ° C. for 2 weeks. Regarding titanium oxide, crystalline cellulose, hypromellose, and crospovidone, it was confirmed that a remarkable amount of lactam was produced by mixing any of these with the powder of the pregabalin drug substance and leaving it in a drying condition at 60 ° C. for 2 weeks. With regard to crystalline cellulose, the formation of a certain amount of lactam was confirmed after storage for 2 weeks in the same manner under each storage condition of 30 ° C. and 75% relative humidity and 40 ° C. and 75% relative humidity.
ポビドン、マクロゴール6000、ショ糖脂肪酸エステルについては、これらのいずれかとプレガバリン原薬の粉末を混合して60℃乾燥条件に2週間置くと、中程度の量のラクタム体が生じた(2週間後の時点で、ポビドン群が0.293%、マクロゴール6000群が0.420%、ショ糖脂肪酸エステル群が0.366%。)。タルク、トウモロコシデンプン、イソマルトについては、これらのいずれかとプレガバリン原薬の粉末を混合して60℃乾燥条件に2週間置くことによって、比較的少ない量とはいえ初期値に比べて約10倍量のラクタム体の生成が確認された(2週間後の時点で、タルク群が0.215%、トウモロコシデンプン群が0.222%、イソマルト群が0.234%。)。 For povidone, macrogol 6000, and sucrose fatty acid ester, a medium amount of lactam was produced when any of these was mixed with the powder of the pregavalin drug substance and placed in a dry condition at 60 ° C. for 2 weeks (after 2 weeks). At this time, the povidone group was 0.293%, the macrogol 6000 group was 0.420%, and the sucrose fatty acid ester group was 0.366%.) For talc, corn starch, and isomalt, by mixing one of these with the powder of the pregavalin drug substance and placing it in a dry condition at 60 ° C for 2 weeks, the amount is about 10 times higher than the initial value, albeit in a relatively small amount. The formation of lactam was confirmed (at 2 weeks, 0.215% in the talc group, 0.222% in the corn starch group, 0.234% in the isomalt group).
一方で、プレガバリン原薬の粉末を単体で60℃乾燥条件に2週間置いても、ラクタム体はほとんど生成しなかった。ステアリン酸マグネシウム、ステアリン酸カルシウム、ヒドロキシプロピルセルロース、乳糖水和物、D−マンニトールについては、これらのいずれかとプレガバリン原薬の粉末を混合して60℃乾燥条件に2週間置いても、ラクタム体はほとんど生成しないか、ラクタム体の生成量はごく僅かであった。 On the other hand, even if the powder of the pregabalin drug substance was left alone at 60 ° C. for 2 weeks, almost no lactam was produced. For magnesium stearate, calcium stearate, hydroxypropyl cellulose, lactose hydrate, and D-mannitol, even if one of these is mixed with pregabalin drug substance powder and left at 60 ° C for 2 weeks, most of the lactams are present. No lactam was produced, or the amount of lactam produced was negligible.
結晶セルロース、ヒプロメロースなどのセルロース系添加物とプレガバリンとの配合によって著しい量のラクタム体を生成する中にあって、ヒドロキシプロピルセルロースに限っては、ごく僅かな量のラクタム体しか生じないことは、驚くべきことであった。 While the combination of cellulosic additives such as crystalline cellulose and hypromellose with pregabalin produces a significant amount of lactam, it is said that only a very small amount of hydroxypropyl cellulose is produced. It was amazing.
配合変化試験(練合した場合);
プレガバリン原薬と添加物の配合変化試験を行った。
各添加物の粉末を、プレガバリン原薬75質量部に対して添加物1.125質量部の質量比となるように添加して水とともに乳鉢で練合した後、検体乾燥機(冨士特殊工業社、型番FHB−10−1)を用いて60℃で1時間乾燥し、全量を30号メッシュで篩過したものを検体とした(検体名:W4〜W13)。これらの検体の流動性を目視及び安息角測定法により確認し、とても良好(◎)、良好(○)、やや悪い(△+)、悪い(△)、とても悪い(×)の5段階で評価した。また、同じ顆粒を、60℃湿度コントロールなしの条件下で保存し、保存開始時、及び3日保存後のラクタム体の質量の、初期のプレガバリン原薬の質量に対する質量比(%)を測定した(表2)。測定は1連で行った。
Combination change test (when kneaded) ;
A combination change test of pregabalin drug substance and additives was conducted.
The powder of each additive is added so as to have a mass ratio of 1.125 parts by mass of the additive to 75 parts by mass of the pregavalin drug substance and kneaded with water in a mortar, and then a sample dryer (Fuji Tokushu Kogyo Co., Ltd.) , Model number FHB-10-1) was dried at 60 ° C. for 1 hour, and the whole amount was sieved with a No. 30 mesh to prepare a sample (specimen name: W4 to W13). The fluidity of these samples was confirmed visually and by the angle of repose measurement method, and evaluated on a scale of 5: very good (◎), good (○), slightly bad (△ +), bad (△), and very bad (×). bottom. In addition, the same granules were stored under the condition of 60 ° C. without humidity control, and the mass ratio (%) of the mass of the lactam form at the start of storage and after storage for 3 days to the mass of the initial pregabalin drug substance was measured. (Table 2). The measurement was performed in a series.
なお、プレガバリン原薬(検体名:W1)、プレガバリン原薬のみを精製水で練合した検体(検体名:W2)、プレガバリン原薬のみを無水エタノールで練合した検体(検体名:W3)も作製して流動性を確認するとともに、保存開始時及び60℃湿度制御なしの条件で3日間保存後のラクタム体の質量の、初期のプレガバリン原薬の質量に対する質量比(%)を測定した(表2)。測定は1連で行った。
また、リリカ(商標)カプセル75mgの内容物についても、その流動性を確認するとともに、これをそのまま打錠した検体(検体名:L13994)の保存開始時及び60℃湿度制御なしの条件で3日間保存後のラクタム体の質量の、初期のプレガバリン原薬の質量に対する質量比(%)を測定した(表2)。測定は1連で行った。
In addition, pregabalin drug substance (specimen name: W1), sample in which only pregabalin drug substance is kneaded with purified water (specimen name: W2), and sample in which only pregabalin drug substance is kneaded with absolute ethanol (sample name: W3) are also available. The mass ratio (%) of the mass of the lactam body to the mass of the initial pregabalin drug substance was measured at the start of storage and after storage for 3 days under the condition of no humidity control at 60 ° C. Table 2). The measurement was performed in a series.
In addition, the fluidity of the contents of 75 mg of Lyrica (trademark) capsules was confirmed, and the sample (specimen name: L13994) that was tableted as it was was stored for 3 days under the condition of no humidity control at 60 ° C. The mass ratio (%) of the mass of the lactam form after storage to the mass of the initial pregabalin drug substance was measured (Table 2). The measurement was performed in a series.
配合変化試験の対象とした添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、イソマルト〔galenIQ800(商標)、BENEO−Palatinit GmbH〕、D−ソルビトール〔メルク株式会社〕、濃グリセリン〔メルク株式会社〕、プロピレングリコール〔BASFジャパン株式会社〕、マクロゴール400〔三洋化成工業株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、キシリトール〔三栄源エフ・エフ・アイ株式会社〕、エリスリトール〔三栄源エフ・エフ・アイ株式会社〕であった。 Additives subject to the compounding change test are hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], D-mannitol [mannitol P (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], Isomalt [galenIQ800 ™, BENEO-Palatinit GmbH], D-sorbitol [Merck Co., Ltd.], concentrated glycerin [Merck Co., Ltd.], propylene glycol [BASF Japan Co., Ltd.], Macrogol 400 [Sanyo Kasei Kogyo Co., Ltd.], They were reduced malt sugar water candy [Amarti MR100 (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], xylitol [Saneigen FFI Co., Ltd.], and erythritol [Saneigen FFI Co., Ltd.].
表2から分かるとおり、得られた顆粒の流動性については、プレガバリン原薬の粉末を濃グリセリン、プロピレングリコール、マクロゴール400、キシリトールのいずれかの水溶液とともに練合、乾燥、篩過して得られた顆粒、並びにリリカ(商標)カプセル75mgの内容物そのものの流動性は、「とても悪い(×)」であった。
プレガバリン原薬の原末を無添加で練合、乾燥、篩過して得られた顆粒、精製水とともに練合、乾燥、篩過して得られた顆粒、無水エタノールとともに練合、乾燥、篩過して得られた顆粒は、いずれも「悪い(△)」であった。
As can be seen from Table 2, the fluidity of the obtained granules was obtained by kneading, drying and sieving the powder of the pregabalin drug substance together with an aqueous solution of concentrated glycerin, propylene glycol, macrogol 400 or xylitol. The fluidity of the granules and the contents of the Lyrica ™ capsule 75 mg itself was "very bad (x)".
Granules obtained by kneading, drying and sieving the bulk powder of the pregavalin drug substance without additives, granules obtained by kneading, drying and sieving with purified water, and kneading, drying and sieving with anhydrous ethanol All of the granules obtained by passing were "bad (Δ)".
プレガバリン原薬の粉末をエリスリトールの水溶液とともに練合、乾燥、篩過して得られた顆粒の流動性は「やや悪い(△+)」であった。
プレガバリン原薬の粉末をイソマルト又はD−ソルビトールのいずれかの水溶液とともに練合、乾燥、篩過して得られた顆粒の流動性は、「良好(○)」であった。
The fluidity of the granules obtained by kneading, drying and sieving the powder of the pregabalin drug substance together with the aqueous solution of erythritol was “slightly poor (Δ+)”.
The fluidity of the granules obtained by kneading, drying and sieving the powder of the pregabalin drug substance together with an aqueous solution of either isomalt or D-sorbitol was “good (◯)”.
プレガバリン原薬の粉末をヒドロキシプロピルセルロース、D−マンニトール、還元麦芽糖水飴のいずれかの水溶液とともに練合、乾燥、篩過して得られた顆粒の流動性は、「とても良好(◎)」であった。 The fluidity of the granules obtained by kneading, drying, and sieving the powder of the pregabalin drug substance together with an aqueous solution of hydroxypropyl cellulose, D-mannitol, or reduced maltose starch syrup was "very good (◎)". rice field.
ラクタム体の生成については、プレガバリン原薬の粉末をヒドロキシプロピルセルロース水溶液とともに練合、乾燥、篩過して得られた顆粒を60℃乾燥条件に3日間置いた場合、及び、プレガバリン原薬の粉末をD−マンニトール、イソマルト、D−ソルビトール、濃グリセリン、プロピレングリコール、マクロゴール400、還元麦芽糖水飴、キシリトール、エリスリトールのいずれかの粉末とともに混合し水を加えて練合、乾燥、篩過して得られた顆粒を60℃乾燥条件に3日間置いた場合には、ラクタム体は、ほとんど生成しないか、ごくわずかしか生成しなかった。 Regarding the formation of lactam, the granules obtained by kneading, drying and sieving the powder of the pregavalin drug substance together with the hydroxypropyl cellulose aqueous solution are placed in a drying condition of 60 ° C. for 3 days, and the powder of the pregavalin drug substance. Is mixed with powder of D-mannitol, isomalt, D-sorbitol, concentrated glycerin, propylene glycol, macrogol 400, reduced maltose candy, xylitol, or erythritol, and water is added for kneading, drying, and sieving. When the obtained granules were placed in a dry condition of 60 ° C. for 3 days, lactams were produced very little or very little.
一方で、リリカ(商標)カプセル75mgの内容物をそのままハンドプレスで打錠した試作錠を60℃乾燥条件に3日間又は2週間置くことによって、著しい量のラクタム体の生成が確認された。プレガバリン原薬の粉末のみを練合、乾燥、篩過してもラクタム体はほとんど生成しないこと、プレガバリン原薬の粉末を精製水又は無水エタノールとともに練合、乾燥、篩過して得られた顆粒を60℃乾燥条件に3日間置いた場合には、ラクタム体は、ほとんど生成しないこと、および、リリカ(商標)カプセル75mgの状態では保存期間中のラクタム体は許容範囲内であるはずであることを考え合わせれば、打錠による衝撃によって、60℃乾燥条件に3日間又は2週間置いた場合のラクタム体の生成が著しく増加したことが理解できた(表2)。 On the other hand, it was confirmed that a remarkable amount of lactam was produced by placing the prototype tablet, which was obtained by manually pressing the contents of 75 mg of Lyrica ™ capsule as it was, under a drying condition of 60 ° C. for 3 days or 2 weeks. Granules obtained by kneading, drying and sieving only the pregabalin drug substance powder to produce almost no lactam, and kneading, drying and sieving the pregabalin drug substance powder with purified water or absolute ethanol. When placed in a drying condition of 60 ° C. for 3 days, almost no lactam form was produced, and in the state of 75 mg of Lyrica ™ capsule, the lactam form during the storage period should be within an acceptable range. In consideration of the above, it was understood that the impact of tableting significantly increased the production of lactams when left in a drying condition of 60 ° C. for 3 days or 2 weeks (Table 2).
圧縮固形製剤の試作;
プレガバリンを含有する圧縮固形製剤の試作を行った。
Prototype of compressed solid preparation ;
A prototype of a compressed solid preparation containing pregabalin was carried out.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、低置換度ヒドロキシプロピルセルロース〔LH−11(商標)、信越化学工業株式会社〕、メタケイ酸アルミン酸マグネシウム〔ノイシリン(商標)、富士化学工業株式会社〕、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、カルメロースカルシウム〔ECG−505(商標)、五徳薬品株式会社〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、部分α化デンプン〔PCS(商標)、旭化成株式会社〕、トウモロコシデンプン〔日食コーンスターチ(商標)、日本食品化工株式会社〕、リン酸二水素カルシウム〔太平化学産業株式会社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、直打用D−マンニトール〔パーテックM100(商標)、Merck Millipore Corporation〕、D−ソルビトール〔メルク株式会社〕、造粒乳糖水和物〔ダイラクトーズS(商標)、フロイント産業株式会社〕、イソマルト〔galenIQ800(商標)、BENEO−Palatinit GmbH〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、ステアリン酸マグネシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], low-substituted hydroxypropyl cellulose [LH-11 (trademark), Shin-Etsu Chemical Industry Co., Ltd.], aluminum metasilicate. Magnesium Acidate [Neucillin ™, Fuji Chemical Industry Co., Ltd.], Crystalline Cellulose [Theoras KG-802 ™, Asahi Kasei Co., Ltd.], Carmellose Calcium [ECG-505 ™, Gotoku Yakuhin Co., Ltd.], Cross Carme Sodium loin [Ac-Di-Sol ™, Wilbur Ellis Co., Ltd.], partially pregelatinized starch [PCS ™, Asahi Kasei Co., Ltd.], corn starch [Nissho Corn Starch ™, Nippon Foods Chemicals Co., Ltd.] , Calcium dihydrogen phosphate [Taipei Chemical Industry Co., Ltd.], D-mannitol [Mannit P (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], D-mannitol for direct hit [Pertec M100 (trademark), Merck Millipore Corporation] , D-Sorbitol [Merck Co., Ltd.], Granulated lactose hydrate [Dilactos S (trademark), Freund Sangyo Co., Ltd.], Isomalt [galenIQ800 (trademark), BENEO-Palatinit GmbH], Calcium stearate [Taipei Chemical Industry Co., Ltd.] ], Magnesium stearate [Taipei Chemical Industry Co., Ltd.].
表3に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び表3に記載の「造粒液中の添加物」の1錠あたりの量の8000倍の量の粉末を秤量して流動層(FD−MP−01型、パウレック)に投入し、精製水800gを毎分12gのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。「造粒液中の添加物」の量は、例えば、1錠あたり4mgのD−マンニトールを加える場合32gのD−マンニトールを添加した。但し、ヒドロキシプロピルセルロースについては粉末で投入せずに、1錠あたり4mgのヒドロキシプロピルセルロースを加える場合には、予め調製しておいた800グラムの4質量%HPC水溶液を毎分12gのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。同様に、1錠あたり2mgのヒドロキシプロピルセルロースを加える場合には、400グラムの4質量%HPC水溶液を毎分12gのスピードで、吸気温度80℃、排気温度30℃で、約33分間にわたって噴霧しながら造粒し、1錠あたり8mgのヒドロキシプロピルセルロースを加える場合には、1600グラムの4質量%HPC水溶液を毎分12gのスピードで、吸気温度80℃、排気温度30℃で、約133分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で5分間乾燥し、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表3に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表3に記載のとおりであった。
Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 3. Specifically, 600 g of the pregavalin drug substance and 8000 times the amount of powder per tablet of the "additives in the granulating solution" shown in Table 3 are weighed and the fluidized bed (FD-MP-01 type) is used. , Paulec), and 800 g of purified water was granulated at a speed of 12 g / min at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 67 minutes while spraying. As for the amount of "additives in the granulation solution", for example, when 4 mg of D-mannitol was added per tablet, 32 g of D-mannitol was added. However, when hydroxypropyl cellulose is not added as a powder and 4 mg of hydroxypropyl cellulose is added per tablet, 800 g of a 4 mass% HPC aqueous solution prepared in advance is added at a speed of 12 g / min. Granulation was performed while spraying at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 67 minutes. Similarly, when 2 mg of hydroxypropyl cellulose is added per tablet, 400 g of 4 mass% HPC aqueous solution is sprayed at a rate of 12 g / min at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 33 minutes. When granulating while adding 8 mg of hydroxypropyl cellulose per tablet, 1600 g of 4 mass% HPC aqueous solution was added at a speed of 12 g / min at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 133 minutes. Granulated while spraying. The obtained granulated product was dried as it was at 80 ° C. for 5 minutes using a fluidized bed, and sieved through a mesh 30 filter. Add the post-additives shown in Table 3 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 3.
試作した圧縮固形製剤の硬度:
試作した圧縮固形製剤の試作直後の硬度を、硬度測定機(KHT−20N、藤原製作所)を用いて測定した。測定結果は、表3に記載のとおりであった。
表3に記載のとおり、錠剤の硬度については、主薬顆粒部分にD−ソルビトールを加えてヒドロキシプロピルセルロースを含有しない造粒液(すなわち水)で造粒した後に後添加物として結晶セルロースとL−HPCとステアリン酸カルシウムを添加した場合(検体名:MP5−1−1)と、主薬顆粒部分をHPC水溶液で造粒した後に後添加物として部分α化デンプンとL−HPCとステアリン酸カルシウムを添加した場合(検体名:MP2−9−1)と、主薬顆粒部分をHPC水溶液で造粒した後に後添加物として造粒乳糖水和物とL−HPCとステアリン酸カルシウムを添加した場合(検体名:MP2−7−1)には、30N未満の硬度となった。しかし、これら以外の検体では、すべて30N以上の十分な硬度を得ることができた。
Hardness of the prototype compressed solid formulation:
The hardness of the prototype compressed solid preparation immediately after the trial production was measured using a hardness measuring machine (KHT-20N, Fujiwara Seisakusho). The measurement results are as shown in Table 3.
As shown in Table 3, regarding the hardness of tablets, after adding D-sorbitol to the main drug granules and granulating with a granulation solution (that is, water) that does not contain hydroxypropyl cellulose, crystalline cellulose and L- are added as post-additives. When HPC and calcium stearate are added (specimen name: MP5-1-1), and when the main drug granules are granulated with an HPC aqueous solution and then partially pregelatinized starch, L-HPC and calcium stearate are added as post-additives. (Sample name: MP2-9-1) and the case where granulated lactose hydrate, L-HPC and calcium stearate are added as post-additives after granulating the main drug granules with an aqueous HPC solution (Sample name: MP2- In 7-1), the hardness was less than 30 N. However, in all the samples other than these, sufficient hardness of 30 N or more could be obtained.
試作した圧縮固形製剤の保存安定性:
それぞれの圧縮固形製剤を、40℃75%相対湿度で1週間、2週間、又は4週間保存した。ただし、リリカ(商標)カプセル75mgの内容物は、打錠せずに、そのまま40℃75%相対湿度で保存した。同様に、プレガバリン原薬のうちの一部は、打錠せずに、そのまま40℃75%相対湿度で保存した。
Storage stability of the prototype compressed solid formulation:
Each compressed solid preparation was stored at 40 ° C. and 75% relative humidity for 1 week, 2 weeks, or 4 weeks. However, the contents of the Lyrica ™ capsule 75 mg were stored as they were at 40 ° C. and 75% relative humidity without locking. Similarly, some of the pregabalin drug substances were stored as is at 40 ° C. and 75% relative humidity without locking.
原薬のみを打錠した場合(検体名:原薬+0.4t、原薬+0.8t、原薬+1.2t)、打錠圧の強弱に関わらず、保存開始時にラクタム体の発生はなく、保存1週間後にもラクタム体はまったく増加しなかった。このことから、ラクタム体の経時的増加は、打錠のみによって生ずるのではなく、特定の添加剤と一緒に打錠したときにのみ生ずることがわかった。 When only the drug substance was tableted (specimen name: drug substance + 0.4t, drug substance + 0.8t, drug substance + 1.2t), no lactam was generated at the start of storage regardless of the strength of the tableting pressure. The lactam body did not increase at all even after 1 week of storage. From this, it was found that the increase in lactams over time is not caused only by tableting, but only when tableted with a specific additive.
同様に、リリカ(商標)カプセル75mgの内容物を打錠せずに40℃75%相対湿度で保存した場合(検体名:リリカ(商標))には、保存開始時のラクタム体の量は0.342%もあったにもかかわらず、保存2週間後及び保存4週間後のラクタム体はまったく増加しなかった。これに対して、実施例2において、リリカ(商標)カプセル75mgの内容物をそのまま打錠して60℃乾燥条件で3日間及び14日間保存した場合(検体名:L13994)には、保存開始時のラクタム体の量が多さが同程度であったにも関わらず、ラクタム体の顕著な増加が観察されたことと考え合わせると、リリカ(商標)カプセル75mgの内容物に含まれる乳糖水和物、トウモロコシデンプン、タルクと一緒にプレガバリンを打錠することが、打錠によって経時的にラクタム体が生成する原因であることがわかった。 Similarly, when the contents of 75 mg of Lyrica (trademark) capsules are stored at 40 ° C. and 75% relative humidity without tableting (specimen name: Lyrica (trademark)), the amount of lactam at the start of storage is 0. Despite a value of .342%, there was no increase in lactams after 2 and 4 weeks of storage. On the other hand, in Example 2, when the content of 75 mg of Lyrica ™ capsule was directly tableted and stored under 60 ° C. drying conditions for 3 days and 14 days (specimen name: L13994), at the start of storage. Lactam hydration contained in the contents of 75 mg of Lyrica ™ capsules, considering that a marked increase in lactam was observed despite the similar amount of lactam. It was found that pregabalin tableting with substances, corn starch, and talc was the cause of lactam formation over time by tableting.
打錠する際に存在することで経時的ラクタム体生成の引き金となる添加物としては、後添加物としてメタケイ酸アルミン酸マグネシウム(ノイシリン)を添加すると、保存開始時のラクタム体量0.066%に比較して、40℃75%相対湿度で1週間保存した後に1.270%もの著しい量のラクタム体の生成を確認した(検体名MP2−2−1)。後添加物としてメタケイ酸アルミン酸マグネシウム(ノイシリン)を添加した場合のラクタム体の生成量は、メタケイ酸アルミン酸マグネシウムの代わりに同じ量の部分α化デンプン(検体名MP2−9−1)、リン酸二水素カルシウム(検体名MP2−6−1)、トウモロコシデンプン(検体名MP2−8−1)、直打用D−マンニトール(検体名MP2−4−1)、造粒乳糖水和物(検体名MP2−7−1)、イソマルト(検体名MP2−3−1)、D−ソルビトール(検体名MP2−5−1)を添加したときのラクタム体の生成量に比べても桁違いに多かった。 When magnesium aluminometasilicate (Neucillin) is added as a post-additive as an additive that is present at the time of tableting and triggers the formation of lactams over time, the amount of lactams at the start of storage is 0.066%. After storage at 40 ° C. and 75% relative humidity for 1 week, a remarkable amount of 1.270% of lactam was produced (specimen name MP2-2-1). When magnesium aluminometasilicate (neucillin) was added as a post-additive, the amount of lactam produced was the same amount of partially pregelatinized starch (specimen name MP2-9-1) and phosphorus instead of magnesium aluminometasilicate. Calcium dihydrogen acid (specimen name MP2-6-1), corn starch (specimen name MP2-8-1), direct hit D-mannitol (specimen name MP2-4-1), granulated lactose hydrate (specimen) It was an order of magnitude higher than the amount of lactam produced when D-sorbitol (specimen name MP2-5-1), isomalto (specimen name MP2-3-1), and isomalto (specimen name MP2-5-1) were added. ..
後添加物として1錠あたり41mgの結晶セルロースを添加した場合にも同様に、保存開始時に比較して、40℃75%相対湿度で2週間及び4週間保存した後に著しい量の経時的なラクタム体の生成を確認した(検体名75−M1、75−M2、75−M3)。40℃75%相対湿度で2週間保存した後の経時的なラクタム体の生成量は、1錠あたり10.5mgの結晶セルロースを添加した場合に比べて、0.164%も多かった(検体名75−M2と検体名MP2−1−1を対比)。 Similarly, when 41 mg of crystalline cellulose is added per tablet as a post-additive, a significant amount of lactam body over time is obtained after storage at 40 ° C. and 75% relative humidity for 2 weeks and 4 weeks as compared with the start of storage. (Specimen names 75-M1, 75-M2, 75-M3). The amount of lactams produced over time after storage at 40 ° C. and 75% relative humidity for 2 weeks was 0.164% higher than when 10.5 mg of crystalline cellulose was added per tablet (specimen name). Compare 75-M2 with sample name MP2-1-1).
後添加物として1錠あたり41mgの結晶セルロースを添加した群の間でも、主薬顆粒に添加したヒドロキシプロピルセルロースの量が多いほど、40℃75%相対湿度の条件下で2週間保存後のラクタム体が増加した(検体名75−M1、75−M2、75−M3)。 Even among the group to which 41 mg of crystalline cellulose was added per tablet as a post-additive, the larger the amount of hydroxypropyl cellulose added to the main drug granules, the more the lactam body after storage under the condition of 40 ° C. and 75% relative humidity for 2 weeks. Increased (specimen names 75-M1, 75-M2, 75-M3).
後添加物としてセルロース系添加剤であるカルメロースカルシウム(検体名MP2−1−2)又はクロスカルメロースナトリウム(検体名MP2−1−3)を加えた場合にも、40℃75%相対湿度の条件下で1週間保存後のラクタム体の量が保存開始時に比較して増加した。 Even when carmellose calcium (specimen name MP2-1-2) or croscarmellose sodium (specimen name MP2-1-3), which are cellulosic additives, are added as post-additives, the relative humidity is 40 ° C. and 75%. Under the conditions, the amount of lactam after storage for 1 week was increased as compared with the start of storage.
しかし、後添加物として1錠あたり10.5mgの結晶セルロースを添加した場合であっても、主薬顆粒中にD−マンニトール(検体名MP3−1−1(ラクタム体が0.089%増加))又はD−ソルビトール(検体名MP4−1−1(ラクタム体が0.018%増加)、MP5−1−1(ラクタム体が0.039%増加)、MP6−1−1(ラクタム体が0.02%増加))を添加した場合には、40℃75%相対湿度の条件下で1週間保存後のラクタム体の増加は、これらを添加しなかった場合(検体名MP2−1−1(ラクタム体が0.12%増加))に比べて抑制された。 However, even when 10.5 mg of crystalline cellulose was added per tablet as a post-additive, D-mannitol (specimen name MP3-1-1 (lactam body increased by 0.089%)) was added to the main drug granules. Or D-sorbitol (specimen name MP4-1-1 (lactam body increased by 0.018%), MP5-1-1 (lactam body increased by 0.039%), MP6-1-1 (lactam body increased by 0.039%). When these were added (02% increase)), the increase in lactams after storage under the condition of 40 ° C. and 75% relative humidity for 1 week was the case when these were not added (specimen name MP2-1-1 (lactam). The body increased by 0.12%)) was suppressed.
同様に、後添加物として結晶セルロースとクロスカルメロースナトリウムを共に添加した場合であっても、後添加物中にD−ソルビトール(検体名MP2−1−3−5−3(ラクタム体が0.031%増加)、MP2−1−3−5−1(ラクタム体が0.032%増加)、MP2−1−3−5(ラクタム体が0.019%増加)、MP2−1−3−5−2(ラクタム体が0.024%増加)、MP2−1−3−5−4(ラクタム体が0.011%増加))を添加した場合には、40℃75%相対湿度の条件下で1週間保存後のラクタム体の増加は、これらを添加しなかった場合(検体名MP2−1−3(ラクタム体が0.087%増加))に比べて抑制された。 Similarly, even when crystalline cellulose and croscarmellose sodium are added together as a post-additive, D-sorbitol (specimen name MP2-1-3-5-3 (specam name: MP2-1-3-5-3 (lactam form is 0.)) is added to the post-additive. 031% increase), MP2-1-3-5-1 (Lactam form increased by 0.032%), MP2-1-3-5 (Lactam form increased by 0.019%), MP2-1-3-5 When -2 (lactam body increased by 0.024%) and MP2-1-3-5-4 (lactam body increased by 0.011%) were added, under the condition of 40 ° C. and 75% relative humidity. The increase in lactams after storage for 1 week was suppressed as compared with the case where these were not added (specimen name MP2-1-3 (lactams increased by 0.087%)).
後添加物として部分アルファー化デンプン(検体名MP2−9−1(ラクタム体が0.088%増加))、顆粒トウモロコシデンプン(検体名MP2−8−1(ラクタム体が0.080%増加))、又はリン酸二水素カルシウム(検体名MP2−6−1(ラクタム体が0.085%増加))を加えた場合には、保存開始時に比較して、40℃75%相対湿度の条件下で1週間保存後のラクタム体が明らかに増加した。 Partially pregelatinized starch (specimen name MP2-9-1 (lactam body increased by 0.088%)), granular corn starch (specimen name MP2-8-1 (lactam body increased by 0.080%)) as post-additives Or, when calcium dihydrogen phosphate (specimen name MP2-6-1 (quantum body increased by 0.085%)) was added, the condition was 40 ° C. and 75% relative humidity compared to the start of storage. There was a clear increase in lactam after storage for 1 week.
一方、主薬顆粒にはHPCのみを添加し、後添加物としてL−HPC以外にはセルロース系添加物を添加しなかった場合には、後添加物として部分アルファー化デンプン(検体名MP2−9−1)、顆粒トウモロコシデンプン(検体名MP2−8−1)、又はリン酸二水素カルシウム(検体名MP2−6−1)を加えた場合を除き、40℃75%相対湿度の条件下で1週間保存したことによるラクタム体の増加は、全く見られないか(検体名MP2−5−1(見かけ上ラクタム体が0.019%減少))、ごく僅かであった(検体名MP2−3−1(ラクタム体が0.030%増加)、MP2−7−1(ラクタム体が0.042%増加)、MP2−4−1(ラクタム体が0.050%増加))。検体名MP2−5−1、MP2−3−1、MP2−7−1、MP2−4−1の各検体は、L−HPC及びステアリン酸カルシウム以外の後添加物として、検体名MP2−5−1がD−ソルビトールを含有し、MP2−3−1がイソマルトを含有し、MP2−7−1が乳糖水和物を含有し、MP2−4−1がD−マンニトールを含有することから、HPC及びL−HPC以外のセルロース系添加物を添加しなければ、打錠しても経時的なラクタム体の生成は生じないこと、並びに、HPC、L−HPC、D−ソルビトール、D−マンニトール、乳糖水和物、及びイソマルトを添加しても、打錠による経時的なラクタム体の生成は生じないことがわかった。 On the other hand, when only HPC was added to the main drug granules and no cellulosic additive other than L-HPC was added as a post-additive, partially pregelatinized starch (specimen name MP2-9-) was added as a post-additive. 1), Granular corn starch (specimen name MP2-8-1), or calcium dihydrogen phosphate (specimen name MP2-6-1) is not added, but under the condition of 40 ° C. and 75% relative humidity for 1 week. There was no increase in lactams due to storage (specimen name MP2-5-1 (apparently a 0.019% decrease in lactams)) or very slight (specimen name MP2-3-1). (Lactam body increased by 0.030%), MP2-7-1 (Lactam body increased by 0.042%), MP2-4-1 (Lactam body increased by 0.050%). Specimen name MP2-5-1, MP2-3-1, MP2-7-1, MP2-4-1 are each sample with sample name MP2-5-1 as a post-additive other than L-HPC and calcium stearate. Contains D-sorbitol, MP2-3-1 contains isomalt, MP2-7-1 contains lactose hydrate, and MP2-4-1 contains D-mannitol. Unless a cellulose-based additive other than L-HPC is added, the formation of lactams over time does not occur even when tableting, and HPC, L-HPC, D-sorbitol, D-mannitol, lactose water It was found that the addition of Japanese products and isomalt did not cause the formation of lactams over time by tableting.
試作した圧縮固形製剤の崩壊性:
検体名MP−2−2−1、MP2−1−2、MP2−1−3、MP2−1−1、MP4−1−1、MP2−8−1、MP2−5−1の圧縮固形製剤についてのみ、日本薬局方に規定する溶出試験の方法に従って、パドル法を用い、1分間に50回転の条件で、ベッセル内での水に対する崩壊時間を測定した。
その結果、下記のとおり、いずれの検体についても日本薬局方において素錠について求められている30分以内の崩壊が達成されており、十分に早い崩壊性を有することがわかった。
Disintegration of the prototype compressed solid formulation:
About compressed solid preparation of sample names MP-2-2-1, MP2-1-2, MP2-1-3, MP2-1-1, MP4-1-1, MP2-8-1, MP2-5-1 Only, according to the dissolution test method specified in the Japanese Pharmacopoeia, the disintegration time with respect to water in the vessel was measured using the paddle method under the condition of 50 revolutions per minute.
As a result, as shown below, it was found that the disintegration within 30 minutes required for the uncoated tablets by the Japanese Pharmacopoeia was achieved for all the samples, and that they had sufficiently fast disintegration.
検体名MP−2−2−1:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgのメタケイ酸アルミン酸マグネシウム(ノイシリン)、1錠あたり10mgのL−HPC、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は12分であった。
Specimen name MP-2-2-1:
After granulating 75 mg of pregabalin per tablet using a 4% aqueous HPC solution (HPC per tablet is 4 mg), 10.5 mg of magnesium aluminometasilicate per tablet (neucillin) per tablet. When 10 mg of L-HPC and 0.5 mg of calcium stearate per tablet were added, mixed, and tableted at a pressure of 0.8 t, the disintegration time was 12 minutes.
検体名MP2−1−2:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgの結晶セルロース、1錠あたり10mgのカルメロースカルシウム、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は11分であった。
Specimen name MP2-1-2:
After granulating 75 mg of pregabalin per tablet using a 4% aqueous HPC solution (HPC per tablet is 4 mg), 10.5 mg of crystalline cellulose per tablet, 10 mg of carmellose calcium per tablet, The disintegration time was 11 minutes when 0.5 mg of calcium stearate was added per tablet, mixed, and tableted at a pressure of 0.8 t.
検体名MP2−1−3:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgの結晶セルロース、1錠あたり10mgのクロスカルメロースナトリウム、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は2.5分であった。
Specimen name MP2-1-3:
After granulating 75 mg of pregabalin per tablet using a 4% aqueous HPC solution (4 mg of HPC per tablet), 10.5 mg of crystalline cellulose per tablet and 10 mg of croscarmellose sodium per tablet. The disintegration time was 2.5 minutes when 0.5 mg of calcium stearate was added per tablet, mixed, and tableted at a pressure of 0.8 t.
検体名MP2−1−1:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgの結晶セルロース、1錠あたり10mgのL−HPC、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は13分であった。
Specimen name MP2-1-1: 1
After granulating 75 mg of pregabalin per tablet using a 4% aqueous HPC solution (HPC per tablet is 4 mg), 10.5 mg of crystalline cellulose per tablet, and 10 mg of L-HPC per tablet, The disintegration time was 13 minutes when 0.5 mg of calcium stearate was added per tablet, mixed, and tableted at a pressure of 0.8 t.
検体名MP4−1−1:
1錠あたり75mgのプレガバリンと1錠あたり4mgのD−ソルビトールを混合し、これに4%のHPC水溶液を1錠あたり4mgのHPCとなるように噴霧して造粒した後に、これに1錠あたり10.5mgの結晶セルロース、1錠あたり10mgのL−HPC、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は5.5分であった。
Specimen name MP4-1: 1:
75 mg of pregabalin per tablet and 4 mg of D-sorbitol per tablet are mixed, and 4% HPC aqueous solution is sprayed on the mixture to obtain 4 mg of HPC per tablet, and then granulated, and then per tablet. Disintegration time is 5.5 minutes when 10.5 mg of crystalline cellulose, 10 mg of L-HPC per tablet, and 0.5 mg of calcium stearate per tablet are added, mixed, and tableted at a pressure of 0.8 t. Met.
検体名MP2−8−1:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgの顆粒トウモロコシデンプン(造粒コーンスターチ)、1錠あたり10mgのL−HPC、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は9.5分であった。
Specimen name MP2-8-1:
After granulating 75 mg of pregavalin per tablet using 4% aqueous HPC solution (HPC per tablet is 4 mg), 10.5 mg of granulated corn starch per tablet (granulated cornstarch) per tablet. When 10 mg of L-HPC and 0.5 mg of calcium stearate per tablet were added, mixed, and tableted at a pressure of 0.8 t, the disintegration time was 9.5 minutes.
検体名MP2−5−1:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンを造粒した後に、これに1錠あたり10.5mgのD−ソルビトール、1錠あたり10mgのL−HPC、及び1錠あたり0.5mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は6.5分であった。
Specimen name MP2-5-1:
After granulating 75 mg of pregabalin per tablet using a 4% aqueous HPC solution (4 mg of HPC per tablet), 10.5 mg of D-sorbitol per tablet and 10 mg of L-HPC per tablet. The disintegration time was 6.5 minutes when 0.5 mg of calcium stearate was added per tablet, mixed, and tableted at a pressure of 0.8 t.
圧縮固形製剤の試作;
プレガバリンを含有する造粒物のみを打錠して圧縮固形製剤の試作を行った。
Prototype of compressed solid preparation ;
A prototype of a compressed solid preparation was made by tableting only the granulated product containing pregabalin.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、D−ソルビトール〔メルク株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], D-mannitol [mannitol P (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], D-sorbitol [Merck]. Co., Ltd.].
表4に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、検体名が75−MPで始まる検体名の検体については、プレガバリン原薬600g及び表4に記載の「造粒液中の添加物」(D−マンニトール又はD−ソルビトール;HPCは造粒液中に添加)の1錠あたりの量の8000倍の量の粉末を秤量して流動層(FD−MP−01型、パウレック)に投入し、4質量%のヒドロキシプロピルセルロース水溶液800グラムを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。例えば、1錠あたり4mgのD−マンニトールを加える場合32gのD−マンニトールを添加した。得られた造粒物をそのまま流動層を用いて80℃で5分間乾燥し、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物を、単発打錠機(AUTOTAB−500、市橋精機)を用いて表4に記載の打錠圧で打錠した。その結果得られた1錠あたりの質量は、表4に記載のとおりであった。なお、打圧欄に「−」と表示されている場合には、打錠していないことを表示している。 Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 4. Specifically, for samples with sample names starting with 75-MP, 600 g of pregavalin drug substance and "additives in granulation solution" (D-mannitol or D-sorbitol; HPC) shown in Table 4 8000 times the amount of powder per tablet (added in the granulation solution) was weighed and put into a fluidized layer (FD-MP-01 type, Paulec), and 800 g of a 4 mass% hydroxypropyl cellulose aqueous solution. Was granulated at a speed of 12 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. while spraying for about 67 minutes. For example, when adding 4 mg of D-mannitol per tablet, 32 g of D-mannitol was added. The obtained granulated product was dried as it was at 80 ° C. for 5 minutes using a fluidized bed, and sieved through a mesh 30 filter. The granulated product after drying and sieving was locked with a single-shot locking machine (AUTOTAB-500, Ichihashi Seiki) at the locking pressure shown in Table 4. The mass per tablet obtained as a result was as shown in Table 4. When "-" is displayed in the pressing pressure column, it means that the tablet is not locked.
なお、検体名:75−M3の検体については、1錠あたり8mgのヒドロキシプロピルセルロースを含むので、4質量%のヒドロキシプロピルセルロース水溶液1600グラムを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約133分間にわたって噴霧しながら造粒し、それ以外は上記と同様にして、試作錠剤を作製した。 Since each tablet of the sample with the sample name: 75-M3 contains 8 mg of hydroxypropyl cellulose, 1600 g of a 4 mass% hydroxypropyl cellulose aqueous solution is exhausted at a speed of 12 g / min at an intake temperature of 80 ° C. Granulation was carried out at a temperature of 30 ° C. while spraying for about 133 minutes, and a trial tablet was prepared in the same manner as above except for the above.
試作した圧縮固形製剤の保存安定性:
表4に記載したとおり、それぞれの造粒物又は圧縮固形製剤を、40℃75%相対湿度で7日間又は14日間保存した。リリカ(商標)カプセル75mgの内容物は、打錠せずに、そのまま40℃75%相対湿度で保存した。
Storage stability of the prototype compressed solid formulation:
As shown in Table 4, each granulated or compressed solid preparation was stored at 40 ° C. and 75% relative humidity for 7 or 14 days. The contents of 75 mg of Lyrica ™ capsules were stored as is at 40 ° C. and 75% relative humidity without locking.
リリカ(商標)カプセル75mgの内容物は、保存開始時点のラクタム体の量こそ多かったものの、40℃75%相対湿度で14日間保存した後のラクタム体の量は全く増加しなかった。これに対して、実施例2において、リリカ(商標)カプセル75mgの内容物をそのまま打錠して60℃乾燥条件で3日間及び14日間保存した場合(検体名:L13994)には、保存開始時のラクタム体の量が多さが同程度であったにも関わらず、ラクタム体の顕著な増加が観察されたことと考え合わせると、ラクタム体の増加は、リリカ(商標)カプセル75mgの内容物に含まれる乳糖水和物、トウモロコシデンプン、タルクと一緒に打錠する衝撃を契機として経時的に進行することが理解できた。 The content of the Lyrica ™ capsule 75 mg had a large amount of lactam at the start of storage, but the amount of lactam after storage at 40 ° C. and 75% relative humidity for 14 days did not increase at all. On the other hand, in Example 2, when the content of 75 mg of Lyrica ™ capsule was directly tableted and stored under 60 ° C. drying conditions for 3 days and 14 days (specimen name: L13994), at the start of storage. Considering that a marked increase in lactam was observed despite similar amounts of lactam in the lactam, the increase in lactam was the content of 75 mg of Lyrica ™ capsules. It was understood that it progresses over time triggered by the impact of tableting together with lactam hydrate, corn starch, and talc contained in.
HPC、D−マンニトール、D−ソルビトールを含むプレガバリンの造粒物については、打錠しない限り、40℃75%相対湿度で7日間保存した後のラクタム体の増加は全く見られなかった。すなわち、4%のHPC水溶液(1錠あたりのHPCは4mg)を用いてプレガバリン75mgを造粒して乾燥したもの(検体名:75−MP2−40、75−MP2−45)、4%のHPCとD−マンニトールの水溶液(1錠あたりのHPCとD−マンニトールは夫々4mg)を用いてプレガバリン75mgを造粒して乾燥したもの(検体名:75−MP3−40、75−MP3−45)、4%のHPCとD−ソルビトールの水溶液(1錠あたりのHPCとD−ソルビトールは夫々4mg)を用いてプレガバリン75mgを造粒して乾燥したもの(検体名:75−MP4−40、75−MP4−45)は、40℃75%相対湿度で7日間保存したことによるラクタム体の増加量はいずれも0.012%以下であり、ラクタム体の増加は全く見られなかった。このことからも、ラクタム体の増加は、所定の添加剤と一緒に打錠する衝撃を契機として経時的に進行することが理解できた。 For pregabalin granules containing HPC, D-mannitol, and D-sorbitol, no increase in lactam was observed after storage at 40 ° C. and 75% relative humidity for 7 days, unless locked. That is, 75 mg of pregavalin was granulated and dried using a 4% HPC aqueous solution (HPC per tablet was 4 mg) (specimen names: 75-MP2-40, 75-MP2-45), and 4% HPC. And D-mannitol aqueous solution (HPC and D-mannitol per tablet are 4 mg each), and 75 mg of pregavalin was granulated and dried (specimen names: 75-MP3-40, 75-MP3-45). Pregabalin 75 mg was granulated and dried using a 4% aqueous solution of HPC and D-sorbitol (HPC and D-sorbitol per tablet were 4 mg each) (specimen names: 75-MP4-40, 75-MP4). In −45), the amount of increase in lactams after storage at 40 ° C. and 75% relative humidity for 7 days was 0.012% or less, and no increase in lactams was observed. From this, it was understood that the increase in lactams progressed over time triggered by the impact of locking with a predetermined additive.
HPC、D−マンニトール、D−ソルビトールを含むプレガバリンの造粒物を打錠した場合には、打錠しなかった場合に比較して、保存開始時のラクタム体の量はごく僅かに増加したものの、40℃75%相対湿度で7日間保存したことによるラクタム体の増加はごく微量であった。すなわち、4%のHPC水溶液(1錠あたりのHPCは4mg)を用いてプレガバリン75mgを造粒して乾燥した後に0.4t、0.8t、1.2tで打錠したもの(検体名75−MP2−04、75−MP2−08、75−MP2−12)、4%のHPCとD−マンニトール(1錠あたりのHPCとD−マンニトールは夫々4mg)を用いてプレガバリン75mgを造粒して乾燥した後に0.4t、0.8t、1.2tで打錠したもの(検体名検体名75−MP3−04、75−MP3−08、75−MP3−12)、及び4%のHPCとD−ソルビトール(1錠あたりのHPCとD−ソルビトールは夫々4mg)を用いてプレガバリン75mgを造粒して乾燥した後に0.4t、0.8t、1.2tで打錠したもの(検体名75−MP4−04、75−MP4−08、75−MP4−12)は、いずれも、40℃75%相対湿度で7日間保存したことによるラクタム体の増加量はいずれも0.026%以下であり、ラクタム体の増加はごく微量であった。また、打圧とラクタム体の増加量との間に明確な関連は見いだせなかった。 When pregabalin granules containing HPC, D-mannitol, and D-sorbitol were tableted, the amount of lactams at the start of storage increased slightly compared to the case without tableting. The increase in lactams due to storage at 40 ° C. and 75% relative humidity for 7 days was negligible. That is, 75 mg of pregavalin was granulated using a 4% HPC aqueous solution (HPC per tablet was 4 mg), dried, and then tableted at 0.4 t, 0.8 t, and 1.2 t (specimen name 75-). Use MP2-04, 75-MP2-08, 75-MP2-12), 4% HPC and D-mannitol (4 mg each of HPC and D-mannitol per tablet) to granulate and dry 75 mg of pregavalin. After that, the tablets were locked at 0.4t, 0.8t, 1.2t (specimen name, sample name 75-MP3-04, 75-MP3-08, 75-MP3-12), and 4% HPC and D-. Pregabalin 75 mg was granulated using sorbitol (HPC and D-sorbitol per tablet were 4 mg each), dried, and then tableted at 0.4 t, 0.8 t, and 1.2 t (specimen name 75-MP4). -04, 75-MP4-08, 75-MP4-12), the amount of increase in lactam form after storage at 40 ° C. and 75% relative humidity for 7 days was 0.026% or less, and lactam. The increase in body was negligible. In addition, no clear association was found between the striking pressure and the amount of increase in lactam.
このことから、γ―アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する圧縮固形製剤にHPCを添加しても、打錠の衝撃を契機として生じる経時的なラクタム体の生成をほとんど生じないことが分かった。 From this, even if HPC is added to a compressed solid preparation containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, the formation of lactams over time triggered by the impact of tableting occurs. It turned out not.
また、γ―アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する圧縮固形製剤にD−マンニトール又はD−ソルビトールを添加しても、打錠の衝撃を契機として生じる経時的なラクタム体の生成をほとんど生じないことが分かった。 Further, even if D-mannitol or D-sorbitol is added to a compressed solid preparation containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, the lactam form over time generated by the impact of tableting It was found that almost no generation occurred.
圧縮固形製剤の試作;
プレガバリンを含有する圧縮固形製剤の試作を行った。
Prototype of compressed solid preparation ;
A prototype of a compressed solid preparation containing pregabalin was carried out.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、低置換度ヒドロキシプロピルセルロース〔LH−11(商標)、信越化学工業株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、直打用D−マンニトール〔パーテックM200(商標)、Merck Millipore Corporation〕、D−ソルビトール〔メルク株式会社〕、造粒乳糖水和物〔ダイラクトーズS(商標)フロイント産業株式会社〕、エリスリトール〔三栄源エフ・エフ・アイ株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], low-substituted hydroxypropyl cellulose [LH-11 (trademark), Shin-Etsu Chemical Industry Co., Ltd.], reduced malt sugar water candy. [Amalti MR100 ™, Mitsubishi Shoji Food Tech Co., Ltd.], Crystalline Cellulose [Theoras KG-802 ™, Asahi Kasei Co., Ltd.], Croscarmellose Sorb [Ac-Di-Sol ™, Wilbur Ellis Co., Ltd.] ], D-mannitol for direct hitting [Partec M200 (trademark), Merck Millipore Corporation], D-sorbitol [Merck Co., Ltd.], granulated lactose hydrate [Dilactos S (trademark) Freund Sangyo Co., Ltd.], Erythritol [Sanei] Source FFI Co., Ltd.] and calcium stearate [Taipei Chemical Industry Co., Ltd.].
表5に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び表5に記載の「造粒部分の添加物(粉末)」の1錠あたりの量の8000倍の量を秤量して流動層(FD−MP−01型、パウレック)に投入し、4質量%HPC水溶液を毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、噴霧しながら造粒した。「造粒部分の添加物(粉末)」の添加量は、1錠あたり4mgのD−ソルビトールを加える場合には32gのD−ソルビトールを粉末で添加し、1錠あたり7mgの還元麦芽糖水飴を加える場合には56gの還元麦芽糖水飴を粉末で添加し、1錠あたり7mgのエリスリトールを加える場合には56gのエリスリトールを粉末で添加した。HPC水溶液の噴霧量及び噴霧時間は、1錠あたり4mgのHPCを加える場合には800グラムの4質量%のHPC水溶液を約67分間にわたって噴霧しながら造粒し、1錠あたり6mgのHPCを加える場合には1200グラムの4質量%のHPC水溶液を約100分間にわたって噴霧しながら造粒し、1錠あたり8mgのHPCを加える場合には1600グラムの4質量%のHPC水溶液を約133分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で5分間乾燥し、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表5に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表5に記載のとおりであった。 Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 5. Specifically, the fluidized layer (FD-MP-01 type) is weighed 8000 times the amount per tablet of 600 g of the pregavalin drug substance and the "additive (powder) of the granulated portion" shown in Table 5. , Paulec), and a 4 mass% HPC aqueous solution was granulated while spraying at a speed of 12 g / min at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. As for the amount of "additive (powder) for granulated portion", when 4 mg of D-sorbitol is added per tablet, 32 g of D-sorbitol is added as powder, and 7 mg of reduced maltose water candy is added per tablet. In some cases, 56 g of reduced maltose syrup was added in powder form, and in the case of adding 7 mg of erythritol per tablet, 56 g of erythritol was added in powder form. Regarding the spray amount and spray time of the HPC aqueous solution, when 4 mg of HPC is added per tablet, 800 g of 4 mass% HPC aqueous solution is sprayed and granulated for about 67 minutes, and 6 mg of HPC is added per tablet. In some cases, 1200 g of 4% by mass HPC aqueous solution is sprayed for about 100 minutes to granulate, and when 8 mg of HPC is added per tablet, 1600 g of 4% by mass of HPC aqueous solution is sprayed for about 133 minutes. Granulated while doing. The obtained granulated product was dried as it was at 80 ° C. for 5 minutes using a fluidized bed, and sieved through a mesh 30 filter. Add the post-additives shown in Table 5 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 5.
表5に示す通り、造粒液は、4%のHPC溶液を1錠あたり4mg、6mg又は8mgの含有量となるように用い、プレガバリンを含有する造粒部分の添加物としてD−ソルビトール、還元麦芽糖水飴、エリスリトールを検討した。なお、後添加物中のセルロース系添加物としては、いずれの検体もクロスカルメロースナトリウムを1錠あたり2mg含有していた。また、検体名:MP7−1(1)、MP7−2(1)、MP7−3(1)、MP8−2(1)の各検体では、さらに1錠あたり10mgの結晶セルロースを含有していた。 As shown in Table 5, a 4% HPC solution was used so as to have a content of 4 mg, 6 mg or 8 mg per tablet, and D-sorbitol was used as an additive for the granulated portion containing pregabalin, and reduced. Maltose starch syrup and erythritol were examined. As the cellulosic additive in the post-additive, each sample contained 2 mg of croscarmellose sodium per tablet. In addition, each sample of sample names: MP7-1 (1), MP7-2 (1), MP7-3 (1), and MP8-2 (1) further contained 10 mg of crystalline cellulose per tablet. ..
試作した圧縮固形製剤の硬度:
試作した圧縮固形製剤の試作直後の硬度を、硬度測定機(KHT−20N、藤原製作所)を用いて測定した。測定結果は、表5に記載のとおりであった。
表5に記載のとおり、錠剤の硬度については、いずれの試作錠剤とも、保存開始時点での硬度は66N以上あり、十分な硬度を有していた。
Hardness of the prototype compressed solid formulation:
The hardness of the prototype compressed solid preparation immediately after the trial production was measured using a hardness measuring machine (KHT-20N, Fujiwara Seisakusho). The measurement results are as shown in Table 5.
As shown in Table 5, the hardness of all the prototype tablets was 66 N or more at the start of storage, which was sufficient.
しかしながら、造粒部分の添加物としてD−ソルビトールを用いた試作錠剤を40℃75%相対湿度で3日間保存した場合には、いずれも、約20N以下に硬度が低下した(検体名MP7−1(1)、MP7−2の(1)〜(5)、MP7−3(1))。一方、造粒部分の添加物として還元麦芽糖水飴又はエリスリトールを用いた試作錠剤を40℃75%相対湿度で3日間保存した場合には、いずれも40Nを超える硬度を維持していた(検体名MP8−2の(1)〜(5)、MP9−2(3))。 However, when the prototype tablets using D-sorbitol as an additive for the granulated portion were stored at 40 ° C. and 75% relative humidity for 3 days, the hardness was reduced to about 20 N or less (specimen name MP7-1). (1), MP7-2 (1) to (5), MP7-3 (1)). On the other hand, when the prototype tablets using reduced maltose starch syrup or erythritol as an additive for the granulated portion were stored at 40 ° C. and 75% relative humidity for 3 days, the hardness was maintained over 40 N (specimen name MP8). -2 (1) to (5), MP9-2 (3)).
試作した圧縮固形製剤の保存安定性:
それぞれの圧縮固形製剤を、40℃75%相対湿度で7日間保存した。
造粒部分の添加物としてD−ソルビトールを用いた試作錠剤は、40℃75%相対湿度で7日間保存することによってラクタム体の量がおよそ倍以上に増加したが、それでも保存後のラクタム体の量は0.1%以下であり、40℃75%相対湿度で7日間保存したことによって増加したラクタム体の量は0.057%以下であった(検体名MP7−1(1)、MP7−2の(1)〜(5)、MP7−3(1))。このことから、結晶セルロース及び/又はクロスカルメロースナトリウムを後添加物に含んでいても、造粒部分にD−ソルビトールを含んでいれば、ラクタム体の増加を十分に抑制しうることがわかった。
Storage stability of the prototype compressed solid formulation:
Each compressed solid preparation was stored at 40 ° C. and 75% relative humidity for 7 days.
Trial tablets using D-sorbitol as an additive for the granulated portion had more than doubled the amount of lactams when stored at 40 ° C and 75% relative humidity for 7 days, but still the lactams after storage. The amount was 0.1% or less, and the amount of lactam compound increased by storing at 40 ° C. and 75% relative humidity for 7 days was 0.057% or less (specimen names MP7-1 (1), MP7-). 2 (1) to (5), MP7-3 (1)). From this, it was found that even if crystalline cellulose and / or sodium croscarmellose is contained in the post-additive, if D-sorbitol is contained in the granulated portion, the increase in the lactam form can be sufficiently suppressed. ..
一方、造粒部分の添加物として還元麦芽糖水飴又はエリスリトールを用いた試作錠剤は、40℃75%相対湿度で7日間保存した後のラクタム体の量はおよそ0.145%以下であり、40℃75%相対湿度で7日間保存したことによって増加したラクタム体の量は0.072%以下であった(検体名MP8−2の(1)〜(5)、MP9−2(3))。このことから、結晶セルロース及び/又はクロスカルメロースナトリウムを後添加物に含んでいても、造粒部分に還元麦芽糖水飴又はエリスリトールを含んでいれば、ラクタム体の増加を十分に抑制しうることがわかった。 On the other hand, in the trial tablet using reduced maltose starch syrup or erythritol as an additive for the granulated portion, the amount of lactam after storage at 40 ° C. and 75% relative humidity for 7 days is about 0.145% or less, and 40 ° C. The amount of lactams increased by storage at 75% relative humidity for 7 days was 0.072% or less ((1) to (5), MP9-2 (3) of sample names MP8-2). From this, even if crystalline cellulose and / or sodium croscarmellose is contained in the post-additive, if the granulated portion contains reduced maltose starch syrup or erythritol, the increase in lactam can be sufficiently suppressed. all right.
試作した圧縮固形製剤の崩壊性:
検体名:MP7−1(1)、MP7−2(1)、MP7−3(1)、MP8−2(2)の圧縮固形製剤についてのみ、日本薬局方に規定する溶出試験の方法に従って、パドル法を用い、1分間に50回転の条件で、ベッセル内での水に対する崩壊時間を測定した。
その結果、下記のとおり、いずれの検体についても日本薬局方において素錠について求められている30分以内の崩壊が達成されており、十分に早い崩壊性を有することがわかった。
Disintegration of the prototype compressed solid formulation:
Specimen name: Only for compressed solid preparations of MP7-1 (1), MP7-2 (1), MP7-3 (1), MP8-2 (2), paddle according to the dissolution test method specified in the Japanese Pharmacopoeia. Using the method, the decay time with respect to water in the vessel was measured under the condition of 50 revolutions per minute.
As a result, as shown below, it was found that the disintegration within 30 minutes required for the uncoated tablets by the Japanese Pharmacopoeia was achieved for all the samples, and that they had sufficiently fast disintegration.
検体名MP7−1(1):
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンと1錠あたり4mgのD−ソルビトールとを造粒した後に、これに1錠あたり10mgの結晶セルロース(KG802)、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は4分であった。
Specimen name MP7-1 (1):
After granulating 75 mg of pregabalin per tablet and 4 mg of D-sorbitol per tablet using a 4% aqueous HPC solution (HPC per tablet is 4 mg), 10 mg of crystalline cellulose per tablet (KG802). ), 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added and mixed, and the disintegration time was 4 minutes when the tablet was beaten at a pressure of 0.8 t.
検体名MP7−2(1):
4%のHPC水溶液(1錠あたりのHPCは6mg)を用いて1錠あたり75mgのプレガバリンと1錠あたり4mgのD−ソルビトールとを造粒した後に、これに1錠あたり10mgの結晶セルロース(KG802)、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は8分であった。
Specimen name MP7-2 (1):
After granulating 75 mg of pregabalin per tablet and 4 mg of D-sorbitol per tablet using a 4% aqueous HPC solution (HPC per tablet is 6 mg), 10 mg of crystalline cellulose per tablet (KG802). ), 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added and mixed, and the disintegration time was 8 minutes when the tablet was beaten at a pressure of 0.8 t.
検体名MP7−3(1):
4%のHPC水溶液(1錠あたりのHPCは8mg)を用いて1錠あたり75mgのプレガバリンと1錠あたり4mgのD−ソルビトールとを造粒した後に、これに1錠あたり10mgの結晶セルロース(KG802)、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は15分であった。
Specimen name MP7-3 (1):
After granulating 75 mg of pregabalin per tablet and 4 mg of D-sorbitol per tablet using a 4% aqueous HPC solution (8 mg HPC per tablet), 10 mg of crystalline cellulose per tablet (KG802). ), 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added and mixed, and the disintegration time was 15 minutes when the tablet was beaten at a pressure of 0.8 t.
検体名MP8−2(2):
4%のHPC水溶液(1錠あたりのHPCは6mg)を用いて1錠あたり75mgのプレガバリンと1錠あたり7mgの還元麦芽糖水飴とを造粒した後に、これに1錠あたり10mgの直打用D−マンニトール(パーテックM200)、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は7分であった。
Specimen name MP8-2 (2):
After granulating 75 mg of pregabalin per tablet and 7 mg of reduced maltose starch syrup per tablet using a 4% aqueous HPC solution (HPC per tablet is 6 mg), 10 mg of D for direct beating per tablet. -Mannitol (Pertec M200), 2 mg of croscarmellose sodium per tablet, and 1 mg of calcium stearate per tablet were added and mixed, and the disintegration time was 7 minutes when tableted at a pressure of 0.8 t. ..
実施例5のまとめ:
以上のとおり、結晶セルロース及び/又はクロスカルメロースナトリウムを後添加物に含む製剤では、崩壊時間は十分に早かった。しかしながら、造粒部分の添加物としてD−ソルビトールを用いた試作錠剤は、40℃75%相対湿度で7日間保存した場合の保存安定性は良好であった一方で、40℃75%相対湿度で3日間保存した後の硬度が著しく低下した。造粒部分の添加物として還元麦芽糖水飴又はエリスリトールを用いた試作錠剤は、40℃75%相対湿度で7日間保存した場合の保存安定性が良好であるとともに、40℃75%相対湿度で3日間保存した後の硬度も良好であった。
Summary of Example 5:
As described above, in the preparation containing crystalline cellulose and / or sodium croscarmellose as a post-additive, the disintegration time was sufficiently fast. However, the prototype tablet using D-sorbitol as an additive for the granulated portion had good storage stability when stored at 40 ° C. and 75% relative humidity for 7 days, while at 40 ° C. and 75% relative humidity. The hardness decreased significantly after storage for 3 days. Trial tablets using reduced maltose starch syrup or erythritol as an additive for the granulated portion have good storage stability when stored at 40 ° C. and 75% relative humidity for 7 days, and at 40 ° C. and 75% relative humidity for 3 days. The hardness after storage was also good.
圧縮固形製剤の試作;
1%、2%、または3%の水分を含有する主薬顆粒を用いて、プレガバリンを含有する圧縮固形製剤の試作を行った。
Prototype of compressed solid preparation ;
A prototype of a compressed solid preparation containing pregabalin was made using the main drug granules containing 1%, 2%, or 3% of water.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced maltose water candy [Amarti MR100 (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], crystalline cellulose [Theoras KG- 802 (trademark), Asahi Kasei Co., Ltd.], croscarmellose sodium [Ac-Di-Sol (trademark), Wilbur Ellis Co., Ltd.], calcium stearate [Taipei Chemical Industry Co., Ltd.].
表6に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び還元麦芽糖水飴56gを秤量して流動層(FD−MP−01型、パウレック)に投入し、4%ヒドロキシプロピルセルロース水溶液800gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%、2%、または3%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表6に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表6に記載のとおりであった。 Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 6. Specifically, 600 g of the pregavalin drug substance and 56 g of the reduced maltose starch syrup were weighed and put into a fluidized bed (FD-MP-01 type, Paulec), and 800 g of a 4% hydroxypropyl cellulose aqueous solution was added at a speed of 12 g / min. Granulation was performed while spraying at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 67 minutes. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%, 2%, or 3%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 6 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 6.
試作した圧縮固形製剤の保存安定性:
1%、2%、または3%の水分を含有する主薬顆粒を用いて、主薬顆粒そのものの保存安定性、主薬顆粒を結晶セルロース、クロスカルメロースナトリウム、ステアリン酸カルシウムとともに混合した打錠用顆粒の保存安定性、及び打錠用顆粒を0.8tで打錠した試作錠剤のそれぞれを、40℃75%相対湿度で7日間保存した。
Storage stability of the prototype compressed solid formulation:
Storage stability of the main ingredient granules themselves using the main ingredient granules containing 1%, 2%, or 3% water, storage of tableting granules in which the main ingredient granules are mixed with crystalline cellulose, croscarmellose sodium, and calcium stearate. Stability and each of the prototype tablets in which the granules for tableting were tableted at 0.8 ton were stored at 40 ° C. and 75% relative humidity for 7 days.
その結果、水分含有量が1%、2%及び3%である主薬顆粒の夫々において、40℃75%相対湿度で7日間保存したことによるラクタム体の増加量は、打錠しない場合が夫々0.014%、0.015%、0.015%であったのに対して、打錠した場合には0.035%、0.042%、0.035%であったことから、水分含有量に関わらず、打錠による衝撃によって、ラクタム体の経時的な増加が生じることが改めて確認された。一方で、主薬顆粒、打錠用顆粒、及び試作した圧縮固形製剤における経時的なラクタム体の増加は、主薬顆粒の水分含有量によっては変化しなかった。 As a result, in each of the main drug granules having a water content of 1%, 2% and 3%, the amount of increase in the lactam form due to storage at 40 ° C. and 75% relative humidity for 7 days was 0 in each case without tableting. The water content was 0.014%, 0.015%, and 0.015%, whereas it was 0.035%, 0.042%, and 0.035% when tableted. Regardless, it was reconfirmed that the impact of tableting caused an increase in lactam body over time. On the other hand, the increase in lactams over time in the main drug granules, the tableting granules, and the prototype compressed solid preparation did not change depending on the water content of the main drug granules.
圧縮固形製剤の試作;
加速条件で保存した後も錠剤の硬度を維持しうるプレガバリン製剤の検討を行った。
Prototype of compressed solid preparation ;
We investigated a pregabalin preparation that can maintain the hardness of tablets even after storage under accelerated conditions.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、α化デンプン〔日澱化學株式会社〕、白糖〔メルク株式会社〕、アラビアゴム〔三栄源エフ・エフ・アイ株式会社〕、ゼラチン〔三栄源エフ・エフ・アイ株式会社〕、ステアリン酸〔太平化学産業株式会社〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、DFE Pharma社〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced malt sugar water candy [Amalti MR100 (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], pregelatinized starch [Nissho]. Kagaku Co., Ltd.], sucrose [Merck Co., Ltd.], Arabic rubber [Saneigen FFI Co., Ltd.], gelatin [Saneigen FFI Co., Ltd.], stearic acid [Taipei Chemical Industry Co., Ltd.], starch Sodium glycolate [Primogel ™, DFE Pharma], croscarmellose sodium [Ac-Di-Sol ™, Wilbur Ellis Co., Ltd.], calcium stearate [Taipei Chemical Industry Co., Ltd.].
表7に従って乳鉢を用いて200錠分の試作錠剤を作製した。具体的には、プレガバリン15g及び還元麦芽糖水飴1.4gを乳鉢で混合し、各造粒用水溶液(0.3gのHPC、0.3gのα化デンプン、0.3gの白糖、0.3gのアラビアゴム、又は0.3gのゼラチンを含む6gの水溶液)を添加後、乳鉢内で造粒し、80℃の乾燥機(電気定温乾燥機、萱垣医理科工業株式会社)で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%以下となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物を100錠分秤取し、表7に記載の後添加物を1錠あたりの量の100倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表7に記載のとおりであった。 200 prototype tablets were prepared using a mortar according to Table 7. Specifically, 15 g of pregavalin and 1.4 g of reduced maltose water candy were mixed in a dairy pot, and each aqueous solution for granulation (0.3 g HPC, 0.3 g pregelatinized starch, 0.3 g sucrose, 0.3 g) was mixed. After adding (6 g aqueous solution containing arabic rubber or 0.3 g of gelatin), granulate in a dairy pot and dry in a dryer at 80 ° C. (electric constant temperature dryer, Kayagaki Medical Science Industry Co., Ltd.) to obtain the obtained product. The granulated product was dried until the water content became 1% or less while measuring the water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). Then, it was sieved with a filter of mesh 30. The granulated product after drying and sieving was weighed for 100 tablets, and the post-additives shown in Table 7 were added in an amount 100 times the amount per tablet and mixed, and a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki) was used to lock the tablet at a tableting pressure of 0.8 ton. The mass per tablet obtained as a result was as shown in Table 7.
なお、ステアリン酸を含有する試作錠剤については、プレガバリン15g及び還元麦芽糖水飴1.4gを乳鉢で混合し、ステアリン酸の粉末1.6gを添加して80℃の乾燥機(電気定温乾燥機、萱垣医理科工業株式会社)で加熱して溶融しながら造粒した。その後、メッシュ30のフィルターで篩過した。篩過後の造粒物に表7に記載の後添加物を1錠あたりの量の100倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表7に記載のとおりであった。 For the prototype tablet containing stearic acid, 15 g of pregavalin and 1.4 g of reduced maltose starch syrup were mixed in a dairy pot, 1.6 g of stearic acid powder was added, and a dryer at 80 ° C. (electric constant temperature dryer, Kayagaki). Granulation was performed while heating and melting at Medical Science Industry Co., Ltd.). Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 7 to the granulated product after sieving in an amount 100 times the amount per tablet, mix, and use a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki) to apply the tableting pressure. It was locked at 0.8 ton. The mass per tablet obtained as a result was as shown in Table 7.
表7に示す通り、検体名:N3−4乃至N3−8の各試作錠剤については、後添加物の種類及び量を1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムに固定し、造粒顆粒中に粉末で添加する還元麦芽糖水飴の量を1錠あたり7mgに固定した上で、造粒液中に溶かして添加する添加物を様々に変えて、40℃75%相対湿度で保存した後の錠剤硬度とラクタム体の増加を検討した。 As shown in Table 7, for each of the prototype tablets of sample names: N3-4 to N3-8, the type and amount of post-additives were fixed to 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet. Then, after fixing the amount of reduced maltose starch syrup to be added as powder to the granulated granules to 7 mg per tablet, the additives to be added by dissolving in the granulated liquid were changed in various ways, and the relative humidity was 40 ° C. and 75%. We examined the increase in tablet hardness and lactam after storage in.
検体名:N3−9の1群のみは、造粒顆粒中に1錠あたり7mgの還元麦芽糖水飴を粉末で添加するとともに、1錠あたり1.5mgのHPCを造粒液中に溶かして造粒液とともに噴霧して造粒し、後添加物として1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加し、混合した後に打錠して試作錠剤を作製し、検体名:N3−4の試作錠剤と対比した。 Specimen name: For only one group of N3-9, 7 mg of reduced starch sugar candy per tablet was added as a powder to the granulated granules, and 1.5 mg of HPC per tablet was dissolved in the granulation solution for granulation. Granulate by spraying with the liquid, add 2 mg of sodium starch glycolate and 1 mg of calcium stearate per tablet as post-additives, mix and then tablet to prepare a prototype tablet. Specimen name: Contrast with N3-4 prototype tablets.
検体名:N4−1の試作錠剤は、ステアリン酸を用いた溶融造粒の可能性を検討したものである。1錠あたりの成分としては、検体名:N3−4の試作錠剤で用いた1錠あたり1.5mgのHPCの代わりに、検体名:N4−1の試作錠剤では1錠あたり8mgのステアリン酸を添加しているので、検体名:N3−4の試作錠剤と検体名:N4−1の試作錠剤とを対比した。 Specimen name: The prototype tablet of N4-1 examined the possibility of melt granulation using stearic acid. As an ingredient per tablet, instead of 1.5 mg of HPC per tablet used in the prototype tablet of sample name: N3-4, 8 mg of stearic acid per tablet of the prototype tablet of sample name: N4-1 was used. Since it was added, the prototype tablet with the sample name: N3-4 and the prototype tablet with the sample name: N4-1 were compared.
試作した圧縮固形製剤の硬度:
試作した圧縮固形製剤の試作直後の硬度を、硬度測定機(KHT−20N、藤原製作所)を用いて測定した。測定結果は、表7に記載のとおりであった。
表7に記載のとおり、錠剤の硬度については、いずれの試作錠剤とも、保存開始時点での硬度が25N以下であり、保存開始時の硬度としては十分な硬度ではなかった。このことから、主薬顆粒中に還元麦芽糖水飴を1錠あたり7mg添加すると錠剤の硬度が低下することがわかった。
Hardness of the prototype compressed solid formulation:
The hardness of the prototype compressed solid preparation immediately after the trial production was measured using a hardness measuring machine (KHT-20N, Fujiwara Seisakusho). The measurement results are as shown in Table 7.
As shown in Table 7, the hardness of all the prototype tablets was 25 N or less at the start of storage, which was not sufficient as the hardness at the start of storage. From this, it was found that the hardness of the tablets was lowered when 7 mg of reduced maltose starch syrup was added to the granules of the main ingredient.
また、造粒部分の添加物として、1錠あたり7mgの還元麦芽糖水飴とともに1錠あたり1.5mgのα化デンプンを加えた場合(検体名N3−5)、同じく1錠あたり1.5mgの白糖を加えた場合(検体名N3−6)、同じく1錠あたり1.5mgのアラビアゴムを加えた場合(検体名N3−7)、同じく1錠あたり1.5mgのゼラチンを加えた場合(検体名N3−8)には、40℃75%相対湿度で7日間保存した後の錠剤の硬度は0(ゼロ)Nまで低下した。このことから、少なくとも、造粒部分にα化デンプン、白糖、アラビアゴム又はゼラチンを加えた場合には、使用期限中の錠剤の硬度を維持できないことがわかった。 In addition, when 1.5 mg of pregelatinized starch is added per tablet together with 7 mg of reduced maltose starch syrup per tablet as an additive for the granulated portion (specimen name N3-5), 1.5 mg of white sugar per tablet is also added. (Sample name N3-6), 1.5 mg of gum arabic per tablet (Sample name N3-7), and 1.5 mg of gelatin per tablet (Sample name) In N3-8), the hardness of the tablet after storage at 40 ° C. and 75% relative humidity for 7 days decreased to 0 (zero) N. From this, it was found that at least when pregelatinized starch, sucrose, gum arabic or gelatin was added to the granulated portion, the hardness of the tablet during the expiration date could not be maintained.
一方、造粒液中の添加物として1錠あたり1.5mgのHPCと1錠あたり7mgの還元麦芽糖水飴を用いた場合(検体名N3−4、N3−9)には、40℃75%相対湿度で7日間保存した後の錠剤の硬度は約10Nを維持しており、造粒部分にHPCを加えることで、使用期間中のプレガバリン錠の硬度を維持できる可能性のあることがわかった。 On the other hand, when 1.5 mg of HPC per tablet and 7 mg of reduced maltose starch syrup per tablet were used as additives in the granulation solution (specimen names N3-4, N3-9), the temperature was 75% relative to 40 ° C. The hardness of the tablets after storage at humidity for 7 days was maintained at about 10 N, and it was found that the hardness of the pregavalin tablets during the period of use may be maintained by adding HPC to the granulated portion.
また、造粒液中の添加物として1錠あたり8mgのステアリン酸と1錠あたり7mgの還元麦芽糖水飴を用いて溶融造粒した場合(検体名N4−1)には、保存開始時に25Nの錠剤硬度があり、40℃75%相対湿度で7日間保存した後にも17Nの硬度を維持できていたことから、造粒部分にステアリン酸を加えた溶融造粒によってプレガバリン製剤の硬度を上昇させるとともに、保存中の錠剤硬度低下を来しにくいことがわかった。 In the case of melt granulation using 8 mg of stearic acid per tablet and 7 mg of reduced maltose water candy per tablet as additives in the granulation liquid (specimen name N4-1), 25 N tablets at the start of storage. Since it had a hardness and could maintain a hardness of 17N even after being stored at 40 ° C. and 75% relative humidity for 7 days, the hardness of the pregavalin preparation was increased by melt granulation in which stearic acid was added to the granulated part, and at the same time. It was found that the tablet hardness during storage is unlikely to decrease.
試作した圧縮固形製剤の保存安定性:
それぞれの圧縮固形製剤を、40℃75%相対湿度で保存して、内径4.6mm、長さ25cmのステンレス管に5μmのオクタデシルシリル化シリカゲルを充てんしたカラムを用いた高速液体クロマトグラムで7日後及び14日後のラクタム体を定量した。
Storage stability of the prototype compressed solid formulation:
Each compressed solid preparation is stored at 40 ° C. and 75% relative humidity, and is subjected to a high-speed liquid chromatogram using a column filled with 5 μm octadecylsilylated silica gel in a stainless steel tube having an inner diameter of 4.6 mm and a length of 25 cm after 7 days. And the lactam body after 14 days was quantified.
造粒部分の添加物として、1錠あたり7mgの還元麦芽糖水飴とともに1錠あたり8mgのステアリン酸を加えて溶融造粒した場合(検体名N4−1)、保存開始時のラクタム体含有量は0.064%であったのに対して、40℃75%相対湿度で14日間保存した後のラクタム体含有量は0.437%に増加しており、ステアリン酸を加えた溶融造粒によって経時的なラクタム体の増加が観察された。 When melt granulation is performed by adding 7 mg of reduced maltose starch syrup per tablet and 8 mg of stearic acid per tablet as an additive for the granulated portion (specimen name N4-1), the lactam content at the start of storage is 0. The lactam content increased to 0.437% after storage at 40 ° C. and 75% relative humidity for 14 days, while it was .064%, and over time due to melt granulation with the addition of stearic acid. An increase in lactam was observed.
同様に、造粒部分の添加物として、1錠あたり7mgの還元麦芽糖水飴とともに1錠あたり1.5mgのゼラチンを加えた場合(検体名N3−8)、40℃75%相対湿度で14日間保存した後のラクタム体含有量は0.176%に増加しており、ゼラチンを加えることによって経時的なラクタム体の増加が観察された。 Similarly, when 1.5 mg of gelatin per tablet is added together with 7 mg of reduced maltose starch syrup per tablet as an additive for the granulated portion (specimen name N3-8), it is stored at 40 ° C. and 75% relative humidity for 14 days. The lactam content increased to 0.176%, and an increase in lactam over time was observed with the addition of gelatin.
造粒部分の添加物として、1錠あたり7mgの還元麦芽糖水飴とともに1錠あたり1.5mgのHPCを加えた場合(検体名N3−4)、同じく1錠あたり1.5mgのα化デンプンを加えた場合(検体名N3−5)、同じく1錠あたり1.5mgの白糖を加えた場合(検体名N3−6)、同じく1錠あたり1.5mgのアラビアゴムを加えた場合(検体名N3−7)には、40℃75%相対湿度で14日間保存した後のラクタム体含有量は0.103%〜0.124%の間であり、40℃75%相対湿度で14日間保存したことによるラクタム体の増加量も0.042%〜0.067%であったことから、僅かな経時的なラクタム体の増加が観察された。 When 1.5 mg of HPC per tablet is added together with 7 mg of reduced maltose starch syrup per tablet (specimen name N3-4), 1.5 mg of pregelatinized starch is also added per tablet as an additive for the granulated portion. (Sample name N3-5), 1.5 mg of maltose per tablet (Sample name N3-6), and 1.5 mg of arabic rubber per tablet (Sample name N3-). In 7), the lactam content after storage at 40 ° C. and 75% relative humidity for 14 days was between 0.103% and 0.124%, which was due to storage at 40 ° C. and 75% relative humidity for 14 days. Since the amount of increase in lactam was also 0.042% to 0.067%, a slight increase in lactam over time was observed.
これに対して、造粒液中の添加物を1錠あたり1.5mgのHPCと1錠あたり7mgの還元麦芽糖水飴とし、後添加物として1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを用いた場合(検体名N3−9)には、40℃75%相対湿度で14日間保存した後のラクタム体含有量は0.066%にとどまり、40℃75%相対湿度で14日間保存したことによるラクタム体の増加も0.028%に過ぎなかったことから、後添加物としてデンプングリコール酸ナトリウムを用いるのが好ましく、検体名:N3−4等との対比から、後添加物としてクロスカルメロースナトリウムを加えることは保存安定性を保つ上で好ましくないことがわかった。 On the other hand, the additives in the granulation solution were 1.5 mg of HPC per tablet and 7 mg of reduced maltose starch syrup per tablet, and 2 mg of sodium starch glycolate per tablet and 1 mg per tablet as post-additives. When calcium stearate was used (specimen name N3-9), the lactam content after storage at 40 ° C. and 75% relative humidity for 14 days remained at 0.066%, and 14 at 40 ° C. and 75% relative humidity. Since the increase in lactam form due to storage for days was only 0.028%, it is preferable to use sodium starch glycolate as a post-additive, and in comparison with the sample name: N3-4, etc., the post-additive It was found that the addition of croscarmellose sodium was not preferable for maintaining storage stability.
圧縮固形製剤の試作;
試作した圧縮固形製剤の保存安定性の検討を行った。
Prototype of compressed solid preparation ;
The storage stability of the prototype compressed solid preparation was examined.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、D−ソルビトール〔メルク株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、エリスリトール〔三栄源エフ・エフ・アイ株式会社〕、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、ステアリン酸マグネシウム〔太平化学産業株式会社〕、低置換度ヒドロキシプロピルセルロース〔LH−11(商標)、信越化学工業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], D-sorbitol [Merck Co., Ltd.], reduced malt sugar water candy [Amarti MR100 (trademark), Mitsubishi Corporation Food Tech Co., Ltd.) Company], Erythritol [Saneigen FFI Co., Ltd.], Crystalline cellulose [Theoras KG-802 (trade), Asahi Kasei Co., Ltd.], Croscarmellose sodium [Ac-Di-Sol (trademark), Wilbur Ellis Co., Ltd. Company], calcium stearate [Taipei Chemical Industry Co., Ltd.], magnesium stearate [Taipei Chemical Industry Co., Ltd.], low-substituted hydroxypropyl cellulose [LH-11 ™, Shin-Etsu Chemical Industry Co., Ltd.].
表8に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び表8に記載の「造粒顆粒中に粉末で加える添加物」の1錠あたりの量の8000倍の量を秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液を毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、噴霧しながら造粒した。HPC水溶液の噴霧量及び噴霧時間は、1錠あたり4mgのHPCを加える場合には4質量%のHPC水溶液800gを約67分間にわたって噴霧しながら造粒し、1錠あたり6mgのHPCを加える場合には4質量%のHPC水溶液1200gを約100分間にわたって噴霧しながら造粒し、1錠あたり8mgのHPCを加える場合には4質量%のHPC水溶液1600gを約133分間にわたって噴霧しながら造粒した。「造粒顆粒中に粉末で加える添加物」の添加量は、1錠あたり1mgのD−ソルビトールを加える場合には8gのD−ソルビトールを粉末で添加し、1錠あたり4mgのD−ソルビトールを加える場合には32gのD−ソルビトールを粉末で添加し、1錠あたり7mgのD−ソルビトールを加える場合には56gのD−ソルビトールを粉末で添加した。還元麦芽糖水飴及びエリスリトールについても、同様に粉末で添加した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表8に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表8に記載のとおりであった。 Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 8. Specifically, the fluidized layer (FD-MP-01) is weighed 8000 times the amount per tablet of 600 g of the pregavalin drug substance and "additives added as powder into granulated granules" shown in Table 8. The 4% by mass HPC aqueous solution prepared in advance for granulation was granulated at a speed of 12 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. while spraying. .. The spray amount and spray time of the HPC aqueous solution are such that when 4 mg of HPC is added per tablet, 800 g of 4 mass% HPC aqueous solution is sprayed for about 67 minutes to granulate, and when 6 mg of HPC is added per tablet. Granulated while spraying 1200 g of a 4 mass% HPC aqueous solution for about 100 minutes, and when 8 mg of HPC was added per tablet, granulated while spraying 1600 g of a 4 mass% HPC aqueous solution for about 133 minutes. The amount of "additives added as powder to granulated granules" is 8 g of D-sorbitol added as powder when 1 mg of D-sorbitol is added per tablet, and 4 mg of D-sorbitol per tablet. When adding, 32 g of D-sorbitol was added in powder form, and when adding 7 mg of D-sorbitol per tablet, 56 g of D-sorbitol was added in powder form. Reduced maltose starch syrup and erythritol were also added in powder form in the same manner. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 8 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 8.
表8に示す通り、検体名がNで始まる試作錠剤においては、1錠あたり4mgのHPC含有量となるように4%のHPC溶液を造粒液として用い、プレガバリンを含有する造粒部分の添加物としてD−ソルビトール、還元麦芽糖水飴、又はエリスリトールを1錠あたり1mg、4mg、又は7mgとなるように粉末で添加した。後添加物は、1錠あたり10mgの結晶セルロース、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを含む組成であった。 As shown in Table 8, in the prototype tablets whose sample name starts with N, a 4% HPC solution was used as the granulation solution so that the HPC content per tablet was 4 mg, and the granulated portion containing pregavalin was added. As a substance, D-sorbitol, reduced maltose starch syrup, or erythritol was added as a powder so as to be 1 mg, 4 mg, or 7 mg per tablet. The post-additive had a composition containing 10 mg of crystalline cellulose per tablet, 2 mg of sodium croscarmellose per tablet, and 1 mg of calcium stearate per tablet.
検体名がMで始まる試作錠剤においては、1錠あたり4mgのHPC含有量となるように4%のHPC溶液を造粒液として用い、プレガバリンを含有する造粒部分の添加物としてD−ソルビトールを1錠あたり4mgとなるように粉末で添加した。 For prototype tablets whose sample name starts with M, a 4% HPC solution was used as the granulation solution so that each tablet contained 4 mg of HPC, and D-sorbitol was used as an additive for the granulated portion containing pregabalin. It was added as a powder so as to be 4 mg per tablet.
後添加物は、表8に記載のとおり、結晶セルロースとステアリン酸カルシウムの1錠あたりの量を固定してL−HPCの量を1錠あたり10mgまたは2mgに変化させた(検体名MP4−1−1とMP4−1−2)。 As for the post-additive, as shown in Table 8, the amount of crystalline cellulose and calcium stearate per tablet was fixed, and the amount of L-HPC was changed to 10 mg or 2 mg per tablet (specimen name MP4-1-1). 1 and MP4-1-2).
あるいは、後添加物は、表8に記載のとおり、クロスカルメロースとステアリン酸カルシウムの1錠あたりの量を固定して結晶セルロースの量を1錠あたり5mg、10mg、又は20mgに変化させた(検体名MP4−2−1、MP4−2−2、及びMP−4−2−3)。 Alternatively, as the post-additive, as shown in Table 8, the amount of croscarmellose and calcium stearate per tablet was fixed, and the amount of crystalline cellulose was changed to 5 mg, 10 mg, or 20 mg per tablet (sample). Names MP4-2-1, MP4-2-2, and MP-4-2-3).
さらに、検体名が75で始まる試作錠剤においては、後添加物を1錠あたり41mgの結晶セルロース、1錠あたり10mgのL−HPC、及び1錠あたり1.5mgのステアリン酸マグネシウムに固定して、プレガバリンを含有する造粒物の製造に用いる造粒液を1錠あたり2mg、4mg又は8mgのHPC含有量となるように4%のHPC溶液の液量を増減して造粒した(検体名MP75−M1、75−M2、及び75−M3)。 Furthermore, in the prototype tablets whose sample name starts with 75, the post-additives are fixed to 41 mg of crystalline cellulose per tablet, 10 mg of L-HPC per tablet, and 1.5 mg of magnesium stearate per tablet. The granulation solution used for producing granulated products containing pregavalin was granulated by increasing or decreasing the amount of 4% HPC solution so as to have an HPC content of 2 mg, 4 mg or 8 mg per tablet (specimen name MP75). -M1, 75-M2, and 75-M3).
試作した圧縮固形製剤の硬度:
試作した圧縮固形製剤の試作直後の硬度を、硬度測定機(KHT−20N、藤原製作所)を用いて測定した。測定結果は、表8に記載のとおりであった。
表8に記載のとおり、錠剤の硬度については、いずれの試作錠剤とも、保存開始時点での硬度は約30N以上あり、十分な硬度を有していた。
Hardness of the prototype compressed solid formulation:
The hardness of the prototype compressed solid preparation immediately after the trial production was measured using a hardness measuring machine (KHT-20N, Fujiwara Seisakusho). The measurement results are as shown in Table 8.
As shown in Table 8, the hardness of all the prototype tablets was about 30 N or more at the start of storage, and had sufficient hardness.
試作した圧縮固形製剤の保存安定性:
それぞれの圧縮固形製剤を、40℃75%相対湿度で保存し、7日後、14日後、又は28日後のラクタム体の量を定量した。
Storage stability of the prototype compressed solid formulation:
Each compressed solid preparation was stored at 40 ° C. and 75% relative humidity, and the amount of lactam was quantified after 7, 14, or 28 days.
造粒部分の添加物として1錠あたり4mgのHPCのみを添加し、後添加物として10mgの結晶セルロース、2mgのクロスカルメロースナトリウム、及び1mgのステアリン酸カルシウムを加えた場合(検体名:N1)には、試作錠剤中のラクタム体は経時的に増加し、40℃75%相対湿度で2週間保存したことによるラクタム体の増加量は0.320%であった。このことから、結晶セルロースやクロスカルメロースナトリウムなどのセルロース系添加物と一緒にプレガバリンを打錠することによって、経時的にラクタム体の量が増加することが窺えた。 When only 4 mg of HPC per tablet was added as an additive for the granulated portion, and 10 mg of crystalline cellulose, 2 mg of croscarmellose sodium, and 1 mg of calcium stearate were added as post-additives (specimen name: N1). The amount of lactam in the trial tablet increased with time, and the amount of increase in lactam after storage at 40 ° C. and 75% relative humidity for 2 weeks was 0.320%. From this, it can be seen that the amount of lactam is increased over time by tableting pregabalin together with cellulosic additives such as crystalline cellulose and croscarmellose sodium.
これに対して、造粒部分の添加物として1錠あたり4mgのHPCに加えて、1錠あたり1mg、4mg、又は7mgのエリスリトールを添加した場合には、40℃75%相対湿度で2週間保存したことによる試作錠剤中のラクタム体の経時的増加量は0.182%〜0.191%に抑制されたものの、エリスリトールの添加量に比例した効果は見られなかった(検体名:N4−1、N4−2、N4−3)。 On the other hand, when 1 mg, 4 mg, or 7 mg of erythritol was added per tablet in addition to 4 mg of HPC per tablet as an additive for the granulated portion, the mixture was stored at 40 ° C. and 75% relative humidity for 2 weeks. Although the amount of increase in lactam in the trial tablet over time was suppressed to 0.182% to 0.191%, no effect proportional to the amount of erythritol added was observed (specimen name: N4-1). , N4-2, N4-3).
造粒部分の添加物として1錠あたり4mgのHPCに加えて、1錠あたり1mg、4mg、または7mgの還元麦芽糖水飴を添加した場合には、試作錠剤中のラクタム体の経時的増加は、添加した還元麦芽糖水飴の量が多いほど抑制され、40℃75%相対湿度で2週間保存したことによる試作錠剤中のラクタム体の経時的増加量は、1錠あたり1mgの還元麦芽糖水飴を加えた場合に0.202%、1錠あたり4mgの還元麦芽糖水飴を加えた場合に0.139%、1錠あたり7mgの還元麦芽糖水飴を加えた場合に0.134%であった。そのため、1錠あたり4mg又は7mgの還元麦芽糖水飴を加えた検体では、同じ量のエリスリトールを添加した場合より少ない量のラクタム体量に維持することができた(検体名:N3−1、N3−2、N3−3)。 When 1 mg, 4 mg, or 7 mg of reduced maltose starch syrup was added per tablet in addition to 4 mg of HPC per tablet as an additive for the granulated portion, the increase in lactam in the prototype tablet over time was added. The larger the amount of reduced maltose starch syrup, the more suppressed it was, and the amount of increase in lactam in the prototype tablet over time due to storage at 40 ° C. and 75% relative humidity for 2 weeks was when 1 mg of reduced maltose starch syrup was added per tablet. 0.202% was 0.139% when 4 mg of reduced maltose starch syrup was added per tablet, and 0.134% when 7 mg of reduced maltose starch syrup was added per tablet. Therefore, in the sample to which 4 mg or 7 mg of reduced maltose starch syrup was added per tablet, the amount of lactam was maintained at a smaller amount than when the same amount of erythritol was added (sample names: N3-1, N3-). 2, N3-3).
造粒部分の添加物として1錠あたり4mgのHPCに加えて、1錠あたり1mg、4mg、または7mgのD−ソルビトールを加えた場合には、試作錠剤中のラクタム体の経時的増加は、添加したD−ソルビトールの量が多いほど抑制され、40℃75%相対湿度で2週間保存したことによる試作錠剤中のラクタム体の経時的増加量は、1錠あたり1mgのD−ソルビトールを加えた場合に0.178%、1錠あたり4mgのD−ソルビトールを加えた場合に0.103%であった。また1錠あたり7mgのD−ソルビトールを加えた場合、40℃75%相対湿度で2週間保存した後のラクタム体の絶対量は0.137%にとどまっていた(保存開始時のデータがないのでラクタム体の経時的増加量は不明)。このように、1錠あたり1mg、4mg、または7mgのD−ソルビトールを加えた検体では、同じ量の還元麦芽糖水飴を添加した場合よりもさらに少ない量のラクタム体量に維持することができた(検体名:N2−1、N2−2、N2−3)。 When 1 mg, 4 mg, or 7 mg of D-sorbitol was added per tablet in addition to 4 mg of HPC per tablet as an additive for the granulated portion, the increase in lactam in the prototype tablet over time was added. The larger the amount of D-sorbitol, the more it was suppressed, and the amount of increase in lactam in the trial tablet over time due to storage at 40 ° C and 75% relative humidity for 2 weeks was obtained when 1 mg of D-sorbitol was added per tablet. 0.178% was 0.103% when 4 mg of D-sorbitol was added per tablet. When 7 mg of D-sorbitol was added per tablet, the absolute amount of lactam was only 0.137% after storage at 40 ° C. and 75% relative humidity for 2 weeks (since there is no data at the start of storage). The amount of lactam body increased over time is unknown). Thus, samples supplemented with 1 mg, 4 mg, or 7 mg of D-sorbitol per tablet were able to maintain a much smaller amount of lactam than when the same amount of reduced maltose starch syrup was added (). Specimen name: N2-1, N2-2, N2-3).
造粒部分の添加物として1錠あたり4mgのHPC及び1錠あたり4mgのD−ソルビトールを添加し、後添加物として1錠あたり10mgの結晶セルロース、1錠あたり1mgのステアリン酸カルシウム、及び1錠あたり2mgのL−HPCを加えた場合(検体名:MP4−1−2)には、40℃75%相対湿度で2週間保存したことによる試作錠剤中のラクタム体の経時的増加量は0.076%にとどまり、当該検体のL−HPC量を同量のクロスカルメロースナトリウムに変更した場合の40℃75%相対湿度で2週間保存したことによる試作錠剤中のラクタム体の経時的増加量0.103%(検体名:N2−2)に比べても、さらに少ない経時的ラクタム体の生成量に維持することができた。このことから、打錠による衝撃を契機とした経時的なラクタム体の増加抑制には、クロスカルメロースナトリウムは好ましくなく、L−HPCが好ましいことがわかった。 4 mg of HPC per tablet and 4 mg of D-sorbitol per tablet were added as additives for the granulated portion, and 10 mg of crystalline cellulose per tablet and 1 mg of calcium stearate per tablet as post-additives, and 1 mg of calcium stearate per tablet. When 2 mg of L-HPC was added (specimen name: MP4-1-2), the amount of increase in lactam in the trial tablet over time due to storage at 40 ° C. and 75% relative humidity for 2 weeks was 0.076. The amount of increase in lactam in the trial tablet over time due to storage at 40 ° C. and 75% relative humidity for 2 weeks when the amount of L-HPC of the sample was changed to the same amount of croscarmellose sodium. Compared with 103% (specimen name: N2-2), the amount of lactam produced over time could be maintained even smaller. From this, it was found that croscarmellose sodium is not preferable and L-HPC is preferable for suppressing the increase of lactams over time triggered by the impact of tableting.
しかも、上記MP4−1−2のL−HPCの量を1錠あたり2mgから1錠あたり10mgに増やしても、経時的なラクタム体の生成量はほぼ同等であった(検体名N4−1−1)。このことから、L−HPCは、経時的なラクタム体の増加にあまり影響しないことがわかった。 Moreover, even if the amount of L-HPC of MP4-1-2 was increased from 2 mg per tablet to 10 mg per tablet, the amount of lactam produced over time was almost the same (specimen name N4-1-1). 1). From this, it was found that L-HPC does not significantly affect the increase of lactams over time.
造粒部分の添加物として1錠あたり4mgのHPC及び1錠あたり4mgのD−ソルビトールを添加し、後添加物として1錠あたり10mgの結晶セルロース、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを加えた検体(検体名:MP4−2−2)を40℃75%相対湿度で2週間保存した後のラクタム体の量(0.158%)に比べて、後添加物の結晶セルロースの量を1錠あたり5mgに減らした検体(検体名4−2−1)を40℃75%相対湿度で2週間保存した後のラクタム体の量は0.150%に減少し、後添加物の結晶セルロースの量を1錠あたり20mgに増やした検体(検体名4−2−3)を40℃75%相対湿度で2週間保存した後のラクタム体の量は0.132%に増加した。このことから、結晶セルロースと一緒にプレガバリンを打錠することによって、経時的にラクタム体の量が増加し、結晶セルロースの添加量が多いほど経時的なラクタム体の生成量が多いことがわかった。 4 mg HPC per tablet and 4 mg D-sorbitol per tablet were added as additives for the granulated portion, and 10 mg crystalline cellulose per tablet and 2 mg croscarmellose sodium per tablet as post-additives, and 1 A sample (specimen name: MP4-2-2) containing 1 mg of calcium stearate per tablet was added afterwards compared to the amount of lactam (0.158%) after storage at 40 ° C. and 75% relative humidity for 2 weeks. After storing a sample (specimen name 4-2-1) in which the amount of crystalline cellulose of a product was reduced to 5 mg per tablet at 40 ° C. and 75% relative humidity for 2 weeks, the amount of lactam was reduced to 0.150%. The amount of lactam form after storing a sample (specimen name 4-2-3) in which the amount of crystalline cellulose as a post-additive was increased to 20 mg per tablet at 40 ° C. and 75% relative humidity for 2 weeks was 0.132%. Increased to. From this, it was found that by tableting pregabalin together with crystalline cellulose, the amount of lactams increased over time, and the greater the amount of crystalline cellulose added, the greater the amount of lactams produced over time. ..
造粒部分の添加物として1錠あたり2mg、4mgまたは8mgのHPCのみを添加し、後添加物として1錠あたり41mgの結晶セルロース、1錠あたり10mgのL−HPC、及び1錠あたり1.5mgのステアリン酸マグネシウムを加えた検体(検体名75−M1、75−M2、75−M3)を40℃75%相対湿度で2週間保存したことによるラクタム体の生成量は、1錠あたり2mgのHPC添加で0.337%、1錠あたり4mgのHPC添加で0.387%、1錠あたり8mgのHPC添加で0.428%であり、いずれも、経時的なラクタム体の生成量が多すぎて実用には程遠い製剤であった。このことから、1錠あたり41mgもの結晶セルロース添加した場合には、基本的に経時的なラクタム体の生成が多すぎることがわかった。また、加えたHPCの量が多いと経時的なラクタム体の生成量が微増する傾向が見られたことから、ある程度の量までのHPCであれば、経時的なラクタム体の生成量が許容できる範囲内であるとしても、経時的なラクタム体の生成抑制のためには、HPCの量は少ない方が好ましいことがわかった。 Only 2 mg, 4 mg or 8 mg of HPC per tablet was added as an additive for the granulated portion, and 41 mg of crystalline cellulose per tablet was added as a post-additive, 10 mg of L-HPC per tablet, and 1.5 mg per tablet. The amount of lactam produced by storing the samples (specimen names 75-M1, 75-M2, 75-M3) to which magnesium stearate was added at 40 ° C. and 75% relative humidity for 2 weeks was 2 mg of HPC per tablet. The addition was 0.337%, the addition of 4 mg of HPC per tablet was 0.387%, and the addition of 8 mg of HPC per tablet was 0.428%. It was a formulation far from practical use. From this, it was found that when 41 mg of crystalline cellulose was added per tablet, basically too much lactam body was produced over time. In addition, since the amount of lactam produced over time tended to increase slightly when the amount of HPC added was large, the amount of lactam produced over time was acceptable if the amount of HPC was up to a certain level. Even if it is within the range, it was found that a small amount of HPC is preferable for suppressing the production of lactams over time.
試作した圧縮固形製剤の崩壊性:
検体名MP4−1−1の圧縮固形製剤についてのみ、日本薬局方に規定する溶出試験の方法に従って、パドル法を用い、1分間に50回転の条件で、ベッセル内での水に対する崩壊時間を測定した。
その結果、下記のとおり、検体名:MP4−1−1の検体は、日本薬局方において素錠について求められている30分以内の崩壊が達成されており、十分に早い崩壊性を有することがわかった。
Disintegration of the prototype compressed solid formulation:
Only for the compressed solid preparation with the sample name MP4-1-1, the disintegration time with respect to water in the vessel is measured using the paddle method according to the dissolution test method specified in the Japanese Pharmacopoeia under the condition of 50 rotations per minute. bottom.
As a result, as shown below, the sample with the sample name: MP4-1-1 has achieved the disintegration within 30 minutes required for the uncoated tablets by the Japanese Pharmacopoeia, and has sufficiently fast disintegration property. all right.
検体名MP4−1−1:
4%のHPC水溶液(1錠あたりのHPCは4mg)を用いて1錠あたり75mgのプレガバリンと1錠あたり4mgのD−ソルビトールとを造粒した後に、これに1錠あたり10mgの結晶セルロース(KG802)、1錠あたり10mgのL−HPC、及び1錠あたり1mgのステアリン酸カルシウムを加えて混合して0.8tの圧力で打錠した場合の崩壊時間は5.5分であった。
Specimen name MP4-1: 1:
After granulating 75 mg of pregabalin per tablet and 4 mg of D-sorbitol per tablet using a 4% aqueous HPC solution (HPC per tablet is 4 mg), 10 mg of crystalline cellulose per tablet (KG802). ), 10 mg of L-HPC per tablet and 1 mg of calcium stearate per tablet were added, mixed, and tableted at a pressure of 0.8 t, and the disintegration time was 5.5 minutes.
圧縮固形製剤の試作;
40℃75%相対湿度で保存した場合に硬度を維持することができ、かつ、保存安定なプレガバリン製剤の処方を確立するべく、様々な試作錠剤の硬度とラクタム体の量を検討した。実施例9の試作では、結晶セルロースはラクタム体の経時的な増加を引き起こすので使用しなかった。
Prototype of compressed solid preparation ;
The hardness and amount of lactams of various prototype tablets were examined in order to establish a formulation of a pregabalin preparation that can maintain hardness when stored at 40 ° C. and 75% relative humidity and is stable in storage. In the prototype of Example 9, crystalline cellulose was not used because it causes an increase in lactams over time.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、D−ソルビトール〔メルク株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、エリスリトール〔三栄源エフ・エフ・アイ株式会社〕、イソマルト〔galenIQ800(商標)、BENEO−Palatinit GmbH〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], D-mannitol [Mannitol P (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], D-sorbitol [Merck]. Co., Ltd.], Reduced malt sugar candy [Amarti MR100 (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], Erythritol [Saneigen FFI Co., Ltd.], Isomalt [galenIQ800 (trademark), BENEO-Palatinit GmbH], Crosscarme They were sodium loin [Ac-Di-Sol ™, Wilbur Ellis Co., Ltd.] and calcium stearate [Taipei Chemical Industry Co., Ltd.].
表9に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び表9に記載の「造粒顆粒中に粉末で加える添加物」の1錠あたりの量の8000倍の量を秤量して粉末で流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液を毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、噴霧しながら造粒した。HPC水溶液の噴霧量及び噴霧時間は、1錠あたり4mgのHPCを加える場合には4質量%のHPC水溶液800gを約67分間にわたって噴霧しながら造粒し、1錠あたり8mgのHPCを加える場合には4質量%のHPC水溶液1600gを約133分間にわたって噴霧しながら造粒した。「造粒顆粒中に粉末で加える添加物」の添加量は、1錠あたり4mgのD−ソルビトールを加える場合には32gのD−ソルビトールを粉末で添加し、1錠あたり4mgのD−マンニトールを加える場合には32gのD−マンニトールを粉末で添加し、1錠あたり7mgの還元麦芽糖水飴を加える場合には56gの還元麦芽糖水飴を粉末で添加し、1錠あたり7mgのエリスリトールを加える場合には56gのエリスリトールを粉末で添加した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表9に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表9に記載のとおりであった。 Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 9. Specifically, 600 g of the pregavalin drug substance and 8000 times the amount per tablet of "additives added as powder in granulated granules" shown in Table 9 are weighed and powdered into a fluidized layer (FD-MP). -01 type, Paulec) and prepared for granulation in advance with 4% by mass HPC aqueous solution at a speed of 12 grams per minute at an intake temperature of 80 ° C and an exhaust temperature of 30 ° C while spraying. Granulated. The spray amount and spray time of the HPC aqueous solution are such that when 4 mg of HPC is added per tablet, 800 g of 4 mass% HPC aqueous solution is sprayed for about 67 minutes to granulate, and when 8 mg of HPC is added per tablet. Was granulated while spraying 1600 g of a 4 mass% HPC aqueous solution for about 133 minutes. The amount of "additives added as powder to granulated granules" is as follows: when 4 mg of D-sorbitol is added per tablet, 32 g of D-sorbitol is added as powder and 4 mg of D-mannitol is added per tablet. When adding 32 g of D-mannitol in powder form, when adding 7 mg of reduced maltose sorbitol per tablet, add 56 g of reduced maltose sorbitol in powder form, and when adding 7 mg of erythritol per tablet 56 g of erythritol was added in powder form. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 9 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 9.
検体名:MP2−Bの試作錠剤においては、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり1mgのステアリン酸カルシウムのみを添加した。検体名:MP2−Aの試作錠剤においては、前記MP2−Bの試作錠剤に、1錠あたり2mgのクロスカルメロースナトリウムを後添加物として加えた。 Specimen name: In the MP2-B prototype tablet, only 4% HPC solution was used as the granulation solution so as to have an HPC content of 4 mg per tablet, and only 1 mg of calcium stearate per tablet was used as a post-additive. Added. Specimen name: In the MP2-A prototype tablet, 2 mg of croscarmellose sodium per tablet was added as a post-additive to the MP2-B prototype tablet.
検体名:MP5の試作錠剤においては、検体名:MP2−Aの試作錠剤で用いたHPC溶液による造粒の代わりに、1錠あたり4mgのD−ソルビトールの粉末を添加して、水を噴霧して造粒した。
検体名:MP3の試作錠剤においては、検体名:MP2−Aの試作錠剤のプレガバリンを含有する造粒部分の添加物として、さらに1錠あたり4mgのD−マンニトールを粉末で添加した。
In the prototype tablet of sample name: MP5, instead of granulation with the HPC solution used in the prototype tablet of sample name: MP2-A, 4 mg of D-sorbitol powder was added per tablet and water was sprayed. Granulated.
In the sample tablet of the sample name: MP3, 4 mg of D-mannitol was further added as a powder as an additive for the granulated portion containing the pregabalin of the sample tablet of the sample name: MP2-A.
検体名:MP4の試作錠剤においては、検体名:MP2−Aの試作錠剤のプレガバリンを含有する造粒部分の添加物として、さらに1錠あたり4mgのD−ソルビトールを粉末で添加した。 In the sample tablet of the sample name: MP4, 4 mg of D-sorbitol was further added as a powder as an additive for the granulated portion containing pregabalin of the sample tablet of the sample name: MP2-A.
検体名:MP7−1、MP7−3、MP8−1、MP8−3、MP9−1、MP9−3の試作錠剤においては、後添加物を1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムに固定して、プレガバリンを含有する造粒部分の添加物として、1錠あたり4mgのD−ソルビトール(検体名:MP7−1、MP7−3)、1錠あたり7mgの還元麦芽糖水飴(検体名:MP8−1、MP8−3)、又は1錠あたり7mgのエリスリトール(検体名:MP9−1、MP9−3)を添加するとともに、これらの夫々において、造粒に用いるHPCの量を1錠あたり4mg(検体名:MP7−1、MP8−1、MP9−1)又は8mg(検体名:MP7−3、MP8−3、MP9−3)とした。 Specimen name: In the prototype tablets of MP7-1, MP7-3, MP8-1, MP8-3, MP9-1, and MP9-3, the post-additives were 2 mg of croscarmellose sodium per tablet and 1 mg per tablet. 4 mg of D-sorbitol (specimen names: MP7-1, MP7-3) per tablet as an additive for the granulated portion containing pregavalin fixed to calcium stearate (specimen names: MP7-1, MP7-3) Specimen name: MP8-1, MP8-3) or 7 mg of erythritol (specimen name: MP9-1, MP9-3) was added per tablet, and the amount of HPC used for granulation was 1 in each of these. The dose was 4 mg (specimen names: MP7-1, MP8-1, MP9-1) or 8 mg (specimen names: MP7-3, MP8-3, MP9-3) per tablet.
検体名:MP2―A−1及びMP2−A−2の試作錠剤においては、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム及び1錠あたり1mgのステアリン酸カルシウムを添加した試作錠剤(検体名:MP2−A)の後添加物に加えて、さらに1錠あたり10mgのイソマルト(検体名:MP2―A−1)又は1錠あたり10mgのD−ソルビトール(検体名:MP2―A−2)を後添加した。 Specimen name: In the prototype tablets of MP2-A-1 and MP2-A-2, only a 4% HPC solution was used as the granulating solution so as to have an HPC content of 4 mg per tablet, and 1 as a post-additive. In addition to the post-additives of the prototype tablet (specimen name: MP2-A) to which 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate were added per tablet, an additional 10 mg of isomalt (specimen name: MP2-A) per tablet. A-1) or 10 mg of D-sorbitol (specimen name: MP2-A-2) per tablet was post-added.
検体名:MP8−1−1の試作錠剤は、検体名:MP2−A−1の試作錠剤の造粒物中に、1錠あたり7mgの還元麦芽糖水飴を粉末で添加した試作錠剤である。すなわち、MP8−1−1の試作錠剤では、1錠あたり75mgのプレガバリンと1錠あたり7mgの還元麦芽糖水飴を混合したものに、1錠あたり4mgのHPC含有量となるように4%のHPC溶液を噴霧して得た造粒物に、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、1錠あたり1mgのステアリン酸カルシウム、及び1錠あたり10mgのイソマルトを添加した。 The prototype tablet of sample name: MP8-1-1 is a prototype tablet in which 7 mg of reduced maltose starch syrup is added as a powder to the granulated product of the prototype tablet of sample name: MP2-A-1. That is, in the MP8-1-1 prototype tablet, a mixture of 75 mg of pregabalin per tablet and 7 mg of reduced maltose starch syrup per tablet was mixed with a 4% HPC solution so as to have an HPC content of 4 mg per tablet. As post-additives, 2 mg of croscarmellose sodium per tablet, 1 mg of calcium stearate per tablet, and 10 mg of isomalt per tablet were added to the granulated product obtained by spraying.
検体名:MP8−3−1の試作錠剤は、検体名:MP8−1−1の試作錠剤の造粒物中のHPC含有量を1錠あたり8mgに増量した試作錠剤である。すなわち、MP8−3−1の試作錠剤では、1錠あたり75mgのプレガバリンと1錠あたり7mgの還元麦芽糖水飴を混合したものに、1錠あたり8mgのHPC含有量となるように4%のHPC溶液を噴霧して得た造粒物に、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、1錠あたり1mgのステアリン酸カルシウム、及び1錠あたり10mgのイソマルトを添加した。 The prototype tablet of sample name: MP8-3-1 is a prototype tablet in which the HPC content in the granulated product of the prototype tablet of sample name: MP8-1-1 is increased to 8 mg per tablet. That is, in the MP8-3-1 prototype tablet, a mixture of 75 mg of pregabalin per tablet and 7 mg of reduced maltose starch syrup per tablet was mixed with a 4% HPC solution so as to have an HPC content of 8 mg per tablet. As post-additives, 2 mg of croscarmellose sodium per tablet, 1 mg of calcium stearate per tablet, and 10 mg of isomalt per tablet were added to the granulated product obtained by spraying.
検体名:MP8−1−2の試作錠剤においては、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり10mgのD−ソルビトール、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加した試作錠剤(検体名:MP2−A−2)の造粒物中に、1錠あたり7mgの還元麦芽糖水飴を添加した試作錠剤である。すなわち、MP8−1−2の試作錠剤では、1錠あたり75mgのプレガバリンと1錠あたり7mgの還元麦芽糖水飴を混合したものに、1錠あたり4mgのHPC含有量となるように4%のHPC溶液を噴霧して得た造粒物に、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、1錠あたり1mgのステアリン酸カルシウム、及び1錠あたり10mgのD−ソルビトールを添加した。 Specimen name: In the prototype tablet of MP8-1-2, only 4% HPC solution was used as the granulating solution so as to have an HPC content of 4 mg per tablet, and 10 mg of D- per tablet as a post-additive. 7 mg of reduced maltose starch syrup per tablet in the granulated product of a prototype tablet (specimen name: MP2-A-2) containing 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet. It is a trial tablet to which. That is, in the MP8-1-2 prototype tablet, a mixture of 75 mg of pregabalin per tablet and 7 mg of reduced maltose starch syrup per tablet was mixed with a 4% HPC solution so as to have an HPC content of 4 mg per tablet. As post-additives, 2 mg of croscarmellose sodium per tablet, 1 mg of calcium stearate per tablet, and 10 mg of D-sorbitol per tablet were added to the granulated product obtained by spraying.
さらに、検体名MP8−3−2の試作錠剤は、検体名:MP8−1−2の試作錠剤のHPC量を1錠あたり8mgに増量した試作錠剤とした。すなわち、MP8−3−2の試作錠剤では、1錠あたり75mgのプレガバリンと1錠あたり7mgの還元麦芽糖水飴を混合したものに、1錠あたり8mgのHPC含有量となるように4%のHPC溶液を噴霧して得た造粒物に、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、1錠あたり1mgのステアリン酸カルシウム、及び1錠あたり10mgのD−ソルビトールを添加した。 Further, the prototype tablet having the sample name MP8-3-2 was a prototype tablet in which the HPC amount of the prototype tablet having the sample name: MP8-1-2 was increased to 8 mg per tablet. That is, in the MP8-3-2 prototype tablet, a mixture of 75 mg of pregabalin per tablet and 7 mg of reduced maltose starch syrup per tablet was mixed with a 4% HPC solution so as to have an HPC content of 8 mg per tablet. As post-additives, 2 mg of croscarmellose sodium per tablet, 1 mg of calcium stearate per tablet, and 10 mg of D-sorbitol per tablet were added to the granulated product obtained by spraying.
試作した圧縮固形製剤の硬度:
試作した圧縮固形製剤の試作直後の硬度を、硬度測定機(KHT−20N、藤原製作所)を用いて測定した。測定結果は、表9に記載のとおりであった。
Hardness of the prototype compressed solid formulation:
The hardness of the prototype compressed solid preparation immediately after the trial production was measured using a hardness measuring machine (KHT-20N, Fujiwara Seisakusho). The measurement results are as shown in Table 9.
表9に記載のとおり、HPCを用いずにD−ソルビトールのみを用いて造粒したプレガバリン含有顆粒に、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP5)の保存開始時の硬度が22Nしかなかったことを除けば、それ以外のHPC水溶液を用いて造粒したプレガバリン含有顆粒を用いた試作錠剤は、いずれも、保存開始時点での硬度は約30N以上あり、十分な硬度を有していた。 As shown in Table 9, 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added as post-additives to the pregabalin-containing granules granulated using only D-sorbitol without HPC. The prototype tablet (specimen name: MP5), which was added and mixed and then tableted with a tableting pressure of 0.8 t, was prepared using other HPC aqueous solutions except that the hardness at the start of storage was only 22 N. All of the prototype tablets using the granulated pregabalin-containing granules had a hardness of about 30 N or more at the start of storage, and had sufficient hardness.
しかしながら、造粒物中の添加物として1錠あたり4mgのD−ソルビトールを含有する試作錠剤(検体名:MP4、MP5、MP7−1、MP7−3)は、いずれも、40℃75%相対湿度で7日間保管した後には、20N未満の錠剤硬度に低下してしまい、錠剤硬度の維持が不十分であった。造粒物中のHPCの含有量を1錠あたり4mgから8mgに増やすことによって、40℃75%相対湿度で7日間保管した後の錠剤硬度が6N(検体名:MP7−1)から12.5N(検体名:MP7−3)に増加したものの、依然として20N未満であった(検体名MP7−3)。 However, the prototype tablets (specimen names: MP4, MP5, MP7-1, MP7-3) containing 4 mg of D-sorbitol per tablet as an additive in the granulated product have a relative humidity of 40 ° C. and 75%. After storage for 7 days, the tablet hardness decreased to less than 20 N, and the maintenance of the tablet hardness was insufficient. By increasing the content of HPC in the granulated product from 4 mg to 8 mg per tablet, the tablet hardness after storage at 40 ° C. and 75% relative humidity for 7 days is 6 N (specimen name: MP7-1) to 12.5 N. Although it increased to (specimen name: MP7-3), it was still less than 20N (specimen name MP7-3).
同様に、後添加物として1錠あたり10mgのD−ソルビトールを添加した場合にも、40℃75%相対湿度で7日間保管した後の錠剤硬度は0Nに低下してしまい、錠剤硬度の維持は全く不十分であった(検体名:MP2−A−2、MP8−1−2、MP8−3−2)。 Similarly, even when 10 mg of D-sorbitol is added per tablet as a post-additive, the tablet hardness after storage at 40 ° C. and 75% relative humidity for 7 days decreases to 0N, and the tablet hardness is maintained. It was completely inadequate (specimen names: MP2-A-2, MP8-1-2, MP8-3-2).
1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり10mgのイソマルト、1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加した試作錠剤(検体名:MP2−A−1)の錠剤硬度は、保存開始時の錠剤硬度が36.5Nあり、40℃75%相対湿度で7日間保管した後にも40.3Nの錠剤硬度を維持していた。 Only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, 10 mg isomalt per tablet as a post-additive, 2 mg croscarmellose sodium per tablet, and per tablet. The tablet hardness of the prototype tablet (specimen name: MP2-A-1) to which 1 mg of calcium stearate was added has a tablet hardness of 36.5 N at the start of storage, and is 40 even after storage at 40 ° C. and 75% relative humidity for 7 days. The tablet hardness of .3N was maintained.
しかしながら、検体名:MP2−A−1の前記試作錠剤の造粒物中の添加物として1錠あたり7mgの還元麦芽糖水飴を添加した場合には、保存開始時には60.5Nあった錠剤硬度が、40℃75%相対湿度で7日間保管した後には僅か8.0Nの錠剤硬度に低下していた(検体名:MP8−1−1)。前記の検体名:MP8−1−1の試作錠剤の造粒物中のHPC含有量を1錠あたり8mgに増加した場合には、40℃75%相対湿度で7日間保管した後にも20.0Nの錠剤硬度を維持していたが、依然として満足できる錠剤硬度ではなかった(検体名:MP8−3−1)。 However, when 7 mg of reduced maltose starch syrup was added per tablet as an additive in the granulated product of the prototype tablet of sample name: MP2-A-1, the tablet hardness was 60.5 N at the start of storage. After storage at 40 ° C. and 75% relative humidity for 7 days, the tablet hardness decreased to only 8.0 N (specimen name: MP8-1-1). When the HPC content in the granulated product of the above-mentioned sample name: MP8-1-1 prototype tablet was increased to 8 mg per tablet, 20.0 N was obtained even after storage at 40 ° C. and 75% relative humidity for 7 days. The tablet hardness was maintained, but the tablet hardness was still not satisfactory (specimen name: MP8-3-1).
これに対して、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり1mgのステアリン酸カルシウムのみを添加した試作錠剤(検体名:MP2−B)、前記MP2−Bの試作錠剤に1錠あたり2mgのクロスカルメロースナトリウムを後添加物として加えた試作錠剤(検体名:MP2−A)、及び前記MP2−Aの試作錠剤のプレガバリンを含有する造粒部分の添加物として1錠あたり4mgのD−マンニトールを添加した試作錠剤(検体名:MP3)においては、保存開始時においても、40℃75%相対湿度で7日間保管した後にも、約30N以上の十分良い錠剤硬度を有していた。 On the other hand, a trial tablet (specimen name) in which only a 4% HPC solution was used as a granulating solution so as to have an HPC content of 4 mg per tablet, and only 1 mg of calcium stearate was added as a post-additive. : MP2-B), the prototype tablet (specimen name: MP2-A) in which 2 mg of croscarmellose sodium was added as a post-additive to the prototype tablet of MP2-B, and the prototype tablet of MP2-A. In the trial tablet (specimen name: MP3) to which 4 mg of D-mannitol was added per tablet as an additive for the granulated portion containing pregabalin, the tablet was stored at 40 ° C. and 75% relative humidity for 7 days even at the start of storage. Later, it had a sufficiently good tablet hardness of about 30 N or more.
同様に、1錠あたり4mg又は8mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを後添加して、混合し、打錠した試作錠剤(検体名:MP8−1、MP8−3)は、40℃75%相対湿度で7日間保管した後にも、約50N以上の極めて良好な錠剤硬度を維持していた。 Similarly, granulated products containing 4 mg or 8 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet were granulated in a fluidized bed, and 2 mg of croscarmellose sodium per tablet was added. The prototype tablets (specimen names: MP8-1, MP8-3) after adding 1 mg of calcium stearate per tablet, mixing and tableting were approximately stored at 40 ° C. and 75% relative humidity for 7 days. It maintained an extremely good tablet hardness of 50 N or more.
同様に、1錠あたり4mg又は8mgのHPCと1錠あたり7mgのエリスリトールと1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを後添加して、混合し、打錠した試作錠剤(検体名:MP9−1、MP9−3)は、40℃75%相対湿度で7日間保管した後にも、44.0N以上の良好な錠剤硬度を維持していた。 Similarly, granulations containing 4 mg or 8 mg HPC per tablet, 7 mg erythritol per tablet and 75 mg pregabalin per tablet were fluidized bed granulated, and 2 mg croscarmellose sodium and 1 tablet per tablet. The prototype tablets (specimen names: MP9-1, MP9-3) that were post-added, mixed, and tableted with 1 mg of calcium stearate per tablet were 44.0 N even after being stored at 40 ° C. and 75% relative humidity for 7 days. The above-mentioned good tablet hardness was maintained.
これらの実験結果から、D−ソルビトールを添加すると、加速条件で保存した後の錠剤硬度が著しく低下すること、及び、還元麦芽糖水飴とイソマルトを組み合わせて用いると加速条件で保存した後の錠剤硬度が著しく低下することがわかった。また、エリスリトールは加速条件で保存した後の錠剤硬度を低下させないこと、及び、イソマルト又はD−ソルビトールと組み合わせて使用しない限り、還元麦芽糖水飴を主薬造粒部に加えることによって、加速条件で保存した後の錠剤硬度が著しく向上することがわかった。 From these experimental results, the addition of D-sorbitol significantly reduces the tablet hardness after storage under accelerated conditions, and the combined use of reduced maltose starch syrup and isomalt results in tablet hardness after storage under accelerated conditions. It was found to be significantly reduced. In addition, erythritol did not reduce the tablet hardness after storage under accelerated conditions, and unless it was used in combination with isomalt or D-sorbitol, reduced maltose starch syrup was stored under accelerated conditions by adding reduced maltose starch syrup to the main drug granulation part. It was found that the later tablet hardness was significantly improved.
試作した圧縮固形製剤の保存安定性:
それぞれの圧縮固形製剤を、40℃75%相対湿度で保存し、7日後のラクタム体の量を高速液体クロマトグラフィーによって定量した。
Storage stability of the prototype compressed solid formulation:
Each compressed solid preparation was stored at 40 ° C. and 75% relative humidity, and the amount of lactam after 7 days was quantified by high performance liquid chromatography.
表9に記載のとおり、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり1mgのステアリン酸カルシウムのみを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−B)では、40℃75%相対湿度で7日間保管した後においてもラクタム体の量はほとんど増えなかった。
このことから、1錠あたり4mgのHPC含有量では、本質的に、打錠後の経時的なラクタム体の増加は見られないことがわかった。
As shown in Table 9, only 4% HPC solution was used as the granulating solution so as to have an HPC content of 4 mg per tablet, and only 1 mg of calcium stearate was added and mixed as a post-additive. In the prototype tablet (specimen name: MP2-B), which was later tableted with a tableting pressure of 0.8 t, the amount of lactam was hardly increased even after storage at 40 ° C. and 75% relative humidity for 7 days.
From this, it was found that at an HPC content of 4 mg per tablet, essentially no increase in lactams was observed over time after tableting.
1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−A)では、40℃75%相対湿度で7日間保管した後のラクタム体の量が著しく増加していた。
このことから、クロスカルメロースナトリウムを添加することによって、打錠後の経時的なラクタム体の生成が著しく増加することがわかった。
Only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, and 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added as post-additives. In the prototype tablet (specimen name: MP2-A), which was mixed and then tableted at a tableting pressure of 0.8 ton, the amount of lactam was significantly increased after storage at 40 ° C. and 75% relative humidity for 7 days. ..
From this, it was found that the addition of sodium croscarmellose significantly increased the production of lactams over time after tableting.
これに対して、前記の検体名:MP2−Aの試作錠剤の造粒物中に1錠あたり4mgのD−ソルビトールを添加した試作錠剤(検体名:MP4、MP7−1)では、経時的なラクタム体の増加は大幅に抑制された。
このことから、1錠あたり4mgのD−ソルビトールを添加することによって、打錠後の経時的なラクタム体の生成を大幅に抑制できることがわかった。
On the other hand, the prototype tablet (specimen name: MP4, MP7-1) in which 4 mg of D-sorbitol was added per tablet to the granulated product of the prototype tablet of the sample name: MP2-A over time. The increase in lactam was significantly suppressed.
From this, it was found that by adding 4 mg of D-sorbitol per tablet, the production of lactams over time after tableting can be significantly suppressed.
そして、検体名:MP2−Aの試作錠剤の造粒物中から1錠あたり4mgのHPCを除外すると経時的なラクタム体の増加はさらに僅かに抑制され(検体名:MP5)、造粒物中のHPC量を1錠あたり8mgに増量すると経時的なラクタム体の増加の抑制度合いは低下した(検体名:MP7−3)。
このことから、HPCは、本質的に、打錠後の経時的なラクタム体の生成を促さないものの、添加量に応じて、わずかに、打錠後の経時的なラクタム体を生じさせることがわかった。
Then, when 4 mg of HPC per tablet was excluded from the granulated product of the prototype tablet of sample name: MP2-A, the increase of lactams over time was further slightly suppressed (specimen name: MP5), and it was contained in the granulated product. When the amount of HPC was increased to 8 mg per tablet, the degree of suppression of the increase in lactams over time decreased (specimen name: MP7-3).
From this, HPC essentially does not promote the production of lactams over time after tableting, but can slightly produce lactams over time after tableting, depending on the amount added. all right.
同様に、前記の検体名:MP2−Aの試作錠剤の造粒物中に4mgのD−ソルビトールを添加する代わりに、後添加物として1錠あたり10mgのD−ソルビトールを添加した試作錠剤(検体名:MP2−A−2)でも、経時的なラクタム体の増加は大幅に抑制された。
このことからも、D−ソルビトールを添加することによって、打錠後の経時的なラクタム体の生成を大幅に抑制できることがわかった。
Similarly, a prototype tablet (specimen) in which 10 mg of D-sorbitol was added as a post-additive instead of adding 4 mg of D-sorbitol to the granulated product of the prototype tablet of the above-mentioned sample name: MP2-A (sample). Name: MP2-A-2) also significantly suppressed the increase in lactams over time.
From this, it was found that the addition of D-sorbitol can significantly suppress the production of lactams over time after tableting.
さらに、前記の検体名:MP2−A−2の試作錠剤の造粒物中に1錠あたり7mgの還元麦芽糖水飴を加えた試作錠剤(検体名:MP8−1−2)でも、検体名:MP2−A−2の試作錠剤と同程度に経時的なラクタム体の増加は大幅に抑制された。
このことから、1錠あたり7mgの還元麦芽糖水飴を添加しても、打錠後の経時的なラクタム体の生成を促さないことがわかった。
Further, a prototype tablet (specimen name: MP8-1-2) in which 7 mg of reduced maltose starch syrup is added to each granulated product of the prototype tablet of the sample name: MP2-A-2 also has a sample name: MP2. The increase in lactam over time was significantly suppressed to the same extent as the prototype tablet of -A-2.
From this, it was found that the addition of 7 mg of reduced maltose starch syrup per tablet did not promote the production of lactams over time after tableting.
そして、検体名:MP8−1−2の試作錠剤における経時的なラクタム体の増加の大幅な抑制は、造粒物中のHPCの量を1錠あたり8mgに増量した試作錠剤(検体名:MP8−3−2)においても、同程度に抑制されたままであった。
このことからも、HPCは、本質的に、打錠後の経時的なラクタム体の生成を促さないことがわかった。
Then, the significant suppression of the increase in lactams over time in the prototype tablet of sample name: MP8-1-2 was achieved by increasing the amount of HPC in the granulated product to 8 mg per tablet (specimen name: MP8). In -3-2), it remained suppressed to the same extent.
From this, it was found that HPC essentially does not promote the production of lactams over time after tableting.
1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−A)に対して、この試作錠剤の造粒物中に1錠あたり4mgのD−マンニトールを添加した試作錠剤(検体名:MP3)では、経時的なラクタム体の増加はまったく抑制されなかった。
このことから、1錠あたり4mgのD−マンニトールは、打錠後の経時的なラクタム体の生成を促進することも抑制することもしないことがわかった。
Only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, and 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added as post-additives. To a trial tablet (specimen name: MP2-A) that was tableted with a tableting pressure of 0.8 ton after mixing, 4 mg of D-mannitol was added to the granulated product of this trial tablet. Tablets (specimen name: MP3) did not suppress the increase in lactams over time.
From this, it was found that 4 mg of D-mannitol per tablet did not promote or suppress the production of lactams over time after tableting.
同様に、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−A)に対して、この試作錠剤の後添加物として1錠あたり10mgのイソマルトを添加した試作錠剤(検体名:MP2−A−1)では、経時的なラクタム体の増加は僅かに抑制されたにとどまった。
このことから、1錠あたり10mgのイソマルトは、打錠後の経時的なラクタム体の生成を僅かに抑制することがわかった。
Similarly, only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, 2 mg croscarmellose sodium per tablet as post-additives, and 1 mg calcium stearate per tablet. To a prototype tablet (specimen name: MP2-A) that was tableted with a tableting pressure of 0.8 t after adding and mixing, 10 mg of isomalt was added to each tablet as a post-additive of the prototype tablet. With tablets (specimen name: MP2-A-1), the increase in lactams over time was only slightly suppressed.
From this, it was found that 10 mg of isomalt per tablet slightly suppressed the production of lactams over time after tableting.
これに対して、前記の検体名:MP2−A−1の試作錠剤に対して、その造粒物中に1錠あたり7mgの還元麦芽糖水飴を添加した試作錠剤(検体名:MP8−1−1)では、経時的なラクタム体の増加は大幅に抑制された。
このことから、1錠あたり7mgの還元麦芽糖水飴を添加することによって、打錠後の経時的なラクタム体の生成を抑制できることがわかった。
On the other hand, a prototype tablet (specimen name: MP8-1-1) in which 7 mg of reduced maltose starch syrup was added to the granulated product of the prototype tablet of the sample name: MP2-A-1. ), The increase in lactams over time was significantly suppressed.
From this, it was found that the production of lactams over time after tableting can be suppressed by adding 7 mg of reduced maltose starch syrup per tablet.
そして、前記検体名:MP8−1−1の試作錠剤の造粒物中のHPCの量を1錠あたり8mgに増量した試作錠剤(検体名:MP8−3−1)においても、経時的なラクタム体の増加は大幅に抑制されたままであった。
このことからも、HPCは、本質的に、打錠後の経時的なラクタム体の生成を促さないことがわかった。
Lactam over time is also present in the prototype tablet (specimen name: MP8-3-1) in which the amount of HPC in the granulated product of the prototype tablet of the sample name: MP8-1-1 is increased to 8 mg per tablet. Body growth remained significantly suppressed.
From this, it was found that HPC essentially does not promote the production of lactams over time after tableting.
1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−A)に対して、この試作錠剤の造粒物中に7mgの還元麦芽糖水飴を添加した試作錠剤(検体名:MP8−1)では、4mgのD−ソルビトールを添加した試作錠剤(検体名:MP4、MP7−1)ほどの大幅な経時的なラクタム体の増加抑制ではなかったものの、経時的なラクタム体の増加はある程度抑制された。
このことからも、1錠あたり7mgの還元麦芽糖水飴を添加することによって、打錠後の経時的なラクタム体の生成を抑制できることがわかった。
Only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, and 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added as post-additives. To the trial tablet (specimen name: MP2-A) that was tableted with a tableting pressure of 0.8 ton after mixing, a trial tablet (specimen) in which 7 mg of reduced maltose water candy was added to the granulated product of this trial tablet. Name: MP8-1) did not significantly suppress the increase in lactam over time as much as the prototype tablets (specimen names: MP4, MP7-1) to which 4 mg of D-sorbitol was added, but lactam over time. The increase was suppressed to some extent.
From this, it was found that the production of lactams over time after tableting can be suppressed by adding 7 mg of reduced maltose starch syrup per tablet.
検体名:MP8−1の試作錠剤の造粒物中のHPC量を1錠あたり8mgに増量した試作錠剤(検体名:MP8−3)でも、検体名:MP8−1の試作錠剤と同様に中程度の経時的なラクタム体の増加抑制が観察されたが、造粒物中のHPC量を増量することによって経時的なラクタム体の生成量がやや増加した。
このことから、HPCは、本質的に、打錠後の経時的なラクタム体の生成を促さないものの、添加量に応じて、わずかに、打錠後の経時的なラクタム体を生じさせることがわかった。
Specimen name: The prototype tablet (specimen name: MP8-3) in which the amount of HPC in the granulated product of the prototype tablet of MP8-1 is increased to 8 mg per tablet is also medium in the same manner as the prototype tablet of sample name: MP8-1. Although a degree of suppression of the increase in lactams over time was observed, the amount of lactams produced over time was slightly increased by increasing the amount of HPC in the granulated product.
From this, HPC essentially does not promote the production of lactams over time after tableting, but can slightly produce lactams over time after tableting, depending on the amount added. all right.
1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり2mgのクロスカルメロースナトリウム、及び1錠あたり1mgのステアリン酸カルシウムを添加して混合した後に0.8tの打錠圧で打錠した試作錠剤(検体名:MP2−A)に対して、この試作錠剤の造粒物中に1錠あたり7mgのエリスリトールを添加した試作錠剤(検体名:MP9−1)では、4mgのD−ソルビトールを添加した試作錠剤(検体名:MP4、MP7−1)ほどの大幅な経時的なラクタム体の増加抑制ではなかったものの、経時的なラクタム体の増加は、ある程度抑制された。
このことから、1錠あたり7mgのエリスリトールを添加することによって、打錠後の経時的なラクタム体の生成をある程度まで抑制できることがわかった。
Only 4% HPC solution was used as the granulation solution so that the HPC content was 4 mg per tablet, and 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added as post-additives. To the prototype tablet (specimen name: MP2-A) that was tableted with a tableting pressure of 0.8 ton after mixing, 7 mg of erythritol was added to the granulated product of this trial tablet (sample name: MP2-A). Specimen name: MP9-1) did not significantly suppress the increase of lactam over time as much as the trial tablet (specimen name: MP4, MP7-1) to which 4 mg of D-sorbitol was added, but lactam over time. Body growth was suppressed to some extent.
From this, it was found that by adding 7 mg of erythritol per tablet, the production of lactams over time after tableting can be suppressed to some extent.
検体名:MP9−1の試作錠剤の造粒物中のHPC量を1錠あたり8mgに増量した試作錠剤(検体名:MP9−3)でも、検体名:MP9−1の試作錠剤と同様に中程度の経時的なラクタム体の増加抑制が観察されたが、造粒物中のHPC量を増量することによって経時的なラクタム体の生成量がやや増加した。
このことから、HPCは、本質的に、打錠後の経時的なラクタム体の生成を促さないものの、添加量に応じて、わずかに、打錠後の経時的なラクタム体を生じさせることがわかった。
Specimen name: The prototype tablet (specimen name: MP9-3) in which the amount of HPC in the granulated product of the prototype tablet of MP9-1 is increased to 8 mg per tablet is also medium in the same manner as the prototype tablet of sample name: MP9-1. Although a degree of suppression of the increase in lactams over time was observed, the amount of lactams produced over time was slightly increased by increasing the amount of HPC in the granulated product.
From this, HPC essentially does not promote the production of lactams over time after tableting, but can slightly produce lactams over time after tableting, depending on the amount added. all right.
これらの実験結果から、40℃75%相対湿度で7日間保管した後のラクタム体の量は、クロスカルメロースの後添加によって大幅に増加することがわかった。 From these experimental results, it was found that the amount of lactams after storage at 40 ° C. and 75% relative humidity for 7 days was significantly increased by the post-addition of croscarmellose.
この経時的なラクタム体の増加は、造粒物中のHPCの量を増やすことによって僅かに増加する一方、造粒物中にD−マンニトールを添加してもラクタム体の量に変化はなく、造粒物中に還元麦芽糖水飴又はエリスリトールを添加することによって中程度に抑制されることがわかった。また、この経時的なラクタム体の増加は、造粒物中にD−ソルビトールを添加することによって大幅に抑制されること、及び、後添加物としてイソマルトと又はD−ソルビトールを添加することによっても大幅に抑制されることがわかった。 This increase in lactams over time is slightly increased by increasing the amount of HPC in the granules, while the addition of D-mannitol in the granules does not change the amount of lactams. It was found that the addition of reduced maltose starch syrup or erythritol to the granulated product was moderately suppressed. In addition, this increase in lactams over time can be significantly suppressed by adding D-sorbitol to the granulated product, and by adding isomalt or D-sorbitol as a post-additive. It was found to be significantly suppressed.
しかしながら、40℃75%相対湿度で7日間保管した後の錠剤硬度は、造粒物中にD−ソルビトールを添加した場合と、後添加物としてD−ソルビトールを添加した場合には、錠剤硬度を保つことができないこともわかった。40℃75%相対湿度で7日間保管した後の錠剤硬度は、造粒物中にプレガバリン原薬とHPCと還元麦芽糖水飴を含有し、かつ、後添加物としてイソマルトを添加した場合にも、錠剤硬度を保つことができないことがわかった。
したがって、表9に記載の試作錠剤では、1錠あたり4mgのHPC含有量となるように4%のHPC溶液のみを造粒液として用い、後添加物として1錠あたり1mgのステアリン酸カルシウムのみを添加した試作錠剤(検体名:MP2−B)を除き、使用期限中の錠剤硬度の維持と保存安定性とを両立させることはできなかった。
However, the tablet hardness after storage at 40 ° C. and 75% relative humidity for 7 days is the tablet hardness when D-sorbitol is added to the granulated product and when D-sorbitol is added as a post-additive. I also found that I couldn't keep it. The tablet hardness after storage at 40 ° C. and 75% relative humidity for 7 days is that the tablet contains pregavalin drug substance, HPC, reduced maltose starch syrup, and isomalt as a post-additive. It turned out that the hardness could not be maintained.
Therefore, in the prototype tablets shown in Table 9, only a 4% HPC solution was used as the granulating solution so as to have an HPC content of 4 mg per tablet, and only 1 mg of calcium stearate was added as a post-additive. Except for the prototype tablet (specimen name: MP2-B), it was not possible to maintain the tablet hardness and storage stability during the expiration date.
圧縮固形製剤の試作;
40℃75%相対湿度で保存した場合に硬度を維持することができ、かつ、保存安定なプレガバリン製剤の処方を確立するべく、さらに様々な試作錠剤を作製して、その錠剤硬度とラクタム体の量を検証した。
Prototype of compressed solid preparation ;
In order to establish a formulation of a pregabalin preparation that can maintain hardness when stored at 40 ° C. and 75% relative humidity and is stable in storage, various prototype tablets were prepared to obtain the tablet hardness and lactam form. The amount was verified.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、松谷化学工業〕、ヒドロキシプロピルスターチ〔HPS−101(商標)、フロイント産業株式会社〕、トウモロコシデンプン〔日食コーンスターチ(商標)、日本食品化工株式会社〕、部分α化デンプン〔PCS(商標)、旭化成株式会社〕、α化デンプン〔アミコール(商標)、日澱化学〕、低置換度ヒドロキシプロピルセルロース〔LH−11(商標)、信越化学工業株式会社〕、直打用D−マンニトール〔パーテックM100(商標)、Merck Millipore Corporation〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced malt sugar water candy [Amalti MR100 (trademark), Mitsubishi Corporation Food Tech Co., Ltd.], sodium starch glycolate [Primo]. Gel (trademark), Matsutani Chemical Industry], Hydroxypropyl starch [HPS-101 (trademark), Freund Sangyo Co., Ltd.], Corn starch [Nissho Corn Starch (trademark), Nippon Food Chemicals Co., Ltd.], Partially pregelatinized starch [PCS] (Trademark), Asahi Kasei Co., Ltd.], Pregelatinized starch [Amicol (trademark), Nissho Chemical], Low-substituted hydroxypropyl cellulose [LH-11 (trademark), Shin-Etsu Chemical Industry Co., Ltd.], D-mannitol for direct hitting [Partec M100 ™, Merck Millipore Corporation], croscarmellose sodium [Ac-Di-Sol ™, Wilbur Ellis Co., Ltd.], calcium stearate [Taipei Chemical Industry Co., Ltd.].
表10に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600グラム及び還元麦芽糖水飴の粉末を秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液を毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、噴霧しながら造粒した。HPC水溶液の噴霧量及び噴霧時間は、1錠あたり4mgのHPCを加える場合には4質量%のHPC水溶液800gを約67分間にわたって噴霧しながら造粒し、1錠あたり1.3mgのHPCを加える場合には4質量%のHPC水溶液260gを約22分間にわたって噴霧しながら造粒した。還元麦芽糖水飴の添加量は、1錠あたり7mgの還元麦芽糖水飴を加える場合には56gの還元麦芽糖水飴を粉末で添加し、1錠あたり20mgの還元麦芽糖水飴を加える場合には160gの還元麦芽糖水飴を粉末で添加した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表10に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表10に記載のとおりであった。
Prototype tablets were prepared using the amount of the main ingredient and additives for 8000 tablets according to Table 10. Specifically, 600 grams of pregavalin drug substance and powder of reduced maltose starch syrup were weighed and put into a fluidized layer (FD-MP-01 type, Paulec), and 4% by mass prepared in advance for granulation. The HPC aqueous solution was granulated while spraying at a speed of 12 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. Regarding the spray amount and spray time of the HPC aqueous solution, when 4 mg of HPC is added per tablet, 800 g of 4 mass% HPC aqueous solution is sprayed for about 67 minutes to granulate, and 1.3 mg of HPC is added per tablet. In the case, 260 g of a 4 mass% HPC aqueous solution was sprayed for about 22 minutes for granulation. The amount of reduced maltose starch syrup added is 56 g of reduced maltose starch syrup when 7 mg of reduced maltose starch syrup is added per tablet, and 160 g of reduced maltose starch syrup when 20 mg of reduced maltose starch syrup is added per tablet. Was added in powder form. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 10 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 10.
表10に記載の試作錠剤のうち、検体名がMP10で始まる検体については、いずれも、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり1mgのステアリン酸カルシウムに加えて、表10に記載の添加物を表10に記載の1錠あたりの添加量となるように添加して、混合し、0.8tの打錠圧で打錠することによって、錠剤硬度の維持とラクタム体の経時的増加防止を両立しうる試作錠剤の検討を行った。 Among the prototype tablets shown in Table 10, all the samples whose sample names start with MP10 are granulated containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet. After granulating the product in a fluidized bed and drying it, in addition to 1 mg of calcium stearate per tablet, the additives shown in Table 10 were added so as to be the amount added per tablet shown in Table 10. By mixing and tableting with a tableting pressure of 0.8 t, a trial tablet capable of maintaining the tablet hardness and preventing the increase of the lactam body over time was examined.
表10に記載の試作錠剤のうち、検体名がMP11で始まる検体については、1錠あたり1.3mgのHPCと1錠あたり20mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり0.7mgのステアリン酸カルシウム及び1錠あたり3mgのデンプングリコール酸ナトリウムに加えて、1錠あたり20mg又は40mgの直打用D−マンニトールを添加して、混合し、0.6tの打錠圧で打錠することによって、錠剤硬度の維持とラクタム体の経時的増加防止を両立しうる試作錠剤の検討を行った。 Among the prototype tablets shown in Table 10, the samples whose sample names start with MP11 are granulated products containing 1.3 mg of HPC per tablet, 20 mg of reduced maltose starch syrup per tablet, and 75 mg of pregavalin per tablet. After granulating the fluidized bed and drying, in addition to 0.7 mg of calcium stearate per tablet and 3 mg of sodium starch glycolate per tablet, 20 mg or 40 mg of D-mannitol for direct impact was added per tablet. Then, by mixing and tableting with a tableting pressure of 0.6 t, a trial tablet capable of maintaining the tablet hardness and preventing the increase of the lactam body over time was examined.
まず、検体名:MP10−8の試作錠剤においては、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり1mgのステアリン酸カルシウムに加えて、1錠あたり2mgのクロスカルメロースナトリウムを添加して、混合し、0.8tの打錠圧で打錠した。 First, in the prototype tablet of sample name: MP10-8, a granulated product containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet was granulated in a fluidized bed and dried. After that, in addition to 1 mg of calcium stearate per tablet, 2 mg of sodium croscarmellose per tablet was added, mixed, and tableted at a tableting pressure of 0.8 t.
検体名:MP10−9の試作錠剤においては、クロスカルメロースナトリウムの量を1錠あたり1mgに減量した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 The prototype tablet of sample name: MP10-9 was produced in the same manner as the prototype tablet of sample name: MP10-8, except that the amount of croscarmellose sodium was reduced to 1 mg per tablet.
検体名:MP10−1の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgのデンプングリコール酸ナトリウムを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-1 prototype tablet was the same as the MP10-8 prototype tablet, except that 4 mg of sodium starch glycolate was post-added instead of 2 mg of croscarmellose sodium per tablet. Manufactured in the same way.
検体名:MP10−2の試作錠剤においては、デンプングリコール酸ナトリウムの量を1錠あたり3mgに減量した以外は、検体名:MP10−1の試作錠剤と同様に製造した。 The prototype tablet of sample name: MP10-2 was produced in the same manner as the prototype tablet of sample name: MP10-1, except that the amount of sodium starch glycolate was reduced to 3 mg per tablet.
検体名:MP10−3の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgのヒドロキシプリピルスターチを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-3 prototype tablets, except that 4 mg of hydroxyprepyl starch per tablet was post-added instead of 2 mg of croscarmellose sodium per tablet. Manufactured in the same way.
検体名:MP10−4の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgのコーンスターチを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-4 prototype tablets were manufactured in the same manner as the MP10-8 prototype tablets, except that 4 mg of cornstarch per tablet was post-added instead of 2 mg of croscarmellose sodium per tablet. bottom.
検体名:MP10−5の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgの部分α化デンプンを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-5 prototype tablet, except that 4 mg of partially pregelatinized starch per tablet was post-added instead of 2 mg of croscarmellose sodium per tablet. Manufactured in the same way.
検体名:MP10−6の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgのα化デンプンを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: The prototype tablet of MP10-6 is the same as the prototype tablet of sample name: MP10-8, except that 4 mg of pregelatinized starch was post-added per tablet instead of 2 mg of croscarmellose sodium per tablet. Manufactured in.
検体名:MP10−7の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgの低置換度ヒドロキシプロピルセルロースを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-7 prototype Tablets, except that 4 mg of low-substituted hydroxypropyl cellulose per tablet was post-added instead of 2 mg of croscarmellose sodium per tablet. Manufactured in the same way as tablets.
検体名:MP10−10の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムに加えて1錠あたり3mgのデンプングリコール酸ナトリウムを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: MP10-10 prototype tablet, except that 3 mg of sodium starch glycolate was post-added in addition to 2 mg of croscarmellose sodium per tablet, and the sample name: MP10-8 prototype tablet. Manufactured in the same way.
検体名:MP10−11の試作錠剤においては、1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり7mgのデンプングリコール酸ナトリウムと1錠あたり60mgの直打用マンニトールを後添加した以外は、検体名:MP10−8の試作錠剤と同様に製造した。 Specimen name: In the prototype tablet of MP10-11, except that 7 mg of sodium starch glycolate and 60 mg of direct-hit mannitol per tablet were post-added instead of 2 mg of croscarmellose sodium per tablet. Specimen name: Manufactured in the same manner as the prototype tablet of MP10-8.
検体名:MP11−1の試作錠剤においては、1錠あたり1.3mgのHPCと1錠あたり20mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり1mgのステアリン酸カルシウムに加えて、1錠あたり3mgのデンプングリコール酸ナトリウムと1錠あたり20mgの直打用マンニトールを加えて、混合し、0.8tの打錠圧で打錠した。 Specimen name: In the prototype tablet of MP11-1, a granulated product containing 1.3 mg of HPC per tablet, 20 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet was granulated in a fluidized bed and dried. After that, in addition to 1 mg of calcium stearate per tablet, 3 mg of sodium starch glycolate per tablet and 20 mg of mannitol for direct striking per tablet were added, mixed, and tableted at a tableting pressure of 0.8 t. bottom.
検体名:MP11−2試作錠剤においては、直打用マンニトールの量を1錠あたり40mgに増量した以外は、検体名:MP11−1の試作錠剤と同様に製造した。 Specimen name: MP11-2 prototype tablet was produced in the same manner as the prototype tablet of sample name: MP11-1 except that the amount of mannitol for direct impact was increased to 40 mg per tablet.
試作した圧縮固形製剤の経時的な硬度変化及びラクタム体の増加:
試作した圧縮固形製剤を、40℃75%相対湿度で保存し、保存開始時及び7日後の錠剤硬度及びラクタム体の量を測定した。測定結果は、表10に記載のとおりであった。
Changes in hardness and increase in lactam form over time of the prototype compressed solid formulation:
The prototype compressed solid preparation was stored at 40 ° C. and 75% relative humidity, and the tablet hardness and the amount of lactam were measured at the start of storage and after 7 days. The measurement results are as shown in Table 10.
1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを加えて混合し、0.8tの打錠圧で打錠した試作錠剤(検体名:MP10−8)は、40℃75%相対湿度で7日間保存した後も、39.5Nの錠剤硬度を維持し、経時的なラクタム体の増加量も少量であった。この結果は、同じ処方である実施例9(表9)の検体名:MP8−1の試作錠剤でも錠剤硬度が維持され、経時的ラクタム体増加が中程度であったことと概ね符合した。 Granulation containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet was granulated in a fluidized bed, dried, and then 2 mg of croscarmellose sodium and 1 tablet. The prototype tablet (specimen name: MP10-8), which was mixed by adding 1 mg of calcium stearate per tablet and tableted at a tableting pressure of 0.8 ton, was 39 even after being stored at 40 ° C. and 75% relative humidity for 7 days. The tablet hardness of .5N was maintained, and the amount of increase in lactam over time was also small. This result was generally consistent with the fact that the tablet hardness was maintained and the increase in lactams over time was moderate even with the prototype tablet of Example 9 (Table 9) having the same formulation and sample name: MP8-1.
このことから、1錠あたり2mgのクロスカルメロースナトリウムを後添加することによる打錠後の経時的なラクタム体の生成は、主薬顆粒中に1錠あたり7mgの還元麦芽糖水飴を添加することによって、ある程度抑制できることがわかった。 From this, the formation of lactams over time after tableting by post-adding 2 mg of croscarmellose sodium per tablet was achieved by adding 7 mg of reduced maltose starch syrup per tablet to the main drug granules. It turned out that it can be suppressed to some extent.
前記の検体名:MP10−8の試作錠剤において、クロスカルメロースナトリウムの添加量を1錠あたり1mgに減量した試作錠剤(検体名:MP10−9)においても、同様に、40℃75%相対湿度で7日間保存した後も錠剤硬度が維持され、かつ、経時的なラクタム体の増加量もさらに少量にとどまった。
このことから、クロスカルメロースナトリウムの添加量は、少ない方が、打錠後の経時的なラクタム体の生成が少ないことがわかった。
Similarly, in the prototype tablet of the sample name: MP10-8, the amount of croscarmellose sodium added was reduced to 1 mg per tablet, and the prototype tablet (specimen name: MP10-9) also had a relative humidity of 40 ° C. and 75%. The tablet hardness was maintained even after storage for 7 days, and the amount of increase in lactam over time was even smaller.
From this, it was found that the smaller the amount of croscarmellose sodium added, the smaller the production of lactams over time after tableting.
前記の検体名:MP10−8の試作錠剤における1錠あたり2mgのクロスカルメロースナトリウムの代わりに1錠あたり4mgのデンプングリコール酸ナトリウムを後添加した試作錠剤(検体名:MP10−1)においては、40℃75%相対湿度で7日間保存したことによって、経時的なラクタム体の増加量は全く観察されなかったが、錠剤硬度は15.0Nに低下した。
このことから、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、経時的に錠剤硬度を低下させることがわかった。
In the trial tablet (specimen name: MP10-1) in which 4 mg of sodium starch glycolate was post-added per tablet instead of 2 mg of croscarmellose sodium per tablet in the prototype tablet of MP10-8. By storing at 40 ° C. and 75% relative humidity for 7 days, no increase in lactam was observed over time, but the tablet hardness decreased to 15.0 N.
From this, it was found that sodium starch glycolate did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time.
検体名:MP10−1の試作錠剤の1錠あたり4mgのデンプングリコール酸ナトリウム量を1錠あたり3mgに減らした試作錠剤(検体名:MP10−2)でも、40℃75%相対湿度で7日間保存したことによって、経時的なラクタム体の増加量は全く観察されなかったが、錠剤硬度は20.0Nに低下した。
このことから、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかるとともに、デンプングリコール酸ナトリウムの添加量に応じて経時的に錠剤硬度を低下させることがわかった。
Specimen name: Even a trial tablet (specimen name: MP10-2) in which the amount of sodium starch glycolate of 4 mg per tablet of the prototype tablet of MP10-1 is reduced to 3 mg per tablet is stored at 40 ° C. and 75% relative humidity for 7 days. As a result, no increase in lactam was observed over time, but the tablet hardness decreased to 20.0 N.
From this, it was found that sodium starch glycolate does not promote the formation of lactams over time after tableting, and that the tablet hardness decreases over time depending on the amount of sodium starch glycolate added. rice field.
前記の検体名:MP10−8の試作錠剤における1錠あたり2mgのクロスカルメロースナトリウムの代わりに、1錠あたり4mgのヒドロキシプリピルスターチを後添加した試作錠剤(検体名:MP10−3)、1錠あたり4mgのコーンスターチを後添加した試作錠剤(検体名:MP10−4)、1錠あたり4mgの部分α化デンプンを後添加した試作錠剤(検体名:MP10−5)、1錠あたり4mgのα化デンプンを後添加した試作錠剤(検体名:MP10−6)、1錠あたり4mgのL−HPCを後添加した試作錠剤(検体名:MP10−7)は、いずれも、40℃75%相対湿度で7日間保存した後も、錠剤硬度は約38N以上に維持されており、かつ、経時的なラクタム体の増加量も僅かな量にとどまった。
したがって、これらの処方は、使用期限中の錠剤硬度の維持と、打錠後の経時的なラクタム体の生成抑制とを両立しうる処方であることがわかった。
Specimen name: MP10-8 prototype tablet (specimen name: MP10-3), 1 Trial tablet with 4 mg corn starch post-added per tablet (specimen name: MP10-4), trial tablet with post-addition of 4 mg partially pregelatinized starch per tablet (specimen name: MP10-5), 4 mg α per tablet The trial tablets (specimen name: MP10-6) to which the starch-forming starch was post-added and the trial tablets (specimen name: MP10-7) to which 4 mg of L-HPC was post-added per tablet were all at 40 ° C. and 75% relative humidity. The tablet hardness was maintained at about 38 N or more even after storage for 7 days, and the amount of increase in lactam over time was small.
Therefore, it was found that these prescriptions can both maintain the tablet hardness during the expiration date and suppress the production of lactams over time after tableting.
前記の検体名:MP10−8の試作錠剤において、さらに1錠あたり3mgのデンプングリコール酸ナトリウムを後添加した試作錠剤(検体名:MP10−10)では、40℃75%相対湿度で7日間保存した後の経時的なラクタム体の増加量はごく微量にとどまったが、錠剤硬度は23.8Nに低下した。
このことから、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、経時的に錠剤硬度を低下させることがわかった。
In the above-mentioned sample tablet of sample name: MP10-8, the trial tablet (specimen name: MP10-10) to which 3 mg of sodium starch glycolate was added after each tablet was stored at 40 ° C. and 75% relative humidity for 7 days. The subsequent increase in lactams over time was negligible, but the tablet hardness decreased to 23.8N.
From this, it was found that sodium starch glycolate did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time.
前記の検体名MP10−8の試作錠剤において、1錠あたり2mgのクロスカルメロースナトリウムの代わりに、1錠あたり7mgのデンプングリコール酸ナトリウムと1錠あたり60mgの直打用マンニトールを後添加した試作錠剤(検体名:MP10−11)では、40℃75%相対湿度で7日間保存した後の経時的なラクタム体の増加量は少量にとどまったが、錠剤硬度は20.5Nに低下した。
このことからも、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、経時的に錠剤硬度を低下させることがわかった。
In the above-mentioned prototype tablet with the sample name MP10-8, instead of 2 mg of croscarmellose sodium per tablet, 7 mg of sodium starch glycolate per tablet and 60 mg of mannitol for direct impact were post-added per tablet. In (Sample name: MP10-11), the amount of increase in lactam compound over time after storage at 40 ° C. and 75% relative humidity for 7 days was small, but the tablet hardness decreased to 20.5 N.
From this, it was found that sodium starch glycolate did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time.
前記の検体名:MP10−11の試作錠剤における添加物の量を調整して、1錠あたり1.3gのHPCと1錠あたり20mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり3mgのデンプングリコール酸ナトリウムと1錠あたり20mgの直打用D−マンニトールと1錠あたり1mgのステアリン酸カルシウムを加えて混合し、0.8tの打錠圧で打錠した試作錠剤(検体名:MP11−1)は、40℃75%相対湿度で7日間保存した後の経時的なラクタム体の増加量は少量にとどまったが、錠剤硬度は15.0Nに低下した。
このことからも、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、経時的に錠剤硬度を低下させることがわかった。
Granulation containing 1.3 g of HPC per tablet, 20 mg of reduced maltose syrup per tablet, and 75 mg of pregabalin per tablet by adjusting the amount of additives in the prototype tablet of MP10-11. After granulating the product in a fluidized layer and drying it, add 3 mg of sodium starch glycolate per tablet, 20 mg of D-mannitol for direct impact per tablet, and 1 mg of calcium stearate per tablet, mix, and mix, 0.8 t. The trial tablet (specimen name: MP11-1) tableted with the tableting pressure of No. 1 had a small increase in lactam over time after being stored at 40 ° C. and 75% relative humidity for 7 days, but the tablet hardness was small. Decreased to 15.0N.
From this, it was found that sodium starch glycolate did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time.
前記の検体名:MP11−1の試作錠剤における直打用D−マンニトールの量を1錠あたり40mgに増量した試作錠剤(検体名:MP11−2)では、40℃75%相対湿度で7日間保存した後の経時的なラクタム体の増加量はさらに微増し、錠剤硬度は13.5Nに低下した。
このことからも、デンプングリコール酸ナトリウムは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、経時的に錠剤硬度を低下させることがわかった。また、直打用D−マンニトールは、打錠後の経時的なラクタム体の生成を促さないことがわかったが、同時に、添加量に応じて経時的に錠剤硬度を低下させることがわかった。
The prototype tablet (specimen name: MP11-2) in which the amount of D-mannitol for direct hitting in the prototype tablet of the sample name: MP11-1 was increased to 40 mg per tablet was stored at 40 ° C. and 75% relative humidity for 7 days. The amount of increase in lactams over time was further slightly increased, and the tablet hardness decreased to 13.5 N.
From this, it was found that sodium starch glycolate did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time. It was also found that D-mannitol for direct striking did not promote the formation of lactams over time after tableting, but at the same time, it was found that the tablet hardness decreased over time depending on the amount added.
以上の実験結果から、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり1mgのステアリン酸カルシウムとともに添加する後添加物としては、1錠あたり4mgのヒドロキシプロピルスターチ(検体名:MP10−3)、1錠あたり4mgのコーンスターチ(検体名:MP10−4)、1錠あたり4mgの部分α化デンプン(検体名:MP10−5)、1錠あたり4mgのα化デンプン(検体名:MP10−6)、1錠あたり4mgのL−HPC(検体名:MP10−7)は、40℃75%相対湿度で7日間保存した後も、錠剤硬度は約38N以上に維持されており、かつ、経時的なラクタム体の増加量も僅かな量にとどまったことから、錠剤硬度の維持と経時的なラクタム体生成の防止の両立の為に、最も適していた。 Based on the above experimental results, granulated products containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch candy per tablet, and 75 mg of pregabalin per tablet were granulated in a fluid layer, dried, and then 1 mg per tablet. Post-additives to be added with calcium stearate include 4 mg hydroxypropyl starch per tablet (specimen name: MP10-3), 4 mg cornstarch per tablet (specimen name: MP10-4), and 4 mg partial α per tablet. 4 mg of pregelatinized starch (specimen name: MP10-6) per tablet (specimen name: MP10-5), 4 mg of L-HPC per tablet (specimen name: MP10-7) is 75% at 40 ° C. Even after storage at relative humidity for 7 days, the tablet hardness was maintained at about 38 N or higher, and the amount of increase in lactam over time was very small. Therefore, the tablet hardness was maintained and the tablet hardness was maintained over time. It was most suitable for both prevention of lactam formation.
また、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり1mgのステアリン酸カルシウムとともに添加する後添加物としては、1錠あたり4mgのデンプングリコール酸ナトリウム(検体名:MP10−1)又は1錠あたり3mgのデンプングリコール酸ナトリウム(検体名:MP10−2)を用いた場合には、40℃75%相対湿度で7日間保存した後も、経時的なラクタム体の増加が全く観察されず、経時的なラクタム体生成の防止という点で最も優れていたが、錠剤硬度の維持は不十分であった。 In addition, granulated products containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregavalin per tablet were granulated in a fluid layer, dried, and then added together with 1 mg of calcium stearate per tablet. When 4 mg of sodium starch glycolate (specimen name: MP10-1) or 3 mg of sodium starch glycolate (specimen name: MP10-2) per tablet was used as the post-additive, 40. Even after storage at 75% relative humidity for 7 days, no increase in lactam was observed over time, which was the best in terms of preventing lactam formation over time, but the maintenance of tablet hardness was insufficient. Met.
1錠あたり4mgのデンプングリコール酸ナトリウム(検体名:MP10−1)又は1錠あたり3mgのデンプングリコール酸ナトリウム(検体名:MP10−2)を用いた場合には、デンプングリコール酸ナトリウムの添加量に比例して錠剤硬度が低下する傾向が観察されたものの、1錠あたり4mgのデンプングリコール酸ナトリウムを含有する試作錠剤(検体名:MP10−1)は、1錠あたり4mgのヒドロキシプロピルスターチ(検体名MP10−3)、1錠あたり4mgのコーンスターチ(検体名:MP10−4)、1錠あたり4mgの部分α化デンプン(検体名:MP10−5)、1錠あたり4mgのα化デンプン(検体名MP10−6)、1錠あたり4mgのL−HPCを用いた場合に比べて、良好な崩壊性を示した。すなわち、溶出試験機で水、50回転の崩壊時間を確認したところ、1錠あたり4mgのデンプングリコール酸ナトリウムを含有する試作錠剤(検体名:MP10−1)が約12〜13分で崩壊したのに対して、MP10−3乃至MP10−6の試作錠剤の崩壊時間は15分以上であった。 When 4 mg of sodium starch glycolate (specimen name: MP10-1) or 3 mg of sodium starch glycolate (specimen name: MP10-2) per tablet was used, the amount of sodium starch glycolate added was increased. Although a tendency for tablet hardness to decrease proportionally was observed, the prototype tablet (specimen name: MP10-1) containing 4 mg of sodium starch glycolate per tablet was 4 mg of hydroxypropyl starch (specimen name) per tablet. MP10-3) 4 mg cornstarch per tablet (specimen name: MP10-4), 4 mg partially pregelatinized starch per tablet (specimen name: MP10-5), 4 mg pregelatinized starch per tablet (specimen name MP10) -6) Good disintegration was shown as compared with the case of using 4 mg of L-HPC per tablet. That is, when the disintegration time of water and 50 rotations was confirmed with an dissolution tester, the prototype tablet (specimen name: MP10-1) containing 4 mg of sodium starch glycolate per tablet disintegrated in about 12 to 13 minutes. On the other hand, the disintegration time of the prototype tablets of MP10-3 to MP10-6 was 15 minutes or more.
これらの結果から、検体名:MP10−1又は検体名:MP10−2の処方におけるデンプングリコール酸ナトリウムの添加量をさらに検討して最適化することを検討する必要があると考えられた。 From these results, it was considered necessary to further study and optimize the amount of sodium starch glycolate added in the formulation of sample name: MP10-1 or sample name: MP10-2.
実施例9及び実施例10の結果を受けて、実施例9の検体名:MP2−Aの試作錠剤(検体名:MP2主薬顆粒、MP2打錠用末、MP2錠剤、MP2錠剤粉砕品)、及び実施例10の検体名:MP10−2の試作錠剤のデンプングリコール酸ナトリウムの量を1錠あたり2mgに減量した試作錠剤(検体名:MP8−1−4主薬顆粒、MP8−1−4打錠用末、MP8−1−4錠剤、MP8−1−4錠剤粉砕品)の夫々について、その主薬顆粒、その打錠用粉末、錠剤、及び錠剤を乳鉢で粉砕したものについて、40℃75%相対湿度で7日間保管前後の状態のラクタム体の量を検討した。また、検体名:MP2の試作錠剤、及び検体名:MP8−1−4の試作錠剤については、40℃75%相対湿度で7日間保管前後の状態の錠剤硬度を測定した。 Based on the results of Examples 9 and 10, the sample name of Example 9: the prototype tablet of MP2-A (specimen name: MP2 main drug granule, powder for MP2 tableting, MP2 tablet, MP2 tablet crushed product), and Specimen name of Example 10: Trial tablet in which the amount of sodium starch glycolate in the trial tablet of MP10-2 was reduced to 2 mg per tablet (specimen name: MP8-1-4 main ingredient granules, MP8-1-4 for tableting For each of the powder, MP8-1-4 tablet, MP8-1-4 tablet crushed product), the main drug granule, the tableting powder, the tablet, and the tablet crushed in a dairy pot, 40 ° C. 75% relative humidity. The amount of lactam in the state before and after storage for 7 days was examined. For the prototype tablet with the sample name: MP2 and the prototype tablet with the sample name: MP8-1--4, the tablet hardness was measured before and after storage at 40 ° C. and 75% relative humidity for 7 days.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、松谷化学工業〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced maltose water candy [Amarti MR100 (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], sodium starch glycolate [Primo]. Gel (trademark), Matsutani Chemical Industry], croscarmellose sodium [Ac-Di-Sol (trademark), Wilbur Ellis Co., Ltd.], calcium stearate [Taipei Chemical Industry Co., Ltd.].
表11に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、検体名:MP8−1−4の検体については、プレガバリン原薬600g及び還元麦芽糖水飴の粉末56gを秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%HPC水溶液800gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。検体名:MP2の検体については、プレガバリン原薬600gを秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%HPC水溶液800gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。
得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表11に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表11に記載のとおりであった。
The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 11 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 11.
まず、検体名がMP2で始まる検体については、1錠あたり4mgのHPCと1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して、「主薬顆粒」を製造し、これに1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して、「打錠用末」を製造し、これを0.8tの打錠圧で打錠して試作錠剤を製造し、さらに、これを、乳鉢を用いて粉砕した「錠剤粉砕品」を製造した。 First, for a sample whose sample name starts with MP2, a granulated product containing 4 mg of HPC per tablet and 75 mg of pregavalin per tablet is granulated in a fluid layer and dried to produce "main drug granules". To this, 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet were added and mixed to produce a "tablet powder", which was tableted with a tableting pressure of 0.8 tons. A prototype tablet was produced, and the tablet was crushed using a dairy pot to produce a "crushed tablet product".
検体名がMP8−1−4で始まる検体については、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して、「主薬顆粒」を製造し、これに1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して、「打錠用末」を製造し、これを0.8tの打錠圧で打錠して試作錠剤を製造し、さらにこれを乳鉢を用いて粉砕した「錠剤粉砕品」を製造した。 For samples whose sample name starts with MP8-1-4, granules containing 4 mg of HPC per tablet, 7 mg of reduced starch sugar candy per tablet and 75 mg of pregavalin per tablet are granulated in a fluid layer and dried. Then, "main drug granules" are produced, and 2 mg of sodium starch glycolate per tablet and 1 mg of calcium stearate per tablet are added and mixed to produce "tablet powder". A prototype tablet was produced by tableting with a tableting pressure of 0.8 ton, and further pulverized using a dairy pot to produce a "crushed tablet product".
試作した圧縮固形製剤の経時的な硬度変化及びラクタム体の増加:
試作した圧縮固形製剤の圧縮固形製剤を、40℃75%相対湿度で保存し、保存開始時及び7日後の錠剤硬度及びラクタム体の量を測定した。測定結果は、表11に記載のとおりであった。
Changes in hardness and increase in lactam form over time of the prototype compressed solid formulation:
The compressed solid preparation of the prototype compressed solid preparation was stored at 40 ° C. and 75% relative humidity, and the tablet hardness and the amount of lactam were measured at the start of storage and after 7 days. The measurement results are as shown in Table 11.
1錠あたり4mgのHPCと1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して得た「主薬顆粒」(検体名:MP2主薬顆粒)のラクタム体の量は、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。 The amount of lactam in the "main agent granules" (specimen name: MP2 main agent granules) obtained by granulating a granule containing 4 mg of HPC per tablet and 75 mg of pregabalin per tablet in a fluidized bed and drying it is There was almost no change before and after storage at 40 ° C. and 75% relative humidity for 7 days.
当該「主薬顆粒」(検体名:MP2主薬顆粒)に1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して得た「打錠用末」(検体名:MP2打錠用末)のラクタム体の量も、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。 "Powder for tableting" (specimen name:: powder for tableting) obtained by adding 2 mg of croscarmellose sodium per tablet and 1 mg of calcium stearate per tablet to the "main drug granules" (specimen name: MP2 main drug granules) and mixing them. The amount of lactams (MP2 tableting powder) did not change much before and after storage at 40 ° C. and 75% relative humidity for 7 days.
しかし、当該「打錠用末」(検体名:MP2打錠用末)を0.8tの打錠圧で打錠して得た「錠剤」(検体名:MP2錠剤)は、40℃75%相対湿度で7日間保存することによって経時的にラクタム体の量が顕著に増加した。当該「錠剤」(検体名:MP2錠剤)は、40℃75%相対湿度で7日間保存した前後において、その錠剤硬度がほとんど変化せず、7日間保存後において38Nの錠剤硬度を維持していた。 However, the "tablet" (specimen name: MP2 tablet) obtained by tableting the "tablet powder" (specimen name: MP2 tableting powder) with a tableting pressure of 0.8 t is 75% at 40 ° C. Storage at relative humidity for 7 days significantly increased the amount of lactams over time. The "tablet" (specimen name: MP2 tablet) had almost no change in tablet hardness before and after storage at 40 ° C. and 75% relative humidity for 7 days, and maintained a tablet hardness of 38 N after storage for 7 days. ..
このことから、クロスカルメロースを添加しても、それだけでは、経時的なラクタム体の生成は生じないものの、これを打錠すると、経時的なラクタム体の生成が生じることがわかった。また、クロスカルメロースを含有する検体名:MP2の錠剤は、錠剤硬度の維持という点では優れていることがわかった。 From this, it was found that the addition of croscarmellose alone did not cause the formation of lactams over time, but when the tablets were tableted, the formation of lactams over time occurred. Further, it was found that the tablet containing croscarmellose and having the sample name: MP2 was excellent in maintaining the tablet hardness.
当該「錠剤」(検体名:MP2錠剤)を乳鉢で粉砕して得た「錠剤粉砕品」(検体名:MP2錠剤粉砕品)もまた、40℃75%相対湿度で7日間保存することによって経時的にラクタム体の量が顕著に増加した。
このことから、打錠後の経時的なラクタム体の生成は、単に圧密状態によってではなく、打錠の衝撃によってラクタム体の経時的な生成が促進されて保存安定性が損なわれ、一旦打錠した後は、解砕して圧密状態を解いてもラクタム体の経時的な生成が促進されたままであることがわかった。
The "tablet crushed product" (specimen name: MP2 tablet crushed product) obtained by crushing the "tablet" (specimen name: MP2 tablet) in a mortar is also aged by storing at 40 ° C. and 75% relative humidity for 7 days. The amount of lactam was significantly increased.
From this, the formation of lactams over time after tableting is not simply due to the consolidation state, but the impact of tableting promotes the formation of lactams over time, impairing storage stability, and once locking. After that, it was found that the production of lactams over time remained promoted even after crushing and releasing the consolidation state.
一方、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して得た「主薬顆粒」(検体名:MP8−1−4主薬顆粒)のラクタム体の量は、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。 On the other hand, "main drug granules" obtained by fluidizing a granule containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet and 75 mg of pregabalin per tablet, and drying the granules (specimen name:: The amount of lactams (MP8-1--4 main drug granules) did not change much before and after storage at 40 ° C. and 75% relative humidity for 7 days.
当該「主薬顆粒」(検体名:MP8−1−4主薬顆粒)に1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して得た「打錠用末」(検体名MP8−1−4打錠用末)のラクタム体の量も、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。 "Powder for tableting" obtained by adding 2 mg of sodium starch glycolate and 1 mg of calcium stearate per tablet to the "main drug granules" (specimen name: MP8-1--4 main drug granules) and mixing them. The amount of lactam (specimen name MP8-1-4 powder for tableting) also hardly changed before and after storage at 40 ° C. and 75% relative humidity for 7 days.
当該「打錠用末」(検体名:MP8−1−4打錠用末)を0.8tの打錠圧で打錠して得た「錠剤」(検体名:MP8−1−4錠剤)のラクタム体の量も、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。当該「錠剤」(検体名:MP8−1−4錠剤)は、40℃75%相対湿度で7日間保存することによって錠剤硬度が57.3Nから36.3Nに低下したが、依然として十分な錠剤硬度を有していた。 A "tablet" (specimen name: MP8-1-4 tablet) obtained by tableting the "tablet powder" (specimen name: MP8-1-4 tableting powder) with a tableting pressure of 0.8 ton. The amount of lactams in the tablet was also almost unchanged before and after storage at 40 ° C. and 75% relative humidity for 7 days. The tablet hardness of the "tablet" (specimen name: MP8-1-4 tablet) decreased from 57.3N to 36.3N by storing at 40 ° C. and 75% relative humidity for 7 days, but the tablet hardness was still sufficient. Had.
したがって、HPCと還元麦芽糖水飴を用いて主薬顆粒を造粒し、後添加物中の1錠あたりのデンプングリコール酸ナトリウムの量を2mgに抑えた検体名:MP8−1−4の試作錠剤は、使用期限中の錠剤硬度の維持と、打錠後の経時的なラクタム体の生成抑制とを両立しうる処方であることがわかった。 Therefore, the prototype tablet of sample name: MP8-1-4, in which the main ingredient granules were granulated using HPC and reduced maltose starch syrup and the amount of sodium starch glycolate per tablet in the post-additive was suppressed to 2 mg, It was found that the formulation can achieve both maintenance of tablet hardness during the expiration date and suppression of lactam formation over time after tableting.
当該「錠剤」(検体名:MP8−1−4錠剤)を乳鉢で粉砕して得た「錠剤粉砕品」(検体名:MP8−1−4錠剤粉砕品)のラクタム体の量も、40℃75%相対湿度で7日間保存した前後においてほとんど変化しなかった。
このことから、打錠後の経時的なラクタム体の生成が生じない処方であれば、これを粉砕しても、同様に打錠後の経時的なラクタム体の生成が生じないことがわかった。
The amount of lactam in the "tablet crushed product" (specimen name: MP8-1--4 tablet crushed product) obtained by crushing the "tablet" (specimen name: MP8-1-4 tablet) in a mortar was also 40 ° C. There was almost no change before and after storage at 75% relative humidity for 7 days.
From this, it was found that if the formulation does not produce lactams over time after tableting, even if it is crushed, lactams will not be produced over time after tableting. ..
以上の実験結果から、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して「主薬顆粒」を製造し、これに1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して「打錠用末」を製造し、これを0.8tの打錠圧で打錠して得た試作錠剤(検体名:MP8−1−4)は、経時的なラクタム体の増加が全く見られない上に、40℃75%相対湿度で7日間保存した後にも、36.3Nという十分な錠剤硬度を保持できることがわかった。 Based on the above experimental results, granules containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet were granulated in a fluid layer and dried to produce "main drug granules". Then, 2 mg of sodium starch glycolate per tablet and 1 mg of calcium stearate per tablet were added and mixed to produce a "tablet powder", which was tableted at a tableting pressure of 0.8 tons. The trial tablet (specimen name: MP8-1--4) obtained in this manner showed no increase in lactams over time, and even after being stored at 40 ° C. and 75% relative humidity for 7 days, it was 36.3 N. It was found that sufficient tablet hardness can be maintained.
一方、1錠あたり4mgのHPCと1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥して、「主薬顆粒」を製造し、これに1錠あたり2mgのクロスカルメロースナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合して、「打錠用末」を製造し、これを0.8tの打錠圧で打錠して得た試作錠剤(検体名:MP2錠剤)は、40℃75%相対湿度で7日間保存した後の錠剤硬度は十分であったものの、経時的なラクタム体の顕著な増加がみられた。 On the other hand, granules containing 4 mg of HPC per tablet and 75 mg of pregavalin per tablet are granulated in a fluidized bed and dried to produce "base drug granules", to which 2 mg of croscarmellose per tablet is produced. A prototype tablet (specimen name: MP2) obtained by adding and mixing sodium and 1 mg of calcium stearate per tablet to produce a "tablet powder" and tableting this with a tableting pressure of 0.8 ton. Tablets) had sufficient tablet hardness after being stored at 40 ° C. and 75% relative humidity for 7 days, but a marked increase in lactams was observed over time.
これは、検体名「MP2錠剤」の試作錠剤が、経時的なラクタム体の増加をもたらすセルロース系化合物であるクロスカルメロースナトリウムを含有する上に、カルボキシメチル基又はヒドロキシプロポキシル基で修飾されたデンプンも糖アルコールも全く含まないために経時的なラクタム体の増加を抑制することができなかったためと考えられた。 This is because the prototype tablet with the sample name "MP2 tablet" contains croscarmellose sodium, which is a cellulosic compound that causes an increase in lactams over time, and is modified with a carboxymethyl group or a hydroxypropoxyl group. It was considered that the increase of lactam compounds over time could not be suppressed because it contained neither starch nor sugar alcohol.
また、検体名「MP2錠剤」の試作錠剤を粉砕して、圧密状態を解いた検体であっても、粉砕しなかった場合と同様の経時的なラクタム体の顕著な増加が観察されたことは、打錠品の経時的なラクタム体の増加が、保存中の「圧密状態」によってもたらされるのではなく、打錠の衝撃によって、ラクタム体の増加が開始することを意味しており、驚くべき結果であった。 In addition, even in the case where the prototype tablet with the sample name "MP2 tablet" was crushed and the consolidation state was released, a remarkable increase in lactams over time was observed as in the case where the sample was not crushed. It is surprising that the increase in lactams over time in tablets is not brought about by the "consolidation" during storage, but the impact of tableting initiates the increase in lactams. It was a result.
圧縮固形製剤の試作;
40℃75%相対湿度で保存した場合に、硬度を維持することができ、かつ、打錠後の経時的なラクタム体生成が生じず、さらに、良好な溶出性を有するプレガバリン製剤の処方を確立するべく、さらに様々な試作錠剤の硬度とラクタム体の量を、シャーレ開放条件とアルミ密封条件で検討した。
Prototype of compressed solid preparation ;
Established a formulation of a pregabalin preparation that can maintain hardness when stored at 40 ° C. and 75% relative humidity, does not generate lactams over time after tableting, and has good dissolution properties. In order to do so, the hardness of various prototype tablets and the amount of lactam were examined under the conditions of opening the chalet and sealing the aluminum.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、松谷化学工業〕、クロスカルメロースナトリウム〔Ac−Di−Sol(商標)、ウイルバー・エリス株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕であった。
The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced maltose water candy [Amarti MR100 (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], sodium starch glycolate [Primo]. Gel (trademark), Matsutani Chemical Industry], croscarmellose sodium [Ac-Di-Sol (trademark), Wilbur Ellis Co., Ltd.], calcium stearate [Taipei Chemical Industry Co., Ltd.].
表12に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、プレガバリン原薬600g及び還元麦芽糖水飴の粉末56gを秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液を毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、噴霧しながら造粒した。HPC水溶液の噴霧量及び噴霧時間は、1錠あたり4mgのHPCを加える場合には4質量%のHPC水溶液800gを約67分間にわたって噴霧しながら造粒し、1錠あたり8mgのHPCを加える場合には4質量%のHPC水溶液1600gを約133分間にわたって噴霧しながら造粒し、1錠あたり1.5mgのHPCを加える場合には4質量%のHPC水溶液300gを約25分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表12に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた1錠あたりの質量は、表12に記載のとおりであった。 Prototype tablets were prepared using 8000 tablets of the active ingredient and additives according to Table 12. Specifically, 600 g of the pregavalin drug substance and 56 g of the powder of reduced maltose starch syrup were weighed and put into a fluidized layer (FD-MP-01 type, Paulec), and 4% by mass prepared in advance for granulation. The HPC aqueous solution was granulated while spraying at a speed of 12 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. The spray amount and spray time of the HPC aqueous solution are such that when 4 mg of HPC is added per tablet, 800 g of 4 mass% HPC aqueous solution is sprayed for about 67 minutes to granulate, and when 8 mg of HPC is added per tablet. Granulates while spraying 1600 g of 4 mass% HPC aqueous solution for about 133 minutes, and when adding 1.5 mg of HPC per tablet, granulates while spraying 300 g of 4 mass% HPC aqueous solution for about 25 minutes. bottom. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. Add the post-additives shown in Table 12 to the granulated product after drying and sieving in an amount of 8000 times the amount per tablet, mix, and beat using a single-shot tableting machine (AUTOTAB-500, Ichihashi Seiki). The tablet was tableted at a tablet pressure of 0.8 t. The mass per tablet obtained as a result was as shown in Table 12.
まず、検体名:MP8−1−3の試作錠剤においては、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり1mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合し、0.8tの打錠圧で打錠した。 First, in the prototype tablet of sample name: MP8-1--3, a mixture containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregavalin per tablet was granulated in a fluidized bed and dried. After that, 1 mg of sodium starch glycolate and 1 mg of calcium stearate per tablet were added and mixed, and the tablets were tableted with a tableting pressure of 0.8 t.
検体名:MP8−1−4の試作錠剤においては、デンプングリコール酸ナトリウムの量を1錠あたり2mgに増量した以外は、検体名:MPMP8−1−3の試作錠剤と同様に製造した。 The prototype tablet of sample name: MP8-1--4 was produced in the same manner as the prototype tablet of sample name: MPMP8-1-3, except that the amount of sodium starch glycolate was increased to 2 mg per tablet.
検体名:MP8−1−5の試作錠剤においては、デンプングリコール酸ナトリウムの量を1錠あたり4mgに増量した以外は、検体名:MPMP8−1−3の試作錠剤と同様に製造した。 The prototype tablet with the sample name: MP8-1-5 was produced in the same manner as the prototype tablet with the sample name: MPMP8-1-3, except that the amount of sodium starch glycolate was increased to 4 mg per tablet.
検体名:MP8−3−3の試作錠剤においては、デンプングリコール酸ナトリウムの量を1錠あたり4mgに増量するとともに、HPCの量を1錠あたり8mgに増量した以外は、検体名:MPMP8−1−3の試作錠剤と同様に製造した。 Specimen name: In the prototype tablet of MP8-3-3, sample name: MPMP8-1 except that the amount of sodium starch glycolate was increased to 4 mg per tablet and the amount of HPC was increased to 8 mg per tablet. It was manufactured in the same manner as the prototype tablet of -3.
検体名:N3−9の試作錠剤においては、1錠あたり1.5mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合し、0.8tの打錠圧で打錠した Specimen name: In the prototype tablet of N3-9, a mixture containing 1.5 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet was granulated in a fluidized bed and dried. 1 mg of sodium starch glycolate and 1 mg of calcium stearate per tablet were added and mixed, and the tablets were tableted at a tableting pressure of 0.8 t.
検体名:N3−4の試作錠剤においては、検体名:N3−9の試作錠剤における1錠あたり2mgのデンプングリコール酸ナトリウムを1錠あたり2mgのクロスカルメロースナトリウムに変更した以外、検体名N3−9の試作錠剤と同様に製造した。 In the prototype tablet of sample name: N3-4, sample name N3- except that 2 mg of sodium starch glycolate per tablet in the prototype tablet of sample name: N3-9 was changed to 2 mg of croscarmellose sodium per tablet. It was produced in the same manner as the prototype tablet of 9.
試作した圧縮固形製剤の溶出性、経時的な硬度変化及びラクタム体の増加:
検体名:MP8−1−3、検体名:MP8−1−4、検体名:MP8−1−5、及び検体名:MP8−3−3の試作錠剤は、夫々、40℃75%相対湿度で、シャーレ開放条件及びアルミ袋に密封した状態で保存し、保存開始時、7日後、14日後の錠剤硬度及びラクタム体の量を測定した。
Dissolution of the prototype compressed solid preparation, change in hardness over time, and increase in lactam form:
Specimen name: MP8-1-3, Specimen name: MP8-1--4, Specimen name: MP8-1-5, and Specimen name: MP8-3-3 are each prototype tablets at 40 ° C. and 75% relative humidity. , The tablet was stored under open conditions and sealed in an aluminum bag, and the tablet hardness and the amount of lactam were measured at the start of storage, after 7 days and after 14 days.
検体名:N3−9の試作錠剤と検体名:N3−4の試作錠剤は、40℃75%相対湿度で、シャーレ開放条件でのみ保存し、保存開始時及び7日保存後の錠剤硬度、及び保存開始時、7日後、14日後のラクタム体の量を測定した。
測定結果は、表12に記載のとおりであった。
Specimen name: N3-9 prototype tablet and sample name: N3-4 prototype tablet are stored at 40 ° C. and 75% relative humidity only under the conditions of opening the chalet, and the tablet hardness at the start of storage and after storage for 7 days, and The amount of lactam was measured at the start of storage, 7 days and 14 days later.
The measurement results are as shown in Table 12.
1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり1mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを加えて混合し、0.8tの打錠圧で打錠した試作錠剤(検体名:MP8−1−3)は、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後も、経時的なラクタム体の増加はほとんど見られず、同じく7日間保存した後の錠剤硬度も41.3Nの良好な錠剤硬度を維持していたものの、水における15分後の溶出率は65.5%にとどまり、溶出性が不十分であった。 A mixture containing 4 mg of HPC per tablet, 7 mg of reduced maltose water candy per tablet and 75 mg of pregabalin per tablet was granulated in a fluidized bed, dried, and then 1 mg of sodium starch glycolate per tablet and per tablet. The prototype tablet (specimen name: MP8-1-3), which was mixed by adding 1 mg of calcium stearate and tableted at a tableting pressure of 0.8 t, was stored in a chalet open condition at 40 ° C. and 75% relative humidity for 14 days. Even after this, there was almost no increase in the lactam form over time, and the tablet hardness after storage for 7 days also maintained a good tablet hardness of 41.3 N, but the dissolution rate after 15 minutes in water. Was only 65.5%, and the dissolution property was insufficient.
検体名:MP8−1−3の試作錠剤において後添加する1錠あたり1mgのデンプングリコール酸ナトリウムを1錠あたり2mgに増量した試作錠剤(検体名:MP8−1−4)は、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後も、経時的なラクタム体の増加はほとんど見られず、同じく7日間保存した後の錠剤硬度も36.3Nの良好な錠剤硬度を維持していたものの、水における15分後の溶出率は80.5%にとどまり、溶出性が不十分であった。 Specimen name: The trial tablet (specimen name: MP8-1--4) in which 1 mg of sodium starch glycolate added afterwards in the trial tablet of MP8-1-3 was increased to 2 mg per tablet was 75% at 40 ° C. Even after 14 days of storage in relative humidity under open conditions, there was almost no increase in lactams over time, and the tablet hardness after storage for 7 days also maintained a good tablet hardness of 36.3 N. However, the dissolution rate in water after 15 minutes was only 80.5%, and the dissolution property was insufficient.
検体名:MP8−1−3の試作錠剤において後添加する1錠あたり1mgのデンプングリコール酸ナトリウムを1錠あたり4mgに増量した試作錠剤(検体名:MP8−1−5)は、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後も、経時的なラクタム体の増加はほとんど見られず、水における15分後の溶出率も99.0%に達して極めて良好であったが、40℃75%相対湿度中にシャーレ開放条件で7日間保存した後の錠剤硬度は、23.3Nに低下しており、錠剤硬度を20N以上に維持できない可能性があった。そこで、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後の錠剤硬度を追跡したところ、依然として23.0Nの錠剤硬度を維持していたことから、これ以上の錠剤硬度の低下が進行しないことを確認できた。
このことから、検体名:MP8−1−3の試作錠剤は、40℃75%相対湿度で保存した場合に、硬度を維持することができ、かつ、打錠後の経時的なラクタム体生成が生じず、さらに、良好な溶出性を有するプレガバリン製剤の処方であることがわかった。
Specimen name: The trial tablet (specimen name: MP8-1-5) in which 1 mg of sodium starch glycolate added after the trial tablet of MP8-1-3 was increased to 4 mg per tablet was 75% at 40 ° C. Even after 14 days of storage in relative humidity under open petri dishes, there was almost no increase in lactams over time, and the elution rate in water after 15 minutes reached 99.0%, which was extremely good. The tablet hardness after storage in a petri dish open condition at 40 ° C. and 75% relative humidity for 7 days was lowered to 23.3N, and there was a possibility that the tablet hardness could not be maintained at 20N or more. Therefore, when the tablet hardness after storage in a petri dish open condition at 40 ° C. and 75% relative humidity for 14 days was followed, the tablet hardness was still maintained at 23.0 N, so that the tablet hardness was further reduced. I was able to confirm that it did not progress.
From this, the prototype tablet having the sample name: MP8-1-3 can maintain its hardness when stored at 40 ° C. and 75% relative humidity, and the lactam body is produced over time after tableting. It was found that it was a formulation of a pregabalin preparation that did not occur and had good dissolution properties.
検体名:MP8−1−3の試作錠剤において後添加する1錠あたり1mgのデンプングリコール酸ナトリウムを1錠あたり4mgに増量するとともに、造粒物中のHPCの量を1錠あたり4mgから1錠あたり8mgに増量した試作錠剤(検体名:MP8−3−3)は、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後に経時的なラクタム体の増加が僅かに認められ、同じく7日間保存した後の錠剤硬度も29.0Nを維持していたが、水における15分後の溶出率も54.5%にとどまり、溶出性が不十分であった。 Specimen name: In the prototype tablet of MP8-1--3, the amount of 1 mg of sodium starch glycolate added afterwards was increased to 4 mg per tablet, and the amount of HPC in the granulated product was increased from 4 mg to 1 tablet per tablet. The trial tablet (specimen name: MP8-3-3) whose dose was increased to 8 mg per tablet showed a slight increase in lactam over time after being stored in a chalet open condition at 40 ° C. and 75% relative humidity for 14 days. The tablet hardness after storage for 7 days also maintained 29.0 N, but the dissolution rate in water after 15 minutes was only 54.5%, and the dissolution property was insufficient.
一方、上記の検体名:MP8−1−3、MP8−1−4、MP8−1−5、及びMP8−3−3の試作錠剤をアルミ袋に密封して40℃75%相対湿度の環境下で保存したところ、これらすべての試作錠剤において、14日後のラクタム体の量が著しく増加していた。
このことから、γアミノ酪酸誘導体を含有する錠剤を密封保存することは、却って打錠後の経時的なラクタム体の生成を促進するので望ましくないこと、したがって、密封包装ではなく、気密包装の包装形態とすることが望ましいことがわかった。
On the other hand, the prototype tablets of the above sample names: MP8-1-3, MP8-1--4, MP8-1-5, and MP8-3-3 are sealed in an aluminum bag and placed in an environment of 40 ° C. and 75% relative humidity. When stored in, the amount of lactam after 14 days was significantly increased in all of these prototype tablets.
For this reason, it is not desirable to store tablets containing the γ-aminobutyric acid derivative in a sealed manner because it promotes the formation of lactams over time after tableting. Therefore, packaging in an airtight package rather than a sealed package. It was found that the form was desirable.
1錠あたり1.5mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり2mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを加えて混合し、0.8tの打錠圧で打錠した試作錠剤(検体名:N3−9)は、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後も、経時的なラクタム体の増加はほとんど見られなかったが、錠剤硬度は、保存開始時の時点でも20.5Nしかなく、7日経過後には10.5Nに低下しており、錠剤硬度が不十分であった。
このことから、錠剤硬度を維持するためには、主薬顆粒中のHPCの量が1錠あたり1,5mgでは不十分であり、1錠あたり4mg以上のHPCが必要であることがわかった。
A mixture containing 1.5 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet was fluidized, dried, and then 2 mg of sodium starch glycolate and 1 tablet. The prototype tablet (specimen name: N3-9), which was mixed by adding 1 mg of calcium stearate per tablet and tableted at a tableting pressure of 0.8 ton, was stored in a chalet open condition at 40 ° C. and 75% relative humidity for 14 days. Although there was almost no increase in the lactam form over time, the tablet hardness was only 20.5 N at the start of storage and decreased to 10.5 N after 7 days. The hardness was insufficient.
From this, it was found that in order to maintain the tablet hardness, the amount of HPC in the main drug granules was not sufficient at 1.5 mg per tablet, and HPC of 4 mg or more per tablet was required.
検体名:N3−9の試作錠剤における1錠あたり2mgのデンプングリコール酸ナトリウムの後添加物を1錠あたり2mgのクロスカルメロースナトリウムに変更した試作錠剤(検体名:N3−4)についても、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後の経時的ラクタム体の増加は少量にとどまったが、錠剤硬度は、保存開始時の時点でも21.5Nしかなく、7日経過後には10.0Nに低下しており、錠剤硬度が不十分であった。
このことからも、錠剤硬度を維持するためには、主薬顆粒中のHPCの量が1錠あたり1,5mgでは不十分であり、1錠あたり4mg以上のHPCが必要であることがわかった。
Specimen name: The prototype tablet (specimen name: N3-4) in which the post-additive of 2 mg of sodium starch glycolate was changed to 2 mg of croscarmellose sodium per tablet in the prototype tablet of N3-9 was also 40. The increase in lactams over time after storage in 75% relative humidity for 14 days under the open conditions of chalet was small, but the tablet hardness was only 21.5 N at the start of storage, and after 7 days had passed. Was lowered to 10.0 N, and the tablet hardness was insufficient.
From this, it was found that, in order to maintain the tablet hardness, the amount of HPC in the main drug granules was not sufficient at 1.5 mg per tablet, and HPC of 4 mg or more per tablet was required.
以上の実験結果から、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する造粒物を流動層造粒し、乾燥した後に、1錠あたり4mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを後添加して混合し、0.8tの打錠圧で打錠した試作錠剤(検体名:MP8−1−5)が、極めて良好な溶出性を示すとともに、40℃75%相対湿度中にシャーレ開放条件で14日間保存した後も、経時的なラクタム体の増加はほとんど見られず、かつ良好な錠剤硬度を維持できることが確認できた。 Based on the above experimental results, granulated products containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregabalin per tablet were granulated in a fluidized bed, dried, and then 4 mg per tablet. A prototype tablet (specimen name: MP8-1-5) obtained by adding and mixing sodium starch glycolate and 1 mg of calcium stearate per tablet and tableting at a tableting pressure of 0.8 ton has extremely good dissolution property. It was confirmed that even after the tablet was stored in a chalet open condition at 40 ° C. and 75% relative humidity for 14 days, almost no increase in the lactam body was observed over time, and good tablet hardness could be maintained.
しかしながら、これをアルミ袋などを用いて密封する包装形態とすると、経時的なラクタム体の著しい増加を生じることから、密封包装とすべきではないことがわかった。通常、医薬製剤の安定性保持のために好ましい包装形態は、(1)密封包装、(2)気密包装、(3)密閉包装の順であり、密封包装が最も好ましいので、密封包装することによって、プレガバリン製剤中のプレガバリンの安定性が損なわれることは、驚くべき事であった。 However, it was found that if this is in a packaging form that is sealed using an aluminum bag or the like, a significant increase in lactams will occur over time, and therefore a sealed packaging should not be used. Usually, the preferred packaging form for maintaining the stability of the pharmaceutical preparation is (1) sealed packaging, (2) airtight packaging, and (3) sealed packaging, and since sealed packaging is the most preferable, sealed packaging is used. It was surprising that the stability of pregabalin in the pregabalin preparation was impaired.
圧縮固形製剤の試作;
40℃75%相対湿度で保存した場合に、錠剤硬度を維持することができ、良好な溶出性を有し、かつ、保存安定なプレガバリン製剤の処方を確立するべく、さらに様々な試作錠剤を作製して検討した。
Prototype of compressed solid preparation ;
Further various prototype tablets were prepared in order to establish a formulation of a pregabalin preparation that can maintain tablet hardness, have good dissolution property, and is stable in storage when stored at 40 ° C. and 75% relative humidity. And examined.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、松谷化学工業〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、酸化チタン〔フロイント産業株式会社〕、タルク〔三栄源エフ・エフ・アイ株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced malt sugar water candy [Amarti MR100 (trademark), Mitsubishi Corporation Foodtech Co., Ltd.], sodium starch glycolate [Primo]. Gel (trademark), Matsutani Chemical Industry], calcium stearate [Taipei Chemical Industry Co., Ltd.], titanium oxide [Freund Sangyo Co., Ltd.], and talc [Saneigen FFI Co., Ltd.].
表13に従って8000錠分の量の主薬及び添加剤を用いて試作錠剤を作製した。具体的には、検体名:MP10S、MP10−1、MP10−2、MP10−3、MP10−4の各試作錠剤については、プレガバリン原薬600g及び還元麦芽糖水飴の粉末56gを秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液800gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約67分間にわたって噴霧しながら造粒した。検体名:MP11S、MP11−1、MP11−2、MP11−4の各試作錠剤については、プレガバリン原薬600g及び還元麦芽糖水飴の粉末480gを秤量して流動層(FD−MP−01型、パウレック)に投入し、予め造粒用に調製しておいた4質量%のHPC水溶液1400gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約117分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に表13に記載の後添加物を1錠あたりの量の8000倍の量で加えて混合し、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.8tで打錠した。その結果得られた素錠及びフィルムコーティング錠の1錠あたりの質量は、表13に記載のとおりであった。
各試作錠剤の製造方法は、以下のとおりであった。
まず、検体名:MP10Sの試作錠剤(素錠)においては、1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり4mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合し、0.8tの打錠圧で打錠した。
The manufacturing method of each prototype tablet was as follows.
First, in the sample tablet (uncoated tablet) of sample name: MP10S, a mixture containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet, and 75 mg of pregavalin per tablet was granulated in a fluidized bed and dried. After that, 4 mg of sodium starch glycolate and 1 mg of calcium stearate per tablet were added and mixed, and the tablets were tableted with a tableting pressure of 0.8 t.
検体名:MP10−1の試作錠剤においては、検体名:MP10Sの試作錠剤(素錠)に、1錠あたり0.9mgのHPCと1錠あたり0.1mgの還元麦芽糖水飴によるコーティングを施した。 In the prototype tablet of sample name: MP10-1, the prototype tablet (bare tablet) of sample name: MP10S was coated with 0.9 mg of HPC per tablet and 0.1 mg of reduced maltose starch syrup per tablet.
検体名:MP10−2の試作錠剤においては、検体名:MP10Sの試作錠剤(素錠)に、1錠あたり1.8mgのHPCと1錠あたり0.2mgの還元麦芽糖水飴によるコーティングを施した。 In the prototype tablet of sample name: MP10-2, the prototype tablet (bare tablet) of sample name: MP10S was coated with 1.8 mg of HPC per tablet and 0.2 mg of reduced maltose starch syrup per tablet.
検体名:MP10−3の試作錠剤においては、検体名:MP10−2の試作錠剤(FC錠)に、さらに、1錠あたり0.8mgのHPCと、1錠あたり0.1mgの酸化チタンと、1錠あたり0.1mgのタルクによる2層目のコーティングを施した。 In the prototype tablet of sample name: MP10-3, in addition to the prototype tablet (FC tablet) of sample name: MP10-2, 0.8 mg of HPC per tablet and 0.1 mg of titanium oxide per tablet were added. A second layer coating with 0.1 mg talc per tablet was applied.
検体名:MP10−4の試作錠剤においては、検体名:MP10−2の試作錠剤(FC錠)に、さらに、1錠あたり1.6mgのHPCと、1錠あたり0.2mgの酸化チタンと、1錠あたり0.2mgのタルクによる2層目のコーティングを施した。 In the prototype tablet of sample name: MP10-4, in addition to the prototype tablet (FC tablet) of sample name: MP10-2, 1.6 mg of HPC per tablet and 0.2 mg of titanium oxide per tablet were added. A second layer coating with 0.2 mg talc per tablet was applied.
次に、検体名:MP11Sの試作錠剤(素錠)においては、1錠あたり7mgのHPCと1錠あたり60mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり7mgのデンプングリコール酸ナトリウムと1錠あたり2mgのステアリン酸カルシウムを添加して混合し、0.55tの打錠圧で打錠した。 Next, in the prototype tablet (uncoated tablet) of sample name: MP11S, a mixture containing 7 mg of HPC per tablet, 60 mg of reduced maltose starch syrup per tablet, and 75 mg of pregavalin per tablet was granulated in a fluidized bed. After drying, 7 mg of sodium starch glycolate and 2 mg of calcium stearate per tablet were added and mixed, and tablets were tableted at a tableting pressure of 0.55 t.
検体名:MP11−1の試作錠剤においては、検体名:MP11Sの試作錠剤(素錠)に、1錠あたり0.9mgのHPCと1錠あたり0.1mgの還元麦芽糖水飴によるコーティングを施した。 In the prototype tablet of sample name: MP11-1, the prototype tablet (bare tablet) of sample name: MP11S was coated with 0.9 mg of HPC per tablet and 0.1 mg of reduced maltose starch syrup per tablet.
検体名:MP11−2の試作錠剤においては、検体名:MP11Sの試作錠剤(素錠)に、1錠あたり1.8mgのHPCと1錠あたり0.2mgの還元麦芽糖水飴によるコーティングを施した。 In the prototype tablet of sample name: MP11-2, the prototype tablet (bare tablet) of sample name: MP11S was coated with 1.8 mg of HPC per tablet and 0.2 mg of reduced maltose starch syrup per tablet.
検体名:MP11−4の試作錠剤においては、検体名:MP11−2の試作錠剤(FC錠)に、さらに、1錠あたり1.6mgのHPCと、1錠あたり0.2mgの酸化チタンと、1錠あたり0.2mgのタルクによる2層目のコーティングを施した。 In the prototype tablet of sample name: MP11-4, in addition to the prototype tablet (FC tablet) of sample name: MP11-2, 1.6 mg of HPC per tablet and 0.2 mg of titanium oxide per tablet were added. A second layer coating with 0.2 mg talc per tablet was applied.
試作した圧縮固形製剤の溶出性、経時的な硬度変化及びラクタム体の増加:
1錠あたり4mgのHPCと1錠あたり7mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり4mgのデンプングリコール酸ナトリウムと1錠あたり1mgのステアリン酸カルシウムを添加して混合し、0.8tの打錠圧で打錠した素錠(検体名:MP10Sの試作錠剤)を有する試作錠剤(検体名:MP10S、MP10−1、MP10−2、MP10−3、MP10−4)は、すべて、40℃75%相対湿度中にシャーレ開放条件で7日間保存した後の経時的なラクタム体の増加はごく微量にとどまった。
Dissolution of the prototype compressed solid preparation, change in hardness over time, and increase in lactam form:
A mixture containing 4 mg of HPC per tablet, 7 mg of reduced maltose starch syrup per tablet and 75 mg of pregabalin per tablet was granulated in a fluidized bed, dried, and then 4 mg of sodium starch glycolate per tablet and per tablet. Trial tablets (specimen names: MP10S, MP10-1, MP10-2) having uncoated tablets (specimen name: MP10S trial tablet) that were mixed by adding 1 mg of calcium stearate and tableted at a tableting pressure of 0.8 ton. , MP10-3, MP10-4) were all stored in a chalet open condition at 40 ° C. and 75% relative humidity for 7 days, and the increase in lactams over time was negligible.
また、これらのうちで、検体名:MP10S、MP10−2、MP10−4の試作錠剤は、保存開始時点において、水に対して15分後に95%溶出し、極めて良好な溶出性を示した(検体名:MP10−1及びMP10−3の溶出性は未確認。)。 Among these, the prototype tablets having sample names: MP10S, MP10-2, and MP10-4 were 95% eluted with water after 15 minutes at the start of storage, and showed extremely good dissolution (the elution property was extremely good). Specimen name: The elution of MP10-1 and MP10-3 has not been confirmed.)
同様に、検体名:MP10S、MP10−2、MP10−4の試作錠剤は、40℃75%相対湿度中にシャーレ開放条件で7日間保存した後も、夫々順に、20.0N、23.0N、23.0Nの錠剤硬度を有しており、いずれも許容可能な錠剤硬度であった(検体名:MP10−1及びMP10−3の錠剤硬度は未確認。)。 Similarly, the prototype tablets of sample names: MP10S, MP10-2, and MP10-4 were stored at 40 ° C. and 75% relative humidity for 7 days under the open condition of the chalet, respectively, in order of 20.0N, 23.0N, respectively. It had a tablet hardness of 23.0 N, which was an acceptable tablet hardness (specimen names: MP10-1 and MP10-3 have unconfirmed tablet hardness).
これらのことから、検体名:MP10Sの試作錠剤及びこれにフィルムコーティングを施した試作錠剤(検体名:MP10−1、MP10−2、MP10−3、MP10−4)は、40℃75%相対湿度で保存した場合に、錠剤硬度を維持することができ、良好な溶出性を有し、かつ、保存安定なプレガバリン製剤の処方であることがわかった。 From these facts, the prototype tablet having the sample name: MP10S and the prototype tablet having a film coating applied thereto (specimen names: MP10-1, MP10-2, MP10-3, MP10-4) have a relative humidity of 40 ° C. and 75%. It was found that the pregabalin preparation which can maintain the tablet hardness, has good dissolution property, and is stable in storage when stored in.
1錠あたり7mgのHPCと1錠あたり60mgの還元麦芽糖水飴と1錠あたり75mgのプレガバリンを含有する混合物を流動層造粒し、乾燥した後に、1錠あたり7mgのデンプングリコール酸ナトリウムと1錠あたり2mgのステアリン酸カルシウムを添加して混合し、0.55tの打錠圧で打錠した素錠(検体名:MP11Sの試作錠剤)を有する試作錠剤(検体名:MP11S、MP11−1、MP11−2、MP11−4)は、すべて、40℃75%相対湿度中にシャーレ開放条件で7日間保存した後の経時的なラクタム体の増加は少量にとどまったが、前記の検体名:MP10S、MP10−1、MP10−2、MP10−3、MP10−4の試作錠剤よりは明らかに多かった。 A mixture containing 7 mg HPC per tablet, 60 mg reduced maltose starch syrup per tablet and 75 mg pregabalin per tablet was fluidized bed granulated, dried, and then 7 mg sodium starch glycolate per tablet and per tablet. Trial tablets (specimen names: MP11S, MP11-1, MP11-2) having uncoated tablets (specimen name: MP11S trial tablet) that were mixed by adding 2 mg of calcium stearate and tableted at a tableting pressure of 0.55 ton. , MP11-4) all had a small increase in lactams over time after being stored in a chalet open condition at 40 ° C. and 75% relative humidity for 7 days, but the above-mentioned sample names: MP10S, MP10- 1, MP10-2, MP10-3, MP10-4 were clearly more than the prototype tablets.
また、これらのうちで、検体名:MP11S、MP11−2、MP11−4の試作錠剤は、保存開始時点における、水に対する15分後の溶出割合が、夫々順に、77.0%、73.0%、79.0%であり、85%に満たない不十分な溶出性であった。 Among these, the prototype tablets having sample names: MP11S, MP11-2, and MP11-4 had elution ratios of 77.0% and 73.0 in order after 15 minutes with respect to water at the start of storage, respectively. The elution rate was 79.0%, which was less than 85%.
これらの検体名:MP11S、MP11−2、MP11−4の試作錠剤を、40℃75%相対湿度中にシャーレ開放条件で7日間保存した後の錠剤硬度は、夫々順に、30.0N、23.0N、23.0Nの錠剤硬度を有しており、いずれも許容可能な錠剤硬度であった。 The tablet hardnesses of the prototype tablets of these sample names: MP11S, MP11-2, and MP11-4 after being stored in a relative humidity of 40 ° C. and 75% for 7 days under the conditions of opening the chalet were 30.0 N and 23. It had a tablet hardness of 0N and 23.0N, both of which were acceptable tablet hardness.
以上の実験結果から、主薬顆粒中に多量の還元麦芽糖水飴を含む検体名:MP11S、MP11−1、MP11−2、MP11−4の試作錠剤の配合比は、打錠後の経時的なラクタム体の生成は少量にとどまり、十分な錠剤硬度を維持できるものの、溶出性の点で好ましくないことがわかった。 From the above experimental results, the compounding ratio of the prototype tablets containing a large amount of reduced maltose starch syrup in the main drug granules: MP11S, MP11-1, MP11-2, MP11-4 is the lactam compound over time after tableting. Although the production of starch syrup was limited to a small amount and sufficient tablet hardness could be maintained, it was found to be unfavorable in terms of elution.
また、HPCの添加量は1錠質量中の4.4%程度(1錠あたり4mg)である場合に錠剤硬度を維持することができ、デンプングリコール酸ナトリウムの添加量は1錠質量中の4.4%程度(1錠あたり4mg)である場合に良好な溶出性をもたらすことがわかった(検体名:MP10−1、MP10−2、MP10−3、MP10−4)。また、打錠後の経時的なラクタム体生成を抑制するためには、1錠質量中の7.7%程度(1錠あたり7mg)の還元麦芽糖水飴を含有すれば十分であること(検体名:MP10−1、MP10−2、MP10−3、MP10−4)、及び、1錠質量中40%程度(1錠あたり60mg)の還元麦芽糖水飴を含有すると、溶出性が悪化することがわかった(検体名:MP11S、MP11−1、MP11−2、MP11−4)。 Further, the tablet hardness can be maintained when the amount of HPC added is about 4.4% (4 mg per tablet) in the mass of one tablet, and the amount of sodium starch glycolate added is 4 in the mass of one tablet. It was found that good dissolution was obtained when the content was about 4% (4 mg per tablet) (specimen names: MP10-1, MP10-2, MP10-3, MP10-4). In addition, in order to suppress the production of lactams over time after tableting, it is sufficient to contain about 7.7% (7 mg per tablet) of reduced maltose starch syrup in the mass of one tablet (specimen name). : It was found that the dissolution property deteriorates when MP10-1, MP10-2, MP10-3, MP10-4) and about 40% (60 mg per tablet) of reduced maltose starch syrup are contained in the mass of one tablet. (Sample names: MP11S, MP11-1, MP11-2, MP11-4).
このように、検体名:MP10S、MP10−1、MP10−2、MP10−3、MP10−4の各試作錠剤と検体名:MP11S、MP11−1、MP11−2、MP11−4の試作錠剤の対比から、還元麦芽糖水飴を増量しても、打錠後の経時的なラクタム体の増加が抑制されることはなく、錠剤硬度の経時的な低下が抑制されることもなく、溶出性はむしろ低下することがわかった。 In this way, the comparison between the prototype tablets of the sample names: MP10S, MP10-1, MP10-2, MP10-3, and MP10-4 and the prototype tablets of the sample names: MP11S, MP11-1, MP11-2, and MP11-4. Therefore, even if the amount of reduced maltose starch syrup is increased, the increase in lactams over time after tableting is not suppressed, the decrease in tablet hardness over time is not suppressed, and the elution property is rather lowered. I found out that I would do it.
一方、主薬顆粒中の還元麦芽糖水飴の量が少ないMP10S、MP10−1、MP10−2、MP10−3、MP10−4の試作錠剤の配合比であれば、経時的ラクタム体の増加が極めて少なく、極めて良好な溶出性を有し、かつ、加速条件で保管した後も十分な錠剤硬度を有することがわかった。なお、錠剤硬度は、フィルムコーティングによって改善することがわかった。 On the other hand, if the amount of reduced maltose starch syrup in the main drug granules is small, and the compounding ratio of the trial tablets of MP10S, MP10-1, MP10-2, MP10-3, and MP10-4, the increase in lactam over time is extremely small. It was found that it had extremely good dissolution property and had sufficient tablet hardness even after storage under accelerated conditions. It was found that the tablet hardness was improved by film coating.
圧縮固形製剤の試作;
実施例1〜13の結果から、実施例13の検体名:MP10Sの試作錠剤を1錠あたり75mgのプレガバリンを含有する錠剤(以下、「75mg錠」という。)の処方として決定し、当該試作錠剤の各添加物の量を倍量にした錠剤を1錠あたり150mg(以下、「150mg錠」という。)のプレガバリンを含有する錠剤の仮最終処方(製造処方)として決定して、加速試験を実施した。なお、以下の製造処方には、実施例13に用いたのと同じ添加物を用いた。
Prototype of compressed solid preparation ;
From the results of Examples 1 to 13, the prototype tablet of the sample name: MP10S of Example 13 was determined as a prescription of a tablet containing 75 mg of pregabalin per tablet (hereinafter referred to as "75 mg tablet"), and the prototype tablet was determined. A tablet obtained by doubling the amount of each additive in the above is determined as a provisional final prescription (manufacturing prescription) of a tablet containing 150 mg (hereinafter referred to as "150 mg tablet") of pregabalin per tablet, and an accelerated test is carried out. bottom. The same additives used in Example 13 were used in the following production formulations.
75mg錠の実際の製造処方としては、5万錠スケールで2バッチ製造した。具体的には、プレガバリン原薬3750g及び還元麦芽糖水飴の粉末350gを秤量して流動層(FLO−5、フロイント産業)に投入し、予め造粒用に調製しておいた4質量%HPC水溶液5000gを毎分50グラムのスピードで、吸気温度80℃、排気温度30℃で、100分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。これを2回繰り返し、2バッチ分の乾燥、篩過後の造粒物にデンプングリコール酸ナトリウム400g及びステアリン酸カルシウム100gを添加して混合し、打錠機(HT−P18A、畑鐵工所)を用いて、1錠あたり91mgの質量で、打錠圧0.8tで打錠した。 As an actual production formula for 75 mg tablets, 2 batches were produced on a scale of 50,000 tablets. Specifically, 3750 g of pregavalin drug substance and 350 g of powder of reduced maltose starch syrup were weighed and put into a fluidized layer (FLO-5, Freund industry), and 5000 g of a 4 mass% HPC aqueous solution prepared in advance for granulation. Was granulated at a speed of 50 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. while spraying for 100 minutes. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. This was repeated twice, and 400 g of sodium starch glycolate and 100 g of calcium stearate were added to the granulated product after drying and sieving for 2 batches, mixed, and used with a tableting machine (HT-P18A, Hata Iron Works). The tablet was tableted with a mass of 91 mg per tablet and a tableting pressure of 0.8 t.
150mg錠の実際の製造処方としては、2.5万錠スケールで2バッチ製造した。具体的には、プレガバリン原薬3750g及び還元麦芽糖水飴の粉末350gを秤量して流動層(FLO−5、フロイント産業)に投入し、予め造粒用に調製しておいた4質量%HPC水溶液5000gを毎分50グラムのスピードで、吸気温度80℃、排気温度30℃で、100分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。これを2回繰り返し、2バッチ分の乾燥、篩過後の造粒物にデンプングリコール酸ナトリウム400g及びステアリン酸カルシウム100gを添加して混合し、打錠機(HT−P18A、畑鐵工所)を用いて、1錠あたり182mgの質量で、打錠圧0.8tで打錠した。 As an actual production prescription for 150 mg tablets, 2 batches were produced on a scale of 25,000 tablets. Specifically, 3750 g of pregavalin drug substance and 350 g of powder of reduced maltose starch syrup were weighed and put into a fluidized layer (FLO-5, Freund industry), and 5000 g of a 4 mass% HPC aqueous solution prepared in advance for granulation. Was granulated at a speed of 50 grams per minute at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. while spraying for 100 minutes. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. This was repeated twice, and 400 g of sodium starch glycolate and 100 g of calcium stearate were added to the granulated product after drying and sieving for 2 batches, mixed, and used with a tableting machine (HT-P18A, Hata Iron Works). The tablet was tableted with a mass of 182 mg per tablet and a tableting pressure of 0.8 t.
一方、1錠あたり25mgのプレガバリンを含有する錠剤(以下、「25mg錠」という。)の処方として、実施例13の検体名:MP10Sの試作錠剤の各添加物の量を単純に75mg錠の3分の1にしてしまうと、1錠あたりの質量が30.3mgしかなくなり、あまりに小さな錠剤になりすぎてしまうため、25mg錠の主薬顆粒については、添加するプレガバリン、HPC及び還元麦芽糖水飴の含量を単純に75mg錠の3分の1の量(1錠あたり、プレガバリン25mg、HPC1.3mg、還元麦芽糖水飴2.3mg)にする一方で、25mg錠の後添加物については、単純に3分の1の量とはせず、デンプングリコール酸ナトリウムについては3分の1の量である1錠あたり1.3mgよりも多い1錠あたり3mgとし、ステアリン酸カルシウムについては3分の1の量である1錠あたり0.3mgよりも多い1錠あたり0.7mgとするとともに、1錠あたり37.7mgの直打用D−マンニトールを後添加物として添加して製造した錠剤を25mg錠の仮最終処方として決定して、加速試験を実施した。 On the other hand, as a prescription of a tablet containing 25 mg of pregabalin per tablet (hereinafter referred to as "25 mg tablet"), the amount of each additive of the sample name: MP10S prototype tablet of Example 13 is simply 3 of 75 mg tablet. If it is reduced to 1/1, the mass per tablet will be only 30.3 mg, and the tablet will be too small. Therefore, for the main ingredient granules of 25 mg tablets, the content of pregabalin, HPC and reduced maltose water candy to be added Simply make it one-third the amount of 75 mg tablets (pregabalin 25 mg, HPC 1.3 mg, reduced maltose water candy 2.3 mg per tablet), while the post-additives of 25 mg tablets are simply one-third. For sodium starch glycolate, the amount is 3 mg per tablet, which is more than 1.3 mg per tablet, which is one-third, and for calcium stearate, one tablet is one-third. 0.7 mg per tablet, which is more than 0.3 mg per tablet, and tablets produced by adding 37.7 mg of D-mannitol for direct impact as a post-additive per tablet are determined as the provisional final formulation of 25 mg tablets. Then, an acceleration test was carried out.
25mg錠の実際の製造処方としては、10万錠スケールで製造し、プレガバリン原薬2500g及び還元麦芽糖水飴の粉末230gを秤量して流動層(FLO−5、フロイント産業)に投入し、予め造粒用に調製しておいた4質量%HPC水溶液3250gを毎分50グラムのスピードで、吸気温度80℃、排気温度30℃で、約65分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30のフィルターで篩過した。乾燥、篩過後の造粒物に直打用D−マンニトール3770g、デンプングリコール酸ナトリウム300g、及びステアリン酸カルシウム70gを添加して混合し、打錠機(HT−P18A、畑鐵工所)を用いて、1錠あたり70mgの質量で、打錠圧0.8tで打錠した。 As an actual production formula for 25 mg tablets, it is produced on a scale of 100,000 tablets, 2500 g of pregavalin drug substance and 230 g of powder of reduced maltose starch syrup are weighed and put into a fluidized layer (FLO-5, Freund industry), and granulated in advance. 3250 g of the 4 mass% HPC aqueous solution prepared for use was granulated at a speed of 50 g / min at an intake temperature of 80 ° C. and an exhaust temperature of 30 ° C. for about 65 minutes while spraying. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, it was sieved with a filter of mesh 30. 3770 g of D-mannitol for direct striking, 300 g of sodium starch glycolate, and 70 g of calcium stearate are added to the granulated product after drying and sieving, mixed, and used with a tableting machine (HT-P18A, Hata Iron Works). Each tablet was tableted with a mass of 70 mg and a tableting pressure of 0.8 t.
上記の25mg錠、75mg錠、及び150mg錠の仮最終処方について、これらを実製造スケールで製造し、詳細な確認を行った。 Regarding the provisional final prescriptions of the above 25 mg tablets, 75 mg tablets, and 150 mg tablets, these were manufactured on an actual production scale and detailed confirmation was performed.
具体的には、(1)造粒・乾燥工程での不具合の有無、(2)乾燥顆粒の粒度分布、(3)後添加後の混合均一性、(4)ステアリン酸カルシウム添加後の混合物(打錠用末)の嵩密度及び安息角、(5)打錠障害の有無、(6)各錠剤の質量のばらつき、(7)水に対する溶出性、(8)pH1.2の溶出試験液に対する溶出性、(9)pH4.0の溶出試験液に対する溶出性、(10)pH6.8の溶出試験液に対する溶出性、(11)錠剤硬度の経時的な変化、(12)ラクタム体量の経時的な変化、(13)苦みについて確認した。 Specifically, (1) presence or absence of defects in the granulation / drying process, (2) particle size distribution of dried granules, (3) mixing uniformity after addition, and (4) mixture after addition of calcium stearate (beating). Bulk density and rest angle of (tablet powder), (5) presence / absence of tableting disorder, (6) variation in mass of each tablet, (7) dissolution in water, (8) dissolution in pH 1.2 elution test solution Sex, (9) Elution to pH 4.0 elution test solution, (10) Elution to pH 6.8 elution test solution, (11) Changes in tablet hardness over time, (12) Lactam mass over time We confirmed the changes and (13) bitterness.
75mg錠の具体的な製造工程は下記のとおりであった。25mg錠と150mg錠の製造についても、添加物の量が異なる以外、製造工程は共通であった。 The specific manufacturing process of the 75 mg tablet was as follows. Regarding the production of the 25 mg tablet and the 150 mg tablet, the production process was the same except that the amount of the additive was different.
(1)主薬顆粒の製造
3750gのプレガバリン原薬の粉末と350gの還元麦芽糖水飴(アマルティMR100)を流動層造粒装置(FLO−5、フロイント産業)を用いて混合し、200gのHPCを4800gの水に溶解した液をスプレーしながら造粒した。造粒後、流動層造粒装置で乾燥し、約10gをサンプリングして、乾燥減量測定装置(MOC−120H、島津製作所製)を用いて乾燥減量を測定し、乾燥減量が1%以下となったことを確認した。これを2回繰り返した。
(1) Production of main drug granules 3750 g of Pregavalin drug substance powder and 350 g of reduced maltose starch syrup (Amarti MR100) were mixed using a fluidized bed granulator (FLO-5, Freund Sangyo), and 200 g of HPC was added to 4800 g. Granulation was performed while spraying a solution dissolved in water. After granulation, it is dried with a fluidized bed granulator, about 10 g is sampled, and the dry weight loss is measured using a dry weight loss measuring device (MOC-120H, manufactured by Shimadzu Corporation), and the dry weight loss is 1% or less. I confirmed that. This was repeated twice.
引き続きND−30Sの整粒器を使用し、直径0.5mmのスクリーンを用いて整粒して、これを主薬顆粒とし、約10gサンプリングして整粒後の主薬顆粒の粒度分布をマイクロトラックMT3000(マイクロトラック・ベル株式会社)を用いて乾式条件で測定した。 Subsequently, using an ND-30S granulator, sizing using a screen with a diameter of 0.5 mm, using this as the main ingredient granules, sampling about 10 g and measuring the particle size distribution of the main ingredient granules after sizing, Microtrack MT3000 Measurement was performed under dry conditions using (Microtrack Bell Co., Ltd.).
(2)後添加物の添加及び混合(打錠用末)
上記の工程(1)で製造した主薬顆粒の全量を流動層造粒装置から取出し、400gのデンプングリコール酸ナトリウムを添加して、V−20混合装置(徳寿工作所)を用いて10分間混合し、後添加混合物Aとした。 5か所から約10gずつサンプリングして混合均一性を確認した結果、混合均一性の平均値は97.5%〜102.5%に収まり、個々の錠剤の含量も95%〜105%の範囲内であることを確認した。
(2) Addition and mixing of post-additives (end for tableting)
The entire amount of the main drug granules produced in the above step (1) is taken out from the fluidized bed granulator, 400 g of sodium starch glycolate is added, and the mixture is mixed for 10 minutes using a V-20 mixing device (Tokuju Kosakusho). , The post-addition mixture A. As a result of confirming the mixing uniformity by sampling about 10 g from 5 places, the average value of the mixing uniformity was within 97.5% to 102.5%, and the content of each tablet was also in the range of 95% to 105%. It was confirmed that it was inside.
上記の後添加混合物Aにさらに100gのステアリン酸カルシウムを添加してV−20混合装置(徳寿工作所)を用いて混合して打錠用末とした。打錠用末から約60gサンプリングしてルーズ嵩密度及びタップ嵩密度を測定した。また、打錠用末から約500gサンプリングして安息角測定器で安息角を測定した。 Further, 100 g of calcium stearate was added to the above-mentioned post-addition mixture A and mixed using a V-20 mixing device (Tokuju Kosakusho) to prepare a powder for tableting. About 60 g of the powder for tableting was sampled to measure the loose bulk density and the tap bulk density. In addition, about 500 g was sampled from the powder for tableting and the angle of repose was measured with an angle of repose measuring device.
(3)打錠
打錠機(HT−P18A、畑鐵工所)に杵をセットして打錠圧0.8〜0.9tで打錠した。使用した杵は、25mg錠が直径6.0mmの両面とも割線のない円形杵、75mg錠が直径6.5mmの両面とも割線のない円形杵、150mg錠が直径8.0mmの上杵にのみ割線を有する円形杵であった。
(3) Locking A pestle was set in a locking machine (HT-P18A, Hata Iron Works) and locked at a locking pressure of 0.8 to 0.9 t. The pestle used was a circular pestle with a diameter of 6.0 mm and no score line on both sides, a 75 mg tablet with a circular pestle with a diameter of 6.5 mm and no score line on both sides, and a 150 mg tablet with a score line only on the upper pestle with a diameter of 8.0 mm. It was a circular pestle with.
平均錠厚は、25mg錠が2.140mm、75mg錠が2.631mm、150mg錠が3.524mmであった。 The average tablet thickness was 2.140 mm for the 25 mg tablet, 2.631 mm for the 75 mg tablet, and 3.524 mm for the 150 mg tablet.
リリカカプセルの大きさは、25mgカプセルが直径5.3mm長さ14.3mmの略円筒形、75mgカプセルが直径5.3mm長さ14.3mmの略円筒形、150mgカプセルが直径6.4mm長さ18.0mmの略円筒形であるから、カプセル剤よりも小さく、しかも、カプセルのようなゼラチン材質ではない素錠であるから、のどに付着しにいことは明らかであった。 The size of the Lyrica capsule is as follows: the 25 mg capsule is 5.3 mm in diameter and 14.3 mm in length, and the 75 mg capsule is 5.3 mm in diameter and 14.3 mm in length, and the 150 mg capsule is 6.4 mm in length. Since it has a substantially cylindrical shape of 18.0 mm, it is smaller than a capsule, and since it is an uncoated tablet that is not made of gelatin like a capsule, it is clear that it does not easily adhere to the throat.
(4)包装
包装形態としては、PTP包装品とバラ包装品を作製した。PTP包装品については、各錠剤を、厚み0.2mmのポリ塩化ビニルフィルムとアルミニウム箔を用いてPTPシートとし、紙箱に入れた。バラ包装品については、各錠剤を直接ポリエチレン製容器に入れて装栓し、紙袋に入れた。
(4) Packaging As the packaging form, PTP packaging products and loose packaging products were produced. For PTP packages, each tablet was made into a PTP sheet using a polyvinyl chloride film having a thickness of 0.2 mm and aluminum foil, and placed in a paper box. For loosely packaged products, each tablet was placed directly in a polyethylene container, capped, and placed in a paper bag.
150mg錠については、上記の(1)〜(4)の工程における各添加物の添加量を表14Aに記載のとおりに変更した。
25mg錠については、上記の(1)〜(4)の工程における各添加物の添加量を表14Aに記載のとおりに変更し、後添加混合物Aの製造に際して、300gのデンプングリコール酸ナトリウムに加えて3770gの直打用D−マンニトールを添加した。
また、25mg錠については、上記の後添加混合物Aにさらに70gのステアリン酸カルシウムを添加してV−20混合装置(徳寿工作所)を用いて混合して打錠用末とした。
The 150mg tablet, and the amount of each additive in the process of the above (1) to (4) were changed as described in Table 14 A.
The 25mg tablets, the amount of each additive in the steps of (1) - (4) were changed as described in Table 14 A, the production of the post-addition mixture A, the sodium starch glycolate 300g In addition, 3770 g of D-mannitol for direct hitting was added.
For the 25 mg tablet, 70 g of calcium stearate was further added to the above-mentioned post-addition mixture A and mixed using a V-20 mixing device (Tokuju Kosakusho) to prepare a powder for tableting.
プレガバリンのフリー体の原薬は、不純物0.1%、D10が12.6μm、D50が64.8μm、D90が218.3μmの粒度の原薬を用いた。 As the drug substance of the free form of pregabalin, the drug substance having a particle size of 0.1% impurities, 12.6 μm for D10, 64.8 μm for D50, and 218.3 μm for D90 was used.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−L(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、直打用D−マンニトール〔パーテックM100(商標)、Merck Millipore Corporation〕、デンプングリコール酸ナトリウム〔プリモジェル(商標)、松谷化学工業〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、であった。 The additives used were hydroxypropyl cellulose [HPC-L (trademark) normal particle type, Nippon Soda Co., Ltd.], reduced maltose starch syrup [Amalti MR100 (trademark), Mitsubishi Shoji Food Tech Co., Ltd.], and D-mannitol for direct hitting. [Partec M100 ™, Merck Millipore Corporation], sodium starch glycolate [Primogel ™, Matsutani Chemical Industry], calcium stearate [Taipei Chemical Industry Co., Ltd.].
(1)造粒・乾燥工程での不具合の有無
造粒・乾燥工程において、紛体の流動を良好に維持でき、錠剤中の主薬含量に影響を及ぼすプレガバリンのロスは認められなかった。
(1) Presence or absence of defects in the granulation / drying process In the granulation / drying process, the flow of the powder could be maintained well, and no loss of pregabalin, which affects the content of the active ingredient in the tablets, was observed.
(2)整粒後の乾燥顆粒の粒度分布
整粒後の乾燥顆粒の粒度分布は、約200μmにシャープなピークを有する良好な粒度分布が得られた。
(2) Particle size distribution of dried granules after sizing As for the particle size distribution of dried granules after sizing, a good particle size distribution with a sharp peak at about 200 μm was obtained.
(3)後添加物後の混合均一性
25mg錠、75mg錠、150mg錠のいずれについても、後添加混合物Aの混合均一性の平均値は97.5%〜102.5%に収まり、個々の錠剤の含量も95%〜105%の範囲内であることを確認した。
(3) Mixing uniformity after the post-additive For all of the 25 mg tablets, 75 mg tablets, and 150 mg tablets, the average value of the mixing homogeneity of the post-additive mixture A was within 97.5% to 102.5%, and each of them. It was confirmed that the content of the tablets was also in the range of 95% to 105%.
(4)打錠用末の嵩密度及び安息角
25mg錠、75mg錠、150mg錠の打錠用末のルーズ嵩密度は、それぞれ順に、0.56g/mL、0.42g/mL、0.45g/mLであった。
25mg錠、75mg錠、150mg錠の打錠用末のタップ嵩密度は、それぞれ順に、0.62g/mL、0.49g/mL、0.55g/mLであった。
25mg錠、75mg錠、150mg錠の打錠用末の安息角は、それぞれ順に、37°、37°、39°であった。
(4) Bulk density and angle of repose of the powder for tableting The loose bulk density of the powder for tableting of 25 mg tablets, 75 mg tablets, and 150 mg tablets are 0.56 g / mL, 0.42 g / mL, and 0.45 g, respectively. It was / mL.
The tap bulk densities of the 25 mg tablet, 75 mg tablet, and 150 mg tablet at the end of the lock were 0.62 g / mL, 0.49 g / mL, and 0.55 g / mL, respectively.
The angles of repose at the end of the 25 mg tablet, 75 mg tablet, and 150 mg tablet for tableting were 37 °, 37 °, and 39 °, respectively.
(5)打錠障害の有無
25mg錠は、10万錠打錠して、キャッピングは0錠、スティッキングは0錠、ラミネーションは0錠であった。
75mg錠は、10万錠打錠して、キャッピングは0錠、スティッキングはほぼ全錠数、ラミネーションは0錠であった。但し、75mg錠のスティッキングは、表面を窒化クロムコートした杵を用いることで完全に防止できることを確認した。
150mg錠は、5万錠打錠して、キャッピングは0錠、スティッキングは2錠、ラミネーションは0錠であった。
(5) Presence or absence of tableting disorder The 25 mg tablet was 100,000 tablets, capping was 0 tablets, sticking was 0 tablets, and lamination was 0 tablets.
The 75 mg tablets were 100,000 tablets, capping was 0 tablets, sticking was almost the total number of tablets, and lamination was 0 tablets. However, it was confirmed that sticking of the 75 mg tablet can be completely prevented by using a pestle whose surface is coated with chromium nitride.
The 150 mg tablets were 50,000 tablets, 0 tablets for capping, 2 tablets for sticking, and 0 tablets for lamination.
(6)各錠剤の質量のばらつき
粉流れは良好であり、25mg錠、75mg錠、150mg錠のいずれについても、各錠剤の質量のばらつきは、変動係数2%以内であり、ばらつきは認められなかった。
(6) Variation in mass of each tablet The powder flow was good, and the variation in mass of each tablet was within 2% of the coefficient of variation for all of the 25 mg, 75 mg, and 150 mg tablets, and no variation was observed. rice field.
(7)水に対する溶出性
水に対する溶出性は良好であり、25mg錠、75mg錠、150mg錠のいずれについても、保存開始時、40℃75%相対湿度で1箇月保存後、3箇月保存後、6箇月保存後の各時点において、15分後に85%以上溶出していた(表14B参照)。
(7) Elution to water The elution to water is good, and all of the 25 mg, 75 mg, and 150 mg tablets are stored at 40 ° C. and 75% relative humidity for 1 month and then for 3 months at the start of storage. At each time point after storage for 6 months, 85% or more was eluted after 15 minutes ( see Table 14B ).
実施例14の最終処方の保存開始時、40℃75%相対湿度で1箇月保存後、40℃75%相対湿度で3箇月保存後、40℃75%相対湿度で6箇月保存後の、ラクタム体(%)、溶出試験結果(%)、及び錠剤硬度(N)。
(ラクタム体の定量は1回の試験結果である。溶出試験は18ベッセルの試験結果(パドル法50r.p.m、水、15分時点)である。錠剤硬度は10錠の試験結果である。)
At the start of storage of the final formulation of Example 14, the lactam body was stored at 40 ° C. and 75% relative humidity for 1 month, then stored at 40 ° C. and 75% relative humidity for 3 months, and then stored at 40 ° C. and 75% relative humidity for 6 months. (%), Dissolution test result (%), and tablet hardness (N).
(The quantification of lactam is the result of one test. The dissolution test is the test result of 18 Vessel (
(8)pH1.2の溶出試験液に対する溶出性
pH1.2の溶出試験液に対する溶出性は良好であり、25mg錠、75mg錠、150mg錠のいずれについても、15分後に85%以上溶出していた。
(8) Elution to pH 1.2 elution test solution The elution property to pH 1.2 elution test solution is good, and 85% or more of all 25 mg tablets, 75 mg tablets, and 150 mg tablets are eluted after 15 minutes. rice field.
(9)pH4.0の溶出試験液に対する溶出性
pH4.0の溶出試験液に対する溶出性は良好であり、25mg錠、75mg錠、150mg錠のいずれについても、15分後に85%以上溶出していた。
(9) Elution to pH 4.0 elution test solution The elution property to pH 4.0 elution test solution is good, and 85% or more of all 25 mg tablets, 75 mg tablets, and 150 mg tablets are eluted after 15 minutes. rice field.
(10)pH6.8の溶出試験液に対する溶出性
pH4.0の溶出試験液に対する溶出性は良好であり、25mg錠、75mg錠、150mg錠のいずれについても、15分後に85%以上溶出していた。
(10) Elution to pH 6.8 elution test solution Elution to pH 4.0 elution test solution is good, and 85% or more of all 25 mg tablets, 75 mg tablets, and 150 mg tablets are eluted after 15 minutes. rice field.
(11)錠剤硬度の経時的な変化
錠剤硬度は良好であり、打錠直後の錠剤硬度の平均値は、25mg錠が64.9N、75mg錠が64.4N、150mg錠が70.0Nであった(表14B参照)。
(11) Changes in tablet hardness over time The tablet hardness is good, and the average tablet hardness immediately after tableting is 64.9 N for 25 mg tablets, 64.4 N for 75 mg tablets, and 70.0 N for 150 mg tablets. ( See Table 14B ).
40℃75%相対湿度中にPTPシートで1箇月間保存した後の錠剤硬度も良好であり、錠剤硬度の平均値は、25mg錠が30.0N、75mg錠が34.6N、150mg錠が44.6Nであった(表14B参照)。
The tablet hardness after being stored in a PTP sheet at 40 ° C. and 75% relative humidity for one month is also good, and the average tablet hardness is 30.0 N for 25 mg tablets, 34.6 N for 75 mg tablets, and 44 for 150 mg tablets. It was .6N ( see Table 14B ).
40℃75%相対湿度中にPTPシートで3箇月間保存した後の錠剤硬度も良好であり、錠剤硬度の平均値は、25mg錠が34.2N、75mg錠が39.4N、150mg錠が47.5Nであった(表14B参照)。
The tablet hardness after storage in a PTP sheet at 40 ° C. and 75% relative humidity for 3 months is also good, and the average tablet hardness is 34.2N for 25mg tablets, 39.4N for 75mg tablets, and 47 for 150mg tablets. It was .5N ( see Table 14B ).
40℃75%相対湿度中にPTPシートで6箇月間保存した後の錠剤硬度も良好であり、錠剤硬度の平均値は、25mg錠が26.6N、75mg錠が26.6N、150mg錠が44.3Nであった(表14B参照)。
The tablet hardness after storage in a PTP sheet at 40 ° C. and 75% relative humidity for 6 months is also good, and the average tablet hardness is 26.6N for 25mg tablets, 26.6N for 75mg tablets, and 44 for 150mg tablets. It was .3N ( see Table 14B ).
(12)ラクタム体量の経時的な変化
保存安定性も良好であり、40℃75%相対湿度中にポリ塩化ビニルフィルムとアルミニウム箔でできたPTPシートで包装して保存したときの保存開始時のラクタム体の量の平均値は、25mg錠が0.007%、75mg錠が0.005%、150mg錠が0.005%であったのに対して、保存1箇月後のラクタム体の量は、25mg錠が0.018%、75mg錠が0.011%、150mg錠が0.010%であった(表14B参照)。
(12) Changes in lactam mass over time
The storage stability is also good, and the average value of the amount of lactam at the start of storage when wrapped in a PTP sheet made of polyvinyl chloride film and aluminum foil in a relative humidity of 40 ° C. and 75% is 25 mg. The tablets were 0.007%, 75 mg tablets were 0.005%, and 150 mg tablets were 0.005%, whereas the amount of lactam after 1 month of storage was 0.018% and 75 mg for 25 mg tablets. The tablets were 0.011% and the 150 mg tablets were 0.010% ( see Table 14B ).
同様に、40℃75%相対湿度中にポリ塩化ビニルフィルムとアルミニウム箔でできたPTPシートで包装して3箇月間保存した後のラクタム体の量の平均値は、25mg錠が0.036%、75mg錠が0.022%、150mg錠が0.021%であった(表14B参照)。
Similarly, the average amount of lactams after packaging in a PTP sheet made of polyvinyl chloride film and aluminum foil at 40 ° C. and 75% relative humidity and storing for 3 months is 0.036% for 25 mg tablets. , 75 mg tablets were 0.022% and 150 mg tablets were 0.021% ( see Table 14B ).
同様に、40℃75%相対湿度中にポリ塩化ビニルフィルムとアルミニウム箔でできたPTPシートで包装して6箇月間保存した後のラクタム体の量の平均値は、25mg錠が0.059%、75mg錠が0.036%、150mg錠が0.027%であった。 Similarly, the average amount of lactams after packaging in a PTP sheet made of polyvinyl chloride film and aluminum foil at 40 ° C. and 75% relative humidity and storing for 6 months is 0.059% for 25 mg tablets. , 75 mg tablets were 0.036%, and 150 mg tablets were 0.027%.
(13)苦味マスキング
プレガバリン原薬150mg及びプレガバリン150mg錠の夫々について、10人の健常ボランティアによる苦み評価試験を行った。150mg錠を選定した理由は、プレガバリン錠の規格において最も原薬の含有量が多く、苦味の評価としてワーストケースを想定できると考えられたためである。
(13) Bitterness masking
A bitterness evaluation test was conducted by 10 healthy volunteers for each of the pregabalin drug substance 150 mg and pregabalin 150 mg tablets. The reason for selecting the 150 mg tablet is that the content of the drug substance is the highest in the pregabalin tablet standard, and it is considered that the worst case can be assumed as an evaluation of bitterness.
10人の健常ボランティアは、以下の評価手順に従って苦みを評価した。
(1) 口中を水でよくすすぐ。
(2) プレガバリン原薬150mg全量を口に含む。
(3) プレガバリン原薬150mgを5秒間口に含んだ時の苦味を評価する(今回は、原薬の苦味を5段階中の5として評価)。
(4) 口中を水でよくすすぐ(プレガバリン原薬の後味がなくなるまですすぐ)。
(5) プレガバリン錠150mg 1錠を口に含む。
(6) プレガバリン錠150mg 1錠を5秒間口に含んだ時の苦味を評価する(原薬の苦味を5段階中の5としたとき、相対的な苦味を評価)。
Ten healthy volunteers evaluated their bitterness according to the following evaluation procedure.
(1) Rinse the mouth thoroughly with water.
(2) The total amount of pregabalin drug substance 150 mg is contained in the mouth.
(3) Evaluate the bitterness when 150 mg of pregabalin drug substance is contained in the mouth for 5 seconds (this time, the bitterness of the drug substance is evaluated as 5 out of 5).
(4) Rinse the mouth thoroughly with water (rinse until the aftertaste of the pregabalin drug substance disappears).
(5) Contains 1 pregabalin tablet 150 mg in the mouth.
(6) Evaluate the bitterness when one pregabalin tablet 150 mg is taken in the mouth for 5 seconds (when the bitterness of the drug substance is set to 5 out of 5 levels, the relative bitterness is evaluated).
苦みの評価は、以下の5段階で行った。
1 : 苦味が無い
2 : 苦味をやや弱く感じる
3 : 苦味を感じる
4 : 苦味をやや強く感じる
5 : 苦味を強く感じる
The bitterness was evaluated in the following five stages.
1: No bitterness 2: Slightly weak bitterness 3: Feeling bitterness 4: Slightly strong bitterness 5: Strongly bitterness
その結果、プレガバリン錠150mgの苦味は、プレガバリン原薬と比較して顕著に苦味が抑制されていた(表14C)。一方、プレガバリン原薬については、原薬の細かさに起因して口中への苦味の広がり、または後味の不快さが顕著であった(表14C)。
苦みが抑制された理由としては、プレガバリン錠とすることで、プレガバリン原薬が、HPC、還元麦芽糖水飴、及びデンプングリコール酸ナトリウムに覆われることによって苦味を感じにくくなったためと考えられた。
As a result, the bitterness of 150 mg of pregabalin tablets was significantly suppressed as compared with the pregabalin drug substance (Table 14C ). On the other hand, with regard to the pregabalin drug substance, the spread of bitterness in the mouth or the discomfort of the aftertaste was remarkable due to the fineness of the drug substance (Table 14C ).
It is considered that the reason why the bitterness was suppressed was that the pregabalin drug substance was covered with HPC, reduced maltose starch syrup, and sodium starch glycolate, so that the bitterness was less likely to be felt.
苦み感応試験
Bitter sensitivity test
以上の実験結果から、表14Aに記載の25mg錠、75mg錠、150mg錠は、いずれも、3年間の使用期限までの期間を通じてラクタム体の生成を1.0%以下に保つことができ、3年間の使用期限までの期間を通じて十分な硬度を保つことができ、3年間の使用期限までの期間を通じて十分な溶出性を有し、キャッピング、スティッキング、ラミネーションなどの打錠障害が生じず、粉流れも良く、ロスなく歩留まり良く安定的に製造することができ、各錠剤の質量のバラつきもなく、良好な含量均一性を有することがわかった。
From the above experimental results, 25 mg tablet according to Table 14 A, 75 mg tablets, 150 mg tablets, either, it is possible to maintain the production of lactams below 1.0% throughout the period until the expiration date of three years, Sufficient hardness can be maintained throughout the period up to the expiration date of 3 years, sufficient elution is provided throughout the period up to the expiration date of 3 years, no tableting problems such as capping, sticking and lamination occur, and powder It was found that the flow was good, the yield was good without loss, stable production was possible, there was no variation in the mass of each tablet, and the content had good uniformity.
しかも、表14Aに記載の25mg錠、75mg錠、150mg錠は、いずれも、分割したり、解砕したりして、非圧縮状態にした後でもラクタム体の生成を1.0%以下に保つことができることが確認できた。
Moreover, Table 14 25 mg tablet according to A, 75 mg tablets, 150 mg tablets are both or split, or by crushing, the generation of any lactam body after the uncompressed state below 1.0% It was confirmed that it could be kept.
また、表14Aに記載の25mg錠、75mg錠、150mg錠は、カプセル剤よりも小さく、しかも、のどに付着しにくく、フィルムコーティングすることができ、割線を入れることで分割も可能であった。
Further, 25 mg tablet according to Table 14 A, 75 mg tablets, 150 mg tablets, smaller than capsules, moreover, difficult to adhere to the throat, can be film-coated, were divided possible by putting secant ..
さらに、表14Aに記載の25mg錠、75mg錠、150mg錠は、十分に苦みを抑制できていることが確認できた。 Further, 25 mg tablet according to Table 14 A, 75 mg tablets, 150 mg tablets, were confirmed to have sufficiently suppressed bitterness.
口腔内崩壊性の固形製剤の試作
(ステアリン酸カルシウムによる主薬核顆粒の乾式被覆の効果);
実施例15では、γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩と、ヒドロキシプロピル置換セルロース以外のセルロース系添加物とが接触しないようにするための手段として、主薬顆粒をステアリン酸カルシウムの粉末と混合することにより、主薬顆粒の表面をステアリン酸カルシウムで被覆して主薬の溶出を遅らせ、それによって口腔内で崩壊した後に口の中に苦味が広がるのを抑えられないか試みた。
Prototype of orally disintegrating solid preparation
(Effect of dry coating of main drug nucleus granules with calcium stearate) ;
In Example 15, the main ingredient granules are steered as a means to prevent contact between a compound having a γ-aminobutyric acid structure and a pharmaceutically acceptable salt thereof and a cellulosic additive other than hydroxypropyl-substituted cellulose. By mixing with a powder of calcium phosphate, the surface of the main drug granules was coated with calcium stearate to delay the elution of the main drug, thereby trying to prevent the bitterness from spreading in the mouth after disintegrating in the oral cavity.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−SL(商標)通常粒子タイプ、ヒドロキシプロピルセルロース〔HPC−SSL(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、サッカリンナトリウム水和物〔A−2、大和化成株式会社〕、オイドラギットEで〔EVONIK社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、D−マンニトール〔ペアリトール200SD(商標)、Roquette社〕、軽質無水ケイ酸〔アドソリダー101(商標)、フロイント産業株式会社〕、クロスポビドン(コリドンCL−F、BASF社)、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、グレープフルーツオイル〔三栄源エフ・エフ・アイ株式会社〕、スクラロース〔三栄源エフ・エフ・アイ株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-SL (trademark) ordinary particle type, hydroxypropyl cellulose [HPC-SSL (trademark) ordinary particle type, Nippon Soda Co., Ltd.], reduced malt sugar syrup [Amarti MR100 (trademark),). Mitsubishi Corporation Food Tech Co., Ltd.], Calcium stearate [Taipei Chemical Industry Co., Ltd.], Saccharin sodium hydrate [A-2, Yamato Kasei Co., Ltd.], Eudragit E [EVONIK], D-mannitol [Mannitol P (trademark) ), Mitsubishi Corporation Food Tech Co., Ltd.], D-mannitol [Pearitol 200SD ™, Roquette], Light anhydrous silicic acid [Adsolider 101 ™, Freund Sangyo Co., Ltd.], Crospovidone (Corridon CL-F, BASF) , Crystalline cellulose [Theoras KG-802 (trade), Asahi Kasei Co., Ltd.], Grapefruit oil [Saneigen FFI Co., Ltd.], Sclarose [Saneigen FFI Co., Ltd.].
表15に従って5000錠分の量の主薬及び添加剤を用いて75mgのプレガバリンを含有する試作錠剤を作製した。製造方法の概略は、プレガバリンを含有する主薬顆粒、口腔内崩壊性を付与するための賦形顆粒、及び後添加物を混合して、1錠重量が190mgとなるように打錠した。 Prototype tablets containing 75 mg of pregabalin were prepared using 5000 tablets of the active ingredient and additives according to Table 15. The outline of the production method was that pregabalin-containing main ingredient granules, shaped granules for imparting orally disintegrating properties, and post-additives were mixed and tableted so that the weight of one tablet was 190 mg.
主薬顆粒の製造は、以下に述べるように、第1工程でプレガバリンを含有する主薬核顆粒1を造粒し、第2工程で核顆粒をステアリン酸カルシウムと混合して主薬核顆粒2を製造し、第3工程で流動層造粒・乾燥・微粒子コーティング装置を用いて、核顆粒2に対してコート液1によるコーティングを行って主薬コート顆粒1を作製し、第4工程で流動層造粒・乾燥・微粒子コーティング装置を用いて、コート顆粒1に対してコート液2によるコーティングを行って主薬顆粒(主薬コート顆粒2)を作製した。
In the production of the main ingredient granules, as described below, the main ingredient
ステアリン酸カルシウムによる主薬核顆粒の乾式被覆の効果を検証するために、第2工程において、主薬顆粒と乾式混合するステアリン酸カルシウムの粉末の量を、1錠あたり7.5mg(試作錠剤S−1)、1錠あたり0mg(試作錠剤S−2)、1錠あたり2.5mg(試作錠剤S−3)として、3種類の試作錠剤を作製した。 In order to verify the effect of dry coating of the main drug nucleus granules with calcium stearate, in the second step, the amount of calcium stearate powder to be dry-mixed with the main drug granules was 7.5 mg per tablet (prototype tablet S-1). Three types of prototype tablets were prepared at 0 mg per tablet (prototype tablet S-2) and 2.5 mg per tablet (prototype tablet S-3).
第1工程では、ヒドロキシプロピルセルロース(HPC−SL)37.5g(1錠処方7.5mg)、及びサッカリンナトリウム水和物(A−2)7.5g(1錠処方1.5mg)を秤取し、337.5g(1錠処方67.5mg)の精製水に溶解して主薬顆粒造粒液を作成した。別途、プレガバリン375g(1錠処方75mg)、粉末還元麦芽糖水飴(アマルティMR100)18.75g(1錠処方3.75mg)、ステアリン酸カルシウム7.5g(1錠処方1.5mg)を混合し、流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた主薬顆粒造粒液382.5gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約35分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して主薬核顆粒1を作製した。
In the first step, 37.5 g of hydroxypropyl cellulose (HPC-SL) (1 tablet formulation 7.5 mg) and 7.5 g of saccharin sodium hydrate (A-2) (1 tablet formulation 1.5 mg) were weighed. , 337.5 g (1 tablet formulation 67.5 mg) of purified water was dissolved to prepare a main drug granule granulation solution. Separately, 375 g of pregavalin (1 tablet formulation 75 mg), 18.75 g of powdered reduced maltose water candy (Amalti MR100) (1 tablet formulation 3.75 mg), and calcium stearate 7.5 g (1 tablet formulation 1.5 mg) are mixed to form a fluidized bed. 382.5 g of the main ingredient granulation liquid prepared for granulation in advance by putting it into a granulation / drying / coating device (FD-MP-01-SFP) at a speed of 12 grams per minute and an intake temperature of 80. Granulation was performed while spraying at ° C. and an exhaust temperature of 30 ° C. for about 35 minutes. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, the main
第2工程では、1錠処方0.75mgのステアリン酸カルシウムで主薬核顆粒1を乾式に被覆する試作錠剤S−1については、446.25g(1錠処方89.25mg)の乾燥・整粒後の主薬核顆粒1、及びステアリン酸カルシウム3.75g(1錠処方0.75mg)を秤取してポリ袋にて混合し、試作錠剤S−1用の主薬核顆粒2を製造し、「試作錠剤S−1用の主薬核顆粒2」とした。
In the second step, for the prototype tablet S-1 in which the main drug
なお、ステアリン酸カルシウムで主薬核顆粒1を乾式に被覆しない主薬核顆粒2と、標準の半分量のステアリン酸カルシウムで主薬核顆粒1を乾式に被覆した主薬核顆粒2を作製し、夫々、「試作錠剤S−2用の主薬核顆粒2」、「試作錠剤S−3用の主薬核顆粒2」とした。「試作錠剤S−2用の主薬核顆粒2」については、第2工程を行わない主薬核顆粒1をそのまま「試作錠剤S−2用の主薬核顆粒2」として用いた。「試作錠剤S−3用の主薬核顆粒2」については、446.25g(1錠処方89.25mg)の乾燥・整粒後の主薬核顆粒1、及びステアリン酸カルシウム1.25g(1錠処方0.25mg)を秤取してポリ袋にて混合し、試作錠剤S−3用の主薬核顆粒2を製造し、「試作錠剤S−3用の主薬核顆粒2」とした。
In addition, the main ingredient
第3工程では、無水エタノール840g(1錠処方168mg)と精製水105g(1錠処方21mg)を混合後に、アミノアルキルメタクリレートE(オイドラギットE)105g(1錠処方21mg)を溶解し、これにステアリン酸カルシウム9g(1錠処方1.8mg)を分散してコート液1を作製した。
In the third step, after mixing 840 g of absolute ethanol (168 mg of 1 tablet formulation) and 105 g of purified water (21 mg of 1 tablet formulation), 105 g of aminoalkyl methacrylate E (Eudragit E) (21 mg of 1 tablet formulation) is dissolved, and steer is added thereto. A
次に、試作錠剤S−1用の主薬コート顆粒1の作製のために450gの「試作錠剤S−1用の主薬核顆粒2」を秤取して流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた1059gのコート液1を毎分8グラムのスピードで、吸気温度60℃、排気温度30℃で、約135分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて60℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して「試作錠剤S−1用のコート顆粒1」を作製した。
Next, in order to prepare the main ingredient coated
「試作錠剤S−2用の主薬コート顆粒1」の作製は、「試作錠剤S−2用の主薬核顆粒2」を用いて、「試作錠剤S−1用の主薬コート顆粒1」の作製と同じ方法で作製した。
「試作錠剤S−3用の主薬コート顆粒1」の作製は、「試作錠剤S−3用の主薬核顆粒2」を用いて、「試作錠剤S−1用の主薬コート顆粒1」の作製と同じ方法で作製した。
The production of "main agent-coated
The production of "main agent-coated
第4工程では、精製水180g(1錠処方36mg)にD−マンニトール(マンニットP)45g(1錠処方9mg)を秤取して溶解してコート液2を作製した。
次に、試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)の作製のために564gの「試作錠剤S−1用のコート顆粒1」(1錠処方112.8mg)を秤取して流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた225g(1錠処方45mg)のコート液2を毎分6グラムのスピードで、吸気温度80℃、排気温度30℃で、約40分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ22(直径0.7mm)のスクリーンで篩過して試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)を作製した。
In the fourth step, 45 g (1 tablet formulation 9 mg) of D-mannitol (mannit P) was weighed and dissolved in 180 g of purified water (1 tablet formulation 36 mg) to prepare a
Next, 564 g of "Coated Granules for Trial Tablets S-1" (1 tablet formulation 112. 8 mg) was weighed and charged into a fluidized layer granulation / drying / coating device (FD-MP-01-SFP), and 225 g (1 tablet formulation 45 mg) of
「試作錠剤S−2用の主薬コート顆粒2(試作錠剤S−2用の主薬顆粒)」の作製は、「試作錠剤S−2用の主薬コート顆粒1」を用いて、「試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)」の作製と同じ方法で作製した。
「試作錠剤S−3用の主薬コート顆粒2(試作錠剤S−2用の主薬顆粒)」の作製は、「試作錠剤S−3用の主薬コート顆粒1」を用いて、「試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)」の作製と同じ方法で作製した。
"Main agent coated
"Main agent coated
賦形顆粒の製造は、まず、精製水304g(1錠処方7.6mg)にヒドロキシプロピルセルロース(HPC−SSL)16g(1錠処方0.4mg)を溶解して、賦形顆粒造粒液を作製した。次いで、D−マンニトール1168g(1錠処方29.2mg)、軽質無水ケイ酸44g(1錠処方1.1mg)、クロスポビドン292g(1錠処方7.3mg)をハイスピードミキサー(深江 パウテック アース テクニカ、FS−GS−10J)に投入し、予め造粒用に調製しておいた賦形顆粒造粒液320gを毎分320グラムのスピードで投入しながら撹拌造粒した。得られた造粒物を流動層造粒・乾燥・コーティング装置(フロイント産業、FLO−5)に投入し、80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して賦形顆粒を作製した。 To produce the excipient granules, first, 16 g (1 tablet formulation 0.4 mg) of hydroxypropyl cellulose (HPC-SSL) is dissolved in 304 g (1 tablet formulation 7.6 mg) of purified water to prepare an excipient granule granule. Made. Next, 1168 g of D-mannitol (1 tablet prescription 29.2 mg), 44 g of light anhydrous silicic acid (1 tablet prescription 1.1 mg), and crospovidone 292 g (1 tablet prescription 7.3 mg) were added to a high-speed mixer (Fukae Pautech EarthTechnica, Inc.). It was charged into FS-GS-10J), and 320 g of a shaped granulation granulating solution prepared in advance for granulation was added at a speed of 320 g / min for stirring and granulation. The obtained granulated product was put into a fluidized bed granulation / drying / coating device (Freund Sangyo, FLO-5) and dried at 80 ° C., and the obtained granulated product was used as a moisture meter (MOC-120H, Shimadzu Corporation). While measuring the water content using (manufactured by), the product was dried until the water content reached 1%. Then, the shaped granules were prepared by sieving with a screen of mesh 30 (diameter 0.5 mm).
その後、「試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)」609g(1錠処方121.8mg)、賦形顆粒190g(1錠処方38mg)、並びに、後添加物として結晶セルロース(セオラスKG−802)146.5g(1錠処方29.3mg)、グレープフルーツオイル0.45g(1錠処方0.09mg)、スクラロース0.9g(1錠処方0.18mg)及びステアリン酸カルシウム4.5g(1錠処方0.9mg)をポリ袋にて混合し、1錠あたり190mgを秤取して、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.5tで打錠して試作錠剤S−1を得た。
After that, 609 g (1 tablet prescription 121.8 mg) of "main agent coated
試作錠剤S−2については、「試作錠剤S−2用の主薬コート顆粒2(試作錠剤S−2用の主薬顆粒)」605.25g(1錠処方121.05mg)を用いたこと以外、試作錠剤S−1の作製と同じ方法で、試作錠剤S−2を作製した。
試作錠剤S−3については、「試作錠剤S−3用の主薬コート顆粒2(試作錠剤S−3用の主薬顆粒)」606.5g(1錠処方121.3mg)を用いたこと以外、試作錠剤S−1の作製と同じ方法で、試作錠剤S−3を作製した。
Regarding the prototype tablet S-2, a trial production was performed except that 605.25 g (1 tablet prescription 121.05 mg) of "main agent coated
Regarding the prototype tablet S-3, a trial production was performed except that 606.5 g (1 tablet prescription 121.3 mg) of "main agent coated
試作錠剤S−1、試作錠剤S−2、及び試作錠剤S−3の1錠あたりの組成は表15Aのとおりである。
主薬顆粒をステアリン酸カルシウムの粉末と混合することにより、主薬顆粒の表面をステアリン酸カルシウムで被覆して主薬の溶出を遅らせることができたかの検証のため、試作錠剤S−1、試作錠剤S−2、及び試作錠剤S−3の精製水に対する50rpmでの溶出率を0分(開始前)、1分、2分、3分、4分、5分、10分、15分で測定した。測定結果を図2に示す。図2において、夫々、「ステアリン酸Ca 0.75mg/錠」と記載されている試作錠剤が「試作錠剤S−1」であり、「ステアリン酸Caなし」と記載されている試作錠剤が「試作錠剤S−2」であり、「ステアリン酸Ca 0.25mg/錠」と記載されている試作錠剤が「試作錠剤S−3」である。 To verify whether the surface of the main ingredient granules could be coated with calcium stearate to delay the elution of the main ingredient by mixing the main ingredient granules with the powder of calcium stearate, the prototype tablets S-1, the prototype tablets S-2, and the prototype tablets S-2, and The elution rate of the prototype tablet S-3 with respect to purified water at 50 rpm was measured at 0 minutes (before the start), 1 minute, 2 minutes, 3 minutes, 4 minutes, 5 minutes, 10 minutes, and 15 minutes. The measurement results are shown in FIG. In FIG. 2, the prototype tablet described as "Ca 0.75 mg / tablet of stearate" is "prototype tablet S-1", and the prototype tablet described as "without Ca stearate" is "prototype". The prototype tablet described as "tablet S-2" and "Ca 0.25 mg / tablet of stearate" is "prototype tablet S-3".
図2からわかるとおり、プレガバリンを含有する主薬核顆粒をステアリン酸カルシウムで乾式被覆することにより、プレガバリンの溶出を遅らせることができた。ただし、15分後のプレガバリンの精製水に対する溶出率はほぼ100%であり、リリカ(商標)カプセル75mgと同様のプレガバリンの薬効が得られると考えられた。 As can be seen from FIG. 2, the elution of pregabalin could be delayed by dry-coating the main drug nucleus granules containing pregabalin with calcium stearate. However, the dissolution rate of pregabalin in purified water after 15 minutes was almost 100%, and it was considered that the same medicinal effect of pregabalin as 75 mg of Lyrica ™ capsules could be obtained.
リリカ(商標)カプセル75mgの内容物を錠剤化した製剤との溶出性の比較のために、リリカ(商標)カプセル75mgの内容物を打錠圧0.5tでそのまま打錠した試作錠剤(試作錠剤L13994)を作製した。
リリカ(商標)カプセル75mgの内容物を錠剤化した製剤の溶出率も合わせた検証結果を表15Bに示す。表15Bにおいて、夫々、「ステアリン酸Ca 0.75mg/錠」と記載されている試作錠剤が「試作錠剤S−1」であり、「ステアリン酸Caなし」と記載されている試作錠剤が「試作錠剤S−2」であり、「ステアリン酸Ca 0.25mg/錠」と記載されている試作錠剤が「試作錠剤S−3」であり、「先発製剤75mg錠」と記載されている試作錠剤が「リリカ(商標)カプセル75mgの内容物を錠剤化した製剤」である。
A prototype tablet (prototype tablet) in which the content of the Lyrica (trademark) capsule 75 mg was directly tableted at a tableting pressure of 0.5 t for comparison with the drug product in which the content of the Lyrica (trademark) capsule 75 mg was tableted. L13994) was produced.
Table 15B shows the verification results including the dissolution rate of the pharmaceutical product obtained by tableting the contents of 75 mg of Lyrica ™ capsules. In Table 15B, the prototype tablet described as "Ca 0.75 mg / tablet of stearate" is "prototype tablet S-1", and the prototype tablet described as "without Ca stearate" is "prototype". The prototype tablet described as "tablet S-2" and "Ca 0.25 mg / tablet of stearate" is "trial tablet S-3", and the prototype tablet described as "initiative product 75 mg tablet" is It is a "tablet formulation of the contents of 75 mg of Lyrica (trademark) capsules".
次に、プレガバリンを含有する主薬顆粒をステアリン酸カルシウムの粉末と混合することにより、主薬顆粒の表面をステアリン酸カルシウムで被覆して主薬の溶出を遅らせ、それによって口腔内で崩壊した後に口の中に苦味が広がるのを抑えられたか否かの検証のために、3人の被験者にダブルブラインドで、試作錠剤S−1、試作錠剤S−2、試作錠剤S−3、及び「リリカ(商標)カプセル75mgの内容物を錠剤化した製剤」の苦味の官能評価を行った。評価は、各試作錠剤を口腔内に1分間保持し、苦味を感じない場合に苦味0と評価し、苦味の程度に応じて、強く苦味を感じる場合に苦味5と評価し、その中間の苦味を苦味1(わずかに苦味を感じる)、苦味2(弱い苦味を感じる)、苦味3(中程度の苦味を感じる)、苦味4(やや強く苦味を感じる)とする6段階で評価した。結果を表15Cに示す。
Next, by mixing the main drug granules containing pregavalin with the powder of calcium stearate, the surface of the main drug granules is coated with calcium stearate to delay the elution of the main drug, thereby causing a bitter taste in the mouth after disintegrating in the oral cavity. In order to verify whether or not the spread was suppressed, three subjects were given double-blind trial tablets S-1, trial tablets S-2, trial tablets S-3, and "Lyrica ™ Capsules 75 mg." The sensory evaluation of the bitterness of "a tableted formulation of the contents of" was performed. In the evaluation, each prototype tablet was held in the oral cavity for 1 minute, and when no bitterness was felt, it was evaluated as 0 bitterness, and depending on the degree of bitterness, it was evaluated as
表15Cからわかるとおり、ステアリン酸カルシウムで乾式被覆していない試作錠剤S−2の苦味は平均4.67いうとても強い苦味であり、「リリカ(商標)カプセル75mgの内容物を錠剤化した製剤」とほぼ同程度の苦味であった。
これに対して、1錠あたり0.75mgのステアリン酸カルシウムで主薬核顆粒を乾式被覆した試作錠剤S−1の苦味は1.67というわずかな苦味にとどまった。
また、1錠あたり0.25mgのステアリン酸カルシウムで主薬核顆粒を乾式被覆した試作錠剤S−3の苦味は2.67であったことから、ステアリン酸カルシウムによる主薬核顆粒の苦味抑制効果は、乾式被覆に用いるステアリン酸カルシウムの量に依存することがわかった。1錠あたり0.75mgのステアリン酸カルシウムで乾式被覆した試作錠剤S−1の苦味が最も軽度であり、苦味1(わずかに苦味を感じる)〜苦味2(弱い苦味を感じる)程度の弱い苦味に抑制できた。
As can be seen from Table 15C, the bitterness of the prototype tablet S-2, which is not dry-coated with calcium stearate, is a very strong bitterness with an average of 4.67. The bitterness was about the same.
On the other hand, the bitterness of the prototype tablet S-1, which was dry-coated with 0.75 mg of calcium stearate per tablet, was only 1.67.
Further, since the bitterness of the prototype tablet S-3 in which the main drug nuclei granules were dry-coated with 0.25 mg of calcium stearate per tablet was 2.67, the bitterness-suppressing effect of the main drug nuclei granules by calcium stearate was dry-coated. It was found that it depends on the amount of calcium stearate used in. The prototype tablet S-1 dry-coated with 0.75 mg of calcium stearate per tablet has the mildest bitterness, and is suppressed to a weak bitterness of bitterness 1 (slightly bitter) to bitterness 2 (weak bitterness). did it.
以上の結果から、主薬核顆粒表面にステアリン酸カルシウムの疎水性被膜を形成させることで、口腔内で崩壊させている間に顆粒への唾液の浸潤を抑制することで、主成分の溶解を遅延させて苦味を感じにくくできたことがわかった。
From the above results, by forming a hydrophobic film of calcium stearate on the surface of the main drug nucleus granules, the infiltration of saliva into the granules is suppressed during the disintegration in the oral cavity, and the dissolution of the main component is delayed. It turned out that the bitterness was less likely to be felt.
口腔内崩壊性の固形製剤の試作
(D−マンニトールによる主薬核顆粒のコーティングによる口腔内崩壊性及びマウスフィールの改善効果);
実施例15の試作錠剤S−1では、γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩と、ヒドロキシプロピル置換セルロース以外のセルロース系添加物とが接触しないようにするための手段として、ステアリン酸カルシウムによる主薬核顆粒の乾式被覆に加えて、オイドラギットE及びステアリン酸カルシウムを含有するコート液1で被覆し、さらに、D−マンニトールを含有するコート液2で被覆した。
Prototype of orally disintegrating solid preparation
(Coating of the main drug nuclear granules with D-mannitol has the effect of improving oral disintegration and mouthfeel) ;
In the prototype tablet S-1 of Example 15, a means for preventing contact between a compound having a γ-aminobutyric acid structure and a pharmaceutically acceptable salt thereof and a cellulosic additive other than hydroxypropyl-substituted cellulose. In addition to the dry coating of the main drug nucleus granules with calcium stearate, the
オイドラギットEによる被覆は、γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩とヒドロキシプロピル置換セルロース以外のセルロース系添加物との接触を遮断する目的に加えて、プレガバリンの苦味をマスクするためである。
同様に、ステアリン酸カルシウムによる主薬核顆粒の乾式被覆は、γ−アミノ酪酸構造を有する化合物及び薬学的に許容可能なその塩とヒドロキシプロピル置換セルロース以外のセルロース系添加物との接触を遮断する目的、及び、プレガバリンの苦味をマスクする目的をさらに強化するためである。
Coating with Eudragit E masks the bitterness of pregabalin, in addition to the purpose of blocking contact between compounds having a γ-aminobutyric acid structure and their pharmaceutically acceptable salts with cellulosic additives other than hydroxypropyl-substituted cellulose. To do.
Similarly, dry coating of the active nucleus granules with calcium stearate is intended to block contact between compounds having a γ-aminobutyric acid structure and their pharmaceutically acceptable salts with cellulosic additives other than hydroxypropyl-substituted cellulose. And to further strengthen the purpose of masking the bitterness of pregabalin.
しかしながら、主薬核顆粒をステアリン酸カルシウムによる乾式被覆及びオイドラギットEによる湿式被覆を行っただけの主薬顆粒を用いた試作錠剤を作製したところ、口腔内での崩壊が遅くなり、口に含んだ時に「ザラザラ」「モタモタ」とした不快な口腔内の触感(マウスフィール)が生じることが判った。
そこで、試作錠剤S−1では、主薬核顆粒をステアリン酸カルシウムによる乾式被覆及びオイドラギットEによる湿式被覆を行うことに加えて、さらにその外側をD−マンニトールによって被覆している。
However, when a prototype tablet was prepared using the main ingredient granules, which was simply a dry coating of the main ingredient nuclear granules with calcium stearate and a wet coating with Eudragit E, the disintegration in the oral cavity was delayed, and when it was put in the mouth, it became "rough." It was found that an unpleasant oral tactile sensation (mouse feel) was generated.
Therefore, in the prototype tablet S-1, in addition to the dry coating with calcium stearate and the wet coating with Eudragit E, the main drug nucleus granules are further coated with D-mannitol on the outside.
そこで、実施例16では、主薬核顆粒をステアリン酸カルシウムによる乾式被覆及びオイドラギットEによる湿式被覆を行うことに加えて、さらにその外側をD−マンニトールによって被覆することによって、苦味抑制効果を失うことなく、口腔内崩壊性及び口腔内の触感(マウスフィール)を改善しうるか否かを確認した。 Therefore, in Example 16, in addition to dry-coating the main drug nuclear granules with calcium stearate and wet-coating with Eudragit E, the outside thereof is further coated with D-mannitol without losing the bitterness-suppressing effect. It was confirmed whether or not the disintegration property in the oral cavity and the tactile sensation in the oral cavity (mouse feel) could be improved.
用いた添加物は、ヒドロキシプロピルセルロース〔HPC−SL(商標)通常粒子タイプ、ヒドロキシプロピルセルロース〔HPC−SSL(商標)通常粒子タイプ、日本曹達株式会社〕、還元麦芽糖水飴〔アマルティMR100(商標)、三菱商事フードテック株式会社〕、ステアリン酸カルシウム〔太平化学産業株式会社〕、サッカリンナトリウム水和物〔A−2、大和化成株式会社〕、オイドラギットEで〔EVONIK社〕、D−マンニトール〔マンニットP(商標)、三菱商事フードテック株式会社〕、D−マンニトール〔ペアリトール200SD(商標)、Roquette社〕、軽質無水ケイ酸〔アドソリダー101(商標)、フロイント産業株式会社〕、クロスポビドン(コリドンCL−F、BASF社)、結晶セルロース〔セオラスKG−802(商標)、旭化成株式会社〕、グレープフルーツオイル〔三栄源エフ・エフ・アイ株式会社〕、スクラロース〔三栄源エフ・エフ・アイ株式会社〕であった。 The additives used were hydroxypropyl cellulose [HPC-SL (trademark) ordinary particle type, hydroxypropyl cellulose [HPC-SSL (trademark) ordinary particle type, Nippon Soda Co., Ltd.], reduced malt sugar syrup [Amarti MR100 (trademark),). Mitsubishi Corporation Food Tech Co., Ltd.], Calcium stearate [Taipei Chemical Industry Co., Ltd.], Saccharin sodium hydrate [A-2, Yamato Kasei Co., Ltd.], Eudragit E [EVONIK], D-mannitol [Mannitol P (trademark) ), Mitsubishi Corporation Food Tech Co., Ltd.], D-mannitol [Pearitol 200SD ™, Roquette], Light anhydrous silicic acid [Adsolider 101 ™, Freund Sangyo Co., Ltd.], Crospovidone (Corridon CL-F, BASF) , Crystalline cellulose [Theoras KG-802 (trade), Asahi Kasei Co., Ltd.], Grapefruit oil [Saneigen FFI Co., Ltd.], Sclarose [Saneigen FFI Co., Ltd.].
表16Aに従って5000錠分の量の主薬及び添加剤を用いて75mgのプレガバリンを含有する試作錠剤を作製した。製造方法の概略は、実施例15と同様に、試作錠剤S−1について、プレガバリンを含有する主薬顆粒、口腔内崩壊性を付与するための賦形顆粒、及び後添加物を混合して、1錠重量が190mgとなるように打錠した。 Prototype tablets containing 75 mg of pregabalin were prepared using 5000 tablets of the active ingredient and additives according to Table 16A. As for the outline of the production method, as in Example 15, the prototype tablet S-1 is mixed with pregabalin-containing main ingredient granules, shaped granules for imparting orally disintegrating properties, and post-additives, and 1 The tablets were tableted so that the tablet weight was 190 mg.
主薬顆粒の製造は、以下に述べるように、第1工程でプレガバリンを含有する主薬核顆粒1を造粒し、第2工程で核顆粒をステアリン酸カルシウムと混合して主薬核顆粒2を製造し、第3工程で流動層造粒・乾燥・微粒子コーティング装置を用いて、核顆粒2に対してコート液1によるコーティングを行って主薬コート顆粒1を作製し、第4工程で流動層造粒・乾燥・微粒子コーティング装置を用いて、コート顆粒1に対してコート液2によるコーティングを行って主薬顆粒(主薬コート顆粒2)を作製した。
In the production of the main ingredient granules, as described below, the main ingredient
D−マンニトールによる湿式被覆の効果を検証するために、第4工程において、主薬コート顆粒1に対して湿式被覆するD−マンニトールの量を、1錠あたり9mg(試作錠剤S−1)、1錠あたり0mg(試作錠剤T−1)、1錠あたり12mg(試作錠剤T−2)として、3種類の試作錠剤を作製した。
In order to verify the effect of wet coating with D-mannitol, in the fourth step, the amount of D-mannitol to be wet-coated with respect to the main drug-coated
第1工程は、実施例15と同じ方法で行った。
すなわち、第1工程では、ヒドロキシプロピルセルロース(HPC−SL)37.5g(1錠処方7.5mg)、及びサッカリンナトリウム水和物(A−2)7.5g(1錠処方1.5mg)を秤取し、337.5g(1錠処方67.5mg)の精製水に溶解して主薬顆粒造粒液を作成した。別途、プレガバリン375g(1錠処方75mg)、粉末還元麦芽糖水飴(アマルティMR100)18.75g(1錠処方3.75mg)、ステアリン酸カルシウム7.5g(1錠処方1.5mg)を混合し、流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた主薬顆粒造粒液382.5gを毎分12グラムのスピードで、吸気温度80℃、排気温度30℃で、約35分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して主薬核顆粒1を作製した。
The first step was carried out in the same manner as in Example 15.
That is, in the first step, 37.5 g of hydroxypropyl cellulose (HPC-SL) (1 tablet formulation 7.5 mg) and 7.5 g of saccharin sodium hydrate (A-2) (1 tablet formulation 1.5 mg) are weighed. It was taken and dissolved in 337.5 g (1 tablet formulation 67.5 mg) of purified water to prepare a main drug granule granulation solution. Separately, 375 g of pregavalin (1 tablet formulation 75 mg), 18.75 g of powdered reduced maltose water candy (Amalti MR100) (1 tablet formulation 3.75 mg), and calcium stearate 7.5 g (1 tablet formulation 1.5 mg) are mixed to form a fluidized bed. 382.5 g of the main ingredient granulation liquid prepared for granulation in advance by putting it into a granulation / drying / coating device (FD-MP-01-SFP) at a speed of 12 grams per minute and an intake temperature of 80. Granulation was performed while spraying at ° C. and an exhaust temperature of 30 ° C. for about 35 minutes. The obtained granulated product was dried as it was at 80 ° C. using a fluidized bed, and the obtained granulated product was measured for water content using a moisture meter (MOC-120H, manufactured by Shimadzu Corporation). It was dried to 1%. Then, the main
第2工程も実施例15の試作錠剤S−1の作製と同じ方法で行った。
すなわち、第2工程では、試作錠剤S−1、試作錠剤T−1、及び試作錠剤T−2ともに、1錠処方0.75mgのステアリン酸カルシウムで主薬核顆粒1を乾式に被覆するために、446.25g(1錠処方89.25mg)の乾燥・整粒後の主薬核顆粒1、及びステアリン酸カルシウム3.75g(1錠処方0.75mg)を秤取してポリ袋にて混合し、試作錠剤S−1、試作錠剤T−1、及び試作錠剤T−2に共通の主薬核顆粒2を製造した。
The second step was also carried out in the same manner as in the preparation of the prototype tablet S-1 of Example 15.
That is, in the second step, in order to dry-coat the main drug
第3工程は、実施例15と同じ方法で行った。
第3工程では、無水エタノール840g(1錠処方168mg)と精製水105g(1錠処方21mg)を混合後に、アミノアルキルメタクリレートE(オイドラギットE)105g(1錠処方21mg)を溶解し、これにステアリン酸カルシウム9g(1錠処方1.8mg)を分散してコート液1を作製した。
The third step was carried out in the same manner as in Example 15.
In the third step, after mixing 840 g of absolute ethanol (168 mg of 1 tablet formulation) and 105 g of purified water (21 mg of 1 tablet formulation), 105 g of aminoalkyl methacrylate E (Eudragit E) (21 mg of 1 tablet formulation) is dissolved, and steer is added thereto. A
次に、試作錠剤S−1、試作錠剤T−1、及び試作錠剤T−2ともに、450gの主薬核顆粒2を秤取して流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた1059gのコート液1を毎分8グラムのスピードで、吸気温度60℃、排気温度30℃で、約135分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて60℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して試作錠剤S−1、試作錠剤T−1、及び試作錠剤T−2に共通の「主薬コート顆粒1」を作製した。
Next, for each of the trial tablet S-1, the trial tablet T-1, and the trial tablet T-2, 450 g of the main
第4工程では、精製水180g(1錠処方36mg)にD−マンニトール(マンニットP)45g(1錠処方9mg)を秤取して溶解してコート液2を作製した。
次に、試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)の作製のために564gの主薬コート顆粒1(1錠処方112.8mg)を秤取して流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた225g(1錠処方45mg)のコート液2を毎分6グラムのスピードで、吸気温度80℃、排気温度30℃で、約40分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ22(直径0.7mm)のスクリーンで篩過して試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)を作製した。
In the fourth step, 45 g (1 tablet formulation 9 mg) of D-mannitol (mannit P) was weighed and dissolved in 180 g of purified water (1 tablet formulation 36 mg) to prepare a
Next, 564 g of the main ingredient coated granule 1 (1 tablet formulation 112.8 mg) was weighed and fluidized in order to prepare the main ingredient coated
試作錠剤T−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)は、主薬コート顆粒1をそのまま、試作錠剤T−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)として用いた。
The main ingredient coated
試作錠剤T−2用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)の作製のために564gの主薬コート顆粒1(1錠処方112.8mg)を秤取して流動層造粒・乾燥・コーティング装置(FD−MP−01−SFP)に投入し、予め造粒用に調製しておいた300g(1錠処方45mg)のコート液2を毎分6グラムのスピードで、吸気温度80℃、排気温度30℃で、約53分間にわたって噴霧しながら造粒した。得られた造粒物をそのまま流動層を用いて80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ22(直径0.7mm)のスクリーンで篩過して試作錠剤T−2用の主薬コート顆粒2(試作錠剤T−2用の主薬顆粒)を作製した。
In order to prepare the main ingredient coated
賦形顆粒の製造は、実施例15と同じ方法で行った。
すなわち、賦形顆粒の製造は、まず、精製水304g(1錠処方7.6mg)にヒドロキシプロピルセルロース(HPC−SSL)16g(1錠処方0.4mg)を溶解して、賦形顆粒造粒液を作製した。次いで、D−マンニトール1168g(1錠処方29.2mg)、軽質無水ケイ酸44g(1錠処方1.1mg)、クロスポビドン292g(1錠処方7.3mg)をハイスピードミキサー(深江 パウテック アース テクニカ、FS−GS−10J)に投入し、予め造粒用に調製しておいた賦形顆粒造粒液320gを毎分320グラムのスピードで投入しながら撹拌造粒した。得られた造粒物を流動層造粒・乾燥・コーティング装置(フロイント産業、FLO−5)に投入し、80℃で乾燥し、得られた造粒物を水分計(MOC−120H、島津製作所製)を用いて水分含量を測定しながら、水分含量が1%となるまで乾燥した。その後、メッシュ30(直径0.5mm)のスクリーンで篩過して賦形顆粒を作製した。
The shaped granules were produced in the same manner as in Example 15.
That is, in the production of the excipient granules, first, 16 g (1 tablet formulation 0.4 mg) of hydroxypropyl cellulose (HPC-SSL) is dissolved in 304 g of purified water (1 tablet formulation 7.6 mg) to granulate the excipient granules. A liquid was prepared. Next, 1168 g of D-mannitol (1 tablet prescription 29.2 mg), 44 g of light anhydrous silicic acid (1 tablet prescription 1.1 mg), and crospovidone 292 g (1 tablet prescription 7.3 mg) were added to a high-speed mixer (Fukae Pautech EarthTechnica, Inc.). It was charged into FS-GS-10J), and 320 g of a shaped granulation granulating solution prepared in advance for granulation was added at a speed of 320 g / min for stirring and granulation. The obtained granulated product was put into a fluidized bed granulation / drying / coating device (Freund Sangyo, FLO-5) and dried at 80 ° C., and the obtained granulated product was used as a moisture meter (MOC-120H, Shimadzu Corporation). While measuring the water content using (manufactured by), the product was dried until the water content reached 1%. Then, the shaped granules were prepared by sieving with a screen of mesh 30 (diameter 0.5 mm).
その後、「試作錠剤S−1用の主薬コート顆粒2(試作錠剤S−1用の主薬顆粒)」609g(1錠処方121.8mg)、賦形顆粒190g(1錠処方38mg)、並びに、後添加物として結晶セルロース(セオラスKG−802)146.5g(1錠処方29.3mg)、グレープフルーツオイル0.45g(1錠処方0.09mg)、スクラロース0.9g(1錠処方0.18mg)及びステアリン酸カルシウム4.5g(1錠処方0.9mg)をポリ袋にて混合し、1錠あたり190mgを秤取して、単発打錠機(AUTOTAB−500、市橋精機)を用いて打錠圧0.5tで打錠して試作錠剤S−1を得た。
After that, 609 g (1 tablet prescription 121.8 mg) of "main agent coated
試作錠剤S−2については、「試作錠剤S−2用の主薬コート顆粒2(試作錠剤S−2用の主薬顆粒)」564g(1錠処方112.8mg)を用いたこと以外、試作錠剤S−1の作製と同じ方法で、試作錠剤S−2を作製した。
試作錠剤S−3については、「試作錠剤S−3用の主薬コート顆粒2(試作錠剤S−3用の主薬顆粒)」624g(1錠処方124.8mg)を用いたこと以外、試作錠剤S−1の作製と同じ方法で、試作錠剤S−3を作製した。
Regarding the prototype tablet S-2, the prototype tablet S was used except that 564 g (1 tablet prescription 112.8 mg) of "main agent coated
Regarding the prototype tablet S-3, the prototype tablet S was used except that 624 g (1 tablet prescription 124.8 mg) of "main agent coated
試作錠剤S−1、試作錠剤T−1、及び試作錠剤T−2の1錠あたりの組成は表16Aのとおりである。
主薬核顆粒をステアリン酸カルシウムによる乾式被覆及びオイドラギットEによる湿式被覆を行うことに加えて、さらにその外側をD−マンニトールによって被覆することによって、苦味抑制効果を失うことなく、口腔内崩壊性及び不快な口腔内の触感(マウスフィール)を改善しうるか否かの確認は、<>・・の方法によって行った。
また、併せて、3人の被験者にダブルブラインドで苦味評価の官能試験を行った。評価は、各試作錠剤を口腔内に1分間保持し、苦味を感じない場合に苦味0と評価し、苦味の程度に応じて、強く苦味を感じる場合に苦味5と評価し、その中間の苦味を苦味1(わずかに苦味を感じる)、苦味2(弱い苦味を感じる)、苦味3(中程度の苦味を感じる)、苦味4(やや強く苦味を感じる)とする6段階で評価した。結果を表16Bに示す。 なお、表16B中の苦味の評価の値は、平均値を示している。
In addition to dry coating with calcium stearate and wet coating with Eudragit E, the main drug nucleus granules are further coated with D-mannitol on the outside, so that the effect of suppressing bitterness is not lost, and the oral disintegration and discomfort are achieved. Whether or not the tactile sensation (mouse feel) in the oral cavity could be improved was confirmed by the method of <> ....
In addition, a sensory test of bitterness evaluation was conducted on three subjects in a double-blind manner. In the evaluation, each prototype tablet was held in the oral cavity for 1 minute, and when no bitterness was felt, it was evaluated as 0 bitterness, and depending on the degree of bitterness, it was evaluated as
表16Bからわかるとおり、D−マンニトールによる主薬コーティング(2)を行わなかった試作錠剤T−1の口腔内崩壊時間は1分以上要したのに対して、1錠あたり9mgのD−マンニトールによる主薬コーティング(2)を行った試作錠剤S−1の口腔内崩壊時間は25秒であったので、D−マンニトールによる主薬コーティング(2)を行うことで、口腔内崩壊性を口腔内崩壊錠として十分な水準に改善できたことを確認できた。
これに対して、主薬コーティング(2)の量を1錠あたり12mgのD−マンニトールに増量した場合の口腔内崩壊時間は24秒であったことから、主薬コーティング(2)におけるD−マンニトールの量は1錠あたり9mgで十分であり、12mgに増量しても、口腔内崩壊性の改善はわずかであることがわかった。
口腔内崩壊性の改善とともに、口に含んだ時に「ザラザラ」「モタモタ」とした不快な口腔内の触感(マウスフィール)も低減したことを確認できた。
苦味の評価については、試作錠剤S−1と試作錠剤T−1ともに苦味2(弱い苦味を感じる)であったことから、主薬コーティング(2)の有無は、試作錠剤の苦味に影響しないことがわかった。
これに対して、主薬コーティング(2)の量を1錠あたり12mgのD−マンニトールに増量した試作錠剤T−2の苦味は、苦味3(中程度の苦味を感じる)であったことから、主薬コーティング(2)におけるD−マンニトールの量を1錠あたり12mgに増量すると、苦味は若干増加することがわかった。
As can be seen from Table 16B, the oral disintegration time of the prototype tablet T-1 without the main drug coating (2) with D-mannitol took 1 minute or more, whereas the main drug with 9 mg of D-mannitol per tablet. Since the orally disintegrating time of the prototype tablet S-1 coated (2) was 25 seconds, the orally disintegrating property is sufficient as an orally disintegrating tablet by applying the main drug coating (2) with D-mannitol. It was confirmed that the improvement was achieved to a certain level.
On the other hand, when the amount of the main drug coating (2) was increased to 12 mg of D-mannitol per tablet, the oral disintegration time was 24 seconds. Therefore, the amount of D-mannitol in the main drug coating (2). It was found that 9 mg per tablet was sufficient, and that even if the dose was increased to 12 mg, the improvement in oral disintegration was slight.
It was confirmed that the disintegration property in the oral cavity was improved and the unpleasant texture (mouth feel) in the oral cavity, which was "rough" and "motamota" when it was put in the mouth, was also reduced.
Regarding the evaluation of bitterness, since both the prototype tablet S-1 and the prototype tablet T-1 had a bitterness 2 (feeling a weak bitterness), the presence or absence of the main ingredient coating (2) did not affect the bitterness of the prototype tablet. all right.
On the other hand, the bitterness of the prototype tablet T-2, in which the amount of the main drug coating (2) was increased to 12 mg of D-mannitol per tablet, was bitterness 3 (a moderate bitterness was felt). It was found that when the amount of D-mannitol in the coating (2) was increased to 12 mg per tablet, the bitterness was slightly increased.
さらに、口に含んだ時の「ザラザラ」「モタモタ」とした不快な口腔内の触感(マウスフィール)について、客観的なデータを得るために、試作錠剤T−1について、ステアリン酸カルシウムによる乾式被覆後の主薬核顆粒2、オイドラギットEによるコーティング(1)を行った後の主薬コート顆粒1、及びD−マンニトールによるコーティング(2)を行った後の主薬コート顆粒2の夫々について、走査電子顕微鏡写真を撮影した(図3)。図3において、「造粒後」はステアリン酸カルシウムによる乾式被覆後の主薬核顆粒2を意味し、「オイドラコート後」は、オイドラギットEによるコーティング(1)を行った後の主薬コート顆粒1を意味し、「D−マンニトールコート後」は、D−マンニトールによるコーティング(2)を行った後の主薬コート顆粒2を意味する。
Furthermore, in order to obtain objective data on the unpleasant oral texture (mouse feel) that was "rough" and "motamota" when it was put in the mouth, the prototype tablet T-1 was dry-coated with calcium stearate. Scanning electron micrographs of the main drug
図3からわかるとおり、オイドラギットEによるコーティング(1)を行った後の主薬核顆粒2は、ステアリン酸カルシウムによる乾式被覆後の主薬核顆粒2と比較して、表面が平滑化していた。そして、D−マンニトールによるコーティング(2)を行った後の主薬コート顆粒2は、オイドラギットEによるコーティング(1)を行った後の主薬核顆粒2と比較して表面の凹凸が増えていた。D−マンニトールをコートすることで表面の凹凸が増え、錠剤化した際に間隙から唾液が浸潤しやすくなり、速やかに崩壊して、口に含んだ時の「ザラザラ」「モタモタ」とした不快な口腔内の触感(マウスフィール)が改善されることが裏付けられた。
As can be seen from FIG. 3, the surface of the main
以上の結果から、 主薬核顆粒をステアリン酸カルシウムによる乾式被覆及びオイドラギットEによる湿式被覆を行うことに加えて、さらにその外側をD−マンニトールによって被覆することによって、苦味抑制効果を失うことなく、口腔内崩壊性を改善しうることがわかった。また、D−マンニトールの量は1錠あたり9mgが、口腔内崩壊性の改善と苦味抑制の両立に適した量であることがわかった。 From the above results, in addition to dry coating with calcium stearate and wet coating with Eudragit E, the core granules are further coated with D-mannitol on the outside, so that the bitterness-suppressing effect is not lost in the oral cavity. It was found that the disintegration property could be improved. It was also found that the amount of D-mannitol was 9 mg per tablet, which was suitable for both improvement of oral disintegration and suppression of bitterness.
口腔内崩壊性の固形製剤の保存安定性の確認
試作錠剤S−1の打錠用顆粒の保存安定性を60℃(ガラス瓶密栓)で保存した場合の1週間後及び2週間後のラクタム体の量を評価し、これをプレガバリンと結晶セルロース(1:1)の配合試験結果、プレガバリンと軽質無水ケイ酸(1:0.1)の配合試験結果、プレガバリンとクロスポビドン(1:1)の配合試験結果と対比した。結果を表17に示す。
Confirmation of storage stability of orally disintegrating solid preparation The storage stability of the tableting granules of the prototype tablet S-1 after 1 week and 2 weeks when stored at 60 ° C (glass bottle sealed) Evaluate the amount, and use this as the result of the combination test of pregabalin and crystalline cellulose (1: 1), the result of the combination test of pregabalin and light anhydrous silicic acid (1: 0.1), and the combination of pregabalin and crospovidone (1: 1). It was compared with the test result. The results are shown in Table 17.
表17からわかるとおり、試作錠剤S−1は、プレガバリンを含有する固形製剤において経時的にラクタム体の生成を促進して保存安定性を損なう結晶セルロース(KG−802)、軽質無水ケイ酸(アドソリダー101)、及びクロスポビドン(コリドンCL−F)を含有しているにも拘らず、これらの添加物とプレガバリンとの接触が遮断されているために、ラクタム体の生成は低い水準にとどまった。
特に、軽質無水ケイ酸を加えた場合に、60℃(ガラス瓶密栓)で2週間保存した後のラクタム体の量が1.640%であったのに対して、試作錠剤S−1でが、0.067%にとどまったことは驚くべき経時的保存安定性の改善効果であった。
As can be seen from Table 17, the prototype tablet S-1 is a crystalline cellulose (KG-802) and light anhydrous silicic acid (additiver) that promote the production of lactams over time and impair storage stability in a solid preparation containing pregabalin. Despite containing 101) and crospovidone (corridone CL-F), the production of lactams remained at a low level due to the blockage of contact between these additives and pregabalin.
In particular, when light silicic anhydride was added, the amount of lactams after storage at 60 ° C. (sealed in a glass bottle) for 2 weeks was 1.640%, whereas that of the prototype tablet S-1 was The fact that it remained at 0.067% was a surprising effect of improving storage stability over time.
試作錠剤S−1の経時的保存安定性を確認するために、試作錠剤S−1、リリカ(商標)OD錠25mg、リリカ(商標)OD錠75mg、及びリリカ(商標)OD錠150mgを、アルミ袋に密封して、40℃75%相対湿度の加速条件で保存し、経時的なラクタム体の生成を測定した。結果を図4に示す。図4において、先発品25mg錠はリリカ(商標)OD錠25mgを意味し、先発品75mg錠はリリカ(商標)OD錠75mgを意味し、先発品150mg錠はリリカ(商標)OD錠150mgを意味する。図4において、試作品75mg錠は、試作錠剤S−1を意味する。 In order to confirm the storage stability of the prototype tablet S-1 over time, the prototype tablet S-1, Lyrica ™ OD tablet 25 mg, Lyrica ™ OD tablet 75 mg, and Lyrica ™ OD tablet 150 mg were added to aluminum. It was sealed in a bag and stored under accelerated conditions of 40 ° C. and 75% relative humidity, and the formation of lactams over time was measured. The results are shown in FIG. In FIG. 4, the original 25 mg tablet means Lyrica ™ OD tablet 25 mg, the original 75 mg tablet means Lyrica ™ OD tablet 75 mg, and the original 150 mg tablet means Lyrica ™ OD tablet 150 mg. do. In FIG. 4, the prototype 75 mg tablet means the prototype tablet S-1.
図4からわかるとおり、40℃75%相対湿度の加速条件で1か月間保存した後のラクタム体の量は約0.02%にとどまり、6か月間保存した後のラクタム体の推定量は0.12%程度と考えられるため、余裕をもって、安全性の閾値である0.2%以下の条件をクリアできた。 As can be seen from FIG. 4, the amount of lactams after storage at 40 ° C. and 75% relative humidity for 1 month is only about 0.02%, and the estimated amount of lactams after storage for 6 months is 0. Since it is considered to be about .12%, the condition of 0.2% or less, which is the safety threshold, could be cleared with a margin.
試作錠剤S−1の経時的保存安定性を確認するために、試作錠剤S−1をアルミ袋に密封して、40℃75%相対湿度の加速条件で保存し、保存開始する前、0.5月保存後、及び保存1月後の精製水に対する溶出率を測定した。試験条件は、パドル法、50回転で行った。結果を図5に示す。値は、3ベッセルの平均値を示す。図5において、先発OD75mgはリリカ(商標)OD錠75mgを意味する。また、図5において、先発OD75mg以外の線は、試作錠剤S−1を意味する。「先発OD75mg開始時」は、対照群として、加速条件で保存していないリリカ(商標)OD錠75mgの溶出率を測定したものである。「開始時」、「4075−0.5M」、「4075−1M」は、夫々、試作錠剤S−1をアルミ袋に密封して、40℃75%相対湿度の加速条件で、保存開始する前、0.5月保存後、及び1月保存後の溶出率を測定したものである。 In order to confirm the storage stability of the prototype tablet S-1 over time, the prototype tablet S-1 was sealed in an aluminum bag and stored under accelerated conditions of 40 ° C. and 75% relative humidity. The elution rate with respect to purified water after storage in May and after storage in January was measured. The test conditions were the paddle method and 50 rotations. The results are shown in FIG. The value indicates the average value of 3 vessels. In FIG. 5, the starting OD 75 mg means Lyrica ™ OD tablet 75 mg. Further, in FIG. 5, lines other than the starting OD 75 mg mean the prototype tablet S-1. “At the start of the starting OD 75 mg” is a measurement of the elution rate of Lyrica ™ OD tablet 75 mg not stored under acceleration conditions as a control group. "At the start", "4075-0.5M", and "4075-1M" are each before starting storage under the acceleration condition of 40 ° C. and 75% relative humidity by sealing the prototype tablet S-1 in an aluminum bag. , 0.5 months storage, and January storage elution rate was measured.
図5からわかるとおり、40℃75%相対湿度の加速条件で1箇月保存した後も、溶出遅延は全く認められない良好な保存安定性を示した。 As can be seen from FIG. 5, even after storage for one month under the acceleration condition of 40 ° C. and 75% relative humidity, no elution delay was observed and good storage stability was shown.
上記の結果から、主成分の苦味はオイドラギットEによりマスキングされているが、口腔内で100%抑制されてはいないことがわかった。そこで、プレガバリンの苦味を軽減する香料を種々検討した結果、微量の柑橘系の香料を添加することにより、プレガバリンの苦味が主観的に軽減して感じられるのみならず、さわやかな服用感を得られることを見出した。中でも、グレープフルーツ香料とレモン香料とオレンジ香料がプレガバリンの苦味を軽減するとともにさわやかな服用感をもたらした。特に、グレープフルーツ香料もっとも良好なプレガバリンの苦味軽減作用及び爽快な服用感を有していた。 From the above results, it was found that the bitterness of the main component was masked by Eudragit E, but it was not 100% suppressed in the oral cavity. Therefore, as a result of various studies on fragrances that reduce the bitterness of pregabalin, by adding a small amount of citrus fragrance, not only the bitterness of pregabalin is subjectively reduced, but also a refreshing feeling can be obtained. I found that. Among them, grapefruit flavor, lemon flavor and orange flavor reduced the bitterness of pregabalin and brought a refreshing feeling. In particular, the grapefruit flavor had the best pregabalin bitterness-reducing effect and a refreshing feeling of administration.
実施例のまとめ:
以上のとおり、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する本願の医薬製剤は、セルロース系添加物を添加して打錠することによって、経時的にラクタム体が増加することがわかった。
Summary of Examples:
As described above, in the pharmaceutical preparation of the present application containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof, the lactam form increases over time by adding a cellulosic additive and tableting. I understood.
ただし、HPC及びL−HPCは、経時的に生じるラクタム体の生成がごく僅かであるため、γ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤へ添加することを許容することができた。 However, HPC and L-HPC are allowed to be added to pharmaceutical preparations containing a γ-aminobutyric acid derivative or a pharmaceutically acceptable salt thereof because the formation of lactams generated over time is very small. I was able to.
したがって、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を添加しないことにより、打錠による経時的なラクタム体の生成を生じない保存安定な圧縮固形製剤を製造しうることがわかった。 Therefore, it was found that by not adding a cellulosic additive other than hydroxypropyl-substituted cellulose, it is possible to produce a storage-stable compressed solid preparation that does not produce lactams over time due to tableting.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、α化デンプン、白糖、アラビアゴム、ゼラチン、及びD−ソルビトールのいずれも含有しないことにより、使用期限を通じて20N以上の錠剤硬度を維持できることがわかった。 In addition, the pharmaceutical preparation containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof does not contain any of pregelatinized starch, sucrose, gum arabic, gelatin, and D-sorbitol, so that the expiration date is reached. It was found that the tablet hardness of 20 N or more can be maintained through the above.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、マンニトール、還元麦芽糖水飴、マルチトールなどの糖アルコール、ヒドロキシプロピルスターチ、又はデンプングリコール酸ナトリウムを含有することにより、打錠後の経時的なラクタム体の生成を顕著に抑制できることがわかった。 In addition, pharmaceutical preparations containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof contain sugar alcohols such as mannitol, reduced maltose starch syrup, maltitol, hydroxypropyl starch, or sodium starch glycolate. Therefore, it was found that the formation of lactams over time after tableting can be remarkably suppressed.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、ポリ塩化ビニル、ポリプロピレン、ポリエチレン等とアルミシートを圧着して得られる気密状態のブリスター包装中に保存することによって、打錠後の経時的なラクタム体の生成が抑制されることがわかった。 Further, the pharmaceutical preparation containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof is stored in an airtight blister package obtained by crimping an aluminum sheet with polyvinyl chloride, polypropylene, polyethylene or the like. It was found that this suppresses the production of lactams over time after tableting.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、適切な量のデンプングリコール酸ナトリウムを含有することにより、錠剤硬度を維持し、かつ、打錠後の経時的なラクタム体の生成を防止しつつ、良好な溶出性を有することがわかった。 In addition, the pharmaceutical preparation containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof maintains the tablet hardness by containing an appropriate amount of sodium starch glycolate, and after tableting. It was found that it has good dissolution property while preventing the formation of lactam form over time.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、圧縮前の粉体が良好な流動性を有し、良好な含量均一性を有し、キャッピング、スティッキング、ラミネーションなどの打錠障害を生じることもなく、各錠剤の質量のバラつきもなく、かつ、ロスなく歩留まり良く安定的に生産しうることがわかった。 Further, in the pharmaceutical preparation containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof, the powder before compression has good fluidity, good content uniformity, and capping. It was found that there is no tableting disorder such as sticking and lamination, there is no variation in the mass of each tablet, and stable production is possible with good yield without loss.
また、本願のγ−アミノ酪酸誘導体または薬学的に許容可能なその塩を含有する医薬製剤は、プレガバリンの苦みをマスクできることがわかった。 It was also found that a pharmaceutical preparation containing the γ-aminobutyric acid derivative of the present application or a pharmaceutically acceptable salt thereof can mask the bitterness of pregabalin.
Claims (6)
該活性成分が、糖衣基剤、水溶性フィルムコーティング基剤、腸溶性フィルムコーティング基剤、D−マンニトール、及び、ステアリン酸カルシウムからなる群から選択される1以上の成分で被覆された顆粒(但し、該顆粒は、1以上の任意の添加物を含有し、該顆粒及び該顆粒に接する被覆は、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有しない)中に存在することにより、
該活性成分が、前記顆粒の外に存在する、ヒドロキシプロピル置換セルロース以外のセルロース系添加物(但し、前記顆粒の外にヒドロキシプロピル置換セルロースが存在しても良い)と接触しない製剤構造を有し、
ヒドロキシプロピル置換セルロース以外のセルロース系添加物と前記活性成分とが接触する状態で打錠することにより生じる、経時的なラクタム体の生成が抑制された即時放出性の口腔内崩壊錠。
Contains one or more active ingredients selected from the group consisting of pregabalin and its pharmaceutically acceptable salt.
Granules in which the active ingredient is coated with one or more ingredients selected from the group consisting of a cellulose coating base, a water-soluble film coating base, an enteric film coating base, D-mannitol, and calcium stearate. The granules contain one or more optional additives, and the granules and the coating in contact with the granules do not contain cellulosic additives other than hydroxypropyl-substituted cellulose).
The active ingredient has a pharmaceutical structure that does not come into contact with a cellulosic additive other than hydroxypropyl-substituted cellulose (however, hydroxypropyl-substituted cellulose may be present outside the granules) existing outside the granules. ,
An instantly release orally disintegrating tablet in which the formation of lactams over time is suppressed, which is produced by tableting in a state where a cellulosic additive other than hydroxypropyl-substituted cellulose is in contact with the active ingredient.
Claimed to contain one or more components selected from the group consisting of carboxymethyl group modified starch or pharmaceutically acceptable salts thereof, sugar alcohols, calcium stearate, lactose hydrate, and hydroxypropyl substituted cellulose. Item 2. The tablet according to item 1.
The tablet according to claim 1 or 2 , which contains one or more sugar alcohols selected from the group consisting of erythritol, mannitol, isomalt, reduced starch syrup, reduced maltose starch syrup, maltitol, and sorbitol.
One or more active ingredients selected from the group consisting of pregavalin and its pharmaceutically acceptable salt are magnesium aluminometasilicate, light anhydrous silicic acid, hydrous silicon dioxide, talc, titanium oxide, povidone, crospovidone, macro. Any of claims 1 to 3 , which has a pharmaceutical structure that does not come into contact with one or more components selected from the group consisting of goal, sucrose fatty acid ester, hypromerose, gelatin, starch, partially pregelatinized starch, and calcium dihydrogen phosphate. The tablet according to paragraph 1.
The tablet according to any one of claims 1 to 4 , which does not contain 1.7% or more of the tablet weight of one or more components selected from the group consisting of pregelatinized starch, sucrose, gum arabic, and gelatin.
(1) プレガバリン及び薬学的に許容可能なその塩からなる群から選択される1以上の活性成分を、1以上の任意の添加物(但し、該添加物は、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有しない)とともに混合する工程、
(2) 前記の混合物にヒドロキシプロピル置換セルロース溶液を噴霧して造粒する工程、
(3) 前記の造粒物を、糖衣基剤、水溶性フィルムコーティング基剤、腸溶性フィルムコーティング基剤、D−マンニトール、及び、ステアリン酸カルシウムからなる群から選択される1以上の成分を含有する被覆材(但し、該被覆材は、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を含有しない)で被覆する工程、
(4) 前記の被覆造粒物を、ヒドロキシプロピル置換セルロース以外のセルロース系添加物を1以上含有する添加剤もしくは造粒物とともに混合して打錠する工程。
The method for producing an orally disintegrating tablet according to any one of claims 1 to 5 , which comprises the following steps:
(1) One or more active ingredients selected from the group consisting of pregavalin and a pharmaceutically acceptable salt thereof, and one or more arbitrary additives (provided that the additives are cellulosic other than hydroxypropyl-substituted cellulose). The process of mixing with (without additives),
(2) A step of spraying a hydroxypropyl-substituted cellulose solution onto the above mixture to granulate the mixture.
(3) The granulated product contains one or more components selected from the group consisting of a cellulose coating base, a water-soluble film coating base, an enteric film coating base, D-mannitol, and calcium stearate. A step of coating with a coating material (however, the coating material does not contain a cellulosic additive other than hydroxypropyl-substituted cellulose) .
(4) a pre-Symbol coating granulated material, a step of tableting are mixed with additives or granules containing hydroxypropyl-substituted cellulose than the cellulose-based additive of the one or more.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017009736 | 2017-01-23 | ||
| JP2017009736 | 2017-01-23 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018118966A JP2018118966A (en) | 2018-08-02 |
| JP2018118966A5 JP2018118966A5 (en) | 2021-06-10 |
| JP6919119B2 true JP6919119B2 (en) | 2021-08-18 |
Family
ID=63043564
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018009249A Active JP6919119B2 (en) | 2017-01-23 | 2018-01-23 | A compressed solid pharmaceutical composition containing a γ-aminobutyric acid derivative substituted at the 3-position. |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6919119B2 (en) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7138666B2 (en) * | 2018-01-24 | 2022-09-16 | 大原薬品工業株式会社 | METHOD FOR IMPROVING CHEMICAL STABILITY OF TABLETS CONTAINING γ-AMINOBUTYRIC ACID DERIVATIVES |
| JP6504638B1 (en) * | 2018-05-31 | 2019-04-24 | 武田テバファーマ株式会社 | Tablet and method for producing the same |
| WO2019244649A1 (en) | 2018-06-22 | 2019-12-26 | ソニー株式会社 | Drawing and erasing device and erasing method |
| JPWO2022168968A1 (en) * | 2021-02-05 | 2022-08-11 | ||
| CN115340427B (en) * | 2022-03-10 | 2023-04-11 | 南开大学 | Hematite-carboxymethyl cellulose-nutrient salt compound and preparation method and application thereof |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL139298A0 (en) * | 1998-05-15 | 2001-11-25 | Warner Lambert Co | Stabilized pharmaceutical preparations of gamma-aminobutyric acid derivatives and process for preparing the same |
| CN100337687C (en) * | 1998-05-15 | 2007-09-19 | 沃尼尔·朗伯公司 | Gamma-aminobutyric acid derivatives containing, solid compositions and process for preparing the same |
| FR2781793B1 (en) * | 1998-08-03 | 2001-07-20 | Prographarm Lab | PROCESS FOR PRODUCING COATED GABAPENTINE GRANULES |
| FR2795962B1 (en) * | 1999-07-08 | 2003-05-09 | Prographarm Laboratoires | PROCESS FOR THE MANUFACTURE OF MASK TASTE COATED GRANULES AND IMMEDIATE RELEASE OF THE ACTIVE INGREDIENT |
| MX2007008833A (en) * | 2005-01-21 | 2008-03-25 | Pharmanova Inc | Pharmaceutical formulations and methods of use. |
| NL2000281C2 (en) * | 2005-11-02 | 2007-08-07 | Pfizer Prod Inc | Solid pharmaceutical compositions containing pregabalin. |
| DE102007019071A1 (en) * | 2007-04-23 | 2008-10-30 | Ratiopharm Gmbh | Stabilized pharmaceutical composition containing pregabalin |
| US8454993B2 (en) * | 2007-11-23 | 2013-06-04 | Lupin Limited | Controlled release pharmaceutical compositions of pregabalin |
| TR200909613A1 (en) * | 2009-12-22 | 2011-07-21 | Sanovel İlaç San. Ve Ti̇c. A.Ş. | Pharmaceutical compositions of pregabalin. |
| KR101484382B1 (en) * | 2010-02-24 | 2015-01-19 | 조에티스 엘엘씨 | Veterinary compositions |
| HU230031B1 (en) * | 2010-03-01 | 2015-05-28 | Egis Gyógyszergyár Nyilvánosan Működő Részvénytársaság | Stabilized pharmaceutical composition containing pregabalin and isomalt |
| EP2415460A1 (en) * | 2010-08-03 | 2012-02-08 | ratiopharm GmbH | Formulations of pregabalin for oral administration |
| CN103702664B (en) * | 2011-07-26 | 2016-10-19 | 柳韩洋行 | By the slow releasing tablet containing Pregabalin of biphase controlled release system |
| CN103385870A (en) * | 2012-05-09 | 2013-11-13 | 鲁南制药集团股份有限公司 | Medical application of pregabalin |
| GB201301242D0 (en) * | 2013-01-24 | 2013-03-06 | Hofmeyr Phillip R | Tennis teaching aids |
| EP2826470B1 (en) * | 2013-07-19 | 2017-09-06 | Arven Ilac Sanayi ve Ticaret A.S. | Pharmaceutical combinations of pregabalin |
| IN2014MU00215A (en) * | 2014-01-22 | 2015-08-28 | Intas Pharmaceuticals Ltd | |
| CN104906064B (en) * | 2015-05-15 | 2017-12-22 | 中国药科大学 | A kind of Pregabalin gastric floating slow-release tablet and preparation method thereof |
| CN108478537A (en) * | 2018-05-03 | 2018-09-04 | 南京易亨制药有限公司 | A kind of elementary osmotic pump controlled release tablet agent containing Pregabalin |
-
2018
- 2018-01-23 JP JP2018009249A patent/JP6919119B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018118966A (en) | 2018-08-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6919119B2 (en) | A compressed solid pharmaceutical composition containing a γ-aminobutyric acid derivative substituted at the 3-position. | |
| JP6092936B2 (en) | Method for producing orally disintegrating tablets | |
| EP2646003B1 (en) | Rapidly dispersing granules, orally disintegrating tablets and methods | |
| JP4989733B2 (en) | Orally disintegrating tablets | |
| CN106913553A (en) | Oral disnitegration tablet and its manufacture method | |
| JP2017141299A (en) | Irbesartan-containing pharmaceutical composition showing excellent elution, and orally disintegrable tablet | |
| JP2019019113A (en) | Orally disintegrating tablet containing memantine hydrochloride | |
| TW201217001A (en) | Particle coating preparation | |
| JP5978335B2 (en) | Irbesartan-containing pharmaceutical composition with good dissolution and orally disintegrating tablet | |
| WO2010119851A1 (en) | Orally disintegrating tablet | |
| EP3398588A1 (en) | Compression-molded preparation | |
| JP7148319B2 (en) | Orally disintegrating tablet containing prasugrel | |
| EP3251661B1 (en) | Raloxifene sprinkle composition | |
| JP6151413B2 (en) | Irbesartan-containing pharmaceutical composition with good dissolution and orally disintegrating tablet | |
| JP7023186B2 (en) | Orally disintegrating tablets containing dementia treatment | |
| JP5714652B2 (en) | Irbesartan-containing pharmaceutical composition with good dissolution and orally disintegrating tablet | |
| JP7308022B2 (en) | Orally disintegrating tablet with suppressed bitterness of fast-dissolving drug | |
| JP6855387B2 (en) | Compression molding formulation | |
| JP6150564B2 (en) | Orally rapidly disintegrating tablets | |
| WO2019098327A1 (en) | Orally disintegrating tablet having suppressed bitterness of fast dissolving drug | |
| JP2019203031A (en) | Irbesartan-containing pharmaceutical composition showing excellent elution, and orally disintegrable tablet | |
| JP2005194225A (en) | Gastric-disintegrable tablet |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20201006 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210121 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210121 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20210123 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20210208 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210423 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210519 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210611 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6919119 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |