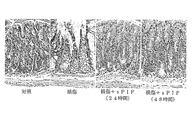
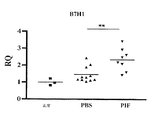
JP6806685B2 - 急性放射線症候群を治療するための組成物及び方法 - Google Patents
急性放射線症候群を治療するための組成物及び方法 Download PDFInfo
- Publication number
- JP6806685B2 JP6806685B2 JP2017534526A JP2017534526A JP6806685B2 JP 6806685 B2 JP6806685 B2 JP 6806685B2 JP 2017534526 A JP2017534526 A JP 2017534526A JP 2017534526 A JP2017534526 A JP 2017534526A JP 6806685 B2 JP6806685 B2 JP 6806685B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- pif
- peptide
- pharmaceutically acceptable
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 162
- 208000001395 Acute radiation syndrome Diseases 0.000 title claims description 89
- 206010068142 Radiation sickness syndrome Diseases 0.000 title claims description 89
- 238000000034 method Methods 0.000 title description 182
- 108010022347 proteolysis-inducing peptide Proteins 0.000 claims description 343
- 150000003839 salts Chemical class 0.000 claims description 283
- 210000004027 cell Anatomy 0.000 claims description 174
- 210000001519 tissue Anatomy 0.000 claims description 100
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 96
- 210000000056 organ Anatomy 0.000 claims description 92
- 210000001185 bone marrow Anatomy 0.000 claims description 52
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 42
- 230000005855 radiation Effects 0.000 claims description 39
- 231100000636 lethal dose Toxicity 0.000 claims description 33
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 32
- 230000006378 damage Effects 0.000 claims description 25
- 230000003111 delayed effect Effects 0.000 claims description 13
- 208000027418 Wounds and injury Diseases 0.000 claims description 12
- 230000000112 colonic effect Effects 0.000 claims description 12
- 208000014674 injury Diseases 0.000 claims description 12
- 231100000569 acute exposure Toxicity 0.000 claims description 6
- 238000002347 injection Methods 0.000 claims description 6
- 239000007924 injection Substances 0.000 claims description 6
- 210000001035 gastrointestinal tract Anatomy 0.000 claims description 5
- 210000001100 crypt cell Anatomy 0.000 claims 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 1388
- 102100026992 Dermcidin Human genes 0.000 description 281
- 238000002054 transplantation Methods 0.000 description 101
- 238000011282 treatment Methods 0.000 description 90
- 150000001875 compounds Chemical class 0.000 description 89
- 241000699670 Mus sp. Species 0.000 description 71
- 230000000694 effects Effects 0.000 description 70
- 239000008194 pharmaceutical composition Substances 0.000 description 69
- 230000003278 mimic effect Effects 0.000 description 44
- 239000000243 solution Substances 0.000 description 42
- 206010073306 Exposure to radiation Diseases 0.000 description 36
- 239000003937 drug carrier Substances 0.000 description 34
- 230000014509 gene expression Effects 0.000 description 34
- 238000002474 experimental method Methods 0.000 description 30
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 30
- 102000004196 processed proteins & peptides Human genes 0.000 description 30
- 108090000623 proteins and genes Proteins 0.000 description 30
- -1 amine cations Chemical class 0.000 description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 29
- 230000001919 adrenal effect Effects 0.000 description 28
- 235000001014 amino acid Nutrition 0.000 description 28
- 229940024606 amino acid Drugs 0.000 description 27
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 27
- 150000001413 amino acids Chemical class 0.000 description 26
- 238000004519 manufacturing process Methods 0.000 description 25
- 238000011084 recovery Methods 0.000 description 24
- 210000002540 macrophage Anatomy 0.000 description 23
- 230000037396 body weight Effects 0.000 description 22
- 210000001072 colon Anatomy 0.000 description 22
- 208000024908 graft versus host disease Diseases 0.000 description 22
- 208000009329 Graft vs Host Disease Diseases 0.000 description 21
- 238000009472 formulation Methods 0.000 description 21
- 239000003814 drug Substances 0.000 description 19
- 230000007774 longterm Effects 0.000 description 19
- 210000004153 islets of langerhan Anatomy 0.000 description 18
- 201000010099 disease Diseases 0.000 description 17
- 238000001802 infusion Methods 0.000 description 17
- 241001465754 Metazoa Species 0.000 description 16
- 241000700159 Rattus Species 0.000 description 16
- 238000004458 analytical method Methods 0.000 description 16
- 230000004069 differentiation Effects 0.000 description 16
- 210000000265 leukocyte Anatomy 0.000 description 16
- 239000000126 substance Substances 0.000 description 16
- 208000024891 symptom Diseases 0.000 description 16
- 102000004127 Cytokines Human genes 0.000 description 15
- 108090000695 Cytokines Proteins 0.000 description 15
- 210000002798 bone marrow cell Anatomy 0.000 description 15
- 229960000890 hydrocortisone Drugs 0.000 description 15
- 210000004698 lymphocyte Anatomy 0.000 description 15
- 230000004083 survival effect Effects 0.000 description 15
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 14
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 14
- 230000027455 binding Effects 0.000 description 14
- 230000009885 systemic effect Effects 0.000 description 14
- 230000001225 therapeutic effect Effects 0.000 description 14
- 230000000735 allogeneic effect Effects 0.000 description 13
- 210000001772 blood platelet Anatomy 0.000 description 13
- 239000003795 chemical substances by application Substances 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 12
- 206010061218 Inflammation Diseases 0.000 description 12
- 230000001154 acute effect Effects 0.000 description 12
- 238000009739 binding Methods 0.000 description 12
- 208000035475 disorder Diseases 0.000 description 12
- 210000002064 heart cell Anatomy 0.000 description 12
- 230000002519 immonomodulatory effect Effects 0.000 description 12
- 230000004054 inflammatory process Effects 0.000 description 12
- 235000018102 proteins Nutrition 0.000 description 12
- 230000028327 secretion Effects 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- 210000000601 blood cell Anatomy 0.000 description 11
- 210000002216 heart Anatomy 0.000 description 11
- 230000001976 improved effect Effects 0.000 description 11
- 230000001681 protective effect Effects 0.000 description 11
- 230000035899 viability Effects 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- 239000004480 active ingredient Substances 0.000 description 10
- 230000003394 haemopoietic effect Effects 0.000 description 10
- 208000032839 leukemia Diseases 0.000 description 10
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 10
- 238000006467 substitution reaction Methods 0.000 description 10
- 239000003826 tablet Substances 0.000 description 10
- 239000003981 vehicle Substances 0.000 description 10
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 9
- 239000002775 capsule Substances 0.000 description 9
- 230000034994 death Effects 0.000 description 9
- 239000000546 pharmaceutical excipient Substances 0.000 description 9
- 230000001105 regulatory effect Effects 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- 208000023275 Autoimmune disease Diseases 0.000 description 8
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 8
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- 241000282412 Homo Species 0.000 description 8
- 206010028980 Neoplasm Diseases 0.000 description 8
- 229920002472 Starch Polymers 0.000 description 8
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 8
- 238000007792 addition Methods 0.000 description 8
- 210000004100 adrenal gland Anatomy 0.000 description 8
- 150000001408 amides Chemical class 0.000 description 8
- 239000003085 diluting agent Substances 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 8
- 239000000839 emulsion Substances 0.000 description 8
- 150000002148 esters Chemical class 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 230000002489 hematologic effect Effects 0.000 description 8
- 230000028993 immune response Effects 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- 239000000825 pharmaceutical preparation Substances 0.000 description 8
- 230000000770 proinflammatory effect Effects 0.000 description 8
- 210000000130 stem cell Anatomy 0.000 description 8
- 210000000689 upper leg Anatomy 0.000 description 8
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 230000006907 apoptotic process Effects 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 201000011510 cancer Diseases 0.000 description 7
- 239000000306 component Substances 0.000 description 7
- 210000003743 erythrocyte Anatomy 0.000 description 7
- 239000003018 immunosuppressive agent Substances 0.000 description 7
- 208000027866 inflammatory disease Diseases 0.000 description 7
- 210000003734 kidney Anatomy 0.000 description 7
- 210000004185 liver Anatomy 0.000 description 7
- 230000036542 oxidative stress Effects 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 238000001959 radiotherapy Methods 0.000 description 7
- 235000019698 starch Nutrition 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 6
- 241000283690 Bos taurus Species 0.000 description 6
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 6
- 108010010803 Gelatin Proteins 0.000 description 6
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 6
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 6
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 6
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 6
- 125000000217 alkyl group Chemical group 0.000 description 6
- 125000000539 amino acid group Chemical group 0.000 description 6
- 230000009286 beneficial effect Effects 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- 238000001516 cell proliferation assay Methods 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 230000018109 developmental process Effects 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 230000004064 dysfunction Effects 0.000 description 6
- 239000008273 gelatin Substances 0.000 description 6
- 229920000159 gelatin Polymers 0.000 description 6
- 235000019322 gelatine Nutrition 0.000 description 6
- 235000011852 gelatine desserts Nutrition 0.000 description 6
- 210000000987 immune system Anatomy 0.000 description 6
- 238000000126 in silico method Methods 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- 239000008101 lactose Substances 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 230000008816 organ damage Effects 0.000 description 6
- 229940127557 pharmaceutical product Drugs 0.000 description 6
- 239000006187 pill Substances 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000003755 preservative agent Substances 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 5
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 5
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- 239000012190 activator Substances 0.000 description 5
- 230000000202 analgesic effect Effects 0.000 description 5
- 230000003110 anti-inflammatory effect Effects 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 238000010322 bone marrow transplantation Methods 0.000 description 5
- 230000000747 cardiac effect Effects 0.000 description 5
- 230000003833 cell viability Effects 0.000 description 5
- 238000002512 chemotherapy Methods 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 210000003714 granulocyte Anatomy 0.000 description 5
- 208000014951 hematologic disease Diseases 0.000 description 5
- 210000002865 immune cell Anatomy 0.000 description 5
- 239000007943 implant Substances 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 5
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 5
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 5
- 230000035935 pregnancy Effects 0.000 description 5
- 230000000069 prophylactic effect Effects 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 235000010356 sorbitol Nutrition 0.000 description 5
- 239000000600 sorbitol Substances 0.000 description 5
- 210000004988 splenocyte Anatomy 0.000 description 5
- 239000008107 starch Substances 0.000 description 5
- 230000000699 topical effect Effects 0.000 description 5
- GLXYOFXNKBTMQL-YKCHQESGSA-N (2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-1-[(2S)-6-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-4-methylsulfanylbutanoyl]amino]-3-methylbutanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-methylpentanoyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]acetyl]amino]-3-hydroxypropanoyl]amino]propanoyl]amino]-4-oxobutanoyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]butanedioic acid Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N1[C@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O)CCC1 GLXYOFXNKBTMQL-YKCHQESGSA-N 0.000 description 4
- 208000005676 Adrenogenital syndrome Diseases 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- 208000019838 Blood disease Diseases 0.000 description 4
- 208000008448 Congenital adrenal hyperplasia Diseases 0.000 description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 description 4
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 4
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 4
- 206010019280 Heart failures Diseases 0.000 description 4
- 102000001554 Hemoglobins Human genes 0.000 description 4
- 108010054147 Hemoglobins Proteins 0.000 description 4
- 102100021496 Insulin-degrading enzyme Human genes 0.000 description 4
- 108090000828 Insulysin Proteins 0.000 description 4
- 108090000978 Interleukin-4 Proteins 0.000 description 4
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 4
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 229930195725 Mannitol Natural products 0.000 description 4
- AXDLCFOOGCNDST-UHFFFAOYSA-N N-Methyltyrosine Chemical compound CNC(C(O)=O)CC1=CC=C(O)C=C1 AXDLCFOOGCNDST-UHFFFAOYSA-N 0.000 description 4
- KSPIYJQBLVDRRI-UHFFFAOYSA-N N-methylisoleucine Chemical compound CCC(C)C(NC)C(O)=O KSPIYJQBLVDRRI-UHFFFAOYSA-N 0.000 description 4
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 4
- 102100029438 Nitric oxide synthase, inducible Human genes 0.000 description 4
- 101710089543 Nitric oxide synthase, inducible Proteins 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 4
- 210000001789 adipocyte Anatomy 0.000 description 4
- 239000000443 aerosol Substances 0.000 description 4
- 239000003963 antioxidant agent Substances 0.000 description 4
- 235000006708 antioxidants Nutrition 0.000 description 4
- 125000004429 atom Chemical group 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 238000004422 calculation algorithm Methods 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 235000010980 cellulose Nutrition 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 206010012601 diabetes mellitus Diseases 0.000 description 4
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 4
- 239000008298 dragée Substances 0.000 description 4
- 239000003995 emulsifying agent Substances 0.000 description 4
- 239000002158 endotoxin Substances 0.000 description 4
- 239000000945 filler Substances 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 230000002496 gastric effect Effects 0.000 description 4
- 208000018706 hematopoietic system disease Diseases 0.000 description 4
- 230000011132 hemopoiesis Effects 0.000 description 4
- 229940088597 hormone Drugs 0.000 description 4
- 239000005556 hormone Substances 0.000 description 4
- 238000009396 hybridization Methods 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- 230000000366 juvenile effect Effects 0.000 description 4
- 231100000518 lethal Toxicity 0.000 description 4
- 230000001665 lethal effect Effects 0.000 description 4
- 229920006008 lipopolysaccharide Polymers 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 239000000594 mannitol Substances 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 238000003032 molecular docking Methods 0.000 description 4
- 210000000496 pancreas Anatomy 0.000 description 4
- 210000003024 peritoneal macrophage Anatomy 0.000 description 4
- 230000000704 physical effect Effects 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 239000006188 syrup Substances 0.000 description 4
- 235000020357 syrup Nutrition 0.000 description 4
- 239000000454 talc Substances 0.000 description 4
- 229910052623 talc Inorganic materials 0.000 description 4
- 235000012222 talc Nutrition 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- TXHAHOVNFDVCCC-UHFFFAOYSA-N 2-(tert-butylazaniumyl)acetate Chemical compound CC(C)(C)NCC(O)=O TXHAHOVNFDVCCC-UHFFFAOYSA-N 0.000 description 3
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 3
- 206010067484 Adverse reaction Diseases 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 3
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 3
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 3
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 3
- 206010062016 Immunosuppression Diseases 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 102100022338 Integrin alpha-M Human genes 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 3
- 210000004322 M2 macrophage Anatomy 0.000 description 3
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 3
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical class CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- AKCRVYNORCOYQT-YFKPBYRVSA-N N-methyl-L-valine Chemical compound CN[C@@H](C(C)C)C(O)=O AKCRVYNORCOYQT-YFKPBYRVSA-N 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 239000012891 Ringer solution Substances 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 3
- 208000002903 Thalassemia Diseases 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 239000000695 adrenergic alpha-agonist Chemical class 0.000 description 3
- 230000006838 adverse reaction Effects 0.000 description 3
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 3
- 230000003288 anthiarrhythmic effect Effects 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 239000003416 antiarrhythmic agent Chemical class 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 210000004204 blood vessel Anatomy 0.000 description 3
- 229910002092 carbon dioxide Inorganic materials 0.000 description 3
- 230000005779 cell damage Effects 0.000 description 3
- 208000037887 cell injury Diseases 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 210000003690 classically activated macrophage Anatomy 0.000 description 3
- 238000007621 cluster analysis Methods 0.000 description 3
- 230000008951 colonic inflammation Effects 0.000 description 3
- 239000011162 core material Substances 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 235000003599 food sweetener Nutrition 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- 239000007903 gelatin capsule Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 208000019622 heart disease Diseases 0.000 description 3
- 238000005534 hematocrit Methods 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 238000010562 histological examination Methods 0.000 description 3
- 208000026278 immune system disease Diseases 0.000 description 3
- 230000001506 immunosuppresive effect Effects 0.000 description 3
- 229960003444 immunosuppressant agent Drugs 0.000 description 3
- 229940124589 immunosuppressive drug Drugs 0.000 description 3
- 230000028709 inflammatory response Effects 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 206010022498 insulinoma Diseases 0.000 description 3
- 230000005865 ionizing radiation Effects 0.000 description 3
- 239000012669 liquid formulation Substances 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 230000004898 mitochondrial function Effects 0.000 description 3
- 201000006417 multiple sclerosis Diseases 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 210000000440 neutrophil Anatomy 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 150000007523 nucleic acids Chemical group 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 238000001543 one-way ANOVA Methods 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 208000021255 pancreatic insulinoma Diseases 0.000 description 3
- 239000000123 paper Substances 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- 210000005259 peripheral blood Anatomy 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 3
- 235000021317 phosphate Nutrition 0.000 description 3
- 230000026731 phosphorylation Effects 0.000 description 3
- 238000006366 phosphorylation reaction Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000008707 rearrangement Effects 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 238000007363 ring formation reaction Methods 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 239000007909 solid dosage form Substances 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 239000007929 subcutaneous injection Substances 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- 239000000375 suspending agent Substances 0.000 description 3
- 230000002459 sustained effect Effects 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 235000002906 tartaric acid Nutrition 0.000 description 3
- 239000011975 tartaric acid Substances 0.000 description 3
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- XJODGRWDFZVTKW-LURJTMIESA-N (2s)-4-methyl-2-(methylamino)pentanoic acid Chemical compound CN[C@H](C(O)=O)CC(C)C XJODGRWDFZVTKW-LURJTMIESA-N 0.000 description 2
- CCAIIPMIAFGKSI-DMTCNVIQSA-N (2s,3r)-3-hydroxy-2-(methylazaniumyl)butanoate Chemical compound CN[C@@H]([C@@H](C)O)C(O)=O CCAIIPMIAFGKSI-DMTCNVIQSA-N 0.000 description 2
- PAJPWUMXBYXFCZ-UHFFFAOYSA-N 1-aminocyclopropanecarboxylic acid Chemical compound OC(=O)C1(N)CC1 PAJPWUMXBYXFCZ-UHFFFAOYSA-N 0.000 description 2
- RDFMDVXONNIGBC-UHFFFAOYSA-N 2-aminoheptanoic acid Chemical compound CCCCCC(N)C(O)=O RDFMDVXONNIGBC-UHFFFAOYSA-N 0.000 description 2
- XNPKNHHFCKSMRV-UHFFFAOYSA-N 4-(cyclohexylamino)butane-1-sulfonic acid Chemical compound OS(=O)(=O)CCCCNC1CCCCC1 XNPKNHHFCKSMRV-UHFFFAOYSA-N 0.000 description 2
- XWHHYOYVRVGJJY-QMMMGPOBSA-N 4-fluoro-L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(F)C=C1 XWHHYOYVRVGJJY-QMMMGPOBSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- PIGFYZPCRLYGLF-UHFFFAOYSA-N Aluminum nitride Chemical compound [Al]#N PIGFYZPCRLYGLF-UHFFFAOYSA-N 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 239000005711 Benzoic acid Substances 0.000 description 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 208000020446 Cardiac disease Diseases 0.000 description 2
- 206010007559 Cardiac failure congestive Diseases 0.000 description 2
- 238000003731 Caspase Glo 3/7 Assay Methods 0.000 description 2
- 102000047934 Caspase-3/7 Human genes 0.000 description 2
- 108700037887 Caspase-3/7 Proteins 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 208000011231 Crohn disease Diseases 0.000 description 2
- WHUUTDBJXJRKMK-GSVOUGTGSA-N D-glutamic acid Chemical compound OC(=O)[C@H](N)CCC(O)=O WHUUTDBJXJRKMK-GSVOUGTGSA-N 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 102100023374 Forkhead box protein M1 Human genes 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 208000032843 Hemorrhage Diseases 0.000 description 2
- 101000907578 Homo sapiens Forkhead box protein M1 Proteins 0.000 description 2
- 206010061598 Immunodeficiency Diseases 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102100037644 Kelch-like protein 41 Human genes 0.000 description 2
- 108050003242 Kelch-like protein 41 Proteins 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 208000034486 Multi-organ failure Diseases 0.000 description 2
- 208000010718 Multiple Organ Failure Diseases 0.000 description 2
- CZCIKBSVHDNIDH-NSHDSACASA-N N(alpha)-methyl-L-tryptophan Chemical compound C1=CC=C2C(C[C@H]([NH2+]C)C([O-])=O)=CNC2=C1 CZCIKBSVHDNIDH-NSHDSACASA-N 0.000 description 2
- SCIFESDRCALIIM-UHFFFAOYSA-N N-Me-Phenylalanine Natural products CNC(C(O)=O)CC1=CC=CC=C1 SCIFESDRCALIIM-UHFFFAOYSA-N 0.000 description 2
- GDFAOVXKHJXLEI-VKHMYHEASA-N N-methyl-L-alanine Chemical compound C[NH2+][C@@H](C)C([O-])=O GDFAOVXKHJXLEI-VKHMYHEASA-N 0.000 description 2
- XLBVNMSMFQMKEY-BYPYZUCNSA-N N-methyl-L-glutamic acid Chemical compound CN[C@H](C(O)=O)CCC(O)=O XLBVNMSMFQMKEY-BYPYZUCNSA-N 0.000 description 2
- SCIFESDRCALIIM-VIFPVBQESA-N N-methyl-L-phenylalanine Chemical compound C[NH2+][C@H](C([O-])=O)CC1=CC=CC=C1 SCIFESDRCALIIM-VIFPVBQESA-N 0.000 description 2
- 102100028452 Nitric oxide synthase, endothelial Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 108050003267 Prostaglandin G/H synthase 2 Proteins 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 238000012193 PureLink RNA Mini Kit Methods 0.000 description 2
- 238000011529 RT qPCR Methods 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 102100036407 Thioredoxin Human genes 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 206010052779 Transplant rejections Diseases 0.000 description 2
- 208000006110 Wiskott-Aldrich syndrome Diseases 0.000 description 2
- 210000000683 abdominal cavity Anatomy 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 150000003973 alkyl amines Chemical class 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000012197 amplification kit Methods 0.000 description 2
- 230000003444 anaesthetic effect Effects 0.000 description 2
- 238000000540 analysis of variance Methods 0.000 description 2
- 239000002220 antihypertensive agent Substances 0.000 description 2
- 238000003782 apoptosis assay Methods 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000001363 autoimmune Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 235000010233 benzoic acid Nutrition 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 230000000740 bleeding effect Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 230000021523 carboxylation Effects 0.000 description 2
- 238000006473 carboxylation reaction Methods 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 235000015165 citric acid Nutrition 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 235000019441 ethanol Nutrition 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- QEWYKACRFQMRMB-UHFFFAOYSA-N fluoroacetic acid Chemical compound OC(=O)CF QEWYKACRFQMRMB-UHFFFAOYSA-N 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 239000003205 fragrance Substances 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 238000003500 gene array Methods 0.000 description 2
- 235000021472 generally recognized as safe Nutrition 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 239000003862 glucocorticoid Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 230000004217 heart function Effects 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 2
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 2
- 239000003701 inert diluent Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 239000003456 ion exchange resin Substances 0.000 description 2
- 229920003303 ion-exchange polymer Polymers 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 230000029226 lipidation Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 239000008176 lyophilized powder Substances 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 210000001161 mammalian embryo Anatomy 0.000 description 2
- 230000008774 maternal effect Effects 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000007102 metabolic function Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 210000005087 mononuclear cell Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 208000029744 multiple organ dysfunction syndrome Diseases 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 235000001968 nicotinic acid Nutrition 0.000 description 2
- 239000011664 nicotinic acid Substances 0.000 description 2
- 229960003512 nicotinic acid Drugs 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- GHLZUHZBBNDWHW-UHFFFAOYSA-N nonanamide Chemical compound CCCCCCCCC(N)=O GHLZUHZBBNDWHW-UHFFFAOYSA-N 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- NPKKRSHVJIQBKU-UHFFFAOYSA-N ornogenin Natural products CC(OC(=O)C=Cc1ccccc1)C2(O)CCC3(O)C4(O)CC=C5CC(O)CCC5(C)C4CC(OC(=O)C=Cc6ccccc6)C23C NPKKRSHVJIQBKU-UHFFFAOYSA-N 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 235000011007 phosphoric acid Nutrition 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 230000010287 polarization Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 125000001500 prolyl group Chemical class [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 235000019260 propionic acid Nutrition 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000009711 regulatory function Effects 0.000 description 2
- 230000003938 response to stress Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 230000008080 stochastic effect Effects 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 230000008718 systemic inflammatory response Effects 0.000 description 2
- 108060008226 thioredoxin Proteins 0.000 description 2
- 229940094937 thioredoxin Drugs 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 238000010798 ubiquitination Methods 0.000 description 2
- 230000034512 ubiquitination Effects 0.000 description 2
- 238000002604 ultrasonography Methods 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 238000003026 viability measurement method Methods 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- 238000002689 xenotransplantation Methods 0.000 description 2
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- OSBJZDSTRAMDPL-VIFPVBQESA-N (2s)-2-(methylamino)-3-(1h-pyrrolo[2,3-b]pyridin-3-yl)propanoic acid Chemical compound C1=CC=C2C(C[C@H](NC)C(O)=O)=CNC2=N1 OSBJZDSTRAMDPL-VIFPVBQESA-N 0.000 description 1
- SNLOIIPRZGMRAB-QMMMGPOBSA-N (2s)-2-azaniumyl-3-(1h-pyrrolo[2,3-b]pyridin-3-yl)propanoate Chemical compound C1=CC=C2C(C[C@H]([NH3+])C([O-])=O)=CNC2=N1 SNLOIIPRZGMRAB-QMMMGPOBSA-N 0.000 description 1
- 125000006582 (C5-C6) heterocycloalkyl group Chemical class 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N (R)-alpha-Tocopherol Natural products OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N (e)-2-hydroxybut-2-enedioic acid Chemical compound OC(=O)\C=C(\O)C(O)=O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- FVTVMQPGKVHSEY-UHFFFAOYSA-N 1-AMINOCYCLOBUTANE CARBOXYLIC ACID Chemical compound OC(=O)C1(N)CCC1 FVTVMQPGKVHSEY-UHFFFAOYSA-N 0.000 description 1
- WOXWUZCRWJWTRT-UHFFFAOYSA-N 1-amino-1-cyclohexanecarboxylic acid Chemical compound OC(=O)C1(N)CCCCC1 WOXWUZCRWJWTRT-UHFFFAOYSA-N 0.000 description 1
- NILQLFBWTXNUOE-UHFFFAOYSA-N 1-aminocyclopentanecarboxylic acid Chemical compound OC(=O)C1(N)CCCC1 NILQLFBWTXNUOE-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 1
- HGIPIEYZJPULIQ-UHFFFAOYSA-N 2-(methylazaniumyl)-2-phenylacetate Chemical compound CNC(C(O)=O)C1=CC=CC=C1 HGIPIEYZJPULIQ-UHFFFAOYSA-N 0.000 description 1
- JINGUCXQUOKWKH-UHFFFAOYSA-N 2-aminodecanoic acid Chemical compound CCCCCCCCC(N)C(O)=O JINGUCXQUOKWKH-UHFFFAOYSA-N 0.000 description 1
- QUBNFZFTFXTLKH-UHFFFAOYSA-N 2-aminododecanoic acid Chemical compound CCCCCCCCCCC(N)C(O)=O QUBNFZFTFXTLKH-UHFFFAOYSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-UHFFFAOYSA-N 2-aminohexanoic acid Chemical compound CCCCC(N)C(O)=O LRQKBLKVPFOOQJ-UHFFFAOYSA-N 0.000 description 1
- AKVBCGQVQXPRLD-UHFFFAOYSA-N 2-aminooctanoic acid Chemical compound CCCCCCC(N)C(O)=O AKVBCGQVQXPRLD-UHFFFAOYSA-N 0.000 description 1
- HASUJDLTAYUWCO-UHFFFAOYSA-N 2-aminoundecanoic acid Chemical compound CCCCCCCCCC(N)C(O)=O HASUJDLTAYUWCO-UHFFFAOYSA-N 0.000 description 1
- JVPFOKXICYJJSC-UHFFFAOYSA-N 2-azaniumylnonanoate Chemical compound CCCCCCCC(N)C(O)=O JVPFOKXICYJJSC-UHFFFAOYSA-N 0.000 description 1
- AUVALWUPUHHNQV-UHFFFAOYSA-N 2-hydroxy-3-propylbenzoic acid Chemical class CCCC1=CC=CC(C(O)=O)=C1O AUVALWUPUHHNQV-UHFFFAOYSA-N 0.000 description 1
- PKRSYEPBQPFNRB-UHFFFAOYSA-N 2-phenoxybenzoic acid Chemical compound OC(=O)C1=CC=CC=C1OC1=CC=CC=C1 PKRSYEPBQPFNRB-UHFFFAOYSA-N 0.000 description 1
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 1
- KWWFNGCKGYUCLC-UHFFFAOYSA-N 3,3-dimethyl-2-(methylamino)butanoic acid Chemical compound CNC(C(O)=O)C(C)(C)C KWWFNGCKGYUCLC-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 102100026105 3-ketoacyl-CoA thiolase, mitochondrial Human genes 0.000 description 1
- RXXCIBALSKQCAE-UHFFFAOYSA-N 3-methylbutoxymethylbenzene Chemical compound CC(C)CCOCC1=CC=CC=C1 RXXCIBALSKQCAE-UHFFFAOYSA-N 0.000 description 1
- DPDPQQHHTHKSRN-UHFFFAOYSA-N 4-aminooxane-4-carboxylic acid Chemical compound OC(=O)C1(N)CCOCC1 DPDPQQHHTHKSRN-UHFFFAOYSA-N 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 208000020576 Adrenal disease Diseases 0.000 description 1
- GNRLUBOJIGSVNT-UHFFFAOYSA-N Aminoethoxyacetic acid Chemical compound NCCOCC(O)=O GNRLUBOJIGSVNT-UHFFFAOYSA-N 0.000 description 1
- 102000004452 Arginase Human genes 0.000 description 1
- 102100021723 Arginase-1 Human genes 0.000 description 1
- 101710129000 Arginase-1 Proteins 0.000 description 1
- 108700024123 Arginases Proteins 0.000 description 1
- BMFMQGXDDJALKQ-BYPYZUCNSA-N Argininic acid Chemical compound NC(N)=NCCC[C@H](O)C(O)=O BMFMQGXDDJALKQ-BYPYZUCNSA-N 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 1
- 241000826760 Barnea Species 0.000 description 1
- 102000015735 Beta-catenin Human genes 0.000 description 1
- 108060000903 Beta-catenin Proteins 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 108090000312 Calcium Channels Proteins 0.000 description 1
- 102000003922 Calcium Channels Human genes 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- GXGJIOMUZAGVEH-UHFFFAOYSA-N Chamazulene Chemical group CCC1=CC=C(C)C2=CC=C(C)C2=C1 GXGJIOMUZAGVEH-UHFFFAOYSA-N 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 241001432959 Chernes Species 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 108010069514 Cyclic Peptides Proteins 0.000 description 1
- 102000001189 Cyclic Peptides Human genes 0.000 description 1
- DCXYFEDJOCDNAF-UWTATZPHSA-N D-Asparagine Chemical compound OC(=O)[C@H](N)CC(N)=O DCXYFEDJOCDNAF-UWTATZPHSA-N 0.000 description 1
- AGPKZVBTJJNPAG-RFZPGFLSSA-N D-Isoleucine Chemical compound CC[C@@H](C)[C@@H](N)C(O)=O AGPKZVBTJJNPAG-RFZPGFLSSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UHFFFAOYSA-N D-OH-Asp Natural products OC(=O)C(N)CC(O)=O CKLJMWTZIZZHCS-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-SCSAIBSYSA-N D-Proline Chemical compound OC(=O)[C@H]1CCCN1 ONIBWKKTOPOVIA-SCSAIBSYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UWTATZPHSA-N D-Serine Chemical compound OC[C@@H](N)C(O)=O MTCFGRXMJLQNBG-UWTATZPHSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UWTATZPHSA-N D-alanine Chemical compound C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- ODKSFYDXXFIFQN-SCSAIBSYSA-N D-arginine Chemical compound OC(=O)[C@H](N)CCCNC(N)=N ODKSFYDXXFIFQN-SCSAIBSYSA-N 0.000 description 1
- CKLJMWTZIZZHCS-UWTATZPHSA-N D-aspartic acid Chemical compound OC(=O)[C@H](N)CC(O)=O CKLJMWTZIZZHCS-UWTATZPHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-GSVOUGTGSA-N D-glutamine Chemical compound OC(=O)[C@H](N)CCC(N)=O ZDXPYRJPNDTMRX-GSVOUGTGSA-N 0.000 description 1
- ROHFNLRQFUQHCH-RXMQYKEDSA-N D-leucine Chemical compound CC(C)C[C@@H](N)C(O)=O ROHFNLRQFUQHCH-RXMQYKEDSA-N 0.000 description 1
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 1
- COLNVLDHVKWLRT-MRVPVSSYSA-N D-phenylalanine Chemical compound OC(=O)[C@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-MRVPVSSYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-STHAYSLISA-N D-threonine Chemical compound C[C@H](O)[C@@H](N)C(O)=O AYFVYJQAPQTCCC-STHAYSLISA-N 0.000 description 1
- QIVBCDIJIAJPQS-SECBINFHSA-N D-tryptophane Chemical compound C1=CC=C2C(C[C@@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-SECBINFHSA-N 0.000 description 1
- OUYCCCASQSFEME-MRVPVSSYSA-N D-tyrosine Chemical compound OC(=O)[C@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-MRVPVSSYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-SCSAIBSYSA-N D-valine Chemical compound CC(C)[C@@H](N)C(O)=O KZSNJWFQEVHDMF-SCSAIBSYSA-N 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 239000004338 Dichlorodifluoromethane Substances 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 208000017701 Endocrine disease Diseases 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- OTMSDBZUPAUEDD-UHFFFAOYSA-N Ethane Chemical compound CC OTMSDBZUPAUEDD-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 208000013875 Heart injury Diseases 0.000 description 1
- 206010019315 Heart transplant rejection Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 208000031220 Hemophilia Diseases 0.000 description 1
- 208000009292 Hemophilia A Diseases 0.000 description 1
- 206010019663 Hepatic failure Diseases 0.000 description 1
- 101000835276 Homo sapiens 3-ketoacyl-CoA thiolase, mitochondrial Proteins 0.000 description 1
- 101001080568 Homo sapiens Heat shock cognate 71 kDa protein Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000873851 Homo sapiens N(G),N(G)-dimethylarginine dimethylaminohydrolase 1 Proteins 0.000 description 1
- 101001128156 Homo sapiens Nanos homolog 3 Proteins 0.000 description 1
- 101001124309 Homo sapiens Nitric oxide synthase, endothelial Proteins 0.000 description 1
- 101001120760 Homo sapiens Olfactomedin-4 Proteins 0.000 description 1
- 101100041816 Homo sapiens SCD gene Proteins 0.000 description 1
- 101000997314 Homo sapiens Voltage-gated potassium channel subunit beta-1 Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 208000025282 Hypothalamo-pituitary disease Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 101150109636 Inos gene Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 1
- 235000000072 L-ascorbyl-6-palmitate Nutrition 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- 231100000111 LD50 Toxicity 0.000 description 1
- 206010023799 Large intestinal ulcer Diseases 0.000 description 1
- 208000007177 Left Ventricular Hypertrophy Diseases 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- 102100032352 Leukemia inhibitory factor Human genes 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 102100034104 Maestro heat-like repeat-containing protein family member 2B Human genes 0.000 description 1
- 101710091075 Maestro heat-like repeat-containing protein family member 2B Proteins 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 239000004909 Moisturizer Substances 0.000 description 1
- 101100394237 Mus musculus Hand1 gene Proteins 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- PQNASZJZHFPQLE-UHFFFAOYSA-N N(6)-methyllysine Chemical compound CNCCCCC(N)C(O)=O PQNASZJZHFPQLE-UHFFFAOYSA-N 0.000 description 1
- 102100035854 N(G),N(G)-dimethylarginine dimethylaminohydrolase 1 Human genes 0.000 description 1
- PSFABYLDRXJYID-VKHMYHEASA-N N-Methylserine Chemical compound CN[C@@H](CO)C(O)=O PSFABYLDRXJYID-VKHMYHEASA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- PSFABYLDRXJYID-UHFFFAOYSA-N N-methyl-DL-serine Natural products CNC(CO)C(O)=O PSFABYLDRXJYID-UHFFFAOYSA-N 0.000 description 1
- YAXAFCHJCYILRU-YFKPBYRVSA-N N-methyl-L-methionine Chemical compound C[NH2+][C@H](C([O-])=O)CCSC YAXAFCHJCYILRU-YFKPBYRVSA-N 0.000 description 1
- 102000006746 NADH Dehydrogenase Human genes 0.000 description 1
- 108010086428 NADH Dehydrogenase Proteins 0.000 description 1
- 102000002673 NFATC Transcription Factors Human genes 0.000 description 1
- 108010018525 NFATC Transcription Factors Proteins 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 101150074334 NOSIP gene Proteins 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 108010021487 Nitric Oxide Synthase Proteins 0.000 description 1
- 102000008299 Nitric Oxide Synthase Human genes 0.000 description 1
- 108010008858 Nitric Oxide Synthase Type I Proteins 0.000 description 1
- 102100022397 Nitric oxide synthase, brain Human genes 0.000 description 1
- 101710090055 Nitric oxide synthase, endothelial Proteins 0.000 description 1
- 101150100944 Nos2 gene Proteins 0.000 description 1
- 102100030569 Nuclear receptor corepressor 2 Human genes 0.000 description 1
- 101710153660 Nuclear receptor corepressor 2 Proteins 0.000 description 1
- 102100026071 Olfactomedin-4 Human genes 0.000 description 1
- 208000001388 Opportunistic Infections Diseases 0.000 description 1
- 206010053159 Organ failure Diseases 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000010067 Pituitary ACTH Hypersecretion Diseases 0.000 description 1
- 208000014993 Pituitary disease Diseases 0.000 description 1
- 208000020627 Pituitary-dependent Cushing syndrome Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000002151 Pleural effusion Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- RWCOTTLHDJWHRS-YUMQZZPRSA-N Pro-Pro Chemical compound OC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 RWCOTTLHDJWHRS-YUMQZZPRSA-N 0.000 description 1
- 102100038280 Prostaglandin G/H synthase 2 Human genes 0.000 description 1
- 108090000315 Protein Kinase C Proteins 0.000 description 1
- LCTONWCANYUPML-UHFFFAOYSA-M Pyruvate Chemical compound CC(=O)C([O-])=O LCTONWCANYUPML-UHFFFAOYSA-M 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 241000220010 Rhode Species 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- 101150097713 SCD1 gene Proteins 0.000 description 1
- 101150081328 Slc5a6 gene Proteins 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 102100028897 Stearoyl-CoA desaturase Human genes 0.000 description 1
- 102000014169 Steroid 21-Hydroxylase Human genes 0.000 description 1
- 108010011732 Steroid 21-Hydroxylase Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 206010047486 Virilism Diseases 0.000 description 1
- 102100034081 Voltage-gated potassium channel subunit beta-1 Human genes 0.000 description 1
- 238000001793 Wilcoxon signed-rank test Methods 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 230000002730 additional effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 210000002556 adrenal cortex cell Anatomy 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000037354 amino acid metabolism Effects 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229960004909 aminosalicylic acid Drugs 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000002424 anti-apoptotic effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 229940127088 antihypertensive drug Drugs 0.000 description 1
- 210000000702 aorta abdominal Anatomy 0.000 description 1
- 230000005756 apoptotic signaling Effects 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- RXQNHIDQIJXKTK-UHFFFAOYSA-N azane;pentanoic acid Chemical compound [NH4+].CCCCC([O-])=O RXQNHIDQIJXKTK-UHFFFAOYSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000004958 brain cell Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 210000005252 bulbus oculi Anatomy 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- YCGZGGJSAXLJFQ-SCGRZTRASA-L calcium;(2s)-2-amino-5-(diaminomethylideneamino)pentanoate Chemical compound [Ca+2].[O-]C(=O)[C@@H](N)CCCN=C(N)N.[O-]C(=O)[C@@H](N)CCCN=C(N)N YCGZGGJSAXLJFQ-SCGRZTRASA-L 0.000 description 1
- AVVIDTZRJBSXML-UHFFFAOYSA-L calcium;2-carboxyphenolate;dihydrate Chemical compound O.O.[Ca+2].OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O AVVIDTZRJBSXML-UHFFFAOYSA-L 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical group [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000003683 cardiac damage Effects 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 239000008004 cell lysis buffer Substances 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000003822 cell turnover Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 229940099112 cornstarch Drugs 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000011461 current therapy Methods 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 229960001305 cysteine hydrochloride Drugs 0.000 description 1
- 210000004292 cytoskeleton Anatomy 0.000 description 1
- 230000000254 damaging effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 125000004431 deuterium atom Chemical group 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 125000005265 dialkylamine group Chemical group 0.000 description 1
- 230000003205 diastolic effect Effects 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 230000000431 effect on proliferation Effects 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002308 embryonic cell Anatomy 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 208000030172 endocrine system disease Diseases 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940079360 enema for constipation Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000004720 fertilization Effects 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- UHCBBWUQDAVSMS-UHFFFAOYSA-N fluoroethane Chemical compound CCF UHCBBWUQDAVSMS-UHFFFAOYSA-N 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 210000003736 gastrointestinal content Anatomy 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 238000003633 gene expression assay Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 231100000722 genetic damage Toxicity 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000011331 genomic analysis Methods 0.000 description 1
- 125000005612 glucoheptonate group Chemical group 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 125000002795 guanidino group Chemical group C(N)(=N)N* 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 230000003779 hair growth Effects 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000005745 host immune response Effects 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 208000021822 hypotensive Diseases 0.000 description 1
- 230000001077 hypotensive effect Effects 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000008938 immune dysregulation Effects 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000003832 immune regulation Effects 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 239000003978 infusion fluid Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 101150032953 ins1 gene Proteins 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 238000010212 intracellular staining Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000007915 intraurethral administration Methods 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- 239000008141 laxative Substances 0.000 description 1
- 230000002475 laxative effect Effects 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 210000005240 left ventricle Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 231100000835 liver failure Toxicity 0.000 description 1
- 208000007903 liver failure Diseases 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 208000018191 liver inflammation Diseases 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 238000002824 mRNA display Methods 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000005055 memory storage Effects 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 238000005649 metathesis reaction Methods 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 210000001700 mitochondrial membrane Anatomy 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 230000001333 moisturizer Effects 0.000 description 1
- 238000000329 molecular dynamics simulation Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 230000004660 morphological change Effects 0.000 description 1
- 230000004682 mucosal barrier function Effects 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 125000005487 naphthalate group Chemical group 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000000955 neuroendocrine Effects 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 239000002687 nonaqueous vehicle Substances 0.000 description 1
- 231100001160 nonlethal Toxicity 0.000 description 1
- 238000007474 nonparametric Mann- Whitney U test Methods 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000008183 oral pharmaceutical preparation Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229920000620 organic polymer Polymers 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- VYNDHICBIRRPFP-UHFFFAOYSA-N pacific blue Chemical compound FC1=C(O)C(F)=C2OC(=O)C(C(=O)O)=CC2=C1 VYNDHICBIRRPFP-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000008855 peristalsis Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 108010042412 prolactin-inhibitory factor receptor Proteins 0.000 description 1
- 108010077112 prolyl-proline Proteins 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 239000002510 pyrogen Substances 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000003762 quantitative reverse transcription PCR Methods 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 239000013074 reference sample Substances 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 238000000611 regression analysis Methods 0.000 description 1
- 230000008263 repair mechanism Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 229940100486 rice starch Drugs 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000011519 second-line treatment Methods 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000012056 semi-solid material Substances 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 231100000075 skin burn Toxicity 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- CSMWJXBSXGUPGY-UHFFFAOYSA-L sodium dithionate Chemical compound [Na+].[Na+].[O-]S(=O)(=O)S([O-])(=O)=O CSMWJXBSXGUPGY-UHFFFAOYSA-L 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- YEENEYXBHNNNGV-XEHWZWQGSA-M sodium;3-acetamido-5-[acetyl(methyl)amino]-2,4,6-triiodobenzoate;(2r,3r,4s,5s,6r)-2-[(2r,3s,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound [Na+].CC(=O)N(C)C1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I.O[C@H]1[C@H](O)[C@@H](CO)O[C@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 YEENEYXBHNNNGV-XEHWZWQGSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000012439 solid excipient Substances 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 210000003046 sporozoite Anatomy 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000012058 sterile packaged powder Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 150000003900 succinic acid esters Chemical class 0.000 description 1
- 239000007940 sugar coated tablet Substances 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 238000006277 sulfonation reaction Methods 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- 238000011191 terminal modification Methods 0.000 description 1
- 125000001302 tertiary amino group Chemical group 0.000 description 1
- CBXCPBUEXACCNR-UHFFFAOYSA-N tetraethylammonium Chemical compound CC[N+](CC)(CC)CC CBXCPBUEXACCNR-UHFFFAOYSA-N 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- 150000003556 thioamides Chemical class 0.000 description 1
- 239000007143 thioglycolate medium Substances 0.000 description 1
- 125000005505 thiomorpholino group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 210000002303 tibia Anatomy 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 230000009258 tissue cross reactivity Effects 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- AOBORMOPSGHCAX-DGHZZKTQSA-N tocofersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-DGHZZKTQSA-N 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000006208 topical dosage form Substances 0.000 description 1
- 125000005490 tosylate group Chemical group 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- GYDJEQRTZSCIOI-LJGSYFOKSA-N tranexamic acid Chemical compound NC[C@H]1CC[C@H](C(O)=O)CC1 GYDJEQRTZSCIOI-LJGSYFOKSA-N 0.000 description 1
- 229960000401 tranexamic acid Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 229940029284 trichlorofluoromethane Drugs 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 229940100445 wheat starch Drugs 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/10—Peptides having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/07—Tetrapeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/001—Preparations to induce tolerance to non-self, e.g. prior to transplantation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0647—Haematopoietic stem cells; Uncommitted or multipotent progenitors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/998—Proteins not provided for elsewhere
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Diabetes (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Cell Biology (AREA)
- Transplantation (AREA)
- Mycology (AREA)
- Developmental Biology & Embryology (AREA)
- Dermatology (AREA)
- Urology & Nephrology (AREA)
- Oncology (AREA)
- Toxicology (AREA)
- Obesity (AREA)
Description
本出願は、「Methods for Treating Acute Radiation Syndrome」と題される、2014年9月16日に出願された米国仮出願第62/051,077号、「PIF Binding as a Marker for Immune Dysregulation」と題される、2015年2月6日に出願された米国仮出願第62/113,298号、及び「Compositions and Methods for the Treatment of Neurodamage」と題される、2015年8月28日に出願された米国仮出願第62/211,660号の優先権及び利益を主張する。各出願の内容は、それらそれぞれの全体が、参照により本明細書に組み込まれる。
本発明の様々な態様を以下に示す。
1.被ばく後の、それを必要とする対象における急性放射線症候群を治療及び/または予防する方法であって、前記対象に対してPIFペプチド、その模倣物、その薬学的に許容される塩、及びそれらの組み合わせを、治療有効量投与することを含む、方法。
2.前記対象が、骨髄移植を受けない、上記1に記載の方法。
3.前記治療有効量が、約0.10ミリグラム/キログラム/日〜約10.00ミリグラム/キログラム/日である、上記1または2に記載の方法。
4.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.50ミリグラム/キログラム/日である、上記1〜3のいずれかに記載の方法。
5.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.00ミリグラム/キログラム/日である、上記1〜4のいずれかに記載の方法。
6.前記PIFペプチドが、被ばく後約24時間以内に投与される、上記1〜5のいずれかに記載の方法。
7.前記PIFペプチドが、約2〜約14日間の期間にわたって、断続的または持続的に投与される、上記1〜6のいずれかに記載の方法。
8.前記PIFペプチドが断続的に投与され、投与レジメンが、少なくとも約12週間にわたる約1日1回または約2日毎に1回の投与を含む、上記1〜7のいずれかに記載の方法。
9.前記PIFペプチドが、静脈内、筋肉内、または皮下投与される、上記1〜8のいずれかに記載の方法。
10.前記PIFペプチドが、間欠注入または持続注入で投与される、上記1〜9のいずれかに記載の方法。
11.前記急性放射線症候群が、致死線量または亜致死線量の被ばくによって引き起こされる、上記1〜10のいずれかに記載の方法。
12.前記急性放射線症候群が、約100rad〜約6000radの放射線量に対する曝露によって引き起こされる、上記1〜11のいずれかに記載の方法。
13.前記急性放射線症候群が、任意の臓器、組織、または細胞に対する損傷を含む、急性被ばくの遅発効果を含む、上記1〜12のいずれかに記載の方法。
14.前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩のうちの1つまたはそれらの組み合わせを含む、上記1〜13のいずれかに記載の方法。
15.配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなるPIFペプチドを治療有効量含む、急性放射線病または急性放射線症候群の治療のための、薬学的組成物。
16.対象が、骨髄移植を受けない、上記15に記載の薬学的組成物。
17.前記治療有効量が、約0.10ミリグラム/キログラム/日〜約10.00ミリグラム/キログラム/日である、上記15または16に記載の薬学的組成物。
18.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.50ミリグラム/キログラム/日である、上記15〜17のいずれかに記載の薬学的組成物。
19.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.00ミリグラム/キログラム/日である、上記15〜18のいずれかに記載の薬学的組成物。
20.前記PIFペプチドが、被ばく後24時間以内に投与される、上記15〜19のいずれかに記載の薬学的組成物。
21.前記PIFペプチドが、約2〜約14日間の期間にわたって、断続的または持続的に投与される、上記15〜20のいずれかに記載の薬学的組成物。
22.前記PIFペプチドが断続的に投与され、投与レジメンが、少なくとも約12週間にわたる約1日1回または約2日毎に1回の投与を含む、上記15〜21のいずれかに記載の薬学的組成物。
23.前記PIFペプチドが、静脈内、筋肉内、または皮下投与される、上記15〜22のいずれかに記載の薬学的組成物。
24.前記PIFペプチドが、間欠注入または持続注入で投与される、上記15〜23のいずれかに記載の薬学的組成物。
25.前記急性放射線症候群が、致死線量または亜致死線量の被ばくによって引き起こされる、上記15〜24のいずれかに記載の薬学的組成物。
26.前記急性放射線症候群が、約100rad〜約6000radの放射線量に対する曝露によって引き起こされる、上記15〜25のいずれかに記載の薬学的組成物。
27.前記急性放射線症候群が、任意の臓器、組織、または細胞に対する損傷を含む、急性被ばくの遅発効果を含む、上記15〜26のいずれかに記載の薬学的組成物。
28.配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなるPIFペプチドを治療有効量含む薬学的組成物の、急性放射線病または急性放射線症候群を治療するための薬物の製造のための、使用。
29.対象が、骨髄移植を受けないか、または受けていない、上記28に記載の使用。
30.前記治療有効量が、約0.10ミリグラム/キログラム/日〜約10.00ミリグラム/キログラム/日である、上記28または29に記載の使用。
31.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.50ミリグラム/キログラム/日である、上記28〜30のいずれかに記載の使用。
32.前記治療有効量が、約0.75ミリグラム/キログラム/日〜約1.00ミリグラム/キログラム/日である、上記28〜31のいずれかに記載の使用。
33.前記PIFペプチドが、被ばく後24時間以内に投与される、上記28〜32のいずれかに記載の使用。
34.前記PIFペプチドが、約2〜約14日間の期間にわたって、断続的または持続的に投与される、上記28〜33のいずれかに記載の使用。
35.前記PIFペプチドが断続的に投与され、投与レジメンが、少なくとも約12週間にわたる約1日1回または約2日毎に1回の投与を含む、上記34に記載の使用。
36.前記PIFペプチドが、静脈内、筋肉内、または皮下投与される、上記28〜35のいずれかに記載の使用。
37.前記PIFペプチドが、間欠注入または持続注入で投与される、上記28〜36のいずれかに記載の使用。
38.前記急性放射線症候群が、致死線量または亜致死線量の被ばくによって引き起こされる、上記28〜37のいずれかに記載の使用。
39.前記急性放射線症候群が、約100rad〜約6000radの放射線量に対する曝露によって引き起こされる、上記28〜38のいずれかに記載の使用。
40.前記急性放射線症候群が、任意の臓器、組織、または細胞に対する損傷を含む、急性被ばくの遅発効果を含む、上記28〜39のいずれかに記載の使用。
41.被ばく後の急性放射線症候群を治療及び/または予防する方法であって、それを必要とする対象に1つまたは複数の骨髄細胞を移植することを含み、前記1つまたは複数の骨髄細胞が、移植前に、治療有効量のPIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選択されるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
42.前記急性放射線症候群が、致死線量または亜致死線量の被ばくによって引き起こされる、上記41に記載の方法。
43.前記急性放射線症候群が、約100rad〜約6000radの放射線量に対する曝露によって引き起こされる、上記41または42に記載の方法。
44.前記急性放射線症候群が、急性被ばくの遅発効果を含む、上記41〜43のいずれかに記載の方法。
45.PIFペプチドの前記治療有効量が、約0.10ミリグラム/キログラム/日〜約10.00ミリグラム/キログラム/日である、上記41〜44のいずれかに記載の方法。
46.前記1つまたは複数の骨髄細胞が、移植前に、前記骨髄細胞を予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記41〜45のいずれかに記載の方法。
47.前記1つまたは複数の骨髄細胞が、移植前に、前記骨髄細胞のコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記41〜46のいずれかに記載の方法。
48.前記骨髄が、PIFが約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記41〜47のいずれかに記載の方法。
49.前記対象が、最大約8週間以上、前記骨髄移植後にPIFペプチドによる追加的な治療を受けない、上記41〜48のいずれかに記載の方法。
50.成人型または若年型のI型またはII型糖尿病を治療及び/または予防する方法であって、それを必要とする対象に1つまたは複数の膵島細胞を移植することを含み、前記膵島細胞が、移植前に、治療有効量のPIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
51.前記対象が、若年型I型糖尿病を有する、上記50に記載の方法。
52.前記対象が、成人型I型糖尿病を有する、上記50または51に記載の方法。
53.前記1つまたは複数の膵島細胞が、移植前に、前記膵島細胞を移植のために予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記50〜52のいずれかに記載の方法。
54.前記1つまたは複数の膵島細胞が、移植前に、前記膵島細胞のコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記50〜53のいずれかに記載の方法。
55.前記1つまたは複数の膵島細胞が、移植前に、前記膵島細胞のインスリン分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記50〜53のいずれかに記載の方法。
56.前記1つまたは複数の膵島細胞が、約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記50〜55のいずれかに記載の方法。
57.前記対象が、最大約8週間以上、前記膵島細胞移植後にPIFペプチドによる追加的な治療を受けない、上記50〜56のいずれかに記載の方法。
58.移植された臓器、組織、または細胞の生着が成功する可能性を増加させる方法であって、それを必要とする対象に臓器、組織、または細胞を移植することを含み、前記臓器、組織、または細胞が、移植前に、PIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選ばれるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
59.前記移植が骨髄移植である、上記58に記載の方法。
60.前記移植が膵島細胞移植である、上記58に記載の方法。
61.前記移植が副腎細胞移植である、上記58に記載の方法。
62.前記移植が心臓移植である、上記58に記載の方法。
63.治療有効量のPIFペプチドが、前記移植と同時または前記移植後に、前記対象に投与され、前記PIFペプチドの前記治療有効用量が、約0.1ミリグラム/キログラム〜約10ミリグラム/キログラムである、上記58〜62のいずれかに記載の方法。
64.前記1つまたは複数の臓器、組織、または細胞が、移植前に、前記臓器、組織、または細胞を移植のために予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記58〜63のいずれかに記載の方法。
65.前記1つまたは複数の臓器、組織、または細胞が、移植前に、臓器、組織、または細胞からのコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記58〜64のいずれかに記載の方法。
66.前記1つまたは複数の膵島細胞が、移植前に、前記臓器、組織、または細胞の内因性ホルモン分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記58〜65のいずれかに記載の方法。
67.前記1つまたは複数の膵島細胞が、約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記58〜66のいずれかに記載の方法。
68.前記臓器、組織、または細胞が、骨髄細胞、皮膚細胞、副腎からの細胞、膵臓細胞、膵島細胞、胃腸細胞、脳細胞、心臓細胞、肺細胞、腎細胞、脾臓細胞、及び肝細胞から選ばれる細胞のうちの1つまたはそれらの組み合わせから選択される、上記58〜67のいずれかに記載の方法。
69.前記臓器、組織、または細胞が、骨髄、皮膚、副腎、膵臓、心臓、肺、腎臓、脾臓、及び肝臓から選ばれる臓器のうちの1つまたはそれらの組み合わせから選択される、上記58〜67のいずれかに記載の方法。
70.移植を必要とする対象に臓器、組織、または細胞を移植する前に、その生存度を増加させる方法であって、前記臓器、組織、または細胞を、移植前に、治療有効量のPIFペプチドで処理することを含み、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選ばれるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
71.対象へのドナー臓器、組織、または細胞の移植片の受け入れの可能性を増加させる方法であって、前記臓器、組織、または細胞を前記対象に移植する前に、前記臓器、組織、または細胞を、少なくとも1つのPIFペプチド、またはその変異体、またはその薬学的に許容される塩を含む1つ以上の組成物に曝露することを含む、方法。
72.生着される組織の拒絶の可能性を低減する方法であって、前記組織を対象に移植する前に、前記生着される組織を、少なくとも1つのPIFペプチド、またはその変異体、またはその薬学的に許容される塩を治療有効量含む1つ以上の薬学的組成物に曝露することを含む、方法。
73.対象における造血細胞の生産を増加させる方法であって、少なくとも1つのPIFペプチド、またはその変異体、またはその薬学的に許容される塩を治療有効量含む1つ以上の薬学的組成物を投与することを含む、方法。
74.前記造血細胞が、赤血球及び血小板からなる群から選択される、上記73に記載の方法。
75.血液障害を治療及び/または予防する方法であって、それを必要とする対象に1つまたは複数の造血細胞を移植することを含み、前記造血細胞が、移植前に、治療有効量のPIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選ばれるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
76.前記対象が、血液のがんを有するか、またはそれを有する疑いがある、上記75に記載の方法。
77.前記対象が、白血病を有するか、またはそれを有する疑いがある、上記75または76に記載の方法。
78.前記対象が、骨髄細胞及び/または血液細胞の欠乏を有するか、またはそれを有する疑いがある、上記75〜77のいずれかに記載の方法。
79.前記対象が、放射線により誘発された、骨髄細胞の欠乏を有するか、またはそれを有する疑いがある、上記75〜78のいずれかに記載の方法。
80.前記1つまたは複数の造血細胞が、移植前に、前記造血細胞を移植のために予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記75〜79のいずれかに記載の方法。
81.前記1つまたは複数の造血細胞が、移植前に、前記造血細胞からのコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記75〜80のいずれかに記載の方法。
82.前記1つまたは複数の造血細胞が、約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記75〜81のいずれかに記載の方法。
83.前記対象が、最大約8週間以上、移植後にPIFペプチドによる追加的な治療を受けない、上記75〜82のいずれかに記載の方法。
84.副腎細胞障害を治療及び/または予防する方法であって、それを必要とする対象に1つまたは複数の副腎細胞を移植することを含み、前記副腎細胞が、移植前に、治療有効量のPIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選ばれるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
85.前記対象が、先天性副腎過形成症を有するか、またはそれを有する疑いがある、上記84に記載の方法。
86.前記対象が、機能障害ホルモンの分泌の理由と関連付けられるがんを有するか、またはそれを有する疑いがある、上記84に記載の方法。
87.前記対象が、副腎の障害を有するか、またはそれを有する疑いがある、上記84に記載の方法。
88.前記対象が、下垂体の障害を有するか、またはそれを有する疑いがある、上記84に記載の方法。
89.前記1つまたは複数の副腎細胞が、移植前に、前記副腎細胞を移植のために予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記85〜88のいずれかに記載の方法。
90.前記1つまたは複数の副腎細胞が、移植前に、前記副腎細胞からのコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記85〜89のいずれかに記載の方法。
91.前記1つまたは複数の副腎細胞が、約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記85〜90のいずれかに記載の方法。
92.前記対象が、最大約8週間以上、移植後にPIFペプチドによる追加的な治療を受けない、上記85〜91のいずれかに記載の方法。
93.心臓障害または心不全を治療及び/または予防する方法であって、それを必要とする対象に1つまたは複数の心臓細胞を移植することを含み、前記心臓細胞が、移植前に、治療有効量のPIFペプチドに前曝露され、前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、配列番号29から選ばれるアミノ酸配列と少なくとも86%の配列相同性を有するアミノ酸配列、その模倣物、及びその薬学的に許容される塩、ならびにそれらの組み合わせを含むか、またはそれらからなる、方法。
94.前記対象が、鬱血性心不全を有するか、またはそれを有する疑いがある、上記93に記載の方法。
95.前記1つまたは複数の心臓細胞が、移植前に、前記心臓細胞を移植のために予備馴化させるのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記93または94に記載の方法。
96.前記1つまたは複数の心臓細胞が、移植前に、前記心臓細胞からのコルチゾール分泌を刺激するのに十分な期間及び条件の下、ある濃度のPIFペプチドに前曝露される、上記93〜95のいずれかに記載の方法。
97.前記1つまたは複数の心臓細胞が、約10nM〜約1000nMの濃度の、PIFペプチドのうちの1つまたはそれらの組み合わせに、約1時間〜約4時間前曝露される、上記93〜96のいずれかに記載の方法。
98.前記対象が、最大約8週間以上、移植後にPIFペプチドによる追加的な治療を受けない、上記93〜97のいずれかに記載の方法。
以下の材料及び方法を使用して、本明細書に記載される実験を行った。
致死線量放射線からのPIFの保護が明示された(図1A)。マウス(C57BL/6、n=36)を、低用量PIF(0.75mg/kg)または高用量PIF(1.25mg/kg)2回/日で、致死線量8Gyの照射後2時間から開始して14日間治療した。かかる被ばくは、治療を停止した後2週間で100%の生存率につながった。それとは反対に、放射線及び(PBS、ビヒクル)を受けたが、PIF治療を受けていない対照マウス(n=雄14、雌7)は、ARSを発症し、23日目までに死亡した(生存率0%)。図1Bは、グローバルWBC数が、12日目には既に非常に低いグローバルWBC数であった対照群と比較して、両方のPIF治療群において、9日目と比較して0日目に保存されたことを示す。図1Cは、PIF0.75mg/kg 2回/日(低用量、高用量:0.75mg/kg)で、8Gy放射線被ばく後2時間から開始して14日間治療された雌マウス(n=9、雄と同様の結果)からのデータを示す。上パネルは、0〜19日目に測定された免疫表現型を示す。第2のパネルは、合計の%として表された同じ免疫プロファイルを示す。第3のパネルは、詳細な赤血球指標(血球数、ヘモグロビン、ヘマトクリット、及びRBC体積)を示す。下パネルは、血小板数及び体積を有する。図1D及び1Eは、PIF治療群において、29日目、すなわちPIF投与を停止した後2週間まで測定した場合、免疫表現型、RBC、及び血小板数が保存されたことを示す。
C57BL/6マウスの生存に対する照射のsPIF効果:用量設定実験:本研究に使用されるC57BL/6マウスは、比較的放射線耐性のある株である。第1に、様々な線量(6〜10Gry)の全身照射に被ばくされたマウスにおける生存曲線を評価することによって、当実験に必要な放射線強度を決定した(図2)。6Gryへの被ばく後は、全てのマウス(n=10)が30日目に生存していたが、10Gryへの被ばく後は、全てのマウス(n=10)が30日以内に死亡した。Bは、PIFが7Gyの被ばくに続いて血小板数を改善することを示した。したがって、6Gryは、血液学的プロファイル、サイトカイン発現、及び遺伝子発現に対するsPIFの効果を決定するために、亜致死線量として定義され、10Gryは、BM移植研究の場合の致死線量として定義された。加えて、PIFは、ARS設定において最初に試験されたため、sPIFを単独療法として使用することによって、及び放射線後の感染予防において重要な役割を有する抗生物質の伝統的使用なしに、以下の研究を実行した。そのようなものとして、sPIF作用に関与した特定の機序は、明確に分析することができた。
sPIFは、治療後長期間にわたって亜致死線量の照射後に血液学的回復を促進する:亜致死線量の照射の結果として、遅い回復と関連付けられる長期的な造血抑制である。sPIFがWBCプロファイルを回復する能力を決定した(図3A)。6Gry照射後24時間の早期sPIF投与(1mg/kg/日で2週間)は、急速な回復につながり、PBS対照と比較して、総循環WBCの再構成を著しく改善した(図3B)。これは、WBCが、PBS治療群における250細胞/μLと比較して、sPIF治療群において600細胞/μLの平均値に到達した場合、照射後2週間目に既に明らかであった。かかる600WBC/μLのレベルは、これらのマウスが、この時点で既にそれほど免疫低下状態でないことを示す。特にsPIFの保護的効果は、2週間の治療を過ぎて拡大し、犠牲死の時点で治療後2週間の照射後4週間でも著しい差異が観察された(図3C)。更に、投与後2週間で、sPIFは、リンパ球数を増加させたが、循環顆粒球のパーセンテージを、正常な未治療群(対照)において観察されるレベル近くまで低減した(図3D)。それとは反対に、模擬PBS治療群において、sPIF治療群と比較して、リンパ球数はより低く、顆粒球数は著しく増加した。好中球数の低減、すなわち、適合性免疫応答において見出されるリンパ球の増加と関連付けられる炎症応答は、正常なマウスにおいて見られるものに対して、有益な回復された免疫プロファイルを反映する。リンパ球集合が、被ばくに続いて長期的に影響を受け、高い易感染性につながるため、これは特に関連している。これらの結果は、亜致死線量の被ばく後に全身免疫細胞プロファイルを回復することにおける長期的なsPIFの有効性を明示する。
短期的なsPIFは、亜致死線量の照射後に全身炎症促進性サイトカインレベルを低減する:全身炎症応答は、電離放射線に素早く追従する。したがって、6Gyまたは7Gry照射後24時間で開始し、3日間だけ投与されるsPIFの効果を調べた。(図4A)sPIFは、PBSと比較して、主要な炎症促進性サイトカインIL−2及びIL1α循環レベルの著しい低減につながった。(図4B及び4C)。加えて、正常マウスにおけるレベルと比較した場合、両方のサイトカインレベルの差異は認められなかった。他のサイトカインに対する効果は有意でなかった。これらの結果は、被ばく後早期の全身炎症環境におけるsPIFにより誘発された低減が、ARS発達からの保護において重要な役割を果たすことを示唆する。
sPIF局所及び全身保護:亜致死線量被ばく後の結腸陰窩回復を促進する:ARSは、GI炎症及び損傷を素早くもたらし、sPIFは、長期的な致死線量照射後の過酷なマウスGVHDモデルにおいてGI路潰瘍及び肝炎症を改善する。上記の実験は、sPIFが、全身炎症媒介物質を低減することにおいて保護的であり、長期的な回復につながることをインビボ及びインビトロの両方で実証した。しかしながら、PIFの効果も局所的であるかどうか、高い細胞ターンオーバーを有する結腸という臓器を標的とするかどうか、及びどれがARSによってしばしば影響を受けるかは知られていない。被ばく後24時間または48時間における亜致死線量の被ばく(6Gry)後2日間または3日間の短期的なsPIF注入は、図5Aに示されるように、結腸炎症から保護する。使用されたモデルは、sPIFが、結腸炎症を著しく低減し、結腸陰窩形態を回復したことを示す(図5B及び5C)。注目すべきことに、保護効果は、照射後48時間においてのみ、sPIF治療が開始された場合にも観察された。Dは、PIF陰窩回復が正常なマウスの場合と同様であることを示す。E.PIFは、iNOS酸化ストレス遺伝子を低減する一方で、結腸においてB7H1保護遺伝子を促進する(RTPCR)。この効果は、PIF治療が治療後48時間で開始された場合に認められた。これは、sPIFが統合された全身(造血、サイトカイン)及び局所保護の両方を発揮するという見解を支持する。
sPIFは、酸化ストレスを低減し、ミトコンドリア機能、免疫応答を調節することによって結腸回復を促進する。上記データは、sPIFが、結腸構造を回復する放射線の損傷効果を低減する一方で、全身炎症促進性免疫応答を低減して長期的な造血を可能にする、二重の局所及び全身効果を有することを示した。したがって、NOS2及びB7H1に対するRT PCR(図5D及び5E)効果及びグローバルゲノム解析(図10)の両方を使用して、主に2つの挿入項目である局所保護及び結腸機能を調べることに焦点を当てた。sPIF治療は(亜致死線量と比較して)、いくつかの経路の著しい変調をもたらした(図10)。興味深いことに、これらの遺伝子は、主に3つの群に分類され、それらは、免疫調節及びアポトーシスシグナル伝達、細胞内エネルギー移行、及び効果的な代謝機能に必要とされるタンパク質−RNA相互作用に関与し得る。最初の2つは、防御効果に関連し、後者は修復機序に関連する。
sPIFは、結腸炎症を予防し、一酸化窒素(NOS2)を下方調節し、HSP及びB7H1発現を上方調節して代謝機能を可能にする:結腸組織像(図5B)は、sPIFが、結腸陰窩を回復することによって、炎症から保護することを示した。sPIFは、肝臓及びマクロファージの両方における酸化ストレス及びeNOS(NOS2)経路を通じた一酸化窒素(NO)の形成から保護することにおいて重要な役割を果たす。sPIFは、結腸においても同様に、NOS2遺伝子発現を下方調節した(図5E)。NOSIP遺伝子を促進することによって、NOS1及びNOS3がこれらの酵素の活性を減衰するアクチン細胞骨格に転座されると、NO生成は減少した。増加したPTS(6−ピルボイルテトラヒドロプテリン合成酵素)、DDAH1、及びSPR、ならびに減少したWASL(ウィスコット・アルドリッチ症候群)遺伝子は、NOS2活性を更に制限する。加えて、NDOFA12及び6調節性ミトコンドリア膜呼吸系NADH脱水素酵素の非触媒サブユニット発現も同様に減少した。低減された酸化ストレスに加えて、sPIFはまた、sPIFによって標的されることも知られているHSPala及びHSPA8遺伝子を増加させることによって、タンパク質の誤った折り畳みを予防し、インビボでも調節される。B7H1発現によって示される局所結腸に固有の免疫系は、全身免疫性及びB7H1から独立し、結腸炎症からの主要な保護因子として報告された。注目すべきことに、sPIFは、対照と比較してB7H1遺伝子発現を促進した(図5E)。B7H1の増加は、模擬物においてより高く、強力な保護応答を示す。著しい保護は、sPIF療法が放射線後わずか48時間で開始された場合にも認められた。最高の発現遺伝子は、CFDであり、結腸損傷の結果である感染から保護する補体D因子である。これは、追加の抗アポトーシス効果を有するOLFM4の効果によって結合される。局所代謝を優先するために、SCD1及びCYP3A11及びATP5fiの上方調節は、かかる重要なタスクに必要なエネルギーを提供する。上方調節される主な遺伝子の中で、脂肪酸及び選択的アミノ酸代謝に関与するのはACAA2であり、特に果糖代謝に関与するのはKHKであった。溶質輸送に関与するSlc5a6発現も上方調節された。このデータは、sPIFにより誘発された結腸保護が、遺伝子発現を促進する増強された代謝と関連付けられることを示す。
sPIFは、致死線量の照射に続いて半同種BMT後に造血回復を増強する:高レベル(致死線量)の放射線に被ばくした患者の場合、造血幹細胞移植がルーチン的に考慮される。ドナーは、急な通知で入手可能でなければならないため、ハプロタイプ一致の同種移植が唯一のオプションであり得る。したがって、致死線量の全身照射に続いて、親から子への移植に類似する半同種BMT後の造血回復に対するsPIFの効果を評価することが決定される。移植片対宿主反応が生成される臨床状況を模倣するために、F1(C57BL/6×バルブ/c)マウスを、10Gryの全身照射に被ばくさせた後、翌日にC57BL/6BM細胞を静脈内投与した。(図6A)sPIF(1mg/kg/日)またはPBSを、Alzet浸透圧ポンプを使用し、照射後24時間から開始して2週間にわたって持続的に投与した(0.25mL/時)。臨床病態及び造血回復を、照射後4週間まで追跡した。この実験は、更に、sPIFがWBCの低減を予防するかどうか、及び/またはBM再集合回復造血においても有効であるかどうかを明示することを目的とする。BMTに続く照射後3週間で、sPIFは、PBS治療群と比較して、末梢血中の総WBCの回復を著しく増加させた(図6B)。加えて、sPIF治療は、PBS治療対照マウスと比較して、リンパ球/顆粒球比を改善した(図6C)。このWBC比は、亜致死線量の照射に続いて見出されたものと同様であった。血液学的回復に対するsPIFの効果を更に評価するために、大腿骨の組織学的検査も行った。骨髄細胞充実性における有意差は、照射後4週間、及びBMTでは治療後2週間で観察された。正常、PBS、及びPIF治療されたマウスの大腿骨からの骨髄の組織学的画像を、図6D、6E、及び6Fにそれぞれ提示する。sPIF治療群の大腿骨BM切片における脂肪細胞数は、PBS対照マウスと比較して著しく低く(図6G)、sPIF治療群におけるBM細胞の回復の改善を示す。注目すべきことに、sPIF治療群における脂肪細胞の数は、正常マウスにおいて観察されるものと同様であった。かかる観察は、致死線量の照射後に、PIFと結合されたBMTが、循環ならびに骨髄貯留部の両方を急速に回復するのを助けることができることを示す。
sPIF前治療された同種骨髄の移植は、長期的な致死線量の照射後に血液学的再構成を増強する:sPIFは免疫応答を調節する。したがって、sPIFが移植された骨髄細胞に対して、それらの生着を改善する直接的な影響を有するかどうかを調べた。あるいは、sPIFは、BMT生着を促進することによって、その免疫調節特性を受容者において発揮することによってのみ血液学的再構成につながる。かかる重要な問題に対処するために、ドナーBM細胞(同種)を、sPIFで2時間、培養物中でプレインキュベートし、次いで細胞を、移植前に洗い流した。受容者は、致死線量で(10Gry)照射され、24時間後に予備馴化されたBM移植片を移植された。追加の治療は投与されなかった。(図7A)
sPIFは、マクロファージ分化を改変する:ARSにおける免疫応答の重要性及び単球に対するsPIFの免疫調節効果を考慮して、インビトロでのマクロファージに対するsPIFの効果を試験した。PIFがマクロファージ内でB7H1を上方調節し、T細胞増殖に対する免疫調節効果を反映することを以前に示されていた。この上方調節は、活性化されたT細胞との共培養に続くsPIFプライムマクロファージが低減された増殖をもたらしたため、更に確認された。現在の実験は、亜致死線量及び致死線量の両方のARSモデルにおけるsPIFの保護効果が、マクロファージ極性のシフトに起因し、それにより電離放射線に続く炎症応答を低減するかどうかを調べることを目的とした。マクロファージは、免疫応答の重要な媒介物質であり、炎症性(M1)及び調節性(M2)マクロファージに分化し得る。したがって、C57BL/6マウスから腹腔マクロファージを入手し、それらをsPIFの存在下でM1またはM2表現型に分化させた(図8及び9)。予想通りに、sPIFは、M1分化マクロファージにおいて、iNOS(NOS2)及びCOX−2遺伝子の発現(それぞれ図8A及び8B)を著しく減少させ、M2調節性マクロファージのマーカーであるアルギナーゼ−1の発現を増強した(図8C)。追加として、FACS解析は、M2マクロファージ表現型に類似させるように、マクロファージ細胞表面CD11b及びF4/80発現の下方調節を確認した(図8D及び8E)。図9は、PIFがCD16/32及びCD206の発現をシフトすることを示し、M2へのシフトを更に証明する。集約的に、これらの結果は、sPIFが、M1/M2マクロファージを標的とすることによって、照射されたマウスにおいて免疫応答を調節し得ることを示唆する。
PIFコアペプチド配列の調査:PIFwtのインシリコドッキングは、KCNAB1(Κv1.3β)四量体の鎖Aが、3つの他の鎖よりもPIF標的となる可能性が高いことを明らかにする。ドッキングされたPIFwtのインシリコ突然変異誘発:Κv1.3βインターフェースもまた、M*RIKP*Nの重要性を明らかにするが(M1、I4、K5、P6、及びN10における突然変異が、最強のインターフェース攪乱物質である)、四量体ドメイン間で類似性を示さない。a.PIFのFlexPepDockサーバードッキングは、PIFが、鎖Aに結合する場合により安定していることを示唆した。b.突然変異時にPIF配列のどのアミノ酸が、より高いエネルギーPIF−Kv1.3P:A〜D複合体を生じ、したがってより安定性の低い構造をもたらすかを予測するために、BeatMusicサーバーを、インシリコ突然変異誘発に使用した。したがって、2つの推定突然変異体、突然変異体−1:P6→E6、及び突然変異体−3:I4→G4を想定した。c.表は、考慮される突然変異体を表し、それらのうちの2つは、リガンド−受容体攪乱物質のオプションとしてのそれらの推定の使用可能性に基づいて合成された。突然変異体1(P6→E6)は、Κv1.3βの鎖Dにより特異的であり、その形態はまた、高エネルギーの結合及びインターフェーススコアを有していた。突然変異体3(I4→G4)は、Κv1.3βの鎖Aとの結合を攪乱することが予測される。いくつかのPIF標的を使用するインシリコ突然変異誘発に関する更なる詳細を有する例もまた、RIKPがコア配列であることを示唆する。これらの突然変異体の検証を、PIF−IDEの別の標的に関して図11に示す(分化シフトアッセイに関するデータを示す)。突然変異体の検証は、図12にも示され、これはΚv1.3βに関する分化シフトアッセイデータを示す。
図14は、2週間の持続的注入及び後次の週2回の注入に続いて、sPIFが、研究の19週後の対照と比較して、ラットの体重を改善することを示した。この効果は、ビヒクル治療されたラットに対して有意であった。成長曲線は、非照射ラットと同様であった。
Claims (22)
- 被ばく後の、それを必要とする対象における急性放射線症候群を治療及び/または予防するための、治療有効量のPIFペプチドまたはその薬学的に許容される塩を含む組成物であって、
前記対象が、骨髄移植を受けず、
前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29と少なくとも約90%の配列同一性を有するアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、組成物。 - 前記治療有効量が、約0.10ミリグラム/キログラム/日〜約10.00ミリグラム/キログラム/日である、請求項1に記載の組成物。
- 前記PIFペプチドが、被ばく後約24時間以内に投与される、請求項1または2に記載の組成物。
- 前記PIFペプチドが、約2〜約14日間の期間にわたって、断続的または持続的に投与される、請求項1〜3のいずれか一項に記載の組成物。
- 前記PIFペプチドが断続的に投与され、投与レジメンが、少なくとも約12週間にわたる約1日1回または約2日毎に1回の投与を含む、請求項1〜3のいずれか一項に記載の組成物。
- 前記PIFペプチドが、静脈内、筋肉内、または皮下投与される、請求項1〜5のいずれか一項に記載の組成物。
- 前記PIFペプチドが、間欠注入または持続注入で投与される、請求項1〜6のいずれか一項に記載の組成物。
- 前記急性放射線症候群が、致死線量または亜致死線量の被ばくによって引き起こされる、請求項1〜7のいずれか一項に記載の組成物。
- 前記急性放射線症候群が、約100rad〜約6000radの放射線量に対する曝露によって引き起こされる、請求項1〜8のいずれか一項に記載の組成物。
- 前記急性放射線症候群が、任意の臓器、組織、または細胞に対する損傷を含む、急性被ばくの遅発効果を含む、請求項1〜9のいずれか一項に記載の組成物。
- 前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29のアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、請求項1〜10のいずれか一項に記載の組成物。
- 前記PIFペプチドが、被ばく後24時間以内に投与される、請求項1〜11のいずれか一項に記載の組成物。
- 被ばく後の急性放射線症候群を有する前記対象における、結腸形態又は結腸陰窩細胞形態を回復させるための、及び/または結腸傷害を逆行させるための、請求項1〜12のいずれか一項に記載の組成物。
- それを必要とする対象における急性放射線症候群に伴う胃腸(GI)管の傷害を治療するための、請求項1〜13のいずれか一項に記載の組成物。
- それを必要とする対象における急性放射線症候群に伴う胃腸(GI)管の傷害を治療するための、治療有効量のPIFペプチドまたはその薬学的に許容される塩を含む組成物であって、
前記対象が、骨髄移植を受けず、
前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29と少なくとも約90%の配列同一性を有するアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、組成物。 - 前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29のアミノ酸配列を含むもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、請求項15に記載の組成物。
- 放射線で処置された対象における結腸構造を回復させるための、治療有効量のPIFペプチドまたはその薬学的に許容される塩を含む組成物であって、
前記対象が、骨髄移植を受けず、
前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29と少なくとも約90%の配列同一性を有するアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、組成物。 - 前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29のアミノ酸配列を含むもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、請求項17に記載の組成物。
- 放射線で処置された対象における結腸陰窩細胞形態を回復させるための、治療有効量のPIFペプチドまたはその薬学的に許容される塩を含む組成物であって、
前記対象が、骨髄移植を受けず、
前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29と少なくとも約90%の配列同一性を有するアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、組成物。 - 前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29のアミノ酸配列を含むもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、請求項19に記載の組成物。
- 放射線で処置された対象における結腸傷害を逆行させるための、治療有効量のPIFペプチドまたはその薬学的に許容される塩を含む組成物であって、
前記対象が、骨髄移植を受けず、
前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29と少なくとも約90%の配列同一性を有するアミノ酸配列を含むかもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、組成物。 - 前記PIFペプチドが、配列番号1、配列番号2、配列番号3、配列番号4、配列番号6、配列番号7、配列番号10、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26、配列番号27、配列番号28、もしくは配列番号29のアミノ酸配列を含むもしくはそれからなるペプチド、またはその薬学的に許容される塩を含む、請求項21に記載の組成物。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462051077P | 2014-09-16 | 2014-09-16 | |
| US62/051,077 | 2014-09-16 | ||
| US201562113298P | 2015-02-06 | 2015-02-06 | |
| US62/113,298 | 2015-02-06 | ||
| US201562211660P | 2015-08-28 | 2015-08-28 | |
| US62/211,660 | 2015-08-28 | ||
| PCT/US2015/050532 WO2016044493A1 (en) | 2014-09-16 | 2015-09-16 | Compositions and methods for treating acute radiation syndrome |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020201734A Division JP2021046432A (ja) | 2014-09-16 | 2020-12-04 | 急性放射線症候群を治療するための組成物及び方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017529396A JP2017529396A (ja) | 2017-10-05 |
| JP2017529396A5 JP2017529396A5 (ja) | 2018-11-01 |
| JP6806685B2 true JP6806685B2 (ja) | 2021-01-06 |
Family
ID=55533820
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017534526A Active JP6806685B2 (ja) | 2014-09-16 | 2015-09-16 | 急性放射線症候群を治療するための組成物及び方法 |
| JP2020201734A Pending JP2021046432A (ja) | 2014-09-16 | 2020-12-04 | 急性放射線症候群を治療するための組成物及び方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020201734A Pending JP2021046432A (ja) | 2014-09-16 | 2020-12-04 | 急性放射線症候群を治療するための組成物及び方法 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US20170319645A1 (ja) |
| EP (1) | EP3193903A4 (ja) |
| JP (2) | JP6806685B2 (ja) |
| CN (1) | CN106999534A (ja) |
| AU (3) | AU2015317771A1 (ja) |
| CA (1) | CA2961375A1 (ja) |
| IL (2) | IL251108B (ja) |
| WO (1) | WO2016044493A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11096987B2 (en) | 2015-08-28 | 2021-08-24 | Bioincept, Llc | Mutant peptides and methods of treating subjects using the same |
| EP3341006A4 (en) | 2015-08-28 | 2019-03-13 | BioIncept LLC | COMPOSITIONS AND METHODS FOR TREATING NERVE DAMAGE |
| EP3585420A4 (en) * | 2017-02-22 | 2021-04-07 | Bioincept LLC | PEPTIDES AND METHODS OF TREATMENT OF DYSTROPHY RELATED CONDITIONS USING THEM |
| US20200246424A1 (en) * | 2017-07-17 | 2020-08-06 | Bioincept, Llc | Peptides and methods of transplantation and restorative organ function |
| WO2022047196A1 (en) * | 2020-08-28 | 2022-03-03 | Nisibis, Llc-S | Pten inhibitors for treatment and prevention of bone marrow loss |
| EP4408175A1 (en) * | 2021-10-01 | 2024-08-07 | The Regents Of The University Of Colorado, A Body Corporate | Compositions and methods for reduced toxicity in transplantation using janus kinase (jak) inhibitors |
| EP4248985A1 (en) * | 2022-03-25 | 2023-09-27 | Consejo Superior de Investigaciones Científicas (CSIC) | Peptides for the treatment of retinitis pigmentosa |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4629722A (en) * | 1984-07-12 | 1986-12-16 | Ribi Immunochem Research, Inc. | Method of inhibiting the onset of acute radiation syndrome |
| WO2005040196A2 (en) * | 2003-10-22 | 2005-05-06 | Bioincept, Llc | Pif peptides biologic activities, site of action, and the antibody to detect pif |
| US7723290B2 (en) * | 2004-10-22 | 2010-05-25 | Bioincept, Llc | Compositions and methods for modulating the immune system |
| EP2680872B1 (en) * | 2011-03-02 | 2018-08-15 | BioIncept LLC | Use of pif peptides for treating infections, atherosclerosis and peritonitis |
| EP2802338B1 (en) * | 2012-01-09 | 2018-03-07 | Serpin Pharma, LLC | Peptides and methods of using same |
| AU2014340075A1 (en) * | 2013-10-22 | 2016-05-19 | Bioincept, Llc | PIF-transfected cells and methods of use |
-
2015
- 2015-09-16 US US15/512,001 patent/US20170319645A1/en not_active Abandoned
- 2015-09-16 WO PCT/US2015/050532 patent/WO2016044493A1/en active Application Filing
- 2015-09-16 CN CN201580061796.4A patent/CN106999534A/zh active Pending
- 2015-09-16 JP JP2017534526A patent/JP6806685B2/ja active Active
- 2015-09-16 AU AU2015317771A patent/AU2015317771A1/en not_active Abandoned
- 2015-09-16 EP EP15842062.0A patent/EP3193903A4/en not_active Withdrawn
- 2015-09-16 CA CA2961375A patent/CA2961375A1/en not_active Abandoned
- 2015-09-16 IL IL251108A patent/IL251108B/en unknown
- 2015-09-16 IL IL295025A patent/IL295025A/en unknown
-
2019
- 2019-04-18 AU AU2019202741A patent/AU2019202741A1/en not_active Abandoned
-
2020
- 2020-12-04 JP JP2020201734A patent/JP2021046432A/ja active Pending
-
2021
- 2021-04-16 AU AU2021202310A patent/AU2021202310A1/en not_active Abandoned
- 2021-09-10 US US17/472,574 patent/US20220249595A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| IL251108A0 (en) | 2017-04-30 |
| JP2017529396A (ja) | 2017-10-05 |
| EP3193903A4 (en) | 2018-03-14 |
| AU2021202310A1 (en) | 2021-05-20 |
| CA2961375A1 (en) | 2016-03-24 |
| AU2015317771A1 (en) | 2017-04-06 |
| AU2019202741A1 (en) | 2019-05-16 |
| CN106999534A (zh) | 2017-08-01 |
| IL251108B (en) | 2022-08-01 |
| EP3193903A1 (en) | 2017-07-26 |
| JP2021046432A (ja) | 2021-03-25 |
| US20220249595A1 (en) | 2022-08-11 |
| IL295025A (en) | 2022-09-01 |
| US20170319645A1 (en) | 2017-11-09 |
| WO2016044493A1 (en) | 2016-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6806685B2 (ja) | 急性放射線症候群を治療するための組成物及び方法 | |
| Panel et al. | Small-molecule inhibitors of cyclophilins block opening of the mitochondrial permeability transition pore and protect mice from hepatic ischemia/reperfusion injury | |
| Kruger et al. | Prolonged cenicriviroc therapy reduces hepatic fibrosis despite steatohepatitis in a diet‐induced mouse model of nonalcoholic steatohepatitis | |
| JP7358484B2 (ja) | 併用療法 | |
| AU2016323468A1 (en) | Cenicriviroc combination therapy for the treatment of fibrosis | |
| CN105163749A (zh) | 治疗骨髓性白血病的方法 | |
| JP4545440B2 (ja) | 疾患および損傷の処置のための一酸化窒素ドナー | |
| JP2022050478A (ja) | Ilc2細胞に関連する疾患を処置する方法 | |
| WO2017082186A1 (ja) | Npr-aアゴニストの新規用途 | |
| US11096987B2 (en) | Mutant peptides and methods of treating subjects using the same | |
| US20240350580A1 (en) | Compositions and method for treating acute radiation syndrome | |
| US20240358791A1 (en) | Peptides and methods of treating dystrophy-related disorders using the same | |
| JPWO2021007245A5 (ja) | ||
| NL8700191A (nl) | Immunosuppressieve middelen, farmaceutische preparaten die ze bevatten en het toepassen van deze middelen. | |
| US20230381179A1 (en) | Methods of Treating Chronic Graft-Versus-Host Disease Following Allogeneic Hematopoietic Stem Cell Transplantation | |
| Maksymowych et al. | Amelioration of accelerated collagen induced arthritis by a novel calcineurin inhibitor, ISA (TX) 247. | |
| EP4066850A2 (en) | Peptides and methods of treating dystrophy-related disorders using the same | |
| WO2024150014A1 (en) | Medicinal products and methods for the alleviation of cancer immunotherapy-associated cytokine release syndrome | |
| WO2022016231A1 (en) | Methods of treatment | |
| WO2023164311A2 (en) | Compositions and methods of treating amyotrophic lateral sclerosis (als) and related disorders | |
| Ling et al. | Shared epitope antagonistic ligands-a new therapeutic strategy in erosive arthritis | |
| rSV40 Viral | 1041. Delayed Infusion of Hematopoietic Stem Cells Improves Engraftment after Low-Dose Parenterally Administered Busulfan in a Congenic Murine Transplant Model | |
| Badiwala et al. | 489: Cilostazol as an Adjunct to Cyclosporine Prevents Neointimal Hyperplasia after Vascular Injury | |
| JP2002535283A (ja) | 進行中の急性同種移植片拒絶反応を抑制する方法 | |
| Fingerhut et al. | 3 Deazaadenosin prevents leukocyte evasion by suppression of adhesion molecule expression during acute cardiac allograft rejection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20170901 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20170901 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180918 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180918 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190716 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191016 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200331 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200624 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200930 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20201104 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20201204 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6806685 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |