JP5951627B2 - 一酸化炭素含有ガス状基質の発酵の操作方法 - Google Patents
一酸化炭素含有ガス状基質の発酵の操作方法 Download PDFInfo
- Publication number
- JP5951627B2 JP5951627B2 JP2013541975A JP2013541975A JP5951627B2 JP 5951627 B2 JP5951627 B2 JP 5951627B2 JP 2013541975 A JP2013541975 A JP 2013541975A JP 2013541975 A JP2013541975 A JP 2013541975A JP 5951627 B2 JP5951627 B2 JP 5951627B2
- Authority
- JP
- Japan
- Prior art keywords
- clostridium
- bioreactor
- uptake
- microorganisms
- specific
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/40—Preparation of oxygen-containing organic compounds containing a carboxyl group including Peroxycarboxylic acids
- C12P7/54—Acetic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M21/00—Bioreactors or fermenters specially adapted for specific uses
- C12M21/04—Bioreactors or fermenters specially adapted for specific uses for producing gas, e.g. biogas
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M21/00—Bioreactors or fermenters specially adapted for specific uses
- C12M21/12—Bioreactors or fermenters specially adapted for specific uses for producing fuels or solvents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M27/00—Means for mixing, agitating or circulating fluids in the vessel
- C12M27/02—Stirrer or mobile mixing elements
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M29/00—Means for introduction, extraction or recirculation of materials, e.g. pumps
- C12M29/04—Filters; Permeable or porous membranes or plates, e.g. dialysis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M29/00—Means for introduction, extraction or recirculation of materials, e.g. pumps
- C12M29/18—External loop; Means for reintroduction of fermented biomass or liquid percolate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/06—Ethanol, i.e. non-beverage
- C12P7/065—Ethanol, i.e. non-beverage with microorganisms other than yeasts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/16—Butanols
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E50/00—Technologies for the production of fuel of non-fossil origin
- Y02E50/10—Biofuels, e.g. bio-diesel
Description
適切な栄養素と微量のミネラルを含有する培地に一酸化炭素を含むガス状基質の微生物発酵から、クロストリジウム(Clostridium)属由来のもの等の一定の微生物を用いて有機酸、例えば酢酸及びアルコール、例えばエタノール等の化学薬品を生産する方法は実証されている。例えば、Gaddyらの米国特許第5,173,429号は、合成ガスからエタノールとアセタートを生産する嫌気性微生物であるクロストリジウム・リュングダーリイ(Clostridium ljungdahlii)ATCC第49587号を開示している。Gaddyらの米国特許第5,807,722号は、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)ATCC第55380号等の嫌気性細菌を用いて廃ガスを有機酸及びアルコール等の有用な製品に変換するための方法及び装置を開示している。Gaddyらの米国特許第6,136,577号は、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)ATCC第55988号及び第55989号等の嫌気性細菌を用いて廃ガスを有機酸及びアルコール(特にエタノール)等の有用な製品に変換するための方法及び装置を開示している。
米国特許出願第20070275447号は、廃ガスからバイオ燃料として有用な製品を合成できるクロストリジウム細菌種(クロストリジウム・カルボキシジボランス(Clostridium carboxidivorans)、ATCC BAA-624、「P7」)を開示している。米国特許第7,704,723号は、廃ガスからバイオ燃料として有用な製品を合成できるクロストリジウム細菌種(クロストリジウム・ラグスダレイ(Clostridium ragsdalei),ATCC BAA-622,「P11」)を開示している。
WO 2007/117157は、一酸化炭素を含有する基質の嫌気性発酵によるエタノール生産のためのクロストリジウム・オートエタノゲナム(Clostridium autoethanogenum)(受け入れ番号DSM 10061、DSMZ、独国)の使用を開示している。WO 2009/064200は、一酸化炭素を含有する基質の嫌気性発酵によるエタノール生産のための別の細菌(クロストリジウム・オートエタノゲナム(Clostridium autoethanogenum)、受け入れ番号DSM 19630、DSMZ、独国)を開示している。
Gaddyの米国特許第6,136,577号は、細胞再循環を利用して細胞密度を高める発酵プロセスでエタノールを生産するプロセスを開示している。
Gaddyらの米国特許第7,285,402号は、過剰のH2が存在した保存培養を用いてスタートアップ中に細胞密度を高める方法が存在するアルコール生産のための嫌気性微生物発酵プロセスを開示している。
保存培養からのバッチ接種材料を用いるスタートアップは、混入物のない健康な接種材料を保証するが、特に接種直後にガス速度及び撹拌速度等の方法パラメーターが非常に急激に押し上げられる場合には、むしろ低い細胞密度が利用されるため、接種手順として常に成功するわけではない。
本開示は、一酸化炭素(CO)を含むガス状基質をバイオリアクター内の水性培地中に発酵させる工程を含んでなる、ガス状基質から1種以上のアルコールを生産する方法であって、前記水性培地内で特定CO取込みを調整することによって細胞密度を高める工程を含み、ここで特定CO取込みの変化速度はCOの流入(インプット)速度を制御する工程を含み、ここで特定CO取込みの変化速度はCO流入(インプット)速度を測定する工程;CO流出(アウトプット)速度を測定する工程;及び細胞質量を測定する工程を含み;さらに所定量で特定CO取込みを変える工程を含み;場合により、前記所定量は約0.001〜約10.0ミリモル/分/グラム(乾燥細胞)の範囲を含み;前記所定量は約0.01〜約5.0ミリモル/分/グラム(乾燥細胞)の範囲を含み;前記所定量は約0.1〜約1.0ミリモル/分/グラム(乾燥細胞)の範囲を含む;さらに水性培地の流れをバイオリアクターに加える工程;バイオリアクターから発酵ブロスの流れを除去する工程を含み;さらに水性培地の連続流れをバイオリアクターに加える工程;バイオリアクターから発酵ブロスの連続流れを除去する工程を含み(場合により、前記水性培地は、生物学的に純粋な微生物、天然微生物、非天然微生物、遺伝子修飾により生成された非天然微生物、天然微生物のミュータント、非天然微生物のミュータント、組換え微生物、遺伝子操作された微生物、人工的に合成された微生物を含めた1種以上の微生物を含み;前記バイオリアクターは1つ以上のバイオリアクターを含み;前記バイオリアクターは細胞再循環装置を含み;前記CO含有基質は水素を含む);さらに前記バイオリアクターに栄養培地を加える工程を含む方法を提供する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含んでなる、ガス状基質の発酵方法であって、目標とする特定CO取込みを選択する工程;特定CO取込みが、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、細胞密度を測定する工程;ガス状基質の流入を調整して細胞密度を高める工程;特定CO取込みを約0.001〜約10.0ミリモル/分/グラム(乾燥細胞)の範囲の所定量で変える工程を含む方法を提供する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、目標とする特定CO取込みを選択する工程;特定CO取込みが、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
実施形態として、本開示の前記微生物は、生物学的に純粋な微生物、天然微生物、非天然微生物、遺伝子修飾により生成された非天然微生物、天然微生物のミュータント、非天然微生物のミュータント、組換え微生物、遺伝子操作された微生物、人工的に合成された微生物を含めた1種以上の微生物を含み;場合により、前記微生物は、下記から選択されるものを含む:アセトゲニウム・キブイ(Acetogenium kivui)、アセトバクテリウム・ウッディイ(Acetobacterium woodii)、アセトアネロビウム・ノテラエ(Acetoanaerobium noterae)、ブチリバクテリウム・メチロトロフィクム(Butyribacterium methylotrophicum)、カルダナエロバクター・サブテラネウス(Caldanaerobacter subterraneus)、カルダナエロバクター・サブテラネウス・パシフィカム(Caldanaerobacter subterraneus pacificus)、カルボキシドサーマス・ヒドロゲノホルマンス(Carboxydothermus hydrogenoformans)、クロストリジウム・アセティクム(Clostridium aceticum)、クロストリジウム・アセトブチリクム(Clostridium acetobutylicum)、クロストリジウム・オートエタノゲナム(Clostridium autoethanogenum)(DSM 23693)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 19630)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 10061)、クロストリジウム・サーモアセチカム(Clostridium thermoaceticum)、ユウバクテリウム・リモサム(Eubacterium limosum)、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)PETC(ATCC 49587)、クロストリジウム・リュングダーリイERI2(ATCC 55380)、クロストリジウム・リュングダーリイC-01(ATCC 55988)、クロストリジウム・リュングダーリイO-52(ATCC 55889)、クロストリジウム・ウルツネンス(Clostridium ultunense)、クロストリジウム・ラグスダレイ(Clostridium ragsdalei)P11(ATCC BAA-622)、アルカリバクルム・バッキ(Alkalibaculum bacchi)CP11(ATCC BAA-1772)、クロストリジウム・コスカチイ(Clostridium coskatii)、クロストリジウム・カルボキシディボランス(Clostridium carboxidivorans)P7(ATCC PTA-7827)、ゲオバクター・スルフレデュセンス(Geobacter sulfurreducens)、ムーレラ・サーモアセチカ(Moorella thermacetica)、ペプトストレプトコッカス・プロダクツス(Peptostreptococcus productus)、クロストリジウム・ドラケイ(Clostridium drakei)、組換え微生物(DSM 24138)、及びその混合物。
本開示の方法の実施形態として、前記微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株から選択される宿主生物に1つ以上の選択遺伝子を挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
本開示の方法の実施形態として、前記微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株由来の1つ以上の遺伝子をいずれかの宿主生物に挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
本開示の方法の実施形態として、前記バイオリアクターは1つ以上のバイオリアクターを含み;場合により、前記バイオリアクターは細胞再循環装置を含み;場合により、前記CO含有基質は水素を含む。
実施形態として、前記バイオリアクターに栄養培地を加える工程をさらに含む。
特に定義しない限り、本開示のこの明細書全体を通じて使用する下記用語は、以下のように定義され、下記定義の単数形又は複数形のどちらも包含し得る。
いずれの量をも修飾する用語「約」は、微生物培養を維持する実世界条件、例えば、研究室、パイロットプラント、又は生産施設で遭遇する当該量の変動を表す。例えば、「約」で修飾されている場合、混合物又は含量で用いられる成分量又は測定量は、生産プラント又は研究室の実験条件で測定する際に典型的に採用される管理の変動及び程度を包含する。例えば、産物の成分の「約」で修飾された量は、プラント又は研究室における複数の実験のバッチ間の変動及び分析方法に固有の変動を包含する。「約」による修飾の有無にかかわらず、量は、当該量に等価な量を包含する。本明細書に記載の「約」で修飾されたいずれの含量も、本明細書では「約」で修飾されない量として採用することもできる。
用語「アセトゲン(acetogen)」又は「酢酸生成(acetogenic)」は、嫌気性呼吸の産物としてアセタートを生成する細菌を指す。これらの微生物は、既知のアセトゲンが全て細菌であることから、酢酸生成菌とも呼ばれる。アセトゲンは、一般的に嫌気性(酸素を欠く)様々な生息地で見られる。アセトゲンはエネルギー源及び炭素源として種々の化合物を使用することができ;酢酸生成代謝物の最良の研究形態は、炭素源として二酸化炭素の使用及びエネルギー源として水素の使用を含む。
用語「バイオリアクター」、「リアクター」、又は「発酵バイオリアクター」には、1つ以上の容器及び/又は塔又は配管から成る発酵装置が含まれ、連続撹拌槽型反応器(Continuous Stirred Tank Reactor)(CSTR)、気泡塔(Bubble Column)、ガスリフト発酵槽(Gas lift Fermenter)、静的ミキサー(Static Mixer)、又は気液接触に適した他の装置が挙げられる。この開示の方法では、発酵バイオリアクターは、発酵ブロスを第2の発酵バイオリアクターに供給する成長リアクターを含み、この中で産物エタノールのほとんどが生成される。
用語「細胞密度」は、発酵ブロスの単位体積当たりの微生物の質量、例えば、g/リットルを意味する。
用語「細胞再循環」は、発酵ブロス内の固体微生物細胞から液体(パーミエート(permeate))を分離し、前記分離された固体微生物細胞の全て又は一部を、前記微生物を用いて前記発酵ブロスを生成した発酵槽に戻す配置を意味する。一般的にろ過装置を用いて前記分離を達成する。パーミエートストリームのない固体微生物のストリーム及び濃縮した固体微生物のストリームがろ過装置から生成される。パーミエートストリームのない固体は、規定粒径未満の固体粒子を含有し得る。
用語「転化率」は、産物に変換される流入量の割合を意味し;これは下記方程式で表される:(流入量−流出量)/(流入量)。
用語「エタノール生産性」は、1日当たりの発酵槽の単位体積毎に生産されるエタノールの量を意味する。発酵槽体積は、発酵槽内の有効容積又は液体体積である。
用語「発酵ブロス」は、発酵培地の組成が、発酵ブロスに最終的に含まれることになるいずれをも含むことを意味し、原基質、発酵産物、微生物と微生物由来成分、化学的添加剤、栄養素、ガスが含まれる。発酵ブロス内には3つの全ての主要相、すなわち固相、液相及び気相並びにそれらの可能な相互作用が存在する。
用語「遺伝子」はDNAのセグメントを意味し;コードDNAに先行する領域及びコードDNAに続く領域並びにエクソン間のイントロンを含み;遺伝の単位であり;この開示では、用語「遺伝子」には、表現型/機能に寄与するDNAセグメント;細胞がRNAに転写し、少なくとも部分的にタンパク質に翻訳するDNAのセグメント;A、T、C、及びGの組合せで構成される塩基の配列(ストリング)が含まれる。一般的に、この開示で与えられる場合、定義は単数又は複数の意味を表し得る。
用語「特定CO取込み」は、分の単位時間当たりに微生物の単位質量(g)によって消費されるミリモルのCOの量、すなわち、ミリモル/g/分を意味する。
用語「基質」は、酵素又は微生物により作用されると発酵産物を生成する物質を意味する。例えば、酵素による糖発酵では糖がエタノールを生成し、微生物によるシンガス発酵ではCO、CO2及びH2の1種以上が1種以上のカルボン酸及びアルコールを生成する。
用語「シンガス」又は「合成ガス」は、様々な量の一酸化炭素と水素を含有するガス混合物に与えられる名称である合成ガスを意味する。生産方法の例には天然ガス又は炭化水素の水蒸気改質、石炭のガス化及びある種の廃棄物エネルギー転換ガス化設備(waste-to-energy gasification facilities)でのガス化がある。この名称は、合成天然ガス(SNG)の製造において及びアンモニア又はメタノールの生産のための中間体としてのそれらの用途に由来している。シンガスは、燃料又は潤滑油として使用するための合成石油のフィッシャー・トロプシュ合成経由の製造及び以前のMobil社のメタノールからガソリンへの変換プロセスにおいても中間体として用いられる。シンガスは、主に水素と、一酸化炭素と、多くの場合いくらかの二酸化炭素とから成なる。
本開示は、一酸化炭素(CO)を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、前記水性培地内の1種以上の前記微生物の特定CO取込みを調整することによって細胞密度を高める工程を含み(場合により、特定CO取込みの変化速度は、下記工程:COの流入速度を制御する工程;CO流入速度を測定する工程;CO流出速度を測定する工程;細胞質量を測定する工程;の1以上を調整及び/又は制御する工程を含み);さらに、所定量内で特定CO取込みを変える工程(場合により、前記所定量は約0.001〜約10.0ミリモル/分/グラム(乾燥細胞)の範囲を含み;必要に応じて一実施形態では、前記所定量は約0.01〜約5.0ミリモル/分/グラム(乾燥細胞)の範囲及び/又は約0.1〜約1.0ミリモル/分/グラム(乾燥細胞)の範囲を含み;一実施形態は必要に応じてバイオリアクターに水性培地の連続流れを加える工程;前記バイオリアクターから発酵ブロスの連続流れを除去する工程を含み;ここで、約1〜約50g/Lの範囲の所望エタノール生産性を得るまで前記工程を繰り返す(一実施形態では、必要に応じてバイオリアクターに水性培地の連続流れを加え;前記バイオリアクターから発酵ブロスの連続流れを除去し;ここで、発酵ブロス内で約1〜約50g/Lの範囲の所望エタノール濃度を得るまで前記工程を繰り返す)方法を提供する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、目標とする特定CO取込みを選択する工程;特定CO取込みが、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程を含む方法を開示する。
実施形態として、本開示は、一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約0.1〜約15g/Lの範囲の所望細胞密度を達成するまで前記工程を繰り返す工程;前記所望細胞密度を達成したらすぐに連続操作モードに変換する工程を含む方法を開示する。
実施形態として、前記微生物は、下記から選択されるものを含む:アセトゲニウム・キブイ(Acetogenium kivui)、アセトバクテリウム・ウッディイ(Acetobacterium woodii)、アセトアネロビウム・ノテラエ(Acetoanaerobium noterae)、ブチリバクテリウム・メチロトロフィクム(Butyribacterium methylotrophicum)、カルダナエロバクター・サブテラネウス(Caldanaerobacter subterraneus)、カルダナエロバクター・サブテラネウス・パシフィカム(Caldanaerobacter subterraneus pacificus)、カルボキシドサーマス・ヒドロゲノホルマンス(Carboxydothermus hydrogenoformans)、クロストリジウム・アセティクム(Clostridium aceticum)、クロストリジウム・アセトブチリクム(Clostridium acetobutylicum)、クロストリジウム・オートエタノゲナム(Clostridium autoethanogenum)(DSM 23693)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 19630)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 10061)、クロストリジウム・サーモアセチカム(Clostridium thermoaceticum)、ユウバクテリウム・リモサム(Eubacterium limosum)、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)PETC(ATCC 49587)、クロストリジウム・リュングダーリイERI2(ATCC 55380)、クロストリジウム・リュングダーリイC-01(ATCC 55988)、クロストリジウム・リュングダーリイO-52(ATCC 55889)、クロストリジウム・ウルツネンス(Clostridium ultunense)、クロストリジウム・ラグスダレイ(Clostridium ragsdalei)P11(ATCC BAA-622)、アルカリバクルム・バッキ(Alkalibaculum bacchi)CP11(ATCC BAA-1772)、クロストリジウム・コスカチイ(Clostridium coskatii)、クロストリジウム・カルボキシディボランス(Clostridium carboxidivorans)P7(ATCC PTA-7827)、ゲオバクター・スルフレデュセンス(Geobacter sulfurreducens)、ムーレラ・サーモアセチカ(Moorella thermacetica)、ペプトストレプトコッカス・プロダクツス(Peptostreptococcus productus)、クロストリジウム・ドラケイ(Clostridium drakei)、組換え微生物(DSM 24138)、及びその混合物。
本開示の方法の実施形態として、前記微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株から選択される宿主生物に1つ以上の選択遺伝子を挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
本開示の方法の実施形態として、前記微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株由来の1つ以上の遺伝子をいずれかの宿主生物に挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
本開示の方法の実施形態として、前記バイオリアクターは1つ以上のバイオリアクターを含み;場合により、前記バイオリアクターは細胞再循環装置を含み;場合により、前記CO含有基質は水素を含む。
実施形態として、前記バイオリアクターに栄養培地を加える工程をさらに含む。
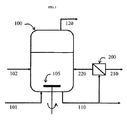
パーミエートストリーム(210)は、前記細胞再循環装置から前記化学薬品の回収プロセスに向けられる。一実施形態では、発酵槽ブロスのストリーム(110)の少なくとも一部が前記アルコール産物混合物の回収プロセスに向けられる。一実施形態では、発酵ブロスのストリーム(210)の少なくとも一部が前記アルコール産物混合物の回収プロセスに向けられる。
一実施形態では、バイオリアクター(100)は、ガス状基質を含むガスストリームの液体発酵培地との接触を容易にし、かつ液体発酵培地とのガス状基質の質量移動を促進するために撹拌を与えるための撹拌器(105)を備えている。発酵プロセスの間ずっとバイオリアクター内で良い質量移動、ひいては十分な撹拌があることが望ましい。
バイオリアクターに導入されたガス状基質を含むガスストリーム(101)及びバイオリアクターを去るオフガス(120)のサンプルを収集するための配置がある(図1には示さず)。バイオリアクターの発酵ブロスのサンプルを収集するための配置がある(図1には示さず)。
前記ガスサンプル及び液体サンプルを間隔をあけて収集し、種々のガス成分消費又は生成、種々の産物の生成及び発酵ブロスの光学密度について分析する。
これらの測定値を用いて、下記方程式を利用してバイオリアクター内の発酵ブロス中の特定一酸化炭素(CO)取込み(SCU)及び細胞密度を計算することができる。
CO取込み(ミリモル/分)=(CO流入(ミリモル/分))−(CO流出(ミリモル/分)) (1)
細胞密度(g/L)=(光学密度)・(希釈係数)・(細胞質量定数) (2)
細胞質量(g)=(細胞密度)・(バイオリアクターの容積) (3)
特定CO取込み(ミリモル/分/g)=(CO取込み)/(細胞質量) (4)
細胞密度は、発酵ブロスの単位体積当たりの細胞の質量である。バイオリアクターの容積は、撹拌を止めたときのバイオリアクター内の液体の体積である。細胞質量定数は、光学密度が1の発酵ブロス1リットル当たりの乾燥細菌細胞の質量(g)である。光学密度は、生理食塩水等の適切な溶媒で発酵ブロスを希釈した後に得たサンプルの光学密度である。
本開示の方法で使用する微生物は、1種以上の天然嫌気性酢酸生成細菌を含んでよく;1種以上の非天然嫌気性酢酸生成細菌を含んでよく;宿主生物として嫌気性酢酸生成細菌を用いる遺伝子修飾により生成された1種以上の非天然嫌気性酢酸生成細菌を含んでよく;嫌気性酢酸生成細菌の遺伝子を宿主生物に挿入することにより生成された1種以上の非天然嫌気性酢酸生成細菌を含んでよい。
本開示の方法で使用する微生物は、下記から選択される1種以上の細菌を含んでよい:アセトゲニウム・キブイ(Acetogenium kivui)、アセトバクテリウム・ウッディイ(Acetobacterium woodii)、アセトアネロビウム・ノテラエ(Acetoanaerobium noterae)、ブチリバクテリウム・メチロトロフィクム(Butyribacterium methylotrophicum)、カルダナエロバクター・サブテラネウス(Caldanaerobacter subterraneus)、カルダナエロバクター・サブテラネウス・パシフィカム(Caldanaerobacter subterraneus pacificus)、カルボキシドサーマス・ヒドロゲノホルマンス(Carboxydothermus hydrogenoformans)、クロストリジウム・アセティクム(Clostridium aceticum)、クロストリジウム・アセトブチリクム(Clostridium acetobutylicum)、クロストリジウム・オートエタノゲナム(Clostridium autoethanogenum)(DSM 23693)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 19630)、クロストリジウム・オートエタノゲナム(DSMZ独国のDSM 10061)、クロストリジウム・サーモアセチカム(Clostridium thermoaceticum)、ユウバクテリウム・リモサム(Eubacterium limosum)、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)PETC(ATCC 49587)、クロストリジウム・リュングダーリイERI2(ATCC 55380)、クロストリジウム・リュングダーリイC-01(ATCC 55988)、クロストリジウム・リュングダーリイO-52(ATCC 55889)、クロストリジウム・ウルツネンス(Clostridium ultunense)、クロストリジウム・ラグスダレイ(Clostridium ragsdalei)P11(ATCC BAA-622)、アルカリバクルム・バッキ(Alkalibaculum bacchi)CP11(ATCC BAA-1772)、クロストリジウム・コスカチイ(Clostridium coskatii)、クロストリジウム・カルボキシディボランス(Clostridium carboxidivorans)P7(ATCC PTA-7827)、ゲオバクター・スルフレデュセンス(Geobacter sulfurreducens)、ムーレラ・サーモアセチカ(Moorella thermacetica)、ペプトストレプトコッカス・プロダクツス(Peptostreptococcus productus)、クロストリジウム・ドラケイ(Clostridium drakei)、組換え微生物(DSM 24138)、及びその混合物。
一実施形態では、本開示の方法で使用する微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株から選択される宿主生物に1つ以上の選択遺伝子を挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
一実施形態では、本開示の方法で使用する微生物は、いずれかのクロストリジウム・リュングダーリイ株、又はいずれかのクロストリジウム・ラグスダレイ株、又はいずれかのクロストリジウム・カルボキシディボランス株、又はいずれかのクロストリジウム・オートエタノゲナム株由来の1つ以上の遺伝子をいずれかの宿主生物に挿入することにより生成された1種以上の遺伝子修飾微生物を含む。
一実施形態では、細胞密度が目標とする細胞密度未満である場合、本方法は、目標とする特定CO取込みを選択する工程及び特定CO取込みが前記目標とするCO取込みに等しくなるまで、ガス状基質を含むガスストリームの流れを調整する工程;並びに目標とする特定CO取込みを選択する工程及び特定CO取込みが前記目標とするCO取込みに等しくなるまで、ガス状基質を含むガスストリームの流れを調整する工程を繰り返す工程を含む。
前記特定CO取込みの値は、乾燥微生物1グラム当たり毎分約0.1〜約10.0ミリモルのCOの範囲を含み得る。前記所望特定CO取込みの値は、約0.1〜約10ミリモル/分/gの範囲を含み得る。
前記目標とする細胞密度の値は、約0.1〜約50g/Lの範囲を含み得る。前記目標とする細胞密度の値は、0.5〜50g/Lの範囲を含み得る。
前記所望エタノール生産性の値は、1〜50g/L/日の範囲を含む。
発酵ブロス内の前記所望エタノール濃度の値は、1〜20g/Lの範囲を含む。
典型的にNew Brunswick Bioflow Iバイオリアクター等の研究室規模のバイオリアクターでは、毎分300〜900回転(rpm)の範囲の撹拌速度が、望ましい質量移動速度に適した十分な撹拌を与える。一実施形態では、500〜700rpmの範囲の撹拌速度を用いる。一実施形態では、550〜650rpmの撹拌速度を用いる。一実施形態では、約600rpmの撹拌速度を用いる。
約100〜500リットルサイズのバイオリアクター等の大規模バイオリアクターの実施形態では、撹拌のために約50〜約500rpmの範囲の撹拌速度を用いる。約100,000〜約1000,000リットルサイズの商業規模バイオリアクターの実施形態では、撹拌のために約1〜約50rpmの範囲の撹拌速度を用いる。種々の実施形態において、より大きいバイオリアクターは、より小さいバイオリアクターに比べて小さいrpmを必要とする。
本開示の方法の一実施形態では、前記バイオリアクターは1つのリアクターを含む。本開示の方法の一実施形態では、前記バイオリアクターは2つ以上のリアクターを含む。
本開示の方法の一実施形態では、前記バイオリアクターは細胞再循環装置を含む。
本開示の方法の一実施形態では、COを含むガス状基質を含んでなる前記ガスストリームは水素をも含む。一実施形態では、COを含むガス状基質を含んでなる前記ガスストリームはシンガスを含む。一実施形態では、COを含むガス状基質を含んでなる前記ガスストリームは製鋼所オフガスを含む。一実施形態では、COを含むガス状基質を含んでなる前記ガスストリームは、バイオマスを含む炭素質材料のガス化により得られたシンガスを含む。
一実施形態では、1つ以上の成長発酵槽又は種発酵槽が接種材料の細菌細胞の初期供給を与える。一実施形態では、1つ以上の成長発酵槽又は種発酵槽はこの開示の方法と関連してバイオリアクターに細菌細胞を供給し続ける。本開示の一実施形態では、方法は細胞再循環を含む。
一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなるアルコール産物混合物の生産方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;約1〜約50g/Lの範囲の所望エタノール生産性を得るまで前記工程を繰り返す工程を含み;さらに、水性培地の連続流れをバイオリアクターに加える工程;前記バイオリアクターから発酵ブロスの連続流れを除去する工程を含む方法。
一酸化炭素を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなるアルコール産物混合物の生産方法であって、約0.01〜約10ミリモル/分/グラム(乾燥細胞)の範囲の、目標とする特定CO取込みを選択する工程、特定CO取込みが前記目標とする特定CO取込みに等しくなるようにガス状基質の流れを調整する工程;発酵ブロス内で約1〜約50g/Lの範囲の所望エタノール濃度を達成するまで前記工程を繰り返す工程を含み;さらに、水性培地の連続流れをバイオリアクターに加える工程;前記バイオリアクターから発酵ブロスの連続流れを除去する工程を含む方法。
本開示は、一酸化炭素(CO)を含むガス状基質をバイオリアクター内の水性培地中に加える工程を含み;前記水性培地が1種以上の微生物を含んでなる、ガス状基質の発酵方法であって、細胞密度を測定する工程;COの流入速度及びCOの流出速度を測定する工程;特定CO取込みを決定する工程;特定CO取込みが所定量で変化するように、COの流入速度を調整して細胞密度を高める工程;必要に応じてこれらの行為を繰り返す工程を含む方法を提供する。
栄養培地は、選択微生物の成長を可能にする1種以上のビタミン及びミネラルを含有し得る微生物成長培地を含む。表1は、本開示が企図する栄養培地の実施形態を提供する。
本開示に適した他の栄養培地は技術上周知である。
さらに、当技術分野では開示されていないが、表1に記載の種々の成分から導かれる栄養培地を本発明で利用することができる。本開示は、栄養培地の改良された組成を提供する。
*Na+濃度はNaCl由来のみである。それはNa2WO4・2H2O等の他成分由来のNa+を含まない。
**Ca+濃度はパントテン酸、カルシウム塩(すなわちd-パントテン酸カルシウム)由来のカルシウムを含まない。
リアクターの接種用の保存培養を調製するため、クロストリジウム・リュングダーリイ(Clostridium ljungdahlii)、株C-01(ATCC受け入れ番号55988)の培養を150mLの血清ボトル内、CO、C02及びH2上、塩及びビタミン中、1g/Lの酵母エキスと1g/Lのトリプチケース(trypticase)を含む富栄養培地内で成長させた。採用したビタミン濃度は、50.5mg/Lのパントテン酸カルシウム、20.6mg/Lのd-ビオチン及び50.6mg/LのチアミンHC1を含む水溶液の培地に対して0.4mL/Lであった。シェーカーインキュベーター内37℃でボトルをインキュベートした。視覚検査により判定しながら、培養を指数増殖期まで成長させた。各接種ごとに、約90mLの保存培養を血清ボトルから1リットルの培地に移し、9体積%の接種となった。成功した接種については後述する。概要を述べた手順を数回繰り返すと接種に成功し得る。
接種に成功したときは、0.4mL/Lのビタミンと塩を含む基本培地の1リットルのバッチに90mL/Lの接種材料を添加した(t=0)。撹拌速度は240rpm、pHは5.3、温度は38.5℃、ガス保持時間(連続ガス流)は110分であった。ガス供給原料は62%のH2、31%のCO及び7%のC2H6を含有した。13時間後(t=13時間)に一部のCO変換に気づき、t=23時間で撹拌速度を240rpmから300rpmに上げた。t=27時間でガス保持時間を100分に減らし、t=46時間でガス保持時間をさらに減らした。t=28時間、59時間、72時間及び85時間で撹拌速度も100rpmの増分で上げた。
t=l10時間までに、80分のガス保持時間と600rpmの撹拌速度でシステムを操作した。細胞濃度は0.5g/Lであり、CO転化率は35%であった。まだH2変換はなかったが、バッチ培養ブロス内に小量のエタノールとアセタート(それぞれ約1g/L)蓄積していた。この時間までの努力はリアクター内の細胞増殖を強調した。
t=120時間で基本培地と同一濃度を用いて培地流れを0.4ml/分の速度で開始した。次に、システムを過剰H2下で慎重に維持しながら、ガス速度、撹拌速度及び培地速度の名目上の増加のプログラムを開始した。t=210時間までに、エタノール濃度は17g/L、アセタート濃度は1g/L、細胞濃度は1.6g/L、CO転化率はほぼ100%及びH2転化率は90%になった。エタノール生産性は11.4g/L/日に達した。
徐々のガス速度増加のプログラムを再び始めた。同時にビタミン増加も行なって0.7ml/L(培地)のビタミン添加速度とした。t=610時間までに、リアクターは20g/Lのエタノールと約2g/Lのアセタートを生産した。CO転化率はほぼ100%であり、H2転化率は85%であった。エタノール生産性は14g/L/日に達した。
実施例1〜5の発酵培地は、表1に示した成分から選択される1種以上の成分を含む。
0.32g/Lの活発に増殖するクロストリジウム・リュングダーリイPETC株を用いて、発酵培地を含むNew Brunswick Bioflow Iリーダーを始動した。実験の開始時にリアクターの撹拌速度を600rpmに設定した。この撹拌速度を実験の間ずっと維持した。バイオリアクター内の温度は実験の間ずっと約38.5〜約39℃の範囲に維持した。バイオリアクターへのシンガス供給原料と、バイオリアクターからのオフガスと、バイオリアクター内の発酵ブロスとのサンプルを間隔をあけて取った。例えば供給原料ガス、オフガス及び発酵ブロスをそれぞれほぼ毎日、2時間に1回及び4時間に1回採取した。種々のガス成分の消費又は生成、ブロスの酢酸濃度、ブロスのエタノール濃度及び培養の光学密度(細胞密度)について上記サンプルを分析した。リアクターの未刺激の容積は実験の間ずっと1300〜1400mLに維持した。
このようにして上記方程式(1)〜(4)を用いて特定CO取込み(SCU)を決定した。
この特定の実施例では、目標とするSCU値を0.75〜0.89ミリモル/分/g(細胞の)に設定した。また、任意の時点で、リアクターに供給されたCOの80%を培養が利用していない場合、ガスのリアクターへの流速を高めなかった。
この特定の実験では、実験開始前に細胞再循環システム(CRS)をリアクターに取り付けた。接種18.6時間後に60mLの成長培地を直接培地に添加してからリアクターへの培地流れを0.41mL/分で開始した。接種21.5時間後に栄養素のリアクターへの流速を1.1mL/分に高め、細胞再循環システムを介して1mL/分のパーミエートをリアクターから引き出した。上記工程を行なって培養内に阻害量の酢酸とエタノールが蓄積するのを防止し、かつ培養に十分な量の栄養素を与えた。
時間とともにリアクターの細胞密度が増加し、リアクターの接種後45時間以内に3g/Lの細胞に達した。この時点で培養は6g/Lを超えるエタノールと約8g/Lの酢酸を生成した。
この特定の実験では、実験の間ずっと培養のpHを4.69〜4.71に維持した。
細菌がリアクター内で活発に増殖し始めた後(リアクターの細胞密度が初期細胞密度より約50%多くなったとき)、培養ブロスの酢酸濃度が所定値未満の場合は培養にビタミンの組成を補充した(培地に既にあるビタミンに加えて)。ビタミンのカクテルを添加するために用いた判断基準は以下のとおりだった:培養ブロスの酢酸が約2.5g/L未満の場合、培養1リットル当たり約0.34mLのビタミンを添加し、培養ブロスの酢酸が約2g/L未満の場合、培養1リットル当たり約0.67mLのビタミンを添加し、培養ブロスの酢酸が約1.5g/L未満の場合、培養1リットル当たり約ImLのビタミンを添加した。これらの実験で用いたビタミンの組成は以下のとおりだった。
ビオチン 0.08〜1μM
チアミンHC1 0.12〜1.5μM
d-パントテン酸カルシウム 0.15〜2μM
ATCCビタミン栄養補助剤(カタログ番号MD-VS)をPETC実施例に添加して、ビオチン、チアミン及びパントテン酸カルシウムに加えて最終濃度1%(発酵培地の)にした。
0.3g/Lの活発に増殖するクロストリジウム・リュングダーリイC-01株を用いて、約1.5リットル(例えば1.45〜1.65リットルの範囲)の発酵培地を含むNew Brunswick Bioflow Iバイオリアクターを始動した。実験の開始時にリアクターの撹拌速度を600rpmに設定した。この撹拌速度を実験の間ずっと維持した。バイオリアクター内の温度は実験の間ずっと約36〜約37.9℃の範囲に維持した。下記サンプルを異なる間隔で取って分析した(例えば1〜4時間間隔):バイオリアクターへのシンガス供給原料;バイオリアクターからのオフガス;バイオリアクター内の発酵ブロス。サンプル分析は下記を与えた:種々のガス成分の消費、種々のガス成分の生成、発酵ブロスの酢酸濃度、エタノール濃度及び光学密度。
このようにして上記方程式(1)〜(4)を用いて特定CO取込み(SCU)を決定した。
最初に、上記方程式を用いて約1.4ミリモル/分/gのSCUに対応するシンガス流入値を計算し、この計算値でシンガスの流れを、細胞密度が上昇して約1.5g/Lの値に到達するまに維持した。
リアクターの細胞密度が約1.5g/Lに到達したらすぐに、ガスを予測するための設定SCU値を約1.2ミリモル/分/gに下げた。その後、リアクターの細胞質量が約2.5g/Lに到達したらすぐに、ガスを予測するための設定SCU値を約1.0ミリモル/分/gに下げた。時間とともに細胞質量が増加し、リアクターの接種後約79時間以内で2.8g/Lの期待細胞質量に到達した。この時点で培養は約20g/Lを超えるエタノールを生成した。
接種の約13.97時間後にリアクターへの培地流れを約0.2ml/分(細胞保持時間:約125時間を近似する)で開始した。接種の約28.08時間後にリアクターへの培地流れを約0.5ml/分(細胞保持時間:約52時間を近似する)に増やした。実験中、pHは約4.5周辺で維持した。
スタートアップ手順の間ずっと設定SCUを徐々に下げるのは、培養が徐々に低SCU(約0.7〜約0.9ミリモル/分/g)に変化するのを促してリアクターの生産モード(定常状態)の間維持するためである。
上記プロセスは、リアクターの細胞質量の設定目標(約2.8g/L)に到達するのに約80時間未満しかかからない。
約0.47g/Lの活発に増殖するクロストリジウム・オートエタノゲナムを用いて、約1.5リットル(例えば約1.45〜約1.65リットルの範囲)の発酵培地を含むNew Brunswick Bioflow Iバイオリアクターを始動した。実験の開始時点で、バイオリアクターの撹拌速度を約600rpmに設定した。この撹拌速度を実験の間ずっと維持した。バイオリアクター内の温度は実験の間ずっと約36〜約37.5℃の範囲に維持した。下記サンプルを異なる間隔で取って分析した(例えば1〜4時間間隔):バイオリアクターへのシンガス供給原料;バイオリアクターからのオフガス;バイオリアクター内の発酵ブロス。サンプル分析は下記を与えた:種々のガス成分の消費、種々のガス成分の生成、発酵ブロスの酢酸濃度、エタノール濃度及び光学密度。
このようにして上記方程式(1)〜(4)を用いて特定CO取込み(SCU)を決定した。
最初に、上記方程式を用いて約0.4ミリモル/分/gのSCU値に対応するシンガス流入値を計算し、細胞密度が上昇するまでこの計算値でシンガスの流れを維持した。約0.4ミリモル/分/gの目標SCU値に対応するガス流れを約19時間維持した。接種後19〜21時間の間、目標SCU値は約0.5ミリモル/分/gであった。接種後約21時間に目標SCU値を約0.6に設定した。時間とともに細胞密度が上昇し、リアクターの接種後約79時間以内で約3g/Lに達した。この時点で培養は約15g/Lを超えるエタノールを生産していた。接種後約26時間にリアクターへの培地流れを約0.1ml/分(細胞保持時間:約240時間を近似する)で開始した。接種後約50時間にリアクターへの培地流れを約0.2ml/分(細胞保持時間:約119時間を近似する)に増やした。接種後約71時間にリアクターへの培地流れを約0.5ml/分(細胞保持時間:約50時間を近似する)に増やした。実験中、pHは約4.5周辺で維持した。
約0.47g/Lの活発に増殖するクロストリジウム・オートエタノゲナムを用いて、約1.5リットル(例えば約1.45〜約1.65リットルの範囲)の発酵培地を含むNew Brunswick Bioflow Iバイオリアクターを始動した。実験の開始時点で、バイオリアクターの撹拌速度を約600rpmに設定した。この撹拌速度を実験の間ずっと維持した。バイオリアクター内の温度は実験の間ずっと約36〜約37.5℃の範囲に維持した。下記サンプルを異なる間隔で取って分析した(例えば1〜4時間間隔):バイオリアクターへのシンガス供給原料;バイオリアクターからのオフガス;バイオリアクター内の発酵ブロス。サンプル分析は下記を与えた:種々のガス成分の消費、種々のガス成分の生成、発酵ブロスの酢酸濃度、エタノール濃度及び光学密度。
このようにして上記方程式(1)〜(4)を用いて特定CO取込み(SCU)を決定した。
最初に、上記方程式を用いて約0.6ミリモル/分/gのSCU値に対応するシンガス流入値を計算し、細胞密度が上昇するまでこの計算値でシンガスの流れを維持した。接種後約26時間に目標SCU値を約0.7に設定した。時間とともに細胞密度が上昇し、リアクターの接種後約79時間以内で約2.97g/Lに達した。この時点で培養は約18g/Lを超えるエタノールを生産した。接種後約18.3時間にリアクターへの培地流れを約0.1ml/分(細胞保持時間:約242時間を近似する)で開始した。接種後約41.6時間にリアクターへの培地流れを約0.2ml/分(細胞保持時間:約121時間を近似する)に増やした。実験中、pHは約4.5周辺で維持した。
この実験では、非クロストリジウムアセトゲンを用いて特定一酸化炭素取込みスタートアップ法を試験した。
この実験は、前述した発酵培地内で活発に増殖する1.31g/Lのブチリバクテリウム・メチロトロフィクムを含むNew Brunswick bioflow Iリアクターで開始した。実験の開始時点で、リアクターの撹拌速度を約700rpmに設定した。この撹拌速度を実験の間ずっと維持した。バイオリアクター内の温度は実験の間ずっと約38.5〜約38.6℃の範囲に維持した。
バイオリアクターへのシンガス供給原料と、バイオリアクターからのオフガスと、バイオリアクター内の発酵ブロスとのサンプルを間隔をあけて取った。例えば供給原料ガス、オフガス及び発酵ブロスをそれぞれほぼ毎日、2時間に1回及び4時間に1回採取した。種々のガス成分の消費又は生成、ブロスの酢酸濃度、ブロスのエタノール濃度及び培養の光学密度(細胞密度)について上記サンプルを分析した。リアクターの未刺激の容積は実験の間ずっと1150〜1100mLに維持した。
このようにして上記方程式(1)〜(4)を用いて特定CO取込み(SCU)を決定した。
この特定の実施例では、目標とするSCU値を0.8ミリモル/分/g(細胞の)に設定した。
任意の時点で、リアクターに供給されたCOの80%を培養が利用していない場合は、培養の安定性を維持するため、ガスのリアクターへの流速を高めなかった。
この特定の実験では、実験開始前に細胞再循環システム(CRS)をリアクターに取り付けた。リアクターへの発酵培地(栄養素)の流れを1mL/分の速度で開始し、CRSを介して0.9mL/分のパーミエートをリアクターから引き出した。
時間とともにリアクターの細胞密度が増加し、リアクターの接種後24時間以内に5.27g/Lの細胞に達した。この時点で培養は15g/Lを超えるエタノール、0.3g/Lのブタノール、及び2g/Lを超える酢酸を生産していた。
この特定の実験では、実験の間ずっと培養のpHを4.67〜4.71に維持した。
Claims (5)
- (a)一酸化炭素(CO)を含むガス状基質をバイオリアクター内の水性栄養培地中に添加する工程、ここで、前記水性栄養培地は、1種以上の微生物を含む;
(b)CO流入速度、CO流出速度、及び細胞質量を測定することによって、特定CO取込み量を求める工程;及び
(c)COの流入速度を制御することによって、前記1種以上の微生物の特定CO取込みの量を、0.1〜1.4ミリモル/分/グラム(乾燥細胞)の範囲内で調整し、これにより細胞密度を増大させる工程;
を含む、ガス状基質の発酵方法であって、
前記工程(a)〜(c)は、1日1〜50g/Lの範囲内でエタノール生産性が得られるまで繰り返される、前記方法。 - 前記水性栄養培地が、生物学的に純粋な微生物、天然微生物、非天然微生物、遺伝子修飾により生成された非天然微生物、天然微生物のミュータント、非天然微生物のミュータント、組換え微生物、遺伝子操作された微生物、人工的に合成された微生物を含めた1種以上の微生物を含む、請求項1の方法。
- 前記バイオリアクターが2以上のリアクターを含む、請求項1又は2の方法。
- 前記バイオリアクターが細胞再循環装置を含む、請求項1〜3のいずれか1項に記載の方法。
- 前記CO含有基質が水素を含む、請求項1〜4のいずれか1項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US45890310P | 2010-12-03 | 2010-12-03 | |
| US61/458,903 | 2010-12-03 | ||
| PCT/US2011/001900 WO2012074543A1 (en) | 2010-12-03 | 2011-11-14 | Fermentation process involving adjusting specific co-uptake |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013544106A JP2013544106A (ja) | 2013-12-12 |
| JP2013544106A5 JP2013544106A5 (ja) | 2016-03-03 |
| JP5951627B2 true JP5951627B2 (ja) | 2016-07-13 |
Family
ID=45496244
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013541975A Active JP5951627B2 (ja) | 2010-12-03 | 2011-11-14 | 一酸化炭素含有ガス状基質の発酵の操作方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20130252277A1 (ja) |
| EP (1) | EP2646560A1 (ja) |
| JP (1) | JP5951627B2 (ja) |
| KR (1) | KR101950042B1 (ja) |
| CN (1) | CN103476935B (ja) |
| BR (1) | BR112013013408B1 (ja) |
| CA (1) | CA2819284C (ja) |
| MX (1) | MX344896B (ja) |
| NZ (1) | NZ611186A (ja) |
| RU (1) | RU2573918C2 (ja) |
| TW (1) | TWI595094B (ja) |
| WO (1) | WO2012074543A1 (ja) |
| ZA (1) | ZA201304024B (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2929038A4 (en) * | 2012-12-05 | 2016-07-20 | Lanzatech New Zealand Ltd | fermentation |
| US10100337B2 (en) * | 2013-02-14 | 2018-10-16 | Ineos Bio Sa | Process for fermenting co-containing gaseous substrates |
| US9850503B2 (en) * | 2013-06-10 | 2017-12-26 | Ineos Bio Sa | Control of conductivity in anaerobic fermentation |
| PT3017053T (pt) * | 2013-07-04 | 2021-05-04 | Lanzatech New Zealand Ltd | Sistema de reator múltiplo e processo para fermentação gasosa contínua |
| US9617566B2 (en) * | 2014-07-11 | 2017-04-11 | Lanzatech New Zealand Limited | Control of bioreactor processes |
| CN106536705A (zh) * | 2014-07-30 | 2017-03-22 | 积水化学工业株式会社 | 利用废弃物制造有机物质的装置及利用废弃物制造有机物质的方法 |
| US9873859B2 (en) * | 2015-08-20 | 2018-01-23 | H R D Corporation | Microorganism growth and products recovery |
| PE20191635A1 (es) * | 2016-03-22 | 2019-11-06 | Shell Int Research | Un proceso para preparar un producto de parafina |
| US20190144908A1 (en) * | 2016-06-10 | 2019-05-16 | White Dog Labs, Inc. | High cell density anaerobic fermentation for protein expression |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4533211A (en) | 1983-01-31 | 1985-08-06 | International Business Machines Corporation | Frequency multiplexed optical spatial filter based upon photochemical hole burning |
| US5173429A (en) | 1990-11-09 | 1992-12-22 | The Board Of Trustees Of The University Of Arkansas | Clostridiumm ljungdahlii, an anaerobic ethanol and acetate producing microorganism |
| US5593886A (en) | 1992-10-30 | 1997-01-14 | Gaddy; James L. | Clostridium stain which produces acetic acid from waste gases |
| US5807722A (en) | 1992-10-30 | 1998-09-15 | Bioengineering Resources, Inc. | Biological production of acetic acid from waste gases with Clostridium ljungdahlii |
| US5821111A (en) | 1994-03-31 | 1998-10-13 | Bioengineering Resources, Inc. | Bioconversion of waste biomass to useful products |
| US6136577A (en) | 1992-10-30 | 2000-10-24 | Bioengineering Resources, Inc. | Biological production of ethanol from waste gases with Clostridium ljungdahlii |
| GB9720593D0 (en) * | 1997-09-26 | 1997-11-26 | Exxon Chemical Patents Inc | Catalysts and processes using them |
| UA72220C2 (uk) | 1998-09-08 | 2005-02-15 | Байоенджініерінг Рісорсиз, Інк. | Незмішувана з водою суміш розчинник/співрозчинник для екстрагування оцтової кислоти, спосіб одержання оцтової кислоти (варіанти), спосіб анаеробного мікробного бродіння для одержання оцтової кислоти (варіанти), модифікований розчинник та спосіб його одержання |
| AU764291B2 (en) | 1999-05-07 | 2003-08-14 | Emmaus Foundation, Inc. | Clostridium strains which produce ethanol from substrate-containing gases |
| DE60121335T2 (de) | 2000-07-25 | 2007-08-02 | Emmaus Foundation, Inc., Fayetteville | Verfahren zur steigerung der ethanolproduktion bei der mikrobiellen fermentation |
| NZ546496A (en) | 2006-04-07 | 2008-09-26 | Lanzatech New Zealand Ltd | Gas treatment process |
| US20070275447A1 (en) | 2006-05-25 | 2007-11-29 | Lewis Randy S | Indirect or direct fermentation of biomass to fuel alcohol |
| DE102006030001A1 (de) | 2006-06-29 | 2008-01-03 | Robert Bosch Gmbh | Regel- und Steuersystem in einem Fahrzeugverbund |
| US7704723B2 (en) | 2006-08-31 | 2010-04-27 | The Board Of Regents For Oklahoma State University | Isolation and characterization of novel clostridial species |
| EP2017346A1 (en) * | 2007-07-19 | 2009-01-21 | Ineos Europe Limited | Process for the production of alcohols |
| KR101375029B1 (ko) | 2007-11-13 | 2014-03-14 | 란자테크 뉴질랜드 리미티드 | 신규 세균 및 이의 이용 방법 |
| EP2307556B1 (en) | 2008-06-09 | 2020-08-05 | Lanzatech New Zealand Limited | Production of butanediol by anaerobic microbial fermentation |
| PL2391724T3 (pl) * | 2009-01-29 | 2017-06-30 | Lanzatech New Zealand Limited | Sposób poprawy wydajności fermentacji mikrobiologicznej |
| ES2827845T3 (es) * | 2009-07-02 | 2021-05-24 | Lanzatech New Zealand Ltd | Proceso de producción de alcohol |
-
2011
- 2011-11-14 EP EP11808971.3A patent/EP2646560A1/en not_active Withdrawn
- 2011-11-14 CA CA2819284A patent/CA2819284C/en active Active
- 2011-11-14 NZ NZ611186A patent/NZ611186A/en not_active IP Right Cessation
- 2011-11-14 CN CN201180058216.8A patent/CN103476935B/zh active Active
- 2011-11-14 WO PCT/US2011/001900 patent/WO2012074543A1/en active Application Filing
- 2011-11-14 US US13/989,111 patent/US20130252277A1/en not_active Abandoned
- 2011-11-14 JP JP2013541975A patent/JP5951627B2/ja active Active
- 2011-11-14 RU RU2013130169/10A patent/RU2573918C2/ru not_active IP Right Cessation
- 2011-11-14 MX MX2013006106A patent/MX344896B/es active IP Right Grant
- 2011-11-14 KR KR1020137017312A patent/KR101950042B1/ko active IP Right Grant
- 2011-11-14 BR BR112013013408-9A patent/BR112013013408B1/pt active IP Right Grant
- 2011-11-29 TW TW100143704A patent/TWI595094B/zh active
-
2013
- 2013-05-31 ZA ZA2013/04024A patent/ZA201304024B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| TW201305347A (zh) | 2013-02-01 |
| ZA201304024B (en) | 2014-02-26 |
| NZ611186A (en) | 2015-10-30 |
| EP2646560A1 (en) | 2013-10-09 |
| CN103476935A (zh) | 2013-12-25 |
| US20130252277A1 (en) | 2013-09-26 |
| CA2819284C (en) | 2018-12-04 |
| CA2819284A1 (en) | 2012-06-07 |
| WO2012074543A1 (en) | 2012-06-07 |
| MX2013006106A (es) | 2013-09-02 |
| MX344896B (es) | 2017-01-09 |
| JP2013544106A (ja) | 2013-12-12 |
| BR112013013408B1 (pt) | 2021-01-19 |
| CN103476935B (zh) | 2016-06-01 |
| KR101950042B1 (ko) | 2019-02-19 |
| BR112013013408A2 (pt) | 2016-08-16 |
| KR20140010010A (ko) | 2014-01-23 |
| TWI595094B (zh) | 2017-08-11 |
| RU2573918C2 (ru) | 2016-01-27 |
| RU2013130169A (ru) | 2015-01-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5951627B2 (ja) | 一酸化炭素含有ガス状基質の発酵の操作方法 | |
| JP5951628B2 (ja) | 水素を含むガス状基質の発酵の操作方法 | |
| EP2646561B1 (en) | Method of operation of fermentation of carbon monoxide and hydrogen containing gaseous substrate | |
| KR101991538B1 (ko) | 합성가스 발효 동안의 에탄올 농도 관리 | |
| US9920334B2 (en) | Aerobic method of producing alcohols | |
| CN105008544A (zh) | 发酵方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20141112 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20150716 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150805 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20151105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160105 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20160105 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20160509 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20160608 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5951627 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |