JP5520504B2 - Method for producing copper fine particle dispersion - Google Patents
Method for producing copper fine particle dispersion Download PDFInfo
- Publication number
- JP5520504B2 JP5520504B2 JP2009068766A JP2009068766A JP5520504B2 JP 5520504 B2 JP5520504 B2 JP 5520504B2 JP 2009068766 A JP2009068766 A JP 2009068766A JP 2009068766 A JP2009068766 A JP 2009068766A JP 5520504 B2 JP5520504 B2 JP 5520504B2
- Authority
- JP
- Japan
- Prior art keywords
- copper fine
- copper
- fine particles
- cathode
- reduction reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P10/00—Technologies related to metal processing
- Y02P10/20—Recycling
Description
本発明は、銅イオンの電解還元反応により一次粒子の粒子径が1〜500nmの範囲にある銅微粒子分散液の製造方法に関する。 The present invention relates to a method for producing a copper fine particle dispersion in which the particle size of primary particles is in the range of 1 to 500 nm by electrolytic reduction reaction of copper ions.
従来から、金属微粒子は、融点の低下、触媒活性、磁気特性、比熱特性、光学特性の変化等を発現することから、電子材料、触媒材料、蛍光体材料、発光体材料等の分野で広く用いられている。特に、電子材料用の導電性ペーストのような配線形成材料として、プリント配線、半導体の内部配線、プリント配線板と電子部品との接続等に利用されている。最近では、インクジェットプリンターを用いて金属微粒子を含有するインクにより配線パターンの印刷を行い、低温焼成して配線を形成する技術が着目され、研究開発が進められている。しかし、インクジェットプリンターの場合、インクに含まれる金属微粒子は、インク中において長期間分散性を保つことが要請されており、そのため金属微粒子のより微細化が必要となっている。 Conventionally, metal fine particles have been widely used in the fields of electronic materials, catalyst materials, phosphor materials, phosphor materials, etc. because they exhibit melting point reduction, catalytic activity, magnetic properties, specific heat properties, changes in optical properties, etc. It has been. In particular, it is used as a wiring forming material such as a conductive paste for electronic materials for printed wiring, semiconductor internal wiring, connection between a printed wiring board and an electronic component, and the like. Recently, a technique for printing a wiring pattern with ink containing metal fine particles using an ink jet printer and firing at a low temperature to form a wiring has attracted attention, and research and development have been promoted. However, in the case of an ink jet printer, the metal fine particles contained in the ink are required to maintain dispersibility in the ink for a long period of time, and therefore, it is necessary to make the metal fine particles finer.
下記特許文献1には、銅(I)アンミン錯イオンを含む水溶液に酸を加えてpHを低下させ、銅(I)イオン(Cu+)を、銅(II)イオン(Cu2+)と金属銅(Cu)とに不均化分解反応させることによって、銅を析出させることを特徴とする銅微粒子製造方法が記載されている。特許文献2には、塩化銅(II)を添加して成るデキストリン・銅水溶液に、還元剤として水素化ホウ素ナトリウムを加えて銅イオンを還元・析出する銅ナノ粒子製造方法が開示されている。
特許文献3には、10〜100nm程度の粒子径の銅ナノ粒子を提供するために、有機溶媒中で、該有機溶媒に溶解可能な銅を構成元素とする化合物と、多価アルコールと、保護剤とを含む組成液を非酸化条件下で加熱することによって還元された銅ナノ粒子の形成が開示されている。
特許文献4には、銅の酸化物、水酸化物又は塩をポリエチレングリコール又はエチレングリコール溶液中で加熱還元して銅微粒子を得る方法において、核生成のためのパラジウムイオンを添加すると共に、分散剤としてポリエチレンイミンを添加し、パラジウムを含有する粒子径50nm以下の銅微粒子を得る方法が記載されている。
In the following Patent Document 1, an acid is added to an aqueous solution containing a copper (I) ammine complex ion to lower the pH, so that the copper (I) ion (Cu + ), the copper (II) ion (Cu 2+ ) and the metal copper are added. A copper fine particle production method is described, in which copper is precipitated by causing a disproportionation decomposition reaction with (Cu).
In Patent Document 3, in order to provide copper nanoparticles having a particle size of about 10 to 100 nm, a compound having copper as a constituent element that can be dissolved in an organic solvent, a polyhydric alcohol, and protection in an organic solvent The formation of copper nanoparticles reduced by heating a composition solution containing an agent under non-oxidizing conditions is disclosed.
In Patent Document 4, in a method of obtaining copper fine particles by heating and reducing copper oxide, hydroxide or salt in a polyethylene glycol or ethylene glycol solution, palladium ion for nucleation is added and a dispersing agent is added. As a method, a method of adding polyethyleneimine to obtain copper fine particles containing palladium and having a particle diameter of 50 nm or less is described.
特許文献5には、カソード上に析出させた平均粒径5〜50μm程度の銅粒子を剥離して回収する手段として、ブラシ、掻き取り、及び逆電流を用いる手段、カソードを電解還元溶液の水面上に持ち上げて還元反応水溶液や水を噴霧する手段、及び電流付近で乱流を発生する手段が開示されている。
特許文献6には、電解採取により金属粉末を生成するための装置として、振動器、衝撃デバイス、パルス流動システム、パルス電力源、超音波発生器、気泡発生器、またはそれらの組み合わせた装置が開示されている。
また、特許文献6には、電解採取用電解槽の運転電流密度は、銅粉末生成物の形態に影響し、一般に、電流密度が高くなると、銅粉末粒径が縮小することは記載されているが具体的な粒子径については開示されていない。
特許文献7には、電解採取により銅粉末を生成するプロセスが開示されている。
特許文献7の請求項8には、分粒段階において、スラリー流中の少なくとも一部の粗大銅粉末粒子(150μmよりも大きな銅粉末粒子)を、該スラリー流中の少なくとも一部の微細な銅粉末粒子(約45μm小さな銅粉末粒子)から分離する工程を包含するプロセスが記載されている。
In
Patent Document 7 discloses a process for producing copper powder by electrowinning.
According to claim 8 of Patent Document 7, at least part of the coarse copper powder particles (copper powder particles larger than 150 μm) in the slurry stream is used as at least part of fine copper powder in the slurry stream in the sizing stage. A process is described that includes separating from powder particles (about 45 μm small copper powder particles).
上記特許文献1の銅微粒子製造方法では不均化分解反応によるので、反応収量が必ずしも十分といえない。特許文献2の銅ナノ粒子製造方法にはAu、Ag、Pd、Pt、Ru、Rh等の貴金属の場合は、加熱のみで還元反応が生じるために、還元剤を使用せずに金属ナノ粒子を合成することが可能であり、還元剤の除去が不要であると記載されている。一方、Cu、Co、Ni等は、加熱のみでは還元され難いために、還元剤を使用することが好ましいと記載されているが、還元反応後に還元剤を効率よく除去して高純度の銅微粒子を合成する方法は開示されていない。
Since the copper fine particle production method of Patent Document 1 uses a disproportionation decomposition reaction, the reaction yield is not necessarily sufficient. In the method for producing copper nanoparticles of
特許文献3に記載の銅ナノ粒子の形成法では、銅化合物(例えばアセチルアセトナト銅錯体)と還元剤として機能しうる多価アルコールで金属イオンを還元する方法が適用されるが、還元反応後にポリビニルピロリドン等の分散剤で覆われた状態の銅ナノ粒子の精製法については開示されていない。特許文献4に記載の銅微粒子製造方法では、ポリエチレングリコール又はエチレングリコールを用いて得られる銅微粒子の分散性を向上しているが、得られる微粒子のデンドライト化を抑制する対策が開示されていない。また、パラジウムイオンの添加が必要であるという問題点もある。
特許文献5〜7には、比較的大きな粒径(5μm以上)を有する金属微粒子をカソード表面から回収する方法について記載されているが、ナノサイズ(ここでナノサイズとは粒子径が1μm以下のものをいう)の金属微粒子をカソード表面から回収する方法については開示されていない。
また、特許文献5〜7には、カソード近傍から銅微粒子を回収するのに、逆電流を用いる手段、還元反応水溶液や水を噴霧する手段、及び電流付近で乱流を発生する等の手段が記載されているが、本発明でカソード表面近傍に形成された銅微粒子の剥離、回収技術に特許文献5〜7に開示された手段を採用すると、銅微粒子の二次凝集塊が崩壊して電解水溶液中に広く分散し、銅微粒子の沈降速度が極めて遅くなり、銅微粒子スラリーとしての回収が困難になる。
従って、一次粒子の粒子径が小さく、分散安定性に優れかつデンドライト化が抑制された銅微粒子を、簡便な方法でかつ大量に生成することのできる製造方法は未だ確立されていない。
また、デンドライト化が抑制された粒子径がナノサイズの銅微粒子がカソード近傍に析出されている場合に、これらの微粒子をスラリーとして回収し、回収された銅微粒子を分散溶液に分散させてインクジェット用のインクとして使用すると有用である。
In the method of forming copper nanoparticles described in Patent Document 3, a method of reducing metal ions with a copper compound (for example, acetylacetonato copper complex) and a polyhydric alcohol that can function as a reducing agent is applied. A method for purifying copper nanoparticles covered with a dispersant such as polyvinylpyrrolidone is not disclosed. In the method for producing copper fine particles described in Patent Document 4, the dispersibility of copper fine particles obtained using polyethylene glycol or ethylene glycol is improved, but a measure for suppressing dendrite formation of the obtained fine particles is not disclosed. There is also a problem that it is necessary to add palladium ions.
Therefore, a production method capable of producing a large amount of copper fine particles having a small primary particle size, excellent dispersion stability, and suppressed dendrite formation has not been established yet.
In addition, when nano-sized copper fine particles with suppressed dendrite formation are deposited in the vicinity of the cathode, these fine particles are recovered as a slurry, and the recovered copper fine particles are dispersed in a dispersion solution for inkjet use. It is useful when used as an ink .
本発明者らは、上記従来技術に鑑みて、有機物分散媒とアルカリ金属イオンとの存在する還元反応水溶液で銅イオンの電解還元反応を行うと得られる粒子径1〜500nmの銅微粒子のデンドライト化が抑制された銅微粒子をカソード表面近傍に析出させ、更に該カソード表面近傍に析出した銅微粒子を特定の速度で掻き取ることにより、該銅微粒子の早い沈降速度で電解槽下部から銅微粒子スラリーを速やかに回収できることを見出し、本発明を完成するに至った。尚、ここで、電解還元において還元反応が行われる溶液を還元反応水溶液という。 In view of the above prior art, the present inventors made dendrites of copper fine particles having a particle diameter of 1 to 500 nm obtained by performing an electrolytic reduction reaction of copper ions in a reduction reaction aqueous solution in which an organic dispersion medium and alkali metal ions are present. The copper fine particles with suppressed copper are deposited near the cathode surface, and further, the copper fine particles deposited near the cathode surface are scraped at a specific rate, so that the copper fine particle slurry can be formed from the lower part of the electrolytic cell at a high sedimentation rate. The present inventors have found that it can be quickly recovered and have completed the present invention. Here, a solution in which a reduction reaction is performed in electrolytic reduction is referred to as a reduction reaction aqueous solution.
即ち、本発明は、以下の(1)〜(12)に記載する発明を要旨とする。
(1)銅微粒子分散液の製造方法であって、
少なくとも、銅イオン、アルカリ金属イオン、及び有機物分散媒が溶解している還元反応水溶液において、銅イオンの電解還元反応により一次粒子の粒子径が1〜500nmの範囲にある銅微粒子をカソード表面近傍に析出させる工程(工程1)
前記カソード表面近傍に析出した銅微粒子を掻き取り用ブレードを用い、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取とって、銅微粒子を沈降させて還元反応水溶液下部にスラリーで濃縮し、該スラリーを抜き出して該スラリー中の銅微粒子を洗浄液で洗浄して銅微粒子を回収する工程(工程2)、及び
回収した銅微粒子を分散液に分散する工程(工程3)
を含むことを特徴とする、銅微粒子分散液の製造方法。
(2)前記工程1における、アルカリ金属イオンが、リチウムイオン、ナトリウムイオン、及びカリウムイオンから選択される1種又は2種以上である、前記(1)に記載の銅微粒子分散液の製造方法。
(3)前記工程1における、アルカリ金属イオンの供給源がフッ化物、塩化物、臭化物、沃化物、酢酸塩、炭酸塩、炭酸水素塩、硫酸塩、ピロリン酸塩、及びシアン化物から選択される1種又は2種以上である、前記(1)又は(2)に記載の銅微粒子分散液の製造方法。
(4)前記工程1における、還元反応水溶液中のアルカリ金属イオン濃度が0.002〜1.0モル/リットルである、前記(1)ないし(3)のいずれかに記載の銅微粒子分散液の製造方法。
(5)前記工程1における、有機物分散媒が水溶性化合物であって、ポリビニルピロリドン、ポリエチレンイミン、ポリアクリル酸、カルボキシメチルセルロース、ポリアクリルアミド、ポリビニルアルコール、ポリエチレンオキシド、デンプン、及びゼラチンから選択される1種又は2種以上である、前記(1)ないし(4)のいずれかに記載の銅微粒子分散液の製造方法。
(6)前記工程1における、還元反応水溶液における有機物分散媒の添加量が該還元反応水溶液に存在する銅原子に対する質量比([有機物分散媒/Cu]質量比)で0.01〜5である、前記(1)ないし(5)のいずれかに記載の銅微粒子分散液の製造方法。
That is, the gist of the present invention is the invention described in the following (1) to ( 12 ).
(1) A method for producing a copper fine particle dispersion,
In the reduction reaction aqueous solution in which at least copper ions, alkali metal ions, and organic dispersion media are dissolved, copper fine particles having a primary particle diameter in the range of 1 to 500 nm are obtained near the cathode surface by electrolytic reduction reaction of copper ions. Precipitation process (process 1)
Using a blade for scraping copper fine particles deposited in the vicinity of the cathode surface, the relative moving speed between the scraping blade and the cathode is slower than the sedimentation speed of the copper fine particles in the reduction reaction aqueous solution at a speed of 2 cm / sec or less. The copper fine particles are settled and concentrated in a slurry at the bottom of the reduction reaction aqueous solution, the slurry is extracted, and the copper fine particles in the slurry are washed with a washing liquid to recover the copper fine particles (step 2), And the step of dispersing the recovered copper fine particles in the dispersion (step 3)
A method for producing a copper fine particle dispersion, comprising:
(2) The method for producing a copper fine particle dispersion according to (1), wherein the alkali metal ions in Step 1 are one or more selected from lithium ions, sodium ions, and potassium ions.
(3) In step 1, the alkali metal ion source is selected from fluoride, chloride, bromide, iodide, acetate, carbonate, bicarbonate, sulfate, pyrophosphate, and cyanide. The method for producing a copper fine particle dispersion according to (1) or (2), which is one type or two or more types.
(4) The copper fine particle dispersion according to any one of (1) to (3), wherein the alkali metal ion concentration in the aqueous reduction reaction solution in Step 1 is 0.002 to 1.0 mol / liter. Production method.
(5) In step 1, the organic dispersion medium is a water-soluble compound, and is selected from polyvinyl pyrrolidone, polyethyleneimine, polyacrylic acid, carboxymethylcellulose, polyacrylamide, polyvinyl alcohol, polyethylene oxide, starch, and gelatin. The method for producing a copper fine particle dispersion according to any one of the above (1) to (4), which is a seed or two or more kinds.
(6) The addition amount of the organic dispersion medium in the reduction reaction aqueous solution in Step 1 is 0.01 to 5 in terms of mass ratio ([organic dispersion medium / Cu] mass ratio) to copper atoms present in the reduction reaction aqueous solution. The method for producing a copper fine particle dispersion according to any one of (1) to (5).
(7)前記工程1における、還元反応水溶液に存在する銅イオン濃度が0.01〜4.0モル/リットルである、前記(1)ないし(6)のいずれかに記載の銅微粒子分散液の製造方法。
(8)前記工程2における、還元反応水溶液下部に濃縮したスラリー中の銅微粒子濃度が0.3〜5質量%であることを特徴とする、前記(1)ないし(7)のいずれかに記載の銅微粒子分散液の製造方法。
(9)前記工程2における、ブレードを用いた掻き取り方法が、軸方向が垂直方向の円柱形状であるカソード外表面を、外形が全体として輪型形状である掻き取り用ブレードを用いて、カソード上部近傍から垂直下部方向に向かってカソード表面近傍に析出した銅微粒子を掻き取る方法である、前記(1)ないし(8)のいずれかに記載の銅微粒子分散液の製造方法。
(10)前記工程2における、ブレードを用いた掻き取りが水平方向を回転軸として円周方向に回転する円柱形状のカソードの円周面を固定ブレードでカソード表面近傍に析出した銅微粒子を掻き取る方法である、前記(1)ないし(8)のいずれかに記載の銅微粒子分散液の製造方法。
(11)前記工程2における、ブレードがゴム又はプラスチック材料である、前記(1)ないし(10)のいずれかに記載の銅微粒子分散液の製造方法。
(12)前記工程2における、洗浄液が炭素原子数1〜4の低級アルコールであることを特徴とする、前記(1)ないし(11)のいずれかに記載の銅微粒子分散液の製造方法。
(7) The copper fine particle dispersion according to any one of (1) to (6), wherein the concentration of copper ions present in the reduction reaction aqueous solution in Step 1 is 0.01 to 4.0 mol / liter. Production method.
(8) The copper fine particle concentration in the slurry concentrated in the lower part of the reduction reaction aqueous solution in the
(9) The scraping method using a blade in the
(10) In the
(11) The method for producing a copper fine particle dispersion according to any one of (1) to (10), wherein the blade in
( 12 ) The method for producing a copper fine particle dispersion according to any one of (1) to ( 11 ), wherein the cleaning liquid in
本発明の「銅微粒子の製造方法」において、電解還元反応の際に還元反応水溶液にアルカリ金属イオン、及び有機物分散媒を存在させることにより、粒子径が小さく、粒度分布が比較的狭く、分散安定性に優れ、デンドライト状の凝集が抑制された顆粒状の銅粒子をカソード表面近傍に析出することが可能となる。
又、前記カソード表面近傍に析出した銅微粒子を掻き取り用ブレードを用い、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取ることにより、該銅微粒子の早い沈降速度で電解槽下部から銅微粒子スラリーを回収できる。
銅微粒子を回収後、洗浄して有機分散液に分散して得られる銅微粒子分散液は、インクジェットプリンター用インク等に好適に使用することができる。
In the “method for producing copper fine particles” of the present invention, the presence of alkali metal ions and an organic dispersion medium in the reduction reaction aqueous solution during the electrolytic reduction reaction makes the particle size small, the particle size distribution relatively narrow, and the dispersion stable. It is possible to deposit granular copper particles having excellent properties and dendrite-like aggregation in the vicinity of the cathode surface.
Also, using a scraping blade for scraping copper fine particles deposited in the vicinity of the cathode surface, the relative movement speed between the scraping blade and the cathode is slower than the sedimentation speed of the copper fine particles in the aqueous reduction reaction solution , 2 cm / sec or less. The copper fine particle slurry can be recovered from the lower part of the electrolytic cell at a fast sedimentation rate of the copper fine particles.
The copper fine particle dispersion obtained by recovering the copper fine particles and then washing and dispersing them in the organic dispersion can be suitably used for ink for inkjet printers.
以下に、本発明について詳述する。
本発明の「銅微粒子の製造方法」は、
少なくとも、銅イオン、アルカリ金属イオン、及び有機物分散媒が溶解している還元反応水溶液において、銅イオンの電解還元反応により一次粒子の粒子径が1〜500nmの範囲にある銅微粒子をカソード表面近傍に析出させる工程(工程1)
前記カソード表面近傍に析出した銅微粒子を掻き取り用ブレードを用い、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取とって、銅微粒子を沈降させて還元反応水溶液下部にスラリーで濃縮し、該スラリーを抜き出して該スラリー中の銅微粒子を洗浄液で洗浄して銅微粒子を回収する工程(工程2)、及び
回収した銅微粒子を分散液に分散する工程(工程3)
を含むことを特徴とする。
The present invention is described in detail below.
The “method for producing copper fine particles” of the present invention includes:
In the reduction reaction aqueous solution in which at least copper ions, alkali metal ions, and organic dispersion media are dissolved, copper fine particles having a primary particle diameter in the range of 1 to 500 nm are obtained near the cathode surface by electrolytic reduction reaction of copper ions. Precipitation process (process 1)
Using a blade for scraping copper fine particles deposited in the vicinity of the cathode surface, the relative moving speed between the scraping blade and the cathode is slower than the sedimentation speed of the copper fine particles in the reduction reaction aqueous solution at a speed of 2 cm / sec or less. The copper fine particles are settled and concentrated in a slurry at the bottom of the reduction reaction aqueous solution, the slurry is extracted, and the copper fine particles in the slurry are washed with a washing liquid to recover the copper fine particles (step 2), And the step of dispersing the recovered copper fine particles in the dispersion (step 3)
It is characterized by including.
〔1〕工程1
工程1は、少なくとも、銅イオン、アルカリ金属イオン、及び有機物分散媒が溶解している還元反応水溶液において、銅イオンの電解還元反応により一次粒子の粒子径が1〜500nmの範囲にある銅微粒子をカソード表面近傍に析出させる工程である。
(1)還元反応水溶液
還元反応水溶液を構成する銅イオン、アルカリ金属イオン、及び有機物分散媒について説明する。
尚、還元反応水溶液としては水溶液、該水溶液にメタノール、エタノール等の親水性化合物を添加した混合溶液、及び親水性溶液が使用可能であるが、メタノールやエタノール等の親水性化合物を添加しない水溶液の使用がより好ましい。
(i)銅イオン
還元反応水溶液中に存在する銅イオンは、電解還元により銅微粒子を生成する。
銅イオンは、一価ないし二価の銅イオンを生成するイオン性化合物を使用することができる。
使用可能なイオン性化合物として、酢酸銅、硝酸銅、ハロゲン化銅、シアン化銅、ピロリン酸銅、硫酸銅等が挙げられるが、酢酸銅の使用が好ましく、実用上酢酸銅(II)の1水和物((CH3COO)2Cu・1H2O)の使用が特に望ましい。還元反応水溶液中の好ましい銅イオン濃度は、0.01〜4.0モル/リットルである。銅イオン濃度が0.01モル/リットル未満では、銅粒子の生成量が低減し反応相からの銅微粒子の収率が低下するという不都合を生じ、4.0モル/リットルを超えると生成される粒子間での粗大な凝集がおこるおそれがある。よリ好ましい銅イオン濃度は、0.05〜0.5モル/リットルである。
[1] Step 1
In step 1, at least in a reduction reaction aqueous solution in which copper ions, alkali metal ions, and an organic dispersion medium are dissolved, copper fine particles having a primary particle diameter in the range of 1 to 500 nm by electrolytic reduction reaction of copper ions. This is a step of depositing near the cathode surface.
(1) Reduction reaction aqueous solution The copper ion, alkali metal ion, and organic substance dispersion medium which comprise a reduction reaction aqueous solution are demonstrated.
As the reduction reaction aqueous solution, an aqueous solution, a mixed solution obtained by adding a hydrophilic compound such as methanol or ethanol to the aqueous solution, or a hydrophilic solution can be used, but an aqueous solution not containing a hydrophilic compound such as methanol or ethanol can be used. Use is more preferred.
(I) Copper ions Copper ions present in the reduction reaction aqueous solution generate copper fine particles by electrolytic reduction.
As the copper ion, an ionic compound that generates monovalent to divalent copper ions can be used.
Usable ionic compounds include copper acetate, copper nitrate, copper halide, copper cyanide, copper pyrophosphate, copper sulfate, etc., but the use of copper acetate is preferred and practically 1 of copper (II) acetate. The use of hydrates ((CH 3 COO) 2 Cu · 1H 2 O) is particularly desirable. The preferable copper ion concentration in the reduction reaction aqueous solution is 0.01 to 4.0 mol / liter. If the copper ion concentration is less than 0.01 mol / liter, the production amount of copper particles is reduced and the yield of copper fine particles from the reaction phase is lowered. There is a risk of coarse aggregation between particles. A more preferable copper ion concentration is 0.05 to 0.5 mol / liter.
(ii)有機物分散媒
本発明における有機物分散媒の作用についてのメカニズムは、明らかではないが、有機物分散媒は、還元反応水溶液に存在して、銅イオンが還元されて結晶核が生成するのを助長し、更に析出してくる銅粒子結晶を分散させる機能を有しているものと推定される。
有機物分散媒としては、上記機能を有するものであれば特に限定されるものではないが、このような機能を有する好ましいものとして、水溶性化合物が挙げられ、水溶性化合物の中でも水溶性高分子化合物がより好ましい。該水溶性高分子化合物としてポリビニルピロリドン、ポリエチレンイミン等のアミン系の高分子、ポリアクリル酸、カルボキシメチルセルロース等のカルボン酸基を有する炭化水素系高分子、ポリアクリルアミド等のアクリルアミド、ポリビニルアルコール、ポリエチレンオキシド、更にはデンプン、ゼラチン等が例示できる。
(Ii) Organic dispersion medium The mechanism of the action of the organic dispersion medium in the present invention is not clear, but the organic dispersion medium exists in the reduction reaction aqueous solution, and the copper ions are reduced to produce crystal nuclei. It is presumed to have a function of promoting and further dispersing the precipitated copper particle crystals.
The organic dispersion medium is not particularly limited as long as it has the above-mentioned functions, but preferred examples of such functions include water-soluble compounds. Among water-soluble compounds, water-soluble polymer compounds are also included. Is more preferable. Examples of the water-soluble polymer compound include amine polymers such as polyvinylpyrrolidone and polyethyleneimine, hydrocarbon polymers having a carboxylic acid group such as polyacrylic acid and carboxymethylcellulose, acrylamide such as polyacrylamide, polyvinyl alcohol, and polyethylene oxide. Furthermore, starch, gelatin and the like can be exemplified.
上記例示した水溶性の高分子化合物の具体例として、ポリビニルピロリドン(分子量:1,000〜500,000)、ポリエチレンイミン(分子量:100〜100,000)、カルボキシメチルセルロース(ヒドロキシル基Na塩のカルボキシメチル基への置換度:0.4以上、分子量:1,000〜100,000)、ポリアクリルアミド(分子量:100〜6,000,000)、ポリビニルアルコール(分子量:1,000〜100,000)、ポリエチレングリコール(分子量:100〜50,000)、ポリエチレンオキシド(分子量:50,000〜900,000)、ゼラチン(平均分子量:61,000〜67,000)、水溶性のデンプン等が挙げられる。上記かっこ内にそれぞれの高分子化合物の数平均分子量を示すが、このような分子量範囲にあるものは水溶性を有するので、本発明の有機物分散媒として好適に使用できる。尚、これらの2種以上を混合して使用することもできる。
また、有機物分散媒の添加量は、還元反応水溶液に存在する銅原子に対する質量比([有機物分散媒/Cu]質量比)で0.01〜5.00が好ましい。有機物分散媒の添加量が前記質量比で5.00を超えると溶液の粘性が高くなり還元反応終了後の銅粒子精製に支障をきたす場合がある。一方、前記質量比で0.01未満では粒子分散の効果が十分に発揮されなくなる。より好ましい上記添加量は、質量比で0.5〜2.0である。
Specific examples of the water-soluble polymer compounds exemplified above include polyvinylpyrrolidone (molecular weight: 1,000 to 500,000), polyethyleneimine (molecular weight: 100 to 100,000), carboxymethyl cellulose (carboxymethyl of hydroxyl group Na salt). Substitution degree: 0.4 or more, molecular weight: 1,000 to 100,000), polyacrylamide (molecular weight: 100 to 6,000,000), polyvinyl alcohol (molecular weight: 1,000 to 100,000), Examples include polyethylene glycol (molecular weight: 100 to 50,000), polyethylene oxide (molecular weight: 50,000 to 900,000), gelatin (average molecular weight: 61,000 to 67,000), and water-soluble starch. The number average molecular weight of each polymer compound is shown in the parentheses, but those having such molecular weight range are water-soluble and can be suitably used as the organic dispersion medium of the present invention. In addition, these 2 or more types can also be mixed and used.
Moreover, the addition amount of the organic dispersion medium is preferably 0.01 to 5.00 in terms of mass ratio ([organic dispersion medium / Cu] mass ratio) to copper atoms present in the reduction reaction aqueous solution. When the addition amount of the organic dispersion medium exceeds 5.00 by the mass ratio, the viscosity of the solution becomes high, which may hinder the purification of copper particles after the reduction reaction. On the other hand, if the mass ratio is less than 0.01, the effect of particle dispersion is not sufficiently exhibited. The more preferable addition amount is 0.5 to 2.0 by mass ratio.
(iii)アルカリ金属イオン
本発明におけるアルカリ金属イオンの作用についてのメカニズムは、明らかではないが、アルカリ金属イオンが還元反応水溶液中に好適な濃度範囲で存在していると、還元反応により銅微粒子の結晶が結晶核から成長する際に、銅イオン(陽イオン)が銅微粒子に接近するのをアルカリ金属イオン(陽イオン)が妨げ、銅微粒子がデンドライト状に凝集するのを抑制して、結晶が顆粒状に成長していくのを助長しているものと推定される。
一方、還元反応水溶液中にアルカリ金属イオンを存在させずに、銅化合物及び有機物分散媒が溶解している水溶液から電解還元により銅微粒子を析出させた場合には、析出した結晶中に原料の銅化合物の混入、及び該銅化合物の結晶面を介して結晶がデンドライト状に成長する現象が観察される。
従って、アルカリ金属イオンは、還元反応水溶液中でデンドライト状の凝集を顕著に抑制して、粒子形状が顆粒状に成長するのを助長していることが確認される。
このようなアルカリ金属イオンとしては、リチウムイオン、ナトリウムイオン、及びカリウムイオンから選択される1種又は2種以上が好ましい。上記アルカリ金属イオンのうち特に好ましいのは、ナトリウムイオンである。また、前記アルカリ金属イオンの供給源としては、フッ化物、塩化物、臭化物、沃化物、酢酸塩、炭酸塩、炭酸水素塩、硫酸塩、ピロリン酸塩、及びシアン化物が挙げられる。これらは2種以上であってもよい。
(Iii) Alkali metal ion The mechanism of the action of the alkali metal ion in the present invention is not clear. However, when the alkali metal ion is present in a suitable concentration range in the aqueous solution of the reduction reaction, the reduction reaction causes the copper fine particles. When the crystal grows from the crystal nucleus, the alkali metal ion (cation) prevents the copper ion (cation) from approaching the copper fine particle, and the copper fine particle is prevented from agglomerating in a dendritic form. It is presumed that they are helping to grow into granules.
On the other hand, when copper fine particles are precipitated by electrolytic reduction from an aqueous solution in which the copper compound and the organic dispersion medium are dissolved without the presence of alkali metal ions in the reduction reaction aqueous solution, the raw material copper is added to the precipitated crystals. It is observed that the compound is mixed and the crystal grows in a dendrite shape through the crystal plane of the copper compound.
Therefore, it is confirmed that the alkali metal ions remarkably suppress dendrite-like aggregation in the reduction reaction aqueous solution and promote the growth of the particle shape into granules.
As such an alkali metal ion, 1 type, or 2 or more types selected from a lithium ion, a sodium ion, and a potassium ion are preferable. Of the alkali metal ions, sodium ions are particularly preferable. Examples of the source of alkali metal ions include fluoride, chloride, bromide, iodide, acetate, carbonate, bicarbonate, sulfate, pyrophosphate, and cyanide. Two or more of these may be used.
還元反応水溶液中での上記アルカリ金属イオンの濃度は、還元反応水溶液中において0.002〜1.0モル/リットル(L)が好ましい。アルカリ金属イオンの濃度が前記0.002モル/L未満ではデンドライト形状の混入という不都合を生じ、1.0モル/Lを超えるとアルカリ金属イオンを除去するのに不都合を生じるおそれがある。
より好ましいアルカリ金属イオンの濃度は、0.005〜0.2モル/Lである。
The concentration of the alkali metal ion in the reduction reaction aqueous solution is preferably 0.002 to 1.0 mol / liter (L) in the reduction reaction aqueous solution. If the concentration of the alkali metal ions is less than 0.002 mol / L, there is a disadvantage that the dendritic shape is mixed, and if it exceeds 1.0 mol / L, there is a possibility of causing inconvenience in removing the alkali metal ions.
A more preferable concentration of alkali metal ions is 0.005 to 0.2 mol / L.
(iv)その他の添加剤
還元反応水溶液のpH調整等は特に不要である。光沢剤(アミン誘導体とエピハロヒドリンとのモル比1:1の反応生成物等)や光沢補助剤(パラホルムアルデヒド等のアルデヒド誘導体)を添加すると析出物が膜状となり、粒子状物の析出を抑制するので、これらの添加剤の添加は避けるべきである。
以下に、本発明の銅微粒子の製造方法の具体例について説明する。
(Iv) Other additives It is not particularly necessary to adjust the pH of the aqueous reduction reaction solution. Addition of brighteners (reaction products with a 1: 1 molar ratio of amine derivative to epihalohydrin) and gloss auxiliary agents (aldehyde derivatives such as paraformaldehyde) form a film that suppresses the precipitation of particulate matter. So the addition of these additives should be avoided.
Below, the specific example of the manufacturing method of the copper fine particle of this invention is demonstrated.
(2)電解還元
(i)電解槽
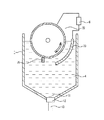
電解槽は、本発明が実施可能な構造であれば特に制限されるものではないが、本発明が実施可能な構造の例を図1、2に示す。
図1は、カソードが縦型円柱形状である電解槽の例である。電解槽1内には軸方向が垂直方向の円柱形状であるカソード2、カソード2の周囲には該カソード表面と相対する位置に円筒形状のアノード3が配設されている。また、電解槽1内には後述する還元反応水溶液4が供給されていて、カソード2とアノード3には直流電源6から印加されることにより、電解還元反応が進行して、カソード2の外表面近傍に銅微粒子が析出する。カソード2外表面近傍に析出した銅微粒子はカソード上部近傍から下方に移動可能な、外形が全体として輪型形状であるブレード5によって、カソード上部近傍から垂直下部方向に向かって掻き取られて、漏斗状のスラリー回収部11に濃縮され、スラリー回収弁を開けることにより、スラリー回収口から回収される。
(2) Electrolytic reduction (i) Electrolytic cell Although an electrolytic cell will not be restrict | limited especially if the structure which can implement this invention is shown, The example of the structure which can implement this invention is shown in FIG.
FIG. 1 is an example of an electrolytic cell in which the cathode has a vertical cylindrical shape. Inside the electrolytic cell 1, a
図2は、カソードが横型円柱形状である電解槽の例である。電解槽1内には軸方向が水平方向の円柱形状で、周方向に回転可能であるカソード22、とカソード22の該表面と相対する一部の周囲にはクオーターパイプ形状のアノード23が配設されている。また、電解槽1内には後述する還元反応水溶液4が供給されていて、カソード22とアノード23には直流電源6から印加されることにより、電解還元反応が進行して、カソード22の外表面近傍に銅微粒子が析出する。カソード22外表面近傍に析出した銅微粒子はカソードを円周方向に回転させることにより、固定ブレード25によって、掻き取られて、漏斗状のスラリー回収部11に濃縮され、スラリー回収弁を開けることにより、スラリー回収口から回収される。
尚、電解還元反応を回分式で行う方法について記載したが、図1、2の概念図に示す電解槽を使用して電解還元反応を連続的に行うことも可能である。この場合、図1の縦型円柱形状カソードが配置された電解槽を使用する場合には、掻き取り用のブレードを例えば垂直方向に2分割可能な構造(以下、2分割型ということがある)として、カソード上部近傍から下部近傍にブレードを下降させて掻き取り操作を行った後に、円周方向に2分割型を開いてカソード上部近傍まで上昇させ、その後2分割型を閉じて再び下降させる操作を繰り返し、スラリー回収部に銅微粒子が濃縮されているスラリーをスラリー回収口から断続的に回収すればよい。
又、図2の縦型円柱形状カソードが配置された電解槽を使用する場合には、カソードを円周方向に連続的に回転させて、ブレードにより銅微粒子を連続的に掻き取り、スラリー回収部に銅微粒子が濃縮されているスラリーをスラリー回収口から断続的に回収すればよい。
(ii)還元反応水溶液
還元反応水溶液は、少なくとも銅イオン、アルカリ金属イオン、及び有機物分散媒を含む溶液である。それぞれの好ましい濃度は上記した通りである。
(iii)電極
カソード(陰極)材料としては、白金、カーボン等の棒状、板状電極、ドット電極のようなナノ構造電極が例示でき、アノード(陽極)材料としては、Cu、カーボン、白金等の棒状・板状・網状の形状電極が例示できる。
FIG. 2 is an example of an electrolytic cell in which the cathode has a horizontal cylindrical shape. In the electrolytic cell 1, a
In addition, although described about the method of performing an electrolytic reduction reaction by a batch type, it is also possible to perform an electrolytic reduction reaction continuously using the electrolytic vessel shown to the conceptual diagram of FIG. In this case, when using the electrolytic cell in which the vertical columnar cathode shown in FIG. 1 is used, the scraping blade can be divided into, for example, two parts in the vertical direction (hereinafter sometimes referred to as a two-part type). After the scraping operation by lowering the blade from the vicinity of the upper part of the cathode to the vicinity of the lower part, the two-part type is opened in the circumferential direction and raised to the vicinity of the upper part of the cathode, and then the two-part type is closed and lowered again. Is repeated, and the slurry in which the copper fine particles are concentrated in the slurry collecting unit may be intermittently collected from the slurry collecting port.
When using the electrolytic cell in which the vertical cylindrical cathode shown in FIG. 2 is used, the cathode is continuously rotated in the circumferential direction, and the copper fine particles are continuously scraped off by the blade, and the slurry recovery unit What is necessary is just to collect | recover intermittently the slurry in which the copper fine particle is concentrated from the slurry collection port.
(Ii) Reduction reaction aqueous solution The reduction reaction aqueous solution is a solution containing at least copper ions, alkali metal ions, and an organic dispersion medium. Each preferable concentration is as described above.
(Iii) Electrode Examples of the cathode (cathode) material include nanostructure electrodes such as rods, plate electrodes, and dot electrodes such as platinum and carbon. Examples of the anode (anode) material include Cu, carbon, and platinum. A rod-shaped, plate-shaped, or net-shaped electrode can be exemplified.
(iv)電流密度、電解温度
電流密度は好ましくは0.1〜150A/dm2、より好ましくは3〜100A/dm2程度であり、直流のほかパルス電流とすることもできる。
還元温度は、10〜70℃が好ましく、10〜40℃がより好ましい。還元温度は、高温になるほど還元反応速度は速くなり、低温になるほど析出する粒子の粒子径は小さくなる傾向がある。
(Iv) Current density and electrolysis temperature The current density is preferably 0.1 to 150 A / dm 2 , more preferably about 3 to 100 A / dm 2 , and can be a pulse current in addition to direct current.
10-70 degreeC is preferable and, as for reduction temperature, 10-40 degreeC is more preferable. As the reduction temperature increases, the reduction reaction rate increases, and as the temperature decreases, the particle size of the precipitated particles tends to decrease.
〔2〕工程2
工程2は、前記工程1でカソード表面近傍に析出した銅微粒子を掻き取り用ブレードを用い、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取とって、銅微粒子を沈降させて還元反応水溶液下部にスラリーで濃縮し、該スラリーを抜き出して該スラリー中の銅微粒子を洗浄液で洗浄して銅微粒子を回収する工程である。
一般にスラリーとは、粒子と液体の混合状態であり高い流動性を持つものである。当該スラリーは、工程1に記載の電解還元により析出し、その後ブレードでカソード表面から掻き取られて電解槽底部に沈降した微粒子と、該微粒子間に存在する還元反応水溶液から構成されている。
(1)ブレードを使用したカソード表面近傍からの銅微粒子の掻き取り
電解槽の構造の例は、前記した通りである。尚、ブレードの材質は特に制限されるものではないが、ポリテトラフルオロエチレン等の合成樹脂を使用することが可能である。
縦型円柱形状カソードの場合には図1に示す通り、カソード2を固定させて、ブレード5を垂直方向に向かって移動させることにより銅微粒子を掻き取って、銅微粒子を下方方向に沈降させてスラリー回収部11にスラリーとして回収する。
この場合のカソード2の外形形状は円柱形状、角柱形状等を採用することが可能であるが外形が全体として輪型形状である掻き取り用ブレード5を用いて掻き取ることから、円柱形状の使用が好ましい。縦型円柱形状カソードの場合にはカソードを固定させて、ブレードを垂直方向に向かって移動させることにより銅微粒子を掻き取って、銅微粒子を下方方向に沈降させてスラリー回収部にスラリーとして回収する。
[2]
Generally, a slurry is a mixed state of particles and liquid and has high fluidity. The slurry is composed of fine particles deposited by electrolytic reduction described in Step 1, and then scraped off from the cathode surface by a blade and settled on the bottom of the electrolytic cell, and a reduction reaction aqueous solution existing between the fine particles.
(1) An example of the structure of the electrolytic cell for scraping copper fine particles from the vicinity of the cathode surface using a blade is as described above. The material of the blade is not particularly limited, but a synthetic resin such as polytetrafluoroethylene can be used.
In the case of a vertical cylindrical cathode, as shown in FIG. 1, the
In this case, the outer shape of the
横型円柱形状カソードの場合には図2に示す通り、カソード22を円周方向に回転させて、ブレード25を固定させることにより銅微粒子を掻き取って、銅微粒子を下方方向に沈降させてスラリー回収部にスラリーとして回収する。
この場合のカソード22の外形形状は、ブレード25を固定させていることから円柱形状の使用が好ましい。横型円柱形状カソードの場合には円筒形状のカソード22を円周方向に回転させて、固定ブレード25によりカソード表面近傍の銅微粒子を掻き取って、銅微粒子を下方方向に沈降させてスラリー回収部にスラリーとして回収する。
In the case of a horizontal cylindrical cathode, as shown in FIG. 2, the
The outer shape of the
(2)ブレードによる銅微粒子の掻き取り速度
工程2において、前記カソード表面近傍に析出した銅微粒子を掻き取り用ブレードを用い、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取とって、銅微粒子を沈降させて還元反応水溶液下部にスラリーで濃縮し、該スラリーを抜き出しすることを特徴とする。
電解還元反応によりカソード表面に析出する銅微粒子の粒子径が10μm程度を超える程度のナノ粒子に相当しない場合には、掻き取られた粒子の沈降速度も速く、金属粒子の回収は比較的容易に行うことができる。一方、本発明におけるような銅微粒子の粒子径が1〜500nmの場合には、ブレードによる掻き取り速度が早いとき、還元反応水溶液や水を噴霧する手段、及び電流付近で乱流を発生する等の手段を用いると銅微粒子の二次凝集塊が崩壊して、電解還元水溶液中に広く分散して銅微粒子の沈降速度が極めて遅くなり、銅微粒子スラリーとしての迅速な回収が困難になる。
本発明においては、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取ることにより、銅微粒子の二次凝集塊の崩壊を抑制して、銅微粒子の沈降速度を早くすることを可能にしている。
(2) Copper fine particle scraping speed by blade In
When the particle size of the copper fine particles deposited on the cathode surface by the electroreduction reaction does not correspond to nanoparticles of about 10 μm, the settling rate of the scraped particles is high, and the metal particles can be recovered relatively easily. It can be carried out. On the other hand, when the particle size of the copper fine particles as in the present invention is 1 to 500 nm, when the scraping speed by the blade is high, a means for spraying the reduction reaction aqueous solution or water, and generating turbulence near the current, etc. When this means is used, the secondary agglomerates of the copper fine particles are disintegrated and widely dispersed in the electrolytic reduction aqueous solution, and the sedimentation rate of the copper fine particles becomes extremely slow, making it difficult to quickly collect the copper fine particle slurry.
In the present invention, the secondary agglomeration of the copper fine particles is carried out by scraping at a rate of 2 cm / sec or less, wherein the relative moving speed between the scraping blade and the cathode is slower than the sedimentation speed of the copper fine particles in the reduction reaction aqueous solution. The collapse of the lump is suppressed, and the sedimentation rate of the copper fine particles can be increased.
尚、電解還元を実際に行う系における銅微粒子の沈降速度は、例えば下記方法により求めることができる。
銅微粒子沈降速度の測定は前述の透明なガラス製電解槽中で析出を行い、カソードに析出した粒子がブレードにより掻き取られて剥離する過程を動画で撮影し、カソードから剥離した粒子が5cm沈降する時間を計測し、沈降速度を算出する。
In addition, the sedimentation rate of the copper fine particles in the system in which electrolytic reduction is actually performed can be obtained by, for example, the following method.
The copper fine particle sedimentation rate was measured in the above-mentioned transparent glass electrolytic cell, and the process of separating the particles deposited on the cathode by scraping them with a blade was filmed, and the particles separated from the cathode settled 5 cm. Measure the settling time and calculate the sedimentation speed.
(3)生成銅微粒子の洗浄と回収
カソード表面近傍に析出した銅微粒子は、還元反応水溶液中に長い時間保持されると、該水溶液中に溶解している酸素により徐々に酸化を受けて、酸化銅を形成する虞がある。
一方、エタノール等のアルコール溶媒中では、金属銅微粒子は比較的酸化を受けづらく、安定して存在する。
従って、電解槽のスラリー回収口13から回収された銅微粒子スラリーはろ過操作により、銅微粒子を回収して、炭素原子数1〜4の低級アルコールを洗浄液として、還元反応水溶液から同伴されてきた不純物を除去するために、洗浄されることが望ましい。
洗浄操作の具体例としては、回収した銅微粒子にエタノールを加えて撹拌洗浄して遠心分離機で銅微粒子を回収するエタノール洗浄操作を1度又は2度以上行い、次にエタノール等のアルコールを添加して撹拌洗浄後、遠心分離機で銅微粒子を回収する洗浄操作を1度又は2度以上行い、その後、得られた銅微粒子を回収する。
(3) Cleaning and recovery of the generated copper fine particles When the copper fine particles deposited in the vicinity of the cathode surface are kept in the reduction reaction aqueous solution for a long time, they are gradually oxidized by the oxygen dissolved in the aqueous solution and oxidized. There is a risk of forming copper.
On the other hand, in an alcohol solvent such as ethanol, the metal copper fine particles are relatively hardly oxidized and exist stably.
Therefore, the copper fine particle slurry recovered from the
As a specific example of the washing operation, ethanol is added to the collected copper fine particles, stirred and washed, and then the ethanol washing operation for collecting the copper fine particles with a centrifuge is performed once or twice or more, and then alcohol such as ethanol is added Then, after washing with stirring, a washing operation for collecting the copper fine particles with a centrifugal separator is performed once or twice or more, and then the obtained copper fine particles are collected.
(4)回収銅微粒子
上記電解還元で得られる銅微粒子には、酸化銅が1質量%以下で還元剤や他の金属は含まれない。不純物の除去は溶媒を用いた洗浄により比較的容易であるので、比較的容易な操作で高純度の銅微粒子を得ることができる。
上記した電解還元により得られる銅微粒子は、粒子径が1〜500nm程度の範囲にあり、その形状はデンドライト状に凝集していない顆粒状の微粒子である。
ここで、一次粒子の平均粒径とは、二次粒子を構成する個々の金属等の微粒子の一次粒子の直径の意味である。該一次粒子径は、電子顕微鏡を用いて測定することができる。また、平均粒径とは、一次粒子の数平均粒径を意味する。
尚、還元反応水溶液にアルカリ金属イオンを使用しないと、銅イオンの原料となる銅化合物(例えば酢酸銅(II)一水和物を原料に使用すると、無水酢酸銅(II))が20〜30質量%混入し、更に得られる微粒子は、複数の基本粒子がデンドライト状に凝集をおこして、1μmから10μmぐらいの凝集体になる。
(4) Recovered copper fine particles The copper fine particles obtained by the above electrolytic reduction contain 1% by mass or less of copper oxide and do not contain a reducing agent or other metals. Since removal of impurities is relatively easy by washing with a solvent, high-purity copper fine particles can be obtained by a relatively easy operation.
The copper fine particles obtained by the above-described electrolytic reduction are granular fine particles having a particle diameter in the range of about 1 to 500 nm and not aggregated in a dendritic shape.
Here, the average particle diameter of primary particles means the diameter of primary particles of fine particles such as individual metals constituting secondary particles. The primary particle diameter can be measured using an electron microscope. Moreover, an average particle diameter means the number average particle diameter of a primary particle.
In addition, if an alkali metal ion is not used for the reduction reaction aqueous solution, a copper compound (for example, copper (II) acetate monohydrate is used as a raw material when copper (II) acetate monohydrate is used as a raw material) is 20-30. In the fine particles obtained by mixing in mass%, a plurality of basic particles aggregate in a dendrite shape to form aggregates of about 1 μm to 10 μm.
〔3〕工程3
工程3は、回収した銅微粒子を分散液に分散する工程である。
工程2で得られた銅微粒子を以下に記載する分散溶媒に分散させて、その濃度が2〜70質量%となる分散溶液を得る。
尚、銅微粒子濃度が2質量%未満では、燒結後の導電材の機械的強度が低くなるという不都合を生ずるおそれがあり、一方、70質量%を超えると分散溶液中で高い分散性を得ることが困難になるおそれがある。
[3] Step 3
Step 3 is a step of dispersing the recovered copper fine particles in a dispersion.
The copper fine particles obtained in
If the copper fine particle concentration is less than 2% by mass, there is a risk that the mechanical strength of the conductive material after sintering is lowered. On the other hand, if it exceeds 70% by mass, high dispersibility is obtained in the dispersion solution. May become difficult.
(i)分散溶媒の成分
分散溶媒の成分として使用可能な多価アルコールは、エチレングリコール、ジエチレングリコール、1,2−プロパンジオール、1,3−プロパンジオール、1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2−ブテン−1,4−ジオール、2,3−ブタンジオール、ペンタンジオール、ヘキサンジオール、オクタンジオール、グリセロール、1,1,1−トリスヒドロキシメチルエタン、2−エチル−2−ヒドロキシメチル−1,3−プロパンジオール、1,2,6−ヘキサントリオール、1,2,3−ヘキサントリオール、1,2,4−ブタントリオール、グリセロール、トレイトール、エリトリトール、ペンタエリスリトール、ペンチトール、キシリトール、リビトール、アラビトール、ヘキシトール、マンニトール、ソルビトール、ズルシトール、グリセリンアルデヒド、ジオキシアセトン、トレオース、エリトルロース、エリトロース、アラビノース、リボース、リブロース、キシロース、キシルロース、リキソース、グルコース、フルクトース、マンノース、イドース、ソルボース、グロース、タロース、タガトース、ガラクトース、アロース、アルトロース、ラクトース、イソマルトース、グルコヘプトース、ヘプトース、マルトトリオース、ラクツロース、及びトレハロースの中から選択される1種又は2種以上であることが好ましい。
(I) Component of dispersion solvent Polyhydric alcohol that can be used as a component of dispersion solvent is ethylene glycol, diethylene glycol, 1,2-propanediol, 1,3-propanediol, 1,2-butanediol, 1,3- Butanediol, 1,4-butanediol, 2-butene-1,4-diol, 2,3-butanediol, pentanediol, hexanediol, octanediol, glycerol, 1,1,1-trishydroxymethylethane, 2 -Ethyl-2-hydroxymethyl-1,3-propanediol, 1,2,6-hexanetriol, 1,2,3-hexanetriol, 1,2,4-butanetriol, glycerol, threitol, erythritol, penta Erythritol, pentitol, xylitol, ribitol, arabito Hexitol, mannitol, sorbitol, dulcitol, glyceraldehyde, dioxyacetone, threose, erythrulose, erythrose, arabinose, ribose, ribulose, xylose, xylulose, lyxose, glucose, fructose, mannose, idose, sorbose, growth, talose, tagatose , Galactose, allose, altrose, lactose, isomaltose, glucoheptose, heptose, maltotriose, lactulose, and trehalose are preferable.
分散溶媒の成分としては、多価アルコール以外にアミド基を有する有機溶媒が例示できる。前記アミド基を有する有機溶媒としては、N−メチルアセトアミド、N−メチルホルムアミド、N−メチルプロパンアミド、ホルムアミド、N,N−ジメチルアセトアミド、1,3−ジメチル−2−イミダゾリジノン、N,N−ジメチルホルムアミド、1−メチル−2−ピロリドン、ヘキサメチルホスホリックトリアミド、2−ピロリジノン、ε−カプロラクタム、及びアセトアミドの中から選択される1種又は2種以上が例示できる。 Examples of the component of the dispersion solvent include organic solvents having an amide group in addition to the polyhydric alcohol. Examples of the organic solvent having an amide group include N-methylacetamide, N-methylformamide, N-methylpropanamide, formamide, N, N-dimethylacetamide, 1,3-dimethyl-2-imidazolidinone, N, N Examples thereof include one or more selected from dimethylformamide, 1-methyl-2-pyrrolidone, hexamethylphosphoric triamide, 2-pyrrolidinone, ε-caprolactam, and acetamide.
更に、分散溶媒の他の成分としては、一般式R1−O−R2(R1、R2は、それぞれ独立にアルキル基で、炭素原子数は1〜4である。)で表されるエーテル系化合物、一般式R3−OH(R3は、アルキル基で、炭素原子数は1〜4である。)で表されるアルコール、R4−C(=O)−R5(R4、R5は、それぞれ独立にアルキル基で、炭素原子数は1〜2である。)で表されるケトン系化合物、及び一般式R6−(N−R7)−R8(R6、R7、R8は、それぞれ独立にアルキル基、又は水素で、炭素原子数は0〜2である。)で表されるアミン系化合物が例示できる。
前記エーテル系化合物の具体例として、ジエチルエーテル、メチルプロピルエーテル、ジプロピルエーテル、ジイソプロピルエーテル、メチル−t−ブチルエーテル、t−アミルメチルエーテル、ジビニルエーテル、エチルビニルエーテル、及びアリルエーテルの中から選択される1種又は2種以上が例示でき、
前記アルコールの具体例として、メタノール、エタノール、1−プロパノール、2−プロパノール、2−ブタノール、及び2−メチル2−プロパノールの中から選択される1種又は2種以上が例示でき、
前記ケトン系化合物の具体例として、アセトン、メチルエチルケトン、及びジエチルケトンの中から選択される1種又は2種以上が例示でき、
前記アミン系化合物の具体例として、トリエチルアミン、及び/又はジエチルアミンが例示できる。
Furthermore, the other component of the dispersion solvent is represented by the general formula R 1 —O—R 2 (wherein R 1 and R 2 are each independently an alkyl group having 1 to 4 carbon atoms). An ether compound, an alcohol represented by the general formula R 3 —OH (R 3 is an alkyl group and has 1 to 4 carbon atoms), R 4 —C (═O) —R 5 (R 4 And R 5 are each independently an alkyl group having 1 to 2 carbon atoms.), And a ketone compound represented by the general formula R 6 — (N—R 7 ) —R 8 (R 6 , R 7 and R 8 are each independently an alkyl group or hydrogen, and the number of carbon atoms is 0 to 2).
Specific examples of the ether compound are selected from diethyl ether, methyl propyl ether, dipropyl ether, diisopropyl ether, methyl-t-butyl ether, t-amyl methyl ether, divinyl ether, ethyl vinyl ether, and allyl ether. 1 type or 2 types or more can be illustrated,
Specific examples of the alcohol include one or more selected from methanol, ethanol, 1-propanol, 2-propanol, 2-butanol, and 2-methyl 2-propanol,
Specific examples of the ketone compound include one or more selected from acetone, methyl ethyl ketone, and diethyl ketone,
Specific examples of the amine compound include triethylamine and / or diethylamine.
(ii)銅微粒子分散溶液の分散性の向上
銅微粒子分散溶液中には、一次粒子の平均粒径が1〜500nmの銅微粒子が少なくともその表面の一部が有機物分散媒で覆われて分散液中に、二次凝集性が少ない状態で分散されていることが好ましい。有機物分散媒の成分は前記した通りである。
(Ii) Improvement of dispersibility of the copper fine particle dispersion solution In the copper fine particle dispersion solution, at least a part of the surface of the copper fine particles having an average primary particle diameter of 1 to 500 nm is covered with an organic dispersion medium. It is preferable that it is dispersed in a state in which the secondary aggregation property is low. The components of the organic dispersion medium are as described above.
銅微粒子分散溶液の分散性を向上するのに、撹拌手段を採用することが望ましい。分散溶液の撹拌方法としては、公知の撹拌方法を採用することができるが、超音波照射方法を採用するのが好ましい。
上記超音波照射時間は、特に制限はなく任意に選択することが可能である。例えば、超音波照射時間を5〜60分間の間で任意に設定すると照射時間が長い方が平均二次凝集サイズは小さくなる傾向にある。更に超音波照射時間を長くすると分散性は一層向上する。
このようにして得られた分散溶液は、銅微粒子が有機物分散剤に覆われた状態で分散溶液中に分散している。このような有機物分散剤が銅微粒子を分散させるメカニズムは完全に解明されてはいないが、有機物分散剤を使用する場合には、例えば高分子に存在する官能基の非共有電子対を有する原子部分が銅微粒子の表面に吸着して、分子層を形成し、互いに銅微粒子同士の接近をさせない、斥力が発生していることが予想される。
In order to improve the dispersibility of the copper fine particle dispersion, it is desirable to employ a stirring means. As a stirring method of the dispersion solution, a known stirring method can be adopted, but an ultrasonic irradiation method is preferably adopted.
The ultrasonic irradiation time is not particularly limited and can be arbitrarily selected. For example, when the ultrasonic irradiation time is arbitrarily set between 5 and 60 minutes, the average secondary aggregation size tends to be smaller as the irradiation time is longer. Further, when the ultrasonic wave irradiation time is lengthened, the dispersibility is further improved.
The dispersion solution thus obtained is dispersed in the dispersion solution in a state where the copper fine particles are covered with the organic dispersant. The mechanism by which such organic dispersants disperse copper fine particles has not been completely elucidated, but when using organic dispersants, for example, atomic parts having unshared electron pairs of functional groups present in polymers. Is adsorbed on the surface of the copper fine particles to form a molecular layer, and repulsive force that prevents the copper fine particles from approaching each other is expected to be generated.
本発明を実施例により具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
以下に本実施例、比較例において使用した電解槽、及び銅微粒子の沈降速度の測定方法を記載する。
(1)電解槽
(i)縦型円柱形状カソードが配設された電解槽
本実施例、比較例において使用した電解槽は図1に示す縦型の回分式タイプの電解槽で、透明なガラス製容器内に、カソード、アノード、及び掻き取り用のブレードが設けられている。カソードは直径4cm、長さ7cmの円柱形状をしており、円柱の底部から5cmが還元反応水溶液に浸かった状態になっている。還元反応水溶液に浸かっていないカソード及びアノード部分は直流電源と接続されている。
アノードは、カソード表面から3cm離れた位置に設置された内径8cmの円筒形状物で、チタン表面に白金メッキを施したメッシュ形状のものである。また、円筒型アノードには析出過程を観察するために、液面から深さ6cmの位置まで、幅1cmの開口部が一ヶ所設けられている。
電解槽下部には漏斗状のスラリー回収部が配設され、その底部にはスラリーを電解槽外に回収するためのスラリー回収弁が設けられている。
カソード周囲には、カソード表面近傍に金属イオンが還元されて析出した金属微粒子を掻き取るための、上下に移動可能なブレードが配設されて、該ブレードは下降する際にはカソード表面の金属微粒子を掻き取り可能な形状である。尚、ブレードにはポリテトラフルオロエチレン製ブレードを使用した。
EXAMPLES The present invention will be specifically described with reference to examples, but the present invention is not limited to these examples.
Below, the electrolytic cell used in the present Example and the comparative example, and the measuring method of the sedimentation rate of a copper fine particle are described.
(1) Electrolytic cell (i) Electrolytic cell provided with a vertical cylindrical cathode The electrolytic cell used in the examples and comparative examples is a vertical batch-type electrolytic cell shown in FIG. A cathode, an anode, and a scraping blade are provided in the container. The cathode has a cylindrical shape with a diameter of 4 cm and a length of 7 cm, and 5 cm from the bottom of the cylinder is immersed in the reduction reaction aqueous solution. The cathode and anode portions not immersed in the reduction reaction aqueous solution are connected to a DC power source.
The anode is a cylindrical object having an inner diameter of 8 cm installed at a position 3 cm away from the cathode surface, and has a mesh shape in which the titanium surface is plated with platinum. In addition, in order to observe the deposition process, the cylindrical anode is provided with one opening having a width of 1 cm from the liquid surface to a depth of 6 cm.
A funnel-shaped slurry recovery unit is disposed at the lower part of the electrolytic cell, and a slurry recovery valve for recovering the slurry outside the electrolytic cell is provided at the bottom.
Around the cathode, there is disposed a vertically movable blade for scraping the metal fine particles deposited by reduction of metal ions in the vicinity of the cathode surface, and when the blade descends, the metal fine particles on the cathode surface It is a shape that can be scraped off. A blade made of polytetrafluoroethylene was used as the blade.
(ii)横型円柱形状カソードが配設された電解槽
本実施例において使用した横型の回分式タイプの電解槽は、図2の概念図に示す電解槽である。
透明なガラス製容器内に、カソード、アノード、及び掻き取り用のブレードが設けられている。カソードは直径6cm、長さは5cmの円柱形状をしており、還元反応水溶液面は円周方向の回転軸近傍の位置である。カソードの還元反応水溶液に浸かっていない部分で直流電源と接続されている。
アノードは、カソード表面から2cm離れた位置に設置された内径10cmのクオーターパイプ形状で、チタン表面に白金メッキを施したメッシュ形状のものである。また、円柱状の電極の回転軸方向から容器内部における析出過程を観察することができる。
電解槽上部は角型筒状になっている。電解槽下部には上部角パイプと滑らかに接続された、漏斗状のスラリー回収部が配設され、その底部にはスラリーを電解槽外に回収するためのスラリー回収弁が設けられている。
カソード外周面の下部近傍に、カソード表面近傍に金属イオンが還元されて析出した金属微粒子を掻き取るための、ポリテトラフルオロエチレン製固定ブレードが配設されている。
(Ii) Electrolytic cell provided with a horizontal cylindrical cathode The horizontal batch-type electrolytic cell used in this example is the electrolytic cell shown in the conceptual diagram of FIG.
A cathode, an anode, and a scraping blade are provided in a transparent glass container. The cathode has a cylindrical shape with a diameter of 6 cm and a length of 5 cm, and the reduction reaction aqueous solution surface is at a position near the rotation axis in the circumferential direction. It is connected to a DC power source at a portion not immersed in the reduction reaction aqueous solution of the cathode.
The anode has a quarter pipe shape with an inner diameter of 10 cm installed at a
The upper part of the electrolytic cell has a square cylindrical shape. A funnel-shaped slurry recovery section that is smoothly connected to the upper square pipe is disposed at the bottom of the electrolytic cell, and a slurry recovery valve for recovering the slurry outside the electrolytic cell is provided at the bottom.
A polytetrafluoroethylene stationary blade is disposed near the lower part of the outer peripheral surface of the cathode for scraping off metal fine particles deposited by reduction of metal ions near the cathode surface.
(2)銅微粒子の沈降速度の測定方法
銅微粒子沈降速度の測定は前述の透明なガラス製電解槽中で析出を行い、電極の回転軸方向から粒子がブレードにより掻き取られて剥離する過程を動画で撮影し、カソードから剥離した粒子が5cm沈降する時間を計測し、沈降速度を算出した。
(2) Method for measuring the copper fine particle sedimentation rate The copper fine particle sedimentation rate is measured in the above-described transparent glass electrolytic bath by depositing the particles and scraping them off from the electrode in the direction of the axis of rotation. The time taken for the particles peeled off from the cathode to settle for 5 cm was measured, and the sedimentation rate was calculated.
[実施例1]
縦型円柱形状カソードが配設された図1に示す電解槽を用いて、銅微粒子を電解還元によりカソード表面に析出させ、該析出した銅微粒子をブレードで掻き取り、スラリーとして回収した後、洗浄して分散溶液に分散して銅微粒子分散液を調製した。
(1)銅微粒子の電解還元による析出(工程1)
銅イオンとして酢酸銅(II)の1水和物((CH3COO)2Cu・1H2O)20g、有機物分散剤としてポリビニルピロリドン5g([有機物分散剤/Cu]質量比で0.78)、及びアルカリ金属イオンとして酢酸ナトリウムの3水和物(CH3COONa・3H2O)1.36gを使用して、還元反応水溶液1Lを調製した。尚、還元反応水溶液中のアルカリ金属イオン濃度は0.01モル/リットル(L)であり、pHは約5.0であった。
次にこの溶液500mlを図1に示す縦型円柱形状カソードが配設された電解槽に供給し、2.5Aで2分間通電して、カソード表面近傍に銅微粒子を析出させた。
[Example 1]
Using the electrolytic cell shown in FIG. 1 provided with a vertical cylindrical cathode, copper fine particles are deposited on the cathode surface by electrolytic reduction, and the deposited copper fine particles are scraped with a blade and collected as a slurry, followed by washing. Then, it was dispersed in a dispersion solution to prepare a copper fine particle dispersion.
(1) Precipitation by electrolytic reduction of copper fine particles (Step 1)
Copper acetate (II) monohydrate ((CH 3 COO) 2 Cu · 1H 2 O) 20 g as copper ion, polyvinyl pyrrolidone 5 g as organic dispersant ([organic dispersant / Cu] 0.78 in mass ratio) , And 1.36 g of sodium acetate trihydrate (CH 3 COONa · 3H 2 O) as an alkali metal ion was used to prepare 1 L of a reduction reaction aqueous solution. The alkali metal ion concentration in the reduction reaction aqueous solution was 0.01 mol / liter (L), and the pH was about 5.0.
Next, 500 ml of this solution was supplied to the electrolytic cell in which the vertical columnar cathode shown in FIG. 1 was disposed, and energized at 2.5 A for 2 minutes to deposit copper fine particles near the cathode surface.
(2)銅微粒子の回収(工程2)
カソード表面上を上端部近傍から下端部近傍に向かって、2cm/secの速度で移動するようにブレードを可動させて、カソード表面上の銅微粒子をブレードで掻き取った。掻き取られた銅微粒子は電解槽の下方に沈降していき、電解槽底部の錐状部分にスラリーとして沈降・濃縮した。沈降したスラリー10ml(ミリリットル)を、回収口より取り出した。
尚、掻き取られた銅微粒子の電解槽における沈降速度は、2.4〜3.2cm/secであり、スラリー中の銅微粒子濃度は2質量%であった。
回収したスラリーを40mlのエタノール中に滴下し、銅微粒子を沈降させて沈降した粒子を抽出し、遠沈管に採取した。該遠沈管にエタノール50mlを添加し、超音波ホモジナイザーを用いて良く撹拌した後、遠心分離器で銅微粒子成分を回収するエタノール洗浄を3度繰り返した。続いて、同じく遠沈管中に、得られた銅微粒子と1−ブタノール50mlを入れ、超音波ホモジナイザーを用いて良く撹拌した後、遠心分離器で粒子成分を回収する1−ブタノール洗浄を3度繰り返した。
上記操作により、200mgの銅微粒子が得られた。
(2) Recovery of copper fine particles (Step 2)
The blade was moved so as to move at a speed of 2 cm / sec from the vicinity of the upper end to the vicinity of the lower end on the cathode surface, and copper fine particles on the cathode surface were scraped off with the blade. The scraped copper fine particles settled down below the electrolytic cell, and settled and concentrated as a slurry on the conical portion at the bottom of the electrolytic cell. 10 ml (milliliter) of the settled slurry was taken out from the collection port.
In addition, the sedimentation speed | rate in the electrolytic vessel of the copper fine particle scraped off was 2.4-3.2 cm / sec, and the copper fine particle density | concentration in a slurry was 2 mass%.
The recovered slurry was dropped into 40 ml of ethanol, the copper fine particles were allowed to settle, and the precipitated particles were extracted and collected in a centrifuge tube. After adding 50 ml of ethanol to the centrifuge tube and stirring well using an ultrasonic homogenizer, ethanol washing for recovering copper fine particle components with a centrifuge was repeated three times. Subsequently, the obtained copper fine particles and 50 ml of 1-butanol are similarly put in a centrifuge tube, and after thoroughly stirring using an ultrasonic homogenizer, 1-butanol washing for recovering particle components with a centrifuge is repeated three times. It was.
By the above operation, 200 mg of copper fine particles were obtained.
(3)銅微粒子の分散溶液中への分散(工程3)
銅微粒子を、エチレングリコールに混合して超音波ホモジナイザーで5分間撹拌することで、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥を行ったところ、銅の純度は95質量%以上であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ一次粒子径は7〜350nmの範囲で、形状は顆粒状でありデンドライト状の凝集は観察されなかった。
(3) Dispersion of copper fine particles in a dispersion solution (Step 3)
The copper fine particles were mixed with ethylene glycol and stirred with an ultrasonic homogenizer for 5 minutes to obtain a copper fine particle dispersion.
When the obtained copper fine particle dispersion was applied on a glass substrate and then vacuum-dried , the purity of copper was 95% by mass or more.
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh with a carbon support film attached, and after removing the solvent by drying, the primary particle diameter was in the range of 7 to 350 nm when observed with a transmission electron microscope. It was granular and no dendrite-like aggregation was observed.
[実施例2]
実施例1で使用したのと同様の電解槽を用いて、電解還元によりカソード表面に析出させ、該析出した銅微粒子をブレードの掻き取り速度を実施例1とは異なる速度で掻き取り、スラリーとして回収した後、洗浄して分散溶液に分散して銅微粒子分散液を調製した。
(1)銅微粒子の電解還元による析出(工程1)
実施例1で使用したと同様の電解槽を用いて、実施例1と同様にして、カソード表面近傍に銅微粒子を析出させた。
(2)銅微粒子の回収(工程2)
カソード表面上を上端部近傍から下端部近傍に向かって、ブレードの移動速度を1.5cm/secの速度で移動させて掻き取りを行った以外は実施例1に記載したと同様にして、銅微粒子の回収を行った。掻き取られた銅微粒子は電解槽の下方に沈降していき、電解槽底部の錐状部分にスラリーとして沈降・濃縮した。沈降したスラリー10ml(ミリリットル)を、回収口より取り出した。
尚、掻き取られた銅微粒子の電解槽における沈降速度は、2.7〜5.0cm/secであった。
回収したスラリーを40mlのエタノール中に滴下し、銅微粒子を沈降させて沈降した粒子を抽出し、遠沈管に採取した。該遠沈管にエタノール50mlを添加し、超音波ホモジナイザーを用いて良く撹拌した後、遠心分離器で銅微粒子成分を回収するエタノール洗浄を3度繰り返した。続いて、同じく遠沈管中に、得られた銅微粒子と1−ブタノール50mlを入れ、超音波ホモジナイザーを用いて良く撹拌した後、遠心分離器で粒子成分を回収する1−ブタノール洗浄を3度繰り返した。
上記操作により、200mgの銅微粒子が得られた
(3)銅微粒子の分散溶液中への分散(工程3)
銅微粒子を、エチレングリコールに混合して超音波ホモジナイザーで5分間撹拌することで、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は98質量%以上であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ一次粒子径は7〜350nmの範囲で、形状は顆粒状でありデンドライト状の凝集は観察されなかった。
[Example 2]
Using the same electrolytic cell as used in Example 1, it was deposited on the cathode surface by electrolytic reduction, and the deposited copper fine particles were scraped off at a blade scraping rate different from that in Example 1 to obtain a slurry. After the collection, it was washed and dispersed in a dispersion solution to prepare a copper fine particle dispersion.
(1) Precipitation by electrolytic reduction of copper fine particles (Step 1)
Using the same electrolytic cell as used in Example 1, copper fine particles were deposited in the vicinity of the cathode surface in the same manner as in Example 1.
(2) Recovery of copper fine particles (Step 2)
In the same manner as described in Example 1, except that scraping was performed by moving the blade at a speed of 1.5 cm / sec from the vicinity of the upper end to the vicinity of the lower end on the cathode surface. Fine particles were collected. The scraped copper fine particles settled down below the electrolytic cell, and settled and concentrated as a slurry on the conical portion at the bottom of the electrolytic cell. 10 ml (milliliter) of the settled slurry was taken out from the collection port.
In addition, the sedimentation speed | rate in the electrolytic vessel of the copper fine particle scraped off was 2.7-5.0 cm / sec.
The recovered slurry was dropped into 40 ml of ethanol, the copper fine particles were allowed to settle, and the precipitated particles were extracted and collected in a centrifuge tube. After adding 50 ml of ethanol to the centrifuge tube and stirring well using an ultrasonic homogenizer, ethanol washing for recovering copper fine particle components with a centrifuge was repeated three times. Subsequently, the obtained copper fine particles and 50 ml of 1-butanol are similarly put in a centrifuge tube, and after thoroughly stirring using an ultrasonic homogenizer, 1-butanol washing for recovering particle components with a centrifuge is repeated three times. It was.
200 mg of copper fine particles were obtained by the above operation. (3) Dispersion of copper fine particles in a dispersion solution (Step 3)
The copper fine particles were mixed with ethylene glycol and stirred with an ultrasonic homogenizer for 5 minutes to obtain a copper fine particle dispersion.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The purity of copper was 98% by mass or more.
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh with a carbon support film attached, and after removing the solvent by drying, the primary particle diameter was in the range of 7 to 350 nm when observed with a transmission electron microscope. It was granular and no dendrite-like aggregation was observed.
[実施例3]
横型円柱形状カソードが配設された図2に示す電解槽を用いて、銅微粒子を電解還元によりカソード表面に析出させ、該析出した銅微粒子をブレードで掻き取り、スラリーとして回収した後、洗浄して分散溶液に分散して銅微粒子分散液を調製した。
(1)銅微粒子の電解還元による析出(工程1)
実施例1と同様の方法で、還元反応水溶液を調整した。
次にこの還元反応水溶液500mlを図2に示す横型円柱形状カソードが配設された電解槽に供給し、1.9Aで2分間通電して、カソード表面近傍に銅微粒子を析出させたところ、アノードと対向している面において、銅微粒子の析出がみられた。
[Example 3]
Using the electrolytic cell shown in FIG. 2 provided with a horizontal cylindrical cathode, copper fine particles are deposited on the cathode surface by electrolytic reduction, and the deposited copper fine particles are scraped with a blade, collected as a slurry, and then washed. Then, a fine copper particle dispersion was prepared by dispersing in a dispersion.
(1) Precipitation by electrolytic reduction of copper fine particles (Step 1)
A reduction reaction aqueous solution was prepared in the same manner as in Example 1.
Next, 500 ml of this reduction reaction aqueous solution was supplied to an electrolytic cell in which a horizontal cylindrical cathode shown in FIG. 2 was disposed, and energized at 1.9 A for 2 minutes to deposit copper fine particles near the cathode surface. Precipitation of copper fine particles was observed on the surface facing.
(2)銅微粒子の回収(工程2)
カソード表面が、2cm/secの速度で移動するように図2において時計回りの方向に回転させて、カソード表面上の銅微粒子をブレードで掻き取った。掻き取られた銅微粒子は電解槽の下方に沈降していき、電解槽底部の錐状部分にスラリーとして沈降・濃縮した。沈降したスラリー10ml(ミリリットル)を、回収口より取り出した。
尚、掻き取られた銅微粒子の電解槽における沈降速度は、2.4〜3.2cm/secであり、スラリー中の銅微粒子濃度は2質量%であった。
実施例1と同様にして銅微粒子を洗浄したところ、150mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散(工程3)
銅微粒子を、エチレングリコールに混合して超音波ホモジナイザーで5分間撹拌することで、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は95質量%以上であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ一次粒子径は7〜350nmの範囲で、形状は顆粒状でありデンドライト状の凝集は観察されなかった。
(2) Recovery of copper fine particles (Step 2)
The cathode surface was rotated in the clockwise direction in FIG. 2 so as to move at a speed of 2 cm / sec, and the copper fine particles on the cathode surface were scraped with a blade. The scraped copper fine particles settled down below the electrolytic cell, and settled and concentrated as a slurry on the conical portion at the bottom of the electrolytic cell. 10 ml (milliliter) of the settled slurry was taken out from the collection port.
In addition, the sedimentation speed | rate in the electrolytic vessel of the copper fine particle scraped off was 2.4-3.2 cm / sec, and the copper fine particle density | concentration in a slurry was 2 mass%.
When the copper fine particles were washed in the same manner as in Example 1, 150 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution (Step 3)
The copper fine particles were mixed with ethylene glycol and stirred with an ultrasonic homogenizer for 5 minutes to obtain a copper fine particle dispersion.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The purity of copper was 95% by mass or more.
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh with a carbon support film attached, and after removing the solvent by drying, the primary particle diameter was in the range of 7 to 350 nm when observed with a transmission electron microscope. It was granular and no dendrite-like aggregation was observed.
[比較例1]
(1)銅微粒子の電解還元による析出
実施例1で使用したと同様の電解槽を用いて、実施例1と同様にして、カソード表面近傍に銅微粒子を析出させた。
(2)銅微粒子の回収
カソード表面上を上端部近傍から下端部近傍に向かって、ブレードの移動速度を3cm/secの速度で移動させて掻き取りを行った以外は実施例1に記載したと同様にして、銅微粒子の回収を行った。
この場合、大半の粒子が沈降するのに10分以上要した。液面から容器底部までの距離は10cm程度であったことから、沈降速度は、0.017cm/sec以下であったと想定される。
実施例1に記載したと同様の方法により、得られた金属微粒子を洗浄した。
上記操作により、215mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は70質量%、酸化銅の含有量は30質量%であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ一次粒子径は7〜500nmの範囲であった。
[Comparative Example 1]
(1) Precipitation by electrolytic reduction of copper fine particles Using the same electrolytic cell as used in Example 1, copper fine particles were deposited in the vicinity of the cathode surface in the same manner as in Example 1.
(2) Recovery of copper fine particles As described in Example 1 except that scraping was performed by moving the blade at a speed of 3 cm / sec from the vicinity of the upper end toward the vicinity of the lower end on the cathode surface. Similarly, copper fine particles were collected.
In this case, it took 10 minutes or more for most of the particles to settle. Since the distance from the liquid level to the bottom of the container was about 10 cm, the sedimentation speed is assumed to be 0.017 cm / sec or less.
The obtained fine metal particles were washed by the same method as described in Example 1.
By the above operation, 215 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. As a result, the purity of copper was 70% by mass and the content of copper oxide was 30% by mass. .
Moreover, when the obtained copper fine particle dispersion solution was extract | collected on the aluminum mesh which attached the carbon support film, the solvent was dried and removed, when observed with the transmission electron microscope, the primary particle diameter was the range of 7-500 nm.
[比較例2]
(1)銅微粒子の電解還元による析出
実施例1で使用したと同様の電解槽を用いて、実施例1と同様にして、カソード表面近傍に銅微粒子を析出させた。
(2)銅粒子の回収
ブレードを動かさずに、超音波ホモジナイザーを電解槽に挿入し還元反応水溶液を2分間撹拌したところ、カソード上の粒子が分散し還元反応水溶液の懸濁がみられた。この場合、大半の粒子が沈降するのに1時間以上要したことから、粒子の沈降速度は0.0028cm/sec以下であったと想定される。
実施例1に記載したと同様の方法により、得られた金属微粒子を洗浄した。
上記操作により、220mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は1質量%、酸化銅の含有量は99質量%であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ酸化凝集をおこしており粒子径は0.1〜10μmの範囲であった。
[Comparative Example 2]
(1) Precipitation by electrolytic reduction of copper fine particles Using the same electrolytic cell as used in Example 1, copper fine particles were deposited in the vicinity of the cathode surface in the same manner as in Example 1.
(2) Recovery of copper particles An ultrasonic homogenizer was inserted into the electrolytic cell without moving the blade, and the reduction reaction aqueous solution was stirred for 2 minutes. As a result, the particles on the cathode were dispersed and suspension of the reduction reaction aqueous solution was observed. In this case, since it took 1 hour or more for most of the particles to settle, the sedimentation rate of the particles is assumed to be 0.0028 cm / sec or less.
The obtained fine metal particles were washed by the same method as described in Example 1.
By the above operation, 220 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The copper purity was 1% by mass and the copper oxide content was 99% by mass. .
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, it was observed by a transmission electron microscope and caused oxidative aggregation, and the particle size was 0.1 to 0.1. The range was 10 μm.
[比較例3]
(1)銅微粒子の電解還元による析出
実施例1で使用したと同様の電解槽を用いて、実施例1と同様にして、カソード表面近傍に銅微粒子を析出させた。
(2)銅粒子の回収
ブレードを動かさずに、超音波ホモジナイザーを電解槽に挿入し還元反応水溶液を2分間撹拌したところ、カソード上のから剥離した粒子が、分散し還元反応水溶液の懸濁がみられた。還元反応水溶液を2分間遠心分離にかけて、銅粒子スラリーを回収した。
実施例1に記載したと同様の方法により、得られた金属微粒子を洗浄した。
上記操作により、220mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は1質量%、酸化銅の含有量は99質量%であった。
また、得られた銅微粒子分散溶液をカーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ酸化凝集をおこしており粒子径は0.1〜10μmの範囲であった。
[Comparative Example 3]
(1) Precipitation by electrolytic reduction of copper fine particles Using the same electrolytic cell as used in Example 1, copper fine particles were deposited in the vicinity of the cathode surface in the same manner as in Example 1.
(2) Recovery of copper particles Inserting an ultrasonic homogenizer into an electrolytic cell without moving the blade and stirring the reduction reaction aqueous solution for 2 minutes, the particles peeled off from the cathode are dispersed and the reduction reaction aqueous solution is suspended. It was seen. The aqueous solution of the reduction reaction was centrifuged for 2 minutes to recover the copper particle slurry.
The obtained fine metal particles were washed by the same method as described in Example 1.
By the above operation, 220 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The copper purity was 1% by mass and the copper oxide content was 99% by mass. .
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, it was observed by a transmission electron microscope and caused oxidative aggregation, and the particle size was 0.1 to 0.1. The range was 10 μm.
[比較例4]
(1)銅微粒子の電解還元による析出
酢酸ナトリウム濃度を0モル/Lとした以外は実施例1と同様に、還元反応水溶液を調製し、還元反応を行った。
(2)銅粒子の回収
実施例1と同様の方法で、銅微粒子を洗浄・回収したところ230mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は70〜80質量%、酸化銅の含有量は1質量%以下、無水酢酸銅((CH3COO)2Cu)20〜30質量%であった。
また、得られた銅微粒子分散溶液を、カーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところデンドライト状に凝集をおこしており粒子径は1〜10μmの範囲であった。
[Comparative Example 4]
(1) Precipitation by electrolytic reduction of copper fine particles A reduction reaction aqueous solution was prepared and a reduction reaction was performed in the same manner as in Example 1 except that the sodium acetate concentration was 0 mol / L.
(2) Recovery of copper particles By washing and collecting copper fine particles in the same manner as in Example 1, 230 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
When the obtained copper fine particle dispersion solution was applied onto a glass substrate and then vacuum-dried and analyzed by X-ray diffraction, the purity of copper was 70 to 80% by mass, and the content of copper oxide was 1% by mass or less. , Anhydrous copper acetate ((CH 3 COO) 2 Cu), 20-30% by mass.
The obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, it was agglomerated in a dendritic state when observed with a transmission electron microscope. It was in the range of -10 μm.
[比較例5]
(1)銅微粒子の電解還元による析出
酢酸ナトリウム濃度を1.5モル/Lとした以外は実施例1と同様に、還元反応水溶液を調製し、還元反応を行ったところ水素発生が顕著になり、銅粒子が析出しにくくなった。還元反応水溶液のpHは約5.5であった。
(2)銅粒子の回収
実施例1と同様の方法で、銅微粒子を洗浄・回収したところ220mgの銅微粒子が得られた。洗浄する際にアルカリ金属イオンが除去しづらくなっていた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は85質量%、水酸化銅(Cu(OH)2)10質量%、酸化銅の含有量は1質量%以下、無水酢酸銅((CH3COO)2Cu)1質量以下%であった。
また、得られた銅微粒子分散溶液を、カーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ一次粒子の粒子径は1〜200nmの範囲で、形状は顆粒状でありデンドライト状の凝集は観察されなかった。
[Comparative Example 5]
(1) Precipitation by electrolytic reduction of copper fine particles Except for setting the sodium acetate concentration to 1.5 mol / L, a reduction reaction aqueous solution was prepared and a reduction reaction was performed in the same manner as in Example 1, and hydrogen generation became remarkable. Copper particles are less likely to precipitate. The pH of the aqueous reduction reaction solution was about 5.5.
(2) Recovery of copper particles By washing and collecting copper fine particles in the same manner as in Example 1, 220 mg of copper fine particles were obtained. It was difficult to remove alkali metal ions during washing.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The purity of copper was 85% by mass, and copper hydroxide (Cu (OH) 2 ) 10% by mass. %, The content of copper oxide was 1% by mass or less, and anhydrous copper acetate ((CH 3 COO) 2 Cu) was 1% by mass or less.
The obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, the particle diameter of the primary particles was in the range of 1 to 200 nm when observed with a transmission electron microscope. The shape was granular and no dendrite-like aggregation was observed.
[比較例6]
(1)実施例3で使用したと同様の電解槽を用いて、実施例3と同様にして、カソード表面でアノードと対向している近傍に銅微粒子を析出させた。
(2)銅微粒子の回収
カソード表面が3cm/secの速度で動くように、銅粒子の掻き取りを行った以外は実施例3に記載したと同様にして、銅微粒子の回収を行った。
この場合、大半の粒子が沈降するのに5分以上要した。固定されたブレードから容器底部までの距離は5cm程度であったことから、沈降速度は、0.017cm/sec以下であったと想定される。
実施例1に記載したと同様の方法により、得られた金属微粒子を洗浄した。
上記操作により、161mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は1質量%、酸化銅の含有量は99質量%であった。
また、得られた銅微粒子分散溶液を、カーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ酸化凝集をおこしており粒子径は0.1〜10μmの範囲であった。
[Comparative Example 6]
(1) Using the same electrolytic cell as used in Example 3, as in Example 3, copper fine particles were deposited in the vicinity of the cathode surface facing the anode.
(2) Recovery of copper fine particles Copper fine particles were recovered in the same manner as described in Example 3 except that the copper particles were scraped so that the cathode surface moved at a speed of 3 cm / sec.
In this case, it took more than 5 minutes for most of the particles to settle. Since the distance from the fixed blade to the bottom of the container was about 5 cm, the sedimentation speed is assumed to be 0.017 cm / sec or less.
The obtained fine metal particles were washed by the same method as described in Example 1.
By the above operation, 161 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The copper purity was 1% by mass and the copper oxide content was 99% by mass. .
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, it was observed by a transmission electron microscope. It was in the range of -10 μm.
[比較例7]
(1)実施例3で使用したと同様の電解槽を用いて、実施例3と同様にして、カソード表面でアノードと対向している近傍に銅微粒子を析出させた。
(2)銅粒子の回収
カソードを動かさずに、超音波ホモジナイザーを電解槽に挿入し還元反応水溶液を2分間撹拌したところ、カソード上のから剥離した粒子が、分散し還元反応水溶液の懸濁がみられた。還元反応水溶液を2分間遠心分離にかけて、銅粒子スラリーを回収した。
実施例1に記載したと同様の方法により、得られた金属微粒子を洗浄した。
上記操作により、165mgの銅微粒子が得られた。
(3)銅微粒子の分散溶液中への分散
実施例1に記載したと同様の操作を行って、銅微粒子分散溶液を得た。
得られた、銅微粒子分散溶液をガラス基板上に塗布後、真空乾燥させてX線回折による分析を行ったところ、銅の純度は1質量%、酸化銅の含有量は99質量%であった。
また、得られた銅微粒子分散溶液を、カーボン支持膜を取り付けたアルミメッシュ上に採取し、溶媒を乾燥除去したのち、透過電子顕微鏡で観察したところ酸化凝集をおこしており粒子径は0.1〜10μmの範囲であった。
[Comparative Example 7]
(1) Using the same electrolytic cell as used in Example 3, as in Example 3, copper fine particles were deposited in the vicinity of the cathode surface facing the anode.
(2) Recovery of copper particles Without moving the cathode, an ultrasonic homogenizer was inserted into the electrolytic cell and the aqueous reduction reaction solution was stirred for 2 minutes. As a result, the particles peeled off from the cathode were dispersed and suspended in the aqueous reduction reaction solution. It was seen. The aqueous solution of the reduction reaction was centrifuged for 2 minutes to recover the copper particle slurry.
The obtained fine metal particles were washed by the same method as described in Example 1.
By the above operation, 165 mg of copper fine particles were obtained.
(3) Dispersion of copper fine particles in a dispersion solution The same operations as described in Example 1 were performed to obtain a copper fine particle dispersion solution.
The obtained copper fine particle dispersion was applied onto a glass substrate, then vacuum dried and analyzed by X-ray diffraction. The copper purity was 1% by mass and the copper oxide content was 99% by mass. .
Further, the obtained copper fine particle dispersion was collected on an aluminum mesh provided with a carbon support film, and after removing the solvent by drying, it was observed by a transmission electron microscope. It was in the range of -10 μm.
1 電解槽
2 カソード
3 アノード
4 還元反応水溶液
5 ブレード
6 直流電源
11 スラリー回収部
12 スラリー回収弁
13 スラリー回収口
22 カソード
23 アノード
25 ブレード
DESCRIPTION OF SYMBOLS 1
Claims (12)
前記カソード表面近傍に析出した銅微粒子を掻き取り用ブレードにより、該掻き取り用ブレードとカソード間の相対移動速度が該還元反応水溶液における銅微粒子の沈降速度よりも遅い、2cm/sec以下の速度で掻き取とって、銅微粒子を沈降させて還元反応水溶液下部にスラリーで濃縮し、該スラリーを抜き出して該スラリー中の銅微粒子を洗浄液で洗浄して銅微粒子を回収する工程(工程2)、及び
回収した銅微粒子を分散液に分散する工程(工程3)
を含むことを特徴とする、銅微粒子分散液の製造方法。 A method for producing a copper fine particle dispersion, wherein at least a reduction reaction aqueous solution in which copper ions, alkali metal ions, and an organic dispersion medium are dissolved has a primary particle diameter of 1 to 500 nm by electrolytic reduction reaction of copper ions. Step of depositing copper fine particles in the range of the cathode near the cathode surface (Step 1)
The copper fine particles deposited in the vicinity of the cathode surface are scraped off at a rate of 2 cm / sec or less, the relative moving speed between the scraping blade and the cathode being slower than the settling speed of the copper fine particles in the reduction reaction aqueous solution. Scraping and precipitating the copper fine particles, concentrating with a slurry at the lower part of the reduction reaction aqueous solution, extracting the slurry and washing the copper fine particles in the slurry with a washing liquid (step 2), and A step of dispersing the recovered copper fine particles in a dispersion (step 3)
A method for producing a copper fine particle dispersion, comprising:
The method for producing a copper fine particle dispersion according to any one of claims 1 to 11 , wherein the cleaning liquid in Step 2 is a lower alcohol having 1 to 4 carbon atoms.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009068766A JP5520504B2 (en) | 2009-03-19 | 2009-03-19 | Method for producing copper fine particle dispersion |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009068766A JP5520504B2 (en) | 2009-03-19 | 2009-03-19 | Method for producing copper fine particle dispersion |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010222603A JP2010222603A (en) | 2010-10-07 |
| JP2010222603A5 JP2010222603A5 (en) | 2012-01-19 |
| JP5520504B2 true JP5520504B2 (en) | 2014-06-11 |
Family
ID=43040112
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009068766A Active JP5520504B2 (en) | 2009-03-19 | 2009-03-19 | Method for producing copper fine particle dispersion |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5520504B2 (en) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101428860B1 (en) | 2012-09-28 | 2014-08-14 | 한국원자력연구원 | Electrolytic Recovery Device |
| CN106048657B (en) * | 2016-08-09 | 2018-02-27 | 成都虹华环保科技股份有限公司 | A kind of laboratory silver recovery unit |
| CN106048656B (en) * | 2016-08-09 | 2018-09-25 | 成都虹华环保科技股份有限公司 | A kind of silver recovery unit of silver-containing liquid waste |
| CN106048664B (en) * | 2016-08-17 | 2018-10-19 | 株洲优瑞科有色装备有限公司 | A kind of device and method for non-ferrous metal on prestripping cathode plate |
| JP2018131660A (en) * | 2017-02-16 | 2018-08-23 | アークレイ株式会社 | Electrolysis device |
| CN109972172A (en) * | 2019-05-17 | 2019-07-05 | 四川海英电子科技有限公司 | Copper recycling and reusing device and recovery method in circuit board etching solution |
| CN110067010A (en) * | 2019-06-13 | 2019-07-30 | 重庆科技学院 | A kind of copper powder preparation facilities and preparation method |
| CN113913869A (en) * | 2021-09-30 | 2022-01-11 | 合肥工业大学 | Electrolytic copper recovery equipment with cyclone function and operation method thereof |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61106788A (en) * | 1984-10-29 | 1986-05-24 | Toppan Printing Co Ltd | Metal collecting method and its device |
| US7393438B2 (en) * | 2004-07-22 | 2008-07-01 | Phelps Dodge Corporation | Apparatus for producing metal powder by electrowinning |
| JP4699105B2 (en) * | 2005-06-24 | 2011-06-08 | アサヒプリテック株式会社 | Gold recovery method and apparatus |
| JP5202858B2 (en) * | 2007-03-23 | 2013-06-05 | 古河電気工業株式会社 | Method for producing copper fine particles |
| JP5255223B2 (en) * | 2007-03-29 | 2013-08-07 | 古河電気工業株式会社 | Method for producing copper alloy fine particles, and copper alloy fine particles obtained by the production method |
-
2009
- 2009-03-19 JP JP2009068766A patent/JP5520504B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010222603A (en) | 2010-10-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5520504B2 (en) | Method for producing copper fine particle dispersion | |
| JP5202858B2 (en) | Method for producing copper fine particles | |
| JP5485239B2 (en) | Method for producing copper fine particles | |
| US8088193B2 (en) | Method for making nanoparticles | |
| JP5252843B2 (en) | Silver ink and its manufacturing method | |
| CN103170645B (en) | The preparation method of nano silver wire | |
| Nekouie et al. | Effect of organic additives on synthesis of copper nano powders by pulsing electrolysis | |
| JP5235193B2 (en) | Spherical copper fine powder and method for producing the same | |
| JP5306966B2 (en) | Method for producing copper fine particle dispersed aqueous solution and method for storing copper fine particle dispersed aqueous solution | |
| JP5065072B2 (en) | Method for producing copper fine particles | |
| JP5211029B2 (en) | Method for producing metal nanoparticles using metal seed and metal nanoparticles containing metal seed | |
| JP2007084930A (en) | Metal nanoparticles and method for manufacturing thereof | |
| JP2008013846A (en) | Method for producing metal nanoparticle, and metal nanoparticle | |
| Yan et al. | Morphology control of ultrafine cuprous oxide powder and its growth mechanism | |
| JP2016011448A (en) | Fine particle, method for producing fine particle, and fine particle dispersion solution | |
| JP5213592B2 (en) | Copper fine powder, dispersion thereof and method for producing copper fine powder | |
| CN1778682A (en) | Production of nanometer copper oxide with controllable microstructure | |
| JP5162383B2 (en) | Method for producing silver-coated copper fines | |
| JP2010222603A5 (en) | ||
| WO2021018159A1 (en) | Method for preparing elemental material by using reduction of monoatomic carbon | |
| KR101537149B1 (en) | Method of producing metal nano-particles | |
| Wang et al. | Effect of OH− on morphology of Cu2O particles prepared through reduction of Cu (II) by glucose | |
| JP6097578B2 (en) | Method for producing copper fine particles, copper fine particle dispersion, and method for storing copper fine particle dispersion | |
| JP2009007593A (en) | Fine particle dispersion and method for producing fine particle dispersion | |
| JP5922810B1 (en) | Fine particles, fine particle dispersion solution, and method for producing fine particles |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111125 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111125 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20130829 |
|
| RD05 | Notification of revocation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7425 Effective date: 20131011 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20131219 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131224 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140221 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140311 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140407 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 5520504 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |