JP5294397B2 - 金属錯体化合物 - Google Patents
金属錯体化合物 Download PDFInfo
- Publication number
- JP5294397B2 JP5294397B2 JP2008227072A JP2008227072A JP5294397B2 JP 5294397 B2 JP5294397 B2 JP 5294397B2 JP 2008227072 A JP2008227072 A JP 2008227072A JP 2008227072 A JP2008227072 A JP 2008227072A JP 5294397 B2 JP5294397 B2 JP 5294397B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- complex compound
- transition metal
- hydroxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *c(c(*)c1)cc(*2=Cc(c(cccc3)c3cc3)c3O*22*3)c1*2=Cc1*3ccc2c1cccc2 Chemical compound *c(c(*)c1)cc(*2=Cc(c(cccc3)c3cc3)c3O*22*3)c1*2=Cc1*3ccc2c1cccc2 0.000 description 2
- FYLYHNXYIWQPDE-UHFFFAOYSA-N Oc(cc1)c(C=O)c(cc2)c1c(C=O)c2O Chemical compound Oc(cc1)c(C=O)c(cc2)c1c(C=O)c2O FYLYHNXYIWQPDE-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
(式中、Rは、互いに独立して、水素、C1−C18アルキル基またはアリール基であり、R′は、互いに独立して、水素、水酸基、C1−C8アルキル基、C1−C8アルコキシル基またはアリール基であり、そしてMは、2価もしくは3価の遷移金属カチオンである)で表される単核錯体化合物。
(式中、Rは、互いに独立して、水素、C1−C18アルキル基またはアリール基であり、R′は、互いに独立して、水素、水酸基、C1−C8アルキル基、C1−C8アルコキシル基またはアリール基であり、そしてMは、2価もしくは3価の遷移金属カチオンである)
で表される二核錯体化合物。
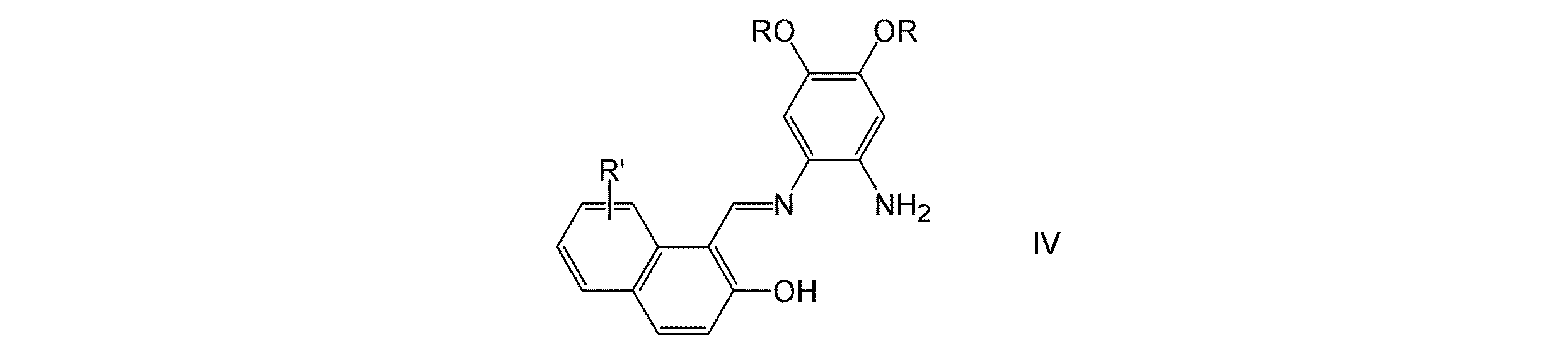
(式中、R、R′およびMは、上記に定義したとおりである)で表される単核錯体化合物の製造方法であって、式IV:
(式中、RおよびR′は、上記に定義したとおりである)で表されるN−(2−ヒドロキシ−1−ナフタリデン)−o−フェニレンジアミン化合物と、式V:
(式中、R′は、上記に定義したとおりである)で表される2−ヒドロキシ−1−ナフトアルデヒド化合物との混合物を、遷移金属化合物と反応させることを特徴とする、方法。
(式中、R、R′およびMは、上記に定義したとおりである)で表される二核錯体化合物の製造方法であって、式IV:
(式中、RおよびR′は、上記に定義したとおりである)で表されるN−(2−ヒドロキシ−1−ナフタリデン)−o−フェニレンジアミン化合物と、式VI:
の2,6−ジヒドロキシ−1,5−ナフタレンジカルバルデヒドとの混合物を、遷移金属化合物と反応させることを特徴とする、方法。
−電子吸収スペクトル
測定機器:JASCO V-630 spectrophotometer
測定試料:各実施例化合物の1×10−4Mピリジン(分析用グレード)溶液
−NMRスペクトル
測定機器:JEOL JNM-AL400(400 MHz for 1H)
−IRスペクトル
測定機器:Shimadzu FTIR-8700
−MSスペクトル
測定機器:JEOL JMS-600H
−元素分析
測定機器:FUSION INSTRUMENTS EA1108
2,6−ジヒドロキシナフトアルデヒド(207mg, 1.1mmol;C. Schieleら, Tetrahedron 24 (1968) p2293-2296 に従って合成した)を、THF(4mL)に溶解し、これを4,5−ビス(デシルオキシ)−1,2−フェニレンジアミン(239mg, 0.5mmol;D. T. Rosaら, Inorg. Synth. 33 (2002) p112-119 に従って合成した)のTHF/メタノール(v/v=1/1,5mL)溶液に、室温で加えた。12時間撹拌した後、反応混合物にメタノールを加え、沈殿を促した。析出した沈殿物をろ取し、赤紫色の結晶性固体として目的化合物139mg(収率34%)を得た。
IR (KBr) 3365 (νO-H), 1611 (νC=N) cm-1;
FAB(+) MS m/z 817.8 (817.5 calcd. for M+H+);
Elemental Analysis Calcd. for C52H68N2O6: C, 76.44; H, 8.39; N, 3.43. Found: C, 76.15; H, 8.40; N, 3.41.;
1H NMR (DMSO-d6) δ 0.85 (t (7.3 Hz), CH3, 6H), 1.20-1.40 (m, -CH2-, 32H), 1.42-1.51 (m, -CH2-, 4H), 1.73-1.80 (m, -CH2-, 4H), 4.15 (t (5.9 Hz), -CH2O-, 4H), 7.01 (d (9.2 Hz), ArH, 2H), 7.10-7.12 (m, ArH, 4H), 7.38 (s, ArH, 2H), 7.76 (d (9.3 Hz), ArH, 2H), 8.39 (d (9.7 Hz), ArH, 2H), 9.54 (br, ArOH, 2H), 9.56 (s, -CH=N-, 2H), 15.05 (br, ArOH, 2H).
2,6−ジヒドロキシナフトアルデヒド(753mg, 4.0mmol)を、THF−エタノール(v/v=1/4,25mL)に溶解し、これを4,5−ビス(デシルオキシ)−1,2−フェニレンジアミン(954mg, 2.0mmol)のTHF/エタノール(v/v=1/1,35mL)溶液に、室温で加えた。12時間撹拌した後、反応混合物を真空エバポレータで濃縮し、次いでメタノール30mLを加え、さらなる沈殿を促した。析出した沈殿物をろ取し、橙色の結晶性固体として目的化合物946mg(収率73%)を得た。
IR (KBr) 3192 (νO-H), 1607 (νC=N) cm-1;
FAB(+) MS m/z 647.5 (647.5 calcd. for M+H+);
Elemental Analysis Calcd. for C41H62N2O4・0.5H2O: C, 75.07; H, 9.68; N, 4.27. Found: C, 74.84; H, 9.71; N, 4.30.;
1H NMR (DMSO-d6) δ 0.85 (t (6.6 Hz), CH3, 6H), 1.19-1.38 (m, -CH2-, 32H), 1.40-1.48 (m, -CH2-, 4H), 1.64-1.74 (m, -CH2-, 4H), 3.90 (t (6.3 Hz), -CH2O-, 2H), 3.95 (t (6.4 Hz), -CH2O-, 2H), 4.76 (s, ArNH2, 2H), 6.50 (s, ArH, 1H), 7.04 (d (9.1 Hz), ArH, 1H), 7.10-7.13 (m, ArH, 2H), 7.22 (s, ArH, 1H), 7.72 (d (9.1 Hz), ArH, 1H), 8.41 (d (8.8 Hz), ArH, 1H), 9.49 (s, -CH=N-, 1H), 15.43 (s, ArOH, 1H).
実施例1で得られたリガンド(40.9mg, 0.05mmol)を、THF(5mL)に溶解し、それに酢酸亜鉛(II)・二水和物(12.1mg, 0.055mmol)のメタノール(1mL)溶液を、室温で滴下した。18時間撹拌した後、メタノール(6mL)を加え、次いで混合物を真空エバポレータで、固体が析出するまで濃縮した。析出した沈殿物をろ取し、赤紫色の結晶性固体として目的化合物38mg(収率86%)を得た。
FAB(+) MS m/z 879.6 (879.4 calcd. for M+H+);
Elemental Analysis Calcd. for C52H66N2O6Zn・2H2O: C, 68.15; H, 7.70; N, 3.06. Found: C, 68.18; H, 7.44; N, 3.00.;
1H NMR (DMSO-d6) δ 0.85 (t (6.5 Hz), CH3, 6H), 1.20-1.42 (m, -CH2-, 32H), 1.48-1.56 (m, -CH2-, 4H), 1.75-1.83 (m, -CH2-, 4H), 4.20 (t (6.0 Hz), -CH2O-, 4H), 6.92 (d (9.1 Hz), ArH, 2H), 6.99 (s, ArH, 2H), 7.03 (d (8.9 Hz), ArH, 2H), 7.56 (s, ArH, 2H), 7.59 (d 9.3 Hz), ArH, 2H), 8.29 (d (9.3 Hz), ArH, 2H), 9.23 (s, -CH=N-, 2H), 9.58 (s, ArOH, 2H).
実施例1で得られたリガンド(40.9mg, 0.05mmol)を、THF(2mL)に溶解し、それに酢酸銅(II)・無水物(10.0mg, 0.055mmol)のメタノール(2mL)溶液を、室温で滴下した。さらにメタノール(1mL)を加え、16時間撹拌すると、沈殿物が得られた。それをろ取し、暗紫色の結晶性固体として目的化合物45mg(収率100%)を得た。
FAB(+) MS m/z 878.5 (878.4 calcd. for M+H+), 900.7 (900.4 calcd. for M+Na+); Elemental Analysis Calcd. for C52H66CuN2O6・H2O: C, 69.65; H, 7.64; N, 3.12. Found: C, 69.38; H, 7.64; N, 3.15.
実施例1で得られたリガンド(40.9mg, 0.05mmol)を、THF(5mL)に溶解し、それに酢酸ニッケル(II)・四水和物(13.7mg, 0.055mmol)のメタノール(1mL)溶液を、室温で滴下した。混合物は速やか沈殿を形成した。これをろ取し、暗紫色の結晶性固体として目的化合物41mg(収率94%)を得た。
FAB(+) MS m/z 873.7 (873.4 calcd. for M+H+), 895.7 (895.4 calcd. for M+Na+);
Elemental Analysis Calcd. for C52H66N2NiO6・H2O: C, 70.03; H, 7.69; N, 3.14. Found: C, 69.85; H, 7.54; N, 3.16.;
1H NMR (DMSO-d6) δ 0.84 (t (6.3 Hz), CH3, 6H), 1.20-1.40 (m, -CH2-, 32H), 1.45-1.54 (m, -CH2-, 4H), 1.73-1.80 (m, -CH2-, 4H), 4.18 (t (6.8 Hz), -CH2O-, 4H), 7.04 (d (9.1 Hz), ArH, 2H), 7.08 (s, ArH, 2H), 7.10 (d (8.9 Hz), ArH, 2H), 7.64 (d 9.2 Hz), ArH, 2H), 7.80 (s, ArH, 2H), 8.38 (d (8.5 Hz), ArH, 2H), 9.06 (s, -CH=N-, 2H), 9.44 (s, ArOH, 2H).
実施例1で得られたリガンド(40.9mg, 0.05mmol)を、THF(2mL)に溶解し、それに塩化鉄(III)・六水和物(14.9mg, 0.055mmol)のメタノール(1mL)溶液を、室温で滴下した。トリエチルアミン(5μL)を加え、混合物を18時間放置した。メタノール(6mL)を加えた後、真空エバポレータで濃縮すると、沈殿が得られた。それをろ取し、暗褐色の結晶性固体として目的化合物29mg(収率64%)を得た。
FAB(+) MS m/z 870.6 (870.4 calcd. for M-Cl-), 905.6 (905.4 calcd. for M+);
Elemental Analysis Calcd. for C52H66ClFeN2O6・H2O: C, 67.56; H, 7.41; N, 3.03. Found: C, 67.44; H, 6.83; N, 2.80.
実施例2で得られたハーフリガンド(129.4mg, 0.2mmol)を、THF(5mL)に溶解し、それに2,6−ジヒドロキシ−1,5−ナフタレンジカルバルデヒド(21.6mg,0.1mmol;A. P. Kuriakose et al., Jour. Indian Chem. Soc., Vol. 43, No. 6, 1966 に記載の方法に従って合成した)のTHF(5mL)溶液を加えた。混合物が赤褐色の溶液に変化した後、酢酸亜鉛(II)・二水和物(48.3mg, 0.22mmol)のメタノール(3mL)溶液を、室温で滴下した。4時間撹拌した後、沈殿物が得られた。沈殿物をろ取し、メタノールで洗浄し、赤紫色の結晶性固体として目的化合物127.6mg(収率80%)を得た。
FAB(+) MS m/z 1599.7 (1597.8 calcd. for M+H+);
Elemental Analysis Calcd. for C94H124N4O10Zn2・4H2O: C, 67.49; H, 7.95; N, 3.35. Found: C, 67.38; H, 7.46; N, 3.48.;
1H NMR (pyridine-d5) δ 0.89 (t (6.6 Hz), CH3, 12H), 1.20-1.39 (m, -CH2-, 72H), 1.48-1.58 (m, -CH2-, 8H), 1.77-1.87 (m, -CH2-, 8H), 4.18 (t (6.4 Hz), -CH2O-, 4H), 4.22 (t (6.3 Hz), -CH2O-, 4H), 7.48 (d (9.3 Hz), ArH, 2H), 7.51 (d (9.2 Hz), ArH, 2H), 7.56 (s, ArH, 2H), 7.77 (d (9.5 Hz), ArH, 2H), 7.85 (s, ArH, 2H), 7.92 (s, ArH, 2H), 8.65 (d (9.3 Hz), ArH, 2H), 8.74 (d, ArH, 2H), 8.83 (d (9.3 Hz), ArH, 2H), 10.16 (s, -CH=N-, 2H), 10.20 (s, -CH=N-, 2H), 11.44 (s, ArOH, 2H).
実施例2で得られたハーフリガンド(129.4mg, 0.2mmol)を、THF(5mL)に溶解し、それに2,6−ジヒドロキシ−1,5−ナフタレンジカルバルデヒド(21.6mg,0.1mmol)のTHF(5mL)溶液を加えた。混合物が赤褐色の溶液に変化した後、酢酸銅(II)・無水物(40.0mg, 0.22mmol)のメタノール/THF(v/v=1/3,8mL)溶液を、室温で滴下した。11時間撹拌した後、沈殿物が得られた。沈殿物をろ取し、メタノールで洗浄し、暗紫色の結晶性固体として目的化合物137.5mg(収率86%)を得た。
FAB(+) MS m/z 1596.9 (1594.8 calcd. for M+H+);
Elemental Analysis Calcd. for C94H124Cu2N4O10・2H2O: C, 69.13; H, 7.90; N, 3.43. Found: C, 68.92; H, 7.81; N, 3.35.
実施例2で得られたハーフリガンド(129.4mg, 0.2mmol)を、THF(5mL)に溶解し、それに2,6−ジヒドロキシ−1,5−ナフタレンジカルバルデヒド(21.6mg,0.1mmol)のTHF(5mL)溶液を加えた。混合物が赤褐色の溶液に変化した後、酢酸ニッケル(II)・四水和物(54.7mg, 0.22mmol)のメタノール/THF(v/v=1/3,8mL)溶液を、室温で滴下した。12時間撹拌した後、沈殿物が得られた。沈殿物をろ取し、メタノールで洗浄し、赤紫色の結晶性固体として目的化合物132.2mg(収率83%)を得た。
FAB(+) MS m/z 1585.4 (1585.8 calcd. for M+H+);
Elemental Analysis Calcd. for C94H124N4Ni2O10・3H2O: C, 68.78; H, 7.98; N, 3.41. Found: C, 69.15; H, 7.79; N, 3.41.
実施例2で得られたハーフリガンド(64.7mg, 0.1mmol)を、THF(3mL)に溶解し、それに2,6−ジヒドロキシ−1,5−ナフタレンジカルバルデヒド(10.8mg,0.05mmol)のTHF(4mL)溶液を加えた。混合物が赤褐色の溶液に変化した後、塩化鉄(III)・六水和物(29.7mg, 0.11mmol)のメタノール(2mL)溶液を、室温で滴下した。トリエチルアミン(10μL)を加え、混合物を16時間放置した。沈殿物が得られ、それをろ取し、メタノールで洗浄し、黒色の結晶性固体として目的化合物33.0mg(収率40%)を得た。
FAB(+) MS m/z 1580.7 (1580.8 calcd. for M+-2Cl-);
Elemental Analysis Calcd. for C94H124Cl2Fe2N4O10・2H2O: C, 66.86; H, 7.64; N, 3.32. Found: C, 66.70; H, 7.09; N, 3.45.
実施例3〜10で得られた単核および二核錯体化合物の電子吸収スペクトルを、紫外可視分光光度計(JASCO V-630 spectrophotometer)にて測定した。試料は、実施例3〜10の化合物をピリジン(分析用グレード)に溶解し、1×10−4M溶液としたものを使用した。結果を図1〜4に示す。この電子吸収スペクトルから明らかなように、本発明の錯体化合物は、添付の図面に示すように、600nmを超える長波長領域に吸収を示すことから、半導体特性、導電性又は発光性などの特性を発揮することが期待される。
Claims (8)
- 遷移金属カチオンが、周期表第4周期の遷移金属から選択されるものである、請求項1または2に記載の錯体化合物。
- 遷移金属カチオンが、亜鉛(II)、銅(II)、ニッケル(II)、コバルト(II)、マンガン(II)または鉄(III)である、請求項3に記載の錯体化合物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008227072A JP5294397B2 (ja) | 2008-09-04 | 2008-09-04 | 金属錯体化合物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008227072A JP5294397B2 (ja) | 2008-09-04 | 2008-09-04 | 金属錯体化合物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010059103A JP2010059103A (ja) | 2010-03-18 |
| JP5294397B2 true JP5294397B2 (ja) | 2013-09-18 |
Family
ID=42186349
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008227072A Expired - Fee Related JP5294397B2 (ja) | 2008-09-04 | 2008-09-04 | 金属錯体化合物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5294397B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5569009B2 (ja) * | 2010-01-27 | 2014-08-13 | 株式会社Ihi | 有機el用発光材料、および、これを用いた有機el素子 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH596276A5 (ja) * | 1974-07-31 | 1978-03-15 | Ciba Geigy Ag | |
| DE2460396A1 (de) * | 1974-12-20 | 1976-06-24 | Hoechst Ag | Wasserunloesliche disazomethinverbindungen, verfahren zu ihrer herstellung und ihre verwendung als farbmittel |
| DE19757510A1 (de) * | 1997-12-23 | 1999-06-24 | Henkel Kgaa | Verwendung von Übergangsmetallkomplexen und Färbemittel |
-
2008
- 2008-09-04 JP JP2008227072A patent/JP5294397B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010059103A (ja) | 2010-03-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Fujisawa et al. | Reversible thermal-mode control of luminescence from liquid-crystalline gold (I) complexes | |
| Han et al. | A new TICT and AIE-active tetraphenylethene-based Schiff base with reversible piezofluorochromism | |
| Pitchaimani et al. | Synthesis, crystal structures, luminescence properties and catalytic application of lanthanide (III) piperidine dithiocarbamate complexes | |
| Chang et al. | Synthesis of photo-luminescent Zn (II) Schiff base complexes and its derivative containing Pd (II) moiety | |
| George et al. | Near-infrared luminescence of Nd 3+ and Yb 3+ complexes using a polyfluorinated pyrene-based β-diketonate ligand | |
| Yuan et al. | Structure and photophysical properties of a dimeric Zn (II) complex based on 8-hydroxyquinoline group containing 2, 6-dichlorobenzene unit | |
| Wang et al. | AIE-active TPA modified Schiff base for successive sensing of Cu 2+ and His via an on–off–on method and its application in bioimaging | |
| Lin et al. | Synthesis of alkynylated photo-luminescent Zn (II) and Mg (II) Schiff base complexes | |
| Wu et al. | Synthesis, photoluminescence and electrochemical properties of a series of carbazole-functionalized ligands and their silver (I) complexes | |
| CN104370968B (zh) | 异喹啉金属配合物及其制备方法与应用 | |
| JP5294397B2 (ja) | 金属錯体化合物 | |
| Ghosh et al. | Structural, spectroscopic and redox properties of transition metal complexes of dipyrido [3, 2-f: 2′, 3′-h]-quinoxaline (dpq) | |
| CN105037423B (zh) | 一种短波紫外激发的高效的稀土配合物发光材料 | |
| CN102558247A (zh) | 4-膦基-1,5-萘啶衍生物铜(i)配合物发光材料和应用 | |
| JP5841783B2 (ja) | 新規フルオレン化合物 | |
| JP2006143680A (ja) | 新規化合物及びその製造方法並びにその利用 | |
| Anbalagan et al. | Spectral and photophysical properties of mono and dinuclear Pt (II) and Pd (II) complexes: An unusual emission behaviour | |
| CN101792432A (zh) | 具有聚集态荧光增强与双光子荧光特性的吡啶查尔酮衍生物 | |
| JP5506306B2 (ja) | 発光物質 | |
| He et al. | Synthesis and luminescent properties of novel Cu (II), Zn (II) polymeric complexes based on 1, 10-phenanthroline and biphenyl groups | |
| Chen et al. | Synthesis, crystal structures and photophysical properties of novel copper (I) complexes with 4-diphenylphosphino-1, 5-naphthyridine ligands | |
| Priyadarshini et al. | Luminescence cobalt (II) complexes: synthesis, characterization, photophysical and DFT study | |
| Shi et al. | Synthesis and crystal structure of metal-organic frameworks [Ln2 (pydc-3, 5) 3 (H2O) 9] n3nH2O (Ln= Sm, Eu, Gd, Dy; pydc-3, 5= pyridine-3, 5-dicarboxylate) along with the photoluminescent property of its europium one | |
| Zhu et al. | Syntheses, crystal structures and luminescent properties of two novel lanthanide/4-pya complexes:[Ln (4-pya) 3 (H2O) 2] 2 (Ln= Eu, La; 4-pya= trans-4-pyridylacrylate) | |
| JP2013522180A (ja) | 発光団 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110520 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130528 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130607 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5294397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |