JP5262011B2 - Lactic acid production method and production apparatus - Google Patents
Lactic acid production method and production apparatus Download PDFInfo
- Publication number
- JP5262011B2 JP5262011B2 JP2007200439A JP2007200439A JP5262011B2 JP 5262011 B2 JP5262011 B2 JP 5262011B2 JP 2007200439 A JP2007200439 A JP 2007200439A JP 2007200439 A JP2007200439 A JP 2007200439A JP 5262011 B2 JP5262011 B2 JP 5262011B2
- Authority
- JP
- Japan
- Prior art keywords
- lactic acid
- membrane
- calcium
- concentration
- solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Abstract
Description
本発明は、微生物の発酵培養により培養液中に生産された乳酸を分離して製造する方法に関する。詳しくは、微生物培養液中に残存しているカルシウム成分をナノ濾過膜によって除去して乳酸溶液を得る乳酸の製造方法および製造装置に関する。 The present invention relates to a method for separating and producing lactic acid produced in a culture solution by fermentation culture of microorganisms. Specifically, the present invention relates to a lactic acid production method and a production apparatus for obtaining a lactic acid solution by removing calcium components remaining in a microorganism culture solution with a nanofiltration membrane.
乳酸は、食品用、医薬用などといった用途の他に、生分解性プラスチックのモノマー原料として工業的用途にまで広く適用され、需要が増加している。2−ヒドロキシプロピオン酸、即ち乳酸は、微生物による発酵により生産されることが知られており、微生物はグルコースに代表される炭水化物を含有する基質を乳酸に変換する。乳酸は、カルボニルα位の炭素に結合している水酸基の立体により、(L)−体および(D)−体の光学異性体に分類される。微生物発酵によれば、微生物を適宜選択することにより(L)−体または(D)−体の乳酸を選択的に、または(L)−体及び(D)−体の混合体(ラセミ体)の乳酸を生産することができる。 Lactic acid is widely applied to industrial uses as a monomer raw material for biodegradable plastics in addition to uses such as foods and pharmaceuticals, and the demand is increasing. 2-Hydroxypropionic acid, i.e., lactic acid, is known to be produced by fermentation by a microorganism, and the microorganism converts a substrate containing a carbohydrate typified by glucose into lactic acid. Lactic acid is classified into (L) -form and (D) -form optical isomers depending on the configuration of the hydroxyl group bonded to the carbon at the carbonyl α-position. According to microbial fermentation, (L) -form or (D) -form lactic acid is selectively selected by appropriately selecting microorganisms, or a mixture of (L) -form and (D) -form (racemic form). Of lactic acid.
微生物発酵による乳酸の生産は、一般に、培養液中にアルカリ性物質を添加することで、微生物発酵に最適なpHに保持されながら行われる。微生物発酵により生産された酸性物質である乳酸の多くは、アルカリ性物質が添加されているために、培養液中では乳酸塩として存在している。この場合、フリーの乳酸は、発酵終了後、培養液に酸性物質を添加することで得られる。
The production of lactic acid by microbial fermentation is generally carried out while maintaining an optimum pH for microbial fermentation by adding an alkaline substance to the culture solution. Many lactic acid is an acidic substance produced by microbial fermentation, in order to alkaline material is added, the culture is present as a lactate. In this case, free lactic acid can be obtained by adding an acidic substance to the culture solution after the end of fermentation.
具体的には、培養液中に添加するアルカリ性物質として水酸化カルシウムがしばしば用いられるが、この場合、微生物発酵により生産された乳酸は培養液中では乳酸カルシウムとして存在している。その後、培養終了後の培養液に酸性物質(例えば、硫酸)を添加することで、フリーの乳酸溶液を得ることができるが、カルシウム塩(例えば、硫酸カルシウム)が副生する。 Specifically, calcium hydroxide is often used as an alkaline substance added to the culture solution. In this case, lactic acid produced by microbial fermentation exists as calcium lactate in the culture solution. Thereafter, a free lactic acid solution can be obtained by adding an acidic substance (for example, sulfuric acid) to the culture solution after completion of the culture, but a calcium salt (for example, calcium sulfate) is by-produced.
ここで生じたカルシウム塩を除去して乳酸分離する方法としては、硫酸カルシウムのようにカルシウム塩が難溶性で沈殿する場合は、定性濾紙等により濾別する方法が用いられている。しかしながら、この方法の場合、固体として沈殿しているカルシウム塩は除去されるが、溶液中に溶解している微量のカルシウム塩は除去されず、乳酸溶液中に残存してしまう。そのために、この乳酸を含む濾液を、例えばその後の精製工程において濃縮操作を行うと、フリーの乳酸溶液中に再びカルシウム塩が析出(沈殿)するという問題がある。また、カルシウムイオンが十分に除去されていない状態のまま、蒸留等の操作により乳酸溶液を加熱すると、カルシウムイオンの影響により、乳酸のラセミ化およびオリゴマー化が進行することが知られている。そのために、乳酸溶液中に残留する微量のカルシウム成分(カルシウム塩)を効果的に除去する方法が求められている。 As a method of removing the calcium salt generated here and separating lactic acid, a method of filtering with a qualitative filter paper or the like is used when the calcium salt is hardly soluble, such as calcium sulfate. However, in this method, the calcium salt precipitated as a solid is removed, but a trace amount of calcium salt dissolved in the solution is not removed and remains in the lactic acid solution. Therefore, when the filtrate containing this lactic acid is subjected to a concentration operation in a subsequent purification step, for example, there is a problem that a calcium salt precipitates (precipitates) again in the free lactic acid solution. In addition, it is known that when a lactic acid solution is heated by an operation such as distillation in a state where calcium ions are not sufficiently removed, racemization and oligomerization of lactic acid proceed due to the influence of calcium ions. Therefore, a method for effectively removing a trace amount of calcium component (calcium salt) remaining in the lactic acid solution is required.
乳酸溶液から微量のカルシウム成分を除去する方法としては、イオン交換樹脂を用いる方法が開示されている(例えば、特許文献1参照)。しかしながら、イオン交換樹脂のイオン交換性能を保持するためには、定期的にイオン交換樹脂を再生する必要がある。また、イオン交換樹脂の再生には大量の塩化ナトリウム水溶液を用いて行われるが、再生に伴い、大量の廃液が排出され、廃液処理に多額のコストがかかるという問題点がある。さらに、繰り返しイオン交換樹脂の再生を行うとイオン交換樹脂の再生率が低下する上に、イオン交換性能が低下し、カルシウム塩の除去率が低下するという問題点があった。 As a method for removing a trace amount of calcium component from a lactic acid solution, a method using an ion exchange resin is disclosed (for example, see Patent Document 1). However, in order to maintain the ion exchange performance of the ion exchange resin, it is necessary to periodically regenerate the ion exchange resin. In addition, regeneration of the ion exchange resin is performed using a large amount of sodium chloride aqueous solution. However, with the regeneration, a large amount of waste liquid is discharged, and there is a problem that the waste liquid treatment is costly. Further, when the ion exchange resin is repeatedly regenerated, there is a problem that the regeneration rate of the ion exchange resin is lowered and the ion exchange performance is lowered and the removal rate of the calcium salt is lowered.
また、電気透析装置を用いたバイポーラ膜によって、乳酸溶液から微量のカルシウム成分を除去する方法も知られている(例えば、特許文献2参照)。しかしながら、この方法で用いるバイポーラ膜は高価な上に、カルシウム塩の除去効率が決して高くないという問題点があった。
本発明は、上述したような課題、すなわち、カルシウム塩の存在下で微生物発酵により乳酸を製造する場合において、培養液中のカルシウム成分を効果的に除去するという課題を解決し、効率よく乳酸を製造する方法を提供することを目的とする。
The invention, object that looks as though it was described above, i.e., in the case of producing lactic acid by microbial fermentation in the presence of calcium salts, and solve the problem of effectively removing a calcium component in the culture medium, efficiently lactate The object is to provide a method of manufacturing.
本発明者らは、上記課題を解決するため鋭意研究を行った結果、微生物発酵培養液をナノ濾過膜を用いて濾過することにより、培養液中のカルシウム成分を高効率で除去することができることを見出し、本発明を完成するに至った。 As a result of intensive studies to solve the above problems, the present inventors are able to remove the calcium component in the culture solution with high efficiency by filtering the microorganism fermentation culture solution using a nanofiltration membrane. As a result, the present invention has been completed.
すなわち、本発明は、次の(1)〜(6)から構成される。
(1)カルシウム塩の存在下で微生物の発酵培養により培養液中に生産された乳酸を分離して製造する方法であって、該培養液中のカルシウム成分を硫酸を加えて難溶性硫酸塩として除去して乳酸を含む分離液を得る工程A、工程Aで得られた乳酸を含む分離液をナノ濾過膜に通じて濾過し、カルシウム成分を除去して乳酸溶液を得る工程Bを含み、工程Bのナノ濾過膜のメタノールの除去率が10%以下かつイソプロピルアルコールの除去率が20%以上50%以下かつクエン酸の除去率が70%以上95%以下かつショ糖の除去率が95%以上であることを特徴とする乳酸の製造方法。
(2)前記ナノ濾過膜の膜素材が架橋ピペラジンポリアミドを主成分とし、かつ、化学式1で示される構成成分を含有することを特徴とする(1)に記載の乳酸の製造方法。
That is, this invention is comprised from following (1)-(6).
(1) A method for separating and producing lactic acid produced in a culture solution by fermentation of microorganisms in the presence of a calcium salt, wherein the calcium component in the culture solution is added with sulfuric acid to form a hardly soluble sulfate salt. A step A for obtaining a separation liquid containing lactic acid by removing, a step B for obtaining a lactic acid solution by removing the calcium component by filtering the separation liquid containing lactic acid obtained in step A through a nanofiltration membrane, nanofiltration membranes methanol removal rate of 10% or less or one isopropyl alcohol removal rate of 20% to 50% and removal rate removal rate of 95% or less and sucrose 70% or more of citric acid of the B 95% It is the above, The manufacturing method of lactic acid characterized by the above-mentioned.
(2) The method for producing lactic acid according to (1), wherein the membrane material of the nanofiltration membrane contains a crosslinked piperazine polyamide as a main component and a constituent represented by Chemical Formula 1.
(式中、Rは−Hまたは−CH3、nは0から3までの整数を表す。)
(3)前記工程Bで得られる乳酸溶液を、さらに、1Pa以上大気圧以下の圧力下において、25℃以上200℃以下で蒸留する工程Cを含む、(1)または(2)に記載の乳酸の製造方法。
(4)前記工程Bで得られる乳酸溶液を、さらに、逆浸透膜で濾過して乳酸濃度を高める工程Dを含む、(1)または(2)に記載の乳酸の製造方法。
(5)前記工程Dの後に前記工程Bで得られる乳酸溶液を、さらに、1Pa以上大気圧以下の圧力下において、25℃以上200℃以下で蒸留する工程Cを含む、(4)に記載の乳酸の製造方法。
(6)カルシウム塩の存在下で微生物の発酵培養により培養液中に生産された乳酸を分離して製造する際に用いられる乳酸の製造装置であって、乳酸を分離して製造する際には、該培養液中のカルシウム成分を硫酸を加えて難溶性硫酸塩として除去して乳酸を含む分離液を得る工程A、工程Aで得られた乳酸を含む分離液をナノ濾過膜に通じて濾過し、カルシウム成分を除去して乳酸溶液を得る工程Bを含み、工程Bのナノ濾過膜のメタノールの除去率が10%以下かつイソプロピルアルコールの除去率が20%以上50%以下かつクエン酸の除去率が70%以上95%以下かつショ糖の除去率が95%以上であることを特徴とする乳酸の製造装置。
(In the formula, R represents —H or —CH 3 , and n represents an integer of 0 to 3.)
(3) The lactic acid according to (1) or (2), further comprising a step C of distilling the lactic acid solution obtained in the step B at a pressure of 1 Pa or higher and an atmospheric pressure of 25 ° C. or higher and 200 ° C. or lower. Manufacturing method.
(4) The method for producing lactic acid according to (1) or (2), further comprising a step D in which the lactic acid solution obtained in the step B is further filtered through a reverse osmosis membrane to increase the lactic acid concentration.
(5) The method according to (4) , further comprising a step C of distilling the lactic acid solution obtained in the step B after the step D at a temperature of 25 ° C. or higher and 200 ° C. or lower under a pressure of 1 Pa or higher and atmospheric pressure or lower. Of producing lactic acid.
(6) A manufacturing apparatus of lactic acid used lactic acid produced in the culture solution by microbial fermentation in the presence of calcium salts when you manufactured separately, in manufacturing to separate the lactic acid Removes the calcium component in the culture solution as a poorly soluble sulfate by adding sulfuric acid to obtain a separation liquid containing lactic acid, and the separation liquid containing lactic acid obtained in step A is passed through a nanofiltration membrane. filtered, comprising the step B of obtaining a lactic acid solution to remove the calcium component, step nano methanol removal rate of the filtration membrane 10% or less or one of isopropyl alcohol 50% or less and citric acid at least 20% removal rate of the B An apparatus for producing lactic acid, wherein the removal rate of lactic acid is 70% to 95% and the sucrose removal rate is 95% or more.
本発明に係る乳酸の製造方法は、発酵培養液中に溶解し又は難溶性固体として含まれるカルシウム成分を簡単な操作により効果的に除去することができる。従って、例えばその後の濃縮操作、蒸留操作等の精製工程において、濃縮によるカルシウム塩の再析出(沈殿)、残存カルシウムイオンによる乳酸のラセミ化やオリゴマー化を抑制することが可能となる。 The method for producing lactic acid according to the present invention can effectively remove a calcium component dissolved in a fermentation broth or contained as a hardly soluble solid by a simple operation. Therefore, for example, in subsequent purification steps such as concentration operation and distillation operation, reprecipitation (precipitation) of calcium salt due to concentration, and racemization and oligomerization of lactic acid due to residual calcium ions can be suppressed.
以下、本発明をより詳細に説明する。 Hereinafter, the present invention will be described in more detail.
本発明の乳酸の製造方法は、カルシウム塩の存在下で微生物の発酵培養により培養液中に生産された乳酸を分離して製造する方法であって、発酵培養液をナノ濾過膜に通じて濾過して、発酵培養液中のカルシウム成分を除去して乳酸溶液を得る工程Bを含むものである。 The method for producing lactic acid of the present invention is a method for separating and producing lactic acid produced in a culture solution by fermentation of microorganisms in the presence of a calcium salt, and filtering the fermentation culture solution through a nanofiltration membrane. And the process B which removes the calcium component in a fermentation culture solution and obtains a lactic acid solution is included.
本発明の乳酸の製造方法の工程Bで用いるナノ濾過膜とは、ナノフィルトレーション膜、NF膜とも呼ばれるものであり、「一価のイオンは透過し、二価のイオンを阻止する膜」と一般に定義される膜である。数ナノメートル程度の微小空隙を有していると考えられる膜で、主として、水中の微小粒子や分子、イオン、塩類等を阻止するために用いられる。本発明の発明者らは、このナノ濾過膜の分画性能と、乳酸の透過性能およびカルシウムイオンの阻止性能および硫酸イオンの阻止性能との関係を詳細に検討した結果、本発明に用いるナノ濾過膜の分画性能が乳酸の透過性能およびカルシウムイオンの阻止性能および硫酸イオンの阻止性能と密接に関係があることを見出した。 The nanofiltration membrane used in Step B of the method for producing lactic acid of the present invention is also called a nanofiltration membrane or NF membrane, and “a membrane that transmits monovalent ions and blocks divalent ions”. It is a film generally defined as It is a membrane that is considered to have a minute gap of about several nanometers, and is mainly used to block minute particles, molecules, ions, salts, and the like in water. The inventors of the present invention have studied in detail the relationship between the fractionation performance of the nanofiltration membrane and the permeation performance of lactic acid, the inhibition performance of calcium ions and the inhibition performance of sulfate ions, and as a result, the nanofiltration used in the present invention It was found that the fractionation performance of the membrane is closely related to the permeation performance of lactic acid, the inhibition performance of calcium ions and the inhibition performance of sulfate ions.
ナノ濾過膜や逆浸透膜の分離性能は、一般に荷電反発の影響がある塩化ナトリウム水溶液や硫酸マグネシウムの濾過テストおよび荷電反発の影響がないメタノール、エタノール、イソプロピルアルコール、アセトン、ホルマリン、尿素、ブドウ糖、ショ糖などの大きさの異なる有機物や、酢酸、クエン酸、エチレンジアミンなどの分子をpHを調整して非解離状態とした分子を含む水溶液の濾過テストによって評価される。分離性能は塩の除去率や分画分子量曲線で評価され、その際の濾過水量で透水性能が評価される。分離性能と透水性能は相反する性能で、すなわち分子の阻止性能を高めるために膜構造を緻密化すると透水性能が低下するので、単純に膜構造を平均的に緻密にすれば良いというものではなく、細かく種々の大きさの分子の阻止性能を評価・把握して、必要な分画曲線のシャープさ(均一性)を決めた上で、出来るだけ透水性能が高くなるような分子構造にする必要があるため、膜構造の設計は難易度が高い課題である。
Separation performance of nanofiltration membranes and reverse osmosis membranes is generally due to filtration tests of sodium chloride aqueous solution and magnesium sulfate that have the effect of charge repulsion and methanol, ethanol , isopropyl alcohol, acetone, formalin, urea, glucose, It is evaluated by a filtration test of an aqueous solution containing organic substances having different sizes such as sucrose and molecules in which molecules such as acetic acid, citric acid and ethylenediamine are adjusted to a non-dissociated state by adjusting pH. Separation performance is evaluated by the salt removal rate and the molecular weight cut-off curve, and the water permeability is evaluated by the amount of filtrate at that time. Separation performance and water permeation performance are contradictory, that is, if the membrane structure is densified in order to increase molecular blocking performance, the water permeation performance will be reduced, so it is not simply a matter of densifying the membrane structure on average. It is necessary to evaluate and grasp the blocking performance of molecules of various sizes, determine the sharpness (uniformity) of the required fraction curve, and make the molecular structure as high as possible in water permeability. Therefore, the design of the film structure is a difficult task.
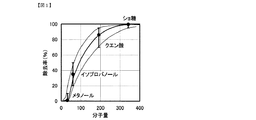
ここで本発明のナノ濾過膜は、メタノールの除去率が10%以下かつイソプロピルアルコールの除去率が20%以上50%以下かつクエン酸の除去率が70%以上95%以下かつショ糖の除去率が95%以上であると、乳酸の透過率が高く、カルシウムイオンの阻止率および硫酸イオンの阻止率が高くなることを見出すに至った。図1に本発明のナノ濾過膜の分画分子量曲線を示す。
Here nanofiltration membranes of the present invention, removal removal of methanol is 10% or less or One removal of the isopropyl alcohol is 20% or more 50% or less and the removal rate of citric acid 70% to 95% or less and sucrose When the rate is 95% or more, the inventors have found that the lactic acid permeability is high, and the calcium ion rejection rate and the sulfate ion rejection rate are increased. FIG. 1 shows a molecular weight cut-off curve of the nanofiltration membrane of the present invention.
メタノール、イソプロピルアルコール、クエン酸、ショ糖の分子径をB3LYP/6−31+G(d,p)レベルの分子軌道計算によって分子の構造最適化を行った後、分子内の各原子間の距離を計算し、最も遠い原子間距離とすると、それぞれ0.28nm、0.43nm、0.74nm、0.96nmとなる。一方、非解離の乳酸の大きさは0.50nmであるが、大きさ0.28nmのメタノールの除去率が10%を超えたり、大きさ0.43nmのイソプロピルアルコールの除去率が50%を超えたり、大きさ0.74nmのクエン酸の除去率が95%を超えると乳酸の透過率と透水性能が低下してしまい、本発明用のナノ濾過膜として好ましくないことを見出した。
After optimizing the molecular structure of the molecular diameter of methanol , isopropyl alcohol, citric acid, and sucrose by molecular orbital calculation at B3LYP / 6-31 + G (d, p) level, calculate the distance between each atom in the molecule The farthest interatomic distances are 0.28 nm, 0.43 nm, 0.74 nm, and 0.96 nm, respectively. On the other hand, the size of undissociated lactic acid is a 0.50 nm, Ri methanol removal rate of the size 0.28nm exceeds 10%, the 50% removal of the isopropyl alcohol in size 0.43nm Ri exceeds, the removal rate of citrate size 0.74nm exceeds 95% will be reduced transmittance and water permeability of the lactic acid, it was found that undesirable as nanofiltration membranes for the present invention.
また、カルシウムイオンの水和イオン構造を分子動力学計算によって求めたところ、カルシウムイオンは水分子が27水和した構造となっており、その水和イオンの大きさは1.2nmであることを明らかにした。このことを考慮してカルシウムの除去率を検討した結果、ショ糖の除去率が95%以上で、かつイソプロピルアルコールの除去率が20%以上かつクエン酸の除去率が70%以上であれば、カルシウムイオンやその対イオンである硫酸イオンの除去率が高くなることを見出した。
Further, when the hydrated ion structure of calcium ion was determined by molecular dynamics calculation, the calcium ion had a structure in which 27 water molecules were hydrated, and the size of the hydrated ion was 1.2 nm. Revealed. This result of examining the rate of removal of calcium in mind, if the removal rate of sucrose 95% or more, or One removal of the isopropyl alcohol removal rate of 20% or more and citric acid 70% The present inventors have found that the removal rate of calcium ions and sulfate ions which are counter ions thereof is increased.
したがって、図1に示すように本発明のナノ濾過膜のメタノールの除去率が10%以下かつイソプロピルアルコールの除去率が20%以上50%以下かつクエン酸の除去率が70%以上95%以下かつショ糖の除去率が95%以上であると、乳酸の透過率はおよそ40%から60%の間となり、カルシウムイオンの除去率はほぼ100%に近い値になり好ましく、ナノ濾過膜の分画性能が特定の範囲になる様にナノ濾過膜を設計してやることで高効率に乳酸が精製できることを見出した。
Thus, 95% or less as nanofiltration membranes methanol removal rate of 10% or less or One isopropyl alcohol removal rate of the of the present invention are removal rate of 20% to 50% and citric acid 70% 1 When the sucrose removal rate is 95% or more, the lactic acid permeability is preferably between about 40% and 60%, and the calcium ion removal rate is preferably close to 100%. It was found that lactic acid can be purified with high efficiency by designing a nanofiltration membrane so that the drawing performance falls within a specific range.
ここで、メタノール、イソプロピルアルコール、クエン酸、ショ糖の除去率の測定条件は次の通りである。膜面積30cm2程度の平膜を用いて、原水濃度1,000mg/L、原水温度25℃、原水圧力0.75MPaで濾過して式1から求めた。原水pHは、メタノール、イソプロピルアルコール、ショ糖は6.5、クエン酸は2.8とした。
除去率(%)=(1−(透過水濃度/原水濃度))×100‥‥‥(式1)
ナノ濾過膜の素材には、酢酸セルロース系ポリマー、ポリアミド、ポリエステル、ポリイミド、ビニルポリマー、ポリアクリロニトリル、スルホン化ポリスルホンなどの高分子素材を使用することができる。またその膜構造は、膜の少なくとも片面に緻密層を持ち、緻密層から膜内部あるいはもう片方の面に向けて徐々に大きな孔径の微細孔を有する非対称膜や、非対称膜の緻密層の上に別の素材で形成された非常に薄い機能層を有する複合膜のどちらでもよい。
Here, the measurement conditions for the removal rate of methanol , isopropyl alcohol, citric acid, and sucrose are as follows. Using a flat membrane having a membrane area of about 30 cm 2 , the raw water concentration was 1,000 mg / L, the raw water temperature was 25 ° C., and the raw water pressure was 0.75 MPa. The raw water pH was 6.5 for methanol , isopropyl alcohol, sucrose, and 2.8 for citric acid.
Removal rate (%) = (1− (permeate concentration / raw water concentration)) × 100 (Equation 1)
As the material for the nanofiltration membrane, polymer materials such as cellulose acetate polymer, polyamide, polyester, polyimide, vinyl polymer, polyacrylonitrile, sulfonated polysulfone, and the like can be used. In addition, the membrane structure has a dense layer on at least one side of the membrane, and on the asymmetric membrane having fine pores gradually increasing from the dense layer to the inside of the membrane or the other side, or on the dense layer of the asymmetric membrane. Either a composite film having a very thin functional layer formed of another material may be used.
これらの中でも高耐圧性と高透水性、高溶質除去性能を兼ね備え、優れたポテンシャルを有する、ポリアミドを機能層とした複合膜が好ましい。操作圧力に対する耐久性と、高い透水性、阻止性能を維持できるためには、ポリアミドを機能層とし、それを多孔質膜や不織布からなる支持体で保持する構造のものが適している。また、ポリアミド半透膜としては、多官能アミンと多官能酸ハロゲン化物との重縮合反応により得られる架橋ポリアミドの機能層を支持体に有してなる複合半透膜が適している。 Among these, a composite film having a high-pressure resistance, high water permeability, and high solute removal performance and having an excellent potential and using a polyamide as a functional layer is preferable. In order to maintain durability against operating pressure, high water permeability, and blocking performance, a structure in which polyamide is used as a functional layer and is held by a support made of a porous membrane or nonwoven fabric is suitable. As the polyamide semipermeable membrane, a composite semipermeable membrane having a functional layer of a crosslinked polyamide obtained by polycondensation reaction of a polyfunctional amine and a polyfunctional acid halide on a support is suitable.
ポリアミドを膜素材として含むナノ濾過膜において、ポリアミドを構成する単量体の好ましいカルボン酸成分としては、例えば、トリメシン酸、ベンゾフェノンテトラカルボン酸、トリメリット酸、ピロメット酸、イソフタル酸、テレフタル酸、ナフタレンジカルボン酸、ジフェニルカルボン酸、ピリジンカルボン酸などの芳香族カルボン酸が挙げられるが、製膜溶媒に対する溶解性を考慮すると、トリメシン酸、イソフタル酸、テレフタル酸、およびこれらの混合物がより好ましい。前記ポリアミドを構成する単量体の好ましいアミン成分としては、架橋ピペラジンポリアミドを主成分とし、かつ、前記化学式1で示される構成成分を含有するアミン成分が好ましく、例えばピペラジン、ピペリジンなどが挙げられるが、ピペラジン、ピペリジンは、耐圧性、耐久性の他に、耐熱性、耐薬品性を有していることからより好ましく用いられる。また、化学式1中、n=3のものがより好ましく用いられる。上記化学式1で示される構成成分としては、例えば、特開昭62−201606号公報に記載のものが挙げられる。 In the nanofiltration membrane containing polyamide as a membrane material, preferable carboxylic acid components of monomers constituting the polyamide include, for example, trimesic acid, benzophenone tetracarboxylic acid, trimellitic acid, pyrometic acid, isophthalic acid, terephthalic acid, naphthalene Aromatic carboxylic acids such as dicarboxylic acid, diphenyl carboxylic acid, pyridine carboxylic acid and the like can be mentioned, but considering solubility in a film forming solvent, trimesic acid, isophthalic acid, terephthalic acid, and a mixture thereof are more preferable. A preferred amine component of the monomer constituting the polyamide is preferably an amine component mainly composed of a crosslinked piperazine polyamide and containing the component represented by the chemical formula 1, and examples thereof include piperazine and piperidine. Piperazine and piperidine are more preferably used because they have heat resistance and chemical resistance in addition to pressure resistance and durability. In Chemical Formula 1, those having n = 3 are more preferably used. Examples of the structural component represented by Chemical Formula 1 include those described in JP-A No. 62-201606.
本発明の乳酸の製造方法の工程Bで用いるナノ濾過膜は、上記の1種類の素材で構成する膜に限定されず、複数の膜素材を含む膜又は複数の膜を組み合わせた複合膜であってもよい。例えば、特開昭62−201606号公報に記載のように、ポリスルホンを膜素材とする支持膜に上記素材からなるナノ濾過膜を分離機能層として構成させた複合膜を用いることができる。 The nanofiltration membrane used in Step B of the method for producing lactic acid according to the present invention is not limited to the membrane composed of the above-mentioned one type of material, but is a membrane containing a plurality of membrane materials or a composite membrane combining a plurality of membranes. May be. For example, as described in JP-A-62-201606, a composite membrane in which a nanofiltration membrane made of the above material is formed as a separation functional layer on a support membrane made of polysulfone as a membrane material can be used.
ナノ濾過膜は一般にスパイラル型の膜エレメントとして使用されるが、本発明で用いるナノ濾過膜も、スパイラル型の膜エレメントとして使用されることが好ましく、採用できる。 The nanofiltration membrane is generally used as a spiral membrane element, but the nanofiltration membrane used in the present invention is also preferably used as a spiral membrane element.
本発明の乳酸の製造方法の工程Bにおける、「ナノ濾過膜で濾過する」とは、微生物の発酵培養により生産された乳酸を含む分離液を、ナノ濾過膜に通じて濾過し、溶解しているカルシウム成分を除去または阻止し、乳酸溶液を濾液として透過させることを意味する。ここで、カルシウム成分には、培養液中に含まれるカルシウムイオン、カルシウム塩、カルシウムを含む化合物のいずれの形態のものも含まれ、また培養液中において溶解しているもの、培養液中に析出し若しくは沈殿して含まれているもののいずれも含まれる。 In the step B of the method for producing lactic acid of the present invention, “filtering with a nanofiltration membrane” means filtering and dissolving a separation liquid containing lactic acid produced by fermentation culture of microorganisms through a nanofiltration membrane. This means that the calcium component is removed or blocked, and the lactic acid solution is permeated as a filtrate. Here, the calcium component includes any form of calcium ions, calcium salts, and compounds containing calcium contained in the culture solution, and those dissolved in the culture solution and precipitated in the culture solution. Or any that are precipitated and included.
溶解または固体として析出しているカルシウム成分の除去または阻止の程度を評価する方法としては、カルシウムイオン除去率(阻止率)を算出することで評価する方法が挙げられるが、この方法に限定されるものではない。カルシウムイオン阻止率(除去率)は、イオンクロマトグラフィーに代表される分析により、原水(分離液)中に含まれるカルシウムイオン濃度(原水カルシウムイオン濃度)および透過水(乳酸溶液)中に含まれるカルシウムイオンの濃度(透過水カルシウムイオン濃度)を測定することで、式2によって算出することができる。 Examples of the method for evaluating the degree of removal or inhibition of the calcium component precipitated as dissolved or solid include a method of evaluating by calculating a calcium ion removal rate (blocking rate), but are limited to this method. It is not a thing. The calcium ion blocking rate (removal rate) is determined by analysis represented by ion chromatography. The calcium ion concentration contained in the raw water (separated liquid) (raw water calcium ion concentration) and the calcium contained in the permeated water (lactic acid solution). By measuring the ion concentration (permeated water calcium ion concentration), it can be calculated by Equation 2.
カルシウムイオン除去率(%)=(1−(透過水カルシウムイオン濃度/原水カルシウムイオン濃度))×100‥‥‥(式2)
乳酸水溶液のナノ濾過膜透過性の評価方法としては、乳酸透過率を算出して評価する方法が挙げられるが、この方法に限定されるものではない。乳酸透過率は、高速液体クロマトグラフィーに代表される分析により、原水(分離液)中に含まれる乳酸濃度(原水乳酸濃度)および透過水(乳酸溶液)中に含まれる乳酸濃度(透過水乳酸濃度)を測定することで、式3によって算出することができる。
Calcium ion removal rate (%) = (1− (permeated water calcium ion concentration / raw water calcium ion concentration)) × 100 (Formula 2)
Examples of a method for evaluating the nanofiltration membrane permeability of an aqueous lactic acid solution include a method of calculating and evaluating lactic acid permeability, but the method is not limited to this method. Lactic acid permeability is determined by analysis represented by high performance liquid chromatography. Lactic acid concentration (raw water lactic acid concentration) contained in raw water (separate) and lactic acid concentration (permeated lactic acid concentration) contained in permeated water (lactic acid solution). ) Can be calculated by Equation 3.
乳酸透過率(%)=(透過水乳酸濃度/原水乳酸濃度)×100‥‥‥(式3)
膜単位面積、単位圧力当たりの透過流量(膜透過流束)の評価方法としては、透過水量および透過水量を採水した時間および膜面積を測定することで、式4によって算出することができる。
Lactic acid permeability (%) = (permeated lactic acid concentration / raw water lactic acid concentration) × 100 (Formula 3)
As a method for evaluating the membrane unit area and the permeation flow rate (membrane permeation flux) per unit pressure, the permeated water amount, the time during which the permeated water amount was sampled, and the membrane area can be calculated by Equation 4.
膜透過流束(m3/(m2・日))=透過水量/(膜面積×採水時間)‥‥‥(式4)
本発明の乳酸の製造方法の工程Bにおいて、微生物培養液のナノ濾過膜による濾過は、圧力をかけて分離を行う。その濾過圧は、0.1MPa以上8MPa以下の範囲で好ましく用いられるが、0.1MPaより低ければ膜透過速度が低下し、8MPaより高ければ膜の損傷に影響を与えるため、0.5MPa以上7MPa以下で用いれば、膜透過流束が高いことから、乳酸溶液を効率的に透過させることができ、膜の損傷に影響を与える可能性が少ないことからより好ましく、1MPa以上6MPa以下で用いることが特に好ましい。
Membrane permeation flux (m 3 / (m 2 · day)) = permeate amount / (membrane area × water sampling time) (Equation 4)
In step B of the method for producing lactic acid according to the present invention, filtration of the microorganism culture solution through the nanofiltration membrane is performed by applying pressure. The filtration pressure is preferably used in the range of 0.1 MPa or more and 8 MPa or less, but if it is lower than 0.1 MPa, the membrane permeation rate decreases, and if it is higher than 8 MPa, it affects the damage of the membrane. When used in the following, the membrane permeation flux is high, so that the lactic acid solution can be efficiently permeated and is less likely to affect the membrane damage, and is preferably used at 1 MPa or more and 6 MPa or less. Particularly preferred.
本発明の乳酸の製造方法の工程Bにおいて、ナノ濾過膜による濾過に供する分離液のpHは、4.5以下とするのが好ましい。ナノ濾過膜は、溶液中でイオン化している物質の方が、イオン化していない物質に比べて除去率が高い。したがって乳酸の解離定数pKaが3.86であることから、pHを3.86以上とすると、乳酸イオンと水素イオンに解離が進み、効率的な乳酸の透過が出来なくなってくる。pHの上限については、乳酸の透過率の観点から検討した結果、pHが4.5を超えると乳酸の透過率が効率的でなくなってくるので分離液のpHは4.5以下、好ましくは乳酸の解離定数pKaより小さい3.8以下とすることが重要である。
In Step B of the method for producing lactic acid according to the present invention, the pH of the separation liquid used for the filtration through the nanofiltration membrane is preferably 4.5 or less. In the nanofiltration membrane, a substance ionized in a solution has a higher removal rate than a substance that is not ionized. Therefore, since the dissociation constant pKa of lactic acid is 3.86, when the pH is 3.86 or more, dissociation proceeds to lactic acid ions and hydrogen ions, and efficient lactic acid permeation cannot be performed. The upper limit of pH was examined from the viewpoint of lactic acid permeability. As a result, when the pH exceeds 4.5 , the lactic acid permeability becomes inefficient, so the pH of the separation liquid is 4.5 or less, preferably lactic acid. It is important that the dissociation constant pKa is 3.8 or less.
本発明の乳酸の製造方法の工程Bで用いるナノ濾過膜の透水性能としては、塩化ナトリウム(500mg/L)で0.3MPaの濾過圧において、水の透過水量(m3/m2/日)が0.5以上0.8以下のものが好ましく用いられる。 As the water permeation performance of the nanofiltration membrane used in Step B of the method for producing lactic acid of the present invention, the permeated water amount (m 3 / m 2 / day) at a filtration pressure of 0.3 MPa with sodium chloride (500 mg / L). Is preferably 0.5 or more and 0.8 or less.
ナノ濾過膜による分離で用いる微生物培養液中の乳酸溶液中の乳酸の濃度は、特に限定されないが、高濃度であれば、透過液中に含まれる乳酸の濃度も高いため、濃縮する時間を短縮することができることからコスト削減に好適であり、例えば10g/L以上100g/L以下が好ましい。 The concentration of lactic acid in the lactic acid solution in the microorganism culture solution used for separation by the nanofiltration membrane is not particularly limited. However, if the concentration is high, the concentration of lactic acid contained in the permeate is also high, so the concentration time is shortened. Therefore, it is suitable for cost reduction, for example, 10 g / L or more and 100 g / L or less is preferable.
本発明の乳酸の製造方法の工程Bにおいて、培養液中に含まれるカルシウム成分の濃度は、飽和溶解度以下であることが好ましい。すなわち、カルシウム成分が飽和溶解度以下であれば培養溶液中に溶解しており、ナノ濾過膜エレメント内部での析出が起こらなく、安定した分離操作が継続できる。一方飽和溶解度以上であれば、カルシウム成分が一部析出しているため、ナノ濾過膜による安定した乳酸の分離が困難となる。したがってカルシウム成分の濃度は飽和溶解度以下、すなわち2g/L以下が好ましい。 In step B of the method for producing lactic acid according to the present invention, the concentration of the calcium component contained in the culture solution is preferably not more than the saturation solubility. That is, if the calcium component is less than or equal to the saturation solubility, it is dissolved in the culture solution, and precipitation within the nanofiltration membrane element does not occur, and stable separation operation can be continued. On the other hand, if the solubility is higher than the saturation solubility, a part of the calcium component is precipitated, so that it is difficult to stably separate lactic acid by the nanofiltration membrane. Therefore, the concentration of the calcium component is preferably not more than the saturation solubility, that is, not more than 2 g / L.
本発明の乳酸の製造方法では、培養液中のカルシウム成分を難溶性の硫酸塩として除去する工程Aを行った後に得られる乳酸を含む分離液を、工程Bのナノ濾過膜に通じて濾過する工程に供する。具体的には、工程Aとして、例えば培養液中に硫酸を添加して、培養液中のカルシウム成分を、難溶性の硫酸カルシウムとして沈殿させ、沈殿物を重力濾過機、圧濾機、濾葉濾過機、真空連続濾過機などの濾過機や遠心分離器、精密濾過膜や限外濾過膜、濾布、濾紙などのフィルターなどで濾別する工程Aを行い、その濾液(乳酸を含む分離液)を工程Bのナノ濾過膜に通じることで、効果的にカルシウム成分を除去または阻止することができる。 In the method for producing lactic acid according to the present invention, the separation liquid containing lactic acid obtained after the step A of removing the calcium component in the culture solution as a hardly soluble sulfate is filtered through the nanofiltration membrane of the step B. Provide to process. Specifically, as step A, for example, sulfuric acid is added to the culture solution, and the calcium component in the culture solution is precipitated as hardly soluble calcium sulfate, and the precipitate is filtered through a gravity filter, a pressure filter, a filter leaf. Perform the step A of separating with a filter such as a filter, a vacuum continuous filter, a centrifuge, a microfiltration membrane, an ultrafiltration membrane, a filter cloth, a filter paper, etc., and the filtrate (separate containing lactic acid) ) Through the nanofiltration membrane of step B, the calcium component can be effectively removed or blocked.
本発明の乳酸の製造方法において、工程Aの培養液をナノ濾過膜で濾過して得られる乳酸溶液を、さらに蒸留する工程Cに供することで、高純度の乳酸を得ることができる。蒸留工程は、1Pa以上大気圧(常圧、約101kPa)以下の減圧下で行うことが好ましい。減圧下で行う場合の蒸留温度は、20℃以上200℃以下で行うことが好ましいが、180℃以上で蒸留を行った場合、不純物の影響により、乳酸がラセミ化する虞があるため、50℃以上180℃以下であれば、好適に乳酸の蒸留を行うことができる。この蒸留工程に供する前に、ナノ濾過膜を透過した乳酸溶液を、一旦エバポレーターに代表される濃縮装置を用いて乳酸溶液を濃縮してもよい。 In the method for producing lactic acid of the present invention, high-purity lactic acid can be obtained by subjecting the lactic acid solution obtained by filtering the culture solution of step A through a nanofiltration membrane to step C of further distillation. The distillation step is preferably performed under a reduced pressure of 1 Pa or more and atmospheric pressure (normal pressure, about 101 kPa) or less. The distillation temperature when performing under reduced pressure is preferably 20 ° C. or more and 200 ° C. or less. However, when distillation is performed at 180 ° C. or more, lactic acid may be racemized due to the influence of impurities. If it is more than 180 degreeC, the distillation of lactic acid can be performed suitably. Before being subjected to this distillation step, the lactic acid solution that has permeated the nanofiltration membrane may be once concentrated using a concentrating device represented by an evaporator.
また、工程Bで得られる乳酸溶液を、さらに、逆浸透膜で濾過して乳酸濃度を高める工程Dに供することも好ましく採用できる。ここで逆浸透膜とは、被処理水の浸透圧以上の圧力差を駆動力にイオンや低分子量分子を除去する濾過膜である。ここで使用される逆浸透膜としては、例えば酢酸セルロースなどのセルロース系や、多官能アミン化合物と多官能酸ハロゲン化物とを重縮合させて微多孔性支持膜上にポリアミド分離機能層を設けた膜などが採用できる。逆浸透膜表面の汚れすなわちファウリングを抑制するために、酸ハライド基と反応する反応性基を少なくとも1個有する化合物の水溶液をポリアミド分離機能層の表面に被覆して、分離機能層表面に残存する酸ハロゲン基と該反応性基との間で共有結合を形成させた主に下水処理用の低ファウリング逆浸透膜なども好ましく採用できる。本発明の工程Bで二価のカルシウムイオンを大部分除去できているため、逆浸透膜面でのスケールの生成もなく安定した膜濃縮が行える。
Moreover, it is also preferably employable to subject the lactic acid solution obtained in Step B to Step D to further increase the lactic acid concentration by filtration through a reverse osmosis membrane. Here, the reverse osmosis membrane is a filtration membrane that removes ions and low molecular weight molecules using a pressure difference equal to or higher than the osmotic pressure of water to be treated as a driving force. As the reverse osmosis membrane used here, for example, a cellulose separation functional layer is provided on a microporous support membrane by polycondensation of a cellulose type such as cellulose acetate or a polyfunctional amine compound and a polyfunctional acid halide. A membrane can be used. In order to suppress fouling on the reverse osmosis membrane surface, the surface of the polyamide separation functional layer is coated with an aqueous solution of a compound having at least one reactive group that reacts with an acid halide group and remains on the surface of the separation functional layer. A low fouling reverse osmosis membrane mainly for sewage treatment in which a covalent bond is formed between the acid halogen group to be reacted and the reactive group can also be preferably employed. Since most of the divalent calcium ions can be removed in the step B of the present invention , stable membrane concentration can be performed without generating scale on the reverse osmosis membrane surface.
以下、本発明の乳酸の製造方法に供される微生物の発酵培養による乳酸生産について説明する。 Hereinafter, lactic acid production by fermentation culture of microorganisms used in the method for producing lactic acid of the present invention will be described.
微生物の発酵培養による乳酸生産に使用する発酵原料としては、培養する微生物の生育を促し、目的とする発酵生産物である乳酸を良好に生産させうるものであればよく、炭素源、窒素源、無機塩類、及び必要に応じてアミノ酸、ビタミンなどの有機微量栄養素を適宜含有する通常の液体培地が良い。炭素源としては、グルコース、シュークロース、フラクトース、ガラクトース、ラクトース等の糖類、これら糖類を含有する澱粉糖化液、甘藷糖蜜、甜菜糖蜜、ハイテストモラセス、更には酢酸等の有機酸、エタノールなどのアルコール類、グリセリンなども使用される。 The fermentation raw material used for lactic acid production by fermentation culture of microorganisms may be any material that promotes the growth of the microorganisms to be cultured and can produce lactic acid as the desired fermentation product, A normal liquid medium containing inorganic salts and organic micronutrients such as amino acids and vitamins as appropriate is preferable. Carbon sources include sugars such as glucose, sucrose, fructose, galactose, lactose, starch saccharified solution containing these sugars, sweet potato molasses, sugar beet molasses, high test molasses, and organic acids such as acetic acid, alcohols such as ethanol And glycerin are also used.
窒素源としてはアンモニアガス、アンモニア水、アンモニウム塩類、尿素、硝酸塩類、その他補助的に使用される有機窒素源、例えば油粕類、大豆加水分解液、カゼイン分解物、その他のアミノ酸、ビタミン類、コーンスティープリカー、酵母または酵母エキス、肉エキス、ペプトン等のペプチド類、各種発酵菌体およびその加水分解物などが使用される。無機塩類としてはリン酸塩、マグネシウム塩、カルシウム塩、鉄塩、マンガン塩等を適宜添加することができる。 Nitrogen sources include ammonia gas, aqueous ammonia, ammonium salts, urea, nitrates, and other supplementary organic nitrogen sources such as oil cakes, soybean hydrolysates, casein degradation products, other amino acids, vitamins, corn Steep liquor, yeast or yeast extract, meat extract, peptides such as peptone, various fermented cells and hydrolysates thereof are used. As inorganic salts, phosphates, magnesium salts, calcium salts, iron salts, manganese salts, and the like can be appropriately added.
本発明に使用する微生物が生育のために特定の栄養素(例えば、アミノ酸など)を必要とする場合には、その栄養物をそれ自体もしくはそれを含有する天然物として添加する。また、消泡剤も必要に応じて使用してもよい。本発明において、培養液とは、発酵原料に微生物または培養細胞が増殖した結果得られる液のことを言う。培養液に追加する発酵原料の組成は、目的とする乳酸の生産性が高くなるように、培養開始時の発酵原料組成から適宜変更しても良い。 When the microorganism used in the present invention requires a specific nutrient (for example, an amino acid) for growth, the nutrient is added as such or as a natural product containing it. Moreover, you may use an antifoamer as needed. In the present invention, the culture solution refers to a solution obtained as a result of growth of microorganisms or cultured cells as fermentation raw materials. You may change suitably the composition of the fermentation raw material added to a culture solution from the fermentation raw material composition at the time of a culture | cultivation start so that the productivity of the target lactic acid may become high.
本発明では、微生物の培養は、通常pH4−8、温度20−40℃の範囲で行われる。培養液のpHはアルカリ性物質、具体的には塩基性のカルシウム塩によって上記範囲内のあらかじめ定められた値に調節する。塩基性カルシウム塩としては、水酸化カルシウム、炭酸カルシウム、リン酸カルシウム、酸化カルシウム、酢酸カルシウムなどが好ましく用いられる。 In the present invention, microorganisms are usually cultured in the range of pH 4-8 and temperature 20-40 ° C. The pH of the culture solution is adjusted to a predetermined value within the above range with an alkaline substance, specifically, a basic calcium salt. As the basic calcium salt, calcium hydroxide, calcium carbonate, calcium phosphate, calcium oxide, calcium acetate and the like are preferably used.
微生物の培養において、酸素の供給速度を上げる必要があれば、空気に酸素を加えて酸素濃度を21%以上に保つ、あるいは培養を加圧する、攪拌速度を上げる、通気量を上げるなどの手段を用いることができる。 In the culture of microorganisms, if it is necessary to increase the oxygen supply rate, add oxygen to the air to maintain the oxygen concentration at 21% or higher, or pressurize the culture, increase the stirring speed, increase the aeration rate, etc. Can be used.
微生物の培養初期にBatch培養またはFed−Batch培養を行って微生物濃度を高くした後に、連続培養(引き抜き)を開始しても良いし、高濃度の菌体をシードし、培養開始とともに連続培養を行っても良い。適当な時期から原料培養液の供給及び培養物の引き抜きを行うことが可能である。原料培養液供給と培養物の引き抜きの開始時期は必ずしも同じである必要はない。また、原料培養液の供給と培養物の引き抜きは連続的であってもよいし、間欠的であってもよい。原料培養液には上記に示したような菌体増殖に必要な栄養素を添加し、菌体増殖が連続的に行われるようにすればよい。培養液中の微生物または培養細胞の濃度は、培養液の環境が微生物または培養細胞の増殖にとって不適切となって死滅する比率が高くならない範囲で、高い状態で維持することが効率よい生産性を得るのに好ましく、一例として、乾燥重量として5g/L以上に維持することで良好な生産効率が得られる。 After cultivating microorganisms, batch culture or fed-batch culture is performed to increase the concentration of microorganisms, and then continuous culture (pulling) may be started. You can go. It is possible to supply the raw material culture solution and extract the culture from an appropriate time. The starting times of the supply of the raw material culture solution and the withdrawal of the culture are not necessarily the same. Further, the supply of the raw material culture solution and the withdrawal of the culture may be continuous or intermittent. What is necessary is just to add a nutrient required for microbial cell growth as shown above to a raw material culture solution so that microbial cell growth may be performed continuously. The concentration of microorganisms or cultured cells in the culture solution should be maintained at a high level so that the environment of the culture solution is not suitable for the growth of microorganisms or cultured cells and the rate of death does not increase. As an example, good production efficiency can be obtained by maintaining the dry weight at 5 g / L or more.
発酵生産能力のあるフレッシュな菌体を増殖させつつ行う連続培養操作は、通常、単一の発酵槽で行うのが、培養管理上好ましい。しかしながら、菌体を増殖しつつ生産物を生成する連続培養法であれば、発酵槽の数は問わない。発酵槽の容量が小さい等の理由から、複数の発酵槽を用いることもあり得る。この場合、複数の発酵槽を配管で並列または直列に接続して連続培養を行っても発酵生産物の高生産性は得られる。 The continuous culture operation performed while growing fresh cells having fermentation production ability is usually preferably performed in a single fermenter in terms of culture management. However, the number of fermenters is not limited as long as it is a continuous culture method for producing a product while growing cells. A plurality of fermenters may be used because the capacity of the fermenter is small. In this case, high productivity of the fermented product can be obtained even if continuous fermentation is performed by connecting a plurality of fermenters in parallel or in series by piping.
本発明で使用される微生物については特に制限はないが、例えば、発酵工業においてよく使用されるパン酵母などの酵母、大腸菌、コリネ型細菌などのバクテリア、糸状菌、放線菌などが挙げられる。動物細胞、昆虫細胞等の培養細胞も、本発明で使用される微生物に含まれる。使用する微生物は、自然環境から単離されたものでもよく、また、突然変異や遺伝子組換えによって一部性質が改変されたものであってもよい。 Although there is no restriction | limiting in particular about the microorganisms used by this invention, For example, yeasts, such as baker's yeast often used in fermentation industry, bacteria, such as colon_bacillus | E._coli and coryneform bacteria, filamentous fungi, actinomycetes, etc. are mentioned. Cultured cells such as animal cells and insect cells are also included in the microorganism used in the present invention. The microorganism to be used may be isolated from the natural environment, or may be partially modified by mutation or genetic recombination.
以下、実施例を用いて本発明をより詳細に説明するが、本発明は以下の実施例に限定されるものではない。 EXAMPLES Hereinafter, although this invention is demonstrated in detail using an Example, this invention is not limited to a following example.
(乳酸生産能力を持つ酵母株の作製)
参考例1 乳酸生産能力を持つ酵母株の作製
乳酸生産能力を持つ酵母株を下記のように造成した。具体的には、ヒト由来LDH遺伝子を酵母ゲノム上のPDC1プロモーターの下流に連結することでL−乳酸生産能力を持つ酵母株を造成した。ポリメラーゼ・チェーン・リアクション(PCR)には、La−Taq(宝酒造社製)、あるいはKOD-Plus-polymerase(東洋紡社製)を用い、付属の取扱説明に従って行った。
(Production of yeast strains capable of producing lactic acid)
Reference Example 1 Production of Yeast Strain Having Lactic Acid Production Capacity A yeast strain having a lactic acid production capacity was constructed as follows. Specifically, a yeast strain capable of producing L-lactic acid was constructed by linking a human-derived LDH gene downstream of the PDC1 promoter on the yeast genome. For polymerase chain reaction (PCR), La-Taq (manufactured by Takara Shuzo) or KOD-Plus-polymerase (manufactured by Toyobo Co., Ltd.) was used according to the attached instruction manual.
ヒト乳ガン株化細胞(MCF−7)を培養回収後、TRIZOL Reagent(Invitrogen社製)を用いてtotal RNAを抽出し、得られたtotal RNAを鋳型としてSuperScript Choice System(Invitrogen社製)を用いた逆転写反応によりcDNAの合成を行った。これらの操作の詳細は、それぞれ付属のプロトコールに従った。得られたcDNAを続くPCRの増幅鋳型とした。 After culturing and recovering human breast cancer cell line (MCF-7), total RNA was extracted using TRIZOL Reagent (Invitrogen), and SuperScript Choice System (Invitrogen) was used with the obtained total RNA as a template. CDNA was synthesized by reverse transcription reaction. Details of these operations followed the attached protocol. The obtained cDNA was used as an amplification template for subsequent PCR.
上記操作で得られたcDNAを増幅鋳型とし、配列番号1および配列番号2で表されるオリゴヌクレオチドをプライマーセットとしたKOD-Plus-polymeraseによるPCRによりL−ldh遺伝子のクローニングを行った。各PCR増幅断片を精製し末端をT4 Polynucleotide Kinase(TAKARA社製)によりリン酸化後、pUC118ベクター(制限酵素HincIIで切断し、切断面を脱リン酸化処理したもの)にライゲーションした。ライゲーションは、DNA Ligation Kit Ver.2(TAKARA社製)を用いて行った。ライゲーションプラスミド産物で大腸菌DH5αを形質転換し、プラスミドDNAを回収することにより各種L−ldh遺伝子(配列番号3)がサブクローニングされたプラスミドを得た。得られたL−ldh遺伝子が挿入されたpUC118プラスミドを制限酵素XhoIおよびNotIで消化し、得られた各DNA断片を酵母発現用ベクターpTRS11のXhoI/NotI切断部位に挿入した。このようにしてヒト由来L−ldh遺伝子発現プラスミドpL−ldh5(L−ldh遺伝子)を得た。 The L-ldh gene was cloned by PCR using KOD-Plus-polymerase using the cDNA obtained by the above operation as an amplification template and the oligonucleotides represented by SEQ ID NO: 1 and SEQ ID NO: 2 as a primer set. Each PCR amplified fragment was purified and the end was phosphorylated with T4 Polynucleotide Kinase (manufactured by TAKARA), and then ligated to a pUC118 vector (cut with the restriction enzyme HincII and the cut surface was dephosphorylated). Ligation was performed using DNA Ligation Kit Ver.2 (manufactured by TAKARA). Escherichia coli DH5α was transformed with the ligation plasmid product, and plasmid DNA was collected to obtain a plasmid in which various L-ldh genes (SEQ ID NO: 3) were subcloned. The obtained pUC118 plasmid into which the L-ldh gene was inserted was digested with restriction enzymes XhoI and NotI, and each of the obtained DNA fragments was inserted into the XhoI / NotI cleavage site of the yeast expression vector pTRS11. In this way, a human-derived L-ldh gene expression plasmid pL-ldh5 (L-ldh gene) was obtained.
ヒト由来LDH遺伝子を含むプラスミドpL−ldh5を増幅鋳型とし、配列番号4および配列番号5で表されるオリゴヌクレオチドをプライマーセットとしたPCRにより1.3kbのヒト由来LDH遺伝子、及びサッカロミセス・セレビセ由来のTDH3遺伝子のターミネーター配列含むDNA断片を増幅した。また、プラスミドpRS424を増幅鋳型として、配列番号6および配列番号7で表されるオリゴヌクレオチドをプライマーセットとしたPCRにより1.2kbのサッカロミセス・セレビセ由来のTRP1遺伝子を含むDNA断片を増幅した。それぞれのDNA断片を1.5%アガロースゲル電気泳動により分離、常法に従い精製した。ここで得られた1.3kb断片、1.2kb断片を混合したものを増幅鋳型とし、配列番号4および配列番号7で表されるオリゴヌクレオチドをプライマーセットとしたPCR法によって得られた産物を1.5%アガロースゲル電気泳動して、ヒト由来LDH遺伝子及びTRP1遺伝子が連結された2.5kbのDNA断片を常法に従い調製した。この2.5kbのDNA断片で出芽酵母NBRC10505株を常法に従いトリプトファン非要求性に形質転換した。 By PCR using the plasmid pL-ldh5 containing the human-derived LDH gene as an amplification template and the oligonucleotides represented by SEQ ID NO: 4 and SEQ ID NO: 5 as primer sets, a 1.3-kb human-derived LDH gene and Saccharomyces cerevisiae derived A DNA fragment containing the terminator sequence of the TDH3 gene was amplified. In addition, a DNA fragment containing the TRP1 gene derived from Saccharomyces cerevisiae of 1.2 kb was amplified by PCR using the plasmid pRS424 as an amplification template and the oligonucleotides represented by SEQ ID NO: 6 and SEQ ID NO: 7 as a primer set. Each DNA fragment was separated by 1.5% agarose gel electrophoresis and purified according to a conventional method. A product obtained by the PCR method using a mixture of the 1.3 kb fragment and the 1.2 kb fragment obtained here as an amplification template and the oligonucleotides represented by SEQ ID NO: 4 and SEQ ID NO: 7 as a primer set is 1 2.5% agarose gel electrophoresis was carried out to prepare a 2.5 kb DNA fragment linked with human-derived LDH gene and TRP1 gene according to a conventional method. Saccharomyces cerevisiae strain NBRC10505 was transformed with this 2.5 kb DNA fragment in a conventional manner so as not to require tryptophan.
得られた形質転換細胞がヒト由来LDH遺伝子を酵母ゲノム上のPDC1プロモーターの下流に連結されている細胞であることの確認は、下記のように行った。まず、形質転換細胞のゲノムDNAを常法に従って調製し、これを増幅鋳型とした配列番号8および配列番号9で表されるオリゴヌクレオチドをプライマーセットとしたPCRにより0.7kbの増幅DNA断片が得られることで確認した。また、形質転換細胞が乳酸生産能力を持つかどうかは、SC培地(METHODS IN YEAST GENETICS 2000 EDITION、 CSHL PRESS)で形質転換細胞を培養した培養上澄に乳酸が含まれていることを下記に示す条件でHPLC法により乳酸量を測定することで確認した。 Confirmation that the obtained transformed cells were cells in which the human-derived LDH gene was linked downstream of the PDC1 promoter on the yeast genome was performed as follows. First, genomic DNA of a transformed cell was prepared according to a conventional method, and a 0.7 kb amplified DNA fragment was obtained by PCR using the oligonucleotides represented by SEQ ID NO: 8 and SEQ ID NO: 9 as a primer set. Confirmed by being. In addition, whether or not the transformed cells have lactic acid production ability is shown below that lactic acid is contained in the culture supernatant obtained by culturing the transformed cells in SC medium (METHODS IN Yeast GENETICS 2000 EDITION, CSHL PRESS). It confirmed by measuring the amount of lactic acid by HPLC method on conditions.
カラム:Shim-Pack SPR-H(島津社製)、移動相:5mM p−トルエンスルホン酸(流速0.8mL/min)、反応液:5mM p−トルエンスルホン酸、20mM ビストリス、0.1mM EDTA・2Na(流速0.8mL/min)、検出方法:電気伝導度、温度:45℃。 Column: Shim-Pack SPR-H (manufactured by Shimadzu Corporation), mobile phase: 5 mM p-toluenesulfonic acid (flow rate 0.8 mL / min), reaction solution: 5 mM p-toluenesulfonic acid, 20 mM Bistris, 0.1 mM EDTA 2Na (flow rate 0.8 mL / min), detection method: electrical conductivity, temperature: 45 ° C.
また、L−乳酸の光学純度測定は以下の条件でHPLC法により測定した。 The optical purity of L-lactic acid was measured by the HPLC method under the following conditions.
カラム:TSK-gel Enantio L1(東ソー社製)、移動相 :1mM 硫酸銅水溶液、流速:1.0ml/min、検出方法 :UV254nm、温度 :30℃。 Column: TSK-gel Enantio L1 (manufactured by Tosoh Corporation), mobile phase: 1 mM copper sulfate aqueous solution, flow rate: 1.0 ml / min, detection method: UV254 nm, temperature: 30 ° C.
また、L−乳酸の光学純度は式5で計算される。ここで、LはL−乳酸の濃度、DはD−乳酸の濃度を表す。
Moreover, the optical purity of L-lactic acid is calculated by
光学純度(%)=100×(L−D)/(L+D)‥‥‥(式5)
HPLC分析の結果、4g/LのL−乳酸が検出され、D−乳酸は検出限界以下であった。以上の検討により、この形質転換体がL−乳酸生産能力を持つことを確認した。得られた形質転換細胞を酵母SW−1株として、続く実施例に用いた。
Optical purity (%) = 100 × (LD) / (L + D) (Formula 5)
As a result of HPLC analysis, 4 g / L of L-lactic acid was detected, and D-lactic acid was below the detection limit. From the above examination, it was confirmed that this transformant has L-lactic acid production ability. The obtained transformed cells were used in subsequent examples as yeast strain SW-1.
参考例2 バッチ発酵によるL−乳酸の製造
微生物を用いた発酵形態として最も典型的なバッチ発酵を行い、その乳酸生産性を評価した。表1に示す乳酸発酵培地を用い、バッチ発酵試験を行った。該培地は高圧蒸気滅菌(121℃、15分)して用いた。微生物として参考例1で造成した酵母SW−1株を用い、生産物である乳酸の濃度の評価には、参考例1に示したHPLCを用いて評価し、グルコース濃度の測定にはグルコーステストワコーC(和光純薬)を用いた。参考例2の運転条件を以下に示す。
Reference Example 2 Production of L-lactic acid by batch fermentation The most typical batch fermentation was performed as a fermentation form using microorganisms, and the lactic acid productivity was evaluated. A batch fermentation test was conducted using the lactic acid fermentation medium shown in Table 1. The medium was used after autoclaving (121 ° C., 15 minutes). The yeast SW-1 strain constructed in Reference Example 1 was used as a microorganism, and the concentration of lactic acid as a product was evaluated using the HPLC shown in Reference Example 1, and the glucose concentration was measured using a glucose test Wako. C (Wako Pure Chemical Industries) was used. The operating conditions of Reference Example 2 are shown below.
反応槽容量(乳酸発酵培地量):2(L)、 温度調整:30(℃)、反応槽通気量:0.2(L/min)、反応槽攪拌速度:400(rpm)、pH調整:1N 水酸化カルシウムによりpH5に調整。
Reaction tank capacity (lactic acid fermentation medium amount): 2 (L), temperature adjustment: 30 (° C.), reaction tank aeration rate: 0.2 (L / min), reaction tank stirring speed: 400 (rpm), pH adjustment: Adjust to
まず、SW−1株を試験管で5mlの乳酸発酵培地で一晩振とう培養した(前々培養)。前々培養液を新鮮な乳酸発酵培地100mlに植菌し500ml容坂口フラスコで24時間振とう培養した(前培養)。温度調整、pH調整を行い、発酵培養を行った。この時の菌体増殖量は、600nmでの吸光度で15であった。回分発酵の結果を表2に示す。 First, the SW-1 strain was cultured with shaking in a 5 ml lactic acid fermentation medium overnight in a test tube (pre-culture). The culture solution was inoculated into 100 ml of fresh lactic acid fermentation medium and cultured with shaking in a 500 ml Sakaguchi flask for 24 hours (pre-culture). Temperature adjustment and pH adjustment were performed, and fermentation culture was performed. The amount of bacterial cell growth at this time was 15 in terms of absorbance at 600 nm. The results of batch fermentation are shown in Table 2.
実施例1
(ナノ濾過膜で分離する分離液の準備)
参考例1、2で乳酸発酵した培養液(2L)をpHが2.6になるまで濃硫酸(和光純薬製)を滴下後、1時間25℃で撹拌し、培養液中の乳酸カルシウムを乳酸と硫酸カルシウムに変換した。次いで、沈殿した硫酸カルシウムを定性濾紙No2(アドバンテック製)を用いて吸引濾過により、沈殿物を濾別し、濾液2Lを回収した。
Example 1
(Preparation of separation liquid to be separated by nanofiltration membrane)
Concentrated sulfuric acid (manufactured by Wako Pure Chemical Industries, Ltd.) was added dropwise to the culture solution (2 L) fermented with lactic acid in Reference Examples 1 and 2 until the pH reached 2.6, and then stirred at 25 ° C. for 1 hour, so that calcium lactate in the culture solution Converted to lactic acid and calcium sulfate. Subsequently, the precipitated calcium sulfate was filtered off with suction using qualitative filter paper No. 2 (manufactured by Advantech), and the precipitate was filtered off, and 2 L of filtrate was recovered.
(ナノ濾過膜による分離実験)
次いで、図2に示す、膜濾過装置の原水槽1に上記で得られた濾液2Lを注入した。メタノールの除去率が1%かつイソプロピルアルコールの除去率が35%かつクエン酸の除去率が86%かつショ糖の除去率が99.7%であるナノ濾過膜7(ピペラジンポリアミド半透膜UTC60、東レ社製)を直径64mmφに切り取り、図3のステンレス(SUS316製)製のセルにセットし、高圧ポンプ3の圧力を4MPaに調整し、透過水4を回収した。原水槽1、透過水4に含まれる、硫酸イオン、カルシウムイオンの濃度をイオンクロマトグラフィー(DIONEX製)、乳酸濃度を、高速液体クロマトグラフィー(島津製作所製)により分析した。結果を表3に示す。
(Separation experiment with nanofiltration membrane)
Next, 2 L of the filtrate obtained above was injected into the raw water tank 1 of the membrane filtration apparatus shown in FIG. Nanofiltration membrane 7 35% removal of methanol is 1% or One isopropyl alcohol removal rate of and removal rate of the citric acid 86% and sucrose removal rates are 99.7% (piperazine polyamide semipermeable membrane UTC60 , Manufactured by Toray Industries, Inc.) was cut to a diameter of 64 mmφ and set in a stainless steel (SUS316) cell shown in FIG. 3, the pressure of the high-pressure pump 3 was adjusted to 4 MPa, and the permeated water 4 was recovered. The concentrations of sulfate ions and calcium ions contained in the raw water tank 1 and the permeated water 4 were analyzed by ion chromatography (manufactured by DIONEX), and the lactic acid concentration was analyzed by high performance liquid chromatography (manufactured by Shimadzu Corporation). The results are shown in Table 3.
表3に示すように、硫酸イオン、カルシウムイオンが高効率で除去されたことがわかった。 As shown in Table 3, it was found that sulfate ions and calcium ions were removed with high efficiency.
実施例2
(乳酸溶液の蒸留)
実施例1のナノ濾過膜分離した、透過液1L(乳酸濃度:24g/L)をロータリーエバポレーター(東京理化社製)を用いて、減圧下(50hPa)で水を蒸発させて濃縮した。この時、硫酸カルシウムの析出は見られなかった。
Example 2
(Distillation of lactic acid solution)
The permeate 1 L (lactic acid concentration: 24 g / L) separated from the nanofiltration membrane of Example 1 was concentrated by evaporating water under reduced pressure (50 hPa) using a rotary evaporator (manufactured by Tokyo Rika Co., Ltd.). At this time, precipitation of calcium sulfate was not observed.
次いで、133Pa、130℃で減圧蒸留を行った。蒸留した乳酸のラセミ化を確認するために、蒸留の前後で光学純度を高速液体クロマトグラフィーにより測定を行ったところ、光学純度の低下は見られなかった。表4に結果を示す。 Subsequently, vacuum distillation was performed at 133 Pa and 130 ° C. In order to confirm the racemization of distilled lactic acid, the optical purity was measured by high performance liquid chromatography before and after the distillation, and no decrease in the optical purity was observed. Table 4 shows the results.
以上の実施例及び比較例の結果から、メタノールの除去率が10%以下かつイソプロピルアルコールの除去率が20%以上50%以下かつクエン酸の除去率が70%以上95%以下かつショ糖の除去率が95%以上であるナノ濾過膜により、培養液中の硫酸カルシウムおよび硫酸を高効率で除去できることが明らかとなった。すなわち、本発明によって、微生物培養液中の乳酸溶液中のカルシウム成分および硫酸イオンをナノ濾過膜によって高効率で除去することができ、濃縮してもカルシウム成分が析出せず、さらに、蒸留工程にかけてもラセミ化、オリゴマー化が進行しないことが明らかとなった。
From the results of Examples and Comparative Examples, removal of methanol is 10% or less or One removal of the isopropyl alcohol is 20% or more 50% or less and the removal rate of citric acid 70% to 95% or less and sucrose It has been clarified that the nanofiltration membrane with a removal rate of 95% or more can remove calcium sulfate and sulfuric acid in the culture solution with high efficiency. That is, according to the present invention, the calcium component and sulfate ion in the lactic acid solution in the microorganism culture solution can be removed with high efficiency by the nanofiltration membrane, and the calcium component does not precipitate even when concentrated, and further subjected to the distillation step. It was revealed that racemization and oligomerization did not proceed.
1 原水槽
2 ナノ濾過膜が装着されたセル
3 高圧ポンプ
4 膜透過液の流れ
5 膜濃縮液の流れ
6 高圧ポンプにより送液された培養液の流れ
7 ナノ濾過膜
8 支持板
DESCRIPTION OF SYMBOLS 1 Raw water tank 2 Cell equipped with nanofiltration membrane 3 High pressure pump 4 Flow of membrane permeate 5 Flow of membrane concentrate 6 Flow of culture solution sent by high pressure pump 7
Claims (5)
該培養液中のカルシウム成分を硫酸を加えて難溶性硫酸塩として除去して乳酸を含む分離液を得る工程A、
工程Aで得られた乳酸を含む分離液をナノ濾過膜に通じて濾過し、カルシウム成分を除去して乳酸溶液を得る工程Bを含み、
0.75MPaの操作圧力で、25℃、pH6.5、濃度1,000mg/Lのメタノール水溶液を透過させたときのメタノールの除去率が10%以下であり、0.75MPaの操作圧力で、25℃、pH6.5、濃度1,000mg/Lのイソプロピルアルコール水溶液を透過させたときのイソプロピルアルコールの除去率が20%以上50%以下であり、0.75MPaの操作圧力で、25℃、pH2.8、濃度1,000mg/Lのクエン酸水溶液を透過させたときのクエン酸の除去率が70%以上95%以下であり、かつ、0.75MPaの操作圧力で、25℃、pH6.5、濃度1,000mg/Lのショ糖水溶液を透過させたときのショ糖の除去率が95%以上であるナノ濾過膜を工程Bに用いることを特徴とする乳酸の製造方法。 A method for separating and producing lactic acid produced in a culture solution by fermentation of microorganisms in the presence of a calcium salt,
A step A of obtaining a separation liquid containing lactic acid by removing the calcium component in the culture liquid as a hardly soluble sulfate by adding sulfuric acid;
Including the step B of filtering the separation liquid containing lactic acid obtained in step A through a nanofiltration membrane to remove the calcium component to obtain a lactic acid solution;
At an operating pressure of 0.75 MPa, the methanol removal rate when passing through a methanol aqueous solution at 25 ° C., pH 6.5, and a concentration of 1,000 mg / L is 10% or less , and at an operating pressure of 0.75 MPa, 25 The removal rate of isopropyl alcohol is 20% or more and 50% or less when an aqueous isopropyl alcohol solution having a concentration of 1,000 mg / L is permeated at 25 ° C., pH 6.5, and an operating pressure of 0.75 MPa. 8. When the citric acid aqueous solution having a concentration of 1,000 mg / L is permeated, the citric acid removal rate is 70% to 95% , and the operating pressure is 0.75 MPa, 25 ° C., pH 6.5, production side of lactic acid sucrose removal rates is characterized by using a nanofiltration membrane of 95% or more in step B of when is transmitted through the sucrose aqueous solution with a concentration 1,000 mg / L .
25℃以上200℃以下で蒸留する工程Cを含む、請求項1または2に記載の乳酸の製造方法。 The lactic acid solution obtained in the step B is further subjected to a pressure of 1 Pa or more and atmospheric pressure or less.
The manufacturing method of lactic acid of Claim 1 or 2 including the process C distilled at 25 degreeC or more and 200 degrees C or less.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007200439A JP5262011B2 (en) | 2007-08-01 | 2007-08-01 | Lactic acid production method and production apparatus |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007200439A JP5262011B2 (en) | 2007-08-01 | 2007-08-01 | Lactic acid production method and production apparatus |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2009034030A JP2009034030A (en) | 2009-02-19 |
| JP2009034030A5 JP2009034030A5 (en) | 2010-07-22 |
| JP5262011B2 true JP5262011B2 (en) | 2013-08-14 |
Family
ID=40436561
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007200439A Expired - Fee Related JP5262011B2 (en) | 2007-08-01 | 2007-08-01 | Lactic acid production method and production apparatus |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5262011B2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009142265A (en) * | 2007-11-20 | 2009-07-02 | Toray Ind Inc | Method for producing lactic acid |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5593597B2 (en) * | 2008-09-02 | 2014-09-24 | 東レ株式会社 | Method for producing lactic acid |
| JP2013043860A (en) * | 2011-08-24 | 2013-03-04 | Hitachi Plant Technologies Ltd | Producing method of purified lactic acid |
| WO2014017469A1 (en) * | 2012-07-23 | 2014-01-30 | 三井化学株式会社 | Method for producing d-lactic acid, method for producing polymer, and polymer |
| US10640445B2 (en) | 2013-09-06 | 2020-05-05 | Toray Industries, Inc. | Method of producing lactic acid and polylactic acid |
| CN113198596B (en) * | 2021-04-29 | 2023-12-26 | 江苏戚伍水产发展股份有限公司 | Loop circulation type edible fungus crushing system |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62201606A (en) * | 1985-09-20 | 1987-09-05 | Toray Ind Inc | Composite semipermeable membrane and its production |
| JPS6272646A (en) * | 1985-09-25 | 1987-04-03 | Taki Chem Co Ltd | Separation and purification of lactic acid |
| BE1011197A3 (en) * | 1997-06-06 | 1999-06-01 | Brussels Biotech En Abrege Bb | Process for purification lactic acid. |
| NZ523459A (en) * | 2000-05-30 | 2004-08-27 | Lactascan Aps | Method for producing lactic acid |
| CN101688224A (en) * | 2007-06-29 | 2010-03-31 | 东丽株式会社 | Lactic acid production method |
-
2007
- 2007-08-01 JP JP2007200439A patent/JP5262011B2/en not_active Expired - Fee Related
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009142265A (en) * | 2007-11-20 | 2009-07-02 | Toray Ind Inc | Method for producing lactic acid |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2009034030A (en) | 2009-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5487617B2 (en) | Method for producing lactic acid | |
| JP5082496B2 (en) | Process for producing chemicals by continuous fermentation and continuous fermentation apparatus | |
| JP5992135B2 (en) | Process for producing lactic acid by continuous fermentation | |
| WO2010074222A1 (en) | Method for producing lactic acid and method for producing polylactic acid | |
| JP5092487B2 (en) | Production method of chemicals by continuous fermentation | |
| JP5262011B2 (en) | Lactic acid production method and production apparatus | |
| JP2008237213A (en) | Continuous fermentation apparatus | |
| JP2009201506A (en) | Method for producing lactic acid | |
| JP5358911B2 (en) | Process for producing chemicals by continuous fermentation | |
| JP2012012322A (en) | Lactic acid and method for producing lactic acid | |
| JP2010126512A (en) | Method for producing hydroxycarboxylic acid | |
| JP2010070474A (en) | Method for producing succinic acid | |
| JP5458565B2 (en) | Method for producing succinate | |
| JP5293157B2 (en) | Method for producing butanol | |
| JP2010095450A (en) | Method for producing monocarboxylic acid | |
| JP2009142265A (en) | Method for producing lactic acid | |
| JP5061639B2 (en) | Continuous fermentation equipment | |
| JP5593597B2 (en) | Method for producing lactic acid | |
| JP2011172492A (en) | Method for producing lactate salt | |
| JP5564783B2 (en) | Method for producing lactic acid | |
| JP2009142210A (en) | Method for producing lactic acid by continuous fermentation | |
| JP2009171879A (en) | Method for producing lactic acid | |
| JP2009065966A (en) | Method for producing chemical product by continuous fermentation | |
| JP2010022321A (en) | Method for producing chemical material by continuous culture | |
| JP2009296921A (en) | Continuous culture device and method for producing chemical |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100331 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100607 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120605 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120803 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130108 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130307 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130402 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130415 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 5262011 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| LAPS | Cancellation because of no payment of annual fees |