JP5201166B2 - Secondary battery - Google Patents
Secondary battery Download PDFInfo
- Publication number
- JP5201166B2 JP5201166B2 JP2010092390A JP2010092390A JP5201166B2 JP 5201166 B2 JP5201166 B2 JP 5201166B2 JP 2010092390 A JP2010092390 A JP 2010092390A JP 2010092390 A JP2010092390 A JP 2010092390A JP 5201166 B2 JP5201166 B2 JP 5201166B2
- Authority
- JP
- Japan
- Prior art keywords
- lithium
- negative electrode
- secondary battery
- compound
- electrolytic solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 229910052744 lithium Inorganic materials 0.000 claims description 72
- -1 imide anion Chemical class 0.000 claims description 68
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 claims description 46
- 239000008151 electrolyte solution Substances 0.000 claims description 37
- 150000001875 compounds Chemical class 0.000 claims description 26
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 23
- 150000004696 coordination complex Chemical class 0.000 claims description 23
- 229910001428 transition metal ion Inorganic materials 0.000 claims description 20
- 239000003792 electrolyte Substances 0.000 claims description 19
- 229910002804 graphite Inorganic materials 0.000 claims description 19
- 239000010439 graphite Substances 0.000 claims description 19
- 229910052723 transition metal Inorganic materials 0.000 claims description 18
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 16
- 239000000956 alloy Substances 0.000 claims description 15
- 229910045601 alloy Inorganic materials 0.000 claims description 13
- 150000003624 transition metals Chemical class 0.000 claims description 13
- 239000002131 composite material Substances 0.000 claims description 11
- 239000007773 negative electrode material Substances 0.000 claims description 11
- VAYTZRYEBVHVLE-UHFFFAOYSA-N 1,3-dioxol-2-one Chemical compound O=C1OC=CO1 VAYTZRYEBVHVLE-UHFFFAOYSA-N 0.000 claims description 10
- 239000007788 liquid Substances 0.000 claims description 8
- 229910003002 lithium salt Inorganic materials 0.000 claims description 8
- 159000000002 lithium salts Chemical class 0.000 claims description 8
- 150000003839 salts Chemical class 0.000 claims description 7
- 229910052710 silicon Inorganic materials 0.000 claims description 7
- FSSPGSAQUIYDCN-UHFFFAOYSA-N 1,3-Propane sultone Chemical compound O=S1(=O)CCCO1 FSSPGSAQUIYDCN-UHFFFAOYSA-N 0.000 claims description 6
- 229910052693 Europium Inorganic materials 0.000 claims description 6
- 229910013870 LiPF 6 Inorganic materials 0.000 claims description 6
- 150000001450 anions Chemical class 0.000 claims description 6
- 229910052691 Erbium Inorganic materials 0.000 claims description 5
- 229910052689 Holmium Inorganic materials 0.000 claims description 5
- 229910052779 Neodymium Inorganic materials 0.000 claims description 5
- 239000000010 aprotic solvent Substances 0.000 claims description 5
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 claims description 5
- 239000003960 organic solvent Substances 0.000 claims description 5
- MHYFEEDKONKGEB-UHFFFAOYSA-N oxathiane 2,2-dioxide Chemical compound O=S1(=O)CCCCO1 MHYFEEDKONKGEB-UHFFFAOYSA-N 0.000 claims description 5
- 229910013063 LiBF 4 Inorganic materials 0.000 claims description 4
- 150000005676 cyclic carbonates Chemical class 0.000 claims description 4
- UYAHIZSMUZPPFV-UHFFFAOYSA-N erbium Chemical compound [Er] UYAHIZSMUZPPFV-UHFFFAOYSA-N 0.000 claims description 4
- KJZYNXUDTRRSPN-UHFFFAOYSA-N holmium atom Chemical compound [Ho] KJZYNXUDTRRSPN-UHFFFAOYSA-N 0.000 claims description 4
- QEFYFXOXNSNQGX-UHFFFAOYSA-N neodymium atom Chemical compound [Nd] QEFYFXOXNSNQGX-UHFFFAOYSA-N 0.000 claims description 4
- HXJUTPCZVOIRIF-UHFFFAOYSA-N sulfolane Chemical compound O=S1(=O)CCCC1 HXJUTPCZVOIRIF-UHFFFAOYSA-N 0.000 claims description 4
- 229910010238 LiAlCl 4 Inorganic materials 0.000 claims description 3
- 229910015015 LiAsF 6 Inorganic materials 0.000 claims description 3
- 229910013684 LiClO 4 Inorganic materials 0.000 claims description 3
- 229910012513 LiSbF 6 Inorganic materials 0.000 claims description 3
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 claims description 3
- 150000005678 chain carbonates Chemical class 0.000 claims description 3
- 150000004292 cyclic ethers Chemical class 0.000 claims description 3
- 150000002170 ethers Chemical class 0.000 claims description 3
- 125000000457 gamma-lactone group Chemical group 0.000 claims description 3
- 150000003949 imides Chemical class 0.000 claims description 3
- 229910013131 LiN Inorganic materials 0.000 claims description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 claims 1
- 150000001335 aliphatic alkanes Chemical class 0.000 claims 1
- 239000010408 film Substances 0.000 description 53
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 26
- 238000000034 method Methods 0.000 description 19
- 238000006243 chemical reaction Methods 0.000 description 15
- 230000000694 effects Effects 0.000 description 14
- 239000003575 carbonaceous material Substances 0.000 description 13
- 229910052751 metal Inorganic materials 0.000 description 12
- 239000002184 metal Substances 0.000 description 12
- 235000002639 sodium chloride Nutrition 0.000 description 12
- 239000000654 additive Substances 0.000 description 11
- 230000000996 additive effect Effects 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- HBBGRARXTFLTSG-UHFFFAOYSA-N Lithium ion Chemical compound [Li+] HBBGRARXTFLTSG-UHFFFAOYSA-N 0.000 description 9
- 229910001416 lithium ion Inorganic materials 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 8
- 229910000733 Li alloy Inorganic materials 0.000 description 8
- 239000013078 crystal Substances 0.000 description 8
- 239000001989 lithium alloy Substances 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000000354 decomposition reaction Methods 0.000 description 7
- 210000001787 dendrite Anatomy 0.000 description 7
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- 229910052782 aluminium Inorganic materials 0.000 description 6
- 230000000052 comparative effect Effects 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 5
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 5
- 239000011248 coating agent Substances 0.000 description 5
- 238000000576 coating method Methods 0.000 description 5
- 230000006866 deterioration Effects 0.000 description 5
- RUOJZAUFBMNUDX-UHFFFAOYSA-N propylene carbonate Chemical compound CC1COC(=O)O1 RUOJZAUFBMNUDX-UHFFFAOYSA-N 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- KMTRUDSVKNLOMY-UHFFFAOYSA-N Ethylene carbonate Chemical compound O=C1OCCO1 KMTRUDSVKNLOMY-UHFFFAOYSA-N 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 239000011888 foil Substances 0.000 description 4
- 229910052747 lanthanoid Inorganic materials 0.000 description 4
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 4
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 4
- 230000014759 maintenance of location Effects 0.000 description 4
- 239000007774 positive electrode material Substances 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- OIFBSDVPJOWBCH-UHFFFAOYSA-N Diethyl carbonate Chemical compound CCOC(=O)OCC OIFBSDVPJOWBCH-UHFFFAOYSA-N 0.000 description 3
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 3
- 239000011149 active material Substances 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 230000007547 defect Effects 0.000 description 3
- 238000007599 discharging Methods 0.000 description 3
- 238000005868 electrolysis reaction Methods 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 230000002427 irreversible effect Effects 0.000 description 3
- 150000002602 lanthanoids Chemical class 0.000 description 3
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 3
- 229910001947 lithium oxide Inorganic materials 0.000 description 3
- ACFSQHQYDZIPRL-UHFFFAOYSA-N lithium;bis(1,1,2,2,2-pentafluoroethylsulfonyl)azanide Chemical compound [Li+].FC(F)(F)C(F)(F)S(=O)(=O)[N-]S(=O)(=O)C(F)(F)C(F)(F)F ACFSQHQYDZIPRL-UHFFFAOYSA-N 0.000 description 3
- 239000011255 nonaqueous electrolyte Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Substances OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 229910052814 silicon oxide Inorganic materials 0.000 description 3
- 239000007784 solid electrolyte Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- ZZXUZKXVROWEIF-UHFFFAOYSA-N 1,2-butylene carbonate Chemical compound CCC1COC(=O)O1 ZZXUZKXVROWEIF-UHFFFAOYSA-N 0.000 description 2
- YEJRWHAVMIAJKC-UHFFFAOYSA-N 4-Butyrolactone Chemical compound O=C1CCCO1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 229910015643 LiMn 2 O 4 Inorganic materials 0.000 description 2
- 239000002033 PVDF binder Substances 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 229910003481 amorphous carbon Inorganic materials 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 238000005229 chemical vapour deposition Methods 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- VUPKGFBOKBGHFZ-UHFFFAOYSA-N dipropyl carbonate Chemical compound CCCOC(=O)OCCC VUPKGFBOKBGHFZ-UHFFFAOYSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229940052303 ethers for general anesthesia Drugs 0.000 description 2
- KLKFAASOGCDTDT-UHFFFAOYSA-N ethoxymethoxyethane Chemical compound CCOCOCC KLKFAASOGCDTDT-UHFFFAOYSA-N 0.000 description 2
- FKRCODPIKNYEAC-UHFFFAOYSA-N ethyl propionate Chemical compound CCOC(=O)CC FKRCODPIKNYEAC-UHFFFAOYSA-N 0.000 description 2
- 229910000040 hydrogen fluoride Inorganic materials 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- HSZCZNFXUDYRKD-UHFFFAOYSA-M lithium iodide Inorganic materials [Li+].[I-] HSZCZNFXUDYRKD-UHFFFAOYSA-M 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- TZIHFWKZFHZASV-UHFFFAOYSA-N methyl formate Chemical compound COC=O TZIHFWKZFHZASV-UHFFFAOYSA-N 0.000 description 2
- 239000012046 mixed solvent Substances 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000006104 solid solution Substances 0.000 description 2
- 238000004544 sputter deposition Methods 0.000 description 2
- 239000010409 thin film Substances 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- VFRGATWKSPNXLT-UHFFFAOYSA-N 1,2-dimethoxybutane Chemical compound CCC(OC)COC VFRGATWKSPNXLT-UHFFFAOYSA-N 0.000 description 1
- VJRYWXNPDKUNNG-UHFFFAOYSA-N 1,3,2lambda5-dioxaphospholane 2-oxide Chemical class O=P1OCCO1 VJRYWXNPDKUNNG-UHFFFAOYSA-N 0.000 description 1
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 1
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 1
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 1
- PPDFQRAASCRJAH-UHFFFAOYSA-N 2-methylthiolane 1,1-dioxide Chemical compound CC1CCCS1(=O)=O PPDFQRAASCRJAH-UHFFFAOYSA-N 0.000 description 1
- VWIIJDNADIEEDB-UHFFFAOYSA-N 3-methyl-1,3-oxazolidin-2-one Chemical compound CN1CCOC1=O VWIIJDNADIEEDB-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 229910001148 Al-Li alloy Inorganic materials 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910012851 LiCoO 2 Inorganic materials 0.000 description 1
- 229910013290 LiNiO 2 Inorganic materials 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- JFBZPFYRPYOZCQ-UHFFFAOYSA-N [Li].[Al] Chemical compound [Li].[Al] JFBZPFYRPYOZCQ-UHFFFAOYSA-N 0.000 description 1
- KLARSDUHONHPRF-UHFFFAOYSA-N [Li].[Mn] Chemical compound [Li].[Mn] KLARSDUHONHPRF-UHFFFAOYSA-N 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 229910002065 alloy metal Inorganic materials 0.000 description 1
- 229910000905 alloy phase Inorganic materials 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229910021383 artificial graphite Inorganic materials 0.000 description 1
- 238000000889 atomisation Methods 0.000 description 1
- LFYJSSARVMHQJB-QIXNEVBVSA-N bakuchiol Chemical compound CC(C)=CCC[C@@](C)(C=C)\C=C\C1=CC=C(O)C=C1 LFYJSSARVMHQJB-QIXNEVBVSA-N 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- 229910002056 binary alloy Inorganic materials 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- 229910021393 carbon nanotube Inorganic materials 0.000 description 1
- 239000002041 carbon nanotube Substances 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000011889 copper foil Substances 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 229960004132 diethyl ether Drugs 0.000 description 1
- IEJIGPNLZYLLBP-UHFFFAOYSA-N dimethyl carbonate Chemical compound COC(=O)OC IEJIGPNLZYLLBP-UHFFFAOYSA-N 0.000 description 1
- 150000004862 dioxolanes Chemical class 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 229910003437 indium oxide Inorganic materials 0.000 description 1
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 229910052746 lanthanum Inorganic materials 0.000 description 1
- 229910052745 lead Inorganic materials 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000000048 melt cooling Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- CXHHBNMLPJOKQD-UHFFFAOYSA-M methyl carbonate Chemical compound COC([O-])=O CXHHBNMLPJOKQD-UHFFFAOYSA-M 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229910021382 natural graphite Inorganic materials 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000005268 plasma chemical vapour deposition Methods 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000003980 solgel method Methods 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- MBDNRNMVTZADMQ-UHFFFAOYSA-N sulfolene Chemical class O=S1(=O)CC=CC1 MBDNRNMVTZADMQ-UHFFFAOYSA-N 0.000 description 1
- 150000003464 sulfur compounds Chemical class 0.000 description 1
- 150000008053 sultones Chemical class 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 229910052714 tellurium Inorganic materials 0.000 description 1
- 229910002058 ternary alloy Inorganic materials 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000002230 thermal chemical vapour deposition Methods 0.000 description 1
- 229910052718 tin Inorganic materials 0.000 description 1
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 1
- 229910001887 tin oxide Inorganic materials 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
本発明は、二次電池に関するものである。 The present invention relates to a secondary battery.
負極に炭素材料、酸化物、リチウム合金又はリチウム金属を用いた非水電解液リチウムイオン又はリチウム二次電池は、高いエネルギー密度を実現できることから携帯電話、ノートパソコン用などの電源として注目されている。 Non-aqueous electrolyte lithium ion or lithium secondary batteries using carbon materials, oxides, lithium alloys or lithium metals for the negative electrode are attracting attention as power sources for mobile phones, laptop computers, etc. because they can achieve high energy density .
この二次電池において、負極の表面には、表面膜、保護膜、SEI、皮膜等と呼ばれる膜(以下、表面膜)が生成することが知られている。この表面膜は、充放電効率、サイクル寿命、安全性に大きな影響を及ぼすことから負極の高性能化には表面膜の制御が不可欠であることが知られている。 In this secondary battery, it is known that a film called a surface film, a protective film, SEI, a film (hereinafter referred to as a surface film) is formed on the surface of the negative electrode. Since this surface film has a great influence on charge / discharge efficiency, cycle life and safety, it is known that control of the surface film is indispensable for improving the performance of the negative electrode.
炭素材料、酸化物材料についてはその不可逆容量の低減が必要であり、リチウム金属、合金負極においては充放電効率の低下とデンドライト(樹枝状結晶)生成による安全性の問題を解決する必要がある。 For carbon materials and oxide materials, it is necessary to reduce the irreversible capacity, and for lithium metal and alloy negative electrodes, it is necessary to solve the problem of safety due to the decrease in charge / discharge efficiency and the generation of dendrites (dendrites).
これらの課題を解決する手法として様々な手法が提案されてきている。例えば、リチウム金属又はリチウム合金の表面に、化学反応を利用してフッ化リチウム等からなる皮膜層を設けることによってデンドライトの生成を抑制することが提案されている。 Various techniques have been proposed as a technique for solving these problems. For example, it has been proposed to suppress the formation of dendrite by providing a film layer made of lithium fluoride or the like using a chemical reaction on the surface of lithium metal or lithium alloy.
特許文献1には、フッ化水素酸を含有する電解液にリチウム負極を曝し、負極をフッ化水素酸と反応させることによりその表面をフッ化リチウムの膜で覆う技術が開示されている。 Patent Document 1 discloses a technique in which a lithium negative electrode is exposed to an electrolytic solution containing hydrofluoric acid, and the negative electrode is reacted with hydrofluoric acid to cover the surface with a lithium fluoride film.
フッ化水素酸は、LiPF6及び微量の水の反応により生成する。一方、リチウム負極表面には、空気中での自然酸化により水酸化リチウムや酸化リチウムの表面膜が形成されている。これらが反応することにより、負極表面にフッ化リチウムの表面膜が生成するのである。 Hydrofluoric acid is produced by the reaction of LiPF 6 and a small amount of water. On the other hand, a surface film of lithium hydroxide or lithium oxide is formed on the surface of the lithium negative electrode by natural oxidation in air. When these react, a surface film of lithium fluoride is formed on the negative electrode surface.
しかしながら、このフッ化リチウム膜は、電極界面と液との反応を利用して形成されるものであり、副反応成分が表面膜中に混入しやすく、均一な膜が得られにくい。また、水酸化リチウムや酸化リチウムの表面膜が均一に形成されていない場合や一部リチウムがむきだしになっている部分が存在する場合もあり、これらの場合には均一な薄膜の形成ができないばかりか、水やフッ化水素等とリチウムが反応することによる安全性の問題が生じる。また、反応が不十分であった場合には、フッ化物以外の不要な化合物成分が残り、イオン伝導性の低下を招く等の悪影響が考えられる。 However, this lithium fluoride film is formed by utilizing the reaction between the electrode interface and the liquid, and side reaction components are easily mixed into the surface film, making it difficult to obtain a uniform film. Also, there may be cases where the surface film of lithium hydroxide or lithium oxide is not uniformly formed or there is a part where lithium is exposed. In these cases, a uniform thin film cannot be formed. In addition, there is a safety problem due to the reaction of lithium with water or hydrogen fluoride. Moreover, when reaction is inadequate, unnecessary compound components other than a fluoride remain, and bad influences, such as causing the fall of ion conductivity, are considered.
更に、このような界面での化学反応を利用してフッ化物層を形成する方法では、利用できるフッ化物や電解液の選択幅が限定され、安定な表面膜を歩留まり良く形成することは困難であった。 Furthermore, in the method of forming a fluoride layer using such a chemical reaction at the interface, the selection range of the available fluoride and electrolyte is limited, and it is difficult to form a stable surface film with a high yield. there were.
特許文献2では、アルゴンとフッ化水素の混合ガスと、アルミニウム−リチウム合金とを反応させ、負極表面にフッ化リチウムの表面膜を得ている。 In Patent Document 2, a mixed gas of argon and hydrogen fluoride is reacted with an aluminum-lithium alloy to obtain a lithium fluoride surface film on the negative electrode surface.
しかしながら、リチウム金属表面にあらかじめ表面膜が存在する場合、特に複数種の化合物が存在する場合には反応が不均一になり易く、フッ化リチウムの膜を均一に形成することが困難である。このため、十分なサイクル特性のリチウム二次電池を得ることが困難となる。 However, when a surface film is present on the lithium metal surface in advance, particularly when a plurality of types of compounds are present, the reaction tends to be non-uniform, and it is difficult to form a lithium fluoride film uniformly. For this reason, it becomes difficult to obtain a lithium secondary battery having sufficient cycle characteristics.
特許文献3には、均一な結晶構造すなわち(100)結晶面が優先的に配向しているリチウムシートの表面に、岩塩型結晶構造を持つ物質を主成分とする表面皮膜構造を形成する技術が開示されている。こうすることにより、均一な析出溶解反応すなわち電池の充放電を行うことができ、リチウム金属のデンドライト析出を抑え、電池のサイクル寿命が向上できるとされている。 Patent Document 3 discloses a technique for forming a surface film structure mainly composed of a substance having a rock salt type crystal structure on the surface of a lithium sheet having a uniform crystal structure, that is, a (100) crystal plane preferentially oriented. It is disclosed. By carrying out like this, it is said that uniform precipitation dissolution reaction, ie, charge / discharge of a battery, can be performed, dendrite precipitation of lithium metal can be suppressed, and the cycle life of the battery can be improved.
表面膜に用いる物質としては、リチウムのハロゲン化物を有していることが好ましく、LiCl、LiBr、LiIより選ばれる少なくとも一種と、LiFとの固溶体を用いることが好ましいと述べられている。 It is stated that the substance used for the surface film preferably has a halide of lithium, and it is preferable to use a solid solution of LiF with at least one selected from LiCl, LiBr, and LiI.
具体的には、LiCl、LiBr、LiIの少なくとも一種と、LiFとの固溶体皮膜を形成するために、押圧処理(圧延)により作成した(100)結晶面が優先的に配向しているリチウムシートを、塩素分子もしくは塩素イオン、臭素分子もしくは臭素イオン、ヨウ素分子もしくはヨウ素イオンのうち少なくとも一種と、フッ素分子もしくはフッ素イオンを含有している電解液に、浸すことにより非水電解質電池用負極を作成している。 Specifically, in order to form a solid solution film of at least one of LiCl, LiBr, and LiI and LiF, a lithium sheet with a (100) crystal plane preferentially oriented formed by pressing (rolling) is used. A negative electrode for a non-aqueous electrolyte battery is prepared by immersing in an electrolyte solution containing at least one of chlorine molecules or chlorine ions, bromine molecules or bromine ions, iodine molecules or iodine ions, and fluorine molecules or fluorine ions. ing.
この技術の場合、圧延のリチウム金属シートを用いており、リチウムシートが大気中に曝され易いため表面に水分などに由来する皮膜が形成され易く、活性点の存在が不均一となり、目的とした安定な表面膜を作ることが困難となり、デントライトの抑制効果は必ずしも充分に得られなかった。 In the case of this technology, a rolled lithium metal sheet is used, and since the lithium sheet is easily exposed to the atmosphere, a film derived from moisture and the like is easily formed on the surface, and the presence of active sites becomes uneven, which is the purpose. It became difficult to produce a stable surface film, and the effect of suppressing dentlite was not always sufficiently obtained.
また、リチウムイオンを吸蔵・放出し得る黒鉛、非晶質炭素等の炭素材料を負極として用いた場合、容量及び充放電効率の向上に係る技術が報告されている。 In addition, when a carbon material such as graphite or amorphous carbon capable of occluding and releasing lithium ions is used as a negative electrode, a technique for improving capacity and charge / discharge efficiency has been reported.
特許文献4では、アルミニウムで炭素材料を被覆した負極が提案されている。これにより、リチウムイオンと溶媒和した溶媒分子の炭素表面での還元分解が抑制され、サイクル寿命の劣化を抑えられるとされている。ただし、アルミニウムが微量の水と反応してしまうため、充放電を繰り返すと急速に容量が低下するという課題を有している。 In patent document 4, the negative electrode which coat | covered the carbon material with aluminum is proposed. Thereby, reductive decomposition on the carbon surface of solvent molecules solvated with lithium ions is suppressed, and deterioration of cycle life is suppressed. However, since aluminum reacts with a small amount of water, there is a problem that the capacity rapidly decreases when charging and discharging are repeated.
また、特許文献5では、炭素材料の表面をリチウムイオン伝導性固体電解質の薄膜を被覆した負極が提示されている。これにより、炭素材料を使用した際に生じる溶媒の分解を抑制し、特に炭酸プロピレンを使用できるリチウムイオン二次電池を提供できるとしている。 Patent Document 5 proposes a negative electrode in which the surface of a carbon material is covered with a thin film of a lithium ion conductive solid electrolyte. Thereby, it is said that the decomposition | disassembly of the solvent which arises when using a carbon material can be suppressed, and especially the lithium ion secondary battery which can use a propylene carbonate can be provided.
しかしながら、リチウムイオンの挿入、脱離時の応力変化により固体電解質中に生じるクラックが特性劣化を導く。また、固体電解質の結晶欠陥等の不均一性により、負極表面において均一な反応が得られずサイクル寿命の劣化につながる。 However, cracks generated in the solid electrolyte due to changes in stress during insertion and desorption of lithium ions lead to deterioration of characteristics. In addition, due to non-uniformity such as crystal defects in the solid electrolyte, a uniform reaction cannot be obtained on the negative electrode surface, leading to deterioration of cycle life.
また、特許文献6では、負極がグラファイトを含む材料からなり、電解液として環状カーボネート及び鎖状カーボネートを主成分とし、且つ前記電解液中に0.1wt%以上4wt%以下の1,3−プロパンスルトン及び/又は1,4−ブタンスルトンを含んだ二次電池が開示されている。 Further, in Patent Document 6, the negative electrode is made of a material containing graphite, and cyclic carbonate and chain carbonate are the main components as the electrolytic solution, and 0.1 to 4 wt% of 1,3-propane is contained in the electrolytic solution. Secondary batteries containing sultone and / or 1,4-butane sultone are disclosed.
ここで、1,3−プロパンスルトンや1,4−ブタンスルトンは、炭素材料表面での不働態皮膜形成に寄与し、天然黒鉛や人造黒鉛などの活性で高結晶化した炭素材料を不働態皮膜で被覆し、電池の正常な反応を損なうことなく電解液の分解を抑制する効果を有するものと考えられている。 Here, 1,3-propane sultone or 1,4-butane sultone contributes to the formation of a passive film on the surface of the carbon material, and the active and highly crystallized carbon material such as natural graphite or artificial graphite is a passive film. It is considered that the coating has an effect of suppressing the decomposition of the electrolyte without impairing the normal reaction of the battery.
また、直井等は、非特許文献1、非特許文献2の学会発表で、ユーロピウム等のランタノイド系遷移金属とイミドアニオンの錯体のリチウム金属負極への効果について報告している。 Naoi et al. Reported on the effect of a complex of a lanthanoid-based transition metal such as europium and an imide anion on a lithium metal negative electrode at the conference presentations of Non-Patent Document 1 and Non-Patent Document 2.
ここでは、プロピレンカーボネート又はエチレンカーボネートと1,2−ジメトキシエタンの混合溶媒にリチウム塩としてLiN(C2F5SO2)2を溶解させた電解液に、さらにEu(CF3SO3)3を添加剤として添加し、電解液中に浸漬されたLi金属上にEu[N(C2F5SO2)2]3錯体からなる表面膜を形成している。 Here, Eu (CF 3 SO 3 ) 3 is further added to an electrolyte obtained by dissolving LiN (C 2 F 5 SO 2 ) 2 as a lithium salt in a mixed solvent of propylene carbonate or ethylene carbonate and 1,2-dimethoxyethane. A surface film made of Eu [N (C 2 F 5 SO 2 ) 2 ] 3 complex is formed on Li metal added as an additive and immersed in the electrolytic solution.
しかしながら、上記した従来技術は、次のような共通する課題を有していた。 However, the above-described prior art has the following common problems.
負極表面に生成する表面膜は、その性質によって充放電効率、サイクル寿命、安全性に深く関わっているが、その膜の制御を長期にわたって行える手法はまだ存在していない。 The surface film formed on the surface of the negative electrode is deeply related to charge / discharge efficiency, cycle life, and safety depending on its properties, but there is still no method for controlling the film for a long time.
例えば、リチウムやその合金からなる層の上にリチウムハロゲン化物又はガラス状酸化物からなる表面膜を形成した場合、初期使用時にはデントライトの抑制効果が一定程度得られるものの、繰り返し使用していると、表面膜が劣化して保護膜としての機能が低下する。 For example, when a surface film made of lithium halide or glassy oxide is formed on a layer made of lithium or an alloy thereof, although a certain degree of dentite suppression effect can be obtained during initial use, The surface film is deteriorated and the function as a protective film is lowered.
これは、リチウムやその合金からなる層は、リチウムを吸蔵・放出することにより体積変化する一方、その上部に位置するリチウムハロゲン化物等からなる被膜は体積変化がほとんどないため、これらの層及びこれらの界面に内部応力が発生することが原因と考えられる。 This is because a layer made of lithium or an alloy thereof changes in volume by occlusion / release of lithium, while a coating made of lithium halide or the like located on the upper layer hardly changes in volume. This is thought to be due to the generation of internal stress at the interface.
このような内部応力が発生することにより、特にリチウムハロゲン化物等からなる表面膜の一部が破損し、デンドライト生成を抑制する機能が低下したものと考えられる。 Due to the occurrence of such internal stress, it is considered that a part of the surface film made of lithium halide or the like is particularly damaged, and the function of suppressing the formation of dendrite is lowered.
黒鉛等の炭素材料に関しては、溶媒分子やアニオンの分解による電荷が不可逆容量成分として現れ、初回充放電効率の低下を導く。また、このとき生じた膜の組成、結晶状態、安定性等がその後の効率、サイクル寿命に大きな影響を及ぼす。 For carbon materials such as graphite, charge due to decomposition of solvent molecules and anions appears as an irreversible capacity component, leading to a decrease in initial charge / discharge efficiency. Further, the composition, crystal state, stability, etc. of the film produced at this time have a great influence on the subsequent efficiency and cycle life.
また、直井等が検討したリチウム金属表面に有機表面膜を形成する方法では、上記の従来技術よりサイクル寿命の改善にある程度の効果が得られているが、まだ十分ではない。 In addition, the method of forming an organic surface film on the lithium metal surface studied by Naoi et al. Has achieved a certain degree of effect in improving the cycle life as compared with the above-described conventional technique, but is still not sufficient.
このように、二次電池用負極に皮膜を形成して、充放電効率、サイクル寿命の改善などを図った研究が進んでいるが、未だ十分な特性が得られておらず如何にして安定で十分な充放電効率を導く皮膜を形成するかが最大の課題である。 In this way, research has been progressing to improve the charge / discharge efficiency and cycle life by forming a film on the negative electrode for secondary batteries.However, sufficient characteristics have not been obtained yet, and how stable it is. The biggest challenge is to form a film that leads to sufficient charge and discharge efficiency.
本発明者らは、鋭意研究を重ねた結果、負極を構成する負極活物質として黒鉛上にSiとLiとからなる合金層を成膜させたもの(黒鉛/Si:Li)を用い、非プロトン性溶媒に、少なくともイミドアニオン、遷移金属イオン及びスルホン化合物が含まれる電解液を用いて二次電池を作製した場合、また、非プロトン性溶媒に電解質塩としてリチウム塩を溶解した電解液に、少なくともイミドアニオンと遷移金属イオンとからなる遷移金属錯体及びスルホン化合物を含む電解液を用いて二次電池を作製した場合に、充放電効率に優れサイクル特性が良好であることを見出し、本発明に至った。 As a result of extensive research, the present inventors have used a non-proton material in which an alloy layer made of Si and Li is formed on graphite (graphite / Si: Li) as a negative electrode active material constituting the negative electrode. In the case where a secondary battery is prepared using an electrolytic solution containing at least an imide anion, a transition metal ion, and a sulfone compound in the protic solvent, or in an electrolytic solution obtained by dissolving a lithium salt as an electrolyte salt in an aprotic solvent. When a secondary battery was prepared using an electrolyte solution containing a transition metal complex consisting of an imide anion and a transition metal ion and a sulfone compound, it was found that the charge / discharge efficiency was excellent and the cycle characteristics were good, leading to the present invention. It was.
すなわち、本発明は、少なくとも正極と負極を備えた二次電池であって、該負極を構成する負極活物質が、黒鉛/Si:Li(黒鉛上にSiとLiからなる合金層を成膜させたもの)であり、かつ、電解液が、非プロトン性溶媒に、少なくともイミドアニオン、遷移金属イオン及びスルホン化合物を含んでおり、該イミドアニオンが、 - N(C n F 2n+1 SO 2 )(C m F 2m+1 SO 2 )(n、mは自然数)であり、イミドアニオン又はその金属錯体として電解液中0.005〜10wt%含まれ、該遷移金属が、ユウロピウム、ネオジウム、エルビウム、ホルミウムからなる群の中から選択され、かつ、該スルホニル基を有する化合物が、1,3−プロパンスルトン、1,4−ブタンスルトン、スルホラン、アルカンスルホン酸無水物、γ−スルトン化合物及びスルホレン化合物からなる群から選択された少なくとも一つであり、電解液中0.01〜10wt%含まれることを特徴とする二次電池である。 That is, the present invention is a secondary battery having at least a positive electrode and a negative electrode, and the negative electrode active material constituting the negative electrode is formed by forming a graphite / Si: Li (alloy layer of Si and Li on graphite). a thing), and electrolyte, an aprotic solvent, at least imide anion, includes a transition metal ion and a sulfonic compound, said imide anion is, - n (C n F 2n + 1 SO 2) (C m F 2m + 1 SO 2 ) (n and m are natural numbers) and contained in the electrolyte as an imide anion or a metal complex thereof in an amount of 0.005 to 10 wt%, and the transition metal is europium, neodymium, erbium, The compound selected from the group consisting of holmium and having the sulfonyl group is selected from the group consisting of 1,3-propane sultone, 1,4-butane sultone, sulfolane, alkanesulfonic acid anhydride, γ-sulphone. At least one selected from the group consisting of tons compounds and sulfolene compound, a secondary battery, characterized in that contained 0.01-10 wt% in the electrolyte.
本発明によれば、非プロトン性溶媒にイミドアニオン、遷移金属イオン及びスルホニル基を有する化合物を含む二次電池用電解液、あるいは、非プロトン性溶媒にリチウム塩を溶解した液に少なくともイミドアニオンと遷移金属イオンとからなる金属錯体及びスルホン化合物を含む電解液を用いた、優れたエネルギー密度、起電力等の特性を有するとともに、サイクル寿命、安全性に優れたリチウム二次電池が提供される。 According to the present invention, at least an imide anion in an electrolyte solution for a secondary battery containing a compound having an imide anion, a transition metal ion and a sulfonyl group in an aprotic solvent, or a solution in which a lithium salt is dissolved in an aprotic solvent. Provided is a lithium secondary battery having excellent characteristics such as energy density and electromotive force, and having excellent cycle life and safety, using an electrolytic solution containing a metal complex composed of a transition metal ion and a sulfone compound.
遷移金属イオンとイミドアニオンが存在する系の場合、充放電によりイミドアニオンと遷移金属イオンとの金属錯体が負極表面に形成される(非特許文献1、2)。 In the case of a system in which a transition metal ion and an imide anion are present, a metal complex of the imide anion and the transition metal ion is formed on the negative electrode surface by charge and discharge (Non-Patent Documents 1 and 2).
また、遷移金属イオンとイミドアニオンとの金属錯体が存在する場合、充放電に関係なく前記金属錯体が負極表面に吸着される。 Moreover, when the metal complex of a transition metal ion and an imide anion exists, the said metal complex is adsorb | sucked by the negative electrode surface irrespective of charging / discharging.
このイミドアニオンと遷移金属イオンとの金属錯体と、スルホニル基を有する化合物の二つの化合物が負極表面に存在することは次のような効果をもたらす。 The presence of the two compounds of the metal complex of the imide anion and the transition metal ion and the compound having a sulfonyl group on the surface of the negative electrode brings about the following effects.
負極表面には、溶媒分子との反応を引き起こすダングリングボンドと、反応性のない部位が存在している。添加するイミド塩によって生成する金属錯体や、イミド塩と遷移金属イオンによって形成される金属錯体は前記反応性のない部位に吸着するによって安定化皮膜を形成し、リチウムイオン伝導を行う。また、スルホニル基を有する化合物は、負極表面での不働態皮膜形成に寄与し、結果として溶媒分子の分解を抑制する。 On the negative electrode surface, there are dangling bonds that cause a reaction with solvent molecules and non-reactive sites. The metal complex formed by the imide salt to be added or the metal complex formed by the imide salt and the transition metal ion forms a stabilized film by adsorbing to the non-reactive site, and conducts lithium ions. Moreover, the compound which has a sulfonyl group contributes to the passive film formation on the negative electrode surface, and suppresses decomposition | disassembly of a solvent molecule as a result.
イミドアニオンの具体例としては、-N(CnF2n+1SO2)(CmF2m+1SO2)(n,mは自然数)があげられる。 Specific examples of the imide anion, - N (C n F 2n + 1 SO 2) (C m F 2m + 1 SO 2) (n, m is a natural number) and the like.
本発明において、遷移金属としてはランタノイド系金属であることが好ましく、特に、ユウロピウム(Eu)、ネオジウム(Nd)、エルビウム(Er)及びホルミウム(Ho)が好ましい。 In the present invention, the transition metal is preferably a lanthanoid metal, particularly europium (Eu), neodymium (Nd), erbium (Er), and holmium (Ho).
イミドアニオン又はその金属錯体は前記電解液中に、0.01〜10wt%含まれることが好ましい。0.01wt%未満では負極表面での皮膜形成に十分効果が得られないことがあり、また、10wt%を越えると溶解しないだけでなく電解液の粘性を大きくすることがあり、好ましくない。本発明において、より好ましくは、0.05〜5wt%の範囲である。 The imide anion or its metal complex is preferably contained in the electrolytic solution in an amount of 0.01 to 10 wt%. If it is less than 0.01 wt%, a sufficient effect may not be obtained for forming a film on the negative electrode surface, and if it exceeds 10 wt%, not only does not dissolve, but the viscosity of the electrolyte may increase, which is not preferable. In this invention, More preferably, it is the range of 0.05-5 wt%.
また、スルホニル基を有する化合物としては、具体的には、スルホラン(特開昭60−154478号公報)、1,3−プロパンスルトンや1,4−ブタンスルトン(特開昭62−100948号公報、特開昭63−102173号公報、特開平11−339850号公報、特開2000−3724号公報)、アルカンスルホン酸無水物(特開平10−189041号公報)、1,3,2−ジオキサホスホラン−2−オキサイド誘導体(特開平10−50342号公報)、γ−スルトン化合物(特開2000−235866号公報)、スルホレン誘導体(特許文献6)などがあげられるが、これらに限定されるものではない。 Specific examples of the compound having a sulfonyl group include sulfolane (Japanese Patent Laid-Open No. 60-154478), 1,3-propane sultone and 1,4-butane sultone (Japanese Patent Laid-Open No. 62-1000094). JP-A-63-102173, JP-A-11-339850, JP-A-2000-3724), alkanesulfonic anhydride (JP-A-10-189041), 1,3,2-dioxaphospholane 2-oxide derivatives (Japanese Patent Laid-Open No. 10-50342), γ-sultone compounds (Japanese Patent Laid-Open No. 2000-235866), sulfolene derivatives (Patent Document 6), and the like, but are not limited thereto. .
スルホニル基を有する化合物は電解液中に0.01〜10wt%含まれることが好ましい。0.01wt%未満では負極表面での皮膜形成に十分効果がないことが多く、また、10wt%を越えると溶解しないだけでなく電解液の粘性を大きくすることがあり、好ましくない。本発明においては、より好ましくは、0.05〜5wt%の範囲である。 The compound having a sulfonyl group is preferably contained in the electrolytic solution in an amount of 0.01 to 10 wt%. If it is less than 0.01 wt%, there are many cases where the film formation on the negative electrode surface is not sufficiently effective, and if it exceeds 10 wt%, not only does not dissolve, but the viscosity of the electrolyte may increase, which is not preferable. In this invention, More preferably, it is the range of 0.05-5 wt%.
更に本発明によれば、電解液中にビニレンカーボネート又はその誘導体を添加又は混合することで更にサイクル特性の改善を図ることができる。ビニレンカーボネート又はその誘導体として、特開平4−169075号公報、特開平7−122296号公報、特開平8−45545号公報、特開平5−82138号公報、特開平5−74486号公報、特開平6−52887号公報、特開平11−260401号公報、特開2000−208169号公報、特開2001−35530号公報あるいは特開2000−138071号公報等に示される化合物を適宜選択して使用することができる。 Furthermore, according to the present invention, the cycle characteristics can be further improved by adding or mixing vinylene carbonate or a derivative thereof in the electrolytic solution. As vinylene carbonate or derivatives thereof, JP-A-4-16975, JP-A-7-122296, JP-A-8-45545, JP-A-5-82138, JP-A-5-74486, JP-A-6 -52887, JP-A No. 11-260401, JP-A No. 2000-208169, JP-A No. 2001-35530, JP-A No. 2000-138071 and the like may be appropriately selected and used. it can.
ビニレンカーボネート又はその誘導体を添加剤として使用する場合には、電解液中に0.01〜10wt%含ませることで効果が得られる。また、溶媒として用いる場合には1〜50wt%含ませることで効果が得られる。 When vinylene carbonate or a derivative thereof is used as an additive, the effect can be obtained by including 0.01 to 10 wt% in the electrolytic solution. Moreover, when using as a solvent, an effect is acquired by including 1-50 wt%.
本発明において使用する非プロトン性有機溶媒は、環状カーボネート類、鎖状カーボネート類、脂肪族カルボン酸エステル類、γ−ラクトン類、環状エーテル類、鎖状エーテル類及びそれらのフッ素化誘導体の有機溶媒であり、これらから適宜1種あるいは2種以上の混合で使用される。 The aprotic organic solvent used in the present invention is an organic solvent of cyclic carbonates, chain carbonates, aliphatic carboxylic acid esters, γ-lactones, cyclic ethers, chain ethers and fluorinated derivatives thereof. From these, one kind or a mixture of two or more kinds is appropriately used.
本発明において、リチウム塩としては、LiPF6、LiBF4、LiAsF6、LiSbF6、LiClO4、LiAlCl4、LiN(CnF2n+1SO2)(CmF2m+1SO2)(n、mは自然数)が好ましく、特に、LiPF6、LiBF4が好ましい。 In the present invention, LiPF 6 , LiBF 4 , LiAsF 6 , LiSbF 6 , LiClO 4 , LiAlCl 4 , LiN (C n F 2n + 1 SO 2 ) (C m F 2m + 1 SO 2 ) (n , M are natural numbers), and LiPF 6 and LiBF 4 are particularly preferable.
また、本発明によれば、リチウムを活物質とする正極、負極を備えた上記二次電池用電解液を用いた二次電池が与えられる。 Moreover, according to this invention, the secondary battery using the said electrolyte solution for secondary batteries provided with the positive electrode and negative electrode which use lithium as an active material is provided.
負極として、リチウムを吸蔵・放出できる材料、リチウム金属、リチウムと合金を形成することができる金属材料、酸化物材料等からなる負極活物質を用いる。ここでリチウムを吸蔵・放出できる材料として炭素を含んだものが好ましく、特に、黒鉛であることが好ましい。 As the negative electrode, a negative electrode active material made of a material capable of inserting and extracting lithium, lithium metal, a metal material capable of forming an alloy with lithium, an oxide material, or the like is used. Here, a material containing carbon is preferable as a material capable of inserting and extracting lithium, and graphite is particularly preferable.
かかる観点から、本発明では、負極活物質として、黒鉛上にSiとLiからなる合金層を成膜させたもの(本明細書中で、「黒鉛/Si:Li」と表す)を使用する。 From this point of view, the present invention uses a negative electrode active material in which an alloy layer made of Si and Li is formed on graphite (referred to as “graphite / Si: Li” in this specification).
本発明の電解液は、安定な皮膜を与えるイミドアニオンと遷移金属イオン、又はイミドアニオンと遷移金属イオンとの遷移金属錯体をあらかじめ添加し、更にスルホニル基を有する化合物を加えることによりもたらされる。 The electrolytic solution of the present invention is obtained by adding in advance a transition metal complex of imide anion and transition metal ion or imide anion and transition metal ion that gives a stable film, and further adding a compound having a sulfonyl group.
ここで遷移金属錯体とは、遷移金属イオンにイミドアニオンが配位した安定な錯体である。この錯体が負極表面へ吸着することにより、負極表面が安定化される。 Here, the transition metal complex is a stable complex in which an imide anion is coordinated to a transition metal ion. By adsorbing this complex to the negative electrode surface, the negative electrode surface is stabilized.
また、スルホニル基を有する化合物は負極界面でダングリングボンドと反応することにより、安定な皮膜を形成する。 Moreover, the compound which has a sulfonyl group reacts with a dangling bond in a negative electrode interface, and forms a stable membrane | film | coat.
この二つの作用(吸着と反応)により、溶媒分子の分解を抑えることができサイクル特性が向上する。 By these two actions (adsorption and reaction), the decomposition of the solvent molecules can be suppressed, and the cycle characteristics are improved.
特に負極活物質が黒鉛/Si:Liであるので、これらの作用がリチウムとの反応生成物であるフッ化リチウム及び遷移金属の一部がリチウムと合金化することにより、電流密度の分布を均一にし、デンドライト等の生成を抑える。 In particular, since the negative electrode active material is graphite / Si: Li, the lithium fluoride which is a reaction product with lithium and a part of the transition metal alloy with lithium so that the current density distribution is uniform. And suppress the generation of dendrites and the like.
また、負極表面のリチウムと負極表面に吸着したイミドアニオンとの反応により、薄く安定なフッ化リチウムの皮膜が生成する。さらに、皮膜が機械的に壊れた際には、その壊れた箇所において、負極表面のリチウムと負極表面に吸着したイミドアニオンとが反応し、皮膜を修復する。このため、イミドアニオンを含むことにより、長期にわたるサイクル寿命が実現される。 In addition, a thin and stable lithium fluoride film is formed by the reaction between lithium on the negative electrode surface and imide anions adsorbed on the negative electrode surface. Furthermore, when the coating is mechanically broken, lithium on the negative electrode surface reacts with imide anions adsorbed on the negative electrode surface to repair the coating. For this reason, a long cycle life is realized by including the imide anion.
本発明においては、リチウムを活物質とする負極と正極を、セパレータを隔てて組み合わせ、電池外装体に挿入した後、金属錯体を含む電解液を含浸させ、電池外装体を封止中にあるいは封止後に電池を充電することにより、負極上に上記した皮膜を形成させる。 In the present invention, a negative electrode using lithium as an active material and a positive electrode are combined with a separator interposed therebetween, inserted into the battery outer package, and then impregnated with an electrolytic solution containing a metal complex, and the battery outer package is sealed or sealed. By charging the battery after stopping, the above-described film is formed on the negative electrode.
図1に本発明に係る電池の一例について概略構造を示す。 FIG. 1 shows a schematic structure of an example of a battery according to the present invention.
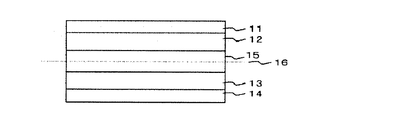
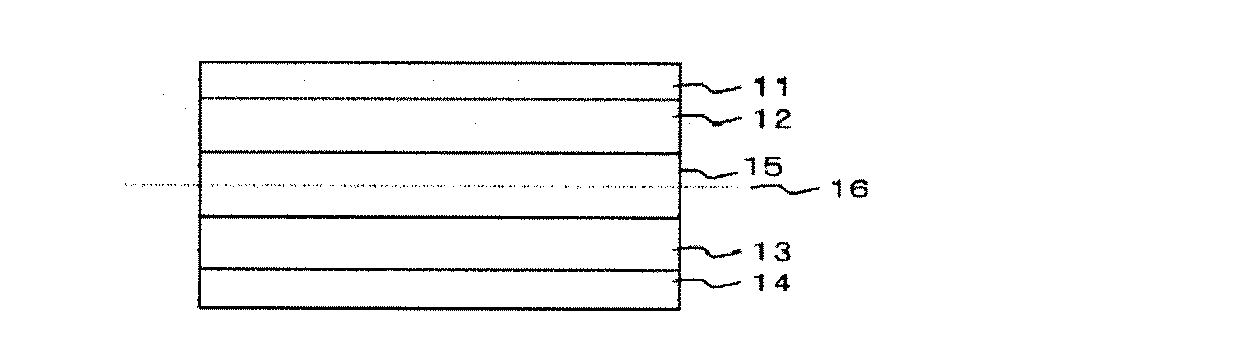
本発明の電池は、正極集電体11、リチウムイオンを吸蔵・放出し得る酸化物又はイオウ化合物、導電性高分子、安定化ラジカル化合物のいずれか又は混合物からなる正極活物質を含有する層12、リチウムイオンを吸蔵・放出する炭素材料又は酸化物、リチウムと合金を形成する金属、リチウム金属自身のいずれかもしくはこれらの混合物からなる負極活物質を含有する層13、負極集電体14、電解液15、及びこれを含む多孔質セパレータ16から構成されている。本発明では、負極活物質を含有する層が、黒鉛/Si:Liで構成されていることが特徴である。
The battery of the present invention includes a positive electrode
ここで、イミドアニオン、又は遷移金属イオンとイミドアニオンからなる金属錯体と、スルホニル基を有する化合物は、電解質としてイミドアニオン又はリチウム塩を含んでいる電解液15に含まれている。
Here, the imide anion or the metal complex composed of a transition metal ion and an imide anion and the compound having a sulfonyl group are contained in the
本発明における電解液としては、プロピレンカーボネート(PC)、エチレンカーボネート(EC)、ブチレンカーボネート(BC)、ビニレンカーボネート(VC)等の環状カーボネート類、ジメチルカーボネート(DMC)、ジエチルカーボネート(DEC)、エチルメチルカーボネート(EMC)、ジプロピルカーボネート(DPC)等の鎖状カーボネート類、ギ酸メチル、酢酸メチル、プロピオン酸エチル等の脂肪族カルボン酸エステル類、γ−ブチロラクトン等のγ−ラクトン類、1,2−エトキシエタン(DEE)、エトキシメトキシエタン(EME)等の鎖状エーテル類、テトラヒドロフラン、2−メチルテトラヒドロフラン等の環状エーテル類、ジメチルスルホキシド、1,3−ジオキソラン、ホルムアミド、アセトアミド、ジメチルホルムアミド、アセトニトリル、プロピルニトリル、ニトロメタン、エチルモノグライム、リン酸トリエステル、トリメトキシメタン、ジオキソラン誘導体、スルホラン、メチルスルホラン、1,3−ジメチル−2−イミダゾリジノン、3−メチル−2−オキサゾリジノン、プロピレンカーボネート誘導体、テトラヒドロフラン誘導体、エチルエーテル、1,3−プロパンスルトン、アニソール、N−メチルピロリドン、フッ素化カルボン酸エステルなどの非プロトン性有機溶媒を一種又は二種以上を混合して使用し、これらの有機溶媒に溶解するリチウム塩を溶解させる。リチウム塩としては、リチウムイミド塩、LiPF6、LiAsF6、LiAlCl4、LiClO4、LiBF4、LiSbF6などがあげられる。 Examples of the electrolytic solution in the present invention include propylene carbonate (PC), ethylene carbonate (EC), butylene carbonate (BC), cyclic carbonates such as vinylene carbonate (VC), dimethyl carbonate (DMC), diethyl carbonate (DEC), ethyl Chain carbonates such as methyl carbonate (EMC) and dipropyl carbonate (DPC), aliphatic carboxylic acid esters such as methyl formate, methyl acetate and ethyl propionate, γ-lactones such as γ-butyrolactone, 1, 2 -Chain ethers such as ethoxyethane (DEE) and ethoxymethoxyethane (EME), cyclic ethers such as tetrahydrofuran and 2-methyltetrahydrofuran, dimethyl sulfoxide, 1,3-dioxolane, formamide, acetamide, Dimethylformamide, acetonitrile, propylnitrile, nitromethane, ethyl monoglyme, phosphoric acid triester, trimethoxymethane, dioxolane derivative, sulfolane, methylsulfolane, 1,3-dimethyl-2-imidazolidinone, 3-methyl-2-oxazolidinone An aprotic organic solvent such as propylene carbonate derivative, tetrahydrofuran derivative, ethyl ether, 1,3-propane sultone, anisole, N-methylpyrrolidone, fluorinated carboxylic acid ester, or a mixture of two or more thereof, Lithium salts that dissolve in these organic solvents are dissolved. The lithium salt, lithium imide salt, LiPF 6, LiAsF 6, LiAlCl 4, LiClO 4, LiBF 4, LiSbF 6 , and the like.
本発明における電解液は、イミド化合物と遷移金属塩を溶解させ、更にスルホニル基を有する化合物を溶解させる場合と、遷移金属イオンとイミドアニオンからなる金属錯体をあらかじめ溶解させ、更にスルホニル基を有する化合物を溶解させる場合の二つの方法により作製される。 The electrolytic solution in the present invention is a compound in which an imide compound and a transition metal salt are dissolved, and a compound having a sulfonyl group is further dissolved, and a metal complex composed of a transition metal ion and an imide anion is dissolved in advance, and further a compound having a sulfonyl group It is prepared by two methods for dissolving the lysate.
前者は、イミド化合物と遷移金属塩とが充放電過程を経て負極上で金属錯体を形成するものである。 In the former, an imide compound and a transition metal salt form a metal complex on the negative electrode through a charge / discharge process.
後者は金属錯体をあらかじめ合成し、これを電解液に溶解することで負極上に吸着させるものである。 In the latter, a metal complex is synthesized in advance and dissolved in an electrolytic solution to be adsorbed on the negative electrode.
このイミドアニオンを含んだ金属錯体は電解液中で負極表面上に吸着することによって、充電時に均一な電場を整え、平滑でスムーズなリチウム吸蔵又は析出過程を与える。特に、リチウム金属を用いた場合、負極上に生成する皮膜は化学的、物理的に強固かつ低抵抗なものとなる。 The metal complex containing the imide anion adsorbs on the surface of the negative electrode in the electrolytic solution, thereby preparing a uniform electric field during charging and providing a smooth and smooth lithium occlusion or precipitation process. In particular, when lithium metal is used, the film formed on the negative electrode is chemically and physically strong and has low resistance.
表面膜の成分は、一部析出した遷移金属と、リチウムとイミドアニオンに含まれるフッ素の反応により生成したフッ化リチウムである。析出した遷移金属はリチウムと合金を形成することで安定化し、フッ化リチウムは化学的、物理的に安定な化合物である。 A component of the surface film is a transition metal partially deposited and lithium fluoride generated by a reaction between lithium and fluorine contained in the imide anion. The deposited transition metal is stabilized by forming an alloy with lithium, and lithium fluoride is a chemically and physically stable compound.
イミド化合物と遷移金属塩を溶解させ、更にスルホニル基を有する化合物を溶解させる場合、電解液に含まれるイミド化合物や遷移金属塩は、特に限定されないが好ましくは電界液全体に対して、0.005〜10wt%である。0.005wt%未満では、電極表面全体に添加剤の効果が行き渡らず、また10Wt%を越えると電解液の粘性が増大するために液抵抗が大きくなるためである。 When the imide compound and the transition metal salt are dissolved, and the compound having a sulfonyl group is further dissolved, the imide compound and the transition metal salt contained in the electrolytic solution are not particularly limited, but preferably 0.005 with respect to the entire electrolysis solution. -10 wt%. If it is less than 0.005 wt%, the effect of the additive does not spread over the entire electrode surface, and if it exceeds 10 Wt%, the viscosity of the electrolyte increases and the liquid resistance increases.
この時、電解液全体に含まれるスルホニル基を有する化合物は0.01〜10wt%が好ましい。0.01wt%未満では、電極表面全体に添加剤の効果が行き渡らず、また10Wt%を越えると電解液の粘性が増大するために液抵抗が大きくなるためである。 At this time, 0.01-10 wt% of the compound which has a sulfonyl group contained in the whole electrolyte solution is preferable. If it is less than 0.01 wt%, the effect of the additive does not spread over the entire electrode surface, and if it exceeds 10 Wt%, the viscosity of the electrolytic solution increases and the liquid resistance increases.
遷移金属イオンとイミドアニオンからなる金属錯体をあらかじめ溶解させ、更にスルホニル基を有する化合物を溶解させる場合電解液に含まれる金属錯体は、特に限定されないが好ましくは電界液全体に対して、0.005〜10wt%が好ましい。0.005wt%未満では、電極表面全体に添加剤の効果が行き渡らず、また10Wt%を越えると電解液の粘性が増大するために液抵抗が大きくなるためである。この時、電解液全体に含まれるスルホン化合物は0.01〜10wt%が好ましい。0.01wt%未満では、電極表面全体に添加剤の効果が行き渡らず、また10wt%を越えると電解液の粘性が増大するために液抵抗が大きくなるためである。 In the case where a metal complex composed of a transition metal ion and an imide anion is dissolved in advance and a compound having a sulfonyl group is further dissolved, the metal complex contained in the electrolytic solution is not particularly limited, but is preferably 0.005 with respect to the entire electrolysis solution. -10 wt% is preferable. If it is less than 0.005 wt%, the effect of the additive does not spread over the entire electrode surface, and if it exceeds 10 Wt%, the viscosity of the electrolyte increases and the liquid resistance increases. At this time, the sulfone compound contained in the entire electrolyte is preferably 0.01 to 10 wt%. If the amount is less than 0.01 wt%, the effect of the additive does not spread over the entire electrode surface. If the amount exceeds 10 wt%, the viscosity of the electrolyte increases and the liquid resistance increases.
遷移金属としては、ランタノイド系遷移金属が好ましく、ユウロピウム(Eu)、ネオジウム(Nd)、エルビウム(Er)、ホルミウム(Ho)のいずれかもしくは混合物が好ましい。これは、Eu、Nd、Er、Hoの酸化還元電位が黒鉛、合金、リチウム金属のそれと同じもしくは近く、リチウムよりも0〜0.8V高い電位で還元可能であることによる。 As the transition metal, a lanthanoid transition metal is preferable, and any of europium (Eu), neodymium (Nd), erbium (Er), and holmium (Ho) or a mixture thereof is preferable. This is because the redox potential of Eu, Nd, Er, and Ho is the same as or close to that of graphite, alloy, and lithium metal, and can be reduced at a potential 0 to 0.8 V higher than lithium.
このように負極活物質の酸化還元電位と近い金属を選択し、これらと安定な錯体を形成するアニオンを選ぶことにより、これらの金属が容易に還元されなくなる。従って、本発明で示したランタノイド系金属イオンとイミドアニオンからなる錯体は、負極と電解液の界面により安定に存在することができる。 Thus, by selecting a metal close to the redox potential of the negative electrode active material and selecting an anion that forms a stable complex with them, these metals are not easily reduced. Therefore, the complex composed of the lanthanoid metal ion and the imide anion shown in the present invention can exist stably at the interface between the negative electrode and the electrolytic solution.
イミドアニオンとしては、-N(CnF2n+1SO2)(CmF2m+1SO2)(n、mは自然数)が好ましく、特に、アルミ腐食抑制の点からパーフルオロエチルスルホニルイミドアニオン[-N(C2F5SO2)2]が好ましい。 The imide anion, - N (C n F 2n + 1 SO 2) (C m F 2m + 1 SO 2) (n, m is a natural number) are preferable, particularly, perfluoro ethyl imide terms of aluminum corrosion inhibition anion [- N (C 2 F 5 SO 2) 2] is preferred.
さらに、皮膜が機械的に壊れた際には、その壊れた箇所において、負極表面のリチウムと負極表面に吸着した上記イミドアニオンとの反応生成物であるフッ化リチウムが、皮膜を修復する機能を有しており、皮膜が破壊された後においても、安定な表面化合物の生成を導く効果を有している。 Furthermore, when the film is mechanically broken, lithium fluoride, which is a reaction product of lithium on the negative electrode surface and the imide anion adsorbed on the negative electrode surface, has a function of repairing the film. And has the effect of leading to the formation of a stable surface compound even after the coating is destroyed.
本発明に係る負極は、上述のように、リチウム金属、リチウム合金又は炭素材料や酸化物等のリチウムを吸蔵・放出できる材料により構成されている。 As described above, the negative electrode according to the present invention is made of a lithium metal, a lithium alloy, or a material that can occlude and release lithium, such as a carbon material or an oxide.
この炭素材料としては、リチウムを吸蔵する黒鉛、非晶質炭素、ダイヤモンド状炭素、カーボンナノチューブなど、あるいはこれらの複合物を用いることができる。本発明では黒鉛が用いられる。 As this carbon material, graphite which occludes lithium, amorphous carbon, diamond-like carbon, carbon nanotube, or a composite thereof can be used. In the present invention, graphite is used.
また、酸化物としては、酸化シリコン、酸化スズ、酸化インジウム、酸化亜鉛、酸化リチウム、リン酸、ホウ酸のいずれか、あるいはこれらの複合物を用いてもよく、特に酸化シリコンを含むことが好ましい。構造としてはアモルファス状態であることが好ましい。これは、酸化シリコンが安定で他の化合物との反応を引き起こさないため、またアモルファス構造が結晶粒界、欠陥といった不均一性に起因する劣化を導かないためである。成膜方法としては、蒸着法、CVD法、スパッタリング法などの方法を用いることができる。 Further, as the oxide, any of silicon oxide, tin oxide, indium oxide, zinc oxide, lithium oxide, phosphoric acid, boric acid, or a composite thereof may be used, and it is particularly preferable to include silicon oxide. . The structure is preferably in an amorphous state. This is because silicon oxide is stable and does not cause a reaction with other compounds, and the amorphous structure does not lead to deterioration due to nonuniformity such as crystal grain boundaries and defects. As a film forming method, a vapor deposition method, a CVD method, a sputtering method, or the like can be used.
リチウム合金とは、リチウム及びリチウムと合金形成可能な金属により構成される。例えば、Al、Si、Pb、Sn、In、Bi、Ag、Ba、Ca、Hg、Pd、Pt、Te、Zn、Laなどの金属とリチウムとの2元又は3元以上の合金により構成される。リチウム金属あるいはリチウム合金としては、特にアモルファス状のものが好ましい。これは、アモルファス構造により結晶粒界、欠陥といった不均一性に起因する劣化が起きにくいためである。かかる観点から、リチウム合金として、SiとLiの合金が好ましく用いられる。 The lithium alloy is composed of lithium and a metal capable of forming an alloy with lithium. For example, it is composed of a binary or ternary alloy of metal such as Al, Si, Pb, Sn, In, Bi, Ag, Ba, Ca, Hg, Pd, Pt, Te, Zn, La and lithium. . The lithium metal or lithium alloy is particularly preferably amorphous. This is because the amorphous structure hardly causes deterioration due to non-uniformity such as crystal grain boundaries and defects. From this viewpoint, an alloy of Si and Li is preferably used as the lithium alloy.
リチウム金属又はリチウム合金は、融液冷却方式、液体急冷方式、アトマイズ方式、真空蒸着方式、スパッタリング方式、プラズマCVD方式、光CVD方式、熱CVD方式、ゾルーゲル方式などの適宜な方式で形成することができる。 Lithium metal or lithium alloy can be formed by an appropriate method such as a melt cooling method, a liquid quenching method, an atomizing method, a vacuum deposition method, a sputtering method, a plasma CVD method, a photo CVD method, a thermal CVD method, a sol-gel method, or the like. it can.
本発明に係る負極は、遷移金属イオンとイミドアニオンからなる錯体を電解質溶液との界面に存在させることによって、金属、合金相の体積変化に対する柔軟性、イオン分布の均一性、物理的・化学的安定性に優れたものとなる。その結果、デンドライト生成やリチウムの微粉化を効果的に防止することができ、サイクル効率と寿命が向上する。 The negative electrode according to the present invention has a complex consisting of a transition metal ion and an imide anion at the interface with the electrolyte solution, thereby allowing flexibility in changing the volume of the metal and alloy phases, uniformity of ion distribution, physical and chemical properties. It is excellent in stability. As a result, dendrite formation and lithium atomization can be effectively prevented, and cycle efficiency and life are improved.
また、炭素材料、酸化物材料の表面に存在するダングリングボンドは、化学的活性が高く、容易に溶媒が分解してしまう。この表面に、遷移金属イオンとイミドアニオンからなる錯体を吸着させることによって、溶媒の分解が抑制され、不可逆容量が大きく減少されるため、充放電効率が減少しない。 In addition, dangling bonds existing on the surfaces of carbon materials and oxide materials have high chemical activity, and the solvent is easily decomposed. By adsorbing a complex composed of a transition metal ion and an imide anion on this surface, the decomposition of the solvent is suppressed and the irreversible capacity is greatly reduced, so the charge / discharge efficiency does not decrease.
本発明において、正極活物質としては、例えば、LiCoO2、LiNiO2、LiMn2O4などのリチウム含有複合酸化物があげられ、これらのリチウム含有複合酸化物の遷移金属部分を他元素で置換したものでもよい。 In the present invention, examples of the positive electrode active material include lithium-containing composite oxides such as LiCoO 2 , LiNiO 2 , and LiMn 2 O 4, and the transition metal portion of these lithium-containing composite oxides is substituted with other elements. It may be a thing.
また、金属リチウム対極電位で4.5V以上にプラトーを有するリチウム含有複合酸化物を用いることもできる。リチウム含有複合酸化物としては、スピネル型リチウムマンガン複合酸化物、オリビン型リチウム含有複合酸化物、逆スピネル型リチウム含有複合酸化物等が例示される。リチウム含有複合酸化物は、例えば下記一般式(I)で表される化合物とすることができる。
Lia(MxMn2-x)O4 (I)
(式中、0<x<2、0<a<1.2である。Mは、Ni、Co、Fe、Cr及びCuよりなる群から選ばれる少なくとも一種である。)
Alternatively, a lithium-containing composite oxide having a plateau at 4.5 V or more at the metal lithium counter electrode potential can be used. Examples of the lithium-containing composite oxide include spinel-type lithium manganese composite oxide, olivine-type lithium-containing composite oxide, and reverse spinel-type lithium-containing composite oxide. The lithium-containing composite oxide can be, for example, a compound represented by the following general formula (I).
Li a (M x Mn 2-x ) O 4 (I)
(In the formula, 0 <x <2, 0 <a <1.2. M is at least one selected from the group consisting of Ni, Co, Fe, Cr, and Cu.)
本発明における正極は、これらの活物質を、カーボンブラック等の導電性物質、ポリビニリデンフルオライド(PVDF)等の結着剤とともにN−メチル−2−ピロリドン(NMP)等の溶剤中に分散混練し、これをアルミニウム箔等の基体上に塗布することにより得ることができる。 In the positive electrode according to the present invention, these active materials are dispersed and kneaded in a solvent such as N-methyl-2-pyrrolidone (NMP) together with a conductive material such as carbon black and a binder such as polyvinylidene fluoride (PVDF). It can be obtained by applying it on a substrate such as an aluminum foil.
本発明に係るリチウム二次電池は、乾燥空気又は不活性ガス雰囲気において、負極及び正極を、セパレータを介して積層し、あるいは積層したものを捲回した後に、電池缶に収容したり、合成樹脂と金属箔との積層体からなる可とう性フィルム等によって封口することによって電池を製造することができる。 The lithium secondary battery according to the present invention comprises a negative electrode and a positive electrode laminated in a dry air or inert gas atmosphere via a separator, or wound in a battery can after being laminated, or a synthetic resin A battery can be manufactured by sealing with a flexible film made of a laminate of metal foil and metal foil.
なお、セパレータとしては、ポリプロピレン、ポリエチレン等のポリオレフィン、フッ素樹脂等の多孔性フィルムが用いられる。 In addition, as a separator, porous films, such as polyolefin, such as a polypropylene and polyethylene, a fluororesin, are used.
本発明に係る二次電池の形状としては、特に制限はないが、例えば、円筒型、角型、コイン型などがあげられる。 The shape of the secondary battery according to the present invention is not particularly limited, and examples thereof include a cylindrical shape, a square shape, and a coin shape.
以下、実施例により本発明を説明する。 Hereinafter, the present invention will be described by way of examples.
(実施例1)
(電池の作製)
正極は正極集電体として厚み20μmのアルミニウム箔を用い、正極活物質としてLiMn2O4を用いた。負極として負極集電体としての厚み10μmの銅箔上に負極活物質として黒鉛上にSiとLiからなる合金層(厚さ2μm)を真空成膜させたもの(Si/Li比 1/4.4。以下、黒鉛/Si:Liと略記)を用いた。また、電解質溶液は、溶媒としてECとDECの混合溶媒(体積比:30/70)を用い、電解質塩としてLiN(C2F5SO2)2(以下、LiBETI)を1molL-1溶解し、次で添加剤として、電解液中に0.3wt%含まれるようにCF3SO3 -を有するEu3+の塩を融解し、さらに、1,3−プロパンスルトン(以下、1,3−PSと略記)を電解液中に1wt%含ませた。そして、負極と正極とをポリエチレンからなるセパレータを介して積層し、本実施例の二次電池を作製した。
Example 1
(Production of battery)
As the positive electrode, an aluminum foil having a thickness of 20 μm was used as the positive electrode current collector, and LiMn 2 O 4 was used as the positive electrode active material. An alloy layer (thickness: 2 μm) made of Si and Li on graphite as a negative electrode active material on a 10 μm thick copper foil as a negative electrode current collector as a negative electrode (Si / Li ratio 1/4. 4. Hereinafter, graphite / Si: Li) was used. Further, the electrolyte solution uses a mixed solvent of EC and DEC (volume ratio: 30/70) as a solvent, and dissolves 1 molL −1 of LiN (C 2 F 5 SO 2 ) 2 (hereinafter, LiBETI) as an electrolyte salt, Next, as an additive, a salt of Eu 3+ having CF 3 SO 3 − so as to be contained at 0.3 wt% in the electrolytic solution is melted, and 1,3-propane sultone (hereinafter referred to as 1,3-PS) is further melted. And 1 wt% in the electrolytic solution. And the negative electrode and the positive electrode were laminated | stacked through the separator which consists of polyethylene, and the secondary battery of a present Example was produced.
(充放電サイクル試験)
温度20℃において、充電レート0.05C、放電レート0.1C、充電終止電圧4.2V、放電終止電圧3.0V、リチウム金属負極の利用率(放電深度)33%とした。容量維持率(%)は300サイクル後の放電容量(mAh)を、10サイクル目の放電容量(mAh)で割った値である。サイクル試験で得られた結果を下記表1に示す。
(Charge / discharge cycle test)
At a temperature of 20 ° C., the charge rate was 0.05 C, the discharge rate was 0.1 C, the charge end voltage was 4.2 V, the discharge end voltage was 3.0 V, and the utilization factor (discharge depth) of the lithium metal negative electrode was 33%. The capacity retention rate (%) is a value obtained by dividing the discharge capacity (mAh) after 300 cycles by the discharge capacity (mAh) at the 10th cycle. The results obtained in the cycle test are shown in Table 1 below.
(比較例1)
CF3SO3 -を有するEu3+の塩を用いずに、実施例1と同様にして二次電池を作製し、実施例1と同様に電池の性能を評価した。結果を表1に示す。
(Comparative Example 1)
A secondary battery was produced in the same manner as in Example 1 without using a Eu 3+ salt having CF 3 SO 3 −, and the performance of the battery was evaluated in the same manner as in Example 1. The results are shown in Table 1.
(比較例2)
1,3−PSを用いずに、実施例1と同様にして二次電池を作製し、実施例1と同様に電池の性能を評価した。結果を表1に示す。
(Comparative Example 2)
A secondary battery was produced in the same manner as in Example 1 without using 1,3-PS, and the performance of the battery was evaluated in the same manner as in Example 1. The results are shown in Table 1.
実施例1に示した電池は、比較例1、2と比較して、サイクル試験後の容量維持率が向上していること、すなわちサイクル特性の改善している。 Compared with Comparative Examples 1 and 2, the battery shown in Example 1 has an improved capacity retention rate after the cycle test, that is, improved cycle characteristics.
(実施例2)
本実施例2は、実施例1がイミドアニオンと金属イオンを添加し、充放電により負極上に金属錯体の皮膜を形成せしめたのに対し、添加剤としてあらかじめ遷移金属錯体を加えることで、該錯体を負極表面に吸着させるものである。
(Example 2)
In Example 2, the imide anion and the metal ion were added in Example 1, and a metal complex film was formed on the negative electrode by charging and discharging, whereas the transition metal complex was added as an additive in advance. The complex is adsorbed on the negative electrode surface.
電解質塩としてLiPF6を用い、添加剤として金属錯体Eu[N(C2F5SO2)2]3を電解液全体に対し0.1wt%用いる他は、実施例1と同様にして二次電池を作製し、実施例1と同様に電池の性能を評価した。結果を表1に示す。 The secondary solution was the same as in Example 1 except that LiPF 6 was used as the electrolyte salt and 0.1 wt% of the metal complex Eu [N (C 2 F 5 SO 2 ) 2 ] 3 was used as the additive with respect to the total electrolyte. A battery was prepared and the performance of the battery was evaluated in the same manner as in Example 1. The results are shown in Table 1.
(比較例3)
金属錯体Eu[N(C2F5SO2)2]3を用いずに、実施例2と同様にして二次電池を作製し、実施例2と同様に電池の性能を評価した。結果を表1に示す。
(Comparative Example 3)
A secondary battery was produced in the same manner as in Example 2 without using the metal complex Eu [N (C 2 F 5 SO 2 ) 2 ] 3, and the performance of the battery was evaluated in the same manner as in Example 2. The results are shown in Table 1.
(比較例4)
1,3−PSを用いずに、実施例2と同様にして二次電池を作製し、実施例2と同様に電池の性能を評価した。結果を表1に示す。
(Comparative Example 4)
A secondary battery was produced in the same manner as in Example 2 without using 1,3-PS, and the performance of the battery was evaluated in the same manner as in Example 2. The results are shown in Table 1.
実施例2に示した電池は、比較例3、4と比較して、サイクル試験後の容量維持率が向上していること、すなわちサイクル特性の改善していることが確認された。 The battery shown in Example 2 was confirmed to have an improved capacity retention rate after the cycle test, that is, improved cycle characteristics, as compared with Comparative Examples 3 and 4.
(実施例3)
本実施例3では、実施例2において、添加剤としてさらにビニレンカーボネート(VC)を含有させた電解液を使用している。
(Example 3)
In Example 3, the electrolytic solution further containing vinylene carbonate (VC) as an additive in Example 2 is used.
添加剤としてさらにVCを電解液中に1wt%加える外は、実施例2と同様にして二次電池を作製し、実施例2と同様に電池の性能を評価した。結果を表1に示す。 A secondary battery was produced in the same manner as in Example 2 except that 1 wt% of VC was further added to the electrolyte as an additive, and the performance of the battery was evaluated in the same manner as in Example 2. The results are shown in Table 1.
実施例3に示した電池は、実施例2と比較して、サイクル試験後の容量維持率が更に向上していること、すなわち金属錯体とスルホン化合物が含まれる電解液にVCを更に添加することでサイクル特性がより改善していることが確認された。 In the battery shown in Example 3, the capacity retention rate after the cycle test is further improved as compared with Example 2, that is, VC is further added to the electrolytic solution containing the metal complex and the sulfone compound. Thus, it was confirmed that the cycle characteristics were further improved.
11 正極集電体
12 正極活物質を含有する層
13 負極活物質を含有する層
14 負極集電体
15 非水電解質溶液
16 多孔質セパレータ
11 Positive
Claims (6)
該負極を構成する負極活物質が、黒鉛/Si:Li(黒鉛上にSiとLiからなる合金層を成膜させたもの)であり、かつ、
電解液が、非プロトン性溶媒に少なくともイミドアニオン、遷移金属イオン及びスルホニル基を有する化合物を含んでおり、
該イミドアニオンが、 - N(C n F 2n+1 SO 2 )(C m F 2m+1 SO 2 )(n、mは自然数)であり、イミドアニオン又はその金属錯体として電解液中0.005〜10wt%含まれ、
該遷移金属が、ユウロピウム、ネオジウム、エルビウム、ホルミウムからなる群の中から選択され、かつ
該スルホニル基を有する化合物が、1,3−プロパンスルトン、1,4−ブタンスルトン、スルホラン、アルカンスルホン酸無水物、γ−スルトン化合物及びスルホレン化合物からなる群から選択された少なくとも一つであり、電解液中0.01〜10wt%含まれる
ことを特徴とする二次電池。 A secondary battery comprising at least a positive electrode and a negative electrode,
The negative electrode active material constituting the negative electrode is graphite / Si: Li (a film in which an alloy layer made of Si and Li is formed on graphite) , and
The electrolytic solution contains a compound having at least an imide anion, a transition metal ion, and a sulfonyl group in an aprotic solvent ,
The imide anion, - N (C n F 2n + 1 SO 2) (C m F 2m + 1 SO 2) (n, m are natural numbers), and the electrolytic solution 0.005 imide anion or metal complex thereof -10 wt% included,
The transition metal is selected from the group consisting of europium, neodymium, erbium, holmium, and
The compound having a sulfonyl group is at least one selected from the group consisting of 1,3-propane sultone, 1,4-butane sultone, sulfolane, alkane sulfonic acid anhydride, γ-sultone compound, and sulfolene compound. A secondary battery comprising 0.01 to 10 wt% in the liquid .
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010092390A JP5201166B2 (en) | 2010-04-13 | 2010-04-13 | Secondary battery |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010092390A JP5201166B2 (en) | 2010-04-13 | 2010-04-13 | Secondary battery |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002170228A Division JP4618399B2 (en) | 2002-06-11 | 2002-06-11 | Secondary battery electrolyte and secondary battery using the same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010182693A JP2010182693A (en) | 2010-08-19 |
| JP5201166B2 true JP5201166B2 (en) | 2013-06-05 |
Family
ID=42764074
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010092390A Expired - Lifetime JP5201166B2 (en) | 2010-04-13 | 2010-04-13 | Secondary battery |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5201166B2 (en) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5869784B2 (en) * | 2011-06-30 | 2016-02-24 | キヤノンアネルバ株式会社 | Method for producing metal oxide high dielectric epitaxial film and substrate processing apparatus |
| JP5861437B2 (en) * | 2011-12-15 | 2016-02-16 | 三洋電機株式会社 | Negative electrode for nonaqueous electrolyte secondary battery and method for producing the same |
| JP7599322B2 (en) * | 2020-12-09 | 2024-12-13 | Muアイオニックソリューションズ株式会社 | Electrolyte, surface treatment agent for electrochemical element electrodes, surface treatment method for electrochemical element electrodes, and manufacturing method for electrochemical element electrodes |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07296798A (en) * | 1994-04-22 | 1995-11-10 | Mitsubishi Cable Ind Ltd | Carbon negative electrode, and li secondary battery |
| JP3823683B2 (en) * | 1999-05-24 | 2006-09-20 | 宇部興産株式会社 | Nonaqueous electrolyte and lithium secondary battery using the same |
| JP4762411B2 (en) * | 2000-06-26 | 2011-08-31 | パナソニック株式会社 | Non-aqueous electrolyte for secondary battery and non-aqueous electrolyte secondary battery using the same |
| JP4843834B2 (en) * | 2000-07-17 | 2011-12-21 | パナソニック株式会社 | Nonaqueous electrolyte secondary battery |
| JP4288400B2 (en) * | 2001-11-15 | 2009-07-01 | 日本電気株式会社 | Method for producing secondary battery electrolyte, secondary battery electrolyte, secondary battery production method, and secondary battery |
-
2010
- 2010-04-13 JP JP2010092390A patent/JP5201166B2/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010182693A (en) | 2010-08-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4033074B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP5169400B2 (en) | Nonaqueous electrolyte and nonaqueous electrolyte secondary battery using the same | |
| JP4379567B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP4618399B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP5305446B2 (en) | Nonaqueous electrolyte and nonaqueous electrolyte secondary battery using the same | |
| JP4352719B2 (en) | ELECTROLYTE SOLUTION FOR LITHIUM ION SECONDARY BATTERY AND LITHIUM ION SECONDARY BATTERY USING THE SAME | |
| JP4465968B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP4433163B2 (en) | Electrolytic solution for lithium secondary battery and lithium secondary battery using the same | |
| JP5300054B2 (en) | Nonaqueous electrolyte and nonaqueous electrolyte secondary battery using the same | |
| JP4968614B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP4544408B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP4304570B2 (en) | Non-aqueous electrolyte and secondary battery using the same | |
| JP4701601B2 (en) | Electrolytic solution for lithium secondary battery and lithium secondary battery using the same | |
| JP4288400B2 (en) | Method for producing secondary battery electrolyte, secondary battery electrolyte, secondary battery production method, and secondary battery | |
| JP4909649B2 (en) | Nonaqueous electrolyte and nonaqueous electrolyte secondary battery using the same | |
| WO2014133169A1 (en) | Electrolyte solution for secondary batteries, and secondary battery using same | |
| JP2009016232A (en) | Nonaqueous electrolyte secondary battery | |
| JP6319092B2 (en) | Secondary battery | |
| JP4265169B2 (en) | Secondary battery electrolyte and secondary battery using the same | |
| JP5201166B2 (en) | Secondary battery | |
| JP4525018B2 (en) | Electrolytic solution for lithium secondary battery and lithium secondary battery using the same | |
| JP3963090B2 (en) | Secondary battery negative electrode, secondary battery electrolyte, and secondary battery using the same | |
| JP6086116B2 (en) | ELECTROLYTE SOLUTION FOR LITHIUM SECONDARY BATTERY AND LITHIUM SECONDARY BATTERY CONTAINING THE SAME | |
| KR20090106993A (en) | Non-aqueous electrolyte and non-aqueous electrolyte secondary battery using same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120911 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121109 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130115 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130128 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5201166 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160222 Year of fee payment: 3 |
|
| EXPY | Cancellation because of completion of term |