JP5191489B2 - 摂食行動を変更するデバイス及び方法 - Google Patents
摂食行動を変更するデバイス及び方法 Download PDFInfo
- Publication number
- JP5191489B2 JP5191489B2 JP2009525171A JP2009525171A JP5191489B2 JP 5191489 B2 JP5191489 B2 JP 5191489B2 JP 2009525171 A JP2009525171 A JP 2009525171A JP 2009525171 A JP2009525171 A JP 2009525171A JP 5191489 B2 JP5191489 B2 JP 5191489B2
- Authority
- JP
- Japan
- Prior art keywords
- tissue
- tether
- stomach
- sinus
- pyloric
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 230000004634 feeding behavior Effects 0.000 title claims description 6
- 238000000034 method Methods 0.000 title description 40
- 210000002784 stomach Anatomy 0.000 claims description 139
- 210000001198 duodenum Anatomy 0.000 claims description 103
- 210000001035 gastrointestinal tract Anatomy 0.000 abstract description 53
- 230000006870 function Effects 0.000 abstract description 21
- 230000020595 eating behavior Effects 0.000 abstract description 12
- 210000001519 tissue Anatomy 0.000 description 235
- 210000001187 pylorus Anatomy 0.000 description 127
- 230000002496 gastric effect Effects 0.000 description 47
- 210000003205 muscle Anatomy 0.000 description 41
- 239000000463 material Substances 0.000 description 40
- 229920001296 polysiloxane Polymers 0.000 description 34
- 241000282887 Suidae Species 0.000 description 31
- 235000013305 food Nutrition 0.000 description 28
- 210000004876 tela submucosa Anatomy 0.000 description 27
- 230000007246 mechanism Effects 0.000 description 25
- 230000033001 locomotion Effects 0.000 description 24
- 238000004873 anchoring Methods 0.000 description 20
- 238000013459 approach Methods 0.000 description 20
- 239000013543 active substance Substances 0.000 description 18
- 239000007943 implant Substances 0.000 description 18
- 239000003814 drug Substances 0.000 description 16
- 229940079593 drug Drugs 0.000 description 16
- 238000001356 surgical procedure Methods 0.000 description 16
- 230000000694 effects Effects 0.000 description 15
- 229910052751 metal Inorganic materials 0.000 description 15
- 239000002184 metal Substances 0.000 description 15
- 239000002253 acid Substances 0.000 description 14
- 230000003628 erosive effect Effects 0.000 description 14
- 230000005291 magnetic effect Effects 0.000 description 14
- 230000002183 duodenal effect Effects 0.000 description 13
- 210000004877 mucosa Anatomy 0.000 description 13
- 239000007787 solid Substances 0.000 description 13
- 210000005070 sphincter Anatomy 0.000 description 13
- 208000008589 Obesity Diseases 0.000 description 12
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 235000020824 obesity Nutrition 0.000 description 12
- 239000002245 particle Substances 0.000 description 12
- 108020003175 receptors Proteins 0.000 description 12
- 230000036186 satiety Effects 0.000 description 11
- 235000019627 satiety Nutrition 0.000 description 11
- 230000000638 stimulation Effects 0.000 description 11
- 201000010099 disease Diseases 0.000 description 10
- 238000002513 implantation Methods 0.000 description 10
- 206010036790 Productive cough Diseases 0.000 description 9
- 230000008901 benefit Effects 0.000 description 9
- 229920000642 polymer Polymers 0.000 description 9
- 208000024794 sputum Diseases 0.000 description 9
- 210000003802 sputum Anatomy 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 8
- 210000004400 mucous membrane Anatomy 0.000 description 8
- 230000002572 peristaltic effect Effects 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- 239000011701 zinc Substances 0.000 description 8
- 206010061218 Inflammation Diseases 0.000 description 7
- 208000012647 Pseudodiverticular disease Diseases 0.000 description 7
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 7
- 238000000576 coating method Methods 0.000 description 7
- 230000008602 contraction Effects 0.000 description 7
- 235000005911 diet Nutrition 0.000 description 7
- 230000037213 diet Effects 0.000 description 7
- 238000005553 drilling Methods 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 230000037406 food intake Effects 0.000 description 7
- 239000007789 gas Substances 0.000 description 7
- 230000004054 inflammatory process Effects 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 230000004580 weight loss Effects 0.000 description 7
- 229910052725 zinc Inorganic materials 0.000 description 7
- -1 CCK Chemical compound 0.000 description 6
- 206010013554 Diverticulum Diseases 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000011248 coating agent Substances 0.000 description 6
- 238000013016 damping Methods 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 230000029087 digestion Effects 0.000 description 6
- 239000013013 elastic material Substances 0.000 description 6
- 210000004211 gastric acid Anatomy 0.000 description 6
- 238000005303 weighing Methods 0.000 description 6
- 208000025865 Ulcer Diseases 0.000 description 5
- 229910045601 alloy Inorganic materials 0.000 description 5
- 239000000956 alloy Substances 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 235000012631 food intake Nutrition 0.000 description 5
- 230000030136 gastric emptying Effects 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 230000014759 maintenance of location Effects 0.000 description 5
- 230000005298 paramagnetic effect Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 230000002441 reversible effect Effects 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 4
- 239000004743 Polypropylene Substances 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 239000005556 hormone Substances 0.000 description 4
- 229940088597 hormone Drugs 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 150000002739 metals Chemical class 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000004899 motility Effects 0.000 description 4
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 description 4
- 229910001000 nickel titanium Inorganic materials 0.000 description 4
- 229920000728 polyester Polymers 0.000 description 4
- 229920001155 polypropylene Polymers 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 229920002379 silicone rubber Polymers 0.000 description 4
- 210000000813 small intestine Anatomy 0.000 description 4
- 231100000397 ulcer Toxicity 0.000 description 4
- 241000242722 Cestoda Species 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- 101800001586 Ghrelin Proteins 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 229910000831 Steel Inorganic materials 0.000 description 3
- 230000003213 activating effect Effects 0.000 description 3
- 210000000941 bile Anatomy 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 239000000919 ceramic Substances 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 235000005686 eating Nutrition 0.000 description 3
- 210000003238 esophagus Anatomy 0.000 description 3
- 239000003925 fat Substances 0.000 description 3
- 230000008713 feedback mechanism Effects 0.000 description 3
- 230000005176 gastrointestinal motility Effects 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 235000003642 hunger Nutrition 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 238000011068 loading method Methods 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- ORQBXQOJMQIAOY-UHFFFAOYSA-N nobelium Chemical compound [No] ORQBXQOJMQIAOY-UHFFFAOYSA-N 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 230000008855 peristalsis Effects 0.000 description 3
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 3
- 239000004810 polytetrafluoroethylene Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 239000004945 silicone rubber Substances 0.000 description 3
- 235000021127 solid diet Nutrition 0.000 description 3
- 230000003068 static effect Effects 0.000 description 3
- 239000010959 steel Substances 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- 235000019786 weight gain Nutrition 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- 102100033367 Appetite-regulating hormone Human genes 0.000 description 2
- 208000030814 Eating disease Diseases 0.000 description 2
- 208000019454 Feeding and Eating disease Diseases 0.000 description 2
- 102000009123 Fibrin Human genes 0.000 description 2
- 108010073385 Fibrin Proteins 0.000 description 2
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 206010021518 Impaired gastric emptying Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 206010054949 Metaplasia Diseases 0.000 description 2
- 208000008469 Peptic Ulcer Diseases 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920006362 Teflon® Polymers 0.000 description 2
- 108010003205 Vasoactive Intestinal Peptide Proteins 0.000 description 2
- 102400000015 Vasoactive intestinal peptide Human genes 0.000 description 2
- 238000004026 adhesive bonding Methods 0.000 description 2
- 235000019789 appetite Nutrition 0.000 description 2
- 230000036528 appetite Effects 0.000 description 2
- 235000021053 average weight gain Nutrition 0.000 description 2
- TZCXTZWJZNENPQ-UHFFFAOYSA-L barium sulfate Chemical compound [Ba+2].[O-]S([O-])(=O)=O TZCXTZWJZNENPQ-UHFFFAOYSA-L 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 238000005452 bending Methods 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 208000006766 bile reflux Diseases 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 235000021051 daily weight gain Nutrition 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 235000014632 disordered eating Nutrition 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 235000006694 eating habits Nutrition 0.000 description 2
- 238000002674 endoscopic surgery Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229950003499 fibrin Drugs 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 235000019525 fullness Nutrition 0.000 description 2
- 210000003736 gastrointestinal content Anatomy 0.000 description 2
- 210000005095 gastrointestinal system Anatomy 0.000 description 2
- GNKDKYIHGQKHHM-RJKLHVOGSA-N ghrelin Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)CN)COC(=O)CCCCCCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C1=CC=CC=C1 GNKDKYIHGQKHHM-RJKLHVOGSA-N 0.000 description 2
- 208000014617 hemorrhoid Diseases 0.000 description 2
- 230000003054 hormonal effect Effects 0.000 description 2
- 206010020718 hyperplasia Diseases 0.000 description 2
- 208000009322 hypertrophic pyloric stenosis Diseases 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 210000000936 intestine Anatomy 0.000 description 2
- VBUWHHLIZKOSMS-RIWXPGAOSA-N invicorp Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)C(C)C)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=C(O)C=C1 VBUWHHLIZKOSMS-RIWXPGAOSA-N 0.000 description 2
- 238000002357 laparoscopic surgery Methods 0.000 description 2
- 238000002350 laparotomy Methods 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 210000000111 lower esophageal sphincter Anatomy 0.000 description 2
- 230000015689 metaplastic ossification Effects 0.000 description 2
- 208000001022 morbid obesity Diseases 0.000 description 2
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 2
- 230000000149 penetrating effect Effects 0.000 description 2
- 208000011906 peptic ulcer disease Diseases 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000007779 soft material Substances 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000003356 suture material Substances 0.000 description 2
- 230000009747 swallowing Effects 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- DBGIVFWFUFKIQN-VIFPVBQESA-N (+)-Fenfluramine Chemical compound CCN[C@@H](C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-VIFPVBQESA-N 0.000 description 1
- ALVZYHNBPIMLFM-UHFFFAOYSA-N 2-[4-[2-(4-carbamimidoylphenoxy)ethoxy]phenyl]-1h-indole-6-carboximidamide;dihydrochloride Chemical compound Cl.Cl.C1=CC(C(=N)N)=CC=C1OCCOC1=CC=C(C=2NC3=CC(=CC=C3C=2)C(N)=N)C=C1 ALVZYHNBPIMLFM-UHFFFAOYSA-N 0.000 description 1
- LVRVABPNVHYXRT-BQWXUCBYSA-N 52906-92-0 Chemical compound C([C@H](N)C(=O)N[C@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O)C(C)C)C1=CC=CC=C1 LVRVABPNVHYXRT-BQWXUCBYSA-N 0.000 description 1
- OJSXICLEROKMBP-FFUDWAICSA-N 869705-22-6 Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(N)=O)C(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 OJSXICLEROKMBP-FFUDWAICSA-N 0.000 description 1
- 244000226021 Anacardium occidentale Species 0.000 description 1
- 206010002650 Anorexia nervosa and bulimia Diseases 0.000 description 1
- YNXLOPYTAAFMTN-SBUIBGKBSA-N C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 Chemical compound C([C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)C1=CC=C(O)C=C1 YNXLOPYTAAFMTN-SBUIBGKBSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 208000008279 Dumping Syndrome Diseases 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 102400000321 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 241000167880 Hirundinidae Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020710 Hyperphagia Diseases 0.000 description 1
- 206010062717 Increased upper airway secretion Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 108010092277 Leptin Proteins 0.000 description 1
- 102000016267 Leptin Human genes 0.000 description 1
- URLZCHNOLZSCCA-VABKMULXSA-N Leu-enkephalin Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1 URLZCHNOLZSCCA-VABKMULXSA-N 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 206010025476 Malabsorption Diseases 0.000 description 1
- 208000004155 Malabsorption Syndromes Diseases 0.000 description 1
- 101710151321 Melanostatin Proteins 0.000 description 1
- 102000002419 Motilin Human genes 0.000 description 1
- 101800002372 Motilin Proteins 0.000 description 1
- 241000238367 Mya arenaria Species 0.000 description 1
- 206010060860 Neurological symptom Diseases 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 102400000441 Obestatin Human genes 0.000 description 1
- 101800000590 Obestatin Proteins 0.000 description 1
- 208000007542 Paresis Diseases 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102100029909 Peptide YY Human genes 0.000 description 1
- 108010088847 Peptide YY Proteins 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 208000032395 Post gastric surgery syndrome Diseases 0.000 description 1
- 201000000660 Pyloric Stenosis Diseases 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000007488 abnormal function Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 239000000883 anti-obesity agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 210000000436 anus Anatomy 0.000 description 1
- 238000007681 bariatric surgery Methods 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- 230000032770 biofilm formation Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000001045 blue dye Substances 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 235000020226 cashew nut Nutrition 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000005786 degenerative changes Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 229960004597 dexfenfluramine Drugs 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 102000038379 digestive enzymes Human genes 0.000 description 1
- 108091007734 digestive enzymes Proteins 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 206010060865 duodenogastric reflux Diseases 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 238000004070 electrodeposition Methods 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 238000001839 endoscopy Methods 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000030135 gastric motility Effects 0.000 description 1
- 210000001156 gastric mucosa Anatomy 0.000 description 1
- 208000008386 gastric outlet obstruction Diseases 0.000 description 1
- 238000011902 gastrointestinal surgery Methods 0.000 description 1
- 208000001288 gastroparesis Diseases 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 210000000514 hepatopancreas Anatomy 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000012966 insertion method Methods 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 229940039781 leptin Drugs 0.000 description 1
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 238000003754 machining Methods 0.000 description 1
- 239000000696 magnetic material Substances 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 210000000412 mechanoreceptor Anatomy 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229920002529 medical grade silicone Polymers 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000002324 minimally invasive surgery Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 239000002991 molded plastic Substances 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- 230000002969 morbid Effects 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- 230000004118 muscle contraction Effects 0.000 description 1
- 108091008709 muscle spindles Proteins 0.000 description 1
- 230000003387 muscular Effects 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 230000003957 neurotransmitter release Effects 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 235000012149 noodles Nutrition 0.000 description 1
- URPYMXQQVHTUDU-OFGSCBOVSA-N nucleopeptide y Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 URPYMXQQVHTUDU-OFGSCBOVSA-N 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 235000014571 nuts Nutrition 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 description 1
- 229960001243 orlistat Drugs 0.000 description 1
- 235000020830 overeating Nutrition 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 208000026435 phlegm Diseases 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000009958 sewing Methods 0.000 description 1
- 229960004425 sibutramine Drugs 0.000 description 1
- UNAANXDKBXWMLN-UHFFFAOYSA-N sibutramine Chemical compound C=1C=C(Cl)C=CC=1C1(C(N(C)C)CC(C)C)CCC1 UNAANXDKBXWMLN-UHFFFAOYSA-N 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 235000021055 solid food Nutrition 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 239000003106 tissue adhesive Substances 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 238000007514 turning Methods 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 210000003934 vacuole Anatomy 0.000 description 1
- 210000001186 vagus nerve Anatomy 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 239000002351 wastewater Substances 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
- 230000037303 wrinkles Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F5/00—Orthopaedic methods or devices for non-surgical treatment of bones or joints; Nursing devices; Anti-rape devices
- A61F5/0003—Apparatus for the treatment of obesity; Anti-eating devices
- A61F5/0013—Implantable devices or invasive measures
- A61F5/0036—Intragastrical devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/24—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body
- A61F2/2476—Valves implantable in the body not otherwise provided for
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F5/00—Orthopaedic methods or devices for non-surgical treatment of bones or joints; Nursing devices; Anti-rape devices
- A61F5/0003—Apparatus for the treatment of obesity; Anti-eating devices
- A61F5/0013—Implantable devices or invasive measures
- A61F5/0076—Implantable devices or invasive measures preventing normal digestion, e.g. Bariatric or gastric sleeves
- A61F5/0079—Pyloric or esophageal obstructions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/04—Surgical instruments, devices or methods, e.g. tourniquets for suturing wounds; Holders or packages for needles or suture materials
- A61B17/0401—Suture anchors, buttons or pledgets, i.e. means for attaching sutures to bone, cartilage or soft tissue; Instruments for applying or removing suture anchors
- A61B2017/0409—Instruments for applying suture anchors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/04—Surgical instruments, devices or methods, e.g. tourniquets for suturing wounds; Holders or packages for needles or suture materials
- A61B17/0401—Suture anchors, buttons or pledgets, i.e. means for attaching sutures to bone, cartilage or soft tissue; Instruments for applying or removing suture anchors
- A61B2017/0417—T-fasteners
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/064—Surgical staples, i.e. penetrating the tissue
- A61B2017/0649—Coils or spirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/30—Surgical pincettes without pivotal connections
- A61B2017/306—Surgical pincettes without pivotal connections holding by means of suction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/24—Heart valves ; Vascular valves, e.g. venous valves; Heart implants, e.g. passive devices for improving the function of the native valve or the heart muscle; Transmyocardial revascularisation [TMR] devices; Valves implantable in the body
Landscapes
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Cardiology (AREA)
- Obesity (AREA)
- Child & Adolescent Psychology (AREA)
- Nursing (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Surgical Instruments (AREA)
- Prostheses (AREA)
- Percussion Or Vibration Massage (AREA)
Description
を具える、対象の摂食行動を変更するシステムを提供する。
Zn → Zn2++2e−
2H++2e− → H2
上述の説明とともに、非限定的に本発明を説明する以下の例を参照する。
幽門に取り付けたデバイスの固定
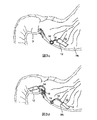
デバイス100は、様々な技術を用いて幽門に挿入することができる。例えば、図7aを参照すると、図5bに記載されているデバイス100を、内視鏡の端部において、開いた底部122を有するチューブ120に送達することができる。このチューブでデバイス100の本体102がばね124に対して装填される。ばね124は、そのままでは下側にへこんでいるが、チューブ120と保持ループ126を通る封入されたチャネルを介してピン128によって上側に突出するように保持される。チューブ120(チューブ120内に退避しており、周辺組織にダメージを与えないようになっているアンカ108を具える)が幽門Pの狭い頂部に配置され、ピン128を引っ張って保持ループ126を開放する。このループは、一方で、本体102とばね124をへこんだ下側位置に開放する。この位置でアンカに力が加わって、幽門組織と幽門Pのアンカデバイス100にかみ合う(図7b)。チューブ120は、デバイス10を固定したまま退避して、幽門内に位置する(図7c)。同じ技術を用いて、下側食道括約筋などその他の消化管組織領域にデバイスを固定することができる。
本発明の豚へのインプラント
Shosh7−10のマークを付けた、約3乃至4月齢、体重60−70kgの4匹のメスの豚を選んで、シリコーンでできた構成が異なる4つの本発明のデバイスをインプラントした。図10a−dは、4匹の豚にインプラントした本発明の4つのデバイスの構成を示す。この図に示す各デバイスは、豚の洞組織に固定して、ここに示す固定位置決めを行った。従って、図10aは、長さ40mm、直径1cmの筒状デバイス本体でできた第1の豚へのインプラント(この研究ではShosh 7)を示しており、このインプラントは、固定位置決め具と、デバイス本体が十二指腸に移動できる長さを有するテザーを用いて洞内に固定した。図10bは、デバイス本体の第2の豚(この研究ではShosh 8)における同様の位置決めを示す図であり、この本体は、固定位置決め具と、デバイス本体が十二指腸に移動できる長さを有するテザーを伴う複数のブラシ状突起を具える。図10cは、第3の豚(この研究ではShosh 9)における、二つのデバイス本体の洞における位置決めを示す。これらの本体は、固定位置決め具とデバイス本体が洞に移動できる長さを有するテザーを伴う複数のブラシ状突起を具える。一方、図10dは、第4の豚(この研究ではShosh 8)における、長さ100mmのデバイス本体の洞−十二指腸(幽門を超えて)における位置決めを示す。これらの本体は、固定位置決め具と、デバイス本体と、デバイス本体が洞から十二指腸までに移動できる長さを有するテザーを伴う複数のブラシ状突起を具える。
固形食餌トライアルに入る前に、4匹の豚に手術後4日の回復期間を与えた。飼育された豚に与える食餌と同じ、ペレット形状の市販の固形食餌(Amber, Israel)をこれらの豚に与えた。
(i)豚に、初回6:00と2回目14:00の一日2回給餌した。
(ii)各食餌において、各豚は2kg給餌され、この量は、1回のセッションの豚の摂食キャパシティを越えるものである。従って、実際の摂食量は、豚の食欲によってのみ制限される。
(iii)時間ゼロ(2kgの食餌を豚に与える)から始まり、10分、20分、30分、45分、60分に、消費された食餌量を測定し、記録した。
(iv)日ゼロから始まり、トライアルに参加した4匹の豚の各々体重を、1週間に2回測定した。
(v)トライアルの21日目に、各豚に内視鏡手術を行って、固定部位からデバイスを放出させ、口を通って豚の胃から内視鏡的に取り出した。
(vi)デバイスが豚の消化管システムにもはや存在しない研究の22−33日間に、研究を行った0−21日間に用いた同じ食餌プロトコルを用いた。
(vii)34日目に、4匹の豚を犠牲死させて、研究を終えた。
生きた豚の胃経由洞固定胃デバイスインプランテーション
生きた豚の幽門固定胃デバイスインプランテーション
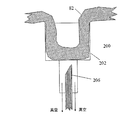
図21a−c及び図22aに記載の送達装置を用いて、本発明の摂食行動改変デバイスを、麻酔をかけた40kgのメス豚の幽門括約筋に固定した。図21a−cに符号200で示す送達装置は、一またはそれ以上の作業チャネル62と、好ましくはカメラ72及び/又は別の内視鏡作業チャネルから出て後方に曲げることができる(〜180°)カメラを有する内視鏡60(遠位先端のみを示す)を具えている。装置200は、固定エレメント13を搬送し、消化管壁組織または括約筋組織を通して送達するよう機能する送達デバイス64(図21a−cにおける針)を具える。送達デバイス64が展開して、作業チャネル62を通って作用する。送達デバイス64は、内視鏡の作業チャネルに引っ込んだとき、内視鏡の作業チップが曲がることを実質的に防止しないように構成することができる。これは、フレキシブルな押し棒にとりつけた短針(例えば10mm)を用いることによって、あるいは、針をニチノールなどの弾性合金で作ることによって達成できる。装置200は更に、内視鏡60の遠位端に装着可能な選択的アラインメントヘッド74を具えている。
固定アプローチ
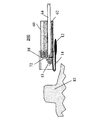
図25a−cは、コイルアンカ内のスクリュを介した本発明のデバイスの組織内固定を示す。この場合、アンカエレメント13は、スプリングコイルあるいは柔組織スクリュ、あるいは金属またはポリマでできており、テザー14またはデバイス本体12に取り付けたオーガである。カップ88は、アンカエレメント13の鋭くとがった先から組織を保護し、真空カップとして作用して、真空手段を用いて組織82に内視鏡60の先端を固定するのに用いることができる。図25aは、組織82の固定位置にアプローチしている装置200を示す。図25bは、組織82に接触しているカップ88と、組織82内へネジ入れたアンカエレメント53を有する送達デバイス64を示す。図25cは、アンカエレメント53から取り外して、内視鏡60の作業チャネル62へ引き戻した送達デバイス64を示す。デバイス10(アンカエレメント13、テザー14及びデバイス本体12からできている)は、ここでは、組織82に固定されている。固定エレメント13も、内視鏡60の作業チャネル62内に完全にフィットするサイズであり、カップ88は必要ない。デバイス10は、テザー14を切ることあるいは、上述と逆の内視鏡手順を用いてアンカエレメント13を外すことによって取り外すことができる。アンカエレメント13は、PLA、PGA、などからできており、時間がたつとテザー14を、おそらくいくらかの突出部またはその他の固定特性付きで、固定テザー14と、従って組織82内にデバイス10を残して、生物分解するように設計されている。
生きた豚の洞固定胃デバイスのインプラント
約2−3月齢、体重45−50kgの3匹の雌豚を選んで、図23a−cに示すデバイスのインプラントした。豚に麻酔をかけて、洞組織にデバイス10をインプラントするのに使用したオリンパスGIF 2T100二重チャネル胃カメラに上述した装置200を取り付けた。穴あけエレメント206は、長さ3.5cmの18ゲージ針である。アンカエレメント13は、25mmの00Etibond(商標)ポリエステルブレード縫合糸にとりつけた、長さ6mmの21ゲージ皮下注射チューブでできたt−アンカであった。この糸は、t−アンカの中央にあけたホールを通って延びており、側部の一つから出て、ボールに熱成型されており、t−アンカチューブの開口端から戻らない。他端をブレード縫合糸材をより小さなt−アンカに同様に取り付けた。このアンカは、長さ2.5cm直径1cmのシリコーン魚雷型デバイスに取り付けた、長さ6cm、直径1.5mmのシリコーン弾性テザーに重層成型(over-molded)した。
豚における本発明のデバイスのインプラント
約3月齢、体重42−46kgの三匹の豚(295、296、299)を選択して、本発明の二つの異なるバージョンをインプラントした。デバイスをインプラントする前に、各豚に麻酔をかけた。
2週間の実験の間、この実験に用いた3匹の豚に関連してなんら問題も副作用も生じなかった。図26には、豚#295(ワッシャなしのt−バー固定)のアンカと取り付けたデバイスを示す。3つのデバイス全てが固定されて残り、2週間の実験を通してインプラント部位に浸食または炎症の兆候は見られなかった。
Claims (3)
- 対象の摂食行動を変更するデバイスにおいて、幽門開口部に届く十分な長さを持つテザーを介して胃の組織に取り付け可能なデバイス本体を具え、前記胃の組織から外したときに、当該デバイス本体が、前記幽門開口部を完全に通過するようなサイズと構造であることを特徴とするデバイス。
- 請求項1に記載のデバイスにおいて、前記テザーの少なくとも一部の長さが、少なくとも25%、可逆的にのびることを特徴とするデバイス。
- 請求項1に記載のデバイスにおいて、前記デバイス本体の少なくとも一部が、前記胃の組織に取り付けられたときに、胃と十二指腸との間で移動可能であることを特徴とするデバイス。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US83941306P | 2006-08-23 | 2006-08-23 | |
| US60/839,413 | 2006-08-23 | ||
| US86080606P | 2006-11-24 | 2006-11-24 | |
| US60/860,806 | 2006-11-24 | ||
| US92486707P | 2007-06-04 | 2007-06-04 | |
| US60/924,867 | 2007-06-04 | ||
| PCT/IL2007/001047 WO2008023374A2 (en) | 2006-08-23 | 2007-08-22 | Devices and methods for altering eating behavior |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010501242A JP2010501242A (ja) | 2010-01-21 |
| JP2010501242A5 JP2010501242A5 (ja) | 2010-10-14 |
| JP5191489B2 true JP5191489B2 (ja) | 2013-05-08 |
Family
ID=39107209
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009525171A Expired - Fee Related JP5191489B2 (ja) | 2006-08-23 | 2007-08-22 | 摂食行動を変更するデバイス及び方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (3) | US8142513B2 (ja) |
| EP (1) | EP2056741A2 (ja) |
| JP (1) | JP5191489B2 (ja) |
| AU (1) | AU2007287201B2 (ja) |
| CA (1) | CA2661191C (ja) |
| WO (1) | WO2008023374A2 (ja) |
Families Citing this family (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3028734A1 (en) | 2004-10-15 | 2016-06-08 | Bfkw, Llc | Bariatric device and method |
| ES2400091T3 (es) | 2005-08-11 | 2013-04-05 | Massachusetts Institute Of Technology | Dispositivo de suministro de fármacos intravesical y método |
| US8142513B2 (en) * | 2006-08-23 | 2012-03-27 | Svip 2 Llc | Devices and methods for altering eating behavior |
| EP2111148B1 (en) * | 2007-01-19 | 2015-08-12 | Given Imaging (Los Angeles) LLC | Micro-remote gastrointestinal physiological measurement device |
| WO2008095183A2 (en) | 2007-02-01 | 2008-08-07 | Proteus Biomedical, Inc. | Ingestible event marker systems |
| US8956288B2 (en) | 2007-02-14 | 2015-02-17 | Proteus Digital Health, Inc. | In-body power source having high surface area electrode |
| US8529431B2 (en) | 2007-02-14 | 2013-09-10 | Bfkw, Llc | Bariatric device and method |
| US8115618B2 (en) * | 2007-05-24 | 2012-02-14 | Proteus Biomedical, Inc. | RFID antenna for in-body device |
| EP2157936A2 (en) | 2007-06-04 | 2010-03-03 | Svip 8 Llc | Tissue anchorable devices |
| US8197504B2 (en) | 2008-05-01 | 2012-06-12 | Ethicon Endo-Surgery, Inc. | Safe tissue puncture device |
| EP2303390A4 (en) | 2008-06-03 | 2011-11-30 | Svip 8 Llc | IN FABRIC ANCHORED DEVICES |
| EP3427660A1 (en) | 2008-07-08 | 2019-01-16 | Proteus Digital Health, Inc. | Ingestible event marker data framework |
| US20100256696A1 (en) * | 2009-04-07 | 2010-10-07 | Boston Scientific Neuromodulation Corporation | Anchoring Units For Implantable Electrical Stimulation Systems And Methods Of Making And Using |
| US8911392B2 (en) | 2009-04-08 | 2014-12-16 | E2, Llc | Systems and methods for treatment of obesity and type 2 diabetes |
| US8403877B2 (en) * | 2009-07-01 | 2013-03-26 | E2 Llc | Systems and methods for treatment of obesity and type 2 diabetes |
| WO2010125570A1 (en) * | 2009-04-30 | 2010-11-04 | Svip 2 Llc | Devices and methods for treating gastrointestinal and metabolic disorders |
| US20110066175A1 (en) * | 2009-05-07 | 2011-03-17 | Rainbow Medical Ltd. | Gastric anchor |
| US8414559B2 (en) | 2009-05-07 | 2013-04-09 | Rainbow Medical Ltd. | Gastroretentive duodenal pill |
| US20110004236A1 (en) * | 2009-07-01 | 2011-01-06 | E2 Llc | Systems and Methods for Treating Obesity and Type 2 Diabetes |
| US8574184B2 (en) * | 2009-07-01 | 2013-11-05 | E2 Llc | Systems and methods for treatment of obesity and type 2 diabetes |
| US9295574B2 (en) | 2009-07-01 | 2016-03-29 | E2, Llc | Systems and methods for treating obesity and type 2 diabetes |
| US8475401B2 (en) * | 2009-07-01 | 2013-07-02 | E2 Llc | Systems and methods for treating obesity and type 2 diabetes |
| US8496608B2 (en) * | 2009-07-01 | 2013-07-30 | E2 Llc | Systems and methods for treating obesity and type 2 diabetes |
| US20110004146A1 (en) * | 2009-07-01 | 2011-01-06 | E2 Llc | Systems and Methods for Treating of Obesity and Type 2 Diabetes |
| TWI517050B (zh) | 2009-11-04 | 2016-01-11 | 普羅托斯數位健康公司 | 供應鏈管理之系統 |
| US8679094B2 (en) | 2009-12-17 | 2014-03-25 | Taris Biomedical, Inc. | Implantable device with intravesical tolerability and methods of treatment |
| TWI557672B (zh) | 2010-05-19 | 2016-11-11 | 波提亞斯數位康健公司 | 用於從製造商跟蹤藥物直到患者之電腦系統及電腦實施之方法、用於確認將藥物給予患者的設備及方法、患者介面裝置 |
| US9526648B2 (en) | 2010-06-13 | 2016-12-27 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| US10420665B2 (en) | 2010-06-13 | 2019-09-24 | W. L. Gore & Associates, Inc. | Intragastric device for treating obesity |
| US10010439B2 (en) | 2010-06-13 | 2018-07-03 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| US8628554B2 (en) | 2010-06-13 | 2014-01-14 | Virender K. Sharma | Intragastric device for treating obesity |
| WO2012006153A1 (en) * | 2010-06-29 | 2012-01-12 | Yale University | Tissue retractor assembly |
| WO2012011105A2 (en) | 2010-07-22 | 2012-01-26 | Pierre Sharvit | Pancreatiobiliary diversion device |
| PL2600800T3 (pl) * | 2010-08-05 | 2021-04-06 | Taris Biomedical Llc | Urządzenie stentu moczowodowego do podawania leku i zestaw |
| US20120245553A1 (en) * | 2011-03-25 | 2012-09-27 | Allergan, Inc. | Intragastric volume occupying device with active agents |
| JP2014527840A (ja) | 2011-06-28 | 2014-10-23 | ノヴァトラクト サージカル インコーポレーテッドNovatract Surgical, Inc. | 組織リトラクター装置 |
| WO2015112603A1 (en) | 2014-01-21 | 2015-07-30 | Proteus Digital Health, Inc. | Masticable ingestible product and communication system therefor |
| US10973513B2 (en) | 2011-09-29 | 2021-04-13 | Ethicon, Llc | Barbed suture having increased holding strength |
| US9149383B2 (en) | 2012-01-23 | 2015-10-06 | Apollo Endosurgery, Inc. | Endolumenal esophageal restriction device |
| US9456916B2 (en) | 2013-03-12 | 2016-10-04 | Medibotics Llc | Device for selectively reducing absorption of unhealthy food |
| US11672529B2 (en) * | 2012-09-17 | 2023-06-13 | Cilag Gmbh International | Barbed sutures having contoured barbs that facilitate passage through tissue and increase holding strength |
| US9409009B2 (en) * | 2012-11-07 | 2016-08-09 | The Florida International University | Multi-lead multi-electrode management system |
| US9011365B2 (en) | 2013-03-12 | 2015-04-21 | Medibotics Llc | Adjustable gastrointestinal bifurcation (AGB) for reduced absorption of unhealthy food |
| US9067070B2 (en) | 2013-03-12 | 2015-06-30 | Medibotics Llc | Dysgeusia-inducing neurostimulation for modifying consumption of a selected nutrient type |
| EP2968880A1 (en) | 2013-03-15 | 2016-01-20 | TARIS Biomedical LLC | Drug delivery devices with drug-permeable component and methods |
| US11744481B2 (en) | 2013-03-15 | 2023-09-05 | Otsuka Pharmaceutical Co., Ltd. | System, apparatus and methods for data collection and assessing outcomes |
| CN103340595B (zh) * | 2013-07-03 | 2015-08-26 | 安翰光电技术(武汉)有限公司 | 一种无线胶囊内窥镜及其电源控制方法 |
| US9492396B2 (en) | 2014-07-15 | 2016-11-15 | Yossi Gross | Enhanced drug delivery pill |
| US9795378B2 (en) | 2014-10-31 | 2017-10-24 | Ethicon, Inc. | Method for approximating wounds |
| US10010400B2 (en) | 2015-03-30 | 2018-07-03 | Taris Biomedical Llc | Devices and methods for local delivery of drug to upper urinary tract |
| WO2016172704A1 (en) | 2015-04-23 | 2016-10-27 | Taris Biomedical Llc | Drug delivery devices with drug-permeable component and methods |
| CN107921263A (zh) * | 2015-06-28 | 2018-04-17 | 亚龙·伊兰 | 胃肠道刺激装置及其用途 |
| US10779980B2 (en) | 2016-04-27 | 2020-09-22 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| US10187121B2 (en) | 2016-07-22 | 2019-01-22 | Proteus Digital Health, Inc. | Electromagnetic sensing and detection of ingestible event markers |
| US10736566B2 (en) | 2017-02-13 | 2020-08-11 | The Board Of Trustees Of The University Of Alabama | Food intake monitor |
| US10675248B2 (en) | 2018-08-14 | 2020-06-09 | Alma Therapeutics Ltd. | Expandable pill |
| CN109010072B (zh) * | 2018-08-28 | 2021-10-22 | 河南优德医疗设备股份有限公司 | 一种可用于辅助治疗吞咽障碍的自动喂饭机 |
| WO2020059377A1 (ja) * | 2018-09-20 | 2020-03-26 | 日本電気株式会社 | 位置推定装置、位置推定方法、及びコンピュータ読み取り可能な記録媒体 |
| US11721425B2 (en) | 2019-01-30 | 2023-08-08 | Remmedy, Llc | Method of system for inducing a Pavlovian conditioned association of an aroma with a state of satiation |
| EP3946151A4 (en) * | 2019-03-25 | 2022-12-07 | Bfkw, Llc | INTRALUMINAL DEVICE AND METHOD WITH ANTI-MIGRATION |
| WO2021080640A1 (en) | 2019-10-24 | 2021-04-29 | Metamodix, Inc. | Systems and methods for anchoring and restraining gastrointestinal prostheses |
| WO2022051662A1 (en) * | 2020-09-04 | 2022-03-10 | Remmedy, Llc | Method of system for inducing a pavlovian conditioned association of an aroma with a state of satiation |
| WO2023219577A1 (en) * | 2022-05-10 | 2023-11-16 | Yeditepe Universitesi | Small intestinal area reducing device for non-surgical obesity treatment |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8603099D0 (en) | 1986-02-07 | 1986-03-12 | Blass K G | Gastrointestinal module |
| US5156641A (en) | 1990-03-07 | 1992-10-20 | Mayo Foundation For Medical Education And Research | Naso-gastric catheter anchor system |
| WO1992019195A1 (en) | 1991-04-25 | 1992-11-12 | Brown University Research Foundation | Implantable biocompatible immunoisolatory vehicle for delivery of selected therapeutic products |
| US5185005A (en) | 1991-06-04 | 1993-02-09 | Board Of Regents, The University Of Texas System | Method and apparatus for securing a nasogastric tube |
| US5234454A (en) * | 1991-08-05 | 1993-08-10 | Akron City Hospital | Percutaneous intragastric balloon catheter and method for controlling body weight therewith |
| KR100470519B1 (ko) | 1997-04-07 | 2005-02-21 | 쿡 유로러지컬 인코포레이티드 | 백-업 보유 부재 배출 카테테르 |
| AU2114299A (en) | 1998-01-14 | 1999-08-02 | Conway-Stuart Medical, Inc. | Electrosurgical device for sphincter treatment |
| US7599736B2 (en) | 2001-07-23 | 2009-10-06 | Dilorenzo Biomedical, Llc | Method and apparatus for neuromodulation and physiologic modulation for the treatment of metabolic and neuropsychiatric disease |
| US6264700B1 (en) | 1998-08-27 | 2001-07-24 | Endonetics, Inc. | Prosthetic gastroesophageal valve |
| US6231589B1 (en) | 1999-03-22 | 2001-05-15 | Microvena Corporation | Body vessel filter |
| US7615076B2 (en) | 1999-10-20 | 2009-11-10 | Anulex Technologies, Inc. | Method and apparatus for the treatment of the intervertebral disc annulus |
| US7141038B2 (en) | 2000-08-07 | 2006-11-28 | Abbeymoor Medical, Inc. | Endourethral device and method |
| US6754536B2 (en) | 2001-01-31 | 2004-06-22 | Medtronic, Inc | Implantable medical device affixed internally within the gastrointestinal tract |
| US20060069429A1 (en) | 2001-04-24 | 2006-03-30 | Spence Paul A | Tissue fastening systems and methods utilizing magnetic guidance |
| US7756582B2 (en) * | 2001-05-01 | 2010-07-13 | Intrapace, Inc. | Gastric stimulation anchor and method |
| US20070162085A1 (en) * | 2001-07-23 | 2007-07-12 | Dilorenzo Biomedical, Llc | Method, apparatus, surgical technique, and stimulation parameters for autonomic neuromodulation for the treatment of obesity |
| US20090187230A1 (en) * | 2001-07-23 | 2009-07-23 | Dilorenzo Daniel J | Method and apparatus for programming of autonomic neuromodulation for the treatment of obesity |
| CA2485249A1 (en) | 2002-05-09 | 2003-11-20 | Thomas D. Egan | Gastric bypass prosthesis |
| US6746460B2 (en) | 2002-08-07 | 2004-06-08 | Satiety, Inc. | Intra-gastric fastening devices |
| US20090149871A9 (en) | 2002-11-01 | 2009-06-11 | Jonathan Kagan | Devices and methods for treating morbid obesity |
| US8048169B2 (en) * | 2003-07-28 | 2011-11-01 | Baronova, Inc. | Pyloric valve obstructing devices and methods |
| US20090259236A2 (en) | 2003-07-28 | 2009-10-15 | Baronova, Inc. | Gastric retaining devices and methods |
| US7054690B2 (en) * | 2003-10-22 | 2006-05-30 | Intrapace, Inc. | Gastrointestinal stimulation device |
| US7699818B2 (en) | 2005-02-08 | 2010-04-20 | Paul J. Gilbert | Insertion system and methods for nasogastric tubes |
| US7805195B2 (en) | 2005-03-24 | 2010-09-28 | Vanderbilt University | Respiratory triggered, bilateral laryngeal stimulator to restore normal ventilation in vocal fold paralysis |
| US8216158B2 (en) | 2005-07-20 | 2012-07-10 | Medtronic, Inc. | Implantation of a medical device within a lumen |
| US8070768B2 (en) | 2006-04-19 | 2011-12-06 | Vibrynt, Inc. | Devices and methods for treatment of obesity |
| US7909037B2 (en) | 2006-04-20 | 2011-03-22 | Pavad Medical | Tethered airway implants and methods of using the same |
| US8038712B2 (en) | 2006-06-29 | 2011-10-18 | Koninklijke Philips Electronics N.V. | Methods and devices for rhinoplasty and treating internal valve stenosis |
| US8142513B2 (en) * | 2006-08-23 | 2012-03-27 | Svip 2 Llc | Devices and methods for altering eating behavior |
| US8430860B2 (en) | 2006-08-30 | 2013-04-30 | Med-El Elektromedizinische Geraete Gmbh | System, apparatus, and method for facilitating interface with laryngeal structures |
| US20080221599A1 (en) * | 2007-03-06 | 2008-09-11 | Starksen Niel F | Devices, methods, and kits for gastrointestinal procedures |
| US20100121371A1 (en) | 2007-04-30 | 2010-05-13 | Spatz Fgia, Inc. | Non-endoscopic insertion and removal of a device |
| EP2157936A2 (en) | 2007-06-04 | 2010-03-03 | Svip 8 Llc | Tissue anchorable devices |
| EP2222359A4 (en) | 2007-12-05 | 2014-03-12 | Svip 7 Llc | DEVICES AND METHOD FOR TREATMENT OF BREATHING IN SLEEP |
| EP2303390A4 (en) | 2008-06-03 | 2011-11-30 | Svip 8 Llc | IN FABRIC ANCHORED DEVICES |
-
2007
- 2007-08-22 US US12/310,359 patent/US8142513B2/en not_active Expired - Fee Related
- 2007-08-22 CA CA2661191A patent/CA2661191C/en not_active Expired - Fee Related
- 2007-08-22 EP EP07805507A patent/EP2056741A2/en not_active Withdrawn
- 2007-08-22 AU AU2007287201A patent/AU2007287201B2/en not_active Ceased
- 2007-08-22 JP JP2009525171A patent/JP5191489B2/ja not_active Expired - Fee Related
- 2007-08-22 WO PCT/IL2007/001047 patent/WO2008023374A2/en active Application Filing
-
2012
- 2012-03-05 US US13/411,696 patent/US8540780B2/en not_active Expired - Fee Related
-
2013
- 2013-07-30 US US13/953,751 patent/US8999002B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US20120165855A1 (en) | 2012-06-28 |
| US20090247992A1 (en) | 2009-10-01 |
| US20130317414A1 (en) | 2013-11-28 |
| WO2008023374A2 (en) | 2008-02-28 |
| US8540780B2 (en) | 2013-09-24 |
| WO2008023374A3 (en) | 2009-04-30 |
| CA2661191C (en) | 2014-12-02 |
| AU2007287201B2 (en) | 2012-11-15 |
| AU2007287201A1 (en) | 2008-02-28 |
| US8142513B2 (en) | 2012-03-27 |
| CA2661191A1 (en) | 2008-02-28 |
| US8999002B2 (en) | 2015-04-07 |
| EP2056741A2 (en) | 2009-05-13 |
| JP2010501242A (ja) | 2010-01-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5191489B2 (ja) | 摂食行動を変更するデバイス及び方法 | |
| US9839546B2 (en) | Apparatus and methods for treatment of morbid obesity | |
| US10322021B2 (en) | Delivery devices and methods for gastrointestinal implants | |
| US7881797B2 (en) | Methods and devices for gastrointestinal stimulation | |
| US7837669B2 (en) | Devices and methods for endolumenal gastrointestinal bypass | |
| US7846138B2 (en) | Cuff and sleeve system for gastrointestinal bypass | |
| US20120041465A1 (en) | Devices and methods for treating gastrointestinal and metabolic disorders | |
| US8323300B2 (en) | Tissue anchorable devices | |
| US20040019388A1 (en) | Methods and implants for retarding stomach emptying to treat eating disorders | |
| US20090118749A1 (en) | Pyloric Devices and Methods | |
| US20110295055A1 (en) | Methods and Devices For The Rerouting Of Chyme To Induct Intestinal Brake | |
| AU2012315575B2 (en) | Delivery devices and methods for gastrointestinal implants | |
| US20140114432A1 (en) | Tissue anchorable devices | |
| IL197198A (en) | Devices for altering eating behavior |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20100227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100802 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110207 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120522 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20120524 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120821 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20120821 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120828 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130115 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130129 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160208 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |