JP4960700B2 - 疾患を治療し、血糖を制御する際に使用するための胃腸処置方法および装置 - Google Patents
疾患を治療し、血糖を制御する際に使用するための胃腸処置方法および装置 Download PDFInfo
- Publication number
- JP4960700B2 JP4960700B2 JP2006520981A JP2006520981A JP4960700B2 JP 4960700 B2 JP4960700 B2 JP 4960700B2 JP 2006520981 A JP2006520981 A JP 2006520981A JP 2006520981 A JP2006520981 A JP 2006520981A JP 4960700 B2 JP4960700 B2 JP 4960700B2
- Authority
- JP
- Japan
- Prior art keywords
- control unit
- gastric
- electrodes
- stomach
- patient
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 230000002496 gastric effect Effects 0.000 title claims description 178
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 title claims description 46
- 239000008103 glucose Substances 0.000 title claims description 46
- 239000008280 blood Substances 0.000 title claims description 45
- 210000004369 blood Anatomy 0.000 title claims description 45
- 238000000034 method Methods 0.000 title description 62
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 title description 13
- 201000010099 disease Diseases 0.000 title description 7
- 210000002784 stomach Anatomy 0.000 claims description 129
- 238000001514 detection method Methods 0.000 claims description 59
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 claims description 48
- 235000005686 eating Nutrition 0.000 claims description 47
- 230000001720 vestibular Effects 0.000 claims description 39
- 210000001519 tissue Anatomy 0.000 claims description 26
- 102000004877 Insulin Human genes 0.000 claims description 24
- 108090001061 Insulin Proteins 0.000 claims description 24
- 229940125396 insulin Drugs 0.000 claims description 24
- 210000002460 smooth muscle Anatomy 0.000 claims description 11
- 230000002051 biphasic effect Effects 0.000 claims description 10
- 210000003205 muscle Anatomy 0.000 claims description 10
- 230000007246 mechanism Effects 0.000 claims description 7
- 230000006870 function Effects 0.000 claims description 6
- 230000003914 insulin secretion Effects 0.000 claims description 4
- 230000004044 response Effects 0.000 description 39
- 230000000638 stimulation Effects 0.000 description 37
- 230000000694 effects Effects 0.000 description 30
- 238000005259 measurement Methods 0.000 description 28
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 24
- 210000000746 body region Anatomy 0.000 description 23
- 210000001035 gastrointestinal tract Anatomy 0.000 description 23
- 102400000322 Glucagon-like peptide 1 Human genes 0.000 description 21
- 238000002474 experimental method Methods 0.000 description 21
- 101800000224 Glucagon-like peptide 1 Proteins 0.000 description 20
- 208000008589 Obesity Diseases 0.000 description 20
- 238000002847 impedance measurement Methods 0.000 description 20
- 230000008602 contraction Effects 0.000 description 18
- 230000008859 change Effects 0.000 description 17
- 210000001072 colon Anatomy 0.000 description 17
- 235000020824 obesity Nutrition 0.000 description 16
- 230000009467 reduction Effects 0.000 description 15
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 15
- 210000004027 cell Anatomy 0.000 description 12
- 206010012601 diabetes mellitus Diseases 0.000 description 12
- 102000049320 CD36 Human genes 0.000 description 9
- 108010045374 CD36 Antigens Proteins 0.000 description 9
- 239000012530 fluid Substances 0.000 description 9
- 230000028327 secretion Effects 0.000 description 9
- 210000000813 small intestine Anatomy 0.000 description 9
- 102100031574 Platelet glycoprotein 4 Human genes 0.000 description 8
- 101710202087 Platelet glycoprotein 4 Proteins 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 238000011038 discontinuous diafiltration by volume reduction Methods 0.000 description 7
- 230000000291 postprandial effect Effects 0.000 description 7
- GCYXWQUSHADNBF-AAEALURTSA-N preproglucagon 78-108 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 GCYXWQUSHADNBF-AAEALURTSA-N 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 230000007423 decrease Effects 0.000 description 6
- 208000035475 disorder Diseases 0.000 description 6
- 235000013305 food Nutrition 0.000 description 6
- 230000002440 hepatic effect Effects 0.000 description 6
- 229940088597 hormone Drugs 0.000 description 6
- 239000005556 hormone Substances 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 206010022489 Insulin Resistance Diseases 0.000 description 5
- 230000000112 colonic effect Effects 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 210000003238 esophagus Anatomy 0.000 description 5
- 208000019622 heart disease Diseases 0.000 description 5
- 230000036186 satiety Effects 0.000 description 5
- 235000019627 satiety Nutrition 0.000 description 5
- 230000004936 stimulating effect Effects 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- MNULEGDCPYONBU-WMBHJXFZSA-N (1r,4s,5e,5'r,6'r,7e,10s,11r,12s,14r,15s,16s,18r,19s,20r,21e,25s,26r,27s,29s)-4-ethyl-11,12,15,19-tetrahydroxy-6'-[(2s)-2-hydroxypropyl]-5',10,12,14,16,18,20,26,29-nonamethylspiro[24,28-dioxabicyclo[23.3.1]nonacosa-5,7,21-triene-27,2'-oxane]-13,17,23-trio Polymers O([C@@H]1CC[C@@H](/C=C/C=C/C[C@H](C)[C@@H](O)[C@](C)(O)C(=O)[C@H](C)[C@@H](O)[C@H](C)C(=O)[C@H](C)[C@@H](O)[C@H](C)/C=C/C(=O)O[C@H]([C@H]2C)[C@H]1C)CC)[C@]12CC[C@@H](C)[C@@H](C[C@H](C)O)O1 MNULEGDCPYONBU-WMBHJXFZSA-N 0.000 description 4
- MNULEGDCPYONBU-DJRUDOHVSA-N (1s,4r,5z,5'r,6'r,7e,10s,11r,12s,14r,15s,18r,19r,20s,21e,26r,27s)-4-ethyl-11,12,15,19-tetrahydroxy-6'-(2-hydroxypropyl)-5',10,12,14,16,18,20,26,29-nonamethylspiro[24,28-dioxabicyclo[23.3.1]nonacosa-5,7,21-triene-27,2'-oxane]-13,17,23-trione Polymers O([C@H]1CC[C@H](\C=C/C=C/C[C@H](C)[C@@H](O)[C@](C)(O)C(=O)[C@H](C)[C@@H](O)C(C)C(=O)[C@H](C)[C@H](O)[C@@H](C)/C=C/C(=O)OC([C@H]2C)C1C)CC)[C@]12CC[C@@H](C)[C@@H](CC(C)O)O1 MNULEGDCPYONBU-DJRUDOHVSA-N 0.000 description 4
- MNULEGDCPYONBU-YNZHUHFTSA-N (4Z,18Z,20Z)-22-ethyl-7,11,14,15-tetrahydroxy-6'-(2-hydroxypropyl)-5',6,8,10,12,14,16,28,29-nonamethylspiro[2,26-dioxabicyclo[23.3.1]nonacosa-4,18,20-triene-27,2'-oxane]-3,9,13-trione Polymers CC1C(C2C)OC(=O)\C=C/C(C)C(O)C(C)C(=O)C(C)C(O)C(C)C(=O)C(C)(O)C(O)C(C)C\C=C/C=C\C(CC)CCC2OC21CCC(C)C(CC(C)O)O2 MNULEGDCPYONBU-YNZHUHFTSA-N 0.000 description 4
- MNULEGDCPYONBU-VVXVDZGXSA-N (5e,5'r,7e,10s,11r,12s,14s,15r,16r,18r,19s,20r,21e,26r,29s)-4-ethyl-11,12,15,19-tetrahydroxy-6'-[(2s)-2-hydroxypropyl]-5',10,12,14,16,18,20,26,29-nonamethylspiro[24,28-dioxabicyclo[23.3.1]nonacosa-5,7,21-triene-27,2'-oxane]-13,17,23-trione Polymers C([C@H](C)[C@@H](O)[C@](C)(O)C(=O)[C@@H](C)[C@H](O)[C@@H](C)C(=O)[C@H](C)[C@@H](O)[C@H](C)/C=C/C(=O)OC([C@H]1C)[C@H]2C)\C=C\C=C\C(CC)CCC2OC21CC[C@@H](C)C(C[C@H](C)O)O2 MNULEGDCPYONBU-VVXVDZGXSA-N 0.000 description 4
- MNULEGDCPYONBU-UHFFFAOYSA-N 4-ethyl-11,12,15,19-tetrahydroxy-6'-(2-hydroxypropyl)-5',10,12,14,16,18,20,26,29-nonamethylspiro[24,28-dioxabicyclo[23.3.1]nonacosa-5,7,21-triene-27,2'-oxane]-13,17,23-trione Polymers CC1C(C2C)OC(=O)C=CC(C)C(O)C(C)C(=O)C(C)C(O)C(C)C(=O)C(C)(O)C(O)C(C)CC=CC=CC(CC)CCC2OC21CCC(C)C(CC(C)O)O2 MNULEGDCPYONBU-UHFFFAOYSA-N 0.000 description 4
- 102000002281 Adenylate kinase Human genes 0.000 description 4
- 108020000543 Adenylate kinase Proteins 0.000 description 4
- 206010020772 Hypertension Diseases 0.000 description 4
- RTRQQBHATOEIAF-UUOKFMHZSA-N acadesine Chemical compound NC1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RTRQQBHATOEIAF-UUOKFMHZSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 210000004413 cardiac myocyte Anatomy 0.000 description 4
- 208000012696 congenital leptin deficiency Diseases 0.000 description 4
- 235000005911 diet Nutrition 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 230000029087 digestion Effects 0.000 description 4
- 230000001079 digestive effect Effects 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 230000002641 glycemic effect Effects 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 208000001022 morbid obesity Diseases 0.000 description 4
- 230000002107 myocardial effect Effects 0.000 description 4
- 229930191479 oligomycin Natural products 0.000 description 4
- MNULEGDCPYONBU-AWJDAWNUSA-N oligomycin A Polymers O([C@H]1CC[C@H](/C=C/C=C/C[C@@H](C)[C@H](O)[C@@](C)(O)C(=O)[C@@H](C)[C@H](O)[C@@H](C)C(=O)[C@@H](C)[C@H](O)[C@@H](C)/C=C/C(=O)O[C@@H]([C@@H]2C)[C@@H]1C)CC)[C@@]12CC[C@H](C)[C@H](C[C@@H](C)O)O1 MNULEGDCPYONBU-AWJDAWNUSA-N 0.000 description 4
- 210000001187 pylorus Anatomy 0.000 description 4
- 230000036982 action potential Effects 0.000 description 3
- 235000019789 appetite Nutrition 0.000 description 3
- 230000036528 appetite Effects 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 230000037213 diet Effects 0.000 description 3
- 230000002183 duodenal effect Effects 0.000 description 3
- 230000037406 food intake Effects 0.000 description 3
- 235000019525 fullness Nutrition 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 235000012054 meals Nutrition 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 210000001186 vagus nerve Anatomy 0.000 description 3
- OBMZMSLWNNWEJA-XNCRXQDQSA-N C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 Chemical compound C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 OBMZMSLWNNWEJA-XNCRXQDQSA-N 0.000 description 2
- 101800001982 Cholecystokinin Proteins 0.000 description 2
- 102100025841 Cholecystokinin Human genes 0.000 description 2
- 101710176384 Peptide 1 Proteins 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 229940107137 cholecystokinin Drugs 0.000 description 2
- 230000003750 conditioning effect Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 235000021185 dessert Nutrition 0.000 description 2
- 235000006694 eating habits Nutrition 0.000 description 2
- 230000003203 everyday effect Effects 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 235000003642 hunger Nutrition 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 239000000859 incretin Substances 0.000 description 2
- MGXWVYUBJRZYPE-YUGYIWNOSA-N incretin Chemical class C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)[C@@H](C)O)[C@@H](C)CC)C1=CC=C(O)C=C1 MGXWVYUBJRZYPE-YUGYIWNOSA-N 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000000111 lower esophageal sphincter Anatomy 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 244000309715 mini pig Species 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 210000000663 muscle cell Anatomy 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 210000003240 portal vein Anatomy 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- IZTQOLKUZKXIRV-YRVFCXMDSA-N sincalide Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)NCC(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](N)CC(O)=O)C1=CC=C(OS(O)(=O)=O)C=C1 IZTQOLKUZKXIRV-YRVFCXMDSA-N 0.000 description 2
- 210000002027 skeletal muscle Anatomy 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 230000005945 translocation Effects 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 102000014156 AMP-Activated Protein Kinases Human genes 0.000 description 1
- 108010011376 AMP-Activated Protein Kinases Proteins 0.000 description 1
- 102000000452 Acetyl-CoA carboxylase Human genes 0.000 description 1
- 108010016219 Acetyl-CoA carboxylase Proteins 0.000 description 1
- 108010018763 Biotin carboxylase Proteins 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 208000030814 Eating disease Diseases 0.000 description 1
- 208000019454 Feeding and Eating disease Diseases 0.000 description 1
- 102000051325 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- 206010020710 Hyperphagia Diseases 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 240000008415 Lactuca sativa Species 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 102000038030 PI3Ks Human genes 0.000 description 1
- 108091007960 PI3Ks Proteins 0.000 description 1
- 102000052651 Pancreatic hormone Human genes 0.000 description 1
- 101800001268 Pancreatic hormone Proteins 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 208000002847 Surgical Wound Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003178 anti-diabetic effect Effects 0.000 description 1
- 230000004596 appetite loss Effects 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 235000014632 disordered eating Nutrition 0.000 description 1
- 210000004921 distal colon Anatomy 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 201000006549 dyspepsia Diseases 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000002674 endoscopic surgery Methods 0.000 description 1
- 235000021183 entrée Nutrition 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000009207 exercise therapy Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000030136 gastric emptying Effects 0.000 description 1
- 230000030135 gastric motility Effects 0.000 description 1
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- -1 glucagon-like peptide-1 compound Chemical class 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 208000024798 heartburn Diseases 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000006362 insulin response pathway Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 150000004668 long chain fatty acids Chemical class 0.000 description 1
- 235000021266 loss of appetite Nutrition 0.000 description 1
- 208000019017 loss of appetite Diseases 0.000 description 1
- 230000031852 maintenance of location in cell Effects 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 230000004118 muscle contraction Effects 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000007383 nerve stimulation Effects 0.000 description 1
- 230000010004 neural pathway Effects 0.000 description 1
- 210000000118 neural pathway Anatomy 0.000 description 1
- 230000004007 neuromodulation Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 235000018343 nutrient deficiency Nutrition 0.000 description 1
- 235000006180 nutrition needs Nutrition 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 238000007410 oral glucose tolerance test Methods 0.000 description 1
- 235000020830 overeating Nutrition 0.000 description 1
- 239000004025 pancreas hormone Substances 0.000 description 1
- 230000004203 pancreatic function Effects 0.000 description 1
- 229940032957 pancreatic hormone Drugs 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002572 peristaltic effect Effects 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 230000033764 rhythmic process Effects 0.000 description 1
- 235000012045 salad Nutrition 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 210000000518 sarcolemma Anatomy 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 235000019615 sensations Nutrition 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 235000014347 soups Nutrition 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 208000018556 stomach disease Diseases 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/36—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation
- A61N1/36007—Applying electric currents by contact electrodes alternating or intermittent currents for stimulation of urogenital or gastrointestinal organs, e.g. for incontinence control
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/05—Electrodes for implantation or insertion into the body, e.g. heart electrode
Landscapes
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Diabetes (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Chemical & Material Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Radiology & Medical Imaging (AREA)
- Hematology (AREA)
- Electrotherapy Devices (AREA)
Description
本出願は、本特許出願の譲受人に譲渡され、参照により本明細書に組み込むものとする、「疾患を治療し、血糖を制御する際に使用するための胃腸のための方法および装置」(Gastrointestinal methods and apparatus for use in treating disorders and controlling blood sugar)という名称の2003年7月21日付けのBen−Haim他の米国仮特許出願第60/488,964号からの優先権を主張する。
本発明は、概して、代謝状態の治療に関し、特に代謝および行動状態を治療するための侵襲性技術および装置に関する。
Diabetes Care17(9)、1039〜44ページ(1994年)掲載のGutniak MK他の、「インクレチン・ホルモン・グルカゴン類似のペプチド1を皮下注射すると、NIDDMの食後の血糖が消滅する」(Subcutaneous injection of the incretin hormone glucagon−like peptide 1 abolishes postprandial glycemia in NIDDM)
J Endocrinol 161(1)、25〜31ページ(1999年)掲載の「人間の体内での食後のグルカゴン類似のペプチド1(7−36)アミドの濃度に対する結腸の影響」(The influence of the colon on postprandial glucagon−like peptide 1 (7−36) amide concentration in man)
J Endocrinol 156(1)、177〜86ページ(1998年)掲載のSchirra J他の、「インスリン非依存性糖尿病に対する皮下グルカゴン類似のペプチド1(7−36)アミドの抗糖尿病作用の機構」(Mechanisms of the antidiabetic action of subcutaneous glucagon−like peptide−1 (7−36) amide in non−insulin dependent diabetes mellitus)
Clin Sci(Lond)95(3)、325〜9ページ(1998年)掲載のTodd JF他の「皮下グルカゴン類似のペプチド−1は、初期のタイプ2の糖尿病患者の食後の血糖を3週間で改善する」(Subcutaneous glucagon−like peptide−1 improves postprandial glycaemic control over a 3−week period in patients with early type 2 diabetes)
Diabetes50(3)、609〜13ページ(2001年)掲載のVilsboll T他の、「タイプ2の糖尿病患者での、無傷の生物学的に活性のグルカゴン類似のペプチド1の食後の濃度の低減」(Reduced postprandial concentrations of intact biologically active glucagon−like peptide 1 in type 2 diabetic patients)
患者の胃の上の2つ以上の部位間の電気インピーダンスを測定し、それに応じてインピーダンス信号を発生するステップと、
姿勢の変化を検出するためにインピーダンス信号を分析するステップとを含む。
さらに患者の潜在摂食の表示を検出するためにインピーダンス信号を分析するステップと、
潜在的摂食の表示を、姿勢の変化が検出されなかった場合だけ、摂食の表示と解釈するステップとを含む。
患者の胃の上の2つ以上の部位間の電気インピーダンスを測定し、それに応じてインピーダンス信号を発生するステップと、
患者の姿勢の変化を検出するために、インピーダンス信号を分析するステップと、
患者の潜在的摂食の表示を検出するためにインピーダンス信号をさらに分析するステップと、
潜在的摂食の表示を、姿勢の変化が検出されなかった場合だけ、摂食の表示と解釈するステップとを含む。
患者の結腸または遠位小腸に電気信号を供給するステップと、
患者を治療するためにグルカゴン類似のペプチド−1(GLP−1)の分泌を増大するために細胞を刺激するように信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の胃に電気信号を供給するステップと、
患者を治療するために患者の血糖値を低減するように電気信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の小腸に電気信号を供給するステップと、
患者を治療するために患者の血糖値を低減するように電気信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の平滑筋に励起可能な組織制御(ETC)信号を供給するステップと、
患者を治療するために患者の血糖値を低減するようにETC信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の心筋組織に励起可能な組織制御(ETC)信号を供給するステップと、
患者を治療するために患者の血糖値を低減するようにETC信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の少なくとも1つの胃の部位に電気信号を供給するステップと、
患者を治療するために患者の血糖値の上昇を低減するように電気信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の少なくとも1つの小腸の部位に電気信号を供給するステップと、
患者を治療するために患者の血糖値の上昇を低減するように電気信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の少なくとも1つの平滑筋の部位に励起可能な組織制御(ETC)電気信号を供給するステップと、
患者を治療するために患者の血糖値の上昇を低減するように電気信号を構成するステップとを含む患者を治療するための方法を提供する。
患者の少なくとも1つの心筋組織部位に励起可能な組織制御(ETC)電気信号を供給するステップと、
患者を治療するために患者の血糖値の上昇を低減するように、ETC電気信号を構成するステップとを含む患者を治療するための方法を提供する。
始動パルスを供給するステップと、
始動パルスが終了した後で少なくとも100msパルスのバーストを供給するステップとを含む。
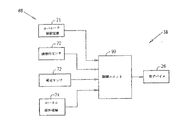
患者の少なくとも1つの各胃の部位に設置することができる一組の少なくとも1つの電極と、
患者の血糖値の上昇を低減するように構成されている電気信号を供給するために、一組の電極を駆動することができる制御ユニットを備える患者を治療するための装置を提供する。
患者の少なくとも1つの各小腸の部位に設置することができる一組の少なくとも1つの電極と、
患者の血糖値の上昇を低減するように構成されている電気信号を供給するために、一組の電極を駆動することができる制御ユニットを備える患者を治療するための装置を提供する。
患者の少なくとも1つの各平滑筋の部位に設置することができる一組の少なくとも1つの電極と、
患者の血糖値の上昇を低減するように構成されている励起可能な組織制御(ETC)電気信号を供給するために、一組の電極を駆動することができる制御ユニットを備える患者を治療するための装置を提供する。
患者の少なくとも1つの各心筋組織の部位に設置することができる一組の少なくとも1つの電極と、
患者の血糖値の上昇を低減するように構成されている励起可能な組織制御(ETC)電気信号を供給するために、一組の電極を駆動することができる制御ユニットを備える患者を治療するための装置を提供する。
・図9〜図11のところで以下に説明する結腸刺激技術および/または
・本特許出願の譲受人に譲渡され、参照により本明細書に組み込むものとする2003年6月20日付けの、「治療、摂食検出およびグルコース・レベル検出のための肝臓デバイス」(Hepatic device for treatment, eating detection, and glucose level detection)という名称の米国仮特許出願が開示している肝臓門脈刺激技術。
さらに、別の方法としてはまたは追加的に、摂食イベントを検出した場合には、制御ユニット90は、下記のものを含むがこれらに限定されない当業者であれば周知の1つまたは複数の技術を使用する。
・インスリン・ポンプの作動
・(ある種の用途の場合に、本明細書に記載する他の技術のうちのいくつかまたは全部がない場合、代謝性または行動性疾患を治療するために行われる)コレシストキニン(CCK)ポンプの作動
・参照により本明細書に組み込むものとするHouben他の米国特許第5,919,216号が開示している技術を使用する膵臓の刺激
・参照により本明細書に組み込むものとするWernicke他の米国特許第5,188,104号、第5,231,988号および/または第5,263,480号が開示しているようなインスリン分泌を調整するための迷走神経の刺激。
・遅波内の行動電位伝搬速度の分析。行動電位伝搬速度は、通常、遅波の持続時間を測定することにより測定される。例えば、遅波の平均の基本的な持続時間は5秒であり、その場合約7〜15%の平均の基本的な持続時間より大きい持続時間の増大(例えば、10%で5.5秒)は、胃の膨張または差し迫った摂食の予想の表示と解釈される。平均の基本的な持続時間の方向への持続時間の以降の低減は、摂食の中止を示す。別の方法としてはまたは追加的に、摂食の開始および終了を決定するために、持続時間の他に遅波の形態学的特徴の変化が分析される。
・摂食の開始または差し迫った開始を示す前庭部の収縮の感知。特定の周波数帯内の感知エネルギーの増大は、前庭部の収縮が起こっていて、摂食が始まっているか、または始まろうとしていることを示すものと解釈されることを示す。ある種の用途の場合には、エネルギー帯は、約0.5Hz〜約3Hzの範囲をカバーしていて、通常約1〜2Hzの範囲内にある。それ故、周期的帯内の感知エネルギーの低減は、摂食の中止を示すものと解釈される。
・自然の胃のペーシングの正規の場所以外の部位の検出。感知したリズム障害が正規の場所以外の部位でスタートすると判断した場合には、このことは、胃の状態(例えば、満腹または空腹)の変化を示すものと解釈される。
・胃の電気的活動の遠心性神経変調の感知。約5Hz以上(例えば、約5〜15Hz)の感知した電気的活動のスタートは、差し迫った摂食の予想または摂食のスタートを示すものと解釈される。胃の上に設置されている電極は、電極が行動電位を伝搬する神経上に直接設置されていない場合でも、この活動を検出する。
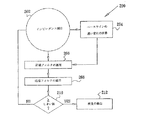
・インピーダンス・チェック・ステップ352において、制御ユニット90は、図5のところで上記のステップ212で発生したインピーダンス状態信号をチェックする。
・インピーダンス・チェック・ステップ362において、制御ユニット90は、図5のところで説明したように、発生した非インピーダンス状態信号をチェックする。
・遅波チェック・ステップ374において、制御ユニット90は、図7のところで説明したように、ステップ316のところで発生した遅波状態信号をチェックする。
・胃バンド32は、胃バンド32を収縮および拡張することができるリニア・モータまたは回転モータのようなモータを備える。例えば、上記米国特許第6,067,991号および/または第6,454,699号、および/または上記米国特許出願第2003/0066536号公報および/または第2001/0011543号が開示しているモータによる調整技術を使用することができる。
・胃バンド32の少なくとも一部は、そのコンプライアンスおよび/または長さが温度の変化に応じて変化する温度感知材料を備える。制御ユニット90は、胃を所望の容量にするために材料に温度の変化を供給する。
・胃バンド32は、充填ポートを通して膨張させることができる部分を備える。例えば、バンドの内面は、膨張させることができる部分を含むことができる。通常、この部分は塩溶液のような液体により膨張する。膨張することができる部分は、通常、チューブにより患者の皮膚の下に移植されている調整リザーバに接続している。バンド32は、さらに、バンドの周囲を調整するために、制御ユニット90からの入力に応じて、閉鎖回路内の液体の決まった量をバンドからリザーバまたはその逆に移送するポンプを備える。例えば、米国特許第5,938,669号、第6,460,543号、第6,453,907号および/または第6,454,699号、および/または上記米国特許出願第2003/0066536号および/または第2001/0011543号公報が開示している調整可能なバンド膨張技術を使用することができる。
・上記特許出願第’414号公報
・上記PCT第WO 02/082968号公報
・上記PCT第WO 02/053093号公報
・2003年6月20日付けの「治療および摂食検出のための肝臓デバイス」(Hepatic device for treatment and eating detection)という名称の上記米国仮特許出願
・本出願の譲受人に譲渡され、参照により本明細書に組み込むものとする、「摂食習慣の規制」(Regulation of eating habits)という名称の2001年1月5日付けの米国仮特許出願第60/259,925号
・本特許出願の譲受人に譲渡され、参照により本明細書に組み込むものとする2003年6月20日付けの「疾患を治療する際に使用するための胃腸のための方法および装置」(Gastrointestinal methods and apparatus for use in treating disorders)という名称の米国仮特許出願
・「背景技術」のところで記載した特許、特許出願公報および/または論文。
・上記特許出願第’414号公報
・上記PCT第WO 02/082968号公報
・上記PCT第WO 02/053093号公報
・2003年6月20日付けの「治療および摂食検出のための肝臓デバイス」(Hepatic device for treatment and eating detection)という名称の上記米国仮特許出願
・上記米国仮特許出願第60/259,925号
・2003年6月20日付けの「疾患を治療する際に使用するための胃腸方法および装置」(Gastrointestinal methods and apparatus for use in treating disorders)という名称の上記米国仮特許出願
・「背景技術」内に記載した特許、特許出願公報および/または論文。
本発明の他の実施形態の場合には、制御ユニット602は、摂食の検出に応じてではなく、ほとんど絶えず電極604を駆動するように構成されている。別の方法としては、日中または夜間のある時間内に、1時間に1回から数回というように周期的にまたは患者からのコマンドに応じて刺激が供給される。
Claims (26)
- 胃部位の平滑筋の各部位に設置され、胃の筋肉層内に挿入されることができる一組の1つ以上の電極と、
血糖値の上昇を低減するように構成されている電気信号を供給するために、前記一組の電極を駆動することができる制御ユニットとを備える治療装置。 - 前記一組の電極が、
胃体部位に移植することができる第1の電極および胃前庭部位に移植することができる第2の電極、及び、胃基底部に移植することができる第1の電極および胃前庭部位に移植することができる第2の電極、
より選択される第1の電極及び第2の電極を備える、請求項1記載の装置。 - 前記制御ユニットが、励起可能な組織制御(ETC)信号を供給するために、前記電極を駆動することができる、請求項1又は2に記載の装置。
- 前記制御ユニットが、血液のインスリン・レベルの上昇を低減するように前記電気信号を構成することができる、請求項1〜3の何れか1項に記載の装置。
- 前記制御ユニットが、複数の各遅波のサイクル中に前記部位に5つ以上のパルスを供給するために、前記一組の電極を駆動することができる、請求項1〜4の何れか1項に記載の装置。
- 前記制御ユニットが、複数の各遅波のサイクル中に前記部位に1〜5パルスと、複数の各遅波のサイクル中に前記部位に1つのパルスと、より選択されるパルスを供給するために、前記一組の電極を駆動することができる、請求項1〜5の何れか1項に記載の装置。
- 前記制御ユニットが、前記電気信号の周波数の範囲を1〜30Hz、10〜30Hz、1〜10Hz、2.5〜7.5Hz、及び100〜200Hzの範囲内より選択されるように構成することができる、請求項1〜6の何れか1項に記載の装置。
- 前記制御ユニットが、前記電気信号の周波数の範囲を30〜100Hzの範囲内より選択されるように構成することができる、請求項1〜6の何れか1項に記載の装置。
- 前記制御ユニットが、前記一組の電極を駆動して前記電気信号をパルスの形で供給し、前記パルスのパルス振幅の範囲を2〜15mA、及び、2.5〜7.5mAより選択されるように構成することができる、請求項1〜8の何れか1項に記載の装置。
- 前記制御ユニットが、前記一組の電極を駆動してパルス列を成すパルスの形で前記電気信号を供給し、前記パルス列の長さの範囲を1〜6秒の長さ、及び、3〜6秒の長さの範囲より選択されるように構成することができる、請求項1〜9の何れか1項に記載の装置。
- 前記制御ユニットが、前記一組の電極を駆動して前記電気信号を二相パルス列として供給することができる、請求項1〜10の何れか1項に記載の装置。
- 前記制御ユニットが、前記二相パルスの各位相の持続時間を1〜10ms、及び、4〜6msの範囲内より選択されるように設定することができる、請求項11に記載の装置。
- 前記制御ユニットが、生理的属性を検出し、それに応じて前記電気信号を供給するために前記一組の電極を駆動することができる、請求項1〜12の何れか1項に記載の装置。
- 前記生理的属性を検出するために、前記制御ユニットが、摂食中であることを検出することができる、請求項13に記載の装置。
- 前記生理的属性を検出するために、前記制御ユニットが、胃管の属性の検出及び遅波の検出より選択される機能を実行することができる、請求項13に記載の装置。
- 前記一組の電極を駆動して前記電気信号を供給するために、前記制御ユニットが、始動パルスを供給するために前記一組の電極を駆動し、
前記始動パルスの終了から少なくとも100ms経過後にパルスのバーストを供給するために前記一組の電極を駆動することができる、請求項1〜15の何れか1項に記載の装置。 - 前記制御ユニットが、前記始動パルスの供給前の1分間以内に感知した任意の生理的属性に応じないで、前記始動パルスを供給するために前記一組の電極を駆動することができること、前記始動パルスの供給前の1分間以内に遅波の任意の感知に応じないで、前記始動パルスを供給するために前記一組の電極を駆動することができること、及び前記パルスのバーストの周波数を1〜10Hzの範囲内に構成することができること、より選択される機能を実行することができる請求項16に記載の装置。
- 前記制御ユニットが、前記パルスのバーストの周波数を10〜100Hzの範囲内に構成することができることができる請求項16に記載の装置。
- 前記生理的属性を検出するために、前記制御ユニットが患者の胃管の属性を検出することができる、請求項13に記載の装置。
- 前記胃管の属性を検出するために、前記制御ユニットが、遅波の表示の検出、及び、摂食の表示の検出より選択された機能を実行することができる、請求項19に記載の装置。
- 前記制御ユニットが、前記始動パルスの終了後4秒以内に前記パルスのバーストの供給をスタートするために前記一組の電極を駆動することができる、請求項16に記載の装置。
- 前記制御ユニットが、前記始動パルスの終了後100〜500ms間に前記パルスのバーストの供給をスタートするために前記一組の電極を駆動することができる、請求項21に記載の装置。
- 前記制御ユニットが、前記始動パルスの持続時間を50〜500msの範囲内に構成することができる、請求項16に記載の装置。
- 前記制御ユニットが、前記持続時間を50〜150msの範囲内に構成することができる、請求項23に記載の装置。
- インスリン分泌の増大以外の機構の仲介によって少なくとも血糖値の一部を低減させるために前記電気信号が選択される、請求項1に記載の装置。
- 前記電気信号は、パルスの持続時間が1〜10msであり、パルス振幅が2〜15mAであるパルスを含む、請求項1に記載の装置。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US48896403P | 2003-07-21 | 2003-07-21 | |
| US60/488,964 | 2003-07-21 | ||
| PCT/IL2004/000664 WO2005007232A2 (en) | 2003-07-21 | 2004-07-21 | Gastrointestinal methods and apparatus for use in treating disorders and controlling blood sugar |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006528019A JP2006528019A (ja) | 2006-12-14 |
| JP2006528019A5 JP2006528019A5 (ja) | 2011-12-01 |
| JP4960700B2 true JP4960700B2 (ja) | 2012-06-27 |
Family
ID=34079466
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006520981A Expired - Lifetime JP4960700B2 (ja) | 2003-07-21 | 2004-07-21 | 疾患を治療し、血糖を制御する際に使用するための胃腸処置方法および装置 |
Country Status (4)
| Country | Link |
|---|---|
| EP (1) | EP1646423A4 (ja) |
| JP (1) | JP4960700B2 (ja) |
| CN (1) | CN1856338B (ja) |
| WO (1) | WO2005007232A2 (ja) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0996482B1 (en) | 1997-07-16 | 2007-02-14 | Metacure NV | Smooth muscle controller |
| US9101765B2 (en) | 1999-03-05 | 2015-08-11 | Metacure Limited | Non-immediate effects of therapy |
| US7338433B2 (en) | 2002-08-13 | 2008-03-04 | Allergan, Inc. | Remotely adjustable gastric banding method |
| NZ548535A (en) | 2004-01-23 | 2010-01-29 | Allergan Sales Llc | Realeasably-securable one-piece adjustable gastric band |
| US7946976B2 (en) * | 2004-03-23 | 2011-05-24 | Michael Gertner | Methods and devices for the surgical creation of satiety and biofeedback pathways |
| US9314633B2 (en) | 2008-01-25 | 2016-04-19 | Cyberonics, Inc. | Contingent cardio-protection for epilepsy patients |
| US8260426B2 (en) | 2008-01-25 | 2012-09-04 | Cyberonics, Inc. | Method, apparatus and system for bipolar charge utilization during stimulation by an implantable medical device |
| US8565867B2 (en) | 2005-01-28 | 2013-10-22 | Cyberonics, Inc. | Changeable electrode polarity stimulation by an implantable medical device |
| WO2006087712A2 (en) | 2005-02-17 | 2006-08-24 | Metacure N.V. | Charger with data transfer capabilities |
| WO2006102626A2 (en) | 2005-03-24 | 2006-09-28 | Metacure Nv | Wireless leads for gastrointestinal tract applications |
| US8251888B2 (en) * | 2005-04-13 | 2012-08-28 | Mitchell Steven Roslin | Artificial gastric valve |
| US7899540B2 (en) * | 2005-04-29 | 2011-03-01 | Cyberonics, Inc. | Noninvasively adjustable gastric band |
| US7835796B2 (en) * | 2005-04-29 | 2010-11-16 | Cyberonics, Inc. | Weight loss method and device |
| US20070016262A1 (en) * | 2005-07-13 | 2007-01-18 | Betastim, Ltd. | Gi and pancreatic device for treating obesity and diabetes |
| EP1931319A2 (en) | 2005-08-09 | 2008-06-18 | Tylerton International Inc. | Satiety |
| US8442841B2 (en) | 2005-10-20 | 2013-05-14 | Matacure N.V. | Patient selection method for assisting weight loss |
| US8043206B2 (en) | 2006-01-04 | 2011-10-25 | Allergan, Inc. | Self-regulating gastric band with pressure data processing |
| US7996079B2 (en) | 2006-01-24 | 2011-08-09 | Cyberonics, Inc. | Input response override for an implantable medical device |
| US7974697B2 (en) | 2006-01-26 | 2011-07-05 | Cyberonics, Inc. | Medical imaging feedback for an implantable medical device |
| US7657310B2 (en) | 2006-01-26 | 2010-02-02 | Cyberonics, Inc. | Treatment of reproductive endocrine disorders by vagus nerve stimulation |
| WO2007115103A1 (en) | 2006-03-29 | 2007-10-11 | Catholic Healthcare West | Microburst electrical stimulation of cranial nerves for the treatment of medical conditions |
| US8870742B2 (en) | 2006-04-06 | 2014-10-28 | Ethicon Endo-Surgery, Inc. | GUI for an implantable restriction device and a data logger |
| US8152710B2 (en) * | 2006-04-06 | 2012-04-10 | Ethicon Endo-Surgery, Inc. | Physiological parameter analysis for an implantable restriction device and a data logger |
| US7962220B2 (en) | 2006-04-28 | 2011-06-14 | Cyberonics, Inc. | Compensation reduction in tissue stimulation therapy |
| US7869885B2 (en) | 2006-04-28 | 2011-01-11 | Cyberonics, Inc | Threshold optimization for tissue stimulation therapy |
| US7869867B2 (en) | 2006-10-27 | 2011-01-11 | Cyberonics, Inc. | Implantable neurostimulator with refractory stimulation |
| US7869884B2 (en) | 2007-04-26 | 2011-01-11 | Cyberonics, Inc. | Non-surgical device and methods for trans-esophageal vagus nerve stimulation |
| US7962214B2 (en) | 2007-04-26 | 2011-06-14 | Cyberonics, Inc. | Non-surgical device and methods for trans-esophageal vagus nerve stimulation |
| US7904175B2 (en) | 2007-04-26 | 2011-03-08 | Cyberonics, Inc. | Trans-esophageal vagus nerve stimulation |
| US7974701B2 (en) | 2007-04-27 | 2011-07-05 | Cyberonics, Inc. | Dosing limitation for an implantable medical device |
| US8417329B2 (en) * | 2007-05-09 | 2013-04-09 | Metacure Ltd. | Analysis and regulation of food intake |
| US7925351B2 (en) | 2007-06-13 | 2011-04-12 | Betastim, Ltd. | Gastrointestinal device for treating obesity and diabetes |
| WO2009013749A2 (en) * | 2007-07-24 | 2009-01-29 | Betastim, Ltd. | Duodenal eating sensor |
| EP2214601B1 (en) * | 2007-10-11 | 2023-11-29 | Implantica Patent Ltd. | Apparatus for controlling food flow through the stomach of a patient |
| HUE058738T2 (hu) * | 2007-10-11 | 2022-09-28 | Implantica Patent Ltd | Készülék nõi nemi diszfunkció kezelésére |
| CA2739833C (en) * | 2007-10-11 | 2022-09-27 | Peter Forsell | Apparatus for controlling flow in a bodily organ |
| EP2211789B1 (en) * | 2007-10-11 | 2023-06-07 | Implantica Patent Ltd. | Apparatus and method for controlling food flow through a compartmentalized stomach of a patient |
| US7865240B2 (en) | 2007-12-28 | 2011-01-04 | Betastim, Ltd. | Implantable pulse generator programming via electrodes |
| CN102056645B (zh) * | 2008-04-04 | 2015-07-01 | 安特罗麦迪克斯公司 | 用于葡萄糖调节的方法和系统 |
| US8204603B2 (en) | 2008-04-25 | 2012-06-19 | Cyberonics, Inc. | Blocking exogenous action potentials by an implantable medical device |
| US8457747B2 (en) | 2008-10-20 | 2013-06-04 | Cyberonics, Inc. | Neurostimulation with signal duration determined by a cardiac cycle |
| US20100185049A1 (en) | 2008-10-22 | 2010-07-22 | Allergan, Inc. | Dome and screw valves for remotely adjustable gastric banding systems |
| US20100191304A1 (en) | 2009-01-23 | 2010-07-29 | Scott Timothy L | Implantable Medical Device for Providing Chronic Condition Therapy and Acute Condition Therapy Using Vagus Nerve Stimulation |
| CA2757599C (en) * | 2009-04-03 | 2017-09-05 | Intrapace, Inc. | Feedback systems and methods for communicating diagnostic and/or treatment signals to enhance obesity treatments |
| FR2955179B1 (fr) * | 2010-01-13 | 2019-11-08 | Universite De Bordeaux 1 | Capteur pour la mesure des besoins d'insuline d'un patient et procede de fabrication de celui-ci |
| WO2011092710A2 (en) | 2010-02-01 | 2011-08-04 | Metacure Limited | Gastrointestinal electrical therapy |
| US8840541B2 (en) | 2010-02-25 | 2014-09-23 | Apollo Endosurgery, Inc. | Pressure sensing gastric banding system |
| US20110270024A1 (en) | 2010-04-29 | 2011-11-03 | Allergan, Inc. | Self-adjusting gastric band having various compliant components |
| US9028394B2 (en) | 2010-04-29 | 2015-05-12 | Apollo Endosurgery, Inc. | Self-adjusting mechanical gastric band |
| US9044298B2 (en) | 2010-04-29 | 2015-06-02 | Apollo Endosurgery, Inc. | Self-adjusting gastric band |
| US20110270025A1 (en) | 2010-04-30 | 2011-11-03 | Allergan, Inc. | Remotely powered remotely adjustable gastric band system |
| US9226840B2 (en) | 2010-06-03 | 2016-01-05 | Apollo Endosurgery, Inc. | Magnetically coupled implantable pump system and method |
| US9211207B2 (en) | 2010-08-18 | 2015-12-15 | Apollo Endosurgery, Inc. | Power regulated implant |
| US20120059216A1 (en) | 2010-09-07 | 2012-03-08 | Allergan, Inc. | Remotely adjustable gastric banding system |
| US8961393B2 (en) | 2010-11-15 | 2015-02-24 | Apollo Endosurgery, Inc. | Gastric band devices and drive systems |
| US8876694B2 (en) | 2011-12-07 | 2014-11-04 | Apollo Endosurgery, Inc. | Tube connector with a guiding tip |
| US8961394B2 (en) | 2011-12-20 | 2015-02-24 | Apollo Endosurgery, Inc. | Self-sealing fluid joint for use with a gastric band |
| US8382775B1 (en) | 2012-01-08 | 2013-02-26 | Vibrynt, Inc. | Methods, instruments and devices for extragastric reduction of stomach volume |
| US9314362B2 (en) | 2012-01-08 | 2016-04-19 | Vibrynt, Inc. | Methods, instruments and devices for extragastric reduction of stomach volume |
| US9486623B2 (en) | 2014-03-05 | 2016-11-08 | Rainbow Medical Ltd. | Electrical stimulation of a pancreas |
| CN107335137B (zh) * | 2016-04-28 | 2021-04-27 | 台湾共振波研发股份有限公司 | 糖尿病舒缓系统 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1017495B (zh) * | 1990-09-12 | 1992-07-22 | 尹振敏 | 胃肠治疗仪 |
| US5188104A (en) * | 1991-02-01 | 1993-02-23 | Cyberonics, Inc. | Treatment of eating disorders by nerve stimulation |
| US5231988A (en) * | 1991-08-09 | 1993-08-03 | Cyberonics, Inc. | Treatment of endocrine disorders by nerve stimulation |
| US5292344A (en) * | 1992-07-10 | 1994-03-08 | Douglas Donald D | Percutaneously placed electrical gastrointestinal pacemaker stimulatory system, sensing system, and pH monitoring system, with optional delivery port |
| US5690691A (en) * | 1996-05-08 | 1997-11-25 | The Center For Innovative Technology | Gastro-intestinal pacemaker having phased multi-point stimulation |
| EP0996482B1 (en) * | 1997-07-16 | 2007-02-14 | Metacure NV | Smooth muscle controller |
| US8019421B2 (en) * | 1999-03-05 | 2011-09-13 | Metacure Limited | Blood glucose level control |
| US6600953B2 (en) * | 2000-12-11 | 2003-07-29 | Impulse Dynamics N.V. | Acute and chronic electrical signal therapy for obesity |
| US7437195B2 (en) * | 2001-01-05 | 2008-10-14 | Metalure N.V. | Regulation of eating habits |
| CN1617753A (zh) * | 2001-11-29 | 2005-05-18 | 冲击动力股份有限公司 | 胰腺电活性的感测 |
-
2004
- 2004-07-21 JP JP2006520981A patent/JP4960700B2/ja not_active Expired - Lifetime
- 2004-07-21 CN CN2004800272833A patent/CN1856338B/zh not_active Expired - Fee Related
- 2004-07-21 WO PCT/IL2004/000664 patent/WO2005007232A2/en active Application Filing
- 2004-07-21 EP EP04745004A patent/EP1646423A4/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| CN1856338B (zh) | 2012-11-14 |
| JP2006528019A (ja) | 2006-12-14 |
| CN1856338A (zh) | 2006-11-01 |
| WO2005007232A2 (en) | 2005-01-27 |
| EP1646423A2 (en) | 2006-04-19 |
| WO2005007232A3 (en) | 2005-08-04 |
| EP1646423A4 (en) | 2010-09-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4960700B2 (ja) | 疾患を治療し、血糖を制御する際に使用するための胃腸処置方法および装置 | |
| JP4943841B2 (ja) | 障害を治療する上で使用するための胃腸方法及び器具 | |
| US8792985B2 (en) | Gastrointestinal methods and apparatus for use in treating disorders and controlling blood sugar | |
| US7437195B2 (en) | Regulation of eating habits | |
| US8295932B2 (en) | Ingestible capsule for appetite regulation | |
| EP1395169B1 (en) | Analysis of eating habits | |
| US6993391B2 (en) | Acute and chronic electrical signal therapy for obesity | |
| US20120277619A1 (en) | Detecting food intake based on impedance | |
| US20070060971A1 (en) | Hepatic device for treatment or glucose detection | |
| US20050222638A1 (en) | Sensor based gastrointestinal electrical stimulation for the treatment of obesity or motility disorders | |
| US8855770B2 (en) | Duodenal eating sensor | |
| EP2150308A2 (en) | Analysis and regulation of food intake | |
| WO2004112883A2 (en) | Hepatic device for treatment or glucose detection |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070723 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070723 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100413 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100713 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110201 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110502 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110712 |
|
| A524 | Written submission of copy of amendment under section 19 (pct) |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20111011 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120306 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120323 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150330 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4960700 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |