JP3847554B2 - Magnetic resonance imaging system - Google Patents
Magnetic resonance imaging system Download PDFInfo
- Publication number
- JP3847554B2 JP3847554B2 JP2000368220A JP2000368220A JP3847554B2 JP 3847554 B2 JP3847554 B2 JP 3847554B2 JP 2000368220 A JP2000368220 A JP 2000368220A JP 2000368220 A JP2000368220 A JP 2000368220A JP 3847554 B2 JP3847554 B2 JP 3847554B2
- Authority
- JP
- Japan
- Prior art keywords
- measurement
- space
- region
- magnetic resonance
- data
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000002595 magnetic resonance imaging Methods 0.000 title claims description 26
- 238000005259 measurement Methods 0.000 claims description 200
- 230000002093 peripheral effect Effects 0.000 claims description 52
- 238000005481 NMR spectroscopy Methods 0.000 claims description 17
- 238000009826 distribution Methods 0.000 claims description 8
- 239000013589 supplement Substances 0.000 claims description 3
- 238000000691 measurement method Methods 0.000 description 22
- 238000000034 method Methods 0.000 description 22
- 239000002872 contrast media Substances 0.000 description 16
- 238000001208 nuclear magnetic resonance pulse sequence Methods 0.000 description 12
- 238000003384 imaging method Methods 0.000 description 10
- 230000005540 biological transmission Effects 0.000 description 8
- 210000004204 blood vessel Anatomy 0.000 description 8
- 230000017531 blood circulation Effects 0.000 description 7
- 238000010586 diagram Methods 0.000 description 6
- 230000015556 catabolic process Effects 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 230000003068 static effect Effects 0.000 description 4
- 238000002583 angiography Methods 0.000 description 3
- 238000009877 rendering Methods 0.000 description 3
- 230000000593 degrading effect Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 230000002123 temporal effect Effects 0.000 description 2
- 230000004087 circulation Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000002594 fluoroscopy Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
Images
Landscapes
- Magnetic Resonance Imaging Apparatus (AREA)
Description
【0001】
【発明の属する技術分野】
本発明は、核磁気共鳴現象を利用して被検体の断層画像を得る磁気共鳴イメージング装置(MRI)に関し、特に、磁気共鳴イメージング装置おけるダイナミック磁気共鳴アンジオグラフィ撮像に好適な計測方法に関するものである。
【0002】
【従来の技術】
MRI(磁気共鳴イメージング装置)は、NMR現象を利用して、被検体中の所望の検査部位における原子核スピンの密度分布、緩和時間分布等を計測して、その計測データから被検体の任意の断面を画像表示するものである。
【0003】
また、このような磁気共鳴イメージング装置を利用して血流画像を得る技術は、MRA(磁気共鳴アンジオグラフィ)と呼ばれる。このMRAは、造影剤を使用しない手法と造影剤を使用する手法に大別することができる。
【0004】
造影剤を用いるMRAの手法としては、Gd-DTPA等のT1短縮型の造影剤とグラジエントエコー系のTRの短いパルスシーケンスを組み合わせる手法が一般的である。この手法では、数ms〜数10msの短時間間隔の高周波磁場による同一領域の励起の繰り返しによって、血流以外の部分のスピンを飽和させ、T1の短い造影剤を含むためにスピンの飽和が起こりにくい血流部分からの信号を高信号で得る。造影剤が血管内にとどまっている間に血管を含む体積の計測を行うことにより血管を他組織に対し高コントラストで描出することができる。さらに、造影前後の画像差分をとるによって、血流部分のコントラストを上げた画像を得る手法DSA(Digital Substraction Angiography)も行われている。
【0005】
このような造影剤を用いるMRAの手法では、通常肘静脈から造影剤を注入する。注入された造影剤は、心臓、動脈系、毛細血管、静脈系と順に循環する。そこで、ダイナミックMRAと呼ばれる技術では、造影剤の循環の各段階において繰り返し計測を行い、各部の血流の時系列画像が得られるようにしている。このような造影剤を用いるMRAの手法やダイナミックMRAについては、例えば「3D Contrast MRAngiography 2nd edition. Prince MR, Grist TM and Debatin JF, Springer, pp3-39,1988」に詳細に記載されている。
【0006】
このようなダイナミックMRAにおける1回の撮像時間は、2次元計測の場合は繰り返し時間TRと位相エンコードステップ数を乗じた時間となり、3次元計測の場合は繰り返し時間TRと位相エンコードステップ数にスライスエンコードステップ数を乗じた時間となる。したがって、空間分解能を向上するためには位相エンコードステップ数やスライスエンコードステップ数を大きくとることが望ましい一方、そのようにすると時間分解能は低下する。すなわち基本的に空間分解能と時間分解能はトレードオフの関係にある。
【0007】
そこで、このような問題を解決するために、計測の繰り返しにおいて前の回で計測したデータを共有するMRフルオロスコピーと呼ばれる手法や、全エンコードステップについては計測したデータをレファレンスとして、以後は一部の領域(低周波領域)のみを計測し更新するキーホール法と呼ばれる手法がある。さらに米国特許5,713,358号、米国特許5,830,143号には、次のような計測方法を提案している。
【0008】
すなわち、これらの技術では、一回の計測においてk空間全てを計測するのではなく、ky-kz空間をky方向に複数の領域に分割し、分割した領域を単位として、k空間の中心領域(低周波数領域)をより高い頻度で、周辺領域をより低い頻度で計測するように、各回で計測するk空間の部分を制御する。そして、今回計測しなかったk空間の部分については、それ以前に計測した回の計測結果を流用する。または、それ以前に計測した複数の回の計測結果から補間によって生成する。
【0009】
この技術によれば、各回の計測において位相エンコードステップの全てを実行しないために、各回の計測時間を短縮し時間分解能を向上することができると共に、比較的、診断に重要なコントラストを決定するk空間の中心領域(低周波領域)については経時的な変化を確実に捉えることができる。
【0010】
【発明が解決しようとする課題】
しかしながら、前記米国特許に記載される技術では、高周波領域のデータについては低い頻度でしか計測されないため、高周波数領域の時間分解能の犠牲が著しく大きかった。また、k空間の分割の仕方がky方向のみと一次元方向のみであるために、計測結果に方向依存性が生じ、これによって生成される画像の品質を劣化する場合があった。
【0011】
そこで、本発明は、MRIにおいて繰り返し撮像を行う際に、高周波数領域の時間分解能を大きく劣化させることなく、各回の計測時間を短縮化する計測方法を提供することを課題とする。また、このような計測方法において、さらに、計測結果の方向依存性を排除することを課題とする。
【0012】
【課題を解決するための手段】
上記課題を達成するために、本発明は、MRI装置を用いて被検体の計測を繰り返し行う計測方法であって、k空間上に、k空間中央領域を含む必須計測領域と、各々前記必須計測領域と重複した領域を持たない周辺計測領域とを設定する初期設定ステップと、周辺計測領域に存在する全サンプル点を、その空間的分布がほぼ均等な複数の群に分けるステップと、前記k空間に配置されるデータとして前記被検体からの核磁気共鳴信号を計測する計測ステップと、前記計測ステップを繰り返し行う繰り返しステップとを有し、前記繰り返しステップによって繰り返し行われる各回の計測ステップは、前記必須計測領域のデータと、前記周辺計測領域の複数の群から選択した一つの群のデータの計測を含み、各回毎に選択する群を順次変更することを特徴とするMRI装置における計測方法を提供する。
【0013】
ここで「サンプル点の空間的分布がほぼ均等な群」とは、各群のサンプル点が、それぞれ空間的に偏りがない(k空間の中心に対し、ほぼ等方的に分布する)状態で存在し、かつ各群が互いに同等であることを意味する。
【0014】
本発明のMRIにおける計測方法は、さらに、計測ステップで計測したデータを用いて画像再構成するステップを含み、当該画像再構成するステップは、今回の計測ステップで計測しなかった群のデータを、他の回(過去の回)の計測ステップで計測された群のデータを用いて生成し、周辺計測領域に補充し、この補充されたk空間のデータに基づいて画像を生成することを特徴とする。
【0015】
このような計測方法によれば、各回の計測ステップにおける測定されるデータに、高周波領域の成分として、必ず周辺計測領域分の一つの群のデータが含まれることになるため、前記従来のk空間分割計測手法(米国特許5,713,358号、米国特許5,830,143号等)に比べ、高周波数領域の時間分解能の劣化は小さく、生成画質の劣化も小さい。しかも各回の周辺計測領域のデータは、空間的に均等であるので、計測結果に方向依存性が生じることがない。
【0016】
本発明の計測方法は、好適には3次元のk空間の計測に適用される。この場合、必須領域と周辺領域を設定するステップにおいて、当該3次元のk空間全体を、前記3次元のk空間を規定する3つの座標軸のうちの少なくとも2つの座標軸で決まる2次元空間について必須計測領域と周辺計測領域を設定する。
一般に3次元k空間の計測法においては、スライスエンコード方向(kz軸)のサンプル数および/または位相エンコード方向(ky軸)のエンコードステップを間引いたときに計測時間の低減効果を得ることができる。従って、本発明の計測方法においてもこれらに2軸で決まる空間について、周波数領域の群の分割を行うことにより、計測時間低減による時間分解能の向上を高めることができる。
【0017】
また、このような計測方法において、k空間の全領域を計測するのではなく、その一部を非計測とすることができる。即ち、必須計測領域および周辺計測領域の和集合空間に外接する直方体状のk空間は、和集合空間と重複しない、非計測領域を有するものとすることができる。この場合、非計測領域についてはゼロデータを埋めて画像再構成する。このように、直方体状のk空間のうちの、計測目的上重要でない空間周波数部分を非計測領域とすることにより、計測目的への適合度を大きく損なうことなく、時間分解能を向上することができる。
【0018】
本発明の計測方法では、さらに、周辺測定領域を低中周波領域と高周波領域に分割し、低中周波領域と高周波領域で、分割する群の数を異ならせることも可能である。例えば低中周波領域の分割数を少なくすることにより、低中周波領域で計測するサンプル点の密度を高くし、この領域が画像コントラストに寄与する部分の画質の劣化を防止することができる。
【0019】
本発明のMRI装置は、被検体に核磁気共鳴を起させる手段と、前記核磁気共鳴信号に位相エンコードを付与する手段と、前記核磁気共鳴信号を測定し、前記核磁気共鳴信号に基づき画像を再構成する手段とを備えた磁気共鳴イメージング装置であって、前記各手段を制御し、位相エンコードで決るk空間の計測を制御する制御手段と、k空間上の、k空間中央領域を含む必須計測領域と、前記必須計測領域と重複した領域を持たない周辺計測領域との設定および前記周辺計測領域のサンプル点を空間的分布が均等である複数の群に分割した群の設定を記憶する記憶手段とを有し、制御手段は、被検体の計測を繰り返し行う制御を行うと共に、繰り返し行う各回の計測において、前記必須計測領域のデータと、計測の各回毎に順次選択した一つの周辺計測領域の群のデータとを計測し、今回の計測で計測しなかった群のデータを、他の回の計測で計測された群のデータを用いて生成し、周辺計測領域に補充することを特徴とする。
【0020】
【発明の実施の形態】
以下、本発明の実施形態について、ダイナミックMRAへの適用を例にとり説明する。
【0021】
図1に、本実施形態に係るMRI装置の構成を示す。
図示するように、このMRI装置は、NMR現象を利用して被検体の断層像を得るもので、静磁場発生磁石2と、傾斜磁場発生系3と、シーケンサ4と、送信系5と、受信系6と、信号処理系7と、中央処理装置(CPU)8とを備えて成る。
【0022】
静磁場発生磁石2は、被検体1の周りにその体軸方向または体軸と直交する方向に均一な静磁場を発生させるもので、被検体1の周りのある広がりをもった空間に永久磁石方式または常電導方式あるいは超電導方式の磁場発生手段が配置されている。
【0023】
傾斜磁場発生系3は、X,Y,Zの三軸方向に巻かれた傾斜磁場コイル9と、それぞれの傾斜磁場コイルを駆動する傾斜磁場電源10とから成り、後述のシーケンサ4からの命令に従ってそれぞれのコイルの傾斜磁場電源10を駆動することにより、X,Y,Zの三軸方向の傾斜磁場Gx,Gy,Gzを被検体1に印加するようになっている。この傾斜磁場の加え方により被検体1の特定のスライス又はスラブを選択的に励起することができ、また計測空間(k空間)における計測点(サンプル点)の位置、計測順序を規定することができる。
【0024】
シーケンサ4は、CPU8の制御で動作し、被検体1の断層像のデータ収集に必要な種々の命令を、傾斜磁場発生系3、送信系5及び受信系6に送るようになっている。シーケンサ4が制御する傾斜磁場発生系3、送信系5及び受信系6の動作タイミングはパルスシーケンスと呼ばれ、ここではパルスシーケンスの一つとして三次元血流撮像のためのシーケンスが採用される。このパルスシーケンスはCPU8に備えられたメモリに予めプログラムとして組み込まれており、他のパルスシーケンスと同様、使用者が撮影の目的に応じて適宜選択することにより実行することができる。シーケンサ4の制御については後に詳述する。
【0025】
送信系5は、シーケンサ4から送り出される高周波パルスにより被検体1の生体組織を構成する原子の原子核に核磁気共鳴を起こさせるために高周波磁場を照射するもので、高周波発振器11と変調器12と高周波増幅器13と送信側の高周波コイル14aとから成る。高周波発振器11から出力された高周波パルスをシーケンサ4の命令にしたがって変調器12で振幅変調し、この振幅変調された高周波パルスを高周波増幅器13で増幅した後に被検体1に近接して配置された高周波コイル14aに供給することにより、電磁波が被検体1に照射されるようになっている。
【0026】
受信系6は、被検体1の生体組織の原子核の核磁気共鳴により放出されるエコー信号(NMR信号)を検出するもので、受信側の高周波コイル14bと増幅器15と直交位相検波器16とA/D変換器17とから成る。上記送信側の高周波コイル14aから照射された電磁波による被検体1の応答の電磁波(NMR信号)は被検体1に近接して配置された高周波コイル14bで検出される。検出されたエコー信号は、増幅器15及び直交位相検波器16を介してA/D変換器17に入力されディジタル量に変換され、さらにシーケンサ4からの命令によるタイミングで直交位相検波器16によりサンプリングされた二系列の収集データとされ、信号処理系7に送られる。
【0027】
信号処理系7は、CPU8と、磁気ディスク18及び磁気テープ19等の記録装置と、CRT等のディスプレイ20とから成り、CPU8で3次元フーリエ変換、補正係数計算像再構成等の処理を行い、任意断面の信号強度分布あるいは複数の信号に適当な演算を行って得られた分布を画像化してディスプレイ20に断層像として表示するようになっている。なお、図1において、送信側及び受信側の高周波コイル14a、14bと傾斜磁場コイル9は、被検体1の周りの空間に配置された静磁場発生磁石2の磁場空間内に設置されている。
【0028】
次に、このようなMRI装置における、ダイナミックMRA撮像動作について説明する。
まず、CPU8の入力装置を介して造影剤を用いたMRAが選択されると、シーケンス4はCPU8によって制御され、三次元MRAシーケンスを実行する。
【0029】
このパルスシーケンスは、例えば図2に示すように、グラディエントエコー法を基本とするシーケンスで、三次元MRAシーケンスに一般的なものである。ただし、Gradient Moment Nulling 等のフローコンペンセーションなどが付加される場合もある。
【0030】
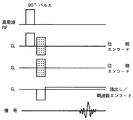
図示した例では、高周波磁場パルスRFを印加して目的血管を含む領域(スラブ)を励起した後、Z方向の位相エンコード傾斜磁場GzおよびY方向の位相エンコード傾斜磁場Gyを印加し、次いで読み出し/周波数エンコード傾斜磁場Gxを印加するとともにその極性を反転させてエコー信号を計測している。3次元イメージングでは、このようなパルスシーケンスを、Z方向の位相エンコード傾斜磁場Gz、Y方向の位相エンコード傾斜磁場Gyの磁場強度の組み合わせを変えながら、所定の繰り返し時間TRで繰り返すことによって、三次元データを得る。
【0031】
ここで、Z、Y方向のエンコードステップ数はZ、Y方向の領域の分割数を決めるもので、例えばそれぞれ128、256などに設定されている。また、このZ、 Y方向のエンコードステップ数によってk空間のky−kz平面のマトリクスサイズが規定される。即ち、図2のシーケンスにおいて、傾斜磁場強度Gzのある値と傾斜磁場強度Gyのある値の組み合わせのときに計測された信号は、Gz、Gyの値に対応するk空間の座標(ky,kz)に配置されることになる。逆に言えば、k空間のky−kz平面のある座標(ky1、kz1)をサンプルするということは、ky1に対応するGyとkz1に対応するGzの組み合わせにおいて、図2のパルスシーケンスを実行することであり、座標(ky1、kz1)をサンプルしないということは、ky1に対応するGyとkz1に対応するGzの組み合わせにおいて、図2のパルスシーケンスの実行を省略するということである。
【0032】
従来の基本的なダイナミックMRAでは、各回の計測におけるZ、Y方向のエンコードステップ数、ステップ幅を固定として、毎回の計測において、全てのGyとGzの組み合わせについて図2のパルスシーケンスを実行し、全ての座標にデータが充足された3次元のk空間を得る。
【0033】
これに対し、本実施形態では、ダイナミックMRA撮像において、各回の計測におけるZ、Y方向のエンコードステップ数、ステップ幅を固定せずに、各回の計測を以下のように制御する。
【0034】
すなわち、本実施形態では、X方向の周波数エンコード数、Z, Y方向の位相エンコードステップ数に応じて大きさを定めたkx, ky, kzの座標軸を有する3次元k空間のky-kz平面上に、原点を中心とする略円形の中央領域である必須計測領域と、その周辺に周辺計測領域を設定する。そして周辺計測領域については、周辺計測領域に存在する全てのサンプル点を複数の群に分割する。その際、分割された各群において、サンプル点は空間的な偏りがないよう分布し、かつ各群が互いに同等であるように分割する。このようなサンプル点の設定分割は、後述する計測の順序とともに、CPU8のメモリに記憶される。
【0035】
各回の計測において、必須計測領域は必ず計測し、周辺計測領域の各群については所望の順序で一つずつ計測する。従って各群の数と同じ数の計測を終了した時点で、周辺計測領域の全てのサンプル点についてのデータを得ることになる。
【0036】
図3および図4に、第1の実施形態として周辺計測領域を3つの群に分割した場合を示す。ここでは、説明を簡単にするために、マトリックスサイズが5×9であるky−kz空間について説明する。
【0037】
本例では、図3に示すように、黒丸で示す、座標原点を含む11のサンプル点が必須計測領域であり、必須計測領域を除く他の領域が周辺計測領域である。周辺計測領域の34のサンプル点は、図3(a)、(b)、(c)に斜線が付された丸で示すように12、11、11に3分割されており、それぞれ空間的にほぼ均等に分散している。
【0038】
最初の計測では、まず図4に示すように、必須計測領域の11のサンプル点と(a)に示す群(以下、群aとする)の計測を行い、必須計測領域と周辺計測領域の12のサンプル点のデータを収集する。次に必須計測領域の11のサンプル点と(b)に示す群bの計測を行い、必須計測領域と周辺計測領域の群aとは異なる11のサンプル点のデータを収集する。さらに3回目の計測では、必須計測領域必須計測領域の11のサンプル点と周辺計測領域のうち群a、b以外の11のサンプル点のデータを収集する。
【0039】
この3回の計測で周辺計測領域について全てのデータが揃うので、ここでk空間の全領域のデータを用いて画像を再構成する。すなわち、3次元のk空間に対して3次元フーリエ変換を施し、3次元データを得、これを投影した2次元画像を得る。
【0040】
4回目の計測では、1回目の計測と同様に必須計測領域と群aについての計測を行い、必須計測領域のデータと周辺計測領域の一部のデータを得る。この回で得られなかった周辺計測領域のデータについては、既に2回目および3回目の計測で得た周辺計測領域のデータを用い、必須計測領域と全ての周辺計測領域のデータが充填された3次元データを作成し、この3次元データを用いて画像を再構成する。
【0041】
5回目以降は、同様に、その回で得た必須計測領域のデータと周辺計測領域の一部のデータと、その回に最も近い過去2回の計測で得た周辺計測領域のデータを用いて、3次元データを作成し、画像再構成する。
【0042】
このようにすることで、1回の計測時間を、k空間の全領域のデータを計測する場合に比べ、大幅に(前掲の例で約1/2程度)短縮することができ、その1回の計測時間と同じ間隔で画像を再構成することができるので、ダイナミックMRAで表示される画像の時間分解能を向上することができる。また形成される画像(すなわち更新される画像)は、k空間の全領域のデータを用いているので、低周波領域のみならず、高周波領域についても画像の劣化がない。さらに低周波領域のデータについては常にその領域内の全サンプル点のデータを含んでいるので、コントラストの高い血流画像を得ることができる。
【0043】
次にサンプル点の計測順序について説明する。k空間を計測する順序としては、セントリックオーダー、シーケンシャルオーダー等が知られている。本発明の計測方法では、これらのいずれも採用できるが、図4に示す例では、サンプル点の原点からの距離によって順序を決めている。すなわち、本例では、まずk空間をky軸またはkz軸に沿って2分割し、一方の領域(例えば、図中下側のE―C領域)では、サンプル点を原点からの距離が遠い順に計測順序をソートし、他方の領域(図中、上側の領域C−E領域)では、サンプル点を原点からの距離が近い順に計測順序をソートする。このように計測順序をソートした後、E−C領域の原点からの距離が最も遠いサンプル点から計測を開始し、その後はソートした計測順序に従って計測を進め、C−E領域の、原点からの距離が最も遠いサンプル点で計測を終了する。あるサンプル点を計測するということは、既に説明したように、そのサンプル点の座標(ky、kz)に対応するスライスエンコード傾斜磁場強度および位相エンコード傾斜磁場強度で、例えば図2のパルスシーケンスを実行することを意味する。
【0044】
このような計測順序は、群が異なっていても同様とする。この計測順序によれば、計測開始から終了までの中央の時点を含む比較的広い時間範囲で低周波領域のデータを計測することになるので、目的とする血管の造影剤濃度が最も高い時点で、低周波領域を計測するようにタイミングを合わせることが容易となるという利点がある。これにより、目的血管についての画像を高コントラストで描画することができる。
【0045】
但し、本発明の計測方法は、このような計測順序に限定されず、例えば図5に示すように、図中、左下端のサンプル点を開始点として、順番に右端まで進み、右端においてkz軸を一つ上に進み、今度は左端に進むというようなシーケンシャルオーダーで行うことも可能である。
【0046】
次に本発明の第2の実施形態として、周辺計測領域をさらに低中周波領域と高周波領域に分割し、それぞれについて領域内のサンプル点を空間的に均等な群に分ける場合を説明する。
【0047】
本例では、図6に示すように、k空間を原点を含む低周波領域の必須計測領域61と、その外側の低中周波領域62と、さらにその外側の高周波領域63に分割する。各領域は互いに排他的な領域であって重ならない。必須計測領域61は、第1の実施形態と同様に、各回の計測でデータ計測を行う領域であり、低中周波領域62と高周波領域63は、サンプル点が空間的に均等である複数の群に分割されており、各回の計測では群の一つずつを順次計測する。この場合、低中周波領域62と高周波領域63とでは、群の分割数を異ならせ、例えば低中周波領域62は2つの群a、bからなり、高周波領域は4つの群a〜dからなる。これは、1回の計測で計測されるサンプル点の密度が、必須計測領域61を1とするとき、低中周波領域62ではその1/2、高周波領域63では1/4になることと同義である。
【0048】
この場合、1回目の計測では、必須計測領域61と低中周波領域の群aと高周波領域の群aを計測し、次の計測では必須計測領域61と低中周波領域の群bと高周波領域の群bを計測し、3回目の計測では必須計測領域61と低中周波領域の群aと高周波領域の群cを計測する、というように、低中周波領域および高周波領域は、それぞれの群を順次、サイクリックに計測する。
【0049】
高周波領域の計測が一巡する4回目で、3次元k空間を埋めるデータが得られ、この3次元データを用いて画像を再構成する。以降は、各回の計測毎にその回で計測したデータと、その回で計測されず、過去の回で計測されたデータを用いて3次元データを作成し画像を再構成する。
【0050】
この実施形態においても、サンプル点の計測順序は、図4に示したようにE−C領域およびC−E領域について、それぞれサンプル点を原点からの距離によって計測順序にソートし計測してもよいし、図5に示したようにシーケンシャルオーダーで計測してもよい。
【0051】
第2の実施形態においても、第1の実施形態と同様に、1回の計測時間を短縮し、画像の時間分解能を向上することができ、その際、低周波領域のみならず高周波領域についても画像の劣化をなくすることができる。またこの実施形態では、周辺計測領域を2つに分割したことにより、目的とする血管の太さなどに応じて高コントラストで血管描出することができる。なお、周辺計測領域の分割数や、周辺計測領域をさらに分割した群のサンプル密度は、撮影の目的に併せて任意に変更することができる。
【0052】
さらに第3の実施形態を説明する。この実施形態では、図7に示すように、k空間を必須計測領域71、周辺計測領域72、非計測領域73に3分割する。必須計測領域71は、図3および図6に示す実施例と同様に、各回の計測で計測する領域である。周辺計測領域72は、この必須計測領域71の外側の領域で、第1の実施形態と同様に、サンプル点が空間的に均等である複数の群に分割されている。この分割数も第1の実施形態と同様に任意である。各計測において、群は一つずつ順次計測される。非計測領域73は、計測を行わない領域である。
【0053】
なお、図では必須計測領域71を原点を中心とする円形(或いは楕円形)の領域とし、周辺計測領域をそれと同心円状の領域とする場合を示したが、これらは必須計測領域をk空間座標の辺と平行な或いは45度傾斜した四角形の組み合わせや、四角形と円形の組み合わせとしてもよい。これは周辺計測領域を2つに分割した図6に示す第2の実施形態についても同様である。
【0054】
この第3の実施形態についても、各回における必須計測領域71および周辺計測領域72の計測は、第1の実施形態と同じであるが、診断等に比較的重要でない3次元のk空間上の角の領域を非計測領域とすることにより、より短い時間で計測を繰り返せるようになるので、比較的小さな画質の劣化において時間分解能を向上することができる。
【0055】
この場合にも画像再構成は、各回毎に行われ、その回で得られた必須計測領域のデータおよび周辺計測領域の一つの群のデータと、その回で得られず最近の過去の回で得られた他の群のデータとを用いると共に、非計測領域についてはゼロフィリングしたデータを用いて3次元データとし、これを3次元フーリエ変換することにより3次元画像データを得る。この3次元画像データから2次元投影画像を作成することは前述の二つの実施形態と同様である。
【0056】
3次元画像データからの画像表示法および2次元投影画像の作成は、公知の手法を用いて行うことができる。例えば、再構成した3次元データと、造影剤投入前に計測しておいて3次元データとの差分をとり、これを最終的な3次元データとしてもよい。この差分は、複素差分であることが好ましいが、強度絶対値の差分であっても良い。また、今回のk空間データと造影剤投入前に計測しておいたk空間データとのk空間データ同士で複素差分を取った後に再構成を行うようにしてもよい。
【0057】
さらに3次元データを、MIP或いはMinIP等の光軸軌跡法を用いて、冠状断、矢状断、軸横断等の任意の方向に投影し2次元画像を生成し、表示する。この場合、ある軸を中心として投影方向を回転させながら順次二次元画像を生成し、これらをつなげて動画像を生成するようにしてもよい。
【0058】
さらにSurface rendering、Volume renderingなどの周知のレンダリング手法を用いてもよい。
以上、本発明の実施形態として、ky-kz方向について必須計測領域および周辺計測領域の境界を設定する場合について説明したが、これはkx,ky,kzの3方向のうちの任意の方向、または、任意の2つの方向の組み合わせ、または、3方向の全てについて、必須計測領域および周辺計測領域の境界を設定するようにしてもよい。
【0059】
また、以上では、Z方向とY方向について位相エンコーディングを行うことにより3次元計測を行う場合について説明したが、Z方向についてはスライス選択傾斜磁場とRFパルスの組み合わせによって、その位置をエンコードする3次元計測を行う場合についても、以上の必須計測領域および周辺計測領域を用いた計測は同様に適用することができる。
【0060】
さらに以上では3次元計測を行う場合について説明したが、2次元計測(1スライス毎の計測)を行う場合についてもkx-ky方向について必須計測領域および周辺計測領域の境界を設定することにより同様に適用することができる、
【0061】
本発明のMRI装置およびそれを用いた計測方法は、造影剤と用いたダイナミックMRAのみならず、MRIにおいて任意の繰り返し計測を行う場合について同様に適用することができる。
【0062】
【発明の効果】
以上のように、本発明によれば、MRIにおいて繰り返し撮像を行う際に、高周波数領域の時間分解能を大きく劣化させることなく、各回の計測時間を短縮化する計測方法を提供することができる。また、このような計測方法において、さらに、計測結果の方向依存性を排除することができる。
【図面の簡単な説明】
【図1】本発明の実施形態に係る磁気共鳴イメージング装置の構成を示すブロック図。
【図2】本発明の実施形態に係る計測に用いることのできるパルスシーケンスの例を示すタイミングチャート。
【図3】本発明の第1の実施形態によるky−kz空間の分割を示す図。
【図4】本発明の第1の実施形態による計測法を示す図。
【図5】本発明の第1の実施形態による計測法を示す図。
【図6】本発明の第2の実施形態による計測法を示す図。
【図7】本発明の第3の実施形態による計測法を示す図。
【符号の説明】
1…被検体
2…磁場発生装置
3…傾斜磁場発生系
4…シーケンサ
5…送信系
6…受信系
7…信号処理系
8…CPU
9…傾斜磁場コイル
14a…送信側の高周波コイル
14b…受信側の高周波コイル[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a magnetic resonance imaging apparatus (MRI) for obtaining a tomographic image of a subject using a nuclear magnetic resonance phenomenon, and more particularly to a measurement method suitable for dynamic magnetic resonance angiography imaging in a magnetic resonance imaging apparatus. .
[0002]
[Prior art]
MRI (Magnetic Resonance Imaging System) uses NMR phenomena to measure the nuclear spin density distribution, relaxation time distribution, etc. at the desired examination site in the subject, and from the measurement data to any cross section of the subject Is displayed as an image.
[0003]
A technique for obtaining a blood flow image using such a magnetic resonance imaging apparatus is called MRA (magnetic resonance angiography). This MRA can be roughly divided into a technique that does not use a contrast agent and a technique that uses a contrast agent.
[0004]
As a method of MRA using a contrast agent, a method of combining a T1 shortening type contrast agent such as Gd-DTPA and a pulse sequence having a short TR of a gradient echo system is common. In this method, by repeating excitation of the same region by a high-frequency magnetic field with a short time interval of several ms to several tens of ms, the spin of the part other than the blood flow is saturated and the spin saturation occurs because the T1 short contrast agent is included. A high signal is obtained from a difficult blood flow portion. By measuring the volume including the blood vessel while the contrast agent remains in the blood vessel, the blood vessel can be depicted with high contrast to other tissues. Furthermore, a technique for obtaining an image in which the contrast of a blood flow part is increased by taking an image difference before and after contrast is also performed.
[0005]
In the MRA technique using such a contrast agent, the contrast agent is usually injected from the elbow vein. The injected contrast medium circulates in order of the heart, the arterial system, the capillaries, and the venous system. Therefore, in a technique called dynamic MRA, measurement is repeatedly performed at each stage of the circulation of the contrast agent, and a time-series image of blood flow in each part is obtained. The MRA technique using such a contrast agent and dynamic MRA are described in detail in, for example, “3D Contrast MR Angiography 2nd edition. Prince MR, Grist ™ and Debatin JF, Springer, pp 3-39, 1988”.
[0006]
In such dynamic MRA, one imaging time is a time obtained by multiplying the repetition time TR and the number of phase encoding steps in the case of two-dimensional measurement, and slice encoding is performed on the repetition time TR and the number of phase encoding steps in the case of three-dimensional measurement. It is the time multiplied by the number of steps. Therefore, in order to improve the spatial resolution, it is desirable to increase the number of phase encoding steps and the number of slice encoding steps, but if this is done, the temporal resolution decreases. That is, basically, spatial resolution and temporal resolution are in a trade-off relationship.
[0007]
Therefore, in order to solve such problems, a method called MR fluoroscopy that shares the data measured in the previous round in the repetition of the measurement, and the measured data as a reference for all encoding steps, and some later There is a technique called a keyhole method that measures and updates only this region (low frequency region). Further, US Pat. No. 5,713,358 and US Pat. No. 5,830,143 propose the following measuring methods.
[0008]
That is, in these techniques, the entire k-space is not measured in one measurement, but the ky-kz space is divided into a plurality of regions in the ky direction, and the central region of k-space ( The portion of the k space that is measured each time is controlled so that the low frequency region) is measured at a higher frequency and the surrounding region is measured at a lower frequency. And about the part of k space which was not measured this time, the measurement result of the time measured before that is diverted. Alternatively, it is generated by interpolation from a plurality of measurement results measured before that time.
[0009]
According to this technique, since all of the phase encoding steps are not executed in each measurement, the measurement time of each time can be shortened and the time resolution can be improved, and a relatively important contrast for diagnosis can be determined. With respect to the central region (low frequency region) of the space, changes over time can be reliably captured.
[0010]
[Problems to be solved by the invention]
However, in the technique described in the above-mentioned US patent, since the data in the high frequency region is measured only with a low frequency, the sacrifice of the time resolution in the high frequency region is significantly large. In addition, since the k-space is divided only in the ky direction and only in the one-dimensional direction, the measurement result may be dependent on the direction, which may deteriorate the quality of the generated image.
[0011]
Therefore, an object of the present invention is to provide a measurement method that shortens the measurement time of each time without greatly degrading the time resolution in the high frequency region when performing repeated imaging in MRI. Further, in such a measurement method, it is further an object to eliminate the direction dependency of the measurement result.
[0012]
[Means for Solving the Problems]
In order to achieve the above object, the present invention provides a measurement method for repeatedly measuring a subject using an MRI apparatus, which includes an essential measurement region including a k-space center region on a k-space, and each of the essential measurements. An initial setting step of setting a peripheral measurement region that does not have an overlapping region and a region, a step of dividing all sample points existing in the peripheral measurement region into a plurality of groups whose spatial distributions are substantially equal, and the k-space A measurement step for measuring a nuclear magnetic resonance signal from the subject as data to be arranged on the object, and a repetition step for repeatedly performing the measurement step, wherein each measurement step repeatedly performed by the repetition step is the essential step Including measurement area data and measurement of data of one group selected from a plurality of groups in the peripheral measurement area, the group to be selected is changed sequentially each time. Provides a measurement method in the MRI apparatus according to claim and.
[0013]
Here, “a group in which the spatial distribution of sample points is substantially equal” means that the sample points in each group are not spatially biased (distributed substantially isotropic with respect to the center of k-space). It exists and means that each group is equivalent to each other.
[0014]
The measurement method in the MRI of the present invention further includes a step of reconstructing an image using data measured in the measurement step, and the step of reconstructing the image includes data of a group not measured in the current measurement step, Generated using group data measured in other measurement steps (past times), supplement the peripheral measurement region, and generate an image based on the supplemented k-space data. To do.
[0015]
According to such a measurement method, the data measured in each measurement step always includes one group of data for the peripheral measurement region as a component of the high frequency region. Compared with the division measurement method (US Pat. No. 5,713,358, US Pat. No. 5,830,143, etc.), the degradation of time resolution in the high frequency region is small, and the degradation of the generated image quality is also small. In addition, since the data in the peripheral measurement area at each time is spatially uniform, there is no direction dependency in the measurement result.
[0016]
The measurement method of the present invention is preferably applied to measurement of a three-dimensional k-space. In this case, in the step of setting the essential region and the peripheral region, the entire three-dimensional k-space is indispensable measurement for a two-dimensional space determined by at least two coordinate axes among the three coordinate axes that define the three-dimensional k-space. Set the area and the peripheral measurement area.
In general, in a three-dimensional k-space measurement method, the measurement time can be reduced when the number of samples in the slice encoding direction (kz axis) and / or the encoding step in the phase encoding direction (ky axis) is thinned out. Therefore, in the measurement method of the present invention, the time resolution can be improved by reducing the measurement time by dividing the frequency domain group for the space determined by these two axes.
[0017]
Moreover, in such a measurement method, it is not possible to measure the entire area of the k-space, but to make a part of it non-measurement. That is, the rectangular parallelepiped k-space circumscribing the union space of the essential measurement area and the peripheral measurement area may have a non-measurement area that does not overlap with the union space. In this case, the non-measurement area is reconstructed by filling in zero data. In this way, by setting a spatial frequency portion that is not important for measurement purposes in the rectangular parallelepiped k-space as a non-measurement region, it is possible to improve time resolution without significantly impairing the suitability for measurement purposes. .
[0018]
In the measurement method of the present invention, it is also possible to divide the peripheral measurement region into a low-medium frequency region and a high-frequency region, and to make the number of groups to be divided different in the low-medium frequency region and the high-frequency region. For example, by reducing the number of divisions in the low and medium frequency region, it is possible to increase the density of sample points measured in the low and medium frequency region, and to prevent the image quality from being deteriorated in a portion where this region contributes to the image contrast.
[0019]
The MRI apparatus of the present invention includes means for causing nuclear magnetic resonance in a subject, means for applying phase encoding to the nuclear magnetic resonance signal, measuring the nuclear magnetic resonance signal, and imaging based on the nuclear magnetic resonance signal. A magnetic resonance imaging apparatus comprising: a control means for controlling each of the means and controlling measurement of k-space determined by phase encoding; and a k-space central region on the k-space. Stores the setting of the essential measurement area and the peripheral measurement area that does not overlap with the essential measurement area, and the setting of the group obtained by dividing the sample points of the peripheral measurement area into a plurality of groups having the same spatial distribution Storage means, and the control means performs control for repeatedly measuring the subject, and in each repeated measurement, the data of the essential measurement region and one selected sequentially for each measurement. Measure the data of the group in the peripheral measurement area, and generate the data of the group that was not measured in the current measurement using the group data measured in other measurements, and supplement the peripheral measurement area It is characterized by that.
[0020]
DETAILED DESCRIPTION OF THE INVENTION
Hereinafter, embodiments of the present invention will be described taking application to dynamic MRA as an example.
[0021]
FIG. 1 shows the configuration of the MRI apparatus according to this embodiment.
As shown in the figure, this MRI apparatus uses a NMR phenomenon to obtain a tomographic image of a subject, and includes a static magnetic field generation magnet 2, a gradient magnetic field generation system 3, a sequencer 4, a transmission system 5, and a reception. The system 6 includes a signal processing system 7 and a central processing unit (CPU) 8.
[0022]
The static magnetic field generating magnet 2 generates a uniform static magnetic field around the subject 1 in the direction of the body axis or in a direction perpendicular to the body axis, and is a permanent magnet in a space around the subject 1 A magnetic field generating means of a normal type, a normal conductive type or a superconductive type is arranged.
[0023]
The gradient magnetic field generation system 3 is composed of a gradient magnetic field coil 9 wound in three axes of X, Y, and Z, and a gradient magnetic field power source 10 for driving each gradient magnetic field coil, according to a command from a sequencer 4 described later. By driving the gradient magnetic field power supply 10 of each coil, gradient magnetic fields Gx, Gy, and Gz in the three-axis directions of X, Y, and Z are applied to the
[0024]
The sequencer 4 operates under the control of the CPU 8, and sends various commands necessary for collecting tomographic data of the subject 1 to the gradient magnetic field generation system 3, the transmission system 5, and the reception system 6. The operation timing of the gradient magnetic field generation system 3, the transmission system 5, and the reception system 6 controlled by the sequencer 4 is called a pulse sequence. Here, a sequence for three-dimensional blood flow imaging is adopted as one of the pulse sequences. This pulse sequence is pre-installed as a program in a memory provided in the CPU 8, and can be executed by the user as appropriate in accordance with the purpose of imaging, as with other pulse sequences. The control of the sequencer 4 will be described in detail later.
[0025]
The transmission system 5 irradiates a high-frequency magnetic field in order to cause nuclear magnetic resonance to occur in the atomic nucleus constituting the living tissue of the subject 1 by the high-frequency pulse sent out from the sequencer 4, and includes a high-frequency oscillator 11, a
[0026]
The receiving system 6 detects an echo signal (NMR signal) emitted by nuclear magnetic resonance of the nucleus of the biological tissue of the subject 1, and receives a high-
[0027]
The signal processing system 7 includes a CPU 8, a recording device such as a
[0028]
Next, a dynamic MRA imaging operation in such an MRI apparatus will be described.
First, when MRA using a contrast medium is selected via the input device of the CPU 8, the sequence 4 is controlled by the CPU 8 to execute a three-dimensional MRA sequence.
[0029]
For example, as shown in FIG. 2, this pulse sequence is a sequence based on the gradient echo method, and is typical for a three-dimensional MRA sequence. However, flow compensation such as Gradient Moment Nulling may be added.
[0030]
In the illustrated example, a high frequency magnetic field pulse RF is applied to excite a region (slab) including a target blood vessel, and then a Z-direction phase encoding gradient magnetic field Gz and a Y-direction phase encoding gradient magnetic field Gy are applied, and then readout / The echo signal is measured by applying the frequency encoding gradient magnetic field Gx and inverting the polarity. In three-dimensional imaging, such a pulse sequence is repeated at a predetermined repetition time TR while changing the combination of the magnetic field strengths of the phase encode gradient magnetic field Gz in the Z direction and the phase encode gradient magnetic field Gy in the Y direction. Get the data.
[0031]
Here, the number of encoding steps in the Z and Y directions determines the number of divisions in the Z and Y directions, and is set to 128 and 256, for example. The matrix size of the ky-kz plane in the k space is defined by the number of encoding steps in the Z and Y directions. That is, in the sequence of FIG. 2, a signal measured when a certain value of the gradient magnetic field strength Gz and a certain value of the gradient magnetic field strength Gy are combined is a coordinate in the k space (ky, kz corresponding to the values of Gz and Gy. ). In other words, sampling a certain coordinate (ky1, kz1) of the ky-kz plane in k-space executes the pulse sequence of FIG. 2 in the combination of Gy corresponding to ky1 and Gz corresponding to kz1. That is, the fact that the coordinates (ky1, kz1) are not sampled means that the execution of the pulse sequence of FIG. 2 is omitted in the combination of Gy corresponding to ky1 and Gz corresponding to kz1.
[0032]
In the conventional basic dynamic MRA, the number of encoding steps in the Z and Y directions and the step width in each measurement are fixed, and the pulse sequence of FIG. 2 is executed for all combinations of Gy and Gz in each measurement. A three-dimensional k-space in which all coordinates are filled with data is obtained.
[0033]
On the other hand, in the present embodiment, in dynamic MRA imaging, each measurement is controlled as follows without fixing the number of encode steps in the Z and Y directions and the step width in each measurement.
[0034]
That is, in this embodiment, on the ky-kz plane of a three-dimensional k space having kx, ky, and kz coordinate axes whose sizes are determined according to the number of frequency encodings in the X direction and the number of phase encoding steps in the Z and Y directions. In addition, an essential measurement area, which is a substantially circular central area centered on the origin, and a peripheral measurement area are set around it. For the peripheral measurement region, all sample points existing in the peripheral measurement region are divided into a plurality of groups. At that time, in each divided group, the sample points are distributed so as not to be spatially biased, and the groups are divided so as to be equal to each other. Such setting division of sample points is stored in the memory of the CPU 8 together with the order of measurement described later.
[0035]
In each measurement, an essential measurement area is always measured, and each group of peripheral measurement areas is measured one by one in a desired order. Therefore, when the same number of measurements as the number of each group is completed, data on all sample points in the peripheral measurement region is obtained.
[0036]
3 and 4 show a case where the peripheral measurement region is divided into three groups as the first embodiment. Here, in order to simplify the description, a ky-kz space having a matrix size of 5 × 9 will be described.
[0037]
In this example, as shown in FIG. 3, eleven sample points including a coordinate origin indicated by a black circle are essential measurement areas, and other areas excluding the essential measurement area are peripheral measurement areas. 34 sample points in the peripheral measurement area are divided into 12, 11 and 11 as shown by hatched circles in FIGS. 3 (a), (b) and (c). Almost evenly distributed.
[0038]
In the first measurement, as shown in FIG. 4, first, 11 sample points in the essential measurement area and a group shown in (a) (hereinafter referred to as group a) are measured, and 12 in the essential measurement area and the peripheral measurement area. Collect data for sample points. Next, 11 sample points in the essential measurement region and measurement of the group b shown in (b) are performed, and data of 11 sample points different from the essential measurement region and the group a in the peripheral measurement region are collected. Furthermore, in the third measurement, data of 11 sample points other than the groups a and b in the 11 measurement points of the essential measurement area and the peripheral measurement area are collected.
[0039]
Since all the data for the peripheral measurement area is obtained by the three measurements, the image is reconstructed using the data of the entire area of the k space. That is, three-dimensional Fourier transform is performed on the three-dimensional k-space to obtain three-dimensional data, and a two-dimensional image obtained by projecting the three-dimensional data is obtained.
[0040]
In the fourth measurement, as in the first measurement, the measurement is performed for the essential measurement region and the group a, and data of the essential measurement region and a part of the peripheral measurement region are obtained. As for the data of the peripheral measurement area not obtained at this time, the data of the peripheral measurement area already obtained by the second and third measurements are used, and the data of the essential measurement area and all the peripheral measurement areas are filled 3 Dimension data is created, and an image is reconstructed using the three-dimensional data.
[0041]
In the fifth and subsequent times, similarly, using the data of the essential measurement area obtained at that time, a part of the data of the peripheral measurement area, and the data of the peripheral measurement area obtained by the past two measurements closest to that
[0042]
In this way, the time required for one measurement can be significantly reduced (about 1/2 in the previous example) compared to measuring the data for the entire area of k-space. Since the image can be reconstructed at the same interval as the measurement time, the time resolution of the image displayed by the dynamic MRA can be improved. Further, since the image to be formed (that is, the image to be updated) uses data of the entire area of the k space, there is no image degradation not only in the low frequency area but also in the high frequency area. Furthermore, since the data of the low frequency region always includes data of all sample points in the region, a blood flow image with high contrast can be obtained.
[0043]
Next, the measurement order of sample points will be described. As the order of measuring the k space, a centric order, a sequential order, and the like are known. Any of these can be employed in the measurement method of the present invention, but in the example shown in FIG. 4, the order is determined by the distance from the origin of the sample points. That is, in this example, the k space is first divided into two along the ky axis or the kz axis, and in one region (for example, the lower E-C region in the figure), the sample points are arranged in order of increasing distance from the origin. The measurement order is sorted, and in the other area (the upper area CE area in the figure), the measurement order is sorted in order of increasing distance from the origin to the sample points. After the measurement order is sorted in this way, the measurement is started from the sample point having the longest distance from the origin of the E-C region, and thereafter, the measurement is advanced according to the sorted measurement order. The measurement ends at the farthest sample point. Measuring a sample point means that, for example, the pulse sequence shown in FIG. 2 is executed with the slice encode gradient magnetic field strength and the phase encode gradient magnetic field strength corresponding to the coordinates (ky, kz) of the sample point, as described above. It means to do.
[0044]
Such a measurement order is the same even if the groups are different. According to this measurement order, data in the low frequency region is measured over a relatively wide time range including the central time point from the start to the end of the measurement, so that the contrast agent concentration of the target blood vessel is the highest. There is an advantage that the timing can be easily adjusted to measure the low frequency region. Thereby, the image about the target blood vessel can be drawn with high contrast.
[0045]
However, the measurement method of the present invention is not limited to such a measurement order. For example, as shown in FIG. 5, the sample point at the lower left in the figure is used as the start point, and the sample proceeds in order to the right end. It is also possible to carry out a sequential order such as going up one step and then going to the left end.
[0046]
Next, as a second embodiment of the present invention, a case will be described in which the peripheral measurement region is further divided into a low-medium frequency region and a high-frequency region, and the sample points in each region are divided into spatially equal groups.
[0047]
In this example, as shown in FIG. 6, the k-space is divided into an
[0048]
In this case, in the first measurement, the
[0049]
In the fourth round of measurement in the high frequency region, data for filling the three-dimensional k-space is obtained, and an image is reconstructed using the three-dimensional data. Thereafter, for each measurement, three-dimensional data is created by using the data measured at that time and the data not measured at that time but measured in the past, and an image is reconstructed.
[0050]
Also in this embodiment, the measurement order of the sample points may be measured by sorting the sample points in the measurement order according to the distance from the origin for each of the EC region and the CE region as shown in FIG. However, it may be measured in a sequential order as shown in FIG.
[0051]
Also in the second embodiment, similarly to the first embodiment, it is possible to shorten the measurement time for one time and improve the time resolution of the image. In this case, not only in the low frequency region but also in the high frequency region. Image degradation can be eliminated. Further, in this embodiment, by dividing the peripheral measurement region into two, blood vessels can be rendered with high contrast according to the thickness of the target blood vessel. Note that the number of divisions of the peripheral measurement region and the sample density of the group obtained by further dividing the peripheral measurement region can be arbitrarily changed according to the purpose of photographing.
[0052]
Further, a third embodiment will be described. In this embodiment, as shown in FIG. 7, the k space is divided into an
[0053]
In the figure, the case where the
[0054]
Also in the third embodiment, the measurement in the
[0055]
In this case as well, image reconstruction is performed each time, and the data of the essential measurement area and the data of one group of the peripheral measurement areas obtained at that time and the latest past times that cannot be obtained at that time. The obtained data of the other group is used, and the non-measurement region is converted into three-dimensional data using zero-filled data, and three-dimensional Fourier transform is performed to obtain three-dimensional image data. Creating a two-dimensional projection image from the three-dimensional image data is the same as in the above-described two embodiments.
[0056]
The image display method from the three-dimensional image data and the creation of the two-dimensional projection image can be performed using a known method. For example, the difference between the reconstructed three-dimensional data and the three-dimensional data measured before the contrast medium is added may be taken as final three-dimensional data. This difference is preferably a complex difference, but may be a difference in intensity absolute value. Further, reconstruction may be performed after taking a complex difference between the k-space data of the current k-space data and the k-space data measured before the injection of the contrast medium.
[0057]
Further, the three-dimensional data is projected in an arbitrary direction such as a coronal cut, a sagittal cut, or a cross-axis using an optical axis trajectory method such as MIP or MinIP to generate and display a two-dimensional image. In this case, a two-dimensional image may be sequentially generated while rotating the projection direction around a certain axis, and these may be connected to generate a moving image.
[0058]
Furthermore, a known rendering method such as surface rendering or volume rendering may be used.
As described above, as an embodiment of the present invention, the case where the boundary of the essential measurement region and the peripheral measurement region is set in the ky-kz direction has been described. This is an arbitrary direction among the three directions of kx, ky, and kz, or The boundary between the essential measurement region and the peripheral measurement region may be set for any combination of two directions or for all three directions.
[0059]
In the above, the case where three-dimensional measurement is performed by performing phase encoding in the Z direction and the Y direction has been described. However, in the Z direction, the position is encoded by a combination of a slice selection gradient magnetic field and an RF pulse. The measurement using the essential measurement area and the peripheral measurement area can be similarly applied to the case where measurement is performed.
[0060]
Furthermore, the case where 3D measurement is performed has been described above, but the case where 2D measurement (measurement for each slice) is performed is similarly performed by setting the boundary between the essential measurement region and the peripheral measurement region in the kx-ky direction. Can be applied,
[0061]
The MRI apparatus of the present invention and the measurement method using the same can be applied not only to dynamic MRA using a contrast agent but also to the case where arbitrary repeated measurement is performed in MRI.
[0062]
【The invention's effect】
As described above, according to the present invention, it is possible to provide a measurement method that shortens the measurement time of each time without greatly degrading the time resolution in the high frequency region when performing repeated imaging in MRI. Further, in such a measurement method, the direction dependency of the measurement result can be further eliminated.
[Brief description of the drawings]
FIG. 1 is a block diagram showing the configuration of a magnetic resonance imaging apparatus according to an embodiment of the present invention.
FIG. 2 is a timing chart showing an example of a pulse sequence that can be used for measurement according to an embodiment of the present invention.
FIG. 3 is a diagram showing division of a ky-kz space according to the first embodiment of the present invention.
FIG. 4 is a diagram showing a measurement method according to the first embodiment of the present invention.
FIG. 5 is a diagram showing a measurement method according to the first embodiment of the present invention.
FIG. 6 is a diagram showing a measurement method according to a second embodiment of the present invention.
FIG. 7 is a diagram showing a measurement method according to a third embodiment of the present invention.
[Explanation of symbols]
1 ... Subject
2 ... Magnetic field generator
3. Gradient magnetic field generation system
4 Sequencer
5 ... Transmission system
6 ... Receiving system
7 ... Signal processing system
8 ... CPU
9… Gradient magnetic field coil
14a… High-frequency coil on the transmission side
14b ... High frequency coil on the receiving side
Claims (3)
前記制御手段は、前記k空間上に、k空間中央領域を含む必須計測領域と、前記必須計測領域と重複した領域を持たない周辺計測領域とを設定し、前記k空間にデータとして配置される核磁気共鳴信号の計測を繰り返し行い、各回の計測が、前記必須計測領域のデータと、前記周辺計測領域から選択した一部のデータの計測を含み、各回毎に選択する部分を順次変更するように制御する磁気共鳴イメージング装置において、
前記制御手段は、前記周辺計測領域に存在する全サンプル点を、その空間的分布がほぼ均等な複数の群に分け、前記計測の各回毎に選択する群を順次変更するように制御することを特徴とする磁気共鳴イメージング装置。Means for causing nuclear magnetic resonance in a subject; means for applying phase encoding to the nuclear magnetic resonance signal; means for measuring the nuclear magnetic resonance signal; and reconstructing an image based on the nuclear magnetic resonance signal; Control means for controlling each means and controlling measurement in k-space determined by phase encoding,
The control means sets, on the k space, an essential measurement area including a k-space central area and a peripheral measurement area that does not overlap with the essential measurement area, and is arranged as data in the k space. The measurement of the nuclear magnetic resonance signal is repeatedly performed, and each measurement includes data of the essential measurement region and measurement of a part of the data selected from the peripheral measurement region, and the part to be selected is changed sequentially each time. In the magnetic resonance imaging apparatus to control to
The control means divides all the sample points existing in the peripheral measurement region into a plurality of groups whose spatial distributions are substantially equal, and performs control to sequentially change the group to be selected for each measurement. A magnetic resonance imaging apparatus.
前記画像再構成手段は、今回の計測ステップで計測しなかった群のデータを、過去の計測ステップで計測された群のデータから生成し、周辺計測領域に補充し、この補充されたk空間のデータに基づいて画像を生成することを特徴とする磁気共鳴イメージング装置。The magnetic resonance imaging apparatus according to claim 1.
The image reconstruction unit generates group data not measured in the current measurement step from group data measured in the past measurement step, supplements the peripheral measurement region, and replenishes the supplemented k-space. A magnetic resonance imaging apparatus that generates an image based on data.
前記k空間は3次元のk空間であって、前記必須計測領域と周辺計測領域の設定は、当該3次元のk空間全体を、前記3次元のk空間を規定する3つの座標軸のうちの少なくとも2つの座標軸で決まる2次元空間について前記必須領域と周辺領域を設定することを特徴とする磁気共鳴イメージング装置。The magnetic resonance imaging apparatus according to claim 1 or 2,
The k-space is a three-dimensional k-space, and the setting of the essential measurement area and the peripheral measurement area is performed by setting the entire three-dimensional k-space to at least one of the three coordinate axes that define the three-dimensional k-space. A magnetic resonance imaging apparatus, wherein the essential region and the peripheral region are set in a two-dimensional space determined by two coordinate axes.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000368220A JP3847554B2 (en) | 2000-12-04 | 2000-12-04 | Magnetic resonance imaging system |
| US10/433,736 US7167740B2 (en) | 2000-12-04 | 2001-12-03 | Measuring method in magnetic resonance imaging device and magnetic resonance imaging device |
| PCT/JP2001/010538 WO2002045584A1 (en) | 2000-12-04 | 2001-12-03 | Measuring method in magnetic resonance imaging device and magnetic resonance imaging device |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000368220A JP3847554B2 (en) | 2000-12-04 | 2000-12-04 | Magnetic resonance imaging system |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002165776A JP2002165776A (en) | 2002-06-11 |
| JP2002165776A5 JP2002165776A5 (en) | 2005-06-30 |
| JP3847554B2 true JP3847554B2 (en) | 2006-11-22 |
Family
ID=18838513
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000368220A Expired - Fee Related JP3847554B2 (en) | 2000-12-04 | 2000-12-04 | Magnetic resonance imaging system |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3847554B2 (en) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4699739B2 (en) * | 2004-10-28 | 2011-06-15 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | MRI equipment |
| JP4268976B2 (en) | 2006-06-15 | 2009-05-27 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | Imaging device |
| CN101281241B (en) * | 2007-04-06 | 2012-06-20 | Ge医疗系统环球技术有限公司 | MRI equipment and control method thereof |
| WO2009081786A1 (en) * | 2007-12-25 | 2009-07-02 | Hitachi Medical Corporation | Magnetic resonance imaging device and magnetization rate enhancement image picking-up method |
| EP2656094A2 (en) * | 2010-12-22 | 2013-10-30 | Koninklijke Philips N.V. | Rapid parallel reconstruction for arbitrary k-space trajectories |
| BR112015003886A2 (en) * | 2012-08-27 | 2017-07-04 | Koninklijke Philips Nv | magnetic resonance imaging system and magnetic resonance imaging method with a contrast agent |
| US9305347B2 (en) * | 2013-02-13 | 2016-04-05 | Dental Imaging Technologies Corporation | Automatic volumetric image inspection |
| JP6362950B2 (en) * | 2014-07-24 | 2018-07-25 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | Magnetic resonance equipment |
| JP6523808B2 (en) * | 2015-06-12 | 2019-06-05 | 株式会社日立製作所 | Magnetic resonance imaging apparatus and control method thereof |
| JP6580938B2 (en) * | 2015-10-19 | 2019-09-25 | キヤノンメディカルシステムズ株式会社 | Magnetic resonance imaging system |
| US11815577B2 (en) * | 2019-02-25 | 2023-11-14 | Koninklijke Philips N.V. | Parallel MR imaging using wave-encoding |
-
2000
- 2000-12-04 JP JP2000368220A patent/JP3847554B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2002165776A (en) | 2002-06-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4646015B2 (en) | Method of operating a magnetic resonance imaging (MRI) system | |
| JP5221570B2 (en) | Magnetic resonance imaging apparatus and multi-contrast image acquisition method | |
| US7372269B2 (en) | Magnetic resonance imaging method and apparatus | |
| JP3847512B2 (en) | Magnetic resonance imaging system | |
| US7450982B2 (en) | Magnetic resonance imaging system and method | |
| JP3847554B2 (en) | Magnetic resonance imaging system | |
| US6044290A (en) | Time-resolved digital subtraction magnetic resonance angiography using echo-planar imaging | |
| JP4416221B2 (en) | Magnetic resonance imaging system | |
| US7167740B2 (en) | Measuring method in magnetic resonance imaging device and magnetic resonance imaging device | |
| US6198960B1 (en) | Flip angle modulated magnetic resonance angiography | |
| JPH07116144A (en) | Magnetic resonance imaging method and apparatus | |
| JP3516421B2 (en) | MRI equipment | |
| JP2005021691A (en) | System and method for phase encode placement | |
| JP2000296120A (en) | Magnetic resonance image diagnostic system | |
| JP4763142B2 (en) | Magnetic resonance imaging system | |
| JP3847519B2 (en) | Magnetic resonance imaging system | |
| JP3514547B2 (en) | Magnetic resonance imaging system | |
| JP3901448B2 (en) | Magnetic resonance imaging system | |
| JP4391214B2 (en) | Magnetic resonance imaging system | |
| JP4462781B2 (en) | Magnetic resonance imaging system | |
| JP2000316830A (en) | Magnetic resonance imaging method and magnetic resonance imaging device using the same | |
| JP4297541B2 (en) | Magnetic resonance imaging system | |
| JP4266574B2 (en) | Magnetic resonance imaging system | |
| JP4047457B2 (en) | Magnetic resonance imaging system | |
| JP3440134B2 (en) | Magnetic resonance imaging equipment |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20041018 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041018 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060822 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060823 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100901 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110901 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110901 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120901 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120901 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130901 Year of fee payment: 7 |
|
| LAPS | Cancellation because of no payment of annual fees |