JP3847519B2 - Magnetic resonance imaging system - Google Patents
Magnetic resonance imaging system Download PDFInfo
- Publication number
- JP3847519B2 JP3847519B2 JP2000097632A JP2000097632A JP3847519B2 JP 3847519 B2 JP3847519 B2 JP 3847519B2 JP 2000097632 A JP2000097632 A JP 2000097632A JP 2000097632 A JP2000097632 A JP 2000097632A JP 3847519 B2 JP3847519 B2 JP 3847519B2
- Authority
- JP
- Japan
- Prior art keywords
- measurement
- magnetic field
- group
- space
- origin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Magnetic Resonance Imaging Apparatus (AREA)
Description
【0001】
【発明の属する技術分野】
本発明は、核磁気共鳴(以下、NMRという)現象を利用して被検体の所望部位の断層画像を得る磁気共鳴イメージング装置に関し、特に血管系の走行を描出する際に必要最小限の時間で、所望の描出範囲と画質を確保することの可能な磁気共鳴イメージング装置(以下、MRI装置という)に関するものである。
【0002】
【従来の技術】
MRI装置は、NMR現象を利用して被検体中の所望の検査部位における原子核スピン(以下単にスピンと称す)の密度分布、緩和時間分布等を計測して、その計測データから被検体の任意の断面を画像表示するものである。
【0003】
このMRI装置の撮像機能に、血流を描画する MRアンジオグラフィ(以下、MRAと略す)があり、MRAには造影剤を使用しない方法と造影剤を使用する方法がある。
造影剤を用いる方法としてはGd-DTPAなどのT1短縮型の造影剤とグラジェントエコー系の短いTRのシーケンスを組み合わせる方法が一般的である。この方法では、T1短縮型の造影剤を含む血流スピンが周囲組織より短いT1を有しているために、高周波磁場による励起を短い繰り返し時間TRで受けた場合に飽和が起こりにくく相対的に他の組織より高信号を発することを利用し、造影剤を含む血液に満たされた血管を他組織に対し高コントラストで描出するものである。造影剤が目的とする血管内にとどまっている間に血管を含むVolumeのデータ(具体的には三次元)の計測を行ない、得られた三次元画像を重ね合わせて投影処理を行うことにより、血流を描画する。ここで一般的には広範囲で高分解能の情報を得るために、三次元グラディエントエコー法を基本とするシーケンスが用いられる。
【0004】
このような三次元造影MRAにおいて良好な画像を得るためには、(1)造影剤の注入法、(2)撮像時間およびタイミングが重要である。(1)については、造影剤を撮像対象とする血管内に安定して高濃度を維持するように注入しなければならない。このため通常は自動注入器を使用した急速注入が一般的に用いられる。
【0005】
(2)については、例えば動脈のみを分離し選択的に撮像するためには、データ収集時に動脈における造影剤の濃度が高くなるように撮像タイミングを設定する必要がある。特に画像のコントラストを支配しているk空間の中心部分(低周波領域)において造影剤濃度がピークに達するのが理想であり、使用するパルスシーケンスのデータ収集法に応じてタイミングを設定する。
【0006】
データ収集法には、主にk空間の高周波側一端から低周波領域を経て高周波側他端まで計測するシーケンシャルオーダー(Sequential Order)と、k空間の低周波領域から交互に高周波両端に向かって計測するセントリックオーダー(Centric Order)があり、一般的にはセントリックオーダーが用いられている。三次元計測のセントリックオーダーでは、位相エンコードループ、スライスエンコードループを一方を外側、他方を内側のループとし、そのどちらかあるいは両方をセントリックオーダーで制御している。
【0007】
しかしながら、この場合のセントリックオーダーは、図1(b)に示すようにk空間上の原点から計測点(サンプリング点)の距離が変動し真のセントリックオーダーではないため、体動の影響を受けやすく、また動静脈の分離が不十分の場合があった。
【0008】
このような問題を解決する方法として ky-kz空間において相対FOVをも考慮し、信号計測が進むに従いk空間上の原点からの距離が徐々に離れていくように制御するエリプティカルセントリックオーダリング(Elliptical Centric Ordering)が提案されている(図1(c))("Performance of an Ellipitical Centric View Order for Signal Enhancement and Motion Artifact Suppression in Breath-hold Three-Dimensional Gradient Echo Imaging. Alan,et al. Magnetic Resonance in Medicine 38:793-802,1997")。
【0009】
【発明が解決しようとする課題】
このデータ収集法では、撮像時間の初めに画像のコントラストを決定する低周波データを計測するので、目的とする血管の造影剤濃度が増加したときに撮像を開始することにより選択的に動静脈像を得ることが可能となった。
【0010】
しかしながら上述したセントリックオーダーやエリプティカルセントリックオーダリングでは、画像のコントラストを早期に決定でき選択的に動脈像を得るのに有効であるものの、至適撮像タイミングがずれた場合、造影剤濃度が薄い時間帯のときにのみ低周波情報を取得してしまうために画質が劣化しやすいという問題がある。特に計測開始が早すぎた場合、低周波領域のデータは血管内が極めて低信号である時間帯にサンプリングされることになり、一方、高周波領域のデータは血管内が高信号である時間帯にサンプリングされるため、直流成分のないリンギングアーチファクトを発生させることになる。
【0011】
これに対しシーケンシャルオーダーでは計測タイミングが少々ずれても画像に顕著なアーチファクトが現れにくく安定した画像が取得できるが、前述のセントリックオーダーと同様に被検体の体動に弱く、動静脈分離も十分に行われないという問題があった。
【0012】
そこで本発明は、至適撮像タイミングのずれによる画質への影響を軽減しつつ、短時間に目的とする血管全体を高コントラストで描出することができるMRI装置を提供することを目的とする。また体動の影響を受け難く、MRAにおいて動脈と静脈を分離して描出することの可能なMRI装置を提供することを目的とする。さらに本発明はMRAに好適なデータ収集法を提供することを目的とする。
【0013】
【課題を解決するための手段】
上記目的を達成するために、本発明においては、ky-kz空間の計測点を互いに複素共役の関係にある2つの群に分けて計測し、最初に計測する第1の群では原点から所定の距離の計測点を始点とし原点からの距離が漸次減少するように原点に向かって計測し、その後計測する第2の群では逆に原点から計測点までの距離が漸次的に増加するデータ収集法を採用する。
【0014】
即ち、本発明のMRI装置は、被検体の置かれる空間に静磁場を発生する静磁場発生手段と、前記空間にスライス方向、位相エンコード方向及び読み出し方向の各傾斜磁場を与える傾斜磁場発生手段と、前記被検体の生体組織の原子核に核磁気共鳴を起こさせるために高周波磁場を照射する送信系と、前記核磁気共鳴により放出されるエコー信号を検出する受信系と、前記傾斜磁場発生手段、送信系および受信系を制御する制御系と、受信系で検出したエコー信号を用いて画像再構成演算を行なう信号処理系と、得られた画像を表示する手段とを備え、前記制御系は、スライスエンコード及び位相エンコードを付与する三次元シーケンスを実行し、この際、スライスエンコード数および位相エンコード数で規定されるk空間の計測点を、原点を共有し、互いに複素共役の関係にある第1及び第2の群に分割し、第1の群では原点から計測点までの距離が計測順に漸減し、第2の群では原点から計測点までの距離が計測順に漸増するように前記スライス方向および位相エンコード方向の傾斜磁場発生手段を制御する。
【0015】
計測点を2つの群に分割する場合、隣り合う計測点は異なる群に属するように分割することが好ましい。尚、2つの群の計測点が互いに複素共役の関係にあるという条件を満たすためには、原点の近傍において一部隣り合う計測点が同一の群に属する必要がある。従って本明細書において「隣り合う計測点は異なる群に属するように分割する」とは、複素共役の関係にあるという条件を満たし、且つ隣り合う計測点が異なる群に属するという条件が最大限満たされている状態をいう。
【0016】
本発明の三次元画像データ収集法は、被検体の所定の領域を選択して励起し、少なくとも二方向にエンコードする傾斜磁場を印加し、前記領域から生じるエコー信号を計測するステップを前記傾斜磁場の強度を変えながら複数回繰り返し、三次元画像データを収集するデータ収集方法において、前記二方向のエンコード傾斜磁場強度で規定される計測空間の計測点を、原点を共有し、互いに複素共役の関係で且つ隣り合う計測点は異なる群に属するように第1及び第2の群に分割し、第1及び第2の群について順次計測を行い、その際、最初に計測される第1の群では、前記計測空間の原点から計測点までの距離が計測順に漸減するように計測し、後で計測される第2の群では前記計測空間の原点から計測点までの距離が計測順に漸増するように計測する。
【0017】
本発明のデータ収集方法によれば、図1(a)に示すように原点からの距離変動のない計測を行うことができ、最も低周波成分を計測する時点と目的とする血管の信号強度が造影剤によってピークとなる時点とを一致させることにより、目的血管を高コントラストで描出することができる。また低周波成分を計測する時点と信号強度のピークに多少のずれがあっても、確実に低周波成分を計測することができ、画像の劣化がない。尚、図1(b)〜(d)に従来のセントリックオーダー、エリプティカルセントリックオーダー、シーケンシャルオーダーにおけるk空間原点からの距離変化を示す。
【0018】
本発明のデータ収集法の好適な態様によれば、第1の群では、全計測点のうち、一部の計測点のみを計測し、第2の群では全計測点を計測することを特徴とする。
2つの群は複素共役の関係にあるので、一方の群は一部の計測点を計測しなくても、計測しなかったデータを他の群の計測データから推定することができる。これにより一方の群の計測時間を短縮することができる。特に造影剤濃度が増加してピークまでの間に第1群の計測を行う場合に、信号強度が低い不要なデータの計測をなくすことができ、良好な画像を得ることができる。
【0019】
【発明の実施の形態】
以下、本発明の実施例について添付図面を参照して説明する。
図2は本発明によるMRI装置の全体構成を示すブロック図である。このMRI装置は、NMR現象を利用して被検体の断層像を得るもので、静磁場発生磁石2と、磁場勾配発生系3と、シーケンサ4と、送信系5と、受信系6と、信号処理系7と、中央処理装置(CPU)8とを備えている。
【0020】
静磁場発生磁石2は、被検体1の周りにその体軸方向または体軸と直交する方向に均一な静磁場を発生させるもので、被検体1の周りのある広がりをもった空間に永久磁石方式または常電導方式あるいは超電導方式の磁場発生手段が配置されている。
【0021】
磁場勾配発生系3は、X,Y,Zの三軸方向に巻かれた傾斜磁場コイル9と、それぞれの傾斜磁場コイルを駆動する傾斜磁場電源10とから成り、後述のシーケンサ4からの命令に従ってそれぞれのコイルの傾斜磁場電源10を駆動することにより、X,Y,Zの三軸方向の傾斜磁場Gx,Gy,Gzを被検体1に印加するようになっている。この傾斜磁場の加え方により被検体1の特定のスライス又はスラブを選択的に励起することができ、また計測空間(k空間)における計測点(サンプリング点)の位置、計測順序を規定することができる。
【0022】
シーケンサ4は、CPU8の制御で動作し、被検体1の断層像のデータ収集に必要な種々の命令を、磁場勾配発生系3、送信系5及び受信系6に送るようになっている。シーケンサ4が制御する磁場勾配発生系3、送信系5及び受信系6の動作タイミングはパルスシーケンスと呼ばれ、ここではパルスシーケンスの一つとして三次元血流撮像のためのシーケンスが採用される。シーケンサ4の制御については後に詳述する。
【0023】
送信系5は、シーケンサ4から送り出される高周波パルスにより被検体1の生体組織を構成する原子の原子核に核磁気共鳴を起こさせるために高周波磁場を照射するもので、高周波発振器11と変調器12と高周波増幅器13と送信側の高周波コイル14aとから成る。高周波発振器11から出力された高周波パルスをシーケンサ4の命令にしたがって変調器12で振幅変調し、この振幅変調された高周波パルスを高周波増幅器13で増幅した後に被検体1に近接して配置された高周波コイル14aに供給することにより、電磁波が被検体1に照射されるようになっている。
【0024】
受信系6は、被検体1の生体組織の原子核の核磁気共鳴により放出されるエコー信号(NMR信号)を検出するもので、受信側の高周波コイル14bと増幅器15と直交位相検波器16とA/D変換器17とから成る。上記送信側の高周波コイル14aから照射された電磁波による被検体1の応答の電磁波(NMR信号)は被検体1に近接して配置された高周波コイル14bで検出される。検出されたエコー信号は、増幅器15及び直交位相検波器16を介してA/D変換器17に入力されディジタル量に変換され、さらにシーケンサ4からの命令によるタイミングで直交位相検波器16によりサンプリングされた二系列の収集データとされ、信号処理系7に送られる。
【0025】
信号処理系7は、CPU8と、磁気ディスク18及び磁気テープ19等の記録装置と、CRT等のディスプレイ20とから成り、CPU8でフーリエ変換、補正係数計算像再構成等の処理を行い、任意断面の信号強度分布あるいは複数の信号に適当な演算を行って得られた分布を画像化してディスプレイ20に断層像として表示するようになっている。なお、図2において、送信側及び受信側の高周波コイル14a、14bと傾斜磁場コイル9は、被検体1の周りの空間に配置された静磁場発生磁石2の磁場空間内に設置されている。
【0026】
次に本発明のMRI装置における血流撮像機能について説明する。
既に述べたようにシーケンス4は、所定のパルスシーケンス、ここでは三次元MRAシーケンス、に従い磁場勾配発生系3、送信系5及び受信系6の動作タイミングを制御する。このパルスシーケンスはCPU8に備えられたメモリに予めプログラムとして組み込まれており、他のパルスシーケンスと同様、使用者が撮影の目的に応じて適宜選択することにより実行することができる。即ち、CPU8の入力装置を介して造影剤を用いたMRAが選択されると、シーケンス4はCPU8によって制御され、三次元MRAシーケンスを実行する。
【0027】
このパルスシーケンスは、例えば図3に示すように、グラディエントエコー法を基本とするシーケンスで、三次元MRAシーケンスに一般的なものである。即ち、領域選択傾斜磁場Gsと同時に高周波磁場パルスRFを印加して目的血管を含む領域(スラブ)を励起した後、スライス方向の傾斜磁場パルスGe1および位相エンコード方向の傾斜磁場パルスGe2を印加し、次いで読み出し傾斜磁場Gr印加するとともにその極性を反転させてエコー信号を計測する。高周波磁場パルスRFからエコー信号計測までをスライス方向の傾斜磁場Ge1および位相エンコード方向の傾斜磁場Ge2の磁場強度を変えながら、所定の繰り返し時間TRで繰り返し、三次元データを得る。
【0028】
スライス方向および位相エンコード方向のエンコード数は両方向の画像分解能を決めるもので、計測時間等を考慮して予め設定されている。例えば位相エンコード方向のエンコード数は128、256など、スライス方向は10〜30などに設定されている。またこのスライス方向および位相エンコード方向のエンコード数によってk空間(ky−kz)が規定される。即ち図3のシーケンスにおいて、スライス方向の傾斜磁場強度のある値Ge1(Gz)と位相エンコード方向の傾斜磁場強度のある値Ge2(Gy)のときに計測された信号は、Gz、Gyに対応するk空間の格子点、(ky,kz)に配置されることになる。
【0029】
例えば図3に示す三次元MRAシーケンス自体はMRAにおいて一般的なものであるが、本実施例が採用するこのシーケンスでは、データ収集法が従来のセントリックオーダー或いはエリプティカルセントリックオーダリングとは異なる。
【0030】
この方法では、ky-kz空間(以下、単にk空間という)の格子点、即ち計測点を2つの群に分割し、これら2つの群を順次計測する。計測点を2つの群に分割する場合、1)2つの群は原点を共有し、2つの群に属する計測点が互いに複素共役の関係にあること、2)k空間において隣接する計測点が異なる群に属することが必要である。
【0031】
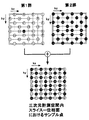
図4に上述のデータ収集法の単純化した一例として、スライスエンコード数が8、位相エンコード数が8である8*8マトリックスのk空間を示す。このマトリクスには64の格子点(計測点)が存在し、これら格子点は図中、左側に示す第1群と右側に示す第2群に分割されている。これら2つの群に属する格子点は互いに複素共役の関係にあり、隣接する格子点は異なる群に属する。但し、複素共役の関係を満たすために、原点の近傍においては、隣接する格子点は一つの群に属することになる。
【0032】
これら2つの群のうち最初に計測する第1の群では、k空間上の原点0からの距離が大きい点から計測を開始し、その後漸次原点0に近づくようにサンプリング点を高周波成分から低周波成分に向かってサンプリング制御する。また第2の群では、逆に原点0或いはその近傍から、原点0からの距離が漸次離れていくようにサンプリング点を低周波成分から高周波成分に向かってサンプリング制御する。
【0033】
図中、丸で囲まれた数字はデータ収集順序を示す。同じ数字の計測点には序列がなく、それらのうちのいずれから計測してもよいことを示している。
最初に計測を開始する第1群では原点(番号33が付された格子点)から最も遠い格子点(番号1)、即ち最も高周波成分から計測を開始し、次に番号2の格子点、番号3の格子点というように順次原点まで計測を行う。続いて第2群の計測を行い、ここでは原点に最も近い格子点(番号34)、即ち低周波成分から計測を開始し、順次原点から離れる順序で計測を行う。
【0034】
次にこのようなデータ収集法を採用した上記MRI装置による造影MRAの一実施例を図5を参照して説明する。
まず被検体を静磁場磁石内の計測空間に配置し、目的とする血管を含む撮像領域を決定し、タイミング撮像を行なう。タイミング撮像はテストインジェクション法によって行なう。この方法では、少量の造影剤(約1〜2ml)をテスト注入して、図5に示すように、対象部位における時間―信号曲線を得、そこから造影剤の到達時刻(信号強度がピークとなる時刻)t1を計測し、この結果を基にして本撮像を行なうタイミングを決定する方法である。タイミング撮像の方法としては、このテストインジェクション法の他に、造影剤の到達に関してモニタ領域内で特定の部位にROIを設定し、同部位の信号変化を捉え、設定した閾値を超えた時点で自動的に撮像が始まる方法やフルオロスコピーと呼ばれる短時間撮像、表示の繰り返しによって目的とする血管をリアルタイムで観察し適切な信号上昇がえられた時点で撮像を開始する方法があり、これらの方法を採用することも可能であるが、テストインジェクション法は造影剤を本撮像に先行して使用することにより、正確にタイミングを測定することができるので好適である。
【0035】
タイミング撮像の後、図5(b)に示すように本撮像を行なう。本撮像は造影剤注入後の撮像のみを行ってもよいが、好適には造影剤注入前と造影注入後の画像を撮像する。造影前と造影後の撮像は、同一条件で同一スライスまたはスラブ位置について連続的に行なう。
撮像シーケンスは図3に示すような短TRの三次元グラディエントエコー法を基本とするシーケンスである。この場合、血流を撮像対象としているので、流れによるディフェイズをリフェイズするための傾斜磁場即ちグラディエントモーメントヌリング(Gradient Moment Nulling)を付加してもよいが、これは必須ではなく、TR/TE短縮のためにはむしろ単純なグラディエントエコーとするのが好ましい。
【0036】
パルスシーケンスの繰り返し時間TRおよびマトリクスサイズ(スライスエンコード数及び位相エンコード数)並びに加算数が決まると撮像時間Tが決まるので、上記タイミング撮像で得られた目的とする血管の造影剤到達時刻t1を基に、目的とする血管に造影剤が到達した時にky-kz空間の低周波領域のデータ計測が行われるように、撮像開始時刻t2(造影剤を注入してから撮像を開始するまでの時間)を設定する。撮像はまず第1群の計測を開始し、続いて第2群の計測を行なう。この場合、シーケンサ4は先に計測する第1群ではスライス方向傾斜磁場パルスと位相エンコード方向の傾斜磁場パルスをともに高周波成分から低周波成分を順に計測するように制御し、またその後に計測する第2群では低周波成分から高周波成分の順に計測するように制御する。こうして造影後の三次元画像データを得る。
【0037】
これと同じ手順で造影前についても三次元画像データを得ておけば、これらの差分を取ることにより、血管のみの三次元データを得ることができる。差分処理は、例えば三次元内のスライス位置の一致するスライス間でそれぞれ複素差分することにより行う。差分は絶対値の差分でもよい。このように造影前後の画像間で差分処理を行なって血管以外の組織を除去する方法は3D MR-DSA(Digital Subtraction Angiography)と呼ばれ公知の手法であり、本発明において必須ではないが、特に血管以外の組織とのコントラストを十分に得られにくい細い血管の描出に好適である。
【0038】
さらに差分処理後の三次元データを、冠状断、矢状断、軸横断等、任意の方向に投影することにより立体的に観察できる。投影の手法としては公知の最大値投影法(Maximum Intensity Projection)等を採用することができる。またボリュームレンダリングのような擬似的三次元表示処理を行うことも可能であり、差分後のデータを使用してるため単純な全スライス積分処理を行うことも可能である。
【0039】
このように本発明の造影MRAによれば、目的とする血管に造影剤が到達し目的血管を流れる血液の信号強度が最も高くなった時点でk空間の低周波成分を計測することとなり、動脈の画像を高いコントラストで描画できる。しかも図5に示すように造影剤到達時刻t1を挟んで両側に低周波成分を計測する時間帯が存在するので、タイミング撮像と本撮像との間のわずかな条件の違い等によって両者の造影剤到達時刻t1にずれが生じた場合にも、画質の劣化が殆どない高品質の画像を得ることができる。
【0040】
尚、以上の実施例では、データ収集法としては第1群と第2群のいずれも群に属する全計測点を計測する場合を説明したが、図5(c)に示すように第1群は所定の高周波成分の計測を省き、短時間で低周波成分の計測を行うデータ収集法を採用してもよい。
【0041】
このようなデータ収集法の一例を図6に示す。図6でも、スライスエンコード数が8、位相エンコード数が8である8*8マトリックスのk空間を例示した。この実施例でも図4に示す実施例と同様の条件でk空間を2つの群に分割しているが、ここでは最初に計測する第1群では所定の高周波成分の計測を行わず、低周波成分のみを計測する。図示する実施例ではk空間の格子点のうち低周波領域の4*4マトリックスに存在する格子点のみが計測される。まずこれら低周波領域の格子点のうち原点(番号9の格子点)からの距離が一番遠い格子点を始点とし、番号2の格子点、番号3の格子点の順に、原点まで計測する。
【0042】
第2群では、図4に示す実施例と同様に原点に隣接する格子点(番号10)から計測し、原点から離れる順序で最高周波成分まで第2群に属する格子点全体を計測する。
【0043】
この場合、第1群のうち計測されなかった高周波領域のデータは、第1群と第2群の複素共役性に基づき推定することができる。未計測データの推定方法は、公知のハーフフーリエ再構成法に基づく方法を採用することができる。図7はこれらの処理を模式的に示したものである。計測データをまず周波数エンコード方向(kx方向)に一次元フーリエ変換し、三次元ハイブリッド空間の実計測データを得る。この実計測データから三次元推定データを得て、実計測データと推定データとを合成することによりハイブリッド空間データを得る。このハイブリッド空間データを二次元フーリエ変換することにより三次元画像データを得る。
【0044】
これによりデータ点数を削減しても空間分解能を劣化させることがない。
この実施例でも、図4に示すデータ収集法と同様に目的とする血管に造影剤が到達し目的血管を流れる血液の信号強度が最も高くなった時点でk空間の低周波成分を計測することとなり、動脈の画像を高いコントラストで描画できる。
【0045】
また一般に図7に示すように造影剤注入後、造影剤濃度(信号強度)は急激に上昇するので、最も低周波成分を計測する時点を信号強度のピークに合わせ、かつ造影剤到達前の不要な信号の計測を避けるためには、ピーク前の計測が短い本実施例が好適である。
【0046】
撮像法(データ収集法)の違いによる動静脈分離の違いをシミュレーションした結果を図8及び図9に示す。このシミュレーションは、動脈および静脈の模擬血管を用い、これに流速40cm/s、動脈静脈還流時間7秒、注入速度2cc/sで造影剤を流入し、これを異なる撮像法で撮像したものである。図8は、上記条件における信号強度を示し、最初に動脈からの信号のピークが見られ、遅れて静脈からの信号のピークが現れる。また図9(a)は本発明の撮像法による画像、同図(b)はエリプティカルセントリックオーダーによる画像である。
【0047】
図からわかるように、エリプティカルセントリックオーダーでは動脈の他に静脈も画像化してしまい、動静脈分離が完全でないのに対し、本発明の撮像法では動脈のみを高コントラストで描画できる。
【0048】
尚、以上の実施例では三次元MRAシーケンスとしてグラディエントエコー法によるシーケンスを例示したが、1回の励起で複数のエコー信号を計測するEPI(Echo Planer Imaging)法や分割型のEPIなども採用することができる。
【0049】
さらにk空間におけるデータ収集は、図4や図6に示すような矩形のマトリクッスに限らず、図10に示すように原点を中心とする円(楕円)内のデータを収集することも可能である。図中、実線で示す第1の群では、k空間上の原点0からの距離が大きい点から計測を開始し、その後漸次原点0に近づくようにサンプリング点を高周波成分から低周波成分に向かってサンプリング制御する。また第2の群では、逆に原点0或いはその近傍から、原点0からの距離が漸次離れていくようにサンプリング点を低周波成分から高周波成分に向かってサンプリング制御する。
【0050】
この場合にも図4および図6に示す実施例と同様の効果を得ることができる。またこの場合にも必要に応じて第1群の高周波成分の計測を省略することができる。
【0051】
【発明の効果】
以上説明したように本発明のMRI装置によれば、ky-kz空間の計測点を互いに複素共役の関係にある2つの群に分割し、第1群、第2群の順に計測し、その際第1群ではk空間上の原点からの距離が漸次的に近づくようにサンプル点を高周波成分から低周波成分に向かってサンプリング制御し、第2群では逆にその距離が漸次的に離れていくようにサンプル点を低周波成分から高周波成分に向かってサンプリング制御するようにしたので、撮像タイミングのずれによる影響を低減し、従来の造影MRAで問題となっていた造影タイミングに依存したアーチファクトの発生や、動静脈の重なりを防ぎ、血管描出能を向上することが可能となる。また、最初に計測する第1群の計測点数を少なくすることにより、不要な信号の計測とそれによる画像の劣化をなくし、しかも撮像時間の短縮を図ることができる。
【図面の簡単な説明】
【図1】本発明によるMRI装置が採用するデータ収集法および従来のデータ収集法を説明する概略図
【図2】本発明が適用されるMRI装置の全体構成を示すブロック図
【図3】本発明のMRI装置が実行する造影MRA計測のパルスシーケンスの一実施例を示す図
【図4】本発明によるk空間のデータ収集順序の一実施例を模式的に示す図
【図5】本発明のMRI装置によるMRA撮像を説明する図
【図6】本発明によるk空間のデータ収集順序の他の実施例を模式的に示す図
【図7】図6のデータ収集法を適用した画像再構成法を説明する図
【図8】本発明のMRI装置によるMRA撮像を評価するためのシミュレーションを示す図
【図9】本発明のMRI装置によるMRA撮像および従来法によるMRA撮像をシミュレーションした結果を示す図
【図10】本発明によるk空間のデータ収集順序の他の実施例を模式的に示す図
【符号の説明】
1…被検体
2…磁場発生装置
3…磁場勾配発生系
4…シーケンサ
5…送信系
6…受信系
7…信号処理系
8…CPU
9…傾斜磁場コイル
14a、…送信側の高周波コイル
14b…受信側の高周波コイル[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a magnetic resonance imaging apparatus that obtains a tomographic image of a desired part of a subject by utilizing a nuclear magnetic resonance (hereinafter referred to as NMR) phenomenon, and in particular, in a minimum time required for depicting the running of a vascular system. The present invention relates to a magnetic resonance imaging apparatus (hereinafter referred to as an MRI apparatus) capable of ensuring a desired rendering range and image quality.
[0002]
[Prior art]
The MRI apparatus uses the NMR phenomenon to measure the density distribution, relaxation time distribution, etc. of nuclear spins (hereinafter simply referred to as spins) at a desired examination site in the subject, The cross section is displayed as an image.
[0003]
As an imaging function of this MRI apparatus, there is MR angiography (hereinafter abbreviated as MRA) for drawing a blood flow, and MRA includes a method using no contrast agent and a method using a contrast agent.
As a method using a contrast agent, a method of combining a T1 shortened contrast agent such as Gd-DTPA with a short TR sequence of a gradient echo system is generally used. In this method, since the blood flow spin containing the T1 shortening type contrast agent has a T1 shorter than that of the surrounding tissue, saturation is unlikely to occur when excitation by a high-frequency magnetic field is received for a short repetition time TR. A blood vessel filled with blood containing a contrast agent is depicted with high contrast with respect to other tissues by using a high signal emitted from other tissues. By measuring the volume data (specifically three-dimensional) including blood vessels while the contrast agent stays in the target blood vessel, by superimposing the obtained three-dimensional image and performing projection processing, Draw blood flow. Here, in general, a sequence based on a three-dimensional gradient echo method is used in order to obtain high-resolution information in a wide range.
[0004]
In order to obtain a good image in such a three-dimensional contrast MRA, (1) a contrast medium injection method and (2) an imaging time and timing are important. As for (1), the contrast medium must be injected so as to stably maintain a high concentration in the blood vessel to be imaged. For this reason, rapid injection using an automatic injector is generally used.
[0005]
With regard to (2), for example, in order to separate and selectively image only an artery, it is necessary to set the imaging timing so that the concentration of the contrast agent in the artery becomes high during data collection. In particular, it is ideal that the contrast agent concentration reaches a peak in the central portion (low frequency region) of the k space that governs the contrast of the image, and the timing is set according to the data acquisition method of the pulse sequence to be used.
[0006]
In the data collection method, the sequential order is mainly measured from one end of the high frequency side of the k space to the other end of the high frequency side through the low frequency region, and the measurement is alternately performed from the low frequency region of the k space toward both ends of the high frequency. There is a centric order, and a centric order is generally used. In the centric order of three-dimensional measurement, one or both of the phase encoding loop and the slice encoding loop are controlled to be the outer loop and the other is controlled to the centric order.
[0007]
However, the centric order in this case is not a true centric order because the distance from the origin on the k space to the measurement point (sampling point) varies as shown in FIG. It was easy to receive, and there were cases where arteriovenous separation was insufficient.
[0008]
Elliptical centric ordering that takes into account the relative FOV in the ky-kz space as a method to solve such problems and controls the distance from the origin in the k space to gradually move away as the signal measurement progresses (Elliptical Centric Ordering) has been proposed (Fig. 1 (c)) ("Performance of an Ellipitical Centric View Order for Signal Enhancement and Motion Artifact Suppression in Breath-hold Three-Dimensional Gradient Echo Imaging. Alan, et al. Magnetic Resonance in Medicine 38: 793-802,1997 ").
[0009]
[Problems to be solved by the invention]
In this data acquisition method, low-frequency data that determines the contrast of the image is measured at the beginning of the imaging time, so that an arteriovenous image can be selectively obtained by starting imaging when the contrast agent concentration of the target blood vessel increases. It became possible to get.
[0010]
However, although the centric order and elliptical centric ordering described above are effective in determining the contrast of an image early and selectively obtaining an arterial image, if the optimal imaging timing is deviated, the contrast agent concentration is reduced. Since the low frequency information is acquired only in a thin time zone, there is a problem that the image quality is likely to deteriorate. In particular, if the measurement starts too early, the data in the low frequency region will be sampled in a time zone where the blood vessel has a very low signal, while the data in the high frequency region will be sampled in a time zone where the blood vessel has a high signal. Since sampling is performed, ringing artifacts having no DC component are generated.
[0011]
On the other hand, in the sequential order, even if the measurement timing is slightly shifted, it is possible to obtain a stable image with no noticeable artifacts appearing in the image. However, as with the centric order described above, it is weak to the subject's body movement and has sufficient arteriovenous separation. There was a problem that was not done.
[0012]
Accordingly, an object of the present invention is to provide an MRI apparatus capable of rendering the entire target blood vessel with high contrast in a short time while reducing the influence on the image quality due to the shift of the optimum imaging timing. It is another object of the present invention to provide an MRI apparatus that is hardly affected by body movement and can separately depict arteries and veins in MRA. A further object of the present invention is to provide a data collection method suitable for MRA.
[0013]
[Means for Solving the Problems]
In order to achieve the above object, in the present invention, the measurement points in the ky-kz space are measured by dividing them into two groups having a complex conjugate relationship with each other. Data collection method in which the distance from the origin to the measurement point is gradually increased in the second group that measures from the measurement point of the distance to the origin so that the distance from the origin gradually decreases. Is adopted.
[0014]
That is, the MRI apparatus of the present invention includes a static magnetic field generating means for generating a static magnetic field in a space where a subject is placed, and a gradient magnetic field generating means for applying gradient magnetic fields in the slice direction, the phase encoding direction, and the readout direction to the space. A transmission system that irradiates a high-frequency magnetic field to cause nuclear magnetic resonance in the nucleus of the biological tissue of the subject; a reception system that detects an echo signal emitted by the nuclear magnetic resonance; and the gradient magnetic field generation means, A control system for controlling the transmission system and the reception system, a signal processing system for performing image reconstruction calculation using an echo signal detected by the reception system, and a means for displaying the obtained image, the control system comprising: A three-dimensional sequence to which slice encoding and phase encoding are applied is executed. At this time, measurement points in k space defined by the slice encoding number and the phase encoding number are shared with the origin. In the first group, the distance from the origin to the measurement point gradually decreases in the order of measurement, and in the second group, the distance from the origin to the measurement point. Are controlled so as to gradually increase in the order of measurement.
[0015]
When dividing the measurement points into two groups, it is preferable to divide adjacent measurement points so that they belong to different groups. In order to satisfy the condition that the measurement points of the two groups are in a complex conjugate relationship with each other, it is necessary that measurement points that are partially adjacent to each other in the vicinity of the origin belong to the same group. Therefore, in this specification, “dividing adjacent measurement points so as to belong to different groups” satisfies the condition that they are in a complex conjugate relationship and satisfies the maximum condition that adjacent measurement points belong to different groups. The state that has been done.
[0016]
In the three-dimensional image data acquisition method of the present invention, a step of selecting and exciting a predetermined region of a subject, applying a gradient magnetic field encoded in at least two directions, and measuring an echo signal generated from the region is performed by the gradient magnetic field. In a data collection method that collects three-dimensional image data by repeating multiple times while changing the intensity of the measurement point, the measurement point in the measurement space defined by the encode gradient magnetic field intensity in the two directions shares the origin and has a complex conjugate relationship with each other. In addition, the adjacent measurement points are divided into the first and second groups so as to belong to different groups, and the first and second groups are sequentially measured. At that time, in the first group measured first, In the second group, which is measured later, the distance from the origin of the measurement space to the measurement point gradually increases in the order of measurement. To measure to.
[0017]
According to the data collection method of the present invention, as shown in FIG. 1 (a), it is possible to perform measurement without variation in the distance from the origin, and when the lowest frequency component is measured and the signal intensity of the target blood vessel is The target blood vessel can be depicted with high contrast by matching the peak point with the contrast agent. Moreover, even if there is a slight difference between the time point when the low frequency component is measured and the peak of the signal intensity, the low frequency component can be reliably measured, and the image is not deteriorated. FIGS. 1B to 1D show changes in distance from the k-space origin in the conventional centric order, elliptical centric order, and sequential order.
[0018]
According to a preferred aspect of the data collection method of the present invention, the first group measures only some of the measurement points, and the second group measures all measurement points. And
Since the two groups are in a complex conjugate relationship, even if one group does not measure some measurement points, data that is not measured can be estimated from the measurement data of the other groups. Thereby, the measurement time of one group can be shortened. In particular, when measurement of the first group is performed between the time when the concentration of the contrast medium increases and the peak, unnecessary data with low signal intensity can be eliminated, and a good image can be obtained.
[0019]
DETAILED DESCRIPTION OF THE INVENTION
Embodiments of the present invention will be described below with reference to the accompanying drawings.
FIG. 2 is a block diagram showing the overall configuration of the MRI apparatus according to the present invention. This MRI apparatus uses a NMR phenomenon to obtain a tomographic image of a subject, and includes a static magnetic
[0020]
The static magnetic
[0021]
The magnetic field
[0022]
The
[0023]
The
[0024]
The receiving
[0025]
The
[0026]
Next, the blood flow imaging function in the MRI apparatus of the present invention will be described.
As already described, the
[0027]
This pulse sequence is a sequence based on the gradient echo method as shown in FIG. 3, for example, and is typical for a three-dimensional MRA sequence. That is, after exciting the region (slab) including the target blood vessel by applying the high-frequency magnetic field pulse RF simultaneously with the region selection gradient magnetic field Gs, applying the gradient magnetic field pulse Ge1 in the slice direction and the gradient magnetic field pulse Ge2 in the phase encoding direction, Next, the read gradient magnetic field Gr is applied and the polarity is reversed to measure the echo signal. The high-frequency magnetic field pulse RF to echo signal measurement are repeated at a predetermined repetition time TR while changing the magnetic field strength of the gradient magnetic field Ge1 in the slice direction and the gradient magnetic field Ge2 in the phase encoding direction, and three-dimensional data is obtained.
[0028]
The number of encodings in the slice direction and the phase encoding direction determines the image resolution in both directions, and is set in advance in consideration of the measurement time and the like. For example, the number of encodes in the phase encode direction is set to 128, 256, and the slice direction is set to 10-30. The k space (ky-kz) is defined by the number of encodes in the slice direction and the phase encode direction. That is, in the sequence of FIG. 3, signals measured when the gradient magnetic field strength value Ge1 (Gz) in the slice direction and the gradient magnetic field strength value Ge2 (Gy) in the phase encoding direction correspond to Gz and Gy. It is arranged at a lattice point in the k space, (ky, kz).
[0029]
For example, the three-dimensional MRA sequence itself shown in FIG. 3 is general in MRA, but in this sequence adopted by this embodiment, the data collection method is different from the conventional centric order or elliptical centric ordering. .
[0030]
In this method, grid points in a ky-kz space (hereinafter simply referred to as k space), that is, measurement points are divided into two groups, and these two groups are sequentially measured. When dividing the measurement points into two groups, 1) the two groups share the origin, the measurement points belonging to the two groups are in a complex conjugate relationship with each other, and 2) the adjacent measurement points are different in k-space. It is necessary to belong to a group.
[0031]
FIG. 4 shows an 8 * 8 matrix k-space in which the number of slice encodings is 8 and the number of phase encodings is 8, as a simplified example of the above-described data collection method. There are 64 grid points (measurement points) in this matrix, and these grid points are divided into a first group shown on the left side and a second group shown on the right side in the figure. The lattice points belonging to these two groups have a complex conjugate relationship with each other, and adjacent lattice points belong to different groups. However, in order to satisfy the complex conjugate relationship, adjacent lattice points belong to one group in the vicinity of the origin.
[0032]
In the first group to be measured first of these two groups, the measurement starts from a point with a large distance from the
[0033]
In the figure, the numbers in circles indicate the data collection order. The measurement points with the same number have no order, indicating that measurement may be performed from any of them.
In the first group that starts measurement first, the measurement starts from the grid point (number 1) farthest from the origin (the grid point numbered 33), that is, the highest frequency component, and then the
[0034]
Next, an embodiment of contrast-enhanced MRA using the MRI apparatus employing such a data collection method will be described with reference to FIG.
First, a subject is placed in a measurement space in a static magnetic field magnet, an imaging region including a target blood vessel is determined, and timing imaging is performed. Timing imaging is performed by the test injection method. In this method, a small amount of contrast medium (about 1 to 2 ml) is test-injected to obtain a time-signal curve at the target site, as shown in FIG. This is a method of measuring the time t1 and determining the timing for performing the main imaging based on this result. As a timing imaging method, in addition to this test injection method, an ROI is set for a specific region within the monitor area regarding the arrival of the contrast agent, signal changes in the same region are captured, and when the set threshold is exceeded, automatic There are methods that start imaging, short-time imaging called fluoroscopy, and methods of observing the target blood vessel in real time by repeated display and starting imaging when an appropriate signal rise is obtained. Although it is possible to adopt, the test injection method is preferable because the timing can be accurately measured by using the contrast agent prior to the main imaging.
[0035]
After timing imaging, main imaging is performed as shown in FIG. Although the main imaging may be performed only after the contrast agent injection, preferably the images before and after the contrast agent injection are captured. Imaging before and after contrasting is continuously performed for the same slice or slab position under the same conditions.
The imaging sequence is a sequence based on the short TR three-dimensional gradient echo method as shown in FIG. In this case, since blood flow is an imaging target, a gradient magnetic field, that is, a gradient moment nulling (Gradient Moment Nulling) for rephasing the phase due to the flow may be added, but this is not essential, and TR / TE For shortening, it is preferable to use a simple gradient echo.
[0036]
Since the imaging time T is determined when the repetition time TR of the pulse sequence, the matrix size (number of slice encodes and phase encodes), and the number of additions are determined, the contrast agent arrival time t1 of the target blood vessel obtained by the above timing imaging is determined. In addition, the imaging start time t2 (time from the injection of the contrast agent to the start of imaging) so that the data measurement of the low frequency region of the ky-kz space is performed when the contrast agent reaches the target blood vessel Set. In imaging, first measurement of the first group is started, and then measurement of the second group is performed. In this case, the
[0037]
If three-dimensional image data is obtained before contrasting in the same procedure, three-dimensional data only for blood vessels can be obtained by taking these differences. The difference processing is performed by, for example, performing a complex difference between slices having the same slice position in three dimensions. The difference may be an absolute difference. In this way, the method of removing tissue other than blood vessels by performing difference processing between images before and after contrast is a known technique called 3D MR-DSA (Digital Subtraction Angiography), which is not essential in the present invention. It is suitable for rendering thin blood vessels where it is difficult to obtain sufficient contrast with tissues other than blood vessels.
[0038]
Furthermore, the three-dimensional data after the difference processing can be stereoscopically observed by projecting it in an arbitrary direction such as a coronal section, a sagittal section, or an axis crossing. As a projection method, a known maximum value projection method or the like can be employed. It is also possible to perform pseudo three-dimensional display processing such as volume rendering, and it is also possible to perform simple all-slice integration processing because data after difference is used.
[0039]
As described above, according to the contrast-enhanced MRA of the present invention, the low-frequency component in the k-space is measured when the contrast agent reaches the target blood vessel and the signal intensity of the blood flowing through the target blood vessel becomes the highest. Can be drawn with high contrast. In addition, as shown in FIG. 5, there is a time zone for measuring the low frequency component on both sides of the contrast agent arrival time t1, so that the contrast agents of the two may differ depending on slight differences in conditions between timing imaging and main imaging. Even when there is a shift in the arrival time t1, it is possible to obtain a high-quality image with almost no deterioration in image quality.
[0040]
In the above embodiment, the case of measuring all measurement points belonging to both the first group and the second group as the data collection method has been described. However, as shown in FIG. May omit the measurement of a predetermined high-frequency component, and may adopt a data collection method for measuring a low-frequency component in a short time.
[0041]
An example of such a data collection method is shown in FIG. FIG. 6 also illustrates an 8 * 8 matrix k-space with 8 slice encodings and 8 phase encodings. In this embodiment as well, the k-space is divided into two groups under the same conditions as in the embodiment shown in FIG. 4, but in this case, the first group to be measured first does not measure a predetermined high-frequency component, and the low frequency Measure only the components. In the illustrated embodiment, only the lattice points existing in the 4 * 4 matrix in the low frequency region among the lattice points in the k space are measured. First, the grid point having the longest distance from the origin (the grid point of No. 9) among the grid points in the low frequency region is used as a starting point, and the grid point of No. 2 and the grid point of No. 3 are measured in that order.
[0042]
In the second group, measurement is performed from the lattice point (number 10) adjacent to the origin as in the embodiment shown in FIG. 4, and the entire lattice points belonging to the second group are measured up to the highest frequency component in the order away from the origin.
[0043]
In this case, the data of the high frequency region that was not measured in the first group can be estimated based on the complex conjugates of the first group and the second group. As a method for estimating unmeasured data, a method based on a known half-Fourier reconstruction method can be employed. FIG. 7 schematically shows these processes. First, the measurement data is subjected to a one-dimensional Fourier transform in the frequency encoding direction (kx direction) to obtain actual measurement data in a three-dimensional hybrid space. Hybrid space data is obtained by obtaining three-dimensional estimation data from the actual measurement data and synthesizing the actual measurement data and the estimation data. Three-dimensional image data is obtained by two-dimensional Fourier transform of the hybrid space data.
[0044]
Thereby, even if the number of data points is reduced, the spatial resolution is not deteriorated.
In this embodiment as well, the low frequency component of the k-space is measured when the contrast medium reaches the target blood vessel and the signal intensity of the blood flowing through the target blood vessel becomes the highest as in the data collection method shown in FIG. Thus, an artery image can be drawn with high contrast.
[0045]
In general, as shown in FIG. 7, the contrast agent concentration (signal intensity) rises sharply after injection of the contrast agent, so that the time point at which the lowest frequency component is measured is aligned with the peak of the signal intensity, and is unnecessary before reaching the contrast agent. In order to avoid measurement of a large signal, this embodiment is preferable because the measurement before the peak is short.
[0046]
The results of simulating differences in arteriovenous separation due to differences in imaging methods (data collection methods) are shown in FIGS. This simulation uses simulated blood vessels of arteries and veins, in which a contrast medium is introduced at a flow rate of 40 cm / s, arterial venous return time of 7 seconds, and injection speed of 2 cc / s, and this is imaged by different imaging methods. . FIG. 8 shows the signal intensity under the above conditions. First, the peak of the signal from the artery is seen, and the peak of the signal from the vein appears later. FIG. 9A shows an image obtained by the imaging method of the present invention, and FIG. 9B shows an image obtained by an elliptical centric order.
[0047]
As can be seen from the figure, in the elliptical centric order, veins as well as arteries are imaged, and arteriovenous separation is not complete, whereas the imaging method of the present invention can draw only the arteries with high contrast.
[0048]
In the above embodiment, the gradient echo method is exemplified as the three-dimensional MRA sequence. However, an EPI (Echo Planer Imaging) method for measuring a plurality of echo signals by one excitation, a division type EPI, or the like is also employed. be able to.
[0049]
Furthermore, the data collection in the k-space is not limited to the rectangular matrix as shown in FIGS. 4 and 6, but it is also possible to collect data in a circle (ellipse) centered on the origin as shown in FIG. . In the first group indicated by a solid line in the figure, the measurement starts from a point where the distance from the
[0050]
Also in this case, the same effect as the embodiment shown in FIGS. 4 and 6 can be obtained. Also in this case, measurement of the first group of high frequency components can be omitted as necessary.
[0051]
【The invention's effect】
As described above, according to the MRI apparatus of the present invention, the measurement points in the ky-kz space are divided into two groups having a complex conjugate relationship with each other, and measurement is performed in the order of the first group and the second group. In the first group, the sampling point is controlled from the high frequency component to the low frequency component so that the distance from the origin in the k space gradually approaches, and in the second group, the distance gradually increases. In this way, sampling points are controlled from the low-frequency component to the high-frequency component in this way, so that the effects of imaging timing shifts are reduced, and artifacts that depend on the contrast timing, which has been a problem with conventional contrast MRA, are generated. In addition, it is possible to prevent overlapping of the arteries and veins and improve blood vessel rendering ability. Further, by reducing the number of measurement points of the first group to be measured first, unnecessary signal measurement and image degradation caused thereby can be eliminated, and the imaging time can be shortened.
[Brief description of the drawings]
FIG. 1 is a schematic diagram for explaining a data collection method employed by an MRI apparatus according to the present invention and a conventional data collection method. FIG. 2 is a block diagram showing an overall configuration of an MRI apparatus to which the present invention is applied. The figure which shows one Example of the pulse sequence of the contrast MRA measurement which the MRI apparatus of invention performs FIG. 4 The figure which shows typically one Example of the data collection order of k space by this invention FIG. Fig. 6 is a diagram for explaining MRA imaging by an MRI apparatus. Fig. 6 is a diagram schematically showing another embodiment of the k-space data collection order according to the present invention. Fig. 7 is an image reconstruction method to which the data collection method of Fig. 6 is applied. FIG. 8 is a diagram showing a simulation for evaluating MRA imaging by the MRI apparatus of the present invention. FIG. 9 is a diagram showing results of simulating MRA imaging by the MRI apparatus of the present invention and MRA imaging by a conventional method. FIG. 10 shows k-space data according to the present invention. Diagram showing another embodiment of the current sequence schematically EXPLANATION OF REFERENCE NUMERALS
DESCRIPTION OF
9 ... Gradient magnetic field coil
14a, ... High-frequency coil on the transmission side
14b ... High frequency coil on the receiving side
Claims (6)
前記制御系は、スライスエンコード及び位相エンコードの少なくとも一方を付与して二次元又は三次元シーケンスを実行し、この際、スライスエンコード数および位相エンコード数の少なくとも一方で規定されるk空間の計測点を、原点を共有し、互いに複素共役の関係にある第1及び第2の群に分割し、第1の群では原点から計測点までの距離が計測順に漸減し、第2の群では原点から計測点までの距離が計測順に漸増するように前記スライス方向および位相エンコード方向の少なくとも一方の傾斜磁場発生手段を制御することを特徴とする磁気共鳴イメージング装置。A static magnetic field generating means for generating a static magnetic field in a space in which the subject is placed; a gradient magnetic field generating means for applying gradient magnetic fields in the slice direction, phase encoding direction, and readout direction to the space; and a nucleus of the biological tissue of the subject A transmission system that irradiates a high-frequency magnetic field to cause nuclear magnetic resonance in the antenna, a reception system that detects an echo signal emitted by the nuclear magnetic resonance, and a control that controls the gradient magnetic field generating means, the transmission system, and the reception system In a magnetic resonance imaging apparatus comprising: a system; a signal processing system for performing image reconstruction calculation using an echo signal detected by a receiving system; and a means for displaying the obtained image
The control system assigns at least one of slice encoding and phase encoding to execute a two-dimensional or three-dimensional sequence, and at this time, k-space measurement points defined by at least one of the slice encoding number and the phase encoding number are set. , Share the origin, and divide into the first and second groups that are in a complex conjugate relationship with each other. In the first group, the distance from the origin to the measurement point gradually decreases in the order of measurement, and in the second group, the measurement starts from the origin. A magnetic resonance imaging apparatus characterized by controlling at least one of the gradient magnetic field generating means in the slice direction and the phase encoding direction so that the distance to the point gradually increases in the order of measurement.
前記制御手段は、前記二方向のエンコード傾斜磁場強度で規定されるk空間の計測点を、原点を共有し、互いに複素共役の関係で且つ隣り合う格子点は異なる群に属するように第1及び第2の群に分割し、第1及び第2の群について順次計測を行い、その際、最初に計測される第1の群では、前記k空間の原点から計測点までの距離が計測順に漸減するように計測し、後で計測される第2の群では前記k空間の原点から計測点までの距離が計測順に漸増するように計測することを特徴とする磁気共鳴イメージング装置。Means for selecting and exciting a predetermined region of the subject; gradient magnetic field applying means for applying gradient magnetic fields in at least two directions to the subject; measuring means for measuring an echo signal generated from the region; and the excitation means The step of controlling the gradient magnetic field applying means and the measuring means, applying the gradient magnetic field encoded in at least two directions, and measuring the echo signal generated from the region is repeated a plurality of times while changing the intensity of the gradient magnetic field, thereby obtaining a three-dimensional image. In a magnetic resonance imaging apparatus comprising a control means for collecting data,
The control means share the origin of the measurement points in the k-space defined by the encode gradient magnetic field strengths in the two directions, have a complex conjugate relationship with each other, and adjacent lattice points belong to different groups. Dividing into the second group, the first group and the second group are measured sequentially. At that time, in the first group measured first, the distance from the origin of the k-space to the measurement point gradually decreases in the order of measurement. In the second group to be measured later, the magnetic resonance imaging apparatus performs measurement so that the distance from the origin of the k space to the measurement point gradually increases in the measurement order.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000097632A JP3847519B2 (en) | 2000-03-31 | 2000-03-31 | Magnetic resonance imaging system |
| PCT/JP2001/000832 WO2001058352A1 (en) | 2000-02-07 | 2001-02-07 | Magnetic resonance imaging device |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000097632A JP3847519B2 (en) | 2000-03-31 | 2000-03-31 | Magnetic resonance imaging system |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001276016A JP2001276016A (en) | 2001-10-09 |
| JP2001276016A5 JP2001276016A5 (en) | 2005-06-30 |
| JP3847519B2 true JP3847519B2 (en) | 2006-11-22 |
Family
ID=18612227
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000097632A Expired - Fee Related JP3847519B2 (en) | 2000-02-07 | 2000-03-31 | Magnetic resonance imaging system |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3847519B2 (en) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4201089B2 (en) * | 2002-05-31 | 2008-12-24 | 株式会社日立メディコ | Magnetic resonance imaging apparatus and multi-station CE-MRA method |
| US7660618B2 (en) | 2002-06-07 | 2010-02-09 | Hitachi Medical Corporation | Magnetic resonance imaging device |
| US7467006B2 (en) | 2003-10-07 | 2008-12-16 | Hitachi Medical Corporation | Magnetic resonance imaging system and contrast-enhanced angiography |
| EP1812101A4 (en) * | 2004-11-16 | 2014-04-23 | Medrad Inc | Modeling of pharmaceutical propagation |
| JP5133711B2 (en) * | 2008-01-10 | 2013-01-30 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | Magnetic resonance imaging apparatus and magnetic resonance image generation method |
| WO2010045003A1 (en) * | 2008-10-14 | 2010-04-22 | Mayo Foundation For Medical Education And Research | Method for time-of-arrival mapping in magnetic resonance imaging |
| JP6362950B2 (en) * | 2014-07-24 | 2018-07-25 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | Magnetic resonance equipment |
-
2000
- 2000-03-31 JP JP2000097632A patent/JP3847519B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2001276016A (en) | 2001-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3847512B2 (en) | Magnetic resonance imaging system | |
| JP4127889B2 (en) | Magnetic resonance imaging system | |
| JP3845714B2 (en) | Method for performing magnetic resonance angiography using a contrast agent | |
| US9700220B2 (en) | Magnetic resonance imaging apparatus and magnetic resonance imaging method | |
| US8228063B2 (en) | Magnetic resonance imaging apparatus and magnetic resonance imaging method | |
| US5873825A (en) | Three dimensional digital subtraction magnetic resonance angiography with limited k-space mask | |
| JP5127841B2 (en) | Magnetic resonance imaging apparatus and magnetic susceptibility weighted imaging method | |
| EP1145029A1 (en) | Contrast detection and guided reconstruction in contrast-enhanced magnetic resonance angiography | |
| US20130241552A1 (en) | Magnetic resonance imaging apparatus and contrast-enhanced image acquisition method | |
| WO2011114264A1 (en) | Simultaneous and dynamic determination of longitudinal and transversal relaxation times of a nuclear spin system | |
| JP4807833B2 (en) | Magnetic resonance imaging apparatus and contrast angiography method using the same | |
| US20150042335A1 (en) | Mr imaging with b1 mapping | |
| US7307420B2 (en) | MRI method for simultaneous phase contrast angiography and invasive device tracking | |
| US7450982B2 (en) | Magnetic resonance imaging system and method | |
| US6044290A (en) | Time-resolved digital subtraction magnetic resonance angiography using echo-planar imaging | |
| US6198960B1 (en) | Flip angle modulated magnetic resonance angiography | |
| JPH07116144A (en) | Magnetic resonance imaging method and apparatus | |
| JP3847554B2 (en) | Magnetic resonance imaging system | |
| US7167740B2 (en) | Measuring method in magnetic resonance imaging device and magnetic resonance imaging device | |
| JP3847519B2 (en) | Magnetic resonance imaging system | |
| JP2008055023A (en) | Magnetic resonance imaging apparatus | |
| JP4763142B2 (en) | Magnetic resonance imaging system | |
| JP3903276B2 (en) | Magnetic resonance imaging device | |
| JP4462781B2 (en) | Magnetic resonance imaging system | |
| JP4266574B2 (en) | Magnetic resonance imaging system |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20041018 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041018 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060822 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060823 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100901 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110901 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110901 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120901 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120901 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130901 Year of fee payment: 7 |
|
| LAPS | Cancellation because of no payment of annual fees |