JP2019530640A - 多量体ox40結合分子及びその使用 - Google Patents
多量体ox40結合分子及びその使用 Download PDFInfo
- Publication number
- JP2019530640A JP2019530640A JP2019502573A JP2019502573A JP2019530640A JP 2019530640 A JP2019530640 A JP 2019530640A JP 2019502573 A JP2019502573 A JP 2019502573A JP 2019502573 A JP2019502573 A JP 2019502573A JP 2019530640 A JP2019530640 A JP 2019530640A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- binding
- binding molecule
- domain
- igm
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 230000027455 binding Effects 0.000 title claims abstract description 672
- 238000009739 binding Methods 0.000 title claims abstract description 667
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 title claims abstract description 227
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 title claims abstract description 219
- 239000000539 dimer Substances 0.000 claims abstract description 84
- 238000000034 method Methods 0.000 claims abstract description 64
- 239000000556 agonist Substances 0.000 claims abstract description 55
- 230000005809 anti-tumor immunity Effects 0.000 claims abstract description 16
- 239000012634 fragment Substances 0.000 claims description 172
- 239000000427 antigen Substances 0.000 claims description 139
- 102000036639 antigens Human genes 0.000 claims description 139
- 108091007433 antigens Proteins 0.000 claims description 139
- 210000004027 cell Anatomy 0.000 claims description 124
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 100
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 96
- 229920001184 polypeptide Polymers 0.000 claims description 91
- 241000282414 Homo sapiens Species 0.000 claims description 86
- 150000001413 amino acids Chemical class 0.000 claims description 80
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 79
- 108091033319 polynucleotide Proteins 0.000 claims description 67
- 102000040430 polynucleotide Human genes 0.000 claims description 67
- 239000002157 polynucleotide Substances 0.000 claims description 67
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 55
- 101000840258 Homo sapiens Immunoglobulin J chain Proteins 0.000 claims description 53
- 102100029571 Immunoglobulin J chain Human genes 0.000 claims description 53
- 206010028980 Neoplasm Diseases 0.000 claims description 44
- 239000000178 monomer Substances 0.000 claims description 35
- 239000013598 vector Substances 0.000 claims description 33
- 108060003951 Immunoglobulin Proteins 0.000 claims description 29
- 102000018358 immunoglobulin Human genes 0.000 claims description 29
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 claims description 28
- 150000007523 nucleic acids Chemical group 0.000 claims description 27
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 25
- 201000011510 cancer Diseases 0.000 claims description 24
- 230000014509 gene expression Effects 0.000 claims description 24
- 239000000203 mixture Substances 0.000 claims description 24
- 238000004132 cross linking Methods 0.000 claims description 21
- 230000011664 signaling Effects 0.000 claims description 19
- 238000006467 substitution reaction Methods 0.000 claims description 19
- 230000004913 activation Effects 0.000 claims description 18
- 238000011282 treatment Methods 0.000 claims description 18
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 claims description 13
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 claims description 13
- 230000001404 mediated effect Effects 0.000 claims description 13
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 13
- 210000003289 regulatory T cell Anatomy 0.000 claims description 13
- 230000019491 signal transduction Effects 0.000 claims description 11
- 102400001107 Secretory component Human genes 0.000 claims description 10
- 210000004881 tumor cell Anatomy 0.000 claims description 10
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 claims description 9
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 claims description 9
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 claims description 9
- 101001055311 Equus asinus Immunoglobulin heavy constant alpha Proteins 0.000 claims description 8
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 8
- 210000003162 effector t lymphocyte Anatomy 0.000 claims description 8
- 230000001939 inductive effect Effects 0.000 claims description 8
- 230000035755 proliferation Effects 0.000 claims description 8
- 102000004127 Cytokines Human genes 0.000 claims description 7
- 108090000695 Cytokines Proteins 0.000 claims description 7
- 230000004044 response Effects 0.000 claims description 7
- 230000003213 activating effect Effects 0.000 claims description 6
- 230000001270 agonistic effect Effects 0.000 claims description 5
- 230000036039 immunity Effects 0.000 claims description 4
- 230000002401 inhibitory effect Effects 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 230000022534 cell killing Effects 0.000 claims description 3
- 230000002757 inflammatory effect Effects 0.000 claims description 3
- 230000000977 initiatory effect Effects 0.000 claims description 3
- 231100000590 oncogenic Toxicity 0.000 claims description 3
- 230000002246 oncogenic effect Effects 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 2
- 230000005012 migration Effects 0.000 claims description 2
- 238000013508 migration Methods 0.000 claims description 2
- 235000001014 amino acid Nutrition 0.000 description 89
- 229940024606 amino acid Drugs 0.000 description 78
- 108090000623 proteins and genes Proteins 0.000 description 41
- 102000004169 proteins and genes Human genes 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 23
- 102000005962 receptors Human genes 0.000 description 22
- 108020003175 receptors Proteins 0.000 description 22
- 102000039446 nucleic acids Human genes 0.000 description 20
- 108020004707 nucleic acids Proteins 0.000 description 20
- 101000679851 Homo sapiens Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 18
- 230000006870 function Effects 0.000 description 15
- 238000002965 ELISA Methods 0.000 description 14
- 101100153537 Mus musculus Tnfrsf4 gene Proteins 0.000 description 14
- 239000012636 effector Substances 0.000 description 14
- 241000699666 Mus <mouse, genus> Species 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 239000000499 gel Substances 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 108091026890 Coding region Proteins 0.000 description 12
- 238000003556 assay Methods 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 108010076504 Protein Sorting Signals Proteins 0.000 description 10
- 102000050320 human TNFRSF4 Human genes 0.000 description 10
- 210000004899 c-terminal region Anatomy 0.000 description 9
- 238000005516 engineering process Methods 0.000 description 9
- 108020004999 messenger RNA Proteins 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 230000001976 improved effect Effects 0.000 description 8
- 238000013518 transcription Methods 0.000 description 8
- 230000035897 transcription Effects 0.000 description 8
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 7
- 108010057466 NF-kappa B Proteins 0.000 description 7
- 108700026244 Open Reading Frames Proteins 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- 238000012286 ELISA Assay Methods 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 6
- 230000006052 T cell proliferation Effects 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 5
- 206010009944 Colon cancer Diseases 0.000 description 5
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 5
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 238000010790 dilution Methods 0.000 description 5
- 239000012895 dilution Substances 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 239000003623 enhancer Substances 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 238000000684 flow cytometry Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 5
- 230000009870 specific binding Effects 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 239000004971 Cross linker Substances 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 description 4
- 230000006044 T cell activation Effects 0.000 description 4
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 4
- 102100026890 Tumor necrosis factor ligand superfamily member 4 Human genes 0.000 description 4
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 4
- 239000012190 activator Substances 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
- 230000001506 immunosuppresive effect Effects 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 4
- 229920000136 polysorbate Polymers 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 230000000284 resting effect Effects 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- -1 tripeptide Proteins 0.000 description 4
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 4
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 3
- 101000610605 Homo sapiens Tumor necrosis factor receptor superfamily member 10A Proteins 0.000 description 3
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 3
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 3
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 3
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 3
- 206010062016 Immunosuppression Diseases 0.000 description 3
- 208000008839 Kidney Neoplasms Diseases 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- 206010025323 Lymphomas Diseases 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 206010033128 Ovarian cancer Diseases 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 102100040113 Tumor necrosis factor receptor superfamily member 10A Human genes 0.000 description 3
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 3
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 230000030833 cell death Effects 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 230000005754 cellular signaling Effects 0.000 description 3
- 208000029742 colonic neoplasm Diseases 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 230000001024 immunotherapeutic effect Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000002601 intratumoral effect Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 208000020816 lung neoplasm Diseases 0.000 description 3
- 201000001441 melanoma Diseases 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 238000010369 molecular cloning Methods 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 3
- 230000001737 promoting effect Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000009261 transgenic effect Effects 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- 244000105975 Antidesma platyphyllum Species 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 101150013553 CD40 gene Proteins 0.000 description 2
- 210000005236 CD8+ effector T cell Anatomy 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101000764263 Homo sapiens Tumor necrosis factor ligand superfamily member 4 Proteins 0.000 description 2
- 101000610602 Homo sapiens Tumor necrosis factor receptor superfamily member 10C Proteins 0.000 description 2
- 101000610609 Homo sapiens Tumor necrosis factor receptor superfamily member 10D Proteins 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 102000003945 NF-kappa B Human genes 0.000 description 2
- 108010042215 OX40 Ligand Proteins 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 239000011542 SDS running buffer Substances 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 2
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 102100040115 Tumor necrosis factor receptor superfamily member 10C Human genes 0.000 description 2
- 102100040110 Tumor necrosis factor receptor superfamily member 10D Human genes 0.000 description 2
- 102100032236 Tumor necrosis factor receptor superfamily member 11B Human genes 0.000 description 2
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 2
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 2
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 2
- 101150013568 US16 gene Proteins 0.000 description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 210000000612 antigen-presenting cell Anatomy 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 238000012575 bio-layer interferometry Methods 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 238000001516 cell proliferation assay Methods 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000012412 chemical coupling Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 208000016496 colorectal squamous cell carcinoma Diseases 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 235000009424 haa Nutrition 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 239000012723 sample buffer Substances 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 230000007781 signaling event Effects 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 229940126625 tavolimab Drugs 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 229960000187 tissue plasminogen activator Drugs 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 1
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 1
- BRMWTNUJHUMWMS-UHFFFAOYSA-N 3-Methylhistidine Natural products CN1C=NC(CC(N)C(O)=O)=C1 BRMWTNUJHUMWMS-UHFFFAOYSA-N 0.000 description 1
- 229940117976 5-hydroxylysine Drugs 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 244000303258 Annona diversifolia Species 0.000 description 1
- 235000002198 Annona diversifolia Nutrition 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 1
- 102000006942 B-Cell Maturation Antigen Human genes 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010004593 Bile duct cancer Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 206010016334 Feeling hot Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 1
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000998953 Homo sapiens Immunoglobulin heavy variable 1-2 Proteins 0.000 description 1
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 1
- 101000648505 Homo sapiens Tumor necrosis factor receptor superfamily member 12A Proteins 0.000 description 1
- 101000795167 Homo sapiens Tumor necrosis factor receptor superfamily member 13B Proteins 0.000 description 1
- 101000679903 Homo sapiens Tumor necrosis factor receptor superfamily member 25 Proteins 0.000 description 1
- 101000679907 Homo sapiens Tumor necrosis factor receptor superfamily member 27 Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000597785 Homo sapiens Tumor necrosis factor receptor superfamily member 6B Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 101000920026 Homo sapiens Tumor necrosis factor receptor superfamily member EDAR Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 102000009490 IgG Receptors Human genes 0.000 description 1
- 108010073807 IgG Receptors Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 102100036887 Immunoglobulin heavy variable 1-2 Human genes 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 239000012515 MabSelect SuRe Substances 0.000 description 1
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101000933447 Mus musculus Beta-glucuronidase Proteins 0.000 description 1
- JDHILDINMRGULE-LURJTMIESA-N N(pros)-methyl-L-histidine Chemical compound CN1C=NC=C1C[C@H](N)C(O)=O JDHILDINMRGULE-LURJTMIESA-N 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 108010035042 Osteoprotegerin Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000709664 Picornaviridae Species 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000002067 Protein Subunits Human genes 0.000 description 1
- 108010001267 Protein Subunits Proteins 0.000 description 1
- 102000018795 RELT Human genes 0.000 description 1
- 108010052562 RELT Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 229940126530 T cell activator Drugs 0.000 description 1
- 230000010782 T cell mediated cytotoxicity Effects 0.000 description 1
- 108010000449 TNF-Related Apoptosis-Inducing Ligand Receptors Proteins 0.000 description 1
- 102000002259 TNF-Related Apoptosis-Inducing Ligand Receptors Human genes 0.000 description 1
- 108010014401 TWEAK Receptor Proteins 0.000 description 1
- 102000016946 TWEAK Receptor Human genes 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 108020004566 Transfer RNA Proteins 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100028786 Tumor necrosis factor receptor superfamily member 12A Human genes 0.000 description 1
- 102100029675 Tumor necrosis factor receptor superfamily member 13B Human genes 0.000 description 1
- 102100029690 Tumor necrosis factor receptor superfamily member 13C Human genes 0.000 description 1
- 101710178300 Tumor necrosis factor receptor superfamily member 13C Proteins 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 description 1
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 description 1
- 102100022203 Tumor necrosis factor receptor superfamily member 25 Human genes 0.000 description 1
- 102100022202 Tumor necrosis factor receptor superfamily member 27 Human genes 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 102100035284 Tumor necrosis factor receptor superfamily member 6B Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 102100030810 Tumor necrosis factor receptor superfamily member EDAR Human genes 0.000 description 1
- 241000282458 Ursus sp. Species 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000005975 antitumor immune response Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000000386 athletic effect Effects 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 208000026900 bile duct neoplasm Diseases 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 108010006025 bovine growth hormone Proteins 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000000837 carbohydrate group Chemical group 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 238000003568 cytokine secretion assay Methods 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 238000003197 gene knockdown Methods 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000005746 immune checkpoint blockade Effects 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229960001438 immunostimulant agent Drugs 0.000 description 1
- 239000003022 immunostimulating agent Substances 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 229940065638 intron a Drugs 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 208000022013 kidney Wilms tumor Diseases 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 210000003071 memory t lymphocyte Anatomy 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 230000037230 mobility Effects 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 208000030427 mucinous ovarian cancer Diseases 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 230000006654 negative regulation of apoptotic process Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 239000013639 protein trimer Substances 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 108020004418 ribosomal RNA Proteins 0.000 description 1
- 210000003935 rough endoplasmic reticulum Anatomy 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- AIDBEARHLBRLMO-UHFFFAOYSA-M sodium;dodecyl sulfate;2-morpholin-4-ylethanesulfonic acid Chemical compound [Na+].OS(=O)(=O)CCN1CCOCC1.CCCCCCCCCCCCOS([O-])(=O)=O AIDBEARHLBRLMO-UHFFFAOYSA-M 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 230000002483 superagonistic effect Effects 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000001296 transplacental effect Effects 0.000 description 1
- PIEPQKCYPFFYMG-UHFFFAOYSA-N tris acetate Chemical compound CC(O)=O.OCC(N)(CO)CO PIEPQKCYPFFYMG-UHFFFAOYSA-N 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5047—Cells of the immune system
- G01N33/505—Cells of the immune system involving T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/35—Valency
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/51—Complete heavy chain or Fd fragment, i.e. VH + CH1
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/515—Complete light chain, i.e. VL + CL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hematology (AREA)
- Cell Biology (AREA)
- Urology & Nephrology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physics & Mathematics (AREA)
- Tropical Medicine & Parasitology (AREA)
- Toxicology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
本出願は、その全体で参照によって本明細書に組み込まれる2016年7月20日出願の米国特許仮出願62/364,763号の利益を主張する。
腫瘍壊死因子スーパーファミリー受容体(TNFSFR)タンパク質は、腫瘍免疫治療薬のための重要な標的である。例えば、TNFSFR標的、例えば、多くのなかでも、CD40、GITR、CD137、及びOX40を指向するアゴニストモノクローナル抗体は現在、無数のがん適応症について治験中である。
本開示は、多量体、例えば、2、5、または6個の二価結合ユニットまたはそのバリアントもしくは断片を含む二量体、五量体、または六量体結合分子であって、各結合ユニットが、抗原結合ドメインとそれぞれ結合している2つのIgAもしくはIgM重鎖定常領域またはその断片を含み、結合分子の抗原結合ドメインのうちの少なくとも3個が、活性化T細胞、例えば、CTLの表面上に、または休止または活性化Treg上に発現されるOX40に特異的に、かつアゴニスティックに結合し、結合分子が、二次架橋部分の非存在下で、Tregまたは活性化CTL上に発現される多数の、例えば、3個以上のOX40モノマーに結合し、それによって、抗腫瘍免疫応答を誘発することができる多量体結合分子を提供する。
定義
「1つの(a)」または「1つの(an)」という用語を付された物は、その物の1つまたは複数を指すことに留意されたい;例えば、「1個の結合分子(a binding molecule)」は、1個または複数の結合分子を表すと理解される。したがって、「1つの(a)」(または「an」)、「1つまたは複数」、及び「少なくとも1つ」という用語は、本明細書において互換的に使用され得る。
配列番号7
配列番号8
IgMは、抗原による刺激に応答してB細胞によって産生される最初の免疫グロブリンであり、5日の半減期で血清中におよそ1.5mg/mlで存在する。IgMは五量体または六量体分子である。IgM結合ユニットは、2本の軽鎖及び2本の重鎖を含む。IgGが3つの重鎖定常ドメイン(CH1、CH2、及びCH3)を含有する一方で、IgMの重(μ)鎖は追加で、C末端の「尾片」を含む第4の定常ドメイン(CH4)を含有する。ヒトIgM定常領域は典型的に、アミノ酸配列の配列番号1を含む。ヒトCμ1領域は、配列番号1のアミノ酸のおよそ5位からアミノ酸のおよそ102位までの範囲であり;ヒトCμ2領域は、配列番号1のアミノ酸のおよそ114位からアミノ酸のおよそ205位までの範囲であり、ヒトCμ3領域は、配列番号1のアミノ酸のおよそ224位からアミノ酸のおよそ319位までの範囲であり、Cμ4領域は、配列番号1のアミノ酸のおよそ329位からアミノ酸のおよそ430位までの範囲であり、かつ尾片は、配列番号1のアミノ酸のおよそ431位からアミノ酸のおよそ453位までの範囲である。配列番号1を下に示す。
本開示は、3個以上、例えば、4個以上、例えば、5、6、7、8、9、10、11、または12個のOX40モノマー、例えば、マウス及び/またはヒトOX40モノマーに特異的に結合し得る五量体または六量体結合分子、すなわち本明細書で定義するとおりの5または6個の「結合ユニット」を有する結合分子を提供する。ある種の態様では、OX40が、細胞、例えば、T細胞、例えば、Tregまたは活性化エフェクターCTL上に発現される場合、本明細書で提供するとおりの五量体または六量体結合分子は、その細胞上の多数の、例えば、3個以上のOX40モノマーを十分に会合させて、二次架橋部分の非存在下でシグナル伝達経路を開始させ、それによって、抗腫瘍免疫を誘導することができる。本明細書で提供するとおりの結合分子は、単一の結合ユニットから構成される結合分子、例えば二価IgG抗体と比較して、改善された結合特性または生物活性を有し得る。例えば、五量体または六量体結合分子は、細胞の表面上の多数の、3個以上のOX40受容体をより効率的に架橋することができ、及び/または、例えば、これに限定されないが、FcγRなどの二次架橋部分の非存在下で細胞の表面上の多数の、例えば、3個以上のOX40受容体を効果的に架橋することができ、それによって、抗腫瘍免疫を促進することができる。
IgAは、粘膜免疫において重要な役割を果たし、産生される全免疫グロブリンの約15%を占める。IgAは、単量体または二量体分子である。IgA結合ユニットは、2本の軽鎖及び2本の重鎖を含む。IgAは、3つの重鎖定常ドメイン(Cα1、Cα2、及びCα3)を含有し、C末端の「尾片」を含む。ヒトIgAには、2つのサブタイプ、IgA1及びIgA2がある。ヒトIgA1定常領域は典型的に、アミノ酸配列の配列番号3を含む。ヒトCα1領域は、配列番号3のアミノ酸のおよそ6位からアミノ酸のおよそ98位までの範囲であり;ヒトCα2領域は、配列番号3のアミノ酸のおよそ125位からアミノ酸のおよそ220位までの範囲であり、ヒトCα3領域は、配列番号3のアミノ酸のおよそ228位からアミノ酸のおよそ330位までの範囲であり、かつ尾片は、配列番号3のアミノ酸のおよそ331位からアミノ酸のおよそ352位までの範囲である。ヒトIgA2定常領域は典型的に、アミノ酸配列の配列番号4を含む。ヒトCα1領域は、配列番号4のアミノ酸のおよそ6位からアミノ酸のおよそ98位までの範囲であり;ヒトCα2領域は、配列番号4のアミノ酸のおよそ112位からアミノ酸のおよそ207位までの範囲であり、ヒトCα3領域は、配列番号4のアミノ酸のおよそ215位からアミノ酸のおよそ317位までの範囲であり、かつ尾片は、配列番号4のアミノ酸のおよそ318位からアミノ酸のおよそ340位までの範囲である。配列番号3及び4を下に示す。
配列番号3
配列番号4
配列番号5
配列番号6
本開示は、3個以上または最高4個のOX40モノマー、例えば、ヒトまたはマウスOX40モノマーに特異的に結合し得る二量体結合分子、例えば本明細書で定義するとおりの2個のIgA「結合ユニット」を有する結合分子を提供する。ある種の態様では、OX40が細胞、例えば、T細胞、例えば、Tregまたは活性化エフェクターCTL上に発現される場合、その細胞上の多数のOX40受容体と、本明細書で提供するとおりの結合分子との接触は、二次架橋部分の非存在下でシグナル伝達経路を開始させ、それによって、抗腫瘍免疫を誘導することができる。本明細書で提供するとおりの二量体結合分子は、単一の結合ユニットから構成される結合分子、例えば、二価IgG抗体と比較して、改善された結合特性または生物活性を有し得る。例えば、IgA結合分子は、細胞の表面上の多数の、例えば、3個以上のOX40受容体をより効率的に架橋することができ、及び/または二次架橋部分、例えば、これに限定されないが、FcγRの非存在下で細胞の表面上の多数の、例えば、3個以上のOX40受容体を効率的に架橋し、それによって、抗腫瘍免疫を促進することができる。さらに、IgA結合分子は、粘膜部位に到達し、本明細書で提供する結合分子のより多大な組織分布を提供し得る。IgAベースの結合分子の使用は、例えば、本明細書で提供する結合分子のより多大な組織分布を可能にし得る。粘膜分布は、ある種のがん、例えば、肺癌、卵巣癌、結腸直腸癌、または扁平上皮癌の腫瘍微小環境に達するために有益であり得る。同様に、本明細書で提供するとおりの二量体結合分子は、5または6個の結合ユニットを含む結合分子、例えば六量体または五量体IgM抗体と区別され得る結合特性または生物活性を有し得る。例えば、二量体結合分子はより小さく、例えば、固形腫瘍においてより良好な組織浸透を達成し得る。
本明細書で提供するとおりの多重特異性、例えば、二重特異性二量体OX40アゴニスト結合分子は、IgA抗体の二量体型に基づくことができ、その際、結合した軽鎖配列を伴って、または伴わずに、2対のIgA重鎖配列が存在し得る。例えば、本明細書で提供するとおりの二重特異性二量体OX40アゴニスト結合分子は、J鎖、例えば、本明細書の他の箇所で提供するとおりの修飾J鎖を含む、2つのIgA(IgA1またはIgA2)二量体から構成されてよい。
ある種の態様では、本明細書で提供するとおりの二量体または五量体結合分子のJ鎖は、その結合標的(複数可)と会合及び結合するIgMまたはIgA結合分子の能力を妨害することなく、例えば、異種部分、または2つ以上の異種部分の導入によって修飾されていてよい。それぞれ、その全体で参照によって本明細書に組み込まれるPCT出願番号PCT/US2015/024149(公報WO2015/153912)、PCT出願番号PCT/US2016/055053(公報WO2017/059387)、及びPCT出願番号PCT/US2016/055041(公報WO2017/059380)を参照されたい。したがって、本明細書の他の箇所で記載するとおりの多重特異性二量体または五量体結合分子を含む、本明細書で提供するとおりの二量体または五量体結合分子は、J鎖またはその断片に導入された異種部分を含む修飾J鎖またはその機能性断片を含むことができる。ある種の態様では、異種部分は、フレームでJ鎖に融合している、またはJ鎖に化学的にコンジュゲートしているペプチドまたはポリペプチド配列であってよい。ある種の態様では、異種部分は、J鎖にコンジュゲートしている化学的部分であってよい。J鎖に結合される異種部分には、限定ではないが、結合部分、例えば、抗体もしくはその抗原結合断片、例えば、一本鎖Fv(ScFv)分子、二量体もしくは五量体結合分子の半減期を増大させ得る安定化ペプチド、または化学的部分、例えば、ポリマーもしくは細胞毒素が含まれ得る。
本明細書で提供するとおりのOX40アゴニスト結合分子は、それぞれ2、5、または6個の二価結合ユニットを含む二量体、五量体、または六量体であってよい。結合ユニットは、全長またはその、結合機能を保持しているバリアントもしくは断片であってよい。
本開示はさらに、上記のとおりの二量体、五量体、または六量体結合分子のポリペプチドサブユニットをコードする核酸配列を含むポリヌクレオチド、例えば、単離された、組換え、及び/または天然に存在しないポリヌクレオチドをさらに提供する。「ポリペプチドサブユニット」とは、独立して翻訳され得る、結合分子、結合ユニット、または抗原結合ドメインの部分を意味する。例には、限定ではないが、抗体可変ドメイン、例えば、VHまたはVL、J鎖、分泌成分、一本鎖Fv、抗体重鎖、抗体軽鎖、抗体重鎖定常領域、抗体軽鎖定常領域、及び/またはその任意の断片、バリアント、もしくは誘導体が含まれる。
本開示は、本明細書で提供するとおりの二量体、五量体、または六量体IgAまたはIgMベースのOX40アゴニスト結合分子を使用して、OX40を発現する細胞においてシグナル伝達を活性化させるための改善された方法を提供する。下記の方法は、限定ではないが、表2に示されている抗体、またはそのバリアント、誘導体、もしくは類似体を含む任意の既存のOX40抗体に由来するOX40結合ドメインを含む結合分子を利用することができ、その際、二量体、五量体、または六量体OX40アゴニスト結合分子は、同等の二価抗体、断片、バリアント、誘導体、または類似体と比較して、OX40発現細胞において、改善された活性を提供し得る。例えば、本明細書で提供するとおりの二量体、五量体、または六量体結合分子が3つ以上の受容体モノマーに結合することによって受容体が活性化すると、細胞、例えば、T細胞、例えば、Tregまたは活性化エフェクターCTLは、細胞においてシグナル伝達経路を開始させることができ、それによって、抗腫瘍免疫を誘導することができる。ある種の態様では、二量体、五量体、または六量体OX40アゴニスト結合分子の使用は、同等の単一結合ユニット分子よりも、効力のあるT細胞活性化をもたらすことができ、次いで、腫瘍微小環境において、例えば、サイトカイン放出、CTL増殖、腫瘍細胞の死滅、及び/またはTreg細胞の抑制作用の中断によって、より効力のある抗腫瘍免疫を誘導することができる。本開示に基づいて、目的の任意のOX40結合ドメインを含む、二量体、五量体、または六量体IgAまたはIgMベースのOX40アゴニスト結合分子の構築は、十分に当業者の能力の範囲内である。活性の改善により、例えば、使用される用量の低減を可能にすることができるか、以前は治療不可能なままであったがんを処置することができるか、またはより有効か、もしくは長期持続する抗腫瘍免疫をもたらすことができる。
本明細書で提供するとおりの二量体、五量体、または六量体OX40アゴニスト結合分子を調製する方法、及びそれを必要とする対象に投与する方法は、当業者に周知であるか、または本開示を考慮して当業者によって容易に決定される。TNF受容体結合分子の投与経路は、例えば、腫瘍内で、経口で、非経口で、吸入による、または局所であってよい。非経口という用語は、本明細書で使用する場合、例えば、静脈内、動脈内、腹腔内、筋肉内、皮下、直腸内、または膣内投与を含む。これらの投与形態が適切な形態として企図される一方で、投与形態の別の例は、注射用の、特に、腫瘍内、静脈内または動脈内の注射または点滴用の液剤である。適切な医薬組成物は、緩衝液(例えば、酢酸、リン酸、またはクエン酸緩衝液)、界面活性剤(例えば、ポリソルベート)、任意選択で安定剤(例えば、ヒトアルブミン)などを含み得る。
抗OX40IgM及び抗OX40IgG#1及び#2
標準的なクローニングプロトコルに従って、例示的な構築物として、表2からの2つの抗OX40抗体のVH及びVL領域をIgM(野生型J鎖を含む)及びIgG型に組み込んだ。抗OX40#1は、それぞれVH及びVLアミノ酸配列の配列番号49及び配列番号50を含み、抗OX40#2は、それぞれVH及びVLアミノ酸配列の配列番号51及び配列番号52を含む。これらの抗体構築物を発現させ、下記のとおりに精製した。IgM(J鎖を含む)分子を、次のとおり、還元型及び非還元型ゲル上で分割した。精製抗OX40IgM抗体を還元及び非還元条件下でSDS−PAGEゲル上で分析した。図1Aは、IgM重鎖及び軽鎖を示すための還元型ゲルを示しており、図1Cは、高分子量IgMを分割するための非還元型ゲルを示している。非還元型ゲルサンプルをNuPage LDS Sample Buffer(Life Technologies#NP0007)と混合し、NativePage Novex 3〜12%Bis−Tris Gel(Life Technologies#BN1003)に装填した。Novex Tris−Acetate SDS Running Buffer(Life Technologies#LA0041)をゲル電気泳動のために使用し、ゲルをColloidal Blue Stain(Life Technologies#LC6025)で染色した。還元型ゲルでは、サンプルをサンプル緩衝液及びNuPage還元剤(Life Technologies#NP0004)と混合し、10分間にわたって80℃に加熱し、NuPage Novex 4〜12%Bis−Tris Gel(Life Technologies#NP0322)に装填した。NuPage MES SDS Running Buffer(Life Technologies#NP0002)をゲル電気泳動のために使用し、ゲルをColloidal Blueで染色した。結果は、抗OX40IgM五量体が均一に集合して、IgM重鎖及び軽鎖を示すことを実証している。
OX86は、それぞれVH及びVLアミノ酸配列の配列番号9及び配列番号10を含むIgG1アイソタイプのラット抗マウスOX40モノクローナル抗体(例えば、eBioscience,Inc.、San Diego、CAから入手可能)である。標準的なクローニングプロトコルに従って、VH及びVLを、ラット、マウス、またはヒトIgM及びIgG型に組み込む。標準的なクローニングプロトコルに従って、選択されたVH及びVL配列、例えば、表2に列挙されているものをヒトIgM及びIgG型に組み込むことによって、抗ヒトOX40IgMを生成する。加えて、ヒトOX40に対する新たな抗体を生成し、例えば、OX40−OX40L相互作用を妨害する、及び/またはT細胞シグナル伝達の成熟、T細胞増殖、及び/またはサイトカイン分泌を可能にするそれらの能力に基づき選択する。選択された抗体結合ドメインを、従来どおりIgM結合分子として再フォーマットする。
遺伝子導入。重鎖、軽鎖、及び修飾または未修飾J鎖DNA(IgM五量体構築物で)を、例えば、CHO細胞またはHEK293細胞に遺伝子導入する。発現ベクターのためのDNAをポリエチルアミン(PEI)試薬と混合し、次いで、細胞に添加する。確立された技法に従って、CHO−S細胞でのPEI遺伝子導入を行う(「Biotechnology and Bioengineering,Vol.87,553−545」を参照されたい)。
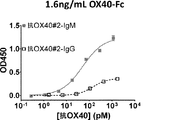
ELISAによる抗体特異性の測定
ヒトOX40についての、抗OX40#1及び抗OX40#2のIgG及びIgMバージョンの特異性を次のとおり、2つの異なる抗原密度で、ELISAアッセイにおいて測定した。ELISAプレートを100mM炭酸水素ナトリウムpH9.5中で希釈された0.4または1.6ng/mLのOX40−Fc(R&D)で終夜コーティングした。すべての後続の洗浄液はPBS+0.05%Tweenを使用し、すべてのインキュベーションステップをブロック緩衝液(PBS中2%BSA)中で行った。プレートを3回洗浄し、1時間にわたってブロックし、次いで、再度洗浄した。次いで、プレートを抗OX40#1−IgG、抗OX40#1−IgM、抗OX40#2−IgG、及び抗OX40#2−IgMの4倍希釈曲線で、1時間にわたってインキュベートした。洗浄後に、プレートを1:6000のマウス抗ヒトカッパ軽鎖−HRP(Southern Biotech)と共に1時間にわたってインキュベートした。プレートを5回洗浄し、ELISAを、2N H2SO4停止溶液を用いるTMB(BD Biosciences)を使用して展開した。プレートをSpectraMax340(Molecular Devices)で、SoftMax Proソフトウェアを使用してOD450で読み取った。1つの代表的実験からの技術的反復の平均±SEMが示されている。3つの独立した実験を行った。次いで、各コーティング密度で、GraphPad Prismソフトウェアにおいて、Hill勾配で1サイト特異的結合を使用して、Bmaxを計算した。IgM量が抗原感受性を上昇させることを実証するために、IgMに対するIgGの比として、変化倍率を計算した。
ヒトまたはマウスOX40−Ig(Enzo Life Sciences,Inc.、Farmingdale、NY)、及び対照タンパク質をMaxisorb ELISAプレート(Nunc、VWR)上に、炭酸水素緩衝液中で0.2〜2.0μg/mlの濃度でプレーティングし、終夜、4℃でインキュベートする。使用前に、プレートを解凍し、一度洗浄し、次いで、洗浄緩衝液(0.05%Tween−20を含むPBS)中0.5%BSAでブロックする。様々な濃度の、実施例1に記載のとおりに生成した抗OX40MAbまたは対照抗KLH抗体を添加し、サンプルを1時間にわたって室温でインキュベートし、3回洗浄し、ブロッキング緩衝液中のビオチン化抗ヒトカッパ(Southern Biotech、Birmingham、AL)の1:7,000希釈液と共に1時間にわたってインキュベートする。次いで、ストレプトアビジン−HRP(Jackson ImmunoResearch、West Grove、PA)をTMB基質(Thermo Scientific、Rockford、IL)と共に添加し、光学密度をSpectramax plate readerで650nmで読み取る。OX40に対する正味シグナルと他の標的に対する正味シグナルとの比として、選択性を計算する。
末梢血単核細胞(PBMC)を、実施例1に記載のとおりに生成した抗OX40Mabで30分間にわたって4℃で染色する。細胞を洗浄し、抗カッパ−A647検出抗体で15分間にわたって4℃で染色し、再び洗浄する。CD4+及びCD8+エフェクターT細胞及びCD4+FoxP3+調節性T細胞への結合をフローサイトメトリーによって評価する。
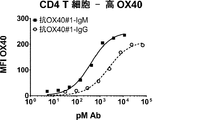
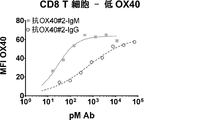
活性化T細胞上のOX40に結合する抗OX40#1及び抗OX40#2のIgG及びIgMバージョンの能力を評価するために、結合アッセイを行った。CD8+T細胞で低レベルのOX40(図3A、3C)またはCD4+T細胞で高レベルのOX40(図3B、3D)を誘導するためにHuman T cell Activator Dynabeads(Thermo−Fisher)で3日間にわたって活性化させたPBMCで、Ab結合を試験した。0.5×105細胞/条件を抗OX40#1及び抗OX40#2のIgG及びIgMバージョンの3倍希釈、続いて、20μg/mL Alexa Fluor(登録商標)488抗ヒトIg軽鎖κ抗体MHK−49で染色した。PBMCでは、CD4+CD3+CD4T細胞及びCD4−CD3+CD8T細胞でゲートするために、抗CD3−A647(Biolegend)及びCD4−PerCP−CY5.5(Biolegend)も含まれた。FACSデータをFACSCalibur(BD)で取得し、FlowJo(TreeStar)で解析し、GraphPad Prismでプロットした。代表的な実験の1つをCD8T細胞(n=3ドナー)及びCD4T細胞(n=5ドナー)について示した。各抗体で、GraphPad Prismソフトウェアにおいて、Hill勾配で1サイト特異的結合を使用して、Kdを計算した。IgM量が抗原感受性を上昇させることを実証するために、IgMに対するIgGの比として、変化倍率を計算した。
市販のOX40 Signaling Assay NF−κBリポーターアッセイ(DisoverX)を使用して、抗体のアゴニスト活性を決定する。製造者プロトコルに従って、アッセイを行った。抗OX40#1−IgG及び抗OX40#1−IgMまたは抗OX40#2−IgG及び抗OX40#2−IgMの2倍希釈液を単独で、または他にも10μg/mLのプレート結合抗ヒトIgG Fcクロスリンカー(Biolegend #409302)と共に、PathHunter U20S OX40 Signaling Assay(DisoverX)で16時間にわたって、続いて、PK/PL基質と共に1時間にわたってインキュベートした。細胞を溶解し、ルミノメータで読み取った。抗体の最高濃度からのRLUを使用して、IgGと比較して、IgMによるシグナル伝達の強度(変化倍率)の上昇を計算した。
実施例1において記載したとおりに生成された抗OX40Mabをプレート上に、抗CD3 Mabを伴って、または伴わずに1時間にわたってコーティングし、次いで、ナイーブT細胞をプレーティングする。15時間後に、T細胞増殖を、Cell Titer Glo luminescent reagent(Promega)を使用して測定する。調節性T細胞の存在下でのエフェクターT細胞増殖を評価するために、エフェクターT細胞をカルボキシフルオレセインスクシンイミジルエステル(CFSE)色素で標識し、調節性T細胞と1:1の比で混合し、次いで、抗CD3を伴うか、または伴わずに抗OX40Mabで事前コーティングされたプレートに添加する。エフェクターT細胞増殖をフローサイトメトリーによってモニターする。
T細胞を、抗CD3抗体の存在下または非存在下で、実施例1において記載したとおりに生成された抗OX40Mabで刺激する。24時間後に、IFNγ+及びTNFα+T細胞をフローサイトメトリーによって解析する。加えて、上清に分泌されたサイトカインIL−2及びIFNγを、標準的なELISAキットを使用して測定する。
エフェクターT細胞を、腫瘍細胞特異的ペプチドで7日間にわたって刺激する。マウスCT26結腸腫瘍細胞またはA20B細胞リンパ腫細胞をCFSE色素で標識し、次いで、活性化T細胞及び実施例1において記載したとおりに生成された抗OX40MAbと混合する。24時間後に、腫瘍細胞細胞傷害性をフローサイトメトリーによって測定する。
OX86IgM及びOX86IgG抗体では、同系マウスモデルを使用する。Balb/cマウスに、CT26またはA20腫瘍細胞を皮下移植し、次いで、マウスを腫瘍サイズに従って無作為化する。次いで、動物にOX86IgG、OX86IgM、またはビヒクル対照を投与し、腫瘍体積を測定する。
Claims (46)
- 2個、5個、または6個の二価結合ユニットまたはそのバリアントもしくは断片を含む多量体結合分子であって、
各結合ユニットが、抗原結合ドメインとそれぞれ結合している2つのIgAまたはIgM重鎖定常領域またはその断片を含み、
前記結合分子の抗原結合ドメインのうちの少なくとも3個が、OX40を発現する細胞上のOX40モノマーに特異的に、かつアゴニスティックに結合し、かつ
前記結合分子が、二次架橋部分の非存在下で、前記細胞においてOX40媒介性シグナル伝達を誘導することができる、
前記多量体結合分子。 - 二次架橋部分の非存在下で、前記細胞の表面上に発現される3個以上のOX40モノマーに結合し、かつそれらを会合させることができる、請求項1に記載の多量体結合分子。
- OX40を発現する前記細胞がT細胞である、請求項1または請求項2に記載の多量体結合分子。
- 前記T細胞が細胞傷害性Tリンパ球(CTL)である、請求項3に記載の多量体結合分子。
- 前記細胞におけるOX40媒介性シグナル伝達が、OX40の表面発現を増加させることができる、CTL増殖を増加させることができる、炎症性サイトカインの産生を増加させることができる、CD4+CD25+FoxP3+Treg細胞の阻害作用に対する抵抗性を増加させることができる、腫瘍細胞の死滅を増加もしくは増強させることができる、またはそれらの組合せを可能にする、請求項3または請求項4に記載の多量体結合分子。
- 前記T細胞が、CD4+CD25+FoxP3+Treg細胞である、請求項3に記載の多量体結合分子。
- 前記細胞におけるOX40媒介性シグナル伝達が、腫瘍微小環境において抗腫瘍免疫を抑制する前記細胞の能力を妨害することができる、請求項3または請求項6に記載の多量体結合分子。
- 2個の同等のOX40抗原結合ドメインを含む等量の二価IgG抗体またはその断片よりも高い効力で、OX40を発現する前記細胞においてOX40媒介性シグナル伝達を誘導することができる、請求項1〜7のいずれか1項に記載の多量体結合分子。
- 前記細胞の表面上に発現されるOX40モノマーに特異的に、かつアゴニスティックに結合する少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または12個の抗原結合ドメインを含み、それによって、前記細胞においてOX40媒介性シグナル伝達を活性化させる、請求項1〜8のいずれか1項に記載の多量体結合分子。
- 前記少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または12個の抗原結合ドメインが、同じ細胞外OX40エピトープに結合する、請求項9に記載の多量体結合分子。
- 少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または12個の抗原結合ドメインがそれぞれ、2つ以上の異なる細胞外OX40エピトープの群のうちの1つに特異的に結合する、請求項9に記載の多量体結合分子。
- 前記2個、5個、または6個の結合ユニットが、ヒト、ヒト化、またはキメラ免疫グロブリン結合ユニットである、請求項1〜11のいずれか1項に記載の多量体結合分子。
- 前記結合分子の少なくとも3個の抗原結合ドメインが、OX40アゴニスト結合ドメインであり、かつ少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または12個の抗原結合ドメインが重鎖可変領域(VH)及び軽鎖可変領域(VL)を含み、前記VH及びVLが、6つの免疫グロブリン相補性決定領域HCDR1、HCDR2、HCDR3、LCDR1、LCDR2、及びLCDR3を含み、前記HCDR1、HCDR2、HCDR3、LCDR1、LCDR2、及びLCDR3が、
それぞれ配列番号9及び配列番号10;配列番号11及び配列番号12;配列番号13及び配列番号14;配列番号15及び配列番号16;配列番号17及び配列番号18;配列番号19及び配列番号20;配列番号21及び配列番号22;配列番号23及び配列番号24;配列番号25及び配列番号26;配列番号25及び配列番号28;配列番号27及び配列番号26;配列番号27及び配列番号28;配列番号29及び配列番号26;配列番号29及び配列番号28;配列番号30及び配列番号31;配列番号30及び配列番号33;配列番号32及び配列番号31;配列番号32及び配列番号33;配列番号34及び配列番号31;配列番号34及び配列番号33;配列番号35及び配列番号36;配列番号37及び配列番号38;配列番号39及び配列番号40;配列番号41及び配列番号42;配列番号43及び配列番号44;配列番号45及び配列番号46;配列番号47及び配列番号48;配列番号49及び配列番号50;もしくは配列番号51及び配列番号52を含むかもしくはそれらの中に含まれるVH及びVLアミノ酸配列を含む抗体のCDR、または
CDRの1つもしくは複数における1つもしくは2つのアミノ酸置換を除いて、それぞれ配列番号9及び配列番号10;配列番号11及び配列番号12;配列番号13及び配列番号14;配列番号15及び配列番号16;配列番号17及び配列番号18;配列番号19及び配列番号20;配列番号21及び配列番号22;配列番号23及び配列番号24;配列番号25及び配列番号26;配列番号25及び配列番号28;配列番号27及び配列番号26;配列番号27及び配列番号28;配列番号29及び配列番号26;配列番号29及び配列番号28;配列番号30及び配列番号31;配列番号30及び配列番号33;配列番号32及び配列番号31;配列番号32及び配列番号33;配列番号34及び配列番号31;配列番号34及び配列番号33;配列番号35及び配列番号36;配列番号37及び配列番号38;配列番号39及び配列番号40;配列番号41及び配列番号42;配列番号43及び配列番号44;配列番号45及び配列番号46;配列番号47及び配列番号48;配列番号49及び配列番号50;もしくは配列番号51及び配列番号52を含むかもしくはそれらの中に含まれるVH及びVLアミノ酸配列を含む抗体のCDR
を含む、
請求項1〜12のいずれか1項に記載の多量体結合分子。 - 少なくとも1個、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または12個の抗原結合ドメインが抗体VH及びVLを含み、前記VH及びVLが、それぞれ配列番号9及び配列番号10;配列番号11及び配列番号12;配列番号13及び配列番号14;配列番号15及び配列番号16;配列番号17及び配列番号18;配列番号19及び配列番号20;配列番号21及び配列番号22;配列番号23及び配列番号24;配列番号25及び配列番号26;配列番号25及び配列番号28;配列番号27及び配列番号26;配列番号27及び配列番号28;配列番号29及び配列番号26;配列番号29及び配列番号28;配列番号30及び配列番号31;配列番号30及び配列番号33;配列番号32及び配列番号31;配列番号32及び配列番号33;配列番号34及び配列番号31;配列番号34及び配列番号33;配列番号35及び配列番号36;配列番号37及び配列番号38;配列番号39及び配列番号40;配列番号41及び配列番号42;配列番号43及び配列番号44;配列番号45及び配列番号46;配列番号47及び配列番号48;配列番号49及び配列番号50;または配列番号51及び配列番号52を含むかまたはそれらの中に含まれる成熟VH及びVLアミノ酸配列と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%または100%同一なアミノ酸配列を含む、請求項1〜13のいずれか1項に記載の多量体結合分子。
- 2個の二価IgA結合ユニットまたはその断片とJ鎖またはその断片もしくはバリアントとを含む二量体結合分子である多量体結合分子であって、ここで、各結合ユニットが、抗原結合ドメインとそれぞれ結合している2つのIgA重鎖定常領域またはその断片を含む、請求項1〜14のいずれか1項に記載の多量体結合分子。
- 分泌成分またはその断片もしくはバリアントをさらに含む、請求項15に記載の多量体結合分子。
- 前記IgA重鎖定常領域またはその断片がそれぞれ、Cα2ドメインまたはCα3−tpドメインを含む、請求項15または請求項16に記載の多量体結合分子。
- 1つまたは複数のIgA重鎖定常領域またはその断片が、Cα1ドメインをさらに含む、請求項17に記載の多量体結合分子。
- 前記IgA重鎖定常領域がヒトIgA定常領域である、請求項15〜18のいずれか1項に記載の多量体結合分子。
- 各結合ユニットが、前記IgA定常領域またはその断片のアミノ末端側に位置するVHをそれぞれ含む2本のIgA重鎖と、免疫グロブリン軽鎖定常領域のアミノ末端側に位置するVLをそれぞれ含む2本の免疫グロブリン軽鎖とを含む、請求項15〜19のいずれか1項に記載の多量体結合分子。
- 5または6個の二価IgM結合ユニットをそれぞれ含む五量体または六量体結合分子である多量体結合分子であって、ここで、各結合ユニットが、抗原結合ドメインとそれぞれ結合している2つのIgM重鎖定常領域またはその断片を含む、請求項1〜14のいずれか1項に記載の多量体結合分子。
- 前記IgM重鎖定常領域またはその断片がそれぞれ、Cμ3ドメインまたはその断片もしくはバリアント及びCμ4−tpドメインまたはその断片もしくはバリアントを含む、請求項21に記載の多量体結合分子。
- 1つまたは複数のIgM重鎖定常領域またはその断片が、Cμ2ドメイン、Cμ1ドメイン、またはそれらの任意の組合せをさらに含む、請求項21または請求項22に記載の多量体結合分子。
- 五量体であり、かつJ鎖、またはその断片、またはそのバリアントをさらに含む、請求項21〜23のいずれか1項に記載の多量体結合分子。
- 前記IgM重鎖定常領域がヒトIgM定常領域である、請求項21〜24のいずれか1項に記載の多量体結合分子。
- 各結合ユニットが、前記IgM定常領域またはその断片のアミノ末端側に位置するVHをそれぞれ含む2本のIgM重鎖と、免疫グロブリン軽鎖定常領域のアミノ末端側に位置するVLをそれぞれ含む2本の免疫グロブリン軽鎖とを含む、請求項21〜25のいずれか1項に記載の多量体結合分子。
- 各結合ユニットが2本の重鎖及び2本の軽鎖を含み、前記重鎖及び軽鎖が、それぞれ配列番号9及び配列番号10;配列番号11及び配列番号12;配列番号13及び配列番号14;配列番号15及び配列番号16;配列番号17及び配列番号18;配列番号19及び配列番号20;配列番号21及び配列番号22;配列番号23及び配列番号24;配列番号25及び配列番号26;配列番号25及び配列番号28;配列番号27及び配列番号26;配列番号27及び配列番号28;配列番号29及び配列番号26;配列番号29及び配列番号28;配列番号30及び配列番号31;配列番号30及び配列番号33;配列番号32及び配列番号31;配列番号32及び配列番号33;配列番号34及び配列番号31;配列番号34及び配列番号33;配列番号35及び配列番号36;配列番号37及び配列番号38;配列番号39及び配列番号40;配列番号41及び配列番号42;配列番号43及び配列番号44;配列番号45及び配列番号46;配列番号47及び配列番号48;配列番号49及び配列番号50;または配列番号51及び配列番号52を含むかまたはそれらの中に含まれる成熟VH及びVLアミノ酸配列と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%または100%同一なVH及びVLアミノ酸配列を含む、請求項1〜26のいずれか1項に記載の多量体結合分子。
- 五量体IgM分子であり、J鎖またはその断片もしくはバリアントをさらに含む、請求項1〜14または21〜27のいずれか1項に記載の多量体結合分子。
- 請求項1〜28のいずれか1項に記載の多量体結合分子を含む、組成物。
- 請求項1〜28のいずれか1項に記載の結合分子のポリペプチドサブユニットをコードする核酸配列を含む、ポリヌクレオチド。
- 前記ポリペプチドサブユニットが、IgM重鎖定常領域と、前記多量体結合分子の前記抗原結合ドメインの少なくとも抗体VH部分とを含む、請求項30に記載のポリヌクレオチド。
- 前記ポリペプチドサブユニットが、
(a)配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、配列番号27、配列番号29、配列番号30、配列番号32、配列番号34、配列番号35、配列番号37、配列番号39、配列番号41、配列番号43、配列番号45、配列番号47、配列番号49、もしくは配列番号51を含むかもしくはその中に含まれるVHアミノ酸配列に含まれるCDRを含む、HCDR1、HCDR2、及びHCDR3領域;または、HCDRの1つもしくは複数において1つもしくは2つの単一アミノ酸置換を有する、配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、配列番号27、配列番号29、配列番号30、配列番号32、配列番号34、配列番号35、配列番号37、配列番号39、配列番号41、配列番号43、配列番号45、配列番号47、配列番号49、もしくは配列番号51を含むかもしくはその中に含まれるVHアミノ酸配列に含まれるCDRを含む、HCDR1、HCDR2、及びHCDR3領域;あるいは
(b)配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、配列番号27、配列番号29、配列番号30、配列番号32、配列番号34、配列番号35、配列番号37、配列番号39、配列番号41、配列番号43、配列番号45、配列番号47、配列番号49、または配列番号51を含むかまたはその中に含まれる成熟VHアミノ酸配列と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%または100%同一なアミノ酸配列
を含むVH
のC末端に融合されたヒトIgM定常領域またはその断片
を含む、
請求項31に記載のポリヌクレオチド。 - 前記ポリペプチドサブユニットが、軽鎖定常領域と、前記多量体結合分子の前記抗原結合ドメインの抗体VL部分とを含む、請求項30〜32のいずれか1項に記載のポリヌクレオチド。
- 前記ポリペプチドサブユニットが、
(a)配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、配列番号26、配列番号28、配列番号31、配列番号33、配列番号36、配列番号38、配列番号40、配列番号42、配列番号44、配列番号46、配列番号48、配列番号50、もしくは配列番号52を含むかもしくはその中に含まれるVLアミノ酸配列に含まれるCDRを含む、LCDR1、LCDR2、及びLCDR3領域;または、LCDRの1つもしくは複数において1つもしくは2つの単一アミノ酸置換を有する、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、配列番号26、配列番号28、配列番号31、配列番号33、配列番号36、配列番号38、配列番号40、配列番号42、配列番号44、配列番号46、配列番号48、配列番号50、もしくは配列番号52を含むかもしくはその中に含まれるVLアミノ酸配列に含まれるCDRを含む、LCDR1、LCDR2、及びLCDR3領域;あるいは
(b)配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、配列番号26、配列番号28、配列番号31、配列番号33、配列番号36、配列番号38、配列番号40、配列番号42、配列番号44、配列番号46、配列番号48、配列番号50、または配列番号52を含むかまたはその中に含まれる成熟VLアミノ酸配列と少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%または100%同一なアミノ酸配列
を含むVL
のC末端に融合されたヒトカッパまたはラムダ軽鎖定常領域またはその断片
を含む、
請求項33に記載のポリヌクレオチド。 - 請求項30〜32のいずれか1項に記載のポリヌクレオチド、及び請求項30、33、または34のいずれか1項に記載のポリヌクレオチドを含む、組成物。
- 前記ポリヌクレオチドが別々のベクター上にある、請求項35に記載の組成物。
- 前記ポリヌクレオチドが単一のベクター上にある、請求項35に記載の組成物。
- J鎖、またはその断片、またはそのバリアントをコードする核酸配列を含むポリヌクレオチドをさらに含む、請求項35〜37のいずれか1項に記載の組成物。
- 請求項37に記載のベクター。
- 請求項36に記載のベクター。
- 請求項30〜34のいずれか1項に記載のポリヌクレオチド、請求項35〜38のいずれか1項に記載の組成物、または請求項39または40のいずれか1項に記載のベクターを含み、請求項1〜28のいずれか1項に記載の結合分子またはそのサブユニットを発現することができる、宿主細胞。
- 請求項1〜28のいずれか1項に記載の結合分子を生成する方法であって、請求項41に記載の宿主細胞を培養すること、及び前記結合分子を回収することを含む、前記方法。
- OX40発現細胞においてOX40媒介性活性化を誘導する方法であって、前記OX40発現細胞を、請求項1〜28のいずれか1項に記載の多量体結合分子と接触させることを含む、前記方法。
- OX40発現T細胞においてOX40の移動及びクラスター化を誘導する方法であって、OX40発現T細胞を、請求項1〜28のいずれか1項に記載の多量体結合分子と接触させることを含む、前記方法。
- 処置を必要とする対象に、請求項1〜28のいずれか1項に記載の多量体結合分子の有効量を投与することを含む、がんを処置する方法であって、前記多量体結合分子は、OX40発現エフェクターT細胞を活性化させることができ、それによって、殺腫瘍性CTL応答を開始させる、前記方法。
- 前記対象がヒトである、請求項45に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662364763P | 2016-07-20 | 2016-07-20 | |
| US62/364,763 | 2016-07-20 | ||
| PCT/US2017/043165 WO2018017888A1 (en) | 2016-07-20 | 2017-07-20 | Multimeric ox40 binding molecules and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019530640A true JP2019530640A (ja) | 2019-10-24 |
| JP2019530640A5 JP2019530640A5 (ja) | 2020-08-13 |
Family
ID=60996094
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019502573A Withdrawn JP2019530640A (ja) | 2016-07-20 | 2017-07-20 | 多量体ox40結合分子及びその使用 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US20190330374A1 (ja) |
| EP (1) | EP3487533A4 (ja) |
| JP (1) | JP2019530640A (ja) |
| CN (1) | CN109562165A (ja) |
| AU (1) | AU2017298483A1 (ja) |
| CA (1) | CA3030647A1 (ja) |
| IL (1) | IL263799A (ja) |
| MX (1) | MX2019000796A (ja) |
| WO (1) | WO2018017888A1 (ja) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3041862B1 (en) | 2013-09-05 | 2020-05-06 | IGM Biosciences, Inc. | Constant chain modified bispecific, penta- and hexavalent ig-m antibodies |
| CN105992772A (zh) | 2014-02-10 | 2016-10-05 | Igm生命科学股份有限公司 | IgA多特异性结合分子 |
| EP3126383B8 (en) | 2014-04-03 | 2019-02-27 | IGM Biosciences, Inc. | Modified j-chain |
| PL3247728T3 (pl) | 2015-01-20 | 2020-11-16 | Igm Biosciences, Inc. | Cząsteczki wiążące receptor nadrodziny czynnika martwicy nowotworów (TNF) i ich stosowanie |
| HUE054642T2 (hu) | 2015-03-04 | 2021-09-28 | Igm Biosciences Inc | CD20 kötõ molekulák és ezek felhasználása |
| WO2016154593A1 (en) | 2015-03-25 | 2016-09-29 | Igm Biosciences, Inc. | Multi-valent hepatitis b virus antigen binding molecules and uses thereof |
| WO2016168758A1 (en) | 2015-04-17 | 2016-10-20 | Igm Biosciences, Inc. | Multi-valent human immunodeficiency virus antigen binding molecules and uses thereof |
| HK1252791A1 (zh) | 2015-09-30 | 2019-06-06 | Igm Biosciences, Inc. | 具有經修飾的j鏈的結合分子 |
| ES2819870T3 (es) | 2015-09-30 | 2021-04-19 | Igm Biosciences Inc | Moléculas de unión con cadena J modificada |
| ES2899361T3 (es) | 2016-05-09 | 2022-03-11 | Igm Biosciences Inc | Anticuerpos anti-PD-L1 |
| MX2019011986A (es) | 2017-04-07 | 2019-11-07 | Igm Biosciences Inc | Regiones constantes de igm humana modificadas para la modulacion de la funcion efectora de la citolisis dependiente de complemento referencia cruzada a solicitudes relacionadas. |
| AU2019227984A1 (en) | 2018-03-01 | 2020-09-10 | Igm Biosciences, Inc. | IgM Fc and J-chain mutations that affect IgM serum half-life |
| WO2020063668A1 (zh) * | 2018-09-25 | 2020-04-02 | 信达生物制药(苏州)有限公司 | 包含抗ox40抗体的制剂、其制备方法及其用途 |
| CN112839677A (zh) * | 2018-10-23 | 2021-05-25 | Igm生物科学股份有限公司 | 基于IgM-Fc和IgA-Fc的多价结合分子 |
| CN110172090B (zh) * | 2019-06-03 | 2020-04-03 | 中山标佳生物科技有限公司 | Cd134单克隆抗体及其制备方法和癌症治疗中的应用 |
| MX2022001934A (es) | 2019-08-15 | 2022-03-11 | Igm Biosciences Inc | Moleculas de union multimericas inmunoestimuladoras. |
| KR20230005228A (ko) | 2020-04-22 | 2023-01-09 | 아이쥐엠 바이오사이언스 인코포레이티드 | Pd-1 효능제 다량체 결합 분자 |
| CN112957475B (zh) * | 2021-02-04 | 2022-07-22 | 李文峰 | 一种预防和或治疗肿瘤的组合物及应用 |
| US20220332837A1 (en) * | 2021-04-08 | 2022-10-20 | Colorado State University Research Foundation | Methods and compositions for ox40 activation in treatment of canine cancer |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140294825A1 (en) * | 2011-09-26 | 2014-10-02 | Jn Biosciences Llc | Hybrid constant regions |
| US20150307617A1 (en) * | 2014-03-31 | 2015-10-29 | Genentech, Inc. | Anti-ox40 antibodies and methods of use |
| US20160137740A1 (en) * | 2014-10-10 | 2016-05-19 | Medimmune, Llc | Humanized anti-ox40 antibodies and uses thereof |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB201116092D0 (en) * | 2011-09-16 | 2011-11-02 | Bioceros B V | Antibodies and uses thereof |
| AU2012369202A1 (en) * | 2012-02-06 | 2014-09-25 | Providence Health & Services - Oregon | Cancer treatment and monitoring methods using OX40 agonists |
| CN108883153A (zh) * | 2016-01-11 | 2018-11-23 | 印希比股份有限公司 | 多价和多特异性ox40结合融合蛋白 |
-
2017
- 2017-07-20 MX MX2019000796A patent/MX2019000796A/es unknown
- 2017-07-20 CN CN201780044931.3A patent/CN109562165A/zh active Pending
- 2017-07-20 JP JP2019502573A patent/JP2019530640A/ja not_active Withdrawn
- 2017-07-20 CA CA3030647A patent/CA3030647A1/en not_active Abandoned
- 2017-07-20 AU AU2017298483A patent/AU2017298483A1/en not_active Abandoned
- 2017-07-20 US US16/317,814 patent/US20190330374A1/en not_active Abandoned
- 2017-07-20 WO PCT/US2017/043165 patent/WO2018017888A1/en unknown
- 2017-07-20 EP EP17831908.3A patent/EP3487533A4/en not_active Withdrawn
-
2018
- 2018-12-18 IL IL263799A patent/IL263799A/en unknown
-
2022
- 2022-02-17 US US17/673,864 patent/US20220169751A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140294825A1 (en) * | 2011-09-26 | 2014-10-02 | Jn Biosciences Llc | Hybrid constant regions |
| US20150307617A1 (en) * | 2014-03-31 | 2015-10-29 | Genentech, Inc. | Anti-ox40 antibodies and methods of use |
| US20160137740A1 (en) * | 2014-10-10 | 2016-05-19 | Medimmune, Llc | Humanized anti-ox40 antibodies and uses thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| CN109562165A (zh) | 2019-04-02 |
| US20190330374A1 (en) | 2019-10-31 |
| AU2017298483A1 (en) | 2019-02-07 |
| US20220169751A1 (en) | 2022-06-02 |
| IL263799A (en) | 2019-02-28 |
| WO2018017888A1 (en) | 2018-01-25 |
| CA3030647A1 (en) | 2018-01-25 |
| EP3487533A1 (en) | 2019-05-29 |
| MX2019000796A (es) | 2019-06-03 |
| EP3487533A4 (en) | 2020-03-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220169751A1 (en) | Multimeric ox40 binding molecules and uses thereof | |
| JP7499813B2 (ja) | 腫瘍壊死因子 (tnf) スーパーファミリー受容体結合分子およびその使用 | |
| US20220177595A1 (en) | Multimeric gitr binding molecules and uses thereof | |
| US20210388098A1 (en) | Multimeric cd137/4-1bb binding molecules and uses thereof | |
| US20220106399A1 (en) | Multimeric cd40 binding molecules and uses thereof | |
| WO2020163646A1 (en) | Anti-gitr antigen-binding domains and uses thereof | |
| HK40043005A (en) | Tumor necrosis factor (tnf) superfamily receptor binding molecules and uses thereof | |
| HK1242348B (en) | Tumor necrosis factor (tnf) superfamily receptor binding molecules and uses thereof | |
| HK1242348A1 (en) | Tumor necrosis factor (tnf) superfamily receptor binding molecules and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190319 Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20190118 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200629 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200629 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210514 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210721 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210826 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220314 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20220627 |