JP2016530291A - Method for treating fragile X syndrome and related disorders - Google Patents
Method for treating fragile X syndrome and related disorders Download PDFInfo
- Publication number
- JP2016530291A JP2016530291A JP2016539645A JP2016539645A JP2016530291A JP 2016530291 A JP2016530291 A JP 2016530291A JP 2016539645 A JP2016539645 A JP 2016539645A JP 2016539645 A JP2016539645 A JP 2016539645A JP 2016530291 A JP2016530291 A JP 2016530291A
- Authority
- JP
- Japan
- Prior art keywords
- metadoxine
- mice
- treatment
- administration
- treated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4415—Pyridoxine, i.e. Vitamin B6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Abstract
本発明は、脆弱X症候群、および自閉症スペクトラム障害などの関連障害の徴候または症状を緩和する方法を提供する。The present invention provides a method for alleviating the signs or symptoms of fragile X syndrome and related disorders such as autism spectrum disorders.
Description
関連出願
本出願は、2013年9月9日出願の仮出願第USSN61/875,384号、2013年9月26日出願の第USSN14/038258号、および2014年5月9日出願の仮出願第USSN61/991,351号の優先権および利益を主張するものであり、これらの内容はそれぞれそれらの全内容が引用することにより本明細書の一部とされる。
Related Applications This application includes provisional application USSN 61 / 875,384 filed on September 9, 2013, USSN 14/038258 filed on September 26, 2013, and provisional application filed on May 9, 2014. The priority and benefit of USSN 61 / 991,351 are claimed, each of which is hereby incorporated by reference in its entirety.
発明の分野
本発明は一般に、脆弱X症候群および関連障害の症状を処置または緩和する方法に関する。
The present invention relates generally to methods for treating or alleviating symptoms of fragile X syndrome and related disorders.
脆弱X症候群(fragile X Syndrome)(FXS)は、その名称が意味するように、マップ位置Xq 27.3で中期染色体の同腕染色分体ギャップとして表される脆弱部位に関連する。脆弱X症候群は、X染色体上に位置する脆弱X精神遅滞1(FMR1)遺伝子の5’非翻訳領域の突然変異によって引き起こされる遺伝的な障害である。FXSを引き起こす突然変異は、脆弱X精神遅滞遺伝子FMR1中のCGGリピートに関連する。ほとんどの健常者では、CGGリピートの総数は10未満〜40の範囲であり、平均は約29である。脆弱X症候群では、このCGG配列が200〜1,000回を超えて繰り返される。対象者が約200を超えるCGGリピートを有する場合、その脆弱X遺伝子は過剰にメチル化されるようになり、遺伝子は沈黙する(silences)。結果として、脆弱X精神遅滞タンパク質(FMRP)が産生されないか、または低レベルでしか産生されず、対象者はFXSの兆候を示す。 Fragile X Syndrome (FXS), as its name implies, is associated with a fragile site represented as a metaphase chromosome iso-arm chromatid gap at map position Xq 27.3. Fragile X syndrome is a genetic disorder caused by mutations in the 5 'untranslated region of the fragile X mental retardation 1 (FMR1) gene located on the X chromosome. The mutation that causes FXS is associated with a CGG repeat in the fragile X mental retardation gene FMR1. For most healthy individuals, the total number of CGG repeats ranges from less than 10 to 40, with an average of about 29. In fragile X syndrome, this CGG sequence is repeated more than 200 to 1,000 times. If a subject has more than about 200 CGG repeats, the fragile X gene becomes over-methylated and the gene is silenced. As a result, fragile X mental retardation protein (FMRP) is not produced or produced only at low levels, and the subject shows signs of FXS.
FMR1遺伝子の前変異拡大(55〜200CGGリピート)は一般集団で頻繁に見られ、推定保有率は女性259人に1人、男性812人に1人である。前変異の保有者は、不安などの感情問題が共通しているが、一般に正常なIQを有する。高齢男性の前変異保有者(50歳以上)は、進行性の企図振戦および運動失調を発症する。これらの運動障害は、多くの場合、記憶喪失、不安、および実行機能の欠陥、引きこもりまたは過敏性行動、および認知症を含む進行性の認知・行動問題を伴う。この障害は脆弱X関連振戦/運動失調症候群(FXTAS)と呼ばれている。FXTASを有する対象者の磁気共鳴画像法から、中小脳脚および隣接する小脳白質におけるT2強調シグナル強度の増強が明らかである。 Pre-mutation expansion of the FMR1 gene (55-200 CGG repeat) is frequently seen in the general population, with an estimated prevalence of 1 in 259 women and 1 in 812 men. Premutation holders share a common emotional problem such as anxiety, but generally have a normal IQ. Elderly male premutation carriers (over 50 years old) develop progressive intention tremor and ataxia. These movement disorders are often accompanied by progressive cognitive / behavioral problems including memory loss, anxiety, and executive function deficits, withdrawal or hypersensitivity behavior, and dementia. This disorder is called fragile X-related tremor / ataxia syndrome (FXTAS). From the magnetic resonance imaging of subjects with FXTAS, an increase in T2-weighted signal intensity in the middle cerebellar limb and adjacent cerebellar white matter is evident.
FXSは、浸透率の低いX連鎖優性障害として分離している。いずれの性別でも、脆弱X突然変異を有する場合には知的障害を示し得るが、重篤度は様々である。FXSを有する小児および成人は、自閉症様の特徴および傾向を含む、様々な程度の知的障害または学習障害および行動・感情問題を有する。FXSを有する幼児は、座り方、歩き方および話し方の学習などの発達のマイルストーンに遅れを有する場合が多い。罹患小児は頻繁なかんしゃく、注意欠陥、頻繁な発作(例えば、側頭葉発作)を有する場合があり、多くの場合、高い不安を示し、打ちのめされやすく、感覚過覚醒障害、消化管障害を示すことがあり、会話障害および手をひらひらさせる、手を噛むなどの異常行動を示す場合がある。 FXS is isolated as an X-linked dominant disorder with low penetrance. Any gender can show intellectual disability if it has a fragile X mutation, but the severity varies. Children and adults with FXS have varying degrees of intellectual or learning disabilities and behavioral and emotional problems, including autism-like features and trends. Infants with FXS often have delays in developmental milestones such as learning how to sit, walk and speak. Affected children may have frequent tantrums, attention deficits, frequent seizures (eg, temporal lobe seizures), often show high anxiety, are easily beaten, and exhibit hyperesthesia and gastrointestinal disorders Occasionally, it may exhibit abnormal behavior such as speech disability and fluttering, biting hands.
FXSは、被験者由来のサンプル(例えば、血液サンプル、口内サンプル)に対して行われる確立された遺伝子検査によって診断することができる。この検査は、CGGリピートの数に基づき被験者のFMR1遺伝子に突然変異または前変異が存在するかどうかを判定する。 FXS can be diagnosed by established genetic tests performed on samples from subjects (eg, blood samples, oral samples). This test determines whether there is a mutation or premutation in the subject's FMR1 gene based on the number of CGG repeats.
FXSを有する対象者は自閉症も有する場合がある。自閉症と診断された全小児の約5%がFMR1遺伝子に突然変異を有し、脆弱X症候群(FXS)も有する。自閉症スペクトラム障害(ASD)は、FXSを有する男性のおよそ30%、女性の20%に見られ、FXS者のさらに30%が、ASD診断を持たずに自閉症症状を示す。知的障害がFXSの顕著な特徴であるが、FXS者は、軽度症例では内気、目を合わさない、および社交不安から、重度罹患では手をひらひらさせる、手を噛むおよび保続的会話までにわたる自閉症的特徴を示す場合が多い。FXS者は、注意欠陥および多動、発作、感覚刺激に対する過敏性、強迫性行動および消化管機能の変化などの自閉症に関連する他の症状も示す。FMR1突然変異は、単一のタンパク質(FMRP)の発現を抑制するか、または大幅に低下させる。FMRPの不在下での脳発達は、FXSの主な症状を生じさせると思われる。 Subjects with FXS may also have autism. About 5% of all children diagnosed with autism have a mutation in the FMR1 gene and also have fragile X syndrome (FXS). Autism spectrum disorder (ASD) is found in approximately 30% of men with FXS and 20% of women, with an additional 30% of people with FXS showing autistic symptoms without ASD diagnosis. Although intellectual disability is a prominent feature of FXS, people with FXS range from shyness, disagreement, and social anxiety in mild cases to flirting, chewing hands, and sustained conversation in severe illness Often exhibits autistic features. FXS individuals also exhibit other symptoms associated with autism such as attention deficit and hyperactivity, seizures, hypersensitivity to sensory stimuli, obsessive-compulsive behavior and changes in gastrointestinal function. FMR1 mutations suppress or greatly reduce the expression of a single protein (FMRP). Brain development in the absence of FMRP appears to give rise to the main symptoms of FXS.
中核症状に加え、FXSを有する小児は、易刺激性、攻撃および自傷行為などの重篤な行動障害を有する場合が多い。FXSを有する男性(8〜24歳)の最近の研究では、2か月の観察期間での自傷行為は被験者の79%、攻撃行動は75%と報告された。 In addition to core symptoms, children with FXS often have severe behavioral disorders such as irritability, aggression and self-harm. A recent study of men with FXS (8-24 years) reported 79% self-injurious behavior and 75% aggressive behavior in a 2-month observation period.
FXSを有するヒトに対する現在利用可能な治療計画としては、例えば、行動修正ならびに抗鬱薬および抗精神病薬を含む一定範囲の投薬(FXSの治療としてはFDAにより承認されていない)による処置が含まれる。認知行動療法は、FXSおよび自閉症者において言語および社会化を改善するために使用されている。近年では、非定型抗精神病薬リスペリドンによる薬理学的処置が、自閉症者の治療において非薬理学的アプローチを増強するために一般に使用されている。自閉症小児におけるリスペリドンの作為化プラセボ対照試験では、異常行動チェックリストおよび臨床全般印象改善の易刺激性サブスケールに有意な改善が示された(McCracken, J. T., et al., N. Engl. J. Med. 347:314-321 (2002))。しかしながら、有害事象は、体重増加、食欲増加、疲労、傾眠、目眩、および流涎を含んだ。社会的孤立およびコミュニケーションはリスペリドンの投与により改善されず、錐体外路系症状およびジスキネジアなどの有害な副作用は自閉症の小児においてリスペリドンと関連付けられた。現行の治療計画は有効でない場合が多いか、または特に抗精神病薬の場合には、長期使用により望ましくない副作用を生じるおそれがあるので、新たな治療の必要がある。 Currently available treatment regimens for humans with FXS include, for example, treatment with behavior modification and a range of medications (not approved by the FDA for the treatment of FXS) including antidepressants and antipsychotics. Cognitive behavioral therapy has been used to improve language and socialization in FXS and autistic individuals. In recent years, pharmacological treatment with the atypical antipsychotic drug risperidone has been commonly used to enhance non-pharmacological approaches in the treatment of autistic individuals. A randomized placebo-controlled trial of risperidone in children with autism showed significant improvements in the abnormal behavior checklist and the irritability subscale of improving clinical general impressions (McCracken, JT, et al., N. Engl. J. Med. 347: 314-321 (2002)). However, adverse events included weight gain, increased appetite, fatigue, somnolence, dizziness, and fluency. Social isolation and communication were not improved by the administration of risperidone, and adverse side effects such as extrapyramidal symptoms and dyskinesia were associated with risperidone in autistic children. Current treatment regimens are often ineffective or, especially in the case of antipsychotics, there is a need for new treatments because long-term use can cause undesirable side effects.
種々の面において、本発明は、必要とする対象者にメタドキシンを含んでなる組成物を投与することにより脆弱X症候群または関連障害の症状を治療または緩和する方法を提供する。症状は例えば、学習障害または社会的行動障害である。対象者は脆弱X症候群または自閉症スペクトラム障害を有する。関連障害は自閉症スペクトラム障害である。 In various aspects, the present invention provides a method of treating or alleviating symptoms of fragile X syndrome or related disorders by administering a composition comprising metadoxine to a subject in need thereof. Symptoms are, for example, learning disabilities or social behavior disorders. The subject has fragile X syndrome or autism spectrum disorder. A related disorder is autism spectrum disorder.
いくつかの面では、100〜3000mgの間の総一日用量のメタドキシンが投与され、メタドキシンは毎日、1日おきに、または毎週(weekly)投与される。 In some aspects, a total daily dose of metadoxine of between 100 and 3000 mg is administered, with metadoxine being administered daily, every other day, or weekly.
場合により、メタドキシンは、1日当たり1、2、または3種類の剤形(one, two, or three dosage forms)で投与される。いくつかの実施態様では、メタドキシンは、持続放出経口剤形(a sustained release oral dosage form)で投与され、この場合、メタドキシンは徐放形態と即時放出形態の組合せ(a combination of slow release and immediate release forms)として処方される。 Optionally, metadoxine is administered in one, two, or three dosage forms per day. In some embodiments, metadoxine is administered in a sustained release oral dosage form, wherein metadoxine is a combination of slow release and immediate release form. forms).
例えば、徐放形態は、少なくとも8時間のメタドキシンの持続放出を提供する。徐放メタドキシンと即時放出メタドキシンの相対比(the relative proportion of the slow release metadoxine to the immediate release metadoxine)は、約60:40〜80:20の間である。好ましくは、徐放メタドキシンと即時放出メタドキシンの相対比は約65:35である。 For example, the sustained release form provides a sustained release of metadoxine for at least 8 hours. The relative proportion of the slow release metadoxine to the immediate release metadoxine is between about 60:40 and 80:20. Preferably, the relative ratio of sustained release metadoxine and immediate release metadoxine is about 65:35.
そうではないことが定義されない限り、本明細書で使用される総ての技術用語および科学用語は、本発明が属する技術分野の熟練者が一般に理解しているものと同じ意味を有する。本発明の実施には本明細書に記載されているものと類似または等価な方法および材料が使用可能であるが、好適な方法および材料を以下に記載する。本明細書に記載されている総ての刊行物、特許出願、特許および他の参照文献は、それらの全内容が明示的に引用することにより本明細書の一部とされる。矛盾があれば、定義を含む本明細書が優先する。加えて、本明細書に記載の材料、方法、および例は単に例示であり、限定することを意図するものではない。 Unless defined otherwise, all technical and scientific terms used herein have the same meaning as commonly understood by one of ordinary skill in the art to which this invention belongs. Although methods and materials similar or equivalent to those described herein can be used in the practice of the present invention, suitable methods and materials are described below. All publications, patent applications, patents and other references mentioned herein are hereby incorporated by reference in their entirety. In case of conflict, the present specification, including definitions, will control. In addition, the materials, methods, and examples described herein are illustrative only and are not intended to be limiting.
本発明の他の特徴および利点は、以下の詳細な説明および特許請求の範囲から明らかになり、それらに包含される。 Other features and advantages of the invention will be apparent from and encompassed by the following detailed description and claims.
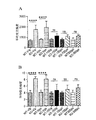
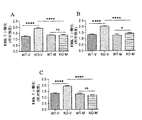
本発明は、メタドキシンは脆弱X症候群の検証済み動物モデルにおいて認知および社会機能を有意に改善するという発見に関する。 The present invention relates to the discovery that metadoxine significantly improves cognitive and social function in validated animal models of fragile X syndrome.
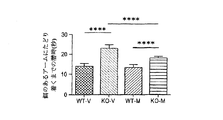
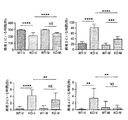
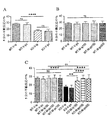
具体的には、メタドキシンは、文脈的恐怖パラダイム(contextual fear paradigm)の際の記憶および学習を用量依存的に有意に改善し、2種類の最高用量レベル(150および200mg/kg)は、Fmr1 KOマウスの学習および記憶欠陥をWTマウスレベルと同等の程度まで完全に救済した。さらに、150mg/kgのメタドキシンで処置したFmr1 KOマウスにおいて記憶の有意な改善がT迷路などの挙動試験で認められ、認知結果の有意な改善を示した。これらの所見は、150mg/kgのメタドキシンで処置したKOマウスの社会的相互作用の改善により補足された。重要なことには、検証済み脆弱Xマウスモデルにおけるメタドキシン処置後の認知実行機能、作業記憶および社会的相互作用の改善は、ニューロンシグナル伝達経路および酸化ストレスを反映する生化学的マーカー正常化と相関している。 Specifically, metadoxine significantly improves memory and learning during the contextual fear paradigm in a dose-dependent manner, with the two highest dose levels (150 and 200 mg / kg) being Fmrl KO. Mouse learning and memory deficits were fully rescued to the same extent as WT mouse levels. Furthermore, a significant improvement in memory was observed in behavioral tests such as the T-maze in Fmrl KO mice treated with 150 mg / kg metadoxine, indicating a significant improvement in cognitive results. These findings were complemented by improved social interaction in KO mice treated with 150 mg / kg metadoxine. Importantly, improvements in cognitive executive function, working memory and social interaction after metadoxine treatment in a validated fragile X mouse model correlate with normalization of biochemical markers reflecting neuronal signaling pathways and oxidative stress doing.
脆弱X症候群は、自閉症の最も広まっている一遺伝子性の原因であり、少年間の精神遅滞の遺伝性の原因である。FMR1遺伝子突然変異を有する人は子供に受け渡す可能性がある。疾病管理予防センター(CDC)によれば、男性では4,000人に、女性では8,000人におよそ1人が脆弱X症候群を有する。この突然変異を有する総ての人が脆弱Xの徴候または症状を示すわけではなく、障害は軽度から重度にわたり、長い顔、大きなまたは突出した耳、大きな精巣(巨精巣症)などの身体的特徴と、常同性運動(例えば、手をひらひらさせる)および社交不安などの行動的特徴を伴う。脆弱Xは、X染色体に見られる脆弱X精神遅滞1(Fragile X Mental Retardation 1)(FMR1)遺伝子の変化または突然変異を原因とする。この遺伝子は通常、脆弱X精神遅滞タンパク質またはFMRPと呼ばれるタンパク質を生成する。このタンパク質は脳および神経系の細胞間の接続を作り出し、維持するために重要である。この突然変異は身体にこのタンパク質の小片しか作らせず、またはタンパク質を全く作らせず、多くの場合で脆弱Xの症状をもたらす。 Fragile X syndrome is the most prevalent monogenic cause of autism and an inherited cause of mental retardation among boys. A person with an FMR1 gene mutation may be handed over to a child. According to the Centers for Disease Control and Prevention (CDC), approximately 1 in 4,000 men and approximately 1 in 8,000 women have fragile X syndrome. Not all people with this mutation show signs or symptoms of fragile X, and the disorder ranges from mild to severe, with physical features such as long faces, large or overhanging ears, and large testes (macrochiosis) With behavioral features such as stereotypic movements (eg, fluttering hands) and social anxiety. Fragile X is caused by a change or mutation in the Fragile X Mental Retardation 1 (FMR1) gene found on the X chromosome. This gene usually produces a protein called fragile X mental retardation protein or FMRP. This protein is important for creating and maintaining connections between cells of the brain and nervous system. This mutation causes the body to make only a small piece of this protein or no protein at all, often resulting in symptoms of fragile X.
脆弱X症候群(FXS)は、自閉症スペクトラム障害などの他の病態を併存する場合が多い。自閉症スペクトラム障害(ASD)は、重大な社会的、コミュニケーションおよび行動的問題を引き起こし得る一群の発達障害である。ASDを有する人々は、脳での情報の取り扱いが他の人々と異なる。 Fragile X syndrome (FXS) often coexists with other conditions such as autism spectrum disorder. Autism spectrum disorder (ASD) is a group of developmental disorders that can cause serious social, communication and behavioral problems. People with ASD have different information handling in the brain than others.
ASDは「スペクトラム障害」である。これは、ASDが人によって異なる影響を及ぼし、ごく軽度から重度までの範囲に及び得ることを意味する。ASDを有する人々は、社会的相互作用に伴う問題など、いくつかの類似症状を共通に持つ。しかし、症状がいつ始まるか、どの程度重篤か、および症状の厳密な性質には違いがある。ASDは、自閉症性障害(「古典的」自閉症とも呼ばれる)、アスペルガー症候群および広汎性発達障害を含む。 ASD is a “spectrum failure”. This means that ASD has different effects from person to person and can range from very mild to severe. People with ASD have several similar symptoms in common, such as problems with social interaction. However, there are differences in when symptoms begin, how severe they are, and the exact nature of the symptoms. ASD includes autistic disorders (also called “classical” autism), Asperger's syndrome and pervasive developmental disorders.
現在のところ、食品医薬品局(FDA)は、脆弱Xまたはその症状の治療に対して薬物は特に承認していない。脆弱X症候群の特定の症状を処置するために適応外で使用される薬物はあるが、結果は患者によって大きく異なり、これらの薬物のいくつかは重大なリスクを持ち、最初は症状を悪化させたる場合や効果が出るまでに数週間かかる場合がある。本発明は、脆弱Xまたはその症状を治療するための薬物の、まだ対処されていない需要を提示する。 Currently, the Food and Drug Administration (FDA) does not specifically approve drugs for the treatment of fragile X or its symptoms. There are drugs that are used off-label to treat certain symptoms of fragile X syndrome, but the results vary widely from patient to patient, some of these drugs have significant risks and initially worsen the symptoms It may take a few weeks to be effective. The present invention presents an unmet need for drugs for treating fragile X or its symptoms.
よって、本発明は、対象者にメタドキシンを含んでなる組成物を投与することにより脆弱X症候群および/または自閉症スペクトラム障害の徴候または症状を治療、予防または緩和する方法を提供する。 Thus, the present invention provides a method for treating, preventing or alleviating signs or symptoms of fragile X syndrome and / or autism spectrum disorder by administering to a subject a composition comprising metadoxine.
一般に、脆弱Xの徴候および症状は、5つのカテゴリーに入り、例えば、知能および学習;一般に脆弱Xに伴うまたは特徴を共通に持つ身体障害、社会障害および感情障害、会話障害および言語障害および感覚障害を含む。脆弱Xを有する個人は、知的機能障害、社交不安、言語障害および特定の感覚に対する感受性を有する。メタドキシンによる処置は学習を改善し、脆弱X症候群を有する対象者において社会性を増強する。 In general, signs and symptoms of fragile X fall into five categories, for example, intelligence and learning; physical disabilities, social and emotional disorders, conversational and language disorders, and sensory disorders that generally accompany or share characteristics with fragile X including. Individuals with fragile X have a sensitivity to intellectual dysfunction, social anxiety, language impairment and specific sensations. Treatment with metadoxine improves learning and enhances sociality in subjects with fragile X syndrome.
自閉症スペクトラム障害は、脆弱X症候群を有する個人に一般に随伴する。自閉症の徴候および症状としては、顕著な言語遅滞、社会性およびコミュニケーションの問題、ならびに異常な行動および関心が含まれる。自閉症性障害を有する多くの人が知的障害も有する。アスペルガー症候群を有する個人は通常、自閉症性障害の何らかの軽度症状を有する。例えば、これらの人は社会的問題ならびに異常な行動および関心を有する場合がある。広汎性発達障害(PDD−NOS)を有する個人は、自閉症性障害またはアスペルガー症候群の判定基準の、総てではないがいくつかを満たし、PDD−NOSと診断される場合がある。PDD−NOSを有する人々は通常、自閉症性障害を有する人々よりも症状が少なくかつ軽度である。これらの症状は、社会的およびコミュニケーションの問題のみを引き起こす場合がある。メタドキシンによる処置は、自閉症の症状を改善する。 Autism spectrum disorders are commonly associated with individuals with fragile X syndrome. Signs and symptoms of autism include significant language lag, social and communication problems, and abnormal behavior and interest. Many people with autistic disorders also have intellectual disabilities. Individuals with Asperger's syndrome usually have some mild symptoms of autistic disorder. For example, these people may have social problems and abnormal behavior and interest. Individuals with pervasive developmental disorder (PDD-NOS) may meet some, but not all, criteria for autistic disorder or Asperger syndrome and be diagnosed with PDD-NOS. People with PDD-NOS are usually less symptomatic and milder than those with autistic disorders. These symptoms may only cause social and communication problems. Treatment with metadoxine improves the symptoms of autism.
メタドキシンは、カルボン酸ピロリドン(PCA)とピリドキシン(ビタミンB6)の間のイオン対であり、これら2つの化合物が塩化により単一の生成物として連結されている。PCAとの対合は、ピリドキシンの薬理活性を相乗的に増強する(例えば、米国特許第4,313,952号参照)。メタドキシンは水および胃液に制限なく可溶である。この薬物の経口吸収は速く、高いバイオアベイラビリティ(60〜80%)を持つ。ヒト血清中でのメタドキシンの半減期は短く(40〜60分)、経口投与と静脈内投与の間に目に見える違いはない(Addolorato et al., 前掲; Lu Yuan et al., Chin. Med. 1 2007 120(2) 160-168)。 Metadoxine is an ion pair between pyrrolidone carboxylate (PCA) and pyridoxine (vitamin B6), and these two compounds are linked as a single product by salification. Pairing with PCA synergistically enhances the pharmacological activity of pyridoxine (see, eg, US Pat. No. 4,313,952). Metadoxine is soluble in water and gastric juice without limitation. The oral absorption of this drug is fast and has high bioavailability (60-80%). The half-life of metadoxine in human serum is short (40-60 minutes) and there is no visible difference between oral and intravenous administration (Addolorato et al., Supra; Lu Yuan et al., Chin. Med). 1 2007 120 (2) 160-168).
メタドキシンは、数カ国で、500mg錠剤および300mg注射剤の形態での処方薬として上市している。錠剤は、500mgのメタドキシン、微晶質セルロースおよびステアリン酸マグネシウムを含有する。アンプルは、300mgのメタドキシン、メタ重亜硫酸ナトリウム、EDTAナトリウム、メチル−p−ヒドロキシベンゾエートおよび水を含有する。 Metadoxine is marketed in several countries as a prescription drug in the form of 500 mg tablets and 300 mg injections. The tablets contain 500 mg metadoxine, microcrystalline cellulose and magnesium stearate. Ampoule contains 300 mg of metadoxine, sodium metabisulfite, sodium EDTA, methyl-p-hydroxybenzoate and water.
特定の実施態様では、例えば完全にまたは部分的に持続放出または制御放出用に処方された本発明のメタドキシン組成物は、脆弱X症候群および自閉症スペクトラム障害などのその関連の病態/障害の徴候または症状の治療、予防および/または緩和においてメタドキシンのより効率的な使用を可能とする。 In certain embodiments, a metadoxine composition of the invention formulated, for example, fully or partially for sustained or controlled release, is an indication of its associated pathology / disorder, such as fragile X syndrome and autism spectrum disorder Or allows more efficient use of metadoxine in the treatment, prevention and / or alleviation of symptoms.
本発明の上記方法のあるものにおいて、メタドキシンまたはその許容可能な誘導体は、対象者への投与時に即時放出するように処方してもよい。本発明の上記方法のあるものにおいて、メタドキシンまたはその許容可能な誘導体は、持続放出および/または制御制御用に処方してもよく、また場合によって、対象者への投与時に即時放出特徴と持続放出および/または制御放出特徴の両方を持つように処方してもよい。特定の実施態様では、メタドキシンまたはその生理学的に許容可能な誘導体は、非慢性投与用に処方される。本発明の方法に有用なメタドキシン製剤(formulation)を以下にさらに詳細に記載する。 In certain of the above methods of the invention, metadoxine or an acceptable derivative thereof may be formulated to be released immediately upon administration to a subject. In some of the above methods of the invention, metadoxine or an acceptable derivative thereof may be formulated for sustained release and / or controlled control, and in some cases immediate release characteristics and sustained release upon administration to a subject. And / or may be formulated to have both controlled release characteristics. In certain embodiments, metadoxine or a physiologically acceptable derivative thereof is formulated for non-chronic administration. Metadoxine formulations useful in the methods of the present invention are described in further detail below.
特定の実施態様では、本発明は、脆弱X症候群および/または自閉症スペクトラム障害などのその関連の病態/障害の徴候または症状の改善、治療、予防および/または緩和のための、対象者に投与した際に持続放出および/または制御放出されるように処方された、メタドキシンまたはその誘導体を含んでなる組成物を提供する。 In certain embodiments, the present invention provides a subject for improvement, treatment, prevention and / or alleviation of signs or symptoms of its associated pathology / disorder, such as fragile X syndrome and / or autism spectrum disorder. Provided is a composition comprising metadoxine or a derivative thereof formulated to be sustained release and / or controlled release upon administration.
特定の実施態様では、本発明は、メタドキシンまたはその誘導体を含んでなり、メタドキシンまたは誘導体の一部が対象者に投与された際に持続放出および/または制御放出するように処方され、また、メタドキシンまたは誘導体の一部が即時放出するように処方されている、脆弱X症候群および/または自閉症スペクトラム障害などのその関連の病態/障害の徴候または症状の改善、治療、予防および/または緩和のための組成物を提供する。 In certain embodiments, the present invention comprises metadoxine or a derivative thereof, wherein the metadoxine or a portion of the derivative is formulated for sustained and / or controlled release when administered to a subject, Or improvement, treatment, prevention and / or alleviation of signs or symptoms of its associated pathology / disorder, such as fragile X syndrome and / or autism spectrum disorder, where a portion of the derivative is formulated for immediate release A composition is provided.
特定の実施態様では、有効成分の有効血清レベルは、メタドキシンまたはメタドキシン誘導体の投与後、約10分〜約20分または30分または40分または50分または60分、90分、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間以内に達成される。特定の実施態様では、前記対象者における有効成分の有効血清レベルは、メタドキシンまたはメタドキシン誘導体の投与後、約5分〜約20分または30分または40分または50分または60分、90分、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間以内に達成される。特定の実施態様では、有効成分の有効血清レベルは、メタドキシンまたはメタドキシン誘導体の投与後、約20分〜約20分または30分または40分または50分または60分、90分、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間以内に達成される。特定の実施態様では、有効成分の有効血清レベルは、約5分、10分、15分、20分、30分、40分、50分または60分、90分、2時間、3時間、4時間、5時間、6時間、7時間、8時間、9時間、10時間以内に達成される。 In certain embodiments, the effective serum level of the active ingredient is about 10 minutes to about 20 minutes or 30 minutes or 40 minutes or 50 minutes or 60 minutes, 90 minutes, 2 hours, 3 hours after administration of metadoxine or a metadoxine derivative. It is achieved within 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours and 10 hours. In certain embodiments, the effective serum level of the active ingredient in the subject is about 5 minutes to about 20 minutes or 30 minutes or 40 minutes or 50 minutes or 60 minutes, 90 minutes, 2 minutes after administration of metadoxine or a metadoxine derivative. Within 3 hours, 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours and 10 hours. In certain embodiments, the effective serum level of the active ingredient is about 20 minutes to about 20 minutes or 30 minutes or 40 minutes or 50 minutes or 60 minutes, 90 minutes, 2 hours, 3 hours after administration of metadoxine or a metadoxine derivative. It is achieved within 4 hours, 5 hours, 6 hours, 7 hours, 8 hours, 9 hours and 10 hours. In certain embodiments, the effective serum level of the active ingredient is about 5 minutes, 10 minutes, 15 minutes, 20 minutes, 30 minutes, 40 minutes, 50 minutes or 60 minutes, 90 minutes, 2 hours, 3 hours, 4 hours. It is achieved within 5 hours, 6 hours, 7 hours, 8 hours, 9 hours and 10 hours.
本発明者らは、腸内経路(消化管を介する)および/または非経口経路(消化管以外の経路)に基づくメタドキシンまたはメタドキシン誘導体の投与のための革新的アプローチを開発した(W02009/004629、その内容は引用することによりその全体が本明細書の一部とされる)。これらのアプローチは、対象とする送達系のための担体、例えば、適当な界面活性剤/補助界面活性剤組成物または有効成分を封入するマイクロ/ナノ粒子(例えば、リポソームもしくはナノリポソーム)、または他の添加剤もしくは賦形剤の細心の選択に基づく、所望の特性を有する送達系の合理的設計を提供する。腸内送達系は、経口投与(錠剤、サシェ剤、トローチ剤、カプセル剤、ゲルキャップ、滴剤、もしくは他の味の良い(palatable)形態)または直腸投与(坐剤もしくは(ミニ)浣腸形態)用に設計してもよい。加えて、対象とする送達系は、液体形態、例えば、滴剤溶液、シロップであってもよい。さらに、対象とする送達系は、飲料または食品の形態であってもよい。よって、本発明により使用される有効成分は、飲料、特に、ジュース、ネクター、水、炭酸水および他の炭酸飲料、シェイク、ミルクシェイクおよび他のミルク系飲料などのようなソフトドリンク中に含まれてよい。液体製剤はまた、水または炭酸水で希釈するための濃縮シロップの形態であってもよい。あるいは、有効成分は、スナックバー、ヘルスバー、ビスケット、クッキー、スィーツ、菓子製品、アイスクリーム、アイスキャンディーなどの食品中に含まれてもよい。 The inventors have developed an innovative approach for the administration of metadoxine or metadoxine derivatives based on the intestinal route (via the gastrointestinal tract) and / or the parenteral route (the route other than the gastrointestinal tract) (W02009 / 004629, The contents of which are incorporated herein by reference in their entirety). These approaches include carriers for the intended delivery system, such as micro / nanoparticles (eg, liposomes or nanoliposomes) encapsulating the appropriate surfactant / co-surfactant composition or active ingredient, or others It provides a rational design of a delivery system with the desired properties based on careful selection of additives or excipients. Intestinal delivery systems can be administered orally (tablets, sachets, troches, capsules, gelcaps, drops, or other palatable forms) or rectal (suppositories or (mini) enema forms). May be designed for In addition, the targeted delivery system may be in liquid form, for example, a drop solution, syrup. Further, the targeted delivery system may be in the form of a beverage or food. Thus, the active ingredients used according to the present invention are contained in beverages, in particular soft drinks such as juices, nectars, water, carbonated water and other carbonated beverages, shakes, milk shakes and other milk-based beverages etc. It's okay. The liquid formulation may also be in the form of a concentrated syrup for dilution with water or carbonated water. Alternatively, the active ingredient may be contained in foods such as snack bars, health bars, biscuits, cookies, sweets, confectionery products, ice cream, ice candy.
さらにまた、送達系は、生理学的に活性なピリドキシン誘導体、特に、ピリドキソールL,2−ピロリドン−5カルボキシレート(メタドキシン)を含んでなる食品または飲料製品であってもよい。特定の実施態様では、本発明の食品または飲料製品の摂取は、その摂取後約10分から約40〜60分以内に有効成分の血清レベルの達成をもたらし得る。例としては、スィーツ、チョコレート、キャンディーおよびキャンディーバー、エネルギーバー、アイスクリーム、ペーストリー製品などが挙げられる。 Furthermore, the delivery system may be a food or beverage product comprising a physiologically active pyridoxine derivative, in particular pyridoxol L, 2-pyrrolidone-5 carboxylate (metadoxine). In certain embodiments, ingestion of a food or beverage product of the present invention can result in achieving serum levels of the active ingredient within about 10 minutes to about 40-60 minutes after ingestion. Examples include sweets, chocolate, candy and candy bars, energy bars, ice cream, pastry products and the like.
投与の非経口経路としては、皮下、転移(transferal)(無傷な皮膚を経た拡散)、経粘膜(粘膜を経た拡散)、舌下、口内(歯肉線近傍の頬を経た吸収)投与、または吸入による投与が含まれる。特定の実施態様では、本発明により使用される組成物は、侵襲的処置様式では投与されない(すなわち、非侵襲的である)。特定の実施態様では、メタドキシンまたはメタドキシン誘導体組成物は、静注によっては投与されない。 The parenteral route of administration is subcutaneous, transferal (diffusion through intact skin), transmucosal (diffusion through mucosa), sublingual, buccal (absorption through the cheek near the gingival line), or inhalation Administration is included. In certain embodiments, the compositions used in accordance with the present invention are not administered in an invasive mode of treatment (ie, are non-invasive). In certain embodiments, the metadoxine or metadoxine derivative composition is not administered by intravenous injection.
特定の実施態様では、本発明により使用される組成物は、噴霧に好適な微晶質粉末または溶液として;腟内または直腸内投与のために、膣坐剤、坐剤、クリームまたはフォームとして送達される。好ましい製剤は、経口投与用製剤である。別の好ましい製剤は、局所投与用のものである。別の好ましい製剤は、経粘膜投与、舌下、口内(歯肉線近傍の頬を経た吸収)投与、吸入による投与または眼内投与、例えば、点眼剤用のものである。 In a particular embodiment, the composition used according to the invention is delivered as a microcrystalline powder or solution suitable for spraying; for vaginal or rectal administration, delivered as a vaginal suppository, suppository, cream or foam Is done. A preferred formulation is a formulation for oral administration. Another preferred formulation is for topical administration. Another preferred formulation is for transmucosal administration, sublingual, buccal (absorption via the cheek near the gingival line), inhalation or intraocular administration, eg for eye drops.
医学的用途のためのメタドキシンまたはメタドキシン誘導体の投与は、安全かつ効率的な送達系を必要とする。本発明は、特殊な物理化学的特徴、特に、非侵襲的手段による直接吸収、および結果としての副作用の回避による種々の物質の安全な送達のための送達系を提供する。本送達系は、対象者に生物学的に活性な形態で送達される物質の濃度または量の低減を可能とするそのユニークな物理化学的特徴に基づき、メタドキシンまたはメタドキシン誘導体の吸収の効率および質を有意に高める。本発明の送達系は、組織への有効物質の直接的接近を提供し、従って、処置対象に対してメタドキシンまたはメタドキシン誘導体の即時的または即時的に近い効果を与える。よって、特定の実施態様では、本発明は、生理学的に活性なピリドキシン、特に、ピリドキソールL,2−ピロリドン−5カルボキシレート(メタドキシン)、またはその生理学的に許容可能な誘導体の改善された投与のための、好適な担体中に有効成分として前記生理学的に活性なピリドキシンを含んでなる非侵襲的医薬送達系を使用する。特定の実施態様では、有効成分の血清レベルは、投与後約10分から約40分〜60分以内に達成される。別の実施態様では、本発明は、必要とする対象者における認知行動の改善に使用することを目的とした、生理学的に活性なピリドキシン誘導体、特に、ピリドキソールL,2−ピロリドン−5カルボキシレート(メタドキシン)の改善された投与のための、好適な担体中に有効成分として前記ピリドキシン誘導体を含んでなる非侵襲的医薬送達系を使用する。特定の実施態様では、前記有効成分の血清レベルは、投与後約10分から約40分〜60分以内に達成される。 Administration of metadoxine or metadoxine derivatives for medical use requires a safe and efficient delivery system. The present invention provides a delivery system for the safe delivery of various substances with special physicochemical characteristics, in particular direct absorption by non-invasive means, and avoidance of the resulting side effects. The delivery system is based on its unique physicochemical characteristics that allow for a reduction in the concentration or amount of a substance delivered in a biologically active form to a subject, and the efficiency and quality of absorption of metadoxine or metadoxine derivatives. Is significantly increased. The delivery system of the present invention provides direct access of the active substance to the tissue and thus provides an immediate or near immediate effect of metadoxine or a metadoxine derivative on the treated subject. Thus, in certain embodiments, the present invention provides improved administration of a physiologically active pyridoxine, particularly pyridoxol L, 2-pyrrolidone-5 carboxylate (metadoxine), or a physiologically acceptable derivative thereof. Therefore, a non-invasive pharmaceutical delivery system comprising the physiologically active pyridoxine as an active ingredient in a suitable carrier is used. In certain embodiments, the serum level of the active ingredient is achieved within about 10 minutes to about 40 minutes to 60 minutes after administration. In another embodiment, the present invention provides a physiologically active pyridoxine derivative, in particular pyridoxol L, 2-pyrrolidone-5 carboxylate (intended for use in improving cognitive behavior in a subject in need thereof. For improved administration of (metadoxine), a non-invasive pharmaceutical delivery system comprising said pyridoxine derivative as active ingredient in a suitable carrier is used. In certain embodiments, the serum level of the active ingredient is achieved within about 10 minutes to about 40 minutes to 60 minutes after administration.
特定の実施態様では、本発明により使用される薬物送達系は、経口、経鼻、眼内、直腸、皮下、転移(transferal)、経粘膜、舌下、口内または吸入投与用に設計することができる。薬物送達系は、有効物質を制御放出様式で提供し得る。特定の実施態様では、本発明の薬物送達系は、少なくとも1種類の付加的な薬学的に活性な薬剤をさらに含んでなり得る。本発明により使用される送達系は、一般に、緩衝剤、その浸透圧を調整する薬剤、および場合により、1種類以上の当技術分野で公知の薬学上許容可能な担体、賦形剤および/または添加剤を含んでなり得る。補助的な薬学上許容可能な有効成分も本組成物に配合可能である。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、および液体ポリエチレングリコールなど)、それらの好適な混合物、および植物油を含有する溶媒または分散媒であり得る。適切な流動性は、例えば、レシチンなどのコーティング剤の使用により、分散物の場合には必要な粒径の維持により、および界面活性剤の使用により維持することができる。本明細書で使用する場合、「薬学上許容可能な担体」は、溶媒、分散媒、コーティング剤、抗菌剤および抗真菌剤などのいずれかおよび総てを含む。薬学的に有効な物質のためのこのような媒体および薬剤の使用は当技術分野で周知である。従来の媒体または薬剤が有効成分と不適合である場合を除き、治療用組成物中でのその使用が企図される。有効性薬剤はいずれの薬学上許容可能な経路によりおよびいずれの薬学上許容可能な剤形でも送達可能であると考えられる。経口形としては、限定されるものではないが、錠剤、カプセル剤、丸剤、サシェ剤、トローチ剤、滴剤、散剤、顆粒剤、エリキシル剤、チンキ、懸濁液、シロップ、およびエマルションが含まれる。また、経口急速放出、制御放出、および遅延放出医薬剤形も含まれる。有効薬物成分は単一の剤形で投与することもできるし、または一緒もしくは独立に投与される別個の剤形で投与することもできる。有効薬物成分は、好適な医薬希釈剤、賦形剤または担体(本明細書では「担体」と総称する)との混合物として投与することができ、材料は意図される投与形態に対して適宜選択される。送達系が経口投与用であって、錠剤またはカプセル剤などの形態である場合、有効薬物成分は、ラクトース、デンプン、スクロース、グルコース、修飾糖、加工デンプン、メチルセルロースおよびその誘導体、リン酸二カルシウム、硫酸カルシウム、マンニトール、ソルビトール、および他の還元および非還元糖、ステアリン酸マグネシウム、ステアリン酸、フマル酸ステアリルナトリウム、ベヘン酸グリセリル、ステアリン酸カルシウムなどの非毒性の薬学上許容可能な不活性担体と組み合わせることができる。液体形態の経口投与では、有効薬物成分は、エタノール、グリセロール、水などの非毒性の薬学上許容可能な不活性担体と組み合わせることができる。所望により、または必要であれば、好適な結合剤、滑沢剤、崩壊剤、着色剤および香味剤を本混合物に配合することができる。抗酸化剤、没食子酸プロピル、アスコルビン酸ナトリウム、クエン酸、メタ重亜硫酸カルシウム、ヒドロキノン、および7−ヒドロキシクマリンなどの分解防止剤も、本剤形を安定化させるために添加することができる。他の好適な化合物としては、ゼラチン、甘味剤、アラビアガム、トラガカントガム、またはアルギネートどの天然および合成ガム、カルボキシメチルセルロース、ポリエチレン、グリコール、ワックスなどを含み得る。 In certain embodiments, the drug delivery system used in accordance with the present invention may be designed for oral, nasal, intraocular, rectal, subcutaneous, transferal, transmucosal, sublingual, buccal or inhalation administration. it can. The drug delivery system may provide the active substance in a controlled release manner. In certain embodiments, the drug delivery system of the present invention may further comprise at least one additional pharmaceutically active agent. The delivery system used in accordance with the present invention generally comprises a buffer, an agent that modulates its osmotic pressure, and optionally one or more pharmaceutically acceptable carriers, excipients and / or known in the art. An additive may be included. Supplementary pharmaceutically acceptable active ingredients can also be incorporated into the compositions. The carrier can be a solvent or dispersion medium containing, for example, water, ethanol, polyol (for example, glycerol, propylene glycol, and liquid polyethylene glycol, and the like), suitable mixtures thereof, and vegetable oils. The proper fluidity can be maintained, for example, by the use of a coating such as lecithin, by the maintenance of the required particle size in the case of dispersion and by the use of surfactants. As used herein, “pharmaceutically acceptable carrier” includes any and all of solvents, dispersion media, coatings, antibacterial and antifungal agents and the like. The use of such media and agents for pharmaceutically effective substances is well known in the art. Except where a conventional vehicle or drug is incompatible with the active ingredient, its use in a therapeutic composition is contemplated. It is contemplated that the active agent can be delivered by any pharmaceutically acceptable route and in any pharmaceutically acceptable dosage form. Oral forms include, but are not limited to, tablets, capsules, pills, sachets, troches, drops, powders, granules, elixirs, tinctures, suspensions, syrups, and emulsions It is. Also included are oral rapid release, controlled release, and delayed release pharmaceutical dosage forms. The active drug ingredients can be administered in a single dosage form or can be administered in separate dosage forms that are administered together or independently. The active drug ingredient can be administered as a mixture with suitable pharmaceutical diluents, excipients or carriers (collectively referred to herein as “carriers”), with the materials selected as appropriate for the intended dosage form. Is done. When the delivery system is for oral administration and is in a form such as a tablet or capsule, the active drug ingredient is lactose, starch, sucrose, glucose, modified sugar, modified starch, methylcellulose and its derivatives, dicalcium phosphate, Combine with non-toxic pharmaceutically acceptable inert carriers such as calcium sulfate, mannitol, sorbitol, and other reducing and non-reducing sugars, magnesium stearate, stearic acid, sodium stearyl fumarate, glyceryl behenate, calcium stearate, etc. Can do. For oral administration in liquid form, the active drug ingredient can be combined with non-toxic pharmaceutically acceptable inert carriers such as ethanol, glycerol, water and the like. If desired or necessary, suitable binders, lubricants, disintegrating agents, coloring agents, and flavoring agents can be incorporated into the mixture. Antioxidants, propyl gallate, sodium ascorbate, citric acid, calcium metabisulfite, hydroquinone, and anti-degradation agents such as 7-hydroxycoumarin can also be added to stabilize the dosage form. Other suitable compounds may include natural and synthetic gums such as gelatin, sweeteners, gum arabic, tragacanth, or alginate, carboxymethylcellulose, polyethylene, glycols, waxes, and the like.
これらの医薬組成物に使用可能な、さらなる好適な薬学上許容可能な担体としては、限定されるものではないが、イオン交換体、アルミナ、ステアリン酸アルミニウム、ステアリン酸マグネシウム、レシチン、ヒト血清アルブミンなどの血清タンパク質、バッファー物質、例えば、リン酸塩、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物脂肪酸の部分グリセリド混合物、水、塩または電解質、例えば、硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイドシリカ、三ケイ酸マグネシウム、ポリビニルピロリドン、セルロース系物質、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリレート、ワックス、ポリエチレン−ポリオキシプロピレンブロックポリマー、ポリエチレングリコールおよび羊毛脂が含まれる。いくつかの実施態様では、薬学上許容可能な担体は、ステアリン酸マグネシウムである。一般に認知され使用されているさらなる医薬賦形剤は、例えば、Remington's Pharmaceutical Sciences (Gennaro, A., ed., Mack Pub., 1990)に見られる。 Further suitable pharmaceutically acceptable carriers that can be used in these pharmaceutical compositions include, but are not limited to, ion exchangers, alumina, aluminum stearate, magnesium stearate, lecithin, human serum albumin and the like. Serum proteins, buffer substances such as phosphate, glycine, sorbic acid, potassium sorbate, partial glyceride mixtures of saturated plant fatty acids, water, salts or electrolytes such as protamine sulfate, disodium hydrogen phosphate, hydrogen phosphate Potassium, sodium chloride, zinc salt, colloidal silica, magnesium trisilicate, polyvinylpyrrolidone, cellulosic material, polyethylene glycol, sodium carboxymethyl cellulose, polyacrylate, wax, polyethylene-polyoxypropylene block polymer Mer, polyethylene glycol and wool fat. In some embodiments, the pharmaceutically acceptable carrier is magnesium stearate. Additional pharmaceutical excipients commonly recognized and used can be found, for example, in Remington's Pharmaceutical Sciences (Gennaro, A., ed., Mack Pub., 1990).
非経口投与の目的で、ゴマ油もしくは落花生油などの好適な油中または水性プロピレングリコール中の溶液、ならびに対応する水溶性塩の無菌水溶液を使用することができる。このような水溶液は必要に応じて適宜緩衝させてもよく、液体希釈剤はまず十分な生理食塩水またはグルコースで等張としてもよい。これらの水溶液は、静脈内、筋肉内、皮下および腹腔内注射の目的で特に好適である。これに関して、使用される無菌水性媒体は総て、当業者に周知の標準技術によって容易に得ることができる。一定量の有効成分を含む種々の医薬組成物を調製する方法は既知であるか、または当業者には本開示に鑑みれば自明である。ヒト血清中でのメタドキシンの半減期は極めて短い。Lu Yuan et al. (Chin. Med. J 2007 120(2) 160-168)は、平均半減期が約0.8時間であると示している。活性部分の血清レベルを延長する1つの方法は、材料を持続放出製剤として投与することによるものである。メタドキシンは水および種々の体液に制限無く可溶であることから、その放出を持続させ、その吸収時間を延長することは困難である。従って、持続放出が達成できるとは予想されなかった。メタドキシンまたはメタドキシン誘導体の制御放出剤形は、長期間にわたって血漿レベルの小さな変動で持続的作用をもたらす、体液中への有効成分の所定の徐放出に基づくものであり得る。 For parenteral administration, solutions in suitable oils such as sesame oil or peanut oil or in aqueous propylene glycol, as well as sterile aqueous solutions of the corresponding water-soluble salts can be used. Such an aqueous solution may be appropriately buffered as necessary, and the liquid diluent may first be made isotonic with sufficient saline or glucose. These aqueous solutions are especially suitable for intravenous, intramuscular, subcutaneous and intraperitoneal injection purposes. In this regard, all sterile aqueous media used can be readily obtained by standard techniques well known to those skilled in the art. Methods for preparing various pharmaceutical compositions containing a certain amount of active ingredient are known or will be apparent to those skilled in the art in view of the present disclosure. The half-life of metadoxine in human serum is very short. Lu Yuan et al. (Chin. Med. J 2007 120 (2) 160-168) shows an average half-life of about 0.8 hours. One way to prolong the serum level of the active moiety is by administering the material as a sustained release formulation. Since metadoxine is soluble in water and various body fluids without limitation, it is difficult to maintain its release and extend its absorption time. Therefore, it was not expected that sustained release could be achieved. Controlled release dosage forms of metadoxine or metadoxine derivatives may be based on a predetermined sustained release of the active ingredient into bodily fluids that provides a sustained action with small fluctuations in plasma levels over a long period of time.
特定の実施態様では、本発明により使用される送達系は、制御放出製剤で投与することができる。特定の実施態様では、投与方法は対象者の病態および必要の評価の後に担当の医師またはその他の当業者によって決定される。本発明の方法の実施態様は、本明細書に記載の治療用化合物を持続放出形で投与することである。Langer, Science 249(4976):1527-33 (1990)に記載されているものなど、当業者に既知の制御放出法または持続放出法はいずれも本発明の組成物および方法とともに使用可能である。このような方法は、持続放出組成物、坐剤、またはコーティングされた埋め込み可能な医療装置を、治療上有効な用量の本発明の組成物がこのような方法の対象に継続的に送達されるように投与することを含んでなる。持続放出はまた、この目的で設計および処方されたパッチを用いて達成してもよい。本発明の組成物は、一定期間にわたって薬剤の持続放出を可能とするカプセルによって送達してもよい。制御放出または持続放出組成物としては、親油性デポー(例えば、脂肪酸、ワックス、油類)中の製剤が含まれる。また、ポリマー(例えば、ポロキサマーまたはポロキサミン)でコーティングされた粒状組成物も本発明により包含される。持続放出製剤もしくは装置、または任意の局所用製剤は、その組成物を安定化させるため、または皮膚もしくは粘膜などの生理学的障壁を透過するためにさらに組成物を含んでもよい。付加的成分の例としては、任意の生理学的に許容可能な洗剤、または例えばジメチルスルホキシド(DMSO)などの溶媒を含み得る。 In certain embodiments, the delivery system used in accordance with the present invention can be administered in a controlled release formulation. In certain embodiments, the method of administration is determined by the attending physician or other person skilled in the art after assessment of the subject's condition and needs. An embodiment of the method of the invention is to administer the therapeutic compound described herein in sustained release form. Any controlled or sustained release method known to those skilled in the art can be used with the compositions and methods of the present invention, such as those described in Langer, Science 249 (4976): 1527-33 (1990). Such methods include sustained release compositions, suppositories, or coated implantable medical devices in which a therapeutically effective dose of the composition of the invention is continuously delivered to the subject of such methods. Administering. Sustained release may also be achieved using patches designed and formulated for this purpose. The compositions of the invention may be delivered by capsules that allow sustained release of the drug over a period of time. Controlled or sustained release compositions include formulations in lipophilic depots (eg, fatty acids, waxes, oils). Also encompassed by the present invention are particulate compositions coated with a polymer (eg, poloxamer or poloxamine). The sustained release formulation or device, or any topical formulation, may further comprise a composition to stabilize the composition or to penetrate a physiological barrier such as the skin or mucosa. Examples of additional ingredients may include any physiologically acceptable detergent or solvent such as dimethyl sulfoxide (DMSO).
本発明の総ての実施態様において、本発明の方法および使用は、単一の用量として処方された本発明により定義される塩付加物を含んでなる組成物を用い得る。前記単一の製剤は、当業者に公知の即時放出製剤、バースト製剤、長期放出製剤、持続放出製剤またはその他の制御放出製剤であり得る。 In all embodiments of the present invention, the methods and uses of the present invention may employ compositions comprising a salt adduct as defined by the present invention formulated as a single dose. The single formulation may be an immediate release formulation, burst formulation, extended release formulation, sustained release formulation or other controlled release formulation known to those skilled in the art.
本発明の方法および使用の他の実施態様では、本発明により定義される塩付加物を含んでなる組成物は、異なるタイプの製剤が、すなわち、単一用量でまたは個別に、付随して(concomitantly)もしくは逐次に与えられる個別用量で与えられる当業者に公知の即時放出製剤、バースト製剤、長期放出製剤、持続放出製剤または他の任意の制御放出製剤の任意の組合せが、対象者に投与される組合せ投与製剤であってよく、ここで、個別用量の投与間の時間間隔は、対象者の疾患もしくは障害の状態および重篤度または前記対象者の身体の状態に基づいて定義される。 In other embodiments of the methods and uses of the invention, a composition comprising a salt adduct as defined by the invention is associated with different types of formulations, i.e., in a single dose or individually ( concomitantly) or any combination of immediate release formulation, burst formulation, extended release formulation, sustained release formulation or any other controlled release formulation known to those skilled in the art given in individual doses given sequentially or administered to the subject Wherein the time interval between administration of the individual doses is defined based on the condition and severity of the subject's disease or disorder or the physical condition of the subject.
いくつかの実施態様では、本発明の方法により使用される組成物は組合せ剤形として処方され、ここで、本発明により定義される塩付加物(suit adduct)の少なくとも1つの剤形は即時放出形態であり、本発明により定義される塩付加物の少なくとも1つの剤形(即時放出製剤で処方された塩付加物と同じまたは異なる)は、制御(緩徐および/または持続)放出製剤として処方される。他の実施態様では、前記少なくとも1つの即時放出製剤および少なくとも1つの制御放出製剤中に含まれる本発明により定義される塩付加物の重量比は、1:1、1:2、2:1、3:2、2:3、1:3、3:1、4:1、1:4、5:2、2:5、1:5、5:1であり得る。本発明の方法または使用においてこのような組合せ剤形を使用する場合、上記で定義される塩付加物の前記少なくとも1つの即時放出形態および少なくとも1つの制御放出形態は、個別に、付随し、逐次に、同時に(concurrently)、連続してなどで対象者に投与してよい。いくつかの実施態様では、前記少なくとも1つの即時放出形態が最初に投与される。他の実施態様では、前記少なくとも1つの制御放出製剤が最初に投与される。 In some embodiments, the composition used by the method of the present invention is formulated as a combination dosage form, wherein at least one dosage form of the salt adduct as defined by the present invention is immediate release. In form, at least one dosage form of the salt adduct defined by the present invention (same or different from the salt adduct formulated in the immediate release formulation) is formulated as a controlled (slow and / or sustained) release formulation. The In another embodiment, the weight ratio of the salt adduct defined by the present invention contained in said at least one immediate release formulation and at least one controlled release formulation is 1: 1, 1: 2, 2: 1, 3: 2, 2: 3, 1: 3, 3: 1, 4: 1, 1: 4, 5: 2, 2: 5, 1: 5, 5: 1. When using such a combination dosage form in the method or use of the present invention, said at least one immediate release form and at least one controlled release form of the salt adduct as defined above are individually associated with and sequentially Alternatively, it may be administered to the subject concurrently, sequentially, and the like. In some embodiments, the at least one immediate release form is administered first. In another embodiment, the at least one controlled release formulation is administered first.
特定の実施態様では、本発明の組成物中のメタドキシンまたはメタドキシン誘導体は、少なくとも0.5、1、2、3、4、5、6、7、8、9、10、11または12時間の期間にわたる持続放出または制御放出用に処方することができる。特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、約0.5、1、2、3、4、5、6、7、8、9、10、11または12時間の期間にわたる持続放出または制御放出用に処方することができる。特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、約0.5または1または2または3または4時間〜および約5、6、7、8、9、10、11または12時間の間の期間にわたる持続放出または制御放出用に処方することができる。特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、約5または6または7または8時間〜約9、10、11または12時間の間の期間にわたる持続放出または制御放出用に処方することができる。 In certain embodiments, the metadoxine or metadoxine derivative in the composition of the invention has a duration of at least 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12 hours. Can be formulated for sustained or controlled release over a wide range. In a particular embodiment, the metadoxine or metadoxine derivative in the composition used according to the invention is about 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12 It can be formulated for sustained or controlled release over a period of time. In a particular embodiment, the metadoxine or metadoxine derivative in the composition used according to the invention is from about 0.5 or 1 or 2 or 3 or 4 hours to about 5, 6, 7, 8, 9, 10, It can be formulated for sustained or controlled release over a period of between 11 or 12 hours. In certain embodiments, the metadoxine or metadoxine derivative in the composition used according to the invention is sustained release or controlled over a period of between about 5 or 6 or 7 or 8 hours to about 9, 10, 11 or 12 hours. Can be formulated for release.
特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、即時放出形態、急速放出形態またはバースト放出形態(immediate, fast of burst release form)であり得る。 In certain embodiments, the metadoxine or metadoxine derivative in the composition used according to the present invention may be in an immediate release form, a rapid release form or an immediate, fast of burst release form.
特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、約0.5、1、2、3、4、5、6、7または8時間で総メタドキシンまたはメタドキシン誘導体の5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、99、99.5または100%までを放出するように処方することができる。特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、約0.5、1、2、3、4、5、6、7または8時間で総メタドキシンまたはメタドキシン誘導体の5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、99、99.5または100%以上を放出するように処方することができる。
In certain embodiments, the metadoxine or metadoxine derivative in the composition used according to the present invention is about 0.5, 1, 2, 3, 4, 5, 6, 7 or 8 hours of total metadoxine or metadoxine derivative. Release up to 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99, 99.5 or 100% Can be prescribed as follows. In certain embodiments, the metadoxine or metadoxine derivative in the composition used according to the present invention is about 0.5, 1, 2, 3, 4, 5, 6, 7 or 8 hours of total metadoxine or metadoxine derivative.
特定の実施態様では、本発明により使用される組成物中のメタドキシンまたはメタドキシン誘導体は、持続放出形態または徐放形態および即時放出形態または急速放出形態の組合せであり得る。特定の実施態様では、持続放出または徐放メタドキシンまたはメタドキシン誘導体と即時放出または急速放出メタドキシンまたはメタドキシン誘導体の相対比は、例えば、1対99、5対95、10対90、15対85、20対80、25対75、30対70、35対65、40対60、45対55、50対50、55対45、60対40、65対35、70対30、75対25、80対20、85対15、90対10、95対5、または99対1である。 In certain embodiments, the metadoxine or metadoxine derivative in the composition used according to the present invention may be a combination of sustained release form or sustained release form and immediate release form or rapid release form. In certain embodiments, the relative ratio of sustained or sustained release metadoxine or metadoxine derivative to immediate or rapid release metadoxine or metadoxine derivative is, for example, 1 to 99, 5 to 95, 10 to 90, 15 to 85, 20 to 80, 25 to 75, 30 to 70, 35 to 65, 40 to 60, 45 to 55, 50 to 50, 55 to 45, 60 to 40, 65 to 35, 70 to 30, 75 to 25, 80 to 20, 85 to 15, 90 to 10, 95 to 5, or 99 to 1.
特定の実施態様では、メタドキシンまたはメタドキシン誘導体の放出を持続させるまたは制御するためにポリマー材料が使用される。特定の実施態様では、ポリマー材料のタイプおよびその使用量は、本発明の生成物からのメタドキシンまたはメタドキシン誘導体の放出速度に強い影響を持つ。ポリマーの例としては、疎水性および親水性双方のポリマーが含まれる。疎水性ポリマーの例としては、限定されるものではないが、エチルセルロースおよび他のセルロース誘導体、グリセロールパルミトステレート、密蝋、グリコワックス、キャスターワックス、カルナウバワックス、グリセロールモノステレートまたはステアリルアルコールなどの脂肪類、疎水性ポリアクリルアミド誘導体および疎水性メタクリル酸誘導体、ならびにこれらのポリマーの混合物が含まれる。親水性ポリマーとしては、限定されるものではないが、親水性セルロース誘導体、例えば、メチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースナトリウムおよびヒドロキシエチルメチルセルロース ポリビニルアルコール、ポリエチレン、ポリプロピレン、ポリスチレン、ポリアクリルアミド、エチレン酢酸ビニルコポリマー、ポリアクリレート、ポリ−ウレタン、ポリビニルピロリドン、ポリメチルメタクリレート、ポリ酢酸ビニル、ポリヒドロキシエチルメタクリレート、ならびにこれらのポリマーの混合物が含まれる。さらに、1以上の疎水性ポリマーと1以上の親水性ポリマーの任意の混合物が場合により使用可能である。 In certain embodiments, polymeric materials are used to sustain or control the release of metadoxine or metadoxine derivatives. In certain embodiments, the type of polymeric material and the amount used thereof has a strong impact on the release rate of metadoxine or metadoxine derivatives from the products of the present invention. Examples of polymers include both hydrophobic and hydrophilic polymers. Examples of hydrophobic polymers include, but are not limited to, ethyl cellulose and other cellulose derivatives, glycerol palmitosterate, beeswax, glycowax, castor wax, carnauba wax, glycerol monosterate or stearyl alcohol, etc. Fatty, hydrophobic polyacrylamide derivatives and hydrophobic methacrylic acid derivatives, and mixtures of these polymers are included. Hydrophilic polymers include, but are not limited to, hydrophilic cellulose derivatives such as methyl cellulose, hydroxypropyl methyl cellulose, hydroxyethyl cellulose, hydroxypropyl cellulose, carboxymethyl cellulose, carboxymethyl cellulose sodium and hydroxyethyl methyl cellulose polyvinyl alcohol, polyethylene, polypropylene , Polystyrene, polyacrylamide, ethylene vinyl acetate copolymer, polyacrylate, poly-urethane, polyvinyl pyrrolidone, polymethyl methacrylate, polyvinyl acetate, polyhydroxyethyl methacrylate, and mixtures of these polymers. In addition, any mixture of one or more hydrophobic polymers and one or more hydrophilic polymers can optionally be used.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、FMC BioPolymer’sにより製造された「Avicel PH 101」などの微晶質セルロースである。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is microcrystalline cellulose such as “Avicel PH 101” manufactured by FMC BioPolymer's.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、Shin−Etsu Chemical Coにより生産される「Metholose」などのヒドロキシプロピルメチルセルロースである。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is a hydroxypropyl methylcellulose such as “Metrose” produced by Shin-Etsu Chemical Co.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、The Dow Chemical Companyにより製造される「Ethocel(商標)」などのエチルセルロースである。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is ethylcellulose such as “Ethocel ™” manufactured by The Dow Chemical Company.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、Rohm GmbHにより生産される「Eudragit RS(商標)」などのアクリル系ポリマーである。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is an acrylic polymer such as “Eudragit RS ™” produced by Rohm GmbH.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、Degussaにより製造される「Aerosil(商標)」などのコロイド状二酸化ケイ素である。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is colloidal silicon dioxide such as “Aerosil ™” manufactured by Degussa.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、BASFにより製造される「Kollicoat SR」などのポリ(酢酸ビニル)である。 In a particular embodiment, the polymeric material used in the composition of the invention or used according to the invention is a poly (vinyl acetate) such as “Kollicoat SR” manufactured by BASF.
特定の実施態様では、本発明の、または本発明により使用される組成物中に使用されるポリマー材料は、Delasco Dermatologic Lab & Supply、Inc.により製造される「Duro−Tak」などの酢酸エチルおよび酢酸ビニル溶液である。 In a particular embodiment, the polymeric material used in the compositions of the invention or used according to the invention can be obtained from Delasco Dermatologic Lab & Supply, Inc. Ethyl acetate and vinyl acetate solutions such as “Duro-Tak” manufactured by
特定の実施態様では、本発明の、または本発明により使用される組成物は、約50、100、150、200、250、300、400、500、600、700、800、または900mg〜約1000、1500、2000、2500または3000mgのメタドキシンまたはメタドキシン誘導体を含んでなるか、またはから本質的になる。特定の実施態様では、本発明の、または本発明により使用される組成物は、約5、100、500、または1000mg〜約2000、4000、10,000、15,000、または20,000mgのAvicel PH 101(商標)を含んでなるか、またはから本質的になる。特定の実施態様では、本発明の、または本発明により使用される組成物は、約25、50、100、150、200、250、300、350、400、450、500、550または600mg〜約650、700、750、800、850、900、950、1000、5000、10,000、15,000または20,000mgのポリマー材料を含んでなるか、またはから本質的になる。特定の実施態様では、ポリマー材料は、Metholose、Ethocel E10(商標)またはEudragit RS(商標)である。特定の実施態様では、Metholoseは、製剤の1〜90%の間、好ましくは5〜70%の間で含んでなるか、またはから本質的になる。特定の実施態様では、Ethocel(商標)は、製剤の1〜30%の間、好ましくは2〜20%の間で含んでなるか、またはから本質的になる。特定の実施態様では、Eudragit(商標)は、製剤の1〜90%の間、好ましくは5〜70%の間で含んでなるか、またはから本質的になる。 In certain embodiments, the compositions of the invention or used in accordance with the invention have about 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, or 900 mg to about 1000, Comprise or consist essentially of 1500, 2000, 2500 or 3000 mg of metadoxine or a metadoxine derivative. In certain embodiments, compositions of the invention or used in accordance with the invention have from about 5, 100, 500, or 1000 mg to about 2000, 4000, 10,000, 15,000, or 20,000 mg of Avicel. PH 101 (TM) comprises or consists essentially of. In certain embodiments, the compositions of the invention or used in accordance with the invention have about 25, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550 or 600 mg to about 650. 700, 750, 800, 850, 900, 950, 1000, 5000, 10,000, 15,000 or 20,000 mg of polymeric material or consist essentially of. In certain embodiments, the polymeric material is Methorose, Ethocel E10 ™ or Eudragit RS ™. In certain embodiments, the Methorose comprises or consists essentially of between 1-90%, preferably between 5-70% of the formulation. In certain embodiments, Ethocel ™ comprises or consists essentially of between 1-30%, preferably between 2-20% of the formulation. In certain embodiments, Eudragit ™ comprises or consists essentially of between 1-90% of the formulation, preferably between 5-70%.
特定の実施態様では、本発明の、または本発明により使用される送達系は、送達デバイスを含んでなる。特定の実施態様では、本発明の、または本発明により使用される組成物は、浸透圧ポンプによるなどの制御された速度での浸透圧的プロセスにより送達される。この系は、浸透圧活性剤を速度制御半透膜でコーティングすることにより構築することができる。この膜は、薬剤が送達される臨界サイズのオリフィスを含み得る。この剤形は、水性流体と接触するようになった後、膜の流体透過性とおよびコア製剤の浸透圧によって決定される速度で水を吸収する。この水の浸透性の吸収は、コア内で活性材料の飽和溶液の形成をもたらし、これは膜中の送達オリフィスから制御された速度で分配される。 In certain embodiments, the delivery system of or used in accordance with the present invention comprises a delivery device. In certain embodiments, the compositions of the invention or used in accordance with the invention are delivered by an osmotic process at a controlled rate, such as by an osmotic pump. This system can be constructed by coating an osmotically active agent with a rate-controlling semipermeable membrane. The membrane may include a critical size orifice through which the drug is delivered. After the dosage form comes into contact with an aqueous fluid, it absorbs water at a rate determined by the fluid permeability of the membrane and the osmotic pressure of the core formulation. This osmotic absorption of water results in the formation of a saturated solution of active material within the core, which is dispensed at a controlled rate from the delivery orifice in the membrane.
特定の実施態様では、本発明の、または本発明により使用される組成物は、生分解性微粒子を用いて送達される。特定の実施態様では、微粒子を調製するための系は、揮発性溶媒と溶解しているポリマーから構成される有機相および水相中に乳化され、封入される材料からなる。特定の実施態様では、微粒子マトリックスに使用可能な生分解性ポリマーは、ポリ乳酸(PLA)または乳酸とグリコール酸のコポリマー(PLAGA)を含んでなる。PLAGAポリマーは、加水分解により経時的にそのモノマー成分に分解し、これらは自然代謝により身体から容易に除去される。 In certain embodiments, the compositions of or used in accordance with the present invention are delivered using biodegradable microparticles. In a particular embodiment, the system for preparing the microparticles consists of a material emulsified and encapsulated in an organic and aqueous phase composed of a volatile solvent and a dissolved polymer. In certain embodiments, the biodegradable polymer that can be used in the particulate matrix comprises polylactic acid (PLA) or a copolymer of lactic acid and glycolic acid (PLAGA). PLAGA polymers degrade over time into their monomer components by hydrolysis, which are easily removed from the body by natural metabolism.
本発明の、または本発明により使用される製剤はまた、吸収促進剤および他の任意選択の成分を含有してよい。吸収促進剤の例としては、限定されるものではないが、シクロデキストリン、リン脂質、キトサン、DMSO、Tween、Brij、グリココール酸塩、サポニン、フシジン酸塩およびエネルギーに基づく吸収促進装置が含まれる。 The formulations of or used in accordance with the present invention may also contain absorption enhancers and other optional ingredients. Examples of absorption enhancers include, but are not limited to, cyclodextrin, phospholipid, chitosan, DMSO, Tween, Brij, glycocholate, saponin, fusidate and energy-based absorption enhancers. .
剤形中に存在する任意選択の成分としては、限定されるものではないが、希釈剤、結合剤、滑沢剤、界面活性剤、着色剤、香味剤、緩衝剤、保存剤、分解防止剤などが含まれる。 Optional ingredients present in the dosage form include, but are not limited to, diluents, binders, lubricants, surfactants, colorants, flavoring agents, buffering agents, preservatives, anti-degradation agents. Etc. are included.
「増量剤」とも呼ばれる希釈剤としては、例えば、リン酸二カルシウム二水和物、硫酸カルシウム、ラクトース、セルロース、カオリン、マンニトール、塩化ナトリウム、乾燥デンプン、加水分解デンプン、二酸化ケイ素、コロイドシリカ、酸化チタン、アルミナ、タルク、微晶質セルロース、および粉末糖が含まれる。液体形態での投与に関して、希釈剤としては、例えば、エタノール、ソルビトール、グリセロール、水などが含まれる。 Diluents, also called “bulking agents” include, for example, dicalcium phosphate dihydrate, calcium sulfate, lactose, cellulose, kaolin, mannitol, sodium chloride, dry starch, hydrolyzed starch, silicon dioxide, colloidal silica, oxidation Titanium, alumina, talc, microcrystalline cellulose, and powdered sugar are included. For administration in liquid form, diluents include, for example, ethanol, sorbitol, glycerol, water and the like.
結合剤は、製剤に凝集性の品質を付与するために使用される。好適な結合剤材料としては、限定されるものではないが、デンプン(コーンスターチおよびアルファ化デンプンを含む)、ゼラチン、糖類(スクロース、グルコース、デキストロース、ラクトースおよびソルビトールを含む)、ポリエチレングリコール、ワックス、天然および合成ガム、例えば、アラビアガム、トラガカントガム、アルギン酸ナトリウム、セルロース、およびビーガム、ならびにポリメタクリレートおよびポリビニルピロリドンなどの合成ポリマーが含まれる。 Binders are used to impart cohesive quality to the formulation. Suitable binder materials include, but are not limited to, starch (including corn starch and pregelatinized starch), gelatin, sugar (including sucrose, glucose, dextrose, lactose and sorbitol), polyethylene glycol, wax, natural And synthetic gums such as gum arabic, gum tragacanth, sodium alginate, cellulose, and bee gum, and synthetic polymers such as polymethacrylate and polyvinylpyrrolidone.
滑沢剤は、製造を容易にするために使用される;好適な滑沢剤の例としては、例えば、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸、ベヘン酸グリセリル、およびポリエチレングリコールが含まれる。 Lubricants are used to facilitate manufacture; examples of suitable lubricants include, for example, magnesium stearate, calcium stearate, stearic acid, glyceryl behenate, and polyethylene glycol.
界面活性剤は、陰イオン性、陽イオン性、両性または非イオン性界面活性剤であり得、陰イオン性界面活性剤が好ましい。好適な陰イオン性界面活性剤としては、限定されるものではないが、ナトリウムイオン、カリウムイオンおよびアンモニウムイオンなどの陽イオンと会合される、カルボン酸イオン、スルホン酸イオンおよび硫酸イオンを含有するものが含まれる。特に好ましい界面活性剤としては、限定されるものではないが、長鎖アルキルスルホネートおよびアルキルアリールスルホネート、例えば、ナトリウムドデシルベンゼンスルホネート;ジアルキルナトリウムスルホスクシネート、例えば、ナトリウムビス−(2−エチルヘキシル)−スルホスクシネート;および硫酸アルキル、例えば、ラウリル硫酸ナトリウムが含まれる。 The surfactant can be an anionic, cationic, amphoteric or nonionic surfactant, with an anionic surfactant being preferred. Suitable anionic surfactants include, but are not limited to, those containing carboxylate ions, sulfonate ions, and sulfate ions that are associated with cations such as sodium ions, potassium ions, and ammonium ions. Is included. Particularly preferred surfactants include, but are not limited to, long chain alkyl sulfonates and alkyl aryl sulfonates such as sodium dodecylbenzene sulfonate; dialkyl sodium sulfosuccinate such as sodium bis- (2-ethylhexyl)- Sulfosuccinates; and alkyl sulfates such as sodium lauryl sulfate.
抗酸化剤などの分解防止剤としては、限定されるものではないが、没食子酸プロピル、アスコルビン酸ナトリウム、クエン酸、メタ重亜硫酸カルシウム、ヒドロキノン、および7−ヒドロキシクマリンが含まれる。 Degradation inhibitors such as antioxidants include, but are not limited to, propyl gallate, sodium ascorbate, citric acid, calcium metabisulfite, hydroquinone, and 7-hydroxycoumarin.
所望により、本発明の、または本発明により使用される組成物はまた、湿潤剤または乳化剤、保存剤など、微量の非毒性補助物質も含有してよい。 If desired, the compositions of the invention or used according to the invention may also contain minor amounts of non-toxic auxiliary substances such as wetting or emulsifying agents, preservatives and the like.
本発明の、または本発明により使用される組成物はいずれも単独でまたは認知行動の改善のための1以上の付加的治療薬と組み合わせて使用可能である。付加的治療薬の例は、アンフェタミン、メチルフェニデートHCl、塩酸デクスメチルフェニデート、アトモキセチン、レボキセチン、フルオキサチン(fluoxetine)、セルトラリン、パロキセチン、フルオロキサミン、シタロプラム、ベンラファキシン、ブプロピオン、ネファゾドンおよびミルタザピンである。 Any of the compositions of or used in accordance with the present invention can be used alone or in combination with one or more additional therapeutic agents for improving cognitive behavior. Examples of additional therapeutic agents are amphetamine, methylphenidate HCl, dexmethylphenidate hydrochloride, atomoxetine, reboxetine, fluoxetine, sertraline, paroxetine, fluoroxamine, citalopram, venlafaxine, bupropion, nefazodone and mirtazapine is there.
単一の剤形を作製するために担体材料と組み合わせ得る化合物と付加的治療薬両方の量は、処置される宿主および特定の投与様式によって異なる。好ましくは、本発明の組成物は、0.1〜1g/kg体重/日、好ましくは、0.1〜300mg/kg体重の間の用量が投与可能なように処方されるべきである。化合物の用量は、患者の状態および疾病、ならびに所望の一日用量によって異なる。ヒトの療法では、経口一日用量は、10〜3000mg、または好ましくは100〜3000mgである。例えば、一日用量は、10、25、50 100、150、200、250、300、350、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900,または3000mgである。これらの用量は単位剤形で投与され、単一の一日用量で投与してもよいし、または特定の場合には各日2〜3回の少用量に分割してもよい。 The amount of both compound and additional therapeutic agent that can be combined with the carrier materials to produce a single dosage form will vary depending upon the host treated and the particular mode of administration. Preferably, the compositions of the present invention should be formulated so that doses between 0.1-1 g / kg body weight / day, preferably 0.1-300 mg / kg body weight can be administered. The dose of the compound depends on the patient's condition and disease and the desired daily dose. For human therapy, the oral daily dose is 10 to 3000 mg, or preferably 100 to 3000 mg. For example, the daily dose is 10, 25, 50 100, 150, 200, 250, 300, 350, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, or 3000 mg. These doses are administered in unit dosage form and may be administered in a single daily dose or, in certain cases, divided into two or three smaller doses each day.
特定の実施態様では、本発明の組成物は、互いに組み合わせて相乗作用を示す場合があり、また、付加的治療薬の存在下でさらに相乗作用を示す場合がある。従って、このような組成物中の1または複数の化合物および1または複数の付加的治療薬の量は、その治療薬のみを使用する単剤療法で必要とされる量よりも少なくなる。このような組成物では、0.1〜1g/kg体重/日の間の用量の付加的治療薬が投与可能である。 In certain embodiments, the compositions of the present invention may be synergistic in combination with each other and may be further synergistic in the presence of additional therapeutic agents. Accordingly, the amount of one or more compounds and one or more additional therapeutic agents in such compositions is less than that required for monotherapy using only that therapeutic agent. In such compositions, doses of additional therapeutic agent between 0.1-1 g / kg body weight / day can be administered.
定義
便宜のため、本明細書、実施例、および付属の実施態様で使用される特定の用語をここにまとめる。そうではないことが定義されない限り、本明細書で使用される総ての技術用語および科学用語は、本発明が属する技術分野の熟練者(ordinary skilled in the art)が一般に理解しているものと同じ意味を有する。
Definitions For convenience, certain terms used in the specification, examples, and appended embodiments are collected here. Unless defined otherwise, all technical and scientific terms used herein are generally understood by those skilled in the art to which this invention belongs. Have the same meaning.
冠詞「a」および「an」は、本明細書では、その冠詞の文法上の目的語の1以上(すなわち、少なくとも1つの)を指して用いられる。例として、「一要素(an element)」は、1つの要素または2つ以上の要素を意味する。 The articles “a” and “an” are used herein to refer to one or more (ie, at least one) of the grammatical objects of the article. By way of example, “an element” means one element or more than one element.
用語「含む」は、本明細書では、「限定されるものではないが含む」という句を意味して使用され、その句と互換的に使用される。 The term “including” is used herein to mean and is used interchangeably with the phrase “including but not limited to”.
用語「または」は、本明細書では、文脈がそうではないことを明示しない限り、「および/または」という用語を意味して使用され、それと互換的に使用される。 The term “or” is used herein to mean and interchangeably with the term “and / or” unless the context clearly indicates otherwise.
用語「などの」は、本明細書では、「限定されるものではないがなどの」という句を意味して使用され、それと互換的に使用される。 The term “such as” is used herein to mean and is used interchangeably with the phrase “such as, but not limited to”.
用語「予防的」または「治療的」処置は、対象者に1以上の本発明の組成物を投与することを意味する。望ましくない病態(例えば、宿主動物の臨床状態または他の望ましくない状態)の臨床発現の前に投与される場合には、その処置は予防的であり、すなわち、それは望ましくない病態の発症に対する予防、すなわち、対象の保護に寄与し、一方、望ましくない病態の発現の後に投与される場合には、その処置は治療的である(すなわち、望ましくない病態の進行またはそれからの副作用を消散、改善または回避することが意図される)。 The term “prophylactic” or “therapeutic” treatment means administering to a subject one or more compositions of the invention. If administered prior to clinical manifestation of an undesirable condition (e.g., a host animal clinical condition or other undesirable condition), the treatment is prophylactic, i.e., it prevents prevention of the development of an undesirable condition, That is, it contributes to the protection of the subject, whereas if administered after the development of an undesirable condition, the treatment is therapeutic (i.e., resolves, ameliorates or avoids the progression of the undesirable condition or its side effects) Intended to).
用語「治療効果」は、薬理学的に有効な1または複数の物質により引き起こされる動物、特に、哺乳動物、より詳しくは、ヒトにおける局所性または全身性の効果を意味する。従って、この用語は、疾患の診断、治癒、緩和、治療もしくは予防、または動物もしくはヒトにおける望ましい身体もしくは精神発達および状態の増進における使用を意図したいずれの物質も意味する。用語「治療上有効な量」は、いずれの処置にも適用可能な妥当な利益/リスク比で何らかの所望の局所性または全身性の効果をもたらす、このような物質の量を意味する。特定の実施態様では、化合物または組成物の治療上有効な量はその治療係数、溶解度などによって異なる。例えば、本発明の特定のメタドキシンまたはメタドキシン誘導体製剤は、当業者により決定され得るように、選択された処置に適用可能な妥当な利益/リスク比を生じるのに十分な量で投与してよい。 The term “therapeutic effect” means a local or systemic effect in an animal, particularly a mammal, more particularly a human, caused by one or more pharmacologically effective substances. Thus, this term refers to any substance intended for use in diagnosing, curing, alleviating, treating or preventing a disease, or promoting desirable physical or mental development and conditions in an animal or human. The term “therapeutically effective amount” means the amount of such a substance that produces any desired local or systemic effect at a reasonable benefit / risk ratio applicable to any treatment. In certain embodiments, the therapeutically effective amount of a compound or composition depends on its therapeutic index, solubility, and the like. For example, a particular metadoxine or metadoxine derivative formulation of the present invention may be administered in an amount sufficient to produce a reasonable benefit / risk ratio applicable to the chosen treatment, as can be determined by one skilled in the art.
用語「有効量」は、適当な用量および投与計画で対象者に投与した際に少なくとも1つの所望の結果を生じる治療用試薬の量を意味する。 The term “effective amount” means an amount of a therapeutic reagent that produces at least one desired result when administered to a subject in a suitable dose and dosing regimen.
本発明の方法により処置される「対象者」または「患者」は、ヒトまたは非ヒト動物のいずれか、好ましくは、哺乳動物を指し得る。用語「対象者」は、本明細書で使用する場合、健康な個体または脆弱X症候群もしくは自閉症スペクトラム障害に罹患している対象者を指し得る。別の実施態様では、用語「対象者」および「健康な対象者」および「必要とする対象者」および「必要とする患者」は、本明細書で使用する場合、どんな形であれアルコール摂取後にアルコールの影響下にある対象者、アルコール中毒者(アルコール嗜癖者)、および禁酒中のアルコール中毒者を除く。 A “subject” or “patient” to be treated by the methods of the invention can refer to either a human or non-human animal, preferably a mammal. The term “subject” as used herein may refer to a healthy individual or a subject suffering from fragile X syndrome or an autism spectrum disorder. In another embodiment, the terms “subject” and “healthy subject” and “subject in need” and “patient in need” as used herein are in any form after alcohol consumption. Excludes subjects affected by alcohol, alcohol addicts (alcoholics), and alcohol addicts who are not drinking alcohol.
本明細書で使用する場合、用語「塩付加物」は、2つ以上の異なるイオンの直接的付加の塩生成物を包含するものとし、この場合、この塩付加物の全体的な電荷はゼロである。特定の実施態様では、塩付加物は、単一の正電荷官能基を有する1つの正電荷部分(すなわち、この正電荷部分は+1の正味電荷を有する)と、単一の負電荷官能基を有する1つの負電荷部分(すなわち、この負電荷部分は−1の正味電荷を有する)を含んでなる。特定の実施態様では、塩付加物は、同じであっても異なっていてもよい2つの正電荷官能基を有する1つの正電荷部分(すなわち、この正電荷部分は+2正味電荷を有する)と、同じであっても異なっていてもよく、それぞれ単一の負電荷官能基を有する2つの負電荷部分(すなわち、各負電荷部分は−1の正味電荷を有する)を含んでなる。特定の実施態様では、塩付加物は、同じであっても異なっていてもよく、それぞれ1つの正電荷官能基を有する2つの正電荷部分(すなわち、各正電荷部分は+1の正味電荷を有する)と、同じまたは異なる2つの負電荷官能基を有する1つの負電荷部分(すなわち、この負電荷部分は−2の正味電荷を有する)を含んでなる。特定の実施態様では、塩付加物は、+nの正味電荷(同じであっても異なっていてもよい1以上の正電荷官能基に起源する)を有する正電荷部分と−nの正味電荷(同じであっても異なっていてもよい1以上の負電荷官能基の起源する)を有する負電荷部分を含んでなり、ここで、nは1、2、3、4、5または6に相当し得る整数である。 As used herein, the term “salt adduct” is intended to encompass the salt product of the direct addition of two or more different ions, where the overall charge of the salt adduct is zero. It is. In certain embodiments, the salt adduct comprises a single positively charged moiety having a single positively charged functional group (ie, the positively charged moiety has a +1 net charge) and a single negatively charged functional group. Having one negative charge portion (ie, this negative charge portion has a net charge of −1). In certain embodiments, the salt adduct is one positively charged moiety having two positively charged functional groups that may be the same or different (ie, the positively charged moiety has a +2 net charge); It may be the same or different and comprises two negatively charged moieties each having a single negatively charged functional group (ie, each negatively charged moiety has a net charge of −1). In certain embodiments, the salt adducts can be the same or different and each has two positively charged moieties (ie, each positively charged moiety has a +1 net charge) with one positively charged functional group. ) And one negatively charged moiety having two negatively charged functional groups that are the same or different (ie, the negatively charged moiety has a net charge of -2). In certain embodiments, the salt adduct has a positive charge moiety having a net charge of + n (derived from one or more positively charged functional groups, which may be the same or different) and a net charge of -n (same A negatively charged moiety having one or more negatively charged functional groups, which may be different or different, wherein n may correspond to 1, 2, 3, 4, 5 or 6 It is an integer.
本明細書で使用する場合、本発明の「塩付加物の正電荷部分」は、ピリドキシンの対応する酸、またはその任意の誘導体である。特定の実施態様では、正電荷部分の正電荷は、ピリドキシンのプロトン化塩基性窒素原子に由来するか(例えば、化合物(2)の場合)、またはその任意の誘導体に由来する(例えば、式(I)の化合物)。特定の実施態様では、正電荷ピリドキシン誘導体は、例えば、−NH3 +、−CH2NH3 +、NH2R+、−NHR2 +(ここで、各Rは独立にC1−C6アルキルであり)などの正電荷官能基で置換され、これは、いくつかの実施態様で、ピリジン環内の正電荷プロトン化塩基性芳香族窒素原子に加えて存在する。 As used herein, a “positively charged moiety of a salt adduct” of the present invention is the corresponding acid of pyridoxine, or any derivative thereof. In certain embodiments, the positive charge of the positively charged moiety is derived from the protonated basic nitrogen atom of pyridoxine (eg, in the case of compound (2)) or from any derivative thereof (eg, the formula ( Compounds of I)). In certain embodiments, the positively charged pyridoxine derivative is, for example, —NH 3 + , —CH 2 NH 3 + , NH 2 R + , —NHR 2 + (wherein each R is independently C 1 -C 6 alkyl In some embodiments, in addition to the positively charged protonated basic aromatic nitrogen atom in the pyridine ring.
本発明の塩付加物の部分はそれぞれ少なくとも1つのキラル中心を含む場合があり、従って、エナンチオマー、ジアステレオマー、または限定されるものではないがラセミ混合物を含むその任意の混合物を含むその任意の立体異性体として存在し、また単離される場合があると理解されるべきである。本発明は、本発明の塩付加物の各部分のいずれかの任意の存在し得る立体異性体(例えば、エナンチオマー、ジアステレオマー)、限定されるものではないがラセミ混合物を含むその任意の混合物を含む。本発明の塩付加物の部分のそれぞれの調製のための本明細書に記載のプロセスが立体異性体の混合物を生成する場合、これらの異性体は、分取クロマトグラフィーなどの従来技術によって分離することができる。本発明の塩付加物の部分は、限定されるものではないが、そのラセミ混合物を含む、存在し得るその立体異性体のいずれの混合物でも、それぞれ製造可能であり、または個々の立体異性体(例えば、エナンチオマー、ジアステレオマー)は、エナンチオ特異的合成により、またはラセミ化合物のキラルクロマトグラフィー分離により調製可能である。アミノ酸という場合にはいつも、本発明は、天然および非天然アミノ酸またはその任意の誘導体を包含するものと理解されるべきである。 Each of the salt adduct moieties of the present invention may contain at least one chiral center and thus any of its enantiomers, diastereomers, or any mixture thereof including but not limited to racemic mixtures. It should be understood that they exist as stereoisomers and may be isolated. The invention includes any possible stereoisomers (eg enantiomers, diastereomers) of any of the moieties of the salt adducts of the invention, any mixture thereof including but not limited to racemic mixtures including. If the process described herein for the preparation of each of the salt adduct portions of the present invention produces a mixture of stereoisomers, these isomers are separated by conventional techniques such as preparative chromatography. be able to. The portions of the salt adducts of the present invention can each be prepared in any mixture of its stereoisomers, including but not limited to its racemic mixtures, or individual stereoisomers ( For example, enantiomers, diastereomers) can be prepared by enantiospecific synthesis or by chiral chromatographic separation of racemates. Whenever amino acids are referred to, the present invention should be understood to encompass natural and unnatural amino acids or any derivatives thereof.
本明細書を通じて、「を含んでなる(comprise)」という語または「を含んでなる(comprises)」または「を含んでなる(comprising)」などの変形形態は、記載の整数または整数群の包含を意味するが、他の任意の整数または整数群の排除を意味しないと理解される。 Throughout this specification, the word “comprise” or variations such as “comprises” or “comprising” are intended to encompass the stated integer or group of integers. Is understood not to mean the exclusion of any other integer or group of integers.
用語「バイオアベイラブル」は、特定の化合物の少なくとも一部の量が体循環中に存在することを意味する。経口バイオアベイラビリティの形式的計算はF値に関して記載されている("Fundamentals of Clinical Pharmacokinetics," John G. Wegner, Drug Intelligence Publications; Hamilton, Ill. 1975)。F値は、静脈内投与後の体循環(例えば、血漿)中の親薬物の濃度と非静脈経路(例えば、経口)による投与後の体循環中の親薬物の濃度の比から導き出される。従って、本発明の範囲内の経口バイオアベイラビリティは、静脈内投与と比較した経口投与後の血漿中に検出可能な親薬物の量の比またはF値を企図する。 The term “bioavailable” means that at least some amount of a particular compound is present in the systemic circulation. Formal calculations of oral bioavailability have been described in terms of F values ("Fundamentals of Clinical Pharmacokinetics," John G. Wegner, Drug Intelligence Publications; Hamilton, Ill. 1975). The F value is derived from the ratio of the parent drug concentration in the systemic circulation (eg, plasma) after intravenous administration to the parent drug concentration in the systemic circulation after administration by a non-venous route (eg, oral). Accordingly, oral bioavailability within the scope of the present invention contemplates the ratio or F value of the amount of parent drug detectable in plasma after oral administration compared to intravenous administration.
用語「処置する(treating)」または「処置(treatment)」は、ヒトなどの哺乳動物における、少なくとも、病態、疾患もしくは障害の症状に対する鎮静、改善、軽減もしくは緩和、または病態、疾患もしくは障害に関連する確認できる測定値の改善を意味する。処置は、本明細書で使用する場合、健康な個人におけるものも包含する。 The term “treating” or “treatment” relates to at least sedation, amelioration, reduction or alleviation of symptoms, symptoms or disorders, or conditions, diseases or disorders in mammals such as humans. Improve the measured value that can be confirmed. Treatment as used herein also includes in healthy individuals.
メタドキシンまたはメタドキシン誘導体に関して用語「許容可能な誘導体」は、対象者に投与した際に(直接的または間接的に)メタドキシンまたはその代謝産物もしくは機能的残渣、または測定可能なメタドキシン活性を提供し得る、メタドキシンの任意の塩、コンジュゲート、エステル、複合体もしくは他の化学誘導体、または前記を含んでなる部分のいずれかを意味する。用語「生理学的に適合するメタドキシン誘導体」は、本明細書において、用語「許容可能な誘導体」と互換的に使用でき、メタドキシンの機能的で活性な薬学上許容可能な誘導体を意味する。 The term “acceptable derivative” with respect to metadoxine or a metadoxine derivative may provide metadoxine or a metabolite or functional residue thereof or measurable metadoxine activity (directly or indirectly) when administered to a subject. It means any salt, conjugate, ester, complex or other chemical derivative of metadoxine, or a moiety comprising said. The term “physiologically compatible metadoxine derivative” is used herein interchangeably with the term “acceptable derivative” and refers to a functional and active pharmaceutically acceptable derivative of metadoxine.
用語「賦形剤」は、製剤中で有効成分の担体として使用される不活性物質を意味する。 The term “excipient” means an inert substance used as a carrier for the active ingredient in a formulation.
用語「制御放出」は、制御された速度で長時間薬剤を送達し、所望の薬剤レベルプロファイルを達成するように設計されたいずれの製剤をも意味する。 The term “controlled release” means any formulation designed to deliver a drug at a controlled rate for an extended period of time to achieve a desired drug level profile.
用語「持続放出(sustained release)」は、その従来の意味で、長時間にわたって活性材料の漸進放出を提供する、特定の実施態様では、長時間にわたって実質的に一定の血液レベル、すなわち、制御放出もさらにもたらし得る製剤を意味して使用される。 The term “sustained release”, in its conventional sense, provides a gradual release of active material over time, in a specific embodiment, a blood level that is substantially constant over time, i.e. controlled release. Is also used to mean a formulation that can further result.
用語「即時放出」は、その従来の意味で、投与時に活性材料の非遅延または制御放出を提供する製剤を意味して使用される。 The term “immediate release” is used in its conventional sense to mean a formulation that provides non-delayed or controlled release of the active material upon administration.
物質の「半減期」という用語は、ある物質がその薬理学的、生理学的、またはその他の活性の半分を失うのに要する時間である。生体半減期は、重要な薬物動態パラメーターであり、通常、省略形tinで表される。 The term “half-life” of a substance is the time it takes for a substance to lose half of its pharmacological, physiological, or other activity. Biological half-life is an important pharmacokinetic parameter and is usually represented by the abbreviation tin.
用語「非侵襲的」は、皮膚を穿刺しない処置様式を意味する。 The term “non-invasive” means a mode of treatment that does not puncture the skin.
用語「非慢性投与」は、本明細書では、用語「急性投与」と互換的に使用でき、不規則な方法で対象者に測定または非測定量または部分の薬剤を与えることを意味する。非慢性投与は、単回用量処置であってもまたは複数用量処置であってもよく、場合により経時的に(over time)与えてもよい。常にではないが一般に、非慢性投与は非慢性病態を治療または予防するために与えられる。特定の慢性病態が、本明細書に記載のメタドキシンまたはメタドキシン誘導体組成物の非慢性投与からも利益を受け得る。 The term “non-chronic administration” can be used interchangeably herein with the term “acute administration” and means that a subject is given a measured or non-measured amount or portion of an agent in an irregular manner. Non-chronic administration may be a single dose treatment or a multiple dose treatment, optionally given over time. In general, but not always, non-chronic administration is given to treat or prevent non-chronic conditions. Certain chronic conditions may also benefit from non-chronic administration of the metadoxine or metadoxine derivative compositions described herein.
用語「慢性投与」は、対象者に規則的な方法で測定量の薬剤を与えることを意味する。いくつかの実施態様では、慢性投与は、1以上の慢性病態、障害または疾患の治療または予防を目的とする。慢性疾患は、以下の特徴のうち1以上を有する:慢性疾患は永続的である、後遺障害を残す、不可逆的病理変化によって生じる、リハビリテーションに患者の特別な訓練を必要とする、または長期の指導、観察、またはケアを必要とすると思われる。 The term “chronic administration” means giving a subject a measured amount of drug in a regular manner. In some embodiments, chronic administration is intended for the treatment or prevention of one or more chronic conditions, disorders or diseases. Chronic disease has one or more of the following characteristics: chronic disease is permanent, leaves behind disability, results from irreversible pathological changes, requires special patient training in rehabilitation, or long-term guidance , Need to be observed, or care.
用語「単回用量処置」は、一度に摂取される測定量の薬剤を与えることを意味する。これは、個人の必要に応じて、規則的な方法で非慢性病態を治療するために与えられる。 The term “single dose treatment” means giving a measured amount of drug taken at one time. This is given to treat non-chronic conditions in a regular way, depending on the needs of the individual.
用語「tmax」は、濃度がピークに達する時間を意味する。単回用量投与後に最大濃度が生じる時間の計算は下式に従って実行される。
式中、λαおよびλzは、それぞれ見掛けの吸収および排出速度定数である。 Where λα and λz are the apparent absorption and discharge rate constants, respectively.
実施例1:一般法
本明細書に記載の実施例は一般に下記の試薬および方法を用いて実施した。
Example 1 General Methods The examples described herein were generally performed using the following reagents and methods.
試験動物
まず、ノックアウトマウス(KO2)マウス(The Dutch−Belgium Frafgil X Consortium、1994)をJackson Laboratoryから入手し、野生型(WT)同腹子をC57BL/6Jバックグラウンドで作成し、8世代を超えてC57BL/6Jバックグラウンドに対して繰り返し戻し交配した。Fmr1ノックアウトマウスを、12時間明暗周期(午前7時から午後7時まで点灯;試験は明期に行った)の温度および湿度制御室で同じ遺伝子型の群内で飼育した。食餌および水を自由摂取させつつ、飼育室内で室温および湿度を継続的に記録した。試験は、行動試験中2または6か月齢の健康なFmr1ノックアウトマウスおよびそれらの野生型同腹子(処置群当たりマウスN=10)で行った。マウスは市販のプラスチックケージで飼育し、試験はUK Aminals(Scientific Procedures) Act、1986の要件に従って行った。総ての試験は、遺伝子型および薬物処置に対して盲検として行った。動物には実験を行う前に1週間の最小環境順化期間を設けた。環境順化期間には予防または治療処置は投与しなかった。
Test animals First, knockout mice (KO2) mice (The Dutch-Belgium Fraggil X Consortium, 1994) were obtained from Jackson Laboratory and wild-type (WT) littermates were created in the C57BL / 6J background, over 8 generations. Repeated backcrossing against C57BL / 6J background. Fmrl knockout mice were housed in groups of the same genotype in a temperature and humidity control room with a 12-hour light-dark cycle (lights on from 7 am to 7 pm; the test was conducted during the light period). Room temperature and humidity were continuously recorded in the breeding room with free access to food and water. The study was performed in healthy Fmrl knockout mice and their wild type littermates (mouse N = 10 per treatment group) 2 or 6 months of age during behavioral testing. Mice were housed in commercially available plastic cages and testing was performed according to the requirements of UK Minals (Scientific Procedures) Act, 1986. All studies were performed blind to genotype and drug treatment. Animals were given a minimum environmental acclimation period of 1 week prior to experimentation. No prophylactic or therapeutic treatment was administered during the environmental acclimatization period.
薬物
試験1(実施例2)では、メタドキシンを生理食塩水に溶かし、7日間、100、150、または200mg/kg/1日1回の用量で腹膜内投与した。試験2(実施例3)のin vivo試験では、メタドキシンを生理食塩水に溶かし、7日間、1日1回、150mg/kg/日の腹腔内用量または150または300mg/kg/日(容量0.1ml)の経口用量で投与した。試験2のin vitro試験では、メタドキシンを5時間、300μMの濃度で投与した。総ての場合で、生理食塩水をビヒクル(対照)として使用した。
In Drug Test 1 (Example 2), metadoxine was dissolved in physiological saline and administered intraperitoneally at a dose of 100, 150, or 200 mg / kg / day for 7 days. In the in vivo test of Test 2 (Example 3), metadoxine was dissolved in physiological saline, and once a day for 7 days, an intraperitoneal dose of 150 mg / kg / day or 150 or 300 mg / kg / day (
行動試験
社会的相互作用および社会的認知記憶:マウスは、接近、追跡、匂い嗅ぎ、グルーミング、攻撃的遭遇、交尾、養育行動、ネスティング、および身を寄せ合って群れで眠るなどの、容易にスコア化される社会的行動を営む社会的な種である。マウスにおける社会的接近は、初見マウスに対する匂い嗅ぎの時間によって評価した。
Behavioral testing Social interaction and social cognitive memory: mice score easily, such as approaching, tracking, sniffing, grooming, aggressive encounters, mating, nurturing behavior, nesting, and snuggling together It is a social species that conducts social behavior. Social access in mice was assessed by the time of sniffing for first-time mice.
マウスを、新鮮な木材チップを床に敷いた、成体のホームケージと同桁のサイズの試験アリーナ/ケージ(40×23×12cmケージ、マウスの観察を助けるためにパースペックスの蓋を持つ)に置いた。試験前に数匹の試験に用いないマウスをこの装置に置くことで、バックグラウンドのマウスの匂いをつけた。マウスは試験の10〜15分前にこの試験室に移した。試験対象および若年個体をこの試験ケージに同時に置いた。試験マウスによる刺激若年個体の匂い嗅ぎおよび近接追跡(尾から<2cm)として定義される社会調査の対面の総時間および回数を3分間評価した。30分後、同じ刺激若年個体を用いて試験を繰り返した。収集したデータパラメーターは習得および認知のための匂い嗅ぎの対面の総時間および総数であった。トライアル2/トライアル1+2と定義される社会的記憶比を導いた。従って、記憶なし(例えば、20/(20+20)=0.5および記憶あり(例えば、10/(20+10)=<0.5)。 Mice in test arena / cage (40 x 23 x 12 cm cage, with a perspex lid to help the mouse observe) of the same size as an adult home cage, with fresh wood chips on the floor placed. Prior to the test, a few mice not used in the test were placed on the device to smell the background mice. Mice were transferred to this laboratory 10-15 minutes prior to testing. Test subjects and young individuals were placed in the test cage at the same time. The total time and number of face-to-face social surveys defined as sniffing and proximity tracking (<2 cm from the tail) of young stimulants with test mice were evaluated for 3 minutes. After 30 minutes, the test was repeated using the same stimulated young individuals. The data parameters collected were the total time and total number of face-to-face sniffing for acquisition and recognition. A social memory ratio defined as trial 2 / trial 1 + 2 was derived. Thus, no memory (eg, 20 / (20 + 20) = 0.5 and memory (eg, 10 / (20 + 10) = <0.5).
Y迷路交替行動: 2つの課題を実施した。1つ目は、アーム選択間の自発的交替行動のアンラーニングアセスメントであった。2つ目は空間参照記憶課題であり、ここでは、動物は2つのアームのうちどちらに食餌報酬があったかを学習しなければならなかった。この訓練の開始の前日に、マウスにこの迷路を5分間自由に探索させた。次に、これらのマウスは、餌が左のアームに置かれていたものと、餌が右のアームに置かれていたものの2つのトライアルを受けた。この手順により、これらのアームのうち一方の偏好が生じるのを防いだ。 Y maze replacement behavior : Two tasks were implemented. The first was an unlearning assessment of voluntary alternation between arm selections. The second was a spatial reference memory task, where the animal had to learn which of the two arms had a food reward. The day before the start of the training, the mice were allowed to explore this maze freely for 5 minutes. These mice then underwent two trials, one with food on the left arm and one with food on the right arm. This procedure prevented the biasing of one of these arms.
Y水迷路: 透明なパースペックスY迷路に20℃の水を2cmまで入れた。これはマウスを一方のアームの遠位端の出口チューブまでパドリングした後に迷路を離れるよう誘導した。この迷路を顕著な視覚的刺激に取り囲まれた部屋の中央に置いた。 Y water maze : A transparent perspex Y maze was charged with 20 ° C. water up to 2 cm. This led the mouse to leave the maze after paddling to the exit tube at the distal end of one arm. This maze was placed in the middle of a room surrounded by prominent visual stimuli.
報酬付きT迷路交替行動: 高架または壁のあるT字型の装置(水平に配置)を用いた。マウスをTの基部に置き、このステムの他端に隣接するゴールアームの一方を選択させる。2回のトライアルを迅速に連続して行い、2回目のトライアルは、最初の選択の記憶を反映してマウスにそれまでにいなかったアームを選択するように要求した(自発的交替行動)。この傾向はマウスを空腹にさせ、マウスが交替行動を起こせば好みの餌の報酬を与えることによって強化された。具体的には、このT迷路に対する4日間の順化期間の後に、マウスを、アーム選択を変えて甘いコンデンスミルクを報酬として受けるよう訓練した。 Rewarded T-maze replacement behavior : A T-shaped device with an elevated or wall (placed horizontally) was used. The mouse is placed at the base of T and one of the goal arms adjacent to the other end of the stem is selected. Two trials were performed in quick succession, and the second trial required the mouse to select an arm that had never been before, reflecting the memory of the first choice (spontaneous alternation behavior). This trend was enhanced by making the mice hungry and rewarding the food of their choice if the mice took turns. Specifically, after a 4-day acclimation period to this T maze, mice were trained to change their arm selection and receive sweet condensed milk as a reward.
連続小路: この装置は、4つの連続する直線上に配置された、塗装木材製の不安を増す小路(各連続する小路は薄い色を塗り、低い壁を備え、かつ/または手前の小路よりも狭くなっていた)からなった。各セクションまたは小路は25cmの長さであった。小路1は、高さ25cmの壁を備え、8.5cm幅であり、黒に塗られていた。0.5cm下がって小路2となり、これはまた8.5cm幅であるが、高さ1.3cmの壁を備え、灰色であった。1.0cm下がって小路3となり、これは3.5cm幅であり、高さ0.8cmの壁を備え、白色であった。0.4cm下がって小路4となり、これはまた白色であったが、1.2cm幅であり、高さ0.2cmの壁であった。この装置は、小路1の裏を50cmの高さでスタンドに固定することによって高架とした。マウスが落ちた場合にアーム3と4の下にパディングを設けた。各マウスを小路1の閉鎖末端に壁に向けて置いた。タイマーをスタートし、1)試験の全長(5分)+各アームに入る潜時、および2)小路1で過ごす時間を測定した。マウスが4本の脚を総て次の小路に置いた場合に、その小路に入ったと見なした。各小路で過ごす総時間(4本の脚総て)を記録した。 Consecutive alleys : This device is arranged on four consecutive straight lines, which increase the anxiety made of painted wood (each successive alley is lightly colored, has a low wall and / or is less than the one in front. It was narrow). Each section or alley was 25 cm long. The alley 1 was 25 cm high and 8.5 cm wide and painted black. Down 0.5 cm, there was a path 2 which was also 8.5 cm wide but with a 1.3 cm high wall and was gray. Down 1.0 cm, it became a path 3, which was 3.5 cm wide, with 0.8 cm high walls and was white. It fell 0.4 cm to a path 4, which was also white, but was 1.2 cm wide and 0.2 cm high. This device was elevated by fixing the back of the alley 1 to a stand at a height of 50 cm. Padding was provided under arms 3 and 4 when the mouse fell. Each mouse was placed at the closed end of Path 1 facing the wall. The timer was started and 1) the total length of the test (5 minutes) + the latency to enter each arm, and 2) the time spent on alley 1 was measured. A mouse was considered to have entered the alley if all four legs were placed on the next alley. The total time spent on each alley (all four legs) was recorded.
文脈的恐怖条件付け: 文脈的恐怖条件付け試験では、マウスを新規な環境(暗チャンバー)に置き、および合図と電気フットショック(0.2mA 1秒(試験1)または0.7mA 0.5秒(試験2))の対を与えた。次に、初期トレーニングとして試験した際に、マウスは不動反応(freezing)(Blanchard, 1969)または文脈的恐怖条件付けと呼ばれる自然の防御応答を示した。不動反応時間は、マウスが呼吸をせずに不動挙動で過ごした時間として定義された。このデータは試験期間に対するパーセンテージとして表した。トレーニングセッションの24時間後に、マウスを5分間、ショック提供のないトレーニングチャンバーで試験し、不動反応挙動を観察した。 Contextual fear conditioning : In the contextual fear conditioning test, mice are placed in a new environment (dark chamber) and cue and electric foot shock (0.2 mA 1 second (Test 1) or 0.7 mA 0.5 seconds (Test 2)) pair was given. Next, when tested as an initial training, mice exhibited a natural protective response called freezing (Blanchard, 1969) or contextual fear conditioning. Immobility reaction time was defined as the time the mouse spent in immobile behavior without breathing. This data was expressed as a percentage of the test period. 24 hours after the training session, the mice were tested for 5 minutes in a non-shocked training chamber and observed for immobile reaction behavior.
統計学: 多変量分散分析を用いて、データの群の差異を評価した。行動データについて反復測定ANOVAを行った。各ANOVAにおける統計学的に有意な効果を、ニューマン−コイルス検定(試験1)またはチューキー検定(試験2)を用い、事後比較で追跡した。0.05未満のp値を有意と見なした。 Statistics : Multivariate analysis of variance was used to assess differences in groups of data. Repeated measures ANOVA were performed on behavioral data. Statistically significant effects in each ANOVA were followed by post hoc comparison using the Newman-Coils test (Test 1) or Tukey test (Test 2). A p value of less than 0.05 was considered significant.
生化学試験
リン酸化ERKおよびAkt: Ras−Mek−ERKおよびPI3K−Akt−mToRシグナル伝達経路は、シナプスの可塑性の変化の基礎にある遺伝子転写に依存する活性の媒介に関与する(Klann and Dever, 2004)。リン酸化ERKおよびAktタンパク質の発現は、Lopez Verrilli (Lopez Verrilli et al., 2009)により従前に記載されているようにウエスタンブロット解析によって測定した。用いた抗体は、Akt(1/1000)およびキナーゼ(ERK)1/2(1/2000)に対する抗リン酸特異的抗体であった(Cell Signaling Technology, Danvers, MA, USA)。ホスホ−ERKに対する抗体は、ホスホ−ERK1/2(Thr202/Tyr204)におけるリン酸化を検出し、ホスホ−Aktに対する抗体は、ホスホ−Akt(Thr308)におけるリン酸化を検出する。総AktおよびERK1/2タンパク質含量およびリン酸化ERK およびAktは、抗ホスホ−Akt抗体(1/1000)および抗ホスホ−ERK抗体(1/2000)(Cell Signaling Technology, Danvers, MA, USA)で膜をブロットすることにより評価した。AktまたはERKのリン酸化は、同じサンプル中のタンパク質含量に対して正規化し、基底レベルを100%として、基底状態に対する変化の%として表した。タンパク質付加量は、膜を剥離し、β−アクチン抗体(1/1000)(Sigma-Aldrich, St. Louis, MO, USA)で再ブロットすることによって評価した。血液リンパ球でのリン酸化ERKおよびAktタンパク質の発現は、フローサイトメトリーにより測定した。リンパ球のバイオマーカーの決定のために、FACStar plus(Becton Dickinson)を488nmに合わせた励起レーザーとともに用い、FITCからの緑色蛍光(GST)を、515〜545nmバンドパスフィルターを通して採取した。平均FITC蛍光強度を参照細胞の蛍光に対して計算した。平均細胞蛍光強度(MFI)は、細胞当たりに結合したAb分子の平均数に正比例する。
Biochemical studies Phosphorylated ERK and Akt: The Ras-Mek-ERK and PI3K-Akt-mToR signaling pathways are involved in mediating activity dependent on gene transcription underlying the changes in synaptic plasticity ( Klann and Dever, 2004). The expression of phosphorylated ERK and Akt proteins was measured by Western blot analysis as previously described by Lopez Verrilli (Lopez Verrilli et al., 2009). The antibodies used were anti-phosphate specific antibodies against Akt (1/1000) and kinase (ERK) 1/2 (1/2000) (Cell Signaling Technology, Danvers, MA, USA). The antibody against phospho-ERK detects phosphorylation at phospho-ERK1 / 2 (Thr202 / Tyr204), and the antibody against phospho-Akt detects phosphorylation at phospho-Akt (Thr308). Total Akt and ERK1 / 2 protein content and phosphorylated ERK and Akt were membraned with anti-phospho-Akt antibody (1/1000) and anti-phospho-ERK antibody (1/2000) (Cell Signaling Technology, Danvers, MA, USA). Were evaluated by blotting. Akt or ERK phosphorylation was normalized to protein content in the same sample and expressed as% change relative to ground state, with basal levels as 100%. Protein loading was assessed by exfoliating the membrane and replotting with β-actin antibody (1/1000) (Sigma-Aldrich, St. Louis, MO, USA). Expression of phosphorylated ERK and Akt protein in blood lymphocytes was measured by flow cytometry. For the determination of lymphocyte biomarkers, FACStar plus (Becton Dickinson) was used with an excitation laser tuned to 488 nm, and green fluorescence (GST) from FITC was collected through a 515-545 nm bandpass filter. Mean FITC fluorescence intensity was calculated relative to the fluorescence of the reference cells. Mean cell fluorescence intensity (MFI) is directly proportional to the average number of Ab molecules bound per cell.
ニューロンの形態: 海馬細胞培養物を、妊娠胎生17.5日目(E17.5)の野生型およびFmr1 KO胎児マウスから調製した。マウスを頚椎脱臼により殺し、摘出した海馬細胞を15mmマルチウェルバイアル(Falcon Primaria)に播種した。in vitroで5日後、薬物処置後の樹状突起棘形態形成のモニタリングを助けるために緑色蛍光タンパク質(GFP)をトランスフェクトした(Ethell and Yamaguchi, 1999; Ethell et al., 2001, Henkemeyer et al., 2003)。樹状突起棘はin vitro16日目(DIV)前後に見られた。in vitro17日目に培養物を300μM濃度のメタドキシンで5時間処理した。 Neuronal morphology : Hippocampal cell cultures were prepared from wild-type and Fmrl KO fetal mice on day 17.5 of gestation (E17.5). Mice were killed by cervical dislocation and excised hippocampal cells were seeded into 15 mm multiwell vials (Falcon Primaria). After 5 days in vitro, green fluorescent protein (GFP) was transfected to help monitor dendritic spine morphogenesis after drug treatment (Ethell and Yamaguchi, 1999; Ethell et al., 2001, Henkemeyer et al. , 2003). Dendritic spines were seen around day 16 (DIV) in vitro. On day 17 in vitro, the cultures were treated with metadoxine at a concentration of 300 μM for 5 hours.
GFPトランスフェクトニューロンの糸状仮足密度を、スタックトZeiss共焦点で生成した画像(40×対物レンズ、20×0.2μmのスタック)のSholl分析を行うことによって定量した。Metamorphソフトウエアを用い、同心円の均等間隔の円(総て20μm)を各ニューロンの細胞体の前後に描き、次に、糸状仮足の量を円ごとに計数した。計数値の平均を対応のない両側スチューデントのT検定を用いて比較した。 The filopodia density of GFP-transfected neurons was quantified by performing a Sholl analysis of images (40 × objective, 20 × 0.2 μm stack) generated with stacked Zeiss confocals. Using Metamorph software, concentric equally spaced circles (total 20 μm) were drawn before and after the cell body of each neuron, and then the amount of filopodia was counted for each circle. The mean counts were compared using an unpaired two-tailed Student's T test.
GFPトランスフェクトニューロンの突起棘の成熟度を、Metamorphソフトウエア(Molecular Devices, Sunnyvale, CA)を用いて解析した。突起棘形態測定分析のため、各ニューロンについて70〜100μmの2か所の遠位樹状セグメントを選択した。各突起棘に関して、長さと幅を測定した。長さは突起の基部から先端までの距離と定義され;幅は突起棘の長軸に対して垂直の最大距離として定義された。測定値は対応のない両側スチューデントのT検定を用いて比較し、多重比較のためのANOVA補正を行った。 The maturity of process spines of GFP-transfected neurons was analyzed using Metamorph software (Molecular Devices, Sunnyvale, CA). Two distal dendritic segments of 70-100 μm were selected for each neuron for process of spinous morphometry analysis. The length and width were measured for each process spine. The length was defined as the distance from the base of the process to the tip; the width was defined as the maximum distance perpendicular to the long axis of the process spine. Measurements were compared using unpaired two-sided Student's T test and ANOVA corrections for multiple comparisons were made.
de novo海馬タンパク質合成: 海馬横断面切片(400μm)を6週齢のFmr1ノックアウトおよびWTマウスから得た。タンパク質合成アッセイは、個々の哺乳動物細胞で、またヘテロ細胞集団でグローバルなタンパク質合成のモニタリングおよび定量を可能とする非放射性の蛍光活性化細胞選別に基づくアッセイであるsurface sensing of translation(SUnSET)法(Hoeffer, 2011)を用いて従前に記載されたように行った。この試験で用いたメタドキシンの濃度は300μMであった。 de novo hippocampal protein synthesis : Hippocampal cross-sections (400 μm) were obtained from 6-week-old Fmrl knockout and WT mice. The protein synthesis assay is a surface sensing of translation (SUNSET) method, an assay based on non-radioactive, fluorescence activated cell sorting that allows global protein synthesis monitoring and quantification in individual mammalian cells and in heterogeneous cell populations. (Hoeffer, 2011) and performed as previously described. The concentration of metadoxine used in this test was 300 μM.
実施例2:脆弱X症候群のFmr1ノックアウトマウスモデルにおける学習および記憶欠陥ならびに生化学的異常に対するメタドキシン(100〜200mg/kg)処置の効果(試験1)
行動分析
文脈的恐怖条件付け: 最初の試験では、N=10のWTおよびFmr1ノックアウトマウス群における文脈的恐怖条件付けに対するビヒクルまたは150mg/kgメタドキシン1日1回、7日間の腹腔内投与の効果を調べた。ビヒクル処置Fmr1ノックアウトマウスは、試験セッション中の不動反応の減少に反映される文脈的恐怖条件付けパラダイムにおいて学習の欠損を示した(図1、パネルA(p<0.0001))。メタドキシン投与は、Fmr1ノックアウトマウスにおける学習欠損効果を逆転させ、メタドキシン処置マウスはメタドキシン処置WTマウスとは異なっていたので(p<0.05)、この逆転は部分的なものであった。この試験を繰り返し、N=10のWTおよびFmr1ノックアウトマウス群における文脈的恐怖条件付けに対するビヒクル、100または200mg/kgメタドキシン1日1回、7日間の腹腔内投与の用量依存効果を検討した(図1、パネルBおよびC)。この試験において、ビヒクル処置Fmr1ノックアウトマウスは、ビヒクル処置WTマウスに比べて学習欠損を示し(p<0.0001)、最初の試験の再現となった。100mg/kgメタドキシンは、Fmr1ノックアウトマウスの欠損の逆転をもたしたが(P<0.05)、メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置野生型マウスとは異なっていたことから(p<0.0001)、これは部分的な逆転であった。Fmr1ノックアウトマウスで見られた学習欠損は、200mg/kg i.p.メタドキシンによる処置の後に完全に逆転された(処置されたFmr1マウスはビヒクル処置Fmr1ノックアウトマウスとは異なっていたが(P<0.0001)、メタドキシン処置WTマウスとは異なっていなかった)。メタドキシン処置は、どちらの試験でもWTマウスに対して効果はなかった(図1、パネルA〜C)。
Example 2: Effect of metadoxine (100-200 mg / kg) treatment on learning and memory deficits and biochemical abnormalities in Fmrl knockout mouse model of fragile X syndrome (Study 1)
Behavior analysis
Contextual fear conditioning : In the first study, the effect of intraperitoneal administration of vehicle or 150 mg / kg metadoxine once daily for 7 days on contextual fear conditioning in N = 10 WT and Fmrl knockout mice groups was investigated. Vehicle-treated Fmrl knockout mice showed a learning deficit in a contextual fear conditioning paradigm that is reflected in decreased immobility response during the test session (Figure 1, Panel A (p <0.0001)). Metadoxine administration reversed the learning deficit effect in Fmrl knockout mice, and this reversal was partial because metadoxine treated mice were different from metadoxine treated WT mice (p <0.05). This study was repeated to examine the dose-dependent effects of intraperitoneal administration of vehicle, 100 or 200 mg / kg metadoxine once daily for 7 days on contextual fear conditioning in N = 10 WT and Fmrl knockout mice groups (Figure 1). Panels B and C). In this study, vehicle-treated Fmr1 knockout mice showed learning deficits compared to vehicle-treated WT mice (p <0.0001), which was a reproduction of the first study. 100 mg / kg metadoxine had reversed defects in Fmrl knockout mice (P <0.05), but metadoxine treated Fmrl knockout mice were different from metadoxine treated wild type mice (p <0.0001). ) This was a partial reversal. The learning deficit seen in Fmrl knockout mice was 200 mg / kg i. p. It was completely reversed after treatment with metadoxine (treated Fmr1 mice were different from vehicle-treated Fmr1 knockout mice (P <0.0001) but not metadoxine-treated WT mice). Metadoxine treatment had no effect on WT mice in either test (Figure 1, Panels AC).
社会的接近: ビヒクル処置Fmr1ノックアウトマウスは、匂いの嗅ぎ合いにより示される社会的接近の低さを示した(図2(p<0.0001))。7日間の1日1回、150mg/kgメタドキシンでの腹腔内処置は、Fmr1ノックアウトマウスの社会的接近を増やした(ビヒクル処置Fmr1ノックアウトマウスと比べてp<0.0001)。メタドキシンで処置されたFmr1ノックアウトマウスは、WTマウスの効果に近づく傾向はあったものの、メタドキシン処置WTマウスとは異なっていた(p<0.05)。メタドキシン処置はWTマウスに効果は無かった。 Social access : Vehicle-treated Fmrl knockout mice showed low social access as indicated by scent sniffing (Figure 2 (p <0.0001)). Intraperitoneal treatment with 150 mg / kg metadoxine once daily for 7 days increased the social access of Fmr1 knockout mice (p <0.0001 compared to vehicle-treated Fmr1 knockout mice). Fmr1 knockout mice treated with metadoxine were different from metadoxine-treated WT mice, although they tended to approach the effects of WT mice (p <0.05). Metadoxine treatment had no effect on WT mice.
Y迷路自発的交替行動: N=10のWTまたはFmr1ノックアウトマウス群における自発的交替行動に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンによる処置の効果を図3パネルAに示す。ビヒクル処置Fmr1ノックアウトマウスは、ビヒクル処置Wマウスよりも低い自発的交替行動を示した(p<0.0001)。メタドキシン処置は、Fmr1ノックアウトマウスにおけるビヒクル処置に比べて自発的交替行動を増やしたが(p<0.0001)、メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスに比べて欠損を示した(p<0.01)。従って、メタドキシンは、Fmr1ノックアウトマウスに見られる欠損の部分的逆転をもたらした。 Y-maze spontaneous alternation behavior : The effect of treatment with vehicle or 150 mg / kg metadoxine once a day for seven days on spontaneous alternation behavior in N = 10 WT or Fmrl knockout mice groups is shown in FIG. Vehicle treated Fmrl knockout mice showed lower spontaneous alternation behavior than vehicle treated W mice (p <0.0001). Metadoxine treatment increased spontaneous alternation behavior compared to vehicle treatment in Fmrl knockout mice (p <0.0001), whereas metadoxine treated Fmrl knockout mice showed a deficiency compared to metadoxine treated WT mice (p <0). .01). Thus, metadoxine resulted in partial reversal of the defect found in Fmrl knockout mice.
Y迷路参照記憶課題: N=10のWTまたはFmr1ノックアウトマウス群における報酬付き参照記憶学習に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンによる処置の効果を図3パネルBに示す。ビヒクル処置Fmr1ノックアウトマウスは、ビヒクル処置WTマウスよりも低い適当なアーム選択を行った(p<0.0001)。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスとは異なっていなかったので、メタドキシン処置は、ビヒクル処置Fmr1ノックアウトマウスに比べてこの欠損を軽減していた(p<0.0001)。メタドキシン処置はWTマウスに効果は無かった。 Y-maze reference memory task : FIG. 3 panel B shows the effect of treatment with vehicle or 150 mg / kg metadoxine once daily for 7 days on rewarded reference memory learning in N = 10 WT or Fmrl knockout mice. Vehicle treated Fmr1 knockout mice had a lower appropriate arm selection than vehicle treated WT mice (p <0.0001). Metadoxine-treated Fmr1 knockout mice were not different from metadoxine-treated WT mice, so metadoxine treatment reduced this deficiency compared to vehicle-treated Fmr1 knockout mice (p <0.0001). Metadoxine treatment had no effect on WT mice.
Y水迷路左右弁別: N=10のWTまたはFmr1ノックアウトマウス群における嫌悪的動機付け空間弁別学習に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンによる処置の効果を図3パネルCに示す。ビヒクル処置Fmr1ノックアウトマウスは、ビヒクル処置WTマウスよりも不適切なアーム選択の回数が多いことを示した。この欠損はメタドキシン処置により軽減された。 Y Water Maze Left-Right Discrimination : The effect of treatment with vehicle or 150 mg / kg metadoxine once daily for 7 days on aversive motivational spatial discrimination learning in N = 10 WT or Fmrl knockout mice groups is shown in FIG. . Vehicle treated Fmrl knockout mice showed a higher number of inappropriate arm selections than vehicle treated WT mice. This deficiency was alleviated by metadoxine treatment.
T迷路報酬付き交替行動課題: N=10のWTまたはFmr1ノックアウトマウス群における報酬交替行動作業記憶に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンによる処置の効果を図4に示す。ビヒクル処置Fmr1ノックアウトマウスは、ビヒクル処置WTマウスに比べて正しいアームに到達する潜時が長いことを示した(p<0.0001)。メタドキシン処置は、Fmr1ノックアウトマウスにおけるビヒクル処置に比べてこの欠損を軽減し(p<0.0001)、メタドキシン処置Fmr1ノックアウトマウスはWTマウスよりも応答が遅かったことから(p<0.0001)この逆転は部分的なものであった。 T-maze rewarded alternation behavior task : FIG. 4 shows the effect of treatment with vehicle or 150 mg / kg metadoxine once a day for 7 days on reward alternation behavior working memory in a group of N = 10 WT or Fmr1 knockout mice. Vehicle treated Fmrl knockout mice showed a longer latency to reach the correct arm compared to vehicle treated WT mice (p <0.0001). Metadoxine treatment alleviates this deficiency compared to vehicle treatment in Fmrl knockout mice (p <0.0001), since metadoxine treated Fmrl knockout mice responded slower than WT mice (p <0.0001). The reversal was partial.
連続小路: N=10のWTまたはFmr1ノックアウトマウス群における連続小路課題での行動に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンによる処置の効果を図5に示し、以下にさらに記載する。 Continuous alley : The effect of treatment with vehicle or 150 mg / kg metadoxine once a day for 7 days on behavior in a continuous alley task in a group of N = 10 WT or Fmrl knockout mice is shown in FIG. 5 and further described below. .
連続小路試験は、不安(小路1進入潜時)および活動過多(小路2〜4)を効果的に測定した。小路1から連続小路2、3、および4への進行は、ますます低くなる壁と狭くなり、より露出度の高くなる開放的アームを有するますます明るい色になる環境に曝されることを伴う。開放的アームで費やす時間および開放的アームへの進入は不安の指標となり;逆に、より開放的なアームで費やす時間が増えることは、活動過多を表した。これらの因子は、活動過多を伴う一定範囲の不安様行動を一括して取り扱う高感度試験を可能とした。 The continuous path test effectively measured anxiety (latency 1 approach latency) and overactivity (paths 2-4). Progression from alley 1 to continuous alleys 2, 3, and 4 involves exposure to an increasingly brighter environment with increasingly lower walls and narrower, more open open arms. . Time spent in the open arm and entry into the open arm is an indicator of anxiety; conversely, increased time spent in the more open arm represented overactivity. These factors enabled high-sensitivity tests that collectively handle a range of anxiety-like behaviors with excessive activity.
小路1: Fmr1ノックアウトマウスはWTマウスよりも大きい不安を示した(p<0.001)。完全な正常化が見られたので、メタドキシンで処置したFmr1ノックアウトマウスは、ビヒクル処置Fmr1ノックアウトマウスに比べて不安の改善を示した(p<0.001)。メタドキシン処置Fmr1ノックアウトとメタドキシン処置WTマウスの間に差異は無かった。また、メタドキシン処置はWTマウスに効果は無かった。 Path 1 : Fmr1 knockout mice showed greater anxiety than WT mice (p <0.001). Since complete normalization was seen, Fdrl1 knockout mice treated with metadoxine showed improved anxiety compared to vehicle treated Fmr1 knockout mice (p <0.001). There was no difference between metadoxine-treated Fmrl knockout and metadoxine-treated WT mice. Metadoxine treatment had no effect on WT mice.
小路2: WTマウスは、Fmr1ノックアウトマウスと比べた場合、小路2で低い活性を示した(p<0.0001)。メタドキシン処置はFmr1ノックアウトマウスの活動過多を軽減したが(p<0.001)、メタドキシン処置Fmr1ノックアウトとWTマウスは異なっていたことから(p<0.001)、この活動過多の逆転は部分的なものであった。メタドキシン処置はWTマウスに対して効果はなかった。 Path 2 : WT mice showed lower activity in path 2 when compared to Fmr1 knockout mice (p <0.0001). Metadoxine treatment reduced hyperactivity in Fmr1 knockout mice (p <0.001), but metadoxine-treated Fmr1 knockout and WT mice were different (p <0.001), and this reversal of hyperactivity was partially It was something. Metadoxine treatment had no effect on WT mice.
小路3: Fmr1ノックアウトマウスは、WTマウスに比べて活動過多を示した(p<0.0001)。メタドキシン処置Fmr1ノックアウトマウスはビヒクル処置Fmr1ノックアウトマウスとは異なっていなかったことから、この活動過多はメタドキシンにより逆転されたものではなかった。メタドキシン処置はWTマウスに対して効果はなかった。 Path 3 : Fmr1 knockout mice showed overactivity compared to WT mice (p <0.0001). This hyperactivity was not reversed by metadoxine since metadoxine-treated Fmr1 knockout mice were not different from vehicle-treated Fmr1 knockout mice. Metadoxine treatment had no effect on WT mice.
小路4: Fmr1ノックアウトマウスは、WTマウスに比べて活動過多を示した(p<0.01)。メタドキシン処置Fmr1ノックアウトマウスはビヒクル処置Fmr1ノックアウトマウスよりも低い活動を示したことから(p<0.01)、メタドキシン処置はこの活動過多を逆転していた。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったことから、この効果は正常化を表した。メタドキシン処置はWTマウスに対して効果はなかった。 Path 4 : Fmr1 knockout mice showed overactivity compared to WT mice (p <0.01). Metadoxine treatment reversed this overactivity, as metadoxine-treated Fmr1 knockout mice showed lower activity than vehicle-treated Fmr1 knockout mice (p <0.01). This effect represented a normalization because metadoxine-treated Fmrl knockout mice were not different from metadoxine-treated WT mice. Metadoxine treatment had no effect on WT mice.
全体的に見れば、特定の理論に縛られることを望むものではないが、連続小路試験は、Fmr1ノックアウトマウスはWTマウスに比べて不安および活動過多の増大を呈するということを示したと考えられる。メタドキシン処置は、Fmr1ノックアウトマウスにおけるこの不安および活動過多を軽減したが、WTマウスは影響を受けないままであった。 Overall, while not wishing to be bound by any particular theory, it is believed that continuous alley testing has shown that Fmrl knockout mice exhibit increased anxiety and hyperactivity compared to WT mice. Metadoxine treatment alleviated this anxiety and hyperactivity in Fmrl knockout mice, while WT mice remained unaffected.
生化学的分析
ERKおよびAktのリン酸化: N=5のFmr1ノックアウトまたはWTマウスにおける、脳のERKまたはAktの全脳リン酸化に対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンいずれかの腹腔内処置の効果を図6に示す。リン酸化レベルは全ERKに対するリン酸化物の比として評価した。この比の増大はERKの活性化を示した。ERKのリン酸化は、ビヒクル対照に比べてビヒクル処置Fmr1ノックアウトマウスで増大したが(p<0.001)、この効果は脆弱X症候群を有するヒト対象で見られるERKの異常な活性化を再現した(Wang et al., 2012)。メタドキシン処置WTマウスと比べた場合に差異は見られなかったので、この効果はメタドキシン処置により低減された(p<0.01)。メタドキシンは、WTマウスのERKのリン酸化またはいずれのマウスにおいても総ERKレベルに対して効果は無かった。総AKTに対するリン酸化Aktの比はまた、ビヒクル処置WTマウスに比べてビヒクル処置Fmr1ノックアウトマウスで増大した(p<0.0001)。Fmr1ノックアウトマウスは対照と差異が無かったので、メタドキシン処置は、Fmr1ノックアウトマウスにおけるリン酸化Aktの相対レベルを低減した(p<0.01)。メタドキシン処置はWTマウスに対して、またはいずれのマウスにおいても総Aktレベルに対して効果は無かった。
Biochemical analysis
ERK and Akt phosphorylation : Intraperitoneal treatment of either vehicle or 150 mg / kg metadoxine once daily for 7 days against total brain phosphorylation of brain ERK or Akt in N = 5 Fmrl knockout or WT mice. The effect is shown in FIG. The phosphorylation level was evaluated as the ratio of phosphorylation to total ERK. An increase in this ratio indicated ERK activation. ERK phosphorylation was increased in vehicle-treated Fmrl knockout mice compared to vehicle control (p <0.001), but this effect reproduced the abnormal activation of ERK seen in human subjects with fragile X syndrome (Wang et al., 2012). This effect was reduced by metadoxine treatment (p <0.01) since no difference was seen when compared to metadoxine treated WT mice. Metadoxine had no effect on ERK phosphorylation in WT mice or total ERK levels in any mouse. The ratio of phosphorylated Akt to total AKT was also increased in vehicle treated Fmrl knockout mice compared to vehicle treated WT mice (p <0.0001). Metadoxine treatment reduced the relative levels of phosphorylated Akt in Fmr1 knockout mice, as Fmr1 knockout mice were not different from controls (p <0.01). Metadoxine treatment had no effect on WT mice or on total Akt levels in any mouse.
実施例3:Fmr1ノックアウト脆弱Xマウスモデルにおけるメタドキシンの評価(試験2)
6か月齢Fmr1ノックアウトマウスにおけるメタドキシンの行動効果
文脈的恐怖条件付け: 最初の試験では、N=10の6か月齢WTおよびFmr1ノックアウトマウス群における文脈的恐怖条件付けに対するビヒクルまたは150mg/kgメタドキシン1日1回、7日間の腹腔内投与の効果を調べた。ビヒクル処置Fmr1ノックアウトマウス(KO−V)は、試験セッション中の不動反応の減少に反映される、ビヒクル処置WTマウス(WT−V)と比べた場合の文脈的恐怖条件付けパラダイムにおける学習欠損を示した(図7(p<0.0001))。メタドキシン投与は、Fmr1ノックアウトマウスにおける学習欠損効果を逆転させた(p<0.0001 KO−M−150対KO−V)。メタドキシン処置KOマウスはメタドキシン処置WTマウスと異ならなかったので、これは完全な逆転であった。
Example 3: Evaluation of metadoxine in the Fmr1 knockout fragile X mouse model (Test 2)
Behavioral effects of metadoxine in 6-month-old Fmr1 knockout mice
Contextual fear conditioning : The first study investigated the effect of intraperitoneal administration of vehicle or 150 mg / kg metadoxine once daily for 7 days on contextual fear conditioning in a group of 6 months old WT and Fmrl knockout mice with N = 10 It was. Vehicle-treated Fmrl knockout mice (KO-V) showed a learning deficit in the contextual fear conditioning paradigm compared to vehicle-treated WT mice (WT-V), reflected in decreased immobility response during the test session (FIG. 7 (p <0.0001)). Metadoxine administration reversed the learning deficit effect in Fmrl knockout mice (p <0.0001 KO-M-150 vs. KO-V). This was a complete reversal because metadoxine-treated KO mice were not different from metadoxine-treated WT mice.
社会的接近および社会的記憶: 社会的接近データ(最初のトライアル1)を図8パネルA(匂いの嗅ぎ合いの回数)およびパネルC(匂い嗅ぎの持続時間)に示す。匂いの嗅ぎ合い社会的記憶データ(トライアル2、トライアル1の24時間後)を図8パネルB(匂いの嗅ぎ合いの回数)およびパネルD(匂い嗅ぎの持続時間)に示す。これらの結果を以下にさらに考察する。 Social access and social memory : Social access data (first trial 1) is shown in FIG. 8 panel A (number of sniffing) and panel C (smelling duration). Odor sniffing social memory data (24 hours after trial 2, trial 1) are shown in FIG. 8 panel B (number of sniffing) and panel D (duration of smell sniffing). These results are further discussed below.
トライアル1では、Fmr1ノックアウトマウスは、WTマウスに比べ、匂いの嗅ぎ合いの回数は多く(p<0.0001)(図8パネルA参照)、匂い嗅ぎの持続時間は少なかった(p<0.0001)(図8パネルC)。これらの社会的相互作用欠損は、他の研究者らによりFmr1ノックアウトマウスで報告されているものに一致する(Thomas et al., 2011)。対面の回数および匂い嗅ぎの持続時間の両方に関して、メタドキシン処置Fmr1ノックアウトマウスは匂いの嗅ぎ合いの回数の測定値に関してメタドキシン処置WTマウスと異ならなかったので、メタドキシン処置は、Fmr1ノックアウトマウスにおける異常の逆転をもたらした(p<0.0001 それぞれKO−M−150対KO−V)。匂い嗅ぎの持続時間の測定値に関して救済が示されたものの、Fmr1ノックアウトマウスはメタドキシン処置のWTマウスに比べて差異があるままであったので(p<0.05)、この効果は部分的なものであった。メタドキシンは、WTマウスに対して効果は無かった。これらのデータは、Fmr1ノックアウトマウスにおける異常な社会的接近行動がメタドキシンにより救済されたことを示した。 In trial 1, Fmr1 knockout mice had more olfactory sniffing (p <0.0001) than WT mice (see FIG. 8 panel A), and odor sniffing lasted less (p <0. 0001) (FIG. 8 panel C). These social interaction deficiencies are consistent with those reported by other investigators in Fmrl knockout mice (Thomas et al., 2011). Metadoxine treatment did not differ from metadoxine-treated WT mice in terms of the number of scent sniffing, both in terms of number of face-to-face and odor sniffing, so metadoxine treatment reversed the abnormalities in Fmrl knockout mice. (P <0.0001 KO-M-150 vs. KO-V, respectively). Although relief was shown in terms of scent duration measurements, Fmrl knockout mice remained different compared to metadoxine-treated WT mice (p <0.05), so this effect was partially It was a thing. Metadoxine had no effect on WT mice. These data indicated that abnormal social access behavior in Fmrl knockout mice was rescued by metadoxine.
トライアル2では、Fmr1ノックアウトマウスは、野生型マウスに比べて匂いの嗅ぎ合いの回数の増加と匂い嗅ぎの持続時間の増加の両方を示した(各測定に関してp<0.0001、それぞれ図8パネルBおよびD)。これは順化の失敗、従って、社会的記憶の欠損を反映した。メタドキシン処置は、これらの差異を軽減した(p<0.0001 KO−M−150対KO−V)。メタドキシン処置Fmr1ノックアウトマウスとメタドキシン処置WTマウスの間の差異が維持されたことから(p<0.05)、この匂いの嗅ぎ合いの回数の逆転は部分的なものであった。メタドキシン処置Fmr1ノックアウトとメタドキシン処置WTマウスの間に差異は見られかったことから、このメタドキシンによる逆転は、匂い嗅ぎの持続時間に関しては完全なものであった。メタドキシン処置は、WTマウスに対して効果は無かった。これらのデータは、メタドキシンがFmr1ノックアウトマウスにおける社会的記憶障害を軽減したことを示した。この社会的記憶欠損の軽減を、社会的記憶比(実施例1に記載)の計算により以下に示す。 In trial 2, Fmr1 knockout mice showed both increased scent sniffing and increased scent sniffing time compared to wild type mice (p <0.0001 for each measurement, FIG. 8 panel, respectively). B and D). This reflected a failure to acclimatize, and thus a lack of social memory. Metadoxine treatment alleviated these differences (p <0.0001 KO-M-150 vs. KO-V). This reversal in the number of scent sniffing was partial, as the difference between metadoxine treated Fmrl knockout mice and metadoxine treated WT mice was maintained (p <0.05). This reversal by metadoxine was complete with respect to scent duration, as no difference was seen between metadoxine-treated Fmrl knockout and metadoxine-treated WT mice. Metadoxine treatment had no effect on WT mice. These data indicated that metadoxine reduced social memory impairment in Fmrl knockout mice. This reduction in social memory deficit is shown below by calculation of the social memory ratio (described in Example 1).
社会的記憶比は、匂いの嗅ぎ合いの持続時間:トライアル2/トライアル1+2として定義された。従って、記憶無しの例は、例えば、20/(20+20)=0.5であり、記憶有りの例は、例えば、10/(20+10)=<0.5である。 The social memory ratio was defined as the duration of smell sniffing: trial 2 / trial 1 + 2. Accordingly, an example without storage is, for example, 20 / (20 + 20) = 0.5, and an example with storage is, for example, 10 / (20 + 10) = <0.5.
計算された社会的記憶比は次の通りであった。
WT−V トライアル2/トライアル1+トライアル2:12.4/12.4+26.8=0.3、<0.5 記憶有り
KO−V トライアル2/トライアル1+トライアル2:325/325+24.1=0.9、記憶無し
WT−M トライアル2/トライアル1+トライアル2:12.5/38.5+12.5=0.2、<0.5 記憶有り
KO−M トライアル2/トライアル1+トライアル2:12.7/28.4+12.7=0.3、<0.5 記憶有り
The calculated social memory ratio was as follows.
WT-V Trial 2 / Trial 1 + Trial 2: 12.4 / 12.4 + 26.8 = 0.3, <0.5 Memory KO-V Trial 2 / Trial 1 + Trial 2: 325/325 + 24.1 = 0. 9. WT-M Trial 2 / Trial 1 + Trial 2: 12.5 / 38.5 + 12.5 = 0.2, <0.5 Memory KO-M Trial 2 / Trial 1 + Trial 2: 12.7 / 28.4 + 12.7 = 0.3, <0.5 with memory
6か月齢Fmr1ノックアウトマウスにおけるメタドキシンの生化学的効果
N=10のFmr1ノックアウトまたはWTマウスにおける全脳pERKに対する7日間の1日1回、ビヒクルまたは150mg/kgメタドキシンいずれかのip処置の効果(図9パネルA)および上記挙動試験後の脳のpAkt(図9、パネルB)を図9に示す。具体的には、図9パネルAは、従前の試験で見られたようにWTマウスに比べてFmr1ノックアウトマウスで増加したpAktの脳レベルを示す(P<0.0001)。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったので、メタドキシン処置は、脳のpAktにおけるこの増加を逆転していた(p<0.0001 KO−M−150対KO−V)。図9パネルBは、従前の試験で見られたようにWTマウスに比べてFmr1ノックアウトマウスで増加したpERKの脳レベルを示す(p<0.0001 KO−M−150対KO−V)。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったので、この増加はメタドキシン処置により逆転されていた(p<0.0001)。
Biochemical effects of metadoxine in 6 month old Fmr1 knockout mice Effect of ip treatment with either vehicle or 150 mg / kg metadoxine once daily for 7 days on N = 10 Fmr1 knockout or whole brain pERK in WT mice (Figure 9 panel A) and pAkt of the brain after the behavior test (FIG. 9, panel B) are shown in FIG. Specifically, FIG. 9 panel A shows increased brain levels of pAkt in Fmrl knockout mice as compared to WT mice as seen in previous studies (P <0.0001). Metadoxine treatment reversed this increase in brain pAkt (p <0.0001 KO-M-150 vs. KO-V) since metadoxine-treated Fmrl knockout mice were not different from metadoxine-treated WT mice. FIG. 9 panel B shows increased brain levels of pERK in Fmrl knockout mice compared to WT mice as seen in previous studies (p <0.0001 KO-M-150 vs. KO-V). This increase was reversed by metadoxine treatment because metadoxine-treated Fmrl knockout mice were not different from metadoxine-treated WT mice (p <0.0001).
2か月齢マウスの行動に対する腹腔内または経口投与後のメタドキシンの効果
図10は、2か月齢のFmr1ノックアウトおよびWTマウスにおける文脈的恐怖条件付けに対する7日間の1日1回、150mg/kg ip用量または150および300mg/kg経口用量でのメタドキシン投与の効果を示す。具体的には、図10パネルAは、ビヒクルのipおよび経口処置後のFmr1ノックアウトおよびWTマウスから得られた文脈的恐怖条件付けデータを示す。ビヒクルの投与経路に関する差異は無かった。Fmr1ノックアウトマウスは、ipおよび経口経路を介したビヒクル処置後、WTマウスに比べて不動反応行動の減少を示した(各場合でp<0.0001)。図10パネルBは、WTマウスにおける両投与経路によるメタドキシン処置の効果を示す。効果は見られなかった。図10パネルCは、Fmr1ノックアウトマウスにおけるip 150mg/kgおよび経口150および300mg/kgメタドキシン処置がFmr1ノックアウトマウスに見られる不動反応行動の減少を逆転したことを示す(p<0.01、p<0.0001、およびp<0.0001、それぞれKO−M−ip、KO−M−po150、およびKO−M−po 300対KO−V−ipおよびKO−V po)。150mg poメタドキシンによる投与効果は、300mg/kg poメタドキシンの投与効果と異ならなかった。Fmr1ノックアウトマウスにおける150および300mg/kg経口メタドキシンの効果は、150mg/kg ipメタドキシンの効果と異ならなかった。各場合において、メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったので、この逆転は完全なものであった。
Effect of metadoxine after intraperitoneal or oral administration on the behavior of 2-month-old mice FIG. 10 shows a 150 mg / kg ip dose once daily for 7 days for 2-month-old Fmrl knockout and contextual fear conditioning in WT mice. The effects of metadoxine administration at 150 and 300 mg / kg oral doses are shown. Specifically, FIG. 10 panel A shows contextual fear conditioning data obtained from Fmr1 knockout and WT mice after vehicle ip and oral treatment. There was no difference regarding the route of vehicle administration. Fmrl knockout mice showed a reduction in immobile response behavior compared to WT mice after vehicle treatment via ip and oral routes (p <0.0001 in each case). FIG. 10 panel B shows the effect of metadoxine treatment by both routes of administration in WT mice. No effect was seen. FIG. 10 panel C shows that
図11は、Fmr1ノックアウトおよびWTマウスにおける社会的接近および社会的記憶に対する7日間の1日1回、150mg/kg ipまたは150および300mg/kg経口用量でのメタドキシンの投与の効果を示す。具体的には、図11パネルAは、Fmr1ノックアウトまたはWTマウスにおける社会的接近行動に対するビヒクルまたは150mg/kg ipまたは150および300mg/kg経口でのメタドキシンの効果を示す。ビヒクルによるipまたは経口処置後、Fmr1ノックアウトマウスの匂い嗅ぎ行動の持続時間は、WTマウスに比べて減少した(各場合でp<0.0001)。メタドキシン処置はいずれの用量でもWTマウスに効果は無かった。しかしながら、150mg/kg ip、150mg/kg、および300mg/kg経口でのメタドキシン処置は、Fmr1ノックアウトマウスに見られる社会的接近の欠損の逆転をもたらした(p<0.0001 それぞれKO−M−po150およびKO−M−po300対KO−V po)。経口メタドキシンのこの効果は、150〜300mg/kgの間では用量依存的でなかった。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったので、この逆転は完全なものであった。Fmr1ノックアウトマウスにおける150mg/kg ipメタドキシンの効果は、150mg/kg経口または300mg/kg経口メタドキシンの効果と異ならなかった。図11パネルBは、Fmr1ノックアウトまたはWTマウスにおける社会的記憶に対する150mg/kg ipまたは150および300mg/kg経口でのビヒクルまたはメタドキシンの効果を示す。ビヒクルによるipまたは経口処置後、Fmr1ノックアウトマウスの匂い嗅ぎ行動の持続時間は、WTマウスに比べて増加した(各場合でp<0.0001)。メタドキシン処置はいずれの用量でもWTマウスに効果は無かった。しかしながら、150mg/kg ip、150mg/kg経口、および300mg/kg経口でのメタドキシン処置は、Fmr1ノックアウトマウスに見られる社会的接近の欠損の逆転をもたらした(p<0.0001、p<0.05、およびp<0.01 それぞれKO−M−ip150、KO−M−po150、およびKO−M−po 300対KO−V−ipおよびKO−V po)。メタドキシン処置Fmr1ノックアウトマウスはメタドキシン処置WTマウスと異ならなかったので、この逆転は完全なものであった。Fmr1ノックアウトマウスにおける150mg/kg ipメタドキシンの効果は、150mg/kg経口または300mg/kg経口メタドキシンの効果と異ならなかった。また、150mg/kg〜300mg/kgの間ではこれらの経口メタドキシン処置の効果に用量依存性は無かった。
FIG. 11 shows the effect of administration of metadoxine at 150 mg / kg ip or 150 and 300 mg / kg oral doses once daily for 7 days on social access and social memory in Fmrl knockout and WT mice. Specifically, FIG. 11 panel A shows the effect of vehicle or 150 mg / kg ip or 150 and 300 mg / kg oral metadoxine on social access behavior in Fmrl knockout or WT mice. After ip or oral treatment with vehicle, the duration of scent behavior in Fmrl knockout mice was reduced compared to WT mice (p <0.0001 in each case). Metadoxine treatment had no effect on WT mice at any dose. However, 150 mg / kg ip, 150 mg / kg, and 300 mg / kg oral metadoxine treatment resulted in reversal of the deficits in social access seen in Fmrl knockout mice (p <0.0001 KO-M-po150 respectively). And KO-M-po300 vs. KO-V po). This effect of oral metadoxine was not dose dependent between 150-300 mg / kg. This reversal was complete because metadoxine treated Fmrl knockout mice were not different from metadoxine treated WT mice. The effect of 150 mg / kg ip metadoxine in Fmrl knockout mice was not different from the effect of 150 mg / kg oral or 300 mg / kg oral metadoxine. FIG. 11 panel B shows the effect of 150 mg / kg ip or 150 and 300 mg / kg oral vehicle or metadoxine on social memory in Fmrl knockout or WT mice. After ip or vehicle treatment, the duration of scent behavior in Fmrl knockout mice was increased compared to WT mice (p <0.0001 in each case). Metadoxine treatment had no effect on WT mice at any dose. However, 150 mg / kg ip, 150 mg / kg oral, and 300 mg / kg oral metadoxine treatment resulted in reversal of the deficits in social access seen in Fmrl knockout mice (p <0.0001, p <0. 05, and p <0.01 KO-M-ip150, KO-M-po150, and KO-M-
2か月齢マウスにおける腹腔内または経口投与後の生化学マーカーに対するメタドキシンの効果
末梢リンパ球: 図12は、2か月齢のFmr1ノックアウトおよびWTマウスにおけるフローサイトメトリーにより決定された、リンパ球pAkt(図12パネルA)およびpERK(図12パネルB)に対する7日間の1日1回、150mg/kg ipまたは150mg/kgおよび300mg/kg経口用量でのメタドキシンの投与の効果を示す。具体的には、図12パネルAは、ビヒクル処置Fmr1ノックアウトマウスが、同等のビヒクル処置を受けたWTマウスに比べてリンパ球Aktのリン酸化の増大を呈したことを示す(ip投与および経口投与の両方に関してp<0.0001)。Aktレベルは、同じ処置を受けたメタドキシン処置Fmr1ノックアウトマウスおよびWTマウスの間で異ならなかったので、7日間の1日1回、150mg/kg ipまたは150mg/kgまたは300mg/kg経口用量でのメタドキシン処置は、過剰に活性化されたAktを正常化した。図12パネルBは、ビヒクル処置Fmr1ノックアウトマウスが同等のビヒクル処置を受けたWTマウスに比べてリンパ球ERKのリン酸化の増大を示したことを示す(ip投与および経口投与の両方に関してp<0.0001)。pERKレベルは、同じ処置を受けたメタドキシン処置Fmr1ノックアウトマウスとWTマウスの間で異ならなかったので、7日間の1日1回、150mg/kg ipまたは150mg/kgまたは300mg/kg経口用量でのメタドキシン処置は、過剰に活性化されたERKを正常化した。
Effect of metadoxine on biochemical markers after intraperitoneal or oral administration in 2-month-old mice
Peripheral lymphocytes : FIG. 12 shows one day of 7 days against lymphocytes pAkt (FIG. 12 panel A) and pERK (FIG. 12 panel B) as determined by flow cytometry in 2 month old Fmrl knockouts and WT mice. The effects of administration of metadoxine at a single dose of 150 mg / kg ip or 150 mg / kg and 300 mg / kg are shown. Specifically, FIG. 12 panel A shows that vehicle-treated Fmrl knockout mice exhibited increased phosphorylation of lymphocyte Akt compared to WT mice that received comparable vehicle treatment (ip and oral administration). P <0.0001) for both. Akt levels were not different between metadoxine-treated Fmrl knock-out mice and WT mice that received the same treatment, so metadoxine at 150 mg / kg ip or 150 mg / kg or 300 mg / kg oral dose once daily for 7 days Treatment normalized the overactivated Akt. FIG. 12 panel B shows that vehicle-treated Fmrl knockout mice showed increased phosphorylation of lymphocyte ERK compared to WT mice that received comparable vehicle treatment (p <0 for both ip and oral administration). .0001). pERK levels were not different between metadoxine-treated Fmrl knockout mice and WT mice that received the same treatment, so metadoxine at 150 mg / kg ip or 150 mg / kg or 300 mg / kg oral dose once daily for 7 days Treatment normalized over-activated ERK.
脳領域: 図13は、海馬、前頭前皮質、および線条体のpERKレベルに対する7日間の150mg/kgメタドキシン投与の効果を示す。pERKレベルは、3つの脳領域の総てでWTマウスに比べてFmr1ノックアウトマウスで増加していた(総ての場合でp<0.0001)。pERKレベルは、ビヒクル処置Fmr1ノックアウトマウスに比べてメタドキシン処置Fmr1ノックアウトマウスにおいて低下した(総ての場合でp<0.0001)。KO−M群とWT−M群の間で海馬および線条体に差異は無く、ERKの活性化の完全な逆転を示す。前頭前皮質における効果は部分的なものであり、KO−V群とKO−M群には差異があるままであった(p<0.05)。メタドキシンはWTマウスに対して効果は無かった。 Brain Region : FIG. 13 shows the effect of 150 mg / kg metadoxine administration for 7 days on hippocampal, prefrontal cortex, and striatal pERK levels. pERK levels were increased in Fmr1 knockout mice compared to WT mice in all three brain regions (p <0.0001 in all cases). pERK levels were decreased in metadoxine-treated Fmr1 knockout mice compared to vehicle-treated Fmr1 knockout mice (p <0.0001 in all cases). There is no difference in hippocampus and striatum between the KO-M and WT-M groups, indicating a complete reversal of ERK activation. The effect on the prefrontal cortex was partial and the KO-V and KO-M groups remained different (p <0.05). Metadoxine had no effect on WT mice.
図14は、海馬、前頭前皮質および線条体のpAktレベルに対する7日間の150mg/kgメタドキシン投与の効果を示す。pAktレベルは、3つの脳領域の総てでWTマウスに比べてFmr1ノックアウトマウスで増加していた(総ての場合でp<0.0001)。pAktレベルは、3つの脳領域の総てでビヒクル処置Fmr1ノックアウトマウスに比べてメタドキシン処置Fmr1ノックアウトマウスにおいて低下した(総ての場合でp<0.0001)。総ての場合で、KO−M群とWT−M群の間で差異は無く、Aktの活性化の完全な逆転を示す。メタドキシンはWTマウスに対して効果は無かった。脳および血液で上昇したリン酸化ERKおよびAktレベルの減少はFmr1ノックアウトマウスの行動結果の改善と相関しており、このことは、リン酸化レベルがメタドキシン処置応答のバイオマーカーであることを示唆する。 FIG. 14 shows the effect of 7 days of 150 mg / kg metadoxine administration on pAkt levels in the hippocampus, prefrontal cortex and striatum. pAkt levels were increased in Fmr1 knockout mice compared to WT mice in all three brain regions (p <0.0001 in all cases). pAkt levels were reduced in metadoxine-treated Fmr1 knockout mice compared to vehicle-treated Fmr1 knockout mice in all three brain regions (p <0.0001 in all cases). In all cases, there is no difference between the KO-M and WT-M groups, indicating a complete reversal of Akt activation. Metadoxine had no effect on WT mice. Decreased levels of phosphorylated ERK and Akt in the brain and blood correlate with improved behavioral outcomes in Fmrl knockout mice, suggesting that phosphorylation levels are biomarkers of metadoxine treatment response.
in vitroにおけるFmr1ノックアウトマウス由来の樹状突起糸状仮足密度および初代海馬ニューロンの成熟に対するメタドキシンの効果
図15(パネルA〜C)は、300μMメタドキシンによる5時間の処置の効果を示す。樹状突起は、それぞれ神経細胞体からの距離に基づいて10μmの10セグメントに分けた(左から右へ近位から遠位)。突起棘密度は、セグメント3では、WTマウス由来ニューロンに比べてFmr1ノックアウトマウス由来ニューロンで増加していた。具体的には、図15パネルAは、ニューロンの糸状仮足密度を示す。Fmr1ノックアウトマウス由来の初代海馬ニューロンは、糸状仮足密度の増加を示した(p<0.001)。300μMメタドキシンによる処置は、Fmr1ノックアウトマウスにおけるニューロンの糸状仮足密度の異常な増加を軽減した(p<0.001)。Fmr1ノックアウトマウス由来ニューロンは、未熟な特徴を有し、より長く(図15パネルB(p<0.01))、かつ、幅の狭い(図15パネルC(p<0.01))糸状仮足を示した。メタドキシン処置は、この糸状仮足長の増大を逆転させ(図15パネルB(p<0.01))、幅の増加を逆転させた(図15パネルC(p<0.001))。
Effect of metadoxine on dendritic filopodia density and primary hippocampal neuron maturation from Fmrl knockout mice in vitro FIG. 15 (panels AC) shows the effect of treatment with 300 μM metadoxine for 5 hours. The dendrites were divided into 10 segments of 10 μm based on the distance from the neuronal cell body (from proximal to distal from left to right). The process spine density was increased in neurons derived from Fmrl knockout mice in segment 3 compared to neurons derived from WT mice. Specifically, FIG. 15 panel A shows the filopodia density of neurons. Primary hippocampal neurons from Fmr1 knockout mice showed an increase in the density of filopodia (p <0.001). Treatment with 300 μM metadoxine alleviated an abnormal increase in neuronal filopodia density in Fmrl knockout mice (p <0.001). Neurons derived from Fmr1 knockout mice have immature features, are longer (FIG. 15 panel B (p <0.01)) and narrower (FIG. 15 panel C (p <0.01)). Showed legs. Metadoxine treatment reversed this increase in the length of the fistula (FIG. 15 panel B (p <0.01)) and reversed the increase in width (FIG. 15 panel C (p <0.001)).
in vitroでのFmr1ノックアウトマウスにおけるde novo海馬タンパク質合成に対するメタドキシンの効果
図16は、Fmr1ノックアウトまたはWTマウス由来400μM海馬切片における基底de novoタンパク質合成に対するビヒクルまたは300μMメタドキシンのいずれかによる処置の効果を示す。タンパク質合成は、ビヒクル処置WT対照海馬よりもビヒクル処置Fmr1ノックアウトマウス由来海馬で高かった(p<0.0001)。メタドキシン処置は、Fmr1ノックアウトマウス海馬におけるタンパク質合成速度を低下させた。Fmr1ノックアウトマウス由来海馬はメタドキシン処置WTマウス由来海馬よりも高いタンパク質合成速度を維持していたことから(p<0.001)、この効果は部分的なものであった。
Effect of metadoxine on de novo hippocampal protein synthesis in Fmr1 knockout mice in vitro FIG. 16 shows the effect of treatment with either vehicle or 300 μM metadoxine on basal de novo protein synthesis in 400 μM hippocampal sections from Fmr1 knockout or WT mice. . Protein synthesis was higher in the hippocampus from vehicle-treated Fmrl knockout mice than in the vehicle-treated WT control hippocampus (p <0.0001). Metadoxine treatment reduced the rate of protein synthesis in the hippocampus of Fmrl knockout mice. This effect was partial because the hippocampus from Fmrl knockout mice maintained a higher protein synthesis rate than the hippocampus from metadoxine-treated WT mice (p <0.001).
Claims (10)
(b)徐放メタドキシンと即時放出メタドキシンの相対比が約60:40〜80:20の間である、
請求項5に記載の方法。 (A) the sustained release form provides a sustained release of said metadoxine for at least 8 hours; and
(B) the relative ratio of sustained release metadoxine and immediate release metadoxine is between about 60:40 and 80:20;
The method of claim 5.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361875384P | 2013-09-09 | 2013-09-09 | |
| US61/875,384 | 2013-09-09 | ||
| US14/038,258 US20150073023A1 (en) | 2013-09-09 | 2013-09-26 | Method Of Treating Fragile X Syndrome And Related Disorders |
| US14/038,258 | 2013-09-26 | ||
| US201461991351P | 2014-05-09 | 2014-05-09 | |
| US61/991,351 | 2014-05-09 | ||
| PCT/IB2014/002398 WO2015033224A2 (en) | 2013-09-09 | 2014-09-09 | Methods of treating fragile x syndrome and related disorders |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016530291A true JP2016530291A (en) | 2016-09-29 |
| JP2016530291A5 JP2016530291A5 (en) | 2017-10-19 |
Family
ID=52629036
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016539645A Pending JP2016530291A (en) | 2013-09-09 | 2014-09-09 | Method for treating fragile X syndrome and related disorders |
| JP2016540930A Pending JP2016530536A (en) | 2013-09-09 | 2014-09-09 | Of determining response to therapy |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016540930A Pending JP2016530536A (en) | 2013-09-09 | 2014-09-09 | Of determining response to therapy |
Country Status (12)
| Country | Link |
|---|---|
| EP (2) | EP3043792A2 (en) |
| JP (2) | JP2016530291A (en) |
| KR (2) | KR20160086818A (en) |
| CN (2) | CN105517546A (en) |
| AU (2) | AU2014315026A1 (en) |
| CA (2) | CA2922901A1 (en) |
| EA (2) | EA201690559A1 (en) |
| IL (2) | IL244343A0 (en) |
| MX (2) | MX2016003002A (en) |
| SG (2) | SG11201601605YA (en) |
| TW (2) | TW201605443A (en) |
| WO (2) | WO2015033224A2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023521274A (en) * | 2020-02-07 | 2023-05-24 | ニューロヴェンティ カンパニー リミテッド | Compositions for treating Fragile X syndrome or related developmental disorders comprising a rilmenidine compound as an active ingredient |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3027629B1 (en) * | 2013-07-31 | 2017-06-14 | UDC Ireland Limited | Luminescent diazabenzimidazole carbene metal complexes |
| US20150073023A1 (en) | 2013-09-09 | 2015-03-12 | Alcobra Ltd. | Method Of Treating Fragile X Syndrome And Related Disorders |
| CN108538365A (en) * | 2017-03-24 | 2018-09-14 | 华东师范大学 | A kind of self-closing disease sociability assessment system based on data analysis technique |
| CN112055587A (en) * | 2018-04-13 | 2020-12-08 | Healx有限公司 | Treatment of fragile X syndrome |
| KR20190121569A (en) * | 2018-04-18 | 2019-10-28 | 건국대학교 글로컬산학협력단 | Pharmaceutical Composition for Improving Fragile X Syndrome Comprising Agmatine or its derivatives |
| WO2019236938A1 (en) | 2018-06-07 | 2019-12-12 | Ovid Therapeutics Inc. | Use of (s)-3-amino-4-(difluoromethylenyl) cyclopent-1-ene-1-carboxylic acid and related compounds, (1s,3s)-3-amino-4-(difluoromethylidene) cyclopentane-1-carboxylic acid and vigabatrin in the treatment of developmental disorders |
| CN115335053A (en) * | 2020-01-08 | 2022-11-11 | 株式会社纽若梵提 | Composition comprising an lisuride compound as active ingredient for treating fragile X syndrome or related developmental disorders |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002043507A2 (en) * | 2000-11-30 | 2002-06-06 | The Health Research Institute | Nutrient supplements and methods for treating autism and for preventing the onset of autism |
| JP2012531402A (en) * | 2009-06-25 | 2012-12-10 | アルコブラ、リミテッド | How to treat, alleviate, reduce, ameliorate and prevent cognitive diseases, disorders or conditions |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1131856B (en) | 1980-06-30 | 1986-06-25 | Baldacci Lab Spa | PHARMACEUTICAL COMPOSITION FOR THE TREATMENT OF ALCOHOLIC INTOXICATIONS |
| IL187159A0 (en) | 2007-07-03 | 2009-02-11 | Gur Megiddo | Use of metadoxine in relief of alcohol intoxication |
-
2014
- 2014-09-05 TW TW103130856A patent/TW201605443A/en unknown
- 2014-09-05 TW TW103130859A patent/TW201606304A/en unknown
- 2014-09-09 JP JP2016539645A patent/JP2016530291A/en active Pending
- 2014-09-09 SG SG11201601605YA patent/SG11201601605YA/en unknown
- 2014-09-09 SG SG11201601830PA patent/SG11201601830PA/en unknown
- 2014-09-09 MX MX2016003002A patent/MX2016003002A/en unknown
- 2014-09-09 MX MX2016003006A patent/MX2016003006A/en unknown
- 2014-09-09 WO PCT/IB2014/002398 patent/WO2015033224A2/en active Application Filing
- 2014-09-09 EP EP14830858.8A patent/EP3043792A2/en not_active Withdrawn
- 2014-09-09 JP JP2016540930A patent/JP2016530536A/en active Pending
- 2014-09-09 AU AU2014315026A patent/AU2014315026A1/en not_active Abandoned
- 2014-09-09 CA CA2922901A patent/CA2922901A1/en not_active Abandoned
- 2014-09-09 KR KR1020167009042A patent/KR20160086818A/en not_active Application Discontinuation
- 2014-09-09 EA EA201690559A patent/EA201690559A1/en unknown
- 2014-09-09 CA CA2923421A patent/CA2923421A1/en not_active Abandoned
- 2014-09-09 CN CN201480049671.5A patent/CN105517546A/en active Pending
- 2014-09-09 WO PCT/US2014/054816 patent/WO2015035402A1/en active Application Filing
- 2014-09-09 AU AU2014316779A patent/AU2014316779A1/en not_active Abandoned
- 2014-09-09 CN CN201480060722.4A patent/CN105917225A/en active Pending
- 2014-09-09 EP EP14776939.2A patent/EP3044589A1/en not_active Withdrawn
- 2014-09-09 KR KR1020167009040A patent/KR20160078956A/en not_active Application Discontinuation
- 2014-09-09 EA EA201690557A patent/EA201690557A1/en unknown
-
2016
- 2016-02-29 IL IL244343A patent/IL244343A0/en unknown
- 2016-03-06 IL IL244453A patent/IL244453A0/en unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002043507A2 (en) * | 2000-11-30 | 2002-06-06 | The Health Research Institute | Nutrient supplements and methods for treating autism and for preventing the onset of autism |
| JP2012531402A (en) * | 2009-06-25 | 2012-12-10 | アルコブラ、リミテッド | How to treat, alleviate, reduce, ameliorate and prevent cognitive diseases, disorders or conditions |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2023521274A (en) * | 2020-02-07 | 2023-05-24 | ニューロヴェンティ カンパニー リミテッド | Compositions for treating Fragile X syndrome or related developmental disorders comprising a rilmenidine compound as an active ingredient |
| JP7412583B2 (en) | 2020-02-07 | 2024-01-12 | ニューロヴェンティ カンパニー リミテッド | Composition for treating Fragile X syndrome or related developmental disorder comprising a rilmenidine compound as an active ingredient |
Also Published As
| Publication number | Publication date |
|---|---|
| TW201605443A (en) | 2016-02-16 |
| TW201606304A (en) | 2016-02-16 |
| AU2014316779A1 (en) | 2016-03-17 |
| WO2015035402A1 (en) | 2015-03-12 |
| AU2014315026A1 (en) | 2016-03-24 |
| WO2015033224A3 (en) | 2015-07-02 |
| SG11201601830PA (en) | 2016-04-28 |
| EP3044589A1 (en) | 2016-07-20 |
| KR20160086818A (en) | 2016-07-20 |
| CA2923421A1 (en) | 2015-03-12 |
| MX2016003002A (en) | 2016-09-08 |
| CN105517546A (en) | 2016-04-20 |
| JP2016530536A (en) | 2016-09-29 |
| EA201690559A1 (en) | 2016-08-31 |
| CN105917225A (en) | 2016-08-31 |
| KR20160078956A (en) | 2016-07-05 |
| SG11201601605YA (en) | 2016-04-28 |
| EP3043792A2 (en) | 2016-07-20 |
| CA2922901A1 (en) | 2015-03-12 |
| MX2016003006A (en) | 2016-06-10 |
| WO2015033224A2 (en) | 2015-03-12 |
| IL244343A0 (en) | 2016-04-21 |
| IL244453A0 (en) | 2016-04-21 |
| EA201690557A1 (en) | 2016-07-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2016530291A (en) | Method for treating fragile X syndrome and related disorders | |
| CA2580619C (en) | Use of memantine (namenda) to treat autism, compulsivity, and impulsivity | |
| ES2750728T3 (en) | Use of cannabinoids in combination with Aripriprazole | |
| KR102014883B1 (en) | New compositions for treating amyotrophic lateral sclerosis | |
| JP5875191B2 (en) | New compositions for treating CMT and related disorders | |
| ES2690061T3 (en) | Compositions to treat Parkinson's disease | |
| JP2010504338A (en) | Hydrogenated pyrido [4,3-b] indole for the treatment of amyotrophic lateral sclerosis (ALS) | |
| WO2001068136A1 (en) | Drugs for complications of diabetes and neuropathy and utilization thereof | |
| JP2021521122A (en) | Combination therapy for the treatment of amyotrophic lateral sclerosis and related disorders | |
| JP2008515778A (en) | Combination methods, compositions and therapies for treating ocular conditions with 13-cis-retinyl derivatives | |
| JP2019527216A (en) | Administration and dosage of diaminophenothiazine | |
| CN108463224A (en) | SGC stimulants are used for the application of gastrointestinal dysfunction treatment | |
| ES2891306T3 (en) | Combination of ibudilast and riluzole and methods of using them | |
| BR112021006132A2 (en) | biphenyl sulfonamide compounds for the treatment of type iv collagen diseases | |
| US9851354B2 (en) | Methods of treating fragile X syndrome and related disorders | |
| JP2019516791A (en) | Phenolic compounds for the treatment of central nervous system and vasculature disorders and their combination with benzodiazepine fused to 1,4-dihydropyridine | |
| CN109069450A (en) | The new combination treatment of neurological disorder | |
| JP2023546924A (en) | Administration of antipurinergic compositions to treat nervous system disorders | |
| US20110065674A1 (en) | Methods and compositions for improving cognitive function | |
| EP3297611B1 (en) | Extended release pharmaceutical compositions of levetiracetam | |
| EP3661492A1 (en) | Methods and compositions for treating neurological conditions | |
| AU2011235981B2 (en) | Use of Memantine (Namenda) to Treat Autism, Compulsivity, and Impulsivity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170908 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170908 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180425 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180508 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181204 |