本技術は、概して、左室(LV)リモデリングの治療または予防を必要とする対象への治療的に有効な量の芳香族カチオン性ペプチドの投与による、哺乳類における左室(LV)リモデリングの治療または予防に関する。本技術は、心不全を治療または予防するための芳香族カチオン性ペプチドの使用にも関する。いくつかの実施形態では、芳香族カチオン性ペプチドは、心組織におけるミトコンドリア発生(mitochondrial biogenesis)を安定化する。
いくつかの態様では、左室(LV)リモデリングの治療、予防、または改良を必要とする哺乳類対象における左室(LV)リモデリングを治療、予防、または改良する方法が提供される。いくつかの実施形態では、本方法は、治療的に有効な量芳香族カチオン性ペプチドを投与することを含み、芳香族カチオン性ペプチドは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2またはその薬学的に許容される塩を含む。
いくつかの実施形態では、対象は、心筋梗塞を罹患している。いくつかの実施形態では、心筋梗塞は、高血圧、虚血性心疾患、心毒性化合物への曝露、心筋炎、甲状腺疾患、ウイルス感染、歯肉炎、薬物乱用、アルコール乱用、心膜炎、アテローム性動脈硬化症、血管疾患、肥大型心筋症、急性心筋梗塞、左室収縮機能障害、冠動脈バイパス手術、飢餓、摂食障害、及び遺伝的欠陥のうちの1つに起因する。
いくつかの実施形態では、芳香族カチオン性ペプチドは、心筋梗塞の約0.5時間〜4時間後に投与される。
いくつかの実施形態では、処置された対象は、ペプチドを投与されなかった対照対象と比較して向上したLV機能を示す。
いくつかの実施形態では、向上したLV機能は、減少したLV拍出量、改善されたLV駆出率、改善された短縮率、低減した梗塞拡大、改善された血行動態、及び減少した肺容量から成る群から選択された1つ以上の生理学的測定因子によって決定される。
いくつかの実施形態では、対象は、ヒトである。
いくつかの実施形態では、ペプチドは、経口、局所、全身、静脈内、皮下、腹腔内、または筋肉内投与される。
さらにまたはあるいは、いくつかの実施形態では、本方法は、対象に、心血管作動薬を別個に、連続して、または同時に投与することを含む。いくつかの実施形態では、心血管作動薬は、抗不整脈薬(anti-arrhthymia agent)、血管拡張薬、抗狭心症薬、副腎皮質ステロイド、強心配糖体(cardioglycoside)、利尿薬、鎮静薬、アンジオテンシン変換酵素(ACE)阻害薬、アンジオテンシンII拮抗薬、血栓溶解薬、カルシウムチャネル遮断薬、トロンボキサン受容体拮抗薬(throboxane receptor antagonist)、ラジカルスカベンジャー、抗血小板薬、βアドレナリン受容体遮断薬、α受容体遮断薬、交感神経抑制剤、ジギタリス製剤、変力物質(inotrope)、カプトプリル、及び抗高脂血症薬から成る群から選択される。
いくつかの態様では、LV機能の改善を必要とする対象におけるLV機能を改善するための方法が提供される。いくつかの実施形態では、本方法は、対象に、治療的に有効な量の芳香族カチオン性ペプチドを投与することを含み、芳香族カチオン性ペプチドは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2またはその薬学的に許容される塩を含む。
いくつかの実施形態では、改善されたLV機能は、減少したLV拍出量、改善されたLV駆出率、改善された短縮率、低減した梗塞拡大、改善された血行動態、及び減少した肺容量から成る群から選択された1つ以上の生理学的因子によって決定される。
いくつかの実施形態では、ペプチドは、心筋梗塞の約0.5時間〜4時間後に投与される。
いくつかの実施形態では、ペプチドは、経口、局所、全身、静脈内、皮下、腹腔内、または筋肉内投与される。
いくつかの実施形態では、対象に、心血管作動薬を別個に、連続して、または同時に投与することをさらに含む、方法。
いくつかの実施形態では、心血管作動薬は、抗不整脈薬、血管拡張薬、抗狭心症薬、副腎皮質ステロイド、強心配糖体、利尿薬、鎮静薬、アンジオテンシン変換酵素(ACE)阻害薬、アンジオテンシンII拮抗薬、血栓溶解薬、カルシウムチャネル遮断薬、トロンボキサン受容体拮抗薬、ラジカルスカベンジャー、抗血小板薬、βアドレナリン受容体遮断薬、α受容体遮断薬、交感神経抑制剤、ジギタリス製剤、変力物質、カプトプリル、及び抗高脂血症薬から成る群から選択される。
いくつかの態様では、ミトコンドリア発生、ミトコンドリア脂肪酸酸化、ミトコンドリア遺伝子発現の回復、またはそれらの組み合わせの促進を必要とする哺乳類対象におけるミトコンドリア発生、ミトコンドリア脂肪酸酸化、ミトコンドリア遺伝子発現の回復、またはそれらの組み合わせを促進するための方法が提供される。いくつかの実施形態では、本方法は、哺乳類対象に、治療的に有効な量の芳香族カチオン性ペプチドを投与することを含み、芳香族カチオン性ペプチドは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2またはその薬学的に許容される塩を含む。
いくつかの実施形態では、ミトコンドリア発生を促進することは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置された境界域細胞(border zone cell)におけるペルオキシソーム増殖因子活性化受容体ガンマコアクチベータ(PGC1)、NRF1、Tfam、またはそれらの組み合わせの発現レベルを安定化することを含む。
いくつかの実施形態では、ペプチドは、心筋梗塞の約0.5時間〜4時間後に投与される。
いくつかの実施形態では、ペプチドは、経口、局所、全身、静脈内、皮下、腹腔内、または筋肉内投与される。
いくつかの実施形態では、ミトコンドリア脂肪酸酸化を促進することは、D−Arg−2′6′−Dmt−Lys−Phe−NH2で処置された境界域細胞におけるERRa、PPARa、GLUT4、CD36、またはそれらの組み合わせの発現レベルを安定化することを含む。
いくつかの実施形態では、ミトコンドリア遺伝子発現の回復は、D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置された境界域細胞におけるミトコンドリア遺伝子発現の増加を含む。
いくつかの実施形態では、対象は、心筋梗塞を罹患している。
一態様では、本開示は、哺乳類対象に、治療的に有効な量の芳香族カチオン性ペプチドまたはその薬学的に許容される塩、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2を投与することを含む、LVリモデリングの治療または予防を提供する。いくつかの実施形態では、芳香族カチオン性ペプチドは、
少なくとも1個の正味の正電荷と、
最低4個のアミノ酸と、
最大約20個のアミノ酸と、
3pmがr+1以下の最大数である、正味の正電荷の最小数(pm)とアミノ酸残基の合計数(r)との間の関係と、2aがpt+1以下の最大数であるが、aが1である場合、ptも1であり得ることを除く、芳香族基の最小数(a)と正味の正電荷の合計数(pt)との間の関係と、を有する、ペプチドである。特定の実施形態では、哺乳類対象は、ヒトである。
いくつかの実施形態では、2pmは、r+1以下の最大数であり、ptに等しくてもよい。芳香族カチオン性ペプチドは、最低2または最低3個の正電荷を有する水溶性ペプチドであり得る。
いくつかの実施形態では、ペプチドは1つ以上の非自然発生アミノ酸、例えば1つ以上のDアミノ酸を含む。いくつかの実施形態では、C末端のアミノ酸のC末端カルボキシ基はアミド化される。特定の実施形態では、ペプチドは、最低4個のアミノ酸を有する。ペプチドは、最大約6個、最大約9個、または最大約12個のアミノ酸を有し得る。
いくつかの実施形態では、ペプチドはN末端にチロシンまたは2′,6′−ジメチルチロシン(ジメチルチロシンはDmtによって表される)残基を含む。例えば、ペプチドは式Tyr−D−Arg−Phe−Lys−NH2または2′,6′−Dmt−D−Arg−Phe−Lys−NH2を有し得る。別の実施形態では、ペプチドはN末端にフェニルアラニンまたは2′,6′−ジメチルフェニルアラニン残基を含む。例えば、ペプチドは式Phe−D−Arg−Phe−Lys−NH2または2′,6′−Dmp−D−Arg−Phe−Lys−NH2を有し得る。特定の実施形態では、芳香族カチオン性ペプチドは式D−Arg−2′,6′−Dmt−Lys−Phe−NH2を有する。
いくつかの実施形態では、ペプチドは式Iによって定義され、
式中R
1及びR
2は、
(i)水素、
(ii)直鎖または分岐C
1〜C
6アルキル、
から各々が独立して選択され、
R
3及びR
4は、
(i)水素、
(ii)直鎖または分岐C
1〜C
6アルキル、
(iii)C
1〜C
6アルコキシ、
(iv)アミノ、
(v)C
1〜C
4アルキルアミノ、
(vi)C
1〜C
4ジアルキルアミノ、
(vii)ニトロ、
(viii)ヒドロキシル、
(ix)「ハロゲン」がクロロ、フルオロ、ブロモ、及びヨードを包括する、ハロゲン、から各々が独立して選択され、
R
5、R
6、R
7、R
8、及びR
9は、
(i)水素、
(ii)直鎖または分岐C
1〜C
6アルキル、
(iii)C
1〜C
6アルコキシ、
(iv)アミノ、
(v)C
1〜C
4アルキルアミノ、
(vi)C
1〜C
4ジアルキルアミノ、
(vii)ニトロ、
(viii)ヒドロキシル、
(ix)「ハロゲン」がクロロ、フルオロ、ブロモ、及びヨードを包括する、ハロゲン、から各々が独立して選択され、
nは1〜5の整数である。
いくつかの実施形態では、R1及びR2は水素であり、R3及びR4はメチルであり、R5、R6、R7、R8、及びR9は全て水素であり、nは4である。
いくつかの実施形態では、ペプチドは式IIによって定義され、
式中R
1及びR
2は、
(i)水素、
(ii)直鎖または分岐C
1〜C
6アルキル、
から各々が独立して選択され、
R
3、R
4、R
5、R
6、R
7、R
8、R
9、R
10、R
11、及びR
12は、
(i)水素、
(ii)直鎖または分岐C
1〜C
6アルキル、
(iii)C
1〜C
6アルコキシ、
(iv)アミノ、
(v)C
1〜C
4アルキルアミノ、
(vi)C
1〜C
4ジアルキルアミノ、
(vii)ニトロ、
(viii)ヒドロキシル、
(ix)「ハロゲン」がクロロ、フルオロ、ブロモ、及びヨードを包括する、ハロゲン、から各々が独立して選択され、
nは1〜5の整数である。
いくつかの実施形態では、R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、及びR12は全て水素であり、nは4である。別の実施形態では、R1、R2、R3、R4、R5、R6、R7、R8、R9、及びR11は全て水素であり、R8及びR12はメチルであり、R10はヒドロキシルであり、nは4である。
いくつかの実施形態では、芳香族カチオン性ペプチドはD−Arg−2′,6′−Dmt−Lys−Phe−NH2または任意のその薬学的な塩である。いくつかの実施形態では、対象は、心筋梗塞を罹患している。
本発明の実質的な理解を提供するために、本発明の特定の態様、モード、実施形態、変形、及び特長は、様々なレベルの詳細さで下記に記載されることが理解されるべきである。本明細書において使用される特定の用語の定義は下記に提供される。別途定義されない限り、本明細書で使用される専門用語及び科学用語は、概して本発明が属する技術の当業者によって一般的に理解されるのと同じ意味を有する。
本明細書及び添付の請求項において使用される場合、単数形「a」、「an」、及び「the」は、文脈が明白に別途述べない限り、複数形の指示対象を含む。例えば「細胞(a cell)」への言及は、2つ以上の細胞の組み合わせ等を含む。
本明細書で使用される場合、対象への薬剤、薬物、またはペプチドの「投与」は、その意図された機能を果たすために、対象に化合物を導入または送達する任意の経路を含む。投与は、経口、鼻腔内、非経口(静脈内、筋肉内、腹腔内、もしくは皮下)、または局所を含む、任意の好適な経路によって実行されてもよい。投与は自己投与及び別人による投与を含む。
本明細書で使用される場合、「アミノ酸」という用語は、自然発生アミノ酸及び合成アミノ酸、ならびに自然発生アミノ酸と同様の様式で機能するアミノ酸類似体及びアミノ酸模倣物を含む。自然発生アミノ酸は、遺伝コードによってコードされたもの、ならびに後に修飾されるアミノ酸、例えばヒドロキシプロリン、γ−カルボキシグルタミン酸、及びO−ホスホセリンである。アミノ酸類似体は、自然発生アミノ酸と同じ基本的な化学構造、すなわち水素、カルボキシ基、アミノ基、及びR基に結合するα炭素を有する化合物、例えばホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムを指す。
かかる類似体は、修飾されたR基(例えばノルロイシン)または修飾されたペプチド骨格を有するが、自然発生アミノ酸と同じ基本的な化学構造を保持する。アミノ酸模倣物は、アミノ酸の一般的な化学構造とは異なる構造を有するが、自然発生アミノ酸と同様の様式で機能する化学化合物を指す。アミノ酸は本明細書において、それらの一般的に知られている3文字記号によって、またはIUPAC−IUB Biochemical Nomenclature Commissionによって推奨される1文字記号によって指され得る。
本明細書で使用される場合、「境界域細胞」という用語は梗塞域と境界を接する、梗塞域を取り囲む、または梗塞域にごく近接して存在する心臓細胞を指す。いくつかの実施形態では、境界域は瘢痕を取り囲む幅約2mmの非梗塞心臓細胞のストリップである。境界域細胞は梗塞に起因する壊死心組織を補うため、境界域細胞は左室リモデリングの対象の心臓細胞である。
本明細書で使用される場合、「遠隔細胞」という用語は境界域細胞を隔てた心臓細胞を指す。これらの細胞は梗塞域からより遠く離れて存在し、通常梗塞からの影響を受けないままである。
本明細書で使用される場合、「対照」という用語は当技術におけるその慣習的な意味を有し、例えば治療薬または試験薬、例えばかかる芳香族カチオン性ペプチドで処置されていない、境界域細胞または遠隔細胞等の細胞を指し得る。対照は、当業者に既知のように、特定の処置の効果を確定するための「標準」として使用され得る。例えば、対照(治療されなかった)境界域細胞及び遠隔細胞は、芳香族カチオン性ペプチド処置の境界域細胞及び遠隔細胞への効果を決定するために使用され得る。
本明細書で使用される場合、「有効量」という用語は、所望の治療効果及び/または予防効果を達成するのに十分な量、例えばLVリモデリングまたはLVリモデリングと関連付けられる1つ以上の症状の予防または低減をもたらす量を指す。治療応用または予防応用の文脈では、対象に投与される組成物の量は、疾患の種類及び重度、ならびに全体的な健康、年齢、性別、体重、及び薬物耐性等の個体の特徴に依存する。これは疾患の程度、重度、及び種類にも依存する。当業者はこれら及び他の因子に依存して適切な投与量を決定することができる。組成物は1つ以上の追加の治療化合物と組み合わせてもまた投与され得る。本明細書に記載される方法では、芳香族カチオン性ペプチドは、増加したLV拍出量、低減したLV駆出率、不良な短縮率、増加した梗塞拡大、不良な血行動態、LV心筋における増加した瘢痕形成、及び増加した肺容量等の、LVリモデリングの1つ以上の兆候または症状を有する対象に投与され得る。例えば、「治療的に有効な量」の芳香族カチオン性ペプチドは、LVリモデリングの生理学的効果が最低でも改良されるレベルを含む。いくつかの実施形態では、有効量は、長期間、例えば3日間〜1年間以上の期間にわたって、定期的に(例えば毎日、毎週、毎月)投与され得る。
本明細書で使用される場合、「左室(LV)リモデリング」という用語は当業者に既知の意味を有し、増加した左室壁応力及び増加した酸素必要量によって典型的に特徴付けられる病態を指す。LVリモデリングは、左室の非梗塞心臓細胞におけるLV拡張及び遠心性肥大の発達もまた含み得る。このプロセスの間、筋節が周囲または縦方向様式で付加される。心室が拡張すると、このプロセスは、最初に減少した拍出量を補うのを助けるが、進行性の拡張及び肥大は最終的にうっ血性心不全をもたらす。心筋梗塞の1年後の死の最も強力な予測因子の1つは、左室の容量である。拡張すればするほど死の確率が高くなる。LVリモデリングの兆候には、増加したLV拍出量、低減したLV駆出率、不良な短縮率、増加した梗塞拡大、不良な血行動態、LV心筋における増加した瘢痕形成、及び増加した肺容量が挙げられるがこれらに限定されない。
本明細書で使用される場合、「単離された」または「純化された」ポリペプチドまたはペプチドという用語は、薬剤が誘導される細胞もしくは組織源からの細胞物質もしくは他の汚染ポリペプチドを実質的に有さない、または化学合成された場合に化学前駆体もしくは他の化学物質を実質的に有さない、ポリペプチドまたはペプチドを指す。例えば単離された芳香族カチオン性ペプチドは、薬剤の診断用途または治療用途を妨害し得る物質を有し得ない。かかる妨害物質は酵素、ホルモン、ならびに他のタンパク質性及び非タンパク質性溶質を含み得る。
本明細書で使用される場合、「正味の電荷」は、ペプチド中に存在するアミノ酸によって担持される正電荷の数と負電荷の数との均衡を指す。本明細書では、正味の電荷は生理的pHで測定されることが理解される。生理的pHで正電荷を有する自然発生アミノ酸には、L−リジン、L−アルギニン、及びL−ヒスチジンが挙げられる。生理的pHで負電荷を有する自然発生アミノ酸には、L−アスパラギン酸及びL−グルタミン酸が挙げられる。
本明細書で使用される場合、「薬学的に許容される塩」という用語は、哺乳類等の患者への投与を許容される塩基または酸から調製された塩(例えば、所与の投与体制に対して許容される哺乳類の安全性を有する塩)を指す。しかしながら、塩は、患者への投与を意図されない中間化合物の塩等の、薬学的に許容される塩でなくてもよいことが理解される。薬学的に許容される塩は、薬学的に許容される無機塩基または有機塩基から、及び薬学的に許容される無機酸または有機酸から誘導され得る。加えて、ペプチドがアミン、ピリジン、またはイミダゾール等の塩基性部分と、カルボン酸またはテトラゾール等の酸性部分との両方を含有する場合、双性イオンが形成され得、本明細書で使用される「塩」という用語に含まれる。
本明細書で使用される場合、「薬学的に許容される担体」という用語は薬学的な投与に適合する、生理食塩水、溶剤、分散媒、コーティング、抗菌及び抗真菌剤、等張性かつ吸収遅延剤等を含む。
本明細書で使用される場合、「ポリペプチド」、「ペプチド」、及び「タンパク質」という用語は、ペプチド結合または修飾されたペプチド結合すなわちペプチドアイソスターによって互いと結合する、2個以上のアミノ酸を含むポリマーを意味するために、本明細書で交換可能に使用される。ポリペプチドは、一般的にペプチド、糖ペプチド、またはオリゴマーと称される短鎖、及び概してタンパク質と称されるより長い鎖の両方を指す。ポリペプチドは、20個の遺伝子コードアミノ酸以外のアミノ酸を含有し得る。ポリペプチドは、翻訳後処理等の自然プロセスによって、または当業者に公知の化学修飾技術によって修飾された、アミノ酸配列を含む。
本明細書で使用される場合、「同時の」治療用途という用語は、同じ経路による、同時または実質的に同時の少なくとも2つの活性成分の投与を指す。
本明細書で使用される場合、「別個の」治療用途という用語は、異なる経路による、同時または実質的に同時の少なくとも2つの活性成分の投与を指す。
本明細書で使用される場合、「連続的な」治療用途という用語は、投与経路が同一または異なる、異なる時間の少なくとも2つの活性成分の投与を指す。より具体的には、連続的な用途は、他の活性成分(単数)または他の活性成分(複数)の投与が開始する前の、活性成分のうちの1つの投与全体を指す。よって、他の活性成分または成分を投与する前に、活性成分のうちの1つを数分間、数時間、または数日間にわたって投与することが可能である。この場合、同時処置はない。
本明細書で使用される場合、「治療する」もしくは「治療」または「軽減」という用語は、治療を指し、目的は標的の病理病態または障害を予防するか、または遅延させる(和らげる)ことである。例えば、本明細書に記載される方法に従い治療的に有効量の芳香族カチオン性ペプチドを受けた後、対象が、例えばLV拍出量、改善されたLV駆出率、改善された短縮率、低減した梗塞拡大、改善された血行動態、LV心筋における低減した瘢痕形成、及び減少した肺容量等の、1つ以上の兆候及び症状の観察可能かつ/または測定可能な低減または不在を示す場合、対象は、LVリモデリングを成功裏に「治療」される。記載される医学的病態の治療または予防の様々なモードは、完全だけでなく完全未満の治療または予防も含む「実質的」を意味することが意図され、何らかの生物学的または医学的に関連性のある結果が達成されることもまた理解されるべきである。LVリモデリングの治療は、本明細書で使用される場合、ミトコンドリア発生の増加またはミトコンドリア発生の死亡の予防もまた指す。
本明細書で使用される場合、障害または病態の「予防」または「予防すること」は、統計的な試料において、処置されなかった対照試料に対して処置された試料における障害もしくは病態の発症を低減する、または、処置されなかった対照試料に対して障害もしくは病態のうちの1つ以上の発症を遅延させるもしくはその重度を低減する化合物を指す。本明細書で使用される場合、LVリモデリングを予防することは、LVリモデリングの開始を予防すること、LVリモデリングの開始を遅延させること、LVリモデリングの進行または増進を予防すること、LVリモデリングの進行または増進を遅くすること、LVリモデリングの進行または増進を遅延させること、及びLVリモデリングの進行を進行期からより進行の低い段階に戻すことを含む。
本明細書で使用される場合、遺伝子発現に関して「安定化する」または「安定化」という用語は、境界域または遠隔梗塞心臓細胞における遺伝子発現レベルを、非梗塞正常心臓細胞と約同じレベルに維持または回復することを指す。遺伝子発現に関して安定化するまたは安定化は、処置されなかった境界域対照細胞と比較して、上昇したレベルの遺伝子発現を有するペプチドで処置された境界域心臓細胞も指し得る。安定化は遺伝子発現レベルを上昇させることまたは低減させることに起因し得る。
本明細書で使用される場合、投与に関して「長期」という用語は、約3日間、約4日間、約5日間、約6日間、約1週間、約2週間、約3週間、4週間、5週間6週間、約2ヶ月間、約3ヶ月間、約6ヶ月間、約9ヶ月間、約1年間以上にわたる芳香族カチオン性ペプチド等の治療薬の投与を指す。いくつかの実施形態では、長期投与は、1日1回、1日2回、1日3〜5回、1日おき、2日おき、1週間に1回、または1ヶ月に1回の投与を含む。
芳香族カチオン性ペプチド
本技術は、特定の芳香族カチオン性ペプチドの投与による、LVリモデリング及び関連する病態の治療または予防に関する。芳香族カチオン性ペプチドは水溶性かつ高極性である。これらの性質にも関わらず、ペプチドは細胞膜に容易に浸透することができる。芳香族カチオン性ペプチドは典型的に、ペプチド結合によって共有結合する最低3個のアミノ酸または最低4個のアミノ酸を含む。芳香族カチオン性ペプチド中に存在するアミノ酸の最大数は、ペプチド結合によって共有結合する約20個のアミノ酸である。好適にはアミノ酸の最大数は、約12個、より好ましくは約9個、最も好ましくは約6個である。
芳香族カチオン性ペプチドのアミノ酸は任意のアミノ酸であり得る。アミノ酸は自然発生であり得る。自然発生アミノ酸は、例えば哺乳類タンパク質において通常見られる20個の最も一般的な左旋性(L)アミノ酸、すなわちアラニン(Ala)、アルギニン(Arg)、アスパラギン(Asn)、アスパラギン酸(Asp)、システイン(Cys)、グルタミン(Gln)、グルタミン酸(Glu)、グリシン(Gly)、ヒスチジン(His)、イソロイシン(Ile)、ロイシン(Leu)、リジン(Lys)、メチオニン(Met)、フェニルアラニン(Phe)、プロリン(Pro)、セリン(Ser)、トレオニン(Thr)、トリプトファン、(Trp)、チロシン(Tyr)、及びバリン(Val)を含む。他の自然発生アミノ酸には、例えばタンパク質合成とは関連付けられない代謝プロセスにおいて合成されるアミノ酸が挙げられる。例えば、アミノ酸であるオルニチン及びシトルリンは、尿素の生成中に哺乳類の代謝において合成される。自然発生アミノ酸の別の例にはヒドロキシプロリン(Hyp)が挙げられる。
ペプチドは、任意で1個以上の非自然発生アミノ酸を含有し得る。最適には、ペプチドは自然発生のアミノ酸を有さない。非自然発生アミノ酸は左旋性(L−)、右旋性(D−)、またはそれらの混合物であり得る。非自然発生アミノ酸は、典型的に生物における通常の代謝プロセスにおいて合成されず、タンパク質において自然発生しないアミノ酸である。加えて、非自然発生アミノ酸は、好適には、一般的なプロテアーゼによっても認識されない。非自然発生アミノ酸は、ペプチドにおける任意の位置に存在し得る。例えば、非自然発生アミノ酸は、N末端、C末端、またはN末端とC末端との間の任意の位置にあり得る。
非自然アミノ酸は、例えば自然アミノ酸において見られないアルキル基、アリール基、またはアルキルアリール基を含み得る。非自然アルキルアミノ酸のいくつかの例にはα−アミノ酪酸、β−アミノ酪酸、γ−アミノ酪酸、δ−アミノ吉草酸、及びε−アミノカプロン酸を含む。非自然アリールアミノ酸のいくつかの例にはオルト−、メタ、及びパラ−アミノ安息香酸が挙げられる。非自然アルキルアリールアミノ酸のいくつかの例には、オルト−、メタ−、及びパラ−アミノフェニル酢酸、ならびにγ−フェニル−β−アミノ酪酸が挙げられる。非自然発生アミノ酸は、自然発生アミノ酸の誘導体を含む。自然発生アミノ酸の誘導体は、例えば自然発生アミノ酸への1個以上の化学基の付加を含み得る。
例えば、1個以上の化学基がフェニルアラニンまたはチロシン残基の芳香環の2′、3′、4′、5′、もしくは6′位のうちの1つ以上、またはトリプトファン残基のベンゾ環の4′、5′、6′、もしくは7′位に付加され得る。この基は、芳香環に付加され得る任意の化学基であり得る。かかる基のいくつかの例には、分岐または非分岐C1〜C4アルキル、例えばメチル、エチル、n−プロピル、イソプロピル、ブチル、イソブチル、もしくはt−ブチル、C1〜C4アルキルオキシ(すなわちアルコキシ)、アミノ、C1〜C4アルキルアミノ、及びC1〜C4ジアルキルアミノ(例えばメチルアミノ、ジメチルアミノ)、ニトロ、ヒドロキシル、ハロ(すなわちフルオロ、クロロ、ブロモ、またはヨード)が挙げられる。自然発生アミノ酸の非自然発生誘導体のいくつかの具体的な例には、ノルバリン(Nva)及びノルロイシン(Nle)が挙げられる。
ペプチドにおけるアミノ酸の修飾の別の例は、ペプチドのアスパラギン酸またはグルタミン酸残基のカルボキシ基の誘導体化である。誘導体化の1つの例は、アンモニアを用いる、または一級もしくは二級アミン、例えばメチルアミン、エチルアミン、ジメチルアミン、もしくはジエチルアミンを用いるアミド化である。誘導体化の別の例には、例えばメチルまたはエチルアルコールを用いるエステル化が挙げられる。別のかかる修飾には、リジン、アルギニン、またはヒスチジン残基のアミノ基の誘導体化が挙げられる。例えばかかるアミノ基はアシル化され得る。いくつかの好適なアシル基には、例えば、アセチルまたはプロピオニル基等の、上述したC1〜C4アルキル基のうちのいずれかを含むベンゾイル基またはアルカノイル基を含む。
非自然発生アミノ酸は、好適には、一般的なプロテアーゼに耐性または非感受性である。プロテアーゼに耐性または非感受性の非自然発生アミノ酸の例には、上述した自然発生L−アミノ酸のいずれかの右旋性(D−)形態ならびにL−及び/またはD−非自然発生アミノ酸が挙げられる。D−アミノ酸はタンパク質においては通常発生しないが、これらは細胞の通常のリボソームタンパク質合成機構以外の手段によって合成される、特定のペプチド抗生物質において見られる。本明細書で使用される場合、D−アミノ酸は非自然発生アミノ酸であると考えられる。
プロテアーゼ感受性を最小にするために、ペプチドは、アミノ酸が自然発生であるか非自然発生であるかに関係なく、一般的なプロテアーゼによって認識される5個未満、好ましくは4個未満、より好ましくは3個未満、及び最も好ましくは2個未満の連続するL−アミノ酸を有するべきである。最適には、ペプチドはD−アミノ酸のみを有し、L−アミノ酸を有さない。ペプチドがアミノ酸のプロテアーゼ感受性配列を含有する場合、アミノ酸のうちの少なくとも1個は、好ましくは非自然発生D−アミノ酸であり、それによってプロテアーゼ耐性を与える。プロテアーゼ感受性配列の例には、エンドペプチダーゼ及びトリプシン等の一般的なプロテアーゼによって容易に切断される、2個以上の連続する塩基性アミノ酸が挙げられる。塩基性アミノ酸の例には、アルギニン、リジン、及びヒスチジンが挙げられる。
芳香族カチオン性ペプチドは、ペプチドにおけるアミノ酸残基の合計数と比較して、生理的pHで最小数の正味の正電荷を有するべきである。生理的pHでの正味の正電荷の最小数は下記で(pm)と称される。ペプチドにおけるアミノ酸残基の合計数は下記で(r)と称される。下記で論じられる正味の正電荷の最小数は、全て生理的pHのものである。本明細書で使用される「生理的pH」という用語は、哺乳類の体の組織及び器官の細胞における通常のpHを指す。例えば、ヒトの生理的pHは通常およそ7.4であるが、哺乳類における通常の生理的pHは約7.0〜約7.8の任意のpHであり得る。
典型的に、芳香族カチオン性ペプチドは、正電荷を有するN末端アミノ基及び負電荷を有するC末端カルボキシ基を有する。電荷は生理的pHで互いを相殺する。正味の電荷の計算の例として、ペプチドTyr−Arg−Phe−Lys−Glu−His−Trp−D−Argは、負電荷を有する1個のアミノ酸(すなわちGlu)及び正電荷を有する4個のアミノ酸(すなわち2個のArg残基、1個のLys残基、及び1個のHis残基)を有する。したがって、上記のペプチドは、3個の正味の正電荷を有する。
一実施形態では、芳香族カチオン性ペプチドは、3p
mがr+1以下の最大数である、生理的pHでの正味の正電荷の最小数(p
m)とアミノ酸残基の合計数(r)との関係を有する。この実施形態では、正味の正電荷の最小数(p
m)とアミノ酸残基の合計数(r)との間の関係は、以下の通りである。
別の実施形態では、芳香族カチオン性ペプチドは、2p
mがr+1以下の最大数である、正味の正電荷の最小数(p
m)とアミノ酸残基の合計数(r)との間の関係を有する。この実施形態では、正味の正電荷の最小数(p
m)とアミノ酸残基の合計数(r)との間の関係は、以下の通りである。
一実施形態では、正味の正電荷の最小数(pm)とアミノ酸残基の合計数(r)とは等しい。別の実施形態では、ペプチドは、3個または4個のアミノ酸残基、ならびに最低1個の正味の正電荷、好適には最低2個の正味の正電荷、及びより好ましくは最低3個の正味の正電荷を有する。
芳香族カチオン性ペプチドが、正味の正電荷の合計数(pt)と比較して芳香族基の最小数を有することもまた重要である。芳香族基の最小数は下記で(a)と称される。芳香族基を有する自然発生アミノ酸には、アミノ酸ヒスチジン、トリプトファン、チロシン、及びフェニルアラニンが挙げられる。例えば、ヘキサペプチドLys−Gln−Tyr−D−Arg−Phe−Trpは、2個の正味の正電荷(リジン及びアルギニン残基によって寄与される)ならびに3個の芳香族基(チロシン、フェニルアラニン、及びトリプトファン残基によって寄与される)を有する。
芳香族カチオン性ペプチドは、3aがp
t+1以下の最大数であるが、p
tが1である場合、aも1であり得ることを除く、芳香族基の最小数(a)と生理的pHでの正味の正電荷の合計数(p
t)との間の関係もまた有するべきである。この実施形態では、芳香族基の最小数(a)と正味の正電荷の合計数(p
t)との間の関係は、以下の通りである。
別の実施形態では、芳香族カチオン性ペプチドは、2aがp
t+1以下の最大数である、芳香族基の最小数(a)と正味の正電荷の合計数(p
t)との間の関係を有する。この実施形態では、芳香族アミノ酸残基の最小数(a)と正味の正電荷の合計数(p
t)との間の関係は、以下の通りである。
別の実施形態では、芳香族基の数(a)と正味の正電荷の合計数(pt)とは等しい。
カルボキシ基、特にC末端アミノ酸の末端カルボキシ基は、例えばアンモニアを用いて好適にアミド化され、C末端アミドを形成する。あるいは、C末端アミノ酸の末端カルボキシ基は、任意の一級または二級アミンを用いてアミド化され得る。一級または二級アミンは、例えばアルキル、特に分岐もしくは非分岐C1〜C4アルキル、またはアリールアミンであり得る。結果的に、ペプチドのC末端のアミノ酸は、アミド基、N−メチルアミド基、N−エチルアミド基、N,N−ジメチルアミド基、N,N−ジエチルアミド基、N−メチル−N−エチルアミド基、N−フェニルアミド基、またはN−フェニル−N−エチルアミド基に変換され得る。芳香族カチオン性ペプチドのC末端で発生しないアスパラギン、グルタミン、アスパラギン酸、及びグルタミン酸残基の遊離カルボキシレート基もまた、それらがペプチド内で発生するあらゆる場所でアミド化され得る。これらの内部位置でのアミド化は、アンモニアまたは上記される一級または二級アミンのうちのいずれかを用いるものであり得る。
一実施形態では、芳香族カチオン性ペプチドは、2個の正味の正電荷及び少なくとも1個の芳香族アミノ酸を有するトリペプチドである。特定の実施形態では、芳香族カチオン性ペプチドは、2個の正味の正電荷及び2個の芳香族アミノ酸を有するトリペプチドである。
芳香族カチオン性ペプチドは、以下のペプチドの例を含むがこれらに限定されない。
Lys−D−Arg−Tyr−NH2
Phe−D−Arg−His
D−Tyr−Trp−Lys−NH2
Trp−D−Lys−Tyr−Arg−NH2
Tyr−His−D−Gly−Met
Phe−Arg−D−His−Asp
Tyr−D−Arg−Phe−Lys−Glu−NH2
Met−Tyr−D−Lys−Phe−Arg
D−His−Glu−Lys−Tyr−D−Phe−Arg
Lys−D−Gln−Tyr−Arg−D−Phe−Trp−NH2
Phe−D−Arg−Lys−Trp−Tyr−D−Arg−His
Gly−D−Phe−Lys−Tyr−His−D−Arg−Tyr−NH2
Val−D−Lys−His−Tyr−D−Phe−Ser−Tyr−Arg−NH2
Trp−Lys−Phe−D−Asp−Arg−Tyr−D−His−Lys
Lys−Trp−D−Tyr−Arg−Asn−Phe−Tyr−D−His−NH2
Thr−Gly−Tyr−Arg−D−His−Phe−Trp−D−His−Lys
Asp−D−Trp−Lys−Tyr−D−His−Phe−Arg−D−Gly−Lys−NH2
D−His−Lys−Tyr−D−Phe−Glu−D−Asp−D−His−D−Lys−Arg−Trp−NH2
Ala−D−Phe−D−Arg−Tyr−Lys−D−Trp−His−D−Tyr−Gly−Phe
Tyr−D−His−Phe−D−Arg−Asp−Lys−D−Arg−His−Trp−D−His−Phe
Phe−Phe−D−Tyr−Arg−Glu−Asp−D−Lys−Arg−D−Arg−His−Phe−NH2
Phe−Try−Lys−D−Arg−Trp−His−D−Lys−D−Lys−Glu−Arg−D−Tyr−Thr
Tyr−Asp−D−Lys−Tyr−Phe−D−Lys−D−Arg−Phe−Pro−D−Tyr−His−Lys
Glu−Arg−D−Lys−Tyr−D−Val−Phe−D−His−Trp−Arg−D−Gly−Tyr−Arg−D−Met−NH2
Arg−D−Leu−D−Tyr−Phe−Lys−Glu−D−Lys−Arg−D−Trp−Lys−D−Phe−Tyr−D−Arg−Gly
D−Glu−Asp−Lys−D−Arg−D−His−Phe−Phe−D−Val−Tyr−Arg−Tyr−D−Tyr−Arg−His−Phe−NH2
Asp−Arg−D−Phe−Cys−Phe−D−Arg−D−Lys−Tyr−Arg−D−Tyr−Trp−D−His−Tyr−D−Phe−Lys−Phe
His−Tyr−D−Arg−Trp−Lys−Phe−D−Asp−Ala−Arg−Cys−D−Tyr−His−Phe−D−Lys−Tyr−His−Ser−NH2
Gly−Ala−Lys−Phe−D−Lys−Glu−Arg−Tyr−His−D−Arg−D−Arg−Asp−Tyr−Trp−D−His−Trp−His−D−Lys−Asp
Thr−Tyr−Arg−D−Lys−Trp−Tyr−Glu−Asp−D−Lys−D−Arg−His−Phe−D−Tyr−Gly−Val−Ile−D−His−Arg−Tyr−Lys−NH2
一実施形態では、ペプチドはμ−オピオイド受容体作動薬活性を有する(すなわち、それらはμ−オピオイド受容体を活性化する)。μ−オピオイド受容体作動薬活性を有するペプチドは、典型的に、N末端(すなわち第1のアミノ酸位置)にチロシン残基またはチロシン誘導体を有するペプチドである。チロシンの好適な誘導体には、2′−メチルチロシン(メチルチロシンはMmtによって表される)、2′,6′−ジメチルチロシン(2′6′−Dmt)、3′,5′−ジメチルチロシン(3′5′Dmt)、N,2′,6′−トリメチルチロシン(トリメチルチロシンはTmtによって表される)、及び2′−ヒドロキシ−6′−メチルトリオシン(methyltryosine)(Hmt)が挙げられる。
一実施形態では、μ−オピオイド受容体作動薬活性を有するペプチドは、式Tyr−D−Arg−Phe−Lys−NH2を有する。Tyr−D−Arg−Phe−Lys−NH2は、アミノ酸のチロシン、アルギニン、及びリジンによって寄与される3個の正味の正電荷を有し、アミノ酸のフェニルアラニン及びチロシンによって寄与される2個の芳香族基を有する。Tyr−D−Arg−Phe−Lys−NH2のチロシンは、式2′,6′−Dmt−D−Arg−Phe−Lys−NH2を有する化合物を生成するための2′,6′−ジメチルチロシン(ジメチルチロシンはDmtによって表される)におけるもの等の、チロシンの修飾された誘導体であり得る。2′,6′−Dmt−D−Arg−Phe−Lys−NH2は640の分子量を有し、生理的pHで正味3個の正電荷を担持する。2′,6′−Dmt−D−Arg−Phe−Lys−NH2は、エネルギー依存様式で、いくつかの哺乳類細胞型の形質膜に容易に浸透する(Zhao et al.,J.Pharmacol Exp Ther.,304:425−432,2003)。
あるいは、他の場合では、芳香族カチオン性ペプチドはμ−オピオイド受容体作動薬活性を有さない。例えば、慢性疾患状態または病態等における長期間治療の間、μ−オピオイド受容体を活性化する芳香族カチオン性ペプチドの使用は禁忌であり得る。これらの場合、芳香族カチオン性ペプチドの潜在的に有害または中毒性の効果が、ヒト患者または他の哺乳類の治療レジメンにおける、μ−オピオイド受容体を活性化する芳香族カチオン性ペプチドの使用を妨げ得る。潜在的な有害効果には、鎮静作用、便秘、及び呼吸抑制作用が挙げられ得る。かかる場合、μ−オピオイド受容体を活性化しない芳香族カチオン性ペプチドが適切な処置であり得る。μ−オピオイド受容体作動薬活性を有さないペプチドは、概してN末端(すなわちアミノ酸位置1)にチロシン残基またはチロシンの誘導体を有さない。N末端のアミノ酸は、チロシン以外の任意の自然発生または非自然発生アミノ酸であり得る。一実施形態では、N末端のアミノ酸はフェニルアラニンまたはその誘導体である。フェニルアラニンの例示的な誘導体には、2′−メチルフェニルアラニン(Mmp)、2′,6′−ジメチルフェニルアラニン(2′,6′−Dmp)、N,2′,6′−トリメチルフェニルアラニン(Tmp)、及び2′−ヒドロキシ−6′−メチルフェニルアラニン(Hmp)が挙げられる。
μ−オピオイド受容体作動薬活性を有さない芳香族カチオン性ペプチドの例は、式Phe−D−Arg−Phe−Lys−NH2を有する。あるいは、N末端フェニルアラニンは、2′,6′−ジメチルフェニルアラニン(2′6′−Dmp)等のフェニルアラニンの誘導体であり得る。アミノ酸位置1に2′,6′−ジメチルフェニルアラニンを含有するPhe−D−Arg−Phe−Lys−NH2は、式2′,6′−Dmp−D−Arg−Phe−Lys−NH2を有する。一実施形態では、2′,6′−Dmt−D−Arg−Phe−Lys−NH2のアミノ酸配列は、DmtがN末端にならないように再配置される。μ−オピオイド受容体作動薬活性を有さないかかる芳香族カチオン性ペプチドの例は、式D−Arg−2′6′−Dmt−Lys−Phe−NH2を有する。
本明細書に一覧されるペプチドの好適な置換変形は、保守的なアミノ酸置換を含む。アミノ酸は、以下のようにそれらの物理化学的な特徴に従ってグループ化され得る。
(a)無極性アミノ酸:Ala(A)Ser(S)Thr(T)Pro(P)Gly(G)Cys(C)、
(b)酸性アミノ酸:Asn(N)Asp(D)Glu(E)Gln(Q)、
(c)塩基性アミノ酸:His(H)Arg(R)Lys(K)、
(d)疎水性アミノ酸:Met(M)Leu(L)Ile(I)Val(V)、及び
(e)芳香族アミノ酸:Phe(F)Tyr(Y)Trp(W)His(H)。
同じグループ内の別のアミノ酸による、ペプチドにおけるアミノ酸の置換は、保守的な置換と称され、元のペプチドの物理化学的な特徴を保存し得る。対照的に、異なるグループ内の別のアミノ酸による、ペプチドにおけるアミノ酸の置換は、概して元のペプチドの特徴を変更する可能性がより高い。
μ−オピオイド受容体を活性化するペプチドの例には、表5に示される芳香族カチオン性ペプチドが挙げられるがこれらに限定されない。
μ−オピオイド受容体を活性化しないペプチドの例には、表6に示される芳香族カチオン性ペプチドが挙げられるがこれらに限定されない。
表5及び6に示されるペプチドのアミノ酸はL−またはD−構成のどちらであってもよい。
ペプチドは、当業者に公知の方法のいずれかによって合成され得る。タンパク質を化学合成するための好適な方法には、例えばSolid Phase Peptide Synthesis,Second Edition,Pierce Chemical Company(1984)及びMethods Enzymol.,289,Academic Press,Inc,New York(1997)において、Stuart及びYoungによって説明されるものが挙げられる。
左室リモデリング
心筋梗塞に続き、LV拡張、心不全、及び死に寄与する動的かつ進行性のLVリモデリングは起こる。心筋梗塞(MI)の1週間以内に、壊死域は薄くなって伸び(梗塞拡大)、梗塞域の局部的な拡張に寄与する。この現象は左室壁応力を増加させ、よって酸素必要量を増加させる。心筋喪失及び減少した拍出量を補うのを助けるために、左室は全体的な拡張を発達させ、左室の非梗塞壁は遠心性肥大を発達させ、それによって筋節が周囲または縦方向様式で付加される。心室が拡張すると、このプロセスは、最初に減少した拍出量を補うのを助けるが、進行性の拡張及び肥大は最終的にうっ血性心不全をもたらす。MIの1年後の死の最も強力な予測因子の1つは、左室の容量である。拡張すればするほど死の確率が高くなる。非梗塞心筋及び梗塞境界域の心筋の代謝異常及び機能異常は、LVリモデリング現象に寄与し得る。ミトコンドリア構造及び機能の異常は、弱化した心臓を支持するためにまさに必要な筋肉におけるATPの生成の減少をもたらし得る。したがって、D−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドは、心不全対象における残存する生存心筋の機能を安定化する及び強化するのに有用であり得る。いくつかの実施形態では、芳香族カチオン性ペプチドは、心筋梗塞後、対象に長期投与される。
本明細書に開示される組成物及び方法は、心筋梗塞及び/またはLVリモデリングの原因によって限定されることが意図されない。限定ではなく例として、心筋梗塞は、高血圧、虚血性心疾患、心毒性化合物への曝露、心筋炎、甲状腺疾患、ウイルス感染、歯肉炎、薬物乱用、アルコール乱用、心膜炎、アテローム性動脈硬化症、血管疾患、肥大型心筋症、急性心筋梗塞、左室収縮機能障害、冠動脈バイパス手術、飢餓、摂食障害、または遺伝的欠陥に起因し得る。
ミトコンドリア発生の促進
上記されたように、梗塞の周囲の非梗塞細胞すなわち境界域細胞は、減少した拍出量を補うためにそれらの構造を変化させる。境界域心臓細胞の構造及び機能の変化は、ミトコンドリア機能障害、ミトコンドリアの損失、及びミトコンドリアの再生の妨害をもたらす、ミトコンドリアの異常をもたらし得る。転写コアクチベータ(PGC1α及びPGC1β)を含むペルオキシソーム増殖因子活性化受容体ガンマコアクチベータ−1(PGC1)族は、ミトコンドリア発生の主要制御因子である。PGC1は、ミトコンドリア転写因子A(Tfam)の発現を制御するために、核コード呼吸タンパク質(NRF)を同時活性化し得る。TfamはミトコンドリアDNAの複製及び転写の両方に関与する。
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、MIの後のミトコンドリア発生を促進する。ミトコンドリア発生の促進は、PGC1(例えばPGC1α及びPGC1β)、NRF1、Tfam、またはそれらの組み合わせの発現の安定化及び/または増加を含むがこれらに限定されない。
グルコース及び脂肪酸酸化の制御
健常な成人の心臓では、脂肪酸の異化は、ATPの最大90%を提供する。しかしながら、心不全は、基質利用のグルコース酸化への移行を呈する。PGC1αは、直接的にペルオキシソーム増殖因子活性化受容体(PPAR)及びエストロゲン関連受容体(ERRα)を同時活性化する。PPAR及びERRαの両方のシミュレーションは増加した脂肪酸β−酸化をもたらす。さらに、PGC1は脂肪酸輸送体であるCD36及びグルコース輸送体であるGLUT4もまた制御する。
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、MI後のグルコース及び脂肪酸酸化を制御する。グルコース及び脂肪酸酸化の制御は、PPAR、ERRα、CD36、GLUT4、またはそれらの組み合わせの発現の安定化及び/または増加を含むがこれらに限定されない。
ミトコンドリア遺伝子発現の制御
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、MI後のミトコンドリア遺伝子発現を増加させる。MIの後、境界域細胞におけるミトコンドリア遺伝子発現は下方制御される。ミトコンドリア遺伝子発現の減少は、境界域細胞における酸化ストレスを増加させる。
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、MI後のミトコンドリアエネルギー代謝を上昇させる。上述されたように、ミトコンドリア遺伝子発現はMI後に下方制御される。特に、ミトコンドリア呼吸を含む遺伝子は減少した発現を示す。
心臓アポトーシスの減少
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、MI後の境界域心臓細胞のアポトーシスを減少させる。上記されたように、境界域細胞の追加のストレスは細胞アポトーシスをもたらし得る。アポトーシスは、酸化ストレスの組み合わせ、減少したミトコンドリア遺伝子発現、またはそれらの組み合わせに起因し得る。
心機能の改善
いくつかの実施形態では、例えばD−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、梗塞後の左室の心機能を改善する。左室心機能の改善は、減少したLV容量、改善されたLV短縮率、改善されたLV駆出率、低減した梗塞拡大、改善された血行動態、及び減少した肺容量を含むがこれらに限定されない。
いくつかの実施形態では、D−Arg−2′,6′−Dmt−Lys−Phe−NH2等の芳香族カチオン性ペプチドでの処置は、梗塞後の左室における瘢痕化を低減する。瘢痕化の低減は、減少した瘢痕周囲、減少した瘢痕厚さ、減少したセプタム厚さ、及び減少した拡大指数(LV内腔面積/合計LV面積×セプタム厚さ/瘢痕厚さとして表現される)を含むがこれらに限定されない。
芳香族カチオン性ペプチドの予防用途及び治療用途
概要。本明細書に記載される芳香族カチオン性ペプチドは、疾患を予防または治療するのに有用である。具体的には、本開示は、LVリモデリングを有するか、またはその危険性がある(罹りやすい)対象を処置する予防方法及び治療方法の両方を提供する。したがって、本方法は、有効量の芳香族カチオン性ペプチドを、それを必要とする対象に投与することによる、対象におけるLVリモデリングの予防及び/または治療を提供する。Tsutsui et al.“Mitochondrial oxidative stress,DNA damage,and heart failure.”Antioxidants and Redox Signaling.8(9):1737−1744(2006)を参照されたい。
治療方法。本技術の一態様は、治療目的のために対象におけるLVリモデリングを治療する方法を含む。治療応用では、組成物または薬品は、かかる疾患の疑いがあるまたは既に罹患している対象に、疾患の進行におけるその合併症及び中間病理表現型を含む疾患の症状を、治癒させるまたは少なくとも部分的に制止するのに十分な量で投与される。したがって、本発明はLVリモデリングを患っている個体を治療する方法を提供する。
LVリモデリングを罹患している対象は、当業者に既知の診断アッセイまたは予後アッセイのうちのいずれかまたはそれらの組み合わせによって特定され得る。例えば、LVリモデリングの典型的な症状には、増加したLV拍出量、低減したLV駆出率、不良な短縮率、増加した梗塞拡大、不良な血行動態、LV心筋における増加した瘢痕形成、及び増加した肺容量が挙げられる。
予防方法。一態様では、本発明は、対象に、梗塞を取り囲むLVリモデリングの開始または進行を予防する芳香族カチオン性ペプチドを投与することにより、対象におけるLVリモデリングを予防するための方法を提供する。LVリモデリングの危険性のある対象は、例えば本明細書に記載される診断アッセイまたは予後アッセイのうちのいずれかまたはそれらの組み合わせによって特定され得る。予防応用では、芳香族カチオン性ペプチドの医薬組成物または薬品は、疾患または病態に罹りやすいか、またはさもなければその危険性のある対象に、危険性を排除もしくは低減する、重度を和らげる、または疾患の生化学的、組織学的、及び/もしくは行動的症状、疾患の進行の間に呈するその合併症及び中間病理表現型を含む、疾患の発症を遅延させるのに十分な量で投与される。予防芳香族カチオン性ペプチドの投与は、疾患または障害が予防されるか、またはあるいはその進行を遅延するように、異常な特徴を示す症状の兆候の前に起こってもよい。
芳香族カチオン性ペプチド系治療薬の生物学的効果の決定。様々な実施形態では、好適なインビトロまたはインビボアッセイが、具体的な芳香族カチオン性ペプチド系治療薬の効果及びその投与が治療に適応されるかどうかを決定するために実施される。様々な実施形態では、インビトロアッセイは、所与の芳香族カチオン性ペプチド系治療薬が心不全の予防または治療において所望の効果を及ぼすかどうかを決定するために、代理の動物モデルを用いて実施され得る。治療における使用のための化合物は、ヒト対象において試験する前に、ラット、マウス、ニワトリ、ウシ、サル、ウサギ等を含むがこれらに限定されない好適な動物モデル系において試験され得る。同様に、インビボ試験については、ヒト対象への投与の前に、当業者に既知の動物モデル系のいずれかが使用され得る。
投与のモード及び有効な投与量
細胞、器官、または組織をペプチドに接触させるための当業者に既知の任意の方法が用いられ得る。好適な方法は、インビトロ、エクスビボ、またはインビボ方法を含む。インビボ方法は典型的に、上記されたもの等の芳香族カチオン性ペプチドの、哺乳類、好適にはヒトへの投与を含む。治療のためにインビボで使用された場合、芳香族カチオン性ペプチドは有効量(すなわち所望の治療効果を有する量)で対象に投与される。服用量及び投与量レジメンは、対象における感染の程度、使用される特定の芳香族カチオン性ペプチドの特徴、例えばその治療指数、対象、及び対象の病歴に依存する。
有効量は、医師及び臨床医が精通している方法によって前臨床試験及び臨床試験の間に決定され得る。本方法において有用なペプチドの有効量は、医薬化合物を投与するための多数の公知の方法のいずれかによって、それを必要とする哺乳類に投与され得る。ペプチドは全身または局所投与され得る。
ペプチドは、薬学的に許容される塩として製剤され得る。薬学的に許容される無機塩基から誘導される塩には、アンモニウム塩、カルシウム塩、銅塩、第二鉄塩、第一鉄塩、リチウム塩、マグネシウム塩、マンガン塩、亜マンガン塩、カリウム塩、ナトリウム塩、及び亜鉛塩等が挙げられる。薬学的に許容される有機塩基から誘導される塩には、アルギニン、ベタイン、カフェイン、コリン、N,N′−ジベンジルエチレンジアミン、ジエチルアミン、2−ジエチルアミノエタノール、2−ジメチルアミノエタノール、エタノールアミン、エチレンジアミン、N−エチルモルホリン、N−エチルピペリジン、グルカミン、グルコサミン、ヒスチジン、ヒドラバミン、イソプロピルアミン、リジン、メチルグルカミン、モルホリン、ピペラジン、ピペラディン(piperadine)、ポリアミン樹脂、プロカイン、プリン、テオブロミン、トリエチルアミン、トリメチルアミン、トリプロピルアミン、トロメタミン等の、置換アミン、環状アミン、自然発生アミン等を含む、一級、二級、及び三級アミンの塩を含む。薬学的に許容される無機酸から誘導される塩には、ホウ酸、炭酸、ハロゲン化水素酸(臭化水素酸、塩酸、フッ化水素酸、またはヨウ化水素酸)、硝酸、リン酸、スルファミン酸、及び硫酸の塩が挙げられる。薬学的に許容される有機酸から誘導される塩には、脂肪族ヒドロキシル酸(例えばクエン酸、グルコン酸、グリコール酸、乳酸、ラクトビオン酸、リンゴ酸、及び酒石酸)、脂肪族モノカルボン酸(例えば酢酸、酪酸、プロパン酸、及びトルフルオロ酢酸)、アミノ酸(例えばアスパラギン酸及びグルタミン酸)、芳香族カルボン酸(例えば安息香酸、p−クロロ安息香酸、ジフェニル酢酸、ゲンチジン酸、馬尿酸、及びトリフェニル酢酸)、芳香族ヒドロキシル酸(例えばo−ヒドロキシ安息香酸、p−ヒドロキシ安息香酸、1−ヒドロキシナフタレン−2−カルボン酸、及び3−ヒドロキシナフタレン−2−カルボン酸)、アスコルビン酸、ジカルボン酸(例えばフマル酸、マレイン酸、シュウ酸、及びコハク酸)、グルクロン酸、マンデル酸、粘液酸、ニコチン酸、オロチン酸、パモン酸、パントテン酸、スルホン酸(例えばベンゼンスルホン酸、カンホスルホン酸(camphosulfonic acid)、エジシル酸(edisylic acid)、エタンスルホン酸、イセチオン酸、メタンスルホン酸、ナフタレンスルホン酸、ナフタレン−1,5−ジスルホン酸、ナフタレン−2,6−ジスルホン酸、ならびにp−トルエンスルホン酸)、キシナホン酸(xinafonic acid)等の塩が挙げられる。いくつかの実施形態では、塩はアセテートまたはトリフルオロアセテート塩である。
本明細書に記載される芳香族カチオン性ペプチドは、本明細書に記載される障害の治療または予防のために、対象に単独でまたは組み合わせて投与するための、医薬組成物に組み込まれ得る。かかる組成物は、典型的に活性剤及び薬学的に許容される担体を含む。補助活性化合物もまた組成物に組み込まれ得る。
医薬組成物は、典型的にその意図される投与経路に適合するように製剤される。投与経路の例には、非経口(例えば静脈内、皮内、腹腔内、または皮下)、経口、吸入、経皮(局所)、眼内、イオン導入、及び経粘膜投与が挙げられる。非経口、皮内、または皮下用途のために使用される溶液または懸濁液は、以下の構成成分:注射用蒸留水、生理食塩水、固定油、ポリエチレングリコール、グリセリン、プロピレングリコール、または他の合成溶剤等の滅菌希釈液;ベンジルアルコールまたはメチルパラベン等の抗菌剤;アスコルビン酸または亜硫酸水素ナトリウム等の抗酸化剤;エチレンジアミンテトラ酢酸等のキレート剤;アセテート、シトレート、またはホスフェート等の緩衝剤、及び塩化ナトリウムまたはブドウ糖等の浸透圧の調節のための薬剤を含み得る。pHは、塩酸または水酸化ナトリウム等の酸または塩基で調節され得る。非経口調製物は、ガラスまたはプラスチック製のアンプル、使い捨て注射器、または複数服用量バイアルに封入され得る。患者または治療する医師の利便性のために、投薬製剤は、治療過程(例えば7日間の治療)のための全ての必要な道具(例えば薬物のバイアル、希釈液のバイアル、注射器、及び注射針)を含むキット内に提供され得る。
注射可能な用途に好適な医薬組成物は、滅菌水溶液(水溶性の場合)または分散物、及び滅菌注射可能溶液または分散物の即時調製のための滅菌粉末を含み得る。静脈内投与については、好適な担体は、生理食塩水、静菌水、Cremophor EL(商標)(BASF,Parsippany,N.J.)、またはホスフェート緩衝生理食塩水(PBS)を含む。全ての場合で、非経口投与のための組成物は滅菌でなくてはならず、容易な注射可能性が存在する程度に流体であるべきである。これは製造及び保存の条件下で安定であるべきであり、細菌及び真菌等の微生物の汚染作用から保護されなくてはならない。
芳香族カチオン性ペプチド組成物は、例えば水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、及び液体ポリエチレングリコール等)、及びそれらの好適な混合物を含有する溶剤または分散媒であり得る、担体を含み得る。適切な流体性は、例えば、レシチン等のコーティングの使用によって、分散の場合は必要とされる粒径の維持によって、及び界面活性剤の使用によって、維持され得る。微生物の作用の予防は、様々な抗菌剤及び抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、チオメラソール(thiomerasol)等によって達成され得る。グルタチオン及び他の抗酸化剤が酸化を予防するために含まれ得る。多くの場合、組成物内に等張剤、例えば、糖、マンニトール等のポリアルコール、ソルビトール、または塩化ナトリウムを含むことが望ましい。注射可能な組成物の持続的吸収は、組成物内に吸収を遅延させる薬剤、例えばモノステアリン酸アルミニウムまたはゼラチンを含むことによってもたらされ得る。
注射可能な滅菌溶液は、活性化合物を、必要に応じて上記に列挙された成分のうちの1つまたは組み合わせを有する適切な溶剤中に、必要とされる量で組み込み、その後ろ過滅菌することによって調製され得る。概して、分散物は、活性化合物を、塩基性分散媒及び上記に列挙されたものからの必要とされる他の成分を含有する、滅菌媒体に組み込むことによって調製される。注射可能な滅菌溶液の調製のための滅菌粉末の場合、調製の典型的な方法は、真空乾燥及び凍結乾燥を含み、これはその事前に滅菌ろ過された溶液から活性成分及び任意の追加の所望の成分の粉末を産出することができる。
経口組成物は概して不活性希釈液または可食担体を含む。経口治療投与の目的のために、活性化合物は賦形剤と共に組み込まれ得、例えばタブレット、トローチ、またはカプセル、例えばゼラチンカプセルの形態で使用され得る。経口組成物は、マウスウォッシュとしての使用のために、流体担体を使用してもまた調製され得る。薬学的に適合する結合剤及び/またはアジュバント物質が組成物の一部として含まれ得る。タブレット、ピル、カプセル、トローチ等は、以下の成分:結晶セルロース、トラガントガム、もしくはゼラチン等の結合剤;デンプンもしくはラクトース等の賦形剤、アルギン酸、Primogel、もしくはトウモロコシデンプン等の崩壊剤;ステアリン酸マグネシウムもしくはSterotes等の潤滑剤;コロイド状二酸化ケイ素等の滑剤;スクロースもしくはサッカリン等の甘味料;またはペパーミント、サリチル酸メチル、もしくはオレンジ香味等の香味料のいずれかまたは同様の本質の化合物を含有し得る。
吸入による投与については、化合物は、好適な噴霧剤例えば二酸化炭素等のガスを含有する加圧容器もしくはディスペンサー、またはネブライザーからの、エアロゾルスプレーの形態で送達され得る。かかる方法は米国特許第6,468,798号に記載されるものを含む。
本明細書に記載される治療化合物の全身投与は、経粘膜または経皮手段によるものでもあり得る。経粘膜または経皮投与については、透過されるバリアに適切な浸透剤が製剤において使用される。かかる浸透剤は、概して当業者に既知であり、例えば経粘膜投与については、洗浄剤、胆汁酸塩、及びフシジン酸誘導体を含む。経粘膜投与は経鼻スプレーの使用によって達成され得る。経皮投与については、活性化合物は、当業者において概して既知である軟膏、膏薬、ゲル、またはクリームへと製剤される。一実施形態では、経皮投与はイオン導入によって実施され得る。
治療芳香族カチオン性タンパク質または芳香族カチオン性ペプチドは、担体系において製剤され得る。担体はコロイド系であり得る。コロイド系は、リポソーム、リン脂質二重層媒体であり得る。一実施形態では、治療ペプチドはペプチドの完全性を維持しながらリポソーム内に被包される。当業者に理解され得るように、リポソームを調製する様々な方法がある。Lichtenberg et al.,Methods Biochem.Anal.,33:337−462(1988);Anselem et al.,Liposome Technology,CRC Press(1993)を参照されたい。リポソーム製剤はクリアランスを遅延させ得、細胞取り込みを増加させ得る。Reddy,Ann.Pharmacother.,34(7−8):915−923(2000)を参照されたい。活性剤は、可溶性、不溶性、透過性、非透過性、生分解性、または胃保持型(gastroretensive)ポリマーまたはリポソームを含むがこれらに限定されない、薬学的に許容される成分から調製された粒子にも充填され得る。かかる粒子は、例えば、ナノ粒子、生分解性ナノ粒子、ミクロ粒子、生分解性ミクロ粒子、ナノ球体、生分解性ナノ球体、ミクロ球体、生分解性ミクロ球体、カプセル、乳剤、リポソーム、ミセル、及びウイルスベクター系を含むがこれらに限定されない。
担体はポリマー、例えば生分解性で生体適合性のポリマーマトリクスでもあり得る。一実施形態では、治療ペプチドはタンパク質完全性を維持しながら、ポリマーマトリクスに包埋され得る。ポリマーは、ポリペプチド、タンパク質、もしくは多糖等の自然、またはポリα−ヒドロキシ酸等の合成であり得る。例には、例えばコラーゲン、フィブロネクチン、エラスチン、セルロースアセテート、セルロースニトレート、多糖、フィブリン、ゼラチン、及びそれらの組み合わせで作られた担体が挙げられる。一実施形態では、ポリマーはポリ乳酸(PLA)または乳酸グリコール酸共重合体(PGLA)である。ポリマーマトリクスは、ミクロ球形及びナノ球形を含む様々な形態及び大きさで調製及び単離され得る。ポリマー製剤は、治療効果の持続的な期間をもたらし得る。(Reddy,Ann.Pharmacother.,34(7−8):915−923(2000)を参照されたい)。ヒト成長ホルモン(hGH)のためのポリマー製剤が、臨床試験において使用されている。Kozarich and Rich,Chemical Biology,2:548−552(1998)を参照されたい。
ポリマーミクロ球形持続放出製剤の例は、PCT公開第WO99/15154号(Tracyら)、米国特許第5,674,534号及び同第5,716,644号(両方Zaleら)、PCT公開第WO96/40073号(Zaleら)、ならびにPCT公開第WO00/38651号(Shahら)に記載される。米国特許第5,674,534号及び同第5,716,644号、ならびにPCT公開第WO96/40073号は、塩の凝集に対して安定化しているエリスロポエチンの粒子を含有するポリマーマトリクスを記載する。
いくつかの実施形態では、治療芳香族カチオン性化合物は、移植片及びマイクロカプセル化送達系を含む制御放出製剤等の、体からの急速な排除から治療化合物を保護する担体を用いて調製される。生分解性で生体適合性のポリマー、例えばエチレンビニルアセテート、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステエル、及びポリ乳酸が使用され得る。かかる製剤は既知の技術を使用して調製され得る。担体物質は商用的に、例えばAlza Corporation及びNova Pharmaceuticals,Inc.から得ることができる。リポソーム懸濁液(細胞特異性抗原へのモノクローナル抗体を有する特異的な細胞を標的とするリポソームを含む)もまた薬学的に許容される担体として使用され得る。これらは、例えば米国特許第4,522,811号に記載されるような当業者に既知の方法に従って調製され得る。
治療化合物は、細胞内送達を強化するためにも製剤され得る。例えば、リポソーム送達系は当業者に既知であり、例えばChonn and Cullis,“Recent Advances in Liposome Drug Delivery Systems,”Current Opinion in Biotechnology 6:698−708(1995);Weiner,“Liposomes for Protein Delivery:Selecting Manufacture and Development Processes,”Immunomethods,4(3):201−9(1994);及びGregoriadis,“Engineering Liposomes for Drug Delivery:Progress and Problems,”Trends Biotechnol.,13(12):527−37(1995)を参照されたい。Mizguchi et al.,Cancer Lett.,100:63−69(1996)は、インビボ及びインビトロ両方で細胞にタンパク質を送達するための融合誘導リポソームの使用を記載する。
治療薬の投与量、毒性、及び治療効果は、例えばLD50(集合のうちの50%に致死的な服用量)及びED50(集合のうちの50%において治療的に有効な服用量)を決定するために、細胞培養液または実験動物において標準薬学的手順によって決定され得る。毒性効果と治療効果との間の服用量比は治療指数であり、これは比LD50/ED50として表現することができる。高い治療指数を呈する化合物が好ましい。有毒な副作用を呈する化合物が使用され得るが、感染していない細胞への潜在的な損傷を最小化し、それによって副作用を低減するために、かかる化合物が影響を受けた組織の部位を標的とする送達系を設計するように配慮するべきである。
細胞培養液アッセイ及び動物実験から得られたデータは、人における使用のための投与量の範囲を公式化することにおいて使用することができる。かかる化合物の投与量は、好ましくは、毒性をほとんどまたは全く有さないED50を含む、血中濃度の範囲に存在する。投与量は、用いられる投薬形態及び利用される投与経路に依存して、この範囲で変化し得る。方法において使用される任意の化合物について、治療的に有効な服用量は、最初に細胞培養液アッセイから推定され得る。服用量は、細胞培養液において決定されたIC50(すなわち、症状の最大半減抑制を達成する試験化合物の濃度)を含む循環血漿中濃度範囲を達成するように、動物モデルにおいて公式化され得る。かかる情報は、人における有用な服用量をより正確に決定するために使用され得る。血漿中のレベルは、例えば高速液体クロマトグラフィによって測定され得る。
典型的に、治療または予防効果を達成するのに十分な、芳香族カチオン性ペプチドの有効量は、1日当たり体重1キログラム当たり約0.000001mg〜1日当たり体重1キログラム当たり約10,000mgの範囲である。好適には、投与量範囲は1日当たり体重1キログラム当たり約0.0001mg〜1日当たり体重1キログラム当たり約100mgである。例えば、投与量は、毎日、1日おき、もしくは2日おきに1mg/kg体重もしくは10mg/kg体重、または毎週、2週間に1回、もしくは3週間に1回1〜10mg/kgの範囲であり得る。一実施形態では、ペプチドの単回投与量は体重1キログラム当たり0.001〜10,000マイクログラムの範囲である。一実施形態では、担体における芳香族カチオン性ペプチド濃度は、送達された1ミリリットル当たり0.2〜2000マイクログラムの範囲である。例示的な治療体制は、1日1回または1週間に1回の投与を必要とする。治療応用では、比較的短い間隔での比較的多い投与量は、疾患の進行が低減されるか、または終結するまで、かつ好ましくは、対象が疾患の症状の部分的または完全な改良を示すまで、必要とされることがある。その後、患者は、予防体制を投与され得る。
いくつかの実施形態では、芳香族カチオン性ペプチドの治療的に有効な量は、10-12〜10-6モル、例えばおよそ10-7モルの、標的組織でのペプチドの濃度として定義され得る。この濃度は、0.001〜100mg/kgの全身服用量または体の表面積による同等の服用量によって、送達され得る。服用量のスケジュールは、最も好ましくは単一の毎日または毎週の投与によって、しかし連続投与(例えば非経口点滴または経皮応用)もまた含み、標的組織での治療濃度を維持するように最適化され得る。
当業者は、疾患または障害の重度、以前の治療、対象の全体的な健康及び/または年齢、ならびに存在する他の疾患を含むがこれらに限定されない特定の因子が、対象を有効に治療するために必要とされる投与量及びタイミングに影響を及ぼし得ることを理解するだろう。さらに、治療的に有効な量の本明細書に記載される治療組成物での対象の治療は、単一の治療または一連の治療を含み得る。
本方法に従って治療される哺乳類は、例えば、ヒツジ、ブタ、ウシ、及びウマ等の家畜動物、イヌ及びネコ等のペット動物、ラット、ネズミ、及びウサギ等の実験室動物を含む、任意の哺乳類であってもよい。好ましい実施形態では、哺乳類はヒトである。
芳香族カチオン性ペプチド及び他の治療薬を用いた組み合わせ療法
いくつかの実施形態では、芳香族カチオン性ペプチドは、心不全の予防または治療のための1つ以上の追加の薬剤と組み合わされ得る。心不全のための薬物処置は、典型的に利尿薬、ACE阻害薬、ジゴキシン(ジギタリスとも呼ばれる)、カルシウムチャネル遮断薬、及びベータ遮断薬を含む。軽度の場合、25〜50mg/日のヒドロクロロチアジドまたは250〜500mg/日のクロロチアジド等の、チアジド利尿薬が有用である。しかしながら、慢性多尿は低カリウム血性アルカローシスを引き起こすため、補助的な塩化カリウムが必要とされ得る。さらに、チアジド利尿薬はたいてい心不全の進行した症状を有する患者において有効でない。ACE阻害薬の典型的な服用量は、25〜50mg/日のカプトプリル及び10mg/日のキナプリルを含む。
一実施形態では、芳香族カチオン性ペプチドはアドレナリン作用性ベータ−2作動薬と組み合わされる。「アドレナリン作用性ベータ−2作動薬」は、アドレナリン作用性ベータ−2作動薬ならびにその類似体及び誘導体を指し、例えばアドレナリン作用性ベータ−2作動薬生物活性を有する自然または合成機能的変異体、ならびにアドレナリン作用性ベータ−2作動薬生物活性を有するアドレナリン作用性ベータ−2作動薬の断片を含む。「アドレナリン作用性ベータ−2作動薬生物活性」という用語は、対象におけるアドレナリン及びノルアドレナリンの効果を模倣し、心不全を有する患者における心筋収縮力を改善する活性を指す。一般的に既知のアドレナリン作用性ベータ−2作動薬には、クレンブテノール、アルブテロール、ホルメオテロール(formeoterol)、レバルブテロール、メタプロテレノール、ピルブテロール、サルメテロール、及びテルブタリンが挙げられるが、これらに限定されない。
一実施形態では、芳香族カチオン性ペプチドはアドレナリン作用性ベータ−1拮抗薬と組み合わされる。アドレナリン作用性ベータ−1拮抗薬及びアドレナリン作用性ベータ−1遮断薬は、アドレナリン作用性ベータ−1拮抗薬ならびにその類似体及び誘導体を指し、例えば、アドレナリン作用性ベータ−1拮抗薬生物活性を有する自然または合成機能的変異体、ならびにアドレナリン作用性ベータ−1拮抗薬生物活性を有するアドレナリン作用性ベータ−1拮抗薬の断片を含む。アドレナリン作用性ベータ−1拮抗薬生物活性は、ベータ受容体へのアドレナリンの効果を遮断する活性を指す。一般的に既知のアドレナリン作用性ベータ−1拮抗薬には、アセブトロール、アテノロール、ベータキソロール、ビソプロロール、エスモロール、及びメトプロロールが挙げられるがこれらに限定されない。
例えばクレンブテノールは、Spiropent(登録商標)(Boehinger Ingelheim)、Broncodil(登録商標)(Von Boch I)、Broncoterol(登録商標)(Quimedical PT)、Cesbron(登録商標)(Fidelis PT)、及びClenbuter(登録商標)(Biomedica Foscama)を含む多数の商標名の下で入手可能である。同様に、メトプロロール等のアドレナリン作用性ベータ−1拮抗薬ならびにそれらの類似体及び誘導体を調製する方法は、当業者に公知である。特にメトプロロールは、Novartis Pharmaceuticals Corporation,One Health Plaza,East Hanover,N.J.07936−1080によって製造されるLopressor(登録商標)(メトプロロールターテート(tartate))の商標名の下で商用的に入手可能である。Lopressor(登録商標)のジェネリック医薬品は、Mylan Laboratories Inc.,1500 Corporate Drive,Suite 400,Canonsburg,Pa.15317、及びWatson Pharmaceuticals,Inc.,360Mt.Kemble Ave.Morristown,N.J.07962からも入手可能である。メトプロロールは、Astra Zeneca,LPによって製造されるToprol XL(登録商標)という商標名の下でもまた商用的に入手可能である。
一実施形態では、相乗的な治療効果が生成されるように、追加の治療薬が芳香族カチオン性ペプチドと組み合わせて対象に投与される。したがって、治療薬のうちの1つまたは両方のより少ない服用量が、LVリモデリングの治療において使用され得、上昇した治療効果及び低減した副作用をもたらす。
任意の場合で、複数の治療薬が任意の順序でまたは同時にすら投与されてもよい。同時の場合、複数の治療薬は、単一の統一形態でまたは複数の形態で(単なる例としては、単一のピルとしてまたは2つの別個のピルとして)提供され得る。治療薬のうちの1つは複数の服用量で与えられ得、または両方が複数の服用量として与えられ得る。同時でない場合、複数の服用量の間のタイミングは、0週間を超えて4週間未満の間で変化し得る。加えて、組み合わせ方法、組成物、及び製剤は、2つの薬剤のみの使用に限定されない。
実施例1:心筋梗塞後に投与されたD−Arg−2′,6′−Dmt−Lys−Phe−NH2が心機能を改善し左室リモデリングを予防した
この実験の目的は、1)ミトコンドリア機能及び発生の制御因子及び媒介物、2)ミトコンドリア遺伝子発現、3)ミトコンドリアエネルギー代謝、4)心臓アポトーシス、及び5)慢性心筋梗塞ラットモデルにおける心筋梗塞(MI)の炎症における変化への、D−Arg−2′,6′−Dmt−Lys−Phe−NH2の効果を調査することであった。
方法
RNA単離及びqRT−PCR
正常な非梗塞ラット、水で処置された(境界域及び遠隔領域)MIを有するラット、及びD−Arg−2′,6′−Dmt−Lys−Phe−NH
2で処置されたMIを有するラットにおける、新鮮な凍結した左室組織からの全RNAを、Trizol試薬(Invitrogen)を使用して抽出した。全RNAは、RNase−free DNaseで処置し、RNaseミニキット(Qiagen)を使用して純化した。iScript(商標)cDNA Synthesis Kit(Bio−Rad)をcDNA合成のために使用し、定量RT−PCRをCFX96 TouchリアルタイムPCRシステム(Bio−Rad)を使用して実施した。実験で使用されたPCRプライマーを表7に記載する。
全RNAは、RNase−free DNaseで処置し、RNaseミニキット(Qiagen)を使用して純化した。逆転写反応を、RT2−First Strand Kit(SABiosciences)を使用し、全RNAの500ngを用いて実施した。ラットミトコンドリアPCRアレイ及びミトコンドリアエネルギー代謝PCRアレイは、ミトコンドリア関連遺伝子発現(ラットミトコンドリア、PARN−087ZD;ラットミトコンドリアエネルギー代謝、PARN−008ZD、SABiosciences)を測定するために、Bio−radのCFX96TouchリアルタイムPCR解析システムを使用して実施された。データ分析は、ΔΔCT方法を使用し、ウェブ系ソフトウェアによって実施した。
TUNELアッセイ
TUNELアッセイを、製造者の説明書に従ってIn Situ Cell Death Detection Kit(Roche)を使用することにより実施した。切片はホルマリン固定パラフィン包埋心臓組織のものであった。核はDAPI(Vector Laboratories)で対比染色した。ビュー当たりのTUNEL陽性細胞及び合計細胞数を、蛍光顕微鏡下で計数及び記録した。
統計的分析
全ての結果は、手段+/−SEMとして表現し、適切なようにスチューデントt検定または一元配置分散分析を使用して分析する。統計的に有意な差はp<0.05で確立した。
結果
D−Arg−2′,6′−Dmt−Lys−Phe−NH2はミトコンドリア発生を促進する。
D−Arg−2′,6′−Dmt−Lys−Phe−NH2が、慢性心筋梗塞ラットモデルにおけるミトコンドリア発生を促進することができるかどうかを決定するために、以下の群:1)擬似(非梗塞正常心臓)、2)MI/BZ(処置されなかったMI心臓の境界域)、3)MI/BZ+D−Arg−2′6′−Dmt−Lys−Phe−NH2(D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置されたMI心臓の境界域)、4)MI/R(処置されなかったMI心臓の遠隔領域)、及び5)MI/R+D−Arg−2′,6′−Dmt−Lys−Phe−NH2(D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置されたMI心臓の遠隔領域)が、実験された。データは、PGC1α、PGC1β、NRF1、及びTfamが、MI/BZ群において減少し、MI/R群のいずれにおいても変更しなかったことを示した(図1B、1D、1F、及び1H)。図に示されるように、D−Arg−2′,6′−Dmt−Lys−Phe−NH2は、PGC1及びその標的遺伝子の発現レベルを安定化した(図1A、1C、1E、及び1G)。
D−Arg−2′6′−Dmt−Lys−Phe−NH2はグルコース及び脂肪酸酸化を制御する
D−Arg−2′,6′−Dmt−Lys−Phe−NH2がグルコース及び脂肪酸酸化に影響を及ぼしたかどうかを決定するために、ERRα、PPARα、及びPPARδの発現レベルを測定した。図2は、D−Arg−2′,6′−Dmt−Lys−Phe−NH2が境界域心筋細胞におけるERRα及びPPARαの発現を安定化し(図2A及び2C)、一方で、PPARδ発現レベルは境界域細胞において低いままであったこと(図2E)を実証する。加えて、脂肪酸輸送体であるCD36、及びグルコース輸送体であるGLUT4の発現レベルを測定した。これらの2つの遺伝子は、PGC1の下流標的でもあり、脂肪酸及びグルコース酸化に関与する。PGC1の効果と同様に、CD36及びGLUT4の発現は、擬似と比較して、MI/BZ群において有意に減少した。さらに、D−Arg−2′,6′−Dmt−Lys−Phe−NH2は、これらの2つの遺伝子の発現レベルを有意に安定化した(図2G及び2I)。遠隔領域における変化は、図2B、2D、2F、2H、及び2Jに示す。
D−Arg−2′6′−Dmt−Lys−Phe−NH2は6週間の炎症に効果を示さない。
公開された原稿は、D−Arg−2′,6′−Dmt−Lys−Phe−NH2が炎症を低減することを示す。D−Arg−2′,6′−Dmt−Lys−Phe−NH2の慢性心筋梗塞ラットモデルにおける炎症への効果を決定するために、5つの一般的な炎症サイトカインを評価した。インターロイキン6(IL−6)及びMCP1の遺伝子発現は、擬似に対してMI/BZ及びMI/Rにおいて増加した(図3C、3D、3E、及び3F)。TNFα及びインターフェロン発現は、擬似に対してMI/BZ群において減少した(図3G及び3I)。TGFβ1は変わらないままであった(図3A及び3B)。D−Arg−2′,6′−Dmt−Lys−Phe−NH2の効果は、図3A〜3Iで6週間モデルにおける心臓組織について示される。
D−Arg−2′,6′−Dmt−Lys−Phe−NH2は、ミトコンドリア遺伝子発現を回復する
D−Arg−2′,6′−Dmt−Lys−Phe−NH2での長期処置が心筋梗塞後におけるミトコンドリア遺伝子発現に影響を及ぼすかどうかを決定するために、ラットミトコンドリアPCRアレイを、擬似、群1(MI/BZ)、群2(MI/BZ+D−Arg−2′,6′−Dmt−Lys−Phe−NH2)、群3(MI/R)、及び群4(MI/R+D−Arg−2′,6′−Dmt−Lys−Phe−NH2)からのミトコンドリア機能に関与する84遺伝子の発現を測定するために使用した。データは、ミトコンドリア遺伝子のほとんど(84遺伝子のうち74)が、擬似と比較して群1(MI/BZ)において減少したことを明らかにした。データは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2の投与が、群1に対して群2におけるミトコンドリア遺伝子発現を安定化したことを示した。ボルカノプロット(volcano plot)は、群1に対して群2において上昇した発現レベルと関連付けられる有意の変化を示す15遺伝子があったことを特定した(図4)。その15遺伝子は表8にまとめる。しかしながら、D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置された非虚血性遠隔領域または処置されなかった非虚血性遠隔領域におけるミトコンドリア遺伝子発現に有意な差はなかった(図5)。
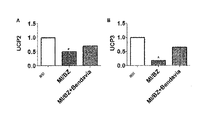
さらに、qRT−PCRは、脱共役タンパク質−2(UCP2)発現レベル及び脱共役タンパク質−3(UCP3)発現レベルが、擬似と比較してMI/BZ群において有意に減少したことを示した(図13)。データは、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2が、境界域におけるUCP2及びUCP3の発現を安定化したことを示した(図13A及び13B)。
ミトコンドリアエネルギー代謝PCRアレイを、5つのミトコンドリア複合体全てを含む、ミトコンドリア呼吸に関与する遺伝子発現を測定するために使用した。ヒートマップは、擬似に対する群1における遺伝子発現(84のうち70)の減少が、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2の投与によって大きく逆転されたことを示した。遺伝子のほとんどの遺伝子発現は、図6(群1対群2)に示されるように、処置されなかった試料と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2投与によって増加した。発現において統計的に有意な上昇を示す5遺伝子を表9にまとめる。
D−Arg−2′,6′−Dmt−Lys−Phe−NH2が心機能を改善する機構を調査するために、境界域における細胞アポトーシスの程度を試験した。D−Arg−2′,6′−Dmt−Lys−Phe−NH2での処置は、処置されなかったMI境界域群と比較して、境界域細胞におけるTUNEL陽性核の減少の傾向を示した(図7)。
実施例2: 心筋梗塞後に投与されたD−Arg−2′,6′−Dmt−Lys−Phe−NH2はLV機能を改善した
本実験は、ラットにおける経壁の非再潅流梗塞による心不全の誘導の2時間後に開始される、D−Arg−2′,6′−Dmt−Lys−Phe−NH2での長期処置が、結果を改善し得ることを実証する。D−Arg−2′,6′−Dmt−Lys−Phe−NH2処置が永続的冠動脈閉塞の2時間後に開始するため、あらゆる利益はノーリフロー減少等の現象から独立し得る。冠動脈閉塞の2時間後、虚血性壊死によって死ぬことになっていた細胞の全てまたはほぼ全てが、ラットモデルにおいて死んだ。本実験は、D−Arg−2′,6′−Dmt−Lys−Phe−NH2の、LV容量を減少させ、短縮率及び駆出率を改善し、梗塞拡大を低減し、生存を改善し、血行動態を改善し、肺容量を減少させる能力を測定した。
方法
ラットを麻酔し、通気し、左第4肋間腔において開胸を実施した。ラットを手順の間温熱パッド上に置くことで、温度を36℃に維持した。心膜を切除し、近位の左冠動脈を単離し縫合術で永続的に閉塞させた。冠動脈閉塞を、心室の前壁のチアノーゼ及びアキネジアによって確認した。胸は閉じられ、空気を排出し、ラットを回復させた。獣医によって鎮痛剤が投与された。心エコー図は、冠動脈閉塞のおよそ15分後に得られた。2時間後、ラットを無作為化し、長期の毎日のD−Arg−2′,6′−Dmt−Lys−Phe−NH2(Alzet Osmotic Pumpによって3mg/kg/日で皮下送達された)または水を受けた。Osmotic Pumpは、6週間にわたりおよそ0.15μl/時を送達した(モデル2006、200μl)。Azlatポンプは、ラットがなお麻酔されている間に、肩甲骨の間で皮下に埋め込んだ。6週間後、ラットを再び麻酔し、計量し、麻酔下で第2の心エコー図が得られた。頸動脈及び頸静脈を単離するために、血管切開を実施した。心拍数及び血圧を測定した。Millarカテーテルを左室に挿入し、LV収縮期圧、LV拡張終期圧、+dP/dt、及び−dP/dtを測定した。左室造影を、LV拍出量及び駆出率を決定するために、IV蛍光透視対比を使用して実施した。深い麻酔下で、心臓を切除し、計量し、ホルマリンで11mmHgに圧力固定した。肺も切除し計量した。死後の左室容量を、LV内腔を流体で充填し合計流体を測定することによって測定した。心臓は4つの横断面に切り、組織学的スライドガラスを調製し、ヘマトキシリン及びエオシンで、ならびにコラーゲンを染色するピクロシリウスレッドで染色した。定量組織学的分析は、合計周囲、瘢痕周囲、非梗塞壁周囲、合計LV面積、合計LV内腔面積、LV壁厚さ(数箇所で)、非梗塞壁厚さ、心筋梗塞拡大指数を含んだ。
統計的分析
全てのデータを手段±SEMとして報告する。群間の値をスチューデントt検定によって比較した。pはp<0.05レベルで有意である。
結果
合計83匹のラットが本実験に関与した。9匹のラットが冠動脈閉塞の2時間後以内(D−Arg−2′,6′−Dmt−Lys−Phe−NHまたは水での処置の前)に死亡した。74匹のラットを無作為化し、D−Arg−2′,6′−Dmt−Lys−Phe−NH2または水を受け、その後の6週間の処置の間に死亡したラットはいなかった。20のラットの心臓(各群において10)を、遺伝子発現実験の評価のために収集した。54匹のラットは心機能及び梗塞後のリモデリング実験の評価のために使用した。
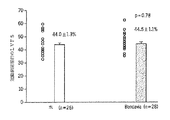
心エコー検査によるLV短縮率
冠動脈閉塞の前の基線の左室短縮率(LVFS)は水群(44.0±1.3%)とD−Arg−2′,6′−Dmt−Lys−Phe−NH2群(44.5±1.1%、p=0.78)との間で同様であった(図8A)。冠動脈閉塞の15分後、LVFSは2つの群の間で同様のままであった(水群において42.7±1.6及びD−Arg−2′6′−Dmt−Lys−Phe−NH2群において45±1.8、p=0.36)(LVFSはおそらく非虚血性心筋における高収縮のため15分で減少しなかった)(図8B)。
処置の6週間後、LVFSは基線に対して低下したが、D−Arg−2′,6′−Dmt−Lys−Phe−NH2群において(28.8±1.7%)、水群(23.8±1.8%、p=0.047)においてよりも、有意に高かった(図8C)。
LV心室造影法によるLV拍出量及び駆出率
処置の6週間後、水群(0.231±0.008、p=0.029)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置された群において有意に高いLV拍出量(0.257±0.008ml)があった(図9A)。さらに、水群(49.3±1.4%、p=0.005)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH2で処置された群において有意により高いLV駆出率(55.3±1.4%)があった(図9B)。
血行動態
処置の6週間後で、2つの群の間に心拍数、収縮期及び拡張期血圧において有意な差は認められなかった(表10)。左室陽性/陰性dP/dt、収縮終期左室圧、拡張終期左室圧、Tau(Weiss)及びTau(Glantz)は、2つの群の間で比較可能であった(表11)。水群(2.23±0.70mmHg、p=0.082)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2群(0.64±0.55mmHg)においてより低い最小左室圧の傾向があった(表11)。
LV容量を心臓重量によって標準化すると、水群と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2で処置された群において有意により低い死後LV容量があった(D−Arg−2′,6′−Dmt−Lys−Phe−NH
2群における0.72±0.02対水群における0.79±0.08、p=0.0019)(表12、図10)。
処置の6週間後、組織学的分析は、LV非瘢痕周囲が、水群(13.7±0.0.6mm、p=0.02)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2群において(15.4±0.4mm)有意により長かったことを明らかにした(図11A)。さらに、瘢痕周囲は水群(12.1±0.7%、p=0.025)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2群において(9.9±0.6mm)有意により短かった(図11B)。データは、合計LV周囲の百分率として表現される瘢痕周囲が、水群(47.4±0.03%、p=0.024)と比較して、D−Arg−2′,6′−Dmt−Lys−Phe−NH
2群(39.7±2.2%)において有意に小さいことも示した(表13、図11C)。瘢痕厚さ、セプタム厚さ、及び[LV内腔面積/合計LV面積×セプタム厚さ/瘢痕厚さ]として表現される拡大指数は、2つの群の間で比較可能であった(表13)。
肺の乾燥重量及び湿潤重量を測定し、乾燥/湿潤の比は2つの群において同様であった。
データは、ラットにおける結紮左冠動脈による心筋梗塞の誘導の2時間後に開始される、D−Arg−2′,6′−Dmt−Lys−Phe−NH2での長期処置が、処置の6週間後に、心機能を改善し、心筋梗塞後のリモデリングを予防することを実証した。D−Arg−2′6′−Dmt−Lys−Phe−NH2は、瘢痕厚さを増加させずに瘢痕周囲を減少させ、この現象は他の療法では以前に観察されていない。
実施例3. D−Arg−2′,6′−Dmt−Lys−Phe−NH2の、心不全のげっ歯類モデルにおける梗塞後のリモデリング及び心機能への効果
この実験では、D−Arg−2′,6′−Dmt−Lys−Phe−NH2を、それが心機能を改善し、心不全の梗塞後モデルにおける有益なミトコンドリア遺伝子発現をもたらし得るかどうかを調べるために、試験した。
方法
ラットは実施例2に記載されたように永続的な冠動脈結紮を受けた。ラットは2つの群に分け、200〜300ng/mlのD−Arg−2′,6′−Dmt−Lys−Phe−NH2または0.9%NaCl(生理食塩水)で、各動物に埋め込まれた小型浸透圧ポンプにより連続して6週間にわたり処置した。
6週間後、LV機能を心エコー検査で評価した。さらに、心臓を切除し、テトラゾリウム塩染色を使用して心臓組織をLV心臓室容量について分析した。梗塞の周囲の境界域及び遠隔領域における心臓細胞もまた、回収され、ミトコンドリア代謝に関与する遺伝子の発現レベルを決定するために、遺伝子アレイ分析を受けた。
結果
図12は、D−Arg−2′,6′−Dmt−Lys−Phe−NH2での処置が、LV容量/心臓重量の減少をもたらしたことを示す。
データは、D−Arg−2′,6′−Dmt−Lys−Phe−NH2での長期処置が、心不全の梗塞後モデルにおけるLV拡張を低減したことを示す。
等価物
本発明は、本出願に記載される特定の実施形態に関して限定されず、それらは本発明の個々の態様の単一の例示として意図される。本発明の多くの修正及び変形は、当業者にとって明らかであるように、その精神及び範囲から逸脱することなくなされ得る。本明細書に列挙されるのものに加え、本発明の範囲内の機能的に等価の方法及び装置は、上述の説明から当業者にとって明らかである。かかる修正及び変形は、添付の特許請求の範囲内に収まることが意図される。本発明は、添付の特許請求の範囲の用語及びかかる特許請求の範囲に権利がある等価物の完全な範囲によってのみ限定される。本発明は、特定の方法、試薬、化合物組成物、または生体系に限定されず、これらは当然のことながら変化し得ることが理解される。本明細書で使用される用語は、特定の実施形態を説明することのみを目的としており、限定的であることは意図されないこともまた理解される。
加えて、本開示の特長または態様がMarkush群に関して記載される場合、当業者は、本開示が、それによってMarkush群の任意の個々のメンバーまたはメンバーの下位群に関しても記載されることを認識するだろう。
当業者によって理解されるように、任意の及び全ての目的のために、特に書かれた説明を提供することに関して、本明細書に開示される全ての範囲は、その任意の及び全ての起こりうる下位範囲及び下位範囲の組み合わせもまた包括する。任意の記載される範囲は、同じ範囲が少なくとも2等分、3等分、4等分、5等分、10等分等に分解されることを十分に説明し、可能にすると容易に認識することができる。非限定的な例として、本明細書に記載される各範囲は、下部3分の1、中部3分の1、及び上部3分の1等に容易に分解することができる。同様に当業者に理解されるように、「最大」、「少なくとも」、「を超える」、「未満」等の言葉は、列挙される数を含み、上記されるように後に下位範囲に分解され得る範囲を指す。最後に、当業者によって理解されるように、範囲は各個々のメンバーを含む。よって、例えば、1〜3細胞を有する群は、1、2、または3細胞を有する群を指す。同様に、1〜5細胞を有する群は、1、2、3、4、または5細胞を有する群を指し、同様に続く。
本明細書で参照または引用された全ての特許、特許出願、仮出願、及び刊行物は、全ての図面及び表を含み、それらが本明細書の明白な教示と矛盾しない限り、それらの全体が参照により組み込まれる。
他の実施形態は、以下の特許請求の範囲で説明される。