JP2015521201A - Novel compounds and compositions for the treatment of respiratory control disorders or respiratory control disorders - Google Patents
Novel compounds and compositions for the treatment of respiratory control disorders or respiratory control disorders Download PDFInfo
- Publication number
- JP2015521201A JP2015521201A JP2015515140A JP2015515140A JP2015521201A JP 2015521201 A JP2015521201 A JP 2015521201A JP 2015515140 A JP2015515140 A JP 2015515140A JP 2015515140 A JP2015515140 A JP 2015515140A JP 2015521201 A JP2015521201 A JP 2015521201A
- Authority
- JP
- Japan
- Prior art keywords
- propylamino
- bis
- hydroxylamine
- triazin
- methyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CC(*)C(C(C(CC*)Br)O)[S+] Chemical compound CC(*)C(C(C(CC*)Br)O)[S+] 0.000 description 2
- VBHLVFXNKATLIC-UHFFFAOYSA-N CCCN(c1cc(NC(C)C)nc(N(CCC)N)n1)N Chemical compound CCCN(c1cc(NC(C)C)nc(N(CCC)N)n1)N VBHLVFXNKATLIC-UHFFFAOYSA-N 0.000 description 1
- ZGGUAWWFBSMLHX-UHFFFAOYSA-N CCCNc1nc(NCCC)nc(Cl)c1 Chemical compound CCCNc1nc(NCCC)nc(Cl)c1 ZGGUAWWFBSMLHX-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/53—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with three nitrogens as the only ring hetero atoms, e.g. chlorazanil, melamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/433—Thidiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
- A61K31/522—Purines, e.g. adenine having oxo groups directly attached to the heterocyclic ring, e.g. hypoxanthine, guanine, acyclovir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5355—Non-condensed oxazines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/16—Central respiratory analeptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/50—Three nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/26—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hetero atoms directly attached to ring carbon atoms
- C07D251/40—Nitrogen atoms
- C07D251/54—Three nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Abstract
本発明は、それを必要とする対象における呼吸制御疾患または呼吸制御障害の処置に有用な組成物を含む。本発明はまた、それを必要とする対象において呼吸疾患または呼吸障害を処置する方法であって、本発明の薬学的製剤の治療有効量を該対象に投与する段階を含む、方法を含む。本発明はさらに、それを必要とする対象において呼吸リズムの不安定化を予防するかまたは呼吸リズムを安定化させる方法であって、本発明の薬学的製剤の治療有効量を該対象に投与する段階を含む、方法を含む。The present invention includes compositions useful for the treatment of respiratory control disorders or disorders in a subject in need thereof. The invention also includes a method of treating a respiratory disease or disorder in a subject in need thereof, comprising the step of administering to the subject a therapeutically effective amount of a pharmaceutical formulation of the invention. The present invention is further a method of preventing or stabilizing respiratory rhythm instability in a subject in need thereof, wherein a therapeutically effective amount of a pharmaceutical formulation of the present invention is administered to the subject Including methods, including steps.
Description
関連出願の相互参照
本出願は、2012年5月29日出願の米国特許出願第13/482,837号の優先権を主張するものであり、米国特許出願第13/482,837号は、2011年11月29日出願の米国特許出願第13/306,349号の一部継続出願であってその優先権を主張するものであり、米国特許出願第13/306,349号には、2010年11月29日出願の米国仮特許出願第61/417,777号および2011年6月7日出願の米国仮特許出願第61/494,268号の米国特許法第119(e)条に基づく優先権が与えられ、これらの出願はいずれもその全体が参照により本明細書に組み入れられる。
This application claims priority from U.S. Patent Application No. 13 / 482,837 filed May 29, 2012, which is dated November 29, 2011. This is a continuation-in-part of U.S. Patent Application No. 13 / 306,349, which claims priority, and U.S. Patent Application No. 13 / 306,349 includes a US provisional application filed on Priority is granted under 35 U.S.C. 119 (e) of patent application 61 / 417,777 and U.S. provisional patent application 61 / 494,268 filed June 7, 2011, both of which are The entirety of which is hereby incorporated by reference.
発明の背景
呼吸の正常な制御は、血液中、組織中および脳内の二酸化炭素、pHおよび酸素などの化学的刺激のレベルに対する身体の解釈および応答を部分的に包含する複雑なプロセスである。呼吸制御は覚醒状態(すなわち患者が起きているかまたは眠っているか)、感情、姿勢および発声などの他の因子にも影響される。脳髄質内に存在する呼吸制御中枢は、呼吸に影響を与える様々なフィードフォワードシグナルおよびフィードバックシグナルを解釈し、呼吸作業を行う筋肉に指令を発する。主要な筋肉群は腹部、横隔膜、咽頭および胸部に位置する。次に、中枢および末梢に位置するセンサは、変化する代謝要件に対する応答を可能にする入力を脳の中枢呼吸制御区域に与える。
BACKGROUND OF THE INVENTION Normal control of respiration is a complex process that partially involves the body's interpretation and response to levels of chemical stimuli such as carbon dioxide, pH and oxygen in the blood, tissue and brain. Respiratory control is also affected by other factors such as wakefulness (ie whether the patient is awake or asleep), emotion, posture and vocalization. The respiratory control center that exists in the cerebral medulla interprets various feedforward and feedback signals that affect respiration and issues commands to the muscles that perform the breathing work. Major muscle groups are located in the abdomen, diaphragm, pharynx and chest. The centrally and peripherally located sensors then provide inputs to the central respiratory control area of the brain that allow responses to changing metabolic requirements.
例えば、身体の代謝的要求に適合するために十分な換気は、二酸化炭素レベル(CO2)の変化に対する身体の速やかな応答によって主に維持される。CO2レベルの増大が、呼吸の速度および深さを増大させるように身体にシグナルを送ることで、血中酸素レベルが上昇し、続いて血中CO2レベルが低下する。逆に、低CO2レベルは、呼吸に対する刺激が減少することから、低呼吸(呼吸減少)、または極端な場合では無呼吸(呼吸なし)の期間を生じさせることがある。これは、個人が過換気になる際に起こることである。 For example, sufficient ventilation to meet the body's metabolic needs is maintained primarily by the body's rapid response to changes in carbon dioxide levels (CO 2 ). An increase in CO 2 level signals the body to increase the rate and depth of respiration, which increases blood oxygen levels and subsequently decreases blood CO 2 levels. Conversely, low CO 2 levels may result in periods of hypopnea (respiratory decline) or, in extreme cases, apnea (no breathing), as stimulation to breathing is reduced. This is what happens when an individual becomes hyperventilated.
多くの疾患においては、正常な呼吸制御の損失が疾患の一次的または二次的な特徴である。呼吸制御の一次的な損失を伴う疾患の例としては、無呼吸(中枢性、混合型または閉塞性; 呼吸が10〜60秒間繰り返し中断する)および先天性中枢性低換気症候群がある。呼吸制御の二次的な損失は、慢性心肺疾患(例えば心不全、慢性気管支炎、肺気腫および切迫呼吸不全)、過体重(例えば肥満低換気症候群)、特定の薬物(例えば麻酔薬、鎮静薬、抗不安薬、睡眠薬、アルコールおよび麻薬性鎮痛薬)、ならびに/または神経系に影響を与える因子(例えば脳卒中、腫瘍、外傷、放射線障害およびALS)が理由でありうる。身体が慢性的に高レベルの二酸化炭素に曝露される慢性閉塞性肺疾患では、CO2/pH呼吸刺激を部分的に中和する効果を有する炭酸水素塩の腎臓媒介保持によって、身体が比較的低いpHに順応する。したがって、患者は、代謝的要求の変化に対する正常な換気応答を開始することができない。 In many diseases, loss of normal respiratory control is a primary or secondary feature of the disease. Examples of diseases with a primary loss of respiratory control include apnea (central, mixed or obstructive; breathing is interrupted repeatedly for 10-60 seconds) and congenital central hypoventilation syndrome. Secondary loss of respiratory control includes chronic cardiopulmonary disease (e.g. heart failure, chronic bronchitis, emphysema and impending respiratory failure), overweight (e.g. obesity hypoventilation syndrome), certain drugs (e.g. anesthetics, sedatives, anti Anxiety drugs, sleeping pills, alcohol and narcotic analgesics), and / or factors affecting the nervous system (eg, stroke, tumors, trauma, radiation damage and ALS) may be the reason. In chronic obstructive pulmonary disease, where the body is chronically exposed to high levels of carbon dioxide, kidney-mediated retention of bicarbonate, which has the effect of partially neutralizing CO 2 / pH respiratory stimuli, makes the body relatively Adapt to low pH. Thus, the patient cannot initiate a normal ventilation response to changes in metabolic demand.
睡眠呼吸障害は、呼吸制御の異常がヒトにおける重大な一般的疾患を導く一例である。睡眠時無呼吸は、頻繁な無呼吸または部分呼吸の期間を特徴とする。これらの無呼吸に寄与する主要な因子としては、解剖学的因子(肥満などの)、高炭酸ガス血性および低酸素性の換気応答の減少(例えば、それぞれ高二酸化炭素レベルおよび低酸素レベルに対する応答の減少)、ならびに「覚醒状態」(すなわち咽頭開大筋の駆動)の損失が挙げられる。無呼吸事象によって低酸素症(および関連する酸化ストレス)、最終的には重度の心血管事象(高血圧、脳卒中、心発作)が生じる。 Sleep-disordered breathing is one example where abnormal breathing control leads to a serious common disease in humans. Sleep apnea is characterized by periods of frequent apneas or partial breaths. Major factors contributing to these apneas include anatomical factors (such as obesity), decreased hypercapnic and hypoxic ventilation responses (e.g. response to high carbon dioxide and hypoxia levels, respectively) Loss), as well as loss of “wakefulness” (ie drive of the pharyngeal open muscle). Apnea events result in hypoxia (and associated oxidative stress) and ultimately severe cardiovascular events (hypertension, stroke, heart attack).
呼吸制御が損なわれる状態に罹患している米国の個人の推定数は、睡眠時無呼吸(1500万〜2000万人); 肥満低換気症候群(500万〜1000万人); 慢性心疾患(500万人); 慢性閉塞性肺疾患(COPD)/慢性気管支炎(1000万人); 薬物誘発性低換気(200万〜500万人); および人工呼吸離脱(50万人)を含む。 The estimated number of U.S. individuals suffering from impaired respiratory control is sleep apnea (15-20 million); obesity hypoventilation syndrome (5-10 million); chronic heart disease (500 Including chronic obstructive pulmonary disease (COPD) / chronic bronchitis (10 million); drug-induced hypoventilation (2 million to 5 million); and ventilatory withdrawal (500,000).
CO2および/または酸素の変化に応答する身体の正常な呼吸制御系の全体または一部を最小限の副作用で修復するために使用可能な新規化合物が当技術分野に求められている。そのような化合物は、呼吸制御障害の発症率および重症度を減少させる上で有益であろう。本発明はこれらの要求に対処および適合する。 There is a need in the art for new compounds that can be used to repair all or part of the body's normal respiratory control system in response to changes in CO 2 and / or oxygen with minimal side effects. Such compounds would be beneficial in reducing the incidence and severity of impaired respiratory control. The present invention addresses and meets these needs.
発明の簡単な概要
本発明は、以下からなる群より選択される少なくとも1つの化合物を含む組成物を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。
BRIEF SUMMARY OF THE INVENTION The present invention includes a composition comprising at least one compound selected from the group consisting of: N- (2,4-bis-n-propylamino) -N- (6-methylamino) )-[1,3,5] triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine (CLXXIII), N- (2,4, 6-Tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), its salts, and any combination thereof.
一態様では、塩は硫酸水素塩、塩酸塩、リン酸塩、リン酸水素塩またはリン酸二水素塩である。別の態様では、本組成物は少なくとも1つの薬学的に許容される担体をさらに含む。 In one aspect, the salt is hydrogen sulfate, hydrochloride, phosphate, hydrogen phosphate or dihydrogen phosphate. In another embodiment, the composition further comprises at least one pharmaceutically acceptable carrier.
本発明はまた、それを必要とする対象において呼吸制御障害または呼吸制御疾患を予防または処置する方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と以下からなる群より選択される少なくとも1つの化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。 The invention also includes a method of preventing or treating a respiratory control disorder or respiratory control disorder in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound selected from the group consisting of: N- (2, 4-Bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1 , 3,5] triazine (CLXXIII), N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), its salts, and any combinations thereof.
一態様では、呼吸制御障害または呼吸制御疾患は、呼吸抑制、睡眠時無呼吸、未熟児無呼吸、肥満低換気症候群、原発性肺胞低換気症候群、呼吸困難、低酸素症および高炭酸ガス血症からなる群より選択される。別の態様では、呼吸抑制は麻酔薬、鎮静薬、抗不安薬、睡眠薬、アルコールまたは麻薬によって引き起こされる。さらに別の態様では、呼吸制御障害または呼吸制御疾患を処置するために有用な少なくとも1つのさらなる化合物を含む組成物を対象にさらに投与する。さらに別の態様では、少なくとも1つのさらなる化合物は、アセタゾラミド、アルミトリン、テオフィリン、カフェイン、メチルプロゲステロン、セロトニンモジュレーター、カンナビノイドおよびアンパカインからなる群より選択される。さらに別の態様では、製剤を、対象に対する人工呼吸装置または気道陽圧装置の使用と組み合わせて投与する。さらに別の態様では、対象は哺乳動物である。さらに別の態様では、哺乳動物はヒトである。さらに別の態様では、製剤を、吸入、局所、経口、頬側、直腸、経膣、筋肉内、皮下、経皮、くも膜下腔内、腹腔内、胸腔内、胸膜内または静脈内経路によって対象に投与する。 In one aspect, the respiratory control disorder or respiratory control disorder is respiratory depression, sleep apnea, premature infant apnea, obesity hypoventilation syndrome, primary alveolar hypoventilation syndrome, dyspnea, hypoxia and hypercapnia Selected from the group consisting of symptoms. In another aspect, respiratory depression is caused by anesthetics, sedatives, anxiolytics, hypnotics, alcohol or narcotics. In yet another embodiment, the subject is further administered a composition comprising at least one additional compound useful for treating a respiratory control disorder or respiratory control disorder. In yet another embodiment, the at least one additional compound is selected from the group consisting of acetazolamide, aluminin, theophylline, caffeine, methylprogesterone, serotonin modulators, cannabinoids and ampakines. In yet another aspect, the formulation is administered in combination with the use of a ventilator or positive airway pressure device to the subject. In yet another aspect, the subject is a mammal. In yet another aspect, the mammal is a human. In yet another aspect, the formulation is administered by inhalation, topical, oral, buccal, rectal, vaginal, intramuscular, subcutaneous, transdermal, intrathecal, intraperitoneal, intrathoracic, intrapleural or intravenous route. To be administered.
本発明はまた、それを必要とする対象において呼吸リズムの不安定化を予防するかまたは呼吸リズムを安定化させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と以下からなる群より選択される少なくとも1つの化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。 The invention also includes a method of preventing or stabilizing respiratory rhythm instability in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound selected from the group consisting of: N- (2, 4-Bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1 , 3,5] triazine (CLXXIII), N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), its salts, and any combinations thereof.
一態様では、不安定化は、呼吸抑制、睡眠時無呼吸、未熟児無呼吸、肥満低換気症候群、原発性肺胞低換気症候群、呼吸困難、低酸素症および高炭酸ガス血症からなる群より選択される呼吸制御障害または呼吸制御疾患に関連している。別の態様では、呼吸抑制は麻酔薬、鎮静薬、抗不安薬、睡眠薬、アルコールまたは麻薬によって引き起こされる。さらに別の態様では、呼吸制御障害または呼吸制御疾患を処置するために有用な少なくとも1つのさらなる化合物を含む組成物を対象にさらに投与する。さらに別の態様では、少なくとも1つのさらなる化合物は、アセタゾラミド、アルミトリン、テオフィリン、カフェイン、メチルプロゲステロン、セロトニンモジュレーター、カンナビノイドおよびアンパカインからなる群より選択される。さらに別の態様では、製剤を、対象に対する人工呼吸装置または気道陽圧装置の使用と組み合わせて投与する。さらに別の態様では、対象は哺乳動物である。さらに別の態様では、哺乳動物はヒトである。さらに別の態様では、製剤を、吸入、局所、経口、頬側、直腸、経膣、筋肉内、皮下、経皮、くも膜下腔内、腹腔内、胸腔内、胸膜内または静脈内経路によって対象に投与する。 In one aspect, the destabilization consists of respiratory depression, sleep apnea, premature infant apnea, obesity hypoventilation syndrome, primary alveolar hypoventilation syndrome, dyspnea, hypoxia and hypercapnia It is associated with a more selected respiratory control disorder or respiratory control disorder. In another aspect, respiratory depression is caused by anesthetics, sedatives, anxiolytics, hypnotics, alcohol or narcotics. In yet another embodiment, the subject is further administered a composition comprising at least one additional compound useful for treating a respiratory control disorder or respiratory control disorder. In yet another embodiment, the at least one additional compound is selected from the group consisting of acetazolamide, aluminin, theophylline, caffeine, methylprogesterone, serotonin modulators, cannabinoids and ampakines. In yet another aspect, the formulation is administered in combination with the use of a ventilator or positive airway pressure device to the subject. In yet another aspect, the subject is a mammal. In yet another aspect, the mammal is a human. In yet another aspect, the formulation is administered by inhalation, topical, oral, buccal, rectal, vaginal, intramuscular, subcutaneous, transdermal, intrathecal, intraperitoneal, intrathoracic, intrapleural or intravenous route. To be administered.
本発明はまた、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)またはその塩を含み、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)が、(XXXV)またはその塩に対して約1%(w/w)に等しいまたはそれ未満のレベルで存在している、組成物を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) or a salt thereof, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is equal to or about 1% (w / w) relative to (XXXV) or a salt thereof Including a composition that is present at a level of less than.
一態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は(XXXV)またはその塩に対して約0.5%(w/w)に等しいまたはそれ未満のレベルで存在している。別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は(XXXV)またはその塩に対して約0.3%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は(XXXV)またはその塩に対して約0.2%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は(XXXV)またはその塩に対して約0.15%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は(XXXV)またはその塩に対して約0.1%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)は前記組成物中に本質的に存在していない。 In one aspect, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is about 0.5% (w / w) relative to (XXXV) or a salt thereof. Present at equal or lesser level. In another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is about 0.3% (w / w) based on (XXXV) or a salt thereof. Is present at a level less than or equal to In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is about 0.2% (w / w) relative to (XXXV) or a salt thereof. ) Is present at a level less than or equal to. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is about 0.15% (w / w) relative to (XXXV) or a salt thereof. ) Is present at a level less than or equal to. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is about 0.1% (w / w) relative to (XXXV) or a salt thereof. ) Is present at a level less than or equal to. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol (CLXXVIII) is essentially absent from the composition.
本発明はまた、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)またはその塩を含み、緩衝液および液体担体をさらに含む、組成物を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) or a salt thereof, The composition further comprises a buffer and a liquid carrier.
一態様では、(XXXV)の塩は硫酸水素塩(XXXVI)である。別の態様では、組成物はクエン酸をさらに含む。さらに別の態様では、組成物のpHは塩基によって調整されている。さらに別の態様では、塩基は水酸化ナトリウムを含む。さらに別の態様では、液体担体は水を含む。さらに別の態様では、組成物のpHは約2.5〜約6の範囲である。さらに別の態様では、組成物のpHは約2.5〜約5の範囲である。さらに別の態様では、組成物のpHは約3〜約4の範囲である。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約1〜10mg/mLである。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約5〜10mg/mLである。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約10mg/mLである。さらに別の態様では、本組成物は(XXXV)に対して0.5%(w/w)未満の(CLXXVIII)を含む。さらに別の態様では、(XXXV)に対して0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間6ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間12ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間18ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間24ヶ月にわたって形成される。 In one embodiment, the salt of (XXXV) is hydrogen sulfate (XXXVI). In another aspect, the composition further comprises citric acid. In yet another embodiment, the pH of the composition is adjusted with a base. In yet another aspect, the base comprises sodium hydroxide. In yet another aspect, the liquid carrier includes water. In yet another embodiment, the pH of the composition ranges from about 2.5 to about 6. In yet another embodiment, the pH of the composition ranges from about 2.5 to about 5. In yet another embodiment, the pH of the composition ranges from about 3 to about 4. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 1-10 mg / mL. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 5-10 mg / mL. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 10 mg / mL. In yet another embodiment, the composition comprises less than 0.5% (w / w) (CLXXVIII) relative to (XXXV). In yet another embodiment, less than 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol (XXXV) CLXXVIII) is formed at 2-8 ° C. over a 6 month shelf life of the composition. In yet another embodiment, less than 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol (XXXV) CLXXVIII) is formed at 2-8 ° C. over a 12 month shelf life of the composition. In yet another embodiment, less than 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol (XXXV) CLXXVIII) is formed at 2-8 ° C. over a shelf life of 18 months. In yet another embodiment, less than 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol (XXXV) CLXXVIII) is formed at 2-8 ° C. over a 24 month shelf life of the composition.
本発明はまた、図22のXRPDスペクトルを有するN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)の結晶性遊離塩基形態Aを含む。 The present invention also provides N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) having the XRPD spectrum of FIG. ) Crystalline free base form A.
本発明はまた、以下からなる群より選択される、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N.O-ジメチル-ヒドロキシルアミン(XXXV)の少なくとも1つの結晶性塩を含む: 図14のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態A; 図23のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性硫酸水素塩(XXXVI); 図24のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態C; 図25のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態D; 図26のXRPDスペクトルを有する、形態Aと形態Dとの混合物を含む結晶性硫酸水素塩(XXXVI); 図27のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態A; 図28のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態C; 図29のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性リン酸塩(CLXXX); 図30のXRPDスペクトルを有する、形態Cと形態Dとの混合物を含む結晶性リン酸塩(CLXXX); 図31のXRPDスペクトルを有する、形態Cと形態Eとの混合物を含む結晶性リン酸塩(CLXXX); およびそれらの任意の混合物。 The present invention also provides N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -NO-dimethyl-hydroxylamine (XXXV) selected from the group consisting of: At least one crystalline salt of: crystalline hydrogen sulfate (XXXVI) form A having the XRPD spectrum of FIG. 14; crystalline comprising a mixture of form A and form B having the XRPD spectrum of FIG. Crystalline hydrogen sulfate (XXXVI) Form C with XRPD spectrum of Figure 25; Crystalline hydrogen sulfate (XXXVI) Form D with XRPD spectrum of Figure 25; XRPD spectrum of Figure 26 Crystalline hydrogen sulfate (XXXVI) comprising a mixture of Form A and Form D having a crystalline phosphate (CLXXX) form A having an XRPD spectrum of FIG. 27; a crystal having an XRPD spectrum of FIG. Phosphate (CLXXX) Form C; Crystalline Phosphate (CLXXX) containing a mixture of Form A and Form B with the XRPD spectrum of Figure 29; XRPD of Figure 30 Crystalline phosphate (CLXXX) comprising a mixture of Form C and Form D having a cuttle; Crystalline phosphate (CLXXX) comprising a mixture of Form C and Form E having the XRPD spectrum of FIG. 31; And any mixture of them.
本発明はまた、硫酸約1モル当量を含む、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XXXV)の塩を含む。一態様では、塩は水1モル当量をさらに含む。 The present invention also includes a salt of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XXXV) containing about 1 molar equivalent of sulfuric acid. . In one aspect, the salt further comprises 1 molar equivalent of water.
本発明はまた、リン酸少なくとも1モル当量を含む、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N.O-ジメチル-ヒドロキシルアミン(XXXV)の塩を含む。一態様では、塩はリン酸約1モル当量を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -NO-dimethyl-hydroxylamine (XXXV) containing at least 1 molar equivalent of phosphoric acid. ) Salt. In one aspect, the salt comprises about 1 molar equivalent of phosphoric acid.
本発明はまた、それを必要とする対象においてカリウムmaxi-KもしくはBKチャネルの開口チャネル部分を減少または最小化させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物またはその塩とを含む薬学的製剤の有効量を対象に投与する段階を含む:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;R4はH、アルキルまたは置換アルキルであり;R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;R6はH、アルキル、置換アルキルまたはアルケニルであり;Xは結合、OまたはNR4であり;YはN、CR6またはCであり;ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;
YがCである場合、結合b1は単結合であり、かつ(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
The invention also includes a method of reducing or minimizing the open channel portion of a potassium maxi-K or BK channel in a subject in need thereof. The method comprises administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forms a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl; R 3 is H, alkyl , substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -NR 1 R 2, -C ( O) OR 1, acyl also Aryl; R 4 is an H, alkyl or substituted alkyl; R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1, -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 taken together to form 3,6,9-trioxa Forming a biradical selected from the group consisting of -undecane-1,11-diyl and 3,6-dioxa-octane-1,8-diyl; R 6 is H, alkyl, substituted alkyl or alkenyl; X is Bond, O or NR 4 ; Y is N, CR 6 or C; where
When Y is N or CR 6 , bond b 1 is not present and (i) Z is H, bond b 2 is a single bond and A is CH; or (ii) Z is absent, bond b 2 is absent and A is a single bond;
When Y is C, bond b 1 is a single bond, and (i) Z is CH 2 , bond b 2 is a single bond, and A is CH; or (ii) Z Is CH, bond b 2 is a double bond, and A is C.
本発明はまた、それを必要とする対象においてTASK-1(KCNK3)チャネルを阻害する方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物またはその塩とを含む薬学的製剤の有効量を対象に投与する段階を含む:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;R4はH、アルキルまたは置換アルキルであり;R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;R6はH、アルキル、置換アルキルまたはアルケニルであり;Xは結合、OまたはNR4であり;YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;
YがCである場合、結合b1は単結合であり、かつ(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
The invention also includes a method of inhibiting a TASK-1 (KCNK3) channel in a subject in need thereof. The method comprises administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forms a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl; R 3 is H, alkyl , substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -NR 1 R 2, -C ( O) OR 1, acyl also Aryl; R 4 is an H, alkyl or substituted alkyl; R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1, -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 taken together to form 3,6,9-trioxa Forming a biradical selected from the group consisting of -undecane-1,11-diyl and 3,6-dioxa-octane-1,8-diyl; R 6 is H, alkyl, substituted alkyl or alkenyl; X is A bond, O or NR 4 ; Y is N, CR 6 or C; where
When Y is N or CR 6 , bond b 1 is not present and (i) Z is H, bond b 2 is a single bond and A is CH; or (ii) Z is absent, bond b 2 is absent and A is a single bond;
When Y is C, bond b 1 is a single bond, and (i) Z is CH 2 , bond b 2 is a single bond, and A is CH; or (ii) Z Is CH, bond b 2 is a double bond, and A is C.
本発明はまた、それを必要とする対象において分時換気量を増大させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物またはその塩とを含む薬学的製剤の有効量を対象に投与する段階を含む:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;R4はH、アルキルまたは置換アルキルであり;R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;R6はH、アルキル、置換アルキルまたはアルケニルであり;Xは結合、OまたはNR4であり;YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;
YがCである場合、結合b1は単結合であり、かつ(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
The invention also includes a method of increasing minute ventilation in a subject in need thereof. The method comprises administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forms a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl; R 3 is H, alkyl , substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -NR 1 R 2, -C ( O) OR 1, acyl also Aryl; R 4 is an H, alkyl or substituted alkyl; R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1, -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 taken together to form 3,6,9-trioxa Forming a biradical selected from the group consisting of -undecane-1,11-diyl and 3,6-dioxa-octane-1,8-diyl; R 6 is H, alkyl, substituted alkyl or alkenyl; X is A bond, O or NR 4 ; Y is N, CR 6 or C; where
When Y is N or CR 6 , bond b 1 is not present and (i) Z is H, bond b 2 is a single bond and A is CH; or (ii) Z is absent, bond b 2 is absent and A is a single bond;
When Y is C, bond b 1 is a single bond, and (i) Z is CH 2 , bond b 2 is a single bond, and A is CH; or (ii) Z Is CH, bond b 2 is a double bond, and A is C.
一態様では、式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-(メトキシ(メチル)アミノ)-6-(n-プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン、6-[1,2]オキサジナン-2-イル-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン、6-((ベンジルオキシ)(イソプロピル)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン、6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン、4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(ピリジン-4-イル-メチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(テトラヒドロピラン-4-イル-メチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン、2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-N'-メチルヒドラジン、2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン、2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン、8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール、N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン、その塩、およびそれらの混合物。 In one embodiment, the compound of formula (I) is selected from the group consisting of: N- (4,6-bis-methylamino- [1,3,5] triazin-2-yl) -N, O— Dimethyl-hydroxylamine, N- (4,6-bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-cyclopropylmethyl)- N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-ethylamino) -N- (6-n-propyl Amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2-methylpropylamino)) [1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N , O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4,6-bis -n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4- (methoxy (methyl) amino) -6- (n-propylamino) -1,3,5-triazin-2-yl) propionamide, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, 6- (methoxy (methyl) amino) -N 2 -propyl-1,3,5-triazine-2,4-diamine, N- (4 , 6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [ 1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N- Isopropyl-hydroxy Ruamine, 6- [1,2] oxazinan-2-yl-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine, N- (4,6-bis-n-propylamino -[1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5 ] Triazin-2-yl) -N-ethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine, 6-((benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine, N- (4,6-bis-n-propylamino- [ 1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl ) -O-isobutyl-N-methyl-hydroxylamine, 6- (methyl (thiophen-2-ylmethoxy) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4 -Diamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine, N- (4,6 -Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1, 3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine, 4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6- N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (1-N-methylimidazol-2-yl) -methyl Amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (2-dimethylamino) Ethyl) amino)-[ 1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (pyridin-4-yl-methyl) amino)-[1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (tetrahydropyran-4-yl-methyl) amino]-[1,3,5] triazin-2-yl) -N, O- Dimethyl-hydroxylamine, N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -Trien-17-yl) -N, O-dimethylhydroxylamine, 2,6-bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (4,6-bis-n-propylamino -[1,3,5] Triazin-2-yl) -N-methyl-N'-methyl Hydrazine, 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-dimethylamino-7-methyl -Pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine, 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine, 8- (7-methyl-2- (n-propylamino)- Pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol, N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2-n-propylamino-7-methyl- Pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N -Methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N, N-dimethyl-N '-(2-n-propylamino-7 -Methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine, N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine, N- (2,4- Scan -n- propylamino) -N- (6-i- propylamino) -1,3-pyrimidine, its salts, and mixtures thereof.
一態様では、式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-n-プロピルアミノ-1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-[(2,6-ビス-n-プロピルアミノ)-ピリミジン-4-イル]-N,O-ジメチル-ヒドロキシルアミン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、その塩、およびそれらの混合物。 In one embodiment, the compound of formula (I) is selected from the group consisting of: N- (4,6-bis-n-propylamino-1,3,5] triazin-2-yl) -O-methyl -Hydroxylamine, N- (4,6-bis-n-propylamino-1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (2,4-bis-n -Propylamino) -N- (6-methylamino)-[1,3,5] triazine, N-[(2,6-bis-n-propylamino) -pyrimidin-4-yl] -N, O- Dimethyl-hydroxylamine, N, N-dimethyl-N ′-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, its salts, and mixtures thereof.
一態様では、式(I)の化合物はN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミンまたはその塩である。 In one embodiment, the compound of formula (I) is N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine or a salt thereof It is.
一態様では、薬学的製剤を静脈内注入によって投与する。別の態様では、薬学的製剤の注入量は少なくとも約0.016mg/kg/分である。さらに別の態様では、薬学的製剤の注入量は約0.016mg/kg/分である。さらに別の態様では、薬学的組成物の注入量は、対象において少なくとも約726ng/mLの血漿中濃度をもたらす。さらに別の態様では、対象は哺乳動物である。さらに別の態様では、哺乳動物はヒトである。 In one aspect, the pharmaceutical formulation is administered by intravenous infusion. In another embodiment, the infusion rate of the pharmaceutical formulation is at least about 0.016 mg / kg / min. In yet another embodiment, the dosage of the pharmaceutical formulation is about 0.016 mg / kg / min. In yet another embodiment, the infusion amount of the pharmaceutical composition results in a plasma concentration of at least about 726 ng / mL in the subject. In yet another aspect, the subject is a mammal. In yet another aspect, the mammal is a human.
本発明を例示する目的で、本発明の特定の態様を図面に示す。しかし、本発明は、図面に示す態様の正確な配置および機器構成に限定されない。 For the purpose of illustrating the invention, certain aspects of the invention are shown in the drawings. However, the present invention is not limited to the exact arrangement and configuration of the embodiments shown in the drawings.
発明の詳細な説明
一局面では、本発明は、本発明の化合物が呼吸刺激薬であって呼吸制御障害または呼吸制御疾患の処置において有用であるという予想外の発見に関する。
DETAILED DESCRIPTION OF THE INVENTION In one aspect, the present invention relates to the unexpected discovery that the compounds of the present invention are respiratory stimulants and are useful in the treatment of respiratory control disorders or respiratory control disorders.
定義
本明細書において使用される以下の各用語は、この節においてそれに関連づけられる意味を有する。
Definitions As used herein, each of the following terms has the meaning associated with it in this section.
別途定義しない限り、本明細書において使用されるすべての技術用語および科学用語は、本発明が属する技術分野の当業者が通常理解するものと同一の意味を一般に有する。一般に、本明細書において使用される命名法、ならびに動物薬理学、薬科学、分離科学および有機化学における実験手法は、当技術分野において周知でかつ一般的に使用されるものである。 Unless defined otherwise, all technical and scientific terms used herein generally have the same meaning as commonly understood by one of ordinary skill in the art to which this invention belongs. In general, the nomenclature used herein and experimental techniques in animal pharmacology, pharmaceutical science, separation science and organic chemistry are those well known and commonly used in the art.
本明細書において使用される「1つの」および「ある」という冠詞は、該冠詞の文法上の対象が1つまたは2つ以上(すなわち少なくとも1つ)であることを意味する。例として、「ある要素」とは1つの要素または2つ以上の要素を意味する。 As used herein, the articles “one” and “a” mean that the grammatical object of the article is one or more (ie, at least one). By way of example, “an element” means one element or more than one element.
本明細書において使用される「約」という用語は、当業者に理解されるものであり、それが使用される文脈によってある程度異なる。量、持続時間などの測定可能な値に言及する際に本明細書において使用される「約」という用語は、特定の値から±20%または±10%、より好ましくは±5%、さらに好ましくは±1%、さらに好ましくは±0.1%の変動であって、開示される方法を行う上で適切である変動を包含するように意図されている。 The term “about” as used herein is understood by one of ordinary skill in the art and will vary to some extent on the context in which it is used. The term “about” as used herein when referring to measurable values such as amount, duration, etc., is ± 20% or ± 10%, more preferably ± 5%, more preferably from a particular value. Is a variation of ± 1%, more preferably ± 0.1%, and is intended to encompass variations that are appropriate in performing the disclosed methods.
本明細書において使用される「対象」はヒトまたは非ヒト哺乳動物でありうる。非ヒト哺乳動物としては例えばヒツジ、ウシ、ブタ、イヌ、ネコおよびマウス哺乳動物などの家畜およびペットが挙げられる。好ましくは、対象はヒトである。 A “subject” as used herein can be a human or non-human mammal. Non-human mammals include, for example, livestock and pets such as sheep, cows, pigs, dogs, cats and mouse mammals. Preferably, the subject is a human.
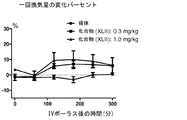
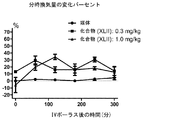
非限定的な態様では、血液ガス測定値を報告するために使用する以下の用語法は、当業者に周知であり、以下のように定義することができる。分時換気量(MV)は、単位時間辺りの呼吸量の尺度であり、本明細書ではmL/分として示す。pCO2は、血液(動脈血)中の二酸化炭素(ガス)の分圧であり、mmHg(ミリメートルHg)で測定される。pO2は、血液(動脈血)中の酸素(ガス)の分圧であり、mmHg(ミリメートルHg)で測定される。SaO2は、血液中のオキシヘモグロビン形態のヘモグロビンの割合であり;呼気終末CO2は、比色分析またはカプノメトリーを使用して検出される呼気二酸化炭素ガスの測定値である。 In a non-limiting embodiment, the following terminology used to report blood gas measurements is well known to those skilled in the art and can be defined as follows: Minute ventilation (MV) is a measure of respiratory volume per unit time and is indicated herein as mL / min. pCO 2 is the partial pressure of carbon dioxide (gas) in blood (arterial blood) and is measured in mmHg (millimeter Hg). pO 2 is the partial pressure of oxygen (gas) in blood (arterial blood) and is measured in mmHg (millimeter Hg). SaO 2 is the proportion of hemoglobin in the form of oxyhemoglobin in the blood; end-tidal CO 2 is a measure of exhaled carbon dioxide gas detected using colorimetry or capnometry.
本明細書において使用されるED50という用語は、製剤が投与される対象の50%において所与の効果を生成するその製剤の有効量を意味する。 As used herein, the term ED 50 means an effective amount of a formulation that produces a given effect in 50% of the subjects to which the formulation is administered.
本明細書において使用される「疾患」とは、動物が恒常性を維持することができず、疾患が寛解しなければ動物の健康が悪化し続ける、動物の健康状態のことである。 As used herein, a “disease” is an animal health condition in which the animal cannot maintain homeostasis and the animal's health continues to deteriorate unless the disease is in remission.
本明細書において使用される動物の「障害」とは、動物が恒常性を維持可能であるが、動物の健康状態が障害の非存在下の場合よりも好ましくない、健康状態のことである。処置されないままでも、障害は動物の健康状態のさらなる低下を必ずしも引き起こすわけではない。 As used herein, an “disorder” of an animal is a health condition in which the animal is capable of maintaining homeostasis, but the health condition of the animal is less favorable than in the absence of the disorder. Even if left untreated, the disorder does not necessarily cause a further decline in the animal's health.
本明細書において使用される、化合物の「有効量」、「治療有効量」または「薬学的有効量」とは、化合物が投与される対象に有益な効果を与えるために十分な化合物の量のことである。本明細書において使用される「処置する」という用語は、症状を患者もしくは対象が経験する頻度を減少させること、または症状を経験する重症度を減少させるために薬剤もしくは化合物を投与することを意味する。 As used herein, an “effective amount”, “therapeutically effective amount” or “pharmaceutically effective amount” of a compound is an amount of the compound sufficient to provide a beneficial effect to the subject to which the compound is administered. That is. As used herein, the term “treating” means reducing the frequency with which a patient or subject experiences symptoms, or administering a drug or compound to reduce the severity of experiencing the symptoms. To do.
本明細書において使用される「薬学的に許容される」という用語は、本発明の範囲内で有用である化合物の生物活性または特性を抑止せず、相対的に無毒である、担体または希釈剤などの材料を意味し、すなわち、この材料は、望ましくない生物学的効果を引き起こすことなく、または組成物に含有されるそのいずれかの成分との有害な相互作用を起こすことなく、個人に投与することができる。 The term “pharmaceutically acceptable” as used herein refers to a carrier or diluent that does not abrogate the biological activity or properties of the compounds useful within the scope of the invention and is relatively non-toxic. I.e. the material is administered to an individual without causing an undesirable biological effect or without causing a harmful interaction with any of its components contained in the composition. can do.
本明細書において使用される「塩」という用語は、本発明の方法の範囲内で有用な遊離酸または遊離塩基の付加塩を意味する。また「塩」という用語は、単離形態の(例えば固体として)または溶液中の、塩とその対応する遊離酸または遊離塩基との混合物も意味する。 The term “salt” as used herein means an addition salt of a free acid or free base that is useful within the scope of the method of the invention. The term “salt” also means a mixture of a salt and its corresponding free acid or free base in isolated form (eg, as a solid) or in solution.
本明細書において使用される「薬学的に許容される塩」という語句は、無機酸、無機塩基、有機酸、無機塩基を含む薬学的に許容される無毒の酸および塩基から調製される投与化合物の塩、その溶媒和物、水和物およびクラスレートを意味する。 As used herein, the phrase “pharmaceutically acceptable salts” refers to administered compounds prepared from pharmaceutically acceptable non-toxic acids and bases, including inorganic acids, inorganic bases, organic acids, inorganic bases. Salts, solvates, hydrates and clathrates thereof.
本明細書において使用される「組成物」または「薬学的組成物」という用語は、本発明の範囲内で有用な少なくとも1つの化合物と薬学的に許容される担体との混合物を意味する。薬学的組成物は、対象に対する化合物の投与を容易にする。 The term “composition” or “pharmaceutical composition” as used herein refers to a mixture of at least one compound useful within the scope of the present invention and a pharmaceutically acceptable carrier. The pharmaceutical composition facilitates administration of the compound to a subject.
本明細書において使用される「薬学的に許容される担体」という用語は、本発明の範囲内で有用な化合物がその意図される機能を行うことができるようにそれを対象内でまたは対象に運搬または輸送することに関与する、液体もしくは固体の充填剤、安定剤、分散剤、懸濁化剤、希釈剤、賦形剤、増粘剤、溶媒または封入材料などの薬学的に許容される材料、組成物または担体を意味する。典型的には、そのような構築物は身体の1つの器官または部分から身体の別の器官または部分に運搬または輸送される。各担体は、本発明の範囲内で有用な化合物を含む製剤の他の成分と適合性があって、対象に有害ではないという意味で、「許容される」ものでなければならない。薬学的に許容される担体として役立ちうる材料のいくつかの例としては、ラクトース、グルコースおよびスクロースなどの糖; コーンスターチおよびジャガイモデンプンなどのデンプン; セルロース、ならびにカルボキシメチルセルロースナトリウム、エチルセルロースおよび酢酸セルロースなどのその誘導体; トラガント末; 麦芽; ゼラチン; タルク; カカオバターおよび坐薬ワックスなどの賦形剤; ピーナッツ油、綿実油、紅花油、ゴマ油、オリーブ油、トウモロコシ油および大豆油などの油; プロピレングリコールなどのグリコール; グリセリン、ソルビトール、マンニトールおよびポリエチレングリコールなどのポリオール; オレイン酸エチルおよびラウリン酸エチルなどのエステル; 寒天; 水酸化マグネシウムおよび水酸化アルミニウムなどの緩衝剤; 界面活性剤; アルギン酸; パイロジェンフリー水; 等張食塩水; リンゲル液; エチルアルコール; リン酸緩衝液; ならびに薬学的製剤に使用される他の無毒で適合性のある物質が挙げられる。本明細書において使用される「薬学的に許容される担体」は、本発明の範囲内で有用である化合物の活性と適合性があって、対象に生理学的に許容される、あらゆるコーティング、抗菌剤および抗真菌剤、ならびに吸収遅延剤なども含む。補足的な活性化合物も本組成物に組み入れることができる。「薬学的に許容される担体」は、本発明の範囲内で有用な化合物の薬学的に許容される塩をさらに含みうる。本発明の実施において使用される薬学的組成物に含まれうる他のさらなる成分は、当技術分野において公知であり、例えば参照により本明細書に組み入れられるRemington's Pharmaceutical Sciences (Genaro, Ed., Mack Publishing Co., 1985, Easton, PA)に記載されている。 As used herein, the term “pharmaceutically acceptable carrier” refers to a compound useful within or within the subject, such that a compound useful within the scope of the invention can perform its intended function. Pharmaceutically acceptable, such as liquid or solid fillers, stabilizers, dispersants, suspending agents, diluents, excipients, thickeners, solvents or encapsulating materials involved in transportation or transportation Means a material, composition or carrier. Typically, such constructs are transported or transported from one organ or part of the body to another organ or part of the body. Each carrier must be “acceptable” in the sense of being compatible with the other ingredients of the formulation comprising the compound useful within the scope of the invention and not injurious to the subject. Some examples of materials that can serve as pharmaceutically acceptable carriers include sugars such as lactose, glucose and sucrose; starches such as corn starch and potato starch; cellulose and its such as sodium carboxymethylcellulose, ethylcellulose and cellulose acetate Derivatives; tragacanth powder; malt; gelatin; talc; excipients such as cocoa butter and suppository wax; oils such as peanut oil, cottonseed oil, safflower oil, sesame oil, olive oil, corn oil and soybean oil; glycols such as propylene glycol; glycerin Polyols such as sorbitol, mannitol and polyethylene glycol; esters such as ethyl oleate and ethyl laurate; agar; magnesium hydroxide and aluminum hydroxide Buffers; surfactants; alginic acid; pyrogen-free water; isotonic saline; Ringer's solution; ethyl alcohol; phosphate buffer; and substances which are compatible with other non-toxic to be used in pharmaceutical formulations and the like. As used herein, a “pharmaceutically acceptable carrier” is any coating, antimicrobial, compatible with the activity of the compounds useful within the scope of the present invention and physiologically acceptable to the subject. And antifungal agents, absorption delaying agents, and the like. Supplementary active compounds can also be incorporated into the compositions. A “pharmaceutically acceptable carrier” can further include a pharmaceutically acceptable salt of a compound useful within the scope of the present invention. Other additional ingredients that may be included in the pharmaceutical compositions used in the practice of the present invention are known in the art, eg, Remington's Pharmaceutical Sciences (Genaro, Ed., Mack Publishing, incorporated herein by reference). Co., 1985, Easton, PA).
本明細書において使用される「プロセス関連不純物」という語句は、任意の出発原料、中間体、反応物、溶媒、および薬学的有効成分それ自体を合成プロセスの条件に曝露することによってもたらされる、薬学的有効成分を製造する該プロセスの間に形成される不純物を意味する。 As used herein, the phrase “process-related impurities” refers to pharmaceuticals that result from exposing any starting materials, intermediates, reactants, solvents, and the pharmaceutically active ingredient itself to the conditions of the synthetic process. Means impurities formed during the process of producing the active ingredient.
本明細書において使用される「疾患または障害を処置する」とは、疾患または障害の症状を対象が経験する頻度を減少させることを意味する。本明細書において、疾患および障害は互換的に使用される。 As used herein, “treating a disease or disorder” means reducing the frequency with which a subject experiences symptoms of a disease or disorder. In the present specification, disease and disorder are used interchangeably.
本明細書において使用される「特異的に結合する」という用語は、第1の分子が第2の分子(例えば特定の受容体または酵素)に優先的に結合するが、必ずしもその第2の分子にしか結合しないわけではないことを意味する。 As used herein, the term “specifically binds” means that a first molecule binds preferentially to a second molecule (eg, a particular receptor or enzyme), but not necessarily that second molecule. It means that it doesn't bind only to.
本明細書において使用される、単独でのまたは別の置換基の一部としての「アルキル」という用語は、別途明記しない限り、指定される炭素原子の数を有する(すなわちC1〜C10とは1〜10個の炭素原子を意味する)直鎖または分岐鎖の炭化水素を意味し、直鎖、分岐鎖または環状の置換基を含む。例としてはメチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert-ブチル、ペンチル、ネオペンチル、ヘキシルおよびシクロプロピルメチルが挙げられる。エチル、メチル、イソプロピル、イソブチル、n-ペンチル、n-ヘキシルおよびシクロプロピルメチルなどであるがそれに限定されない(C1〜C6)アルキルが最も好ましい。 As used herein, the term "alkyl" or as part of another substituent alone, unless otherwise specified, a (i.e. C 1 -C 10 having a number of carbon atoms designated Means a straight-chain or branched hydrocarbon (meaning 1 to 10 carbon atoms) and includes a straight-chain, branched or cyclic substituent. Examples include methyl, ethyl, propyl, isopropyl, butyl, isobutyl, tert-butyl, pentyl, neopentyl, hexyl and cyclopropylmethyl. Most preferred is (C 1 -C 6 ) alkyl, including but not limited to ethyl, methyl, isopropyl, isobutyl, n-pentyl, n-hexyl, and cyclopropylmethyl.
本明細書において使用される、単独でのまたは別の置換基の一部としての「シクロアルキル」という用語は、別途明記しない限り、指定される炭素原子の数を有する(すなわちC3〜C6とは、3〜6個の炭素原子からなる環基を含む環状基を意味する)環状鎖の炭化水素を意味し、直鎖、分岐鎖または環状の置換基を含む。例としてはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチルおよびシクロオクチルが挙げられる。シクロプロピル、シクロブチル、シクロペンチルおよびシクロヘキシルなどであるがそれに限定されない(C3〜C6)シクロアルキルが最も好ましい。 As used herein, the term “cycloalkyl”, alone or as part of another substituent, has the specified number of carbon atoms (ie, C 3 -C 6), unless otherwise specified. Means a cyclic hydrocarbon group (which means a cyclic group containing a cyclic group consisting of 3 to 6 carbon atoms), and includes a linear, branched or cyclic substituent. Examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl and cyclooctyl. Most preferred is (C 3 -C 6 ) cycloalkyl, including but not limited to cyclopropyl, cyclobutyl, cyclopentyl and cyclohexyl.
本明細書において使用される、単独でまたは他の用語との組み合わせで使用される「アルケニル」という用語は、別途明記しない限り、明記される炭素原子の数を有する安定な一不飽和または二不飽和の直鎖または分岐鎖の炭化水素基を意味する。例としてはビニル、プロペニル(またはアリル)、クロチル、イソペンテニル、ブタジエニル、1,3-ペンタジエニル、1,4-ペンタジエニル、ならびに高級同族体および異性体が挙げられる。アルケンを表す官能基は-CH2-CH=CH2によって例示される。 As used herein, the term “alkenyl” used alone or in combination with other terms, unless otherwise specified, is a stable monounsaturated or diunsaturated having the number of carbon atoms specified. It means a saturated linear or branched hydrocarbon group. Examples include vinyl, propenyl (or allyl), crotyl, isopentenyl, butadienyl, 1,3-pentadienyl, 1,4-pentadienyl, and higher homologs and isomers. A functional group representing an alkene is exemplified by —CH 2 —CH═CH 2 .
本明細書において使用される、単独でまたは他の用語との組み合わせで使用される「アルキニル」という用語は、別途明記しない限り、明記される炭素原子の数を有する三重炭素-炭素結合を伴う安定な直鎖または分岐鎖の炭化水素基を意味する。例としてはエチニルおよびプロピニル、ならびに高級同族体および異性体が挙げられる。 As used herein, the term “alkynyl” used alone or in combination with other terms, unless otherwise specified, is stable with a triple carbon-carbon bond having the number of carbon atoms specified. A straight or branched hydrocarbon group. Examples include ethynyl and propynyl, and higher homologs and isomers.
本明細書において使用される「置換アルキル」、「置換シクロアルキル」、「置換アルケニル」または「置換アルキニル」という用語は、ハロゲン、-OH、アルコキシ、テトラヒドロ-2-H-ピラニル、-NH2、-N(CH3)2、(1-メチル-イミダゾール-2-イル)、ピリジン-2-イル、ピリジン-3-イル、ピリジン-4-イル、-C(=O)OH、トリフルオロメチル、-C≡N、-C(=O)O(C1〜C4)アルキル、-C(=O)NH2、-C(=O)NH(C1〜C4)アルキル、-C(=O)N((C1〜C4)アルキル)2、-SO2NH2、-C(=NH)NH2および-NO2からなる群より選択される1個、2個または3個の置換基で置換され、好ましくは、ハロゲン、-OH、アルコキシ、-NH2、トリフルオロメチル、-N(CH3)2および-C(=O)OHより選択され、より好ましくはハロゲン、アルコキシおよび-OHより選択される1個または2個の置換基を含有する、上記定義のアルキル、シクロアルキル、アルケニルまたはアルキニルを意味する。置換アルキルの例としては2,2-ジフルオロプロピル、2-カルボキシシクロペンチルおよび3-クロロプロピルが挙げられるがそれに限定されない。
As used herein, the terms “substituted alkyl”, “substituted cycloalkyl”, “substituted alkenyl” or “substituted alkynyl” are halogen, —OH, alkoxy, tetrahydro-2-H-pyranyl, —NH 2 , -N (CH 3) 2, ( 1- methyl - imidazol-2-yl) pyridin-2-yl, pyridin-3-yl, pyridin-4-yl, -C (= O) OH, trifluoromethyl, -C≡N, -C (= O) O (C 1 ~C 4) alkyl, -C (= O) NH 2 , -C (= O) NH (
本明細書において使用される、単独でまたは他の用語との組み合わせで使用される「アルコキシ」という用語は、別途明記しない限り、酸素原子を経由して分子の残りに接続された、指定される炭素原子の数を有する上記定義のアルキル基、例えばメトキシ、エトキシ、1-プロポキシ、2-プロポキシ(イソプロポキシ)、ならびに高級同族体および異性体を意味する。エトキシおよびメトキシなどであるがそれに限定されない(C1〜C3)アルコキシが好ましい。 As used herein, the term “alkoxy” used alone or in combination with other terms, unless otherwise specified, is designated as connected to the rest of the molecule via an oxygen atom. It means an alkyl group as defined above having the number of carbon atoms, for example methoxy, ethoxy, 1-propoxy, 2-propoxy (isopropoxy), and higher homologs and isomers. (C 1 -C 3 ) alkoxy is preferred, including but not limited to ethoxy and methoxy.
本明細書において使用される、単独でのまたは別の置換基の一部としての「ハロ」または「ハロゲン」という用語は、別途明記しない限り、フッ素、塩素、臭素またはヨウ素原子、好ましくはフッ素、塩素または臭素、より好ましくはフッ素または塩素を意味する。 As used herein, the term “halo” or “halogen”, alone or as part of another substituent, unless otherwise stated, is a fluorine, chlorine, bromine or iodine atom, preferably fluorine, It means chlorine or bromine, more preferably fluorine or chlorine.
本明細書において使用される、単独でのまたは別の用語との組み合わせでの「ヘテロアルキル」という用語は、別途明記しない限り、明記される数の炭素原子とO、NおよびSからなる群より選択される1個または2個のヘテロ原子とからなり、窒素原子および硫黄原子が酸化されていてもよく、窒素ヘテロ原子が四級化されていてもよい、安定な直鎖または分岐鎖のアルキル基を意味する。ヘテロ原子は、ヘテロアルキル基の残りとそれが結合している断片との間を含むヘテロアルキル基の任意の位置に配置しうるものであり、ヘテロアルキル基の最も遠位の炭素原子に結合しうる。例としては-O-CH2-CH2-CH3、-CH2-CH2-CH2-OH、-CH2-CH2-NH-CH3、-CH2-S-CH2-CH3および-CH2CH2-S(=O)-CH3が挙げられる。例えば-CH2-NH-OCH3または-CH2-CH2-S-S-CH3などのように最大2個のヘテロ原子が連続的でありうる。 As used herein, the term “heteroalkyl”, alone or in combination with another term, unless specified otherwise, comes from the group consisting of the specified number of carbon atoms and O, N, and S. A stable linear or branched alkyl consisting of one or two selected heteroatoms, wherein the nitrogen and sulfur atoms may be oxidized and the nitrogen heteroatoms may be quaternized Means group. A heteroatom can be placed at any position of the heteroalkyl group, including between the remainder of the heteroalkyl group and the fragment to which it is attached, and is attached to the most distal carbon atom of the heteroalkyl group. sell. Examples are -O-CH 2 -CH 2 -CH 3 , -CH 2 -CH 2 -CH 2 -OH, -CH 2 -CH 2 -NH-CH 3 , -CH 2 -S-CH 2 -CH 3 And —CH 2 CH 2 —S (═O) —CH 3 . Up to two heteroatoms can be consecutive, such as, for example, —CH 2 —NH—OCH 3 or —CH 2 —CH 2 —SS—CH 3 .
本明細書において使用される、単独でのまたは別の用語との組み合わせでの「ヘテロアルケニル」という用語は、別途明記しない限り、明記される数の炭素原子とO、NおよびSからなる群より選択される1個または2個のヘテロ原子とからなり、窒素原子および硫黄原子が酸化されていてもよく、窒素ヘテロ原子が四級化されていてもよい、安定な直鎖または分岐鎖の一不飽和または二不飽和のアルキル基を意味する。最大2個のヘテロ原子が連続的に配置されうる。例としては-CH=CH-O-CH3、-CH=CH-CH2-OH、-CH2-CH=N-OCH3、-CH=CH-N(CH3)-CH3および-CH2-CH=CH-CH2-SHが挙げられる。 As used herein, the term "heteroalkenyl", alone or in combination with another term, unless specified otherwise, comes from the group consisting of the specified number of carbon atoms and O, N, and S. A stable straight or branched chain consisting of one or two selected heteroatoms, wherein the nitrogen and sulfur atoms may be oxidized and the nitrogen heteroatoms may be quaternized. An unsaturated or diunsaturated alkyl group is meant. A maximum of 2 heteroatoms can be arranged sequentially. Examples include -CH = CH-O-CH 3 , -CH = CH-CH 2 -OH, -CH 2 -CH = N-OCH 3 , -CH = CH-N (CH 3 ) -CH 3 and -CH 2 -CH = CH-CH 2 -SH.
本明細書において使用される「芳香族」という用語は、1個または複数のポリ不飽和環を有しかつ芳香族性を有する、すなわちnが整数である(4n+2)個の非局在化π(パイ)電子を有する、炭素環または複素環を意味する。 As used herein, the term “aromatic” refers to (4n + 2) delocalizations having one or more polyunsaturated rings and having aromaticity, i.e., n is an integer. A carbocyclic or heterocyclic ring having a π (pi) electron.
本明細書において使用される、単独でまたは他の用語との組み合わせで使用される「アリール」という用語は、別途明記しない限り、1個または複数の環(典型的には1個、2個または3個の環)を含有する炭素環式芳香族系を意味し、そのような環はビフェニルのようにペンダント式で一緒に結合しうるか、またはナフタレンのように縮合しうる。例としてはフェニル、アントラシルおよびナフチルが挙げられる。フェニルおよびナフチルが好ましく、フェニルが最も好ましい。 As used herein, the term `` aryl '' used alone or in combination with other terms, unless stated otherwise, refers to one or more rings (typically 1, 2 or Means a carbocyclic aromatic system containing 3 rings), such rings can be linked together pendant like biphenyl or fused like naphthalene. Examples include phenyl, anthracyl and naphthyl. Phenyl and naphthyl are preferred and phenyl is most preferred.
本明細書において使用される「アリール-(C1〜C3)アルキル」という用語は、炭素数1〜3のアルキレン鎖がアリール基に結合している官能基、例えば-CH2CH2-フェニルまたは-CH2-フェニル(ベンジル)を意味する。アリール-CH2-およびアリール-CH(CH3)-が好ましい。「置換アリール-(C1〜C3)アルキル」という用語は、アリール基が置換されたアリール-(C1〜C3)アルキル官能基を意味する。置換アリール(CH2)-が好ましい。同様に、本明細書において使用される「ヘテロアリール-(C1〜C3)アルキル」という用語は、炭素数1〜3のアルキレン鎖がヘテロアリール基に結合している官能基、例えば-CH2CH2-ピリジルを意味する。ヘテロアリール-(CH2)-が好ましい。「置換ヘテロアリール-(C1〜C3)アルキル」という用語は、ヘテロアリール基が置換されたヘテロアリール-(C1〜C3)アルキル官能基を意味する。置換ヘテロアリール-(CH2)-が好ましい。
The term “aryl- (C 1 -C 3 ) alkyl” as used herein refers to a functional group in which an alkylene chain having 1 to 3 carbon atoms is bonded to an aryl group, such as —CH 2 CH 2 -phenyl. or -CH 2 - means phenyl (benzyl). Aryl-CH 2 -and aryl-CH (CH 3 )-are preferred. The term “substituted aryl- (C 1 -C 3 ) alkyl” refers to an aryl- (C 1 -C 3 ) alkyl functional group substituted with an aryl group. Substituted aryl (CH 2 ) — is preferred. Similarly, the term “heteroaryl- (C 1 -C 3 ) alkyl” as used herein refers to a functional group in which an alkylene chain having 1 to 3 carbon atoms is bonded to a heteroaryl group, such as —
本明細書において使用される、単独でのまたは別の置換基の一部としての「複素環」または「ヘテロシクリル」または「複素環式」という用語は、別途明記しない限り、炭素原子とN、OおよびSからなる群より選択される少なくとも1個のヘテロ原子とからなり、窒素および硫黄ヘテロ原子が酸化されていてもよく、窒素原子が四級化されていてもよい、非置換または置換の安定な単環式または多環式の複素環系を意味する。複素環系は、別途明記しない限り、安定な構造を与える任意のヘテロ原子または炭素原子において結合しうる。複素環は芳香族性または非芳香族性でありうる。一態様では、複素環はヘテロアリールである。 As used herein, the term “heterocycle” or “heterocyclyl” or “heterocyclic”, alone or as part of another substituent, unless otherwise specified, includes carbon atoms and N, O And at least one heteroatom selected from the group consisting of S, nitrogen and sulfur heteroatoms may be oxidized, and the nitrogen atom may be quaternized, unsubstituted or substituted stable Means a monocyclic or polycyclic heterocyclic ring system. Heterocyclic systems can be attached at any heteroatom or carbon atom that results in a stable structure, unless otherwise specified. Heterocycles can be aromatic or non-aromatic. In one aspect, the heterocycle is heteroaryl.
本明細書において使用される「ヘテロアリール」または「ヘテロ芳香族」という用語は、芳香族性を有する複素環を意味する。多環式ヘテロアリールは、部分飽和の1個または複数の環を含みうる。例としてはテトラヒドロキノリンおよび2,3-ジヒドロベンゾフリルが挙げられる。 The term “heteroaryl” or “heteroaromatic” as used herein refers to a heterocycle having aromatic character. A polycyclic heteroaryl may contain one or more rings that are partially saturated. Examples include tetrahydroquinoline and 2,3-dihydrobenzofuryl.
非芳香族複素環の例としては、アジリジン、オキシラン、チイラン、アゼチジン、オキセタン、チエタン、ピロリジン、ピロリン、イミダゾリン、ピラゾリジン、ジオキソラン、スルホラン、2,3-ジヒドロフラン、2,5-ジヒドロフラン、テトラヒドロフラン、チオファン、ピペリジン、1,2,3,6-テトラヒドロピリジン、1,4-ジヒドロピリジン、ピペラジン、モルホリン、チオモルホリン、ピラン、2,3-ジヒドロピラン、テトラヒドロピラン、1,4-ジオキサン、1,3-ジオキサン、ホモピペラジン、ホモピペリジン、1,3-ジオキセパン、4,7-ジヒドロ-1,3-ジオキセピンおよびヘキサメチレンオキシドなどの単環式基が挙げられる。 Examples of non-aromatic heterocycles include aziridine, oxirane, thiirane, azetidine, oxetane, thietane, pyrrolidine, pyrroline, imidazoline, pyrazolidine, dioxolane, sulfolane, 2,3-dihydrofuran, 2,5-dihydrofuran, tetrahydrofuran, Thiophane, piperidine, 1,2,3,6-tetrahydropyridine, 1,4-dihydropyridine, piperazine, morpholine, thiomorpholine, pyran, 2,3-dihydropyran, tetrahydropyran, 1,4-dioxane, 1,3- Monocyclic groups such as dioxane, homopiperazine, homopiperidine, 1,3-dioxepane, 4,7-dihydro-1,3-dioxepin and hexamethylene oxide.
ヘテロアリール基の例としてはピリジル、ピラジニル、ピリミジニル(2-および4-ピリミジニルなどであるがそれに限定されない)、ピリダジニル、チエニル、フリル、ピロリル、イミダゾリル、チアゾリル、オキサゾリル、ピラゾリル、イソチアゾリル、1,2,3-トリアゾリル、1,2,4-トリアゾリル、1,3,4-トリアゾリル、テトラゾリル、1,2,3-チアジアゾリル、1,2,3-オキサジアゾリル、1,3,4-チアジアゾリルならびに1,3,4-オキサジアゾリルが挙げられる。 Examples of heteroaryl groups include pyridyl, pyrazinyl, pyrimidinyl (including but not limited to 2- and 4-pyrimidinyl), pyridazinyl, thienyl, furyl, pyrrolyl, imidazolyl, thiazolyl, oxazolyl, pyrazolyl, isothiazolyl, 1,2, 3-triazolyl, 1,2,4-triazolyl, 1,3,4-triazolyl, tetrazolyl, 1,2,3-thiadiazolyl, 1,2,3-oxadiazolyl, 1,3,4-thiadiazolyl and 1,3, 4-oxadiazolyl is mentioned.
多環式複素環の例としてはインドリル(3-、4-、5-、6-および7-インドリルなどであるがそれに限定されない)、インドリニル、キノリル、テトラヒドロキノリル、イソキノリル(1-および5-イソキノリルなどであるがそれに限定されない)、1,2,3,4-テトラヒドロイソキノリル、シンノリニル、キノキサリニル(2-および5-キノキサリニルなどであるがそれに限定されない)、キナゾリニル、フタラジニル、1,8-ナフチリジニル、1,4-ベンゾジオキサニル、クマリン、ジヒドロクマリン、1,5-ナフチリジニル、ベンゾフリル(3-、4-、5-、6-および7-ベンゾフリルなどであるがそれに限定されない)、2,3-ジヒドロベンゾフリル、1,2-ベンゾイソオキサゾリル、ベンゾチエニル(3-、4-、5-、6-および7-ベンゾチエニルなどであるがそれに限定されない)、ベンゾオキサゾリル、ベンゾチアゾリル(2-ベンゾチアゾリルおよび5-ベンゾチアゾリルなどであるがそれに限定されない)、プリニル、ベンゾイミダゾリル、ベンゾトリアゾリル、チオキサンチニル、カルバゾリル、カルボリニル、アクリジニル、ピロリジジニルならびにキノリジジニルが挙げられる。 Examples of polycyclic heterocycles include indolyl (including but not limited to 3-, 4-, 5-, 6- and 7-indolyl), indolinyl, quinolyl, tetrahydroquinolyl, isoquinolyl (1- and 5- Such as but not limited to isoquinolyl), 1,2,3,4-tetrahydroisoquinolyl, cinnolinyl, quinoxalinyl (including but not limited to 2- and 5-quinoxalinyl), quinazolinyl, phthalazinyl, 1,8- Naphthyridinyl, 1,4-benzodioxanyl, coumarin, dihydrocoumarin, 1,5-naphthyridinyl, benzofuryl (including but not limited to 3-, 4-, 5-, 6- and 7-benzofuryl), 2, 3-dihydrobenzofuryl, 1,2-benzisoxazolyl, benzothienyl (including but not limited to 3-, 4-, 5-, 6- and 7-benzothienyl), benzoxazolyl, Examples include benzothiazolyl (including but not limited to 2-benzothiazolyl and 5-benzothiazolyl), purinyl, benzimidazolyl, benzotriazolyl, thioxanthinyl, carbazolyl, carbolinyl, acridinyl, pyrrolididinyl and quinolizidinyl.
ヘテロシクリル部分およびヘテロアリール部分の上述のリストは、限定的でなく代表的であるように意図されている。 The above list of heterocyclyl and heteroaryl moieties is intended to be representative rather than limiting.
本明細書において使用される「置換された」という用語は、原子または原子群が水素を、別の基に結合した置換基として置き換えたことを意味する。 The term “substituted” as used herein means that an atom or group of atoms has replaced a hydrogen as a substituent attached to another group.
アリール基、アリール-(C1〜C3)アルキル基およびヘテロシクリル基では、これらの基の環に適用される「置換された」という用語は、任意の許容される置換のレベル、すなわち一置換、二置換、三置換、四置換または五置換を意味する。置換基は独立して選択され、置換は任意の化学的に接近可能な位置に存在しうる。一態様では、置換基の数は1個〜4個で変動する。別の態様では、置換基の数は1個〜3個で変動する。さらに別の態様では、置換基の数は1個〜2個で変動する。さらに別の態様では、置換基はC1〜6アルキル、-OH、C1〜6アルコキシ、ハロ、アミノ、アセトアミドおよびニトロからなる群より独立して選択される。本明細書において使用される置換基がアルキル基またはアルコキシ基である場合、炭素鎖は分岐状、直鎖状または環状でありうるものであり、直鎖状が好ましい。 For aryl groups, aryl- (C 1 -C 3 ) alkyl groups and heterocyclyl groups, the term “substituted” as applied to the ring of these groups refers to any permissible level of substitution, ie mono-substitution, Means disubstituted, trisubstituted, tetrasubstituted or pentasubstituted. The substituents are independently selected, and the substitution can be at any chemically accessible position. In one embodiment, the number of substituents varies from 1 to 4. In another embodiment, the number of substituents varies from 1 to 3. In yet another embodiment, the number of substituents varies from 1 to 2. In yet another embodiment, the substituents are independently selected from the group consisting of C 1-6 alkyl, —OH, C 1-6 alkoxy, halo, amino, acetamide and nitro. When the substituent used in the present specification is an alkyl group or an alkoxy group, the carbon chain may be branched, linear or cyclic, and is preferably linear.
本明細書において使用される「AcOH」という用語は酢酸を意味し、「nBuOH」という用語はn-ブタノールを意味し、「CH2Cl2」という用語はジクロロメタン(二塩化メチレンとしても知られる)を意味し、「DMSO」という用語はジメチルスルホキシドを意味し、「EtOAc」という用語は酢酸エチルを意味し、「EtOH」という用語はエタノールを意味し、「HCl」という用語は塩酸または塩酸塩を意味し、「HPLC」という用語は高圧液体クロマトグラフィーを意味し、「H2SO4」という用語は硫酸を意味し、「LCMS」という用語は液体クロマトグラフィー質量分析を意味し、「MS」という用語は質量分析を意味し、「MeOH」という用語はメタノールを意味し、「NaCl」という用語は塩化ナトリウムを意味し、「NaHCO3」という用語は炭酸水素ナトリウムを意味し、「NaOH」という用語は水酸化ナトリウムを意味し、「Na2SO4」という用語は硫酸ナトリウムを意味し、「mpk」という用語はmg/kgを意味し、「NMR」という用語は核磁気共鳴を意味し、「PE」または「petエーテル」という用語は石油エーテルを意味し、「POCl3」という用語はオキシ塩化リンを意味し、「ppm」という用語は百万分率を意味し、「xphos」という用語は2-ジシクロヘキシルホスフィノ-2',4',6'-トリイソプロピルビフェニルを意味し、「dba」という用語はtrans,trans-ジベンジリデンアセトンを意味する。 As used herein, the term “AcOH” refers to acetic acid, the term “nBuOH” refers to n-butanol, and the term “CH 2 Cl 2 ” refers to dichloromethane (also known as methylene dichloride). The term `` DMSO '' means dimethyl sulfoxide, the term `` EtOAc '' means ethyl acetate, the term `` EtOH '' means ethanol, the term `` HCl '' means hydrochloric acid or hydrochloride Meaning `` HPLC '' means high pressure liquid chromatography, the term `` H 2 SO 4 '' means sulfuric acid, the term `` LCMS '' means liquid chromatography mass spectrometry, and `` MS '' The term means mass spectrometry, the term “MeOH” means methanol, the term “NaCl” means sodium chloride, the term “NaHCO 3 ” means sodium bicarbonate, “Na The term `` OH '' means sodium hydroxide, the term `` Na 2 SO 4 '' means sodium sulfate, the term `` mpk '' means mg / kg, the term `` NMR '' means nuclear magnetic resonance. The term `` PE '' or `` pet ether '' means petroleum ether, the term `` POCl 3 '' means phosphorus oxychloride, the term `` ppm '' means parts per million, and `` xphos The term “” means 2-dicyclohexylphosphino-2 ′, 4 ′, 6′-triisopropylbiphenyl and the term “dba” means trans, trans-dibenzylideneacetone.
本明細書において使用される「説明用資料」という用語は、キット中の、本発明の組成物および/または化合物の有用性を伝達するために使用可能な刊行物、記録、図表または任意の他の表現媒体を含む。キットの説明用資料は、例えば本発明の化合物および/または組成物を収容する容器に取り付けることができ、あるいは該化合物および/または組成物を収容する容器と共に輸送することができる。あるいは、説明用資料は、レシピエントが説明用資料および化合物を一体的に使用するという意図で、容器とは別に輸送することができる。説明用資料の運搬は、例えばキットの有用性を伝達する刊行物または他の表現媒体の物理的運搬によるものでもよく、あるいは、例えばコンピュータによる電子的伝送、例えば電子メール、またはウェブサイトからのダウンロードによって実現してもよい。 As used herein, the term “explanatory material” refers to a publication, record, chart or any other that can be used to convey the utility of the compositions and / or compounds of the invention in a kit. Including expression media. The instructional material for the kit can be attached, for example, to a container containing the compound and / or composition of the present invention, or can be shipped with the container containing the compound and / or composition. Alternatively, the explanatory material can be shipped separately from the container with the intention that the recipient uses the explanatory material and the compound together. Delivery of the explanatory material may be, for example, by physical transport of a publication or other expression medium that conveys the usefulness of the kit, or, for example, electronic transmission by computer, eg, e-mail, or download from a website It may be realized by.
本発明の化合物および組成物
本発明は、本発明の化合物、およびそのような化合物を含む任意の組成物を含む。
Compounds and Compositions of the Invention The present invention includes compounds of the invention and any composition comprising such compounds.
本発明は、以下からなる群より選択される少なくとも1つの化合物を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。 The present invention includes at least one compound selected from the group consisting of: N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[1,3,5] Triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine (CLXXIII), N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), salts thereof, and them Any combination of.
一態様では、塩は硫酸水素塩、塩酸塩、リン酸塩、リン酸水素塩またはリン酸二水素塩である。別の態様では、少なくとも1つの化合物は少なくとも1つの薬学的に許容される担体と共に製剤化される。 In one aspect, the salt is hydrogen sulfate, hydrochloride, phosphate, hydrogen phosphate or dihydrogen phosphate. In another embodiment, at least one compound is formulated with at least one pharmaceutically acceptable carrier.
本発明はまた、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)またはその塩を含み、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールが、(XXXV)またはその塩に対して約1%(w/w)に等しいまたはそれ未満のレベルで存在している、組成物を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) or a salt thereof, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to or less than about 1% (w / w) relative to (XXXV) or a salt thereof Including a composition present in
一態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは (XXXV)またはその塩に対して約0.5%(w/w)に等しいまたはそれ未満のレベルで存在している。別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは(XXXV)またはその塩に対して約0.3%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは(XXXV)またはその塩に対して約0.2%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは(XXXV)またはその塩に対して約0.15%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは(XXXV)またはその塩に対して約0.1%(w/w)に等しいまたはそれ未満のレベルで存在している。さらに別の態様では、4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オールは前記組成物中に本質的に存在していない。 In one aspect, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to or less than about 0.5% (w / w) relative to (XXXV) or a salt thereof. Exists at less than levels. In another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to about 0.3% (w / w) relative to (XXXV) or a salt thereof, or It exists at a lower level. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to about 0.2% (w / w) relative to (XXXV) or a salt thereof. Or exist at a level below that. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to about 0.15% (w / w) relative to (XXXV) or a salt thereof. Or exist at a level below that. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is equal to about 0.1% (w / w) relative to (XXXV) or a salt thereof. Or exist at a level below that. In yet another embodiment, 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol is essentially absent from the composition.
本発明はまた、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)またはその塩を含み、緩衝液および液体担体をさらに含む、組成物を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) or a salt thereof, The composition further comprises a buffer and a liquid carrier.
一態様では、(XXXV)の塩は硫酸水素塩(XXXVI)である。別の態様では、組成物はクエン酸をさらに含む。さらに別の態様では、組成物のpHは塩基によって調整されている。さらに別の態様では、塩基は水酸化ナトリウムを含む。さらに別の態様では、液体担体は水を含む。さらに別の態様では、組成物のpHは約2.5〜約6の範囲である。さらに別の態様では、組成物のpHは約2.5〜約5の範囲である。さらに別の態様では、組成物のpHは約3〜約4の範囲である。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約1〜10mg/mLである。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約5〜10mg/mLである。さらに別の態様では、組成物中の(XXXV)またはその塩の濃度は約10mg/mLである。さらに別の態様では、本組成物は(XXXV)に対して約0.5%(w/w)未満の4,6-ビス-(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)を含む。さらに別の態様では、(XXXV)に対して約0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間少なくとも6ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して約0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間少なくとも12ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して約0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間少なくとも18ヶ月にわたって形成される。さらに別の態様では、(XXXV)に対して約0.5%(w/w)未満のN-(4,6-ビス-n-プロピルアミノ)-[1,3,5]-トリアジン-2-オール(CLXXVIII)が、2〜8℃で前記組成物の保存期間少なくとも24ヶ月にわたって形成される。 In one embodiment, the salt of (XXXV) is hydrogen sulfate (XXXVI). In another aspect, the composition further comprises citric acid. In yet another embodiment, the pH of the composition is adjusted with a base. In yet another aspect, the base comprises sodium hydroxide. In yet another aspect, the liquid carrier includes water. In yet another embodiment, the pH of the composition ranges from about 2.5 to about 6. In yet another embodiment, the pH of the composition ranges from about 2.5 to about 5. In yet another embodiment, the pH of the composition ranges from about 3 to about 4. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 1-10 mg / mL. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 5-10 mg / mL. In yet another embodiment, the concentration of (XXXV) or salt thereof in the composition is about 10 mg / mL. In yet another embodiment, the composition comprises less than about 0.5% (w / w) 4,6-bis- (n-propylamino) -1,3,5-triazin-2-ol relative to (XXXV) (CLXXVIII) is included. In yet another embodiment, less than about 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol relative to (XXXV) (CLXXVIII) is formed at 2-8 ° C over the shelf life of the composition for at least 6 months. In yet another embodiment, less than about 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol relative to (XXXV) (CLXXVIII) is formed at 2-8 ° C. over the shelf life of the composition for at least 12 months. In yet another embodiment, less than about 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol relative to (XXXV) (CLXXVIII) is formed at 2-8 ° C. over the shelf life of the composition for at least 18 months. In yet another embodiment, less than about 0.5% (w / w) N- (4,6-bis-n-propylamino)-[1,3,5] -triazin-2-ol relative to (XXXV) (CLXXVIII) is formed at 2-8 ° C. over the shelf life of the composition for at least 24 months.
本発明はまた、図22のXRPDスペクトルを有するN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)の結晶性遊離塩基形態Aを含む。 The present invention also provides N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) having the XRPD spectrum of FIG. ) Crystalline free base form A.
本発明はまた、以下からなる群より選択される、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N.O-ジメチル-ヒドロキシルアミン(XXXV)の少なくとも1つの結晶性塩を含む: 図14のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態A; 図23のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性硫酸水素塩(XXXVI); 図24のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態C; 図25のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態D; 図26のXRPDスペクトルを有する、形態Aと形態Dとの混合物を含む結晶性硫酸水素塩(XXXVI); 図27のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態A; 図28のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態C; 図29のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性リン酸塩(CLXXX); 図30のXRPDスペクトルを有する、形態Cと形態Dとの混合物を含む結晶性リン酸塩(CLXXX); 図31のXRPDスペクトルを有する、形態Cと形態Eとの混合物を含む結晶性リン酸塩(CLXXX); およびそれらの任意の混合物。 The present invention also provides N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -NO-dimethyl-hydroxylamine (XXXV) selected from the group consisting of: At least one crystalline salt of: crystalline hydrogen sulfate (XXXVI) form A having the XRPD spectrum of FIG. 14; crystalline comprising a mixture of form A and form B having the XRPD spectrum of FIG. Crystalline hydrogen sulfate (XXXVI) Form C with XRPD spectrum of Figure 25; Crystalline hydrogen sulfate (XXXVI) Form D with XRPD spectrum of Figure 25; XRPD spectrum of Figure 26 Crystalline hydrogen sulfate (XXXVI) comprising a mixture of Form A and Form D having a crystalline phosphate (CLXXX) form A having an XRPD spectrum of FIG. 27; a crystal having an XRPD spectrum of FIG. Phosphate (CLXXX) Form C; Crystalline Phosphate (CLXXX) containing a mixture of Form A and Form B with the XRPD spectrum of Figure 29; XRPD of Figure 30 Crystalline phosphate (CLXXX) comprising a mixture of Form C and Form D having a cuttle; Crystalline phosphate (CLXXX) comprising a mixture of Form C and Form E having the XRPD spectrum of FIG. 31; And any mixture of them.
本発明はまた、硫酸約1モル当量を含む、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XXXV)の塩を含む。一態様では、塩は水1モル当量をさらに含む。 The present invention also includes a salt of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XXXV) containing about 1 molar equivalent of sulfuric acid. . In one aspect, the salt further comprises 1 molar equivalent of water.
本発明はまた、リン酸少なくとも1モル当量を含む、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N.O-ジメチル-ヒドロキシルアミン(XXXV)の塩を含む。一態様では、塩はリン酸約1モル当量を含む。 The present invention also includes N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -NO-dimethyl-hydroxylamine (XXXV) containing at least 1 molar equivalent of phosphoric acid. ) Salt. In one aspect, the salt comprises about 1 molar equivalent of phosphoric acid.
本発明はまた、式(I)の化合物またはその塩を含む:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;
R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;
R4はH、アルキルまたは置換アルキルであり;
R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;
R6はH、アルキル、置換アルキルまたはアルケニルであり;
Xは結合、OまたはNR4であり;かつ
YはN、CR6またはCであり;ここで、
YがNまたはCR6である場合、結合b1は存在せず、かつ
(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;かつ
YがCである場合、結合b1は単結合であり、かつ
(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
The present invention also includes a compound of formula (I) or a salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forming a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl;
R 3 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, —NR 1 R 2 , —C (O) OR 1 , acyl or aryl;
R 4 is H, alkyl or substituted alkyl;
R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1 , -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, Are substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 together are 3,6,9-trioxa-undecane-1,11-diyl and 3,6-dioxa-octane Forming a biradical selected from the group consisting of -1,8-diyl;
R 6 is H, alkyl, substituted alkyl or alkenyl;
X is a bond, O or NR 4 ; and
Y is N, CR 6 or C; where
If Y is N or CR 6 then there is no bond b 1 and
(i) Z is H, bond b 2 is a single bond, and A is CH; or (ii) Z is not present, bond b 2 is not present, and A is a single bond And; and
When Y is C, the bond b 1 is a single bond, and
(i) Z is CH 2 and bond b 2 is a single bond and A is CH; or (ii) Z is CH, bond b 2 is a double bond and A Is C.
一態様では、R3はH、アルキル、置換アルキル、アルケニル、シクロアルキル、置換シクロアルキルまたは置換アルケニルである。別の態様では、R5はH、アルキル、置換アルキル、アルケニル、置換アルケニル、アシル、シクロアルキルまたは置換シクロアルキルである。 In one aspect, R 3 is H, alkyl, substituted alkyl, alkenyl, cycloalkyl, substituted cycloalkyl or substituted alkenyl. In another embodiment, R 5 is H, alkyl, substituted alkyl, alkenyl, substituted alkenyl, acyl, cycloalkyl or substituted cycloalkyl.
一態様では、YはNであり、結合b1は存在せず、ZはHであり、結合b2は単結合であり、AはCHであり、本発明の化合物は式(II-a)の1,3,5-トリアジンまたはその塩である。
In one embodiment, Y is N, bond b 1 is absent, Z is H, bond b 2 is a single bond, A is CH, and the compounds of the invention have the formula (II-a) 1,3,5-triazine or a salt thereof.
一態様では、YはNであり、結合b1は存在せず、Zは存在せず、結合b2は存在せず、Aは結合であり、本発明の化合物は式(II-b)の1,3,5-トリアジンまたはその塩である。
In one embodiment, Y is N, bond b 1 is not present, Z is not present, bond b 2 is not present, A is a bond, and the compounds of the invention have the formula (II-b) 1,3,5-triazine or a salt thereof.
一態様では、YはCR6であり、結合b1は存在せず、ZはHであり、結合b2は単結合であり、AはCHであり、本発明の化合物は式(III-a)のピリミジンまたはその塩である。
In one aspect, Y is CR 6 , bond b 1 is absent, Z is H, bond b 2 is a single bond, A is CH, and the compounds of the invention have the formula (III-a ) Pyrimidine or a salt thereof.
一態様では、YはCR6であり、結合b1は存在せず、Zは存在せず、結合b2は存在せず、Aは結合であり、本発明の化合物は式(III-b)のピリミジンまたはその塩である。
In one aspect, Y is CR 6 , bond b 1 is not present, Z is not present, bond b 2 is not present, A is a bond, and the compounds of the present invention have the formula (III-b) Pyrimidine or a salt thereof.
一態様では、YはCであり、結合b1は単結合であり、ZはCH2であり、結合b2は単結合であり、AはCHであり、本発明の化合物は式(IV)のピロリジノピリミジンまたはその塩である。
In one embodiment, Y is C, bond b 1 is a single bond, Z is CH 2 , bond b 2 is a single bond, A is CH, and the compounds of the invention have the formula (IV) Pyrrolidinopyrimidine or a salt thereof.
一態様では、YはCであり、結合b1は単結合であり、ZはCHであり、結合b2は二重結合であり、AはCであり、本発明の化合物は式(V)のピロロピリミジンまたはその塩である。
In one embodiment, Y is C, bond b 1 is a single bond, Z is CH, bond b 2 is a double bond, A is C, and the compounds of the invention have the formula (V) Of pyrrolopyrimidine or its salt.
一態様では、式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-(メトキシ(メチル)アミノ)-6-(n-プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン、6-[1,2]オキサジナン-2-イル-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン、6-((ベンジルオキシ)(イソプロピル)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン、6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン、4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(ピリジン-4-イル-メチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(テトラヒドロピラン-4-イル-メチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン、2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-N'-メチルヒドラジン、2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン、2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン、8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール、N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン、その塩、およびそれらの混合物。 In one embodiment, the compound of formula (I) is selected from the group consisting of: N- (4,6-bis-methylamino- [1,3,5] triazin-2-yl) -N, O— Dimethyl-hydroxylamine, N- (4,6-bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-cyclopropylmethyl)- N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-ethylamino) -N- (6-n-propyl Amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2-methylpropylamino)) [1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N , O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4,6-bis -n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4- (methoxy (methyl) amino) -6- (n-propylamino) -1,3,5-triazin-2-yl) propionamide, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, 6- (methoxy (methyl) amino) -N 2 -propyl-1,3,5-triazine-2,4-diamine, N- (4 , 6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [ 1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N- Isopropyl-hydroxy Ruamine, 6- [1,2] oxazinan-2-yl-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine, N- (4,6-bis-n-propylamino -[1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5 ] Triazin-2-yl) -N-ethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine, 6-((benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine, N- (4,6-bis-n-propylamino- [ 1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl ) -O-isobutyl-N-methyl-hydroxylamine, 6- (methyl (thiophen-2-ylmethoxy) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4 -Diamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine, N- (4,6 -Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1, 3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine, 4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6- N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (1-N-methylimidazol-2-yl) -methyl Amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (2-dimethylamino) Ethyl) amino)-[ 1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (pyridin-4-yl-methyl) amino)-[1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (tetrahydropyran-4-yl-methyl) amino]-[1,3,5] triazin-2-yl) -N, O- Dimethyl-hydroxylamine, N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -Trien-17-yl) -N, O-dimethylhydroxylamine, 2,6-bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (4,6-bis-n-propylamino -[1,3,5] Triazin-2-yl) -N-methyl-N'-methyl Hydrazine, 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-dimethylamino-7-methyl -Pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine, 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine, 8- (7-methyl-2- (n-propylamino)- Pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol, N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2-n-propylamino-7-methyl- Pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N -Methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N, N-dimethyl-N '-(2-n-propylamino-7 -Methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine, N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine, N- (2,4- Scan -n- propylamino) -N- (6-i- propylamino) -1,3-pyrimidine, its salts, and mixtures thereof.
一態様では、少なくとも1つの化合物は2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミンまたはその塩である。別の態様では、塩は硫酸水素塩、塩酸塩、リン酸塩、リン酸水素塩またはリン酸二水素塩である。 In one embodiment, the at least one compound is 2,6-bis- (N-n-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine or a salt thereof. In another embodiment, the salt is hydrogen sulfate, hydrochloride, phosphate, hydrogen phosphate or dihydrogen phosphate.
一態様では、少なくとも1つの化合物は以下からなる群より選択される: 2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVI)、2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVIII)、2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXXI)、2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン(CXXXVI)、2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン(CXLIX)、2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン(CLII)、8-(7-メチル-2-(プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLV)、その塩、およびそれらの混合物。別の態様では、塩は硫酸水素塩、塩酸塩、リン酸塩、リン酸水素塩またはリン酸二水素塩である。 In one embodiment, the at least one compound is selected from the group consisting of: 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVI ), 2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVIII), 2- (n-propyl) amino-4-methylamino-7-methyl -Pyrrolidino [2,3-d] pyrimidine (CXXXI), 2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine (CXXXVI) 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine (CXLIX), 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine (CLII), 8- (7-methyl-2- (propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] Octane-3-ol (CLV), salts thereof, and mixtures thereof In another embodiment, the salt is sulfated water. Basic salt, hydrochloride, phosphate, hydrogen phosphate or dihydrogen phosphate.
一態様では、少なくとも1つの化合物は以下からなる群より選択される: N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-O,N-ジメチル-ヒドロキシルアミン(CXLI)、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLVIII)、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLX)、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O,N-ジメチル-ヒドロキシルアミン(CLXII)、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLXIV)、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVI)、N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVIII)、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXX)、その塩、およびそれらの混合物。別の態様では、塩は硫酸水素塩、塩酸塩、リン酸塩、リン酸水素塩またはリン酸二水素塩である。 In one embodiment, the at least one compound is selected from the group consisting of: N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -O, N-dimethyl-hydroxylamine ( CXLI), N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLVIII), N- (2 -(Propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (CLX), N- (2-n-propylamino-7-methyl -Pyrrolo [2,3d] pyrimidin-4-yl) -O, N-dimethyl-hydroxylamine (CLXII), N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4- Yl) -O-methyl-hydroxylamine (CLXIV), N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVI), N-methyl-N -(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVIII), N , N-dimethyl-N ′-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXX), its salts, and mixtures thereof. In another embodiment, the salt is hydrogen sulfate, hydrochloride, phosphate, hydrogen phosphate or dihydrogen phosphate.
一態様では、本化合物は少なくとも1つの薬学的に許容される担体と共に製剤化される。 In one aspect, the compound is formulated with at least one pharmaceutically acceptable carrier.
本発明の化合物の調製
本発明の化合物は、以下に記載の合成スキームに例示される一般的方法論に従って調製することができる。本明細書に記載の試薬および条件は、本発明の化合物の調製を可能にするように修正することができ、そのような修正は当業者に公知である。本明細書に含まれるスキームは、本発明の化合物を作製するために当業者が使用可能な化学反応および方法論を制限するのではなく例示するように意図されている。
Preparation of the Compounds of the Invention The compounds of the invention can be prepared according to the general methodology illustrated in the synthetic schemes described below. The reagents and conditions described herein can be modified to allow for the preparation of the compounds of the invention, and such modifications are known to those skilled in the art. The schemes contained herein are intended to illustrate rather than limit the chemical reactions and methodologies that can be used by those skilled in the art to make the compounds of the present invention.
一局面では、式(I)の化合物を、以下のスキーム1に示すように、好適に塩素化された中間体(VI)に(i) 第一級アミン、(ii) N-アルコキシ-N-アルキルアミンまたは(iii) 適切に置換されたヒドラジン(H2N-NHR2もしくはR1HN-NHR2)を逐次加えることで調製することができる。
In one aspect, the compound of formula (I) is converted to a suitably chlorinated intermediate (VI) with (i) a primary amine, (ii) N-alkoxy-N--, as shown in
別の局面では、式(IV)または(V)の化合物を、好適に塩素化されたアミノ-ピロリジノ-ピリミジンまたはアミノ-ピロロ-ピリミジンの還元的アルキル化によってそれぞれ調製することができる(スキーム2)。
In another aspect, compounds of formula (IV) or (V) can be prepared by reductive alkylation of suitably chlorinated amino-pyrrolidino-pyrimidines or amino-pyrrolo-pyrimidines, respectively (Scheme 2) .
さらに別の局面では、式(II)のトリアジン化合物を、好適に塩素化されたトリアジンに第一級アミンおよび(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2を逐次加えることで調製することができる。適切な条件下では、反応は、トリアジン環に1個または2個のアミン置換基を加えることを可能にしうる。あるいは、トリアジンに最初にN-アルコキシ-N-アルキルアミン、ヒドラジンH2N-NHR2またはヒドラジンR1HN-NHR2を加えた後、アミンを加えることができる。 In yet another aspect, the triazine compound of formula (II) is converted to a suitably chlorinated triazine with a primary amine and (i) N-alkoxy-N-alkylamine, (ii) hydrazine H 2 N-NHR 2 Or (iii) It can be prepared by adding hydrazine R 1 HN-NHR 2 sequentially. Under appropriate conditions, the reaction may allow one or two amine substituents to be added to the triazine ring. Alternatively, the N-alkoxy-N-alkylamine, hydrazine H 2 N—NHR 2 or hydrazine R 1 HN—NHR 2 can be added to the triazine first, followed by the amine.
非限定的な例では、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中の2,4,6-トリクロロトリアジンの溶液に第一級アミン(VII)の溶液を加え、反応を周囲温度で進行させるかまたは加熱することでモノ-アミン付加体(VIII)またはビス-アミン付加体(IX)を単離する。 In a non-limiting example, a solution of primary amine (VII) is added to a solution of 2,4,6-trichlorotriazine in a suitable aprotic or protic solvent containing an inorganic or organic base and the reaction Is allowed to proceed at ambient temperature or heated to isolate the mono-amine adduct (VIII) or bis-amine adduct (IX).
引き続く反応において、モノ-アミン付加体(VIII)を別の第一級アミンまたは第二級アミン(X)と反応させることで非対称性モノクロロ-ビス-アミノ-トリアジン付加体(XI)を得る。引き続く反応において、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中でモノクロロ-ビス-アミノ-トリアジン付加体(XI)を(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2と反応させることで、所望の式(II)の化合物を生成する(スキーム3)。 In the subsequent reaction, the asymmetric monochloro-bis-amino-triazine adduct (XI) is obtained by reacting the mono-amine adduct (VIII) with another primary amine or secondary amine (X). In subsequent reactions, the monochloro-bis-amino-triazine adduct (XI) is converted to (i) N-alkoxy-N-alkylamine, (ii) in a suitable aprotic or protic solvent containing an inorganic or organic base. Reaction with hydrazine H 2 N—NHR 2 or (iii) hydrazine R 1 HN—NHR 2 yields the desired compound of formula (II) (Scheme 3).
あるいは、引き続く反応において、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中でビス-アミン付加体(IX)を(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2と反応させることで、R3CH2がR5である所望の式(II)の化合物を生成する(スキーム4)。
Alternatively, in a subsequent reaction, the bis-amine adduct (IX) is converted to (i) N-alkoxy-N-alkylamine, (ii) hydrazine in a suitable aprotic or protic solvent containing an inorganic or organic base. H 2 N—NHR 2 or (iii) Reaction with hydrazine R 1 HN—NHR 2 yields the desired compound of formula (II) where R 3 CH 2 is R 5 (Scheme 4).
さらに別の局面では、式(III)のピリミジン化合物を、好適に塩素化されたピリミジンに第一級アミンおよび(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2を逐次加えることで調製することができる。 In yet another aspect, the pyrimidine compound of formula (III) is converted to a suitably chlorinated pyrimidine with a primary amine and (i) N-alkoxy-N-alkylamine, (ii) hydrazine H 2 N-NHR 2 Or (iii) It can be prepared by adding hydrazine R 1 HN-NHR 2 sequentially.
非限定的な例では、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中の2,4,6-トリクロロピリミジン(XII)の溶液に第一級アミン(VII)の溶液を加え、反応を周囲温度で進行させるかまたは加熱することでビス-アミン付加体(XIII)を得る。引き続く反応において、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中でビス-アミン付加体(XIII)を(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2と反応させることで、所望の式(III)の化合物を生成する(スキーム5)。
In a non-limiting example, a solution of primary amine (VII) is added to a solution of 2,4,6-trichloropyrimidine (XII) in a suitable aprotic or protic solvent containing an inorganic or organic base. In addition, the reaction proceeds at ambient temperature or is heated to give the bis-amine adduct (XIII). In the subsequent reaction, the bis-amine adduct (XIII) is converted to (i) N-alkoxy-N-alkylamine, (ii) hydrazine H 2 in a suitable aprotic or protic solvent containing an inorganic base or an organic base. Reaction with N-NHR 2 or (iii) hydrazine R 1 HN-NHR 2 yields the desired compound of formula (III) (Scheme 5).
さらに別の局面では、式(IV)のピロリジノ-ピリミジンまたは式(V)のピロロ-ピリミジン化合物を、適切に塩素化されたアミノピロリジノピリミジンまたはアミノピロロピリミジン中間体からそれぞれ調製することができる。 In yet another aspect, a pyrrolidino-pyrimidine of formula (IV) or a pyrrolo-pyrimidine compound of formula (V) can be prepared from an appropriately chlorinated aminopyrrolidinopyrimidine or aminopyrrolopyrimidine intermediate, respectively.
非限定的な例では、2,6-ジアミノ-4-ヒドロキシ-1,3-ピリミジン(XIV)の極性プロトン性溶媒溶液に2-クロロアセトアルデヒドを周囲温度または加熱下で加えることで環化付加体(XV)を得ることができる。オキシ塩化リンなどであるがそれに限定されない塩素化剤での引き続く処理によってクロロ中間体(XVI)を生成する。中間体(XVI)をプロトン性溶媒中、水素化ホウ素(非限定的な例ではシアノ水素化ホウ素)などの還元剤の存在下、周囲温度または高温でのアルデヒドとの還元的アルキル化に供することでアミノ置換付加体(XVII)を生成することができる。引き続く反応において、無機塩基または有機塩基を含有する適切な非プロトン性またはプロトン性溶媒中でアミノ置換付加体(XVII)を(i) N-アルコキシ-N-アルキルアミン、(ii) ヒドラジンH2N-NHR2または(iii) ヒドラジンR1HN-NHR2と反応させることで、R3およびR4がHである所望の式(V)の化合物を生成する(スキーム6)。 In a non-limiting example, a cycloadduct is obtained by adding 2-chloroacetaldehyde to a polar protic solvent solution of 2,6-diamino-4-hydroxy-1,3-pyrimidine (XIV) at ambient temperature or under heating. (XV) can be obtained. Subsequent treatment with a chlorinating agent, such as but not limited to phosphorus oxychloride, produces the chloro intermediate (XVI). Subjecting the intermediate (XVI) to a reductive alkylation with an aldehyde at ambient or elevated temperature in a protic solvent in the presence of a reducing agent such as borohydride (non-limiting example cyanoborohydride). An amino-substituted adduct (XVII) can be generated with In subsequent reactions, the amino-substituted adduct (XVII) is converted to (i) N-alkoxy-N-alkylamine, (ii) hydrazine H 2 N in a suitable aprotic or protic solvent containing an inorganic base or an organic base. -NHR 2 or (iii) Reaction with hydrazine R 1 HN-NHR 2 yields the desired compound of formula (V) where R 3 and R 4 are H (Scheme 6).
非限定的な例では、式(IV)のピロリジノピリミジン化合物を対応するピロロピリミジン類似体から還元を経由して調製することができる(スキーム7)。 In a non-limiting example, a pyrrolidinopyrimidine compound of formula (IV) can be prepared from the corresponding pyrrolopyrimidine analog via reduction (Scheme 7).
医薬品有効成分(API)の製造によって、中間体または最終医薬品有効化合物において不純物が導入されるかまたは発生することがある。これらの不純物としては微量の金属、加工助剤残留物(例えばシリカ、セルロース繊維)、または購入した出発原料に由来する溶媒を挙げることができる。他の不純物は、出発原料、プロセス中間体、または有効成分自体がそれに曝露される条件の結果として形成されうる。これらの不純物は、製造プロセス全体、および特に有効成分(例えばその純度および結晶性、ならびにその単離および結晶化の条件)に影響するという点で問題でありうる。そのような不純物は単離されたAPIにしばしば入り込む。
The manufacture of active pharmaceutical ingredients (APIs) can introduce or generate impurities in intermediates or final active pharmaceutical compounds. These impurities include trace metals, processing aid residues (eg, silica, cellulose fibers), or solvents derived from purchased starting materials. Other impurities can be formed as a result of the conditions that the starting material, process intermediate, or active ingredient itself is exposed to. These impurities can be problematic in that they affect the overall manufacturing process, and in particular the active ingredient (eg its purity and crystallinity, and its isolation and crystallization conditions). Such impurities often enter the isolated API.
出発原料、中間体、反応物、溶媒またはAPIが関与する分解または副反応に由来するプロセス関連不純物は、API自体の構造にしばしば関連する。規制ガイダンス(例えばIQC Q3b R3)は、構造的に関連する可能性があるそのような種が有効成分中に最大で存在しうる許容限界を設けており、かつそのような不純物がそれを上回ると同定されるべきまたは同定されかつ制限されるべきである閾値レベルを、毒性学データと共に設けている。いくつかの例では、所与の不純物が許容レベル内で存在してもなお、試験用にまたは承認された医学的使用向けに製剤化される薬品としての有効成分の挙動に影響することがある。例えば、規制上の観点から許容されるレベル内で有効成分に存在するプロセス不純物は、非経口用製剤中で許容されない析出物を形成することがある。 Process-related impurities derived from decomposition or side reactions involving starting materials, intermediates, reactants, solvents or APIs are often related to the structure of the API itself. Regulatory guidance (e.g., IQC Q3b R3) sets a tolerance limit at which such species that may be structurally related may be present in the active ingredient at the maximum, and if such impurities exceed it A threshold level to be identified or to be identified and restricted is provided along with toxicology data. In some instances, the presence of a given impurity within acceptable levels may still affect the behavior of the active ingredient as a drug formulated for testing or approved medical use . For example, process impurities present in the active ingredient within acceptable levels from a regulatory point of view may form unacceptable precipitates in parenteral formulations.
本発明の化合物およびそれらの合成中間体が酸性またはアルカリ性の水性環境に曝露される特定の条件下では、芳香族複素環と環置換基との間の結合が加水分解的開裂を起こしやすいことがある。例えば、式(II-a)の化合物の中間体において、2位のハロ置換基(スキーム3および4)が加水分解によってヒドロキシル基で置き換えられることでN-(4,6-ビス(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)が生じうる。同様に、式(II-a)の化合物のアミン置換基もヒドロキシル基で置き換えられることがある。理論によって拘束されることを望むものではないが、付加的なアミン側鎖の先行的な酸化などの一連の化学的変化が、最終的変換としてのヒドロキシルによる加水分解的置き換えと共に生じることで、この置換が可能になりうる。非限定的な具体例として、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)のN,O-ジメチルヒドロキシルアミノ置換基が水の存在下での加工中にヒドロキシルで部分的に置き換えられることで、(CLXXVIII)がプロセス不純物として形成されることがある。(CLXXVIII)は未報告であり、大部分の有機溶媒中での非常に低い溶解性を示し、水性環境に難溶性である。意外にも、高温であっても(CLXXVIII)が有効成分に比べて非常に不溶性であることが観察された。したがって、API中の微量のこの化合物は液体製剤において問題となりうる。一態様では、遊離塩基としての有効成分の溶液を高温で濾過することで、加工中に形成された(CLXXVIII)を系から除去する。そのような濾過後に存在する残留レベルの不純物は、母液および最終生成物洗浄液中での固体生成物単離の間にパージすることができる。一態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して1%(w/w)未満である。さらに別の態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して0.5%(w/w)未満である。さらに別の態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して0.3%(w/w)未満である。さらに別の態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して0.2%(w/w)未満である。さらに別の態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して0.15%(w/w)未満である。さらに別の態様では、単離(XXXVI)中の(CLXXVIII)のレベルは(XXXVI)に対して0.1%(w/w)未満である。さらに別の態様では、単離(XXXVI)は4,6-ビス(n-プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)を本質的に含まない。
Under certain conditions where the compounds of the invention and their synthetic intermediates are exposed to an acidic or alkaline aqueous environment, the bond between the aromatic heterocycle and the ring substituent may be prone to hydrolytic cleavage. is there. For example, in an intermediate of a compound of formula (II-a), the halo substituent at the 2-position (
製剤および薬品の安定性
(XXXVI)の好適な液体製剤を考案するために大規模な実験を行った。実験は(XXXVI)のpKaが約5.6であることを示した。適切なpHの単純な緩衝溶液としてIV製剤用に(XXXVI)を製剤化することの実現可能性を評価するために、pH溶解度試験を行った。溶解度は、単独の(XXXV)(図19A)、またはクエン酸と混合し、6N水酸化ナトリウムでpH 3〜5.5に調整した場合の(XXXV)(図19B)について評価した。得られたデータ(表12A、図19B)から(XXXV)の溶解度がpH約3.86で10mg/mL、pH約3.46で25mg/mL、pH約3.16で50mg/mLであると計算された。水中溶解度試験は、有用な濃度を可能にする上でpH約3.6超での溶解度が不適切でありうることを示唆した。pH 3.6未満での製剤化は、製剤化された薬物が投与前に希釈される場合には許容可能でありうるが、そのような低pHでは薬物安定性が問題になることがある。
Formulation and drug stability
Extensive experiments were conducted to devise a suitable liquid formulation of (XXXVI). The experiment showed that the pKa of (XXXVI) is about 5.6. To evaluate the feasibility of formulating (XXXVI) for IV formulations as a simple buffer solution with appropriate pH, a pH solubility test was performed. Solubility was evaluated for (XXXV) alone (FIG. 19A) or (XXXV) (FIG. 19B) when mixed with citric acid and adjusted to pH 3-5.5 with 6N sodium hydroxide. From the data obtained (Table 12A, FIG. 19B), the solubility of (XXXV) was calculated to be 10 mg / mL at pH about 3.86, 25 mg / mL at pH about 3.46, and 50 mg / mL at pH about 3.16. Water solubility tests suggested that solubility at pH above about 3.6 could be inadequate to allow useful concentrations. Formulations below pH 3.6 may be acceptable if the formulated drug is diluted prior to administration, but drug stability may be an issue at such low pH.
完全水性製剤の可能性をさらに評価するために、pHの関数としての(XXXV)の安定性試験を、緩衝液の存在下で、薬物析出を最小化しかつ緩衝液によって触媒される薬物分解を回避するように薬物および緩衝液の濃度に特に注意して行った(図20A、表12B)。水中(XXXVI)(1mg/mL)をクエン酸およびグリシン(各10mM)の溶液と混合し、混合物をpH 2〜5に調整し、40℃、60℃、25℃(対照)および-70℃(対照)に曝露し、1週間、2週間および4週間の保存後の物理的外観、pH、アッセイおよび関連物質について評価した。40℃および60℃において、pH 2での分解物レベルはpH 3〜6に対して約10倍高かったが、pH 3〜6では、レベル0.2超までの不純物の増加が一般的に依然として観察された。pH 3.6超での(XXXV)の溶解度が限られていることから、pH 2〜5について使用したものと同様の方法論を使用して、安定性をpH範囲2〜3.6で評価した(図20B、表12C)。アッセイおよび試料pHはほとんど変化を示さなかったが、不純物の増加がこの範囲にわたって生じ、pH 2での不純物レベルはpH 3.6での不純物レベルよりも10倍以上高かった。
To further evaluate the potential of fully aqueous formulations, test stability of (XXXV) as a function of pH to minimize drug precipitation and avoid buffer-catalyzed drug degradation in the presence of buffer Special attention was paid to drug and buffer concentrations (Figure 20A, Table 12B). Water (XXXVI) (1 mg / mL) is mixed with a solution of citric acid and glycine (10 mM each), the mixture is adjusted to pH 2-5, 40 ° C., 60 ° C., 25 ° C. (control) and −70 ° C. ( Control) and evaluated for physical appearance, pH, assay and related substances after 1 week, 2 weeks and 4 weeks of storage. At 40 ° C and 60 ° C, degradation levels at
別のオプションとして、共溶媒マトリックスを含む製剤が、好適なpHでの塩および遊離塩基の形態の良好な溶解度を実現する上で有用なことがある。(XXXV)および(XXXVI)の溶解度を、0.9% NaCl、5%デキストロース、エタノール、メタノール、アセトニトリル、30% PEG 400、70% PEG 400および100% PEG 400、5% Tween 80、ならびにプロピレングリコールを含む様々な溶媒および標準的IV溶液中で評価した(表12D)。(XXXVI)の溶解度は水(400mg/mL超)、IV溶液(0.9%生理食塩水および5%デキストロース)、エタノールおよびメタノール、ならびに30%、70%および100%プロピレングリコール中で90mg/mLを超えた。100% PEG-400中でのその溶解度は約36mg/mLであったが、30%および70% PEG-400中では90mg/mL以上であった。水中での(XXXV)の飽和溶解度は約0.21mg/mLであり、これはpH溶解度試験からの予測値と一致していた。エタノール、メタノールおよびアセトニトリル中での溶解度は90mg/mL超であった。PEG-400およびプロピレングリコール系中での溶解度は共溶媒のレベル増大に従って改善した。
As another option, formulations containing a co-solvent matrix may be useful in achieving good solubility of the salt and free base forms at a suitable pH. (XXXV) and (XXXVI) solubility, including 0.9% NaCl, 5% dextrose, ethanol, methanol, acetonitrile, 30
安定性に対する緩衝液強度の影響を、(XXXV)とクエン酸10〜250ミリモルとの混合物をpH 3で使用して試験した(表12F)。不純物レベルは最高緩衝液濃度で有意に増大したが、製剤に適した緩衝液濃度の範囲(約10〜50mM)内では40℃での緩衝液強度の影響はなかった。 The effect of buffer strength on stability was tested using a mixture of (XXXV) and 10-250 mmol of citrate at pH 3 (Table 12F). Impurity levels increased significantly at the highest buffer concentration, but there was no effect of buffer strength at 40 ° C. within the buffer concentration range appropriate for the formulation (approximately 10-50 mM).
単純緩衝溶液、共溶媒系および非水性溶液を含む合計9つの(XXXVI)プロトタイプ製剤を調製した(表12G)。溶液は、35mg/mL(XXXVI)に対応する遊離塩基としての25mg/mL(XXXV)で調製した。プロトタイプ6、7および8は、調製中に著しい析出を生じさせたことから、さらなる評価は行わなかった。残りのプロトタイプは血清バイアル中にて2〜8℃、室温、40℃および60℃で保存した。2〜8℃および室温で保存した試料を安定性について選択された時点で分析した(表12G.1〜表12G.6)。
A total of nine (XXXVI) prototype formulations including simple buffer solution, co-solvent system and non-aqueous solution were prepared (Table 12G). The solution was prepared at 25 mg / mL (XXXV) as the free base corresponding to 35 mg / mL (XXXVI).
この試験は、pH 3近傍の(XXXV)の緩衝水性製剤が冷蔵条件または25℃条件下で安定であることを示唆した(表12G.1)。図19Bを作成するために使用したデータに基づけば、(XXXV)の濃度を半減させることで製剤のpHが約0.3単位上昇するし、表12Cにおいてわかるように、0.3単位のpH上昇によって製剤の安定性が実質的に改善された。したがって、表12Gの1行目による製剤中の(XXXV)の濃度は25mg/mLから10mg/mLに減少し、pHは3.0から3.2に上昇し、緩衝液濃度は比例して50mMから20mMに減少した。最終製剤を表12Hに示す。
This study suggested that (XXXV) buffered aqueous formulations near
臨床用に製剤化された(XXXVI)のバッチを正式のGMP安定性下に設置した(表20I.1および表12I.2)。得られたデータは、単一の分解物が経時的に形成されたことを示す。分解物はN-(4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)と同定された。GMP安定性試験の結果は、分解物が少なくとも2年間は0.5%未満にとどまると予想されうることを示した(図21、表12J)。 Batches of clinically formulated (XXXVI) were placed under formal GMP stability (Table 20I.1 and Table 12I.2). The data obtained indicates that a single degradation product has formed over time. The degradation product was identified as N- (4,6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII) .The results of the GMP stability test showed that the degradation product was at least 2 years old. It was shown that it could be expected to stay below 0.5% (Figure 21, Table 12J).
一局面では、本発明の化合物が水、または好適な有機溶媒を含む水性混合物に部分的または完全に溶解する際に、加水分解性分解物が経時的に観察されることがある。例えば、水性製剤中でN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)が分解されて4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)になることがある。pHが3の値未満に減少するに従って、分解はますます顕著になった(図20Aおよび図20B)。(XXXV)では、溶解度はpH 3.5以下で高く、pH約3.5〜約4.4で急速に減少した(図19Aおよび図19B)。 In one aspect, hydrolyzable degradation products may be observed over time as the compounds of the present invention are partially or fully dissolved in water or an aqueous mixture containing a suitable organic solvent. For example, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) is decomposed in an aqueous formulation to yield 4 , 6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII). As pH decreased below the value of 3, degradation became more pronounced (FIGS. 20A and 20B). For (XXXV), solubility was high below pH 3.5 and decreased rapidly from about pH 3.5 to about 4.4 (FIGS. 19A and 19B).
別の局面では、選択される任意の温度において溶解度と加水分解安定性とを均衡させるために、(XXXV)を含有する混合物のpHを特定の範囲に調整する。(XXXV)の分解速度は、(XXXV)の可溶性が臨床的に有用なレベルに達するpH範囲において最高であった。一態様では、液体担体中の(XXXV)の臨床的に有用な濃度は約1〜10mg/mLである。別の態様では、液体担体中の(XXXV)の臨床的に有用な濃度は約5〜10mg/mLである。また、水性環境中での(XXXV)の分解は非常に温度依存的であり、冷温が分解を遅延させた。 In another aspect, the pH of the mixture containing (XXXV) is adjusted to a specific range to balance solubility and hydrolysis stability at any selected temperature. The degradation rate of (XXXV) was highest in the pH range where the solubility of (XXXV) reached clinically useful levels. In one aspect, the clinically useful concentration of (XXXV) in the liquid carrier is about 1-10 mg / mL. In another embodiment, the clinically useful concentration of (XXXV) in the liquid carrier is about 5-10 mg / mL. In addition, the decomposition of (XXXV) in an aqueous environment was very temperature dependent, and cold temperature delayed the decomposition.
一態様では、溶解度を最適化しかつ分解を最小化するために、液体担体中の硫酸水素塩(XXXVI)としての(XXXV)を、pHを調整するための薬剤と混合する。別の態様では、液体担体中の硫酸水素塩(XXXVI)としての(XXXV)を緩衝助剤と混合する。好適な緩衝助剤としてはクエン酸、アスコルビン酸、一塩基性リン酸および乳酸が挙げられるがそれに限定されない。一態様では、緩衝助剤はクエン酸である。別の態様では、溶解度を最適化しかつ加水分解性分解を最小化するために、硫酸水素塩(XXXVI)としての(XXXV)をクエン酸、および必要に応じてpHを調整するための塩基と混合する。好適な塩基としては水酸化ナトリウム、水酸化カリウム、水酸化アンモニウムおよび二塩基性リン酸水素カリウムが挙げられるがそれに限定されない。一態様では、pHを水酸化ナトリウムで調整する。別の態様では、液体担体は水と好適な有機共溶媒との混合物である。好適な有機共溶媒としてはグリセリン、プロピレングリコール、ポリエチレングリコール400、エタノール、1,4-ブタンジオールおよびジメチルスルホキシドが挙げられるがそれに限定されない。別の態様では、液体担体は水である。
In one embodiment, (XXXV) as hydrogen sulfate (XXXVI) in a liquid carrier is mixed with an agent to adjust the pH to optimize solubility and minimize degradation. In another embodiment, (XXXV) as hydrogen sulfate (XXXVI) in a liquid carrier is mixed with a buffering aid. Suitable buffering aids include, but are not limited to, citric acid, ascorbic acid, monobasic phosphate and lactic acid. In one aspect, the buffering aid is citric acid. In another embodiment, (XXXV) as bisulfate (XXXVI) is mixed with citric acid and a base to adjust the pH as needed to optimize solubility and minimize hydrolytic degradation. To do. Suitable bases include but are not limited to sodium hydroxide, potassium hydroxide, ammonium hydroxide and dibasic potassium hydrogen phosphate. In one embodiment, the pH is adjusted with sodium hydroxide. In another aspect, the liquid carrier is a mixture of water and a suitable organic cosolvent. Suitable organic cosolvents include, but are not limited to glycerin, propylene glycol,
一態様では、硫酸塩(XXXVI)としての(XXXV)とクエン酸および水酸化ナトリウムとを水中で含む混合物をpH約2.5〜6に調整する。別の態様では、混合物をpH約3〜5に調整する。さらに別の態様では、混合物をpH約3〜4に調整する。 In one embodiment, a mixture comprising (XXXV) as sulfate (XXXVI), citric acid and sodium hydroxide in water is adjusted to a pH of about 2.5-6. In another embodiment, the mixture is adjusted to a pH of about 3-5. In yet another embodiment, the mixture is adjusted to a pH of about 3-4.
一態様では、硫酸水素塩としての(XXXV)を含む混合物を、該化合物の分解速度を遅延させる低温で保存することができる。別の態様では、温度は約0〜15℃の範囲でありうる。さらに別の態様では、冷温は2〜8℃の範囲でありうる。さらに別の態様では、硫酸水素塩(XXXVI)としての(XXXV)ならびにクエン酸および水酸化ナトリウムを含む混合物をpH約3〜4に調整し、約2〜8℃で保存する。分解物増加速度は2〜8℃で遅く、25℃以上ではるかに速くなった。図21に示すように、(XXXVI)を非経口投与用に製剤化する(非限定的条件: pH 3〜4の水性媒体)際に形成される(CLXXVIII)のレベルを、2〜8℃で製剤を保存することで2年超にわたって0.5%未満に維持することができる(図21)。 In one aspect, a mixture comprising (XXXV) as a hydrogen sulfate salt can be stored at a low temperature that retards the degradation rate of the compound. In another embodiment, the temperature can range from about 0-15 ° C. In yet another embodiment, the cold temperature can range from 2-8 ° C. In yet another embodiment, a mixture comprising (XXXV) as hydrogen sulfate (XXXVI) and citric acid and sodium hydroxide is adjusted to a pH of about 3-4 and stored at about 2-8 ° C. The rate of degradation was slow at 2-8 ° C and much faster above 25 ° C. As shown in FIG. 21, the level of (CLXXVIII) formed when formulating (XXXVI) for parenteral administration (non-limiting conditions: aqueous medium at pH 3-4) is 2-8 ° C. The formulation can be stored and maintained below 0.5% for over 2 years (Figure 21).
本発明は、有効成分、塩形成剤、混合された緩衝助剤、混合されたベースpH、および液体担体を含む製剤を、薬物溶解度を最適化しかつ加水分解性分解物を許容レベル内に維持するために必要な保存条件と共に含む。 The present invention optimizes drug solubility and maintains hydrolyzable degradation products within acceptable levels for formulations comprising active ingredients, salt formers, mixed buffering aids, mixed base pH, and liquid carrier. Including with necessary storage conditions.
塩
本明細書に記載の化合物は酸と塩を形成することができ、そのような塩は本発明に含まれる。一態様では、塩は薬学的に許容される塩である。「塩」という用語は、本発明の方法の範囲内で有用な遊離酸の付加塩を包含する。「薬学的に許容される塩」という用語は、薬学的用途での有用性を与える範囲内の毒性プロファイルを有する塩を意味する。本発明の実施における有用性、例えば本発明の方法の範囲内で有用な化合物の合成、精製または製剤化の過程における有用性を有するにもかかわらず薬学的に許容されない塩は、高い結晶性などの特性を有することがある。
Compounds described salts herein can form a salt with an acid, such salts are included in the present invention. In one aspect, the salt is a pharmaceutically acceptable salt. The term “salt” encompasses the free acid addition salts useful within the method of the invention. The term “pharmaceutically acceptable salt” means a salt having a toxicity profile within a range that confers utility in pharmaceutical applications. Salts that are not pharmaceutically acceptable despite having utility in the practice of the invention, for example, in the process of synthesis, purification, or formulation of compounds useful within the methods of the invention are highly crystalline, etc. May have the following characteristics.
好適な薬学的に許容される酸付加塩は無機酸または有機酸から調製することができる。無機酸の例としては硫酸塩、硫酸水素塩、塩酸、臭化水素酸、ヨウ化水素酸、硝酸、炭酸、硫酸、ならびにリン酸(リン酸水素塩およびリン酸二水素塩を含む)が挙げられる。適切な有機酸は脂肪族、脂環式、芳香族、芳香脂肪族、複素環、カルボン酸およびスルホン酸クラスの有機酸から選択することができ、その例としてはギ酸、酢酸、プロピオン酸、コハク酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、グルクロン酸、マレイン酸、フマル酸、ピルビン酸、アスパラギン酸、グルタミン酸、安息香酸、アントラニル酸、4-ヒドロキシ安息香酸、フェニル酢酸、マンデル酸、エンボン酸(パモ酸)、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、パントテン酸、トリフルオロメタンスルホン酸、2-ヒドロキシエタンスルホン酸、p-トルエンスルホン酸、スルファニル酸、シクロヘキシルアミノスルホン酸、ステアリン酸、アルギン酸、β-ヒドロキシ酪酸、サリチル酸、ガラクタル酸およびガラクツロン酸が挙げられる。 Suitable pharmaceutically acceptable acid addition salts can be prepared from inorganic or organic acids. Examples of inorganic acids include sulfate, hydrogen sulfate, hydrochloric acid, hydrobromic acid, hydroiodic acid, nitric acid, carbonic acid, sulfuric acid, and phosphoric acid (including hydrogen phosphate and dihydrogen phosphate). It is done. Suitable organic acids can be selected from aliphatic, cycloaliphatic, aromatic, araliphatic, heterocyclic, carboxylic and sulfonic acid classes of organic acids such as formic acid, acetic acid, propionic acid, succinic acid. Acid, glycolic acid, gluconic acid, lactic acid, malic acid, tartaric acid, citric acid, ascorbic acid, glucuronic acid, maleic acid, fumaric acid, pyruvic acid, aspartic acid, glutamic acid, benzoic acid, anthranilic acid, 4-hydroxybenzoic acid, Phenylacetic acid, mandelic acid, embonic acid (pamoic acid), methanesulfonic acid, ethanesulfonic acid, benzenesulfonic acid, pantothenic acid, trifluoromethanesulfonic acid, 2-hydroxyethanesulfonic acid, p-toluenesulfonic acid, sulfanilic acid, cyclohexyl Aminosulfonic acid, stearic acid, alginic acid, β-hydroxybutyric acid, sari Le acid, galactaric and galacturonic acid.
本発明の化合物の好適な薬学的に許容される塩基付加塩としては例えば、例えばカルシウム塩、マグネシウム塩、カリウム塩、ナトリウム塩および亜鉛塩などのアルカリ金属塩、アルカリ土類金属塩および遷移金属塩を含む金属塩が挙げられる。薬学的に許容される塩基付加塩としては、例えばN,N'-ジベンジルエチレン-ジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N-メチルグルカミン)およびプロカインなどの塩基性アミンから作製される有機塩も挙げられる。すべてのこれらの塩は、対応する化合物から、例えば適切な酸または塩基と該化合物とを反応させることで調製することができる。 Suitable pharmaceutically acceptable base addition salts of the compounds of the present invention include, for example, alkali metal salts, alkaline earth metal salts and transition metal salts such as calcium salts, magnesium salts, potassium salts, sodium salts and zinc salts. And metal salts containing. Examples of pharmaceutically acceptable base addition salts are made from basic amines such as N, N'-dibenzylethylene-diamine, chloroprocaine, choline, diethanolamine, ethylenediamine, meglumine (N-methylglucamine) and procaine. Also included are organic salts. All these salts can be prepared from the corresponding compound, for example by reacting the compound with the appropriate acid or base.
併用療法
一態様では、本発明の化合物は、本発明の方法において、呼吸制御障害を処置するために有用な少なくとも1つのさらなる化合物との組み合わせで有用である。これらのさらなる化合物は、本発明の化合物、または呼吸障害を処置し、予防しまたはその症状を減少させることが知られる市販の化合物などの他の化合物を含みうる。一態様では、少なくとも1つの本発明の化合物またはその塩と呼吸障害を処置するために有用な少なくとも1つのさらなる化合物との組み合わせは、呼吸障害の処置および睡眠関連呼吸障害の処置において相加効果、補完効果または相乗効果を示す。
Combination Therapy In one aspect, the compounds of the invention are useful in combination with at least one additional compound that is useful for treating respiratory control disorders in the methods of the invention. These additional compounds may include other compounds such as compounds of the present invention or commercially available compounds known to treat, prevent or reduce symptoms of respiratory disorders. In one aspect, the combination of at least one compound of the invention or a salt thereof and at least one additional compound useful for treating respiratory disorders is an additive effect in the treatment of respiratory disorders and the treatment of sleep-related respiratory disorders, Shows complementary or synergistic effects.
非限定的な例では、本発明の化合物またはその塩は、以下の1つまたは複数の薬物との組み合わせで使用することができる: アセタゾラミド、アルミトリン、テオフィリン、カフェイン、メチルプロゲステロンおよび関連化合物、セロトニン作動性モジュレーター、カンナビノイド(ドロナビノールなどであるがそれに限定されない)、ならびにアンパカインとして知られる化合物。アンパカインの非限定的な例としては、ピラセタムおよびアニラセタムなどのピロリジン誘導体ラセタム薬; CX-516(6-(ピペリジン-1-イル-カルボニル)キノキサリン)、CX-546(2,3-ジヒドロ-1,4-ベンゾジオキシン-7-イル-(1-ピペリジル)-メタノン)、CX-614(2H,3H,6aH-ピロリジノ(2,1-3',2')-1,3-オキサジノ-(6',5'-5,4)ベンゾ(e)1,4-ジオキサン-10-オン)、CX-691(2,1,3-ベンゾオキサジアゾール-6-イル-ピペリジン-1-イル-メタノン)、CX-717、CX-701、CX-1739、CX-1763およびCX-1837などの一連のベンゾイルピペリジン構造およびベンゾイルピロリジン構造を包含する「CX」系の薬物; シクロチアジドおよびIDRA-21(7-クロロ-3-メチル-3,4-ジヒドロ-2H-1,2,4-ベンゾチアジアジン 1,1-ジオキシド)などのベンゾチアジド誘導体; LY-392,098、LY-404,187(N-[2-(4'-シアノビフェニル-4-イル)プロピル]プロパン-2-スルホンアミド)、LY-451,646およびLY-503,430(4'-{(1S)-1-フルオロ-2-[(イソプロピルスルホニル)アミノ]-1-メチルエチル}-N-メチルビフェニル-4-カルボキサミド)などのビアリールプロピルスルホンアミドがある。 In a non-limiting example, a compound of the present invention or salt thereof can be used in combination with one or more of the following drugs: acetazolamide, aluminthrin, theophylline, caffeine, methylprogesterone and related compounds, Serotonergic modulators, cannabinoids (including but not limited to dronabinol), and compounds known as ampakines. Non-limiting examples of ampakines include pyrrolidine derivative racetam drugs such as piracetam and aniracetam; CX-516 (6- (piperidin-1-yl-carbonyl) quinoxaline), CX-546 (2,3-dihydro-1, 4-benzodioxin-7-yl- (1-piperidyl) -methanone), CX-614 (2H, 3H, 6aH-pyrrolidino (2,1-3 ', 2')-1,3-oxazino- (6 ' , 5'-5,4) benzo (e) 1,4-dioxane-10-one), CX-691 (2,1,3-benzooxadiazol-6-yl-piperidin-1-yl-methanone) CX-series drugs including a series of benzoylpiperidine and benzoylpyrrolidine structures such as CX-717, CX-701, CX-1739, CX-1763 and CX-1837; cyclothiazide and IDRA-21 (7- Benzothiazide derivatives such as chloro-3-methyl-3,4-dihydro-2H-1,2,4-benzothiadiazine 1,1-dioxide); LY-392,098, LY-404,187 (N- [2- ( 4'-Cyanobiphenyl-4-yl) propyl] propane-2-sulf Amide), LY-451,646 and LY-503,430 (4 ′-{(1S) -1-fluoro-2-[(isopropylsulfonyl) amino] -1-methylethyl} -N-methylbiphenyl-4-carboxamide) There are biarylpropylsulfonamides.
相乗効果は、例えばシグモイド-Emax方程式(Holford & Scheiner, 19981, Clin. Pharmacokinet. 6: 429-453)、Loewe相加性方程式(Loewe & Muischnek, 1926, Arch. Exp. Pathol Pharmacol. 114: 313-326)およびメジアン効果方程式(Chou & Talalay, 1984, Adv. Enzyme Regul. 22: 27-55)などの好適な方法を使用して例えば計算することができる。上記で言及した各方程式を実験データに適用することで、薬物組み合わせの効果を評価するために役立つ対応グラフを作成することができる。上記で言及した方程式に関連する対応グラフはそれぞれ濃度-効果曲線、アイソボログラム曲線および組み合わせ指数曲線である。 Synergistic effects include, for example, sigmoid-E max equation (Holford & Scheiner, 19981, Clin. Pharmacokinet. 6: 429-453), Loewe additive equation (Loewe & Muischnek, 1926, Arch. Exp. Pathol Pharmacol. 114: 313 -326) and the median effect equation (Chou & Talalay, 1984, Adv. Enzyme Regul. 22: 27-55). By applying each equation mentioned above to the experimental data, a correspondence graph useful for evaluating the effect of the drug combination can be created. The corresponding graphs associated with the equations referred to above are the concentration-effect curve, isobologram curve and combination index curve, respectively.
本発明の方法
本発明は、それを必要とする対象において呼吸制御障害または呼吸制御疾患を予防または処置する方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と以下からなる群より選択される少なくとも1つの化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。
Methods of the Invention The present invention includes methods for preventing or treating respiratory control disorders or respiratory control disorders in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound selected from the group consisting of: N- (2, 4-Bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1 , 3,5] triazine (CLXXIII), N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), its salts, and any combinations thereof.
本発明はまた、それを必要とする対象において呼吸リズムの不安定化を予防するかまたは呼吸リズムを安定化させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と以下からなる群より選択される少なくとも1つの化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む: N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン(CLXXV)、その塩、およびそれらの任意の組み合わせ。 The invention also includes a method of preventing or stabilizing respiratory rhythm instability in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound selected from the group consisting of: N- (2, 4-Bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine (CLXXII), N- (2,4,6-tris-n-propylamino)-[1 , 3,5] triazine (CLXXIII), N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (CLXXIV), N- (2,4-bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine (CLXXV), its salts, and any combinations thereof.
一態様では、呼吸制御障害または呼吸制御疾患は、呼吸抑制、睡眠時無呼吸、未熟児無呼吸、肥満低換気症候群、原発性肺胞低換気症候群、呼吸困難、低酸素症および高炭酸ガス血症からなる群より選択される。別の態様では、呼吸抑制は麻酔薬、鎮静薬、抗不安薬、睡眠薬、アルコールまたは麻薬によって引き起こされる。さらに別の態様では、呼吸制御障害または呼吸制御疾患を処置するために有用な少なくとも1つのさらなる化合物を含む組成物を対象にさらに投与する。さらに別の態様では、少なくとも1つのさらなる化合物は、アセタゾラミド、アルミトリン、テオフィリン、カフェイン、メチルプロゲステロン、セロトニンモジュレーター、カンナビノイドおよびアンパカインからなる群より選択される。さらに別の態様では、製剤を、対象に対する人工呼吸装置または気道陽圧装置の使用と組み合わせて投与する。さらに別の態様では、対象は哺乳動物である。さらに別の態様では、哺乳動物はヒトである。さらに別の態様では、製剤を、吸入、局所、経口、頬側、直腸、経膣、筋肉内、皮下、経皮、くも膜下腔内または静脈内経路によって対象に投与する。 In one aspect, the respiratory control disorder or respiratory control disorder is respiratory depression, sleep apnea, premature infant apnea, obesity hypoventilation syndrome, primary alveolar hypoventilation syndrome, dyspnea, hypoxia and hypercapnia Selected from the group consisting of symptoms. In another aspect, respiratory depression is caused by anesthetics, sedatives, anxiolytics, hypnotics, alcohol or narcotics. In yet another embodiment, the subject is further administered a composition comprising at least one additional compound useful for treating a respiratory control disorder or respiratory control disorder. In yet another embodiment, the at least one additional compound is selected from the group consisting of acetazolamide, aluminin, theophylline, caffeine, methylprogesterone, serotonin modulators, cannabinoids and ampakines. In yet another aspect, the formulation is administered in combination with the use of a ventilator or positive airway pressure device to the subject. In yet another aspect, the subject is a mammal. In yet another aspect, the mammal is a human. In yet another embodiment, the formulation is administered to the subject by inhalation, topical, oral, buccal, rectal, vaginal, intramuscular, subcutaneous, transdermal, intrathecal or intravenous route.
本発明はまた、それを必要とする対象においてカリウムmaxi-KもしくはBKチャネルの開口チャネル部分を減少または最小化させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む。 The invention also includes a method of reducing or minimizing the open channel portion of a potassium maxi-K or BK channel in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I).
本発明はまた、それを必要とする対象においてTASK-1(KCNK3)チャネルを阻害する方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物とを含む薬学的製剤の有効量を対象に投与する段階を含む。 The invention also includes a method of inhibiting a TASK-1 (KCNK3) channel in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I).
本発明はまた、それを必要とする対象において分時換気量を増大させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物とを含む有効量の薬学的製剤の有効量を対象に投与する段階を含む。 The invention also includes a method of increasing minute ventilation in a subject in need thereof. The method comprises administering to the subject an effective amount of an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I).
一態様では、式(I)の化合物は下記式またはその塩である:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;R4はH、アルキルまたは置換アルキルであり;R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;R6はH、アルキル、置換アルキルまたはアルケニルであり;Xは結合、OまたはNR4であり;YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;
YがCである場合、結合b1は単結合であり、かつ(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
In one aspect, the compound of formula (I) is of the formula:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forms a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl; R 3 is H, alkyl , substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -NR 1 R 2, -C ( O) OR 1, acyl also Aryl; R 4 is an H, alkyl or substituted alkyl; R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1, -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 taken together to form 3,6,9-trioxa Forming a biradical selected from the group consisting of -undecane-1,11-diyl and 3,6-dioxa-octane-1,8-diyl; R 6 is H, alkyl, substituted alkyl or alkenyl; X is A bond, O or NR 4 ; Y is N, CR 6 or C; where
When Y is N or CR 6 , bond b 1 is not present and (i) Z is H, bond b 2 is a single bond and A is CH; or (ii) Z is absent, bond b 2 is absent and A is a single bond;
When Y is C, bond b 1 is a single bond, and (i) Z is CH 2 , bond b 2 is a single bond, and A is CH; or (ii) Z Is CH, bond b 2 is a double bond, and A is C.
別の態様では、式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-(メトキシ(メチル)アミノ)-6-(n-プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン、6-[1,2]オキサジナン-2-イル-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン、6-((ベンジルオキシ)(イソプロピル)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン、6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン、4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(ピリジン-4-イル-メチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(テトラヒドロピラン-4-イル-メチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン、2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-N'-メチルヒドラジン、2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン、2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン、8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール、N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン、その塩、およびそれらの混合物。別の態様では、式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-n-プロピルアミノ-1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-[(2,6-ビス-n-プロピルアミノ)-ピリミジン-4-イル]-N,O-ジメチル-ヒドロキシルアミン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、その塩、およびそれらの混合物。さらに別の態様では、 In another embodiment, the compound of formula (I) is selected from the group consisting of: N- (4,6-bis-methylamino- [1,3,5] triazin-2-yl) -N, O -Dimethyl-hydroxylamine, N- (4,6-bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-ethylamino) -N- (6-n- Propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2-methylpropylamino)) [1,3,5 ] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine , N- (4,6-bi Su-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4- (methoxy (methyl) amino) -6- (n-propylamino ) -1,3,5-Triazin-2-yl) propionamide, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxyl Amine, O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, N- (4,6-bis-n-propylamino -[1,3,5] triazin-2-yl) -hydroxylamine, 6- (methoxy (methyl) amino) -N 2 -propyl-1,3,5-triazine-2,4-diamine, N- ( 4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N -Isopropyl-hydro Silamine, 6- [1,2] oxazinan-2-yl-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine, N- (4,6-bis-n-propylamino -[1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5 ] Triazin-2-yl) -N-ethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine, 6-((benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine, N- (4,6-bis-n-propylamino- [ 1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl ) -O-isobutyl-N-methyl-hydroxylamine, 6- (methyl (thiophen-2-ylmethoxy) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine- 2,4-diamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine, N- ( 4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine, 4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) ) Amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino -6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (1-N-methylimidazol-2-yl) ) -Methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (2 -Dimethylaminoethyl) amino )-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (pyridin-4-yl-methyl) amino)-[1,3 , 5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazine-2 -Yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (tetrahydropyran-4-yl-methyl) amino]-[1,3,5] triazin-2-yl) -N , O-dimethyl-hydroxylamine, N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -Trien-17-yl) -N, O-dimethylhydroxylamine, 2,6-bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl- Hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (4,6-bis-n -Propylamino- [1,3,5] triazin-2-yl) -N-methyl-N'-me Ruhydrazine, 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-dimethylamino-7- Methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4 -(i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine, 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine, 2 -(n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine, 8- (7-methyl-2- (n-propylamino) -Pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol, N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4- Yl) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidine-4- Yl) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2-n-propylamino-7-methyl- Pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N -Methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N, N-dimethyl-N '-(2-n-propylamino-7 -Methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine, N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine, N- (2, 4-Bis-n-propylamino) -N- (6-i-propylamino) -1,3-pyrimidine, its salts, and mixtures thereof. In another embodiment, the compound of formula (I) is selected from the group consisting of: N- (4,6-bis-n-propylamino-1,3,5] triazin-2-yl) -O- Methyl-hydroxylamine, N- (4,6-bis-n-propylamino-1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (2,4-bis- n-propylamino) -N- (6-methylamino)-[1,3,5] triazine, N-[(2,6-bis-n-propylamino) -pyrimidin-4-yl] -N, O -Dimethyl-hydroxylamine, N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, its salts, and mixtures thereof. In yet another aspect,
一態様では、対象は哺乳動物である。別の態様では、哺乳動物はヒトである。式(I)の化合物はN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミンまたはその塩である。 In one aspect, the subject is a mammal. In another aspect, the mammal is a human. The compound of formula (I) is N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine or a salt thereof.
一態様では、薬学的製剤を静脈内注入によって投与する。別の態様では、薬学的製剤の注入量は少なくとも約0.016mg/kg/分である。さらに別の態様では、薬学的製剤の注入量は約0.016mg/kg/分である。さらに別の態様では、薬学的組成物の注入量は、対象において少なくとも約726ng/mLの血漿中濃度をもたらす。さらに別の態様では、薬学的組成物の注入量は、哺乳動物において少なくとも約726ng/mLの血漿中濃度をもたらす。 In one aspect, the pharmaceutical formulation is administered by intravenous infusion. In another embodiment, the infusion rate of the pharmaceutical formulation is at least about 0.016 mg / kg / min. In yet another embodiment, the dosage of the pharmaceutical formulation is about 0.016 mg / kg / min. In yet another embodiment, the infusion amount of the pharmaceutical composition results in a plasma concentration of at least about 726 ng / mL in the subject. In yet another embodiment, the infusion amount of the pharmaceutical composition results in a plasma concentration of at least about 726 ng / mL in the mammal.
本発明はまた、それを必要とする対象において呼吸制御障害または呼吸制御疾患を予防または処置する方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物またはその塩とを含む薬学的製剤の有効量を対象に投与する段階を含む:
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;R4はH、アルキルまたは置換アルキルであり;R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;R6はH、アルキル、置換アルキルまたはアルケニルであり;Xは結合、OまたはNR4であり;YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ(i) ZはHであり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) Zは存在せず、結合b2は存在せず、かつAは単結合であり;
YがCである場合、結合b1は単結合であり、かつ(i) ZはCH2であり、結合b2は単結合であり、かつAはCHであるか; あるいは、(ii) ZはCHであり、結合b2は二重結合であり、かつAはCである。
The invention also includes a method of preventing or treating a respiratory control disorder or respiratory control disorder in a subject in need thereof. The method comprises administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forms a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl; R 3 is H, alkyl , substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -NR 1 R 2, -C ( O) OR 1, acyl also Aryl; R 4 is an H, alkyl or substituted alkyl; R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1, -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 taken together to form 3,6,9-trioxa Forming a biradical selected from the group consisting of -undecane-1,11-diyl and 3,6-dioxa-octane-1,8-diyl; R 6 is H, alkyl, substituted alkyl or alkenyl; X is A bond, O or NR 4 ; Y is N, CR 6 or C; where
When Y is N or CR 6 , bond b 1 is not present and (i) Z is H, bond b 2 is a single bond and A is CH; or (ii) Z is absent, bond b 2 is absent and A is a single bond;
When Y is C, bond b 1 is a single bond, and (i) Z is CH 2 , bond b 2 is a single bond, and A is CH; or (ii) Z Is CH, bond b 2 is a double bond, and A is C.
本発明はまた、それを必要とする対象において呼吸リズムの不安定化を予防するかまたは呼吸リズムを安定化させる方法を含む。本方法は、少なくとも1つの薬学的に許容される担体と少なくとも1つの式(I)の化合物またはその塩とを含む薬学的製剤の有効量を対象に投与する段階を含む。 The invention also includes a method of preventing or stabilizing respiratory rhythm instability in a subject in need thereof. The method includes administering to the subject an effective amount of a pharmaceutical formulation comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or salt thereof.
一態様では、本発明の製剤を投与する段階は対象の呼吸リズムを安定化する。別の態様では、本発明の製剤を投与する段階は対象の分時換気量を増大させる。 In one aspect, administering the formulation of the present invention stabilizes the subject's respiratory rhythm. In another aspect, administering the formulation of the present invention increases the subject's minute ventilation.
一態様では、不安定化は呼吸制御障害または呼吸制御疾患に関連している。 In one aspect, the destabilization is associated with a respiratory control disorder or respiratory control disorder.
一態様では、呼吸障害または呼吸疾患は、麻薬誘発性呼吸抑制、麻酔薬誘発性呼吸抑制、鎮静薬誘発性呼吸抑制、抗不安薬誘発性呼吸抑制、催眠薬誘発性呼吸抑制、アルコール誘発性呼吸抑制、鎮痛薬誘発性呼吸抑制、睡眠時無呼吸、未熟児無呼吸、肥満低換気症候群、原発性肺胞低換気症候群、呼吸困難、高山病、低酸素症、高炭酸ガス血症および慢性閉塞性肺疾患(COPD)からなる群より選択される。別の態様では、呼吸抑制は麻酔薬、鎮静薬、抗不安薬、催眠剤、アルコールまたは麻薬によって引き起こされる。 In one aspect, the respiratory disorder or disorder is narcotic-induced respiratory depression, anesthetic-induced respiratory depression, sedation-induced respiratory depression, anxiolytic-induced respiratory depression, hypnotic-induced respiratory depression, alcohol-induced breathing Suppression, analgesic-induced respiratory depression, sleep apnea, premature infant apnea, obesity hypoventilation syndrome, primary alveolar hypoventilation syndrome, dyspnea, altitude sickness, hypoxia, hypercapnia and chronic obstruction Selected from the group consisting of congenital lung disease (COPD). In another aspect, respiratory depression is caused by anesthetics, sedatives, anxiolytics, hypnotics, alcohol or narcotics.
一態様では、呼吸障害または呼吸疾患を処置するために有用な少なくとも1つのさらなる化合物を対象にさらに投与する。別の態様では、少なくとも1つのさらなる化合物は、アセタゾラミド、アルミトリン、テオフィリン、カフェイン、メチルプロゲステロンおよび関連化合物、セロトニン作動性モジュレーター、カンナビノイドおよびアンパカインからなる群より選択される。さらに別の態様では、製剤を、機械的人工呼吸装置または気道陽圧装置の使用と組み合わせて対象に投与する。一態様では、製剤を、吸入、局所、経口、頬側、直腸、膣内、筋肉内、皮下、経皮、くも膜下腔内または静脈内経路によって対象に投与する。別の態様では、対象は、マウス、ラット、フェレット、モルモット、サル、イヌ、ネコ、ウマ、雌ウシ、ブタおよび他の家畜を含むがそれに限定されない哺乳動物である。 In one aspect, at least one additional compound useful for treating a respiratory disorder or disorder is further administered to the subject. In another embodiment, the at least one additional compound is selected from the group consisting of acetazolamide, alumintrine, theophylline, caffeine, methylprogesterone and related compounds, serotonergic modulators, cannabinoids and ampakines. In yet another aspect, the formulation is administered to the subject in combination with the use of a mechanical ventilator or a positive airway pressure device. In one aspect, the formulation is administered to the subject by inhalation, topical, oral, buccal, rectal, intravaginal, intramuscular, subcutaneous, transdermal, intrathecal or intravenous route. In another aspect, the subject is a mammal, including but not limited to mice, rats, ferrets, guinea pigs, monkeys, dogs, cats, horses, cows, pigs and other domestic animals.
一態様では、対象はヒトである。別の態様では、少なくとも1つの式(I)の化合物は以下からなる群より選択される: N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4-(メトキシ(メチル)アミノ)-6-(n-プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン、O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン、6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン、6-[1,2]オキサジナン-2-イル-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン、O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン、6-((ベンジルオキシ)(イソプロピル)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン、6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン、4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-(N-(ピリジン-4-イル-メチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、4,6-ビス-[N-(テトラヒドロピラン-4-イル-メチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン、2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-N'-メチルヒドラジン、2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン、2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン、2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン、8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール、N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン、N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン、N-(2,4-ビス-n-プロピルアミノ)-N-(6-i-プロピルアミノ)-1,3-ピリミジン、その塩、およびそれらの混合物。 In one aspect, the subject is a human. In another embodiment, the at least one compound of formula (I) is selected from the group consisting of: N- (4,6-bis-methylamino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine, N- (4,6-bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-cyclo Propylmethyl) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4-ethylamino) -N- (6 -n-propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2-methylpropylamino)) [1, 3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazine-2- Yl) -N, O-dimethyl-hydroxylamine, N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl -Hydroxyl Amine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, N- (4- (methoxy (methyl) amino ) -6- (n-propylamino) -1,3,5-triazin-2-yl) propionamide, N- (4,6-bis-n-propylamino- [1,3,5] triazine-2 -Yl) -O-methyl-hydroxylamine, O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, N- (4 , 6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine, 6- (methoxy (methyl) amino) -N 2 -propyl-1,3,5-triazine- 2,4-diamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, O-benzyl-N- (4, 6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5 ] Triazin-2-yl) -N-iso Lopyl-hydroxylamine, 6- [1,2] oxazinan-2-yl-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine, N- (4,6-bis-n -Propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine, O-benzyl-N- (4,6-bis-n-propylamino- [1, 3,5] triazin-2-yl) -N-ethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl- Hydroxylamine, 6-((benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine, N- (4,6-bis-n-propyl Amino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazine- 2-yl) -O-isobutyl-N-methyl-hydroxylamine, 6- (methyl (thiophen-2-ylmethoxy) amino) -N 2 , N 4 -dipropyl- 1,3,5-triazine-2,4-diamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N- Methyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine, N- (4,6 -Bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine, 4-N- (2-dimethylaminoethyl) amino- 6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (3- (1-N-methylimidazole-2 -Yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4-N- (1- N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6 -Bis- (N- (2-dimethylamino Noethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- (N- (pyridin-4-yl-methyl) amino)-[ 1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine, 4,6-bis- [N- (tetrahydropyran-4-yl-methyl) amino]-[1,3,5] triazin-2-yl ) -N, O-dimethyl-hydroxylamine, N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19 ), 16 (17) -Trien-17-yl) -N, O-dimethylhydroxylamine, 2,6-bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O -Dimethyl-hydroxylamine, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine, N- (4,6- Bis-n-propylamino- [1,3,5] triazine-2-y ) -N-methyl-N'-methylhydrazine, 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) Amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine, 2 -(n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine, 2,4-bis- (n-propyl) amino-7H-pyrrolidino [ 2,3-d] pyrimidine, 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine, 8- (7-methyl -2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol, N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2 , 3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl)- O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine, N- (2-n- Propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine, N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidine-4 -Yl) -hydrazine, N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N, N-dimethyl-N '-(2 -n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine, N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[ 1,3,5] triazine, N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine, N- (2,4,6-tris-n-propylamino) -1,3- Rimijin, N-(2,4-bis -n- propylamino) -N- (6-i- propylamino) -1,3-pyrimidine, its salts, and mixtures thereof.
薬学的組成物および製剤
本発明はまた、本発明の方法を実施するための、少なくとも1つの本発明の化合物またはその塩の薬学的組成物の使用を包含する。
Pharmaceutical Compositions and Formulations The present invention also encompasses the use of a pharmaceutical composition of at least one compound of the present invention or a salt thereof for practicing the methods of the present invention.
そのような薬学的組成物は、対象に対する投与に好適な形態での少なくとも1つの本発明の化合物またはその塩からなりうるものであり、あるいは、薬学的組成物は、少なくとも1つの本発明の化合物またはその塩と1つもしくは複数の薬学的に許容される担体、1つもしくは複数のさらなる成分、またはこれらの何らかの組み合わせとを含みうる。当技術分野において周知のように、少なくとも1つの本発明の化合物は、例えば生理学的に許容されるカチオンまたはアニオンと組み合わせた生理学的に許容される塩の形態で、薬学的組成物中に存在しうる。 Such a pharmaceutical composition may consist of at least one compound of the invention or a salt thereof in a form suitable for administration to a subject, or the pharmaceutical composition comprises at least one compound of the invention Or a salt thereof and one or more pharmaceutically acceptable carriers, one or more additional ingredients, or some combination thereof. As is well known in the art, at least one compound of the invention is present in a pharmaceutical composition, for example in the form of a physiologically acceptable salt in combination with a physiologically acceptable cation or anion. sell.
一態様では、本発明の方法を実施するために有用な薬学的組成物を、1ng/kg/日〜100mg/kg/日の用量を送達するために投与することができる。別の態様では、本発明を実施するために有用な薬学的組成物を、1ng/kg/日〜500mg/kg/日の用量を送達するために投与することができる。 In one aspect, a pharmaceutical composition useful for performing the methods of the invention can be administered to deliver a dose of 1 ng / kg / day to 100 mg / kg / day. In another embodiment, a pharmaceutical composition useful for practicing the present invention can be administered to deliver a dose of 1 ng / kg / day to 500 mg / kg / day.
本発明の薬学的組成物中の有効成分、薬学的に許容される担体および任意のさらなる成分の相対量は、処置される対象の身元、サイズおよび状態、さらには組成物が投与される予定の経路に応じて変動する。例として、組成物は0.1%〜100%(w/w)の有効成分を含みうる。 The relative amounts of the active ingredient, pharmaceutically acceptable carrier and any further ingredients in the pharmaceutical composition of the invention are determined by the identity, size and condition of the subject being treated, as well as the composition to be administered. It varies depending on the route. By way of example, the composition may comprise between 0.1% and 100% (w / w) active ingredient.
本発明の方法に有用な薬学的組成物は、吸入、経口、直腸、膣内、非経口、局所、経皮、経肺、鼻腔内、頬側、経眼、くも膜下腔内、静脈内または別の投与経路に好適に開発することができる。本発明の方法の範囲内で有用な組成物は、哺乳動物の脳、脳幹、または中枢神経系の任意の他の部分に直接投与することができる。他の想定される製剤としては放出型(projected)ナノ粒子、リポソーム調製物、有効成分を含有する再封入赤血球、および免疫学に基づく製剤が挙げられる。投与経路は当業者に容易に明らかであり、処置される疾患の種類および重症度、処置される獣医学患者またはヒト患者の種類および年齢などを含む任意の数の要因に依存する。 Pharmaceutical compositions useful in the methods of the present invention include inhalation, oral, rectal, vaginal, parenteral, topical, transdermal, pulmonary, intranasal, buccal, ocular, intrathecal, intravenous or It can be suitably developed for other administration routes. Compositions useful within the methods of the invention can be administered directly to the mammalian brain, brainstem, or any other part of the central nervous system. Other contemplated formulations include projected nanoparticles, liposome preparations, re-encapsulated red blood cells containing the active ingredient, and immunologically based formulations. The route of administration will be readily apparent to those skilled in the art and will depend on any number of factors including the type and severity of the disease being treated, the type and age of the veterinary or human patient being treated, and the like.
本明細書に記載の薬学的組成物の製剤は、薬理学分野において公知のまたは今後開発される任意の方法によって調製することができる。一般に、そのような調製方法は、有効成分を担体または1つもしくは複数の他の副成分と結合させる工程、および次に必要なまたは望ましい場合に生成物を所望の単一用量または複数用量単位に成形または包装する工程を含む。 Formulations of the pharmaceutical compositions described herein can be prepared by any method known or later developed in the pharmacology field. In general, such preparative methods include the step of bringing into association the active ingredient with the carrier or one or more other accessory ingredients and then, when necessary or desirable, the product into the desired single dose or multiple dose units. Forming or packaging.
本明細書において使用される「単位用量」とは、所定量の有効成分を含む薬学的組成物の離散量のことである。有効成分の量は、対象に投与される有効成分の投与量、またはそのような投与量の好都合な画分、例えばそのような投与量の2分の1もしくは3分の1と一般に等しい。単位剤形は単一の一日量向け、または複数の一日量(例えば1日当たり約1〜4回もしくはそれ以上)のうち1つ向けでありうる。複数の一日量を使用する場合、単位剤形は各用量について同一でも異なっていてもよい。 As used herein, a “unit dose” is a discrete amount of a pharmaceutical composition that contains a predetermined amount of an active ingredient. The amount of the active ingredient is generally equal to the dose of the active ingredient administered to the subject, or a convenient fraction of such a dose, for example one half or one third of such a dose. The unit dosage form can be for a single daily dose or one of multiple daily doses (eg, about 1 to 4 times or more per day). When multiple daily doses are used, the unit dosage form may be the same or different for each dose.
本明細書において示される薬学的組成物の記載は、ヒトに対する倫理的投与に好適な薬学的組成物を主に対象とするが、当業者は、そのような組成物がすべての種類の動物に対する投与に一般に好適であると理解するであろう。様々な動物に対する投与に好適な組成物を与えるためにヒトに対する投与に好適な薬学的組成物を修正することは十分に理解されており、通常の知識を有する獣医薬理学者は、そのような修正を実験によるとしても単に通常の実験で設計および実行することができる。本発明の薬学的組成物の投与が想定される対象としては、ヒトおよび他の霊長類、ウシ、ブタ、ウマ、ヒツジ、ネコおよびイヌなどの商業的に関連性のある哺乳動物を含む哺乳動物が挙げられるがそれに限定されない。 While the description of pharmaceutical compositions presented herein is primarily directed to pharmaceutical compositions suitable for ethical administration to humans, those skilled in the art will recognize that such compositions are suitable for all types of animals. It will be understood that it is generally suitable for administration. It is well understood to modify a pharmaceutical composition suitable for administration to humans to provide a composition suitable for administration to various animals, and veterinary scientists with ordinary knowledge will be able to make such modifications. Even if it is based on an experiment, it can be designed and implemented by a normal experiment. Subjects envisaged for administration of the pharmaceutical composition of the present invention include mammals including humans and other primates, commercially relevant mammals such as cattle, pigs, horses, sheep, cats and dogs. But is not limited thereto.
一態様では、本発明の組成物は、1つまたは複数の薬学的に許容される賦形剤または担体を使用して製剤化される。一態様では、本発明の薬学的組成物は、治療有効量の少なくとも1つの本発明の化合物と薬学的に許容される担体とを含む。有用な薬学的に許容される担体としてはグリセリン、水、食塩水、エタノール、ならびにリン酸塩および有機酸塩などの他の薬学的に許容される塩の溶液が挙げられるがそれに限定されない。これらのおよび他の薬学的に許容される担体の例はRemington's Pharmaceutical Sciences (1991, Mack Publication Co., New Jersey)に記載されている。 In one aspect, the compositions of the invention are formulated using one or more pharmaceutically acceptable excipients or carriers. In one aspect, the pharmaceutical composition of the invention comprises a therapeutically effective amount of at least one compound of the invention and a pharmaceutically acceptable carrier. Useful pharmaceutically acceptable carriers include, but are not limited to, glycerin, water, saline, ethanol, and solutions of other pharmaceutically acceptable salts such as phosphates and organic acid salts. Examples of these and other pharmaceutically acceptable carriers are described in Remington's Pharmaceutical Sciences (1991, Mack Publication Co., New Jersey).
担体は、水、エタノール、ポリオール(例えばグリセリン、プロピレングリコールおよび液体ポリエチレングリコールなど)、その好適な混合物、ならびに植物油を例えば含有する溶媒または分散媒でありうる。例えば、レシチンなどのコーティングの使用、分散液の場合の必要な粒径の維持、および界面活性剤の使用により、適当な流動性を維持することができる。微生物の作用の阻止を各種抗菌剤および抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、チメロサールなどで実現することができる。多くの場合、等張化剤、例えば糖、塩化ナトリウム、またはマンニトールおよびソルビトールなどの多価アルコールを組成物中に含むことが好ましい。注射用組成物の長期吸収を、組成物中に吸収を遅延させる薬剤、例えばモノステアリン酸アルミニウムまたはゼラチンを含むことでもたらすことができる。一態様では、薬学的に許容される担体はDMSO単独ではない。 The carrier can be a solvent or dispersion medium containing, for example, water, ethanol, polyol (for example, glycerol, propylene glycol, and liquid polyethylene glycol, and the like), suitable mixtures thereof, and vegetable oils. The proper fluidity can be maintained, for example, by the use of a coating such as lecithin, the maintenance of the required particle size in the case of dispersions, and the use of surfactants. Prevention of the action of microorganisms can be achieved with various antibacterial and antifungal agents, for example, parabens, chlorobutanol, phenol, ascorbic acid, thimerosal, and the like. In many cases, it will be preferable to include isotonic agents, for example, sugars, sodium chloride, or polyalcohols such as mannitol and sorbitol, in the composition. Prolonged absorption of injectable compositions can be brought about by including in the composition an agent that delays absorption, for example, aluminum monostearate or gelatin. In one aspect, the pharmaceutically acceptable carrier is not DMSO alone.
製剤は、経口、非経口、経鼻、吸入、静脈内、皮下、経皮、経腸、または当技術分野に公知である任意の他の好適な投与様式に好適な、通常の賦形剤、すなわち薬学的に許容される有機または無機担体物質との混合物として使用することができる。薬学的調製物は滅菌されていてもよく、所望であれば、補助剤、例えば潤滑剤、保存料、安定剤、湿潤剤、乳化剤、浸透圧に影響を与えるための塩、緩衝剤、着色物質、香味物質および/または芳香物質などと混合されていてもよい。所望であれば、それらを他の活性薬剤、例えば他の鎮痛薬と組み合わせてもよい。本明細書において使用される「さらなる成分」としては、薬学的担体として使用可能な1つまたは複数の成分が挙げられるがそれに限定されない。 The formulations are conventional excipients suitable for oral, parenteral, nasal, inhalation, intravenous, subcutaneous, transdermal, enteral, or any other suitable mode of administration known in the art, That is, it can be used as a mixture with pharmaceutically acceptable organic or inorganic carrier materials. The pharmaceutical preparation may be sterilized and, if desired, adjuvants such as lubricants, preservatives, stabilizers, wetting agents, emulsifiers, salts to influence osmotic pressure, buffers, coloring substances Further, it may be mixed with a flavor substance and / or a fragrance substance. If desired, they may be combined with other active agents, such as other analgesics. As used herein, “further ingredients” include, but are not limited to, one or more ingredients that can be used as a pharmaceutical carrier.
本発明の組成物は、該組成物の総重量の約0.005%〜2.0%の保存料を含みうる。保存料は、環境中の汚染物質に対する曝露の場合の損傷を防止するために使用される。本発明に従って有用な保存料の例としては、ベンジルアルコール、ソルビン酸、パラベン、イミド尿素、およびその組み合わせからなる群より選択されるものが挙げられるがそれに限定されない。特に好ましい保存料は、約0.5%〜2.0%のベンジルアルコールと0.05%〜0.5%のソルビン酸との組み合わせである。 The composition of the present invention may comprise preservatives of about 0.005% to 2.0% of the total weight of the composition. Preservatives are used to prevent damage in the event of exposure to environmental pollutants. Examples of preservatives useful according to the present invention include, but are not limited to, those selected from the group consisting of benzyl alcohol, sorbic acid, paraben, imidourea, and combinations thereof. A particularly preferred preservative is a combination of about 0.5% to 2.0% benzyl alcohol and 0.05% to 0.5% sorbic acid.
本組成物は、化合物の分解を阻害する抗酸化剤およびキレート剤を含むことが好ましい。いくつかの化合物に好ましい抗酸化剤は、好ましい範囲が組成物の総重量の約0.01重量%〜0.3重量%のBHT、BHA、α-トコフェロールおよびアスコルビン酸、より好ましくは0.03重量%〜0.1重量%の範囲のBHTである。好ましくは、キレート剤は組成物の総重量の0.01重量%〜0.5重量%の量で存在する。特に好ましいキレート剤としては、組成物の総重量の約0.01重量%〜0.20重量%の重量範囲、より好ましくは0.02重量%〜0.10重量%の範囲のエデト酸塩(例えばエデト酸二ナトリウム)およびクエン酸が挙げられる。キレート剤は、製剤の有効期間に不利益でありうる組成物中の金属イオンをキレート化するために有用である。BHTおよびエデト酸二ナトリウムがいくつかの化合物に特に好ましいそれぞれ抗酸化剤およびキレート剤であるが、当業者に公知である他の好適でかつ同等の抗酸化剤およびキレート剤でそれを置き換えてもよい。 The composition preferably contains an antioxidant and a chelating agent that inhibit the degradation of the compound. Preferred antioxidants for some compounds are preferred ranges of about 0.01% to 0.3% BHT, BHA, α-tocopherol and ascorbic acid, more preferably 0.03% to 0.1% by weight of the total weight of the composition. BHT in the range. Preferably, the chelating agent is present in an amount from 0.01% to 0.5% by weight of the total weight of the composition. Particularly preferred chelating agents include edetate (e.g. disodium edetate) and citric acid in a weight range of about 0.01% to 0.20% by weight, more preferably 0.02% to 0.10% by weight of the total weight of the composition. Examples include acids. Chelating agents are useful for chelating metal ions in compositions that can be detrimental to the shelf life of the formulation. BHT and disodium edetate are particularly preferred antioxidants and chelators, respectively, for some compounds, but may be replaced by other suitable and equivalent antioxidants and chelators known to those skilled in the art. Good.
通常の方法を使用して液体懸濁液を調製することで水性または油性媒体中の有効成分の懸濁液を得ることができる。水性媒体としては例えば水および等張食塩水が挙げられる。油性媒体としては例えばアーモンド油、油性エステル、エチルアルコール、ラッカセイ油、オリーブ油、ゴマ油またはヤシ油などの植物油、精留植物油、および流動パラフィンなどの鉱物油が挙げられる。液体懸濁液は、懸濁化剤、分散剤または湿潤剤、乳化剤、粘滑剤、保存料、緩衝剤、塩、香味料、着色料および甘味料を含むがそれに限定されない1つまたは複数のさらなる成分をさらに含みうる。油性懸濁液は増粘剤をさらに含みうる。公知の懸濁化剤としてはソルビトールシロップ、硬化食用脂、アルギン酸ナトリウム、ポリビニルピロリドン、トラガカントゴム、アラビアゴム、およびカルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロースなどのセルロース誘導体が挙げられるがそれに限定されない。公知の分散剤または湿潤剤としてはレシチンなどの天然ホスファチド、アルキレンオキシドと脂肪酸、長鎖脂肪族アルコール、脂肪酸およびヘキシトールから誘導される部分エステル、または脂肪酸および無水ヘキシトールから誘導される部分エステルとの縮合物(例えばそれぞれステアリン酸ポリオキシエチレン、ヘプタデカエチレンオキシセタノール、ポリオキシエチレンソルビトールモノオレエートおよびポリオキシエチレンソルビタンモノオレエート)が挙げられるがそれに限定されない。公知の乳化剤としてはレシチンおよびアラビアゴムが挙げられるがそれに限定されない。公知の保存料としてはパラ-ヒドロキシ安息香酸メチル、エチルまたはn-プロピル、アスコルビン酸、およびソルビン酸が挙げられるがそれに限定されない。公知の甘味料としては例えばグリセリン、プロピレングリコール、ソルビトール、スクロースおよびサッカリンが挙げられる。油性懸濁液用の公知の増粘剤としては例えば蜜ろう、固形パラフィンおよびセチルアルコールが挙げられる。 A suspension of the active ingredient in an aqueous or oily medium can be obtained by preparing a liquid suspension using conventional methods. Examples of the aqueous medium include water and isotonic saline. Examples of the oily medium include almond oil, oily ester, ethyl alcohol, peanut oil, olive oil, sesame oil or coconut oil, and other vegetable oils, rectified vegetable oil, and mineral oil such as liquid paraffin. Liquid suspensions include one or more additional agents including but not limited to suspending agents, dispersing or wetting agents, emulsifying agents, demulcents, preservatives, buffering agents, salts, flavoring agents, coloring agents and sweetening agents. Ingredients may further be included. The oily suspension may further contain a thickening agent. Known suspending agents include, but are not limited to, sorbitol syrup, hardened edible fat, sodium alginate, polyvinylpyrrolidone, tragacanth gum, gum arabic, and cellulose derivatives such as sodium carboxymethylcellulose, methylcellulose, hydroxypropylmethylcellulose. Known dispersants or wetting agents include natural phosphatides such as lecithin, condensation of alkylene oxides with fatty acids, long chain fatty alcohols, partial esters derived from fatty acids and hexitol, or partial esters derived from fatty acids and anhydrous hexitol. Products such as, but not limited to, polyoxyethylene stearate, heptadecaethyleneoxycetanol, polyoxyethylene sorbitol monooleate and polyoxyethylene sorbitan monooleate, respectively. Known emulsifiers include but are not limited to lecithin and gum arabic. Known preservatives include, but are not limited to, methyl para-hydroxybenzoate, ethyl or n-propyl, ascorbic acid, and sorbic acid. Known sweeteners include, for example, glycerin, propylene glycol, sorbitol, sucrose, and saccharin. Known thickening agents for oily suspensions include, for example, beeswax, hard paraffin and cetyl alcohol.
水性または油性溶媒中の有効成分の液体溶液は、液体懸濁液と実質的に同様にして調製することができるが、主要な違いは有効成分を溶媒に懸濁させるというよりむしろ溶解させるということである。本明細書において使用される「油性」液体とは、炭素含有液体分子を含有しかつ水よりも低い極性を示す液体のことである。本発明の薬学的組成物の液体溶液は、液体懸濁液に関して記載の各成分を含みうるものであり、懸濁化剤が溶媒中の有効成分の溶解に必ずしも役立つわけではないと理解されよう。水性溶媒としては例えば水および等張食塩水が挙げられる。油性溶媒としては例えばアーモンド油、油性エステル、エチルアルコール、ラッカセイ油、オリーブ油、ゴマ油またはヤシ油などの植物油、精留植物油、および流動パラフィンなどの鉱物油が挙げられる。 Liquid solutions of the active ingredient in aqueous or oily solvents can be prepared in substantially the same way as liquid suspensions, the main difference being that the active ingredient is dissolved rather than suspended in the solvent. It is. As used herein, an “oily” liquid is a liquid that contains carbon-containing liquid molecules and exhibits a lower polarity than water. It will be understood that a liquid solution of the pharmaceutical composition of the present invention may contain each of the ingredients described with respect to the liquid suspension, and that the suspending agent does not necessarily help dissolve the active ingredient in the solvent. . Examples of the aqueous solvent include water and isotonic saline. Examples of the oily solvent include almond oil, oily ester, ethyl alcohol, peanut oil, vegetable oil such as olive oil, sesame oil or coconut oil, rectified vegetable oil, and mineral oil such as liquid paraffin.
本発明の薬学的調製物の粉末製剤および顆粒製剤は公知の方法を使用して調製することができる。そのような製剤は対象に直接投与することもでき、例えば錠剤を形成するために、カプセル剤を充填するために、または水性もしくは油性媒体をそれに加えることで水性もしくは油性の溶液もしくは懸濁液を調製するために使用することもできる。これらの各製剤は分散剤または湿潤剤、懸濁化剤、および保存料の1つまたは複数をさらに含みうる。充填剤および甘味料、香味料または着色料などのさらなる成分もこれらの製剤に含まれうる。 Powder formulations and granule formulations of the pharmaceutical preparation of the present invention can be prepared using known methods. Such formulations can also be administered directly to a subject, for example to form an aqueous or oily solution or suspension, for example, to form tablets, to fill capsules, or to add aqueous or oily media thereto. It can also be used to prepare. Each of these formulations may further comprise one or more of a dispersing or wetting agent, suspending agent, and preservative. Additional ingredients such as fillers and sweetening, flavoring or coloring agents may also be included in these formulations.
本発明の薬学的組成物は水中油型乳剤または油中水型乳剤の形態で調製、包装または販売してもよい。油相はオリーブ油もしくはラッカセイ油などの植物油、流動パラフィンなどの鉱物油、またはこれらの混合物でありうる。そのような組成物は、アラビアゴムまたはトラガカントゴムなどの天然ゴム、大豆またはレシチンホスファチドなどの天然ホスファチド、ソルビタンモノオレエートなどの、脂肪酸と無水ヘキシトールとの組み合わせから誘導されるエステルまたは部分エステル、およびポリオキシエチレンソルビタンモノオレエートなどの、そのような部分エステルとエチレンオキシドとの縮合物などの1つまたは複数の乳化剤をさらに含みうる。これらの乳剤は、甘味料または香味料を例えば含むさらなる成分を含有してもよい。 The pharmaceutical compositions of the invention may be prepared, packaged or sold in the form of an oil-in-water emulsion or a water-in-oil emulsion. The oily phase may be a vegetable oil such as olive or arachis oil, a mineral oil such as liquid paraffin, or a mixture of these. Such compositions include esters or partial esters derived from combinations of fatty acids and anhydrous hexitol, such as natural gums such as gum arabic or tragacanth, natural phosphatides such as soy or lecithin phosphatide, sorbitan monooleate, And one or more emulsifiers such as condensates of such partial esters with ethylene oxide, such as polyoxyethylene sorbitan monooleate. These emulsions may contain further ingredients including, for example, sweetening or flavoring agents.
材料を化学組成物に含浸するかまたは材料を化学組成物でコーティングするための方法は、当技術分野において公知であり、化学組成物を表面上に堆積または結合させる方法、材料の合成(すなわち例えば生理学的に分解可能な材料による)中に化学組成物を材料の構造中に組み入れる方法、および水性または油性の溶液または懸濁液を吸収性材料中に後続の乾燥ありまたはなしで吸収させる方法が挙げられるがそれに限定されない。 Methods for impregnating a material with a chemical composition or coating a material with a chemical composition are known in the art and include methods for depositing or bonding a chemical composition on a surface, synthesis of materials (i.e., e.g., A method of incorporating a chemical composition into the structure of the material (by a physiologically degradable material) and a method of absorbing an aqueous or oily solution or suspension into the absorbent material with or without subsequent drying. But not limited to.
投与/投薬
投与レジメンは、何が有効量を構成するかに影響を与えることがある。治療用製剤は、呼吸障害事象の発症の前または後のいずれかに患者に投与することができる。さらに、いくつかの分割投薬量および時差投薬量を毎日または順次投与してもよく、あるいは用量を連続注入してもよく、ボーラス注射してもよい。さらに、治療用製剤の投薬量を、急迫した治療状況または予防状況が示すように比例的に増大または減少させることができる。
Dosing / dosing regimens can affect what constitutes an effective amount. The therapeutic formulation can be administered to the patient either before or after the onset of a respiratory disorder event. In addition, several divided and staggered dosages may be administered daily or sequentially, or doses may be continuously infused or bolus injected. Furthermore, the dosage of the therapeutic formulation can be increased or decreased proportionally as indicated by an impending treatment or prevention situation.
患者、好ましくは哺乳動物または鳥類、より好ましくはヒトに対する本発明の組成物の投与は、公知の手法を使用して、患者における呼吸制御障害を処置するために有効な投薬量および期間で行うことができる。治療効果を得るために必要な治療用化合物の有効量は、使用される特定の化合物の活性; 投与時間; 化合物の排出速度; 処置の持続時間; 化合物と組み合わせて使用される他の薬物、化合物または材料; 処置される患者の疾患または障害の状況、年齢、性別、体重、状態、全身的健康および既往歴、ならびに医学分野において周知である同様の要因などの要因によって変動しうる。最適な治療応答を与えるように投薬レジメンを調整することができる。例えば、いくつかの分割用量を毎日投与してもよく、あるいは、急迫した治療状況が示すように用量を比例的に減少させてもよい。本発明の治療用化合物の有効量範囲の非限定的な例は約0.01mg/kgから50mg/kg体重/日である。当業者は、関連性のある要因を検討し、過度の実験なしに治療用化合物の有効量に関する決定を行うことができるであろう。 Administration of the composition of the present invention to a patient, preferably a mammal or a bird, more preferably a human, is carried out using known techniques at a dosage and for a period effective to treat a disorder of respiratory control in the patient. Can do. The effective amount of therapeutic compound required to obtain a therapeutic effect is the activity of the particular compound used; administration time; rate of compound excretion; duration of treatment; other drugs, compounds used in combination with the compound Or material; it can vary depending on factors such as the condition, age, sex, weight, condition, general health and history of the patient or disease being treated, and similar factors well known in the medical field. Dosage regimens can be adjusted to provide the optimum therapeutic response. For example, several divided doses may be administered daily, or the dose may be reduced proportionally as indicated by an impending treatment situation. A non-limiting example of an effective range of therapeutic compounds of the present invention is about 0.01 mg / kg to 50 mg / kg body weight / day. One skilled in the art will be able to review the relevant factors and make a determination regarding the effective amount of the therapeutic compound without undue experimentation.
化合物は、1日数回の頻度で動物に投与することができ、あるいはより少ない頻度で、例えば1日1回、週1回、2週間に1回、月に1回、またはさらに少ない頻度で、例えば数ヶ月に1回、さらには年1回またはそれ未満で投与することができる。1日当たりの化合物の投薬量を非限定的な例では毎日、隔日、2日おき、3日おき、4日おきまたは5日おきに投与することができると理解されよう。例えば、隔日投与では、1日当たり5mgの投薬を月曜日に開始し、第1の引き続く1日当たり5mgの用量を水曜日に投与し、第2の引き続く1日当たり5mgの用量を金曜日に投与することができる。投薬頻度は、当業者には容易に明らかであり、処置される疾患の種類および重症度、動物の種類および年齢などであるがそれに限定されない任意の数の要因に依存する。 The compound can be administered to the animal several times a day, or less frequently, for example once a day, once a week, once every two weeks, once a month, or even less frequently, For example, it can be administered once every few months, even once a year or less. It will be understood that the daily dosage of the compound may be administered daily, every other day, every 2 days, every 3 days, every 4 days or every 5 days in non-limiting examples. For example, with alternate day administration, a 5 mg per day dosing may be started on Monday, a first subsequent 5 mg dose per day administered on Wednesday, and a second subsequent 5 mg per day dose administered on Friday. The frequency of dosing will be readily apparent to those skilled in the art and will depend on any number of factors, including but not limited to, the type and severity of the disease being treated, the type and age of the animal.
本発明の薬学的組成物中の有効成分の実際の投薬量レベルは、患者に対して毒性であることなく、所望の特定患者に対する治療応答、所望の組成および所望の投与様式を実現するために有効な有効成分の量を得るように変動しうる。 The actual dosage level of the active ingredient in the pharmaceutical composition of the present invention is not toxic to the patient to achieve the desired therapeutic response, desired composition and desired mode of administration for the particular patient. It can be varied to obtain an effective amount of active ingredient.
当技術分野において通常の知識を有する医師、例えば内科医または獣医は、薬学的組成物の所望の有効量を容易に決定および処方することができる。例えば、内科医または獣医は、薬学的組成物に使用される本発明の化合物の投薬を、所望の治療効果を得るために必要なレベルよりも低いレベルで開始し、所望の効果が得られるまで投薬量を徐々に増大させることができる。 A physician having ordinary knowledge in the art, such as a physician or veterinarian, can readily determine and prescribe the desired effective amount of the pharmaceutical composition. For example, a physician or veterinarian can begin dosing a compound of the invention used in a pharmaceutical composition at a level lower than that required to obtain the desired therapeutic effect, until the desired effect is obtained. The dosage can be increased gradually.
特定の態様では、投与の容易さおよび投与量の均一性が理由で、単位剤形で化合物を製剤化することが特に有利である。本明細書において使用される単位剤形とは、処置される患者用の単位投薬量として適した物理的に別々の単位を意味し、各単位は、所要の薬学的担体と共同して所望の治療効果を生成するように計算される所定量の治療用化合物を含有する。本発明の単位剤形は(a) 治療用化合物の独自の特徴、および実現すべき特定の治療効果、ならびに(b) 患者における呼吸障害の処置用にそのような治療用化合物を処方/製剤化する技術分野に内在的な限界により決定づけられかつそれに直接依存する。 In certain embodiments, it is particularly advantageous to formulate the compound in unit dosage form for ease of administration and uniformity of dosage. As used herein, a unit dosage form means a physically discrete unit suitable as a unit dosage for the patient being treated, each unit being in association with the required pharmaceutical carrier as desired. Contains a predetermined amount of the therapeutic compound calculated to produce a therapeutic effect. The unit dosage forms of the present invention formulate / formulate (a) the unique characteristics of the therapeutic compound and the specific therapeutic effect to be realized, and (b) the treatment of respiratory disorders in the patient. Is determined by and directly dependent on the limitations inherent in the technical field.
一態様では、本発明の組成物は、1日当たり1〜5回またはそれ以上の範囲の投薬で患者に投与される。別の態様では、本発明の組成物は、1日1回、2日に1回、3日に1回〜週1回、および2週間に1回を含むがそれに限定されない投薬の範囲で患者に投与される。当業者には、本発明の様々な組み合わせ組成物の投与頻度が、年齢、処置すべき疾患または障害、性別、全身的健康、および他の要因を含むがそれに限定されない多くの要因に応じて対象毎に異なるということは容易に明らかであろう。したがって、本発明を、任意の特定の投薬レジームに限定されると解釈すべきではなく、任意の患者に投与される正確な投薬量および組成は、主治医が患者に関するすべての他の要因を考慮に入れて決定する。 In one aspect, the compositions of the invention are administered to a patient at dosages ranging from 1 to 5 times or more per day. In another embodiment, the composition of the present invention comprises a patient in a dosage range including, but not limited to, once a day, once every two days, once every three days to once a week, and once every two weeks. To be administered. Those skilled in the art will appreciate that the frequency of administration of the various combination compositions of the present invention depends on a number of factors including, but not limited to, age, the disease or disorder to be treated, gender, general health, and other factors. It will be readily apparent that this is different. Thus, the present invention should not be construed as limited to any particular dosage regime, and the exact dosage and composition administered to any patient will allow the attending physician to consider all other factors associated with the patient. Put in and decide.
投与用の本発明の化合物は、約1μg〜約7,500mg、約20μg〜約7,000mg、約40μg〜約6,500mg、約80μg〜約6,000mg、約100μg〜約5,500mg、約200μg〜約5,000mg、約400μg〜約4,000mg、約800μg〜約3,000mg、約1mg〜約2,500mg、約2mg〜約2,000mg、約5mg〜約1,000mg、約10mg〜約750mg、約20mg〜約600mg、約30mg〜約500mg、約40mg〜約400mg、約50mg〜約300mg、約60mg〜約250mg、約70mg〜約200mg、約80mg〜約150mg、およびそれらの間のあらゆる整数増分または部分増分の範囲でありうる。 The compounds of the invention for administration are from about 1 μg to about 7,500 mg, from about 20 μg to about 7,000 mg, from about 40 μg to about 6,500 mg, from about 80 μg to about 6,000 mg, from about 100 μg to about 5,500 mg, from about 200 μg to about 5,000 mg About 400 μg to about 4,000 mg, about 800 μg to about 3,000 mg, about 1 mg to about 2,500 mg, about 2 mg to about 2,000 mg, about 5 mg to about 1,000 mg, about 10 mg to about 750 mg, about 20 mg to about 600 mg, about 30 mg To about 500 mg, about 40 mg to about 400 mg, about 50 mg to about 300 mg, about 60 mg to about 250 mg, about 70 mg to about 200 mg, about 80 mg to about 150 mg, and any integer or partial increment range between them .
いくつかの態様では、本発明の化合物の用量は約0.5μgから約5,000mgである。いくつかの態様では、本明細書に記載の組成物に使用される本発明の化合物の用量は約5,000mg未満、または約4,000mg未満、または約3,000mg未満、または約2,000mg未満、または約1,000mg未満、または約800mg未満、または約600mg未満、または約500mg未満、または約200mg未満、または約50mg未満である。同様に、いくつかの態様では、本明細書に記載の第2の化合物の用量は約1,000mg未満、または約800mg未満、または約600mg未満、または約500mg未満、または約400mg未満、または約300mg未満、または約200mg未満、または約100mg未満、または約50mg未満、または約40mg未満、または約30mg未満、または約25mg未満、または約20mg未満、または約15mg未満、または約10mg未満、または約5mg未満、または約2mg未満、または約1mg未満、または約0.5mg未満、およびそれらのあらゆる整数増分もしくは部分増分である。 In some embodiments, the dose of a compound of the invention is from about 0.5 μg to about 5,000 mg. In some embodiments, the dose of a compound of the invention used in the compositions described herein is less than about 5,000 mg, or less than about 4,000 mg, or less than about 3,000 mg, or less than about 2,000 mg, or about Less than 1,000 mg, or less than about 800 mg, or less than about 600 mg, or less than about 500 mg, or less than about 200 mg, or less than about 50 mg. Similarly, in some embodiments, the dose of the second compound described herein is less than about 1,000 mg, or less than about 800 mg, or less than about 600 mg, or less than about 500 mg, or less than about 400 mg, or about 300 mg. Less than, or less than about 200 mg, or less than about 100 mg, or less than about 50 mg, or less than about 40 mg, or less than about 30 mg, or less than about 25 mg, or less than about 20 mg, or less than about 15 mg, or less than about 10 mg, or about 5 mg. Less than, or less than about 2 mg, or less than about 1 mg, or less than about 0.5 mg, and any integer or partial increment thereof.
一態様では、本発明は、治療有効量の本発明の化合物を単独でまたは第2の医薬品と組み合わせて保持する容器と; 患者における呼吸障害を処置し、予防しまたはその1つもしくは複数の症状を減少させるために該化合物を使用するための説明書とを含む、包装された薬学的組成物に関する。 In one aspect, the invention includes a container that holds a therapeutically effective amount of a compound of the invention alone or in combination with a second pharmaceutical agent; treating, preventing, or one or more symptoms of breathing disorder in a patient And a packaged pharmaceutical composition comprising instructions for using the compound to reduce
「容器」という用語は、薬学的組成物を保持するための任意の入れ物を含む。例えば、一態様では、容器は、薬学的組成物を収容する包装である。他の態様では、容器は、薬学的組成物を収容する包装ではなく、すなわち、容器は、包装された薬学的組成物または包装されていない薬学的組成物と該薬学的組成物の使用説明書とを収容するボックスまたはバイアルなどの入れ物である。さらに、包装技術は当技術分野において周知である。薬学的組成物の使用説明書が、該薬学的組成物を収容する包装上に含まれうるものであり、したがって該説明書と包装製品との機能的関係性が増大すると理解すべきである。しかし、説明書が、化合物がその意図される機能を、例えば対象における呼吸障害の処置、予防または減少を行う能力に関する情報を含みうると理解すべきである。 The term “container” includes any container for holding a pharmaceutical composition. For example, in one aspect, the container is a package that contains the pharmaceutical composition. In other embodiments, the container is not a package containing the pharmaceutical composition, i.e., the container is a packaged pharmaceutical composition or an unpackaged pharmaceutical composition and instructions for using the pharmaceutical composition. And a container such as a box or a vial. In addition, packaging techniques are well known in the art. It should be understood that instructions for use of the pharmaceutical composition can be included on the package containing the pharmaceutical composition, thus increasing the functional relationship between the instruction and the packaged product. However, it is to be understood that the instructions may include information regarding the ability of the compound to perform its intended function, for example, the ability to treat, prevent or reduce respiratory impairment in a subject.
投与経路
任意の本発明の組成物の投与経路としては吸入、経口、経鼻、直腸、非経口、舌下、経皮、経粘膜(例えば舌下、経舌、(経)頬側、(経)尿道、膣内(例えば経膣的および膣周囲)、鼻腔(内)ならびに(経)直腸)、膀胱内、肺内、十二指腸内、胃内、くも膜下腔内、皮下、筋肉内、皮内、動脈内、静脈内、気管支内、吸入、腹腔内、胸腔内、胸膜内、ならびに局所投与が挙げられる。
Route of administration Any route of administration of the composition of the present invention includes inhalation, oral, nasal, rectal, parenteral, sublingual, transdermal, transmucosal (e.g. sublingual, translingual, (trans) buccal, (trans ) Urethra, intravaginal (e.g. transvaginal and perivaginal), nasal cavity (inner) and (trans) rectal), intravesical, intrapulmonary, duodenum, intragastric, intrathecal, subcutaneous, intramuscular, intradermal Intraarterial, intravenous, intrabronchial, inhalation, intraperitoneal, intrathoracic, intrapleural, and topical administration.
好適な組成物および剤形としては例えば錠剤、カプセル剤、カプレット剤、丸剤、ゲルカプセル剤、トローチ剤、分散剤、懸濁剤、液剤、シロップ剤、顆粒剤、ビーズ剤、経皮パッチ剤、ゲル剤、散剤、ペレット剤、マグマ剤、舐剤、クリーム剤、ペースト剤、プラスター剤、ローション剤、ディスク剤、坐薬、経鼻または経口投与用液体スプレー剤、吸入用乾燥粉末製剤またはエアゾール製剤、膀胱内投与用組成物および製剤などが挙げられる。本発明において有用であろう製剤および組成物は、本明細書に記載の特定の製剤および組成物に限定されないと理解すべきである。 Suitable compositions and dosage forms include, for example, tablets, capsules, caplets, pills, gel capsules, troches, dispersions, suspensions, solutions, syrups, granules, beads, transdermal patches. , Gel, powder, pellet, magma, electuary, cream, paste, plaster, lotion, disc, suppository, liquid spray for nasal or oral administration, dry powder formulation or aerosol formulation for inhalation And compositions and preparations for intravesical administration. It should be understood that formulations and compositions that would be useful in the present invention are not limited to the specific formulations and compositions described herein.
経口投与
経口適用では、錠剤、糖衣錠剤、液剤、液滴剤、坐薬、またはカプセル剤、カプレット剤およびゲルカプセル剤が特に好適である。経口投与に好適な他の製剤としては粉末もしくは顆粒製剤、水性もしくは油性懸濁剤、水性もしくは油性液剤、ペースト剤、ゲル剤、練り歯磨き剤、洗口剤、コーティング、オーラルリンス、または乳剤が挙げられるがそれに限定されない。経口的使用が意図される組成物は、当技術分野において公知である任意の方法に従って調製することができ、そのような組成物は、錠剤の製造に好適である不活性で無毒の薬学的賦形剤からなる群より選択される1つまたは複数の薬剤を含有しうる。そのような賦形剤としては例えば、ラクトースなどの不活性希釈剤; コーンスターチなどの造粒剤および崩壊剤; デンプンなどの結合剤; ならびにステアリン酸マグネシウムなどの潤滑剤が挙げられる。
Oral administration For oral application, tablets, dragees, solutions, drops, suppositories, or capsules, caplets and gel capsules are particularly suitable. Other formulations suitable for oral administration include powder or granule formulations, aqueous or oily suspensions, aqueous or oily solutions, pastes, gels, toothpastes, mouth washes, coatings, oral rinses, or emulsions. However, it is not limited to that. Compositions intended for oral use can be prepared according to any method known in the art, and such compositions are inert and non-toxic pharmaceutical formulations suitable for the manufacture of tablets. It may contain one or more agents selected from the group consisting of dosage forms. Such excipients include, for example, inert diluents such as lactose; granulating and disintegrating agents such as corn starch; binders such as starch; and lubricants such as magnesium stearate.
錠剤は、コーティングされていなくてもよく、あるいは、対象の胃腸管内での遅延崩壊を実現することで有効成分の持続放出および吸収が行われるように公知の方法を使用してコーティングされていてもよい。例として、モノステアリン酸グリセリンまたはジステアリン酸グリセリンなどの材料を使用して錠剤をコーティングすることができる。さらに例として、米国特許第4,256,108号; 第4,160,452号; および第4,265,874号に記載の方法を使用して錠剤をコーティングすることで浸透圧制御放出錠剤を形成することができる。錠剤は、甘味料、香味料、着色料、保存料、または薬学的に上品で口当たりの良い調製物を与えるためのこれらの何らかの組み合わせをさらに含みうる。 The tablets may be uncoated or they may be coated using known methods to achieve sustained release and absorption of the active ingredient by providing delayed disintegration in the subject's gastrointestinal tract. Good. By way of example, materials such as glyceryl monostearate or glyceryl distearate can be used to coat tablets. By way of further example, osmotic controlled release tablets can be formed by coating the tablets using the methods described in US Pat. Nos. 4,256,108; 4,160,452; and 4,265,874. Tablets may further comprise sweetening, flavoring, coloring, preserving, or some combination of these to give a pharmaceutically elegant and palatable preparation.
有効成分を含む硬カプセル剤は、ゼラチンなどの生理学的に分解可能な組成物を使用して作製することができる。そのような硬カプセル剤は有効成分を含むものであり、炭酸カルシウム、リン酸カルシウムまたはカオリンなどの不活性固体希釈剤を例えば含むさらなる成分をさらに含みうる。 Hard capsules containing the active ingredient can be made using a physiologically degradable composition such as gelatin. Such hard capsules contain the active ingredient and may further comprise additional ingredients including, for example, an inert solid diluent such as calcium carbonate, calcium phosphate or kaolin.
有効成分を含む軟ゼラチンカプセル剤は、ゼラチンなどの生理学的に分解可能な組成物を使用して作製することができる。そのような軟カプセル剤は有効成分を含むものであり、有効成分は水、またはピーナッツ油、流動パラフィンもしくはオリーブ油などの油媒体と混合されていてもよい。 Soft gelatin capsules containing the active ingredients can be made using a physiologically degradable composition such as gelatin. Such soft capsules contain an active ingredient, which may be mixed with water or an oil medium such as peanut oil, liquid paraffin or olive oil.
経口投与では、本発明の化合物は、結合剤; 充填剤; 潤滑剤; 崩壊剤; または湿潤剤などの薬学的に許容される賦形剤によって通常の手段で調製される錠剤またはカプセル剤の形態でありうる。所望であれば、錠剤を好適な方法およびコーティング材料、例えばペンシルベニア州ウエストポイントのColorconから入手可能なOPADRY(商標)フィルムコーティングシステム(例えばOPADRY(商標)OY型、OYC型、有機腸溶性OY-P型、水性腸溶性OY-A型、OY-PM型、およびOPADRY(商標)White、32K18400)を使用してコーティングすることができる。 For oral administration, the compounds of the invention may be in the form of tablets or capsules prepared by conventional means with pharmaceutically acceptable excipients such as binders; fillers; lubricants; disintegrants; or wetting agents. It can be. If desired, tablets can be prepared using suitable methods and coating materials such as the OPADRYTM film coating system available from Colorcon, West Point, Pa. (E.g. OPADRYTM OY, OYC, organic enteric OY-P Type, aqueous enteric OY-A type, OY-PM type, and OPADRY ™ White, 32K18400).
経口投与用の液体調製物は液剤、シロップ剤または懸濁剤の形態でありうる。液体調製物は、懸濁化剤(例えばソルビトールシロップ、メチルセルロースまたは硬化食用脂); 乳化剤(例えばレシチンまたはアラビアゴム); 非水性媒体(例えばアーモンド油、油性エステルまたはエチルアルコール); および保存料(例えばパラ-ヒドロキシ安息香酸メチルもしくはプロピル、またはソルビン酸)などの薬学的に許容される添加剤によって通常の手段で調製することができる。経口投与に好適である本発明の薬学的組成物の液体製剤は、液体形態、または使用前に水もしくは別の好適な媒体による再構成が意図される乾燥製品の形態のいずれかで調製、包装または販売することができる。 Liquid preparations for oral administration can be in the form of solutions, syrups or suspensions. Liquid preparations include suspending agents (e.g. sorbitol syrup, methylcellulose or hardened edible fat); emulsifiers (e.g. lecithin or gum arabic); non-aqueous media (e.g. almond oil, oily esters or ethyl alcohol); and preservatives (e.g. Can be prepared by conventional means with pharmaceutically acceptable additives such as methyl or propyl para-hydroxybenzoate, or sorbic acid). Liquid formulations of the pharmaceutical composition of the present invention suitable for oral administration are prepared and packaged either in liquid form or in the form of a dry product intended for reconstitution with water or another suitable medium prior to use. Or can be sold.
有効成分を含む錠剤は、有効成分を場合によっては1つまたは複数のさらなる成分と共に圧縮または成形することによって例えば作製することができる。圧縮錠剤は、結合剤、潤滑剤、賦形剤、界面活性剤および分散剤の1つまたは複数と場合によって混合されている粉末調製物または顆粒調製物などの易流動性形態の有効成分を好適な装置中で圧縮することによって調製することができる。成形錠剤は、有効成分と、薬学的に許容される担体と、少なくとも混合物を湿らせるために十分な液体との混合物を好適な装置中で成形することによって調製することができる。錠剤の製造に使用される薬学的に許容される賦形剤としては不活性希釈剤、造粒剤および崩壊剤、結合剤、ならびに潤滑剤が挙げられるがそれに限定されない。公知の分散剤としてはジャガイモデンプンおよびデンプングリコール酸ナトリウムが挙げられるがそれに限定されない。公知の界面活性剤としてはラウリル硫酸ナトリウムが挙げられるがそれに限定されない。公知の希釈剤としては炭酸カルシウム、炭酸ナトリウム、ラクトース、結晶セルロース、リン酸カルシウム、リン酸水素カルシウムおよびリン酸ナトリウムが挙げられるがそれに限定されない。公知の造粒剤および崩壊剤としてはコーンスターチおよびアルギン酸が挙げられるがそれに限定されない。公知の結合剤としてはゼラチン、アラビアゴム、アルファ化トウモロコシデンプン、ポリビニルピロリドンおよびヒドロキシプロピルメチルセルロースが挙げられるがそれに限定されない。公知の潤滑剤としてはステアリン酸マグネシウム、ステアリン酸、シリカおよびタルクが挙げられるがそれに限定されない。 A tablet containing the active ingredient may be made, for example, by compressing or molding the active ingredient, optionally with one or more additional ingredients. Compressed tablets favor active ingredients in free-flowing form such as powder or granule preparations optionally mixed with one or more of binders, lubricants, excipients, surfactants and dispersants Can be prepared by compression in a simple apparatus. Molded tablets can be prepared by molding in a suitable apparatus a mixture of the active ingredient, a pharmaceutically acceptable carrier and at least a liquid sufficient to wet the mixture. Pharmaceutically acceptable excipients used in the manufacture of tablets include, but are not limited to, inert diluents, granulating and disintegrating agents, binders, and lubricants. Known dispersing agents include, but are not limited to, potato starch and sodium starch glycolate. Known surfactants include, but are not limited to, sodium lauryl sulfate. Known diluents include, but are not limited to, calcium carbonate, sodium carbonate, lactose, crystalline cellulose, calcium phosphate, calcium hydrogen phosphate and sodium phosphate. Known granulating and disintegrating agents include, but are not limited to, corn starch and alginic acid. Known binders include, but are not limited to, gelatin, gum arabic, pregelatinized corn starch, polyvinyl pyrrolidone and hydroxypropyl methylcellulose. Known lubricants include, but are not limited to, magnesium stearate, stearic acid, silica and talc.
有効成分の出発粉末または他の粒子状材料を改質するための造粒技術は薬学分野において周知である。典型的には、粉末を結合剤材料と混合して、「造粒物」と呼ばれるより大きく恒久的な易流動性の凝集体または顆粒にする。例えば、溶媒を使用する「湿式」造粒プロセスは、粉末を結合剤材料と一緒にし、湿式造粒塊の形成を生じさせる条件下で水または有機溶媒で湿らせ、次に造粒塊から必ず溶媒を蒸発させることを一般に特徴とする。 Granulation techniques for modifying the active ingredient starting powders or other particulate materials are well known in the pharmaceutical arts. Typically, the powder is mixed with a binder material into larger permanent free-flowing aggregates or granules called “granulates”. For example, a “wet” granulation process that uses a solvent involves combining the powder with a binder material, moistening with water or an organic solvent under conditions that result in the formation of a wet granulation mass, and then always starting from the granulation mass. It is generally characterized by evaporating the solvent.
溶融造粒は一般に、本質的に水または他の液体溶媒の添加の非存在下での粉末材料または他の材料の造粒を促進するための、室温で固体または半固体である(すなわち相対的に低い軟化点または融点の範囲を有する)材料の使用に本質がある。低融点固体は、融点範囲の温度に加熱される際に液化して結合剤または造粒媒体として作用する。液化固体は、それが接触する粉末材料の表面上に拡散し、冷却時に、最初の材料が一緒に結合した固体造粒塊を形成する。次に得られた溶融造粒物を、経口剤形を調製するために、錠剤プレスに供するかまたはカプセル化することができる。溶融造粒は、固体分散体または固溶体を形成することで有効成分(すなわち薬物)の溶解速度およびバイオアベイラビリティを向上させる。 Melt granulation is generally solid or semi-solid at room temperature (i.e., relative to facilitate granulation of powdered materials or other materials in the absence of the addition of water or other liquid solvent in nature. The use of materials with a low softening point or melting point range. The low melting point solid liquefies when heated to a temperature in the melting range and acts as a binder or granulation medium. The liquefied solid diffuses onto the surface of the powder material it contacts and upon cooling forms a solid agglomerate with the initial materials bound together. The resulting melt granulate can then be subjected to a tablet press or encapsulated to prepare an oral dosage form. Melt granulation improves the dissolution rate and bioavailability of the active ingredient (ie drug) by forming a solid dispersion or solid solution.
米国特許第5,169,645号では、改善された流動性を有する直接圧縮性ワックス含有顆粒が開示されている。顆粒は、ワックスを溶融物中で特定の流動性向上添加剤と混合した後、混合物を冷却および造粒する際に得られる。特定の態様では、ワックスと添加剤との溶融組み合わせ中でワックスそれ自体のみが溶融し、他の場合では、ワックスと添加剤との両方が溶融する。 US Pat. No. 5,169,645 discloses directly compressible wax-containing granules having improved flowability. Granules are obtained when the wax is mixed with certain flow enhancing additives in the melt and then the mixture is cooled and granulated. In certain embodiments, only the wax itself melts in the melt combination of wax and additive, and in other cases both the wax and additive melt.
本発明はまた、本発明の方法の範囲内で有用な1つまたは複数の化合物の遅延放出を行う層と、本発明の方法の範囲内で有用な1つまたは複数の化合物の即時放出を行うさらなる層とを含む、多層錠剤を含む。ワックス/pH感受性ポリマー混合物を使用して、有効成分が封入されることでその遅延放出を確実にする胃不溶性組成物を得ることができる。 The present invention also provides a layer that provides delayed release of one or more compounds useful within the method of the present invention and an immediate release of one or more compounds useful within the method of the present invention. Including multi-layer tablets, including additional layers. A wax / pH sensitive polymer mixture can be used to obtain a gastric insoluble composition that encapsulates the active ingredient to ensure its delayed release.
非経口投与
本明細書において使用される、薬学的組成物の「非経口投与」は、対象の組織への物理的開口、および組織内の開口部を通じた薬学的組成物の投与を特徴とする、任意の投与経路を含む。したがって、非経口投与としては、組成物の注射、外科的切開を通じての組成物の適用、組織貫通性非外科的創傷を通じての組成物の適用などによる薬学的組成物の投与が挙げられるがそれに限定されない。特に、非経口投与は、皮下注射、静脈内注射、腹腔内注射、筋肉内注射、胸骨内注射および腎透析注入技術を含むがそれに限定されないように想定される。
Parenteral Administration As used herein, “parenteral administration” of a pharmaceutical composition is characterized by the administration of the pharmaceutical composition through a physical opening into the tissue of interest and through the opening in the tissue. Including any route of administration. Accordingly, parenteral administration includes, but is not limited to, administration of a pharmaceutical composition by injection of the composition, application of the composition through a surgical incision, application of the composition through a tissue penetrating non-surgical wound, and the like. Not. In particular, parenteral administration is envisioned including but not limited to subcutaneous injection, intravenous injection, intraperitoneal injection, intramuscular injection, intrasternal injection, and renal dialysis infusion techniques.
非経口投与に好適な薬学的組成物の製剤は、有効成分と滅菌水または滅菌等張食塩水などの薬学的に許容される担体との組み合わせを含む。そのような製剤は、ボーラス投与または連続投与に好適な形態で調製、包装または販売することができる。注射用製剤は、例えばアンプル中、または保存料を収容する複数用量容器中の単位剤形で調製、包装または販売することができる。非経口投与用製剤としては懸濁剤、液剤、油性または水性媒体中乳剤、ペースト剤、および埋め込み式持続放出または生分解性製剤が挙げられるがそれに限定されない。そのような製剤は、懸濁化剤、安定剤または分散剤を含むがそれに限定されない1つまたは複数のさらなる成分をさらに含みうる。非経口投与用製剤の一態様では、有効成分は、再構成組成物の非経口投与前に好適な媒体(例えば滅菌パイロジェンフリー水)で再構成される乾燥(すなわち粉末または顆粒)形態で与えられる。 A formulation of a pharmaceutical composition suitable for parenteral administration comprises a combination of the active ingredient with a pharmaceutically acceptable carrier such as sterile water or sterile isotonic saline. Such formulations can be prepared, packaged, or sold in a form suitable for bolus administration or continuous administration. Injectable preparations can be prepared, packaged, or sold in unit dosage forms, for example, in ampoules or in multi-dose containers containing preservatives. Formulations for parenteral administration include, but are not limited to, suspensions, solutions, emulsions in oily or aqueous media, pastes, and implantable sustained release or biodegradable formulations. Such formulations may further comprise one or more additional ingredients including but not limited to suspending, stabilizing or dispersing agents. In one embodiment of a formulation for parenteral administration, the active ingredient is provided in a dry (ie, powder or granule) form that is reconstituted with a suitable vehicle (e.g., sterile pyrogen-free water) prior to parenteral administration of the reconstituted composition. .
薬学的組成物は、滅菌注射用の水性または油性懸濁剤または液剤の形態で調製、包装または販売することができる。この懸濁剤または液剤は、公知の技術に従って製剤化することができ、有効成分に加えて、本明細書に記載の分散剤、湿潤剤または懸濁化剤などのさらなる成分を含みうる。そのような滅菌注射用製剤は、例えば水または1,3-ブタンジオールなどの無毒の非経口的に許容される希釈剤または溶媒を使用して調製することができる。他の許容される希釈剤および溶媒としてはリンゲル液、等張塩化ナトリウム溶液、および合成モノグリセリドまたはジグリセリドなどの不揮発性油が挙げられるがそれに限定されない。有用な他の非経口的に投与可能な製剤としては、有効成分を微結晶形態で、リポソーム調製物で、または生分解性ポリマー系の一成分として含む製剤が挙げられる。持続放出または埋め込み用組成物は、乳濁液、イオン交換樹脂、難溶性ポリマーまたは難溶性塩などの薬学的に許容されるポリマー材料または疎水性材料を含みうる。 The pharmaceutical compositions can be prepared, packaged or sold in the form of a sterile injectable aqueous or oleaginous suspension or solution. This suspension or solution can be formulated according to known techniques and can contain, in addition to the active ingredient, further ingredients such as dispersing, wetting or suspending agents described herein. Such sterile injectable formulations can be prepared using a non-toxic parenterally acceptable diluent or solvent such as water or 1,3-butanediol. Other acceptable diluents and solvents include, but are not limited to, Ringer's solution, isotonic sodium chloride solution, and non-volatile oils such as synthetic monoglycerides or diglycerides. Other parentally-administrable formulations that are useful include formulations that contain the active ingredient in microcrystalline form, in a liposomal preparation, or as a component of a biodegradable polymer system. Sustained release or embedding compositions can include pharmaceutically acceptable polymeric or hydrophobic materials such as emulsions, ion exchange resins, sparingly soluble polymers or sparingly soluble salts.
局所投与
医薬品の局所投与の障壁は表皮の角質層である。角質層は、タンパク質、コレステロール、スフィンゴ脂質、遊離脂肪酸および様々な他の脂質で構成される抵抗性の高い層であり、角化細胞および生細胞を含む。角質層を通じた化合物の浸透率(流量)を制限する要因の1つは、皮膚表面上に付加または適用可能な活性物質の量である。皮膚の単位面積当たりに適用される活性物質の量が多いほど、皮膚表面と皮膚の下層との間の濃度勾配が大きくなり、したがって皮膚を通じての活性物質の拡散力が大きくなる。したがって、比較的大きな濃度の有効物質を含有する製剤は、比較的小さな濃度を有するが他のすべてのことが同じである製剤よりも、皮膚を通じて活性物質をより多く、より一貫した比率で浸透させる可能性が高い。
Topical administration The barrier to local administration of pharmaceuticals is the stratum corneum of the epidermis. The stratum corneum is a highly resistant layer composed of proteins, cholesterol, sphingolipids, free fatty acids and various other lipids and includes keratinocytes and living cells. One factor that limits the penetration rate (flow rate) of a compound through the stratum corneum is the amount of active substance that can be added or applied to the skin surface. The greater the amount of active substance applied per unit area of skin, the greater the concentration gradient between the skin surface and the lower layer of the skin, and thus the greater the diffusivity of the active substance through the skin. Thus, a formulation containing a relatively large concentration of active substance will penetrate more active substance through the skin at a more consistent rate than a formulation with a relatively small concentration but all the same Probability is high.
局所投与に好適な製剤としてはリニメント剤、ローション剤、クリーム剤などの水中油型もしくは油中水型乳剤、軟膏剤またはペースト剤、および液剤または懸濁剤などの液体または半液体調製物が挙げられるがそれに限定されない。局所投与可能な製剤は例えば約1%〜約10%(w/w)の有効成分を含みうるが、有効成分の濃度の高さは溶媒中の有効成分の溶解度限界と同じであることがある。局所投与用製剤は、本明細書に記載の1つまたは複数のさらなる成分をさらに含みうる。 Formulations suitable for topical administration include oil-in-water or water-in-oil emulsions such as liniments, lotions, creams, ointments or pastes, and liquid or semi-liquid preparations such as solutions or suspensions. However, it is not limited to that. Topically administrable formulations may contain, for example, about 1% to about 10% (w / w) active ingredient, although the active ingredient concentration may be the same as the solubility limit of the active ingredient in the solvent . Formulations for topical administration can further comprise one or more additional ingredients as described herein.
浸透促進剤を使用することができる。これらの材料は、皮膚を通じた薬物の浸透率を増大させる。当技術分野における典型的な促進剤としてはエタノール、グリセロールモノラウレート、PGML(ポリエチレングリコールモノラウレート)、ジメチルスルホキシドなどが挙げられる。他の促進剤としてはオレイン酸、オレイルアルコール、エトキシジグリコール、ラウロカプラム、アルカンカルボン酸、ジメチルスルホキシド、極性脂質またはN-メチル-2-ピロリドンが挙げられる。 Penetration enhancers can be used. These materials increase the penetration rate of the drug through the skin. Typical accelerators in the art include ethanol, glycerol monolaurate, PGML (polyethylene glycol monolaurate), dimethyl sulfoxide, and the like. Other accelerators include oleic acid, oleyl alcohol, ethoxydiglycol, laurocapram, alkane carboxylic acid, dimethyl sulfoxide, polar lipids or N-methyl-2-pyrrolidone.
本発明のいくつかの組成物の局所送達に許容される1つの媒体はリポソームを含有しうる。リポソームの組成およびそれらの使用は当技術分野において公知である(例えばConstanzaの米国特許第6,323,219号を参照)。 One vehicle acceptable for topical delivery of some compositions of the invention may contain liposomes. The composition of liposomes and their use are known in the art (see, eg, US Pat. No. 6,323,219 to Constanza).
代替態様では、局所的に活性な薬学的組成物は、補助剤、抗酸化剤、キレート剤、界面活性剤、発泡剤、湿潤剤、乳化剤、増粘剤、緩衝剤、保存料などの他の成分と組み合わせてもよい。別の態様では、浸透促進剤が組成物に含まれており、浸透促進剤を欠く組成物に対して角質層中へのおよび角質層を通じた有効成分の経皮浸透を向上させる上で有効である。オレイン酸、オレイルアルコール、エトキシジグリコール、ラウロカプラム、アルカンカルボン酸、ジメチルスルホキシド、極性脂質またはN-メチル-2-ピロリドンを含む様々な浸透促進剤が当業者に公知である。別の局面では、組成物は屈水性剤をさらに含みうるものであり、屈水性剤は、角質層の構造の無秩序を増大させるように機能し、したがって角質層を通じた輸送の増大を可能にする。イソプロピルアルコール、プロピレングリコールまたはナトリウムキシレンスルホネートなどの様々な屈水性剤が当業者に公知である。 In alternative embodiments, the topically active pharmaceutical composition may include other adjuvants, antioxidants, chelating agents, surfactants, foaming agents, wetting agents, emulsifiers, thickeners, buffers, preservatives, and the like. You may combine with an ingredient. In another embodiment, a penetration enhancer is included in the composition and is effective in improving transdermal penetration of the active ingredient into and through the stratum corneum relative to a composition lacking the penetration enhancer. is there. Various penetration enhancers are known to those skilled in the art including oleic acid, oleyl alcohol, ethoxydiglycol, laurocapram, alkanecarboxylic acid, dimethyl sulfoxide, polar lipids or N-methyl-2-pyrrolidone. In another aspect, the composition may further comprise a hydrophile, which functions to increase the structural disorder of the stratum corneum, thus allowing for increased transport through the stratum corneum. . Various hydrophobizing agents are known to those skilled in the art, such as isopropyl alcohol, propylene glycol or sodium xylene sulfonate.
局所的に活性な薬学的組成物は、所望の変化を行うために有効な量で適用すべきである。本明細書において使用される「有効量」とは、変化が望まれる皮膚表面の領域を覆うために十分な量を意味するものとする。活性化合物は組成物の約0.0001重量%〜約15重量%の量で存在すべきである。より好ましくは、組成物の約0.0005%〜約5%の量で存在すべきであり、最も好ましくは、組成物の約0.001%〜約1%の量で存在すべきである。そのような化合物は合成由来でも天然由来でもよい。 Topically active pharmaceutical compositions should be applied in an amount effective to effect the desired change. As used herein, “effective amount” shall mean an amount sufficient to cover the area of the skin surface where a change is desired. The active compound should be present in an amount of about 0.0001% to about 15% by weight of the composition. More preferably, it should be present in an amount of about 0.0005% to about 5% of the composition, and most preferably it should be present in an amount of about 0.001% to about 1% of the composition. Such compounds may be synthetic or natural.
頬側投与
本発明の薬学的組成物は、頬側投与に好適な製剤として調製、包装または販売することができる。そのような製剤は、通常の方法を使用して作製される錠剤または舐剤の形態で例えばありうるものであり、例えば0.1〜20%(w/w)の有効成分を含有しうるものであり、残部は経口的に溶解性または分解性の組成物、および場合によって本明細書に記載の1つまたは複数のさらなる成分を含む。あるいは、頬側投与に好適な製剤は、有効成分を含む、粉末、またはエアゾール化もしくは微粒化した溶液もしくは懸濁液を含みうる。そのような粉末、エアゾール化またはエアゾール化製剤は、分散時に約0.1〜約200ナノメートルの範囲の平均粒径または液滴径を示すことが好ましく、本明細書に記載の1つまたは複数のさらなる成分をさらに含みうる。本明細書に記載の製剤の例は網羅的なものではなく、本発明が、本明細書に記載されていないが当業者に公知であるこれらのおよび他の製剤のさらなる修正を含むと理解されよう。
Buccal administration The pharmaceutical composition of the invention can be prepared, packaged or sold as a formulation suitable for buccal administration. Such formulations can be, for example, in the form of tablets or electuary made using conventional methods, such as those containing 0.1-20% (w / w) active ingredient. The remainder comprises an orally soluble or degradable composition, and optionally one or more additional ingredients as described herein. Alternatively, formulations suitable for buccal administration can include powders or aerosolized or atomized solutions or suspensions containing the active ingredients. Such a powder, aerosolized or aerosolized formulation preferably exhibits an average particle size or droplet size in the range of about 0.1 to about 200 nanometers when dispersed, and one or more of the additional ones described herein Ingredients may further be included. The examples of formulations described herein are not exhaustive and it is understood that the present invention includes further modifications of these and other formulations not described herein but known to those of skill in the art. Like.
直腸投与
本発明の薬学的組成物は、直腸投与に好適な製剤として調製、包装または販売することができる。そのような組成物は例えば坐薬、停留浣腸製剤、および直腸または結腸洗浄用液剤の形態でありうる。
Rectal Administration The pharmaceutical composition of the present invention can be prepared, packaged or sold as a formulation suitable for rectal administration. Such compositions can be in the form of, for example, suppositories, retention enemas, and rectal or colonic lavage solutions.
坐薬製剤は、有効成分と、普通の室温(すなわち約20℃)で固体でありかつ対象の直腸温度(すなわち健康なヒトでは約37℃)で液体である非刺激性の薬学的に許容される賦形剤とを組み合わせることで作製することができる。好適な薬学的に許容される賦形剤としてはカカオバター、ポリエチレングリコールおよび様々なグリセリドが挙げられるがそれに限定されない。坐薬製剤は、抗酸化剤および保存料を含むがそれに限定されない様々なさらなる成分をさらに含みうる。 Suppository formulations are non-irritating pharmaceutically acceptable active ingredients and solids at normal room temperature (ie about 20 ° C) and liquid at the subject's rectal temperature (ie about 37 ° C in healthy humans) It can produce by combining with an excipient | filler. Suitable pharmaceutically acceptable excipients include, but are not limited to, cocoa butter, polyethylene glycol and various glycerides. Suppository formulations may further comprise a variety of additional ingredients including, but not limited to, antioxidants and preservatives.
停留浣腸製剤、または直腸もしくは結腸洗浄用液剤は、有効成分と薬学的に許容される液体担体とを組み合わせることで作製することができる。当技術分野において周知のように、浣腸製剤は、対象の直腸の解剖学的形態に適応した送達装置を使用して投与することができ、該送達装置内に包装することができる。浣腸製剤は、抗酸化剤および保存料を含むがそれに限定されない様々なさらなる成分をさらに含みうる。 A retention enema formulation or rectal or colonic irrigation solution can be made by combining the active ingredient with a pharmaceutically acceptable liquid carrier. As is well known in the art, enema formulations can be administered and packaged within a delivery device adapted to the subject's rectal anatomy. Enema formulations can further include a variety of additional ingredients including, but not limited to, antioxidants and preservatives.
さらなる投与形態
本発明のさらなる剤形としては米国特許第6,340,475号、第6,488,962号、第6,451,808号、第5,972,389号、第5,582,837号および第5,007,790号に記載の剤形が挙げられる。本発明のさらなる剤形としては米国特許出願公開第20030147952号、第20030104062号、第20030104053号、第20030044466号、第20030039688号および第20020051820号に記載の剤形も挙げられる。本発明のさらなる剤形としてはPCT出願WO 03/35041号、WO 03/35040号、WO 03/35029号、WO 03/35177号、WO 03/35039号、WO 02/96404号、WO 02/32416号、WO 01/97783号、WO 01/56544号、WO 01/32217号、WO 98/55107号、WO 98/11879号、WO 97/47285号、WO 93/18755号およびWO 90/11757号に記載の剤形も挙げられる。
Additional Dosage Forms Additional dosage forms of the present invention include the dosage forms described in US Pat. Nos. 6,340,475, 6,488,962, 6,451,808, 5,972,389, 5,582,837 and 5,007,790. Further dosage forms of the present invention include those described in US Patent Application Publication Nos. 20030147952, 20030104062, 20030104053, 20030044466, 20030039688 and 20020051820. Further dosage forms of the present invention include PCT applications WO 03/35041, WO 03/35040, WO 03/35029, WO 03/35177, WO 03/35039, WO 02/96404, WO 02/32416 No., WO 01/97783, WO 01/56544, WO 01/32217, WO 98/55107, WO 98/11879, WO 97/47285, WO 93/18755 and WO 90/11757 Mention may also be made of the dosage forms described.
制御放出製剤および薬物送達システム
本発明の薬学的組成物の制御放出または持続放出製剤は、通常の技術を使用して作製することができる。いくつかの場合では、使用される剤形は、ヒドロプロピルメチルセルロース、他のポリマーマトリックス、ゲル、浸透膜、浸透圧系、多層コーティング、微粒子、リポソームもしくはミクロスフェア、または所望の放出プロファイルを与える様々な割合でのそれらの組み合わせを例えば使用する、剤形中の1つまたは複数の有効成分の緩徐放出または制御放出として与えることができる。本明細書に記載のものを含む、当業者に公知の好適な制御放出製剤は、本発明の薬学的組成物での使用のために容易に選択することができる。したがって、制御放出に適応した、錠剤、カプセル剤、ゲルカプセル剤およびカプレット剤などの経口投与に好適な単一の単位剤形が、本発明に包含される。
Controlled Release Formulations and Drug Delivery Systems Controlled or sustained release formulations of the pharmaceutical compositions of the invention can be made using conventional techniques. In some cases, the dosage forms used can be hydropropyl methylcellulose, other polymer matrices, gels, osmotic membranes, osmotic systems, multilayer coatings, microparticles, liposomes or microspheres, or a variety that provides the desired release profile. Combinations thereof in proportions can be provided as a slow or controlled release of one or more active ingredients in the dosage form, eg, used. Suitable controlled release formulations known to those skilled in the art, including those described herein, can be readily selected for use in the pharmaceutical compositions of the present invention. Thus, single unit dosage forms suitable for oral administration, such as tablets, capsules, gel capsules and caplets, adapted for controlled release are encompassed by the present invention.
大部分の薬学的制御放出製品は、その非制御性の対応物が実現する薬物治療に比べて薬物治療を改善するという共通の目標を有する。理想的には、医学的処置における最適に設計された制御放出製剤の使用は、最小量の時間で状態を治癒または制御するために使用される最小限の原薬を特徴とする。制御放出製剤の利点としては、薬物の活性の長期化、投薬頻度の減少、および患者コンプライアンスの増大が挙げられる。さらに、制御放出製剤は、作用の発生時間、または薬物の血中レベルなどの他の特性に影響を与えるために使用でき、したがって、副作用の出現に影響を与えることができる。 Most pharmaceutical controlled release products have a common goal of improving drug treatment compared to drug treatment achieved by their uncontrolled counterparts. Ideally, the use of optimally designed controlled release formulations in medical treatment is characterized by the minimal drug substance used to cure or control the condition with the least amount of time. Advantages of controlled release formulations include prolonged drug activity, reduced dosage frequency, and increased patient compliance. In addition, controlled release formulations can be used to affect other properties such as the time of onset of action, or the blood level of the drug, and thus can affect the appearance of side effects.
大部分の制御放出製剤は、所望の治療効果を迅速に生成する量の薬物を最初に放出するように、また長期間にわたってこのレベルの治療効果を維持する他の量の薬物を徐々に連続して放出するように設計される。この一定の薬物レベルを体内で維持するために、身体から代謝および排泄される薬物の量を置き換える速度で、薬物を剤形から放出しなければならない。 Most controlled-release formulations gradually release other doses that maintain this level of therapeutic effect over an extended period of time, with the initial release of the drug that rapidly produces the desired therapeutic effect. Designed to release. In order to maintain this constant drug level in the body, the drug must be released from the dosage form at a rate that will replace the amount of drug being metabolized and excreted from the body.
有効成分の制御放出は、様々な誘導因子、例えばpH、温度、酵素、水、または他の生理条件もしくは化合物によって刺激することができる。本発明の文脈での「制御放出成分」という用語は、ポリマー、ポリマーマトリックス、ゲル、浸透膜、リポソームもしくはミクロスフェア、または有効成分の制御放出を容易にするそれらの組み合わせを含むがそれに限定されない化合物として本明細書において定義される。 Controlled release of the active ingredient can be stimulated by various inducers such as pH, temperature, enzymes, water, or other physiological conditions or compounds. The term “controlled release component” in the context of the present invention includes compounds, including but not limited to polymers, polymer matrices, gels, osmotic membranes, liposomes or microspheres, or combinations thereof that facilitate controlled release of active ingredients. As defined herein.
特定の態様では、本発明の製剤は短期放出、急速オフセット、ならびに制御放出、例えば持続放出、遅延放出およびパルス放出製剤でありうるがそれに限定されない。 In certain embodiments, the formulations of the present invention can be, but are not limited to, short release, rapid offset, and controlled release, such as sustained release, delayed release and pulsed release formulations.
持続放出という用語は、その通常の意味で使用されるものであり、長期間にわたって薬物を徐々に放出しかつ、必ずというわけではないが長期間にわたって薬物の実質的に一定の血中レベルをもたらしうる、薬物製剤を意味する。期間は1ヶ月以上の長さでありうるものであり、ボーラス形態で投与される同一量の薬剤よりも長い放出であるべきである。 The term sustained release is used in its normal sense to gradually release a drug over a long period of time and, if not necessarily, result in a substantially constant blood level of the drug over a long period of time. Means a drug formulation. The period can be as long as one month or longer and should be a longer release than the same amount of drug administered in bolus form.
持続放出では、化合物に持続放出性を与える好適なポリマーまたは疎水性材料と共に化合物を製剤化することができる。したがって、本発明の方法で使用される化合物は、微粒子の形態で例えば注射によって、またはオブラートもしくはディスクの形態で埋め込みによって、投与することができる。 For sustained release, the compound can be formulated with a suitable polymer or hydrophobic material that imparts sustained release to the compound. Thus, the compounds used in the method of the invention can be administered in the form of microparticles, for example by injection or by implantation in the form of an oblate or disc.
本発明の好ましい態様では、持続放出製剤を使用して、本発明の化合物を、患者に単独でまたは別の医薬品と組み合わせて投与する。 In a preferred embodiment of the invention, sustained release formulations are used to administer the compound of the invention to the patient alone or in combination with another pharmaceutical agent.
遅延放出という用語は、その通常の意味で本明細書において使用されるものであり、薬物投与に続く何らかの遅延の後に薬物を初めて放出しかつ、必ずというわけではないが約10分から最大約12時間の遅延を含みうる、薬物製剤を意味する。 The term delayed release is used herein in its ordinary sense to release the drug for the first time after any delay following drug administration and not necessarily from about 10 minutes up to about 12 hours. Means a drug formulation that can contain
パルス放出という用語は、その通常の意味で使用されるものであり、薬物投与後にパルス状の血漿プロファイルを生成するように薬物の放出を行う薬物製剤を意味する。 The term pulsed release is used in its normal sense and refers to a drug formulation that releases drug so as to produce a pulsed plasma profile after drug administration.
即時放出という用語は、その通常の意味で使用されるものであり、薬物投与後直ちに薬物の放出を行う薬物製剤を意味する。 The term immediate release is used in its normal sense and refers to a drug formulation that releases drug immediately after drug administration.
本明細書において使用される短期とは、薬物投与後約8時間、約7時間、約6時間、約5時間、約4時間、約3時間、約2時間、約1時間、約40分、約20分または約10分、およびそれらのあらゆる整数増分もしくは部分増分を含むそれまでの任意の期間を意味する。 As used herein, short term refers to about 8 hours, about 7 hours, about 6 hours, about 5 hours, about 4 hours, about 3 hours, about 2 hours, about 1 hour, about 40 minutes after drug administration, Means any period up to and including about 20 minutes or about 10 minutes and any integer or partial increments thereof.
本明細書において使用される急速オフセットとは、薬物投与後約8時間、約7時間、約6時間、約5時間、約4時間、約3時間、約2時間、約1時間、約40分、約20分または約10分、およびそれらのあらゆる整数増分もしくは部分増分を含むそれまでの任意の期間を意味する。 As used herein, rapid offset is about 8 hours, about 7 hours, about 6 hours, about 5 hours, about 4 hours, about 3 hours, about 2 hours, about 1 hour, about 40 minutes after drug administration. , About 20 minutes or about 10 minutes, and any period up to that including any integer or partial increments thereof.
機械的装置
本発明の一局面では、正常な呼吸および正常な呼吸制御を欠く患者を処置する方法は、本発明の範囲内で有用である本明細書に記載の組成物を投与する段階、および正常な呼吸の欠如の処置用の装置を使用して患者をさらに処置する段階を含む。そのような装置としては換気装置、CPAPおよびBiPAP装置が挙げられるがそれに限定されない。
In one aspect of the present invention, a method of treating a patient lacking normal breathing and normal breathing control comprises administering a composition described herein that is useful within the scope of the present invention, and Further treating the patient using a device for treatment of lack of normal breathing. Such devices include, but are not limited to, ventilators, CPAP and BiPAP devices.
機械的人工呼吸は、自発呼吸を機械的に補助または代替する方法である。機械的人工呼吸は、気管内チューブまたは気管開口術チューブを気道に挿入する手法である侵襲的挿管後に典型的に使用される。それは通常、手術室またはICUなどの深刻な状況で、手術、医療手技、または重篤な疾病の間に、短期間使用される。それは、長期換気支援を必要とする慢性疾病を患者が有する場合に在宅でまたは看護施設もしくはリハビリテーション施設で使用されることもある。機械的人工呼吸の主な形態は、患者の気道の圧力を増大させることで空気を肺内に押し込むことによって働く陽圧換気である。患者の胸部の周りに陰圧環境を作り出すことで空気を肺内に引き込む陰圧換気装置(例えば「鉄の肺」)は、今日それほど一般的ではない。機械的人工呼吸は、多くの場合では救命介入であるが、気胸、気道損傷、肺胞障害および換気装置関連肺炎を含む多くの潜在的合併症を伴う。このため、使用されるガスの圧力および体積は厳密に制御され、できるだけ速やかに減少させられる。機械的人工呼吸の種類としては通常の換気、高頻度換気、非侵襲的換気(非侵襲的陽圧換気またはNIPPV)、比例補助換気(PAV)、適応補助換気(ASV)および神経調節補助換気(NAVA)がある。 Mechanical ventilation is a method that mechanically assists or substitutes for spontaneous breathing. Mechanical ventilation is typically used after invasive intubation, which is a technique for inserting an endotracheal tube or tracheostomy tube into the airway. It is usually used for a short time during surgery, medical procedures, or serious illnesses in serious situations such as operating rooms or ICUs. It may be used at home or in a nursing or rehabilitation facility if the patient has a chronic illness that requires long-term ventilation support. The main form of mechanical ventilation is positive pressure ventilation, which works by pushing air into the lungs by increasing the pressure of the patient's airways. Negative pressure ventilators (eg, “iron lungs”) that draw air into the lungs by creating a negative pressure environment around the patient's chest are less common today. Mechanical ventilation is often a lifesaving intervention, but it has many potential complications, including pneumothorax, airway damage, alveolar damage, and ventilator-associated pneumonia. For this reason, the pressure and volume of the gas used are strictly controlled and reduced as quickly as possible. The types of mechanical ventilation include normal ventilation, high frequency ventilation, non-invasive ventilation (non-invasive positive pressure ventilation or NIPPV), proportional assisted ventilation (PAV), adaptive assisted ventilation (ASV) and neuromodulated assisted ventilation ( NAVA).
非侵襲的換気とは、気管内チューブの使用なしに換気を補助するすべての様式を意味する。非侵襲的換気は、侵襲的換気に関連する患者の不快感および合併症を最小化することを主に目的としており、多くの場合、心疾患、慢性肺疾患の増悪、睡眠時無呼吸および神経筋疾患において使用される。非侵襲的換気は患者との接合面のみに関するものであり、使用される換気様式に関するものではない。様式としては自発様式または制御様式を挙げることができ、圧力または体積のいずれかに関する様式でありうる。いくつかの一般的に使用されるNIPPVの様式としては以下が挙げられる。
(a) 持続的気道陽圧(CPAP): この種の機械は、在宅時の睡眠時無呼吸の処置用に患者によって主に使用されてきたが、現在では集中治療室において換気形態の1つとして広範に使用されている。CPAP機械は、非閉塞呼吸が可能になるように気道を固定する(空気圧下でそれを開放したまま保持する)鼻枕、鼻マスクまたはフルフェイスマスクへのホースを介して圧縮空気の流れを送達することで上気道閉塞を停止させて、無呼吸および低呼吸を減少させかつ/または予防する。マスクを頭上に配置する前に機械をオンにすると、空気の流れがマスクを通り抜ける。マスクを頭上に配置した後、それは顔面を塞ぎ、空気は流れることをやめる。この時点で、所望の結果を達成するのは気圧のみである。これには、睡眠時無呼吸に時々付随する非常に大きないびきを減少させるかまたは除去するというさらなる利点がある。
(b) バイレベル気道陽圧(BIPAP): 圧力は、患者の労力によって吸気気道陽圧(IPAP)とより低い呼気気道陽圧(EPAP)とが交互に生じる。多くのそのような装置では、患者が呼吸を開始できない場合でもIPAP圧力を送達するバックアップレートを設定することができる。
(c) マウスピースまたはマスクを介する間欠的陽圧換気(IPPV)。
Non-invasive ventilation means any mode that assists ventilation without the use of endotracheal tubes. Non-invasive ventilation is primarily aimed at minimizing patient discomfort and complications associated with invasive ventilation, often in heart disease, exacerbation of chronic lung disease, sleep apnea and nerves. Used in muscle disease. Non-invasive ventilation relates only to the patient interface and not to the type of ventilation used. The mode may include a spontaneous mode or a control mode, and may be a mode related to either pressure or volume. Some commonly used NIPPV formats include the following.
(a) Continuous Positive Airway Pressure (CPAP): This type of machine has been used primarily by patients for the treatment of sleep apnea at home, but is now one of the forms of ventilation in the intensive care unit. As widely used. CPAP machine delivers a flow of compressed air via a hose to a nasal pillow, nasal mask or full face mask that secures the airway to allow non-occlusive breathing (holds it open under air pressure) To stop upper airway obstruction and reduce and / or prevent apnea and hypopnea. If the machine is turned on before placing the mask over the head, air flow will pass through the mask. After placing the mask over the head, it closes the face and the air stops flowing. At this point, only atmospheric pressure achieves the desired result. This has the added benefit of reducing or eliminating the very large snoring that sometimes accompanies sleep apnea.
(b) Bi-level positive airway pressure (BIPAP): The pressure alternates between positive inspiratory airway pressure (IPAP) and lower positive expiratory airway pressure (EPAP) depending on patient effort. For many such devices, a backup rate can be set that delivers IPAP pressure even if the patient is unable to begin breathing.
(c) Intermittent positive pressure ventilation (IPPV) through mouthpiece or mask.
当業者は、本明細書に記載の具体的な手法、態様、請求項および実施例の数多くの等価物を認識するか、または単なる日常的な実験を使用して確認できるであろう。そのような等価物は、本発明の範囲内にあって、本明細書に添付される特許請求の範囲によって網羅されるものと考えられよう。例えば、反応時間、反応サイズ/規模、ならびに実験試薬、例えば溶媒、触媒、圧力、雰囲気条件、例えば窒素雰囲気、および還元剤/酸化剤を含むがそれに限定されない反応条件を、当技術分野で認識されている代替物によってかつ単に日常的な実験を使用して修正することが、本出願の範囲内であると考えるべきである。 Those skilled in the art will recognize, or be able to ascertain using no more than routine experimentation, many equivalents to the specific techniques, aspects, claims, and examples described herein. Such equivalents are considered to be within the scope of this invention and are covered by the claims appended hereto. For example, reaction times, reaction sizes / scales, and experimental reagents such as solvents, catalysts, pressures, atmospheric conditions such as nitrogen atmospheres, and reaction conditions including but not limited to reducing / oxidizing agents are recognized in the art. It is to be considered within the scope of this application to modify by means of alternatives and simply using routine experimentation.
値および範囲を示す本明細書のあらゆる箇所において、範囲という形での記述が、単に便宜性および簡潔さのためであって、本発明の範囲に対する硬直的な制限と解釈されるべきではないということを理解すべきである。したがって、これらの値および範囲が包含するすべての値および範囲は、本発明の範囲内に包含されるように意図される。さらに、これらの範囲内にあるすべての値、および値の範囲の上限または下限も、本出願によって想定される。範囲に関する記述は、すべての可能な部分範囲、およびその範囲内の個々の数値、ならびに適切であれば範囲内の数値の部分整数を具体的に開示したものと考えるべきである。例えば、1〜6などの範囲に関する記述は、1〜3、1〜4、1〜5、2〜4、2〜6、3〜6などの部分範囲、ならびにその範囲内の個々の数、例えば1、2、2.7、3、4、5、5.3および6を具体的に開示したものと考えるべきである。これは範囲の幅に関係なく当てはまる。 In all places in this specification that indicate values and ranges, the description in the form of ranges is merely for convenience and brevity and should not be construed as a rigid limitation on the scope of the invention. You should understand that. Accordingly, all values and ranges encompassed by these values and ranges are intended to be included within the scope of the present invention. In addition, all values within these ranges, and the upper or lower limits of the range of values are also contemplated by this application. A range description should be considered to have specifically disclosed all the possible subranges, as well as individual numerical values within that range, and, where appropriate, subintegers of the numerical values within the range. For example, a description relating to a range such as 1 to 6 includes subranges such as 1-3, 1-4, 1-5, 2-4, 2-6, 3-6, as well as individual numbers within the range, for example 1, 2, 2.7, 3, 4, 5, 5.3 and 6 should be considered as specifically disclosed. This is true regardless of the range width.
以下の実施例は、本発明の態様をさらに示す。しかし、それらは、本明細書に記載の本発明に関する教示または開示を限定するものでは決してない。 The following examples further illustrate aspects of the present invention. However, they are in no way intended to limit the teaching or disclosure relating to the invention described herein.
ここで、以下の実施例を参照して本発明を説明する。これらの実施例は例示目的でのみ示されるものであり、本発明はこれらの実施例に限定されず、むしろ、本明細書に示される教示の結果として明白なすべての変形を包含する。 The invention will now be described with reference to the following examples. These examples are given for illustrative purposes only, and the invention is not limited to these examples, but rather encompasses all variations apparent as a result of the teachings presented herein.
材料
別途記述がない限り、すべての残りの出発原料は商業的供給業者から入手し、精製せずに使用した。別途記述がない限り、最終生成物は塩酸付加塩として典型的に単離される。
Materials Unless otherwise stated, all remaining starting materials were obtained from commercial suppliers and used without purification. Unless otherwise stated, the final product is typically isolated as a hydrochloric acid addition salt.
実施例1:
N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XX)
Example 1:
N- (4,6-Bis-methylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XX)
2-クロロ-N-(4,6-ビス-メチルアミノ)-[1,3,5]トリアジン(XIX)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(5.0g、27mmol)をアセトン(35mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。N-メチルアミン塩酸塩(3.66g、54mmol)の水(20mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(54mL、108mmol)を、温度を0℃〜5℃に保持するように滴下した。混合物を周囲温度で30分間、50℃でさらに60分間攪拌した。析出物を濾過し、水(3x25mL)で洗浄した。無水塩化カルシウムで高真空乾燥後、2-クロロ-N-(4,6-ビス-メチルアミノ)-[1,3,5]トリアジン(XIX)を白色粉末(4.2g、収率89%)として単離した。LCMS (ESI) m/z = 174 (M+H)+。
2-Chloro-N- (4,6-bis-methylamino)-[1,3,5] triazine (XIX)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (5.0 g, 27 mmol) was dissolved in acetone (35 mL) and poured into ice water (50 mL) to form a very fine suspension. . A solution of N-methylamine hydrochloride (3.66 g, 54 mmol) in water (20 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added dropwise 2N NaOH (54 mL, 108 mmol) so as to keep the temperature between 0 ° C and 5 ° C. The mixture was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. The precipitate was filtered and washed with water (3 × 25 mL). After high vacuum drying with anhydrous calcium chloride, 2-chloro-N- (4,6-bis-methylamino)-[1,3,5] triazine (XIX) as a white powder (4.2 g, 89% yield) Isolated. LCMS (ESI) m / z = 174 (M + H) + .
N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XX)
2-クロロ-N-(4,6-ビス-メチルアミノ)-[1,3,5]トリアジン(XIX)(1.74g、10mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(3.88g、40mmol)およびDIPEA(7.74g、60mmol)のEtOH(200mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(150mL)に溶解させ、水(100mL)およびブライン溶液(100mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を減圧除去した。粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1→5/3)で精製して所望の生成物899mg(23%)を得た。単離した遊離アミン(380mg、2mmol)をH2O(10mL)中に入れ、0.5M HCl水溶液(6mL)を加えた。得られた溶液を凍結乾燥に供して所望の生成物N-(4,6-ビス-メチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XX)を白色固体(468mg)として得た。
N- (4,6-Bis-methylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XX)
2-Chloro-N- (4,6-bis-methylamino)-[1,3,5] triazine (XIX) (1.74 g, 10 mmol), N, O-dimethylhydroxylamine hydrochloride (3.88 g, 40 mmol) And a mixture of DIPEA (7.74 g, 60 mmol) in EtOH (200 mL) was heated at 100 ° C. for 16 h before the solvent was removed in vacuo. The residue was dissolved in EtOAc (150 mL), washed with water (100 mL) and brine solution (100 mL), then dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1 → 5/3) to give 899 mg (23%) of the desired product. The isolated free amine (380 mg, 2 mmol) was taken up in H 2 O (10 mL) and 0.5 M aqueous HCl (6 mL) was added. The resulting solution is lyophilized to give the desired product N- (4,6-bis-methylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XX) was obtained as a white solid (468 mg).
実施例2:
N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXII)
Example 2:
N- (4,6-Bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXII)
2-クロロ-N-(4,6-ビス-エチルアミノ)-[1,3,5]トリアジン(XXI)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(5.0g、27mmol)をアセトン(35mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。エチルアミン(2.43g、54mmol)の水(20mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(27mL、54mmol)を、温度を0℃〜5℃に保持するように滴下した。混合物を周囲温度で30分間、50℃でさらに60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。無水塩化カルシウムで高真空乾燥後、2-クロロ-N-(4,6-ビス-エチルアミノ)-[1,3,5]トリアジン(XXI)を白色粉末(5.0g、収率92%)として単離した。LCMS (ESI) m/z = 202 (M+H)+。
2-Chloro-N- (4,6-bis-ethylamino)-[1,3,5] triazine (XXI)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (5.0 g, 27 mmol) was dissolved in acetone (35 mL) and poured into ice water (50 mL) to form a very fine suspension. . A solution of ethylamine (2.43 g, 54 mmol) in water (20 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added 2N NaOH (27 mL, 54 mmol) dropwise so as to keep the temperature between 0 ° C and 5 ° C. The mixture was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). After drying in anhydrous calcium chloride under high vacuum, 2-chloro-N- (4,6-bis-ethylamino)-[1,3,5] triazine (XXI) as a white powder (5.0 g, yield 92%) Isolated. LCMS (ESI) m / z = 202 (M + H) + .
N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXII)
2-クロロ-N-(4,6-ビス-エチルアミノ)-[1,3,5]トリアジン(XXI)(4.03g、20mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(9.7g、100mmol)およびDIPEA(1.806g、140mmol)のEtOH(200mL)中混合物を100℃で16時間加熱した。この後、溶媒を減圧除去した。残渣をEtOAc(400mL)に溶解させ、水(100mL)およびブライン溶液(100mL)で洗浄した後、Na2SO4で乾燥させ、濃縮した。粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1→5/2)で精製して所望の生成物811mg(18%)を得た。単離した遊離アミン(811mg、3.58mmol)をH2O(10mL)に溶解させ、H2O中0.5M HCl溶液(7.2mL)を加えた。得られた溶液を凍結乾燥させて所望の生成物N-(4,6-ビス-エチルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXII)を白色固体(938mg)として得た。
N- (4,6-Bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXII)
2-Chloro-N- (4,6-bis-ethylamino)-[1,3,5] triazine (XXI) (4.03 g, 20 mmol), N, O-dimethylhydroxylamine hydrochloride (9.7 g, 100 mmol) And a mixture of DIPEA (1.806 g, 140 mmol) in EtOH (200 mL) was heated at 100 ° C. for 16 h. Thereafter, the solvent was removed under reduced pressure. The residue was dissolved in EtOAc (400 mL) and washed with water (100 mL) and brine solution (100 mL), then dried over Na 2 SO 4 and concentrated. The crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1 → 5/2) to give 811 mg (18%) of the desired product. The isolated free amine (811 mg, 3.58 mmol) was dissolved in H 2 O (10 mL) and 0.5 M HCl solution in H 2 O (7.2 mL) was added. The resulting solution was lyophilized to give the desired product N- (4,6-bis-ethylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride ( XXII) was obtained as a white solid (938 mg).
実施例3:
N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXV)
Example 3:
N- (4-Cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXV)
2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(20g、109mmol)をアセトン(100mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。プロパン-1-アミン(7.1g、120mmol)の水(20mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(60mL、120mmol)を、温度を-5℃〜0℃に保持するように滴下した。混合物を0℃で60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。塩化カルシウムで高真空乾燥後、2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)を白色粉末(18g、収率80%)として単離した。LCMS (ESI) m/z = 208 (M+H)+。
2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (20 g, 109 mmol) was dissolved in acetone (100 mL) and poured into ice water (50 mL) to form a very fine suspension. A solution of propan-1-amine (7.1 g, 120 mmol) in water (20 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added 2N NaOH (60 mL, 120 mmol) dropwise so as to keep the temperature between -5 ° C and 0 ° C. The mixture was stirred at 0 ° C. for 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). 2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII) isolated as a white powder (18 g, 80% yield) after high vacuum drying with calcium chloride did. LCMS (ESI) m / z = 208 (M + H) + .
2-クロロ-N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン(XXIV)
2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)(18g、87mmol)をアセトン(100mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。シクロプロピルメタンアミン(6.7g、95mmol)のアセトン(30mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(44mL、88mmol)を、温度を0℃〜5℃に保持するように滴下した。混合物を周囲温度で30分間、50℃でさらに60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。無水塩化カルシウムで高真空乾燥後、2-クロロ-N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン(XXIV)を白色粉末(12g、収率57%)として単離した。LCMS (ESI) m/z = 242 (M+H)+。
2-Chloro-N- (4-cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazine (XXIV)
2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII) (18 g, 87 mmol) was dissolved in acetone (100 mL) and poured into ice water (50 mL) to A fine suspension was formed. A solution of cyclopropylmethanamine (6.7 g, 95 mmol) in acetone (30 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added 2N NaOH (44 mL, 88 mmol) dropwise so as to keep the temperature between 0 ° C and 5 ° C. The mixture was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). After high vacuum drying with anhydrous calcium chloride, 2-chloro-N- (4-cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazine (XXIV) was added to a white powder (12 g, Isolated as 57% yield). LCMS (ESI) m / z = 242 (M + H) + .
N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXV)
2-クロロ-N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン(XXIV)(1.5g、6.2mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(3.0g、31.0mmol)およびDIPEA(6.5g、49.6mmol)のEtOH(50mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(400mL)に溶解させ、水(100mL)、次にブライン溶液(100mL)で洗浄し、Na2SO4で乾燥させた。粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1→5/2)で精製した。溶媒を減圧除去して所望の生成物500mg(26%)を得た。単離した遊離アミン(500mg、1.88mmol)をH2O(10mL)に溶解させ、0.5M HCl水溶液(4.0mL)を加えた。得られた溶液を凍結乾燥に供して所望の生成物N-(4-シクロプロピルメチル)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXV、520mg)を褐色油状物として得た。
N- (4-Cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXV)
2-Chloro-N- (4-cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazine (XXIV) (1.5 g, 6.2 mmol), N, O-dimethylhydroxylamine After a mixture of hydrochloride (3.0 g, 31.0 mmol) and DIPEA (6.5 g, 49.6 mmol) in EtOH (50 mL) was heated at 100 ° C. for 16 h, the solvent was removed in vacuo. The residue was dissolved in EtOAc (400 mL), washed with water (100 mL) then brine solution (100 mL) and dried over Na 2 SO 4 . The crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1 → 5/2). The solvent was removed in vacuo to give 500 mg (26%) of the desired product. The isolated free amine (500 mg, 1.88 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (4.0 mL) was added. The resulting solution is lyophilized to give the desired product N- (4-cyclopropylmethyl) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXV, 520 mg) was obtained as a brown oil.
実施例4:
N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXVII)
Example 4:
N- (4-Ethylamino) -N- (6-n-propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXVII)
2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(20g、109mmol)をアセトン(100mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。プロパン-1-アミン(7.1g、120mmol)の水(20mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(60mL、120mmol)を、温度を-5℃〜0℃に保持するように滴下した。次に混合物を0℃で60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。無水塩化カルシウムで高真空乾燥後、2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)を白色粉末(18g、収率80%)として単離した。LCMS (ESI) m/z = 208 (M+H)+。
2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (20 g, 109 mmol) was dissolved in acetone (100 mL) and poured into ice water (50 mL) to form a very fine suspension. A solution of propan-1-amine (7.1 g, 120 mmol) in water (20 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added 2N NaOH (60 mL, 120 mmol) dropwise so as to keep the temperature between -5 ° C and 0 ° C. The mixture was then stirred at 0 ° C. for 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). After drying in anhydrous calcium chloride under high vacuum, 2,4-dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII) was obtained as a white powder (18 g, 80% yield). Released. LCMS (ESI) m / z = 208 (M + H) + .
2-クロロ-N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXVI)
2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)(4.0g、19.5mmol)をアセトン(40mL)に溶解させ、氷水(40mL)に注いで非常に微細な懸濁液を形成した。エタンアミン塩酸塩(1.91g、23.4mmol)の水(10mL)溶液を加え、温度を約0℃に維持した。NaOH(2.34g、58.5mmol)の水(10mL)溶液を、温度を0℃〜5℃に保持するように滴下した。次に混合物を室温で40分間攪拌し、濃縮した。析出物を濾去し、水(3x25mL)で洗浄した。塩化カルシウムで高真空乾燥後、所望の生成物2-クロロ-N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXVI)を白色粉末(3.89g、収率92%)として単離した。LCMS (ESI) m/z = 216 (M+H)+。
2-Chloro-N- (4-ethylamino) -N- (6-n-propylamino)-[1,3,5] triazine (XXVI)
2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII) (4.0 g, 19.5 mmol) is dissolved in acetone (40 mL) and poured into ice water (40 mL). A very fine suspension was formed. A solution of ethanamine hydrochloride (1.91 g, 23.4 mmol) in water (10 mL) was added and the temperature was maintained at about 0 ° C. A solution of NaOH (2.34 g, 58.5 mmol) in water (10 mL) was added dropwise to keep the temperature between 0 ° C and 5 ° C. The mixture was then stirred at room temperature for 40 minutes and concentrated. The precipitate was filtered off and washed with water (3 × 25 mL). After high vacuum drying with calcium chloride, the desired product 2-chloro-N- (4-ethylamino) -N- (6-n-propylamino)-[1,3,5] triazine (XXVI) is white powder Isolated as (3.89 g, 92% yield). LCMS (ESI) m / z = 216 (M + H) + .
N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXVII)
2-クロロ-N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXVI)(2g、9.3mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(4.5g、46.5mmol)およびDIPEA(8.4g、65.1mmol)のEtOH(20mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(150mL)に溶解させ、水(100mL)で洗浄し、ブライン溶液(100mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=10/1→2/1)で精製して所望の生成物(820mg、37%)を得た。単離した遊離アミン(820mg、3.42mmol)をH2O(10mL)に溶解させ、0.5M HCl水溶液(11mL)を加えた。得られた溶液を凍結乾燥に供して所望の生成物N-(4-エチルアミノ)-N-(6-n-プロピルアミノ)[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXVII)を無色油状物(944mg)として得た。
N- (4-Ethylamino) -N- (6-n-propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXVII)
2-Chloro-N- (4-ethylamino) -N- (6-n-propylamino)-[1,3,5] triazine (XXVI) (2 g, 9.3 mmol), N, O-dimethylhydroxylamine hydrochloride After a mixture of salt (4.5 g, 46.5 mmol) and DIPEA (8.4 g, 65.1 mmol) in EtOH (20 mL) was heated at 100 ° C. for 16 h, the solvent was removed in vacuo. The residue was dissolved in EtOAc (150 mL), washed with water (100 mL), washed with brine solution (100 mL) and then dried over Na 2 SO 4 . The solvent was removed under reduced pressure and the residue was purified by flash column chromatography (petroleum ether / ethyl acetate = 10/1 → 2/1) to give the desired product (820 mg, 37%). The isolated free amine (820 mg, 3.42 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (11 mL) was added. The resulting solution is lyophilized to give the desired product N- (4-ethylamino) -N- (6-n-propylamino) [1,3,5] triazin-2-yl) -N, O -Dimethyl-hydroxylamine hydrochloride (XXVII) was obtained as a colorless oil (944 mg).
実施例5:
N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXIX)
Example 5:
N- (bis-4,6- (2-methylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXIX)
2-クロロ-N-(4,6-ビス-(2-メチルプロピルアミノ)-[1,3,5]トリアジン(XXVIII)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(5.0g、27mmol)をアセトン(35mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。2-メチルプロパン-1-アミン(4.0g、54mmol)のアセトン(20mL)溶液を加え、温度を約0℃に維持した。この混合物に2N NaOH(27mL、54mmol)を、温度を0℃〜5℃に保持するように滴下した。混合物を周囲温度で30分間、50℃でさらに60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。無水塩化カルシウムで高真空乾燥後、2-クロロ-N-(4,6-ビス-(2-メチルプロピルアミノ)-[1,3,5]トリアジン(XXVIII)を白色粉末(6.0g、収率87%)として単離した。LCMS (ESI) m/z = 258 (M+H)+。
2-Chloro-N- (4,6-bis- (2-methylpropylamino)-[1,3,5] triazine (XXVIII)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (5.0 g, 27 mmol) was dissolved in acetone (35 mL) and poured into ice water (50 mL) to form a very fine suspension. . A solution of 2-methylpropan-1-amine (4.0 g, 54 mmol) in acetone (20 mL) was added and the temperature was maintained at about 0 ° C. To this mixture was added 2N NaOH (27 mL, 54 mmol) dropwise so as to keep the temperature between 0 ° C and 5 ° C. The mixture was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). After drying in anhydrous calcium chloride under high vacuum, 2-chloro-N- (4,6-bis- (2-methylpropylamino)-[1,3,5] triazine (XXVIII) was white powder (6.0 g, yield) 87%) LCMS (ESI) m / z = 258 (M + H) + .
N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXIX)
2-クロロ-N-(4,6-ビス-(2-メチルプロピルアミノ)-[1,3,5]トリアジン(XXVIII)(2.57g、10mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(1.94g、20mmol)およびDIPEA(5.16g、40mmol)のEtOH(100mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(200mL)に溶解させ、水(2x100mL)で洗浄し、ブライン溶液(100mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を減圧除去した。残渣をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1)で精製して所望の生成物(920mg、33%)を得た。単離した遊離アミン(920mg、3.3mmol)をH2O(10mL)に溶解させ、0.5M HCl水溶液(6.6mL)を加えた。得られた溶液を凍結乾燥に供して所望の生成物N-(ビス-4,6-(2-メチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXIX)を白色固体(1.0g)として得た。
N- (bis-4,6- (2-methylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXIX)
2-Chloro-N- (4,6-bis- (2-methylpropylamino)-[1,3,5] triazine (XXVIII) (2.57 g, 10 mmol), N, O-dimethylhydroxylamine hydrochloride (1.94 g, 20 mmol) and DIPEA (5.16 g, 40 mmol) in EtOH (100 mL) was heated at 100 ° C. for 16 h, and then the solvent was removed in vacuo.The residue was dissolved in EtOAc (200 mL) and washed with water (2 × 100 mL). Washed and washed with brine solution (100 mL), then dried over Na 2 SO 4. Solvent was removed under reduced pressure and the residue was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1) The isolated free amine (920 mg, 3.3 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (6.6 mL) was added. The solution is subjected to lyophilization to the desired product N- (bis-4,6- (2-methylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine The hydrochloride salt (XXIX) was obtained as a white solid (1.0 g).
実施例6:
N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXXI)
Example 6:
N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXXI)
N-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(30g、163mmol)をアセトン(300mL)に溶解させ、N,O-ジメチルヒドロキシルアミン塩酸塩(15.8g、163mmol)およびDIPEA(42g、326mmol)を加えた後、混合物を0℃で1時間攪拌した。溶液を濃縮し、残渣をEtOAc(750mL)で処理し、水(100mL)で洗浄し、有機層をNa2SO4で乾燥させた。揮発物を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=50/1→10/1)で精製して所望の生成物N-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)を白色の固体(25g、収率73%)として得た。LCMS (ESI) m/z = 210 (M+H)+。
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (30 g, 163 mmol) was dissolved in acetone (300 mL) and N, O-dimethylhydroxylamine hydrochloride (15.8 g, 163 mmol) and DIPEA ( 42 g, 326 mmol) was added and the mixture was stirred at 0 ° C. for 1 h. The solution was concentrated, the residue was treated with EtOAc (750 mL), washed with water (100 mL), and the organic layer was dried over Na 2 SO 4 . Volatiles were removed under reduced pressure and the residue was purified by flash column chromatography (petroleum ether / ethyl acetate = 50/1 → 10/1) to give the desired product N- (4,6-dichloro [1,3,5 ] Triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) was obtained as a white solid (25 g, 73% yield). LCMS (ESI) m / z = 210 (M + H) + .
N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXI)
N-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(1g、4.78mmol)、2,2-ジメチルプロパン-1-アミン(832.5mg、9.57mmol)およびDIPEA(1.85g、14.34mmol)のEtOH(20mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(40mL)に溶解させ、水(20mL)およびブライン溶液(20mL)で洗浄し、Na2SO4で乾燥させた後、濃縮した。粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=20/1→5/1)で精製して所望の生成物(1.4g、95%)を得た。単離した遊離アミン(1.4g、4.52mmol)をH2O(10mL)に溶解させ、H2O中0.5M HCl溶液(14.5mL)を加え、得られた溶液を凍結乾燥に供して所望の生成物N-(ビス-4,6-(2,2-ジメチルプロピルアミノ))[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩を白色固体(1.67g)として得た。
N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXI)
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (1 g, 4.78 mmol), 2,2-dimethylpropan-1-amine After a mixture of (832.5 mg, 9.57 mmol) and DIPEA (1.85 g, 14.34 mmol) in EtOH (20 mL) was heated at 100 ° C. for 16 h, the solvent was removed in vacuo. The residue was dissolved in EtOAc (40 mL), washed with water (20 mL) and brine solution (20 mL), dried over Na 2 SO 4 and concentrated. The crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 20/1 → 5/1) to give the desired product (1.4 g, 95%). The isolated free amine (1.4 g, 4.52 mmol) is dissolved in H 2 O (10 mL), 0.5 M HCl solution in H 2 O (14.5 mL) is added and the resulting solution is subjected to lyophilization to the desired The product N- (bis-4,6- (2,2-dimethylpropylamino)) [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride was converted to a white solid (1.67 g).
実施例7:
4,6-ビス-N-シクロプロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXXIII)
Example 7:
4,6-Bis-N-cyclopropylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXXIII)
2-クロロ-N-(4,6-ビス-(シクロプロピルアミノ)-[1,3,5]トリアジン(XXXII)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(40g、217mmol)をアセトン200mLに溶解させ、氷水(250mL)に注いで非常に微細な懸濁液を形成した。シクロプロパンアミン(24.8g、435mmol)の溶液を0℃で攪拌しながら加えた。この混合物に2N NaOH(218mL、435mmol)を、温度を0℃〜5℃に保持する速度で滴下した。得られた混合物を周囲温度で30分間、次に50℃でさらに60分間攪拌した。析出物を濾去し、水(3x100mL)で洗浄した。塩化カルシウムで高真空乾燥後、クロロ-N-(4,6-ビス-(シクロプロピルアミノ)-[1,3,5]トリアジン(XXXII)を白色粉末(46g、収率93%)として単離した。LCMS (ESI) m/z = 226 (M+H)+。
2-Chloro-N- (4,6-bis- (cyclopropylamino)-[1,3,5] triazine (XXXII)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (40 g, 217 mmol) was dissolved in 200 mL of acetone and poured into ice water (250 mL) to form a very fine suspension. A solution of cyclopropanamine (24.8 g, 435 mmol) was added at 0 ° C. with stirring. To this mixture was added 2N NaOH (218 mL, 435 mmol) dropwise at a rate to keep the temperature between 0 ° C and 5 ° C. The resulting mixture was stirred at ambient temperature for 30 minutes and then at 50 ° C. for an additional 60 minutes. The precipitate was filtered off and washed with water (3 × 100 mL). Isolation of chloro-N- (4,6-bis- (cyclopropylamino)-[1,3,5] triazine (XXXII) as white powder (46 g, 93% yield) after high vacuum drying with calcium chloride LCMS (ESI) m / z = 226 (M + H) + .
4,6-ビス-N-シクロプロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXIII)
クロロ-N-(4,6-ビス-(シクロプロピルアミノ)-[1,3,5]トリアジン(XXXII)(2.25g、10mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(1.94g、20mmol)およびDIPEA(5.16g、40mmol)のEtOH(100mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(200mL)に溶解させ、水(2x100mL)およびブライン(100mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を減圧除去した。残渣をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=3/1)で精製して所望の生成物1.0g(40%)を得た。単離した遊離アミン(1.0g、4.0mmol)をH2O(10mL)および0.5M HCl水溶液(8mL)に溶解させた後、溶液を凍結乾燥させてN-(4,6-ビス-シクロプロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(XXXIII)を白色固体(1.05g)として得た。
4,6-Bis-N-cyclopropylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXIII)
Chloro-N- (4,6-bis- (cyclopropylamino)-[1,3,5] triazine (XXXII) (2.25 g, 10 mmol), N, O-dimethylhydroxylamine hydrochloride (1.94 g, 20 mmol) And a mixture of DIPEA (5.16 g, 40 mmol) in EtOH (100 mL) was heated at 100 ° C. for 16 h, then the solvent was removed under reduced pressure, the residue was dissolved in EtOAc (200 mL), water (2 × 100 mL) and brine (100 mL) And then dried over Na 2 SO 4. The solvent was removed under reduced pressure and the residue was purified by flash column chromatography (petroleum ether / ethyl acetate = 3/1) to give 1.0 g (40% of the desired product). The isolated free amine (1.0 g, 4.0 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (8 mL), and then the solution was lyophilized to give N- (4,6 -Bis-cyclopropylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (XXXIII) was obtained as a white solid (1.05 g).
実施例8A:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)
実施例9A:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)
Example 8A:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV)
Example 9A:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(15.00g、81.34mmol)およびn-プロピルアミン(13.4mL、162.68mmol)のアセトン(300mL)および水(15mL)中懸濁液に2M NaOH溶液(82mL、162.68mmol)を0℃で滴下した。反応混合物を50℃で3時間加熱した後、冷却した。水(100mL)を反応混合物に加え、得られた析出物を濾過し、水、エチルエーテルで洗浄し、乾燥させて2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(15.88g、収率85%)を得た。
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV)
Suspension of 2,4,6-trichloro-1,3,5-triazine (XVIII) (15.00 g, 81.34 mmol) and n-propylamine (13.4 mL, 162.68 mmol) in acetone (300 mL) and water (15 mL) To the solution was added 2M NaOH solution (82 mL, 162.68 mmol) dropwise at 0 ° C. The reaction mixture was heated at 50 ° C. for 3 hours and then cooled. Water (100 mL) was added to the reaction mixture and the resulting precipitate was filtered, washed with water, ethyl ether and dried to give 2-chloro-N- (4,6-bis- (n-propylamino)- [1,3,5] triazine (XXXIV) (15.88 g, 85% yield) was obtained.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(10.00g、43.53mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(8.49g、87.06mmol)およびNaOH(3.13g、78.35mmol)の1,4-ジオキサン(120mL)および水(30mL)中混合物を60℃で6時間加熱した後、揮発物を減圧除去した。飽和NaHCO3溶液(500mL)を残渣に加え、混合物をEtOAc(3x200mL)で抽出した。一緒にした有機抽出物を水(300mL)、次にブライン溶液(300mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、得られた残渣をシリカゲルを通じて、溶離液CH2Cl2/EtOH(9/1 v/v)を使用して濾過して、N-(4,6-ビス-n-プロピルアミノ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)(9.96g、収率90%)を得た。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) (10.00 g, 43.53 mmol), N, O-dimethylhydroxylamine hydrochloride (8.49 g, 87.06mmol) and NaOH (3.13 g, was heated for 6 hours at 1,4-dioxane (120 mL) and water (30 mL) in a mixture of 78.35mmol) 60 ℃, volatiles were removed under reduced pressure. saturated NaHCO 3 Solution (500 mL) was added to the residue and the mixture was extracted with EtOAc (3 × 200 mL) The combined organic extracts were washed with water (300 mL) then brine solution (300 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure and the resulting residue was filtered through silica gel using eluent CH 2 Cl 2 / EtOH (9/1 v / v) to give N- (4,6-bis-n- Propylamino [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV) (9.96 g, 90% yield) was obtained.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV、3.24g、12.74mmol)の1,4-ジオキサン(100mL)溶液に濃(95%)H2SO4(0.72mL、12.74mmol)を0℃で滴下した。混合物を室温で0.5時間攪拌し、揮発物を減圧除去した。残渣を乾燥トルエン(3x25mL)で共蒸発させた。得られた白色残渣をエタノール/エチルエーテルから結晶化してN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI、3.86g、収率86%)を白色固体として得た。
融点: 134〜135℃。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI)
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV, 3.24 g, 12.74 mmol) of 1,4- Concentrated (95%) H 2 SO 4 (0.72 mL, 12.74 mmol) was added dropwise at 0 ° C. to a dioxane (100 mL) solution. The mixture was stirred at room temperature for 0.5 hour and volatiles were removed in vacuo. The residue was coevaporated with dry toluene (3 × 25 mL). The resulting white residue was crystallized from ethanol / ethyl ether to give N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine Hydrogen sulfate (XXXVI, 3.86 g, 86% yield) was obtained as a white solid.
Melting point: 134-135 ° C.
実施例8B:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)
実施例9B:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)
Example 8B:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXV)
Example 9B:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI)
段階1: 2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)
概要: 2当量のn-プロピルアミンによるジ-クロロ置換。一態様では、2当量以上のn-プロピルアミンは出発原料のビス-プロピルアミン誘導体しか生成しなかった。反応の進行をHPLCでモニタリングしたところ、所望の中間体(2-クロロ-4,6-ビス-n-プロピルアミノ-s-トリアジン)が析出していた。インプロセスQC検査を行った。
Step 1: 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV)
Summary: Di-chloro substitution with 2 equivalents of n-propylamine. In one embodiment, 2 equivalents or more of n-propylamine produced only the starting bis-propylamine derivative. When the progress of the reaction was monitored by HPLC, a desired intermediate (2-chloro-4,6-bis-n-propylamino-s-triazine) was precipitated. In-process QC inspection was performed.
メカニカルスターラー、熱電対、冷却器、添加漏斗および温度制御マントルを備えた好適なガラス反応器にアセトン8L、続いて塩化シアヌル1kg(5.42モル)を加えた。攪拌混合物を15℃に予め冷却し、添加漏斗を介してn-プロピルアミン(周囲温度で)をゆっくりと、温度を45℃未満に維持するように加えた。2M NaOH溶液を調製して、温度を45℃未満に維持する速度で混合物に加えた。混合物のpHは酸性(およびpH=4)であり、6N NaOHを加えてpHを8〜9に調整した。混合物を40〜50℃で0.5時間攪拌し、反応の完了をIPC HPLC分析でモニタリングした。塩化シアヌルの検出が2%未満である場合、反応が完了したと見なした。反応が完了するまで分析を1時間ごとに繰り返した。 To a suitable glass reactor equipped with a mechanical stirrer, thermocouple, condenser, addition funnel and temperature control mantle was added 8 L acetone followed by 1 kg (5.42 mol) cyanuric chloride. The stirred mixture was pre-cooled to 15 ° C and n-propylamine (at ambient temperature) was added slowly via an addition funnel to maintain the temperature below 45 ° C. A 2M NaOH solution was prepared and added to the mixture at a rate that maintained the temperature below 45 ° C. The pH of the mixture was acidic (and pH = 4) and the pH was adjusted to 8-9 by adding 6N NaOH. The mixture was stirred at 40-50 ° C. for 0.5 h and reaction completion was monitored by IPC HPLC analysis. The reaction was considered complete when the detection of cyanuric chloride was less than 2%. The analysis was repeated every hour until the reaction was complete.
反応が完了した後、温度を50℃未満に維持するようにWFI(滅菌水)をゆっくりと加えた。得られた懸濁液を攪拌しながら室温に終夜冷却した。固体をポリプロピレン濾布を通じて濾過し、アセトン/水(1:2)、続いてMTBE 1.5Lで洗浄した。固体をフィルター上で乾燥させ(減圧補助)、次に真空オーブン(45±5℃、>29"Hg)中に最低6時間入れたところ、0.5%未満の重量減少変化が示された。試料を分析検査(QC HPLC分析およびカールフィッシャー分析)用に収集し、2gをQA保持用に収集した。段階1において生成された生成物は白色固体であった。この粉末を乾燥パンからナイロンタイ付きで二重袋のポリバッグに移し、ファイバードラムに入れ、検疫保管用にラベル付けしてQAに供した。
After the reaction was complete, WFI (sterile water) was slowly added to maintain the temperature below 50 ° C. The resulting suspension was cooled to room temperature overnight with stirring. The solid was filtered through a polypropylene filter cloth and washed with acetone / water (1: 2) followed by 1.5 L MTBE. The solid was dried on the filter (vacuum assist) and then placed in a vacuum oven (45 ± 5 ° C.,> 29 "Hg) for a minimum of 6 hours, showing a weight loss change of less than 0.5%. Collected for analytical inspection (QC HPLC analysis and Karl Fischer analysis) and 2 g was collected for QA retention The product produced in
段階2、工程1: N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXV)
概要: 1当量のN-メトキシメチルアミンによるクロロ置換。反応の進行をHPLCでモニタリングし、所望の生成物である遊離塩基の析出を、水を加えて冷却することで達成した。インプロセスQC検査を行った。遊離塩基を結晶化によって対応する硫酸塩に変換し、最終生成物を真空オーブン乾燥に供した。インプロセスQC検査および最終生成物QC検査を行った。
Summary: Chloro substitution with 1 equivalent of N-methoxymethylamine. The progress of the reaction was monitored by HPLC, and precipitation of the desired product free base was achieved by adding water and cooling. In-process QC inspection was performed. The free base was converted to the corresponding sulfate salt by crystallization and the final product was subjected to vacuum oven drying. In-process QC inspection and final product QC inspection were performed.
メカニカルスターラー、熱電対、冷却器および加熱マントルを備えた好適な丸底フラスコにN,N-ジメチルアセトアミド(DMA)6L、続いて6-クロロ-N,N-ジプロピル-[1,3,5]-トリアジン-2,4-ジアミン(段階1生成物)1kg(4.35モル)を加えた。この攪拌混合物にK2CO3(1.2kg、6.53モル、2当量)を室温で、少量のさらなるDMAですすぎながら加えた。これにN,O-ジメチルヒドロキシルアミン塩酸塩(0.637kg、8.71モル、1.5当量)を、発泡を減少させるように(かつ温度を60℃未満に維持しながら)約5〜10分かけて少しずつ、少量のさらなるDMAを使用してすすぎながら加えた。混合物を75〜80℃に加熱し、最低0.5時間攪拌した。75〜80℃で一度、反応の完了をHPLCでモニタリングした。混合物を65℃未満に冷却し、水(12L)を加えた。得られた懸濁液を攪拌しながら室温に終夜(18時間)冷却した。得られた固体を濾過し、水1.2Lで洗浄した。フィルターケーキを1時間風乾させ、OVIアミンGC分析用試料を得た。残りの固体を最低6時間真空オーブン乾燥(45℃、>29"Hg)させた(NMT 1%重量変化)。所望の生成物(遊離塩基(XXXV))は稠密な白色固体であった。検査用IPC試料を得た。
In a suitable round bottom flask equipped with a mechanical stirrer, thermocouple, condenser and heating mantle, N, N-dimethylacetamide (DMA) 6L followed by 6-chloro-N, N-dipropyl- [1,3,5] -1 kg (4.35 mol) of triazine-2,4-diamine (
結晶性N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン遊離塩基(XXXV)
(XXXV)遊離塩基の塩化メチレン溶液を速やかに蒸発乾固させた。得られた固体を約25℃で約45分間減圧乾燥させた(XXXV遊離塩基形態A)。DSC: 約95.2℃で鋭い吸熱。XRPD: 図22。
Crystalline N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine free base (XXXV)
(XXXV) The free base in methylene chloride was quickly evaporated to dryness. The resulting solid was dried under reduced pressure at about 25 ° C. for about 45 minutes (XXXV free base form A). DSC: Sharp endotherm at about 95.2 ℃. XRPD: Figure 22.
段階2、工程2: N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の塩形成および結晶化
基質遊離塩基(XXXV)2,800g(12.2モル)にメチルエチルケトン(20L)を加えた。混合物を攪拌し、40℃に加熱した後、中多孔度の焼結ガラス漏斗を通じて仕上げ濾過して72L反応器に入れることで、透明溶液および綿毛状の白色残渣(12g、遊離塩基の重量の0.43%)を得た。混合物を45℃に昇温させ、濃H2SO4(12.8モル、予備濾過重量に対して1.05当量)を添加漏斗経由で1時間かけてゆっくりと加えた。混合物を冷却しながら終夜(18時間)攪拌した(固体析出物が約36℃で形成を始めることが観察された; 最終温度 = 27℃)。
混合物を15℃にさらに冷却し、0.5時間攪拌し、濾過した。固体生成物ケーキをメチルエチルケトン(6L)で洗浄し、ブフナー漏斗上で4時間風乾させ(減圧補助)、次に真空オーブン(29''Hg超、50〜55℃)に入れ、少なくとも6時間乾燥させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)3,252g(84%)を白色固体として得た。1H NMR (400MHz, DMSO-d6) δ ppm 0.88 (五重項, 6 H), 1.41-1.63 (m, 4 H), 3.16-3.40 (m, 7 H), 3.69-3.83 (m, 3 H), 7.50-8.56 (m, 2 H)。プロセス中純度(210nmでのHPLC(AUC)) = 99.81%。濾過残渣: 1H NMR (400 MHz, メタノール-d4) 3.27-3.35 (m), 1.55-1.65 (q) 0.90-0.95 (t)。MS m/z: 212 [M+H]、N-(4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)のデータと一致(比較例1参照)。単離された表記化合物は検出可能な(CLXXVIII)を含有しなかった。 The mixture was further cooled to 15 ° C., stirred for 0.5 h and filtered. The solid product cake is washed with methyl ethyl ketone (6 L), air dried on a Buchner funnel for 4 hours (assisted vacuum), then placed in a vacuum oven (over 29 '' Hg, 50-55 ° C.) and dried for at least 6 hours. N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) 3,252 g (84%) Obtained as a white solid. 1 H NMR (400MHz, DMSO-d 6 ) δ ppm 0.88 (pentet, 6 H), 1.41-1.63 (m, 4 H), 3.16-3.40 (m, 7 H), 3.69-3.83 (m, 3 H), 7.50-8.56 (m, 2 H). In-process purity (HPLC (AUC) at 210 nm) = 99.81%. Filtration residue: 1 H NMR (400 MHz, methanol-d 4 ) 3.27-3.35 (m), 1.55-1.65 (q) 0.90-0.95 (t). MS m / z: 212 [M + H], consistent with the data of N- (4,6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII) (see Comparative Example 1). The isolated title compound contained no detectable (CLXXVIII).
段階1:
IPC検査1: 添加中の温度チャート記録 −
工程において指定される温度制御を維持
IPC検査2: IPC HPLC分析−
塩化シアヌルの検出が2%未満である場合に反応完了とする。
反応が完了するまで分析を1時間ごとに繰り返す。
3回目の試料採取後に反応が完了しない場合、監督者に連絡する。
段階1生成物QC検査:
QC HPLC分析 −
塩化シアヌルおよび2-クロロ-4,6-ビス-n-プロピルアミノ-s-トリアジンのアッセイの記録結果
カールフィッシャー −
記録結果
Stage 1:
IPC inspection 1: Temperature chart recording during addition −
Maintains temperature control specified in the process
IPC test 2: IPC HPLC analysis
The reaction is complete when the detection of cyanuric chloride is less than 2%.
The analysis is repeated every hour until the reaction is complete.
If the reaction is not complete after the third sampling, contact your supervisor.
QC HPLC analysis −
Recorded results of cyanuric chloride and 2-chloro-4,6-bis-n-propylamino-s-triazine assay Karl Fischer −
Record result
段階2:
工程1: 反応:
IPC検査1: 添加中の温度チャート記録 −
工程において指定される温度制御を維持
IPC検査2: IPC HPLC分析 −
2-クロロ-4,6-ビス-n-プロピルアミノ-s-トリアジンの検出が2%未満である場合に反応完了とする。
反応が完了するまで分析を1時間ごとに繰り返す。
3回目の試料採取後に反応が完了しない場合、監督者に連絡する。
IPC検査3: 残留アミン分析(GCによる) −
n-プロピルアミンおよびN,O-ジメチルヒドロキシルアミンレベルNMT 0.1%
IPC検査4: 乾燥中の重量変化 −
NMT 1%
IPC検査5: IPC HPLC分析 −
HPLC(AUC)による純度の記録結果
工程2: 塩形成および結晶化
IPC検査1: 濃硫酸添加中の温度チャート記録 −
工程において指定される温度制御を維持
IPC検査2: GCによるMEKおよびDMAcのOVI −
NMT各800ppm
IPC検査4: 乾燥中の重量変化 −
NMT 1%
Stage 2:
Step 1: reaction:
IPC inspection 1: Temperature chart recording during addition −
Maintains temperature control specified in the process
IPC inspection 2: IPC HPLC analysis −
The reaction is complete when the detection of 2-chloro-4,6-bis-n-propylamino-s-triazine is less than 2%.
The analysis is repeated every hour until the reaction is complete.
If the reaction is not complete after the third sampling, contact your supervisor.
IPC inspection 3: Residual amine analysis (by GC) −
n-Propylamine and N, O-dimethylhydroxylamine levels NMT 0.1%
IPC inspection 4: Weight change during drying −
IPC test 5: IPC HPLC analysis −
Purity recording results by HPLC (AUC) Step 2: Salt formation and crystallization
IPC inspection 1: Temperature chart recording during addition of concentrated sulfuric acid −
Maintains temperature control specified in the process
IPC inspection 2: GC MEK and DMAc OVI −
NMT 800ppm each
IPC inspection 4: Weight change during drying −
プロトン核磁気共鳴(NMR)分光法
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の1H NMRデータを400MHzでDMSO-d6中溶液として得た。これを図10に提示する。シフト帰属を表1に提示する。
Proton nuclear magnetic resonance (NMR) spectroscopy
1 H NMR data of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) at 400 MHz Obtained as a solution in DMSO-d 6 . This is presented in FIG. Shift attribution is presented in Table 1.
(表1)DMSO-d6中(XXXVI)の25℃での1H化学シフト帰属
(Table 1) 1 H chemical shift assignment of (XXXVI) in DMSO-d 6 at 25 ° C
炭素-13 NMR分光法
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の13C NMRデータを100MHzでDMSO-d6中溶液として得た。これを図11に提示する。シフト帰属を表2に提示する。
Carbon-13 NMR spectroscopy
13 C NMR data of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) at 100 MHz Obtained as a solution in DMSO-d 6 . This is presented in FIG. Shift attribution is presented in Table 2.
(表2)DMSO-d6中(XXXVI)の25℃での13C化学シフト帰属
(Table 2) Assignment of 13 C chemical shift at 25 ° C in (XXXVI) in DMSO-d 6
フーリエ変換赤外(FTIR)分光法
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)のFTIRスペクトルを表3および図12に提示する。
Fourier transform infrared (FTIR) spectroscopy
The FTIR spectrum of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogen sulfate (XXXVI) is shown in Table 3 and Fig. Presented in 12.
(表3)(XXXVI)のFTIRスペクトル
(Table 3) FTIR spectrum of (XXXVI)
高分解能および低分解能質量分析
液体クロマトグラフィー質量分析(LCMS)から得られた質量は254amuであった。これはN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の理論的質量と一致している。直接注射を通じて得られた高分解能結果を表4に提示する。
The mass obtained from high resolution and low resolution mass spectrometry liquid chromatography mass spectrometry (LCMS) was 254 amu. This is consistent with the theoretical mass of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI). I'm doing it. The high resolution results obtained through direct injection are presented in Table 4.
(表4)(XXXVI)の質量分析結果
(Table 4) Mass spectrometry result of (XXXVI)
クロマトグラフィー純度
RSのHPLCクロマトグラフィー純度は100.0面積%であると決定され、関連する物質は検出されなかった。
Chromatographic purity
The HPLC chromatographic purity of RS was determined to be 100.0 area% and no related material was detected.
含水量の決定
含水量はカールフィッシャー滴定によって0.04%であると決定された。
Determination of water content The water content was determined to be 0.04% by Karl Fischer titration.
元素分析
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の元素分析を得た。表5に提示する。
Elemental analysis
Elemental analysis of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was obtained. Presented in Table 5.
(表5)(XXXVI)の元素分析結果
(Table 5) Elemental analysis results of (XXXVI)
示差走査熱量測定(DSC)による熱分析
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)を、cUSP<891>/EP 2.2.34に従って毎分10℃の速度で25℃から250℃まで分析したところ、90.19℃、126.38℃および138.30℃において吸熱を示すことがわかった(図13)。
Thermal analysis by differential scanning calorimetry (DSC)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was added to cUSP <891> / EP Analysis from 25 ° C to 250 ° C at a rate of 10 ° C per minute according to 2.2.34 showed endotherms at 90.19 ° C, 126.38 ° C and 138.30 ° C (Figure 13).
X線粉末回折
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)のXRPD回折パターンを得たところ、形態Aと一致している。図14に提示する。
X-ray powder diffraction
XRPD diffraction pattern of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogen sulfate (XXXVI) was obtained. , Consistent with form A. Presented in FIG.
対イオン含有量
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は、27.13%の硫酸イオン含有量を有することが滴定でわかった。
Counter ion content
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogen sulfate (XXXVI) contains 27.13% sulfate ions It was found by titration to have a quantity.
水溶液のpH
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の1%水溶液はpH 1.89を生じさせた。
PH of aqueous solution
A 1% aqueous solution of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) has a pH of 1.89. Was generated.
物理的記述
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は白色結晶性固体であると決定された。
Physical description
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) is a white crystalline solid It has been determined.
実施例10: N-(4-(メトキシ(メチル)アミノ)-6-(プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド(XL)
Example 10: N- (4- (methoxy (methyl) amino) -6- (propylamino) -1,3,5-triazin-2-yl) propionamide (XL)
6-アミノ-2,4-ジクロロ-[1,3,5]トリアジン(XXXVII)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(10.0g、55mmol)をアセトン(80mL)に溶解させ、氷水(80mL)に注いで非常に微細な懸濁液を形成した。この混合物に1N水酸化アンモニウム溶液(108mL、109.4mmol)を0℃で加えた。反応液を周囲温度で30分間、25℃でさらに60分間攪拌した。析出物を濾去し、水(3x25mL)で洗浄した。塩化カルシウムで高真空乾燥後、6-アミノ-2,4-ジクロロ-[1,3,5]トリアジン(XXXVII)を白色粉末(7.4g、収率82%)として単離した。LCMS (ESI) m/z = 165 (M+H)+。
6-Amino-2,4-dichloro- [1,3,5] triazine (XXXVII)
2,4,6-Trichloro-1,3,5-triazine (XVIII) (10.0 g, 55 mmol) was dissolved in acetone (80 mL) and poured into ice water (80 mL) to form a very fine suspension. . To this mixture was added 1N ammonium hydroxide solution (108 mL, 109.4 mmol) at 0 ° C. The reaction was stirred at ambient temperature for 30 minutes and at 25 ° C. for an additional 60 minutes. The precipitate was filtered off and washed with water (3 × 25 mL). After high vacuum drying with calcium chloride, 6-amino-2,4-dichloro- [1,3,5] triazine (XXXVII) was isolated as a white powder (7.4 g, 82% yield). LCMS (ESI) m / z = 165 (M + H) + .
6-アミノ-2-クロロ-4-n-プロピルアミノ-[1,3,5]トリアジン(XXXVIII)
6-アミノ-2,4-ジクロロ-[1,3,5]トリアジン(XXXVII)(30.0g、187mmol)をアセトン(100mL)に溶解させ、氷水(100mL)に注いで非常に微細な懸濁液を形成した。この混合物にプロパン-1-アミン(11.0g、187mmol)のアセトン(20mL)溶液を0℃で加えた。この反応液に2N NaOH(94mL、187mmol)を、温度を0℃〜5℃に保持する速度で滴下した。混合物を周囲温度で30分間、50℃でさらに60分間攪拌した。混合物を濃縮した後、析出物を濾去し、水(3x100mL)で洗浄した。塩化カルシウムで高真空乾燥後、6-アミノ-2-クロロ-4-n-プロピルアミノ-[1,3,5]トリアジン(XXXVIII)を白色粉末(35g、収率100%)として単離した。LCMS (ESI) m/z = 188 (M+H)+。
6-Amino-2-chloro-4-n-propylamino- [1,3,5] triazine (XXXVIII)
6-Amino-2,4-dichloro- [1,3,5] triazine (XXXVII) (30.0 g, 187 mmol) dissolved in acetone (100 mL) and poured into ice water (100 mL) to form a very fine suspension Formed. To this mixture was added propan-1-amine (11.0 g, 187 mmol) in acetone (20 mL) at 0 ° C. 2N NaOH (94 mL, 187 mmol) was added dropwise to the reaction at a rate that maintained the temperature between 0 ° C. and 5 ° C. The mixture was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. After concentrating the mixture, the precipitate was filtered off and washed with water (3 × 100 mL). After high vacuum drying with calcium chloride, 6-amino-2-chloro-4-n-propylamino- [1,3,5] triazine (XXXVIII) was isolated as a white powder (35 g, 100% yield). LCMS (ESI) m / z = 188 (M + H) + .
N-(6-アミノ-4-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXIX)
6-アミノ-2-クロロ-4-n-プロピルアミノ-[1,3,5]トリアジン(XXXVIII)(5g、26.65mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(13g、133.24mmol)およびDIPEA(27.5g、213.2mmol)のEtOH(100mL)中混合物を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(400mL)に溶解させ、水(200mL)、次にブライン溶液(200mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去してN-(6-アミノ-4-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXIX)を白色固体(5g、収率89%)として得た。LCMS (ESI) m/z = 213 (M+H)+。
N- (6-Amino-4-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXIX)
6-amino-2-chloro-4-n-propylamino- [1,3,5] triazine (XXXVIII) (5 g, 26.65 mmol), N, O-dimethylhydroxylamine hydrochloride (13 g, 133.24 mmol) and DIPEA After a mixture of (27.5 g, 213.2 mmol) in EtOH (100 mL) was heated at 100 ° C. for 16 h, the solvent was removed under reduced pressure. The residue was dissolved in EtOAc (400 mL), washed with water (200 mL), then brine solution (200 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure to give N- (6-amino-4-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXIX) as a white solid (5 g Yield 89%). LCMS (ESI) m / z = 213 (M + H) + .
N-(4-(メトキシ(メチル)アミノ)-6-(プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド(XL)
N-(6-アミノ-4-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXXIX)(5g、23.58mmol)をTHF(50mL)に溶解させた。塩化プロピオニル(3.25g、35.38mmol)およびDIPEA(5.47g、42.44mmol)を0℃で加えた。得られた混合物を周囲温度で10分間攪拌し、次に70℃で16時間攪拌した後、溶媒を減圧除去した。残渣をEtOAc(250mL)に溶解させ、この抽出物を水(80mL)、次にブライン溶液(80mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去し、粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1→2/1)で精製して所望の生成物930mg(15%)を得た。単離した遊離アミン(930mg、3.47mmol)をH2O(10mL)、およびH2O中0.5M HCl溶液(10.4mL)に溶解させた後、溶液を凍結乾燥させてN-(4-(メトキシ(メチル)アミノ)-6-(n-プロピルアミノ)-1,3,5-トリアジン-2-イル)プロピオンアミド(XL)を無色油状物(1.06g)として得た。
N- (4- (methoxy (methyl) amino) -6- (propylamino) -1,3,5-triazin-2-yl) propionamide (XL)
N- (6-amino-4-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXXIX) (5 g, 23.58 mmol) in THF (50 mL) Dissolved in. Propionyl chloride (3.25 g, 35.38 mmol) and DIPEA (5.47 g, 42.44 mmol) were added at 0 ° C. The resulting mixture was stirred at ambient temperature for 10 minutes and then stirred at 70 ° C. for 16 hours, after which the solvent was removed under reduced pressure. The residue was dissolved in EtOAc (250 mL) and the extract was washed with water (80 mL) then brine solution (80 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure and the crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1 → 2/1) to give 930 mg (15%) of the desired product. The isolated free amine (930 mg, 3.47 mmol) was dissolved in H 2 O (10 mL) and 0.5 M HCl solution in H 2 O (10.4 mL), then the solution was lyophilized to give N- (4- ( Methoxy (methyl) amino) -6- (n-propylamino) -1,3,5-triazin-2-yl) propionamide (XL) was obtained as a colorless oil (1.06 g).
実施例11:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン(XLI)
実施例12:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン塩酸塩(XLII)
Example 11:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine (XLI)
Example 12:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine hydrochloride (XLII)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)
2,4,6-トリクロロ-1,3,5-トリアジン(XVIII)(30.0g、162.68mmol)およびn-プロピルアミン(26.8mL、325.36mmol)のアセトン(600mL)および水(30mL)中懸濁液に2M NaOH溶液(163mL、325.36mmol)を0℃(水-氷/NaCl浴)で滴下した。氷浴を取り外し、反応混合物を50℃で3時間加熱した後、冷却した。水(200mL)を反応混合物に加え、析出物を濾過し、水(200mL)で洗浄し、P2O5によって40℃で20時間乾燥させて2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV、33.6g、収率90%)を得た。
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV)
Suspension of 2,4,6-trichloro-1,3,5-triazine (XVIII) (30.0 g, 162.68 mmol) and n-propylamine (26.8 mL, 325.36 mmol) in acetone (600 mL) and water (30 mL) To the solution was added 2M NaOH solution (163 mL, 325.36 mmol) dropwise at 0 ° C. (water-ice / NaCl bath). The ice bath was removed and the reaction mixture was heated at 50 ° C. for 3 hours and then cooled. Water (200 mL) is added to the reaction mixture, the precipitate is filtered, washed with water (200 mL), dried with P 2 O 5 at 40 ° C. for 20 hours and 2-chloro-N- (4,6-bis- (n-Propylamino)-[1,3,5] triazine (XXXIV, 33.6 g, yield 90%) was obtained.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン(XLI)
6-クロロ-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン(XXXIV)(2.30g、10.01mmol)、O-メチル-ヒドロキシルアミン塩酸塩(1.67g、20.02mmol)およびNaOH(0.72g、18.00mmol)の1,4-ジオキサン(30mL)および水(6mL)中混合物を60℃で3時間加熱した。この後、NaOH(0.72g、18.00mmol)を加え、反応混合物をさらに3時間加熱した。揮発物を減圧除去した。飽和NaHCO3溶液(100mL)を残渣に加え、混合物をEtOAc(3x25mL)で抽出した。一緒にした有機抽出物を水(50mL)、ブライン(50mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1)からCH2Cl2/EtOH(95:5)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン(XLI)2.17g(90%)を得た。ESI-MS (m/z): 241 [M+H]+
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine (XLI)
6-chloro-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine (XXXIV) (2.30 g, 10.01 mmol), O-methyl-hydroxylamine hydrochloride (1.67 g, 20.02 mmol) ) And NaOH (0.72 g, 18.00 mmol) in 1,4-dioxane (30 mL) and water (6 mL) were heated at 60 ° C. for 3 h. After this time NaOH (0.72 g, 18.00 mmol) was added and the reaction mixture was heated for an additional 3 hours. Volatiles were removed in vacuo. Saturated NaHCO 3 solution (100 mL) was added to the residue and the mixture was extracted with EtOAc (3 × 25 mL). The combined organic extracts were washed with water (50 mL), brine (50 mL) and dried over Na 2 SO 4 . The solvent was removed in vacuo and the crude product was purified by flash column chromatography using gradient elution from CH 2 Cl 2 / EtOH (99: 1) to CH 2 Cl 2 / EtOH (95: 5) to give N- 2.17 g (90%) of (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine (XLI) was obtained. ESI-MS (m / z): 241 [M + H] +
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン塩酸塩(XLII)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン(XLI)(2.17g、9.03mmol)の1,4-ジオキサン(5mL)溶液に2M HCl/エチルエーテル(4.5mL、9.00mmol)を0℃で加えた。混合物を0℃で0.5時間攪拌し、揮発物を減圧除去してN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-メチル-ヒドロキシルアミン塩酸塩(XLII)を定量的収率で得た。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine hydrochloride (XLII)
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxylamine (XLI) (2.17 g, 9.03 mmol) of 1,4-dioxane To the (5 mL) solution was added 2M HCl / ethyl ether (4.5 mL, 9.00 mmol) at 0 ° C. The mixture was stirred at 0 ° C. for 0.5 h, volatiles were removed in vacuo and N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-methyl-hydroxyl Amine hydrochloride (XLII) was obtained in quantitative yield.
実施例13:
O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XLIII)
実施例14:
O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン塩酸塩(XLIV)
Example 13:
O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XLIII)
Example 14
O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine hydrochloride (XLIV)
O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(2.00g、8.71mmol)、O-アリル-ヒドロキシルアミン塩酸塩(1.91g、17.42mmol)およびNaOH(0.70g、17.42mmol)の1,4-ジオキサン(25mL)および水(5mL)中混合物を60℃で4時間加熱した。揮発物を減圧除去した。飽和NaHCO3溶液(100mL)を残渣に加え、混合物をEtOAc(3x25mL)で抽出した。一緒にした有機抽出物を水(50mL)、ブライン(50mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1)からCH2Cl2/EtOH(95:5)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してO-アリル-N-(4,6-ビス-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XLIII、2.05g、収率88%)を得た。ESI-MS (m/z) 267 [M+H]+。
O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) (2.00 g, 8.71 mmol), O-allyl-hydroxylamine hydrochloride (1.91 g , 17.42mmol) and NaOH (0.70g, 17.42mmol) in 1,4-dioxane (25 mL) and water (5 mL) in a mixture was heated for 4 hours at 60 ° C.. volatiles were removed under reduced pressure. saturated NaHCO 3 solution ( 100 mL) was added to the residue and the mixture was extracted with EtOAc (3 × 25 mL) The combined organic extracts were washed with water (50 mL), brine (50 mL) and dried over Na 2 SO 4. The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography using gradient elution from CH 2 Cl 2 / EtOH (99: 1) to CH 2 Cl 2 / EtOH (95: 5) to give O-allyl-N- Obtained (4,6-bis-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XLIII, 2.05 g, 88% yield) ESI-MS (m / z) 267 [M + H] + .
O-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン塩酸塩
実施例12に記載のようにO-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XLIII)および2M HCl/エチルエーテルからO-アリル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン塩酸塩(XLIV)を調製した。
融点: 130〜132℃。
O-allyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine hydrochloride As described in Example 12, O-allyl-N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XLIII) and 2M HCl / ethyl ether to O-allyl-N- (4,6-bis -n-Propylamino- [1,3,5] triazin-2-yl) -hydroxylamine hydrochloride (XLIV) was prepared.
Melting point: 130-132 ° C.
実施例15:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XLV)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)およびヒドロキシルアミン塩酸塩からN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-ヒドロキシルアミン(XLV)を調製した(収率99%)。
融点: 138〜141℃。
Example 15:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XLV)
From 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and hydroxylamine hydrochloride as described in Example 13, N- (4, 6-bis-n-propylamino- [1,3,5] triazin-2-yl) -hydroxylamine (XLV) was prepared (99% yield).
Melting point: 138-141 ° C.
実施例16
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン(XLVI)
実施例19に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)およびN,N-ジメチルヒドラジンからN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N',N'-ジメチルヒドラジン(XLVI)を調製することができる。
Example 16
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ', N'-dimethylhydrazine (XLVI)
From 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and N, N-dimethylhydrazine as described in Example 19, N- ( 4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N ′, N′-dimethylhydrazine (XLVI) can be prepared.
実施例17
6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン(XLVII)
実施例10に記載のように6-アミノ-2-クロロ-4-n-プロピルアミノ-[1,3,5]トリアジン(XXXVIII)およびN,O-ジメチルヒドロキシルアミンから6-(メトキシ(メチル)アミノ)-N2-プロピル-1,3,5-トリアジン-2,4-ジアミン(XLVII)を調製することができる。
Example 17
6- (Methoxy (methyl) amino) -N2-propyl-1,3,5-triazine-2,4-diamine (XLVII)
From 6-amino-2-chloro-4-n-propylamino- [1,3,5] triazine (XXXVIII) and N, O-dimethylhydroxylamine as described in Example 10, 6- (methoxy (methyl) Amino) -N2-propyl-1,3,5-triazine-2,4-diamine (XLVII) can be prepared.
実施例18:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(XLVIII)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)およびN-メチル-ヒドロキシルアミン塩酸塩からN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(XLVIII)を調製した(収率90%)。
Example 18:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (XLVIII)
From 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and N-methyl-hydroxylamine hydrochloride as described in Example 13 -(4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (XLVIII) was prepared (yield 90%).
実施例19:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン(XLIX)
実施例20:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン硫酸水素塩(L)
Example 19:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N'-dimethyl-hydrazine (XLIX)
Example 20
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N'-dimethyl-hydrazine hydrogensulfate (L)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン(XLIX)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(2.50g、10.88mmol)、N,N'-ジメチル-ヒドラジン二塩酸塩(2.89g、21.76mmol)およびNaOH(2.18g、54.40mmol)の1,4-ジオキサン(40mL)および水(20mL)中混合物を60℃で18時間加熱した。揮発物を減圧除去した。飽和NaHCO3溶液(100mL)を残渣に加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機抽出物を水(75mL)、ブライン(75mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、勾配溶離(CH2Cl2/EtOH(99:1)からCH2Cl2/EtOH(95:5)まで)を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン(1.17g、42%)を得た。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N'-dimethyl-hydrazine (XLIX)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) (2.50 g, 10.88 mmol), N, N′-dimethyl-hydrazine dihydrochloride A mixture of (2.89 g, 21.76 mmol) and NaOH (2.18 g, 54.40 mmol) in 1,4-dioxane (40 mL) and water (20 mL) was heated for 18 h at 60 ° C. The volatiles were removed in vacuo. Three solutions (100 mL) were added to the residue and the mixture was extracted with EtOAc (3 × 50 mL) The combined organic extracts were washed with water (75 mL), brine (75 mL) and dried over Na 2 SO 4 . Was removed in vacuo and the crude product was purified by flash column chromatography using gradient elution (CH 2 Cl 2 / EtOH (99: 1) to CH 2 Cl 2 / EtOH (95: 5)) to give N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N′-dimethyl-hydrazine (1.17 g, 42%) was obtained.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン硫酸水素塩_(L)
6-(N,N'-ジメチル-ヒドラジノ)-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン(XLIX)(1.17g、4.62mmol)の1,4-ジオキサン(10mL)溶液に95% H2SO4(0.26mL、4.62mmol)を0℃で滴下した。混合物を室温で0.5時間攪拌し、揮発物を減圧除去した。残渣を乾燥トルエン(3x25mL)で共蒸発させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,N'-ジメチル-ヒドラジン硫酸水素塩(L)を定量的収率で得た。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N'-dimethyl-hydrazine hydrogensulfate_ (L)
6- (N, N′-Dimethyl-hydrazino) -N, N′-dipropyl- [1,3,5] triazine-2,4-diamine (XLIX) (1.17 g, 4.62 mmol) of 1,4-dioxane To the (10 mL) solution, 95% H 2 SO 4 (0.26 mL, 4.62 mmol) was added dropwise at 0 ° C. The mixture was stirred at room temperature for 0.5 hour and volatiles were removed in vacuo. The residue was coevaporated with dry toluene (3x25mL) to give N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, N'-dimethyl-hydrazine hydrogen sulfate Salt (L) was obtained in quantitative yield.
実施例21:
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(LIII)
実施例22:
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン硫酸水素塩(LIV)
Example 21:
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (LIII)
Example 22:
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine hydrogensulfate (LIV)
ホルムアルデヒドO-ベンジル-オキシム(LI)
O-ベンジル-ヒドロキシルアミン塩酸塩(5.00g、31.32mmol)およびホルムアルデヒド(H2O中約37重量%)(2.3mL、31.32mmol)のトルエン(40mL)中混合物にNaOH(1.25g、31.32mmol)の水(6mL)溶液を加えた。反応混合物を室温で1時間攪拌した。この後、有機相を分離し、水相をジクロロメタン(3x30mL)で抽出した。一緒にした有機相をNa2SO4で乾燥させ、減圧濃縮してホルムアルデヒドO-ベンジル-オキシム(LI、4.15g、98%)を得た。
Formaldehyde O-benzyl-oxime (LI)
O- benzyl - hydroxylamine hydrochloride (5.00g, 31.32mmol) and formaldehyde (H 2 O in about 37 wt.%) (2.3mL, 31.32mmol) NaOH in toluene (40 mL) in a mixture of (1.25g, 31.32mmol) Of water (6 mL) was added. The reaction mixture was stirred at room temperature for 1 hour. After this time, the organic phase was separated and the aqueous phase was extracted with dichloromethane (3 × 30 mL). The combined organic phases were dried over Na 2 SO 4 and concentrated in vacuo to give formaldehyde O-benzyl-oxime (LI, 4.15 g, 98%).
O-ベンジル-N-メチル-ヒドロキシルアミン(LII)
ホルムアルデヒドO-ベンジル-オキシム(3.85g、28.48mmol)のEtOH溶液に1M HCl/EtOH溶液(50mL)を0℃で滴下した。混合物を室温で1時間攪拌し、揮発物を減圧除去した。残渣をジクロロメタン(100mL)に溶解させ、飽和NaHCO3溶液(75mL)、水(75mL)で洗浄し、Na2SO4で乾燥させた。石油エーテル/EtOAc(9:1)から石油エーテル/EtOAc(7:1)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで生成物を精製してO-ベンジル-N-メチル-ヒドロキシルアミン(1.72g、44%)を得た。
O-Benzyl-N-methyl-hydroxylamine (LII)
To a solution of formaldehyde O-benzyl-oxime (3.85 g, 28.48 mmol) in EtOH was added 1M HCl / EtOH solution (50 mL) dropwise at 0 ° C. The mixture was stirred at room temperature for 1 hour and volatiles were removed in vacuo. The residue was dissolved in dichloromethane (100 mL), washed with saturated NaHCO 3 solution (75 mL), water (75 mL) and dried over Na 2 SO 4 . The product was purified by flash column chromatography using gradient elution from petroleum ether / EtOAc (9: 1) to petroleum ether / EtOAc (7: 1) to give O-benzyl-N-methyl-hydroxylamine (1.72
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(LIII)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-ベンジル-N-メチル-ヒドロキシルアミン(LII)とを反応させてO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(LIII)(収率29%)を得た。
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (LIII)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-benzyl-N-methyl-hydroxylamine as described in Example 13 (LII) to react with O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (LIII) ( Yield 29%) was obtained.
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン硫酸水素塩(LIV)
実施例20に記載のようにO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン(LIII)と95% H2SO4とを反応させてO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン硫酸水素塩(LIV)を定量的収率で得た。
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine hydrogensulfate (LIV)
O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine (LIII) as described in Example 20 O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine sulfate reacted with 95% H 2 SO 4 Hydrogen salt (LIV) was obtained in quantitative yield.
実施例23:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン(LV)
実施例24:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン硫酸水素塩(LVI)
Example 23:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine (LV)
Example 24:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine hydrogensulfate (LVI)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン(LV)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とN-イソプロピル-ヒドロキシルアミン塩酸塩とを反応させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン(LV)(収率61%)を得た。ESI-MS (m/z): 269 [M+H]+。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine (LV)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and N-isopropyl-hydroxylamine hydrochloride as described in Example 13 The reaction yielded N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine (LV) (61% yield). ESI-MS (m / z): 269 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン硫酸水素塩(LVI)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン(LV)および95% H2SO4からN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-イソプロピル-ヒドロキシルアミン硫酸水素塩(LVI)を調製した(収率95%)。
融点: 154〜156℃。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine hydrogensulfate (LVI)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine (LV) and 95% H 2 as described in Example 20 N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-isopropyl-hydroxylamine hydrogensulfate (LVI) was prepared from SO 4 (yield 95 %).
Melting point: 154-156 ° C.
実施例25:
6-[1,2]オキサジナン-2-イル-N,N'-ジプロピル-[1,3,5]トリアジン-2,4-ジアミン(LVII)
実施例26:
6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン硫酸水素塩(LVIII)
Example 25:
6- [1,2] oxazinan-2-yl-N, N'-dipropyl- [1,3,5] triazine-2,4-diamine (LVII)
Example 26:
6- [1,2] oxazinan-2-yl-N, N'-di-n-propyl- [1,3,5] triazine-2,4-diamine hydrogensulfate (LVIII)
6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン(LVII)
ACE(登録商標)圧力管に2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(1.50g、6.53mmol)、N-エチルジイソプロピルアミン(19.59mmol)、1,2-オキサジナン塩酸塩(1.61g、13.06mmol)およびテトラヒドロフランを加えた。反応混合物を100℃で2時間加熱した後、冷却し、飽和NaHCO3溶液(50mL)に注いだ。懸濁液をEtOAc(3x25mL)で抽出した。一緒にした有機抽出物を水(50mL)、ブライン(50mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1)からCH2Cl2/EtOH(95:5)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製して6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン(LVII)(1.63g、89%)を得た。ESI-MS (m/z): 281 [M+H]+。
6- [1,2] oxazinan-2-yl-N, N'-di- n- propyl- [1,3,5] triazine-2,4-diamine (LVII)
An ACE® pressure tube was charged with 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) (1.50 g, 6.53 mmol), N-ethyl Diisopropylamine (19.59 mmol), 1,2-oxazinane hydrochloride (1.61 g, 13.06 mmol) and tetrahydrofuran were added and the reaction mixture was heated at 100 ° C. for 2 hours, then cooled and poured into saturated NaHCO 3 solution (50 mL). The suspension was extracted with EtOAc (3 × 25 mL) The combined organic extracts were washed with water (50 mL), brine (50 mL) and dried over Na 2 SO 4. The solvent was removed under reduced pressure, The crude product was purified by flash column chromatography using gradient elution from CH 2 Cl 2 / EtOH (99: 1) to CH 2 Cl 2 / EtOH (95: 5) to give 6- [1,2] oxazinane. -2-yl-N, N′-di- n- propyl- [1,3,5] triazine-2,4-diamine (LVII) (1.63 g, 89%) was obtained.ESI-MS (m / z): 281 [M + H] + .
6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン硫酸水素塩(LVIII)
実施例20に記載のように6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン(LVII)および95% H2SO4から6-[1,2]オキサジナン-2-イル-N,N'-ジ-n-プロピル-[1,3,5]トリアジン-2,4-ジアミン硫酸水素塩(LVIII)を調製した。定量的収量を単離した。
融点: 134〜137℃。
6- [1,2] oxazinan-2-yl-N, N'-di- n- propyl- [1,3,5] triazine-2,4-diamine hydrogensulfate (LVIII)
6- [1,2] oxazinan-2-yl-N, N′-di- n- propyl- [1,3,5] triazine-2,4-diamine (LVII) and as described in Example 20 95% H 2 SO 4 to 6- [1,2] oxazinan-2-yl-N, N'-di- n- propyl- [1,3,5] triazine-2,4-diamine hydrogensulfate (LVIII ) Was prepared. A quantitative yield was isolated.
Melting point: 134-137 ° C.
実施例27:Example 27:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン(LXIV)N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine (LXIV)
実施例28:Example 28:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン硫酸水素塩(LXV)N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine hydrogen sulfate (LXV)
2-イソプロポキシ-イソインドール-1,3-ジオン(LIX)
プロパン-2-オール(4.7mL、61.30mmol)、トリフェニルホスフィン(19.30g、73.56mmol)およびN-ヒドロキシフタルイミド(10.00g、61.30mmol)のTHF(50mL)中攪拌懸濁液にアゾジカルボン酸ジエチル(14.5mL、73.56mmol)を0℃で滴下した。混合物を室温で20時間攪拌し、蒸発乾固させた。石油エーテル/EtOAc(9:1)から石油エーテル/EtOAc(5:1)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで生成物を精製して2-イソプロポキシ-イソインドール-1,3-ジオン(LIX、10.92g、87%)を得た。
2-Isopropoxy-isoindole-1,3-dione (LIX)
To a stirred suspension of propan-2-ol (4.7 mL, 61.30 mmol), triphenylphosphine (19.30 g, 73.56 mmol) and N-hydroxyphthalimide (10.00 g, 61.30 mmol) in THF (50 mL) was added diethyl azodicarboxylate. (14.5 mL, 73.56 mmol) was added dropwise at 0 ° C. The mixture was stirred at room temperature for 20 hours and evaporated to dryness. The product was purified by flash column chromatography using gradient elution from petroleum ether / EtOAc (9: 1) to petroleum ether / EtOAc (5: 1) to give 2-isopropoxy-isoindole-1,3-dione (LIX, 10.92 g, 87%).
O-イソプロピル-ヒドロキシルアミン塩酸塩(LX)
2-イソプロポキシ-イソインドール-1,3-ジオン(LIX、10.78g、52.50mmol)およびヒドラジン一水和物(5.1mL、105.00mmol)のCH2Cl2(60mL)中混合物を室温で20時間攪拌した。反応混合物を濾過した。濾液を水(70mL)、ブライン(70mL)で洗浄し、Na2SO4で乾燥させた。乾燥剤を濾去した後、4M HCl/1,4-ジオキサン(13.8mL、55.00mmol)を加え、揮発物を減圧除去してO-イソプロピル-ヒドロキシルアミン塩酸塩(LX、3.91g、収率67%)を得た。
O-isopropyl-hydroxylamine hydrochloride (LX)
A mixture of 2-isopropoxy-isoindole-1,3-dione (LIX, 10.78 g, 52.50 mmol) and hydrazine monohydrate (5.1 mL, 105.00 mmol) in CH 2 Cl 2 (60 mL) at room temperature for 20 hours. Stir. The reaction mixture was filtered. The filtrate was washed with water (70 mL), brine (70 mL) and dried over Na 2 SO 4 . After the desiccant was filtered off, 4M HCl / 1,4-dioxane (13.8 mL, 55.00 mmol) was added, the volatiles were removed under reduced pressure and O-isopropyl-hydroxylamine hydrochloride (LX, 3.91 g, yield 67). %).
O-ベンジル-N-イソプロポキシカルバメート(LXI)
O-イソプロピル-ヒドロキシルアミン塩酸塩(3.89g、34.87mmol)のCH2Cl2(150mL)中予備冷却(0℃)溶液にN,N-ジイソプロピル-エチルアミン(14.4mL、87.18mmol)およびクロロギ酸ベンジル(5.0mL、34.87mmol)を加えた。得られた溶液を室温で5時間攪拌した。この時点で溶液を飽和NaHCO3水溶液(30mL)で2回洗浄し、Na2SO4で乾燥させた。石油エーテル/EtOAc(95:5)から石油エーテル/EtOAc(6:1)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで生成物を精製してO-ベンジル-N-イソプロポキシカルバメート(LXI、4.98g、68%)を得た。
O-Benzyl-N-isopropoxycarbamate (LXI)
To a precooled (0 ° C.) solution of O-isopropyl-hydroxylamine hydrochloride (3.89 g, 34.87 mmol) in CH 2 Cl 2 (150 mL) was added N, N-diisopropyl-ethylamine (14.4 mL, 87.18 mmol) and benzyl chloroformate. (5.0 mL, 34.87 mmol) was added. The resulting solution was stirred at room temperature for 5 hours. At this point, the solution was washed twice with saturated aqueous NaHCO 3 (30 mL) and dried over Na 2 SO 4 . The product was purified by flash column chromatography using gradient elution from petroleum ether / EtOAc (95: 5) to petroleum ether / EtOAc (6: 1) to give O-benzyl-N-isopropoxycarbamate (LXI, 4.98 g, 68%).
O-ベンジル-N-メチル-N-イソプロポキシカルバメート(LXII)
ACE(登録商標)圧力管にベンジルイソプロポキシカルバメート(4.98g、23.80mmol)、無水K2CO3(4.94g、35.70mmol)、ヨウ化メチル(6.7mL、107.10)および無水アセトン(30mL)を加えた。反応混合物を70℃で24時間加熱した。反応混合物を濾過し、アセトンを蒸発させた。得られたスラリーをEtOAcに溶解させ、水(3x50mL)で洗浄し、乾燥させ(Na2SO4)、濾過した。溶媒を除去してベンジルイソプロポキシ(メチル)カルバメート(4.96g、93%)を得た。
O-Benzyl-N-methyl-N-isopropoxycarbamate (LXII)
Add benzylisopropoxycarbamate (4.98 g, 23.80 mmol), anhydrous K 2 CO 3 (4.94 g, 35.70 mmol), methyl iodide (6.7 mL, 107.10) and anhydrous acetone (30 mL) to an ACE® pressure tube. It was. The reaction mixture was heated at 70 ° C. for 24 hours. The reaction mixture was filtered and the acetone was evaporated. The resulting slurry was dissolved in EtOAc, washed with water (3 × 50 mL), dried (Na 2 SO 4 ) and filtered. Removal of the solvent gave benzylisopropoxy (methyl) carbamate (4.96 g, 93%).
O-イソプロピル-N-メチル-ヒドロキシルアミン塩酸塩(LXIII)
O-ベンジル-N-メチル-Nイソプロポキシカルバメート(4.96g、22.22mmol)および33% HBr/AcOH(45mL)を室温で20分間攪拌した。飽和NaHCO3溶液(400mL)を加え、懸濁液をCH2Cl2(3x150mL)で抽出した。一緒にした有機抽出物をNa2SO4で乾燥させた。乾燥剤を濾去した後、4M HCl/1,4-ジオキサン(6.7mL、26.65mmol)を加え、揮発物を減圧除去してO-イソプロピル-N-メチル-ヒドロキシルアミン塩酸塩(2.09g、75%)を得た。
O-isopropyl-N-methyl-hydroxylamine hydrochloride (LXIII)
O-Benzyl-N-methyl-N isopropoxycarbamate (4.96 g, 22.22 mmol) and 33% HBr / AcOH (45 mL) were stirred at room temperature for 20 minutes. Saturated NaHCO 3 solution (400 mL) was added and the suspension was extracted with CH 2 Cl 2 (3 × 150 mL). The combined organic extracts were dried with Na 2 SO 4 . After the desiccant was filtered off, 4M HCl / 1,4-dioxane (6.7 mL, 26.65 mmol) was added, the volatiles were removed in vacuo and O-isopropyl-N-methyl-hydroxylamine hydrochloride (2.09 g, 75 %).
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン(LXIV)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)(1.65g、16.61mmol)、O-イソプロピル-N-メチル-ヒドロキシルアミン塩酸塩(LXIII、2.09g、16.61mmol)およびNaOH(0.66g、16.61mmol)の1,4-ジオキサン(50mL)および水(5mL)中混合物を100℃で16時間加熱した。次に揮発物を減圧除去した。飽和NaHCO3溶液(50mL)を残渣に加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機抽出物を水(50mL)、ブライン(50mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1)からCH2Cl2/EtOH(95:5)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン(LXIV、1.93g、95%)を得た。ESI-MS (m/z): 283 [M+H]+。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine (LXIV)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) (1.65 g, 16.61 mmol), O-isopropyl-N-methyl-hydroxylamine hydrochloride A mixture of salt (LXIII, 2.09 g, 16.61 mmol) and NaOH (0.66 g, 16.61 mmol) in 1,4-dioxane (50 mL) and water (5 mL) was heated for 16 h at 100 ° C. The volatiles were then reduced in vacuo. Saturated NaHCO 3 solution (50 mL) was added to the residue and the mixture was extracted with EtOAc (3 × 50 mL) The combined organic extracts were washed with water (50 mL), brine (50 mL) and Na 2 SO 4 . dried solvent was removed in vacuo, CH 2 Cl 2 / EtOH ( 99: 1) from CH 2 Cl 2 / EtOH (95 : 5) until the crude product is purified by flash column chromatography using a gradient elution of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine (LXIV, 1.93 g, 95%) ESI-MS (m / z): 283 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン硫酸水素塩(LXV)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン(LXIV、1.93g、6.83mmol)の1,4-ジオキサン(6mL)溶液に95% H2SO4(0.36mL、6.83mmol)を0℃で滴下した。混合物を室温で0.5時間攪拌した後、揮発物を減圧除去した。残渣を乾燥トルエン(3x25mL)で共蒸発させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-N-メチル-ヒドロキシルアミン硫酸水素塩(ほぼ定量的収率)を得た。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine hydrogen sulfate (LXV)
1,-(4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine (LXIV, 1.93 g, 6.83 mmol) To a solution of 4-dioxane (6 mL), 95% H 2 SO 4 (0.36 mL, 6.83 mmol) was added dropwise at 0 ° C. After the mixture was stirred at room temperature for 0.5 h, volatiles were removed under reduced pressure. The residue was coevaporated with dry toluene (3 × 25 mL) to give N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-N-methyl-hydroxylamine Hydrogen sulfate (almost quantitative yield) was obtained.
実施例29:
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン(LXVIII)
実施例30:
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン硫酸水素塩(LXIX)
Example 29:
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine (LXVIII)
Example 30:
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine hydrogensulfate (LXIX)
O-ベンジル-N-ビニル-ヒドロキシルアミン(LXVI)
O-ベンジル-ヒドロキシルアミン塩酸塩(7.00g、43.85mmol)の水(100mL)およびMeOH(20mL)中冷却溶液(0℃)にアセトアルデヒド(24.7mL、44.2mmol)を滴下した。反応混合物を16時間攪拌した。揮発物を減圧除去し、水性懸濁液をEtOAc(2x75mL)で抽出した。一緒にした有機抽出物をブラインで洗浄した後、Na2SO4で乾燥させ、蒸発させてO-ベンジル-N-ビニル-ヒドロキシルアミン(LXVI)を定量的収率で得た。
O-Benzyl-N-vinyl-hydroxylamine (LXVI)
Acetaldehyde (24.7 mL, 44.2 mmol) was added dropwise to a cooled solution (0 ° C.) of O-benzyl-hydroxylamine hydrochloride (7.00 g, 43.85 mmol) in water (100 mL) and MeOH (20 mL). The reaction mixture was stirred for 16 hours. Volatiles were removed in vacuo and the aqueous suspension was extracted with EtOAc (2 × 75 mL). The combined organic extracts were washed with brine, then dried over Na 2 SO 4 and evaporated to give O-benzyl-N-vinyl-hydroxylamine (LXVI) in quantitative yield.
O-ベンジル-N-エチル-ヒドロキシルアミン(LXVII)
O-ベンジル-N-ビニル-ヒドロキシルアミン(LXVI、6.52g、43.70mmol)のAcOH(10mL)溶液にNaCNBH3(11.00g、175.05mmol)を少しずつ加えた。反応混合物を室温で1時間攪拌した。混合物を1N NaOHで中和し(pH 7)、EtOAc(3x75mL)で抽出した。一緒にした有機抽出物を飽和NaHCO3溶液(2x100mL)で洗浄し、Na2SO4で乾燥させ、フラッシュカラムクロマトグラフィー(溶離液: 石油エーテル/EtOAc(9:1)→石油エーテル/EtOAc(1:4))で精製してO-ベンジル-N-エチル-ヒドロキシルアミン(LXVII、2.10g、32%)を得た。
O-Benzyl-N-ethyl-hydroxylamine (LXVII)
To a solution of O-benzyl-N-vinyl-hydroxylamine (LXVI, 6.52 g, 43.70 mmol) in AcOH (10 mL) was added NaCNBH 3 (11.00 g, 175.05 mmol) little by little. The reaction mixture was stirred at room temperature for 1 hour. The mixture was neutralized with 1N NaOH (pH 7) and extracted with EtOAc (3 × 75 mL). The combined organic extracts were washed with saturated NaHCO 3 solution (2 × 100 mL), dried over Na 2 SO 4 and flash column chromatography (eluent: petroleum ether / EtOAc (9: 1) → petroleum ether / EtOAc (1 : 4)) to give O-benzyl-N-ethyl-hydroxylamine (LXVII, 2.10 g, 32%).
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン(LXVIII)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-ベンジル-N-エチル-ヒドロキシルアミン(LXVII)とを反応させてO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン(LXVIII、収率38%)を得た。
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine (LXVIII)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-benzyl-N-ethyl-hydroxylamine as described in Example 13 (LXVII) to react with O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine (LXVIII, yield)
O-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン硫酸水素塩(LXIX)
実施例9に記載のようにO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-ヒドロキシルアミン(LXVIII)と95% H2SO4とを反応させてO-ベンジル-N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-メチル-ヒドロキシルアミン硫酸水素塩(LXIX)を定量的収率で得た。
O-Benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine hydrogensulfate (LXIX)
O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-hydroxylamine (LXVIII) as described in Example 9 O-benzyl-N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-methyl-hydroxylamine sulfate reacted with 95% H 2 SO 4 Hydrogen salt (LXIX) was obtained in quantitative yield.
実施例31:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン(LXX)
実施例32:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン硫酸水素塩(LXXI)
Example 31:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine (LXX)
Example 32:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine hydrogensulfate (LXXI)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン(LXX)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-イソプロピル-ヒドロキシルアミン塩酸塩とを反応させた(収率80%)。ESI-MS (m/z): 269 [M+H]+。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine (LXX)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-isopropyl-hydroxylamine hydrochloride as described in Example 13 Reaction (80% yield) ESI-MS (m / z): 269 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン硫酸水素塩(LXXI)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソプロピル-ヒドロキシルアミン(LXX)と95% H2SO4とを反応させた(定量的収率)。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine hydrogensulfate (LXXI)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isopropyl-hydroxylamine (LXX) and 95% H 2 as described in Example 20. Reaction with SO 4 (quantitative yield).
実施例33:
6-((ベンジルオキシ)(イソプロピル)アミノ)-N 2 ,N 4 -ジプロピル-1,3,5-トリアジン-2,4-ジアミン(LXXII)
実施例34:
6-((ベンジルオキシ)(イソプロピル)アミノ)-N 2 ,N 4 -ジプロピル-1,3,5-トリアジン-2,4-ジアミン硫酸水素塩(LXXIII)
実施例13に例示のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-ベンジル-N-イソプロピル-ヒドロキシルアミンとを反応させて6-((ベンジルオキシ)(イソプロピル)アミノ)-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン(LXXII)を調製した。実施例20に記載のように対応する硫酸水素塩(LXXIII)を調製した。
Example 33:
6-((Benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine (LXXII)
Example 34:
6-((Benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine hydrogensulfate (LXXIII)
As illustrated in Example 13, 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-benzyl-N-isopropyl-hydroxylamine To produce 6-((benzyloxy) (isopropyl) amino) -N 2 , N 4 -dipropyl-1,3,5-triazine-2,4-diamine (LXXII). The corresponding hydrogen sulfate (LXXIII) was prepared as described.
実施例35:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン(LXXVI)
実施例36:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン硫酸水素塩(LXXVII)
Example 35:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine (LXXVI)
Example 36:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine hydrogensulfate (LXXVII)
O-ベンジル-N-エチル-N-イソプロポキシ-カルバメート(LXXIV)
ACE(登録商標)圧力管にベンジルイソプロポキシカルバメート(4.08g、19.50mmol)、無水K2CO3(4.04g、29.25mmol)、ヨウ化エチル(7.0mL、87.75mmol)および無水アセトン(30mL)を加えた。反応混合物を70℃で24時間加熱した。ヨウ化エチル(7.0mL、87.75mmol)およびK2CO3(4.04g、29.25mmol)を加え、反応混合物を24時間加熱した。反応混合物を濾過し、アセトンを蒸発させた。得られたスラリーをEtOAc(150mL)に溶解させ、水(3x50mL)で洗浄し、乾燥させ(Na2SO4)、濾過した。溶媒を除去してO-ベンジル-N-エチル-N-イソプロポキシ-カルバメート(3.86g、83%)を得た。
O-Benzyl-N-ethyl-N-isopropoxy-carbamate (LXXIV)
ACE® pressure tube was charged with benzylisopropoxycarbamate (4.08 g, 19.50 mmol), anhydrous K 2 CO 3 (4.04 g, 29.25 mmol), ethyl iodide (7.0 mL, 87.75 mmol) and anhydrous acetone (30 mL). added. The reaction mixture was heated at 70 ° C. for 24 hours. Ethyl iodide (7.0 mL, 87.75 mmol) and K 2 CO 3 (4.04 g, 29.25 mmol) were added and the reaction mixture was heated for 24 hours. The reaction mixture was filtered and the acetone was evaporated. The resulting slurry was dissolved in EtOAc (150 mL), washed with water (3 × 50 mL), dried (Na 2 SO 4 ) and filtered. The solvent was removed to give O-benzyl-N-ethyl-N-isopropoxy-carbamate (3.86 g, 83%).
N-エチル-O-イソプロピル-ヒドロキシルアミン塩酸塩(LXXV)
化合物LXIIIの調製について実施例27に記載のようにO-ベンジル-N-エチル-N-イソプロポキシ-カルバメートとHBr/AcOHとを反応させた(収率71%)。
N-ethyl-O-isopropyl-hydroxylamine hydrochloride (LXXV)
O-benzyl-N-ethyl-N-isopropoxy-carbamate and HBr / AcOH were reacted as described in Example 27 for the preparation of compound LXIII (71% yield).
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン(LXXVI)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とN-エチル-O-イソプロピル-ヒドロキシルアミン塩酸塩(LXXV)とを反応させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン(LXXVI)(収率88%)を得た。ESI-MS (m/z): 297 [M+H]+。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine (LXXVI)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and N-ethyl-O-isopropyl-hydroxylamine as described in Example 13 Reaction with hydrochloride (LXXV) to give N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine (LXXVI (Yield 88%) ESI-MS (m / z): 297 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン硫酸水素塩(LXXVII)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N-エチル-O-イソプロピル-ヒドロキシルアミン(LXXVI)と95% H2SO4とを反応させた(定量的収率)。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine hydrogensulfate (LXXVII)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N-ethyl-O-isopropyl-hydroxylamine (LXXVI) as described in Example 20 95% H 2 SO 4 was reacted (quantitative yield).
実施例37:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン(LXXXII)
実施例38:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン硫酸水素塩(LXXXIII)
Example 37:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isobutyl-N-methyl-hydroxylamine (LXXXII)
Example 38:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isobutyl-N-methyl-hydroxylamine hydrogensulfate (LXXXIII)
O-ベンジル-N-イソブトキシカルバメート(LXXIX)
化合物LXIの調製について実施例27に記載のようにO-イソブチル-ヒドロキシルアミン塩酸塩(LXXVIII)とクロロギ酸ベンジルとを反応させてO-ベンジル-N-イソブトキシカルバメート(LXXIX)(収率87%)を得た。
O-Benzyl-N-isobutoxycarbamate (LXXIX)
For the preparation of compound LXI, O-isobutyl-hydroxylamine hydrochloride (LXXVIII) was reacted with benzyl chloroformate as described in Example 27 to give O-benzyl-N-isobutoxycarbamate (LXXIX) (87% yield). )
O-ベンジル-N-メチル-N-イソブトキシカルバメート(LXXX)
化合物LXIIの調製について実施例27に記載のようにO-ベンジル-N-イソブトキシカルバメートとヨウ化メチルとを反応させてO-ベンジル-N-メチル-N-イソブトキシカルバメートを収率78%で得た。
O-Benzyl-N-methyl-N-isobutoxycarbamate (LXXX)
For the preparation of compound LXII, O-benzyl-N-isobutoxycarbamate was reacted with methyl iodide as described in Example 27 to yield O-benzyl-N-methyl-N-isobutoxycarbamate in 78% yield. Obtained.
O-イソブチル-N-メチル-ヒドロキシルアミン塩酸塩(LXXXI)
化合物LXIIIの調製について実施例27に記載のようにO-ベンジル-N-メチル-N-イソブトキシカルバメートとHBr/AcOHとを反応させた(収率38%)。
O-isobutyl-N-methyl-hydroxylamine hydrochloride (LXXXI)
O-benzyl-N-methyl-N-isobutoxycarbamate and HBr / AcOH were reacted as described in Example 27 for the preparation of compound LXIII (38% yield).
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン(LXXXII)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-イソブチル-N-メチル-ヒドロキシルアミン塩酸塩とを反応させてLXXXIIを収率82%で得た。ESI-MS (m/z) 297 [M+H]+。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isobutyl-N-methyl-hydroxylamine (LXXXII)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-isobutyl-N-methyl-hydroxylamine as described in Example 13 Reaction with hydrochloride gave LXXXII in 82% yield, ESI-MS (m / z) 297 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン硫酸水素塩(LXXXIII)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-イソブチル-N-メチル-ヒドロキシルアミン(LXXXII)と95% H2SO4とを反応させた(定量的収率)。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isobutyl-N-methyl-hydroxylamine hydrogensulfate (LXXXIII)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-isobutyl-N-methyl-hydroxylamine (LXXXII) as described in Example 20 95% H 2 SO 4 was reacted (quantitative yield).
実施例39:
6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N 2 ,N 4 -ジ-n-プロピル-1,3,5-トリアジン-2,4-ジアミン(LXXXIV)
実施例40:
6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N 2 ,N 4 -ジ-n-プロピル-1,3,5-トリアジン-2,4-ジアミン硫酸水素塩(LXXXV)
実施例13に例示のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-(チオフェン-2-イル-メチル)-N-メチル-ヒドロキシルアミンとを反応させて6-(メチル(チオフェン-2-イルメトキシ)アミノ)-N2,N4-ジ-n-プロピル-1,3,5-トリアジン-2,4-ジアミン(LXXXIV)を調製することができる。
Example 39:
6- (methyl (thiophen-2-ylmethoxy) amino) -N 2, N 4 - di -n- propyl-1,3,5-triazine-2,4-diamine (LXXXIV)
Example 40:
6- (methyl (thiophen-2-ylmethoxy) amino) -N 2, N 4 - di -n- propyl-1,3,5-triazine-2,4-diamine hydrogen sulfate (LXXXV)
As illustrated in Example 13, 2-chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O- (thiophen-2-yl-methyl) ) -N-methyl-hydroxylamine to react with 6- (methyl (thiophen-2-ylmethoxy) amino) -N 2 , N 4 -di-n-propyl-1,3,5-triazine-2,4 -Diamine (LXXXIV) can be prepared.
実施例41:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン(XCI)
実施例42:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン硫酸水素塩(XCII)
Example 41:
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine (XCI)
Example 42:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine hydrogensulfate (XCII)
2-シクロプロピルメトキシ-イソインドール-1,3-ジオン(LXXXVI)
化合物LIXについて実施例27に記載のようにN-ヒドロキシフタルイミドとシクロプロピル-メタノールとを反応させてLXXXVIを収率87%で得た。
2-Cyclopropylmethoxy-isoindole-1,3-dione (LXXXVI)
Compound LIX was reacted with N-hydroxyphthalimide and cyclopropyl-methanol as described in Example 27 to give LXXXVI in 87% yield.
O-シクロプロピルメチル-ヒドロキシルアミン塩酸塩(LXXXVII)
化合物LXについて実施例27に記載のように2-シクロプロピルメトキシ-イソインドール-1,3-ジオンとヒドラジンとを反応させた(LXXXVII、収率67%)。
O-cyclopropylmethyl-hydroxylamine hydrochloride (LXXXVII)
Compound LX was reacted with 2-cyclopropylmethoxy-isoindole-1,3-dione and hydrazine as described in Example 27 (LXXXVII, 67% yield).
O-ベンジル-N-シクロプロピルメトキシカルバメート(LXXXVIII)
化合物LXIについて実施例27に記載のようにO-シクロプロピルメチル-ヒドロキシルアミン塩酸塩とクロロギ酸ベンジルとを反応させた(LXXXVIII、収率88%)。
O-Benzyl-N-cyclopropylmethoxycarbamate (LXXXVIII)
Compound LXI was reacted with O-cyclopropylmethyl-hydroxylamine hydrochloride and benzyl chloroformate as described in Example 27 (LXXXVIII, 88% yield).
O-ベンジル-N-メチル-N-シクロプロピルメトキシ-カルバメート(LXXXIX)
化合物LXIIについて実施例27に記載のようにO-ベンジルN-シクロプロピルメトキシカルバメートとヨウ化メチルとを反応させた(LXXXIX、収率95%)。
O-Benzyl-N-methyl-N-cyclopropylmethoxy-carbamate (LXXXIX)
Compound LXII was reacted with O-benzyl N-cyclopropylmethoxycarbamate and methyl iodide as described in Example 27 (LXXXIX, 95% yield).
O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン塩酸塩(XC)
化合物LXIIIについて実施例27に記載のようにO-ベンジル-N-メチル-N-シクロプロピルメトキシカルバメートとHBr/AcOHとを反応させてXCを収率77%で得た。
O-cyclopropylmethyl-N-methyl-hydroxylamine hydrochloride (XC)
Compound LXIII was reacted with O-benzyl-N-methyl-N-cyclopropylmethoxycarbamate and HBr / AcOH as described in Example 27 to give XC in 77% yield.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン(XCI)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-シクロプロピルメチル-N-メチル-ヒドロキシルアミン塩酸塩(XC)とを反応させて(XCI)を収率99%で得た。
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine (XCI)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-cyclopropylmethyl-N-methyl- as described in Example 13 Reaction with hydroxylamine hydrochloride (XC) gave (XCI) in 99% yield.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン硫酸水素塩(XCII)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-シクロプロピルメチル-N-メチル-ヒドロキシルアミン(XCI)と95% H2SO4とを反応させて(XCII)を定量的収率で得た。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine hydrogensulfate (XCII)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-cyclopropylmethyl-N-methyl-hydroxylamine (XCI) as described in Example 20 ) And 95% H 2 SO 4 were reacted to give (XCII) in quantitative yield.
実施例43:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン(XCVI)
実施例44:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン硫酸水素塩(XCVII)
Example 43:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine (XCVI)
Example 44:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine hydrogensulfate (XCVII)
tert-ブチルエトキシカルバメート(XCIII)
O-エチル-ヒドロキシルアミン(1.76g、18.0mmol)および二炭酸ジ-tert-ブチル(5.13g、23.67mmol)のジクロロメタン(45.0mL)溶液に飽和Na2CO3溶液(45.0mL)を室温で滴下し、24時間攪拌した。水を加え、混合物のpHを6N HClの添加により2に調整し、得られた系をジクロロメタン(3x50mL)で抽出した。一緒にした有機抽出物をNa2SO4で乾燥させ、蒸発させた。石油エーテル/EtOAc(98:2)から石油エーテル/EtOAc(95:5)までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してtert-ブチルエトキシカルバメート(XCIII)(2.62g、90%)を得た。
tert-Butylethoxycarbamate (XCIII)
To a solution of O-ethyl-hydroxylamine (1.76 g, 18.0 mmol) and di-tert-butyl dicarbonate (5.13 g, 23.67 mmol) in dichloromethane (45.0 mL), saturated Na 2 CO 3 solution (45.0 mL) was added dropwise at room temperature. And stirred for 24 hours. Water was added and the pH of the mixture was adjusted to 2 by the addition of 6N HCl and the resulting system was extracted with dichloromethane (3 × 50 mL). The combined organic extracts were dried over Na 2 SO 4 and evaporated. The crude product was purified by flash column chromatography using gradient elution from petroleum ether / EtOAc (98: 2) to petroleum ether / EtOAc (95: 5) to give tert-butylethoxycarbamate (XCIII) (2.62 g, 90%) was obtained.
tert-ブチルエトキシ(メチル)カルバメート(XCIV)
60%水素化ナトリウム(0.66g、16.92mmol)のDMF(5mL)懸濁液にtert-ブチルエトキシカルバメート(XCIII、2.48g、15.38mmol)のDMF(10mL)溶液を0℃で滴下した。30分後、DMF(10mL)中ヨウ化メチル(1.95mL、31.32mmol)を加え、反応混合物を室温で24時間攪拌した。水(100mL)を加え、生成物を酢酸エチル(3x50mL)で抽出し、Na2SO4で乾燥させ、減圧濃縮してtert-ブチルエトキシ(メチル)カルバメート(XCIV、2.34g、87%)を得た。
tert-Butylethoxy (methyl) carbamate (XCIV)
To a suspension of 60% sodium hydride (0.66 g, 16.92 mmol) in DMF (5 mL), a solution of tert-butylethoxycarbamate (XCIII, 2.48 g, 15.38 mmol) in DMF (10 mL) was added dropwise at 0 ° C. After 30 minutes, methyl iodide (1.95 mL, 31.32 mmol) in DMF (10 mL) was added and the reaction mixture was stirred at room temperature for 24 hours. Water (100 mL) was added and the product was extracted with ethyl acetate (3 × 50 mL), dried over Na 2 SO 4 and concentrated under reduced pressure to give tert-butylethoxy (methyl) carbamate (XCIV, 2.34 g, 87%). It was.
O-エチル-N-メチル-ヒドロキシルアミン塩酸塩(XCV)
tert-ブチルエトキシ(メチル)カルバメート(XCIV、2.34g、13.35mmol)に4M HCl/1,4-ジオキサン溶液(25mL)を少しずつ0℃で加えた。混合物を室温で4時間攪拌した。揮発物を減圧除去し、エチルエーテルを用いて残渣を摩砕し、濾過して固体(O-エチル-N-メチル-ヒドロキシルアミン塩酸塩、XCV、1.35g、91%)を得た。
O-ethyl-N-methyl-hydroxylamine hydrochloride (XCV)
To tert-butylethoxy (methyl) carbamate (XCIV, 2.34 g, 13.35 mmol), 4M HCl / 1,4-dioxane solution (25 mL) was added in portions at 0 ° C. The mixture was stirred at room temperature for 4 hours. Volatiles were removed in vacuo and the residue was triturated with ethyl ether and filtered to give a solid (O-ethyl-N-methyl-hydroxylamine hydrochloride, XCV, 1.35 g, 91%).
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン(XCVI)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-エチル-N-メチル-ヒドロキシルアミン塩酸塩とを反応させてXCVIを収率93%で得た。ESI-MS (m/z) 269 [M+H]+。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine (XCVI)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O-ethyl-N-methyl-hydroxylamine as described in Example 13 Reaction with hydrochloride gave XCVI in 93% yield, ESI-MS (m / z) 269 [M + H] + .
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン硫酸水素塩(XCVII)
実施例20に記載のようにN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-エチル-N-メチル-ヒドロキシルアミン(XCVI)と95% H2SO4とを反応させて(XCVII)を収率91%で得た。
融点: 84〜86℃。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine hydrogensulfate (XCVII)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O-ethyl-N-methyl-hydroxylamine (XCVI) as described in Example 20 Reaction with 95% H 2 SO 4 gave (XCVII) in 91% yield.
Melting point: 84-86 ° C.
実施例45:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン(C)
実施例46:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン硫酸水素塩(CI)
Example 45:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine (C)
Example 46:
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine hydrogensulfate (CI)
2-(2,2-ジフルオロ-エトキシ)-イソインドール-1,3-ジオン(XCVIII)
化合物LXIについて実施例27に記載のようにN-ヒドロキシフタルイミドと2,2-ジフルオロ-エタノールとを反応させてXCVIIIを収率52%で得た。
2- (2,2-Difluoro-ethoxy) -isoindole-1,3-dione (XCVIII)
Compound LXI was reacted with N-hydroxyphthalimide and 2,2-difluoro-ethanol as described in Example 27 to give XCVIII in 52% yield.
O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン塩酸塩(XCIX)
化合物LXについて実施例27に記載のように2-(2,2-ジフルオロ-エトキシ)-イソインドール-1,3-ジオンとヒドラジンとを反応させてXCIXを収率73%で得た。
O- (2,2-difluoro-ethyl) -hydroxylamine hydrochloride (XCIX)
Compound LX was reacted with 2- (2,2-difluoro-ethoxy) -isoindole-1,3-dione and hydrazine as described in Example 27 to give XCIX in 73% yield.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン(C)
実施例13に記載のように2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5]トリアジン(XXXIV)とO-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン塩酸塩とを反応させてCを収率59%で得た。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine (C)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5] triazine (XXXIV) and O- (2,2-difluoro-ethyl) as described in Example 13 ) -Hydroxylamine hydrochloride to give C in 59% yield.
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン硫酸水素塩(CI)
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン(C、1.02g、3.51mmol)と95% H2SO4(0.19mL、3.51mmol)とをジエチルエーテル(3mL)中にて0℃で反応させた。EtOH 2滴を加え、得られた結晶を濾過し、ジエチルエーテルで洗浄し、乾燥させてN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-O-(2,2-ジフルオロ-エチル)-ヒドロキシルアミン硫酸水素塩(CI)(1.26g、93%)を得た。
融点: 91〜93℃。
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine hydrogensulfate (CI)
N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine (C, 1.02 g, 3.51 mmol ) And 95% H 2 SO 4 (0.19 mL, 3.51 mmol) were reacted in diethyl ether (3 mL) at 0 ° C. 2 drops of EtOH are added and the resulting crystals are filtered, washed with diethyl ether and dried to give N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -O- (2,2-difluoro-ethyl) -hydroxylamine hydrogensulfate (CI) (1.26 g, 93%) was obtained.
Melting point: 91-93 ° C.
実施例47:
4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CIII)
実施例48:
4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CIV)
Example 47:
4-N- (2-Dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CIII)
Example 48:
4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CIV )
2-クロロ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CII)
2,4-ジクロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン(XXIII)(18g、87mmol)をアセトン(100mL)に溶解させ、氷水(50mL)に注いで非常に微細な懸濁液を形成した。N,O-ジメチルヒドロキシルアミン塩酸塩(9.3g、95mmol)の水(30mL)溶液を、温度を0℃(氷浴)に保持しながら加えた。この混合物に2N NaOH(44mL、88mmol)を、温度を0℃〜5℃に保持するように調整された速度で滴下した。反応液を周囲温度で30分間、50℃でさらに60分間攪拌した。得られた析出物を濾去し、水(3x25mL)で洗浄した。塩化カルシウムで高真空乾燥後、2-クロロ-N-(6-n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CII、12g、60%)を白色粉末として単離した。LCMS (ESI) m/z = 232 (M+H)+。
2-Chloro-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CII)
2,4-Dichloro-N- (6-n-propylamino)-[1,3,5] triazine (XXIII) (18 g, 87 mmol) was dissolved in acetone (100 mL) and poured into ice water (50 mL) to A fine suspension was formed. A solution of N, O-dimethylhydroxylamine hydrochloride (9.3 g, 95 mmol) in water (30 mL) was added while maintaining the temperature at 0 ° C. (ice bath). To this mixture was added 2N NaOH (44 mL, 88 mmol) dropwise at a rate adjusted to maintain the temperature between 0 ° C and 5 ° C. The reaction was stirred at ambient temperature for 30 minutes and at 50 ° C. for an additional 60 minutes. The resulting precipitate was filtered off and washed with water (3 × 25 mL). After high vacuum drying with calcium chloride, 2-chloro-N- (6-n-propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CII, 12 g, 60%) was isolated as a white powder. LCMS (ESI) m / z = 232 (M + H) + .
4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CIII)
2-クロロ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CII、1.5g、6.5mmol)、N,N-ジメチルエタン-1,2-ジアミン(3.5g、39mmol)およびDIPEA(2.5g、20mmol)のEtOH(30mL)中混合物を100℃で16時間加熱した。次に溶媒を減圧除去した。残渣をEtOAc(80mL)に溶解させ、水(2x50mL)、次にブライン溶液(50mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去した。残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=20/1→5/1)で精製して4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(620mg、33%)を得た。
4-N- (2-Dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CIII)
2-Chloro-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CII, 1.5 g, 6.5 mmol), N, N A mixture of -dimethylethane-1,2-diamine (3.5 g, 39 mmol) and DIPEA (2.5 g, 20 mmol) in EtOH (30 mL) was heated at 100 ° C. for 16 h. The solvent was then removed under reduced pressure. The residue was dissolved in EtOAc (80 mL), washed with water (2 × 50 mL), then brine solution (50 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The residue was purified by flash column chromatography (DCM / MeOH = 20/1 → 5/1) to give 4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1, 3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine (620 mg, 33%) was obtained.
4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CIV)
4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(610mg、2.1mmol)をH2O(10mL)および0.5M HCl水溶液(6.6mL)に溶解させ、溶液を凍結乾燥させて4-N-(2-ジメチルアミノエチル)アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CIV、630mg)を無色油状物として得た。LCMS (ESI) m/z = 284 (M+H)+。
4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CIV )
4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (610 mg, 2.1 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (6.6 mL) and the solution was lyophilized to give 4-N- (2-dimethylaminoethyl) amino-6-N- (n-propyl) Amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CIV, 630 mg) was obtained as a colorless oil. LCMS (ESI) m / z = 284 (M + H) + .
実施例49:
4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CV)
実施例50:
4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVI)
Example 49:
4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine (CV)
Example 50:
4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine hydrochloride (CVI)
4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CV)
EtOH(50mL)中の2-クロロ-6-N-(n-プロピルアミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CII)(400mg、2.9mmol)、DIPEA(5.16g、40mmol)および3-(1-メチル-1H-イミダゾール-2-イル)プロパン-1-アミン(J. Heterocyclic Chem., 2005, 42:1011-15)(732mg、3.2mmol)を100℃で16時間加熱した。この後、溶媒を減圧除去した。残渣をDCM/MeOH(400mL/200mL)に溶解させ、水(50mL)で洗浄した後、Na2SO4で乾燥させた。溶媒を減圧除去した。粗生成物をフラッシュカラムクロマトグラフィー(DCM/MeOH=50/1→10/1)で精製して4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CV、210mg、22%)を得た。
4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine (CV)
2-Chloro-6-N- (n-propylamino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CII) (400 mg, 2.9 in EtOH (50 mL)) mmol), DIPEA (5.16 g, 40 mmol) and 3- (1-methyl-1H-imidazol-2-yl) propan-1-amine (J. Heterocyclic Chem., 2005, 42: 1011-15) (732 mg, 3.2 mmol) was heated at 100 ° C. for 16 h. Thereafter, the solvent was removed under reduced pressure. The residue was dissolved in DCM / MeOH (400 mL / 200 mL), washed with water (50 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography (DCM / MeOH = 50/1 → 10/1) to give 4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino- 6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CV, 210 mg, 22%) was obtained.
4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVI)
4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CV)(210mg、0.63mmol)をH2O(10mL)および0.5M HCl水溶液(1.3mL)に溶解させ、溶液を凍結乾燥させて4-N-(3-(1-N-メチルイミダゾール-2-イル)-プロピル)-アミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVI、210mg)を黄色油状物として得た。
4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine hydrochloride (CVI)
4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl)- N, O-dimethyl-hydroxylamine (CV) (210 mg, 0.63 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (1.3 mL) and the solution was lyophilized to give 4-N- (3- (1-N-methylimidazol-2-yl) -propyl) -amino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxyl Amine hydrochloride (CVI, 210 mg) was obtained as a yellow oil.
実施例51:
4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CVII)
実施例52:
4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVIII)
Example 51:
4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl -Hydroxylamine (CVII)
Example 52:
4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl -Hydroxylamine hydrochloride (CVIII)
4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CVII)
EtOH(50mL)中の2-クロロ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CII)(1g、4.5mmol)、(1-メチル-1H-イミダゾール-2-イル)メタンアミン(600mg、5.4mmol)およびK2CO3(1.24g、9mmol)を100℃で16時間加熱した。反応混合物を濾過し、揮発物を減圧除去した。残渣をEtOAc(100mL)に溶解させ、水(30mL)、次にブライン溶液(30mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去した。粗生成物をフラッシュカラムクロマトグラフィー(DCM/MeOH=20/1→8/1)で精製して4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CVII、650mg、47%)を得た。
4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl -Hydroxylamine (CVII)
2-Chloro-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CII) (1 g, 4.5) in EtOH (50 mL) mmol), (1-methyl-1H-imidazol-2-yl) methanamine (600 mg, 5.4 mmol) and K 2 CO 3 (1.24 g, 9 mmol) were heated at 100 ° C. for 16 h. The reaction mixture was filtered and volatiles were removed in vacuo. The residue was dissolved in EtOAc (100 mL), washed with water (30 mL), then brine solution (30 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography (DCM / MeOH = 20/1 → 8/1) to give 4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- ( n-Propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CVII, 650 mg, 47%) was obtained.
4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVIII)
4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CVII、650mg、2.1mmol)をH2O(10mL)および0.5M HCl水溶液(6.3mL)に溶解させた。得られた溶液を凍結乾燥に供して4-N-(1-N-メチルイミダゾール-2-イル)-メチルアミノ-6-N-(n-プロピル)アミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CVIII、389mg)を無色油状物として得た。
4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl -Hydroxylamine hydrochloride (CVIII)
4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazin-2-yl) -N, O-dimethyl - dissolved hydroxylamine (CVII, 650mg, 2.1mmol) in a H 2 O (10mL) and 0.5M HCl aqueous solution (6.3 mL). The resulting solution was subjected to lyophilization to give 4-N- (1-N-methylimidazol-2-yl) -methylamino-6-N- (n-propyl) amino- [1,3,5] triazine- 2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CVIII, 389 mg) was obtained as a colorless oil.
実施例53:
4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CIX)
実施例54:
4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CX)
Example 53:
4,6-Bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CIX)
Example 54:
4,6-Bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CX)
4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CIX)
THF(250mL)中のN-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(7g、33.5mmol)、N,N-ジメチル-エタン-1,2-ジアミン(6.05g、68.7mmol)およびK2CO3(10.2g、73.7mmol)を70℃で5時間加熱した後、溶媒を減圧除去した。残渣を逆相フラッシュカラムクロマトグラフィーで精製して4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(270mg、3%)を得た。
4,6-Bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CIX)
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (7 g, 33.5 mmol), N, N- in THF (250 mL) Dimethyl-ethane-1,2-diamine (6.05 g, 68.7 mmol) and K 2 CO 3 (10.2 g, 73.7 mmol) were heated at 70 ° C. for 5 hours, and then the solvent was removed under reduced pressure. The residue was purified by reverse phase flash column chromatography to give 4,6-bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl -Obtained hydroxylamine (270 mg, 3%).
4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CX)
4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(270mg、0.86mmol)をH2O(10mL)および0.5M HCl水溶液(2mL)に溶解させ、得られた溶液を凍結乾燥させて4,6-ビス-(N-(2-ジメチルアミノエチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(290mg)を無色油状物として得た。
4,6-Bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CX)
4,6-bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (270 mg, 0.86 mmol) in H 2 Dissolve in O (10 mL) and 0.5 M aqueous HCl (2 mL) and lyophilize the resulting solution to 4,6-bis- (N- (2-dimethylaminoethyl) amino)-[1,3,5 Triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (290 mg) was obtained as a colorless oil.
実施例55:
4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXI)
実施例56:
4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXII)
Example 55:
4,6-Bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXI)
Example 56:
4,6-Bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXII)
4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXI)
EtOH(80mL)中のN-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(1g、4.78mmol)、ピリジン-4-イルメタンアミン(1.14、10.52mmol)およびDIPEA(1.85g、14.34mmol)を100℃で16時間加熱した後、溶媒を減圧除去した。粗生成物をフラッシュクロマトグラフィーで濾過して4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXI)(450mg、27%)を得た。
4,6-Bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXI)
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (1 g, 4.78 mmol), pyridine-4-in EtOH (80 mL) After ilmethamineamine (1.14, 10.52 mmol) and DIPEA (1.85 g, 14.34 mmol) were heated at 100 ° C. for 16 hours, the solvent was removed under reduced pressure. The crude product was filtered by flash chromatography and 4,6-bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl- Hydroxylamine (CXI) (450 mg, 27%) was obtained.
4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXII)
4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXI)(450mg、1.28mmol)をH2O(10mL)および0.5M HCl水溶液(3.84mL)に溶解させ、得られた溶液を凍結乾燥させて4,6-ビス-(N-(ピリジン-4-イルメチル)アミノ)-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン_塩酸塩(497mg)を黄色固体として得た。
4,6-Bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXII)
4,6-bis- (N- (pyridin-4-ylmethyl) amino)-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXI) (450 mg, 1.28 mmol) Is dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (3.84 mL), and the resulting solution is lyophilized to give 4,6-bis- (N- (pyridin-4-ylmethyl) amino)-[1 , 3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine_hydrochloride (497 mg) was obtained as a yellow solid.
実施例57:
4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXIII)
実施例58:
4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXIV)
Example 57:
4,6-Bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXIII)
Example 58:
4,6-Bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXIV)
4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXIII)
EtOH(50mL)中のN-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(1g、4.78mmol)、3-メトキシプロパン-1-アミン(936mg、10.52mmol)およびDIPEA(1.85g、14.34mmol)を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(200mL)に溶解させ、水(50mL)、次にブライン溶液(50mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去した。粗生成物をフラッシュカラムクロマトグラフィー(石油エーテル/酢酸エチル=5/1→1/2)で精製して4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXIII)(1.4g、93%)を得た。
4,6-Bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXIII)
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (1 g, 4.78 mmol), 3-methoxypropane in EtOH (50 mL) After 1-amine (936 mg, 10.52 mmol) and DIPEA (1.85 g, 14.34 mmol) were heated at 100 ° C. for 16 hours, the solvent was removed in vacuo. The residue was dissolved in EtOAc (200 mL), washed with water (50 mL), then brine solution (50 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography (petroleum ether / ethyl acetate = 5/1 → 1/2) to give 4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1 , 3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXIII) (1.4 g, 93%) was obtained.
4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXIV)
4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXIII、1.4g、4.46mmol)をH2O(10mL)および0.5M HCl水溶液(13.4mL)に溶解させ、得られた溶液を凍結乾燥させて4,6-ビス-[N-(3-メトキシ-n-プロピル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(1.56g)を無色油状物として得た。
4,6-Bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXIV)
4,6-bis- [N- (3-methoxy-n-propyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXIII, 1.4 g, 4.46 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (13.4 mL) and the resulting solution was lyophilized to give 4,6-bis- [N- (3-methoxy-n-propyl) amino. ]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (1.56 g) was obtained as a colorless oil.
実施例59:
4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXV)
実施例60:
4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXVI)
Example 59:
4,6-Bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXV)
Example 60:
4,6-Bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXVI)
4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXV)
EtOH(50mL)中のN-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(1g、4.78mmol)、(テトラヒドロ-2H-ピラン-4-イル)メタンアミン(1.21g、10.52mmol)およびDIPEA(1.85g、14.34mmol)を100℃で16時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(200mL)に溶解させ、水(50mL)、次にブライン溶液(50mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去した。粗生成物をフラッシュカラムクロマトグラフィー(PE/EA=5/1→1/1)で精製して4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXV)(1.5g、85%)を得た。
4,6-Bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXV)
N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (1 g, 4.78 mmol), (tetrahydro-2H) in EtOH (50 mL) After -pyran-4-yl) methanamine (1.21 g, 10.52 mmol) and DIPEA (1.85 g, 14.34 mmol) were heated at 100 ° C. for 16 hours, the solvent was removed under reduced pressure. The residue was dissolved in EtOAc (200 mL), washed with water (50 mL), then brine solution (50 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure. The crude product was purified by flash column chromatography (PE / EA = 5/1 → 1/1) to give 4,6-bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3, 5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXV) (1.5 g, 85%) was obtained.
4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXVI)
4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(CXV)(1.5g、4.1mmol)をH2O(10mL)および0.5M HCl水溶液(12.3mL)に溶解させ、得られた溶液を凍結乾燥させて4,6-ビス-[N-(テトラヒドロピラン-4-イルメチル)アミノ]-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXVI)(1.65g)を白色固体として得た。
4,6-Bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXVI)
4,6-Bis- [N- (tetrahydropyran-4-ylmethyl) amino]-[1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (CXV) (1.5 g, 4.1 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (12.3 mL) and the resulting solution was lyophilized to give 4,6-bis- [N- (tetrahydropyran-4-ylmethyl) amino] -[1,3,5] Triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXVI) (1.65 g) was obtained as a white solid.
実施例61:
N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン(CXVII)
実施例62:
N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン塩酸塩(CXVIII)
Example 61:
N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -triene-17- Yl) -N, O-dimethylhydroxylamine (CXVII)
Example 62:
N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -triene-17- Yl) -N, O-dimethylhydroxylamine hydrochloride (CXVIII)
N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン(CXVII)
2,2'-(2,2'-オキシビス(エタン-2,1-ジイル)ビス(オキシ))ジエタンアミン(Org. Biomol. Chem. 2005, 3:2255-61)(1.5g、7.8mmol)およびDIPEA(2.01g、15.6mmol)にEtOH(100mL)中N-(4,6-ジクロロ[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン(XXX)(1.63g、7.8mmol)を加えた。反応液を100℃で3時間加熱した後、溶媒を減圧除去した。残渣をEtOAc(200mL)に溶解させ、水(2x100mL)、次にブライン溶液(100mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=50/1→20/1)で精製してN-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン(CXVII)(700mg)を無色油状物(収率27%)として得た。
N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -triene-17- Yl) -N, O-dimethylhydroxylamine (CXVII)
2,2 ′-(2,2′-oxybis (ethane-2,1-diyl) bis (oxy)) dietanamine (Org. Biomol. Chem. 2005, 3: 2255-61) (1.5 g, 7.8 mmol) and DIPEA (2.01 g, 15.6 mmol) to N- (4,6-dichloro [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine (XXX) (1.63 g) in EtOH (100 mL) 7.8 mmol). The reaction solution was heated at 100 ° C. for 3 hours, and then the solvent was removed under reduced pressure. The residue was dissolved in EtOAc (200 mL), washed with water (2 × 100 mL), then brine solution (100 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure, and the residue was purified by flash column chromatography (DCM / MeOH = 50/1 → 20/1) to give N- (5,8,11-trioxa-2,14,16,18,19- Pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -trien-17-yl) -N, O-dimethylhydroxylamine (CXVII) (700 mg) was obtained as a colorless oil ( Yield 27%).
N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン塩酸塩(CXVIII)
N-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン(CXVII)(700mg、2.1mmol)をH2O(10mL)および0.5M HCl水溶液(4.3mL)に溶解させ、得られた溶液を凍結乾燥させてN-(5,8,11-トリオキサ-2,14,16,18,19-ペンタアザビシクロ[13.3.1]ノナデカ-1(18),15(19),16(17)-トリエン-17-イル)-N,O-ジメチルヒドロキシルアミン塩酸塩(CXVIII)(750mg)を無色油状物として得た。
N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -triene-17- Yl) -N, O-dimethylhydroxylamine hydrochloride (CXVIII)
N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -triene-17- Yl) -N, O-dimethylhydroxylamine (CXVII) (700 mg, 2.1 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (4.3 mL), and the resulting solution was lyophilized to give N- (5,8,11-trioxa-2,14,16,18,19-pentaazabicyclo [13.3.1] nonadeca-1 (18), 15 (19), 16 (17) -trien-17-yl) -N, O-dimethylhydroxylamine hydrochloride (CXVIII) (750 mg) was obtained as a colorless oil.
実施例63:
2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXX)
実施例64:
2,6-ビス-(N-n-プロピルアミノ)-[1,3]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(CXXI)
Example 63:
2,6-Bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CXX)
Example 64:
2,6-Bis- (Nn-propylamino)-[1,3] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (CXXI)
4-クロロ-2,6-ビス-[N-n-プロピルアミノ]-1,3-ピリミジン(CXIX)
EtOH中の2,4,6-トリクロロ-ピリミジン(5.00g、27.26mmol)およびn-プロピルアミン(13.5mL、163.56mmol)を60℃で24時間加熱した後、冷却した。揮発物を減圧除去した。水(100mL)を加え、得られた懸濁液をCH2Cl2(3x75mL)で抽出した。一緒にした有機抽出物を水(150mL)、次にブライン溶液(100mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去して4-クロロ-2,6-ビス-[N-n-プロピルアミノ]-1,3-ピリミジン(CXIX)(5.78g、93%)を得た。
4-Chloro-2,6-bis- [Nn-propylamino] -1,3-pyrimidine (CXIX)
2,4,6-Trichloro-pyrimidine (5.00 g, 27.26 mmol) and n-propylamine (13.5 mL, 163.56 mmol) in EtOH were heated at 60 ° C. for 24 hours and then cooled. Volatiles were removed in vacuo. Water (100 mL) was added and the resulting suspension was extracted with CH 2 Cl 2 (3 × 75 mL). The combined organic extracts were washed with water (150 mL) then brine solution (100 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure to give 4-chloro-2,6-bis- [Nn-propylamino] -1,3-pyrimidine (CXIX) (5.78 g, 93%).
(2,6-ビス-N-[n-プロピルアミノ]-ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXX)
1,4-ジオキサン(400mL)および水(20mL)中の4-クロロ-2,6-ビス-[N-n-プロピルアミノ]-1,3-ピリミジン(CXIX)(5.78g、25.27mmol)、N,O-ジメチルヒドロキシルアミン塩酸塩(4.93g、50.54mmol)およびNaOH(2.02g、50.54mmol)を60℃で24時間加熱した。N,O-ジメチルヒドロキシルアミン塩酸塩(4.93g、50.54mmol)およびNaOH(3.03g、75.81mmol)を反応混合物に加え、加熱を110℃で3日間続けた。揮発物を減圧除去した。飽和NaHCO3溶液(50mL)を残渣に加え、混合物をCH2Cl2(3x75mL)で抽出した。一緒にした有機抽出物を水(150mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(CH2Cl2/EtOH(25/1))で精製して(2,6-ビス-N-[n-プロピルアミノ]-ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXX)(1.2g、19%)を得た。
(2,6-Bis-N- [n-propylamino] -pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CXX)
4-chloro-2,6-bis- [Nn-propylamino] -1,3-pyrimidine (CXIX) (5.78 g, 25.27 mmol) in 1,4-dioxane (400 mL) and water (20 mL), N, O-dimethylhydroxylamine hydrochloride (4.93 g, 50.54 mmol) and NaOH (2.02 g, 50.54 mmol) were heated at 60 ° C. for 24 hours. N, O-dimethylhydroxylamine hydrochloride (4.93 g, 50.54 mmol) and NaOH (3.03 g, 75.81 mmol) were added to the reaction mixture and heating was continued at 110 ° C. for 3 days. Volatiles were removed in vacuo. Saturated NaHCO 3 solution (50 mL) was added to the residue and the mixture was extracted with CH 2 Cl 2 (3 × 75 mL). The combined organic extracts were washed with water (150 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure and the residue was purified by flash column chromatography (CH 2 Cl 2 / EtOH (25/1)) to give (2,6-bis-N- [n-propylamino] -pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine (CXX) (1.2 g, 19%) was obtained.
(2,6-ビス-N-[n-プロピルアミノ]-ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(CXXI)
1,4-ジオキサン(15mL)中(2,6-ビス-N-[n-プロピルアミノ]-ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(1.20g、4.74mmol)を、0℃で95% H2SO4(0.27mL、4.74mmol)を滴下して処理した。混合物を室温で0.5時間攪拌した後、揮発物を減圧除去した。得られた残渣を乾燥トルエン(3x5mL)で共蒸発させて(2,6-ビス-N-[n-プロピルアミノ]-ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(CXXI)を定量的収率で得た。
融点: 123〜126℃。
(2,6-Bis-N- [n-propylamino] -pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (CXXI)
(2,6-Bis-N- [n-propylamino] -pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (1.20 g, 4.74 mmol) in 1,4-dioxane (15 mL) was added to 0. Treated dropwise at 95 ° C. with 95% H 2 SO 4 (0.27 mL, 4.74 mmol). After the mixture was stirred at room temperature for 0.5 h, volatiles were removed under reduced pressure. The resulting residue was coevaporated with dry toluene (3 × 5 mL) to give (2,6-bis-N- [n-propylamino] -pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate ( CXXI) was obtained in quantitative yield.
Melting point: 123-126 ° C.
実施例65:
2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVI)
実施例66:
2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXVII)
Example 65:
2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVI)
Example 66:
2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXVII)
2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7H-ピロロ[2,3-d]ピリミジン(CXXII)
2-アミノ-4-クロロ-7H-ピロロ[2,3-d]ピリミジン(8.7g、52mmol)のジクロロメタン(100mL)溶液にEt3N(26g、260mmol)を加え、混合物を-30℃で攪拌した。この後、TBDMSOTf(15.1g、57.2mmol)をゆっくりと滴下し、得られた反応液を周囲温度で1.5時間攪拌した。観察された固体材料を完全に溶解させて淡褐色溶液を形成した。次に混合物を1N NaOH(100mL)で反応停止させ、DCM(250mL)で抽出した。有機層をH2O(150mL)、次にブライン溶液(150mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=10/1→5/1)で精製して2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7H-ピロロ[2,3-d]ピリミジン(CXXII、11.4g、79%)を淡黄色固体として得た。LCMS: (ESI) m/z = 283 (M+H)+。
2- (t-Butyl-dimethylsilyl) amino-4-chloro-7H-pyrrolo [2,3-d] pyrimidine (CXXII)
Et 3 N (26 g, 260 mmol) was added to a solution of 2-amino-4-chloro-7H-pyrrolo [2,3-d] pyrimidine (8.7 g, 52 mmol) in dichloromethane (100 mL) and the mixture was stirred at −30 ° C. did. After this time, TBDMSOTf (15.1 g, 57.2 mmol) was slowly added dropwise and the resulting reaction was stirred at ambient temperature for 1.5 hours. The observed solid material was completely dissolved to form a light brown solution. The mixture was then quenched with 1N NaOH (100 mL) and extracted with DCM (250 mL). The organic layer was washed with H 2 O (150 mL) then brine solution (150 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure, and the residue was purified by flash column chromatography (PE / EtOAc = 10/1 → 5/1) to give 2- (t-butyl-dimethylsilyl) amino-4-chloro-7H-pyrrolo [2 , 3-d] pyrimidine (CXXII, 11.4 g, 79%) was obtained as a pale yellow solid. LCMS: (ESI) m / z = 283 (M + H) + .
2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIII)
DMF(10mL)中の2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7H-ピロロ[2,3-d]ピリミジン(CXXII)(700mg、2.5mmol)、ヨウ化メチル0.18mL(3.5mmol)とK2CO3(552mg、4mmol)とを周囲温度で15時間反応させた。H2O(10mL)を加えた後、反応液をEtOAc(100mL)で抽出し、有機層をブライン溶液(10mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=10/1→5/1)で精製して2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIII)(750mg、100%)を淡黄色油状物として得た。LCMS (ESI) m/z = 297 (M+H)+。
2- (t-Butyl-dimethylsilyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIII)
2- (t-Butyl-dimethylsilyl) amino-4-chloro-7H-pyrrolo [2,3-d] pyrimidine (CXXII) (700 mg, 2.5 mmol), 0.18 mL of methyl iodide (3.5 mL) in DMF (10 mL) mmol) and K 2 CO 3 (552 mg, 4 mmol) were reacted at ambient temperature for 15 hours. After adding H 2 O (10 mL), the reaction was extracted with EtOAc (100 mL) and the organic layer was washed with brine solution (10 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure, and the residue was purified by flash column chromatography (PE / EtOAc = 10/1 → 5/1) to give 2- (t-butyl-dimethylsilyl) amino-4-chloro-7-methyl-pyrrolo. [2,3-d] pyrimidine (CXXIII) (750 mg, 100%) was obtained as a pale yellow oil. LCMS (ESI) m / z = 297 (M + H) + .
2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIV)
窒素雰囲気下で2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIII、5.0g、17mmol)および1-ヨードプロパン(4.3g、25mmol)をDMF(20mL)に溶解させた。反応混合物を激しく攪拌しながら0℃に冷却した後、NaH(ミネラルオイル中60%分散液1g、21mmol)を加えた。混合物を10分間攪拌し、水(50mL)をゆっくりと加えて反応液を反応停止させた。水溶液をEtOAc(200mL)で抽出し、有機層を水(50mL)およびブライン溶液(50mL)で洗浄し、最後に無水Na2SO4で乾燥させた。揮発物の蒸発後、黄色油状残渣(5.7g)を単離した。残渣をEt2O(50mL)に溶解させ、濃塩酸(10mL)を攪拌しながら0℃で加えた。混合物をさらに10分間反応させた。この後、溶液をEtOAc(200mL)および1N NaOH(200mL)で抽出した。有機層をH2O(150mL)、次にブライン溶液(150mL)で洗浄し、最後にNa2SO4で乾燥させた。溶媒を減圧除去し、得られた残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=10/1→5/1)で精製して所望の生成物2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(3.78g、100%)を黄色固体として得た。LCMS: (ESI) m/z = 225 (M+H)+。
2- (n-propyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIV)
2- (t-Butyl-dimethylsilyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIII, 5.0 g, 17 mmol) and 1-iodopropane (4.3 g, under nitrogen atmosphere) 25 mmol) was dissolved in DMF (20 mL). After the reaction mixture was cooled to 0 ° C. with vigorous stirring, NaH (1 g of a 60% dispersion in mineral oil, 21 mmol) was added. The mixture was stirred for 10 minutes and water (50 mL) was added slowly to quench the reaction. The aqueous solution was extracted with EtOAc (200 mL) and the organic layer was washed with water (50 mL) and brine solution (50 mL) and finally dried over anhydrous Na 2 SO 4 . After evaporation of the volatiles, a yellow oily residue (5.7 g) was isolated. The residue was dissolved in Et 2 O (50 mL) and concentrated hydrochloric acid (10 mL) was added at 0 ° C. with stirring. The mixture was allowed to react for an additional 10 minutes. After this time, the solution was extracted with EtOAc (200 mL) and 1N NaOH (200 mL). The organic layer was washed with H 2 O (150 mL) then brine solution (150 mL) and finally dried over Na 2 SO 4 . The solvent was removed under reduced pressure and the resulting residue was purified by flash column chromatography (PE / EtOAc = 10/1 → 5/1) to give the desired product 2- (n-propyl) amino-4-chloro-7. -Methyl-pyrrolo [2,3-d] pyrimidine (3.78 g, 100%) was obtained as a yellow solid. LCMS: (ESI) m / z = 225 (M + H) + .
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXV)
2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(1.6g、7.1mmol)のn-ブタノール(10mL)溶液に炭酸カリウム(4.9g、35.5mmol)、続いてプロパン-2-アミン(632mg、10.7mmol)を加えた。攪拌機を備えたオートクレーブ中で混合物を140℃で16時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、最後に無水Na2SO4で乾燥させた。揮発物を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=3/1)で精製して2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-メチル-ピロロ[2,3-d]ピリミジン(1.2g、75%)を黄色固体として得た。LCMS: (ESI) m/z = 248 (M+H)+。
2- (n-propyl) amino-4- (i-propyl) amino-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXV)
To a solution of 2- (n-propyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (1.6 g, 7.1 mmol) in n-butanol (10 mL) was added potassium carbonate (4.9 g, 35.5 mmol). ) Followed by propan-2-amine (632 mg, 10.7 mmol). The mixture was stirred at 140 ° C. for 16 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 50 mL). The combined organic layers were washed with water, then with a brine solution, and finally dried over anhydrous Na 2 SO 4 . Volatiles were removed under reduced pressure and the residue was purified by flash column chromatography (PE / EtOAc = 3/1) to give 2- (n-propyl) amino-4- (i-propyl) amino-7-methyl-pyrrolo [ 2,3-d] pyrimidine (1.2 g, 75%) was obtained as a yellow solid. LCMS: (ESI) m / z = 248 (M + H) <+> .
2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVI)
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXV、1.0g、4mmol)のEtOAc(50mL)溶液に10% Pd/C(1.0g)およびAcOH(2.43g、40mmol)を加えた。混合物を水素化装置に取り付け、系を排気した後、水素で再充填した。反応液を周囲温度で48時間攪拌した。この後、混合物をガラスフィルター上のシリカゲル10gの上で濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=50/1→10/1)で精製して2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVI、500mg、50%)を黄色固体として得た。
2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVI)
2- (n-propyl) amino-4- (i-propyl) amino-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXV, 1.0 g, 4 mmol) in EtOAc (50 mL) in 10% Pd / C (1.0 g) and AcOH (2.43 g, 40 mmol) were added. The mixture was attached to a hydrogenator and the system was evacuated and refilled with hydrogen. The reaction was stirred at ambient temperature for 48 hours. After this time, the mixture was filtered over 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (DCM / MeOH = 50/1 → 10/1) to give 2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVI, 500 mg, 50%) was obtained as a yellow solid.
2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXVII)
単離した遊離アミン(CXXVI、500mg、2mmol)をH2O(10mL)および0.5M HCl水溶液(4mL)に溶解させ、溶液を凍結乾燥させて2-(n-プロピル)アミノ-4-(i-プロピルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXVII、525mg)を褐色固体として得た。
2- (n-propyl) amino-4- (i-propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXVII)
The isolated free amine (CXXVI, 500 mg, 2 mmol) was dissolved in H 2 O (10 mL) and 0.5 M aqueous HCl (4 mL) and the solution was lyophilized to give 2- (n-propyl) amino-4- (i -Propylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXVII, 525 mg) was obtained as a brown solid.
実施例67:
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVIII)
実施例68:
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXIX)
Example 67:
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVIII)
Example 68:
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXIX)
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXVII)
n-ブタノール(20mL)中2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(1.0g、4.5mmol)(CXXIV)に炭酸カリウム(3.7g、27mmol)およびジメチルアミン塩酸塩(1.0g、22mmol)を加えた。攪拌機を備えたオートクレーブ中で混合物を120℃で16時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=6/1)で精製して2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXVII、800mg、76%)を黄色固体として得た。LCMS (ESI) m/z = 234 (M+H)+。
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXVII)
2- (n-propyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (1.0 g, 4.5 mmol) (CXXIV) in n-butanol (20 mL) to potassium carbonate (3.7 g, 27 mmol) and dimethylamine hydrochloride (1.0 g, 22 mmol) were added. The mixture was stirred at 120 ° C. for 16 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 50 mL). The combined organic layers were washed with water then brine solution and dried over anhydrous Na 2 SO 4 . The solvent was removed under reduced pressure and the residue was purified by flash column chromatography (PE / EtOAc = 6/1) to give 2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolo [2,3-d ] Pyrimidine (CXXVII, 800 mg, 76%) was obtained as a yellow solid. LCMS (ESI) m / z = 234 (M + H) + .
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVIII)
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXVII、800mg、3.4mmol)のEtOAc(30mL)溶液に10% Pd/C(1.0g)およびAcOH(3mL)を加え、混合物を水素化装置に取り付けた。系を排気した後、水素で再充填した。混合物を周囲温度で48時間攪拌した。混合物をガラスフィルター上のシリカゲル10gを通じて濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(EtOAc/MeOH=25/1)で精製して2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVIII、600mg、75%)を黄色固体として得た。
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVIII)
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXVII, 800 mg, 3.4 mmol) in EtOAc (30 mL) in 10% Pd / C (1.0 g ) And AcOH (3 mL) were added and the mixture was attached to a hydrogenator. The system was evacuated and then refilled with hydrogen. The mixture was stirred at ambient temperature for 48 hours. The mixture was filtered through 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (EtOAc / MeOH = 25/1) to give 2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] Pyrimidine (CXXVIII, 600 mg, 75%) was obtained as a yellow solid.
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXIX)
2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXVIII、600mg、2.6mmol)をH2O(10mL)および0.5M HCl水溶液(5.2mL)に溶解させ、溶液を凍結乾燥させて2-(n-プロピル)アミノ-4-ジメチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXIX、600mg)を黄色固体として得た。
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXIX)
2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXVIII, 600 mg, 2.6 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (5.2 mL ) And lyophilized the solution to give 2- (n-propyl) amino-4-dimethylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXIX, 600 mg) as a yellow solid It was.
実施例69:
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXXI)
実施例70:
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXXII)
Example 69:
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXXI)
Example 70:
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXXII)
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXXI)
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXX)(2.0g、9.13mmol)のEtOAc(50mL)溶液に10% Pd/C(2.1g)およびAcOH(8mL)を加え、混合物を水素化装置に取り付けた。系を排気し、水素で再充填した。混合物を周囲温度で48時間攪拌した。混合物をガラスフィルター上のシリカゲル10gを通じて濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=60/1→10/1)で精製して2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXXI、700mg、43%)を黄色固体として得た。
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXXI)
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXX) (2.0 g, 9.13 mmol) in EtOAc (50 mL) in 10% Pd / C ( 2.1 g) and AcOH (8 mL) were added and the mixture was attached to a hydrogenator. The system was evacuated and refilled with hydrogen. The mixture was stirred at ambient temperature for 48 hours. The mixture was filtered through 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (DCM / MeOH = 60/1 → 10/1) to give 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2, 3-d] pyrimidine (CXXXI, 700 mg, 43%) was obtained as a yellow solid.
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXXII)
2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(CXXX、700mg、3.2mmol)をH2O(10mL)および0.5M HCl水溶液(7mL)に溶解させ、溶液を凍結乾燥させて2-(n-プロピル)アミノ-4-メチルアミノ-7-メチル-ピロリジノ[2,3-d]ピリミジン(717mg)を褐色固体として得た。
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXXII)
2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (CXXX, 700 mg, 3.2 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (7 mL) And the solution was lyophilized to give 2- (n-propyl) amino-4-methylamino-7-methyl-pyrrolidino [2,3-d] pyrimidine (717 mg) as a brown solid.
実施例71:
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン(CXXXVI)
実施例72:
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXXVII)
Example 71:
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine (CXXXVI)
Example 72:
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXXVII)
2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXIII)
DMF(20mL)中の2-(t-ブチル-ジメチルシラニル)アミノ-4-クロロ-7H-ピロロ[2,3-d]ピリミジン(CXXII)(5g、17.7mmol)、2-ヨードプロパン(4.5g、26.6mmol)およびK2CO3(4.3g、26.6mmol)を周囲温度で15時間反応させた。H2O(50mL)を反応混合物に加えた後、水溶液をEtOAc(300mL)で抽出し、有機層をブライン溶液(50mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=10/1→5/1)で精製して2-(t-ブチル-ジメチルシリル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXIII、5.7g、100%)を淡黄色油状物として得た。LCMS: (ESI) m/z = 325 (M+H)+。
2- (t-Butyl-dimethylsilyl) amino-4-chloro-7-i-propyl-pyrrolo [2,3-d] pyrimidine (CXXXIII)
2- (t-Butyl-dimethylsilanyl) amino-4-chloro-7H-pyrrolo [2,3-d] pyrimidine (CXXII) (5 g, 17.7 mmol), 2-iodopropane (4.5) in DMF (20 mL). g, 26.6 mmol) and K 2 CO 3 (4.3 g, 26.6 mmol) were reacted at ambient temperature for 15 hours. After adding H 2 O (50 mL) to the reaction mixture, the aqueous solution was extracted with EtOAc (300 mL) and the organic layer was washed with brine solution (50 mL) and dried over Na 2 SO 4 . The solvent was removed under reduced pressure, and the residue was purified by flash column chromatography (petroleum ether / EtOAc = 10/1 → 5/1) to give 2- (t-butyl-dimethylsilyl) amino-4-chloro-7-i- Propyl-pyrrolo [2,3-d] pyrimidine (CXXXIII, 5.7 g, 100%) was obtained as a pale yellow oil. LCMS: (ESI) m / z = 325 (M + H) + .
2-(n-プロピル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXIV)
窒素雰囲気下で2-(t-ブチル-ジメチルシラニル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(5.7g、17.6mmol)および1-ヨードプロパン(4.5g、26.4mmol)をDMF(20mL)に溶解させた。反応混合物を激しく攪拌しながら0℃に冷却し、NaH(ミネラルオイル中60%分散液1.06g、26.4mmol)(60%)を加えた。混合物を10分間攪拌した後、水(50mL)をゆっくりと加えて反応液を反応停止させた。混合物をEtOAc(300mL)で抽出し、有機層を水(50mL)、次にブライン溶液(50mL)で洗浄し、最後に無水Na2SO4で乾燥させた。溶媒の蒸発後、黄色油状残渣を単離した(6.5g)。残渣をEt2O(50mL)に溶解させ、濃塩酸(10mL)を攪拌しながら0℃で加え、混合物をさらに10分間攪拌した。反応が完了した後、溶液をEtOAc(200mL)および1N NaOH(200mL)で抽出した。有機層をH2O(150mL)、次にブライン溶液(150mL)で洗浄し、Na2SO4で乾燥させた。溶媒を減圧濃縮し、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=10/1→5/1)で精製して2-(n-プロピル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXIV、4.5g、100%)を黄色固体として得た。LCMS (ESI) m/z = 253 (M+H)+。
2- (n-propyl) amino-4-chloro-7-i-propyl-pyrrolo [2,3-d] pyrimidine (CXXXIV)
2- (t-butyl-dimethylsilanyl) amino-4-chloro-7-i-propyl-pyrrolo [2,3-d] pyrimidine (5.7 g, 17.6 mmol) and 1-iodopropane (4.5) under nitrogen atmosphere g, 26.4 mmol) was dissolved in DMF (20 mL). The reaction mixture was cooled to 0 ° C. with vigorous stirring and NaH (60% dispersion in mineral oil 1.06 g, 26.4 mmol) (60%) was added. After the mixture was stirred for 10 minutes, water (50 mL) was slowly added to quench the reaction. The mixture was extracted with EtOAc (300 mL) and the organic layer was washed with water (50 mL) then brine solution (50 mL) and finally dried over anhydrous Na 2 SO 4 . After evaporation of the solvent, a yellow oily residue was isolated (6.5 g). The residue was dissolved in Et 2 O (50 mL), concentrated hydrochloric acid (10 mL) was added at 0 ° C. with stirring, and the mixture was stirred for an additional 10 minutes. After the reaction was complete, the solution was extracted with EtOAc (200 mL) and 1N NaOH (200 mL). The organic layer was washed with H 2 O (150 mL) then brine solution (150 mL) and dried over Na 2 SO 4 . The solvent was concentrated under reduced pressure, and the residue was purified by flash column chromatography (PE / EtOAc = 10/1 → 5/1) to give 2- (n-propyl) amino-4-chloro-7-i-propyl-pyrrolo [ 2,3-d] pyrimidine (CXXXIV, 4.5 g, 100%) was obtained as a yellow solid. LCMS (ESI) m / z = 253 (M + H) + .
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXV)
n-ブタノール(10mL)中2-(n-プロピル)アミノ-4-クロロ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXIV、3.0g、12mmol)にプロパン-2-アミン(1.05g、18mmol)および炭酸カリウム(2.5g、18mmol)を加えた。攪拌機を備えたオートクレーブ中で得られた混合物を140℃で16時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去した後、残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=5/1→3/1)で精製して2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(CXXXV、1.2g、36%)を黄色固体として得た。LCMS: (ESI) m/z = 276 (M+H)+。
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolo [2,3-d] pyrimidine (CXXXV)
2- (n-Propyl) amino-4-chloro-7-i-propyl-pyrrolo [2,3-d] pyrimidine (CXXXIV, 3.0 g, 12 mmol) in n-butanol (10 mL) to propan-2-amine ( 1.05 g, 18 mmol) and potassium carbonate (2.5 g, 18 mmol) were added. The resulting mixture in an autoclave equipped with a stirrer was stirred at 140 ° C. for 16 hours. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 50 mL). The combined organic layers were washed with water then brine solution and dried over anhydrous Na 2 SO 4 . After removing the solvent under reduced pressure, the residue was purified by flash column chromatography (PE / EtOAc = 5/1 → 3/1) to give 2- (n-propyl) amino-4- (i-propyl) amino-7- i-Propyl-pyrrolo [2,3-d] pyrimidine (CXXXV, 1.2 g, 36%) was obtained as a yellow solid. LCMS: (ESI) m / z = 276 (M + H) + .
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン(CXXXVI)
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(1.0g、3.6mmol)のEtOAc(10mL)溶液に10% Pd/C(1.0g)およびAcOH(2.43g、40mmol)を加えた。混合物を水素化装置に取り付けた。系を排気し、水素ガスで再充填した。混合物を周囲温度で48時間攪拌し、ガラスフィルター上のシリカゲル10gを通じて濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=100/1→20/1)で精製して2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン(CXXXVI)(800mg、79%)を黄色固体として得た。
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine (CXXXVI)
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolo [2,3-d] pyrimidine (1.0 g, 3.6 mmol) in EtOAc (10 mL) in 10% Pd / C (1.0 g) and AcOH (2.43 g, 40 mmol) were added. The mixture was attached to a hydrogenator. The system was evacuated and refilled with hydrogen gas. The mixture was stirred at ambient temperature for 48 hours and filtered through 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (DCM / MeOH = 100/1 → 20/1) to give 2- (n-propyl) amino-4- (i-propyl) amino-7-i- Propyl-pyrrolidino [2,3-d] pyrimidine (CXXXVI) (800 mg, 79%) was obtained as a yellow solid.
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CXXXVII)
2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロロ[2,3-d]ピリミジン(200mg、0.72mmol)をH2O(10mL)および0.5M HCl水溶液(1.5mL)に溶解させ、次に溶液を凍結乾燥させて2-(n-プロピル)アミノ-4-(i-プロピル)アミノ-7-i-プロピル-ピロリジノ[2,3-d]ピリミジン塩酸塩(225mg、95%)を黄色固体として得た。
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CXXXVII)
2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolo [2,3-d] pyrimidine (200 mg, 0.72 mmol) in H 2 O (10 mL) and 0.5 M HCl Dissolve in aqueous solution (1.5 mL) and then freeze-dry the solution to give 2- (n-propyl) amino-4- (i-propyl) amino-7-i-propyl-pyrrolidino [2,3-d] pyrimidine The hydrochloride salt (225 mg, 95%) was obtained as a yellow solid.
実施例73: N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXLI)
実施例74: N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXLII)
Example 73: N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CXLI)
Example 74: N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXLII)
2-アミノ-4-オキソ-4,7-ジヒドロ-3H-ピロロ[2,3d]ピリミジン(CXXXVIII)
2,4-ジアミノ-6-ヒドロキシピリミジン(50g、397mmol)のH2O(750mL)溶液に2-クロロアセトアルデヒド(H2O中40%、85g、437mmol)を0℃で滴下した。混合物を65℃で2時間攪拌した後、反応が完了するまで100℃で加熱した。得られた固体を濾過し、残渣をEtOH(750mL)中で加熱還流させた。さらなる固体を濾過し、母液を濃縮して2-アミノ-4-オキソ-4,7-ジヒドロ-3H-ピロロ[2,3d]ピリミジン(CXXXVIII)を黄色固体40g(約67%、純度約70%)として得た。LCMS (ESI) m/z = 151 (M+H)+。
2-Amino-4-oxo-4,7-dihydro-3H-pyrrolo [2,3d] pyrimidine (CXXXVIII)
To a solution of 2,4-diamino-6-hydroxypyrimidine (50 g, 397 mmol) in H 2 O (750 mL) was added 2-chloroacetaldehyde (40% in H 2 O, 85 g, 437 mmol) dropwise at 0 ° C. The mixture was stirred at 65 ° C. for 2 hours and then heated at 100 ° C. until the reaction was complete. The resulting solid was filtered and the residue was heated to reflux in EtOH (750 mL). Further solids were filtered and the mother liquor was concentrated to give 2-amino-4-oxo-4,7-dihydro-3H-pyrrolo [2,3d] pyrimidine (CXXXVIII) as a yellow solid 40 g (about 67%, purity about 70% ). LCMS (ESI) m / z = 151 (M + H) + .
2-アミノ-4-クロロ-7H-ピロロ[2,3d]ピリミジン(CXXXIX)
2-アミノ-4-オキソ-4,7-ジヒドロ-3H-ピロロ[2,3d]ピリミジン(CXXXVIII、25g、167mmol)をPOCl3(200mL)に懸濁させ、氷浴中で冷却した。混合物をゆっくりと昇温させ、120℃に3時間加熱した。この後、揮発物(過剰のPOCl3)を減圧蒸発させた。この残渣に氷水(200mL)を加え、得られた固体を濾過して2-アミノ-4-クロロ-7H-ピロロ[2,3d]ピリミジン(CXXXIX)を黄色固体(20g、約71%、純度約75%)として得た。LCMS (ESI) m/z = 169 (M+H)+。
2-Amino-4-chloro-7H-pyrrolo [2,3d] pyrimidine (CXXXIX)
2-Amino-4-oxo-4,7-dihydro-3H-pyrrolo [2,3d] pyrimidine (CXXXVIII, 25 g, 167 mmol) was suspended in POCl 3 (200 mL) and cooled in an ice bath. The mixture was allowed to warm slowly and heated to 120 ° C. for 3 hours. After this time, volatiles (excess POCl 3 ) were evaporated under reduced pressure. Ice water (200 mL) was added to the residue, and the resulting solid was filtered to give 2-amino-4-chloro-7H-pyrrolo [2,3d] pyrimidine (CXXXIX) as a yellow solid (20 g, about 71%, purity about 75%). LCMS (ESI) m / z = 169 (M + H) + .
4-クロロ-2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン(CXL)
2-アミノ-4-クロロ-7H-ピロロ[2,3d]ピリミジン(CXXXIX、26g、155mmol)およびn-プロピオンアルデヒド(27g、464mmol)のMeOH(600mL)溶液にAcOH(50mL)を加えた。反応液を周囲温度で30分間攪拌した。この後、NaBH3CN(49g、775mmol)を少しずつ-20℃で30分間加えた。得られた混合物を80℃で3時間攪拌し、揮発物を除去した。得られた残渣をEtOAc(3x300mL)で抽出し、一緒にした有機物をブライン溶液(2x100mL)で洗浄した。有機層をNa2SO4で乾燥させ、濃縮し、シリカゲルカラムクロマトグラフィー(石油エーテル/EtOAc(5/1))で精製して4-クロロ-2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン(CXL)を黄色固体(6g、18%)として得た。LCMS (ESI) m/z = 211 (M+H)+。
4-Chloro-2-n-propylamino-7H-pyrrolo [2,3d] pyrimidine (CXL)
AcOH (50 mL) was added to a solution of 2-amino-4-chloro-7H-pyrrolo [2,3d] pyrimidine (CXXXIX, 26 g, 155 mmol) and n-propionaldehyde (27 g, 464 mmol) in MeOH (600 mL). The reaction was stirred at ambient temperature for 30 minutes. After this time, NaBH 3 CN (49 g, 775 mmol) was added in portions at −20 ° C. for 30 minutes. The resulting mixture was stirred at 80 ° C. for 3 hours to remove volatiles. The resulting residue was extracted with EtOAc (3 × 300 mL) and the combined organics were washed with brine solution (2 × 100 mL). The organic layer was dried over Na 2 SO 4 , concentrated and purified by silica gel column chromatography (petroleum ether / EtOAc (5/1)) to give 4-chloro-2-n-propylamino-7H-pyrrolo [2, 3d] pyrimidine (CXL) was obtained as a yellow solid (6 g, 18%). LCMS (ESI) m / z = 211 (M + H) + .
N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXLI)
4-クロロ-2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン(CXL、1.0g、4.8mmol)のn-BuOH(5mL)溶液に炭酸カリウム(3.3g、5.0当量)およびN,O-ジメチルヒドロキシルアミン塩酸塩(1.1g、4.0当量)を加えた。攪拌機を備えたオートクレーブ中で混合物を100℃で8時間攪拌した。周囲温度に冷却後、水(20mL)を加え、混合物をEtOAc(3x25mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去し、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=5/1)で精製してN-(2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXLI、500mg、45%)を得た。
N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CXLI)
4-Chloro-2-n-propylamino-7H-pyrrolo [2,3d] pyrimidine (CXL, 1.0 g, 4.8 mmol) in n-BuOH (5 mL) was added potassium carbonate (3.3 g, 5.0 eq) and N, O-dimethylhydroxylamine hydrochloride (1.1 g, 4.0 eq) was added. The mixture was stirred at 100 ° C. for 8 hours in an autoclave equipped with a stirrer. After cooling to ambient temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 25 mL). The combined organic layers were washed with water then brine solution and dried over anhydrous Na 2 SO 4 . The solvent was removed under reduced pressure, and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 5/1) to give N- (2-n-propylamino-7H-pyrrolo [2,3d] pyrimidine-4. -Yl) -N, O-dimethyl-hydroxylamine (CXLI, 500 mg, 45%) was obtained.
N-(2-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CXLII)
N-(2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CXLI、500mg、2.1mmol)をH2O(10mL)および0.5M HCl水溶液(5mL)に溶解させた。次に溶液を凍結乾燥させてN-(2-n-プロピルアミノ-7H-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩を白色固体として(CXLII、550mg)得た。
N- (2-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CXLII)
N- (2-n-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CXLI, 500 mg, 2.1 mmol) with H 2 O (10 mL) and 0.5 Dissolved in M HCl aqueous solution (5 mL). The solution was then lyophilized to give N- (2-n-propylamino-7H-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride as a white solid (CXLII, 550 mg).
実施例75: 2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン(CXLIX)Example 75: 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine (CXLIX)
実施例76: 2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン塩酸塩(CL)Example 76: 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine hydrochloride (CL)
5-アリル-2-アミノ-4,6-ジヒドロキシピリミジン(CXLIII)
冷無水EtOH(200mL)およびNaOEt(エタノール中30%)(200mL)にグアニジン塩酸塩(27g、0.28mol)を加え、混合物を0℃で10分間攪拌した。この後、アリルマロン酸ジエチル(55g、0.28mol)を加えた。次に反応混合物を室温で18時間攪拌した。3N HClでの酸性化によって粗生成物(pH=6)が析出した。固体を濾取し、エタノールで洗浄した。水からの再結晶によって純粋な5-アリル-2-アミノ-4,6-ジヒドロキシピリミジン(CXLIII)29g(62%)を得た。LCMS (ESI) m/z = 168 (M+H)+。
5-Allyl-2-amino-4,6-dihydroxypyrimidine (CXLIII)
To cold anhydrous EtOH (200 mL) and NaOEt (30% in ethanol) (200 mL) was added guanidine hydrochloride (27 g, 0.28 mol) and the mixture was stirred at 0 ° C. for 10 min. This was followed by the addition of diethyl allylmalonate (55 g, 0.28 mol). The reaction mixture was then stirred at room temperature for 18 hours. Acidification with 3N HCl precipitated the crude product (pH = 6). The solid was collected by filtration and washed with ethanol. Recrystallization from water gave 29 g (62%) of pure 5-allyl-2-amino-4,6-dihydroxypyrimidine (CXLIII). LCMS (ESI) m / z = 168 (M + H) + .
5-アリル-2-アミノ-4,6-クロロピリミジン(CXLIV)
PCl5(6.6g、29.5mmol)のPOCl3(180mL)溶液に5-アリル-2-アミノ-4,6-ジヒドロキシピリミジン(4.9g、28.0mmol)を60℃で少しずつ加え、ジエチルアニリン(3g)を滴下した。温度を120℃に上昇させた。反応混合物を終夜加熱還流させた後、蒸発乾固させた。熱水(100℃)(100mL)を残渣にゆっくりと加え、得られた懸濁液を冷却し、CH2Cl2(2x100mL)で抽出した。水性抽出物がpH=5超になるまで、一緒にした有機層を冷水で3回洗浄した。有機層を乾燥させ(Na2SO4)、減圧蒸発乾固させた。得られた残渣をカラムクロマトグラフィー(EtOAc/石油エーテル=1:10)で精製して5-アリル-2-アミノ-4,6-クロロピリミジン(CXLIV、2.5g、42%)を得た。LCMS (ESI) m/z = 204 (M+H)+。
5-Allyl-2-amino-4,6-chloropyrimidine (CXLIV)
To a solution of PCl 5 (6.6 g, 29.5 mmol) in POCl 3 (180 mL), 5-allyl-2-amino-4,6-dihydroxypyrimidine (4.9 g, 28.0 mmol) was added little by little at 60 ° C., and diethylaniline (3 g ) Was added dropwise. The temperature was raised to 120 ° C. The reaction mixture was heated to reflux overnight and then evaporated to dryness. Hot water (100 ° C.) (100 mL) was slowly added to the residue and the resulting suspension was cooled and extracted with CH 2 Cl 2 ( 2 × 100 mL). The combined organic layers were washed 3 times with cold water until the aqueous extract was above pH = 5. The organic layer was dried (Na 2 SO 4 ) and evaporated to dryness under reduced pressure. The resulting residue was purified by column chromatography (EtOAc / petroleum ether = 1: 10) to give 5-allyl-2-amino-4,6-chloropyrimidine (CXLIV, 2.5 g, 42%). LCMS (ESI) m / z = 204 (M + H) + .
2-(2-アミノ-4,6-クロロピリミジン-5-イル)エタナール(CXLV)
5-アリル-2-アミノ-4,6-クロロピリミジン(1g、4.9mmol)を酢酸エチル(40mL)に溶解させ、オゾンガスと-78℃で約1時間反応させた(速度1L/分の約5%オゾン)。反応をTLC(石油エーテル/AcOEt=3/1(v/v))でモニタリングし、出発原料が消費された時点で反応混合物を酸素で10分間洗い流した。この時点で冷反応混合物にNaI(3g)および氷酢酸(3mL)を同時に加え、連続的に攪拌しながら温度を60分かけて20℃に昇温させた。反応混合物が無色になるまでチオ硫酸ナトリウム溶液(67g/H2O 100mL)をそれに加えた。得られた混合物を水(30mL)で希釈し、CH2Cl2(4x70mL)で抽出した。一緒にした有機抽出物をH2O(4x30mL)、飽和NaHCO3溶液(30mL)およびブライン溶液(30mL)で連続して洗浄し、最後に無水Na2SO4で乾燥させた。濾過および蒸発後、2-(2-アミノ-4,6-クロロピリミジン-5-イル)エタナール(CXLV、1.1g、87%)を白色固体として純度約80%で単離した。LCMS (ESI) m/z = 207 (M+H)+。
2- (2-Amino-4,6-chloropyrimidin-5-yl) ethanal (CXLV)
5-Allyl-2-amino-4,6-chloropyrimidine (1 g, 4.9 mmol) was dissolved in ethyl acetate (40 mL) and reacted with ozone gas at −78 ° C. for about 1 hour (rate about 1 L / min about 5 %ozone). The reaction was monitored by TLC (petroleum ether / AcOEt = 3/1 (v / v)) and when the starting material was consumed, the reaction mixture was flushed with oxygen for 10 minutes. At this point, NaI (3 g) and glacial acetic acid (3 mL) were added simultaneously to the cold reaction mixture and the temperature was raised to 20 ° C. over 60 minutes with continuous stirring. Sodium thiosulfate solution (67 g / H 2 O 100 mL) was added to it until the reaction mixture became colorless. The resulting mixture was diluted with water (30 mL) and extracted with CH 2 Cl 2 (4 × 70 mL). The combined organic extracts were washed successively with H 2 O (4 × 30 mL), saturated NaHCO 3 solution (30 mL) and brine solution (30 mL) and finally dried over anhydrous Na 2 SO 4 . After filtration and evaporation, 2- (2-amino-4,6-chloropyrimidin-5-yl) ethanal (CXLV, 1.1 g, 87%) was isolated as a white solid with a purity of about 80%. LCMS (ESI) m / z = 207 (M + H) + .
2-アミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVI)
2-(2-アミノ-4,6-クロロピリミジン-5-イル)エタナール(CXLV、1.2g、5.8mmol)およびパラ-メトキシベンジルアミン(PMBNH2)(1.6g、11.6mmol)のTHF(20mL)およびAcOH(2mL)溶液を周囲温度で30分間攪拌した。この混合物にNaBH(OAc)3(6.2g、29mmol)を少しずつ加え、反応液を終夜攪拌した。混合物を減圧濃縮し、EtOAc(3x80mL)で抽出した。次に一緒にした有機抽出物をブライン溶液(2x50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧濃縮した。得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=10/1)で精製して2-アミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVI、950mg、52%)を黄色固体(52%)として得た。LCMS (ESI) m/z = 291 (M+H)+。
2-Amino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] pyrimidine (CXLVI)
2- (2-amino-4,6-chloropyrimidin-5-yl) ethanal (CXLV, 1.2 g, 5.8 mmol) and para-methoxybenzylamine (PMBNH 2 ) (1.6 g, 11.6 mmol) in THF (20 mL) And AcOH (2 mL) solution was stirred at ambient temperature for 30 min. To this mixture was added NaBH (OAc) 3 (6.2 g, 29 mmol) little by little and the reaction was stirred overnight. The mixture was concentrated under reduced pressure and extracted with EtOAc (3 × 80 mL). The combined organic extracts were then washed with brine solution (2 × 50 mL), dried over anhydrous Na 2 SO 4 , filtered and concentrated under reduced pressure. The resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 10/1) to give 2-amino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] pyrimidine ( CXLVI, 950 mg, 52%) was obtained as a yellow solid (52%). LCMS (ESI) m / z = 291 (M + H) + .
2-n-プロピルアミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVII)
MeOH(30mL)およびAcOH(3mL)中の2-アミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVI、950mg、3.3mmol)およびプロピオンアルデヒド(575mg、16.5mmol)を周囲温度で30分間攪拌した。この時点でNaBH3CN(1.0g、16.5mmol)を少しずつ加えた後、反応液を85℃で16時間加熱した。冷却後、混合物を蒸発させ、EtOAc(2x50mL)で抽出した。次に一緒にした有機物をブライン溶液(2x50mL)で洗浄した。有機層を無水Na2SO4で乾燥させ、濾過し、減圧濃縮した。得られた残渣をフラッシュカラムクロマトグラフィー(PE/EtOAc=10/1)で精製して2-n-プロピルアミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVII、920mg、85%)を得た。LCMS (ESI) m/z = 333 (M+H)+。
2-n-propylamino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] pyrimidine (CXLVII)
2-Amino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] pyrimidine (CXLVI, 950 mg, 3.3 mmol) and propionaldehyde (575 mg) in MeOH (30 mL) and AcOH (3 mL) 16.5 mmol) at ambient temperature for 30 minutes. At this point, NaBH 3 CN (1.0 g, 16.5 mmol) was added in portions and the reaction was heated at 85 ° C. for 16 hours. After cooling, the mixture was evaporated and extracted with EtOAc (2 × 50 mL). The combined organics were then washed with brine solution (2 × 50 mL). The organic layer was dried over anhydrous Na 2 SO 4 , filtered and concentrated under reduced pressure. The resulting residue was purified by flash column chromatography (PE / EtOAc = 10/1) to give 2-n-propylamino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] Pyrimidine (CXLVII, 920 mg, 85%) was obtained. LCMS (ESI) m / z = 333 (M + H) + .
2-n-プロピルアミノ-4-クロロ-7H-ピロリジノ[2,3-d]ピリミジン(CXLVIII)
2-n-プロピルアミノ-4-クロロ-7-(4-メトキシ)ベンジル-ピロリジノ[2,3-d]ピリミジン(CXLVII、920mg、3.2mmol)のTFA(5mL)溶液を85℃で3時間加熱した。冷却後、混合物を蒸発させ、EtOAc(2x50mL)で抽出した。一緒にした有機物をブライン溶液(2x50mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧濃縮した。得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=5/1)で精製して2-n-プロピルアミノ-4-クロロ-7H-ピロリジノ[2,3-d]ピリミジン(CXLVIII、500mg、85%)を無色固体として得た。LCMS (ESI) m/z = 213 (M+H)+。
2-n-propylamino-4-chloro-7H-pyrrolidino [2,3-d] pyrimidine (CXLVIII)
A solution of 2-n-propylamino-4-chloro-7- (4-methoxy) benzyl-pyrrolidino [2,3-d] pyrimidine (CXLVII, 920 mg, 3.2 mmol) in TFA (5 mL) was heated at 85 ° C. for 3 hours did. After cooling, the mixture was evaporated and extracted with EtOAc (2 × 50 mL). The combined organics were washed with brine solution (2 × 50 mL), dried over Na 2 SO 4 , filtered and concentrated under reduced pressure. The resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 5/1) to give 2-n-propylamino-4-chloro-7H-pyrrolidino [2,3-d] pyrimidine (CXLVIII, 500 mg, 85%) was obtained as a colorless solid. LCMS (ESI) m / z = 213 (M + H) + .
2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン(CXLIX)
2-n-プロピルアミノ-4-クロロ-7H-ピロリジノ[2,3-d]ピリミジン(CXLVIII、500mg、2.38mmol)をn-ブタノール(5mL)に溶解させ、炭酸カリウム(1.64g、5.0当量)およびプロパン-1-アミン(923mg、4.0当量)を加えた。攪拌機を備えたオートクレーブ中で混合物を100℃で72時間攪拌した。室温に冷却後、水20mLを加え、混合物をEtOAc(3x20mL)で抽出した。一緒にした有機層を水およびブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒の減圧除去後、得られた残渣を分取HPLCで精製して2-n-プロピルアミノ-4-クロロ-7H-ピロリジノ[2,3-d]ピリミジン(CXLIX、210mg、収率37%)を得た。
2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine (CXLIX)
2-n-propylamino-4-chloro-7H-pyrrolidino [2,3-d] pyrimidine (CXLVIII, 500 mg, 2.38 mmol) is dissolved in n-butanol (5 mL) and potassium carbonate (1.64 g, 5.0 eq) And propan-1-amine (923 mg, 4.0 eq) were added. The mixture was stirred at 100 ° C. for 72 hours in an autoclave equipped with a stirrer. After cooling to room temperature, 20 mL of water was added and the mixture was extracted with EtOAc (3 × 20 mL). The combined organic layers were washed with water and brine solution and dried over anhydrous Na 2 SO 4 . After removing the solvent under reduced pressure, the resulting residue was purified by preparative HPLC to give 2-n-propylamino-4-chloro-7H-pyrrolidino [2,3-d] pyrimidine (CXLIX, 210 mg, 37% yield) Got.
2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン塩酸塩(CL)
2-n-プロピルアミノ-4-クロロ-7H-ピロリジノ[2,3-d]ピリミジン(CXLIX、210mg、0.89mmol)をH2O(5mL)および0.5M HCl水溶液(2.0mL)に溶解させ、溶液を凍結乾燥させて2,4-ビス-(n-プロピル)アミノ-7H-ピロリジノ[2,3-d]ピリミジン塩酸塩(CL、242mg、収率95%)を橙色固体として得た。
2,4-Bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine hydrochloride (CL)
2-n-propylamino-4-chloro-7H-pyrrolidino [2,3-d] pyrimidine (CXLIX, 210 mg, 0.89 mmol) was dissolved in H 2 O (5 mL) and 0.5 M aqueous HCl (2.0 mL), The solution was lyophilized to give 2,4-bis- (n-propyl) amino-7H-pyrrolidino [2,3-d] pyrimidine hydrochloride (CL, 242 mg, 95% yield) as an orange solid.
実施例77:
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン(CLII)
実施例78:
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CLIII)
Example 77:
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine (CLII)
Example 78:
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CLIII)
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロロ[2,3-d]ピリミジン(CLI)
n-ブタノール(10mL)に2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIV)(1.6g、7.1mmol)、続いて炭酸カリウム(4.9g、35.5mmol)およびピペリジン-4-オール塩酸塩(632mg、10.7mmol)を加えた。攪拌機を備えたオートクレーブ中で混合物を130℃で16時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去し、残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=3/1)で精製して2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロロ[2,3-d]ピリミジン(1.2g、75%)を黄色固体として得た。LCMS (ESI) m/z = 290 (M+H)+。
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolo [2,3-d] pyrimidine (CLI)
n-Butanol (10 mL) to 2- (n-propyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIV) (1.6 g, 7.1 mmol) followed by potassium carbonate (4.9 g, 35.5 mmol) and piperidin-4-ol hydrochloride (632 mg, 10.7 mmol) were added. The mixture was stirred at 130 ° C. for 16 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 50 mL). The combined organic layers were washed with water then brine solution and dried over anhydrous Na 2 SO 4 . The solvent was removed under reduced pressure and the residue was purified by flash column chromatography (petroleum ether / EtOAc = 3/1) to give 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7- Methyl-pyrrolo [2,3-d] pyrimidine (1.2 g, 75%) was obtained as a yellow solid. LCMS (ESI) m / z = 290 (M + H) + .
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン(CLII)
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロロ[2,3-d]ピリミジン(CLI、1.0g、4mmol)のEtOAc(50mL)溶液に10% Pd/C(1.0g)およびAcOH(2.43g、40mmol)を加えた。混合物を水素化装置に取り付けた。系を排気し、水素ガスで再充填した。混合物を周囲温度で48時間攪拌した。混合物をガラスフィルター上のシリカゲル10gを通じて濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=50/1→10/1)で精製して2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン(CLII、500mg、収率50%)を黄色固体として得た。
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine (CLII)
To a solution of 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolo [2,3-d] pyrimidine (CLI, 1.0 g, 4 mmol) in EtOAc (50 mL) 10% Pd / C (1.0 g) and AcOH (2.43 g, 40 mmol) were added. The mixture was attached to a hydrogenator. The system was evacuated and refilled with hydrogen gas. The mixture was stirred at ambient temperature for 48 hours. The mixture was filtered through 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (DCM / MeOH = 50/1 → 10/1) to give 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl)- 7-methyl-pyrrolidino [2,3-d] pyrimidine (CLII, 500 mg, 50% yield) was obtained as a yellow solid.
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(CLIII)
2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン(CLII、500mg、2mmol)をH2O(10mL)、およびH2O中0.5M HCl溶液(4mL)に溶解させ、溶液を凍結乾燥させて2-(n-プロピル)アミノ-4-(4-ヒドロキシピペリジン-1-イル)-7-メチル-ピロリジノ[2,3-d]ピリミジン塩酸塩(525mg)を黄色固体として得た。
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine hydrochloride (CLIII)
2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [2,3-d] pyrimidine (CLII, 500 mg, 2 mmol) in H 2 O (10 mL), And 0.5M HCl solution in H 2 O (4 mL) and the solution lyophilized to give 2- (n-propyl) amino-4- (4-hydroxypiperidin-1-yl) -7-methyl-pyrrolidino [ 2,3-d] pyrimidine hydrochloride (525 mg) was obtained as a yellow solid.
実施例79:
8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLV)
実施例80:
8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール塩酸塩(CLVI)
Example 79
8- (7-Methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLV)
Example 80
8- (7-Methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol hydrochloride (CLVI)
8-(7-メチル-2-(n-プロピルアミノ)-7H-ピロロ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLIV)
2-(n-プロピル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIV)(1.0g、4.5mmol)のn-ブタノール(10mL)溶液にDIPEA(1.0g、7.8mmol)および8-アザ-ビシクロ[3.2.1]オクタン-3-オール塩酸塩(1.1g、6.7mmol)を加えた。混合物を125℃で16時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機層を水、次にブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧蒸発させ、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=6/1)で精製して8-(7-メチル-2-(n-プロピルアミノ)-7H-ピロロ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLIV)(800mg、収率57%)を黄色固体として得た。LCMS (ESI) m/z = 316 (M+H)+。
8- (7-Methyl-2- (n-propylamino) -7H-pyrrolo [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLIV)
2- (n-propyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIV) (1.0 g, 4.5 mmol) in n-butanol (10 mL) in DIPEA (1.0 g, 7.8 mmol) and 8-aza-bicyclo [3.2.1] octan-3-ol hydrochloride (1.1 g, 6.7 mmol) were added. The mixture was stirred at 125 ° C. for 16 hours. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 50 mL). The combined organic layers were washed with water then brine solution and dried over anhydrous Na 2 SO 4 . The solvent was evaporated under reduced pressure and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 6/1) to give 8- (7-methyl-2- (n-propylamino) -7H-pyrrolo [2 , 3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLIV) (800 mg, 57% yield) was obtained as a yellow solid. LCMS (ESI) m / z = 316 (M + H) + .
8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLV)
2-(n-プロピル)アミノ-4-(4-ヒドロキシ-1-アザ-ビシクロ[3.2.1]オクタン-1-イル)-7-メチル-ピロロ[2,3-d]ピリミジン(CLIV、1.00g、3.2mmol)のEtOAc(10mL)溶液に10% Pd/C(1.0g)およびAcOH(3mL)を加えた。混合物を水素化装置に取り付けた。系を排気し、水素で再充填した。混合物を周囲温度で48時間攪拌した。混合物をガラスフィルター上のシリカゲル10gを通じて濾過した。濾液を濃縮し、残渣をフラッシュカラムクロマトグラフィー(EtOAc/MeOH=50/1)で精製して8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLV)(500mg、収率49%)を黄色固体として得た。
8- (7-Methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLV)
2- (n-propyl) amino-4- (4-hydroxy-1-aza-bicyclo [3.2.1] octan-1-yl) -7-methyl-pyrrolo [2,3-d] pyrimidine (CLIV, 1.00 g, 3.2 mmol) in EtOAc (10 mL) was added 10% Pd / C (1.0 g) and AcOH (3 mL). The mixture was attached to a hydrogenator. The system was evacuated and refilled with hydrogen. The mixture was stirred at ambient temperature for 48 hours. The mixture was filtered through 10 g of silica gel on a glass filter. The filtrate was concentrated and the residue was purified by flash column chromatography (EtOAc / MeOH = 50/1) to give 8- (7-methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidine- 4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLV) (500 mg, 49% yield) was obtained as a yellow solid.
8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール塩酸塩(CLVI)
8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール(CLV、200mg、0.63mmol)をH2O(10mL)および0.5M HCl水溶液(1.3mL)に溶解させ、溶液を凍結乾燥させて8-(7-メチル-2-(n-プロピルアミノ)-ピロリジノ[2,3-d]ピリミジン-4-イル)-8-アザビシクロ[3.2.1]オクタン-3-オール塩酸塩(CLVI)(224mg)を黄色固体として得た。
8- (7-Methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol hydrochloride (CLVI)
8- (7-Methyl-2- (n-propylamino) -pyrrolidino [2,3-d] pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol (CLV, 200 mg, 0.63 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (1.3 mL), and the solution was lyophilized to give 8- (7-methyl-2- (n-propylamino) -pyrrolidino [2,3- d] Pyrimidin-4-yl) -8-azabicyclo [3.2.1] octan-3-ol hydrochloride (CLVI) (224 mg) was obtained as a yellow solid.
実施例81:
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLVIII)
実施例82:
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CLIX)
Example 81:
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLVIII)
Example 82:
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CLIX)
2-(プロペン-2-イル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CLVII)
窒素雰囲気下で2-(t-ブチル-ジメチルシラニル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CXXIII)(7.5g、25mmol)をDMF(100ml)に溶解させ、3-ヨードプロパ-1-エン(6.38g、38mmol)を加えた。混合物を激しく攪拌しながら0℃に冷却した後、NaH(ミネラルオイル中60%分散液1.5g、38mmol)を加えた。混合物を30分間攪拌し、水(50mL)をゆっくりと加えて反応液を反応停止させた。水性混合物をEtOAc(300mL)で抽出し、有機層を水(100mL)、次にブライン溶液(100mL)で洗浄し、無水Na2SO4で乾燥させた。蒸発後、黄色油状残渣8.6gを単離した。この材料をEt2O(100mL)に溶解させ、濃塩酸(20mL)を攪拌しながら0℃で加えた。次に混合物をさらに10分間攪拌した。混合物をEtOAc(200mL)および1N NaOH(200mL)で抽出した。有機層を分離し、H2O(150mL)およびブライン溶液(150mL)で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去し、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=10/1→5/1)で精製して2-(プロペン-2-イル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(6g、収率100%)を黄色固体として得た。LCMS: (ESI) m/z = 223 (M+H)+。
2- (propen-2-yl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CLVII)
2- (t-Butyl-dimethylsilanyl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CXXIII) (7.5 g, 25 mmol) dissolved in DMF (100 ml) under nitrogen atmosphere 3-iodoprop-1-ene (6.38 g, 38 mmol) was added. After the mixture was cooled to 0 ° C. with vigorous stirring, NaH (60% dispersion in mineral oil 1.5 g, 38 mmol) was added. The mixture was stirred for 30 minutes and the reaction was quenched by the slow addition of water (50 mL). The aqueous mixture was extracted with EtOAc (300 mL) and the organic layer was washed with water (100 mL) then brine solution (100 mL) and dried over anhydrous Na 2 SO 4 . After evaporation, 8.6 g of a yellow oily residue was isolated. This material was dissolved in Et 2 O (100 mL) and concentrated hydrochloric acid (20 mL) was added at 0 ° C. with stirring. The mixture was then stirred for an additional 10 minutes. The mixture was extracted with EtOAc (200 mL) and 1N NaOH (200 mL). The organic layer was separated, washed with H 2 O (150 mL) and brine solution (150 mL) and dried over anhydrous Na 2 SO 4 . The solvent was removed under reduced pressure, and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 10/1 → 5/1) to give 2- (propen-2-yl) amino-4-chloro-7- Methyl-pyrrolo [2,3-d] pyrimidine (6 g, 100% yield) was obtained as a yellow solid. LCMS: (ESI) m / z = 223 (M + H) + .
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLVIII)
2-(プロペン-2-イル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CLVII、500mg、2.38mmol)にn-ブタノール(5mL)、炭酸カリウム(1.64g、5.0当量)およびN,O-ジメチルヒドロキシルアミン塩酸塩(923mg、4.0当量)を加えた。攪拌機を備えたオートクレーブ中で混合物を100℃で8時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x20mL)で抽出した。一緒にした有機層を水およびブライン溶液で洗浄し、無水Na2SO4で乾燥させた。次に溶媒を減圧蒸発させ、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=3/1)で精製してN-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLVIII、310mg、収率55%)を得た。
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLVIII)
2- (propen-2-yl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CLVII, 500 mg, 2.38 mmol) to n-butanol (5 mL), potassium carbonate (1.64 g, 5.0 eq.) And N, O-dimethylhydroxylamine hydrochloride (923 mg, 4.0 eq.) Were added. The mixture was stirred at 100 ° C. for 8 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 20 mL). The combined organic layers were washed with water and brine solution and dried over anhydrous Na 2 SO 4 . The solvent was then evaporated under reduced pressure and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 3/1) to give N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLVIII, 310 mg, 55% yield) was obtained.
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CLIX)
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(310mg、1.32mmol)をH2O(5mL)および0.5M HCl水溶液(2.7mL)に溶解させ、溶液を凍結乾燥させてN-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CLIX、325mg)を白色固体として得た。
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CLIX)
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (310 mg, 1.32 mmol) was added to H 2 O ( 5 mL) and 0.5 M aqueous HCl (2.7 mL), and the solution was lyophilized to give N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl ) -N, O-dimethyl-hydroxylamine hydrochloride (CLIX, 325 mg) was obtained as a white solid.
実施例83:
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLX)
実施例84:
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン塩酸塩(CLXI)
Example 83:
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (CLX)
Example 84:
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine hydrochloride (CLXI)
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLX)
2-(2-プロペン-2-イル)アミノ-4-クロロ-7-メチル-ピロロ[2,3-d]ピリミジン(CLVII)(700mg、3.15mmol)をn-ブタノールに溶解させ、炭酸カリウム(2.2g、5.0当量)およびO-メチルヒドロキシルアミン塩酸塩(768mg、4.0当量)を加えた。攪拌機を備えたオートクレーブ中で混合物を100℃で12時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x25mL)で抽出した。一緒にした有機層を水およびブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧蒸発させ、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=5/1)で精製してN-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(370mg、収率46%)を得た。
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (CLX)
2- (2-propen-2-yl) amino-4-chloro-7-methyl-pyrrolo [2,3-d] pyrimidine (CLVII) (700 mg, 3.15 mmol) was dissolved in n-butanol and potassium carbonate ( 2.2 g, 5.0 eq) and O-methylhydroxylamine hydrochloride (768 mg, 4.0 eq) were added. The mixture was stirred at 100 ° C. for 12 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 25 mL). The combined organic layers were washed with water and brine solution and dried over anhydrous Na 2 SO 4 . The solvent was evaporated under reduced pressure and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 5/1) to give N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2 , 3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (370 mg, 46% yield) was obtained.
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン塩酸塩(CLXI)
N-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(370mg、1.59mmol)をH2O(5mL)および0.5M HCl水溶液(2mL)に溶解させ、溶液を凍結乾燥させてN-(2-(プロペン-2-イル)アミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン塩酸塩(383mg)を白色固体として得た。
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine hydrochloride (CLXI)
N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (370 mg, 1.59 mmol) in H 2 O (5 mL) And 0.5M HCl aqueous solution (2 mL) and the solution is lyophilized to give N- (2- (propen-2-yl) amino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O -Methyl-hydroxylamine hydrochloride (383 mg) was obtained as a white solid.
実施例85:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLXII)
実施例86:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン塩酸塩(CLXIII)
Example 85:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLXII)
Example 86:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine hydrochloride (CLXIII)
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-N,O-ジメチル-ヒドロキシルアミン(CLXII)
実施例73に記載のように4-クロロ-2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジンおよびN,O-ジメチル-ヒドロキシルアミンから所望の化合物を調製した。
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -N, O-dimethyl-hydroxylamine (CLXII)
The desired compound was prepared from 4-chloro-2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidine and N, O-dimethyl-hydroxylamine as described in Example 73.
実施例87:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLXIV)
実施例88:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン塩酸塩(CLXV)
Example 87:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (CLXIV)
Example 88:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine hydrochloride (CLXV)
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-O-メチル-ヒドロキシルアミン(CLXIV)
実施例73に記載のように4-クロロ-2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジンおよびO-メチル-ヒドロキシルアミンから所望の化合物を調製した。
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -O-methyl-hydroxylamine (CLXIV)
The desired compound was prepared from 4-chloro-2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidine and O-methyl-hydroxylamine as described in Example 73.
実施例89:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVI)
実施例90:
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXVII)
Example 89:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVI)
Example 90:
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXVII)
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVI)
4-クロロ-2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン(CXXIV、1.0g、4.5mmol)のエタノール(70mL)溶液にヒドラジン(14mL)を加え、混合物を3時間加熱還流させた。室温に冷却後、溶媒を減圧除去した。残渣をフラッシュカラムクロマトグラフィー(CH2Cl2/MeOH=30/1)で精製してN-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVI、1.0g、収率80%)を得た。
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVI)
Hydrazine (14 mL) is added to a solution of 4-chloro-2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidine (CXXIV, 1.0 g, 4.5 mmol) in ethanol (70 mL) and the mixture is heated for 3 hours. Refluxed. After cooling to room temperature, the solvent was removed under reduced pressure. The residue was purified by flash column chromatography (CH 2 Cl 2 / MeOH = 30/1) to give N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVI, 1.0 g, yield 80%) was obtained.
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXVII)
N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(460mg、2.0mmol)をH2O(10mL)および0.5M HCl水溶液(4mL)に溶解させ、溶液を凍結乾燥させてN-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(440mg)を褐色固体として得た。
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXVII)
N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (460 mg, 2.0 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (4 mL) Upon dissolution, the solution was lyophilized to give N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (440 mg) as a brown solid.
実施例91:
N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVIII)
実施例92:
N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXIX)
Example 91:
N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVIII)
Example 92
N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXIX)
N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVIII)
4-クロロ-2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン(CXXIV、800mg、3.42mmol)のn-ブタノール(5mL)溶液に炭酸カリウム(2.36g、5.0当量)およびメチルヒドラジン(630mg、4.0当量)を加えた。攪拌機を備えたオートクレーブ中で混合物を100℃で15時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x25mL)で抽出した。一緒にした有機層を水およびブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧蒸発させ、得られた残渣をフラッシュカラムクロマトグラフィー(石油エーテル/EtOAc=3/1→DCM/MeOH=10/1)で精製してN-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXVIII、220mg、収率36%)を得た。
N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVIII)
4-Chloro-2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidine (CXXIV, 800 mg, 3.42 mmol) in n-butanol (5 mL) in potassium carbonate (2.36 g, 5.0 eq) and methyl Hydrazine (630 mg, 4.0 eq) was added. The mixture was stirred at 100 ° C. for 15 hours in an autoclave equipped with a stirrer. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 25 mL). The combined organic layers were washed with water and brine solution and dried over anhydrous Na 2 SO 4 . The solvent was evaporated under reduced pressure, and the resulting residue was purified by flash column chromatography (petroleum ether / EtOAc = 3/1 → DCM / MeOH = 10/1) to give N-methyl-N- (2-n-propylamino). -7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXVIII, 220 mg, 36% yield) was obtained.
N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXIX)
N-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(220mg、0.94mmol)をH2O(10mL)および0.5M HCl水溶液(2mL)に溶解させ、溶液を凍結乾燥させてN-メチル-N-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXIX、238mg)を褐色固体として得た。
N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXIX)
N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (220 mg, 0.94 mmol) in H 2 O (10 mL) and 0.5 M aqueous HCl (2 mL) and the solution was lyophilized to give N-methyl-N- (2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXIX, 238 mg) was obtained as a brown solid.
実施例93:
N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXX)
実施例94:
N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXXI)
Example 93
N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXX)
Example 94:
N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXXI)
N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXX)
4-クロロ-2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]-ピリミジン(1.1g、5mmol)および1,1-ジメチルヒドラジン(450mg、7.5mmol)のジオキサン(30mL)溶液にxphos(622mg、1mmol)、Pd2(dba)3(458mg、0.5mmol)およびCs2CO3(2.45g、7.5mmo)を加えた。注射針を使用して溶液にアルゴンを10分間吹き込むことで溶液を脱気した。次に混合物を80℃で2時間攪拌した。室温に冷却後、水(20mL)を加え、混合物をEtOAc(3x40mL)で抽出した。一緒にした有機層を水およびブライン溶液で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧蒸発させ、得られた残渣をフラッシュカラムクロマトグラフィー(DCM/MeOH=30/1→5/1)で精製してN,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(CLXX、100mg、収率8%、純度約85%)を得た。
N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXX)
4-Chloro-2-n-propylamino-7-methyl-pyrrolo [2,3d] -pyrimidine (1.1 g, 5 mmol) and 1,1-dimethylhydrazine (450 mg, 7.5 mmol) in dioxane (30 mL) in xphos (622 mg, 1 mmol), Pd 2 (dba) 3 (458 mg, 0.5 mmol) and Cs 2 CO 3 (2.45 g, 7.5 mmo) were added. The solution was degassed by bubbling argon through the solution for 10 minutes using a syringe needle. The mixture was then stirred at 80 ° C. for 2 hours. After cooling to room temperature, water (20 mL) was added and the mixture was extracted with EtOAc (3 × 40 mL). The combined organic layers were washed with water and brine solution and dried over anhydrous Na 2 SO 4 . The solvent was evaporated under reduced pressure, and the resulting residue was purified by flash column chromatography (DCM / MeOH = 30/1 → 5/1) to give N, N-dimethyl-N ′-(2-n-propylamino-7 -Methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (CLXX, 100 mg, yield 8%, purity about 85%) was obtained.
N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン塩酸塩(CLXXI)
N,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3d]ピリミジン-4-イル)-ヒドラジン(100mg、0.4mmol)をH2O(5mL)および0.5M HCl水溶液(1mL)に溶解させ、溶液を凍結乾燥させてN,N-ジメチル-N'-(2-n-プロピルアミノ-7-メチル-ピロロ[2,3-d]ピリミジン-4-イル)-ヒドラジン塩酸塩(110mg)を黄色油状物として得た。
N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine hydrochloride (CLXXI)
N, N-dimethyl-N ′-(2-n-propylamino-7-methyl-pyrrolo [2,3d] pyrimidin-4-yl) -hydrazine (100 mg, 0.4 mmol) in H 2 O (5 mL) and 0.5 Dissolve in aqueous M HCl (1 mL) and freeze-dry the solution to N, N-dimethyl-N '-(2-n-propylamino-7-methyl-pyrrolo [2,3-d] pyrimidin-4-yl ) -Hydrazine hydrochloride (110 mg) was obtained as a yellow oil.
実施例95:
N-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(CLXXII)
圧力管に2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5-トリアジン(XXXIV)(1.50g、6.53mmol)、N,N-ジイソプロピルエチルアミン(5.4mL、32.65mmol)、メチルアミン塩酸塩(2.2g、32.65mmol)およびテトラヒドロフラン(20mL)を加えた。反応混合物を70℃で48時間加熱した。さらなる量のN,N-ジイソプロピルエチルアミン(5.4mL、32.65mmol)およびメチルアミン塩酸塩(2.2g、32.65mmol)を加え、反応混合物を70℃でさらに48時間加熱した。混合物を飽和NaHCO3溶液(40mL)に注いだ。懸濁液をEtOAc(3x70mL)で抽出した。一緒にした有機抽出物を水(70mL)、次にブライン溶液(70mL)で洗浄し、最後に無水Na2SO4で乾燥させた。溶媒を減圧除去し、石油エーテル/EtOAc(9:1(v/v))から石油エーテル/EtOAc(1:4(v/v))までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで粗生成物を精製してN-(2,4-ビス-n-プロピルアミノ)-N-(6-メチルアミノ)-[1,3,5]トリアジン(0.35g、24%)を得た。
Example 95:
N- (2,4-bis-n-propylamino) -N- (6-methylamino)-[1,3,5] triazine (CLXXII)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5-triazine (XXXIV) (1.50 g, 6.53 mmol), N, N-diisopropylethylamine (5.4 mL, 32.65 mmol), methylamine hydrochloride (2.2 g, 32.65 mmol) and tetrahydrofuran (20 mL) were added and the reaction mixture was heated for 48 hours at 70 ° C. An additional amount of N, N-diisopropylethylamine (5.4 mL, 32.65 mmol) and methylamine hydrochloride (2.2 g, 32.65 mmol) were added and the reaction mixture was heated for a further 48 hours at 70 ° C. The mixture was poured into saturated NaHCO 3 solution (40 mL) The suspension was EtOAc (3 × 70 mL). The combined organic extracts were washed with water (70 mL), then brine solution (70 mL) and finally dried over anhydrous Na 2 SO 4. The solvent was removed in vacuo and petroleum ether / EtOAc. The crude product was purified by flash column chromatography using gradient elution from (9: 1 (v / v)) to petroleum ether / EtOAc (1: 4 (v / v)) to give N- (2,4 -Bis-n- Ropiruamino)-N-(6- methylamino) - [1,3,5] triazine (0.35 g, to obtain a 24%).
実施例96:
N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)
実施例97:
N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン硫酸水素塩(CLXXIV)
Example 96:
N- (2,4,6-Tris-n-propylamino)-[1,3,5] triazine (CLXXIII)
Example 97
N- (2,4,6-Tris-n-propylamino)-[1,3,5] triazine hydrogensulfate (CLXXIV)
N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(CLXXIII)
2-クロロ-N-(4,6-ビス-(n-プロピルアミノ)-[1,3,5-トリアジン(XXXIV)(1.00g、4.35mmol)、NaOH(348mg、8.70mmol)およびn-プロピルアミン(1.4mL、17.40mmol)の1,4-ジオキサン(40mL)中混合物を60℃で4時間加熱した。次に揮発物を減圧除去した。水(50mL)を残渣に加え、混合物をEtOAc(3x50mL)で抽出した。一緒にした有機抽出物を水(50mL)、次にブライン溶液(50mL)で洗浄し、最後に無水Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1(v/v))からCH2Cl2/EtOH(97:3(v/v))までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで残渣を精製してN-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン(790mg、72%)を得た。
N- (2,4,6-Tris-n-propylamino)-[1,3,5] triazine (CLXXIII)
2-Chloro-N- (4,6-bis- (n-propylamino)-[1,3,5-triazine (XXXIV) (1.00 g, 4.35 mmol), NaOH (348 mg, 8.70 mmol) and n-propyl A mixture of amine (1.4 mL, 17.40 mmol) in 1,4-dioxane (40 mL) was heated for 4 h at 60 ° C. The volatiles were then removed under reduced pressure, water (50 mL) was added to the residue and the mixture was added EtOAc ( The combined organic extracts were washed with water (50 mL), then with brine solution (50 mL) and finally dried over anhydrous Na 2 SO 4. The solvent was removed under reduced pressure and CH 2 Cl The residue was purified by flash column chromatography using gradient elution from 2 / EtOH (99: 1 (v / v)) to CH 2 Cl 2 / EtOH (97: 3 (v / v)) to give N- ( 2,4,6-Tris-n-propylamino)-[1,3,5] triazine (790 mg, 72%) was obtained.
N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジン硫酸水素塩(CLXXIV)
実施例8Aに記載のように、N-(2,4,6-トリス-n-プロピルアミノ)-[1,3,5]トリアジンおよび95% H2SO4から定量的収率で標記化合物を調製した。
N- (2,4,6-Tris-n-propylamino)-[1,3,5] triazine hydrogensulfate (CLXXIV)
The title compound was obtained in quantitative yield from N- (2,4,6-tris-n-propylamino)-[1,3,5] triazine and 95% H 2 SO 4 as described in Example 8A. Prepared.
実施例98:
N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)
実施例99:
N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン硫酸水素塩(CLXXVI)
Example 98:
N- (2,4,6-Tris-n-propylamino) -1,3-pyrimidine (CLXXIV)
Example 99:
N- (2,4,6-Tris-n-propylamino) -1,3-pyrimidine hydrogensulfate (CLXXVI)
N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(CLXXIV)
圧力管に4-クロロ-2,6-ビス-(N-n-プロピルアミノ)-1,3-ピリミジン(CXIX)(1.53g、6.65mmol)、n-プロピルアミン(2.7mL、33.25mmol)、N,N-ジイソプロピルエチルアミン(2.3mL、13.30mmol)およびピリジン(15mL)を加えた。反応混合物を130℃で48時間加熱した。揮発物を減圧除去した。水(50mL)を残渣に加え、混合物をCH2Cl2(3x50mL)で抽出した。一緒にした有機抽出物を水(100mL)で洗浄し、無水Na2SO4で乾燥させた。溶媒を減圧除去し、CH2Cl2/EtOH(99:1(v/v))からCH2Cl2/EtOH(95:5(v/v))までの勾配溶離を使用するフラッシュカラムクロマトグラフィーで残渣を精製してN-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン(0.90g、54%)を得た。
N- (2,4,6-Tris-n-propylamino) -1,3-pyrimidine (CLXXIV)
4-Chloro-2,6-bis- (Nn-propylamino) -1,3-pyrimidine (CXIX) (1.53 g, 6.65 mmol), n-propylamine (2.7 mL, 33.25 mmol), N, N-diisopropylethylamine (2.3 mL, 13.30 mmol) and pyridine (15 mL) were added. The reaction mixture was heated at 130 ° C. for 48 hours. Volatiles were removed in vacuo. Water (50 mL) was added to the residue and the mixture was extracted with CH 2 Cl 2 (3 × 50 mL). The combined organic extracts were washed with water (100 mL) and dried over anhydrous Na 2 SO 4 . The solvent was removed in vacuo, CH 2 Cl 2 / EtOH ( 99: 1 (v / v)) from CH 2 Cl 2 / EtOH (95 : 5 (v / v)) to flash column chromatography using a gradient elution of The residue was purified by to give N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine (0.90 g, 54%).
N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジン硫酸水素塩(CLXXVI)
実施例8Aに記載のように、N-(2,4,6-トリス-n-プロピルアミノ)-1,3-ピリミジンおよび95% H2SO4から定量的収率で標記化合物を調製した。
N- (2,4,6-Tris-n-propylamino) -1,3-pyrimidine hydrogensulfate (CLXXVI)
The title compound was prepared in quantitative yield from N- (2,4,6-tris-n-propylamino) -1,3-pyrimidine and 95% H 2 SO 4 as described in Example 8A.
実施例100:
N-(4-i-プロピルアミノ)-N-(2,6-ビス-n-プロピルアミノ)-1,3-ピリミジン(CLXXVII)
実施例101:
N-(4-i-プロピルアミノ)-N-(2,6-ビス-n-プロピルアミノ)-1,3-ピリミジン硫酸水素塩(CLXXVIII)
Example 100:
N- (4-i-propylamino) -N- (2,6-bis-n-propylamino) -1,3-pyrimidine (CLXXVII)
Example 101:
N- (4-i-propylamino) -N- (2,6-bis-n-propylamino) -1,3-pyrimidine hydrogensulfate (CLXXVIII)
N-(4-i-プロピルアミノ)-N-(2,6-ビス-n-プロピルアミノ)-1,3-ピリミジン(CLXXVII)
実施例98に記載のように、4-クロロ-2,6-ビス-(N-n-プロピルアミノ)-1,3-ピリミジン(CXIX)およびi-プロピルアミンから収率16%で標記化合物を調製した。
N- (4-i-propylamino) -N- (2,6-bis-n-propylamino) -1,3-pyrimidine (CLXXVII)
The title compound was prepared from 4-chloro-2,6-bis- (Nn-propylamino) -1,3-pyrimidine (CXIX) and i-propylamine in 16% yield as described in Example 98. .
N-(4-i-プロピルアミノ)-N-(2,6-ビス-n-プロピルアミノ)-1,3-ピリミジン硫酸水素塩(CLXXVIII)
実施例8Aに記載のように、N-(4-i-プロピルアミノ)-N-(2,6-ビス-n-プロピルアミノ)-1,3-ピリミジンおよび95% H2SO4から定量的収率で標記化合物を調製した。
N- (4-i-propylamino) -N- (2,6-bis-n-propylamino) -1,3-pyrimidine hydrogensulfate (CLXXVIII)
Quantitatively from N- (4-i-propylamino) -N- (2,6-bis-n-propylamino) -1,3-pyrimidine and 95% H 2 SO 4 as described in Example 8A The title compound was prepared in yield.
比較例1:
N-(4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)
バイアルに6-クロロ-N2,N4-ジプロピル-1,3,5-トリアジン-2,4-ジアミン(XXXIV)(800mg、3.48mmol)、NaOH(696mg、17.40mmol)、水(3mL)および1,4-ジオキサン(3mL)を加えた。反応混合物をマイクロ波照射下にて140℃で30分間加熱した。混合物を1N HClでpH 5に酸性化し、析出物を濾過し、水で洗浄した。生成物を50%トリフルオロ酢酸(30mL)に溶解させ、未溶解残渣を濾去した。濾液を飽和NaHCO3溶液で中和し、形成された析出物を濾過し、水、アセトンで洗浄し、乾燥させて4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)550mg(75%)を得た。
Comparative Example 1:
N- (4,6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII)
The vial 6-Chloro -N 2, N 4 - dipropyl-1,3,5-triazine-2,4-diamine (XXXIV) (800mg, 3.48mmol) , NaOH (696mg, 17.40mmol), water (3 mL) and 1,4-Dioxane (3 mL) was added. The reaction mixture was heated at 140 ° C. for 30 minutes under microwave irradiation. The mixture was acidified with 1N HCl to
N-(4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール硫酸水素塩(CLXXIX)
4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)(110mg、0.52mmol)の1,4-ジオキサン(2mL)懸濁液に95% H2SO4(28μL、0.52mmol)を加えた。混合物を室温で30分間攪拌した。得られた析出物を濾過し、Et2Oで洗浄し、乾燥させて4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール硫酸水素塩(CLXXIX)を定量的収率で得た。
主要断片(M+H) 170, 128, 86。
N- (4,6-bis (propylamino) -1,3,5-triazin-2-ol hydrogen sulfate (CLXXIX)
To a suspension of 4,6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII) (110 mg, 0.52 mmol) in 1,4-dioxane (2 mL) was added 95% H 2 SO 4 ( 28 μL, 0.52 mmol) was added. The mixture was stirred at room temperature for 30 minutes. The resulting precipitate was filtered, washed with Et 2 O and dried to quantitatively collect 4,6-bis (propylamino) -1,3,5-triazin-2-ol hydrogen sulfate (CLXXIX). Obtained at a rate.
Major fragment (M + H) 170, 128, 86.
実施例102:
(XXXVI)塩形態A(図1)の調製
方法A:
周囲温度の酢酸エチル中(XXXV)(約151mg/mL、透明溶液)に濃硫酸1モル当量のエタノール溶液を加えた。透明溶液を周囲温度で約1日間攪拌した後(透明)、イソプロピルエーテル6体積当量(酢酸エチルに対して)を加えて混濁混合物を得た。混合物を3日間攪拌した後、濾過して固体生成物(硫酸水素塩形態A)を得た。
Example 102:
(XXXVI) Preparation of salt form A (Figure 1) Method A:
A solution of 1 molar equivalent of concentrated sulfuric acid in ethanol (XXXV) (about 151 mg / mL, clear solution) in ethyl acetate at ambient temperature was added. The clear solution was stirred at ambient temperature for about 1 day (clear) and then 6 volume equivalents of isopropyl ether (relative to ethyl acetate) was added to give a turbid mixture. The mixture was stirred for 3 days and then filtered to obtain a solid product (hydrogen sulfate salt form A).
方法B:
約65℃のメチルエチルケトン中(約104mg/mL、透明溶液)に濃硫酸1モル当量を加えた。直ちに形成された析出物を速やかに再溶解させた。混合物を約65℃で約5時間攪拌し、約1時間かけて周囲温度に徐冷した。混合物を周囲温度で1日間攪拌した後、濾過して固体生成物(収率61%)(硫酸水素塩形態A)を得た。
Method B:
1 molar equivalent of concentrated sulfuric acid was added in methyl ethyl ketone (about 104 mg / mL, clear solution) at about 65 ° C. Immediately formed precipitates were quickly redissolved. The mixture was stirred at about 65 ° C. for about 5 hours and slowly cooled to ambient temperature over about 1 hour. The mixture was stirred at ambient temperature for 1 day and then filtered to give a solid product (61% yield) (hydrogen sulfate salt form A).
方法C:
約65℃のメチルエチルケトン中(XXXV)(約100mg/mL、透明溶液)に濃硫酸1モル当量を加えた。直ちに形成された析出物を速やかに再溶解させた。混合物を約65℃で約1時間攪拌し、1時間かけて周囲温度に徐冷して固体を棒状物の形態で得た。混合物を周囲温度で約4時間攪拌した。ヘプタン1体積当量(メチルエチルケトンに対して)を加え、混合物を周囲温度で1日間攪拌した後、濾過して固体生成物(収率81%)(硫酸水素塩形態A)を得た。
Method C:
1 molar equivalent of concentrated sulfuric acid was added to (XXXV) (about 100 mg / mL, clear solution) in methyl ethyl ketone at about 65 ° C. Immediately formed precipitates were quickly redissolved. The mixture was stirred at about 65 ° C. for about 1 hour and slowly cooled to ambient temperature over 1 hour to give a solid in the form of a rod. The mixture was stirred at ambient temperature for about 4 hours. 1 volume equivalent of heptane (relative to methyl ethyl ketone) was added and the mixture was stirred at ambient temperature for 1 day and then filtered to give a solid product (81% yield) (hydrogen sulfate form A).
方法D:
約69℃のメチルエチルケトン中(XXXV)(約200mg/mL、透明溶液)に濃硫酸1モル当量を加えた。直ちに形成された析出物を速やかに再溶解させた。混合物を約69℃で約1時間攪拌し、周囲温度に急冷し、約0.5時間攪拌して濃厚ペースト状物を得た。混合物を氷浴中で約45分間攪拌した後、濾過して固体生成物(硫酸水素塩形態A)を収集した。
Method D:
1 molar equivalent of concentrated sulfuric acid was added to (XXXV) (about 200 mg / mL, clear solution) in methyl ethyl ketone at about 69 ° C. Immediately formed precipitates were quickly redissolved. The mixture was stirred at about 69 ° C. for about 1 hour, quenched to ambient temperature, and stirred for about 0.5 hour to give a thick paste. The mixture was stirred in an ice bath for about 45 minutes and then filtered to collect the solid product (bisulfate form A).
方法E:
約67℃のメチルエチルケトン中(XXXV)(約101mg/mL、透明溶液)に濃硫酸1モル当量を加えた。混合物を約67℃で約1時間攪拌し、周囲温度に徐冷した。混合物を周囲温度で約1.5時間攪拌した後、メチルtert-ブチルエーテル1体積当量(メチルエチルケトンに対して)を加え、混合物を1日間攪拌した後、濾過して固体生成物(収率76%)(硫酸水素塩形態A)を収集した。
Method E:
1 molar equivalent of concentrated sulfuric acid was added to (XXXV) (about 101 mg / mL, clear solution) in methyl ethyl ketone at about 67 ° C. The mixture was stirred at about 67 ° C. for about 1 hour and allowed to cool slowly to ambient temperature. After the mixture was stirred at ambient temperature for about 1.5 hours, 1 volume equivalent of methyl tert-butyl ether (based on methyl ethyl ketone) was added and the mixture was stirred for 1 day before being filtered to obtain a solid product (76% yield) (sulfuric acid Hydrogen salt form A) was collected.
方法F:
約50℃のアセトン中(XXXV)(約199mg/mL、透明溶液)に濃硫酸1モル当量を加えて透明溶液を形成した。混合物を約50℃で約1時間攪拌し、周囲温度に徐冷し、その時点で固体が形成された。混合物にメチルtert-ブチルエーテル約2体積当量(メチルエチルケトンに対して)を加えた。混合物を周囲温度で1日間攪拌した後、濾過して固体生成物(収率79%)(硫酸水素塩形態A)を収集した。
Method F:
A 1 mol equivalent of concentrated sulfuric acid was added to (XXXV) (about 199 mg / mL, clear solution) in acetone at about 50 ° C. to form a clear solution. The mixture was stirred at about 50 ° C. for about 1 hour and allowed to cool slowly to ambient temperature, at which point a solid formed. To the mixture was added about 2 volume equivalents (based on methyl ethyl ketone) of methyl tert-butyl ether. The mixture was stirred at ambient temperature for 1 day and then filtered to collect the solid product (yield 79%) (hydrogen sulfate salt form A).
実施例103:
(XXXVI)塩形態Aと(XXXVI)塩形態Bとの混合物の調製
約65℃の酢酸エチル中(XXXV)(99mg/mL、透明溶液)に濃硫酸1モル当量を加えた。5分以内に少量の粘着性材料と共に濃厚懸濁液。混合物を約65℃で約5時間攪拌し、周囲温度に徐冷し、4日間攪拌した後、濾過して図23の固体生成物(形態Bとの混合物としての硫酸水素塩形態A)を収集した。
Example 103:
Preparation of a mixture of (XXXVI) salt form A and (XXXVI)
実施例104:
(XXXVI)塩形態Cの調製
(XXXVI)形態Aの試料を周囲温度で相対湿度97%に4日間曝露した。得られた固体形態を硫酸水素塩形態Cと呼んだ。熱重量分析試験下の得られた材料は約30〜50℃で4.6重量%を失い、これは水約1モル当量と一致していた(図24)。
Example 104:
(XXXVI) Preparation of salt form C
(XXXVI) Form A samples were exposed to ambient humidity 97% at ambient temperature for 4 days. The resulting solid form was called bisulfate form C. The resulting material under thermogravimetric analysis lost 4.6% by weight at about 30-50 ° C., which was consistent with about 1 molar equivalent of water (FIG. 24).
実施例105:
(XXXVI)塩形態Dの調製
約65℃の酢酸エチル中(XXXV)(約100mg/mL)に濃硫酸1モル当量を加えた。粘着性材料が直ちに析出し、さらなる固体が約5分後に観察された。これらの固体の小口試料をピペットで除去し、冷却せずに濾過した。これらの固体を硫酸水素塩形態D(図25)と呼んだ。
Example 105:
(XXXVI) Preparation of Salt Form D One mole equivalent of concentrated sulfuric acid was added to (XXXV) (about 100 mg / mL) in ethyl acetate at about 65 ° C. The sticky material precipitated immediately and additional solids were observed after about 5 minutes. These small solid samples were removed with a pipette and filtered without cooling. These solids were called bisulfate form D (Figure 25).
実施例106:
(XXXVI)塩形態Aと(XXXVI)塩形態Dとの混合物の調製
約80℃の酢酸イソプロピル中(XXXV)(203mg/mL、透明溶液)に濃硫酸1モル当量を酢酸イソプロピル中溶液として加えた。析出物が形成された。混合物を約80℃で約45分間攪拌した後、周囲温度に徐冷し、1日間攪拌した後、濾過して固体生成物(収率83%)、すなわち硫酸水素塩形態Dとの混合物としての硫酸水素塩形態A(図26)を得た。
Example 106:
Preparation of a mixture of (XXXVI) salt form A and (XXXVI)
実施例107:
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミンリン酸塩(CLXXX)形態Aの調製
周囲温度のアセトニトリル中(XXXV)にリン酸2モル当量を加えた。混合物を2日間攪拌した後、形成された固体を濾取し、窒素流下にてフィルター上で乾燥させた(リン酸塩形態A; 図27)。
Example 107:
Preparation of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine phosphate (CLXXX) Form A Acetonitrile at
実施例108:
(CLXXX)形態Cの調製
周囲温度のメタノール中(XXXV)(透明溶液)にリン酸1モル当量を加えて透明溶液を得た。該溶液を含むバイアルをイソプロピルエーテルのバイアルと共に密閉室に入れ、蒸気を拡散させて固体を形成し、これを濾取した(リン酸塩形態C、図28)。
Example 108:
Preparation of (CLXXX)
実施例109:
(CLXXX)形態Aと(CLXXX)形態Bとの混合物の調製
周囲温度のアセトニトリル中(XXXV)(スラリー)にリン酸1モル当量を加えた。濃厚スラリーが形成された。スラリーを周囲温度で3日間超音波処理した後、濾過して固体生成物(形態Bとの混合物としてのリン酸塩形態A、図29)を収集した。
Example 109:
Preparation of a mixture of (CLXXX) Form A and (CLXXX)
実施例110:
(CLXXX)形態Cと(CLXXX)形態Dとの混合物の調製
酢酸エチル中(XXXV)(透明溶液)にリン酸2モル当量をエタノール中溶液として加えた。析出物が形成された。混合物を酢酸エチルでさらに希釈し、3日間攪拌した後、濾過して固体生成物(リン酸塩形態Cとリン酸塩形態Dとの混合物、図30)を収集した。
Example 110:
Preparation of a mixture of (CLXXX) Form C and (CLXXX)
実施例111:
(CLXXX)形態Cと(CLXXX)形態Eとの混合物の調製
周囲温度のテトラヒドロフラン中(XXXV)(透明溶液)にリン酸3モル当量を加えた。析出物が形成された。混合物を周囲温度で3日間攪拌した後、濾過して固体生成物(リン酸塩形態Cとリン酸塩形態Eとの混合物、図31)を収集した。
Example 111:
Preparation of a mixture of (CLXXX) Form C and (CLXXX)
実施例112:
ラットにおけるオピオイド誘発性呼吸抑制に対する化合物(XXXVI)の効果
(薬物を投与するために)頸静脈に予めカニューレ挿入されたラットを最低60分間、または動物が不穏でなくなるまで、プレチスモグラフィー室に順化させた。各動物には、濃度10mg/mLで滅菌水に溶解した硫酸モルヒネ(10mg/kg)(Baxter Healthcare Corporationが供給)を、5〜10秒かけての頸静脈カテーテルへの注射を介して投薬した。
Example 112:
Effect of compound (XXXVI) on opioid-induced respiratory depression in rats
Rats pre-cannulated in the jugular vein (for drug administration) were acclimated to the plethysmography room for a minimum of 60 minutes or until the animals were not disturbing. Each animal was dosed with morphine sulfate (10 mg / kg) (supplied by Baxter Healthcare Corporation) dissolved in sterile water at a concentration of 10 mg / mL via injection into the jugular vein catheter over 5-10 seconds.
化合物(XXXVI)を20%ヒドロキシプロピルβ-シクロデキストラン(グラフ上で20%bcd)に濃度0.45mg/mLにてpH 5で溶解させた。5分後、化合物(A)と表示される化合物(XXXVI)を、頸静脈への注入を介して用量0.10mg/kg/分で20分間、次に用量0.30mg/kg/分で20分間(例えば0.03mpk/分を生じさせる20μL/分/0.3kgラットで)投与した。
Compound (XXXVI) was dissolved in 20% hydroxypropyl β-cyclodextran (20% bcd on the graph) at a concentration of 0.45 mg / mL at
この用量で20分の注入後、輸液ポンプを停止させ、すべての動物に20分の回復期間を与えた後、ラットの健康および挙動に関する研究後分析を行った。分時換気量データは、化合物(XXXVI)がラットにおけるオピオイド誘発性呼吸抑制を媒体に比べて著しく逆転させたことを示す。結果を図1に示す。 After an infusion of 20 minutes at this dose, the infusion pump was stopped and all animals were allowed a 20 minute recovery period before a post-study analysis on rat health and behavior. Minute ventilation data shows that compound (XXXVI) significantly reversed opioid-induced respiratory depression in rats compared to vehicle. The results are shown in Figure 1.
実施例113:
ラットにおける血液ガスに対するモルヒネおよび化合物(XXXVI)の効果
(それぞれ薬物を投与するためおよび血液試料を取得するために)頸静脈および大腿動脈カテーテルに予めカニューレ挿入されたラットをHarlan laboratoriesから得て、実験手法までGalleon Pharmaceuticalsの動物施設に保持した。各動物には、濃度10mg/mlで食塩水に溶解した硫酸モルヒネ(10mg/kg)を、0.9% NaCl食塩水での20秒の洗い流しを伴う20秒かけての頸静脈への注射を介して投薬した。モルヒネ投与前に2つの250μL動脈血試料を大腿動脈から吸引して、予めヘパリン処理したシリンジに入れた。試料をRadiometerのABL Flex 800上で分析し、pO2、pCO2、pH、SaO2および他のパラメータを記録した。血液量減少を防止するために、吸引量の動脈血を室温の滅菌食塩水(約300μL)で置き換え、滅菌食塩水はげっ歯類の大腿動脈カテーテル中にゆっくりと逆方向に洗い流した。次にモルヒネを投与し、2分後に別の血液試料を採取した。
Example 113:
Effects of morphine and compound (XXXVI) on blood gases in rats
Rats pre-cannulated into jugular vein and femoral artery catheters (to administer drugs and obtain blood samples, respectively) were obtained from Harlan laboratories and held at the Galleon Pharmaceuticals animal facility until experimental procedures. Each animal received morphine sulfate (10 mg / kg) dissolved in saline at a concentration of 10 mg / ml via a 20-second injection into the jugular vein with a 20-second washout with 0.9% NaCl saline. Dosed. Prior to morphine administration, two 250 μL arterial blood samples were aspirated from the femoral artery and placed in a pre-heparinized syringe. Samples were analyzed on a
モルヒネの投与から5分後、化合物(A)と表示される化合物(XXXVI)を、頸静脈への注入を介して、用量0.1、0.3および1.0mg/kg/分(PBS緩衝液に溶解)で投与した。注入はt=15分に開始し、t=35分に終了した。動脈血ガス分析はt=12、18、25、35、40、45および50分の時点に行われた。データは、化合物(XXXVI)がラットにおけるオピオイド誘発性呼吸抑制を媒体に比べて著しく逆転させることを示す。結果を図2aおよび図2bならびに付随する表6に示す。 Five minutes after administration of morphine, compound (XXXVI), labeled as compound (A), was administered at doses of 0.1, 0.3 and 1.0 mg / kg / min (dissolved in PBS buffer) via jugular vein infusion. Administered. The infusion started at t = 15 minutes and ended at t = 35 minutes. Arterial blood gas analysis was performed at t = 12, 18, 25, 35, 40, 45 and 50 minutes. The data show that compound (XXXVI) significantly reverses opioid-induced respiratory depression in rats compared to vehicle. The results are shown in FIGS. 2a and 2b and the accompanying Table 6.
(表6)
(Table 6)
実施例114:
ラットにおける低酸素換気応答(HVR)およびHVRに対する化合物(XXXVI)の効果
(薬物を投与するために)頸静脈に予めカニューレ挿入されたラットを最低60分間、または動物が不穏でなくなるまで、プレチスモグラフィー室に順化させた。各動物には、化合物(A)と表示される化合物(XXXVI)を0.03mg/kg/分で頸静脈カテーテルへの注入を介して50分間投薬した。20分後、等炭酸ガス性低酸素混合物(12% O2、残余N2)を全室内にガス混合器(CWE inc. GSM-3ガス混合器)を使用して20分間投入した。この後、ガス混合器を停止させて通常の大気を室内に送り込んだ。10分後、輸液ポンプを停止させ、すべての動物に20分の回復期間を与えた後、ラットの健康および挙動に関する研究後分析を行った。分時換気量データは、化合物(XXXVI)がラットにおける低酸素換気応答を媒体に比べて著しく増強することを示す。結果を図3に示す。
Example 114:
Effects of compound (XXXVI) on hypoxic ventilation response (HVR) and HVR in rats
Rats pre-cannulated in the jugular vein (for drug administration) were acclimated to the plethysmography room for a minimum of 60 minutes or until the animals were not disturbing. Each animal was dosed with Compound (XXXVI) labeled Compound (A) at 0.03 mg / kg / min for 50 minutes via infusion into the jugular vein catheter. After 20 minutes, an isocarbonic low oxygen mixture (12% O 2 , residual N 2 ) was charged into the whole room for 20 minutes using a gas mixer (CWE inc. GSM-3 gas mixer). Thereafter, the gas mixer was stopped and normal air was sent into the room. Ten minutes later, the infusion pump was turned off and all animals were allowed a 20 minute recovery period, followed by a post-study analysis of rat health and behavior. Minute ventilation data shows that compound (XXXVI) significantly enhances hypoxic ventilation response in rats compared to vehicle. The results are shown in Figure 3.
実施例115:
サルにおけるオピオイド誘発性呼吸抑制に対する化合物(XXXVI)の効果
若齢のマカク(4歳齢のカニクイザル、2〜5kg、n=13)を研究に使用した。動物飼育をUSDA指針の下で行い、プロトコールはEast Carolina Universityの施設内動物管理および使用委員会により承認された。
Example 115:
Effect of compound (XXXVI) on opioid-induced respiratory depression in monkeys Young macaques (4-year-old cynomolgus monkeys, 2-5 kg, n = 13) were used in the study. Animal husbandry was conducted under USDA guidelines and the protocol was approved by the Institutional Animal Care and Use Committee at East Carolina University.
麻酔を5%イソフルランで誘導した後、1.5〜2%イソフルラン(100% O2、2L/分)で維持した。前腕静脈にカニューレ挿入した。インダクタンスプレチスモグラフィーによって呼吸機能をモニタリングするためにVivometrics Lifeshirts(カリフォルニア州ベンチュラ)を動物に装着した。腹部および胸郭のたわみを定性診断較正(QDC)手技によって較正し、一回換気量を、通常の技術を使用して既に測定されたこれらの動物の典型的な一回換気量を表す15mLに正規化した。心拍数を3リードECGで連続的にモニタリングした。 Anesthesia was induced with 5% isoflurane and then maintained with 1.5-2% isoflurane (100% O2, 2 L / min). The forearm vein was cannulated. Animals were equipped with Vivometrics Lifeshirts (Ventura, CA) to monitor respiratory function by inductance plethysmography. Abdominal and thorax deflections are calibrated by a Qualitative Diagnostic Calibration (QDC) procedure, and tidal volume is normalized to 15 mL representing typical tidal volume of these animals already measured using normal techniques Turned into. Heart rate was continuously monitored with a 3-lead ECG.
マイクロストリームCO2センサ(Cardellモニタ、モデル9405)に接続された新生仔経鼻カニューレを介してETCO2を測定した。上腕の内側に位置決めされた反射率プローブ(Nelcor Max-Fast)を使用してパルスオキシメトリーでSpO2およびHRをモニタリングした。HRは、動物の活動がパルスオキシメトリー信号の整合性を損なう際に測定を可能にするECGからも決定された。足首に位置決めされるカフを使用して麻酔下動物においてBPを測定した。 ETCO 2 was measured via a neonatal nasal cannula connected to a microstream CO 2 sensor (Cardell monitor, model 9405). SpO 2 and HR were monitored by pulse oximetry using a reflectance probe (Nelcor Max-Fast) positioned inside the upper arm. HR was also determined from an ECG that allowed measurements when animal activity compromised the integrity of the pulse oximetry signal. BP was measured in anesthetized animals using a cuff positioned at the ankle.
化合物(XXXVI)を20%ヒドロキシプロピルβ-シクロデキストラン(HPBCD)に溶解させ、2μシリンジフィルターによって滅菌濾過した。次に、化合物(A)と表示される化合物(XXXVI)を速度0.20mg/kg/分で5分間送達した後、注入速度を0.10mg/kg/分に10分間減少させた。分時換気量および呼気終末CO2をモニタリングした。ナロキソンHCl(0.05mg/kg静脈内)を送達することでモルヒネ効果を逆転させ、実験を終了させた。データは、化合物(A)が、オピオイドが引き起こした呼気終末二酸化炭素増大の完全逆転を生成し、さらに分時換気量を増大させたことを示した(図4)。 Compound (XXXVI) was dissolved in 20% hydroxypropyl β-cyclodextran (HPBCD) and sterile filtered through a 2 μ syringe filter. Next, compound (XXXVI) labeled Compound (A) was delivered at a rate of 0.20 mg / kg / min for 5 minutes, and then the infusion rate was reduced to 0.10 mg / kg / min for 10 minutes. Minute ventilation and end-tidal CO 2 were monitored. Delivery of naloxone HCl (0.05 mg / kg iv) reversed the morphine effect and terminated the experiment. The data showed that Compound (A) produced a complete reversal of the end-tidal carbon dioxide increase caused by opioids and further increased minute ventilation (Figure 4).
実施例116:
未処理ラットにおける分時換気量(MV)に対する化合物(XXXVI)および(L)の用量依存的効果
すべての外科手技を、医療用圧縮空気中にて2%イソフルランによって誘導される麻酔下で行った。ラットを仰臥位にして、ポリエチレンチューブ(PE-50)を使用して右大腿静脈にカテーテル挿入した。このカテーテルを流体および薬物投与に使用した。同時に、血圧をモニタリングするために右大腿動脈にもカテーテル挿入した。自発呼吸ラットにおいて呼吸パラメータを測定するために、13ゲージ気管内チューブ(内径2.5mm、ペンシルベニア州、Instech Solomon)を使用して気管に挿管した。
Example 116:
Dose-dependent effects of compounds (XXXVI) and (L) on minute ventilation (MV) in untreated rats All surgical procedures were performed under medical anesthesia induced by 2% isoflurane in compressed medical air . The rat was placed in a supine position and a catheter was inserted into the right femoral vein using a polyethylene tube (PE-50). This catheter was used for fluid and drug administration. At the same time, a catheter was also inserted into the right femoral artery to monitor blood pressure. To measure respiratory parameters in spontaneously breathing rats, the trachea was intubated using a 13 gauge endotracheal tube (inner diameter 2.5 mm, Instech Solomon, PA).
1.5%イソフルランで安定したベースラインを確立した後、それぞれ化合物(A)および化合物(B)と表示される化合物(XXXVI)および(L)に対する累積的な用量依存的(0.01、0.03、0.1、0.3、1、3、10mg/kg)換気応答を自発呼吸ラットから作成した。対応する薬物の各用量での最大ピーク分時換気量(MV)値を計算して、ED50値を作成するために使用した。結果を図5に示す。化合物(XXXVI)および(L)はいずれも分時換気量を用量依存的に増大させ、ED50計算値はそれぞれ0.14および0.13mg/kgであった。 After establishing a stable baseline with 1.5% isoflurane, cumulative dose-dependent (0.01, 0.03, 0.1, 0.3) for compounds (XXXVI) and (L) labeled as Compound (A) and Compound (B), respectively. , 1, 3, 10 mg / kg) ventilatory responses were generated from spontaneously breathing rats. Maximum peak minute ventilation (MV) values at each dose of the corresponding drug were calculated and used to generate ED 50 values. The results are shown in FIG. Compound (XXXVI) and (L) are both increased minute ventilation in a dose-dependent manner, ED 50 calculated values were, respectively, 0.14 and 0.13 mg / kg.
実施例117:
未処理ラットにおける用量依存的分時換気量(MV)に対する化合物(CXXI)の効果
上記の手法に従って、化合物(C)と表示される化合物(CXXI)は、用量依存的に分時換気量を増大させることが示された。結果を図6に示す。
Example 117:
Effect of Compound (CXXI) on Dose-Dependent Minute Ventilation (MV) in Untreated Rats According to the above procedure, compound (CXXI) labeled Compound (C) increases minute ventilation in a dose-dependent manner It was shown that The results are shown in FIG.
実施例118:
オピオイド処理ラットにおける化合物(L)の効果
実施例6の手法に従って、化合物(B)と表示される化合物(L)は、図7A〜7Dに示すように、pH、SaO2およびpO2を増大させることおよびpCO2レベルを減少させることで、ラットにおいて血液ガスおよびpHに対するオピオイドの効果を逆転させることが示された。
Example 118:
Effect of Compound (L) in Opioid Treated Rats According to the procedure of Example 6, compound (L), labeled as compound (B), increases pH, SaO 2 and pO 2 as shown in FIGS. 7A-7D And reducing pCO 2 levels have been shown to reverse the effects of opioids on blood gas and pH in rats.
実施例119:
オピオイド処理ラットにおける化合物(CXLII)の効果
実施例6の手法に従って、化合物(D)と表示される化合物(CXLII)は、図8A〜8Dに示すように、pO2レベルを増大させること、(SaO2)酸素飽和を増大させること、pCO2レベルを減少させることおよびpHを上昇させることで、ラットにおいて血液ガスおよびpHに対するオピオイドの効果を逆転させることが示された。
Example 119:
Effect of Compound (CXLII) in Opioid Treated Rats According to the procedure of Example 6, compound (CXLII), designated as compound (D), increases pO 2 levels, as shown in FIGS. 8A-8D, (SaO 2) increasing the oxygen saturation, by raising the and pH decrease the pCO 2 levels were shown to reverse the effects of opioids on blood gases and pH in rats.
実施例120:
ラットにおけるオピオイド誘発性呼吸抑制に対する化合物(CXLII)の効果
実施例5の手法に従って、化合物(D)と表示される化合物(CXLII)は、プレチスモグラフィーで決定されるように、分時換気量(MV)を増大させることでラットにおいてオピオイド誘発性呼吸抑制を逆転させることが示された。結果を図9に示す。
Example 120:
Effect of Compound (CXLII) on Opioid-Induced Respiratory Suppression in Rats According to the procedure of Example 5, compound (CXLII), designated as compound (D), was subject to minute ventilation (as determined by plethysmography) Increasing MV) has been shown to reverse opioid-induced respiratory depression in rats. The results are shown in FIG.
実施例121:
未処理ラットにおける分時換気量(MV)および心血管パラメータに対する化合物の効果
すべての外科手技を、医療用圧縮空気中にて2%イソフルランによって誘導される麻酔下で行った。ラットを仰臥位にして、ポリエチレンチューブ(PE-50)を使用して右大腿静脈にカテーテル挿入した。このカテーテルを流体および薬物投与に使用した。同時に、血圧および心拍数をモニタリングするために右大腿動脈にもカテーテル挿入した。自発呼吸ラットにおいて呼吸パラメータを測定するために、13ゲージ気管内チューブ(内径2.5mm、ペンシルベニア州、Instech Solomon)を使用して気管に挿管した。
Example 121:
Effect of compounds on minute ventilation (MV) and cardiovascular parameters in untreated rats All surgical procedures were performed under anesthesia induced by 2% isoflurane in medical compressed air. The rat was placed in a supine position and a catheter was inserted into the right femoral vein using a polyethylene tube (PE-50). This catheter was used for fluid and drug administration. At the same time, the right femoral artery was also catheterized to monitor blood pressure and heart rate. To measure respiratory parameters in spontaneously breathing rats, the trachea was intubated using a 13 gauge endotracheal tube (inner diameter 2.5 mm, Instech Solomon, PA).
1.5%イソフルランで安定したベースラインを確立した後、化合物(典型的には用量1mpk)を静脈内投与し、換気パラメータを心血管出力(平均動脈圧(MAP)および心拍数)と共に自発呼吸ラットから作成した。最大ピーク分時換気量(MV)応答(MPR)を分時換気量対ベースラインの変化(DMV)と共に以下の表に示すように得た。 After establishing a stable baseline with 1.5% isoflurane, the compound (typically a dose of 1 mpk) is administered intravenously and ventilation parameters from spontaneously breathing rats with cardiovascular output (mean arterial pressure (MAP) and heart rate). Created. Maximum peak minute ventilation (MV) response (MPR) was obtained as shown in the following table along with minute ventilation versus baseline change (DMV).
(表7)
(Table 7)
(表8)
(Table 8)
実施例122:
ベンゾジアゼピン誘発性呼吸抑制(BIRD)に対する化合物(XXXVI)の効果
一局面では、本研究の目的は、ラットにおいてミダゾラムが誘発する呼吸抑制に対する化合物(XXXVI)の静脈内注入の効果を評価することにあった。
Example 122:
Effect of Compound (XXXVI) on Benzodiazepine-Induced Respiratory Inhibition (BIRD) It was.
手法:
化合物(XXXVI)を滅菌水中20%ヒドロキシプロピル-β-シクロデキストランに溶解させ、pH試験紙およびNaOHまたはHClを使用してpH 4〜8に滴定することで、濃度1.5mg/mLの透明で安定した溶液を得た。他の化合物: 10mg/ml溶液として供給された硫酸モルヒネ(Baxter, Inc)、および5mg/mL溶液として供給されたミダゾラム(Hospira, Inc.)。
Method:
Compound (XXXVI) dissolved in 20% hydroxypropyl-β-cyclodextran in sterile water and titrated to pH 4-8 using pH test paper and NaOH or HCl, clear and stable at a concentration of 1.5 mg / mL Solution was obtained. Other compounds: Morphine sulfate supplied as a 10 mg / ml solution (Baxter, Inc) and Midazolam supplied as a 5 mg / mL solution (Hospira, Inc.).
材料:
雄Sprague-Dawleyラット(Harlan, Inc.)、投薬時250〜350g、Harlanによって頸静脈カニューレを用いて外科的に調製。温度/湿度補償(Epstein et al., 1980, J. Apply Physiol. 49:1107-1115)を備えたBuxco, Inc.の12室プレチスモグラフィーシステム(PLY 3223; 米国ノースカロライナ州ウィルミントン、Buxco, Inc)。Biosystem XAソフトウェアv2.11.1。カスタマイズ12部位自動注入システム(Harvard装置; Instech, Inc)
material:
Male Sprague-Dawley rats (Harlan, Inc.), 250-350 g upon dosing, prepared surgically using a jugular vein cannula with Harlan. Buxco, Inc.'s 12-chamber plethysmography system (PLY 3223; Buxco, Inc., Wilmington, NC, USA) with temperature / humidity compensation (Epstein et al., 1980, J. Apply Physiol. 49: 1107-1115) ). Biosystem XA software v2.11.1. Customized 12-site automatic injection system (Harvard device; Instech, Inc)
方法:
ラット全身プレチスモグラフィーを使用することで分時換気量および呼吸パターンを評価および定量化した。動物と室内との間の空気の交換から呼吸波形を作成した。この交換は空気量の変化を誘導することで呼吸波形を構成し、この変化は圧力トランスデューサーで測定した。また、大気の温度および湿度を、室内条件をサンプリングする温度および湿度プローブを使用して測定した。次に補償因子を決定し、標準化アルゴリズム(Epstein et al., 1980, J. Apply Physiol. 49:1107-1115)を使用して呼吸波形に適用することで呼吸条件を補償し、これをパラメータCOMP(付録参照)として報告した。
Method:
Minute ventilation and respiratory patterns were evaluated and quantified using rat whole body plethysmography. A respiratory waveform was created from the exchange of air between the animal and the room. This exchange constructed a breathing waveform by inducing a change in air volume, and this change was measured with a pressure transducer. In addition, atmospheric temperature and humidity were measured using a temperature and humidity probe that samples room conditions. The compensation factor is then determined and compensated for the respiratory condition by applying it to the respiratory waveform using a standardization algorithm (Epstein et al., 1980, J. Apply Physiol. 49: 1107-1115) and this is applied to the parameter COMP (See Appendix).
すべての動物を少なくとも1時間、または動物が不穏でなくなるまでデータ収集前に(最大2時間)、プレチスモグラフィー室に順化させた。ボーラス静脈内(IV)投薬を投薬当たり5〜10秒の速度で行い、カテーテルを滅菌食塩水350μLで洗い流して薬物送達の完了を確実にした。全12匹の動物(6匹媒体処理; 6匹薬物処理)に60秒以内に同時に投薬した。静脈内注入では、媒体または試験化合物を記載のように0.1mg/mLストックで調製し、Harvard装置輸液ポンプで投与した。ミダゾラムのボーラスIV投与の5分後に、化合物(XXXVI)を速度20μL/分/0.3kgで30分かけて、用量0.1mg/kg/分を与えるように注入を介して投与した。同時投薬中の複数の動物のロジスティックスが理由で、包含される研究はいずれも盲検で行われなかった。すべてのプレチスモグラフィーデータはBuxco機器によって自動的に記録した。 All animals were acclimated to the plethysmography room for at least 1 hour, or before data collection (up to 2 hours) until the animals were no longer disturbing. Bolus intravenous (IV) dosing was performed at a rate of 5-10 seconds per dose and the catheter was flushed with 350 μL of sterile saline to ensure drug delivery was complete. All 12 animals (6 vehicle treatment; 6 drug treatment) were dosed simultaneously within 60 seconds. For intravenous infusion, vehicle or test compound was prepared as described in a 0.1 mg / mL stock and administered with a Harvard device infusion pump. Five minutes after midazolam bolus IV administration, compound (XXXVI) was administered via infusion to give a dose of 0.1 mg / kg / min over 30 minutes at a rate of 20 μL / min / 0.3 kg. None of the included studies were conducted blindly due to the logistics of multiple animals during co-medication. All plethysmographic data were recorded automatically by a Buxco instrument.
統計分析:
呼吸データを呼吸ごとに収集し、データ解析用に1分の時間ビンに平均した。投薬間の時間である指定の各取得期間について、呼吸数(f)、一回換気量(TV)、累積量(AV)、分時換気量(MV)、吸気時間(Ti)、呼気時間(Te)、ピーク吸気流量(PIF)、ピーク呼気流量(PEF)、緩和時間(RT)、吸気終末休止期(EIP)、呼気終末休止期間(EEP)、デルタ量(DV)、50% TVでの呼気流量(EF50)、拒絶指数(Rinx)、補償(Comp)、エンハンスドポーズ(Penh)、休止期(PAU)、PEF速度(Rpef)、相対湿度(RH)および気温(Temp)を含む複数の換気パラメータに関する処理前ベースライン値からの変化パーセントを各コホートについて計算した。
Statistical analysis:
Respiratory data was collected for each breath and averaged into 1 minute time bins for data analysis. For each specified acquisition period, which is the time between medications, respiratory rate (f), tidal volume (TV), cumulative volume (AV), minute ventilation (MV), inspiratory time (Ti), expiration time ( Te), peak inspiratory flow (PIF), peak expiratory flow (PEF), relaxation time (RT), end-inspiratory rest period (EIP), end-expiratory rest period (EEP), delta amount (DV), 50% on TV Multiple ventilations including expiratory flow (EF50), rejection index (Rinx), compensation (Comp), enhanced pause (Penh), rest period (PAU), PEF rate (Rpef), relative humidity (RH) and temperature (Temp) The percent change from pre-treatment baseline values for the parameters was calculated for each cohort.
差異パーセントを計算するために、カスタマイズビジュアルベーシック再構築分析マクロを使用する規定の取得期間ごとの曲線下面積(AUC)およびピーク応答値を使用して、各パラメータを媒体と比較した。さらに、化合物による薬物誘発性呼吸抑制の逆転パーセントを、研究におけるすべての動物の平均処理前ベースラインとの比較による、すべての媒体(または未処理)動物から誘導される平均呼吸抑制を使用して計算した。 To calculate the percent difference, each parameter was compared to the media using the area under the curve (AUC) and peak response value for each specified acquisition period using a customized visual basic reconstruction analysis macro. In addition, the percent reversal of drug-induced respiratory depression by the compound was calculated using the mean respiratory depression derived from all vehicle (or untreated) animals, compared to the mean pretreatment baseline for all animals in the study. Calculated.
結果:
化合物(XXXVI)(0.1mg/kg/分)は、注入期間の終わり(t=38)までにMVのBIRD誘発性減少を100逆転させた。化合物(XXXVI)は、MV(図15)、TV(図16)、AV、Te、PIF、PEFおよびEEPに対するミダゾラムの効果を逆転させる効果を示したが、f(図17)、Ti、RT、EIP、dv、EF50、Rinx、Comp、Penh、PAU、Rpef、RHおよびTempに対しては明白な効果を示さなかった。IVボーラス注射中に、すべての群における分時換気量の小さな増大がしばしば見られたが、これは動物覚醒による注射人為現象と見なされ、換気に対する他の明らかな影響は示されなかった。
result:
Compound (XXXVI) (0.1 mg / kg / min) reversed BIRD-induced reduction of MV by 100 by the end of the infusion period (t = 38). Compound (XXXVI) showed the effect of reversing the effect of midazolam on MV (Figure 15), TV (Figure 16), AV, Te, PIF, PEF and EEP, but f (Figure 17), Ti, RT, There was no apparent effect on EIP, dv, EF50, Rinx, Comp, Penh, PAU, Rpef, RH and Temp. During IV bolus injection, a small increase in minute ventilation in all groups was often seen, which was considered an injection artifact due to animal arousal and showed no other apparent effect on ventilation.
潜在的有害事象をモニタリングしたが、試験用量での化合物(XXXVI)の投与後には挙動に対する有害な効果は観察されなかった。これらの実験の結果は、化合物(XXXVI)が、ラットにおいて試験用量でミダゾラム誘発性呼吸抑制を逆転させることおよび十分に忍容性を示すようであることを示した。 Potential adverse events were monitored, but no adverse effects on behavior were observed after administration of compound (XXXVI) at the test dose. The results of these experiments indicated that compound (XXXVI) appeared to reverse and be well tolerated with midazolam-induced respiratory depression at the test dose in rats.
実施例123:
高炭酸ガス血症に対する化合物(XXXVI)の効果
一局面では、本研究の目的は、ラットにおいて高炭酸ガス血性換気応答(HCVR)に対する静脈内注入で投与される化合物(XXXVI)の効果を評価することにあった。
Example 123:
Effect of Compound (XXXVI) on Hypercapnia In one aspect, the aim of this study is to evaluate the effect of compound (XXXVI) administered intravenously on hypercapnic ventilatory response (HCVR) in rats There was a thing.
滅菌水中20%ヒドロキシプロピル-β-シクロデキストランである媒体を、予め秤量した化合物に加え、徹底的に混合することで透明溶液を得た。1.5mg/mLストックを作り出すことで注入量0.10mg/kg/分を得た。別の0.45mg/mLストックを作り出すことで注入量0.03mg/kg/分を得た。すべての化合物溶液および媒体を、pH試験紙を使用してNaOHまたはHCl溶液で滴定することで、pH 4〜8を示すように滴定した。 A medium which is 20% hydroxypropyl-β-cyclodextran in sterile water was added to the pre-weighed compound and mixed thoroughly to obtain a clear solution. An injection volume of 0.10 mg / kg / min was obtained by creating a 1.5 mg / mL stock. An injection volume of 0.03 mg / kg / min was obtained by creating another 0.45 mg / mL stock. All compound solutions and media were titrated to show pH 4-8 by titrating with NaOH or HCl solution using pH test paper.
投薬時250〜350gの雄Sprague-Dawleyラット(Harlan, Inc.)は、Harlanによって頸静脈カニューレを含むように外科的に調製されていた。温度/湿度補償(Epstein et al., 1980, J. Apply Physiol. 49:1107-1115)を備えたBuxco, Inc.の12室プレチスモグラフィーシステム(PLY 3223; 米国ノースカロライナ州ウィルミントン、Buxco, Inc)。Biosystem XAソフトウェアv2.11.1およびカスタマイズ12部位自動注入システム(Harvard装置、Instech, Inc)を使用。高炭酸ガス血症濃度(3% CO2、21% O2、残余は窒素)を与えるためにガス混合器(CWE Inc.)をこの実験に使用した。100% O2、CO2および窒素を収容する3つのタンクをガス混合器に取り付け、カスタマイズしたガス混合物を各プレチスモグラフに速度2L/分で供給した。 Male Sprague-Dawley rats (Harlan, Inc.) 250-350 g at the time of dosing were surgically prepared by Harlan to include a jugular vein cannula. Buxco, Inc.'s 12-chamber plethysmography system (PLY 3223; Buxco, Inc., Wilmington, NC, USA) with temperature / humidity compensation (Epstein et al., 1980, J. Apply Physiol. 49: 1107-1115) ). Using Biosystem XA software v2.11.1 and a customized 12 site automatic injection system (Harvard instrument, Instech, Inc). A gas mixer (CWE Inc.) was used for this experiment to provide hypercapnic concentrations (3% CO 2 , 21% O 2 , balance nitrogen). Three tanks containing 100% O 2 , CO 2 and nitrogen were attached to the gas mixer and a customized gas mixture was fed to each plethysmograph at a rate of 2 L / min.
ラット全身プレチスモグラフィーを使用することで分時換気量および呼吸パターンを評価および定量化した。動物と室内との間の空気の交換から呼吸波形を作成した。この交換は空気量の変化を誘導することで呼吸波形を構成し、この変化は圧力トランスデューサーで測定した(Lomask M., 2005, "Respiration measurement in the whole body plethysmography," Buxco Inc.、http://www.buxco.com/downloads/LomaskWBP.pdfから検索)。また、大気の温度および湿度を、室内条件をサンプリングする温度および湿度プローブを使用して測定した。次に補償因子を決定し、標準化アルゴリズム(Epstein et al., 1980, J. Apply Physiol. 49:1107-1115)を使用して呼吸波形に適用することで呼吸条件を補償し、これをパラメータCOMPとして報告した。 Minute ventilation and respiratory patterns were evaluated and quantified using rat whole body plethysmography. A respiratory waveform was created from the exchange of air between the animal and the room. This exchange constructed a respiratory waveform by inducing a change in air volume, which was measured with a pressure transducer (Lomask M., 2005, "Respiration measurement in the whole body plethysmography," Buxco Inc., http: // Search from www.buxco.com/downloads/LomaskWBP.pdf). In addition, atmospheric temperature and humidity were measured using a temperature and humidity probe that samples room conditions. The compensation factor is then determined and compensated for the respiratory condition by applying it to the respiratory waveform using a standardization algorithm (Epstein et al., 1980, J. Apply Physiol. 49: 1107-1115) and this is applied to the parameter COMP As reported.
すべての動物を少なくとも1時間、または動物が不穏でなくなるまで(データ収集前に最大2時間)、プレチスモグラフィー室に順化させた。分時換気量(MV)を、Biosystem XAソフトウェアによって一回換気量(TV)および呼吸数(f)の直接測定値から式MV = TV x fを使用して計算した。分時換気量(mL/分)は、換気パフォーマンスを評価するための一般的なエンドポイントである。プロトコールは、化合物(XXXVI)の20分の注入としての投与と、それに続く化合物(XXXVI)注入に加えての3%高炭酸ガス血症に対する20分の曝露とを含んだ。20分の高炭酸ガス血症後、化合物(XXXVI)注入をさらに10分間続けることで化合物(XXXVI)の総注入時間を50分とした。各実験は、試験化合物(XXXVI)(0.03または0.10mg/kg/分)を投与した6匹の動物 対 媒体を投与した6匹の動物を含み、いずれも高炭酸ガス血症(3%)に曝露された。挙動に対する有害な効果について動物を連続的にモニタリングおよび観察した。各試験動物についてそのような発見を実験ノートに記録した。 All animals were acclimated to the plethysmography room for at least 1 hour or until the animals were not disturbing (up to 2 hours before data collection). Minute ventilation (MV) was calculated from the direct measurements of tidal volume (TV) and respiratory rate (f) using the formula MV = TV x f by Biosystem XA software. Minute ventilation (mL / min) is a common endpoint for assessing ventilation performance. The protocol included administration as a 20 minute infusion of compound (XXXVI) followed by a 20 minute exposure to 3% hypercapnia in addition to the compound (XXXVI) infusion. After 20 minutes of hypercapnia, compound (XXXVI) infusion was continued for another 10 minutes, resulting in a total compound (XXXVI) infusion time of 50 minutes. Each experiment included 6 animals dosed with test compound (XXXVI) (0.03 or 0.10 mg / kg / min) versus 6 animals dosed with vehicle, all of which were hypercapnic (3%). Exposed. Animals were continuously monitored and observed for adverse effects on behavior. Such findings were recorded in experimental notes for each test animal.
統計分析
呼吸データを呼吸ごとに収集し、データ解析用に1分の時間ビンに平均した。投薬間の時間である指定の各取得期間について、呼吸数(f)、一回換気量(TV)、累積量(AV)、分時換気量(MV)、吸気時間(Ti)、呼気時間(Te)、ピーク吸気流量(PIF)、ピーク呼気流量(PEF)、緩和時間(RT)、吸気終末休止期(EIP)、呼気終末休止期間(EEP)、デルタ量(dV)、50% TVでの呼気流量(EF50)、拒絶指数(Rinx)、補償(Comp)、エンハンスドポーズ(Penh)、休止期(PAU)、PEF速度(Rpef)、相対湿度(RH)および気温(Temp)を含む複数の換気パラメータに関する処理前ベースライン値からのAUC変化パーセントを各コホートについて計算した。差異パーセントを計算するために、カスタマイズビジュアルベーシック再構築分析マクロを使用する規定の取得期間ごとの曲線下面積(AUC)およびピーク応答値を使用して、各パラメータを媒体と比較した(Lopotosky, S. Galleon Buxco Restructure tool, v5.2, 2008)。単一の独立型研究のすべてのデータ解析はこの再構築分析マクロを使用して行った(Lopotosky, S. Galleon Buxco Restructure tool, v5.2, 2008)。高炭酸ガス血症研究において、両方の投薬に関するすべての併合型データ解析をMV、TVおよびfのみについてGraphpad Prismで行った。さらに、群のピーク応答に対する高炭酸ガス血症曝露の直前のコホート平均に対する増大パーセントを計算した。併合型高炭酸ガス血症研究ではt=62〜t=67を使用した。
Statistical analysis Respiration data were collected for each breath and averaged into 1-minute time bins for data analysis. For each specified acquisition period, which is the time between medications, respiratory rate (f), tidal volume (TV), cumulative volume (AV), minute ventilation (MV), inspiratory time (Ti), expiration time ( Te), peak inspiratory flow (PIF), peak expiratory flow (PEF), relaxation time (RT), end inspiratory pause (EIP), end expiratory pause (EEP), delta volume (dV), 50% on TV Multiple ventilations including expiratory flow (EF50), rejection index (Rinx), compensation (Comp), enhanced pause (Penh), rest period (PAU), PEF rate (Rpef), relative humidity (RH) and temperature (Temp) The percent AUC change from the pre-treatment baseline value for the parameters was calculated for each cohort. To calculate the percent difference, each parameter was compared to the media using the area under the curve (AUC) and peak response value for each acquisition period using the customized visual basic reconstruction analysis macro (Lopotosky, S Galleon Buxco Restructure tool, v5.2, 2008). All data analysis of a single stand-alone study was performed using this reconstruction analysis macro (Lopotosky, S. Galleon Buxco Restructure tool, v5.2, 2008). In the hypercapnia study, all combined data analysis for both medications was performed with Graphpad Prism for MV, TV and f only. In addition, the percent increase over the cohort average just prior to hypercapnia exposure to the group peak response was calculated. In the combined hypercapnia study, t = 62 to t = 67 was used.
結果および考察:
化合物(XXXVI)の投与は、0.10mg/kg/分で未処理動物における呼吸を刺激したが、0.03mg/kg/分ではほとんどまたは全く効果がなかった。さらに、動物に化合物(XXXVI)を投与した場合、高炭酸ガス血症(3% CO2)に対する曝露は、媒体処理のみに比べて用量依存的に増大したMV応答を生じさせた。静脈内0.03または0.1mg/kg/分での化合物(XXXVI)は、0.10mg/kg/分の比較的大きな用量では高炭酸ガス血症換気応答(HCVR)の増大を生じさせたが、0.03mg/kg/分では効果がなかった。0.03mg/kg/分群および媒体群はt=62からt=67までにHCVRの60%促進を生じさせた。0.10mg/kg/分は、化合物(XXXVI)のみによるMV上昇に加えて、同時点でのHCVR曝露中のMVの44%増大を示した。HCVRに対する0.03mg/kg/分での化合物(XXXVI)は、PIFのみに対して効果を生じさせ、f、TV、AV、MV、Ti、Te、PEF、RT、EIP、EEP、dv、EF50、Rinx、Comp、penh、PAU、Rpef、RHまたはTempの識別可能な変化を生じさせなかった。用量0.10mg/kg/分は、f、TV、AV、MV、Ti、Te、PIF、PEF、EIP、EF50、CompおよびRHに対して効果を示し、EEP、dV、Rinx、Penh、PAU、RpefおよびTempの識別可能な変化を生じさせなかった。これらのデータは、注入液として投与される化合物(XXXVI)が高炭酸ガス血症の換気効果を強化することで、急性低酸素血症時の換気を容易にすることができることを示唆している。さらに、試験用量での化合物(XXXVI)に関連する有害な臨床知見は存在しなかった。
Results and Discussion:
Compound (XXXVI) administration stimulated respiration in untreated animals at 0.10 mg / kg / min, but had little or no effect at 0.03 mg / kg / min. Furthermore, when the animals were administered compound (XXXVI), exposure to hypercapnia (3% CO 2 ) produced a dose-dependent increased MV response compared to vehicle treatment alone. Compound (XXXVI) at intravenous 0.03 or 0.1 mg / kg / min caused an increase in hypercapnic ventilatory response (HCVR) at relatively large doses of 0.10 mg / kg / min, but 0.03 mg No effect at / kg / min. The 0.03 mg / kg / min group and the vehicle group produced 60% acceleration of HCVR from t = 62 to t = 67. 0.10 mg / kg / min showed a 44% increase in MV during HCVR exposure at the same time, in addition to an increase in MV by compound (XXXVI) alone. Compound (XXXVI) at 0.03 mg / kg / min against HCVR has an effect on PIF only, f, TV, AV, MV, Ti, Te, PEF, RT, EIP, EEP, dv, EF50, No discernible change in Rinx, Comp, penh, PAU, Rpef, RH or Temp. Dose 0.10 mg / kg / min is effective against f, TV, AV, MV, Ti, Te, PIF, PEF, EIP, EF50, Comp and RH, EEP, dV, Rinx, Penh, PAU, Rpef And did not cause a discernable change in Temp. These data suggest that compound (XXXVI) administered as an infusion can facilitate ventilation during acute hypoxemia by enhancing the ventilation effect of hypercapnia . Furthermore, there were no adverse clinical findings associated with compound (XXXVI) at the test dose.
実施例124:
ラットにおける呼吸数、一回換気量、分時換気量、および分時換気量の変化の5分平均に対する化合物(XLII)の効果
一般的方法:
成体雄Sprague Dawleyラット(体重250〜350g; 米国インディアナ州インディアナポリス、Harlan)を酸素中イソフルランで麻酔した。大腿静脈にカニューレを挿入して化合物を投与した。実験中は体温を36.0〜37.2℃に維持した。気管気流を測定するために、気管の頸部にカニューレを挿入し、ラットのサイズの呼吸流量計を取り付けた。外科的な機器設定が完了した後、イソフルランをゆっくりと中断し、一方でウレタン(1.8g/kg)を10〜15分かけて静脈内投与して麻酔を維持した。ラットに自発呼吸させ酸素を100%吸気させた。イソフルランの中断の少なくとも30〜45分後に、ベースライン気管気流を20〜30分間記録し、続いて化合物を投与した。媒体および試験化合物を15〜25秒かけて一定量(1mL/kg)で静脈内投与した。化合物の各投与の間には少なくとも15分をおいた。化合物投与の前、途中および後に気管気流を連続的に記録した。一回換気量を気流の積分から導出し、呼吸数を1分当たりの吸気サイクルの数から導出した。分時換気量を一回換気量および呼吸数の積として計算した(図32)。
Example 124:
Effect of compound (XLII) on the 5-minute mean of respiratory rate, tidal volume, minute ventilation, and minute ventilation changes in rats General methods:
Adult male Sprague Dawley rats (weight 250-350 g; Harlan, Indianapolis, IN, USA) were anesthetized with isoflurane in oxygen. The femoral vein was cannulated to administer the compound. During the experiment, body temperature was maintained at 36.0-37.2 ° C. To measure tracheal airflow, a cannula was inserted into the neck of the trachea and a rat-sized respiratory flow meter was attached. After completion of the surgical instrument setup, isoflurane was slowly interrupted while urethane (1.8 g / kg) was administered intravenously over 10-15 minutes to maintain anesthesia. Rats breathed spontaneously and inhaled 100% of oxygen. At least 30-45 minutes after the interruption of isoflurane, baseline tracheal airflow was recorded for 20-30 minutes, followed by compound administration. The vehicle and test compound were administered intravenously at a constant volume (1 mL / kg) over 15-25 seconds. There was at least 15 minutes between each dose of compound. Tracheal airflow was continuously recorded before, during and after compound administration. The tidal volume was derived from the airflow integral and the respiratory rate was derived from the number of inspiratory cycles per minute. Minute ventilation was calculated as the product of tidal volume and respiratory rate (Figure 32).
結果:
化合物(XLII)は呼吸数および一回換気量の両方、ならびにそれらの積である分時換気量を媒体に比べて増大させた。
result:
Compound (XLII) increased both respiratory rate and tidal volume, and their product, minute ventilation, relative to vehicle.
実施例125:
ラットにおける呼吸数、一回換気量、分時換気量、および分時換気量の変化の5分平均に対する化合物(CLXXII)の効果
一般的方法: 上記実施例124を参照
Example 125:
Effect of compound (CLXXII) on 5-minute average of respiratory rate, tidal volume, minute ventilation, and minute ventilation changes in rats General method: See Example 124 above
結果
化合物(CLXXII)は呼吸数および一回換気量の両方、ならびにそれらの積である分時換気量を媒体に比べて増大させた。
Results Compound (CLXXII) increased both respiratory rate and tidal volume, and their product, minute ventilation, relative to vehicle.
実施例126:
GH3細胞中のBKカリウムチャネル電流に対する化合物(XXXV)の効果
実験手法
試験物のストック溶液をジメチルスルホキシド(DMSO)中で調製し、凍結保存した。ストック溶液を生理食塩水中に希釈することで試験物濃度を毎日新たに調製した(組成はmM単位): KCl、125; CaCl2、8.5; HEPES、10; EGTA、11.25; pHはKOHで7.2に調整(使用するまで毎週調製し冷蔵)。すべての試験溶液には0.1% DMSOを含めた。
Example 126:
Effect of compound (XXXV) on BK potassium channel current in GH3 cells Experimental procedure Stock solutions of test articles were prepared in dimethyl sulfoxide (DMSO) and stored frozen. Stock solutions of the test compound concentration by diluting with physiological saline were freshly prepared daily (composition in mM): KCl, 125; CaCl 2 , 8.5; HEPES, 10; EGTA, 11.25; pH to 7.2 with KOH Adjust (prepare weekly until use and refrigerate). All test solutions contained 0.1% DMSO.
標準的手法を使用してGH3細胞を培養液中で増殖させた。イオン電流をGH3細胞の内側外面型パッチから測定した。チャネル活性を対称K+条件下にて保持電位-60mVでモニタリングした。各濃度の試験物の存在前および存在下の活性をそれぞれ3分間以下にわたり記録した。 GH3 cells were grown in culture using standard techniques. The ionic current was measured from the inner and outer patch of GH3 cells. Channel activity was monitored at a holding potential of -60 mV under symmetric K + conditions. Activity before and in the presence of each concentration of test article was recorded over a period of 3 minutes each.
データ解析
pCLAMP(Ver. 8.2)プログラム(カリフォルニア州サニーベール、MDS-AT)のスイートを使用してデータの取得および解析を行った。下記式を使用して試験物による阻害パーセントを計算した: 100*(NPo対照 - NPo試験)/NPo対照
Data analysis
Data acquisition and analysis were performed using a suite of pCLAMP (Ver. 8.2) program (Sunnyvale, Calif., MDS-AT). The percent inhibition by the test article was calculated using the following formula: 100 * (NPo control -NPo test ) / NPo control
結果
化合物(XXXV)を1および10μMで評価し、陽性対照であるアルミトリンを1μMで評価した。チャネル効果を試験物の適用後の定常状態での活性の変化から推定した。化合物(XXXV)の効果を表9に要約する。1μM(XXXV)の前および後のサンプル記録ならびに全点ヒストグラムを図21に示す。
Results Compound (XXXV) was evaluated at 1 and 10 μM, and positive control aluminumtrin was evaluated at 1 μM. The channel effect was estimated from the change in activity at steady state after application of the test article. The effects of compound (XXXV) are summarized in Table 9. Sample recordings before and after 1 μM (XXXV) and all point histograms are shown in FIG.
(表9)内側外面型パッチにおいて記録されたGH3細胞中で発現した単一のBKカリウムチャネルに対する化合物(XXXV)の効果
NPo: 総チャネル開口確率。
阻害(%) = 100*(NPo対照 - NPo試験)/NPo対照
洗い出しはパッチC 05 SP 101007 0000に対して1μMアルミトリンの適用の前および後に行い、パッチB 05 SP 101012 000に対して10μM(XXXV)の適用後に行った。
Table 9: Effect of compound (XXXV) on single BK potassium channel expressed in GH3 cells recorded in medial exterior patch
NPo: Total channel opening probability.
Inhibition (%) = 100 * (NPo control -NPo test ) / NPo control
Washing was performed before and after application of 1 μM aluminin for patch C 05 SP 101007 0000 and after application of 10 μM (XXXV) for patch B 05 SP 101012 000.
概要および結論
図34に示すように、化合物(XXXV)は、GH3細胞中で発現する天然BKチャネルの濃度依存的阻害を実行した。最高試験濃度(10μM)において、化合物(XXXV)は総チャネル開口確率を42%減少させた。
Overview and Conclusion As shown in FIG. 34, compound (XXXV) performed concentration-dependent inhibition of the native BK channel expressed in GH3 cells. At the highest test concentration (10 μM), compound (XXXV) reduced the total channel opening probability by 42%.
実施例127:
ラットTASK-1(KCNK1)およびヒトTASK-3(KCNK9)チャネルを通じたタリウム流に対する化合物の効果
実験手法
(a) 細胞播種プレート:
テトラサイクリン誘導性組換えラットKCNK3/TASK-1を発現させるCHO細胞(KCNK3-CHO細胞)を、ポリ-D-リジンコーティング384ウェルプレートに6,000細胞/ウェル(120,000細胞/mLの50μl/ウェル)の密度でプレーティングし、5% CO2および1μg/mLテトラサイクリンの存在下、30℃で72時間インキュベートした。テトラサイクリン誘導性組換えヒトKCNK9/TASK-3を発現させるHEK細胞(KCNK9-HEK細胞)を、1ウェル当たり15,000細胞(50μl/ウェル、300,000細胞/mL)の密度でプレーティングし、1μg/mLテトラサイクリンの存在下、37℃および5% CO2で終夜インキュベートした。
Example 127:
Effect of compounds on thallium flow through rat TASK-1 (KCNK1) and human TASK-3 (KCNK9) channels <br/> Experimental approach
(a) Cell seeding plate:
CHO cells expressing tetracycline-inducible recombinant rat KCNK3 / TASK-1 (KCNK3-CHO cells) at a density of 6,000 cells / well (50 μl / well of 120,000 cells / mL) in poly-D-lysine-coated 384-well plates And incubated for 72 hours at 30 ° C. in the presence of 5% CO 2 and 1 μg / mL tetracycline. HEK cells expressing tetracycline-inducible recombinant human KCNK9 / TASK-3 (KCNK9-HEK cells) are plated at a density of 15,000 cells per well (50 μl / well, 300,000 cells / mL) and 1 μg / mL tetracycline Incubated overnight at 37 ° C. and 5% CO 2 .
(b) 化合物含有プレートの調製:
10mM 100% DMSO母プレートから薬物プレートを調製した。化合物を384ウェル薬物プレートに移し、合計希釈9回の100% DMSO中1:3系列希釈で滴定した。希釈プレートは、母プレートから2.4μlを取得し、アッセイ緩衝液17.6μlに加えて12% DMSO希釈プレートにすることで作製する。希釈プレートの1μlを取得し、アッセイ緩衝液40μlに加えて最終DMSO濃度0.3%にすることで、希釈プレートから最終娘プレートを調製する。各化合物を二つ組で評価し、評価される濃度範囲は3nM〜30μMとした。
(b) Preparation of compound-containing plates:
Drug plates were prepared from 10
アッセイプロトコール:
チャネルを開口させるための刺激と共にタリウムを細胞外溶液に加えた時、Tl+はその濃度勾配を下って細胞に流入した。サイトゾル蛍光を増大させる指示薬色素FluxOR(商標)によってチャネル活性を検出した。FluxOR(商標)指示薬色素は、膜透過性アセトキシメチルエステルとして細胞中に添加した。各アッセイ日に、20 mM HEPESで緩衝されてNaOHでpH 7.4に調整されたハンクス平衡塩類溶液(HBSS)から、FluxOR(商標)アッセイ緩衝液を新たに作製した。色素添加溶液は製造者の説明書に従って調製し、プレーティング培地を細胞から手作業で除去した後で色素溶液25μlをマルチスポイトによって各ウェルに適用した。色素は暗室中にて室温で90分間添加した。
Assay protocol:
When thallium was added to the extracellular solution along with a stimulus to open the channel, Tl + flowed down the concentration gradient into the cell. Channel activity was detected by the indicator dye FluxOR ™ that increases cytosolic fluorescence. FluxOR ™ indicator dye was added into the cells as a membrane permeable acetoxymethyl ester. On each assay day, a new FluxOR ™ assay buffer was made from Hanks Balanced Salt Solution (HBSS) buffered with 20 mM HEPES and adjusted to pH 7.4 with NaOH. The dye addition solution was prepared according to the manufacturer's instructions and 25 μl of dye solution was applied to each well with a multi-dropper after manually removing the plating medium from the cells. The dye was added for 90 minutes at room temperature in a dark room.
90分の色素添加インキュベーションおよび引き続く手作業での色素除去の後、薬物娘プレート24μlをcybi-wellシステムによって細胞プレートに移し、次に室温で20分間インキュベートしてウェル内での平衡化を可能にした。5X塩化物フリー緩衝液、タリウムおよび硫酸カリウムから、10mM K+ 2.8mM Tl+という所望の最終アッセイ濃度の5倍を含有する刺激緩衝液を調製した。次に細胞プレートをFDSS 6000動態イメージングプレートリーダー(Hamamatsu)に移した。525nmでの蛍光(励起488nm)を1Hzで10秒間測定することでプレート全体のベースラインを確立した。ベースラインを確立した後、刺激緩衝液6μl/ウェルを加え、蛍光シグナルをさらに140秒間記録した。 After 90 minutes of dye addition and subsequent manual dye removal, 24 μl of the drug daughter plate is transferred to the cell plate by the cybi-well system and then incubated for 20 minutes at room temperature to allow in-well equilibration did. Stimulation buffer containing 5 times the desired final assay concentration of 10 mM K + 2.8 mM Tl + was prepared from 5X chloride-free buffer, thallium and potassium sulfate. The cell plates were then transferred to a FDSS 6000 dynamic imaging plate reader (Hamamatsu). A baseline for the entire plate was established by measuring fluorescence at 525 nm (excitation 488 nm) at 1 Hz for 10 seconds. After establishing the baseline, 6 μl / well of stimulation buffer was added and the fluorescence signal was recorded for an additional 140 seconds.
データ解析
Galleon化合物の非存在下および存在下の蛍光シグナルから、阻害濃度曲線をプロットし、IC50値を曲線フィッティングアルゴリズムを使用して推定した。
Data analysis
Inhibitory concentration curves were plotted from the fluorescence signals in the absence and presence of Galleon compounds and IC 50 values were estimated using a curve fitting algorithm.
結果
結果を表10に要約する。ラットTASK-1およびヒトTASK-3の活性の指標としてTl+流を使用すると、いくつかの化合物はrTASK-1の遮断を示した。
Results The results are summarized in Table 10. When Tl + current was used as an indicator of the activity of rat TASK-1 and human TASK-3, some compounds showed rTASK-1 blockade.
(表10)ラットTASK-1およびhTASK-3の阻害に関するIC50値
Table 10: IC 50 values for inhibition of rat TASK-1 and hTASK-3
実施例128:
ヒトボランティアにおける換気に対する化合物(XXXVI)の効果
同様の設計の2つの単回投与試験の際、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)をヒトに投与した。
Example 128:
Effect of Compound (XXXVI) on Ventilation in Human Volunteers N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl during two single-dose trials of similar design ) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was administered to humans.
第1の試験(GAL-021-101)は、健康な対象における用量漸増単回投与試験とした。注入部位における軽度/中程度の灼熱感が、プラセボと薬物処置対象との間で異なる唯一の有害事象であった。最高用量(0.96mg/kg/時)において、分時換気量の刺激および呼気終末CO2(ETCO2)の減少が認められた。 The first study (GAL-021-101) was a dose escalation single dose study in healthy subjects. A mild / moderate burning sensation at the injection site was the only adverse event that differed between placebo and drug-treated subjects. At the highest dose (0.96 mg / kg / hr), stimulation of minute ventilation and a decrease in end-tidal CO 2 (ETCO 2 ) were observed.
第2の試験(GAL-021-102)は、最初の試験の間に調査した用量範囲を2倍に拡張し、オピオイドまたは麻酔薬の同時使用なしで健康な対象における最大呼吸刺激用量を確立した。0.96mg/kg/時で分時換気量の同様の変化が認められ、最高用量(1.92mg/kg/時)で効果はより大きくなった。 The second study (GAL-021-102) doubled the dose range investigated during the first study and established the maximum respiratory stimulating dose in healthy subjects without concurrent use of opioids or anesthetics . A similar change in minute ventilation was observed at 0.96 mg / kg / hour, with a greater effect at the highest dose (1.92 mg / kg / hour).
フェーズIデータ
(a) フェーズI臨床安全性の概要
第1の試験(GAL-021-101)は、健康な対象の3つの交互の(alternating)コホートにおける、9つの期間の、二重盲検無作為化プラセボ対照用量漸増単回投与試験とした。対象10名の3つのコホートをそれぞれ、回転パネル設計において4:1の比(処置8、プラセボ2)で処置に対して無作為に分けた(図35)。第1コホートの対象は投与期間1、4および7に参加し、第2コホートは投与期間2、5および8に参加し、第3コホートは投与期間3、6および9に参加した。第1の投与期間においてプラセボを投与した対象には、第2および第3の投与期間においてもプラセボを投与した。同様に、薬物処置対象には3つすべての投与期間において薬物を投与した。終夜の絶食後、対象にN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)またはプラセボを静脈内注入し、次に続く24時間の間にPD、PKおよび安全性の評価を行った。
Phase I data
(a) Phase I clinical safety summary The first study (GAL-021-101) is a nine-period, double-blind, randomized placebo in three alternating cohorts of healthy subjects. Control dose escalation single dose study. Each of the 3 cohorts of 10 subjects was randomly divided into treatments with a 4: 1 ratio (
8つの静脈内用量レベルを投与し、最初7つの用量は1、2、3または4時間の固定速度注入(0.1〜0.96mg/kg/時)とし、最後は負荷量(0.72mg/kg/時で1時間)を用い、その後、維持量(0.36mg/kg/時で3時間)を投与した。 Eight intravenous dose levels are administered, with the first seven doses being fixed rate infusions (0.1-0.96 mg / kg / hour) for 1, 2, 3 or 4 hours, and finally the loading dose (0.72 mg / kg / hour) 1 hour) followed by administration of a maintenance dose (0.36 mg / kg / hour for 3 hours).
第2の試験(GAL-021-102)は、健康な対象の交互のコホートにおける、4つの期間の、二重盲検無作為化プラセボ対照用量漸増単回投与試験とした。対象9名の2つのコホートをそれぞれ、回転パネル設計において2:1の比(処置6、プラセボ3)で処置に対して無作為に分けた。第1コホートの対象は投与期間1および3に参加し、第2コホートは投与期間2および4に参加した。対象には試験中にプラセボを最大1回投与した。終夜の絶食後、対象にN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)またはプラセボを静脈内注入し、次に続く24時間の間にPD、PKおよび安全性の評価を行った。
The second study (GAL-021-102) was a four-blind, randomized, placebo-controlled, dose escalating single dose study in an alternating cohort of healthy subjects. Two cohorts of 9 subjects were each randomized to treatment with a 2: 1 ratio (
3つの静脈内用量レベルを固定速度注入(0.96〜1.92mg/kg/時間)で2時間投与した。第3の処置期間中、2名の対象が呼吸努力の増大およびETCO2の低下を示し(最下点: 22および29mmHg)、注入を停止したところ呼吸努力は速やかに減少した。さらなる用量漸増の停止基準に適合した。第4および最終の処置期間中、対象を以前の処置に基づくより低い2つの用量レベルに再び割り当てることで、これらの用量レベルを投与する対象の総数を増大させた。 Three intravenous dose levels were administered for 2 hours with a fixed rate infusion (0.96-1.92 mg / kg / hour). During the third treatment period, two subjects showed an increase in respiratory effort and a decrease in ETCO 2 (lowest points: 22 and 29 mmHg), and the respiratory effort decreased rapidly when the infusion was stopped. The criteria for stopping further dose escalation were met. During the fourth and final treatment period, subjects were reassigned to two lower dose levels based on the previous treatment to increase the total number of subjects receiving these dose levels.
第3の試験、すなわち2パートの、4処置期間の、クロスオーバー型の二重盲検プラセボ対照段階的注入試験では、オピオイド誘発性呼吸抑制モデルにおける呼吸駆動に対するN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の換気PD効果を評価した。パート1では、動的呼気終末CO2強制技術を使用した。これは、標的分時換気量20L/分を生じさせる進行性高炭酸ガス血症である。達成された時点でPCO2を処置期間の残りを通じて同一レベルに維持する(クランプする)ことで、分時換気量に対するCO2変化の交絡的影響を除去する。
A third study, a two-part, four-treatment, cross-over, double-blind, placebo-controlled, step-by-step infusion study, N- (4,6-bis-) on respiratory drive in an opioid-induced respiratory depression model. The ventilation PD effect of n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was evaluated.
各パートでは、対象を2つの処置(プラセボまたはN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI))に無作為に分け、各対象には各処置を1回行った。パート2では、パート1の処置順序およびオピオイド投与を、周囲空気条件および疼痛評価の追加の下で繰り返した。すべての処置期間を経時的設計によって7つのセグメントに細分した(処置期間の詳細は図36に示す)。用量反応の予備的評価を行うために、アルフェンタニルの2つの用量レベルおよび(XXXVI)の2つの用量レベルが各処置期間に含まれた。
In each part, subjects were treated with two treatments (placebo or N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogen sulfate Salt (XXXVI)) and each subject received one treatment. In
パート2では、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)がオピオイドの疼痛低減を妨げるか否かを判定するために、脛骨の上での経皮的電気刺激を使用して疼痛を評価した。
In
23名の対象が試験に参加した。12名の対象がパート1の両処置期間を完了し、参加した8名の対象がパート2の両処置期間を完了した。3名の対象がパート1の一方の処置期間を完了した。これらの対象のうち、2名が第1の処置期間を完了した後に試験を中断し、3人目の対象は第2の処置期間のセグメント2を完了する前に中断した。これら3名の対象のうち1名がパート2を成功裏に完了した。6名の対象が第1のセグメントの開始直前からセグメント2の完了までの間で試験から脱落した。セグメント2を完了した場合、対象は処置期間の残り5つのセグメントを完了した。これらの対象による脱落の主要な理由は、手技に関連する理由(例えば動脈ラインの設置、マスクに関連する不安)、または追加の吸気CO2が誘導した高炭酸ガス血症によって誘導された過換気に順応する上での困難であった。
23 subjects participated in the study. Twelve subjects completed both treatment periods in
図36に示すように、各試験パート中、対象を無作為に、第1の処置期間中にN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)またはプラセボに割り当て、第2の処置期間中に他方を投与した。すべての対象は、アルフェンタニル投与に続くパイロット試験における重度の悪心および嘔吐が理由で、オンダンセトロンおよびメトクロプラミドで前処置された。パート1のセグメント1中、約20分間の周囲空気の自由呼吸後、青い逆三角形
で示される各セグメントの終わりの10分間の評価期間にベースライン換気パラメータを評価した。セグメント2中、対象が分時換気量20L/分を達成するまでガス混合器を使用してCO2濃度をゆっくりと増大させた。セグメント3において、呼気終末分時換気量の25〜35%減少、およびセグメント2の終わりと同じ呼気終末PCO2を維持するように調整されたCO2吸入量を達成するように、アルフェンタニルを用量設定した。残りのセグメントを通じて同様のCO2調整を行った。セグメント4において、低用量N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)を、最初は急速注入(2.0mg/kg/分)で、次に維持注入(0.4mg/kg/時)で、低用量の定常状態濃度まで投与した。セグメント5において、2回目の急速注入(2.0mg/kg/時)およびより多量の維持注入(1.1mg/kg/時)を使用して、高定常状態濃度での一次エンドポイント(分時換気量)を評価した。その後(セグメント6)、個別化されたアルフェンタニルの負荷量および維持量を(セグメント3から)2倍にし、換気パラメータを評価した。最終セグメント7のはじめに、アルフェンタニルおよびN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)/プラセボの注入を停止し、対象を観察した。パート1のセグメント1において個々のアルフェンタニル用量を確立した後、パート1および2の残りすべてのセグメントで同じ注入量を使用した。パート2では、周囲空気を呼吸しながらCO2クランピング技術を使用せずに同じセグメント進行を使用した。パート2では、脛骨の上での経皮的電気刺激(TENS)を使用することで、疼痛の検出限界および最大忍容度を確立した。疼痛試験中、電流を漸進的に増大させ、対象は、ボタンを押すことで疼痛の開始および忍容可能な最大の疼痛を知らせ、その時点で電流を停止させた。セグメント1〜6中、疼痛評価を換気評価間隔の前に行う。
As shown in FIG. 36, during each study part, subjects were randomly selected during the first treatment period with N- (4,6-bis-n-propylamino- [1,3,5] triazine-2- Yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) or placebo and the other was administered during the second treatment period. All subjects were pretreated with ondansetron and metoclopramide because of severe nausea and vomiting in a pilot study following alfentanil administration. During
Baseline ventilation parameters were evaluated during the 10-minute evaluation period at the end of each segment. During
(b) フェーズI薬力学の概要
薬力学(PD)評価は一回換気量、呼吸数、分時換気量、呼気終末CO2および経皮的ヘモグロビン酸素飽和度(SpO2)を含んだ。ベースライン呼吸データを投与の1時間前に取得した。記録領域の除去後のその期間にわたるパラメータ平均は、分析前の処置盲検の睡眠ポリグラフ専門家による人為的結果を含む。注入完了の約1時間後にPDデータを収集した。ベースラインからの時間加重の変化パーセントをすべての呼吸パラメータについて計算した。群6および7(0.72mg/kg/時で2時間以上)の最初の2時間のデータをPD分析用にプールした。すべての用量において、呼吸数の変化は小さく、通常は10%未満であった。一回換気量の変化も小さく、用量0.96mg/kg/時のみが10%未満の一貫した増大を示した(図37)。
(b) Phase I Pharmacodynamic Overview Pharmacodynamic (PD) assessments included tidal volume, respiratory rate, minute ventilation, end-tidal CO 2 and percutaneous hemoglobin oxygen saturation (SpO 2 ). Baseline respiratory data was acquired 1 hour before dosing. The parameter average over that period of time after removal of the recording area includes an artificial result by a treatment-blind polysomnographic specialist before analysis. PD data was collected approximately 1 hour after completion of infusion. Percent time-weighted change from baseline was calculated for all respiratory parameters. Data for the first 2 hours of
呼吸変化をさらに評価するために、注入開始後の最初2時間にわたって応答を積算した。Drager呼吸流量計に基づくシステムを使用した際に、分時換気量は有意には変化しなかったが、但し、2つの最高注入速度では7〜16%の増大が認められた(図38A)。呼気終末CO2は分時換気量の増大に平行して減少し、積算減少は約6%であった(図38B)。分時換気量およびETCO2に対する効果の開始は速やかであり、最大半量効果超が7.5分(第1の評価時点)で観察された。分時換気量、一回換気量および呼吸数の同様の変化パターン(図38C〜図38D)がNOX-T3インダクタンスプレチスモグラフィーに基づくシステムによって観察され、分時換気量は約24%増大した。経皮的ヘモグロビンO2分圧はプラセボとは有意な差はなかったが、但し、用量0.96mg/kg/時では平均変化は+0.85%対-0.05%であった(p<0.05)。 To further assess respiratory changes, responses were integrated over the first 2 hours after the start of infusion. When using a system based on the Drager respiratory flow meter, minute ventilation did not change significantly, although an increase of 7-16% was observed at the two highest infusion rates (FIG. 38A). End expiratory CO 2 decreased in parallel with the increase in minute ventilation, and the cumulative decrease was approximately 6% (FIG. 38B). The onset of effects on minute ventilation and ETCO 2 was rapid, with a half-maximum effect exceeding 7.5 minutes (at the first evaluation). A similar pattern of change in minute ventilation, tidal volume and respiratory rate (FIGS. 38C-38D) was observed by the system based on NOX-T3 inductance plethysmography, with minute ventilation increased by approximately 24%. Percutaneous hemoglobin O 2 partial pressure was not significantly different from placebo, except that the mean change was + 0.85% vs. -0.05% at a dose of 0.96 mg / kg / hour (p <0.05).
第2の試験を第1の試験と同じ臨床部位において行い、同様のPD評価および設備を利用した。第1の用量は、2時間という長い持続時間で第1の試験と同じ注入速度(0.96mg/kg/時)とした。分時換気量は速やかに増大し、2時間の注入期間中の平均増大は15.4%であり、第1の試験(16.1%)と同様の結果が得られた。中用量が同様の増大(13.6%)を示した一方で、高用量はより大きな増大(24.3%)を示した。分時換気量の変化は3つすべての用量レベルにおいて統計的に有意であった(図39A)。分時換気量の変化の基礎となる一回換気量および呼吸数に対する効果は変動がより大きく、低用量は一回換気量に対して、中用量は呼吸数に対して、高用量は両者の組み合わせに対して第一の効果を示した。呼気終末CO2もすべての用量レベルにおいて減少し、最高用量は注入期間にわたって平均減少8%超を示した(図39B)。ETCO2および一回換気量の低用量および高用量での変化はプラセボとは統計的に異なっていた。分時換気量、一回換気量およびETCO2の最大半量効果は5分間の評価(最初の測定時点)の前または直後に生じた(図39B〜図39D)。速やかな初期応答は第1の試験においてより低い注入速度で既に観察されていたが、その後まもなく減少する傾向にあった。その一方で、PD応答は用量0.72mg/kg/時以上で維持された。 A second study was conducted at the same clinical site as the first study and utilized similar PD assessments and equipment. The first dose had the same infusion rate (0.96 mg / kg / hour) as the first study with a long duration of 2 hours. Minute ventilation increased rapidly, with an average increase of 15.4% during the 2-hour infusion period, similar to the first study (16.1%). Medium dose showed a similar increase (13.6%), while higher dose showed a greater increase (24.3%). Changes in minute ventilation were statistically significant at all three dose levels (Figure 39A). The effects on tidal volume and respiratory rate, which are the basis for changes in minute ventilation, are more variable, with low doses being relative to tidal volume, medium doses being related to respiratory rate, and high doses being both The first effect was shown for the combination. End expiratory CO 2 also decreased at all dose levels, with the highest dose showing an average decrease of over 8% over the infusion period (FIG. 39B). Changes in ETCO 2 and tidal volume at low and high doses were statistically different from placebo. Minute ventilation, tidal volume and half-maximal effects of ETCO 2 occurred before or immediately after the 5-minute evaluation (first measurement time point) (FIGS. 39B-39D). A rapid initial response was already observed at lower infusion rates in the first trial, but tended to decrease shortly thereafter. On the other hand, PD response was maintained at doses above 0.72 mg / kg / hour.
第1の試験における最高注入速度(0.96mg/kg/時)と同様に、ヘモグロビンO2飽和度(SpO2)が注入開始後に速やかに増大し、統計的に有意な差が低用量および高用量に関して25〜75分で認められた(図40)。2時間の注入にわたる積算効果は低用量および高用量でプラセボ(0.13%、p<0.05)に対してそれぞれ0.60%および0.76%増大した。中用量では、1〜2時間の期間において、最初の1時間(10.0%)を上回る分時換気量の増大(17.2%)が示され、プラセボに対するSpO2の統計的に有意な増大(0.41%対-0.02%、p<0.05)も示された。 Similar to the maximum infusion rate (0.96 mg / kg / hr) in the first study, hemoglobin O 2 saturation (SpO 2 ) increases rapidly after the start of infusion, with statistically significant differences between low and high doses Was observed at 25-75 minutes (FIG. 40). The cumulative effect over the 2 hour infusion increased by 0.60% and 0.76% for placebo (0.13%, p <0.05) at low and high doses, respectively. Medium dose shows an increase in minute ventilation (17.2%) over the first hour (10.0%) in the 1-2 hour period, and a statistically significant increase in SpO 2 relative to placebo (0.41%) Vs. -0.02%, p <0.05) was also shown.
呼吸抑制概念証明試験(GAL-021-104)中に、換気パラメータを連続的に捕捉し、最終10分の間隔にわたって一次エンドポイントとして積算し、セグメント5を一次推測統計比較とした。分時換気量が20リットル/分(ベースラインの約2.5倍)に増大するように初期CO2漸増(セグメント2)をゆっくりと行った(図41A)。その後、CO2刺激による分時換気量の増加が約2/3減少する(絶対減少37%)ようにアルフェンタニルを用量設定した。最小刺激(XXXVI)量(0.4mg/kg/時)を添加した場合、分時換気量はプラセボ(p<0.07)から乖離する傾向を示し、最高注入速度(1.1mg/kg/時)で統計的有意に達した(p<0.0001)。第6のセグメントにおいてアルフェンタニルの負荷量および注入速度を2倍にしたところ、GAL-021およびプラセボの両方について分時換気量が減少した一方で、2つの処置間の統計的に有意な乖離は続いた(p<0.005)。一回換気量(図41B)および呼吸数(図41C)では、統計的に有意な差の同様のパターンが認められた。
During the respiratory suppression concept proof test (GAL-021-104), ventilation parameters were continuously captured and integrated as the primary endpoint over the final 10-minute interval, and
試験のパート2の際、対象にはパート1と同じアルフェンタニル負荷量および注入速度で投与した。対象には周囲空気を呼吸させ、呼気終末CO2または分時換気量を規制する試みは行われなかった。また、最小限の筋肉効果が生成されるように前脛骨領域の上に設置される経皮的電気神経刺激装置(TENS)を使用して、疼痛を評価した。試験中、電流を漸進的に増大させて、疼痛の開始および忍容可能な最大の疼痛に関連する電流閾値を生成した(図36)。アルフェンタニルの投与によって疼痛開始閾値は増大した(図42)。N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の投与によって疼痛の開始または忍容可能な最大の閾値は減少しなかった。
During
アルフェンタニル注入の開始によって分時換気量が減少した(図43A)。プラセボ処置対象は、セグメント6におけるより高用量のアルフェンタニルまでは安定したままであり、セグメント6において分時換気量はさらに減少した。パート1と同様に、分時換気量はプラセボ処置と低用量N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)処置とで乖離し、セグメント5における高用量で統計的有意に達した。パート1(セグメント6)において高用量のアルフェンタニルがN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)刺激を減少させたが、室内空気条件下での分時換気量の減少はなかった。公知のオピオイド効果と一致して、呼気終末CO2は高用量アルフェンタニル投与によってさらに増大した(図43B)。N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の投与は呼気終末CO2濃度を減少させる傾向にあり、高用量アルフェンタニル(セグメント6)で統計的有意性が認められた。呼吸数に差はなかった(図43C)。一回換気量は、低用量および高用量の両方のアルフェンタニル注入において、高用量N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)により、プラセボ処置に比べて増大した(図43D)。
Minute ventilation decreased with the start of alfentanil infusion (FIG. 43A). Placebo-treated subjects remained stable until higher doses of alfentanil in
パート1およびパート2の間、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は、より高い注入速度(1.1mg/kg/時)で、プラセボに比べて臨床的および統計的に有意な一貫した効果を示した。この効果は、オピオイド投与に続く外因性CO2の存在または内因性CO2の保持とは無関係であった。最小刺激低用量のN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)はプラセボ処置と乖離しており、分時換気量の変化はその効果を達成する前に統計的有意に達した。同様の低用量N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の傾向が両試験パートにおいて認められた。分時換気量の増大は、両試験パートにおいて認められた一回換気量の増大によって引き起こされる傾向にあった。呼吸数の変化はパート1においてのみ認められた。全体的に、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)はオピオイド投与後の換気状態を改善し、これはラットおよび非ヒト霊長類における以前の観察と一致した。N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)投与後の換気状態の改善はアルフェンタニルの鎮痛効果を損なわなかった。このことは、この2つの薬剤を同時投与する際に、オピオイド鎮痛と呼吸抑制効果とを均衡させる上での現在の困難がより少なくなりうることを示唆している。
Between
(c) フェーズI薬物動態の概要
概して、血漿中濃度-時間プロファイルの全体的形状は両試験において同様であった。血漿中濃度は注入中には速やかに上昇し、注入後には最初は急激に、続いて徐々に低下した。図44に示すように、一般的には注入の終わりに、または二相性注入の場合は負荷量注入の終わりに平均最大血漿中濃度(Cmax)に到達した。
(c) Phase I Pharmacokinetic Summary In general, the overall shape of the plasma concentration-time profile was similar in both studies. Plasma concentrations rose rapidly during the infusion, initially rapidly after the infusion and then gradually decreased. As shown in FIG. 44, the mean maximum plasma concentration (C max ) was generally reached at the end of the infusion, or in the case of a biphasic infusion at the end of the loading dose infusion.
注入の終わりの後の第1の試験において、すべての血漿中濃度-時間プロファイルは、急な分布相および緩やかな消失相を伴う見かけの双指数関数的減衰を示し、平均終末半減期(t1/2)は4.3〜6.5時間の範囲であった(図44A)。健康なボランティアにおけるN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の薬物動態は概して2コンパートメントモデルによって最もよく記述され、分布半減期は20分未満であった。平均全身性血漿クリアランス値(CLp)はヒトにおける肝血流量の約半分であった。1.7〜2.5L/kgの範囲である平均定常状態分布容積値(Vss)はヒトにおける全体内水分の約2〜3倍であった。このことは、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)が組織に高度に分布したことを示唆している。注入1時間後の血漿中濃度C1h(範囲: 54.9〜930ng/mL)はすべての試験注入速度において用量比例的であった。同様に、全身曝露(AUC0-∞)も用量比例的であった。C1hおよびAUCは用量比例性に関する統計的要件を満たした。概して、t1/2、CLpおよびVssに関して、対象内での変動は対象間での変動よりも小さい。 In the first study after the end of infusion, all plasma concentration-time profiles showed an apparent biexponential decay with a steep distribution phase and a slow elimination phase, with an average terminal half-life (t 1 / 2 ) ranged from 4.3 to 6.5 hours (Figure 44A). The pharmacokinetics of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) in healthy volunteers Generally best described by a two-compartment model with a distribution half-life of less than 20 minutes. Mean systemic plasma clearance value (CL p) was about half of liver blood flow in humans. Average steady-state distribution volume values (V ss ) ranging from 1.7 to 2.5 L / kg were about 2 to 3 times the total water content in humans. This indicates that N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) is highly It is suggested that it was distributed. Plasma concentration C 1h at 1 hour after injection (range: 54.9-930 ng / mL) was dose proportional at all test infusion rates. Similarly, systemic exposure (AUC 0-∞ ) was dose proportional. C 1h and AUC met the statistical requirements for dose proportionality. In general, for t 1/2 , CL p and V ss , the variation within a subject is less than the variation between subjects.
(表11A)ヒト血漿中のN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の平均薬物動態パラメータ
aデータは各パラメータの幾何平均値(変動係数%)であるが、但しTmaxは中央値(範囲)で表す。
b6名の対象由来。
**/60Kgの対象を想定する。
対象012は注入の中途終了のためコホート2、期間2 PKの分析に含めない
Table 11A: N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) in human plasma Mean pharmacokinetic parameters
The a data is the geometric mean value (variation coefficient%) of each parameter, where T max is represented by the median value (range).
b From 6 subjects.
** Assumes target of / 60Kg.
Subject 012 is not included in
(表11B)ヒト血漿中のN-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)の平均薬物動態パラメータ(GAL-021-102)a
aデータは各パラメータの幾何平均値(変動係数%)であるが、但しTmaxは中央値(範囲)で表す。
b4名の対象から(対象107および109は注入の中途終了のため分析に含めない)。
Table 11B: N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) in human plasma Mean pharmacokinetic parameters (GAL-021-102) a
The a data is the geometric mean value (variation coefficient%) of each parameter, where T max is represented by the median value (range).
b From 4 subjects (Subjects 107 and 109 are not included in the analysis due to the end of the infusion).
第2の試験中、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)を0.96、1.44および1.92mg/kg/時で2時間注入した。一般に、より高い用量での血漿中濃度-時間プロファイルは、ファースト・イン・ヒューマン試験において観察されたものと同様であった。一般に、表11Bおよび図44Bに示すように、注入の終わりに平均最大血漿中濃度(Cmax)に到達した。注入の終わりの後で、すべての血漿中濃度-時間プロファイルは、急な分布相および緩やかな消失相を伴う見かけの双指数関数的減衰を示し、平均終末半減期(t1/2)は5.2〜8.1時間の範囲であった。 During the second test, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was 0.96. Infused at 1.44 and 1.92 mg / kg / hr for 2 hours. In general, plasma concentration-time profiles at higher doses were similar to those observed in first-in-human studies. In general, the mean maximum plasma concentration (C max ) was reached at the end of the infusion, as shown in Table 11B and FIG. 44B. After the end of the infusion, all plasma concentration-time profiles show an apparent biexponential decay with a steep distribution phase and a slow elimination phase, with an average terminal half-life (t 1/2 ) of 5.2. It was in the range of ~ 8.1 hours.
ファースト・イン・ヒューマン試験において観察された値と同様に、10.5〜12.4ml/分/kgの範囲の平均全身性血漿クリアランス値(CLp)はヒトにおける肝血流量の約半分であった。1.8〜2.5L/kgの範囲である平均定常状態分布容積値(Vss)はヒトにおける全体内水分の約2〜3倍であった。 Similar to the values observed in the first-in-human test, mean systemic plasma clearance values (CL p ) ranging from 10.5 to 12.4 ml / min / kg were about half of the hepatic blood flow in humans. Mean steady-state volume distribution values (V ss ) ranging from 1.8 to 2.5 L / kg were about 2 to 3 times the total water content in humans.
一般に、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は、試験した用量範囲内で健康なボランティアに静脈内投与した際に、挙動良好な薬物動態を示した。血漿中濃度-時間プロファイルは2コンパートメントモデルに良好にフィットし、分布半減期は20分未満と短かった。第1の試験(0.1〜0.96mg/kg/時)においてCmaxおよびAUC0-∞が用量比例的であり、t1/2、CLpおよびVssが用量非依存的であり、第2の試験中には予測される直線性からの明確な偏差はなかった。直線的な薬物動態の結果として、将来の投与レジメンの調整は単純化できる可能性がある。終末半減期(t1/2約6時間)は、24時間後にはほとんど蓄積が生じないことを示唆しており、これは測定可能な血漿C24hが低いことと一致している。 In general, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) Showed good pharmacokinetics when administered intravenously to healthy volunteers. The plasma concentration-time profile fits well in the two-compartment model with a short distribution half-life of less than 20 minutes. In the first study (0.1-0.96 mg / kg / hr) C max and AUC 0-∞ are dose proportional, t 1/2 , CL p and V ss are dose independent, the second There was no clear deviation from the expected linearity during the test. As a result of linear pharmacokinetics, future dosing regimen adjustments may be simplified. The terminal half-life (t 1/2 approximately 6 hours) suggests that little accumulation occurs after 24 hours, which is consistent with low measurable plasma C 24h .
(d) フェーズI臨床試験の全体的結論
N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は第1の臨床試験中に良好な忍容性が認められ、注入部位における軽度/中程度の灼熱感のみがプラセボと異なった。分時換気量は2つの最高注入速度(0.72および0.96mg/kg/時)において増大した。第2の試験中に、過換気が高用量(1.92mg/kg/時)で生じることで、呼吸抑制剤で未処置の健康な対象におけるPD最大量が確立された。注入速度0.96mg/kg/時での分時換気量の刺激は2つの試験において同様であり(約16%)、高用量での刺激はより大きかった(25%)。薬物の薬物動態の挙動は良好であり、濃度は初期注入期間中に速やかに上昇し、注入停止によって速やかに減少した。この化合物はAUCおよびC1hの両方に関して用量比例的であり、対象間および対象内での変動は小さい。
(d) Overall conclusion of Phase I clinical trial
N- (4,6-Bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) was tested during the first clinical trial. Good tolerability was observed and only mild / moderate burning sensation at the injection site was different from placebo. Minute ventilation increased at the two highest infusion rates (0.72 and 0.96 mg / kg / hr). During the second study, hyperventilation occurred at high doses (1.92 mg / kg / hr), establishing the PD maximum in healthy subjects untreated with respiratory inhibitors. Stimulation of minute ventilation at an infusion rate of 0.96 mg / kg / hour was similar in the two studies (approximately 16%), and the stimulation at the higher dose was greater (25%). The pharmacokinetic behavior of the drug was good, and the concentration increased rapidly during the initial infusion period and decreased rapidly with infusion cessation. This compound is dose proportional with respect to both AUC and C1h , with little variation between and within subjects.
オピオイド誘導呼吸抑制の存在下で、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)投与はプラセボに比べて同等の良好な忍容性が認められ、数名の対象において注入部位における軽度の灼熱感があったのみであった。クランプされた高炭酸ガス血症の存在下で、分時換気量、一回換気量および呼吸数は(XXXVI)用量1.1mg/kg/時によって統計的および臨床的に有意な程度まで増大した。室内空気を呼吸した際に、分時換気量、呼気終末CO2および一回換気量に関して同様の換気改善が認められた。全体的に、N-(4,6-ビス-n-プロピルアミノ-[1,3,5]トリアジン-2-イル)-N,O-ジメチル-ヒドロキシルアミン硫酸水素塩(XXXVI)は、術後状況での刺激における有用な薬理作用を示し、術後呼吸抑制における潜在的な臨床的有用性を示す。 N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) in the presence of opioid-induced respiratory depression ) Administration was as well tolerated as placebo, with only a slight burning sensation at the injection site in several subjects. In the presence of clamped hypercapnia, minute ventilation, tidal volume, and respiratory rate increased to a statistically and clinically significant extent with a (XXXVI) dose of 1.1 mg / kg / hr. Similar ventilation improvements were noted for minute ventilation, end-tidal CO 2 and tidal volume when room air was breathed. Overall, N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -N, O-dimethyl-hydroxylamine hydrogensulfate (XXXVI) Shows useful pharmacological effects in contextual stimulation and potential clinical utility in postoperative respiratory depression.
実施例129
(XXXVI)の液体製剤の開発
A. pHの関数としての(XXXV)の溶解度
方法論
pH 2.5の100mMクエン酸中の濃度約107mg/mLの(XXXVI)の濃度を調製した。この溶液の約150μLのアリコートを6つの別々のガラスHPLCバイアルに移した。各アリコートを6N水酸化ナトリウムで3〜5.5の範囲の異なるpH値に滴定した(表12A)。pH2.5の溶液を含むすべての試料を室温で旋回振盪機を使用して終夜振盪した。振盪後、試料を析出物の存在について目視で評価し、次に0.45μmシリンジチップフィルター(直径4mm)を通じて3,000rpmで20分間濾過した。濾液の最終pH値を測定した。次に濾液を適宜希釈し、(XXXV)濃度についてHPLCアッセイを使用して分析した。
Example 129
Development of liquid preparation of (XXXVI)
A. Solubility of (XXXV) as a function of pH Methodology
A concentration of (XXXVI) at a concentration of about 10 7 mg / mL in 100 mM citric acid at pH 2.5 was prepared. Approximately 150 μL aliquots of this solution were transferred to six separate glass HPLC vials. Each aliquot was titrated with 6N sodium hydroxide to different pH values ranging from 3 to 5.5 (Table 12A). All samples containing pH 2.5 solutions were shaken overnight at room temperature using a swirl shaker. After shaking, the samples were visually assessed for the presence of precipitates and then filtered through a 0.45 μm syringe tip filter (4 mm diameter) at 3,000 rpm for 20 minutes. The final pH value of the filtrate was measured. The filtrate was then diluted appropriately and analyzed using HPLC assay for (XXXV) concentration.
結果
終夜振盪の前および後の試料のpH値、外観、および試料の(XXXV)濃度を表12Aに示す。標的pH値2.5、3.0および3.5で調製した溶液は透明であり(過剰の固体が存在しない)、したがって、これらの試料の(XXXV)濃度値は飽和溶解度値を表さない。pH溶解度プロファイルを図19Bに示す。黒菱形は飽和溶解度値とし、白菱形は非飽和試料(過剰の固体が存在しない)における測定濃度とする。点線は最良適合曲線を表し、式1を使用してこれをプロットした。この式は、弱塩基の溶解度平衡の単純化された表現であり、対象となるpH範囲の遊離塩基の溶解度よりも総溶解度がはるかに大きいことを想定している。
log S = log S0 + log (1 + 10pKa-pH) 式1
式中、「S」は総溶解度であり、「S0」は遊離塩基の溶解度である。
Results The pH value, appearance, and (XXXV) concentration of the sample before and after overnight shaking are shown in Table 12A. Solutions prepared with target pH values of 2.5, 3.0 and 3.5 are clear (no excess solids are present) and therefore the (XXXV) concentration values of these samples do not represent saturation solubility values. The pH solubility profile is shown in FIG. 19B. The black rhombus is the saturation solubility value, and the white rhombus is the measured concentration in the unsaturated sample (excess solid is not present). The dotted line represents the best-fit curve and was plotted using
log S = log S 0 + log (1 + 10 pKa-pH )
In the formula, “S” is the total solubility, and “S 0 ” is the solubility of the free base.
Microsoft Excel Solver関数および(XXXVI)のpKa値5.6を使用して、式1を実験的に決定されたpH-溶解度プロファイルに適合させた。したがって、遊離塩基の溶解度計算値は0.18mg/mLとなった。この式に基づいて、溶解度(遊離塩基で表す)はpH約3.86で10mg/mL、pH約3.46で25mg/mL、pH約3.16で50mg/mLであると予測される。
(表12A)pH溶解度結果
(Table 12A) pH solubility results
B. pHの関数としての(XXXV)の安定性
方法論
pH範囲2〜6のクエン酸およびグリシン各約10mMを含有する緩衝溶液は、両緩衝剤を含有する単一のストック250mLを1N NaOH/1N HClで滴定して所定のpH値の50mLアリコートを除去することで、調製した。pH 2〜5の緩衝液中1mg/mLのXXXVI溶液は、XXXVI約25mgを所与の緩衝液約23mLに溶解させてpHを標的値まで調整し、メスフラスコ中で量を25.0mLにすることで、調製した。pH 6の(XXXVI)溶液も同様に調製したが、(XXXVI) 6.68mgを使用して薬物濃度を0.25mg/mLとより低くした。
B. Stability of (XXXV) as a function of pH Methodology
A buffer solution containing approximately 10 mM each of citrate and glycine in the pH range 2-6 is titrated with 1N NaOH / 1N HCl to remove a 50 mL aliquot of the desired pH value, with a single stock of 250 mL containing both buffers. To prepare. For a 1 mg / mL XXXVI solution in a pH 2-5 buffer solution, adjust the pH to the target value by dissolving approximately 25 mg of XXXVI in approximately 23 mL of the given buffer and bring the volume to 25.0 mL in a volumetric flask. And prepared. A (XXXVI) solution at
各緩衝XXXV溶液を0.2μmポリエーテルスルホンシリンジフィルターを通じて濾過してメスフラスコに入れた。メスフラスコは事前に70%エタノールですすぎ、ラミナーフローフード中で乾燥させておいた。濾過後、各緩衝(XXXV)溶液を10個のアリコート(各2.5mLの9個のアリコートおよび2mLの1個のアリコート)に分割して5mL血清バイアルに入れた。バイアルは事前に70%エタノールですすぎ、ラミナーフローフード中で乾燥させておいた。アリコートの濾過および調製をラミナーフローフード中で行った。各緩衝(XXXV)溶液の2mLアリコートをT0分析(HPLCアッセイおよび関連物質)に供した。 Each buffer XXXV solution was filtered through a 0.2 μm polyethersulfone syringe filter into a volumetric flask. The volumetric flask was rinsed beforehand with 70% ethanol and dried in a laminar flow hood. After filtration, each buffer (XXXV) solution was divided into 10 aliquots (9 aliquots of 2.5 mL each and 1 aliquot of 2 mL) and placed into 5 mL serum vials. The vial was previously rinsed with 70% ethanol and dried in a laminar flow hood. An aliquot was filtered and prepared in a laminar flow hood. A 2 mL aliquot of each buffer (XXXV) solution was subjected to TO analysis (HPLC assay and related materials).
9個の2.5mLアリコートのうち、各3個のアリコートを40℃および60℃で保存し、2個のアリコートを25℃で保存し、1個のアリコートを-70℃で保存した。40℃および60℃で保存した試料を、1週間、2週間および4週間保存後に物理的外観、pH、アッセイ、および関連物質について評価した。25℃および-70℃での試料は、必要に応じて分析される対照とした。 Of the 9 2.5 mL aliquots, each 3 aliquots were stored at 40 ° C. and 60 ° C., 2 aliquots were stored at 25 ° C. and 1 aliquot was stored at −70 ° C. Samples stored at 40 ° C. and 60 ° C. were evaluated for physical appearance, pH, assay, and related substances after 1 week, 2 weeks and 4 weeks storage. Samples at 25 ° C and -70 ° C served as controls to be analyzed as needed.
結果
pH安定性データを表12Bに示す。40℃および60℃の両方において、すべての試料は保存最大4週間にわたって透明、無色および無粒子のままであった。両保存温度において、すべての試料のpH値は最大4週間にわたって相対的に一定のままであった。アッセイおよび不純物データはいずれも、(XXXV)のpH 2での安定性が残りのpH評価値に比べて有意に低いことを示している。pH範囲3〜6では特定の傾向は観察されなかった。60℃でのpH安定性プロファイルを図20Aに示す(不純物%)。
result
The pH stability data is shown in Table 12B. At both 40 ° C. and 60 ° C., all samples remained clear, colorless and particle free for up to 4 weeks of storage. At both storage temperatures, the pH value of all samples remained relatively constant for up to 4 weeks. Both assay and impurity data indicate that (XXXV) has a significantly lower stability at
(表12B)pH 2〜5での(XXXV)のpH安定性(GAL 021)
n.d. = 検出せず
(Table 12B) pH stability of (XXXV) at pH 2-5 (GAL 021)
nd = not detected
C. 狭いpH(pH 2〜3.6)にわたる(XXXV)の安定性
方法論
pH範囲2〜3.6のクエン酸およびグリシン各約10mMを含有する緩衝溶液は、両緩衝剤を含有する単一のストック250mLを1N NaOH/1N HClで滴定して所定のpH値の50mLアリコートを除去することで、調製した。緩衝液中1mg/mLの(XXXVI)溶液は、(XXXVI)約25mgを所与の緩衝液約23mLに溶解させてpHを標的値まで調整し、メスフラスコ中で量を25.0mLにすることで、調製した。各緩衝(XXXV)溶液を0.2μmポリエーテルスルホンシリンジフィルターを通じて濾過してメスフラスコに入れた。メスフラスコは事前に70%エタノールですすぎ、ラミナーフローフード中で乾燥させておいた。濾過後、各緩衝(XXXV)溶液を9個のアリコートに分割して5mL血清バイアルに入れた。バイアルは事前に70%エタノールですすぎ、ラミナーフローフード中で乾燥させておいた。アリコートの濾過および調製をラミナーフローフード中で行った。9個のアリコートのうち、各3個のアリコートを40℃および60℃で保存し、2個のアリコートを25℃で保存し、1個のアリコートをT0試験に供した。T0時点で、ならびに40℃および60℃での1週間、2週間および4週間保存後に、試料をpH、アッセイ、および関連物質について評価した。25℃で保存した試料は、必要に応じて分析される対照とした。
C. Stability of (XXXV) over a narrow pH (pH 2-3.6) Methodology
A buffer solution containing approximately 10 mM citrate and glycine each in the
結果
データを表12Cおよび図20Bに要約する。この試験の最も注目すべき結果は、40℃および60℃両方での保存中に、試験したpH範囲全体にわたり、pHの増大に従って不純物レベルが有意に減少したということである。このことは、製剤のpHにおける全ての増大が、水性製剤に適したpH範囲内での安定性の改善を導いたことを意味している。
Results Data are summarized in Table 12C and FIG. 20B. The most notable result of this test is that during storage at both 40 ° C. and 60 ° C., impurity levels decreased significantly with increasing pH over the entire pH range tested. This means that any increase in the pH of the formulation led to improved stability within the pH range suitable for aqueous formulations.
(表12C)pH 2〜3.6での(XXXV)のpH安定性
n.d. = 検出せず
(Table 12C) pH stability of (XXXV) at
nd = not detected
D. 溶媒およびIV溶液中での(XXXV)の溶解度の評価
方法論
(XXXVI)およびXXXVの溶解度を様々な溶媒およびIV溶液中で評価した。溶媒、および溶解度評価のための標的濃度を表12Dに示す。試験を行った時点でのAPI供給に対する制限のため、大部分の溶媒系は、たとえ該溶液がそのレベルで飽和していなかったとしても、100mg/mLのレベルまでしか評価されなかった。水中でのみ、その溶解度がどれほど高いかにかかわらず、飽和溶解度に到達させる試みがなされた。各溶媒中の塩/遊離塩基の溶解度を二つ組で評価した。
D. Evaluation of solubility of (XXXV) in solvents and IV solutions Methodology
The solubility of (XXXVI) and XXXV was evaluated in various solvents and IV solutions. Solvents and target concentrations for solubility assessment are shown in Table 12D. Due to restrictions on API supply at the time of testing, most solvent systems were only evaluated to a level of 100 mg / mL, even if the solution was not saturated at that level. Attempts were made to reach saturation solubility only in water, regardless of how high its solubility was. The solubility of salt / free base in each solvent was evaluated in duplicate.
標的値200mg/mLでの0.9% NaCl、5%デキストロース、エタノール、30% PEG 400、70% PEG 400および100% PEG 400中での(XXXVI)の溶解度の評価は、薬物約100mgを溶媒500μLに加えることで行った。水を除く残りの溶解度評価は、薬物(XXXVIまたはXXXV)約50mgを溶媒500μLに加えることで行った。水中溶解度については、断続的振盪下で薬物を加えることで、飽和および13mm PTFE 0.2μmシリンジフィルターの目詰まりを示す過剰の未溶解薬物が存在することを確実にした。濾液を適宜希釈し、(XXXV)濃度についてHPLCで分析した。
To assess the solubility of (XXXVI) in 0.9% NaCl, 5% dextrose, ethanol, 30
結果
溶解度結果を表12Dに示す。
(XXXVI): (XXXVI)の溶解度は水中で400mg/mLaを上回り、IV溶液(0.9%生理食塩水および5%デキストロース)中で少なくとも200mg/mLであった。水中での(XXXV)塩の溶解度の評価中に、API約350〜400mgが水500μLに完全に溶解したことが認められたが、試料は室温で約2時間の振盪後に混濁ゲルを形成し、これは水(約80〜250μL)の添加によって溶解した。この透明溶液を室温で終夜さらに振盪することで混濁ゲルが形成された。水の別の小さなアリコート(約60〜220μL)を加えることで懸濁液が得られ、これを濾過して(XXXV)濃度について分析することができた。水中での(XXXVI)のこの挙動の正確な理由は明らかにならなかったが、過飽和溶液の形成を示唆している可能性がある。また、塩はエタノールおよびメタノールに易溶性であり、約68mg/mLというアセトニトリル中の飽和溶解度を示した。30%、70%および100%プロピレングリコール中での溶解度は少なくとも90mg/mLであった。100% PEG-400中での溶解度は約36mg/mLで飽和に達したが、(XXXVI)は70% PEG-400中では少なくとも90mg/mLまで、30% PEG-400中では約198mg/mLまで可溶性であった。
Results Solubility results are shown in Table 12D.
(XXXVI): The solubility of (XXXVI) was greater than 400 mg / mLa in water and at least 200 mg / mL in IV solution (0.9% saline and 5% dextrose). During the evaluation of the solubility of (XXXV) salt in water, it was observed that about 350-400 mg of API was completely dissolved in 500 μL of water, but the sample formed a turbid gel after about 2 hours of shaking at room temperature, This was dissolved by the addition of water (about 80-250 μL). The clear solution was further shaken overnight at room temperature to form a turbid gel. The addition of another small aliquot of water (about 60-220 μL) gave a suspension that could be filtered and analyzed for (XXXV) concentration. The exact reason for this behavior of (XXXVI) in water has not been clarified, but may suggest the formation of a supersaturated solution. The salt was readily soluble in ethanol and methanol, and showed a saturated solubility in acetonitrile of about 68 mg / mL. Solubility in 30%, 70% and 100% propylene glycol was at least 90 mg / mL. Solubility in 100% PEG-400 reached saturation at about 36 mg / mL, but (XXXVI) was at least 90 mg / mL in 70% PEG-400 and up to about 198 mg / mL in 30% PEG-400 It was soluble.
(XXXV): 水中での(XXV)の飽和溶解度は約0.21mg/mLであり、これは実施例129Aにおいて詳述したpH-溶解度曲線からの予測値と一致していた。エタノール、メタノールおよびアセトニトリル中での溶解度はそれぞれ約92mg/mL、約102mg/mLおよび約45mg/mLであった。5% Tween 80分散系中での遊離塩基の溶解度は約2.7mg/mLであった。PEG-400およびプロピレングリコール系中での溶解度は共溶媒のレベル増大に従って増大するようである。遊離塩基の溶解度はPEG-400(約73mg/mL)中よりもプロピレングリコール(約90mg/mL)中のほうが高かった。データは、同様のpH値において、プロピレングリコール系中でのXXXV遊離塩基の溶解度がPEG-400系中での溶解度よりも高いことを示唆している。
(XXXV): The saturated solubility of (XXV) in water was about 0.21 mg / mL, consistent with the predicted value from the pH-solubility curve detailed in Example 129A. The solubilities in ethanol, methanol and acetonitrile were about 92 mg / mL, about 102 mg / mL and about 45 mg / mL, respectively. The solubility of the free base in 5
(表12D)溶媒およびIV溶液中での(XXXV)の溶解度
* NA = 該当なし。回収不能として列挙された試料は濾過の失敗により失われた。
(Table 12D) Solubility of (XXXV) in solvents and IV solutions
* NA = Not applicable. Samples listed as unrecoverable were lost due to filtration failure.
E. 緩衝液強度の関数としての(XXXV)の安定性
方法論
pH 3.0の100mMクエン酸緩衝液およびpH 3.0の500mMクエン酸緩衝液中の(XXXVI)の10mg/mL溶液を調製した。表12Eに示すように、これら2つのストック溶液を使用して、10〜250mMの範囲の様々な濃度のクエン酸緩衝液中の(XXXVI)の1mg/mL溶液を調製した。
E. Stability of (XXXV) as a function of buffer strength Methodology
A 10 mg / mL solution of (XXXVI) in 100 mM citrate buffer at pH 3.0 and 500 mM citrate buffer at pH 3.0 was prepared. As shown in Table 12E, these two stock solutions were used to prepare 1 mg / mL solutions of (XXXVI) in various concentrations of citrate buffer ranging from 10 to 250 mM.
(表12E)緩衝液強度の関数としての安定性の評価用の溶液
Table 12E: Solutions for evaluation of stability as a function of buffer strength
上記各溶液を5mL血清バイアル中で約2.5〜3mLのアリコート(全7個のアリコート)として保存した。各2個のアリコートを40℃、60℃および25℃で保存した。25℃で保存したアリコートは、必要に応じて評価される対照とした。T0時点で、ならびに40℃および60℃での2週間保存後に、試料をpH、アッセイ、および関連物質について評価した。 Each of the above solutions was stored as approximately 2.5-3 mL aliquots (total of 7 aliquots) in 5 mL serum vials. Two aliquots of each were stored at 40 ° C, 60 ° C and 25 ° C. An aliquot stored at 25 ° C served as a control to be evaluated as needed. Samples were evaluated for pH, assay, and related substances at T0 and after 2 weeks storage at 40 ° C and 60 ° C.
結果
緩衝液効果試験のデータを表12Fに要約する。不純物レベルは最高緩衝液濃度で有意に増大したが、製剤に適した緩衝液濃度の範囲内では40℃での緩衝液強度の影響はなかった。
Results The buffer effect test data are summarized in Table 12F. Impurity levels increased significantly at the highest buffer concentration, but there was no effect of buffer strength at 40 ° C. within the range of buffer concentrations suitable for the formulation.
(表12F)(XXXV)安定性に対する緩衝液強度の影響
n.d. = 検出せず
Table 12F: Effect of buffer strength on (XXXV) stability
nd = not detected
F. プロトタイプ製剤
方法論
単純緩衝溶液、共溶媒系および非水性溶液を含む合計9つの(XXXV)プロトタイプを調製した。これらを表12Gに示す。プロトタイプ6、7および8は、調製中に著しい析出を生じさせたことから、さらに評価しなかった。残りのプロトタイプは血清バイアル中にて2〜8℃、室温、40℃および60℃で保存した。2〜8℃および室温で保存した試料を、選択された時点で分析した。
F. Prototype formulation Methodology A total of nine (XXXV) prototypes were prepared including simple buffer solution, co-solvent system and non-aqueous solution. These are shown in Table 12G.
結果
これまでに収集したデータを表12G.1〜表12G.6に示す。水性の緩衝製剤(プロトタイプ番号1)は室温および冷蔵下で安定であることがわかったが、促進条件下では多少の分解が観察された。1つまたは2つの雪片様粒子として記述される非常に少量の析出物が、60℃で2週間後および40℃で8週間後に観察されたことが特に関心対象となった。60℃保存中のこの析出物の出現が第一の不純物ピークの実際の減少と一致していたことから、分解物が不溶性である可能性が調べられる。
Results The data collected so far is shown in Tables 12G.1 to 12G.6. The aqueous buffer formulation (Prototype No. 1) was found to be stable at room temperature and under refrigeration, but some degradation was observed under accelerated conditions. Of particular interest was the very small amount of precipitates described as one or two snowflake-like particles observed after 2 weeks at 60 ° C and after 8 weeks at 40 ° C. The appearance of this precipitate during storage at 60 ° C. was consistent with the actual decrease in the first impurity peak, thus examining the possibility that the degradation product is insoluble.
(XXXV)はプロトタイプ番号2、すなわちpH調整なしの50% PEG/50%水中で不安定であった。不安定性はおそらくこの製剤の低いpHが理由であった。この薬物は、(同じ50% PEG基剤を有するが、見かけのpHを最大約4.5にするために十分な水酸化ナトリウムも含有する)プロトタイプ番号3中ではるかに安定であることがわかった。同様に、良好な安定性は、プロトタイプ番号9、すなわち見かけのpHを約5.3にするための酢酸アンモニウム緩衝液を伴う70%プロピレングリコール/30%水中で見られた。PEG中またはプロピレングリコール中のこの塩の単純溶液中でも、おそらくは反応物としての水が存在しないことが理由で、良好な安定性が見られた。
(XXXV) was unstable in
(表12G)安定性評価用の(XXXVI)プロトタイプ
(Table 12G) (XXXVI) prototype for stability evaluation
(表12G.1)(XXXV)プロトタイプ製剤番号1の安定性
(Table 12G.1) (XXXV) Stability of
(表12G.2)(XXXV)プロトタイプ製剤番号2の安定性
(Table 12G.2) (XXXV)
(表12G.3)(XXXV)プロトタイプ製剤番号3の安定性
(Table 12G.3) (XXXV)
(表12G.4)(XXXV)プロトタイプ製剤番号4の安定性
(Table 12G.4) (XXXV)
(表12G.5)(XXXV)プロトタイプ製剤番号5の安定性
(Table 12G.5) (XXXV)
(表12G.6)(XXXV)プロトタイプ製剤番号9の安定性
(Table 12G.6) (XXXV) Stability of prototype formulation number 9
G. 最終製剤およびGMP薬品安定性データ
最終製剤を表12Hに示す。25℃/相対湿度60%および2〜8℃での表12Hの薬品製剤の安定性データをそれぞれ表12I.1および表12I.2に示す。安定性試験中に測定したN-(4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)のレベルを表12Jに示す。
G. Final formulation and GMP drug stability data The final formulation is shown in Table 12H. The stability data for the drug formulations of Table 12H at 25 ° C / 60% relative humidity and 2-8 ° C are shown in Tables 12I.1 and 12I.2, respectively. The levels of N- (4,6-bis (propylamino) -1,3,5-triazin-2-ol (CLXXVIII) measured during the stability test are shown in Table 12J.
(表12H)(XXXV)の最終製剤
(Table 12H) Final formulation of (XXXV)
(表12I.1)(XXXVI)製剤GMPロット番号041I0511aの長期安定性結果(25℃/相対湿度60%)
a. GMPバッチの包装成分: 50mL透明、20mm開口、USP 1型ガラス(Wheaton 223745); テフロン2でコーティングされた灰色ブチルをストッパーとする。4416/50(West 1014 4937); フリップオフシール、20mm、3766白、8-ブリッジ(West 5420 3028)。
b. 無色〜淡黄色の液体。透明および無粒子
c. 無色液体。透明および無粒子
d. バイアルにはひび割れなし、ストッパがしっかりと定位置にあり、漏洩の兆候なし
e. 両バイアルにはひび割れなし、ストッパがしっかりと定位置にあり、漏洩の兆候なし
f. 各容器について、10μm以上の粒子 NMT 6000個; 25μm以上の粒子 NMT 600個
*(I) = 倒立; **(U) = 直立
(Table 12I.1) Long-term stability results for (XXXVI) formulation GMP lot number 041I0511 a (25 ° C./60% relative humidity)
GMP batch packaging ingredients: 50 mL clear, 20 mm aperture,
b. Colorless to pale yellow liquid. Transparent and particle free
c. Colorless liquid. Transparent and particle free
d. Vials are not cracked, stopper is firmly in place, no signs of leakage
e. No crack on both vials, stopper is firmly in place, no signs of leakage
f. For each container, 6000 particles NMT over 10μm; 600 particles NMT over 25μm
* (I) = inverted; ** (U) = upright
(表12I.2)(XXXVI)製剤GMPロット番号041I0511aの長期安定性結果(5℃/周囲)
a. GMPバッチの包装成分: 50mL透明、20mm開口、USP 1型ガラス(Wheaton 223745); テフロン2でコーティングされた灰色ブチルをストッパーとする。4416/50(West 1014 4937); フリップオフシール、20mm、3766白、8-ブリッジ(West 5420 3028)。
b. 無色〜淡黄色の液体。透明および無粒子
c. 無色液体。透明および無粒子
d. バイアルにはひび割れなし、ストッパがしっかりと定位置にあり、漏洩の兆候なし
e. 両バイアルにはひび割れなし、ストッパがしっかりと定位置にあり、漏洩の兆候なし
f. 各容器について、10μm以上の粒子 NMT 6000個; 25μm以上の粒子 NMT 600個
*(I) = 倒立; **(U) = 直立
(Table 12I.2) Long-term stability results for (XXXVI) formulation GMP lot number 041I0511 a (5 ° C / ambient)
GMP batch packaging ingredients: 50 mL clear, 20 mm aperture,
b. Colorless to pale yellow liquid. Transparent and particle free
c. Colorless liquid. Transparent and particle free
d. Vials are not cracked, stopper is firmly in place, no signs of leakage
e. No crack on both vials, stopper is firmly in place, no signs of leakage
f. For each container, 6000 particles NMT over 10μm; 600 particles NMT over 25μm
* (I) = inverted; ** (U) = upright
(表12J)分解物4,6-ビス(プロピルアミノ)-1,3,5-トリアジン-2-オール(CLXXVIII)のレベル
GMP安定性試験、ロット番号 GMPロット番号041I0511
(Table 12J) Level of
GMP stability test, lot number GMP lot number 041I0511
本明細書において引用されるすべての特許、特許出願および刊行物の開示は、参照によりその全体が本明細書に組み入れられる。特定の態様を参照して本発明を開示してきたが、当業者が、本発明の真意および範囲を逸脱することなく、本発明の他の態様および変形を考案することができることは明らかである。添付の特許請求の範囲は、すべてのそのような態様および同等の変形を含むものと解釈されるように意図されている。 The disclosures of all patents, patent applications and publications cited herein are hereby incorporated by reference in their entirety. While the invention has been disclosed with reference to particular embodiments, it will be apparent to those skilled in the art that other embodiments and variations of the invention can be devised without departing from the spirit and scope of the invention. The appended claims are intended to be construed to include all such embodiments and equivalent variations.
Claims (69)
(i) 図14のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態A;
(ii) 図23のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性硫酸水素塩(XXXVI);
(iii) 図24のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態C;
(iv) 図25のXRPDスペクトルを有する、結晶性硫酸水素塩(XXXVI)形態D;
(v) 図26のXRPDスペクトルを有する、形態Aと形態Dとの混合物を含む結晶性硫酸水素塩(XXXVI);
(vi) 図27のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態A;
(vii) 図28のXRPDスペクトルを有する、結晶性リン酸塩(CLXXX)形態C;
(viii) 図29のXRPDスペクトルを有する、形態Aと形態Bとの混合物を含む結晶性リン酸塩(CLXXX);
(ix) 図30のXRPDスペクトルを有する、形態Cと形態Dとの混合物を含む結晶性リン酸塩(CLXXX);
(x) 図31のXRPDスペクトルを有する、形態Cと形態Eとの混合物を含む結晶性リン酸塩(CLXXX);
およびそれらの任意の混合物。 At least one of N- (4,6-bis-n-propylamino- [1,3,5] triazin-2-yl) -NO-dimethyl-hydroxylamine (XXXV), selected from the group consisting of Crystalline salt:
(i) crystalline hydrogen sulfate (XXXVI) Form A having the XRPD spectrum of FIG. 14;
(ii) crystalline hydrogen sulfate (XXXVI) comprising a mixture of Form A and Form B having the XRPD spectrum of FIG. 23;
(iii) crystalline hydrogen sulfate (XXXVI) Form C having the XRPD spectrum of FIG. 24;
(iv) Crystalline hydrogen sulfate (XXXVI) Form D having the XRPD spectrum of FIG. 25;
(v) crystalline hydrogen sulfate (XXXVI) comprising a mixture of Form A and Form D having the XRPD spectrum of FIG. 26;
(vi) Crystalline phosphate (CLXXX) form A, having the XRPD spectrum of FIG. 27;
(vii) Crystalline phosphate (CLXXX) Form C having the XRPD spectrum of FIG. 28;
(viii) crystalline phosphate (CLXXX) comprising a mixture of Form A and Form B having the XRPD spectrum of FIG. 29;
(ix) crystalline phosphate (CLXXX) comprising a mixture of Form C and Form D, having the XRPD spectrum of FIG. 30;
(x) crystalline phosphate (CLXXX) comprising a mixture of Form C and Form E having the XRPD spectrum of FIG. 31;
And any mixture of them.
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;
R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;
R4はH、アルキルまたは置換アルキルであり;
R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;
R6はH、アルキル、置換アルキルまたはアルケニルであり;
Xは結合、OまたはNR4であり;
YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ
(i) ZはHであり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) Zは存在せず、結合b2は存在せず、Aは単結合であり;
YがCである場合、結合b1は単結合であり、かつ
(i) ZはCH2であり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) ZはCHであり、結合b2は二重結合であり、AはCである。 A method of reducing or minimizing the open channel portion of a potassium maxi-K or BK channel in a subject in need thereof, comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or Administering to the subject an effective amount of a pharmaceutical formulation comprising the salt thereof:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forming a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl;
R 3 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, —NR 1 R 2 , —C (O) OR 1 , acyl or aryl;
R 4 is H, alkyl or substituted alkyl;
R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1 , -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, Are substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 together are 3,6,9-trioxa-undecane-1,11-diyl and 3,6-dioxa-octane Forming a biradical selected from the group consisting of -1,8-diyl;
R 6 is H, alkyl, substituted alkyl or alkenyl;
X is a bond, O or NR 4 ;
Y is N, CR 6 or C; where
If Y is N or CR 6 then there is no bond b 1 and
(i) Z is H, the bond b 2 is a single bond, and A is CH;
(ii) Z is absent, bond b 2 is absent, and A is a single bond;
When Y is C, the bond b 1 is a single bond, and
(i) Z is CH 2 , bond b 2 is a single bond, and A is CH;
(ii) Z is CH, bond b 2 is a double bond, and A is C.
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;
R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;
R4はH、アルキルまたは置換アルキルであり;
R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;
R6はH、アルキル、置換アルキルまたはアルケニルであり;
Xは結合、OまたはNR4であり;
YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ
(i) ZはHであり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) Zは存在せず、結合b2は存在せず、Aは単結合であり;
YがCである場合、結合b1は単結合であり、かつ
(i) ZはCH2であり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) ZはCHであり、結合b2は二重結合であり、AはCである。 A method of inhibiting TASK-1 (KCNK3) channel in a subject in need thereof, comprising at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof Administering to the subject an effective amount of a formulation:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forming a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl;
R 3 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, —NR 1 R 2 , —C (O) OR 1 , acyl or aryl;
R 4 is H, alkyl or substituted alkyl;
R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1 , -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, Are substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 together are 3,6,9-trioxa-undecane-1,11-diyl and 3,6-dioxa-octane Forming a biradical selected from the group consisting of -1,8-diyl;
R 6 is H, alkyl, substituted alkyl or alkenyl;
X is a bond, O or NR 4 ;
Y is N, CR 6 or C; where
If Y is N or CR 6 then there is no bond b 1 and
(i) Z is H, the bond b 2 is a single bond, and A is CH;
(ii) Z is absent, bond b 2 is absent, and A is a single bond;
When Y is C, the bond b 1 is a single bond, and
(i) Z is CH 2 , bond b 2 is a single bond, and A is CH;
(ii) Z is CH, bond b 2 is a double bond, and A is C.
式中、
R1およびR2は独立してH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、フェニル、置換フェニル、フェニルアルキル、置換フェニルアルキル、アリール、置換アリール、アリールアルキル、置換アリールアルキル、ヘテロアリールアルキル、置換ヘテロアリールアルキル、ヘテロアリールまたは置換ヘテロアリールであるか; あるいは、R1およびR2は一緒になって、3-ヒドロキシ-ペンタン-1,5-ジイル、6-ヒドロキシ-シクロヘプタン-1,4-ジイル、プロパン-1,3-ジイル、ブタン-1,4-ジイルおよびペンタン-1,5-ジイルからなる群より選択されるビラジカルを形成し;
R3はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-NR1R2、-C(O)OR1、アシルまたはアリールであり;
R4はH、アルキルまたは置換アルキルであり;
R5はH、アルキル、置換アルキル、シクロアルキル、置換シクロアルキル、アルケニル、置換アルケニル、-OR1、-NR1R2、-C(O)OR1、アシル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、複素環または置換複素環であるか; あるいは、R3およびR5は一緒になって、3,6,9-トリオキサ-ウンデカン-1,11-ジイルおよび3,6-ジオキサ-オクタン-1,8-ジイルからなる群より選択されるビラジカルを形成し;
R6はH、アルキル、置換アルキルまたはアルケニルであり;
Xは結合、OまたはNR4であり;
YはN、CR6またはCであり; ここで
YがNまたはCR6である場合、結合b1は存在せず、かつ
(i) ZはHであり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) Zは存在せず、結合b2は存在せず、Aは単結合であり;
YがCである場合、結合b1は単結合であり、かつ
(i) ZはCH2であり、結合b2は単結合であり、AはCHであるか; あるいは、
(ii) ZはCHであり、結合b2は二重結合であり、AはCである。 A method for increasing minute ventilation in a subject in need thereof, comprising: at least one pharmaceutically acceptable carrier and at least one compound of formula (I) or a salt thereof. Administering an amount to the subject comprising:
Where
R 1 and R 2 are independently H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, phenyl, substituted phenyl, phenylalkyl, substituted phenylalkyl, aryl, substituted aryl, arylalkyl, substituted aryl Alkyl, heteroarylalkyl, substituted heteroarylalkyl, heteroaryl or substituted heteroaryl; or R 1 and R 2 taken together are 3-hydroxy-pentane-1,5-diyl, 6-hydroxy- Forming a biradical selected from the group consisting of cycloheptane-1,4-diyl, propane-1,3-diyl, butane-1,4-diyl and pentane-1,5-diyl;
R 3 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, —NR 1 R 2 , —C (O) OR 1 , acyl or aryl;
R 4 is H, alkyl or substituted alkyl;
R 5 is H, alkyl, substituted alkyl, cycloalkyl, substituted cycloalkyl, alkenyl, substituted alkenyl, -OR 1 , -NR 1 R 2 , -C (O) OR 1 , acyl, aryl, substituted aryl, heteroaryl, Are substituted heteroaryl, heterocycle or substituted heterocycle; or R 3 and R 5 together are 3,6,9-trioxa-undecane-1,11-diyl and 3,6-dioxa-octane Forming a biradical selected from the group consisting of -1,8-diyl;
R 6 is H, alkyl, substituted alkyl or alkenyl;
X is a bond, O or NR 4 ;
Y is N, CR 6 or C; where
If Y is N or CR 6 then there is no bond b 1 and
(i) Z is H, the bond b 2 is a single bond, and A is CH;
(ii) Z is absent, bond b 2 is absent, and A is a single bond;
When Y is C, the bond b 1 is a single bond, and
(i) Z is CH 2 , bond b 2 is a single bond, and A is CH;
(ii) Z is CH, bond b 2 is a double bond, and A is C.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/482,837 | 2012-05-29 | ||
| US13/482,837 US20120295911A1 (en) | 2010-11-29 | 2012-05-29 | Novel Compounds and Compositions for Treatment of Breathing Control Disorders or Diseases |
| PCT/US2013/043052 WO2013181217A2 (en) | 2012-05-29 | 2013-05-29 | Novel compounds and compositions for treatment of breathing control disorders or diseases |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015521201A true JP2015521201A (en) | 2015-07-27 |
| JP2015521201A5 JP2015521201A5 (en) | 2016-07-14 |
Family
ID=49674035
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015515140A Pending JP2015521201A (en) | 2012-05-29 | 2013-05-29 | Novel compounds and compositions for the treatment of respiratory control disorders or respiratory control disorders |
Country Status (10)
| Country | Link |
|---|---|
| EP (1) | EP2855438A4 (en) |
| JP (1) | JP2015521201A (en) |
| KR (1) | KR20150020616A (en) |
| CN (1) | CN104602694A (en) |
| AU (1) | AU2013267570A1 (en) |
| BR (1) | BR112014029703A2 (en) |
| CA (1) | CA2875012A1 (en) |
| HK (1) | HK1209118A1 (en) |
| SG (1) | SG11201407964YA (en) |
| WO (1) | WO2013181217A2 (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104926816A (en) * | 2014-03-19 | 2015-09-23 | 江苏先声药物研究有限公司 | Tofacitinib analog and preparation method and application thereof |
| FR3076751B1 (en) * | 2018-01-18 | 2020-10-23 | Lebronze Alloys | WELDING ELECTRODE FOR ALUMINUM OR STEEL SHEETS AND PROCESS FOR OBTAINING THE ELECTRODE |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5661148A (en) * | 1989-09-19 | 1997-08-26 | Teijin Limited | Pyrrolo[2,3-d]pyrimidine derivatives, process for producing the same and pharmaceutical preparation comprising the same as active ingredient |
| JP5907986B2 (en) * | 2010-11-29 | 2016-04-26 | ガリオン ファーマシューティカルズ インコーポレイテッド | Compounds as respiratory stimulants for the treatment of respiratory control disorders or respiratory control disorders |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4269832A (en) * | 1978-04-12 | 1981-05-26 | American Cyanamid Company | Method of treating arthritic disease |
| DE3401675A1 (en) * | 1984-01-19 | 1985-07-25 | Bayer Ag, 5090 Leverkusen | NEW POLYAMINE AND A METHOD FOR THEIR PRODUCTION |
| US7169785B2 (en) * | 2001-09-21 | 2007-01-30 | Reddy Us Therapeutics, Inc. | Methods and compositions of novel triazine compounds |
| CN101885707B (en) * | 2009-05-15 | 2012-08-29 | 中国科学院化学研究所 | Triazine derivative and preparation method thereof as well as new application as insecticide |
| US20120295911A1 (en) * | 2010-11-29 | 2012-11-22 | Galleon Pharmaceuticals, Inc. | Novel Compounds and Compositions for Treatment of Breathing Control Disorders or Diseases |
| KR20150082633A (en) * | 2012-11-15 | 2015-07-15 | 갈레온 파마슈티칼스, 인코포레이티드 | Novel Orally Bioavailable Breathing Control Modulating Compounds, and Methods of Using Same |
-
2013
- 2013-05-29 KR KR20147036621A patent/KR20150020616A/en not_active Application Discontinuation
- 2013-05-29 SG SG11201407964YA patent/SG11201407964YA/en unknown
- 2013-05-29 EP EP13798039.7A patent/EP2855438A4/en not_active Withdrawn
- 2013-05-29 AU AU2013267570A patent/AU2013267570A1/en not_active Abandoned
- 2013-05-29 WO PCT/US2013/043052 patent/WO2013181217A2/en active Application Filing
- 2013-05-29 CA CA2875012A patent/CA2875012A1/en not_active Abandoned
- 2013-05-29 BR BR112014029703A patent/BR112014029703A2/en not_active IP Right Cessation
- 2013-05-29 JP JP2015515140A patent/JP2015521201A/en active Pending
- 2013-05-29 CN CN201380040132.0A patent/CN104602694A/en active Pending
-
2015
- 2015-10-08 HK HK15109840.6A patent/HK1209118A1/en unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5661148A (en) * | 1989-09-19 | 1997-08-26 | Teijin Limited | Pyrrolo[2,3-d]pyrimidine derivatives, process for producing the same and pharmaceutical preparation comprising the same as active ingredient |
| JP5907986B2 (en) * | 2010-11-29 | 2016-04-26 | ガリオン ファーマシューティカルズ インコーポレイテッド | Compounds as respiratory stimulants for the treatment of respiratory control disorders or respiratory control disorders |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013181217A2 (en) | 2013-12-05 |
| BR112014029703A2 (en) | 2017-06-27 |
| AU2013267570A1 (en) | 2014-12-18 |
| CA2875012A1 (en) | 2013-12-05 |
| CN104602694A (en) | 2015-05-06 |
| HK1209118A1 (en) | 2016-03-24 |
| EP2855438A4 (en) | 2016-02-24 |
| KR20150020616A (en) | 2015-02-26 |
| EP2855438A2 (en) | 2015-04-08 |
| SG11201407964YA (en) | 2014-12-30 |
| WO2013181217A3 (en) | 2014-02-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5907986B2 (en) | Compounds as respiratory stimulants for the treatment of respiratory control disorders or respiratory control disorders | |
| US9162992B2 (en) | Compounds and compositions for treatment of breathing control disorders or diseases | |
| JP6731427B2 (en) | Novel respiratory control modulating compounds, and methods of making and using same | |
| KR20180088462A (en) | 2-phenyl-3- (piperazinomethyl) imidazo [1,2-a] pyridine derivative as a TASK-1 and TASK-2 channel blocker for the treatment of sleep-related respiratory disorders | |
| CN104918923A (en) | Novel orally bioavailable breathing control modulating compounds, and methods of using same | |
| CN105682659A (en) | Diaminopyrimidine P2X3 and P2X2/3 receptor modulators for treatment of acute, sub-acute or chronic cough | |
| ZA200205314B (en) | Dihydro-1,3,5-triazine amine derivatives and their therapeutic uses | |
| CA2441425A1 (en) | Antipruritics | |
| JP2015521201A (en) | Novel compounds and compositions for the treatment of respiratory control disorders or respiratory control disorders | |
| WO2021047528A1 (en) | Maleate of nicotinyl alcohol ether derivative, crystal form thereof, and application thereof | |
| US11459301B2 (en) | Crystalline form of s-apomorphine | |
| JP2016516714A (en) | Respiratory regulatory compound and method of using the same | |
| CA3215383A1 (en) | Pharmaceutical composition, and preparation method therefor and application thereof | |
| CN117836284A (en) | Methods of treating nerve agent-induced seizures | |
| BR112017028487B1 (en) | RESPIRATION CONTROL MODULATION COMPOUND AND PHARMACEUTICAL COMPOSITION |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160525 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160525 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170522 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170821 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180131 |