JP2015516989A - Modulation of immune response - Google Patents
Modulation of immune response Download PDFInfo
- Publication number
- JP2015516989A JP2015516989A JP2015510379A JP2015510379A JP2015516989A JP 2015516989 A JP2015516989 A JP 2015516989A JP 2015510379 A JP2015510379 A JP 2015510379A JP 2015510379 A JP2015510379 A JP 2015510379A JP 2015516989 A JP2015516989 A JP 2015516989A
- Authority
- JP
- Japan
- Prior art keywords
- sting
- cells
- trex1
- dna
- nucleic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/711—Natural deoxyribonucleic acids, i.e. containing only 2'-deoxyriboses attached to adenine, guanine, cytosine or thymine and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
Abstract
STINGのモジュレーターは、免疫反応をアップレギュレートまたはダウンレギュレートすることが可能である。そのようなモジュレーターの投与を用いて、直接または他の作用剤との組合せのいずれかで被験体における疾患または他の望ましくない病態を治療することが可能である。STING modulators can up-regulate or down-regulate immune responses. Administration of such modulators can be used to treat a disease or other undesirable condition in a subject, either directly or in combination with other agents.
Description
政府の権利
本明細書に記載の発明は、国立衛生研究所(National Institutes of Health)により授与された助成金第R01A1079336号に基づいて米国政府の支援を受けた。米国政府は、本発明に関する一定の権利を有する。
Government Rights The invention described herein was supported by the US Government under Grant No. R01A1079336 awarded by the National Institutes of Health. The United States government has certain rights in this invention.
本発明の実施形態は、被験体において先天性免疫および適応免疫を変調するための、ならびに/または免疫関連障害、癌、自己免疫を治療するための、感染症を治療および予防するための、組成物および方法に関する。 Embodiments of the invention are compositions for treating and preventing infections for modulating innate and adaptive immunity and / or for treating immune related disorders, cancer, autoimmunity in a subject. Things and methods.
病原体侵入に対する細胞宿主防御反応には、抗病原体遺伝子の誘導をもたらす、リポ多糖または鞭毛タンパク質を含むウイルス核酸や細菌細胞壁成分などの病原体関連分子パターン(PAMP)の検出が主に必要とされる。たとえば、ウイルスRNAは、小胞体(ER)および/またはエンドソームに存在する膜結合Toll様レセプター(TLR)(たとえば、TLR3および7/8)により、またはレチノイン酸誘導遺伝子1(RIG−I)として参照されるTLR非依存性細胞内DExD/HボックスRNAヘリカーゼもしくは黒色腫分化関連抗原5(IFIH1およびヘリカードとしても参照されるMDA5)により、検出可能である。これらのイベントの結果、下流シグナリングイベント(その多くは未知のままである)が活性化され、I型IFNを含む、NF−κB依存性遺伝子およびIRF3/7依存性遺伝子の転写がもたらされる。 Cell host defense reactions against pathogen invasion mainly require detection of pathogen-associated molecular patterns (PAMPs) such as viral nucleic acids and bacterial cell wall components, including lipopolysaccharide or flagellar proteins, that lead to induction of anti-pathogen genes. For example, viral RNA is referenced by the membrane-bound Toll-like receptor (TLR) present in the endoplasmic reticulum (ER) and / or endosomes (eg, TLR3 and 7/8) or as retinoic acid-inducible gene 1 (RIG-I) TLR-independent intracellular DExD / H box RNA helicase or melanoma differentiation associated antigen 5 (IFIH1 and MDA5, also referred to as helicard). These events result in activation of downstream signaling events, many of which remain unknown, resulting in transcription of NF-κB-dependent and IRF3 / 7-dependent genes, including type I IFN.
先天性免疫反応で重要な役割を果たす分子STING(インターフェロン遺伝子のスティミュレーター)は、主に小胞体(ER)に存在する5つの推定膜貫通(TM)領域を含み、NF−κBおよびIRF3の両方の転写経路を活性化させてI型IFNを誘導するとともに発現後に強力な抗ウイルス状態を発揮することが可能である。米国特許出願第13/057,662号明細書および国際出願第PCT/US2009/052767号パンフレットを参照されたい。STINGの損失により、I型IFNを活性化するポリICの能力が低下し、標的相同組換えによりSTINGの欠如したネズミ胚性線維芽細胞(−/−MEF)が生成され、水疱性口内炎ウイルス(VSV)感染症に罹患しやすくなった。STINGの不在下ではDNA媒介I型IFN反応が阻害されたことから、STINGは、ウイルス、細菌、および細胞に感染可能な他の病原体に由来するDNAを認識するうえで重要な役割を果たしうることが示唆された。酵母ツーハイブリッドおよび共免疫沈降の研究の結果、STINGは、RIG−Iと相互作用すること、かつ翻訳後にER膜を横切るタンパク質移行に必要とされるトランスロコン関連タンパク質(TRAP)複合体のメンバーSsr2/TRAPβと相互作用すること、が示唆された。TRAPβのRNAi破壊により、STING機能が阻害され、ポリICに反応するI型IFNの産生が妨害された。 The molecule STING (interferon gene stimulator), which plays an important role in the innate immune response, contains five putative transmembrane (TM) regions present mainly in the endoplasmic reticulum (ER) and contains NF-κB and IRF3. Both transcriptional pathways can be activated to induce type I IFN and exert a strong antiviral state after expression. See US Patent Application No. 13 / 057,662 and International Application No. PCT / US2009 / 052767. Loss of STING reduces the ability of Poly IC to activate type I IFN, and target homologous recombination produces murine embryonic fibroblasts ( − / − MEF) lacking STING, resulting in vesicular stomatitis virus ( VSV) became more susceptible to infections. SING can play an important role in recognizing DNA from viruses, bacteria, and other pathogens capable of infecting cells, because the DNA-mediated type I IFN response was inhibited in the absence of STING Was suggested. As a result of yeast two-hybrid and co-immunoprecipitation studies, STING is a member of the translocon-related protein (TRAP) complex Ssr2 that interacts with RIG-I and is required for protein translation across the ER membrane after translation It was suggested that it interacts with / TRAPβ. RNAi disruption of TRAPβ inhibited STING function and prevented production of type I IFN in response to poly IC.
さらなる実験の結果、STINGは、それ自体が病原体由来DNAやアポトーシスDNAなどの一本鎖および二本鎖のDNAを含めて核酸に結合し、DNA媒介関節炎や癌などの炎症病態において炎症誘発性遺伝子発現を調節するうえで中心的な役割を果たすことが示された。本明細書には、STINGの発現または機能をアップレギュレートする種々の新しい方法および組成物が、STINGと相互作用する他の細胞分子のさらなる特徴付けと共に、記載されている。これらの発見により、免疫系および他の系を調節する新しいアジュバント、ワクチン、および療法の設計が可能になる。 As a result of further experiments, STING binds to nucleic acids, including single-stranded and double-stranded DNA such as pathogen-derived DNA and apoptotic DNA, and is a pro-inflammatory gene in inflammatory pathologies such as DNA-mediated arthritis and cancer. It has been shown to play a central role in regulating expression. Described herein are various new methods and compositions for upregulating STING expression or function, along with further characterization of other cellular molecules that interact with STING. These discoveries allow the design of new adjuvants, vaccines, and therapies that regulate the immune and other systems.
本明細書には、異常STING機能に関連付けられる疾患または障害を有する被験体において免疫反応を変調する方法が記載されている。本方法は、STING機能を変調する作用剤と薬学的に許容可能な担体とを含む医薬組成物を、医薬組成物が被験体の異常STING機能を改善するのに有効な量で、被験体に投与するステップを含みうる。作用剤は、STING機能を増加もしくは減少させる低分子または細胞内条件下でSTINGに結合する核酸分子でありうる。STING結合核酸分子は、40〜150塩基対長の一本鎖DNAまたは40〜150、60〜120、80〜100、もしくは85〜95塩基対長の二本鎖DNAまたはそれよりも長いものでありうる。STING結合核酸分子は、ヌクレアーゼ耐性でありうる。たとえば、ヌクレアーゼ耐性ヌクレオチドで構成されうる。それはまた、膜貫通輸送を促進する分子に関連するものでありうる。本方法では、疾患または障害は、DNA依存性炎症性疾患でありうる。 Described herein are methods for modulating an immune response in a subject having a disease or disorder associated with abnormal STING function. The method comprises administering to a subject a pharmaceutical composition comprising an agent that modulates STING function and a pharmaceutically acceptable carrier in an amount that is effective for the pharmaceutical composition to improve the subject's abnormal STING function. Administering. Can include the step of administering. The agent can be a small molecule that increases or decreases STING function or a nucleic acid molecule that binds to STING under intracellular conditions. STING binding nucleic acid molecules can be 40-150 base pair long single stranded DNA or 40-150, 60-120, 80-100, or 85-95 base pair long double stranded DNA or longer. . A STING binding nucleic acid molecule can be nuclease resistant. For example, it can be composed of nuclease resistant nucleotides. It can also be related to molecules that facilitate transmembrane transport. In this method, the disease or disorder can be a DNA-dependent inflammatory disease.
本明細書にはまた、炎症性免疫細胞が浸潤した癌性腫瘍を有する被験体において癌を治療する方法も記載されている。本方法は、STINGの機能および発現をダウンレギュレートする作用剤と薬学的に許容可能な担体とを含む医薬組成物を、医薬組成物が、癌性腫瘍に浸潤する炎症性免疫細胞の数を少なくとも50%(たとえば、少なくとも50、60、70、80、もしくは90%、または炎症性細胞浸潤の低減が組織診もしくは走査により検出可能に低減されるまで)低減するのに有効な量で、被験体に投与するステップを含みうる。 Also described herein are methods of treating cancer in a subject having a cancerous tumor infiltrated with inflammatory immune cells. The method comprises a pharmaceutical composition comprising an agent that down-regulates STING function and expression and a pharmaceutically acceptable carrier, wherein the pharmaceutical composition determines the number of inflammatory immune cells infiltrating a cancerous tumor. Test in an amount effective to reduce at least 50% (eg, at least 50, 60, 70, 80, or 90%, or until the reduction in inflammatory cell infiltration is detectably reduced by histology or scanning) Administering to the body.
本明細書には、異常STING機能に関連付けられる疾患または障害を有する被験体において免疫反応を変調するための方法および組成物が記載されている。以下に記載の好ましい実施形態には、この組成物および方法の適応が例示されている。それにもかかわらず、この実施形態の説明から、本発明の他の態様を以下に提供される説明に基づいて作成および/または実施することが可能である。 Described herein are methods and compositions for modulating an immune response in a subject having a disease or disorder associated with abnormal STING function. The preferred embodiments described below illustrate the application of this composition and method. Nevertheless, from the description of this embodiment, other aspects of the invention can be made and / or implemented based on the description provided below.
異常STING機能に関連付けられる疾患または障害を有する被験体(たとえば、ヒト、イヌ、ネコ、ウマ、ウシ、ヤギ、ブタなど)において免疫反応を変調するための方法および組成物は、STING機能を変調する作用剤と薬学的に許容可能な担体とを含む医薬組成物を必要とする。ただし、その量は、医薬組成物が被験体において異常STING機能を改善するのに有効な量である。 Methods and compositions for modulating an immune response in a subject (eg, human, dog, cat, horse, cow, goat, pig, etc.) having a disease or disorder associated with abnormal STING function modulate STING function There is a need for a pharmaceutical composition comprising an agent and a pharmaceutically acceptable carrier. However, the amount is an amount that is effective for the pharmaceutical composition to improve abnormal STING function in the subject.
異常STING機能に関連付けられる疾患または障害は、STINGの機能および発現の欠損した細胞が疾患または障害の身体症状を引き起こすものまたはそれを増悪するもののいずれかでありうる。通常、そのような疾患または障害、たとえば、炎症病態、自己免疫病態、癌(たとえば、乳癌、結腸直腸癌、前立腺癌、卵巣癌、白血病癌、肺癌、子宮内膜癌、または肝臓癌)、アテローム硬化症、関節炎(たとえば、骨関節炎または関節リウマチ)、炎症性腸疾患(たとえば、潰瘍性結腸炎またはクローン病)、末梢血管疾患、脳血管偶発症候(発作)、慢性炎症が存在するもの、炎症性細胞浸潤を有する病変により特徴付けられるもの、脳にアミロイド斑が存在するもの(たとえば、アルツハイマー病)、アイカルディ・グチエール症候群、若年性関節炎、骨粗鬆症、筋萎縮性側索硬化症、または多発性硬化症は、免疫系細胞により媒介される。 A disease or disorder associated with abnormal STING function can be either a cell that is deficient in STING function and expression causes or exacerbates the physical symptoms of the disease or disorder. Usually such disease or disorder, eg inflammatory condition, autoimmune condition, cancer (eg breast cancer, colorectal cancer, prostate cancer, ovarian cancer, leukemia cancer, lung cancer, endometrial cancer or liver cancer), atheroma Sclerosis, arthritis (eg osteoarthritis or rheumatoid arthritis), inflammatory bowel disease (eg ulcerative colitis or Crohn's disease), peripheral vascular disease, cerebrovascular accident (seizure), chronic inflammation present, inflammation Characterized by lesions with sexual cell infiltration, amyloid plaques in the brain (eg, Alzheimer's disease), Aicardi Gutierre syndrome, juvenile arthritis, osteoporosis, amyotrophic lateral sclerosis, or multiple Sclerosis is mediated by immune system cells.
作用剤は、STINGの機能および発現を増加もしくは減少させる低分子(すなわち、500、1000、もしくは2000ダルトン未満の分子量を有する有機もしくは無機の分子)または細胞内条件下(すなわち、STINGが正常に位置する細胞内条件下)でSTINGに結合する核酸分子でありうる。作用剤はまた、一本鎖(ss)または二本鎖(ds)のRNAまたはDNAでありうるSTING結合核酸分子でありうる。好ましくは、核酸は、40〜150、60〜120、80〜100、もしくは85〜95塩基対長であるか、またはそれよりも長い。STING結合核酸分子は、ヌクレアーゼ耐性でありうる。たとえば、ヌクレアーゼ耐性ヌクレオチドで構成されうるか、または環状ジヌクレオチド形態でありうる。それはまた、膜貫通輸送を促進する分子に関連するものでありうる。 Agents are small molecules that increase or decrease STING function and expression (ie, organic or inorganic molecules having a molecular weight of less than 500, 1000, or 2000 Daltons) or intracellular conditions (ie, STING is normally located). Nucleic acid molecules that bind to STING under intracellular conditions). The agent can also be a STING binding nucleic acid molecule, which can be single stranded (ss) or double stranded (ds) RNA or DNA. Preferably, the nucleic acid is 40 to 150, 60 to 120, 80 to 100, or 85 to 95 base pairs in length or longer. A STING binding nucleic acid molecule can be nuclease resistant. For example, it can be composed of nuclease resistant nucleotides or can be in the form of a cyclic dinucleotide. It can also be related to molecules that facilitate transmembrane transport.
炎症性免疫細胞で浸潤された癌性腫瘍を有する被験体において癌を治療するための方法および組成物は、STINGの機能および発現をダウンレギュレートする作用剤と薬学的に許容可能な担体とを含む医薬組成物を必要とする。ただし、その量は、医薬組成物が、癌性腫瘍に浸潤する炎症性免疫細胞の数を少なくとも50%(たとえば、少なくとも50、60、70、80、もしくは90%、または炎症性細胞浸潤の低減が組織診もしくは走査により検出可能に低減されるまで)低減するのに有効な量である。 Methods and compositions for treating cancer in a subject having a cancerous tumor infiltrated with inflammatory immune cells comprise an agent that down regulates STING function and expression and a pharmaceutically acceptable carrier. A pharmaceutical composition comprising is required. However, the amount is at least 50% of the number of inflammatory immune cells that infiltrate the cancerous tumor (eg, at least 50, 60, 70, 80, or 90%, or reduced inflammatory cell infiltration). Effective amount to reduce (until it is detectably reduced by histology or scanning).
本明細書に記載の組成物は、経口投与、直腸投与、腟投与、局所投与、経真皮投与、皮下投与、静脈内投与、筋肉内投与、吹送投与、髄腔内投与、および鼻腔内投与をはじめとするさまざまな経路により投与可能な医薬組成物を作製するために、1種以上の薬学的に許容可能な担体または賦形剤と共に含まれうる。本発明で使用するのに好適な製剤は、Remington’s Pharmaceutical Sciences,Mack Publishing Company,Philadelphia,Pa.,17th ed.(1985)に見いだされる。 The compositions described herein are for oral, rectal, vaginal, topical, transdermal, subcutaneous, intravenous, intramuscular, insufflation, intrathecal, and intranasal administration. It can be included with one or more pharmaceutically acceptable carriers or excipients to make a pharmaceutical composition that can be administered by a variety of routes including the following. Formulations suitable for use in the present invention include Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Pa. , 17th ed. (1985).
活性成分は、賦形剤と混合可能であるか、賦形剤により希釈可能であるか、および/またはカプセル剤、サシェ剤、ペーパー剤、もしくは他の容器の形態をとりうる担体内に封入可能である。賦形剤が希釈剤として機能する場合、それは、活性成分に対する媒体、担体、または媒質として作用する固体材料、半固体材料、または液体材料でありうる。組成物は、錠剤、丸剤、粉末剤、ロゼンジ剤、サシェ剤、カシェ剤、エリキシル剤、サスペンジョン剤、エマルジョン剤、溶液剤、シロップ剤、エアロゾル剤(固体としてまたは液体媒質中)、軟膏剤、軟質および硬質のゼラチンカプセル剤、坐剤、無菌注射用溶液剤、鼻腔内投与用の無菌液剤(たとえば、スプレー装置)、または無菌パッケージ化粉末剤の形態をとりうる。製剤は、滑沢剤、たとえば、タルク、マグネシウムステアレート、および鉱油、湿潤剤、乳化剤および懸濁化剤、保存剤、たとえば、メチルベンゾエートおよびプロピルヒドロキシベンゾエート、甘味剤、および風味剤を追加的に含みうる。本発明に係る組成物は、当技術分野で公知の手順を利用することにより、患者への投与後に活性成分の急速放出、持続放出、または遅延放出を提供するように製剤化可能である。 The active ingredient can be mixed with or diluted with the excipient and / or encapsulated in a carrier that can take the form of a capsule, sachet, paper, or other container It is. Where the excipient functions as a diluent, it can be a solid, semi-solid, or liquid material that acts as a medium, carrier, or medium for the active ingredient. Compositions include tablets, pills, powders, lozenges, sachets, cachets, elixirs, suspensions, emulsions, solutions, syrups, aerosols (as solids or in liquid media), ointments, It can take the form of soft and hard gelatin capsules, suppositories, sterile injectable solutions, sterile solutions for intranasal administration (eg, spray devices), or sterile packaged powders. Formulations additionally contain lubricants such as talc, magnesium stearate, and mineral oils, wetting agents, emulsifiers and suspending agents, preservatives such as methyl and propyl hydroxybenzoates, sweeteners, and flavoring agents. May be included. Compositions according to the present invention can be formulated to provide rapid, sustained or delayed release of the active ingredient after administration to a patient by utilizing procedures known in the art.
錠剤などの固形製剤を調製するために、組成物を医薬賦形剤と混合して化合物の均一混合物を含有する固形プレ製剤組成物を形成することが可能である。錠剤または丸剤を被覆して、さもなければ配合して、遷延作用の利点を与える製剤を提供しうる。たとえば、錠剤または丸剤は、内側投与成分と外側投与成分とを含み、後者は、前者を覆う包囲体の形態をとりうる。胃内での崩壊に耐えるようにかつ内側成分をインタクトな状態で十二指腸内に送るかまたはその放出を遅延するように機能する腸溶層により、二成分を分離することが可能である。そのような腸溶層または腸溶コーティングに対してさまざまな材料を使用することが可能であり、そのような材料としては、いくつかの高分子酸および高分子酸とシェラック、セチルアルコール、セルロースアセテートなどの材料との混合物が挙げられる。 To prepare a solid formulation such as a tablet, the composition can be mixed with pharmaceutical excipients to form a solid pre-formulation composition containing a homogeneous mixture of compounds. Tablets or pills can be coated or otherwise compounded to provide a formulation that provides the benefit of prolonged action. For example, a tablet or pill may comprise an inner dosage component and an outer dosage component, the latter taking the form of an enclosure over the former. It is possible to separate the two components by an enteric layer that functions to resist disintegration in the stomach and to deliver the inner component intact into the duodenum or delay its release. A variety of materials can be used for such enteric layers or enteric coatings, including several polymeric acids and polymeric acids and shellac, cetyl alcohol, cellulose acetate. And a mixture with such materials.
液体形態の製剤としては、サスペンジョン剤およびエマルジョンが挙げられる。血清中半減期を増大させるために、製剤をカプセル化したり、リポソームのルーメンに導入したり、コロイドとして調製したり、またはリポソームの層に組み込んだりしうる。たとえば、Szokaらの米国特許第4,235,871号明細書、同第4,501,728号明細書、および同第4,837,028号明細書(それぞれ参照により本明細書に組み込まれる)に記載されるように、リポソームを調製するためにさまざまな方法が利用可能である。 Liquid form preparations include suspensions and emulsions. To increase serum half-life, the formulation can be encapsulated, introduced into the lumen of a liposome, prepared as a colloid, or incorporated into a layer of liposomes. For example, Szoka et al., U.S. Pat. Nos. 4,235,871, 4,501,728, and 4,837,028, each incorporated herein by reference. Various methods are available for preparing liposomes, as described in.
組成物は、好ましくは、活性成分のユニット製剤の形態で製剤化される。患者への投与量は、投与されるもの、投与の目的(たとえば、予防または治療)、患者の状態、投与の方式などに依存して異なるであろう。それらはすべて、認定医および認定薬剤師の技能の範囲内である。治療用途では、組成物は、疾患およびその合併症を治癒したりまたはその症状を少なくとも部分的に停止させたりするのに十分な量で、すでに疾患に罹患している患者に投与される。この使用に有効な量は、治療される疾患病態に依存するであろう。さらには、症状の重症度、患者の年齢、体重、および全身状態などの因子に依存して担当臨床医が判断されるであろう。 The composition is preferably formulated in the form of a unit dosage form of the active ingredient. The dosage to a patient will vary depending on what is being administered, the purpose of administration (eg, prophylaxis or treatment), the condition of the patient, the mode of administration, and the like. They are all within the skills of certified physicians and certified pharmacists. For therapeutic use, the composition is administered to a patient already suffering from the disease in an amount sufficient to cure the disease and its complications or at least partially cease its symptoms. Effective amounts for this use will depend on the disease state being treated. Furthermore, the attending clinician will be judged depending on such factors as the severity of the symptoms, the age, weight and general condition of the patient.
本明細書に挙げられた文書はすべて、参照により本明細書に組み込まれる。本出願に引用された出版物および特許文書はすべて、あたかもそれぞれ個別の出版物または特許文書が個別に示されたのと同程度まで、あらゆる目的で参照により組み込まれる。本文書に種々の参照文献を引用することにより、出願人は、いかなる特定の参照文献も本発明に対する「先行技術」であることを容認するものではない。発明の組成物および方法の実施形態は、以下の実施例で例示される。 All documents cited herein are hereby incorporated by reference. All publications and patent documents cited in this application are incorporated by reference for all purposes to the same extent as if each individual publication or patent document was presented separately. By citing various references in this document, Applicants do not admit that any particular reference is "prior art" to the present invention. Embodiments of inventive compositions and methods are illustrated in the following examples.
実施例1:先天性免疫を調節する細胞質DNAとのトランスロコン関連STING複合体
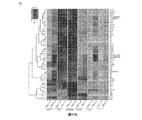
線維芽細胞、マクロファージ、および樹状細胞(DC)で細胞質dsDNAさらにはDNAウイルスおよび細胞内細菌に反応するI型IFNの産生に不可欠であることが実証されたSTING(インターフェロン遺伝子のスティミュレーター)として参照される小胞体(ER)の新しい膜貫通成分の単離については、すでに記載された(米国特許出願第13/057,662号明細書および国際出願第PCT/US2009/052767号パンフレットを参照されたい)。ネズミ細胞でSTING依存性I型IFNシグナリングを活性化するのに必要とされるdsDNAの最小サイズは、ネズミ細胞で約45塩基対であることが確認された。しかしながら、正常ヒト細胞(hTERT)では、I型IFNを完全に活性化するために約90塩基対のdsDNA(本明細書ではインターフェロン刺激性dsDNA90として参照される)が必要とされることが観測された。RNAiノックダウン手順を用いて、STINGは、hTERTでI型IFNの産生に実際に不可欠であることがさらに確認された(図1B)。mRNA発現を測定するマイクロアレイ手順を用いたさらなる分析から、細胞質dsDNAは、hTERT細胞でI型IFNのほかに広範にわたる一連の先天性免疫遺伝子を誘導可能であることが示唆された(図5A〜G)。hTERTでのSTINGのRNAiノックダウンが細胞質dsDNAによる刺激を大きく排除したので、IFITファミリーのメンバーを含むこれらの先天性分子の誘導は、STING依存性であるように思われた(図5A〜G)。細胞質dsDNAがSTING依存的にさまざまな先天性免疫遺伝子を誘導することは、STING+/+または−/−ネズミ胚性線維芽細胞(MEF)を用いて確認された(図1C)。これらのmRNAの誘導がSTING依存性遺伝子(SDG)でありかつI型IFN依存性オートクリンまたはパラクリンシグナリングにより刺激されないことを確認するために、I型IFNシグナリング欠損STAT1−/−MEFを同様にdsDNAで処理してSDGの産生が影響されない状態を維持することを検証した(図1C)。逆転写酵素(RT)PCR分析によりアレイ結果を確認した(図6A〜Hおよび7A〜H)。45ヌクレオチドのssDNA(ssDNA45)は、先天性免疫遺伝子産生をhTERTSでは弱くMEFではさらに弱く誘導することが確認された。しかしながら、90ヌクレオチドを含むトランスフェクトssDNA(ssDNA90)は、hTERT細胞でI型IFNを含めて一連の遺伝子をよりロバストに活性化することが観測された(図1D、1E)。細胞質ssDNA90がSTING依存的に先天性免疫遺伝子の産生を誘導することは、STING+/+または−/−ネズミ胚性線維芽細胞(MEF)を用いて同様に確認された(図1Fおよび7A〜H)。STINGは、おそらくヒト細胞およびネズミ細胞の両方のERでホモ二量体として存在し、細胞質ssDNAまたはdsDNAリガンドの存在下でERから核周囲領域に移行してI型IFN依存性転写因子を活性化することが観測された(図1Gおよび8A〜E)。HSV1は、STING依存的に先天性免疫遺伝子産生を活性化することが同様に観測された(図9A〜I)。SDGの多くは、それらのプロモーター領域にIRF7結合部位を含有することが確認された(図10A〜F)。したがって、トランスフェクトプラスミドDNAを含めて細胞質ssDNAまたはdsDNAは、STINGに依存する広範にわたる一連の先天性免疫関連遺伝子の転写を強力に誘導可能である。
Example 1: Translocon-related STING complex with cytoplasmic DNA that regulates innate immunity Type I IFN reacts with cytoplasmic dsDNA as well as DNA viruses and intracellular bacteria in fibroblasts, macrophages, and dendritic cells (DC) The isolation of a new transmembrane component of the endoplasmic reticulum (ER), referred to as STING (interferon gene stimulator), which has been demonstrated to be essential for the production of ER, has already been described (US Patent Application No. 13 / 057,662 and International Application No. PCT / US2009 / 052767). The minimum size of dsDNA required to activate STING-dependent type I IFN signaling in murine cells was confirmed to be approximately 45 base pairs in murine cells. However, it has been observed that in normal human cells (hTERT), approximately 90 base pair dsDNA (referred to herein as interferon-stimulated dsDNA90) is required to fully activate type I IFN. It was. Using the RNAi knockdown procedure, it was further confirmed that STING is actually essential for the production of type I IFN at hTERT (FIG. 1B). Further analysis using a microarray procedure to measure mRNA expression suggested that cytoplasmic dsDNA can induce a wide array of innate immune genes in addition to type I IFN in hTERT cells (FIGS. 5A-G). ). The induction of these innate molecules, including members of the IFIT family, appeared to be STING-dependent because RNAi knockdown of STING at hTERT greatly eliminated stimulation by cytoplasmic dsDNA (FIGS. 5A-G). . It has been confirmed that cytoplasmic dsDNA induces various innate immunity genes in a STING-dependent manner using STING + / + or − / − murine embryonic fibroblasts (MEF) (FIG. 1C). In order to confirm that the induction of these mRNAs is a STING-dependent gene (SDG) and is not stimulated by type I IFN-dependent autocrine or paracrine signaling, the type I IFN signaling deficient STAT1 − / − MEF was similarly treated with dsDNA. It was verified that the state in which the production of SDG was not affected by the treatment with Fig. 1C was maintained (Fig. 1C). Array results were confirmed by reverse transcriptase (RT) PCR analysis (FIGS. 6A-H and 7A-H). It was confirmed that 45 nucleotide ssDNA (ssDNA45) induces innate immune gene production weakly in hTERTS and weaker in MEF. However, transfected ssDNA containing 90 nucleotides (ssDNA90) was observed to more robustly activate a series of genes, including type I IFN, in hTERT cells (FIGS. 1D, 1E). It was similarly confirmed that cytoplasmic ssDNA90 induced innate immune gene production in a STING-dependent manner using STING + / + or − / − murine embryonic fibroblasts (MEF) (FIGS. 1F and 7A- H). STING probably exists as a homodimer in the ER of both human and murine cells and activates type I IFN-dependent transcription factors by translocating from the ER to the perinuclear region in the presence of cytoplasmic ssDNA or dsDNA ligands To be observed (FIGS. 1G and 8A-E). HSV1 was also observed to activate innate immune gene production in a STING-dependent manner (FIGS. 9A-I). Many of the SDGs were confirmed to contain IRF7 binding sites in their promoter regions (FIGS. 10A-F). Thus, cytoplasmic ssDNA or dsDNA, including transfected plasmid DNA, can strongly induce transcription of a wide range of innate immunity-related genes that depend on STING.
STING自体がDNA種に会合しうる可能性をさらに評価するために、293T細胞をSTINGでトランスフェクトし、細胞溶解後、ビオチン標識dsDNA90を用いてSTINGのC末端領域(aa181〜349)を沈降させうることを観測した(図2A)。STINGのN末端領域(aa1〜195)および3つの同様にHAタグ付けされた対照(GFP、NFAR1、およびIPS1)は、dsDNA90に会合しなかった。DNA結合エキソヌクレアーゼTREX1は、陽性対照として機能した。さらなる一連の広範な研究から、STINGのアミノ酸領域242〜341は、この領域の欠如したSTING変異体が核酸に会合できなかったので、おそらくdsDNAへの結合に関与することが示唆された(図2B〜D)。in vitro発現されたSTINGもまた、高塩かつ高界面活性剤の条件下でdsDNAに結合した(同様に領域242〜341の欠如した変異体を除く)(図11A〜F)。ビオチン標識dsDNA90をhTERTにトランスフェクトし、そのような細胞を可逆架橋試薬(DSS)またはUV光で処理することにより、STINGがおそらく二量体としてdsDNAと複合体を形成しうることを示すさらなる証拠を得た。両方の処理の場合で、STINGは、細胞溶解後、DNAへの会合を維持することが観測された(図2Eおよび図12A〜G)。hTERT細胞でSTINGのRNAiノックダウンを行うと、観測された結合は排除され、STING−DNA複合体は、野生型MEF(+/+)でのみ同様に観測され、STINGの欠如したMEF(−/−)では観測されなかった(図12A〜G)。HSV1、サイトメガロウイルス(CMV)、さらにはアデノウイルス(ADV)に関連するdsDNAの競争実験から、STINGはまた、dsDNAたけでなくssDNA(ssDNA90)にも結合しうるが、dsRNAには結合しえないことが示唆されることが同様に確認された(図2F)。このことは、in vitroでSTINGを発現させてssDNA90との会合を観測することにより、確認された(図2G)。分析されたSTING変異体はすべて、293T細胞でIFN型プロモーターを活性化する能力が欠如していた(図2H)。また、dsDNAをhTERTまたはMEF細胞にトランスフェクトし、ホルムアルデヒドで処理して細胞タンパク質を核酸に架橋した。STINGプルダウンに続く後続のCHIP分析から、トランスフェクトDNAは、dsDNA90特異的プライマーを用いて決定したとき、STINGに直接会合可能であることがさらに確認された(図2Iおよび2J)。STINGは、ELISAアッセイでビオチン標識DNAに結合しうることが観測された(図14A〜C)。ssDNAおよびdsDNA媒介先天性シグナリングイベントは、STINGに依存することがデータから示唆され、さらに、STING自体がこれらの核酸構造に複合体化してこれらのイベントの誘発を支援しうることを示す証拠が示唆された。 To further evaluate the possibility that STING itself can associate with DNA species, 293T cells were transfected with STING, and after cell lysis, the C-terminal region (aa181 to 349) of STING was precipitated using biotin-labeled dsDNA90. Observing was observed (FIG. 2A). The STING N-terminal region (aa1-195) and three similarly HA-tagged controls (GFP, NFAR1, and IPS1) did not associate with dsDNA90. The DNA binding exonuclease TREX1 served as a positive control. A further series of extensive studies suggested that the amino acid region 242-241 of STING is probably involved in binding to dsDNA because STING variants lacking this region could not associate with nucleic acids (FIG. 2B). ~ D). In vitro expressed STING also bound to dsDNA under high salt and high detergent conditions (also excluding mutants lacking regions 242-341) (FIGS. 11A-F). Further evidence that STING may form a complex with dsDNA, possibly as a dimer, by transfecting biotin-labeled dsDNA90 into hTERT and treating such cells with a reversible cross-linking reagent (DSS) or UV light. Got. In both treatments, STING was observed to maintain association to DNA after cell lysis (FIG. 2E and FIGS. 12A-G). When STING RNAi knockdown was performed in hTERT cells, the observed binding was eliminated, and STING-DNA complexes were similarly observed only in wild-type MEF ( + / + ), and STING-deficient MEFs ( − // - ) Was not observed (FIGS. 12A to G). From competition experiments with dsDNA related to HSV1, cytomegalovirus (CMV) and even adenovirus (ADV), STING can also bind not only to dsDNA but also to ssDNA (ssDNA90) but can bind to dsRNA. It was similarly confirmed that there was no suggestion (FIG. 2F). This was confirmed by expressing STING in vitro and observing the association with ssDNA90 (FIG. 2G). All analyzed STING mutants lacked the ability to activate the IFN-type promoter in 293T cells (FIG. 2H). DsDNA was also transfected into hTERT or MEF cells and treated with formaldehyde to crosslink cellular proteins to nucleic acids. Subsequent CHIP analysis following the STING pull-down further confirmed that the transfected DNA was able to associate directly with STING as determined using dsDNA90 specific primers (FIGS. 2I and 2J). It was observed that STING can bind to biotin-labeled DNA in an ELISA assay (FIGS. 14A-C). The data suggests that ssDNA and dsDNA-mediated innate signaling events are dependent on STING, and further evidence suggests that STING itself can be complexed to these nucleic acid structures to help trigger these events It was done.
3’→5’DNAエキソヌクレアーゼTREX1もまた、ER関連分子であり、それがなければ免疫系を活性化しうるチェックポイント活性化ssDNA種の分解に重要である。hTERT細胞でTREX1をサイレンシングするために使用されるRNAiは、dsDNA90によるI型IFNのSTING依存性産生を有意に増加させた(図3Aおよび3B)。付随的に、dsDNAウイルスHSV1の複製は、おそらくI型IFNおよび抗ウイルスIFN刺激遺伝子(ISG)の産生の増加に起因して、TREX1の欠如したhTERT細胞で大幅に低減された(図3CおよびD)。ルシフェラーゼ遺伝子を発現する組換えHSVからのルシフェラーゼ発現もまた、TREX1をサイレンシングするためにRNAiで処理されたhTERT感染細胞で有意に低下した(図15A〜D)。これらの観測がTREX1欠損MEFを用いて拡張されたことから、細胞質dsDNA依存性遺伝子誘導は、TREX1の不在下で大きく増加し、かつHSV1複製は、有意に低減されることが同様に示唆された(図3E〜G)。STINGがTREX1の不在下で観測されたI型IFNの産生の増加に関与していたかを決定するために、TREX1欠如hTERTまたはTREX1−/−MEFでSTINGをサイレンシングし、これらの細胞を細胞質dsDNAまたはHSV1で処理した。STINGの欠如したTREX1欠損細胞(hTERTおよびMEFの両方)でI型IFN産生の大幅な低減が、結果から示唆されたことから、TREX1の不在下で観測されたI型IFNのレベルの増加は、STING依存性であることが示唆される(図3A〜F)。同様に、TREX−/−MEFでSTINGのRNAiノックダウンを行っても、ssDNA90媒介I型IFN産生および先天性遺伝子刺激が排除されることが確認された(図16)。TREX1およびSTINGは、ERに共局在化されることが、共焦点分析から確認された(図3H)。しかしながら、細胞質dsDNAは、STINGと同様にERから核周囲領域へのTREX1の輸送を強力に誘導しなかった(図3H)。したがって、共免疫沈降分析により決定したとき、STINGおよびTREX1は、ロバストに相互作用しないことが観測された。非刺激条件下のTREX1+/+または−/−MEFでは、STING依存性遺伝子の発現の劇的な差は、確認されなかった(図17A〜H)。しかしながら、TREX1はdsDNA誘導遺伝子であり、このことは、確認されており、STING依存的にアップレギュレート可能である(図17A〜H)。したがって、dsDNA種は、STINGおよびアクセサリー分子と複合体を形成して、輸送イベントと、TREX1を含む一次先天性免疫遺伝子の誘導に関与する転写因子IRF3/7およびNF−κBを活性化する下流シグナリングイベントと、を媒介する可能性が高い。STING活性化TREX1がER領域に存在し、アクチベーターdsDNAを分解して負のフィードバックの形で細胞質dsDNAシグナリングを抑制することが、証拠から示唆される。したがって、TREX1は、STINGの負のレギュレーターである。 The 3 ′ → 5 ′ DNA exonuclease TREX1 is also an ER-related molecule and is important for the degradation of checkpoint activated ssDNA species that otherwise could activate the immune system. RNAi used to silence TREX1 in hTERT cells significantly increased STING-dependent production of type I IFN by dsDNA90 (FIGS. 3A and 3B). Concomitantly, dsDNA viral HSV1 replication was significantly reduced in hTERT cells lacking TREX1 probably due to increased production of type I IFN and antiviral IFN stimulating gene (ISG) (FIGS. 3C and D). ). Luciferase expression from recombinant HSV expressing the luciferase gene was also significantly reduced in hTERT infected cells treated with RNAi to silence TREX1 (FIGS. 15A-D). These observations were extended using TREX1-deficient MEFs, suggesting that cytoplasmic dsDNA-dependent gene induction is greatly increased in the absence of TREX1 and that HSV1 replication is significantly reduced. (FIGS. 3E-G). To determine if STING was involved in the increased production of type I IFN observed in the absence of TREX1, silencing STING with TREX1 deficient hTERT or TREX1 − / − MEFs and cytosolic dsDNA Alternatively, it was treated with HSV1. Since the results suggested a significant reduction in type I IFN production in TRING1 deficient cells (both hTERT and MEF) lacking STING, the increased level of type I IFN observed in the absence of TREX1 is It is suggested to be STING dependent (FIGS. 3A-F). Similarly, TREX - / - be subjected to RNAi knockdown of STING in MEF, ssDNA90 mediated type I IFN production and congenital gene stimulation was confirmed to be eliminated (Fig. 16). It was confirmed from confocal analysis that TREX1 and STING were colocalized in the ER (FIG. 3H). However, cytoplasmic dsDNA, like STING, did not strongly induce TREX1 transport from the ER to the perinuclear region (FIG. 3H). Thus, it was observed that STING and TREX1 do not interact robustly as determined by coimmunoprecipitation analysis. TREX1 + / + or − / − MEF under unstimulated conditions did not confirm dramatic differences in STING-dependent gene expression (FIGS. 17A-H). However, TREX1 is a dsDNA-inducible gene, which has been confirmed and can be upregulated in a STING-dependent manner (FIGS. 17A-H). Thus, dsDNA species complex with STING and accessory molecules to activate downstream signaling that activates transport events and transcription factors IRF3 / 7 and NF-κB involved in the induction of primary innate immune genes including TREX1 There is a high possibility of mediating events. Evidence suggests that STING-activated TREX1 is present in the ER region and degrades activator dsDNA and suppresses cytoplasmic dsDNA signaling in the form of negative feedback. Therefore, TREX1 is a negative regulator of STING.
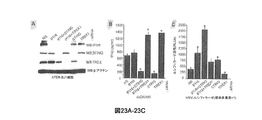
STINGは、トランスロコン複合体の一部としてERに存在し、トランスロコン関連タンパク質β(TRAPβ)に会合することが、本明細書のデータから実証された。トランスロコン複合体は、TRAPα、β、γ、およびδに結合されたSec61α、β、およびγを含み、リボソームに結合可能である。分泌タンパク質および膜タンパク質は、エクスポートされる前に適正なフォールディングおよびグリコシル化のためにER内に移行される。TREX1結合パートナーを同定するために、全長TREX1をツーハイブリッド酵母スクリーンでベイトとして使用した。TREX1は、68kDaのI型膜貫通タンパク質かつオリゴサッカリルトランスフェラーゼ(OST)複合体のメンバーであるリボホリンI(RPN1)として参照されるタンパク質と反復的に相互作用することが、結果から示唆された(図4A〜E、図18A〜D)。OST複合体は、トランスロコンを介してERに入ると、新生ポリペプチドのアスパラギン残基へのマンノースオリゴ糖の転移を触媒する。RPN1、RPN2、OST48、OST4、STT3A/B、TUSC3、およびDAD1を含めて、少なくとも7種のタンパク質がOST複合体を含む。重要なこととして、STINGをベイトとして用いた類似のスクリーンでは、STINGはまた、16kDaの膜貫通タンパク質であるDAD1(アポトーシス細胞死に対するディフェンダー)に会合しうることが確認された(図14F〜H)。酵母ツーハイブリッド法を用いたこれらの会合のさらなる分析から、膜貫通領域を含むTREX1のC末端領域(アミノ酸241〜369)がRPN1のアミノ酸258〜397への結合に関与することが示唆された(図18A〜D)。さらに、STINGのアミノ酸242〜310は、全長DAD1との会合に関与した(図18A〜D)。共免疫沈降研究から、これらの分子の相互作用が確認された(図4Dおよび4Gおよび図29A〜C)。さらなる共免疫沈降実験から、TREX1とDAD1との会合が示唆された(図19A〜C)。共焦点分析から、細胞内に共局在化されたTREX1およびRPN1は、細胞質dsDNAに反応して輸送されないことが確認された(図4Eおよび図20)。同様に、STINGおよびDAD1は、細胞のER内に共局在化されたが、後者の分子は、細胞質dsDNAの存在下でSTINGをエンドソーム区画に連行しなかった(図4H)。ERを含む細胞ミクロソーム区画を分画により単離し、スクロース勾配分析により検査した。TREX1およびSTINGは、ERマーカーであるRPN1およびRPN2、DAD1、ならびにカルレティキュリンと共分画されるが、核ヒストンH3とは共分画されないことが、この研究から示唆されたことから、それらの細胞内局在化は、トランスロコン/OST複合体の成分から識別できないことが確認された(図4I)。したがって、TREX1は、STINGを含むERのOST/トランスロコン複合体にターゲッティングされ、この会合は、RPN1との会合を介して行われるが、TREX1のTM領域は、ERへのTREX1の局在化に関与することが分かった。OST、TRAP、またはSRP(シグナル認識ペプチド)複合体のメンバーがdsDNA依存性シグナリングに影響を及ぼすかを同定するために、RNAiスクリーンを行ってこれらの成分の発現をサイレンシングした。しかしながら、STING(DNA媒介I型IFN産生に不可欠、図21A〜H)の抑制およびTREX1の抑制(I型IFN産生を大きく増加させる)以外では、Sec61αおよびTRAPβのサイレンシングのみが、シグナリングおよびHSV1複製に有意に影響を及ぼしたことから、この経路の制御におけるこれらのトランスロコンメンバーの役割が実証された(図4Jおよび図22)。細胞質DNAセンシングにも関与するIFI16のサイレンシングは、少なくともhTERT細胞では、dsDNA依存性シグナリングをロバストに抑制しないことが観測された(図23A〜C)。IFI16レスキューの損失は、STINGの損失と同様に、TREX1の不在下でdsDNAによるIFN産生を拡大させた(図23A〜C)。しかしながら、IFI16を低減させたところより効果的なHSV1遺伝子発現が可能になったことから、ウイルス複製に影響を及ぼすこの分子の重要な役割が確認された。また、RPN1または2をサイレンシングしても、HSV1遺伝子発現の増加がもたらされるが、I型IFN産生に有意に影響を及ぼさなかったことから、OSTのこれらの成分は、主にN−グリコシル化に関与しうることが実証された。 It was demonstrated from the data herein that STING is present in the ER as part of the translocon complex and associates with the translocon-related protein β (TRAPβ). The translocon complex includes Sec61α, β, and γ bound to TRAPα, β, γ, and δ and is capable of binding to ribosomes. Secreted and membrane proteins are transferred into the ER for proper folding and glycosylation before being exported. To identify the TREX1 binding partner, full-length TREX1 was used as a bait on a two-hybrid yeast screen. The results suggest that TREX1 interacts repetitively with a protein referred to as ribophorin I (RPN1), a 68 kDa type I transmembrane protein and a member of the oligosaccharyltransferase (OST) complex ( 4A-E, FIGS. 18A-D). When the OST complex enters the ER via a translocon, it catalyzes the transfer of the mannose oligosaccharide to the asparagine residue of the nascent polypeptide. At least seven proteins, including RPN1, RPN2, OST48, OST4, STT3A / B, TUSC3, and DAD1, contain the OST complex. Importantly, a similar screen using STING as a bait confirmed that STING could also associate with DAD1, a 16 kDa transmembrane protein (defender for apoptotic cell death) (FIGS. 14F-H). . Further analysis of these associations using the yeast two-hybrid method suggested that the C-terminal region of TREX1 (amino acids 241 to 369), including the transmembrane region, was involved in the binding of RPN1 to amino acids 258 to 397 ( 18A-D). In addition, amino acids 242-210 of STING were involved in the association with full-length DAD1 (FIGS. 18A-D). Co-immunoprecipitation studies confirmed the interaction of these molecules (FIGS. 4D and 4G and FIGS. 29A-C). Further co-immunoprecipitation experiments suggested an association of TREX1 and DAD1 (FIGS. 19A-C). Confocal analysis confirmed that TREX1 and RPN1 colocalized within the cell were not transported in response to cytoplasmic dsDNA (FIGS. 4E and 20). Similarly, STING and DAD1 were colocalized within the ER of the cell, but the latter molecule did not entrain STING into the endosomal compartment in the presence of cytoplasmic dsDNA (FIG. 4H). Cellular microsomal compartments containing ER were isolated by fractionation and examined by sucrose gradient analysis. TREX1 and STING are co-fractionated with ER markers RPN1 and RPN2, DAD1, and calreticulin, but this study suggests that they are not co-fractionated with nuclear histone H3. Was confirmed to be indistinguishable from the components of the translocon / OST complex (FIG. 4I). Thus, TREX1 is targeted to the ER OST / translocon complex containing STING, and this association occurs via association with RPN1, while the TREX1 TM region is responsible for TREX1 localization to the ER. I found it involved. To identify whether members of the OST, TRAP, or SRP (signal recognition peptide) complex affect dsDNA-dependent signaling, RNAi screens were performed to silence expression of these components. However, except for suppression of STING (essential for DNA-mediated type I IFN production, FIGS. 21A-H) and TREX1 suppression (which greatly increases type I IFN production), only Sec61α and TRAPβ silencing is responsible for signaling and HSV1 replication. The role of these translocon members in the control of this pathway was demonstrated (Figure 4J and Figure 22). It was observed that silencing of IFI16, which is also involved in cytoplasmic DNA sensing, did not robustly suppress dsDNA-dependent signaling, at least in hTERT cells (FIGS. 23A-C). Loss of IFI16 rescue expanded IFN production by dsDNA in the absence of TREX1, similar to the loss of STING (FIGS. 23A-C). However, reducing IFI16 allowed more effective HSV1 gene expression, confirming the important role of this molecule that affects viral replication. Silencing RPN1 or 2 also resulted in increased HSV1 gene expression, but did not significantly affect type I IFN production, so these components of OST are primarily N-glycosylated. It has been demonstrated that it can be involved in
STINGは、プラスミドベースのDNAおよび遺伝子療法ベクターを含みうる細胞質細胞内ssDNAおよびdsDNAと複合体を形成可能であり、広範にわたる一連の先天性免疫遺伝子、たとえば、I型IFN、IFITファミリー、ならびに抗ウイルス活性および適応免疫反応の開始に重要なさまざまなケモカインの誘導を調節可能であることが、データから実証される。STING活性化は、クラスリン被覆エンドソーム区画へのTBK1のエスコートを促進して、いまだに十分に解明されていない機序によりIRF3/7を活性化する可能性が高い。TREX1は、細胞内に低レベルで存在するように思われ、それ自体は、STINGにより誘導可能である。翻訳後、TREX1は、非活性化STING(同様にOST/トランスロコン複合体に存在する)にごく近接してOST複合体に局在化し、そこでおそらく、それがなければSTING作用を誘発可能なDNA種を分解する。この時点ではSTINGとTREX1とを含むトランスロコン/OST複合体の成分は、細胞質ssDNAおよびdsDNA媒介先天性免疫シグナリングを調節する。TREX1が損失するとI型IFN産生の増加を介して自己免疫障害が現われるので、この疾患は、STING活性を介して誘発される可能性がある。 STING is capable of complexing with cytoplasmic intracellular ssDNA and dsDNA, which can include plasmid-based DNA and gene therapy vectors, and a wide range of innate immune genes such as type I IFN, IFIT family, and antiviral The data demonstrate that the induction of various chemokines important for the initiation of active and adaptive immune responses can be modulated. STING activation promotes the escort of TBK1 to the clathrin-coated endosomal compartment and is likely to activate IRF3 / 7 by a mechanism that has not yet been fully elucidated. TREX1 appears to be present at low levels in the cell and can itself be induced by STING. After translation, TREX1 localizes to the OST complex in close proximity to non-activated STING (also present in the OST / translocon complex), where it is probably DNA that can induce STING action without it. Decompose seeds. At this point, components of the translocon / OST complex, including STING and TREX1, regulate cytoplasmic ssDNA and dsDNA-mediated innate immune signaling. Since loss of TREX1 manifests an autoimmune disorder through increased type I IFN production, the disease may be induced through STING activity.
実施例2:STINGモジュレーター
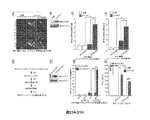
STINGの発現、機能、活性などを変調する作用剤を同定するために、薬剤ライブラリーをスクリーニングした。図24は、STING細胞ベースアッセイのステップを示している。
Example 2: STING Modulator A drug library was screened to identify agents that modulate STING expression, function, activity, and the like. FIG. 24 shows the steps of the STING cell-based assay.
ライブラリーは、BioMol ICCB既知生物活性剤ライブラリー(500種の標的)、薬理活性化合物のLOPAC1280(商標)ライブラリー、Enzo Life Sciences,Screen−Well(商標)ホスファターゼ阻害剤ライブラリー(33種の既知ホスファターゼ阻害剤)を含んでいた。 Libraries include BioMol ICCB known bioactive agent library (500 targets), LOPAC1280 ™ library of pharmacologically active compounds, Enzo Life Sciences, Screen-Well ™ phosphatase inhibitor library (33 known) Phosphatase inhibitor).
MicroSourceスペクトルコレクション 2000種の成分、50%の薬剤成分、30%の天然物、20%の他の生物活性成分、EMD:InhibitorSelect(商標)96ウェルプロテインキナーゼ阻害剤ライブラリーI、InhibitorSelect(商標)96ウェルプロテインキナーゼ阻害剤ライブラリーII、InhibitorSelect(商標)96ウェルプロテインキナーゼ阻害剤ライブラリーIIIa、キナーゼライブラリーBキナーゼTrueCloneコレクション、キナーゼ欠損TrueCloneコレクション。 MicroSource Spectrum Collection 2000 components, 50% drug component, 30% natural product, 20% other bioactive components, EMD: InhibitorSelect ™ 96 well protein kinase inhibitor library I, InhibitorSelect ™ 96 Well protein kinase inhibitor library II, InhibitorSelect ™ 96 well protein kinase inhibitor library IIIa, kinase library B kinase TrueClone collection, kinase deficient TrueClone collection.
1種の薬剤(「薬剤A」と称される)は、STING輸送を誘導することが、結果から示された(図60)。他の薬剤(「薬剤X」と称される)は、IFNβ mRNA産生を阻害した(図61)。
表2:以下のものがSTING阻害剤として同定された。
Results showed that one drug (designated “Drug A”) induces STING transport (FIG. 60). Another drug (designated “Drug X”) inhibited IFNβ mRNA production (FIG. 61).
Table 2: The following were identified as STING inhibitors:
STINGのアクチベーターは、ジヒドロウアバインおよびBNTXマレエート塩水和物を含んでいた。 STING activators included dihydroouabain and BNTX maleate salt hydrate.
実施例3:STINGは自己DNA依存性炎症性疾患を発症する
骨髄誘導マクロファージ(BMDM)をSting+/+およびSting−/−マウスから取得し、STING経路を活性化する90塩基対dsDNA(dsDNA90)でまたはデキサメタゾン(Dex)処理胸腺細胞に由来するアポトーシスDNA(aDNA)でそれらをトランスフェクトした。両方のタイプのDNAによりBMDMおよび通常の樹状細胞(BMDC)でSTING依存的にIFNβの産生が強力に誘導されることが観測された。DNAマイクロアレイ実験から、aDNAは、BMDMでTNFαさらにはIFNβなどの広範にわたる一連の先天性免疫サイトカインおよび炎症関連サイトカインのSTING依存性産生を誘発することが確認された(表3)。これらのデータは、aDNAで処理されたSting+/+またはSting−/−BMDMでサイトカイン産生を測定することにより確認された。したがって、STINGは、BMDMさらにはBMDCでアポトーシスDNA媒介炎症誘発性遺伝子産生を促進可能である。
Example 3: STING develops a self-DNA-dependent inflammatory disease Bone marrow-derived macrophages (BMDM) are obtained from Sting + / + and Sting − / − mice, and 90 base pair dsDNA (dsDNA90) activates the STING pathway They were transfected with apoptotic DNA (aDNA) derived from or from dexamethasone (Dex) treated thymocytes. It was observed that both types of DNA strongly induced IFNβ production in BMDM and normal dendritic cells (BMDC) in a STING-dependent manner. DNA microarray experiments confirmed that aDNA induces a STING-dependent production of a broad array of innate immune cytokines and inflammation-related cytokines such as TNFα and even IFNβ in BMDM (Table 3). These data were confirmed by measuring cytokine production with Sting + / + or Sting − / − BMDM treated with aDNA. Thus, STING can promote apoptotic DNA-mediated pro-inflammatory gene production in BMDM and even BMDC.
表3は、アポトーシスDNA(aDNA)で処理されたBMDMでより高発現された遺伝子の遺伝子発現を示している。
Table 3 shows the gene expression of genes that were more highly expressed in BMDM treated with apoptotic DNA (aDNA).
STINGがDNアーゼII関連炎症性疾患で一定の役割を果たすかを決定するために、RNAiを用いてTHP1細胞またはBMDMでSTINGおよび/またはDNアーゼIIをノックダウンしたところ、DNアーゼIIの損失によりaDNAに反応してSTING依存的にI型IFNを含むサイトカインのアップレギュレーションが促進されることが分かった。DNアーゼII−/−マウスは、通常、出生前に死亡するので、DNアーゼII−/−、Sting−/−、またはSting−/−DNアーゼII−/−DKOの17日胚(E17日)を分析した。RT−PCRおよび免疫ブロットを含めて、遺伝子型解析から、胚は、Sting、DNアーゼII、または両方の機能性遺伝子が欠如していることが確認された。DNアーゼII−/−胚は、以上に記載したように、貧血を呈することが観測され、Sting−/−DNアーゼII−/−DKO胚またはこの表現型が顕著に欠如した対照とは有意な相違を示した。致死的貧血は、発生時における赤血球新生のI型IFN阻害に起因することが報告されてきた。続いて、DNアーゼII−/−胚の肝臓は、高レベルのサイトカインの産生に関与する貪食されたアポトーシス細胞で満たされた多数の浸潤マクロファージを含有することが、ヘマトキシリンおよびエオシン染色により観測された。対照マウスとは対照的に、Sting−/−DNアーゼII−/−胚の肝臓は、類似の表現型を呈した。TUNEL(末端デオキシヌクレオチドトランスフェラーゼ媒介dUTPビオチンニック末端標識化)による胎仔肝臓の分析から、Sting−/−DNアーゼII−/−胚およびDNアーゼII欠損ただし非野生型の胎仔の肝臓は、多数の大きい不適切に消化された死細胞を含有することが確認された。in vitro分析から、野生型マウスまたはDNアーゼII−/−マウスの胚のマクロファージは、アポトーシス細胞を十分に貪食することが示唆された。しかしながら、貪食されたアポトーシス細胞のDNAは、野生型マクロファージのリソソームでは効率的に分解されるが、DNアーゼII−/−マクロファージは、貪食された核を蓄積してDNAを消化できない。このイベントは、先天性免疫シグナリング経路の刺激および自己免疫関連サイトカインの産生をもたらす。このことを考慮して、アポトーシス細胞の貧食およびDNAの消化を行うかに関して、DNアーゼIIおよびSTINGの両方が欠如した胚性肝臓由来マクロファージの能力を評価した。Sting−/−DNアーゼII−/−マクロファージは、DNアーゼII−/−マクロファージと同様に、野生型マウスまたはSting−/−マウスから採取された対照マクロファージと比較して、デキサメタゾン処理されたアポトーシス胸腺細胞からの貪食された核を消化できないことが確認された。したがって、Sting−/−DNアーゼII−/−胚性マウスの肝臓から採取されたマクロファージは、DNアーゼII−/−マクロファージと類似して、同様に、貪食されたアポトーシス細胞を消化する能力を示さない。 To determine if STING plays a role in DNase II-related inflammatory disease, knocking down STING and / or DNase II in THP1 cells or BMDM using RNAi resulted in loss of DNase II It was found that upregulation of cytokines including type I IFN is promoted in a STING-dependent manner in response to aDNA. Since DNase II − / − mice usually die before birth, DNase II − / − , Sting − / − , or Sting − / − DNase II − / − 17 day embryos of DKO (day E17) Was analyzed. Genotypic analysis, including RT-PCR and immunoblot, confirmed that embryos lacked Sting, DNase II, or both functional genes. DNase II − / − embryos, as described above, were observed to present anemia and were significantly different from Sting − / − DNase II − / − DKO embryos or controls lacking this phenotype significantly. Showed the difference. Lethal anemia has been reported to result from type I IFN inhibition of erythropoiesis at development. Subsequently, it was observed by hematoxylin and eosin staining that the liver of DNase II − / − embryos contained numerous infiltrating macrophages filled with phagocytic apoptotic cells involved in the production of high levels of cytokines. . In contrast to control mice, Sting-/-DNase II-/-embryo livers exhibited a similar phenotype. From analysis of fetal livers by TUNEL (terminal deoxynucleotide transferase-mediated dUTP biotinic end labeling), Sting − / − DNase II − / − embryos and DNase II deficient but non-wild type fetal livers have a large number of large It was confirmed to contain improperly digested dead cells. In vitro analysis suggested that macrophages of wild-type or DNase II − / − mouse embryos phagocytose apoptotic cells sufficiently. However, phagocytic apoptotic cell DNA is efficiently degraded in lysosomes of wild-type macrophages, but DNase II − / − macrophages cannot accumulate phagocytic nuclei and digest DNA. This event results in the stimulation of innate immune signaling pathways and the production of autoimmune related cytokines. In view of this, the ability of embryonic liver-derived macrophages lacking both DNase II and STING to be evaluated for phagocytosis of apoptotic cells and DNA digestion was evaluated. Sting - / - DN DNase II - / - macrophages, DN DNase II - / - as with macrophages, wild-type mice or Sting - / - as compared to the control macrophages harvested from mice, dexamethasone treated apoptotic thymocytes It was confirmed that phagocytic nuclei from cells could not be digested. Thus, macrophages harvested from the liver of Sting − / − DNase II − / − embryonic mice show similar ability to DNase II − / − macrophages as well as the ability to digest phagocytic apoptotic cells. Absent.
胚性マウスの肝臓でmRNA発現レベルを分析することにより、以上の分析を補完した。この研究から、野生型胚またはSting−/−胚の肝臓でごくわずかな炎症性遺伝子産生が示唆された。しかしながら、DNアーゼII−/−胚の肝臓は、異常に高レベルのサイトカイン関連mRNAを含有することが観測された。重要なこととして、Sting−/−DNアーゼII−/−マウスの肝臓では、DNアーゼII−/−マウスと比較して、先天性免疫遺伝子発現活性のレベルが劇的に低減された。これらの結果は、RT−PCRにより胚性肝臓で所定の先天性免疫遺伝子のmRNA発現レベルを解析することにより、確認された。たとえば、IFNβの産生は、DNアーゼII−/−マウスと比較して、Sting−/−DNアーゼII−/−マウスで数分の1に低減された。2’−5’オリゴアデニル酸シンテターゼ(OAS)、テトラトリコペプチドリピートを有するインターフェロン誘導タンパク質(IFIT)インターフェロン誘導タンパク質27(IFI27)、ユビキチン様モディファイヤー(ISG15)などのインターフェロン刺激遺伝子(ISG)の産生もまた、劇的に低減された。TNFαやIL1βなどの炎症誘発性サイトカインもまた、DNアーゼII−/−マウスと比較して、Sting−/−およびSting−/−DNアーゼII−/−の胚性肝臓で低減された。先天性免疫遺伝子の産生は、STINGの不在下で劇的に抑制されたが、いくつかの遺伝子の存在は、アレイ分析により決定したとき、Sting−/−DNアーゼII−/−マウスで低レベルではあるがわずかに増加した状態を維持した。これは、分析された動物間でのmRNA発現の変動によるかまたはおそらく他の経路の刺激によるものであろう。これらの遺伝子の多くは、NF−κB経路およびインターフェロン調節因子(IRF)経路により調節される。したがって、これらの転写因子の機能を14日胚(E14日)から発生させたSting−/−DNアーゼII−/−または対照のネズミ胚性線維芽細胞(MEF)で評価した。ほとんどの場合、細胞質DNAに暴露された時、Sting−/−DNアーゼII−/−MEFでNF−κB活性(p65リン酸化)の欠損が観測された。細胞質DNAだけでなくアポトーシスDNAに暴露された時も、Sting−/−DNアーゼII−/−BMDMで同一の欠損が得られた。このことは、NF−κBさらにはIRF3もまた、dsDNAへの暴露後、Sting−/−DNアーゼII−/−MEFでは移行できないが、対照MEFでは移行できることに注目することにより、確認された。したがって、STINGは、おそらく、致死的胚性赤血球新生の誘発に関与する自己DNA誘導炎症性サイトカイン産生の制御に関与する。 The above analysis was complemented by analyzing mRNA expression levels in the liver of embryonic mice. This study suggested negligible inflammatory gene production in the livers of wild type or Sting − / − embryos. However, it was observed that the DNase II − / − embryonic liver contained abnormally high levels of cytokine-associated mRNA. Importantly, the level of innate immunity gene expression activity was dramatically reduced in the liver of Sting − / − DNase II − / − mice compared to DNase II − / − mice. These results were confirmed by analyzing the mRNA expression level of a predetermined innate immune gene in the embryonic liver by RT-PCR. For example, IFNβ production was reduced by a fraction of Sting − / − DNase II − / − mice compared to DNase II − / − mice. Production of interferon-stimulated genes (ISG) such as 2′-5 ′ oligoadenylate synthetase (OAS), interferon-inducing protein with tetratricopeptide repeat (IFIT), interferon-inducing protein 27 (IFI27), ubiquitin-like modifier (ISG15) Was also dramatically reduced. Pro-inflammatory cytokines such as TNFα and IL1β were also reduced in Sting − / − and Sting − / − DNase II − / − embryonic liver compared to DNase II − / − mice. Innate immune gene production was dramatically suppressed in the absence of STING, but the presence of some genes was low in Sting − / − DNase II − / − mice as determined by array analysis However, it maintained a slightly increased state. This may be due to fluctuations in mRNA expression between the analyzed animals or possibly due to stimulation of other pathways. Many of these genes are regulated by the NF-κB pathway and the interferon regulatory factor (IRF) pathway. Therefore, the function of these transcription factors was evaluated in Sting − / − DNase II − / − or control murine embryonic fibroblasts (MEFs) generated from 14 day embryos (E14 days). In most cases, deficiency of NF-κB activity (p65 phosphorylation) was observed in Sting − / − DNase II − / − MEF when exposed to cytoplasmic DNA. The same deficiency was obtained with Sting − / − DNase II − / − BMDM when exposed to apoptotic DNA as well as cytoplasmic DNA. This was confirmed by noting that NF-κB and also IRF3, after exposure to dsDNA, could not be transferred with Sting − / − DNase II − / − MEF but could be transferred with control MEF. Thus, STING is probably involved in the control of self DNA-induced inflammatory cytokine production that is involved in the induction of lethal embryonic erythropoiesis.
自己DNAにより促進される致死的赤血球新生を媒介するうえでのSTINGの重要性を強調するために、DNアーゼII−/−マウスがSTINGの不在下で出生可能であるかを評価した。重要なこととして、Sting−/−バックグラウンドに交配した場合、DNアーゼII−/−マウスが明白なメンデルの頻度で出生されることが観測された。PCR遺伝子型解析、ノーザンブロット解析、RT−PCR解析、および免疫ブロット解析から、後代マウスでDNアーゼIIおよびSTINGの欠損が確認された。Sting−/−DNアーゼII−/−ダブルノックアウトマウス(DKO)は、正常に成長するように思われ、対照マウスと比較して、類似のサイズおよび体重を呈したが、Sting−/−マウスは、依然として不明な理由でややより大きいことが確認された。予備的免疫学的評価からもまた、Sting−/−DNアーゼII−/−DKO動物は、Sting−/−マウスおよび野生型マウスに類似して、類似のCD4+/CD8+プロファイルを共有したが、DKOは、加齢に伴って巨脾症の発症が認められることが示唆された。巨脾症はまた、I型IFNシグナリングの欠如した生存DNアーゼII欠損マウス(DNアーゼII−/−Ifnar1−/−マウス)でも認められ、赤髄の腫脹が原因であると報告されてきた。しかしながら、Sting−/−DNアーゼII−/−マウスの血清の分析から、一般的な測定可能な低レベルのサイトカインが産生されるため、8週齢の対照マウスと比較して、検出可能な異常サイトカイン産生は、示唆されなかった。これらの研究を通じて、in vitroでは、Sting−/−DNアーゼII−/−マクロファージは、DNアーゼII−/−マクロファージと同様に、野生型マウスまたはSting−/−マウスから採取された対照マクロファージと比較して、アポトーシス胸腺細胞(Dex+)からの貪食された核を消化できないことが確認された。WT胸腺細胞を標的(Dex−)として使用した場合、DNアーゼII−/−Sting−/−マクロファージ内の未消化のDNAの蓄積は、それほど顕著ではなかった。したがって、Sting−/−DNアーゼII−/−マウスに由来するBMDMもまた、アポトーシス細胞のDNAを消化できないが、DNアーゼII−/−BMDMとは対照的に、炎症性サイトカイン反応を生成しない。 To highlight the importance of STING in mediating lethal erythropoiesis promoted by self DNA, we evaluated whether DNase II − / − mice can be born in the absence of STING. Importantly, it was observed that DNase II − / − mice were born at an apparent Mendelian frequency when mated to the Sting − / − background. PCR genotyping, Northern blot analysis, RT-PCR analysis, and immunoblot analysis confirmed DNase II and STING deficiency in progeny mice. Sting − / − DNase II − / − double knockout mice (DKO) appeared to grow normally and exhibited similar size and weight compared to control mice, but Sting − / − mice It was still confirmed that it was slightly larger for unknown reasons. From preliminary immunological assessments, Sting − / − DNase II − / − DKO animals shared similar CD4 + / CD8 + profiles, similar to Sting − / − and wild type mice. It was suggested that DKO has onset of splenomegaly with aging. Splenomegaly has also been observed in surviving DNase II-deficient mice lacking type I IFN signaling (DNase II − / − Ifnar1 − / − mice) and has been reported to be due to swelling of the red pulp. However, the analysis of Sting − / − DNase II − / − mice sera produced low levels of common measurable cytokines, so that detectable abnormalities compared to 8 week old control mice Cytokine production was not suggested. Through these studies, the in vitro, Sting - / - DN DNase II - / - compared with control macrophages collected from mice - macrophages, DN DNase II - / - as with macrophages, wild-type mice or Sting - / It was confirmed that phagocytic nuclei from apoptotic thymocytes (Dex + ) could not be digested. When WT thymocytes were used as a target (Dex − ), the accumulation of undigested DNA in DNase II − / − Sting − / − macrophages was less pronounced. Thus, BMDM derived from Sting − / − DNase II − / − mice also cannot digest DNA of apoptotic cells, but in contrast to DNase II − / − BMDM, does not produce an inflammatory cytokine response.
DNアーゼII+/−マウスとI型IFN欠損Ifnar1−/−マウスとを交配することによりDNアーゼII媒介胚致死を回避することが可能であるが、得られる後代は、未消化DNAが先天性免疫シグナリング経路を活性化してTNFαなどの炎症性サイトカインの産生を誘発するので、出生の約8週間後、重症多発性関節炎(関節炎スコア2)に罹患する。重要なこととして、Sting−/−DNアーゼII−/−マウスは、出生後、多発性関節炎の徴候がなんら現れないことが確認された。関節炎スコアは、Sting−/−DNアーゼII−/−では、12ヶ月齢まで約0(スコアなし)に維持されたが、これとは対照的に、報告されたDNアーゼII−/−Ifnar1−/−マウスでは、類似の期間後、7までの関節炎スコアを呈した。DNアーゼII−/−Sting−/−マウスの脾臓組織および胸腺組織のH&E染色およびTUNEL染色では、アポトーシスDNAをも含有する浸潤マクロファージの存在が示されたが、6ヶ月齢のSting−/−DNアーゼII−/−マウスの関節の組織診断では、関節構造にパンヌス浸潤の証拠がなく、正常な硬骨(B) 滑膜関節(S)、および軟骨(C)の構造を呈した。Sting−/−DNアーゼII−/−マウスの血清からのTNFα、IL1β、およびIL6のレベルは、STINGの欠如したBMDMでの我々のアレイ解析から予想されるように、低レベルの状態を維持した(表3)。Sting−/−DNアーゼII−/−マウスの関節内では、CD4、CD68、またはTRAP陽性の細胞浸潤の証拠は、存在しなかった。また、Sting−/−DNアーゼII−/−マウスの血清の分析から、リウマチ因子(RF)、抗dsDNA抗体、またはMMP3のレベルの上昇は、示唆されなかった。したがって、STINGの損失により、自己DNA媒介多発性関節炎に関与する炎症誘発性サイトカイン産生が回避される。 Although it is possible to avoid DNase II-mediated embryonic lethality by mating DNase II +/− mice with type I IFN-deficient Ifnar1 − / − mice, the progeny obtained is that the undigested DNA is congenital Severe polyarthritis (arthritis score 2) occurs about 8 weeks after birth because it activates immune signaling pathways and induces the production of inflammatory cytokines such as TNFα. Importantly, Sting − / − DNase II − / − mice were confirmed to show no signs of polyarthritis after birth. The arthritis score was maintained at about 0 (no score) until 12 months of age in Sting − / − DNase II − / − , in contrast to the reported DNase II − / − Ifnar1 − / - mice, after similar period, exhibited arthritic score of up to 7. DNase II − / − Sting − / − H & E staining and TUNEL staining of spleen and thymus tissue of mice showed the presence of infiltrating macrophages that also contained apoptotic DNA, but 6 month old Sting − / − DN Histological diagnosis of the joints of ase II − / − mice showed no evidence of pannus infiltration in the joint structure, and exhibited normal bone (B) synovial joint (S) and cartilage (C) structures. Levels of TNFα, IL1β, and IL6 from Sting − / − DNase II − / − mouse sera remained at low levels, as expected from our array analysis in BMDM lacking STING. (Table 3). There was no evidence of CD4, CD68, or TRAP positive cell infiltration in the joints of Sting − / − DNase II − / − mice. Also, analysis of Sting − / − DNase II − / − mice sera did not suggest elevated levels of rheumatoid factor (RF), anti-dsDNA antibodies, or MMP3. Thus, loss of STING avoids pro-inflammatory cytokine production involved in self DNA-mediated polyarthritis.
STINGは、たとえば、アイカルディ・グチエール症候群(AGS)などの炎症性疾患に関与する。AGSは、遺伝的に決定される脳症であり、基底核および白質の石灰化、脱髄により特徴付けられる。脳脊髄液中の高レベルのリンパ球およびI型IFN。特徴は、慢性感染症によく似ている。I型IFNの血清中レベルもまた、自己免疫症候群の全身性紅斑性狼瘡(SLE)で上昇する。AGSは、3’−5’DNAエキソヌクレアーゼTREX1の突然変異により引き起こされる。TREX1機能が損失すると、DNA種は、細胞のER内に蓄積し、細胞質DNAセンサー(STING)を活性化する。TREX1は、このDNA源を消化して先天性免疫遺伝子活性化を防止する(ハウスキーピング機能)。 STING is involved in inflammatory diseases such as, for example, Aicardi Gutierre syndrome (AGS). AGS is a genetically determined encephalopathy characterized by calcification and demyelination of the basal ganglia and white matter. High levels of lymphocytes and type I IFN in the cerebrospinal fluid. The characteristics are very similar to chronic infections. Serum levels of type I IFN are also elevated in autoimmune syndrome systemic lupus erythematosus (SLE). AGS is caused by mutations in the 3'-5 'DNA exonuclease TREX1. When TREX1 function is lost, DNA species accumulate in the ER of the cell and activate the cytoplasmic DNA sensor (STING). TREX1 digests this DNA source to prevent innate immune gene activation (housekeeping function).
STINGがアポトーシス欠損マウスで炎症性疾患に関与すると思われることを考慮して、次に、他の型の自己DNA誘発疾患がSTING経路の活性化を介して起こるかを評価した。たとえば、3’修復エキソヌクレアーゼ1(Trex1)欠損患者は、脳脊髄液中に高レベルのI型IFN産生が存在することにより特徴付けられる致死的脳炎を引き起こすアイカルディ・グチエール症候群(AGS)に罹患する。Trex1欠損マウスは、サイトカイン産生の誘発および致死的炎症性悪性心筋炎の誘発を行ういまだに特徴付けられていない自己DNA(おそらく通常はTrex1により消化される)が細胞内DNAセンサーを活性化するので、約10週間のメジアン寿命を呈する。STINGの損失によりTrex1−/−マウスの寿命を伸ばすことが可能であるが、その原因は不明であることが、最近のデータから示唆される。これらの研究を拡張し、dsDNA90に暴露されたTrex1欠損BMDC(Trex1−/−BMDC)でI型IFN産生のレベルがわずかに増加することを確認した。重要なこととして、STINGの損失(Sting−/−Trex1−/−BMDC)により、Trex1欠損BMDMでI型IFN産生を増加させるDNAの能力が排除された。興味深いことに、Trex1−/−マウスと比較してSting−/−Trex1−/−、Sting−/+Trex1−/−の心臓のサイズ減少が観測された。また、心筋炎の証拠は、Trex1−/−単独と比較してSting−/−Trex1−/−で劇的に低減されることが確認された。それに加えて、Trex1−/−マウスの血清中にかなり蔓延していることが観測された抗核自己抗体(ANA)は、Sting−/−Trex1−/−マウスの血清中にはほぼ完全に不在であった。Sting−/−Trex1−/−、Sting−/+Trex1−/−の心臓中の炎症誘発性遺伝子のレベルがTrex1−/−マウスと比較して劇的に低減されることが、マイクロアレイ解析から実証された。まとめると、これらのデータから、STINGは、Trex1欠損マウスおよびおそらくAGSで炎症誘発性遺伝子誘導に関与することが示唆される。 Given that STING appears to be involved in inflammatory diseases in apoptosis-deficient mice, it was next evaluated whether other types of self-DNA-induced diseases occur via activation of the STING pathway. For example, a 3 ′ repair exonuclease 1 (Trex1) deficient patient suffers from Aicardi Gutierre syndrome (AGS) causing lethal encephalitis characterized by the presence of high levels of type I IFN production in the cerebrospinal fluid To do. Because Trex1-deficient mice activate intracellular DNA sensors, autologous DNA that has not yet been characterized to induce cytokine production and induce lethal inflammatory malignant myocarditis (probably normally digested by Trex1) It exhibits a median life of about 10 weeks. Although loss of STING can extend the lifespan of Trex1 − / − mice, recent data suggest that the cause is unknown. These studies were expanded to confirm that Trex1-deficient BMDCs exposed to dsDNA90 (Trex1 − / − BMDC) slightly increased the level of type I IFN production. Importantly, loss of STING (Sting − / − Trex1 − / − BMDC) eliminated the ability of DNA to increase type I IFN production in Trex1 deficient BMDM. Interestingly, a decrease in the size of the Sting − / − Trex1 − / − and Sting − / + Trex1 − / − hearts was observed compared to Trex1 − / − mice. It was also confirmed that the evidence of myocarditis was dramatically reduced with Sting − / − Trex1 − / − compared to Trex1 − / − alone. In addition, Trex1 - / - antinuclear autoantibodies It was observed that quite prevalent in the sera of mice (ANA) is, Sting - / - Trex1 - / - almost completely absent in the sera of mice Met. Microarray analysis demonstrates that the levels of pro-inflammatory genes in the heart of Sting − / − Trex1 − / − , Sting − / + Trex1 − / − are dramatically reduced compared to Trex1 − / − mice It was done. Taken together, these data suggest that STING is involved in proinflammatory gene induction in Trex1-deficient mice and possibly AGS.
実施例4:STINGのS366に対するキナーゼのスクリーニング
基質としての2種のペプチド(A366およびS366)に対して、217種のプロテインキナーゼ標的の活性を評価した。プロテインキナーゼを各ペプチドおよび次いで33P−ATPと混合し、活性(CPM)を測定した。以下のキナーゼは、STING中のS366をリン酸化するものとして同定された。このセリンを標的とするキナーゼの同定は、薬剤発見の道を開く。この会合を標的とする薬剤は、STING活性を阻害しうる。また、治療目的でSTING活性を阻害するために使用しうる。STINGの過剰活性は、癌を増悪する可能性のある炎症性疾患をもたらしうる。
Example 4: Screening of kinases for STING S366 The activity of 217 protein kinase targets was evaluated against two peptides (A366 and S366) as substrates. Protein kinases were mixed with each peptide and then 33 P-ATP and activity (CPM) was measured. The following kinases were identified as phosphorylating S366 in STING. The identification of a serine-targeting kinase opens the way for drug discovery. Agents that target this association can inhibit STING activity. It can also be used to inhibit STING activity for therapeutic purposes. STING overactivity can lead to inflammatory diseases that can exacerbate cancer.
表4:STINGのS366に対するキナーゼのスクリーニング
Table 4: Screening of kinases for STING S366
実施例5:STINGは炎症関連癌に関与する
STING WTおよびSTING−/−の動物をDNA損傷剤で処理したところ、STINGの欠如したマウスは、腫瘍形成に対して耐性であった。この理由は、樹状細胞、マクロファージなどの浸潤免疫細胞が、壊死またはアポトーシスを受けた損傷細胞を貧食し、そのような細胞のDNAまたは他のリガンドが、STINGおよび腫瘍形成を促進するサイトカインの産生を活性化することにある。STINGは、多種多様な他の癌で腫瘍進行の促進に関与しうる。
Example 5: STING is involved in inflammation-related cancer When STING WT and STING − / − animals were treated with DNA damaging agents, mice lacking STING were resistant to tumor formation. This is because infiltrating immune cells such as dendritic cells, macrophages phagocytose damaged cells that have undergone necrosis or apoptosis, and DNA or other ligands of such cells produce STING and cytokines that promote tumorigenesis. Is to activate. STING may be involved in promoting tumor progression in a wide variety of other cancers.
図29A〜Dは、STING欠損マウスがDMBA誘発炎症および皮膚腫瘍形成に耐性であることを示している。STING+/+およびSTING−/−マウスの剃毛背部にアセトン処理または10μgDMBA処理のいずれかを20週間にわたり毎週1回行った。図29A:STING欠損動物は、皮膚癌を引き起こすDNA損傷剤に耐性である。皮膚腫瘍なしのマウスのパーセントをカプラン・マイヤー曲線に示した。図29B:各処理群の代表的マウスの写真を示した。図29C:モック処理またはDMBA処理された皮膚/皮膚腫瘍の生検試料でH&E染色により病理組織学的検査を行った。20倍の倍率で画像を得た。図29D:発癌性物質に暴露されたSTING発現マウスにおけるサイトカインアップレギュレーション。モック処理またはDMBA処理された皮膚/皮膚腫瘍の生検試料から抽出されたRNAを、Illumina Sentrix BeadChip Array(Mouse WG6 バージョン2)によりデュプリケート方式で、分析した。全遺伝子発現を分析した。最も変動しやすい遺伝子を選択した。行は、個別の遺伝子を表し、列は、個別のサンプルを表す。擬似カラーは、転写レベルが平均よりも少ないか、平均に等しいか、または平均よりも多いかを表す。遺伝子発現の変化倍率は、log10スケールで−5〜5の範囲内である。サイトカインは、STING欠損動物の皮膚で観測されなかった。
Figures 29A-D show that STING deficient mice are resistant to DMBA-induced inflammation and skin tumor formation. STING + / + and STING − / − mice were treated with either acetone or 10 μg DMBA once weekly for 20 weeks on the shaved back. FIG. 29A: STING deficient animals are resistant to DNA damaging agents that cause skin cancer. The percentage of mice without skin tumors is shown on the Kaplan-Meier curve. FIG. 29B: Pictures of representative mice in each treatment group are shown. FIG. 29C: Histopathological examination was performed by H & E staining on mock- or DMBA-treated skin / skin tumor biopsy samples. Images were obtained at 20x magnification. FIG. 29D: Cytokine upregulation in STING expressing mice exposed to carcinogens. RNA extracted from mock- or DMBA-treated biopsy samples of skin / skin tumors was analyzed in a duplicated manner by the Illumina Sentry BeadChip Array (Mouse WG6 version 2). Total gene expression was analyzed. The most variable gene was selected. Rows represent individual genes and columns represent individual samples. The pseudo color represents whether the transfer level is less than, equal to, or greater than the average. The rate of change of gene expression is in the range of -5 to 5 on the log10 scale. Cytokines were not observed in the skin of STING deficient animals.
Claims (13)
In a method of treating cancer in a subject having a cancerous tumor infiltrated with inflammatory immune cells, a pharmaceutical composition comprising an agent that down-regulates the function and expression of STING and a pharmaceutically acceptable carrier And administering the pharmaceutical composition to the subject in an amount effective to reduce the number of inflammatory immune cells infiltrating the cancerous tumor by at least 50%.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/460,408 US20130039933A1 (en) | 2008-08-04 | 2012-04-30 | Sting (stimulator of interferon genes), a regulator of innate immune responses |
| US13/460,408 | 2012-04-30 | ||
| PCT/US2013/038840 WO2013166000A1 (en) | 2012-04-30 | 2013-04-30 | Modulating immune responses |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015516989A true JP2015516989A (en) | 2015-06-18 |
| JP2015516989A5 JP2015516989A5 (en) | 2016-06-23 |
Family
ID=49514802
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015510379A Pending JP2015516989A (en) | 2012-04-30 | 2013-04-30 | Modulation of immune response |
Country Status (7)
| Country | Link |
|---|---|
| EP (1) | EP2844756A4 (en) |
| JP (1) | JP2015516989A (en) |
| KR (1) | KR20150004416A (en) |
| CN (1) | CN104540945A (en) |
| AU (1) | AU2013256468A1 (en) |
| CA (1) | CA2907616A1 (en) |
| WO (1) | WO2013166000A1 (en) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2876150A1 (en) | 2012-06-08 | 2013-12-12 | The Johns Hopkins University | Compostions and methods for cancer immunotherapy |
| BR112015013440B1 (en) | 2012-12-13 | 2020-12-08 | Aduro Biotech, Inc | compositions comprising cyclic purine dinucleotides with stereochemistry |
| PL2934598T3 (en) | 2012-12-19 | 2018-10-31 | Board Of Regents, The University Of Texas System | Pharmaceutical targeting of a mammalian cyclic di-nucleotide signaling pathway |
| WO2014179335A1 (en) | 2013-04-29 | 2014-11-06 | Memorial Sloan Kettering Cancer Center | Compositions and methods for altering second messenger signaling |
| WO2014179760A1 (en) | 2013-05-03 | 2014-11-06 | The Regents Of The University Of California | Cyclic di-nucleotide induction of type i interferon |
| US9549944B2 (en) | 2013-05-18 | 2017-01-24 | Aduro Biotech, Inc. | Compositions and methods for inhibiting “stimulator of interferon gene”—dependent signalling |
| ES2754269T3 (en) | 2013-05-18 | 2020-04-16 | Aduro Biotech Inc | Compositions and Activation Methods of "Interferon Gene Stimulator-dependent" Signaling |
| US10176292B2 (en) | 2013-07-31 | 2019-01-08 | Memorial Sloan-Kettering Cancer Center | STING crystals and modulators |
| PE20170198A1 (en) | 2014-06-04 | 2017-04-08 | Glaxosmithkline Ip Dev Ltd | CYCLIC DINUCLEOTIDES AS STING MODULATORS |
| GB201501462D0 (en) | 2015-01-29 | 2015-03-18 | Glaxosmithkline Ip Dev Ltd | Novel compounds |
| JO3746B1 (en) | 2015-03-10 | 2021-01-31 | Aduro Biotech Inc | Compositions and methods for activating “stimulator of interferon gene”-dependent signalling |
| RU2020113165A (en) | 2015-12-03 | 2020-06-09 | Глэксосмитклайн Интеллекчуал Проперти Дивелопмент Лимитед | CYCLIC PURINE DINUCLEOTIDES AS STING MODULATORS |
| CN106540260A (en) * | 2015-12-09 | 2017-03-29 | 聊城市奥润生物医药科技有限公司 | Interferon gene stimulatory protein(SP)(STING)Application of the agonist in anti-alzheimer's disease |
| WO2017161349A1 (en) | 2016-03-18 | 2017-09-21 | Immune Sensor, Llc | Cyclic di-nucleotide compounds and methods of use |
| CN106539757A (en) * | 2016-03-20 | 2017-03-29 | 聊城市奥润生物医药科技有限公司 | Application of the ring dinucleotide cGAMP- liposomees in antitumor |
| JP2019510802A (en) | 2016-04-07 | 2019-04-18 | グラクソスミスクライン、インテレクチュアル、プロパティー、ディベロップメント、リミテッドGlaxosmithkline Intellectual Property Development Limited | Heterocyclic amides useful as protein modulators |
| MY189100A (en) | 2016-04-07 | 2022-01-25 | Glaxosmithkline Ip Dev Ltd | Heterocyclic amides useful as protein modulators |
| WO2018009466A1 (en) | 2016-07-05 | 2018-01-11 | Aduro Biotech, Inc. | Locked nucleic acid cyclic dinucleotide compounds and uses thereof |
| BR112019015797A2 (en) | 2017-02-01 | 2020-03-17 | Modernatx, Inc. | IMMUNOMODULATORY THERAPEUTIC MRNA COMPOSITIONS THAT CODE ACTIVATING ONCOGEN MUTATION PEPTIDES |
| CN106667914B (en) * | 2017-03-13 | 2022-02-01 | 杭州星鳌生物科技有限公司 | Composition of targeted liposome-cyclic dinucleotide, preparation method and application of targeted liposome-cyclic dinucleotide in resisting tumors |
| US20200330556A1 (en) | 2017-10-05 | 2020-10-22 | Glaxosmithkline Intellectual Property Development Limited | Methods for Administering STING Agonists |
| US11377440B2 (en) | 2017-10-05 | 2022-07-05 | Glaxosmithkline Intellectual Property Development Limited | Modulators of stimulator of interferon genes (STING) |
| EP3692033A1 (en) | 2017-10-05 | 2020-08-12 | GlaxoSmithKline Intellectual Property Development Limited | Modulators of stimulator of interferon genes (sting) useful in treating hiv |
| GB201807924D0 (en) | 2018-05-16 | 2018-06-27 | Ctxt Pty Ltd | Compounds |
| TW202019408A (en) | 2018-06-28 | 2020-06-01 | 美商永恒生物科技公司 | Fused tricyclic heterocycle compounds and therapeutic uses thereof |
| TW202104214A (en) | 2019-04-05 | 2021-02-01 | 英商葛蘭素史密斯克藍智慧財產發展有限公司 | Chemical compounds |
| GB201910304D0 (en) | 2019-07-18 | 2019-09-04 | Ctxt Pty Ltd | Compounds |
| GB201910305D0 (en) | 2019-07-18 | 2019-09-04 | Ctxt Pty Ltd | Compounds |
| US11897888B1 (en) | 2020-04-30 | 2024-02-13 | Stinginn Llc | Small molecular inhibitors of sting signaling compositions and methods of use |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110262485A1 (en) * | 2008-08-04 | 2011-10-27 | University Of Miami | Sting (stimulator of interferon genes), a regulator of innate immune responses |
-
2013
- 2013-04-30 EP EP13784572.3A patent/EP2844756A4/en not_active Ceased
- 2013-04-30 AU AU2013256468A patent/AU2013256468A1/en not_active Abandoned
- 2013-04-30 CN CN201380029115.7A patent/CN104540945A/en active Pending
- 2013-04-30 KR KR20147033632A patent/KR20150004416A/en not_active Application Discontinuation
- 2013-04-30 JP JP2015510379A patent/JP2015516989A/en active Pending
- 2013-04-30 CA CA2907616A patent/CA2907616A1/en not_active Abandoned
- 2013-04-30 WO PCT/US2013/038840 patent/WO2013166000A1/en active Application Filing
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110262485A1 (en) * | 2008-08-04 | 2011-10-27 | University Of Miami | Sting (stimulator of interferon genes), a regulator of innate immune responses |
Non-Patent Citations (1)
| Title |
|---|
| ISHIKAWA H, ET AL.: "STING regulates intracellular DNA-mediated, type I interferon-dependent innate immunity", NATURE, vol. Vol.461, JPN6017046058, 8 October 2009 (2009-10-08), pages 788 - 792, XP055021931, DOI: doi:10.1038/nature08476 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013166000A1 (en) | 2013-11-07 |
| EP2844756A4 (en) | 2016-02-24 |
| CN104540945A (en) | 2015-04-22 |
| EP2844756A1 (en) | 2015-03-11 |
| CA2907616A1 (en) | 2013-11-07 |
| AU2013256468A1 (en) | 2014-12-04 |
| KR20150004416A (en) | 2015-01-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2015516989A (en) | Modulation of immune response | |
| US20200392492A1 (en) | Modulating Immune Responses | |
| Taft et al. | Human TBK1 deficiency leads to autoinflammation driven by TNF-induced cell death | |
| Zhang et al. | USP29 maintains the stability of cGAS and promotes cellular antiviral responses and autoimmunity | |
| Mukai et al. | SH3BP2 Cherubism Mutation Potentiates TNF‐α–Induced Osteoclastogenesis via NFATc1 and TNF‐α–Mediated Inflammatory Bone Loss | |
| Duan et al. | Deficiency of ATP6V1H causes bone loss by inhibiting bone resorption and bone formation through the TGF-β1 pathway | |
| Runde et al. | The role of TBK1 in cancer pathogenesis and anticancer immunity | |
| US20200206344A1 (en) | Methods for modulating the interaction between ews-fli1 and baf complexes | |
| Sun et al. | 1, 25 (OH) 2D3 inhibited Th17 cells differentiation via regulating the NF‐κB activity and expression of IL‐17 | |
| JP2018519278A (en) | Cancer treatment and diagnosis | |
| Tanaka et al. | Dual pharmacological inhibition of glutathione and thioredoxin systems synergizes to kill colorectal carcinoma stem cells | |
| Badodi et al. | Inositol treatment inhibits medulloblastoma through suppression of epigenetic-driven metabolic adaptation | |
| Wei et al. | Retracted: Daidzin inhibits RANKL‐induced osteoclastogenesis in vitro and prevents LPS‐induced bone loss in vivo | |
| Ke et al. | Lack of NOD2 attenuates ovariectomy-induced bone loss via inhibition of osteoclasts | |
| Miyahara et al. | Suppressed expression of autophagosomal protein LC3 in cortical tubers of tuberous sclerosis complex | |
| Liu et al. | Inhibiting checkpoint kinase 1 protects bone from bone resorption by mammary tumor in a mouse model | |
| US9814741B2 (en) | Methods relating to DNA-sensing pathway related conditions | |
| Makise et al. | Loss of H3K27 trimethylation in a distinct group of de‐differentiated chordoma of the skull base | |
| Zeng et al. | P53 inhibitor pifithrin‐α inhibits ropivacaine‐induced neuronal apoptosis via the mitochondrial apoptosis pathway | |
| Liu et al. | Implication of myeloid differentiation factor 88 inhibitor TJ‐M2010‐5 for therapeutic intervention of hepatocellular carcinoma | |
| Appalla et al. | Mammalian target of rapamycin inhibitor induced complete remission of a recurrent subependymal giant cell astrocytoma in a patient without features of tuberous sclerosis complex | |
| Hu et al. | Histone demethylase LSD1 promotes RIG-I poly-ubiquitination and anti-viral gene expression | |
| JP2020527558A (en) | Targeting the HDAC2-SP3 complex to enhance synaptic function | |
| Buchou et al. | Upregulation of the mevalonate pathway through EWSR1-FLI1/EGR2 regulatory axis confers ewing cells exquisite sensitivity to statins. Cancers. 2022; 14: 2327 | |
| EP4360650A1 (en) | Novel therapeutic agent that suppresses metastasis and proliferation of osteosarcoma and glioma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160428 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160428 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170110 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170410 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170612 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20171205 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180305 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180507 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180605 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20180724 |